KR20130082453A - 아밀로이드 병리의 치료 및 예방을 위한 플루페녹신 유도체 - Google Patents
아밀로이드 병리의 치료 및 예방을 위한 플루페녹신 유도체 Download PDFInfo
- Publication number
- KR20130082453A KR20130082453A KR1020127033736A KR20127033736A KR20130082453A KR 20130082453 A KR20130082453 A KR 20130082453A KR 1020127033736 A KR1020127033736 A KR 1020127033736A KR 20127033736 A KR20127033736 A KR 20127033736A KR 20130082453 A KR20130082453 A KR 20130082453A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- group
- optionally substituted
- formula
- alkyl
- Prior art date
Links
- 230000007170 pathology Effects 0.000 title claims abstract description 18
- FDHPZDXAAGIHFC-UHFFFAOYSA-N 4-[(3-fluorophenoxy)-phenylmethyl]piperidine Chemical class FC1=CC=CC(OC(C2CCNCC2)C=2C=CC=CC=2)=C1 FDHPZDXAAGIHFC-UHFFFAOYSA-N 0.000 title description 2
- 230000002265 prevention Effects 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims abstract description 117
- 208000024891 symptom Diseases 0.000 claims abstract description 10
- 150000003839 salts Chemical class 0.000 claims description 51
- 239000012453 solvate Substances 0.000 claims description 42
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 23
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical group C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 16
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 15
- 229910052739 hydrogen Inorganic materials 0.000 claims description 15
- 239000001257 hydrogen Substances 0.000 claims description 15
- 238000000034 method Methods 0.000 claims description 13
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 12
- 125000003118 aryl group Chemical group 0.000 claims description 11
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 11
- 229910052799 carbon Inorganic materials 0.000 claims description 10
- 239000003814 drug Substances 0.000 claims description 10
- 125000000623 heterocyclic group Chemical group 0.000 claims description 10
- 239000008194 pharmaceutical composition Substances 0.000 claims description 10
- 125000001072 heteroaryl group Chemical group 0.000 claims description 9
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 claims description 9
- 125000000217 alkyl group Chemical group 0.000 claims description 8
- 229930192474 thiophene Chemical group 0.000 claims description 8
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 7
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 6
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 claims description 6
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims description 6
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims description 6
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 claims description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 125000001624 naphthyl group Chemical group 0.000 claims description 5
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 4
- 125000004122 cyclic group Chemical group 0.000 claims description 4
- 125000005843 halogen group Chemical group 0.000 claims description 4
- 229910052740 iodine Inorganic materials 0.000 claims description 4
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 3
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 claims description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 3
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 3
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 3
- 125000005842 heteroatom Chemical group 0.000 claims description 3
- 150000002431 hydrogen Chemical class 0.000 claims description 3
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 claims description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 claims description 3
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 claims description 3
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 claims description 3
- 125000000041 C6-C10 aryl group Chemical group 0.000 claims description 2
- 125000001831 (C6-C10) heteroaryl group Chemical group 0.000 claims 1
- 208000024827 Alzheimer disease Diseases 0.000 abstract description 19
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 36
- 239000000243 solution Substances 0.000 description 36
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 35
- 239000000203 mixture Substances 0.000 description 27
- -1 hydrocarbon chain radical Chemical class 0.000 description 21
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical class Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 19
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical class OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 19
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 19
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 18
- 210000004027 cell Anatomy 0.000 description 17
- 210000002569 neuron Anatomy 0.000 description 17
- 239000007787 solid Substances 0.000 description 16
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 15
- 239000012044 organic layer Substances 0.000 description 15
- 239000011734 sodium Substances 0.000 description 15
- 239000011541 reaction mixture Substances 0.000 description 14
- 239000003921 oil Substances 0.000 description 13
- 235000019198 oils Nutrition 0.000 description 13
- 108090000765 processed proteins & peptides Proteins 0.000 description 13
- 230000002490 cerebral effect Effects 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 11
- 230000028327 secretion Effects 0.000 description 11
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 239000002904 solvent Substances 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 241000699660 Mus musculus Species 0.000 description 9
- 229940126214 compound 3 Drugs 0.000 description 9
- 238000011830 transgenic mouse model Methods 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 8
- 229940125773 compound 10 Drugs 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 8
- 229910052757 nitrogen Inorganic materials 0.000 description 8
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 7
- 229940125898 compound 5 Drugs 0.000 description 7
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 7
- 230000026731 phosphorylation Effects 0.000 description 7
- 238000006366 phosphorylation reaction Methods 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 6
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 6
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 6
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 6
- 229940125877 compound 31 Drugs 0.000 description 6
- 229940125807 compound 37 Drugs 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 239000008187 granular material Substances 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 5
- OMBVEVHRIQULKW-DNQXCXABSA-M (3r,5r)-7-[3-(4-fluorophenyl)-8-oxo-7-phenyl-1-propan-2-yl-5,6-dihydro-4h-pyrrolo[2,3-c]azepin-2-yl]-3,5-dihydroxyheptanoate Chemical compound O=C1C=2N(C(C)C)C(CC[C@@H](O)C[C@@H](O)CC([O-])=O)=C(C=3C=CC(F)=CC=3)C=2CCCN1C1=CC=CC=C1 OMBVEVHRIQULKW-DNQXCXABSA-M 0.000 description 5
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 5
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 5
- 239000003242 anti bacterial agent Substances 0.000 description 5
- 229940088710 antibiotic agent Drugs 0.000 description 5
- 125000004432 carbon atom Chemical group C* 0.000 description 5
- 229940127204 compound 29 Drugs 0.000 description 5
- 229940125878 compound 36 Drugs 0.000 description 5
- 229940126540 compound 41 Drugs 0.000 description 5
- 238000003818 flash chromatography Methods 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 4
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 4
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 4
- 101710137189 Amyloid-beta A4 protein Proteins 0.000 description 4
- 101710151993 Amyloid-beta precursor protein Proteins 0.000 description 4
- 102100022704 Amyloid-beta precursor protein Human genes 0.000 description 4
- 206010012289 Dementia Diseases 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- 239000012043 crude product Substances 0.000 description 4
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 4
- 125000001153 fluoro group Chemical group F* 0.000 description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 210000002682 neurofibrillary tangle Anatomy 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 208000037259 Amyloid Plaque Diseases 0.000 description 3
- 239000012583 B-27 Supplement Substances 0.000 description 3
- BQXUPNKLZNSUMC-YUQWMIPFSA-N CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 Chemical compound CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 BQXUPNKLZNSUMC-YUQWMIPFSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical group C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- DZHSAHHDTRWUTF-SIQRNXPUSA-N amyloid-beta polypeptide 42 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O)[C@@H](C)CC)C(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C(C)C)C1=CC=CC=C1 DZHSAHHDTRWUTF-SIQRNXPUSA-N 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- 210000001638 cerebellum Anatomy 0.000 description 3
- 210000003618 cortical neuron Anatomy 0.000 description 3
- 125000004093 cyano group Chemical group *C#N 0.000 description 3
- 235000019439 ethyl acetate Nutrition 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 3
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 3
- 125000002950 monocyclic group Chemical group 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 239000004533 oil dispersion Substances 0.000 description 3
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 3
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 3
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 3
- 239000004300 potassium benzoate Substances 0.000 description 3
- 229940103091 potassium benzoate Drugs 0.000 description 3
- 235000010235 potassium benzoate Nutrition 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 230000009261 transgenic effect Effects 0.000 description 3
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 2
- 0 *N(CC1)CCC1C(c1ccccc1)=O Chemical compound *N(CC1)CCC1C(c1ccccc1)=O 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- JQZAEUFPPSRDOP-UHFFFAOYSA-N 1-chloro-4-(chloromethyl)benzene Chemical compound ClCC1=CC=C(Cl)C=C1 JQZAEUFPPSRDOP-UHFFFAOYSA-N 0.000 description 2
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 2
- 125000004179 3-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(Cl)=C1[H] 0.000 description 2
- 230000007082 Aβ accumulation Effects 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- 201000011240 Frontotemporal dementia Diseases 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 208000016285 Movement disease Diseases 0.000 description 2
- HPKJGHVHQWJOOT-ZJOUEHCJSA-N N-[(2S)-3-cyclohexyl-1-oxo-1-({(2S)-1-oxo-3-[(3S)-2-oxopyrrolidin-3-yl]propan-2-yl}amino)propan-2-yl]-1H-indole-2-carboxamide Chemical compound C1C(CCCC1)C[C@H](NC(=O)C=1NC2=CC=CC=C2C=1)C(=O)N[C@@H](C[C@H]1C(=O)NCC1)C=O HPKJGHVHQWJOOT-ZJOUEHCJSA-N 0.000 description 2
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 230000006933 amyloid-beta aggregation Effects 0.000 description 2
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 2
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 229940126086 compound 21 Drugs 0.000 description 2
- 229940125961 compound 24 Drugs 0.000 description 2
- 229940125851 compound 27 Drugs 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- RWTNPBWLLIMQHL-UHFFFAOYSA-N fexofenadine Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 RWTNPBWLLIMQHL-UHFFFAOYSA-N 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- XNXVOSBNFZWHBV-UHFFFAOYSA-N hydron;o-methylhydroxylamine;chloride Chemical compound Cl.CON XNXVOSBNFZWHBV-UHFFFAOYSA-N 0.000 description 2
- 230000006951 hyperphosphorylation Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 231100000053 low toxicity Toxicity 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 235000006408 oxalic acid Nutrition 0.000 description 2
- 239000001301 oxygen Chemical group 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 125000003386 piperidinyl group Chemical group 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000012047 saturated solution Substances 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 229910052717 sulfur Chemical group 0.000 description 2
- 239000011593 sulfur Chemical group 0.000 description 2
- 125000004434 sulfur atom Chemical group 0.000 description 2
- 229960001685 tacrine Drugs 0.000 description 2
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 2
- ITLCXSHKUNNAHG-UHFFFAOYSA-N tert-butyl 4-benzoylpiperidine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)CCC1C(=O)C1=CC=CC=C1 ITLCXSHKUNNAHG-UHFFFAOYSA-N 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- ZPHGMBGIFODUMF-UHFFFAOYSA-N thiophen-2-ylmethanol Chemical compound OCC1=CC=CS1 ZPHGMBGIFODUMF-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 1
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 1
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- GCTFTMWXZFLTRR-GFCCVEGCSA-N (2r)-2-amino-n-[3-(difluoromethoxy)-4-(1,3-oxazol-5-yl)phenyl]-4-methylpentanamide Chemical compound FC(F)OC1=CC(NC(=O)[C@H](N)CC(C)C)=CC=C1C1=CN=CO1 GCTFTMWXZFLTRR-GFCCVEGCSA-N 0.000 description 1
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- 125000006727 (C1-C6) alkenyl group Chemical group 0.000 description 1
- UEMGWPRHOOEKTA-UHFFFAOYSA-N 1,3-difluorobenzene Chemical compound FC1=CC=CC(F)=C1 UEMGWPRHOOEKTA-UHFFFAOYSA-N 0.000 description 1
- VHFVKMTVMIZMIK-UHFFFAOYSA-N 1-(3-chlorophenyl)piperazine Chemical compound ClC1=CC=CC(N2CCNCC2)=C1 VHFVKMTVMIZMIK-UHFFFAOYSA-N 0.000 description 1
- KVSVNRFSKRFPIL-UHFFFAOYSA-N 1-(bromomethyl)-3,5-difluorobenzene Chemical compound FC1=CC(F)=CC(CBr)=C1 KVSVNRFSKRFPIL-UHFFFAOYSA-N 0.000 description 1
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 1
- IPBXMCTWVOMGJC-UHFFFAOYSA-N 1-[4-(thiophene-2-carbonyl)piperidin-1-yl]ethanone Chemical compound C1CN(C(=O)C)CCC1C(=O)C1=CC=CS1 IPBXMCTWVOMGJC-UHFFFAOYSA-N 0.000 description 1
- WFCLWJHOKCQYOQ-UHFFFAOYSA-N 1-acetylpiperidine-4-carboxylic acid Chemical compound CC(=O)N1CCC(C(O)=O)CC1 WFCLWJHOKCQYOQ-UHFFFAOYSA-N 0.000 description 1
- QDKWLJJOYIFEBS-UHFFFAOYSA-N 1-fluoro-4-$l^{1}-oxidanylbenzene Chemical group [O]C1=CC=C(F)C=C1 QDKWLJJOYIFEBS-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000005999 2-bromoethyl group Chemical group 0.000 description 1
- INUNLMUAPJVRME-UHFFFAOYSA-N 3-chloropropanoyl chloride Chemical compound ClCCC(Cl)=O INUNLMUAPJVRME-UHFFFAOYSA-N 0.000 description 1
- TXEBWPPWSVMYOA-UHFFFAOYSA-N 4-[3-[(1-amino-2-chloroethyl)amino]propyl]-1-[[3-(2-chlorophenyl)phenyl]methyl]-5-hydroxyimidazolidin-2-one Chemical compound NC(CCl)NCCCC1NC(=O)N(Cc2cccc(c2)-c2ccccc2Cl)C1O TXEBWPPWSVMYOA-UHFFFAOYSA-N 0.000 description 1
- RHMPLDJJXGPMEX-UHFFFAOYSA-N 4-fluorophenol Chemical compound OC1=CC=C(F)C=C1 RHMPLDJJXGPMEX-UHFFFAOYSA-N 0.000 description 1
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 1
- YUXWMCKGSHXUGW-UHFFFAOYSA-N 4-methyl-6-[2-[5-[3-(methylamino)propyl]pyridin-3-yl]ethyl]pyridin-2-amine Chemical compound CC1=CC(=NC(=C1)CCC=1C=NC=C(C=1)CCCNC)N YUXWMCKGSHXUGW-UHFFFAOYSA-N 0.000 description 1
- 125000006164 6-membered heteroaryl group Chemical group 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 208000000044 Amnesia Diseases 0.000 description 1
- 102100029470 Apolipoprotein E Human genes 0.000 description 1
- 101710095339 Apolipoprotein E Proteins 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- FOPBPOXXRBGLRM-UHFFFAOYSA-N C1OC=2C=C(OC3=C(C(=CC(=C3)F)F)C)C=CC2O1 Chemical compound C1OC=2C=C(OC3=C(C(=CC(=C3)F)F)C)C=CC2O1 FOPBPOXXRBGLRM-UHFFFAOYSA-N 0.000 description 1
- 208000005145 Cerebral amyloid angiopathy Diseases 0.000 description 1
- 102000003914 Cholinesterases Human genes 0.000 description 1
- 108090000322 Cholinesterases Proteins 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical class [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 229940127007 Compound 39 Drugs 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical group [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 201000010374 Down Syndrome Diseases 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 1
- 101100268553 Homo sapiens APP gene Proteins 0.000 description 1
- 101001071233 Homo sapiens PHD finger protein 1 Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 208000001089 Multiple system atrophy Diseases 0.000 description 1
- 102000008092 Norepinephrine Plasma Membrane Transport Proteins Human genes 0.000 description 1
- 108010049586 Norepinephrine Plasma Membrane Transport Proteins Proteins 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 102100036879 PHD finger protein 1 Human genes 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 206010033799 Paralysis Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102000005877 Peptide Initiation Factors Human genes 0.000 description 1
- 108010044843 Peptide Initiation Factors Proteins 0.000 description 1
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 1
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 1
- 102000019208 Serotonin Plasma Membrane Transport Proteins Human genes 0.000 description 1
- 108010012996 Serotonin Plasma Membrane Transport Proteins Proteins 0.000 description 1
- LUSZGTFNYDARNI-UHFFFAOYSA-N Sesamol Chemical compound OC1=CC=C2OCOC2=C1 LUSZGTFNYDARNI-UHFFFAOYSA-N 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 206010044688 Trisomy 21 Diseases 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical group [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- NELWQUQCCZMRPB-UBPLGANQSA-N [(2r,3r,4r,5r)-4-acetyloxy-5-(4-amino-5-ethenyl-2-oxopyrimidin-1-yl)-2-methyloxolan-3-yl] acetate Chemical compound CC(=O)O[C@@H]1[C@H](OC(C)=O)[C@@H](C)O[C@H]1N1C(=O)N=C(N)C(C=C)=C1 NELWQUQCCZMRPB-UBPLGANQSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 108010064397 amyloid beta-protein (1-40) Proteins 0.000 description 1
- 108010064539 amyloid beta-protein (1-42) Proteins 0.000 description 1
- 230000003941 amyloidogenesis Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000001430 anti-depressive effect Effects 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 201000007201 aphasia Diseases 0.000 description 1
- 239000011260 aqueous acid Substances 0.000 description 1
- 229940039856 aricept Drugs 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 238000007630 basic procedure Methods 0.000 description 1
- KGNDCEVUMONOKF-UGPLYTSKSA-N benzyl n-[(2r)-1-[(2s,4r)-2-[[(2s)-6-amino-1-(1,3-benzoxazol-2-yl)-1,1-dihydroxyhexan-2-yl]carbamoyl]-4-[(4-methylphenyl)methoxy]pyrrolidin-1-yl]-1-oxo-4-phenylbutan-2-yl]carbamate Chemical compound C1=CC(C)=CC=C1CO[C@H]1CN(C(=O)[C@@H](CCC=2C=CC=CC=2)NC(=O)OCC=2C=CC=CC=2)[C@H](C(=O)N[C@@H](CCCCN)C(O)(O)C=2OC3=CC=CC=C3N=2)C1 KGNDCEVUMONOKF-UGPLYTSKSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 210000005013 brain tissue Anatomy 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229940048961 cholinesterase Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940125833 compound 23 Drugs 0.000 description 1
- 229940125900 compound 59 Drugs 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 235000008504 concentrate Nutrition 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 239000000645 desinfectant Substances 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 208000010643 digestive system disease Diseases 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 229960003530 donepezil Drugs 0.000 description 1
- 238000007908 dry granulation Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- OUAQKVIBEFYQDD-UHFFFAOYSA-N ethanamine;oxalic acid Chemical compound CCN.OC(=O)C(O)=O OUAQKVIBEFYQDD-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 210000001061 forehead Anatomy 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 210000001652 frontal lobe Anatomy 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 229960003980 galantamine Drugs 0.000 description 1
- ASUTZQLVASHGKV-UHFFFAOYSA-N galanthamine hydrochloride Natural products O1C(=C23)C(OC)=CC=C2CN(C)CCC23C1CC(O)C=C2 ASUTZQLVASHGKV-UHFFFAOYSA-N 0.000 description 1
- 208000018685 gastrointestinal system disease Diseases 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical class I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical class II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- JXDYKVIHCLTXOP-UHFFFAOYSA-N isatin Chemical compound C1=CC=C2C(=O)C(=O)NC2=C1 JXDYKVIHCLTXOP-UHFFFAOYSA-N 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 231100000863 loss of memory Toxicity 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 229940126601 medicinal product Drugs 0.000 description 1
- BUGYDGFZZOZRHP-UHFFFAOYSA-N memantine Chemical compound C1C(C2)CC3(C)CC1(C)CC2(N)C3 BUGYDGFZZOZRHP-UHFFFAOYSA-N 0.000 description 1
- 229960004640 memantine Drugs 0.000 description 1
- 210000002418 meninge Anatomy 0.000 description 1
- WSFSSNUMVMOOMR-BJUDXGSMSA-N methanone Chemical compound O=[11CH2] WSFSSNUMVMOOMR-BJUDXGSMSA-N 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 150000002829 nitrogen Chemical group 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000002767 noradrenalin uptake inhibitor Substances 0.000 description 1
- 229960002748 norepinephrine Drugs 0.000 description 1
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 description 1
- 229940127221 norepinephrine reuptake inhibitor Drugs 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- WLCAJVVSNAVBSM-UHFFFAOYSA-N oxalic acid;piperidine Chemical compound C1CCNCC1.OC(=O)C(O)=O WLCAJVVSNAVBSM-UHFFFAOYSA-N 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006201 parenteral dosage form Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 125000005010 perfluoroalkyl group Chemical group 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 1
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N phenylbenzene Natural products C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000004194 piperazin-1-yl group Chemical group [H]N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 125000003367 polycyclic group Polymers 0.000 description 1
- 210000002243 primary neuron Anatomy 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- UMSVPCYSAUKCAZ-UHFFFAOYSA-N propane;hydrochloride Chemical compound Cl.CCC UMSVPCYSAUKCAZ-UHFFFAOYSA-N 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960004136 rivastigmine Drugs 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000820 toxicity test Toxicity 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- GBXQPDCOMJJCMJ-UHFFFAOYSA-M trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;bromide Chemical compound [Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C GBXQPDCOMJJCMJ-UHFFFAOYSA-M 0.000 description 1
- 229910052722 tritium Chemical group 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000031836 visual learning Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000005550 wet granulation Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4465—Non condensed piperidines, e.g. piperocaine only substituted in position 4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4525—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with oxygen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4535—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a heterocyclic ring having sulfur as a ring hetero atom, e.g. pizotifen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/20—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms
- C07D211/22—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/20—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms
- C07D211/24—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms by sulfur atoms to which a second hetero atom is attached
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- General Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Plural Heterocyclic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
본 발명은 알츠하이머병과 같은 아밀로이드 또는 타우 병리의 치료 및/또는 그 증상의 개선에 유용한 플루페녹신 유도체에 관한 것이다.
알츠하이머병 (AD)은 가장 광범위하게 연구된 아밀로이드 병리이고, 전 세계적으로 1,500만 여명에 이르는 노령 인구 및 85세 이상의 40%에서 나타나는 치매의 가장 흔한 원인이다. 이 질병은 환자의 전적인 무능력화와 함께 기억, 언어능력 및 운동 능력이 점진적으로 상실되고 최종적으로 죽음에 이르게 되는 것에 특징이 있다.
현재 이용가능한 아밀로이드 병리에 대한 치료법은 없다. 오늘날, 약물 치료는 그 증상과 그들의 다양한 단계를 제어하는 것에 초점을 맞추고 있다. 예를 들면 약하거나 중간 정도의 AD는 코그넥스 (R) (타크린), 아리셉트 (도네페질), 엑셀론 (R) (리바스티그민) 또는 라자딘 (R) (갈란타민)과 같은 콜린스테라아제 저해제를 사용한 치료와 관련될 수 있다. 반면 중간 내지 중증 AD는 나멘타 (R)(메만틴)으로 치료될 수 있다. 이들 의약은 제한된 시간 동안 AD 증상이 악화되는 것을 지연 또는 예방하는 것을 도울 수 있다.
그러므로 아밀로이드 병리, 예를 들면 AD를 치료 및/또는 개선할 수 있는 추가적인 약물의 제공에 대한 요구가 있다. 이들 약물은 바람직하게는, 예를 들면 증가된 효율, 저독성, 개선된 생체이용율 등과 같은 특성을 갖고 있어야 한다.
부검에서 두뇌 조직의 연구는 AD의 두 개의 주된 특징, 즉 세포외 아밀로이드 플라크 (amyloid plaque) 침착 및 세포내 신경섬유 매듭 (neurofibrillary tangle, NFT)을 확인했다.
아밀로이드 플라크는 아밀로이드 전구체 단백질 (APP)의 단백질 분해에서 유래하는 응집된 아밀로이드-베타 (Aβ) 펩타이드로 주로 구성된다. 40-아미노산 (Aβ40)의 모노머는 응집 프론보다 훨씬 더 우세하며, Aβ42 종을 손상시킨다. 생산과 클리어런스 간의 불균형으로 인해 Aβ의 축적이 초래되고, 이와 같은 과잉이 AD의 개시 요인이 될 수 있다. 이 견해는 가족력 AD 돌연변이 초기 발생의 분석과 이식 유전자 동물 모델에서의 연속적인 확인에 의해 강력하게 지지된다. 따라서, 인간 APP 유전자의 돌연변이 형태를 발현하는 이식 유전자 마우스는 미소섬유 아밀로이드 플라크와 공간 학습 결핍을 수반하는 알츠하이머 유사 두뇌 병리를 나타낸다.
또한, AD의 주된 유전적 위험 요소인 APOE4 (아폴리포 단백질 E, Apolipoprotein E)가 AD 증상 발현 전에 뇌에서 과도한 아밀로이드 축척을 초래할 수 있다는 가설도 제안되고 있다. 따라서 Aβ침착은 임상적 AD에 선행하는 것으로 생각된다.
따라서 뇌에서의 아밀로이드 축적은 신경퇴행성 질병 (Tebbenkamp AT, Borchelt DR. Methods Mol Biol. 2009;566:85-91), 예를 들면 알츠하이머병 (De Arai, T, Ikeda, K, Akiyama, H, Tsuchiya, K, Iritani, S, Ishiguro, K, Yagishita, S, Oda, T, Odawara, T, Iseki, E (2003) ACTA NEUROPATHOLOGICA 105: 489-498), 파킨슨병 (Burack MA, Hartlein J, Flores HP, Taylor-Reinwald L, Perlmutter JS, Cairns NJ Neurology 2010 Jan 5;74(1):77-84), 크로이츠펠트-야콥병 또는 루이소체 치매 (Dupiereux I, Zorzi W, Quadrio I, Perret-Liaudet A, Kovacs GG, Heinen E, Elmoualij B. Cent Nerv Syst Agents Med Chem. 2009 Mar;9(1):2-11)와 직접 관련된다.
NFT는 그 주된 성분이 과인산화된 타우, 신경소관 연합 단백질인 PHF (쌍나선 필라멘트, paired helical filaments) 다발을 함유한다. 과인산화된 타우는 다른 가닥의 타우와 쌍을 이루기 시작한다는 것 역시 가설로서 제안되었다. 결국, 그들은 신경세포체 내에서 신경섬유매듭을 형성한다. 이 때 신경소관이 분해되어 뉴론의 수송 시스템이 붕괴된다. 이것은 우선 뉴론들 간의 생화학적 소통에서의 이상을 초래하고, 이후에 세포의 사멸을 초래한다.
그러므로, 타우 과인산화 역시 예를 들면 알츠하이머병 (De Arai, T, et al (2003) ACTA NEUROPATHOLOGICA 105: 489-498), 파킨슨병 (Morishima-Kawashima, M, et al (2002) Journal of Neuroscience Research 70: 392-401), 피크병 (Bird, T, et al (2003) Annals of Neurology 54: S29-S31), 진행성 핵상 마비 (Berry, RW, et al (2004) JOURNAL OF NEUROCYTOLOGY 33: 287-295), DCB (Weeks, RA, et al (2003) MOVEMENT DISORDERS 18: 331-336), 이마 관자엽 치매 (Binetti, G, et al (2003) NEUROSCIENCE LETTERS 338: 85-87), 전두엽 증후군 (M, Larsson, et al (2003) Journal of Neurology, Neurosurgery and Psychiatry 74: 867-871), 다운 증후군 (Barbiero, L, et al (2003) Experimental Neurology 182: 335-345), 치매 (Bornebroek, M, et al (2004) Clinical Neuroscience Research 3: 349-361), 전두엽 경도 인지 장애 (de Mendonca, A, et al (2004) REVISTA DE LA ENFERMEDAD DE ALZHEIMER 6: 1-9), 피질 기저 퇴화 (Graham, NL, et al (2003) TRASTORNOS DEL MOVIMIENTO 18: 1224-1232), 진행성 일차 실어증 (Sobrido, MJ, et al (2003) NEUROLOGIA 60: 862-864), 근위축성 측색 경화증 (73. Lomen-Hoerth, C, et al (2002) The overlap of amyotrophic lateral sclerosis and frontotemporal dementia . NEUROLOGY 59: 1077-1079), 다계통 위축증 (Neumann, M, et al (2004) ACTA NEUROPATHOLOGICA 107: 489-496), 진행성 초로성 치매, 양측 측두부 위축 (Ostojic, J, et al (2004) GERIARTICA 17: 298-301), 크로이츠펠트-야콥 (Shimamura, M, Uyama, et al (2003) MEDICINA INTERNA 42: 195-198), 대뇌 아밀로이드 맥관병증 (Weeks, RA, et al (2003) MOVEMENT DISORDERS 18: 331-336)과 같은 신경 퇴행성 질병과 관련된다 (Armstrong, RA, Lantos, PL, Cairns, NJ (2005) Neuropatologia 25: 111-124; Avila, J, Lim, F, Moreno, F, Belmonte, C, Cuello, AC (2002) Neurobiologia Molecular 25: 213-231; Avila, J, Perez, M, Lim, F, Gomez-Ramos, A, Hernandez, F, Lucas, JJ (2004) Neurotoxicidad Investigacion 6: 477-482).
따라서, 타우 인산화 및/또는 베타아밀로이드 침착의 저해가 가능하여 아밀로이드 및 타우 병리의 치료에 유용한 화합물의 탐색에 대한 지대한 관심이 존재한다.
WO2005/105763는 치환된 모르폴린 고리에 의해 특징지워지는 화합물 군의 노르에피네프린 재흡수 저해제 및 알츠하이머병 치료에 대한 잠재적인 약물로서의 유용성에 대해 개시하고 있다.
플루페녹신 및 그 염은 세로토닌 및/또는 노르아드레날린의 흡수를 저해하는 것으로 알려져 있으며, 항우울 특성을 갖는 것으로 알려져 있다. Orjales et al J. Med . Chem, 2003, 46, 5512-5532에서는, 플루페녹신 유도체가 세로토닌 수송체 (그들 대부분은 또한 노르에피네프린 수송체이기도 하다)에 대해 높은 친화성을 갖는 화합물인 것으로 기재하고 있지만, 알츠하이머병과 같은 아밀로이드 병리의 치료에 유용할 수 있다는 것에 대한 시사는 없다.
US6518284는 화학식 (I)의 화합물을 기재하고 있지만, 알츠하이머병과 같은 아밀로이드 병리의 치료에 대한 유용성에 대한 시사는 없다.
본 발명자들은 공지의, 그리고 신규한 플루페녹신 유도체들이 놀랍게도 아밀로이드 및 타우 병리의 치료에 유용하고, 예를 들면 증가된 효율, 저독성 및/또는 개선된 생체이용율을 나타낸다는 것을 발견하였다. 상기 화합물들은 놀랍게도 효과적이다. 상기 화합물들은 아밀로이드 및 타우 병리의 조직병리학적 마커에 있어서, 아밀로이드 침착과 타우 과인산화에서 생물학적 활성을 나타낸다. 이와 같은 이중의 활성은 AD와 같은 아밀로이드 또는 타우 병리의 전개를 정확하게 변경시킬 수 있는 약물을 가능하게 한다.
따라서 본 발명의 일 측면에 의하면, 본 발명은 아밀로이드 또는 타우 병리또는 그 증상을 치료 또는 개선시키기 위한 방법에 사용하기 위한 화학식 (I)의 화합물 또는 그의 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물에 관한 것이다.
여기서, R1 은 수소 또는 -(CH2)w-(C=O)y-(CH2)x-R2로 이루어지는 군에서 선택되며, 여기서 R2 는 -NH2, -SH, -OH 또는 C3-C8 시클로알킬에 의해 선택적으로 치환되는 C1-C6 알킬기이거나 또는 R2 는 치환 또는 비치환된 페닐 또는 치환 또는 비치환된 5 또는 6원 헤테로아릴기에 의해 선택적으로 치환된 헤테로시클릴기이고; w 는 0, 1, 2, 또는 3으로부터 선택되는 정수이며; x 는 0, 1, 2 또는 3으로부터 선택되는 정수이고; y 는 0 또는 1이며;
Ar 은 선택적으로 치환된 페닐 또는 선택적으로 치환된 5 또는 6원 헤테로아릴기이고;
A 가 -C(H)- 일 때; B 는 -(CH2)-O-, -(CH2)-S-, -O- 또는 -S-; 및 C 는 선택적으로 치환된 페닐, 선택적으로 치환된 벤질 또는 선택적으로 치환된 나프틸기이거나; 또는
A 가 -C(=)-일 때; B 는 =C(H)- 이고, C 는 -OH, -O(C1-C3-알킬) 및 -O(C7-C10-아릴알킬)로 이루어지는 군에서 선택되거나 또는 선택적으로 치환된 페닐 또는 선택적으로 치환된 나프틸기이고; 및
n은 0, 1 또는 2로부터 선택되는 정수이다.
아밀로이드 또는 타우 병리의 치료에서 공통의 유용성을 갖는 몇 가지 유도체들은 신규한 화학적 화합물이다. 따라서 본 발명의 다른 측면은 화학식 (II), 화학식 (III), 화학식 (IV) 또는 화학식 (V)의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물에 관한 것이다.
여기서, 각각의 경우에 적절하게,
R1 은 상기 정의된 바와 같으며, 바람직하게는 R1 은 수소 또는 선택적으로 -NH2, -SH, -OH 또는 C3-C8 시클로알킬기로 치환된 C1-C6 알킬기이고;
Ar 은 선택적으로 치환된 페닐 또는 선택적으로 치환된 5- 또는 6-원 헤테로아릴기이고;
R4 은 -(CH2)w-(C=O)y-(CH2)x-R2 이고, 여기서 R2 는 치환 또는 비치환 페닐기 또는 치환 또는 비치환 5 또는 6-원 헤테로아릴기로 선택적으로 치환된 헤테로시클릴기이고; w는 0, 1, 2 또는 3으로부터 선택되는 정수이며; x는 0, 1, 2 또는 3으로부터 선택되는 정수이고, y는 0 또는 1이고;
R5 는 수소, C1-C6 알킬, C7-C10-아릴알킬 및 C6-C10-아릴기로 이루어지는 군에서 선택되고;
J 는 벤즈이미다졸, 벤조티아졸, 티오펜, 퓨란, 피롤, 피리미딘, 이소티아졸, 이미다졸, 인돌, 퓨린, 퀴놀린 및 티아디아졸로 이루어지는 군에서 선택되는, 선택적으로 치환된 5- 또는 6-원 헤테로아릴기이고;
Halo 는 -F, -Cl, -Br 또는 -I이고;
R3 는 수소, -F, -Cl, -Br, -I, C1-C3 알킬, C1-C3 알케닐, C1-C3 퍼플루오로알킬, -O-C1-C3-알킬, -O-C1-C3-알케닐, -CN으로 이루어지는 군에서 선택되며;
m 은 1, 2 또는 3이고;
p 는 0 또는 1이다.
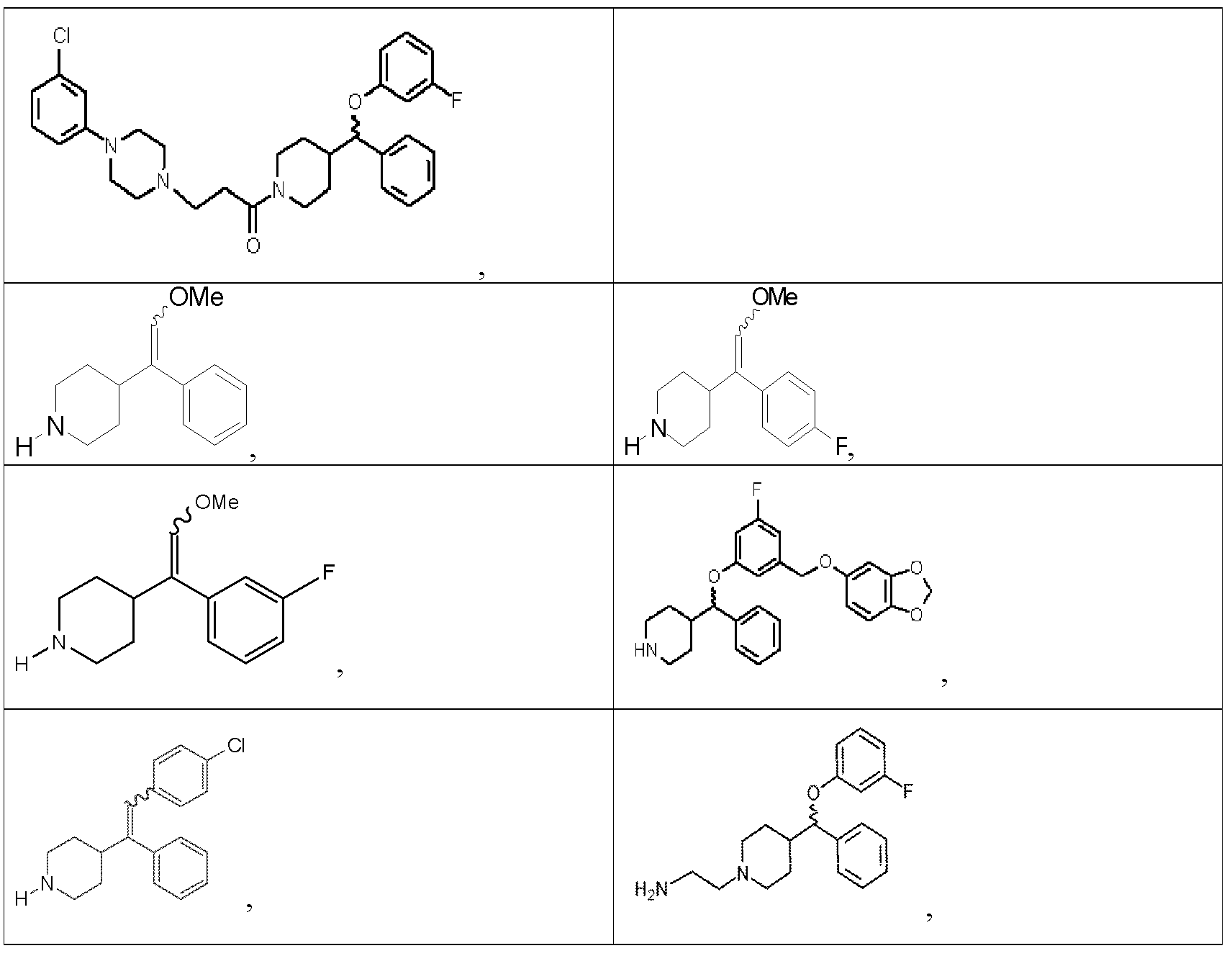
본 발명의 다른 측면은 하기의 화합물로 이루어진 군에서 선택되는 유도체 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물에 관한 것이다.
본 발명의 또 다른 측면은 상기 정의된 화학식 (II), (III), (IV), 또는 (V) 또는 상기 정의된 유도체 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물 및 적어도 하나의 약학적으로 수용가능한 담체를 포함하는 약학 조성물에 관한 것이다.
본 발명의 또 다른 측면은 의약으로서 사용되기 위한 상기 정의된 화학식 (II), (III), (IV), 또는 (V) 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물에 관한 것이다.
본 발명의 또 다른 측면은 아밀로이드 또는 타우 병리 또는 그 증상의 치료 또는 개선 방법에 사용되는 상기 정의된 화학식 (II), (III), (IV), 또는 (V) 의 화합물 또는 그 약학적으로 수용가능한 염, 입체화물 및/또는 용매화물에 관한 것이다.
발명의 상세한 설명
본 발명의 맥락에서 다음 용어들은 하기에 설명된 의미를 갖는다.
"C1 -6 알킬" 또는 "C1-C6-알킬"은 불포화기를 포함하지 않는 탄소와 수소 원자로 이루어진 직쇄 또는 분지 탄화수소쇄 라디칼을 의미하며, 단일 결합에 의해 분자의 나머지 부분에 결합되는 1 내지 6개, 바람직하게는 1 내지 3개의 탄소원자 ("C1-3 알킬" 또는 "C1-C3-알킬")를 가지고, 비제한적으로 예를 들면 메틸, 에틸, n-프로필, i-프로필, n-부틸 t-부틸, n-펜틸 등을 포함한다.
"시클로알킬"이라는 용어는 단일 결합에 의해 분자의 나머지 부분에 결합되는 3 내지 8, 바람직하게는 3 내지 6의 탄소 원자를 갖는 포화 또는 부분적으로 포화된 모노 또는 폴리시클릴 지방족기를 나타내며, 예를 들면 비제한적인 의미에서 시클로프로필, 시클로헥실, 시클로펜틸 등을 포함한다.
"아릴"이라는 용어는 탄소-탄소 결합에 의해 결합되거나 또는 융합된 1 또는 2개의 방향족 핵을 포함하고, 6 내지 10개, 바람직하게는 6 내지 8개를 갖는, 방향족기를 의미하며, 비제한적 의미에서 페닐, 나프틸, 디페닐, 인데닐 등을 포함한다. 바람직하게는 "아릴"은 페닐을 지칭한다.
"아릴 알킬"이라는 용어는 예를 들면 C6-C10-아릴-C1-C2-알킬과 같이 알킬기를 통해 분자의 나머지 부분에 결합된 아릴기를 나타낸다.
"퍼플루오로 알킬"이라는 용어는 모든 가능한 위치에 -F로 치환된 알킬기를 의미한다.
"C1 -6 알케닐" 또는 "C1-C6-알케닐"이라는 용어는 탄소와 수소 원자로 이루어지는 직쇄 또는 분지쇄 탄화수소쇄 라디칼을 나타내며, 적어도 하나의 불포화를 함유하고, 단일 결합에 의해 분자의 나머지 부분에 결합되는 1 내지 6개, 바람직하게는 1 내지 3개 ("C1 -3 알케닐" 또는 "C1-C3-알케닐")의 탄소원자를 가지며, 비제한적 의미에서 에틸렌, n-프로필렌 등을 포함한다.
"헤테로시클릴"이라는 용어는 안정한 3 내지 10원 고리 라디칼을 나타내며, 탄소 원자와, 질소, 산소, 황으로 이루어지는 군에서 선택되는 5개의 헤테로원자로 이루어지며, 부분적으로 또는 완전히 포화될 수 있다. 본 발명의 목적을 위해 헤테로시클릴은 모노시클릴, 바이시클릴 또는 트리시클릴 고리 시스템이 될 수 있으며, 융합된 고리 시스템을 포함할 수 있고, 헤테로 시클릴 라디칼 내의 질소, 탄소 또는 황 원자는 선택적으로 산화될 수도 있으며, 질소 원자는 선택적으로 4급화될 수 있다. 상기와 같은 헤테로시클릴의 예는 비제한적으로 피롤리딘, 피페리딘, 피페라진, 모르폴린, 테트라하이드로퓨란을 포함한다. 일 실시 형태에 의하면, 헤테로시클릴기는 5 또는 6원 환이다. 또 다른 실시 형태에 의하면, 헤테로시클릴기는 6 내지 10 개의 탄소 원자를 갖는다 (C6-C10).
"헤테로아릴" 이라는 용어는 안정한 5-원 또는 6-원 방향족 고리를 의미하며, 탄소 원자 및 질소, 산소 및 황으로 이루어진 군에서 선택되는 1 내지 5개의 헤테로원자로 이루어진다. 본 발명의 목적에서, 헤테로아릴은 모노시클릴, 비시클릴 또는 트리시클릴 고리 시스템일 수 있으며, 융합 고리의 시스템을 포함할 수 있으며, 헤테로아릴 라디칼 내의 질소, 탄소 또는 황 원자는 선택적으로 산화될 수 있고, 질소 원자는 선택적으로 4급화될 수 있다.
그와 같은 헤테로아릴의 예에는 비제한적으로 벤즈이미다졸, 벤조티아졸, 퓨란, 피롤, 피리딘, 피리미딘, 이소티아졸, 이미다졸, 인돌, 퓨린, 퀴놀린, 티아디아졸이 포함된다. 바람직하게는 "헤테로아릴"은 티오펜을 지칭한다.
"할로겐" 또는 "할로"라는 용어는 브로모, 클로로, 요오도 또는 플루오로를 지칭한다.
이 기술 분야에서 이해되는 바와 같이, 상기 정의된 라디칼에 대해서는 어느 정도의 치환이 존재할 수 있다. 따라서 본 발명의 모든 기들에 대해 치환이 있을 수 있다. 본 발명의 기들에서 치환된 기에 대한 참고 문헌들은 특정 라디칼은 하나 이상의 치환기에 의해 하나 이상의 이용가능한 위치에서 치환될 수 있음을 나타낸다. 상기 치환기들은 비제한적으로 C1 -6 알킬, 시클로알킬, 아릴, 헤테로시클릴, 헤테로아릴, 할로겐, 시아노, 니트로, 트리플루오로메틸, -N(Ra)(Rb), -ORc, -SRd, -C(O)Re, -C(O)ORf, -C(O)N(Rg)(Rh), -OC(O)Ri을 포함하며; 여기서 Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh 및 Ri 는 독립적으로 수소, C1-C6 알킬, 아릴, 헤테로시클릴, 헤테로아릴 및 트리플루오로메틸로부터 선택된다.
본 발명의 실시 형태에 의하면, A 는 -C(H)- 이고, B 는 -O- 이다.
본 발명의 실시 형태에 의하면, C 는 -F, -Cl, -Br, -I, C1-C3 알킬 (예를 들면 메틸), C1-C3 알케닐, C1-C3 퍼플루오로알킬, -O-C1-C3-알킬 (예를 들면 메톡시), -O-C1-C3-알케닐, -CN, C6-C10 아릴, C7-C10 아릴알킬로부터 독립적으로 선택되는 하나 이상의 기에 의해 선택적으로 치환되는 페닐기이고, 여기서 상기 C1-C3 알킬 및 상기 -O-C1-C3-알킬기의 알킬기는 -O-C6-C10 헤테로아릴기에 의해 치환될 수 있다. 다른 실시 형태에 의하면, C는 적어도 -F, -Cl, -Br 또는 -I, 더욱 구체적으로는 -F 또는 -Cl로 치환된 페닐기이다.
추가의 실시 형태에 의하면, C 는 화학식 (VII)의 페닐기이다.
여기서, 할로, R3 및 m은 상기에서 정의된 바와 같다.
본 발명의 일 실시 형태에 의하면, Ar은 페닐기이다. 본 발명의 일 실시 형태에 의하면, Ar은 -F, -Cl, Br 또는 -I에 의해 치환된 퓨란, 티오펜 및 페닐기다.
본 발명의 일 실시 형태에 의하면, n은 0이다.
본 발명의 일 실시 형태에 의하면, R1 은 수소이다.
또 다른 실시 형태에 의하면, R1 은 -NH2, -SH 또는 -OH 에 의해 치환된 C1-C6 알킬기이다.
또 다른 실시 형태에 의하면, R1 은 화학식 (VIII)의 기이다.
여기서, x, y 및 w 는 상기에 정의된 바와 같고, x, y 또는 w 중 적어도 하나는 0이 아니고, Q 는 플루오로, 클로로, 브로모, 요오도 및 O-C1-C6 알킬로 이루어지는 군에서 선택되는 하나 또는 두 개의 군에 의해 선택적으로 치환된 페닐기이거나 또는 Q는 고리 안에 두 개의 질소 원자 중 하나를 갖는 6-원 헤테로아릴기이다. 본 발명의 더욱 구체적인 실시 형태에 의하면 Q는 플루오로, 브로모, 요오도 및 메톡시로 이루어지는 군에서 선택되는 하나 또는 두 개의 기로 치환된 페닐기이다. 본 발명의 구체적인 실시 형태에 의하면, Q는 하나의 플루오로, 하나의 클로로 또는 하나의 메톡시에 의해 치환된 페닐기이다. 본 발명의 더욱 구체적인 실시 형태에 의하면, Q는 p-플루오로페닐, m-클로로페닐, p-클로로페닐 또는 o-메톡시페닐이다.
또 다른 실시 형태에 의하면, x, y 및 w 는 상기와 같이 정의되고, x, y 또는 w 중 적어도 하나는 0 이 아니고, Q 는 피페라지닐 또는 피리디닐, 바람직하게는 피페라진-2-일이다.
또 다른 실시 형태에 의하면, 피페리딘기는 3위치를 통해 분자의 나머지 부분에 결합된다. 또 다른 실시 형태에 의하면. 피페리딘기는 4위치를 통해 분자의 나머지 부분에 결합된다.
본 발명의 다른 실시 형태에 의하면, 화학식 (I)의 화합물은 바람직하게는 다음으로 이루어지는 군 또는 그 약학적으로 수용가능한 염, 입체 이성질체 및/또는 용매화물로부터 선택된다.
본 발명의 또 다른 실시 형태는 화합물 3의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
또 발명의 또 다른 실시 형태는 화합물 10의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 4의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 9(+)의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 5(-)의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 5(+)의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 31의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 41의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 34의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 29의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 37의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 40의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 27의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 24의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 32의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 18의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 36의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 35의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 또 다른 실시 형태는 화합물 21의 화합물 또는 그 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물이다.
본 발명의 일 실시 형태에 의하면, 화학식 (III)의 화합물에서 R5 는 메틸이다. 본 발명의 일 실시 형태에 의하면, 화학식 (III)의 화합물에서 R5 는 수소이다.
본 발명의 일 실시 형태에 의하면, 화학식 (III)의 화합물에서 R5 는 벤질이다.
본 발명의 일 실시형태에 의하면, 화학식 (II)의 화합물에서 R4 는 선택적으로 아미노기에 의해 치환된 C2-C4-알킬기이다.
본 발명의 일 실시형태에 의하면, 화학식 (III), (IV), 또는 (V)의 화합물에서 R3는 수소이다.
본 발명의 일 실시 형태에 의하면, 화학식 (V)의 화합물에서 "J"는 퓨란 또는 티오펜이다..
화학식 (I)의 화합물은 염의 형태일 수 있으며, 바람직하게는 약학적으로 수용가능한 염, 또는 용매화물의 형태일 수 있다. 수용자에게 투여될 때, 상기 염 또는 용매화물은 여기에 설명된 화합물을 (직접 또는 간접적으로) 제공할 수 있다. 그럼에도, 약학적으로 수용가능하지 않은 염 역시도 그들이 약학적으로 수용가능한 염의 제조에 유용할 수 있기 때문에 본 발명의 범위 내에 포함된다. 염은 본 기술 분야에서 공지된 방법으로 제조될 수 있다. "약학적으로 수용가능한"이란 바람직하게는 인간 또는 동물에게 투여될 때 생리학적으로 수용가능하고, 알러지 반응 또는 위장 질환, 현기증 등과 같은 유사한 바람직하지 않은 반응을 전형적으로 초래하지 않는 분자체 또는 조성물에 관한 것이다. "약학적으로 수용가능한"이란 용어는 연방 또는 주 정부의 규제 기관에 의해 승인되거나 또는 미국 약전 또는 동물 및 더욱 구체적으로는 인간에 대해 사용되기 위한 일반적으로 인정되는 약전에 포함되는 것을 의미한다.
본 발명에 의한 "용매화물"이라는 용어는 비-공유 결합을 통해 결합된 다른 분자 (아마도 극성 용매)를 갖는 본 발명에 의한 유효 화합물의 어떤 형태를 의미하는 것으로 이해된다. 용매화물은 수화물 및 예를 들면 메탄올화물과 같은 알콜화물을 포함한다. 바람직하게는, 용매화물은 약학적으로 수용가능한 용매화물이다.
염 및 용매화물의 제조는 본 기술 분야에서 공지된 방법으로 수행될 수 있다. 예를 들면, 여기서 제공되는 화합물의 약학적으로 수용가능한 염은 기본 부분을 함유하는 모화합물로부터 종래의 화학적 방법에 의해 합성된다. 일반적으로 그와 같은 염은 예를 들면 이들 화합물의 자유 염기 형태를 물 또는 유기 용매 또는 이들의 혼합물에서 적절한 염기 또는 산과 반응시켜 제조된다. 일반적으로 에테르, 에틸 아세테이트, 에탄올, 이소프로판올 또는 아세토니트릴과 같은 비수성 매체가 바람직하다. 산부가염의 예는 예를 들면 하이드로클로라이드, 하이드로브로마이드, 하이드로요오다이드, 설페이트, 니트레이트, 포스페이트의 모노- 및 디-염과 같은 무기산 부가염, 아세테이트, 말레에이트, 퓨마레이트, 시트레이트, 옥살레이트, 숙시네이트, 타르트레이트, 말레이트, 만델레이트, 메탄설포네이트 및 p-톨루엔술포네이트와 같은 유기산부가염을 포함한다. 바람직한 실시 형태에서, 염은 디클로로하이드레이트 염 또는 헤미설페이트염 또는 메탄설포네이트이다.
하나의 바람직한 약학적으로 수용가능한 형태는 결정형으로, 약학적 조성물에서 그와 같은 형태를 포함한다. 염과 용매화물의 경우, 부가적인 이온성 및 용매 부분 역시 반드시 비독성이어야 한다. 본 발명의 화합물은 서로 다른 결정다형일 수 있으며, 본 발명은 그와 같은 형태를 포함하는 것을 의도한다.
본 출원에서 "입체 이성질체"는 동일한 결합 순서에 의해 결합된 동일한 원자로 이루어지지만, 상호교환가능하지 않은 서로 다른 3차원 구조를 갖는 화합물을 나타내며, 주어진 화합물 또는 화학식의 에난티오머 및 부분 입체 이성질체를 포함한다.
본 발명의 화합물은 또한 하나 이상의 동위원소적으로 풍부화된 원자의 존재에서만 서로 다른 화합물을 포함하는 것을 의도한다. 예를 들면 수소가 중수소 또는 삼중수소에 의해 치환된 것을 제외하고는 본 발명의 구조를 갖는 화합물, 또는 탄소가 13C- 또는 14C- 풍부화된 탄소로 대체되거나 또는 질소가 15N- 풍부화된 질소로 치환된 화합물은 본 발명의 범위 내에 포함된다.
상술한 화학식 (Ⅰ)으로 나타내는 본 발명의 화합물은 키랄 중심의 존재에 따른 에난티오머 또는 다중 결합의 존재에 따른 이성질체 (예를 들면 Z, E)를 포함할 수 있다. 단일한 이성질체, 에난티오머 또는 부분 입체 이성질체 및 그들의 혼합물은 본 발명의 범위 내에 포함된다.
본 명세서의 맥락 내에서 "치료" 또는 "치료하다"라는 용어는 질병 또는 질병과 관련된 하나 이상의 증상을 예방, 개선 또는 제거하기 위해 본 발명에 의한 화합물 또는 제제를 투여하는 것을 의미한다. "치료"는 또한 질병의 생리학적 후유증의 예방, 개선 또는 제거 역시 포함한다.
본 발명의 맥락에서 "개선한다"는 용어는 치료되는 환자의 상황의 개선 - 주관적이거나 (환자의 기분에 의한) 또는 객관적인 (파라미터에 의해 측정) 개선을 의미하는 것을 이해된다.
약학 조성물
본 발명의 또 다른 측면은 상기 정의된 화학식 (II), (III), (IV), 또는 (V) 또는 그의 상기 정의된 유도체, 또는 약학적으로 수용가능한 염, 입체이성질체 및/또는 용매화물 및 적어도 하나의 약학적으로 수용가능한 담체를 포함하는 약학적 조성물이다.
"담체"라는 용어는 유효 성분과 함께 투여되는 희석제, 보조제, 부형제 또는 비히클을 지칭한다. 그와 같은 약학적 담체는 물 및 땅콩유, 대두유, 미네랄유, 참깨유 등과 같은 석유, 동물, 식물 또는 합성 기원의 오일을 포함하는 오일과 같은 살균 액체일 수 있다. 물 또는 수성용액, 생리 식염수 및 수성 덱스트로스 및 글리세롤 용액이 담체로서, 특히 주사가능한 용액으로서 바람직하게 사용된다. 적절한 약학적 담체는 E.W. Martin에 의한 "Remington's Pharmaceutical Sciences", 21st Edition, 2005에 기술된다. 바람직하게는 본 발명의 담체는 연방 또는 주 정부의 규제 기관에 의해 승인되거나 또는 미국 약전, 또는 동물 및 특히 인간에게 사용되는 것으로 일반적으로 인식되는 다른 약전에 열거된 것이다.
본 발명의 약학 조성물의 투여의 바람직한 약학적 형태를 제조하기 위해 필요한 담체 및 보조 성분은 다른 요소들 중에서도 선택된 투여의 약학적 형태에 의해 의존한다. 상기 약학 조성물의 투여의 약학적 형태는 본 기술 분야에서 숙련된 기술자에게 공지된 통상의 방법에 의해 제조될 수 있다. 다른 유효 성분의 투여 방법, 그들을 제조하기 위해 사용되고 처리되는 부형제에 대한 검토가 "Tratado de Farmacia Galenica", C. Fauli i Trillo, Luzan 5, S.A. de Ediciones, 1993 또는"Handbook of Pharmaceutical Excipients", Rowe C. R.; Paul J. S.; Marian E. Q., sixth Edition에서 이루어졌다.
약학적 조성물의 예는 경구, 국부 또는 비경구 투여를 위한 어떤 고체 (정제, 알약, 캡슐, 과립 등) 또는 액체 (용액, 서스펜션 또는 에멀전) 조성물도 포함한다.
바람직한 실시 형태에서, 약학 조성물은 경구 형태이다. 경구 투여를 위한 적절한 복용 형태는 정제 및 캡슐이고, 이 기술 분야에서 공지된 종래의 부형제, 예를 들면 시럽, 아카시아, 젤라틴, 솔비톨, 트라칸트 또는 폴리비닐피롤리돈과 같은 결합제; 락토스, 슈가, 옥수수전분, 칼슘 포스페이트, 솔비톨 또는 글리신과 같은 충전제; 마그네슘 스테아레이트와 같은 정제화 윤활제; 전분, 폴리비닐피롤리돈, 소듐 전분 글리콜레이트 또는 미소결정 셀룰로오스와 같은 붕해제; 또는 소듐 라우릴 설페이트와 같은 약학적으로 수용가능한 습윤제를 포함할 수 있다.
고형 경구 조성물은 혼합, 충전 또는 정제화의 종래의 방법으로 제조될 수 있다. 대량의 충전제를 사용하는 조성물 전체에 걸쳐 유효 성분을 분재시키기 위해 반복된 혼합 조작이 사용될 수 있다. 그와 같은 조작은 이 기술 분야에서 통상적이다. 정제는 예를 들면 건조 과립화 또는 습윤 과립화 및 선택적으로 통상의 약학 제조에서 잘 알려진 방법에 의한 코팅에 의해 제조될 수 있고, 특히 장용성 코팅될 수 있다.
약학적 조성물은 적절한 단위 투여 형태의 소독액, 서스펜션 또는 동결건조 제품과 같이 비경구 투여 형태로 될 수 있다. 벌킹제, 버퍼링제 또는 계면활성제와 같은 적절한 부형제가 사용될 수 있다.
언급된 제제는 스페인 및 미국 약전 그리고 유사한 참고 문헌에 기술되거나 언급된 표준 방법을 사용하여 제조될 수 있다.
본 발명의 화합물 또는 조성물은 정맥 내 주입, 경구 제제 및 복강 내 및 정맥 내 투여와 같은 적절한 방법에 의해 투여될 수 있다. 환자의 편리성과 치료 질병의 만성 특성으로 인해 경구 투여가 바람직하다.
본 발명의 화합물의 일반적인 유효 투여량은 선택된 화합물의 상대적 유효성, 치료될 질병의 중증도 및 환자의 체중에 따른다. 그러나 유효 화합물은 전형적으로 하루에 일 회 또는 그 이상, 예를 들면 하루에 1, 2, 3 또는 4회, 전형적인 일일 전체 복용량으로 0.01 내지 1000mg/kg/일의 범위로 투여될 수 있다.
실시예
화학식 (II), (III), (IV), 또는 (V)의 화합물을 포함하는 본 발명의 화합물은 N°9802420, EP1002794 A1, US 6,518,284, 또는 PCT/EP2007/053582에 기재된 일반적인 방법에 따라 제조될 수 있다.
화학식 (V)의 화합물 또는 관련된 화합물은 또한 대응하는 케톤을 Me3S(O)I 또는 MeOCH2PPh3 (P.J.Gilligan et al J. Med. Chem. 1992, 35, 23, 4349)로 처리하고 환원함으로써 하기의 스킴 1에 따라 제조할 수 있다.
스킴 1
또 다른 대표적인 실시예가 하기에 주어진다.
실시예
1
(+/-)-4-[(나프탈렌-1-
옥시
)(4-
클로로페닐
)
메틸
]피페리딘
헤미설페이트
화합물 31의 제조
다음 방법은 J. Med. Chem. 2003, Vol 46, 25, 5512-5532에 기술된 화합물 15au의 제조방법과 유사하다.
Med Chem 2003, vol 46, 25, 5512-5532의 화합물 14b (1.6 g, 4.8 mmol)를 무수 DMSO 10mL의 헥산 세정된 NaH (0.2g, 60% 오일 분산)의 교반된 서스펜션에 일정 비율씩 부가한다. 반응액을 실온에서 30분간 교반하고, 포타슘 벤조에이트 (0.7g)을 부가하고, 반응 혼합물을 15시간 동안 85℃로 가열한 다음 실온으로 냉각시켰다. 물과 염수의 혼합물을 부가하고, 디에틸에테르로 오일을 추출하였다. 유기층을 진공 하에 농축하고, 메탄올 (35 Ml) 및 10% 염산 수용액 (30mL)으로 15시간 동안 환류 교반하였다. 용매 제거 후에, 잔여물을 10% 염산 수용액과 CHCl3로 분리하였다. 수성 산 용액을 pH > 9 가 될 때까지 5% NaOH 수용액으로 처리하고 분리된 오일은 CHCl3로 추출하고, 무수 Na2SO4 상에서 건조, 여과하고, 감압 하에 용매 제거하여 호박색 오일을 수득했다. 조 생성물을 물 (20mL)과 H2SO4 (0.4 mL) 용액으로 30분간 교반하였다. 형성된 옅은 갈색의 고체를 여과하고 물로 세정하여 표제 화합물 1.2g (수율:67%)를 얻었다.
실시예
2
(+/-)-4-[3-
플루오로
-5-[(3,4-
메틸렌디옥시
)
페녹시
]
메틸
]
페녹시
]
메틸
]
피레
리딘
하이드로클로라이드
화합물 32의 제조
아세토니트릴 (50mL)의 3,4-(메틸렌)디옥시페놀 (세사몰 또는 5-벤조디옥솔올) (3.4 g, 25 mmol) 용액에 무수 K2CO3 (4.2 g)을 부가하고, 3,5-디플루오로벤질 브로마이드 (4.2 g, 25.0 mmol)를 부가하였다. 혼합물을 6시간 동안 환류하고, 실온으로 냉각하고, 감압 하에 용매를 제거하였다. 5% NaOH 수용액을 잔류물에 부가하고 혼합물을 CH2Cl2로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조, 여과하고 진공에서 농축하여 옅은 황색 고체로서 1-[(3,4-메틸렌디옥시)페녹시]메틸-3,5-디플루오로벤젠을 얻었다 (mp 53-56 ℃, 수율: 78 %).
J. Med. Chem. 2003, vol 46, 25, 5512-5532의 화합물 14j (2.0 g, 10.5 mmol)를 일정 비율로 20mL 무수 DMSO의 헥산 NaH (0.6 g, 60% 오일 분산)의 교반 서스펜션에 일정 비율씩 부가하였다. 반응물을 실온에서 1시간 동안 교반하고, 포타슘 벤조에이트 (0.2 g)를 부가하고, 30분간 교반을 계속하였다. 20mL 무수 DMSO의 1-[(3,4-메틸렌디옥시)페녹시]메틸-3,5-디플루오로젠젠 (3.0 g, 11.4 mmol) 용액을 부가하고, 반응 혼합물을 실온에서 20시간 동안 교반하고, 물과 10% 염산 수용액으로 처리하고, CHCl3로 처리하였다. 유기층을 10% NaOH 수용액으로 세정하고 무수 Na2SO4 상에서 건조하고, 여과하고 진공하에 농축하여 호박색 오일 (2.9g, 수율: 70 %)을 얻었고, 이것을 디에틸 에테르 내의 포화 염산 수용액으로 30분간 교반하여 표제 화합물을 옅은 갈색 고체로서 얻었다 (mp 55℃ (d)).
실시예
3
(+/-)-4-[(3-
플루오로페녹시
)(2-
티오페닐
)
메틸
]피페리딘
옥살레이트
화합물 39의 제조
85% 인산 (2mL) 및 티오펜 (4mL)의 혼합물에 1-아세틸-피페리딘-4-카르복실산 (4.3 g, 26.0 mmol)을 부가하였다. 반응 혼합물을 트리플루오로아세트산 무수물 (15mL, 발열 반응이 관측됨)으로 한 방울씩 처리하고, 4시간 동안 80-90℃로 가열하였다. 반응을 실온으로 냉각하고, 물과 CHCl3을 분리하였다. 유기층을 10% NaOH 수용액으로 세정하고, 무수 Na2SO4 상에서 건조하고, 여과하고, 감압 하에 용매를 제거하여 옅은 노란색 고체로서 (1-아세틸피페리딘-4-일)(2-티오페닐)메탄온을 얻었다 (6.2 g, 수율: 98 %, mp 112-116 ℃).
(1-아세틸피페리딘-4-일)(2-티오페닐)메탄온 (6.1 g, 26.0 mmol)과 메탄올 (50 mL)의 혼합물을 물 (5mL)의 NaBH4 (0.7 g)의 용액으로 한 방울씩 처리하였다. 반응 혼합물을 3시간 동안 60℃로 가열하고, 실온으로 냉각한 다음 350mL의 물로 처리하고, CHCl3로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조하고, 여과하고 감압 하에 농축하여 옅은 노란색 고체로서 (+/-)-(1-아세틸피페리딘-4-일)(2-티오페닐)메탄올을 얻었다 (5.6 g, 수율: 93 %).
(+/-)-(1-아세틸피페리딘-4-일)(2-티오페닐)메탄올 (3.5 g, 17.8 mmol)을 30mL의 무수 DMSO의 헥산 세정된 NaH (1.1g, 60% 오일 분산)의 교반된 서스펜션에 부가하였다. 반응물을 30분간 실온에서 교반하고, 포타슘 벤조에이트 (0.3 g)를 부가하고 30분간 교반을 계속하였다. 1,3-디플루오로벤젠 (2.2 mL)을 부가하고 반응 혼합물을 20시간 동안 실온에서 교반하였다. 그리고, 반응 혼합물을 물과 10% 염산 수용액으로 처리하고 CHCl3로 추출하였다. 유기층을 5% NaOH 수용액으로 세정하고 무수 Na2SO4 상에서 건조, 여과하고, 진공에서 농축하여 호박색 오일을 얻었다 (4.0 g, 수율: 77 %). 조 생성물 (2.0 g)을 5 mL의 에탄올에 용해하고 옥살산 (0.9 g, 6.8 mmol)을 가하였다. 얻어진 용액을 진공에서 농축하여 옅은 노란색 고체를 얻었고, 이것을 디옥산 (40 mL)에서 결정화하여 표제 화합물의 무색 결정을 얻었다 (2.2 g, 수율: 85 %, mp 142-143 ℃).
실시예
4
(+/-)-3-[4-(3-
클로로페닐
)피페라진-1-일]-1-[4-[(3-
플루오로페녹시
)
페닐메
틸]피페리딘-1-일]
프로판온
하이드로클로라이드
화합물 28의 제조
J. Med. Chem. 2003, vol 46, 25, 5512-5532 의 화합물 15j (3.0 g, 10.5 mmol)의 디클로로메탄 (10 mL) 용액을 0-5 ℃로 냉각하고, 디클로로메탄 (4mL)의 3-클로로프로피오닐 클로라이드 (1.5 mL, 15 mmol) 용액을 한 방울씩 가하였다. 반응 혼합물을 20시간 동안 실온에서 교반하고, 5% NaOH 수용액으로 세정하였다. 유기층을 무수 Na2SO4 상에서 건조, 여과하고 감압하에서 옅은 노란색 오일 (3.65 g)을 얻었다. 조 생성물의 시료(1.9 g)을 실리카겔 상에서 플래쉬 크래마토그래피 (EtOAc:헥산 6/4)으로 정제하여 (+/-)- 3-클로로-1-[4-[(3-플루오로페녹시)페닐메틸]피페리딘-1-일]프로판온을 얻었다.
아세토니트릴 (35 mL)의 (+/-)- 3-클로로-1-[4-[(3-플로오로페녹시)페닐메틸]피페리딘-1-일]프로판온 (1.7 g, 4.6 mmol) 용액 무수 K2CO3 (0.9 g), KI (10 mg) 및 1-(3-클로로페닐)피페라진 (1.0 g, 5.2 mmol)에 부가하였다. 혼합물을 24시간 동안 85℃로 가열하고 실온으로 냉각한 다음 감압 하에 용매를 제거하였다. 잔류물에 물을 가하고 혼합물을 CHCl3로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조하고, 여과하고 진공 하에 농축하고 잔류물을 실리카 겔 상에서 플래쉬 크로마토그래피 (CHCl3/메탄올/이소프로필아민 95/5/5)으로 정제하여 (+/-)-3-[4-(3-클로로페닐)피페라진-1-일]-1-[4-[(3-플루오로페녹시)페닐메틸]피페리딘-1-일]프로판온을 오일로서 얻고, 이것을 디에틸 에테르의 염산 포화 용액으로 처리하여 옅은 갈색 고체로서 표제 화합물을 얻었다 (0.75 g, mp 150-152 ℃).
실시예
5
(+/-)-4-[(3-
플루오로페녹시
)
페닐메틸
]피페리딘-1-일]
에틸아민
옥살레이트
화합물 37의 제조
J. Med. Chem. 2003, vol 46, 25, 5512-5532 의 화합물 15j (2.9 g, 10.3 mmol)와 무수 K2CO3 (6 g), 2-(2-브로모에틸)-1,3(2H)-이소인돌디온(3.2 g, 13 mmol) 및 디옥산 (40 mL)의 혼합물을 24시간 동안 115℃로 가열한다. 반응 혼합물을 실온으로 냉각하고 감압 하에 용매를 제거한다. 잔류물에 물을 가하고, 3.5% 염산 수용액으로 pH를 7.5로 조정하였다. 혼합물을 CHCl3로 추출하고, 유기층을 무수 Na2SO4 상에서 건조, 여과하고 진공에서 농축하여 얻어진 잔류물을 실리카겔 상에서 플래쉬 크로마토그래피 (EtOAc/헥산 8/2)로 정제하여 오렌지색 오일로서 (+/-)-2-[2-[4-[(3-플루오로페녹시)페닐메틸]피페리딘-1-일]에틸]-1H-이소인돌-1,3(2H)-디온을 얻었다 (2.8 g, 수율: 60 %).
70mL 에탄올의 (+/-)-2-[2-[4-[(3-플루오로페녹시)페닐메틸]피페리딘-1-일]에틸]-1H-이소인돌-1,3(2H)-디온 (2.5 g)을 히드라진 하이드레이트 (98 %, 2 mL)에 가하고 백색 고체가 관찰되었다. 실온에서 20시간 후에 백색 고체를 여과하고 5% NaOH 수용액으로 세정하였다. 여과물을 감압 하에 농축하여 옅은 황색 오일을 얻었다. 조 생성물의 시료 (0.8g)을 5mL 에탄올에 녹이고 옥살산 (0.3g, 2.4mmol)을 가하였다. 옅은 갈색 고체를 얻었고, 여과 후 디에틸 에테르로 세정하여 표제 화합물 0.9g을 얻었다 (mp 108℃ (d).
실시예
6
(Z)-4-[(1-
페닐
)-2-(4-
클로로페닐
)
에텐
-1-일]피페리딘 화합물 36의 제조
NaHCO3 (173 g)와 물 (1.5 L)의 혼합물을 J. Med. Chem. 2003, vol 46, 25, 5512-5532의 화합물 11a (119.3 g, 0.63 mol)에 부가하였다. 반응물을 15분 간 실온에서 교반하고 (Boc)2O 를 가하였다. 실온에서 15시간 동안 교반한 후, 백체 고체를 여과하고 물로 세정하여 4-벤조일-1-[(1,1-디메틸에틸옥시)카보닐]피페리딘 164g을 얻었다 (수율: 90 %, mp 91-93 ℃). 무수 디에틸 에테르 (40mL)의 마그네슘 터닝스 (1.0g)의 서스펜션을 제조하여 무수 디에틸에테르 (40mL)의 4-클로로벤질 클로라이드 (4.6 g, 27.0 mmol) 용액의 1/3과 요오드 결정으로 처리하였다. 혼합물을 원활한 환류가 관찰되고 색깔이 사라질 때까지 가열한다. 4-클로로벤질 클로라이드 용액의 나머지를 가하였다. 환류를 3.5시간 동안 계속하고 반응 혼합물을 실온으로 냉각하였다. 무수 디에틸에테르 (50 mL)의 4-벤조일-1-[(1,1-디메틸에틸옥시) 카보닐]피페리딘 (6.4 g, 22.4 mmol) 용액을 한 반울씩 가하고, 반응을 3시간 동안 환류시켰다. 포화 NH4Cl 수용액 (50 mL)을 가하고, 디에틸에테르를 증발시키고, 혼합물을 CHCl3로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조하고, 여과한 다음 진공에서 농축하여 얻은 노란색 고체를 헥산으로 세정하였다. 이 고체를 클로로포름 (100 mL)에 녹이고, 트리플루오로아세트산 (8 mL)으로 처리하고 15시간 동안 환류하였다. 반응 혼합물을 실온으로 냉각하고 10% NaOH 수용액으로 처리한 다음 클로로포름으로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조시키고, 여과한 다음 감압 하에 증발시켜 E/Z 이성질체 혼합물을 얻었다. 실리카겔 상에서의 플래쉬 크로마토그래피 (디에틸 에테르: 이소프로필아민 10/0.5)에 의해 1.6g의 표제 화합물의 Z 이성질체를 얻었다 (수율: 22 %, mp 121-124 ℃).
실시예
7
(E,Z)-4-(1-
페닐
-2-
메톡시비닐
)피페리딘
하이드로클로라이드
화합물 30의 제조
J. Med. Chem. 2003, vol 46, 25, 5512-5532 의 화합물 11a (1.0 g, 5.3 mmol), 물 (20 mL) 및 소듐 아세테이트 (4 g)의 혼합물을 메톡시아민 하이드로클로라이드 (3.0 g)에 가하였다. 반응 혼합물을 3시간 동안 80℃로 가열하고 실온으로 냉각한 다음 pH > 9가 될 때까지 10% KOH 수용액으로 처리하고 클로로포름으로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조하고, 여과한 다음 감압 하에 증발시켜 오일을 얻었고, 이것을 디에틸 에테르의 HCl 포화 용액으로 처리하여 표제 화합물의 E/Z 이성질체의 혼합물을 얻었다 (1.1 g, mp 202-204 ℃).
실시예
8
(E,Z)-4-[1-(4-
플루오로페닐
)-2-
메톡시비닐
]피페리딘
하이드로클로라이드
화합물 23의 제조
J. Med. Chem. 2003, vol 46, 25, 5512-5532)의 화합물 11c (0.5 g), 물 (10 mL) 및 소듐 아세테이트 (4 g)의 혼합물을 메톡시아민 하이드로클로라이드 (2.0 g)에 가하였다. 반응 혼합물을 2시간 동안 80℃로 가열하고 실온으로 냉각한 다음 10% NaOH 수용액으로 pH > 9가 될 때까지 처리하고 클로로포름으로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조하고 여과하고 감압 하에 증발시켜 오일을 얻었으며, 이것을 디에틸 에테르의 HCl 포화 용액으로 처리하여 표제 화합물의 E/Z 이성질체 혼합물을 백색 고체로서 얻었다 (0.6 g, mp 201-206 ℃).
실시예
9
(+/-)-4-[2-(4-
플루오로페녹시
)-1-
페닐에틸
]피페리딘 화합물 59의 제조
THF (50 mL) 내의 2-페닐-2-피페리딘-4-일에탄올 (2.6 g, 10.5 mmol) 화합물의 용액을 트리페닐포스핀 (2.7 g, 10.5 mmol)과 4-플루오로페놀 (1.3 g, 11.9 mmol)로 처리하였다. 그 다음, THF (10 mL)의 DEAD (1.7 mL) 용액을 한 방울씩 가하였다. 반응 혼합물을 실온에서 15시간 동안 교반하고 용매를 감압 하에 제거하였다. 5 % NaOH 수용액을 잔류물에 가하고 혼합물을 CH2Cl2로 추출하였다. 유기층을 무수 Na2SO4 상에서 건조하고 여과한 다음 진공에서 농축하여 얻은 잔류물을 환류 하에 메탄올 (20 mL) 및 10% HCl 수용액 (60 mL)으로 8시간 동안 처리하였다. 반응 혼합물을 실온으로 냉각되도록 한 다음 물 (100 mL)로 처리하고, CH2Cl2로 추출하였다. 유기층을 5% NaOH 수용액으로 세정하고, 무수 Na2SO4 상에서 건조하고 여과한 다음 진공에서 농축하여 얻은 잔류물을 실리카겔 상에서 플래쉬 크로마토그래피 (클로로포름/이소프로필아민 9/0.2)에 의해 정제하여 노란색 오일로서 (+/-)-4-[2-(4-플루오로페녹시)-1-페닐에틸]피페리딘을 얻었다 (2.0 g, 수율: 63%).
생물학적 검사
일차 세포배양
a) - 마우스 대뇌 피질 뉴론: 16-18 일령의 배로부터 얻은 뇌를 두 개의 반구, 후각신경구와 뇌간으로 분리하였다. 뇌척수막을 제거하고 절단된 조직을 50 ml 플라스크로 옮겼다. Ca, Mg (페놀레드 없음)가 없는 10 HBSS를 가하였다. 3ml HBSS 로 두 번 세정하고 37℃에서 트립신-DNase로 소화시켰다. 서스펜션을 서로 다른 지름의 유리 피펫을 통과시켜 분해하였다. 세포를 절단하고 둘베코 변형 이글 배지 (DMEM) + 10% FCS에서 배양하였다. 3시간 후 최종 배지를 뉴로바살 배지 + B27 보충제 + KCl + 글루타민 + 항생제에 위치시켰다.
b) CGN: 야생형 또는 유전자변형 마우스로부터 유래하는 소뇌 과립 뉴론을 6일령의 마우스로부터 얻었다. 기본 절차는 이전 것과 유사하다: 조직의 입수 및 분리는 유사하고, 배양 및 최종 배지에서의 유지는 동일하다. 소뇌를 트립신-EDTA로 15-20분간 처리하여 분해하고 이어서 혈청 없는 배지, 뉴로바살 배지 + B27 보충제 + KCl + 글루타민 + 항생제의 배지에서 유지하였다.
독성 및 세포 생존가능성
본 화합물의 존재 하에 서로 다른 스트레인의 세포 생존가능성이 연구되었다. 따라서 세포 생존 가능성은:
- 화합물 3, 화합물 10, 화합물 4, 화합물 9(+), 화합물 41, 화합물 34, 화합물 35, 화합물 29, 화합물 36, 화합물 31 및 화합물 37의 화합물과 CGN의 일차 배양에서, 마지막 두 가지가 특정 농도에서 약간 독성을 가졌다.
- 화합물, 3, 화합물 10 및 화합물 4 화합물의 CHO-APP-PS1 세포주와의 배양에서 이들 중 어느 것도 통계적으로 관련 있는 독성 레벨을 나타내지 않았다.
- 화합물 3, 화합물 10, 화합물 4, 화합물 5(+) 및 화합물 5(-)와 Tg-APP-PS1 마우스로부터 유래하는 뉴론의 일차 배양에서 후자가 어떤 농도에서만 독성을 나타내었다.
독성 검사에서, 세포 (뉴론 또는 확립된 세포주)를 24-웰 플레이트에 파종하고 1차 뉴론이 사용될 때의 둘베코 변형 이글 배지 (DMEM) + 10% FCS 또는 뉴로바잘 배지 + B27 보충제 + KCl + 글루타민 + 항생제에서 서로 다른 농도의 약품에 노출시켰다. 처리는 세포를 4% 파라포름알데히드로 30분간 고정함으로써 24 시간 또는 48시간 후에 중단되었다. 고정된 세포는 주변 온도에서 1시간 동안 10% 아세트산/40% 메탄올에서 0.2% 쿠마쉬 브릴리언트 블루 R-250으로 염색되었다. 염색된 세포를 증류수로 철저히 세정하고, 건조한 다음 포함되어 있는 염료를 50% 메탄올에서 0.1N NaOH로 추출하였다. 그 다음 10% 트리클로로아세트산으로 산성화하고 세포 수를 595nm의 흡광도로 엘리사 판독기로 측정하였다. DMSO (10㎕/웰)를 대조군으로서 사용하였다.
아밀로이드
펩타이드의
방출 측정
APP-PS1로 안정하게 형질주입된 차이니즈 햄스터 난소 (CHO) 세포주를 사용하였다: 10% 비활성화된 소 태아 혈청, 글루타민 (2mM) 및 항생제 (페니실린/스트렙토마이신)과 G-418 항생제 (200/ml)의 혼합물과 함께 둘베코 변형 이글 배지 (DMEM)에서 유지되었다. 세포는 연속 성장에서 유지되고 검사할 약품을 가하기 전에 새로운 배지가 대체되었다. 다른 처리에서 배양 배지가 수집된 후에는 항상 해당 용매 대조군을 취하였다. 배지는 6시간 동안 수집되었고, 5번 희석되고, 바이오소스 ELISA 키트 (h 1-140 β-아밀로이드 -Ref # KHB3482) 를 이용하여 중복 분석되었다.
APP-PS1 유전자변형 마우스로부터 유래하는 소뇌의 일차 배양에 대해, 절차는 이 종류의 배양에 대응하는 배양 배지 (NB-B27)과 화합물이 부가되거나 되지 않은 후 24시간 후에 배지가 수집되는 점을 제외하고는 유사하다. 최종 데이터는 밀리미터당 분비된 베타 아밀로이드의 농도에서 최종 데이터를 발현하는 키트의 베타 아밀로이드 표준 커브에서 내삽하여 얻었다.
실시예
10: 소뇌 과립
뉴론
(
CGN
) 및/또는 마우스 (야생 스트레인)으로부터 유래하는 대뇌 피질의 일차 배양에서
타우인산화
조정 능력
타우 인산화 수준을 조정하는 능력에 대한 연구에 기초하여, 화합물 3, 화합물 10, 화합물 4, 화합물 9(+)의 화합물은 타우 인산화를 조정할 수 있다고 결론지을 수 있다. 또한 5(-), 화합물 5(+), 화합물 31, 화합물 41, 화합물 34, 화합물 29, 화합물 37, 화합물 40, 화합물 27, 화합물 24, 화합물 32, 화합물 18, 화합물 36, 화합물 35 및 화합물 21 역시 타우 인산화를 5 및/또는 10 마이크로몰에서 조정할 수 있다.
데이터는 지시된 화합물로 처리된 소뇌 과립 뉴론 또는 대뇌 피질 뉴론으로부터 얻은 용해가능한 세포 추출물의 타우-1의 상대적 수준의 3개의 독립된 시험의 평균값에 대해 얻어졌다. 결과는 도 1에 도시된다.
래트의 대뇌피질 뉴론 또는 소뇌 과립 뉴론에서 타우 인산화의 조정 능력은 1, 2, 및 3 배양 시간 후에 일련의 포스포 에피토프 (타우 1, PHF1)에서 특정 항체를 이용하여 웨스턴 블럿을 통해 분석되었다. 액틴이 기준으로서 사용되었다 (전체 질량을 나타냄).
실시예
11:
CHO
-
APP
-
PS1
유전자 변형 세포주의 아밀로이드
펩틴
(β1-40)의 분비 수준을 조정하는 능력
측정은 배양 배지에서 분비된 ng/ml에서 행해지고, 각각의 경우 100%로 간주되는 용매인 대조군에 대해 정규화되었다. 5-6 실험에서 얻어진 데이터는 n=3인 화합물 9(+)을 제외하고는 분석 당 2회를 나타낸다. 결과는 도 2 (화합물 3), 도 3 (화합물 10), 도 4 (화합물 9(+)) 및 도 5 (화합물 4)에 도시된다.
실시예
12:
APP
-
PS1
유전자변형된 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서
펩타이드
β1-40의 분비 수준을 조정하는 능력
화합물들은 24시간과 48시간에서 두 번 및 2μM 및 5μM의 두 번의 농도에서 초기 검사되었다. 데이터는 24시간에서 행해진 세 번의 서로 다른 실험의 평균값을 나타낸다. 결과는 도 6 (화합물 3, 화합물 10 및 화합물 4), 도 7 (화합물 9 (+)), 도 8 (화합물 31 및 화합물 41), 도 9 (화합물 34, 화합물 29 및 화합물 37), 도 10 (화합물 2, 화합물 36 및 화합물 35) 및 도 11 (화합물 5(-) 및 화합물 5(+))에 도시된다.
명세서 전반에 걸쳐 "화합물" 및 "Comp"는 상호 변화, 대체가능하고 동일한 의미를 갖는다.
도 1: 지시된 화합물들로 처리된 소뇌 과립 뉴런으로부터 얻은 용해가능한 세포 추출물의 상대적 타우-1 레벨의 3회의 독립적 실험의 평균값으로서의 타우 인산화. 화합물 6은 기준 화합물이다.
도 2: 화합물 3의 유전자변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 3: 화합물 10의 유전자 변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 4: 화합물 9(+)의 유전자 변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 5: 화합물 4의 유전자 변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 6: 화합물 3, 화합물 10 및 화합물 4의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 7: 화합물 9(+)의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 8: 화합물 31 및 화합물 41의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 9: 화합물 34, 화합물 29 및 화합물 37의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 10: 화합물 2, 화합물 36 및 화합물 35의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 11: 화합물 5(-) 및 화합물 5(+)의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 2: 화합물 3의 유전자변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 3: 화합물 10의 유전자 변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 4: 화합물 9(+)의 유전자 변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 5: 화합물 4의 유전자 변형 세포주 CHO-APP-PS1의 아밀로이드 펩타이드 (β1-40)의 분비 수준 변형 능력.
도 6: 화합물 3, 화합물 10 및 화합물 4의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 7: 화합물 9(+)의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 8: 화합물 31 및 화합물 41의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 9: 화합물 34, 화합물 29 및 화합물 37의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 10: 화합물 2, 화합물 36 및 화합물 35의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
도 11: 화합물 5(-) 및 화합물 5(+)의 Tg-APP-PS1 유전자 변형 마우스로부터 유래하는 소뇌 뉴런의 일차 배양에서 펩타이드 β1-40의 분비 수준 변형 능력.
Claims (15)
- 아밀로이드 또는 타우 병리 또는 그 증상을 치료 또는 개선시키기 위한 방법에 사용하기 위한 화학식 (Ⅰ)의 화합물 또는 그 약학적으로 수용가능한 염, 입체 이성질체 및/또는 용매화물.
여기서, R1 은 수소 또는 -(CH2)w-(C=O)y-(CH2)x-R2로 이루어지는 군에서 선택되며, R2 는 -NH2, -SH, -OH 또는 C3-C8 시클로알킬에 의해 선택적으로 치환된 C1-C6 알킬기이거나, 또는 R2 는 치환 또는 비치환된 페닐, 또는 치환 또는 비치환된 5 또는 6원 헤테로아릴기에 의해 선택적으로 치환된 헤테로시클릴기이고; w 는 0, 1, 2, 또는 3으로부터 선택되는 정수이며; x 는 0, 1, 2 또는 3으로부터 선택되는 정수이고; y 는 0 또는 1이며;
Ar 은 선택적으로 치환된 페닐 또는 선택적으로 치환된 5 또는 6원 헤테로아릴기이고;
A 가 -C(H)- 일 때; B 는 -(CH2)-O-, -(CH2)-S-, -O- 또는 -S-이고; 및 C 는 선택적으로 치환된 페닐, 선택적으로 치환된 벤질 또는 선택적으로 치환된 나프틸기이거나; 또는
A 가 -C(=)-일 때; B 는 =C(H)-이고; C 는 -OH, -O(C1-C3-알킬) 및 -O(C7-C10-아릴알킬)로 이루어지는 군에서 선택되거나, 또는 선택적으로 치환된 페닐 또는 선택적으로 치환된 나프틸기이고; 및
n은 0, 1 또는 2로부터 선택되는 정수이다. - 제1항에 있어서, A는 -C(H)- 이고 B는 -O-인 화합물
- 선행하는 청구항들 중 어느 하나에 있어서, C는 -F, -Cl, -Br, -I, C1-C3 알킬, C1-C3 알케닐, C1-C3 퍼플루오로알킬, -O-C1-C3-알킬, -O-C1-C3-알케닐, -CN, C6-C10 아릴 또는 C7-C10 아릴알킬로부터 독립적으로 선택되는 하나 이상의 기에 의해 선택적으로 치환되는 페닐기이며, 상기 C1-C3 알킬 및 상기 O-C1-C3-알킬기의 알킬기는 C6-C10 헤테로아릴기에 의해 치환될 수 있는 것인 화합물.
- 선행하는 청구항들 중 어느 하나의 항에 있어서, Ar은 페닐기인 것인 화합물.
- 제1항 내지 제3항 중 어느 하나의 항에 있어서, Ar은 -F, -Cl, -Br 또는 -I 에 의해 치환된 퓨란, 티오펜 및 페닐로 이루어지는 군에서 선택되는 것인 화합물.
- 선행하는 청구항들 중 어느 하나의 항에 있어서, n은 0인 것인 화합물.
- 선행하는 청구항들 중 어느 하나의 항에 있어서, R1 은 수소인 것인 화합물.
- 화학식 (II), 화학식 (III), 화학식 (IV) 또는 화학식 (V) 의 화합물 또는 그 약학적으로 수용가능한 염, 입체 이성질체 및/또는 용매화물.
여기서, 각각의 경우에서 적절하게,
R1 은 선행 청구항들에서 정의된 바와 같으며, 바람직하게는 R1 은 수소 또는 선택적으로 -NH2, -SH, -OH 또는 C3-C8 시클로알킬기로 치환된 C1-C6 알킬기이고;
Ar 은 선택적으로 치환된 페닐 또는 선택적으로 치환된 5- 또는 6-원 헤테로시클릴기이고;
R4 은 -(CH2)w-(C=O)y-(CH2)x-R2 이고, 여기서 R2 는 치환 또는 비치환 페닐기 또는 치환 또는 비치환 5 또는 6-원 헤테로아릴기로 선택적으로 치환된 헤테로시클릴기이고; w는 0, 1, 2 또는 3으로부터 선택되는 정수이며; x는 0, 1, 2 또는 3으로부터 선택되는 정수이고, y는 0 또는 1이고;
R5 는 수소, C1-C6 알킬, C7-C10-아릴알킬 및 C6-C10-아릴기로 이루어지는 군에서 선택되고;
J 는 벤즈이미다졸, 벤조티아졸, 티오펜, 퓨란, 피롤, 피리미딘, 이소티아졸, 이미다졸, 인돌, 퓨린, 퀴놀린 및 티아디아졸로 이루어지는 군에서 선택되는, 선택적으로 치환된 5- 또는 6-원 헤테로아릴기이고;
Halo 는 -F, -Cl, -Br 또는 -I이고;
R3 는 수소, -F, -Cl, -Br, -I, C1-C3 알킬, C1-C3 알케닐, C1-C3 퍼플루오로알킬, -O-C1-C3-알킬, -O-C1-C3-알케닐, -CN으로 이루어지는 군에서 선택되고;
m 은 1, 2 또는 3;
p 는 0 또는 1이다. - 제9항에 있어서, 화학식 (III), (IV) 또는 (V) 에서 R3 는 수소인 것인 화합물.
- 제9항에 있어서, 화학식 (V) 에서 J는 퓨란 또는 티오펜인 것인 화합물.
- 제9항 내지 제11항 중 어느 하나의 항에 정의된 화학식 (II), (III), (IV), 또는 (V)의 화합물, 또는 제12항에 정의된 화합물 또는 그 약학적으로 허용가능한 염, 입체 이성질체 및/또는 용매화물 및 적어도 하나의 약학적으로 수용가능한 담체를 포함하는 것인 약학 조성물.
- 의약으로서 사용되기 위한 제9항 내지 제11항 중 어느 하나의 항에 정의된 화학식 (II), (III), (IV), 또는 (V)의 화합물 또는 제12항에 정의된 화합물 또는 그 약학적으로 허용가능한 염, 입체 이성질체 및/또는 용매화물.
- 아밀로이드 또는 타우 병리 또는 그 증상을 치료 또는 개선하는 방법에 사용되는 것인 제9항 내지 제11항 중 어느 하나의 항에 정의된 화학식 (II), (III), (IV), 또는 (V)의 화합물 또는 제12항에 정의된 화합물 또는 그 약학적으로 허용가능한 염, 입체 이성질체 및/또는 용매화물.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP10382140.1 | 2010-05-24 | ||
| EP10382140A EP2390248A1 (en) | 2010-05-24 | 2010-05-24 | Flufenoxine derivatives for the treatment and prevention of amiloyd pathologies |
| EP10382197.1 | 2010-07-15 | ||
| EP10382197 | 2010-07-15 | ||
| PCT/EP2011/058374 WO2011147780A1 (en) | 2010-05-24 | 2011-05-23 | Flufenoxine derivatives for the treatment and prevention of amiloyd pathologies |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130082453A true KR20130082453A (ko) | 2013-07-19 |
Family
ID=44119200
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127033736A KR20130082453A (ko) | 2010-05-24 | 2011-05-23 | 아밀로이드 병리의 치료 및 예방을 위한 플루페녹신 유도체 |
Country Status (18)
| Country | Link |
|---|---|
| US (1) | US20130131079A1 (ko) |
| EP (1) | EP2576509A1 (ko) |
| JP (1) | JP2013526597A (ko) |
| KR (1) | KR20130082453A (ko) |
| CN (1) | CN103025714A (ko) |
| AR (1) | AR084962A1 (ko) |
| AU (1) | AU2011257306A1 (ko) |
| BR (1) | BR112012029815A2 (ko) |
| CA (1) | CA2800384A1 (ko) |
| CL (1) | CL2012003280A1 (ko) |
| CO (1) | CO6640307A2 (ko) |
| IL (1) | IL223219A0 (ko) |
| MA (1) | MA34327B1 (ko) |
| MX (1) | MX2012013581A (ko) |
| RU (1) | RU2012155839A (ko) |
| TW (1) | TW201208683A (ko) |
| UY (1) | UY33401A (ko) |
| WO (1) | WO2011147780A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104887675B (zh) * | 2014-03-05 | 2018-08-07 | 江苏恩华药业股份有限公司 | [(芳氧基)(杂芳基)]甲基哌啶衍生物在制备治疗抑郁症的药物中的应用 |
| US20220296593A1 (en) * | 2020-12-11 | 2022-09-22 | Institut De Cardiologie De Montreal | Methods of treating elevated plasma cholesterol |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6518284B2 (en) | 1998-11-18 | 2003-02-11 | Faes, Fabrica Espanola De Productos Quimicos Y Farmaceuticos S.A. | 4-substituted piperidines |
| ES2157148B1 (es) | 1998-11-18 | 2002-03-01 | Faes Fabrica Espanola De Produ | Nuevas piperidinas 4-sustituidas. |
| CA2471943C (en) * | 2001-12-27 | 2011-09-20 | Daiichi Pharmaceutical Co., Ltd. | .beta.-amyloid protein production-secretion inhibitors |
| BRPI0510453A (pt) | 2004-04-30 | 2007-10-30 | Warner Lambert Co | composto substituìdos com morfolina para o tratamento de distúrbios do sistema nervoso central |
-
2011
- 2011-05-23 BR BR112012029815A patent/BR112012029815A2/pt not_active IP Right Cessation
- 2011-05-23 KR KR1020127033736A patent/KR20130082453A/ko not_active Application Discontinuation
- 2011-05-23 US US13/699,613 patent/US20130131079A1/en not_active Abandoned
- 2011-05-23 CA CA2800384A patent/CA2800384A1/en not_active Abandoned
- 2011-05-23 AU AU2011257306A patent/AU2011257306A1/en not_active Abandoned
- 2011-05-23 CN CN2011800260145A patent/CN103025714A/zh active Pending
- 2011-05-23 EP EP11722384.2A patent/EP2576509A1/en not_active Withdrawn
- 2011-05-23 UY UY0001033401A patent/UY33401A/es not_active Application Discontinuation
- 2011-05-23 MA MA35479A patent/MA34327B1/fr unknown
- 2011-05-23 JP JP2013511634A patent/JP2013526597A/ja not_active Withdrawn
- 2011-05-23 RU RU2012155839/04A patent/RU2012155839A/ru not_active Application Discontinuation
- 2011-05-23 MX MX2012013581A patent/MX2012013581A/es not_active Application Discontinuation
- 2011-05-23 TW TW100117948A patent/TW201208683A/zh unknown
- 2011-05-23 WO PCT/EP2011/058374 patent/WO2011147780A1/en active Application Filing
- 2011-05-24 AR ARP110101787A patent/AR084962A1/es unknown
-
2012
- 2012-11-22 IL IL223219A patent/IL223219A0/en unknown
- 2012-11-23 CL CL2012003280A patent/CL2012003280A1/es unknown
- 2012-12-10 CO CO12223421A patent/CO6640307A2/es not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| RU2012155839A (ru) | 2014-06-27 |
| MA34327B1 (fr) | 2013-06-01 |
| IL223219A0 (en) | 2013-02-03 |
| US20130131079A1 (en) | 2013-05-23 |
| AU2011257306A1 (en) | 2012-12-20 |
| AR084962A1 (es) | 2013-07-24 |
| CL2012003280A1 (es) | 2013-03-22 |
| BR112012029815A2 (pt) | 2017-03-07 |
| JP2013526597A (ja) | 2013-06-24 |
| TW201208683A (en) | 2012-03-01 |
| MX2012013581A (es) | 2013-02-15 |
| CA2800384A1 (en) | 2011-12-01 |
| EP2576509A1 (en) | 2013-04-10 |
| CO6640307A2 (es) | 2013-03-22 |
| UY33401A (es) | 2011-12-30 |
| CN103025714A (zh) | 2013-04-03 |
| WO2011147780A1 (en) | 2011-12-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11414423B1 (en) | Substituted 1,2,3,4,5,6-hexahydroazepino[4,5-b]indoles for treating brain disorders | |
| KR102331422B1 (ko) | 아이소인돌린 조성물 및 신경퇴행성 질환을 치료하는 방법 | |
| KR101857315B1 (ko) | S1p 조절 작용제 | |
| RU2681211C2 (ru) | (гетеро)арилциклопропиламины в качестве ингибиторов lsd1 | |
| JP2019510026A (ja) | 複素環化合物 | |
| JP6843114B2 (ja) | ムスカリン作動薬 | |
| JPWO2008059854A1 (ja) | ピペリジン誘導体またはその塩 | |
| JP2013542973A (ja) | 神経変性疾患または神経変性状態を治療するためのビピリジンスルホンアミド誘導体 | |
| DE60305037T2 (de) | Piperazinylacylpiperidinderivate, deren herstellung und deren therapeutische anwendung | |
| JP2017206545A (ja) | 神経変性疾患を処置する組成物及び方法 | |
| CN105793259A (zh) | 氟-萘基衍生物 | |
| FI107607B (fi) | Menetelmä terapeuttisesti käyttökelpoisen 1,4-piperidiinijohdannaisen valmistamiseksi | |
| JP2000086603A (ja) | 桂皮酸アミド誘導体および3―フェニルプロピオン酸アミド誘導体 | |
| WO2019189781A1 (ja) | 神経細胞内カルシウム濃度上昇抑制剤 | |
| JP5165578B2 (ja) | イソキノリンおよびベンゾ[h]イソキノリン誘導体、調製およびヒスタミンh3受容体のアンタゴニストとしてのこの治療上の使用 | |
| EP1562898A1 (en) | Indole derivatives as somatostatin agonists or antagonists | |
| JP5476373B2 (ja) | (架橋ピペラジニル)−1−アルカノンの新規な誘導体およびp75阻害剤としてのこれらの使用 | |
| JP2011522868A (ja) | 2−オキソ−アルキル−1−ピペラジン−2−オンの誘導体、これらの調製方法およびこれらの治療的使用 | |
| KR20130082453A (ko) | 아밀로이드 병리의 치료 및 예방을 위한 플루페녹신 유도체 | |
| WO2004041282A1 (ja) | 受容体調節剤 | |
| EA011635B1 (ru) | Новые производные амида гетероциклической карбоновой кислоты | |
| WO2005054227A1 (fr) | Derives de (4-phenylpiperazin-1-yl)acylpiperidine, leur preparation et leur application en therapeutique | |
| EP2390248A1 (en) | Flufenoxine derivatives for the treatment and prevention of amiloyd pathologies | |
| TW201400453A (zh) | 反式-2-癸烯酸衍生物及含該衍生物之藥劑 | |
| CN108727350A (zh) | 一类哌啶烷基苯酞类化合物、其制备方法和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |