KR20120091174A - 골질환 치료제의 제조를 위한 sglt-1/sglt-2 억제제 활성을 갖는 화합물의 용도 - Google Patents
골질환 치료제의 제조를 위한 sglt-1/sglt-2 억제제 활성을 갖는 화합물의 용도 Download PDFInfo
- Publication number
- KR20120091174A KR20120091174A KR1020127011291A KR20127011291A KR20120091174A KR 20120091174 A KR20120091174 A KR 20120091174A KR 1020127011291 A KR1020127011291 A KR 1020127011291A KR 20127011291 A KR20127011291 A KR 20127011291A KR 20120091174 A KR20120091174 A KR 20120091174A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- phenyl
- conh
- alkylene
- substituted
- Prior art date
Links
- 0 CC(OCC(CC(*)C1OC(C)=O)C(*)(*)C1OC(C)=O)=O Chemical compound CC(OCC(CC(*)C1OC(C)=O)C(*)(*)C1OC(C)=O)=O 0.000 description 8
- SHAWVXKUTQLKDG-UHFFFAOYSA-N C/[O]=C(/c1ccccc1)\OC(C(C(C(COC(c1ccccc1)=O)O1)F)OC(c2ccccc2)=O)C1Br Chemical compound C/[O]=C(/c1ccccc1)\OC(C(C(C(COC(c1ccccc1)=O)O1)F)OC(c2ccccc2)=O)C1Br SHAWVXKUTQLKDG-UHFFFAOYSA-N 0.000 description 1
- BTBKZMAYBVZXNC-ZTVFICENSA-N CC(/C=C(\C(\C(NCc(cc1)ccc1OC)=O)=C(/C)\OC(C(C1O)O)OC(CO)C1F)/O)=C Chemical compound CC(/C=C(\C(\C(NCc(cc1)ccc1OC)=O)=C(/C)\OC(C(C1O)O)OC(CO)C1F)/O)=C BTBKZMAYBVZXNC-ZTVFICENSA-N 0.000 description 1
- XTMSAPTWOXBOLW-BQYQJAHWSA-N CC(C)c1c(Cc2ccc(/C=C/C(NCCO)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 Chemical compound CC(C)c1c(Cc2ccc(/C=C/C(NCCO)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 XTMSAPTWOXBOLW-BQYQJAHWSA-N 0.000 description 1
- CNJLCULVVMIBLG-UHFFFAOYSA-N CC(C)c1c(Cc2ccc(CCC(NCC(N)=O)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 Chemical compound CC(C)c1c(Cc2ccc(CCC(NCC(N)=O)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 CNJLCULVVMIBLG-UHFFFAOYSA-N 0.000 description 1
- AHJVMEGPMWNIKB-UHFFFAOYSA-N CC(C)c1c(Cc2ccc(CCCC(N3CCOCC3)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 Chemical compound CC(C)c1c(Cc2ccc(CCCC(N3CCOCC3)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 AHJVMEGPMWNIKB-UHFFFAOYSA-N 0.000 description 1
- JUKMWXIUXDCOIV-UHFFFAOYSA-N CC(C)c1c(Cc2ccc(CCCC(NCCC(N)=O)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 Chemical compound CC(C)c1c(Cc2ccc(CCCC(NCCC(N)=O)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 JUKMWXIUXDCOIV-UHFFFAOYSA-N 0.000 description 1
- ZROCEUFWPPQAGA-UHFFFAOYSA-N CC(OC(C(C1OC(C2=CC=CCC2)=O)OC(c2ccccc2)=O)OC(COC(c2ccccc2)=O)C1F)=O Chemical compound CC(OC(C(C1OC(C2=CC=CCC2)=O)OC(c2ccccc2)=O)OC(COC(c2ccccc2)=O)C1F)=O ZROCEUFWPPQAGA-UHFFFAOYSA-N 0.000 description 1
- ZOYLXCCDXVFFRQ-UHFFFAOYSA-N CC(OCC(C(C(C1OC(C)=O)OC(C)=O)F)OC1Br)=O Chemical compound CC(OCC(C(C(C1OC(C)=O)OC(C)=O)F)OC1Br)=O ZOYLXCCDXVFFRQ-UHFFFAOYSA-N 0.000 description 1
- ZDPAWHACYDRYIW-UHFFFAOYSA-N CC(c(cc1)ccc1F)=O Chemical compound CC(c(cc1)ccc1F)=O ZDPAWHACYDRYIW-UHFFFAOYSA-N 0.000 description 1
- HJBPRODEIKXWNX-UHFFFAOYSA-N CC(c(cc1)ccc1Oc(cccc1)c1OC)=O Chemical compound CC(c(cc1)ccc1Oc(cccc1)c1OC)=O HJBPRODEIKXWNX-UHFFFAOYSA-N 0.000 description 1
- UXQREJVIYIDRHB-UHFFFAOYSA-N CCc(cc1)ccc1Oc1ccccc1O Chemical compound CCc(cc1)ccc1Oc1ccccc1O UXQREJVIYIDRHB-UHFFFAOYSA-N 0.000 description 1
- BKSLZCVFXVQYFG-UHFFFAOYSA-N CCc(cc1)ccc1Oc1ccccc1OC Chemical compound CCc(cc1)ccc1Oc1ccccc1OC BKSLZCVFXVQYFG-UHFFFAOYSA-N 0.000 description 1
- DIJCUJJYNKHAJY-UHFFFAOYSA-N COC(C(C1OC(c2ccccc2)=O)OC(c2ccccc2)=O)OC(COC(c2ccccc2)=O)C1F Chemical compound COC(C(C1OC(c2ccccc2)=O)OC(c2ccccc2)=O)OC(COC(c2ccccc2)=O)C1F DIJCUJJYNKHAJY-UHFFFAOYSA-N 0.000 description 1
- WXFFEILSURAFKL-UHFFFAOYSA-N COC(C(C1OC(c2ccccc2)=O)OC(c2ccccc2)=O)OC(COC(c2ccccc2)=O)C1O Chemical compound COC(C(C1OC(c2ccccc2)=O)OC(c2ccccc2)=O)OC(COC(c2ccccc2)=O)C1O WXFFEILSURAFKL-UHFFFAOYSA-N 0.000 description 1
- DHTGSKUZVBCXAQ-UHFFFAOYSA-N COc1ccc(Cc(cccc2)c2OC(C(C2O)O)OC(CO)C2F)cc1 Chemical compound COc1ccc(Cc(cccc2)c2OC(C(C2O)O)OC(CO)C2F)cc1 DHTGSKUZVBCXAQ-UHFFFAOYSA-N 0.000 description 1
- LHGVFZTZFXWLCP-UHFFFAOYSA-N COc1ccccc1O Chemical compound COc1ccccc1O LHGVFZTZFXWLCP-UHFFFAOYSA-N 0.000 description 1
- NNZVDIAYHJUUTH-UHFFFAOYSA-N C[O](C(CO)C(C(C1O)O)F)C1Oc1c(C(CCc(cc2)ccc2O)=O)c(O)cc(O)c1 Chemical compound C[O](C(CO)C(C(C1O)O)F)C1Oc1c(C(CCc(cc2)ccc2O)=O)c(O)cc(O)c1 NNZVDIAYHJUUTH-UHFFFAOYSA-N 0.000 description 1
- MHBVJOCWNZJKII-UHFFFAOYSA-N Cc1c(Cc2ccc(CCCC(NCCC(N)=O)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 Chemical compound Cc1c(Cc2ccc(CCCC(NCCC(N)=O)=O)cc2)c(OC(C(C2O)O)OC(CO)C2F)n[nH]1 MHBVJOCWNZJKII-UHFFFAOYSA-N 0.000 description 1
- AVPWLGKQAHQSCG-UHFFFAOYSA-N OCC(C(C(C1O)O)(F)F)OC1Oc1c(Cc2ccccc2)cccc1 Chemical compound OCC(C(C(C1O)O)(F)F)OC1Oc1c(Cc2ccccc2)cccc1 AVPWLGKQAHQSCG-UHFFFAOYSA-N 0.000 description 1
- YNCKQYVJYAJXEJ-UHFFFAOYSA-N OCC(C(C(C1O)O)F)OC1Oc1c(Cc2ccccc2)cccc1 Chemical compound OCC(C(C(C1O)O)F)OC1Oc1c(Cc2ccccc2)cccc1 YNCKQYVJYAJXEJ-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/7056—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing five-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Rheumatology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Hematology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Cardiology (AREA)
- Pulmonology (AREA)
- Obesity (AREA)
- Psychiatry (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Heart & Thoracic Surgery (AREA)
- Emergency Medicine (AREA)
- Oncology (AREA)
- Child & Adolescent Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Communicable Diseases (AREA)
- Ophthalmology & Optometry (AREA)
- Pain & Pain Management (AREA)
- Dermatology (AREA)
Abstract
SGLT-1/SGLT-2 억제제 활성을 갖는 화합물의 골질환 치료제의 제조를 위한 용도. 본 발명은 골다공증과 같은 골질환 치료제의 제조에 사용하기 위한 SGLT-1/SGLT-2 억제제 활성을 갖는 화합물의 용도에 관한 것이다. 바람직하게는, 본 발명은 라디칼이 본원에 정의된 바와 같은 화학식 I의 화합물의 용도에 관한 것이다.
화학식 I
화학식 I
Description
골질환 치료제의 제조를 위한 SGLT-1/SGLT-2 억제제 활성을 갖는 화합물의 용도
본 발명은 골질환 치료제의 제조를 위한 SGLT-1/SGLT-2 억제제 활성을 갖는 화합물 및 이의 생리학적으로 허용되는 염 및 이의 생리학적 기능성 유도체의 용도에 관한 것이다.
WO 2004/052902 및 WO 2004/059203에는 SGLT에 대해 억제제 활성을 갖는 플루오로글리코사이드 유도체 화합물이 기술되어 있다. 이들 화합물은 1형 및 2형 당뇨병의 예방 및 치료에 적합한 것으로 제시되고 있다.
본 발명자들은 이들 화합물이 SGLT-1 및 SGLT-2 억제제 활성을 나타낸다는 것을 발견하였다. WO 2005/121161에는 장에서의 낮은 흡수에 의해 SGLT-1에 대한 주요 억제제 활성을 갖는 플루오로글리코사이드 유도체가 기술되어 있다.
본 발명은 골질환의 치료를 위해 사용될 수 있으며 특히 골다공증의 치료에 치료학적으로 유용한 화합물을 제공하는 목적을 기본으로 한다.
따라서, 본 발명은 골질환의 치료제를 제조하기 위한 하기 화학식 I의 화합물 및 이의 약제학적으로 허용되는 염의 용도에 관한 것이다:
[화학식 I]
상기 화학식 I에서,
R1 및 R2는 서로 독립적으로 F 또는 H이고, 여기서, 라디칼 R1 및 R2 중 하나는 F이어야 하며;
A는 O, NH, CH2, S 또는 결합이고;
R3은 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO-(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C3-C6)-사이클로알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C6)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬, 페닐, 벤질, (C1-C6)-알콕시카르보닐(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C7)-알킬, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이고;
R4는 수소, (C1-C6)-알킬, (C2-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이며;
B는 (C0-C15)-알킬렌(여기서, 알킬렌 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO)2-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 대체될 수 있다)이고;
R5, R6 및 R7은 서로 독립적으로, 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C8)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SCF3, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C6)-알킬, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C8)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R6 및 R7은 이들을 갖는 탄소 원자와 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc1(여기서, 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S로 대체될 수 있고, Cyc1은 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서 각 경우에 CH2 그룹 1개는 O로 대체될 수 있다)에 의해 치환되거나 H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다)을 형성하며;
X는 CO, O, NH, S, SO, SO2 또는 결합이고;
L은 (C1-C6)-알킬렌, (C2-C5)-알케닐렌, (C2-C5)-알키닐렌(여기서 각 경우에 CH2 그룹 1개 또는 2개는 O 또는 NH로 대체될 수 있다)이며;
Y는 CO, NHCO, SO, SO2 또는 결합이고;
R8 및 R9는 서로 독립적으로 수소, SO3H, 당 잔기, (C1-C6)-알킬(여기서, 알킬 라디칼의 CH2 그룹 1개 이상은 서로 독립적으로 (C1-C6)-알킬, OH, (C1-C6)-알킬렌-OH, (C2-C6)-알케닐렌-OH, O-당 잔기, OSO3H, NH2, NH-(C1-C6)-알킬, N[(C1-C6)-알킬]2, NH-CO-(C1-C6)-알킬, NH-당 잔기, NH-SO3H, (C1-C6)-알킬렌-NH2, (C2-C6)-알케닐렌-NH2, (C0-C6)-알킬렌-COOH, (C0-C6)-알킬렌-CONH2, (C0-C6)-알킬렌-CONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SONH2, (C0-C6)-알킬렌-SONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SO2NH2, (C0-C6)-알킬렌-SO2NH-(C1-C6)-알킬, 아다만틸에 의해 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 N 원자와 함께, 5원 내지 7원 포화 환 Cyc2[여기서, 환의 CH2 그룹 1개 이상은 또한 O, S, NH, NSO3H, N-당 잔기, N-(C1-C6)-알킬(여기서, 알킬 라디칼의 CH2 그룹 1개 이상은 서로 독립적으로 (C1-C6)-알킬, OH, (C1-C6)-알킬렌-OH, (C2-C6)-알케닐렌-OH, NH2, NH-(C1-C6)-알킬, N[(C1-C6)-알킬]2, NH-CO-(C1-C6)-알킬, NH-당 잔기, (C1-C6)-알킬렌-NH2, (C2-C6)-알케닐렌-NH2, (C0-C6)-알킬렌-COOH, (C0-C6)-알킬렌-CONH2, (C0-C6)-알킬렌-CONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SONH2, (C0-C6)-알킬렌-SONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SO2NH2, (C0-C6)-알킬렌-SO2NH-(C1-C6)-알킬에 의해 치환될 수 있다)에 의해 대체될 수 있다]을 형성한다.
당 잔기는 D 또는 L 계열에 속할 수 있는 탄소수 3 내지 7의 알도스 및 케토스로부터 유도된 화합물을 의미하며, 또한 아미노사카라이드, 당 알코올 또는 사카라이드 산 (Jochen Lehmann, Chemie der Kohlenhydrate, Thieme Verlag 1976)을 포함한다. 예로는 글루코스, 만노스, 프럭토스, 갈락토스, 리보스, 에리트로스, 글리세르알데하이드, 세도헵툴로스, 글루코사민, 갈락토사민, 글루쿠론산, 갈락투론산, 글루콘산, 갈락톤산, 만논산, 글루카민, 3-아미노-1,2-프로판디올, 글루카르산 및 갈락타르산을 들 수 있다. 또한, 화합물들은 알파 및 베타 형태로 존재할 수 있다.
환에 A, B, R3 및 R5의 연결점은 제한없이 선택될 수 있다. 생성된 모든 화학식 I의 화합물은 본 발명에 포함된다.
바람직하게는 본 발명은 다음과 같이 정의되는 화학식 I의 화합물의 용도를 제공한다:
A는 O, NH 또는 결합이고;
R3은 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO-(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C6)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬, 페닐, 벤질, (C1-C4)-알킬렌-COOH, SO-(C1-C6)-알킬(여기서, 알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 치환될 수 있다)이며; 또는
R4는 수소, (C1-C6)-알킬, (C2-C6)-알케닐 또는 (C3-C6)-사이클로알킬이고;
B는 (C0-C6)-알킬렌(여기서, 알킬렌 라디칼의 1개 이상의 탄소 원자(들)는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬렌)-, -N((C1-C6)-알킬렌-페닐렌)- 또는 -NH-에 의해 치환될 수 있다)이다.
당 잔기가 베타(β)로 연결되어 있고 당 잔기의 2번, 3번 및 5번 위치의 입체화학이 D-글루코 배열을 갖는 화학식 I의 화합물의 용도가 더욱 바람직하다.
또한 바람직하게는, 본 발명은 다음과 같이 정의되는 화학식 I의 화합물의 용도를 제공한다:
R1은 수소이고
R2는 불소이거나; 또는
R1은 불소이고
R2는 수소이고;
A는 O 또는 NH이고;
R3은 수소, F, Cl, Br, I, OH, CF3, (C1-C6)-알킬, (C3-C6)-사이클로알킬, (C2-C6)-알케닐, O-(C1-C6)-알킬(여기서, 알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 치환될 수 있다)이며;
R4는 수소, (C1-C6)-알킬 또는 (C3-C6)-사이클로알킬이고;
B는 (C0-C4)-알킬렌(여기서, 알킬렌 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -CH(OH)-, -CHF-, -CF2- 또는 -NH-에 의해 치환될 수 있다)이며;
R5, R6 및 R7은 서로 독립적으로, 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C8)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소는 불소에 의해 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C6)-알킬이거나;
R6 및 R7은 이들을 갖는 탄소 원자와 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc1[여기서, 환의 1개 또는 2개의 탄소 원자(들)는 또한 N, O 또는 S로 치환될 수 있고, Cyc1은 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서 각 경우에 1개의 CH2 그룹은 O로 치환될 수 있다)에 의해 치환되거나 H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]을 형성하며;
X는 CO, O, NH 또는 결합이고;
L은 (C1-C6)-알킬렌, (C2-C5)-알케닐렌(여기서 각 경우에 1개 또는 2개의 CH2 그룹(들)은 O 또는 NH로 치환될 수 있다)이며;
Y는 CO, NHCO 또는 결합이다.
특히 바람직하게는, 다음과 같이 정의되는 화학식 I의 화합물의 용도를 제공한다:
R1은 수소이고;
R2는 불소이며;
A는 O이고;
R3은 CF3, 메틸 또는 이소프로필이며;
R4는 수소이고;
B는 (C0-C4)-알킬렌(여기서, 알킬렌 라디칼의 1개 이상의 탄소 원자(들)는 서로 독립적으로 -O-, -(C=O)-, -CHF- 또는 -CF2-에 의해 치환될 수 있다)이며;
X는 CO, O 또는 결합이고;
L은 (C1-C4)-알킬렌 또는 (C2-C4)-알케닐렌(여기서, 각 경우에 1개 또는 2개의 CH2 그룹(들)은 O 또는 NH에 의해 치환될 수 있다)이며;
Y는 CO, NHCO 또는 결합이다.
특히 바람직하게는, 본 발명은 다음과 같이 정의되는 화학식 I의 화합물의 용도를 제공한다:
R1은 수소이고;
R2는 불소이며;
A는 O이고;
B는 -CH2-이며;
R5는 수소, Cl, 메틸, 에틸, OH 또는 CF3이고;
R6 및 R7은 수소이며;
X는 CO, O 또는 결합이고;
L은 (C1-C3)-알킬렌 또는 (C2-C3)-알케닐렌(여기서, 각 경우에 1개의 CH2 그룹은 O 또는 NH에 의해 치환될 수 있다)이며;
Y는 CO, NHCO 또는 결합이다.
특히 바람직하게는, 치환체 A 및 B가 인접한 위치 (오르토 위치)를 점유하고 R3이 B에 인접한 위치 (오르토 위치)를 점유한 화학식 I의 화합물의 용도를 제공한다.
더욱 특히 바람직하게는, 다음과 같이 정의되는 화학식 I의 화합물의 용도를 제공한다:
R8 및 R9는 서로 독립적으로 수소, SO3H, 당 잔기, (C1-C4)-알킬(여기서, 알킬 라디칼은 서로 독립적으로 (C1-C2)-알킬, OH, (C1-C2)-알킬렌-OH, OSO3H, NH2, CONH2, SO2NH2, NH-SO3H 또는 아다만틸에 의해 1회 이상 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 N 원자와 함께, (C1-C2)-알킬, (C1-C2)-알킬렌-OH 또는 SO3H에 의해 N-치환될 수 있는 피페라진, 피페리딘, 아제판, 피롤리딘 또는 모르폴린의 그룹으로부터 선택되는 5원 내지 7원 포화 환 Cyc2를 형성한다.
화학식 I의 화합물의 특정 양태로서, 치환체 B 및 X는 페닐 환의 파라 위치에 배치된다.
화학식 I의 화합물의 추가의 양태로서, 치환체 A는 피라졸 환의 3번 위치에 배치되고, 치환체 B는 피라졸 환의 4번 위치에 배치되며, 치환체 R3은 피라졸 환의 5번 위치에 배치된다.
화학식 I의 화합물의 추가의 양태로서, 치환체 A는 피라졸 환의 5번 위치에 배치되고, 치환체 B는 피라졸 환의 4번 위치에 배치되며, 치환체 R3은 피라졸 환의 3번 위치에 배치된다.
치환체 R3, R4, R5, R6, R7, R8 및 R9에서 알킬 라디칼은 직쇄형 또는 분지형일 수 있다. 할로겐은 F, Cl, Br, I를 의미하며 바람직하게는 F 및 Cl이다.
또한, 본 발명은 골질환의 치료제를 제조하기 위한 하기 화학식 II의 화합물 및 이의 약제학적으로 허용되는 염의 용도에 관한 것이다:
[화학식 II]
상기 화학식 II에서,
R1 및 R2는 서로 독립적으로 F 또는 H이거나, 라디칼 R1 및 R2 중 하나는 OH이며;
R3은 OH 또는 F이며(여기서, 라디칼 R1, R2 및 R3 중 하나 이상은 F이어야 한다);
R4는 OH이며;
A는 O, NH, CH2, S 또는 결합이고;
X는 C, O, S 또는 N이며(여기서, Y가 O 또는 S인 경우 X는 C이어야 한다);
Y는 N, O 또는 S이고;
m은 1 또는 2의 수이며;
R5는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질 또는 (C1-C6)-알콕시카르복실(여기서, 상기 알킬, 알콕시, 알케닐 또는 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
Y가 S인 경우, R5 및 R6은 이들을 갖는 C 원자들과 함께, 페닐을 형성하며;
R6은 임의로 H, (C1-C6)-알킬, (C1-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 C 원자들은 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 대체될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 3원 내지 7원 포화, 부분 포화 또는 불포화 환(여기서, 1개의 C 원자는 O, N 또는 S에 의해 대체될 수 있다)이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬(여기서, 상기 알킬, 알콕시, 알케닐 또는 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SCF3, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, (C1-C8)-알콕시, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 C 원자들과 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 상기 환의 1개 또는 2개의 탄소 원자(들)는 또한 N, O 또는 S에 의해 대체될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 1개의 CH2 그룹은 O에 의해 대체될 수 있다)에 의해 치환되거나, H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다.
환에 대한 A, B 및 R5의 연결점은 제한없이 선택될 수 있다. 본 발명은 생성된 모든 화학식 II의 화합물의 용도를 포함한다.
X 및 Y를 포함하는 중심 빌딩 블록의 적합한 헤테로사이클은 티오펜, 푸란, 피롤, 피라졸, 이소옥사졸 및 이소티아졸이며, 바람직한 것은 티오펜, 피라졸 및 이소옥사졸이다. 특히 바람직한 화학식 II의 화합물은 중심 빌딩 블록으로서 티오펜 또는 피라졸을 포함하는 화합물이다.
다음과 같이 정의되는 화학식 II의 화합물의 용도가 바람직하다:
R1 및 R2는 서로 독립적으로 F 또는 H이고, 라디칼 R1 및 R2 중 하나는 OH이며(여기서, 라디칼 R1 및 R2 중 하나는 F이어야한다);
R3은 OH이며;
R4는 OH이고;
A는 O 또는 NH이며;
X는 C, O 또는 N이고(여기서, X는 Y가 S인 경우 C이어야 한다);
Y는 S 또는 N이고;
m은 1 또는 2의 수이며;
R5는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질, (C1-C4)-알킬카르복실, SO-(C1-C6)-알킬(여기서, 알킬 또는 알콕시 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 치환될 수 있다)이거나;
Y가 S인 경우, R5 및 R6은 이들을 갖는 탄소 원자와 함께, 페닐을 형성하고;
R6은 임의로 H, (C1-C6)-알킬, (C1-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이며;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 C 원자(들)는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 치환될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 3 내지 7원 포화, 부분 포화 또는 불포화 환이고(여기서, 1개의 탄소 원자는 O 또는 S에 의해 치환될 수 있다);
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, S-(C1-C6)-알킬, SCF3, SO-(C1-C6)-알킬(여기서, 알킬 또는 알콕시 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 탄소 원자와 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S에 의해 치환될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 CH2 그룹 1개는 O에 의해 치환될 수 있다)에 의해 치환되거나 H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다.
당 잔기가 베타(β)-연결되어 있고 당 잔기의 2번, 3번 및 5번 위치의 입체화학이 D-글루코 배열을 갖는 화학식 II의 화합물의 용도가 더욱 바람직하다.
치환체 A 및 B가 인접한 위치(오르토 위치)를 점유한 화학식 II의 화합물의 용도가 특히 바람직하다.
본 발명은 다음과 같이 정의되는 화학식 II의 화합물의 용도가 특히 바람직하다:
R1 및 R2는 서로 독립적으로 F 또는 H이고, 라디칼 R1 또는 R2 중 하나는 OH이며, 여기서 라디칼 R1 또는 R2 중 하나는 F이어야 하고;
R3은 OH이며;
R4는 OH이고;
A는 O이며;
X는 C, O 또는 N이고, 단 X는 Y가 S인 경우 C이어야 하며;
Y는 S 또는 N이고;
m은 1의 수이며;
R5는 수소, (C1-C5)-알킬, (C1-C4)-알콕시, HO-(C1-C4)-알킬, (C1-C4)-알킬-O-(C1-C4)-알킬, F, Cl, CF3, OCF3, OCH2CF3 (C1-C4)-알킬-CF2-, 페닐, 벤질, (C1-C4)-알킬카르복실, (C2-C4)-알케닐, (C2-C4)-알키닐, COO(C1-C4)-알킬이거나;
Y가 S인 경우, R5 및 R6은 이들을 갖는 탄소 원자와 함께, 페닐을 형성하고;
R6은 임의로 H, (C1-C6)-알킬, (C1-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이며;
B는 (C1-C4)-알칸디일(여기서, 1개의 CH2 그룹은 또한 -(C=O)-, -CH(OH)-, -CO-NH-, -CHF-, -CF2-, -O-에 의해 치환될 수 있다)이고;
n은 2 또는 3의 수이며;
Cyc1은 불포화 5원 또는 6원 환(여기서, 1개의 탄소 원자는 O 또는 S에 의해 치환될 수 있다)이고;
R7, R8 및 R9는 수소, (C1-C4)-알킬, (C1-C8)-알콕시, S-(C1-C4)-알킬, SCF3, F, Cl, Br, I, OCF3, OCH2CF3, OH, HO-(C1-C4)-알킬, (C1-C4)-알킬-O-(C1-C4)-알킬이거나;
R8 및 R9는 함께 -CH=CH-O-, -CH=CH-S-, CH=CH-CH=CH-(여기서, 각 경우는 임의로 (C1-C4)-알콕시에 의해 치환된다) 또는 -O-(CH2)p-O-(여기서, p는 1 또는 2이다)이고;
R7은 수소이다.
다음과 같이 정의되는 화학식의 화합물의 용도가 특히 매우 바람직하다:
R1 및 R2는 H 또는 F이고(여기서, 라디칼 R1 및 R2 중 하나는 F이어야 한다);
R3은 OH이고;
R4는 OH이며;
A는 O이고;
X는 C이며 Y는 S이거나,
X는 O이며 Y는 N이거나,
X는 N이며 Y는 N이고;
m은 1의 수이며;
R5는 수소, CF3, (C1-C6)-알킬이거나, 또는 Y가 S인 경우, R5 및 R6은 이들을 갖는 탄소 원자와 함께, 페닐을 형성하고;
R6은 임의로 H, (C1-C4)-알킬 또는 페닐이며;
B는 -CH2-, -C2H4-, -C3H6-, -CO-NH-CH2- 또는 -CO-CH2-CH2-이고;
n은 2 또는 3의 수이며;
Cyc1은 불포화 5원 또는 6원 환(여기서, 1개의 탄소 원자는 S에 의해 치환될 수 있다)이고;
R7, R8 및 R9는 수소, (C1-C6)-알킬, (C1-C4)-알콕시, S-(C1-C4)-알킬, SCF3, F, Cl, Br, I, OCF3이거나;
R8 및 R9는 함께 임의로 (C1-C4)-알콕시에 의해 치환되는 -CH=CH-O-, -CH=CH-CH=CH-이며;
R7은 수소이다.
다음과 같이 정의되는 화학식 II의 화합물의 용도가 더욱 더 특히 바람직하다:
R1 및 R2는 H 또는 F이고(여기서, 라디칼 R1 또는 R2 중 하나는 F이어야 한다);
R3은 OH이고;
R4는 OH이며;
A는 O이고;
X는 C이며 Y는 S이거나,
X는 N이며 Y는 N이고;
m은 1의 수이며;
R5는 수소, (C1-C4)-알킬 또는 CF3이거나, 또는 Y가 S인 경우, R5 및 R6은 이들을 갖는 탄소 원자와 함께 페닐을 형성하고;
R6은 임의로 H 또는 (C1-C4)-알킬이며;
B는 -CH2- 또는 -CO-NH-CH2-이고;
n은 2 또는 3의 수이며;
Cyc1은 페닐 또는 티오펜이고;
R7은 수소, 메톡시, F, Cl, Br, I, (C1-C4)-알킬, OCF3이며;
R8 및 R9는 수소 또는 Cl이거나,
R8 및 R9는 이들을 갖는 탄소 원자와 함께, 메톡시에 의해 임의로 치환될 수 있는 페닐, 또는 푸란을 형성하고;
R7은 수소이다.
특히 바람직하게는 치환제 A 또는 B 중 하나의 연결은 가변 Y에 인접한 위치에서 발생한다.
추가로 특히 매우 바람직한 것으로 언급될 수 있는 화합물은 Y가 S인 화합물 및 R1이 H이고 R2가 F인 화합물이다.
본 발명은 라세미체, 라세미체 혼합물, 순수한 거울상이성질체, 및 이들의 부분 입체 이성질체, 및 이들의 혼합물의 형태인 화학식 II의 화합물의 용도에 관한 것이다.
치환체 R4, R5, R6, R7, R8 및 R9에서의 알킬 라디칼은 직쇄형 또는 분지형일 수 있다. 할로겐은 F, Cl, Br, I를 의미하며, 바람직하게는 F 또는 Cl이다.
또한, 본 발명은 골질환의 치료제를 제조하기 위한 하기 화학식 III의 화합물 및 이의 약제학적으로 허용되는 염의 용도에 관한 것이다:
[화학식 III]
상기 화학식 III에서,
R1 및 R2는 OH, F 또는 H이고, R1 및 R2는 F이며, 단 R1=F, R2=OH인 조합, R1=OH, R2=F인 조합 및 R1, R2=OH인 조합 3가지는 배제하고;
R3은 OH 또는 F이며, 여기서 라디칼 R1, R2, R3 중 하나 이상은 F이어야 하며;
A는 O, NH, CH2, S 또는 결합이고;
R4, R5 및 R6은 수소, F, Cl, Br, I, OH, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질(여기서, 상기 알킬, 알콕시, 알케닐 및 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬-페닐)- 또는 -NH-에 의해 치환될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 탄소 원자 1개가 O, N 또는 S에 의해 대체될 수 있는 3원 내지 7원 포화, 부분 포화 또는 불포화 환이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO-(C1-C4)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, (C1-C6)-알킬-OH, (C1-C6)-알킬-O-(C1-C6)-알킬(여기서, 상기 알킬 라디칼들의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, (C1-C8)-알콕시, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 탄소 원자들과 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 상기 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S에 의해 치환될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 CH2 그룹 1개는 O에 의해 대체될 수 있다)에 의해 치환되거나, H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다.
페닐 환에 R4, R5, R6 및 B의 결합점은 자유롭게 선택될 수 있다. 페닐 환에서의 B 치환체가 A 치환체에 대하여 오르토 위치(인접한 위치)에 배치된 화학식 III의 화합물이 바람직하다.
다음과 같이 정의되는 화학식 III의 화합물의 용도가 바람직하다:
R1 및 R2는 OH, F 또는 H이고, R1 및 R2는 F이며, 단 라디칼 R1 또는 R2 중 하나는 F이어야 하고, 단 R1=F, R2=OH인 조합, R1=OH, R2=F인 조합 및 R1, R2=OH인 조합은 배제하고;
R3은 OH이며;
A는 O 또는 NH이고;
R4, R5 및 R6은 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO-(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질, SO-(C1-C6)-알킬(여기서, 알킬, 알콕시, 알케닐 및 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 치환될 수 있다)이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 탄소 원자 1개 이상은 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 치환될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 탄소 원자 1개가 O, N 또는 S에 의해 치환될 수 있는 3원 내지 7원 포화, 부분 포화 또는 불포화 환이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO-(C1-C4)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, (C1-C6)-알킬-OH, (C1-C6)-알킬-O-(C1-C6)-알킬, SO-(C1-C6)-알킬(여기서, 알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 탄소 원자와 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S에 의해 치환될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 CH2 그룹 1개는 O에 의해 치환될 수 있다)에 의해 치환되거나 H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다.
당 잔기가 베타(β)-연결되어 있고 당 잔기의 2번, 3번 및 5번 위치의 입체화학이 D-글루코 배열을 갖는 화학식 III의 화합물의 용도가 더욱 바람직하다.
다음과 같이 정의되는 화학식 III의 화합물의 용도가 특히 바람직하다:
R1 및 R2는 OH, F 또는 H이고, R1 및 R2는 F이며, 단 라디칼 R1 또는 R2 중 하나는 F이어야 하며, 단 R1=F, R2=OH인 조합, R1=OH, R2=F인 조합 및 R1, R2=OH인 조합은 배제하고;
R3은 OH이며;
A는 O이고;
R4, R5 및 R6은 수소, OH, (C1-C6)-알킬, (C1-C4)-알콕시, HO-(C1-C4)-알킬, (C1-C4)-알킬-O-(C1-C4)-알킬, F, Cl, Br, I, CF3, OCF3, OCH2CF3 (C1-C4)-알킬-CF2-, 페닐, 벤질, (C2-C4)-알케닐, (C2-C4)-알키닐, COO(C1-C4)-알킬이고;
B는 (C1-C4)-알칸디일(여기서, CH2 그룹 1개는 -(C=O)-, -CH(OH)-, -CO-NH-, -CO-N(C1-C6)-알킬-, -CHF-, -CF2-, -O-, 또는 -NH-에 의해 치환될 수 있다)이고;
n은 2 또는 3의 수이며;
Cyc1은 탄소 원자 1개가 O, N 또는 S에 의해 치환될 수 있는 불포화 5원 또는 6원 환이고;
R7, R8 및 R9는 수소, (C1-C6)-알킬, (C1-C8)-알콕시, OCF3, OCH2CF3, OH, (C1-C4)-알킬-OH, (C1-C4)-알킬-O-(C1-C4)-알킬, F, Cl, Br이거나;
R8 및 R9는 함께 -CH=CH-O-, -CH2-CH2-O-, -CH=CH-S-, -CH=CH-CH=CH-, -O-(CH2)p-O-(여기서, p는 1 또는 2이다)이며;
R7은 메틸, 에틸, OMe, F, Cl, Br 또는 수소이다.
다음과 같이 정의되는 화학식 III의 화합물의 용도가 특히 매우 바람직하다:
R1은 F이고 R2는 H이거나;
R1은 H이고 R2는 F이거나;
R1은 F이고 R2는 F이고;
R3은 OH이며;
A는 O이고;
R4, R5 및 R6은 수소, OH, (C1-C4)-알콕시, CF3, (C1-C4)-알킬, F, Cl, Br, I이며;
B는 -CH2-, -C2H4-, -C3H6-, -CH(OH)-, -(C=O)-, -CO-NH-CH2- 또는 -CO-CH2-CH2-, -O-, -NH-이고;
n은 2 또는 3의 수이며;
Cyc1은 탄소 원자 1개가 N에 의해 치환될 수 있는 불포화 6원 환이거나 탄소 원자 1개가 S에 의해 치환될 수 있는 불포화 5원 환이고;
R7, R8 및 R9는 수소, OH, (C1-C4)-알킬, (C1-C7)-알콕시, OCF3, 할로겐이거나;
R8 및 R9는 함께 -CH=CH-O-, -CH2-CH2-O-, -CH=CH-CH=CH-, -O-(CH2)p-O-(여기서, p는 1 또는 2이다)이며;
R7은 메틸, 에틸, 메톡시, F, Cl, Br 또는 수소이다.
하기의 화학식 IIIa의 화합물의 용도가 특히 더욱 더 바람직하다:
[화학식 IIIa]
상기 화학식 IIIa에서,
R1은 F이고 R2는 H이거나;
R1은 H이고 R2는 F이거나;
R1은 F이고 R2는 F이거나;
R3은 OH이고;
A는 O이며;
R4는 수소, (C1-C4)-알킬, (C1-C4)-알콕시 또는 OH이고;
R5는 수소, F, 메톡시 또는 에톡시며;
R6은 수소 또는 OH이고;
B는 -CH2-, -CO-NH-CH2- 또는 -CO-CH2-CH2-이고;
Cyc1은 페닐 또는 티오펜이며;
R7, R8 및 R9는 수소, OH, Cl, OCF3, (C1-C4)-알킬 또는 (C1-C4)-알콕시이거나;
R8 및 R9는 함께 -CH=CH-O-, -CH=CH-CH=CH- 또는 -CH2-CH2-O-이며;
R7은 수소이다.
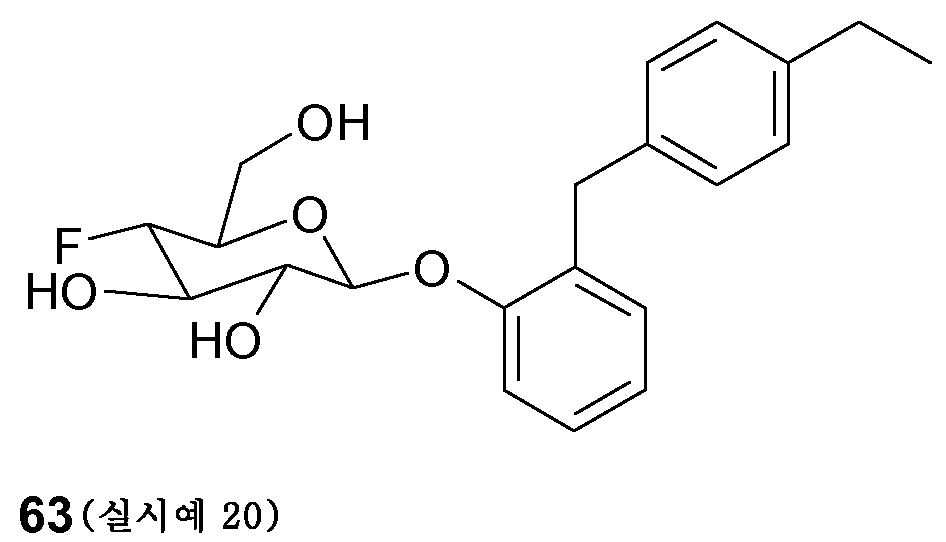
또한, 특히 바람직하고 중요한 화합물의 용도는 하기 화학식 IIIb의 화합물의 용도이다:
[화학식 IIIb]
상기 화학식 IIIb에서,
R1은 F이고 R2는 H이거나;
R1은 H이고 R2는 F이거나;
R1은 F이고 R2는 F이고;
R3은 OH이며;
A는 O이고;
R4는 수소, 메틸, 메톡시 또는 OH이며;
R5는 수소, F 또는 메톡시이고;
R6은 수소 또는 OH이며;
B는 -CH2-, -CO-NH-CH2-; -O- 또는 -CO-CH2-CH2-이고;
Cyc1은 페닐이며;
R7은 수소이고;
R8은 수소, OH, 에틸, Cl, OCF3 또는 메톡시이며;
R9는 수소이거나;
R8 및 R9는 함께 -CH=CH-O- 또는 -CH2-CH2-O-이다.
R1이 H이고 R2가 F인 화학식 III의 화합물의 용도가 특히 추가로 매우 바람직하다.
치환체 R4, R5, R6, R7, R8 및 R9에서의 알킬 라디칼은 직쇄형 또는 분지형일 수 있다. 할로겐은 F, Cl, Br 또는 I를 의미하며, 바람직하게는 F 또는 Cl이다.
본 발명은 호변 이성체, 라세미체, 라세미체 혼합물 및 순수한 거울상 이성질체의 형태인 화학식 I, II 및 III의 화합물 및 이들의 부분 입체 이성질체, 및 이들의 혼합물에 관한 것이다. 본 발명은 모든 이들 이성질체를 포함하며 필요한 경우 화학식 I, II 및 III의 화합물의 호변이성질체 형태를 포함한다. 이들 이성질체 형태는 명확히 기재되어 있지 않은 경우(몇몇의 경우) 공지 방법에 의해 수득할 수 있다.
약제학적으로 허용되는 염은 이들의 수용성이 출발 또는 기본 화합물의 수용성보다 크기 때문에 의약 용도로 특히 적합하다. 이들 염은 약제학적으로 허용되는 음이온 또는 양이온을 갖는다. 본 발명에 따른 화합물의 적합한 약제학적으로 허용되는 산 부가염은 염산, 브롬화수소산, 인산, 메타인산, 질산 및 황산과 같은 무기산, 및 예를 들면 아세트산, 벤젠설폰산, 벤조산, 시트르산, 에탄설폰산, 푸마르산, 글루콘산, 글리콜산, 이세티온산, 락트산, 락토바이온산, 말레산, 말산, 메탄설폰산, 석신산, p-톨루엔설폰산 및 타르타르산과 같은 유기산의 염이다. 적합한 약제학적으로 허용되는 염기성 염은 암모늄 염, 알카리 금속염(예, 나트륨 및 칼륨 염), 알카리 토금속 염(예, 마그네슘 및 칼슘 염) 및 트로메타몰의 염(2-아미노-2-하이드록시메틸-1,3-프로판디올), 디에탄올아민, 라이신 또는 에틸렌디아민이다.
약제학적으로 허용되지 않는 음이온(예, 트리플루오로아세테이트)과의 염도 약제학적으로 허용되는 염의 제조 또는 정제를 위한 중간체로서 유용한 것으로서 및/또는 비치료용(예, 시험관내에서 응용)으로서 본 발명의 범위에 속한다.
본원에 사용된 용어 "생리학적 기능성 유도체"는 본 발명에 따른 화학식 I, II 및 III의 화합물의 생리학적으로 허용되는 임의의 유도체를 가리키며, 예로는 사람과 같은 포유동물에 투여했을 때 화학식 I, II 및 III의 화합물 또는 이의 활성 대사물을 (직접적으로 또는 간접적으로) 형성할 수 있는 에스테르를 들 수 있다.
생리학적 기능성 유도체는 예를 들어 H, Okada et al., Chem. Pharm. Bull. 1994, 42, 57-61에 기술된 바와 같은 본 발명의 화합물의 프로드러그를 포함한다. 이와 같은 프로드러그는 생체내에서 본 발명의 화합물로 대사될 수 있다. 이들 프로드러그는 자체로 활성일 수 있거나 그렇지 않을 수 있다. 당의 6번 위치의 카보네이트(참조: WO 0280936 및 WO 0244192)가 바람직하며, 특히 메틸 카보네이트 및 에틸 카보네이트가 바람직하다.
또한, 본 발명의 화합물은 무정형 및 결정성 다형형과 같은 다양한 다형 형태로 존재할 수 있다. 본 발명에 따른 화합물의 모든 다형 형태는 본 발명의 범위에 속하며 본 발명의 추가의 관점이다.
이하에 언급되는 모든 "화학식 I, II 및 III의 화합물(들)"은 상기된 화학식 I, II 및 III의 화합물(들) 및 본원에 기술된 그들의 염, 용매화물 및 생리학적 기능성 유도체를 가리킨다.
도 1 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 전신 - LSMean (SELSM)
도 2 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 요추 - LSMean (SELSM)
도 3 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 전체 대퇴골 - LSMean (SELSM)
도 4 - 사전처리 기간으로부터의 변화 비율(%)로서 이중에너지 X-선 흡수 계측법에 의한 골 밀도 측정값 - 중간 대퇴골 - LSMean (SELSM)
도 2 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 요추 - LSMean (SELSM)
도 3 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 전체 대퇴골 - LSMean (SELSM)
도 4 - 사전처리 기간으로부터의 변화 비율(%)로서 이중에너지 X-선 흡수 계측법에 의한 골 밀도 측정값 - 중간 대퇴골 - LSMean (SELSM)
용도
화학식 I, II 및 III의 화합물은 글루코스 대사에 대한 이로운 효과에 의해 구분된다; 특히 이들 화합물은 혈당 수준을 강하시키며 1형 및 2형 당뇨병의 치료에 적합하다. 따라서, 이들 화합물은 단독으로 사용하거나 다른 혈당 강하 활성 성분 (항당뇨병제)와 배합하여 사용할 수 있다.
또한, 화학식 I, II 및 III의 화합물은 당뇨병의 후기 손상, 예를 들면 신장병, 망막병증, 신경병증 및 X 증후군, 비만, 심근경색, 말초 동맥 폐색증, 혈전증, 동맥경화증, 염증, 면역 질환, 자가면역 질환(예, AIDS), 천식, 골다공증, 암, 건선, 알츠하이머병, 정신분열증 및 감염성 질환의 예방 및 치료에 적합하고, 바람직하게는, 1형 및 2형 당뇨병의 치료 및 당뇨병의 후기 손상인 X 증후군 및 비만의 예방 및 치료에 적합하다.
또한, 화학식 I, II 및 III의 화합물과 같이 SGLT-1/SGLT-2 억제제 활성을 갖는 화합물에 대해 동물 연구에서 얻은 예상치 못한 결과는 골 파라미터에 대한 이로운 효과를 입증한다.
궁극적으로 이들 화합물은 골 전환을 감소시켜 골 질량 및 골 강도와 연관된 파라미터에 양성 효과를 제공할 수 있다. 따라서, 화학식 I, II 및 III의 화합물과 같이 SGLT-1/SGLT-2 억제제 활성을 갖는 화합물은 골다공증, 골용해 또는 관절 임플란트에서의 무균성 이완과 같은 골 질환의 예방 및/또는 치료에 적합하고, 바람직하게는 골다공증의 예방 및/또는 치료에 사용된다.
제형
목적하는 생물학적 효과를 달성하는데 필요한 화학식 I, II 및 III의 화합물의 양은 많은 요인에 의해 좌우되며, 예로는 선택된 특정 화합물, 의도하는 용도, 투여 방식 및 환자의 임상 상태를 들 수 있다. 일반적으로, 일일 용량은 하루 당 및 체중 킬로그램 당 0.3 mg 내지 100 mg(전형적으로는 3 mg 내지 50 mg의 범위)이며, 예를 들면 3 내지 10 mg/kg/일이다. 예를 들면, 정제 또는 캡슐과 같이 경구로 투여될 수 있는 단일 용량의 제형은 예를 들면 1.0 내지 1000 mg을 함유할 수 있으며, 전형적으로는 10 내지 600 mg이다. 상기된 증세의 치료요법에 관해서, 화학식 I, II 및 III의 화합물은 화합물 자체로 사용할 수 있으나, 바람직하게는 허용되는 담체와 함께 약제학적 조성물의 형태로 사용한다. 물론, 담체는 조성물의 다른 성분들과 혼화할 수 있고 환자의 건강에 해를 주지 않는 의미로 허용되는 것이다. 담체는 고체, 액체 또는 양쪽 다 가능할 수 있으며, 예를 들어, 0.05 내지 95 중량%의 활성 성분을 함유할 수 있는 정제와 같이 화합물과 단일 용량으로서 제형화되는 것이 바람직하다. 마찬가지로 화학식 I, II 및 III의 다른 화합물을 포함하여 다른 약제학적 활성 물질이 함유될 수 있다. 본 발명의 약제학적 조성물은 공지된 약제학적 방법 중 하나에 따라 제조할 수 있으며, 그러한 방법은 필수적으로 성분들을 약물학적으로 허용되는 담체 및/또는 부형제와 혼합하는 것으로 구성된다.
본 발명의 약제학적 조성물은, 비록 가장 적합한 투여 방식이 각 환자가 치료받아야 하는 증세의 특성 및 중증도나 각 경우에 사용된 화학식 I, II 및 III의 화합물의 특성에 의해 좌우되지만, 경구, 직장, 국소, 구강(예를 들면, 설하)으로 투여하는 것이 적합하다. 또한, 피복 제형 및 서방성 피복 제형이 본 발명의 범위에 속한다. 바람직하게는, 내산성 및 위액 내성 제형이다. 위액에 내성인 적합한 피복제는 셀룰로스 아세테이트 프탈레이트, 폴리비닐 아세테이트 프탈레이트, 하이드록시프로필메틸셀룰로스 프탈레이트 및 메타크릴산과 메틸 메타크릴레이트의 음이온성 중합체를 포함한다.
경구 투여에 적합한 약제학적 화합물은 개별 단위 형태(예, 화학식 I, II 및III의 화합물을 한정량으로 함유하는 각각의 캡슐, 카세, 흡입정 또는 정제); 산제 또는 과립 형태; 수성 또는 비수성 액체의 용액 또는 현탁액 형태; 또는 유중수 또는 수중유 에멀젼 형태일 수 있다. 이들 조성물은 상기된 바와 같이 활성 성분과 담체(하나 이상의 추가 성분들로 구성될 수 있음)를 접촉시키는 단계를 포함하는 임의의 적합한 약제학적 방법에 의해서도 제조할 수 있다. 일반적으로, 조성물은 활성 성분을 액체 및/또는 미분 고체 담체와 균일하고 균질하게 혼합한 후 필요한 경우 산물을 타정함으로써 제조한다. 따라서, 예를 들면, 화합물의 분말 또는 과립을 필요한 경우 하나 이상의 추가 성분과 함께 압축 또는 성형하여 정제를 제조할 수 있다. 압축 정제는 적합한 기기에서 예를 들면, 분말 또는 과립과 같은 자유-유동성 형태의 화합물을 필요한 경우 결합제, 활택제, 불활성 희석제 및/또는 하나(또는 그 이상)의 계면활성/분산제(들)와 혼합하여 타정함으로써 제조할 수 있다. 성형 정제는 적합한 기기에서 분말 형태이고 불활성 액체 희석제로 습윤된 화합물을 성형하여 제조할 수 있다.
구강(설하) 투여에 적합한 약제학적 조성물은 화학식 I, II 및 III의 화합물을 풍미제(보통 슈크로스 및 아라비아 고무 또는 트래거캔스)와 함께 함유하는 흡입정 및 화합물을 젤라틴과 글리세롤 또는 슈크로스와 아라비아고무와 같은 불활성 기제 중에 함유하는 패스틸제를 포함한다.
비경구 투여에 적합한 약제학적 조성물은 바람직하게는 의도된 수령인의 혈액과 등장성인 화학식 I, II 및 III의 화합물의 멸균 수성 제제를 포함하는 것이 바람직하다. 이들 제제는 바람직하게는 정맥내로 투여되지만, 또한 피하, 근육내 또는 경피 주사로 투여될 수 있다. 바람직하게는 이들 제제는 화합물을 물과 혼합하고 생성된 용액을 멸균시키고 혈액과 등장성으로 만들어 제조할 수 있다. 본 발명의 주사 가능한 조성물은 일반적으로 0.1 내지 5 중량%의 활성 화합물을 함유한다.
직장 투여에 적합한 약제학적 조성물은 바람직하게는 단일 용량의 좌제 형태이다. 이들은 화학식 I, II 및 III의 화합물을 하나 이상의 통상적인 고체 담체(예, 코코아 버터)와 혼합하고 생성된 혼합물을 타정함으로써 제조할 수 있다.
피부에 국소적으로 사용하기에 적합한 약제학적 조성물은 바람직하게는 연고, 크림, 로션, 페이스트, 스프레이, 에어로졸 또는 오일의 형태이다. 사용될 수 있는 담체는 페트롤라툼, 라놀린, 폴리에틸렌 글리콜, 알코올 및 이들 물질의 두 가지 이상의 배합물이다. 일반적으로, 활성 성분은 조성물의 0.1 내지 15 중량%의 농도로 존재하며, 예를 들면 0.5 내지 2중량%이다.
또한 경피 투여가 가능하다. 경피 용도에 적합한 약제학적 조성물은 환자의 진피와 장기간 밀착하기에 적합한 일회용 반창고 형태일 수 있다. 적합하게는 그와 같은 반창고는 적절히 완충된 활성 성분을 접착제 중에 용해 및/또는 분산시키거나 중합체 중에 분산시켜 함유한다. 적합한 활성 성분 농도는 약 1% 내지 35%이며, 바람직하게는 약 3% 내지 15%이다. 특별하게, 활성 성분은 예를 들어 Pharmaceutical Research, 2(6): 318 (1986)에 기술된 바와 같이 전계 확산 또는 이온토포레시스에 의해 방출시킬 수 있다.
예시 화합물의 제조는 아래에 상세히 기술된다. 화학식 I의 화합물은 WO 0414932 및 WO 0418491에 기술된 방법과 유사하게 또는 그 방법에 따라서 수득할 수 있다.
화학식 II의 화합물은 공정 A, B 및 C로 도시한 아래 반응식에 따라서 수득할 수 있다.
공정 A:
공정 B:
공정 C:
공정 A, B 및 C에 도시된 반응식은 부가적으로 설명하지 않아도 이해될 수 있으며 이에 당업자에 의해 실시될 수 있다. 그럼에도 불구하고 보다 자세한 설명이 실험부에 기술되어 있다. 실시예 1 내지 31의 화합물은 공정 A, B 및 C에 의해 수득되었다. 화학식 II의 다른 화합물은 상응하게 또는 공지된 공정에 의해 수득할 수 있다.
화학식 III의 화합물은 아래 공정 A3 내지 F3의 반응식에 따라서 수득할 수 있다.
공정 A3:
공정 B3:
공정 C3:
공정 D3:
공정 E3:
공정 F3:
공정 A3 내지 F3에 도시된 반응식은 부가적으로 설명하지 않아도 이해될 수 있으며 이에 당업자에 의해 실시될 수 있다. 그럼에도 불구하고 보다 자세한 설명이 실시예에 기술되어 있다. 실시예 1 내지 24의 화합물은 공정 A3 내지 F3에 의해 수득되었다. 화학식 III의 다른 화합물은 상응하게 또는 공지된 공정에 의해 수득할 수 있다.
또한, 화학식 I, II 및 III의 화합물(들)은 다른 활성 성분과 배합하여 투여될 수 있다.
배합 생성물에 적합한 추가의 활성 성분은 Rote Liste 2001, chapter 12에 기술된 모든 항당뇨병제이다. 이들은 특히 효과의 상승적 향상을 위해 본 발명의 화학식 I, II 및 III의 화합물과 배합될 수 있다. 활성 성분 배합물의 투여는 환자에게 활성 성분의 개별 투여에 의해서거나 복수의 활성 성분들이 하나의 약제학적 제제에 존재하는 배합 생성물의 형태로 이루어질 수 있다. 하기에 열거된 활성 성분 중 대부분은 USP Dictionary of USAN 및 International Drug Names, US Pharmacopeia, Rockville 2001에 기술되어 있다.
항당뇨병제는 인슐린 및 인슐린 유도체(예, Lantus®(참조: www.lantus.com) 또는 HMR 1964), 속효성 인슐린(참조: 미국특허 제6,221,633호), GLP-1 유도체(예, Novo Nordisk A/S의 WO 98/08871에 기술된 것) 및 경구적으로 효과적인 혈당강하 활성 성분을 포함한다.
경구적으로 효과적인 혈당강하 활성 성분은 바람직하게는 설포닐우레아, 비구아니딘, 메글리티니드, 옥사디아졸리딘디온, 티아졸리딘디온, 글루코시다제 억제제, 글루칸 길항제, GLP-1 효능제, 칼륨 채널 개시제(예, Novo Nordisk A/S의 WO 97/26265 및 WO 99/03861에 기술된 것), 인슐린 감작제, 글루코스 신생합성 및/또는 글리코겐 분해의 자극에 연루된 간 효소의 억제제, 글루코스 흡수 조절제, 지질대사 변경 화합물(예, 항고지혈증 활성 성분), 식욕 억제 화합물, PPAR 및 PXR 효능제 및 베타 세포의 ATP-의존성 칼륨 채널에 작용하는 활성 성분을 포함한다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 심바스타틴, 플루바스타틴, 프라바스타틴, 로바스타틴, 아토르바스타틴, 세리바스타틴 및 로수바스타틴과 같은 HMGCoA 리덕타제 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 에제티미베, 티퀘사이드 및 파마퀘사이드와 같은 콜레스테롤 흡수 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 로시글리타존, 피오글리타존, JTT-501 및 GI 262570과 같은 PPAR 감마 효능제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, GW 9578 및 GW 7647과 같은 PPAR 알파 효능제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, GW 1536, AVE 8042, AVE 8134, AVE 0847, AVE 0897 및 WO 00/64888, WO 00/64876 또는 WO 03/20269에 기술된 것과 같은 혼합된 PPAR 알파/감마 효능제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 페노피브레이트, 클로피브레이트 및 베자피브레이트와 같은 피브레이트와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 임플리타파이드, BMS-201038 및 R-103757과 같은 MTP 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, HMR 1741과 같은 담즙산 흡수 억제제(예, 미국특허 제6,245,744호 또는 제6,221,897호 참조)와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, JTT-705와 같은 CETP 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 콜레스티라민 및 콜레세벨람과 같은 담즙산 흡수제 중합체와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, HMR1171 및 HMR1586과 같은 LDL 수용체 유도체(참조: 미국특허 제6,342,512호)와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 아바시미베와 같은 ACAT 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, OPC-14117과 같은 항산화제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, NO-1886과 같은 지단백질 리파제 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, SB-204990과 같은 ATP-시트레이트 리아제 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, BMS-188494와 같은 스쿠알렌 합성 효소 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, CI-1027 또는 니콘틴산과 같은 지단백질 길항제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 오를리스타트와 같은 리파제 억제제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 인슐린과 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면 톨부타미드, 글리벤클라마이드, 글리피자이드 또는 글리메피라이드와 같은 설포닐우레아와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 메트포르민과 같은 비구아나이드와 배합하여 투여된다.
한 가지 추가의 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 라파글리나이드와 같은 메글리티나이드와 배합하여 투여된다.
한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 트로글리타존, 시글리타존, 피오글리타존, 로시글리타존 또는 Dr. Reddy's Research Foundation의 WO 97/41097에 기술된 화합물, 특히 5-[[4-[(3,4-디하이드로-3-메틸-4-옥소-2-퀴나졸리닐메톡시]페닐]메틸]-2,4-티아졸리딘디온과 같은 티아졸리딘디온과 배합하여 투여된다.
한 가지 양태로서, 화학식 I, II 및 III의 화합물은 예를 들면, 미글리톨 또는 아카보스와 같은 α-글루코시다제 억제제와 배합하여 투여된다.
한 가지 양태로서, 화학식 I, II 및 III의 화합물은 베타 세포의 ATP-의존성 칼륨 채널에 작용하는 활성 성분(예, 톨부타마이드, 글리벤클라마이드, 글리피자이드, 글리메피라이드 또는 레파글리나이드)과 배합하여 투여된다.
한 가지 양태로서, 화학식 I, II 및 III의 화합물은 상기된 화합물 중 하나 이상과 배합하여, 예를 들면 설포닐우레아와 메트포르민과 배합하여, 설포닐우레아와 아카보스와 배합하여, 레파글리나이드와 메트포르민과 배합하여, 인슐린과 설포닐우레아와 배합하여, 인슐린과 메트포르민과 배합하여, 인슐린과 트로글리타존과 베합하여, 인슐린과 로바스타틴과 배합하여 투여된다.
추가의 양태로서, 화학식 I, II 및 III의 화합물은 CART 조절제(참조: "Cocaine-amphetamine-regulated transcript influences energy metabolism, anxiety and gastric emptying in mice" Asakawa, A, et al., M.: Hormone and Metabolic Reseach (2001), 33(9), 554-558), NPY 길항제(예, 나프탈렌-1-설폰산 {4-[(4-아미노퀴나졸린-2-일아미노)메틸]-사이클로헥실메틸}아마이드; 하이드로클로라이드(CGP 71683A)), MC4 효능제(예, 1-아미노-1,2,3,4-테트라하이드로나프탈렌-2-카르복실산[2-(3a-벤질-2-메틸-3-옥소-2,3,3,a,4,6,7-헥사하이드로피라졸로[4,3-c]피리딘-5-일)-1-(4-클로로페닐)-2-옥소에틸]-아미드; (WO 01/91752)), 오렉신 길항제(예, 1-(2-메틸벤조옥사졸-6-일)-3-[1,5]나프티리딘-4-일우레아; 하이드로클로라이드(SB-334867-A)), H3 효능제(3-사이클로헥실-1-(4,4-디메틸-1,4,6,7-테트라하이드로이미다조[4,5-c]피리딘-5-일)프로판-1-온 옥살산 염(WO 00/63208)); TNF 효능제, CRF 길항제(예, [2-메틸-9-(2,4,6-트리메틸페닐)-9H-1,3,9-트리아자플루오렌-4-일]디프로필아민(WO 00/66585)), CRF BP 길항제(예, 유로코르틴), 유로코르틴 효능제, β3 효능제(예, 1-(4-클로로-3-메탄설포닐메틸페닐)-2-[2-(2,3-디메틸-1H-인돌-6-일옥시)에틸아미노]-에탄올 하이드로클로라이드(WO 01/83451)), MSH(멜라닌세포-자극 호르몬) 효능제, CCK-A 효능제(예, {2-[4-(4-클로로-2,5-디메톡시페닐)-5-(2-사이클로헥실에틸)티아졸-2-일카르바모일]-5,7-디메틸인돌-1-일}아세트산 트리플루오로아세트산 염(WO 99/15525)), 세로토닌 재흡수 억제제(예, 덱스펜플루라민), 혼합된 세로토닌성과 노르아드레날린성 화합물(예, WO 00/71549), 5HT 효능제(예, 1-(3-에틸벤조푸란-7-일)피페라진 옥살산 염(WO 01/09111), 봄베신 효능제, 갈라닌 길항제, 성장 호르몬(예, 사람 성장 호르몬), 성장 호르몬-분비 화합물(6-벤질옥시-1-(2-디이소프로필아미노에틸카르바모일)-3,4-디하이드로-1H-이소퀴놀린-2-카르복실산 3급-부틸 에스테르(WO 01/85695)), TRH 효능제(예를 들면, EP 0 462 884 참조), 비결합 단백질 2 또는 3 조절제, 렙틴 효능제(예를 들면, Lee, Daniel W.; Leinung, Matthew C.; Rozhavskaya-Arena, Marina; Grasso, Patricia. Leptin agonists as a potential approach to the treatment of obesity. Drugs of the Future (2001), 26(9), 873-881 참조), DA 효능제(브로모크립틴, 도프렉신), 리파제/아밀라제 억제제(예, WO 00/40569), PPAR 조절제(예, WO 00/78312), RXR 조절제 또는 TR-β 효능제와 배합하여 투여된다.
본 발명의 한 가지 양태로서, 다른 활성 성분은 렙틴(참조예: "Perspectives in the therapeutic use of leptin", Salvador, Javier; Gomez-Ambrosi, Javier; Fruhbeck, Gema, Expert Opinion on Pharmacotherapy (2001), 2(10), 1615-1622).
한 가지 양태로서, 다른 활성 성분은 덱삼파타민 또는 암페타민이다.
한 가지 양태로서, 다른 활성 성분은 펜플루라민 또는 덱스펜플루라민이다.
다른 양태로서, 다른 활성 성분은 시부트라민이다.
한 가지 양태로서, 다른 활성 성분은 오를리스타트이다.
한 가지 양태로서, 다른 활성 성분은 마진돌 또는 펜테르민이다.
한 가지 양태로서, 화학식 I, II 및 III의 화합물은 증량제, 바람직하게는 불용성 증량제(참조예: carob/Caromax®(Zunft H J., et al., Carob pulp preparation for treatment of hypercholesterolemia, ADVANCES IN THERAPY (2001 Sep-Oct), 18(5), 230-6)와 배합하여 투여된다. Caromax는 Nutrinova, Nutrition Specialties & Food Ingredients GmbH(Industriepark Hochst, 65926 Frankfurt/Main)의 carob-함유 생성물이다. Caromax®는 하나의 제제로 투여 가능하며, 또한 화학식 I, II 및 III의 화합물과 별도로 투여하는 것도 가능하다. 이와 관련하여 Caromax®는 예를 들면, 베이커리 제품 또는 뮈슬리바와 같은 식품의 형태로도 투여될 수 있다.
본 발명의 화합물이 상기된 화합물 중 하나 이상 및 임의로 다른 약물학적 활성 물질 하나 이상의 모든 적합한 배합은 본 발명의 범위에 포함되는 것으로 간주되어야 한다.
화합물의 활성은 다음과 같이 시험되었다:
토끼, 랫트 및 돼지의 소장으로부터의 융모막 소포의 제조
소위 Mg2 + 침전법에 의해 소장 세포로부터 융모막 소포를 제조하였다. 소장의 점막을 박리하고 60 ml의 빙냉 Tris/HCl 완충액(pH 7.1)/300 mM 만니톨, 5 mM EGTA에 현탁시켰다. 빙냉 증류수로 300 ml로 희석한 후 빙냉시키면서 Ultraturrax(18 축, IKA Werk Staufen, FRG)로 최대 전력의 75%에서 2 x 1분간 균질화하였다. 3 ml의 1M MgCl2 용액을 첨가한 후(최종 농도 10 mM) 혼합물을 정확하게 15분 동안 0℃에 방치해 두었다. Mg2+의 첨가에 의해 융모막을 제외한 세포막이 응집하여 침전한다. 3,000 x g(5000 rpm, SS-34 회전자)로 15분 원심분리한 후, 침전물을 버리고 융모막을 함유한 상청액을 26,700 x g (15,000 rpm, SS-34 회전자)로 30분간 원심분리한다. 상청액을 버리고, 침전물을 Potter Elvejhem 균질화기(Braun, Melsungen, 900 rpm, 10회 스트로크)를 이용하여 60 ml의 12 mM Tris/HCl 완충액(pH 7.1)/60 mM 만니톨, 5 mM EGTA에 재균질화한다. 0.1 ml의 1M MgCl2 용액을 첨가하고 0℃에서 15분간 배양한 후 다시 3000 x g로 15분간 원심분리한다. 이어서, 상청액을 재차 46,000 xg(20,000 rpm, SS-34 회전자)로 30분간 원심분리한다. 침전물을 30 ml의 20 mM Tris/Hepes 완충액(pH 7.4)/280 mM 만니톨에 충진시키고 Potter Elveihem 균질화기를 1,000 rpm으로 이용하여 20회 스트로크에 의해 균질하게 재현탁시킨다. 48,000 x g(20,000 rpm, SS-34 회전자)로 30분간 원심분리한 후, 침전물을 0.5 내지 2 ml의 Tris/Hepes 완충액(pH 7.4)/280 mM 만니톨에 충진시키고(최종 농도 20 mg/ml), 27 게이지 침의 투베르쿨린 주사기를 사용하여 재현탁시킨다.
소포는 표지 또는 이송 연구를 위해 제조한 후 직접 사용하거나 액체 질소하에 4 mg씩 분취하여 -196℃에 보관해 두었다.
랫트의 소장으로부터 융모막 소포를 제조하기 위해, 6 내지 10 마리 수컷 Wistar 랫트(Kastengrund, Aventis Pharma에서 사육)를 경추 탈골에 의해 사멸시키고, 소장을 제거하여 냉각 등장 염수로 세정하였다. 장을 절단하고 점막을 박리하였다. 상기한 바와 같이 융모막을 분리하였다. 세포 골격 분획을 제거하기 위해 랫트 소장 유래의 융모막 소포를 카오트로픽 이온으로서 KSCN으로 처리하였다.
토끼 소장으로부터 융모막을 제조하기 위해, 토끼에 테트라카인 HCl 2.5 mg, m-부트라마이드 100 mg 및 메베조늄 요오다이드 25 mg의 수용액 0.5 ml를 정맥내 주사로 사멸시켰다. 소장을 제거하고 빙냉 생리 식염수로 세정한 다음, 4 내지 12주 동안 -80℃, 질소 하에 플라스틱 백에 동결 보존하였다. 막 소포의 제조를 위해, 동결된 장을 30℃ 수욕에서 해동한 후 점막을 박리하였다. 상기한 바와 같이 막 소포를 제공하기 위해 프로세싱하였다.
돼지 장으로부터 융모막 소포를 제조하기 위해, 방금 도살된 돼지의 공장 절편을 빙냉 등장 염수로 세정하고 -80℃, 질소 하에 플라스틱 백에 동결 보존하였다. 상기한 바와 같이 막 소포를 제조하였다.
융모막 소포에 의한 글루코스 흡수의 측정
융모막 소포 내로 [14C]-표지된 글루코스의 흡수를 막 여과법으로 측정하였다. 10 mM Tris/Hepes 완충액(pH 7.4)/300 mM 만니톨 중의 융모막 소포 10 ㎕를 20℃에서 10 mM Tris/Hepes 완충액(pH 7.4)/100 mM NaCl/100 mM 중의 10 pM [14C]D 글루코스 및 적당한 농도의 관련 억제제(5 내지 200 μM)의 용액 90 ㎕에 첨가하였다.
15초간 배양한 후, 1 ml의 빙냉 정지 용액(10 mM Tris/Hepes 완충액(pH 7.4)/150 mM KCl)을 첨가하여 이송 과정을 정지시키고, 즉시 소포 현탁액을 25 내지 35 mbar의 진공 하에서 셀룰로스 니트레이트 막 필터(0.45 ㎛, 25 mm 직경, Schleicher & Schull)를 통해 흡인 여과하였다. 필터를 5ml의 빙냉 정지 용액으로 세정하였다. 각각의 측정은 2회 또는 3회 측정으로 실시하였다.
방사선표지된 기질의 흡수를 측정하기 위해, 막 필터를 4 ml의 적절한 신틸레이터(Quickszint 361, Zinsser Analytik GmbH, Frankfurt am Main)에 용해시키고 액체 신틸레이션 측정에 의해 방사성을 측정하였다. 표준 시료를 이용한 기기의 교정 후 및 임의의 화학 발광의 존재를 보정한 후 측정값을 dpm(분당 분해)으로 수득하였다.
활성 성분들은 토끼 소장 융모막 소포에 대한 선택된 물질의 이송 검정에서 얻은 IC50 데이터를 기초로 활성에 대해 비교한다. (절대값은 종- 및 실험-의존성일 수 있다).
화합물의 활성을 시험하는 다른 방법은 사람 나트륨-의존성 글루코스 트랜스포터 1(SGLT1, SLC5A1)의 시험관내 이송 활성의 억제이다:
1. 사람 SGLT1 의 발현 벡터 클로닝
사람 SGLT1의 cDNA를 Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition에 기술된 바와 같은 분자 생물학의 표준 방법에 의해 pcDNA4/TO 벡터(Invitrogen)에 도입하였다. 이어서 삽입체를 서열 분석하였고, 그 결과 Hediger et al., Proc. Natl. Acad. Sci. USA 1989, 86, 5748-5752에 기술되어 있고 GenBank 서열 데이터베이스(GenBank 등록번호: M24847)에 기탁된 사람 SGLT1의 염기 서열 중 염기 11번 내지 2005번과 완전히 일치하였다. 염기 11번 내지 2005번은 사람 SGLT1의 완전한 암호 영역에 상응한다.
2. 사람 SGLT1 의 유도성 발현을 갖는 재조합 세포주의 제조
FuGene6 리포펙션(Roche)을 사용하여 CHO-TRex 세포(Invitrogen) 내로 사람 SGLT1의 발현 벡터를 도입하였다. 단일 세포 클론을 선별하기 위해, 세포 배양 배지(10% 소 태아 혈청(BD Biosciences), 10 ㎍/ml 블라스티시딘 S(CN Biosciences), 100 units/ml 페니실린, 100 units/ml 스트렙토마이신이 보충된 Nutrient Mixture F-12 (Ham), (Invitrogen))에 600 ㎍/ml Zeocin(Invitrogen)을 첨가하였다. 선별하여 얻은 단일 세포 클론의 기능을 방사성표지된 메틸 α-D-글루코피라노사이드에 대한 흡수 활성을 통해 시험하였다. 메틸 α-D-글루코피라노사이드에 대해 가장 높은 흡수 활성을 갖는 세포 클론(이하, CHO-TRex-hSGLT1이라 한다)이 추가 실험을 위해 선별되었고 600 ㎍/ml Zeocin의 존재 하에 계속 배양하였다.
3. 메틸 α-D- 글루코피라노사이드(α-MDG)의 흡수에 대한 피검 물질의 억제 효과의 측정
CHO-TRex-hSGLT1 세포를 세포 배양 배지 중 Cytostar-T 신틸레이션 96-웰 평판(Amersham Biosciences)에 웰당 50,000 세포의 농도로 식종하고 24시간 배양하였다. 1 ㎍/ml 테트라사이클린을 첨가하여 추가로 24시간 동안 재조합 사람 SGLT1의 발현을 유도하였다. α-MDG 흡수 실험을 위해, 세포를 PBS로 세척한 다음 1시간 동안 37℃에서 기아상태로 두었다(10% 소 태아 혈청이 보충된 PBS). 이송 검정 완충액(140 mM 염화나트륨, 2 mM 염화칼륨, 1 mM 염화마그네슘, 1 mM 염화칼슘, 10 mM HEPES/Tris, pH 7.5)으로의 추가 세척 단계 후, 세포를 피검 물질의 부재 하에 또는 각종 농도로 존재 하에 실온에서 15분간 배양하였다. 디메틸 설폭사이드 중의 10 mM 원액으로 출발하여 이송 검정 완충액(40 ㎕/웰)에 피검 물질을 적절히 희석하였다. 그런 후 방사성표지된 메틸 α-D-[U-14C]글루코피라노사이드(Amersham)와 비표지된 메틸 α-D-글루코피라노사이드(Acros)의 혼합물 10 ㎕를 첨가하여 검정을 개시하였다. 검정에서 메틸α-D-글루코피라노사이드의 최종 농도는 50 μM이었다. 실온에서 30분간 배양한 후 이송 검정 완충액(4℃)에 50 ㎕/웰의 10 mM 메틸 α-D-글루코피라노사이드를 첨가하여 반응을 정지시키고, MicroBeta Scintillation Microplate Reader(Wallac)로 세포에 의한 방사성 흡수를 측정하였다. 피검 물질의 최대-절반 억제 효과(IC50)를 다음과 같은 방식으로 측정하였다:
1. 0% 억제 값의 설정. 이것은 피검 물질의 부재하에 나트륨-함유 이송 검정 완충액에서 측정한 값이다.
2. 100% 억제 값의 설정. 이것은 물질의 부재 하에 나트륨-유리된 이송 검정 완충액(140 mM 콜린 클로라이드, 2 mM 염화칼륨, 1 mM 염화마그네슘, 1 mM 염화칼슘, 10 mM HEPES/Tris, pH 7.5)에서 측정한 값이다.
3. 각종 농도로 피검 물질의 존재 하에 실시된 측정에서의 억제율(%)의 계산. 이로부터 메틸 α-D-글루코피라노사이드의 흡수를 50%(IC50)까지 감소시킨 피검 물질의 농도를 확인하는 것이 가능하였다.
사람 나트륨-의존성 글루코스 트랜스포터 2(SGLT2, SLC5A2)의 이송 활성의 시험관내 억제
1. 사람 SGLT2 의 발현 벡터 클로닝
사람 SGLT2의 cDNA를 Sambrook et al., Molecular Cloning, A Laboratory Manual, Second Edition에 기술된 바와 같은 분자 생물학의 표준 방법에 의해 pcDNA4/TO 벡터(Invitrogen)에 도입하였다. 이어서 삽입체를 서열분석하였고, 그 결과 Wells 등에 의해 기술되어 있고 GenBank 서열 데이터베이스(GenBank 등록번호 M95549)에 기탁된 사람 SGLT2의 염기 서열 중 21번 내지 2039번과 완전히 일치하였다. 염기 21번 내지 2039번은 사람 SGLT2의 완전한 암호 영역에 상응한다.
2. 사람 SGLT2 의 유도성 발현을 갖는 재조합 세포주의 제조
FuGene6 리포펙션(Roche)을 사용하여 CHO-TRex 세포(Invitrogen) 내로 사람 SGLT2의 발현 벡터를 도입하였다. 단일 세포 클론을 선별하기 위해, 세포 배양 배지(10% 소 태아 혈청(FBS Gold, PAA), 10 ㎍/ml 블라스티시딘 S(CN Biosciences), 100 units/ml 페니실린, 100 units/ml 스트렙토마이신이 보충된 Nutrient Mixture F-12 (Ham)(Invitrogen))에 600 ㎍/ml Zeocin(Invitrogen)을 첨가하였다. 선별하여 얻은 단일 세포 클론의 기능을 방사성 표지된 메틸 α-D-글루코피라노사이드에 대한 흡수 활성을 통해 시험하였다. 메틸 α-D-글루코피라노사이드에 대해 가장 높은 흡수 활성을 갖는 세포 클론(이하, CHO-TRex-hSGLT2라 한다)이 추가 실험을 위해 선별되었고 600 ㎍/ml Zeocin의 존재 하에 계속 배양하였다.
3. 메틸α-D-글루코피라노사이드 (α-MDG)의 흡수에 대한 피검 물질의 억제 효과의 측정
CHO-TRex-hSGLT2 세포를 세포 배양 배지 중 Cytostar-T 신틸레이션 96-웰 평판(Amersham Biosciences)에 웰당 50,000 세포의 농도로 식종하고 24시간 배양하였다. 1 ㎍/ml 테트라사이클린을 첨가하여 추가로 24시간 동안 재조합 사람 SGLT2의 발현을 유도하였다. α-MDG 흡수 실험을 위해, 세포를 PBS로 세척한 다음 1시간 동안 기아 배지(10% 소 태아 혈청이 보충된 PBS)에서 37℃에서 기아상태로 두었다. 이송 검정 완충액(140 mM 염화나트륨, 2 mM 염화칼륨, 1 mM 염화마그네슘, 1 mM 염화칼슘, 10 mM HEPES/Tris, pH 7.5)으로의 추가 세척 단계 후, 세포를 피검 물질의 부재 하에 또는 각종 농도로 존재하에 실온에서 15분간 배양하였다. 디메틸 설폭사이드 중의 10 mM 원액으로 출발하여 이송 검정 완충액(40 ㎕/웰)에 피검 물질을 적절히 희석하였다. 그런 후 방사성표지된 메틸 α-D-[U-14C]글루코피라노사이드(Amersham)와 비표지된 메틸 α-D-글루코피라노사이드(Acros)의 혼합물 10 ㎕/웰을 첨가하여 검정을 개시하였다. 검정에서 메틸α-D-글루코피라노사이드의 최종 농도는 50 μM이었다. 37℃에서 120분간 배양한 후 이송 검정 완충액(4℃)에 50 ㎕/웰의 10 mM 메틸 α-D-글루코피라노사이드를 첨가하여 반응을 정지시키고, MicroBeta Scintillation Microplate Reader(Wallac)로 세포에 의한 방사성 흡수를 측정하였다. 피검 물질의 최대-절반 억제 효과(IC50)를 다음과 같은 방식으로 측정하였다:
4. 0% 억제 값의 설정. 이것은 피검 물질의 부재 하에 나트륨-함유 이송 검정 완충액에서 측정한 값이다.
5. 100% 억제 값의 설정. 이것은 물질의 부재 하에 나트륨-유리된 이송 검정 완충액(140 mM 콜린 클로라이드, 2 mM 염화칼륨, 1 mM 염화마그네슘, 1 mM 염화칼슘, 10 mM HEPES/Tris, pH 7.5)에서 측정한 값이다.
6. 각종 농도로 피검 물질의 존재 하에 실시된 측정에서의 억제율(%)의 계산. 이로부터 메틸 α-D-글루코피라노사이드의 흡수를 50%(IC50)까지 감소시킨 피검 물질의 농도를 확인하는 것이 가능하였다.
문헌:
Wells et al. (1992) Am. J. Physiol. Vol. 263: F459-F465
피검 물질의 IC50 값(μM)
[메틸 α-D-글루코피라노사이드의 흡수의 시험관내 시험
화학식 I
화학식 II
화학식 III
시험관내 검사에 따라 상술한 바와 같은 재조합 SGLT1 및 SGLT2 표적을 사용하여 IC50 값을 수득했다.
실시예
각종 실시예의 제조가 아래에 상세히 기술되며, 화학식 I, II 및 III의 다른 화합물이 유사하게 수득되었다:
동물 연구 - 연구 디자인
암컷 Sprague-Dawley 성숙 및 미성숙 성체 랫트에 화학식 II의 실시예 5의 화합물을 최소 28일 동안 매일 위관 영양 투여에 따라 시험하여 골 질의 특정 종말점을 연구하였다.
피검 화합물:
연구 디자인은 아래 표에 상세히 기술되어 있다:
다음 항목이 평가되었다: 임상 징후(적어도 매주), 체중(매주), 사료 소모(매주), 호르몬(13일째 및 27일째), 골 전환의 혈청 및 뇨 생화학적 마커(13일째 및 27일째), 혈청화학(부검시), 이중 에너지 X-선 흡수계측법(DXA) 및 말초 정량 컴퓨터 단층촬영(pQCT)(2주째 및 4주째 뿐만 아니라 생체외)에 의한 골 밀도 측정, 부검시 현미경 관찰, 기관 중량, 조직병리, 생체역학적 강도 시험 및 대퇴부 길이 측정.
방법
1. 골 미네랄 밀도 측정
동물 처리에 대해 정보를 제공받지 않은 전문가에 의해 이중 에너지 X-선 흡수 계측법(DXA) 및 말초 정량 컴퓨터 단층촬영(pQCT)을 이용하여 골 밀도 스캔 및 평가를 실시하였다. 모든 동물은 각각의 처리 과정에서 동일한 밀도 측정기로 스캐닝되었다. DXA 및 pQCT 스캔은 동물이 받을 스트레스를 줄이기 위해 같은 날에 실시하였다. DXA 및 pQCT 스캔하기 전에 및 하는 동안에 동물들은 이소플루란을 이용하여 마취하였다. 마취 유도 후 각 안구에 안과용 윤활 연고를 투여하였고 필요한 경우 재차 적용하였다.
1.1 생체내 이중 에너지 X-선 흡수계측법(DXA)
Discovery A Hologic 밀도 측정기를 이용하여 골 미네랄 밀도 측정을 실시하였다. 모든 스캔 재분석 데이터가 유지되었고 재분석 결과들이 문서화되었다. DXA 스캔을 이용하여 골 미네랄 밀도(BMD) 및 골 미네랄 함량(BMC) 및 전신, 요추(L1-L4) 및 우측 대퇴골(근부, 중간부 및 말단부 대퇴골에서 해당 영역 전체)의 면적을 측정하였다. 각 연구 동물로부터 단일 스캔을 2주째 마지막에 처리 개시전 한번 획득하고 처리 기간 마지막에 재차 획득하였다. 동물들은 PCS-MTL 표준 운영 절차에 따라 처리되었다. 연구 감독관의 요청시 검증을 위해 추가의 스캔을 획득하였다. 스캔 방식 및 분석은 아래 표 1에 수록되어 있다:
1.2 말초 정량 컴퓨터 단층촬영(pQCT)
말초 QCT를 이용하여 모든 동물에 대해 골 미네랄 함량(BMC), 골 미네랄 밀도(BMD) 및 기하 변수를 측정하였다.
말초 QCT 스캔은 소프트웨어 버젼 5.50D의 XCT Research SA 또는 SA+ 골 스캐너를 이용하여 모든 동물의 우측 근위 경골에서 얻었다. 스캔은 근위 경골의 골간단 및 골간(각 부위에서 일회 슬라이스)에서 획득하였다. 최적의 스캔과 데이터 확보를 위해 적절하다고 판단되는 경우 추가의 슬라이스를 수득하였다. 이 경우에, 단지 최상의 스캔만이 고려되었다. 스캔 슬라이스의 정확한 위치가 원데이터에 문서로 정리되었다(표 4). 후속 스캔을 위해 CT 스캔 라인의 위치 및 설정이 확인되고 최초 스캐닝 동안 얻은 예비 스캔과 비교되었다.
골간단 부위의 경우, 스캔을 나타내기 위한 가장 적절한 분석 방식이 결정되어 문서로 정리되었고 표 2에 보고되어 있다. 골간 부위에서 수득한 스캔은 Cortmode 2를 이용하여 분석되었다(표 2). 보고된 스캐닝 변수는 표 3에 요약되어 있다. 모든 스캔 분석 데이터는 보존되었고 재분석은 문서로 정리되었다. 모든 분석은 LOOP 옵션을 이용하여 실시되었다. LOOP 옵션의 결과로서 생성된 모든 다른 데이터는 원데이터와 함께 보존되어 있으나 여기에 기술되지는 않는다.
골 미네랄 밀도의 측정 결과는 도면 및 표에 나타낸다:
도 1 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 전신 - LSMean (SELSM)
도 2 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 요추 - LSMean (SELSM)
도 3 - 사전처리 기간으로부터의 변화 비율(%)로서 이중 에너지 X-선 흡수계측법에 의한 골 밀도 측정값 - 전체 대퇴골 - LSMean (SELSM)
도 4 - 사전처리 기간으로부터의 변화 비율(%)로서 이중에너지 X-선 흡수 계측법에 의한 골 밀도 측정값 - 중간 대퇴골 - LSMean (SELSM)
[표 1a]
[표 2a]
[표 3a]
[표 4a]
2. 생체역학 시험
858 Mini Bionix Servohydraulic Test System 모델 242.03을 이용하여 생체역학 시험을 수행하였다. 모든 데이터는 TestStarTM 소프트웨어 버젼 4.0C 대신 TestWorks® 버젼 3.8A를 이용하여 수집하였다.
부검시 모든 시료를 세정하여 (박리되지 않은) 과도한 조직은 제거하고 염수로 적신 거즈로 각각 감고 플라스틱 필름으로 덮어 적절히 표지된 플라스틱 백에 넣는다. 골 시료는 아래와 같은 생체역학 평가를 실시할 때까지 냉동 상태(약 -20℃)를 유지하였다:
골 시험
우측 대퇴골 3점 굴곡 시험
요추(L3, L4) 압박 시험
2.1 시료 제조
시료를 하기와 같이 제조하기 전에 냉장고(약 4℃)에서 밤새 해동하거나 손질하는 당일에 냉동기에서 직접 꺼낸다(시험 당일이 아닌 다른 날에 제조하더라도 시험에 미치는 영향은 없다):
3점 굴곡 시험시, 우측 대퇴골로부터 연조직을, 특히 경간 영역의 골간에서 세척하여 제거하였다.
압박 시험의 경우, 추골궁을 제거하고 양쪽 추간판을 제거함으로써 척추골의 척추체를 분리하였다. 수득된 절편은 2개의 평행 절단면을 갖고 섬유주 골이 노출되었다.
2.2 3점 굴곡 시험
우측 대퇴골을 3점 굴곡 파손에 대해 시험하여 대퇴골 피질골의 재질 특성을 결정하였다. 앞쪽 측면에 표시된 점은 각 대퇴골에 대해 상부의 하중점으로서 작용하였고 액츄에이터는 파손이 일어날 때까지 1 mm/초의 속도로 설정되었다. 하중 및 변위 데이터를 수집하였다. 생성된 하중 대 변위 곡선으로부터 피크 하중을 결정하고 요골, 관성의 횡단 모멘트 및 기간을 이용하여 극한 응력으로 변환시켰다. 곡선 아래 면적(AUC)으로부터 파손 작업을 결정하고 인성을 계산하였다. 대략적인 중간 강성값(하중 대 변위 곡선의 선형/탄성 영역의 기울기로서 정의됨)을 기록하고 pQCT 데이터로부터 수득된 관성 모멘트를 이용하여 모듈러스를 계산하였다.
2.3 척추 압박
L3 및 L4 척추체를 압박 파손에 대해 시험하였다. 하중 속도는 20 mm/분으로 설정하였다. 하중 및 변위 데이터를 수집하고, pQCT 스캔으로부터 피크 하중, 강성, 개별 척추체 높이 및 횡단면적을 이용하여 겉보기 강도 및 모듈러스를 계산하였다. 곡선 아래 면적(AUC)으로부터 파손 작업을 결정하고 인성을 계산하였다. 0.2% 오프셋을 이용하여 처음에 항복 하중을 얻었지만 0.1% 오프셋이 더 적절한 것으로 판단되었고 항복 응력을 계산하였다. 0.2% 오프셋 항복 하중으로부터 얻은 모든 데이터는 연구 파일에 보존되었지만, 보고되지는 않았다. 아래 표 4는 보고된 생체역학 시험 및 변수를 요약한 것이다.
3 생체외 골 미네랄 밀도 측정
3.1 생체외 이중 에너지 X-선 흡수계측법(DXA)
DXA를 이용하여 골 미네랄 밀도(BMD), 골 미네랄 함량(BMC) 및 면적을 측정하였다. 처리 기간 종료 시점에 안락사된 모든 동물(손상된 대퇴골 관절구로 인한 세 마리 동물은 제외)뿐만 아니라 사망한 것으로 발견된 두 마리 동물로부터 절개된 우측 대퇴골에 대해 일회 DXA 스캔을 수득하였다. 각 동물 그룹에서 충분한 시료가 측정되었기 때문에 그러한 절개는 전체적인 연구 결과에 부정적 영향을 미치지 않았다. 스캔은 PCS-MTL 표준 작업 절차에 따라서 골밀도 측정기 Hologic Discovery A로 실시하였다. 표 5는 보고된 스캔 부위를 요약한 것이다:
3.2 생체외 말초 정량 컴퓨터 단층촬영(pQCT)
소프트웨어 버젼 5.50D가 설치된 XCT Research SA 또는 SA+ 골 스캐너를 이용하여 생체외에서 말초 QCT 스캔을 실시하였다. 처리 기간 종료 시점에 안락사된 모든 동물뿐만 아니라 사망한 것으로 발견된 두 마리 동물로부터 우측 대퇴골, L3 및 L4 요추에서 스캔을 얻었다. 이들 두 동물은 기술적 실수로 인해 2회 스캔하였으나, 획득한 첫번째 스캔만이 보고되었고 두번째 스캔은 연구 파일에 보존하였고, 이것은 양쪽 스캔이 동일한 것으로 판단되었기 때문에 연구에 영향을 미치는 바는 없다.
대퇴골의 경우 스캐닝 부위는 예측된 3점 굴곡 골절 부위(골간)였다. 이 부위는 피질 골 측정에 대해서만 Cortmode 2를 이용하여 분석하였다(표 5). 골간단에서 추가의 슬라이스를 수득하였다. 세 마리 동물의 대퇴골에 골간단 스캔은 실시하지 않았고, 그 이유는 트리밍 동안에 대퇴골로부터 관절구가 떨어져 나가기 때문이었다. 스캔 슬라이스의 정확한 위치는 원데이터에 정리되어 있으며 표 5에 수록되어 있다.
생체외 pQCT 스캐닝 절차의 일부로서 대퇴골 길이를 측정하였고 이는 손상된 대퇴골 관절구로 인한 세 마리 동물을 제외하고 모든 동물의 우측 대퇴골에 대해 보고된 것이다.
척추의 경우, 중간점에서 스캔을 획득하였다. 네 마리 동물로부터 L3 척추가 그리고 네 마리 동물로부터 L4 척추가 트리밍시에 손상되었고 한 마리 동물로부터 L4 척추가 트리밍 동안에 소실되었으며, 결국 이들 척추에 대한 스캔은 확보되지 못했다. 최적의 스캔 및 데이터 획득을 보장할 것으로 판단되는 추가의 슬라이스를 수득하였다.
모든 분석은 분석용 소프트웨어의 LOOP 옵션을 이용하여 실시하였다. LOOP 옵션의 결과로서 생성된 모든 다른 데이터는 원데이터와 함께 보존하였으나 보고하지는 않았다. 대퇴골 및 요추에 가장 적절한 분석 모드를 사용하였고 원데이터에 정리해 두었고, 세부 분석 내용은 표 6에 기술되어 있다. 모든 스캔 분석 데이터는 보존되어 있으며 재분석 또한 문서로 정리되어 있다.
보고된 생체외 pQCT 스캐닝 변수는 표 7에 요약된다.
4.4 척추 압박
L3 및 L4 척추체를 압박 파손으로 시험하였다. 하중 속도는 20 mm/분으로 설정하였다. 하중 및 변위 데이터를 수집하고, pQCT 스캔으로부터 피크 하중, 강성, 개별 척추체 높이 및 횡단면적을 이용하여 겉보기 강도 및 모듈러스를 계산하였다. 곡선 아래 면적(AUC)으로부터 파손 작업을 측정하고 인성을 계산하였다. 0.2% 오프셋을 이용하여 처음에 항복 하중을 얻었지만 0.1% 오프셋이 더 적절한 것으로 판단되었고 항복 응력을 계산하였다. 0.2% 오프셋 항복 하중으로부터 유도된 모든 데이터는 연구 파일에 보존되었지만, 보고되지는 않았다. 아래 표 8은 보고된 생체역학 시험 및 변수를 요약한 것이다.
결과는 아래 표에 나타나 있다:
[표 5a]
[표 6a]
[표 7a]
[표 8a]
생체역학 결과
피검 화합물은 두 랫트 군 모두에서 두 용량 수준 모두로 골 질량 및 골 강도와 연관된 변수에 양성 효과를 나타냈으며, 이것은 조직병리학적으로 (미성숙 성체의 경우만) 주목된 해면골의 증가와 일치된 효과를 보여준다. 강도 변수는 요추에서 양성 효과가 나타났다 (50 mg/kg/일).
아래에 상세히 기술된 실시예는 본 발명을 예시적으로 설명하는 것이지만, 이들 실시예는 본 발명을 한정하는 것은 아니다.
이들과 상이한 추가의 LCMS 구배가 실험부에 나타나 있다:
구배 2: 0분 96% H2O (0.05% TFA)에서 2.0분-95% MeCN로, 이어서 2.4분 95% MeCN으로; 이어서 4% MeCN으로 2.45분까지; 1mL/분; 110-1000MW; 0.4 L (YMC J'sphere ODS H80 20X2 1.4.
구배 3: 0분 95% H2O (5 mmol 암모늄 아세테이트)에서 3.5분 95% MeCN으로, 이어서 2분간 95% ACN으로, 이어서 1분간 5% MeCN; 0.5 mL/분; 115-1000MW; 1 L (Merck Purospher 3, 2x55 mm).
표시 "MS"에서 "ok"는 질량 스펙트럼 또는 HPLC/MS가 기록되었고 여기서 분자 피크 M+1 (MH+) 및/또는 M+18 (MNH4+) 및/또는 M+23 (NMa+)가 검출되었음을 의미한다. 결합은 실험부에서 실시예들의 설명에 나타나 있다.
본 발명은 추가로 화학식 I의 화합물을 제조하는 방법에 관한 것이다.
실험부:
제조 실시예가 아래에 상세히 기술된다. 본 발명의 화합물은 WO 0414932 및 WO 0418491에 기술된 방법과 유사하게 또는 그에 따라서 수득할 수 있다.
화학식 I의 화합물의 제조
반응식: α-브로모글리코사이드 4의 합성
메틸
2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시
-α-D-
글루코피라노사이드
(2)
3.0 g의 메틸 2,3,6-트리-O-벤조일-α-D-갈락토피라노사이드(Reist et al., J. Org. Chem. 1965, 30, 2312)를 디클로로메탄에 주입하고 -30℃로 냉각시킨다. 이어서, 3.06 ml의 [비스(2-메톡시에틸)아미노]설퍼 트리플루오라이드(BAST)를 적가한다. 반응 용액을 실온으로 가온하고 12시간 동안 교반한다. 혼합물을 디클로로메탄으로 희석하고, 유기상을 H2O, NaHCO3 용액 및 NaCl 포화 용액으로 추출한다. 유기상을 Na2SO4로 건조시키고 농축한다. 조 생성물을 에틸 아세테이트 및 헵탄으로부터 결정화한다. 1.95 g의 생성물 2를 무색 고체로 수득한다. C28H25FO8 (508.51) MS (ESI+) 526.18 (M+NH4 +). 다른 방법으로서, 2.8 당량의 디에틸아미노설퍼 트리플루오라이드(DAST)를 사용하여 반응을 실시할 수 있고, 이 경우에, 첨가 후 18시간 동안 반응 용액을 환류시킨다. 후처리는 위 설명과 동일하게 실시한다.
1-O-아세틸-2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시글루코스
(3)
12.0 g의 화합물 메틸 2,3,6-트리-O-벤조일-4-플루오로-4-데옥시-α-D-글루코피라노사이드를 150 ml의 아세트산 무수물에 현탁시킨다. 8.4 ml의 진한 황산을 150 ml의 빙초산과 혼합하고 빙냉시키면서 상기 혼합물에 첨가한다. 혼합물을 실온에서 60시간 동안 교반시킨다. 혼합물을 NaHCO3 용액에 붓고 이 용액을 디클로로메탄으로 추출한다. 유기상을 NaCl 용액으로 추출하고 Na2SO4로 건조시켜 농축한다. 잔류물을 에틸 아세테이트/헵탄으로 재결정화한다. 5.97 g의 생성물 3을 무색 고체로 수득한다. C29H25FO9 (536.52) MS (ESI+) 554.15 (M+NH4 +)
1-
브로모
-4-
데옥시
-4-
플루오로
-2,3,6-트리-O-
벤조일
-알파-D-
글루코스
(4)
1.44 g의 1-O-아세틸-2,3,6-트리-O-벤조일-4-플루오로-4-데옥시글루코스를 빙초산 중의 하이드로브롬산(33%) 20 ml에 용해시키고 실온에서 교반시킨다. 5시간 후 혼합물을 빙수에 붓고, 수성상을 디클로로메탄으로 3회 추출한다. 수거한 유기상을 염화나트륨 포화 용액으로 세척하고, 황산나트륨으로 건조시킨 다음, 증발 건조시킨다. 조 생성물을 실리카 겔 컬럼을 통해 에틸 아세테이트/헵탄 70:30으로 여과한다. 1.40 g의 생성물 4를 무색 고체로 수득한다. C27H22BrF07 (557.37) MS (ESI+) 574.05/576.05 (M+NH4 +)
반응식 I: 실시예 1의 합성:
4-(4-
브로모벤질
)-5-
이소프로필피라즈
-3-올 (6):
15.2 g의 메틸 이소부티릴아세테이트(5)를 테트라하이드로푸란 250 ml중의 수화나트륨(60%, 3.85 g)의 현탁액에 빙냉시키면서 첨가한다. 이어서, THF 100 ml중의 4-브로모벤질 브로마이드 20.0 g의 용액을 첨가하고 혼합물을 실온에서 48시간 동안 교반한다. H2O 300 ml 및 EtOAc 300 ml를 첨가한 후, 유기상을 MgSO4으로 건조시키고 용매를 회전식 증발기에서 제거한다. 얻어진 조 생성물을 120 ml의 톨루엔 중에 용해시키고, 하이드라진 하이드레이트(8.01 g)와 혼합한 후 워터 트랩으로 환류 하에 12시간 동안 가열시킨다. 반응 혼합물을 50 ml의 체적으로 농축시키고 0℃로 냉각시킨다. 결정 생성물을 흡인 여과하고 헵탄으로 세척한다. 10.8 g의 화합물 6을 담황색 고체로 수득한다. C13H15BrN20 (295.18) MS (ESI+) 294.04 (M+H+).
화합물 7:
530 mg의 4-(4-브로모벤질)-5-이소프로필피라즈-3-올(6) 및 1.50 g의 브로마이드 4를 50 ml의 메틸렌 클로라이드 중에 용해시킨다. 이 용액에 1.86 g의 탄산칼륨, 91 mg의 벤질트리에틸암모늄 브로마이드 및 0.8 ml의 물을 차례로 첨가한 후 실온에서 24시간 동안 교반한다. 반응 용액을 분리 깔대기로 옮기고 물 및 염화나트륨 포화 용액으로 차례로 세척한다. 유기상을 황산마그네슘으로 건조시키고 회전식 증발기에서 농축시킨다. 조 생성물을 실리카 겔 상에서의 크로마토그래피(EtOAc/헵탄)에 의해 분리한다. 193 mg의 7을 무색 고체로 수득한다. C40H36BrFN208 (771.6) MS (ESI+) 773.1 (M+H+).
화합물 8:
193 mg의 글리코사이드 7을 1.25 ml의 DMF 중에 용해시키고, 2.3 mg의 Pd(OAc)2, 6.09 mg의 트리-o-톨릴포스핀, 0.25 ml의 트리에틸아민 및 84.6 ml의 1-알릴피페라진을 첨가한다. 반응 혼합물을 100℃의 오일욕에서 18시간 동안 가열한다. 용매를 회전식 증발기에서 제거하고, 조 생성물을 실리카 겔 상에서의 크로마토그래피(EtOAcMeOH)에 의해 정제한다. 117 mg의 화합물 8을 무색 왁스로 수득한다. C47H49FN408 (816.9). MS(ESI+) 817.05(M+H+).
화합물 9(
실시예
1):
98mg의 글리코사이드 8을 메탄올/물/트리에틸아민(3:3:1)의 혼합물 4ml에 흡수시키고 실온에서 48시간 동안 교반한다. 반응 혼합물을 회전증발기에서 농축하고, 잔류물을 실리카겔 크로마토그래피에 의해 정제한다(메틸렌클로라이드/메탄올/농축 암모니아). 34mg의 화합물 9가 무색 고체로서 수득된다. C26H37FN4O5(504.61) MS(ESI+) 505.47(M+H+).
반응식 II: 실시예 2의 합성:
화합물 10:
7.20g의 글리코사이드 7을 109ml 아세토니트릴에 용해하고, 41.9mg Pd(OAc)2, 113.6mg 트리-o-톨릴포스핀, 39.2ml 트리에틸아민 및 1.04g 비닐 아세트산을 첨가한다. 반응 혼합물을 60시간 동안 환류 하에 가열한다. 회전 증발기에서 용매를 제거하고 조 생성물은 실리카겔 크로마토그래피에 의해 정제한다(CH2Cl2/MeOH/농축 암모니아=30/5/1). 6.18g의 화합물 10을 무색 왁스로서 수득한다. C44H41FN2O10(776.8).
화합물 11:
100 mg의 화합물 10을 4.00 ml의 디클로로메탄 중에 용해시키고, 9.41 mg의 n-부틸아민, 119.8 mg의 디이소프로필에틸아민, 26.1 mg의 1-하이드록시벤조트리아졸 및 30 mg의 N-(3-디메틸아미노프로필)-N-에틸카르보디이미드를 첨가한다. 반응 혼합물을 20℃에서 16시간 동안 교반시킨다. 용액을 5 ml의 NaHCO3 용액, 5 ml의 0.2 M 염산 및 5 ml의 NaCl 포화 용액으로 연속 세척한다. 용매를 회전식 증발기에서 제거하고, 조 생성물을 추가로 정제하지 않고 화합물 12로 변환시킨다. C48H50FN2309 (831.9).
화합물 12:
82 mg의 화합물 11을 5.00 ml의 메탄올 중에 용해시키고, 활성탄에 담지된 팔라듐(10%) 10.5 mg을 첨가한다. 반응 혼합물을 H2 1 바아의 대기 하에서 16시간 동안 교반시킨다. 탄소에 담지된 팔라듐을 여과 제거하고, 회전식 증발기에 의해 용매를 제거한다. 실리카 겔로 조 생성물을 추가로 정제하는 것은 필요하지 않다. 72 mg의 목적 화합물 12를 무색 왁스로 수득한다. C48H52FN2309 (834.0).
화합물 13 (
실시예
2):
72 mg의 글리코사이드 12를 10 ml의 메탄올 중에 용해시키고, 1.72 ml의 2 M 나트륨 메톡사이드 메탄올 용액을 첨가한다. 반응 혼합물을 20℃에서 4시간 동안 교반시키고, 46.2 mg의 염화암모늄을 첨가한다. 용매를 회전식 증발기에서 제거하고 조 생성물을 실리카 겔 상에서(처음에 에틸 아세테이트/헵탄 = 5/1로; 이어서 메틸 클로라이드/메탄올/진한 암모니아 = 30/5/1로) 정제한다. 24 mg의 화합물 13을 무색 고체로 수득한다. C27H40FN309 (521.63): MS (ESI+) 522.57 (M+H+).
화합물 14 (
실시예
3):
화합물 14는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 3-아미노프로피온아미드 하이드로클로라이드와 반응시키고, 후속적인 수소화는 수행하지 않고서 화합물 14를 무색 고체로 수득한다. C26H35FN407 (534.6): MS (ESI+) 535.44 (M+H+).
화합물 15 (
실시예
4):
화합물 15는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 3-아미노프로피온아미드 하이드로클로라이드와 반응시키고, 화합물 15를 무색 고체로 수득한다. C26H37FN407 (536.6): MS (ESI+) 537.44 (M+H+).
화합물 16 (
실시예
5):
화합물 16은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 글리신아미드 하이드로클로라이드와 반응시키고, 화합물 16을 무색 왁스로 수득한다. C25H35FN407 (522.6): MS (ESI+) 523.38 (M+H+).
화합물 17:
화합물 17은 화합물 7(반응식 I)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 에틸 아세토아세테이트를 메틸 이소부티릴아세테이트 대신에 출발 물질로 사용한다. 화합물 17을 무색 고체로 수득한다. C38H32BrFN208 (743.6).
화합물 18 (
실시예
6):
화합물 18은 화합물 15(실시예 4)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 17을 글리코사이드 10 대신에 출발 물질로 사용한다. 화합물 18을 무색 고체로 수득한다. C24H33FN407 (508.6): MS (ESI+) 509.33 (M+H+).
화합물 19 (
실시예
7):
화합물 19는 화합물 15(실시예 4)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 브로모 화합물 7을 비닐아세트산 대신에 아크릴산과 반응시킨다. 화합물 19를 무색 왁스로 수득한다. C25H35FN407 (522.6): MS (ESI+) 523.42 (M+H+).
화합물 20 (
실시예
8):
화합물 20은 화합물 19(실시예 7)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 아미드 결합시에 3-아미노프로피온아미드 하이드로클로라이드를 글리신아미드 하이드로클로라이드로 대체한다. 화합물 20을 무색 왁스로 수득한다. C24H33FN407 (508.6): MS (ESI+) 509.29 (M+H+).
화합물 21 (
실시예
9):
화합물 21은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 L-세린아미드 하이드로클로라이드와 반응시키고, 화합물 21을 무색 고체로 수득한다. C26H37FN408 (552.6): MS (ESI+) 553.29 (M+H+).
화합물 22 (
실시예
10):
화합물 22는 화합물 18(실시예 6)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 17로 출발하여 3-아미노프로피온아미드 하이드로클로라이드가 아니라 L-세린아미드 하이드로클로라이드와 반응시키고, 화합물 22를 무색 왁스로 수득한다. C24H33FN408 (524.6): MS (ESI+) 525.31 (M+H+).
화합물 23 (
실시예
11):
화합물 23은 화합물 18(실시예 6)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 17로 출발하여 3-아미노프로피온아미드 하이드로클로라이드가 아니라 N-(2-하이드록시에틸)피페라진과 반응시키고, 화합물 23을 무색 왁스로 수득한다. C27H39FN407 (550.6): MS (ESI+) 551.30 (M+H+).
화합물 24 (
실시예
12):
화합물 24는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 N-메틸피페라진과 반응시키고, 화합물 24를 무색 왁스로 수득한다. C28H41FN406 (548.7): MS (ESI+) 549.30 (M+H+).
화합물 25 (
실시예
13):
화합물 25는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 피페리딘과 반응시키고, 화합물 25를 무색 왁스로 수득한다. C28H40FN306 (533.7): MS (ESI+) 534.54 (M+H+).
화합물 26 (실시예 14):
화합물 26은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 헥사하이드로-1H-아제핀과 반응시키고, 화합물 26을 무색 왁스로 수득한다. C29H42FN306 (547.7): MS (ESI+) 548.56 (M+H+).
화합물 27 (
실시예
15):
화합물 27은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 피롤리딘과 반응시키고, 화합물 27을 무색 왁스로 수득한다. C27H38SFN306 (519.6): MS (ESI+) 520.52 (M+H+).
화합물 28 (
실시예
16):
화합물 28은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 벤질 1-피페라진카르복실레이트와 반응시키고, 화합물 28을 무색 왁스로 수득한다. C27H39FN406 (534.6): MS (ESI+) 535.32 (M+H+).
화합물 29 (
실시예
17):
화합물 29는 화합물 19(실시예 7)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 아미드 결합시에 3-아미노프로피온아미드 하이드로클로라이드를 2-아미노에탄올로 대체한다. 화합물 29를 무색 오일로 수득한다. C24H34FN307 (495.6): MS (ESI+) 496.43 (M+H+).
화합물 30 (실시예 18):
화합물 30은 화합물 19(실시예 7)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 아미드 결합 반응에서 3-아미노프로피온아미드 하이드로클로라이드를 2-아미노-2-메틸-1-프로판올로 대체한다. 화합물 30을 무색 오일로 수득한다. C26H38FN307 (523.6): MS (ESI+) 524.26 (M+H+).
화합물 31 (
실시예
19):
화합물 31은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 2-아미노-2-메틸-1-프로판올과 반응시키고, 화합물 31을 무색 고체로 수득한다. C27H40FN307 (537.6): MS (ESI+) 538.28 (M+H+).
화합물 32 (
실시예
20):
화합물 32는 화합물 29(실시예 17)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 수소화 단계는 실시하지 않는다. 화합물 32를 무색 왁스로서 수득한다. C24H32FN307 (493.6): MS (ESI+) 494.28 (M+H+).
화합물 33 (
실시예
21):
화합물 33은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 트리스(하이드록시메틸)아미노메탄과 반응시키고, 화합물 33을 무색 고체로 수득한다. C27H40FN309 (569.6): MS (ESI+) 570.33 (M+H+).
화합물 34 (
실시예
22):
화합물 34는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 N-카르보벤즈옥시-1,3-디아미노프로판 하이드로클로라이드와 반응시키고, 화합물 34를 무색 오일로 수득한다. C26H39FN406 (522.6): MS (ESI+) 522.52 (M+H+).
화합물 35 (
실시예
23):
화합물 35는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 1-아다만탄메틸아민과 반응시키고, 화합물 35를 무색 왁스로 수득한다. C34H48FN306 (613.8): MS (ESI+) 614.45 (M+H+).
화합물 36 (
실시예
24):
화합물 36은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 2,3,4,6-테트라-O-아세틸-1-아미노-1-데옥시-베타-D-글루코스와 반응시키고, 화합물 36을 무색 오일로 수득한다. C29H42FN3011 (627.7): MS (ESI+) 628.25 (M+H+).
화합물 37 (
실시예
25):
화합물 37은 화합물 28(실시예 16)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 마지막 단계로 나트륨 메타놀레이트로 탈보호하고 3산화황-트리에틸아민 복합체와 반응시킨다: 이 반응은 메탄올 10.0 ml 중에 피페라진 화합물 63.0 mg을 용해시키고 0℃에서 202 mg의 3산화황 트리에틸아민 복합체를 첨가한 후 0℃에서 2시간 동안 교반시킴으로써 이루어진다. 용매를 회전식 증발기에서 제거하고 조 생성물을 실리카 겔(메틸렌 클로라이드/메탄올/진한 암모니아 = 30/5/1) 상에서 정제한다. 59 mg의 설페이트 화합물을 수득하고, 나트륨 메톡사이드로 화합물 28을 합성하는 경로와 동일하게 화합물 37로 변환시켜 무색 왁스를 수득한다. C27H39FN409S (614.7): MS (ESI+) 615.42 (M+H+).
화합물 38 (
실시예
26):
화합물 38은 화합물 37(실시예 25)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 벤질 1-피페라진카르복실레이트가 아니라 N-카르보벤조옥시-1,3-디아미노프로판 하이드로클로라이드와 반응시키고, 화합물 38을 무색 왁스로 수득한다. C26H39FN409S (602.7): MS (ESI+) 603.41 (M+H+).
화합물 39 (
실시예
27):
화합물 39는 화합물 37(실시예 25)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 벤질 1-피페라진카르복실레이트가 아니라 2-아미노에탄올과 반응시키고, 화합물 39를 무색 왁스로 수득한다. C25H36FN301OS (589.6): MS (ESI+) 588.50 (M+-H).
화합물 40 (
실시예
28):
화합물 40은 화합물 37(실시예 25)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 벤질 1-피페라진카르복실레이트가 아니라 2-아미노-2-메틸-1-프로판올과 반응시키고, 화합물 40을 무색 왁스로 수득한다. C27H40FN301OS (617.7): MS (ESI+) 616.52 (M+-H).
화합물 41 (
실시예
29):
화합물 41은 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 모르폴린과 반응시키고, 화합물 41을 담황색 왁스로 수득한다. C27H38FN307 (535.6): MS (ESI+) 536.48 (M+H+).
화합물 42 (
실시예
30):
화합물 42는 화합물 13(실시예 2)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 글리코사이드 10으로 출발하여 n-부틸아민이 아니라 tert-아밀아민과 반응시키고, 화합물 42를 담황색 왁스로 수득한다. C28H42FN306 (535.7): MS (ESI+) 536.54 (M+H+).
화합물 43 (
실시예
31)
41.3 mg의 1-알릴-3-프로필우레아를 5.00 ml의 THF 중에 용해시키고, 톨루엔 중 0.5 M 9-BBN 용액 1.21 ml를 첨가한 다음, 혼합물을 20℃에서 4시간 동안 교반시킨다. 이어서, 톨루엔 10.0 ml 중의 글리코사이드 17 180 mg의 용액, 트리-o-톨릴포스핀 7.4mg, 인산칼륨 102.7 mg 및 Pd(OAc)2 2.7 mg을 첨가한다. 반응 혼합물을 100℃로 3시간 동안 가열한다. 침전물을 여과하고, 유기상을 10 ml의 물로 세척한 다음 황산마그네슘으로 건조시킨다. 용매를 회전식 증발기에서 제거하고, 조 생성물을 실리카 겔 상에서의 크로마토그래피(EtOAc/헵탄)에 의해 정제한다. 59 mg의 무색 고체를 수득하고 화합물 13(실시예 2)의 제조와 동일하게 나트륨 메톡사이드와 반응시킨다. 화합물 43을 무색 왁스로 수득한다. C24H35FN406 (494.6) MS (ESI+) 494.12 (M+).
4-(2-
에톡시카르보닐
-4-
메틸
-3-옥소-
펜트
-1-
에닐
)벤조산 (E/Z 이성체 혼합물)(44):
29.0 g의 에틸 이소부티릴아세테이트 및 33.0 g의 4-카르복시벤즈알데하이드를 워터 트랩으로 6시간 동안 가열한다. 반응 용액을 농축시키고, 에틸 아세테이트에 투입시킨 다음, 20% 강 염화암모늄 용액 및 염화나트륨 포화 용액으로 추출한다. 유기상을 황산마그네슘으로 건조시키고, 농축한 다음 45에 직접 반응시킨다. 50.0 g의 오일을 수득한다. C16H1805 (290.3): MS (ESI+): 291.1 (M+H)+, t R = 1.42분 (구배 2).
4-(2-
에톡시카르보닐
-4-
메틸
-3-옥소-
펜틸
)벤조산 (45):
50 g의 4-(2-에톡시카르보닐-4-메틸-3-옥소-펜트-1-에닐)벤조산을 300 ml의 THF 중에 용해시키고, 탄소에 담지된 팔라듐(10%) 1.00 g을 첨가하고, 혼합물을 오토클레이브에서 4 바아의 수소압 하에 24시간 동안 수소화한다. 혼합물을 디클로로메탄으로 희석하고 셀라이트(Celite)를 통해 흡인 여과한다. 잔류물을 디클로로메탄으로 세척하고 진공 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/n-헵탄 = 3/1)에 의해 정제한다. 45 g의 화합물 45를 오일로 수득한다. C16H2005 (292.3) MS (ESI+): 293.1 (M+H)+, t R = 1.37분 (구배 2).
4-[1-(2-
시아노에틸
)-5-
하이드록시
-3-이소프로필-1H-
피라졸
-4-
일메틸
]벤조산 (46)
15 g의 화합물 45를 100 ml의 빙초산에 용해시킨다. 7.4 ml의 2-시아노에틸하이드라진을 첨가하고, 용액을 100℃로 2시간 동안 가열한다. 혼합물을 빙수에 첨가하고 에틸 아세테이트로 수회 추출한다. 유기상을 20% 강 염화암모늄 용액 및 염화나트륨 포화 용액으로 추출하고 황산나트륨으로 건조시킨다. 2.40 g의 목적 화합물 46을 에틸 아세테이트 상으로 결정화한다. 모액을 농축하고 실리카 겔 상에서 크로마토그래피(디클로로메탄:메탄올:빙초산 = 100:10:1)한다. 추가로 1.10 g의 화합물 46과 7.0 g의 재분리된 전구물 45를 수득한다. C17H19N303 (313.4); MS (ESI+): 314.2 (M+H)+, tR = 0.97분 (구배 2).
N-(2-카르바모일에틸)-4-[1-(2-시아노-에틸)-5-하이드록시-3-이소프로필-1H-피라졸-4-
일메틸
]
벤즈아미드
(47):
500 mg의 화합물 46 및 145 mg의 β-알라닌아미드 하이드로클로라이드를 10 ml의 디클로로메탄에 투입하고, 0.8 ml의 N,N-디이소프로필에틸아민, 215 mg의 1-하이드록시벤조트리아졸 및 306 mg의 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 하이드로클로라이드를 첨가한다. 용액을 12시간 동안 교반시킨다. 용액을 농축시키고 조 생성물을 실리카 겔 상에서의 크로마토그래피(디클로로메탄/메탄올/빙초산 = 100:0:5 → 100:10:5)에 의해 정제한다. 440 mg의 목적 화합물 47을 수득한다. C20H25N503 (383.5); MS (ESI+): 384.2 (M+H)+, tR = 3.58분 (구배 3).
화합물 48:
300 mg의 화합물 47, 436 mg의 화합물 4 및 324 mg의 탄산칼륨을 25 ml의 아세토니트릴 및 2.5 ml의 물에 현탁시키고 72시간 동안 교반한다. 반응 혼합물을 여과하고 잔류물을 디클로로메탄으로 세척한 다음, 합친 유기상을 물 및 염화나트륨 포화 용액으로 추출한다. 유기상을 황산나트륨으로 건조시키고, 잔류물을 실리카 겔 상에서 크로마토그래피(디클로로메탄/메탄올 = 100/5)한다. 207 mg의 글리코사이드 48을 무색 고체로서 수득한다. C47H46FN501O (859.9); MS (ESI+): 860.3 (M+H)+, t R = 1.70분 (구배 2).
화합물 49 (실시예 32):
200 mg의 화합물 48을 15 ml의 THF 중에 용해시키고 아르곤 하에 -78℃로 냉각시킨다. 0.81 ml의 리튬 비스(트리메틸실릴)아미드 용액 (헥산 중 1M)을 격막을 통해 서서히 첨가한다. 30분 후, 2 ml의 20% 강 염화암모늄 용액을 냉각 하에 첨가하고, 용액을 실온으로 가온한다. 2 ml의 염화나트륨 포화 용액을 첨가하고, 유기상을 분리하여 버리고, 수성상을 에틸 아세테이트로 2회 추출한다. 합친 유기상을 농축하고 잔류물을 트리에틸아민:메탄올:물의 혼합물(14 ml, 1:3:3)에 투입한다. 용액을 24시간 동안 교반시킨 다음, 건조 농축시킨 후 실리카 겔 상에서의 크로마토그래피에 의해 정제한다. 50 mg의 화합물 49를 무색 고체로 수득한다. C23H31FN407 (494.5); MS (ESI-): 493.2 (M-H)-, tR = 3.58분 (구배 3); tR = 0.97분 (구배 1).
화합물 50 (
실시예
33):
화합물 50은 화합물 49(실시예 32)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, β-알라닌아미드 대신에 글리신아미드 하이드로클로라이드를 사용한다. 화합물 50을 무색 고체로서 수득한다. C22H29FN4O7 (480.5): MS(ESI+) 481.19 (M+H+).
화합물 51 (실시예 34):
화합물 51은 화합물 49(실시예 32)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 출발 물질로서 에틸 이소부틸아세테이트 대신에 4,4,4-트리플루오로아세토아세테이트를 사용한다. 화합물 51을 무색 고체로서 수득한다. C21H24F4N4O7 (520.4): MS(ESI+) 521.16 (M+H+).
화합물 52 (실시예 35):
화합물 52는 화합물 50(실시예 33)에 대해 기술한 합성 경로와 동일하게 합성한다. 다만, 출발 물질로서 에틸 이소부틸아세테이트 대신에 4,4,4-트리플루오로아세토아세테이트를 사용한다. 화합물 52를 무색 고체로서 수득한다. C20H22F4N4O7 (506.4): MS(ESI+) 507.16 (M+H+).
화합물 53 (
실시예
36):
화합물 53은 화합물 43(실시예 31)에 대해 기술한 합성 경로와 동일하게 합성하지만, 출발 물질로서 1-알릴-3-프로필우레아 대신에 1-(N-메틸피페라진)-3-알릴우레아를 사용하고, 글리코사이드 17 대신에 글리코사이드 7을 사용한다. 화합물 53을 무색 고체로서 수득한다. C28H42FN5O6 (563.7).
화합물 54 (실시예 37):
화합물 54는 화합물 43(실시예 31)에 대해 기술한 합성 경로와 동일하게 합성하지만, 출발 물질로서 1-알릴-3-프로필우레아 대신에 1-(N-메틸피페라진)-3-알릴우레아를 사용하고, 글리코사이드 17 대신에 글리코사이드 7을 사용한다. 화합물 54를 무색 고체로서 수득한다. C27H41FN4O7 (552.7).
실험부: 화학식 II의 화합물
반응식: α-브로모글리코사이드의 합성
1-
브로모
-4-
데옥시
-4-
플루오로
-2,3,6-트리-O-아세틸-알파-D-
글루코스
(2)
5.0 g의 4-데옥시-4-플루오로-D-글루코피라노스 1(27.5 mmol)(Apollo)를 50 ml의 피리딘 및 50 ml의 아세트산 무수물 중에 현탁시킨다. 반응 용액을 45℃에서 4시간 동안 교반시킨다. 그 결과 투명한 반응 용액이 생성되며, 이 용액을 농축시킨다. 12.0 g의 조 생성물을 수득한다. 이 조 생성물을 빙초산 중 33% 강 HBr 160 ml에 용해시키고, 실온에 2시간 동안 방치해 둔다. 이어서, 반응 용액을 얼음 300 g과 에틸 아세테이트 300 ml의 혼합물에 붓는다. 유기상을 NaCl 수용액으로 2회 세척하고, 실리카 겔을 통해 여과한 후 농축한다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 = 1/1)하여 분리한다. 8.19 g(2 단계를 통해 80%)의 2를 담황색 고체로 수득한다.
1-
브로모
-4-
데옥시
-4-
플루오로
-2,3,6-트리-O-아세틸-알파-D-갈락토스 (4)
화합물 2의 제조와 동일하게 100 mg(0.55 mmol)의 3을 3.5 ml의 피리딘과 3.5 ml의 아세트산 무수물과 반응시킨다. 89 mg (44%)의 4를 무정형 고체로 수득한다.
1-
브로모
-3-
데옥시
-3-
플루오로
-2,4,6-트리-O-아세틸-알파-D-
글루코스
(6)
화합물 2의 제조와 동일하게 335 mg (1.84 mmol)의 5를 10 ml의 피리딘과 10 ml의 아세트산 무수물과 반응시킨다. 628 mg (92%)의 6을 무정형 고체로서 수득한다.
반응식: α-브로모글리코사이드 10의 합성
1-
메톡시
-4-
데옥시
-4,4-
디플루오로
-2,3,6-트리-O-벤질-알파-D-
글루코스
(8)
3.69 g(7.9 mmol)의 1-메톡시-2,3,6-트리-O-벤질-알파-D-글루코스 7(Tetrahedron Asymmetry 2000, 11, 385-387)을 110 ml의 메틸렌 클로라이드 중에 용해시키고, 아르곤 대기 하에 3.6 g (8.5 mmol)의 데스-마틴 시약(Aldrich)을 적가한다. 실온에서 3시간 후, 혼합물을 300 ml의 에틸 아세테이트/n-헵탄(1:1)으로 희석시키고, NaHCO3으로 1회 및 Na2S2O3 용액으로 1회 세척한다. 유기상을 실리카 겔을 통해 여과하고 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/n-헵탄 1:1)에 의해 분리한다. 2.90 g(79%)의 케톤을 수득한다. 이 케톤을 30 ml의 메틸렌 클로라이드 중에 용해시키고, 아르곤 대기 하에 4.0 ml의 BAST([비스(2-메톡시에틸)아미노]설퍼 트리플루오라이드, Aldrich)를 적가한다. 실온에서 20시간 후 혼합물을 200 ml의 에틸 아세테이트로 희석하고 NaHCO3 냉용액으로 조심스럽게 (다량의 거품) 세척한다. 유기상을 실리카 겔을 통해 여과하고 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/n-헵탄 1:1)에 의해 분리한다. 2.6 g (85%)의 8을 무색 오일로서 수득한다.
4-
데옥시
-4,4-
디플루오로
-1,2,3,6-
테트라
-O-아세틸-알파-D-
글루코스
(9)
2.30 g (4.7 mmol)의 8 및 2.0 g의 Pd/C (10% Pd)를 150 ml의 메탄올과 10 ml의 아세트산 중에 용해시키고, 5 바아의 수소 대기 하에 실온에서 16시간 동안 수소화한다. 반응 용액을 농축시키고, 잔류물을 섬광 크로마토그래피(메틸렌 클로라이드/메탄올/진한 암모니아 = 30/5/1)에 의해 정제한다. 850 mg (83%)의 1-메톡시-4-데옥시-4,4-디플루오로-알파-D-글루코스를 백색 무정형 고체로 수득한다. C7H12F2O5 (214.17) MS(DCI): 215.4 (M+H+).
상기 생성물 700 mg (3.3 mmol)을 3.5 ml의 아세트산과 6.3 ml의 아세트산 무수물 중에 용해시킨다. 0.2 ml의 진한 황산을 첨가한 후 60℃에서 5시간 동안 교반시킨다. 이어서, 반응 용액을 얼음 30 g과 에틸 아세테이트 30 ml의 혼합물에 붓는다. 유기상을 NaCl 수용액으로 2회 세척하고 실리카 겔을 통해 여과하고 농축한다. 잔류물을 실리카 겔로 크로마토그래피(에틸 아세테이트/n-헵탄 1:1)에 의해 분리한다. 300 mg (25%)의 9를 아노머의 혼합물로서 수득한다. C14H18F2O9 (368.29) MS(DCI): 369.3 (M+H+).
1-
브로모
-4-
데옥시
-4,4-
디플루오로
-2,3,6-트리-O-아세틸-알파-D-
글루코스
(10)
300 mg(0.8 mmol)의 테트라아세테이트 9를 빙초산 중의 33% HBr 13 ml 중에 용해시키고 실온에서 6시간 동안 방치해 둔다. 이어서, 반응 용액을 얼음 10 g과 에틸 아세테이트 10 ml의 혼합물에 붓는다. 유기상을 NaCl 수용액으로 2회 세척하고, 약간의 실리카 겔을 통해 여과하고 농축시킨다. 잔류물을 크로마토그래피(SiO2)(에틸 아세테이트/헵탄 1:1)에 의해 분리한다. 112 mg(35%)의 10을 무색 고체로서 수득한다. C12H15BrF2O7 (389.5) MS (DCI): 389.2 (M+H+).
반응식: α-브로모글리코사이드 14의 합성
메틸
2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시
-α-D-
글루코피라노사이드
(12)
3.0 g의 메틸 2,3,6-트리-O-벤조일-α-D-갈락토피라노사이드 (Reist et al., J. Org. Chem 1965, 30, 2312)를 디클로로메탄에 투입하고 -30℃로 냉각시킨다. 이어서, 3.06 ml의 [비스(2-메톡시에틸)아미노]설퍼 트리플루오라이드(BAST)를 적가한다. 반응 용액을 실온으로 가온하고 12시간 동안 교반시킨다. 혼합물을 디클로로메탄으로 희석하고, 유기상을 물, NaHCO3 용액 및 NaCl 포화 용액으로 추출한다. 유기상을 Na2SO4으로 건조시키고 농축시킨다. 조 생성물을 에틸 아세테이트 및 헵탄으로 결정화한다. 1.95 g의 생성물 12를 무색 고체로서 수득한다. C28H25FO8 (508.51) MS (ESI+) 526.18 (M+NH4 +). 다른 방법으로서, 2.8 당량의 디에틸아미노설퍼 트리플루오라이드(DAST)를 사용하여 반응을 수행할 수도 있고; 이 경우에, 반응 용액을 첨가 후 18시간 동안 환류시킨다. 후처리는 상기 설명과 동일하게 실시한다.
1-O-아세틸-2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시
-
글루코스
(13)
12.0 g의 화합물 메틸 2,3,6-트리-O-벤조일-4-플루오로-4-데옥시-α-D-글루코피라노사이드를 150 ml의 아세트산 무수물 중에 현탁시킨다. 8.4 ml의 진한 황산을 150 ml의 빙초산과 혼합하고 이 혼합물에 현탁액을 빙냉시키면서 첨가한다. 혼합물을 실온에서 60시간 동안 교반시킨다. 반응 혼합물을 NaHCO3 용액에 붓고, 이 용액을 클로로메탄으로 추출한다. 유기상을 NaCl 용액으로 세척하고, Na2SO4으로 건조시키고 농축시킨다. 잔류물을 에틸 아세테이트 및 헵탄으로 재결정하한다. 5.97 g의 생성물 13을 무색 고체로서 수득한다. C29H25FO9 (536.52) MS(ESI+) 554.15 (M+NH4 +).
1-
브로모
-4-
데옥시
-4-
플루오로
-2,3,6-트리-O-
벤조일
-알파-D-
글루코스
(14)
1.44 g의 1-O-아세틸, 2,3,6-트리-O-벤조일-4-플루오로-4-데옥시글루코스를 빙초산 중 브롬산(33%) 20 ml에 용해시키고 실온에서 교반시킨다. 5시간 후 혼합물을 빙수에 첨가하고, 수성상을 디클로로메탄으로 3회 추출한다. 수거한 유기상을 염화나트륨 포화 용액으로 세척하고, 황산나트륨으로 건조시킨 후, 증발 건조시킨다. 조 생성물을 실리카 겔을 통해 에틸 아세테이트/헵탄(70:30)으로 여과한다. 1.40 g의 생성물 14를 무색 고체로 수득한다. C27H22BrFO7 (557.37) MS(ESI+) 574.05/576.05 (M+NH4 +)
반응식 A: 실시예 1의 합성
추가 예시 화합물:
실시예 1 (화합물 17)
400 mg(1.7 mmol)의 (3-하이드록시티오펜-2-일)(4-메톡시페닐)메타논(15) CDE 출원 번호 10231370.9(2002/0049) 및 200 mg (0.54 mmol)의 브로마이드 2를 6 ml의 메틸렌 클로라이드 중에 용해시킨다. 이 용액에 160 mg의 Bu3BnNCl(PTC = 상 전이 촉매), 320 mg의 K2CO3 및 0.4 ml의 물을 순차적으로 첨가한 후 실온에서 20시간 동안 교반시킨다. 반응 용액을 20 ml의 에틸 아세테이트로 희석하고 실리카 겔을 통해 여과한다. 여액을 농축하고 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 = 1/1)에 의해 분리한다. 160 mg (56%)의 16을 무색 고체로서 수득한다. C24H25FO10S (524.52) MS (ESI+) 525.12 (M+H+).
150 mg (0.29 mmol)의 화합물 16을 4 ml의 아세토니트릴 중에 용해시킨다. 이 용액을 빙욕에서 냉각시킨 후 150 mg의 NaCNBH3 및 0.2 ml의 TMSCl을 첨가한다. 이어서, 빙욕을 제거하고 혼합물을 실온에서 2시간 동안 교반시킨다. 반응 용액을 20 ml의 에틸 아세테이트로 희석하고 실리카 겔을 통해 여과한다. 여액을 농축시키고, 150 mg의 조 생성물을 수득한다. 이 조 생성물을 4 ml의 메탄올에 투입하고, MeOH 중의 1M NaOMe 1 ml를 첨가한다. 1시간 후 혼합물을 메탄올 HCl로 중화시키고 농축한 후 잔류물을 실리카 겔 상에서의 크로마토그래피(메틸렌 클로라이드/메탄올/진한 암모니아 30/5/1)에 의해 정제한다. 76 mg (2 단계에 걸쳐 69%)의 17을 무색 고체로서 수득한다. C18H21FO6S (384.43) ME(ESI+) 403.21 (M+H2O+H+)
실시예 2 (화합물 18)
100 mg(0.47 mmol)의 (3-하이드록시벤조티오펜-2-일)(4-메톡시페닐)메타논 (Eur. J. Med. Chem. 1985, 20, 187-189) 및 300 mg (0.80 mmol)의 브로마이드 2를 10 ml의 클로로포름 중에 용해시킨다. 이 용액에 120 mg의 Bu3BnNCl(PTC = 상-전이 촉매) 및 1.5 ml의 1N 수산화나트륨 수용액을 차례로 첨가한 후 4시간 동안 환류 하에 비등시킨다. 반응 용액을 20 ml의 에틸 아세테이트로 희석시키고 실리카 겔을 통해 여과한다. 여액을 농축시키고, 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 = 1/1)에 의해 분리한다. 135 mg(51%)의 담황색 고체를 수득한다. 이 고체를 화합물 17의 제조와 동일하게 100 mg의 NaCNBH3과 0.2 ml의 TMSCl과 반응시킨 다음 NaOMe/MeOH와 반응시켜 화합물 18로 변환시킨다. 46 mg의 18을 수득한다. C22H23FO6S (434.49) MS(ESI-) 479.18 (M+CHO2 +).
실시예 3 (화합물 19)
178 mg의 (3-하이드록시티오펜-2-일)(4-메톡시페닐)메타논(15)과 90 mg의 브로마이드 4를 실시예 1의 합성과 동일하게 반응시키고, 49 mg의 19를 무색 고체로서 수득한다. C18H21FO6S (384.43) MS(ESI+) 403.21 (M+H2O+H+).
실시예 4 (화합물 20)
200 mg의 (3-하이드록시티오펜-2-일)(4-메톡시페닐)메타논(15)과 100 mg의 브로마이드 6을 실시예 1의 합성과 동일하게 반응시키고, 59 mg의 20을 무색 고체로서 수득한다. C18H21FO6S (384.43) MS(ESI+) 403.21 (M+H2O+H+).
실시예 11(화합물 25) 및 15(화합물 21)을 적절한 하이드록시티오펜 및 브로마이드 2로부터 출발하여 실시예 1의 합성과 동일하게 합성한다.
실시예 16(화합물 32), 17(화합물 23), 18(화합물 22), 19(화합물 24), 21(화합물 27), 22(화합물 28), 23(화합물 29), 24(화합물 31), 25(화합물 30), 26(화합물 46), 27(화합물 47), 28(화합물 48) 및 29(화합물 49)는 적절한 하이드록시티오펜 및 브로마이드 14로부터 출발하여 실시예 1의 합성과 동일하게 합성한다.
실시예 12(화합물 26)는 적절한 하이드록시티오펜 및 브로마이드 6으로부터 출발하여 실시예 4의 합성과 동일하게 합성한다.
실시예 13(화합물 33) 및 14(화합물 34)는 적절한 하이드록시티오펜을 브로마이드 2와 반응시키고 이어서 실시예 1과 동일하게 NaOMe/MeOH로 탈보호시킴으로써 화합물 16을 합성한 것과 동일하게 합성한다.
실시예 20(화합물 35)를 하이드록시티오펜 15 및 브로마이드 10으로부터 출발하여 실시예 1의 합성과 동일하게 합성한다.
반응식 B: 실시예 5의 합성
추가 예시 화합물:
실시예 5 (화합물 36)
200 mg의 4-(4-메톡시벤질)-5-메틸-1H-피라졸-3-올(35)(J. Med. Chem. 1996, 39, 3920-3928)을 실시예 1의 합성과 동일하게 100 mg의 브로마이드 2로 당화시킨 다음, 실시예 1과 동일하게 NaOMe/MeOH로 탈보호한다. 49 mg의 화합물 36을 무색 고체로 수득한다. C18H20F4N2O6 (436.36) MS(ESI+) 437.21 (M+H+).
실시예 6 (화합물 37)
200 mg의 4-(4-메톡시벤질)-5-메틸-1H-피라졸-3-올(35) 및 100 mg의 브로마이드 4를 실시예 1의 합성과 동일하게 당화시킨 다음, 실시예 1과 동일하게 NaOMe/MeOH로 탈보호한다. 89 mg의 화합물 37을 무색 고체로 수득한다. C18H20F4N2O6 (436.36) MS(ESI+) 437.21 (M+H+).
실시예 20 (화합물 38)
110 mg의 4-(4-메톡시벤질)-5-메틸-1H-피라졸-3-올(35) 및 60 mg의 브로마이드 10을 실시예 1의 합성과 유사하게 당화시킨 다음, 실시예 1과 동일하게 NaOMe/MeOH로 탈보호한다. 49 mg의 화합물 38을 무색 고체로 수득한다. C18H19F5N2O6 (454.35) MS(ESI+) 455.22 (M+H+).
반응식 C: 실시예 8 및 실시예 10의 합성
추가 예시 화합물:
실시예 8 (화합물 42)
500 mg(1.73 mmol)의 에틸 2-(2,4-디클로로벤질)-3-옥소부티레이트(39)(Bionet)를 톨루엔 15 ml 중의 51% 순수 하이드라진 하이드레이트(3.46 mmol) 0.21 ml와 함께 워터 트랩으로 1.5 시간 동안 비등시킨다. 냉각 후, 고체를 흡인 여과시키고 톨루엔 및 에테르로 세척한다. 400 mg(90%)의 화합물 40을 부피가 큰 백색 침전물로서 수득한다. C11H10C12N2O (257.12) MS(ESI): 257 (M+H+).
270 mg(1.05 mmol)의 4-(2,4-디클로로벤질)-5-메틸-1H-피라졸-3-올(40)을 25 ml의 메틸렌 클로라이드에 용해시키고, 0.7 ml의 물, 1.2 g(8.68 mmol)의 탄산칼륨, 84 mg(0.31 mmol)의 벤질트리에틸암모늄 브로마이드 및 428 mg(1.15 mmol)의 브로마이드 2를 첨가한 후 혼합물을 실온에서 18시간 동안 교반시킨다. 반응 용액을 메틸렌 클로라이드로 희석시키고 물 및 포화염수로 각각 1회씩 세척한 후, MgSO4으로 건조시키고 농축한다. 조 생성물을 실리카 겔 상에서 정제한다. 122 mg(21%)의 화합물 41을 백색 고체로 수득한다. C23H25Cl2FN2O8 (547.37) MS(ESI): 547 (M+H+).
70 mg (0.1278 mmol)의 화합물 41을 경로 A에 따라서 2 ml의 메탄올에 용해시키고, 테트라하이드로푸란 중의 나트륨 메타놀레이트 용액(0.5 M) 1.02 ml(0.511 mmol)을 첨가한다. 5분 후, 27.6 mg(0.516 mmol)의 염화암모늄 및 2.0 g의 SiO2를 첨가한다. 용액을 농축시키고 생성물을 실리카 겔을 통해 여과한 후 우선 EtOAc로, 이어서 EtOAc/메탄올(20:1)로 세척한다. 50 mg(90%)의 화합물 42를 무색 고체로 수득한다. C17H19C12FN2O5 (421.26) MS(ESI): 420 (M+H+).
실시예 10 (화합물 43)
50 mg의 화합물 41을 경로 B에 따라 2.0 ml의 DMF 중에 용해시키고, 실온에서 50 mg의 K2CO3 및 57 ㎕의 메틸 요오다이드를 첨가한다. 14일 후 30 ml의 EtOAc를 첨가하고, 유기상을 각각 20 ml의 H2O로 2회 세척하고 농축한다. 조 생성물을 컬럼 크로마토그래피(EtOAc/헵탄 = 3:1)에 의해 정제하고 화합물 42의 제조와 동일하게 NaOMe/MeOH와 반응시킨다. 9.1 mg의 화합물 43을 무색 왁스로서 수득한다. C18H21C12FN2O5 (435.24) MS(ESI): 434 (M+H+).
실시예 8(화합물 42)을 위해 기술된 합성과 동일하게 실시예 7(화합물 44), 30(화합물 50) 및 31(화합물 51)은 적절한 β-케토 에스테르로부터 출발하여 합성한다.
실시예 9(화합물 45)는 적절한 β-케토 에스테르로부터 출발하여 실시예 10(화합물 43)을 위해 기술된 합성과 동일하게 합성한다.
실험부: 화학식 III의 화합물
반응식: α-브로모글리코사이드의 합성
1-
브로모
-4-
데옥시
-4-
플루오로
-2,3,6-트리-O-아세틸-알파-D-
글루코스
2
5 g (27.5 mmol)의 4-데옥시-4-플루오로-D-글루코피라노즈 1(Apollo)을 50 ml의 피리딘 및 50 ml의 아세트산 무수물 중에 현탁시킨다. 반응 용액을 45℃에서 4시간 동안 교반시킨다. 이 결과 투명한 반응 용액이 형성되며, 이어서 이를 농축시킨다. 12 g의 조 생성물을 수득한다. 조 생성물을 빙초산 중의 33% 강 HBr 160 ml에 용해시키고 실온에서 2시간 동안 방치해 둔다. 이어서, 반응 용액을 얼음 300 g과 에틸 아세테이트 300 ml의 혼합물에 붓는다. 유기상을 NaCl 수용액으로 2회 이상 세척하고, 약간의 실리카 겔을 통해 여과한 후 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 = 1/1)에 의해 분리한다. 8.19 g(2 단계에 걸쳐 80%)의 2를 담황색 고체로서 수득한다.
1-
브로모
-4-
데옥시
-4-
플루오로
-2,3,6-트리-O-아세틸-알파-D-
갈락토스
4
100 mg(0.55 mmol)의 3을 3.5 ml의 피리딘 및 3.5 ml의 아세트산 무수물과 화합물 2의 제조와 동일한 방법으로 반응시킨다. 89 mg(44%)의 4를 무정형 고체로서 수득한다.
1-
브로모
-3-
데옥시
-3-
플루오로
-2,3,6-트리-O-아세틸-알파-D-
갈락토스
6
335 mg(1.84 mmol)의 5를 10 ml의 피리딘 및 10 ml의 아세트산 무수물과 화합물 2의 제조와 동일한 방법으로 반응시킨다. 628 mg(92%)의 6을 무정형 고체로서 수득한다.
하기는 유사한 방식으로 제조되었다:
실시예 1 (화합물 9)
100 mg(0.47 mmol)의 2-(4-메톡시벤질)페놀 7 및 370 mg(1.17 mmol)의 브로마이드 2를 6 ml의 메틸렌 클로라이드 중에 용해시킨다. 이 용액에 160 mg의 Bu3BnNCl(PTC = 상 전이 촉매), 320 mg의 K2CO3 및 0.4 ml의 물을 연속적으로 첨가한 후, 실온에서 20시간 동안 교반시킨다. 반응 용액을 20 ml의 에틸 아세테이트로 희석하고 실리카 겔을 통해 여과한다. 여액을 농축시키고 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 = 1/1)에 의해 분리한다. 72 mg의 8을 무색 고체로서 수득한다. 생성된 72 mg의 8을 4 ml의 메탄올에 투입하고, 1 ml의 1N NaOMe/MeOH를 첨가한다. 1시간 후 혼합물을 메탄올 HCl로 중화시키고 농축시킨 후, 잔류물을 실리카 겔 상에서의 크로마토그래피(메틸렌 클로라이드/메탄올/진한 암모니아, 30/5/1)에 의해 분리한다. 29 mg의 9를 무색 고체로서 수득한다. C20H23FO6 (378.40) MS (ESI-) 423.22 (M+CHO2 -).
실시예 2 (화합물 10)
100 mg(0.47 mmol)의 2-벤질페놀과 370 mg(1.17 mmol)의 브로마이드 2를 화합물 9의 합성과 동일한 방법으로 반응시키고, 31 mg의 10을 무색 고체로서 수득한다. C19H21FO5 (348.37) MS (ESI-) 393.15 (M+CHO2 -).
실시예 3 (화합물 11)
200 mg(0.94 mmol)의 2-(4-메톡시벤질)페놀 7과 200 mg(0.63 mmol)의 브로마이드 4를 화합물 9의 합성과 동일한 방법으로 반응시키고, 110 mg의 11을 무색 고체로서 수득한다. C20H23FO6 (378.40) MS (ESI-) 423.22 (M+CHO2 -).
하기는 유사한 방식으로 제조되었다:
실시예 4 (화합물 14)
90 mg(0.30 mmol)의 3-벤조푸란-5-일-1-(2,6-디하이드록시-4-메틸페닐)프로판-1-온 12와 280 mg(0.76 mmol)의 브로마이드 2를 화합물 8의 합성과 동일한 방법으로 반응시키고, 400 mg의 13을 조 생성물로 수득한 후, 이 생성물을 글루코사이드 9의 합성과 동일한 방법으로 NaOMe/MeOH로 직접 탈보호한다. 75 mg의 14(2단계에 걸쳐 54%)를 무색 고체로서 수득한다. C24H25FO8 (460.46) MS (ESI-) 459.03 (M-H+).
실시예 5 (화합물 15)
100 mg(0.33 mmol)의 3-벤조푸란-5-일-1-(2,6-디하이드록시-4-메틸페닐)프로판-1-온 12와 150 mg(0.40 mmol)의 브로마이드 4를 화합물 14의 합성과 동일한 방법으로 반응시키고, 75 mg의 15를 무색 고체로서 수득한다. C24H25FO8 (460.46) MS (ESI-) 459.03 (M-H+).
실시예 6 (화합물 16)
150 mg(0.5 mmol)의 3-(2,3-디하이드록시벤조푸란-5-일-1-(2,6-디하이드록시-4-메틸페닐)프로판-1-온과 150 mg(0.40 mmol)의 브로마이드 4를 화합물 14의 합성과 동일한 방법으로 반응시키고, 75 mg의 16을 무색 고체로서 수득한다. C24H27FO8 (462.46) MS (ESI-) 461.03 (M-H+).
하기는 유사한 방식으로 제조되었다:
실시예 7 (화합물 20)
1.0 g(6.0 mmol)의 1-(2,6-디하이드록시-4-메틸페닐)에타논 17 및 1.0 g(2.7 mmol)의 브로마이드 2를 30 ml의 메틸렌 클로라이드 중에 용해시킨다. 이 용액에 800 mg의 벤질트리부틸암모늄 클로라이드(PTC), 1.6 g의 탄산칼륨 및 1.5 ml의 물을 격렬하게 교반시키면 순차적으로 첨가한다. 이 현탁액을 18시간 동안 빛으로부터 보호하면서(알루미늄 호일) 교반시킨 후 150 ml의 에틸 아세테이트 및 150 ml의 n-헵탄으로 희석시킨다. 고체 성분을 약간의 실리카 겔을 통해 여과하고 농축한다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 = 1/2)에 의해 분리한다. 430 mg의 18을 담황색 고체로서 수득한다(이 고체는 동일하게 이동하는 부산물로 인해 분리하는데 곤란을 겪을 수 있으며, 이에 순도는 약 50%에 불과하다. 부산물을 다음 단계에서 간단히 제거할 수 있다). C21H25010F (456.43) MS(ESI-): 455.25 (M - H+).
200 mg의 화합물 18(순도 약 50%) 및 225 mg의 아니스알데하이드(Fluka)를 10 ml의 메탄올 중에 용해시킨다. 5 ml의 1N NaOMe/MeOH 용액을 첨가한 후, 반응 용액을 12시간 동안 환류 하에 비등시킨다. 반응 용액을 메탄올 HCl로 중화시킨 후 농축하고, 잔류물을 실리카 겔 상에서의 크로마토그래피(메틸렌 클로라이드/메탄올/진한 암모니아, 30/5/1)에 의해 60 mg의 19를 황색 고체로서 수득한다.
60 mg(0.13 mmol)의 칼콘 19 및 50 mg의 Pd/C(10% Pd)를 15 ml의 메탄올 중에 현탁시키고 5시간 동안 실온에서 5 바아 수소 대기 하에 수소화시킨다. 반응 용액을 농축시키고, 잔류물을 섬광 크로마토그래피(메틸렌 클로라이드/메탄올/진한 암모니아, 30/5/1)에 의해 정제한다. 25 mg(42%)의 20을 백색 무정형 고체로 수득한다. C23H27FO8 (424.47) MS(ESI-): 449.17 (M - H+).
실시예 8 (화합물 21)
200 mg의 화합물 18(약 50% 순도) 및 350 mg의 p-벤질옥시벤즈알데하이드(Fluka)를 화합물 20의 합성과 동일한 방법으로 반응시킨다. 36 mg의 21을 무색 고체로서 수득한다. C22H25FO8 (436.44) MS(ESI-) 481.08 (M + CH02 -).
실시예 9 (화합물 27)
350 mg의 브로마이드 2, 100 mg의 페놀 22 및 350 mg의 p-벤질옥시벤즈알데하이드(Fluka)를 화합물 21의 합성과 동일한 방법으로 반응시킨다. 40 mg의 27을 무색 고체로서 수득한다. C21H23FO9 (438.41) MS(ESI-) 483.15 (M + CH02 -).
실시예 10 (화합물 28)
110 mg의 브로마이드 4, 80 mg의 페놀 22 및 350 mg의 p-벤질옥시벤즈알데하이드(Fluka)를 화합물 21의 합성과 동일한 방법으로 반응시킨다. 50 mg의 28을 무색 고체로서 수득한다. C21H23FO9 (438.41) MS(ESI-) 483.15 (M + CH02 -).
실시예 11 (화합물 30)
200 mg의 브로마이드 2 및 300 mg의 페놀 29를 화합물 14의 합성과 동일한 방법으로 반응시킨다. 40 mg의 30을 무색 고체로서 수득한다. C21H24FNO8 (437.43) MS(ESI-) 482.15 (M + CH02 -).
실시예 12 (화합물 31)
200 mg의 브로마이드 4 및 300 mg의 페놀 29를 화합물 14의 합성과 동일한 방법으로 반응시킨다. 115 mg의 31을 무색 고체로서 수득한다. C21H24FNO8 (437.43) MS(ESI-) 482.15 (M + CH02 -).
실시예 13 (화합물 33)
200 mg의 브로마이드 2 및 300 mg의 페놀 32를 화합물 14의 합성과 동일한 방법으로 반응시킨다. 80 mg의 33을 무색 고체로서 수득한다. C22H26FNO8 (451.45) MS(ESI-) 496.17 (M + CH02 -).
실시예 14 (화합물 34)
200 mg의 브로마이드 4 및 300 mg의 페놀 32를 화합물 14의 합성과 동일한 방법으로 반응시킨다. 130 mg의 34를 무색 고체로서 수득한다. C21H24FNO8 (451.45) MS(ESI-) 496.15 (M + CH02 -).
1-(2,6-비스벤질옥시-4-메틸페닐)에타논 36
1.62 g(9.75 mmol)의 1-(2,6-디하이드록시-4-메틸페닐)에타논(35)를 30 ml의 디메틸포름아미드 중에 용해시키고, 4.0 ml(33.7 mmol)의 벤질 브로마이드 및 13.8 g(100 mmol)의 탄산칼륨을 첨가한다. 반응 혼합물을 실온에서 3시간 동안 교반시킨다. 이어서, 물을 첨가하고, 에틸 아세테이트로 2회 추출한다. 합한 유기상을 염화나트륨 포화 용액으로 세척한 후, 황산나트륨으로 건조시키고 회전식 증발기에서 농축시킨다. 1.35 g(40%)의 화합물 36을 무색 결정물로서 수득한다. C23H2203 (346.2) MS (ESI+): 347.15 (M+H+).
1-(2,6-
비스벤질옥시
-4-
메틸페닐
)-3-(4-
메톡시페닐
)
프로페논
37
3.46 g(10 mmol)의 1-(2,6-비스벤질옥시-4-메틸페닐)에타논(36)을 150 ml의 에탄올 중에 용해시키고, 1.34 ml의 p-아니스알데하이드를 첨가한다. 이어서, 7 ml의 수산화칼륨 포화 용액을 적가한다. 반응액을 실온에서 12시간 동안 교반시킨다.
용매의 절반을 회전식 증발기에서 제거한다. 혼합물을 빙냉시키면서 2M 염산으로 중화시킨 후, 물과 에틸 아세테이트로 3회 추출한다. 유기상을 합쳐 염화나트륨 포화 용액으로 세척하고, 황산나트륨으로 건조시킨 다음, 농축시킨다. 분리된 오일을 결정화한다. 결정을 디에틸 에테르에서 교반시키고, 흡인 여과한 후, 건조시킨다. 4.3 g(92%)의 화합물 37을 무색 고체로서 수득한다. g/mol C31H2804 (464.2) MS (ESI+): 465.10 (M+H+).
1-(2,6-
디하이드록시
-4-
메틸페닐
)-3-(4-
메톡시페닐
)프로판-1-온 38
1.50 g(3.23 mmol)의 1-(2,6-비스벤질옥시-4-메틸페닐)에타논(37)을 40 ml의 에틸 아세테이트 중에 용해시키고, 아르곤 대기 하에 400 mg의 활성탄에 담지된 팔라듐(10%)을 첨가한다. 실온, 3 바아 하에 수소화 오토클레이브에서 수소화를 2시간 동안 수행한다. 이어서, 촉매를 여과시키고, 에틸 아세테이트로 세척한 후, 생성 용액을 회전식 증발기에서 농축시킨다. 조 생성물을 컬럼 크로마토그래피(SiO2, 에틸 아세테이트/n-헵탄 1:3)에 의해 정제한다.
600 mg의 생성물 38(65%)을 무색 고체로서 분리한다. C17H1804 286.3 MS (ESI+): 287.10 (M+H+).
참조 실시예 7
(화합물 20)
174.4 mg(0.61 mmol)의 화합물 38을 50 ml의 톨루엔 중에 용해시키고, 340 mg(0.61 mmol)의 브로마이드 60 및 421 mg의 탄산칼륨(2.44 mmol)을 첨가한다. 반응 혼합물을 워터 트랩으로 1시간 동안 환류시킨다. 탄산 카드뮴을 여과시키고, 생성된 투명한 용액을 회전식 증발기에서 농축시킨다. 조 생성물을 25 ml의 메탄올 중에 현탁시키고, 5.0 ml의 0.5 M 메탄올 NaOMe 용액과 혼합한 후, 실온에서 12시간 동안 교반시킨다. 반응 용액에 메탄올 HCl을 첨가하여 중화시키고, 섬광 크로마트그래피(SiO2, EtOAc/헵탄 1:4 → 1:1)에 의해 정제한다. 78.8 mg(29%)의 화합물 20을 무색 고체로서 수득한다. C23H27FO8 450.5 MS (ESI+): 473.15 (M+Na+).
화합물 40(실시예 15), 41(실시예 16), 42(실시예 17) 및 43(실시예 18)을 유사한 방법으로 제조하였다.
1-
메톡시
-4-
데옥시
-4,4-
디플루오로
-2,3,6-트리-O-벤질-알파-D-
글루코스
45
3.69 g(7.9 mmol)의 1-메톡시-2,3,6-트리-O-벤질-α-D-글루코스 44(Tetrahedron Asymmetry 11 (2000) 385-387)를 110 ml의 메틸렌 클로라이드 중에 용해시키고, 아르곤 대기 하에 3.6 g(8.5 mmol)의 데스-마틴 시약 (Aldrich)을 적가한다. 실온에서 3시간 경과한 후, 혼합물을 300 ml의 에틸 아세테이트/n-헵탄(1:1)으로 희석하고, NaHCO3 용액으로 1회, Na2S2O3 용액으로 1회 세척한다. 유기상을 실리카 겔을 통해 여과하고 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/n-헵탄 1:1)에 의해 분리한다. 2.9 g(79%)의 케톤을 수득한다. 케톤을 30 ml의 메틸렌 클로라이드 중에 용해시키고, 아르곤 대기 하에 4 ml의 BAST(Aldrich)를 적가한다. 실온에서 20시간 후, 혼합물을 200 ml의 에틸 아세테이트로 희석하고, NaHCO3 냉각 용액으로 조심스럽게 (촘촘한 거품) 세척한다. 유기상을 실리카 겔을 통해 여과하고 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/n-헵탄 1:1)에 의해 분리한다. 2.6 g(85%)의 45를 무색 오일로서 수득한다.
4-
데옥시
-4,4-
디플루오로
-1,2,3,6-
테트라
-O-아세틸-알파-D-
글루코스
46
2.3 g(4.7 mmol)의 45 및 2 g의 Pd/C(10% Pd)을 150 ml의 메탄올 및 10 ml의 아세트산 중에 용해시키고, 수소 5 바아의 대기 하에 실온에서 16시간 동안 수수화시킨다. 반응 용액을 농축시키고, 잔류물을 섬광 크로마트그래피(메틸렌 클로라이드/메탄올/진한 암모니아, 30/5/1)에 의해 정제한다. 850 mg(83%)의 1-메톡시-4-데옥시-4,4-디플루오로-알파-D-글루코스를 백색 무정형 고체로서 수득한다. C7H12F205 (214.17) MS(DCI): 215.4 (M + H+).
700 mg(3.3 mmol)의 1-메톡시-4-데옥시-4,4-디플루오로-알파-D-글루코스를 3.5 ml의 아세트산 및 6.3 ml의 아세트산 무수물 중에 용해시킨다. 0.2 ml의 진한 황산을 첨가한 후, 60℃에서 5시간 동안 교반시킨다. 이어서, 반응 용액을 얼음 30 g과 에틸 아세테이트 30 ml의 혼합물에 붓는다. 유기상을 NaCl 수용액으로 2회 이상 세척하고, 약간의 실리카 겔을 통해 여과한 후, 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/n-헵탄 1:1)에 의해 분리한다. 300 mg(25%)의 46을 아노머의 혼합물로서 수득한다. C14H18F209 (368.29) MS(DCI): 369.3 (M + H+).
1-
브로모
-4-
데옥시
-4,4-
디플루오로
-2,3,6-트리-O-아세틸-알파-D-
글루코스
47
300 mg(0.8 mmol)의 테트라아세테이트 46을 빙초산 중 33% 강 HBr 13 ml 중에 용해시키고, 실온에 6시간 동안 방치해 둔다. 이어서, 반응 용액을 얼음 10 g과 에틸 아세테이트 10 ml의 혼합물에 붓는다. 유기상을 NaCl 수용액으로 2회 이상 세척하고, 실리카 겔을 통해 여과한 후, 농축시킨다. 잔류물을 실리카 겔 상에서의 크로마토그래피(에틸 아세테이트/헵탄 1:1)에 의해 분리한다. 112 mg(35%)의 47을 무색 고체로서 수득한다. C12H15BrF207(389.15) MS(DCI): 389.2 (M + H+).
실시예 19 (화합물 50)
100 mg(0.47 mmol)의 2-벤질페놀(Aldrich) 및 40 mg(0.10 mmol)의 디플루오로 브로마이드 47을 화합물 9의 합성과 동일한 방법으로 반응시키고, 21 mg의 50을 무색 고체로서 수득한다. C19H20F205 (366.37) MS(ESI-) 411.15 (M + CH02 -).
(4-
메톡시페닐
)-(2-
메톡시페닐
)메탄올 51
1.5 g의 o-아니스알데하이드를 THF 중에 용해시키고, 0℃로 냉각시킨다. 혼합물에 24.2 ml의 4-메톡시페닐마그네슘 브로마이드(THF 중에 0.5 M)를 첨가한다. 반응 용액을 실온에서 밤새 교반시킨 다음, 20% NH4Cl 용액에 붓고 에틸 아세테이트로 추출한다. 2.63 g의 생성물을 수득하고, 이 생성물은 추가로 정제하지 않고 사용할 수 있다. C15H1603 (244.29) MS (ESI+) 227.05 (M-OH)+
(4-
메톡시페닐
)-(2-
메톡시페닐
)
메타논
52
2.63 g의 (4-메톡시페닐)(2-메톡시페닐)메탄올 51을 디클로로메탄 중에 용해시키고, 5.03 g의 데스-마틴 시약을 첨가한다. 혼합물을 실온에서 2시간 동안 교반시킨다. 이어서, 20% Na2SO3 및 NaHCO3 용액을 첨가하고, 혼합물을 디에틸 에테르로 추출한다. 유기상을 NaCl 포화 용액으로 추출하고, 황산나트륨으로 건조시킨다. 용액을 진공 하에 농축시키고, 컬럼 여과에 의해 정제한다. 2.61 g의 52를 수득한다. C15H1403 (242.28) MS (ESI+) 243.04 (M+H+)
다른 방법으로서 존스 시약으로의 산화를 수행할 수 있다:
155 mg의 (4-메톡시페닐)(2-메톡시페닐)메탄올 51을 10 ml의 아세톤 중에 용해시키고, 2 ml의 존스 시약을 적가한다. 실온에서 2시간 후, 혼합물에 50 L의 MTB 에테르 및 30 ml의 물을 첨가한다. 유기상을 물로 수회 세척하고, NaCl 포화 용액으로 추출한 다음, 황산나트륨으로 건조시키고, 증발 건조시킨다. 이 방법으로 수득한 생성물(126 mg)은 추가의 반응을 위해 충분한 순도를 갖는다.
(2-하이드록시페닐)(4-메톡시페닐)메타논 53
2.61 g의 (4-메톡시페닐)(2-메톡시페닐)메타논 52를 디클로로메탄 중에 용해시킨다. 혼합물을 빙욕에서 냉각시키고, 3.71 g의 3브롬화붕소-디메틸 설파이드 복합체를 첨가한다. 혼합물을 실온으로 가온하고, 3시간 동안 교반시킨다. 이어서, 빙수를 부어 반응을 정지시키고, 디클로로메탄상을 분리한 후, 수성상을 에틸 아세테이트로 수회 추출한다. 합친 유기상을 물 및 염화나트륨 용액으로 세척한 후, 황산나트륨으로 건조시키고, 농축시킨다. 조 생성물을 실리카 겔 상에서 크로마토그래피(에틸 아세테이트/헵탄)한다. 1.26 g의 생성물을 수득한다. C14H1203 (228.25) MS (DCI) 229.2 (M+H+)
2-(4-메톡시벤질)페놀 7
0.78 g의 (2-하이드록시페닐)(4-메톡시페닐)메타논을 아세토니트릴 중에 용해시키고, 0℃로 냉각시킨다. 혼합물에 2 ml의 TMSCl을 적가한 후, 1 g의 나트륨 시아노보로하이드라이드를 첨가한다. 혼합물을 실온에서 3시간 동안 교반시킨다. 반응 용액을 디클로로메탄으로 희석하고, 셀라이트로 여과한다. 유기상을 물 및 염화나트륨 포화 용액으로 세척한 후, 황산나트륨으로 건조시키고, 진공 하에 농축한다. 조 생성물을 실리카 겔 상에서 크로마토그래피(에틸 아세테이트/헵탄(1/2))한다. 0.72 g의 목적 생성물을 수득한다. C14H1402 (214.27) MS (ESI+):232.20 (M+NH4 +)+
(4-에틸페닐)(2-메톡시페닐)메탄올 54
1.01 g의 o-아니스알데하이드를 THF 중에 용해시키고 0℃로 냉각시킨다. 혼합물에 16.29 ml의 4-에틸페닐마그네슘 브로마이드(THF 중의 0.5 M)를 첨가한다. 반응 용액을 실온에서 밤새 교반시킨 다음, 20% NH4Cl 용액에 붓고 에틸 아세테이트로 추출한다. 1.92 g의 생성물을 수득하고, 이 생성물은 추가로 정제하지 않고서 사용할 수 있다. C16H18O2 (242.32) MS (ESI+) 225.15 (M-OH)+
4-
에틸페닐(2-메톡시페닐)메탄
55
1.34 g의 (4-에틸페닐)(2-메톡시페닐)메탄올을 아세토니트릴 중에 용해시키고 0℃로 냉각시킨다. 혼합물에 1.50 g의 나트륨 시아노보로하이드라이드를 첨가한 후, 3.00 ml의 트리메틸실릴 클로라이드를 첨가한다. 혼합물을 실온에서 밤새 교반시킨다. 반응 용액을 셀라이트를 통해 여과하고, NaCl 포화 용액으로 추출한다. 유기상을 황산나트륨으로 건조시키고, 농축한다. 조 생성물을 실리카 겔 상에서 크로마토그래피(에틸 아세테이트/헵탄(1/12))한다. 0.83 g의 생성물을 수득한다. C16H180 (226.32) MS (DCI) 227.4 (M+H+)
2-(4-
에틸벤질
)페놀 56
0.83 g의 (4-에틸페닐)(2-메톡시페닐)메탄 55를 디클로로메탄 중에 용해시킨다. 혼합물에 11.0 ml의 3브롬화붕소(CH2Cl2 중의 1M)를 적가한다. 혼합물을 실온에서 5시간 동안 교반시키고, 물을 첨가한 후, 디클로로메탄 상을 분리하여 제거한다. 수성상을 에틸 아세테이트로 추출한다. 합친 유기상을 물 및 NaCl 용액으로 세척하고, 황산나트륨으로 건조시킨 다음, 농축시킨다. 0.77 g의 조 생성물을 수득하고, 이 생성물은 크로마토그래피에 의해 정제할 수 있다. C15H160 (212.29) MS (ESI): 235.20 (M+Na+).
메틸 2,3,6-트리-O-벤조일-4-플루오로-4-데옥시-α-D-글루코피라노사이드 58
3 g의 메틸 2,3,6-트리-O-벤조일-α-D-갈락토피라노사이드 57(Reist et al., J. Org. Chem. 1965, 30, 2312)을 디클로로메탄에 투입하고, -30℃로 냉각시킨다. 이어서, 3.06 ml의 [비스(2-메톡시에틸)아미노]설퍼 트리플루오라이드(BAST)를 적가한다. 반응 용액을 실온으로 가온하고 밤새 교반시킨다. 혼합물을 디클로로메탄으로 희석시키고, 유기상을 H2O, NaHCO3 용액 및 NaCl 포화 용액으로 추출한다. 유기상을 Na2SO4로 건조시키고, 농축시킨다. 조 생성물을 에틸 아세테이트 및 헵탄으로부터 결정화한다. 1.95 g의 58을 무색 고체로서 수득한다. C28H25FO8 (508.51) MS (ESI+) 526.18 (M+NH4 +). 다른 방법으로서, 2.8 당량의 디에틸아미노설퍼 트리플루오라이드(DAST)를 사용하여 반응을 실시할 수 있고; 이 경우에, 반응 용액은 첨가 후 18시간 동안 환류시킨다. 후처리는 상기 설명과 동일하게 실시한다.
1-O-아세틸-2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시글루코스
59
12 g의 메틸 2,3,6-트리-O-벤조일-4-플루오로-4-데옥시-α-D-글루코피라노사이드 58을 150 ml의 아세트산 무수물 중에 현탁시킨다. 8.4 ml의 진한 황산을 150 ml의 빙초산과 혼합시키고 혼합물에 빙냉시키면서 첨가한다. 혼합물을 실온에서 60시간 동안 교반시킨다. 혼합물을 NaHCO3 용액에 붓고, 이 용액을 디클로로메탄으로 추출한다. 유기상을 NaCl 용액으로 추출하고, Na2SO4으로 건조시킨 다음, 농축시킨다. 잔류물을 에틸 아세테이트/헵탄으로부터 재결정화한다. 5.97 g의 생성물을 무색 고체로서 수득한다. C29H25FO9 (536.52) MS (ESI+) 554.15 (M+NH4 +)
2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시글루코실
브로마이드 60
1.44 g의 1-O-아세틸-2,3,6-트리-O-벤조일-4-플루오로-4-데옥시글루코스를 20 ml의 빙초산 중의 브롬화수소산(33%) 20 ml에 용해시키고, 실온에서 교반시킨다. 5시간 후, 혼합물을 빙수에 붓고, 수성상을 디클로로메탄으로 3회 추출한다. 합친 유기상을 염화나트륨 포화 용액으로 추출하고 황산나트륨으로 건조시킨 후, 증발 건조시킨다. 조 생성물을 에틸 아세테이트/헵탄 70:30를 이용하여 실리카 겔 컬럼을 통해 여과한다. 1.40 g의 생성물을 고체로서 수득한다. C27H22BrF07 (557.37) MS (ESI+) 574.05/576.05 (M+NH4 +).
2,3,6-트리-O-
벤조일
-4-
플루오로
-4-
데옥시글루코스
61
1.60 g의 1-O-아세틸-2,3,6-트리-O-벤조일-4-플루오로-4-데옥시글루코스를 디클로로메탄 중에 용해시킨다. 이 용액에 173 ㎕의 하이드라진 하이드레이트를 첨가한다. 16시간 후 반응 용액을 디클로로메탄과 H2O로 분할한다. 유기상을 NaCl 용액으로 추출하고, 황산나트륨으로 건조시킨 다음, 증발 건조시킨다. 조 생성물을 컬럼 여과에 의해 정제시킨다. 1.22 g의 목적 생성물을 수득한다. C27H23FO8 (494.48) MS (ESI+): 512.15 (M+NH4 +).
화합물 62
건조 디클로로메탄 2 ml 중의 2-(4-에틸벤질)페놀(56) 248 mg, 2,3,6-트리-O-벤조일-4-플루오로-4-데옥시글루코스(61) 550 mg 및 트리페닐포스핀 335 mg을 아르곤 하에 0℃로 냉각시킨다. 0.193 ml의 디에틸 아조디카르복실레이트를 서서히 적가한다. 이 용액을 실온으로 가온하고 밤새 교반시킨다. 이어서, 용액을 디클로로메탄으로 희석시키고, 물, 0.5 M NaOH 및 NaCl 포화 용액으로 추출한다. 유기상을 황산나트륨으로 건조시키고, 진공 하에 농축시킨다. 잔류물을 크로마토그래피(헵탄:에틸 아세테이트 3:1)에 의해 정제한다. 200 mg의 목적 생성물을 수득한다. C42H37FO8 (688.76) MS (ESI): 706.30 (M+NH4)+.
실시예
20
(화합물 63)
200 mg의 62를 10 ml의 무수 메탄올에 투입하고, 1 ml의 나트륨 메타놀레이트 용액(메탄올 ml 당 나트륨 메타놀레이트 10 mg)을 첨가한다. 용액을 8시간 동안 교반시킨다. Amberlyst 15 (H+ 형태)를 첨가하여 나트륨을 제거하고, 이온 교환체를 여과 제거하고, 잔류물을 철저히 세척한다. 생성물을 실리카 겔 여과(디클로로메탄:메탄올 96:4)에 의해 정제한다. 56 mg의 목적 생성물을 수득한다. C21H25F05 (376.43) MS (ESI): 394.25 (M+NH4 +)
아래 실시예는 적절한 아글리콘을 사용하여 실시예 20과 유사한 방법으로 제조한다:
적절한 아글리콘은 예를 들면 화합물 7 또는 56에 대해 기술된 방법에 의해 수득할 수 있다.
1-[4-(2-
메톡시페녹시
)
페닐
]
에타논
69
0.15 ml의 구아이아콜 67, 167 mg의 4-플루오로아세토페논 68 및 335 mg의 탄산칼륨을 5 ml의 디메틸 설폭사이드 중에서 전자레인지로 170℃로 10분간 가열한다. 반응 용액을 물에 붓고, 에멀젼을 에틸 tert-부틸 에테르로 3회 추출한다. 합친 유기상을 1N NaOH로 2회 추출하고 NaCl 포화 용액으로 1회 추출한 후, 건조시키고, 진공 하에 농축시킨다. 240 mg의 목적 생성물을 수득한다. C15H1403 (242.28) MS (ESI): 215.10 (M+H+).
2-(4-
에틸페녹시
)
메톡시벤젠
70
960 mg의 1-[4-(2-메톡시페녹시)페닐]에타논 69를 20 ml의 아세토니트릴에 용해시키고, 빙욕에서 냉각시킨 다음, 1.05 g의 나트륨 시아노보로하이드라이드 및 2.01 ml의 트리메틸실릴 클로라이드를 첨가한다. 1시간 후, 혼합물을 디클로로메탄으로 희석하고 셀라이트를 통해 여과한 후, 유기상을 염화나트륨 용액으로 추출하고, 황산나트륨으로 건조시킨 다음, 농축한다. 잔류물을 크로마토그래피(헵탄:에틸 아세테이트 7:1)에 의해 정제한다. 710 mg의 목적 생성물을 수득한다. C15H1602 (228.29) MS (ESI): 246.20 (M+NH4 +).
2-(4-
에틸페녹시
)페놀 71
710 mg의 2-(4-에틸페녹시)메톡시벤젠 70을 5 ml의 무수 디클로로메탄 중에 용해시킨다. 0.6 ml의 3브롬화붕소 (1 M 디클로로메탄)을 적가하고, 용액을 6시간 동안 교반시킨다. 추가의 BBr3을 첨가하고, 혼합물을 반응이 LCMS에 따라 거의 완료될 때까지 교반시킨다. 용액을 빙수에 붓고 유기상을 분리 제거한 후, 수성상을 디클로로메탄으로 3회 추출한다. 합친 유기상을 건조시키고, 증발 건조시킨 다음, 크로마토그래피에 의해 정제한다. 450 mg의 목적 생성물을 수득한다. C14H1402 (214.27) MS (ESI): 215.10 (M+H+).
화합물 72
화합물 61(466 mg)과 페놀 71(242 mg)을 화합물 62의 합성과 동일하게 반응시킨다. 생성물을 컬럼 크로마토그래피(헵탄:에틸 아세테이트 4:1)에 의해 정제할 수 있다. 240 mg의 목적 생성물을 수득한다. C41H35FO9 (690.73) MS (ESI): 708.25 (M+NH4 +).
화합물 24 (화합물 39)
230 mg의 화합물 72를 실시예 20의 유리와 동일하게 나트륨 메타놀레이트와 반응시킨다. 화합물을 실리카 겔로 크로마토그래피(디클로로메탄:메탄올 96:4)에 의해 정제할 수 있다. 119 mg의 목적 생성물을 수득한다. C20H23F06 (378.40) MS (ESI): 396.15 (M+NH4 +).
Claims (10)
- 골다공증의 예방제 및/또는 치료제를 제조하기 위한 SGLT-1/SGLT-2 억제제 활성을 갖는 화합물의 용도.
- 골다공증의 예방제 및/또는 치료제를 제조하기 위한, 하기 화학식 I의 화합물 및 이의 약제학적으로 허용되는 염 또는 하기 화학식 II의 화합물 및 이의 약제학적으로 허용되는 염 또는 하기 화학식 III의 화합물 및 이의 약제학적으로 허용되는 염의 용도:
화학식 I
상기 화학식 I에서,
R1 및 R2는 서로 독립적으로 F 또는 H이고, 여기서, 라디칼 R1 및 R2 중 하나는 F이어야 하며;
A는 O, NH, CH2, S 또는 결합이고;
R3은 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO-(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C3-C6)-사이클로알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C6)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬, 페닐, 벤질, (C1-C6)-알콕시카르보닐(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C7)-알킬, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이고;
R4는 수소, (C1-C6)-알킬, (C2-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이며;
B는 (C0-C15)-알킬렌(여기서, 알킬렌 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO)2-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 대체될 수 있다)이고;
R5, R6 및 R7은 서로 독립적으로, 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C8)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SCF3, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C6)-알킬, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C8)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R6 및 R7은 이들을 갖는 탄소 원자와 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc1[여기서, 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S로 대체될 수 있고, Cyc1은 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서 각 경우에 CH2 그룹 1개는 O로 대체될 수 있다)에 의해 치환되거나 H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]을 형성하며;
X는 CO, O, NH, S, SO, SO2 또는 결합이고;
L은 (C1-C6)-알킬렌, (C2-C5)-알케닐렌, (C2-C5)-알키닐렌(여기서 각 경우에 CH2 그룹 1개 또는 2개는 O 또는 NH로 대체될 수 있다)이며;
Y는 CO, NHCO, SO, SO2 또는 결합이고;
R8 및 R9는 서로 독립적으로 수소, SO3H, 당 잔기, (C1-C6)-알킬(여기서, 알킬 라디칼의 CH2 그룹 1개 이상은 서로 독립적으로 (C1-C6)-알킬, OH, (C1-C6)-알킬렌-OH, (C2-C6)-알케닐렌-OH, O-당 잔기, OSO3H, NH2, NH-(C1-C6)-알킬, N[(C1-C6)-알킬]2, NH-CO-(C1-C6)-알킬, NH-당 잔기, NH-SO3H, (C1-C6)-알킬렌-NH2, (C2-C6)-알케닐렌-NH2, (C0-C6)-알킬렌-COOH, (C0-C6)-알킬렌-CONH2, (C0-C6)-알킬렌-CONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SONH2, (C0-C6)-알킬렌-SONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SO2NH2, (C0-C6)-알킬렌-SO2NH-(C1-C6)-알킬, 아다만틸에 의해 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 N 원자와 함께, 5원 내지 7원 포화 환 Cyc2[여기서, 환의 CH2 그룹 1개 이상은 또한 O, S, NH, NSO3H, N-당 잔기, N-(C1-C6)-알킬(여기서, 알킬 라디칼의 CH2 그룹 1개 이상은 서로 독립적으로 (C1-C6)-알킬, OH, (C1-C6)-알킬렌-OH, (C2-C6)-알케닐렌-OH, NH2, NH-(C1-C6)-알킬, N[(C1-C6)-알킬]2, NH-CO-(C1-C6)-알킬, NH-당 잔기, (C1-C6)-알킬렌-NH2, (C2-C6)-알케닐렌-NH2, (C0-C6)-알킬렌-COOH, (C0-C6)-알킬렌-CONH2, (C0-C6)-알킬렌-CONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SONH2, (C0-C6)-알킬렌-SONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SO2NH2, (C0-C6)-알킬렌-SO2NH-(C1-C6)-알킬에 의해 치환될 수 있다)에 의해 대체될 수 있다]을 형성한다.
화학식 II
상기 화학식 II에서,
R1 및 R2는 서로 독립적으로 F 또는 H이거나, 라디칼 R1 및 R2 중 하나는 OH이며;
R3은 OH 또는 F이며(여기서, 라디칼 R1, R2 및 R3 중 하나 이상은 F이어야 한다);
R4는 OH이며;
A는 O, NH, CH2, S 또는 결합이고;
X는 C, O, S 또는 N이며(여기서, Y가 O 또는 S인 경우 X는 C이어야 한다);
Y는 N, O 또는 S이고;
m은 1 또는 2의 수이며;
R5는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질 또는 (C1-C6)-알콕시카르복실(여기서, 상기 알킬, 알콕시, 알케닐 또는 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
Y가 S인 경우, R5 및 R6은 이들을 갖는 C 원자들과 함께, 페닐을 형성하며;
R6은 임의로 H, (C1-C6)-알킬, (C1-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 C 원자들은 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 대체될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 3원 내지 7원 포화, 부분 포화 또는 불포화 환(여기서, 1개의 C 원자는 O, N 또는 S에 의해 대체될 수 있다)이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬(여기서, 상기 알킬, 알콕시, 알케닐 또는 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SCF3, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, (C1-C8)-알콕시, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 C 원자들과 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 상기 환의 1개 또는 2개의 탄소 원자(들)는 또한 N, O 또는 S에 의해 대체될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 1개의 CH2 그룹은 O에 의해 대체될 수 있다)에 의해 치환되거나, H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다.
화학식 III
상기 화학식 III에서,
R1 및 R2는 OH, F 또는 H이고, R1 및 R2는 F이며, 단 R1=F, R2=OH인 조합, R1=OH, R2=F인 조합 및 R1, R2=OH인 조합 3가지는 배제하고;
R3은 OH 또는 F이며, 여기서 라디칼 R1, R2, R3 중 하나 이상은 F이어야 하며;
A는 O, NH, CH2, S 또는 결합이고;
R4, R5 및 R6은 수소, F, Cl, Br, I, OH, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질(여기서, 상기 알킬, 알콕시, 알케닐 및 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬-페닐)- 또는 -NH-에 의해 치환될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 탄소 원자 1개가 O, N 또는 S에 의해 대체될 수 있는 3원 내지 7원 포화, 부분 포화 또는 불포화 환이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO-(C1-C4)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, (C1-C6)-알킬-OH, (C1-C6)-알킬-O-(C1-C6)-알킬(여기서, 상기 알킬 라디칼들의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, (C1-C8)-알콕시, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 탄소 원자들과 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 상기 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S에 의해 치환될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 CH2 그룹 1개는 O에 의해 대체될 수 있다)에 의해 치환되거나, H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다. - 제 1 항 내지 제 4 항에 있어서, 골 용해 또는 관절 임플란트에서의 무균성 이완의 예방제 및/또는 치료제의 제조를 위한 화합물의 용도.
- 골다공증, 골용해 또는 관절 임플란트에서의 무균성 이완의 예방제 및/또는 치료제에 사용하기 위한 하기 화학식 I의 화합물 및 이의 약제학적으로 허용되는 염:
화학식 I
상기 화학식 I에서,
R1 및 R2는 서로 독립적으로 F 또는 H이고, 여기서, 라디칼 R1 및 R2 중 하나는 F이어야 하며;
A는 O, NH, CH2, S 또는 결합이고;
R3은 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO-(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C3-C6)-사이클로알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C6)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬, 페닐, 벤질, (C1-C6)-알콕시카르보닐(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C7)-알킬, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이고;
R4는 수소, (C1-C6)-알킬, (C2-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이며;
B는 (C0-C15)-알킬렌(여기서, 알킬렌 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO)2-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 대체될 수 있다)이고;
R5, R6 및 R7은 서로 독립적으로, 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, O-(C1-C8)-알킬, HO-(C1-C6)-알킬렌, (C1-C6)-알킬렌-O-(C1-C6)-알킬(여기서, 상기 알킬, 알케닐, 알키닐 및 O-알킬 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SCF3, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-CO-(C1-C6)-알킬, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C8)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R6 및 R7은 이들을 갖는 탄소 원자와 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc1[여기서, 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S로 대체될 수 있고, Cyc1은 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서 각 경우에 CH2 그룹 1개는 O로 대체될 수 있다)에 의해 치환되거나 H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]을 형성하며;
X는 CO, O, NH, S, SO, SO2 또는 결합이고;
L은 (C1-C6)-알킬렌, (C2-C5)-알케닐렌, (C2-C5)-알키닐렌(여기서 각 경우에 CH2 그룹 1개 또는 2개는 O 또는 NH로 대체될 수 있다)이며;
Y는 CO, NHCO, SO, SO2 또는 결합이고;
R8 및 R9는 서로 독립적으로 수소, SO3H, 당 잔기, (C1-C6)-알킬(여기서, 알킬 라디칼의 CH2 그룹 1개 이상은 서로 독립적으로 (C1-C6)-알킬, OH, (C1-C6)-알킬렌-OH, (C2-C6)-알케닐렌-OH, O-당 잔기, OSO3H, NH2, NH-(C1-C6)-알킬, N[(C1-C6)-알킬]2, NH-CO-(C1-C6)-알킬, NH-당 잔기, NH-SO3H, (C1-C6)-알킬렌-NH2, (C2-C6)-알케닐렌-NH2, (C0-C6)-알킬렌-COOH, (C0-C6)-알킬렌-CONH2, (C0-C6)-알킬렌-CONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SONH2, (C0-C6)-알킬렌-SONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SO2NH2, (C0-C6)-알킬렌-SO2NH-(C1-C6)-알킬, 아다만틸에 의해 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 N 원자와 함께, 5원 내지 7원 포화 환 Cyc2[여기서, 환의 CH2 그룹 1개 이상은 또한 O, S, NH, NSO3H, N-당 잔기, N-(C1-C6)-알킬(여기서, 알킬 라디칼의 CH2 그룹 1개 이상은 서로 독립적으로 (C1-C6)-알킬, OH, (C1-C6)-알킬렌-OH, (C2-C6)-알케닐렌-OH, NH2, NH-(C1-C6)-알킬, N[(C1-C6)-알킬]2, NH-CO-(C1-C6)-알킬, NH-당 잔기, (C1-C6)-알킬렌-NH2, (C2-C6)-알케닐렌-NH2, (C0-C6)-알킬렌-COOH, (C0-C6)-알킬렌-CONH2, (C0-C6)-알킬렌-CONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SONH2, (C0-C6)-알킬렌-SONH-(C1-C6)-알킬, (C0-C6)-알킬렌-SO2NH2, (C0-C6)-알킬렌-SO2NH-(C1-C6)-알킬에 의해 치환될 수 있다)에 의해 대체될 수 있다]을 형성한다. - 골다공증, 골용해 또는 관절 임플란트에서의 무균성 이완의 예방제 및/또는 치료제에 사용하기 위한 하기 화학식 II의 화합물 및 이의 약제학적으로 허용되는 염:
화학식 II
상기 화학식 II에서,
R1 및 R2는 서로 독립적으로 F 또는 H이거나, 라디칼 R1 및 R2 중 하나는 OH이며;
R3은 OH 또는 F이며(여기서, 라디칼 R1, R2 및 R3 중 하나 이상은 F이어야 한다);
R4는 OH이며;
A는 O, NH, CH2, S 또는 결합이고;
X는 C, O, S 또는 N이며(여기서, Y가 O 또는 S인 경우 X는 C이어야 한다);
Y는 N, O 또는 S이고;
m은 1 또는 2의 수이며;
R5는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질 또는 (C1-C6)-알콕시카르복실(여기서, 상기 알킬, 알콕시, 알케닐 또는 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
Y가 S인 경우, R5 및 R6은 이들을 갖는 C 원자들과 함께, 페닐을 형성하며;
R6은 임의로 H, (C1-C6)-알킬, (C1-C6)-알케닐, (C3-C6)-사이클로알킬, 또는 임의로 할로겐 또는 (C1-C4)-알킬에 의해 치환될 수 있는 페닐이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 C 원자들은 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬페닐)- 또는 -NH-에 의해 대체될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 3원 내지 7원 포화, 부분 포화 또는 불포화 환(여기서, 1개의 C 원자는 O, N 또는 S에 의해 대체될 수 있다)이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO(C1-C4)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, HO-(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬(여기서, 상기 알킬, 알콕시, 알케닐 또는 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SCF3, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH-(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, (C1-C8)-알콕시, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 C 원자들과 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 상기 환의 1개 또는 2개의 탄소 원자(들)는 또한 N, O 또는 S에 의해 대체될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 1개의 CH2 그룹은 O에 의해 대체될 수 있다)에 의해 치환되거나, H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다. - 골다공증, 골용해 또는 관절 임플란트에서의 무균성 이완의 예방제 및/또는 치료제에 사용하기 위한 하기 화학식 III의 화합물 및 이의 약제학적으로 허용되는 염:
화학식 III
상기 화학식 III에서,
R1 및 R2는 OH, F 또는 H이고, R1 및 R2는 F이며, 단 R1=F, R2=OH인 조합, R1=OH, R2=F인 조합 및 R1, R2=OH인 조합 3가지는 배제하고;
R3은 OH 또는 F이며, 여기서 라디칼 R1, R2, R3 중 하나 이상은 F이어야 하며;
A는 O, NH, CH2, S 또는 결합이고;
R4, R5 및 R6은 수소, F, Cl, Br, I, OH, NO2, CN, COOH, CO(C1-C6)-알킬, COO(C1-C6)-알킬, CONH2, CONH(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C6)-알콕시, HO(C1-C6)-알킬, (C1-C6)-알킬-O-(C1-C6)-알킬, 페닐, 벤질(여기서, 상기 알킬, 알콕시, 알케닐 및 알키닐 라디칼의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이고;
B는 (C0-C15)-알칸디일(여기서, 알칸디일 라디칼의 1개 이상의 탄소 원자는 서로 독립적으로 -O-, -(C=O)-, -CH=CH-, -C≡C-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N((C1-C6)-알킬)-, -N((C1-C6)-알킬-페닐)- 또는 -NH-에 의해 치환될 수 있다)이고;
n은 0 내지 4의 수이며;
Cyc1은 탄소 원자 1개가 O, N 또는 S에 의해 대체될 수 있는 3원 내지 7원 포화, 부분 포화 또는 불포화 환이고;
R7, R8 및 R9는 수소, F, Cl, Br, I, OH, CF3, NO2, CN, COOH, COO(C1-C6)-알킬, CO-(C1-C4)-알킬, CONH2, CONH-(C1-C6)-알킬, CON[(C1-C6)-알킬]2, (C1-C6)-알킬, (C2-C6)-알케닐, (C2-C6)-알키닐, (C1-C8)-알콕시, (C1-C6)-알킬-OH, (C1-C6)-알킬-O-(C1-C6)-알킬(여기서, 상기 알킬 라디칼들의 1개, 1개 초과 또는 모든 수소(들)는 불소에 의해 대체될 수 있다);
SO2-NH2, SO2-NH(C1-C6)-알킬, SO2N[(C1-C6)-알킬]2, S-(C1-C6)-알킬, S-(CH2)o-페닐, SO-(C1-C6)-알킬, SO-(CH2)o-페닐, SO2-(C1-C6)-알킬, SO2-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 라디칼은 F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-알킬, (C1-C6)-알킬, NH2에 의해 2회까지 치환될 수 있다);
NH2, NH-(C1-C6)-알킬, N((C1-C6)-알킬)2, NH(C1-C7)-아실, 페닐, O-(CH2)o-페닐(여기서, o는 0 내지 6일 수 있고, 상기 페닐 환은 F, Cl, Br, I, OH, CF3, NO2, CN, OCF3, (C1-C8)-알콕시, (C1-C6)-알킬, NH2, NH(C1-C6)-알킬, N((C1-C6)-알킬)2, SO2-CH3, COOH, COO-(C1-C6)-알킬, CONH2에 의해 1회 내지 3회 치환될 수 있다)이거나;
R8 및 R9는 이들을 갖는 탄소 원자들과 함께, 5원 내지 7원 포화, 부분 불포화 또는 완전 불포화 환 Cyc2[여기서, 상기 환의 탄소 원자 1개 또는 2개는 또한 N, O 또는 S에 의해 치환될 수 있고, Cyc2는 임의로 (C1-C6)-알킬, (C2-C5)-알케닐, (C2-C5)-알키닐(여기서, 각 경우에 CH2 그룹 1개는 O에 의해 대체될 수 있다)에 의해 치환되거나, H, F, Cl, OH, CF3, NO2, CN, COO(C1-C4)-알킬, CONH2, CONH(C1-C4)-알킬, OCF3에 의해 치환될 수 있다]를 형성한다.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP09290759 | 2009-10-02 | ||
| EP09290759.1 | 2009-10-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120091174A true KR20120091174A (ko) | 2012-08-17 |
Family
ID=41316222
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127011291A KR20120091174A (ko) | 2009-10-02 | 2010-10-01 | 골질환 치료제의 제조를 위한 sglt-1/sglt-2 억제제 활성을 갖는 화합물의 용도 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20120270819A1 (ko) |
| EP (1) | EP2482823A2 (ko) |
| JP (1) | JP2013506635A (ko) |
| KR (1) | KR20120091174A (ko) |
| CN (1) | CN102753184A (ko) |
| AU (1) | AU2010302642A1 (ko) |
| BR (1) | BR112012007349A2 (ko) |
| CA (1) | CA2774903A1 (ko) |
| IL (1) | IL218853A0 (ko) |
| MX (1) | MX2012003400A (ko) |
| RU (1) | RU2012117560A (ko) |
| WO (1) | WO2011039338A2 (ko) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UA113086C2 (xx) * | 2012-05-10 | 2016-12-12 | Піразольні сполуки як інгібітори sglt1 | |
| TW201425326A (zh) | 2012-10-05 | 2014-07-01 | Lilly Co Eli | 新穎脲化合物 |
| AR098670A1 (es) * | 2013-11-08 | 2016-06-08 | Lilly Co Eli | Inhibidor de sglt1 |
| EP3655402A1 (de) | 2017-07-18 | 2020-05-27 | Bayer CropScience Aktiengesellschaft | Substituierte 3-heteroaryloxy-1h-pyrazole sowie deren salze und ihre verwendung als herbizide wirkstoffe |
| EP3891145B1 (en) * | 2018-12-06 | 2023-04-12 | Constellation Pharmaceuticals, Inc. | Modulators of trex1 |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2663336B1 (fr) | 1990-06-18 | 1992-09-04 | Adir | Nouveaux derives peptidiques, leur procede de preparation et les compositions pharmaceutiques qui les contiennent. |
| IL125071A0 (en) | 1996-01-17 | 1999-01-26 | Novo Nordisk As | Fused 1,2,4-thiadiazine and fused 1,4-thiazine derivatives their preparation and use |
| KR100556067B1 (ko) | 1996-08-30 | 2006-03-07 | 노보 노르디스크 에이/에스 | 지엘피 - 1 유도체 |
| RU2200161C2 (ru) | 1996-12-31 | 2003-03-10 | Др. Редди'З Рисерч Фаундейшн | Новые производные азолидиндиона, способ их получения (варианты), фармацевтические композиции на их основе, способ предупреждения или лечения, способ снижения глюкозы и промежуточное соединение |
| DE19726167B4 (de) | 1997-06-20 | 2008-01-24 | Sanofi-Aventis Deutschland Gmbh | Insulin, Verfahren zu seiner Herstellung und es enthaltende pharmazeutische Zubereitung |
| RU2215004C2 (ru) | 1997-07-16 | 2003-10-27 | Ново Нордиск А/С | Конденсированное производное 1,2,4-тиадиазина, фармацевтическая композиция и способ получения лекарственного препарата |
| CO4970713A1 (es) | 1997-09-19 | 2000-11-07 | Sanofi Synthelabo | Derivados de carboxamidotiazoles, su preparacion, composiciones farmaceuticas que los contienen |
| US6221897B1 (en) | 1998-06-10 | 2001-04-24 | Aventis Pharma Deutschland Gmbh | Benzothiepine 1,1-dioxide derivatives, a process for their preparation, pharmaceuticals comprising these compounds, and their use |
| DE19845405C2 (de) | 1998-10-02 | 2000-07-13 | Aventis Pharma Gmbh | Arylsubstituierte Propanolaminderivate und deren Verwendung |
| GB9900416D0 (en) | 1999-01-08 | 1999-02-24 | Alizyme Therapeutics Ltd | Inhibitors |
| EP1173438A1 (en) | 1999-04-16 | 2002-01-23 | Novo Nordisk A/S | Substituted imidazoles, their preparation and use |
| WO2000064876A1 (en) | 1999-04-28 | 2000-11-02 | Aventis Pharma Deutschland Gmbh | Tri-aryl acid derivatives as ppar receptor ligands |
| HUP0201291A3 (en) | 1999-04-28 | 2002-11-28 | Sanofi Aventis Deutschland | Di-aryl acid derivatives as ppar receptor ligands and pharmaceutical compositions containing them |
| JP2002543200A (ja) | 1999-04-30 | 2002-12-17 | ニューロゲン コーポレイション | 9H−ピリミド[4、5−b]インドール誘導体:CRF1特異性リガンド |
| GB9911863D0 (en) | 1999-05-21 | 1999-07-21 | Knoll Ag | Therapeutic agents |
| CA2376919C (en) | 1999-06-18 | 2008-11-04 | Merck & Co., Inc. | Arylthiazolidinedione and aryloxazolidinedione derivatives |
| ES2203498T3 (es) | 1999-07-29 | 2004-04-16 | Eli Lilly And Company | Benzofurilpiperazinas: agonistas de receptor 5-ht2c de la serotonina. |
| DE50011035D1 (de) | 1999-09-01 | 2005-09-29 | Aventis Pharma Gmbh | Sulfonylcarboxamidderivate, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| AU5257401A (en) | 2000-04-28 | 2001-11-12 | Asahi Chemical Ind | Novel bicyclic compounds |
| ATE310728T1 (de) | 2000-05-11 | 2005-12-15 | Bristol Myers Squibb Co | Tetrahydroisochinolin-analoga als wachstumshormon-sekretagoga |
| EP1289526A4 (en) | 2000-05-30 | 2005-03-16 | Merck & Co Inc | MELANOCORTIN RECEPTOR AGONISTS |
| CA2429833A1 (en) | 2000-11-30 | 2002-06-06 | Kissei Pharmaceutical Co., Ltd. | Glucopyranosyloxybenzylbenzene derivatives, medicinal compositions containing the same and intermediates in the production thereof |
| CN100577175C (zh) | 2001-04-04 | 2010-01-06 | 奥索-麦克尼尔药品公司 | 包括葡萄糖重吸收抑制剂和ppar调节剂的联合疗法 |
| KR100915108B1 (ko) | 2001-08-31 | 2009-09-03 | 사노피-아벤티스 도이칠란트 게엠베하 | Ppar-활성화제로서의 디아릴사이클로알킬 유도체 및 이를 포함하는 약제학적 조성물 |
| JP4540475B2 (ja) * | 2002-08-08 | 2010-09-08 | キッセイ薬品工業株式会社 | ピラゾール誘導体、それを含有する医薬組成物、その医薬用途及びその製造中間体 |
| JP2004137245A (ja) | 2002-08-23 | 2004-05-13 | Kissei Pharmaceut Co Ltd | ピラゾール誘導体、それを含有する医薬組成物、その医薬用途及びその製造中間体 |
| DE10258007B4 (de) | 2002-12-12 | 2006-02-09 | Sanofi-Aventis Deutschland Gmbh | Aromatische Fluorglycosidderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zur Herstellung dieser Arzneimittel |
| DE10258008B4 (de) * | 2002-12-12 | 2006-02-02 | Sanofi-Aventis Deutschland Gmbh | Heterocyclische Fluorglycosidderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zur Herstellung dieser Arzneimittel |
| DE10261557B4 (de) | 2002-12-23 | 2005-06-02 | Weinhold, Karl, Dipl.-Ing. | Kupplung für Stahlwendelschläuche |
| DE102004028241B4 (de) * | 2004-06-11 | 2007-09-13 | Sanofi-Aventis Deutschland Gmbh | Neue Fluorglykosidderivate von Pyrazolen, diese Verbindungen enthaltende Arzneimittel und Herstellung dieser Arzneimittel |
| JP2008007405A (ja) * | 2004-12-07 | 2008-01-17 | Takeda Chem Ind Ltd | カルボキサミド誘導体 |
| DE102006053637B4 (de) * | 2006-11-14 | 2011-06-30 | Sanofi-Aventis Deutschland GmbH, 65929 | Neue mit Fluor substituierte 1,4-Benzothiepin-1,1-Dioxidderivate, diese Verbindungen enthaltende Arzneimittel und deren Verwendung |
| JP2009107947A (ja) * | 2007-10-26 | 2009-05-21 | Taisho Pharmaceutical Co Ltd | ピラゾリル5−チオグルコシド化合物を有効成分とする糖尿病治療剤 |
-
2010
- 2010-10-01 JP JP2012531438A patent/JP2013506635A/ja not_active Abandoned
- 2010-10-01 RU RU2012117560/15A patent/RU2012117560A/ru not_active Application Discontinuation
- 2010-10-01 EP EP10765409A patent/EP2482823A2/en not_active Withdrawn
- 2010-10-01 BR BR112012007349A patent/BR112012007349A2/pt not_active IP Right Cessation
- 2010-10-01 CA CA2774903A patent/CA2774903A1/en not_active Abandoned
- 2010-10-01 AU AU2010302642A patent/AU2010302642A1/en not_active Abandoned
- 2010-10-01 CN CN2010800548603A patent/CN102753184A/zh active Pending
- 2010-10-01 MX MX2012003400A patent/MX2012003400A/es not_active Application Discontinuation
- 2010-10-01 WO PCT/EP2010/064620 patent/WO2011039338A2/en active Application Filing
- 2010-10-01 KR KR1020127011291A patent/KR20120091174A/ko not_active Application Discontinuation
- 2010-10-01 US US13/499,597 patent/US20120270819A1/en not_active Abandoned
-
2012
- 2012-03-26 IL IL218853A patent/IL218853A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011039338A3 (en) | 2011-08-25 |
| IL218853A0 (en) | 2012-06-28 |
| EP2482823A2 (en) | 2012-08-08 |
| CA2774903A1 (en) | 2011-04-07 |
| AU2010302642A1 (en) | 2012-04-26 |
| RU2012117560A (ru) | 2013-11-10 |
| WO2011039338A2 (en) | 2011-04-07 |
| JP2013506635A (ja) | 2013-02-28 |
| CN102753184A (zh) | 2012-10-24 |
| BR112012007349A2 (pt) | 2019-09-24 |
| MX2012003400A (es) | 2012-04-10 |
| US20120270819A1 (en) | 2012-10-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7820804B2 (en) | Fluoroglycoside derivatives of pyrazoles, medicaments containing these compounds, and the use thereof | |
| RU2339641C2 (ru) | Новые гетероциклические фторгликозидные производные, содержащие эти соединения лекарственные средства и их применение | |
| RU2340622C2 (ru) | Новые ароматические фторгликозидные производные, содержащие эти соединения лекарственные средства, и их применение | |
| AU2003246620B2 (en) | Novel thiophenylglycoside derivatives, methods for production thereof, medicaments comprising said compounds and use thereof | |
| KR20120091174A (ko) | 골질환 치료제의 제조를 위한 sglt-1/sglt-2 억제제 활성을 갖는 화합물의 용도 | |
| KR101164434B1 (ko) | 피라졸의 신규 플루오로글리코시드 유도체, 당해 화합물을함유하는 의약 및 이의 용도 | |
| NZ540694A (en) | Novel aromatic fluoroglycoside derivatives, pharmaceutical products containing said compounds and the use thereof | |
| NZ537583A (en) | Novel thiophene glycoside derivatives, methods for production thereof, medicaments comprising said compounds and use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |