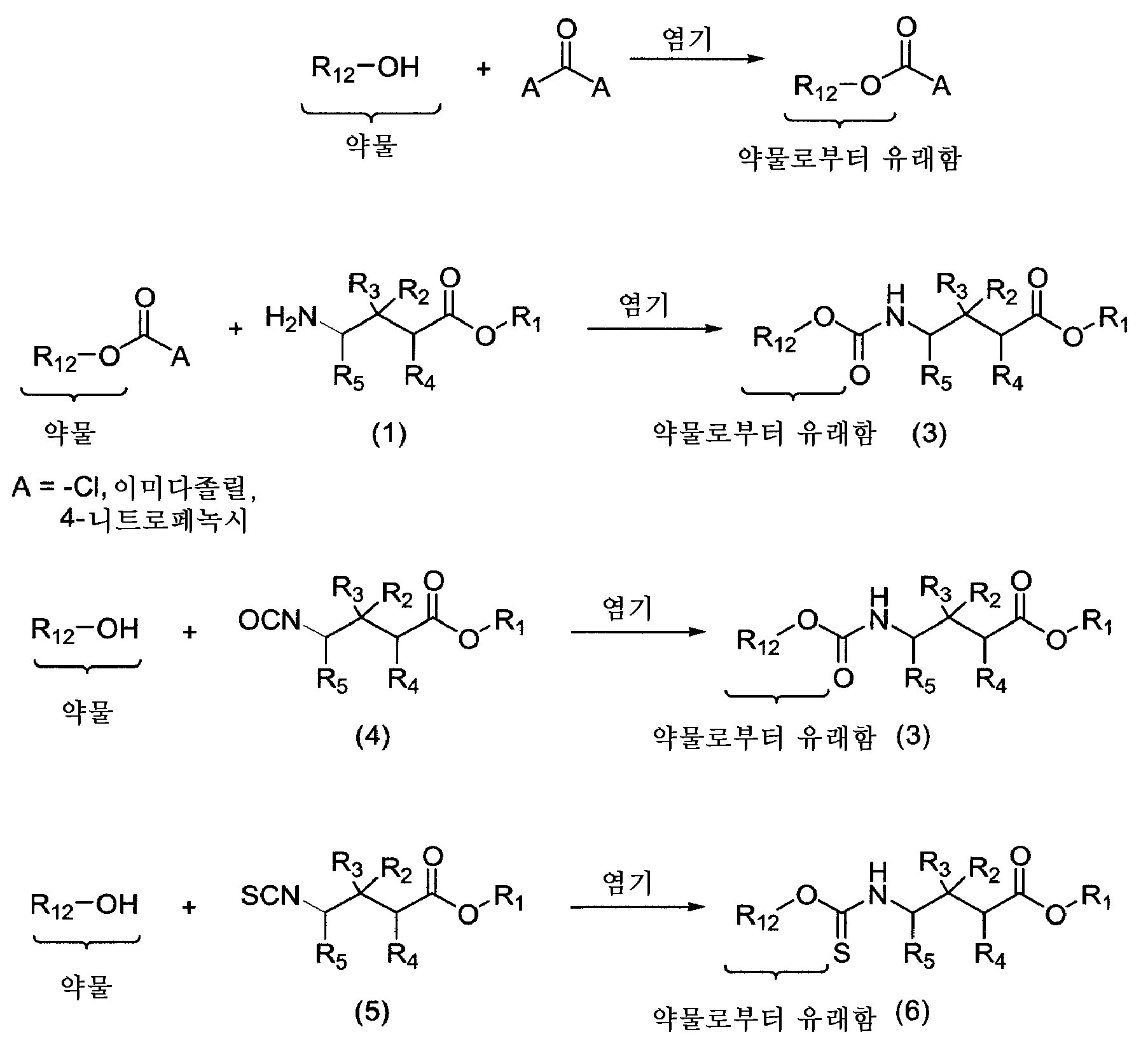
KR20110081839A - Gaba 접합체 및 그의 사용 방법 - Google Patents
Gaba 접합체 및 그의 사용 방법 Download PDFInfo
- Publication number
- KR20110081839A KR20110081839A KR1020117010420A KR20117010420A KR20110081839A KR 20110081839 A KR20110081839 A KR 20110081839A KR 1020117010420 A KR1020117010420 A KR 1020117010420A KR 20117010420 A KR20117010420 A KR 20117010420A KR 20110081839 A KR20110081839 A KR 20110081839A
- Authority
- KR
- South Korea
- Prior art keywords
- residue
- gaba
- compound
- drug
- bonds
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 115
- 239000003814 drug Substances 0.000 claims abstract description 220
- 229940079593 drug Drugs 0.000 claims abstract description 184
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical class NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 claims abstract description 184
- 230000036407 pain Effects 0.000 claims abstract description 78
- 208000012902 Nervous system disease Diseases 0.000 claims abstract description 17
- 208000027520 Somatoform disease Diseases 0.000 claims abstract description 14
- 208000027753 pain disease Diseases 0.000 claims abstract description 14
- 208000025966 Neurological disease Diseases 0.000 claims abstract description 10
- 150000001875 compounds Chemical class 0.000 claims description 151
- 208000002193 Pain Diseases 0.000 claims description 77
- 239000003795 chemical substances by application Substances 0.000 claims description 56
- 229940035676 analgesics Drugs 0.000 claims description 54
- 239000008194 pharmaceutical composition Substances 0.000 claims description 53
- 239000000730 antalgic agent Substances 0.000 claims description 52
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 claims description 50
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 claims description 48
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 43
- SJZRECIVHVDYJC-UHFFFAOYSA-N 4-hydroxybutyric acid Chemical group OCCCC(O)=O SJZRECIVHVDYJC-UHFFFAOYSA-N 0.000 claims description 41
- 208000035475 disorder Diseases 0.000 claims description 38
- 238000011282 treatment Methods 0.000 claims description 35
- 230000000694 effects Effects 0.000 claims description 34
- 229940124597 therapeutic agent Drugs 0.000 claims description 33
- 229960003692 gamma aminobutyric acid Drugs 0.000 claims description 28
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 27
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 claims description 25
- 125000006239 protecting group Chemical group 0.000 claims description 25
- 230000001225 therapeutic effect Effects 0.000 claims description 25
- 229960002870 gabapentin Drugs 0.000 claims description 24
- 238000010521 absorption reaction Methods 0.000 claims description 22
- AYXYPKUFHZROOJ-ZETCQYMHSA-N pregabalin Chemical compound CC(C)C[C@H](CN)CC(O)=O AYXYPKUFHZROOJ-ZETCQYMHSA-N 0.000 claims description 22
- 229960001233 pregabalin Drugs 0.000 claims description 22
- 230000002378 acidificating effect Effects 0.000 claims description 20
- 125000002843 carboxylic acid group Chemical group 0.000 claims description 19
- 239000000935 antidepressant agent Substances 0.000 claims description 17
- 241001465754 Metazoa Species 0.000 claims description 15
- 239000003937 drug carrier Substances 0.000 claims description 15
- 208000019901 Anxiety disease Diseases 0.000 claims description 14
- KPYSYYIEGFHWSV-UHFFFAOYSA-N Baclofen Chemical group OC(=O)CC(CN)C1=CC=C(Cl)C=C1 KPYSYYIEGFHWSV-UHFFFAOYSA-N 0.000 claims description 14
- 229960000794 baclofen Drugs 0.000 claims description 14
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 claims description 13
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 claims description 12
- 206010010904 Convulsion Diseases 0.000 claims description 12
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 12
- 230000001154 acute effect Effects 0.000 claims description 11
- 150000001413 amino acids Chemical class 0.000 claims description 11
- 125000003277 amino group Chemical group 0.000 claims description 11
- 230000036506 anxiety Effects 0.000 claims description 10
- 208000012661 Dyskinesia Diseases 0.000 claims description 9
- 208000028017 Psychotic disease Diseases 0.000 claims description 9
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 claims description 9
- 206010015037 epilepsy Diseases 0.000 claims description 9
- 206010022437 insomnia Diseases 0.000 claims description 9
- 206010067484 Adverse reaction Diseases 0.000 claims description 8
- 208000005793 Restless legs syndrome Diseases 0.000 claims description 8
- 230000006838 adverse reaction Effects 0.000 claims description 8
- 230000001684 chronic effect Effects 0.000 claims description 8
- 150000002466 imines Chemical class 0.000 claims description 8
- ACVYVLVWPXVTIT-UHFFFAOYSA-N phosphinic acid Chemical group O[PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-N 0.000 claims description 8
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 claims description 8
- 239000012896 selective serotonin reuptake inhibitor Substances 0.000 claims description 8
- 206010042772 syncope Diseases 0.000 claims description 8
- 230000001430 anti-depressive effect Effects 0.000 claims description 7
- 239000003112 inhibitor Substances 0.000 claims description 7
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 claims description 6
- 239000005557 antagonist Substances 0.000 claims description 6
- 208000010877 cognitive disease Diseases 0.000 claims description 6
- 230000004968 inflammatory condition Effects 0.000 claims description 6
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 claims description 6
- 229960002748 norepinephrine Drugs 0.000 claims description 6
- 125000000626 sulfinic acid group Chemical group 0.000 claims description 6
- 229940100578 Acetylcholinesterase inhibitor Drugs 0.000 claims description 5
- 229910019142 PO4 Inorganic materials 0.000 claims description 5
- 229940035678 anti-parkinson drug Drugs 0.000 claims description 5
- 230000000561 anti-psychotic effect Effects 0.000 claims description 5
- 239000002899 monoamine oxidase inhibitor Substances 0.000 claims description 5
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 5
- 239000010452 phosphate Substances 0.000 claims description 5
- 239000003196 psychodysleptic agent Substances 0.000 claims description 5
- 201000000980 schizophrenia Diseases 0.000 claims description 5
- 239000000932 sedative agent Substances 0.000 claims description 5
- PJDFLNIOAUIZSL-UHFFFAOYSA-N vigabatrin Chemical compound C=CC(N)CCC(O)=O PJDFLNIOAUIZSL-UHFFFAOYSA-N 0.000 claims description 5
- 229960005318 vigabatrin Drugs 0.000 claims description 5
- 208000024827 Alzheimer disease Diseases 0.000 claims description 4
- 208000027534 Emotional disease Diseases 0.000 claims description 4
- 201000004311 Gilles de la Tourette syndrome Diseases 0.000 claims description 4
- 208000023105 Huntington disease Diseases 0.000 claims description 4
- 208000019022 Mood disease Diseases 0.000 claims description 4
- 206010033864 Paranoia Diseases 0.000 claims description 4
- 208000027099 Paranoid disease Diseases 0.000 claims description 4
- 208000018737 Parkinson disease Diseases 0.000 claims description 4
- 208000000323 Tourette Syndrome Diseases 0.000 claims description 4
- 208000016620 Tourette disease Diseases 0.000 claims description 4
- 208000018459 dissociative disease Diseases 0.000 claims description 4
- 201000001119 neuropathy Diseases 0.000 claims description 4
- 230000007823 neuropathy Effects 0.000 claims description 4
- 208000022821 personality disease Diseases 0.000 claims description 4
- 238000011321 prophylaxis Methods 0.000 claims description 4
- 206010044565 Tremor Diseases 0.000 claims description 2
- 230000003111 delayed effect Effects 0.000 claims description 2
- 201000006549 dyspepsia Diseases 0.000 claims description 2
- 230000008569 process Effects 0.000 claims description 2
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 claims 4
- 125000004423 acyloxy group Chemical group 0.000 claims 4
- 229940126570 serotonin reuptake inhibitor Drugs 0.000 claims 2
- 239000003772 serotonin uptake inhibitor Substances 0.000 claims 2
- 208000004929 Facial Paralysis Diseases 0.000 claims 1
- HOKKHZGPKSLGJE-UHFFFAOYSA-N N-methyl-D-aspartic acid Natural products CNC(C(O)=O)CC(O)=O HOKKHZGPKSLGJE-UHFFFAOYSA-N 0.000 claims 1
- 208000036826 VIIth nerve paralysis Diseases 0.000 claims 1
- 208000022531 anorexia Diseases 0.000 claims 1
- 206010061428 decreased appetite Diseases 0.000 claims 1
- 230000004064 dysfunction Effects 0.000 claims 1
- 230000003274 myotonic effect Effects 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 135
- 238000009472 formulation Methods 0.000 description 47
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 37
- 239000000243 solution Substances 0.000 description 34
- -1 anti-anxiety drug Substances 0.000 description 30
- 125000003710 aryl alkyl group Chemical group 0.000 description 28
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- 235000002639 sodium chloride Nutrition 0.000 description 27
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 26
- 239000000443 aerosol Substances 0.000 description 25
- 235000019441 ethanol Nutrition 0.000 description 24
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 24
- 239000003380 propellant Substances 0.000 description 24
- 230000015572 biosynthetic process Effects 0.000 description 23
- 238000013268 sustained release Methods 0.000 description 23
- 239000012730 sustained-release form Substances 0.000 description 23
- 125000000753 cycloalkyl group Chemical group 0.000 description 22
- 229910001868 water Inorganic materials 0.000 description 22
- 125000001072 heteroaryl group Chemical group 0.000 description 20
- 239000000725 suspension Substances 0.000 description 20
- 125000005647 linker group Chemical group 0.000 description 19
- 238000003786 synthesis reaction Methods 0.000 description 19
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 17
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 17
- 239000001257 hydrogen Substances 0.000 description 17
- 229910052739 hydrogen Inorganic materials 0.000 description 17
- 229940005483 opioid analgesics Drugs 0.000 description 17
- 239000003755 preservative agent Substances 0.000 description 17
- 239000002904 solvent Substances 0.000 description 17
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 17
- 238000002360 preparation method Methods 0.000 description 16
- 150000003839 salts Chemical class 0.000 description 16
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 15
- 239000007864 aqueous solution Substances 0.000 description 15
- 238000006243 chemical reaction Methods 0.000 description 15
- 150000002148 esters Chemical group 0.000 description 15
- 239000000126 substance Substances 0.000 description 15
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 14
- 239000000839 emulsion Substances 0.000 description 14
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 14
- 210000004027 cell Anatomy 0.000 description 13
- 102000005962 receptors Human genes 0.000 description 13
- 108020003175 receptors Proteins 0.000 description 13
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- 125000000217 alkyl group Chemical group 0.000 description 12
- 230000000202 analgesic effect Effects 0.000 description 12
- 125000003118 aryl group Chemical group 0.000 description 12
- 150000002431 hydrogen Chemical group 0.000 description 12
- 239000007788 liquid Substances 0.000 description 12
- 230000003533 narcotic effect Effects 0.000 description 12
- 208000004296 neuralgia Diseases 0.000 description 12
- 125000000547 substituted alkyl group Chemical group 0.000 description 12
- 239000013543 active substance Substances 0.000 description 11
- 125000002252 acyl group Chemical group 0.000 description 11
- 210000004369 blood Anatomy 0.000 description 11
- 239000008280 blood Substances 0.000 description 11
- 239000000969 carrier Substances 0.000 description 11
- 239000002552 dosage form Substances 0.000 description 11
- 238000001727 in vivo Methods 0.000 description 11
- 238000002347 injection Methods 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 239000002502 liposome Substances 0.000 description 11
- 239000011734 sodium Substances 0.000 description 11
- 239000011780 sodium chloride Substances 0.000 description 11
- 235000000346 sugar Nutrition 0.000 description 11
- 239000003826 tablet Substances 0.000 description 11
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 10
- 150000001408 amides Chemical class 0.000 description 10
- 238000004458 analytical method Methods 0.000 description 10
- 230000008901 benefit Effects 0.000 description 10
- 239000000872 buffer Substances 0.000 description 10
- 239000002775 capsule Substances 0.000 description 10
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 10
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 10
- 230000005764 inhibitory process Effects 0.000 description 10
- 239000000463 material Substances 0.000 description 10
- 239000000843 powder Substances 0.000 description 10
- 125000003107 substituted aryl group Chemical group 0.000 description 10
- 239000003981 vehicle Substances 0.000 description 10
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 9
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 9
- 210000003169 central nervous system Anatomy 0.000 description 9
- 210000001072 colon Anatomy 0.000 description 9
- 238000013270 controlled release Methods 0.000 description 9
- 230000002496 gastric effect Effects 0.000 description 9
- 150000002513 isocyanates Chemical class 0.000 description 9
- 239000004005 microsphere Substances 0.000 description 9
- 229960005181 morphine Drugs 0.000 description 9
- 239000003921 oil Substances 0.000 description 9
- 239000000546 pharmaceutical excipient Substances 0.000 description 9
- 229920001223 polyethylene glycol Polymers 0.000 description 9
- 229920000642 polymer Polymers 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 9
- 239000007787 solid Substances 0.000 description 9
- 230000009885 systemic effect Effects 0.000 description 9
- 230000000699 topical effect Effects 0.000 description 9
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 8
- 208000000094 Chronic Pain Diseases 0.000 description 8
- 241000282412 Homo Species 0.000 description 8
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 8
- 239000002202 Polyethylene glycol Substances 0.000 description 8
- 241000700159 Rattus Species 0.000 description 8
- 230000009692 acute damage Effects 0.000 description 8
- 150000001298 alcohols Chemical class 0.000 description 8
- 239000006071 cream Substances 0.000 description 8
- 239000012530 fluid Substances 0.000 description 8
- 210000001035 gastrointestinal tract Anatomy 0.000 description 8
- 239000000499 gel Substances 0.000 description 8
- 238000001990 intravenous administration Methods 0.000 description 8
- 230000001404 mediated effect Effects 0.000 description 8
- 108010010803 Gelatin Proteins 0.000 description 7
- 229920002472 Starch Polymers 0.000 description 7
- 230000009471 action Effects 0.000 description 7
- 229940005513 antidepressants Drugs 0.000 description 7
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 238000002648 combination therapy Methods 0.000 description 7
- 239000008273 gelatin Substances 0.000 description 7
- 229920000159 gelatin Polymers 0.000 description 7
- 229940014259 gelatin Drugs 0.000 description 7
- 235000019322 gelatine Nutrition 0.000 description 7
- 235000011852 gelatine desserts Nutrition 0.000 description 7
- NONOKGVFTBWRLD-UHFFFAOYSA-N isocyanatosulfanylimino(oxo)methane Chemical compound O=C=NSN=C=O NONOKGVFTBWRLD-UHFFFAOYSA-N 0.000 description 7
- 235000019198 oils Nutrition 0.000 description 7
- 239000002674 ointment Substances 0.000 description 7
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 7
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 7
- 229940002612 prodrug Drugs 0.000 description 7
- 239000000651 prodrug Substances 0.000 description 7
- 102000004169 proteins and genes Human genes 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- 239000007921 spray Substances 0.000 description 7
- 150000008163 sugars Chemical class 0.000 description 7
- 239000000829 suppository Substances 0.000 description 7
- 239000004094 surface-active agent Substances 0.000 description 7
- YEJRWHAVMIAJKC-UHFFFAOYSA-N 4-Butyrolactone Chemical compound O=C1CCCO1 YEJRWHAVMIAJKC-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 6
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 6
- 241000282693 Cercopithecidae Species 0.000 description 6
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 6
- 239000002671 adjuvant Substances 0.000 description 6
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 6
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 6
- 239000003086 colorant Substances 0.000 description 6
- 235000011187 glycerol Nutrition 0.000 description 6
- 125000004404 heteroalkyl group Chemical group 0.000 description 6
- 229930195733 hydrocarbon Natural products 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- 239000008101 lactose Substances 0.000 description 6
- 210000004185 liver Anatomy 0.000 description 6
- 239000000314 lubricant Substances 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 229920000609 methyl cellulose Polymers 0.000 description 6
- 235000010981 methylcellulose Nutrition 0.000 description 6
- 239000001923 methylcellulose Substances 0.000 description 6
- 229940127240 opiate Drugs 0.000 description 6
- 230000035699 permeability Effects 0.000 description 6
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- 235000019698 starch Nutrition 0.000 description 6
- 239000000375 suspending agent Substances 0.000 description 6
- 239000002562 thickening agent Substances 0.000 description 6
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- 206010019233 Headaches Diseases 0.000 description 5
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- 229930195725 Mannitol Natural products 0.000 description 5
- 208000019695 Migraine disease Diseases 0.000 description 5
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 5
- 239000000654 additive Substances 0.000 description 5
- 238000010171 animal model Methods 0.000 description 5
- 239000003963 antioxidant agent Substances 0.000 description 5
- 235000006708 antioxidants Nutrition 0.000 description 5
- 239000007900 aqueous suspension Substances 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 210000004556 brain Anatomy 0.000 description 5
- 125000004432 carbon atom Chemical group C* 0.000 description 5
- 239000001768 carboxy methyl cellulose Substances 0.000 description 5
- 229920002678 cellulose Polymers 0.000 description 5
- 239000001913 cellulose Substances 0.000 description 5
- 235000010980 cellulose Nutrition 0.000 description 5
- 229960003920 cocaine Drugs 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 239000002270 dispersing agent Substances 0.000 description 5
- 229960003638 dopamine Drugs 0.000 description 5
- 238000012377 drug delivery Methods 0.000 description 5
- 239000002532 enzyme inhibitor Substances 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000000945 filler Substances 0.000 description 5
- 231100000869 headache Toxicity 0.000 description 5
- 150000002430 hydrocarbons Chemical class 0.000 description 5
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 5
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 5
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 5
- 208000014674 injury Diseases 0.000 description 5
- 238000007918 intramuscular administration Methods 0.000 description 5
- 239000006210 lotion Substances 0.000 description 5
- 235000010355 mannitol Nutrition 0.000 description 5
- 239000000594 mannitol Substances 0.000 description 5
- 206010027599 migraine Diseases 0.000 description 5
- 230000000926 neurological effect Effects 0.000 description 5
- 239000002858 neurotransmitter agent Substances 0.000 description 5
- 239000012074 organic phase Substances 0.000 description 5
- 206010039073 rheumatoid arthritis Diseases 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 239000003381 stabilizer Substances 0.000 description 5
- 239000000454 talc Substances 0.000 description 5
- 229910052623 talc Inorganic materials 0.000 description 5
- 235000012222 talc Nutrition 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 230000008733 trauma Effects 0.000 description 5
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 4
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 4
- 102000005915 GABA Receptors Human genes 0.000 description 4
- 108010005551 GABA Receptors Proteins 0.000 description 4
- 208000018522 Gastrointestinal disease Diseases 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 4
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 4
- 241000282567 Macaca fascicularis Species 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- 208000001132 Osteoporosis Diseases 0.000 description 4
- 235000019483 Peanut oil Nutrition 0.000 description 4
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 4
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 4
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical class C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 4
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 4
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 4
- 230000003110 anti-inflammatory effect Effects 0.000 description 4
- 229960000686 benzalkonium chloride Drugs 0.000 description 4
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 229920000249 biocompatible polymer Polymers 0.000 description 4
- 239000012267 brine Substances 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 239000003889 eye drop Substances 0.000 description 4
- 229940012356 eye drops Drugs 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 239000003205 fragrance Substances 0.000 description 4
- 150000002334 glycols Chemical class 0.000 description 4
- 150000004820 halides Chemical class 0.000 description 4
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 4
- 238000006460 hydrolysis reaction Methods 0.000 description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 4
- 229960001680 ibuprofen Drugs 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 4
- 238000001802 infusion Methods 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 230000000968 intestinal effect Effects 0.000 description 4
- 150000003951 lactams Chemical class 0.000 description 4
- 210000002429 large intestine Anatomy 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 4
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 4
- 229960002009 naproxen Drugs 0.000 description 4
- 239000000014 opioid analgesic Substances 0.000 description 4
- 230000003204 osmotic effect Effects 0.000 description 4
- 239000000312 peanut oil Substances 0.000 description 4
- 230000002093 peripheral effect Effects 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 230000036470 plasma concentration Effects 0.000 description 4
- 230000002980 postoperative effect Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 4
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- 235000010356 sorbitol Nutrition 0.000 description 4
- 239000000600 sorbitol Substances 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- 238000010189 synthetic method Methods 0.000 description 4
- 230000001839 systemic circulation Effects 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 230000000451 tissue damage Effects 0.000 description 4
- 231100000827 tissue damage Toxicity 0.000 description 4
- 230000001988 toxicity Effects 0.000 description 4
- 231100000419 toxicity Toxicity 0.000 description 4
- 238000011269 treatment regimen Methods 0.000 description 4
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 3
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 229920001817 Agar Polymers 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- 239000004215 Carbon black (E152) Substances 0.000 description 3
- 206010010774 Constipation Diseases 0.000 description 3
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- ACFIXJIJDZMPPO-NNYOXOHSSA-N NADPH Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](OP(O)(O)=O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 ACFIXJIJDZMPPO-NNYOXOHSSA-N 0.000 description 3
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 3
- 206010028813 Nausea Diseases 0.000 description 3
- 239000005642 Oleic acid Substances 0.000 description 3
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 3
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 108010029485 Protein Isoforms Proteins 0.000 description 3
- 102000001708 Protein Isoforms Human genes 0.000 description 3
- 206010037660 Pyrexia Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 description 3
- 239000008272 agar Substances 0.000 description 3
- 235000010419 agar Nutrition 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 229940035674 anesthetics Drugs 0.000 description 3
- 150000008064 anhydrides Chemical class 0.000 description 3
- 229940125681 anticonvulsant agent Drugs 0.000 description 3
- 239000001961 anticonvulsive agent Substances 0.000 description 3
- 239000008346 aqueous phase Substances 0.000 description 3
- 239000003125 aqueous solvent Substances 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 230000008499 blood brain barrier function Effects 0.000 description 3
- 210000001218 blood-brain barrier Anatomy 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 239000004202 carbamide Substances 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 3
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 3
- 229960004926 chlorobutanol Drugs 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 238000011260 co-administration Methods 0.000 description 3
- 229960004126 codeine Drugs 0.000 description 3
- 235000005687 corn oil Nutrition 0.000 description 3
- 239000002285 corn oil Substances 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 231100000517 death Toxicity 0.000 description 3
- 239000003405 delayed action preparation Substances 0.000 description 3
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 229960004242 dronabinol Drugs 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 239000003925 fat Substances 0.000 description 3
- 235000019197 fats Nutrition 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 239000003193 general anesthetic agent Substances 0.000 description 3
- 150000008282 halocarbons Chemical class 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 3
- 235000010445 lecithin Nutrition 0.000 description 3
- 239000000787 lecithin Substances 0.000 description 3
- 229940067606 lecithin Drugs 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 239000002480 mineral oil Substances 0.000 description 3
- 235000010446 mineral oil Nutrition 0.000 description 3
- 229940035363 muscle relaxants Drugs 0.000 description 3
- 239000003158 myorelaxant agent Substances 0.000 description 3
- 230000008693 nausea Effects 0.000 description 3
- 210000002569 neuron Anatomy 0.000 description 3
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 3
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 3
- 235000021313 oleic acid Nutrition 0.000 description 3
- 239000006186 oral dosage form Substances 0.000 description 3
- 230000004962 physiological condition Effects 0.000 description 3
- 239000011591 potassium Substances 0.000 description 3
- 229910052700 potassium Inorganic materials 0.000 description 3
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical class [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 3
- 230000003518 presynaptic effect Effects 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 208000037821 progressive disease Diseases 0.000 description 3
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 210000002345 respiratory system Anatomy 0.000 description 3
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 3
- 238000002390 rotary evaporation Methods 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 239000008159 sesame oil Substances 0.000 description 3
- 235000011803 sesame oil Nutrition 0.000 description 3
- 235000009518 sodium iodide Nutrition 0.000 description 3
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 3
- 210000004872 soft tissue Anatomy 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 230000002195 synergetic effect Effects 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 150000007970 thio esters Chemical class 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 3
- LNPDTQAFDNKSHK-UHFFFAOYSA-N valdecoxib Chemical compound CC=1ON=C(C=2C=CC=CC=2)C=1C1=CC=C(S(N)(=O)=O)C=C1 LNPDTQAFDNKSHK-UHFFFAOYSA-N 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 2
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 2
- ARIWANIATODDMH-AWEZNQCLSA-N 1-lauroyl-sn-glycerol Chemical compound CCCCCCCCCCCC(=O)OC[C@@H](O)CO ARIWANIATODDMH-AWEZNQCLSA-N 0.000 description 2
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 2
- 239000003185 4 aminobutyric acid B receptor stimulating agent Substances 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 2
- PJJGZPJJTHBVMX-UHFFFAOYSA-N 5,7-Dihydroxyisoflavone Chemical compound C=1C(O)=CC(O)=C(C2=O)C=1OC=C2C1=CC=CC=C1 PJJGZPJJTHBVMX-UHFFFAOYSA-N 0.000 description 2
- USSIQXCVUWKGNF-UHFFFAOYSA-N 6-(dimethylamino)-4,4-diphenylheptan-3-one Chemical compound C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 USSIQXCVUWKGNF-UHFFFAOYSA-N 0.000 description 2
- YAFGHMIAFYQSCF-UHFFFAOYSA-N 7-ethoxy-2-oxochromene-3-carbonitrile Chemical compound C1=C(C#N)C(=O)OC2=CC(OCC)=CC=C21 YAFGHMIAFYQSCF-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 208000028698 Cognitive impairment Diseases 0.000 description 2
- 108010037464 Cyclooxygenase 1 Proteins 0.000 description 2
- 108010037462 Cyclooxygenase 2 Proteins 0.000 description 2
- 206010012335 Dependence Diseases 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- QEVGZEDELICMKH-UHFFFAOYSA-N Diglycolic acid Chemical compound OC(=O)COCC(O)=O QEVGZEDELICMKH-UHFFFAOYSA-N 0.000 description 2
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- NIGWMJHCCYYCSF-UHFFFAOYSA-N Fenclonine Chemical compound OC(=O)C(N)CC1=CC=C(Cl)C=C1 NIGWMJHCCYYCSF-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 229920002683 Glycosaminoglycan Polymers 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 2
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 2
- ARIWANIATODDMH-UHFFFAOYSA-N Lauric acid monoglyceride Natural products CCCCCCCCCCCC(=O)OCC(O)CO ARIWANIATODDMH-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 229940127523 NMDA Receptor Antagonists Drugs 0.000 description 2
- GQPLMRYTRLFLPF-UHFFFAOYSA-N Nitrous Oxide Chemical compound [O-][N+]#N GQPLMRYTRLFLPF-UHFFFAOYSA-N 0.000 description 2
- 108010019160 Pancreatin Proteins 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 102100038277 Prostaglandin G/H synthase 1 Human genes 0.000 description 2
- 102100038280 Prostaglandin G/H synthase 2 Human genes 0.000 description 2
- 102000004005 Prostaglandin-endoperoxide synthases Human genes 0.000 description 2
- 108090000459 Prostaglandin-endoperoxide synthases Proteins 0.000 description 2
- 229920002385 Sodium hyaluronate Polymers 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- 229940123445 Tricyclic antidepressant Drugs 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000009056 active transport Effects 0.000 description 2
- 125000004442 acylamino group Chemical group 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 150000001335 aliphatic alkanes Chemical class 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 2
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 239000003708 ampul Substances 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 230000036592 analgesia Effects 0.000 description 2
- 125000000129 anionic group Chemical group 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 239000000227 bioadhesive Substances 0.000 description 2
- 229920002988 biodegradable polymer Polymers 0.000 description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 235000010216 calcium carbonate Nutrition 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 150000001718 carbodiimides Chemical class 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- KYKAJFCTULSVSH-UHFFFAOYSA-N chloro(fluoro)methane Chemical compound F[C]Cl KYKAJFCTULSVSH-UHFFFAOYSA-N 0.000 description 2
- AOGYCOYQMAVAFD-UHFFFAOYSA-N chlorocarbonic acid Chemical class OC(Cl)=O AOGYCOYQMAVAFD-UHFFFAOYSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 230000000112 colonic effect Effects 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 239000002537 cosmetic Substances 0.000 description 2
- 235000012343 cottonseed oil Nutrition 0.000 description 2
- 239000002385 cottonseed oil Substances 0.000 description 2
- PAFZNILMFXTMIY-UHFFFAOYSA-N cyclohexylamine Chemical compound NC1CCCCC1 PAFZNILMFXTMIY-UHFFFAOYSA-N 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 125000004663 dialkyl amino group Chemical group 0.000 description 2
- 229960001259 diclofenac Drugs 0.000 description 2
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- HUPFGZXOMWLGNK-UHFFFAOYSA-N diflunisal Chemical compound C1=C(O)C(C(=O)O)=CC(C=2C(=CC(F)=CC=2)F)=C1 HUPFGZXOMWLGNK-UHFFFAOYSA-N 0.000 description 2
- 229960000616 diflunisal Drugs 0.000 description 2
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 229940125532 enzyme inhibitor Drugs 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- 230000002964 excitative effect Effects 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 150000002191 fatty alcohols Chemical class 0.000 description 2
- 238000010579 first pass effect Methods 0.000 description 2
- 235000019634 flavors Nutrition 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000003349 gelling agent Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 2
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 2
- 125000005553 heteroaryloxy group Chemical group 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 229960000905 indomethacin Drugs 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 2
- QWTDNUCVQCZILF-UHFFFAOYSA-N isopentane Chemical compound CCC(C)C QWTDNUCVQCZILF-UHFFFAOYSA-N 0.000 description 2
- 235000015110 jellies Nutrition 0.000 description 2
- 239000008274 jelly Substances 0.000 description 2
- 229960003299 ketamine Drugs 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000003589 local anesthetic agent Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- FQXXSQDCDRQNQE-UHFFFAOYSA-N markiertes Thebain Natural products COC1=CC=C2C(N(CC3)C)CC4=CC=C(OC)C5=C4C23C1O5 FQXXSQDCDRQNQE-UHFFFAOYSA-N 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229960003464 mefenamic acid Drugs 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 229960001797 methadone Drugs 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 239000003094 microcapsule Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 210000004877 mucosa Anatomy 0.000 description 2
- 210000004400 mucous membrane Anatomy 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 239000002077 nanosphere Substances 0.000 description 2
- 229940097496 nasal spray Drugs 0.000 description 2
- 239000007922 nasal spray Substances 0.000 description 2
- CRSOQBOWXPBRES-UHFFFAOYSA-N neopentane Chemical compound CC(C)(C)C CRSOQBOWXPBRES-UHFFFAOYSA-N 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 201000008482 osteoarthritis Diseases 0.000 description 2
- 229960002739 oxaprozin Drugs 0.000 description 2
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 2
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 2
- 229940055695 pancreatin Drugs 0.000 description 2
- 208000019906 panic disease Diseases 0.000 description 2
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 230000003285 pharmacodynamic effect Effects 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 230000001766 physiological effect Effects 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 150000004804 polysaccharides Chemical class 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 239000001103 potassium chloride Substances 0.000 description 2
- 235000011164 potassium chloride Nutrition 0.000 description 2
- 230000002335 preservative effect Effects 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000001294 propane Substances 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 150000003180 prostaglandins Chemical class 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 230000001624 sedative effect Effects 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 210000000813 small intestine Anatomy 0.000 description 2
- 229940010747 sodium hyaluronate Drugs 0.000 description 2
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical compound [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 239000003549 soybean oil Substances 0.000 description 2
- 235000012424 soybean oil Nutrition 0.000 description 2
- 239000012086 standard solution Substances 0.000 description 2
- 239000008174 sterile solution Substances 0.000 description 2
- 239000008223 sterile water Substances 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- IIACRCGMVDHOTQ-UHFFFAOYSA-M sulfamate Chemical compound NS([O-])(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-M 0.000 description 2
- 150000003462 sulfoxides Chemical class 0.000 description 2
- MLKXDPUZXIRXEP-MFOYZWKCSA-N sulindac Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)=O)C=C1 MLKXDPUZXIRXEP-MFOYZWKCSA-N 0.000 description 2
- 229960000894 sulindac Drugs 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 150000003512 tertiary amines Chemical class 0.000 description 2
- FQXXSQDCDRQNQE-VMDGZTHMSA-N thebaine Chemical compound C([C@@H](N(CC1)C)C2=CC=C3OC)C4=CC=C(OC)C5=C4[C@@]21[C@H]3O5 FQXXSQDCDRQNQE-VMDGZTHMSA-N 0.000 description 2
- 229930003945 thebaine Natural products 0.000 description 2
- 150000003573 thiols Chemical class 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 239000012049 topical pharmaceutical composition Substances 0.000 description 2
- 229960004380 tramadol Drugs 0.000 description 2
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 239000003029 tricyclic antidepressant agent Substances 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- RGZSQWQPBWRIAQ-CABCVRRESA-N (-)-alpha-Bisabolol Chemical compound CC(C)=CCC[C@](C)(O)[C@H]1CCC(C)=CC1 RGZSQWQPBWRIAQ-CABCVRRESA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- 239000001500 (2R)-6-methyl-2-[(1R)-4-methyl-1-cyclohex-3-enyl]hept-5-en-2-ol Substances 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- NAWXUBYGYWOOIX-SFHVURJKSA-N (2s)-2-[[4-[2-(2,4-diaminoquinazolin-6-yl)ethyl]benzoyl]amino]-4-methylidenepentanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C=C1CCC1=CC=C(C(=O)N[C@@H](CC(=C)C(O)=O)C(O)=O)C=C1 NAWXUBYGYWOOIX-SFHVURJKSA-N 0.000 description 1
- WCDDVEOXEIYWFB-VXORFPGASA-N (2s,3s,4r,5r,6r)-3-[(2s,3r,5s,6r)-3-acetamido-5-hydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-4,5,6-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@@H]1C[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](C(O)=O)O[C@@H](O)[C@H](O)[C@H]1O WCDDVEOXEIYWFB-VXORFPGASA-N 0.000 description 1
- ZJMWDULLCAJDLQ-VGMFFHCQSA-N (3s)-3-(aminomethyl)-5-methylhexanoic acid Chemical compound CC(C)C[C@H](CN)CC(O)=O.CC(C)C[C@H](CN)CC(O)=O ZJMWDULLCAJDLQ-VGMFFHCQSA-N 0.000 description 1
- ALSTYHKOOCGGFT-KTKRTIGZSA-N (9Z)-octadecen-1-ol Chemical compound CCCCCCCC\C=C/CCCCCCCCO ALSTYHKOOCGGFT-KTKRTIGZSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- XUKSWKGOQKREON-UHFFFAOYSA-N 1,4-diacetoxybutane Chemical compound CC(=O)OCCCCOC(C)=O XUKSWKGOQKREON-UHFFFAOYSA-N 0.000 description 1
- WDQFELCEOPFLCZ-UHFFFAOYSA-N 1-(2-hydroxyethyl)pyrrolidin-2-one Chemical compound OCCN1CCCC1=O WDQFELCEOPFLCZ-UHFFFAOYSA-N 0.000 description 1
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- NZJXADCEESMBPW-UHFFFAOYSA-N 1-methylsulfinyldecane Chemical compound CCCCCCCCCCS(C)=O NZJXADCEESMBPW-UHFFFAOYSA-N 0.000 description 1
- KRUABTDBQQLWLS-UHFFFAOYSA-N 1-methylsulfinyltetradecane Chemical compound CCCCCCCCCCCCCCS(C)=O KRUABTDBQQLWLS-UHFFFAOYSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- 239000003315 2-(4-chlorophenoxy)-2-methylpropanoic acid Substances 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- HZLCGUXUOFWCCN-UHFFFAOYSA-N 2-hydroxynonadecane-1,2,3-tricarboxylic acid Chemical compound CCCCCCCCCCCCCCCCC(C(O)=O)C(O)(C(O)=O)CC(O)=O HZLCGUXUOFWCCN-UHFFFAOYSA-N 0.000 description 1
- JDTUPLBMGDDPJS-UHFFFAOYSA-N 2-methoxy-2-phenylethanol Chemical compound COC(CO)C1=CC=CC=C1 JDTUPLBMGDDPJS-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- WHBMMWSBFZVSSR-UHFFFAOYSA-N 3-hydroxybutyric acid Chemical compound CC(O)CC(O)=O WHBMMWSBFZVSSR-UHFFFAOYSA-N 0.000 description 1
- 239000003412 4 aminobutyric acid B receptor blocking agent Substances 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-M 4-hydroxybenzoate Chemical compound OC1=CC=C(C([O-])=O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-M 0.000 description 1
- 229940090248 4-hydroxybenzoic acid Drugs 0.000 description 1
- BTJIUGUIPKRLHP-UHFFFAOYSA-N 4-nitrophenol Chemical compound OC1=CC=C([N+]([O-])=O)C=C1 BTJIUGUIPKRLHP-UHFFFAOYSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- BSYNRYMUTXBXSQ-FOQJRBATSA-N 59096-14-9 Chemical compound CC(=O)OC1=CC=CC=C1[14C](O)=O BSYNRYMUTXBXSQ-FOQJRBATSA-N 0.000 description 1
- CVMYUKGCOCQLHT-UHFFFAOYSA-N 7-methoxy-3-(trifluoromethyl)chromen-2-one Chemical compound C1=C(C(F)(F)F)C(=O)OC2=CC(OC)=CC=C21 CVMYUKGCOCQLHT-UHFFFAOYSA-N 0.000 description 1
- LJNCNXXYHHZALN-UHFFFAOYSA-N 7-phenylmethoxy-3-(trifluoromethyl)chromen-2-one Chemical compound C1=C2OC(=O)C(C(F)(F)F)=CC2=CC=C1OCC1=CC=CC=C1 LJNCNXXYHHZALN-UHFFFAOYSA-N 0.000 description 1
- 229930000680 A04AD01 - Scopolamine Natural products 0.000 description 1
- OZAIFHULBGXAKX-VAWYXSNFSA-N AIBN Substances N#CC(C)(C)\N=N\C(C)(C)C#N OZAIFHULBGXAKX-VAWYXSNFSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 240000002470 Amphicarpaea bracteata Species 0.000 description 1
- 241001535291 Analges Species 0.000 description 1
- 229930003347 Atropine Natural products 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- QWOJMRHUQHTCJG-UHFFFAOYSA-N CC([CH2-])=O Chemical compound CC([CH2-])=O QWOJMRHUQHTCJG-UHFFFAOYSA-N 0.000 description 1
- 0 CC*NC(*)*(*)C(*)C(C)C(C(C)(C)O*)=O Chemical compound CC*NC(*)*(*)C(*)C(C)C(C(C)(C)O*)=O 0.000 description 1
- 108090000312 Calcium Channels Proteins 0.000 description 1
- 102000003922 Calcium Channels Human genes 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000008697 Cannabis sativa Nutrition 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- BYMMIQCVDHHYGG-UHFFFAOYSA-N Cl.OP(O)(O)=O Chemical compound Cl.OP(O)(O)=O BYMMIQCVDHHYGG-UHFFFAOYSA-N 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 208000002881 Colic Diseases 0.000 description 1
- 208000033001 Complex partial seizures Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 108010074922 Cytochrome P-450 CYP1A2 Proteins 0.000 description 1
- 108010026925 Cytochrome P-450 CYP2C19 Proteins 0.000 description 1
- 108010000543 Cytochrome P-450 CYP2C9 Proteins 0.000 description 1
- 108010001237 Cytochrome P-450 CYP2D6 Proteins 0.000 description 1
- 108010001202 Cytochrome P-450 CYP2E1 Proteins 0.000 description 1
- 108010081668 Cytochrome P-450 CYP3A Proteins 0.000 description 1
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 1
- 102000003849 Cytochrome P450 Human genes 0.000 description 1
- 102100026533 Cytochrome P450 1A2 Human genes 0.000 description 1
- 102100029363 Cytochrome P450 2C19 Human genes 0.000 description 1
- 102100029358 Cytochrome P450 2C9 Human genes 0.000 description 1
- 102100021704 Cytochrome P450 2D6 Human genes 0.000 description 1
- 102100024889 Cytochrome P450 2E1 Human genes 0.000 description 1
- 102100039205 Cytochrome P450 3A4 Human genes 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 108010065372 Dynorphins Proteins 0.000 description 1
- 208000005171 Dysmenorrhea Diseases 0.000 description 1
- 206010013935 Dysmenorrhoea Diseases 0.000 description 1
- ZGTMUACCHSMWAC-UHFFFAOYSA-L EDTA disodium salt (anhydrous) Chemical compound [Na+].[Na+].OC(=O)CN(CC([O-])=O)CCN(CC(O)=O)CC([O-])=O ZGTMUACCHSMWAC-UHFFFAOYSA-L 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010049140 Endorphins Proteins 0.000 description 1
- 102000009025 Endorphins Human genes 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 108010092674 Enkephalins Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- IBHSRCBKJMEBQB-VMPREFPWSA-N Fetidine Chemical compound CN1CCC2=CC(OC)=C(O)C3=C2[C@@H]1CC1=C3C=C(OC)C(OC2=C(OC)C(OC)=CC=C2C[C@@H]2N(C)CCC=3C=C(C(=CC=32)OC)OC)=C1 IBHSRCBKJMEBQB-VMPREFPWSA-N 0.000 description 1
- IBHSRCBKJMEBQB-UHFFFAOYSA-N Fetidine Natural products CN1CCC2=CC(OC)=C(O)C3=C2C1CC1=C3C=C(OC)C(OC2=C(OC)C(OC)=CC=C2CC2N(C)CCC=3C=C(C(=CC=32)OC)OC)=C1 IBHSRCBKJMEBQB-UHFFFAOYSA-N 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 206010017999 Gastrointestinal pain Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 241000282575 Gorilla Species 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 1
- RKUNBYITZUJHSG-UHFFFAOYSA-N Hyosciamin-hydrochlorid Natural products CN1C(C2)CCC1CC2OC(=O)C(CO)C1=CC=CC=C1 RKUNBYITZUJHSG-UHFFFAOYSA-N 0.000 description 1
- STECJAGHUSJQJN-GAUPFVANSA-N Hyoscine Natural products C1([C@H](CO)C(=O)OC2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-GAUPFVANSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010065390 Inflammatory pain Diseases 0.000 description 1
- 108090000862 Ion Channels Proteins 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 108010044467 Isoenzymes Proteins 0.000 description 1
- ALFGKMXHOUSVAD-UHFFFAOYSA-N Ketobemidone Chemical compound C=1C=CC(O)=CC=1C1(C(=O)CC)CCN(C)CC1 ALFGKMXHOUSVAD-UHFFFAOYSA-N 0.000 description 1
- 150000007649 L alpha amino acids Chemical class 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- MKXZASYAUGDDCJ-SZMVWBNQSA-N LSM-2525 Chemical compound C1CCC[C@H]2[C@@]3([H])N(C)CC[C@]21C1=CC(OC)=CC=C1C3 MKXZASYAUGDDCJ-SZMVWBNQSA-N 0.000 description 1
- 239000004166 Lanolin Substances 0.000 description 1
- URLZCHNOLZSCCA-VABKMULXSA-N Leu-enkephalin Chemical class C([C@@H](C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=CC=C1 URLZCHNOLZSCCA-VABKMULXSA-N 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 239000007987 MES buffer Substances 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- SBDNJUWAMKYJOX-UHFFFAOYSA-N Meclofenamic Acid Chemical compound CC1=CC=C(Cl)C(NC=2C(=CC=CC=2)C(O)=O)=C1Cl SBDNJUWAMKYJOX-UHFFFAOYSA-N 0.000 description 1
- XADCESSVHJOZHK-UHFFFAOYSA-N Meperidine Chemical compound C=1C=CC=CC=1C1(C(=O)OCC)CCN(C)CC1 XADCESSVHJOZHK-UHFFFAOYSA-N 0.000 description 1
- 208000036631 Metastatic pain Diseases 0.000 description 1
- DUGOZIWVEXMGBE-UHFFFAOYSA-N Methylphenidate Chemical class C=1C=CC=CC=1C(C(=O)OC)C1CCCCN1 DUGOZIWVEXMGBE-UHFFFAOYSA-N 0.000 description 1
- 208000001089 Multiple system atrophy Diseases 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- MMOXZBCLCQITDF-UHFFFAOYSA-N N,N-diethyl-m-toluamide Chemical compound CCN(CC)C(=O)C1=CC=CC(C)=C1 MMOXZBCLCQITDF-UHFFFAOYSA-N 0.000 description 1
- 102000004868 N-Methyl-D-Aspartate Receptors Human genes 0.000 description 1
- 108090001041 N-Methyl-D-Aspartate Receptors Proteins 0.000 description 1
- STECJAGHUSJQJN-UHFFFAOYSA-N N-Methyl-scopolamin Natural products C1C(C2C3O2)N(C)C3CC1OC(=O)C(CO)C1=CC=CC=C1 STECJAGHUSJQJN-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 229940099433 NMDA receptor antagonist Drugs 0.000 description 1
- BVMWIXWOIGJRGE-UHFFFAOYSA-N NP(O)=O Chemical class NP(O)=O BVMWIXWOIGJRGE-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 229940127450 Opioid Agonists Drugs 0.000 description 1
- 108010093625 Opioid Peptides Proteins 0.000 description 1
- 102000001490 Opioid Peptides Human genes 0.000 description 1
- 102000003840 Opioid Receptors Human genes 0.000 description 1
- 108090000137 Opioid Receptors Proteins 0.000 description 1
- 206010031127 Orthostatic hypotension Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- UQCNKQCJZOAFTQ-ISWURRPUSA-N Oxymorphone Chemical compound O([C@H]1C(CC[C@]23O)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O UQCNKQCJZOAFTQ-ISWURRPUSA-N 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 206010033664 Panic attack Diseases 0.000 description 1
- 206010033892 Paraplegia Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical compound OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- 229920002565 Polyethylene Glycol 400 Polymers 0.000 description 1
- 241000282405 Pongo abelii Species 0.000 description 1
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 1
- 208000004550 Postoperative Pain Diseases 0.000 description 1
- HUMXXHTVHHLNRO-KAJVQRHHSA-N Prednisolone tebutate Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)CC(C)(C)C)(O)[C@@]1(C)C[C@@H]2O HUMXXHTVHHLNRO-KAJVQRHHSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 208000004756 Respiratory Insufficiency Diseases 0.000 description 1
- 206010038678 Respiratory depression Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 206010039897 Sedation Diseases 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- 239000004147 Sorbitan trioleate Substances 0.000 description 1
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 1
- 208000032930 Spastic paraplegia Diseases 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 206010046274 Upper gastrointestinal haemorrhage Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 239000001089 [(2R)-oxolan-2-yl]methanol Substances 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 208000005298 acute pain Diseases 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 238000012387 aerosolization Methods 0.000 description 1
- 229940040563 agaric acid Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- RGZSQWQPBWRIAQ-LSDHHAIUSA-N alpha-Bisabolol Natural products CC(C)=CCC[C@@](C)(O)[C@@H]1CCC(C)=CC1 RGZSQWQPBWRIAQ-LSDHHAIUSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229940124277 aminobutyric acid Drugs 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 1
- 229960000836 amitriptyline Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 239000002280 amphoteric surfactant Substances 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 230000001078 anti-cholinergic effect Effects 0.000 description 1
- 230000002082 anti-convulsion Effects 0.000 description 1
- 230000003474 anti-emetic effect Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000001754 anti-pyretic effect Effects 0.000 description 1
- 230000002421 anti-septic effect Effects 0.000 description 1
- 229940125713 antianxiety drug Drugs 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000002221 antipyretic Substances 0.000 description 1
- 229940027983 antiseptic and disinfectant quaternary ammonium compound Drugs 0.000 description 1
- 229940064004 antiseptic throat preparations Drugs 0.000 description 1
- 239000012062 aqueous buffer Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 229940114079 arachidonic acid Drugs 0.000 description 1
- 235000021342 arachidonic acid Nutrition 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 235000021311 artificial sweeteners Nutrition 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 210000001815 ascending colon Anatomy 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- RKUNBYITZUJHSG-SPUOUPEWSA-N atropine Chemical compound O([C@H]1C[C@H]2CC[C@@H](C1)N2C)C(=O)C(CO)C1=CC=CC=C1 RKUNBYITZUJHSG-SPUOUPEWSA-N 0.000 description 1
- 229960000396 atropine Drugs 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 150000001539 azetidines Chemical class 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- 229960003872 benzethonium Drugs 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 235000013361 beverage Nutrition 0.000 description 1
- 229940110331 bextra Drugs 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- ACBQROXDOHKANW-UHFFFAOYSA-N bis(4-nitrophenyl) carbonate Chemical compound C1=CC([N+](=O)[O-])=CC=C1OC(=O)OC1=CC=C([N+]([O-])=O)C=C1 ACBQROXDOHKANW-UHFFFAOYSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 229960003655 bromfenac Drugs 0.000 description 1
- ZBPLOVFIXSTCRZ-UHFFFAOYSA-N bromfenac Chemical compound NC1=C(CC(O)=O)C=CC=C1C(=O)C1=CC=C(Br)C=C1 ZBPLOVFIXSTCRZ-UHFFFAOYSA-N 0.000 description 1
- HZFGMQJYAFHESD-UHFFFAOYSA-M bromfenac sodium Chemical compound [Na+].NC1=C(CC([O-])=O)C=CC=C1C(=O)C1=CC=C(Br)C=C1 HZFGMQJYAFHESD-UHFFFAOYSA-M 0.000 description 1
- 229960002716 bromfenac sodium Drugs 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- SXGBREZGMJVYRL-UHFFFAOYSA-N butan-1-amine;hydrobromide Chemical compound [Br-].CCCC[NH3+] SXGBREZGMJVYRL-UHFFFAOYSA-N 0.000 description 1
- CDQSJQSWAWPGKG-UHFFFAOYSA-N butane-1,1-diol Chemical compound CCCC(O)O CDQSJQSWAWPGKG-UHFFFAOYSA-N 0.000 description 1
- FZKPWSBMFSLEFL-UHFFFAOYSA-N butane-1,1-diol;butane-1,4-diol Chemical compound CCCC(O)O.OCCCCO FZKPWSBMFSLEFL-UHFFFAOYSA-N 0.000 description 1
- 235000014121 butter Nutrition 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 230000009460 calcium influx Effects 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 239000003557 cannabinoid Substances 0.000 description 1
- 229930003827 cannabinoid Natural products 0.000 description 1
- 229940065144 cannabinoids Drugs 0.000 description 1
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 1
- 229960000623 carbamazepine Drugs 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 229940096529 carboxypolymethylene Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000003093 cationic surfactant Substances 0.000 description 1
- 229940047495 celebrex Drugs 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 239000013553 cell monolayer Substances 0.000 description 1
- 229920003086 cellulose ether Polymers 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 235000013351 cheese Nutrition 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000007910 chewable tablet Substances 0.000 description 1
- 150000008280 chlorinated hydrocarbons Chemical class 0.000 description 1
- QOPVNWQGBQYBBP-UHFFFAOYSA-N chloroethyl chloroformate Chemical compound CC(Cl)OC(Cl)=O QOPVNWQGBQYBBP-UHFFFAOYSA-N 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 235000020971 citrus fruits Nutrition 0.000 description 1
- TXCGAZHTZHNUAI-UHFFFAOYSA-N clofibric acid Chemical compound OC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 TXCGAZHTZHNUAI-UHFFFAOYSA-N 0.000 description 1
- 229950008441 clofibric acid Drugs 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 235000008504 concentrate Nutrition 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000000599 controlled substance Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 229940099112 cornstarch Drugs 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 150000003950 cyclic amides Chemical class 0.000 description 1
- JURKNVYFZMSNLP-UHFFFAOYSA-N cyclobenzaprine Chemical compound C1=CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 JURKNVYFZMSNLP-UHFFFAOYSA-N 0.000 description 1
- 229960003572 cyclobenzaprine Drugs 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 230000001120 cytoprotective effect Effects 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 229940080861 demerol Drugs 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 229960001985 dextromethorphan Drugs 0.000 description 1
- XLMALTXPSGQGBX-GCJKJVERSA-N dextropropoxyphene Chemical compound C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 XLMALTXPSGQGBX-GCJKJVERSA-N 0.000 description 1
- 229960004193 dextropropoxyphene Drugs 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 229960002069 diamorphine Drugs 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- RBOXVHNMENFORY-DNJOTXNNSA-N dihydrocodeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC RBOXVHNMENFORY-DNJOTXNNSA-N 0.000 description 1
- 229960000920 dihydrocodeine Drugs 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- AFABGHUZZDYHJO-UHFFFAOYSA-N dimethyl butane Natural products CCCC(C)C AFABGHUZZDYHJO-UHFFFAOYSA-N 0.000 description 1
- SIYLLGKDQZGJHK-UHFFFAOYSA-N dimethyl-(phenylmethyl)-[2-[2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethoxy]ethyl]ammonium Chemical compound C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 SIYLLGKDQZGJHK-UHFFFAOYSA-N 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 230000008406 drug-drug interaction Effects 0.000 description 1
- 206010013781 dry mouth Diseases 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- JMNJYGMAUMANNW-FIXZTSJVSA-N dynorphin a Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=CC=C1 JMNJYGMAUMANNW-FIXZTSJVSA-N 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 229940124274 edetate disodium Drugs 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940079360 enema for constipation Drugs 0.000 description 1
- 150000002085 enols Chemical group 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- HQPMKSGTIOYHJT-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2-diol Chemical compound OCCO.CC(O)CO HQPMKSGTIOYHJT-UHFFFAOYSA-N 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- KMPQIYXXLIFPKA-UHFFFAOYSA-N ethyl 4-acetyloxybutanoate Chemical compound CCOC(=O)CCCOC(C)=O KMPQIYXXLIFPKA-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 230000002550 fecal effect Effects 0.000 description 1
- 229960002428 fentanyl Drugs 0.000 description 1
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 238000002594 fluoroscopy Methods 0.000 description 1
- 229960002390 flurbiprofen Drugs 0.000 description 1
- SYTBZMRGLBWNTM-UHFFFAOYSA-N flurbiprofen Chemical compound FC1=CC(C(C(O)=O)C)=CC=C1C1=CC=CC=C1 SYTBZMRGLBWNTM-UHFFFAOYSA-N 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 231100000414 gastrointestinal toxicity Toxicity 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 239000008202 granule composition Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 125000004836 hexamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229940014041 hyaluronate Drugs 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- LLPOLZWFYMWNKH-CMKMFDCUSA-N hydrocodone Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)CC(=O)[C@@H]1OC1=C2C3=CC=C1OC LLPOLZWFYMWNKH-CMKMFDCUSA-N 0.000 description 1
- 229960000240 hydrocodone Drugs 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- WVLOADHCBXTIJK-YNHQPCIGSA-N hydromorphone Chemical compound O([C@H]1C(CC[C@H]23)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O WVLOADHCBXTIJK-YNHQPCIGSA-N 0.000 description 1
- 229960001410 hydromorphone Drugs 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 235000015243 ice cream Nutrition 0.000 description 1
- 239000002117 illicit drug Substances 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000006749 inflammatory damage Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910001410 inorganic ion Inorganic materials 0.000 description 1
- 229960004717 insulin aspart Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 208000003243 intestinal obstruction Diseases 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000003402 intramolecular cyclocondensation reaction Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 239000001282 iso-butane Substances 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 210000004731 jugular vein Anatomy 0.000 description 1
- 229960003029 ketobemidone Drugs 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229940039717 lanolin Drugs 0.000 description 1
- 235000019388 lanolin Nutrition 0.000 description 1
- 229960003639 laurocapram Drugs 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 229960004502 levodopa Drugs 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 229940059904 light mineral oil Drugs 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 229960005015 local anesthetics Drugs 0.000 description 1
- 239000003509 long acting drug Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000012931 lyophilized formulation Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000014380 magnesium carbonate Nutrition 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229960003803 meclofenamic acid Drugs 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 230000008986 metabolic interaction Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- WLAKXJVBZHPARL-UHFFFAOYSA-N methyl 4-acetyloxybutanoate Chemical compound COC(=O)CCCOC(C)=O WLAKXJVBZHPARL-UHFFFAOYSA-N 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 210000002200 mouth mucosa Anatomy 0.000 description 1
- 239000003703 n methyl dextro aspartic acid receptor blocking agent Substances 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- 210000000282 nail Anatomy 0.000 description 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 1
- 229960003086 naltrexone Drugs 0.000 description 1
- 201000003631 narcolepsy Diseases 0.000 description 1
- 239000003887 narcotic antagonist Substances 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 235000021096 natural sweeteners Nutrition 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 230000005015 neuronal process Effects 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 230000000324 neuroprotective effect Effects 0.000 description 1
- HNDXBGYRMHRUFN-CIVUWBIHSA-N nicomorphine Chemical compound O([C@H]1C=C[C@H]2[C@H]3CC=4C5=C(C(=CC=4)OC(=O)C=4C=NC=CC=4)O[C@@H]1[C@]52CCN3C)C(=O)C1=CC=CN=C1 HNDXBGYRMHRUFN-CIVUWBIHSA-N 0.000 description 1
- 229960004300 nicomorphine Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000001272 nitrous oxide Substances 0.000 description 1
- 238000013546 non-drug therapy Methods 0.000 description 1
- 239000012740 non-selective inhibitor Substances 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 231100000956 nontoxicity Toxicity 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000012053 oil suspension Substances 0.000 description 1
- 229960002969 oleic acid Drugs 0.000 description 1
- 229940055577 oleyl alcohol Drugs 0.000 description 1
- XMLQWXUVTXCDDL-UHFFFAOYSA-N oleyl alcohol Natural products CCCCCCC=CCCCCCCCCCCO XMLQWXUVTXCDDL-UHFFFAOYSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000003399 opiate peptide Substances 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 239000008203 oral pharmaceutical composition Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000003791 organic solvent mixture Substances 0.000 description 1
- 229960002085 oxycodone Drugs 0.000 description 1
- 229960005118 oxymorphone Drugs 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 210000001002 parasympathetic nervous system Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 210000001428 peripheral nervous system Anatomy 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000003209 petroleum derivative Substances 0.000 description 1
- 239000008249 pharmaceutical aerosol Substances 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000008238 pharmaceutical water Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 229960002895 phenylbutazone Drugs 0.000 description 1
- VYMDGNCVAMGZFE-UHFFFAOYSA-N phenylbutazonum Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=CC=C1 VYMDGNCVAMGZFE-UHFFFAOYSA-N 0.000 description 1
- 229940067107 phenylethyl alcohol Drugs 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000004714 phosphonium salts Chemical class 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 229920001495 poly(sodium acrylate) polymer Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920000151 polyglycol Polymers 0.000 description 1
- 239000010695 polyglycol Substances 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000001242 postsynaptic effect Effects 0.000 description 1
- 229910001414 potassium ion Inorganic materials 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229940116317 potato starch Drugs 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- 229960004259 prednisolone tebutate Drugs 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 229940001470 psychoactive drug Drugs 0.000 description 1
- 239000004089 psychotropic agent Substances 0.000 description 1
- 230000000506 psychotropic effect Effects 0.000 description 1
- 230000010349 pulsation Effects 0.000 description 1
- 210000001747 pupil Anatomy 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000007670 refining Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000036387 respiratory rate Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 229940100486 rice starch Drugs 0.000 description 1
- 229960000371 rofecoxib Drugs 0.000 description 1
- 235000014438 salad dressings Nutrition 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 210000003752 saphenous vein Anatomy 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- STECJAGHUSJQJN-FWXGHANASA-N scopolamine Chemical compound C1([C@@H](CO)C(=O)O[C@H]2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-FWXGHANASA-N 0.000 description 1
- 229960002646 scopolamine Drugs 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000036280 sedation Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- RYYKJJJTJZKILX-UHFFFAOYSA-M sodium octadecanoate Chemical compound [Na+].CCCCCCCCCCCCCCCCCC([O-])=O RYYKJJJTJZKILX-UHFFFAOYSA-M 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- NNMHYFLPFNGQFZ-UHFFFAOYSA-M sodium polyacrylate Chemical compound [Na+].[O-]C(=O)C=C NNMHYFLPFNGQFZ-UHFFFAOYSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000012439 solid excipient Substances 0.000 description 1
- 239000012265 solid product Substances 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 235000019337 sorbitan trioleate Nutrition 0.000 description 1
- 229960000391 sorbitan trioleate Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 125000005415 substituted alkoxy group Chemical group 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 238000009495 sugar coating Methods 0.000 description 1
- BUUPQKDIAURBJP-UHFFFAOYSA-N sulfinic acid Chemical compound OS=O BUUPQKDIAURBJP-UHFFFAOYSA-N 0.000 description 1
- 150000003451 sulfinic acid amides Chemical class 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 235000020238 sunflower seed Nutrition 0.000 description 1
- 230000000475 sunscreen effect Effects 0.000 description 1
- 239000000516 sunscreening agent Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 230000000946 synaptic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- BSYVTEYKTMYBMK-UHFFFAOYSA-N tetrahydrofurfuryl alcohol Chemical compound OCC1CCCO1 BSYVTEYKTMYBMK-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 150000003595 thromboxanes Chemical class 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 235000019149 tocopherols Nutrition 0.000 description 1
- 229960001017 tolmetin Drugs 0.000 description 1
- UPSPUYADGBWSHF-UHFFFAOYSA-N tolmetin Chemical compound C1=CC(C)=CC=C1C(=O)C1=CC=C(CC(O)=O)N1C UPSPUYADGBWSHF-UHFFFAOYSA-N 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 231100000816 toxic dose Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- LLPOLZWFYMWNKH-UHFFFAOYSA-N trans-dihydrocodeinone Natural products C1C(N(CCC234)C)C2CCC(=O)C3OC2=C4C1=CC=C2OC LLPOLZWFYMWNKH-UHFFFAOYSA-N 0.000 description 1
- 230000037317 transdermal delivery Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 206010044652 trigeminal neuralgia Diseases 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- FQCQGOZEWWPOKI-UHFFFAOYSA-K trisalicylate-choline Chemical compound [Mg+2].C[N+](C)(C)CCO.OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O FQCQGOZEWWPOKI-UHFFFAOYSA-K 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 210000002438 upper gastrointestinal tract Anatomy 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 238000005292 vacuum distillation Methods 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 229960002004 valdecoxib Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 229940087652 vioxx Drugs 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 239000011345 viscous material Substances 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 229920003169 water-soluble polymer Polymers 0.000 description 1
- 229940100445 wheat starch Drugs 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical compound [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 1
- PIAOXUVIBAKVSP-UHFFFAOYSA-N γ-hydroxybutyraldehyde Chemical compound OCCCC=O PIAOXUVIBAKVSP-UHFFFAOYSA-N 0.000 description 1
- QUEDXNHFTDJVIY-UHFFFAOYSA-N γ-tocopherol Chemical class OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1 QUEDXNHFTDJVIY-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/22—Bridged ring systems
- C07D221/28—Morphinans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/191—Carboxylic acids, e.g. valproic acid having two or more hydroxy groups, e.g. gluconic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/27—Esters, e.g. nitroglycerine, selenocyanates of carbamic or thiocarbamic acids, meprobamate, carbachol, neostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C269/00—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C269/00—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C269/04—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups from amines with formation of carbamate groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/22—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to carbon atoms of hydrocarbon radicals substituted by carboxyl groups
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Psychology (AREA)
- Dermatology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Anesthesiology (AREA)
- Addiction (AREA)
- Rheumatology (AREA)
- Emergency Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
한 측면에서, 본 발명은 약물과 GABA 유사체의 공유 결합 접합체의 조성물을 제공한다. 또다른 측면에서, 본 발명은 GABA 유사체의 접합체를 이용하여 통증 및 신경 장애를 치료하는 방법을 제공한다.
Description
본원은 이 거명에 의해 본원에 포함된, 2008년 10월 8일에 출원된 미국 가출원 번호 61/103,800의 우선권의 이익을 주장한다.
단일 약물의 투여를 수반하는 수많은 치료가 신경 통증을 비롯한 통증의 경감용으로 현재 추천되고 있다. 마약성 진통제인 감마 (γ)-아미노부티르산 (GABA) 유사체, 예컨대 가바펜틴, 프레가발린 및 바클로펜, 항-우울제 및 비-스테로이드성 항-염증성 약물 (NSAID)의 단일 투여는 임상 시험 및 다양한 동물 모델에서 통증 완화 특성을 보이는 것으로 나타났다.
현재의 단일 약물의 통증 경감 섭생으로부터 유래한 이익에도 불구하고, 이러한 섭생은 단점을 갖는다. 우려의 한 부분은, 오늘날 이용가능한 많은 통증 치료 섭생에 의해 유발되는 원치 않는 부작용의 발생에 관한 것이다. 마약성 진통제, 예컨대 모르핀은, 이의 단일 투여로부터 발생되는 것으로 널리 공지되어 있는 중독성 효과, 중추신경계 (CNS) 부작용 및 위장 부작용 때문에, 만성 통증용으로 거의 처방되지 않는다.
현재의 통증 치료 섭생에 대한 또다른 우려는 이들의 유효성에 관한 것이다. 현재의 통증 경감 섭생에 사용되는 많은 단일 활성 성분, 예컨대 항-우울제 또는 GABA 유사체는 중증의 특정 통증 상태에서, 이들의 최대 허용 치료 용량으로도 충분한 통증 완화를 달성할 수 없다. 충분한 통증 완화를 달성할 수 없는 것 외에, 약물 용량의 증가는 원치 않는 부작용, 예컨대 인지 손상, 메스꺼움 및 변비를 일으킬 수 있다.
게다가, GABA 유사체 및 많은 마약성 진통제에 대한 다른 우려는, 덜 유리한 이들의 약동학적 특성 및 생리학적 특성에 관한 것이다. 경구 투여되는 많은 오피오이드 분자는 전신성 순환에 도달하기 전에 소화 기관에 의해 광범위하게 대사작용된다. 일부 GABA 유사체의 신속한 전신성 제거 및 포화 흡수는, 이러한 약물이 통증 및 다른 CNS 장애의 치료에서 이들의 충분한 잠재력에 도달하는 것을 제한한다. 이러한 최적 이하의 특성은 대체로 환자에서 충분치 않은 효능 및 원치 않는 부작용으로 이어진다.
서방성 제제는 당업자에게 널리 공지되어 있는, 신속한 전신성 제거의 문제를 처리하는 통상의 방법이다 (예를 들어, 문헌 ["Remingtion's Pharmaceutical Sciences," Philadelphia College of Pharmacy and Science, 17th Edition, 1985]). GABA 유사체, 예컨대 바클로펜, 가바펜틴 및 프레가발린는 대장을 통해 흡수되지 않는다. 그보다는, 이러한 화합물은 전형적으로 중성 아미노 수송계에 의해 소장에서 흡수된다 (문헌 [Jezyk et al., Pharm. Res., 1999, 16, 519-526]). 통상적인 관의 신속한 통과는, 이러한 GABA 유사체에 서방성 접근법을 성공적으로 적용하는 것을 방해해 왔다.
이러한 우려의 관점에서, 향상된 치료 이점 (즉, 통증의 감소된 중증도 및/또는 빈도)을 제공하고/하거나 현재의 많은 섭생에 의해 유발되는 원치 않는 부작용의 발생을 감소시키는, 향상된 통증 섭생에 대한 필요성이 존재한다는 것은 명백하다. 게다가, GABA 유사체의 약동학적 프로파일의 향상은 또한 환자의 필요에 따라 더욱 맞춤화된 투여 섭생으로 이어질 것이다.
<본 발명의 요약>
한 측면에서, 본 발명은, 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 화합물을 제공한다. 또다른 측면에서, 본 발명은, 카르복실산 기를 통해 제2 잔기에 공유 결합되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 GABA, 또는 GABA의 유사체 또는 유도체인 화합물을 제공한다. 본 발명은 또한 본원에 개시된 본 발명의 화합물 및 제약상 허용되는 담체를 포함하는 제약 조성물을 실시한다.
또다른 측면에서, 본 발명은 치료 유효량의 본 발명의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애의 예방 또는 치료 방법을 제공한다. 일부 실시양태에서, 상기 치료 방법에 사용되는 화합물은, 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제 2잔기를 포함하고, 여기서 제1 잔기는 GABA, 또는 GABA의 유사체 또는 유도체이다. 다른 실시양태에서, 상기 치료 방법에 사용되는 화합물은, 카르복실산 기를 통해 제2 잔기에 공유 결합되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 GABA 또는 GABA의 유사체 또는 유도체이다. 또다른 실시양태에서, 상기 방법은 치료 유효량의 본 발명의 제약 조성물을 그를 필요로 하는 대상체에게 투여하는 것을 포함한다. 이러한 제약 조성물은 본 발명의 화합물 및 제약상 허용되는 담체를 포함한다.
또다른 측면에서, 본 발명은 치료 유효량의 본 발명의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애의 치료와 연관된 역작용을 감소시키는 방법을 제공한다. 일부 실시양태에서, 상기 화합물은, 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 GABA, 또는 GABA의 유사체 또는 유도체이다. 다른 실시양태에서, 상기 화합물은, 카르복실산 기를 통해 제2 잔기에 공유 결합되고 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 GABA, 또는 GABA의 유사체 또는 유도체이다. 또다른 실시양태에서, 장애의 치료와 연관된 역작용을 감소시키는 방법은, 치료 유효량의 본 발명의 제약 조성물을 그를 필요로 하는 대상체에게 투여하는 것을 포함한다. 이러한 제약 조성물은 본 발명의 화합물 및 제약상 허용되는 담체를 포함한다.
또다른 측면에서, 본 발명은, 치료 유효량의 본 발명의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애 치료의 치료 효능을 향상시키는 방법을 제공한다. 일부 실시양태에서, 상기 화합물은, 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 GABA, 또는 GABA의 유사체 또는 유도체이다. 다른 실시양태에서, 상기 화합물은 카르복실산 기를 통해 제2 잔기에 연결되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 GABA, 또는 GABA의 유사체 또는 유도체이다. 또다른 실시양태, 장애 치료의 치료 효능을 향상시키는 방법은, 치료 유효량의 본 발명의 제약 조성물을 그를 필요로 하는 대상체에게 투여하는 것을 포함한다. 이러한 제약 조성물은 본 발명의 화합물 및 제약상 허용되는 담체를 포함한다.
본원에 개시된 본 발명의 일부 측면을 실시함에 있어, 화합물의 제1 잔기는 GABA 유사체이다. 일부 실시양태에서, 제1 잔기는 바클로펜, 비가바트린, 가바펜틴 또는 프레가발린, 또는 γ-아미노-포스핀산 유도체이다. 일부 실시양태에서, 제2 잔기는 이들로 한정되지는 않지만, 비스테로이드성 항-염증성 약물 (NSAID), 오피오이드, 마취제, 근이완제 또는 항우울제를 비롯한 진통성 약물이다. 다른 실시양태에서, 제2 잔기는 γ-히드록시부티르산 (GHB), 또는 GHB의 유사체, 유도체 또는 변이체이다. 제1 잔기 및 제2 잔기는 바람직하게는 공유 결합을 통해 연결된다. 이러한 공유 결합은 에스테르 결합, 아미드 결합, 이민 결합, 카르바메이트 결합, 카르보네이트 결합, 티오에스테르 결합, 아실옥시카르바메이트 결합, 아실옥시카르보네이트 결합, 포스페이트 결합, 아실옥시포스페이트 결합 또는 모노-, 디-알킬포스포르아미데이트 결합일 수 있다. 일부 실시양태에서, 본 발명은 제1 잔기를 제2 잔기에 공유 결합으로 연결하는 링커를 추가로 포함한다. 이러한 링커는 바람직하게는 생리학적으로 불안정하다. 일부 실시양태에서, 본 발명은 화합물의 제1 잔기 또는 제2 잔기에 이온 결합 또는 공유 결합으로 연결된 제3 잔기를 추가로 포함한다. 다른 실시양태에서, 화합물은, 항-정신병 약물, 항불안제 약물, 항-우울제 약물, 진정제 약물, 항파킨슨병 약물, 아세틸콜린 에스테라아제 억제제, MAO 억제제, 선택적인 세로토닌 재흡수 억제제 (SSRI), N-메틸-D-아스파르트산 (NMDA) 길항제 또는 선택적인 노르아드레날린 대체 억제제일 수 있는, 하나 이상의 다른 치료제와 조합하여 사용될 수 있다. 이러한 다른 치료제는 본 발명의 화합물의 투여에 우선하여, 이와 함께 또는 이에 후속으로 투여될 수 있다. 일부 실시양태에서, 본 발명은 또한 제1 잔기, 예를 들어 GABA 유사체의 아미노 말단에 연결된 보호 기를 제공한다. 보호 기는 아미노산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬포스포르아미데이트, 또는 아실옥시카르바메이트일 수 있다. 바람직하게는, 보호 기는 대상체에게 투여된 후, 제1 잔기의 아미노 기로부터 절단될 수 있다.
본 발명은 또한, 장애의 치료에 사용하기 위한 방법, 본 발명의 화합물에 의해 유도되는 부작용을 감소시키는 방법 및 본 발명의 화합물의 치료 효능을 향상시키는 방법을 제공한다. 본원에 개시된 방법을 임의의 대상체에게 실시함에 있어, 바람직하게는 치료될 장애가 통증 또는 신경 장애이다. 일부 실시양태에서, 통증은 급성, 만성 또는 염증성 통증이다. 다른 실시양태, 신경 장애는 불안 장애, 우울증, 해리성 장애, 인격 장애, 인지 장애, 기분 장애, 정서 장애, 신경퇴행 장애, 경련성 장애, 파킨슨병, 알츠하이머병, 간질, 정신분열증, 편집증, 정신병, 헌팅턴병, 질 드 라 투렛 증후군, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황 장애, 불면증, 중독성 장애 및 하지 불안 증후군이다. 특정 실시양태에서, 대상체는 동물, 바람직하게는 포유동물, 보다 바람직하게는 인간이다. 일부 실시양태에서, 본 발명의 화합물 또는 제약 조성물의 투여는, 개별 잔기의 단독 투여와 비교하여 적어도 하나의 부작용을 덜 발생시킨다. 다른 실시양태에서, 본 발명의 화합물 또는 제약 조성물의 투여는, 개별 잔기의 단독 투여와 비교하여 치료 활성을 향상시킨다. 특정 실시양태에서, 화합물 또는 제약 조성물은 또다른 작용제와 조합하여 투여된다. 이러한 다른 작용제는 본 발명의 화합물 또는 제약 조성물의 투여에 우선하여, 이와 함께 또는 이에 후속으로 투여될 수 있다.
본 발명은, 본 발명의 화합물 또는 본 발명의 화합물의 제약 조성물 및 키트의 사용에 대한 지침을 포함하는, 대상체에서의 통증 또는 신경 장애의 예방용 또는 치료용 키트를 추가로 제공한다. 일부 실시양태에서, 대상체는 동물, 바람직하게는 인간이다. 다른 실시양태에서, 키트는 통증 또는 신경 장애에 사용하기 위한, 본 발명의 화합물에 의해 유도되는 부작용을 감소시키기 위한, 및/또는 본 발명의 화합물의 치료 효능을 향상시키기 위한 하나 이상의 다른 작용제를 추가로 포함한다.
<거명에 의한 포함>
본 명세서에 언급된 모든 간행물, 특허 및 특허 출원은, 마치 각각의 개별 간행물, 특허 또는 특허 출원이 상세하고 개별적으로 본원에 기재된 것처럼 이 거명에 의해 본원에 포함된다.
한 측면에서, 본 발명은 공유 결합을 통해 연결된 적어도 2개의 잔기를 포함하는 GABA-약물 접합체를 제공한다. 접합체의 제1 잔기는 바람직하게는 GABA 유사체를 포함한다. 일부 실시양태에서, 접합체의 제2 잔기는 진통성 약물을 포함한다. 다른 실시양태에서, 접합체의 제2 잔기는 감마 (γ)-히드록시부티르산 (GHB)을 포함한다. 접합체의 제2 잔기의 진통제로는, 이들로 한정되지는 않지만, 마약성 진통제, NSAID, 항우울제, 마취제, 근이완제, 감마-히드록시부티르산, 이중-작용성 오피오이드 효능제, N-메틸-D-아스파르트산 (NMDA) 수용체 길항제, 및 본원에 언급된 약물의 임의의 제약 조성물을 들 수 있다. 본 발명은 또한 이러한 GABA-약물 접합체의 합성 및 제조 방법을 제공한다. 추가로, 본 발명은 본 발명의 GABA-약물 접합체를 이용하는 방법, 및 장애를 치료 및/또는 예방하기 위한 GABA-약물 접합체의 제약 조성물을 포함한다.
본 발명의 GABA-약물 접합체는 바람직하게는 의약에 사용되는 제약상 이점을 제공한다. 첫째로, 이러한 GABA-약물 접합체는 생체내에서 불안정하여 효소적 또는 화학적 경로 중 하나에 의해 절단되고, 이는 전신성 순환에 도달시에 상당한 양의 GABA 유사체 및 약물, 예를 들어 마약성 진통제, NSAID, 항우울제, 이중-작용성 오피오이드, 마취제, 근이완제 및 감마-히드록시부티르산으로부터 선택되는 진통제를 생성시킨다. 둘째로, 생체내에서 절단시 GABA-약물 접합체의 각각의 개별 잔기는, 필요한 치료, 예를 들어 통증 또는 신경 장애의 치료와 관련된 상이한 또는 비-중복성의 생물학적 표적을 표적화한다. 따라서, GABA-약물 접합체는 생체내에서 절단시, 1종 초과의 생물학적 표적을 표적화할 수 있고, 상가적 또는 상승작용적 생물학적 효과를 도출할 수 있으며, 이는 향상된 치료 효능으로 귀결된다. 적절한 투여 섭생으로 대상체에 투여되는 경우, GABA-약물 접합체로부터 방출되는 링커는 일반적으로 비-독성이다.
산성 기의 예로는, 이들로 한정되지는 않지만, 포스핀산, 포스폰산, 술폰산, 술핀산 또는 카르복실산 등을 들 수 있다. 아미노 말단은 또한 N-말단, NH2-말단, N-종결 말단 또는 아민-말단으로 공지되어 있다. 이러한 용어는 본원에서 호환성 있게 사용된다. 아미노 말단으로는 유리 아민 기 (-NH2)를 갖는 아미노산으로 종결된, 단백질 또는 폴리펩티드의 말단을 들 수 있다. 다리 결합된 시클로알킬로는,
을 포함하는 라디칼을 들 수 있으며,
여기서,
A는 (CR35R36)b이고,
R35 및 R36은 독립적으로 수소 및 메틸로 이루어진 군으로부터 선택되고,
R33 및 R34는 독립적으로 수소 및 메틸로 이루어진 군으로부터 선택되고,
b는 1 내지 4의 정수이고,
c는 0 내지 2의 정수이다.
GABA 유사체의 예로는, 이들로 한정되지는 않지만 하기 구조식을 들 수 있으며,
여기서,
R은 수소, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬이거나, R 및 R4는 이들이 부착되어 있는 원자와 함께 아제티딘, 치환된 아제티딘, 피롤리딘 또는 치환된 피롤리딘 고리를 형성하고;
R4 및 R5는 독립적으로 수소, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되고;
R2 및 R3은 독립적으로 수소, 알킬, 치환된 알킬, 아실, 치환된 아실, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되거나, 임의로, R4 및 R5는 이들이 부착되어 있는 탄소 원자와 함께 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬 및 다리 결합된 시클로알킬 고리를 형성한다.
R1 및 R23은 독립적으로 수소, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택된다.
본 발명의 화합물은 하나 이상의 키랄 중심 및/또는 이중 결합을 함유할 수 있고, 이에 따라 입체이성질체, 예컨대 이중-결합 이성질체 (즉, 기하이성질체), 거울상이성질체 또는 부분입체이성질체로서 존재할 수 있다. 따라서, 본원에 묘사된 화학 구조식은, 이들로 한정되지는 않지만, 입체이성질체상 순수한 (예를 들어, 기하학상 순수한, 거울상이성질체상 순수한 또는 부분입체이성질체상 순수한) 형태, 및 거울상이성질체 및 입체이성질체 혼합물을 비롯한, 예시된 화합물의 모든 가능한 거울상이성질체 및 입체이성질체를 포함한다. 거울상이성질체 및 입체이성질체 혼합물은, 당업자에게 공지된 분리 기법 또는 키랄 합성 기법을 이용하여, 이들의 거울상이성질체 또는 입체이성질체 성분으로 분리될 수 있다. 본 발명의 화합물은 또한, 이들로 한정되지는 않지만, 에놀 형태, 케토 형태 및 이들의 혼합물을 비롯한 몇몇의 호변이성질체 형태로 존재할 수 있다. 따라서, 본원에 묘사된 화학 구조식은 예시된 화합물의 모든 가능한 호변이성질체 형태를 포함할 수 있다. 본 발명의 화합물로는 또한, 이로 한정되지는 않지만, 하나 이상의 원자가 자연에서 통상적으로 발견되는 원자 질량과 상이한 원자 질량을 갖는, 동위원소로 표지된 화합물을 들 수 있다. 본 발명의 화합물에 혼입될 수 있는 동위원소의 예로는, 이들로 한정되지는 않지만, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F 및 36Cl를 들 수 있다. 또한, 본 발명의 화합물의 부분 구조식이 예시되는 경우에, 대괄호는 분자의 나머지 부분에 대한 부분 구조식의 부착 지점을 나타내는 것으로 이해되어야 한다.
한 측면에서, 본 발명의 제2 잔기, 예를 들어 약물은 전형적으로 제1 잔기, 예를 들어 GABA 유사체의 감마-아미노 기에 부착된다. 2개의 잔기는, GABA 유사체의 감마-아미노 기를 통해 직접 부착되어, 이들로 한정되지는 않지만, 카르복실산 아미드, 포스폰산 아미드, 포스핀산 아미드, 술폰산 아미드, 술핀산 아미드 및 이민을 비롯한 링커를 형성하거나, 또는 생체내에서 절단될 수 있는 링커 "X"를 통해 임의로 연결될 수 있다. 또다른 측면에서, 본 발명의 제2 잔기는 제1 잔기의 산성 기를 통해 제1 잔기 (예를 들어, GABA 유사체)에 부착된다. 본원에서 사용되는 산성 기로는, 이들로 한정되지는 않지만, 카르복실산, 포스핀산 및 술핀산 기를 들 수 있다. 접합체의 제2 잔기는 제1 잔기의 산성 기에 공유 결합으로 연결되어, 이들로 한정되지는 않지만, 카르복실레이트, 티오-에스테르, 포스피네이트, 술피네이트 및 카르복실산 아미드를 비롯한 링커를 형성한다. 별법으로, 2개의 잔기는 생체내에서 절단될 수 있는 링커 "Z"를 통해 임의로 연결될 수 있다.
일부 실시양태에서, 본 발명은 하기 화학식 I 및 화학식 II의 GABA-약물 접합체, 또는 그의 제약상 허용되는 염, 수화물, 용매화물 및 동위원소를 제공하며,
여기서,
t는 0 또는 1이고;
X는
로 이루어진 군으로부터 선택되는, 약물과 GABA 유사체 사이의 링커를 통한 공유 결합으로서 정의되고;
Z는
로 이루어진 군으로부터 선택되는, 약물과 GABA 유사체 사이의 링커를 통한 공유 결합으로서 정의되고;
R1은 독립적으로 수소, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로알킬, 치환된 헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되고;
R2 및 R3은 독립적으로 수소, 알킬, 치환된 알킬, 아실, 치환된 아실, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 아릴알킬, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되거나, 임의로, R2 및 R3은 이들이 부착되어 있는 탄소 원자와 함께 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬 또는 다리 결합된 시클로알킬 고리를 형성하고;
R4 및 R5는 독립적으로 수소, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되고;
R6 및 R7은 독립적으로 수소, 알킬, 치환된 알킬, 아실, 치환된 알콕시카르보닐, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 카르바모일, 시클로알킬, 치환된 시클로알킬, 시클로알콕시카르보닐, 치환된 시클로알콕시카르보닐, 헤테로아릴, 치환된 헤테로아릴, 아릴알킬, 치환된 아릴알킬, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되거나, 임의로, R4 및 R5는 이들이 부착되어 있는 탄소 원자와 함께 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬 또는 다리 결합된 시클로알킬 고리를 형성하고;
R20은 독립적으로 수소, 알킬, 치환된 알킬, 알콕시, 치환된 알콕시, 아실, 치환된 아실, 아실아미노, 치환된 아실아미노, 알킬아미노, 치환된 알킬아미노, 알킬술피닐, 치환된 알킬술피닐, 알킬술포닐, 치환된 알킬술포닐, 알킬티오, 치환된 알킬티오, 알콕시카르보닐, 치환된 알콕시카르보닐, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 아릴옥시, 치환된 아릴옥시, 카르바모일, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 디알킬아미노, 치환된 디알킬아미노, 할로, 헤테로알킬, 치환된 헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬, 치환된 헤테로아릴알킬, 헤테로알킬옥시, 치환된 헤테로알킬옥시, 헤테로아릴옥시 및 치환된 헤테로아릴옥시로 이루어진 군으로부터 선택되거나; 임의로,
R21 및 R22는 독립적으로 수소, 아실, 치환된 아실, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로알킬, 치환된 헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되거나, 임의로 R20 및 R21은 이들이 부착되어 있는 탄소 원자와 함께 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬 또는 치환된 시클로헤테로알킬 고리를 형성한다.
또다른 측면에서, 본 발명의 제2 잔기는, 제1 잔기의 C (카르복실)-말단을 통해 제1 잔기 (예를 들어, GABA 유사체)에 부착되고, 제1 잔기의 N (아미노) 말단은 보호 기 "P"에 부착된다. 일부 실시양태에서, 본 발명의 GABA-약물 접합체는 하기 화학식 III을 갖는다.
<화학식 III>
여기서,
R2 및 R3은 독립적으로 수소, 알킬, 치환된 알킬, 아실, 치환된 아실, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 아릴알킬, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되거나, 임의로, R2 및 R3은 이들이 부착되어 있는 탄소 원자와 함께 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬 및 다리 결합된 시클로알킬 고리를 형성하고;
R4 및 R5는 독립적으로 수소, 알킬, 치환된 알킬, 아릴, 치환된 아릴, 아릴알킬, 치환된 아릴알킬, 시클로알킬, 치환된 시클로알킬, 시클로헤테로알킬, 치환된 시클로헤테로알킬, 헤테로아릴, 치환된 헤테로아릴, 헤테로아릴알킬 및 치환된 헤테로아릴알킬로 이루어진 군으로부터 선택되고;
Z는
로 이루어진 군으로부터 선택되는, 약물과 GABA 유사체 사이의 링커를 통한 공유 결합으로서 정의되고;
P는 아미노산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬 포스포르아미데이트, 아실옥시카르바메이트로서 정의된다.
I. 제1
잔기
:
GABA
및
GABA
유사체
한 측면에서, 본 발명은 통증 또는 신경 장애의 치료를 위한 조성물을 제공한다. 일부 실시양태에서, 조성물의 제1 잔기는 GABA 유사체이다.
감마-아미노부티르산 (GABA)은 포유동물의 중추신경계에서의 억제성 신경전달물질 중 하나이다. 이는, 시냅스전 및 시냅스후 뉴런 과정 둘 모두의 원형질 막에서 특이적 막횡단 수용체에 결합함으로써 뇌의 억제성 시냅스에 작용한다. 이러한 결합은 이온 채널을 열리게 하여, 음전하의 염소 이온이 세포 안으로 유입되게 하거나, 양전하의 칼륨 이온이 세포 밖으로 유출되도록 한다. 상기 작용은 음전하의 막횡단 전위를 일으키고, 이는 보통 과-분극화를 일으킨다. 3개의 일반적인 GABA 수용체는 GABAA, GABAB 및 GABAC로 확인되었다. GABAA 및 GABAC는 이온성 수용체인 반면에, GABAB는 G 단백질 커플링된 대사성 수용체이다. 저수준의 GABA는, 이들로 한정되지는 않지만, 간질 발작, 다발성 경화증, 떨림, 공황, 불안증 및 우울증을 비롯한 다수의 질환과 관련되어 왔다.
다양한 질환 상태에서의 GABA의 역할은, 혈뇌 장벽 침투성이 부족한 GABA와 비교하여 보다 양호한 제약 특성을 갖는 GABA 유사체의 제조에 대한 흥미를 자극하였다. 따라서, 수많은 GABA 유사체가 당업계에서 합성되었다 (사칭거(Satzinger) 등의 미국 특허 번호 4,04,175; 실버만(Silverman) 등의 미국 특허 번호 5,563,175; 6,028,214; 6,117,906; 국제 공개 번호 WO92/09560; 93/23383; 호르웰(Horwell) 등의 미국 특허 번호 6,020,370; 국제 공개 번호 WO97/29101, 97/33858; 97/33859; 브라이언스(Bryans) 등의 국제 공개 번호 WO 99/31057; 99/31075; 99/61424; 00/15511; 00/31020; 00/50027; 02/00209; 구글리에타(Guglietta) 등의 국제 공개 번호 WO 99/08671).
수많은 GABA 유사체가 확인되었다. 이러한 GABA 유사체로는, 이들로 한정되지는 않지만, 하기에 나타낸 바와 같은 바클로펜 [화학식 IV의 (a)], 비가바트린 [화학식 IV의 (b)], 가바펜틴 [화학식 IV의 (c)] 및 프레가발린 [화학식 IV 의(d)]을 들 수 있다. GABA 그 자체와는 달리, 이러한 GABA 유도체는, 아마 능동 수송 메카니즘에 의해 혈뇌 장벽을 통과할 수 있을뿐만 아니라, 제약 효용성을 임상적으로 증명할 수 있다. 바클로펜은, 특히 척수 손상, 경련성 양마비, 다발성 경화증 및 삼차신경통과 같은, 경련성 움직임의 치료 또는 통증의 완화를 위해 임상적으로 사용되는 GABAB 효능제이다. 비가바트린은, 간질 및 복합 부분 발작과 같은 질환의 부수적 치료제로서 사용되어 온 항-경련제이다. GABA 유사체 중에서, 가바펜틴 및 프레가발린은 원래는 간질 치료용으로 개발되었지만, 만성 통증, 특히 신경 통증 (예컨대, 당뇨병성 신경 통증 및 대상포진 후의 신경통)의 경감에 효과적인 것으로 입증되었다. 가바펜틴 및 프레가발린은 또한 섬유조직염 치료에서 유효성을 나타냈다. 가바펜틴 및 프레가발린은 일반적으로 대부분의 환자에서 좋은 내약성을 보이고, 상대적으로 가벼운 부작용 프로파일, 최소의 대사 및 약물-약물 상호작용을 갖는다. 가바펜틴 및 프레가발린은 GABA 수용체와 최소의 상호작용을 갖는 것으로 보인다. 연구들은, 신경 통증 완화 작용이 뉴런 막에서 높은 친화력의 결합 부위인, 전압-개폐형 N-형 칼슘 이온 채널의 알파-2-델타 소단위를 통해 매개된다는 것을 제시한다 (문헌 [Rose, M.A. et al, Anesthesia, 2002, 57(5), 451-462]). 이러한 소단위는 신경 통증의 모델에서의 기계적 과민성의 지속성과 연관되어 있다. 칼슘 이온은 신경전달물질을 함유하는 비히클이 시냅스전 막과 융합되도록 하고, 이러한 작용은 시냅스 간극을 억제하는 신경전달물질의 방출을 촉진한다. 가바펜틴 및 프레가발린 둘 모두는, 알파-2-델타 수용체를 통한 칼슘 유입을 차단하고 뉴런간에 침해수용성 신호를 전달하는 신경전달물질의 방출을 감소시킴으로써, 이들의 치료학적 효과를 발휘할 가능성이 크다. 시험관내 연구 결과는, 가바펜틴이 흥분성 신경전달물질, 예컨대 글루타메이트 및 노르에피네프린의 시냅스전 방출을 감소시킬 수 있다는 것을 제시한다.
<화학식 IV>
다른 진통제, 예컨대 마약성 진통제, 이중-작용성 오피오이드 진통제, NSAID, 항우울제, NMDA 길항제와 함께 GABA 유사체 (예를 들어 가바펜틴, 프레가발린 및 바클로펜)를 이용하는 조합 요법은 만성 통증 제어능을 향상시킨다. GABA 유사체 및 상기의 진통제가 함께 투여되는 경우에, 이들은 상승작용적 또는 상가적 방식으로 상호작용하여 만성 통증을 제어할 수 있다. 이러한 상승작용은 각각의 화합물의 요구되는 용량을 잠재적으로 감소시킬 수 있고, 이는 부작용의 감소 및 이들 화합물의 임상적 유용성의 향상에 이르게 한다. 진통성 효과는 GABA 유사체 (가바펜틴, 프레가발린 및 바클로펜)와 오피오이드, 예컨대 모르핀의 병용-투여에 의해 향상될 수 있다 (문헌 [Keskinbora K. J. of Pain and Symptom Management 2007, 34(2), 183-189]; [Kazi, J. A., Gee, C. F. J. Mol. Neurosci. 2007, 32, 47-52]; [Berger, A. et al. Clinical Therapeutics 2003, 25(11), 2809-2821]; [Eckhardt, K. et al. Anesth Analg 2000, 91, 185-191]; [Granados-Soto, V. et al. Pharmacology 2005, 74, 200-208]; [Tiippana, E. M. et al. Anesthesia & Analgesia 2007, 104(6), 1545-1556]; [Codd. E. E. et al. Pain 2008, 134, 254-262]). 또한, 본 발명에 따르면, 진통성 효과가 GABA 유사체 (가바펜틴, 프레가발린)와 NSAID 또는 NMDA 수용체 길항제와의 병용-투여에 의해 향상될 수 있다는 것이 보고되었다 (문헌 [Yoon, M. H. et al., Anesthesiology 1999, 91(4), 1006-1013]; [Hurley, R. W., et al., 2002, 97(5), 1263-1273]; [Durmus, M. et al., Acta Anaesthesiol Scand 2007, 51, 299-304]; 라이언, 엠.(Ryan, M.) 등의 국제 특허 번호 WO99/12537).
GABA 유사체 및 다른 진통제의 병용-투여 사용에 대한 이익에도 불구하고, 이러한 섭생은, 1) 결과적으로 전신성 순환에서 치료학적 또는 예방적 농도를 유지하기 위해 잦은 투여를 요구하는, 이들로 한정되지는 않지만, 가바펜틴, 프레가발린 및 바클로펜을 비롯한 GABA 유사체의 신속한 전신성 제거; 2) 더 높은 용량 (1.8 내지 3.6 g/d의 분할 용량)에서의 가바펜틴의 흡수 포화에 기인한 환자간 가변성; 3) 서방성 제제 용액을 제한하는, 대장에서의 최소 흡수율; 4) 진통제, 예를 들어 NSAID에 의해 유발되는 GI 독성; 및 5) 일부의 마약성 진통제, 예컨대 모르핀의 광범위한 일차 통과 대사의 단점을 갖는다.
한 측면에서, 본 발명은, 바람직하게는 상기 언급된 치료 섭생에 대해 몇몇의 분명한 이점을 갖는 신규한 화학물질을 갖는, 신규한 GABA-약물 접합체를 제공한다. 일부 실시양태에서, GABA-약물 접합체는 대장에서 흡수될 수 있다. 결과적으로, 투여 빈도는 서방성 제제를 사용함으로써 감소될 수 있다. 다른 실시양태에서, GABA-약물 접합체는, 아마 수동 확산을 통해 GABA 유사체의 흡수 메카니즘을 변경하고, 환자 중에서 보다 예측가능한 약동학적 성과 및 치료학적 성과를 제공할 수 있다. 추가의 실시양태에서, 제1 잔기 (예를 들어, GABA 유사체)와 제2 잔기 (예를 들어, 진통제) 사이의 링커를 최적화함으로써, GABA-약물 접합체로부터의 활성 약물 (즉, GABA 유사체의 활성 형태 및 진통제의 활성 형태)의 방출 속도는 최적화될 수 있다. 결과적으로, 일부의 GI 불안정성, 예컨대 일차 통과 대사 또는 GI 부작용은 모 약물의 투여와 비교하여 감소될 수 있다. 본 발명은 또한 GABA-진통제 접합체, 예를 들어 GABA-NSAID 접합체를 포함할 수 있다. 본 발명의 GABA-NSAID 접합체의 투여는 잠재적으로, NSAID에 의해 유발되는 위장 손상을 예방하고/하거나, 감소시키고/시키거나 치료할 수 있다.
II
. 제2
잔기
일부 실시양태에서, 본 발명의 조성물의 제2 잔기는 진통성 약물이다.
A. 진통제
진통제는 통증을 경감시키는 데 사용되는 약물 군의 임의의 구성원이다. 진통성 약물은 말초신경계 및 중추신경계에서 다양한 방식으로 작용한다. 몇몇의 진통제 클래스가 존재하고, 여기에는, 이들로 한정되지는 않지만, 파라세타몰 (아세트아미노펜), 비-스테로이드성 항-염증성 약물 (NSAID), 예컨대 나프록센, 마약성 약물 (예컨대, 모르핀 및 아편제), 마약성 특성을 갖는 합성 약물, 예컨대 트라마돌, 및 다양한 기타 약물이 있다.
진통제에 대한 선택은, 중증도 및 다른 약물 치료에 대한 반응에 의해 결정되고, 또한 통증의 유형에 의해 결정된다. 예를 들어, 신경 통증에는 기존의 진통제는 덜 효과적이고, 보통 고려되지 않는 진통제, 예컨대 트리사이클릭 항-우울제및 항경련제인 약물 클래스는 대체로 유익하다.
비-스테로이드성 항-염증성 약물 (NSAID)
때때로 비-스테로이드성 항-염증성 작용제/진통제 (NSAIA) 또는 비-스테로이드성 항-염증성 의약 (NSAIM)으로도 지칭되는 비-스테로이드성 항-염증성 약물 (NSAID 또는 NAID)은, 진통성 및 해열성을 갖고 더 높은 용량에서는 항-염증성 효과를 갖는 약물이다. NSAID는 통증, 열 및 염증을 감소시킬 수 있다. 용어 "비-스테로이드성"은, 상기의 약물을 유사한 에이코사노이드-우울성, 항-염증성 효과를 갖는 스테로이드와 구별하기 위해 사용된다. 진통제로서, NSAID는 비-마약성이다. NSAID로는, 이들로 한정되지는 않지만, 디클로페낙, 에토돌락, 인도메타신, 술린닥, 톨메틴, 나부메톤, 피록시캄, 아세트아미노펜, 페노프로펜, 플루르비프로펜, 이부프로펜, 케토프로펜, 타프록센, 옥사프로진, 아스피린, 콜린 마그네슘 트리살리실레이트, 디플루니살, 메클로페남산, 메페남산, 페닐부타존, 플루오시놀론 아세토나이드, 프레드니솔론, 프레드니솔론 3차-부틸아세테이트, 덱사메타손, 또는 이들의 전구약물 또는 활성 대사물을 들 수 있다. 이러한 약물 군 중에서 가장 중요한 구성원은 아스피린, 이부프로펜 및 나프록센이다. 파라세타몰 (아세트아미노펜)은 무시할만한 항-염증성 활성을 갖고, NSAID가 아니다.
대부분의 NSAID는, 시클로옥시게나아제-1 (COX-1) 및 시클로옥시게나아제-2 (COX-2) 동질효소 둘 모두를 억제하는, 효소 시클로옥시게나아제의 비-선택적 억제제로서 작용한다. 시클로옥시게나아제는, 아라키돈산으로부터의 프로스타글란딘 및 트롬복산의 형성을 촉매한다. 프로스타글란딘은 염증 과정에서 전달자로서 작용한다. NSAID는 보통, 통증 및 염증이 존재하는 급성 또는 만성 병태의 치료용으로 처방된다. COX-2 억제제로는, 이들로 한정되지는 않지만, 로페콕시브 (VIOXX.RTM., 또는 4-[4-(메틸술포닐)페닐]-3-페닐-2(5H)-푸라논), 셀레콕시브 (CELEBREX.RTM., 또는 4-[5-(4-메틸페닐)-3-(트리플루오로메틸)-1H-피라졸-1-일]벤젠술폰아미드), 및 발데콕시브 (BEXTRA.RTM., 및 4-(5-메틸-3-페닐-4-이속사졸릴) 벤젠술폰아미드)를 들 수 있다.
NSAID는 일반적으로, 이들로 한정되지는 않지만, 류마티스성 관절염, 골관절염, 염증성 관절증, 급성 통풍, 월경 곤란증, 전이성 골 통증, 두통 및 편두통, 수술후 통증, 염증 및 조직 손상에 기인한 경증 내지 중증의 통증, 발열 (열), 장폐색 및 신장 산통을 비롯한 병태의 증후성 경감용으로 처방된다.
NSAID와 연관된 2개의 주요한 약물 유해 반응 (ADR)은 작용제의 위장성 (GI) 효과 및 신장성 효과와 관련된다. 이러한 효과는 용량-의존성이고, 많은 경우에 궤양 천공, 상부 위장관 출혈 및 사망의 위험을 제기할 만큼 충분히 심각하여, NSAID 요법의 사용을 제한한다. NSAID 환자 중 10 내지 20%가 소화불량을 경험하는 것으로 추정되고, NSAID-연관된 상부 위장관의 유해 반응은, 미국에서 매년 103,000명의 입원 환자 및 16,500명의 사망자를 발생시키고, 43%의 약물-관련 응급 방문자를 나타내는 것으로 추정된다.
일부 측면에서, 본 발명은, 기존의 진통제와 연관된 부작용을 감소시키고 치료의 치료 효능을 증가시킬 수 있는 조성물을 제공한다.
마약성 진통제
두 유형의 마약성 진통제, 즉 아편제 및 오피오이드 (아편제의 유도체)가 존재한다. 아편제는, 이들로 한정되지는 않지만, 모르핀, 코데인 및 테바인을 비롯한, 아편에서 발견되는 알칼로이드이다. 오피오이드는 중추신경계 또는 위장관에서 오피오이드 수용체에 결합하는 임의의 의약물이다. 4개의 광범위한 오피오이드 클래스, 즉 내인성 오피오이드 펩티드 (신체에서 생성됨: 엔도르핀, 다이노르핀, 엔케팔린); 아편 알칼로이드 (모르핀, 코데인, 테바인); 반-합성 오피오이드 (헤로인, 옥시코돈, 히드로코돈, 디히드로코데인, 히드로모르폰, 옥시모르폰, 니코모르핀); 및 완전히 합성된 오피오이드 (페티딘 또는 데메롤, 메타돈, 펜타닐, 프로폭시펜, 펜타조신, 부프레놀핀, 부토파놀, 트라마돌 등)가 존재한다.
오피오이드는 중증 또는 만성 통증의 경감을 위해 강한 진통제로서 의약물에 사용된다. 통증 경감을 달성하기 위해 사용되는 오피오이드의 투여량에 대한 상한치는 없지만, 용량은 역작용 (예를 들어, 호흡성 우울증)에 대한 내성을 발전시킬 수 있도록 점진적으로 증가되어야 한다. 오피오이드의 중독 가능성 대 비-악성 만성 통증, 예컨대 만성 관절염 치료에 대한 이들의 진통 특성의 유익에 대한 논쟁이 존재한다. 마약성 진통제의 용법과 연관된 많은 부작용과 역반응이 존재한다. 흔한 부작용으로는, 이들로 한정되지는 않지만, 메스꺼움, 구토, 졸음, 구강 건조, 축동 (동공 수축), 기립성 저혈압, 요폐, 변비 및/또는 분변 매복을 들 수 있다.
향정신성 약물
카나비스 사티바(Cannabis sativa) 식물 또는 합성물 중 어느 하나로부터의 테트라히드로카나비놀 (THC)과 몇몇의 다른 카나비노이드는 진통 특성을 갖는다. 다른 향정신성 진통제로는, 이들로 한정되지는 않지만, 케타민 (NMDA 수용체 길항제), 클로니딘 및 다른 α2-아드레날린수용체 효능제, 멕실레틴 및 다른 국부 마취제 유사체를 들 수 있다.
비전형적 및/또는 보조적 진통제
올페나드린, 시클로벤자프린, 스코폴아민, 아트로핀, 가바펜틴, 제1-세대 항-우울제, 및 항콜린작용성 및/또는 항경련성 특성을 갖는 다른 약물은 많은 경우에 진통제와 함께 사용되어, 특히 신경병 기원의 통증에 대해 사용되는 경우에 중점적으로 작용하는 진통제, 예컨대 오피오이드의 효력을 증가시키고, 부교감신경 신경계에서의 작용에 의해 다른 유형의 많은 진통제의 효과를 조절한다. 트리사이클릭 항우울제, 특히 아미트립틸린은 통증을 개선하는 것으로 나타났다. 카르바마제핀, 가바펜틴 및 프레가발린의 정확한 메카니즘은 분명하지 않지만, 이러한 항경련제는 꽤 성공적으로 신경 통증을 치료하는 데 사용된다. 덱스트로메토르판은 오피오이드에 내한 내성의 발전을 늦추고, NMDA 수용체에 대해 작용함으로써 부가적인 무통증을 발휘하는 것으로 주목되고 있다; 일부 진통제, 예컨대 메타돈 및 케토베미돈 및 아마도 피리트라미드는 내인성 NMDA 작용성을 갖는다. 강한 물약은 과거에는 에틸 알콜의 CNS 억제 효과에 기인하여, 통증을 약화시키기 위한 작용제로서 사용되어왔다. 그러나, 알콜의 통증 치료 능력은 사실상, 오늘날 사용되는 모든 진통제 (예를 들어, 모르핀, 코데인)보다 열등하다.
보조 진통제의 사용은 통증-제어 분야에서 증가하고 있는 부분이다. 이러한 많은 약물은 오피오이드 진통제의 부작용을 방지한다. 예를 들어, 올페나드린을 비롯한 항히스타민은, 많은 오피오이드, 메틸페니데이트, 카페인, 에페드린, 덱스트로암페타민에 의해 유발되는 히스타민의 방출을 방지하고, 코카인은 심한 진정 작용에 대항하여 작용하고, 항우울제의 작용과 같이 스트레스를 받은 환자의 기분을 향상시킬 수 있다. 오피오이드에 대해 널리 용인되는, 만성 통증 환자에 대한 THC의 유익은 그의 우수한 항-구토성 작용이다.
B. GHB
다른 실시양태에서, 본 발명의 조성물의 제2 잔기는 감마-히드록시부티르산 (GHB), 또는 GHB의 임의의 유사체, 유도체 또는 변이체이다. GHB는 중추신경계, 와인, 쇠고기, 작은 감귤류 및 거의 모든 동물에서 소량으로 발견되는 자연-발생적 물질이다. GHB는 인간 신체의 세포에서 자연적으로 생성되고, 구조적으로는 케톤체 베타-히드록시부티레이트와 관련된다. 이는 또한 수많은 나라에서 불법 약물로서 분류되는 신경보호성의 치료학적 영양소이다. 이는 현재 미국에서 규제되고 있고, 기면 발작을 가진 환자의 탈력 발작 및 주간 과다 수면을 치료하는 데 사용된다. 보충물/약물로서, 이는 염의 형태로 가장 흔하게 사용된다. GHB는 또한 발효작용의 결과로서 생성된다.
GHB는 중추신경계에서 적어도 2개의 별개의 결합 부위를 갖는다. GHB는 흥분성인 GHB 수용체의 효능제이고 (문헌 [Wu Y, et.al., 2004, Neuropharmacology 47 (8): 1146-56]), 억제성인 GABAB 수용체에서는 약한 효능제이다. GHB는 아마도 GABA성 뉴런에서 GABA로부터 합성되어, 뉴런이 분출될 때 방출된다.
경구적으로 흡수하는 경우에, GABA는 그 자체로 매우 불량하게 혈뇌 장벽을 횡단하고, 일단 뇌 내부로 들어간 경우에도 고농도의 GABA가 매우 비효과적으로 GABA 수용체에 도달한다. GABA는 뇌에서 자연적으로 합성되기 때문에, 정상 농도보다 더 고농도의 GABA는 빠르게 대사작용될 것이다. 그러나, GHB는 약리학적 용량으로는 훨씬 더 고농도로 뇌에 도달하여, 진정 효과를 주로 담당하는 GABAB 수용체를 활성화시킨다 (문헌 [Dimitrijevic N, et.al. 2005, Eur. J. Pharmacol. 519 (3): 246-52]). GHB의 진정 효과는 GABAB 길항제에 의해 차단된다.
GHB 수용체 및 GABAB 둘 모두의 활성화는 GHB의 중독성 프로파일을 관장한다. 도파민 방출에 대한 GHB의 효과는 이상성(biphasic)이고, 저농도는 GHB 수용체를 통한 도파민 방출을 자극한다. 보다 고농도는 다른 GABAB 효능제, 예컨대 바클로펜 및 페니부트와 같이, GABAB 수용체를 통한 도파민 방출을 억제한다 (문헌 [Maitre M, et.al. 1990, J. Pharmacol. Exp. Ther. 255 (2): 657-63]; [Smolders I, et.al., 1995 Eur. J. Pharmacol. 284 (1-2): 83-91]). 억제의 초기 상태 후, GHB 수용체를 통한 도파민 방출은 증가한다. GHB에 의한 도파민 방출의 억제 및 증가 둘 모두는 오피오이드 길항제, 예컨대 날록손 및 날트렉손에 의해 억제된다.
GHB의 다른 전구약물 에스테르 형태로는, 이들로 한정되지는 않지만, 1,4-디아세톡시부탄, 메틸-4-아세톡시부타노에이트 및 에틸-4-아세톡시부타노에이트를 들 수 있다. 이러한 GHB의 전구약물은 추측컨대, 발병을 지연시키고 작용기간을 연장시켰다. 중간체 화합물인 4-히드록시부트알데히드 또한, GHB에 대한 전구약물이다.
GHB는 페인트 스트리퍼로 흔히 사용되는 용매인 GBL (감마-부티로락톤), 또는 플라스틱 및 접착제의 제조에 사용되는 화학물질인 부탄디올 (1,4-부탄디올)과 같은 성분으로 제조될 수 있다. GBL 및 부탄디올 둘 모두는 신체 내에서 GHB로 대사작용된다.
본 발명이 GHB, 또는 GHB의 임의의 유사체, 유도체, 전구약물 형태 또는 임의의 다른 적합한 변이체를 포함하는 것을 유의하여야 한다.
III
.
GABA
-약물 접합체의 합성
본 발명의 GABA-약물 접합체는 반응식 1 내지 8에 예시되어 있는 합성 방법을 통해 수득될 수 있다. 당업자들은, 본 발명의 GABA-약물 접합체로의 바람직한 합성 경로가 마약성 진통제, NSAID, 이중-작용성 오피오이드 진통제, 항우울제, γ-부티르산 및 NMDA 수용체 길항제로부터 선택되는 진통성 약물을 GABA 유사체에 연결하는 것으로 이루어져 있다는 것을 알 것이다. GABA 유사체의 합성에 관한 다수의 방법은 당업계에 기재되어 있다 (사칭거 등의 미국 특허 번호 4,024,175; 실버만 등의 미국 특허 번호 5,563,175; 번호 6,028,214; 번호 6,117,906; 실버만 등의 국제 공개 WO 92/09560; 번호 WO 93/23383; 호르웰 등의 미국 특허 번호 6,020,370; 번호 6,103,932; 호르웰 등의 국제 공개 번호 WO 97/29101; WO 97/33858; WO 97/33859; 브라이언스 등의 국제 공개 번호 WO 98/17627; WO 99/21824; WO 99/31057; WO 99/31075; WO 99/61424; WO 00/15611; WO 00/31020; WO 00/50027; 구글리에타 등의 국제 공개 번호 WO 99/08671; 벨리오티(Belliotti) 등의 국제 공개 번호 WO 99/31074). GABA 유사체의 합성에 대한 다른 방법인 당업계에 공지되어 있고, 당업자들은 이에 쉽게 접근가능하다. 본원에 기재된 진통제는 당업계에 공지되어 있고, 공지된 절차에 따라 제조될 수 있다. 또한, 다양한 관능기 (예를 들어, 카르복실산, 히드록실, 티올, 아민, 술폰아미드)를 함유한 진통제 분자를 GABA 유사체에 연결하는 분야도 확립된 절차에 의해 널리 공지되어 있다 (예를 들어, 문헌 [Green et al., "Protective Groups in Organic Chemistry", (Wiley, 2nd ed. 1991)]; [Harrison et al., "Compendium of Synthetic Organic Methods", Vols. 1-8 (John Wiley and Sons, 1971-1996)]; ["Beilstein Handbook of Organic Chemistry", Beilstein Institute of Organic Chemistry, Frankfurt, Germany]; [Feiser et al., "Reagents for Organic Synthesis," Volumes 1-17, Wiley Interscience]; [Trost et al., "Comprehensive Organic Synthesis," Pergamon Press, 1991]; ["Theilheimer's Synthetic Methods of Organic Chemistry," Volumes 1-45, Karger, 1991]; [March, "Advanced Organic Chemistry," Wiley Interscience, 1991]; [Laroc "Comprehensive Organic Transformations," VCH Publishers, 1989]; [Paquette, "Encyclopedia of Reagents for Organic Synthesis," John Wiley & Sons, 1995, Bodanzsky, "Principles of Peptide Synthesis," Springer Verlag, 1984]; [Bodanzsky, "Practice of Peptide Synthesis," Springer Verlag, 1984]를 참조함).
따라서, 본 발명의 화합물 및 그의 중간체의 제조에 유용한 출발 물질은 시판되고 있거나 널리 공지된 합성 방법에 의해 제조될 수 있다. 본원에 기재된 GABA-약물 접합체의 합성에 대한 다른 방법은 당업계에 기재되어 있거나, 또는 본원의 상기에 제공된 참고문헌에 의해 당업자에게 매우 명백할 것이고, 본 발명의 GABA-약물 접합체를 합성하는 데 사용될 수 있다. 따라서, 본원에 기재된 반응식에 나타낸 방법은 포괄적이라기보다는 예시적이다.
한 측면에서, 본 발명은 접합체의 제1 잔기, 예를 들어 GABA 유사체가 제1 잔기의 카르복실산 기 이외의 아미노 또는 N-말단 또는 산성 말단을 통해 제2 잔기, 예를 들어 약물에 연결된 GABA-약물 접합체를 제공한다. 일부 실시양태에서, 제1 잔기는 아미노-말단을 통해 제2 잔기에 연결된다. 다른 실시양태에서, 제1 잔기는, 이들로 한정되지는 않지만, 포스핀산 기 및 술핀산 기를 비롯한 산성 기를 통해 제2 잔기에 연결된다. 일부 예에서, GABA 유사체는, 특히 카르복실 기가 에스테르에 의해 보호되는 경우 카르복실 관능성을 갖는 감마 아미노 기의 분자내 고리화를 통해 사이클릭 아미드인 감마-락탐을 형성한다. 상기의 부산물인 락탐의 형성은 잠재적으로 생체내에서 독성을 발생시킬 수 있다. 따라서, 일부 실시양태에서, 아미노 기를 통해 2개의 잔기를 연결하는 것은 잠재적으로, 생체내 락탐의 형성을 감소시키거나 방지함으로써 부작용을 최소화할뿐만 아니라, 접합체가 합성되는 동안 부작용을 최소화할 것이다.
하기의 임의의 반응식에서, GABA 유사체의 아미노 기가 진통성 약물 또는 다른 보호 기일 수 있는 제2 잔기에 연결된 후, 카르복실산 기는 당업자에게 널리 공지되어 있는 많은 합성 방법에 의해 에스테르 또는 티오에스테르로 전환될 수 있다. 한 바람직한 실시양태에서, GABA 유사체는 커플링 시약 (예를 들어, 카르보디이미드 및 디메틸아미노피리딘)의 존재하에 알콜 또는 티올과 반응하여 에스테르를 제공할 수 있다. 또다른 바람직한 실시양태에서, GABA 유사체는 염기의 존재하에 알킬 할라이드와 반응하여 에스테르를 산출할 수 있다. GABA 유사체를 에스테르 또는 티오에스테르로 전환하는 다른 방법은 본원에 제공되는 참고문헌에 의해 당업자의 이해 범위내에 있다.
<반응식 1>
상기 반응식 1에 예시된 바와 같이, 카르복실산을 함유한 약물은 GABA 유사 유도체 (1)의 말단 아미노 기에 직접 커플링되어 부가물 (2)을 제공할 수 있다. 상기 반응을 시행하기 위한 시약은 당업자에게 널리 공지되어 있고, 상기 시약으로는, 이들로 한정되지는 않지만, 카르보디이미드, 아미늄 염, 포스포늄 염 등을 들 수 있다. 별법으로, 약물의 카르복실산의 반응은 아실 염화물을 형성함으로써 활성화될 수 있고, 염기 (예를 들어, 히드록시드, 3차 아민 등)의 존재하에 무수물에 따른 GABA 유사체 (1)는 (2)를 합성하는 데 사용될 수 있다.
<반응식 2>
반응식 2에 예시된 바와 같이, GABA 유사 유도체 (1) 및 히드록실 잔기를 함유하는 약물은, 염기의 존재하에 알콜을 포스겐, 디이미다졸 카르바메이트 또는 디-p-니트로페닐 카르보네이트와 우선 반응시키는 것에 이어서, 염기성 조건하에 GABA 유사체를 첨가하여, 카르바메이트 또는 티오카르바메이트 링커를 통해 연결될 수 있다. 별법으로, 널리 공지되어 있는, 이소시아네이트 (4) 또는 티오이소시아네이트 (5)로의 알콜의 부가반응은 또한 (3) 및 (6)을 합성하는 데 사용될 수 있다.
<반응식 3>
화학식 (8)의 GABA-약물 접합체를 합성하기 위한 하나의 방법이 반응식 3에 예시되어 있다. 클로로포르메이트는 우선 염기의 존재하에 방향족 이탈 기, 예컨대 p-니트로페놀로 처리되어 p-니트로페닐카르보네이트를 제공하고, 이는 요오드화나트륨 및 염기 (3차 아민, Cs2CO3, Ag2CO3)의 존재하에 카르복실산을 함유한 약물과 반응하여 화합물 (7)을 제공한다. 염기의 존재하에 중간체 (7)을 GABA 유사체로 처리하는 것은 화학식 (8)의 GABA-약물 접합체를 형성한다.
<반응식 4>
화학식 (10)의 GABA-약물 접합체의 합성은 반응식 4에 예시되어 있다. 클로로포르메이트는 우선 염기의 존재하에 GABA 유사체로 처리되어 중간체 (9)를 제공하고, 이는 이어서 요오드화나트륨의 존재하에 히드록실 기를 함유한 약물 및 염기와 반응하여 최종 GABA-약물 접합체 (10)을 제공한다.
<반응식 5>
화학식 (14)의 GABA-약물 접합체의 합성 방법은 반응식 5에 예시되어 있다. 히드록실 관능기를 함유한 약물은 우선 염기의 존재하에 클로로포르메이트 (또는 다른 활성 카르바메이트 또는 카르보네이트)와 반응한다. 할라이드의 상호교환은중간체 (13)을 제공하고, 이는 이산화탄소의 존재하에 염기성 조건에서 GABA 유사체와 반응하여 화학식 (14)의 최종 GABA-약물 접합체를 제공한다.
<반응식 6>
화학식 (17)의 GABA-약물 접합체의 합성 방법은 반응식 6에 예시되어 있다. 약물로부터 유래한 활성화된 클로로포르메이트 (또는 다른 활성 카르바메이트 또는 카르보네이트)는 염기의 존재하에 α-히드록시 알킬 아세테이트와 반응하여 카르보네이트를 제공한다. 그 다음, 에스테르를 제거하여 중간체 (15)를 제공한다. 화합물 (15)는 염기 및 요오드화나트륨의 존재하에 할라이드 치환된 카르보네이트와 반응하여 화합물 (16)을 형성한다. 그 다음, 화합물 (16)은 염기성 조건하에 GABA 유사체와 커플링하여 화학식 (17)의 최종 화합물을 제공한다.
<반응식 7>
화학식 (18)의 GABA-약물 접합체의 합성은 반응식 7에 예시되어 있다. 약물로부터 유래한 활성화된 클로로포르메이트 (또는 다른 활성 카르바메이트 또는 카르보네이트)는 염기성 조건 하에 α-히드록시 알킬 아세테이트와 반응한 다음, 에스테르를 제거하여 화합물 (15)를 제공한다. 그 다음, 화합물 (15) 중의 에스테르를 GABA 유사체와 커플링하여 화학식 (18)의 갖는 최종 화합물을 제공한다.
또다른 측면에서, 본 발명은 접합체의 제1 잔기 (예를 들어, GABA 유사체)가 제1 잔기의 카르복실, 즉 카르복실산 기를 통해 제2 잔기 (예를 들어, 약물)에 연결되고, 제1 잔기의 아미노, 즉 N-말단은 보호 기에 연결된, GABA-약물 접합체를 제공한다. 이러한 접합체의 구조는, 부작용 및 독성의 증가에 기여할 수 있는 락탐의 형성을 방지하거나 감소시킨다.
보호 기는 아미노 산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬 포스포르아미데이트, 또는 아실옥시카르바메이트를 포함한다.
<반응식 8>
카르복실 기를 통해 화학식 (21)의 GABA-약물 접합체를 합성하는 것은 반응식 8에 예시되어 있다. 출발 GABA 유사체는 우선 염기의 존재하에 디알킬 포스페이트 클로라이드와 반응한다. 에스테르 (19)의 탈보호 후, 유리 카르복실산 (20)은 염기성 조건 하에 클로라이드와 반응하여, 락탐 형성을 방지하도록 보호된 아미노기를 갖는 최종 약물 접합체를 제공한다.
링커
본 발명에서, 제1 잔기는 제2 잔기에 공유 결합으로 연결된다. 일부 실시양태에서, 2개의 잔기는 링커를 통해 연결된다. 본 발명에 사용될 수 있는 링커로는, 이들로 한정되지는 않지만,
을 들 수 있다.
생리학적으로 불안정한 연결은, 생리적 유체, 예컨대 혈장에서 발견되는 것과 유사한 생리학적 조건하에서 불안정한, 임의의 적합한 연결일 수 있다. 결합은 직접 결합 (예를 들어, 아미드, 에스테르, 카르보네이트, 카르바메이트, 아실옥시카르바메이트, 술포네이트 또는 술파메이트 연결)이거나, 연결 기 (예를 들어, C1-C12 디알콜, C1-C12 히드록실알칸산, C1-C12 히드록시알킬아민, C1-C12 디산, C1-C12 아미노산 또는 C1-C12 디아민)일 수 있다. 특히 바람직한 연결은, 직접적인 아미드, 에스테르, 카르보네이트, 카르바메이트 및 술파메이트 연결, 및 그의 숙신산, 살리실산, 디글리콜산, 옥사산, 옥사메틸렌 및 할라이드를 통한 연결이다. 상기 연결은 일반적으로 약 6 내지 약 8의 pH를 의미하는 생리적 조건하에서 불안정하다. 연결의 불안정성은 결합의 특정 유형, 생리적 유체의 정확한 pH 및 이온 세기, 및 생체내 가수분해 반응을 촉매화하는 경향이 있는 효소의 존재 또는 부재에 좌우된다. 일반적으로, 생체내 연결의 불안정성은, 화합물이 생리적 유체에 가용화되지 않는 경우의 연결의 안정성에 대하여 측정된다. 따라서, 본 발명에 따른 일부 화합물은 일부의 생리적 유체에서 상대적으로 안정할 수 있는 반면, 이들은 비-생리적 유체 (예를 들어, 비-수성 용매, 예컨대 아세톤)에서 니트(neat)하거나 또는 용해되는 경우와 비교하여, 생체내 (또는, 자연 발생되든지 시뮬레이션 되든지 간에 생리적 유체에 용해되는 경우에는 시험관내) 가수분해는 상대적으로 약하다. 따라서, 불안정한 연결은, 약물이 수성 용액, 특히 생리적 유체, 예컨대 혈장에 용해되는 경우에 반응물을 가수분해 생성물을 생성하도록 추진된다.
디산, 디알콜, 아미노산 등이 적합한 링커로서 상기에 기재되어 있기는 하지만, 다른 링커도 본 발명 내에 포함된다. 예를 들어, 본 발명에 따른 화합물의 가수분해 생성물은 디산을 포함할 수 있고, 결합을 만들기 위해 사용되는 실제 시약은, 예를 들어 디아실할라이드 (예컨대, 숙시닐 클로라이드) 또는 무수물 (예컨대, 숙신산 무수물 또는 디글리콜산 무수물)일 수 있다. 당업자는 다른 가능한 산, 알콜, 아미노, 술페이토 및 술파모일 유도체가 상응하는 연결을 만들기 위한 시약으로서 사용될 수 있다는 것을 알 것이다.
IV
. 본 발명의 제약 조성물
본 발명의 또다른 측면은 본 발명의 GABA-약물 공유결합 접합체 또는 다른 작용제와의 접합체의 조합물을 포함하는 제약 조성물에 대한 제제화, 투여 경로 및 유효량에 관한 것이다.
본 발명의 화합물은, 경구 (구강 및 설하를 포함함), 직장, 비강, 국소, 경피 패치, 폐, 질, 좌제, 또는 비경구 (근육내, 동맥내, 협막내, 피내, 복막내, 피하 및 정맥내) 투여에 적합한 제제를 비롯한 제약 제제로서, 또는 에어로졸화, 흡입법 또는 통기법에 의한 투여에 적합한 형태로 투여될 수 있다. 약물 전달 시스템에 대한 일반적인 정보는 문헌[Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems (Lippencott Williams & Wilkins, Baltimore Md. (1999)]에서 찾아볼 수 있다.
다양한 실시양태에서, 제약 조성물은 담체 및 부형제 (이들로 한정되지는 않지만, 완충제, 탄수화물, 만니톨, 폴리펩티드 또는 아미노산, 예컨대 글리신, 항산화제, 세균 발육 저지제, 킬레이트제, 현탁화제, 증점제 및/또는 보존제를 포함함), 물, 오일 (이들로 한정되지는 않지만, 석유, 동물성, 식물성 또는 합성 기원의 오일, 예컨대 땅콩유, 대두유, 광유, 참깨유 등을 포함함), 염수 용액, 수성 덱스트로스 및 글리세롤 용액, 방향제, 착색제, 점착방지제 및 다른 허용되는 첨가제, 보조제 또는 결합제, 생리학적 조건과 근사하게 하기 위해 요구되는 바와 같은 제약상 허용되는 다른 보조 물질, 예컨대 pH 완충제, 삼투성 조절제, 유화제, 습윤제 등을 포함할 수 있다. 부형제의 예로는, 이들로 한정되지는 않지만, 전분, 글루코스, 락토스, 수크로스, 젤라틴, 맥아, 쌀, 밀가루, 백악, 실리카 겔, 나트륨 스테아레이트, 글리세롤 모노스테아레이트, 활석, 염화나트륨, 건조된 탈지유, 글리세롤, 프로필렌, 글리콜, 물, 에탄올 등을 들 수 있다. 일부 실시양태에서, 제약 제제는 실질적으로는 보존제가 없다. 다른 실시양태에서, 제약 제제는 하나 이상의 보존제를 함유할 수 있다. 제약 투여 형태에 대한 일반적인 방법론은 문헌 [Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems (Lippencott Williams & Wilkins, Baltimore Md. (1999)]에서 찾아볼 수 있다. 보통의 기술을 가진 자에게 공지되어 있는 임의의 적합한 담체가 본 발명의 조성물의 투여에 사용될 수 있으며, 담체의 유형은 투여 방식에 따라 달라질 것이라는 것을 알 것이다.
또한, 화합물은 널리 공지되어 있는 기술을 이용하여 리포좀내에서 캡슐화될 수 있다. 생분해성 미립구는 또한 본 발명의 제약 조성물에 대한 담체로서 사용될 수 있다. 적합한 생분해성 미립구는, 예를 들어 미국 특허 번호 4,897,268; 5,075,109; 5,928,647; 5,811,128; 5,820,883; 5,853,763; 5,814,344 및 5,942,252에 개시되어 있다.
화합물은 리포좀 또는 미립구 (또는 미립자)로 투여될 수 있다. 환자에게 투여하기 위한 리포좀 및 미립구를 제조하는 방법은 당업자에게 널리 공지되어 있다. 미국 특허 번호 4,789,734 (이 거명에 의해 그 내용이 본원에 포함됨)는 리포좀에서 생물학적 물질을 캡슐화하는 방법을 기재한다. 본질적으로, 물질은 수용액 중에 용해되고, 요구되는 경우 계면활성제와 함께 적절한 인지질 및 지질이 첨가되고, 필요한 경우 물질은 투석되거나 초음파 처리된다. 공지된 방법에 대한 검토는 문헌 [G. Gregoriadis, Chapter 14, "Liposoms," Drug Carriers in Biology and Medicine, pp. 2.sup.87-341 (Academic Press, 1979)]에 의해 제공된다.
중합체 또는 단백질의 형성된 미립구는 당업자에게 널리 공지되어 있고, 위장관을 통과하여 바로 혈류로 가도록 맞춤 제조될 수 있다. 별법으로, 수일 내지 수개월 범위의 기간에 걸친 지효성을 위해 상기 화합물이 포함될 수 있고, 미립구 또는 미립구의 합성물이 피하주입될 수 있다. 예를 들어, 미국 특허 번호 4,906,474, 4,925,673 및 3,625,214, 및 문헌 [Jein, TIPS 19:155-157 (1998)]을 참고하고, 이들은 이 거명에 의해 그 내용이 본원에 포함된다.
당업계에 널리 공지되어 있는 바와 같이, 약물의 농도는 조절될 수 있고, 완충 용액의 pH 및 등장성은 정맥내 주사와 융화되도록 조절될 수 있다.
본 발명의 화합물은, 당업계에 널리 공지되어 있는 적합한 비히클의 형태로 멸균 용액 또는 현탁액으로서 제제화될 수 있다. 제약 조성물은 통상의 널리 공지되어 있는 멸균 기법에 의해 멸균화되거나 멸균 여과될 수 있다. 생성된 수용액은 그 자체로 사용될 수 있도록 포장되거나 동결건조될 수 있고, 동결 건조된 제제는 멸균 용액과 조합하여 투여된다. 적합한 제제 및 부가적 담체는 문헌 [Remington "The Science and Practice of Pharmacy" (20th Ed., Lippincott Williams & Wilkins, Baltimore MD)]에 기재되어 있으며, 이는 이 거명에 의해 그의 전문이 본원에 포함되는 것을 나타낸다.
작용제 또는 그의 제약상 허용되는 염은 단독으로, 또는 하나 이상의 다른 작용제 또는 하나 이상의 다른 형태와 조합하여 제공될 수 있다. 예를 들어, 제제는 각각의 작용제의 상대적 효능 및 의도되는 징후에 따라, 특정 비율로 하나 이상의 작용제를 포함할 수 있다. 예를 들어, 효능이 유사한 2종의 상이한 숙주 표적을 표적화하기 위한 조성물에서, 약 1:1 비의 작용제가 사용될 수 있다. 상기의 2개의 형태는 동일한 투여 단위, 예를 들어 하나의 크림, 좌제, 정제, 캡슐, 에어로졸 스프레이, 또는 분말 패킷으로 함께 제제화되어 음료에 용해될 수 있거나, 또는 각각의 형태는 개별 단위, 예를 들어 2종의 크림, 2종의 좌제, 2종의 정제, 2종의 캡슐, 1종의 정제 및 정제를 용해시키기 위한 1종의 액체, 2종의 에어로졸 스프레이, 또는 1종의 분말 패킷 및 분말을 용해시키기 위한 1종의 액체 등으로 제제화될 수 있다.
전형적인 제약상 허용되는 염으로는 무기 이온, 예컨대 나트륨, 칼륨, 칼슘, 마그네슘 이온 등의 염이 있다. 이러한 염으로는 무기 또는 유기산, 예컨대 염산, 브롬화수소산, 인산, 질산, 황산, 메탄술폰산, p-톨루엔술폰산, 아세트산, 푸마르산, 숙신산, 락트산, 만델산, 말산, 시트르산, 타르타르산 또는 말레산과의 염을 들 수 있다. 또한, 작용제가 카르복시 기 또는 다른 산성 기를 포함하는 경우, 이는 무기 또는 유기 염기와의 제약상 허용되는 부가염으로 전환될 수 있다. 적합한 염기로의 예로는, 이들로 한정되지는 않지만, 수산화나트륨, 수산화칼륨, 암모니아, 시클로헥실아민, 디시클로헥실-아민, 에탄올아민, 디에탄올아민, 트리에탄올아민 등을 들 수 있다.
제약상 허용되는 에스테르 또는 아미드로는, 이들로 한정되지는 않지만, 에틸, 메틸, 이소부틸, 에틸렌 글리콜 등을 들 수 있다. 전형적인 아미드로는, 이들로 한정되지는 않지만, 비치환된 아미드, 알킬 아미드, 디알킬 아미드 등을 들 수 있다.
필요하거나 바람직한 경우, 접합체 및/또는 접합체의 조합물은 다른 작용제와 함께 투여될 수 있다. 본 발명의 접합체 및/또는 접합체의 조합물과 함께 병용-투여될 수 있는 작용제에 대한 선택은, 적어도 부분적으로는 치료될 병태에 따라 좌우될 수 있다. 본 발명의 제제에 특정하게 사용되는 작용제로는, 이로 한정되지는 않지만, 예를 들어 통증에 대한 치료 효과를 갖는 임의의 작용제를 들 수 있고, 이는 (이들로 한정되지는 않지만, 예를 들어 염증성 병태, 우울증, 정신분열증, 불면증 및 불안증의 치료에 사용되는 약물을 포함한다.
작용제 (또는 그의 제약상 허용되는 염, 에스테르 또는 아미드)는 그 자체로, 또는 활성제가 하나 이상의 제약상 허용되는 담체와의 혼화물 또는 혼합물로 존재하는 제약 조성물의 형태로 투여될 수 있다. 본원에서 사용되는 제약 조성물은 대상체에게 투여하기 위해 제조된 임의의 조성물일 수 있다. 본 발명에 따라 사용하기 위한 제약 조성물은, 부형제, 희석제, 및/또는 예를 들어, 투여될 수 있는 제제로 활성제를 가공하는 것을 촉진하는 보조제를 포함하는, 하나 이상의 생리학상 허용되는 담체를 사용하는 통상의 방법으로 제제화될 수 있다. 적당한 제제는, 적어도 부분적으로는, 선택된 투여 경로에 따라 좌우될 수 있다. 본 발명에 유용한 작용제, 또는 그의 제약상 허용되는 염, 에스테르 또는 아미드는, 이들로 한정되지는 않지만, 경구, 구강, 국소, 직장, 경피, 점막, 피하, 정맥내 및 근육내 적용을 비롯한 수많은 경로 또는 투여 방식의 사용뿐만 아니라 흡입에 의해 환자에게 전달될 수 있다.
본 발명의 바람직한 조성물은 구강 전달용, 특히 서방성 경구 투여용으로 제제화된다. 경구 투여용으로, GABA-약물 접합체는 활성 GABA-약물 접합체를 당업계에 널리 공지되어 있는 제약상 허용되는 담체와 혼합하여 쉽게 제제화될 수 있다. 이러한 담체는, 본 발명의 GABA-약물 접합체가 치료될 환자에 의한 경구 섭취용으로, 이들로 한정되지는 않지만, 저작가능한 정제, 환제, 당제, 캡슐, 로젠지, 경질의 캔디, 액체, 젤, 시럽, 슬러리, 분말, 현탁액, 엘릭시르, 웨이퍼 등을 비롯한 정제로서 제제화될 수 있도록 한다. 이러한 제제는, 이들로 한정되지는 않지만, 고체 희석제 또는 충전재, 멸균 수성 매질 및 다양한 비독성 유기 용매를 비롯한 제약상 허용되는 담체를 포함할 수 있다. 고체 담체는, 희석제, 방향제, 가용화제, 윤활제, 현탁화제, 결합제, 보존제, 정제 붕해제 또는 캡슐화 물질로도 작용할 수 있는 하나 이상의 물질일 수 있다. 분말에서, 담체는 일반적으로, 미세 분할된 활성 성분과의 갖는 혼합물인 미세 분할된 고체이다. 정제에서, 활성 성분은 일반적으로, 적합한 비율로 필요한 결합 용량을 갖는 담체와 혼합되고, 원하는 형태 및 크기로 압착된다. 분말 및 정제는 바람직하게는 약 1 내지 약 70 퍼센트의 활성 화합물을 함유한다. 적합한 담체로는, 이들로 한정되지는 않지만, 마그네슘 카르보네이트, 마그네슘 스테아레이트, 활석, 당, 락토스, 펙틴, 덱스트린, 전분, 젤라틴, 트래거캔스, 메틸셀룰로스, 나트륨 카르복시메틸셀룰로스, 저용융 왁스, 코코아 버터 등을 들 수 있다. 일반적으로, 본 발명의 작용제는 원하는 투여 단위를 제공하기에 충분한 양인, 경구 투여 형태의 총 조성물의 약 0.5 중량%, 약 5 중량%, 약 10 중량%, 약 20 중량%, 또는 약 30 중량% 내지 약 50 중량%, 약 60 중량%, 약 70 중량%, 약 80 중량% 또는 약 90 중량% 범위의 농도 수준으로 포함될 것이다. 게다가, 정제 또는 환제 형태에서, 조성물은 위장 관에서의 분해 및 흡수를 지연시키기 위해 코팅될 수 있으며, 이에 따라 연장된 기간에 걸쳐 서방성 작용을 제공할 수 있다. 또한, 삼투적 활성을 추진하는 화합물을 둘러싸고 있는, 선택적으로 투과성인 막은 본 발명의 화합물 및 조성물의 경구 투여용으로 적합하다. 이러한 후자의 플랫폼에서, 캡슐을 둘러싸고 있는 환경으로부터의 유체는 추진 화합물에 의해 흡수되고, 이는 팽창하여 구멍을 통해 작용제 또는 작용제 조성물의 위치를 변화시킨다. 이러한 전달 플랫폼은 속방성 제제의 스파이크 프로파일에 반대되는, 본질적으로 0차인 전달 프로파일을 제공할 수 있다. 또한 시간 지연 물질, 예컨대 글리세롤 모노스테아레이트 또는 글리세롤 스테아레이트가 사용될 수 있다.
경구용 수성 현탁액은, 제약상 허용되는 부형제, 예컨대 현탁화제 (예를 들어, 메틸 셀룰로스), 습윤제 (예를 들어, 레시틴, 리소레시틴 및/또는 장쇄 지방 알콜) 뿐만 아니라 착색제, 보존제, 방향제 등과 함께 본 발명의 접합체를 함유할 수 있다. 적합한 담체, 부형제 또는 희석제로는, 이들로 한정되지는 않지만, 물, 염수, 알킬렌글리콜 (예를 들어, 프로필렌 글리콜), 폴리알킬렌 글리콜 (예를 들어, 폴리에틸렌 글리콜) 오일, 알콜, pH 4와 pH 6 사이의 약산성인 완충제 (예를 들어, 약 5 mM 내지 약 50 mM의 아세테이트, 시트레이트, 아스코르베이트) 등을 들 수 있다. 부가적으로, 방항제, 보존제, 착색제, 담즙 염, 아실카르니틴 등이 첨가될 수 있다.
일부 실시양태에서, 유성 또는 비-수성 용매는, 예를 들어 대형 친유성 잔기의 존재에 기인하여, 작용제를 용액으로 들어오게 하기 위해서 요구될 수 있다. 별법으로, 에멀젼, 현탁액 또는 다른 제제, 예를 들어 리포좀 제제가 사용될 수 있다. 리포좀 제제에 관하여, 소정의 병태를 치료하기 위한 리포좀을 제조하는, 임의의 공지되어 있는 방법이 사용될 수 있다. 예를 들어, 문헌 [Bangham et al., J. Mol. Biol. 23: 238-252 (1965)] 및 [Szoka et al., Proc. Natl Acad. Sci. USA 75: 4194-4198 (1978)]을 참고하며, 이들은 이 거명에 의해 본원에 포함된다. 리간드는 또한 리포좀에 부착되어 이러한 조성물을 특정 작용 부위로 향하게 할 수 있다. 또한, 본 발명의 GABA-약물 접합체는 식품, 예를 들어 크림 치즈, 버터, 샐러드 드레싱 또는 아이스크림에 포함되어, 임의의 환자 집단에서 가용화, 투여 및/또는 순응도를 촉진할 수 있다.
경구용 제약 제제는, 임의로, 생성된 혼합물을 분쇄하고, 과립 혼합물을 가공하여 고형 부형제로서 수득될 수 있고, 원하는 경우, 적합한 보조제를 첨가한 후 정제 또는 당제 코어를 수득할 수 있다. 적합한 부형제로는, 특히 충전재, 예컨대 이들로 한정되지는 않지만, 락토스, 수크로스, 만니톨 또는 소르비톨을 비롯한 당; 방향성 요소, 셀룰로스 제제, 예를 들어 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 검 트래거캔스, 메틸 셀룰로스, 히드록시프로필메틸-셀룰로스, 나트륨 카르복시메틸셀룰로스 및/또는 폴리비닐 피롤리돈 (PVP)을 들 수 있다. 원하는 경우, 붕해제, 예컨대 가교결합된 폴리비닐 피롤리돈, 한천, 또는 알긴산 또는 그의 염, 예컨대 나트륨 알기네이트가 첨가될 수 있다. GABA-약물 접합체는 또한 서방성 제제로서 제제화될 수 있다.
당제 코어는 적합한 코팅으로 제공될 수 있다. 이러한 목적으로 농축된 당 용액이 사용될 수 있고, 이는 임의로 아라비아 검, 활석, 폴리비닐 피롤리돈, 카르보폴 겔, 폴리에틸렌 글리콜, 및/또는 티타늄 디옥시드, 래커 용액, 및 적합한 유기 용매 또는 용매 혼합물을 함유할 수 있다. 염료 또는 안료는 활성 GABA-약물 접합체의 상이한 조합물을 확인 또는 특징화하기 위해 정제 또는 당제 코팅에 첨가될 수 있다.
경구적으로 사용될 수 있는 제약 제제로는, 젤라틴으로 만들어진 푸쉬-핏 (push-fit) 캡슐뿐만 아니라 젤라틴 및 가소제, 예컨대 글리세롤 또는 소르비톨로 만들어진 연질의 밀봉된 캡슐을 들 수 있다. 푸쉬-핏 캡슐은 충전재 (예컨대, 락토스), 결합제 (예컨대, 전분), 및/또는 윤활제 (예컨대, 활석 또는 마그네슘 스테아레이트) 및 임의로 안정화제와의 혼합물에 활성 성분을 함유할 수 있다. 연질의 캡슐에서, 활성제는 적합한 액체, 예컨대 지방성 오일, 액체 파라핀 또는 액체 폴리에틸렌 글리콜 중에 용해 또는 현탁될 수 있다. 또한, 안정화제가 첨가될 수 있다. 경구 투여용의 모든 제제는 투여에 적합한 투여량을 가져야 한다.
경구 투여용으로 적합한 다른 형태로는, 이들로 한정되지는 않지만 에멀젼, 시럽, 엘릭시르, 수용액, 수성 현탁액을 비롯한 액체 형태 제제, 또는 액체 형태 제제로 사용하기 진전에 전환되도록 의도되는 고체 형태 제제를 들 수 있다. 에멀젼은 용액, 예를 들어, 수성 프로필렌 글리콜 용액 중에서 제조될 수 있거나, 또는 유화제, 예를 들어 레시틴, 소르비탄 모노올레에이트 또는 아카시아를 함유할 수 있다. 수용액은 물에 활성 성분을 용해시키고 적합한 착색제, 향미제, 안정화제 및 증점제를 첨가함으로써 제조될 수 있다. 수성 현탁액은 미세 분할된 활성 성분을 점성 물질, 예컨대 천연 또는 합성 검, 수지, 메틸셀룰로스, 나트륨 카르복시메틸셀룰로스 및 널리 공지되어 있는 다른 현탁화제와 함께 물 중에 분산시킴으로써 제조될 수 있다. 조성물과 함께 투여될 수 있는 적합한 충전재 또는 담체로는, 이들로 한정되지는 않지만, 한천, 알콜, 지방, 락토스, 전분, 셀룰로스 유도체, 다당류, 폴리비닐피롤리돈, 실리카, 멸균 염수 등, 또는 적합한 양으로 사용되는 이들의 혼합물을 들 수 있다. 고체 형태 제제로는 용액, 현탁액 및 에멀젼을 들 수 있고, 고체 형태 제제는 활성 성분, 착색제, 향미제, 안정화제, 완충제, 인공 및 천연 감미제, 분산제, 증점제, 가용화제 등을 또한 함유할 수 있다.
시럽 또는 현탁액은 활성 화합물을 농축된 당 (예를 들어, 수크로스) 수용액에 첨가함으로써 제조되고, 이에는 임의의 보조적 성분이 또한 첨가될 수 있다. 이러한 보조적 성분으로는, 당의 결정화를 지연시키는 향미제 또는 임의의 다른 성분, 예를 들어 폴리히드릭 알콜 (예컨대, 글리세롤 또는 소르비톨)의 용해도를 증가시키는 작용제를 들 수 있다.
본 발명의 화합물을 경구 투여용으로 제제화하는 경우에, 위장체류성 제제를 이용하여 위장 (GI) 관으로부터의 흡수를 향상시키는 것이 바람직할 수 있다
수시간 동안 위에서 머무르는 제제는 본 발명의 화합물을 서서히 방출시키고, 본 발명의 일부 실시양태에서 바람직할 수 있는 서방성을 제공한다. 이러한 위장-체류성 제제의 개시는 문헌 [Klausner, E.A.; Lavy, E.; Barta, M.; Cserepes, E.; Friedman, M.; Hoffman, A. 2003 "Novel gastroretentive dosage forms: evaluation of gastroretentivity and its effect on levodopa in humans." Pharm. Res. 20, 1466-73], [Hoffman, A.; Stepensky, D.; Lavy, E.; Eyal, S. Klausner, E.; Friedman, M. 2004 "Pharmacokinetic and Pharmacodynamic aspects of gastroretentive dosage forms" Int. J. Pharm. 11, 141-53], [Streubel, [A.; Siepmann, J.; Bodmeier, R.; 2006 "Gastroretentive drug delivery systems" Expert Opin. Drug Deliver. 3, 217-3], and [Chavanpatil, M.D.; Jain, P.; Chaudhari, S.; Shear, R.; Vavia, P.R. "Novel sustained release, swellable and bioadhesive gastroretentive drug delivery system for olfoxacin" Int. J. Pharm. 2006 epub March 24]에서 발견된다. 확장성, 유리성 및 생접착성 기법은 본 발명의 화합물의 흡수를 최대화하기 위해 이용될 수 있다.
본 발명의 화합물은 (예를 들어, 주사, 예컨대 일시 주사 또는 연속 주입에 의한) 비경구 투여용으로 제제화될 수 있고, 앰플, 예비-충전된 실린지, 작은 부피의 주입물의 단위 투여 형태로 존재하거나, 또는 첨가된 보존제와 함께 다-용량 용기 내에 단위 투여 형태로 존재할 수 있다. 조성물은 유성 또는 수성 비히클에서의 현탁액, 용액 또는 에멀젼과 같은 형태, 예를 들어 수성 폴리에틸렌 글리콜에서의 용액의 형태를 가질 수 있다.
주사가능한 제제로는, 비히클이 수용액 또는 오일 현탁액, 또는 참깨유, 옥수수유, 면실유, 또는 땅콩유를 갖는 에멀젼뿐만 아니라 엘릭시르, 만니톨, 덱스트로스 또는 멸균 수용액을 비롯한, 당업자에게 적합한 것으로 공지된 것, 및 유사한 제약 비히클로부터 선택될 수 있다. 제제는 또한 생체적합성, 생분해성인 중합체 조성물, 예컨대 폴리(락트-코(co)-글리콜)산을 포함한다. 이러한 물질은 미립구 또는 나노구로 제조되어 약물과 함께 로딩되고, 추가로 코팅되거나 유도체화되어 우수한 서방성 성능을 제공할 수 있다. 안와부 또는 안내 주사용으로 적합한 비히클로는, 예를 들어 주사용수에서의 치료제의 현탁액, 리포좀 및 친유성 물질에 적합한 비히클을 들 수 있다. 안와부 또는 안내 주사용의 다른 비히클은 당업계에 널리 공지되어 있다.
바람직한 실시양태에서, 조성물은 인간으로의 정맥내 투여용으로 적응시킨 제약 조성물과 같은 일반적인 절차에 따라 제제화된다. 전형적으로, 정맥내 투여용 조성물은 멸균 등장성의 수성 완충제 중의 용액이다. 필요한 경우, 조성물은 또한 가용화제 및 국부 마취제, 예컨대 주사 부위의 통증을 완화하는 리도카인을 포함할 수 있다. 일반적으로, 성분은 완전히 밀봉된 용기 (예컨대, 활성제의 양을 나타내는 앰플 또는 사쉐(sachette))에서, 예를 들어 동결건조된 분말 또는 물이 없는 농축액으로서 단위 투여 형태로 개별적으로 또는 함께 혼합되어 공급된다. 조성물이 주입에 의해 투여되는 경우, 이는 멸균 제약용수 또는 염수를 함유한 주입 병에 의해 분배될 수 있다. 조성물이 주사에 의해 투여되는 경우, 주사용 멸균수 또는 염수의 앰플은 투여 전에 성분들이 혼합될 수 있도록 제공된다.
활성 화합물이 주사에 의해 투여되는 경우, 이는 수용액, 특히 생리학적으로 융화성인 완충제, 예컨대 행크스(Hanks) 용액, 링거(Ringer) 용액, 또는 생리학상 염수 완충제에서 제제화될 수 있다. 용액은 제제화 작용제, 예컨대 현탁화제, 완정화제 및/또는 분산제를 함유할 수 있다. 별법으로, 활성 화합물은 적합한 비히클, 예를 들어 발열원이 없는 멸균수와의 구성을 위해, 사용 전에는 분말 형태일 수 있다. 일부 실시양태에서, 제약 조성물은 GABA-약물 접합체에 의해 자극되는 면역 반응을 향상시키기 위해 첨가되는 보조 물질 또는 임의의 다른 물질을 포함하지 않는다. 일부 실시양태에서, 제약 조성물은 GABA-약물 접합체에 대한 면역 반응을 억제하는 물질을 포함한다. 제제화 방법은, 예를 들어 문헌 [Remington's Pharmaceutical Sciences, latest edition, Mack Publishing Co., Easton P]에 개시된 바와 같이 당업계에 공지되어 있다.
이전에 기재된 제제 이외에, 작용제는 또한 데포(depot) 제제로서 제제화될 수 있다. 장기간 작용하는 상기 제제는, 피하주입 또는 경피성 전달 (예를 들어, 피하 또는 근육내), 근육내 주사 또는 경피 패치의 사용에 의하여 투여될 수 있다. 따라서, 예를 들어 GABA-약물 접합체는, (예를 들어, 허용되는 오일 중의 에멀젼으로서의) 적합한 중합체 또는 소수성 물질, 또는 이온 교환 수지와 함께 제제화되거나 또는 난용성 유도체, 예를 들어 난용성 염으로서 제제화될 수 있다.
일부 실시양태에서, 본 발명의 하나 이상의 GABA-약물 접합체를 포함하는 제약 조성물은, 국소 투여되거나 통증의 근접한 특정 부위에 주사되는 경우, 국부성 및 국지성 효과를 나타낸다. 예를 들어, 점성 액체, 용액, 현탁액, 디메틸술폭시드 (DMSO)-계 용액, 리포좀 제제, 겔, 젤리, 크림, 로션, 연고, 좌제, 발포체 또는 에어로졸 스프레이의 직접적인 국소 도포는 국부 투여용으로 사용되어, 예를 들어 국부성 및/또는 국지성 효과를 산출할 수 있다. 이러한 제제에 대해 제약상 적절한 비히클로는, 예를 들어 저급 지방족 알콜, 폴리글리콜 (예를 들어, 글리세롤 또는 폴리에틸렌 글리콜), 지방산 에스테르, 오일, 지방, 실리콘 등을 들 수 있다. 이러한 제제로는 또한, 보존제 (예를 들어, p-히드록시벤조산 에스테르) 및/또는 항산화제 (예를 들어, 아스코르브산 및 토코페롤)를 들 수 있다. 또한, 문헌 [Dermatological Formulations: Percutaneous absorption, Barry (Ed.), Marcel Dekker Incl, 1983]을 참조한다. 일부 실시양태에서, 효소 억제제를 포함하는 국부성/국소성 제제는 표피 또는 점막의 바이러스성 감염 치료에 사용된다.
본 발명의 제약 조성물은 화장품용으로 또는 피부과적으로 허용되는 담체를 함유할 수 있다. 이러한 담체는 피부, 손발톱, 점막, 조직 및/또는 모발과 융화성이고, 이러한 요구사항을 충족시키는, 통상적으로 사용되는 임의의 화장품용 또는 피부과적 담체를 포함할 수 있다. 보통의 기술을 가진 자들도 이러한 담체를 쉽게 선택할 수 있다. 피부 연고의 제제화시, 본 발명의 작용제 또는 작용제의 조합물은 유성의 탄화수소 염기, 무수성 흡수 염기, 유중수 흡수 염기, 수중유, 물-제거성 염기 및/또는 수용성 염기에서 제제화될 수 있다. 이러한 담체 및 부형제의 예로는, 이들로 한정되지는 않지만, 습윤제 (예를 들어, 우레아), 글리콜 (예를 들어, 프로필렌 글리콜), 알콜 (예를 들어, 에탄올), 지방산 (예를 들어, 올레산), 계면활성제 (예를 들어, 이소프로필 미리스테이트 및 나트륨 라우릴 술페이트), 피롤리돈, 글리세롤 모노라우레이트, 술폭시드, 테르펜 (예를 들어, 멘톨), 아민, 아미드, 알칸, 알칸올, 물, 탄산칼슘, 칼슘 포스페이트, 다양한 당, 전분, 셀룰로스 유도체, 젤라틴 및 중합체 (예컨대, 폴리에틸렌 글리콜)를 들 수 있다.
연고 및 크림은 예를 들어, 적합한 증점제 및/또는 겔화제를 첨가하여 수성 또는 유성 염기와 함께 제제화될 수 있다. 로션은 수성 또는 유성 염기와 함께 제제화될 수 있고, 일반적으로 하나 이상의 유화제, 안정화제, 분산제, 현탁화제, 증점제 또는 착색제를 또한 함유할 것이다. 제약 활성제의 전달을 위한 경피 패치의 구성 및 용도는 당업계에 널리 공지되어 있다. 예를 들어, 미국 특허 번호 5,023,252, 4,992,445 및 5,001,139를 참고한다. 이러한 패치는 연속성, 박동성으로 구성되거나, 또는 제약 작용제의 수요 전달에 따라 구성될 수 있다.
본 발명의 제약 조성물 및 투여 형태의 형성에 사용될 수 있는 윤활제로는, 이들로 한정되지는 않지만, 칼슘 스테아레이트, 마그네슘 스테아레이트, 광유, 경광유, 글리세린, 소르비톨, 만니톨, 폴리에틸렌 글리콜, 다른 글리콜, 스테아르산, 나트륨 라우릴 술페이트, 활석, 수소화 식물성 오일 (예를 들어, 땅콩유, 면실유, 해바라기씨유, 참깨유, 올리브유, 옥수수유 및 대두유), 아연 스테아레이트, 에틸 올레에이트, 에틸 라우레이트, 한천 또는 이들의 혼합물을 들 수 있다. 추가적인 윤활제로는, 예를 들어 실로이드 실리카 겔, 합성 실리카의 응집 에어로졸 또는 이들의 혼합물을 들 수 있다. 윤활제는 제약 조성물의 약 1 중량% 미만의 양으로 임의로 첨가될 수 있다.
본 발명에 따른 조성물은, 이들로 한정되지는 않지만 수성, 수성-알콜성 또는 유성 용액, 로션 또는 혈청 분산액, 수성, 무수성 또는 유성 겔, 수성 상 중에 지방 상을 분산시켜 수득한 에멀젼 (O/W 또는 수중유) 또는 반대로 수득한 것 (W/O 또는 유중수), 미세에멀젼 또는 별법으로 미세캡슐, 미립자 또는 이온성 및/또는 비이온성 유형의 지질 비히클 분산액을 비롯한, 국소 도포에 적합한 임의의 형태일 수 있다. 이러한 조성물은 통상의 방법에 따라 제조될 수 있다. 본 발명의 작용제 이외에, 본 발명에 따른 조성물의 다양한 구성물의 양은 당업계에서 통상적으로 사용되는 양이다. 이러한 조성물은 특히 안면, 손 및 신체용, 및/또는 점막용, 또는 피부 클렌징용 보호, 치료 또는 케어 크림, 유제, 로션, 겔 또는 발포체를 구성한다. 조성물은 또한 비누 또는 클렌징 바를 구성하는 고형 제제로 이루어질 수 있다.
본 발명의 조성물은 또한 화장품 및 피부과학 분야에서 흔한 보조제, 예컨대 친수성 또는 친유성 겔화제, 친수성 또는 친유성 활성제, 보존제, 항산화제, 용매, 방향제, 충전재, 선스크린제, 냄새-흡수제 및 염료제를 함유할 수 있다. 이러한 다양한 보조제의 양은 당업계에서 통상적으로 사용되는 양이고, 예를 들어 조성물의 총 중량의 약 0.01 중량% 내지 약 20 중량%이다. 이들의 성질에 따라, 상기 보조제는 지방 상, 수성 상 및/또는 지질 비히클에 도입될 수 있다.
일부 실시양태에서, 눈과 관련된 통증은 본 발명의 활성제 또는 활성제의 조합물을 포함하는 점안제, 현탁액, 연고, 또는 삽입물을 이용하여 효과적으로 치료될 수 있다. 안약은 활성 성분을 멸균 수용액, 예컨대 생리학상 염수, 완충 용액 등에 용해함으로써, 또는 용해될 분말 조성물을 사용 전에 조합함으로써 제조될 수 있다. 이들로 한정되지는 않지만, 평형 염 용액, 염수 용액, 수용성 폴리에테르, 예컨대 폴리에틸렌 글리콜, 폴리비닐, 예컨대 폴리비닐 알콜 및 포비돈, 셀룰로스 유도체, 예컨대 메틸셀룰로스 및 히드록시프로필 메틸셀룰로스, 석유 유도체, 예컨대 광유 및 백색 바셀린, 동물성 지방, 예컨대 라놀린, 아크릴산의 중합체, 예컨대 카르복시폴리메틸렌 겔, 식물성 지방, 예컨대 땅콩유 및 다당류, 예컨대 덱스트란, 및 글리코스아미노글리칸, 예컨대 히알루론산나트륨을 비롯한 다른 비히클은 당업계에 공지된 바와 같이 선택될 수 있다. 원하는 경우, 안약에 보통 사용되는 첨가제가 첨가될 수 있다. 이러한 첨가제로는, 이들로 한정되지는 않지만, 등장성화제 (예를 들어, 염화나트륨 등), 완충제 (예를 들어, 보론산, 나트륨 모노수소 포스페이트, 나트륨 디수소 포스페이트 등), 보존제 (예를 들어, 벤잘코늄 클로라이드, 벤제토늄 클로라이드, 클로로부탄올 등), 증점제 (예를 들어, 당류, 예컨대 락토스, 만니톨, 말토스 등; 예를 들어, 히알루론산 또는 그의 염, 예컨대 히알루론산나트륨, 히알루론산칼륨 등; 예를 들어, 뮤코다당류, 예컨대 콘드로이틴 술페이트 등; 예를 들어, 나트륨 폴리아크릴레이트, 카르복시비닐 중합체, 가교결합된 폴리아크릴레이트, 폴리비닐 알콜, 폴리비닐 피롤리돈, 메틸 셀룰로스, 히드록시 프로필 메틸셀룰로스, 히드록시에틸 셀룰로스, 카르복시메틸 셀룰로스, 히드록시 프로필 셀룰로스 또는 당업자에게 공지되어 있는 다른 작용제)를 들 수 있다.
본 발명의 조성물 성분의 용해도는 조성물에서 계면활성제 또는 다른 적절한 공-용매에 의해 향상될 수 있다. 이러한 공용매로는, 이들로 한정되지는 않지만, 폴리소르베이트 20, 60 및 80, 플루로닉 F68, F-84 및 P-103, 시클로덱스트린, 또는 당업자에게 공지되어 있는 다른 작용제를 들 수 있다. 이러한 공-용매는 약 0.01 중량 % 내지 2 중량%의 수준으로 사용될 수 있다.
본 발명의 조성물은 다용량 형태로 포장될 수 있다. 보존제는, 이가 사용되는 동안 미생물성 오염을 방지하기에 바람직하다. 적합한 보존제로는, 이들로 한정되지는 않지만, 벤잘코늄 클로라이드, 티메로살, 클로로부탄올, 메틸 파라벤, 프로필 파라벤, 페닐에틸 알콜, 에데테이트 디나트륨, 소브르산, 오나머 엠(Onamer M), 또는 당업자에게 공지되어 있는 다른 작용제를 들 수 있다. 점안 생성물에 관한 선행 기술에서, 이러한 보존제는 0.004 % 내지 0.02 %의 수준으로 사용될 수 있다. 본 출원의 조성물에서, 보존제, 바람직하게는 벤잘코늄 클로라이드는 0.001 중량% 내지 0.01 중량% 미만, 예를 들어 0.001 중량% 내지 0.008 중량%, 바람직하게는 약 0.005 중량%의 수준으로 사용될 수 있다. 0.005 % 농도의 벤잘코늄 클로라이드가 미생물성 발작으로부터 본 발명의 조성물을 충분히 보존할 수 있는 것으로 밝혀졌다.
일부 실시양태에서, 귀와 연관된 통증은 본 발명의 GABA-약물 접합체 또는 GABA-약물 접합체의 조합물을 포함하는 점이액, 현탁액, 연고 또는 삽입물을 이용하여 효과적으로 치료될 수 있다.
일부 실시양태에서, 본 발명의 GABA-약물 접합체는 현탁액 형태보다는 가용성 상태로 전달되어, 작용 부위로 보다 신속하게 그리고 정량적으로 흡수된다. 일반적으로, 젤리, 크림, 로션, 좌제 및 연고와 같은 제제는, 본 발명의 작용제에 보다 넓게 노출된 영역을 제공하는 반면, 용액 중의 제제, 예를 들어 스프레이는 보다 신속한 단기 노출을 제공한다.
국소적/국부적 도포와 관련된 일부 실시양태에서, 제약 조성물은 하나 이상의 침투 인핸서를 포함할 수 있다. 예를 들어, 제제는, 투과성 장벽 (예를 들어, 피부)으로 본 발명의 GABA-약물 접합체 또는 GABA-약물 접합체 조합물의 침투를 증가시키거나, 이들의 전달을 보조하는 적합한 고체 또는 겔 상 담체 또는 부형제를 포함할 수 있다. 이러한 다수의 침투-향상 화합물은 국소 제제 당업계에 공지되어 있고, 이들로는, 예를 들어 물, 알콜 (예를 들어, 메탄올, 에탄올, 2-프로판올과 같은 테레펜), 술폭시드 (예를 들어, 디메틸 술폭시드, 데실메틸 술폭시드, 테트라데실메틸 술폭시드), 피롤리돈 (예를 들어, 2-피롤리돈, N-메틸-2-피롤리돈, N-(2-히드록시에틸)피롤리돈), 라우로카프람, 아세톤, 디메틸아세트아미드, 디메틸포름아미드, 테트라히드로푸르푸릴 알콜, L-α-아미노산, 음이온성, 양이온성, 양쪽성 또는 비이온성 계면활성제 (예를 들어, 이소프로필 미리스테이트 및 나트륨 라우릴 술페이트), 지방산, 지방성 알콜 (예를 들어, 올레산), 아민, 아미드, 클로피브르산 아미드, 헥사메틸렌 라우르아미드, 단백질 분해 효소, α-비사볼롤, d-리포넨, 우레아 및 N,N-디에틸-m-톨루아미드 등을 들 수 있다. 추가적인 예로는, 이들로 한정되지는 않지만, 습윤제 (예를 들어, 우레아), 글리콜 (예를 들어, 프로필렌 글리콜 및 폴리에틸렌 글리콜), 글리세롤 모노라우레이트, 알칸, 알칸올, 오르겔라아제, 탄산칼슘, 칼슘 포스페이트, 다양한 당, 전분, 셀룰로스 유도체, 젤라틴, 및/또는 다른 중합체를 들 수 있다. 일부 실시양태에서, 제약 조성물은 하나 이상의 상기 침투 인핸서를 포함할 것이다.
일부 실시양태에서, 국부적/국소적 도포를 위한 제약 조성물은 하나 이상의 항미생물성 보존제, 예컨대 4차 암모늄 화합물, 유기 수은제, p-히드록시 벤조에이트, 방향족 알콜, 클로로부탄올 등을 포함할 수 있다.
위장 통증은 본 발명의 GABA-약물 접합체 또는 GABA-약물 접합체의 조합물을 포함하는, 경구로 또는 직장으로 전달되는 용액, 현탁액, 연고, 관장제 및/또는 좌제를 이용하여 효과적으로 치료될 수 있다.
호흡계통과 연관된 통증은 본 발명의 GABA-약물 접합체 또는 GABA-약물 접합체의 조합물을 포함하는 에어로졸 용액, 현탁액 또는 건조 분말을 이용하여 효과적으로 치료될 수 있다. 에어로졸은 호흡계통 또는 비강을 통해 투여될 수 있다. 예를 들어, 당업자는 본 발명의 조성물이 적절한 담체, 예를 들어 제약상 허용되는 추진제 중에 현탁 또는 용해될 수 있고, 비강 스프레이 또는 흡입기를 이용하여 바로 폐로 투여될 수 있다. 예를 들어, 효소 억제제를 포함하는 에어로졸 제제는, 예를 들어, 비강 스프레이 또는 흡입기로서의 투여용으로, 추진제 또는 용매 및 추진제의 혼합물 중에 용해, 현탁 또는 유화될 수 있다. 에어로졸 제제는, 당업계에서 통상적으로 사용되는, 압력하에 허용되는 임의의 추진제, 예컨대 화장품용으로 또는 피부과적으로, 또는 제약상 허용되는 추진제를 함유할 수 있다.
비강 투여용 에어로졸 제제는 일반적으로, 적하형이나 스프레이로 비강에 투여되도록 설계된 수용액이다. 비강 용액은, 약 5.5 내지 약 6.5 범위의 pH 값이 추가적으로 사용될 수 있음에도, 이 범위를 유지하기 위해 일반적으로 등장성이고 약간 완충성인 비강 분비액과 유사하다. 항미생물성 작용제 또는 보존제가 또한 제제에 포함될 수 있다.
흡입용 에어로졸 제제 및 흡입기는 본 발명의 작용제 또는 작용제의 조합물이 비강 또는 경구 호흡성 경로에 의해 투여되는 경우, 대상체의 호흡수로 운반되도록 설계될 수 있다. 흡입 용액은, 예를 들어 분무기를 통해 투여될 수 있다. 미세 분말화되거나 액체인 약물을 포함하는 흡입제 또는 통기제는, 예를 들어 방출을 보조하기 위한 추진제 중 작용제 또는 작용제 조합물의 용액 또는 현탁액의 제약 에어로졸로서 호흡계통으로 전달될 수 있다. 추진제는 할로카본, 예를 들어, 플루오로카본, 예컨대 불소화된, 염소화된 탄화수소, 히드로클로로플루오로카본, 및 히드로클로로카본뿐만 아니라 탄화수소 및 탄화수소 에테르를 비롯한 액화 가스일 수 있다.
본 발명에 유용한 할로카본 추진제로는, 모든 수소가 불소로 대체되는 플루오로카본 추진제, 모든 수소가 염소 및 하나 이상의 불소로 대체되는 클로로플루오로카본 추진제, 수소-함유 플루오로카본 추진제, 및 수소-함유 클로로플루오로카본 추진제를 들 수 있다. 할로카본 추진제는 1994년 12월 27일에 존슨(Johnson)에게 허여된 미국 특허 번호 5,376,359; 1993년 3월 2일 바이론(Byron) 등에게 허여된 미국 특허 번호 5,190,029; 및 1998년 7월 7일 퓨어월(Purewal) 등에게 허여된 미국 특허 번호 5,776,434에 기재되어 있다. 본 발명에 유용한 탄화수소 추진제로는, 이들로 한정되지는 않지만, 예를 들어 프로판, 이소부탄, n-부탄, 펜탄, 이소펜탄 및 네오펜탄을 들 수 있다. 또한, 탄화수소의 블렌드가 추진제로서 사용될 수 있다. 에테르 추진제로는, 예를 들어, 디메틸 에테르뿐만 아니라 에테르를 들 수 있다. 또한, 본 발명의 에어로졸 제제는 1종 초과의 추진제를 포함한다. 예를 들어, 에어로졸 제제는 동일한 클래스로부터의 1종 초과의 추진제, 예컨대 2종 이상의 플루오로카본; 또는 상이한 클래스, 예컨대 플루오로탄화수소 및 탄화수소로부터의 1종 초과, 2종 초과, 3종 초과의 추진제를 포함할 수 있다. 또한, 본 발명의 제약 조성물은 압축된 기체, 예를 들어 불활성 기체, 예컨대 이산화탄소, 아산화질소 또는 질소에 의해 분배될 수 있다.
또한, 에어로졸 제제로는 다른 성분, 예를 들어 에탄올, 이소프로판올, 프로필렌 글리콜뿐만 아니라 계면활성제 또는 다른 성분, 예컨대 오일 및 세정제를 포함할 수 있다. 이러한 성분은 제제를 안정화시키고/시키거나 밸브 성분을 매끄럽게 하는 역할을 할 수 있다.
에어로졸 제제는 압력하에 포장될 수 있고, 용액, 현탁액, 에멀젼, 분말 및 반고형 제제를 이용한 에어로졸로서 제제화될 수 있다. 예를 들어, 용액 에어로졸 제제는 본 발명의 GABA-약물 접합체 용액, 예컨대 (실질적으로) 순수한 추진제 중의 효소 억제제, 또는 추진제 및 용매의 혼합물을 포함할 수 있다. 용매는 작용제를 용해시키고/시키거나 추진제의 증발을 지연시키는 데 사용될 수 있다. 본 발명에 유용한 용매로는, 예를 들어 물, 에탄올 및 글리콜을 들 수 있다. 임의의 적합한 용매의 조합물이 임의로 보존제, 항산화제, 및/또는 다른 에어로졸 성분과 조합되어 사용될 수 있다.
에어로졸 제제는 또한 분산액 또는 현탁액일 수 있다. 현탁액 에어로졸 제제는 본 발명의 작용제 (예를 들어, 효소 억제제) 또는 작용제의 조합물의 현탁액, 및 분산제를 포함할 수 있다. 본 발명에 유용한 분산제로는, 예를 들어 소르비탄 트리올레에이트, 올레일 알콜, 올레산, 레시틴 및 옥수수유가 있다. 현탁액 에어로졸 제제로는 또한, 이들로 한정되지는 않지만, 윤활제, 보존제, 항산화제 및/또는 다른 에어로졸 성분을 들 수 있다.
에어로졸 제제는 에멀젼과 유사하게 제제화될 수 있다. 에멀젼 에어로졸 제제로는, 예를 들어 알콜 (예컨대, 에탄올), 계면활성제, 물 및 추진제뿐만 아니라 본 발명의 작용제 (예를 들어, 효소 억제제) 또는 작용제의 조합물을 들 수 있다. 사용되는 계면활성제는 비이온성, 음이온성 또는 양이온성일 수 있다. 하나의 예의 에멀젼 에어로졸 제제는, 예를 들어 에탄올, 계면활성제, 물 및 추진제로 구성된다. 또다른 예의 에멀젼 에어로졸 제제는, 예를 들어 식물성 오일, 글리세릴 모노스테아레이트 및 프로판으로 구성된다.
본 발명의 화합물은 좌제로서의 투여용으로 제제화될 수 있다. 저용융 왁스, 예컨대 트리글리세리드, 지방산 글리세리드, 위텝솔(Witepsol) S55 (독일 소재 다이나마이트 노벨 케미컬(Dynamite Nobel Chemical)의 상표명)의 혼합물, 또는 코코아 버터가 우선 용융되고, 활성 성분은 예를 들어 교반에 의해 균질하게 분산된다. 그 다음, 용융된 균질 혼합물을 편리한 크기의 몰드에 붓고, 냉각시켜 고체화하였다.
본 발명의 화합물은 질 투여용으로 제제화될 수 있다. 활성 성분 이외에 담체와 같은 물질을 함유한 페서리, 탐폰, 크림, 겔, 페이스트, 발포체 또는 스프레이가 적절한 것으로 당업계에 공지되어 있다.
본 발명의 화합물이 국소, 안내, 안와부 또는 전신성 투여용 삽입물 상에 있거나, 그 내부에 있거나, 또는 이에 부착된 서방성 제제용의 생체적합성 중합체에 방출형으로 부착될 수 있다는 것이 추가적으로 예상된다. 생체적합성 중합체로부터의 제어 방출은 수용성 중합체와 함께 이용되어 또한 주입성 제제를 형성할 수 있다. 생체적합성 중합체, 예컨대 PLGA 미립구 또는 나노구로부터의 제어 방출은 또한 서방성 투여를 위한 안내 이식 또는 주사용으로 적합한 제제에서 이용될 수 있다. 임의의 적합한 생분해성 및 생체적합성 중합체가 사용될 수 있다.
본 발명의 GABA-약물 접합체가 산성인 경우에, 이는 유리 산, 제약상 허용되는 염, 용매화물 또는 수화물로서 상기 기재된 임의의 제제에 포함될 수 있다. 제약상 허용되는 염은 실질적으로 유리 산의 활성을 유지하고, 염기와의 반응에 의해 제조될 수 있으며, 수성 용매 및 상응하는 유리 산 형태 이외의 양성자성 용매에 더 잘 용해되는 경향이 있다.
본 발명의 GABA-약물 접합체를 포함하는 제약 조성물은 통상의 혼합, 용해, 과립화, 당제-제조, 연화, 유화, 캡슐화, 트랩핑화 또는 동결건조 공정에 의해 제조될 수 있다.
V. 치료 방법
본 발명은, 치료 유효량의 본 발명의 화합물 또는 제약 조성물을 그를 필요로 하는 대상체에게 투여하는, 예방 및 치료 방법을 제공한다. 일부 실시양태에서, 본 발명의 화합물은 아미노 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기 및 제2 잔기를 포함하고, 여기서 제1 잔기는 γ-아미노부티르 산 (GABA), 또는 GABA의 유사체 또는 유도체이다. 다른 실시양태에서, 장애의 예방적 및/또는 치료학적 치료에 사용되는 본 발명의 화합물은, 카르복실 말단을 통해 제2 잔기에 공유 결합으로 연결되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기 및 제2 잔기를 포함하고, 여기서 제1 잔기는 γ-아미노부티르 산 (GABA), 또는 GABA의 유사체 또는 유도체이다.
적합한 대상체로는, 예를 들어, 인간, (이들로 한정되지는 않지만, 고릴라, 침팬지, 오랑우탄 또는 원숭이를 비롯한) 비-인간 영장류, (이들로 한정되지는 않지만, 마우스, 래트, 기니아 피그 또는 게르빌을 비롯한) 설치류, 개, 고양이, 말, 소, 돼지, 양, 토끼 또는 염소를 들 수 있다. 대상체는 바람직하게는 포유동물이고, 가장 바람직하게는 인간이다.
일부 실시양태에서, 본 발명의 GABA-약물 접합체 및/또는 제약 조성물은 포유동물, 바람직하게는 인간에게 투여되어, 신경 장애, 간질, 또는 이들로 한정되지는 않지만, 중추 매개 통증, 말초 매개 통증, 구조적 또는 연질 조직 손상 관련 통증, 진행성 질환 관련 통증 (즉, 종양학) 및 신경 통증 상태 (급성 (즉, 급성 손상 또는 외상, 수술전 및 수술후 두통, 예컨대 편두통), 만성 (즉, 당뇨병성 말초 신경병증 및 대상포진후 신경통과 같은 신경 통증 병태) 및 염증성 병태 (즉, 골증 또는 류마티스성 관절염, 급성 손상 또는 외상에 의한 후유증) 통증 상태를 포함함)를 비롯한 통증, 우울증, 불안증, 정신병, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 위장 장애, 중독성 장애 (예를 들어, 에탄올, 코카인), 하지 불안 증후군을 치료한다.
다른 실시양태에서, 본 발명의 GABA-약물 접합체 및/또는 조성물은, 신경 장애 소질, 간질, 이들로 한정되지는 않지만, 중추 매개 통증, 말초 매개 통증, 구조적 또는 연질 조직 손상 관련 통증, 진행성 질환 관련 통증 (즉, 종양학) 및 신경 통증 상태 (급성 (즉, 급성 손상 또는 외상, 수술전 및 수술후 두통, 예컨대 편두통), 만성 (즉, 당뇨병성 말초 신경병증 및 대상포진후 신경통과 같은 신경 통증 병태) 및 염증성 병태 (즉, 골증 또는 류마티스성 관절염, 급성 손상 또는 외상에 의한 후유증) 통증 상태를 포함함)를 비롯한 통증, 우울증, 불안증, 정신병, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 위장 장애, 중독성 장애 (예를 들어, 에탄올, 코카인), 하지 불안 증후군을 비롯한 다양한 장애에 대한 예비적/예방적 조치로서 동물, 바람직하게는 인간에게 투여된다.
추가의 실시양태에서, 본 발명의 GABA-약물 접합체 및/또는 조성물은, 하나의 장애의 예방용으로 사용되고 본원의 상기에 언급된 또다른 장애의 치료용으로 동시발생적으로 사용된다, 예를 들어, GABA-약물 접합체는 정신병 또는 중독의 예방용 및 통증의 치료용으로 사용될 수 있다.
신경 장애, 간질, 및 통증, 이들로 한정되지는 않지만, 치료 및/또는 예방에 대한 본 발명의 GABA-약물 접합체 및/또는 조성물의 적합성은 중추 매개 통증, 말초 매개 통증, 구조적 또는 연질 조직 손상 관련 통증, 진행성 질환 관련 통증 (즉, 종양학) 및 신경 통증 상태 (급성 (즉, 급성 손상 또는 외상, 수술전 및 수술후 두통, 예컨대 편두통), 만성 (즉, 당뇨병성 말초 신경병증 및 대상포진후 신경통과 같은 신경 통증 병태) 및 염증성 병태 (즉, 골증 또는 류마티스성 관절염, 급성 손상 또는 외상에 의한 후유증) 통증 상태를 포함함)를 포함한다. 이들로 한정되지는 않지만, 우울증, 불안증, 정신병, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 위장 장애, 중독성 장애 (예를 들어, 에탄올, 코카인), 하지 불안 증후군을 비롯한, 상기 언급된 질환의 치료학적 및 예방적 치료 섭생은 당업계에 기재되어 있는 방법에 의해 결정될 수 있다 (사칭거 등의 미국 특허 번호 4,04,175; 실버만 등의 미국 특허 번호 5,563,175; 6,028,214; 6,117,906; 국제 공개 번호 WO92/09560; 93/23383; 호르웰 등의 미국 특허 번호 6,020,370; 국제 공개 번호 WO97/29101, 97/33858; 97/33859; 브라이언스 등의 국제 공개 번호 WO99/31057; 99/31075; 99/61424; 00/15511; 00/31020; 00/50027; 02/00209; 구글리에타 등의 국제 공개 번호 WO 99/08671; 안드레아(Andrea) 등의 국제 공개 번호 WO99/12537; 애쉬번(Ashbrun) 등의 국제 공개 번호 08/11016; 로젠버그(Rosenburg) 등의 국제 공개 번호 08/09663; 부쉬만(Buschmann) 등의 국제 공개 번호 WO07/90661; 가르시아(Garcia) 등의 국제 공보 WO07/52999; 라오(Rao) 등의 국제 공개 번호 WO07/38620; 윙(Wong) 등의 국제 공보 WO06/113568; 히즈에(Hizue) 등의 국제 공개 번호 WO05/102390; 필드(Field) 등의 국제 공개 번호 WO05/92318; 허르트(Hurtt) 등의 국제 공개 번호 WO00/53225).
투여
본 발명의 GABA-약물 접합체 및/또는 조성물은 단독으로, 또는 이들로 한정되지는 않지만, 본 발명의 다른 화합물을 비롯한 하나 이상의 제약 활성제와 조합하여 투여되거나 도포될 수 있다.
본 발명의 하나 이상의 화합물을 포함하는, 본 발명의 GABA-약물 접합체 및/또는 조성물은 바람직하게는 경구 투여를 통해 투여된다. 또한, 본 발명의 GABA-약물 접합체 및/또는 조성물은 임의의 비경구 경로를 통해, 예를 들어 주입 또는 일시 주사에 의해, 상피성 또는 점막피부 라이닝(lining) (예를 들어 경구 점막, 직장 및 장 점막 등)을 통한 흡수에 의해 투여될 수 있다. 투여는 전신성 또는 국부성일 수 있다. 다양한 전달 시스템이 본 발명의 GABA-약물 접합체 및/또는 조성물의 투여용으로 공지되어 있고, 이의 예로는 리포좀, 미립자, 미세캡슐, 캡슐 등에서의 캡슐화를 들 수 있다. 투여 방법으로는, 본원의 상기 섹션 IV에 기재된 바와 같은, 특히 귀, 코, 눈 또는 피부로의 피내, 근육내, 복막내, 정맥내, 피하, 비강내, 경막외, 경구, 설하, 비강내, 질내, 경피, 직장내, 흡입 및 국소 투여 (이들로 한정되지는 않음)를 들 수 있다. 본 발명의 GABA-약물 접합체 및/또는 조성물은 단독으로, 또는 이들로 한정되지는 않지만 본 발명의 다른 화합물을 비롯한 하나 이상의 제약 활성제와 조합하여 투여되거나 도포될 수 있다.
일부의 바람직한 실시양태에서, 본 발명의 GABA-약물 접합체 및/또는 조성물은 서방성 시스템, 바람직하게는 경구 서방성 시스템을 통해 전달될 수 있다. 한 실시양태에서, 펌프가 사용될 수 있다 (문헌 [Langer, supra; Sefton, 1987, CRC Crit Ref Biomed Eng. 14, 201]; [Saudek et al., 1989, N. Engl. J. Med. 321, 574]를 참조함). 또다른 실시양태에서, 중합체 물질이 사용될 수 있다 (문헌 ["Medical Applications of Controlled Release," Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974)]; ["Controlled Drug Bioavailability," Drug Product Design and Performance, Smoln and Ball (eds.), Wiley, New York (1984)]; [Ranger and Peppas, 1983, J. Macromol. Sci. Rev. Macromol Chem. 23:61]을 참조하고; 또한 [Levy et al., 1985, Science 228: 190]; [During et al., 1989, Ann. Neurol. 25:351]; [Howard et al., 1989, J. Neurosurg. 71:105]를 참조함). 바람직한 실시양태에서, 중합체 물질은 경구 서방성 전달용으로 사용된다. 바람직한 중합체로는, 이들로 한정되지는 않지만, 나트륨 카르복시메틸셀룰로스, 히드록시프로필셀룰로스, 히드록시프로필메틸셀룰로스 및 히드록시에틸셀룰로스, 가장 바람직하게는, 히드록시프로필메틸셀룰로스를 들 수 있다. 다른 바람직한 셀룰로스 에테르가 또한 문헌 [Alderman, Int. J. Pharm. Tech. & Prod. Mfr., 1984, 5(3) 1-9]에 기재되어 있다. 약물 방출에 영향을 주는 인자는 당업자에게 널리 공지되어 있고, 당업계에 기재되어 있다 (문헌 [Bamba et al., Int. J. Pharm., 1979, 2, 307]).
다른 실시양태에서, 장용-코팅된 제제는 경구 서방성 투여용으로 사용될 수 있다. 바람직한 코팅 물질로는, 이들로 한정되지는 않지만, pH-의존성 용해도 (즉, pH-제어 방출)를 갖는 중합체, 느리거나 pH-의존성인 팽창, 용해 또는 부식 속도를 갖는 중합체 (즉, 시간-제어 방출), 압력 상승에 의해 파괴되는 단단한 층을 형성하는 중합체 (즉, 압력-조절 방출)를 들 수 있다.
또다른 실시양태에서, 삼투성 전달 시스템은 경구 서방성 투여용으로 사용된다 (문헌 [Verma et al., Drug Dev. Ind, Pharm., 2000, 26:695-708]). 바람직한 실시양태에서, OROSTM 삼투성 장치는 경구 서방성 전달 장치용으로 사용된다 (테우웨스(Theeuwes) 등의 미국 특허 번호 3,845,770; 번호 3,916,899).
또다른 실시양태에서, 조절된-방출 시스템은 본 발명의 GABA-약물 접합체 및/또는 조성물의 표적에 근접하여 위치될 수 있고, 따라서 이는 전신성 용량의 분획량만을 요구한다 (예를 들어, 문헌 [Goodson, in "Medical Applications of Controlled Release," supra, vol. 2, pp. 115-138 (1984)]). 또한, 문헌 [Langer, 1990, Science 249: 1527-1533]에서 논의되는 다른 조절된-방출 시스템이 사용될 수 있다.
본 발명의 GABA-약물 접합체 및/또는 조성물은 화학적으로 및/또는 효소적으로 절단될 수 있다. 포유동물의 위, 장 내강, 장 조직, 혈액, 간, 뇌 또는 임의의 다른 적합한 조직에 존재하는 하나 이상의 효소는, 본 발명의 GABA-약물 접합체 및/또는 조성물의 링커를 효소적으로 절단할 수 있다. GABA-약물의 절단 메카니즘은 당업계에 공지되어 있는 것이거나, 또는 관련 분야에 공지되어 있지 않거나 신규한 것일 수 있다. 본 발명의 GABA-약물 접합체 및/또는 조성물의 라이너는, (예를 들어, 포유동물의 장 조직, 혈액, 간 또는 다른 적합한 조직에서의) 위장 관에 의한 흡수 전에, 그리고/또는 위장 관에 의한 흡수 후에 절단될 수 있다. 본 발명의GABA-약물 접합체의 링커가 위장 관에 의한 흡수 전에 절단되는 경우, 약물 및 GABA 유사체는 통상적으로 활성 수송 및/또는 수동 확산에 의해 전신성 순환계로 흡수될 수 있다.
투여량
본 발명에 사용하기에 적합한 제약 조성물로는, 활성 성분이 유효량, 즉 하나 이상의 유형의 통증 또는 신경 장애를 가진 숙주에서 치료학적 및/또는 예방적 유익을 달성하기에 효과적인 양으로 존재하는 조성물을 들 수 있다. 유효량의 본 발명의 GABA-약물 접합체는, 이들로 한정되지는 않지만, 통증 (즉, 종양학) 및 급성 (즉, 급성 손상 또는 외상, 수술전 및 수술후 두통, 예컨대 편두통), 만성 (즉, 당뇨병성 말초 신경병증 및 대상포진후 신경통과 같은 신경 통증 병태) 및 염증성 (즉, 골증 또는 류마티스성 관절염, 급성 손상 또는 외상에 의한 후유증) 통증 상태를 포함하는 신경 통증 상태, 우울증, 불안증, 정신병, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 위장 장애, 중독성 장애 (예를 들어, 에탄올, 코카인), 하지 불안 증후군을 비롯한 장애의 치료용 또는 예방용으로 의도된다.
특정한 적용에 효과적인 실제 양은, 병태 또는 치료될 병태, 대상체의 상태, 고통의 중증도, 제제 및 투여 경로뿐만 아니라 당업자에게 공지되어 있는 다른 인자에 따라 좌우될 것이다. 시험관내 또는 생체내 분석법은 최적의 투여량 범위를 확인하는 것을 보조하기 위해 임의로 사용될 수 있다. GABA-약물 접합체의 유효량은, 본원의 개시내용으로 보아, 당업자의 능력내에서 결정되고, 통상의 최적화 기법을 이용하여 결정될 것이다.
인간에 사용하기 위한 유효량은 동물 모델로부터 결정될 수 있다. 예를 들어, 인간에 대한 용량은 동물에서 효과적인 것으로 밝혀진 순환성, 간, 국소성 및/또는 위장 농도를 달성하도록 제제화될 수 있다. 본 발명의 GABA-약물 접합체는 바람직하게는 하나 이상의 동물 모델에서 시험되어 안정성 및 효능을 증명한다. 일부 실시양태에서, 본원에 기재된 치료 유효량의 본 발명의 GABA-약물 접합체는, 투여된 각각의 개별 화합물 또는 공동-제제화된 2종의 모 화합물과 비교하여, 상승작용적 효과를 제공하며, 실질적 독성을 유발하지 않고 치료학적 유익을 제공한다. 본 발명의 GABA-약물 접합체의 독성은 표준 제약 절차를 이용하여 측정될 수 있고, 당업자에 의해 쉽게 확인될 수 있다. 독성 용량 및 치료 유효 용량 사이의 비가 치료 지수이다. 일부 실시양태에서, 본 발명의 GABA-약물 접합체는, 이들의 모 화합물과 비교하여, 본원에 언급된 질환 또는 장애의 치료에 대해 더 높은 치료 지표를 나타낸다. GABA-약물 접합체의 투여량은, 독성이 거의 없거나 완전히 없는 순환 농도의 범위 내에 있다. 당업자는, 특히 본원에 기재된 동물 모델 실험에 비추어, 인간에 사용하기 위한 유효량을 결정할 수 있다. 동물 데이타 및 다른 유형의 유사한 데이타에 근거하여, 당업자는 인간에게 적절한, 본 발명의 조성물의 유효량을 결정할 수 있다.
본 발명의 GABA-약물 접합체 또는 GABA-약물 접합체의 조합물을 지칭하는 경우의 유효량은 일반적으로, 의학 또는 제약 업계의 임의의 다양한 규제 기관 또는 자문 기관 (예를 들어, FDA, AMA)에 의해, 또는 제조업자 또는 공급자에 의해 추천되거나 승인된 용량 범위, 투여 방식, 제제 등을 의미한다.
일부 실시양태에서, 본 발명의 GABA-약물 접합체는 간헐적으로, 예를 들어 2일, 3일, 5일에 1회, 1주에 1회, 1달에 1회 또는 2회 등으로 투여될 수 있다. 일부 실시양태에서, 양, 형태, 및/또는 상이한 형태의 양은 상이한 횟수의 투여로 달라질 수 있다. 예를 들어, 본 발명의 제약 조성물의 투여량은 단일 투여, 다발성 도포 또는 제어 방출에 의해 전달될 수 있다. 바람직한 실시양태에서, 본 발명의 GABA-약물 접합체는 경구 서방성 투여에 의해 전달될 수 있다. 바람직하게는, GABA-약물 접합체는 1일마다 1회 또는 2회로 투여될 수 있다. 경구 투여에 적합한 투여량 범위는 모 GABA-약물 접합체의 효능에 좌우되지만, 일반적으로 체중 1kg 당 약 0.001 mg 내지 약 200 mg의 본 발명의 화합물이다. 바람직하게는, 투여량은 약 0.01 내지 약 50 mg/kg, 보다 바람직하게는 약 0.05 내지 약 25 mg/kg, 보다 바람직하게는 약 0.1 내지 약 10 mg/kg, 그리고 보다 바람직하게는 약 0.2 내지 약 5 mg/kg의 범위이다. 투여는 단독으로 또는 다른 약물과 조합으로 제공되어, 간헐적으로 반복될 수 있다. 상기의 일정은 장애의 효과적 치료가 요구되는 한 지속될 수 있다.
한 실시양태에서, 본 발명 또한 GABA 유사체-NSAID 접합체를 포함하는 조성물을 제공한다. 접합체로부터의 방출에 따른 활성 NSAID는 항-염증성 양, 바람직하게는 단독으로 투여되는 경우에 보통 사용되는 양 미만으로 존재하고, 접합체로부터의 방출에 따른 활성 GABA 유사체는 세포보호성 양, 즉 NSAID에 의해 또한 유발되는 위장 손상을 예방하거나 감소시키는 데 효과적인 양으로 존재한다. 접합체로부터의 생체내 방출에 따른, 활성 형태의 GABA 유사체 및 NSAID 둘 모두는, GABA 유사체 및 NSAID가 단독으로 투여되거나 공동-제제화되는 경우와 비교하여 우수한 치료 효능으로 귀결되는 치료 유효 용량으로 존재한다. 일반적으로, GABA 유사체-NSAID는 0.001 mg 내지 약 200 mg 사이의 용량으로 존재한다. 임의의 NSAID는 본 발명에 따른 임의의 GABA 유사체와 조합될 수 있다. 사용되는 바람직한 GABA 유사체는, 화학식 3 및 화학식 4의 화합물, 즉 가바펜틴 및 프레가발린이다. 조성물에 사용되는 바람직한 NSAID로는, 이들로 한정되지는 않지만, 술린닥, 나프록센, 인도메타신, 메페남산, 디클로페낙, 페노프로펜, 디플루니살, 에토돌락, 이부프로펜, 피록시캄, 아세틸살리실산, 옥사프로진 및 브롬페낙을 들 수 있다. 사용되는 NSAID의 대부분은 일반적으로 염, 예컨대 칼슘, 나트륨 또는 칼륨으로서, 예를 들어, 펜스프로펜 칼슘 및 브롬페낙 나트륨으로서 시판되고 있다. 보다 바람직한 조합물로는, 이들로 한정되지는 않지만, 나프록산 나트륨 또는 이부프로펜과 접합된 프레가발린 또는 가바펜틴을 들 수 있다. 조성물은 상기에 기재된 것과 같은 통상의 제약 부형제를 함유할 수 있다.
당업자는 환자 내에서의 특정 작용제 투여의 효과를 모니터링할 수 있을 것이다. 예를 들어, 통증 척도는 당업계의 표준 기술에 의해 결정될 수 있다.
VII
. 사용 방법
A. 조합 요법
본 발명의 특정 실시양태에서, 본 발명의 GABA-약물 접합체는 하나 이상의 다른 치료제와 함께 조합 요법으로 사용될 수 있다. 본 발명의 GABA-약물 접합체 및 치료제는 부가적으로, 또는 보다 바람직하게는 상승작용적으로 작용할 수 있다.
조합 요법은, 상기 치료제의 공동-작용으로부터 유익한 효과를 제공하도록 의도되는 특정 치료 섭생의 부분으로서, 본 발명의 접합체 및 하나 이상의 제2 작용제의 투여를 포함한다. 조합물의 유익한 효과로는, 이들로 한정되지는 않지만, 치료제의 조합에 기인하는 약동학적 또는 약역학적 공동-작용을 들 수 있다. 조합물 형태의 이러한 치료제의 투여는, 전형적으로 정해진 기간 (보통 선택되는 조합물에 따라 분, 시간, 일수 또는 주)에 걸쳐 수행된다. 조합 요법은 순차적으로, 또는 실질적으로는 동시적으로 수행될 수 있다. 1종 초과의 치료제를 순차적으로 투여하는 경우, 각각의 치료제는 상이한 시간으로 투여된다. 동시 투여의 경우, 2종 이상의 치료제는 동일한 제약 조성물 또는 상이한 제약 조성물 중 하나의 형태로, 실질적으로는 동시적 방식으로 투여된다. 실질적으로 동시 투여는, 예를 들어 고정 비율의 각 치료제를 갖는 단입 캡슐을 대상체에게 투여함으로써 수행되거나, 또는 각각의 치료제에 대한 단일 캡슐을 다회로 대상체엑 투여함으로써 수행될 수 있다. 바람직한 실시양태에서, 본 발명의 GABA-약물 접합체를 포함하는 조성물은, 본 발명의 GABA-약물 접합체와 동일한 조성물 또는 상이한 조성물의 부분일 수 있는 또다른 치료제의 투여와 동시발생적으로 투여된다. 또다른 실시양태에서, 본 발명의 GABA-약물 접합체를 포함하는 조성물은 또다른 치료제의 투여에 우선하여, 또는 후속으로 투여된다.
순차적이거나 실질적으로 동시적인, 각각의 치료제의 투여는, 이들로 한정되지는 않지만, 경구 경로, 정맥내 경로, 근육내 경로, 및 점막 조직을 통합 직접적인 흡수를 비롯한 임의의 적절한 경로에 의해 시행될 수 있다. 치료제는 동일한 경로에 의해 또는 상이한 경로에 의해 투여될 수 있다. 예를 들어, 선택된 조합물의 제1 치료제는 정맥내 주사에 의해 투여될 수 있는 반면, 조합물의 다른 치료제는 경구 투여될 수 있다. 별법으로, 예를 들어, 모든 치료제는 경구 투여될 수 있거나 또는 모든 치료제는 정맥내 주사에 의해 투여될 수 있다. 치료제가 투여되는 순서는 엄밀하게는 중요하지 않다. 조합 요법은 또한, 다른 생물학적 활성 성분을 갖는 추가의 조합물로 상기 기재된 치료제를 투여하는 것 및 비-약물 요법 (예를 들어, 수술 또는 방사선 치료)을 포함한다. 여기서 조합 요법은 비-약물 치료를 추가로 포함하며, 상기 비-약물 치료는, 치료제 및 비-약물 치료의 조합물의 공동-작용으로부터의 유익한 효과가 달성되는 한, 임의의 적합한 기간으로 수행될 수 있다. 예를 들어, 적절한 경우, 유익한 효과는, 비-약물 치료가 치료제의 투여로부터 일시적으로 중지되는 경우에도 유의한 기간으로 달성될 수 있다. 접합체 및 다른 약리상 활성제는 동시적으로, 순차적으로 또는 조합물로 환자에게 투여될 수 있다. 본 발명의 조합물을 사용하는 경우, 본 발명의 화합물 및 다른 약리상 활성제가 제약상 허용되는 동일한 담체에 존재할 수 있으므로 동시에 투여될 수 있다는 것을 알 것이다. 이들은, 동시에 얻은 개별 제약 담체, 예컨대 통상의 경구 투여 형태로 존재할 수 있다. 용어 "조합물"은, 화합물이 개별 투여 형태로 제공되어 순차적으로 투여되는 경우를 추가로 지칭한다.
B. 역작용의 감소 및 치료 효능의 향상
본 발명은 또한, 치료 유효량의 본 발명의 접합체 또는 제약 조성물을 그를 필요로 하는 대상체에게 투여함으로써 장애의 치료와 연관된 역작용을 감소시키고/시키거나 치료 효능을 증가시키는 방법을 실시한다.
본원에 기재된 접합체의 독성 및 치료 효능은, 실험용 동물에서의 표준 제약 절차에 의해, 예를 들어 대상 화합물에 대한 IC50 및 LD50 (시험 동물의 50 %에서 사망을 유발하는 치사량)을 측정함으로써 결정될 수 있다.
한 실시양태에서, 본 발명의 조성물은, 이들로 한정되지는 않지만, 위장 부작용, 인지 손상, 메스꺼움 및 변비를 비롯한 많은 통증 치료 섭생에 의해 유발되는 원치 않는 부작용의 발생을 감소시킨다. 또다른 실시양태에서, 본 발명의 조성물은, 각각의 개별 비접합 약물에 대해 요구되는 것보다 더 낮은 용량으로 충분한 통증 완화를 달성한다. 또다른 실시양태에서, 본 발명의 조성물은, 이들로 한정되지는 않지만, 더 느린 전신성 제거를 비롯한 약동학적 및 생리학적 특성을 향상시키고, GABA 유사체의 흡수를 향상시켜, 이러한 약물이 통증 및 다른 CNS 장애의 치료에서 이들의 충분한 잠재력에 도달하게 한다. 또다른 실시양태에서, 본 발명의 조성물의 전달을 위한 서방성 제제의 사용은, 활성 약물, 즉 GABA 유사체의 신속한 전신성 제거를 추가로 감소시킨다. GABA 유사체, 예컨대 바클로펜, 가바펜틴 및 프레가발린이 대장에서 흡수되기보다는 중성 아미노 수송 시스템에 의해 소장에서 흡수되기 때문에, 본 발명의 조성물은 서방성 접근법을 상기 GABA 유사체에 성공적으로 적용할 수 있게 한다.
본 발명의 바람직한 실시양태가 본원에 나타나고 기재되어 있지만, 이러한 실시양태는 오직 실시예에 의해서만 제공된다는 것은 당업자에게 명백할 것이다. 다수의 변형, 변화 및 치환은 본 발명을 벗어나지 않으면서 당업자에게 일어날 것이다. 본원에 기재된 본 발명의 실시양태에 대한 다양한 별법이 본 발명의 실시에 사용될 수 있다는 것이 이해되어야 한다. 하기의 청구항은 본 발명의 범주를 정의하고, 이러한 청구범위 내의 방법과 구조식 및 이와 동등한 것은 이에 의해 포함되도록 의도된다.
실시예
실시예 1: 프레가발린-나프록센 접합체의 합성
본 발명은, 본 발명의 화합물과 조성물의 제법 및 본 발명의 화합물과 조성물을 사용하기 위한 분석법을 자세히 기재하고 있는 하기 실시예의 언급에 의해 추가로 정의된다. 물질 및 방법 둘 모두에 대한 다수의 변형이 본 발명의 범주를 벗어나지 않으면서 실시될 수 있다는 것은 당업자에게 명백할 것이다.
하기 실시예에서, 하기의 약어는 하기의 용어를 나타낸다. 본원에 정의되지 않은 약어는, 일반적으로 용인되는 그의 의미를 갖는다.
AIBN = 2, 2'-아조비스(이소부티로니트릴)
Atm = 대기압
Boc = tert-부틸옥시카르보닐
Cbz = 카르보벤질옥시
CPM = 분당 계수
DCC = 디시클로헥실카르보디이미드
DMAP = 4-N,N-디메틸아미노피리딘
DMEM = 둘베코(Dulbecco) 최소 이글 매질
DMF = N,N-디메틸포름아미드
DMSO = 디메틸술폭시드
Fmoc = 9-플루오레닐메틸옥시카르보닐
g = 그램
h = 시간
HBSS = 행크스(Hank's) 완충 염수 용액
L = 리터
LC/MS = 액체 크로마토그래피/질량 분석법
M = 몰
min = 분
mL = 밀리리터
mmol = 밀리몰
NBS = N-브로모숙신이미드
NHS = N-히드록시숙신이미드
PBS = 포스페이트 완충 염수
THF = 테트라히드로푸란
TFA = 트리플루오로아세트산
TMS = 트리메틸실릴
㎕ = 마이크로리터
μM = 마이크로몰농도
v/v = 부피 대 부피
아실옥시알킬메탄에티오카르보네이트 (3)
단계 1:
일반적인 절차:
나트륨 메틸티오레이트 (58 g, 0.17 mol)의 21% (w/w) 수용액을 2시간에 걸쳐 CH2Cl2 (45 mL) 중 1-클로로에틸 클로로포르메이트 (25 g, 0.17 mol) 및 테트라부틸암모늄 브로마이드 (1.7 mmol)의 용액에 첨가하였다. 반응 혼합물을 추가 1시간 동안 교반한 다음, 수성상을 분리하고 염수 (2 x 50 mL)로 유기상을 추출하여 워크-업(work-up)하였다. 유기상을 무수 황산나트륨 상에서 건조시키고 진공하에 농축시켰다. 잔류물을 진공 증류에 의해 정제하여 생성물을 무색 액체로서 획득하였다 (수율, 95%). 화합물 2a:
일반적인 절차:
디이소프로필아민 (16 g, 150 mmol)을, (S)-6-메톡시-알파-메틸-2-나프탈렌아세트산 (나프록산, 34 g, 150 mmol) 및 클로로알킬메탄티오카르보네이트 (2, 100 mmol)의 혼합물에 적가하였다. 혼합물을 80 내지 90℃에서 3시간 동안 교반하였다. 그 다음, 30 mL 디클로로메탄을 반응 혼합물에 첨가하였다 . 혼합물을 2시간 동안 교반하였다. 이어서, 반응 혼합물을 50 mL의 물과 100 mL의 에틸 에테르 사이에 분배하였다. 유기상을 물, 포화 탄산칼륨 용액 (K2CO3) 및 염수로 세척한 다음, 무수 황산나트륨 (Na2SO4)상에서 건조시켰다. 용매를 회전 증발에 의해 제거하고 메틸-tert-부틸 에테르 (MTBE) 및 n-헥산의 혼합물에서 재결정화시킨 후, 백색 고체 생성물을 수득하였다.
화합물 (3a): 백색 결정, 수율 90%; mp: 73 내지 74℃.
화합물 (3b, 부분입체이성질체): 백색 결정, 수율: 87%; mp: 65 내지 66℃.
단계 2:
일반적인 절차:
N-히드록시숙신이미드 (NHS, 2.30 g, 20 mmol)를 15 mL 디클로로메탄 및 2.1 g 물 중에 용해시킨 화합물 (3) (10 mmol)에 첨가하였다. 생성된 현탁액을 0℃로 냉각시키고, 25 mL 디클로로메탄 중에 용해시킨 3-클로로퍼옥시벤조산 (m-CPBA, 6.90 g, 40 mmol)을 서서히 첨가하였다. 이어서, 반응 혼합물을 0℃에서 1시간 동안, 그리고 실온에서 15시간 동안 교반하였다.
이어서, 반응 혼합물을 여과하고, 40 mL 에틸 에테르 및 30 mL 포화 중탄산칼륨 용액으로 희석시켰다. 유기상을 분리하고, 포화 탄산칼륨 용액 (30 mL), 물 (40 mL) 및 염수 (2 x 30 mL)로 세척한 다음, 무수 황산나트륨 (Na2SO4) 상에서 건조시켰다. 용매를 회전 증발에 의해 제거한 후, 조 화합물 (4)를 4:1 페트롤 에테르 (60 내지 90℃): 에틸 아세테이트의 실리카 겔 컬럼 크로마토그래피에 의해 정제하고, 에틸 아세테이트 및 n-헥산에서 재결정화시켰다.
화합물 (4a): 수율: 32%, mp: 115 내지 116℃;
HRMS (ESI)를 통해 424.1002로 밝혀졌다 ([M + Na]+, C20H19NO8에 대해 424.1003으로 계산됨).
화합물 (4b, 부분입체이성질체): 백색 결정, 수율 40%; mp: 145 내지 146℃.
HRMS (ESI)를 통해 438.1157로 밝혀졌다 ([M + Na]+, C21H21NO8에 대해 438.1159로 계산됨).
단계 3:
일반적인 절차:
(3S)-3-(아미노메틸)-5-메틸헥산산 (프레가발린, 504 mg, 3.3 mmol) 및 2 mL의 물을, 5 mL 디클로로메탄 중에 용해시킨 화합물 (4) (1.2 g, 3 mmol)에 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 반응 혼합물을 15 mL 에틸 에테르 및 10 mL 물로 희석시켰다. 유기상을 분리하고 물 (10 mL) 및 염수 (2 x 10 mL)로 세척한 다음, 무수 황산나트륨 (Na2SO4) 상에서 건조시켰다. 용매를 회전 증발에 의해 제거한 후, 조 생성물을 4:1 페트롤 에테르 (60 내지 90℃): 에틸 아세테이트의 실리카 겔 컬럼 크로마토그래피에 의해 정제하여 점성 액체 화합물을 수득하였다.
화합물 (5a): 점성 액체, 수율 80%.
HRMS (ESI)를 통해 468.1995로 밝혀졌다 ([M + Na]+, C24H31NO7에 대해 468.1993로 계산됨).
화합물 (5b): 수율 98%. HRMS (ESI)를 통해 482.2145로 밝혀졌다 ([M + Na]+, C25H33NO7 에 대해 482.2149로 계산됨).
키랄 정제 조건:
하기의 나열된 조건을 이용하여 키랄 정제를 달성하였다. 분획물을 수집하고 용매를 진공하에 제거하여, 두 부분입체이성질체 모두를 백색 고체로서 획득하였다.
<표 1>
백색 결정으로서의 화합물 (5b-1) (광학적으로 순수함), mp: 100 내지 101℃.
백색 결정으로서의 화합물 (5b-2) (광학적으로 순수함), mp: 120℃.
실시예 2: 가바펜틴-GHB 접합체의 합성
상기 실시예는 일반적으로 GABA-유사체-γ 히드록시부티르산 (GHB) 접합체, 및 보다 구체적으로는 가바펜틴-GHB 접합체의 합성을 제공한다.
실시예 3: GABAB 효능제-모르핀 접합체의 합성
상기 실시예는 GABA 수용체 효능제-아편제 진통성 약물 접합체, 및 보다 구체적으로는 GABAB 효능제-모르핀 접합체의 합성을 제공한다.
본원의 상기에 제공된 실시예는 예시적이고 비제한적인 것으로 간주되어야 하고, 본 발명은 본원에 제공된 세부사항으로 한정되지는 않지만, 본 발명의 범주 및 동등물 내에서 변형될 수 있다.
실시예 4: GABA-약물 접합체의 Caco-2 세포 투과성에 대한 시험관내 측정
본 발명의 GABA-약물 접합체의 수동적 투과성은 당업계에 공지되어 있는 표준 방법을 이용하여 시험관내에서 평가된다 (예를 들어, 문헌 [Stewart, et al., Pharm. Res., 1995, 12, 693]을 참조함). 예를 들어, 수동적 투과성은, 배양된 극성화 세포 단층 (예를 들어, Caco-2 세포)을 횡단하는 GABA-약물의 유동을 조사하여 평가된다. 연속 배양 (28 미만의 계대배양 횟수)으로부터 수득한 Caco-2 세포를, 트랜스웰(Transwell) 폴리카르보네이트 필터 상에서 고밀도로 씨딩(seeding) 하였다. 세포를 실험일까지 37℃에서 DMEM/ 10% 송아지 태아 혈청 + 0.1 mM 비필수 아미노산 + 2 mM L-Gln, 5% CO2 / 95% O2에서 유지하였다. 유출 펌프 억제제 (250 μM MK-571, 250 uM 베라파밀, 1 mM 오플록사신)의 존재하에, 꼭지면 방향으로는 (1 mM CaCl2, 1mM MgCl2, 150 mM NaCl, 3 mM KCl, 1 mM NaH2PO4, 5 mM 글루코스를 함유한 50 mM MES 완충제 중에서) pH 6.5에서, 그리고 기저측 방향으로는 (10 mM HEPES를 함유한 행크스 평형 염 용액 중에서) pH 7.4에서 투과성 연구를 수행하였다. 완충제을 함유한 12 또는 24 웰 플레이트에 삽입물을 위치시키고, 37℃에서 30분 동안 인큐베이션하였다. 전구약물 (200 μM)을 꼭지면 또는 기저측면 컴파트먼트(compartment) (공여체)에 첨가하고, 반대 컴파트먼트 (수용체)에서의 전구약물 및/또는 방출된 모 약물의 농도를 LC/MS/MS를 이용하여 1시간에 걸친 간격으로 측정하였다. 하기 식을 이용하여 겉보기 투과계수 (Papp)를 계산하였다:
Papp = Vr (dC/dt)/ (ACo)
여기서, Vr은 수용체 컴파트먼트의 부피 (mL)이고; dC/dt는 GABA-약물 및 모 약물의 총 유속(μM/s)이며, 이는 수용체 컴파트먼트에서의 농도 대 시간의 곡선의 기울기로부터 결정되고; Co는 GABA-약물 접합체의 초기 농도 (μM)이고; A는 막의 표면적 (cm2)이다. 바람직하게는, 유의한 세포간 투과성을 갖는 GABA-약물 접합체는, ≥ 1 x 10-6 cm/s의 Papp 값, 보다 바람직하게는 ≥ 1 x 10-5 cm/s의 Papp 값, 또한 보다 바람직하게는 ≥ 5 x 10-5 cm/s의 Papp 값을 나타낸다.
실시예
5: 화학적 안정성
화학적 안정성 연구를 위해, 완충제을 pH 2.0 (0.1M 인산칼륨 및 0.5M NaCl를 이용함), pH 7.4 및 pH 8.0 (0.1M 트리스-HCl 및 0.5M NaCl를 이용함)에서 제조하였다. 화합물 (5 μM)을 온도 조절된 HPLC 오토샘플러 내에서 1시간 동안 37℃에서 완충제으로 인큐베이션하였다. 샘플을, 첨가 후 0시간 및 1시간 후에 주사하였다. 샘플을 하기에 기재된 바와 같이 LC/MS/MS에 의해 분석하였다.
실시예
6: 대사 안정성
혈장 안정성: 화합물 (5 μM)을 37℃에서 1시간 동안 90%의 래트 또는 인간 혈장으로 인큐베이션하였다. 샘플을, 첨가 후 0시간 및 1시간 후에 수득하고 즉시 메탄올로 켄칭시켜, 추가의 전환을 방지하였다. 켄칭된 샘플을 냉동시키고, 분석에 앞서 -80℃에서 유지하였다. 샘플을 하기에 기재된 바와 같이 LC/MS/MS에 의해 분석하였다.
간 균질화액: 화합물 (5 μM)을 pH 7.4에서 1mM NADPH의 존재하에, 37℃에서 1시간 동안 0.5 mg 단백질/mL에서 래트 또는 인간 간 S9로 인큐베이션하였다. 샘플을, 첨가 후 0시간 및 1시간 후에 수득하고 메탄올로 즉시 켄칭시켜, 추가의 전환을 방지하였다. 켄칭된 샘플을 냉동시키고, 분석에 앞서 -80℃에서 유지하였다. 샘플을 하기에 기재된 바와 같이 LC/MS/MS에 의해 분석하였다.
Caco-2 세포 균질화액: Caco-2 세포를 21일에 걸쳐 플라스크에서 증식시켰다. 그 다음, 세포를 빙냉 10 mM 나트륨 포스페이트/0.15 M 칼륨 클로라이드 (pH 7.4)로 세정하고/긁어내었다. 세포는 4℃에서 프로브 소니케이터를 이용한 초음파 처리에 의해 용해되고, 4℃에서 20분 동안 9,000 x g에서 원심분리되고, 생성된 상등액 (Caco-2 세포 균질화액 S9 분획물)의 분취량을 0.5 mL 바이알로 옮기고, 사용에 앞서 -80℃에서 보관하였다. 안정성 연구를 위해, 화합물 (5 μM)을 pH 7.4에서, 그리고 37℃에서 1시간 동안 Caco-2 S9 (1 mL 당 0.5 mg의 단백질)로 인큐베이션하였다. 샘플을, 첨가 후 0시간 및 1시간 후에 수득하고 메탄올로 즉시 켄칭시켜, 추가의 전환을 방지하였다. 켄칭된 샘플을 냉동시키고, 분석에 앞서 -80℃에서 유지하였다. 샘플을 하기에 기재된 바와 같이 LC/MS/MS에 의해 분석하였다.
판크레아틴: 화합물 (5 μM)을 37℃에서 1시간 동안 돼지의 판크레아틴 (pH 7.5 완충제 중 10 mg/mL)으로 인큐베이션하였다. 샘플을, 첨가 후 0시간 및 1시간 후에 수득하고 메탄올로 즉시 켄칭시켜, 추가의 전환을 방지하였다. 켄칭된 샘플을 냉동시키고, 분석에 앞서 -80℃에서 유지하였다. 샘플을 하기에 기재된 바와 같이 LC/MS/MS에 의해 분석하였다.
다양한 종에서의 약물 접합체 대사작용: 약물 접합체 (10 μM)를 37℃에서 1시간 동안 래트, 개, 원숭이 및 인간의 혈장, 장 S9, 폐 S9, 간 S9 및 신장 S9로 인큐베이션하였다. 모든 제제는 1mL 당 1 mg의 단백질을 함유해야 한다. 샘플을, 첨가 후 0시간 및 1시간 후에 수득하고 메탄올로 즉시 켄칭시켜, 추가의 전환을 방지하였다. 켄칭된 샘플을 냉동시키고, 분석에 앞서 -80℃에서 유지하였다. 샘플을 하기에 기재된 바와 같이 LC/MS/MS에 의해 분석하였다. 각각의 매트릭스에서 모 약물로의 약물 접합체의 전환 속도는 1 mg의 단백질 당 pmol/분으로 계산된다.
약물 접합체에 의한 특이적 CYP450 이소형의 억제: GABA-약물 접합체의 선도 후보 물질을 CYP450 이소형의 억제에 대해 시험하였다. 시토크롬 P450-매개 대사작용을 억제하는 약물 접합체의 능력을, 바쿨로좀(bacculosome) (수퍼좀(Supersome)TM)에서 발현되는 특이적 CYP450 이소형을 이용한 표준 방법에 의해 조사하였다. 각각의 이소형에 대한 실험 조건은 하기와 같다. 표준 기질을 사용하여 형광 대사물을 생성시켰다. 실험을 96 웰 형식으로 수행하였다. 모든 인큐베이션은 NADPH 보조인자의 혼합체를 포함한다. 각각의 인큐베이션에서 CYP450 단백질의 최종 농도는 2.5 내지 5.0 pM이어야 한다. 양성 대조군 화합물을 비롯한 모든 화합물을 NADPH 생성계의 용액 중에 순차적으로 희석시켜 400 uM 이하의 최종 농도를 제공하였다. 생성된 용액을 37℃에서 15 내지 45분 동안 특이적 CYP450 이소형 및 관련 기질로 인큐베이션하였다. 정지액 (80% 아세토니트릴/20% 0.5 M 트리스 염기)을 첨가하여 반응을 종결시켰다. 플렉스테이션(FlexStation) 형광 플레이트 판독기를 이용하여 샘플을 분석하였다.
생성물의 형성에 대한 억제율은, 각각의 약물 접합체 농도 및 대조군 억제제에 대해 측정된다. 블랭크 값을 샘플 웰로부터 공제하여 알짜 형광 신호를 수득한다. 50% 억제로 일괄처리되는 약물 접합체의 농도 (CHigh 및 CLow)를 결정한다. 그 다음, 각각의 특이적 이소형의 억제에 대한 IC50 값을, 하기와 같이 선형 보간법을 통하여, 일괄처리 농도 및 상응하는 억제율로부터 결정한다:
IC50 = (50% - %ILow)/(%IHigh - %ILow) x (CHigh - Clow) + CLow
여기서, CLow 및 CHigh는 50% 억제로 일괄처리되는 농도이고, %IHigh 및 %ILow는 각각 저농도 및 고농도에서의 상응하는 억제율이다. 이것은 수퍼좀TM의 공급자에 의해 추천되는 계산 방법이다.
CYP 이소형 (표준 기질): CYP3A4 (7-벤질옥시트리플루오로메틸쿠마린); CYP1A2 (3-시아노-7-에톡시쿠마린); CYP2C9 (7-메톡시트리플루오로메틸쿠마린); CYP2C19 (3-시아노-7-에톡시쿠마린); CYP2D6 (3-[2-(N,N-디에틸-N-메틸아미노)에틸]-7-메티옥시-4-메틸쿠마린); CYP2E1 (7-메티옥시-4-트리플루오로메틸쿠마린).
실시예
7:
래트에서
GABA
유사체, 진통제 또는
GABA
-약물 접합체의
결장내
투여에 따른
GABA
유사체 및 접합체의 흡수
6 내지 24시간에 걸쳐 서서히 약물을 방출하는 서방성 경구 투여 형태는 일반적으로 결장내에서 유의한 비율의 용량을 방출한다. 따라서, 이러한 투여 형태에 사용하기에 적합한 약물은, 바람직하게는 양호한 결장성 흡수를 보인다. 상기 실험은 경구 서방성 제제에 사용하기 위한 GABA-약물 접합체의 적합성을 평가하기 위해 수행되었다.
단계 A: 투여 프로토콜
래트를 통상적으로 수득하고, 이의 상행 결장 및 경정맥 둘 모두에 캐뉼라(cannula)를 미리 꽂았다. 동물은 실험 기간에 의식이 있어야 한다. 모든 동물을 밤새, 그리고 투여 후 4시간이 될 때까지 금식시켰다. 관심있는 화합물을 원하는 용량으로, (물 또는 다른 용매, 예컨대 PEG 400 중의) 용액으로서 캐뉼라를 통해 바로 결장으로 투여하였다. 혈액 샘플 (0.5 mL)을 8시간에 걸친 간격으로 경정맥 캐뉼라로부터 수득하고 아세토니트릴/메탄올을 첨가하여 즉시 켄칭시켜, GABA-약물 접합체의 추가 전환을 방지하였다. 혈액 샘플을 하기와 같이 분석하였다.
단계 B: 결장 흡수 약물용 샘플의 제법
1.5 mL의 빈 에펜도르프(eppendorf) 튜브에서, 300 μL의 50/50 아세토니트릴/메탄올 및 20 μL의 p-클로로페닐알라닌을 내부 표준 물질로서 첨가하였다.
1. 래트 혈액을 상이한 시점으로 수집하고, 100 μL의 혈액을 즉시 에펜도르프 튜브에 첨가하고 와류시켜 혼합하였다.
2. 10 μL의 GABA 유사체 또는 진통성 약물 표준 용액 (0.04, 0.2, 1, 5, 25, 100 μg/mL)을 90 μL의 블랭크 래트 혈액에 첨가하여 최종 교정 표준 용액 (0.004, 0.02, 0.1, 0.5, 2.5, 10 μg/mL)을 형성하였다. 그 다음, 300 μL의 50/50 아세토니트릴/메탄올을 각각의 튜브에 첨가한 후, 20 μL의 p-클로로페닐알라닌을 첨가하였다.
3. 샘플을 10분 동안 14,000 rpm에서 와류시키고 원심분리하였다.
4. LC/MS/MS 분석을 위해 상등액을 채취하였다.
단계 C:
LC
/
MS
/
MS
분석
10ADVp 이원 펌프 및 CTC HTS-PAL 오토샘플러를 구비한 LC/MS/MS 분광계를 분석에 사용하였다. 선택한 컬럼을 분석 동안 45℃로 가열하였다. 이동상은 상이한 용매 혼합물, 예컨대 0.1% 포름산 (A) 및 0.1% 포름산을 포함한 아세토니트릴 (B)의 혼합물일 수 있다. 구배 조건은 분석되는 화합물에 따라 달라질 수 있다. 터보이온스프레이 공급원은 LC/MS/MS 기기, 예컨대 API 2000 상에서 사용될 수 있다. 분석은 양성 및 음성 이온 모드 둘 모두에서 수행될 수 있고, MRM 전이는 화합물의 분석에 기초하여 선택될 수 있다. 20 μL의 샘플을 주사하였다. 피크는 애널리스트(Analyst) 1.1 정량화 소프트웨어를 이용하여 통합될 수 있다. 각각의 상기 GABA-약물 접합체의 결장 투여 후, GABA 유사체 및 진통성 약물의 최대 혈장 농도 (Cmax), 뿐만 아니라 GABA 유사체 및 진통성 약물 혈장 농도 대 시간 곡선의 면적 (AUC)은 모 약물과 비교될 수 있다. 바람직한 접합체는, GABA 유사체 및 진통제 그 자체보다 더 높은 Cmax 및 더 큰 AUC 값을 갖는 GABA 유사체 및 진통성 약물 둘 모두를 제공해야한다. 이 데이타는, 본 발명의 화합물이, 이러한 GABA 유사체의 신속한 전신성 제거에 기인한 투여 빈도를 최소화하기 위해 선택되는 GABA 유사체 및 진통성 약물의 흡수 향상 및/또는 효과적인 서방성에 적합한 조성물로서 제제화될 수 있다는 것을 증명한다.
실시예
8:
사이노몰거스
(
Cynomolgus
) 원숭이로의
정맥내
투여에 따른,
접합
된
GABA
유사체 또는
접합된
진통제의 약동학
GABA 유사체 또는 진통성 약물을 복재 정맥으로의 정맥내 일시 주사에 의해, 원하는 용량으로 수용액으로서 4마리의 수컷 사이노몰거스 원숭이에게 투여하였다. 혈액 샘플을 투여 후 24시간에 걸친 간격으로 모든 동물로부터 수득하였다. 혈액을 4℃에서 혈장으로 즉시 처리하였다. 이어서, 모든 혈장 샘플을 상기에 기재된 LC/MS/MS 분석법을 이용하여 GABA 유사체 또는 진통성 약물에 대해 분석하였다.
실시예
9:
사이노몰거스
원숭이에서
GABA
유사체 또는
GABA
-약물 접합체의 결장내 투여에 따른,
GABA
유사체 또는
접합된
진통성 약물의 흡수
GABA 유사체, 진통성 약물 및 GABA-약물 접합체를 유치 카뉼라를 통한 결장으로의 직접적인 일시 주사를 통해, 원하는 용량으로 수용액 또는 현탁액 중 하나로서 4마리의 수컷 사이노몰거스 원숭이 군에게 투여하였다. 결장성 전달을 위해, 유연한 프랑스 도뇨관을 각각의 원숭이의 직장으로 삽입하고, 형광투시법을 이용하여 근접한 결장 (대략 16 인치)에 도달시켰다. 원숭이는 투여 동안 테트라졸/케타민의 투여에 의해 약간 진정되었다. 치료간에 적어도 5 내지 7일의 세척 기간이 허용된다. 투여 후, 혈액 샘플을 24시간에 걸친 간격으로 수득하여 즉시 켄칭시키고, 4℃에서 혈장으로 처리하였다. 이어서, 모든 혈장 샘플을, 상기에 기재된 LC/MS/MS 분석법을 이용하여 GABA 유사체, 진통성 약물 및 무손상 GABA-약물 접합체에 대해 분석하였다. GABA-약물 접합체의 결장 투여 후, GABA 유사체 및 진통성 약물의 최대 혈장 농도 (Cmax)뿐만 아니라 GABA 유사체 및 진통성 약물 혈장 농도 대 시간 곡선의 면적 (AUC)은, GABA 유사체 그 자체의 결장 투여로부터 생성된 것보다 유의하게 크다. 이 데이타는, 이러한 GABA-약물 접합체가, 이러한 GABA 유사체의 신속한 전신성 제거에 기인하여 투여 빈도를 최소화하기 위해 선택되는 GABA 유사체의 흡수 향상 및/또는 효과적인 서방성에 적합한 조성물로서 제제화될 수 있다는 것을 증명한다.
실시예
10:
사이노몰거스
원숭이로의
GABA
-약물 접합체의 경구 투여에 따른, GABA 유사체 및
접합된
진통성 약물의 흡수
GABA-약물 접합체를 각각 수용액 또는 현탁액 둘 중 하나로서, 경구 위관 영양법에 의해 4마리의 수컷 사이노몰거스 원숭이 군에게 투여하였다. 투여 후, 혈액 샘플을 24시간에 걸친 간격으로 수득하여 즉시 켄칭시키고, 4℃에서 혈장으로 처리하였다. 이어서, 모든 혈장 샘플을, 상기에 기재된 LC/MS/MS 분석법을 이용하여 GABA 유사체, 진통성 약물 및 무손상 GABA-약물 접합체에 대해 분석하였다.
본 발명의 바람직한 실시양태가 본원에 나타나고 기재되어 있지만, 이러한 실시양태는 오직 실시예에 의해서만 제공된다는 것은 당업자에게 명백할 것이다. 다수의 변형, 변화 및 치환은 본 발명을 벗어나지 않으면서 당업자에게 일어날 것이다. 본원에 기재된 본 발명의 실시양태에 대한 다양한 별법이 본 발명의 실시에 사용될 수 있다는 것이 이해되어야 한다. 하기의 청구항은 본 발명의 범주를 정의하고, 이러한 청구범위 내의 방법과 구조식 및 이와 동등한 것은 이에 의해 포함되도록 의도된다.
Claims (93)
- 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 화합물.
- 카르복실산 기를 통해 제2 잔기에 공유 결합으로 연결되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하고, 여기서 제1 잔기는 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 화합물.
- 제1항 또는 제2항에 있어서, 제1 잔기가 GABA 유사체인 화합물.
- 제3항에 있어서, 제1 잔기가 바클로펜, 비가바트린, 가바펜틴 또는 프레가발린, 또는 γ-아미노-포스핀산 유도체인 화합물.
- 제1항 또는 제2항에 있어서, 제2 잔기가 진통성 약물인 화합물.
- 제5항에 있어서, 제2 잔기가 비스테로이드성 항-염증성 약물 (NSAID), 오피오이드 또는 항-우울제인 화합물.
- 제1항 또는 제2항에 있어서, 제2 잔기가 γ-히드록시부티르산 (GHB), 또는 GHB의 유사체, 유도체 또는 변이체인 화합물.
- 제1항 또는 제2항에 있어서, 제1 잔기 및 제2 잔기가 에스테르 결합, 아미드 결합, 이민 결합, 카르바메이트 결합, 카르보네이트 결합, 티오에스테르 결합, 아실옥시카르바메이트 결합, 아실옥시카르보네이트 결합, 포스페이트 결합 및 아실옥시포스페이트 결합으로 이루어진 군으로부터 선택된 공유 결합을 통해 연결된 것인 화합물.
- 제1항 또는 제2항에 있어서, 제1 잔기를 제2 잔기에 공유 결합으로 연결하는 링커를 추가로 포함하는 화합물.
- 제9항에 있어서, 링커가 생리학적으로 불안정한 것인 화합물.
- 제1항 또는 제2항에 있어서, 화합물의 제1 잔기 또는 제2 잔기에 이온 결합 또는 공유 결합으로 연결된 제3 잔기를 추가로 포함하는 화합물.
- 제1항 또는 제2항에 있어서, 하나 이상의 다른 치료제와 조합하여 사용될 수 있는 화합물.
- 제12항에 있어서, 치료제가 항-정신병 약물, 항불안제 약물, 항-우울제 약물, 진정제 약물, 항파킨슨병 약물, 아세틸콜린 에스테라아제 억제제, MAO 억제제, 선택적인 세로토닌 재흡수 억제제 (SSRI), N-메틸-D-아스파르트산 (NMDA) 길항제 및 선택적인 노르아드레날린 대체 억제제로 이루어진 군으로부터 선택되는 것인 화합물.
- 제1항에 있어서, 산성 말단이 포스핀산 기 또는 술핀산 기를 포함하는 것인 화합물.
- 제2항에 있어서, 보호 기가 아미노산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬 포스포르아미데이트, 또는 아실옥시카르바메이트를 포함하는 것인 화합물.
- 제2항에 있어서, 보호 기가 제1 잔기의 아미노 기로부터 절단될 수 있는 것인 화합물.
- 제1항 또는 제2항의 화합물 및 제약상 허용되는 담체를 포함하는 제약 조성물.
- 제17항에 있어서, 하나 이상의 다른 치료제를 추가로 포함하는 제약 조성물.
- 제17항에 있어서, 통증 및/또는 신경 장애의 치료를 위한 제약 조성물.
- 제1항 또는 제2항의 화합물 및 키트의 사용에 대한 지침을 포함하는, 대상체에서의 통증 또는 신경 장애의 예방 또는 치료를 위한 키트.
- 제20항에 있어서, 대상체가 동물, 바람직하게는 인간인 키트.
- 제20항에 있어서, 통증 또는 신경 장애의 치료에 사용하기 위한 하나 이상의 다른 작용제를 추가로 포함하는 키트.
- 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하며, 여기서 제1 잔기가 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 치료 유효량의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애의 예방 또는 치료 방법.
- 카르복실산 기를 통해 제2 잔기에 공유 결합으로 연결되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하며, 여기서 제1 잔기가 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 치료 유효량의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애의 예방 또는 치료 방법.
- 제23항 또는 제24항에 있어서, 제1 잔기가 GABA 유사체인 방법.
- 제23항 또는 제24항에 있어서, 제1 잔기가 바클로펜, 비가바트린, 가바펜틴, 프레가발린 또는 γ-아미노-포스핀산 유도체인 방법.
- 제23항 또는 제24항에 있어서, 제2 잔기가 진통성 약물인 방법.
- 제23항 또는 제24항에 있어서, 제2 잔기가 비스테로이드성 항-염증성 약물 (NSAID), 오피오이드 또는 항-우울제인 방법.
- 제23항 또는 제24항에 있어서, 제2 잔기가 γ-히드록시부티르산 (GHB), 또는 GHB의 유사체, 유도체 또는 변이체인 방법.
- 제23항 또는 제24항에 있어서, 제1 잔기 및 제2 잔기가 에스테르 결합, 아미드 결합, 이민 결합, 카르바메이트 결합, 카르보네이트 결합, 티오에스테르 결합, 아실옥시카르바메이트 결합, 아실옥시카르보네이트 결합, 포스페이트 결합 및 아실옥시포스페이트 결합으로 이루어진 군으로부터 선택된 공유 결합을 통해 연결된 것인 방법.
- 제23항 또는 제24항에 있어서, 제1 잔기를 제2 잔기에 공유 결합으로 연결하는 링커를 추가로 포함하는 것인 방법.
- 제31항에 있어서, 링커가 생리학적으로 불안정한 것인 방법.
- 제23항 또는 제24항에 있어서, 화합물의 제1 잔기 또는 제2 잔기에 이온 결합 또는 공유 결합으로 연결된 제3 잔기를 추가로 포함하는 것인 방법.
- 제23항 또는 제24항에 있어서, 화합물이 하나 이상의 다른 치료제와 조합하여 사용될 수 있는 것인 방법.
- 제34항에 있어서, 치료제가 항-정신병 약물, 항불안제 약물, 항-우울제 약물, 진정제 약물, 항파킨슨병 약물, 아세틸콜린 에스테라아제 억제제, MAO 억제제, 선택적인 세로토닌 재흡수 억제제 (SSRI), N-메틸-D-아스파르트산 (NMDA) 길항제 및 선택적인 노르아드레날린 대체 억제제로 이루어진 군으로부터 선택되는 것인 방법.
- 제23항 또는 제24항에 있어서, 화합물 및 제약상 허용되는 담체를 포함하는 치료 유효량의 제약 조성물을 그를 필요로 하는 대상체에게 투여하는 것을 추가로 포함하는 방법.
- 제23항 또는 제24항에 있어서, 장애가 통증 또는 신경 장애인 방법.
- 제37항에 있어서, 통증이 급성, 만성 또는 염증성 상태인 방법.
- 제37항에 있어서, 신경 장애가 통증 장애, 불안증 장애, 우울증, 해리성 장애, 인격 장애, 인지 장애, 기분 장애, 정서 장애, 신경퇴행 장애, 경련성 장애, 파킨슨병, 알츠하이머병, 간질, 정신분열증, 편집증, 정신병, 헌팅턴병, 질 드 라 투렛(Gilles de la Tourette) 증후군, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 중독성 장애 및 하지 불안 증후군으로 이루어진 군으로부터 선택되는 것인 방법.
- 제23항 또는 제24항에 있어서, 대상체가 동물인 방법.
- 제40항에 있어서, 대상체가 인간인 방법.
- 제23항 또는 제24항에 있어서, 화합물 또는 제약 조성물의 투여가, 개별 잔기의 단독 투여와 비교하여 적어도 하나의 부작용을 덜 일으키는 것인 방법.
- 제23항 또는 제24항에 있어서, 화합물 또는 제약 조성물의 투여가, 개별 잔기의 단독 투여와 비교하여 치료 활성을 향상시키는 것인 방법.
- 제23항 또는 제24항에 있어서, 화합물 또는 제약 조성물이 또다른 작용제와 조합하여 투여되는 것인 방법.
- 제44항에 있어서, 다른 작용제가 화합물 또는 제약 조성물의 투여에 우선하여, 이와 함께 또는 이에 후속으로 투여되는 것인 방법.
- 제23항에 있어서, 산성 말단이 포스핀산 기 또는 술핀산 기를 포함하는 것인 방법.
- 제24항에 있어서, 보호 기가 아미노산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬 포스포르아미데이트, 또는 아실옥시카르바메이트를 포함하는 것인 방법.
- 제24항에 있어서, 보호 기가 제1 잔기의 아미노 기로부터 절단될 수 있는 것인 방법.
- 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하며, 여기서 제1 잔기가 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 치료 유효량의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애의 치료와 연관된 역작용을 감소시키는 방법.
- 카르복실산 기를 통해 제2 잔기에 공유 결합으로 연결되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하며, 여기서 제1 잔기가 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 치료 유효량의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애의 치료와 연관된 역작용을 감소시키는 방법.
- 제49항 또는 제50항에 있어서, 제1 잔기가 GABA 유사체인 방법.
- 제49항 또는 제50항에 있어서, 제1 잔기가 바클로펜, 비가바트린, 가바펜틴, 프레가발린 또는 γ-아미노-포스핀산 유도체인 방법.
- 제49항 또는 제50항에 있어서, 제2 잔기가 진통성 약물인 방법.
- 제49항 또는 제50항에 있어서, 제2 잔기가 비스테로이드성 항-염증성 약물 (NSAID), 오피오이드 또는 항-우울제인 방법.
- 제49항 또는 제50항에 있어서, 제2 잔기가 γ-히드록시부티르산 (GHB), 또는 GHB의 유사체, 유도체 또는 변이체인 방법.
- 제49항 또는 제50항에 있어서, 제1 잔기 및 제2 잔기가 에스테르 결합, 아미드 결합, 이민 결합, 카르바메이트 결합, 카르보네이트 결합, 티오에스테르 결합, 아실옥시카르바메이트 결합, 아실옥시카르보네이트 결합, 포스페이트 결합 및 아실옥시포스페이트 결합으로 이루어진 군으로부터 선택된 공유 결합을 통해 연결된 것인 방법.
- 제49항 또는 제50항에 있어서, 제1 잔기를 제2 잔기에 공유 결합으로 연결하는 링커를 추가로 포함하는 것인 방법.
- 제57항에 있어서, 링커가 생리학적으로 불안정한 것인 방법.
- 제49항 또는 제50항에 있어서, 화합물의 제1 잔기 또는 제2 잔기에 이온 결합 또는 공유 결합으로 연결된 제3 잔기를 추가로 포함하는 것인 방법.
- 제49항 또는 제50항에 있어서, 화합물이 하나 이상의 다른 치료제와 조합하여 사용될 수 있는 것인 방법.
- 제60항에 있어서, 치료제가 항-정신병 약물, 항불안제 약물, 항-우울제 약물, 진정제 약물, 항파킨슨병 약물, 아세틸콜린 에스테라아제 억제제, MAO 억제제, 선택적인 세로토닌 재흡수 억제제 (SSRI), N-메틸-D-아스파르트산 (NMDA) 길항제 및 선택적인 노르아드레날린 대체 억제제로 이루어진 군으로부터 선택되는 것인 방법.
- 제49항 또는 제50항에 있어서, 화합물 및 제약상 허용되는 담체를 포함하는 치료 유효량의 제약 조성물을 그를 필요로 하는 대상체에게 투여하는 것을 추가로 포함하는 방법.
- 제49항 또는 제50항에 있어서, 장애가 통증, 또는 신경 질환 또는 장애인 방법.
- 제63항에 있어서, 통증이 급성, 만성 또는 염증성 상태인 방법.
- 제63항에 있어서, 신경 장애가 통증 장애, 불안증 장애, 우울증, 해리성 장애, 인격 장애, 인지 장애, 기분 장애, 정서 장애, 신경퇴행 장애, 경련성 장애, 파킨슨병, 알츠하이머병, 간질, 정신분열증, 편집증, 정신병, 헌팅턴병, 질 드 라 투렛 증후군, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 중독성 장애 및 하지 불안 증후군으로 이루어진 군으로부터 선택되는 것인 방법.
- 제49항 또는 제50항에 있어서, 대상체가 인간인 방법.
- 제49항 또는 제50항에 있어서, 역부작용이 경직, 떨림, 서동, 완서, 지발성 안면마비, 강직증, 급성 근긴장 이상반응 및 정좌불능증으로 이루어진 군으로부터 선택되는 것인 방법.
- 제49항에 있어서, 산성 말단이 포스핀산 기 또는 술핀산 기를 포함하는 것인 방법.
- 제50항에 있어서, 보호 기가 아미노산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬 포스포르아미데이트, 또는 아실옥시카르바메이트를 포함하는 것인 방법.
- 제50항에 있어서, 보호 기가 제1 잔기의 아미노 기로부터 절단될 수 있는 것인 방법.
- 카르복실산 기 이외의 아미노 말단 또는 산성 말단을 통해 제2 잔기에 공유 결합으로 연결된 제1 잔기, 및 제2 잔기를 포함하며, 여기서 제1 잔기가 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 치료 유효량의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애 치료의 치료 효능을 향상시키는 방법.
- 카르복실산 기를 통해 제2 잔기에 공유 결합으로 연결되고 그의 아미노 말단이 보호 기에 연결된 제1 잔기, 및 제2 잔기를 포함하며, 여기서 제1 잔기가 γ-아미노부티르산 (GABA), 또는 GABA의 유사체 또는 유도체인 치료 유효량의 화합물을 그를 필요로 하는 대상체에게 투여하는 것을 포함하는, 장애 치료의 치료 효능을 향상시키는 방법.
- 제71항 또는 제72항에 있어서, 제1 잔기가 GABA 유사체인 방법.
- 제71항 또는 제72항에 있어서, 제1 잔기가 바클로펜, 비가바트린, 가바펜틴 또는 프레가발린인 방법.
- 제71항 또는 제72항에 있어서, 제2 잔기가 진통성 약물인 방법.
- 제71항 또는 제72항에 있어서, 제2 잔기가 비스테로이드성 항-염증성 약물 (NSAID), 오피오이드 또는 항-우울제인 방법.
- 제71항 또는 제72항에 있어서, 제2 잔기가 γ-히드록시부티르산 (GHB), 또는 GHB의 유사체, 유도체 또는 변이체인 방법.
- 제71항 또는 제72항에 있어서, 제1 잔기 및 제2 잔기가 에스테르 결합, 아미드 결합, 이민 결합, 카르바메이트 결합, 카르보네이트 결합, 티오에스테르 결합, 아실옥시카르바메이트 결합, 아실옥시카르보네이트 결합, 포스페이트 결합 및 아실옥시포스페이트 결합으로 이루어진 군으로부터 선택된 공유 결합을 통해 연결된 것인 방법.
- 제71항 또는 제72항에 있어서, 제1 잔기를 제2 잔기에 공유 결합으로 연결하는 링커를 추가로 포함하는 것인 방법.
- 제79항에 있어서, 링커가 생리학적으로 불안정한 것인 방법.
- 제71항 또는 제72항에 있어서, 화합물의 제1 잔기 또는 제2 잔기에 이온 결합 또는 공유 결합으로 연결된 제3 잔기를 추가로 포함하는 것인 방법.
- 제71항 또는 제72항에 있어서, 화합물이 하나 이상의 다른 치료제와 조합하여 사용될 수 있는 것인 방법.
- 제82항에 있어서, 치료제가 항-정신병 약물, 항불안제 약물, 항-우울제약물, 진정제 약물, 항파킨슨병 약물, 아세틸콜린 에스테라아제 억제제, MAO 억제제, 선택적인 세로토닌 재흡수 억제제 (SSRI), N-메틸-D-아스파르트산 (NMDA) 길항제 및 선택적인 노르아드레날린 대체 억제제로 이루어진 군으로부터 선택되는 것인 방법.
- 제82항에 있어서, 다른 작용제가 화합물의 투여에 우선하여, 이와 함께 또는 이에 후속으로 투여되는 것인 방법.
- 제71항 또는 제72항에 있어서, 화합물 및 제약상 허용되는 담체를 포함하는 치료 유효량의 제약 조성물을 그를 필요로 하는 대상체에게 투여하는 것을 추가로 포함하는 방법.
- 제71항 또는 제72항에 있어서, 장애가 통증, 또는 신경 질환 또는 장애인 방법.
- 제86항에 있어서, 통증이 급성, 만성 또는 염증성 상태인 방법.
- 제86항에 있어서, 신경 장애가 통증 장애, 불안증 장애, 우울증, 해리성 장애, 인격 장애, 인지 장애, 기분 장애, 정서 장애, 신경퇴행 장애, 경련성 장애, 파킨슨병, 알츠하이머병, 간질, 정신분열증, 편집증, 정신병, 헌팅턴병, 질 드 라 투렛 증후군, 실신 발작, 운동감소증, 두개 장애, 신경퇴행 장애, 공황, 불면증, 중독성 장애 및 하지 불안 증후군으로 이루어진 군으로부터 선택되는 것인 방법.
- 제71항 또는 제72항에 있어서, 대상체가 인간인 방법.
- 제71항 또는 제72항에 있어서, 향상된 치료 효능이 화합물의 증가된 흡수 또는 증가된 반감기에 기인한 것인 방법.
- 제71항에 있어서, 산성 말단이 포스핀산 기 또는 술핀산 기를 포함하는 것인 방법.
- 제72항에 있어서, 보호 기가 아미노산, 이민, 카르바메이트, N-디티아숙신이미드, 모노- 또는 디-알킬 포스포르아미데이트, 또는 아실옥시카르바메이트를 포함하는 것인 방법.
- 제72항에 있어서, 보호 기가 제1 잔기의 아미노 기로부터 절단될 수 있는 것인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10380008P | 2008-10-08 | 2008-10-08 | |
| US61/103,800 | 2008-10-08 | ||
| PCT/US2009/060058 WO2010042759A2 (en) | 2008-10-08 | 2009-10-08 | Gaba conjugates and methods of use thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20110081839A true KR20110081839A (ko) | 2011-07-14 |
| KR101810246B1 KR101810246B1 (ko) | 2017-12-18 |
Family
ID=42101220
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117010420A KR101810246B1 (ko) | 2008-10-08 | 2009-10-08 | Gaba 접합체 및 그의 사용 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (3) | US8268887B2 (ko) |
| EP (2) | EP3075722A1 (ko) |
| JP (2) | JP2012505238A (ko) |
| KR (1) | KR101810246B1 (ko) |
| CN (2) | CN102216257B (ko) |
| AU (1) | AU2009302241B2 (ko) |
| BR (1) | BRPI0919811B1 (ko) |
| CA (1) | CA2740087C (ko) |
| ES (1) | ES2589915T3 (ko) |
| HK (1) | HK1220970A1 (ko) |
| WO (1) | WO2010042759A2 (ko) |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010042759A2 (en) | 2008-10-08 | 2010-04-15 | Kyphia Pharmaceuticals Inc | Gaba conjugates and methods of use thereof |
| US20120148595A1 (en) * | 2009-03-12 | 2012-06-14 | Luitpold Pharmaceuticals, Inc. | Gaba-linked anthracycline-lipid conjugates |
| CA2759251C (en) | 2009-04-23 | 2017-01-03 | Concert Pharmaceuticals, Inc. | 4-hydroxybutyric acid analogs |
| WO2012025213A2 (en) * | 2010-08-23 | 2012-03-01 | Grünenthal GmbH | Novel therapeutic compounds |
| ES2804540T3 (es) * | 2011-02-14 | 2021-02-08 | Concert Pharmaceuticals Inc | Análogos deuterados de ácido 4hidroxibutírico |
| WO2012161798A1 (en) * | 2011-02-25 | 2012-11-29 | Catabasis Pharmaceuticals, Inc. | Fatty acid gamma aminobutyric acid (gaba) conjugates and their uses |
| CN103193669B (zh) * | 2013-02-27 | 2014-10-01 | 南京医科大学 | nNOS-Capon解偶联化合物及其制备方法和应用 |
| EA035190B1 (ru) | 2014-06-02 | 2020-05-12 | Кетоген Инк. | Соединения для лечения судорог и других расстройств и патологических состояний центральной нервной системы |
| CA3045004A1 (en) * | 2015-12-16 | 2017-06-22 | Achelios Therapeutics, Inc. | Methods and compositions for treating peripheral neuropathy |
| CN105777586A (zh) * | 2016-04-14 | 2016-07-20 | 安徽省逸欣铭医药科技有限公司 | S(+)氨己烯酸酯衍生物及其制备方法和用途 |
| US11602512B1 (en) | 2016-07-22 | 2023-03-14 | Flamel Ireland Limited | Modified release gamma-hydroxybutyrate formulations having improved pharmacokinetics |
| US11602513B1 (en) | 2016-07-22 | 2023-03-14 | Flamel Ireland Limited | Modified release gamma-hydroxybutyrate formulations having improved pharmacokinetics |
| UY37341A (es) | 2016-07-22 | 2017-11-30 | Flamel Ireland Ltd | Formulaciones de gamma-hidroxibutirato de liberación modificada con farmacocinética mejorada |
| US11504347B1 (en) | 2016-07-22 | 2022-11-22 | Flamel Ireland Limited | Modified release gamma-hydroxybutyrate formulations having improved pharmacokinetics |
| US11986451B1 (en) | 2016-07-22 | 2024-05-21 | Flamel Ireland Limited | Modified release gamma-hydroxybutyrate formulations having improved pharmacokinetics |
| US10092538B2 (en) | 2016-10-21 | 2018-10-09 | Axim Biotechnologies, Inc. | Suppositories comprising cannabinoids |
| US10456386B2 (en) * | 2017-02-02 | 2019-10-29 | Otolanum Ag | Pharmaceutical composition comprising betahistine |
| JP7441181B2 (ja) * | 2018-05-14 | 2024-02-29 | エックスジーン ファーマシューティカル インク. | ナプロキセンとプレガバリンの1-(アシルオキシ)-アルキルカルバメート薬品複合体の結晶形態 |
| CN108863873A (zh) * | 2018-06-26 | 2018-11-23 | 台州学院 | 一种硫烯丙基碳酸酯类化合物及其制备方法 |
| KR102107304B1 (ko) * | 2018-08-24 | 2020-05-06 | (주)엠앤씨생명과학 | 천연 리포좀, 그 제조방법 및 이를 포함하는 식품 조성물 |
| AU2020231916A1 (en) | 2019-03-01 | 2021-08-05 | Flamel Ireland Limited | Gamma-hydroxybutyrate compositions having improved pharmacokinetics in the fed state |
| WO2023019154A1 (en) * | 2021-08-11 | 2023-02-16 | Tris Pharma, Inc. | Oxybate polyethylene glycol prodrugs |
| CN114452256A (zh) * | 2021-12-31 | 2022-05-10 | 浙江大学 | 脊髓损伤靶向药物、聚合物-疏水化合物胶束及其制备方法 |
| US11583510B1 (en) | 2022-02-07 | 2023-02-21 | Flamel Ireland Limited | Methods of administering gamma hydroxybutyrate formulations after a high-fat meal |
| US11779557B1 (en) | 2022-02-07 | 2023-10-10 | Flamel Ireland Limited | Modified release gamma-hydroxybutyrate formulations having improved pharmacokinetics |
| WO2023215323A1 (en) * | 2022-05-02 | 2023-11-09 | The Regents Of The University Of California | Intranasal baclofen |
| WO2024109817A1 (en) * | 2022-11-24 | 2024-05-30 | Xgene Pharmaceutical Inc. | Naproxen and pregabalin 1- (acyloxy) -alkyl carbamate drug conjugate purification process |
| WO2024196851A1 (en) * | 2023-03-17 | 2024-09-26 | Northwestern University | Bicyclic compounds as inactivators of oat and gaba-at |
| CN116585298A (zh) * | 2023-06-30 | 2023-08-15 | 江苏海洋大学 | 一种偶联药物及其组合物和应用 |
Family Cites Families (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US404175A (en) | 1889-05-28 | O g o o o | ||
| US3625214A (en) | 1970-05-18 | 1971-12-07 | Alza Corp | Drug-delivery device |
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US3916899A (en) | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| DE2460891C2 (de) | 1974-12-21 | 1982-09-23 | Gödecke AG, 1000 Berlin | 1-Aminomethyl-1-cycloalkanessigsäuren und deren Ester, Verfahren zu deren Herstellung und diese Verbindungen enthaltende Arzneimittel |
| IL67445A (en) * | 1982-12-09 | 1985-11-29 | Teva Pharma | Ethoxycarbonyloxy ethyl esters of non-steroidal anti-inflammatory carboxylic acids |
| US4906474A (en) | 1983-03-22 | 1990-03-06 | Massachusetts Institute Of Technology | Bioerodible polyanhydrides for controlled drug delivery |
| EP0130119B1 (en) | 1983-06-23 | 1988-11-09 | Merck & Co. Inc. | (acyloxyalkoxy) carbonyl derivatives as bioreversible prodrug moieties for primary and secondary amine functions in drugs, their preparation and pharmaceutical compositions containing said derivatives |
| US4789734A (en) | 1985-08-06 | 1988-12-06 | La Jolla Cancer Research Foundation | Vitronectin specific cell receptor derived from mammalian mesenchymal tissue |
| US5023252A (en) | 1985-12-04 | 1991-06-11 | Conrex Pharmaceutical Corporation | Transdermal and trans-membrane delivery of drugs |
| ES2035824T3 (es) | 1986-03-14 | 1993-05-01 | Fujisawa Pharmaceutical Co., Ltd. | Procedimiento para preparar compuestos profarmacos y preparaciones que los contienen. |
| AU610083B2 (en) | 1986-08-18 | 1991-05-16 | Clinical Technologies Associates, Inc. | Delivery systems for pharmacological agents |
| US5811128A (en) | 1986-10-24 | 1998-09-22 | Southern Research Institute | Method for oral or rectal delivery of microencapsulated vaccines and compositions therefor |
| US5075109A (en) | 1986-10-24 | 1991-12-24 | Southern Research Institute | Method of potentiating an immune response |
| US4992445A (en) | 1987-06-12 | 1991-02-12 | American Cyanamid Co. | Transdermal delivery of pharmaceuticals |
| US5001139A (en) | 1987-06-12 | 1991-03-19 | American Cyanamid Company | Enchancers for the transdermal flux of nivadipine |
| US4897268A (en) | 1987-08-03 | 1990-01-30 | Southern Research Institute | Drug delivery system and method of making the same |
| US5766573A (en) | 1988-12-06 | 1998-06-16 | Riker Laboratories, Inc. | Medicinal aerosol formulations |
| AU9137091A (en) | 1990-11-27 | 1992-06-25 | Northwestern University | Gaba and l-glutamic acid analogs for antiseizure treatment |
| US6197819B1 (en) | 1990-11-27 | 2001-03-06 | Northwestern University | Gamma amino butyric acid analogs and optical isomers |
| US5190029A (en) | 1991-02-14 | 1993-03-02 | Virginia Commonwealth University | Formulation for delivery of drugs by metered dose inhalers with reduced or no chlorofluorocarbon content |
| ES2165857T3 (es) | 1992-05-20 | 2002-04-01 | Univ Northwestern | Analogos de gaba y acido l-glutamico para el tratamiento de trastornos del sistema nervioso central. |
| US5376359A (en) | 1992-07-07 | 1994-12-27 | Glaxo, Inc. | Method of stabilizing aerosol formulations |
| CA2153391C (en) | 1993-01-11 | 2000-08-15 | Kenneth Rock | Inducing cytotoxic t lymphocyte responses |
| DE69712877T2 (de) | 1996-02-07 | 2002-11-14 | Warner-Lambert Co., Morris Plains | Zyklischaminosäure als pharmazeutische mittel |
| CZ293759B6 (cs) | 1996-03-14 | 2004-07-14 | Warner-Lambert Company | Substituovaná cyklická aminokyselina, její použití a farmaceutický prostředek na její bázi |
| IL125364A0 (en) | 1996-03-14 | 1999-03-12 | Warner Lambert Co | Novel bridged cyclic amino acids and pharmaceutical compositions containing them |
| CA2263663C (en) | 1996-10-23 | 2006-05-30 | Justin Stephen Bryans | Substituted gamma aminobutyric acids as pharmaceutical agents |
| AU8668598A (en) | 1997-08-20 | 1999-03-08 | University Of Oklahoma, The | Gaba analogs to prevent and treat gastrointestinal damage |
| WO1999012537A1 (en) | 1997-09-08 | 1999-03-18 | Warner-Lambert Company | Analgesic compositions comprising anti-epileptic compounds and methods of using same |
| ATE323067T1 (de) | 1997-10-27 | 2006-04-15 | Warner Lambert Co | Zyklische aminosäuren und deren derivate als arzneimittel |
| IL135315A0 (en) | 1997-12-16 | 2001-05-20 | Warner Lambert Co | 4(3)-substituted-4(3)-aminomethyl-(thio)pyran or -piperidine derivatives (gabapentin analogues), their preparation and their use in the treatment of neurological disorders |
| NZ503981A (en) | 1997-12-16 | 2002-12-20 | Warner Lambert Co | Novel amines, pharmaceutical compositions containing these amines, and uses thereof |
| HUP0004439A3 (en) | 1997-12-16 | 2001-12-28 | Warner Lambert Co | 1-substituted-1-aminomethyl-cycloalkane derivatives (=gabapentin analogues), their preparation and their use in the treatment of neurological disorders |
| US6316638B1 (en) | 1998-05-26 | 2001-11-13 | Warner-Lambert Company | Conformationally constrained amino acid compounds having affinity for the alpha2delta subunit of a calcium channel |
| EP1112253B1 (en) | 1998-09-14 | 2004-10-20 | Warner-Lambert Company LLC | Branched alkyl pyrrolidine-3-carboxylic acids |
| GB9819926D0 (en) | 1998-09-14 | 1998-11-04 | Mead Corp | A tray container and blank |
| WO2000031020A1 (en) | 1998-11-25 | 2000-06-02 | Warner-Lambert Company | Improved gamma amino butyric acid analogs |
| EP1031350A1 (en) | 1999-02-23 | 2000-08-30 | Warner-Lambert Company | Use of a gabapentin-analog for the manufacture of a medicament for preventing and treating visceral pain |
| US6451857B1 (en) | 1999-03-10 | 2002-09-17 | Warner-Lambert Company | Analgesic compositions comprising anti-epileptic compounds and methods of using same |
| EP1296671B1 (en) | 2000-06-26 | 2008-03-26 | Warner-Lambert Company LLC | Gabapentin analogues for sleep disorders |
| IL158882A0 (en) | 2001-06-05 | 2004-05-12 | Control Delivery Sys Inc | Sustained-release analgesic compounds |
| US6818787B2 (en) * | 2001-06-11 | 2004-11-16 | Xenoport, Inc. | Prodrugs of GABA analogs, compositions and uses thereof |
| US7544681B2 (en) * | 2001-09-27 | 2009-06-09 | Ramot At Tel Aviv University Ltd. | Conjugated psychotropic drugs and uses thereof |
| CN101445494A (zh) * | 2001-09-27 | 2009-06-03 | 特拉维夫大学拉莫特有限公司 | 共轭的精神抑制药及其用途 |
| US7045543B2 (en) | 2001-11-05 | 2006-05-16 | Enzrel Inc. | Covalent conjugates of biologically-active compounds with amino acids and amino acid derivatives for targeting to physiologically-protected sites |
| ITMI20022658A1 (it) | 2002-12-17 | 2004-06-18 | Nicox Sa | Farmaci per il dolore cronico. |
| GB0405200D0 (en) | 2004-03-08 | 2004-04-21 | Pfizer Ltd | Combinations comprising alpha-2-delta ligands |
| WO2005102390A2 (en) | 2004-04-22 | 2005-11-03 | Pfizer Japan, Inc. | Combinations comprising alpha-2-delta ligands and nmda receptor antagonists |
| EP1874269A2 (en) | 2005-04-19 | 2008-01-09 | Alza Corporation | Combination of tramadol and substances that comprise gabapentin |
| CN101247837B (zh) * | 2005-06-07 | 2013-03-20 | 特拉维夫大学拉莫特有限公司 | 新的轭合精神活性药物的盐及其制备方法 |
| US7994220B2 (en) | 2005-09-28 | 2011-08-09 | Cypress Bioscience, Inc. | Milnacipran for the long-term treatment of fibromyalgia syndrome |
| MXPA05011735A (es) | 2005-11-01 | 2007-04-30 | Leopoldo Espinosa Abdala | Composiciones farmaceuticas que comprenden combinaciones de analgesicos y anticonvulsivantes para el tratamiento del dolor agudo y cronico. |
| EP1820502A1 (en) | 2006-02-10 | 2007-08-22 | Laboratorios Del Dr. Esteve, S.A. | Active substance combination comprising azolylcarbinol compounds |
| ES2393933T3 (es) | 2006-07-17 | 2013-01-02 | Ramot, At Tel Aviv University Ltd. | Conjugados que comprenden un fármaco psicotrópico o un agonista GABA y un ácido orgánico y su uso para el tratamiento del dolor y otros transtornos del SNC |
| WO2008011016A2 (en) | 2006-07-18 | 2008-01-24 | Dynogen Pharmaceuticals, Inc. | Treating gastroesophageal reflux disease with 5-ht3- and gaba receptor agonists |
| WO2008009663A1 (en) | 2006-07-19 | 2008-01-24 | Boehringer Ingelheim International Gmbh | Treatment of pain |
| JP2010512314A (ja) * | 2006-12-08 | 2010-04-22 | ゼノポート,インコーポレーテッド | 疾患を治療するためのgabaアナログのプロドラッグの使用 |
| WO2010042759A2 (en) | 2008-10-08 | 2010-04-15 | Kyphia Pharmaceuticals Inc | Gaba conjugates and methods of use thereof |
-
2009
- 2009-10-08 WO PCT/US2009/060058 patent/WO2010042759A2/en active Application Filing
- 2009-10-08 CA CA2740087A patent/CA2740087C/en active Active
- 2009-10-08 BR BRPI0919811-3A patent/BRPI0919811B1/pt active IP Right Grant
- 2009-10-08 CN CN200980145237.6A patent/CN102216257B/zh active Active
- 2009-10-08 KR KR1020117010420A patent/KR101810246B1/ko active IP Right Grant
- 2009-10-08 ES ES09819911.0T patent/ES2589915T3/es active Active
- 2009-10-08 CN CN201510667046.3A patent/CN105330603A/zh active Pending
- 2009-10-08 JP JP2011531180A patent/JP2012505238A/ja not_active Withdrawn
- 2009-10-08 EP EP16159660.6A patent/EP3075722A1/en not_active Withdrawn
- 2009-10-08 AU AU2009302241A patent/AU2009302241B2/en active Active
- 2009-10-08 EP EP09819911.0A patent/EP2344447B1/en active Active
- 2009-10-08 US US12/576,136 patent/US8268887B2/en active Active
-
2012
- 2012-08-09 US US13/571,268 patent/US9186341B2/en active Active
-
2015
- 2015-02-23 JP JP2015032554A patent/JP6167123B2/ja active Active
- 2015-10-09 US US14/879,752 patent/US10478412B2/en active Active
-
2016
- 2016-07-28 HK HK16109028.9A patent/HK1220970A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| WO2010042759A2 (en) | 2010-04-15 |
| ES2589915T3 (es) | 2016-11-17 |
| EP2344447B1 (en) | 2016-06-08 |
| US20160256558A1 (en) | 2016-09-08 |
| US8268887B2 (en) | 2012-09-18 |
| EP2344447A4 (en) | 2012-04-25 |
| JP2012505238A (ja) | 2012-03-01 |
| BRPI0919811B1 (pt) | 2022-04-19 |
| JP2015120740A (ja) | 2015-07-02 |
| WO2010042759A3 (en) | 2010-07-15 |
| US9186341B2 (en) | 2015-11-17 |
| AU2009302241B2 (en) | 2015-10-29 |
| CN105330603A (zh) | 2016-02-17 |
| AU2009302241A1 (en) | 2010-04-15 |
| KR101810246B1 (ko) | 2017-12-18 |
| BRPI0919811A8 (pt) | 2017-10-03 |
| EP2344447A2 (en) | 2011-07-20 |
| US10478412B2 (en) | 2019-11-19 |
| US20130035352A1 (en) | 2013-02-07 |
| CA2740087A1 (en) | 2010-04-15 |
| US20100113497A1 (en) | 2010-05-06 |
| CN102216257A (zh) | 2011-10-12 |
| JP6167123B2 (ja) | 2017-07-19 |
| CA2740087C (en) | 2019-07-23 |
| HK1220970A1 (zh) | 2017-05-19 |
| CN102216257B (zh) | 2015-11-25 |
| BRPI0919811A2 (ko) | 2017-08-29 |
| EP3075722A1 (en) | 2016-10-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10478412B2 (en) | GABA conjugates and methods of use thereof | |
| CN102985402B (zh) | 反苯环丙胺衍生物作为组蛋白去甲基酶lsd1和/或lsd2的抑制剂 | |
| ES2378776T3 (es) | Derivado de ácido aminocarboxílico y uso medicinal del mismo | |
| ES2585262T3 (es) | Compuestos heterocíclicos de hexahidropiran[3,4-d][1,3]tiazin-2-amina sustituidos como inhibidores de PPA, BACE1 y BACE2 | |
| US7897598B2 (en) | Inhibitors of the anandamide transporter | |
| JP2013010773A (ja) | 新規バイオ開裂性リンカー | |
| KR20060073929A (ko) | 질환 치료에 유용한 세미카르바지드 민감성 아민옥시다제(ssao) 및 vap-1 매개 유착의 억제제 | |
| CN103648490A (zh) | 胞内酶用于释放共价连接的生物活性物的用途 | |
| JP2004522710A (ja) | 性機能障害の治療 | |
| Göschke et al. | Novel 2, 7-dialkyl-substituted 5 (S)-amino-4 (S)-hydroxy-8-phenyl-octanecarboxamide transition state peptidomimetics are potent and orally active inhibitors of human renin | |
| US20170224684A1 (en) | Histone deacetylase inhibitors and compositions and methods of use thereof | |
| RU2320369C2 (ru) | Комбинации, содержащие альфа-2-дельта лиганды и ингибиторы обратного захвата серотонина/норадреналина | |
| US20140342989A1 (en) | Novel N-Benzylamide Substituted Derivatives of 2-(Acylamido)acetic Acid and 2-(Acylamido)propionic Acids: Potent Neurological Agents | |
| US8309514B2 (en) | Peptide nucleic acid based guanidinium compounds | |
| Varghese et al. | Polyaminohydroxamic acids and polyaminobenzamides as isoform selective histone deacetylase inhibitors | |
| JP2006070021A (ja) | アナンダミドトランスポーターの阻害剤 | |
| US9505743B2 (en) | Matrix metalloproteinase inhibitors and methods for the treatment of pain and other diseases | |
| ES2694202T3 (es) | Idebenona deuterada | |
| CN101898977A (zh) | Gaba偶合物及其使用方法 | |
| RU2433121C2 (ru) | Производное аминокарбоновой кислоты и применение указанного вещества в медицинских целях |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| N231 | Notification of change of applicant | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |