KR20110063528A - 세포 증식 억제제로서의 피리도(5,4―d)피리미딘 - Google Patents
세포 증식 억제제로서의 피리도(5,4―d)피리미딘 Download PDFInfo
- Publication number
- KR20110063528A KR20110063528A KR1020117008042A KR20117008042A KR20110063528A KR 20110063528 A KR20110063528 A KR 20110063528A KR 1020117008042 A KR1020117008042 A KR 1020117008042A KR 20117008042 A KR20117008042 A KR 20117008042A KR 20110063528 A KR20110063528 A KR 20110063528A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- hydrogen
- compound
- optionally substituted
- membered
- Prior art date
Links
- 0 **=C(*=C(C(*)=I)Nc1ncnc2c1nc(*)nc2N)C(N*)=O Chemical compound **=C(*=C(C(*)=I)Nc1ncnc2c1nc(*)nc2N)C(N*)=O 0.000 description 1
- YBAUXEUJXJTKCH-UHFFFAOYSA-N CSc(nc1)nc2c1ncnc2Cl Chemical compound CSc(nc1)nc2c1ncnc2Cl YBAUXEUJXJTKCH-UHFFFAOYSA-N 0.000 description 1
- YEPWCJHMSVABPQ-UHFFFAOYSA-N Cc(c(N)c1)ccc1C(OC)=O Chemical compound Cc(c(N)c1)ccc1C(OC)=O YEPWCJHMSVABPQ-UHFFFAOYSA-N 0.000 description 1
- YXSDTBSSXUZPLV-UHFFFAOYSA-N Cc(c(Nc1ncnc(cn2)c1nc2SC)c1)ccc1C(OC)=O Chemical compound Cc(c(Nc1ncnc(cn2)c1nc2SC)c1)ccc1C(OC)=O YXSDTBSSXUZPLV-UHFFFAOYSA-N 0.000 description 1
- OFKWGBWNWHBTNJ-UHFFFAOYSA-N Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(Cl)=O Chemical compound Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(Cl)=O OFKWGBWNWHBTNJ-UHFFFAOYSA-N 0.000 description 1
- ULMFVOPMJGFXPW-UHFFFAOYSA-N Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(Nc1cc(C(F)(F)F)cc(Br)c1)=O Chemical compound Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(Nc1cc(C(F)(F)F)cc(Br)c1)=O ULMFVOPMJGFXPW-UHFFFAOYSA-N 0.000 description 1
- DFMMSBQMVYZTJE-UHFFFAOYSA-N Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(O)=O Chemical compound Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(O)=O DFMMSBQMVYZTJE-UHFFFAOYSA-N 0.000 description 1
- BGJGAESRYPJNTJ-UHFFFAOYSA-N Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(OC)=O Chemical compound Cc(c(Nc1ncnc2c1nc(N1CCN(C)CC1)nc2N)c1)ccc1C(OC)=O BGJGAESRYPJNTJ-UHFFFAOYSA-N 0.000 description 1
- HJTLKVYOWNTDPF-UHFFFAOYSA-N Nc1cc(Br)cc(C(F)(F)F)c1 Chemical compound Nc1cc(Br)cc(C(F)(F)F)c1 HJTLKVYOWNTDPF-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Communicable Diseases (AREA)
- Transplantation (AREA)
- Oncology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
Description
본 발명은 다음 화학식 (1)의 신규한 화합물, 그의 토토머, 라세미체, 에난티오머, 디아스테레오머 및 이들의 혼합물, 상기한 모든 형태의 염 및 약제로서 그의 용도에 관한 것이다.
상기 식에서, R1 내지 R4, X1, X2, X3, L1 및 L2 그룹은 특허청구의 범위와 명세서 중에 기재된 의미를 가진다.
발명의 배경
신호전달과 연관되어 있는 티로신키나제를 억제하는 피리미도[5,4-d]피리미딘은 WO 96/07657, WO 97/32880 및 WO 97/32882에 기술되어 있다.
본 발명의 목적은 과도하거나 비정상적인 세포 증식을 특징으로 하는 질환의 예방 및/또는 치료에 사용될 수 있는 신규한 활성 물질을 개발하는 것이다.
발명의 상세한 설명
놀라웁게도, 화학식 (1)의 화합물(여기에서, R1 내지 R4, X1, X2, X3, L1 및 L2 그룹은 이하에 주어진 의미를 가진다.)이 세포 증식 조절과 연관된 특이적 시그널 효소의 억제제로서 작용하는 것을 발견하였다. 따라서, 본 발명에 따른 화합물은, 예를 들면, 시그널 효소의 활성과 연관되고 과도하거나 비정상적인 세포 증식을 특징으로 하는 질환의 치료에 사용할 수 있다.
그러므로, 본 발명은 임의로 토토머, 라세미체, 에난티오머, 디아스테레오머 및 이들의 혼합물 형태로 존재할 수 있는 화학식 (1)의 화합물, 또는 상기한 모든 형태의 약리학적으로 허용가능한 염에 관한 것이다:
상기 식에서,
R1은 수소 또는 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되거나, 또는 -ORc, -SRc, -NRcRc, -NRgNRcRc 및 -S(O)Rc 중에서 선택되는 적합한 치환체이고;
R2는 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
R3는 수소, C1-4알킬, 할로겐, -OH, -O(C1-4알킬), -NH2, -NH(C1-4알킬) 및 -N(C1-4알킬)2 중에서 선택되고;
R4는 수소, -CN, -NO2, -NH2, -NH(C1-4알킬), -N(C1-4알킬)2, C1-4알킬, C1-4할로알킬, C1-4알콕시, C1-5시클로알킬 및 할로겐 중에서 선택되고;
X1, X2 및 X3는 질소와 CR4* 중에서 서로에 대해 독립적으로 각각 선택되고, 여기에서 X1, X2 및 X3 원자 중 2개 이하가 질소 원자일 수 있고 R4*는 수소, -CN, -NO2, -NH2, -NH(C1-4알킬), -N(C1-4알킬)2, C1-4알킬, C1-4할로알킬, C1-4알콕시, C1-5시클로알킬 및 할로겐 중에서 서로에 대해 독립적으로 각각 선택되고;
L1은 -CH2-, -NH-, -NMe-, -O- 및 -S- 중에서 선택되고;
L2는 -C(O)NH-, -C(O)N(C1-4알킬)-, -NHC(O)-, -N(C1-4알킬)C(O)-, -CH2-NHC(O)-, -C(O)-, -C(S)NH-, -NHC(S)-, -NHCH2-, -CH2NH-, -S(O)2NH-, -NHS(O)2, -NHC(O)NH-, -OC(O)NH- 및 -NHC(O)O- 중에서 선택되고;
각각의 Rb는 적합한 치환체이고, -ORc, -SRc, -NRcRc, -ONRcRc, -N(ORc)Rc, -NRgNRcRc, 할로겐, -CN, -NO2, -N3, -C(O)Rc, -C(O)ORc, -C(O)NRcRc, -C(0)NRgNRcRc, -C(0)NRg0Rc, -C(NRg)Rc, -N=CRcRc, -C(NRg)0Rc, -C(NRg)NRcRc, -C(NRg)NRgNRcRc, -C(N0Rg)Rc, -C(N0Rg)NRcRc, -C(NNRgRg)Rc, -OS(O)Rc, -OS(O)ORc, -OS(O)NRcRc, -OS(O)2Rc, -OS(O)2ORc, -OS(O)2NRcRc, -OC(O)Rc, -OC(O)ORc, -0C(0)NRcRc, -OC(NRg)Rc, -0C(NRg)NRcRc, -0NRgC(0)Rc, -S(O)Rc, -S(O)ORc, -S(O)NRcRc, -S(O)2Rc, -S(O)2ORc, -S(O)2NRcRc, -NRgC(0)Rc, -NRgC(0)0Rc, -NRgC(O)NRcRc, -NRgC(O)NRgNRcRc, -NRgC(NRg)Rc, -N=CRcNRcRc, -NRgC(NRg)0Rc, -NRgC(NRg)NRcRc, -NRgC(N0Rg)Rc, -NRgS(0)Rc, -NRgS(0)0Rc, -NRgS(O)2Rc, -NRgS(0)20Rc, -NRgS(O)2NRcRc, -NRgNRgC(0)Rc, -NRgNRgC(O)NRcRc, -NRgNRgC(NRg)Rc 및 -N(0Rg)C(0)Rc 및 2가 치환체 =0, =S, =NRg, =N0Rg, =NNRgRg 및 =NNRgC(0)NRgRg 중에서 서로에 대해 독립적으로 선택되지만, 2가 치환체들은 단지 방향족이 아닌 고리 시스템에서의 치환체일 수 있고;
각각의 Rc는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rd 및/또는 Re에 의해 임의로 치환된 그룹이고, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rd는 적합한 치환체이고, -ORe, -SRe, -NReRe, -ONReRe, -N(ORe)Re, -N(Rg)NReRe, 할로겐, -CN, -NO, -NO2, -N3, -C(O)Re, -C(O)ORe, -C(O)NReRe, -C(0)NRgNReRe, -C(0)NRg0Re, -C(NRg)Re, -N=CReRe, -C(NRg)0Re, -C(NRg)NReRe, -C(NRg)NRgNReRe, -C(N0Rg)Re, -C(N0Rg)NReRe, -C(NNRgRg)Re, -OS(O)Re, -OS(O)ORe, -OS(O)NReRe, -OS(O)2Re, -OS(O)2ORe, -OS(O)2NReRe, -OC(O)Re, -OC(O)ORe, -0C(0)NReRe, -OC(NRg)Re, -0C(NRg)NReRe, -0NRgC(0)Re, -S(O)Re, -S(O)ORe, -S(O)NReRe, -S(O)2Re, -S(O)2ORe, -S(O)2NReRe, -NRgC(0)Re, -NRgC(0)0Re, -NRgC(O)NReRe, -NRgC(O)NRgNReRe, -NRgC(NRg)Re, -N=CReNReRe, -NRgC(NRg)0Re, -NRgC(NRg)NReRe, -NRgC(NRg)SRe, -NRgC(N0Rg)Re, -NRgS(0)Re, -NRgS(0)0Re, -NRgS(O)2Re, -NRgS(0)20Re, -NRgS(O)2NReRe, -NRgNRgC(0)Re, -NRgNRgC(O)NReRe, -NRgNRgC(NRg)Re 및 -N(0Rg)C(0)Re 및 2가 치환체 =0, =S, =NRg, =N0Rg, =NNRgRg 및 =NNRgC(0)NRgRg 중에서 서로에 대해 독립적으로 선택되지만, 2가 치환체들은 단지 방향족이 아닌 고리 시스템에서의 치환체일 수 있고;
각각의 Re는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rf 및/또는 Rg에 의해 임의로 치환된 그룹이고, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rf는 적합한 치환체이고, -ORg, -SRg, -NRgRg, -ONRgRg, -N(ORg)Rg, -N(Rh)NRgRg, 할로겐, -CN, -NO2, -N3, -C(O)Rg, -C(O)ORg, -C(O)NRgRg, -C(0)NRhNRgRg, -C(0)NRh0Rg, -C(NRh)Rg, -N=CRgRg, -C(NRh)0Rg, -C(NRh)NRgRg, -C(NRh)NRhNRgRg, -C(N0Rh)Rg, -C(N0Rh)NRgRg, -C(NNRhRh)Rg, -OS(O)Rg, -OS(O)ORg, -OS(O)NRgRg, -OS(O)2Rg, -OS(O)2ORg, -OS(O)2NRgRg, -OC(O)Rg, -OC(O)ORg, -0C(0)NRgRg, -OC(NRh)Rg, -0C(NRh)NRgRg, -0NRhC(0)Rg, -S(O)Rg, -S(O)ORg, -S(O)NRgRg, -S(O)2Rg, -S(O)2ORg, -S(O)2NRgRg, -NRhC(0)Rg, -NRhC(0)0Rg, -NRhC(O)NRgRg, -NRhC(O)NRhNRgRg, -NRhC(NRh)Rg, -N=CRgNRgRg, -NRhC(NRh)0Rg, -NRhC(NRh)NRgRg, -NRhC(N0Rh)Rg, -NRhS(0)Rg, -NRhS(0)0Rg, -NRhS(O)2Rg, -NRhS(0)20Rg, -NRhS(O)2NRgRg, -NRhNRhC(0)Rg, -NRhNRhC(O)NRgRg, -NRhNRhC(NRh)Rg 및 -N(0Rh)C(0)Rg 및 2가 치환체 =0, =S, =NRh, =N0Rh, =NNRhRh 및 =NNRhC(0)NRhRh 중에서 서로에 대해 독립적으로 선택되지만, 2가 치환체들은 단지 방향족이 아닌 고리 시스템에서의 치환체일 수 있고;
각각의 Rg는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rh 에 의해 임의로 치환된 그룹을 나타내고, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rh는 서로에 대해 독립적으로 수소, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택된다.
일 양태(A1)에서 본 발명은 R3가 수소를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(A2)에서 본 발명은 R3가 -NH2 또는 -NHMe를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(B1)에서 본 발명은 R1이 수소를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(A1B1)에서 본 발명은 R1 및 R3가 수소를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(B2)에서 본 발명은 R1이 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되며, Rb 및 Rc가 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(B3)에서 본 발명은 R1이 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는, 3 내지 7원의 모노시클릭이고 질소를 포함하는 헤테로시클로알킬 또는 6 내지 10원의 바이시클릭이고 질소를 포함하는 헤테로시클로알킬이고, R1은 질소 원자에 의해 피리미도[5,4-d]피리미딘 구조에 결합하며, Rb 및 Rc가 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(B4)에서 본 발명은 R1이 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, 피페리딜, 퍼하이드로-1,4-디아제피닐, 피페라지닐, 옥타하이드로-피롤로[1,2-α]피라지닐, 2,5-디아자바이시클로[2,2,1]-헵틸, 옥타하이드로-피리도[1,2-α]피라지닐, 퍼하이드로-1,4-옥사제피닐, 모폴리닐, 피롤리디닐, 퍼하이드로아제피닐, 티오모폴리닐, 티아졸리디닐 및 아제티디닐 중에서 선택되고, R1은 질소 원자에 의해 피리미도[5,4-d]피리미딘 구조에 결합하며, Rb 및 Rc가 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(B5)에서 본 발명은 R1이 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 2-메틸-2,7-디아자스피로[4,4]노닐이고, 질소 원자에 의해 피리미도[5,4-d]피리미딘 구조에 결합하며, Rb 및 Rc가 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(B6)에서 본 발명은 B2 내지 B5의 구조적 양태 중 하나를 가지는 화합물 (1)에 관한 것으로, 여기에서 R1은 질소 원자에 의해 피리미도[5,4-d]피리미딘 구조에 결합하며, Rbl과 Rcl 중에서 독립적으로 각각 선택되는 하나 이상의 치환체로 임의로 치환되는 헤테로시클로알킬이고;
각각의 Rbl은 -ORcl, -NRclRcl, 할로겐, -C(O)Rcl 및 =0 중에서 서로에 대하여 독립적으로 선택되지만, 후자의 치환체는 단지 비방향족 고리 시스템에서 치환체일 수 있으며,
각각의 Rcl은 서로에 대하여 독립적으로 수소 또는 하나 이상의 같거나 다른 Rdl 및/또는 Rel으로 임의로 치환되는 그룹을 나타내고, C1-6알킬, 페닐, C3-10시클로알킬, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고,
각각의 Rdl은 -ORel 및 -NRelRel 중에서 서로에 대하여 독립적으로 선택되고,
각각의 Rel은 서로에 대하여 독립적으로 수소 또는 하나 이상의 같거나 다른 C1-6알킬로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C3-10시클로알킬, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택된다.
다른 양태(B7)에서 본 발명은 R1이 다음 중에서 선택되는 화합물 (1)에 관한 것이다:
다른 양태(B8)에서 본 발명은 R1이 -NRc2Rc3를 나타내고, Rc2 및 Rc3가 각각 앞서 정의된 Rc와 같이 정의되는 화합물 (1)에 관한 것이다.
다른 양태(B9)에서 본 발명은 화합물 (1)에 관한 것으로, 여기에서
R1은 -NRc2Rc3를 나타내고,
Rc2는 수소, C1-6알킬, C3-6시클로알킬, 페닐, 5 내지 6원의 헤테로아릴 및 3 내지 7원의 헤테로시클로알킬 중에서 선택되고,
Rc3는 하나 이상의 같거나 다른 Rd3 및 Re3로 임의로 치환되는 그룹이고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고,
각각의 Rd3는 서로에 대하여 독립적으로 할로겐, -NRe3Re3 및 -ORc3 중에서 선택되고,
각각의 Re3는 서로에 대하여 독립적으로 수소 또는 하나 이상의 같거나 다른 Rf3 및/또는 Rg3로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고,
각각의 Rf3는 -ORg3를 나타내고,
각각의 Rg3는 서로에 대하여 독립적으로 수소 및 C1-6알킬 중에서 각각 선택된다.
다른 양태(B10)에서 본 발명은 B8 또는 B9의 구조적 양태 중 하나를 가지는 화합물 (1)에 관한 것으로, 여기에서 Rc2는 수소를 나타낸다.
다른 양태(B11)에서 본 발명은 R1이 다음 중에서 선택되는 화합물 (1)에 관한 것이다:
다른 양태(B12)에서 본 발명은 B8 또는 B9의 구조적 양태 중 하나를 가지는 화합물 (1)에 관한 것으로, 여기에서 Rc2는 메틸 또는 에틸을 나타낸다.
다른 양태(B13)에서 본 발명은 R1이 다음 중에서 선택되는 화합물 (1)에 관한 것이다:
다른 양태(C1)에서 본 발명은 R4가 불소, 브롬, 염소 또는 메틸을 나타내는 화합물 (1)에 관한 것이다.
다른 양태(Dl)에서 본 발명은,
X1이 CR4*-1을 나타내고, X2는 CR4*-2를 나타내며, X3는 CR4*-3를 나타내고,
R4*-1, R4*-2 및 R4*-3는 각각 수소, 불소, 염소 및 메틸 중에서 선택되고 R4*-1, R4*-2 및 R4*-3 그룹 중 적어도 2개가 수소를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(D2)에서 본 발명은 X1, X2 및 X3가 각각 CH를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(D3)에서 본 발명은,
X1이 질소를 나타내고, X2는 CR4*-2를 나타내며, X3는 CR4*-3를 나타내고,
R4*-2 및 R4*-3는 각각 수소, 불소, 브롬, 염소 및 메틸 중에서 선택되고 R4*-2 및 R4*-3 그룹 중 적어도 하나가 수소를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(D4)에서 본 발명은 X1이 질소를 나타내고, X2가 CH를 나타내며, X3가 CH를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(El)에서 본 발명은 L1이 -NH- 또는 -NMe-를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(Fl)에서 본 발명은 R2가 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, C6-10아릴 및 5 내지 12원의 헤테로아릴 중에서 선택되고, Rb 및 Rc는 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(F2)에서 본 발명은 R2가 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, 페닐 및 5 내지 6원의 헤테로아릴 중에서 선택되고, Rb 및 Rc는 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(F3)에서 본 발명은 R2가 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 5 내지 6원의 헤테로아릴이고, Rb 및 Rc는 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(F4)에서 본 발명은 R2가 퓨릴, 티에닐, 피롤릴, 옥사졸릴, 티아졸릴, 트리아졸릴, 이소옥사졸릴, 이소티아졸릴, 피라졸릴, 이미다졸릴, 옥사디아졸릴, 티아디아졸릴, 피리딜 및 피리미딜 중에서 선택되는 헤테로아릴이고, C3-7시클로알킬, 페닐, 4 내지 7원의 헤테로시클로알킬, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 1-메틸프로필, 이소부틸, sec-부틸, tert-부틸, n-펜틸, 1-메틸부틸, 1-에틸프로필, 이소펜틸, 네오펜틸, 트리플루오로메틸, 디플루오로메틸, 플루오로메틸, tert-부톡시, 트리플루오로메톡시,
중에서 각각 독립적으로 선택되는, 1개 또는 2개의 치환체로 임의로 치환되는 화합물 (1)에 관한 것이다.
다른 양태(F5)에서 본 발명은 R2가 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 페닐이고, Rb 및 Rc는 이전에 정의된 바와 같은 화합물 (1)에 관한 것이다.
다른 양태(F6)에서 본 발명은 화합물 (1)에 관한 것으로, 여기에서
R5는 수소, C1-6알킬, -OC1-6알킬, C1-6할로알킬, -OC1-6할로알킬, C3-7시클로알킬 및 3 내지 7원의 헤테로시클로알킬 중에서 선택되고, 상기한 그룹 모두는 임의로 C1-6알킬, -CN 또는 -OH로 치환되며;
R6는 수소, C1-6알킬, -OC1-6알킬, C1-6할로알킬, -OC1-6할로알킬, -CN, -OH, 할로겐, -NHC1-6알킬 및 -N(C1-6알킬)2 중에서 선택되고, 후자의 2개는 알킬 잔기에서 -N(C1-6알킬)2 치환체에 의해 임의로 치환되며;
R7은 수소, -OC1-6알킬, 할로겐, -NHS(O)2C1-6알킬, -S(O)2NH2, -S(O)2NH2C1-6알킬, -S(O)2N(C1-6알킬)2,
중에서 선택되고;
R9은 수소 및 C1-6알킬 중에서 선택되고;
Rc4는 수소 또는 하나 이상의 같거나 다른 Rd4 및/또는 Re4로 임의로 치환되는 그룹이고, C1-6알킬 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되며;
각각의 Rd4는 적합한 치환체이고, -ORe4, -NRe4Re4 및 할로겐 중에서 서로에 대해 독립적으로 선택되고;
각각의 Re4는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rf4 및/또는 Rg4로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rf4는 적합한 치환체이고, 2가의 치환체 =O뿐만 아니라 -ORg4, -NRg4Rg4 및 할로겐 중에서 서로에 대해 독립적으로 선택되고, =O는 비방향족 고리 시스템에서만 치환체가 될 수 있으며;
각각의 Rg4는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rh4로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C3-10시클로알킬, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rh4는 C1-6알킬, 2가의 치환체 =O 중에서 서로에 대해 독립적으로 선택되고, =O는 비방향족 고리 시스템에서만 치환체가 될 수 있거나;
또는
-NR9Rc4 그룹은 Rd4 및 Re4 중에서 선택되는 하나 이상의 같거나 다른 그룹에 의해 임의로 치환되는, 질소를 함유하는, 3 내지 14원의 헤테로시클로알킬 또는 5 내지 12원의 헤테로아릴을 나타내며;
-NR9Re4 그룹은 Rf4 및 Rg4 중에서 선택되는 하나 이상의 같거나 다른 그룹에 의해 임의로 치환되는, 질소를 함유하는, 3 내지 14원의 헤테로시클로알킬 또는 5 내지 12원의 헤테로아릴을 나타내며;
-NR9Rg4 그룹은 하나 이상의 같거나 다른 Rh4 그룹에 의해 임의로 치환되는, 질소를 함유하는, 3 내지 14원의 헤테로시클로알킬 또는 5 내지 12원의 헤테로아릴을 나타내며;
R8은 수소, C1-6알킬, -OC1-6알킬, -CN, 할로겐, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택된다.
다른 양태(F7)에서, 본 발명은 R5 내지 R8 그룹 중 적어도 하나는 수소가 아닌, 구조적 양태 F6를 가지는 화합물 (1)에 관한 것이다.
다른 양태(F8)에서, 본 발명은 R5가 다음 중에서 선택되는, 구조적 양태 F6를 가지는 화합물 (1)에 관한 것이다:
다른 양태(F9)에서, 본 발명은 R2가 다음 중에서 선택되고 R'은 링커 유니트 L2와의 결합 부위를 나타내는 화합물 (1)에 관한 것이다:
다른 양태(10)에서, 본 발명은 R2가 다음 중에서 선택되고 R'은 링커 유니트 L2와의 결합 부위를 나타내는 화합물 (1)에 관한 것이다:
다른 양태(11)에서, 본 발명은 R2가 다음 중에서 선택되고 R'은 링커 유니트 L2와의 결합 부위를 나타내는 화합물 (1)에 관한 것이다:
다른 양태(G1)에서, 본 발명은 L2가 (R2)-NHC(O)-를 나타내는 화합물 (1)에 관한 것이다.
다른 양태(G2)에서, 본 발명은 L2가 (R2)-C(O)NH-를 나타내는 화합물 (1)에 관한 것이다.
본 발명에 따른 화합물 (1)의 상이한 분자 부분과 연관되어 있는 상기한 구조적 양태 A 내지 G 모두는 원하는 바와 같이 교환하여 바람직한 화합물 (1)을 얻도록 ABCDEFG 조합물을 형성할 수 있다. 각각의 ABCDEFG 조합물은 개별적인 구현예 또는 본 발명에 따른 화합물의 포괄적인 부분량을 나타내고 정의한다. 모든 개별적 구현예 또는 상기 조합물에 의해 규정되는 부분량은 명백히 포함되어 있고, 본 발명의 목적이다.
다른 양태에서, 본 발명은 약제로서의 화학식 (1)의 화합물-또는 약리학적으로 허용가능한 그의 염-에 관한 것이다.
다른 양태에서, 본 발명은 활성 물질로서 하나 이상의 화학식 (1)의 화합물 또는 약리학적으로 허용가능한 그의 염을, 임의로 통상적인 첨가제 및/또는 담체와 함께 포함하는 약학 제제에 관한 것이다.
다른 양태에서, 본 발명은 암, 감염, 염증 및 자가면역 질환의 치료 및/또는 예방에서 사용하기 위한 화학식 (1)의 화합물에 관한 것이다.
다른 양태에서, 본 발명은 암의 치료 및/또는 예방에서 사용하기 위한 화학식 (1)의 화합물에 관한 것이다.
다른 양태에서, 본 발명은 임의로 토토머, 라세미체, 에난티오머, 디아스테레오머 또는 이들의 혼합물 형태의 화학식 (1)의 화합물, 또는 상기한 모든 형태의 각각의 약리학적으로 허용가능한 염 및, 상기 화학식 (1)과는 상이한 적어도 하나의 세포증식억제 또는 세포독성 활성 물질을 포함하는 약학 제제에 관한 것이다.
정의
여기에서 사용된 바와 같이, 다른 언급이 없는 한, 다음 정의를 적용한다:
접두어 Cx-y(여기에서, x와 y는 각각의 경우에서 자연수(x < y)를 나타낸다.)의 사용은 연결 방향을 지칭하여 언급된 사슬 또는 환형 구조 또는 사슬과 환형 구조의 조합이 전체적으로 최대 y개의 탄소 원자와 최소 x개의 탄소 원자로 구성되는 것을 나타낸다.
하나 이상의 헤테로원자를 포함하는 그룹(헤테로알킬, 헤테로아릴, 헤테로아릴알킬, 헤테로시클로알킬, 헤테로시클로알킬알킬)에서 원자수에 대한 정보는 모든 고리 구성원자 또는 사슬 구성원자의 전체 원자수 또는 모든 고리와 사슬 원자의 전체를 지칭한다.
알킬은 포화 탄화수소 사슬과 불포화 탄화수소 사슬의 서브그룹으로 구성되며, 불포화 탄화수소 사슬 서브그룹은 또한 이중결합을 가지는 탄화수소 사슬(알케닐)과 삼중결합을 가지는 탄화수소 사슬(알키닐)로 재분류할 수 있다. 알케닐은 적어도 하나의 이중 결합을 포함하며, 알키닐은 적어도 하나의 삼중결합을 포함한다. 탄화수소 사슬이 적어도 하나의 이중결합과 적어도 하나의 삼중 결합을 모두 가지는 경우는 정의에 의해 알키닐 서브그룹에 속한다. 상기한 서브그룹들은 모두 직쇄(분지되지 않은) 및 측쇄로 세분할 수 있다. 알킬이 치환되는 경우, 수소를 보유하는 모든 탄소 원자에서 서로에 대하여 독립적으로 단일 또는 다중 치환될 수 있다. 개별적인 서브그룹의 예를 다음에 열거하였다:
직쇄상(분지되지 않은) 또는 측쇄상 포화 탄화수소:
메틸; 에틸; n-프로필; 이소프로필(1-메틸에틸); n-부틸; 1-메틸프로필; 이소부틸; (2-메틸프로필); sec-부틸 (1-메틸프로필); tert-부틸 (1.1-디메틸에틸); n-펜틸; 1-메틸부틸; 1-에틸프로필; 이소펜틸 (3-메틸부틸); 네오펜틸 (2,2-디메틸-프로필); n-헥실; 2,3-디메틸부틸; 2,2-디메틸부틸; 3,3-디메틸부틸; 2-메틸-펜틸; 3-메틸펜틸; n-헵틸; 2-메틸헥실; 3-메틸헥실; 2,2-디메틸펜틸; 2,3-디메틸펜틸; 2,4-디메틸펜틸; 3,3-디메틸펜틸; 2,2,3-트리메틸부틸; 3-에틸펜틸; n-옥틸; n-노닐; n-데실 등.
직쇄상(분지되지 않은) 또는 측쇄상 알케닐:
비닐 (에테닐); 프로프-1-에닐; 알릴 (프로프-2-에닐); 이소프로페닐; 부트-1-에닐; 부트-2-에닐; 부트-3-에닐; 2-메틸-프로프-2-에닐; 2-메틸-프로프-l-에닐; l-메틸-프로프-2-에닐; 1-메틸-프로프-1-에닐; 1-메틸리덴프로필; 펜트-1-에닐; 펜트-2-에닐; 펜트-3-에닐; 펜트-4-에닐; 3-메틸-부트-3-에닐; 3-메틸-부트-2-에닐; 3-메틸-부트-1-에닐; 헥스-1-에닐; 헥스-2-에닐; 헥스-3-에닐; 헥스-4-에닐; 헥스-5-에닐; 2,3-디메틸-부트-3-에닐; 2,3-디메틸-부트-2-에닐; 2-메틸리덴-3-메틸부틸; 2,3-디메틸-부트-1-에닐; 헥사-l,3-디에닐; 헥사-l,4-디에닐; 펜타-l,4-디에닐; 펜타-l,3-디에닐; 부타-l,3-디에닐; 2,3-디메틸부타-l,3-디엔 등.
직쇄상(분지되지 않은) 또는 측쇄상 알키닐:
에티닐; 프로프-1-이닐; 프로프-2-이닐; 부트-1-이닐; 부트-2-이닐; 부트-3-이닐; l-메틸-프로프-2-이닐 등.
프로필, 부틸, 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실 등의 용어는, 다른 언급이 없는 한 상응하는 수의 탄소 원자를 가지는 포화 탄화수소 그룹을 의미하며, 모든 이성질체를 포함한다.
프로페닐, 부테닐, 펜테닐, 헥세닐, 헵테닐, 옥테닐, 노네닐, 데세닐 등의 용어는, 다른 언급이 없는 한 상응하는 수의 탄소 원자와 하나의 이중결합을 가지는 불포화 탄화수소 그룹을 의미하며, 모든 이성질체, 또한 적용가능한 (Z)/(E)-이성질체를 포함한다.
부타디에닐, 펜타디에닐, 헥사디에닐, 헵타디에닐, 옥타디에닐, 노나디에닐, 데카디에닐 등의 용어는, 다른 언급이 없는 한 상응하는 수의 탄소 원자와 2개의 이중결합을 가지는 불포화 탄화수소 그룹을 의미하며, 적용가능한 모든 이성질체, 또한 (Z)/(E)-이성질체를 포함한다.
프로피닐, 부티닐, 펜티닐, 헥시닐, 헵티닐, 옥티닐, 노니닐, 데시닐 등의 용어는, 다른 언급이 없는 한 상응하는 수의 탄소 원자와 하나의 삼중결합을 가지는 불포화 탄화수소 그룹을 의미하며, 모든 이성질체를 포함한다.
앞서 정의된 알킬과 그의 서브그룹으로부터 알킬렌이란 용어도 유도할 수 있다. 알킬과 달리 알킬렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 알킬에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 -CH3와 -CH2, -CH2CH3와 -CH2CH2 또는 >CHCH3 등이 있다. 알킬의 모든 서브그룹에 대하여 알킬렌의 상응물이 있다.
헤테로원자는 산소, 질소 및 황 원자를 의미한다.
헤테로알킬이란 넓은 의미에서 앞서 정의된 바와 같은 알킬로부터 탄화수소 사슬 내에서 하나 이상의 -CH3 그룹을 서로에 대해 독립적으로 -OH, -SH 또는 -NH2로 대체하거나, 하나 이상의 -CH2- 그룹을 서로에 대해 독립적으로 -O-, -S- 또는 -NH-로 대체하거나, 하나 이상의 >CH- 그룹을 >N-으로 대체하거나, 하나 이상의 =CH- 그룹을 =N- 그룹으로 대체하거나, 하나 이상의 =CH2 그룹을 =NH 그룹으로 대체하거나, 또는 하나 이상의 ≡CH 그룹을 ≡N 그룹으로 대체하여 유도되는 그룹을 의미하며, 총 3개 이하의 헤테로원자만이 하나의 헤테로알킬 내에 존재할 수 있지만 2개 산소 원자 사이, 2개 황 원자 사이 또는 하나의 산소와 하나의 황 원자 사이에 적어도 하나의 탄소 원자가 있어야 하며 전체적으로 그룹이 화학적 안정성을 가져야만 한다.
헤테로알킬이 헤테로원자, 헤테로알케닐 및 헤테로알키닐을 가지는 포화 탄화수소 사슬의 서브그룹으로 구성되고, 또한 직쇄(분지되지 않은)와 측쇄로 재분류될 수 있는 것은 알킬로부터의 간접 정의/어원의 직접적인 결과이다. 헤테로알킬이 치환되면, 치환은 수소를 보유하는 산소, 황, 질소 및/또는 탄소 원자 모두에서 서로에 대해 독립적으로 단일- 및/또는 다중 치환될 수 있다. 치환체로서 헤테로알킬 자체는 탄소 원자와 헤테로원자를 통해서 분자에 결합될 수 있다.
예를 들면, 다음과 같다: 디메틸아미노메틸; 디메틸아미노에틸 (1-디메틸아미노에틸; 2-디메틸-아미노에틸); 디메틸아미노프로필 (1-디메틸아미노프로필, 2-디메틸아미노프로필, 3-디메틸아미노프로필); 디에틸아미노메틸; 디에틸아미노에틸 (1-디에틸아미노에틸, 2-디에틸아미노에틸); 디에틸아미노프로필 (1-디에틸아미노프로필, 2-디에틸아미노프로필, 3-디에틸아미노프로필); 디이소프로필아미노에틸 (1-디이소프로필아미노에틸, 2-디이소프로필아미노에틸); 비스-2-메톡시에틸아미노; [2-(디메틸아미노-에틸)-에틸-아미노]-메틸; 3-[2-(디메틸아미노-에틸)-에틸-아미노]-프로필; 하이드록시메틸; 2-하이드록시-에틸; 3-하이드록시프로필; 메톡시; 에톡시; 프로폭시; 메톡시메틸; 2-메톡시에틸 등.
앞서 정의된 헤테로알킬과 그의 서브그룹으로부터 헤테로알킬렌이란 용어도 유도할 수 있다. 헤테로알킬과 달리 헤테로알킬렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 헤테로알킬에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 -CH2NH2와 -CH2NH- 또는 >CHNH2, -NHCH3와 >NCH3 또는 -NHCH2-, -CH2OCH3와 -CH2OCH2- 또는 >CHOCH3 등이 있다. 헤테로알킬의 모든 서브그룹에 대하여 헤테로알킬렌의 상응물이 있다.
할로알킬은 넓은 의미에서 이전에 정의된 바와 같은 알킬로부터 탄화수소 사슬의 수소 원자 하나 이상을 서로에 대하여 독립적으로 같거나 다른 할로겐 원자로 대체하여 유도된다. 할로알킬이 포화 하이드로할로겐 사슬, 할로알케닐 및 할로알키닐 서브그룹으로 구성되고, 또한 직쇄(분지되지 않은) 및 측쇄로 재분류될 수 있다는 것은 알킬로부터의 간접 정의/어원의 직접적인 결과이다. 할로알킬이 치환되면, 수소를 보유하는 탄소 원자 모두에서 서로에 대해 독립적으로 단일- 또는 다중치환될 수 있다. 전형적인 예는 다음과 같다: -CF3, -CHF2, -CH2F, -CF2CF3, -CHFCF3, -CH2CF3, -CF2CH3, -CHFCH3, -CF2CF2CF3, -CF2CH2CH3, -CF=CF2, -CCl=CH2, -CBr=CH2, -CI=CH2, -C≡C-CF3, -CHFCH2CH3 및 -CHFCH2CF3 등.
앞서 정의된 할로알킬과 그의 서브그룹으로부터 할로알킬렌이란 용어도 유도할 수 있다. 할로알킬과 달리 할로알킬렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 할로알킬에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 -CH2F와 -CHF-, -CHFCH2F와 -CHFCHF- 또는 >CFCH2F 등이 있다. 할로알킬의 모든 서브그룹에 대하여 할로알킬렌의 상응물이 있다.
할로겐은 불소, 염소, 브롬 및/또는 요오드 원자를 포함한다.
시클로알킬은 모노시클릭 탄화수소 고리, 바이시클릭 탄화수소 고리 및 스피로탄화수소 고리 서브그룹으로 구성되며, 각각의 서브그룹은 다시 포화 및 불포화(시클로알케닐)로 재분류될 수 있다. 불포화란 용어는 고리 시스템 내에 적어도 하나의 이중 결합이 있으나 방향족 시스템을 형성하지 않는 것을 의미한다. 바이시클릭 탄화수소 고리 내에서 2개의 고리는 적어도 2개의 탄소 원자를 공유하여 결합한다. 스피로탄화수소 고리에서 하나의 탄소 원자(스피로원자)는 2개의 고리에 의해 공유된다. 시클로알킬이 치환되면, 수소를 보유하는 탄소 원자 모두에서 서로에 대해 독립적으로 단일- 또는 다중치환될 수 있다. 치환체로서 시클로알킬 자체는 고리 시스템의 적합한 위치를 통해서 분자에 결합할 수 있다. 개별적인 서브그룹들의 예를 이하에 기재하였다:
모노시클릭 포화 탄화수소 고리:
시클로프로필; 시클로부틸; 시클로펜틸; 시클로헥실; 시클로헵틸 등.
모노시클릭 불포화 탄화수소 고리:
시클로프로프-1-에닐; 시클로프로프-2-에닐; 시클로부트-1-에닐; 시클로부트-2-에닐; 시클로펜트-1-에닐; 시클로펜트-2-에닐; 시클로펜트-3-에닐; 시클로헥스-1-에닐; 시클로헥스-2-에닐; 시클로헥스-3-에닐; 시클로헵트-1-에닐; 시클로헵트-2-에닐; 시클로헵트-3-에닐; 시클로헵트-4-에닐; 시클로부타-1,3-디에닐; 시클로펜타-l,4-디에닐; 시클로펜타-l,3-디에닐; 시클로펜타-2,4-디에닐; 시클로헥사-1,3-디에닐; 시클로헥사-l,5-디에닐; 시클로헥사-2,4-디에닐; 시클로헥사-l,4-디에닐; 시클로헥사-2,5-디에닐 등.
바이시클릭 탄화수소 고리 (포화 및 불포화):
바이시클로[2.2.0]헥실; 바이시클로[3.2.0]헵틸; 바이시클로[3.2.1]옥틸; 바이시클로[2.2.2]옥틸; 바이시클로[4.3.0]노닐 (옥타하이드로인데닐); 바이시클로[4.4.0]데실 (데카하이드로나프탈렌); 바이시클로[2.2.1]헵틸 (노르보닐); (바이시클로[2.2.1]헵타-2,5-디에닐 (노르보나-2,5-디에닐); 바이시클로[2.2.1]헵트-2-에닐 (노르보넨일); 바이시클로[4.1.0]헵틸 (노르카라닐); 바이시클로-[3.1.1]헵틸 (피나닐) 등.
스피로탄화수소 고리 (포화 및 불포화):
스피로[2.5]옥틸, 스피로[3.3]헵틸, 스피로[4.5]데스-2-엔 등.
시클로알킬의 자유 원자가가 포화되면, 지환족 고리가 얻어진다.
앞서 정의된 시클로알킬과 그의 서브그룹으로부터 시클로알킬렌이란 용어도 유도할 수 있다. 시클로알킬과 달리 시클로알킬렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 시클로알킬에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 시클로헥실과 또는 또는 , 시클로펜틸과 또는 또는 또는 등이 있다. 시클로알킬의 모든 서브그룹에 대하여 시클로알킬렌의 상응물이 있다.
시클로알킬알킬은 그의 광범위한 의미로 이전에 정의된 알킬과 시클로알킬 의 조합물을 지칭한다. 선택적으로 시클로알킬알킬은 또한 시클로알킬과 알킬렌의 조합물로 간주될 수 있다. 형식적으로, 시클로알킬알킬은 치환체인 알킬이 직접 분자와 먼저 결합한 다음, 시클로알킬로 치환하여 얻어진다. 알킬과 시클로알킬의 결합은 이러한 목적에 적합한 탄소 원자를 사용하여 양 그룹에서 수행될 수 있다. 알킬(알킬렌)과 시클로알킬의 서브그룹들 각각은 또한 2개 그룹의 조합 내에 포함된다.
아릴은 적어도 하나의 방향족 고리를 가지는 모노-, 바이- 또는 트리시클릭 탄소 고리를 나타낸다. 아릴이 치환되는 경우, 각각의 경우에서 수소를 보유하는 탄소 원자 모두에서 서로에 대하여 독립적으로 단일 또는 다중 치환이 가능하다. 아릴 자체는 고리 시스템의 적합한 위치에 의해 치환체로서 분자에 결합할 수 있다. 일반적인 예로는, 페닐, 나프틸, 인다닐 (2,3-디하이드로인데닐), 1,2,3,4-테트라하이드로나프틸 및 플루오레닐 등이 있다. 아릴의 자유 원자가가 포화되면 방향족 그룹이 얻어진다.
앞서 정의된 아릴로부터 아릴렌이란 용어도 유도할 수 있다. 아릴과 달리 아릴렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 아릴에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 페닐과 또는 또는 , 나프틸과 또는 또는 등이 있다. 아릴의 모든 서브그룹에 대하여 아릴렌의 상응물이 있다.
아릴알킬은 각각의 경우에서 넓은 의미로 이전에 정의된 바와 같은 알킬 그룹과 아릴 그룹의 조합물을 나타낸다. 선택적으로 아릴알킬은 또한 아릴과 알킬렌의 조합물로 간주될 수 있다. 형식적으로, 아릴알킬은 치환체로서 알킬 그룹이 분자에 직접 결합하고, 이것을 아릴 그룹으로 치환하여 얻어진다. 알킬과 아릴은 이러한 목적에 적합한 탄소 원자에 의해 양쪽 그룹 모두에 결합할 수 있다. 또한, 알킬(알킬렌)과 아릴의 각 서브그룹은 2개 그룹의 조합물에 포함된다. 일반적인 예로는 벤질; 1-페닐에틸; 2-페닐에틸; 페닐비닐; 페닐알릴 등이 있다.
헤테로아릴은 모노시클릭 방향족 고리 또는 적어도 하나의 방향족 고리를 가지는 폴리시클릭 고리를 나타내며, 상응하는 아릴 또는 시클로알킬과 비교하여 하나 이상의 탄소 원자 대신에, 질소, 황 및 산소 중에서 서로에 대하여 독립적으로 선택된 하나 이상의 같거나 다른 헤테로원자를 함유하지만, 생성된 그룹은 화학적으로 안정하여야 한다. 헤테로아릴의 존재에 대한 전제조건은 헤테로원자와 방향족 시스템이지만, 헤테로방향족 시스템이 필수적으로 필요하지는 않다. 따라서, 2,3-디하이드로-1H-인돌-6-일은 이 정의에 따라 헤테로아릴일 수 있다. 헤테로아릴이 치환되는 경우, 치환은 서로에 대하여 독립적으로 수소를 보유하는 탄소 및/또는 질소 원자 모두에서 각각 단일 또는 다중치환일 수 있다. 치환체로서 헤테로아릴 자체는 고리 시스템의 적합한 위치, 탄소 및 질소에 의해 분자에 결합할 수 있다. 일반적인 예를 다음에 기재하였다:
모노시클릭 헤테로아릴:
퓨릴, 티에닐, 피롤릴, 옥사졸릴, 티아졸릴, 이소옥사졸릴, 이소티아졸릴, 피라졸릴, 이미다졸릴, 트리아졸릴, 테트라졸릴, 옥사디아졸릴, 티아디아졸릴, 피리딜, 피리미딜, 피리다지닐, 피라지닐, 트리아지닐, 피리딜-N-옥사이드, 피롤릴-N-옥사이드, 피리미디닐-N-옥사이드, 피리다지닐-N-옥사이드, 피라지닐-N-옥사이드, 이미다졸릴-N-옥사이드,이소옥사졸릴-N-옥사이드, 옥사졸릴-N-옥사이드, 티아졸릴-N-옥사이드, 옥사디아졸릴-N-옥사이드, 티아디아졸릴-N-옥사이드, 트리아졸릴-N-옥사이드, 테트라졸릴-N-옥사이드 등.
폴리시클릭 헤테로아릴:
인돌릴, 이소인돌릴, 벤조퓨릴, 벤조티에닐, 벤즈옥사졸릴, 벤조티아졸릴, 벤즈이소옥사졸릴, 디하이드로인돌릴, 벤즈이소티아졸릴, 벤즈이미다졸릴, 인다졸릴, 이소퀴놀리닐, 퀴놀리닐, 퀴녹살리닐, 신놀리닐, 프탈라지닐, 퀴나졸리닐, 벤조트리아지닐, 인돌리지닐, 옥사졸로피리딜, 이미다조피리딜, 나프티리디닐, 인돌리닐, 이소크로마닐, 크로마닐, 테트라하이드로이소퀴놀리닐, 이소인돌리닐, 이소벤조테트라하이드로퓨릴, 이소벤조테트라하이드로티에닐, 이소벤조티에닐, 벤즈옥사졸릴, 피리도피리딜, 벤조테트라하이드로퓨릴, 벤조테트라하이드로티에닐, 퓨리닐, 벤조디옥솔릴, 페녹사지닐, 페노티아지닐, 프테리디닐, 벤조티아졸릴, 이미다조피리딜, 이미다조티아졸릴, 디하이드로벤즈이소옥사지닐, 벤즈이소옥사지닐, 벤즈옥사지닐, 디하이드로벤즈이소티아지닐, 벤조피라닐, 벤조티오피라닐, 쿠마리닐, 이소쿠마리닐, 크로모닐, 크로마노닐, 테트라하이드로퀴놀리닐, 디하이드로퀴놀리닐, 디하이드로퀴놀리노닐, 디하이드로이소퀴놀리노닐, 디하이드로쿠마리닐, 디하이드로이소쿠마리닐, 이소인돌리노닐, 벤조디옥사닐, 벤즈옥사졸리노닐, 퀴놀리닐-N-옥사이드, 인돌릴-N-옥사이드, 인돌리닐-N-옥사이드, 이소퀴놀릴-N-옥사이드, 퀴나졸리닐-N-옥사이드, 퀴녹살리닐-N-옥사이드, 프탈라지닐-N-옥사이드, 인돌리지닐-N-옥사이드, 인다졸릴-N-옥사이드, 벤조티아졸릴-N-옥사이드, 벤즈이미다졸릴-N-옥사이드, 벤조티오피라닐-S-옥사이드 및 벤조티오피라닐-S,S-디옥사이드 등.
헤테로아릴의 자유 원자가가 포화되면, 헤테로방향족 그룹이 얻어진다.
앞서 정의된 헤테로아릴로부터 헤테로아릴렌이란 용어도 유도할 수 있다. 헤테로아릴과 달리 헤테로아릴렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 헤테로아릴에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 피롤과 또는 또는 또는 , 2,3-디하이드로-1H-인돌릴과 또는 또는 또는 또는 등이 있다. 헤테로아릴의 모든 서브그룹에 대하여 헤테로아릴렌의 상응물이 있다.
헤테로아릴알킬은 넓은 의미로 둘 다 이전에 정의된 알킬과 헤테로아릴의 조합물을 나타낸다. 선택적으로 헤테로아릴알킬은 또한 헤테로아릴과 알킬렌의 조합물로 간주될 수 있다. 형식적으로, 헤테로아릴알킬은 치환체인 알킬이 직접 분자와 먼저 결합한 다음, 헤테로아릴로 치환하여 얻어진다. 알킬과 헤테로아릴의 결합은 이러한 목적에 적합한 탄소 원자에 의해 알킬쪽과 이러한 목적에 적합한 탄소 또는 질소 원자에 의해 헤테로아릴쪽에서 얻어질 수 있다. 알킬(알킬렌)과 헤테로아릴의 서브그룹들 각각은 2개 그룹의 조합 내에 포함된다.
헤테로시클로알킬이란 용어는 탄화수소 고리 내에서 하나 이상의 -CH2- 그룹을 서로에 대해 독립적으로 -O-, -S- 또는 -NH-로 대체하거나, 하나 이상의 =CH- 그룹을 =N- 그룹으로 대체하여 앞서 정의된 시클로알킬로부터 유도되는 그룹을 의미하며, 총 5개 이하의 헤테로원자가 존재할 수 있지만 2개의 산소 원자 사이, 2개의 황 원자 사이 또는 하나의 산소와 하나의 황 원자 사이에 적어도 하나의 탄소 원자가 있어야 하며 전체적으로 그룹이 화학적으로 안정하여야 한다. 헤테로원자는 모든 가능한 산화 단계(황 → 설폭사이드 -SO-, 설폰 -SO2-; 질소 → N-옥사이드)에서 동시에 존재할 수 있다. 헤테로시클로알킬이 모노시클릭 헤테로-고리, 바이시클릭 헤테로-고리 및 스피로헤테로-고리 서브그룹으로 구성되며, 각각의 서브그룹은 포화 및 불포화(헤테로시클로알케닐)로 재분류할 수 있다는 것은 시클로알킬에서의 간접 정의/어원에서 명백하다. 불포화란 용어는 해당 고리 시스템 내에 적어도 하나의 이중 결합이 존재하지만 방향족 시스템을 형성하지는 않는 것을 의미한다. 바이시클릭 헤테로-고리에서 2개의 고리는 적어도 2개의 원자를 공유하도록 결합된다. 스피로헤테로-고리에 있어서, 하나의 탄소 원자(스피로원자)는 2개의 고리에 의해 공유된다. 헤테로시클로알킬이 치환될 때, 치환은 수소를 보유하는 탄소 및/또는 질소 원자 모두에서 서로에 대하여 독립적으로 각각의 경우에서 단일 또는 다중치환일 수 있다. 치환체로서 헤테로시클로알킬 자체는 고리 시스템의 적합한 위치에 의해 분자에 결합할 수 있다. 개별적인 서브그룹의 일반예를 다음에 기재하였다.
모노시클릭 헤테로고리(포화 및 불포화):
테트라하이드로퓨릴, 피롤리디닐, 피롤리닐, 이미다졸리디닐, 티아졸리디닐, 이미다졸리닐, 피라졸리디닐, 피라졸리닐, 피페리디닐, 피페라지닐, 옥시라닐, 아지리디닐, 아제티디닐, 1,4-디옥사닐, 아제파닐, 디아제파닐, 모폴리닐, 티오모폴리닐, 호모모폴리닐, 호모피페리디닐, 호모피페라지닐, 호모티오모폴리닐, 티오모폴리닐-S-옥사이드, 티오모폴리닐-S,S-디옥사이드, 1,3-디옥소라닐, 테트라하이드로피라닐, 테트라하이드로티오피라닐, [1,4]-옥사제파닐, 테트라하이드로티에닐, 호모티오모폴리닐-S,S-디옥사이드, 옥사졸리디노닐, 디하이드로피라졸릴, 디하이드로피롤릴, 디하이드로피라지닐, 디하이드로피리딜, 디하이드로피리미디닐, 디하이드로퓨릴, 디하이드로피라닐, 테트라하이드로티에닐-S-옥사이드, 테트라하이드로티에닐-S,S-디옥사이드, 호모티오모폴리닐-S-옥사이드, 2,3-디하이드로아제트, 2H-피롤, 4H-피라닐, 1,4-디하이드로피리디닐 등.
바이시클릭 헤테로고리(포화 및 불포화):
8-아자바이시클로[3.2.1]옥틸, 8-아자바이시클로[5.1.0]옥틸, 2-옥사-5-아자바이시클로[2.2.1]헵틸, 8-옥사-3-아자-바이시클로[3.2.1]옥틸, 3,8-디아자-바이시클로[3.2.1]옥틸, 2.5-디아자-바이시클로[2.2.1]헵틸, 1-아자-바이시클로[2.2.2]옥틸, 3,8-디아자-바이시클로[3.2.1]옥틸, 3,9-디아자-바이시클로[4.2.1]노닐, 2,6-디아자-바이시클로[3.2.2]노닐 등.
스피로-헤테로고리(포화 및 불포화):
l,4-디옥사-스피로[4.5]데실, l-옥사-3.8-디아자-스피로[4.5]데실, 2,6-디아자-스피로[3.3]헵틸, 2,7-디아자-스피로[4.4]노닐, 2,6-디아자-스피로[3.4]옥틸, 3,9-디아자-스피로[5.5]운데실, 2,8-디아자-스피로[4.5]데실 등.
헤테로시클로알킬의 자유 원자가가 포화되면, 헤테로시클릭 고리가 얻어진다.
앞서 정의된 헤테로시클로알킬로부터 헤테로시클로알킬렌이란 용어도 유도할 수 있다. 헤테로시클로알킬과 달리 헤테로시클로알킬렌은 2가이며 2개의 결합 파트너를 필요로 한다. 형식적으로 제2 원자가는 헤테로시클로알킬에서 수소 원자를 제거하여 생성된다. 상응하는 그룹으로는, 예를 들어 피페리디닐과 또는 또는 , 2,3-디하이드로-1H-피롤과 또는 또는 또는 등이 있다. 헤테로시클로알킬의 모든 서브그룹에 대하여 헤테로시클로알킬렌의 상응물이 있다.
헤테로시클로알킬알킬은 그의 넓은 의미로 앞서 정의된 알킬과 헤테로시클로알킬 그룹의 조합물을 나타낸다. 선택적으로 헤테로시클로알킬알킬은 또한 헤테로시클로알킬과 알킬렌의 조합물로 간주될 수 있다. 형식적으로 치환체인 알킬이 직접 분자에 먼저 결합하고 이어서 헤테로시클로알킬에 의해 치환되어 헤테로시클로알킬알킬을 얻는다. 알킬과 헤테로시클로알킬의 결합은 이러한 목적에 적합한 탄소 원자에 의해 알킬 쪽에서 및 이러한 목적에 적합한 탄소 원자 또는 질소 원자에 의해 헤테로시클로알킬 쪽에서 얻어질 수 있다. 알킬과 헤테로시클로알킬의 서브그룹들은 각각 2개 그룹의 조합 내에 포함된다.
치환된다라는 용어는 관심있는 원자에 직접 결합하고 있는 수소 원자를 다른 원자 또는 다른 그룹의 원자들(치환체)로 대체한다는 의미이다. 출발 조건(수소 원자의 수)에 따라 단일- 또는 다중치환이 하나의 원자에서 일어날 수 있다.
2가의 치환체, 예를 들어 =S, =NR, =N0R, =NNRR, =NN(R)C(O)NRR, =N2 등은 단지 탄소 원자들의 치환체일 수 있지만, 2가의 치환체 =O는 또한 황의 치환체일 수 있다. 일반적으로 2가의 치환체에 의한 치환은 단지 고리 시스템에서 일어날 수 있고 2개의 저미널(geminal) 수소 원자, 즉 치환 전에 포화된 동일한 탄소 원자와 결합하고 있는 수소 원자의 교환을 필요로 한다. 따라서 2가 치환체에 의한 치환은 고리 시스템의 -CH2- 그룹 또는 황 원자에서 가능하다.
또한, "적합한 치환체"란 용어는 그의 원자가 때문에 적합하고 화학적으로 안정한 시스템을 유도하는 치환체를 나타낸다.
이하에는 일부 생략된 표기와 그의 구조적 상응물을 나타내었다:
2가의 그룹이 결합하고 있는 원자가가 이웃한 그룹이 중요한 2가의 그룹에 있어서, 상응하는 결합 파트너는 다음 식에서와 같이 괄호 안에 나타내어 명료화하는 것이 필요하다:
그룹들 또는 치환체들은 주로 상응하는 그룹 표시(예를 들어, Ra, Rb 등)를 가지는 임의의 그룹들/치환체들 중에서 선택된다. 이러한 종류의 그룹을 분자의 상이한 부분에서 본 발명에 따른 화합물을 정의하기 위해 반복적으로 사용한다면 각각의 용도가 서로에 대하여 완전히 독립적인 것으로 간주되는 것을 항상 기억하여야 한다.
약어 목록
Ac 아세틸
ATP 아데노신 트리포스페이트
Bn 벤질
Boc tert-부틸옥시카보닐
Bu 부틸
c 농도
chex 시클로헥산
d 일
TLC 박층 크로마토그래피
DCM 디클로로메탄
DEA 디에틸아민
DMAP 4-N,N-디메틸아미노피리딘
DME 1,2-디메톡시에탄
DMF N,N-디메틸포름아미드
DMSO 디메틸설폭사이드
DPPA 디페닐포스포릴아자이드
EDTA 에틸렌디아민테트라아세트산
EE 에틸 아세테이트
EGTA 에틸렌글리콜테트라아세트산
eq 당량
ESI 전기 분무 이온화
Et 에틸
Et2O 디에틸에테르
EtOH 에탄올
h 시간(시)
HATU O-(7-아자벤조트리아졸-1-일)-N,N,N',N'-테트라메틸-
유로니움 헥사플루오로포스페이트
hex 헥실
HPLC 고성능 액체크로마토그래피
i 이소
cat. 촉매, 촉매적으로
conc. 농축(진한)
LC 액체크로마토그래피
sln. 용액
mCPBA 메타-클로로퍼벤조산
Me 메틸
MeOH 메탄올
min 분
MPLC 중압 액체크로마토그래피
MS 질량 분석기
NMP N-메틸피롤리돈
NP 정상(Normal Phase)
n.a. 입수 불가
PBS 인산염 완충 식염수
Ph 페닐
PMSF 벤질설폰산 플루오라이드
Pr 프로필
Py 피리딘
rac 라세믹
red. 환원
Rf(Rf) 체류 인자
RP 역상
RT 실온
SN 친핵성 치환
TBAF 테트라부틸암모늄 플루오라이드
TBME tert-부틸메틸에테르
TBTU O-(벤조트리아졸-1-일)-N,N,N',N'-테트라메틸-유로니움
테트라플루오로보레이트
TEA 트리에틸아민
temp. 온도
tert. 3차
Tf 트리플레이트
TFA 트리플루오로아세트산
THF 테트라하이드로퓨란
TMS 트리메틸실릴
tRet. 체류시간(HPLC)
TRIS 트리스(하이드록시메틸)-아미노메탄
TsOH 파라-톨루엔설폰산
UV 자외선
본 발명의 특징과 이점은 이하의 구체적인 실시예에 의해 분명해질 수 있으며, 하기의 실시예들은 본 발명의 범위를 제한하지 않고 예시의 방법으로 본 발명의 구성을 설명한다:
본 발명에 따른 화합물의 제조
개요
다른 언급이 없으면, 모든 반응은 시중에서 입수할 수 있는 장비로 화학 실험실에서 통상적으로 사용되는 방법을 사용하여 실시하였다. 공기 및/또는 수분에 민감한 출발 물질은 보호 가스 하에 보관하고 상응하는 반응 및 이들을 이용한 조작은 보호 가스(질소 또는 아르곤) 하에서 실시하였다.
마이크로웨이브 반응은 밀봉된 컨테이너(바람직하게, 2, 5 또는 20 mL) 중에서, 바람직하게 교반하면서 Biotage사가 제조한 이니시에이터/반응기에서, 또는 CEM사가 제조한 Explorer에서 실시하였다.
크로마토그래피
제조용 중압 크로마토그래피(MPLC, 정상(normal phase))용으로, Millipore사에서 제조한 실리카겔 (Granula Silica Si-60A 35-70 μm) 또는 Macherey Nagel사에서 제조한 C-18 RP-실리카겔 (RP-상)(Polygoprep 100-50 C 18)을 사용하였다. 자동 정상 크로마토그래피를 Isco사의 CombiFlash Foxy 200 분획 수집기를 구비한 CombiFlash Companion XL 장비에서 수행하였다. 이를 위하여 시중에서 구입할 수 있는 RediSepRf (120 g 실리카겔) 원웨이 컬럼을 사용하였다. 박층 크로마토그래피를 Merck사가 제조한 (형광성 지시약 F-254을 포함하는) 유리 상에 미리 준비한 실리카겔 60 TLC 플레이트에서 수행하였다.
제조용 고압 크로마토그래피(HPLC)를 본 발명에 따른 실시예 화합물에 대하여 Waters사 (제품명: XTerra Prep. MS C18, 5 μm, 30 x 100 mm 또는 XTerra Prep. MS C18, 5 μm, 50 x 100 mm OBD 또는 Symmetrie Cl8, 5 μm, 19 x 100 mm 또는 Sunfire C18 OBD, 19 x 100 mm, 5 μm 또는 Sunfire Prep C 10 μm OBD 50 x 150 mm 또는 X-Bridge Prep Cl8 5 μm OBD 19 x 50 mm), Agilent사 (제품명: Zorbax SB-C8 5 μm PrepHT 21.2 x 50 mm) 및 Phenomenex사 (제품명: Gemini C18 5 μm AXIA 21.2 x 50 mm 또는 Gemini C18 10 μm 50 x 150 mm)의 컬럼으로 수행하였다. H2O/아세토니트릴 또는 H2O/MeOH의 상이한 그래디언트를 사용하여 화합물을 용출하였고, 0.1 % HCOOH를 물에 첨가하였다.
제조용 정상 고압 크로마토그래피(HPLC)를 본 발명에 따른 실시예 화합물에 대하여 Macherey & Nagel사(제품명: Nucleosil, 50-7, 40 x 250 mm) 및 VDSoptilab사(제품명: Kromasil 100 NH2, 10 μM, 50 x 250 mm)의 컬럼으로 수행하였다. DCM/MeOH의 상이한 그래디언트를 사용하여 화합물을 용출하였고, 0.1 % NH3를 MeOH에 첨가하였다.
분석 HPLC(반응 컨트롤)를 중간체 화합물에 대하여 Agilent사 (제품명: Zorbax SB-C8, 5 μm, 21.2 x 50 mm 또는 Zorbax SB-C8 3.5 μm 2.1 x 50 mm)와 Phenomenex사 (제품명: Gemini Cl8 3 μm 2 x 30 mm)의 컬럼을 사용하여 수행하였다. 분석 장치는 또한 각각의 경우에서 질량 검출기와 함께 구비하였다.
HPLC-질량 분석기/UV-분광광도법
본 발명에 따른 실시예 화합물을 특성화하기 위한 체류시간/MS-ESI+를 상이한 HPLC-MS 장비(질량 검출기를 구비한 고성능 액체 크로마토그래피)를 사용하여 만들었다. 인젝션 피크에서 용출되는 화합물의 체류시간을 tRet. = 0.00으로 하였다.
방법의 상세:
HPLC-MS 방법 1
HPLC : Agilent 1100 Series
MS: Agilent LC/MSD SL
컬럼: Waters, Xterra MS C18, 2.5μm, 2.1x30mm, Part.No. 186000592
용리제: A: 0.1 % HCOOH를 포함하는 H2O; B: 아세토니트릴 (HPLC 등급)
검출: MS: 포지티브 및 네가티브 모드
질량 범위: 120 - 900 m/z
유속: l.lO mL/min
컬럼 온도: 40 ℃
그래디언트: 0.00 min: 5 % 용리제 B
0.00 - 2.50 min: 5 % -> 95 % 용리제 B
2.50 - 2.80 min: 95 % 용리제 B
2.81 - 3.10 min: 95 % -> 5 % 용리제 B
HPLC-MS 방법 2
HPLC: HP 1100
MS: Waters ZQ2000
컬럼: Waters, Sunfire C18, 3.5 μm, 4.6 x 50 mm
용리제: A: 0.1 % TFA를 포함하는 H2O;
B: 0.1 % TFA를 포함하는 아세토니트릴
(각각의 경우에 HPLC 등급)
검출: MS: 포지티브 모드
중량 범위: 120 - 820 m/z
유속: 1.5 mL/min
컬럼 온도: 40 ℃
그래디언트: 0.00 min: 5 % 용리제 B
0.00 - 2.00 min: 5 % -> 100 % 용리제 B
2.00 - 2.50 min: 100 % 용리제 B
2.50 - 2.60 min: 100 % -> 5 % 용리제 B
HPLC-MS-방법 3
HPLC: HP 1100
MS: Waters ZQ2000
컬럼: Supelco, Ascentis C18, 2.7 μm, 4.6 x 50 mm
용리제: A: 0.1 % TFA를 포함하는 H2O;
B: 0.1 % TFA를 포함하는 아세토니트릴
(각각의 경우에 HPLC 등급)
검출: MS: 포지티브 모드
중량 범위: 120 - 820 m/z
유속: 1.5 mL/min
컬럼 온도: 40 ℃
그래디언트: 0.00 min: 5 % 용리제 B
0.00 - 2.00 min: 5 % -> 100 % 용리제 B
2.00 - 2.50 min: 100 % 용리제 B
2.50 - 2.60 min: 100 % -> 5 % 용리제 B
본 발명에 따른 화합물은 이하에 기술된 합성 방법에 의해 제조하였으며, 화학식의 치환체들은 앞서 기술한 의미를 가진다. 이러한 방법은 본 발명의 예시를 위한 것으로, 본 발명의 요지와 이 실시예들에 청구된 화합물 범위를 제한하지 않는다. 출발 화합물의 제법을 기술하지 않은 경우, 이들은 시중에서 입수할 수 있거나, 공지의 화합물 또는 여기에 기술된 방법과 유사하게 제조할 수 있다. 문헌에 기술된 물질들은 공개된 합성 방법에 따라 제조하였다.
타입 I의 실시예 화합물:
3치환된 피리미도피리미딘 I을, 예를 들어 반응식 A에 따른 두 가지 선택적 방법에 의해 제조할 수 있다(합성경로 1 또는 2).
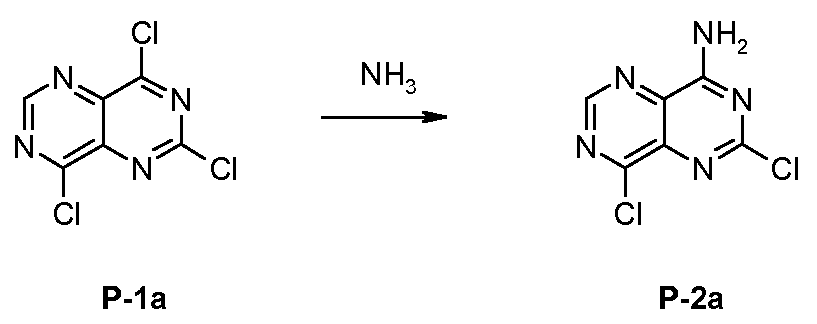
2,4,8-트리클로로-피리미도[5,4-d]피리미딘 P-1a에서 출발하여, 염소 원자를 연속하여 치환하였다. 제1 단계에서, 이 치환을 4-위치에서 암모니아를 사용하여 수행하였다. 제2 단계에서, 중간 생성물 P-2a의 8-위치를, 바람직하게 염기적으로 촉매화된 조건 하의 상승된 온도에서 아닐린 성분 A-1 또는 A-2에 의해 치환하였다.
A-1을 사용하면 최종 화합물 I의 완전한 좌측 분자 부분이 중간체 화합물 Z-2에 삽입되어, 바람직하게 1차 아민과 2차(또한 시클릭) 아민 및 알코올(알콕시드 형태)인 성분 R1-H (E-3)에 의한 2번 위치의 치환이 최종적으로 남는다. 성분 A-1은 니트로카복실산 E-1과 아민 E-2의 아미드 커플링에 의해 중간 생성물 Z-1을 생성하고 이어서 니트로 그룹을 환원하여 얻어진다. 아미드 커플링을 수행하기 위해 펩티드 화학에서 사용되는 통상적인 커플링제(예를 들어, HATU 또는 TBTU)를 임의로 사용하거나, 또는 니트로산 E-1을 다른 방법, 예를 들어 산 할로겐화물(티오닐 클로라이드, 옥살릴 클로라이드, 시약 등)로 활성화시킨다.
한편, A-2를 사용할 경우, R1 그룹이 유사하게 삽입되기 전에 먼저 중앙의 페닐 또는 헤테로아릴 고리와 나중의 링커 L2(예를 들어, 아미드)의 보호된 링커 절편(카복실레이트)을 결합한다. 따라서, 이 경우에는 화합물 I을 얻기 위해 추가의 반응 단계(비누화, 활성화, 아미드화)가 필요하다. 아미드 커플링을 니트로산 E-1에 대하여 앞서 기술한 바와 같이 수행하였다.
P-1a를 대신하여, 연속적이고 선택적인 치환이 가능한, 즉 다른 이탈 그룹을 가지는 다른 반응물 P-1을 사용할 수 있다.
본 발명에 따른 화합물 I의 R1 및 R2 그룹은 모두 다른 반응 단계(나타내지 않음)에서 변성하여 본 발명에 따른 다른 화합물 I을 얻을 수 있다. 이 반응 단계는 치환, 알킬화, 아실화 또는 부가반응일 수 있다.
a) P-1a의 합성방법:
2,4,8-트리하이드록시-피리미도[5,4-d]피리미딘 (40 g, 222 mmol), 염화칼륨 (1.68 g, 22.53 mmol) 및 오염화인 (152 g, 730 mmol)을 옥시염화인(240 mL)에 첨가하였다. 이 반응 혼합물을 5시간 동안 환류하였다. 냉각한 후, 혼합물을 증발시키고, 잔류물을 석유 에테르로 수회 분해하고 따라내었다. 남아있는 침전물을 얼음물과 혼합하고, 흡인 여과하여 DCM에 용해하고 소듐 설페이트 상에서 건조하여 여과하였다. 모액을 활성탄과 혼합하여 가열하였다. 활성탄을 흡인 여과하고, 여액은 실리카겔로 여과하여 DCM으로 세척한 다음, 회전 증발기를 사용하여 증발시켜서 2,4,8-트리클로로-피리미도[5,4-d]피리미딘 P-1a (HPLC-MS: MS (M+H)+ = 234/236/238/240)를 얻었다. P-1a를 추가의 정제 없이 이후에 사용하였다(순도 약 95 %).
b) P-2a의 합성방법:
P-1a (95 %; 4.0 g, 16.14 mmol)를 THF (350 mL)와 TEA (2.26 ml, 16.14 mmol)에 넣었다. 반응 혼합물을 아세톤 항온조와 드라이아이스로 약 -65 ℃로 냉각하였다. 이 후, 암모니아(0.5 M의 디옥산 용액; 41.96 mL, 20.98 mmol)를 서서히 적가하였다. 반응 혼합물을 교반하고 서서히 실온으로 가열하였다. 16시간 후에 반응 혼합물을 증발시키고, 잔류물을 300 mL EE에 용해하여 1 x 200 mL 및 2 x 100 mL의 물로 추출하였다. 유기층을 MgSO4로 건조하고, 여과하여 회전 증발기로 증발시켰다. 중간 생성물 P-2a (HPLC-MS: tRet. = 0.92 min; MS (M+H)+ = 216/218)를 이후에 직접 반응시켰다.
c) A-1a의 합성방법:
4-메틸-3-니트로벤조산 E-1a (2.0 g, 11 mmol)를 DCM (40 mL)중에 용해하여 TEA (5.1 mL, 27.6 mmol) 및 TBTU (3.9 g, 12.2 mmol)와 혼합하였다. 10분 후에 4-메톡시-3-트리플루오로메틸아닐린 E-2a (2.11 g, 11 mmol)를 첨가하고, 이 혼합물을 다시 2시간 동안 실온에서 교반하였다. 생성된 침전물을 여과하고, 물로 반복 세척하고 건조하여 Z-1a (MS (M+H)+ = 355)를 얻었다.
방향족 니트로 화합물 Z-1a (3.5 g, 9.9 mmol)를 EtOH (30 mL)에 용해하고, 염화암모늄 용액(264 mg, 4.94 mmol/20 mL H2O)과 혼합하여 70 ℃로 가열하였다. 이 온도에서 철 분말(5.52 g, 99 mmol)을 회분식으로 첨가하고, 이 혼합물을 70 ℃에서 추가로 4시간 동안 교반하였다. 냉각한 후, 실리카겔로 여과하고, DCM/MeOH로 세척하여, 얻어진 여액을 회전 증발기를 사용하여 건조하여서 A-1a를 얻었다.
d) A-1b의 합성방법:
E-1a (2.0 g, 11.04 mmol)를 DCM (40 mL)에 용해하여 TEA (5.1 mL, 27.6 mmol) 및 HATU (6.3 g, 16.6 mmol)와 혼합하였다. 10분 후에 아닐린 E-2b (3.41 g, 11.04 mmol)를 첨가하고, 이 혼합물을 실온에서 다시 2시간 동안 교반하였다. 반응을 종료하기 위하여 물로 희석하고 층을 분리하였다. 유기층을 포화 NH4Cl 용액으로 1회, 포화 NaHCO3 용액으로 1회 및 포화 NaCl 용액으로 1회 추출하고, MgSO4로 건조한 후, 여과하고, 회전 증발기를 사용하여 증발시켜서 Z-1b를 얻었다.
방향족 니트로 화합물 Z-1b (3.5 g, 8.04 mmol)를 EtOH (30 mL)에 용해하고, 염화암모늄 용액 (215 mg, 4.02 mmol/20 mL H2O)과 합하여 70 ℃로 가열하였다. 이 온도에서 철 분말(4.49 g, 80.4 mmol)을 회분식으로 첨가하고, 이 혼합물을 70 ℃에서 추가로 5시간 동안 교반하였다. 냉각한 후, 실리카겔로 여과하고, DCM/MeOH (9:1)로 세척하여, 얻어진 여액을 회전 증발기를 사용하여 건조하여서 A-1b를 얻었다.
A-1a와 A-1b를 합성하는 방법과 유사하게 다른 아닐린 A-1을 상응하는 반응물 E-1 및 E-2로부터 얻을 수 있다.
e) Z-2a의 합성방법:
P-2a (200 mg, 0.93 mmol), 아닐린 A-1a (300 mg, 0.93 mmol) 및 TEA (155 μL, 1.53 mmol)를 DMF (3 mL)에 첨가하였다. 반응 혼합물을 65 ℃에서 밤새 교반하였다. 이 반응 혼합물을 20 mL의 물과 합하여 15분 동안 교반하였다. 생성된 침전물을 여과하고, 디에틸에테르로 세척하여 톨루엔에 취하여 증발시켜서 Z-2a를 얻었다.
f) Z-2b의 합성방법:
P-2a (200 mg, 0.93 mmol)와 아닐린 A-1c (291 mg, 0.93 mmol)를 디옥산 (3 mL)에 취하였다. 염산 (1 M의 Et2O 용액, 5 μL, 0.102 mmol)을 첨가하였다. 반응 혼합물을 25분 동안 65 ℃에서 마이크로웨이브 반응기로 교반하였다. 생성된 침전물을 여과하여, 물로 세척하고 톨루엔에 취하여 증발시켜서 Z-2b를 얻었다.
Z-2a와 Z-2b를 합성하는 방법과 유사하게 다른 중간체 화합물 Z-2를 성분 A-1과 P-2a를 반응시켜서 얻었다.
g) 실시예 화합물 I-1의 합성방법:
Z-2a (50 mg, 0.1 mmol)와 N-메틸피페라진 E-3a (40 mg, 0.4 mmol)를 0.5 mL DMSO에 취하여 DIPEA (180 μL, 1.4 mmol)를 첨가하였다. 이 반응 혼합물을 25분 동안 120 ℃에서 마이크로웨이브 반응기로 교반하였다. 반응 혼합물을 여과하고 제조용 HPLC로 정제하였다. I-1의 생성물을 포함하는 분획(HPLC-MS: tRet. = 2.17 min; MS (M+H)+ = 568)을 동결건조하였다.
h) Z-3a의 합성방법:
P-2a (1.439 g, 6.6 mmol)와 아닐린 A-2a (1.0 g, 6.05 mmol)를 THF (5 mL)에 취하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 침전물을 여과하고, 건조하여 Z-3a를 얻었다.
Z-3a를 합성하는 방법과 유사하게 다른 중간체 화합물 Z-3을 성분 A-2와 P-2a를 반응시켜서 얻었다.
i) Z-4a의 합성방법:
에스테르 Z-3a (1.3 g, 3.77 mmol)를 25 mL DMSO와 DIPEA (2.979 mL, 17.4 mmol) 중에 취하여 N-메틸피페라진 E-3a (0.443 mL, 4.351 mmol)를 첨가하였다. 반응 혼합물을 20분 동안 120 ℃에서 마이크로웨이브 반응기로 교반하였다. 이 반응 혼합물을 물과 혼합하고, 생성된 침전물을 여과하여 톨루엔에 첨가하고, 2회 공비 증발시켜서 Z-4a를 얻었다.
Z-4a를 합성하는 방법과 유사하게, 다른 중간체 화합물 Z-4를 중간체 화합물 Z-3과 성분 E-3를 반응시켜서 얻었다.
j) 실시예 화합물 I-2의 합성방법:
메틸에스테르 Z-4a (1.216 g, 2.98 mmol)를 MeOH (30 mL)에 첨가하고 실온에서 NaOH 수용액 (5.0 mol/L, 12.146 mL, 60.73 mmol)과 혼합하였다. 이 후, 이 혼합물을 50 ℃에서 밤새 교반하였다. 반응을 종료하기 위하여 HCl 용액을 첨가하여 pH를 중성으로 조절하였다. 이 반응 혼합물을 물/EE(1:1)로 2회 추출하여 유기층을 MgSO4로 건조하고, 여과 및 증발시켜서 Z-5a를 얻었다.
벤조산 Z-5a (100 mg, 0.25 mmol)를 DCM (5 mL) 중에 취하여 아르곤 하에서 티오닐 클로라이드 (300 μL, 2.38 mmol)와 혼합하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 이 후, 이 혼합물을 증발시키고 건조 톨루엔과 함께 공비 건조시켜서 Z-6a를 얻었다.
산 염화물 Z-6a (100 mg, 0.24 mmol)를 DCM (3 mL) 중에 취하여 3-브로모-5-트리플루오로메틸-페닐아민 E-2c (58 mg, 0.24 mmol) 및 피리딘 (100 μL)과 혼합하였다. 반응 혼합물을 실온에서 2시간 동안 교반하였다. 반응을 종료하기 위하여 혼합물을 증발시켜서 DMSO에 용해하고 여과하여 제조용 HPLC로 정제하였다. I-2의 생성물을 포함하는 분획(HPLC-MS: tRet. = 2.44 min; MS (M+H)+ = 616/618)을 동결건조시켰다.
방법 a) 내지 g) (합성경로 1) 또는 a), b) 및 h) 내지 j) (합성경로 2)와 유사하게, I-1 및 I-2 이외에 본 발명에 따른 다음 화합물 I-3 내지 I-88을 제조하였다 (표 1).
표 1
실시예 화합물 I-1 내지 I-88
타입 II의 실시예 화합물:
실시예 화합물 II는 중앙의 (헤테로-)방향족 6원환과 R2 그룹 사이의 반전된 아미드 결합에 의해 타입 I과 다르다(반응식 B). 반응성이 반응 성분 E-4 및 E-5 또는 A-4(E-1 및 E-2 또는 A-2와 비교하여)에서 그에 따라 반전되는 것을 제외하고, 이 화합물들은 사용된 방법면에서 화합물 I과 유사하게 얻어진다.
타입 II의 화합물에 대하여는, 예를 들어 다음과 같은 2가지 합성경로가 가능하다: P-2a에서 출발하여 8-위치를 아닐린 성분 A-3 또는 A-4로 치환한다. A-3의 사용과 관련하여는 반응식 A(중간체 화합물 Z-2에 의한 합성경로 1)에서의 주석을 참조한다. 성분 A-3는 니트로아닐린 E-4와 카복실산 E-5의 아미드 커플링으로 중간체 생성물 Z-7을 얻고, 이어서 니트로 그룹을 환원하여 얻어진다.
A-4를 사용하는 경우, 먼저 중앙의 페닐 또는 헤테로아릴 고리와 나중의 링커 L2의 링커 절편 전구체(니트로 -> 아미노)만을 R1 그룹이 유사하게 삽입되기 전에 결합한다. 이 경우에는 화합물 II를 얻기 위해 추가의 반응 단계(환원, 활성화, 아미드화)가 필요하다.
본 발명에 따른 화합물 II의 R1 및 R2 그룹은 모두 다른 반응 단계(나타내지 않음)에서 변성되어 본 발명에 따른 다른 화합물 II를 얻었다. 이 반응 단계는 치환, 알킬화, 아실화 또는 부가반응일 수 있다.
a) A-3a의 합성방법:
3-트리플루오로메틸벤조산 E-5a (10.03 g, 51.7 mmol)를 150 mL 톨루엔 중에 취하였다. 100 mL 톨루엔 중의 옥살릴 클로라이드 용액(7.6 mL, 57.58 mmol)을 적가하였다. DMF (4 mL)를 첨가하고, 이 반응 혼합물을 2시간 동안 90 ℃에서 교반하였다. 이 후, 이를 증발시키고, 잔류물을 100 mL DCM 중에 취하여 빙냉조에서 냉각하였다. 4-메틸-3-니트로아닐린 E-4a (8.91 g, 56.8 mmol) 및 TEA (8.7 mL, 62.14 mmol)를 첨가하고, 빙냉조를 제거한 다음, 반응 혼합물을 실온에서 밤새 교반하였다. 반응을 종료하기 위하여 여과하고 DCM으로 세척하여 여액을 증발시켰다. 잔류물을 0.5 M NaOH 용액(20 mL)과 혼합하고, 생성된 침전물을 여과한 후, 물로 세척하였다. 고체를 20 mL의 0.5 M HCl 용액과 10 mL의 EE에 현탁하였고, 실온에서 15분 동안 교반하여 여과하였다. 고체를 30 mL의 TBME에 현탁한 후, 10분 동안 초음파 항온조에서 교반하고 여과 및 건조하여 Z-7a (HPLC-MS: tRet. = 2.30 min; MS (M+H)+ = 325)를 얻었다.
방향족 니트로 화합물 Z-7a (4.4 g, 13.57 mmol)를 THF (85 mL)와 MeOH (15 mL) 중에 취하였다. Pd/C (200 mg)를 주의깊게 첨가하였다. 반응 용기를 7 bar의 H2로 충전하고, 반응 혼합물을 실온에서 밤새 교반한 다음, Celite로 여과하여 THF로 세척하고, 얻어진 여액을 회전 증발기로 건조하여 A-3a (HPLC-MS: tRet. = 1.73 min; MS (M+H)+ = 295)를 얻었다.
A-3a의 합성방법과 유사하게 다른 아닐린 A-3을 상응하는 반응물 E-4 및 E-5로부터 얻었다.
b) Z-8a의 합성방법:
P-2a (975 mg, 4.51 mmol)를 DMF (25 mL) 중에 취하여 TEA (754 μL, 5.41 mmol)를 첨가하였다. 이 반응 혼합물을 아닐린 A-3a (1.327 g, 4.51 mmol)와 합하여 실온에서 밤새 교반하였다. 반응을 종료하기 위하여 100 mL의 얼음물을 첨가하고, 생성된 침전물을 여과하여 Z-8a를 얻었다.
Z-8a의 합성방법과 유사하게 다른 중간체 화합물 Z-8을 성분 A-3와 P-2a를 반응시켜서 얻었다.
c) 실시예 화합물 II-1의 합성방법:
Z-8a (50 mg, 0.11 mmol)를 DMSO (900 μL) 중에 취하여, N-메틸피페라진 E-3a (32 mg, 0.32 mmol)와 혼합하고 15분 동안 150 ℃에서 마이크로웨이브 반응기로 교반하였다. 반응 혼합물을 제조용 HPLC로 정제하였다. II-1의 생성물을 포함하는 분획(HPLC-MS: tRet. = 1.59 min; MS (M+H)+ = 538)을 동결건조하였다.
방법 a) 내지 c) (합성경로 1) 또는 기술된 합성경로 2와 유사하게, II-1 이외에 본 발명에 따른 다음 화합물 II-2 내지 II-19를 제조하였다 (표 2).
표 2
실시예 화합물 II-1 내지 II-19
타입 Ⅲ의 실시예 화합물:
2.8-이치환된 피리미도피리미딘 Ⅲ을 또한, 예를 들어 다음과 같은 방법에 의해 제조할 수 있다(반응식 C, 합성경로 1 내지 3):
8-클로로-2-메틸설파닐-피리미도[5,4-d]피리미딘 P-3a에서 출발하여, 바람직하게 염기적으로 촉매화된 조건 하의 상승된 온도에서 8-위치를 아닐린 성분 A-1 또는 A-2에 의해 치환하였다.
A-1을 사용하면(합성경로 1) 최종 화합물 Ⅲ의 완전한 좌측 분자 부분이 중간체 화합물 Z-12에 삽입되어, 바람직하게 1차 아민과 2차(또한 시클릭) 아민 또는 알코올(알콕시드 형태)인 성분 R1-H (E-3)에 의한 2번 위치의 치환이 최종적으로 남는다. 그러나, 이를 위하여 먼저 메틸설파닐 그룹이 산화에 의해 2-위치에서 활성화되어 치환을 위한 상응하는 설폭사이드/설폰을 형성한다(성분 A-1의 합성에 대하여는 반응식 A 하의 주석 참조). 이 반응에서, 일반적으로 설폭사이드와 설폰의 혼합물이 얻어지며 이후 하나로서 반응한다.
한편, A-2를 사용할 경우(합성경로 2와 3), 먼저 중앙의 페닐 또는 헤테로아릴 고리와 나중의 링커 L2(예를 들어, 아미드)의 보호된 링커 절편(카복실레이트)을 R1 그룹이 삽입되기 전에 결합한다. 중간체 화합물 Z-14를 사용하여 메틸설파닐 그룹을 산화/활성화한 다음, 이를 성분 E-3로 치환하고, 마지막으로 비누화한 후에 R2 그룹을 삽입하거나(성분 E-2에 의해서)(반응경로 2), 또는 먼저 비누화 및 산화를 수행하고나서 E-3에 의해 친핵성 치환한 후 E-2의 아미드 커플링(반응경로 3)하는 대체 가능성이 있다. P-3a를 대신하여, 연속적이고 선택적인 치환이 가능한, 즉 다른 이탈 그룹을 가지는 다른 반응물 P-3을 사용할 수 있다.
본 발명에 따른 화합물 Ⅲ의 R1 및 R2 그룹은 모두 다른 반응 단계(나타내지 않음)에서 변성하여 본 발명에 따른 다른 화합물 Ⅲ을 얻을 수 있다. 이 반응 단계는 치환, 알킬화, 아실화 또는 부가반응일 수 있다.
a) P-3a의 합성방법:
8-하이드록시-2-메틸설파닐-피리미도[5,4-d]피리미딘 (16.5 g, 85 mmol)을 아세토니트릴 (125 mL)에 첨가하여, DMF (400 μL)와 합하고 30 ℃로 가열하였다. 이 온도에서 티오닐 클로라이드(16 mL, 215 mmol)를 적가하였다. 반응 혼합물을 4.5 시간 동안 95 ℃에서 교반하였다. 냉각한 후, 이것을 증발시키고, 잔류물을 DCM 중에 취하여 실리카겔에 의해 여과하였다. 여액을 포화 NaHCO3 용액으로 세척하고, Na2SO4로 건조한 다음, 여과하고 용매를 제거하여 P-3a (HPLC-MS: tRet. = 1.64 min; MS (M+H)+ = 213/215)를 얻었다.
b) Z-12a의 합성방법:
아닐린 A-1a (453 mg, 1.4 mmol) 및 8-클로로-2-메틸설파닐-피리미도[5,4-d]피리미딘 P-3a (270 mg, 1.27 mmol)를 디옥산 (3 mL)과 DIPEA (352 μL, 1.9 mmol)에 첨가하여 밤새 환류하였다. 반응을 종료하기 위하여, 반응 혼합물을 증발시키고, 잔류물을 MeOH에 현탁하여 형성된 침전물을 여과하고 건조하여 Z-12a (HPLC-MS: tRet. = 1.99 min; MS (M+H)+ = 501)를 얻었다.
c) Z-12b의 합성방법:
아닐린 A-1b (3.3 g, 8.14 mmol)와 8-클로로-2-메틸설파닐-피리미도[5,4-d]피리미딘 P-3a (1.73 g, 8.14 mmol)를 아세트산 (20 mL)에 첨가하고 50 ℃에서 밤새 교반하였다. 반응을 종료하기 위하여 반응 혼합물을 증발시키고 잔류물을 이소프로판올/물(1:1)에 현탁하고, 형성된 침전물을 여과하고 건조하여 Z-12b를 얻었다.
Z-12a 및 Z-12b를 합성하는 방법과 유사하게 다른 중간체 화합물 Z-12를 성분 A-1과 P-3a를 반응시켜서 얻었다.
d) 실시예 화합물 Ⅲ-1의 합성방법:
Z-12a (310 mg, 0.62 mmol)를 DCM (5 mL) 중에 취하였다. 이 후, 실온에서 mCPBA (70 %, 183 mg, 0.74 mmol)를 첨가하여, 이 반응 혼합물을 실온에서 1시간 동안 교반하였다. 형성된 침전물을 여과하고 DCM으로 세척하고 건조하여 Z-13a를 얻었다.
설폭사이드/설폰 Z-13a (90 mg, 0.174 mmol)와 N-메틸피페라진 E-3a (31 μL, 0.28 mmol)를 디옥산(0.5 mL)에 첨가하였다. TEA (51 μL, 0.35 mmol)를 적가하였다. 반응 혼합물을 2시간 동안 60 ℃에서 교반하였다. 반응을 종료하기 위하여 이 혼합물을 증발시키고, 잔류물을 이소프로판올/물로 현탁한 후, 여과하였다. 얻어진 고체를 물로 세척하고 아세토니트릴/물/2 M HCl 용액에 용해하고, 동결건조하여 Ⅲ-I (HPLC-MS: tRet. = 2.18 min; MS (M+H)+ = 553)을 얻었다.
e) Z-14a의 합성방법:
메틸 3-아미노-4-메틸벤조에이트 A-2a (4.04 g, 24.45 mmol) 및 8-클로로-2-메틸설파닐-피리미도[5,4-d]피리미딘 P-3a (80 %, 5.0 g, 18.81 mmol)를 디옥산 (8 mL)과 DIPEA (4.525 mL, 24.45 mmol)에 첨가하고 교반 하면서 밤새 환류하였다. 반응을 종료하기 위하여 반응 혼합물을 증발시키고, 잔류물을 MeOH에 현탁하여 형성된 침전물을 여과한 후, 건조하여 Z-14a (HPLC-MS: tRet. = 2.01 min; MS (M+H)+ = 342)를 얻었다.
Z-14a를 합성하는 방법과 유사하게 다른 중간체 화합물 Z-14를 성분 A-2와 P-3a를 반응시켜서 얻었다.
f) Z-16a의 합성방법:
Z-14a (5.5 g, 16.1 mmol)를 DCM (40 mL) 중에 취하여 실온에서 mCPBA (70 %, 3.61 g, 16.1 mmol)와 합하여 1시간 동안 교반하였다. 형성된 침전물을 여과하고 DCM으로 세척하고 건조하여 Z-15a (HPLC-MS: tRet. = 1.45 min; MS (M+H(+Na))+ = 358(380))를 얻었다.
설폭사이드/설폰 Z-15a (1.0 g, 2.8 mmol)와 모폴린 E-3b (704 μL, 7.28 mmol)를 디옥산 (30 mL)에 첨가하였다. 이 현탁액에 TEA (815 μL, 5.6 mmol)를 적가한 다음, 60 ℃에서 2시간 동안 가열하였다. 반응을 종료하기 위하여 혼합물을 증발시키고 잔류물을 iPrOH/물로 현탁시키고, 여과 및 건조하여 Z-16a (HPLC-MS: tRet. = 1.94 min; MS (M+H)+ = 381)를 얻었다.
g) Z-16b의 합성방법:
Z-14a (5.5 g, 16.1 mmol)를 DCM (40 mL) 중에 취하여 실온에서 mCPBA (70 %, 3.61 g, 16.1 mmol)와 합하여 1시간 동안 교반하였다. 형성된 침전물을 여과하고 DCM으로 세척하고 건조하여 Z-15a (HPLC-MS: tRet. = 1.45 min; MS (M+H(+Na))+ = 358(380))를 얻었다.
설폭사이드/설폰 Z-15a (3.0 g, 8.4 mmol)와 l-(2-메톡시에틸)-피페라진 E-3c (2.5 mL, 16.8 mmol)를 디옥산 (25 mL)에 첨가하였다. 이 현탁액에 TEA (3 mL, 23 mmol)를 적가한 다음, 이 혼합물을 60 ℃에서 2시간 동안 가열하였다. 반응을 종료하기 위하여 혼합물을 증발시키고 잔류물을 iPrOH/물로 현탁시키고, 여과 및 건조하여 Z-16b (HPLC-MS: tRet. = 1.95 min; MS (M+H)+ = 438)를 얻었다.
Z-16a 및 Z-16b를 합성하는 방법과 유사하게 다른 중간체 화합물 Z-16을 성분 Z-14를 산화하고 아민 E-3와 반응시켜서 얻었다. 다른 중간체 화합물 Z-16을 알코올 E-3(그의 알콕사이드 형태), 예를 들어 소듐 메톡사이드와 반응시켜서 얻었다.
h) 실시예 화합물 Ⅲ-2의 합성방법:
Z-16a (1.0 g, 2.63 mmol)를 THF (15 mL)에 첨가하고 실온에서 LiOH 수용액(1 M, 10.5 mL)과 합하였다. 이 후, 이 혼합물을 교반하면서 2시간 동안 환류하였다. 반응을 종료하기 위하여 pH를 1 N HCl을 첨가하여 5.5로 조절하였다. 진공에서 증발시킨 후, 형성된 침전물을 여과하여 물로 세척하고 건조하여 Z-17a (HPLC-MS: tRet. = 1.31 min; MS (M+H)+ = 367)를 얻었다.
벤조산 Z-17a (1.1 g, 3.0 mmol)를 티오닐 클로라이드에 현탁하여 1시간 동안 60 ℃에서 교반하였다. 반응 혼합물을 증발시키고 건조 톨루엔과 함께 공비 건조하였다. 산 염화물 Z-18a (400 mg, 1.04 mmol)를 약간의 NMP (1.2 mL) 중에 취하여 4-메톡시-3-트리플루오로메틸-페닐아민 E-2a (188 mg, 1.55 mmol) 및 DIPEA (300 μL, 1.75 mmol)와 합하였다. 반응을 종료하기 위하여 물을 첨가하고, 얻어진 침전물을 여과하고 건조하여 실시예 화합물 Ⅲ-2 (HPLC-MS: tRet. = 2.20 min; MS (M+H)+ = 540)를 얻었다.
i) Z-17b의 합성방법:
Z-16b (3.42 g, 7.81 mmol)를 THF (25 mL)에 첨가하고 실온에서 LiOH 수용액(1.3 g, 31.4 mmol/10 mL)과 합하였다. 이 후, 이 혼합물을 교반하면서 2시간 동안 환류하였다. 반응을 종료하기 위하여 pH를 1 N HCl을 첨가하여 5.5로 조절하였다. 진공에서 증발시킨 후, 형성된 침전물을 여과하여 5 mL 물로 세척하고 건조하여 Z-17b (HPLC-MS: tRet. = 1.05 min; MS (M+H)+ = 424)를 얻었다.
j) Z-20a의 합성방법:
Z-14a (880 mg, 2.58 mmol)를 THF (30 mL)에 첨가하고 1 M NaOH 용액 (3.87 mL, 3.87 mmol)을 첨가하였다. 반응 혼합물을 3시간 동안 50 ℃에서 교반한 다음, 밤새 실온에서 교반하였다. 반응을 종료하기 위하여 상기 혼합물을 회전 증발기로 농축하고, 잔류물을 묽은 HCl 용액으로 약간 산성화한 다음, 얻어진 침전물을 흡인 여과하고 물로 세척하였다. 중간체 생성물 Z-19a(HPLC-MS: tRet. = 0.83 min; MS (M+H)+ = 328)를 약간의 EtOH로 분쇄하고 흡인 여과하여 건조하였다.
벤조산 Z-19a (29.0 g, 88.59 mmol)를 빙초산 (800 mL)에 넣고 과요오드산 나트륨 (19.139 g, 88.59 mmol)을 첨가하였다. 반응 혼합물을 3시간 동안 80 ℃로 가열하였다. 냉각한 후, 이 혼합물을 Na2S2O5 수용액(15 mL; 10 %)과 혼합하고 회전 증발기로 대부분 농축하였다. 잔류물을 물과 혼합하고, 형성된 침전물을 흡인 여과하여 물로 세척하고 진공 건조기로 70 ℃에서 건조하여 Z-20a (HPLC-MS: tRet. = 1.81 min; MS (M+H)+ = 360)를 얻었다.
Z-20a를 합성하는 방법과 유사하게 다른 중간체 화합물 Z-20을 성분 Z-14를 비누화하고 산화하여 얻었다.
k) 실시예 화합물 Ⅲ-3의 합성방법:
설폭사이드/설폰 Z-20a (2.0 g, 5.57 mmol), 아민 E-3d (1.137 g, 11.13 mmol) 및 DIPEA (1.94 mL, 11.03 mmol)를 DMF (30 mL) 중에 취하여 실온에서 밤새 교반하였다. 용매를 분리하고, 잔류물을 약간의 물과 혼합하였다. 형성된 침전을 흡인 여과하고, 약간의 냉수로 세척하고 건조하여 Z-17a (HPLC-MS: tRet. = 1.47 min; MS (M+H)+ = 382)를 얻었다.
벤조산 Z-17a (50 mg, 0.13 mmol)를 DCM (5 mL)에 현탁하였다. l-클로로-N,N,2-트리메틸프로페닐아민 (41 mg, 0.30 mmol)을 첨가하고, 이 반응 혼합물을 실온에서 3시간 동안 교반하였다. 이 후, 혼합물을 회전 증발기로 농축하고 잔류물을 디옥산/아세토니트릴 (3 mL, 1:1)에 현탁하였다. 벤질아민 E-2c (100 mg, 0.50 mmol)과 DIPEA (65 mg, 0.50 mmol)를 첨가하고, 반응 혼합물을 실온에서 밤새 교반하였다. 반응을 종료하기 위하여 이 혼합물을 회전 증발하여 농축하고, 잔류물을 DMF 중에 취하여 반응 혼합물을 RP-LC/MS로 정제하였다. Ⅲ-3의 생성물을 포함하는 분획(HPLC-MS: tRet. = 1.91 min; MS (M+H)+ = 525)을 동결건조하였다.
방법 a) 내지 d) (합성경로 1) 또는 a), e) 내지 h) (합성경로 2), 및 a), d), i) 및 k) (합성경로 3)와 유사하게, Ⅲ-1, Ⅲ-2 및 Ⅲ-3 이외에 본 발명에 따른 다음 화합물 Ⅲ-4 내지 Ⅲ-608을 제조하였다 (표 3).
표 3
실시예 화합물 Ⅲ-1 내지 Ⅲ-579 및 Ⅲ-592 내지 Ⅲ-608
실시예 화합물 Ⅲ-580 내지 Ⅲ-587
실시예 화합물 Ⅲ-588 내지 Ⅲ-591
* 아민(E-3) 대신에 NaOMe 사용
** 아닐린 A-1 대신에 페놀 사용
타입 IV의 실시예 화합물:
실시예 화합물 IV는 중앙의 (헤테로-)방향족 6원환과 R2 그룹 사이의 반전된 아미드 결합에 의해 타입 Ⅲ과 다르다(반응식 D). 반응성이 반응 성분 E-4 및 E-5(A-3의 합성에 대하여는 반응식 B 참조) 또는 A-4(E-1 및 E-2 또는 A-2와 비교하여 반응식 A 및 C 참조)에서 그에 따라 반전되는 것을 제외하고, 이 화합물들은 사용된 방법면에서 화합물 Ⅲ과 유사하게 얻어진다.
타입 IV의 화합물에 대하여는, 예를 들어 다음과 같은 2가지 합성경로가 가능하다: P-3a에서 출발하여, 바람직하게 염기적으로 촉매화된 조건 하에 상승된 온도에서 8-위치를 아닐린 성분 A-3 또는 A-4로 치환한다.
A-3의 사용과 관련하여(합성경로 1) 반응식 C(중간체 화합물 Z-12에 의한 합성경로 1)에서의 주석을 참조한다(메틸설파닐 그룹의 산화적 활성화 후에 E-3에 의한 최종 치환; 성분 A-3의 합성과 관련하여는 반응식 B 하의 주석 참조).
A-4를 사용하는 경우(합성경로 2와 3), 먼저 중앙의 페닐 또는 헤테로아릴 고리와 나중의 링커 L2의 링커 절편 전구체(니트로 -> 아미노)만을 결합한다. 중간체 화합물 Z-24를 사용하여 메틸설파닐 그룹을 산화/활성화한 다음, 이를 성분 E-3로 치환하고, 마지막으로 환원한 후에 R2 그룹을 삽입하거나(성분 E-5를 거쳐서)(반응경로 2), 또는 먼저 환원과 E-5와의 아미드 커플링을 수행하고, 산화성 활성화 후에 E-3에 의한 친핵성 치환을 수행(반응경로 3)하는 대체 가능성이 있다.
본 발명에 따른 화합물 IV의 R1 및 R2 그룹은 모두 다른 반응 단계(나타내지 않음)에서 변성하여 본 발명에 따른 다른 화합물 IV를 얻을 수 있다. 이러한 반응 단계는 치환, 알킬화, 아실화 또는 부가반응일 수 있다.
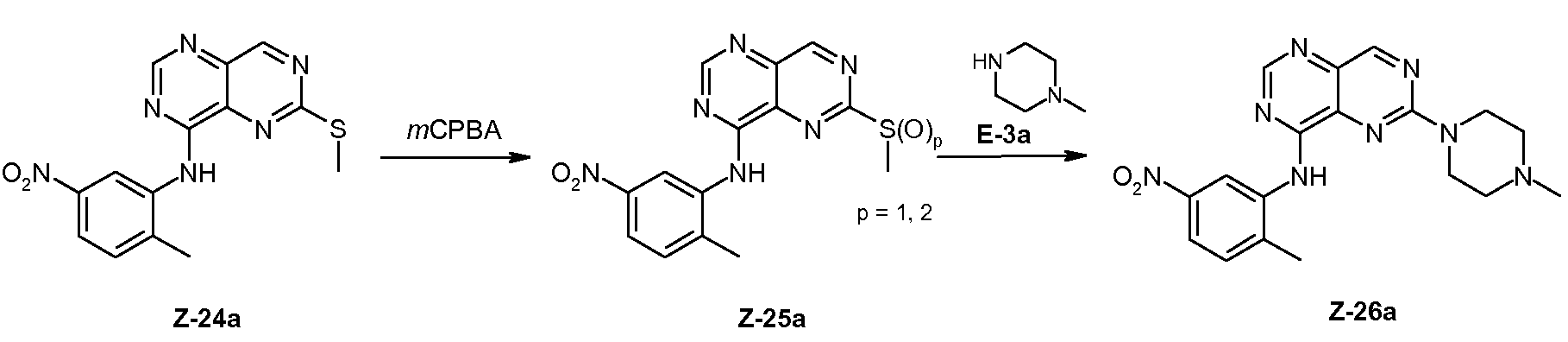
a) Z-24a의 합성방법:
8-클로로-2-메틸설파닐-피리미도[5,4-d]피리미딘 P-3a(3 g, 14.11 mmol)와 니트로아닐린 A-4a (2.21 g, 14.53 mmol)를 디옥산 (25 mL)과 DIPEA (3.393 mL, 18.34 mmol)에 첨가하고 교반 하면서 밤새 환류하였다. 반응을 종료하기 위하여 반응 혼합물을 증발시키고, 잔류물을 MeOH에 현탁하여 형성된 침전물을 여과하고 건조하여 Z-24a (HPLC-MS: tRet. = 2.05 min; MS (M+H)+ = 329)를 얻었다.
Z-24a의 합성방법과 유사하게 다른 중간체 화합물 Z-24를 성분 A-4와 P-3a를 반응시켜서 얻었다.
b) Z-26a의 합성방법:
Z-24a (5 g, 14.47 mmol)를 DCM (50 mL)에 취하여, 실온에서 mCPBA (3.24 g, 14.47 mmol)와 합하고 2시간 동안 실온에서 교반하였다. 반응 혼합물을 여과하고, 여액을 DCM으로 희석한 후, NaHCO3 포화용액으로 3회 세척하였다. 유기층을 Na2SO4로 건조하고 여과한 후, 증발시켜서 Z-25a를 얻었다. Z-25a를 이후에 추가의 정제 없이 직접 반응시켰다(설폭사이드/설폰 함량 약 85 %).
설폭사이드/설폰 Z-25a (85 %, 1 g, 2.47 mmol)와 N-메틸피페라진 E-3a (4.381 mL, 3.95 mmol)를 디옥산 (6 mL)에 첨가하였다. TEA (718 μL, 4.94 mmol)를 상기 현탁액에 적가한 다음, 60 ℃로 가열하고 1시간 동안 교반하였다. 반응을 종료하기 위하여 혼합물을 증발시키고, 잔류물을 iPrOH/물로 현탁하여 여과하고 건조하였다. 침전물을 NP 크로마토그래피에 의해 DCM/MeOH (9:1)를 사용하여 정제하여 Z-26a(HPLC-MS: tRet. = 1.96 min; MS (M+H)+ = 381)를 얻었다.
Z-26a의 합성방법과 유사하게 다른 중간체 화합물 Z-26을 성분 Z-24를 산화하고 아민 E-3와 반응시켜서 얻었다. 다른 중간체 화합물 Z-26을 알코올 E-3(그의 알콕사이드 형태), 예를 들어 소듐 메톡사이드와 반응시켜서 얻었다.
c) 실시예 화합물 IV-1의 합성방법:
니트로 화합물 Z-26a (490 mg, 1.29 mmol)를 EtOH (10 mL) 중에 취하고, 염화암모늄 (34 mg, 0.64 mmol)/물 (10 mL)과 합하여 60 ℃로 가열하였다. 이 온도에서 철 분말 (719 mg, 12.88 mmol)을 회분식으로 첨가하고, 혼합물을 다시 1.5시간 동안 60 ℃에서 교반하였다. 냉각한 후, 이를 실리카겔로 여과하고 DCM/MeOH로 세척하여 얻어진 여액을 회전 증발기로 건조하여 Z-27a (HPLC-MS: tRet. = 1.64 min; MS (M+H)+ = 351)를 얻었다.
4-메톡시-3-트리플루오로메틸벤조산 E-5b (62 mg, 0.29 mmol)를 NMP (750 μL) 중에 취하여 DIPEA (166 μL, 1.03 mmol) 및 HATU (147 mg, 0.39 mmol)와 합하였다. 1시간 후에 아닐린 Z-27a (90 mg, 0.26 mmol)를 첨가하고 이 혼합물을 실온에서 교반하였다. 반응 혼합물을 제조용 HPLC로 정제하여 실시예 화합물 IV-I (HPLC-MS: tRet. = 2.17 min; MS (M+H)+ = 553)을 얻었다.
d) Z-29a의 합성방법:
니트로 화합물 Z-24a (2.96 g, 9.02 mmol)를 디옥산 (100 mL) 중에 취하고, 염화암모늄 (241 mg, 4.51 mmol)/물 (100 mL)과 합하여 70 ℃로 가열하였다. 이 온도에서 철 분말 (5.04 g, 90.2 mmol)을 회분식으로 첨가하고, 혼합물을 다시 5시간 동안 70 ℃에서 교반하였다. 냉각한 후, 이를 실리카겔로 여과하고 DCM/MeOH로 세척하여 얻어진 여액을 회전 증발기로 건조하여 Z-28a (HPLC-MS: tRet. = 1.70 min; MS (M+H)+ = 299)를 얻었다.
벤조산 E-5c (1 g, 5.29 mmol)를 NMP (10 mL) 중에 취하여 DIPEA(3.415 mL, 21.14 mmol) 및 HATU (3.02 g, 7.93 mmol)와 합하였다. 1시간 후에 아닐린 Z-28a (1.58 g, 5.29 mmol)를 첨가하고 이 혼합물을 실온에서 교반하였다. 반응 혼합물을 물과 혼합하였다. 형성된 침전물을 여과하고, 물로 반복 세척한 후 건조하여 Z-29a (HPLC-MS: tRet. = 2.16 min; MS (M+H)+ = 470)를 얻었다.
Z-29a의 합성방법과 유사하게 다른 중간체 화합물 Z-29를 성분 Z-24를 환원하고 산 E-5와 반응시켜서 얻었다.
e) 실시예 화합물 IV-2의 합성방법:
Z-29a (1.91 g, 4.07 mmol)를 DCM (40 mL)에 현탁하고, 0 ℃에서 mCPBA (950 mg, 4.23 mmol)와 합하여 실온에서 2시간 동안 교반하였다. 반응 혼합물을 DCM으로 희석하고 NaHCO3 포화용액으로 2회 세척하였다. 유기층을 Na2SO4로 건조하고 여과한 후 증발시켜서 Z-30a를 얻었다.
설폭사이드/설폰 Z-30a (1.39 g, 2.86 mmol)를 디옥산 (10 mL)에 첨가하여 TEA (1.607 mL, 11.45 mmol)와 혼합하였다. 모폴린 E-3b (250 μL, 2.86 mmol)를 이 현탁액에 적가하고 60 ℃로 가열하여 4시간 동안 교반하였다. 반응을 종료하기 위하여 혼합물을 증발시키고, 잔류물을 DMF에 용해하여 제조용 HPLC로 정제하여 실시예 화합물 IV-2 (HPLC-MS: tRet. = 2.09 min; MS (M+H)+ = 509)를 얻었다.
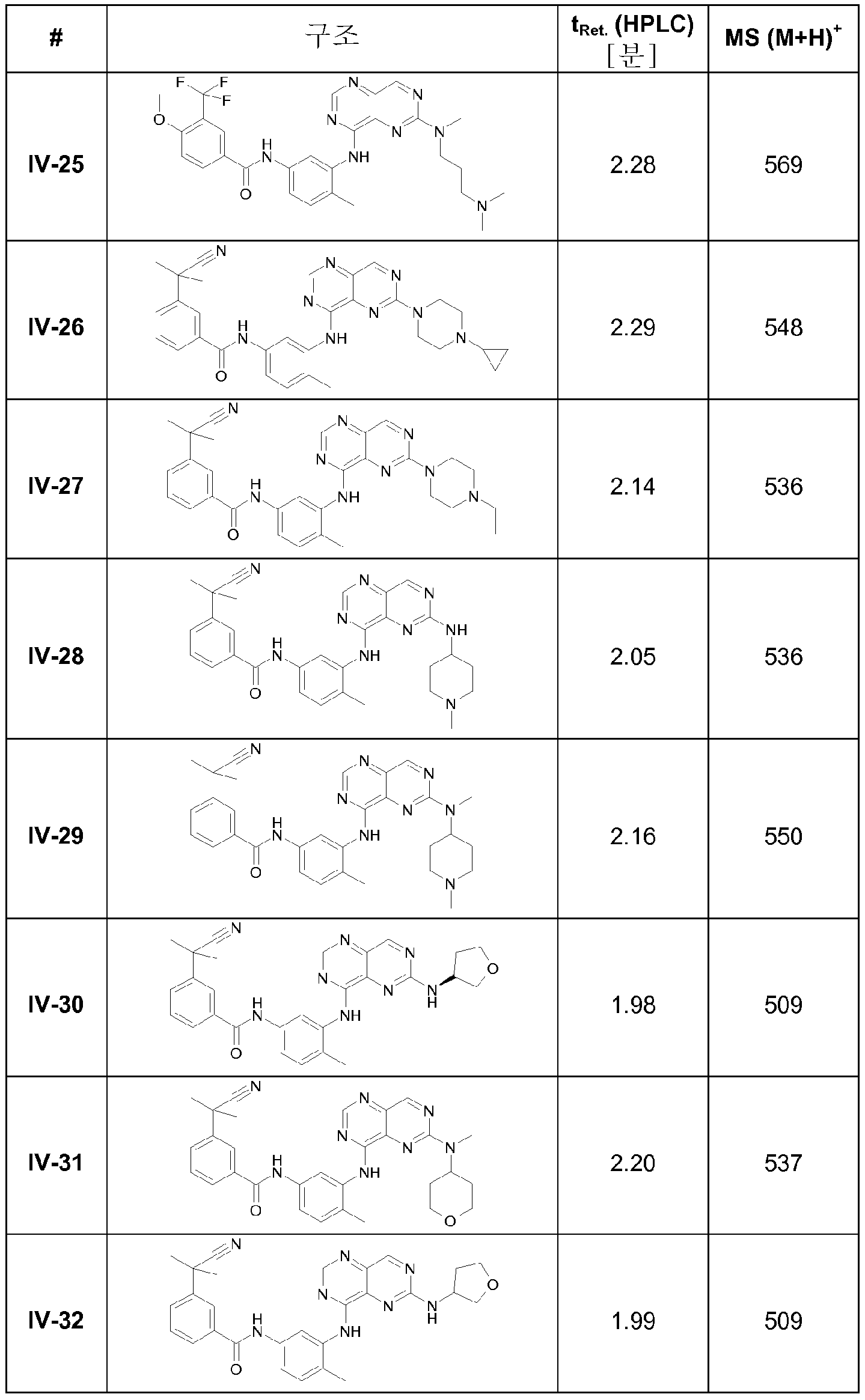
방법 a) 내지 c) (합성경로 2) 또는 a), d) 및 e) (합성경로 3) 및 합성경로 1에 나타낸 방법과 유사하게, IV-1과 IV-2 이외에 본 발명에 따른 다음 화합물 IV-3 내지 IV-68을 제조하였다(표 4).
표 4
실시예 화합물 IV-1 내지 IV-52 및 IV-67과 IV-68
실시예 화합물 IV-53 내지 IV-66
* 아민(E-3) 대신에 NaOMe 사용
** 카복실산 E-5 대신에 설폰산을 중간체 Z-27과 커플링
타입 V 및 VI의 실시예 화합물:
타입 V와 VI의 화합물은 8-위치에 단일치환된 피리미도피리미딘이다(반응식 E).
4,8-디클로로-피리미도[5,4-d]피리미딘 P-4a로 출발하여, 하나의 염소 원자를 아닐린 성분 A-1 (합성경로 1), A-2 (합성경로 2) 또는 A-3 (합성경로 3)로 친핵성 치환하고 다른 염소 원자는 환원하여 제거한다.
중간체 화합물 Z-31 또는 Z-32를 얻기 위한 A-1 또는 A-2에 의한 치환은 반응식 A 또는 C(중간체 화합물 Z-2, Z-3, Z-12 또는 Z-14를 얻는 반응)에 예시한 단계들과 비교가능한 방법으로 수행된다. 실시예 화합물 V는 Z-31(환원)에서 직접 얻을 수 있는 반면, Z-32에서 출발하는 합성에서는 환원 이외에 비누화와 아민 E-2와의 아미드 커플링도 필요하다.
아닐린 A-3을 사용하여, 중간체 화합물 Z-36을 환원한 후, 반전된 아미드 결합을 가지는 실시예 화합물 VI을 얻는다(A-1 또는 A-3의 합성과 관련하여는, 반응식 A 또는 B의 주석을 참조).
a) P-4a의 합성방법:
4,8-디하이드록시피리미도피리미딘 (2.0 g, 12 mmol)을 취하여 옥시염화인 (7.0 mL, 76 mmol)과 염화칼륨 (2.6 g, 35 mmol)을 첨가하였다. 마지막으로, 오염화인 (6.2 g, 30 mmol)을 회분식으로 첨가하였다. 반응 혼합물을 1.5일 동안 130 ℃에서, 그리고 1.5일 동안 실온에서 교반하였다. 과량의 POCl3를 증류하고, 잔류물을 물과 혼합하여 DCM으로 수회 추출하였다. 모아진 유기층을 MgSO4와 혼합하여 실리카겔을 통과시켜 여과하고 DCM으로 세척하였다. 여액을 약 15 mL까지 서서히 증발시켰다. 형성된 침전물을 흡인여과하여 P-4a (HPLC-MS : MS (M+H)+ = 200/202/204)를 얻었다.
b) Z-31a의 합성방법:
4,8-디클로로피리미도피리미딘 P-4a (100 mg, 0.50 mmol)를 얼음으로 냉각하면서 THF (2 mL)에 첨가하였다. 아닐린 A-1d (195 mg, 0.50 mmol)와 DIPEA (0.1 mL, 0.58 mmol)를 첨가하였다. 반응 혼합물을 밤새 실온으로 녹이고 교반하였다. 반응을 종료하기 위해 약간의 아세토니트릴을 혼합하였다. 침전물을 여과하고 건조하여 Z-31a를 얻었다.
Z-31a의 합성방법과 유사하게 다른 중간체 화합물 Z-31을 성분 A-1과 P-4a를 반응시켜서 얻었다.
c) Z-32a의 합성방법:
4,8-디클로로피리미도피리미딘 P-4a (1.0 g, 4.98 mmol)를 THF (20 mL)에 첨가하여 빙냉조에서 냉각하였다. 아닐린 A-2a (840 mg, 4.98 mmol)를 회분식으로 첨가하였다. 반응 혼합물을 DIPEA (940 μL, 5.49 mmol)와 합하여 실온으로 밤새 해동하고 교반하였다. 반응을 종료하기 위하여 혼합물을 증발시켜서 건조한 다음, 아세토니트릴에 취하여 5분 동안 초음파조에서 처리하였다. 침전물을 여과하고 물과 아세토니트릴(1:1)의 혼합물로 세척하고 건조하여, Z-32a (HPLC-MS: tRet. = 1.83 min; MS (M+H)+ = 330)를 얻었다.
Z-32a의 합성방법과 유사하게 다른 중간체 화합물 Z-32를 성분 A-2와 P-4a를 반응시켜서 얻었다.
d) Z-33a의 합성방법:
Z-32a (1.25 g, 3.79 mmol)를 MeOH (130 mL)에 현탁하고, 라니 니켈과 합하여 2 bar에서 밤새 수소첨가반응시켰다. 반응 혼합물을 촉매에서 여과하고 증발시켜서 건조하여 Z-33a (HPLC-MS: tRet. = 1.58 min; MS (M+H)+ = 296)를 얻었으며, 추가 작업 없이 다음에서 반응시켰다(순도 약 80 %).
Z-33a의 합성방법과 유사하게 다른 중간체 화합물 Z-33을 중간체 화합물 Z-32를 환원하여 얻었다.
e) 실시예 화합물 V-1의 합성방법:
에스테르 Z-33a (80 %, 817 mg, 2.21 mmol)를 LiOH의 메탄올 용액 (270 mg, 11.05 mmol LiOH/35 mL MeOH)과 합하였다. 반응 혼합물을 밤새 60 ℃에서 교반하였다. 반응을 종료하기 위하여 혼합물을 15 mL의 물로 희석하고 DCM으로 1회 추출하였다. 수층을 2 N HCl 용액으로 산성 pH로 조절하고 EE로 5회 추출하였다. 모아진 유기층을 NaCl 포화용액으로 1회 추출하고, MgSO4로 건조한 후, 여과하고 증발시켜서 Z-34a (HPLC-MS: tRet. = 0.11 min; MS (M+H)+ = 282)를 얻었다.
벤조산 Z-34a (462 mg, 1.64 mmol)를 티오닐 클로라이드(10 mL, 134 mmol)에 현탁하였다. 반응 혼합물을 1시간 동안 환류하고 60 ℃에서 밤새 교반하였다. 과량의 티오닐 클로라이드를 분리하고 잔류물을 톨루엔과 함께 공비 건조하였다. 산 염화물 Z-35a를 직접 다시 사용하였다.
3-아미노-5-tert-부틸이소옥사졸 E-2d (58 mg, 0.40 mmol)를 DCM (4 mL)에 첨가하고 피리딘 (200 μL, 2.47 mmol)과 합하여 빙냉조에서 냉각하였다. 이 후, 3 mL DCM 중의 산 염화물 Z-35a(120 mg, 0.40 mmol)의 용액을 첨가하였다. 반응 혼합물을 1시간 동안 실온에서 교반하였다. 반응을 완료하기 위해 혼합물을 물로 희석하고, DCM을 분리한 후, DMF를 포함하는 용액에 첨가하여 RP-MPLC (7 % 내지 90 % 아세토니트릴)로 크로마토그래피하였다. V-1의 생성물을 포함하는 분획(HPLC-MS: tRet. = 1.94 min; MS (M+H)+ = 404)을 2N HCl 용액과 혼합하여 동결건조하였다.
방법 a) 및 c) 내지 e) (합성경로 2) 또는 합성경로 1에 나타낸 방법과 유사하게, V-1 이외에 본 발명에 따른 다음 화합물 V-2 내지 V-10을 제조하였다(표 5).
타입 VI의 화합물을 합성경로 3에 나타낸 바에 따라 합성하였다.
표 5
실시예 화합물 V-1 내지 V-10
타입 VII 및 VIII의 실시예 화합물:
타입 VII과 VIII의 화합물은 4-위치와 8-위치에 2치환된 피리미도피리미딘이다(반응식 F).
4,8-디클로로-피리미도[5,4-d]피리미딘 P-4a (합성경로 4 -> Z-37) 또는 중간체 화합물 Z-31, Z-32 또는 Z-36 (반응식 E에 따른 P-4a로부터의 합성 참조)에서 출발하여 4-위치의 염소 원자를 R3-H(암모니아, 메틸아민 또는 물/수산화물)로 치환하였다. 반응식 F에 따른 다른 반응 단계는 이미 기술된 것과 상응한다.
a) VII-1의 합성방법:
물질 Z-31b (34 %, 141.0 mg, 0.109 mmol)를 메틸아민 (THF 중에서 2M, 1 mL)과 혼합하였다. 반응 혼합물을 실온에서 20분 동안 교반하였다. 반응을 종료하기 위하여 증발시키고, 잔류물을 DMSO에 용해하여 제조용 HPLC로 정제하여 실시예 화합물 VII-1 (HPLC-MS: tRet. = 1.85 min; MS (M+H)+ = 433)을 얻었다.
b) Z-42a의 합성방법:
4,8-디클로로피리미도피리미딘 P-4 (2.0 g, 9.95 mmol)를 디옥산 (40 mL)에 첨가하고 빙냉조에서 냉각하였다. 아닐린 A-4a (1.514 g, 9.95 mmol)를 20 mL 디옥산에 취하여 4,8-디클로로피리미도피리미딘 용액에 적가하였다. 이 후, 제이인산칼륨 3수화물(3 M, 6.633 mL, 19.89 mmol)을 첨가하였다. 반응 혼합물을 실온으로 가열하고 65 ℃에서 밤새 교반하였다. 반응을 종료하기 위하여 혼합물을 냉각하고 증발시켰다. 잔류물을 DCM에 용해하여 물로 3회 세척하였다. 유기층을 Na2SO4로 건조하고, 여과하여 증발시켜서 Z-42a (HPLC-MS: tRet. = 1.81 min; MS (M+H)+ = 317)를 얻었다.
c) Z-43a의 합성방법:
물질 Z-42a (100 mg, 0.32 mmol)를 메틸아민 (THF 중에서 2M, 2 mL)과 혼합하였다. 반응 혼합물을 실온에서 30분 동안 교반하였다. 형성된 침전물을 여과하고 약간의 THF로 세척하여 진공에서 건조하여서 Z-43a (HPLC-MS: tRet. = 1.68 min; MS (M+H)+ = 312)를 얻었다.
d) VIII-1의 합성방법:
니트로 화합물 Z-43a (80 mg, 0.26 mmol)를 EtOH (2 mL)에 취하여, 염화암모늄 (7 mg, 0.13 mmol) 수용액 (2 mL)과 혼합하고 75 ℃로 가열하였다. 이 온도에서 철 분말 (72 mg, 1.29 mmol)을 회분식으로 첨가하고, 혼합물을 다시 1시간 동안 75 ℃에서 교반하였다. 냉각한 후, 실리카겔에 의해 여과하고 DCM/MeOH (9:1)로 세척하여 얻어진 여과액을 회전 증발기로 건조하여서 Z-44a (HPLC-MS: tRet. = 1.25 min; MS (M+H)+ = 282)를 얻었다.
벤조산 E-5c (40 mg, 0.21 mmol)를 DCM (1 mL) 중에 취하여 DIPEA (109 μL, 0.63 mmol) 및 HATU (88 mg, 0.23 mmol)와 혼합하였다. 15분 후에 아닐린 Z-44a (60 mg, 0.21 mmol)를 첨가하고 혼합물을 실온에서 교반하였다. 반응을 완료하기 위하여 이 혼합물을 증발시키고, 잔류물을 DMSO로 용해하고 제조용 HPLC로 정제하여 실시예 화합물 VIII-1 (HPLC-MS: tRet. = 1.78 min; MS (M+H)+ = 453)을 얻었다.
표 6
실시예 화합물 VII-1
실시예 화합물 VIII-1 내지 VIII-3
반응식 A 내지 F와 모든 타입의 실시예 화합물(I 내지 VIII)에 대한 추가 정보
본 발명에 따른 화합물 (1)을 합성하기 위해서는 주요 반응물로 특히 E-1, E-2, E-3, E-4, E-5, A-2 및 A-4가 필요하다. 이러한 출발 화합물은 다양한 방법으로 입수할 수 있다. 이러한 합성 성분들의 상당수는 시중에서 입수하거나 또는 당 업자에 의해 일반적인 방법을 사용하여 제조할 수 있다. 또한, 이 성분들과 그 제조방법은 종래 기술로부터 알려져 있거나, 또는 종래 기술에서 알려진 방법과 유사하게 일반적으로 수행되거나 또는 이들로 확장될 수 있다. 특히 다음 간행물에서 공개된 방법들이 포함된다:
WO 2004/050642, WO 2005/056535, WO 2005/090333, WO 2005/115991, US 2006/100204, WO 2008/003770, WO 2005/023761, WO 2008/021388, WO 2007/075896, WO 2007/056016, WO 2008/089034, WO 2009/003999 및 WO 2009/003998.
-C(O)NH- 및 -NHC(O)-와는 상이한 결합 링커 단위 L2에 대하여는 필요한 합성 성분을 일반적으로 전환시킬 수 있다. 따라서, 예를 들어 카복실산 대신에 설폰산을 상응하는 설폰아미드를 합성하는데 사용할 수 있다. 우레아 링커는 이소시아네이트와 아민 또는 2개의 아민 화합물을 카보닐바이셀렉트로필(예를 들어, CDI, 트라이포스젠)에 의해 반응시켜서 얻는다.
이하의 실시예는 본 발명에 따른 화합물의 생물학적 활성을 기술하는 것으로, 본 발명이 하기 실시예에 의해 제한되지는 않는다.
화학식 (1)의 화합물은 치료제 분야에서 다양한 적용 가능성을 특징으로 한다. 특이적 시그널 효소의 억제, 특히 배양된 사람 종양 세포의 증식뿐만 아니라, 예를 들어 내피세포 등의 다른 세포의 증식에 대한 억제 효과와 연관되어 있는 적용 분야를 언급할 수 있다.
키나제 시험 B-RAF (V600E)
연속 희석으로 10 μL의 시험 물질 용액을 멀티웰 플레이트에 옮겼다. 연속 희석은 일반적으로 2 μM 내지 0.119 nM 또는 0.017 nM의 농도 범위가 되도록 선택하였다. 필요하다면 2 μM의 초기 농도를 50 μM, 10 μM 또는 0.4 μM 또는 0.2857 μM로 변화시키고 그에 따라 추가로 희석을 수행하였다. DMSO의 최종농도는 5%였다. 10 μL의 B-Raf (V600E)-키나제 용액(20 mM Tris-HCl pH 7.5, 0.1 mM EDTA, 0.1 mM EGTA, 0.286 mM 소듐 오쏘바나데이트(sodium orthovanadate), 10 % 글리세롤, 1 mg/mL 소 혈청 알부민, 1 mM 디티오트리톨 중 0.5 ng B-Raf (V600E)-키나제 함유)을 파이펫하고, 이 혼합물을 24시간 동안 실온에서 진탕 하에 항온처리하였다. 키나제 반응을 20 μL의 ATP 용액 [최종 농도: 250 μM ATP, 30 mM Tris-HCl pH 7.5, 0.02 % Brij, 0.2 mM 소듐 오쏘바나데이트, 10 mM 마그네슘 아세테이트, 0.1 mM EGTA, 포스파타제 칵테일 (Sigma, # P2850, 제조업체 지시에 따른 희석), 0.1 mM EGTA] 및 10 μL의 MEK1 용액 [50 ng의 비오틴화된 MEKl (표준 방법에 따라, 예를 들어 EZ-Link Sulpho-NHS-LC-Biotin reagent, Pierce, # 21335를 사용하여 정제된 MEK1으로부터 제조) 포함]을 첨가하여 개시하고 60분 동안 실온에서 일정하게 진탕하면서 수행하였다. 12 μL의 100 mM EDTA 용액을 첨가하여 반응을 중지하고 추가로 5분 동안 인큐베이션하였다. 55 μL의 반응 용액을 스트렙타비딘(streptavidin)으로 피복된 플레이트(예를 들어, Streptawell HighBond, Roche, # 11989685001)에 옮겨서 플레이트에 비오틴화된 MEK1을 결합하기 위해 1시간 동안 실온에서 서서히 진탕하였다. 액체를 제거한 후, 플레이트를 200 μL의 1 x PBS와 100 μL의 1차 항체 및 유로피움으로 표지된 2차 항체[Anti Phospho-MEK (Ser217/221), Cell Signaling, # 9121 및 Eu-Nl 표지된 염소-항-래빗 항체, Perkin Elmer, # AD0105] 용액으로 5회 세척하였고, 1차 항체는 1:2000 비율로 희석되었으며 2차 항체는 델피아(Delfia) 에세이 완충액 (Perkin Elmer, # 1244-111)으로 0.4 내지 0.5 μg/mL로 희석되었다. 실온에서 1시간 동안 진탕한 후, 이 용액을 따라내고 200 μL의 델피아 세척 완충액(Perkin Elmer, # 4010-0010/# 1244-114)으로 5회 세척하였다. 200 μL의 인핸스먼트 용액(Perkin Elmer, # 4001-0010/# 1244-105)을 첨가한 후, 혼합물을 실온에서 10분 동안 진탕한 다음, "Delfia Time Resolved Fluorescence (Europium)" 프로그램을 사용하여 Wallac Victor로 측정하였다. IC50값을 소프트웨어 프로그램(GraphPadPrizm)을 사용하여 투약량-활성 곡선으로부터 얻었다.
표 7에는 상기한 B-RAF-키나제 시험을 사용하여 본 발명에 따른 화합물에 대하여 측정된 IC50값을 나타내었다.
배양된 사람 흑색종 세포(SK-MEL-28, 돌연변이 B-RAF
V600E
) 증식의 억제 측정
배양된 사람 종양 세포의 증식을 측정하기 위하여, 흑색종 세포주 SK-MEL-28 [American Type Culture Collection (ATCC)]의 세포를 MEM 배지[10 % 소 태아 혈청, 2 % 탄산수소나트륨, 1 mM 피루브산나트륨, 1 % 비필수 아미노산 (예를 들어, Cambrex의 # BE13-114E) 및 2 mM 글루타민 보충]에서 배양하였다. SK-MEL-28 세포를 96웰의 바닥이 편평한 디쉬에 MEM 배지(상기한 조성 참조)를 보충한 웰 당 2500 세포의 밀도로 옮기고 밤새 인큐베이터(37 ℃, 5% CO2)에서 항온처리하였다. 활성 물질을 세포에 상이한 농도로 첨가하여 농도 범위가 50 μM 내지 3.2 nM가 되게 하였다. 필요하다면, 50 μM의 초기 농도를 10 μM 또는 2 μM로 바꾸고 그에 따라 추가로 희석을 수행하였다(0.6 nM 또는 0.12 nM 까지). 추가로 72시간 동안 항온처리한 다음, 20 μL의 AlamarBlue 시약(Serotec Ltd., # BUFO12B)을 각 웰에 첨가하고 세포를 추가로 3 내지 6시간 동안 항온처리하였다. AlamarBlue 시약의 색상 변화를 형광 분광광도계(예를 들어, Gemini, Molecular Devices)로 측정하였다. EC50 값을 소프트웨어 프로그램(GraphPadPrizm)을 사용하여 계산하였다.
배양된 사람 흑색종 세포(A375, 돌연변이 B-RAF
V600E
) 증식의 억제 측정
배양된 사람 종양 세포의 증식을 측정하기 위하여, 흑색종 세포주 A375 [American Type Culture Collection (ATCC)]의 세포를 DMEM 배지[10 % 소 태아 혈청 및 2 % 탄산수소나트륨 보충]에서 배양하였다. 시험 물질을 (상기한 바와 같은) SK-MEL28 세포에 대해 기술된 방법에 따라 A375 세포에 대해 이들을 각 웰 당 5000 세포를 접종하여 시험하였다.
타입 I 내지 VIII의 실시예 화합물(표 1 내지 6) 대부분은 세포성 A375 및 SK-MEL-28 증식 시험에서 양호 내지 매우 양호한 활성, 즉 5 μM 미만, 일반적으로 1 μM 미만의 EC50 값을 나타냈다.
상기 활성 물질들은 B-RAF 돌연변이를 가지지 않는 세포주에 대하여는 상당히 낮은 항증식 효과를 나타내는 특징이 있으며, 즉 EC50 값이 일반적으로 B-RAF 돌연변이된 세포주의 EC50 값 보다 팩터 10 까지 더 높다
활성 물질의 세포 선택성은 포스포-ERK 환원의 EC50 값이 B-RAF 돌연변이된 세포주에서 항증식 활성의 EC50 값과 연관되어 있는 사실에 의해 입증된다.
배양된 사람 흑색종 세포(SK-MEL-28, 돌연변이 B-RAF
V600E
)에서 포스포-ERK 시그널의 환원 측정
배양된 사람 종양 세포의 포스포-ERK 시그널의 환원을 측정하기 위해서, 흑색종 세포주 SK-MEL-28 [American Type Culture Collection (ATCC)]의 세포를 MEM 배지[10 % 소 태아 혈청, 2 % 탄산수소나트륨, 1 mM 피루브산나트륨, 1 % 비필수 아미노산 (예를 들어, Cambrex의 # BE13-114E) 및 2 mM 글루타민 보충]에서 배양하였다. SK-MEL-28 세포를 96웰의 바닥이 편평한 디쉬에 MEM 배지(상기한 조성 참조)를 보충한 웰 당 7500 세포의 밀도로 옮기고 밤새 인큐베이터(37 ℃, 5% CO2)에서 항온처리하였다. 활성 물질을 세포에 상이한 농도로 첨가하여 농도 범위가 10 μM 내지 2.4 nM가 되게 하였다. 필요하다면, 10 μM의 초기 농도를 50 μM 또는 2.5 μM로 바꾸고 그에 따라 추가로 희석을 수행하였다(12.2 nM 또는 0.6 nM 까지). 추가로 2시간 동안 항온처리한 다음, 세포를 4% 포름알데하이드로 고정하고, PBS 중에서 0.1% Triton X-100으로 투과할 수 있게 하였다. 비특이성 항체 결합을 TBS-T 중에 용해된 5 % 탈지 분유와 함께 항온처리하여 제거하였다. 포스포릴레이티드 ERK를 마우스 모노클로날 안티디포스포릴레이티드 ERK1/2 항체(Sigma, #M8159)로 검출하였다. PBS 중의 0.1 % 트윈 20으로 세척한 후, 결합된 1차 항체를 2차 항체(퍼옥시다제 결합된 폴리클로날 래빗 안티 마우스 IgG, DAKO #P0161)로 검출하였다. 추가의 세척 단계 후에, 기질(TMB 퍼옥시다제 기질 용액, Bender MedSystems #BMS406)을 첨가하였다. 몇 분 후에 1 M 인산을 사용하여 발색 반응을 중지하였다. 색깔을 Spectra max Plus 판독기(Molecular Devices사 제품)를 사용하여 450 nm에서 측정하였다. EC50 값을 소프트웨어 프로그램(GraphPadPrizm)을 사용하여 계산하였다.
본 발명의 물질은 B-RAF-키나제 억제제이다. DNA 염색한 후 FACS 또는 Cellomics Array Scan 분석하여 입증될 수 있는 바와 같이, 본 발명에 따른 화합물에 의해 얻어지는 증식의 억제는 특히 DNA 합성 단계로의 유입을 방해하여 발생한다. 처리된 세포는 세포 주기의 G1 단계에서 저지된다.
따라서, 본 발명에 따른 화합물을 또한 다른 종양 세포에서 시험하였다. 예를 들어 이 화합물들은 결장 암종 세포주, 예를 들면 Colo205에 효과적이며, 이 적응증과 다른 적응증에서 사용할 수 있다. 이것은 다른 종류의 종양을 치료하기 위한 본 발명에 따른 화합물의 유용성을 입증한다.
그의 생물학적 특성을 기초로 하여, 본 발명에 따른 화학식 (1)의 화합물, 그의 토토머, 라세미체, 에난티오머, 디아스테레오머, 이들의 혼합물 및 상기한 모든 형태의 염은 과도하거나 비정상적인 세포 증식을 특징으로 하는 질환을 치료하는데 적합하다.
이러한 질환들로는, 예를 들면 바이러스 감염(HIV 및 Kaposi 육종 등); 염증 및 자가면역 질환(대장염, 관절염, 알츠하이머병, 사구체신염 및 상처치유 등); 박테리아, 진균 및/또는 기생충 감염; 백혈병, 림프종 및 고형 종양(예를 들면, 암종 및 육종 등), 피부 질환(건선 등); 세포 수의 증가를 특징으로 하는 과형성에 기초한 질환(예를 들면, 섬유아세포, 간세포, 골 및 골수세포, 연골 또는 평활근 세포 또는 상피세포(예를 들면, 자궁내막증식증)); 골 질환: 순환기 질환(재협착 및 비대) 등이 있다. 이들은 또한 방사선, UV 처리 및/또는 세포증식억제 처리로 인한 DNA 손상에서 증식 세포(예를 들어, 모발 세포, 장내 세포, 혈액 세포 및 간 세포)를 보호하는데 적합하다.
본 발명에 따른 화합물로 치료할 수 있는 암의 예로는, 뇌종양, 예를 들면, 청신경 초종, 성상세포종 [예를 들면, 모양세포성 성상세포종, 원섬유(fibrillary) 성상세포종, 원형질성(protoplasmic) 성상세포종, 대원형세포성(gemistocytary) 성상세포종, 역형성 성상세포종 및 교모세포종(gioblastoma)], 뇌림프종, 뇌 전이, 뇌하수체 종양[예를 들면, 프롤락틴 분비종양(prolactinoma), HGH(인간 성장 호르몬) 생성 종양 및 ACTH(부신피질자극 호르몬) 생성 종양, 두개인두종, 수모세포종(medulloblastoma), 수막종 및 희소돌기교아세포종]; 신경 종양(신생물), 예를 들면, 식물 신경계의 종양[예를 들면, 교감신경 신경모세포종(neuroblastoma sympathicum), 신경절신경종(ganglioneuroma), 부신경절종(갈색세포종, 크롬친화성 세포종) 및 경동맥 소체 종양)], 말초 신경계의 종양(예를 들면, 절단 신경종, 신경섬유종, 신경초종(neurinoma)(신경집종(neurilemmoma), 슈반세포종(Schwannoma)) 및 악성 슈반세포종) 및 중추신경계의 종양[예를 들면, 뇌 및 골수 종양]; 창자암, 예를 들면, 직장, 결장, 항문, 소장 및 십이지장의 암종; 눈꺼풀 종양, 예를 들면, 기저세포암 또는 기저세포 암종; 췌장암 또는 췌장 암종; 방광암 또는 방광암종; 폐암(기관지 암종), 예를 들면, 소세포 기관지 암종(귀리 세포 암종) 및 비소세포 기관지 암종, 예를 들면, 평판 상피세포 암종, 샘암종 및 거대세포 기관지 암종; 유방암, 예를 들면, 침윤성 도관 암종과 같은 유선 암종, 콜로이드 암종, 소엽 침입성 암종, 관형 암종, 샘낭 암종 및 유두 암종; 비호지킨 림프종(NHL), 예를 들면, 버킷 림프종, 저악성 비호지킨 림프종(NHL) 및 균상식육종; 자궁암 또는 자궁내막 암종 또는 황체 암종; CUP 증후군(Cancer of Unknown Primary)(원발부위 미상 암); 난소암 또는 난소 암종, 예를 들면, 점액성 암, 자궁내막암 또는 장액 암; 담낭암; 담관 암, 예를 들면, 클라츠킨 종양; 고환암, 예를 들면, 정상피종 및 비정상피종; 림프종(lymphosarcoma), 예를 들면, 악성 림프종,호지킨병, 비호지킨 림프종(NHL), 예를 들면, 만성 림프 백혈병, 백혈병성 세망내피증, 면역종, 형질세포종(다발성 골수종), 면역모세포종, 버킷 림프종, T-영역 균상식육종, 거대 세포 미분화 림프모구세포종 및 림프모구 세포종; 후두암, 예를 들면, 성대 종양, 성문상부(supraglottal), 성문 및 성문하부(subglottal) 후두 종양; 골 암, 예를 들면, 골연골증, 연골증, 연골모세포증, 연골점액양섬유종, 골증, 유골 골증, 골모세포증, 호산구성 육아종, 거대 세포 종양, 연골육종, 골육종, 유잉 육종, 세망육종, 형질세포종, 섬유형성이상, 미성숙 골낭 및 동맥류성 골낭; 두경부 종양, 예를 들면, 입술, 혀, 구강저, 구강, 잇몸, 구개, 침샘, 목구멍, 비강, 부비강, 후두 및 중이의 종양; 간암, 예를 들면, 간세포 암종 또는 간세포 암종(HCC); 백혈병, 예를 들면, 급성 림프/림프구성 백혈병(ALL), 급성 골수성 백혈병(AML)과 같은 급성 백혈병; 만성 백혈병, 예를 들면, 만성 림프 백혈병(CLL), 만성 골수성 백혈병(CML); 위암 또는 위 암종, 예를 들면, 유두형, 관형 및 점액성 샘암종, 인환(signet ring) 세포 암종, 선편평 암종, 소세포 암종 및 미분화 암종; 흑색종, 예를 들면, 표재 확장성 흑색종, 결절성 흑색종, 악성 흑색점 및 말단 흑자성 흑색종; 신장암, 예를 들면, 신장 세포 암종 또는 부신종 또는 그라비츠 종양; 식도암 또는 식도 암종; 음경암; 전립선암; 인후암 또는 인두 암종, 예를 들면, 비강인두 암종, 구인두 암종 및 하인두 암종; 망막모세포종, 예를 들면, 질암 또는 질 암종; 플레이트(plate) 상피 암종, 샘암종, 동일반응계의 암종, 악성 흑색종 및 육종; 갑상선 암종, 예를 들면, 유두형, 여포성 및 수질 갑상선 암종, 및 역행성 암종; 스피날리오마(spinalioma), 표피(epidormoid) 암종, 및 피부의 플레이트 상피 암종; 흉선종, 요도암 및 외음부암이 비제한적으로 포함된다.
상기 신규 화합물은 임의로 방사선요법제 또는 다른 최신(state-of-the art) 화합물, 예를 들면 세포정지 또는 세포독성 물질, 세포증식 억제제, 항혈관생성 물질, 스테로이드 또는 항체 등과 함께 상기한 질환의 예방 또는 장기 또는 단기 치료에 사용될 수 있다.
화학식 (1)의 화합물은 단독으로 또는 본 발명에 따른 다른 활성 물질과 배합하여, 또한 임의로 다른 약리학적으로 활성인 물질과 함께 사용할 수 있다.
본 발명에 따른 화합물과 함께 투여할 수 있는 화학요법제로는, 제한적인 것은 아니나, 호르몬, 호르몬 유사물 및 안티호르몬(타목시펜, 토레미펜, 랄록시펜, 풀베스트란트, 메게스트롤 아세테이트, 플루타미드, 닐루타미드, 비칼루타미드, 아미노글루테티미드, 시프로테론 아세테이트, 피나스테리드, 부세렐린 아세테이트, 플루드로코르티손, 플루옥시메스테론, 메드록시프로게스테론, 및 옥트레오티드 등), 아로마타제 억제제(아나스트로졸, 레트로졸, 리아로졸, 보로졸, 엑세메스테인 및 아타메스테인 등), LHRH 아고니스트와 안타고니스트(고세렐린 아세테이트 및 루프롤리드 등), 성장 인자 억제제("혈소판 유도 성장 인자"와 "간세포 성장 인자" 등의 성장 인자, 억제제는 예를 들어 "성장 인자" 항체, "성장 인자 리셉터" 항체 및 티로신 키나제 억제제, 예를 들면 세툭시맵, 게피티닙, 이마티닙, 라파티닙, 및 트라스투주맵 등이다); 항대사성물질(예를 들면, 메토트렉세이트, 랄티트렉세드 등의 엽산길항제, 5-플루오로유라실, 카페시타빈 및 겜시타빈 등의 피리미딘 유사물, 머캡토퓨린, 티오구아닌, 클라드리빈 및 펜토스타틴 등의 퓨린 및 아데노신 유사물, 시타라빈 및 플루다라빈 등); 항종양 항생제(예를 들면, 독소루비신, 다우노루비신, 에피루비신 및 이다루비신 등의 안트라시클린, 미토마이신 C, 블레오마이신, 닥티노마이신, 플리카마이신 및 스트렙토조신); 플래티넘 유도체(예를 들면, 시스플라틴, 옥살리플라틴 및 카보플라틴); 알킬화제(예를 들면, 에스트라무스틴, 메클로레타민, 멜팔란, 클로람부실, 부설판, 다카바진, 시클로포스파미드, 이포스파미드 및 테모졸로미드, 니트로소우레아, 예를 들면 카무스틴 및 로무스틴, 및 티오테파); 항유사분열제(예를 들면, 빈블라스틴, 빈데신, 비노렐빈 및 빈크리스틴 등의 빈카 알칼로이드; 파클리탁셀 및 도세탁셀 등의 탁산); 토포아이소머라제 억제제(예를 들면, 에토포시드 및 에토포포스 등의 에피포도필로톡신, 테니포시드, 암사크린, 토포테칸, 이리노테칸 및 미톡산트론) 및 아미포스틴, 아나그렐리드, 클로드로네이트, 필그라스틴, 인터페론 알파, 로이코보린, 리툭시맵, 프로카바진, 레바미솔, 메스나, 미토탄, 파미드로네이트 및 포피머 등의 기타 화학요법제가 있다.
적합한 제제로는, 예를 들면, 정제, 캡슐제, 좌약제, 용액제, 특히 (피하, 정맥내, 근육내) 주사 및 주입용 용액제, 엘릭서제, 에멀젼제 또는 분산성 산제 등이 있다. 약제학적 활성 화합물(들)의 함량은 조성물 총량의 0.1 내지 90중량%, 바람직하게는 0.5 내지 50중량% 범위, 즉 아래에 기재된 투여량 범위를 달성하기에 충분한 양이어야 한다. 필요한 경우, 기재된 투여량은 하루에 여러 번 제공될 수도 있다.
적합한 정제는, 예를 들면, 상기 활성 물질(들)을 알려진 첨가제, 예를 들면, 불활성 희석제, 예를 들면, 탄산칼슘, 인산칼슘 또는 락토스; 붕해제, 예를 들면, 옥수수 전분 또는 알긴산; 결합제, 예를 들면, 전분 또는 젤라틴; 윤활제, 예를 들면, 스테아린산 마그네슘 또는 탈크; 및/또는 방출 지연제, 예를 들면, 카복시메틸셀룰로스, 셀룰로스 아세테이트 프탈레이트 또는 폴리비닐아세테이트를 혼합하여 수득할 수 있다. 상기 정제는 여러 개의 층을 포함할 수도 있다.
따라서, 코팅정은 정제와 유사하게 제조된 코어를 당 코팅에 일반적으로 사용되는 물질, 예를 들면, 콜리돈 또는 쉘락, 아라비아 검, 탈크, 이산화티탄 또는 당으로 코팅하여 제조할 수 있다. 지연 방출을 달성하고 비혼화성을 방지하기 위해, 코어는 다수의 층으로 이루어질 수 있다. 마찬가지로, 당 코팅은 지연 방출 효과를 얻기 위해 다수의 층을 포함할 수 있으며, 위에서 언급한 정제용 첨가제를 사용할 수 있다.
본 발명에 따른 활성 물질 또는 이들의 배합물을 함유하는 시럽제 또는 엘릭서제는 감미제, 예를 들면, 사카린, 시클라메이트, 글리세롤 또는 설탕; 및 향미증강제, 예를 들면, 바닐린 또는 오렌지 추출물과 같은 향미제를 추가로 함유할 수 있다. 이들은 현탁 보조제 또는 증점제, 예를 들면, 소듐 카복시메틸셀룰로스; 습윤제, 예를 들어 지방 알코올과 에틸렌 옥사이드의 축합물; 또는 보존제, 예를 들면, p-하이드록시벤조에이트를 함유할 수도 있다.
주사 및 주입용 용액제는 일반적인 방법으로, 예를 들면, 등장제, p-하이드록시벤조에이트와 같은 보존제, 또는 에틸렌디아민 테트라아세트산의 알칼리 금속염과 같은 안정화제를 첨가하고, 임의로 에멀젼화제 및/또는 분산제를 사용하여 제조하며, 물을 희석제로서 사용하는 경우, 예를 들면, 임의로 유기 용매를 용매화제 또는 용해 보조제로서 사용할 수 있으며 주사 바이알 또는 앰플 또는 주입 병 속으로 옮겨담을 수 있다.
하나 이상의 활성 물질 또는 이들의 배합물을 함유하는 캡슐제는, 예를 들면, 활성 물질을 락토스 또는 소르비톨과 같은 불활성 담체와 혼합하고 이들을 젤라틴 캡슐제 속에 포장하여 제조할 수 있다.
적합한 좌약제는, 예를 들면, 이러한 목적으로 제공되는 담체, 예를 들면, 중성 지방 또는 폴리에틸렌글리콜 또는 이의 유도체와 혼합하여 제조할 수 있다.
사용가능한 첨가제로는, 예를 들면, 물, 약제학적으로 허용가능한 유기 용매, 예를 들면, 파라핀(예를 들면, 석유 분획), 식물성 오일(예를 들면, 땅콩유 또는 참깨유), 일관능성 또는 다관능성 알코올(예를 들면, EtOH 또는 글리세롤); 담체, 예를 들면, 천연 미네랄 분말(예를 들면, 카올린, 점토, 탈크, 쵸크), 합성 미네랄 분말(예를 들면, 고분산된 규산 및 규산염), 당(예를 들면, 사탕수수 당, 락토스 및 글루코오스), 유화제(예를 들면, 리그닌, 아황산 폐용액(spent sulphite liquors), 메틸셀룰로스, 전분 및 폴리비닐피롤리돈) 및 윤활제(예를 들면, 스테아린산 마그네슘, 탈크, 스테아린산 및 소듐 라우릴 설페이트)등이 있다.
본 발명에 따른 제제는 일반적인 방법으로 투여하며, 바람직하게는 경구 또는 경피 투여, 가장 바람직하게는 경구 투여한다. 경구 투여의 경우, 정제는, 위에서 언급한 담체 이외에도, 시트르산나트륨, 탄산칼슘 및 인산이칼슘과 같은 첨가제를 전분, 바람직하게는 감자 전분, 젤라틴 등과 같은 추가의 각종 첨가제와 함께 포함할 수 있다. 또한, 정제화 공정에서 스테아린산 마그네슘, 소듐 라우릴설페이트 및 탈크와 같은 윤활제를 동시에 사용할 수 있다. 수성 현탁액의 경우, 활성 물질은 위에서 언급된 첨가제 이외에도 각종 기호 개선제 또는 착색제와 배합할 수 있다.
비경구 사용을 위해, 적합한 액상 담체를 갖는 활성 물질 용액을 사용할 수 있다.
정맥내 투여량은 1 내지 1000mg/시, 바람직하게는 5 내지 500mg/시이다. 그러나, 때때로 체중, 투여 경로, 개별적인 약물에 대한 반응, 제형의 성질, 및 약물 투여 시간 또는 간격에 따라, 지정된 투여량으로부터 적절하게 변경할 수도 있다. 따라서, 일부에서는 제시된 최소 투여량 미만으로 사용하는 것이 충분할 수도 있고, 다른 경우, 상한선을 초과할 수도 있다. 대량 투여하는 경우, 상기 투여량을 여러 개의 더 작은 투여량으로 나누어 하루에 걸쳐 분산하는 것이 바람직하다.
다음의 제형예는 본 발명의 범위를 제한하지 않으면서 본 발명을 예시한다:
약제학적 제형의 예
A) 정 제
1정 당
화학식(1)에 따른 활성 물질 100 mg
락토스 140 mg
옥수수 전분 240 mg
폴리비닐피롤리돈 15 mg
스테아린산 마그네슘 5 mg
500 mg
미분된 활성 물질, 락토스 및 옥수수 전분의 일부를 함께 혼합한다. 상기 혼합물을 스크리닝하고, 폴리비닐피롤리돈 수용액으로 습윤시키고, 혼련시키고, 습식 분쇄하여 건조시킨다. 과립, 잔류하는 옥수수 전분 및 스테아린산 마그네슘을 스크리닝하고, 함께 혼합한다. 상기 혼합물을 압착하여 적합한 형태와 크기를 갖는 정제를 제조한다.
B) 정 제
1정 당
화학식(1)에 따른 활성 물질 80 mg
락토스 55 mg
옥수수 전분 190 mg
미정질 셀룰로스 35 mg
폴리비닐피롤리돈 15 mg
소듐 카복시메틸 전분 23 mg
스테아린산 마그네슘 2 mg
400 mg
미분된 활성 물질, 옥수수 전분의 일부, 락토스, 미정질 셀룰로스 및 폴리비닐피롤리돈을 함께 혼합하고, 이 혼합물을 스크리닝하고, 남아있는 옥수수 전분과 물로 작업하여, 과립을 형성시키고, 이를 건조시키고 스크리닝한다. 상기 과립에 소듐 카복시메틸 전분 및 스테아린산 마그네슘을 첨가하고, 혼합하고, 이 혼합물을 압착하여 적합한 크기를 갖는 정제를 제조한다.
C) 앰플 용액
화학식(1)에 따른 활성 물질 50 mg
염화나트륨 50 mg
주사용수 5 ml
고유의 pH에서 또는 임의로 pH 5.5 내지 6.5에서 활성 물질을 물에 용해시키고, 염화나트륨을 첨가하여 등장이 되게 한다. 수득된 용액을 여과하여 피로겐(pyrogen)을 제거하고, 여액을 무균 조건하에 앰플로 옮겨 담고, 멸균시키고, 용해시켜 밀봉한다. 상기 앰플은 5 mg, 25 mg 및 50 mg의 활성 물질을 함유한다.
Claims (18)
- 토토머, 라세미체, 에난티오머, 디아스테레오머 및 이들의 혼합물 형태로 존재할 수 있는 화학식 (1)의 화합물, 또는 상기한 모든 형태의 약리학적으로 허용가능한 그의 염:
상기 식에서,
R1은 수소 또는 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되거나, 또는 -ORc, -SRc, -NRcRc, -NRgNRcRc 및 -S(O)Rc 중에서 선택되는 적합한 치환체이고;
R2는 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는 그룹이고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
R3는 수소, C1-4알킬, 할로겐, -OH, -O(C1-4알킬), -NH2, -NH(C1-4알킬) 및 -N(C1-4알킬)2 중에서 선택되고;
R4는 수소, -CN, -NO2, -NH2, -NH(C1-4알킬), -N(C1-4알킬)2, C1-4알킬, C1-4할로알킬, C1-4알콕시, C1-5시클로알킬 및 할로겐 중에서 선택되고;
X1, X2 및 X3는 질소와 CR4* 중에서 서로에 대해 독립적으로 각각 선택되고, 여기에서 X1, X2 및 X3 원자 중 2개 이하가 질소 원자일 수 있고 R4*는 수소, -CN, -NO2, -NH2, -NH(C1-4알킬), -N(C1-4알킬)2, C1-4알킬, C1-4할로알킬, C1-4알콕시, C1-5시클로알킬 및 할로겐 중에서 서로에 대해 독립적으로 각각 선택되고;
L1은 -CH2-, -NH-, -NMe-, -O- 및 -S- 중에서 선택되고;
L2는 -C(O)NH-, -C(O)N(C1-4알킬)-, -NHC(O)-, -N(C1-4알킬)C(O)-, -CH2-NHC(O)-, -C(O)-, -C(S)NH-, -NHC(S)-, -NHCH2-, -CH2NH-, -S(O)2NH-, -NHS(O)2, -NHC(O)NH-, -OC(O)NH- 및 -NHC(O)O- 중에서 선택되고;
각각의 Rb는 적합한 치환체이고, -ORc, -SRc, -NRcRc, -ONRcRc, -N(ORc)Rc, -NRgNRcRc, 할로겐, -CN, -NO2, -N3, -C(O)Rc, -C(O)ORc, -C(O)NRcRc, -C(0)NRgNRcRc, -C(0)NRg0Rc, -C(NRg)Rc, -N=CRcRc, -C(NRg)0Rc, -C(NRg)NRcRc, -C(NRg)NRgNRcRc, -C(N0Rg)Rc, -C(N0Rg)NRcRc, -C(NNRgRg)Rc, -OS(O)Rc, -OS(O)ORc, -OS(O)NRcRc, -OS(O)2Rc, -OS(O)2ORc, -OS(O)2NRcRc, -OC(O)Rc, -OC(O)ORc, -0C(0)NRcRc, -OC(NRg)Rc, -0C(NRg)NRcRc, -0NRgC(0)Rc, -S(O)Rc, -S(O)ORc, -S(O)NRcRc, -S(O)2Rc, -S(O)2ORc, -S(O)2NRcRc, -NRgC(0)Rc, -NRgC(0)0Rc, -NRgC(O)NRcRc, -NRgC(O)NRgNRcRc, -NRgC(NRg)Rc, -N=CRcNRcRc, -NRgC(NRg)0Rc, -NRgC(NRg)NRcRc, -NRgC(N0Rg)Rc, -NRgS(0)Rc, -NRgS(0)0Rc, -NRgS(O)2Rc, -NRgS(0)20Rc, -NRgS(O)2NRcRc, -NRgNRgC(0)Rc, -NRgNRgC(O)NRcRc, -NRgNRgC(NRg)Rc 및 -N(0Rg)C(0)Rc 및 2가 치환체 =0, =S, =NRg, =N0Rg, =NNRgRg 및 =NNRgC(0)NRgRg 중에서 서로에 대해 독립적으로 선택되지만, 2가 치환체들은 단지 방향족이 아닌 고리 시스템에서의 치환체일 수 있고;
각각의 Rc는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rd 및/또는 Re에 의해 임의로 치환된 그룹이고, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rd는 적합한 치환체이고, -ORe, -SRe, -NReRe, -ONReRe, -N(ORe)Re, -N(Rg)NReRe, 할로겐, -CN, -NO, -NO2, -N3, -C(O)Re, -C(O)ORe, -C(O)NReRe, -C(0)NRgNReRe, -C(0)NRg0Re, -C(NRg)Re, -N=CReRe, -C(NRg)0Re, -C(NRg)NReRe, -C(NRg)NRgNReRe, -C(N0Rg)Re, -C(N0Rg)NReRe, -C(NNRgRg)Re, -OS(O)Re, -OS(O)ORe, -OS(O)NReRe, -OS(O)2Re, -OS(O)2ORe, -OS(O)2NReRe, -OC(O)Re, -OC(O)ORe, -0C(0)NReRe, -OC(NRg)Re, -0C(NRg)NReRe, -0NRgC(0)Re, -S(O)Re, -S(O)ORe, -S(O)NReRe, -S(O)2Re, -S(O)2ORe, -S(O)2NReRe, -NRgC(0)Re, -NRgC(0)0Re, -NRgC(O)NReRe, -NRgC(O)NRgNReRe, -NRgC(NRg)Re, -N=CReNReRe, -NRgC(NRg)0Re, -NRgC(NRg)NReRe, -NRgC(NRg)SRe, -NRgC(N0Rg)Re, -NRgS(0)Re, -NRgS(0)0Re, -NRgS(O)2Re, -NRgS(0)20Re, -NRgS(O)2NReRe, -NRgNRgC(0)Re, -NRgNRgC(O)NReRe, -NRgNRgC(NRg)Re 및 -N(0Rg)C(0)Re 및 2가 치환체 =0, =S, =NRg, =N0Rg, =NNRgRg 및 =NNRgC(0)NRgRg 중에서 서로에 대해 독립적으로 선택되지만, 2가 치환체들은 단지 방향족이 아닌 고리 시스템에서의 치환체일 수 있고;
각각의 Re는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rf 및/또는 Rg에 의해 임의로 치환된 그룹이고, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rf는 적합한 치환체이고, -ORg, -SRg, -NRgRg, -ONRgRg, -N(ORg)Rg, -N(Rh)NRgRg, 할로겐, -CN, -NO2, -N3, -C(O)Rg, -C(O)ORg, -C(O)NRgRg, -C(0)NRhNRgRg, -C(0)NRh0Rg, -C(NRh)Rg, -N=CRgRg, -C(NRh)0Rg, -C(NRh)NRgRg, -C(NRh)NRhNRgRg, -C(N0Rh)Rg, -C(N0Rh)NRgRg, -C(NNRhRh)Rg, -OS(O)Rg, -OS(O)ORg, -OS(O)NRgRg, -OS(O)2Rg, -OS(O)2ORg, -OS(O)2NRgRg, -OC(O)Rg, -OC(O)ORg, -0C(0)NRgRg, -OC(NRh)Rg, -0C(NRh)NRgRg, -0NRhC(0)Rg, -S(O)Rg, -S(O)ORg, -S(O)NRgRg, -S(O)2Rg, -S(O)2ORg, -S(O)2NRgRg, -NRhC(0)Rg, -NRhC(0)0Rg, -NRhC(O)NRgRg, -NRhC(O)NRhNRgRg, -NRhC(NRh)Rg, -N=CRgNRgRg, -NRhC(NRh)0Rg, -NRhC(NRh)NRgRg, -NRhC(N0Rh)Rg, -NRhS(0)Rg, -NRhS(0)0Rg, -NRhS(O)2Rg, -NRhS(0)20Rg, -NRhS(O)2NRgRg, -NRhNRhC(0)Rg, -NRhNRhC(O)NRgRg, -NRhNRhC(NRh)Rg 및 -N(0Rh)C(0)Rg 및 2가 치환체 =0, =S, =NRh, =N0Rh, =NNRhRh 및 =NNRhC(0)NRhRh 중에서 서로에 대해 독립적으로 선택되지만, 2가 치환체들은 단지 방향족이 아닌 고리 시스템에서의 치환체일 수 있고;
각각의 Rg는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rh 에 의해 임의로 치환된 그룹을 나타내고, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rh는 서로에 대해 독립적으로 수소, C1-6알킬, 2 내지 6원의 헤테로알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택된다. - 제1항에 있어서, R1이 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되고 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되는 그룹이고, Rb 및 Rc는 제1항에서와 같이 정의되는 화합물.
- 제2항에 있어서, R1이 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되는, 3 내지 7원의 모노시클릭이고 질소를 포함하는 헤테로시클로알킬 또는 6 내지 10원의 바이시클릭이고 질소를 포함하는 헤테로시클로알킬이며, R1이 피리미도[5,4-d]피리미딘 구조에 질소 원자에 의해 결합되고, Rb 및 Rc는 제1항에서와 같이 정의되는 화합물.
- 제2항 또는 제3항에 있어서, R1이 질소 원자에 의해 피리미도[5,4-d]피리미딘 구조에 결합하며, Rbl과 Rcl 중에서 독립적으로 각각 선택되는 하나 이상의 치환체로 임의로 치환되는 헤테로시클로알킬이고;
각각의 Rbl은 -ORcl, -NRclRcl, 할로겐, -C(O)Rcl 및 =0 중에서 서로에 대하여 독립적으로 선택되지만, 후자의 치환체는 단지 비방향족 고리 시스템에서 치환체일 수 있으며,
각각의 Rcl은 서로에 대하여 독립적으로 수소 또는 하나 이상의 같거나 다른 Rdl 및/또는 Rel으로 임의로 치환되는 그룹을 나타내고, C1-6알킬, 페닐, C3-10시클로알킬, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고,
각각의 Rdl은 -ORel 및 -NRelRel 중에서 서로에 대하여 독립적으로 선택되고, 각각의 Rel은 서로에 대하여 독립적으로 수소 또는 하나 이상의 같거나 다른 C1-6알킬로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C3-10시클로알킬, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되는 화합물. - 제1항에 있어서, R1이 -NRc2Rc3를 나타내고 Rc2 및 Rc3는 각각 제1항의 Rc로서 정의되는 화합물.
- 제5항에 있어서, R1이 -NRc2Rc3를 나타내고,
Rc2는 수소, C1-6알킬, C3-6시클로알킬, 페닐, 5 내지 6원의 헤테로아릴 및 3 내지 7원의 헤테로시클로알킬 중에서 선택되고,
Rc3는 하나 이상의 같거나 다른 Rd3 및 Re3로 임의로 치환되는 그룹이고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고,
각각의 Rd3는 서로에 대하여 독립적으로 할로겐, -NRe3Re3 및 -ORc3 중에서 선택되고,
각각의 Re3는 서로에 대하여 독립적으로 수소 또는 하나 이상의 같거나 다른 Rf3 및/또는 Rg3로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고,
각각의 Rf3는 -ORg3를 나타내고,
각각의 Rg3는 서로에 대하여 독립적으로 수소 및 C1-6알킬 중에서 선택되는 화합물. - 제1항 내지 제6항 중 어느 하나의 항에 있어서,
X1이 CR4*-1을 나타내고, X2는 CR4*-2를 나타내며, X3는 CR4*-3를 나타내고,
R4*-1, R4*-2 및 R4*-3는 각각 수소, 불소, 브롬, 염소 및 메틸 중에서 선택되고 R4*-1, R4*-2 및 R4*-3 그룹 중 적어도 2개가 수소를 나타내는 화합물. - 제1항 내지 제6항 중 어느 하나의 항에 있어서,
X1이 질소를 나타내고, X2는 CR4*-2를 나타내며, X3는 CR4*-3를 나타내고,
R4*-2 및 R4*-3는 각각 수소, 불소, 브롬, 염소 및 메틸 중에서 선택되고 R4*-2 및 R4*-3 그룹 중 적어도 1개가 수소를 나타내는 화합물. - 제1항 내지 제8항 중 어느 하나의 항에 있어서, R2가 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되고, C6-10아릴 및 5 내지 12원의 헤테로아릴 중에서 선택되는 그룹이고, Rb 및 Rc는 제1항에서와 같이 정의되는 화합물.
- 제9항에 있어서, R2가 하나 이상의 같거나 다른 Rb 및/또는 Rc로 임의로 치환되고, 페닐 및 5 내지 6원의 헤테로아릴 중에서 선택되는 그룹이고, Rb 및 Rc는 제1항에서와 같이 정의되는 화합물.
- 제10항에 있어서, R2가 퓨릴, 티에닐, 피롤릴, 옥사졸릴, 티아졸릴, 트리아졸릴, 이소옥사졸릴, 이소티아졸릴, 피라졸릴, 이미다졸릴, 옥사디아졸릴, 티아디아졸릴, 피리딜 및 피리미딜 중에서 선택되는 헤테로아릴이고, C3-7시클로알킬, 페닐, 4 내지 7원의 헤테로시클로알킬, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 1-메틸프로필, 이소부틸, sec-부틸, tert-부틸, n-펜틸, 1-메틸부틸, 1-에틸프로필, 이소펜틸, 네오펜틸, 트리플루오로메틸, 디플루오로메틸, 플루오로메틸, tert-부톡시, 트리플루오로메톡시,
중에서 각각 독립적으로 선택되는 1개 또는 2개의 치환체로 임의로 치환되는 화합물. - 제10항에 있어서, R2는 페닐 을 나타내고;
R5는 수소, C1-6알킬, -OC1-6알킬, C1-6할로알킬, -OC1-6할로알킬, C3-7시클로알킬 및 3 내지 7원의 헤테로시클로알킬 중에서 선택되고, 상기한 그룹 모두는 임의로 C1-6알킬, -CN 또는 -OH로 치환되며;
R6는 수소, C1-6알킬, -OC1-6알킬, C1-6할로알킬, -OC1-6할로알킬, -CN, -OH, 할로겐, -NHC1-6알킬 및 -N(C1-6알킬)2 중에서 선택되고, 후자의 2개는 알킬 잔기에서 -N(C1-6알킬)2 치환체에 의해 임의로 치환되며;
R7은 수소, -OC1-6알킬, 할로겐, -NHS(O)2C1-6알킬, -S(O)2NH2, -S(O)2NH2C1-6알킬, -S(O)2N(C1-6알킬)2,
중에서 선택되고;
R9은 수소 및 C1-6알킬 중에서 선택되고;
Rc4는 수소 또는 하나 이상의 같거나 다른 Rd4 및/또는 Re4로 임의로 치환되는 그룹을 나타내고, C1-6알킬 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되며;
각각의 Rd4는 적합한 치환체이고, -ORe4, -NRe4Re4 및 할로겐 중에서 서로에 대해 독립적으로 선택되고;
각각의 Re4는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rf4 및/또는 Rg4로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C1-6할로알킬, C3-10시클로알킬, C6-10아릴, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rf4는 적합한 치환체이고, 2가의 치환체 =O뿐만 아니라 -ORg4, -NRg4Rg4 및 할로겐 중에서 서로에 대해 독립적으로 선택되고, =O는 비방향족 고리 시스템에서만 치환체가 될 수 있으며;
각각의 Rg4는 서로에 대해 독립적으로 수소 또는 하나 이상의 같거나 다른 Rh4로 임의로 치환되는 그룹을 나타내고, C1-6알킬, C3-10시클로알킬, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되고;
각각의 Rh4는 C1-6알킬, 2가의 치환체 =O 중에서 서로에 대해 독립적으로 선택되고, =O는 비방향족 고리 시스템에서만 치환체가 될 수 있거나;
또는
-NR9Rc4 그룹은 Rd4 및 Re4 중에서 선택되는 하나 이상의 같거나 다른 그룹에 의해 임의로 치환되는, 질소를 함유하는, 3 내지 14원의 헤테로시클로알킬 또는 5 내지 12원의 헤테로아릴을 나타내며;
-NR9Re4 그룹은 Rf4 및 Rg4 중에서 선택되는 하나 이상의 같거나 다른 그룹에 의해 임의로 치환되는, 질소를 함유하는, 3 내지 14원의 헤테로시클로알킬 또는 5 내지 12원의 헤테로아릴을 나타내며;
-NR9Rg4 그룹은 하나 이상의 같거나 다른 Rh4 그룹에 의해 임의로 치환되는, 질소를 함유하는, 3 내지 14원의 헤테로시클로알킬 또는 5 내지 12원의 헤테로아릴을 나타내며;
R8은 수소, C1-6알킬, -OC1-6알킬, -CN, 할로겐, 5 내지 12원의 헤테로아릴 및 3 내지 14원의 헤테로시클로알킬 중에서 선택되는 화합물. - 약제로서의, 제1항 내지 제13항 중 어느 하나의 항에 따른 화학식 (1)의 화합물 또는 그의 약리학적으로 허용가능한 염.
- 활성 물질로서 제1항 내지 제13항 중 어느 하나의 항에 따른 화학식 (1)의 화합물 또는 약리학적으로 허용가능한 그의 염 하나 이상을, 임의로 통상적인 첨가제 및/또는 담체와 함께 포함하는 약학 제제.
- 암, 감염, 염증 및 자가면역 질환의 치료 및/또는 예방에서 사용하기 위한 제1항 내지 제13항 중 어느 하나의 항에 따른 화학식 (1)의 화합물.
- 제16항에 있어서, 암의 치료 및/또는 예방에서 사용하기 위한 화합물.
- 임의로 토토머, 라세미체, 에난티오머, 디아스테레오머 또는 이들의 혼합물 형태의 제1항 내지 제13항 중 어느 하나의 항에 따른 화학식 (1)의 화합물 또는 상기한 모든 형태의 약리학적으로 허용가능한 그의 염 및, 상기 화학식 (1)과는 상이한 적어도 하나의 세포증식억제 또는 세포독성 활성 물질을 포함하는 약학 제제.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08163897 | 2008-09-08 | ||
| EP08163897.5 | 2008-09-08 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110063528A true KR20110063528A (ko) | 2011-06-10 |
Family
ID=40297852
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117008042A KR20110063528A (ko) | 2008-09-08 | 2009-09-08 | 세포 증식 억제제로서의 피리도(5,4―d)피리미딘 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US8653087B2 (ko) |
| EP (1) | EP2350083B1 (ko) |
| JP (1) | JP5576379B2 (ko) |
| KR (1) | KR20110063528A (ko) |
| CN (1) | CN102203098A (ko) |
| AR (1) | AR073501A1 (ko) |
| AU (1) | AU2009289196A1 (ko) |
| CA (1) | CA2736306A1 (ko) |
| CL (1) | CL2011000489A1 (ko) |
| IL (1) | IL211136A0 (ko) |
| MX (1) | MX2011002431A (ko) |
| NZ (1) | NZ591493A (ko) |
| RU (1) | RU2011113402A (ko) |
| TW (1) | TW201014860A (ko) |
| WO (1) | WO2010026262A1 (ko) |
| ZA (1) | ZA201101090B (ko) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PE20090837A1 (es) | 2007-07-02 | 2009-07-24 | Boehringer Ingelheim Int | Nuevos compuestos quimicos |
| AR073501A1 (es) | 2008-09-08 | 2010-11-10 | Boehringer Ingelheim Int | Derivados de pirimido[5,4-d]pirimidina inhibidores de la tirosinoquinasa |
| MX2011003292A (es) | 2008-09-29 | 2011-04-21 | Boehringer Ingelheim Int | Compuestos antiproliferativos. |
| US8569316B2 (en) | 2009-02-17 | 2013-10-29 | Boehringer Ingelheim International Gmbh | Pyrimido [5,4-D] pyrimidine derivatives for the inhibition of tyrosine kinases |
| CA2940954A1 (en) | 2009-05-12 | 2010-11-18 | Romark Laboratories L.C. | Nitazoxanide and tizoxanide for the treatment of rhinovirus and rhabdovirus infections |
| EA030679B1 (ru) | 2009-06-26 | 2018-09-28 | РОМАРК ЛЭБОРЕТЕРИЗ Эл.Си. | Соединения и способы лечения гриппа |
| JP5871896B2 (ja) | 2010-03-26 | 2016-03-01 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | B−rafキナーゼインヒビター |
| JP5871897B2 (ja) | 2010-03-26 | 2016-03-01 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | ピリジルトリアゾール |
| US8710055B2 (en) | 2010-12-21 | 2014-04-29 | Boehringer Ingelheim International Gmbh | Triazolylphenyl sulfonamides as serine/threonine kinase inhibitors |
| JP6165733B2 (ja) | 2011-09-16 | 2017-07-19 | ノバルティス アーゲー | N−置換ヘテロシクリルカルボキサミド類 |
| IN2014DN07954A (ko) | 2012-03-13 | 2015-05-01 | Basf Se | |
| WO2015036059A1 (en) | 2013-09-16 | 2015-03-19 | Basf Se | Fungicidal pyrimidine compounds |
| WO2015036058A1 (en) | 2013-09-16 | 2015-03-19 | Basf Se | Fungicidal pyrimidine compounds |
| EP3609882B1 (en) | 2017-03-17 | 2022-07-13 | Cardio Therapeutics Pty Ltd | Heterocyclic inhibitors of pcsk9 |
| TW202309022A (zh) | 2021-04-13 | 2023-03-01 | 美商努法倫特公司 | 用於治療具egfr突變之癌症之胺基取代雜環 |
| BR112023021640A2 (pt) | 2021-04-19 | 2023-12-19 | Univ Montreal | Pirido[3,2-d]pirimidina compostos, composições compreendendo as mesmas e usos das mesmas |
| AU2022260863A1 (en) * | 2021-04-19 | 2023-11-02 | Universite De Montreal | Pyrimido[5,4,d]pyrimidine compounds, compositions comprising them and uses thereof |
| WO2024077391A1 (en) * | 2022-10-13 | 2024-04-18 | Universite De Montreal | Thiazolo[5,4-d]pyrimidine compounds, compositions comprising them and uses thereof |
| WO2024133302A1 (en) | 2022-12-22 | 2024-06-27 | Boehringer Ingelheim International Gmbh | Crystalline forms of a her2 inhibitor |
Family Cites Families (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL112249A (en) * | 1994-01-25 | 2001-11-25 | Warner Lambert Co | Pharmaceutical compositions containing di and tricyclic pyrimidine derivatives for inhibiting tyrosine kinases of the epidermal growth factor receptor family and some new such compounds |
| TW414798B (en) * | 1994-09-07 | 2000-12-11 | Thomae Gmbh Dr K | Pyrimido (5,4-d) pyrimidines, medicaments comprising these compounds, their use and processes for their preparation |
| SK72996A3 (en) * | 1995-06-07 | 1997-04-09 | Pfizer | Heterocyclic ring-fused pyrimidine derivatives and pharmaceutical compositions on their base |
| DE19608653A1 (de) * | 1996-03-06 | 1997-09-11 | Thomae Gmbh Dr K | Pyrimido[5,4-d]pyrimidine, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| DE19608588A1 (de) | 1996-03-06 | 1997-09-11 | Thomae Gmbh Dr K | Pyrimido [5,4-d]pyrimidine, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| CZ8799A3 (cs) | 1996-07-13 | 1999-06-16 | Glaxo Group Limited | Bicyklické heteroaromatické sloučeniny, způsob jejich výroby a farmaceutický prostředek |
| PT912559E (pt) | 1996-07-13 | 2003-03-31 | Glaxo Group Ltd | Compostos heterociclicos fundidos como inibidores de proteina tirosina quinase |
| EP0837063A1 (en) * | 1996-10-17 | 1998-04-22 | Pfizer Inc. | 4-Aminoquinazoline derivatives |
| JP3270834B2 (ja) * | 1999-01-27 | 2002-04-02 | ファイザー・プロダクツ・インク | 抗がん剤として有用なヘテロ芳香族二環式誘導体 |
| UA71945C2 (en) | 1999-01-27 | 2005-01-17 | Pfizer Prod Inc | Substituted bicyclic derivatives being used as anticancer agents |
| DE19911510A1 (de) * | 1999-03-15 | 2000-09-21 | Boehringer Ingelheim Pharma | Bicyclische Heterocyclen, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| CA2507184C (en) | 2002-11-27 | 2012-01-10 | Boehringer Ingelheim Pharmaceuticals, Inc. | 1, 2, 3- triazole amide derivatives as cytokine inhibitors |
| WO2005023761A2 (en) | 2003-09-11 | 2005-03-17 | Kemia, Inc. | Cytokine inhibitors |
| ES2360292T3 (es) | 2003-12-03 | 2011-06-02 | Boehringer Ingelheim Pharmaceuticals Inc. | Derivados de 1,2,3-triazol amida como inhibidores de la producción de citoquinas. |
| DE102004002557A1 (de) * | 2004-01-17 | 2005-08-04 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verwendung von substituierten Pyrimido(5,4-d)pyrimidinen zur Behandlung von Atemwegserkrankungen |
| AU2005223738B2 (en) | 2004-03-09 | 2011-08-11 | Boehringer Ingelheim Pharmaceuticals, Inc. | 3-'4-heterocyclyl -1,2,3,-triazol-1-yl-n-aryl-benzamides as inhibitors of the cytokines production for the treatment of chronic inflammatory diseases |
| US7485657B2 (en) | 2004-05-12 | 2009-02-03 | Boehringer Ingelheim Pharmaceuticals, Inc. | Anti-cytokine heterocyclic compounds |
| US7531560B2 (en) | 2004-11-10 | 2009-05-12 | Boehringer Ingelheim Pharmaceuticals, Inc. | Anti-cytokine heterocyclic compounds |
| JP2007076376A (ja) | 2005-09-09 | 2007-03-29 | Yanmar Co Ltd | トラクタ |
| WO2007056016A2 (en) | 2005-11-02 | 2007-05-18 | Kemia, Inc. | Bisamide cytokine inhibitors |
| WO2007075896A2 (en) | 2005-12-22 | 2007-07-05 | Kemia, Inc. | Heterocyclic cytokine inhibitors |
| US7858804B2 (en) | 2006-04-18 | 2010-12-28 | Boehringer Ingelheim International Gmbh | Process for making cytokine inhibiting compounds containing 4- and 5-imidazolyl rings and the intermediates thereof |
| KR20080109095A (ko) * | 2006-05-15 | 2008-12-16 | 아이알엠 엘엘씨 | Fgf 수용체 키나제 억제제를 위한 조성물 및 방법 |
| JP5153773B2 (ja) | 2006-07-07 | 2013-02-27 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | フェニル置換ヘテロアリール誘導体及び抗癌剤としてのその使用 |
| PE20080906A1 (es) | 2006-08-17 | 2008-07-05 | Kemia Inc | Derivados heteroarilo como inhibidores de citocina |
| WO2008089034A2 (en) | 2007-01-11 | 2008-07-24 | Kemia, Inc. | Cytokine inhibitors |
| PE20090695A1 (es) | 2007-04-13 | 2009-06-27 | Schering Corp | Derivados de pirimidindiona como agonistas del receptor de acido nicotinico |
| WO2009003998A2 (en) | 2007-07-02 | 2009-01-08 | Boehringer Ingelheim International Gmbh | Antiproliferative compounds based on 5-membered heterocycles |
| PE20090837A1 (es) | 2007-07-02 | 2009-07-24 | Boehringer Ingelheim Int | Nuevos compuestos quimicos |
| NZ582772A (en) | 2007-07-17 | 2012-06-29 | Plexxikon Inc | Compounds and methods for kinase modulation, and indications therefor |
| AR073501A1 (es) | 2008-09-08 | 2010-11-10 | Boehringer Ingelheim Int | Derivados de pirimido[5,4-d]pirimidina inhibidores de la tirosinoquinasa |
| MX2011003292A (es) | 2008-09-29 | 2011-04-21 | Boehringer Ingelheim Int | Compuestos antiproliferativos. |
| WO2010042337A1 (en) | 2008-10-07 | 2010-04-15 | Merck Sharp & Dohme Corp. | Novel 6-azaindole aminopyrimidine derivatives having nik inhibitory activity |
| US8569316B2 (en) | 2009-02-17 | 2013-10-29 | Boehringer Ingelheim International Gmbh | Pyrimido [5,4-D] pyrimidine derivatives for the inhibition of tyrosine kinases |
| JP5871896B2 (ja) | 2010-03-26 | 2016-03-01 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | B−rafキナーゼインヒビター |
| JP5871897B2 (ja) | 2010-03-26 | 2016-03-01 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | ピリジルトリアゾール |
| US8710055B2 (en) | 2010-12-21 | 2014-04-29 | Boehringer Ingelheim International Gmbh | Triazolylphenyl sulfonamides as serine/threonine kinase inhibitors |
| US20130023531A1 (en) | 2011-01-27 | 2013-01-24 | Boehringer Ingelheim International Gmbh | Pyrimido[5,4-d]pyrimidylamino phenyl sulfonamides as serine/threonine kinase inhibitors |
| US8889684B2 (en) | 2011-02-02 | 2014-11-18 | Boehringer Ingelheim International Gmbh | Azaindolylphenyl sulfonamides as serine/threonine kinase inhibitors |
-
2009
- 2009-09-07 AR ARP090103435A patent/AR073501A1/es unknown
- 2009-09-07 TW TW098130118A patent/TW201014860A/zh unknown
- 2009-09-08 AU AU2009289196A patent/AU2009289196A1/en not_active Abandoned
- 2009-09-08 WO PCT/EP2009/061656 patent/WO2010026262A1/en active Application Filing
- 2009-09-08 JP JP2011525573A patent/JP5576379B2/ja active Active
- 2009-09-08 EP EP09782789.3A patent/EP2350083B1/en active Active
- 2009-09-08 CN CN2009801439757A patent/CN102203098A/zh active Pending
- 2009-09-08 MX MX2011002431A patent/MX2011002431A/es unknown
- 2009-09-08 NZ NZ591493A patent/NZ591493A/en not_active IP Right Cessation
- 2009-09-08 RU RU2011113402/04A patent/RU2011113402A/ru not_active Application Discontinuation
- 2009-09-08 CA CA2736306A patent/CA2736306A1/en not_active Abandoned
- 2009-09-08 US US13/062,058 patent/US8653087B2/en active Active
- 2009-09-08 KR KR1020117008042A patent/KR20110063528A/ko not_active Application Discontinuation
-
2011
- 2011-02-09 IL IL211136A patent/IL211136A0/en unknown
- 2011-02-10 ZA ZA2011/01090A patent/ZA201101090B/en unknown
- 2011-03-07 CL CL2011000489A patent/CL2011000489A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CN102203098A (zh) | 2011-09-28 |
| US8653087B2 (en) | 2014-02-18 |
| WO2010026262A1 (en) | 2010-03-11 |
| MX2011002431A (es) | 2011-04-05 |
| EP2350083A1 (en) | 2011-08-03 |
| AU2009289196A1 (en) | 2010-03-11 |
| JP2012502010A (ja) | 2012-01-26 |
| CA2736306A1 (en) | 2010-03-11 |
| ZA201101090B (en) | 2012-10-31 |
| US20120094975A1 (en) | 2012-04-19 |
| AR073501A1 (es) | 2010-11-10 |
| JP5576379B2 (ja) | 2014-08-20 |
| IL211136A0 (en) | 2011-04-28 |
| EP2350083B1 (en) | 2017-05-17 |
| RU2011113402A (ru) | 2012-10-20 |
| NZ591493A (en) | 2012-07-27 |
| TW201014860A (en) | 2010-04-16 |
| CL2011000489A1 (es) | 2011-07-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20110063528A (ko) | 세포 증식 억제제로서의 피리도(5,4―d)피리미딘 | |
| JP5603883B2 (ja) | B−Rafキナーゼを阻害するためのピリミドピリミジン誘導体 | |
| JP5612573B2 (ja) | 新規化学化合物 | |
| JP5622740B2 (ja) | 新規化合物 | |
| JP5619762B2 (ja) | 異常な細胞増殖の治療のためのptk2−インヒビターとしての2,4−ジアミノピリミジン誘導体 | |
| JP5588339B2 (ja) | 新規化学化合物 | |
| JP2011505407A (ja) | 過剰な又は異常な細胞増殖を特徴とする疾患を治療するためのジアミノピリジン | |
| JP2011528026A6 (ja) | 新規化学化合物 | |
| KR20090028822A (ko) | 페닐 치환된 헤테로아릴 유도체 및 항종양제로서의 이의 용도 | |
| KR20110063574A (ko) | 항증식성 화합물 | |
| KR20110128927A (ko) | 암 치료를 위한 치환된 피리미딘 | |
| WO2009003998A2 (en) | Antiproliferative compounds based on 5-membered heterocycles | |
| KR20120135010A (ko) | 과도 또는 이상 세포 증식을 특징으로 하는 질환 치료용 2,4-디아미노피리미딘 | |
| KR20110039474A (ko) | 신규한 화합물 | |
| JP2010529161A (ja) | インドリノン誘導体及び癌等の症状を治療する際のそれらの使用 | |
| US20090186901A1 (en) | Chemical compounds | |
| JP5334844B2 (ja) | 新規化合物 | |
| KR20130030742A (ko) | 5―알키닐―피리미딘 및 키나제 저해제로서 그의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |