KR20080023301A - 폰 빌레브란트 인자에 대한 단일 도메인 vhh 항체 - Google Patents
폰 빌레브란트 인자에 대한 단일 도메인 vhh 항체 Download PDFInfo
- Publication number
- KR20080023301A KR20080023301A KR1020077029416A KR20077029416A KR20080023301A KR 20080023301 A KR20080023301 A KR 20080023301A KR 1020077029416 A KR1020077029416 A KR 1020077029416A KR 20077029416 A KR20077029416 A KR 20077029416A KR 20080023301 A KR20080023301 A KR 20080023301A
- Authority
- KR
- South Korea
- Prior art keywords
- amino acid
- seq
- acid sequence
- sequence
- nanobodies
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/36—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against blood coagulation factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/36—Blood coagulation or fibrinolysis factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P41/00—Drugs used in surgical methods, e.g. surgery adjuvants for preventing adhesion or for vitreum substitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/22—Immunoglobulins specific features characterized by taxonomic origin from camelids, e.g. camel, llama or dromedary
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Epidemiology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Diabetes (AREA)
- Vascular Medicine (AREA)
- Toxicology (AREA)
- Urology & Nephrology (AREA)
- Surgery (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
폰 빌레브란트 인자(von Willebrand Factor; vWF)에 대한 개선된 나노바디스™와, 이러한 나노바디 중 하나 이상을 포함하거나 또는 본질적으로 이 나노바디 중 하나 이상으로 이루어진 폴리펩티드에 관한 것이다. 본 발명은 또한 이러한 나노바디 및 폴리펩티드를 암호화하는 핵산; 이러한 나노바디 및 폴리펩티드를 제조하는 방법; 이러한 나노바디 또는 폴리펩티드를 발현하거나 발현할 수 있는 숙주 세포; 이러한 나노바디, 폴리펩티드, 핵산 또는 숙주 세포를 포함하는 조성물; 그리고 이러한 나노바디, 폴리펩티드, 핵산, 숙주 세포 또는 조성물의 용도, 구체적으로, 예방, 치료 또는 진단용으로서의 용도 예를 들어, 예방, 치료 또는 진단용으로서의 용도에 관한 것이기도 하다.
Description
본 발명은 폰 빌레브란트 인자(von Willebrand Factor; vWF)에 대한 개선된 나노바디스™와, 이러한 나노바디 중 하나 이상을 포함하거나 또는 본질적으로 이 나노바디 중 하나 이상으로 이루어진 폴리펩티드에 관한 것이다[주: 나노바디(Nanobody)™, 나노바디스(Nanobodies)™ 및 나노클론(Nanoclone)™은 에이블링스 엔.브이.(Ablynx N. V.)의 상표임].
본 발명은 또한 이러한 나노바디 및 폴리펩티드를 암호화하는 핵산; 이러한 나노바디 및 폴리펩티드를 제조하는 방법; 이러한 나노바디 또는 폴리펩티드를 발현하거나 발현할 수 있는 숙주 세포; 이러한 나노바디, 폴리펩티드, 핵산 또는 숙주 세포를 포함하는 조성물; 그리고 이러한 나노바디, 폴리펩티드, 핵산, 숙주 세포 또는 조성물의 용도, 구체적으로, 예방, 치료 또는 진단용으로서의 용도 예를 들어, 이하에 기술된 바와 같은 예방, 치료 또는 진단용으로서의 용도에 관한 것이기도 하다.
본 발명의 다른 측면, 구체예, 이점 및 용도는 이하 상세한 설명을 통하여 더욱 명백히 밝혀질 것이다.
본 출원인에 의한 WO 04/062551호는 폰 빌레브란트 인자(vWF)에 대한 나노바디와 이의 제조 방법 및 용도, 구체적으로, 혈소판-매개 응집과 관련된 질병과 질환의 예방 및/또는 치료용으로서의 용도에 관한 것이다.
WO 04/062551호에 따른 항-vWF 나노바디는 인간화될 수 있고, 또한 1가나 다가일 수 있으며, 다가인 경우에는 vWF에 대한 친화도가 증가하게 된다. WO 04/062551호에 따른 항-vWF 나노바디는 또한 다중 특이적일 수도 있고, 특히, vWF에 대한 2개 이상의 나노바디와, 혈청 단백질 예를 들어, 인간 혈청 알부민에 대해 생성된 추가의 나노바디를 포함하는 다중 특이적 구조물(생체 내 반감기를 증가시키는 구조물)의 형태를 가질 수도 있다.
WO 04/062551호에 개시된 항-vWF 나노바디는 vWF의 임의의 에피토프 또는 형태의 것(예를 들어, A1 도메인 또는 A3 도메인)에 대해 생성될 수 있으나, 바람직하게는 A1 도메인에 대해 생성되고, 특히, A1 도메인의 활성화된 형태의 것에 대해 생성될 수 있다.
WO 04/062551호에는 또한 항-vWF 나노바디, 이 항-vWF 나노바디를 암호화하는 뉴클레오티드 서열과, 이 항-vWF 나노바디를 포함하는 약학 조성물의 제조 방법에 관하여도 개시되어 있다.
WO 04/062551호에 개시된 항-vWF 나노바디와 조성물은 혈소판-매개 응집과 관련된 질병 및 질환의 예방 및 치료에 사용될 수 있는데, 이러한 질병 및 질환의 예로서는 예를 들어, 비-폐색성 혈전 형성증, 폐색성 혈전 형성증, 동맥 혈전 형성증, 급성 관상 동맥 폐색증, 말초 동맥 폐색증, 및 관상 동맥 우회로 이식 조성술, 관상 동맥 판막 치환술 및 관상 동맥 개입술 예를 들어, 혈관 형성술, 스텐트 삽입술 또는 죽종 절제술로 인한 재발 협착증 및 질환, 혈관 형성술, 죽종 절제술 또는 동맥 스텐트 삽입술 이후에 발생하는 과형성증, 혈관계에서의 폐색성 증후군 또는 발병 동맥의 비 개통증, 혈전성 혈소판 감소 자반증(TTP), 일과성 뇌 허혈 발작증, 불안정 또는 안정 협심증, 뇌경색, HELLP 증후군, 경동맥 내막 절제술, 경동맥 협착증, 주요 사지 허혈증(critical limb ischaemia), 심장인성 색전증, 말초 혈관계 질병, 재발 협착증 및 심근 경색증이 있다.
WO 04/062551호에 개시된 약학 조성물은 정맥 내, 피하, 경구, 설하, 국소, 비강 내, 질 내 또는 직장 투여나, 흡입에 의한 투여에 적당할 수 있으며; 또한 혈전 용해제 예를 들어, 스타필로키나제, 조직 플라스미노겐 활성 인자, 스트렙토키나제, 단일 사슬 스트렙토키나제, 유로키나제 및 아실 플라스미노겐 스트렙토키나제 복합체를 포함할 수도 있다. WO 04/062551호에 개시된 항-vWF 나노바디는 또한 진단용(임의로는 키트의 일부로서) 또는 의료 장치 예를 들어, 스텐트 코팅용으로서 사용될 수도 있다.
본 발명의 일반적인 목적은 vWF, 구체적으로 인간 vWF에 대한 나노바디를 제공하는 것이다.
구체적으로, 본 발명의 목적은 vWF에 대한 나노바디, 특히, 인간 vWF에 대한 나노바디와, 이 나노바디를 포함하고, 치료 및/또는 진단용, 특히, vWF와 관련되어 있으며/있거나 이 vWF에 의하여 매개되는 하나 이상의 질병 및 질환(예를 들어, 상기 언급한 질병 및 질환)의 예방, 치료 및/또는 진단용으로서 적당하며/적당하거나, vWF와 관련되어 있으며/있거나 이 vWF에 의하여 매개되는 하나 이상의 질병(예를 들어, 상기 언급한 질병)의 예방 및/또는 치료용인 약학 조성물을 제조하는데 사용될 수 있는 단백질 또는 폴리펩티드를 제공하는 것이다.
더욱 구체적으로, 본 발명의 목적은 WO 04/062551에 개시된, vWF에 대한 나노바디 및 폴리펩티드에 대하여 대안적인 것이고/것이며, 상기 WO 04/062551에 개시된, vWF에 대한 나노바디 및 폴리펩티드에 비하여 하나 이상의 개선된 특성 또는 특징을 갖는, vWF에 대한 나노바디와 이 나노바디를 포함하는 단백질 및 폴리펩티드를 제공하는 것이다.
더욱 구체적으로, 본 발명의 목적은 vWF에 대한 나노바디와, 이 나노바디를 포함하는 단백질 또는 폴리펩티드를 제공하는 것으로서, 이 나노바디 및 폴리펩티드는 WO 04/062551에 개시된, vWF에 대한 나노바디 및 폴리펩티드에 비하여 다음과 같은 특성 또는 특징 중 하나 이상이 개선된 것이다:
- 1가 형태이건 다가의 형태이건(예를 들어, 2가 형태), 그리고/또는 다중 특이적 형태이건(예를 들어, WO 04/062551호 또는 이하 본원에 개시된 다중 특이적 형태 중 하나의 형태), vWF에 대한 친화도가 증가함;
- 다가 형태(예를 들어, 2가 형태)로 구성됨에 있어서의 적합성이 우수함;
- 다중 특이적 형태(예를 들어, WO 04/062551 또는 이하 본원에 기술된 바와 같은 다중 특이적 형태 중 하나의 형태)로 구성됨에 있어서의 적합성이 우수함;
- "인간화" 치환체(본원에서 정의됨)에 대한 적합성 또는 민감성이 개선됨;
- 1가 형태이건 다가의 형태이건(예를 들어, 2가 형태), 그리고/또는 다중 특이적 형태(1가 형태일 경우)이건(예를 들어, WO 04/062551호 또는 이하 본원에 개시된 다중 특이적 형태 중 하나의 형태), 면역원성이 감소함;
- 1가 형태이건 다가의 형태이건(예를 들어, 2가 형태), 그리고/또는 다중 특이적 형태(1가 형태일 경우)이건(예를 들어, WO 04/062551호 또는 이하 본원에 개시된 다중 특이적 형태 중 하나의 형태), 안정성이 증가함;
- 1가 형태이건 다가의 형태이건(예를 들어, 2가 형태), 그리고/또는 다중 특이적 형태(1가 형태일 경우)이건(예를 들어, WO 04/062551호 또는 이하 본원에 개시된 다중 특이적 형태 중 하나의 형태), vWF에 대한 특이성이 증가함;
- 상이한 종으로부터 유래하는 vWF와의 교차 반응성이 바람직한 정도로 증가하거나 감소함; 및/또는
- 1가 형태이건 다가의 형태이건(예를 들어, 2가 형태), 그리고/또는 다중 특이적 형태이건(예를 들어, WO 04/062551호 또는 이하 본원에 개시된 다중 특이적 형태 중 하나의 형태), 약학적 용도(예를 들어, 예방용 및/또는 치료용) 및/또는 진단학적 용도(예를 들어, 영상화용)로서 바람직한 특성 중 하나 이상이 개선됨.
이러한 목적은 본원에 개시된, vWF에 대한 나노바디 및 폴리펩티드에 의하여 이룰수 있다. 본원에 개시된, vWF에 대한 나노바디와 폴리펩티드는 구체적으로, 인간 vWF에 대한 나노바디 및 폴리펩티드이지만, 본 발명의 항-vWF 나노바디 및 폴리펩티드 중 몇몇은 기타 척추 동물, 구체적으로, 기타 온혈 동물, 더욱 구체적으로, 기타 포유동물 및 구체적으로, 영장류의 기타 종 예를 들어, 이하 실시예에 사용된 개코 원숭이로부터 유래되는 vWF와 교차-반응성을 나타낼 수 있다는 점에서 본 발명의 범위 내에 포함된다. 그러나, WO 04/062551호에 개시된 항-vWF 나노바디와 같이, 본 발명은 또한 최광의로서 해석되어야 할 것이며, 특히 본 발명의 나노바디 및 폴리펩티드를 생성시키는 vWF의 특이적 에피토프, 도메인 또는 형태에 의해 한정되거나 제한되어서는 안된다. 그러나, 본 발명의 나노바디 및 폴리펩티드는 vWF의 A1 도메인에 대해 생성되는 것으로서, 활성화된 형태이거나 또는 비-활성화된 형태로서 생성되는 것으로 보이며, 또한 그러한 것이 바람직하다.
그러므로, 하나의 측면에서, 본 발명은 vWF에 대하여 생성된 나노바디(본원에 정의됨)에 관한 것으로서, 이 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 이것의
(i) CDR1은
NYGMG (서열 번호 15)
SYTLG (서열 번호 16)
NYNMG (서열 번호 17)
SSAMA (서열 번호 18)
YYNTG (서열 번호 19)
IGAMG (서열 번호 20)
IGTMG (서열 번호 21)
YNPMG (서열 번호 22)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열을 포함하거나 또는 본질적으로 이것으로 이루어져 있고; 또한
(ii) CDR2는
SISWSGTYTAYSDNVKG (서열 번호 23)
GISWSGVSTDYAEFAKG (서열 번호 24)
TSISWSGSYTAYADNVKG (서열 번호 25)
SISWSGMSTYYTDSVKG (서열 번호 26)
TITSGGRTSYADSVKG (서열 번호 27)
AISWSGGLTYYADSVKG (서열 번호 28)
TITSGGSTNYADPVKG (서열 번호 29)
TITSGGSTNYADSVKG (서열 번호 30)
AISRTGGSTYYARSVEG (서열 번호 31)
AISRTGGSTYYPDSVEG (서열 번호 32)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열들 중 어느 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열을 포함하거나 또는 본질적으로 이것으로 이루어져 있으며; 또한
(iii) CDR3는
QSRYRSNYYDHDDKYAY (서열 번호 33)
LGRYRSNWRNIGQYDY (서열 번호 34)
QSRYSSNYYDHDDKYAY (서열 번호 35)
SNRYRTHTTQAMYNY (서열 번호 36)
VVDGKRAP (서열 번호 37)
NRRQKTVQMGERAYDY (서열 번호 38)
NLKQGSYGYRFNDY (서열 번호 39)
NLKQGDYGYRFNDY (서열 번호 40)
AGVRAEDGRVRTLPSEYNF (서열 번호 41)
AGVRAEDGRVRTLPSEYTF (서열 번호 42)
AGVRAEDGRVRSLPSEYTF (서열 번호 43)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열을 포함하거나 또는 본질적으로 이것으로 이루어져 있다.
다른 측면에서, 본 발명은 vWF에 대하여 생성된 나노바디(본원에 정의됨)에 관한 것으로서, 이 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 이것의
(i) CDR1은
NYGMG (서열 번호 15)
SYTLG (서열 번호 16)
NYNMG (서열 번호 17)
SSAMA (서열 번호 18)
YYNTG (서열 번호 19)
IGAMG (서열 번호 20)
IGTMG (서열 번호 21)
YNPMG (서열 번호 22)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이고; 또한
(ii) CDR2는
SISWSGTYTAYSDNVKG (서열 번호 23)
GISWSGVSTDYAEFAKG (서열 번호 24)
TSISWSGSYTAYADNVKG (서열 번호 25)
SISWSGMSTYYTDSVKG (서열 번호 26)
TITSGGRTSYADSVKG (서열 번호 27)
AISWSGGLTYYADSVKG (서열 번호 28)
TITSGGSTNYADPVKG (서열 번호 29)
TITSGGSTNYADSVKG (서열 번호 30)
AISRTGGSTYYARSVEG (서열 번호 31)
AISRTGGSTYYPDSVEG (서열 번호 32)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이며; 또한
(iii) CDR3는
QSRYRSNYYDHDDKYAY (서열 번호 33)
LGRYRSNWRNIGQYDY (서열 번호 34)
QSRYSSNYYDHDDKYAY (서열 번호 35)
SNRYRTHTTQAMYNY (서열 번호 36)
VVDGKRAP (서열 번호 37)
NRRQKTVQMGERAYDY (서열 번호 38)
NLKQGSYGYRFNDY (서열 번호 39)
NLKQGDYGYRFNDY (서열 번호 40)
AGVRAEDGRVRTLPSEYNF (서열 번호 41)
AGVRAEDGRVRTLPSEYTF (서열 번호 42)
AGVRAEDGRVRSLPSEYTF (서열 번호 43)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이다.
상기에 기술된바 및 이하에 더욱 상세히 기술된 vWF에 대한 나노바디를 본원에서는 "본 발명의 나노바디"라 칭한다.
본 발명의 나노바디 중, 상기 명백히 나열된 CDR 중 하나 이상을 포함하는 나노바디가 특히 바람직하고; 상기 명백히 나열된 2RO 이상의 CDR을 포함하는 나노바디가 더욱 바람직하며; 또한 상기 명백히 나열된 CDR 중 3개를 포함하는 나노바디가 가장 특히 바람직하다.
다른 측면에서, 본 발명은 vWF에 대하여 생성된 나노바디에 관한 것으로서, 이 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 다음과 같은 CDR1, CDR2 및 CDR3의 각각의 조합 중 하나를 포함하는 나노바디로 이루어진 군으로부터 선택된다:
- CDR1 :NYGMG; CDR2 :SISWSGTYTAYSDNVKG;
CDR3 :QSRYRSNYYDHDDKYAY
- CDR1 :SYTLG; CDR2 :GISWSGVSTDYAEFAKG;
CDR3 :LGRYRSNWRNIGQYDY
- CDR1 :NYGMG; CDR2 :TSISWSGSYTAYADNVKG;
CDR3 :QSRYSSNYYDHDDKYAY
- CDR1 :NYNMG; CDR2 :SISWSGMSTYYTDSVKG;
CDR3 :SNRYRTHTTQAMYNY
- CDR1 :SSAMA; CDR2 :TITSGGRTSYADSVKG; CDR3 :VVDGKRAP
- CDR1 :YYNTG; CDR2 :AISWSGGLTYYADSVKG;
CDR3 :NRRQKTVQMGERAYDY
- CDR1 :IGAMG: CDR2 :TITSGGSTNYADPVKG; CDR3 :NLKQGSYGYRFNDY
- CDR1 :IGAMG; CDR2 :TITSGGSTNYADSVKG; CDR3 :NLKQGSYGYRFNDY
- CDR1 :IGAMG; CDR2 :TITSGGSTNYADSVKG;
CDR3 :NLKQGDYGYRFNDY
- CDR1 :IGTMG; CDR2 :TITSGGSTNYADSVKG; CDR3 :NLKQGDYGYRFNDY
- CDR1 :YNPMG; CDR2 :AISRTGGSTYYARSVEG;
CDR3 :AGVRAEDGRVRTLPSEYNF
- CDR1 :YNPMG; CDR2 :AISRTGGSTYYPDSVEG;
CDR3 :AGVRAEDGRVRTLPSEYTF
- CDR1 :YNPMG; CDR2 :AISRTGGSTYYPDSVEG;
CDR3 :AGVRAEDGRVRSLPSEYTF
상기 나열한 CDR의 조합을 포함하는 본 발명의 나노바디에 있어서, 각각의 CDR은 상기 CDR과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나(상기 CDR 서열)와 3개, 2개 또는 오로지 1개의 아미노산(전술한 문단에 언급된 바와 같음)에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 CDR에 의해 치환될 수 있다.
그러나, 상기 나열한 CDR의 조합을 포함하는 본 발명의 나노바디 중, 상기 나열한 CDR 중 하나 이상을 포함하는 나노바디가 특히 바람직하고; 상기 나열한 CDR 중 2개 이상을 포함하는 나노바디가 더욱 특히 바람직하며; 또한 상기 나열한 CDR 중 3개를 포함하는 나노바디가 가장 특히 바람직하다.
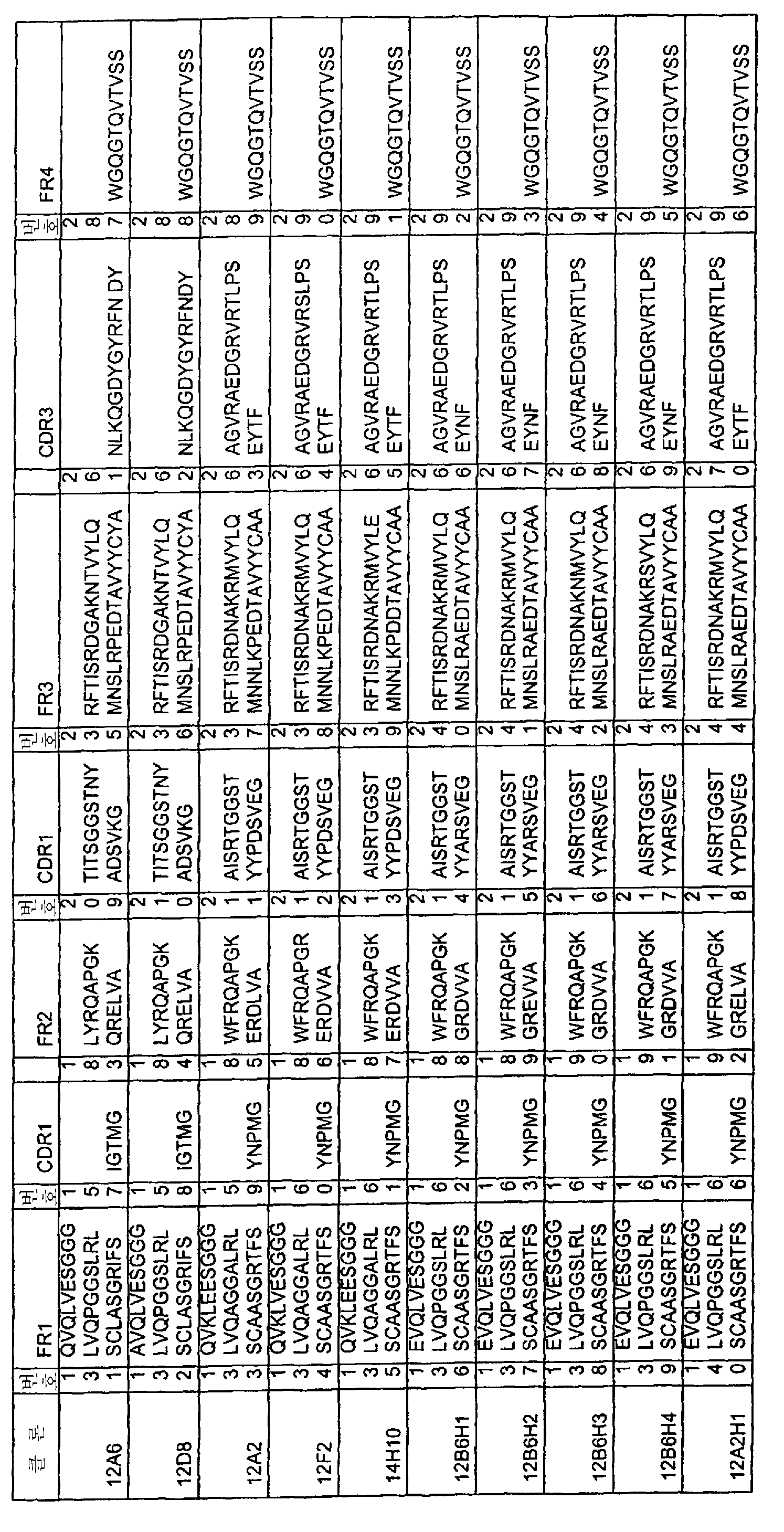
그러므로, 본 발명의 나노바디에 있어서, CDR1, CDR2 및 CDR3 서열 중 하나 이상은 각각 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열로 이루어진 군; 또는 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열 중 하나 이상과의 "서열 동일성"(본원에 정의됨)이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR1, CDR2 및 CDR3 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 CDR1, CDR2 및 CDR3 서열로 이루어진 군으로부터 적당히 선택된다. 본 명세서에 있어서, "적당히 선택된다"는 의미는, 가능하다면, CDR1 서열은 적당한 CDR1 서열들(즉, 본원에 정의된 서열들)로부터 선택되고, CDR2 서열은 적당한 CDR2 서열들(즉, 본원에 정의된 서열들)로부터 선택되며, CDR3 서열은 적당한 CDR3 서열들(즉, 본원에 정의된 서열들)로부터 선택되는 것을 각각 의미한다.
특히, 본 발명의 나노바디에 있어서, 적어도 상기 CDR3 서열은 표 Ia∼표 Ic에 나열된 CDR3 서열로 이루어진 군, 또는 표 Ia∼표 Ic에 나열된 CDR3 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR3 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 CDR3 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"가 있는 CDR3로 이루어진 군으로부터 적당하게 선택된다.
바람직하게, 본 발명의 나노바디에 있어서, 상기 CDR1, CDR2 및 CDR3 서열 중 2개 이상은 각각 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열로 이루어진 군; 또는 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR1, CDR2 및 CDR3 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"가 있는 CDR1, CDR2 및 CDR3 서열로 이루어진 군으로부터 적당히 선택된다.
특히, 본 발명의 나노바디에 있어서, 적어도 상기 CDR3 서열은 표 Ia∼표 Ic에 나열된 CDR3 서열로 이루어진 군, 또는 표 Ia∼표 Ic에 나열된 CDR3 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR3 서열로 이루어진 군으로부터 적당히 선택되고; 상기 CDR1 및 CDR2 서열 중 하나 이상은 각각 표 Ia∼표 Ic에 나열된 CDR1 및 CDR2 서열로 이루어진 군, 또는 표 Ia∼표 Ic에 나열된 CDR1 및 CDR2 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR1 및 CDR2 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 CDR1 및 CDR2 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR1 및 CDR2 서열로 이루어진 군으로부터 적당히 선택된다.
가장 바람직하게, 본 발명의 나노바디에 있어서, 상기 3개의 CDR1, CDR2 및 CDR3 서열 모두는 각각 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열로 이루어진 군; 또는 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR1, CDR2 및 CDR3 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR1, CDR2 및 CDR3 서열로 이루어진 군으로부터 적당히 선택된다.
더욱 바람직하게, 본 발명의 나노바디에 있어서, 상기 CDR1, CDR2 및 CDR3 서열 중 하나 이상은 각각 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열로 이루어진 군으로부터 적당히 선택된다. 바람직하게, 이러한 구체예에서, 상기 2개의 기타 CDR 서열 중 하나 이상 또는 바람직하게는 2개 모두는, 표 Ia∼표 Ic에 나열된 상응하는 CDR 서열들 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 상응하는 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR 서열로 이루어진 군으로부터 적당히 선택된다.
특히, 본 발명의 나노바디에 있어서, 적어도 상기 CDR3 서열은 표 Ia∼표 Ic에 나열된 CDR3으로 이루어진 군으로부터 적당히 선택된다. 바람직하게, 이러한 구체예에서, 상기 CDR1 및 CDR2 서열 중 하나 이상 및 바람직하게는 2개 모두는 각각 표 Ia∼표 Ic에 나열된 CDR1 및 CDR2 서열과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR1 및 CDR2 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 CDR1 및 CDR2 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR1 및 CDR2 서열로 이루어진 군으로부터 적당히 선택된다.
더욱 바람직하게, 본 발명의 나노바디에 있어서, 상기 CDR1, CDR2 및 CDR3 서열 중 2개 이상은 각각 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열로 이루어진 군으로부터 적당히 선택된다. 바람직하게, 이러한 구체예에서, 상기 나머지 CDR 서열들은 표 Ia∼표 Ic에 나열된 상응하는 CDR 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 상응하는 서열 중 하나 이상과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR 서열로 이루어진 군으로부터 적당히 선택된다.
특히, 본 발명의 나노바디에 있어서, 적어도 상기 CDR3 서열은 상기 표 Ia∼표 Ic에 나열된 CDR3 서열로 이루어진 군으로부터 적당히 선택되며, 상기 CDR1 서열 또는 CDR2 서열 중 어느 하나는 각각 상기 표 Ia∼표 Ic에 나열된 CDR1 및 CDR2 서열로 이루어진 군으로부터 적당히 선택된다. 바람직하게, 이러한 구체예에서, 나머지 CDR 서열들은 표 Ia∼표 Ic에 나열된 상응하는 CDR 서열 중 하나 이상과의 서열 동일성이 각각 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR 서열로 이루어진 군; 및/또는 표 Ia∼표 Ic에 나열된 상응하는 CDR 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR 서열로 이루어진 군으로부터 적당히 선택된다.
더욱 바람직하게, 본 발명의 나노바디에 있어서, 상기 3개의 CDR1, CDR2 및 CDR3 서열은 모두 상기 표 Ia∼표 Ic에 나열된 CDR1, CDR2 및 CDR3 서열로 이루어진 군으로부터 적당히 선택된다.
뿐만 아니라, 일반적으로 상기 표 Ia∼표 Ic에 나열된 CDR 조합 군(즉, 표 Ia∼표 Ic의 같은 줄에 기재된 CDR)을 사용하는 것이 바람직하다. 그러므로, 일반적으로 본 발명의 나노바디 중 CDR은 상기 표 Ia∼표 Ic에 나열된 CDR 서열이거나, 또는 상기 표 Ia∼표 Ic에 나열된 CDR 서열과의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR 서열로 이루어진 군; 및/또는 상기 표 Ia∼표 Ic에 나열된 CDR 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR 서열로 이루어진 군[여기서, 기타 CDR 서열 중 하나 이상 및 바람직하게는 2개 모두는 상기 표 Ia∼표 Ic에서 동일한 조합 군에 속하는 CDR 서열(즉, 표 Ia∼표 Ic의 같은 줄에 기재된 CDR 서열)로부터 적당히 선택되거나, 또는 동일한 조합 군에 속하는 CDR 서열(들)과의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR 서열로 이루어진 군; 및/또는 동일한 조합 군에 속하는 CDR 서열(들)과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR 서열로 이루어진 군으로부터 적당히 선택됨]으로부터 적당히 선택된다. 상기 문단에 기재된 기타 바람직한 구체예는 또한 상기 표 Ia∼표 Ic에 기재된 CDR 조합 군에 적용되기도 한다.
그러므로, 비 제한적인 예로서, 본 발명의 나노바디는 예를 들어, 상기 표 Ia∼표 Ic에 기재된 CDR1 서열 중 하나와의 서열 동일성이 80% 이상인 CDR1 서열, 상기 표 Ia∼표 Ic에 기재된(다만, 상이한 조합 군에 속하는) CDR2 서열 중 하나와 3개, 2개 또는 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR2 서열 및 CDR3 서열을 포함한다.
본 발명의 몇몇 바람직한 나노바디는 예를 들어, 다음과 같은 것들을 포함할 수 있다: (1) 상기 표 Ia∼표 Ic에 기재된 CDR1 서열 중 하나와의 서열 동일성이 80% 이상인 CDR1 서열; 상기 표 Ia∼표 Ic에 기재된 CDR2 서열 중 하나(다만, 상이한 조합 군에 속하는 서열)와 3개, 2개 또는 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR2 서열; 및 상기 표 Ia∼표 Ic에 기재된 CDR3 서열 중 하나(다만, 상이한 조합 군에 속하는 서열)와의 서열 동일성이 80% 이상인 CDR3 서열; 또는 (2) 상기 표 Ia∼표 Ic에 기재된 CDR1 서열 중 하나와의 서열 동일성이 80% 이상인 CDR1 서열; 상기 표 Ia∼표 Ic에 기재된 CDR2 서열, 및 CDR3 서열 중 하나; 또는 (3) CDR1 서열; 상기 표 Ia∼표 Ic에 기재된 CDR2 서열 중 하나와의 서열 동일성이 80% 이상인 CDR2 서열; 및 CDR2 서열 조합 군과 동일한 조합 군에 속하는, 상기 표 Ia∼표 Ic에 기재된 CDR3 서열과 3개, 2개 또는 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR3 서열.
본 발명의 특히 바람직한 몇몇 나노바디는 예를 들어, 다음과 같은 것들을 포함할 수 있다: (1) 상기 표 Ia∼표 Ic에 기재된 CDR1 서열 중 하나와의 서열 동일성이 80% 이상인 CDR1 서열; 상기 표 Ia∼표 Ic에 기재된 CDR2 서열(동일한 조합 군에 속하는 CDR2 서열)과 3개, 2개 또는 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR2 서열; 및 상기 표 Ia∼표 Ic에 기재된 CDR3 서열(동일한 조합 군에 속하는 서열)과의 서열 동일성이 80% 이상인 CDR3 서열; (2) CDR1 서열; 상기 표 Ia∼표 Ic에 기재된 CDR2 서열 및 상기 표 Ia∼표 Ic에 기재된 CDR3 서열[여기서, 상기 CDR2 서열과 CDR3 서열은 상이한 조합 군에 속할 수 있음].
본 발명의 더욱 바람직한 몇몇 나노바디는 예를 들어, 다음과 같은 것들을 포함할 수 있다: (1) 상기 표 Ia∼표 Ic에 기재된 CDR1 서열 중 하나와의 서열 동일성이 80% 이상인 CDR1 서열; 상기 표 Ia∼표 Ic에 기재된, 동일한 조합 군에 속하는 CDR2 서열; 및 상기 표 Ia∼표 Ic에 기재된, 상이한 조합 군에 속하는 CDR3 서열; 또는 (2) 상기 표 Ia∼표 Ic에 기재된 CDR1 서열; 상기 표 Ia∼표 Ic에 기재된, 동일한 조합 군에 속하는 CDR2 서열과 3개, 2개 또는 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR2 서열; 및 상기 표 Ia∼표 Ic에 기재된, 동일한 조합 군에 속하는 CDR3 서열과의 서열 동일성이 80% 이상인 CDR3 서열.
본 발명의 특히 바람직한 나노바디는 예를 들어, 상기 표 Ia∼표 Ic에 기재된 CDR1 서열, 상기 표 Ia∼표 Ic에 기재된, 동일한 조합 군에 속하는 CDR2 서열과의 서열 동일성이 80% 이상인 CDR2 서열; 및 상기 표 Ia∼표 Ic에 기재된, 동일한 조합 군에 속하는 CDR3 서열을 포함할 수 있다.
본 발명의 가장 바람직한 나노바디에 있어서, 상기 CDR1, CDR2 및 CDR3 서열은 각각 상기 표 Ia∼표 Ic에 기재된 CDR1, CDR2 및 CDR3 서열의 조합 군 중 하나로부터 적당히 선택된다.
바람직하게, CDR 서열이 상기 표 Ia∼표 Ic에 나열된 CDR 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 CDR 서열로 이루어진 군으로부터 적당히 선택될 때; 및/또는 CDR 서열이 상기 표 Ia∼표 Ic에 나열된 CDR 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 CDR 서열로 이루어진 군으로부터 적당히 선택될 때,
i) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
ii) 이 아미노산 서열은 상기 표 Ia∼표 Ic에 나열된 CDR 서열에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는다.
본 발명의 비 제한적인 바람직한 구체예에 따르면, 본 발명의 나노바디 중 CDR 서열은 상기 정의된 바와 같으며, 또한 본 발명의 나노바디는, 해리 상수(KD) 10-5∼10-12 mole/ℓ(M) 이하, 및 바람직하게는 10-7∼10-12 mole/ℓ(M) 이하, 또는 더욱 바람직하게는 10-8∼10-12 mole/ℓ(M), 및/또는 결합 상수(KA) 107 M-1 이상, 바람직하게는 108 M-1 이상, 더욱 바람직하게는 109 M-1 이상 예를 들어, 1012 M-1 이상; 그리고 특히, KD 500 nM 미만, 바람직하게는 200 nM 미만, 더욱 바람직하게는 10 nM 미만 예를 들어, 500 pM 미만으로 vWF에 결합한다. vWF에 대한 본 발명의 나노바디의 KD 및 KA 값은 그 자체로서 공지된 방법 예를 들어, 본원에 개시된 검정법에 의해 측정될 수 있다. 더욱 일반적으로, 본원에 개시된 나노바디는 vWF에 관한 해리 상수가 본 문단에 나열한 바와 같은 것이 바람직하다.
다른 측면에서, 본 발명은 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97로 이루어진 군, 또는 상기 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 아미노산 서열 중 하나 이상과의 "서열 동일성"(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상 예를 들어, 99% 이상인 아미노산 서열로 이루어진 군으로부터 선택되는 아미노산 서열을 포함하는 나노바디에 관한 것으로서, 여기서, 아미노산 서열은 가장 바람직하게 이하 나노바디의 틀 서열에 관한 일반적인 설명 부분에 더욱 상세히 기술되어 있는 틀 서열을 가진다.
특정의 비 제한적인 구체예에 따르면, 상기 후자의 아미노산 서열은 본원에 더욱 상세히 기술되어 있는 바와 같이 "인간화된" 것이다.
가장 바람직하게, 본 발명의 나노바디는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97로 이루어진 군으로부터 선택되며, 이들 중 서열 번호 86∼서열 번호 97의 "인간화된" 나노바디가 특히 바람직할 수 있다.
본 발명에 따라서 특히 바람직한 나노바디는 나노바디 12B6(서열 번호 62) 및 이의 상동체 및 변이체, 특히, 이의 인간화된 변이체이다. 몇몇 특히 바람직한 비 제한적인 구체예에 있어서, 상동체 및 (인간화된) 변이체로서는 예를 들어, 나노바디 12A2(서열 번호 71); 12F2(서열 번호 72); 14H10(서열 번호 73) 및 이의 인간화된 변이체 예를 들어, 12B6H1(서열 번호 86); 12B6H2(서열 번호 87); 12B6H3(서열 번호 88); 12B6H4(서열 번호 89); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및 12A2H13(서열 번호 94)이 있다.
본 발명의 특히 바람직한 구체예로서는 나노바디 12A2(서열 번호 71) 및 이의 상동체 및 변이체, 및 특히, 이의 인간화된 변이체가 있다. 몇몇 특히 바람직한 비 제한적인 구체예에 있어서, 상동체 및 (인간화된) 변이체로서는 예를 들어, 나노바디 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및 12A2H13(서열 번호 94)이 있으며, 이 중 나노바디 12A2H1(서열 번호 90)이 특히 바람직하다.
그러므로, 본 발명의 하나의 바람직한 비 제한적 측면은 폰 빌레브란트 인자(vWF)에 대한 나노바디에 관한 것으로서, 이 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 이것의
a) CDR1은
- 아미노산 서열 YNPMG; 또는
- 이 아미노산 서열 YNPMG와 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 아미노산 서열을 포함하거나 또는 본질적으로 이것으로 이루어져 있으며
b) CDR2는
- 아미노산 서열 AISRTGGSTYYPDSVEG; 또는
- 이 아미노산 서열 AISRTGGSTYYPDSVEG와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열을 포함하거나 또는 본질적으로 이것으로 이루어져 있고
c) CDR3은
- 아미노산 서열 AGVRAEDGRVRTLPSEYTF; 또는
- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는
- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 아미노산 서열을 포함하거나 또는 본질적으로 이것으로 이루어져 있다.
특히, 본 발명은 다음과 같은 나노바디에 관한 것이다:
- CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이것으로 이루어져 있거나;
- CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나 또는 본질적으로 이것으로 이루어져 있거나;
- CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이것으로 이루어져 있는
나노바디.
예를 들어, 본 발명은 다음과 같은 나노바디에 관한 것이다:
- CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이것으로 이루어져 있고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이것으로 이루어져 있는 나노바디; 또는
- CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이것으로 이루어져 있고; CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나 또는 본질적으로 이것으로 이루어져 있는 나노바디; 또는
- CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나 또는 본질적으로 이것으로 이루어져 있고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이것으로 이루어져 있는 나노바디.
하나의 측면에서, 본 발명은 CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이것으로 이루어져 있고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이것으로 이루어져 있는 나노바디에 관한 것이다.
본 발명은 또한 이러한 나노바디의 인간화된 변이체에 관한 것이기도 하다. 몇몇 바람직한 비 제한적인 인간화 치환에 관하여는 본원에 기술할 것이거나, 또는 당 업자들은 본원에 개시된 상응하는 비-인간화 및 인간화 나노바디를 비교함으로써 알 수 있을 것이다. 몇몇 특히 유용한 인간화 치환으로서는 12A2[당업자들은 12A2H1(서열 번호 90) 서열과 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및 12A2H13(서열 번호 94)의 상응하는 인간화 서열을 비교함으로써 알게될 것임]의 인간화된 변이체에 존재하는 하나 이상의 치환이 있다.
본 발명의 또 다른 바람직한 비 제한적 측면은 폰 빌레브란트 인자(vWF)에 대한 나노바디에 관한 것으로서, 상기 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 이것의
d) CDR1은
- 아미노산 서열 YNPMG; 또는
- 이 아미노산 서열 YNPMG와 2개 또는 오로지 1개 아미노산에 있어서 아미노산 차이가 있는 아미노산 서열이며
e) CDR2는
- 아미노산 서열 AISRTGGSTYYPDSVEG; 또는
- 이 아미노산 서열 AISRTGGSTYYPDSVEG와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는 이 아미노산 서열 AISRTGGSTYYPDSVEG와 2개 또는 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 아미노산 서열이며
f) CDR3은
- 아미노산 서열 AGVRAEDGRVRTLPSEYTF; 또는
- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는
- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와 오로지 1개의 아미노산에 있어서 아미노산 차이가 있는 아미노산 서열이다.
특히, 본 발명은 다음과 같은 나노바디에 관한 것이다:
- CDR1은 아미노산 서열 YNPMG이거나; 또는
- CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG이거나; 또는
- CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF인 나노바디.
예를 들어, 본 발명은 다음과 같은 나노바디에 관한 것이다:
- CDR1은 아미노산 서열 YNPMG이고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF인 나노바디; 또는
- CDR1은 아미노산 서열 YNPMG이고; CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG인 나노바디; 또는
- CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG이고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF인 나노바디.
하나의 측면에서, 본 발명은 CDR1은 아미노산 서열 YNPMG이고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF인 나노바디에 관한 것이다.
본 발명은 또한 이러한 나노바디의 인간화된 변이체에 관한 것이기도 하다. 몇몇 바람직한 비 제한적인 인간화 치환에 관하여는 본원에 기술할 것이거나, 또는 당 업자들은 본원에 개시된 상응하는 비-인간화 및 인간화 나노바디를 비교함으로써 알 수 있을 것이다. 몇몇 특히 유용한 인간화 치환으로서는 12A2[당업자들은 12A2H1(서열 번호 90) 서열과 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및 12A2H13(서열 번호 94)의 상응하는 인간화 서열을 비교함으로써 알게될 것임]의 인간화된 변이체에 존재하는 하나 이상의 치환이 있다.
본원에 개시된 나노바디는 GLEW-군 나노바디, "103 P, R 또는 S"-군 나노바디 또는 "KERE-군 나노바디"(이들 모두에 관하여는 본원에 기술되어 있음)일 수 있다. 특히, 본원에 개시된 나노바디는 KERE-군 나노바디일 수 있으나, 본 발명이 이에 한정되는 것은 아니다.
다른 측면에서, 본 발명은 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97로 이루어진 군으로부터 선택되는 하나 이상의 나노바디와의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디에 관한 것이다.
구체적으로, 본 발명은 나노바디 12B6(서열 번호 62); 12A2(서열 번호 71); 12F2(서열 번호 72); 14H10(서열 번호 73); 12B6H1(서열 번호 86); 12B6H2(서열 번호 87); 12B6H3(서열 번호 88); 12B6H4(서열 번호 89); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94) 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디에 관한 것이다.
더욱 구체적으로, 본 발명은 나노바디 12A2(서열 번호 71); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94) 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디에 관한 것이다.
더더욱 구체적으로, 본 발명은 나노바디 12A2H1(서열 번호 90)과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디에 관한 것이다.
본 발명은 또한 이러한 나노바디의 인간화된 변이체에 관한 것이다. 몇몇 바람직한 비 제한적인 인간화 치환에 관하여는 본원에 기술할 것이거나, 또는 당 업자들은 본원에 개시된 상응하는 비-인간화 및 인간화 나노바디를 비교함으로써 알 수 있을 것이다. 몇몇 특히 유용한 인간화 치환으로서는 12A2[당업자들은 12A2H1(서열 번호 90) 서열과 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및 12A2H13(서열 번호 94)의 상응하는 인간화 서열을 비교함으로써 알게될 것임]의 인간화된 변이체에 존재하는 하나 이상의 치환이 있다.
본 발명은 또한 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디로 이루어진 군으로부터 선택되는 나노바디에 관한 것이다.
구체적으로, 본 발명은 나노바디 12B6(서열 번호 62); 12A2(서열 번호 71); 12F2(서열 번호 72); 14H10(서열 번호 73); 12B6H1(서열 번호 86); 12B6H2(서열 번호 87); 12B6H3(서열 번호 88); 12B6H4(서열 번호 89); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94)으로 이루어진 군으로부터 선택되는 나노바디에 관한 것이다.
더욱 구체적으로, 본 발명은 나노바디 12A2(서열 번호 71); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94)으로 이루어진 군으로부터 선택되는 나노바디에 관한 것이다. 특히 유용한 나노바디는 나노바디 12A2H1(서열 번호 90)이다.
본원에 개시된 나노바디는 본원에 상세히 기술된 틀 서열을 가지는 것이 바람직하다. 몇몇 특히 바람직한 틀 서열(FR1, FR2, FR3 및 FR4)로서는 나노바디 12A2의 틀 서열과 이의 인간화된 변이체; 및 상기 틀 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 틀 서열; 및/또는 상기 틀 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되는 틀 서열이 있다[여기서, 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환이고/이거나; 상기 아미노산 서열은 바람직하게는 아미노산 치환과, 3개 미만의 아미노산 결실 또는 3개 미만의 아미노산 삽입을 함유함]. 이러한 틀 서열을 포함하는, vWF에 대한 나노바디는 본 발명의 추가의 측면을 이룬다.
구체적으로, 본 발명은 vWF에 대한 나노바디에 관한 것으로서, 이것의 FR1은 서열 번호 140이고; FR2는 서열 번호 192이며; FR3은 서열 번호 244이고; FR4는 서열 번호 296인 나노바디; 또는 상기 틀 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 틀 서열; 및/또는 상기 틀 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되는 틀 서열을 가지는 나노바디에 관한 것이다[여기서, 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환이고/이거나; 상기 아미노산 서열은 바람직하게는 아미노산 치환과, 3개 미만의 아미노산 결실 또는 3개 미만의 아미노산 삽입을 함유함].
더욱 구체적으로, 본 발명은 FR1은 서열 번호 140이고; FR2는 서열 번호 192이며; FR3은 서열 번호 244이고; FR4는 서열 번호 296인, vWF에 대한 나노바디에 관한 것이다.
다른 측면에서, 본 발명은 본원에 정의한 바와 같은, vWF에 대한 하나 이상의 나노바디를 포함하거나 또는 본질적으로 이것으로 이루어져 있는 폴리펩티드에 관한 것이다. 이와 같은 폴리펩티드를 "본 발명의 폴리펩티드"라고 칭하며, 이는 또한 이하에 더욱 상세히 기술된바 및/또는 나노바디에 관한 WO 02/062551에 일반적으로 기술된 바와 같을 수 있으며, 또한 예를 들어, 이하에 더욱 상세히 기술되어 있는 다가의 폴리펩티드 또는 다중 특이적인 폴리펩티드일 수도 있다.
바람직하게, 본 발명의 폴리펩티드는 2가 또는 3가(즉, 본 발명의 나노바디를 각각 2개 또는 3개 포함하며, 임의로 이 나노바디는 본원에 정의된 바와 같은 1개 또는 2개의 링커에 의해 결합되어 있음)이거나 다중 특이적 폴리펩티드로서, 본 발명의 나노바디를 1개 또는 2개, 바람직하게는 2개 포함하고, 혈청 단백질, 특히 인간 혈청 단백질 예를 들어, 인간 혈청 알부민에 대해 생성되는 하나 이상의 나노바디를 포함하는 폴리펩티드이다.
하나의 바람직한 비 제한적인 구체예에서, 본 발명의 폴리펩티드 중에 존재하는 본 발명의 나노바디는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97로 이루어진 군, 및 특히, 서열 번호 86∼서열 번호 97의 "인간화된" 나노바디로부터 선택된다. 본 발명의 폴리펩티드 중에 존재하는, 인간 혈청 알부민에 대한 나노바디는 본원에 정의한 바와 같은 것이 바람직하며, 서열 번호 107∼서열 번호 121로 이루어진 군으로부터 선택되는 것이 더욱 바람직하고, 또한 서열 번호 114∼서열 번호 121의, 인간 혈청 알부민에 대한 "인간화된" 나노바디로부터 선택되는 것이 특히 바람직하다.
본 발명의 폴리펩티드에 관한 몇몇 바람직한 비 제한적 구체예로서는 서열 번호 74∼서열 번호 82의 폴리펩티드 및 서열 번호 98∼서열 번호 106의 폴리펩티드가 있다. 본 발명의 기타 폴리펩티드는 예를 들어, 상기 서열 번호 74∼서열 번호 82 및/또는 서열 번호 98∼서열 번호 106의 아미노산 서열 중 하나 이상과의 "서열 동일성"(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상 예를 들어, 99% 이상인 아미노산 서열로 이루어진 군으로부터 선택될 수 있으며, 여기서, 상기 아미노산 서열 중에 포함된 나노바디는 본원에 정의된 바와 같은 것이 바람직하다.
본 발명의 하나의 측면에 따르면, 본원에 개시된 나노바디, 단백질 및 폴리펩티드는 ADAMTS-13에 의한 ULvWF의 절단에 대하여 본질적으로 영향을 받지 않는다. 특히, 본원에 개시된 나노바디, 단백질 및 폴리펩티드가 본원에 개시된 투여량으로 사용될 때, ADAMTS-13에 의한 ULvWF의 절단(투여시 생체 내에서의 절단 및/또는 적당한 검정법 예를 들어, 본원에 기술된 바와 같은 검정법을 이용하여 확인되는 바와 같은 절단)은 본질적으로 ADAMTS-13에 의한 ULvWF의 절단을 50% 이하까지, 바람직하게는 20% 이하까지, 더욱 바람직하게는 10% 이하까지, 예를 들어, 5% 이하까지 또는 본질적으로 전혀 감소시키지 않거나 억제하지 않는다. 그러므로, 본 발명의 다른 측면은 나노바디, 단백질 또는 폴리펩티드, 구체적으로, ADAMTS-13에 의한 ULvWF의 절단을 본질적으로 감소시키지 않거나 억제하지 않는, 본원에 개시된 바와 같은 나노바디, 단백질 또는 폴리펩티드에 관한 것이다.
다른 측면에서, 본 발명은 본 발명의 나노바디 및/또는 본 발명의 폴리펩티드를 암호화하는 핵산에 관한 것이다. 이러한 핵산도 또한 이하에서 "본 발명의 핵산"이라고 칭하여질 것이며, 그 예로서는 본원에 정의된 바와 같은 유전자 구조물의 형태를 가지는 것이 있을 수 있다.
다른 측면에서, 본 발명은 본 발명의 나노바디 및/또는 본 발명의 폴리펩티드를 발현하거나, 이를 발현할 수 있으며/있거나; 본 발명의 나노바디 및/또는 본 발명의 폴리펩티드를 암호화하는 핵산을 함유하는 숙주 또는 숙주 세포에 관한 것이다. 이러한 숙주 또는 숙주 세포는 또한 WO 02/062551에 개시된 숙주 및 숙주 세포와 유사할 수 있지만, 다만, 본 발명의 나노바디 및/또는 본 발명의 폴리펩티드를 발현하거나 또는 발현할 수 있으며/있거나, 본원에 개시된 핵산을 함유한다는 점에서 차이가 있다
본 발명은 또한 본 발명의 나노바디, 본 발명의 폴리펩티드 및/또는 본 발명의 핵산을 함유하거나 또는 포함하는 생산물 또는 조성물에 관한 것이기도 하다. 이러한 생산물 또는 조성물은 예를 들어, 진단용 약학 조성물(이하에 기술함) 또는 생산물 또는 조성물(이하에 기술함)일 수 있다. 이러한 생산물 또는 조성물은 또한 WO 02/062551에 개시된 생산물 및 조성물과 유사할 수 있지만, 다만, 본 발명의 나노바디, 본 발명의 폴리펩티드 또는 본 발명의 핵산을 함유하거나 포함한다는 점에서 차이가 있다.
본 발명은 또한 본원에 기술된 바와 같은 나노바디, 폴리펩티드, 핵산, 숙주 세포, 생산물 및 조성물을 제조 또는 생산하는 방법에 관한 것이기도 하다[그 방법에 관하여는 이하에 더욱 상세히 기술됨]. 또한, 일반적으로, 본원에 개시된 나노바디, 폴리펩티드, 핵산, 숙주 세포, 생산물 및 조성물은 또한 WO 02/062551에 개시된 방식과 유사한 방식으로 제조 및 사용될 수도 있다.
본 발명은 또한 본원에 기술된 상기 나노바디, 폴리펩티드, 핵산, 숙주 세포, 생산물 및 조성물의 응용 분야 및 용도에 관한 것이기도 한데, 여기서, 상기 응용 분야 및 용도는 이하에 기술되어 있는 응용 분야 및 용도, 및/또는 WO 02/062551에 개시된 vWF에 대한 나노바디 및/또는 이를 함유하는 폴리펩티드에 대한 추가의 응용 분야 및 용도를 포함하나, 이에 한정되는 것은 아니다.
본 발명의 기타 측면, 구체예, 이점 및 응용 분야는 이하의 상세한 설명을 통해 명백해질 것이다.
본 발명의 상세한 설명
전술한 바와 같은 본 발명의 측면 및 기타 측면들, 그리고 구체예는 이하에 더욱 상세히 기술된 바로부터 명백해 질 것이다:
a) 달리 언급하거나 정의하지 않는 한, 본원에 사용된 모든 용어는 당 업계에서 통상적으로 사용되고 당 업자도 알고 있는 의미를 갖는다. 참고 자료로서는 예를 들어, 다음과 같은 표준 핸드북들과 여기에 언급된 일반적인 배경 기술이 있다: Sambrook외 다수, "Molecular Cloning: A Laboratory Manual" ( 2nd.Ed.), Vols. 1-3, Cold Spring Harbor Laboratory Press (1989); F. Ausubel외 다수, eds., "Current protocols in molecular biology", Green Publishing and Wiley Interscience, New York (1987); Roitt외 다수, "Immunology" (6th. Ed.), Mosby/Elsevier, Edinburgh (2001); 및 Janeway외 다수, "Immunobiology" (6th Ed ), Garland Science Publishing/Churchill Livingstone, New York (2005);
b) 달리 언급하지 않는 한, "면역 글로불린 서열"이란 용어는, 그것이 중쇄 항체를 의미하는 것으로 사용되었든, 종래의 4-사슬 항체를 의미하는 것으로 사용되었든 간에, 전체 크기의 항체, 이의 개별 사슬들, 그리고 이의 모든 부분, 도메인 또는 단편(예를 들어, 각각 항원-결합 도메인 또는 단편 예를 들어, VHH 도메인 또는 VH/VL 도메인)을 모두 포함하는 일반적인 의미로 사용되는 것이다. 뿐만 아니라, 본원에 사용된 (예를 들어, "면역 글로불린 서열", "항체 서열", "가변 도메인 서열", "VHH 서열" 또는 "단백질 서열"에서와 같이 사용된) "서열"이라는 용어는, 명세서 내용 중 별도의 부가 설명을 필요로 하지 않는 한, 일반적으로 관련 아미노산 서열과 핵산 서열 또는 이것들을 암호화하는 뉴클레오티드 서열을 모두 포함하는 것으로 이해해야 할 것이다;
c) 달리 특정하지 않는 한, 본원에서 상세히 기술되지 않은 모든 방법, 단계, 기술 및 조작 방법은 그 자체로서 당 업자에게 명백하게 공지되어 있는 바와 동일한 방식으로 수행될 수 있으며, 또한 수행되고 있는 것이다. 참고 자료로서는 예를 들어, 표준 핸드북과 상기 언급한 일반적인 배경 기술, 그리고 거기에 언급된 추가의 참고 문헌들이 있다;
d) 아미노산 잔기는 이하 표 1에 나타낸 바와 같이, 표준적인 3 문자 아미노산 코드 또는 1 문자 아미노산 코드로서 나타낼 것이다.
| 1 문자 및 3 문자 아미노산 코드 | |||
| 비극성, 비하전 (pH 6.0∼7.0에서)(3) | 알라닌 | Ala | A |
| 발린 | Val | V | |
| 루신 | Leu | L | |
| 이소루신 | Ile | I | |
| 페닐알라닌 | Phe | F | |
| 메티오닌(1) | Met | M | |
| 트립토판 | Trp | W | |
| 프롤린 | Pro | P | |
| 극성, 비하전 (pH 6.0∼7.0에서) | 글리신(2) | Gly | G |
| 세린 | Ser | S | |
| 트레오닌 | Thr | T | |
| 시스테인 | Cys | C | |
| 아스파라긴 | Asn | N | |
| 글루타민 | Gln | Q | |
| 티로신 | Tyr | Y | |
| 극성, 하전 (pH 6.0∼7.0에서) | 리신 | Lys | K |
| 아르기닌 | Arg | R | |
| 히스티딘(4) | His | H | |
| 아스파테이트 | Asp | D | |
| 글루타메이트 | Glu | E | |
*주:
상기 표 1에 있어서,
(1): 종종 극성 비하전 아미노산으로 간주하기도 함.
(2): 종종 비극성 비하전 아미노산으로 간주하기도 함.
(3): 당 업자에게 명백한 바와 같이, 이 표 1에 기재된 아미노산 잔기가 pH6.0∼7.0에서 하전인지 비하전인지로 나타낸 것은, 어떤 식으로든지 상기 아미노산 잔기가 pH 6.0 이하 및/또는 pH 7.0 이상에서 그러할 수 있다는 것을 반영하는 의미는 아니며; 당 업자가 알고 있는 바와 같이, 상기 표 1에 기재된 아미노산 잔기들은 이와 같은 pH보다 높거나 낮은 pH에서 하전 및/또는 비하전일 수 있음.
(4): 당 업계에 공지되어 있는 바와 같이, His 잔기의 하전은 pH가 조금만 변하여도 쉽게 변할 수 있으나, His 잔기는 일반적으로 pH 약 6.5에서 본질적으로 비하전인 것으로 간주할 수 있음.
e) 2개 이상의 뉴클레오티드 서열들을 비교하기 위한, 제1 뉴클레오티드 서열과 제2 뉴클레오티드 서열 간 "서열 동일성(sequence identity)" %는 [제2 뉴클레오티드 서열 내 제1 뉴클레오티드 서열과 상응하는 위치에 존재하는 뉴클레오티드와 동일한, 제1 뉴클레오티드 서열 내 뉴클레오티드의 수]를 [제1 뉴클레오티드 서열 내에 존재하는 뉴클레오티드의 총 수]로 나눈 후, 여기에 [100%]를 곱함으로써 계산될 수 있는데, 여기서, 제1 뉴클레오티드 서열에 비한, 제2 뉴클레오티드 서열 내에 존재하는 뉴클레오티드 각각의 결실, 삽입, 치환 또는 부가는 단일 뉴클레오티드(위치)에서 발생하는 차이(difference)로서 간주한다. 대안적으로, 2개 이상의 뉴클레오티드 서열간 서열 동일성 정도는 공지의 서열 정렬용 컴퓨터 알고리즘 예를 들어, NCBI Blast v2.0(표준 세팅)을 이용하여 계산될 수 있다.
서열 동일성 정도를 측정하기 위한 몇몇 기타 기술, 컴퓨터 알고리즘 및 세팅 조건들은 예를 들어, WO 04/037999, EP 0 967 284, EP 1 085 089, WO 00/55318, WO 00/78972, WO 98/49185 및 GB 2 357 768-A에 개시되어 있다.
일반적으로, 상기 간단히 소개한 계산 방법에 따라서, 2개의 뉴클레오티드 서열 간 "서열 동일성" %를 계산하기 위해서, 가장 많은 뉴클레오티드를 포함하는 뉴클레오티드 서열을 "제1" 뉴클레오티드 서열로 정할 것이며, 다른 뉴클레오티드 서열은 "제2" 뉴클레오티드 서열로 정할 것이다.
f) 2개 이상의 아미노산 서열을 비교하기 위한, 제1 아미노산 서열 및 제2 아미노산 서열 간 "서열 동일성" %는 [제2 아미노산 서열 내 제1 아미노산 서열과 상응하는 위치에 존재하는 아미노산 잔기와 동일한, 제1 아미노산 서열 내 아미노산 잔기의 수]를 [제1 아미노산 서열 내에 존재하는 뉴클레오티드의 총 수]로 나눈 후, 여기에 [100%]를 곱함으로써 계산될 수 있는데, 여기서, 제1 아미노산 서열에 비한, 제2 아미노산 서열 내에 존재하는 아미노산 잔기 각각의 결실, 삽입, 치환 또는 부가는 단일 아미노산 잔기(위치)에서 발생하는 차이(difference) 즉, "아미노산 차이(amino acid difference)"로서 간주한다.
대안적으로, 2개의 아미노산 서열 간 서열 동일성 정도는, 공지된 컴퓨터 알고리즘 예를 들어, 표준적인 세팅 조건을 적용시켜 뉴클레오티드 서열의 서열 동일성 정도를 측정하는 방법에 관해 언급한 바와 같은 알고리즘을 이용하여 계산될 수 있다.
일반적으로, 상기 간단히 소개한 계산 방법에 따라서, 2개의 아미노산 서열 간 "서열 동일성" %를 계산하기 위해서, 가장 많은 아미노산 잔기를 포함하는 아미노산 서열을 "제1" 아미노산 서열로 정할 것이며, 다른 아미노산 서열은 "제2" 아미노산 서열로 정할 것이다.
또한, 2개의 아미노산 서열 간 서열 동일성 정도를 측정함에 있어서, 당 업자는 소위 "보존적" 아미노산 치환을 고려할 수 있는데, 이와 같은 보존적 아미노산 치환은, 일반적으로 아미노산 잔기가 유사한 화학 구조를 가지는 다른 아미노산 잔기로 치환되어 폴리펩티드의 기능, 활성 또는 기타 생물학적 특성에 거의 영향을 미치지 않거나 또는 본질적으로 아무런 영향을 미치지 않는 아미노산 치환으로서 설명될 수 있다. 이와 같은 보존적 아미노산 치환은 당 업계에 널리 공지되어 있는데, 예를 들어, WO 04/037999, GB-A-2 357 768, WO 98/49185, WO 00/46383 및 WO 01/09300에 개시되어 있으며; 이러한 치환의 (바람직한) 유형 및/또는 조합은 WO 04/037999 및 WO 98/49185, 그리고 여기에 언급된 추가의 참고 문헌들의 관련 교시 사항을 기초로 하여 선택될 수 있다.
이러한 보존적 치환은 바람직하게, 다음과 같은 군들 (a)∼(e)에 속하는 하나의 아미노산이 동일한 군에 속하는 다른 아미노산 잔기로 치환되는 경우이다: (a) 소형의 지방족, 비극성 또는 약 극성 잔기: Ala, Ser, Thr, Pro 및 Gly; (b) 극성, 음 하전 잔기 및 이의 (비하전) 아미드: Asp, Asn, Glu 및 Gln; (c) 극성, 양 하전 잔기: His, Arg 및 Lys; (d) 대형의 지방족, 비극성 잔기: Met, Leu, Ile, Val 및 Cys; 및 (e) 방향족 잔기: Phe, Tyr 및 Trp.
특히 바람직한 보존적 치환으로서는 다음과 같은 경우들이 있다: Ala의 Gly 또는 Ser로의 치환; Arg의 Lys으로의 치환; Asn의 Gln 또는 His으로의 치환; Asp의 Glu로의 치환; Cys의 Ser으로의 치환; Gln의 Asn으로의 치환; Glu의 Asp으로의 치환; Gly의 Ala 또는 Pro으로의 치환; His의 Asn 또는 Gln으로의 치환; Ile의 Leu 또는 Val으로의 치환; Leu의 Ile 또는 Val으로의 치환; Lys의 Arg, Gln 또는 Glu으로의 치환; Met의 Leu, Tyr 또는 Ile으로의 치환; Phe의 Met, Leu 또는 Tyr으로의 치환; Ser의 Thr으로의 치환; Thr의 Ser으로의 치환; Trp의 Tyr으로의 치환; Tyr의 Trp으로의 치환; 및/또는 Phe의 Val, Ile 또는 Leu으로의 치환.
본원에 기술된 폴리펩티드에 적용되는 임의의 아미노산 치환은 또한 문헌[Schulz외 다수, Principles of Protein Structure, Springer-Verlag, 1978]의 저자에 의해 개발된 상이한 종의 상동성 단백질 간 아미노산 변이의 발생 횟수의 분석 결과와, 문헌[Chou and Fasman, Biochemistry 13: 211, 1974 및 Adv. Enzymol., 47: 45-149, 1978]의 저자에 의해 개발된 구조 형성 가능성 분석 결과, 그리고 문헌[Eisenberg외 다수, Proc. Nad. Acad Sci. USA 81 : 140-144, 1984; Kyte & Doolittle; J Molec. Biol. 157: 105-132, 198 1, 및 Goldman외 다수, Ann. Rev. Biophys. Chem. 15: 321-353, 1986]의 저자에 의해 개발된 단백질 내 소수성 패턴에 관한 분석 결과를 바탕으로 할 수도 있다[상기 문헌들은 모두 그 자체로서 참고용으로 인용됨]. 나노바디의 1차, 2차 및 3차 구조에 관한 정보는 본원의 상세한 설명과 상기 일반적인 배경 기술에 제시되어 있다. 또한, 이러한 목적으로, 라마로부터 유래한 VHH 도메인의 결정 구조에 관하여는 예를 들어, 문헌[Desmyter외 다수, Nature Structural Biology, Vol. 3, 9, 803 (1996); Spinelli외 다수, Natural Structural Biology (1996); 3, 752-757; 및 Decanniere외 다수, Structure, Vol. 7, 4, 361 (1999)]에 제시되어 있다.
g) 만일 아미노산 서열 및 핵산 서열이 그 전체 길이에 걸쳐서 100% 서열 동일성(본원에 정의됨)을 가진다면, 이 아미노산 서열 및 핵산 서열은 "정확히 동일한"것이라고 칭한다.
h) 2개의 아미노산 서열을 비교할 때, "아미노산 차이"란 용어는, 제2 서열에 비하여, 제1 서열상의 일정 위치에 하나의 아미노산 잔기가 삽입, 결실 또는 치환된 경우를 의미하며; 2개의 아미노산 서열은 1개, 2개 또는 그 이상의 아미노산 차이를 함유할 수 있음을 이해해야 할 것이다.
i) 핵산 서열 또는 아미노산 서열이 공급원 또는 배지 중에서 그것과 일반적으로 결합되어 있는 하나 이상의 기타 성분들 예를 들어, 다른 핵산, 다른 단백질/폴리펩티드, 다른 생물학적 성분 또는 거대 분자 또는 하나 이상의 오염 물질, 불순물 또는 보조 성분으로부터 분리되었을 때, (예를 들어, 핵산 서열 또는 아미노산 서열이 얻어진 원래의 생물학적 공급원 및/또는 반응 배지 또는 배양 배지와 비교하여), 이 핵산 서열 또는 아미노산 서열은 "본질적으로 분리된 (형태)"인 것으로 간주한다. 특히, 핵산 서열 또는 아미노산 서열은, 그것이 2배 이상, 구체적으로, 10배 이상, 더욱 구체적으로 100배 이상, 그리고 1000배 까지 순수할 때, "본질적으로 분리된" 것으로 간주한다. "본질적으로 분리된 형태인" 핵산 서열 또는 아미노산 서열은, 적당한 기술 예를 들어, 적당한 크로마토그래피 기술 예를 들어, 폴리아크릴아미드-겔 전기 영동 기술을 사용하여 측정하였을 때, 바람직하게는 본질적으로 상동성이다.
j) 본원에 사용된 "도메인"이란 용어는, 항체 사슬의 구상 부위(globular region), 구체적으로는 중쇄 항체의 구상 부위, 또는 본질적으로 이러한 구상 부위로 이루어진 폴리펩티드를 의미하는 것이다. 일반적으로, 이러한 도메인은 예를 들어, 시트 형태로서 안정화되거나 또는 이황화 결합에 의해 안정화된 펩티드 루프(예를 들어, 3개 또는 4개의 펩티드 루프)를 포함할 것이다.
k) "항원 결정기"란 용어는, 항원-결합 분자(예를 들어, 본 발명의 나노바디 또는 폴리펩티드)에 의해 인지되는 항원 상의 에피토프, 더욱 구체적으로는 이 분자의 항원-결합 위치에 의해 인지되는 항원 상의 에피토프를 의미하는 것이다. "항원 결정기" 및 "에피토프"라는 용어는 또한 본원에서 호환되어 사용될 수도 있다.
l) 특정 항원 결정기, 에피토프, 항원 또는 단백질(또는 이것의 하나 이상의 부분, 단편 또는 에피토프)에 결합할 수 있고, 이것에 대한 친화성 및/또는 특이성을 가지는 아미노산 서열(예를 들어, 본 발명의 나노바디, 항체, 폴리펩티드, 또는 일반적으로 이의 항원 결합 단백질 또는 폴리펩티드 또는 단편)을, 상기 항원 결정기, 에피토프, 항원 또는 단백질"에 대한" 것 또는 "~에 대해 생성된" 것이라고 한다.
m) "특이성"이란 용어는, 특정 항원-결합 분자 또는 항원-결합 단백질(예를 들어, 본 발명의 나노바디 또는 폴리펩티드) 분자가 결합할 수 있는 상이한 유형의 항원 또는 항원 결정기의 수를 의미한다. 항원-결합 단백질의 특이성은 친화성 및/또는 결합성을 바탕으로 하여 측정될 수 있다. 항원과 항원-결합 단백질의 해리 평형 상수(KD)로서 표시되는 친화도는 항원-결합 단백질 상 항원-결합 위치 및 항원 결정기 사이의 결합 세기의 척도가 된다: KD값이 작을수록 항원 결정기와 항원-결합 분자 간 결합 세기는 세진다(대안적으로, 친화도 역시 친화도 상수(KA)(1/KD)로서 표시될 수 있음). (예를 들어, 본원에 더욱 상세히 기술되어 있는 바를 바탕으로 하여) 당 업자가 알 수 있는 바와 같이, 친화도는 목적으로 하는 특정 항원에 의존적인 방식으로 측정될 수 있다. 결합성은 항원-결합 분자(예를 들어, 본 발명의 나노바디 또는 폴리펩티드)와 관련 항원 간 결합 세기의 척도이다. 결합성은 항원-결합 분자 상에 존재하는 항원 결합 위치와 항원 결정기 사이의 친화도와, 항원-결합 분자 상에 존재하는 관련 결합 위치들의 수 둘 다와 관련이 있다. 통상적으로, 항원-결합 단백질(예를 들어, 본 발명의 나노바디 및/또는 폴리펩티드)는 해리 상수(KD)가 10-5∼10-12 mole/ℓ(M) 이하, 바람직하게는 10-7∼10-12 mole/ℓ(M) 이하, 그리고 더욱 바람직하게는 10-8∼10-12 mole/ℓ(M) 이하, 및/또는 결합 상수(KA)가 107 M-1 이상, 바람직하게는 108 M-1 이상, 더욱 바람직하게는 109 M-1 이상 예를 들어, 1012 M-1 이상으로 결합할 것이다. 임의의 KD 값이 10-4M보다 크다는 의미는 일반적으로 비 특이적 결합을 한다는 것을 나타낸다. 바람직하게, 본 발명의 나노바디 또는 폴리펩티드는 목적으로 하는 항원에 KD 값 500nM 미만, 바람직하게는 200nM 미만, 더욱 바람직하게는 10nM 미만 예를 들어, 500pM 미만으로 결합할 것이다. 항원-결합 단백질과 항원 또는 항원 결정기의 특이적 결합 능은 공지된 임의의 적당한 방법 예를 들어, 스케챠드 분석법(Scatchard analysis) 및/또는 경쟁적 결합 검정법 예를 들어, 방사성 면역 검정법(RIA), 효소 면역 검정법(EIA) 및 샌드위치 경쟁 분석법, 그리고 당 업계에 알려져 있는 이들 방법의 상이한 변법을 통하여 측정될 수 있다.
n) 이하에 더욱 상세히 기술되어 있는 바와 같이, 나노바디의 아미노산 서열과 구조는 (한정적인 것은 아니지만) 4개의 틀 부위 즉, "FR"로 이루어져 있는 것으로 간주할 수 있는데, 여기서, 이들 부위는 당 업계 및 이하 본원에 기술된 바에 의하면 각각 "틀 부위 1" 또는 "FR1"; "틀 부위 2" 또는 "FR2"; "틀 부위 3" 또는 "FR3"; 그리고 "틀 부위 4" 또는 "FR4"로서 칭하여 지며; 이들 틀 부위 내부에는 3개의 상보성 결정 부위, 즉, "CDR"[당 업계에는 각각 "상보성 결정 부위 1" 또는 "CDR1"; "상보성 결정 부위 2" 또는 "CDR2"; 및 "상보성 결정 부위 3" 또는 "CDR3"라고 칭함]이 삽입되어 있다.
o) 뿐만 아니라, 이하에 더욱 상세히 기술되어 있는 바와 같이, 나노바디 내에 포함된 아미노산 잔기의 총수는 110∼120개, 바람직하게는 112∼115개, 그리고 가장 바람직하게는 113개이다. 그러나, 나노바디의 부분, 단편 또는 유사체(이하에 보다 상세히 설명됨)는, 이 부분, 단편 또는 유사체가 이하에 요약된 추가의 조건을 충족하고 있고, 또한 바람직하게는 본원에 기술된 목적으로서 적당한 한, 이것들의 길이 및/또는 크기에 특별히 제한되지는 않음에 주목해야 한다.
p) 나노바디의 아미노산 잔기는 캐벗(Kabat)외 다수에 의하여 제시된 VH 도메인에 관한 일반적인 번호 메김 원리에 따라서["Sequence of proteins of immunological interest", US Public Health Services, NIH Bethesda, MD, Publication No. 91 참조], 상기 언급된 리헤만 및 뮐더만(Riechmann and Muyldermans)의 논문 중 카멜리드의 VHH 도메인에 적용된 방식과 같이 번호가 메겨진다(예를 들어, 상기 참고 문헌의 도 2 참조). 이와 같은 번호 메김 방식에 따르면, 나노바디의 FR1은 1∼30번 위치에 아미노산 잔기를 포함하고, 나노바디의 CDR1은 31∼36번 위치에 아미노산 잔기를 포함하며, 나노바디의 FR2는 36∼49번 위치에 아미노산을 포함하고, 나노바디의 CDR2은 50∼65번 위치에 아미노산 잔기를 포함하며, 나노바디의 FR3은 66∼94번 위치에 아미노산 잔기를 포함하고, 나노바디의 CDR3은 95∼102번 위치에 아미노산 잔기를 포함하며, 나노바디의 FR4는 103∼113번 위치에 아미노산 잔기를 포함한다. [이러한 측면에서, VH 도메인 및 VHH 도메인에 대해 당 업계에 널리 알려져 있는 바와 같이, CDR의 각각에 존재하는 아미노산 잔기의 총수는 다양할 수 있으며, 캐벗 번호 메김 방식에 의해 표시되는 아미노산 잔기의 총수와 상응하지 않을 수 있다[즉, 캐벗 번호 메김 방식에 따른 하나 이상의 위치는 실제 서열을 점유하지 않을 수 있거나, 또는 실제 서열은 캐벗 번호 메김 방식에 따르는 번호보다 더 많은 수의 아미노산 잔기들을 함유할 수 있다]]. 이것은 일반적으로, 캐벗에 따른 번호 메김 방식은 실제 서열 내에 존재하는 아미노산 잔기의 실제 번호 메김 방식과 상응할 수 있거나 또는 상응할 수 없음을 의미하는 것이다. 그러나, 일반적으로, 캐벗 번호 메김 방식에 따르면, CDR 내 아미노산 잔기의 수와는 상관없이, 캐벗 번호 메김 방식에 따른 1번 위치는 FR1의 개시 부분에 해당하고(그 반대의 경우도 마찬가지임), 캐벗 번호 메김 방식에 따른 36번 위치는 FR2의 개시 부분에 해당하며(그 반대의 경우도 마찬가지임), 캐벗 번호 메김 방식에 따른 66번 위치는 FR3의 개시 부분에 해당하고(그 반대의 경우도 마찬가지임), 또한 캐벗 번호 메김 방식에 따른 103번 위치는 FR4의 개시 부분에 해당한다고 할 수 있다(그 반대의 경우도 마찬가지임).
카멜리드로부터 유래하는 VHH 도메인과 나노바디에서와 유사한 방식으로 적용될 수도 있는, VH 도메인의 아미노산 잔기에 번호를 메기는 또 다른 방법은 문헌[Chothia외 다수, Nature 342, 877-883 (1989)]중 소위 "AbM 정의" 및 "밀착 정의(contact definition)"에 기술되어 있다. 그러나, 본 발명의 상세한 설명, 청구의 범위 및 도면에 있어서는, 달리 언급이 없는 한, 리헤만 및 뮐더만에 의하여 VHH 도메인에 적용된 캐벗 번호 메김 방식을 따를 것이다.
q) 도면, 서열 목록 및 실험 부분/실시예는 본 발명을 추가로 예시하기 위해 제공된 것으로서, 본원에서 달리 언급하지 않는 한, 본 발명의 범위 및/또는 본 발명에 첨부된 청구의 범위를 어떠한 방식으로든지 제한하는 것으로 해석되거나 오인되어서는 아니 될 것이다.
중쇄 항체와 이의 가변 도메인에 관한 일반적인 설명에 있어서, 참고 문헌으로서는 일반적인 배경 기술로서 언급되어 있는 다음과 같은 것들이 있다:
WO 94/04678, WO 95/04079 및 WO 96/34103(Vrije Universiteit Brussel); WO 94/25591, WO 99/37681, WO 00/40968, WO 00/43507, WO 00/65057, WO 01/40310, WO 01/44301, EP 1134231 및 WO 02/48193(Unilever); WO 97/49805, WO 01/21817, WO 03/035694, WO 03/054016 및 WO 03/055527(Vlaams Instituut voor Biotechnologie; VIB); WO 03/050531(Algonomics N.V. 및 출원인); WO 01/90190(National Research Council of Canada); WO 03/025020 (= EP 1 433 793)(Institute of Antibodies); 그리고 WO 04/041867, WO 04/041862, WO 04/041865, WO 04/041863, WO 04/062551(출원인 및 이 출원에 의한 추가의 공개된 특허 출원);
Hamers-Casterman외 다수, Nature 1993 June 3; 363 (6428): 446-8; Davies and Riechmann, FEBS Lett. 1994 Feb 21; 339(3): 285-90; Muyldermans외 다수, Protein Eng. 1994 Sep; 7(9): 1129-3; Davies and Riechmann, Biotechnology (NY) 1995 May; 13(5): 475-9; Gharoudi외 다수, 9th Forum of Applied Biotechnology, Med. Fac. Landbouw Univ. Gent. 1995; 60/4a part I: 2097-2100; Davies and Riechmann, Protein Eng. 1996 Jun; 9(6): 531-7; Desmyter외 다수, Nat Struct Biol. 1996 Sep; 3(9): 803-11; Sheriff외 다수, Nat Struct Biol. 1996 Sep; 3(9): 733-6; Spinelli외 다수, Nat Struct Biol. 1996 Sep; 3(9): 752-7; Arbabi Ghahroudi외 다수, FEBS Lett. 1997 Sep 15; 414(3): 521-6; Vu외 다수, Mol Immunol. 1997 Nov-Dec; 34(16-17): 1121-31; Atarhouch외 다수, Journal of Camel Practice and Research 1997; 4: 177-182; Nguyen외 다수, J. Mol. Biol. 1998 Jan 23; 275(3): 413-8; Lauwereys외 다수, EMBO J. 1998 Jul 1; 17(13): 3512-20; Frenken외 다수, Res Immunol. 1998 Jul-Aug;149(6):589-99; Transue외 다수, Proteins 1998 Sep 1 ; 32(4): 515-22; Muyldermans and Lauwereys, J. Mol. Recognit. 1999 Mar-Apr; 12 (2): 131-40; van der Linden외 다수, Biochim. Biophys. Acta 1999 Apr 12; 1431(1): 37-46.; Decanniere외 다수, Structure Fold. Des. 1999 Apr 15; 7(4): 361-70; Ngyuen외 다수, Mol. Immunol. 1999 Jun; 36(8): 515-24; Woolven외 다수, Immunogenetics 1999 Oct; 50 (1-2): 98-101; Riechmann and Muyldermans, J. Immunol. Methods 1999 Dec 10; 231 (1-2): 25-38; Spinelli외 다수, Biochemistry 2000 Feb 15; 39(6): 1217-22; Frenken외 다수, J. Biotechnol. 2000 Feb 28; 78(1): 11-21; Nguyen외 다수, EMBO J. 2000 Mar 1; 19(5): 921-30; van der Linden외 다수, J. Immunol. Methods 2000 Jun 23; 240 (1-2): 185-95; Decanniere외 다수, J. Mol. Biol. 2000 Jun 30; 300 (1): 83-91; van der Linden외 다수, J. Biotechnol. 2000 Jul 14; 80(3): 261-70; Harmsen외 다수, Mol. Immunol. 2000 Aug; 37(10): 579-90; Perez외 다수, Biochemistry 2001 Jan 9; 40(1): 74-83; Conrath외 다수, J. Biol. Chem. 2001 Mar 9; 276 (10): 7346-50; Muyldermans외 다수, Trends Biochem Sci. 2001 Apr;26(4):230-5; Muyldermans S., J. Biotechnol. 2001 Jun; 74 (4): 277-302; Desmyter외 다수, J. Biol. Chem. 2001 Jul 13 ;276 (28): 26285-90; Spinelli외 다수, J. Mol. Biol. 2001 Aug 3; 311 (1): 123-9; Conrath외 다수, Antimicrob Agents Chemother. 2001 Oct; 45 (10): 2807-12; Decanniere외 다수, J. Mol. Biol. 2001 Oct 26; 313(3): 473-8; Nguyen외 다수, Adv Immunol. 2001 ; 79: 261-96; Muruganandam외 다수, FASEB J. 2002 Feb; 16 (2): 240-2; Ewert외 다수, Biochemistry 2002 Mar 19; 41 (11): 3628-36; Dumoulin외 다수, Protein Sci. 2002 Mar; 11 (3): 500-15; Cortez-Retamozo외 다수, Int. J. Cancer. 2002 Mar 20; 98 (3): 456-62; Su외 다수, Mol. Biol. Evol. 2002 Mar; 19 (3): 205-15; van der Vaart JM., Methods Mol Biol. 2002; 178: 359-66; Vranken외 다수, Biochemistry 2002 Jul 9; 41 (27): 8570-9; Nguyen외 다수, Immunogenetics 2002 Apr; 54 (1): 39-47; Renisio외 다수, Proteins 2002 Jun 1 ; 47 (4): 546-55; Desmyter외 다수, J. Biol. Chem. 2002 Jun 28; 277 (26): 23645-50; Ledeboer외 다수, J. Dairy Sci. 2002 Jun; 85 (6): 1376-82; De Genst외 다수, J. Biol. Chem. 2002 Aug 16; 277 (33): 29897-907; Ferrat외 다수, Biochem. J. 2002 Sep 1; 366 (Pt 2): 415-22; Thomassen외 다수, Enzyme and Microbial Technol. 2002; 30: 273-8; Harmsen외 다수, Appl. Microbiol. Biotechnol. 2002 Dec; 60 (4): 449-54; Jobling외 다수, Nat Biotechnol. 2003 Jan; 21 (1): 77-80; Conrath외 다수, Dev. Comp. Immunol. 2003 Feb; 27 (2): 87-103; Pleschberger외 다수, Bioconjug. Chem. 2003 Mar-Apr; 14 (2): 440-8; Lah외 다수, J. Biol. Chem. 2003 Apr 18; 278 (16): 14101-11; Nguyen외 다수, Immunology. 2003 May; 109 (1): 93-101; Joosten외 다수, Microb. Cell Fact. 2003 Jan 30; 2 (1): 1; Li외 다수, Proteins 2003 Jul 1; 52 (1): 47-50; Loris외 다수, Biol Chem. 2003 Jul 25; 278 (30): 28252-7; van Koningsbruggen외 다수, J. Immunol. Methods. 2003 Aug; 279 (1-2): 149-61; Dumoulin외 다수, Nature. 2003 Aug 14; 424 (6950): 783-8; Bond외 다수, J. Mol. Biol. 2003 Sep 19; 332 (3): 643-55; Yau외 다수, J. Immunol. Methods. 2003 Oct 1; 281 (1-2): 161-75; Dekker외 다수, J. Virol. 2003 Nov; 77 (22): 12132-9; Meddeb-Mouelhi외 다수, Toxicon. 2003 Dec; 42 (7): 785-91; Verheesen외 다수, Biochim. Biophys. Acta 2003 Dec 5; 1624 (1-3): 21-8; Zhang외 다수, J Mol Biol. 2004 Jan 2; 335 (1): 49-56; Stijlemans외 다수, J Biol Chem. 2004 Jan 9; 279 (2): 1256-61; Cortez-Retamozo외 다수, Cancer Res. 2004 Apr 15; 64 (8): 2853-7; Spinelli외 다수, FEBS Lett. 2004 Apr 23; 564 (1-2): 35-40; Pleschberger외 다수, Bioconjug. Chem. 2004 May-Jun; 15 (3): 664-71; Nicaise외 다수, Protein Sci. 2004 Jul; 13 (7): 1882-91; Omidfar외 다수, Tumour Biol. 2004 Jul-Aug; 25 (4): 179-87; Omidfar외 다수, Tumour Biol. 2004 Sep-Dec; 25(5-6): 296-305; Szynol외 다수, Antimicrob Agents Chemother. 2004 Sep;48(9):3390-5; Saerens외 다수, J. Biol. Chem. 2004 Dec 10; 279 (50): 51965-72; De Genst외 다수, J. Biol. Chem. 2004 Dec 17; 279 (51): 53593-601; Dolk외 다수, Appl. Environ. Microbiol. 2005 Jan; 71(1): 442-50; Joosten외 다수, Appl Microbiol Biotechnol. 2005 Jan; 66(4): 384-92; Dumoulin외 다수, J. Mol. Biol. 2005 Feb 25; 346 (3): 773-88; Yau외 다수, J Immunol Methods. 2005 Feb; 297 (1-2): 213-24; De Genst외 다수, J. Biol. Chem. 2005 Apr 8; 280 (14): 14114-21; Huang외 다수, Eur. J. Hum. Genet. 2005 Apr 13; Dolk외 다수, Proteins. 2005 May 15; 59 (3): 555-64; Bond외 다수, J. Mol. Biol. 2005 May 6;348(3):699-709; Zarebski외 다수, J. Mol. Biol. 2005 Apr 21 ; [인쇄 전 E-공개].
전술한 바와 같이, 본 발명은 일반적으로 vWF에 대해 생성된 나노바디와, 이러한 나노바디 중 하나 이상을 포함하거나 또는 본질적으로 이것으로 이루어져 있는 폴리펩티드에 관한 것으로서, 이들 나노바디 및 폴리펩티드는 이하 및 WO 04/062551에 개시된 바와 같이 예방용, 치료용 및/또는 진단용으로서 사용될 수 있다.
뿐만 아니라, 상기 및 이하에 기술된 바와 같이, 본 발명은 또한 이러한 나노바디 및 폴리펩티드를 암호화하는 핵산, 이러한 나노바디 및 폴리펩티드를 제조하는 방법, 이러한 나노바디 또는 폴리펩티드를 발현하거나 발현할 수 있는 숙주 세포, 이러한 나노바디, 폴리펩티드, 핵산 또는 숙주 세포의 용도, 그리고 이러한 나노바디, 폴리펩티드, 핵산 또는 숙주 세포를 포함하는 조성물에 관한 것이기도 하다.
일반적으로, 본원에 최광의로 사용된 나노바디란 용어는, 특정 생물학적 공급원이나 특정 제조 방법에 한정되는 것은 아니라는 사실에 주목해야 할 것이다. 예를 들어, 이하에 더욱 상세히 기술되어 있는 바와 같이, 본 발명의 나노바디는 (1) 천연 생성 중쇄 항체의 VHH 도메인을 분리하고; (2) 천연 생성 VHH 도메인을 암호화하는 뉴클레오티드 서열을 발현시키며; (3) 천연 생성 VHH 도메인을 "인간화"(이하에 기술된 바와 같음)시키거나 또는 이러한 인간화된 VHH 도메인을 암호화하는 핵산을 발현시키고; (4) 천연 생성 VH 도메인을 임의의 동물 종, 구체적으로 포유동물 종 예를 들어, 인간으로부터 "카멜화"(이하에 기술함)시키거나, 이와 같이 카멜화된 VH 도메인을 암호화하는 핵산을 발현시키며; (5) 문헌[Ward외 다수(상동)]에 기술된 바와 같이 "도메인 항체" 또는 "Dab"을 카멜화시키거나, 이와 같이 카멜화된 VH 도메인을 암호화하는 핵산을 발현시키고; (6) 단백질, 폴리펩티드 또는 기타 아미노산 서열을 합성 또는 반 합성하는 기술을 이용하며; (7) 핵산 합성 기술을 이용하여 나노바디를 암호화하는 핵산을 제조한 다음, 얻어진 핵산을 발현시키고/발현시키거나; (8) 이러한 기술들을 임의로 조합하여 사용함으로써 제조될 수 있다. 전술한 바를 수행하는데 적당한 방법 및 기술들은 본원에 개시된 바를 바탕으로 하여 당 업자에게 명백할 것이며, 예를 들어, 이하 본원에 더욱 상세히 기술되어 있는 방법 및 기술들을 포함할 것이다.
그러나, 특정 구체예에 따르면, 본 발명의 나노바디는 천연 생성 VH 도메인의 아미노산 서열 예를 들어, 포유동물, 특히 인간으로부터 유래하는 천연 생성 VH 도메인의 아미노산 서열과 정확하게 일치하는(즉, 서열 동일성 정도가 100%인) 아미노산 서열을 가지지 않는다.
본 발명의 나노바디의 특히 바람직한 하나의 군은 천연 생성 VHH 도메인의 아미노산 서열과 상응하지만, 즉, 상기 천연 생성 VHH 서열의 아미노산 서열 내 하나 이상의 아미노산 잔기를 인간으로부터 유래하는 종래의 4-사슬 항체로부터 유래하는 VH 도메인 내 상응하는 위치(들)에 존재하는 하나 이상의 아미노산 잔기에 의해 치환함으로써(예를 들어, 전술한 바와 같음) "인간화된" 아미노산을 가지는 나노바디를 포함한다. 이러한 과정은 당 업자에게 널리 공지된 방식으로 수행될 수 있는데, 예를 들어, 본원에 언급된 인간화에 관한 선행 기술 및 이하 추가로 기술된 바를 바탕으로 하여 수행될 수 있다. 뿐만 아니라, 본 발명의 이와 같이 인간화된 나노바디는 당 업계에 공지된 임의의 적당한 방식으로[즉, 상기 (1)∼(8)에 기술된 바와 같이] 얻어질 수 있으므로, 출발 물질로서는 천연 생성 VHH 도메인을 포함하는 폴리펩티드로 사용하여 얻어진 폴리펩티드에 엄격하게 한정되는 것은 아니다.
본 발명의 나노바디의 특히 바람직한 기타 군은 즉, 상기 종래의 4-사슬 항체로부터 유래하는 천연 생성 VH 도메인의 아미노산 서열 내 하나 이상의 아미노산 잔기를 중쇄 항체의 VHH 도메인 내 상응하는 위치(들)에 존재하는 아미노산 잔기들 중 하나 이상에 의해 치환함으로써 "카멜화된" 천연 생성 VH 도메인의 아미노산 서열에 상응하는 아미노산 서열을 가지는 나노바디를 포함한다. 이러한 과정은 당 업자에게 널리 공지된 방식으로 수행될 수 있는데, 예를 들어, 이하 추가로 기술된 바를 바탕으로 하여 수행될 수 있다. 참고 문헌으로서는 WO 94/04678이 있다. 이러한 카멜화는 우선적으로 이하에 기술되어 있는 바와 같이, VH-VL 계면과 소위 카멜리드 인증 잔기(camelidae hallmark residue)(예를 들어, WO 94/04678 참조)에 존재하는 아미노산 위치에서 일어날 수 있다. 바람직하게, 카멜화된 나노바디를 생산하거나 디자인하기 위해 출발 물질 또는 출발 지점으로서 사용되는 VH 도메인 또는 서열로서는 바람직하게는 포유동물로부터 유래하는 VH 서열, 더욱 바람직하게는 인간의 VH 서열이 있다. 그러나, 이와 같이 카멜화된 본 발명의 나노바디는 당 업계에 공지된 임의의 적당한 방식으로[즉, 상기 (1)∼(8)에 기술된 바와 같이] 얻어질 수 있으므로, 출발 물질로서는 천연 생성 VH 도메인을 포함하는 폴리펩티드를 사용하여 얻어진 폴리펩티드로 엄격하게 한정되는 것은 아니다.
예를 들어, 이하에 더욱 상세히 기술되어 있는 바와 같이, "인간화" 및 "카멜화"는 둘 다 천연 생성 VHH 도메인 또는 VH 도메인을 각각 암호화하는 뉴클레오티드 서열을 제공한 후, 공지된 방식으로 상기 뉴클레오티드 서열 내 하나 이상의 코돈을 변이시켜 새로운 뉴클레오티드 서열이 본 발명의 인간화 또는 카멜화 나노바디를 각각 암호화하도록 만든 후, 당 업계에 공지된 방식으로 얻어진 뉴클레오티드 서열을 발현시켜 본 발명의 원하는 나노바디를 제공함으로써 수행될 수 있다. 대안적으로, 천연 생성 VHH 도메인 또는 VH 도메인 각각의 아미노산 서열을 바탕으로 하여, 본 발명의 원하는 인간화 나노바디 또는 카멜화 나노바디의 아미노산 서열은 각각 디자인되어, 당 업계에 공지되어 있는 펩티드 합성 기술을 이용하여 실험실 내에서 합성될 수 있다. 또한, 천연 생성 VHH 도메인 또는 VH 도메인 각각의 아미노산 서열 또는 뉴클레오티드 서열을 바탕으로 하여, 본 발명의 원하는 인간화 또는 카멜화 나노바디를 암호화하는 뉴클레오티드 서열은 각각 디자인되어, 당 업계에 공지되어 있는 핵산 합성 기술을 이용하여 실험실 내에서 합성될 수 있으며, 이후, 이와 같이 얻어진 뉴클레오티드 서열은 당 업계에 공지된 방식으로 발현되어 본 발명의 원하는 나노바디를 제공할 수 있다.
본 발명의 나노바디 및/또는 이를 암호화하는 뉴클레오티드 서열 및/또는 핵산을 얻기 위한 기타 적당한 방법 및 기술 즉, 천연 생성 VH 도메인 또는 바람직하게는 VHH 도메인(의 아미노산 서열)을 출발 물질로 하고/하거나, 본 발명의 나노바디를 암호화하는 뉴클레오티드 서열 및/또는 핵산 서열을 출발 물질로 하는 방법 및 기술은 당 업자에게 명백할 것이며, 이와 같은 방법 및 기술은, 예를 들어, 본 발명의 나노바디(를 암호화하는 뉴클레오티드 서열 또는 핵산)를 제공하기에 적당한 방식으로, 천연 생성 VH 도메인으로부터 유래하는 하나 이상의 아미노산 서열 및/또는 뉴클레오티드 서열(예를 들어, 하나 이상의 FR 및/또는 CDR의 아미노산 서열 및/또는 뉴클레오티드 서열)을, 천연 생성 VHH 도메인으로부터 유래하는 하나 이상의 아미노산 서열 및/또는 뉴클레오티드 서열(예를 들어, 하나 이상의 FR 또는 CDR의 아미노산 서열 및/또는 뉴클레오티드 서열)과 결합시키는 과정을 포함할 수 있다.
본 발명의 하나의 바람직한 비 제한적 측면에 따르면, 최광의로 사용된 나노바디는 일반적으로 다음의 서열들을 포함하는 폴리펩티드로서 정의될 수 있다:
a) 3개의 상보성 결정 부위/서열이 중간에 삽입된, 4개의 틀 부위/서열로 이루어진 아미노산 서열로서, 캐벗 번호 메김 방식에 따른 108번 위치에 존재하는 아미노산 잔기가 Q인 아미노산 서열; 및/또는
b) 3개의 상보성 결정 부위/서열이 중간에 삽입된, 4개의 틀 부위/서열로 이루어진 아미노산 서열로서, 캐벗 번호 메김 방식에 따른 44번 위치에 존재하는 아미노산 잔기가 E이고, 캐벗 번호 메김 방식에 따른 45번 위치에 존재하는 아미노산 잔기가 R인 아미노산 서열; 및/또는
c) 3개의 상보성 결정 부위/서열이 중간에 삽입된, 4개의 틀 부위/서열로 이루어진 아미노산 서열로서, 캐벗 번호 메김 방식에 따른 103번 위치에 존재하는 아미노산 잔기는 P, R 및 S로 이루어진 군으로부터 선택되고, 특히 R 및 S로 이루어진 군으로부터 선택되는 아미노산 서열.
그러므로, 제1의 바람직한 비 제한적 측면에 있어서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다.
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q이고/이거나;
ii) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 E이고, 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 R이고/이거나;
iii) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 P, R 및 S로 이루어진 군으로부터 선택되고, 특히 R 및 S로 이루어진 군으로부터 선택되고/선택되거나;
iv) CDR1은
NYGMG (서열 번호 15)
SYTLG (서열 번호 16)
NYNMG (서열 번호 17)
SSAMA (서열 번호 18)
YYNTG (서열 번호 19)
IGAMG (서열 번호 20)
IGTMG (서열 번호 21)
YNPMG (서열 번호 22)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이며;
v) CDR2는
SISWSGTYTAYSDNVKG (서열 번호 23)
GISWSGVSTDYAEFAKG (서열 번호 24)
TSISWSGSYTAYADNVKG (서열 번호 25)
SISWSGMSTYYTDSVKG (서열 번호 26)
TITSGGRTSYADSVKG (서열 번호 27)
AISWSGGLTYYADSVKG (서열 번호 28)
TITSGGSTNYADPVKG (서열 번호 29)
TITSGGSTNYADSVKG (서열 번호 30)
AISRTGGSTYYARSVEG (서열 번호 31)
AISRTGGSTYYPDSVEG (서열 번호 32)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열들 중 어느 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로 이루어진 군으로부터 선택되는 아미노산 서열이며; 또한
(vi) CDR3는
QSRYRSNYYDHDDKYAY (서열 번호 33)
LGRYRSNWRNIGQYDY (서열 번호 34)
QSRYSSNYYDHDDKYAY (서열 번호 35)
SNRYRTHTTQAMYNY (서열 번호 36)
VVDGKRAP (서열 번호 37)
NRRQKTVQMGERAYDY (서열 번호 38)
NLKQGSYGYRFNDY (서열 번호 39)
NLKQGDYGYRFNDY (서열 번호 40)
AGVRAEDGRVRTLPSEYNF (서열 번호 41)
AGVRAEDGRVRTLPSEYTF (서열 번호 42)
AGVRAEDGRVRSLPSEYTF (서열 번호 43)
로 이루어진 군;
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이다.
바람직하게, 본 발명의 나노바디에 있어서:
- CDR1이 (1) NYGMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) SISWSGTYTAYSDNVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) QSRYRSNYYDHDDKYAY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) SYTLG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) GISWSGVSTDYAEFAKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) LGRYRSNWRNIGQYDY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) NYGMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) TSISWSGSYTAYADNVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) QSRYSSNYYDHDDKYAY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) NYNMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) SISWSGMSTYYTDSVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) SNRYRTHTTQAMYNY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) SSAMA; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) TITSGGRTSYADSVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) VVDGKRAP; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) YYNTG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) AISWSGGLTYYADSVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) NRRQKTVQMGERAYDY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) IGAMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) TITSGGSTNYADPVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) NLKQGSYGYRFNDY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) IGAMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) TITSGGSTNYADSVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) NLKQGSYGYRFNDY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) IGAMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) TITSGGSTNYADSVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) NLKQGDYGYRFNDY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) IGTMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) TITSGGSTNYADSVKG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) NLKQGDYGYRFNDY; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) YNPMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) AISRTGGSTYYARSVEG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) AGVRAEDGRVRTLPSEYNF; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) YNPMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) AISRTGGSTYYPDSVEG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) AGVRAEDGRVRTLPSEYTF; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
- CDR1이 (1) YNPMG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되면; CDR2는 (1) AISRTGGSTYYPDSVEG; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고; CDR3은 (1) AGVRAEDGRVRSLPSEYNF; (2) 이 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 및 (3) 상기 아미노산 서열과 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군으로부터 선택되고;
여기서, (1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열이다.
특히, 본 발명에 의한, vWF에 대한 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q이고/이거나;
ii) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 E이고, 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 R이고/이거나;
iii) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 P, R 및 S로 이루어진 군으로부터 선택되고, 특히 R 및 S로 이루어진 군으로부터 선택되거나;
iv) CDR1은 다음과 같은 아미노산 서열들 즉,
NYGMG (서열 번호 15)
SYTLG (서열 번호 16)
NYNMG (서열 번호 17)
SSAMA (서열 번호 18)
YYNTG (서열 번호 19)
IGAMG (서열 번호 20)
IGTMG (서열 번호 21)
YNPMG (서열 번호 22)
로 이루어진 군으로부터 선택되는 아미노산 서열이며;
v) CDR2는 다음과 같은 아미노산 서열들 즉,
SISWSGTYTAYSDNVKG (서열 번호 23)
GISWSGVSTDYAEFAKG (서열 번호 24)
TSISWSGSYTAYADNVKG (서열 번호 25)
SISWSGMSTYYTDSVKG (서열 번호 26)
TITSGGRTSYADSVKG (서열 번호 27)
AISWSGGLTYYADSVKG (서열 번호 28)
TITSGGSTNYADPVKG (서열 번호 29)
TITSGGSTNYADSVKG (서열 번호 30)
AISRTGGSTYYARSVEG (서열 번호 31)
AISRTGGSTYYPDSVEG (서열 번호 32)
로 이루어진 군으로부터 선택되는 아미노산 서열이며;
또한
(vi) CDR3는 다음과 같은 아미노산 서열들 즉,
QSRYRSNYYDHDDKYAY (서열 번호 33)
LGRYRSNWRNIGQYDY (서열 번호 34)
QSRYSSNYYDHDDKYAY (서열 번호 35)
SNRYRTHTTQAMYNY (서열 번호 36)
VVDGKRAP (서열 번호 37)
NRRQKTVQMGERAYDY (서열 번호 38)
NLKQGSYGYRFNDY (서열 번호 39)
NLKQGDYGYRFNDY (서열 번호 40)
AGVRAEDGRVRTLPSEYNF (서열 번호 41)
AGVRAEDGRVRTLPSEYTF (서열 번호 42)
AGVRAEDGRVRSLPSEYTF (서열 번호 43)
로 이루어진 군으로부터 선택되는 아미노산 서열이다.
바람직하게, 후자의 측면에 따른 본 발명의 나노바디에 있어서:
- CDR1이 NYGMG이면; CDR2는 SISWSGTYTAYSDNVKG이고; CDR3은 QSRYRSNYYDHDDKYAY이며;
- CDR1이 SYTLG이면; CDR2는 GISWSGVSTDYAEFAKG이고; CDR3은 LGRYRSNWRNIGQYDY이며;
- CDR1이 NYGMG이면; CDR2는 TSISWSGSYTAYADNVKG이고; CDR3은 QSRYSSNYYDHDDKYAY이며;
- CDR1이 NYNMG이면; CDR2는 SISWSGMSTYYTDSVKG이고; CDR3은 SNRYRTHTTQAMYNY이며;
- CDR1이 SSAMA이면; CDR2는 TITSGGRTSYADSVKG이고; CDR3은 VVDGKRAP이며;
- CDR1이 YYNTG이면; CDR2은 AISWSGGLTYYADSVKG이고; CDR3은 NRRQKTVQMGERAYDY이며;
- CDR1이 IGAMG이면; CDR2는 TITSGGSTNYADPVKG이고; CDR3는 NLKQGSYGYRFNDY이며;
- CDR1이 IGAMG이면; CDR2는 TITSGGSTNYADSVKG이고; CDR3은 NLKQGSYGYRFNDY이며;
- CDR1이 IGAMG이면; CDR2는 TITSGGSTNYADSVKG이고; CDR3은 NLKQGDYGYRFNDY이며;
- CDR1이 IGTMG이면; CDR2는 TITSGGSTNYADSVKG이고; CDR3는 NLKQGDYGYRFNDY이며;
- CDR1이 YNPMG이면; CDR2는 AISRTGGSTYYARSVEG이고; CDR3은 AGVRAEDGRVRTLPSEYNF이며;
- CDR1이 YNPMG이면; CDR2는 AISRTGGSTYYPDSVEG이고; CDR3은 AGVRAEDGRVRTLPSEYTF이며;
- CDR1이 YNPMG이면; CDR2는 AISRTGGSTYYPDSVEG이고; CDR3은 AGVRAEDGRVRSLPSEYTF이다.
특히, 본 발명의 하나의 바람직한 비 제한적 측면에 따르면, 나노바디는 3개의 상보성 결정 부위/서열이 중간에 삽입된, 4개의 틀 부위/서열로 이루어진 아미노산 서열을 포함하는 폴리펩티드로서 정의될 수 있으며, 여기서;
a-1) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 G, E, D, G, Q, R, S, L로 이루어진 군으로부터 선택되며; 바람직하게는 G, E 또는 Q로 이루어진 군으로부터 선택되고; 또한
a-2) 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 L, R 또는 C로 이루어진 군으로부터 선택되며; 바람직하게는 L 또는 R로 이루어진 군으로부터 선택되고; 또한
a-3) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 W, R 또는 S로 이루어진 군으로부터 선택되며; 바람직하게는 W 또는 R이고, 가장 바람직하게는 W이며; 또한
a-4) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q이거나; 또는
b-1) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 E 및 Q로 이루어진 군으로부터 선택되며; 또한
b-2) 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 R이고; 또한
b-3) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 W, R 및 S로 이루어진 군으로부터 선택되며; 바람직하게는 W이고;
b-4) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q 및 L로 이루어진 군으로부터 선택되고; 바람직하게는 Q이거나; 또는
c-1) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 G, E, D, Q, R, S 및 L로 이루어진 군으로부터 선택되며; 바람직하게는 G, E 및 Q로 이루어진 군으로부터 선택되고; 또한
c-2) 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 L, R 및 C로 이루어진 군으로부터 선택되며; 바람직하게는 L 및 R로 이루어진 군으로부터 선택되고; 또한
c-3) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 P, R 및 S, 로 이루어진 군으로부터 선택되며; 특히 R 및 S로 이루어진 군으로부터 선택되고; 또한
c-4) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q 및 L로 이루어진 군으로부터 선택되며; 바람직하게는 Q이다.
그러므로, 본 발명의 기타 바람직한 비 제한적 측면에 있어서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 G, E, D, G, Q, R, S, L로 이루어진 군으로부터 선택되며; 바람직하게는 G, E 또는 Q로 이루어진 군으로부터 선택되고;
ii) 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 L, R 또는 C로 이루어진 군으로부터 선택되며; 바람직하게는 L 또는 R로 이루어진 군으로부터 선택되고;
iii) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 W, R 또는 S로 이루어진 군으로부터 선택되며; 바람직하게는 W 또는 R이고, 가장 바람직하게는 W이며;
iv) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q이고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의된다.
다른 비 제한적인 바람직한 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 E 및 Q로 이루어진 군으로부터 선택되며;
ii) 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 R이고;
iii) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 W, R 및 S로 이루어진 군으로부터 선택되며; 바람직하게는 W이고;
iv) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q이고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의된다.
다른 비 제한적인 바람직한 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 44번 위치의 아미노산 잔기는 G, E, D, Q, R, S 및 L로 이루어진 군으로부터 선택되며; 바람직하게는 G, E 및 Q로 이루어진 군으로부터 선택되고;
ii) 캐벗 번호 메김 방식에 따른 45번 위치의 아미노산 잔기는 L, R 및 C로 이루어진 군으로부터 선택되며; 바람직하게는 L 및 R로 이루어진 군으로부터 선택되고;
iii) 캐벗 번호 메김 방식에 따른 103번 위치의 아미노산 잔기는 P, R 및 S로 이루어진 군으로부터 선택되며; 특히, R 및 S로 이루어진 군으로부터 선택되고;
iv) 캐벗 번호 메김 방식에 따른 108번 위치의 아미노산 잔기는 Q 및 L로 이루어진 군으로부터 선택되고, 바람직하게는 Q이며;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의된다.
본 발명의 나노바디에 관한 2개의 특히 바람직한 비 제한적 군으로서는 상기 a)에 따른 것들; 상기 a-1)∼a-4)에 따른 것들; 상기 b)에 따른 것들; 상기 b-1)∼b-4)에 따른 것들; 상기 c)에 따른 것들; 및/또는 상기 c-1)∼c-4)에 다른 것들이 있으며, 여기서,
a) 캐벗 번호 메김 방식에 따른 44∼47번 위치의 아미노산 잔기는 서열 GLEW(또는 본원에 정의된 바와 같은 GLEW-유사 서열)을 형성하고, 108번 위치의 아미노산 잔기는 Q이거나;
b) 캐벗 번호 메김 방식에 따른 43∼46번 위치의 아미노산 잔기는 서열 KERE 또는 KQRE(즉, KERE-유사 서열)을 형성하고, 108번 위치의 아미노산 잔기는 Q 또는 L이며, 바람직하게는 Q이다.
그러므로, 바람직한 기타 비 제한적 측면에 있어서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 44∼47번 위치의 아미노산 잔기는 서열 GLEW(또는 본원에 정의된 바와 같은 GLEW-유사 서열)을 형성하고, 108번 위치의 아미노산 잔기는 Q이며;
ii) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의된다.
다른 바람직한 비 제한적 측면에 있어서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 캐벗 번호 메김 방식에 따른 43∼46번 위치의 아미노산 잔기는 서열 KERE 또는 KQRE(즉, KERE-유사 서열)을 형성하고, 108번 위치의 아미노산 잔기는 Q 또는 L이고, 바람직하게는 Q이며;
ii) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의된다.
캐벗 번호 메김 방식에 따라서 43∼46번 위치에 존재하는 아미노산 잔기가 서열 KERE 또는 KQRE를 형성하는 본 발명의 나노바디에 있어서, 37번 위치의 아미노산 잔기는 가장 바람직하게는 F이다. 캐벗 번호 메김 방식에 따라서 44∼47번 위치에 존재하는 아미노산 잔기가 서열 GLEW를 형성하는 본 발명의 나노바디에 있어서, 37번 위치의 아미노산 잔기는 Y, H, I, V 또는 F로 이루어진 군으로부터 선택되며, 가장 바람직하게는 F이다.
그러므로, 어떠한 방식으로든 한정되지 않을 경우, 상기 언급한 위치에 존재하는 아미노산 잔기들을 바탕으로 하였을 때, 본 발명의 나노바디는 일반적으로 다음과 같은 3가지 군으로 분류될 수 있다:
a) "GLEW-군": 캐벗 번호 메김 방식에 따라서 44∼47번 위치에 아미노산 서열 GLEW이 존재하고, 캐벗 번호 메김 방식에 따라서 108번 위치에 Q가 존재하는 나노바디. 본원에 더욱 상세히 기술되어 있는 바와 같이, 이 군에 속하는 나노바디는 일반적으로 37번 위치에 V를 가지며, 103번 위치에는 W, P, R 또는 S를 가질 수 있고, 바람직하게 103번 위치에는 W를 가진다. 이 GLEW-군은 또한 몇몇 GLEW-유사 서열 예를 들어, 이하 표 2에 기재된 서열들을 포함한다;
b) "KERE-군": 캐벗 번호 메김 방식에 따라서 43∼46번 위치에 아미노산 서열 KERE 또는 KQRE가 존재하고, 캐벗 번호 메김 방식에 따라서 108번 위치에 Q 또는 L이 존재하는 나노바디. 본원에 더욱 상세히 기술되어 있는 바와 같이, 이 군에 속하는 나노바디는 일반적으로 37번 위치에 F를 가지고, 47번 위치에는 L 또는 F를 가지며; 103번 위치에는 W, P, R 또는 S를 가질 수 있고, 바람직하게는 103번 위치에 W를 가진다;
c) "103 P, R, S-군": 103번 위치에 P, R 또는 S를 가지는 나노바디. 이 나노바디는 캐벗 번호 메김 방식에 따라 44∼47번 위치에 아미노산 서열 GLEW를 가지거나 캐벗 번호 메김 방식에 따라 43∼46번 위치에 아미노산 서열 KERE 또는 KQRE를 가질 수 있으며, 아미노산 서열 KERE 또는 KQRE는 37번 위치에 F를, 그리고 47번 위치에 L 또는 F(KERE-군에 관하여 정의한 바와 같음)를 가지며; 캐벗 번호 메김 방식에 따라서 108번 위치에는 Q 또는 L을, 바람직하게는 Q를 가진다.
그러므로, 기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 GLEW-군(본원에 정의됨)에 속하는 나노바디일 수 있으며, 또한 이의 CDR1, CDR2 및 CDR3는 본원에 정의한 바와 같고, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의한 바와 같으며, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의한 바와 같다.
기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 KERE-군(본원에 정의됨)에 속하는 나노바디일 수 있으며, 또한 이의 CDR1, CDR2 및 CDR3는 본원에 정의한 바와 같고, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의한 바와 같으며, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의한 바와 같다.
그러므로, 기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 103 P, R, S-군(본원에 정의됨)에 속하는 나노바디일 수 있으며, 또한 이의 CDR1, CDR2 및 CDR3는 본원에 정의한 바와 같고, 바람직하게는 상기 바람직한 정의 중 하나에 따라서 정의한 바와 같으며, 더욱 바람직하게는 상기 더욱 바람직한 정의 중 하나에 따라서 정의한 바와 같다.
또한, 더욱 일반적으로, 그리고 상기 108Q, 43E/44R 및 103 P, R, S 잔기에 더하여, 본 발명의 나노바디는, 종래의 VH 도메인에 있어서 VH/VL 계면(의 일부분)을 형성하는 하나 이상의 위치에, 이것과 상응하는 천연 생성 VH 또는 VHH 도메인 내에 존재하는 동일한 위치에 천연 생성되는 아미노산 잔기보다 더 많이 하전되어 있는 하나 이상의 아미노산 잔기, 특히 하나 이상의 하전된 아미노산 잔기(표 1에 기재함)를 함유할 수 있다.
이러한 치환으로서는 이하 표 2에 기재된 GLEW-유사 서열과; 국제 출원 WO 00/29004(소위 "마이크로바디(microbody)"에 관함)에 개시된 치환 예를 들어, 108번 위치의 Q와 44∼47번 위치의 KLEW을 포함하나, 이에 한정되는 것은 아니다.
본 발명의 나노바디에 있어서, 83번 위치의 아미노산 잔기는 L, M, S, V 및 W로 이루어진 군으로부터 선택되고; 바람직하게는 L이다.
또한, 본 발명의 나노바디에 있어서, 83번 위치의 아미노산 잔기는 R, K, N, E, I 및 Q로 이루어진 군으로부터 선택되고; 가장 바람직하게는 K 또는 E(천연 생성 VHH 도메인에 상응하는 나노바디의 경우) 또는 R(이하에 기술된 바와 같이, "인간화된" 나노바디의 경우)이다. 84번 위치의 아미노산 잔기는 P, A, R, S, D 및 V로 이루어진 군으로부터 선택되고, 가장 바람직하게는 P(천연 생성 VHH 도메인에 상응하는 나노바디의 경우) 또는 R(이하에 기술된 바와 같이, "인간화된" 나노바디의 경우)이다.
뿐만 아니라, 본 발명의 나노바디에 있어서, 104번 위치의 아미노산 잔기는 G 및 D로 이루어진 군으로부터 선택되고; 가장 바람직하게는 G이다.
총체적으로, 11, 37, 44, 45, 47, 83, 84, 103, 104 및 108번 위치의 아미노산 잔기 즉, 상기 언급된 바와 같은 나노바디의 잔기는 또한 본원에서 "인증 잔기"(hallmark residue)라고 칭하여지기도 할 것이다. 가장 밀접하게 관련된 인간 VH 도메인, VH3의 상응하는 위치에서의 아미노산 잔기 및 인증 잔기를 표 2에 요약하였다.
천연 생성 VHH 도메인에 존재하는 인증 잔기의 특히 바람직한 몇몇 조합 군을 표 3에 기재하였다. 비교를 위하여, 인간 VH3의 상응하는 아미노산 잔기(DP-47)는 이탤릭체로 나타내었다.
주:
상기 표 2에 있어서,
(1): 특히(반드시 그러한 것은 아니지만), 43∼46번 위치의 KERE 또는 KQRE도 올 수 있음.
(2): 일반적으로 44∼47번 위치의 GLEW.
(3): 일반적으로 43∼46번 위치의 KERE 또는 KQRE 예를 들어, 43∼47번 위치의 KEREL, KEREF, KQREL, KQREF 또는 KEREG. 대안적으로, 서열 예를 들어, TERE(예를 들어, TEREL), KECE(예를 들어, KECEL 또는 KECER), RERE(예를 들어, REREG), QERE(예를 들어, QEREG), KGRE(예를 들어, KGREG), KDRE(예를 들어, KDREV)도 가능함. 기타의 가능한(그러나, 선호도가 떨어지는) 몇몇 서열로서는 예를 들어, DECKL 및 NVCEL을 포함함.
(4): 44∼47번 위치의 GLEW 및 43∼46번 위치의 KERE 또는 KQRE.
(5): 종종, 천연 생성 VHH 도메인의 83∼84번 위치의 KP 또는 EP.
(6): 특히(반드시 그러한 것은 아니지만), 44∼47번 위치의 GLEW도 올 수 있음.
(7): 다만, 44∼47번 위치가 GLEW일 때, 108번 위치는 항상 Q임.
(8): GLEW-군은 또한 44∼47번 위치에 GLEW-유사 서열 예를 들어, GVEW, EPEW, GLER, DQEW, DLEW, GIEW, ELEW, GPEW, EWLP, GPER, GLER 및 ELEW를 포함함.
나노바디에 있어서, 인증 잔기 이외에 임의의 위치에 존재하는 각각의 아미노산 잔기는 천연 생성 VHH 도메인의 상응하는 위치(캐벗 번호 메김 방식에 따름)에 존재하는 임의의 천연 생성 아미노산 잔기일 수 있다.
이러한 아미노산 잔기는 당 업자들도 명백히 알고 있을 것이다. 표 4∼7에는, 천연 생성 VHH 도메인의 FR1, FR2, FR3 및 FR4의 각 위치(캐벗 번호 메김 방식에 따른 위치)에 존재할 수 있는 몇몇 비 제한적인 잔기에 관하여 기재되어 있다. 각각의 위치에 있어서, 천연 생성 VHH 도메인의 각 위치에 가장 많이 출현하는 아미노산 잔기(나노바디의 상기 위치에 올 수 있는 가장 바람직한 아미노산 잔기)는 굵은 글씨로 표시하였으며; 각 위치에 대한 기타 바람직한 아미노산 잔기에는 밑줄을 그어 표시하였다[주: 천연 생성 VHH 도메인의 26∼30번 위치에서 발견되는 아미노산 잔기의 번호는 이러한 위치에 존재하는 잔기들이 이미 CDR1의 일부분을 형성한다는 코티아(Cothia)(상동)의 번호 메김 방식의 근간을 이루는 가설의 밑받침이 되는 것이다].
표 4∼표 7에는, 인간 VH3 도메인의 각 위치에 존재할 수 있는 비 제한적인 몇몇 잔기들도 기재하였다. 뿐만 아니라, 각 위치에 있어서, 천연 생성 인간 VH3 도메인의 각 위치에 가장 빈번히 출현하는 아미노산 잔기는 굵은 글씨로 표시하였으며; 기타 바람직한 아미노산 잔기에는 밑줄을 그어 표시하였다.
그러므로, 기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) 인증 잔기는 본원에 정의한 바와 같고;
ii) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의들 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의들 중 하나에 따라서 정의된다.
기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) FR1은 다음과 같은 아미노산 서열로 이루어진 군;
[1] QVQLQESGGG X VQAGGSLRLSCAASG [26] (서열 번호 1)
또는 상기 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]
으로부터 선택되고;
ii) FR2는 다음과 같은 아미노산 서열로 이루어진 군;
[36] W X RQAPGK XX E X VA [49] (서열 번호 2)
또는 상기 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]
으로부터 선택되며;
iii) FR3은 다음과 같은 아미노산 서열로 이루어진 군;
[66] RFTISRDNAKNTVYLQMNSL XX EDTAVYYCAA [94] (서열 번호 3)
또는 상기 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]
으로부터 선택되며;
iv) FR4는 다음과 같은 아미노산 서열로 이루어진 군;
[103] XX QGT X VTVSS [113] (서열 번호 4)
또는 상기 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않음]
으로부터 선택되고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의들 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의들 중 하나에 따라서 정의되며;
여기서, 인증 잔기는 " X "로 표시하였고, 이에 관하여는 상기 정의하였으며, [] 사이의 번호는 캐벗 번호 메김 방식에 따른 아미노산 위치를 나타내는 것이다.
기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) FR1은 다음과 같은 아미노산 서열로 이루어진 군;
[1] QVQLQESGGG L VQAGGSLRLSCAASG [26] (서열 번호 5)
또는 상기 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며
(3) 특정 위치에 있는 인증 잔기는 상기 서열에 표시된 바와 같음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 바람직하게는 아미노산 치환만을 함유하고, 상기 아미노산 서열(들)에 비하여, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 특정 위치에 있는 인증 잔기는 상기 서열에 표시된 바와 같음]
으로부터 선택되고;
ii) FR2는 다음과 같은 아미노산 서열들로 이루어진 군;
[36] W F RQAPGK ER E L VA [49] (서열 번호 6)
[36] W F RQAPGK ER E F VA [49] (서열 번호 7)
[36] W F RQAPGK ER E G A [49] (서열 번호 8)
[36] W F RQAPGK QR E L VA [49] (서열 번호 9)
[36] W F RQAPGK QR E F VA [49] (서열 번호 10)
[36] W Y RQAPGK GL E W A [49] (서열 번호 11)
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 37, 44, 45 및 47번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 37, 44, 45 및 47번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되며;
iii) FR3은 다음과 같은 아미노산 서열로 이루어진 군;
[66] RFTISRDNAKNTVYLQMNSL KP EDTAVYYCAA [94] (서열 번호 12)
또는 상기 아미노산 서열과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 83 및 84번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 83 및 84번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되며;
iv) FR4는 다음과 같은 아미노산 서열들로 이루어진 군;
[103] WG QGT Q VTVSS [113] (서열 번호 13)
[103] WG QGT L VTVSS [113] (서열 번호 14)
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 103, 104 및 108번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]; 및/또는
상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 103, 104 및 108번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의들 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의들 중 하나에 따라서 정의된다.
기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) FR1은 다음과 같은 아미노산 서열로 이루어진 군;
[1] QVQLQESGGG L VQAGGSLRLSCAASG [26] (서열 번호 5)
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며
(3) 특정 위치에 있는 인증 잔기는 상기 서열에 표시된 바와 같음]으로부터 선택되고;
ii) FR2는 다음과 같은 아미노산 서열들로 이루어진 군;
[36] W F RQAPGK ER E L VA [49] (서열 번호 6)
[36] W F RQAPGK ER E F VA [49] (서열 번호 7)
[36] W F RQAPGK ER E G A [49] (서열 번호 8)
[36] W F RQAPGK QR E L VA [49] (서열 번호 9)
[36] W F RQAPGK QR E F VA [49] (서열 번호 10)
및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 37, 44, 45 및 47번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되며;
iii) FR3은 다음과 같은 아미노산 서열로 이루어진 군;
[66] RFTISRDNAKNTVYLQMNSL KP EDTAVYYCAA [94] (서열 번호 12)
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 83 및 84번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되며;
iv) FR4는 다음과 같은 아미노산 서열들로 이루어진 군;
[103] WG QGT Q VTVSS [113] (서열 번호 13)
[103] WG QGT L VTVSS [113] (서열 번호 14)
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 7에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 103, 104 및 108번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의들 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의들 중 하나에 따라서 정의된다.
기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) FR1은 다음과 같은 아미노산 서열로 이루어진 군;
[1] QVQLQESGGG L VQAGGSLRLSCAASG [26] (서열 번호 5)
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며
(3) 특정 위치에 있는 인증 잔기는 상기 서열에 표시된 바와 같음]으로부터 선택되고;
ii) FR2는 다음과 같은 아미노산 서열로 이루어진 군;
[36] W Y RQAPGK GL E W A [49] (서열 번호 11)
및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 37, 44, 45 및 47번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되며;
iii) FR3은 다음과 같은 아미노산 서열로 이루어진 군;
[66] RFTISRDNAKNTVYLQMNSL KP EDTAVYYCAA [94] (서열 번호 12)
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 83 및 84번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되며;
iv) FR4는 다음과 같은 아미노산 서열로 이루어진 군;
[103] WG QGT Q VTVSS [113] (서열 번호 13)
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 7에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 103, 104 및 108번 위치에 있는 인증 잔기는 상기 각각의 서열에 표시된 바와 같음]
으로부터 선택되고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의들 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의들 중 하나에 따라서 정의된다.
기타 바람직한 비 제한적 측면에서, 본 발명의 나노바디는 다음과 같은 구조를 가질 수 있다:
FR1
-
CDR1
-
FR2
-
CDR2
-
FR3
-
CDR3
-
FR4
여기서, FR1∼FR4는 각각 틀 부위 1∼4를 의미하는 것이고, CDR1∼CDR3은 각각 상보성 결정 부위 1∼3을 의미하는 것이며,
i) FR1은 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디에 존재하는 FR1 서열들로 이루어진 군, 또는
상기 FR1 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR1 서열에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며
(3) 특정 위치에 있는 인증 잔기는 상기 FR1 서열에 표시된 바와 같음]; 및/또는
상기 FR1 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 4a 및 4b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR1 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 특정 위치에 있는 인증 잔기는 상기 FR1 서열에 표시된 바와 같음]
으로부터 선택되고;
ii) FR2는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디에 존재하는 FR2 서열로 이루어진 군,
또는 상기 FR2 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR2 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 37, 44, 45 및 47번 위치에 있는 인증 잔기는 상기 FR2 서열에 표시된 바와 같음]; 및/또는
상기 FR2 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 5에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR2 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 37, 44, 45 및 47번 위치에 있는 인증 잔기는 상기 FR2 서열에 표시된 바와 같음]
으로부터 선택되며;
iii) FR3은 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디에 존재하는 FR3 서열로 이루어진 군,
또는 상기 FR3 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR3 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 83번 및 84번 위치에 있는 인증 잔기는 상기 FR3 서열에 표시된 바와 같음]; 및/또는
상기 FR3 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR3 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 83 및 84번 위치에 있는 인증 잔기는 상기 FR3 서열에 표시된 바와 같음]
으로부터 선택되며;
iv) FR4는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디에 존재하는 FR4 서열로 이루어진 군
또는 상기 FR4 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR4 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 103, 104 및 108번 위치에 있는 인증 잔기는 상기 FR3 서열에 표시된 바와 같음]; 및/또는
상기 FR4 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 인증 위치 이외의 임의의 위치에서 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨) 및/또는 표 6a 및 6b에 정의된 바와 같은 아미노산 치환이고/치환이거나;
(2) 상기 아미노산 서열은 상기 FR4 서열에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입을 함유하지는 않으며;
(3) 103, 104 및 108번 위치에 있는 인증 잔기는 상기 FR4 서열에 표시된 바와 같음]
으로부터 선택되고;
v) CDR1, CDR2 및 CDR3은 본원에 정의된 바와 같으며, 바람직하게는 상기 바람직한 정의들 중 하나에 따라서 정의되고, 더욱 바람직하게는 상기 더욱 바람직한 정의들 중 하나에 따라서 정의된다.
특히 바람직한 본 발명의 몇몇 나노바디는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 아미노산 서열, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디 내 아미노산 서열로 이루어진 군, 또는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97(바람직하게는, 서열 번호 86∼서열 번호 97)의 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군으로부터 선택될 수 있으며, 여기서,
(1) 인증 잔기는 상기 표 2에 제시한 바와 같을 수 있고;
(2) 인증 위치 이외의 임의의 위치에 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의된 바와 같음) 및/또는 표 4∼7에 제시된 아미노산 치환이고/이거나;
(3) 상기 아미노산 서열은 상기 아미노산 서열(들)에 비하여 바람직하게는 아미노산 치환만을 함유하고, 아미노산 치환 또는 삽입을 함유하지는 않는다.
특히 바람직한 본 발명의 몇몇 나노바디는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 아미노산 서열, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디 내 아미노산 서열로 이루어진 군, 또는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97(바람직하게, 서열 번호 86∼서열 번호 97)의 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군으로부터 선택될 수 있으며, 여기서,
(1) 인증 잔기는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97(바람직하게는, 서열 번호 86∼서열 번호 97)로부터 선택되는 적당한 서열에 제시한 바와 같고;
(2) 인증 위치 이외의 임의의 위치에 일어난 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의된 바와 같음) 및/또는 표 4∼7에 제시된 아미노산 치환이고/이거나;
(3) 상기 아미노산 서열은 바람직하게는 상기 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97(바람직하게, 서열 번호 86∼서열 번호 97)로부터 선택되는 적당한 서열에 비하여 아미노산 치환만을 함유하고, 아미노산 결실 또는 삽입은 함유하지 않는다.
가장 바람직한 본 발명의 몇몇 나노바디는 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 아미노산 서열로 이루어진 군, 특히 서열 번호 86∼서열 번호 97의 인간화된 나노바디로부터 선택될 수 있다.
전술한 바로부터 명백히 알 수 있는 바와 같이, 본원에 사용된 본 발명의 나노바디란 용어는 최광의로 사용된 것으로서, 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97에 제시된 나노바디의 천연 또는 합성 돌연 변이체, 변이체, 대립 형질체, 유사체 및 오르토로그(ortholog)(이하, 본원에서는 총칭하여 "유사체"라 함)를 포함하기도 한다.
일반적으로, 이러한 유사체는 예를 들어, 나노바디의 상동성 서열, 기능성 부분 또는 이 상동성 서열의 기능성 부분(이하 추가로 정의함)을 포함할 수 있다. 일반적으로, 이와 같은 유사체에 있어서, 각각의 틀 부위에 존재하는 아미노산 잔기(인증 잔기 이외의 잔기)는 각각 기타 임의의 아미노산 잔기에 의해 치환될 수 있으며, 단, 틀 부위의 전체 서열 동일성 정도는 본원에 정의한 바와 같다. 그러나, 바람직하게, 이러한 유사체에 있어서:
- 상기 틀 서열 중 하나 이상의 아미노산 잔기는 천연 생성 VHH 도메인 내 동일한 위치에 천연 생성되는 하나 이상의 아미노산 잔기에 의해 치환된다. 이러한 치환의 몇몇 예에 관하여는 상기 표 4∼표 7에 제시하였으며/제시하였거나;
- 상기 틀 서열 중 하나 이상의 아미노산 잔기는 전술한 바와 같이 "보존적" 아미노산 치환으로서 간주될 수 있는 하나 이상의 아미노산 잔기에 의하여 치환되며/되거나;
- 상기 틀 서열 중 하나 이상의 아미노산 잔기는 인간의 천연 생성 VH 도메인 내 동일한 위치에 천연 생성되는 하나 이상의 아미노산 잔기에 의해 치환된다. 이를 일반적으로 천연 생성 VHH/나노바디의 "인간화", 특히 상기 위치의 "인간화"라 칭하며, 이에 관하여는 이하에 더욱 상세히 기술되어 있고;
- 상기 표 4∼표 7에 기재된 VH 도메인 및 VHH 도메인 둘 다에 대해 언급된 오로지 1개의 아미노산 잔기의 위치는 바람직하게는 치환되지 않는다.
또한, 일반적으로 그 선호도는 떨어지지만, 이러한 유사체에서, 하나 이상의 아미노산 잔기들은 (임의로는, 전술한 바와 같은 하나 이상의 아미노산 치환에 더하여) 틀 부위로부터 결실되고/결실되거나, 틀 부위에 삽입될 수 있으나, 다만, 틀 부위의 총 서열 동일성 정도는 본원에 정의한 바와 같이 유지된다. 인증 잔기는 결실되어서는 아니 된다. 또한, 가장 바람직하게, 상기 표 4∼표 7의 VH 도메인 및 VHH 도메인 둘 다에 대해 오로지 1개의 아미노산 잔기만이 언급된 아미노산 잔기는 바람직하게는 결실되지 않는다.
바람직하게, 이러한 유사체는 vWF에 결합할 수 있고, 이에 대한 친화성을 가질 수 있으며/있거나, 이에 대한 특이성도 가질 수 있고, 이 경우 친화도 및/또는 특이성은, 적당한 검정법 예를 들어, vWF에 대한 유사체의 결합 능을 측정하는 검정법, 특히, 이하 실시예에서 사용된 검정법 중 하나를 사용하여 측정되는 바와 같이, 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디 중 하나 이상의 친화도 및/또는 특이성의 10% 이상, 바람직하게는 50% 이상, 더욱 바람직하게는 70% 이상, 더더욱 바람직하게는 80% 이상, 예를 들어, 90% 이상, 95% 이상 또는 99% 이상이다.
일반적으로, 이러한 유사체는 예를 들어, 천연 생성 VHH 도메인을 암호화하는 핵산을 제공하고, 인간화될 하나 이상의 아미노산 잔기들을 암호화하는 코돈을 상응하는 인간 아미노산 잔기(들)를 암호화하는 코돈으로 변이시키며, 이렇게 해서 얻어진 핵산/뉴클레오티드 서열을 적당한 숙주 또는 발현 시스템 내에서 발현시키고; 임의로는, 이와 같이 얻어진 유사체를 분리 및/또는 정제하여, 본질적으로 분리된 형태(상기 정의함)의 유사체를 제공함으로써 얻어질 수 있다. 이러한 과정은 일반적으로 당 업계에 공지된 방법 및 기술을 이용하여 수행될 수 있는데, 이러한 방법 및 기술들은 본원에 언급된 핸드북 및 참고 문헌 및/또는 이하 더욱 상세히 기술된 바로부터 당업자가 쉽게 알 수 있을 것이다. 대안적으로, 그리고 예를 들어, 유사체를 암호화하는 핵산은 당 업계에 공지된 방식으로 합성될 수 있으며[예를 들어, 소정의 아미노산 서열을 이용하여 핵산 서열을 합성하기 위한 자동화 장치를 사용하여 합성될 수 있으며], 또한 적당한 숙주 또는 발현 시스템 내에서 발현될 수 있고, 이렇게 해서 얻어진 유사체는 임의로는 분리 및/또는 정제되어, 본질적으로 분리된 형태(상기 정의함)의 유사체를 얻을 수 있게 되는 것이다. 이와 같은 유사체를 제공하는 또 다른 방법은 당 업계에 공지된 펩티드 합성 기술(예를 들어, 이하에 언급된 기술)을 이용하여 적당한 아미노산 서열을 화학적으로 합성하는 것을 포함한다.
또한, 일반적으로 나노바디(이의 유사체 포함)는, 상기 인간 VH 도메인의 아미노산 서열 내 하나 이상의 아미노산 잔기를 변이시켜, 전술한 바와 같이, (a) 108번 위치에 Q를 가지고/가지거나; (b) 44번 위치에 E 및/또는 45번 위치에 R, 그리고 바람직하게 44번 위치에 E 및 45번 위치에 R을 가지고/가지거나; (c) 103번 위치에 P, R, S를 가지는 아미노산 서열을 제공함으로써, 인간 VH 서열(즉, 아미노산 서열 또는 상응하는 뉴클레오티드 서열) 예를 들어, 인간 VH3 서열 예를 들어, DP-47, DP-51, DP-54 또는 DP-29를 출발 물질로 하여 제조될 수 있다는 것을 당업자는 알게 될 것이다. 뿐만 아니라, 이러한 과정은 인간 VH 도메인을 출발 지점으로 하여 아미노산 서열 및/또는 뉴클레오티드 서열을 이용함으로써, 일반적으로 이전 문단에서 언급한 다양한 방법과 기술을 통해 수행될 수 있다.
본원에 최광의로 사용된 나노바디란 용어는 또한, 본원에 정의한 바와 같은 본 발명의 나노바디(유사체 포함)의 부분 또는 단편을 포함하는 의미로서, 이에 관하여는 이하에 다시 기술하였다.
일반적으로, 나노바디 및/또는 유사체의 부분 또는 단편은 이와 상응하는 전장 나노바디 또는 유사체의 아미노산 서열에 비하여, N-말단부에 존재하는 아미노산 잔기 중 하나 이상, C-말단부에 존재하는 아미노산 잔기 중 하나 이상, 하나 이상의 연속 내부 아미노산 잔기 또는 이것의 임의의 조합체가 결실 및/또는 제거된 아미노산 서열을 가진다. 또한, 이와 같은 부분 또는 단편들 중 하나 이상을 결합시켜 본 발명의 나노바디를 제공하는 것도 가능하다.
바람직하게, 전장 나노바디 및/또는 이의 유사체를 이루는 하나 이상의 부분 또는 단편은 상응하는 전장 나노바디를 이루는 아미노산 서열과의 서열 동일성 정도가 50% 이상, 바람직하게는 60% 이상, 더욱 바람직하게는 70% 이상, 예를 들어, 80% 이상, 90% 이상 또는 95% 이상이어야 한다.
뿐만 아니라, 전장 나노바디 및/또는 이의 유사체를 이루는 하나 이상의 부분 또는 단편을 포함하는 나노바디의 아미노산 서열은, 상응하는 전장 나노바디의 아미노산 서열의 10개 이상의 연속 아미노산 잔기, 바람직하게는 20개 이상의 연속 아미노산 잔기, 더욱 바람직하게는 30개 이상의 연속 아미노산 잔기, 예를 들어, 40개 이상의 연속 아미노산 잔기를 포함하는 것이 바람직하다.
일반적으로, 본 발명의 나노바디를 이루는 이러한 부분 또는 단편은 이에 상응하는 본 발명의 전장 나노바디의 아미노산 서열에 비하여, N-말단부에 존재하는 아미노산 잔기 중 하나 이상, C-말단부에 존재하는 아미노산 잔기 중 하나 이상, 하나 이상의 연속 내부 아미노산 잔기 또는 이것의 임의의 조합체가 결여 및/또는 제거된 아미노산 서열을 가질 것이다. 또한, 이와 같은 부분 또는 단편들 중 하나 이상을 결합시켜 본 발명의 나노바디를 제공하는 것도 가능하다.
하나의 바람직한 구체예에 따르면, 본원에 사용된 단편은 본 발명의 전체 길이의 나노바디에 존재하는 CDR 중 하나 이상, 바람직하게는 본 발명의 전체 길이의 나노바디에 존재하는 CDR 중 2개 이상, 더욱 바람직하게는 본 발명의 전체 길이의 나노바디에 존재하는 CDR 중 적어도 CDR2 및 CDR3 예를 들어, 본 발명의 전체 길이의 나노바디에 존재하는 CDR 중 3개 모두를 포함한다.
기타 특히 바람직한 비 제한적 구체예에 따르면, 이러한 부분 또는 단편은 이에 상응하는 본 발명의 전체 길이 나노바디의 적어도 FR3, CDR3 및 FR4를 포함한다[예를 들어, 국제 출원 WO 03/050531(Lasters외 다수) 참조].
바람직하게, 이와 같은 부분 또는 단편은 여전히 vWF에 결합할 수 있고, 이에 대한 친화성을 가질 수 있으며/있거나, 이에 대한 특이성도 가질 수 있고, 이 경우 친화도 및/또는 특이성은, 예를 들어, vWF에 대한 유사체의 결합 능을 측정하는 검정법, 특히, 이하 실시예에서 사용된 검정법 중 하나를 사용하여 측정되는 바와 같이, 본 발명의 상응하는 전체 길이의 나노바디의 친화도 및/또는 특이성의 10% 이상, 바람직하게는 50% 이상, 더욱 바람직하게는 70% 이상, 더더욱 바람직하게는 80% 이상, 예를 들어, 90% 이상, 95% 이상, 99% 이상이다.
전술한 바에 따르면, 본원에 사용된 나노바디의 아미노산 서열은, 천연 생성 VH 도메인의 아미노산 서열, 예를 들어, 인간 항체의 천연 생성 VH 도메인의 아미노산 서열로부터 유래하는 틀 부위 중 하나 이상에 있어서 하나 이상의 아미노산 위치가 상이함을 알게 될 것이다. 특히, 본원에 사용된 나노바디의 아미노산 서열은, 카멜리드 및/또는 인간 항체의 천연 생성 VH 도메인의 아미노산 서열과 같은, 천연 생성 VH 도메인의 아미노산 서열과는 하나 이상의 인증 잔기가 상이함을 알게 될 것이다.
그러므로, 하나의 특정 구체예에 따르면, 본 발명의 나노바디는 천연 생성 VH 도메인의 아미노산 서열로부터 유래하는 틀 부위 중 하나에 있어서 하나 이상의 아미노산 위치가 상이한 아미노산 서열을 가진다. 더욱 구체적이고 비 제한적인 본 발명의 구체예에 따르면, 본 발명의 나노바디는 천연 생성 VH 도메인의 아미노산 서열과는 하나 이상의 인증 잔기가 상이한 아미노산 서열을 가진다.
전술한 바에 따르면, 본 발명의 나노바디 예를 들어, 본 발명의 인간화된 나노바디 중 일부의 아미노산 서열은, 천연 생성 VHH 도메인의 아미노산 서열과는, 틀 부위 중 하나 이상에 존재하는 하나 이상의 아미노산 위치(즉, 인증 잔기 위치 또는 기타 위치)가 상이할 것임을 알게될 것이다. 그러므로, 하나의 구체적이되 비 제한적인 구체예에서, 본 발명의 나노바디는 천연 생성 VHH 도메인의 아미노산 서열과는, 틀 부위 중 하나에 존재하는 하나 이상의 아미노산 위치가 상이한 아미노산 서열을 가진다. 더욱 구체적이되 비 제한적인 본 발명의 구체예에 따르면, 본 발명의 나노바디는 천연 생성 VHH 도메인의 아미노산 서열과는, 하나 이상의 인증 잔기가 상이한 아미노산 서열을 가진다.
전술한 바와 같이, 본 발명은 또한 하나 이상의 VHH 도메인(즉, 본 발명의 방법을 이용하여 동정된 VHH 도메인) 또는 이것으로 구성된 하나 이상의 나노바디를 포함하는 단백질 또는 폴리펩티드에 관한 것이기도 하다.
본 발명의 하나의 비 제한적 구체예에 따르면, 이와 같은 본 발명의 폴리펩티드는 본질적으로 나노바디로 이루어져 있다. "본질적으로 이루어져 있다"는 의미는, 본 발명의 폴리펩티드를 이루는 아미노산 서열이 (전술한 바와 같은) 나노바디의 아미노산 서열과 정확히 일치하거나 또는 제한된 수의 아미노산 잔기 예를 들어, 1∼10개의 아미노산 잔기 및 바람직하게는 1∼6개의 아미노산 잔기 예를 들어, 1, 2, 3, 4, 5 또는 6개의 아미노산 잔기가, 나노바디의 아미노산 잔기의 아미노 말단부, 카복시 말단부 또는 상기 두 말단부(즉, 아미노 말단부 및 카복시 말단부)에 부가된 나노바디의 아미노산 서열에 상응한다는 의미이다.
상기 아미노산 잔기는 나노바디의 (생물학적) 특성을 바꾸거나, 변성시키거나 또는 이에 영향을 미칠 수 있거나 또는 그렇지 않을 수 있으며, 나노바디에 추가의 기능성을 부가할 수 있거나 또는 그렇지 않을 수 있다. 예를 들어, 이러한 아미노산 잔기는
a) "태그 즉, 예를 들어, 상기 서열 또는 잔기에 대해 생성된 나노바디의 정제(예를 들어, 친화성 기술을 사용함)를 가능하게 하거나 또는 이를 촉진하는 아미노산 서열 또는 잔기를 형성할 수 있다. 이후, 상기 서열 또는 잔기는 본 발명의 뉴클레오티드 서열을 제공하기 위해 제거(예를 들어, 화학적 또는 효소적 절단에 의해 제거)될 수 있다[이러한 목적으로서, 상기 서열 또는 잔기는 절단 가능한 링커 서열을 통해 본 발명의 아미노산 서열에 임의로 결합될 수 있다]. 이러한 잔기에 관한 바람직하되 비 제한적인 몇몇 예로서는 다중 히스티딘 잔기 및 글루타치온 잔기가 있다.
또한, 이러한 아미노산 잔기는
b) 예를 들어, 이종 숙주 세포 또는 숙주 유기체 내에서 발현된 N-말단 Met 잔기일 수 있다.
또한, 이러한 아미노산 잔기는
c) 당 업계에 공지된 방식으로 작용화되었고/작용화되었거나, 작용기가 제공될 수 있는 하나 이상의 아미노산 잔기일 수 있다. 예를 들어, 당 업계에 공지된 바와 같이, 아미노산 잔기 예를 들어, 리신, 특히 시스테인은 PEG기의 부착을 가능하게 할 수 있으며, 이는 단백질 상에 존재하는 표면 위치를 마스킹(masking)하여, 예를 들어, 면역원성을 감소시키고, 혈장 중 반감기를 개선시키며, 단백 분해 절단에 대해 안정성을 갖도록 해준다.
또한, 이러한 아미노산 잔기는
d) 본 발명의 나노바디 또는 폴리펩티드의 혈청 중 반감기를 증가시킨다. 생체 내 반감기를 증가시키기 위해서 치료용 단백질에 부착될 수 있으며/있거나 이와 융합될 수 있는 아미노산 서열에 관하여는 당업자에게 널리 공지되어 있으며, 그 예로서는 인간 혈청 단백질 또는 이의 단편(예를 들어, 인간 혈청 알부민 또는 이의 일부 또는 단편), 또는 항체(구체적으로 인간 항체)의 Fc 부분을 포함한다. 또한, 본원에 이미 기술한 바와 같이, 이와 같이 반감기를 증가시키기 위한 아미노산 서열은 혈청 단백질에 대해 생성된 아미노산 서열 예를 들어, 혈청 단백질에 대해 생성된 나노바디 예를 들어, 인간 혈청 알부민에 대해 생성된 나노바디일 수 있다.
페그화와 관련해서, 일반적으로 본 발명은 하나 이상의 아미노산 위치에 페그화가 일어난 본 발명의 임의의 나노바디 및/또는 폴리펩티드도 포함한다는 점에 주목해야 할 것이며, 이 경우, 상기 페그화는 (1) 생체 내 반감기를 증가시키거나; (2) 면역원성을 감소시키거나; (3) 페그화에 관하여 공지된 하나 이상의 유리한 특성을 제공하거나; (4) vWF에 대한 나노바디 및/또는 폴리펩티드의 친화도에 본질적으로 영향을 미치지 않으며/않거나[예를 들어, 이하 실시예에 기술된 적당한 검정법에 의해 측정된 친화도를 90% 이상, 바람직하게는 50% 이하, 더욱 바람직하게는 10% 이하로 감소시키지 않도록], (4) 본 발명의 나노바디 및/또는 폴리펩티드의 기타 원하는 특성 중 임의의 특성에 영향을 미치지 않는 것이 바람직하다. 적당한 PEG-기 및 이를 부착시키는 방법은, 그것이 특이적이든지 아니면 비특이적이든지 간에, 당 업자에게 명백할 것이다. 이러한 페그화에 적당한 키트 및 시약은 예를 들어, 넥타(Nektar)(CA, USA)로부터 입수할 수 있다.
하나의 비 제한적인 구체예에 따르면, PEG-기를 부착시키기 위하여 하나 이상의 특이적 아미노산 잔기를 제공하기 위해서, 하나 이상의 아미노산 잔기가 본 발명의 나노바디 또는 폴리펩티드의 아미노산 서열에 부가, 삽입 및/또는 치환될 수 있다.
본 발명은 또한 일반적으로, 본 발명의 나노바디 또는 폴리펩티드를 발현시키는데 사용되는 숙주 세포에 따라서, 하나 이상의 아미노산 위치가 글리코실화된 본 발명의 폴리펩티드 및/또는 본 발명의 임의의 나노바디를 포함하기도 한다(이하에 더욱 상세히 기술함).
하나의 비 제한적 구체예에 따르면, 하나 이상의 아미노산 잔기는 본 발명의 나노바디 또는 폴리펩티드의 아미노산 서열에 부가, 삽입 및/또는 치환될 수 있으며, 그 결과, 사용된 숙주 유기체에 의해 글리코실화될 수 있는 하나 이상의 특이 아미노산 잔기 및/또는 위치를 제공할 수 있다. 바람직하되, 비 제한적인 예로서, 본 발명의 나노바디의 CDR2 내에 존재하는 50번 위치의 N-잔기는 예를 들어, Q, D 또는 S 잔기에 의해 치환될 수 있으며, 그 결과, 예를 들어, 피치아(Pichia)에 의한 글리코실화용인 글리코실화 위치를 제공할 수 있다.
다른 구체예에 따르면, 본 발명의 폴리펩티드는 나노바디의 아미노산 서열을 포함할 수 있으며, 이와 같은 아미노산 서열은 아미노 말단 부위, 카복시 말단 부위, 또는 이 아미노 말단 및 카복시 말단 부위 둘 다에서 하나 이상의 추가 아미노산 서열과 융합된다.
뿐만 아니라, 상기 추가의 아미노산 서열(들)은 나노바디의 (생물학적) 특성을 바꾸거나, 변성시키거나 이에 영향을 미칠 수 있거나 또는 그러하지 않을 수 있으며, 이 나노바디에 추가의 기능성을 부가할 수 있거나 또는 그러하지 않을 수 있다.
예를 들어, 하나의 바람직하되 비 제한적인 구체예에 따르면, 상기 추가의 아미노산 서열은 하나 이상의 추가의 나노바디를 포함할 수 있으므로, 2개 이상, 예를 들어, 3개, 4개 또는 5개의 나노바디를 포함하는 본 발명의 폴리펩티드를 제공할 수 있는데, 이때, 상기 나노바디는 하나 이상의 링커 서열(본원에 정의됨)을 통해 결합될 수도 있다.
2개 이상의 나노바디를 포함하는 본 발명의 폴리펩티드를 또한 본원에서는 "다가(multivalent)" 폴리펩티드라고도 칭할 것이다. 예를 들어, 본 발명의 "2가(bivalent)" 폴리펩티드는 2개의 나노바디를 포함(임의로는 1개의 링커 서열에 의해 결합되어 있음)하는 반면에, 본 발명의 "3가(trivalent)" 폴리펩티드는 3개의 나노바디를 포함(임의로는 2개의 링커 서열에 의해 결합되어 있음)한다.
본 발명의 다가 폴리펩티드에 있어서, 2개 이상의 나노바디는 동일하거나 상이할 수 있다. 예를 들어, 본 발명의 다가 폴리펩티드에 있어서 2개 이상의 나노바디는:
- 동일한 항원 즉, 이 항원의 동일한 부분 또는 에피토프, 또는 이 항원의 2개 이상의 상이한 부분 또는 에피토프에 대해 생성될 수 있으며/있거나;
- 상이한 항원에 대해 생성될 수 있거나;
아니면, 상기 경우를 조합하여 생성될 수 있다.
그러므로, 본 발명의 2가 폴리펩티드는 예를 들어:
- 2개의 동일한 나노바디를 포함할 수 있거나;
- 항원의 제1 부분 또는 에피토프에 대해 생성된 제1 나노바디와, 이 항원의 동일한 부분 또는 에피토프에 대해 생성된 제2 나노바디, 또는 이 항원의 기타 부분 또는 에피토프에 대해 생성된 제2의 나노바디를 포함할 수 있거나;
- 또는 제1 항원에 대해 생성된 제1 나노바디, 및 이 제1 항원과 상이한 제2 항원에 대해 생성된 제2 나노바디를 포함할 수 있으며;
반면에, 본 발명의 3가 폴리펩티드는 예를 들어,
- 동일한 항원의 동일하거나 상이한 부분 또는 에피토프에 대해 생성된, 3개의 동일하거나 상이한 나노바디를 포함할 수 있거나;
- 제1 항원 상에 존재하는 동일하거나 상이한 부분 또는 에피토프에 대해 생성된 2개의 동일하거나 상이한 나노바디와, 이 제1 항원과 상이한 제2 항원에 대해 생성된 제3의 나노바디를 포함할 수 있거나; 또는
- 제1 항원에 대해 생성된 제1 나노바디, 이 제1 항원과 상이한 제2 항원에 대해 생성된 제2 나노바디, 및 이 제1 항원 및 제2 항원과 상이한 제3 항원에 대해 생성된 제3 나노바디를 포함할 수 있다.
2개 이상의 나노바디를 함유하는 본 발명의 폴리펩티드(여기서, 하나 이상의 나노바디는 제1 항원에 대해 생성된 것이고, 하나 이상의 나노바디는 제1 항원과 상이한 제2 나노바디에 대해 생성된 것임)는 "다중 특이적(multispecific)" 나노바디라고 칭하여 질 것이다. 그러므로, "이중 특이적" 나노바디는 제1 항원에 대해 생성된 하나 이상의 나노바디와, 제2 항원에 대해 생성된 하나 이상의 추가 나노바디를 포함하는 나노바디인 반면에, "삼중 특이적" 나노바디는 제1 항원에 대해 생성된 하나 이상의 나노바디, 제2 항원에 대해 생성된 하나 이상의 추가 나노바디, 그리고 제3 항원에 대해 생성된 하나 이상의 추가 나노바디를 포함하는 나노바디이다.
그러므로, 이 나노바디가 가장 간단한 형태일 때, 본 발명의 이중 특이적 폴리펩티드는 본 발명의 2가 폴리펩티드(본원에 정의됨)로서, 제1 항원에 대해 생성된 제1 나노바디와, 제2 항원에 대해 생성된 제2 나노바디를 포함하며, 여기서, 상기 제1 및 제2 나노바디는 링커 서열(본원에 정의됨)을 통하여 임의로 결합될 수 있는 반면에; 본 발명의 삼중 특이적 폴리펩티드는 가장 간단한 형태일 때, 본 발명의 3가 폴리펩티드(본원에 정의됨)인데, 이는 제1 항원에 대해 생성된 제1 나노바디, 제2 항원에 대해 생성된 제2 나노바디, 그리고 제3 항원에 대해 생성된 제3 나노바디를 포함하고, 여기서, 상기 제1, 제2 및 제3 나노바디는 임의로 하나 이상의 링커 서열, 특히 하나 이상 특히, 2개의 링커 서열을 통하여 결합될 수 있다.
그러나, 전술한 바로부터 명백히 알 수 있는 바와 같이, 본 발명은 여기에 한정되지 않는데, 즉, 본 발명의 다중 특이적 폴리펩티드는 2개 이상의 상이한 항원에 대해 생성된 임의의 수의 나노바디를 포함할 수 있다.
하나 이상의 VHH 도메인을 함유하는 다가 및 다중 특이적 폴리펩티드와 이의 제조 방법에 관하여는 문헌[Conrath외 다수, J. Biol. Chem., Vol. 276, 10. 7346-7350 및 EP 0 822 985]에 개시되어 있다.
다가 및 다중 특이적 폴리펩티드에 사용하기 위한 링커는 당 업자에게 널리 알려져 있을 것이며, 그 예로서는 gly-ser 링커 예를 들어, (glyxsery)z 형, 예를 들어, (gly4ser)3 또는 (gly3ser2)3 [WO 99/42077 참조], 힌지 유사 부위 예를 들어, 천연 생성 중쇄 항체의 힌지부 또는 유사 서열을 포함한다. 기타 적당한 링커에 관하여는 전술한 바와 같은 일반적인 배경 기술에 개시되어 있다. 몇몇 특히 바람직한 링커는 서열 번호 83∼서열 번호 85에 제시되어 있는데, 이 중, 서열 번호 84 및 서열 번호 85의 링커가 특히 바람직하다.
링커는 또한 다가 또는 다중 특이적 폴리펩티드에 몇몇 기능성을 제공할 수 있다. 예를 들어, 하나 이상의 하전된 아미노산 잔기를 함유하는 링커(상기 표 1 참조)는 개선된 친수성을 제공할 수 있는 반면에, 소형 에피토프 또는 태그를 형성하거나 이를 함유하는 링커는 검출, 동정 및/또는 정제용으로서 사용될 수 있다.
본원에 더욱 상세히 기술되어 있는 바와 같이, 바람직한 항원 및 하나 이상의 혈청 단백질 예를 들어, 이하 언급될 혈청 단백질, 구체적으로 인간 혈청 단백질에 대해 생성된, 본 발명의 다중 특이적 폴리펩티드는 상응하는 1가의 나노바디에 비하여, 혈청 중 반감기가 증가할 수 있다.
전술한 바와 같이, 본원에 개시된 방법은 본 발명의 다중 특이적 폴리펩티드의 다가 폴리펩티드를 생산하는데 특히 바람직하다.
본 발명의 폴리펩티드에 있어서, 하나 이상의 나노바디는 또한 종래의 VH 도메인 또는 이 VH 도메인의 천연 유사체 또는 합성 유사체에 결합될 수도 있는데, 임의로는 링커 서열을 통하여 결합될 수 있다.
본 발명의 폴리펩티드에 있어서, 하나 이상의 나노바디는 또한 VL 도메인 또는 이 VL 도메인의 천연 유사체 또는 합성 유사체에 결합될 수도 있는데, 임의로는 링커 서열을 통하여 결합될 수 있으며, 그 결과, 종래의 scFv 단편과 유사하되, VH 도메인 대신 나노바디를 함유하는 형태를 띠는 본 발명의 폴리펩티드를 제공할 수 있다.
본 발명의 폴리펩티드에 있어서, 하나 이상의 나노바디는 또한 CH1, CH2 및/또는 CH3 도메인 중 하나 이상에, 임의로는 링커 서열을 통해 결합될 수도 있다. 예를 들어, 적당한 CH1 도메인에 결합된 나노바디는 예를 들어, (적당한 경쇄와 함께) 종래의 Fab 단편 또는 F(ab')2 단편과 유사하되, 하나 또는 (F(ab')2 단편의 경우에는) 하나 또는 두 개의 종래 VH 도메인이 나노바디에 의해 치환된 항체 단편/구조를 제공하는데 사용될 수 있었다. 이러한 단편은 또한 이종 특이적 또는 이중 특이적일 수 있는데, 즉, 2개 이상의 항원에 대해 생성될 수 있다. 예를 들어, 카멜리드로부터 유래하는 적당한 CH2 및 CH3 도메인에 결합된 나노바디는 단일 특이적 또는 이중 특이적 중쇄 항체를 형성하는데 사용될 수 있었다. 마지막으로, 예를 들어, 인간으로부터 유래하는 적당한 CH1, CH2 및 CH3 도메인에 결합된 나노바디는 (적당한 경쇄와 함께), 종래의 4-사슬 항체와 유사하되, 종래의 VH 도메인 중 하나 또는 두 개가 나노바디에 의해 치환된 항체를 형성하는데 사용될 수 있었다.
또한, 하나 이상의 나노바디에 더하여, 본 발명의 폴리펩티드는 또한 작용기, 부분 또는 잔기 예를 들어, 치료학적으로 활성인 물질 예를 들어, 이하에 언급된 물질 및/또는 마커 또는 표지 예를 들어, 형광성 마커, 동위 원소 등(이하에 추가로 기술됨)을 함유할 수도 있다.
본 발명의 나노바디, 본 발명의 폴리펩티드 및 이를 암호화하는 핵산은 이하에 더욱 상세히 기술되어 있는 바에 따라서 당 업자에게 널리 알려져 있는 바와 같이, 공지의 방식으로 제조될 수 있다. 이와 같은 나노바디, 폴리펩티드 및 핵산을 제조하는 몇몇 바람직하되 비 제한적인 방법으로서는 전술한 방법 및 기술 및/또는 이하에 추가로 기술된 방법 및 기술을 포함한다.
당 업자에게 널리 알려져 있는 바와 같이, 본 발명의 나노바디 및/또는 폴리펩티드를 제조하는데 특히 유용한 하나의 방법은 일반적으로 다음과 같은 단계들을 포함한다:
- 본 발명의 나노바디 또는 폴리펩티드를 암호화하는 핵산(본원에서는 "본 발명의 핵산"이라고도 칭함)을 적당한 숙주 세포 또는 숙주 유기체(본원에서는 "본 발명의 숙주"라고도 칭함) 또는 기타 적당한 발현 시스템에서 발현시키는 단계; 및 임의로는,
- 이와 같이 얻어진 본 발명의 나노바디 또는 폴리펩티드를 분리 및/또는 정제하는 단계.
특히, 이러한 방법은 다음과 같은 단계들을 포함할 수 있다:
- 본 발명의 숙주가 본 발명의 하나 이상의 나노바디 및/또는 폴리펩티드를 발현 및/또는 생산하는 조건 하에서, 본 발명의 숙주를 배양 및/또는 유지시키는 단계; 및 임의로는,
- 이와 같이 얻어진 본 발명의 나노바디 또는 폴리펩티드를 분리 및/또는 정제하는 단계.
본 발명의 핵산은 단일 사슬 또는 이중 사슬 DNA 또는 RNA의 형태일 수 있으며, 또한 바람직하게는 이중 사슬 DNA의 형태이다. 예를 들어, 본 발명의 뉴클레오티드 서열은 게놈형 DNA, cDNA 또는 합성 DNA(예를 들어, 목적 숙주 세포 또는 숙주 유기체 내에서 발현되도록 특별히 맞추어진 코돈 선호도(codon usage)를 가지는 DNA)일 수 있다.
본 발명의 하나의 구체예에 따르면, 본 발명의 핵산은 상기 정의한 바와 같이, 본질적으로 분리된 형태의 것이다.
본 발명의 핵산은 또한 벡터 예를 들어, 플라스미드, 코스미드 또는 YAC(이것들 또한 본질적으로 분리된 형태를 가질 수 있음)의 형태일 수 있고, 이에 존재할 수 있으며/있거나, 이의 일부일 수 있다.
본 발명의 핵산은 본원에 제공된 본 발명의 폴리펩티드에 대한 아미노산 서열 정보를 바탕으로 하여, 당 업계에 공지된 방식으로 제조되거나 얻어질 수 있으며/있거나, 적당한 천연 공급원으로부터 분리될 수 있다. 유사체를 제공하기 위하여, 천연 생성 VHH 도메인을 암호화하는 뉴클레오티드 서열은 예를 들어, 위치-배향 돌연 변이가 유발될 수 있으며, 그 결과, 이 유사체를 암호화하는 본 발명의 핵산이 제공될 수 있는 것이다. 또한, 당 업자에게 널리 알려져 있는 바와 같이, 본 발명의 핵산을 제공하기 위해서, 나노바디를 암호화하는 몇몇 뉴클레오티드 서열, 예를 들어, 하나 이상의 뉴클레오티드 서열과, 예를 들어, 하나 이상의 링커를 암호화하는 핵산은 적당한 방식으로 함께 결합될 수 있다.
본 발명의 핵산을 생산하기 위한 기술은 당 업자에게 명백할 것이며, 그 예로서는 자동화된 DNA 합성법; 위치-배향 돌연 변이 유발법; 2개 이상의 천연 생성 및/또는 합성 서열(또는 이의 2개 이상의 부분들)을 결합시키는 방법, 절단형 발현 생산물을 발현시키는 돌연 변이를 도입하는 방법; (예를 들어, 적당한 제한 효소를 이용하여 용이하게 절단 및/또는 결찰될 수 있는 카세트 및/또는 부위를 생산하기 위해) 하나 이상의 제한 위치를 도입하는 방법, 및/또는 하나 이상의 "미스 매치된" 프라이머와, 예를 들어, 주형으로서 천연 생성 GPCR 서열을 사용하는 PCR 반응에 의해 돌연 변이를 도입하는 방법을 포함하나, 이에 한정되는 것은 아니다. 이와 같은 기술 및 기타 기술은 당 업자에게 널리 알려져 있을 것이며, 참고 문헌으로서는 상기 및 이하 실시예에 기술한 바와 같은 표준 핸드북[예를 들어, Sambrook외 다수 및 Ausubel외 다수]이 있다.
본 발명의 핵산은 또한 당 업자에게 널리 알려져 있는 바와 같이, 유전자 구조물의 형태이고, 이에 존재하며/존재하거나 이의 일부일 수도 있다. 이러한 유전자 구조물은 일반적으로 당 업계에 공지되어 있는 유전자 구조물의 하나 이상의 요소 예를 들어, 하나 이상의 적당한 조절 요소(예를 들어, 적당한 프로모터, 인핸서 및 종결 인자들)와 이하에 기술된 바와 같은 유전자 구조물의 추가 요소에 임의로 결합되어 있는 본 발명의 하나 이상의 핵산을 포함한다. 본 발명의 핵산을 하나 이상 포함하는 이러한 유전자 구조물을 본원에서는 "본 발명의 유전자 구조물"이라고 칭하기도 할 것이다.
본 발명의 유전자 구조물은 DNA 또는 RNA일 수 있으며, 바람직하게는 이중 사슬 DNA이다. 본 발명의 유전자 구조물은 또한 목적 숙주 세포 또는 숙주 유기체의 형질 전환에 적당한 형태, 목적 숙주 세포의 게놈형 DNA에 통합되는데 적당한 형태, 또는 목적 숙주 유기체 내에서 적당히 독립적으로 복제, 유지 및/또는 유전되는 형태일 수도 있다. 예를 들어, 본 발명의 유전자 구조물은 벡터 예를 들어, 플라스미드, 코스미드, YAC, 바이러스 벡터 또는 트랜스포손의 형태일 수 있다. 특히, 벡터는 발현 벡터 즉, 시험관 내 및/또는 생체 내(예를 들어, 적당한 숙주 세포, 숙주 유기체 및/또는 발현 시스템 내) 발현할 수 있는 벡터일 수 있다.
바람직한 비 제한적 구체예에서, 본 발명의 유전자 구조물은
a) 이하 b)에 작동 가능하도록 결합된 본 발명의 하나 이상의 핵산;
b) 하나 이상의 조절 요소 예를 들어, 프로모터 및 임의로는 적당한 종결 인자;
c) 및 임의로는,
d) 당 업계에 공지되어 있는 유전자 구조물 중 하나 이상의 추가 요소들을 포함하는데,
여기서, 상기 "조절 요소", "프로모터", "종결 인자" 및 "작동 가능하도록 결합된"이란 용어는 당 업계에서 통상 사용되는 의미를 가지며(이하에 추가로 기술함); 상기 유전자 구조물에 존재하는 "추가 요소"는 예를 들어, 3'- 또는 5'-UTR 서열, 리더 서열, 선별 마커, 발현 마커/리포터 유전자, 및/또는 형질 전환 또는 통합(의 효율)을 촉진하거나 증가시킬 수 있는 요소들일 수 있다. 이러한 유전자 구조물의 요소들 및 기타 적당한 요소들에 관하여는 당 업자들에게 널리 알려져 있을 것이며, 이것들은 예를 들어, 사용된 구조물의 유형, 목적 숙주 세포 또는 숙주 유기체; 본 발명의 목적 뉴클레오티드 서열이 발현되는 방식(예를 들어, 구성적, 일시적 또는 유도성 발현 방식) 및/또는 사용된 형질 전환 기술에 따라서 달라질 수 있다.
바람직하게, 본 발명의 유전자 구조물에 있어서, 본 발명의 하나 이상의 핵산과 상기 조절 요소, 그리고 임의로는 상기 하나 이상의 추가 요소는 서로 "작동 가능하도록" 결합되어 있는데, 이는 곧, 상기 요소들이 서로 기능상 관련되어 있음을 의미한다. 예를 들어, 만일 프로모터가 암호화 서열의 전사 및/또는 발현을 개시하거나 제어/조절할 수 있으면, 이 프로모터는 암호화 서열에 "작동 가능하도록 결합된" 것으로서 간주되며, 이때 상기 암호화 서열은 상기 프로모터의 "제어 하에" 있는 것으로서 이해해야 할 것이다. 일반적으로, 2개의 뉴클레오티드 서열이 작동 가능하도록 결합되어 있을 때, 이 서열은 동일한 배향으로 있을 것이며, 일반적으로는 동일한 해독 틀 내에 있을 것이다. 이 뉴클레오티드 서열들은 또한 (꼭 그러할 필요는 없지만) 본질적으로 인접하여 존재할 것이다.
바람직하게, 본 발명의 유전자 구조물의 조절 요소 및 추가의 요소는 목적 숙주 세포 또는 숙주 유기체 내에서 의도로 하는 생물학적 기능을 제공할 수 있는 것이다.
예를 들어, 프로모터, 인핸서 또는 종결 인자는 목적으로 하는 숙주 세포 또는 숙주 유기체 내에서 "작동 가능한" 것이어야 하는데, 이는 곧, (예를 들어) 상기 프로모터가 그것이 작동 가능하도록 결합된(본원에 정의됨) 뉴클레오티드 서열(예를 들어, 암호화 서열)의 전사 및/또는 발현을 개시하거나 제어/조절할 수 있어야 한다는 것을 의미한다.
특히 바람직한 몇몇 프로모터로서는 박테리아 세포 내에서의 발현용인 것으로 공지된 프로모터 예를 들어, 이하에 언급된 프로모터 및/또는 실시예에 사용된 프로모터를 포함하나, 이에 한정되는 것은 아니다.
선별 마커는 (적당한 선별 조건 하에서) 본 발명의 뉴클레오티드 서열로 (성공적으로) 형질 전환된 숙주 세포 및/또는 숙주 유기체가 (성공적으로) 형질 전환되지 않은 숙주 세포/유기체와 구별되도록 만들어 주는 것이어야 한다. 이러한 마커에 관한 몇몇 바람직하되 비 제한적인 예로서는 항생제(예를 들어, 카나마이신 또는 암피실린)에 대한 내성을 제공하는 유전자, 온도에 대한 내성을 제공하는 유전자, 또는 숙주 세포 또는 숙주 유기체가 배지 중에 형질 전환되지 않은 세포나 유기체의 생존에 필수적인 임의의 요소, 화합물 및/또는 (식품) 성분이 존재하지 않을 경우에도 유지될 수 있도록 만들어주는 유전자가 있다.
리더 서열은 (목적으로 하는 숙주 세포 또는 숙주 유기체 중에서) 번역 후 변형을 원하는 대로 진행시킬 수 있고/있거나, 전사된 mRNA를 세포의 원하는 부분 또는 기관에 이동시키는 것이어야 한다. 리더 서열은 또한 상기 세포로부터 발현 생산물을 분비시킬 수 있는 것일 수도 있다. 이처럼, 리더 서열은 숙주 세포 또는 숙주 유기체 내에서 작동 가능한 임의의 프로-, 프리- 또는 프리프로-서열일 수 있다. 리더 서열은 박테리아 세포 내에서의 발현에는 필요하지 않을 수도 있다.
발현 마커 또는 리포터 유전자는 (숙주 세포 또는 숙주 유기체 내에서) 유전자 구조물(에 존재하는 유전자 또는 뉴클레오티드 서열)의 발현을 검출할 수 있도록 만드는 유전자이어야 한다. 발현 마커는 또한 예를 들어, 세포의 특정 부분 또는 기관 및/또는 다세포 유기체의 특정 세포(들), 조직(들), 기관(들) 또는 부분(들)에서 발현된 생산물의 국소화를 가능하게 만들어 주는 것일 수도 있다. 이러한 리포터 유전자는 또한 본 발명의 아미노산 서열을 함유하는 단백질 융합체로서 발현될 수도 있다. 몇몇 바람직하되 비 제한적인 예로서는 형광성 단백질 예를 들어, GFP를 포함한다.
적당한 프로모터, 종결 인자 및 추가의 요소에 관한 몇몇 바람직하되 비 제한적인 예로서는 이하 실시예에 사용된 것들을 포함한다. 본 발명의 유전자 구조물에 존재하고/사용될 수 있는 프로모터, 선별 마커, 리더 서열, 발현 마커 및 추가의 요소(예를 들어, 종결 인자, 전사 및/또는 번역 인핸서 및/또는 통합 인자)에 관한 몇몇 (추가의) 비 제한적 예는 문헌[전술한 바와 같은 Sambrook외 다수 및 Ausubel외 다수의 핸드북과, WO 95/07463, WO 96/23810, WO 95/07463, WO 95/21191, WO 97/11094, WO 97/42320, WO 98/06737, WO 98/21355, US-A-6,207,410, US-A-5,693,492 및 EP 1 085 089에 제시된 실시예]에 개시되어 있다. 기타 예는 당 업자에게 널리 알려져 있을 것이다. 참고 문헌으로서는 또한 상기 언급된 일반적인 배경 기술과 이하에 제시된 추가의 참고 문헌들이 있다.
본 발명의 유전자 구조물은 일반적으로, 예를 들어, 일반적인 핸드북(예를 들어, 상기와 같은 Sambrook외 다수 및 Ausubel외 다수의 핸드북)에 개시된 기술을 이용하여, 본 발명의 뉴클레오티드 서열(들)을 전술한 바와 같은 하나 이상의 추가의 요소에 적당히 결합시킴으로써 제공될 수 있다.
종종, 본 발명의 유전자 구조물은 본 발명의 뉴클레오티드 서열을 공지의 적당한 (발현) 벡터 내에 삽입함으로써 얻어질 것이다. 적당한 발현 벡터의 몇몇 바람직한 비 제한적 예로서는 이하 실시예에 사용된 것들과 이하에 기술된 것들이 있다.
본 발명의 핵산 및/또는 본 발명의 유전자 구조물은 본 발명의 나노바디 또는 폴리펩티드를 발현 및/또는 생산하기 위하여, 숙주 세포 또는 숙주 유기체를 형질 전환시키는데 사용될 수 있다. 적당한 숙주 또는 숙주 세포에 관하여는 당업자에게 널리 알려져 있을 것이며, 그 예로서는 임의의 적당한 진균, 원핵 생물 또는 진핵 생물 세포 또는 세포주 또는 임의의 적당한 진균, 원핵 생물 또는 진핵 생물 유기체일 수 있으며, 그 예로서는 다음과 같은 것들이 있다:
- 박테리아 균주 예를 들어, 그람-음성 균주 예를 들어, 에스케리치아 콜라이(Escherichia coli) 균주; 프로테우스(Proteus) 균주 예를 들어, 프로테우스 미라빌리스(Proteus mirabilis) 균주; 슈도모나스(Pseudomonas) 균주 예를 들어, 슈도모나스 플루오레센스(Pseudomonas fluorescens) 균주; 및 그람-양성 균주 예를 들어, 바실러스(Bacillus) 균주 예를 들어, 바실러스 서브틸리스(Bacillus subtilis) 균주 또는 바실러스 브레비스(Bacillus brevis) 균주; 스트렙토마이세스(Streptomyces) 균주 예를 들어, 스트렙토마이세스 리비단스(Streptomyces lividans) 균주; 스타필로코커스(Staphylococcus) 균주 예를 들어, 스타필로코커스 카르노서스(Staphylococcus carnosus); 및 락토코커스(Lactococcus) 균주 예를 들어, 락토코커스 락티스(Lactococcus lactis) 균주;
- 진균 세포 예를 들어, 트리코더마(Trichoderma) 종 예를 들어, 트리코더마 리세이(Trichoderma reesei) 유래 세포; 뉴로스포라(Neurospora) 종 예를 들어, 뉴로스포라 크라사(Neurospora crassa) 유래 세포; 소르다리아(Sordaria) 종 예를 들어, 소르다리아 마크로스포라(Sordaria macrospora) 유래 세포; 아스퍼질러스(Aspergillus) 종 예를 들어, 아스퍼질러스 나이저(Aspergillus niger) 유래 세포 또는 아스퍼질러스 소자에(Aspergillus sojae) 유래 세포; 또는 기타 사상 진균 유래 세포;
- 효모 세포 예를 들어, 사카로마이세스(Saccharomyces) 종 예를 들어, 사카로마이세스 세레비지아에(Saccharomyces cerevisiae) 유래 세포; 쉬조사카로마이세스(Schizosaccharomyces) 종 예를 들어, 쉬조사카로마이세스 폼베(Schizosaccharomyces pombe) 유래 세포; 피치아(Pichia) 종 예를 들어 피치아 파스토리스(Pichia pastoris) 또는 피치아 메타놀리카(Pichia methanolica) 유래 세포; 한세뉼라(Hansenula) 종 예를 들어, 한세뉼라 폴리모르파(Hansenula polymorpha) 유래 세포; 클루이베로마이세스(Kluyveromyces) 종 예를 들어, 클루이베로마이세스 락티스(Kluyveromyces lactis) 유래 세포; 아르줄라(Arxula) 종 예를 들어, 아르줄라 아데니니보란스(Arxula adeninivorans) 유래 세포; 야로위아(Yarrowia) 종 예를 들어, 야로위아 리폴리티카(Yarrowia lipolytica) 유래 세포;
- 양서류 세포 또는 세포주 예를 들어, 제노퍼스(Xenopus) 난모 세포;
- 곤충-유래 세포 또는 세포주 예를 들어, 레피도프테라(lepidoptera) 유래 세포/세포주, 예를 들어, 스포도프테라(Spodoptera) SF9 및 Sf21 세포, 또는 드로소필라(Drosophila) 유래 세포/세포주 예를 들어, 슈나이더(Schneider) 및 Kc 세포;
- 식물 또는 식물 세포 예를 들어, 담배 식물; 및/또는
- 포유동물 세포 또는 세포주 예를 들어, 인간 유래 세포 또는 세포주, 포유동물 유래 세포 또는 세포주 예를 들어, CHO-세포, BHK-세포(예를 들어, BHK-21 세포) 및 인간 세포 또는 세포주 예를 들어, HeLa, COS(예를 들어, COS-7) 및 PER.C6 세포;
그리고, 항체 및 항체 단편(예를 들어, (단일) 도메인 항체 및 ScFv 단편)의 발현 및 생산용인 것으로 공지되어 있는 기타 모든 숙주 또는 숙주 세포로서, 당 업자에게 널리 공지된 세포. 이에 관한 참고 문헌은 본원의 일반적인 배경 기술에 전체적으로 언급되어 있으며, 그 예로서는 문헌[WO 94/29457; WO 96/34103; WO 99/42077; Frenken외 다수, (1998), 상동; Riechmann and Muyldermans, (1999), 상동; van der Linden, (2000), 상동; Thomassen외 다수, (2002), 상동; Joosten외 다수, (2003), 상동; Joosten외 다수, (2005), 상동; 및 본원에 언급된 추가의 참고 문헌]이 있다.
본 발명의 나노바디 및 폴리펩티드는 또한 예를 들어, 예방용 및/또는 치료용(예를 들어, 유전자 치료법)으로서 다세포 유기체의 하나 이상의 세포, 조직 또는 기관 내에 도입되어 발현될 수도 있다. 이러한 목적으로, 본 발명의 뉴클레오티드 서열은 임의의 적당한 방법 예를 들어, 리포좀을 사용하는 방법으로 세포 또는 조직에 도입될 수 있으며, 종종 이 뉴클레오티드 서열은 적당한 유전자 치료용 벡터(예를 들어, 레트로바이러스 예를 들어, 아데노바이러스 또는 파르보바이러스 예를 들어, 아데노-관련 바이러스로부터 유래하는 벡터)에 삽입된 이후에 도입될 수도 있다. 당 업자에게 널리 알려져 있는 바와 같이, 이러한 유전자 치료법은, 본 발명의 핵산 또는 이를 암호화하는 적당한 유전자 치료용 벡터를 환자나 환자의 특정 세포 또는 특정 조직이나 기관에 투여함으로써, 환자의 체 내, 생체 내 및/또는 환부에서 수행될 수 있거나; 또는 적당한 세포(종종 치료받을 환자의 신체로부터 취하는 것으로서, 예를 들어, 적출된 림프구, 골수 흡출물 또는 조직 생검편이 있음)는 본 발명의 뉴클레오티드 서열과 함께 시험관 내에서 처리될 수 있고, 이후 환자의 체내에 적당히 (재)도입될 수 있다. 이와 같은 모든 과정은 유전자 치료용 벡터, 기술 및 전달 시스템을 사용하여 수행될 수 있는데, 이때 상기 유전자 치료용 벡터, 기술 및 전달 시스템은 당 업자에게 널리 공지되어 있는 것이다[Culver, K. W., "Gene Therapy", 1994, p. xii, Mary Ann Liebert, Inc., Publishers, New York, N.Y.; Giordano, Nature F Medicine 2 (1996), 534-539; Schaper, Circ. Res. 79 (1996), 911-919; Anderson, Science 256 (1992),808-813; Verma, Nature 389 (1994),239; Isner, Lancet 348 (1996),370-374; Muhlhauser, Circ. Res. 77 (1995),1077-1086; Onodera, Blood 91 ; (1998),30-36; Verma, Gene Ther. 5 (1998),692-699; Nabel, Ann. N.Y. Acad. Sci. : 811 (1997), 289-292; Verzeletti, Hum. Gene Ther. 9 (1998), 2243-51; Wang, Nature Medicine 2 (1996),714-716; WO 94/29469; WO 97/00957, 미국 특허 제5,580,859호; 1 미국 특허 제5,5895466호; 또는 Schaper, Current Opinion in Biotechnology 7 (1996), 635-640]. 예를 들어, ScFv 단편의 체내 발현에 관한 문헌[Afanasieva외 다수, Gene Ther., 10, 1850-1859 (2003)] 및 다이아바디의 발현에 관한 문헌[Blanco외 다수, J. Immunol, 171, 1070-1077 (2003)]이 있다.
나노바디를 세포 내에서 발현시키기 위해서, 이 나노바디를 소위 "인트라바디"로서 발현시킬 수도 있다[예를 들어, WO 94/02610, WO 95/22618 및 US-A-7004940; WO 03/014960; Cattaneo, A. & Biocca, S. (1997) Intracellular Antibodies: Development and Applications. Landes and Springer-Verlag; 및 Kontermann, Methods 34, (2004), 163-170].
본 발명의 나노바디 및 폴리펩티드를 생산하기 위해서, 이 나노바디 및 폴리펩티드는 또한 예를 들어, 트랜스게닉 포유동물의 모유 예를 들어, 토끼, 소, 염소 또는 양의 모유 중에서 발현시킬 수도 있으며[예를 들어, US-A-6,741,957, US-A-6,304,489 및 US-A-6,849,992; 트랜스유전자를 포유동물에 도입시키는 일반 기술에 관하여 개시됨], 식물 또는 식물의 일부 예를 들어, 잎, 꽃, 과일, 종자, 뿌리 또는 터버(turber)(예를 들어, 담배, 옥수수, 대두 또는 알팔파), 또는 예를 들어, 누에 봄빅스 모리(Bombix mori)의 번데기 내에서 발현시킬 수도 있다
뿐만 아니라, 본 발명의 나노바디 및 폴리펩티드는 또한 무 세포 발현 시스템 내에서 발현 및/또는 생산될 수도 있으며, 이와 같은 시스템의 적당한 예는 당 업자에게 널리 알려져 있을 것이다. 몇몇 바람직하되 비 제한적인 예로서는 맥아 시스템; 토끼 망상 적혈구 용해물; 또는 이.콜라이(E. coli) 주베이(Zubay) 시스템에서의 발현을 포함한다.
전술한 바와 같이, 나노바디를 사용하는데 있어서 한 가지 이점은 나노바디를 주성분으로 하는 폴리펩티드는 적당한 박테리아 시스템 및 적당한 박테리아 발현 시스템, 벡터, 숙주 세포, 조절 요소 등에서 발현시킴으로써 생산될 수 있다는 것이며, 이에 관하여는 당 업자들도 잘 알고 있을 것이다[예를 들어, 상기 참고 문헌 참조]. 그러나, 최광의의 본 발명은 박테리아 시스템에서의 발현에 한정되지 않음에 주목해야 할 것이다.
바람직하게, 본 발명에 있어서, (생체 내 또는 시험관 내) 발현 시스템 예를 들어, 박테리아 발현 시스템은 본 발명의 폴리펩티드를 약학적 용도로서 적당한 형태로 제공하는데 사용되며, 이러한 발현 시스템은 또한 당 업자에게 널리 알려져 있다. 당 업자에게 널리 알려져 있는 바와 같이, 약학적 용도로서 적당한 본 발명의 폴리펩티드는 펩티드 합성 기술을 이용하여 제조될 수 있다.
산업적 규모로 생산함에 있어서, 나노바디 또는 나노바디-함유 단백질 치료제를 (산업적으로) 생산하는데 바람직한 이종 숙주로서는, 거대 규모의 발현/생산/발효 특히, 거대 규모의 약학적 발현/생산/발효에 적당한 이.콜라이, 피치아 파스토리스 및 에스.세레비지아에 균주를 포함한다. 이와 같은 균주의 적당한 예는 당 업자에게 널리 알려져 있을 것이다. 이러한 균주와 생산/발현 시스템은 또한 바이오비트럼(Biovitrum)(Uppsala, Sweden)과 같은 회사에 의해 공급되고 있다.
대안적으로, 포유동물 세포주, 특히, 중국 햄스터 난소(CHO) 세포는 거대 규모의 발현/생산/발효, 구체적으로 거대 규모의 약학적 발현/생산/발효에 사용될 수 있다. 뿐만 아니라, 이러한 발현/생산 시스템은 또한 상기 언급한 회사 중 일부에 의해 공급되고 있다.
특정 발현 시스템의 선택 기준은 부분적으로는 어떠한 번역 후 변형, 더욱 구체적으로는 글리코실화에 대한 필요성 여부에 달려 있을 것이다. 글리코실화가 바람직하거나 필요한 나노바디-함유 재조합 단백질을 생산함에 있어서는, 발현된 단백질을 글리코실화시키는 능력을 가지는 포유동물 발현 숙주를 사용할 필요가 있다. 이러한 측면에서, 결과로 확립된 글리코실화 패턴(즉, 부착된 잔기의 종류, 수 그리고 잔기의 부착 위치)은 발현에 사용되는 세포 또는 세포주에 따라 달라질 것이라는 사실은 당 업자에게 명백할 것이다. 바람직하게, 인간 세포 또는 세포주(즉, 본질적으로 인간 글리코실화 패턴을 가지는 단백질을 발현시키는 것) 또는 다른 포유동물의 세포주 중 어느 하나는 본질적으로 및/또는 기능상 인간 글리코실화와 동일하거나 또는 적어도 인간 글리코실화와 유사한 글리코실화 패턴을 제공하는데 사용된다. 일반적으로, 원핵 생물 숙주 예를 들어, 이.콜라이는 단백질을 글리코실화하는 능력을 가지지 않으며, 하등 진핵 생물 예를 들어, 효모를 사용하면 일반적으로 인간 글리코실화 패턴과 상이한 글리코실화 패턴을 얻을 수 있다. 그러나, 전술한 숙주 세포 및 발현 시스템 모두는 원하는 나노바디 또는 단백질이 얻어지는지 여부에 따라서 본 발명에 사용될 수 있다는 것을 이해해야 할 것이다.
그러므로, 본 발명의 하나의 비 제한적 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 글리코실화된다. 본 발명의 기타 비 제한적인 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 글리코실화되지 않는다.
본 발명의 하나의 바람직한 비 제한적 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 박테리아 세포, 특히 거대 규모의 의약품 생산에 적당한 박테리아 세포 예를 들어, 전술한 균주의 세포 내에서 생산된다.
본 발명의 기타 바람직한 비 제한적 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 효모 세포, 특히 거대 규모의 의약품 생산에 적당한 효모 세포 예를 들어, 전술한 균종의 세포에서 생산된다.
본 발명의 또 다른 바람직한 비 제한적 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 포유동물 세포, 특히 인간 세포 또는 인간 세포주의 세포, 더욱 구체적으로 거대 규모의 의약품 생산에 적당한 인간 세포 또는 인간 세포주의 세포 예를 들어, 전술한 바와 같은 세포주 내에서 생산된다.
숙주 세포 내에서의 발현이 본 발명의 나노바디 및 단백질을 생산하는데 사용될 때, 본 발명의 나노바디 및 단백질은 세포 내에서(예를 들어, 시토졸, 세포질 주변 또는 봉입체 내에서) 생산된 후 숙주 세포로부터 분리되고, 임의로는 추가로 정제될 수 있거나; 또는 세포 외에서(예를 들어, 숙주 세포가 배양되고 있는 배지 중에서) 생산된 후 배양 배지로부터 분리되고, 임의로는 추가로 정제될 수 있다. 진핵 생물 숙주 세포가 사용될 때, 세포 외 생산이 일반적으로 바람직한데, 그 이유는 이러한 세포 외 생산이, 생성된 나노바디 및 폴리펩티드의 추가 분리 및 하류 가공(downstream processing)을 촉진하기 때문이다. 전술한 박테리아 세포 예를 들어, 이.콜라이 균주는 일반적으로 단백질 중 소수의 것들 예를 들어, 독소와 용혈 독소를 제외한 단백질을 세포 외로 분비하지 않으므로, 이.콜라이 내에서의 분비 생산이란, 내부 막을 통과하여 단백질이 세포질 주변 공간으로 이동함을 의미하는 것이다. 세포질 주변 생산은 시토졸 생산에 비하여 몇 가지 이점을 제공한다. 예를 들어, 분비된 생산물의 N-말단 아미노산 서열은 특정 신호 펩티다제에 의해 분비 신호 서열이 절단된 후에 생산된 천연 유전자 생산물의 그것과 동일할 수 있다. 또한, 세포질보다 세포질 주변에서의 프로테아제 활성이 더 떨어지는 것으로 확인된다. 뿐만 아니라, 단백질 정제 과정은, 세포질 주변에 오염 단백질이 더욱 적게 존재하기 때문에 보다 간단하다. 다른 이점은, 세포질 주변은 세포질보다 산화 환경이 더욱 강하기 때문에, 올바른 이황화 결합을 형성할 수 있다는 점이다. 이.콜라이 내에서 과발현되는 단백질은 종종 소위 봉입체라고 부르는 불용성 응집물 내에서 발견된다. 이와 같은 봉입체는 시토졸이나 세포질 주변에 위치할 수 있는데, 이와 같은 봉입체로부터 생물학적으로 활성인 단백질을 회수하는데에는 변성/리폴딩 과정이 필요하다. 다수의 재조합 단백질 예를 들어, 치료용 단백질은 봉입체로부터 회수된다. 대안적으로, 당 업자에게 공지되어 있는 바와 같이, 유전적으로 변형되어 원하는 단백질, 구체적으로 본 발명의 나노바디 또는 폴리펩티드를 분비하는 박테리아의 재조합 균주가 사용될 수 있다.
그러므로, 본 발명의 하나의 비 제한적인 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 세포 내에서 생산되고, 숙주 세포, 구체적으로 박테리아 세포 또는 박테리아 세포 내의 봉입체로부터 분리되는 나노바디 또는 폴리펩티드이다. 본 발명의 기타 비 제한적인 구체예에 따르면, 본 발명의 나노바디 또는 폴리펩티드는 세포 외에서 생산되고, 숙주 세포가 배양된 배지로부터 분리되는 나노바디 또는 폴리펩티드이다.
이러한 숙주 세포와 함께 사용되는 몇몇 바람직하되, 비 제한적인 프로모터로서는 다음의 것들을 포함한다;
- 이.콜라이 내 발현용: lac 프로모터(및 이의 유도체 예를 들어, lacUV5 프로모터); 아라비노스 프로모터; 람다 파지의 좌측(PL) 및 우측(PR) 프로모터; trp 오페론의 프로모터; 하이브리드 lac/trp 프로모터(tac 및 trc); T7-프로모터(더욱 구체적으로 T7-파지 유전자 10의 프로모터) 및 기타 T-파지 프로모터; Tn1O 테트라사이클린 내성 유전자의 프로모터; 외부 조절 작동 유전자 서열 중 하나 이상의 복사체를 포함하는 상기 프로모터의 조작된 변이체;
- 에스.세레비지아에 내 발현용:
구성적 프로모터 = ADH1(알콜 탈수소 효소 1), ENO(에놀라제), CYC1(시토크롬 c 이소-1), GAPDH(글리세르알데히드-3-포스페이트 탈수소 효소); PGK1(포스포글리서레이트 키나제), PYK1(피루베이트 키나제);
조절형 프로모터 = GAL 1,10,7(갈락토스 대사 효소), ADH2(알콜 탈수소 효소 2), PHO5(산성 포스파타제), CUP1(구리 메탈로티오네인);
이종 프로모터 = CaMV(꽃 양배추 모자이크 바이러스 35S 프로모터)
- 피치아 파스토리스 내 발현용: AOX1 프로모터(알콜 산화 효소 I)
- 포유동물 세포 내 발현용: 인간 거대 세포 바이러스(hCMV) 인접 조기 인핸서/프로모터; 2개의 테트라사이클린 작동 유전자 서열을 함유하는 인간 거대 세포 바이러스(hCMV) 인접 조기 프로모터 변이체로서, Tet 억제 유전자에 의해 조절될 수 있는 프로모터; 헤르페스 심플렉스 바이러스 티미딘 키나제(TK) 프로모터; 루 육종(Rous Sarcoma) 바이러스 장 말단 반복부(RSV LTR) 인핸서/프로모터; 인간, 침팬지, 마우스 또는 래트 유래 연장 인자 1α (hEF-1α) 프로모터; SV40 조기 프로모터; HIV-1 장 말단 반복 프로모터; β-액틴 프로모터.
이러한 숙주 세포들과 함께 사용되는 몇몇 바람직한 비 제한적 벡터로서는 다음과 같은 것들을 포함한다:
- 포유동물 세포 내 발현용 벡터: pMAMneo(Clontech), pcDNA3(Invitrogen), pMClneo(Stratagene), pSG5(Stratagene), EBO-pSV2-neo(ATCC 37593), pBPV-1(8-2) (ATCC 37110), pdBPV-MMTneo(342-12)(ATCC 37224), pRSVgpt(ATCC 37199), pRSVneo(ATCC 37198), pSV2-dhfr(ATCC 37146), pUCTag(ATCC 37460) 및 1ZD35(ATCC 37565), 그리고 바이러스계 발현 시스템 예를 들어, 아데노바이러스계 발현 시스템;
- 박테리아 세포 내 발현용 벡터: pET 벡터(Novagen) 및 pQE 벡터(Qiagen);
- 효모 또는 기타 진균 세포 내 발현용 벡터: pYES2(Invitrogen) 및 피치아 발현 벡터(Invitrogen);
- 곤충 세포 내 발현 벡터: pBlueBacII(Invitrogen) 및 기타 바큘로바이러스 벡터;
- 식물 또는 식물 세포 내 발현용 벡터: 예를 들어, 꽃 양배추 모자이크 바이러스 또는 담배 모자이크 바이러스계 벡터, 아그로박테리움(Agrobacterium)의 적당한 균주 또는 Ti-플라스미드계 벡터;
이러한 숙주 세포와 함께 사용되는 몇몇 바람직한 비 제한적 분비 서열로서는 다음과 같은 것들을 포함한다:
- 박테리아 세포 예를 들어, 이.콜라이용: PelB, Bla, OmpA, OmpC, OmpF, OmpT, StII, PhoA, PhoE, MalE, Lpp 및 LamB 등; TAT 신호 펩티드, 용혈 독소 C-말단 분비 신호
- 효모용: α-짝 형성 인자(α-mating factor) 프리프로-서열, 포스파타제(pho1), 인버타제(Suc) 등
- 포유동물 세포용: 표적 단백질이 진핵 생물 기원인 경우 고유의 신호; 쥣과 동물의 Ig κ-사슬 V-J2-C 신호 펩티드 등.
본 발명의 숙주 또는 숙주 세포를 형질 전환시키는데 적당한 기술은 당 업자에게 명백할 것이며, 또한 목적 숙주 세포/숙주 유기체와 사용될 유전자 구조물에 따라서 달라질 수 있다. 이에 관한 참고 문헌으로서는 또한 전술한 바와 같은 핸드북과 특허 출원들이 있다.
형질 전환 시킨 후, 본 발명의 뉴클레오티드 서열/유전자 구조물로 성공적으로 형질 전환된 숙주 세포 또는 숙주 유기체를 검출 및 선별하기 위한 단계가 수행될 수 있다. 이러한 단계는 예를 들어, 본 발명의 유전자 구조물에 존재하는 선별 마커를 바탕으로 하는 선별 단계, 또는 예를 들어, 특정 항체를 사용하여 본 발명의 아미노산 서열을 검출하는 것을 포함하는 단계일 수 있다.
형질 전환된 숙주 세포(안정한 세포주의 형태를 가질 수 있음) 또는 숙주 유기체(안정한 돌연변이 세포주 또는 균주의 형태를 가질 수 있음)는 본 발명의 추가의 측면을 이룬다.
바람직하게, 이와 같은 숙주 세포 또는 숙주 유기체는 본 발명의 아미노산 서열을 (예를 들어, 적당한 조건 하에서) 발현하거나, 또는 (적어도) 이 아미노산 서열을 발현할 수 있는 것이다[숙주 유기체의 경우에는 이것의 적어도 하나의 세포, 부분, 조직 또는 기관 내 발현]. 본 발명은 또한 본 발명의 숙주 세포나 숙주 유기체의 추가의 세대, 자손 및/또는 후손을 포함하는데, 이는 예를 들어, 세포 분열 또는 유성 또는 무성 생식에 의해 얻어질 수 있는 것이다.
본 발명의 아미노산 서열을 생산하고/발현시키기 위해서, 형질 전환된 숙주 세포 또는 형질 전환된 숙주 유기체는 일반적으로 본 발명의 (원하는) 아미노산 서열이 발현/생산되는 조건 하에서 보존, 유지 및/또는 배양될 수 있다. 적당한 조건은 당 업자에게 널리 알려져 있을 것이고, 일반적으로는 사용된 숙주 세포/숙주 유기체에 따라서 달라질 것이며, 또한 본 발명의 (관련 있는) 뉴클레오티드 서열의 발현을 제어하는 조절 요소에 따라서도 달라질 것이다. 또한, 본 발명의 유전자 구조물에 관한 상기 문단에서 언급한 핸드북과 특허 출원을 참조하시오.
일반적으로, 적당한 조건은 적당한 배지를 사용하는 것과, 먹이의 적당한 공급원 및/또는 적당한 영양분의 존재 여부, 적당한 온도, 및 임의로는 적당한 유도 인자나 화합물의 존재 여부(예를 들어, 본 발명의 뉴클레오티드 서열이 유도성 프로모터의 제어하에 있을 경우)를 포함하며; 이것들 모두는 당 업자에 의해 선택될 수 있다. 또한, 이러한 조건하에서, 본 발명의 아미노산 서열은 구성적인 방식, 일시적인 방식으로 발현되거나, 또는 적당히 유도될 때에만 발현된다.
본 발명의 아미노산 서열은 (처음에), 사용된 숙주 세포/숙주 유기체에 따라서 추후 번역 후 변형될 수 있는 미성숙한 형태(상기와 같음)로서 생산될 수 있다. 뿐만 아니라, 본 발명의 아미노산 서열은 사용된 숙주 세포/숙주 유기체에 따라서 글리코실화될 수 있다.
이후, 본 발명의 아미노산 서열은, 당 업계에 알려져 있는 단백질 분리 및/또는 정제 기술 예를 들어, (예비) 크로마토그래피 및/또는 전기 영동 기술, 차등 침전 기술(differential precipitation technique), 친화성 기술(예를 들어, 본 발명의 아미노산 서열에 융합된 특정의, 절단 가능한 아미노산 서열을 이용하는 기술) 및/또는 예비적 면역 기술(즉, 분리될 아미노산 서열에 대해 생성된 항체를 이용하는 기술)을 이용하여, 숙주 세포/숙주 유기체, 및/또는 이 숙주 세포 또는 숙주 유기체가 배양된 배지로부터 분리될 수 있다.
일반적으로, 약학적 용도로서, 본 발명의 폴리펩티드는 하나 이상의 본 발명의 폴리펩티드와 하나 이상의 약학적으로 허용 가능한 담체, 희석제 또는 부형제 및/또는 애쥬반트, 그리고 임의로는 하나 이상의 추가의 약학적으로 활성인 폴리펩티드 및/또는 화합물을 포함하는 약학 제제로서 제형화될 수 있다. 비 제한적인 예로써, 이러한 제형은 경구 투여용, 비 경구 투여용(예를 들어, 정맥 내, 근육 내 또는 피하 주사 또는 정맥 내 흡입), 국소 투여용, 흡입, 피부 패취제, 임플란트, 좌제 등에 의한 투여용으로서 적당한 형태를 가질 수 있다. 이와 같이 적당한 투여형(투여 방식에 따라서 고체, 반고체 또는 액체일 수 있는 투여형)과, 투여형의 제조에 사용되는 방법 및 담체는 당 업자에게 널리 알려져 있을 것이며, 이하에 보다 상세히 기술되어 있다.
그러므로, 추가의 측면에서, 본 발명은 본 발명의 하나 이상의 나노바디, 또는 본 발명의 하나 이상의 폴리펩티드, 그리고 하나 이상의 적당한 담체(즉, 수의학적 용도로서 적당한 담체), 그리고 임의로는 하나 이상의 추가 활성 물질을 함유하는 약학 조성물에 관한 것이다.
본 발명의 하나의 구체예는 다음과 같은 부분들을 포함하는 폴리펩티드 구조물에 관한 것이다: 하나 이상의 본 발명의 나노바디 즉, vWF, vWF A1 도메인, 활성화된 vWF의 A1 도메인, vWF A3 도메인 중 임의의 것에 대해 생성된 나노바디.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 여기서, 활성화된 vWF의 A1 도메인에 대해 생성된 본 발명의 나노바디는 혈전이 형성된 부위에 있는 활성화된 형태의 vWF를 인지하되, 혈중 불활성화된 형태의 vWF와는 결합하지 않는다.
본 발명의 나노바디는 또한 vWF 단편, vWF A1 도메인, 활성화된 vWF의 A1 도메인, vWF A3 도메인 예를 들어, 면역 반응을 유도할 수 있는 단편에 대해서도 생성될 수 있다. 표적으로서는 또한 "모(parent)" 전장 표적에 대해 생성된 본 발명의 나노바디와 결합할 수 있는, vWF 단편, vWF A1 도메인, 활성화된 vWF의 A1 도메인, vWF A3 도메인이 있다.
본원에 있어서 단편이란, 서열의 100% 미만(예를 들어, 99%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% 등)에 해당하되, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 또는 25 개 이상의 아미노산을 포함하는 서열을 의미한다. 단편은 목적으로 하는 상호 작용이 친화도 1×10-6M 이상으로 유지되기에 충분한 크기를 가진다.
본원에 사용된 단편이란, 야생형 표적에 대해 생성된 본 발명의 나노바디에 표적이 결합하는 능력을 실질적으로 변형시키지 않는 하나 이상의 아미노산의 임의의 삽입, 결실 및 치환을 의미한다. 아미노산 삽입부, 결실부 또는 치환부의 아미노산의 수는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 또는 70 개 이하의 아미노산인 것이 바람직하다.
표적에 대해 생성된 본 발명의 나노바디란, 이의 표적과 10-6M 이상의 친화도로 결합할 수 있는 본 발명의 나노바디를 의미한다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 여기서, 본 발명의 하나 이상의 나노바디는 인간화된 서열이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 여기서, 본 발명의 하나 이상의 나노바디는 카멜리드 VHH 항체이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 여기서, 본 발명의 나노바디는 본 발명의 전장 나노바디의 상동성 서열, 기능성 부분 또는 이 상동성 서열의 기능성 부분이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 여기서, 상기 폴리펩티드 구조물은 상기 폴리펩티드 구조물의 상동성 서열, 이의 기능성 부분 또는 이 기능성 부분의 상동성 서열이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 이 구조물은 하나 이상의 혈청 단백질, 특히, 하나 이상의 인간 혈청 단백질에 대해 생성된 본 발명의 하나 이상의 나노바디를 추가로 포함한다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물에 관한 것으로서, 여기서, 상기 하나 이상의 (인간) 혈청 단백질은 (인간) 혈청 알부민, (인간) 혈청 면역 글로불린, (인간) 티록신-결합 단백질, (인간) 트랜스페린 또는 (인간) 피브리노겐 또는 이의 단편 중 임의의 것이다.
본 발명의 구체적이되 비 제한적인 측면에 따르면, 본 발명의 폴리펩티드는, 본 발명의 하나 이상의 나노바디 이외에도, 인간 혈청 알부민에 대해 생성된 하나 이상의 나노바디를 함유한다. 인간 혈청 알부민에 대한 나노바디에 관하여는 일반적으로 WO 04/062551에 기술되어 있는바, 또는 이에 인용된 추가의 참고 문헌에 기술되어 있는 바와 같을 수 있는데, 특히 바람직한 비 제한적 구체예에 따르면, 인간 혈청 알부민에 대한 상기 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 이것의
i) CDR1은
SFGMS (서열 번호 44)
LNLMG (서열 번호 45)
INLLG (서열 번호 46)
NYWMY (서열 번호 47)
로 이루어진 군
및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이고; 또한
(ii) CDR2는
SISGSGSDTLYADSVKG (서열 번호 48)
TITVGDSTNYADSVKG (서열 번호 49)
TITVGDSTSYADSVKG (서열 번호 50)
SINGRGDDTRYADSVKG (서열 번호 51)
AISADSSTKNYADSVKG (서열 번호 52)
AISADSSDKRYADSVKG (서열 번호 53)
RISTGGGYSYYADSVKG (서열 번호 54)
로 이루어진 군
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이며;
iii) CDR3은
DREAQVDTLDFDY (서열 번호 55)
로 이루어진 군
또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
또는
GGSLSR (서열 번호 56)
RRTWHSEL (서열 번호 57)
GRSVSRS (서열 번호 58)
GRGSP (서열 번호 59)
로 이루어진 군
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 아미노산 서열이다.
다른 구체예에서, 본 발명은 vWF에 대한 나노바디에 관한 것으로서, 이 나노바디는 4개의 틀 부위(FR1∼FR4)와 3개의 상보성 결정 부위(CDR1∼CDR3)로 이루어져 있으며, 이 나노바디는 다음과 같은 CDR1, CDR2 및 CDR3의 조합 중 어느 하나를 포함하는 나노바디로 이루어진 군으부터 선택된다:
- CDR1 : SFGMS; CDR2 : SISGSGSDTLYADSVKG; CDR3 : GGSLSR;
- CDR1: LNLMG; CDR2 : TITVGDSTNYADSVKG; CDR3 : RRTWHSEL;
- CDR1 : INLLG; CDR2 : TITVGDSTSYADSVKG; CDR3 : RRTWHSEL;
- CDR1 : SFGMS; CDR2 : SINGRGDDTRYADSVKG; CDR3 : GRSVSRS;
- CDR1 : SFGMS; CDR2 : AISADSSDKRYADSVKG; CDR3 : GRGSP;
- CDR1 : SFGMS; CDR2 : AISADSSDKRYADSVKG; CDR3 : GRGSP;
- CDR1 : NYWMY; CDR2 : RISTGGGYSYYADSVKG; CDR3 : DREAQVDTLDFDY.
상기 나열한 CDR 조합을 포함하는 본 발명의 나노바디에 있어서, 각각의 CDR은 상기 나열한 CDR과의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];
및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 아미노산에 있어서 "아미노산 차이"(본원에 정의됨)가 있는 아미노산 서열(이전 문단에 기술됨)로 이루어진 군
[여기서,
(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;
(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]
으로부터 선택되는 CDR에 의해 치환될 수 있다.
그러나, 상기 언급한 CDR의 조합을 포함하는 본 발명의 나노바디 중에서, 상기 나열한 CDR 중 하나 이상을 포함하는 나노바디가 특히 바람직하고; 상기 나열한 CDR 중 2개 이상을 포함하는 나노바디가 더욱 특히 바람직하며; 또한 상기 나열한 CDR 중 3개를 포함하는 나노바디가 가장 특히 바람직하다.
인간 혈청 알부민에 대해 생성된 이와 같은 나노바디에 있어서, 틀 부위 FR1∼FR4는 본 발명의 나노바디에 대해 상기 정의한 바와 같은 것이 바람직하다.
인간 혈청 알부민에 대해 생성된, 특히 바람직한 나노바디는 서열 번호 107∼서열 번호 121로 이루어진 군으로부터 선택된다. 이와 같은 나노바디는 본 출원인의 공동 계류중인 US 가 명세서 출원[발명의 명칭:"Improved Nanobodies™ against Tumor Necrosis Factor-alpha"(출원일: 2005년 5월 18일)]의 서열 번호 61∼서열 번호 67, 서열 번호 87∼서열 번호 89 및 서열 번호 100∼서열 번호 104의 인간 혈청 알부민에 대한 나노바디에 해당한다.
더욱 일반적으로, 본 발명에 사용하기 적당한, 혈청 알부민에 대한 나노바디에 관하여는 본 출원인에 의한 국제 출원[발명의 명칭:"serum albumin binding proteins"(2006년 5월 17일 출원)]에 개시되어 있다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물을 암호화하는 핵산에 관한 것이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물과 하나 이상의 혈전 용해제를 포함하는, 개체에 동시 투여, 개별 투여 또는 연속 투여되는 조성물에 관한 것이다.
본 발명의 다른 구체예는 전술한 바와 같은 조성물에 관한 것으로서, 상기 혈전 용해제로서는 스타필로키나제, 조직 플라스미노겐 활성 인자, 스트렙토키나제, 단일 사슬 스트렙토키나제, 유로키나제 및 아실 플라스미노겐 스트렙토키나제 복합체 중 임의의 것이 있다.
본 발명의 다른 구체예는 혈소판-매개 응집 관련 질환 또는 기능 장애의 치료, 예방 및/또는 완화용인, 전술한 바와 같은 폴리펩티드 구조물, 또는 전술한 바와 같은 핵산, 또는 조성물에 관한 것이다.
본 발명의 다른 구체예는 혈소판-매개 응집과 관련된 질환 또는 기능 장애의 치료, 예방 및/또는 완화용 의약품의 제조용인, 전술한 바와 같은 폴리펩티드 구조물, 또는 전술한 바와 같은 핵산, 또는 조성물에 관한 것이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물, 핵산 또는 조성물, 또는 이러한 폴리펩티드 구조물, 핵산 또는 조성물의 용도에 관한 것으로서, 여기서, 질환으로서는 일과성 뇌 허혈 발작증, 불안정 또는 안정 협심증, 협심증, 뇌경색, 심근 경색, 말초 동맥 폐색성 질병, 재발 협착증, 관상 동맥 우회로 이식 조성술, 관상 동맥 판막 치환술 및 관상 동맥 개입술 예를 들어, 혈관 형성술, 스텐트 삽입술, 경동맥 내막 절제술 또는 죽종 절제술로부터 유발되는 임의의 질환이 있다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물, 핵산 또는 조성물, 또는 전술한 바와 같은 폴리펩티드 구조물, 핵산 또는 조성물의 용도에 관한 것으로서, 여기서, 질환으로서는 비-폐색성 혈전 형성증, 폐색성 혈전 형성증, 동맥 혈전 형성증, 급성 관상 동맥 폐색증, 재발 협착증, PCTA 또는 스텐트 삽입술 이후의 재발 협착증, 협착 동맥에서의 혈전 형성증, 혈관 형성술, 죽종 절제술 또는 동맥 스텐트 삽입술 이후에 발생하는 과형성증, 혈관계에서의 폐색성 증후군 또는 발병 동맥의 비 개통증 중 임의의 질환이 있다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물, 핵산 또는 조성물, 또는 전술한 바와 같은 폴리펩티드 구조물, 핵산 또는 조성물의 용도에 관한 것으로서, 여기서, 질환으로서는 고 전단 환경 하에서의 플라크 또는 혈전 형성증이 있다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물, 핵산 또는 조성물, 또는 전술한 바와 같은 폴리펩티드 구조물의 용도에 관한 것으로서, 상기 폴리펩티드 구조물은 정맥 내, 피하, 경구, 설하, 국소, 비강 내, 질 내, 직장 내 투여되거나, 또는 흡입에 의해 투여된다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물 또는 이러한 폴리펩티드 구조물을 암호화하는 핵산, 또는 전술한 바와 같은 조성물과 약학적으로 허용 가능한 담체를 포함하는 조성물에 관한 것이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드를 생산하는 방법에 관한 것으로서, 이 방법은 다음과 같은 단계들을 포함한다:
(a) 전술한 바와 같은 폴리펩티드를 암호화할 수 있는 핵산을 포함하는 숙주 세포를, 이 폴리펩티드를 발현시킬 수 있는 조건 하에서 배양하는 단계; 및
(b) 생산된 폴리펩티드를 이 배양액으로부터 회수하는 단계.
본 발명의 다른 구체예는 전술한 바와 같은 방법에 관한 것으로서, 이 방법에 있어서 숙주 세포는 박테리아 또는 효모이다.
본 발명의 다른 구체예는 침투 부위 주변에서의 혈소판-매개 응집을 예방하기 위해 삽입용 의료 장치를 처리하는 방법에 관한 것으로서, 이 방법은 상기 장치를 전술한 바와 같은 폴리펩티드 구조물로 코팅시키는 단계를 포함한다.
본 발명의 다른 구체예는 침투 부위 주변에서의 혈소판-매개 응집을 방지하기 위한 삽입용 의료 장치에 관한 것으로서, 상기 장치는 전술한 바와 같은 폴리펩티드 구조물로 코팅되어 있다.
본 발명의 다른 구체예는 혈소판-매개 응집을 조정하는 제제를 동정하는 방법에 관한 것으로서, 이 방법은
(a) 폴리펩티드들이 결합될 수 있는 조건 하에, 후보 조정 인자의 존재 및 부재 하에서, 전술한 바와 같은 폴리펩티드 구조물과 이의 표적에 해당하는 폴리펩티드 또는 이의 단편을 접촉시키는 단계; 및
(b) 상기 단계 (a)의 폴리펩티드들 사이의 결합 능을 측정하는 단계로서, 여기서, 상기 후보 조정 인자의 부재 하에서의 결합 능에 비하여 상기 후보 조정 인자의 존재하에서의 결합 능이 감소하였음을 통하여, 상기 후보 조정 인자는 혈소판-매개 응집을 조정하는 제제라는 것을 확인하는 단계
를 포함한다.
본 발명의 다른 구체예는 전술한 바와 같은 방법에 따라서 혈소판-매개 응집을 조정하는 제제를 스크리닝하기 위한 키트에 관한 것이다.
본 발명의 다른 구체예는 전술한 바와 같은 방법에 따라서 동정되는 혈소판-매개 응집을 조정하는 미지의 제제에 관한 것이다.
본 발명의 다른 구체예는 혈소판-매개 응집의 기능 장애를 특징으로 하는 질병 또는 질환을 진단하는 방법에 관한 것으로서, 이 방법은 다음과 같은 단계들을 포함한다:
(a) 전술한 바와 같은 폴리펩티드 구조물과 시료를 접촉시키는 단계;
(b) 상기 시료와 상기 폴리펩티드 구조물이 결합하는지 여부를 검출하는 단계; 및
(c) 상기 단계 (b)에서 검출된 결합 능을 표준과 비교하는 단계로서, 여기서, 상기 시료에 대한 결합 능의 차이는 혈소판-매개 응집의 기능 장애를 특징으로 하는 질병 또는 질환을 진단하는 수단이 되는 것인 단계.
본 발명의 다른 구체예는 전술한 바와 같은 방법에 따라서 혈소판-매개 응집의 기능 장애를 특징으로 하는 질병 또는 질환을 진단하기 위해 스크리닝하는 키트에 관한 것이다.
본 발명의 다른 구체예는 전술한 바와 같은 폴리펩티드 구조물을 포함하는, 전술한 바와 같은 키트에 관한 것이다.
본 발명의 폴리펩티드에 있어서, 본 발명의 하나 이상의 나노바디 즉, 표적에 대해 생성된 나노바디는 동일한 서열의 것일 수 있다. 대안적으로, 본 발명의 나노바디는 모두 동일한 서열을 가질 수는 없다. 폴리펩티드가 모두 동일한 서열을 공유하지는 않되, 동일한 표적이나 이것의 단편, 또는 이것의 하나 이상의 항원에 대해 생성된 항-표적 나노바디를 포함하는 본 발명의 폴리펩티드도 본 발명의 범위 내에 포함된다.
본 발명의 폴리펩티드가 본 발명의 나노바디를 2개 이상 포함한다는 사실도 본 발명의 다른 측면에 해당하는데, 여기서, 본 발명의 임의의 2개의 나노바디는 상이한 에피토프들/표적들 즉, vWF, vWF A1 도메인, 활성화된 vWF의 A1 도메인, vWF A3 도메인 중 임의의 것에 대해 생성되는 것이다.
본 발명의 다른 측면은 vWF A1 도메인, 활성화된 vWF의 A1 도메인에 대해 생성된 본 발명의 나노바디와, vWF A3 도메인에 대해 생성된 본 발명의 다른 나노바디를 포함하는 본 발명의 이중 특이적 폴리펩티드에 관한 것이다. 본 발명의 이중 특이적 폴리펩티드는 vWF와 콜라겐 사이의 상호 작용과, vWF와 혈소판 사이의 상호 작용을 억제한다.
본 발명의 하나의 측면에 따르면, 본 발명의 폴리펩티드는 결합되어 있는 본 발명의 2개 이상의 나노바디를 포함할 수 있다. 본 발명의 나노바디는 서열이 동일할 수 있으며, 동일한 표적 또는 항원에 대해 생성될 수 있다. 결합된 VHH의 수에 따라서, 다가 VHH는 2가(2 VHH), 3가(3 VHH), 4가(4 VHH)일 수 있거나, 또는 더욱 가수가 큰 분자를 가질 수 있다.
본 발명은 또한 놀랍게도, 개체의 혈청 단백질에 대해 생성된 하나 이상의 본 발명의 나노바디를 추가로 포함하는, 본 발명의 폴리펩티드의 개체 혈류 내 반감기가, 상기 구조물의 일부분이 아닌, 본 발명의 항-표적 나노바디의 반감기에 비하여 상당히 증가한다는 사실을 바탕으로 한 것이기도 하다. 뿐만 아니라, 상기 구조물은 VHH의 바람직한 특성 예를 들어, 마우스 내에서 원래 상태대로 유지되는 높은 안정성, 극한의 pH에 대한 저항성, 고온에 대한 안정성 및 표적에 대한 높은 친화성과 동일한 특성을 나타내는 것으로 확인되었다.
혈청 단백질은 개체의 혈청 중에서 발견되는 임의의 적당한 단백질 또는 이의 단편일 수 있다. 본 발명의 하나의 측면에서, 상기 혈청 단백질은 혈청 알부민, 혈청 면역 글로불린, 티록신-결합 단백질, 트랜스페린 또는 피브리노겐이다. 의도로 하는 용도 예를 들어, 표적 항원의 효율적인 처리 및/또는 구획화를 위해 필요한 반감기에 따라서, VHH-파트너는 전술한 혈청 단백질 중 하나에 대해 생성될 수 있다.
이러한 구조물은 수일 동안 개체의 혈청 내에서 순환할 수 있으므로, 처리 횟수와 개체가 느끼는 불편함을 줄일 수 있고, 그 결과 처리 비용도 줄일 수 있게된다. 뿐만 아니라, 본원에 개시된 본 발명의 폴리펩티드의 반감기는 상기 구조물에 존재하는 본 발명의 나노바디를 포함하는 항-혈청 단백질의 수에 의해 조절될 수 있다는 사실도 본 발명의 한 측면을 이룬다. 제어 가능한 반감기는 몇몇 환경 예를 들어, 본 발명의 치료용 폴리펩티드를 시간에 맞춰 투여하는 경우에 바람직하다.
본 발명의 다른 구체예는 혈전 용해제를 추가로 포함하는, 전술한 바와 같은 본 발명의 폴리펩티드에 관한 것이다.
상기 혈전 용해제는 공유적 수단 또는 비-공유적 수단을 통하여 본 발명의 나노바디에 비-공유 또는 공유 결합될 수 있다. 이러한 공유적 수단에 관하여는 이하에 기술되어 있다. 비-공유적 수단으로서는 단백질 상호 작용 예를 들어, 바이오틴/스트렙타비딘, 또는 면역 컨쥬게이트를 포함한다.
대안적으로, 혈전 용해제는 동시에, 개별적으로 또는 연속적으로 본 발명의 폴리펩티드와 관련하여 투여될 수 있다.
본 발명의 다른 측면은 본 발명의 하나 이상의 폴리펩티드와 하나 이상의 혈전 용해제를 포함하는, 개체에 동시 투여, 개별 투여 또는 연속 투여하기 위한 조성물에 관한 것이다.
본 발명의 하나의 측면은 유효량만큼의 본 발명의 하나 이상의 폴리펩티드와 하나 이상의 혈전 용해제를 동시에, 개별적으로 또는 연속적으로 투여하는 단계를 포함하는, 자가 면역성 질병을 치료하는 방법에 관한 것이다.
본 발명의 다른 측면은 본 발명의 하나 이상의 폴리펩티드와 하나 이상의 혈전 용해제를 포함하는, 개체에 동시 투여, 개별 투여 또는 연속 투여하기 위한 키트에 관한 것이다. 상기 키트는 본 발명에 따라서 사용될 수 있다는 사실은 본 발명의 한 측면을 이룬다. 상기 키트는 본원에 개시된 질병을 치료하는데 사용될 수 있다는 사실도 본 발명의 한 측면을 이룬다.
동시 투여란, 폴리펩티드와 혈전 용해제를 개체에 동시에 투여하는 것을 의미하는 것이다. 예를 들어, 상기 성분들의 혼합물 또는 이 성분들을 포함하는 조성물로서 동시에 개체에 투여하는 것을 의미하는 것이다. 이와 같은 혼합물 또는 조성물의 예로서는 정맥 내 투여되는 용액, 정제, 액체, 국소 도포용 크림 등을 포함하나, 이에 한정되는 것은 아니며, 각각의 제제는 목적으로 하는 성분들을 포함한다.
개별 투여란, 폴리펩티드와 혈전 용해제를 개체에 동시에 또는 실질적으로 동시에 투여하는 것을 의미하는 것이다. 이 성분들은 별도의 혼합되지 않은 제제로서 키트 내에 존재한다. 예를 들어, 상기 폴리펩티드와 혈전 용해제는 키트 내에 개별 정제로서 존재할 수 있다. 이 정제는, 두 개의 정제를 한꺼번에 삼키던지, 아니면 하나의 정제를 삼킨 후 바로 나머지 정제를 삼킴으로써 개체에 투여될 수 있다.
연속 투여란, 폴리펩티드와 혈전 용해제를 개체에 연속적으로 투여하는 것을 의미하는 것이다. 이 폴리펩티드와 혈전 용해제는 키트 내에 별도의 혼합되지 않은 제제로서 존재한다. 이는 투여 간 어느 정도의 시간 간격이 있는 경우이다. 예를 들어, 하나의 성분은 다른 성분이 투여된 이후 336, 312, 288, 264, 240, 216, 192, 168, 144, 120, 96, 72, 48, 24, 20, 16, 12, 8, 4, 2, 1 또는 0.5시간 이하의 간격으로서 투여될 수 있다.
연속 투여에 있어서, 하나의 성분은 다른 성분을 투여하기 전 및/또는 투여한 후, 1회 또는 다수 회에 걸쳐서 다양한 투여량으로 투여될 수 있다. 연속 투여는 동시 투여 또는 연속 투여와 함께 이루어질 수 있다.
이하에 기술된 본 발명의 폴리펩티드의 의학적 용도는 또한 본 발명의 폴리펩티드와 하나 이상의 폴리펩티드 혈전 용해제를 포함하는, 개체에 동시, 개별 또는 연속 투여하기 위한 조성물에도 적용된다.
본 발명에 따른 혈전 용해제로서는 예를 들어, 스타필로키나제, 조직 플라스미노겐 활성 인자, 스트렙토키나제, 단일 사슬 스트렙토키나제, 유로키나제 및 아실 플라스미노겐 스트렙토키나제 복합체를 포함할 수 있다.
본 발명의 나노바디는 당 업계에 공지된 방법 또는 미래에 발명될 임의의 방법을 이용하여, 본 발명의 하나 이상의 나노바디를 포함하는, 본원에 개시된 본 발명의 폴리펩티드 중 임의의 것을 형성하도록 결합될 수 있디. 예를 들어, 이 나노바디는 아미노산 잔기와 유기 유도체화 제제[예를 들어, Blattler외 다수, Biochemistry 24, 1517-1524; EP294703 참조]의 반응에 의해 화학적으로 가교됨으로써 융합될 수 있다. 대안적으로, 본 발명의 나노바디는 DNA 수준에서 유전적으로 융합될 수 있는데, 즉, 하나 이상의 본 발명의 항-표적 나노바디와 하나 이상의 본 발명의 항-혈청 단백질 나노바디를 포함하는, 본 발명의 완전한 폴리펩티드를 암호화하는 폴리뉴클레오티드 구조물을 형성할 수 있다. 본 발명의 2가 또는 다가의 VHH 폴리펩티드를 생산하는 방법에 관하여는 PCT 특허 출원 WO 96/34103에 개시되어 있다. 본 발명의 다수의 나노바디들을 연결시키는 한 가지 방법으로서는, 직접적으로 또는 펩티드 링커를 통하여 본 발명의 나노바디 암호화 서열을 결합시켜 유전적 경로를 통하는 방법이 있다. 예를 들어, 본 발명의 제1 나노바디의 C-말단부는 본 발명의 그 다음 나노바디의 N-말단부에 결합될 수 있다. 이와 같은 결합 방식은 3가 또는 4가의 기능성 구조물의 구성 및 생산을 위한, 본 발명의 부가의 나노바디를 결합시키기 위한 것으로 확장시킬 수 있다.
본원에 기술된 본 발명의 폴리펩티드 구조물은 당 업계에 공지된 방법 또는 미래에 발명될 임의의 방법에 따라서 당 업자에 의해 제조될 수 있다. 예를 들어, VHH는 당 업계에 공지된 방법 예를 들어, 낙타를 면역화시켜서 이것으로부터 하이브리도마를 얻어내거나, 또는 당 업계에 공지된 분자 생물학적 기술을 이용하여 본 발명의 나노바디의 라이브러리를 클로닝한 후 파지 디스플레이법을 이용하여 선별해 내는 방법을 이용하여 제조될 수 있다.
나노바디는 단일 가변 도메인으로 이루어진 독특한 구조를 가진다. 카멜리드 항체로부터 유래하는 VHH 분자는 공지의 가장 작은 원형 항원-결합 도메인(약 15kDa, 종래의 IgG 보다 10배 작음)이므로, 밀집 조직에 전달되고, 혈소판-매개 응집 과정에 참여하거나 또는 이 과정을 개시하는 거대 분자 사이의 한정된 공간에 접근하기에 적당하다.
나노바디의 작은 크기와 이로 인한 침투시의 이점에도 불구하고, 이렇게 작은 분자가 거대한 중합체 예를 들어, vWF(60개 이하의 단량체로 이루어짐)와 콜라겐 사이의 상호 작용을 고 효율로 억제할 수 있다는 사실은 여전히 놀랍다. vWF의 거대한 다량체 형태만이 지혈 작용에 있어서 활성을 나타낸다고 기술된 바 있다[Furlan, M,. 1996, Ann. Hematol. 72:341-348]. 다량체인 vWF와 콜라겐의 결합은 단량체 vWF 단편과의 결합의 경우에 비하여 약 100배 이상의 친화도로 발생한다.
고 전단 실험을 통하여 얻어진 결과들은, 환자에게 적은 투여량으로 투여할 수 있음을 말해주는 것이다. 그러므로, 부작용(예를 들어, 면역원성 또는 출혈상의 문제점)도 감소할 것으로 예측된다.
본 발명의 다른 구체예에 있어서, 본 발명의 폴리펩티드는 동일한 표적에 대해 생성된 본 발명의 하나 이상의 나노바디를 포함하며, 추가로 동일한 표적에 대해 생성되되 동일한 도메인에 존재하는 상이한 에피토프에 대해 생성된 것인 본 발명의 나노바디를 하나 이상 포함한다.
본 발명의 다른 구체예는 본 발명의 폴리펩티드에 관한 것으로서, 동일한 표적에 대해 생성된 본 발명의 나노바디의 수는 2개 이상이다.
본 발명의 다른 구체예에 있어서, 본 발명의 폴리펩티드는 동일한 표적의 하나의 도메인에 대해 생성된 본 발명의 나노바디 하나 이상과, 동일한 표적에 대해 생성되되 동일한 표적의 다른 도메인에 대해 생성된 것인 하나 이상의 나노바디를 포함한다. 상이한 도메인의 예로서는 vWF의 A1 및 A3 도메인이 있다.
본 발명의 이종 특이적 폴리펩티드 내 A1 도메인에 대해 생성된 하나 이상의 VHH는 vWF의 활성 형태를 인지한다는 사실은 본 발명의 하나의 비 제한적인 측면에 해당한다. 이러한 본 발명의 폴리펩티드는 단량체 VHH보다 훨씬 더 우수한 항 혈전 효과를 나타낼 수 있다. 관류 실험을 유동성 챔버 내에서 수행하여, 고 전단 조건 하에서의 혈소판 응집 현상을 연구하였으며, 그 결과 본 발명의 폴리펩티드의 효과를 알게 되었다.
라마, 단봉 낙타 및 낙타에서 본 발명의 천연 생성 나노바디를 발견하였는데, 이를 통하여, 모노클로날 항체의 이점들 예를 들어, 특이성, 낮은 독성과 작은 분자의 이점 예를 들어, 조직 투과성 및 안정성을 주합한, 치료용 분자의 새로운 군이 규명되었다. 그러나, 불행하게도, 이와 같은 단백질을 바탕으로 하는 적당한 치료용 생산물의 개발에는 단점 즉, 인간으로부터 유래한 것이 아닌, 카멜리드로부터 유래하는 것이라는 단점이 있다. 비-인간 단백질은 인간인 환자에게 주사되었을 때 면역원성을 가질 수 있는 아미노산 잔기들을 함유한다. 연구 결과, 카멜리드-유래 VHH가 마우스에 주사되었을 때 면역원성이 아니라는 점을 알아냈음에도 불구하고, 카멜리드 잔기들을 인간의 잔기들로 치환하는 것이 바람직하다. 이와 같은 인간화된 폴리펩티드는 실질적으로 인간에 있어서 비-면역원성이어야 하나, 야생형 폴리펩티드의 친화성과 활성도 보유하여야 한다.
인간화의 결과는 인간 환자에게 투여하였을 때 면역원성이 최소이거나 나타나지 않아야 바람직하다. 본 발명에 따라서, 폴리펩티드를 인간화하는 과정은, 이 폴리펩티드의 전형적인 특징을 상실시키지 않고서, 카멜리드 아미노산 중 하나 이상을 인간 공통 서열에서 발견되는 아미노산과 치환하는 단계를 포함하는데, 즉, 인간화는 결과로 생성되는 폴리펩티드의 항원 결합 능에 거의 영향을 미치지 않는다.
WO 04/062551과 본원의 추가의 상세한 설명에는, 항체 가변 도메인(VHH)의 아미노산 잔기의 몇몇 바람직한 비 제한적인 예[여기서, 이 아미노산 잔기는 항원에 대한 도메인의 원래 가지고 있던 친화성을 감소시키지 않으면서 이종의 종에 관한 면역원성을 감소시키도록 변형될 수 있음]; 이종 종에 투여하기에 유용한 것으로 확인된 잔기가 변형된 VHH의 용도; 그리고 이와 같이 변형된 VHH에 관하여 기술되어 있다. 더욱 구체적으로, 본 발명은 또한 인간에게 투여하기 위해 변형시킨 변형 VHH의 제제와, 결과로 생성된 이들 VHH 자체, 그리고 인간 질병을 치료함에 있어서의 이러한 "인간화된" VHH의 용도를 포함한다.
WO 04/062551과 본원의 추가의 상세한 설명에 언급된 바와 같이, VHH 폴리펩티드의 인간화에서는 결합 활성 및/또는 억제 활성을 거의 상실시키지 않고, 단일 폴리펩티드 사슬에 존재하는 제한된 수의 아미노산만을 도입 및 돌연 변이시킬 필요가 있다. 이는 2개의 사슬, 경쇄 및 중쇄 내에 아미노산 변이를 도입하고, 상기 양 사슬의 조립체를 보존하는 과정이 필요한, scFv, Fab, (Fab)2 및 IgG의 인간화와는 대조적이다.
인간화 기술은 다음과 같은 잔기들 중 임의의 것만을 치환하거나, 또는 이들을 조합하여 치환하는 과정을 포함하는 방법에 의하여 수행될 수 있다: FR1(1, 5, 28 및 30번 위치), FR2(37, 44, 45 및 47번 위치의 인증 아미노산), FR3(74, 75, 76, 83, 84, 93 및 94번 위치), FR4(103, 104, 108 및 111번 위치)(번호 메김은 캐벗 번호 메김 방식에 따름).
본 발명의 나노바디는 인간 생식 계열 VH DP-47과의 상동성이 크다. 또한, 인간화는 단일 폴리펩티드 사슬 내 아미노산을 제한된 수만큼 도입하여 돌연 변이시키는 단계를 포함할 수도 있다. 이는 2개의 사슬, 경쇄 및 중쇄 내에 아미노산 변이를 도입하고, 상기 양 사슬의 조립체를 보존하는 과정이 필요한, scFv, Fab, (Fab)2 및 IgG의 인간화와는 대조적이다.
본 발명의 폴리펩티드는 FR2 내 인간-유사 잔기를 함유한다. 인간화는 또한 레파토리 클로닝에 사용된 프라이머에 의해 도입되었으며, 라마 서열 내에서 천연 생성되지 않는, FR1 내 1번 및 5번 위치의 잔기를 돌연 변이시키는 단계를 포함할 수도 있다. 이러한 잔기를 돌연 변이시켰을 때, 결합 및/또는 억제 활성은 상실되지 않았다. FR1의 인간화에는 또한 28번 및 30번 위치를 돌연 변이시켜야 한다. 이러한 잔기들을 돌연 변이시키면, 결합 및/또는 억제 활성은 상실되지 않았다.
인간화는 또한 FR3 내 74, 75, 76, 83, 84, 93 및 94번 위치의 잔기를 돌연 변이시키는 과정을 포함할 수도 있다. 이러한 잔기들을 돌연 변이시켰을 때 결합 및/또는 억제 활성은 상실되지 않았다.
인간화는 또한 FR4의 104, 108 및 111번 위치에 있는 잔기를 돌연 변이시키는 과정을 포함할 수도 있다. Q108L을 돌연 변이시키면, 에스케리챠 콜라이 내에서의 생산 수준이 더욱 낮아진다. 카멜리드 VHH에 있어서 108번 위치는 용매에 노출되는 반면에, 인간 항체에 있어서 상기 위치는 VH-VL 계면에 묻히게 된다[Spinelli, 1996; Nieba, 1997]. 분리된 VH에 있어서, 108번 위치는 용매에 노출된다. 극성이고 비하전인 Gln 대신에 비 극성이고 소수성인 Leu을 도입시키면, 분자가 원래부터 가지고 있던 폴딩 특성/안정성에 지대한 영향을 미칠 수 있다.
본 발명의 하나의 구체예에 따르면, VHH를 인간화하는 방법은 다음과 같은 잔기들 중 임의의 것을 단독으로 또는 함께 치환시키는 과정을 필요로 한다:
- FR1의 1, 5, 28 및 30번 위치,
- FR2의 37, 44, 45 및 47번 위치의 인증 아미노산,
- FR3의 74, 75, 76, 83, 84, 93 및 94 번 잔기, 및
- FR4의 103, 104, 108 및 111 번 위치;
(번호는 캐벗의 번호 메김 방식에 따름).
이와 같은 인간화된 서열의 예는 이하 및 첨부된 서열 목록에 제시되어 있다.
예를 들어, 마우스, 양, 염소, 토끼 등과 같은 공급원으로부터 유래되는 항체와 이의 인간화된 유도체를 혈소판 관련 응집의 조정을 필요로 하는 병상의 치료용으로서 사용하는 것은 몇 가지 이유에서 문제가 있다. 전통적인 항체는 실온에서 안정하지 않으므로 제조 및 보관을 위해서는 냉장해야만 하고, 이를 위해서는 실험실용 냉장 기구가 필요할 것이므로, 보관과 운송에 시간과 비용이 소모된다. 냉장 시설은 종종 개발 도상 국가에서는 여의치 않다. Fab 분자의 발현 수율(expression yield)은 매우 낮기 때문에, 생산 방법은 노동 집약적인 과정에 속한다. 또한, 상기 항체를 제조하거나 소규모로 생산하는데에는 비용이 많이 드는데, 그 이유는 원형 그대로의 활성 항체를 발현하는데 필요한 포유동물 세포 시스템은 오랜 시간과 이를 유지할 수 있는 고급 장치를 필요로 하고, 수율도 매우 낮기 때문이다. 뿐만 아니라, 종래의 항체는 pH에 따라서 결합 활성이 달라지므로, pH 범위가 일반적인 생리학적 수준으로 조성되어 있는 외부 환경에 노출될 때, 예를 들어, 위 내 출혈의 치료 또는 위 수술시에 사용하기에는 적당하지 않다. 뿐만 아니라, 종래의 항체는 낮은 pH 또는 높은 pH에서 불안정하므로, 경구 투여용으로서도 적당하지 않다. 그러나, 카멜리드 항체는 극한 조건 예를 들어, 극한의 pH, 변성 시약의 존재 및 고온에서도 견뎌낼 수 있다는 사실이 입증된바 있으므로[Ewert S외 다수, Biochemistry 2002 Mar 19;41(11):3628-36], 이 항체를 경구 투여에 의한 전달용으로서 적당하도록 만들 수 있게 되었다. 뿐만 아니라, 종래의 항체는 온도에 따라서 달라지는 결합 활성을 가지므로, 생물학적으로 활성인 온도 범위(예를 들어, 37±20℃)를 벗어나는 온도에서 수행/사용되는 검정법이나 키트에 사용하기에는 적당하지 않다.
본 발명의 나노바디 및 폴리펩티드는 종래의 항체의 유리한 특징 예를 들어, 낮은 독성 및 높은 특이성만 가지는 것이 아니라, 부가적인 특성도 가진다. 본 발명의 나노바디 및 폴리펩티드는 보다 가용성인데, 이는 곧, 이것이 종래의 항체에 비하여 높은 농도로 보관 및/또는 투여될 수 있음을 의미한다. 본 발명의 나노바디 및 폴리펩티드는 실온에서 안정한데, 이는 곧, 냉장 설비를 사용하지 않고, 비용, 시간 그리고 환경을 보존할 수 있도록, 제조, 보관 및/또는 운송될 수 있음을 의미하는 것이다. 종래의 항체에 비한 기타 이점으로서는, 예를 들어, 혈류 중 반감기가 짧다는 점을 포함하는데, 이러한 특성은 예를 들어, 알부민 커플링, 알부민에 대한 특이성 인자와, 표적에 대한 특이성 인자를 가지는 이중 특이적 나노바디 형성, Fc 커플링, VHH 커플링(2가 VHH)에 의하거나, 또는 페그화에 의하여 본 발명에 따라 조정될 수 있다. 짧고 제어 가능한 반감기는 예를 들어, 제한된 시간 동안 혈소판-매개 응집을 억제할 필요가 있는 수술 과정에 바람직하다. 뿐만 아니라, 출혈로 인한 문제 또는 기타 합병증으로 인한 문제가 발생하였을 때, 즉시 투여량을 줄일 수 있다. 본 발명의 폴리펩티드는 또한 일반적인 생리학적 범위를 넘는 pH 및 온도 범위에서도 결합 활성을 보유하는데, 이는 곧, 상기 폴리펩티드가 혈소판-매개 응집을 조정할 필요가 있는 극한의 pH와 온도 환경 예를 들어, 위 수술, 위 출혈 억제, 실온에서 수행되는 검정법에서 유용할 수 있음을 의미한다. 본 발명의 폴리펩티드는 또한 극한의 pH에서도 오랜 기간 동안 안정성을 가지는데, 이는 곧 상기 폴리펩티드가 경구 투여에 의한 전달에 적당하다는 의미이다. 본 발명의 폴리펩티드는 편리한 재조합 숙주 유기체 예를 들어, 에스케리챠 콜라이 및 효모에서의 발효를 통해 비용 효율이 높게 생산될 수 있는데; 비용이 많이 드는 포유동물 세포 배양 설비를 필요로 하는 종래의 항체와는 달리, 발현 수준도 높일 수 있다. 본 발명의 폴리펩티드 수율의 예로서는 1∼10㎎/㎖(이.콜라이) 및 1g/ℓ 이하(효모)가 있다. 본 발명의 폴리펩티드도 상이한 유형을 가지는 광범위한 항원에 대한 결합 친화성이 높고, 종래의 항체에 의해서는 인지되지 않는 에피토프에 결합하는 능력도 높은데; 예를 들어, 상기 폴리펩티드는 공동(cavity)을 투과할 수 있는 능력을 가지는 긴 CDR계 루프 구조를 가지고, 또한 효소 기능도 억제한다. 뿐만 아니라, 결합은 종종 CDR3 루프만을 통하여 나타나므로, CDR3로부터 유래하는 펩티드를 치료용으로 사용할 수 있게 되었다[Desmyter외 다수, J Biol Chem, 2001, 276: 26285-90]. 본 발명의 폴리펩티드는 또한 효소 또는 독소와의 융합 단백질로서 온전한 결합 능을 보유할 수 있다. 뿐만 아니라, 생체 내에서 원상태의 IgG 또는 F(ab')2를 치료용으로 사용할 때 관찰되는, 혈소판 응집의 Fc:Fc 수용체 매개 활성화 및/또는 F(ab')2-매개 혈소판 가교에 의해 유발되는, 원치 않는 혈소판 감소증은[Cauwenberghs N.외 다수, Arteriosclerosis, Thrombosis and Vascular biology, 2000, 20: 1347], VHH를 사용할 경우에는 발생하지 않을 것으로 기대되는데, 그 이유는 이 VHH가 Fc을 함유하지 않고, 2가인 것도 아니기 때문이다. 그러므로, 본 발명의 폴리펩티드, 이의 상동체 또는 기능성 부분은 혈소판-매개 응집과 관련된 병상의 치료 및 진단에 있어서 비용과 시간을 상당히 절약해주고, 이 폴리펩티드를 필요로 하는 환자에서는 종래의 제제가 안고 있던 문제점들이 거의 나타나지 않게 될 것이다.
혈소판-매개 응집은 vWF-결합 콜라겐이 혈소판 및/또는 혈소판 수용체에 부착하여, 궁극적으로는 혈소판을 활성화시키는 과정이다. 혈소판 활성화로 인하여 피브리노겐을 결합시키게 되고, 결국에는 혈소판을 응집시킨다. 혈소판-매개 응집 예를 들어, vWF-콜라겐 결합, vWF-혈소판 수용체 부착, 콜라겐-혈소판 수용체 부착, 혈소판 활성화, 피브리노겐 결합 및/또는 혈소판 응집을 포함하는 과정을 조정하는 폴리펩티드를 제공하는 것은 본 발명의 범위에 포함된다.
본 발명의 하나의 측면에 따르면, 본 발명의 폴리펩티드는 본 발명의 전장 폴리펩티드의 상동성 서열일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드는 본 발명의 전장 폴리펩티드의 기능성 부분일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드는 본 발명의 전장 폴리펩티드의 상동성 서열일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드는 본 발명의 전장 폴리펩티드의 상동성 서열의 기능성 부분일 수 있다. 본 발명의 한 측면에 따르면, 본 발명의 폴리펩티드는 본 발명의 폴리펩티드의 서열을 포함할 수 있다.
본 발명의 한 측면에 따르면, 본 발명의 폴리펩티드를 형성하는데 사용되는 본 발명의 나노바디는 본 발명의 완전한 나노바디(예를 들어, VHH) 또는 이의 상동성 서열일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드를 형성하는데 사용되는 본 발명의 나노바디는 본 발명의 완전한 나노바디의 기능성 부분일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드를 형성하는데 사용되는 본 발명의 나노바디는 본 발명의 완전한 나노바디의 상동성 서열일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드를 형성하는데 사용된 본 발명의 나노바디는 본 발명의 완전 나노바디의 상동성 서열의 기능성 부분일 수 있다.
본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드는 모 서열의 상동성 서열일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드는 기능성 부분 모 서열일 수 있다. 본 발명의 다른 측면에 따르면, 본 발명의 폴리펩티드는 모 서열의 상동성 서열의 기능성 부분일 수 있다.
본원에 사용된 바와 같이, 상동성 서열은 하나 이상의 아미노산의 부가, 결실 또는 치환을 포함할 수 있으며, 여기서 상기 아미노산의 부가, 결실 또는 치환은 폴리펩티드의 기능상의 특징을 실질적으로 변질시키지 않는다. 아미노산 결실부 또는 치환부의 아미노산 수는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 또는 70 개 이하의 아미노산인 것이 바람직하다.
본 발명에 따른 상동성 서열은 인간 중쇄 항체 또는 인간 단일 사슬 도메인 중쇄 항체를 형성하기 위해 아미노산을 부가하여 연장된 폴리펩티드를 포함하는데, 이와 같이 연장된 폴리펩티드는 변형되지 않은 폴리펩티드의 기능상의 특징을 실질적으로 변질시키지 않는다.
상동성 서열이 서열 동일성으로써 표시되는 경우, 상동성 서열이란, 모 서열과의 서열 동일성이 높은(즉, 서열 동일성이 70%, 75%, 80%, 85%, 90%, 95% 또는 98% 이상인) 서열을 의미하는 것이며, 또한 이는 모 서열의 특성 즉, 친화성과 유사한 특성을 갖는 것을 특징으로 하며, 상기 동일성은 공지의 방법을 이용하여 계산된다.
대안적으로, 상동성 서열은 또한 이하의 법칙에 따라서 모 서열의 위치 중 임의의 번호를 갖는 위치에서 허용 가능한 치환이 일어 남으로 인해 생성된 임의의 아미노산 서열일 수도 있다:
Ser, Thr, Gly 및 Asn에 의해 치환된 Ser;
Arg, His, Gln, Lys 및 Glu 중 하나에 의해 치환된 Arg;
Leu, Ile, Phe, Tyr, Met 및 Val 중 하나에 의해 치환된 Leu;
Pro, Gly, Ala 및 Thr 중 하나에 의해 치환된 Pro;
Thr, Pro, Ser, Ala, Gly, His 및 Gln 중 하나에 의해 치환된 Thr;
Ala, Gly, Thr 및 Pro 중 하나에 의해 치환된 Ala;
Val, Met, Tyr, Phe, Ile 및 Leu 중 하나에 의해 치환된 Val;
Gly, Ala, Thr, Pro 및 Ser 중 하나에 의해 치환된 Gly;
Ile, Met, Tyr, Phe, Val 및 Leu 중 하나에 의해 치환된 Ile;
Phe, Trp, Met, Tyr, Ile, Val 및 Leu 중 하나에 의해 치환된 Phe;
Tyr, Trp, Met, Phe, Ile, Val 및 Leu 중 하나에 의해 치환된 Tyr;
His, Glu, Lys, Gln, Thr 및 Arg 중 하나에 의해 치환된 His;
Gln, Glu, Lys, Asn, His, Thr 및 Arg 중 하나에 의해 치환된 Gln;
Asn, Glu, Asp, Gln 및 Ser 중 하나에 의해 치환된 Asn;
Lys, Glu, Gln, His 및 Arg 중 하나에 의해 치환된 Lys;
Asp, Glu 및 Asn 중 하나에 의해 치환된 Asp;
Glu, Asp, Lys, Asn, Gln, His 및 Arg 중 하나에 의해 치환된 Glu;
Met, Phe, Ile, Val, Leu 및 Tyr 중 하나에 의해 치환된 Met.
본 발명에 따른 상동성 뉴클레오티드 서열이란, 엄중한 혼성화 조건[예를 들어, Sambrook외 다수, Molecular Cloning, Laboratory Manuel, Cold Spring, Harbor Laboratory press, New York에 개시된 조건] 하에서, 폴리펩티드를 암호화할 수 있는 뉴클레오티드 서열의 역-상보체에 혼성화될 수 있는 50, 100, 200, 300, 400, 500, 600, 800 또는 1000 개 이상의 뉴클레오티드로 이루어진 뉴클레오티드 서열을 의미하는 것일 수 있다.
본원에 사용된 바와 같이, 기능성 부분이란, 목적으로 하는 상호 작용이 친화도 1×10-6M 이상으로 유지되기에 충분한 크기를 가지는 본 발명의 나노바디를 의미하는 것이다.
대안적으로, 본 발명의 나노바디의 기능성 부분은 완전 아미노산 서열의 부분적 결실을 포함하지만, 표적과의 상호 작용과 결합에 필요한 결합 위치(들) 및 단백질 도메인(들)은 여전히 보유한다.
대안적으로, 본 발명의 임의의 나노바디의 기능성 부분은 완전 아미노산 서열의 부분적 결실을 포함하지만, vWF 및 콜라겐의 결합을 억제하는데 필요한 결합 위치(들) 및 단백질 도메인(들)은 여전히 보유하는 폴리펩티드이다.
대안적으로, 본 발명의 임의의 나노바디의 기능성 부분은 완전 아미노산 서열의 부분적 결실을 포함하지만, vWF의 A1 도메인과의 결합 및 상호 작용에 필요한 결합 위치(들) 및 단백질 도메인(들)은 여전히 보유하는 폴리펩티드이다.
대안적으로, 본 발명의 임의의 나노바디의 기능성 부분은 완전 아미노산 서열의 부분적 결실을 포함하지만, 콜라겐과의 결합 및 상호 작용에 필요한 결합 위치(들) 및 단백질 도메인(들)은 여전히 보유하는 폴리펩티드이다.
대안적으로, 기능성 부분은 폴리펩티드의 아미노산 서열의 부분적 결실을 포함하지만, 항원과의 결합 및 상호 작용에 필요한 결합 위치(들) 및 단백질 도메인(들)은 여전히 보유한다. 그 예로서는, VHH 도메인을 포함하나, 이에 한정되는 것은 아니다.
본원에 사용된 바와 같이, 기능성 부분이란, 서열의 100% 미만(예를 들어, 99%, 90%, 80%, 70%, 60%, 50% 등)에 해당하되, 5개 이상의 아미노산을 포함하는 부분을 의미한다.
본원에 사용된 바와 같이, 기능성 부분이란, 서열의 100% 미만(예를 들어, 99%, 90%, 80%, 70%, 60%, 50% 등)에 해당하되, 15개 이상의 뉴클레오티드를 포함하는 부분을 의미한다.
본 발명의 한 측면은 본 발명에 의한 폴리펩티드 투여시 주사할 필요가 없다는 점이다. 종래의 항체를 이용하는 치료제는 의약품으로서 상당한 효능을 가지는데, 왜냐하면, 종래의 항체는 이의 표적에 대한 특이성이 적당하고, 본래 가지고 있는 독성이 낮기 때문이다. 종래 항체는 항 가지 치명적인 단점을 가지는데, 즉, 이 항체가 비교적 불안정하고, 또한 단백질 분해 효소에 의한 분해에 민감하다는 단점을 갖는다. 이는 곧, 종래의 항체 의약품은 투여 위치의 낮은 pH와, 투여 위치 및 혈중 단백질 분해 효소의 작용에 견딜 수 없으며/없거나, 항체의 크기가 크기 때문에, 이와 같은 의약품이 경구, 설하, 국소, 비강 내, 질 내, 직장 관 내 투여 또는 흡입에 의해 투여될 수 없다는 것을 의미한다. 이와 같은 항체 의약품은 이러한 문제점들 중 일부를 극복하기 위해, 주사(정맥 내 주사 및 피하 주사 등)에 의해 투여되어야 한다. 주사에 의한 투여 과정은 피하 주사용 시린지 또는 바늘을 정확하고 안전하게 사용하기 위해서 훈련을 받은 전문가에 의해 수행되는 것이 필요하다. 또한 투여 과정에는 멸균 장치, 치료용 폴리펩티드의 액상 제형, 상기 폴리펩티드를 멸균 및 안정한 형태로 포장한 바이알이 필요하고, 또한 개체 내 바늘이 들어갈 적당한 부위도 필요하다. 더욱이, 개체는 일반적으로 주사를 맞기 전과 후에 신체적 및 정신적 스트레스를 경험하기도 한다.
본 발명의 한 측면은 본 발명의 폴리펩티드 구조물을 제공함으로써 선행 기술의 문제점을 극복할 수 있다는 것이다. 이러한 구조물은 충분히 작고, 저항성이 있으며, 안정하기 때문에, 실질적으로 활성을 손실시키지 않고 경구, 설하, 국소, 비강 내, 질 내, 작장 내 전달될 수 있거나 또는 흡입에 의해 전달될 수 있다. 본 발명의 폴리펩티드 구조물은 주사할 필요가 없으며, 비용과 시간을 절약할 수 있을 뿐만 아니라, 개체에게 편리함과 안도감을 줄 수 있다.
본 발명의 하나의 구체예는 불활성화되지 않은 채 위 내 환경을 통과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 본 발명의 폴리펩티드에 관한 것이다.
당 업자에 의해 알려진 바와 같이, 일단 본 발명의 폴리펩티드가 생산되면, 제형화 기술은 정확한 부위(위 및 결장 등)에 최대량의 폴리펩티드를 방출시킬 수 있는 것이다. 이와 같은 전달 방법은 표적이 소화기에 존재하는 질환의 증상을 치료, 예방 및/또는 경감시키는데 중요하다.
본 발명의 하나의 구체예는 불활성화되지 않은 채 위 내 환경을 통과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 방법에 관한 것으로서, 이 방법은 본 발명의 폴리펩티드를 개체에 경구 투여함으로써 수행된다.
본 발명의 다른 구체예는 불활성화되지 않은 채 위 내 환경을 통과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 의약품을 제조함에 있어서의 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다.
본 발명의 하나의 측면은 불활성화되지 않은 채 장 내 환경을 통과할 수 있는, 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 경구 투여함으로써 수행된다.
본 발명의 하나의 측면은 불활성화되지 않은 채 개체의 혈류에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 경구 투여함으로써 수행된다.
본 발명의 다른 구체예는 질 내 및/또는 직장 관 내 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 증상 또는 질환을 치료, 예방 및/또는 경감시키는데 사용되는 본 발명의 나노바디 또는 폴리펩티드에 관한 것이다.
비 제한적인 예에 있어서, 본 발명에 따른 제형은 본 발명의 나노바디 또는 폴리펩티드를 포함하며, 이 제형은 겔, 크림, 좌제, 필름의 형태를 갖거나, 또는 경시적으로 활성 성분을 서서히 방출시키는 스폰지 또는 질 내 삽입 고리의 형태를 갖는다[예를 들어, EP 707473, EP 684814, 미국 특허 제5,629,001호 참조].
본 발명의 한 측면은 질 내 및/또는 직장 관 내 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 만감한 질환의 증상을 치료, 예방 및/또는 경감시키는 방법에 관한 것으로서, 이 방법에 있어서 본 발명의 나노바디 또는 폴리펩티드는 개체에 질 내 및/또는 직장 관 내 투여된다.
본 발명의 다른 측면은 질 내 및/또는 직장 관 내 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 만감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 의약품을 제조함에 있어서, 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다.
본 발명의 한 측면은 비활성화되지 않은 채 질 내 및/또는 직장 관 내 전달된, 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법에 있어서 본 발명의 나노바디 또는 폴리펩티드는 개체에 질 내 및/또는 직장 관 내 투여된다.
본 발명의 한 측면은 불활성화되지 않은 채 개체의 혈류에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 질 내 및/또는 직장 관 내 투여함으로써 수행된다.
본 발명의 다른 구체예는 코, 상기도 및/또는 폐에 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는데 사용되는, 본 발명의 나노바디 또는 폴리펩티드에 관한 것이다.
비 제한적 예에서, 본 발명에 따른 제형은 코 분무형(예를 들어, 에어로졸) 또는 흡입기의 형태를 가질 수 있다. 폴리펩티드 구조물은 작기 때문에, 치료용 IgG 분자보다 더 효율적으로 표적에 도달할 수 있다.
본 발명의 한 측면은 상기도 및 폐에 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 만감한 질환의 증상을 치료, 예방 및/또는 경감시키는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 입이나 코를 통한 흡입에 의해 개체에 투여하는 단계를 포함한다.
본 발명의 다른 구체예는 비활성화되지 않은 채, 코, 상기도 및/또는 폐에 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 만감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 의약품을 제조함에 있어서, 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다.
본 발명의 한 측면은 개체의 코, 상기도 및/또는 폐에 본 발명의 나노바디 또는 폴리펩티드를 투여함으로써, 비활성화되지 않은 채 코, 상기도 및 폐에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것이다.
본 발명의 한 측면은 개체의 코, 상기도 및/또는 폐에 본 발명의 나노바디 또는 폴리펩티드를 투여함으로써, 비활성화되지 않은 채 개체의 혈류에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것이다.
본 발명의 하나의 구체예는 소장 점막에 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는데 사용되는, 본 발명의 나노바디 또는 폴리펩티드에 관한 것으로서, 여기서, 상기 질환은 소장 점막의 투과성을 증가시키는 질환이다. 본 발명의 나노바디 또는 폴리펩티드는 크기가 작기 때문에, 소장 점막을 통과하여, 소장 점막의 투과성을 증가시키는 질환이 발병한 개체의 혈류에 보다 효율적으로 도착할 수 있다.
본 발명의 한 측면은 소장 점막에 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는 방법에 관한 것으로서, 여기서, 상기 질환은 소장 점막의 투과성을 증가시키는 질환이고, 또한 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 경구 투여함으로써 실시된다.
이와 같은 방법은 본 발명의 부가적인 측면(즉, 능동 수송 담체 사용)에 의하여 더욱 강화될 수 있다. 이와 같은 본 발명의 측면에 있어서, VHH는 소장 벽으로부터 혈류로의 운반 과정을 강화하는 담체에 융합된다. 비 제한적인 예에 있어서, 이와 같은 "담체"는 치료용 VHH에 융합된 제2의 VHH이다. 이러한 융합 구조물은 당 업계에 공지된 방법을 통해 제조된다. "담체" VHH는 벽을 통한 능동 수송을 유도하는, 소장 벽에 존재하는 수용체에 특이적으로 결합한다.
본 발명의 다른 구체예는 소장 점막에 전달된, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 의약품을 제조함에 있어서, 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것으로서, 상기 질환은 소장 점막의 투과성을 증가시키는 질환이다.
본 발명의 한 측면은 비활성화되지 않은 채 소장 점막에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 경구 투여함으로써 실시된다.
본 발명의 한 측면은 비활성화되지 않은 채 개체의 혈류에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 경구 투여함으로써 실시된다.
이와 같은 방법은 본 발명의 부가적인 측면(즉, 능동 수송 담체 사용)에 의하여 더욱 강화될 수 있다. 이와 같은 본 발명의 측면에 있어서, 본원에 기술된 바와 같은 본 발명의 나노바디 또는 폴리펩티드는 소장 벽으로부터 혈류로의 운반 과정을 강화하는 담체에 융합된다. 비 제한적인 예에 있어서, 이와 같은 "담체"는 상기 폴리펩티드에 융합된 VHH이다. 이러한 융합 구조물은 당 업계에 공지된 방법을 통해 제조된다. "담체" VHH는 벽을 통한 능동 수송을 유도하는, 소장 벽에 존재하는 수용체에 특이적으로 결합한다.
본 발명의 하나의 구체예는, 혀 밑에 있는 조직을 효과적으로 투과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는데 사용되는, 본 발명의 나노바디 또는 폴리펩티드에 관한 것이다. 본 발명의 나노바디 또는 폴리펩티드의 제형으로서는 예를 들어, 혀 밑에 있을 때, 혀 밑 점막을 투과하여 모세관 망으로 흡수되는 정제, 스프레이 및 점적이 있다.
본 발명의 한 측면은, 혀 밑에 있는 조직을 효과적으로 투과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 설하 투여함으로써 실시된다.
본 발명의 다른 측면은, 혀 밑에 있는 조직을 효과적으로 투과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 의약품을 제조함에 있어서, 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다.
본 발명의 한 측면은 비활성화되지 않은 채 혀 밑의 조직으로 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 설하 투여함으로써 실시된다.
본 발명의 한 측면은 비활성화되지 않은 채 개체의 혈류로 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 경구 투여함으로써 실시된다.
본 발명의 하나의 구체예는 피부를 효과적으로 통과할 수 있는 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는데 사용되는, 본 발명의 나노바디 또는 폴리펩티드에 관한 것이다.
본 발명의 나노바디 또는 폴리펩티드의 제형으로서는 예를 들어, 피부에 있을 때, 이를 통과하여 내부로 들어가는 크림, 필름, 스프레이, 점적 또는 패취가 있다.
본 발명의 한 측면은 피부를 효과적으로 통과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 국소 투여함으로써 실시된다.
본 발명의 다른 구체예는 피부를 효과적으로 통과할 수 있는, 혈소판-매개 응집을 제어하는 물질에 의한 조정 작용에 민감한 질환의 증상을 치료, 예방 및/또는 경감시키기 위한 의약품을 제조함에 있어서, 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다.
본 발명의 한 측면은 비활성화되지 않은 채 피부에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 국소 투여함으로써 실시된다.
본 발명의 한 측면은 개체의 혈류에 혈소판-매개 응집을 제어하는 물질을 전달하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드를 개체에 국소 투여함으로써 실시된다.
본 발명의 다른 구체예에 있어서, 본 발명의 나노바디 또는 폴리펩티드는 상기 본 발명의 나노바디 또는 폴리펩티드를 폐의 루멘으로부터 혈액으로 운반하는 능동 수송 담체로서의 역할을 하는, 본 발명의 담체 나노바디(예를 들어, VHH)를 추가로 포함한다.
본 발명의 나노바디 또는 폴리펩티드는 상기 폴리펩티드를 폐의 루멘으로부터 혈액으로 능동 수송시키는, 점막 표면(기관지 상피 세포)에 존재하는 수용체에 특이적으로 결합하는 담체를 추가로 포함한다. 본 발명의 담체 나노바디는 본 발명의 나노바디 또는 폴리펩티드에 융합될 수 있다. 이와 같은 융합 구조물은 당 업계에 공지된 방법을 이용하여 제조될 수 있으며, 이에 관하여는 본원에 기술되어 있다. 본 발명의 "담체" 나노바디는 표면을 통한 능동 수송을 유도하는 점막 표면상에 존재하는 수용체에 특이적으로 결합한다.
본 발명의 다른 측면은 비 내 투여시 혈류로 능동 수송되는 본 발명의 나노바디(예를 들어, VHH)를 측정하는 방법에 관한 것이다. 이와 유사하게, 변형되지 않은 면역 VHH 파지 라이브러리는 비 내 투여될 수 있으며, 투여 후 상이한 시점에서, 혈액 또는 기관은 분리되어, 혈류에 능동 수송된 파지를 회수할 수 있다. 폐의 루멘으로부터 혈류로의 능동 수송을 위한 수용체에 관한 비 제한적인 예로서는 Fc 수용체 N(FcRn)이 있다. 본 발명의 한 측면은 이 방법에 의해 동정된 VHH 분자를 포함한다. 이러한 VHH는 이후 비 내 투여시 혈류 내 상응하는 표적으로 치료용 VHH를 운반하기 위한 담체 VHH로서 사용될 수 있다.
본 발명의 하나의 구체예는 혈소판-매개 응집과 관련된 질환의 증상 또는 기능 장애를 치료, 예방 및/또는 완화시키는데 사용되는 본 발명의 나노바디 또는 폴리펩티드에 관한 것이다. 상기 질환으로서는, 혈전성 혈소판 감소 자반증(TTP), 일과성 뇌 허혈 발작증, 불안정 또는 안정 협심증, 뇌경색, 심근 경색, 말초 동맥 폐색성 질병, 재발 협착증을 포함한다. 상기 질환으로서는 또한 관상 동맥 우회로 이식 조성술, 관상 동맥 판막 치환술 및 관상 동맥 개입술 예를 들어, 혈관 형성술, 스텐트 삽입술 또는 죽종 절제술 이후에 발생하는 질환을 포함한다.
기타 질환으로서는 비-폐색성 혈전 형성증, 폐색성 혈전 형성증, 동맥 혈전 형성증, 급성 관상 동맥 폐색증, 재발 협착증, PCTA 또는 스텐트 삽입술 이후에 발생하는 재발 협착증, 협착 동맥에서의 혈전 형성증, 혈관 형성술, 죽종 절제술 또는 동맥 스텐트 삽입술 이후에 발생하는 과형성증, 혈관계에서의 폐색성 질환 또는 발병 동맥의 비 개통증 중 임의의 질환이 있다.
본 발명의 한 측면은 혈소판-매개 응집 관련 질환 또는 병상, 또는 기능 장애를 치료, 예방 및/또는 완화하는데 사용되는 본 발명의 나노바디 또는 폴리펩티드에 관한 것으로서, 여기서, 상기 본 발명의 나노바디 또는 폴리펩티드는 정맥 내, 피하, 경구, 설하, 국소, 비강 내, 질 내, 직장 내 투여되거나, 또는 흡입에 의해 투여된다.
본 발명의 다른 측면은 혈소판-매개 응집 관련 질환 또는 병상, 또는 기능 장애를 치료, 예방 및/또는 완화하기 위한 의약품의 제조에 있어서 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것으로서, 여기서, 상기 본 발명의 나노바디 또는 폴리펩티드는 정맥 내, 피하, 경구, 설하, 국소, 비강 내, 질 내, 직장 내 투여되거나, 또는 흡입에 의해 투여된다.
본 발명의 다른 측면은 개체에 본 발명의 나노바디 또는 폴리펩티드를 투여하는 단계를 포함하는, 혈소판-매개 응집 관련 질환 또는 병상, 또는 기능 장애를 치료, 예방 및/또는 완화하는 방법에 관한 것으로서, 여기서, 상기 본 발명의 이종 특이적(heterospecific) 나노바디 또는 폴리펩티드는 정맥 내, 피하, 경구, 설하, 국소, 비강 내, 질 내, 직장 내 투여되거나, 또는 흡입에 의해 투여된다.
본 발명의 다른 측면은 혈소판-매개 응집과 관련된 질환 또는 병상 또는 기능 장애를 치료, 예방 및/또는 완화하는데 사용되는 본 발명의 나노바디 또는 폴리펩티드에 관한 것이다.
본 발명의 다른 측면은 혈소판-매개 응집과 관련된 질환 또는 병상 또는 기능 장애를 치료, 예방 및/또는 완화하기 위한 의약품을 제조함에 있어서 본 발명의 폴리펩티드의 용도에 관한 것이다.
vWF에 대한 폴리펩티드의 결합을 조정하는 제제를 스크리닝하기 위해서, 본 발명의 나노바디 또는 폴리펩티드를 사용할 수 있다. 결합 능 또는 상기 폴리펩티드의 치환 여부를 측정하는 검정법에서 제제를 동정할 때, 이 제제가 혈소판-매개 응집의 조정 인자로서의 역할을 하는지 여부를 결정하는 기능 시험을 수행하여야 할 것이다. 적당한 스크리닝 방법의 몇몇 예에 관하여는 WO 04/062551에 기술되어 있다. 물론, 이 방법은 본원에 개시된 본 발명의 나노바디 또는 폴리펩티드와 vWF 사이의 결합을 변형시키는 후보 조정 인자를 스크리닝하는데에도 용이하게 사용될 수 있다.
본 발명에 유용한 세포는 바람직하게는, 전술한 바와 같은 박테리아 세포 예를 들어, 이.콜라이, 효모 세포 예를 들어, 에스.세레비지아에, 피.파스토리스, 곤충 세포 또는 포유동물 세포로 이루어진 군으로부터 선택된다.
본 발명에 유용한 세포는 본 발명의 나노바디 또는 폴리펩티드를 암호화하는 핵산 서열이 도입되어, 상기 폴리펩티드를 본원에 기술된 바와 같이, 천연 상태에서의 수준 또는 그 이상의 수준으로 발현시킬 수 있는 임의의 세포일 수 있다. 바람직하게, 세포 내에서 발현되는 본 발명의 폴리펩티드는 본원에 정의된 바와 같이 정상적이거나 정상에 가까운 약리학적 특성을 나타낸다.
본 발명의 바람직한 구체예에 따르면, 세포는 COS7-세포, CHO 세포, LM (TK-) 세포, NIH-3T3 세포, HEK-293 세포, K-562 세포 또는 1321N1 성상 세포종 세포 및 기타 형질 감염 가능한 세포주로 이루어진 군으로부터 선택된다.
일반적으로, "치료학적 유효량", "치료학적 유효 투여량" 그리고 "유효량"이란, 원하는 결과(혈소판 응집의 치료 또는 예방)를 얻는데 필요한 양을 의미하는 것이다. 당 업자는 효능 즉, "유효량"은 본 발명에 사용되는 혈소판-매개 응집을 억제하는 다수의 나노바디 또는 폴리펩티드에 따라서 상이할 수 있음을 알고 있을 것이다. 당 업자는 이 나노바디 또는 폴리펩티드의 효능을 용이하게 평가할 수 있다.
"약학적으로 허용 가능한" 물질이란, 생물학적으로 바람직하지 않은 물질 즉, 나노바디 또는 폴리펩티드와, 약학 조성물에 함유된 기타 성분들 중 임의의 성분과 함께 개체에 투여될 때 원치않는 생물 효과를 일으키지 않거나, 유해한 방식으로 상호 작용하지 않을 수 있는 물질을 의미하는 것이다.
본원에 개시된 발명은 개체 내 혈소판-매개 응집 병상을 치료 또는 예방하는데 유용한 것으로서, BTK를 억제하고, 혈소판-매개 응집을 억제하는 나노바디 또는 폴리펩티드 또는 조성물을 약학적으로 유효량만큼 투여하는 단계를 포함한다.
본원에 개시된 발명은 본 발명에 따른 나노바디 또는 폴리펩티드 또는 조성물을 약학적으로 유효량만큼 투여하는 단계를 포함하는, 개체 내 혈전 형성의 첫 번째 단계를 치료 또는 예방하는데 유용하다.
본원에 개시된 발명은 개체 내 재발 협착증을 치료 또는 예방하는데 유용한 것으로서, 본 발명에 따른 나노바디 또는 폴리펩티드 또는 조성물을 약학적으로 유효량만큼 투여하는 단계를 포함한다.
본 발명의 하나의 측면은 개체 내 혈소판-매개 응집의 병상을 치료 또는 예방하기 위한 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것으로서, 이는 약학적 유효량의 나노바디 또는 폴리펩티드와 기타 물질 예를 들어, 아스피린과 함께 투여된다.
본 발명의 하나의 측면은 개체 내 혈소판-매개 응집의 병상을 치료 또는 예방하기 위한 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것으로서, 이는 약학적 유효량의 나노바디 또는 폴리펩티드와 기타 물질 예를 들어, 혈전 용해제와 함께 투여된다.
본 발명의 다른 측면은 개체 내 플라크 또는 혈전 형성증을 치료 또는 예방하는데 있어서 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다. 상기 플라크 또는 혈전 형성증은 고 전단 조건 하에서 이루어질 수 있다. 혈전증 및 재발 폐색증(reocclusion) 모두에 있어서, 혈소판이 고 전단 속도로 부착 또는 결집이 반복되다가, 이후에는 혈소판 상에 존재하는 콜라겐 수용체를 통해 단단하게 부착하게 되고, 결과적으로는 혈소판이 활성화되는데; 손상을 입은 혈관 벽에 도착하게 된 콜라겐과 혈소판이 vWF에 의해 결집되는 과정은 고 전단 조건 하에서 특히 중요하다. 본 발명자들은 본 발명의 나노바디 또는 폴리펩티드가 의외도 고 전단 조건 하에서도 효능이 우수하다는 사실을 알아냈다.
본 발명은 본 발명의 나노바디 또는 폴리펩티드를 포함하는 제형을 투여하는 것에 한정되지 않는다. 치료 또는 예방을 필요로 하는 환자에게 본 발명의 하나 이상의 나노바디 또는 폴리펩티드를 포함하는 제형을 투여하는 병행 치료법도 본 발명의 범위에 포함된다.
혈소판-매개 응집 병상으로서는 불안정 또는 안정 협심증, 협심증, 색전 형성증, 심부정맥 혈전증, 용혈성 요독 증후군, 용혈성 빈혈, 급성 신부전, 혈전 용해성 합병증, 혈전성 혈소판 감소 자반증, 파종성 혈관 내 응고, 혈전증, 관상 동맥 질환, 색전성 합병증, 심근 경색증, 재발 협착증, 및 심방 세동에 있어서의 심방 혈전 형성증, 크롬 불안정성 협심증, 일과성 뇌허혈 발작증 및 뇌졸중, 말초 혈관 질환, 동맥 혈전증, 임신 중독증, 색전증, 재발 협착증, 및/또는 혈관 형성술, 경동맥 내막 절제술 이후의 혈전증, 혈관 이식에 따른 문합에서의 혈전증, 및 심혈관 장치의 크롬 노출로 인한 혈전증을 포함하나, 이에 한정되는 것은 아니다. 이러한 병상들은 또한 혈전 용해 요법 도중 및 이후, 혈관 형성술 이후, 그리고 관상 동맥 우회술 이후에 발생할 수도 있다.
본원에 개시된 표준적인 테스트 방법 또는 기타 유사한 방법을 이용하여 혈소판-매개 응집의 억제율을 측정하는 방법에 관하여는 당 업계에 널리 공지되어 있다. 바람직하게, 본 방법은 혈소판-매개 응집 현상을 10% 이상 예를 들어, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 또는 더욱 바람직하게는 10∼90%까지의 임의의 % 만큼 감소시킬 것이다.
이와 유사하게, 본 발명의 방법은 세포 내 칼슘 이동률을 10% 이상, 예를 들어, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% 감소시킬 것이다. 이와 유사하게, 본 발명의 방법은 인산화된 PLCg 2의 수준을 10% 이상 예를 들어, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% 감소시킬 것이다.
감소율은 예를 들어, 경시적 혈소판 응집 능 측정계(chronology platelet aggregometer)에서 광학 임피던스를 비교함으로써 측정될 수 있다. 기타 임의의 공지된 측정 방법도 사용될 수 있다. 예를 들어, (1) 콜라겐이 자극되면, 콜라겐-유도성 세포 내 칼슘 이동성 수준은 시간이 경과함에 따라서 증가하게 되므로, 측정법은 콜라겐-유도성 세포 내 칼슘의 수준을 측정하는 단계를 포함할 수 있거나, 또는 (2) 콜라겐이 자극되면, 인산화된 PLCg 2의 수준은 시간이 경과함에 따라서 증가하게 되므로, 측정법은 인산화된 PLCg 2의 수준을 측정하는 단계를 포함할 수 있다.
세포는 예를 들어, 본 발명의 나노바디 또는 폴리펩티드를 배양 배지에 첨가하거나(예를 들어, 연속 주입, 일시(bolus) 전달, 또는 배지를 나노바디 또는 폴리펩티드를 함유하는 배지로 교환함에 의함), 또는 세포 외 유체에 나노바디 또는 폴리펩티드를 생체 내 첨가함으로써(예를 들어, 국소 전달, 전신 전달, 흡입, 정맥 내 주사, 일시 전달 또는 연속 주입에 의함), 시험관 내에서 접촉될 수 있다. 세포 또는 세포 군집과의 "접촉" 기간은, 나노바디 또는 폴리펩티드가 생리학적 유효 수준으로 존재하거나 또는 세포(들)를 담가 둔 배지 또는 세포 외 유체 중 생리학적 가정 유효 수준으로 존재하는 시간에 따라서 결정된다. 바람직하게, 접촉 기간은 1∼96 시간, 더욱 바람직하게는 24시간이지만, 이러한 시간은 나노바디 및 폴리펩티드의 반감기에 따라서 다양할 것이며, 통상의 실험을 통하여 당 업자에 의해서 최적화될 수 있다.
본 발명에 유용한 나노바디 또는 폴리펩티드는 약학 조성물로서 제형화될 수 있으며, 이는 포유동물 숙주 예를 들어, 인간 환자 또는 가축에 선택된 투여 경로 즉, 경구 또는 비경구 투여, 비 내 투여, 흡입, 정맥 내, 근육 내, 국소 또는 피하 투여용으로서 적합한 다수의 형태로 투여될 수 있다.
본 발명의 나노바디 또는 폴리펩티드는 또한 유전자 치료 전달 방법을 이용하여 투여될 수도 있다. 예를 들어, 본원에 그 자체로서 참고용으로 인용되어 있는 미국 특허 제5,399,346호를 참조하시오. 유전자 치료 전달 방법을 사용하면, 본 발명의 나노바디 또는 폴리펩티드에 대한 유전자로 형질 감염된 1차 세포는 표적 특이적 기관, 조직, 이식편, 종양 또는 세포에 대한 조직 특이적 프로모터로 형질 감염될 수도 있다.
그러므로, 본 발명의 나노바디 또는 폴리펩티드는 약학적으로 허용 가능한 비이클 예를 들어, 비활성 희석제 또는 동화 가능한 식용 담체와 함께 전신 투여 예를 들어, 경구 투여될 수 있다. 본 발명의 나노바디 또는 폴리펩티드와 약학적으로 허용 가능한 비이클은 경질 또는 연질 외피 젤라틴 캡슐에 밀봉될 수 있거나, 정제로 압착될 수 있거나, 아니면 환자의 식사에 직접 통합될 수도 있다. 치료제를 경구 투여함에 있어서, 본 발명의 나노바디 또는 폴리펩티드는 하나 이상의 부형제와 함께 혼합될 수 있으며, 또한, 섭취 가능한 정제, 협측 정제, 트로키, 캡슐, 엘릭시르, 현탁액, 시럽, 웨이퍼 등의 형태로 사용될 수 있다. 이러한 조성물 및 제제는 0.1% 이상의 나노바디 또는 폴리펩티드를 함유하여야 한다. 조성물 및 제제의 비율은 물론 다양할 수 있으며, 편리하게는 소정의 단위 투여형 중량의 약 2∼약 60%일 수 있다. 이와 같은 치료학적으로 유용한 조성물 중 나노바디 또는 폴리펩티드의 양은 유효 투여량 수준이 얻어지게 될 정도이다.
정제, 트로키, 환약 및 캡슐 등은 또한 다음과 같은 성분들을 함유할 수도 있다: 즉, 결합제 예를 들어, 트래거칸스 고무, 아카시아 고무, 옥수수 전분 또는 젤라틴; 부형제 예를 들어, 이인산칼슘; 붕해제 예를 들어, 옥수수 전분, 감자 전분, 알긴산 등; 윤활제 예를 들어, 스테아린산마그네슘; 및 감미제 예를 들어, 수크로스, 프록토스, 락토스 또는 아스파탐 또는 풍미제 예를 들어, 페퍼민트, 노루발풀 오일 또는 체리향이 첨가될 수 있다. 단위 투여형이 캡슐인 경우, 이는 상기와 같은 종류의 성분들 이외에, 액상 담체 예를 들어, 식물성 오일이나 폴리에틸렌 글리콜을 함유할 수 있다. 기타 다양한 물질들은 코팅물로서 존재할 수 있거나, 또는 고체 단위 투여형의 물리적 변형 형태로서 존재할 수도 있다. 예를 들어, 정제, 환약 또는 캡슐은 젤라틴, 왁스, 셸락 또는 당 등으로 코팅될 수 있다. 시럽 또는 엘릭시르는 본 발명의 나노바디 또는 폴리펩티드, 수크로스 또는 프록토스와 같은 감미제, 메틸 및 프로필파라벤과 같은 보존제, 염료 및 체리 또는 오렌지 향과 같은 풍미제를 함유할 수 있다. 물론, 임의의 단위 투여형을 제조하는데 사용된 임의의 물질은 사용량에 있어서 약학적으로 허용 가능하고 실질적으로 무독성이어야 할 것이다. 뿐만 아니라, 본 발명의 나노바디 또는 폴리펩티드는 지속-방출형 제제 및 장치에 통합될 수 있다.
본 발명의 나노바디 또는 폴리펩티드는 또한 주입 또는 주사에 의하여 정맥 내 또는 복강 내 투여될 수도 있다. 본 발명의 나노바디 또는 폴리펩티드 용액이나 이의 염 용액은 수중에 제조될 수 있으며, 임의로는 무독성 계면 활성제와 혼합될 수도 있다. 분산액은 또한 글리세롤, 액체 폴리에틸렌 글리콜, 트리아세틴 및 이의 혼합물 그리고 오일 중에 제조될 수 있다. 통상의 저장 및 사용 조건 하에서, 이러한 제제는 미생물의 성장을 막아주는 보존제를 함유한다.
주사 또는 주입용으로서 적당한 약학적 투여형으로서는 멸균 주사 또는 주입 용액이나 분산액의 즉석 제조용으로서 적당한 활성 성분을, 임의로는 리포좀 내에 캡슐화하여 포함하는, 멸균 수용액 또는 분산액 또는 멸균 분말을 포함할 수 있다. 모든 경우에 있어서, 궁극적인 투여형은 제조 및 보관시 멸균 상태이어야 하며, 유체이고 안정하여야 한다. 액상 담체 또는 비이클은 예를 들어, 물, 에탄올, 폴리올(예를 들어, 글리세롤, 프로필렌 글리콜, 액체 폴리에틸렌 글리콜 등), 식물성 오일, 무독성 글리세릴 에스테르 및 이의 적당한 혼합물을 포함하는 용매 또는 액체 분산 매질일 수 있다. 유동성은 예를 들어, 리포좀을 형성시키거나, 원하는 입도로 유지시키거나(분산액의 경우) 또는 계면 활성제를 사용하여 적당히 유지될 수 있다. 다양한 항 박테리아제 및 항진균제 예를 들어, 파라벤, 클로로부탄올, 페놀, 소르브산, 티메로살 등을 사용하여 미생물의 활동을 막을 수 있다. 다수의 경우에 있어서, 등장제 예를 들어, 설탕, 완충액 또는 염화나트륨을 포함하는 것이 바람직할 것이다. 흡수 지연제 예를 들어, 모노스테아린산 알루미늄 및 젤라틴을 조성물에 포함시켜 주사용 조성물의 흡수 시간을 연장할 수 있다.
멸균 주사 용액은 필요한 양만큼의 나노바디 또는 폴리펩티드를, 상기 나열한 바와 같이 다양한 기타 성분과 함께 적당한 용매 중에 통합시킨 후, 여과 멸균함으로써 제조된다. 멸균 주사 용액 제조용 멸균 분말의 경우, 바람직한 제조 방법으로서는 이전에 멸균 여과한 용액으로부터 임의의 부가 목적 성분과 활성 성분의 분말을 얻어내는 진공 건조 기술 및 동결 건조 기술이 있다.
국소 투여의 경우, 본 발명의 나노바디 또는 폴리펩티드는 액체일 경우 순수한 형태로서 투여될 수 있다. 그러나, 일반적으로 이 나노바디 또는 폴리펩티드는 액체 또는 고체일 수 있는, 피부과학적으로 허용 가능한 담체와 함께, 조성물 또는 제형으로서 피부에 투여되는 것이 바람직할 것이다.
유용한 고형 담체는 활석, 점토, 미세 결정질 셀룰로스, 실리카 및 알루미나등과 같이 미분된 고체를 포함한다. 유용한 액상 담체로서는 물, 하이드록시알킬 또는 글리콜, 또는 수-알콜/글리콜 배합물을 포함하는데, 여기서 본 발명의 나노바디 또는 폴리펩티드는, 임의로는, 무독성 계면 활성제의 도움을 받아 유효 수준으로 용해 또는 분산될 수 있다. 애쥬반트 예를 들어, 방향제 및 부가 항 미생물 제제도 소정의 용도를 위하여 그 특성을 최적화시키기 위해 첨가될 수 있다. 결과로 생성된 액체 조성물은 흡수 패드를 통해 도포될 수 있거나, 붕대 및 기타 드레싱에 스며들게 하여 사용될 수 있거나, 또는 펌프형 또는 에어로졸 스프레이 장치를 사용하여 발병 부위에 도포될 수 있다.
증점제 예를 들어, 합성 중합체, 지방산, 지방산 염 및 에스테르, 지방산 알콜, 변형 셀룰로스 또는 변형 무기물도 액상 담체와 함께 사용되어, 사용자의 피부에 직접 도포 가능한 페이스트, 겔, 연고 및 비누 등과 같은 투여형을 형성할 수 있다.
본 발명의 나노바디 또는 폴리펩티드를 피부에 전달하는데 사용될 수 있는 유용한 피부과학적 조성물의 예는 당 업계에 공지되어 있다[예를 들어, Jacquet외 다수(미국 특허 제4,608,392호), Geria(미국 특허 제4,992,478호), Smith외 다수(미국 특허 제4,559,157호) 및 Wortzman(미국 특허 제4,820,508호) 참조].
본 발명의 나노바디 또는 폴리펩티드의 유효 투여량은 이것의 시험관 내 활성과 동물 모델에서의 생체 내 활성을 비교함으로써 결정될 수 있다. 마우스 및 기타 동물 내에서의 유효 투여량을 외삽하여 인간에의 유효 투여량을 유추하는 방법은 당 업계에 널리 공지되어 있다[예를 들어, 미국 특허 제4,938,949호 참조].
일반적으로, 본 발명의 나노바디 또는 폴리펩티드의 액상 조성물 예를 들어, 로션 중의 농도는 약 0.1∼25 중량%, 바람직하게는 약 0.5∼10 중량%일 것이다. 겔이나 분말과 같이 반 고체 또는 고체 조성물 내 농도는 약 0.1∼5 중량%, 바람직하게는 약 0.5∼2.5 중량%일 것이다.
본 발명의 나노바디 또는 폴리펩티드가 치료법에 사용될 경우의 필요량은 투여 경로, 치료될 병상의 특성과 환자의 연령, 그리고 병상에 따라서도 달라질 것이며, 궁극적으로는 실험에 참가한 전문의 또는 임상의의 판단력에 따라서 달라질 것이다. 또한, 본 발명의 나노바디 또는 폴리펩티드의 투여량은 표적 세포, 종양, 조직, 이식편 또는 기관에 따라서 달라진다.
목적 투여형은 편리하게는 단일 투여형으로 제공되거나, 적당한 간격을 두고 분리 투여되는(예를 들어, 1일에 2회, 3회 또는 4회 이상 투여되는) 방식으로 제공될 수도 있다. 하위 투여형 자체는 또한 예를 들어, 간격을 길게 하여 별도로 다수 회 나누어 투여될 수도 있는데; 예를 들어, 취입기로써 여러 번 흡입하거나 또는 눈에 여러 번 점안하여 투여될 수도 있다.
투여 방식으로서는 장기 또는 매일 처치 방식을 포함할 수 있다. "장기"란, 2주 이상, 바람직하게는 수주, 수 개월 또는 수년을 의미한다. 투여량 범위는 필요에 따라서 본원에 교시된 통상의 실험을 통하여 당 업자에 의해 조절될 수 있다. 문헌[Remington's Pharmaceutical Sciences (Martin, E.W., ed. 4), Mack Publishing Co., Easton, PA]을 참조하시오. 합병증이 발생할 경우에는 각각의 전문의에 의해 투여량이 조정될 수도 있다.
본 발명은 혈소판-매개 응집의 조정 인자인 제제를 제공한다.
본 발명의 후보 제제는 합성 제제 또는 이러한 제제의 혼합물일 수 있거나, 또는 천연 생성물(예를 들어, 식물 추출물 또는 배양 상청액)일 수 있다. 본 발명에 따른 후보 제제는 합성될 수 있는 소형 분자, 천연 추출물, 펩티드, 단백질, 탄수화물 및 지질 등을 포함한다.
합성 또는 천연 제제의 거대 라이브러리로부터 유래하는 후보 조정 인자 제제가 스크리닝될 수 있다. 당, 펩티드 및 핵산을 주성분으로 하는 제제의 랜덤한 합성법 및 유도 합성법에는 다양한 기술들이 사용되고 있다. 합성 제제 라이브러리는 다수의 제조사 예를 들어, 메이브릿지 케미컬 코포레이션(Maybridge Chemical Co.; Trevillet, Cornwall, UK), 컴제넥스(Comgenex; Princeton, NJ), 브랜든 어소시에이츠(Brandon Associates; Merrimack, NH), 및 마이크로소스(Microsource; New Milford, CT)로부터 시판중에 있다. 희귀한 화학적 라이브러리는 알드리치(Aldrich; Milwaukee, WI)로부터 시판되고 있다. 조합형 라이브러리는 시판되고 있으며, 제조할 수도 있다. 대안적으로, 박테리아, 진균, 식물 및 동물 추출물 형태의 천연 제제 라이브러리는 예를 들어, 팬 레보레토리즈(Pan Laboratories; Bothell, WA) 또는 마이코서치(MycoSearch; NC)로부터 입수할 수 있거나, 당 업계에 널리 공지된 방법에 의해 용이하게 생산될 수 있다. 뿐만 아니라, 천연 및 합성 생산 라이브러리 및 제제는 통상의 화학적, 물리적 및 생화학적 수단을 통해 용이하게 변형된다.
유용한 제제는 다수의 화학적 군에서 살펴볼 수 있다. 유용한 제제는 유기 제제 또는 소형 유기 제제일 수 있다. 소형 유기 제제의 분자량은 50 달톤 이상, 약 2,500 달톤 미만, 바람직하게는 약 750 달톤 미만, 더욱 바람직하게는 약 350 달톤 미만이다. 대표적인 군으로서는 복소환 화합물, 펩티드, 당 및 스테로이드 등을 포함한다. 제제는 효능, 안정성 및 약학적 혼화성 등을 강화시키기 위해 변형될 수 있다. 제제의 구조를 동정한 결과는 부가의 제제를 동정, 생성 또는 스크리닝하는데 이용될 수 있다. 예를 들어, 펩티드 제제가 동정되는 경우, 이 펩티드 제제는 이것의 안정성을 강화시키기 위한 다양한 방법 예를 들어, 인위적 아미노산, 예를 들어, D-아미노산, 구체적으로, D-알라닌을 이용하는 방법, 예를 들어, 아미노기의 경우에는 아실화 또는 알킬화시키기 위하여, 그리고 카복실기의 경우에는 에스테르화 또는 아미드화시키기 위하여, 아미노 말단 또는 카복실 말단을 작용화시키는 방법에 의해 변형될 수 있다.
1차적 스크리닝에 있어서, 본 발명에 따른 후보 제제의 유효 농도는 약 10 mM∼약 100μM 이상이다[즉, 1 mM, 10 mM, 100 mM, 1 M 등]. 1차 스크리닝 농도는 9가지의 추가 농도 중 상한선으로서 이용될 것인데, 여기서, 상기 추가 농도는 2차 스크리닝 또는 농도 곡선 작성을 위해, 로그의 반값만큼의 간격으로 떨어져 있는 1차 스크리닝 농도(예를 들어, 9가지 이상의 농도)를 감소시킴으로써 측정된다.
본 발명에 따른 고 처리량 스크리닝 키트는, 폴리펩티드의 존재하에(바람직하게는 1μM∼1mM의 농도로 존재할 때), 본 발명의 표적 예를 들어, vWF 또는 이의 단편과의 상호 작용에 의해 혈소판-매개 응집을 조정하는 제제의 검출을 수행하기 위한 매질과 필요한 모든 수단을 포함한다. 키트는 다음과 같은 것을 포함한다: vWF 또는 이의 단편을 암호화하는 뉴클레오티드 서열을 포함하고 이를 발현시키는 본 발명의 재조합 세포로서, 고형 지지체 예를 들어, 미세 역가 평판, 더욱 바람직하게는 96 웰 미세 역가 평판상 키트에서, 당 업자에게 널리 공지된 방법(특히, WO 00/02045에 기술된 방법)에 따라서 생육시킨 재조합 세포. 대안적으로, vWF 또는 이의 단편은 예를 들어, 96 웰 미세 역가 평판상에 고정화될 정제된 형태로서 당 업자에 의해 공급된다. 대안적으로, vWF 또는 이의 단편은 예를 들어, 96-웰 미세 역가 평판 상에 미리 고정된 키트에 공급된다. 본 발명에 따른 조정 제제는 약 1μM∼1mM 이상의 농도로, 적당한 농도의 본 발명의 나노바디 또는 폴리펩티드의 존재 하에서, 제한된 웰에 부가되는데, 이때 상기 폴리펩티드의 농도는 1μM∼1mM인 것이 바람직하다. 키트는 본 발명의 폴리펩티드를 하나 이상 함유할 수 있다.
결합 검정법은 본원에 이미 기술된 바와 같은 방법에 따라서 수행되며, 그 결과는 조정 제제가 첨가되지 않았을 경우, 예를 들어, vWF 또는 이의 단편이 본 발명의 폴리펩티드와 결합할 때의 결합력의 기준 수준과 비교된다. 조정 인자가 존재하지 않을 때의 활성 수준에 비하여 (예를 들어) vWF-폴리펩티드 결합이 2배 이상, 바람직하게는 5배 이상, 더욱 바람직하게는 10배 이상, 그리고 가장 바람직하게는 100배이상 증가하거나 감소한 웰을 선택하여 추가로 분석한다.
본 발명은 혈소판-매개 응집의 조정 인자를 스크리닝하는데 유용한 키트와, 혈소판-매개 응집의 하향 조절을 특징으로 하는 질환 또는 질병의 진단에 유용한 키트를 제공한다. 본 발명에 따라서 유용한 키트는 분리된 vWF 또는 이의 단편을 포함할 수 있다. 대안적으로, 또는 부가적으로, 키트는 vWF 또는 이의 단편을 발현하도록 형질 전환된 세포를 포함할 수 있다. 추가의 구체예에서, 본 발명에 의한 키트는 vWF 또는 이의 단편을 암호화하는 폴리뉴클레오티드를 포함할 수 있다. 또 다른 구체예에서, 본 발명에 의한 키트는 vWF 또는 이의 단편을 증폭시키는데 유용한 특정 프라이머를 포함할 수 있다. 본 발명에 의한 키트는 본 발명의 나노바디 또는 폴리펩티드를 포함할 수 있다. 본 발명에 의한 키트는 상기 폴리펩티드를 발현하도록 형질 전환된 세포를 포함할 수 있다. 키트는 하나 이상의 폴리펩티드를 함유할 수 있다. 다른 구체예에서, 본 발명에 의한 키트는 거대 분자 예를 들어, vWF 또는 이의 단편을 암호화하는 폴리뉴클레오티드를 포함할 수 있다. 또 다른 구체예에서, 본 발명에 의한 키트는 거대 분자 예를 들어, vWF 또는 이의 단편을 증폭시키는데 유용한 특정 프라이머를 포함할 수 있다. 본 발명에 의한 모든 키트는 전술한 물질들 또는 이 물질들의 조합과, 이를 포장하고 있는 물질을 포함할 것이다. 키트는 또한 사용에 관한 지침도 포함할 것이다.
본 발명은 또한 본 발명의 나노바디 또는 폴리펩티드 또는 본 발명의 스크리닝 방법으로 얻어진 제제로 코팅된 삽입용 의료 장치를 제공한다. 상기 장치의 비 제한적인 예로서는 수술용 튜브, 폐쇄 장치, 인공 기구를 포함한다. 상기 장치의 사용 분야로서는 삽입 부위 주변에서 일어나는 혈소판-매개 응집을 조정하는데 필요한 수술 과정을 포함한다.
본 발명의 하나의 구체예는 삽입 부위 주변에서 일어나는 혈소판-매개 응집을 예방하는 삽입용 의료 장치를 처리하는 방법에 관한 것으로서, 이 방법은 본 발명의 나노바디 또는 폴리펩티드 또는 본 발명에 따른 제제로 장치를 코팅시키는 단계를 포함한다.
본 발명의 다른 구체예는 삽입 부위 주변에서 일어나는 혈소판-매개 응집을 억제하는 삽입용 의료 장치에 관한 것으로서, 상기 장치는 본 발명의 나노바디 또는 폴리펩티드 또는 본 발명에 의한 제제로 코팅된다.
다른 측면에서, 본 발명은 하나 이상의 응집-매개 질환(본원에 기술함)의 예방 및/또는 치료 방법에 관한 것으로서, 이 방법은 치료 또는 예방을 필요로 하는 개체에 본 발명의 나노바디, 본 발명의 폴리펩티드 및/또는 본 발명의 나노바디 또는 폴리펩티드를 포함하는 약학 조성물을 약학적으로 활성인 양만큼 투여하는 단계를 포함한다.
본 발명의 내용 중, "예방 및/또는 치료"란 용어는, 질병을 예방 및/또는 치료하는 것뿐만 아니라, 일반적으로 발병을 예방하거나, 질병의 진행을 서행 또는 역전시키거나, 질병과 관련된 하나 이상의 증상의 발생을 예방 또는 서행시키거나, 이 질병과 관련된 하나 이상의 증상들을 감소 및/또는 경감시키거나, 질병 및/또는 이 질병과 관련된 임의의 증상의 심각성 및/또는 지속 기간을 감소시키고/시키거나, 질병 및/또는 이 질병과 관련된 임의의 증상이 더욱 심각해지는 것을 예방하거나, 질병으로 인하여 유발되는 신체적 손상을 예방, 감소 또는 역전시키는 것, 그리고 치료받을 환자에게 유리한 임의의 약리학적 작용을 포함하는 의미이다.
치료받을 대상은 임의의 온혈 동물일 수 있으나, 구체적으로는 포유동물, 더욱 구체적으로는 인간이다. 당 업자에게 널리 알려진 바와 같이, 치료받을 대상은 특히, 본원에 언급된 질병과 질환이 발병하였거나 또는 발병할 위험이 있는 사람일 것이다.
본 발명은 또한 본 발명의 나노바디 또는 폴리펩티드를 환자에게 투여함으로써 예방 및/또는 치료 가능한 하나 이상의 질병 또는 질환을 예방 및/또는 치료하는 방법에 관한 것으로서, 이 방법은 예방 및/또는 치료를 필요로 하는 개체에게 본 발명의 나노바디, 본 발명의 폴리펩티드 및/또는 이들을 포함하는 약학 조성물을 약학적으로 활성인 양만큼 투여하는 단계를 포함한다.
더욱 구체적으로, 본 발명은 본원에 나열된 질병 및 질환으로 이루어진 군으로부터 선택되는 하나 이상의 질병 또는 질환을 예방 및/또는 치료하는 방법에 관한 것으로서, 이 방법은 예방 및/또는 치료를 필요로 하는 개체에게 본 발명의 나노바디, 본 발명의 폴리펩티드 및/또는 이들을 포함하는 약학 조성물을 약학적으로 활성인 양만큼 투여하는 단계를 포함한다.
다른 구체예에서, 본 발명은 면역 치료법, 구체적으로 수동 면역 치료법에 관한 것으로서, 이 방법은 본원에 언급된 질병과 질환이 발병하였거나 또는 발병할 위험이 있는 개체에게 본 발명의 나노바디, 본 발명의 폴리펩티드 및/또는 이들을 포함하는 약학 조성물을 약학적으로 활성인 양만큼 투여하는 단계를 포함한다.
상기 방법에 있어서, 본 발명의 나노바디 및/또는 폴리펩티드 및/또는 이것들을 포함하는 약학 조성물은, 사용될 특정 약학 제형 또는 조성물에 따라서, 임의의 적당한 방식으로 투여될 수 있다. 그러므로, 본 발명의 나노바디 및/또는 폴리펩티드 및/또는 이것들을 포함하는 조성물은 예를 들어, 경구, 복막 내(예를 들어, 정맥 내, 피하, 근육 내, 또는 위장관을 피할 수 있는 임의의 기타 경로), 비강 내, 경피, 국소 투여 경로에 의하거나, 좌제, 흡입 경로에 의해 투여될 수 있으며, 이러한 투여 경로는 사용될 특정 약학 제형 또는 조성물에 따라서 결정된다. 임상의는, 예방 또는 치료될 질병이나 질환, 그리고 임상의들에게 널리 알려진 기타 인자에 따라서, 적당한 투여 경로와 이와 같은 투여에 사용될 적당한 약학 제형 또는 조성물을 선택할 수 있을 것이다.
본원에 개시된바 및 당업자에게 널리 알려진 바와 같이, 급성 병상 및 합병증(즉, 본원에 언급된 응집-매개 질환 중 몇몇에서 일어날 수 있는 병상 및 합병증)에 있어서, 일반적으로 흡입이나 주사 또는 임의의 기타 적당한 수단에 의해 혈류에 직접 투여하는 것이 바람직할 것이다.
본 발명의 나노바디 및/또는 폴리펩티드 및/또는 이것들을 포함하는 조성물은 예방 또는 치료될 질병이나 질환을 예방 및/또는 치료하는데 적당한 치료 방식에 따라서 투여된다. 임상의는 일반적으로 인자들 예를 들어, 예방 또는 치료될 질병이나 질환, 치료될 질병의 심각성 및/또는 이의 증상의 심각성, 사용될 본 발명의 특정 나노바디 또는 폴리펩티드, 사용될 특정 투여 경로 및 약학적 제형 또는 조성물, 환자의 연령, 성별, 체중, 식습관, 전체적인 건강 상태와, 임상의에게 널리 알려진 유사한 인자들에 따라서, 적당한 치료 방식을 결정할 수 있다.
일반적으로, 치료 방식은 하나 이상의 본 발명의 나노바디 및/또는 폴리펩티드, 또는 이것들을 포함하는 하나 이상의 조성물을, 한 가지 이상의 치료학적 유효량 또는 투여량만큼 투여하는 것을 포함할 것이다. 투여될 구체적인 양 또는 투여량은 또한 전술한 바와 같은 인자들을 바탕으로 하여, 임상의에 의해 결정될 수 있다.
일반적으로, 본원에 언급된 질병 및 질환을 예방 및/또는 치료함에 있어서, 치료받을 구체적인 질병 또는 질환, 사용될 본 발명의 구체적인 나노바디 및 폴리펩티드의 효능, 구체적인 투여 경로, 및 사용된 구체적인 약학 제형 또는 조성물에 따라서, 본 발명의 나노바디 및 폴리펩티드는 일반적으로 매일 체중 1㎏당 1g∼0.01㎍, 바람직하게는 0.1g∼0.1㎍ 예를 들어, 1, 10, 100 또는 1000㎍의 양만큼, 매일 1회 투여하는 방식으로, 또는 하루에 다수 회 나누어 투여하는 방식에 따라서 연속 투여(예를 들어, 흡입에 의해 투여)될 것이다. 임상의는 일반적으로 본원에 언급된 인자들에 따라서, 적당한 1일 투여량을 결정할 수 있을 것이다. 또한, 특별한 경우, 임상의는 예를 들어, 전술한 바와 같은 인자들과 그의 명철한 판단력을 바탕으로 하여, 이와 같은 투여량에 변화를 줄 수도 있다. 일반적으로, 투여될 양에 관한 몇몇 지침은, 일반적으로 동일한 표적에 대한 상응하는 종래의 항체 또는 항체 단편을 본질적으로 동일한 경로를 통해 투여할 때의 양으로부터 얻어질 수 있으나, 이 경우에는 당 업자에게 널리 공지된 친화도/결합성, 효능, 생체 분포, 반감기 및 유사한 인자들의 차이를 고려하여야 할 것이다.
일반적으로, 전술한 방법에 있어서, 본 발명의 단일 나노바디 또는 폴리펩티드가 사용될 것이다. 그러나, 본 발명의 나노바디 및/또는 폴리펩티드를 2개 이상 함께 사용하는 것도 본 발명의 범위 내에 포함된다.
본 발명의 나노바디 및 폴리펩티드는 또한 상승 효과를 낼 수 있거나 낼 수 없는 하나 이상의 약학적으로 활성인 추가의 화합물 또는 성분과 함께(즉, 병행 처치 방식으로서) 사용될 수도 있다. 또한, 임상의는 이러한 추가의 화합물 또는 성분, 그리고 병행될 적당한 처치 방식을, 전술한 바와 같은 인자들과 그의 냉철한 판단력을 바탕으로 하여 선택할 수 있을 것이다.
특히, 본 발명의 나노바디 및 폴리펩티드는 상승 효과가 얻어질 수 있는지 아니면 얻어질 수 없지 여부에 따라서, 본원에 언급된 질병 및 질환을 예방 및/또는 치료하기 위하거나 또는 여기에 사용될 수 있는 기타 약학적으로 활성인 화합물 또는 성분과 함께 사용될 수 있다. 이러한 화합물 및 성분, 그리고 이것의 투여 경로, 방법 및 약학적 제형 또는 조성물에 관하여는 임상의에게 널리 알려져 있을 것이며, 상기 화합물 및 성분의 예로서는 헤파린, 아스피린(예를 들어, 아스페직(Aspegic)®), 플라빅스(Plavix) 및/또는 레오프로(Reopro)를 포함하나, 이에 한정되는 것은 아니다.
2개 이상의 물질 또는 성분들이 병행 처치 방식의 일부로서 사용될 때, 이러한 물질 또는 성분들은 동일한 투여 경로나 상이한 투여 경로를 통하여, 본질적으로 동일한 시기 또는 상이한 시기에(예를 들어, 본질적으로 동시에, 연속적으로 또는 번갈아가며) 투여될 수 있다. 물질 또는 성분들이 동일한 투여 경로를 통해 동시에 투여될 때, 이와 같은 물질 또는 성분들은 당 업자에게 명백한 바와 같이, 상이한 약학 제형 또는 조성물, 또는 혼합 약학 제형 또는 조성물의 한 성분으로서 투여될 수 있다.
뿐만 아니라, 2개 이상의 활성 물질 또는 성분들이 병행 처치 방식의 일부로서 사용될 때, 이러한 물질 또는 성분들은 각각 동일한 양으로, 이 화합물 또는 성분이 그 자체로서 사용될 때와 동일한 방식에 따라서 투여될 수 있으며, 이와 같이 병용함으로써 상승 효과를 낼 수 있거나 아니면 그렇지 않을 수도 있다. 그러나, 2개 이상의 활성 물질 또는 성분들을 함께 사용하여 상승 효과를 낼 수 있을 때, 투여될 물질 또는 성분들 중 하나 이상 또는 전부의 양을 감소시킬 수도 있음과 동시에, 원하는 치료 작용도 가져올 수 있다. 이는 예를 들어, 상기 물질 또는 성분들이 통상의 양으로 사용될 때, 이 물질 또는 성분 중 하나 이상을 사용함에 따라서 유발되는 원치 않는 임의의 부작용을 피하거나, 제한하거나 또는 감소시키는데 유용할 수 있으며, 또한 원하는 약리 효과 또는 치료 효과를 얻을 수도 있다.
본 발명에 따라서 사용된 처치 방식의 효능은 임상의에게 널리 알려져 있는 바와 같이, 관련 질병 또는 질환에 대해 공지된 임의의 방식으로 결정될 수 있으며/있거나 이에 따를 수 있다. 임상의는 또한 적당한 경우 및/또는 구체적인 상황에 따라서, 처치 방식을 구체적으로 바꾸거나 변형시킬 수 있을 것이며, 그 결과, 원하던 치료 효과를 얻을 수 있고, 원치 않는 부작용을 피하거나, 제한하거나 또는 감소시킬 수 있으며/있거나, 한편으로는 원하는 치료 효과를 이룰 수 있고, 다른 한편으로는 원치않는 부작용을 피하거나, 제한하거나 또는 감소시킬 수 있게 된다.
치료받을 대상은 임의의 온혈 동물일 수 있으나, 구체적으로는 포유동물, 더욱 구체적으로는 인간이다. 당 업자에게 널리 알려진 바와 같이, 치료받을 대상은 특히, 본원에 언급된 질병과 질환이 발병하였거나 또는 발병할 위험이 있는 사람일 것이다.
본 발명은 또한 환자에게 본 발명의 나노바디 또는 폴리펩티드를 투여함으로써 예방 및/또는 치료될 수 있는 하나 이상의 질병 또는 질환(예를 들어, 본원에 언급된 바와 같은 응집성 질환)의 예방 및/또는 치료를 위한 약학 조성물의 제조 방법에 있어서 본 발명의 나노바디 또는 폴리펩티드의 용도에 관한 것이다.
일반적으로 치료 방법은 원하는 치료 효과가 얻어질 때까지, 그리고/또는 원하는 치료 효과가 유지되는 한 계속 실시될 것이다. 또한, 이는 임상의에 의해 결정될 수 있는 문제이다.
마지막으로, 전술한 본 발명의 나노바디에 대한 CDR 중 하나 이상을 기타 "스캐폴드(scaffold)" 예를 들어, 인간 스캐폴드 또는 비-면역 글로불린 스캐폴드에 "그래프트(graft)"시킬 수 있다는 사실도 당 업자에게 명백할 것이다. 적당한 스캐폴드 및 이와 같은 CDR 그래프팅 기술은 당 업자와 당 업계에 명백할 것이며, 예를 들어, 문헌[US-A-7,180,370, WO 01/27160, EP 0 605 522, EP 0 460 167, US-A-7,054,297, Nicaise외 다수, Protein Science (2004), 13: 1882-1891 ; Ewert외 다수, Methods, 2004 Oct; 34(2): 184-199; Kettleborough외 다수, Protein Eng. 1991 Oct; 4(7): 773-783; O'Brien and Jones, Methods Mol. Biol. 2003: 207: 81-100; 및 Skerra, J. Mol. Recognit. 2000: 13: 167-187, 및 Saerens외 다수, J. Mol. Biol. 2005 Sep 23;352(3):597-607; 및 이에 인용된 추가의 참고 문헌들]을 참조할 것이며; 또한 기타 (단일) 도메인 항체의 틀 부위를 포함하기도 할 것이다. 예를 들어, 마우스나 래트의 CDR을 인간 틀 및 스캐폴드에 그래프팅시키는 것으로서 알려져 있는 기술을, 본 발명의 나노바디의 CDR 중 하나 이상과 하나 이상의 인간 틀 부위 또는 서열을 포함하는 키메라 단백질을 제공하는 방법과 유사한 방식으로 사용할 수 있다.
그러므로, 다른 구체예에서, 본 발명은 본원에 언급된 본 발명의 나노바디에 대한 CDR1 서열, CDR2 서열 및 CDR3 서열로 이루어진 군으로부터 선택되는 하나 이상의 CDR 서열을 포함하는 키메라 폴리펩티드를 포함한다. 바람직하게, 이러한 키메라 폴리펩티드는 본원에 언급된 본 발명의 나노바디에 대한 CDR3 서열들로 이루어진 군으로부터 선택되는 하나 이상의 CDR 서열과, 임의로는 본원에 언급된 본 발명의 나노바디에 대한 CDR1 서열 및 CDR2 서열로 이루어진 군으로부터 선택되는 하나 이상의 CDR 서열을 포함하기도 한다. 예를 들어, 이러한 키메라 폴리펩티드는 본원에 언급된 본 발명의 나노바디에 대한 CDR3 서열로 이루어진 군으로부터 선택되는 하나의 CDR 서열, 본원에 언급된 본 발명의 나노바디에 대한 CDR1 서열로 이루어진 군으로부터 선택되는 하나의 CDR 서열, 그리고 본원에 언급된 본 발명의 나노바디에 대한 CDR1 서열 및 CDR2 서열로 이루어진 군으로부터 선택되는 하나의 CDR 서열을 포함할 수 있다. 본원에 언급된 본 발명의 나노바디에 바람직한 CDR 조합은 또한 이와 같은 키메라 폴리펩티드에 대해 바람직할 것이다.
상기 키메라 폴리펩티드에 있어서, CDR은 추가의 아미노산 서열에 결합될 수 있으며/있거나, 아미노산 서열을 통하여 서로 결합될 수 있는데, 여기서, 상기 아미노산 서열은 바람직하게는 틀 서열이거나 틀 서열의 역할을 하는 아미노산 서열이며, 또는 함께 CDR을 제시하는 스캐폴드를 형성한다. 마지막 문단에 언급된 선행 기술을 참조하시오. 하나의 바람직한 구체예에 따르면, 본 발명의 아미노산 서열은 인간의 틀 서열로서, 예를 들어, VH3 틀 서열이다. 그러나, 비-인간, 합성, 반-합성 또는 비-면역 글로불린 틀 서열도 사용될 수 있다. 바람직하게, 사용된 틀 서열은, (1) 키메라 폴리펩티드가 xxxx와 1% 이상, 바람직하게는 5% 이상, 더욱 바람직하게는 10% 이상, 예를 들어, 25% 이상 및 50% 이하 또는 90% 이상의 친화도(본 발명의 상응하는 나노바디의 친화도)로 결합될 수 있고; (2) 키메라 폴리펩티드가 약학적 용도로서 적당하며; (3) 키메라 폴리펩티드가 바람직하게는 약학용으로서 사용되는 조건[본 발명의 나노바디의 사용에 관하여 본원에 개시되어 있는 조건과 본질적으로 유사할 수 있는 조건 즉, 징후, 투여 방식, 투여량 및 처치 방식] 하에서 본질적으로 비-면역원성인 것이다.
하나의 비 제한적인 구체예에 따르면, 키메라 폴리펩티드는 하나 이상의 틀 서열을 통하여 결합되어 있는 2개 이상의 CDR 서열(전술한 바와 같음)을 포함하는데, 여기서, 상기 2개의 CDR 서열 중 하나 이상은 CDR3 서열이고, 다른 CDR 서열은 CDR1 또는 CDR2 서열인 것이 바람직하다. 바람직하되 비 제한적인 구체예에 따르면, 키메라 폴리펩티드는 2개 이상의 틀 서열에 결합되어 있는 2개 이상의 CDR 서열(전술한 바와 같음)을 포함하며, 여기서, 상기 3개의 CDR 서열 중 하나 이상의 서열은 CDR3 서열이고, 나머지 2개의 CDR 서열은 CDR1 서열 또는 CDR2 서열인 것이 바람직하며, 하나의 CDR1 서열과 하나의 CDR2 서열인 것이 바람직하다. 하나의 특히 바람직하되 비 제한적인 구체예에 따르면, 키메라 폴리펩티드는 FR1'-CDR1-FR2'-CDR2-FR3'-CDR3-FR4'와 같은 구조를 가지며, 여기서, 상기 CDR1, CDR2 및 CDR3은 상기 본 발명의 나노바디의 CDR에 대해 정의된 바와 같으며, FR1', FR2', FR3' 및 FR4'는 틀 서열이다. FR1', FR2', FR3' 및 FR4'는 각각 구체적으로 인간 항체(예를 들어, VH3 서열)의 틀 1, 틀 2, 틀 3 및 틀 4 서열 및/또는 이러한 틀 서열의 부분 또는 단편일 수 있다. 또한, FR1'-CDR1-FR2'-CDR2-FR3'-CDR3-FR4와 같은 구조를 가지는 키메라 폴리펩티드의 부분 또는 단편을 사용할 수도 있다. 바람직하게, 이러한 부분 또는 단편은 상기 문단에 제시한 기준에 부합하는 것이다.
본 발명은 다음과 같은 비 제한적인 실시예와 도면을 통해 더욱 상세히 기술될 것이다.
또한, 첨부된 표는 본 발명의 명세서의 완전한 일부를 이룰 것이며, 다음과 같은 표들이 추가로 포함되어 있다:
표 8: 항-vWF 나노바디의 서열 목록.
표 9: 항-vWF 나노바디의 발현 수율.
표 10: 항-vWF 나노바디의 관류 챔버 내에서의 혈소판 부착율.
표 11: 12B6 및 12A5 상동체 나노바디의 서열 목록.
표 12: 12A5 상동체 나노바디에 대한 Kon, Koff 및 KD의 측정치.
표 13: 12B6 상동체 나노바디에 대한 Kon, Koff 및 KD의 측정치.
표 14: 12B6, 12A2 및 12A5 나노바디의 실제 KD값.
표 15: 12B6, 12A2 및 12A5 나노바디의 관류 챔버 내에서의 혈소판 부착율.
표 16: 고온에서 가열한 후 12B6, 12A2 및 12A5 나노바디의 농도.
표 17: 2가 나노바디의 서열 목록.
표 18: 링커 서열의 서열 목록.
표 19: 2가 12B6, 12A2 및 12A5 나노바디의 발현 수율.
표 20: 고온에서 가열한 후 12B6 2가 나노바디의 농도.
표 21: 고온에서 가열한 후 12A2 2가 나노바디의 농도.
표 22: 고온에서 가열한 후 12A5 2가 나노바디의 농도.
표 23: 12A2 2가 나노바디의 관류 챔버 내에서의 혈소판 부착율.
표 24: 인간화된 12B6 나노바디의 서열 목록.
표 25: 야생형 및 인간화된 12B6 나노바디의 발현 수율.
표 26: 고온에서 가열한 후 야생형 및 인간화된 12B6 나노바디의 농도.
표 27: 야생형 및 인간화된 12B6 나노바디에 대한 KD값.
표 28: 인간화된 12A2 나노바디의 서열 목록.
표 29: 야생형 및 인간화된 12A2 나노바디의 발현 수율.
표 30: 고온에서 가열한 후 야생형 및 인간화된 12A2 나노바디의 농도.
표 31: 관류 챔버 내에서의 야생형 및 인간화된 12A2 나노바디(0.7 및 1.5 ug/㎖)와 혈소판의 부착율.
표 32: 관류 챔버 내에서의 야생형 및 인간화된 12A2 나노바디(0.5, 1 및 2 ug/㎖)와 혈소판의 부착율.
표 33: 야생형 및 인간화된 12A2 나노바디에 대한 KD값.
표 34: 인간화된 12A5 나노바디의 서열 목록.
표 35: 야생형 및 인간화된 12A5 나노바디의 발현율.
표 36: 고온에서 가열한 후 야생형 및 인간화된 12A5 나노바디의 농도.
표 37: 야생형 및 인간화된 12A5 나노바디에 대한 KD값.
표 38: 인간화된 2가 나노바디의 서열 목록.
표 39: 인간화된 2가 나노바디의 발현 수율.
표 40: 고온에서 가열한 후 인간화된 2가 나노바디의 농도.
표 41: 야생형 및 인간화된 2가 나노바디의 혈소판 부착율.
표 42: 폴츠 연구(Folts study)에 있어서 상이한 테스트 화합물로 처리한 개코 원숭이.
표 43: 대조군 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음).
표 44: 아스페직™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음).
표 45: 헤파린™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음).
표 46: 플라빅스™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음).
표 47: 레오프로™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음).
표 48: ALX-0081 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음).
표 49: 폴츠 연구에 있어서, 상이한 테스트 화합물로 처리한 개코 원숭이.
표 50: 폴츠 모델에 있어서 상이한 테스트 약물에 대한 CFR의 억제 결과. 상기 언급한 상이한 조건 하에서 CFR 억제를 관찰하는 실험의 번호는 이와 같은 조건의 독립적 반복 실행의 총 횟수에 대한 함수임.
표 51: 아스페직, 헤파린, 플라빅스 및 ALX-0081로 처리한 각각의 개코 원숭이에 대한 CFR 길이(초). 유효 투여량은 황색으로 표시함.
표 52: 플라빅스™ 처리한 동물에 있어서 제2 대조군 거즈에 대한 실혈 양(최종 투여량 함수)(STD = 표준 편차).
표 53: 레오프로™ 처리한 동물에 있어서 제2 대조군 거즈에 대한 실혈 양(최종 투여량 함수)(STD = 표준 편차).
표 54: ALX-0081 처리한 동물에 있어서 제2 대조군 거즈에 대한 실혈 양(최종 투여량 함수)(STD = 표준 편차).
표 55: 제2의 대조군 거즈에 대한, 총 실혈 양(즉, 테스트 화합물을 처음 5회 투여하였을 때의 실혈 양의 합)의 평균.
표 56: 아스페직, 헤파린, 플라빅스 및 ALX-0081 처리한 개코 원숭이 각각에 있어서 제2의 대조군 거즈에 관한, 거즈의 실혈 양(약품 투여량 함수). CFR을 완전히 억제하는 유효 약품 투여량은 황색으로 표시함.
표 57: 아스페직, 헤파린, 플라빅스 및 ALX-0081 처리한 개코 원숭이 각각에 있어서 리스토세틴-유도 혈소판 응집율(%)(약품 투여량 함수).
표 58: 투여 후 10분 경과시 얻은 혈액 시료 중 ALX-0081의 농도[㎍/㎖].
표 59: ALX-0081 및 vWF로 처리한 개코 원숭이에 대한 CFR의 간격[초].
표 60: ADAMTS13에 의한 A1A2A3의 절단 연구에 있어서, 상이한 혼합물을 제조하기 위한 부피[㎕].
도 1: ELISA에 있어서 나노바디와 vWF의 결합.
도 2: 12A5 상동체 나노바디 서열의 배열.
도 3: 12B6 상동체 나노바디 서열의 배열.
도 4: 바이어코어(BIACORE)에 있어서 12A5 상동체 나노바디와 vWF의 결합.
도 5: 바이어코어에 있어서 12B6 상동체 나노바디와 vWF의 결합.
도 6: 상이한 농도의 12B6, 12A2 및 12A5 나노바디와 혈소판의 부착률.
도 7a: 고온에서 가열한 후 12B6 나노바디와 vWF의 결합(ELISA).
도 7b: 고온에서 가열한 후 12A2 나노바디와 vWF의 결합(ELISA).
도 7c: 고온에서 가열한 후 12A5 나노바디와 vWF의 결합(ELISA).
도 8a: ELISA에 있어서 상이한 종으로부터 유래한 vWF와 12B6 나노바디의 결합.
도 8b: ELISA에 있어서 상이한 종으로부터 유래한 vWF와 12A2 나노바디의 결합.
도 8c: ELISA에 있어서 상이한 종으로부터 유래한 vWF와 12A5 나노바디의 결합.
도 9: 바이어코어에 있어서 vWF와 2가 12B6 나노바디의 결합.
도 10: 바이어코어에 있어서 vWF와 2가 12A2 나노바디의 결합.
도 11: 바이어코어에 있어서 vWF와 2가 12A5 나노바디의 결합.
도 12: 고온에서 가열한 후 2가 12B6 나노바디와 vWF의 결합(ELISA).
도 13: 고온에서 가열한 후 2가 12A2 나노바디와 vWF의 결합(ELISA).
도 14: 고온에서 가열한 후 2가 12A5 나노바디와 vWF의 결합(ELISA).
도 15: 인간화된 12B6 나노바디 서열의 배열.
도 16: 야생형 및 인간화된 12B6 나노바디와 vWF의 결합(ELISA).
도 17: 인간화된 12A2 나노바디 서열의 배열.
도 18: 고온에서 가열한 후 인간화된 12A2 나노바디와 vWF의 결합(ELISA).
도 19: 인간화된 12A2 나노바디와 vWF의 결합(ELISA).
도 20: 인간화된 12A5 나노바디 서열의 배열.
도 21: 야생형 및 인간화된 12A5 나노바디와 vWF의 결합(ELISA).
도 22: 2가 형태로서 선택된 나노바디의 배열.
도 23: 상이한 농도의 2가 (인간화) 나노바디와 혈소판의 부착률.
도 24: 개코 원숭이에 있어서 폴츠 모델(Folts model)에 대한 혈류 패턴.
도 25: 개코 원숭이에 있어서 폴츠 모델에 대한 실험 계획.
도 26: 개코 원숭이 대조군의 폴츠 연구 결과. CFR을 나타내고 있는, 혈류의 시간에 대한 함수(각각 2회의 독립 실험에 관함).
도 27: 아스페직 처리된 개코 원숭이 군의 폴츠 연구 결과. CFR을 나타내고 있는, 혈류의 시간에 대한 함수(각각 3회의 독립 실험에 관함).
도 28: 헤파린 처리된 개코 원숭이 군의 연구 결과. CFR을 나타내고 있는, 혈류의 시간에 대한 함수(각각 3회의 독립 실험에 관함).
도 29: 플라빅스 처리된 개코 원숭이 군의 폴츠 연구 결과. CFR을 나타내고 있는, 혈류의 시간에 대한 함(각각 4회의 독립 실험에 관함)수.
도 30: 레오프로 처리된 개코 원숭이 군의 폴츠 연구 결과. CFR을 나타내고 있는, 혈류의 시간에 대한 함수(각각 3회의 독립 실험에 관함).
도 31: ALX-0081(서열 번호 98)로 처리된 개코 원숭이 군의 폴츠 연구 결과. CFR을 나타내고 있는, 혈류의 시간에 대한 함수(각각 8회의 독립 실험에 관함).
도 32: 아스페직, 헤파린, 플라빅스 및 ALX-0081을 조합하여 처리한 개코 원숭이(6번)로부터 얻어진 혈류.
도 33: 플라빅스, 레오프로 및 ALX-0081을 상이한 투여량으로 투여하였을 때의 상대적 실혈 양(평균값).
도 34: 플라빅스를 투여량을 늘려가면서 처리한 동물에 있어서의 평균 CFR 간격 및 상대적 실혈 양(평균값).
도 35: 레오프로를 투여량을 늘려가면서 처리한 동물에 있어서의 평균 CFR 간격 및 상대적 실혈 양(평균값).
도 36: ALX-0081을 투여량을 늘려가면서 처리한 동물에 있어서의 평균 CFR 간격 및 상대적 실혈 양(평균값).
도 37: ALX-0081을 투여량을 늘려가면서 처리한 각 개코 원숭이에 있어서 리스토세틴-유도 응집율(%, ■) 및 CFR 간격(s, ◆).
도 38: ALX-0081을 처리한 개코 원숭이에 있어서 ALX-0081의 혈장 중 농도 대 CFR 간격.
도 39: 거즈로부터 얻은 혈액에 대한 ALX-0081의 혈장 중 농도 대 상대적 실혈 양.
도 40: ALX-0081 및 vWF 처리한 개코 원숭이 1의 폴츠 연구 결과. CFR을 나타내는, 시간에 따른 혈류.
도 41: 자극된 내피 세포로부터 분비된 ULvWF에 부착된 혈소판의 섬유(화살표).
도 42: ALX-0081의 존재 하에 혈소판이 ULvWF에 대해 관류될 때, 혈소판 섬유가 없어짐.
도 43: 대조군 관류 실험: 정상 혈장을 이용한 관류 이전(패널A, 적색 화살표) 및 관류 중(패널 B)에서의 ULvWF 섬유. 패널 B에 있어서, ADAMTS-13에 의해 절단된 ULvWF 섬유 조각을 각각 청색 화살표와 적색 화살표로 나타냄[ULvWF 섬유 조각이 이동한 경우 또는 크게 절단된 ULvWF 섬유].
도 44: ALX-0081의 존재 하에서의 관류 실험. 정상 혈장을 이용한 관류 이전(패널A) 및 관류 후(패널 B)에서의 현미경 이미지(동일 배율 적용). ULvWF 섬유는 패널 A에서 적색 화살표로 나타내었는데, 이 섬유는 ULvWF가 ADAMTS-13에 의해 절단되는 패널 B에서는 나타나지 않음.
도 45: ALX-0081의 부재 및 존재 하에서의 정상 풀 혈장(normal pool plasma; NPP)에 존재하는 A1-A2-A3의 ADAMTS-13에 의한 절단 결과
A.
vWF
에 특이적인
나노바디의
선별 및 스크리닝, 그리고 혈소판 부착 억제
실시예
1: 항원 특이적 1가
나노바디
인간 vWF 또는 vWF의 재조합 A1 도메인으로 면역화된 라마로부터 표 8에 제시한 나노바디(서열 번호 60 및 서열 번호 66)를 얻어냈다. 이 나노바디는 vWF의 A1 도메인과 결합하였으며, 또한 혈소판 상에서 vWF와 gpIb 사이의 상호 작용을 억제하였다.
실시예
2:
나노바디의
발현 및 정제
플라스미드를 제조하여(QIAGEN, 제조자의 지침에 따름) 이를 WK6 또는 TG1 전기-수용성(electro-competent) 세포에 형질 전환시켰다. 하나의 콜로니를 사용하여 2% 글루코스 및 100㎍/㎖의 암피실린을 함유하는 LB 배지에서 밤새도록 배양하였다. 이와 같이 밤새 배양한 배양액을 2×300㎖의 TB 배지(100㎍/㎖의 암피실린 함유) 중에서 100배 희석시킨 후, 이를 OD600이 0.5가 될 때까지 37℃에서 항온 처리하였다. 1 mM의 IPTG를 첨가하고, 배양액을 37℃에서 3시간 더 항온 처리한 다음 8℃에서 밤새도록 항온 처리하였다.
배양액을 4℃에서 20분 동안 10000rpm으로 원심 분리하였다. 펠릿을 밤새도록 동결시키고, -20℃에 1시간 동안 방치하였다. 그 다음, 펠릿을 실온에서 40분 동안 해동시키고, 이를 20㎖의 페리 완충액(50 mM NaH2PO4 및 300 mM NaCl)에 재현탁시킨 다음, 실온에서 1시간 동안 진탕시켰다. 세포질 주변 분획을 4℃에서 20분 동안 20000rpm으로 원심분리하여 분리하였다. 제조자의 지침에 따라서 나노바디를 니켈 컬럼(TALON, Clonetech) 상에서 정제하고, 발현 수율(expression yield)을 계산하여 표 9에 제시하였다.
실시예
3:
ELISA
에 있어서,
나노바디와
vWF
의 결합
실시예 1의 나노바디를 vWF와의 결합 여부에 대해 테스트하였다(ELISA). 즉, 미세 역가 평판(Nunc, Maxisorb)을 200배 희석시킨 vWF(Red Cross)로 코팅한 후, 37℃에서 15분 동안 예비-가온하였다. 이 평판을 밤새도록 4℃에서 코팅하였다. 그 다음, 이 평판을 PBS-Tween으로 세척하고, 실온에서 2시간 동안 PBS-1% 카세인으로 블로킹하였다. 세척 후, 시료를 농도 10㎍/㎖로 만든 후, 이를 PBS 중에 3배 희석하였다. 2시간 동안 항온 처리한 후, 상기 평판을 세척하고, 실온에서 1 시간 동안 마우스 모노클로날 항-myc 항체를 1000배 희석하였다. 이 평판을 세척하고, 실온에서 1시간 동안 폴리클로날 항-마우스-HRP(DAKO)를 1000배 희석하였다. 평판을 세척하고, ABTS/H2O2 기질을 가하였다. 405㎚에서의 OD를 측정하였다. 그 결과를 도 1에 나타내었다.
실시예
4: 유동
챔버
내에서
나노바디에
의한 혈소판 부착의 억제
관류 챔버 내에서 단백질 시료를 분석하였다. 서마녹스(Thermanox) 커버슬립(Nunc)을 밤새도록 80% 에탄올에 침지시킨 다음, 증류수로 철저히 헹구고 공기 건조시켰다. 제III형 인간 태반 콜라겐(Sigma)을 0.05 mol/㎖의 아세트산 중에 용해시키고, 이를 리터칭 에어브러쉬(retouching airbrush)를 사용하여, 최종 밀도 30㎍/㎠가 되도록 커버슬립에 분무하였다. 분무 후, 이 커버슬립을 PBS중 1% 인간 알부민 용액으로 블로킹시켰다(실온, 1시간 이상). 비-박동 흐름 하에서 변형된 소형 관류 챔버(슬릿 길이 = 0.1㎜ 및 슬릿 폭 = 2㎜)를 이용하여 1회 통과 관류 챔버로 관류시켰다. 건강한 지원자의 정맥을 천자하여 혈액을 채취하고, 이를 펜타(Penta)/PPACK를 사용하여 응고를 방지하였다. 3개의 커버슬립을 챔버에 삽입하였다. 혈액 5㎖를 37℃에서 5분 동안 예비 가온한 다음(2㎍/㎖의 나노바디의 존재 하 또는 부재 하), 5분 동안 챔버를 통과하여 순환시켰다(벽 전단율 = 1600 s-1, 주입 펌프 사용). 관류시킨 다음, 상기 커버슬립을 챔버로부터 분리해 내어, 이를 헤 페스 완충 염수(Hepes buffered saline; 10 mM Hepes, 150 mM NaCl, pH 7.4) 중에서 헹구고, 이를 PBS 중 0.5% 글루타르알데히드 중에 고정시킨 다음, 메탄올 중에서 탈수시키고, 다시 메이-그룬왈트(May-Grunwald) 및 김사(Giemsa)(Riedel de Haen)로 염색하였다. 광학 현미경과 컴퓨터-보조 분석을 이용하여 혈소판 표면을 덮는 정도로서 혈소판 침착 여부를 평가하였다. 그 결과를 표 10에 나타내었다. 나노바디 12B6과 12A5는 고 전단율일 때 관류 챔버 내 제III형 콜라겐과 혈소판의 부착을 억제하였음을 확인할 수 있었다.
실시예
5:
상동체
나노바디와
vWF
가 결합하는지 여부에 대한
바이어코어
분석
나노바디 12B6과 12A5는 관류 챔버 내에서 혈소판 부착을 억제한다. 표 11의 서열 번호 67∼서열 번호 73에 나타낸 바와 같이 아미노산 차이를 나타내는 라마로부터 상동체 서열을 구하였다. 도 2 및 도 3은 12A5 및 12B6 상동체 나노바디 서열의 배열을 나타내는 것이다.
아민 커플링을 통하여 vWF를 센서 칩 표면에 결합시켰다. EDC/NHS[0.4 M의 1-에틸-3-(3-디메틸아미노프로필)-카보디이미드와 0.1 M의 N-하이드록시숙신이미드의 수중 1:1 혼합물]를 7분 동안 주사하여 칩의 CM5 표면을 활성화시켰다. 활성화될 때, 6000 반응 단위로 증가할 때까지 vWF를 주사하였다. 과량의 반응기를 1M 에탄올아민-HCl(pH8.5)로 7분 동안 비활성화하였다. 5ul/분으로 고정 과정이 진행되는 동안 유속을 일정하게 유지시켰다. 이때, 용출 완충액은 0,01 M HEPES(pH 7,4) 0,15 M NaCl, 3 mM EDTA 및 0,005 % 계면 활성제 P20의 혼합 용액이었다.
나노바디 12B6과 12A5 그리고 이의 상동체 단백질을 바이어코어에서 vWF를 이용하여 분석하였다[나노바디 농도 = 5㎍/㎖, 도 4 및 도 5 참조]. 측정된 Kon, Koff 및 KD 값을 표 12 및 표 13에 나타내었다. 나노바디 12A5와 12B6은 최상의 Kon 및 Koff 비율을 나타내었다. 나노바디 12A2 및 12B6은 최상의 Kon 비율을 나타내었으며, Koff 비율은 테스트된 모든 나노바디에 있어서 거의 같았다.
표 14는 나노바디가 일정 범위의 농도로 존재할 때 바이어코어에서의 vWF에 대한 실제 KD 값을 나타내는 것이다. 각각의 나노바디에 대해 생성된 한 세트의 커브로부터, 평형에 도달할 경우의 곡선만을 사용하여, 정상 상태 친화도를 통해 KD 값을 유추하였다.
급성 증상을 치료함에 있어서, vWF의 신속한 억제는 매우 중요하므로, Kon 비율이 큰 것이 바람직하다. Kon 비율은 인간 또는 동물에 주사될 때, 나노바디가 얼마나 빨리 그것의 표적(vWF)과 결합하는지를 결정해주는 것이다.
실시예
6: 관류
챔버
내에서 효능에 대한 억제
나노바디의
비교
혈소판 부착을 억제하는 효능을 비교하기 위해, 나노바디 12A2, 12B6 및 12A5를 관류 챔버 내에서 테스트하였다(0.2, 0.4 및 0.6 ㎍/㎖). 본 실험은 모든 나노바디에 대해 동일한 공여체를 사용하여 수행하였다. 그 결과를 표 15와 도 6에 나타내었다. 상기 나노바디는 관류 챔버 내에서의 억제 효능이 거의 동일하였으며, 나노바디 농도가 0.6㎍/㎖일때 혈소판 부착 억제 효능이 최대였다.
실시예
7: 고온에서의
나노바디의
안정성
PBS 중 농도 200㎍/㎖인 나노바디 스톡 용액을 제조하고, 이를 몇몇 튜브에 나누어 넣었다. 나노바디를 함유하는 각 튜브를 상이한 온도에서 1시간 동안 항온 처리한 다음, 실온으로 2시간 동안 냉각시키고, 이것들을 밤새도록 4℃에 방치하였다. 그 다음날, 이 시료들을 30분 동안 13000 rpm에서 원심 분리하고, 상청액의 OD값을 280㎚에서 측정하였다. 상청액의 농도를 분광 분석계로 측정하고, 이를 실온에서의 농도 %로서 표시하였다. 그 결과를 표 16에 요약하였다.
상청액을 또한 ELISA에서 테스트하여, 실시예 3에 기술된 바와 같이 vWF와의 결합 여부에 대해 평가하였다. 도 7a(12B6), 도 7b(12A2) 및 도 7c(12A5)에 나타낸 바와 같이, 상기 나노바디는 고온에서 매우 안정하였다.
실시예
8: 기타 종으로부터 유래하는
vWF
와
나노바디의
교차-반응성
미세 역가 평판을 마우스 항-myc(1/1000)으로 4℃에서 밤새도록 코팅하였다. 이 평판을 PBS-Tween으로 세척하고, 실온에서 2시간 동안 PBS-1% 카세인으로 블로킹하였다. 세척 후, 상기 나노바디를 PBS 중 10㎍/㎖의 농도로 가하였다. 1시간 동안 항온 처리한 후, 상기 평판을 세척한 다음, 혈장(개, 돼지, 인간, 개코 원숭이 및 사이노몰거스 원숭이)을 가하여 처음에는 5배 희석한 후, 그 다음에는 PBS로 2배 더 희석하였다. 상기 평판을 실온에서 1시간 동안 항온 처리하였다. 이 평판을 세척하고, 폴리클로날 항-vWF-HRP(DAKO)를 가하여 실온에서 1시간 동안 2000배 희석하였다. 상기 평판을 세척하고, 여기에 ABTS/H2O2 기질을 가하였다. 405㎚에서의 OD를 측정하였다.
도 8a(12B6), 도 8b(12A2) 및 도 8c(12A5)에 나타낸 바와 같이, 나노바디 12A5, 12A2 및 12B6는 인간, 개코 원숭이 및 사이노몰거스 원숭이 vWF와 교차 반응하였다. 나노바디 12A2 및 12B6은 또한 돼지의 vWF와 교차 반응하였다. 그러므로, 이와 같은 나노바디는 돼지에서의 효능 및 안전성에 대해 테스트될 수 있다. 상기 나노바디 중 어느 것도 개의 vWF와 교차 반응하지 않았다.
B.
vWF
에 대해 특이적이고, 혈소판 부착을 억제하는 2가
나노바디의
구성
실시예
9: 2가
나노바디의
아미노산 서열
표 17(서열 번호 74∼서열 번호 82)은 12B6, 12A2 및 12A5에 대해 구성된 2가 나노바디를 제시하는 것이다. 상기 나노바디는 표 18(서열 번호 83∼서열 번호 85)에 제시한 링커와 결합하였다.
실시예
10: 2가
나노바디의
발현 및 정제
상기 실시예 2에 기술된 바와 같이 발현시켰다. 발현 수율은 표 19에 요약하였다.
실시예
11:
바이어코어
내 2가
나노바디의
분석
실시예 9의 2가 나노바디(1.3 nM)를 상기 실시예 5에 기술된 바와 같이 바이어코어에서 분석하여, vWF 대 1가 나노바디에 대한 친화도를 비교하였다. 상기 2가 나노바디인 12B6(도 9), 12A2(도 10) 및 12A5(도 11)의 vWF에 대한 친화도는 1가 나노바디의 경우와 비교하였을 때 훨씬 우수하였다.
실시예
12: 고온에서의 2가
나노바디의
안정성
상기 실시예 7에 기술된 바와 같이, 2가 나노바디의 안정성을 측정하였다. 상청액 농도(㎍/㎖)를 측정하여 이를 실온에서의 농도 %로서 표시하였다. 그 결과를 표 20(2가 12B6), 표 21(2가 12A2) 및 표 22(2가 12A5)에 요약하였다.
실시예 3에 기술한 바와 같이, ELISA를 통하여, 상청액을 vWF와의 결합 여부에 대해 테스트하였다. 상청액을 다음과 같이 희석하였다: 1/100 → 1/5 희석(PBS 중). 그 결과를 도 12(12B6), 도 13(12A2) 및 도 14(12A5)에 나타내었다.
실시예
13: 유동
챔버
내 1가 및 2가 12A2의 분석
나노바디 12A2(1가 및 2가 형태)를 실시예 4에 기술한 바와 같이, 관류 챔버 내에서 테스트하였다. 모든 나노바디에 대해 동일한 공여체를 사용하여 실험을 수행하였다. 그 결과를 표 23에 요약하였다. 2가 나노바디는 1가 나노바디의 경우에 비하여 혈소판 부착을 보다 효율적으로 억제하였다.
C.
vWF
에 대해 특이적이고 혈소판 부착을 억제하는
나노바디의
인간화
실시예
14: 12B6
나노바디의
인간화
표 24(서열 번호 86∼서열 번호 89)에는 4개의 인간화된 12B6 나노바디를 제시하고 있다. 표 II는 이러한 서열을 얻기 위해 수행되었던 아미노산 변이에 대해 나열하고 있다. 도 15는 12B6에 대한 인간화된 서열의 배열을 제시하고 있다.
실시예 2에 기술한 바와 같이 발현시켰다. 발현 수율은 표 25에 요약하였다.
실시예 7에 기술한 바와 같이 인간화된 나노바디의 안정성을 측정하였다. 표 26은, 실온에서 상청액의 OD 280㎚에서의 농도(㎍/㎖)(%로 표시함)를 요약하고 있다.
도 16은 실시예 3에 기술한 바와 같이 수행된 ELISA에 있어서의 vWF와 인간화된 12B6 나노바디의 결합 여부를 나타내는 것이다.
인간화된 12B6 나노바디와 vWF의 친화도를 바이어코어를 통해 측정하였다. KD 값을 표 27에 요약하였다.
실시예
15: 12A2
나노바디의
인간화
표 28(서열 번호 90∼서열 번호 94)은 5개의 인간화된 12A2 나노바디를 제시하고 있다. 표 III 및 표 IV는 이러한 서열을 얻기 위해 수행된 아미노산 변이를 나열하고 있다. 도 17은 12A2에 대한 인간화된 서열의 배열을 제시하고 있다.
실시예 2에 기술한 바와 같이 발현시켰다. 발현율은 표 29에 요약하였다.
인간화된 나노바디의 안정성은 실시예 7에 기술한 바와 같이 측정하였다. 표30은, 실온에서 상청액의 OD 280㎚에서의 농도(㎍/㎖)(%로 표시함)를 요약하고 있다. 모든 인간화된 12A2 나노바디는 고온으로 가열하였을 때 매우 안정하였다.
도 18 및 도 19의 ELISA는 실시예 3에 기술한 바와 같이 진행되었다. ELISA에 있어서 12A2H1 및 12A2H4는 vWF와 매우 잘 결합하였다.
나노바디를 유동 챔버 내에서 테스트하였다(각각 0.7㎍/㎖ 및 1.5㎍/㎖). 모든 실험에는 동일한 공여체를 사용하였다. 실시예 4에 기술한 바와 같이 실험을 수행하였다. 그 결과를 표 31 및 표 32에 요약하였다.
인간화된 12A2 나노바디와 vWF의 친화도를 바이어코어를 통해 측정하였다. KD값을 표 23에 요약하였다.
실시예
16: 12A5
나노바디의
인간화
표 34(서열 번호 95∼서열 번호 97)에는 3개의 인간화된 12A5 나노바디가 제시되어 있다. 표 V는 이러한 서열을 얻기 위해 수행된 아미노산 변이를 나열하고 있다. 도 20은 12A5에 대한 인간화된 서열의 배열을 제시하고 있다.
실시예 2에 기술한 바와 같이 발현시켰다. TALON 정제 이후의 각 인간화된 12A5 나노바디에 대한 발현 수율을 표 35에 요약하였다.
인간화된 12A5 나노바디의 안정성을 상기 실시예 7에 기술한 바와 같이 측정하였다. 상청액의 OD280을 측정하여, 이를 실온에서의 OD280 %로서 나타내었다. 그 결과를 표 36에 요약하였다. 고온 가열시 인간화된 12A5 나노바디 전부의 안정성은 야생형 나노바디와 거의 동일하였다.
실시예 3에 기술한 바와 같이 ELISA를 수행하였다. 도 21은 ELISA에 있어서 vWF에 대한 결합 활성을 나타내는 것이다.
인간화된 12A5 나노바디의 vWF에 대한 친화도는 바이어코어를 통해 측정하였다. KD 값은 표 37에 요약하였다.
실시예
17: 인간화된 2가
나노바디
3개의 인간화된 나노바디인 12A2H1, 12A2H4 및 12B6H2를 3개의 링커를 이용하여 2가 형태에 대해 선별하였다. 상기 3개의 나노바디의 서열들은 도 22에 나타낸 바와 같이, 소수의 아미노산에 있어서만 차이가 있었다. 표 38(서열 번호 98∼서열 번호 100)은 2가 나노바디의 서열을 나열하고 있다. 표 38(서열 번호 101∼서열 번호 106)은 각각 GS9 및 GS30 링커와 결합된 2가의 인간화된 나노바디의 서열을 나열하고 있다.
실시예 2에 기술한 바와 같이 발현시켰다. 제조자의 지침에 따라서 (His)6-태그를 함유하는 나노바디를 니켈 컬럼(TALON, Clonetech) 상에서 정제하였다. 상기 태그-서열은 EQKLISEEDLNGAAHHHHHH이다. 태그를 가지지 않는 나노바디는 단백질 A상에서 정제되었다. 발현 수율을 계산하여, 이를 표 39에 요약하였다.
인간화된 2가 나노바디의 안정성을 실시예 7에 기술한 바와 같이 측정하였다. 상청액의 OD280을 측정하고, 이를 실온에서의 OD280 %로서 표시하였다. 그 결과를 표 40에 요약하였다.
나노바디(인간화되되, 야생형이기도 함)를 0.15㎍/㎖, 0.3㎍/㎖ 및 0.6㎍/㎖의 농도로, 유동성 챔버 내에서 테스트하였다. 모든 실험에 대해서 동일한 공여체를 사용하였다. 실시예 4에 기술한 바와 같이 실험을 수행하였다. 도 23은 상이한 농도의 2가 나노바디와 혈소판의 부착률을 나타내는 것이다. 표 41은 야생형 및 인간화된 2가 나노바디와 혈소판의 부착률을 나열하고 있다.
D.
개코
원숭이
폴츠
(
FOLTS
) 모델에 있어서 동맥 혈전에 대한 (2가)
나노바
디의 효과
실시예
18:
개코
원숭이
폴츠
모델에서의
ALX
-0081의 효능
본 연구에서는, 개코 원숭이의 폴츠 혈전 모델에서 ALX-0081의 효능과 안전성을 평가하였다.
또한, 개코 원숭이의 폴츠 혈전 모델에 있어서 ALX-0081의 효능과 안전성을 임상 실험에 사용된 기타 약품 예를 들어, 레오프로, 플라빅스, 아스페직, 헤파린 및 에피네프린과 비교하였다. 이들 약품 모두를 0.9%의 염화나트륨에 희석하고, 이를 정맥 내 볼루스 투여하였다. 본 연구는 또한 이들 화합물 각각에 대한 유효 투여량을 측정하도록 디자인하였다.
마지막으로, 개코 원숭이의 폴츠 혈전 모델에 있어서의 다음과 같은 약품 즉, 경피적 심혈관 중재술(PCI)에 현재 사용되고 있는 약품을 조합 사용하였을 때의 효능을 테스트하였다: 아스페직, 헤파린 및 플라빅스. 본 발명자들은 또한 ALX-0081을 가장 많이 투여하였을 경우, 상기 약품을 조합 사용하였을 때의 효능을 개선시킬 수 있는지 여부도 평가하였다.
안전성 매개 변수 예를 들어, 출혈의 유도 여부, vWF 및 VIII 인자의 수준, 그리고 혈소판 갯 수, PT 및 aPTT를 관찰하였다.
연구 과정
이와 같이 수행된 본 연구는 이하에 기술한 바와 같이, 원래의 폴츠 모델을 약간 변형시킨 것이다(Folts JD외 다수, Circulation. 1976;54:365-370).
건강한 수컷 및 암컷 개코 원숭이(파피오 어시누스; Papio ursinus)를 사용하였다. 이 동물의 체중은 8∼17㎏에 달하였으며, 실험 전 적어도 2주 동안에는 질병을 앓지 않은 것이었다. 개코 원숭이에게 건조 표준 규정식만을 주었다. 상이한 시점에서의 개코 원숭이를 사용하였다. 개코 원숭이의 체중을 표 42[ALX-0081의 효능 연구, 각각의 약품과 비교] 및 표 50[각 약품과 ALX-0081(가장 많이 사용)을 함께 사용하였을 때의 효능]에 요약하였다.
동물을 안락사시키고, 가열 테이블을 이용하여 체온을 37℃로 유지시켰다. 대퇴 동맥 분절을 주변 조직과 분리하였다. 션트(shunt)를 대퇴 정맥과 대퇴 동맥 사이에 넣어 고 전단율을 형성하였다. 실험 내내 평균 및 단계별 혈류를 계속해서 기록하였다. 기준 혈류는 20분 동안 기록하였다. 이후, 겸자를 이용하여 1초 동안 상기 2개의 동맥을 겹쳐놓아 대퇴 동맥의 원방 절개 부위를 손상시켰다. 클램프를 손상 부위에 놓아 외부에서 협착시켰다.
혈소판 부착과 응집으로 인해 혈류가 점차적으로 느려짐을 관찰할 수 있었다. 혈류가 0으로 감소하였을 때, 클램프를 열어 혈소판이 풍부한 혈전을 이동시켜 혈류를 복구시켰다. 이와 같이, 기계적 복구 이후 혈류의 반복적 감소 패턴을 순환류 감소 현상(cyclic flow reductions; CFR)이라고 부른다. 이와 같은 개코 원숭이에 있어서 최종적으로 안정한 CFR이 유도되는지 여부에 대해 내피 손상 실험을 필요에 따라서 추가로 반복하였다. 혈전의 이동 횟수는 CFR의 횟수를 결정한다. 도 24는 개코 원숭이의 폴츠 모델에 있어서 혈류 패턴을 나타내는 것이다.
재현 가능한 CFR을 30분 동안 억제한 후, 내부 대조군으로서 비이클을 투여하고, CFR을 30분 이상 동안 진행시켰다. 이 기간이 경과한 후, 테스트 제제[염수(n=2), 레오프로(n=3), 아스페직(n=3), 플라빅스(n=4), 헤파린(n=3) 또는 ALX-0081 나노바디™ (n=9)]를 정맥 내 볼루스 주사를 통해 공급하고[이후, ALX-0081을 연속적으로 주입함], 약품 투여 후 30분에 못 미치는 기간 동안 계속 관찰하였다. 테스트 물질의 투여량을 늘려가면서 이 과정을 몇 번 더 반복하였다. 약품 투여 전과 후의 CFR의 간격을 비교함으로써 항-혈전 효과를 정량하였다. CFR이 완전히 억제될 때, 새로 상처를 내어, 억제 현상이 약품 처리 효과에 의한 것인지 즉, 자연적인 치유 현상에 의한 것이 아닌지 여부를 확인하였다. 실험의 마지막에, 에피네프린(2.2㎍/㎏/분)을 주사하여, CFR의 약한 억제 효과와 강한 억제 효과를 구별하였다. 실제로, 아스피린(약한 항-혈소판 약품)이 동일한 모델에 사용될 때, 에피네프린이 존재하면 CFR이 다시 일어난다는 사실이 입증된 바 있다. 실험 계획을 도 25에 나타내었다.
각각의 테스트 화합물을 투여한 이후 CFR 간격을 표 43∼표 48에 요약하였다. CFR을 완전히 억제하는 투여량을 진하게 나타내었다.
폴츠 모델 실험시 혈류의 각 측정값을 도 26∼도 31에 나타내었다.
이러한 결과를 통하여, CFR은 3시간 이상 동안 대조군 동물에서 나타날 수 있음이 입증되었으며, 이때 그 사이에 새로이 상처를 낼 필요는 없었다. CFR의 평균 간격은 2∼5분이었으며, 염수를 주사하였을 때에는 CFR 간격에 어떠한 영향도 미치지 못했다(도 26 및 표 43).
아스페직
3마리의 동물에 아스페직(주사용 아스피린)을 주사하고, CFR을 억제하는지 여부를 관찰하였다. 임상 실험에서, 경피적 관상 동맥 중재술(PCI) 개시 직전에, 환자에게 250㎎(± 3∼5 ㎎/㎏)을 볼루스 주사하였다. 2마리의 동물(3번 및 5번 개코 원숭이)에 있어서, 80 및 40 ㎎/㎏의 아스페직을 각각 투여하였을 경우 CFR은 억제되지 않았다(도 27 및 표 44). 4번 개코 원숭이에 있어서, 대조군 단계에서 CFR의 안정적인 반복 패턴을 확립하는 것은 매우 어려웠다. 몇 초 더 경과한 후에(염수를 주사하였을 때), CFR은 안정적이었다. 아스페직을 5㎎/㎏ 투여하였을 경우에는 CFR이 완전히 억제되었으나, 그보다 많은 양 투여하였을 경우에는, (비록 CFR의 평균 간격은 아스페직을 투여하기 이전보다 3∼4배 더 길었지만), 새로 상처를 냈을 때 CFR은 재발하였다. 에피네프린을 주입한 직후, CFR은 완전히 재발하였다(표 44).
헤파린
3마리의 동물에 미분획화 헤파린을 주사한 후 CFR이 억제되는지 여부에 대해 관찰하였다. 임상 실험에서, 60∼70IU/㎏을 환자에게 볼루스 주사하고, aPTT(활성화 부분 트롬보플라스틴 시간; activated partial thromboplastin time)을 30분 마다 관찰하였다. aPTT가 250초를 초과할 경우에는 헤파린을 더 투여하였다. 7번 및 8번 개코 원숭이에 있어서, 240 IU/㎏만큼 투여하였을 경우에 CFR은 억제되지 않았다(도 28 및 표 45). 6번 개코 원숭이의 경우, 처음 15IU/㎏ 투여하였을 경우에 CFR은 완전히 억제되었으나, 그 이상으로 투여하였을 경우에는, 새로이 상처를 냈을 때 CFR은 매시간 마다 재발하였다. 최다 240 IU/㎏만큼 투여하였을 경우, 새로이 상처를 냈을 때의 CFR은 억제되었으나, 유속은 감소하였고, 에피네프린을 주입하였을 경우, CFR은 즉시 재발하였다.
플라빅스
4마리의 개코 원숭이에 플라빅스를 처리하여 폴츠 연구에 사용하였다. 플라빅스는 메탄올 중에 재현탁하여 주사용 약품으로서 만들어 사용하였다. 따라서, 다른 약품에 대해서도 투여량 증가 실험을 수행할 수 있었다. 환자에게 300∼600㎎의 플라빅스를 경구 투여하였을 때, 플라빅스를 1회 경구 투여한지 2시간 후에는 혈소판 응집이 억제되었음을 알 수 있었다. 개코 원숭이에 있어서 최종 투여량 2.5㎎/㎏일 경우, CFR 간격에 미치는 효과가 입증되었지만, 이와 같은 억제 효과는 주사 후 10분 정도 경과시부터 나타나기 시작하였다(도 29 및 표 46). 12번 개코 원숭이의 경우, 2.5㎎/㎏ 투여하였을 때에 CFR이 완전히 억제되었다. 나머지 3마리의 개코 원숭이의 경우에는, 최종 투여량 5㎎/㎏일 경우에 CFR이 완전히 억제되었다. 새로이 상처를 냈을 때에 CFR은 억제된 상태로 유지되었으나, 에피네프린을 주입한 후에는 다시 재발하였다. 에피네프린 주입을 멈추었을 때, CFR은 5분 더 유지되었으나, 이후 다시 완전히 억제되었다(도 29).
레오프로
3마리의 개코 원숭이의 폴츠 모델에서의 레오프로의 효능에 대해 테스트하였다. 임상 실험에서, 환자에게 250㎍/㎏를 투여한 후 계속해서 시간당 7.5㎍/㎏씩 주입하였다. 13번, 14번 및 15번 개코 원숭이에서 CFR을 완전히 억제하는데 필요한 투여량 또한 상기와 같았다[최종 투여량 = 170∼420㎍/㎏; 도 30 및 표 47]. 개코 원숭이에게 볼루스 주사만을 하였을 경우도 관찰하였다. 상처를 새로 냈을 때, CFR은 완전히 억제된 상태로 유지되었으며, 에피네프린을 주입하여도 이러한 억제를 상쇄시키지는 못하였다(도 30).
ALX
-0081
9마리의 개코 원숭이에 ALX-0081을 투여하여, 이를 폴츠 모델에 사용하였다. 모든 개코 원숭이의 경우, 시간당 30㎍/㎏ + 45㎍/㎏(최종 투여량 = 43㎍/㎏)을 투여하였을 때 CFR이 완전히 억제되었다. 2마리의 개코 원숭이(17번 및 22번 개코 원숭이)의 경우에서는, 시간당 10㎍/㎏ + 15㎍/㎏을 투여하였을 때 CFR이 완전히 억제되었다. 상처를 새로 냈을 때, CFR은 억제된 상태로 유지되었으며, 9마리의 개코 원숭이 모두에 에피네프린을 주입한 후에도 마찬가지였다(도 31 및 표 48).
아스페직
-헤파린-
플라빅스
-
ALX
-0081(
Asp
/
Hep
/
Plav
/
ALX
) 병용 투여
7마리의 개코 원숭이에게 5㎎/㎏의 아스피린과, 60IU/㎏의 헤파린을 볼루스 주사하고, 여기에 플라빅스를 그 양을 늘려가며 투여하였다. 상이한 시점에 헤파린을 더 투여하여 일정 수준으로 유지시켰다(aPTT는 대조군의 2배 이상이어야 함). 테스트 화합물을 각각 투여한 후 30분 동안 CFR을 관찰하였다. 여기에 1㎎/㎏의 플라빅스를 넣은 후 30분 경과시 다시 1㎎/㎏을 더 넣었다. 약품 투여 전과 후의 CFR의 간격을 비교하여 항-혈전 효과를 정량하였다. CFR이 완전히 억제되었을 때, 새로 상처를 냈다. 실험을 마칠 때까지 여기에 에피네프린을 계속 주사하였다.
만일 CFR이 재발하지 않으면, 상처를 다시 냈다. CFR이 2∼3회 반복된 후, ALX-0081을 그 양을 늘려가면서 투여하였다:(l), 3, 10 또는 30㎍/㎏. 2회의 CFR 진행 동안 ALX-0081을 각각 투여하고 잠시 기다린 후, CFR이 완전히 억제될 때까지 그 투여량을 늘렸다. CFR이 완전히 억제되었을 때, 30분 동안 ALX-0081/㎏/시간의 투여량을 1.5배 늘려 계속해서 주입하고, 에피네프린도 계속 주입하였다. 10∼15분 후에 새로이 상처를 냈다. 본 연구에 사용된 개코 원숭이에 대한 설명은 표 49에 제시하였다.
상기와 같이, 각각의 테스트 화합물에 대한 연구를 통하여 얻은 결과를 표 50에 요약하였다. 아스피린, 헤파린 또는 플라빅스를 투여하였을 때에 비하여, ALX-0081과 레오프로를 투여하였을 때에, 폴츠 혈전 개코 원숭이 모델에 있어서의 항-혈전 효과가 훨씬 뛰어났으며; 새로 상처를 내고, 에피네프린을 주입한 후, 아스페직, 헤파린 또는 플라빅스 처리 동물 모델과는 대조적으로, ALX-0081과 레오프로를 처리한 개코 원숭이의 폴츠 모델에서는 CFR이 재발하지 않았다. CFR을 완전히 억제하는데 필요한 ALX-0081의 투여량은 레오프로의 필요 투여량보다 대략 10배 더 적었다. 그러므로, ALX-0081은 레오프로보다 더욱 효과가 뛰어나다는 결론을 내릴 수 있다.
5㎎/㎏의 아스피린과 60IU/㎏의 헤파린을 함께 투여한 후, 플라빅스를 그 양을 늘려가면서 투여하였을 때, 마지막 투여시 7마리의 개코 원숭이 모두에서는 CFR이 완전히 억제되었다. 이 경우, CFR을 완전히 억제하는데 필요한 플라빅스의 투여량은, 플라빅스만을 단독 투여하였을 때에 필요한 투여량보다 2.5배 더 적었다. 테스트된 모든 개코 원숭이에 있어서, 새로 상처를 냈을 때 CFR은 재발하지 않았다(도 32). 그러나, 에피네프린을 주사하자, 5번, 8번, 9번 및 10번 개코 원숭이에서는 CFR이 자발적으로 재발하였으며, 4번, 6번 및 7번 개코 원숭이에 새로 상처를 내었다. 에피네프린 투여와 동시에 헤파린을 더 주사하였다. CFR이 2회 진행된 후, ALX-0081의 투여량을 늘리고, 에피네프린을 계속 주입하였다. ALX-0081의 투여량은 3∼10회에 걸쳐, 1㎍/㎏에서 30㎍/㎏으로 늘렸다. CFR이 완전히 억제되었을 때, ALX-0081을 계속 주입하였으며, 이때 그 투여량은 유효 투여량/㎏/시간의 1.5배로 하였다. 7마리의 개코 원숭이 전부에 있어서, 투여량이 30㎍/㎏일 때 CFR이 완전히 억제되었다. 이러한 ALX-0081의 유효 투여량은 ALX-0081을 단독 투여한 폴츠 모델에서 CFR을 완전히 억제할 때에 필요한 양과 동일한 양이다.
그러므로, ALX-0081의 효능은 플라빅스, 헤파린 및 아스페직을 동시에 주입함으로써 증가하지는 않음을 알 수 있다. 이와 같은 관찰 결과는 본 발명자들의 가설과도 일치한다: 즉, ALX-0081은 손상을 입은 동맥 벽에 도달한 콜라겐과 혈소판 사이의 최초 상호 작용을 억제한다. 다른 한편으로, 플라빅스와 아스페직은 혈전을 형성시키는 케스케이드가 계속해서 진행되는 것을 억제한다. 그러므로, ALX-0081이 혈전 형성 과정의 제일 첫 번째 단계를 방해하는 것처럼, 플라빅스와 아스피린은 효능을 높이는 역할은 하지 않는다. 더욱이, ALX-0081을 유효 투여량만큼 첨가하면서 새로이 상처를 냈을 때, CFR은 재발하지 않았는데, 이는 곧, 나노바디™의 유력한 항-혈전 효과를 입증하는 것이다. 그 결과를 표 51에 요약하였다.
측정 방법
다음과 같은 매개 변수를 측정하였다: a) 출혈 분석, b) vWF 농도, 인자 VIII의 수준 및 혈소판 갯 수, PT 및 aPTT, c) 리스포세틴-유도 혈소판 응집, d) ALX-0081 농도, e) 재발 협착 여부에 대한 동맥 절편의 분석, 및 f) ALX-0081의 면역원성.
a) 출혈 분석
출혈 여부를 분석하기 위해, 메스로 사타구니를 절개하였다. 이 과정은 기준 유속을 기록한 후 15분 경과시 행해졌으며, 이때 사타구니 동맥을 손상시켰다. 상처 부위에 거즈를 집어넣고, 30분 마다 테스트 화합물을 투여하기 직전에 교환하였다. 거즈의 무게를 측정하여 테스트 화합물을 각각 투여한 후의 실혈 양을 측정하였다. 실혈(Blood loss)은 (염수를 주사하는 동안의) 두 번째 대조군 거즈의 실혈 양에 대해서 나타냈다(표 52∼표 54).
플라빅스와 레오프로를 처리한(유효 투여량으로부터 출발) 모든 개코 원숭이에 있어서, 실혈 양은 매우 많았다(각각에 대한 최다 투여량의 9∼40배 이하). ALX-0081을 처리한 동물에 있어서, 출혈량은 플라빅스 처리한 동물의 경우보다 적었으며, 레오프로 처리한 동물의 경우에 비해서는 훨씬 적었다.
항 혈전 약품인 플라빅스, 레오프로 및 ALX-0081의 안전성 대 효능의 수준을 측정하기 위하여, 상기 약품들에 있어서 두 번째 대조군 거즈에 대한 실혈 양의 평균을, 유효 투여량만큼 복수 회 투여시 약품 투여량의 함수로서 나타냈다(도 33). 플라빅스의 유효 투여량은 5㎎/㎏이고, 레오프로의 유효 투여량은 250㎍/㎎이며, ALX-0081의 유효 투여량은 30㎍/㎏이다(표 46∼표 48). 이와 같은 결과는 레오프로와 플라빅스를 비교하였을 때 ALX-0081의 안전성이 우수함을 입증하는 것으로서; ALX-0081이 출혈량을 거의 증가시키지 않고 투여될 수 있는 범위가 플라빅스와 레오프로의 경우에 비하여 훨씬 넓다는 사실을 말해주는 것이다.
거즈의 평균 실혈 양에 대한 결과를 (가능하다면) CFR 평균 간격과 주합하여 나타내었다(도 34∼도 36).
폴츠 모델에 있어서 ALX-0081의 광범위한 치료 유효 시간(therapeutic window)을 관찰하였다: 강한 항-혈전 효과는 누적 투여량(43∼403㎍/㎏)에서 거의 출혈이 없는 경우를 말한다(도 36). 그러나, 이와는 대조적으로, 동일한 모델에서 레오프로와 플라빅스에 대한 치료 유효 시간은 ALX-0081에 비하여 더욱 짧았는데, 이는 강한 항 혈전 효과와 다량의 실혈 양이 합하여진 결과이다(도 34∼도 35).
두 번째 대조군 거즈에 대한, 실혈 총량(즉, 테스트 화합물을 처음에 5회 투여하였을 경우 거즈로부터 얻어지는 실혈 양의 합)의 평균을 표 55에 요약하였다. 이 표에서, 유효 투여량으로 복수 회 투여할 경우 마지막으로 투여한 투여량(즉, 5회 투여량을 유효 투여량으로 나눈 값의 합)을 알 수 있다. 전술한 바와 같이, 플라빅스의 유효 투여량은 5㎎/㎏, 레오프로의 유효 투여량은 250㎍/㎏이며, ALX-0081의 유효 투여량은 30㎍/㎏이다.
표 55에 나타낸 결과는, 플라빅스 처리한 동물에서는 총 실혈 양이 상당히 증가하여, 레오프로 처리한 동물의 경우보다 훨씬 많았음을 말해주는 것이다. ALX-0081 투여 동물에서의 실혈 양은, 각각 플라빅스 또는 레오프로 처리한 동물의 경우보다 2∼4배 적었다. 이는 또한 출혈 위험 면에 있어서, 비록 ALX-0081의 유효 투여량이 10배 이상 더 많았지만, ALX-0081이 플라빅스와 레오프로보다는 안전성이 뛰어나다는 것을 말해주는 결과이다.
아스페직, 헤파린 및 플라빅스를 유효하게 조합하여 사용한 결과, 대조군 거즈에 비하여 실혈 양이 14배 이하만큼 증가하였다(표 56). 아스페직, 헤파린 및 플라빅스를 조합하여 투여할 때 ALX-0081을 가장 많이 투여하면, 4번 및 7번 개코 원숭이를 제외하고는 출혈이 증가하지 않는다. 7번 개코 원숭이에 있어서는, 에피네프린을 투여하고, 여기에 헤파린과 ALX-0081(유효 투여량으로 투여하지는 않음)을 더 첨가한 후에는 출혈이 증가하였지만, 유효 투여량만큼의 ALX-0081을 투여한 후에는 출혈이 다시 줄어들었다. 이러한 결과를 통하여, 현재 임상에서 적용되는 바와 같이 약품을 조합 투여할 때 ALX-0081을 가장 많이 투여하더라도 ALX-0081은 안전하다는 사실을 입증할 수 있었다.
b)
vWF
농도, 인자
VIII
의 수준, 혈소판 갯 수,
PT
및
aPTT
vWF
면역 흡착 검정법을 사용하여 폴츠 모델에서 상이한 농도의 약품을 투여한 후에 취한 혈액 시료의 혈소판 풍부 혈장(platelet rich plasma; PRP) 중 vWF 수준을 측정하고, 이를 인간 기준(인자 VIII 및 VWF에 관한 WHO 5번째 국제 기준)의 %로서 나타냈다.
그 결과를 통하여, 모델에 사용된 상이한 약품들은 vWF 수준에 거의 영향을 미치지 않음을 입증할 수 있었다.
인자
VIII
aPTT 테스트법을 사용하여 폴츠 모델에서 상이한 농도의 약품을 투여한 후에 취한 혈액 시료의 PRP 중 인자 VIII의 수준을 측정하였다. 헤파린으로 처리한 개코 원숭이의 혈장 시료에 대해서는 테스트하지 않았는데, 그 이유는 헤파린이 aPTT 시간을 연장시킨다는 사실을 알아냈기 때문이다. FVIII 수준을, 대퇴 동맥에 상처를 입힌 후 10시간 경과시에 취한 첫 번째 대조군 시료의 %로서 나타냈다. aPTT 테스트에서 어떠한 치료 효과도 살펴볼 수 없었다.
혈소판 갯 수,
PT
및
aPTT
폴츠 모델 실험시 혈소판의 갯 수를 측정하였다. 데이터를 통하여, 다른 동물에 비하여 15번 개코 원숭이의 혈소판 갯 수가 매우 적음을 알 수 있었다. 모든 종류의 약품을 처리하였을 때(단, 플라빅스 처리 제외) 혈소판 갯 수는 대조군 동물의 혈소판 갯 수와 거의 동일하였으며, 시간이 경과함에 따라서 거의 일정하게 유지되었다.
PT값을 통하여, 240IU/㎏의 헤파린으로 처리한 개코 원숭이(PT가 미약하게 증가함)의 경우를 제외하고, PT 시간에 대한 테스트 화합물의 효능은 나타나지 않음을 입증할 수 있었다.
폴츠 모델 연구에 있어서 aPTT값을 관찰한 결과를 요약하였다. 이 결과는 곧, 헤파린 처리된 개코 원숭이의 경우를 제외하고, 테스트 화합물은 aPTT값에 어떠한 영향도 미치지 않음을 말해주는 것이다. 이 동물에 있어서, aPTT값은 30∼60IU/㎏만큼 증가하였는데, 이는 환자의 경우에서도 마찬가지이다. 헤파린은 항-트롬빈과 복합체를 형성하여, 활성화된 혈액 응고 인자 예를 들어, XIa, IXa, Xa 및 트롬빈(인자 IIa)의 억제를 촉진함으로써, 항응고제로서의 기능을 한다. 이와 같은 인자들은 모두 그 기능이 aPTT 테스트에서 측정되는 내인성 응고 케스케이드에 관여한다.
c)
ALX
-0081로 처리된
개코
원숭이로부터 얻은 혈액 중
리스토세틴
-유도성 혈소판 응집률의 측정
ALX-0081로 처리한 개코 원숭이로부터 얻은 혈액을 혈소판 응집의 억제에 대해 분석하였다. 크로놀로그(Chronolog) 전 혈 및 광학 응집능 측정계(Model 560CA, Chronolog, USA) 상에 혈소판을 응집시켰다. 전 혈을 5분 동안 1200rpm에서 원심 분리시켜 PRP(0.38 mol/ℓ 시트르산염 수집)를 준비하였다. PRP를 함유하는 상층 분획을 조심스럽게 따라내었다. 하층 분획은 10분 동안 3000rpm에서 더 원심 분리시켜 혈소판 부족 혈장(platelet poor plasma; PPP)을 만들었다. PRP에서 혈소판 수를 측정하고, 이를 PPP 중에서 희석시켜, 최종 농도 200.000 혈소판/㎕로 희석하였다. 3㎎/㎖의 리스토세틴(DAKO)을 첨가하고, 응집률을 측정하였다.
ALX-0081 처리된 개코 원숭이를 통한 폴츠 실험에서 채취한 혈액 시료 중 세포 외 혈소판 응집률을 측정하였다. 조정 인자로서 리스토세틴을 사용하여 vWF를 통한 GPTb-IX-V 의존성 혈소판 응집률을 측정하였다. 각각의 시점과 각 투여량에서의 응집 %를 측정하였다. 동맥 손상 후 10분 경과시 대조군 시료를 취하였다.
RIPA 테스트로부터 얻은 결과를, ALX-0081 처리한 각각의 개코 원숭이에 대한 CFR 억제율과 비교하였다(도 37). 도 37에 나타낸 바와 같이, RIPA와 CFR 간격은 반비례 관계에 있다. 뿐만 아니라, 이 결과를 통하여, RIPA 테스트에서는, 16, 18, 19 및 23번 개코 원숭이의 CFR을 완전히 억제하는 투여량보다 낮은 투여량일 때 완전히 억제함을 알 수 있었다. 20, 21, 22 및 24번 개코 원숭이에 있어서, RIPA 테스트 결과는 폴츠 모델에서의 효능에 대한 결과와 확연히 구별되었다.
d) ALX-0081의 농도
미세 역가 평판을 마우스 폴리클로날 항-myc(1000배 희석)으로 4℃에서 밤새도록 코팅하였다. 이 평판을 PBS-Tween으로 세척하고, 2시간 동안 실온에서 PBS-1% 카세인으로 블로킹하였다. 시료를 코팅되지 않은 미세 역가 평판에서 25% 참조 개코 원숭이 혈장으로 희석시켰다. 나노바디를 동일한 참조 개코 원숭이 혈장 시료 중에서 희석하여 표준 곡선을 작성하였다. 시료를 항-myc 코팅된 평판에 도포하고, 이를 실온에서 2시간 동안 결합시켰다. 상기 평판을 PBS-Tween으로 5회 세척하였다. 토끼 항-vWF-HRP(DAKO)를 3000배 희석하여 1시간 동안 실온에서 도포하였다. 405㎚에서의 OD를 측정하기 위하여, 시료를 PBS-Tween으로 5회 세척하고, ABTS/H2O2 기질을 첨가하였다.
각각의 볼루스 주사 후 10분 경과시 채취한 혈장 시료 중 ALX-0081의 농도를 측정하였다. 볼루스 주사를 한 직후 계속해서 주입하였다. 농도(㎍/㎖)를 표 58에 요약하였다.
ELISA를 통하여, ALX-0081을 증량 투여한 이후의 모든 개코 원숭이에 있어서, 혈장 시료 중 ALX-0081 수준의 증가 여부를 측정하였다. 16번 개코 원숭이에 있어서, 10㎍/㎏을 투여한 이후 채취한 혈장 중 ALX-0081 양은, 30㎍/㎏을 투여한 이후 채취한 혈장 중 ALX-0081 양에 비하여 증가하였다. 이 시료 중 ALX-0081의 수준은 또한 ALX-0081을 동일한 스케쥴로 투여한 다른 원숭이 모두에서 살펴볼 수 있는 수준보다 훨씬 높았다. 다량 투여한 이후의 16번 개코 원숭이의 ALX-0081 수준은 예상대로였으며, 이를 통하여, 채혈 중 관찰되는 원인 모를 이상 현상이 이 시료에서의 현상을 설명해 줄 수 있을 것이라 추측하였다.
상이한 개코 원숭이에 ALX-0081을 투여할 때마다 그 농도를 달리하였다. 3㎍/㎏을 투여할 경우에는 농도 범위는 0.03∼0.14㎍/㎖로 하였고, 10㎍/㎏을 투여할 경우에는 농도 범위는 0.18∼1.23㎍/㎖로 하였으며, 30㎍/㎏을 투여할 경우에는 농도 범위는 0.51∼1.14㎍/㎖로 하였고, 90㎍/㎏을 투여할 경우에는 농도 범위는 1.38∼6.77㎍/㎖로 하였으며, 270㎍/㎏을 투여할 경우에는 농도 범위는 4.03∼35.14㎍/㎖로으로 하였다. 도 38에 있어서, 혈장 중 ALX-0081 농도 대 CFR 간격의 관계를 그래프로 나타내었다.
CFR을 완전히 억제하는데 필요한 ALX-0081의 농도는 0.3∼0.5㎍/㎖였는데, 이 농도는, 소량의 ALX-0081을 인간 혈액에 넣었을 때, 고 전단율의 유동 챔버 내에서 콜라겐과 혈소판의 부착을 억제하는데 필요한 농도와 거의 일치하였다. 파란색 부분(도 38의 패널 B)에, 억제 작용을 나타내는 ALX-0081의 농도 범위를 나타냈다(16번 개코 원숭이에 10㎍/㎏을 투여하였을 경우).
ALX-0081 농도 대 거즈로부터의 상대적 실혈 양의 그래프를 작성할 때, 1㎍/㎖ 이상 투여시 출혈 양은 2배 이상 증가하였음을 알 수 있었다(도 39). ALX-0081 농도가 19㎍/㎖일 때 실혈 양은 10배 증가하였는데, 이는 유효 농도의 40∼60배에 해당하는 양이기도 하다.
e) 재발 협착에 대한 동맥 절편의 분석
두 번째 동맥을 처리한 후 4주 경과시, 동맥을 주변 조직으로부터 절개해내었다. 동맥을 내피 상처 부위(션트가 위치하는 부위)의 상부와 하부에 묶었다. 하부(션트 위치)와 상부(협착되어 손상된 위치)로부터 2㎝의 절편을 분리하여, 이를 10% 포름알데히드에 넣어두었다. 이후, 안락사 제제(euthenase)로 개코 원숭이를 안락사시켰다. 동맥에 그 기원을 표시하여 두고 이를 각각 2㎜ 고리 형태가 되도록 잘랐다. 고리를 해부용으로서 적당한 마킹 카세트에 넣었다. 이후, 문헌[Bancroft; Bancroft, John D., Stevens Alan (1990) Theory and Practice of Histological Techniques. Third Edition]에 기술된 바와 같이 처리 스케쥴에 따라서 카세트를 자동화 VIP 조직 Tek 처리기(automated VIP Tissue Tek processor)에 밤새도록 넣어 두었다.
처리 후, 동맥을 마킹된 파라핀 왁스 블록에 매립하여, 이를 동결 평판에서 냉각하였다. 왁스 블록을 회전 마이크로톰에서 각각 4 마이크론씩 잘랐다. 절편을 찍어서 슬라이드 글라스 위에 놓고 해부학적 평가를 위한 염색을 수행하였다. 탄성 섬유 염색을 위해, 각각의 동맥에 대해서 헤마톡실린(Haematoxylin)과 에오신(Eosin), 그리고 베어호프(Verhoeff)법을 수행하였다(Bancroft, John D., Stevens Alan (1990), Theory and Practice of Histological Techniques. Third Edition). 염색 후, 슬라이드를 탈수시켜, 세정하고, 이를 쌓은 후 표지화하였다. 절편에 대해 맹검 분석을 수행하였다.
f) 면역원성 분석
3 마리의 개코 원숭이의 혈장 중 ALX-0081 면역 글로불린의 존재 여부를 2가지 방법으로 평가하였다[즉, ELISA법 및 SPR계 방법(바이어코어 상)]. 8주 동안 개코 원숭이를 ALX-0081으로 처리하였다[처음 투여량은 10㎍/㎏으로 하고, 그 양은 점차 늘려감]. 8주 동안, ALX-0081을 주사하였을 때 어떠한 면역원성 반응도 관찰할 수 없었다. ALX-0081의 밤감기는 7∼9 시간이었다.
실시예 20: ALX-0081에 대한 해결 수단으로서의 vWF의 용도
개코 원숭이에서 입증된 ALX-0081의 안전성과 나노바디™의 신속한 소멸률에도 불구하고, ALX-0081에 대한 해결 수단으로서의 vWF의 용도에 대해 평가해보기로 하였다. 본 실험은 개코 원숭이의 폴츠 모델에서 실시되었으며, 여기서, 본 발명자들은 동맥 혈전 형성에 대한 ALX-0081의 억제 효과가 vWF를 주사함으로써 역전될 수 있는지 여부를 평가하였다.
실험 과정은 원래의 폴츠 모델에서와 같이 진행하였으며, 다만, 실시예 18에 기술된 바와 같이 약간의 변형을 주었다.
건강한 수컷 개코 원숭이(파피오 어시누스)를 사용하였다. 이 동물의 체중은 9∼12㎏에 달하였으며, 실험 전 적어도 2주 동안에는 질병을 앓지 않은 것이었다. 개코 원숭이에게 건조 표준 규정식 만을 주었다.
본 연구에서는 3마리의 개코 원숭이를 사용하였는데, 대조군 단계 동안 즉, 염수, ALX-0081 및 vWF를 투여한 이후의 CFR 간격을 표 59에 요약하였다.
각각의 개코 원숭이에 대한 시간의 함수인 혈류와 실험 계획을 도 40에 나타내었다.
3마리의 개코 원숭이 모두에 있어서, ALX-0081을 시간당 30㎍/㎏ + 45㎍/㎏ 투여하였을 때 CFR이 완전히 억제되었는데, 심지어 새로 상처를 냈을 때에 조차도 CFR이 재발하지 않았다. vWF를 처음 투여하였을 때(250 IU), 혈류는 점차 줄어들었지만, vWF를 250 IU 더 투여할 때까지 CFR은 재발하지 않았다. 이러한 결과는 ALX-0081 활성은 vWF를 투여하였을 때에도 역전될 수 없으며, 따라서 vWF는 나노바디™의 좋은 해결 수단이 될 수 있음을 입증하는 것이다.
그러므로, 본 발명의 다른 측면은 vWF, 이의 적당한 단편, DDAVP(데스모프레시너; desmopressinor) 또는 이의 적당한 단편, 또는 이것들 중 임의의 것을 포함하는 약학 조성물의, 합병증이나 원치 않는 부작용(즉, vWF에 대한 나노바디, 단백질 또는 폴리펩티드, 구체적으로, 본원에 개시된 나노바디, 단백질 또는 폴리펩티드 사용시 일어날 수 있는 합병증이나 부작용)에 대한 해결 수단으로서의 용도에 관한 것이다.
실시예 21: 혈소판과 내피 세포-유래 UlvWF의 부착과, ADAMTS-13 활성에 대한 ALX-0081의 효능
본 연구는 TTP 환자에 있어서 ALX-0081을 치료제로서 사용해도 되는지 여부를 입증하기 위하여 실시되었다. ALX-0081의 부재 하 및 존재 하에서, ULvWF를 분비하는 내피 세포 상에서 TTP 혈장(ADAMTS 13 불포함) 중 재구성된 혈소판 관류를 수행하였다. 별도의 실험에서, vWF의 A1 도메인에 결합하는 ALX-0081이 ADAMTS-13의 활성을 방해하는지 여부를 테스트하였다. ADAMTS-13은 vWF의 A2 도메인에 결합하여 이를 절단한다.
문헌[Maruyama, Z.Zellforsch. Mikrosk. A4nat. 60:69; 1963]에 기술된 방법에 의하여, 내피 세포를 인간 탯줄 정맥으로부터 채취하였다. 내피 세포를 100μM의 히스타민(Sigma-Aldrich, St Louis, MO)으로 실온에서 15분 동안 활성화시킨 후, 관류 실험을 수행하였다.
아스피린이나 기타 비 스테로이드성 소염제(NSAIDs)를 섭취하지 않은 건강한 지원자로부터 채혈하여, 10일 동안 10분의 1 부피의 3.4% 시트르산나트륨으로 처리하였다. 원심 분리(10분, 실온 및 200g)하여 전 혈로부터 혈소판-풍부 혈장(PRP)을 준비하였다. PRP에 10분의 1 부피의 ACD(2.5% 시트르산삼나트륨, 1.5% 시트르산 및 2% D-글루코스)를 가하여 이를 산성화시켜, 혈소판을 침강시켰다(500g, 15분). 혈소판 펠릿을 HEPES(N-2-하이드록시에틸피페라진-N'-2-에탄설폰산)-타이로드 완충액(Tyrode buffer)[1O mM HEPES, 137 mM NaCl, 2.68 mM KCl, 0.42 mM NaH2PO4, 1.7 mM MgCl2, 5 mM D-글루코스, pH 6.5] 중에 재현탁하였다. 프로스타사이클린(Prostacyclin)(PGI2, 10 ng/㎖)을 첨가하여, 이후의 세척 단계에 혈소판이 활성화되는 것을 막았다. 혈소판을 침강시키고, 이를 적은 부피의 HEPES-타이로드 완충액 중에 재현탁하였다. 이 혈소판 현탁액을 pH7.4의 HEPES 완충액 또는 TTP 혈장 중에 희석하였다.
전술한 바와 같이 1회 통과 관류 챔버 내에서 관류를 실시하였다. 이 실험은 실시간 화상 현미경에 의해 실시되었다.
두 번째 유형의 실험에서, 표 60에 요약한 바와 같이 상이한 반응 혼합물을 제조하되, 단, A1A2A3 구조물은 첨가하지 않았다. 상기 A1A2A3 구조물은 vWF의 A1, A2 및 A3 도메인으로 이루어진 재조합 단편이다. 상기 A1A2A3 단편을 첨가한 후 37℃에서 5분 동안 혼합물을 예비-항온 처리한 후, 이 혼합물을 37℃의 수조에서 밤새도록 항온 처리하였다. 다음날, 시료에 대해 환원성 SDS-PAGE[12%, 바이오래드(BioRad)사의 프레시젼 플러스 프로테인 스탠다드(Precision Plus Protein Standard)를 마커로 사용함]를 수행하여, 이모빌론(Immobilon)-FL(Milhpore) 상에 블럿팅하였다. 이 블럿을 실온에서 2시간 동안 블록 완충액으로 블로킹하고[1:1 오디세이 블록 완충액(Odyssey blockbuffer), 1×TBS 중, pH=7,4], 이를 토끼 폴리클로날 항-vWF(DAKO)과 함께 항온 처리하였다. 알렉사 플루어(Alexa Fluor) 680 염소항-토끼를 검출용으로서 사용하였다. 오디세이(ODYSSEY)로 스캔하여, 분해 산물을 검출하였다.
대조군 실험: ULvWF와 혈소판의 결합
탯줄 정맥 내부를 콜라겐 분해 효소로 분해하여 새로 얻은 인간의 탯줄 정맥으로부터 내피 세포를 분리하였다. 이 세포를 상동 군으로서 조직 배양액 중에서 생육시켰다. 배양된 인간 내피 세포를 조밀하게 붙은 다각형의 대형 세포 단일 층으로 생육시켰는데, 이 세포에는 세포질 포함물(와이벌-펄리드체(Weibel-Palade body))을 함유하였다. 인간의 탯줄로부터 분리한, 히스타민 자극 내피 세포는 그 표면에 초대형 폰 빌레브란트 인자(ULvWF)를 발현한다. 이와 같이 자극된 세포를 분리된 혈액 혈소판으로 관류시켰는데, 이때 상기 혈소판은 완충액 또는 후천성 TTP 환자의 혈장 중에 현탁되었으며, 그 결과 ULvWF(8)상에 혈소판이 침착되었다. 이와 같은 ULvWF-부착 혈소판을 소위 "섬유(string)"라고 하는데, 이는 관류 실험에서 실시간 화상 현미경으로 관찰할 때 눈으로 확인할 수 있다(도 41).
ALX-0081에 의한 혈소판 섬유 생성의 억제
혈소판을 완충액 또는 TTP 혈장 중에 재현탁하였으며, 이 실험에 사용된 ALX-0081의 농도는 각각 0.2, 2 및 10㎍/㎖였다. 인간 탯줄로부터 분리한 히스타민-자극 내피 세포를 전술한 바와 같은 혈소판 현탁액으로 관류시켰다.
완충액 또는 TTP 환자로부터 유래한 혈장 중 재현탁된 혈소판에 ALX-0081을 첨가한 결과, 테스트된 모든 조건 하에서 섬유 형성이 완전히 억제되었다(도 42). 전단 스트레스 2.5dyn/㎠에서 4분 동안 관류 실험을 실시하였다. 이와 같이 4분 동안 관류시키는 동안, 나노바디™의 존재 하에 현미경 배율을 20배 이상으로 하여 관찰한 결과, 테스트된 모든 조건 하에서 섬유는 전혀 관찰할 수 없었다(도 42).
ADAMTS-13에 의한 ULvWF의 절단
ADAMTS-13은 vWF A2 도메인 중 Y842/M843 펩티드 결합을 특이적으로 절단함으로써, 대형 및 초대형 vWF 다량체의 크기를 더 작은 크기로 줄인다. 2가지 유형의 검정법(즉, 관류 검정법과 재조합 vWF 단편의 절단을 관찰하는 검정법)을 사용하여 ADAMTS-13에 의한 ULvWF의 절단에 있어서 ALX-0081의 효능을 평가하였다.
첫 번째 실험에서, 히스타민-자극 내피 세포에 비하여, 완충액 중에 재현탁된 세척 혈소판을 4분 동안 관류하였을 때 섬유가 형성되었다. 이후, 완충액을 4분 동안 관류시켜 부착되지 않은 혈소판을 세척해냈다. 이후, 완충액을 4분 더 관류시킨 후, ADAMTS-13을 함유하는, 풀링된 정상 혈장을 4분 동안 관류시켰다. 풀링된 정상 혈장을 관류시키자, 혈소판 섬유가 분리되는 것을 관찰할 수 있었다(도 43). 4분 동안 관류시켰더니, 이 섬유의 95% 이상이 절단되었다.
다음 실험에서는, 히스타민-자극 내피 세포에 비하여, 완충액 중에 재현탁된 세척 혈소판을 4분 동안 관류하였을 때 섬유가 생성되었는데, 이때, 완충액을 4분 동안 관류시켜 부착되지 않은 혈소판을 세척해냈다. 이후, ALX-0081(완충액 중 10㎍/㎖)을 4분 동안 관류시킨 후, ALX-0081(10㎍/㎖ = vWF에 비하여 10배 몰 과량) 및 ADAMTS-13을 함유하는, 풀링된 정상 혈장을 4분 동안 관류시켰다. 4분 동안 관류시켰더니, 이 섬유가 분리되면서 이것의 95% 이상이 절단되었다(도 44).
상기 결과들을 통하여, ALX-0081은 ADAMTS-13에 의한 ULvWF의 절단에 어떠한 영향력도 가지지 않음을 분명히 알 수 있었다.
두 번째 검정법에서, vWF의 A1-A2-A3 도메인을 함유하는 재조합 단편을, ADAMTS-13을 함유하는, 풀링된 정상 혈장(NPP)와 혼합하였더니, 단편이 단백 분해 작용에 의해 분해되었다(웨스턴 블럿 분석법으로 관찰). ADAMTS-13 활성은 10㎍/㎖의 ALX-0081의 부재 및 존재 하에서 테스트되었다. 도 45에 나타낸 바와 같이, ALX-0081은 vWF 단편의 절단에 어떠한 영향력도 가지지 않았다(래인 6∼8).
이와 같이 관찰된 절단이 ADAMTS-13에 특이적이라는 사실을 입증하기 위하여, EDTA 존재하에서 대조군 실험을 수행하였다[EDTA는 ADAMTS-13의 활성을 억제함]. 예상대로, NPP에 EDTA가 존재하면, 단편의 절단을 억제하였다(도 45의 래인 4).
본 실험은 또한 ALX-0081이 ADAMTS-13의 활성에 어떠한 영향력도 가지지 않는다는 사실을 입증하는 것이다.
(△ 표 8: 항-vWF 나노바디의 서열 목록)
(△ 표 9: 항-vWF 나노바디의 발현 수율)
(△ 표 10: 항-vWF 나노바디의 관류 챔버 내에서의 혈소판 부착율)
(△ 표 11: 12B6 및 12A5 상동체 나노바디의 서열 목록)
(△ 표 12: 12A5 상동체 나노바디에 대한 Kon, Koff 및 KD의 측정치)
(△ 표 13: 12B6 상동체 나노바디에 대한 Kon, Koff 및 KD의 측정치)
(△ 표 14: 12B6, 12A2 및 12A5 나노바디의 실제 KD값)
(△ 표 15: 12B6, 12A2 및 12A5 나노바디의 관류 챔버 내에서의 혈소판 부착율)
(△ 표 16: 고온에서 가열한 후 12B6, 12A2 및 12A5 나노바디의 농도)
(△ 표 17: 2가 나노바디의 서열 목록)
(△ 표 18: 링커 서열의 서열 목록)
(△ 표 19: 2가 12B6, 12A2 및 12A5 나노바디의 발현 수율)
(△ 표 20: 고온에서 가열한 후 12B6 2가 나노바디의 농도)
(△ 표 21: 고온에서 가열한 후 12A2 2가 나노바디의 농도)
(△ 표 22: 고온에서 가열한 후 12A5 2가 나노바디의 농도)
(△ 표 23: 12A2 2가 나노바디의 관류 챔버 내에서의 혈소판 부착율)
(△ 표 24: 인간화된 12B6 나노바디의 서열 목록)
(△ 표 25: 야생형 및 인간화된 12B6 나노바디의 발현 수율)
(△ 표 26: 고온에서 가열한 후 야생형 및 인간화된 12B6 나노바디의 농도)
(△ 표 27: 야생형 및 인간화된 12B6 나노바디에 대한 KD값)
(△ 표 28: 인간화된 12A2 나노바디의 서열 목록)
(△ 표 29: 야생형 및 인간화된 12A2 나노바디의 발현 수율)
(△ 표 30: 고온에서 가열한 후 야생형 및 인간화된 12A2 나노바디의 농도)
(△ 표 31: 관류 챔버 내에서의 야생형 및 인간화된 12A2 나노바디(0)7 및 1)5 ug/㎖)와 혈소판의 부착율)
(△ 표 32: 관류 챔버 내에서의 야생형 및 인간화된 12A2 나노바디(0)5, 1 및 2 ug/㎖)와 혈소판의 부착율)
(△ 표 33: 야생형 및 인간화된 12A2 나노바디에 대한 KD값)
(△ 표 34: 인간화된 12A5 나노바디의 서열 목록)
(△ 표 35: 야생형 및 인간화된 12A5 나노바디의 발현율)
(△ 표 36: 고온에서 가열한 후 야생형 및 인간화된 12A5 나노바디의 농도)
(△ 표 37: 야생형 및 인간화된 12A5 나노바디에 대한 KD값)
(△ 표 38: 인간화된 2가 나노바디의 서열 목록)
(△ 표 39: 인간화된 2가 나노바디의 발현 수율)
(△ 표 40: 고온에서 가열한 후 인간화된 2가 나노바디의 농도)
(△ 표 41: 야생형 및 인간화된 2가 나노바디의 혈소판 부착율)
(△ 표 42: 폴츠 연구(Folts study)에 있어서 상이한 테스트 화합물로 처리한 개코 원숭이)
(△ 표 43: 대조군 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음)
(△ 표 44: 아스페직™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음)
(△ 표 45: 헤파린™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음)
(△ 표 46: 플라빅스™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음)
(△ 표 47: 레오프로™ 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음)
(△ 표 48: ALX-0081 처리한 동물에 대한 CFR의 간격(s) (ND = 측정하지 않음)
(△ 표 49: 폴츠 연구에 있어서, 상이한 테스트 화합물로 처리한 개코 원숭이)
(△ 표 50: 폴츠 모델에 있어서 상이한 테스트 약물에 대한 CFR의 억제 결과. 상기 언급한 상이한 조건 하에서 CFR 억제를 관찰하는 실험의 번호는 이와 같은 조건의 독립적 반복 실행의 총 횟수에 대한 함수임)
(△ 표 51: 아스페직, 헤파린, 플라빅스 및 ALX-0081로 처리한 각각의 개코 원숭이에 대한 CFR 길이(초). 유효 투여량은 황색으로 표시함)
(△ 표 52: 플라빅스™ 처리한 동물에 있어서 제2 대조군 거즈에 대한 실혈 양(최종 투여량 함수)(STD = 표준 편차))
(△ 표 53: 레오프로™ 처리한 동물에 있어서 제2 대조군 거즈에 대한 실혈 양(최종 투여량 함수)(STD = 표준 편차))
(△ 표 54: ALX-0081 처리한 동물에 있어서 제2 대조군 거즈에 대한 실혈 양(최종 투여량 함수)(STD = 표준 편차))
(△ 표 55: 제2의 대조군 거즈에 대한, 총 실혈 양(즉, 테스트 화합물을 처음 5회 투여하였을 때의 실혈 양의 합)의 평균)
(△ 표 56: 아스페직, 헤파린, 플라빅스 및 ALX-0081 처리한 개코 원숭이 각각에 있어서 제2의 대조군 거즈에 관한, 거즈의 실혈 양(약품 투여량 함수). CFR을 완전히 억제하는 유효 약품 투여량은 황색으로 표시함)
(△ 표 57: 아스페직, 헤파린, 플라빅스 및 ALX-0081 처리한 개코 원숭이 각각에 있어서 리스토세틴-유도 혈소판 응집율(%)(약품 투여량 함수))
(△ 표 58: 투여 후 10분 경과시 얻은 혈액 시료 중 ALX-0081의 농도[㎍/㎖])
(△ 표 59: ALX-0081 및 vWF로 처리한 개코 원숭이에 대한 CFR의 간격[초])
(△ 표 60: ADAMTS13에 의한 A1A2A3의 절단 연구에 있어서, 상이한 혼합물을 제조하기 위한 부피[㎕])
SEQUENCE LISTING
<110> Ablynx N.V.
<120> Improved Nanobodies for the treatment of aggregation-mediated disorders
<130> P05-003 PCT
<160> 303
<170> PatentIn version 3.1
<210> 1
<211> 26
<212> PRT
<213> Artificial
<220>
<221> misc_feature
<222> (11)..(11)
<223> X = hallmark residue (see table 2)
<400> 1
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Xaa Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
20 25
<210> 2
<211> 14
<212> PRT
<213> Artificial
<220>
<221> misc_feature
<222> (2)..(2)
<223> X = Hallmark residue
<220>
<221> misc_feature
<222> (9)..(9)
<223> X = Hallmark residue
<220>
<221> misc_feature
<222> (10)..(10)
<223> X = Hallmark residue
<220>
<221> misc_feature
<222> (12)..(12)
<223> X = Hallmark residue
<400> 2
Trp Xaa Arg Gln Ala Pro Gly Lys Xaa Xaa Glu Xaa Val Ala
1 5 10
<210> 3
<211> 32
<212> PRT
<213> Artificial
<220>
<221> misc_feature
<222> (21)..(21)
<223> X = Hallmark residue
<220>
<221> misc_feature
<222> (22)..(22)
<223> X = Hallmark residue
<400> 3
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Xaa Xaa Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 4
<211> 11
<212> PRT
<213> Artificial
<220>
<221> misc_feature
<222> (1)..(1)
<223> X = Hallmark residue
<220>
<221> misc_feature
<222> (2)..(2)
<223> X = Hallmark residue
<220>
<221> misc_feature
<222> (6)..(6)
<223> X = Hallmark residue
<400> 4
Xaa Xaa Gln Gly Thr Xaa Val Thr Val Ser Ser
1 5 10
<210> 5
<211> 26
<212> PRT
<213> Artificial
<400> 5
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
20 25
<210> 6
<211> 14
<212> PRT
<213> Artificial
<400> 6
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Leu Val Ala
1 5 10
<210> 7
<211> 14
<212> PRT
<213> Artificial
<400> 7
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Ala
1 5 10
<210> 8
<211> 13
<212> PRT
<213> Artificial
<400> 8
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Ala
1 5 10
<210> 9
<211> 14
<212> PRT
<213> Artificial
<400> 9
Trp Phe Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 10
<211> 14
<212> PRT
<213> Artificial
<400> 10
Trp Phe Arg Gln Ala Pro Gly Lys Gln Arg Glu Phe Val Ala
1 5 10
<210> 11
<211> 13
<212> PRT
<213> Artificial
<400> 11
Trp Tyr Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ala
1 5 10
<210> 12
<211> 32
<212> PRT
<213> Artificial
<400> 12
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 13
<211> 11
<212> PRT
<213> Artificial
<400> 13
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 14
<211> 11
<212> PRT
<213> Artificial
<400> 14
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 15
<211> 5
<212> PRT
<213> Artificial
<400> 15
Asn Tyr Gly Met Gly
1 5
<210> 16
<211> 5
<212> PRT
<213> Artificial
<400> 16
Ser Tyr Thr Leu Gly
1 5
<210> 17
<211> 5
<212> PRT
<213> Artificial
<400> 17
Asn Tyr Asn Met Gly
1 5
<210> 18
<211> 5
<212> PRT
<213> Artificial
<400> 18
Ser Ser Ala Met Ala
1 5
<210> 19
<211> 5
<212> PRT
<213> Artificial
<400> 19
Tyr Tyr Asn Thr Gly
1 5
<210> 20
<211> 5
<212> PRT
<213> Artificial
<400> 20
Ile Gly Ala Met Gly
1 5
<210> 21
<211> 5
<212> PRT
<213> Artificial
<400> 21
Ile Gly Thr Met Gly
1 5
<210> 22
<211> 5
<212> PRT
<213> Artificial
<400> 22
Tyr Asn Pro Met Gly
1 5
<210> 23
<211> 17
<212> PRT
<213> Artificial
<400> 23
Ser Ile Ser Trp Ser Gly Thr Tyr Thr Ala Tyr Ser Asp Asn Val Lys
1 5 10 15
Gly
<210> 24
<211> 17
<212> PRT
<213> Artificial
<400> 24
Gly Ile Ser Trp Ser Gly Val Ser Thr Asp Tyr Ala Glu Phe Ala Lys
1 5 10 15
Gly
<210> 25
<211> 18
<212> PRT
<213> Artificial
<400> 25
Thr Ser Ile Ser Trp Ser Gly Ser Tyr Thr Ala Tyr Ala Asp Asn Val
1 5 10 15
Lys Gly
<210> 26
<211> 17
<212> PRT
<213> Artificial
<400> 26
Ser Ile Ser Trp Ser Gly Met Ser Thr Tyr Tyr Thr Asp Ser Val Lys
1 5 10 15
Gly
<210> 27
<211> 16
<212> PRT
<213> Artificial
<400> 27
Thr Ile Thr Ser Gly Gly Arg Thr Ser Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 28
<211> 17
<212> PRT
<213> Artificial
<400> 28
Ala Ile Ser Trp Ser Gly Gly Leu Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 29
<211> 16
<212> PRT
<213> Artificial
<400> 29
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly
1 5 10 15
<210> 30
<211> 16
<212> PRT
<213> Artificial
<400> 30
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 31
<211> 17
<212> PRT
<213> Artificial
<400> 31
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu
1 5 10 15
Gly
<210> 32
<211> 17
<212> PRT
<213> Artificial
<400> 32
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 33
<211> 17
<212> PRT
<213> Artificial
<400> 33
Gln Ser Arg Tyr Arg Ser Asn Tyr Tyr Asp His Asp Asp Lys Tyr Ala
1 5 10 15
Tyr
<210> 34
<211> 16
<212> PRT
<213> Artificial
<400> 34
Leu Gly Arg Tyr Arg Ser Asn Trp Arg Asn Ile Gly Gln Tyr Asp Tyr
1 5 10 15
<210> 35
<211> 17
<212> PRT
<213> Artificial
<400> 35
Gln Ser Arg Tyr Ser Ser Asn Tyr Tyr Asp His Asp Asp Lys Tyr Ala
1 5 10 15
Tyr
<210> 36
<211> 15
<212> PRT
<213> Artificial
<400> 36
Ser Asn Arg Tyr Arg Thr His Thr Thr Gln Ala Met Tyr Asn Tyr
1 5 10 15
<210> 37
<211> 8
<212> PRT
<213> Artificial
<400> 37
Val Val Asp Gly Lys Arg Ala Pro
1 5
<210> 38
<211> 16
<212> PRT
<213> Artificial
<400> 38
Asn Arg Arg Gln Lys Thr Val Gln Met Gly Glu Arg Ala Tyr Asp Tyr
1 5 10 15
<210> 39
<211> 14
<212> PRT
<213> Artificial
<400> 39
Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 40
<211> 14
<212> PRT
<213> Artificial
<400> 40
Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 41
<211> 19
<212> PRT
<213> Artificial
<400> 41
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Asn Phe
<210> 42
<211> 19
<212> PRT
<213> Artificial
<400> 42
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 43
<211> 19
<212> PRT
<213> Artificial
<400> 43
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Ser Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 44
<211> 5
<212> PRT
<213> Artificial
<400> 44
Ser Phe Gly Met Ser
1 5
<210> 45
<211> 5
<212> PRT
<213> Artificial
<400> 45
Leu Asn Leu Met Gly
1 5
<210> 46
<211> 5
<212> PRT
<213> Artificial
<400> 46
Ile Asn Leu Leu Gly
1 5
<210> 47
<211> 5
<212> PRT
<213> Artificial
<400> 47
Asn Tyr Trp Met Tyr
1 5
<210> 48
<211> 17
<212> PRT
<213> Artificial
<400> 48
Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 49
<211> 16
<212> PRT
<213> Artificial
<400> 49
Thr Ile Thr Val Gly Asp Ser Thr Asn Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 50
<211> 16
<212> PRT
<213> Artificial
<400> 50
Thr Ile Thr Val Gly Asp Ser Thr Ser Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 51
<211> 17
<212> PRT
<213> Artificial
<400> 51
Ser Ile Asn Gly Arg Gly Asp Asp Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 52
<211> 17
<212> PRT
<213> Artificial
<400> 52
Ala Ile Ser Ala Asp Ser Ser Thr Lys Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 53
<211> 17
<212> PRT
<213> Artificial
<400> 53
Ala Ile Ser Ala Asp Ser Ser Asp Lys Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 54
<211> 17
<212> PRT
<213> Artificial
<400> 54
Arg Ile Ser Thr Gly Gly Gly Tyr Ser Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 55
<211> 13
<212> PRT
<213> Artificial
<400> 55
Asp Arg Glu Ala Gln Val Asp Thr Leu Asp Phe Asp Tyr
1 5 10
<210> 56
<211> 6
<212> PRT
<213> Artificial
<400> 56
Gly Gly Ser Leu Ser Arg
1 5
<210> 57
<211> 8
<212> PRT
<213> Artificial
<400> 57
Arg Arg Thr Trp His Ser Glu Leu
1 5
<210> 58
<211> 7
<212> PRT
<213> Artificial
<400> 58
Gly Arg Ser Val Ser Arg Ser
1 5
<210> 59
<211> 5
<212> PRT
<213> Artificial
<400> 59
Gly Arg Gly Ser Pro
1 5
<210> 60
<211> 122
<212> PRT
<213> Artificial
<400> 60
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 61
<211> 126
<212> PRT
<213> Artificial
<400> 61
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Asn Tyr
20 25 30
Gly Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Thr Ser Ile Ser Trp Ser Gly Thr Tyr Thr Ala Tyr Ser Asp Asn Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Gln Ser Arg Tyr Arg Ser Asn Tyr Tyr Asp His Asp Asp Lys
100 105 110
Tyr Ala Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 62
<211> 128
<212> PRT
<213> Artificial
<400> 62
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 63
<211> 126
<212> PRT
<213> Artificial
<400> 63
Ala Val Gln Leu Val Asp Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Glu Arg Thr Thr Phe Ser Ser
20 25 30
Tyr Thr Leu Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe
35 40 45
Val Gly Gly Ile Ser Trp Ser Gly Val Ser Thr Asp Tyr Ala Glu Phe
50 55 60
Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp His Ala Ala Asn Thr Val
65 70 75 80
Tyr Leu Glu Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ala Leu Gly Arg Tyr Arg Ser Asn Trp Arg Asn Ile Gly Gln
100 105 110
Tyr Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 64
<211> 126
<212> PRT
<213> Artificial
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Asn Asn Tyr
20 25 30
Gly Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Thr Ser Ile Ser Trp Ser Gly Ser Tyr Thr Ala Tyr Ala Asp Asn Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Lys Pro Gly Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Gln Ser Arg Tyr Ser Ser Asn Tyr Tyr Asp His Asp Asp Lys
100 105 110
Tyr Ala Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 65
<211> 116
<212> PRT
<213> Artificial
<400> 65
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Ser Ile Phe Ser Ser Ser
20 25 30
Ala Met Ala Trp Tyr Arg Gln Ala Ser Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Arg Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Asp Cys Asn
85 90 95
Phe Val Val Asp Gly Lys Arg Ala Pro Trp Gly Gln Gly Thr Gln Val
100 105 110
Thr Val Ser Ser
115
<210> 66
<211> 125
<212> PRT
<213> Artificial
<400> 66
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ser Ser Gly Arg Ala Phe Ser Tyr Tyr
20 25 30
Asn Thr Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Trp Ser Gly Gly Leu Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asp Met Val Tyr
65 70 75 80
Leu Gln Met Ala Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Asn Arg Arg Gln Lys Thr Val Gln Met Gly Glu Arg Ala Tyr
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 67
<211> 122
<212> PRT
<213> Artificial
<400> 67
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 68
<211> 122
<212> PRT
<213> Artificial
<400> 68
Ala Val Gln Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 69
<211> 122
<212> PRT
<213> Artificial
<400> 69
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Thr Met Gly Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 70
<211> 122
<212> PRT
<213> Artificial
<400> 70
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Thr Met Gly Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 71
<211> 128
<212> PRT
<213> Artificial
<400> 71
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 72
<211> 128
<212> PRT
<213> Artificial
<400> 72
Gln Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Arg Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Ser Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 73
<211> 128
<212> PRT
<213> Artificial
<400> 73
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Glu Met Asn Asn Leu Lys Pro Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 74
<211> 259
<212> PRT
<213> Artificial
<400> 74
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg
165 170 175
Asp Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 75
<211> 265
<212> PRT
<213> Artificial
<400> 75
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Glu Arg Asp Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Asn Leu Lys
210 215 220
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 76
<211> 286
<212> PRT
<213> Artificial
<400> 76
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Asn Leu Lys Pro Glu Gly Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 77
<211> 247
<212> PRT
<213> Artificial
<400> 77
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Ala Ala Ala Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly Ala Met Gly
145 150 155 160
Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala Thr Ile
165 170 175
Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu Gln Met Asn
195 200 205
Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala Asn Leu
210 215 220
Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Gln Val Thr Val Ser Ser
245
<210> 78
<211> 253
<212> PRT
<213> Artificial
<400> 78
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe
145 150 155 160
Ser Ile Gly Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg
165 170 175
Glu Leu Val Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp
180 185 190
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr
195 200 205
Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Tyr Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
245 250
<210> 79
<211> 274
<212> PRT
<213> Artificial
<400> 79
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
145 150 155 160
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Leu Ala
165 170 175
Ser Gly Arg Ile Phe Ser Ile Gly Ala Met Gly Met Tyr Arg Gln Ala
180 185 190
Pro Gly Lys Gln Arg Glu Leu Val Ala Thr Ile Thr Ser Gly Gly Ser
195 200 205
Thr Asn Tyr Ala Asp Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
210 215 220
Gly Pro Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu
225 230 235 240
Asp Thr Ala Val Tyr Tyr Cys Tyr Ala Asn Leu Lys Gln Gly Ser Tyr
245 250 255
Gly Tyr Arg Phe Asn Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val
260 265 270
Ser Ser
<210> 80
<211> 259
<212> PRT
<213> Artificial
<400> 80
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg
165 170 175
Asp Val Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Arg Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 81
<211> 265
<212> PRT
<213> Artificial
<400> 81
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Glu Arg Asp Val Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ala Leu Lys
210 215 220
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 82
<211> 286
<212> PRT
<213> Artificial
<400> 82
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 83
<211> 3
<212> PRT
<213> Artificial
<400> 83
Ala Ala Ala
1
<210> 84
<211> 9
<212> PRT
<213> Artificial
<400> 84
Gly Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 85
<211> 30
<212> PRT
<213> Artificial
<400> 85
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 86
<211> 128
<212> PRT
<213> Artificial
<400> 86
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 87
<211> 128
<212> PRT
<213> Artificial
<400> 87
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 88
<211> 128
<212> PRT
<213> Artificial
<400> 88
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 89
<211> 128
<212> PRT
<213> Artificial
<400> 89
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 90
<211> 128
<212> PRT
<213> Artificial
<400> 90
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 91
<211> 128
<212> PRT
<213> Artificial
<400> 91
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 92
<211> 128
<212> PRT
<213> Artificial
<400> 92
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 93
<211> 128
<212> PRT
<213> Artificial
<400> 93
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 94
<211> 128
<212> PRT
<213> Artificial
<400> 94
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 95
<211> 122
<212> PRT
<213> Artificial
<400> 95
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 96
<211> 122
<212> PRT
<213> Artificial
<400> 96
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 97
<211> 122
<212> PRT
<213> Artificial
<400> 97
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 98
<211> 259
<212> PRT
<213> Artificial
<400> 98
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 99
<211> 259
<212> PRT
<213> Artificial
<400> 99
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 100
<211> 259
<212> PRT
<213> Artificial
<400> 100
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Val Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Arg Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 101
<211> 265
<212> PRT
<213> Artificial
<400> 101
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 102
<211> 265
<212> PRT
<213> Artificial
<400> 102
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 103
<211> 265
<212> PRT
<213> Artificial
<400> 103
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Val Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 104
<211> 286
<212> PRT
<213> Artificial
<400> 104
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 105
<211> 286
<212> PRT
<213> Artificial
<400> 105
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 106
<211> 286
<212> PRT
<213> Artificial
<400> 106
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 107
<211> 117
<212> PRT
<213> Artificial
<400> 107
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Gly Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Glu Arg Ile Phe Asp Leu Asn
20 25 30
Leu Met Gly Trp Tyr Arg Gln Gly Pro Gly Asn Glu Arg Glu Leu Val
35 40 45
Ala Thr Cys Ile Thr Val Gly Asp Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Met Asp Tyr Thr Lys Gln Thr Val Tyr
65 70 75 80
Leu His Met Asn Ser Leu Arg Pro Glu Asp Thr Gly Leu Tyr Tyr Cys
85 90 95
Lys Ile Arg Arg Thr Trp His Ser Glu Leu Trp Gly Gln Gly Thr Gln
100 105 110
Val Thr Val Ser Ser
115
<210> 108
<211> 116
<212> PRT
<213> Artificial
<400> 108
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Glu Gly Gly
1 5 10 15
Ser Leu Arg Leu Ala Cys Ala Ala Ser Glu Arg Ile Trp Asp Ile Asn
20 25 30
Leu Leu Gly Trp Tyr Arg Gln Gly Pro Gly Asn Glu Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Val Gly Asp Ser Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Tyr Asp Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Gly Leu Tyr Tyr Cys Lys
85 90 95
Ile Arg Arg Thr Trp His Ser Glu Leu Trp Gly Gln Gly Thr Gln Val
100 105 110
Thr Val Ser Ser
115
<210> 109
<211> 115
<212> PRT
<213> Artificial
<400> 109
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Glu Pro Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Gln Val Thr
100 105 110
Val Ser Ser
115
<210> 110
<211> 116
<212> PRT
<213> Artificial
<400> 110
Ala Val Gln Leu Val Asp Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Gly Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Tyr Pro Gly Lys Glu Pro Glu Trp Val
35 40 45
Ser Ser Ile Asn Gly Arg Gly Asp Asp Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Glu Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Ser Val Ser Arg Ser Arg Thr Gln Gly Thr Gln Val
100 105 110
Thr Val Ser Ser
115
<210> 111
<211> 114
<212> PRT
<213> Artificial
<400> 111
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Thr Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Asp Gln Glu Trp Val
35 40 45
Ser Ala Ile Ser Ala Asp Ser Ser Thr Lys Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Met Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Ile Gly Arg Gly Ser Pro Ser Ser Pro Gly Thr Gln Val Thr Val
100 105 110
Ser Ser
<210> 112
<211> 114
<212> PRT
<213> Artificial
<400> 112
Gln Val Gln Leu Ala Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Thr Ala Ser Gly Phe Thr Phe Gly Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ala Asp Ser Ser Asp Lys Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Met Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Lys Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Ile Gly Arg Gly Ser Pro Ala Ser Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser
<210> 113
<211> 123
<212> PRT
<213> Artificial
<400> 113
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Tyr Trp Val Arg Val Ala Pro Gly Lys Gly Leu Glu Arg Ile
35 40 45
Ser Arg Asp Ile Ser Thr Gly Gly Gly Tyr Ser Tyr Tyr Ala Asp Ser
50 55 60
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu
65 70 75 80
Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Leu Tyr Tyr
85 90 95
Cys Ala Lys Asp Arg Glu Ala Gln Val Asp Thr Leu Asp Phe Asp Tyr
100 105 110
Arg Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 114
<211> 115
<212> PRT
<213> Artificial
<400> 114
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Glu Pro Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Gln Val Thr
100 105 110
Val Ser Ser
115
<210> 115
<211> 115
<212> PRT
<213> Artificial
<400> 115
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Glu Pro Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Gln Val Thr
100 105 110
Val Ser Ser
115
<210> 116
<211> 115
<212> PRT
<213> Artificial
<400> 116
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Gln Val Thr
100 105 110
Val Ser Ser
115
<210> 117
<211> 115
<212> PRT
<213> Artificial
<400> 117
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 118
<211> 115
<212> PRT
<213> Artificial
<400> 118
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 119
<211> 115
<212> PRT
<213> Artificial
<400> 119
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 120
<211> 115
<212> PRT
<213> Artificial
<400> 120
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 121
<211> 115
<212> PRT
<213> Artificial
<400> 121
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 122
<211> 30
<212> PRT
<213> Artificial
<400> 122
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 123
<211> 30
<212> PRT
<213> Artificial
<400> 123
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 124
<211> 30
<212> PRT
<213> Artificial
<400> 124
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 125
<211> 30
<212> PRT
<213> Artificial
<400> 125
Ala Val Gln Leu Val Asp Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Glu Arg Thr Thr Phe
20 25 30
<210> 126
<211> 30
<212> PRT
<213> Artificial
<400> 126
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Asn
20 25 30
<210> 127
<211> 30
<212> PRT
<213> Artificial
<400> 127
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Ser Ile Phe Ser
20 25 30
<210> 128
<211> 30
<212> PRT
<213> Artificial
<400> 128
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ser Ser Gly Arg Ala Phe Ser
20 25 30
<210> 129
<211> 30
<212> PRT
<213> Artificial
<400> 129
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 130
<211> 30
<212> PRT
<213> Artificial
<400> 130
Ala Val Gln Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 131
<211> 30
<212> PRT
<213> Artificial
<400> 131
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 132
<211> 30
<212> PRT
<213> Artificial
<400> 132
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 133
<211> 30
<212> PRT
<213> Artificial
<400> 133
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 134
<211> 30
<212> PRT
<213> Artificial
<400> 134
Gln Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 135
<211> 30
<212> PRT
<213> Artificial
<400> 135
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 136
<211> 30
<212> PRT
<213> Artificial
<400> 136
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 137
<211> 30
<212> PRT
<213> Artificial
<400> 137
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 138
<211> 30
<212> PRT
<213> Artificial
<400> 138
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 139
<211> 30
<212> PRT
<213> Artificial
<400> 139
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 140
<211> 30
<212> PRT
<213> Artificial
<400> 140
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 141
<211> 30
<212> PRT
<213> Artificial
<400> 141
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 142
<211> 30
<212> PRT
<213> Artificial
<400> 142
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
20 25 30
<210> 143
<211> 30
<212> PRT
<213> Artificial
<400> 143
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 144
<211> 30
<212> PRT
<213> Artificial
<400> 144
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 145
<211> 30
<212> PRT
<213> Artificial
<400> 145
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 146
<211> 30
<212> PRT
<213> Artificial
<400> 146
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 147
<211> 30
<212> PRT
<213> Artificial
<400> 147
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser
20 25 30
<210> 148
<211> 5
<212> PRT
<213> Artificial
<400> 148
Ile Gly Ala Met Gly
1 5
<210> 149
<211> 5
<212> PRT
<213> Artificial
<400> 149
Asn Tyr Gly Met Gly
1 5
<210> 150
<211> 5
<212> PRT
<213> Artificial
<400> 150
Tyr Asn Pro Met Gly
1 5
<210> 151
<211> 6
<212> PRT
<213> Artificial
<400> 151
Ser Ser Tyr Thr Leu Gly
1 5
<210> 152
<211> 5
<212> PRT
<213> Artificial
<400> 152
Asn Tyr Gly Met Gly
1 5
<210> 153
<211> 5
<212> PRT
<213> Artificial
<400> 153
Ser Ser Ala Met Ala
1 5
<210> 154
<211> 5
<212> PRT
<213> Artificial
<400> 154
Tyr Tyr Asn Thr Gly
1 5
<210> 155
<211> 5
<212> PRT
<213> Artificial
<400> 155
Ile Gly Ala Met Gly
1 5
<210> 156
<211> 5
<212> PRT
<213> Artificial
<400> 156
Ile Gly Ala Met Gly
1 5
<210> 157
<211> 5
<212> PRT
<213> Artificial
<400> 157
Ile Gly Thr Met Gly
1 5
<210> 158
<211> 5
<212> PRT
<213> Artificial
<400> 158
Ile Gly Thr Met Gly
1 5
<210> 159
<211> 5
<212> PRT
<213> Artificial
<400> 159
Tyr Asn Pro Met Gly
1 5
<210> 160
<211> 5
<212> PRT
<213> Artificial
<400> 160
Tyr Asn Pro Met Gly
1 5
<210> 161
<211> 5
<212> PRT
<213> Artificial
<400> 161
Tyr Asn Pro Met Gly
1 5
<210> 162
<211> 5
<212> PRT
<213> Artificial
<400> 162
Tyr Asn Pro Met Gly
1 5
<210> 163
<211> 5
<212> PRT
<213> Artificial
<400> 163
Tyr Asn Pro Met Gly
1 5
<210> 164
<211> 5
<212> PRT
<213> Artificial
<400> 164
Tyr Asn Pro Met Gly
1 5
<210> 165
<211> 5
<212> PRT
<213> Artificial
<400> 165
Tyr Asn Pro Met Gly
1 5
<210> 166
<211> 5
<212> PRT
<213> Artificial
<400> 166
Tyr Asn Pro Met Gly
1 5
<210> 167
<211> 5
<212> PRT
<213> Artificial
<400> 167
Tyr Asn Pro Met Gly
1 5
<210> 168
<211> 5
<212> PRT
<213> Artificial
<400> 168
Tyr Asn Pro Met Gly
1 5
<210> 169
<211> 5
<212> PRT
<213> Artificial
<400> 169
Tyr Asn Pro Met Gly
1 5
<210> 170
<211> 5
<212> PRT
<213> Artificial
<400> 170
Tyr Asn Pro Met Gly
1 5
<210> 171
<211> 5
<212> PRT
<213> Artificial
<400> 171
Ile Gly Ala Met Gly
1 5
<210> 172
<211> 5
<212> PRT
<213> Artificial
<400> 172
Ile Gly Ala Met Gly
1 5
<210> 173
<211> 5
<212> PRT
<213> Artificial
<400> 173
Ile Gly Ala Met Gly
1 5
<210> 174
<211> 14
<212> PRT
<213> Artificial
<400> 174
Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 175
<211> 14
<212> PRT
<213> Artificial
<400> 175
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Thr
1 5 10
<210> 176
<211> 14
<212> PRT
<213> Artificial
<400> 176
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val Ala
1 5 10
<210> 177
<211> 14
<212> PRT
<213> Artificial
<400> 177
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Gly
1 5 10
<210> 178
<211> 14
<212> PRT
<213> Artificial
<400> 178
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Thr
1 5 10
<210> 179
<211> 14
<212> PRT
<213> Artificial
<400> 179
Trp Tyr Arg Gln Ala Ser Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 180
<211> 14
<212> PRT
<213> Artificial
<400> 180
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Ala
1 5 10
<210> 181
<211> 14
<212> PRT
<213> Artificial
<400> 181
Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 182
<211> 14
<212> PRT
<213> Artificial
<400> 182
Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 183
<211> 14
<212> PRT
<213> Artificial
<400> 183
Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 184
<211> 14
<212> PRT
<213> Artificial
<400> 184
Leu Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
1 5 10
<210> 185
<211> 14
<212> PRT
<213> Artificial
<400> 185
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val Ala
1 5 10
<210> 186
<211> 14
<212> PRT
<213> Artificial
<400> 186
Trp Phe Arg Gln Ala Pro Gly Arg Glu Arg Asp Val Val Ala
1 5 10
<210> 187
<211> 14
<212> PRT
<213> Artificial
<400> 187
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val Ala
1 5 10
<210> 188
<211> 14
<212> PRT
<213> Artificial
<400> 188
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Asp Val Val Ala
1 5 10
<210> 189
<211> 14
<212> PRT
<213> Artificial
<400> 189
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val Ala
1 5 10
<210> 190
<211> 14
<212> PRT
<213> Artificial
<400> 190
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Asp Val Val Ala
1 5 10
<210> 191
<211> 14
<212> PRT
<213> Artificial
<400> 191
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Asp Val Val Ala
1 5 10
<210> 192
<211> 14
<212> PRT
<213> Artificial
<400> 192
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 193
<211> 14
<212> PRT
<213> Artificial
<400> 193
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 194
<211> 14
<212> PRT
<213> Artificial
<400> 194
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 195
<211> 14
<212> PRT
<213> Artificial
<400> 195
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 196
<211> 14
<212> PRT
<213> Artificial
<400> 196
Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 197
<211> 14
<212> PRT
<213> Artificial
<400> 197
Met Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 198
<211> 14
<212> PRT
<213> Artificial
<400> 198
Met Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 199
<211> 14
<212> PRT
<213> Artificial
<400> 199
Met Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala
1 5 10
<210> 200
<211> 16
<212> PRT
<213> Artificial
<400> 200
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly
1 5 10 15
<210> 201
<211> 17
<212> PRT
<213> Artificial
<400> 201
Ser Ile Ser Trp Ser Gly Thr Tyr Thr Ala Tyr Ser Asp Asn Val Lys
1 5 10 15
Gly
<210> 202
<211> 17
<212> PRT
<213> Artificial
<400> 202
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu
1 5 10 15
Gly
<210> 203
<211> 17
<212> PRT
<213> Artificial
<400> 203
Gly Ile Ser Trp Ser Gly Val Ser Thr Asp Tyr Ala Glu Phe Ala Lys
1 5 10 15
Gly
<210> 204
<211> 17
<212> PRT
<213> Artificial
<400> 204
Ser Ile Ser Trp Ser Gly Ser Tyr Thr Ala Tyr Ala Asp Asn Val Lys
1 5 10 15
Gly
<210> 205
<211> 16
<212> PRT
<213> Artificial
<400> 205
Thr Ile Thr Ser Gly Gly Arg Thr Ser Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 206
<211> 17
<212> PRT
<213> Artificial
<400> 206
Ala Ile Ser Trp Ser Gly Gly Leu Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 207
<211> 16
<212> PRT
<213> Artificial
<400> 207
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 208
<211> 16
<212> PRT
<213> Artificial
<400> 208
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 209
<211> 16
<212> PRT
<213> Artificial
<400> 209
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 210
<211> 16
<212> PRT
<213> Artificial
<400> 210
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 211
<211> 17
<212> PRT
<213> Artificial
<400> 211
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 212
<211> 17
<212> PRT
<213> Artificial
<400> 212
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 213
<211> 17
<212> PRT
<213> Artificial
<400> 213
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 214
<211> 17
<212> PRT
<213> Artificial
<400> 214
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu
1 5 10 15
Gly
<210> 215
<211> 17
<212> PRT
<213> Artificial
<400> 215
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu
1 5 10 15
Gly
<210> 216
<211> 17
<212> PRT
<213> Artificial
<400> 216
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu
1 5 10 15
Gly
<210> 217
<211> 17
<212> PRT
<213> Artificial
<400> 217
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu
1 5 10 15
Gly
<210> 218
<211> 17
<212> PRT
<213> Artificial
<400> 218
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 219
<211> 17
<212> PRT
<213> Artificial
<400> 219
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 220
<211> 17
<212> PRT
<213> Artificial
<400> 220
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 221
<211> 17
<212> PRT
<213> Artificial
<400> 221
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 222
<211> 17
<212> PRT
<213> Artificial
<400> 222
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 223
<211> 16
<212> PRT
<213> Artificial
<400> 223
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly
1 5 10 15
<210> 224
<211> 16
<212> PRT
<213> Artificial
<400> 224
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly
1 5 10 15
<210> 225
<211> 16
<212> PRT
<213> Artificial
<400> 225
Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly
1 5 10 15
<210> 226
<211> 32
<212> PRT
<213> Artificial
<400> 226
Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 227
<211> 32
<212> PRT
<213> Artificial
<400> 227
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asp Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 228
<211> 32
<212> PRT
<213> Artificial
<400> 228
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 229
<211> 32
<212> PRT
<213> Artificial
<400> 229
Arg Phe Thr Ile Ser Arg Asp His Ala Ala Asn Thr Val Tyr Leu Glu
1 5 10 15
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 230
<211> 32
<212> PRT
<213> Artificial
<400> 230
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asp Ser Leu Lys Pro Gly Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 231
<211> 32
<212> PRT
<213> Artificial
<400> 231
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Asp Cys Asn Phe
20 25 30
<210> 232
<211> 32
<212> PRT
<213> Artificial
<400> 232
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asp Met Val Tyr Leu Gln
1 5 10 15
Met Ala Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 233
<211> 32
<212> PRT
<213> Artificial
<400> 233
Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 234
<211> 32
<212> PRT
<213> Artificial
<400> 234
Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 235
<211> 32
<212> PRT
<213> Artificial
<400> 235
Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 236
<211> 32
<212> PRT
<213> Artificial
<400> 236
Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 237
<211> 32
<212> PRT
<213> Artificial
<400> 237
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 238
<211> 32
<212> PRT
<213> Artificial
<400> 238
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 239
<211> 32
<212> PRT
<213> Artificial
<400> 239
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Glu
1 5 10 15
Met Asn Asn Leu Lys Pro Asp Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 240
<211> 32
<212> PRT
<213> Artificial
<400> 240
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 241
<211> 32
<212> PRT
<213> Artificial
<400> 241
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 242
<211> 32
<212> PRT
<213> Artificial
<400> 242
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 243
<211> 32
<212> PRT
<213> Artificial
<400> 243
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 244
<211> 32
<212> PRT
<213> Artificial
<400> 244
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 245
<211> 32
<212> PRT
<213> Artificial
<400> 245
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 246
<211> 32
<212> PRT
<213> Artificial
<400> 246
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 247
<211> 32
<212> PRT
<213> Artificial
<400> 247
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 248
<211> 32
<212> PRT
<213> Artificial
<400> 248
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
20 25 30
<210> 249
<211> 32
<212> PRT
<213> Artificial
<400> 249
Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 250
<211> 32
<212> PRT
<213> Artificial
<400> 250
Arg Phe Thr Ile Ser Arg Asp Gly Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 251
<211> 32
<212> PRT
<213> Artificial
<400> 251
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala
20 25 30
<210> 252
<211> 14
<212> PRT
<213> Artificial
<400> 252
Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 253
<211> 17
<212> PRT
<213> Artificial
<400> 253
Gln Ser Arg Tyr Arg Ser Asn Tyr Tyr Asp His Asp Asp Lys Tyr Ala
1 5 10 15
Tyr
<210> 254
<211> 19
<212> PRT
<213> Artificial
<400> 254
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Asn Phe
<210> 255
<211> 16
<212> PRT
<213> Artificial
<400> 255
Leu Gly Arg Tyr Arg Ser Asn Trp Arg Asn Ile Gly Gln Tyr Asp Tyr
1 5 10 15
<210> 256
<211> 17
<212> PRT
<213> Artificial
<400> 256
Gln Ser Arg Tyr Ser Ser Asn Tyr Tyr Asp His Asp Asp Lys Tyr Ala
1 5 10 15
Tyr
<210> 257
<211> 8
<212> PRT
<213> Artificial
<400> 257
Val Val Asp Gly Lys Arg Ala Pro
1 5
<210> 258
<211> 16
<212> PRT
<213> Artificial
<400> 258
Asn Arg Arg Gln Lys Thr Val Gln Met Gly Glu Arg Ala Tyr Asp Tyr
1 5 10 15
<210> 259
<211> 14
<212> PRT
<213> Artificial
<400> 259
Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 260
<211> 14
<212> PRT
<213> Artificial
<400> 260
Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 261
<211> 14
<212> PRT
<213> Artificial
<400> 261
Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 262
<211> 14
<212> PRT
<213> Artificial
<400> 262
Asn Leu Lys Gln Gly Asp Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 263
<211> 19
<212> PRT
<213> Artificial
<400> 263
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 264
<211> 19
<212> PRT
<213> Artificial
<400> 264
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Ser Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 265
<211> 19
<212> PRT
<213> Artificial
<400> 265
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 266
<211> 19
<212> PRT
<213> Artificial
<400> 266
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Asn Phe
<210> 267
<211> 19
<212> PRT
<213> Artificial
<400> 267
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Asn Phe
<210> 268
<211> 19
<212> PRT
<213> Artificial
<400> 268
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Asn Phe
<210> 269
<211> 19
<212> PRT
<213> Artificial
<400> 269
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Asn Phe
<210> 270
<211> 19
<212> PRT
<213> Artificial
<400> 270
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 271
<211> 19
<212> PRT
<213> Artificial
<400> 271
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 272
<211> 19
<212> PRT
<213> Artificial
<400> 272
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 273
<211> 19
<212> PRT
<213> Artificial
<400> 273
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 274
<211> 19
<212> PRT
<213> Artificial
<400> 274
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 275
<211> 14
<212> PRT
<213> Artificial
<400> 275
Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 276
<211> 14
<212> PRT
<213> Artificial
<400> 276
Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 277
<211> 14
<212> PRT
<213> Artificial
<400> 277
Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr
1 5 10
<210> 278
<211> 11
<212> PRT
<213> Artificial
<400> 278
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 279
<211> 11
<212> PRT
<213> Artificial
<400> 279
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 280
<211> 11
<212> PRT
<213> Artificial
<400> 280
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 281
<211> 11
<212> PRT
<213> Artificial
<400> 281
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 282
<211> 11
<212> PRT
<213> Artificial
<400> 282
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 283
<211> 11
<212> PRT
<213> Artificial
<400> 283
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 284
<211> 11
<212> PRT
<213> Artificial
<400> 284
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 285
<211> 11
<212> PRT
<213> Artificial
<400> 285
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 286
<211> 11
<212> PRT
<213> Artificial
<400> 286
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 287
<211> 11
<212> PRT
<213> Artificial
<400> 287
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 288
<211> 11
<212> PRT
<213> Artificial
<400> 288
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 289
<211> 11
<212> PRT
<213> Artificial
<400> 289
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 290
<211> 11
<212> PRT
<213> Artificial
<400> 290
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 291
<211> 11
<212> PRT
<213> Artificial
<400> 291
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 292
<211> 11
<212> PRT
<213> Artificial
<400> 292
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 293
<211> 11
<212> PRT
<213> Artificial
<400> 293
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 294
<211> 11
<212> PRT
<213> Artificial
<400> 294
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 295
<211> 11
<212> PRT
<213> Artificial
<400> 295
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 296
<211> 11
<212> PRT
<213> Artificial
<400> 296
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 297
<211> 11
<212> PRT
<213> Artificial
<400> 297
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 298
<211> 11
<212> PRT
<213> Artificial
<400> 298
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 299
<211> 11
<212> PRT
<213> Artificial
<400> 299
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 300
<211> 11
<212> PRT
<213> Artificial
<400> 300
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 301
<211> 11
<212> PRT
<213> Artificial
<400> 301
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 302
<211> 11
<212> PRT
<213> Artificial
<400> 302
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 303
<211> 11
<212> PRT
<213> Artificial
<400> 303
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
Claims (78)
- 4개의 틀(framework) 부위(각각 FR1∼FR4)와 3개의 상보성 결정 부위(각각 CDR1∼CDR3)로 이루어진 폰 빌레브란트 인자(Von Willebrand Factor; vWF)에 대한 나노바디로서,(i) CDR1은NYGMG (서열 번호 15)SYTLG (서열 번호 16)NYNMG (서열 번호 17)SSAMA (서열 번호 18)YYNTG (서열 번호 19)IGAMG (서열 번호 20)IGTMG (서열 번호 21)YNPMG (서열 번호 22)로 이루어진 군;또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군[여기서,(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정 의됨)이고/이거나;(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];및/또는 상기 아미노산 서열 중 하나와 2개 또는 오로지 1개의 "아미노산 차이"(본원에 정의됨)를 가지는 아미노산 서열로 이루어진 군[여기서,(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]으로부터 선택되는 아미노산 서열을 포함하거나, 본질적으로 이 아미노산 서열로 이루어지거나, 또는 이 아미노산 서열이며;(ii) CDR2는SISWSGTYTAYSDNVKG (서열 번호 23)GISWSGVSTDYAEFAKG (서열 번호 24)TSISWSGSYTAYADNVKG (서열 번호 25)SISWSGMSTYYTDSVKG (서열 번호 26)TITSGGRTSYADSVKG (서열 번호 27)AISWSGGLTYYADSVKG (서열 번호 28)TITSGGSTNYADPVKG (서열 번호 29)TITSGGSTNYADSVKG (서열 번호 30)AISRTGGSTYYARSVEG (서열 번호 31)AISRTGGSTYYPDSVEG (서열 번호 32)로 이루어진 군;또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군[여기서(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];및/또는 상기 아미노산 서열들 중 어느 하나와 3개, 2개 또는 오로지 1개의 "아미노산 차이"(본원에 정의됨)를 가지는 아미노산 서열로 이루어진 군[여기서,(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]으로부터 선택되는 아미노산 서열을 포함하거나, 본질적으로 이 아미노산 서열로 이루어지거나, 또는 이 아미노산 서열이며;(iii) CDR3는QSRYRSNYYDHDDKYAY (서열 번호 33)LGRYRSNWRNIGQYDY (서열 번호 34)QSRYSSNYYDHDDKYAY (서열 번호 35)SNRYRTHTTQAMYNY (서열 번호 36)VVDGKRAP (서열 번호 37)NRRQKTVQMGERAYDY (서열 번호 38)NLKQGSYGYRFNDY (서열 번호 39)NLKQGDYGYRFNDY (서열 번호 40)AGVRAEDGRVRTLPSEYNF (서열 번호 41)AGVRAEDGRVRTLPSEYTF (서열 번호 42)AGVRAEDGRVRSLPSEYTF (서열 번호 43)로 이루어진 군;또는 상기 아미노산 서열 중 하나와의 서열 동일성(본원에 정의됨)이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열로 이루어진 군[여기서,(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임];및/또는 상기 아미노산 서열 중 하나와 3개, 2개 또는 오로지 1개의 "아미노산 차이"(본원에 정의됨)를 가지는 아미노산 서열로 이루어진 군[여기서,(1) 임의의 아미노산 치환은 바람직하게는 보존적 아미노산 치환(본원에 정의됨)이고/이거나;(2) 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 바람직하게는 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열임]으로부터 선택되는 아미노산 서열을 포함하거나, 본질적으로 이 아미노산 서열로 이루어지거나, 또는 이 아미노산 서열인, 폰 빌레브란트 인자(vWF)에 대한 나노바디.
- 제1항에 의한 나노바디의 인간화된 변이체.
- 4개의 틀 부위(각각 FR1∼FR4)와 3개의 상보성 결정 부위(각각 CDR1∼CDR3)로 이루어진 폰 빌레브란트 인자(vWF)에 대한 나노바디로서,g) CDR1은- 아미노산 서열 YNPMG; 또는- 이 아미노산 서열 YNPMG와 2개 또는 오로지 1개의 아미노산 차이를 가지는 아미노산 서열을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지며;h) CDR2는- 아미노산 서열 AISRTGGSTYYPDSVEG; 또는- 이 아미노산 서열 AISRTGGSTYYPDSVEG와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는- 이 아미노산 서열 AISRTGGSTYYPDSVEG와 2개 또는 오로지 1개의 아미노산 차이를 가지는 아미노산 서열을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지며;i) CDR3은- 아미노산 서열 AGVRAEDGRVRTLPSEYTF; 또는- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와 오로지 1개의 아미노산 차이를 가지는 아미노산 서열을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지는, 폰 빌레브란트 인자(vWF)에 대한 나노바디.
- 제3항에 있어서, 상기 CDR1은 아미노산 서열 YNPMG를 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제3항에 있어서, 상기 CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG를 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제3항에 있어서, 상기 CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF를 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제3항에 있어서,- CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지거나; 또는- CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지고; CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지거나; 또는- CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제3항에 있어서, 상기 CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제3항에 있어서, 상기 CDR1은 아미노산 서열 YNPMG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지고; CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어지며; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제3항 내지 제9항 중 어느 하나의 항에 있어서,- 임의의 아미노산 치환은 보존적 아미노산 치환이고/이거나;- 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열인 나노바디.
- 4개의 틀 부위(각각 FR1∼FR4)와 3개의 상보성 결정 부위(각각 CDR1∼CDR3)로 이루어진 폰 빌레브란트 인자(vWF)에 대한 나노바디로서,a) CDR1은- 아미노산 서열 YNPMG; 또는- 이 아미노산 서열 YNPMG와 2개 또는 오로지 1개의 아미노산 차이를 가지는 아미노산 서열이며;b) CDR2는- 아미노산 서열 AISRTGGSTYYPDSVEG; 또는- 이 아미노산 서열 AISRTGGSTYYPDSVEG와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는- 이 아미노산 서열 AISRTGGSTYYPDSVEG와 2개 또는 오로지 1개의 아미노산 차이를 가지는 아미노산 서열이고;c) CDR3은- 아미노산 서열 AGVRAEDGRVRTLPSEYTF; 또는- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와의 서열 동일성이 80% 이상, 바람직하게는 90% 이상, 더욱 바람직하게는 95% 이상, 더더욱 바람직하게는 99% 이상인 아미노산 서열; 또는- 이 아미노산 서열 AGVRAEDGRVRTLPSEYTF와 오로지 1개의 아미노산 차이를 가지는 아미노산 서열인, 폰 빌레브란트 인자(vWF)에 대한 나노바디.
- 제11항에 있어서, 상기 CDR1은 아미노산 서열 YNPMG인 나노바디.
- 제11항에 있어서, 상기 CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG인 나노바디.
- 제11항에 있어서, 상기 CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF인 나노바디.
- 제11항에 있어서,- CDR1은 아미노산 서열 YNPMG이고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF이거나; 또는- CDR1은 아미노산 서열 YNPMG이고; CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG을 포함하거나; 또는- CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG이고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하는 것인 나노바디.
- 제11항에 있어서, 상기 CDR1은 아미노산 서열 YNPMG이고; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF을 포함하거나 또는 본질적으로 이 아미노산 서열로 이루어진 나노바디.
- 제11항에 있어서, 상기 CDR1은 아미노산 서열 YNPMG이고; CDR2는 아미노산 서열 AISRTGGSTYYPDSVEG이며; CDR3은 아미노산 서열 AGVRAEDGRVRTLPSEYTF인 나노바디.
- 제11항 내지 제16항 중 어느 하나의 항에 있어서,- 임의의 아미노산 치환은 보존적 아미노산 치환이고/이거나;- 이 아미노산 서열은 상기 아미노산 서열(들)에 비하여, 아미노산 치환만을 함유하고, 아미노산의 결실 또는 삽입은 함유하지 않는 아미노산 서열인 나노바디.
- 제3항 내지 제18항 중 어느 하나의 항에 있어서, KERE-군(class) 나노바디인 나노바디.
- 제3항 내지 제19항 중 어느 하나의 항에 의한 나노바디의 인간화된 변이체.
- 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97로 이루어진 군으로부터 선택되는 나노바디 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디.
- 나노바디 12B6(서열 번호 62); 12A2(서열 번호 71); 12F2(서열 번호 72); 14H10(서열 번호 73); 12B6H1(서열 번호 86); 12B6H2(서열 번호 87); 12B6H3(서열 번호 88); 12B6H4(서열 번호 89); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94) 중 하나 이상과의 서열 동일성이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디.
- 나노바디 12A2(서열 번호 71); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94) 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디.
- 나노바디 12A2H1(서열 번호 90)과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상, 또는 99% 이상인 나노바디.
- 제20항 내지 제24항 중 어느 하나의 항에 의한 나노바디의 인간화된 변이체.
- 서열 번호 60∼서열 번호 73 및 서열 번호 86∼서열 번호 97의 나노바디로 이루어진 군으로부터 선택되는 나노바디.
- 나노바디 12B6(서열 번호 62); 12A2(서열 번호 71); 12F2(서열 번호 72); 14H10(서열 번호 73); 12B6H1(서열 번호 86); 12B6H2(서열 번호 87); 12B6H3(서열 번호 88); 12B6H4(서열 번호 89); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94)으로 이루어진 군으로부터 선택되는 나노바디.
- 나노바디 12A2(서열 번호 71); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94)으로 이루어진 군으로부터 선택되는 나노바디.
- 나노바디 12A2H1(서열 번호 90).
- 제1항 내지 제29항 중 어느 하나의 항에 의한 나노바디를 포함하거나 또는 본질적으로 이것으로 이루어져 있는 단백질 또는 폴리펩티드.
- 제30항에 있어서, 제1항 내지 제29항 중 어느 하나의 항에 의한 나노바디를 하나 이상 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제30항 또는 제31항에 있어서, 제1항 내지 제29항 중 어느 하나의 항에 의한 나노바디를 2개 이상 포함하는 것인 단백질 또는 폴리펩티드.
- 제30항 또는 제31항에 있어서, 제1항 내지 제29항 중 어느 하나의 항에 의한 나노바디를 2개 포함하는 것인 단백질 또는 폴리펩티드.
- 제30항 내지 제33항 중 어느 하나의 항에 있어서, 상기 단백질 또는 폴리펩티드 내에 존재하는 나노바디(들)는 제3항 내지 제20항 중 어느 하나의 항에 의한 나노바디인 것인 단백질 또는 폴리펩티드.
- 제30항 내지 제33항 중 어느 하나의 항에 있어서, 상기 단백질 또는 폴리펩티드 내에 존재하는 나노바디(들)는 제22항 내지 제29항 중 어느 하나의 항에 의한 나노바디인 것인 단백질 또는 폴리펩티드.
- 제30항 내지 제33항 중 어느 하나의 항에 있어서, 상기 단백질 또는 폴리펩티드 내에 존재하는 나노바디(들)는 제24항에 의한 나노바디인 것인 단백질 또는 폴리펩티드.
- 제30항 내지 제33항 중 어느 하나의 항에 있어서, 상기 단백질 또는 폴리펩티드 내에 존재하는 나노바디(들)는 나노바디 12B6(서열 번호 62); 12A2(서열 번호 71); 12F2(서열 번호 72); 14H10(서열 번호 73); 12B6H1(서열 번호 86); 12B6H2(서열 번호 87); 12B6H3(서열 번호 88); 12B6H4(서열 번호 89); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94)로 이루어진 군으로부터 선택되는 것인 단백질 또는 폴리펩티드.
- 제30항 내지 제33항 중 어느 하나의 항에 있어서, 상기 단백질 또는 폴리펩티드 내에 존재하는 나노바디(들)는 나노바디 12A2(서열 번호 71); 12A2H1(서열 번호 90); 12A2H3(서열 번호 91); 12A2H4(서열 번호 92); 12A2H11(서열 번호 93) 및/또는 12A2H13(서열 번호 94)으로 이루어진 군으로부터 선택되는 것인 단백질 또는 폴리펩티드.
- 제30항 내지 제33항 중 어느 하나의 항에 있어서, 상기 단백질 또는 폴리펩티드 내에 존재하는 나노바디(들)는 나노바디 12A2H1(서열 번호 90)인 것인 단백질 또는 폴리펩티드.
- 제31항 내지 제39항 중 어느 하나의 항에 있어서, 2개 또는 2개 이상의 나노바디를 포함하며, 상기 2개 또는 2개 이상의 나노바디는 서로 직접 결합되어 있거나, 또는 링커를 통하여 서로 결합되어 있는 것인 단백질 또는 폴리펩티드.
- 제40항에 있어서, 2개 또는 2개 이상의 나노바디를 포함하며, 상기 2개 또는 2개 이상의 나노바디는 링커를 통하여 서로 결합되어 있는 것인 단백질 또는 폴리 펩티드.
- 제41항에 있어서, 상기 링커는 아미노산 서열인 것인 단백질 또는 폴리펩티드.
- 제42항에 있어서, 상기 링커는 2∼30개의 아미노산 잔기와 같이, 1∼40개의 아미노산 잔기를 포함하는 것인 단백질 또는 폴리펩티드.
- 제43항에 있어서, 상기 링커는 글리신 및 세린 잔기를 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제44항에 있어서, 상기 링커는 링커 GS9(서열 번호 84)를 포함하는 것인 단백질 또는 폴리펩티드.
- 제41항에 있어서, 상기 링커는 알라닌 잔기를 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제42항에 있어서, 상기 링커는 1, 2, 3, 4 또는 5개의 아미노산 잔기와 같이, 1∼10개의 아미노산 잔기를 포함하는 것인 단백질 또는 폴리펩티드.
- 서열 번호 74∼서열 번호 82 또는 서열 번호 98∼서열 번호 106으로 이루어진 군으로부터 선택되는 폴리펩티드 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상 또는 99% 이상인 것인 단백질 또는 폴리펩티드.
- 서열 번호 74∼서열 번호 76, 서열 번호 80∼서열 번호 82 또는 서열 번호 98∼서열 번호 106으로 이루어진 군으로부터 선택되는 폴리펩티드 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상 또는 99% 이상인 것인 단백질 또는 폴리펩티드.
- 서열 번호 74∼서열 번호 76, 서열 번호 98, 99, 101, 102, 104, 105 및 106으로 이루어진 군으로부터 선택되는 폴리펩티드 중 하나 이상과의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상 또는 99% 이상인 것인 단백질 또는 폴리펩티드.
- 서열 번호 90의 폴리펩티드와의 서열 동일성(본원에 정의됨)이 80% 이상, 또는 90% 이상, 또는 95% 이상 또는 99% 이상인 것인 단백질 또는 폴리펩티드.
- 서열 번호 90의 폴리펩티드.
- 제1항 내지 제29항 중 어느 하나의 항에 의한 나노바디의 단편.
- 제3항 내지 제20항 중 어느 하나의 항에 의한 나노바디의 단편.
- 제22항 내지 제29항 중 어느 하나의 항에 의한 나노바디의 단편.
- 제24항에 의한 나노바디의 단편.
- 제27항 내지 제29항 중 어느 하나의 항에 의한 나노바디의 단편.
- 제53항 내지 제57항 중 어느 하나의 항에 있어서, 상응하는 전장 나노바디의 아미노산 서열과의 서열 동일성 정도가 50% 이상, 바람직하게는 60% 이상, 더욱 바람직하게는 80% 이상, 90% 이상 또는 95% 이상과 같이, 70% 이상인 것인 단편.
- 제53항 내지 제58항 중 어느 하나의 항에 의한 단편을 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제59항에 있어서, 제53항 내지 제58항 중 어느 하나의 항에 의한 단편을 하나 이상 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제59항 또는 제60항에 있어서, 제53항 내지 제58항 중 어느 하나의 항에 의한 단편을 2개 이상 포함하는 것인 단백질 또는 폴리펩티드.
- 제59항 내지 제61항 중 어느 하나의 항에 있어서, 제1항 내지 제29항 중 어느 하나의 항에 의한 나노바디를 2개 포함하는 단백질 또는 폴리펩티드.
- 제59항 내지 제62항 중 어느 하나의 항에 있어서, 2개 또는 2개 이상의 단편을 포함하고, 상기 2개 또는 2개 이상의 단편은 서로 직접 결합되어 있거나, 또는 링커에 의해 서로 결합되어 있는 것인 단백질 또는 폴리펩티드.
- ADAMTS-13에 의한 ULvWF의 절단을 본질적으로 억제하지 않는 나노바디를 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제59항에 있어서, ADAMTS-13에 의한 ULvWF의 절단을 본질적으로 억제하지 않는 나노바디를 하나 이상 포함하거나 또는 본질적으로 이것으로 이루어진 단백질 또는 폴리펩티드.
- 제59항 또는 제60항에 있어서, ADAMTS-13에 의한 ULvWF의 절단을 본질적으로 억제하지 않는 나노바디를 2개 이상 포함하는 것인 단백질 또는 폴리펩티드.
- 제59항 내지 제61항 중 어느 하나의 항에 있어서, ADAMTS-13에 의한 ULvWF의 절단을 본질적으로 억제하지 않는 나노바디를 2개 포함하는 것인 단백질 또는 폴리펩티드.
- 제64항 내지 제68항 중 어느 하나의 항에 있어서, 2개 또는 2개 이상의 단편을 포함하고, 상기 2개 또는 2개 이상의 단편은 서로 직접 결합되어 있거나, 또는 링커에 의해 서로 결합되어 있는 것인 단백질 또는 폴리펩티드.
- 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴리펩티드 또는 단편을 암호화하는 뉴클레오티드 서열 또는 핵산.
- 제64항에 의한 뉴클레오티드 서열 또는 핵산을 포함하거나, 또는 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴리펩티드 또는 단편을 발현하거나 또는 발현할 수 있는 숙주 세포.
- 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴리펩티드 또는 단편을 제조하는 방법으로서, 이 방법은 제65항에 의한 숙주 세포가 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴리펩티드 또는 단편을 발현 또는 생산하는 조건 하에서, 상기 숙주 세포를 배양 또는 유지시키는 단계; 및 임의로는, 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴 리펩티드 또는 단편을 분리하는 단계를 추가로 포함하는 것인 방법.
- 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴리펩티드 또는 단편 하나 이상과, 임의로는 약학적으로 허용 가능한 담체를 하나 이상 포함하는 약학 조성물.
- 제1항 내지 제73항 중 어느 하나의 항에 있어서, 혈소판-매개 응집 관련 질병 또는 질환을 예방 또는 치료하기 위한 나노바디, 단백질, 폴리펩티드 또는 단편, 또는 약학 조성물.
- 제1항 내지 제68항 또는 제73항 중 어느 하나의 항에 있어서, 비-폐색성 혈전증, 폐색성 혈전 형성증, 동맥 혈전 형성증, 급성 관상 동맥 폐색증, 말초 동맥 폐색증, 및 관상 동맥 우회로 이식 조성술, 관상 동맥 판막 치환술 및, 혈관 형성술, 스텐트 삽입술 또는 죽종 절제술과 같은 관상 동맥 개입술로 인한 재발 협착증 및 질환, 혈관 형성술, 죽종 절제술 또는 동맥 스텐트 삽입술 이후에 발생하는 과형성증, 혈관계에서의 폐색성 증후군 또는 발병 동맥의 비 개통증, 혈전성 혈소판 감소 자반증(TTP), 일과성 뇌 허혈 발작증, 불안정 또는 안정 협심증, 뇌경색, HELLP 증후군, 경동맥 내막 절제술, 경동맥 협착증, 주요 사지 허혈증(critical limb ischaemia), 심장인성 색전증, 말초 혈관계 질병, 재발 협착증 및 심근 경색증으로부터 선택되는 혈소판-매개 응집 관련 질병 또는 질환을 예방 또는 치료하기 위한 나노바디, 단백질, 폴리펩티드 또는 단편, 또는 약학 조성물.
- 제73항에 있어서, 아스피린(아스페직(Aspegic)), 헤파린, 플라빅스(Plavix)® 및/또는 레오프로(Reopro)®와 같은, 응집 매개 질환의 예방 또는 치료를 위한 하나 이상의 기타 활성 물질을 추가로 함유하는 것인 약학 조성물.
- 혈소판-매개 응집 관련 질병 또는 질환의 예방 또는 치료를 위한 의약품의 제조에 있어서 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질, 폴리펩티드 또는 단편의 용도.
- 비-폐색성 혈전 형성증, 폐색성 혈전증, 동맥 혈전 형성증, 급성 관상 동맥 폐색증, 말초 동맥 폐색증, 및 관상 동맥 우회로 이식 조성술, 관상 동맥 판막 치환술 및, 혈관 형성술, 스텐트 삽입술 또는 죽종 절제술과 같은 관상 동맥 개입술로 인한 재발 협착증 및 질환, 혈관 형성술, 죽종 절제술 또는 동맥 스텐트 삽입술 이후에 발생하는 과형성증, 혈관계에서의 폐색성 증후군 또는 발병 동맥의 비 개통증, 혈전성 혈소판 감소 자반증(TTP), 일과성 뇌 허혈 발작증, 불안정 또는 안정 협심증, 뇌경색, HELLP 증후군, 경동맥 내막 절제술, 경동맥 협착증, 주요 사지 허혈증(critical limb ischaemia), 심장인성 색전증, 말초 혈관계 질병, 재발 협착증 및 심근 경색증으로부터 선택되는 혈소판-매개 응집 관련 질병 또는 질환을 예방 또는 치료하기 위한 의약품의 제조에 있어서 제1항 내지 제68항 중 어느 하나의 항 에 의한 나노바디, 단백질, 폴리펩티드 또는 단편의 용도.
- vWF에 대한 나노바디, 단백질 또는 폴리펩티드, 구체적으로, 제1항 내지 제68항 중 어느 하나의 항에 의한 나노바디, 단백질 또는 폴리펩티드 사용과 연관된 합병증이나 원치않는 부작용에 대한 해결 수단(antidote)으로서의 vWF, 이의 적당한 단편, DDAVP(데스모프레시너; desmopressinor) 또는 이의 적당한 단편, 또는 이것들 중 임의의 것을 포함하는 약학 조성물의 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US68347405P | 2005-05-20 | 2005-05-20 | |
| US60/683,474 | 2005-05-20 | ||
| PCT/EP2006/004773 WO2006122825A2 (en) | 2005-05-20 | 2006-05-19 | Single domain vhh antibodies against von willebrand factor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080023301A true KR20080023301A (ko) | 2008-03-13 |
| KR101414438B1 KR101414438B1 (ko) | 2014-07-10 |
Family
ID=37431613
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077029416A KR101414438B1 (ko) | 2005-05-20 | 2006-05-19 | 폰 빌레브란트 인자에 대한 단일 도메인 vhh 항체 |
Country Status (27)
| Country | Link |
|---|---|
| US (3) | US7807162B2 (ko) |
| EP (4) | EP3415535B1 (ko) |
| JP (1) | JP4986997B2 (ko) |
| KR (1) | KR101414438B1 (ko) |
| CN (1) | CN101213214B (ko) |
| AU (1) | AU2006249090B2 (ko) |
| BR (1) | BRPI0609797B8 (ko) |
| CA (2) | CA2960105A1 (ko) |
| CY (2) | CY1122579T1 (ko) |
| DK (1) | DK2444424T3 (ko) |
| ES (2) | ES2852423T3 (ko) |
| FR (1) | FR19C1005I2 (ko) |
| HU (2) | HUE039846T2 (ko) |
| IL (2) | IL187168A (ko) |
| LT (2) | LT2444424T (ko) |
| LU (1) | LUC00099I2 (ko) |
| MX (1) | MX2007014564A (ko) |
| NL (1) | NL300966I2 (ko) |
| NO (3) | NO20076475L (ko) |
| NZ (1) | NZ563392A (ko) |
| PL (2) | PL3415535T3 (ko) |
| PT (2) | PT2444424T (ko) |
| RU (1) | RU2433139C2 (ko) |
| SI (1) | SI2444424T1 (ko) |
| TR (1) | TR201815552T4 (ko) |
| WO (1) | WO2006122825A2 (ko) |
| ZA (1) | ZA200709570B (ko) |
Families Citing this family (230)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1527346B1 (en) | 2002-08-07 | 2011-06-08 | Ablynx N.V. | Modulation of platelet adhesion based on the surface exposed beta-switch loop of platelet glycoprotein ib-alpha |
| US9320792B2 (en) * | 2002-11-08 | 2016-04-26 | Ablynx N.V. | Pulmonary administration of immunoglobulin single variable domains and constructs thereof |
| CN101412759A (zh) * | 2003-01-10 | 2009-04-22 | 埃博灵克斯股份有限公司 | 治疗性多肽,其同源物、其片段及其在调节血小板介导的聚集方面的应用 |
| KR101443473B1 (ko) | 2004-07-22 | 2014-09-22 | 에라스무스 유니버시티 메디컬 센터 로테르담 | Vh 결합 영역의 분리 방법 |
| JP4829897B2 (ja) * | 2005-01-14 | 2011-12-07 | アブリンクス ナームローゼ フェンノートシャップ | 血小板減少及び/又はフォンビルブラント因子(vWF)と血小板との間の自発的相互作用によって特徴づけられる疾患及び障害の異なる形態を区別する方法及びアッセイ |
| KR101414438B1 (ko) | 2005-05-20 | 2014-07-10 | 아블린쓰 엔.브이. | 폰 빌레브란트 인자에 대한 단일 도메인 vhh 항체 |
| WO2008049881A2 (en) * | 2006-10-25 | 2008-05-02 | Umc Utrecht Holding Bv | Polypeptides and pharmaceutical compositions comprising the same for the prevention and treatment of complications associated with infectious diseases |
| WO2008049897A1 (en) * | 2006-10-27 | 2008-05-02 | Ablynx N.V. | Intranasal delivery of polypeptides and proteins |
| WO2008074839A2 (en) | 2006-12-19 | 2008-06-26 | Ablynx N.V. | Amino acid sequences directed against gpcrs and polypeptides comprising the same for the treatment of gpcr-related diseases and disorders |
| US9512236B2 (en) | 2006-12-19 | 2016-12-06 | Ablynx N.V. | Amino acid sequences directed against GPCRS and polypeptides comprising the same for the treatment of GPCR-related diseases and disorders |
| CA2672965C (en) | 2006-12-19 | 2018-02-06 | Ablynx N.V. | Amino acid sequences directed against a metalloproteinase from the adam family and polypeptides comprising the same for the treatment of adam-related diseases and disorders |
| CA2678218A1 (en) * | 2007-02-21 | 2008-08-28 | Ablynx N.V. | Amino acid sequences directed against vascular endothelial growth factor and polypeptides comprising the same for the treatment of conditions and diseases characterized by excessive and/or pathological angiogenesis or neovascularization |
| KR101264473B1 (ko) | 2007-05-24 | 2013-05-29 | 아블린쓰 엔.브이. | Rank-l에 대한 아미노산 서열, 및 이를 포함하는 골 질환 및 장애 치료용 폴리펩티드 |
| AU2008270274B2 (en) | 2007-07-03 | 2012-06-28 | Ablynx N.V. | Providing improved immunoglobulin sequences by mutating CDR and/or FR positions |
| WO2009068625A2 (en) | 2007-11-27 | 2009-06-04 | Ablynx N.V. | Amino acid sequences directed against her2 and polypeptides comprising the same for the treatment of cancers and/or tumors |
| CN101932593B (zh) * | 2008-01-29 | 2014-08-20 | 埃博灵克斯股份有限公司 | 稳定蛋白和多肽的方法 |
| AU2009221106A1 (en) * | 2008-03-05 | 2009-09-11 | Ablynx Nv | Novel antigen binding dimer-complexes, methods of making and uses thereof |
| CA2718081A1 (en) * | 2008-03-21 | 2009-09-24 | Ablynx Nv | Von willebrand factor specific binders and methods of use therefor |
| AU2009235467A1 (en) | 2008-04-07 | 2009-10-15 | Ablynx Nv | Single variable domains against the Notch pathways |
| CN102089325A (zh) | 2008-04-17 | 2011-06-08 | 埃博灵克斯股份有限公司 | 能够结合血清白蛋白的肽,以及包含其的化合物、构建体和多肽 |
| US8444976B2 (en) | 2008-07-02 | 2013-05-21 | Argen-X B.V. | Antigen binding polypeptides |
| GB2461546B (en) * | 2008-07-02 | 2010-07-07 | Argen X Bv | Antigen binding polypeptides |
| WO2010010119A1 (en) | 2008-07-22 | 2010-01-28 | Ablynx Nv | Amino acid sequences directed against multitarget scavenger receptors and polypeptides |
| EP2387583B1 (en) * | 2009-01-14 | 2018-09-19 | Ablynx N.V. | Pulmonary administration of immunoglobulin single variable domains and constructs thereof |
| US9265834B2 (en) | 2009-03-05 | 2016-02-23 | Ablynx N.V. | Stable formulations of polypeptides and uses thereof |
| EP2403873A1 (en) | 2009-03-05 | 2012-01-11 | Ablynx N.V. | Novel antigen binding dimer-complexes, methods of making/avoiding and uses thereof |
| GB0905023D0 (en) * | 2009-03-24 | 2009-05-06 | Univ Erasmus Medical Ct | Binding molecules |
| DK2424889T3 (en) | 2009-04-30 | 2015-11-02 | Ablynx Nv | Process for the preparation of domain antibodies |
| WO2011003622A1 (en) | 2009-07-10 | 2011-01-13 | Ablynx N.V. | Method for the production of variable domains |
| PL2473528T3 (pl) | 2009-09-03 | 2015-05-29 | Ablynx Nv | Stabilne formulacje polipeptydów i ich zastosowanie |
| US20110172398A1 (en) * | 2009-10-02 | 2011-07-14 | Boehringer Ingelheim International Gmbh | Bispecific binding molecules for anti-angiogenesis therapy |
| WO2011067160A1 (en) | 2009-12-01 | 2011-06-09 | Ablynx Nv | Von willebrand factor specific binding agents and uses thereof |
| WO2011073180A1 (en) | 2009-12-14 | 2011-06-23 | Ablynx N.V. | Single variable domain antibodies against ox40l, constructs and therapeutic use |
| WO2011083141A2 (en) | 2010-01-08 | 2011-07-14 | Ablynx Nv | Method for generation of immunoglobulin sequences by using lipoprotein particles |
| JP2013518853A (ja) | 2010-02-05 | 2013-05-23 | アブリンクス エン.ヴェー. | 血清アルブミンと結合することが可能なペプチド並びにこれを含む化合物、構築物及びポリペプチド |
| US9120855B2 (en) | 2010-02-10 | 2015-09-01 | Novartis Ag | Biologic compounds directed against death receptor 5 |
| WO2011098518A2 (en) | 2010-02-11 | 2011-08-18 | Ablynx Nv | Delivery of immunoglobulin variable domains and constructs thereof |
| PL3501499T3 (pl) | 2010-02-11 | 2023-01-09 | Ablynx Nv | Sposoby i kompozycje do wytwarzania aerozoli |
| PE20130527A1 (es) * | 2010-03-03 | 2013-05-09 | Boehringer Ingelheim Int | Polipeptidos de union a a-beta biparatopicos |
| US8937164B2 (en) | 2010-03-26 | 2015-01-20 | Ablynx N.V. | Biological materials related to CXCR7 |
| US9556273B2 (en) | 2010-03-29 | 2017-01-31 | Vib Vzw | Anti-macrophage mannose receptor single variable domains for targeting and in vivo imaging of tumor-associated macrophages |
| US9101674B2 (en) | 2010-03-29 | 2015-08-11 | Vib Vzw | Targeting and in vivo imaging of tumor-associated macrophages |
| KR20130080790A (ko) | 2010-05-20 | 2013-07-15 | 아블린쓰 엔.브이. | Her3와 관련된 생물학적 물질들 |
| WO2011161263A1 (en) | 2010-06-25 | 2011-12-29 | Ablynx Nv | Pharmaceutical compositions for cutaneous administration |
| US11644471B2 (en) | 2010-09-30 | 2023-05-09 | Ablynx N.V. | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobulin single variable domains |
| EP3279214B1 (en) | 2010-10-29 | 2024-10-09 | Ablynx NV | Method for the production of immunoglobulin single variable domains |
| KR101650995B1 (ko) | 2010-11-08 | 2016-08-25 | 노파르티스 아게 | Cxcr2 결합 폴리펩티드 |
| CN103917560B (zh) | 2011-03-28 | 2017-05-24 | 埃博灵克斯股份有限公司 | 双特异性抗‑cxcr7免疫球蛋白单可变结构域 |
| PT2691415T (pt) | 2011-03-28 | 2018-10-19 | Ablynx Nv | Método para produção de formulações sólidas compreendendo domínios variáveis únicos de imunoglobulina |
| US9527925B2 (en) | 2011-04-01 | 2016-12-27 | Boehringer Ingelheim International Gmbh | Bispecific binding molecules binding to VEGF and ANG2 |
| UA117218C2 (uk) | 2011-05-05 | 2018-07-10 | Мерк Патент Гмбх | Поліпептид, спрямований проти il-17a, il-17f та/або il17-a/f |
| EP2707382B1 (en) | 2011-05-09 | 2019-07-17 | Ablynx NV | Method for the production of immunoglobulin single variable domains |
| CA2835340A1 (en) | 2011-05-27 | 2012-12-06 | Ablynx Nv | Inhibition of bone resorption with rankl binding peptides |
| IN2014CN00437A (ko) | 2011-06-23 | 2015-04-03 | Ablynx Nv | |
| EP2944653A1 (en) | 2011-06-23 | 2015-11-18 | Ablynx N.V. | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobin single variable domains |
| EP4350345A3 (en) | 2011-06-23 | 2024-07-24 | Ablynx N.V. | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobin single variable domains |
| EP2723769B2 (en) | 2011-06-23 | 2022-06-15 | Ablynx NV | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobulin single variable domains |
| EP2987806A3 (en) * | 2011-08-17 | 2016-07-13 | Glaxo Group Limited | Modified single variable domain antibodies with reduced binding to anti-drug-antibodies |
| US20150158934A1 (en) | 2011-09-09 | 2015-06-11 | Ucl Business Plc | Broadly neutralizing vhh against hiv-1 |
| CA2849195A1 (en) | 2011-09-23 | 2013-03-28 | Ablynx Nv | Prolonged inhibition of interleukin-6 mediated signaling |
| DE102011121237A1 (de) | 2011-12-14 | 2013-06-20 | Universitätsklinikum Hamburg-Eppendorf | Einzeldomänen-Antikörper gegen Clostridium difficile Toxin CDTa |
| DE102011121238A1 (de) | 2011-12-14 | 2013-06-20 | Universitätsklinikum Hamburg-Eppendorf | Einzeldomänen-antikörper gegen clostridium difficile toxine |
| US9328174B2 (en) | 2012-05-09 | 2016-05-03 | Novartis Ag | Chemokine receptor binding polypeptides |
| CA2874309C (en) | 2012-05-24 | 2021-06-15 | Vib Vzw | Anti-macrophage mannose receptor single variable domains for targeting and in vivo imaging of tumor-associated macrophages |
| EA201492163A1 (ru) * | 2012-06-08 | 2015-08-31 | Гленмарк Фармасьютикалс С.А. | ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К TrkA, СОДЕРЖАЩИЕ АМИНОКИСЛОТНЫЕ ЗАМЕНЫ |
| WO2014087010A1 (en) | 2012-12-07 | 2014-06-12 | Ablynx N.V. | IMPROVED POLYPEPTIDES DIRECTED AGAINST IgE |
| WO2017004144A1 (en) | 2015-07-01 | 2017-01-05 | Immunomedics, Inc. | Antibody-sn-38 immunoconjugates with a cl2a linker |
| WO2014118297A1 (en) | 2013-01-30 | 2014-08-07 | Vib Vzw | Novel chimeric polypeptides for screening and drug discovery purposes |
| JP2016512954A (ja) | 2013-02-05 | 2016-05-12 | フエー・イー・ベー・フエー・ゼツト・ウエー | ムスカリン性アセチルコリン受容体の結合剤およびそれらの使用 |
| WO2014140376A1 (en) | 2013-03-15 | 2014-09-18 | Vib Vzw | Anti-macrophage mannose receptor single variable domains for use in cardiovascular diseases |
| WO2014141192A1 (en) | 2013-03-15 | 2014-09-18 | Erasmus University Medical Center | Generation of heavy chain-only antibodies |
| NL1040254C2 (en) | 2013-05-17 | 2014-11-24 | Ablynx Nv | Stable formulations of immunoglobulin single variable domains and uses thereof. |
| WO2014197885A2 (en) | 2013-06-07 | 2014-12-11 | Duke University | Inhibitors of complement factor h |
| US20160130361A1 (en) * | 2013-06-13 | 2016-05-12 | Biogen Ma Inc. | Anti-factor viii antibodies or uses thereof |
| AU2015217846B2 (en) | 2014-01-30 | 2019-10-10 | The Board Of Trustees Of The Leland Stanford Junior University | Opioid receptor binding agents and uses thereof |
| US10544231B2 (en) * | 2014-04-16 | 2020-01-28 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Antibodies for the prevention or the treatment of bleeding episodes |
| SI3248986T1 (sl) | 2014-05-16 | 2022-04-29 | Ablynx Nv | Variabilne domene imunoglobulina |
| ES2900852T3 (es) | 2014-05-16 | 2022-03-18 | Ablynx Nv | Métodos de detección y/o medición de anticuerpos anti-fármaco, en particular anticuerpos anti-fármaco que se presentan durante el tratamiento |
| NL2013007B1 (en) | 2014-06-16 | 2016-07-05 | Ablynx Nv | Methods of treating TTP with immunoglobulin single variable domains and uses thereof. |
| NL2013661B1 (en) | 2014-10-21 | 2016-10-05 | Ablynx Nv | KV1.3 Binding immunoglobulins. |
| WO2016012363A1 (en) | 2014-07-22 | 2016-01-28 | Vib Vzw | Methods to select for agents that stabilize protein complexes |
| AU2015328370B2 (en) | 2014-10-07 | 2021-08-05 | Immunomedics, Inc. | Neoadjuvant use of antibody-drug conjugates |
| MA41097A (fr) * | 2014-12-05 | 2017-10-10 | Glenmark Pharmaceuticals Sa | Anticorps anti-trka à propriétés inhibitrices améliorées et dérivés desdits anticorps destinés à être utilisés pour traiter les douleurs osseuses |
| PL3233910T3 (pl) | 2014-12-19 | 2020-06-01 | Ablynx N.V. | Dimery nanociał połączone cysteiną |
| AU2016239844B2 (en) | 2015-04-02 | 2021-05-13 | Ablynx N.V. | Bispecific CXCR4-CD-4 polypeptides with potent anti-HIV activity |
| CA2981543A1 (en) | 2015-04-22 | 2016-10-27 | Immunomedics, Inc. | Isolation, detection, diagnosis and/or characterization of circulating trop-2-positive cancer cells |
| SI3294768T1 (sl) | 2015-05-13 | 2019-11-29 | Ablynx Nv | Polipeptidi, ki rekrutirajo celice T, na osnovi reaktivnosti TCR alfa/beta |
| JP7163028B2 (ja) | 2015-05-13 | 2022-10-31 | アブリンクス エン.ヴェー. | Cd3反応性に基づくt細胞リクルートポリペプチド |
| WO2016186994A1 (en) * | 2015-05-15 | 2016-11-24 | Children's Medical Center Corporation | Methods relating to the diagnosis and treatment of thrombotic microangiopathy |
| IL274151B (en) | 2015-05-21 | 2022-07-01 | Harpoon Therapeutics Inc | Trispecific binding proteins and methods of use |
| CA2991637C (en) | 2015-07-31 | 2022-07-05 | Medimmune Limited | Methods for treating hepcidin-mediated disorders |
| NO2768984T3 (ko) | 2015-11-12 | 2018-06-09 | ||
| SI3374392T1 (sl) | 2015-11-13 | 2022-04-29 | Ablynx Nv | Izboljšane variabilne domene imunoglobulina, ki vežejo serumski albumin |
| JP6768800B2 (ja) | 2015-11-18 | 2020-10-14 | メルク・シャープ・アンド・ドーム・コーポレーションMerck Sharp & Dohme Corp. | Ctla4結合性物質 |
| AU2016357460B2 (en) | 2015-11-18 | 2023-07-27 | Ablynx Nv | Improved serum albumin binders |
| CN109071639B (zh) * | 2015-11-18 | 2022-07-08 | 默沙东公司 | Pd1/ctla4结合剂 |
| EP3932945A1 (en) | 2015-11-27 | 2022-01-05 | Ablynx NV | Polypeptides inhibiting cd40l |
| JP7096458B2 (ja) * | 2016-01-26 | 2022-07-06 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | 抗vwf d’d3単一ドメイン抗体及びそれを含むポリペプチド |
| AU2017259876A1 (en) | 2016-05-02 | 2018-10-25 | Ablynx Nv | Treatment of RSV infection |
| MA44993A (fr) * | 2016-05-13 | 2019-03-20 | Medimmune Llc | Polypeptides de fusion cd40l-fc et procédés d'utilisation associés |
| EA201892693A1 (ru) | 2016-05-20 | 2019-04-30 | Харпун Терапьютикс, Инк. | Белки, содержащие одноцепочечный вариабельный фрагмент, связывающийся с cd3 |
| SG11201810327XA (en) | 2016-05-20 | 2018-12-28 | Harpoon Therapeutics Inc | Single domain serum albumin binding protein |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| US20190195866A1 (en) | 2016-06-23 | 2019-06-27 | Ablynx N.V. | Improved pharmacokinetic assays for immunoglobulin single variable domains |
| WO2018007442A1 (en) | 2016-07-06 | 2018-01-11 | Ablynx N.V. | Treatment of il-6r related diseases |
| WO2018029182A1 (en) | 2016-08-08 | 2018-02-15 | Ablynx N.V. | Il-6r single variable domain antibodies for treatment of il-6r related diseases |
| EP3512880A1 (en) | 2016-09-15 | 2019-07-24 | Ablynx NV | Immunoglobulin single variable domains directed against macrophage migration inhibitory factor |
| CN117700549A (zh) | 2016-11-16 | 2024-03-15 | 埃博灵克斯股份有限公司 | 能够结合CD123和TCRα/β的T细胞募集多肽 |
| KR20190087539A (ko) | 2016-11-23 | 2019-07-24 | 하푼 테라퓨틱스, 인크. | Psma 표적화 삼중특이성 단백질 및 사용 방법 |
| CN110198955A (zh) | 2016-11-23 | 2019-09-03 | 哈普恩治疗公司 | 前列腺特异性膜抗原结合蛋白质 |
| WO2018099968A1 (en) | 2016-11-29 | 2018-06-07 | Ablynx N.V. | Treatment of infection by respiratory syncytial virus (rsv) |
| JP7417421B2 (ja) | 2016-12-07 | 2024-01-18 | アブリンクス エン.ヴェー. | 改善された血清アルブミン結合性免疫グロブリン単一可変ドメイン |
| CN110191896B (zh) | 2017-01-17 | 2023-09-29 | 埃博灵克斯股份有限公司 | 改进的血清白蛋白结合物 |
| EP4442708A2 (en) | 2017-01-17 | 2024-10-09 | Ablynx NV | Improved serum albumin binders |
| CN110913900A (zh) | 2017-02-01 | 2020-03-24 | 耶鲁大学 | 利尿剂抵抗的治疗 |
| BR112019017853A2 (pt) | 2017-02-28 | 2021-04-27 | Vib Vzw | Meios e métodos para liberação oral de proteína |
| WO2018160754A2 (en) | 2017-02-28 | 2018-09-07 | Harpoon Therapeutics, Inc. | Inducible monovalent antigen binding protein |
| MX2019011702A (es) | 2017-03-31 | 2019-11-01 | Ablynx Nv | Ensayos de inmunogenicidad mejorados. |
| US10865238B1 (en) * | 2017-05-05 | 2020-12-15 | Duke University | Complement factor H antibodies |
| CA3062238A1 (en) | 2017-05-11 | 2018-11-15 | Vib Vzw | Glycosylation of variable immunoglobulin domains |
| CA3063362A1 (en) | 2017-05-12 | 2018-11-15 | Harpoon Therapeutics, Inc. | Msln targeting trispecific proteins and methods of use |
| BR112019023855B1 (pt) * | 2017-05-12 | 2021-11-30 | Harpoon Therapeutics, Inc | Proteínas de ligação à mesotelina |
| CN110997717A (zh) | 2017-06-02 | 2020-04-10 | 默克专利股份有限公司 | 结合adamts5、mmp13和聚蛋白聚糖的多肽 |
| AU2018278275A1 (en) | 2017-06-02 | 2019-12-19 | Ablynx N.V. | MMP13 binding immunoglobulins |
| CA3065630A1 (en) | 2017-06-02 | 2018-12-06 | Ablynx Nv | Aggrecan binding immunoglobulins |
| AU2018277343A1 (en) | 2017-06-02 | 2020-01-02 | Ablynx N.V. | Adamts binding immunoglobulins |
| JP7241731B2 (ja) | 2017-07-19 | 2023-03-17 | フエー・イー・ベー・フエー・ゼツト・ウエー | 血清アルブミン結合剤 |
| CN111465612B (zh) | 2017-10-13 | 2024-08-27 | 哈普恩治疗公司 | B细胞成熟抗原结合蛋白 |
| CA3078969A1 (en) | 2017-10-13 | 2019-04-18 | Harpoon Therapeutics, Inc. | Trispecific proteins and methods of use |
| WO2019086548A1 (en) | 2017-10-31 | 2019-05-09 | Vib Vzw | Novel antigen-binding chimeric proteins and methods and uses thereof |
| US20200199206A1 (en) * | 2017-12-08 | 2020-06-25 | AC Thera, LLC | Bacterial toxin-neutralizing nanobodies and methods of making and using the same |
| EP3735421A4 (en) | 2018-01-05 | 2021-09-22 | Corvidia Therapeutics, Inc. | METHOD OF TREATMENT OF IL-6 MEDIATED INFLAMMATION WITHOUT IMMUNSUPPRESSION |
| CN112004826B (zh) | 2018-02-05 | 2024-06-14 | 自由大学基金会 | 反向激动性抗us28抗体 |
| JP2021512947A (ja) | 2018-02-06 | 2021-05-20 | アブリンクス・エヌ・フェー | Ttpの初回エピソードを免疫グロブリン単一可変ドメインで処置する方法 |
| WO2019155041A1 (en) | 2018-02-12 | 2019-08-15 | Vib Vzw | Gβγ COMPLEX ANTIBODIES AND USES THEREOF |
| WO2019156566A1 (en) | 2018-02-12 | 2019-08-15 | Umc Utrecht Holding B.V. | Bispecific molecules comprising gamma-delta tcr and t-cell or nk cell binding domain |
| US20200392512A1 (en) | 2018-02-26 | 2020-12-17 | Ablynx N.V. | Nucleotide sequences encoding peptide linkers |
| JP2021514649A (ja) | 2018-03-01 | 2021-06-17 | ブレイエ・ユニバージテイト・ブリュッセルVrije Universiteit Brussel | ヒトpd−l1結合免疫グロブリン |
| WO2019185723A1 (en) | 2018-03-27 | 2019-10-03 | Umc Utrecht Holding B.V. | Targeted thrombolysis for treatment of microvascular thrombosis |
| WO2019226050A2 (en) | 2018-05-24 | 2019-11-28 | Wageningen Universiteit | Novel viral anti-infective reagents |
| KR102101561B1 (ko) * | 2018-07-25 | 2020-04-20 | 가톨릭대학교 산학협력단 | 신생혈관 표적용 조영제 조성물 및 이의 제조방법 |
| IL297931B1 (en) | 2018-09-25 | 2024-11-01 | Harpoon Therapeutics Inc | DLL3 binding proteins and methods of use |
| EP3636657A1 (en) | 2018-10-08 | 2020-04-15 | Ablynx N.V. | Chromatography-free antibody purification method |
| WO2020080941A1 (en) | 2018-10-16 | 2020-04-23 | Umc Utrecht Holding B.V. | Anti- low-density lipoprotein receptor-related protein 5/6 antibodies |
| WO2020130838A2 (en) | 2018-12-21 | 2020-06-25 | Qvq Holding B.V. | Antibodies for preventing or treating candidiasis |
| GB201901608D0 (en) | 2019-02-06 | 2019-03-27 | Vib Vzw | Vaccine adjuvant conjugates |
| EP3715374A1 (en) | 2019-03-23 | 2020-09-30 | Ablevia biotech GmbH | Compound for the sequestration of undesirable antibodies in a patient |
| US11986536B2 (en) | 2019-03-23 | 2024-05-21 | Ablevia Biotech Gmbh | Compound for the sequestration of undesirable antibodies in a patient |
| CN114173809A (zh) | 2019-04-02 | 2022-03-11 | 伊缪纯有限公司 | 免疫刺激组合物及其用途 |
| AU2020266750A1 (en) | 2019-04-29 | 2021-11-25 | Confo Therapeutics N.V. | Screening methods and assays for use with transmembrane proteins, in particular with GPCRS |
| US20220289837A1 (en) | 2019-04-30 | 2022-09-15 | Vib Vzw | Cystic Fibrosis Transmembrane Conductance Regulator Stabilizing Agents |
| WO2020223565A1 (en) | 2019-05-01 | 2020-11-05 | Corvidia Therapeutics, Inc. | Anti-il-6 antibody formulation |
| WO2020239945A1 (en) | 2019-05-28 | 2020-12-03 | Vib Vzw | Cancer treatment by targeting plexins in the immune compartment |
| EP3976067A1 (en) | 2019-05-28 | 2022-04-06 | Vib Vzw | Cd8+ t-cells lacking plexins and their application in cancer treatment |
| WO2021025556A1 (en) | 2019-08-05 | 2021-02-11 | Stichting Vu | Identification and elimination of hcmv-infected cells |
| WO2021039574A1 (ja) * | 2019-08-23 | 2021-03-04 | 株式会社カネカ | O結合型糖鎖修飾が抑制された重鎖抗体 |
| EP3799881A1 (en) | 2019-10-04 | 2021-04-07 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Single domain antibodies specifically binding globo - series glycans |
| US20220380456A1 (en) | 2019-10-21 | 2022-12-01 | Vib Vzw | Nanodisc-specific antigen-binding chimeric proteins |
| CA3160506A1 (en) | 2019-11-11 | 2021-05-20 | Ibi-Ag Innovative Bio Insecticides Ltd. | Insect control nanobodies and uses thereof |
| US20220411495A1 (en) | 2019-11-27 | 2022-12-29 | Vib Vzw | Positive allosteric modulators of the calcium-sensing receptor |
| GB201918279D0 (en) | 2019-12-12 | 2020-01-29 | Vib Vzw | Glycosylated single chain immunoglobulin domains |
| JP2023506961A (ja) | 2019-12-20 | 2023-02-20 | フエー・イー・ベー・フエー・ゼツト・ウエー | ナノボディー交換クロマトグラフィー |
| WO2021140205A1 (en) | 2020-01-10 | 2021-07-15 | Confo Therapeutics N.V. | Methods for generating antibodies and antibody fragments and libraries comprising same |
| WO2021156490A2 (en) | 2020-02-06 | 2021-08-12 | Vib Vzw | Corona virus binders |
| CA3170833A1 (en) | 2020-02-21 | 2021-08-26 | Harpoon Therapeutics, Inc. | Flt3 binding proteins and methods of use |
| CA3173090A1 (en) | 2020-02-25 | 2021-09-02 | Vib Vzw | Leucine-rich repeat kinase 2 allosteric modulators |
| WO2021213435A1 (zh) | 2020-04-22 | 2021-10-28 | 迈威(上海)生物科技股份有限公司 | 一种靶向人程序性死亡配体1(pd-l1)的单可变域抗体及其衍生物 |
| WO2021229104A1 (en) | 2020-05-15 | 2021-11-18 | Université de Liège | Anti-cd38 single-domain antibodies in disease monitoring and treatment |
| AU2021297551A1 (en) * | 2020-06-26 | 2023-01-19 | Monash University | Anti-VWF antibodies and uses thereof |
| WO2022003156A1 (en) | 2020-07-02 | 2022-01-06 | Oncurious Nv | Ccr8 non-blocking binders |
| AR122933A1 (es) | 2020-07-10 | 2022-10-19 | Novo Nordisk As | Métodos para tratar la enfermedad cardiovascular |
| WO2022063957A1 (en) | 2020-09-24 | 2022-03-31 | Vib Vzw | Biomarker for anti-tumor therapy |
| US20230364049A1 (en) | 2020-09-24 | 2023-11-16 | Vib Vzw | Combination of p2y6 inhibitors and immune checkpoint inhibitors |
| CA3195687A1 (en) | 2020-09-25 | 2022-03-31 | Ablynx Nv | Polypeptides comprising immunoglobulin single variable domains targeting il-13 and ox40l |
| WO2022117569A1 (en) | 2020-12-02 | 2022-06-09 | Oncurious Nv | A ccr8 antagonist antibody in combination with a lymphotoxin beta receptor agonist antibody in therapy against cancer |
| EP4255929A2 (en) | 2020-12-02 | 2023-10-11 | Vib Vzw | An ltbr agonist in combination therapy against cancer |
| KR20230125808A (ko) * | 2020-12-18 | 2023-08-29 | 바이오아르디스 엘엘씨 | EpCAM 결합 분자 및 이의 사용 |
| JP2023553694A (ja) | 2020-12-18 | 2023-12-25 | アブリンクス エン.ヴェー. | IL-6およびTNF-αを標的化する免疫グロブリン単一可変ドメインを含むポリペプチド |
| EP4263611A1 (en) * | 2020-12-18 | 2023-10-25 | Bioardis LLC | Cea6 binding molecules and uses thereof |
| WO2022133050A1 (en) * | 2020-12-18 | 2022-06-23 | Bioardis, Llc | Gpc3 binding molecules and uses thereof |
| AU2021403089A1 (en) * | 2020-12-18 | 2023-07-13 | Bioardis, Llc | Mesothelin binding molecules and uses thereof |
| WO2022136693A1 (en) * | 2020-12-23 | 2022-06-30 | Numab Therapeutics AG | Antibody variable domains and antibodies having decreased immunogenicity |
| GB202020502D0 (en) | 2020-12-23 | 2021-02-03 | Vib Vzw | Antibody composistion for treatment of corona virus infection |
| WO2022136647A1 (en) | 2020-12-24 | 2022-06-30 | Oncurious Nv | Human ccr8 binders |
| US20240052044A1 (en) | 2020-12-24 | 2024-02-15 | Vib Vzw | Non-blocking human ccr8 binders |
| CA3206125A1 (en) | 2020-12-24 | 2022-06-30 | Vib Vzw | Murine cross-reactive human ccr8 binders |
| CN117794566A (zh) | 2021-02-05 | 2024-03-29 | Vib研究所 | 沙贝病毒结合剂 |
| JP2024506020A (ja) | 2021-02-05 | 2024-02-08 | ブイアイビー ブイゼットダブリュ | サルベコウイルス結合剤 |
| US20240130999A1 (en) | 2021-02-17 | 2024-04-25 | Vib Vzw | Inhibition of SLC4A4 in the Treatment of Cancer |
| IL305318A (en) | 2021-02-19 | 2023-10-01 | Vib Vzw | Cation-independent mannose-6-phosphate receptor binders |
| WO2022199804A1 (en) | 2021-03-24 | 2022-09-29 | Vib Vzw | Nek6 inhibition to treat als and ftd |
| WO2022216157A1 (en) | 2021-04-09 | 2022-10-13 | Stichting Radboud Universiteit | Off the shelf proximity biotinylation enzyme |
| WO2022242892A1 (en) | 2021-05-17 | 2022-11-24 | Université de Liège | Anti-cd38 single-domain antibodies in disease monitoring and treatment |
| WO2022258606A1 (en) | 2021-06-07 | 2022-12-15 | Gadeta B.V. | Delta T-cell or Gamma T-cell receptor chains or parts thereof that mediate an anti-tumour or anti-infective response |
| WO2022268993A1 (en) | 2021-06-23 | 2022-12-29 | Vib Vzw | Means and methods for selection of specific binders |
| US20240343811A1 (en) | 2021-06-29 | 2024-10-17 | Shandong Simcere Biopharmacutical Co., Ltd. | Cd16 antibody and use thereof |
| WO2023288217A2 (en) * | 2021-07-12 | 2023-01-19 | University Of Pittsburgh-Of The Commonwealth System Of Higher Education | Methods and sytems for nanobody humanization |
| US20240327525A1 (en) | 2021-07-30 | 2024-10-03 | Vib Vzw | Cation-Independent Mannose-6-Phosphate Receptor Binders For Targeted Protein Degradation |
| US20240343803A1 (en) | 2021-07-30 | 2024-10-17 | Shandong Simcere Biopharmaceutical Co., Ltd. | Anti-Pvrig/Anti-Tigit Bispecific Antibodies And Applications Thereof |
| EP4381094A1 (en) | 2021-08-03 | 2024-06-12 | Wageningen Universiteit | Argonaute-based nucleic acid detection system |
| EP4428156A1 (en) | 2021-12-03 | 2024-09-11 | Shandong Simcere Biopharmaceutical Co., Ltd. | Anti-bcma nanobody and use thereof |
| EP4448574A1 (en) | 2021-12-17 | 2024-10-23 | Ablynx N.V. | Polypeptides comprising immunoglobulin single variable domains targeting tcralphabeta, cd33 and cd123 |
| CN118510805A (zh) | 2021-12-31 | 2024-08-16 | 山东先声生物制药有限公司 | 一种gprc5d抗体及其应用 |
| WO2023135198A1 (en) | 2022-01-12 | 2023-07-20 | Vib Vzw | Human ntcp binders for therapeutic use and liver-specific targeted delivery |
| WO2023148397A1 (en) | 2022-02-07 | 2023-08-10 | Vib Vzw | Engineered stabilizing aglycosylated fc-regions |
| WO2023198848A1 (en) | 2022-04-13 | 2023-10-19 | Vib Vzw | An ltbr agonist in combination therapy against cancer |
| WO2023222825A1 (en) | 2022-05-18 | 2023-11-23 | Vib Vzw | Sarbecovirus spike s2 subunit binders |
| WO2023227594A1 (en) | 2022-05-24 | 2023-11-30 | Gadeta Bv | Novel deltat-cell receptor chains, gammat-cell receptor chains, or parts thereof |
| WO2023237541A1 (en) | 2022-06-07 | 2023-12-14 | Gadeta B.V. | Delta t-cell or gamma t-cell receptor chains or parts thereof that mediate an anti-tumour or anti-infective response |
| WO2024003873A1 (en) | 2022-06-30 | 2024-01-04 | Intrexon Actobiotics Nv D/B/A Precigen Actobio | Single variable domain antibodies against tumor necrosis factor-alpha |
| WO2024008755A1 (en) | 2022-07-04 | 2024-01-11 | Vib Vzw | Blood-cerebrospinal fluid barrier crossing antibodies |
| US12098400B2 (en) | 2022-07-08 | 2024-09-24 | Novo Nordisk A/S | Highly potent ISVD compounds capable of substituting for FVIII(A) |
| WO2024013401A1 (en) | 2022-07-15 | 2024-01-18 | Gadeta B.V. | Novel method for identifying gamma t-cell (or delta t-cell) receptor chains (or gammadelta t-cell receptors) or fragments thereof that mediate an anti-tumour or an anti-infective response |
| WO2024023271A1 (en) | 2022-07-27 | 2024-02-01 | Ablynx Nv | Polypeptides binding to a specific epitope of the neonatal fc receptor |
| WO2024068744A1 (en) | 2022-09-27 | 2024-04-04 | Vib Vzw | Antivirals against human parainfluenza virus |
| WO2024083843A1 (en) | 2022-10-18 | 2024-04-25 | Confo Therapeutics N.V. | Amino acid sequences directed against the melanocortin 4 receptor and polypeptides comprising the same for the treatment of mc4r-related diseases and disorders |
| WO2024096735A1 (en) | 2022-10-31 | 2024-05-10 | Stichting Amsterdam UMC | Single domain anti-cd169 antibodies |
| WO2024101989A1 (en) | 2022-11-08 | 2024-05-16 | Stichting Amsterdam UMC | Activation inducible antigen receptors for adoptive immunotherapy |
| WO2024105091A1 (en) | 2022-11-15 | 2024-05-23 | Imec Vzw | Method and system for droplet manipulation |
| WO2024126685A1 (en) * | 2022-12-15 | 2024-06-20 | Institut National de la Santé et de la Recherche Médicale | Single-domain antibody targeting von wilebrand factor a3-domain |
| US20240200085A1 (en) | 2022-12-15 | 2024-06-20 | Aarhus Universitet | Synthetic activation of multimeric transmembrane receptors |
| WO2024133301A1 (en) | 2022-12-19 | 2024-06-27 | Umc Utrecht Holding B.V. | Btn2a1 binding peptide |
| WO2024133935A1 (en) | 2022-12-23 | 2024-06-27 | Ablynx Nv | Protein-based conjugation carriers |
| WO2024156888A1 (en) | 2023-01-27 | 2024-08-02 | Vib Vzw | Cd163-binding conjugates |
| WO2024156881A1 (en) | 2023-01-27 | 2024-08-02 | Vib Vzw | CD8b-BINDING POLYPEPTIDES |
| WO2024165710A1 (en) | 2023-02-09 | 2024-08-15 | Seni-Preps B.V. | Immunoglobulin single variable domains that inhibit urease and use thereof |
| US20240368250A1 (en) | 2023-02-17 | 2024-11-07 | Ablynx N.V. | Polypeptides binding to the neonatal fc receptor |
| WO2024175787A1 (en) | 2023-02-24 | 2024-08-29 | Vrije Universiteit Brussel | Anti-inflammatory pannexin 1 channel inhibitors |
| WO2024189171A1 (en) | 2023-03-14 | 2024-09-19 | Aarhus Universitet | Genetically altered nfr5 receptor kinases |
| WO2024208816A1 (en) | 2023-04-03 | 2024-10-10 | Vib Vzw | Blood-brain barrier crossing antibodies |
Family Cites Families (106)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4559157A (en) | 1983-04-21 | 1985-12-17 | Creative Products Resource Associates, Ltd. | Cosmetic applicator useful for skin moisturizing |
| LU84979A1 (fr) | 1983-08-30 | 1985-04-24 | Oreal | Composition cosmetique ou pharmaceutique sous forme aqueuse ou anhydre dont la phase grasse contient un polyether oligomere et polyethers oligomeres nouveaux |
| US5238919A (en) * | 1986-05-30 | 1993-08-24 | Scipps Clinic And Research Foundation | Peptides that inhibit von Willebrand Factor binding to the platelet SPIB receptor |
| DE3853740T2 (de) | 1987-06-10 | 1995-11-09 | Dana Farber Cancer Inst Inc | Bifunktionelle Antikörperkonstruktionen und Verfahren zur selektiven Tötung von Zellbeständen. |
| US5200510A (en) | 1987-06-16 | 1993-04-06 | Zymogenetics, Inc. | Method for purifying factor viii:c, von willebrand factor and complexes thereof |
| US4820508A (en) | 1987-06-23 | 1989-04-11 | Neutrogena Corporation | Skin protective composition |
| US4992478A (en) | 1988-04-04 | 1991-02-12 | Warner-Lambert Company | Antiinflammatory skin moisturizing composition and method of preparing same |
| US5770198A (en) * | 1988-05-18 | 1998-06-23 | The Research Foundation Of The State Of New York | Platelet-specific chimeric 7E3 immunoglobulin |
| US4938949A (en) | 1988-09-12 | 1990-07-03 | University Of New York | Treatment of damaged bone marrow and dosage units therefor |
| AU634186B2 (en) | 1988-11-11 | 1993-02-18 | Medical Research Council | Single domain ligands, receptors comprising said ligands, methods for their production, and use of said ligands and receptors |
| GB8905400D0 (en) | 1989-03-09 | 1989-04-19 | Jonker Margreet | Medicaments |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5399346A (en) | 1989-06-14 | 1995-03-21 | The United States Of America As Represented By The Department Of Health And Human Services | Gene therapy |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| DK0590060T3 (da) | 1991-06-21 | 1998-05-11 | Univ Cincinnati | Oralt indgivelige terapeutiske proteiner samt fremgangsmåde til fremstilling |
| WO1993006213A1 (en) | 1991-09-23 | 1993-04-01 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| ES2165851T3 (es) | 1991-11-25 | 2002-04-01 | Enzon Inc | Proteinas multivalentes que se unen a antigenos. |
| AU687010B2 (en) | 1992-07-17 | 1998-02-19 | Dana-Farber Cancer Institute | Method of intracellular binding of target molecules |
| DE69334258D1 (de) | 1992-08-21 | 2009-02-26 | Univ Bruxelles | Immunoglobuline ohne Leichtkette |
| WO1994013806A1 (en) | 1992-12-11 | 1994-06-23 | The Dow Chemical Company | Multivalent single chain antibodies |
| EP0684814B1 (en) | 1993-02-22 | 1998-06-17 | Alza Corporation | Compositions for oral delivery of active agents |
| US6838254B1 (en) | 1993-04-29 | 2005-01-04 | Conopco, Inc. | Production of antibodies or (functionalized) fragments thereof derived from heavy chain immunoglobulins of camelidae |
| GB9311454D0 (en) | 1993-06-03 | 1993-07-21 | Agricultural & Food Res | Pharmaceutical compositions |
| CA2164088C (en) | 1993-06-07 | 2005-06-14 | Gary J. Nabel | Plasmids suitable for gene therapy |
| ATE198490T1 (de) | 1993-06-09 | 2001-01-15 | Unilever Nv | Verfahren zur herstellung von fusionsproteinen, die scfv fragmente enthalten, in transformierten schimmelpilzen |
| FR2708622B1 (fr) | 1993-08-02 | 1997-04-18 | Raymond Hamers | Vecteur recombinant contenant une séquence d'un gène de lipoprotéine de structure pour l'expression de séquences de nucléotides. |
| US6091639A (en) | 1993-08-27 | 2000-07-18 | Kabushiki Kaisha Toshiba | Non-volatile semiconductor memory device and data programming method |
| WO1995007463A1 (en) | 1993-09-10 | 1995-03-16 | The Trustees Of Columbia University In The City Of New York | Uses of green fluorescent protein |
| WO1995021191A1 (en) | 1994-02-04 | 1995-08-10 | William Ward | Bioluminescent indicator based upon the expression of a gene for a modified green-fluorescent protein |
| WO1995022618A1 (en) | 1994-02-22 | 1995-08-24 | Dana-Farber Cancer Institute | Nucleic acid delivery system, method of synthesis and uses thereof |
| US5670132A (en) * | 1994-09-20 | 1997-09-23 | Immunomedics, Inc. | Modified radioantibody fragments for reduced renal uptake |
| US5625048A (en) | 1994-11-10 | 1997-04-29 | The Regents Of The University Of California | Modified green fluorescent proteins |
| CN1254275C (zh) * | 1994-11-30 | 2006-05-03 | 味之素株式会社 | 抗血栓药剂和抗维勒布兰德因子单克隆抗体 |
| WO1996022307A1 (en) | 1995-01-19 | 1996-07-25 | The Research Foundation Of State University Of New York | Genes encoding an insect calcium channel |
| EP0739981A1 (en) | 1995-04-25 | 1996-10-30 | Vrije Universiteit Brussel | Variable fragments of immunoglobulins - use for therapeutic or veterinary purposes |
| US5693492A (en) | 1995-05-05 | 1997-12-02 | Merck & Co., Inc. | DNA encoding glutamate gated chloride channels |
| CA2225460A1 (en) | 1995-06-23 | 1997-01-09 | Winston Campbell Patterson | Transcriptional regulation of genes encoding vascular endothelial growth factor receptors |
| WO1997011094A1 (en) | 1995-09-22 | 1997-03-27 | Novo Nordisk A/S | Novel variants of green fluorescent protein, gfp |
| AU2507397A (en) | 1996-04-04 | 1997-10-29 | Unilever Plc | Multivalent and multispecific antigen-binding protein |
| US6027881A (en) | 1996-05-08 | 2000-02-22 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Mutant Aequorea victoria fluorescent proteins having increased cellular fluorescence |
| JP2000515002A (ja) | 1996-06-27 | 2000-11-14 | フラームス・インテルウニフェルジテール・インスティテュート・フォール・ビオテヒノロジー・ヴェーゼットウェー | 標的分子の活性部位またはクレフトと特異的に相互作用する認識分子 |
| US6124128A (en) | 1996-08-16 | 2000-09-26 | The Regents Of The University Of California | Long wavelength engineered fluorescent proteins |
| WO1998021355A1 (en) | 1996-11-15 | 1998-05-22 | Life Technologies, Inc. | Mutants of green fluorescent protein |
| US6329516B1 (en) | 1997-04-28 | 2001-12-11 | Fmc Corporation | Lepidopteran GABA-gated chloride channels |
| US6350860B1 (en) | 1997-08-18 | 2002-02-26 | Innogenetics N.V. | Interferon-gamma-binding molecules for treating septic shock, cachexia, immune diseases and skin disorders |
| US5895466A (en) | 1997-08-19 | 1999-04-20 | At&T Corp | Automated natural language understanding customer service system |
| AU2152299A (en) * | 1997-10-27 | 1999-05-24 | Unilever Plc | Multivalent antigen-binding proteins |
| AU3596599A (en) | 1998-01-26 | 1999-08-09 | Unilever Plc | Method for producing antibody fragments |
| KR20010034512A (ko) | 1998-02-19 | 2001-04-25 | 베렌슨, 론 | 림프구 활성화 조절을 위한 조성물 및 그 방법 |
| ATE535154T1 (de) * | 1998-03-12 | 2011-12-15 | Vhsquared Ltd | Produkten die inaktivierte hefen oder schimmel enthalten, die auf ihrer aussenoberfläche aktive antikörper haben |
| HUP9900956A2 (hu) * | 1998-04-09 | 2002-04-29 | Aventis Pharma Deutschland Gmbh. | Egyláncú, több antigéntkötőhely kialakítására képes molekulák, előállításuk és alkalmazásuk |
| EP0967284A1 (en) | 1998-05-28 | 1999-12-29 | Pfizer Limited | Phosphodiesterases |
| US6872538B1 (en) | 1998-07-06 | 2005-03-29 | Euroscreen S.A. | High-throughput screening diagnostic and/or dosage method of an agonist and/or an antagonist for a calcium-coupled receptor |
| US6228360B1 (en) * | 1998-08-19 | 2001-05-08 | Ajinomoto Co., Inc. | Antithrombotic agent and humanized anti-von Willebrand factor monoclonal antibody |
| US6251393B1 (en) * | 1998-10-23 | 2001-06-26 | The Brigham And Women's Hospital, Inc. | Conformation-specific anti-von Willebrand Factor antibodies |
| EP1002861A1 (en) | 1998-10-26 | 2000-05-24 | Unilever Plc | Antigen-binding proteins comprising a linker which confers restricted conformational flexibility |
| IL127127A0 (en) | 1998-11-18 | 1999-09-22 | Peptor Ltd | Small functional units of antibody heavy chain variable regions |
| WO2000040968A1 (en) | 1999-01-05 | 2000-07-13 | Unilever Plc | Binding of antibody fragments to solid supports |
| AU2291700A (en) | 1999-01-19 | 2000-08-07 | Unilever Plc | Method for producing antibody fragments |
| CA2361678A1 (en) | 1999-02-05 | 2000-08-10 | Rijksuniversiteit Leiden | Method of modulating metabolite biosynthesis in recombinant cells |
| US6419934B1 (en) * | 1999-02-24 | 2002-07-16 | Edward L. Tobinick | TNF modulators for treating neurological disorders associated with viral infection |
| AU784108B2 (en) | 1999-03-15 | 2006-02-02 | University Of British Columbia, The | Methods and reagents for modulating cholesterol levels |
| BR0009866A (pt) | 1999-04-22 | 2002-01-08 | Unilever Nv | Método de inibição de infecção viral, uso de uma proteìna de ligação de antìgeno monovalente, produto alimentìcio, composição farmacêutica ou cosmética, proteìna de ligação de antìgeno monovalente, sequência de nucleotìdeos, vetor de expressão, célula hospedeira, e, métodos de seleção e de indentificação de uma proteìna de ligação de antìgeno |
| WO2000078972A2 (en) | 1999-06-18 | 2000-12-28 | Cv Therapeutics, Inc. | Regulation with binding cassette transporter protein abc1 |
| EP2309275A1 (en) | 1999-07-05 | 2011-04-13 | K.U.Leuven Research & Development | Detection of Von-Willebrand factor (vwf) activity |
| EP1198572A2 (en) | 1999-08-02 | 2002-04-24 | Keygene N.V. | Method for generating cgmmv resistant plants, genetic constructs, and obtained cgmmv-resistant plants |
| GB9922124D0 (en) | 1999-09-17 | 1999-11-17 | Pfizer Ltd | Phosphodiesterase enzymes |
| US6479280B1 (en) | 1999-09-24 | 2002-11-12 | Vlaams Interuniversitair Institutuut Voor Biotechnologie Vzw | Recombinant phages capable of entering host cells via specific interaction with an artificial receptor |
| US6849425B1 (en) | 1999-10-14 | 2005-02-01 | Ixsys, Inc. | Methods of optimizing antibody variable region binding affinity |
| DE19955408A1 (de) | 1999-11-18 | 2001-05-23 | Bayer Ag | GABA-B-Rezeptoren |
| DK1242460T3 (da) | 1999-11-29 | 2006-12-11 | Unilever Nv | Immobilisering af proteiner ved hjælp af et polypeptidsegment |
| DK1233987T3 (da) | 1999-11-29 | 2009-09-28 | Bac Ip B V | Immobiliserede enkelt-domæne antigenbindende molekyler |
| EP1134231B1 (en) | 2000-03-14 | 2009-04-15 | Unilever N.V. | Antibody heavy chain variable domains against human dietary lipases, and their uses |
| US7943129B2 (en) | 2000-05-26 | 2011-05-17 | National Research Council Of Canada | Single-domain brain-targeting antibody fragments derived from llama antibodies |
| US20030190598A1 (en) | 2000-05-26 | 2003-10-09 | Jasmid Tanha | Single-domain antigen-binding antibody fragments derived from llama antibodies |
| US6506901B2 (en) | 2000-07-17 | 2003-01-14 | Wyeth | Substituted 2-(S)-hydroxy-3-(piperidin-4-yl-methylamino)-propyl ethers and substituted 2-aryl-2-(R)-hydroxy-1-(piperidin-4-yl-methyl)-ethylamine β-3 adrenergic receptor agonists |
| US6741957B1 (en) | 2000-07-21 | 2004-05-25 | Daimlerchrysler Corporation | Analytical tire model for vehicle durability and ride comfort analysis |
| CA2422881A1 (en) * | 2000-10-13 | 2002-04-18 | Uab Research Foundation | Human anti-epidermal growth factor receptor single-chain antibodies |
| WO2002048193A2 (en) | 2000-12-13 | 2002-06-20 | Unilever N.V. | Camelidae antibody arrays |
| GB0031448D0 (en) | 2000-12-22 | 2001-02-07 | Leuven K U Res & Dev | Inhibition of the vWF-collagen interaction by anti-human vWF monoclonal antibody (82D6A3) results in abolition of in vivo arterial platelet thrombus formation |
| US7054297B1 (en) | 2000-12-28 | 2006-05-30 | Cisco Technology, Inc. | Distribution of packets to high data rate communications devices using multicast protocols |
| DE10105526B4 (de) | 2001-02-07 | 2004-12-23 | Robert Bosch Gmbh | Verfahren zur Herstellung einer Klappenanordnung |
| EP1425694A2 (en) | 2001-08-03 | 2004-06-09 | Medical Research Council | Method of identifying a consensus sequence for intracellular antibodies |
| JP4213586B2 (ja) | 2001-09-13 | 2009-01-21 | 株式会社抗体研究所 | ラクダ抗体ライブラリーの作製方法 |
| JP2005289809A (ja) | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| KR100599789B1 (ko) | 2001-12-03 | 2006-07-12 | 삼성에스디아이 주식회사 | 방열효율이 향상된 플라즈마 디스플레이 장치 및 그 제조방법 |
| WO2003050531A2 (en) | 2001-12-11 | 2003-06-19 | Algonomics N.V. | Method for displaying loops from immunoglobulin domains in different contexts |
| CA2471116A1 (en) | 2001-12-21 | 2003-07-03 | Serge Muyldermans | Method for cloning of variable domain sequences |
| EP1461085A2 (en) | 2002-01-03 | 2004-09-29 | Vlaams Interuniversitair Instituut voor Biotechnologie vzw. | Immunoconjugates useful for treatment of tumours |
| JP2006512895A (ja) | 2002-06-28 | 2006-04-20 | ドマンティス リミテッド | リガンド |
| US20050136056A1 (en) * | 2002-07-29 | 2005-06-23 | Shunsuke Kageyama | Pharmaceutical composition for the treatment of thrombocytopenia |
| EP1527346B1 (en) * | 2002-08-07 | 2011-06-08 | Ablynx N.V. | Modulation of platelet adhesion based on the surface exposed beta-switch loop of platelet glycoprotein ib-alpha |
| US7004940B2 (en) | 2002-10-10 | 2006-02-28 | Ethicon, Inc. | Devices for performing thermal ablation having movable ultrasound transducers |
| WO2004037999A2 (en) | 2002-10-23 | 2004-05-06 | Ludwig Institute For Cancer Research | A34 and a33-like 3 dna, proteins, antibodies thereto and methods of treatment using same |
| NZ540195A (en) * | 2002-11-08 | 2009-01-31 | Ablynx Nv | Stabilized single domain antibodies |
| EP1558646A2 (en) | 2002-11-08 | 2005-08-03 | Ablynx N.V. | Single domain antibodies directed against interferon- gamma and uses thereof |
| CN101412759A (zh) * | 2003-01-10 | 2009-04-22 | 埃博灵克斯股份有限公司 | 治疗性多肽,其同源物、其片段及其在调节血小板介导的聚集方面的应用 |
| DK1639011T3 (da) * | 2003-06-30 | 2009-02-16 | Domantis Ltd | Pegylerede enkelt-domæne antistoffer (dAb) |
| DE60334645D1 (de) | 2003-11-07 | 2010-12-02 | Ablynx Nv | Camelidae schwere ketten antikörper vhhs gegen epidermalen wachstumfaktor rezeptor (egfr) und ihre verwendung |
| US7180370B2 (en) | 2004-09-01 | 2007-02-20 | Micron Technology, Inc. | CMOS amplifiers with frequency compensating capacitors |
| US7566701B2 (en) * | 2004-09-07 | 2009-07-28 | Archemix Corp. | Aptamers to von Willebrand Factor and their use as thrombotic disease therapeutics |
| CA2583017A1 (en) * | 2004-10-13 | 2006-04-20 | Ablynx N.V. | Single domain camelide anti-amyloid beta antibodies and polypeptides comprising the same for the treatment and diagnosis of degenerative neural diseases such as alzheimer's disease |
| JP4829897B2 (ja) * | 2005-01-14 | 2011-12-07 | アブリンクス ナームローゼ フェンノートシャップ | 血小板減少及び/又はフォンビルブラント因子(vWF)と血小板との間の自発的相互作用によって特徴づけられる疾患及び障害の異なる形態を区別する方法及びアッセイ |
| KR101414438B1 (ko) * | 2005-05-20 | 2014-07-10 | 아블린쓰 엔.브이. | 폰 빌레브란트 인자에 대한 단일 도메인 vhh 항체 |
| WO2008049881A2 (en) | 2006-10-25 | 2008-05-02 | Umc Utrecht Holding Bv | Polypeptides and pharmaceutical compositions comprising the same for the prevention and treatment of complications associated with infectious diseases |
| CA2718081A1 (en) * | 2008-03-21 | 2009-09-24 | Ablynx Nv | Von willebrand factor specific binders and methods of use therefor |
-
2006
- 2006-05-19 KR KR1020077029416A patent/KR101414438B1/ko active IP Right Grant
- 2006-05-19 MX MX2007014564A patent/MX2007014564A/es active IP Right Grant
- 2006-05-19 EP EP18186517.1A patent/EP3415535B1/en active Active
- 2006-05-19 HU HUE12151893A patent/HUE039846T2/hu unknown
- 2006-05-19 CA CA2960105A patent/CA2960105A1/en not_active Abandoned
- 2006-05-19 US US11/920,793 patent/US7807162B2/en active Active
- 2006-05-19 BR BRPI0609797A patent/BRPI0609797B8/pt active IP Right Grant
- 2006-05-19 PL PL18186517T patent/PL3415535T3/pl unknown
- 2006-05-19 LT LTEP12151893.0T patent/LT2444424T/lt unknown
- 2006-05-19 PL PL12151893T patent/PL2444424T3/pl unknown
- 2006-05-19 PT PT12151893T patent/PT2444424T/pt unknown
- 2006-05-19 CA CA2608873A patent/CA2608873C/en not_active Expired - Fee Related
- 2006-05-19 AU AU2006249090A patent/AU2006249090B2/en active Active
- 2006-05-19 EP EP17175833.7A patent/EP3243839A1/en not_active Withdrawn
- 2006-05-19 JP JP2008511652A patent/JP4986997B2/ja active Active
- 2006-05-19 EP EP12151893.0A patent/EP2444424B1/en active Active
- 2006-05-19 EP EP06776035A patent/EP2007814A2/en not_active Withdrawn
- 2006-05-19 DK DK12151893.0T patent/DK2444424T3/en active
- 2006-05-19 TR TR2018/15552T patent/TR201815552T4/tr unknown
- 2006-05-19 NZ NZ563392A patent/NZ563392A/en unknown
- 2006-05-19 WO PCT/EP2006/004773 patent/WO2006122825A2/en active Application Filing
- 2006-05-19 ES ES18186517T patent/ES2852423T3/es active Active
- 2006-05-19 SI SI200632287T patent/SI2444424T1/sl unknown
- 2006-05-19 ES ES12151893T patent/ES2694247T3/es active Active
- 2006-05-19 RU RU2007147381/10A patent/RU2433139C2/ru active
- 2006-05-19 PT PT181865171T patent/PT3415535T/pt unknown
- 2006-05-19 CN CN200680024012.1A patent/CN101213214B/zh active Active
-
2007
- 2007-11-05 IL IL187168A patent/IL187168A/en active IP Right Grant
- 2007-11-06 ZA ZA200709570A patent/ZA200709570B/xx unknown
- 2007-12-17 NO NO20076475A patent/NO20076475L/no not_active Application Discontinuation
-
2010
- 2010-06-24 US US12/822,729 patent/US8372398B2/en active Active
- 2010-10-11 IL IL208607A patent/IL208607A0/en unknown
-
2013
- 2013-01-04 US US13/734,129 patent/US20130136736A1/en not_active Abandoned
-
2018
- 2018-11-07 CY CY20181101166T patent/CY1122579T1/el unknown
-
2019
- 2019-02-06 LU LU00099C patent/LUC00099I2/fr unknown
- 2019-02-11 NL NL300966C patent/NL300966I2/nl unknown
- 2019-02-11 HU HUS1900005C patent/HUS1900005I1/hu unknown
- 2019-02-13 FR FR19C1005C patent/FR19C1005I2/fr active Active
- 2019-02-14 CY CY2019006C patent/CY2019006I2/el unknown
- 2019-02-20 LT LTPA2019504C patent/LTPA2019504I1/lt unknown
- 2019-02-27 NO NO20190279A patent/NO345342B1/no active Protection Beyond IP Right Term
-
2021
- 2021-05-20 NO NO2021020C patent/NO2021020I1/no unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101414438B1 (ko) | 폰 빌레브란트 인자에 대한 단일 도메인 vhh 항체 | |
| KR101308771B1 (ko) | 종양 괴사 인자-알파에 대한 개선된 나노바디스™ | |
| AU2014259481B2 (en) | Improved NanobodiesTM against tumor necrosis factor-alpha | |
| RU2794974C2 (ru) | СВЯЗЫВАЮЩИЙ TNF-α ПОЛИПЕПТИД И СПОСОБ ЛЕЧЕНИЯ СВЯЗАННЫХ С TNF-α ЗАБОЛЕВАНИЙ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E90F | Notification of reason for final refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20170525 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20180523 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20190425 Year of fee payment: 6 |