KR102199640B1 - Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Lanifibranor - Google Patents
Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Lanifibranor Download PDFInfo
- Publication number
- KR102199640B1 KR102199640B1 KR1020200001518A KR20200001518A KR102199640B1 KR 102199640 B1 KR102199640 B1 KR 102199640B1 KR 1020200001518 A KR1020200001518 A KR 1020200001518A KR 20200001518 A KR20200001518 A KR 20200001518A KR 102199640 B1 KR102199640 B1 KR 102199640B1
- Authority
- KR
- South Korea
- Prior art keywords
- stem cells
- exosomes
- derived
- cell
- cells
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/999—Small molecules not provided for elsewhere
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Rheumatology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Developmental Biology & Embryology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Description
본 발명은 라니피브라노르 (Lanifibranor)를 포함하는 줄기세포 유래 엑소좀 (Exosomes) 생성 촉진 및 줄기세포의 기능 강화용 조성물에 관한 것으로, 더욱 상세하게는 줄기세포 배양 시 줄기세포의 줄기세포능 (stemness)을 강화시켜 줄기 세포증식률, 줄기세포능 및 줄기세포 유래 엑소좀의 생산량을 증가시키는 라니피브라노르 포함 줄기세포 유래 엑소좀 (Exosomes) 생성 촉진 및 줄기세포능 강화용 조성물에 관한 것이다.The present invention relates to a composition for promoting the generation of stem cell-derived exosomes including Lanifibranor and enhancing the function of stem cells, and more particularly, to a composition for stem cell cultivation of stem cells ( stemness) to increase the stem cell proliferation rate, stem cell ability, and the production of stem cell-derived exosomes by promoting the production of stem cell-derived exosomes including ranifibranor and enhancing stem cell ability.
미세소포체(Extracellular Vesicles)는 마이크로베지클(Microvesicles), 엑소좀(Exosome) 등을 포함하는 30~1000 nm 크기의 구형 지질이중층(lipid-bilayer)으로 구성된 소포체(vesicle)이다.Extracellular Vesicles are vesicles composed of a 30-1000 nm-sized spherical lipid-bilayer including microvesicles and exosomes.
엑소좀의 지질이중층은 기원 세포(공여세포)와 같은 인지질 이중막 구조로 되어 있으며, 세포가 세포외로 분비하는 물질의 구성체로 세포-세포간의 커뮤니케이션 및 세포성 면역 중재 등의 기능적인 역할을 수행하는 것으로 알려져 있다. The lipid bilayer of exosomes has the same phospholipid double membrane structure as the cells of origin (donor cells), and is a composition of substances secreted by cells extracellularly, and plays a functional role such as cell-cell communication and cellular immunity mediation. It is known.
엑소좀은 기원 세포(공여세포) 특유의 생물학적 기능을 반영하는 세포특이적 구성 성분을 함유하며, 인지질, mRNA, miRNA 외에도 다양한 수용성 단백질, 외재성 단백질 및 막관통 단백질 성분 등을 포함한다. Exosomes contain cell-specific components that reflect the unique biological functions of the cell of origin (donor cell), and include various soluble proteins, exogenous proteins, and transmembrane protein components in addition to phospholipids, mRNA, and miRNA.
이러한 엑소좀은 비만세포, 림프구, 성상세포, 혈소판, 신경세포, 내피세포, 상피세포 등 모든 동물 세포에서 배출되며 혈액, 소변, 점액, 타액, 담즙액, 복수액, 뇌척수액 등의 다양한 체액에서 발견된다. 엑소좀은 뇌혈관 장벽(Blood-Brain Barrier, BBB)도 통과할 수 있으며, 표피 세포와 내피세포의 세포막 투과가 가능할 정도로 선택적 투과성이 높아 특정 약물의 나노캐리어(nanocarrier)인 DDS(drug delivery system) 개발에도 활용되고 있다.These exosomes are excreted from all animal cells, such as mast cells, lymphocytes, astrocytes, platelets, nerve cells, endothelial cells, and epithelial cells, and are found in various body fluids such as blood, urine, mucus, saliva, bile, ascites, and cerebrospinal fluid. do. Exosomes can also pass through the blood-brain barrier (BBB) and have high selective permeability to allow penetration of epidermal cells and endothelial cells into the cell membrane, so the drug delivery system (DDS) is a nanocarrier for specific drugs. It is also being used for development.
중간엽 줄기세포에서 분비하는 엑소좀 및 마이크로베지클(microvesicle)은 세포-세포간 커뮤니케이션(cell-to-cell communication)에 관여하며 줄기세포가 가지는 재생의학적인 치료 효능을 보인다고 알려져 있다.It is known that exosomes and microvesicles secreted from mesenchymal stem cells are involved in cell-to-cell communication and show regenerative medical treatment efficacy of stem cells.
줄기세포를 체내에 이식한 후에 장기간의 생존 없이 세포에서 분비되는 파라크린 인자(paracrine factors)에 트로픽 효과(trophic effect)를 가져오는 것이 알려져 있고, 이러한 인자에는 성장인자(growth factor), 케모카인(chemokine), 사이토카인(cytokine) 등과 같은 저분자가 엑소좀과 같은 세포외 소포체(extracellular vesicle)에 의하여 분비되며, 이러한 엑소좀은 줄기세포에서 유래한다. 따라서 엑소좀은 줄기세포의 특성을 규명하고 이의 치료적 효능을 평가하는데 활용되고 있다.It is known to have a trophic effect on paracrine factors secreted from cells without long-term survival after stem cells are transplanted into the body, and these factors include growth factors and chemokines. ), small molecules such as cytokines are secreted by extracellular vesicles such as exosomes, and these exosomes are derived from stem cells. Therefore, exosomes are used to characterize stem cells and evaluate their therapeutic efficacy.
최근에는 중간엽 줄기세포 자체를 사용하지 않고 중간엽 줄기세포가 분비하는 엑소좀을 이용하여 다양한 질환의 치료효과에 대한 연구가 활발하게 진행 중이며, 학계 및 산업계에서는 이를 통해 기존의 줄기세포 치료법의 한계를 극복할 수 있는 새로운 대안이 될 수 있을 것으로 예상한다.Recently, research on the therapeutic effect of various diseases is being actively conducted using exosomes secreted by mesenchymal stem cells rather than using the mesenchymal stem cells themselves, and through this, the limitations of conventional stem cell therapies in academia and industry. It is expected that it will be a new alternative to overcome the problem.
이러한 엑소좀을 상업적으로 이용하기 위해서는 다량의, 그리고 양질의 엑소좀이 필요하다. 그러나 현재 줄기세포로부터 얻을 수 있는 엑소좀의 양은 매우 소량에 불과하고, 줄기세포 유래 엑소좀의 생산량을 증가시킬 수 있는 물질에 대한 개발도 아직까지 미비한 실정이다.In order to use these exosomes commercially, a large amount of and high quality exosomes are required. However, currently, the amount of exosomes that can be obtained from stem cells is only a very small amount, and development of a substance capable of increasing the production of stem cell-derived exosomes is still insufficient.
한편, 중간엽 줄기세포는 배양 기간이 길어지는 동시에, 여러 번의 계대배양을 거치면서 증식능력과 다양한 계통으로의 분화능력이 감소되는 것으로 알려져 있다. 또한, 초기 계대(passage)의 중간엽 줄기세포에 비해, 후기 계대의 중간엽 줄기세포에서 콜로니 형성 능력이 현저히 감소되는 것으로 알려져 있다. 중간엽 줄기세포의 노화는 골수 공여자의 나이보다는 오랜 배양기간 동안의 약화된 증식능력과 관련이 있으며, 텔로머라아제 활성(telomerase activity)의 감소와도 연관이 있는 것으로 보인다.On the other hand, it is known that the mesenchymal stem cells have a prolonged cultivation period and, at the same time, decrease proliferative capacity and differentiation capacity into various lineages through multiple passages. In addition, it is known that the ability to form colonies is significantly reduced in mesenchymal stem cells in the later passages compared to mesenchymal stem cells in the early passage. Aging of mesenchymal stem cells is associated with weakened proliferative capacity over long culture periods rather than age of bone marrow donors, and appears to be associated with a decrease in telomerase activity.
이렇듯, 현재 사람에서 얻을 수 있는 중간엽 줄기세포의 양은 제한되어 있으며, 이렇게 얻은 세포를 특정 계통으로의 분화 유도를 위해선 계대배양에 따른 분화능력의 감소와 같은 문제점들이 따라올 수밖에 없다. 이러한 단점들은 정확한 타겟 세포로의 분화 유도와 그를 위해 적절한 줄기세포를 대량으로 확보해야 하는 임상적용에 있어서는 비현실적이다. 따라서, 오랜 기간 동안 증식률을 유지하고 여러 계통으로의 분화능력을 유지할 수 있는 방법의 필요성이 대두되고 있다.As such, the amount of mesenchymal stem cells that can be obtained from humans is currently limited, and problems such as a decrease in differentiation capacity due to subculture are inevitable to induce differentiation of the obtained cells into a specific lineage. These shortcomings are unrealistic in clinical application requiring accurate induction of differentiation into target cells and securing a large amount of appropriate stem cells for the same. Accordingly, there is a need for a method capable of maintaining the proliferation rate for a long period of time and maintaining the ability to differentiate into various lines.
이에 따라, 줄기세포 유래 엑소좀의 생산을 촉진할 뿐만 아니라, 오랜 기간 동안 줄기세포의 증식률 및 분화능력을 유지할 수 있는 신규한 방법 및 물질 개발에 대한 필요성이 제기되었다.Accordingly, there has been a need for a new method and material development capable of not only promoting the production of stem cell-derived exosomes, but also maintaining the proliferation rate and differentiation capacity of stem cells for a long period of time.
이에 본 발명자들은 줄기세포 유래 엑소좀의 생산을 촉진할 뿐만 아니라, 오랜 기간 동안 줄기세포의 증식률 및 분화능력을 유지할 수 있는 방법 및 물질을 개발하였고, 라니피브라노르 (Lanifibranor)를 줄기세포에 전처리하는 경우 줄기세포의 줄기세포능(Stemness) 및 증식능(Proliferation)이 증가할 뿐만 아니라, 줄기세포 유래 엑소좀의 수, 엑소좀 내 단백질 및 RNA의 함량을 증가하는 시키는 효과가 월등히 우수한 것을 확인하였다. Accordingly, the present inventors have developed a method and material capable of not only promoting the production of stem cell-derived exosomes, but also maintaining the proliferation rate and differentiation ability of stem cells for a long period of time, and pretreatment of Lanifibranor to stem cells. In this case, it was confirmed that the effect of increasing the number of stem cell-derived exosomes and the content of proteins and RNAs in the exosomes as well as increasing the stemness and proliferation of the stem cells was remarkably excellent.
이에, 본 발명의 목적은, 라니피브라노르를 포함하는 줄기세포 유래 엑소좀 생성 촉진용 조성물을 제공하는 것이다.Accordingly, an object of the present invention is to provide a composition for promoting the generation of stem cells-derived exosomes comprising ranifibranore.
본 발명의 다른 목적은, 라니피브라노르를 포함하는 줄기세포 유래 엑소좀 생성 촉진용 줄기세포 치료제를 제공하는 것이다.Another object of the present invention is to provide a stem cell therapeutic agent for promoting the generation of stem cells-derived exosomes comprising ranifibranore.
본 발명의 또 다른 목적은, 라니피브라노르를 포함하는 줄기세포의 줄기세포능 (stemness) 강화용 조성물을 제공하는 것이다. Another object of the present invention is to provide a composition for enhancing stem cell ability (stemness) of stem cells comprising rani fibra nor.
본 발명의 또 다른 목적은, 라니피브라노르를 포함하는 줄기세포의 줄기세포능 강화용 줄기세포 치료제를 제공하는 것이다.Another object of the present invention is to provide a stem cell therapeutic agent for enhancing stem cell ability of stem cells including ranifibranore.
본 발명의 또 다른 목적은, 라니피브라노르로 전처리된, 줄기세포 유래 엑소좀을 제공하는 것이다.Another object of the present invention is to provide a stem cell-derived exosome that has been pretreated with ranifibranor.
본 발명의 또 다른 목적은, 라니피브라노르로 전처리된 줄기세포 유래 엑소좀을 유효성분으로 포함하는 줄기세포 치료제를 제공하는 것이다.Another object of the present invention is to provide a stem cell therapeutic agent comprising, as an active ingredient, stem cell-derived exosomes pretreated with ranifibranor.
본 발명의 또 다른 목적은, 본 발명의 또 다른 목적은 라니피브라노르를 포함하는 세포배양 배지에 줄기세포를 배양하는 전처리 단계를 포함하는 줄기세포 유래 엑소좀의 생산방법을 제공하는 것이다.Another object of the present invention is to provide a method for producing stem cell-derived exosomes comprising a pretreatment step of culturing stem cells in a cell culture medium containing ranifibranor.
본 발명의 또 다른 목적은, 라니피브라노르를 포함하는 세포배양 배지에 줄기세포를 배양하는 전처리 단계를 포함하는 줄기세포의 줄기세포능을 강화시키는 방법을 제공하는 것이다.Another object of the present invention is to provide a method for enhancing stem cell capacity of stem cells, including a pretreatment step of culturing stem cells in a cell culture medium containing ranifibranor.
본 발명은 라니피브라노르 (Lanifibranor)를 포함하는 줄기세포 유래 엑소좀 (Exosomes) 생성 촉진 및 줄기세포의 줄기세포능 (stemness) 강화용 조성물에 관한 것으로, 본 발명에 따른 라니피브라노르를 포함하는 조성물을 통해 배양된 줄기세포는 엑소좀 생성이 촉진되고 줄기세포의 기능이 강화된다.The present invention relates to a composition for promoting the generation of stem cell-derived exosomes, including Lanifibranor, and for enhancing the stemness of stem cells, including the Ranifibranor according to the present invention. Stem cells cultured through the composition promote exosome production and enhance the function of stem cells.
본 발명자들은 이에 라니피브라노르를 포함하는 줄기세포 유래 엑소좀 생성 촉진 및 줄기세포능 강화용 조성물은, 줄기세포 배양에 전처리 시 줄기세포의 줄기세포능 및 증식능 (Proliferation)이 증가할 뿐만 아니라, 줄기세포 유래 엑소좀의 수, 엑소좀 내 단백질 및 RNA의 함량이 크게 증가하는 것을 확인하였다. The inventors of the present invention have thus determined that the composition for promoting the generation of stem cells-derived exosomes and enhancing stem cell capacity, including ranifibranor, not only increases the stem cell capacity and proliferation capacity (Proliferation) of stem cells when pre-treatment in stem cell culture, It was confirmed that the number of stem cell-derived exosomes and the content of protein and RNA in the exosomes were significantly increased.
이하 본 발명을 더욱 자세히 설명하고자 한다.Hereinafter, the present invention will be described in more detail.
본 발명의 일 양태는, 라니피브라노르를 포함하는 줄기세포 유래 엑소좀 생성 촉진용 조성물이다.One aspect of the present invention is a composition for promoting the generation of exosomes derived from stem cells comprising ranifibranore.
본 발명의 라니피브라노르는 peroxisome proliferator-activated receptors (PPAR) 작용제(agonist)로 PPARα, PPARδ and PPARγ 로 알려진 3가지 PPAR isoforms을 각각 활성화시켜서 신체 내에서 항섬유화, 항염 그리고 유익한 대사 변화를 유도하는 것으로 알려져 있는 small molecule다. PPAR은 유전자의 발현을 조절하는 핵 호르몬 수용체 패밀리에 속하는 리간드-활성화된 전사 인자이다. PPAR은 세포 분화, 발달 및 종양 형성의 조절에 필수적인 역할을 한다. 섬유증을 조절하는 PPAR을 활성화하여 결합 조직의 비정상적인 성장을 감소시키는 것으로 알려져 있다. 또한, 라니피브라노르는 전신 경화증 치료제, 특발성 폐 섬유증 치료제 등의 용도로서 임상적으로 사용되어 왔다.Ranifibranor of the present invention is a peroxisome proliferator-activated receptors (PPAR) agonist, which activates three PPAR isoforms known as PPARα, PPARδ and PPARγ, respectively, to induce antifibrotic, anti-inflammatory and beneficial metabolic changes in the body. It is a known small molecule. PPAR is a ligand-activated transcription factor belonging to the family of nuclear hormone receptors that regulate the expression of genes. PPAR plays an essential role in the regulation of cell differentiation, development and tumor formation. It is known to reduce abnormal growth of connective tissue by activating PPAR, which regulates fibrosis. In addition, ranifibranor has been used clinically as a therapeutic agent for systemic sclerosis and idiopathic pulmonary fibrosis.
본 발명의 일 구현예에서, 라니피브라노르를 포함하는 줄기세포 유래 엑소좀 생성 촉진용 조성물은, 라니피브라노르 외의 공지된 엑소좀 생성 촉진 물질을 더 포함할 수 있다.In one embodiment of the present invention, the composition for promoting the generation of exosomes derived from stem cells including ranifibranor may further include a known exosome generation promoting substance other than ranifibranor.
본 명세서상의 용어 "엑소좀(Exosome)"은 세포 유래성 소포체로, 거의 모든 진핵 생물의 체액에 존재하는 것으로, LDL 단백질보다는 크지만, 적혈구보다는 훨씬 작은 30-100nm 정도의 직경을 갖는 소포체를 의미한다. 엑소좀은 다중소포체 (multivesicular bodies)가 세포막과 융합될 때 세포로부터 방출되거나, 세포막으로부터 곧바로 방출될 수 있고, 응고, 세포간 신호전달 등과 같은 중요하면서도 특화된 기능을 수행한다는 점이 잘 알려져 있다.As used herein, the term "exosome" refers to a cell-derived endoplasmic reticulum, which is present in almost all eukaryotic body fluids, and refers to an endoplasmic reticulum having a diameter of about 30-100 nm, which is larger than LDL protein, but much smaller than red blood cells. do. It is well known that exosomes are released from cells when multivesicular bodies are fused with cell membranes or can be released directly from cell membranes, and perform important and specialized functions such as coagulation and intercellular signaling.
본 명세서상의 용어 "줄기세포(Stem cell)"는 미분화된 세포로서 자기 복제 능력을 가지면서 두 개 이상의 서로 다른 종류의 세포로 분화하는 능력을 갖는 세포를 의미한다.As used herein, the term "stem cell" refers to a cell having the ability to differentiate into two or more different types of cells while having self-replicating ability as undifferentiated cells.
본 발명의 일 구현예에서, 줄기 세포는 자가 또는 동종 유래 줄기세포일 수 있고, 인간 및 비인간 포유류를 포함한 임의 유형의 동물 유래일 수 있으며, 성체로부터 유래된 줄기세포일 수 있고, 배아로부터 유래된 줄기세포일 수 있다. 예를 들어, 줄기세포는 배아 줄기세포, 성체 줄기세포 및 유도만능줄기세포 (induced pluripotent stem cell; iPSC)로 이루어진 군으로부터 선택되는 것일 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the stem cells may be autologous or allogeneic stem cells, may be derived from any type of animal including humans and non-human mammals, may be stem cells derived from adults, and derived from embryos. It may be a stem cell. For example, the stem cells may be selected from the group consisting of embryonic stem cells, adult stem cells, and induced pluripotent stem cells (iPSCs), but are not limited thereto.
본 발명의 일 구현예에서, 성체 줄기세포는 인간 또는 동물 조직 기원의 성체 줄기세포, 인간 또는 동물 조직 유래 중간엽 줄기세포 (mesenchymal stromal cell) 및 인간 또는 동물 조직 기원의 유도만능줄기세포로부터 유래된 중간엽 줄기세포로 이루어진 군으로부터 선택되는 것일 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the adult stem cells are derived from adult stem cells derived from human or animal tissues, mesenchymal stromal cells derived from human or animal tissues, and induced pluripotent stem cells derived from human or animal tissues. It may be selected from the group consisting of mesenchymal stem cells, but is not limited thereto.
본 명세서상의 용어 "배아 줄기세포 (embryonic stem cell)"는 배아의 발생과정에서 추출한 세포로, 수정란이 모체의 자궁에 착상하기 직전인 포배기 배아에서 내세포괴 (inner cell mass)를 추출하여 체외에서 배양한 것을 의미한다.The term "embryonic stem cell" in the present specification is a cell extracted during the development of an embryo, and the inner cell mass is extracted from the blastocyst embryo, just before the fertilized egg implants in the mother's uterus, and cultured in vitro. Means one thing.
배아 줄기세포는 개체의 모든 조직의 세포로 분화할 수 있는 다능성 (多能性, pluripotent)이거나 전능성 (全能性, totipotent)이 있는 자가재생능 (selfrenewal)을 갖는 세포를 의미하며, 넓은 의미로는 배아 줄기세포로부터 유래한 배아체 (embryoid bodies)도 포함하는 것을 의미한다.Embryonic stem cells refer to cells that are pluripotent or totipotent that can differentiate into cells of all tissues of an individual, and have self-renewal capabilities. Means to include embryoid bodies derived from embryonic stem cells.
본 발명의 일 구현예에서, 줄기세포는 인간, 원숭이, 돼지, 말, 소, 양, 개, 고양이, 생쥐, 토끼 등의 모든 유래의 배아 줄기세포를 포함할 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the stem cells may include embryonic stem cells derived from all of humans, monkeys, pigs, horses, cows, sheep, dogs, cats, mice, rabbits, etc., but are not limited thereto.
본 명세서상의 용어 "성체 줄기세포(adult stem cell)"는 제대혈이나 다 자란 성인의 골수, 혈액 등에서 추출되는 세포로 구체적 장기의 세포로 분화되기 직전의 세포를 의미하며, 필요한 때에 신체 내 조직으로 발달할 수 있는 능력을 보유한 미분화 상태의 세포를 의미한다.The term "adult stem cell" as used herein refers to a cell extracted from umbilical cord blood, bone marrow, blood, etc. of a mature adult, and refers to a cell immediately before differentiation into a specific organ cell, and develops into a body tissue when necessary. It refers to cells in an undifferentiated state that have the ability to do so.
본 발명의 일 구현예에서, 성체 줄기세포는 인간 또는 동물의 다양한 조직 기원의 성체 줄기세포, 인간 또는 동물 조직 유래 중간엽 줄기세포 (mesenchymal stromal cell), 인간 또는 동물의 다양한 조직 기원의 유도만능줄기세포로부터 유래된 중간엽 줄기세포 및 다분화능 줄기세포를 포함할 수 있으나, 이에 한정되는 것은 아니다. In one embodiment of the present invention, the adult stem cells are adult stem cells from various tissues of humans or animals, mesenchymal stromal cells derived from human or animal tissues, and induced pluripotent stems from various tissues of humans or animals. Mesenchymal stem cells and multipotent stem cells derived from cells may be included, but are not limited thereto.
본 발명의 일 구현예에서, 인간 또는 동물 또는 동물 조직은 제대, 제대혈, 골수, 지방, 근육, 신경, 피부, 양막 및 태반으로 이루어진 군으로부터 선택되는 것일 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the human or animal or animal tissue may be selected from the group consisting of umbilical cord, cord blood, bone marrow, fat, muscle, nerve, skin, amniotic membrane, and placenta, but is not limited thereto.
본 발명의 일 구현예에서, 인간 또는 동물의 다양한 조직 기원의 줄기세포는 조혈모세포, 유선 줄기세포, 장 줄기세포, 혈관내피 줄기세포, 신경 줄기세포, 후각신경 줄기세포 및 정소 줄기세포로 이루어진 군에서 선택되는 것일 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the stem cells of various tissues of human or animal origin are the group consisting of hematopoietic stem cells, mammary stem cells, intestinal stem cells, vascular endothelial stem cells, neural stem cells, olfactory nerve stem cells and testis stem cells. It may be selected from, but is not limited thereto.
본 명세서상의 용어 "유도만능줄기세포 (induced pluripotent stem cell; iPSC)"는 분화된 세포들로부터 인위적인 역분화 과정을 통해 다능성 분화능을 가지도록 유도된 세포들을 의미하며, "역분화줄기세포"와 동일한 의미로 사용될 수 있다.The term "induced pluripotent stem cell (iPSC)" as used herein refers to cells induced to have pluripotent differentiation from differentiated cells through an artificial dedifferentiation process, and "redifferentiated stem cells" and It can be used in the same sense.
인위적인 역분화 과정은 레트로바이러스, 렌티바이러스 및 센다이바이러스를 이용한 바이러스-매개 또는 비바이러스성 벡터 이용, 단백질 및 세포 추출물 등을 이용하는 비바이러스-매개 역분화 인자의 도입에 의해 수행되거나, 줄기세포 추출물, 화합물 등에 의한 역분화 과정을 포함할 수 있다.The artificial dedifferentiation process is performed by introduction of a non-viral-mediated dedifferentiation factor using a virus-mediated or non-viral vector using retrovirus, lentivirus and Sendai virus, protein and cell extract, etc., or stem cell extract, It may include a dedifferentiation process by a compound or the like.
유도만능줄기세포는 배아 줄기세포와 거의 동일한 특성을 가지며, 구체적으로는, 유사한 세포 모양을 가지고, 유전자, 단백질 발현이 유사하며, in vitro 및 in vivo에서 전분화능을 가지고, 테라토마 (teratoma)를 형성하며, 생쥐의 배반포 (blastocyst)에 삽입시켰을 때, 키메라 (chimera) 생쥐를 형성하고, 유전자의 생식선 전이 (germline transmission)가 가능하다.Induced pluripotent stem cells have almost the same characteristics as embryonic stem cells, specifically, they have a similar cell shape, are similar in gene and protein expression, have pluripotency in vitro and in vivo, and form teratoma. And, when inserted into the blastocyst of a mouse, chimera mice are formed, and germline transmission of genes is possible.
본 발명의 일 구현예에서, 유도만능줄기세포는 인간, 원숭이, 돼지, 말, 소, 양, 개, 고양이, 생쥐, 토끼 등의 모든 유래의 유도만능줄기세포를 포함할 수 있으나, 이에 제한되는 것은 아니다.In one embodiment of the present invention, the induced pluripotent stem cells may include induced pluripotent stem cells derived from all of humans, monkeys, pigs, horses, cattle, sheep, dogs, cats, mice, rabbits, etc., but are limited thereto. It is not.
본 명세서상의 용어, "생성 촉진"이란 대조군에 비하여 특정물질의 생산, 생성, 방출 등이 동일한 시간 내에서 증가되는 것을 의미하며, 구체적으로는, 줄기세포로부터 엑소좀이 생산되는 수량과, 엑소좀 내 단백질, RNA 등의 함량이 증가되는 것을 의미한다.As used herein, the term "promoting production" means that the production, production, release, etc. of a specific substance is increased within the same time as compared to the control group, and specifically, the amount of exosomes produced from stem cells, and exosomes It means that the content of protein, RNA, etc. is increased.
본 발명의 다른 양태는, 라니피브라노르를 포함하는 줄기세포의 줄기세포능 강화용 조성물이다.Another aspect of the present invention is a composition for enhancing stem cell ability of stem cells comprising ranifibranore.
본 명세서상의 용어 "줄기세포능"이란 모든 세포를 생성할 수 있는 능력이 있는 만능성 (pluripotency) 및 자기와 닮은 세포들을 무한정 만들어 낼 수 있는 자기재생능 (self-renewal)을 의미하고, 예를 들어, 미분화 세포를 미분화 상태를 유지하면서 줄기세포의 증식능 (Proliferation)을 증가시키거나, 텔로머라제 활성을 증가시키거나, 줄기세포성 인자 (stemness acting signals)의 발현을 증가시키거나 세포 이동 활성을 증가시키는 것을 말하며, 이들 특징 중 하나 이상이 나타나는 것을 포함할 수 있다.The term "stem cell ability" as used herein refers to pluripotency capable of producing all cells and self-renewal capable of producing cells that resemble magnetism indefinitely, for example For example, increasing the proliferation of stem cells, increasing telomerase activity, increasing the expression of stemness acting signals, or increasing the cell migration activity while maintaining the undifferentiated cells in the undifferentiated state. Refers to increasing, and may include the appearance of one or more of these features.
본 발명의 일 구현예에서, 본 발명의 조성물은 배지조성물로서 줄기세포 배양에 사용될 수 있고, 생체 내 (in vivo) 엑소좀 생성 촉진용도의 약제학적 조성물로서 줄기세포와 함께 생체 내로 병행 투여되거나, 선행 또는 후행적으로 투여되어 줄기세포의 in vivo 효능을 강화할 수 있다. In one embodiment of the present invention, the composition of the present invention may be used for culturing stem cells as a medium composition, and as a pharmaceutical composition for promoting exosome production in vivo, it is administered in parallel with stem cells in vivo, or It can be administered before or after to enhance the in vivo efficacy of stem cells.
본 명세서 상의 용어 "줄기세포의 in vivo 효능 강화"는, 관절염이나 신경병증 등 특정 질환에 대한 치료목적 (in vivo 효능)을 가진 줄기세포의 효능이 줄기세포가 방출하는 엑소좀에 의해 매개됨을 전제로, 본 발명의 상기 조성물을 줄기세포 투여와 함께 투여시 줄기세포로부터 엑소좀의 생성이 촉진되는 결과 줄기세포의 질환 치료 효과 (in vivo 효능)를 강화시키는 용도를 의미한다.The term "strengthening in vivo efficacy of stem cells" in the present specification presupposes that the efficacy of stem cells with therapeutic purposes (in vivo efficacy) for specific diseases such as arthritis or neuropathy is mediated by exosomes released by stem cells. As a result, when the composition of the present invention is administered together with the administration of stem cells, the generation of exosomes from stem cells is promoted, and as a result, it refers to the use of enhancing the disease treatment effect (in vivo efficacy) of stem cells.
본 발명의 일 구현예에서, 배지조성물은 생체 외 (in vitro)에서 세포의 성장과 생존 및 증식에 필요한 필수성분을 포함하는 조성물을 의미하는 것으로, 당해 분야에서 통상적으로 사용되는 줄기세포 배양용 배지를 모두 포함하며, 예를 들어 DMEM (Dulbecco's Modified Eagle's Medium), MEM (Minimal Essential Medium), BME (Basal Medium Eagle), RPMI 1640, DMEM/F-10 (Dulbecco's Modified Eagle's Medium: Nutrient Mixture F-10), DMEM/F-12 (Dulbecco's Modified Eagle's Medium: Nutrient Mixture F-12), α-MEM (α-Minimal essential Medium), G-MEM (Glasgow's Minimal Essential Medium), IMDM (Isocove's Modified Dulbecco's Medium), KnockOut DMEM, E8 (Essential 8 Medium) 등의 상업적으로 제조된 배지 또는 인위적으로 합성한 배지가 이용될 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the medium composition refers to a composition containing essential components necessary for cell growth, survival, and proliferation in vitro, and is a medium for culturing stem cells commonly used in the art. Includes all, for example, DMEM (Dulbecco's Modified Eagle's Medium), MEM (Minimal Essential Medium), BME (Basal Medium Eagle), RPMI 1640, DMEM/F-10 (Dulbecco's Modified Eagle's Medium: Nutrient Mixture F-10) , DMEM/F-12 (Dulbecco's Modified Eagle's Medium: Nutrient Mixture F-12), α-MEM (α-Minimal Essential Medium), G-MEM (Glasgow's Minimal Essential Medium), IMDM (Isocove's Modified Dulbecco's Medium), KnockOut DMEM , E8 (Essential 8 Medium) or the like, a commercially prepared medium or an artificially synthesized medium may be used, but is not limited thereto.
본 발명의 일 구현예에서, 배지조성물은 일반적으로 탄소원, 질소원 및 미량원소 성분을 포함하며, 아미노산, 항생제 등을 더 포함할 수 있다.In one embodiment of the present invention, the medium composition generally includes a carbon source, a nitrogen source, and trace element components, and may further include amino acids, antibiotics, and the like.
본 발명의 일 구현예에서, 배지조성물은 본 발명의 구성성분 라니피브라노르를 종래의 줄기세포 배양용 배지 내에 첨가하여 제조될 수 있다.In one embodiment of the present invention, the medium composition may be prepared by adding the constituent of the present invention ranifibranor into a conventional stem cell culture medium.
본 발명의 일 구현예에서, 라니피브라노르 (Lanifibranor)는 배지 내에 1 내지 1000μM, 1 내지 500μM, 1 내지 100μM, 1 내지 90μM, 1 내지 80μM, 1 내지 70μM, 1 내지 60μM, 1 내지 50μM, 1 내지 40μM, 1 내지 30μM, 1 내지 20μM, 5 내지 1000μM, 5 내지 500μM, 5 내지 100μM, 5 내지 90μM, 5 내지 80μM, 5 내지 70μM, 5 내지 60μM, 5 내지 50μM, 5 내지 40μM, 5 내지 30μM, 5 내지 20μM 첨가될 수 있고, 예를 들어 10μM의 농도로 첨가될 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, Lanifibranor is 1 to 1000 μM, 1 to 500 μM, 1 to 100 μM, 1 to 90 μM, 1 to 80 μM, 1 to 70 μM, 1 to 60 μM, 1 to 50 μM in the medium, 1 to 40 μM, 1 to 30 μM, 1 to 20 μM, 5 to 1000 μM, 5 to 500 μM, 5 to 100 μM, 5 to 90 μM, 5 to 80 μM, 5 to 70 μM, 5 to 60 μM, 5 to 50 μM, 5 to 40 μM, 5 to 30 μM, 5 to 20 μM may be added, for example, it may be added at a concentration of 10 μM, but is not limited thereto.
본 발명의 일 구현예에서, 라니피브라노르를 포함하는 줄기세포의 줄기세포능 강화용 조성물은 약제학적 조성물일 수 있다.In one embodiment of the present invention, the composition for enhancing stem cell ability of stem cells including ranifibranor may be a pharmaceutical composition.
본 발명의 일 구현예에서, 약제학적 조성물은 약제학적으로 허용되는 담체를 포함할 수 있고, 예를 들어, 락토스, 덱스트로스, 수크로스, 솔비톨, 만니톨, 전분, 아카시아 고무, 인산 칼슘, 알기네이트, 젤라틴, 규산 칼슘, 미세결정성 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 물, 시럽, 메틸 셀룰로스, 메틸히드록시벤조에이트, 프로필히드록시벤조에이트, 활석, 스테아르산 마그네슘 및 미네랄 오일 등을 포함할 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the pharmaceutical composition may include a pharmaceutically acceptable carrier, for example, lactose, dextrose, sucrose, sorbitol, mannitol, starch, gum acacia, calcium phosphate, alginate , Gelatin, calcium silicate, microcrystalline cellulose, polyvinylpyrrolidone, cellulose, water, syrup, methyl cellulose, methylhydroxybenzoate, propylhydroxybenzoate, talc, magnesium stearate, and mineral oil. However, it is not limited thereto.
본 발명의 일 구현예에서, 약제학적 조성물은 윤활제, 습윤제, 감미제, 향미제, 유화제, 현탁제, 보존제 등을 추가로 포함할 수 있다. 적합한 약제학적으로 허용되는 담체 및 제제는 Remington's Pharmaceutical Sciences(19th ed., 1995)에 상세히 기재되어 있다.In one embodiment of the present invention, the pharmaceutical composition may further include a lubricant, a wetting agent, a sweetening agent, a flavoring agent, an emulsifying agent, a suspending agent, a preservative, and the like. Suitable pharmaceutically acceptable carriers and formulations are described in detail in Remington's Pharmaceutical Sciences (19th ed., 1995).
본 발명의 일 구현예에서, 약제학적 조성물은 경구 및 비경구로 투여할 수 있고, 예컨대 정맥 내 주입, 피하 주입, 근육 주입, 복강 주입, 국소 투여, 비강 내 투여, 폐내 투여, 직장내 투여, 경막 내 투여, 안구 투여, 피부 투여 및 경피 투여 등으로 투여할 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the pharmaceutical composition may be administered orally and parenterally, such as intravenous injection, subcutaneous injection, intramuscular injection, intraperitoneal injection, topical administration, intranasal administration, intrapulmonary administration, rectal administration, dura mater It may be administered by intramuscular administration, ocular administration, skin administration, and transdermal administration, but is not limited thereto.
본 발명의 일 구현예에서, 약제학적 조성물은 제제화 방법, 투여 방식, 환자의 연령, 체중, 성, 병적 상태, 음식, 투여 시간, 투여 경로, 배설 속도 및 반응 감응성과 같은 요인들에 의해 다양하게 투여량이 정해질 수 있으며, 소망하는 치료 또는 예방에 효과적인 투여량으로 결정 또는 처방될 수 있다. 예를 들어, 본 발명의 약제학적 조성물의 1일 투여량은 0.0001-1000 ㎎/㎏이다.In one embodiment of the present invention, the pharmaceutical composition is variously depending on factors such as formulation method, mode of administration, age, weight, sex, pathological condition, food, administration time, route of administration, excretion rate and response sensitivity of the patient. The dosage may be determined, and may be determined or prescribed as a dosage effective for the desired treatment or prophylaxis. For example, the daily dosage of the pharmaceutical composition of the present invention is 0.0001-1000 mg/kg.
본 발명의 일 구현예에서, 약제학적 조성물은 당해 발명이 속하는 기술 분야에서 통상의 지식을 가진 자가 용이하게 실시할 수 있는 방법에 따라, 약제학적으로 허용되는 담체 및/또는 부형제를 이용하여 제제화 함으로써 단위 용량 형태로 제조되거나 또는 다용량 용기 내에 내입시켜 제조될 수 있다. 이때 제형은 오일 또는 수성 매질중의 용액, 현탁액 또는 유화액 형태이거나 엑스제, 산제, 좌제, 분말제, 과립제, 정제 또는 캅셀제 형태일 수도 있으며, 분산제 또는 안정화제를 추가적으로 포함할 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the pharmaceutical composition is formulated using a pharmaceutically acceptable carrier and/or excipient according to a method that can be easily carried out by a person having ordinary knowledge in the technical field to which the present invention belongs. It can be manufactured in unit dosage form or can be manufactured by putting it inside a multi-dose container. In this case, the formulation may be in the form of a solution, suspension, or emulsion in an oil or aqueous medium, or may be in the form of an extract, powder, suppository, powder, granule, tablet or capsule, and may additionally include a dispersant or a stabilizer, but is limited thereto. It is not.
본 발명의 또 다른 양태는, 라니피브라노르로 전처리된, 줄기세포 유래 엑소좀이다. Another aspect of the present invention is a stem cell-derived exosome pretreated with ranifibranor.
본 발명에 따른 조성물 및 상기 줄기세포 유래 엑소좀 사이에 공통된 내용은 본 명세서의 과도한 복잡성을 피하기 위하여 그 기재를 생략한다.Description of the common content between the composition according to the present invention and the stem cell-derived exosomes will be omitted to avoid excessive complexity of the present specification.
본 발명의 또 다른 양태는, 라니피브라노르를 포함하는 줄기세포 유래 엑소좀 생성 촉진용 줄기세포 치료제이다.Another aspect of the present invention is a stem cell therapeutic agent for promoting the generation of stem cells-derived exosomes, including ranifibranore.
본 발명의 또 다른 양태는, 라니피브라노르를 포함하는 줄기세포 줄기세포능 강화용 줄기세포 치료제이다.Another aspect of the present invention is a stem cell therapeutic agent for enhancing stem cell stem cell ability, including ranifibranor.
본 발명의 또 다른 양태는, 라니피브라노르로 전처리된 줄기세포 유래 엑소좀을 유효성분으로 포함하는 줄기세포 치료제이다.Another aspect of the present invention is a stem cell therapeutic agent comprising, as an active ingredient, stem cell-derived exosomes pretreated with ranifibranor.
본 명세서상의 용어 "세포 치료제"는 세포와 조직의 기능을 복원시키기 위하여 살아있는 자가 (autologous), 동종 (allogenic), 이종 (xenogenic) 세포를 체외에서 증식ㆍ선별하거나 여타한 방법으로 세포의 생물학적 특성을 변화시키는 등의 일련의 행위를 통하여 치료, 진단 및 예방의 목적으로 사용되는 의약품을 의미한다.As used herein, the term "cell therapy" refers to the biological properties of cells by proliferating and selecting in vitro or other methods of living autologous, allogenic, and xenogenic cells to restore the function of cells and tissues. It refers to medicines used for treatment, diagnosis, and prevention purposes through a series of actions such as changing.
이러한 세포치료제는 크게 두 가지로 분류할 수 있으며, 그 첫 번째는 조직 재생, 장기기능 회복 또는 면역세포의 기능조절을 위한 "줄기세포 치료제"이며, 두 번째는 생체 내 면역반응의 억제 혹은 면역반응의 항진 등 면역반응 조절을 위한 "면역세포 치료제"이다.These cell therapy drugs can be classified into two broad categories, the first being "stem cell therapy" for tissue regeneration, organ function recovery, or immune cell function regulation, and the second, suppressing or immune response in vivo. It is a "immune cell therapy" for regulating immune responses such as boosting of
본 발명에 따른 조성물은 줄기세포의 줄기세포능을 증가시키고 줄기세포 유래 엑소좀의 생성을 촉진하며, 이를 통해 줄기세포의 치료적 효능을 강화시키는 효과를 가지므로, 본 명세서 내에서 "세포치료제"는 "줄기세포 치료제"를 의미한다.The composition according to the present invention increases the stem cell ability of stem cells and promotes the generation of stem cell-derived exosomes, thereby enhancing the therapeutic efficacy of stem cells, and therefore, "cell therapy" within the present specification. Means "stem cell therapeutic agent".
본 발명의 일 구현예에서, 줄기세포 치료제는 심근경색, 심부전 등의 심혈관 질환, 간암, 위암, 대장암, 전립선암, 방광암, 폐암 등의 암 질환, 아토피성 피부염, 관절염, 자가면역성 뇌척수염, 전신성 홍반성 루푸스, 대장염 및 다발성 경화증과 같은 염증성 질환, 또는 자가면역성 질환 등의 치료대상 질병을 치료하는 용도로 사용될 수 있으나, 이에 한정되지 않는다. In one embodiment of the present invention, the stem cell therapeutic agent is cardiovascular disease such as myocardial infarction and heart failure, liver cancer, stomach cancer, colon cancer, prostate cancer, bladder cancer, cancer diseases such as lung cancer, atopic dermatitis, arthritis, autoimmune encephalomyelitis, systemic It may be used to treat inflammatory diseases such as lupus erythematosus, colitis, and multiple sclerosis, or diseases to be treated such as autoimmune diseases, but is not limited thereto.
본 발명에 따른 줄기세포 치료제는 상술한 본 발명의 각 조성물과 구성성분을 공통으로 하기 때문에, 이 둘 사이에 공통된 내용은 본 명세서의 과도한 복잡성을 피하기 위하여 그 기재를 생략한다.Since the stem cell therapeutic agent according to the present invention has the above-described compositions and components of the present invention in common, descriptions of the contents in common between the two are omitted in order to avoid excessive complexity of the present specification.
본 발명의 또 다른 양태는, 다음 단계를 포함하는 줄기세포 유래 엑소좀의 생산방법이다: Another aspect of the present invention is a method for producing stem cell-derived exosomes comprising the following steps:
라니피브라노르를 포함하는 세포배양 배지에서 줄기세포를 배양하는 배양 단계.A culture step of culturing stem cells in a cell culture medium containing ranifibranore.
본 발명의 일 구현예에서, 줄기세포 유래 엑소좀의 생산방법은 다음 단계를 더 포함할 수 있다: In one embodiment of the present invention, the method for producing stem cell-derived exosomes may further include the following steps:
배양된 줄기세포를 세척한 후 세포배양 배지에서 추가로 배양하는 추가 배양 단계; 및 An additional culturing step of further culturing in a cell culture medium after washing the cultured stem cells; And
엑소좀을 분리하는 분리 단계.Separation step to separate exosomes.
이하, 본 발명의 줄기세포 유래 엑소좀의 생산방법에 대하여 상세히 설명한다.Hereinafter, a method for producing stem cell-derived exosomes of the present invention will be described in detail.
본 발명에 따른 줄기세포 유래 엑소좀의 생산방법의 배양 단계는, 줄기세포를 라니피브라노르로 전처리하여 줄기세포에 자극을 가하는 과정이다. 본 과정에 의해 줄기세포는 상기 물질로 전처리 되지 않은 줄기세포에 비하여 더 많은 수의 엑소좀을 생산하고, 엑소좀 내 단백질 및 RNA의 함량도 증가된다.The culturing step of the method for producing stem cell-derived exosomes according to the present invention is a process in which stem cells are pretreated with ranifibranor to stimulate stem cells. By this process, stem cells produce a greater number of exosomes than stem cells that have not been pretreated with the above substances, and the content of proteins and RNA in the exosomes is also increased.
본 발명에 따른 줄기세포 유래 엑소좀의 생산방법의 추가 배양 단계는, 본 발명에 따른 라니피브라노르로 전처리 된 줄기세포를 세척하여 전처리 물질을 제거하고, 새로운 세포배양 배지에서 배양함으로써 줄기세포로부터 엑소좀의 분비 또는 생산을 유도하는 과정이다. 배양 단계의 줄기세포 전처리 물질(라니피브라노르)은 상기 추가 배양 단계의 세척 과정에 의해 제거되고, 세척 이후의 줄기세포, 줄기세포에서 생산된 엑소좀 또는 배양배지 내에 잔류하지 않는다. 따라서 배양 단계에서 본 발명의 줄기세포 전처리 물질(라니피브라노르)로 처리된 줄기세포와 줄기세포에서 생산된 엑소좀 및 배양배지는 전처리 물질의 잔류에 의한 영향 없이 후속적 연구 또는 질병의 치료 목적으로 유용하게 사용될 수 있다.In the additional culturing step of the method for producing stem cell-derived exosomes according to the present invention, the stem cells pretreated with Ranifibranor according to the present invention are washed to remove the pretreatment material, and then cultured in a new cell culture medium from stem cells. It is a process that induces the secretion or production of exosomes. The stem cell pretreatment material (Ranifibranor) in the culture step is removed by the washing process in the additional culture step, and does not remain in the stem cells after washing, exosomes produced from stem cells, or the culture medium. Therefore, the stem cells treated with the stem cell pretreatment material (Ranifibranor) of the present invention and exosomes and culture medium produced from the stem cells in the cultivation stage are used for subsequent studies or treatment of diseases without the effect of the residual of the pretreatment material. It can be usefully used.
본 발명의 일 구현예에서, 추가 배양 단계의 세포배양 배지는 엑소좀이 제거된 우태아혈청 (Fetal bovine serum; FBS)을 추가적으로 포함할 수 있다. In one embodiment of the present invention, the cell culture medium in the additional culture step may additionally contain fetal bovine serum (FBS) from which exosomes have been removed.
세포배양 배지에 엑소좀을 제거한 FBS를 사용하는 이유는 일반적으로 사용하는 FBS에는 소 혈청유래의 엑소좀이 매우 많이 포함되어 있기 때문에, 줄기세포가 분비하는 엑소좀 외에 FBS에서 유래된 엑소좀이 혼입되는 것을 방지하기 위함이다.The reason for using FBS with exosomes removed in the cell culture medium is that the FBS generally used contains a lot of exosomes derived from bovine serum, so in addition to exosomes secreted by stem cells, exosomes derived from FBS are mixed. It is to prevent it from becoming.
본 발명의 일 구현예에서, 추가 배양 단계의 추가 배양은 추가 배양은 12시간 내지 120 시간, 24시간 내지 96시간, 48시간 내지 96시간, 또는 60시간 내지 84시간, 예를 들어, 72시간 동안 배양될 수 있으나, 이에 한정되는 것은 아니다.In one embodiment of the present invention, the additional cultivation of the additional culturing step is performed for 12 hours to 120 hours, 24 hours to 96 hours, 48 hours to 96 hours, or 60 hours to 84 hours, for example, 72 hours. It may be cultured, but is not limited thereto.
본 발명에 따른 줄기세포 유래 엑소좀의 생산방법의 분리 단계에서, 추가 배양 단계에서 추가 배양한 줄기세포의 배양 배지를 200-400xg에서 5 내지 20분간 원심분리하여 남아있는 세포와 세포 잔여물을 제거한 뒤, 상층액을 취하여 9,000-12,000xg로 60-80분간 고속원심분리한 후, 다시 상층액을 취하여 90,000-120,000xg로 80-100분간 원심분리하고 상층액을 제거함으로써 하층에 남아 있는 엑소좀을 얻을 수 있다. In the separation step of the method for producing stem cell-derived exosomes according to the present invention, the culture medium of the stem cells additionally cultured in the additional culture step is centrifuged at 200-400xg for 5 to 20 minutes to remove remaining cells and cell residues. After that, take the supernatant and perform high-speed centrifugation at 9,000-12,000xg for 60-80 minutes, then take the supernatant again and centrifuge at 90,000-120,000xg for 80-100 minutes and remove the supernatant to remove the exosomes remaining in the lower layer. Can be obtained.
예를 들어, 중간엽 줄기세포 배양 배지를 수거하여 300xg에서 10분간 원심분리하여 남아있는 세포와 세포잔여물을 제거하고, 상층액을 취하여 0.22μm 필터를 이용하여 여과한 다음, 고속원심분리기 (high speed centrifuge)를 이용하여 10,000xg, 4℃에서 70분간 원심분리하고, 원심분리된 상층액을 다시 취하여 초원심분리기 (ultracentrifuge)를 이용하여 100,000xg, 4℃에서 90분간 원심분리하여 상층액을 제거함으로써 하층에 남아있는 엑소좀을 분리할 수 있으나, 이에 한정되는 것은 아니다.For example, the mesenchymal stem cell culture medium is collected and centrifuged at 300xg for 10 minutes to remove remaining cells and cell residues, and the supernatant is collected and filtered using a 0.22 μm filter, and then a high-speed centrifuge (high speed centrifuge) at 10,000xg and 4℃ for 70 minutes, and then take the centrifuged supernatant again and centrifuge at 100,000xg at 4℃ for 90 minutes using an ultracentrifuge to remove the supernatant. By doing so, it is possible to separate the exosomes remaining in the lower layer, but is not limited thereto.
본 발명의 또 다른 양태는, 다음 단계를 포함하는 줄기세포의 줄기세포능을 강화시키는 방법이다: Another aspect of the present invention is a method of enhancing stem cell ability of stem cells, comprising the following steps:
라니피브라노르를 포함하는 세포배양 배지에서 줄기세포를 배양하는 배양 단계.A culture step of culturing stem cells in a cell culture medium containing ranifibranore.
줄기세포의 줄기세포능을 강화시키는 방법은 상술한 본 발명의 줄기세포 유래 엑소좀의 생산방법과 각 단계를 공통으로 하기 때문에, 이 둘 사이에 공통된 내용은 본 명세서의 과도한 복잡성을 피하기 위하여 그 기재를 생략한다.Since the method of enhancing the stem cell function of stem cells is the same as the method for producing the stem cell-derived exosomes of the present invention described above and each step, the contents in common between the two are described in order to avoid excessive complexity of the present specification. Is omitted.
본 발명은 라니피브라노르 (Lanifibranor)를 포함하는 줄기세포 유래 엑소좀 (Exosomes) 생성 촉진 및 줄기세포의 기능 강화용 조성물에 관한 것으로, 본 발명의 조성물을 줄기세포 배양에 이용하는 경우, 줄기세포의 줄기세포능 및 줄기세포 유래 엑소좀의 생산량이 증가되므로, 보다 효율적으로 양질의 줄기세포 및 줄기세포 유래 엑소좀을 생산할 수 있는 바, 이를 관련 연구개발 및 제품화에 유용하게 사용할 수 있다.The present invention relates to a composition for promoting the production of stem cell-derived exosomes including Lanifibranor and enhancing the function of stem cells. When the composition of the present invention is used for stem cell culture, the Since the production of stem cell ability and stem cell-derived exosomes is increased, it is possible to more efficiently produce high-quality stem cells and stem cell-derived exosomes, and this can be usefully used for related research and development and commercialization.
도 1은 본 발명의 일 실시예에 따라, 줄기세포 전처리 물질(라니피브라노르(Lanifibranor)) 처리에 따른 줄기세포 증식률 (Proliferation) 증가를 확인한 그래프이다.
도 2a 및 2b는 본 발명의 일 실시예에 따라, 줄기세포 전처리 물질(라니피브라노르(Lanifibranor)) 처리에 따른 줄기세포의 줄기세포능 (Stemness) 증가를 확인한 도면이다.
도 3은 본 발명의 일 실시예에 따라, 줄기세포 전처리 물질(라니피브라노르(Lanifibranor)) 처리에 따른 엑소좀의 크기에 따른 분포를 확인한 도면이다.
도 4는 본 발명의 일 실시예에 따라, 줄기세포 전처리 물질(라니피브라노르(Lanifibranor)) 처리에 따른 엑소좀 수 증가를 확인한 도면이다.
도 5는 본 발명의 일 실시예에 따라, 줄기세포 전처리 물질(라니피브라노르(Lanifibranor))처리에 따른 엑소좀 유래 단백질 양 증가를 확인한 도면이다.
도 6은 본 발명의 일 실시예에 따라, 줄기세포 전처리 물질(라니피브라노르(Lanifibranor)) 처리에 따른 엑소좀 유래 RNA 양 증가를 확인한 도면이다.1 is a graph confirming an increase in stem cell proliferation according to treatment with a stem cell pretreatment material (Lanifibranor) according to an embodiment of the present invention.
2A and 2B are diagrams illustrating an increase in stem cell capacity of stem cells according to treatment with a stem cell pretreatment material (Lanifibranor) according to an embodiment of the present invention.
3 is a diagram illustrating the distribution of exosomes according to the size of the stem cell pretreatment material (Lanifibranor) treatment according to an embodiment of the present invention.
4 is a diagram illustrating an increase in the number of exosomes according to treatment with a stem cell pretreatment material (Lanifibranor) according to an embodiment of the present invention.
5 is a diagram illustrating an increase in the amount of exosome-derived protein according to the treatment of a stem cell pre-treatment material (Lanifibranor) according to an embodiment of the present invention.
6 is a diagram illustrating an increase in the amount of exosome-derived RNA according to the treatment of a stem cell pretreatment material (Lanifibranor) according to an embodiment of the present invention.
이하, 본 발명을 하기의 실시예에 의하여 더욱 상세히 설명한다. 그러나 이들 실시예는 본 발명을 예시하기 위한 것일 뿐이며, 본 발명의 범위가 이들 실시예에 의하여 한정되는 것은 아니다.Hereinafter, the present invention will be described in more detail by the following examples. However, these examples are for illustrative purposes only, and the scope of the present invention is not limited by these examples.
실시예: Lanifibranor처리에 따른 줄기세포 유래 엑소좀 분리Example: Isolation of stem cells-derived exosomes according to Lanifibranor treatment
Lanifibranor 전처리Lanifibranor pretreatment
LANIFIBRANOR 10μM이 포함된 배양배지[high glucose DMEM(Gibco, Cat no.11995-065); 10% Fetal bovine Serum (HyClone), 1% MEM Non-Essential Amino Acids Solution (100X) (Gibco, Cat no.11140-050)]에서 제대조직 유래 중간엽 줄기세포 (Primary Umbilical Cord-Derived Mesenchymal Stem Cells, ATCC No. PCS-500-010; Lot No. 63822428)를 1주일간 배양하였다.
추가 배양Further culture
배양을 완료한 후 LANIFIBRANOR 가 전처리 된 중간엽 줄기세포를 세척하고 엑소좀이 제거된 우태아혈청 (FBS)을 10% 첨가한 배양배지에서 추가적으로 72시간 배양하였다. 엑소좀이 제거된 FBS를 사용하는 이유는 일반적으로 사용하는 FBS에는 소 혈청유래의 엑소좀이 매우 많이 포함되어 있기 때문에, 세포가 분비하는 엑소좀 외에 FBS 유래 엑소좀이 혼입되는 것을 방지하기 위함이다.After the culture was completed, the mesenchymal stem cells pretreated with LANIFIBRANOR were washed and cultured for an additional 72 hours in a culture medium containing 10% fetal bovine serum (FBS) from which exosomes were removed. The reason for using FBS from which exosomes have been removed is to prevent the incorporation of FBS-derived exosomes in addition to exosomes secreted by cells, since the commonly used FBS contains a lot of exosomes derived from bovine serum. .
엑소좀 분리Exosome separation
72시간 배양 후 전처리 물질이 처리된 중간엽 줄기세포 배양배지를 수거하여 300xg에서 10분간 원심분리하여 남아있는 세포와 세포잔여물을 제거하였다. 상층액을 취하여 0.22μm 필터를 이용하여 여과한 다음, 고속원심분리기 (high speed centrifuge)를 이용하여 10,000xg, 4℃에서 70분간 원심분리하였다. 원심분리 된 상층액을 다시 취하여 초원심분리기 (ultracentrifuge)를 이용하여 100,000xg, 4℃에서 90분간 원심분리하여 상층액을 제거하였다. 하층에 남아있는 엑소좀을 PBS (phosphate bufferd salin)에 희석하여 이하의 실험에 사용하였다.After 72 hours of incubation, the mesenchymal stem cell culture medium treated with the pre-treatment material was collected and centrifuged at 300xg for 10 minutes to remove the remaining cells and cell residues. The supernatant was taken and filtered using a 0.22 μm filter, and then centrifuged at 10,000xg and 4°C for 70 minutes using a high speed centrifuge. The centrifuged supernatant was retaken and centrifuged at 100,000xg for 90 minutes at 4℃ using an ultracentrifuge to remove the supernatant. The exosomes remaining in the lower layer were diluted in PBS (phosphate buffered salin) and used in the following experiments.
실험예1: Lanifibranor 처리에 따른 줄기세포 기능 강화Experimental Example 1: Enhancement of stem cell function according to Lanifibranor treatment
1-1. Lanifibranor 처리에 따른 줄기세포 증식률(Proliferation) 증가 1-1. Stem cell proliferation increase by lanifibranor treatment
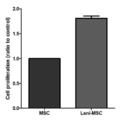
100uL 배양배지[high glucose DMEM(Gibco, Cat no.11995-065), 10% Fetal bovine Serum (HyClone), 1% MEM Non-Essential Amino Acids Solution (100X)(Gibco, Cat no.11140-050)]가 포함된 96-웰 플레이트에 중간엽 줄기세포 및 상기 실시예의 Lanifibranor가 전처리 된 중간엽 줄기세포를 각각 웰당 3000 세포씩 접종 (seeding)한 후, 24시간 동안 CO2 배양기에서 배양하였다. 그 다음, CCK 용액 (10 uL/웰)을 첨가하고 CO2 배양기 (incubator)에서 4시간 동안 배양한 후, 450nm (420~480nm) 파장에서 흡광도를 측정하여 증식률을 확인하였다.100uL culture medium [high glucose DMEM (Gibco, Cat no. 11995-065), 10% Fetal bovine Serum (HyClone), 1% MEM Non-Essential Amino Acids Solution (100X) (Gibco, Cat no. 11140-050)]] Mesenchymal stem cells and mesenchymal stem cells pretreated with Lanifibranor of the above example were seeded at a rate of 3000 cells per well, respectively, in a 96-well plate containing, and then cultured in a CO 2 incubator for 24 hours. Then, after adding a CCK solution (10 uL/well) and incubating for 4 hours in a CO2 incubator, the proliferation rate was confirmed by measuring absorbance at a wavelength of 450nm (420~480nm).
도 1에서 확인할 수 있듯이, 아무 물질도 처리하지 않은 중간엽 줄기세포에 비하여, 줄기세포 전처리 물질[Lanifibranor]을 전처리한 중간엽 줄기세포의 세포 증식률이 1에서 1.81으로 약 181% 증가하였다.As can be seen in FIG. 1, the cell proliferation rate of mesenchymal stem cells pretreated with the stem cell pre-treatment material [Lanifibranor] increased by about 181% from 1 to 1.81 compared to the mesenchymal stem cells not treated with any material.
1-2. Lanifibranor 처리에 따른 줄기세포의 줄기세포능 (Stemness) 증가1-2. Increased stemness of stem cells by lanifibranor treatment
10mL 배양배지[high glucose DMEM(Gibco, Cat no.11995-065), 10% Fetal bovine Serum (HyClone), 1% MEM Non-Essential Amino Acids Solution (100X) (Gibco, Cat no.11140-050)]가 포함된 100mm 세포배양 디쉬 (dish)에 중간엽 줄기세포 및 상기 실시예의 Lanifibranor이 전처리 된 중간엽 줄기세포를 각각 디쉬당 1000 세포씩 접종하고 21일 동안 배양하였다. 배양된 세포가 부착된 디쉬를 PBS로 2회 세척하고 상온에서 약 2분간 95% 메탄올로 고정하였다. 고정된 세포를 PBS로 3회 세척한 후, 0.5% 크리스탈 바이올렛 용액 [crystal violet (sigma, C-3886, USA) 5g, 메탄올 100ml]을 첨가한 후 5분 동안 염색하고 물로 세척 후 실온에서 건조하였다. 각 디쉬에서 50개 이상의 세포로 구성된 콜로니의 수를 계수하여 비교하였다.10mL culture medium [high glucose DMEM (Gibco, Cat no. 11995-065), 10% Fetal bovine Serum (HyClone), 1% MEM Non-Essential Amino Acids Solution (100X) (Gibco, Cat no. 11140-050)] Mesenchymal stem cells and mesenchymal stem cells pretreated with Lanifibranor of the above Example were inoculated at 1000 cells per dish and cultured for 21 days in a 100 mm cell culture dish containing. The dish to which the cultured cells were attached was washed twice with PBS and fixed with 95% methanol for about 2 minutes at room temperature. After washing the fixed cells 3 times with PBS, 0.5% crystal violet solution [crystal violet (sigma, C-3886, USA) 5g, methanol 100ml] was added, stained for 5 minutes, washed with water, and dried at room temperature. . The number of colonies composed of 50 or more cells in each dish was counted and compared.
도 2a 및 2b에서 확인할 수 있듯이, 아무 물질도 처리하지 않은 중간엽 줄기세포 (40개)에 비하여, 줄기세포 전처리 물질[Lanifibranor]을 전처리한 중간엽 줄기세포의 세포 (56.7개)의 CFU-F 콜로니 수가 약 142% 증가하였다. As can be seen in FIGS. 2A and 2B, CFU-F of mesenchymal stem cells (56.7 cells) pretreated with a stem cell pretreatment material [Lanifibranor] compared to mesenchymal stem cells (40 cells) not treated with any material. The number of colonies increased by about 142%.
실험예 2. Lanifibranor 처리에 따른 엑소좀 생산 효율 증가Experimental Example 2. Increased exosome production efficiency according to Lanifibranor treatment
2-1. Lanifibranor 처리에 따른 엑소좀 수 증가2-1. Increased number of exosomes following lanifibranor treatment
나노파티클 트래킹 어세이 (NanoSight NS300, Malvern)를 통하여, 상기 실시예에서 분리된 엑소좀 수를 확인하였다. 이때, 비교를 위하여, 아무 전처리 물질도 처리하지 않은 것을 제외하고 실시예와 동일한 방법으로 분리된 엑소좀의 수를 확인하였다. 결과를 하기 표 1, 도 3 및 도 4에 나타내었다.Through a nanoparticle tracking assay (NanoSight NS300, Malvern), the number of exosomes isolated in the above Example was confirmed. At this time, for comparison, the number of separated exosomes was confirmed in the same manner as in Example except that no pretreatment material was treated. The results are shown in Table 1, FIGS. 3 and 4 below.
(MSC: 미처리 중간엽 줄기세포, Lani-MSC-Exo: Lanifibranor-처리 중간엽 줄기세포)(MSC: untreated mesenchymal stem cells, Lani-MSC-Exo: Lanifibranor-treated mesenchymal stem cells)
상기 표 1 및 도 4에서 확인할 수 있듯이, 아무 물질도 처리하지 않은 중간엽 줄기세포에 비하여, 줄기세포 전처리 물질(Lanifibranor)을 전처리한 중간엽 줄기세포에서 약 4.95배 많은 수의 엑소좀이 생산되었다.As can be seen in Tables 1 and 4, about 4.95 times as many exosomes were produced in mesenchymal stem cells pretreated with a stem cell pre-treatment material (Lanifibranor) compared to mesenchymal stem cells not treated with any material. .
상기 결과로부터, 본 발명에 따른 상기 줄기세포 전처리 물질을 중간엽 줄기세포에 처리시, 중간엽 줄기세포가 생산하는 엑소좀의 수가 증가함을 알 수 있다.From the above results, it can be seen that the number of exosomes produced by the mesenchymal stem cells increases when the stem cell pretreatment material according to the present invention is treated on the mesenchymal stem cells.
2-2. Lanifibranor 처리에 따른 엑소좀 유래 단백질 양 증가2-2. Increased amount of exosome-derived protein by lanifibranor treatment
엑소좀 단백질 분리 키트 (Total exosome RNA and protein isolation kit, Invitrogen)를 이용하여 상기 실시예에서 분리된 엑소좀으로부터 단백질을 분리하고, 브래드포드 분석 (bradford analysis)을 통하여 595nm에서 흡광도를 측정하여 단백질을 정량하였다. 이때, 비교를 위하여, 아무 전처리 물질도 처리하지 않은 것을 제외하고 실시예와 동일한 방법으로 분리된 엑소좀으로부터 단백질을 분리하여 정량하였다. 결과를 하기 표 2 및 도 5에 나타내었다.The protein was isolated from the exosomes isolated in the above example using an exosome protein isolation kit (Total exosome RNA and protein isolation kit, Invitrogen), and the absorbance was measured at 595nm through Bradford analysis to determine the protein. Quantified. At this time, for comparison, proteins were separated and quantified from exosomes separated in the same manner as in Examples, except that no pretreatment material was treated. The results are shown in Table 2 and FIG. 5 below.
(MSC: 미처리 중간엽 줄기세포, Lani-MSC-Exo: Lanifibranor-처리 중간엽 줄기세포)(MSC: untreated mesenchymal stem cells, Lani-MSC-Exo: Lanifibranor-treated mesenchymal stem cells)
상기 표 2 및 도 5에서 확인할 수 있듯이, 아무 물질도 처리하지 않은 중간엽 줄기세포에 비하여, 줄기세포 전처리 물질(Lanifibranor)을 전처리한 중간엽 줄기세포에서 약 4.6배 많은 양의 엑소좀 유래 단백질이 생산되었다.As can be seen in Tables 2 and 5, compared to the mesenchymal stem cells not treated with any material, about 4.6 times more exosome-derived protein in the mesenchymal stem cells pretreated with the stem cell pre-treatment material (Lanifibranor) Was produced.
상기 결과로부터, 본 발명에 따른 상기 줄기세포 전처리 물질을 중간엽 줄기세포에 처리시, 엑소좀의 수뿐만 아니라 엑소좀 유래 단백질 (exosomal protein)의 함량 또한 증가함을 알 수 있다.From the above results, it can be seen that when the stem cell pretreatment material according to the present invention is treated on mesenchymal stem cells, not only the number of exosomes but also the content of exosome-derived proteins is increased.
2-3. Lanifibranor 처리에 따른 엑소좀 유래 RNA 양 증가2-3. Increased amount of exosome-derived RNA by lanifibranor treatment
RNA 분리용 키트 (Total exosome RNA and protein isolation kit, Invitrogen)를 이용하여 상기 실시예에서 분리된 엑소좀으로부터 전체 엑소좀 RNA를 분리하고, 나노드롭 (nanodrop)을 이용하여 RNA의 농도를 측정하였다. 이때, 비교를 위하여, 아무 전처리 물질도 처리하지 않은 것을 제외하고 실시예와 동일한 방법으로 분리된 엑소좀으로부터 전체 엑소좀 RNA를 분리하여 농도를 측정하였다. 결과를 하기 표 3 및 도 6에 나타내었다.Total exosome RNA was isolated from the exosomes isolated in the above example using an RNA isolation kit (Total exosome RNA and protein isolation kit, Invitrogen), and the concentration of RNA was measured using a nanodrop. At this time, for comparison, total exosome RNA was isolated from the isolated exosomes in the same manner as in Example, except that no pretreatment material was treated, and the concentration was measured. The results are shown in Table 3 and FIG. 6 below.
(MSC: 미처리 중간엽 줄기세포, Lani-MSC-Exo: Lanifibranor-처리 중간엽 줄기세포)(MSC: untreated mesenchymal stem cells, Lani-MSC-Exo: Lanifibranor-treated mesenchymal stem cells)
상기 표 3 및 도 도 6에서 확인할 수 있듯이, 아무 물질도 처리하지 않은 중간엽 줄기세포에 비하여, 줄기세포 전처리 물질(Lanifibranor)을 전처리한 중간엽 줄기세포에서 약 4.1배 많은 양의 엑소좀 유래 RNA가 생산되었다.As can be seen in Table 3 and FIG. 6, about 4.1 times more exosome-derived RNA in mesenchymal stem cells pretreated with stem cell pre-treatment material (Lanifibranor) compared to mesenchymal stem cells not treated with any material. Was produced.
상기 결과로부터, 본 발명에 따른 상기 줄기세포 전처리 물질을 중간엽 줄기세포에 처리시, 엑소좀의 수뿐만 아니라 엑소좀 유래 RNA (exosomal RNA)의 함량 또한 증가함을 알 수 있다.From the above results, it can be seen that when the stem cell pretreatment material according to the present invention is treated on mesenchymal stem cells, not only the number of exosomes but also the content of exosome-derived RNA (exosomal RNA) increases.
소결Sintering
본 발명에 따른 줄기세포 전처리 물질 (Lanifibranor)을 중간엽 줄기세포에 처리시 줄기세포의 줄기세포능 (Stemness)이 증가함을 알 수 있다. 또한, 본 발명에 따른 줄기세포 전처리 물질 (Lanifibranor)을 중간엽 줄기세포에 처리시 엑소좀의 수뿐만 아니라 엑소좀 유래 단백질 (exosomal protein)의 생산량 또한 증가하며, 엑소좀 유래 RNA (exosomal RNA)의 함량도 증가함을 알 수 있다.It can be seen that when the stem cell pretreatment material (Lanifibranor) according to the present invention is treated on mesenchymal stem cells, the stem cell ability (Stemness) of the stem cells is increased. In addition, when the stem cell pretreatment material (Lanifibranor) according to the present invention is treated on mesenchymal stem cells, not only the number of exosomes but also the production of exosome-derived proteins increases, and the amount of exosome-derived RNA (exosomal RNA) is increased. It can be seen that the content also increases.
따라서, 본 발명에 따른 줄기세포 전처리 물질 (Lanifibranor)은 줄기세포의 줄기세포능을 증가시킬 뿐만 아니라, 줄기세포 유래 엑소좀 생성을 촉진시키므로, 우수한 기능성을 가진 줄기세포의 생산 및 엑소좀의 대량 생산 용도로의 사용이 기대된다.Therefore, the stem cell pretreatment material (Lanifibranor) according to the present invention not only increases the stem cell ability of stem cells, but also promotes the production of stem cell-derived exosomes, so that the production of stem cells with excellent functionality and mass production of exosomes It is expected to be used for purposes.
Claims (14)
라니피브라노르 (Lanifibranor)를 포함하는 세포배양 배지에서 줄기세포를 배양하는 배양 단계.Stem cell-derived exosome production method comprising the following steps:
A culture step of culturing stem cells in a cell culture medium containing Lanifibranor.
배양된 줄기세포를 세척한 후 세포배양 배지에서 추가로 배양하는 추가 배양 단계; 및
엑소좀을 분리하는 분리 단계.The method of claim 11, wherein the method further comprises the following steps:
An additional culturing step of further culturing in a cell culture medium after washing the cultured stem cells; And
Separation step to separate exosomes.
라니피브라노르 (Lanifibranor)를 포함하는 세포배양 배지에서 줄기세포를 배양하는 배양 단계.A method for enhancing the stemness of stem cells, including the following steps:
A culture step of culturing stem cells in a cell culture medium containing Lanifibranor.
Priority Applications (15)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020200001518A KR102199640B1 (en) | 2020-01-06 | 2020-01-06 | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Lanifibranor |
| CN202311353128.1A CN117384828A (en) | 2019-06-10 | 2020-05-20 | Composition comprising hyaluronic acid for promoting production of stem cell-derived exosomes and increasing dryness |
| CN202410362445.8A CN118147050A (en) | 2019-06-10 | 2020-05-20 | Composition comprising tetrandrine for promoting production of stem cell-derived exosomes and increasing dryness |
| CN202311353123.9A CN117384827A (en) | 2019-06-10 | 2020-05-20 | Compositions comprising lanibranor for promoting stem cell-derived exosome production and increasing dryness |
| CN202410362515.XA CN118147051A (en) | 2019-06-10 | 2020-05-20 | Composition comprising resveratrol for promoting production of stem cell-derived exosomes and increasing dryness |
| EP23157455.9A EP4219686A1 (en) | 2019-06-10 | 2020-05-20 | Composition for promoting production of stem cell-derived exosomes and increasing stemness |
| PCT/KR2020/006574 WO2020251181A1 (en) | 2019-06-10 | 2020-05-20 | Composition for promoting production of stem cell-derived exosomes and increasing stemness |
| EP20823509.3A EP3981871A4 (en) | 2019-06-10 | 2020-05-20 | Composition for promoting production of stem cell-derived exosomes and increasing stemness |
| CN202311353132.8A CN117384829A (en) | 2019-06-10 | 2020-05-20 | Compositions comprising interferon-gamma for promoting stem cell-derived exosome production and increasing dryness |
| US17/601,775 US20220195384A1 (en) | 2019-06-10 | 2020-05-20 | Composition for promoting production of stem cell-derived exosomes and increasing stemness |
| JP2022515458A JP7246569B2 (en) | 2019-06-10 | 2020-05-20 | Composition for promoting stem cell-derived exosome production and enhancing stem cell potency |
| CN202080029413.6A CN113728091B (en) | 2019-06-10 | 2020-05-20 | Compositions for promoting stem cell-derived exosome production and increasing dryness |
| JP2023039190A JP7514349B2 (en) | 2019-06-10 | 2023-03-14 | Composition for promoting stem cell-derived exosome production and enhancing stem cell function, comprising lanifibranol |
| JP2023039189A JP7514348B2 (en) | 2019-06-10 | 2023-03-14 | Composition for promoting the production of stem cell-derived exosomes and enhancing stem cell function, comprising hyaluronic acid |
| JP2023039188A JP2023078272A (en) | 2019-06-10 | 2023-03-14 | Composition for promoting production of stem cell-derived exosomes and increasing stemness |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020200001518A KR102199640B1 (en) | 2020-01-06 | 2020-01-06 | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Lanifibranor |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR102199640B1 true KR102199640B1 (en) | 2021-01-07 |
Family
ID=74126912
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020200001518A KR102199640B1 (en) | 2019-06-10 | 2020-01-06 | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Lanifibranor |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR102199640B1 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210057689A (en) * | 2019-11-12 | 2021-05-21 | 브렉소젠 주식회사 | Composition for Protecting or Treating Kidney disease comprising Exosomes derived from Precursor cell of iPSC-derived mesenchymal stem cell |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101439074B1 (en) | 2014-03-07 | 2014-09-05 | 가천대학교 산학협력단 | Method for recovering stemness of adult stem cells comprising increase of PPAR expression |
| WO2018138352A1 (en) * | 2017-01-27 | 2018-08-02 | Genfit | Pharmaceutical compositions for combination therapy |
| WO2019053235A1 (en) * | 2017-09-15 | 2019-03-21 | Genfit | Non-invasive diagnostic of non-alcoholic fatty liver diseases, non-alcoholic steatohepatitis and/or liver fibrosis |
| WO2020021215A1 (en) * | 2018-07-27 | 2020-01-30 | Inventiva | Deuterated derivatives of lanifibranor |
| WO2020131578A2 (en) * | 2018-12-17 | 2020-06-25 | Mitopower Llc | Nicotinyl riboside compounds and their uses |
-
2020
- 2020-01-06 KR KR1020200001518A patent/KR102199640B1/en active IP Right Grant
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101439074B1 (en) | 2014-03-07 | 2014-09-05 | 가천대학교 산학협력단 | Method for recovering stemness of adult stem cells comprising increase of PPAR expression |
| WO2018138352A1 (en) * | 2017-01-27 | 2018-08-02 | Genfit | Pharmaceutical compositions for combination therapy |
| WO2019053235A1 (en) * | 2017-09-15 | 2019-03-21 | Genfit | Non-invasive diagnostic of non-alcoholic fatty liver diseases, non-alcoholic steatohepatitis and/or liver fibrosis |
| WO2020021215A1 (en) * | 2018-07-27 | 2020-01-30 | Inventiva | Deuterated derivatives of lanifibranor |
| WO2020131578A2 (en) * | 2018-12-17 | 2020-06-25 | Mitopower Llc | Nicotinyl riboside compounds and their uses |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210057689A (en) * | 2019-11-12 | 2021-05-21 | 브렉소젠 주식회사 | Composition for Protecting or Treating Kidney disease comprising Exosomes derived from Precursor cell of iPSC-derived mesenchymal stem cell |
| KR102630220B1 (en) | 2019-11-12 | 2024-01-29 | 브렉소젠 주식회사 | Composition for Protecting or Treating Kidney disease comprising Exosomes derived from Precursor cell of iPSC-derived mesenchymal stem cell |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101980453B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes | |
| KR102135036B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Exendin-4 | |
| KR102123268B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Hyaluronic acid | |
| JP7246569B2 (en) | Composition for promoting stem cell-derived exosome production and enhancing stem cell potency | |
| KR20190063453A (en) | Composition For Promoting Production of Stem Cell-derived Exosomes | |
| US20230190817A1 (en) | Composition including stem cell-derived exosome, and method for producing same | |
| KR102199636B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Interferon-γ | |
| KR102120329B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Resveratrol | |
| KR102199640B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Lanifibranor | |
| KR102232670B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising PMA | |
| KR102168751B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising PMA | |
| KR102130502B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Substance P | |
| EP2898065B1 (en) | Adipose tissue cells | |
| KR102130501B1 (en) | Composition For Promoting Production of Stem Cell-derived Exosomes and Increasing Stemness comprising Tetrandrine | |
| KR102523447B1 (en) | Composition for preventing or treating periodontal disease comprising exosomes derived from induced pluripotent stem cells-derived mesenchymal stem cells | |
| KR20240008054A (en) | Anti-cancer composition comprising stem cell-derived exosomes and method for preparing the same | |
| KR20240094841A (en) | Skin aging inhibiting composition comprising stem cell-derived exosomes and method for preparing the same | |
| KR20220108009A (en) | Composition for promoting the generation of exosomes derived from stem cells containing blueberry extracts | |
| KR20200047096A (en) | Composition for inducing dedifferentiation for induced pluripotent stem cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |