JP7548475B1 - 抗体製剤 - Google Patents
抗体製剤 Download PDFInfo
- Publication number
- JP7548475B1 JP7548475B1 JP2024534766A JP2024534766A JP7548475B1 JP 7548475 B1 JP7548475 B1 JP 7548475B1 JP 2024534766 A JP2024534766 A JP 2024534766A JP 2024534766 A JP2024534766 A JP 2024534766A JP 7548475 B1 JP7548475 B1 JP 7548475B1
- Authority
- JP
- Japan
- Prior art keywords
- formulation
- pharmaceutical composition
- bispecific antibody
- aqueous pharmaceutical
- heavy chain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000002360 preparation method Methods 0.000 title description 24
- 239000000203 mixture Substances 0.000 claims abstract description 292
- 238000009472 formulation Methods 0.000 claims abstract description 288
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 277
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims abstract description 232
- 239000008351 acetate buffer Substances 0.000 claims abstract description 127
- 239000011780 sodium chloride Substances 0.000 claims abstract description 116
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims abstract description 109
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims abstract description 109
- 229940068968 polysorbate 80 Drugs 0.000 claims abstract description 109
- 229920000053 polysorbate 80 Polymers 0.000 claims abstract description 109
- 239000004480 active ingredient Substances 0.000 claims abstract description 93
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims abstract description 80
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims abstract description 80
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims abstract description 80
- 229940074410 trehalose Drugs 0.000 claims abstract description 80
- 238000007920 subcutaneous administration Methods 0.000 claims abstract description 75
- 238000001990 intravenous administration Methods 0.000 claims abstract description 55
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 claims description 203
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 199
- FFEARJCKVFRZRR-SCSAIBSYSA-N D-methionine Chemical compound CSCC[C@@H](N)C(O)=O FFEARJCKVFRZRR-SCSAIBSYSA-N 0.000 claims description 117
- 230000027455 binding Effects 0.000 claims description 114
- 235000017281 sodium acetate Nutrition 0.000 claims description 91
- BDKLKNJTMLIAFE-UHFFFAOYSA-N 2-(3-fluorophenyl)-1,3-oxazole-4-carbaldehyde Chemical compound FC1=CC=CC(C=2OC=C(C=O)N=2)=C1 BDKLKNJTMLIAFE-UHFFFAOYSA-N 0.000 claims description 90
- 229940087562 sodium acetate trihydrate Drugs 0.000 claims description 90
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 81
- 229960000583 acetic acid Drugs 0.000 claims description 78
- 239000000427 antigen Substances 0.000 claims description 67
- 102000036639 antigens Human genes 0.000 claims description 67
- 108091007433 antigens Proteins 0.000 claims description 67
- DPVHGFAJLZWDOC-PVXXTIHASA-N (2r,3s,4s,5r,6r)-2-(hydroxymethyl)-6-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxane-3,4,5-triol;dihydrate Chemical compound O.O.O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 DPVHGFAJLZWDOC-PVXXTIHASA-N 0.000 claims description 52
- 229940074409 trehalose dihydrate Drugs 0.000 claims description 52
- 239000012362 glacial acetic acid Substances 0.000 claims description 35
- 239000002552 dosage form Substances 0.000 claims description 5
- 125000003275 alpha amino acid group Chemical group 0.000 claims 24
- 102100023990 60S ribosomal protein L17 Human genes 0.000 claims 8
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 abstract description 58
- 229960004452 methionine Drugs 0.000 abstract description 58
- FFEARJCKVFRZRR-UHFFFAOYSA-N L-Methionine Natural products CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 abstract description 53
- 229930195722 L-methionine Natural products 0.000 abstract description 53
- 239000000654 additive Substances 0.000 abstract description 28
- 208000024891 symptom Diseases 0.000 abstract description 15
- 208000009329 Graft vs Host Disease Diseases 0.000 abstract description 13
- 208000024908 graft versus host disease Diseases 0.000 abstract description 13
- 208000023275 Autoimmune disease Diseases 0.000 abstract description 11
- 229960002668 sodium chloride Drugs 0.000 abstract description 11
- 230000000996 additive effect Effects 0.000 abstract description 10
- 230000002401 inhibitory effect Effects 0.000 abstract description 10
- 201000005787 hematologic cancer Diseases 0.000 abstract description 9
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 abstract description 9
- 235000002639 sodium chloride Nutrition 0.000 description 113
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 73
- 238000003860 storage Methods 0.000 description 65
- 150000001413 amino acids Chemical class 0.000 description 59
- 238000012360 testing method Methods 0.000 description 59
- 238000004458 analytical method Methods 0.000 description 48
- 239000003963 antioxidant agent Substances 0.000 description 42
- 241000894007 species Species 0.000 description 41
- 230000003078 antioxidant effect Effects 0.000 description 37
- 230000002378 acidificating effect Effects 0.000 description 31
- 238000011156 evaluation Methods 0.000 description 31
- 239000006172 buffering agent Substances 0.000 description 27
- 239000013628 high molecular weight specie Substances 0.000 description 26
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 25
- 238000004255 ion exchange chromatography Methods 0.000 description 23
- 238000005259 measurement Methods 0.000 description 21
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 20
- 239000000047 product Substances 0.000 description 20
- 230000002776 aggregation Effects 0.000 description 19
- 238000004220 aggregation Methods 0.000 description 19
- 239000002245 particle Substances 0.000 description 18
- 230000003647 oxidation Effects 0.000 description 14
- 238000007254 oxidation reaction Methods 0.000 description 14
- 239000000243 solution Substances 0.000 description 14
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 14
- 230000000694 effects Effects 0.000 description 13
- 238000000034 method Methods 0.000 description 13
- 238000004007 reversed phase HPLC Methods 0.000 description 13
- 230000001965 increasing effect Effects 0.000 description 12
- 230000007774 longterm Effects 0.000 description 11
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 10
- 239000000872 buffer Substances 0.000 description 9
- 230000003139 buffering effect Effects 0.000 description 9
- 238000009792 diffusion process Methods 0.000 description 9
- 230000007935 neutral effect Effects 0.000 description 9
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 8
- 238000002835 absorbance Methods 0.000 description 8
- 230000008859 change Effects 0.000 description 8
- 229960003330 pentetic acid Drugs 0.000 description 8
- 238000013112 stability test Methods 0.000 description 8
- 230000003993 interaction Effects 0.000 description 7
- 239000000178 monomer Substances 0.000 description 7
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 6
- 206010042971 T-cell lymphoma Diseases 0.000 description 6
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 6
- 239000010419 fine particle Substances 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 108090000765 processed proteins & peptides Proteins 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 239000006228 supernatant Substances 0.000 description 6
- 208000027190 Peripheral T-cell lymphomas Diseases 0.000 description 5
- 208000031672 T-Cell Peripheral Lymphoma Diseases 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 208000020968 mature T-cell and NK-cell non-Hodgkin lymphoma Diseases 0.000 description 5
- 229930182817 methionine Natural products 0.000 description 5
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 5
- 239000004094 surface-active agent Substances 0.000 description 5
- 208000002460 Enteropathy-Associated T-Cell Lymphoma Diseases 0.000 description 4
- 206010034277 Pemphigoid Diseases 0.000 description 4
- 210000001744 T-lymphocyte Anatomy 0.000 description 4
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 4
- 239000003708 ampul Substances 0.000 description 4
- 230000001363 autoimmune Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 238000005119 centrifugation Methods 0.000 description 4
- 230000008014 freezing Effects 0.000 description 4
- 238000007710 freezing Methods 0.000 description 4
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 4
- 201000005962 mycosis fungoides Diseases 0.000 description 4
- 229920000136 polysorbate Polymers 0.000 description 4
- 229950008882 polysorbate Drugs 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 206010039073 rheumatoid arthritis Diseases 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 230000001629 suppression Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 206010009900 Colitis ulcerative Diseases 0.000 description 3
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 3
- 208000011231 Crohn disease Diseases 0.000 description 3
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- 206010058314 Dysplasia Diseases 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 206010025323 Lymphomas Diseases 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 201000004681 Psoriasis Diseases 0.000 description 3
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 3
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 3
- 108091008874 T cell receptors Proteins 0.000 description 3
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 3
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 3
- 201000006704 Ulcerative Colitis Diseases 0.000 description 3
- 206010047115 Vasculitis Diseases 0.000 description 3
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 3
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 3
- 235000011130 ammonium sulphate Nutrition 0.000 description 3
- 229940090047 auto-injector Drugs 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 208000000594 bullous pemphigoid Diseases 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 230000001506 immunosuppresive effect Effects 0.000 description 3
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 3
- 230000001589 lymphoproliferative effect Effects 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 206010028417 myasthenia gravis Diseases 0.000 description 3
- 230000003204 osmotic effect Effects 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 229940068977 polysorbate 20 Drugs 0.000 description 3
- 229940071643 prefilled syringe Drugs 0.000 description 3
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 230000001954 sterilising effect Effects 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 238000010257 thawing Methods 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 208000026872 Addison Disease Diseases 0.000 description 2
- 206010001367 Adrenal insufficiency Diseases 0.000 description 2
- 208000023328 Basedow disease Diseases 0.000 description 2
- 206010056370 Congestive cardiomyopathy Diseases 0.000 description 2
- 201000010046 Dilated cardiomyopathy Diseases 0.000 description 2
- 208000010201 Exanthema Diseases 0.000 description 2
- 208000007465 Giant cell arteritis Diseases 0.000 description 2
- 208000015023 Graves' disease Diseases 0.000 description 2
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 2
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 2
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 description 2
- 206010028811 Natural killer-cell leukaemia Diseases 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 208000033759 Prolymphocytic T-Cell Leukemia Diseases 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- 201000009594 Systemic Scleroderma Diseases 0.000 description 2
- 206010042953 Systemic sclerosis Diseases 0.000 description 2
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 2
- 208000001106 Takayasu Arteritis Diseases 0.000 description 2
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 2
- 206010047642 Vitiligo Diseases 0.000 description 2
- 102100038968 WAP four-disulfide core domain protein 1 Human genes 0.000 description 2
- 208000017515 adrenocortical insufficiency Diseases 0.000 description 2
- 208000015230 aggressive NK-cell leukemia Diseases 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 150000004683 dihydrates Chemical class 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 201000005884 exanthem Diseases 0.000 description 2
- 210000004475 gamma-delta t lymphocyte Anatomy 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 201000002215 juvenile rheumatoid arthritis Diseases 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 238000001139 pH measurement Methods 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 201000006292 polyarteritis nodosa Diseases 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 206010037844 rash Diseases 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 206010048628 rheumatoid vasculitis Diseases 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 2
- 206010043207 temporal arteritis Diseases 0.000 description 2
- 239000012529 ultrafiltration/diafiltration (UF/DF) membrane Substances 0.000 description 2
- 239000008215 water for injection Substances 0.000 description 2
- 206010056508 Acquired epidermolysis bullosa Diseases 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- 206010002065 Anaemia megaloblastic Diseases 0.000 description 1
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 1
- 206010002412 Angiocentric lymphomas Diseases 0.000 description 1
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 1
- 208000002267 Anti-neutrophil cytoplasmic antibody-associated vasculitis Diseases 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 208000003343 Antiphospholipid Syndrome Diseases 0.000 description 1
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 1
- 206010055128 Autoimmune neutropenia Diseases 0.000 description 1
- 206010069002 Autoimmune pancreatitis Diseases 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000028564 B-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 208000009137 Behcet syndrome Diseases 0.000 description 1
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 1
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 1
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 206010008609 Cholangitis sclerosing Diseases 0.000 description 1
- 208000030939 Chronic inflammatory demyelinating polyneuropathy Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 208000015943 Coeliac disease Diseases 0.000 description 1
- 208000010007 Cogan syndrome Diseases 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 201000003066 Diffuse Scleroderma Diseases 0.000 description 1
- 208000006926 Discoid Lupus Erythematosus Diseases 0.000 description 1
- 206010014954 Eosinophilic fasciitis Diseases 0.000 description 1
- 208000018428 Eosinophilic granulomatosis with polyangiitis Diseases 0.000 description 1
- 208000033371 Extranodal NK/T-cell lymphoma, nasal type Diseases 0.000 description 1
- 208000016937 Extranodal nasal NK/T cell lymphoma Diseases 0.000 description 1
- 206010016207 Familial Mediterranean fever Diseases 0.000 description 1
- 208000004930 Fatty Liver Diseases 0.000 description 1
- 208000001640 Fibromyalgia Diseases 0.000 description 1
- 208000024869 Goodpasture syndrome Diseases 0.000 description 1
- 206010072579 Granulomatosis with polyangiitis Diseases 0.000 description 1
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 1
- 208000008899 Habitual abortion Diseases 0.000 description 1
- 208000001204 Hashimoto Disease Diseases 0.000 description 1
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- 206010020850 Hyperthyroidism Diseases 0.000 description 1
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 1
- 208000021330 IgG4-related disease Diseases 0.000 description 1
- 208000037142 IgG4-related systemic disease Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 208000004187 Immunoglobulin G4-Related Disease Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 208000003456 Juvenile Arthritis Diseases 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- -1 L-methionine Chemical class 0.000 description 1
- 208000006404 Large Granular Lymphocytic Leukemia Diseases 0.000 description 1
- 206010023791 Large granular lymphocytosis Diseases 0.000 description 1
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 1
- 208000034624 Leukocytoclastic Cutaneous Vasculitis Diseases 0.000 description 1
- 208000032514 Leukocytoclastic vasculitis Diseases 0.000 description 1
- 208000001244 Linear IgA Bullous Dermatosis Diseases 0.000 description 1
- 208000012309 Linear IgA disease Diseases 0.000 description 1
- 208000000185 Localized scleroderma Diseases 0.000 description 1
- 206010050551 Lupus-like syndrome Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 208000030289 Lymphoproliferative disease Diseases 0.000 description 1
- 208000000682 Megaloblastic Anemia Diseases 0.000 description 1
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 1
- 208000003250 Mixed connective tissue disease Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 206010061323 Optic neuropathy Diseases 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 241000721454 Pemphigus Species 0.000 description 1
- 208000031845 Pernicious anaemia Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 208000007048 Polymyalgia Rheumatica Diseases 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 208000009052 Precursor T-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 1
- 206010036697 Primary hypothyroidism Diseases 0.000 description 1
- 208000033826 Promyelocytic Acute Leukemia Diseases 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 206010062164 Seronegative arthritis Diseases 0.000 description 1
- 208000009359 Sezary Syndrome Diseases 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 208000010502 Subcutaneous panniculitis-like T-cell lymphoma Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 201000008736 Systemic mastocytosis Diseases 0.000 description 1
- 201000008717 T-cell large granular lymphocyte leukemia Diseases 0.000 description 1
- 208000026651 T-cell prolymphocytic leukemia Diseases 0.000 description 1
- 208000020982 T-lymphoblastic lymphoma Diseases 0.000 description 1
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 1
- 206010052568 Urticaria chronic Diseases 0.000 description 1
- 208000025749 Vogt-Koyanagi-Harada disease Diseases 0.000 description 1
- 208000034705 Vogt-Koyanagi-Harada syndrome Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 229960002964 adalimumab Drugs 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 208000004631 alopecia areata Diseases 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 206010002449 angioimmunoblastic T-cell lymphoma Diseases 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 206010003883 azoospermia Diseases 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- OWMVSZAMULFTJU-UHFFFAOYSA-N bis-tris Chemical compound OCCN(CCO)C(CO)(CO)CO OWMVSZAMULFTJU-UHFFFAOYSA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000000533 capillary isoelectric focusing Methods 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 208000016644 chronic atrophic gastritis Diseases 0.000 description 1
- 201000005795 chronic inflammatory demyelinating polyneuritis Diseases 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000024376 chronic urticaria Diseases 0.000 description 1
- 208000004921 cutaneous lupus erythematosus Diseases 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 201000001981 dermatomyositis Diseases 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000007922 dissolution test Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000002327 eosinophilic effect Effects 0.000 description 1
- 201000011114 epidermolysis bullosa acquisita Diseases 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000013022 formulation composition Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000003168 generic drug Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 206010066957 hepatosplenic T-cell lymphoma Diseases 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 201000006362 hypersensitivity vasculitis Diseases 0.000 description 1
- 208000003532 hypothyroidism Diseases 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000005934 immune activation Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 201000008319 inclusion body myositis Diseases 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000001155 isoelectric focusing Methods 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 208000007282 lymphomatoid papulosis Diseases 0.000 description 1
- 201000001268 lymphoproliferative syndrome Diseases 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 231100001016 megaloblastic anemia Toxicity 0.000 description 1
- 206010063344 microscopic polyangiitis Diseases 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 206010065579 multifocal motor neuropathy Diseases 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- 230000002071 myeloproliferative effect Effects 0.000 description 1
- 208000008795 neuromyelitis optica Diseases 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 1
- 208000020911 optic nerve disease Diseases 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 238000012510 peptide mapping method Methods 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 208000005987 polymyositis Diseases 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 208000000814 primary cutaneous anaplastic large cell lymphoma Diseases 0.000 description 1
- 201000000742 primary sclerosing cholangitis Diseases 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 201000008158 rapidly progressive glomerulonephritis Diseases 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- 208000010157 sclerosing cholangitis Diseases 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 201000009890 sinusitis Diseases 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 231100000046 skin rash Toxicity 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- UHJBUYLXLTVQRO-UHFFFAOYSA-M sodium;acetate;dihydrate Chemical compound O.O.[Na+].CC([O-])=O UHJBUYLXLTVQRO-UHFFFAOYSA-M 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 201000005671 spondyloarthropathy Diseases 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000011100 viral filtration Methods 0.000 description 1
- 239000012905 visible particle Substances 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
Images
Landscapes
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
Abstract
Description
<1> 抗体(好ましくは、抗PD-1/CD3二重特異性抗体)を有効成分として含み、さらに、緩衝剤(好ましくは、酢酸緩衝剤)、トレハロース、酸化防止剤(好ましくは、L-メチオニン)、ポリソルベート80および塩化ナトリウムを含む、皮下投与用もしくは静脈内投与用水性医薬組成物またはその製剤、
<2> 前項<1>記載の水性医薬組成物またはその製剤と生物学的同等性を有する皮下投与用もしくは静脈内投与用水性医薬組成物またはその製剤、ならびに
<3> 前項<1>もしくは<2>記載の水性医薬組成物またはその製剤の自己免疫疾患もしくは移植片対宿主病(GVHD)あるいは血液がんの予防、症状進展抑制、再発抑制および/または治療における使用。
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖から構成される。ここで、
(a)前項(i)の重鎖は、配列番号1、配列番号2、配列番号3、配列番号4および配列番号5から選択される何れか一つのアミノ酸配列からなり、
(b)前項(ii)の重鎖は、配列番号6のアミノ酸配列からなり、ならびに
(c)前項(i)および前項(ii)の軽鎖はともに、配列番号7のアミノ酸配列からなる。
(A)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20 mM、より具体的には、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182 mM、より具体的には、約182.38 mM)のトレハロース、
(d)約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10 mM、より具体的には、約10.05 mM)のL-メチオニン、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、および
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23 mM、より具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である医薬組成物、
(B)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20 mM、より具体的には、約20.07 mM)の酢酸緩衝剤、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182 mM、より具体的には、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10 mM、より具体的には、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、および
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23 mM、より具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である医薬組成物、ならびに、
(C)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20 mM、より具体的には、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182 mM、より具体的には、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10 mM、より具体的には、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、および
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23 mM、より具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である医薬組成物である。なお、これら(A)~(C)の水性医薬組成物は、静脈内投与および皮下投与の何れにおいても使用できる。
(D)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20 mM、より具体的には、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182 mM、より具体的には、約182.38 mM)のトレハロース、
(d)約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10 mM、より具体的には、約10.05 mM)のL-メチオニン、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、および
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23 mM、より具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である医薬組成物、
(E)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20 mM、より具体的には、約20.07 mM)の酢酸緩衝剤、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182 mM、より具体的には、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10 mM、より具体的には、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、および
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23 mM、より具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である医薬組成物、ならびに、
(F)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20 mM、より具体的には、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182 mM、より具体的には、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10 mM、より具体的には、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、および
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23 mM、より具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは約5.0)である医薬組成物である。
(A1)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約7.3~約73.0 mMの酢酸緩衝剤、
(c)約5~約286.1 mMのトレハロース、
(d)約5~約30.2 mMのL-メチオニン、
(e)約0.01~約0.5 %(w/v)のポリソルベート80、および
(f)約0.5~約34.2 mMの塩化ナトリウムを含み、pHが約4.7~約5.3である医薬組成物であり、好ましくは、
(B1)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約14.6~約43.8 mM(好ましくは、約18~約22 mM)の酢酸緩衝剤、
(c)約10~約207.9 mM(好ましくは、約172~約193 mM)のトレハロース、
(d)約5~約20 mM(好ましくは、約5~約15 mM)のL-メチオニン、
(e)約0.05~約0.3 %(w/v)(好ましくは、約0.08~約0.12 %(w/v))のポリソルベート80、および
(f)約1.0~約25.7 mM(好ましくは、約19.6~約25.7 mM)の塩化ナトリウムを含み、pHが約4.9~約5.1である医薬組成物であり、より好ましくは、
(C1)(a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分(好ましくは、抗体α)として含み、さらに、
(b)約20.1 mM(具体的には、約20.07 mM)の酢酸緩衝剤、
(c)約182.4 mM(具体的には、約182.38 mM)のトレハロース、
(d)約10.1 mM(具体的には、約10.05 mM)のL-メチオニン、
(e)約0.1 %(w/v)のポリソルベート80、および
(f)約23.3 mM(具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約5.0である医薬組成物である。なお、これら(A1)~(C1)の水性医薬組成物も、静脈内投与および皮下投与の何れにおいても使用できる。
(D1)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約7.3~約73.0 mMの酢酸緩衝剤、
(c)約5~約286.1 mMのトレハロース、
(d)約5~約30.2 mMのL-メチオニン、
(e)約0.01~約0.5 %(w/v)のポリソルベート80、および
(f)約0.5~約34.2 mMの塩化ナトリウムを含み、pHが約4.7~約5.3である医薬組成物であり、好ましくは、
(E1)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約14.6~約43.8 mM(好ましくは、約18~約22 mM)の酢酸緩衝剤、
(c)約10~約207.9 mM(好ましくは、約172~約193 mM)のトレハロース、
(d)約5~約20 mM(好ましくは、約5~約15 mM)のL-メチオニン、
(e)約0.05~約0.3 %(w/v)(好ましくは、約0.08~約0.12 %(w/v))のポリソルベート80、および
(f)約1.0~約25.7 mM(好ましくは、約19.6~約25.7 mM)の塩化ナトリウムを含み、pHが約4.9~約5.1である医薬組成物であり、より好ましくは、
(F1)(a)約100 mg/mLの抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約20.1 mM(具体的には、約20.07 mM)の酢酸緩衝剤、
(c)約182.4 mM(具体的には、約182.38 mM)のトレハロース、
(d)約10.1 mM(具体的には、約10.05 mM)のL-メチオニン、
(e)約0.1 %(w/v)のポリソルベート80、および
(f)約23.3 mM(具体的には、約23.27 mM)の塩化ナトリウムを含み、pHが約5.0である医薬組成物である。
(A2)(a)約0.5~約6 mgまたは約25~約125 mg(各々好ましくは、約2.5 mg、約5 mgまたは約50 mg)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約3.4~約34.0 mgの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約9.46~約541.2 mgのトレハロース二水和物、
(d)約3.75~約22.5 mgのL-メチオニン、
(e)約0.5~約25.0 mgのポリソルベート80、ならびに
(f)約0.15~約10.0 mgの塩化ナトリウムを含み、pHが約4.7~約5.3である医薬組成物であり、好ましくは、
(B2)(a)約0.5~約6 mgまたは約25~約125 mg(各々好ましくは、約2.5 mg、約5 mgまたは約50 mg)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約6.8~約20.4 mg(好ましくは、約8.4~約10.2 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約18.9~約393.3 mg(好ましくは、約325~約365.1 mg)のトレハロース二水和物、
(d)約3.75~約15.0 mg(好ましくは、約3.75~11.25 mg)のL-メチオニン、
(e)約2.5~約15.0 mg(好ましくは、約4~6 mg)のポリソルベート80、ならびに
(f)約0.29~約7.5 mg(好ましくは、約5.8~約7.5 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1である医薬組成物であり、より好ましくは、
(C2)(a)約2.5 mg、約5 mgまたは約50 mgの抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約9.4 mg(具体的には、約9.35 mg)の酢酸ナトリウム三水和物および約1.9 mgの氷酢酸からなる酢酸緩衝剤、
(c)約345 mgのトレハロース二水和物、
(d)約7.5 mgのL-メチオニン、
(e)約5.0 mgのポリソルベート80、ならびに
(f)約6.8 mgの塩化ナトリウムを含み、pHが約5.0である医薬組成物である。なお、これら(A2)~(C2)の水性医薬組成物も、静脈内投与および皮下投与の何れにおいても使用できる。
(D2)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約0.68~約6.8 mg/mLの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の酢酸からなる酢酸緩衝剤、
(c)約1.9~約108.3 mg/mLのトレハロース二水和物、
(d)約0.75~約4.5 mg/mLのL-メチオニン、
(e)約0.1~約5.0 mg/mLのポリソルベート80、ならびに
(f)約0.03~約2.0 mg/mLの塩化ナトリウムを含み、pHが約4.7~約5.3である医薬組成物であり、好ましくは、
(E2)(a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg/mL(好ましくは、約1.68~約2.05 mg/mL)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg/mL(好ましくは、約65.1~約72.6 mg/mL)のトレハロース二水和物、
(d)約0.75~約3.0 mg/mL(好ましくは、約0.75~約2.25 mg/mL)のL-メチオニン、
(e)約0.5~約3.0 mg/mL(好ましくは、約0.8~約1.2 mg/mL)のポリソルベート80、ならびに
(f)約0.06~約1.5 mg/mL(好ましくは、約1.15~約1.5 mg/mL)の塩化ナトリウムを含み、pHが約4.9~約5.1である医薬組成物であり、より好ましくは、
(F2)(a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約1.9 mg/mL(具体的には、約1.87 mg/mL)の酢酸ナトリウム三水和物および約0.4 mg/mL(具体的には、約0.38 mg/mL)の酢酸からなる酢酸緩衝剤、
(c)約69 mg/mLのトレハロース二水和物、
(d)約1.5 mg/mLのL-メチオニン、
(e)約1.0 mg/mLのポリソルベート80、ならびに
(f)約1.4 mg/mL(具体的には、約1.36 mg/mL)の塩化ナトリウムを含み、pHが約5.0である医薬組成物である。なお、これら(D2)~(F2)の水性医薬組成物も、同様に、静脈内投与および皮下投与の何れにおいても使用できる。
(A3)(a)約80~約150 mg(好ましくは、約100 mg)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約0.68~約6.8 mgの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約1.9~約108.3 mgのトレハロース二水和物、
(d)約0.75~約4.5 mgのL-メチオニン、
(e)約0.1~約5.0 mgのポリソルベート80、ならびに
(f)約0.03~約2.0 mgの塩化ナトリウムを含み、pHが約4.7~約5.3である医薬組成物であり、好ましくは、
(B3)(a)約80~約150 mg(好ましくは、約100 mg)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg(好ましくは、約1.68~約2.05 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mgの(好ましくは、約65.1~約72.6 mg)トレハロース二水和物、
(d)約0.75~約3.0 mg(好ましくは、約0.75~約2.25 mg)のL-メチオニン、
(e)約0.5~約3.0 mgのポリソルベート80、ならびに
(f)約0.06~約1.5 mg(好ましくは、約1.15~約1.5 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1である医薬組成物であり、より好ましくは、
(C3)(a)約100 mgの抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約1.9 mg(具体的には、約1.87 mg)の酢酸ナトリウム三水和物および約0.4 mg(具体的には、約0.38 mg)の氷酢酸からなる酢酸緩衝剤、
(c)約69 mgのトレハロース二水和物、
(d)約1.5 mgのL-メチオニン、
(e)約1.0 mgのポリソルベート80、ならびに
(f)約1.4 mg(具体的には、約1.36 mg)の塩化ナトリウムを含み、pHが約5.0である医薬組成物である。
(D3)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約0.68~約6.8 mg/mLの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の酢酸からなる酢酸緩衝剤、
(c)約1.9~約108.3 mg/mLのトレハロース二水和物、
(d)約0.75~約4.5 mg/mLのL-メチオニン、
(e)約0.1~約5.0 mg/mLのポリソルベート80、ならびに
(f)約0.03~約2.0 mg/mLの塩化ナトリウムを含み、pHが約4.7~約5.3である医薬組成物であり、好ましくは、
(E3)(a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg/mL(好ましくは、約1.68~約2.05 mg/mL)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg/mLの(好ましくは、約65.1~約72.6 mg/mL)トレハロース二水和物、
(d)約0.75~約3.0 mg/mL(好ましくは、約0.75~約2.25 mg/mL)のL-メチオニン、
(e)約0.5~約3.0 mg/mL(好ましくは、約0.8~約1.2 mg/mL)のポリソルベート80、ならびに
(f)約0.06~約1.5 mg/mL(好ましくは、約1.15~約1.5 mg/mL)の塩化ナトリウムを含み、pHが約4.9~約5.1である医薬組成物であり、より好ましくは、
(F3)(a)約100 mg/mLの抗PD-1/CD3二重特異性抗体(好ましくは、抗体α)を有効成分として含み、さらに、
(b)約1.9 mg/mL(具体的には、約1.87 mg/mL)の酢酸ナトリウム三水和物および約0.4 mg/mL(具体的には、約0.38 mg/mL)の酢酸からなる酢酸緩衝剤、
(c)約69 mg/mLのトレハロース二水和物、
(d)約1.5 mg/mLのL-メチオニン、
(e)約1.0 mg/mLのポリソルベート80、ならびに
(f)約1.4 mg/mL(具体的には、約1.36 mg/mL)の塩化ナトリウムを含み、pHが約5.0である医薬組成物である。
抗PD-1/CD3二重特異性抗体にかかる本発明の水性医薬組成物またはその製剤は、自己免疫疾患もしくは移植片対宿主病(GVHD)あるいは血液がんの予防、症状進展抑制、再発抑制および/または治療に有用である。
[1] 抗体(好ましくは、抗PD-1/CD3二重特異性抗体)を有効成分として含み、さらに、緩衝剤(好ましくは、酢酸緩衝剤)、トレハロース、酸化防止剤(好ましくは、L-メチオニン)、ポリソルベート80および塩化ナトリウムを含む、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[2] 抗PD-1/CD3二重特異性抗体が、約0.01~約200 mg/mL(好ましくは、約0.1~約150 mg/mL(好ましくは、約0.1~約1.2 mg/mL、約5~約25 mg/mLまたは約80~約150 mg/mL))である、前項[1]記載の水性医薬組成物またはその製剤;
[3] 抗PD-1/CD3二重特異性抗体が、約0.01 mg/mL、約0.02 mg/mL、約0.03 mg/mL、約0.04 mg/mL、約0.05 mg/mL、約0.06 mg/mL、約0.07 mg/mL、約0.08 mg/mL、約0.09 mg/mL、約0.1 mg/mL、約0.2 mg/mL、約0.3 mg/mL、約0.4 mg/mL、約0.5 mg/mL、約0.6 mg/mL、約0.7 mg/mL、約0.8 mg/mL、約0.9 mg/mL、約1 mg/mL、約1.1 mg/mL、約1.2 mg/mL、約1.3 mg/mL、約1.4 mg/mL、約1.5 mg/mL、約2 mg/mL、約5 mg/mL、約10 mg/mL、約15 mg/mL、約20 mg/mL、約25 mg/mL、約30 mg/mL、約40 mg/mL、約50 mg/mL、約60 mg/mL、約70 mg/mL、約80 mg/mL、約90 mg/mL、約100 mg/mL、約110 mg/mL、約120 mg/mL、約130 mg/mL、約140 mg/mL、約150 mg/mL、約160 mg/mL、約170 mg/mL、約180 mg/mL、約190 mg/mLまたは約200 mg/mLである、前項[1]記載の水性医薬組成物またはその製剤;
[4] 抗PD-1/CD3二重特異性抗体が、約0.5 mg/mL、約1 mg/mL、約10 mg/mLまたは約100 mg/mLである、前項[1]記載の水性医薬組成物またはその製剤;
[5] 酢酸緩衝剤が、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM)である、前項[1]~[4]の何れか一項記載の水性医薬組成物またはその製剤;
[6] 酢酸緩衝剤が、約7.3 mM、約10 mM、約14.6 mM、約15 mM、約18 mM、約20 mM、約20.07 mM、約21 mM、約22 mM、約25 mM、約30 mM、約35 mM、約40 mM、約43.8 mM、約45 mM、約50 mM、約55 mM、約60 mM、約70 mMまたは約73.0 mMである、前項[1]~[4]の何れか一項記載の水性医薬組成物またはその製剤;
[7] 酢酸緩衝剤が、約20.07 mMである、前項[1]~[4]の何れか一項記載の水性医薬組成物またはその製剤;
[8] 酢酸緩衝剤が、酢酸ナトリウム三水和物および酢酸の組み合わせからなる、前項[5]~[7]の何れか一項記載の水性医薬組成物またはその製剤;
[9] トレハロースが、約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM)である、前項[1]~[8]の何れか一項記載の水性医薬組成物またはその製剤;
[10] トレハロースが、約5 mM、約10 mM、約20 mM、約30 mM、約40 mM、約50 mM、約60 mM、約70 mM、約80 mM、約90 mM、約100 mM、約110 mM、約120 mM、約130 mM、約140 mM、約150 mM、約160 mM、約170 mM、約172 mM、約180 mM、約182 mM、約182.3 mM、約182.38 mM、約182.4 mM、約190 mM、約193 mM、約200 mM、約207.9 mM、約210 mM、約220 mM、約225 mM、約230 mM、約240 mM、約250 mM、約260 mM、約270 mM、約280 mM、約285 mM、約286 mMまたは約286.1 mMである、前項[1]~[8]の何れか一項記載の水性医薬組成物またはその製剤;
[11] トレハロースが、約182.38 mMである、前項[1]~[8]の何れか一項記載の水性医薬組成物またはその製剤;
[12] トレハロースが、トレハロース二水和物である、前項[1]~[8]の何れか一項記載の水性医薬組成物またはその製剤;
[13] L-メチオニンが、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM)である、前項[1]~[12]の何れか一項記載の水性医薬組成物またはその製剤;
[14] L-メチオニンが、約5 mM、約10 mM、約10.05 mM、約15 mM、約20 mM、約25 mM、約30 mMまたは約30.2 mMである、前項[1]~[12]の何れか一項記載の水性医薬組成物またはその製剤;
[15] L-メチオニンが、約10.05 mMである、前項[1]~[12]の何れか一項記載の水性医薬組成物またはその製剤;
[16] ポリソルベート80が、約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、さらに好ましくは、約0.08~約0.12 %(w/v))である、前項[1]~[15]の何れか一項記載の水性医薬組成物またはその製剤;
[17] ポリソルベート80が、約0.01 %(w/v)、約0.02 %(w/v)、約0.04 %(w/v)、約0.05 %(w/v)、約0.06 %(w/v)、約0.08 %(w/v)、約0.1 %(w/v)、約0.12 %(w/v)、約0.15 %(w/v)、約0.2 %(w/v)、約0.25 %(w/v)、約0.3 %(w/v)、約0.35 %(w/v)、約0.4 %(w/v)、約0.45 %(w/v)または約0.5 %(w/v)である、前項[1]~[15]の何れか一項記載の水性医薬組成物またはその製剤;
[18] ポリソルベート80が、約0.1 %(w/v)である、前項[1]~[15]の何れか一項記載の水性医薬組成物またはその製剤;
[19] 塩化ナトリウムが、約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM)である、前項[1]~[18]の何れか一項記載の水性医薬組成物またはその製剤;
[20] 塩化ナトリウムが、約0.5 mM、約1 mM、約2 mM、約3 mM、約4 mM、約5 mM、約6 mM、約7 mM、約8 mM、約9 mM、約10 mM、約11 mM、約12 mM、約13 mM、約14 mM、約15 mM、約16 mM、約17 mM、約18 mM、約19 mM、約19.6 mM、約20 mM、約21 mM、約22 mM、約23 mM、約23.27 mM、約24.0 mM、約25 mM、約25.7 mM、約30 mMまたは約34.2 mMである、前項[1]~[18]の何れか一項記載の水性医薬組成物またはその製剤;
[21] 塩化ナトリウムが、約23.27 mMである、前項[1]~[18]の何れか一項記載の水性医薬組成物またはその製剤;
[22] 水性医薬組成物(好ましくは、静脈内投与用)の単位製剤当たりの容量が約5 mLである、前項[1]~[21]の何れか一項記載の水性医薬組成物またはその製剤;
[23] 前項[22]記載の水性医薬組成物に適用される酢酸緩衝剤が、(i)約3.4~約34 mgの酢酸ナトリウム三水和物、および(ii)前項(i)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)となる分量の氷酢酸からなる、前項[22]記載の水性医薬組成物またはその製剤;
[24] 前項[22]記載の水性医薬組成物に適用される酢酸緩衝剤が、(i)約6.8~約20.4 mg(好ましくは、約8.4~約10.2 mg)の酢酸ナトリウム三水和物、および(ii)前項(i)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)となる分量の氷酢酸からなる、前項[22]記載の水性医薬組成物またはその製剤;
[25] 前項[22]記載の水性医薬組成物に適用される酢酸緩衝剤が、約9.4 mg(具体的には、約9.35 mg)の酢酸ナトリウム三水和物および約1.9 mgの氷酢酸からなる、前項[22]記載の水性医薬組成物またはその製剤;
[26] トレハロースがトレハロース二水和物である、前項[22]~[25]の何れか一項記載の水性医薬組成物またはその製剤;
[27] トレハロース二水和物が、約9.46~約541.2 mg(好ましくは、約18.9~約393.3 mg、より好ましくは、約325~約365.1 mg、さらにより好ましくは、約345 mg)である、前項[26]記載の水性医薬組成物またはその製剤;
[28] 酸化防止剤がL-メチオニンである、前項[22]~[27]の何れか一項記載の水性医薬組成物またはその製剤;
[29] L-メチオニンが、約3.75~約22.5 mg(好ましくは、約3.75~約15.0 mg、より好ましくは、約3.75~約11.25 mg、さらにより好ましくは、約7.5 mg)である、前項[28]記載の水性医薬組成物またはその製剤;
[30] ポリソルベート80が、約0.5~約25 mg(好ましくは、約2.5~約15 mg、より好ましくは、約5 mg)である、前項[22]~[29]の何れか一項記載の水性医薬組成物またはその製剤;
[31] 塩化ナトリウムが、約0.15~約10.0 mg(好ましくは、約0.29~約7.5 mg、より好ましくは、約5.8~約7.5 mg、さらにより好ましくは、約6.8 mg)である、前項[22]~[30]の何れか一項記載の水性医薬組成物またはその製剤;
[32] 水性医薬組成物の単位製剤当たりの容量が約2 mLであり、各添加物の分量が、前項[23]~[31]の何れか一または二以上に記載の各添加物の分量の約2/5量である、前項[1]~[21]の何れか一項記載の水性医薬組成物またはその製剤;
[33] 水性医薬組成物(好ましくは、皮下投与用)の単位製剤当たりの容量が約1 mLである、前項[1]~[21]の何れか一項記載の水性医薬組成物またはその製剤;
[34] 前項[33]記載の水性医薬組成物に適用される酢酸緩衝剤が、(i)約0.68~約6.8 mgの酢酸ナトリウム三水和物、および(ii)前項(i)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)となる分量の氷酢酸からなる、前項[33]記載の水性医薬組成物またはその製剤;
[35] 前項[33]記載の水性医薬組成物に適用される酢酸緩衝剤が、(i)約1.36~約4.08 mg(好ましくは、約1.68~約2.05 mg)の酢酸ナトリウム三水和物、および(ii)前項(i)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)となる分量の氷酢酸からなる、前項[33]記載の水性医薬組成物またはその製剤;
[36] 前項[33]記載の水性医薬組成物に適用される酢酸緩衝剤が、約1.9 mg(具体的には、約1.87 mg)の酢酸ナトリウム三水和物および約0.4 mg(具体的には、約0.38 mg)の氷酢酸からなる、前項[33]記載の水性医薬組成物またはその製剤;
[37] トレハロースがトレハロース二水和物である、前項[33]~[36]の何れか一項記載の水性医薬組成物またはその製剤;
[38] トレハロース二水和物が、約1.9~約108.3 mg(好ましくは、約3.8~約78.7 mg、より好ましくは、約65.1~約72.6 mg、さらにより好ましくは、約69 mg)である、前項[37]記載の水性医薬組成物またはその製剤;
[39] 酸化防止剤がL-メチオニンである、前項[33]~[38]の何れか一項記載の水性医薬組成物またはその製剤;
[40] L-メチオニンが、約0.75~約4.5 mg(好ましくは、約0.75~約3.0 mg、より好ましくは、約0.75~約2.25 mg、さらにより好ましくは、約1.5 mg)である、前項[39]記載の水性医薬組成物またはその製剤;
[41] ポリソルベート80が、約0.1~約5.0 mg(好ましくは、約0.5~約3.0 mg、より好ましくは、約1.0 mg)である、前項[33]~[40]の何れか一項記載の水性医薬組成物またはその製剤;
[42] 塩化ナトリウムが、約0.03~約2.0 mg(好ましくは、約0.06~約1.5 mg、より好ましくは、約1.15~約1.5 mg、さらにより好ましくは、約1.4 mg(具体的には、約1.36 mg))である、前項[33]~[41]の何れか一項記載の水性医薬組成物またはその製剤;
[43] 当該水性医薬組成物のpHが、約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である、前項[1]~[42]の何れか一項記載の水性医薬組成物またはその製剤;
[44] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約7.3~約73.0 mMの酢酸緩衝剤、
(c)約5~約286.1 mMのトレハロース、
(d)約5~約30.2 mMのL-メチオニン、
(e)約0.01~約0.5 %(w/v)のポリソルベート80、ならびに
(f)約0.5~約34.2 mMの塩化ナトリウムを含み、pHが約4.7~約5.3である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[45] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約14.6~約43.8 mM(好ましくは、約18~約22 mM)の酢酸緩衝剤、
(c)約10~約207.9 mM(好ましくは、約172~約193 mM)のトレハロース、
(d)約5~約20 mM(好ましくは、約5~約15 mM)のL-メチオニン、
(e)約0.05~約0.3 %(w/v)(好ましくは、約0.08~約0.12 %(w/v))のポリソルベート80、ならびに
(f)約1.0~約25.7 mM(好ましくは、約19.6~約25.7 mM)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[46] (a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約20.07 mMの酢酸緩衝剤、
(c)約182.38 mMのトレハロース、
(d)約10.05 mMのL-メチオニン、
(e)約0.1 %(w/v)のポリソルベート80、ならびに
(f)約23.27 mMの塩化ナトリウムを含み、pHが約5.0である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[47] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約7.3~約73.0 mMの酢酸緩衝剤、
(c)約5~約286.1 mMのトレハロース、
(d)約5~約30.2 mMのL-メチオニン、
(e)約0.01~約0.5 %(w/v)のポリソルベート80、ならびに
(f)約0.5~約34.2 mMの塩化ナトリウムを含み、pHが約4.7~約5.3である、皮下投与用の水性医薬組成物またはその製剤;
[48] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約14.6~約43.8 mM(好ましくは、約18~約22 mM)の酢酸緩衝剤、
(c)約10~約207.9 mM(好ましくは、約172~約193 mM)のトレハロース、
(d)約5~約20 mM(好ましくは、約5~約15 mM)のL-メチオニン、
(e)約0.05~約0.3 %(w/v)(好ましくは、約0.08~約0.12 %(w/v))のポリソルベート80、ならびに
(f)約1.0~約25.7 mM(好ましくは、約19.6~約25.7 mM)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用の水性医薬組成物またはその製剤;
[49] (a)約100 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約20.07 mMの酢酸緩衝剤、
(c)約182.38 mMのトレハロース、
(d)約10.05 mMのL-メチオニン、
(e)約0.1 %(w/v)のポリソルベート80、ならびに
(f)約23.27 mMの塩化ナトリウムを含み、pHが約5.0である、皮下投与用の水性医薬組成物またはその製剤;
[50] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約0.68~約6.8 mg/mLの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の酢酸からなる酢酸緩衝剤、
(c)約1.9~約108.3 mg/mLのトレハロース二水和物、
(d)約0.75~約4.5 mg/mLのL-メチオニン、
(e)約0.1~約5.0 mg/mLのポリソルベート80、ならびに
(f)約0.03~約2.0 mg/mLの塩化ナトリウムを含み、pHが約4.7~約5.3である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[51] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg/mL(好ましくは、約1.68~約2.05 mg/mL)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg/mL(好ましくは、約65.1~約72.6 mg/mL)のトレハロース二水和物、
(d)約0.75~約3.0 mg/mL(好ましくは、約0.75~約2.25 mg/mL)のL-メチオニン、
(e)約0.5~約3.0 mg/mL(好ましくは、約0.8~約1.2 mg/mL)のポリソルベート80、ならびに
(f)約0.06~約1.5 mg/mL(好ましくは、約1.15~約1.5 mg/mL)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[52] (a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約1.9 mg/mL(具体的には、約1.87 mg/mL)の酢酸ナトリウム三水和物および約0.4 mg/mL(具体的には、約0.38 mg/mL)の酢酸からなる酢酸緩衝剤、
(c)約69 mg/mLのトレハロース二水和物、
(d)約1.5 mg/mLのL-メチオニン、
(e)約1.0 mg/mLのポリソルベート80、ならびに
(f)約1.4 mg/mL(具体的には、約1.36 mg/mL)の塩化ナトリウムを含み、pHが約5.0である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[53] (a)約0.5~約6 mgまたは約25~約125 mg(各々好ましくは、約2.5 mg、約5 mgまたは約50 mg)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約3.4~約34.0 mgの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約9.46~約541.2 mgのトレハロース二水和物、
(d)約3.75~約22.5 mgのL-メチオニン、
(e)約0.5~約25.0 mgのポリソルベート80、ならびに
(f)約0.15~約10.0 mgの塩化ナトリウムを含み、pHが約4.7~約5.3であり、単位製剤当たりの容量が約5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[54] (a)約0.5~約6 mgまたは約25~約125 mg(各々好ましくは、約2.5 mg、約5 mgまたは約50 mg)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約6.8~約20.4 mg(好ましくは、約8.4~約10.2 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約18.9~約393.3 mg(好ましくは、約325~約365.1 mg)のトレハロース二水和物、
(d)約3.75~約15.0 mg(好ましくは、約3.75~約11.25 mg)のL-メチオニン、
(e)約2.5~約15.0 mg(好ましくは、約4~6 mg)のポリソルベート80、ならびに
(f)約0.29~約7.5 mg(好ましくは、約5.8~約7.5 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1であり、単位製剤当たりの容量が約5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[55] (a)約2.5 mg、約5 mgまたは約50 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約9.4 mg(具体的には、約9.35 mg)の酢酸ナトリウム三水和物および約1.9 mgの氷酢酸からなる酢酸緩衝剤、
(c)約345 mgのトレハロース二水和物、
(d)約7.5 mgのL-メチオニン、
(e)約5.0 mgのポリソルベート80、ならびに
(f)約6.8 mgの塩化ナトリウムを含み、pHが約5.0であり、単位製剤当たりの容量が約5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[56] (a)約0.2~約2.4 mgまたは約10~約50 mg(各々好ましくは、約1 mg、約2 mgまたは約20 mg)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約13.6 mgの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約3.8~約216.6 mgのトレハロース二水和物、
(d)約1.5~約9.0 mgのL-メチオニン、
(e)約0.2~約10.0 mgのポリソルベート80、ならびに
(f)約0.06~約4.0 mgの塩化ナトリウムを含み、pHが約4.7~約5.3であり、単位製剤当たりの容量が約2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[57] (a)約0.2~約2.4 mgまたは約10~約50 mg(各々好ましくは、約1 mg、約2 mgまたは約20 mg)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約2.72~約8.16 mg(好ましくは、約3.36~約4.1 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約7.6~約157.4 mg(好ましくは、約130.2~約145.2 mg)のトレハロース二水和物、
(d)約1.5~約6.0 mg(好ましくは、約1.5~約4.5 mg)のL-メチオニン、
(e)約1.0~約6.0 mgのポリソルベート80、ならびに
(f)約0.12~約3.0 mg(好ましくは、約2.3~約3.0 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1であり、単位製剤当たりの容量が約2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[58] (a)約1 mg、約2 mgまたは約20 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約3.7 mg(具体的には、約3.74 mg)の酢酸ナトリウム三水和物および約0.8 mg(具体的には、約0.76 mg)の氷酢酸からなる酢酸緩衝剤、
(c)約138 mgのトレハロース二水和物、
(d)約3.0 mgのL-メチオニン、
(e)約2.0 mgのポリソルベート80、ならびに
(f)約2.7 mg(具体的には、約2.72 mg)の塩化ナトリウムを含み、pHが約5.0であり、単位製剤当たりの容量が約2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[59] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約0.68~約6.8 mg/mLの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の酢酸からなる酢酸緩衝剤、
(c)約1.9~約108.3 mg/mLのトレハロース二水和物、
(d)約0.75~約4.5 mg/mLのL-メチオニン、
(e)約0.1~約5.0 mg/mLのポリソルベート80、ならびに
(f)約0.03~約2.0 mg/mLの塩化ナトリウムを含み、pHが約4.7~約5.3である、皮下投与用の水性医薬組成物またはその製剤;
[60] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg/mL(好ましくは、約1.68~約2.05 mg/mL)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg/mL(好ましくは、約65.1~約72.6 mg/mL)のトレハロース二水和物、
(d)約0.75~約3.0 mg/mL(好ましくは、約0.75~約2.25 mg/mL)のL-メチオニン、
(e)約0.5~約3.0 mg/mL(好ましくは、約0.8~約1.2 mg/mL)のポリソルベート80、ならびに
(f)約0.06~約1.5 mg/mL(好ましくは、約1.15~約1.5 mg/mL)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用の水性医薬組成物またはその製剤;
[61] (a)約100 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約1.9 mg/mL(具体的には、約1.87 mg/mL)の酢酸ナトリウム三水和物および約0.4 mg/mL(具体的には、約0.38 mg/mL)の酢酸からなる酢酸緩衝剤、
(c)約69 mg/mLのトレハロース二水和物、
(d)約1.5 mg/mLのL-メチオニン、
(e)約1.0 mg/mLのポリソルベート80、ならびに
(f)約1.4 mg/mL(具体的には、約1.36 mg/mL)の塩化ナトリウムを含み、pHが約5.0である、皮下投与用の水性医薬組成物またはその製剤;
[62] (a)約80~約150 mg(好ましくは、約100 mg)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約0.68~約6.8 mgの酢酸ナトリウム三水和物、および(b2)前記(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.7~約5.3となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約1.9~約108.3 mgのトレハロース二水和物、
(d)約0.75~約4.5 mgのL-メチオニン、
(e)約0.1~約5.0 mgのポリソルベート80、ならびに
(f)約0.03~約2.0 mgの塩化ナトリウムを含み、pHが約4.7~約5.3であり、単位製剤当たりの容量が約1 mLである、皮下投与用の水性医薬組成物またはその製剤;
[63] (a)約80~約150 mg(好ましくは、約100 mg)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg(好ましくは、約1.68~約2.05 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg(好ましくは、約65.1~約72.6 mg)のトレハロース二水和物、
(d)約0.75~約3.0 mg(好ましくは、約0.75~約2.25 mg)のL-メチオニン、
(e)約0.5~約3.0 mgのポリソルベート80、ならびに
(f)約0.06~約1.5 mg(好ましくは、約1.15~約1.5 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1であり、単位製剤当たりの容量が約1 mLである、皮下投与用の水性医薬組成物またはその製剤;
[64] (a)約100 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約1.9 mg(具体的には、約1.87 mg)の酢酸ナトリウム三水和物および約0.4 mg(具体的には、約0.38 mg)の氷酢酸からなる酢酸緩衝剤、
(c)約69 mgのトレハロース二水和物、
(d)約1.5 mgのL-メチオニン、
(e)約1.0 mgのポリソルベート80、ならびに
(f)約1.4 mg(具体的には、約1.36 mg)の塩化ナトリウムを含み、pHが約5.0であり、単位製剤当たりの容量が約1 mLである、皮下投与用の水性医薬組成物またはその製剤;
[65] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182.38 mM)のトレハロース、
(d)約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10.05 mM)のL-メチオニン、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、ならびに
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[66] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20.07 mM)の酢酸緩衝剤、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)であり、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v)である)のポリソルベート80、ならびに
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[67] (a)約0.1~約1.2 mg/mLまたは約5~約25 mg/mL(各々好ましくは、約0.5 mg/mL、約1 mg/mLまたは約10 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、ならびに
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[68] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182.38 mM)のトレハロース、
(d)約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10.05 mM)のL-メチオニン、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、ならびに
(f)約0.5~約34.2 mMの塩化ナトリウム(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23.27 mM)を含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である、皮下投与用の水性医薬組成物またはその製剤;
[69] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20.07 mM)の酢酸緩衝剤、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、ならびに
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは約5.0)である、皮下投与用の水性医薬組成物またはその製剤;
[70] (a)約80~約150 mg/mL(好ましくは、約100 mg/mL)の抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)緩衝剤(好ましくは、約7.3~約73.0 mM(好ましくは、約14.6~約43.8 mM、より好ましくは、約18~約22 mM、さらにより好ましくは、約20.07 mM)の酢酸緩衝剤または当該酢酸緩衝剤と同等のpH緩衝性能を有する緩衝剤)、
(c)約5~約286.1 mM(好ましくは、約10~約207.9 mM、より好ましくは、約172~約193 mM、さらにより好ましくは、約182.38 mM)のトレハロース、
(d)酸化防止剤(好ましくは、約5~約30.2 mM(好ましくは、約5~約20 mM、より好ましくは、約5~約15 mM、さらにより好ましくは、約10.05 mM)のL-メチオニンまたは当該L-メチオニンと同等の酸化防止能を有する酸化防止剤)、
(e)約0.01~約0.5 %(w/v)(好ましくは、約0.05~約0.3 %(w/v)、より好ましくは、約0.08~約0.12 %(w/v)、さらに好ましくは、約0.1 %(w/v))のポリソルベート80、ならびに
(f)約0.5~約34.2 mM(好ましくは、約1.0~約25.7 mM、より好ましくは、約19.6~約25.7 mM、さらにより好ましくは、約23.27 mM)の塩化ナトリウムを含み、pHが約4.7~約5.3(好ましくは、約4.9~約5.1、より好ましくは、約5.0)である、皮下投与用の水性医薬組成物またはその製剤;
[71] 当該抗PD-1/CD3二重特異性抗体が、WO2019/156199により特定される特許出願明細書に開示された当該抗PD-1/CD3二重特異性抗体である、前項[1]~[70]の何れか一項記載の水性医薬組成物またはその製剤;
[72] 当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(a)前項(i)の重鎖が、配列番号1、配列番号2、配列番号3、配列番号4および配列番号5から選択される何れか一つのアミノ酸配列からなり、
(b)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(c)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、前項[1]~[70]の何れか一項記載の水性医薬組成物またはその製剤;
[73] PD-1に特異的に結合する抗原結合部位を構成する重鎖が、配列番号5のアミノ酸配列からなる、前項[72]記載の水性医薬組成物またはその製剤;
[74] 前項[72]または[73]記載のPD-1に特異的に結合する抗原結合部位を構成する重鎖の重鎖定常領域が、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12および配列番号13から選択される何れか一つのアミノ酸配列からなる重鎖定常領域に置換され、前項[72]記載のCD3に特異的に結合する抗原結合部位を構成する重鎖の重鎖定常領域が、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18および配列番号19から選択される何れか一つのアミノ酸配列からなる重鎖定常領域に置換された、前項[71]~[73]の何れか一項記載の水性医薬組成物またはその製剤;
[75] (a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約14.6~約43.8 mM(好ましくは、約18~約22 mM)の酢酸緩衝剤、
(c)約10~約207.9 mM(好ましくは、約172~約193 mM)のトレハロース、
(d)約5~約20 mM(好ましくは、約5~約15 mM)のL-メチオニン、
(e)約0.05~約0.3 %(w/v)(好ましくは、約0.08~約0.12 %(w/v))のポリソルベート80、ならびに
(f)約1.0~約25.7 mM(好ましくは、約19.6~約25.7 mM)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[76] (a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約20.07 mMの酢酸緩衝剤、
(c)約182.38 mMのトレハロース、
(d)約10.05 mMのL-メチオニン、
(e)約0.1 %(w/v)のポリソルベート80、ならびに
(f)約23.27 mMの塩化ナトリウムを含み、pHが約5.0である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[77] (a)約100 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約14.6~約43.8 mM(好ましくは、約18~約22 mM)の酢酸緩衝剤、
(c)約10~約207.9 mM(好ましくは、約172~約193 mM)のトレハロース、
(d)約5~約20 mM(好ましくは、約5~約15 mM)のL-メチオニン、
(e)約0.05~約0.3 %(w/v)(好ましくは、約0.08~約0.12 %(w/v))のポリソルベート80、ならびに
(f)約1.0~約25.7 mM(好ましくは、約19.6~約25.7 mM)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[78] (a)約100 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約20.07 mMの酢酸緩衝剤、
(c)約182.38 mMのトレハロース、
(d)約10.05 mMのL-メチオニン、
(e)約0.1 %(w/v)のポリソルベート80、ならびに
(f)約23.27 mMの塩化ナトリウムを含み、pHが約5.0である、皮下投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[79] (a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg/mL(好ましくは、約1.68~約2.05 mg/mL)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg/mL(好ましくは、約65.1~約72.6 mg/mL)のトレハロース二水和物、
(d)約0.75~約3.0 mg/mL(好ましくは、約0.75~約2.25 mg/mL)のL-メチオニン、
(e)約0.5~約3.0 mg/mL(好ましくは、約0.8~約1.2 mg/mL)のポリソルベート80、ならびに
(f)約0.06~約1.5 mg/mL(好ましくは、約1.15~約1.5 mg/mL)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[80] (a)約0.5 mg/mL、約1 mg/mLまたは約10 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約1.9 mg/mL(具体的には、約1.87 mg/mL)の酢酸ナトリウム三水和物および約0.4 mg/mL(具体的には、約0.38 mg/mL)の酢酸からなる酢酸緩衝剤、
(c)約69 mg/mLのトレハロース二水和物、
(d)約1.5 mg/mLのL-メチオニン、
(e)約1.0 mg/mLのポリソルベート80、ならびに
(f)約1.4 mg/mL(具体的には、約1.36 mg/mL)の塩化ナトリウムを含み、pHが約5.0である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[81] (a)約100 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg/mL(好ましくは、約1.68~約2.05 mg/mL)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg/mL(好ましくは、約65.1~約72.6 mg/mL)のトレハロース二水和物、
(d)約0.75~約3.0 mg/mL(好ましくは、約0.75~約2.25 mg/mL)のL-メチオニン、
(e)約0.5~約3.0 mg/mL(好ましくは、約0.8~約1.2 mg/mL)のポリソルベート80、ならびに
(f)約0.06~約1.5 mg/mL(好ましくは、約1.15~約1.5 mg/mL)の塩化ナトリウムを含み、pHが約4.9~約5.1である、皮下投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、および
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[82](a)約100 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約1.9 mg/mL(具体的には、約1.87 mg/mL)の酢酸ナトリウム三水和物および約0.4 mg/mL(具体的には、約0.38 mg/mL)の酢酸からなる酢酸緩衝剤、
(c)約69 mg/mLのトレハロース二水和物、
(d)約1.5 mg/mLのL-メチオニン、
(e)約1.0 mg/mLのポリソルベート80、ならびに
(f)約1.4 mg/mL(具体的には、約1.36 mg/mL)の塩化ナトリウムを含み、pHが約5.0である、皮下投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[83] (a)約2.5 mg、約5 mgまたは約50 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約6.8~約20.4 mg(好ましくは、約8.4~約10.2 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約18.9~約393.3 mg(好ましくは、約325~約365.1 mg)のトレハロース二水和物、
(d)約3.75~約15.0 mg(好ましくは、約3.75~約11.25 mg)のL-メチオニン、
(e)約2.5~約15.0 mg(好ましくは、約4~6 mg)のポリソルベート80、ならびに
(f)約0.29~約7.5 mg(好ましくは、約5.8~約7.5 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1であり、単位製剤当たりの容量が約5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[84] (a)約2.5 mg、約5 mgまたは約50 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約9.4 mg(具体的には、約9.35 mg)の酢酸ナトリウム三水和物および約1.9 mgの氷酢酸からなる酢酸緩衝剤、
(c)約345 mgのトレハロース二水和物、
(d)約7.5 mgのL-メチオニン、
(e)約5.0 mgのポリソルベート80、ならびに
(f)約6.8 mgの塩化ナトリウムを含み、pHが約5.0であり、単位製剤当たりの容量が約5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[85](a)約1 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約2.72~約8.16 mg(好ましくは、約3.36~約4.1 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約7.6~約157.4 mg(好ましくは、約130.2~約145.2 mg)のトレハロース二水和物、
(d)約1.5~約6.0 mg(好ましくは、約1.5~約4.5 mg)のL-メチオニン、
(e)約1.0~約6.0 mgのポリソルベート80、ならびに
(f)約0.12~約3.0 mg(好ましくは、約2.3~約3.0 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1であり、単位製剤当たりの容量が約2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[86](a)約1 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約3.7 mg(具体的には、約3.74 mg)の酢酸ナトリウム三水和物および約0.8 mg(具体的には、約0.76 mg)の氷酢酸からなる酢酸緩衝剤、
(c)約138 mgのトレハロース二水和物、
(d)約3.0 mgのL-メチオニン、
(e)約2.0 mgのポリソルベート80、ならびに
(f)約2.7 mg(具体的には、約2.72 mg)の塩化ナトリウムを含み、pHが約5.0であり、単位製剤当たりの容量が約2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[87] (a)約100 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)約1.36~約4.08 mg(好ましくは、約1.68~約2.05 mg)の酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが約4.9~約5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)約3.8~約78.7 mg(好ましくは、約65.1~約72.6 mg)のトレハロース二水和物、
(d)約0.75~約3.0 mg(好ましくは、約0.75~約2.25 mg)のL-メチオニン、
(e)約0.5~約3.0 mgのポリソルベート80、ならびに
(f)約0.06~約1.5 mg(好ましくは、約1.15~約1.5 mg)の塩化ナトリウムを含み、pHが約4.9~約5.1であり、単位製剤当たりの容量が約1 mLである、皮下投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、および
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[88](a)約100 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)約1.9 mg(具体的には、約1.87 mg)の酢酸ナトリウム三水和物および約0.4 mg(具体的には、約0.38 mg)の氷酢酸からなる酢酸緩衝剤、
(c)約69 mgのトレハロース二水和物、
(d)約1.5 mgのL-メチオニン、
(e)約1.0 mgのポリソルベート80、ならびに
(f)約1.4 mg(具体的には、約1.36 mg)の塩化ナトリウムを含み、pHが約5.0であり、単位製剤当たりの容量が約1 mLである、皮下投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤;
[89] 導電率が、約2.6~約3.1 mS/cmである、前項[1]~[88]の何れか一項記載の水性医薬組成物またはその製剤;
[90] 抗体(好ましくは、抗PD-1/CD3二重特異性抗体)を有効成分として含み、さらに、緩衝剤(好ましくは、酢酸緩衝剤)、トレハロース、酸化防止剤(好ましくは、L-メチオニン)、ポリソルベート80を含み、導電率が約2.6~約3.1 mS/cmである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤;
[91] 導電率が、約2.8 mS/cmである、前項[1]~[90]の何れか一項記載の水性医薬組成物またはその製剤;
[92] 前項[75]、[76]、[79]、[80]、[83]~[86]および[89]~[91]の何れか一項記載の水性医薬組成物またはその製剤と生物学的同等性を示し、同項記載の抗PD-1/CD3二重特異性抗体を有効成分として含有する、静脈内投与用の水性医薬組成物またはその製剤;
[93] 前項[75]~[91]の何れか一項記載の水性医薬組成物またはその製剤と生物学的同等性を示し、同項記載の抗PD-1/CD3二重特異性抗体を有効成分として含有する、皮下投与用の水性医薬組成物またはその製剤;
[94] 生物学的同等性が、以下の(i)および(ii)の差の90%信頼区間がlog(0.80)~log(1.25)の範囲にある関係である、前項[92]記載の水性医薬組成物またはその製剤:
(i)その投与による生物学的同等性判定パラメータの対数値の平均値、および
(ii)前項[75]、[76]、[79]、[80]、[83]~[86]および[89]~[91]の何れか一項記載の水性医薬組成物またはその製剤の投与による生物学的同等性判定パラメータの対数値の平均値;
[95] 生物学的同等性が、以下の(i)および(ii)の差の90%信頼区間がlog(0.80)~log(1.25)の範囲にある関係である、前項[93]記載の水性医薬組成物またはその製剤:
(i)その投与による生物学的同等性判定パラメータの対数値の平均値、および
(ii)前項[75]~[91]の何れか一項記載の水性医薬組成物またはその製剤の投与による生物学的同等性判定パラメータの対数値の平均値;
[1-2] 前項[1-1]記載のカートリッジが充填されたインジェクターペン、オートインジェクターまたは無針装置;
[1-3] 前項[1]~[95]の何れか一項記載の水性医薬組成物(好ましくは、静脈内投与用)が封入されたバイアル容器またはアンプル容器;
[2-2] 自己免疫疾患が、乾癬、乾癬性関節炎、関節リウマチ、クローン病、潰瘍性大腸炎または重症筋無力症である、前項[2-1]記載の使用;ならびに
[2-3] 血液がんが、末梢性T細胞リンパ腫または皮膚T細胞性リンパ腫である、前項[2-1]記載の使用。
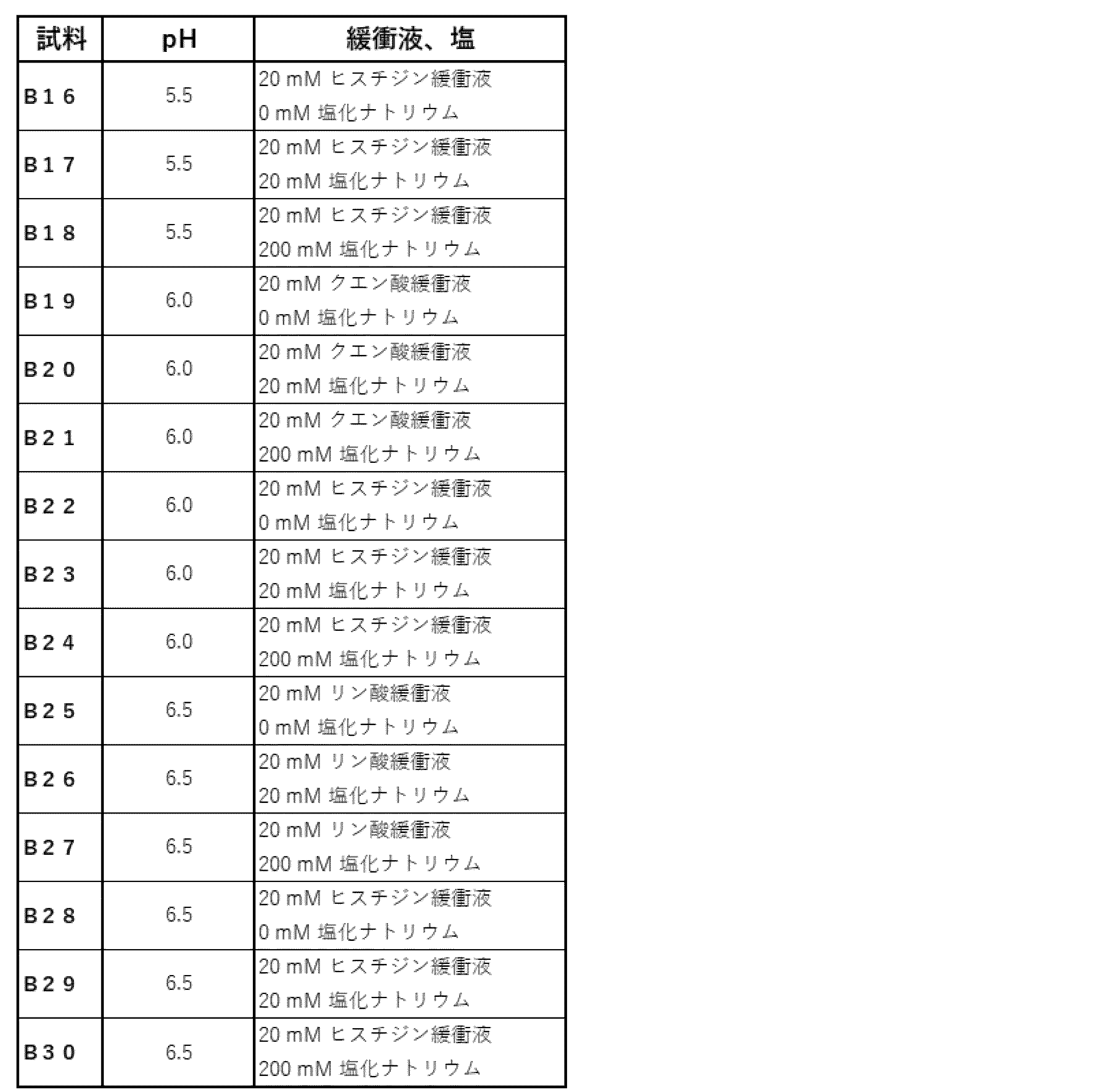
本発明にかかる抗PD-1/CD3二重特異性抗体である抗体αに最適な処方の基本条件の探索を行った。表1および表2の条件で、抗体濃度が各々20 mg/mLとなるよう、試料B1~B30の30種を調製した。
実施例1の評価にて選択された試料番号4、5および22の各処方に、糖(スクロース、トレハロース、D-マンニトールおよびソルビトール)を各々添加した処方S1~S24の24種を表8のとおり調製した。
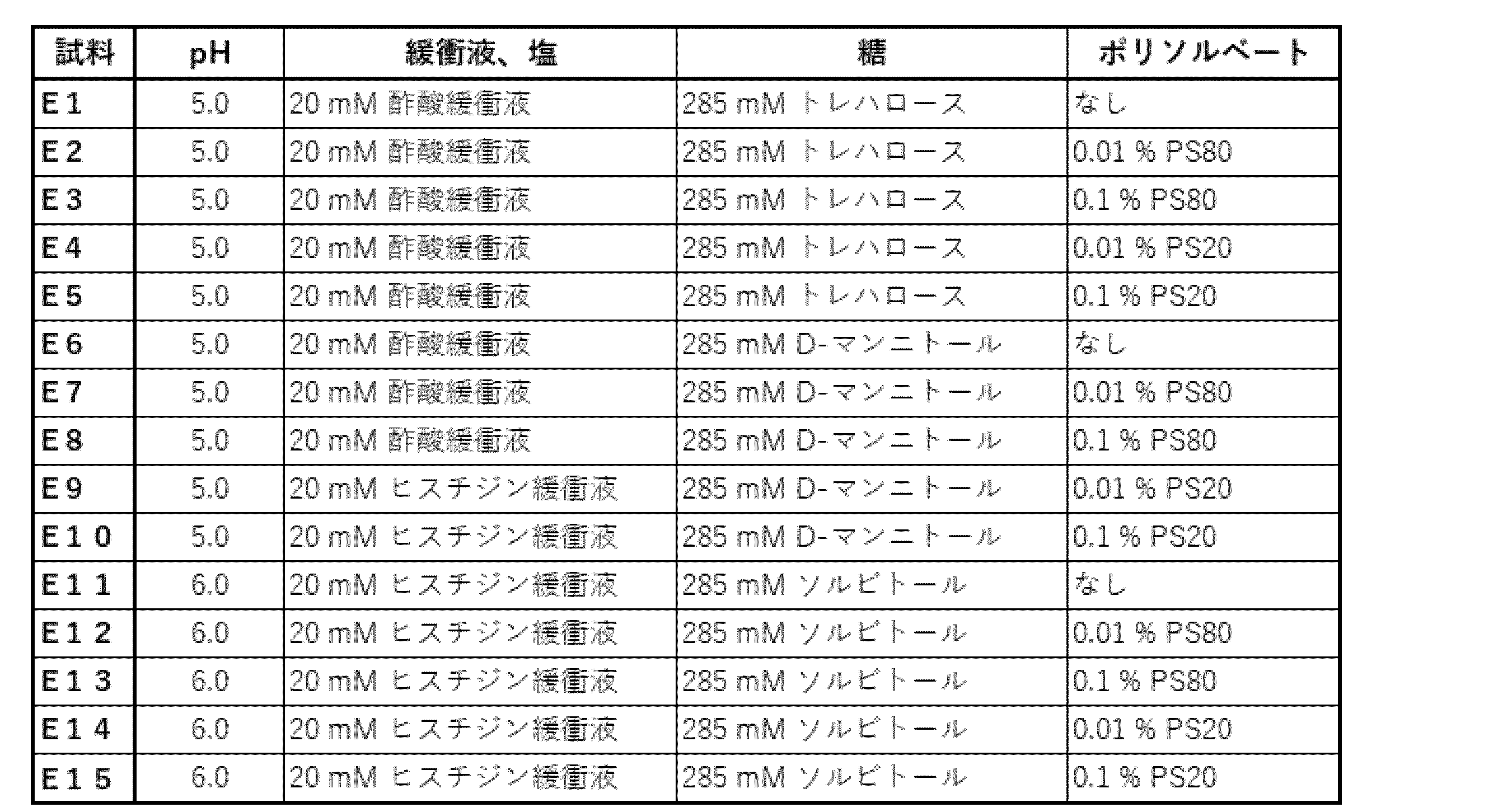
実施例2の評価にて選択された試料S3、S5およびS23の各処方に、ポリソルベート(PS)(ポリソルベート80(PS80)およびポリソルベート20(PD20))を各々添加した試料E1~E15の15種を表11のとおり調製した。
(a)pH測定には、pHメーター(LAQUA F-74(HORIBA))および微量試料測定用電極(マイクロ Tou pH 電極(HORIBA))が使用された。
(b)抗体濃度は、各試料を15,000 g、30分間遠心した上清について、280 nmの吸光度を1 cmまたは2 mmの光路長で測定された。なお、各試料について、吸光度が0.1~1.0になるよう希釈して測定され、抗体の吸光係数ε280 = 1.51(mg/mL)-1cm-1から濃度が算出された。なお、測定には、分光光度計(BioSpectormeter(Eppendorf))が使用された。
(c)濁度測定においては、光路長1 cmで500 nmの吸光度を測定した。なお、測定には、分光光度計が使用された。
(d)SEC-HPLC解析は、表3に示した条件で実施された。
(e)SDS-PAGE解析は、各試料を15,000 g、30分間遠心分離した上清を用い、還元下(100 mM DTT)および非還元下(-DTT)において、2 μgの試料を、4~12% Bis-Trisゲル上で100 V、約30分間電気泳動して実施された。
(f)IE-HPLC解析は、表17に示す条件で実施された。
(h)摺動抵抗測定:測定試料として、15,000 g、30分間遠心分離した上清を用いた。29G staked 1mL COP syringeに試料を400 μLずつ充填し、5時間程度静置した。オートグラフを用い、6 mL/分でシリンジを押し出し、摺動抵抗値が測定された。なお、摺動抵抗測定は、初期状態の試料についてのみ実施した。
(i)FIAにおいては、フローイメージング装置を用いて、150 μLの試料を流速0.05 mL/分で測定し、1 μm以上のサイズの凝集体について評価された。
安定性評価試験前後の試料について、目視での状態確認が実施された。初期状態の試料では、酢酸処方の試料およびヒスチジン処方の試料ともに黄色を呈し、4週間および12週間保管ならびに3日間振とうした各条件下において、明らかな色の変化は見られなかった。ヒスチジン処方の試料に関して、5℃下での4週間保管後ならびに5℃および25℃下で各々12週間保管した後において微粒子が確認された。また、酢酸処方およびヒスチジン処方の試料ともに、40℃下での4週間保管後において微粒子は見られなかったが、全体が白く濁っていた。
(a)安定性評価試験後のすべての試料において、顕著なpHの変化は認められなかった。
(b)安定性試験後のすべての試料において、大きな濃度の変化は見られなかった。
(c)安定性試験前後の濁度の測定結果を表18に示す。
(d)安定性試験前後のSEC-HPLC解析の測定結果を表19に示す。
(e)安定性試験前後のSDS-PAGE解析から、還元条件および非還元条件の何れによっても、初期状態および各試料において、標品と同様のバンドが観察され、精製、濃縮などの試料調製で分解が生じていないことが確認された。
(f)安定性試験前後のIE-HPLC分析の結果を表20に示す。
(g)安定性評価試験前後での粘度測定の結果、何れの処方も、安定性評価試験前後において有意な粘度の変化は見られなかった。
(h)初期状態の試料での摺動抵抗値測定の結果、酢酸処方およびヒスチジン処方の試料の何れにおいても、非常に低い摺動抵抗値(7.66 Nおよび7.46 N)であった。
(i)安定性評価試験前後の抗体を含む各処方の粒子濃度から、処方液のみの粒子濃度を引いた粒子濃度を表21に示す。
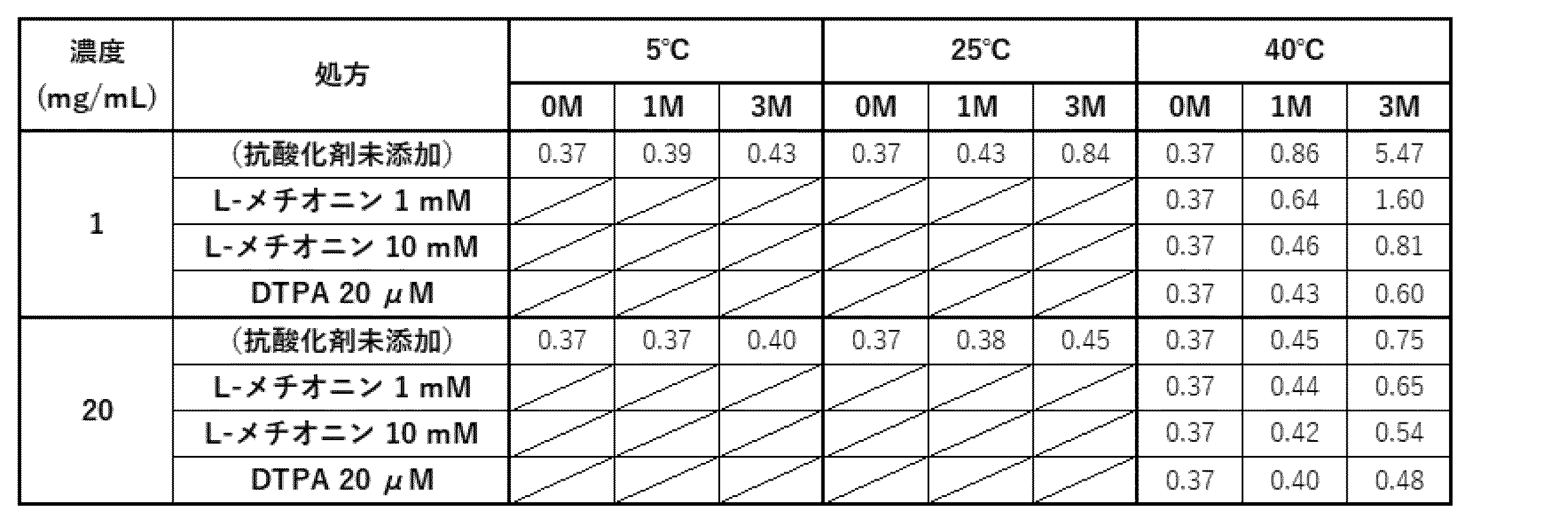
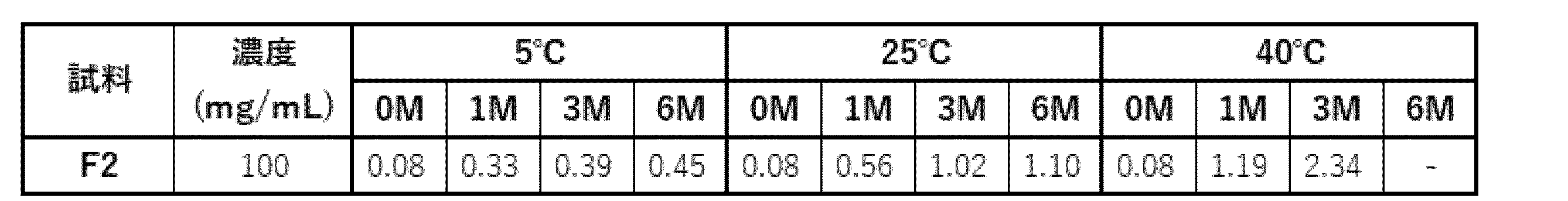
実施例4の評価に基づき選択された酢酸処方(20 mM酢酸緩衝液(pH 5.0)、285 mM トレハロース、0.1 % PS80)について、さらに最適化検討を実施した。
(e)FIAにおいては、フローイメージング装置を用いて、500 μLの試料を流速0.1 mL/分で測定し、2 μm以上のサイズの凝集体が評価された。
(f)ペプチドマップ解析は、LC-MSを用いて実施された。
(保管試験)
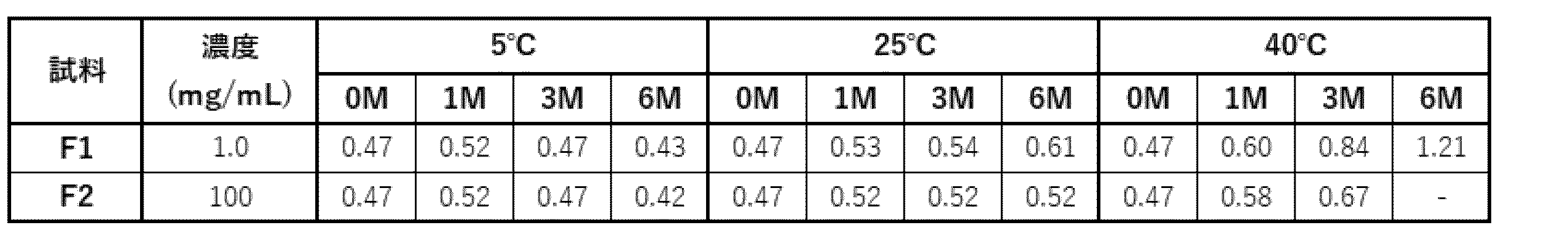
(a)SEC-HPLC解析にて評価した、保管試験前後での高分子種(HMWS)の割合を表27に示す。いずれの濃度においても、5℃下での12週間保管では、HMWSの顕著な増加は認められなかった。25℃下においては、抗体濃度が20 mg/mLの処方では、HMWSの増加は認められなかったものの、100 mg/mLの処方では、HMWSの直線的な増加傾向が認められた。一方、導電率による挙動の差は認められなかった。40℃下では、いずれの濃度においてもHMWSは増加したが、20 mg/mLの処方では、導電率の上昇に伴い、HMWSが高まる傾向が認められた。5℃および25℃下では、安定な処方であることが確認された。
(c)RP-HPLC解析にて評価した、保管試験前後での着色体の割合を表29に示す。
(d)SPRにて評価した、保管試験前後でのPD-1への結合活性の結果を表30に、CD3結合活性の結果を表31に各々示す。各表中の数値は、抗体αの標準品に対する比活性(%)を表す。5℃および25℃下では、PD-1、CD3ともに結合活性の低下は認められなかった。一方、40℃下では、PD-1への結合活性の低下が認められ、さらに、抗体濃度が20 mg/mLにおいては、その結合活性の低下は顕著であった。
(振とう試験)
(a)SEC-HPLCにて、振とう試験前後におけるHMWSの割合を評価したが、すべての試料および条件において、HMWSの顕著な増加は認められなかった。
(b)IE-HPLCにて、振とう試験前後における酸性分子種の割合を評価したが、すべての試料および条件において、酸性分子種の顕著な増加は認められなかった。
(c)RP-HPLCにて、振とう試験前後における着色体の割合を評価したが、すべての試料および条件において、着色体の顕著な増加は認められなかった。
(d)SPRにて、振とう試験前後におけるPD-1およびCD3に対する結合活性を各々評価したが、試料間において結合活性の低下に有意な差は認められなかった。
(e)FIAにて、試料N5およびN8の振とう試験後における粒子数を評価したが、何れについても、振とうストレスによる微粒子数および最大粒子径の増加は認められなかった。
(凍結融解)
(a)SEC-HPLCにて、凍結融解試験前後でのHMWSの割合を評価したが、すべての試料においてHMWSの割合に大きな変化はなく、凍結融解ストレスに安定であることが確認された。
(b)IE-HPLCにて、凍結融解試験前後での酸性分子種の割合を評価したが、すべての試料において酸性分子種の割合に大きな変化はなく、同様に、凍結融解ストレスに安定であることが確認された。
(c)RP-HPLCにて、凍結融解試験前後での着色体の割合を評価したが、すべての試料において着色体の割合にも大きな変化は認められなかった。
(d)SPRにて、凍結融解試験前後でのPD-1およびCD3への結合活性を各々評価したが、すべての試料において結合活性に大きな変化は認められなかった。
(e)FIAにて、試料N5およびN8の凍結融解試験後における粒子数を各々評価したが、何れについても凍結融解ストレスによる微粒子数および最大粒子径の増加は認められなかった。また、評価した試料間に有意な差も認められなかった。
SEC-HPLCにて、試料N8のシリンジ通液試験前後におけるHMWSの割合(%)を評価したが、HMWSの生成は認められなかった。
表30に示したように、40℃下での長期保管におけるPD-1への結合活性の低下について、ペプチドマップによる要因解析を行った。代表例として、PD-1に対する相補性決定領域に存在する101番目のメチオニン残基(以下、「Met101」と略記することがある。)への酸化度(%)を表32に示す。5℃および25℃下では、Met101の酸化度は低値を示しており、試料間差は認められなかった。また、抗体濃度が100 mg/mLの場合に比べ、20 mg/mLの場合において顕著な酸化が認められた。図4に示すように、Met101の酸化とPD-1結合活性の低下には相関関係があった。このような酸化が、結合活性低下の原因である可能性が認められた。
本発明にかかる抗体αが、低濃度において、安定性が低下する可能性が実施例5において示唆されたため、低濃度域での安定性を評価した。
(a)SEC-HPLCにて評価した、保管前後でのHMWSの割合を表35に示す。何れの処方においても、40℃下での長期保管においてHMWSが大幅に上昇したが、抗体が低濃度のL1において、HMWSの蓄積はより顕著であった。低濃度条件で凝集の可能性が高まることが示唆された。
長期保管の影響により、本発明にかかる抗体αの酸化が進行し、PD-1およびCD3への結合活性の低下、特に、PD-1への結合活性の低下が顕著であることが実施例6において示唆された。
(a)SEC-HPLC解析にて評価した、保管前後でのHMWSの割合(%)を表39に示す。抗酸化剤未添加でも、5℃および25℃では変化はなかった。一方で、L-メチオニンを10 mMまたはDTPAを20 μM添加した試料について、40℃下で12週間保管した場合、HMWSの生成が劇的に抑制された。L-メチオニンまたはDTPAのHMWSの生成抑制効果は、抗体濃度1および20 mg/mLにおいても同様に認められた。
実施例1~7までの検討において、本発明にかかる抗体αが、安定に保管され得る条件を見出した。さらに安定な条件を設定するため、糖の濃度範囲を決定することとした。
(a)IE-HPLCにて評価した、保管前後での酸性分子種の割合(%)を表47に示す。何れの処方においても、25℃および40℃下での長期保管において酸性分子種が上昇した。通常の保管温度となる5℃下では安定であった。処方間で差は認められなかった。
実施例1~8までの検討において、本発明にかかる抗体αが、安定に保管され得る条件を見出した。それらを総合して最適と考えられた条件の安定性試験を実施した。
(a)SEC-HPLCにて評価した、保管前後でのHMWSの割合を表53に示す。100 mg/mLの濃度においては、25℃および40℃下の条件でHMWSの増加が認められたが、5℃下では顕著な増加は認められなかった。5℃下では安定であると考えられた。
(a)SEC-HPLCにて評価した、保管前後でのHMWSの割合を表61に示す。0.5 mg/mLおよび1.0 mg/mLの濃度において、5、25および40 ℃の条件下では、HMWSの割合の増加が認められなかった。
本発明の水性医薬組成物を調製する方法について、実施例9の試料F2を例に、以下に示す。なお、同試料F2と抗体濃度が異なる本発明の水性医薬組成物についても、同様に調製することができる。
(a)処方調製液1を、20 mM酢酸緩衝液(pH 5.0)、182.38 mMトレハロース、1.36 mg/mL 塩化ナトリウムおよび10 mM L-メチオニンとなるように調製する。
(b)処方調製液2を、20 mM酢酸緩衝液(pH 5.0)、182.38 mMトレハロース、2 % PS80、1.36 mg/mL 塩化ナトリウムおよび10 mM L-メチオニンとなるように調製する。
(c)処方調製液3を、20 mM酢酸緩衝液(pH 5.0)、182.38 mMトレハロース、0.1 % PS80、1.36 mg/mL 塩化ナトリウムおよび10 mM L-メチオニンとなるように調製する。
(d)抗体αの製造工程のうち、ウイルスろ過工程から得られた工程液を、限外ろ過/透析ろ過膜で処方調製液1に溶液組成を置換する。
(e)前項(d)において、溶液組成を処方調製液1に置換した、抗体αを含む工程液を、限外ろ過/透析ろ過膜で約140 mg/mLまで濃縮する。
(f)前項(e)において濃縮した抗体αを含む工程液に、高濃度のPS80を含む処方調製液2を添加し、PS80濃度が0.1%となるように調製する。
(g)前項(f)において、目的のPS80濃度に調整した抗体αを含む工程液に、処方調製液3を添加し、抗体濃度が目的の100 mg/mLとなるように希釈する。
Claims (12)
- (a)0.1~1.2 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)18~22 mMの酢酸緩衝剤、
(c)172~193 mMのトレハロース、
(d)5~15 mMのL-メチオニン、
(e)0.05~0.3 %(w/v)のポリソルベート80、および
(f)19.6~25.7 mMの塩化ナトリウムを含み、pHが4.9~5.1である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - 抗PD-1/CD3二重特異性抗体が、0.5 mg/mLまたは1 mg/mLである、請求項1記載の水性医薬組成物またはその製剤。
- (a)0.5 mg/mLまたは1 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)20.07 mMの酢酸緩衝剤、
(c)182.38 mMのトレハロース、
(d)10.05 mMのL-メチオニン、
(e)0.1 %(w/v)のポリソルベート80、ならびに
(f)23.27 mMの塩化ナトリウムを含み、pHが5.0である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - (a)0.1~1.2 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)1.68~2.05 mg/mLの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが4.9~5.1となる分量の酢酸からなる酢酸緩衝剤、
(c)65.1~72.6 mg/mLのトレハロース二水和物、
(d)0.75~2.25 mg/mLのL-メチオニン、
(e)0.5~3.0 mg/mLのポリソルベート80、ならびに
(f)1.15~1.5 mg/mLの塩化ナトリウムを含み、pHが4.9~5.1である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - 抗PD-1/CD3二重特異性抗体が、0.5 mg/mLまたは1 mg/mLである、請求項4記載の水性医薬組成物またはその製剤。
- (a)0.5 mg/mLまたは1 mg/mLの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)1.87 mg/mLの酢酸ナトリウム三水和物および0.38 mg/mLの酢酸からなる酢酸緩衝剤、
(c)69 mg/mLのトレハロース二水和物、
(d)1.5 mg/mLのL-メチオニン、
(e)1.0 mg/mLのポリソルベート80、ならびに
(f)1.36 mg/mLの塩化ナトリウムを含み、pHが5.0である、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - (a)0.5~6 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)8.4~10.2 mgの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが4.9~5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)325~365.1 mgのトレハロース二水和物、
(d)3.75~11.25 mgのL-メチオニン、
(e)2.5~15.0 mgのポリソルベート80、ならびに
(f)5.8~7.5 mgの塩化ナトリウムを含み、pHが4.9~5.1であり、単位製剤当たりの容量が5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - 抗PD-1/CD3二重特異性抗体が、2.5 mgまたは5 mgである、請求項7記載の水性医薬組成物またはその製剤。
- (a)2.5 mgまたは5 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)9.35 mgの酢酸ナトリウム三水和物および1.9 mgの氷酢酸からなる酢酸緩衝剤、
(c)345 mgのトレハロース二水和物、
(d)7.5 mgのL-メチオニン、
(e)5.0 mgのポリソルベート80、ならびに
(f)6.8 mgの塩化ナトリウムを含み、pHが5.0であり、単位製剤当たりの容量が5 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - (a)0.2~2.4 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)(b1)3.36~4.1 mgの酢酸ナトリウム三水和物、および(b2)前項(b1)の酢酸ナトリウム三水和物の分量に対応して、pHが4.9~5.1となる分量の氷酢酸からなる酢酸緩衝剤、
(c)130.2~145.2 mgのトレハロース二水和物、
(d)1.5~4.5 mgのL-メチオニン、
(e)1.0~6.0 mgのポリソルベート80、ならびに
(f)2.3~3.0 mgの塩化ナトリウムを含み、pHが4.9~5.1であり、単位製剤当たりの容量が2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。 - 抗PD-1/CD3二重特異性抗体が、1 mgである、請求項10記載の水性医薬組成物またはその製剤。
- (a)1 mgの抗PD-1/CD3二重特異性抗体を有効成分として含み、さらに、
(b)3.74 mgの酢酸ナトリウム三水和物および0.76 mgの氷酢酸からなる酢酸緩衝剤、
(c)138 mgのトレハロース二水和物、
(d)3.0 mgのL-メチオニン、
(e)2.0 mgのポリソルベート80、ならびに
(f)2.72 mgの塩化ナトリウムを含み、pHが5.0であり、単位製剤当たりの容量が2 mLである、皮下投与用もしくは静脈内投与用の水性医薬組成物またはその製剤であって、
ここで、当該抗PD-1/CD3二重特異性抗体が、
(i)PD-1に特異的に結合する抗原結合部位を構成する重鎖および軽鎖、ならびに
(ii)CD3に特異的に結合する抗原結合部位を構成する重鎖および軽鎖からなり、
(α)前項(i)の重鎖が、配列番号5のアミノ酸配列からなり、
(β)前項(ii)の重鎖が、配列番号6のアミノ酸配列からなり、ならびに
(γ)前項(i)および前項(ii)の軽鎖がともに、配列番号7のアミノ酸配列からなる当該二重特異性抗体である、当該水性医薬組成物またはその製剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024126120A JP2024153869A (ja) | 2023-03-16 | 2024-08-01 | 抗体製剤 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023041761 | 2023-03-16 | ||
| JP2023041761 | 2023-03-16 | ||
| JP2023154195 | 2023-09-21 | ||
| JP2023154195 | 2023-09-21 | ||
| PCT/JP2024/010151 WO2024190892A1 (ja) | 2023-03-16 | 2024-03-15 | 抗体製剤 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024126120A Division JP2024153869A (ja) | 2023-03-16 | 2024-08-01 | 抗体製剤 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP7548475B1 true JP7548475B1 (ja) | 2024-09-10 |
Family
ID=92673345
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024534766A Active JP7548475B1 (ja) | 2023-03-16 | 2024-03-15 | 抗体製剤 |
| JP2024126120A Pending JP2024153869A (ja) | 2023-03-16 | 2024-08-01 | 抗体製剤 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024126120A Pending JP2024153869A (ja) | 2023-03-16 | 2024-08-01 | 抗体製剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (2) | JP7548475B1 (ja) |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011161226A2 (en) | 2010-06-25 | 2011-12-29 | F. Hoffmann-La Roche Ag | Novel antibody formulation |
| WO2019156199A1 (ja) | 2018-02-09 | 2019-08-15 | 小野薬品工業株式会社 | 二重特異性抗体 |
| JP2019526627A (ja) | 2016-08-29 | 2019-09-19 | ティジアーナ ライフ サイエンシズ パブリック リミティド カンパニー | 抗−cd3抗体製剤 |
| WO2021210662A1 (ja) | 2020-04-17 | 2021-10-21 | 小野薬品工業株式会社 | タンパク質製剤原薬の着色除去方法 |
| JP2022553058A (ja) | 2019-10-25 | 2022-12-21 | アムジェン インコーポレイテッド | 低タンパク質濃度のタンパク質損失を最小限に抑えるための組成物及び方法 |
| WO2023031969A1 (en) | 2021-09-03 | 2023-03-09 | Dr. Reddy’S Laboratories Limited | A method of improving stability of immune check point inhibitors |
| WO2023031970A1 (en) | 2021-09-03 | 2023-03-09 | Dr. Reddy’S Laboratories Limited | A pharmaceutical formulation of immune check point inhibitors |
-
2024
- 2024-03-15 JP JP2024534766A patent/JP7548475B1/ja active Active
- 2024-08-01 JP JP2024126120A patent/JP2024153869A/ja active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011161226A2 (en) | 2010-06-25 | 2011-12-29 | F. Hoffmann-La Roche Ag | Novel antibody formulation |
| JP2019526627A (ja) | 2016-08-29 | 2019-09-19 | ティジアーナ ライフ サイエンシズ パブリック リミティド カンパニー | 抗−cd3抗体製剤 |
| WO2019156199A1 (ja) | 2018-02-09 | 2019-08-15 | 小野薬品工業株式会社 | 二重特異性抗体 |
| JP2022553058A (ja) | 2019-10-25 | 2022-12-21 | アムジェン インコーポレイテッド | 低タンパク質濃度のタンパク質損失を最小限に抑えるための組成物及び方法 |
| WO2021210662A1 (ja) | 2020-04-17 | 2021-10-21 | 小野薬品工業株式会社 | タンパク質製剤原薬の着色除去方法 |
| WO2023031969A1 (en) | 2021-09-03 | 2023-03-09 | Dr. Reddy’S Laboratories Limited | A method of improving stability of immune check point inhibitors |
| WO2023031970A1 (en) | 2021-09-03 | 2023-03-09 | Dr. Reddy’S Laboratories Limited | A pharmaceutical formulation of immune check point inhibitors |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2024153869A (ja) | 2024-10-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102397713B1 (ko) | 안정한 액체 약제학적 제제 | |
| JP5577098B2 (ja) | ポリペプチドを含有する安定な緩衝化された製剤 | |
| KR102124820B1 (ko) | 항체 제제 | |
| KR101782203B1 (ko) | 동결건조 및 수성 항-cd40 항체 제제 | |
| ES2783448T3 (es) | Métodos de tratamiento del lupus eritematoso sistémico utilizando un anticuerpo de dominio dirigido contra CD28 | |
| EP3991745A1 (en) | Formulations containing anti-cd47/pd-l1 bispecific antibody and preparation method therefor and use thereof | |
| TW200831129A (en) | Stable formulations | |
| KR20180135475A (ko) | 항-pd-l1 및 항-ctla-4 항체의 공제형을 포함하는 조성물 | |
| JP7045327B2 (ja) | 抗血液樹状細胞抗原2抗体の臨床使用のための医薬組成物及び投与レジメン | |
| EP4095158A1 (en) | Pharmaceutical composition containing anti-btla antibody and use thereof | |
| KR20110086705A (ko) | 생리학적 조건 하에 거대분자의 응집을 감소시키는 방법 및 제제 | |
| KR20220124208A (ko) | 프로그램된 세포 사멸 수용체1 항체 제제 및 그 용도 | |
| CN114146174B (zh) | 抗pd-l1/ox40双特异性抗体制剂及其制备方法和用途 | |
| KR20210114989A (ko) | 치료 항체 제제 | |
| CN115698064A (zh) | 用于皮下施用的抗cd38抗体的配制品 | |
| JP7548475B1 (ja) | 抗体製剤 | |
| WO2024190892A1 (ja) | 抗体製剤 | |
| CN109498565B (zh) | 一种稳定的抗pd-1抗体制剂及其用途 | |
| RU2745814C1 (ru) | Водная фармацевтическая композиция левилимаба и ее применение | |
| US11459399B2 (en) | Pharmaceutical compositions of a HER2/neu antibody and use of the same | |
| WO2024025440A1 (en) | Pharmaceutical composition of anti-cd20 antibody and use thereof | |
| US20230053747A1 (en) | Pharmaceutical Compositions of a HER2/neu Antibody and Use of the Same | |
| KR20230032347A (ko) | 안정한 약제학적 제제 | |
| KR20220028972A (ko) | 안정한 약제학적 제제 | |
| JP2024526773A (ja) | B7‐h3抗体の医薬組成物及びその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240611 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240611 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20240611 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240730 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240812 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7548475 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |