JP7233506B2 - 一次染色および免疫組織化学画像に基づくコンピュータ採点 - Google Patents
一次染色および免疫組織化学画像に基づくコンピュータ採点 Download PDFInfo
- Publication number
- JP7233506B2 JP7233506B2 JP2021174267A JP2021174267A JP7233506B2 JP 7233506 B2 JP7233506 B2 JP 7233506B2 JP 2021174267 A JP2021174267 A JP 2021174267A JP 2021174267 A JP2021174267 A JP 2021174267A JP 7233506 B2 JP7233506 B2 JP 7233506B2
- Authority
- JP
- Japan
- Prior art keywords
- image
- features
- tissue
- images
- nuclei
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/0002—Inspection of images, e.g. flaw detection
- G06T7/0012—Biomedical image inspection
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/695—Preprocessing, e.g. image segmentation
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/698—Matching; Classification
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10056—Microscopic image
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
- G06T2207/30024—Cell structures in vitro; Tissue sections in vitro
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
- G06T2207/30096—Tumor; Lesion
Landscapes
- Engineering & Computer Science (AREA)
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Theoretical Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Radiology & Medical Imaging (AREA)
- Medical Informatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Quality & Reliability (AREA)
- Computer Vision & Pattern Recognition (AREA)
- Molecular Biology (AREA)
- Multimedia (AREA)
- Biomedical Technology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Image Analysis (AREA)
Description
ける癌細胞および免疫細胞のような、異なる型の細胞の研究において広く使用されている。免疫細胞に対する染色のコンテキストでは、免疫学的データは、腫瘍試料(tumor sample)内における免疫細胞の型、密度、および位置を示し、このデータは、患者の生存予測を判定するときに、病理医にとって特に関心深いものとなる。つまり、IHC染色は、免疫応答研究のために癌組織における免疫細胞(T-細胞またはB-細胞のような)の異なる表現で示されるバイオマーカの分布および局在化(localization)を理解するために研究において使用することができる。例えば、腫瘍は免疫細胞の浸潤を含有することが多く、これは腫瘍の発生(development)を防止する場合や、または腫瘍の成長(outgrowth)に有利に働く場合がある。
家の読み手(expert reader)が、初期ステップとして、ディスプレイ上において既に走査
/ディジタル化されているスライドを見直すまたはスライドの画像を読み取ることによって、手作業で代表的な視野(FOV)または対象領域(ROI)を顕微鏡の下で選択する。組織スライドが走査されるとき、走査された画像は独立した読み手によって目視され、読み手の個人的好みに基づいてFOVまたはROIに手作業で印が付けられる。FOVまたはROIを選択した後、病理医/読み手は手作業で、選択したFOVまたはROI内にある免疫細胞を計数する。読み手が異なれば、異なるFOVまたはROIを選択して計数することもあり得るので、FOVまたはROIの手作業による選択および計数は、非常に主観的であり、読み手よって偏りが生ずる。したがって、イムノスコアの研究は、手作業のプロセスでは必ずしも再現可能ではない。
解釈からの情報を利用するディジタル病理システムおよびワークフローを提供する。いかなる特定の理論によっても拘束されることは望まないが、IHCおよび/またはISHホール・スライド画像の解釈においてH&Eホール・スライドを使用することにより、IHCおよび/またはISHホール・スライド画像における構造的特徴の、H&Eホール・スライド画像における同じ構造的特徴に対する相関付けが可能になる(allow for)と考えられる。
は、文脈上明白に他の意味が示される場合を除いて、複数の引用物(referent)を含むものとする。 同様に、「または」(or)という単語は、文脈上明白に他の意味が示される場合
を除いて、「および」(and)を含むことを意図している。
「備える」(comprises)、「含む」(includes)、「有する」(has)等も、相互交換可能に使用され、同じ意味を有するものとする。具体的には、これらの用語の各々は、慣習的な米国特許法における「備えている」(comprising)の法的な定義に倣って定義されるものとし、したがって「少なくとも以下の」を意味する開放用語(open term)であると解釈され、更に追加の特徴、限定、態様等を除外しないと解釈されるものとする。つまり、例えば、「コンポーネントa、b、およびcを有するデバイス」とは、このデバイスが少なくともコンポーネントa、b、およびcを含むことを意味する。同様に、「ステップa、b、およびcを伴う方法」という表現は、この方法が少なくともステップa、b、およびcを含むことを意味する。更に、本明細書において、ステップおよびプロセスの概要が特定の順序で説明される場合があるが、順番に現れるステップおよびプロセスは変化してもよいことは、当業者には認められよう。
は、バイオマーカは、 特異的に染色することができ、細胞の生物学的特徴、例えば、細
胞の型または細胞の生理学的状態を示す、タンパク質またはペプチド、例えば、表面タンパク質であってもよい。免疫細胞マーカとは、ほ乳類の免疫応答に関係する特徴(feature)を選択的に示すバイオマーカである。
生物(derivative)であり、マスクにおける各画素が二進値、例えば、「1」または「0」(あるいは「真」または「偽」)として表される。ディジタル画像とマスクを重ねることによって、二進値の特定の1つのマスク画素にマッピングされたディジタル画像の全ての画素は、このディジタル画像に対して適用されるその後の処理ステップにおいて、隠される、除去される、あるいはそうでなければ無視または排除(filter)される。例えば、元の画像の全ての画素に、強度値が閾値より高い場合には真、それ以外には偽を割り当てることによって、元のディジタル画像からマスクを生成することができ、こうすることによって、「偽」マスク画素("false" masked pixel)が重ね合わされた全ての画素を排除するマスクを作成する。
理学のために人または動物の身体から得られた任意の生体試料を指す。例えば、組織試料は、胸部組織、肺組織、前立腺組織等から得られても(derived)よく、腫瘍、腫瘍の疑い
があるもの、または健康な組織から得られた試料を含んでもよい。組織試料および検体(specimen)の他の例、ならびにそれらの調製についても、本明細書において開示する。組織試料は、試料内における構造(例えば、血管、細胞等)の識別において補助するために、アッセイ内において1つ以上の染料によって処置することができる。
[0036] 本開示の少なくともいくつかの実施形態は、1つ以上の一次染色(例えば、ヘマトキシリンおよびエオシン)および1つ以上の検出プローブ(例えば、試料内にあるターゲットの標識付けを容易にする特定の結合エンティティを含有するプローブ)によって染色された組織試料を含む生体試料からキャプチャされたディジタル画像を分析するためのコンピュータ・システムおよび方法に関する。本明細書において更に開示するように、出願人は組織試料のIHCまたはISHスライド画像(以下「バイオマーカ画像」)において選択された領域を使用し、これらの選択された領域を、組織試料のH&E画像における対応領域に「逆マッピングする」システムおよび方法を開発した。H&E画像分析からの結果は、IHC画像の自動化分析において補助するために使用される。
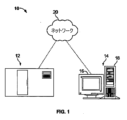
[0039] 検体を分析するためのコンピュータ・ベース検体アナライザ10を図1に示す。コンピュータ・ベース検体アナライザ10は、撮像装置12とコンピュータ14とを備えることができ、撮像装置12およびコンピュータは、通信可能に一緒に結合することができる(例えば、直接、またはネットワーク20を通じて間接的に)。尚、他のコンピュータ・デバイスまたはシステムを利用してもよいこと、そして本明細書において説明するコンピュータ・システムが追加のコンポーネント、例えば、検体アナライザ、スキャナまたは撮像システム、自動化スライド調製機器(slide preparation equipment)等に通信可能に結合されてもよいことは、当業者には認められよう。利用することができるこれらの追加のコンポーネントおよび種々のコンピュータの一部についても、本明細書において説明する。
[0049] 最初のステップにおいて、そして図3Aを参照すると、コンピュータ・システムは少なくとも2つの画像を入力として受け取る(ステップ301)。ある実施形態では、入力として受け取られる画像は、連続組織切片、即ち、同じ異種移植片組織ブロックから導き出された連続切片から導き出される。ある実施形態では、入力画像は、随意に、本明細書において説明するように組織マスキング・モジュール218によってマスキングされる。
), Cold Spring Harbor Laboratory Press (1989)、および Ausubel et alの「Current Protocols in Molecular Biology」(分子生物学における現在のプロトコル), Greene Publishing Associates and Wiley-Intersciences (1987)において論じられている。これらの文献をここで引用したことにより、その内容は本願にも含まれるものとする。
料は、PD-L1バイオマーカを含む1つ以上のバイオマーカの存在を求めて、IHCアッセイにおいて染色される。したがって、ある実施形態では、入力として使用されるバイオマーカ画像は、PD-L1マーカ、CD3マーカ、およびCD8マーカの存在に対応するシグナルを含むIHC画像である。ある実施形態では、コンピュータ実装方法は、更に、分類した核を採点するステップを含む。
[0058] ある実施形態では、インターマーカの位置合わせおよび画像分析(図3Bおよび図3Cのステップ321および310をそれぞれ参照のこと)を容易にするために、ユーザ、医療専門家、または病理医によって入力画像に注釈が付けられる。ある実施形態では、そして図3Bを参照すると、ユーザ、医療専門家、または病理医が、更なる分析(ステップ321)に適したバイオマーカ画像(例えば、IHC全画像)の複数の部分(例えば、小領域)を識別し、これらの識別された部分は、続いてバイオマーカ画像からH&E画像における対応する部分に転写される(ステップ326)。これについては本明細書において明記する。ある実施形態では、識別された部分は、特異的バイオマーカ、例えば、特異的IHCマーカの過剰表現腫瘍領域を表す。
[0062] 第1および第2画像、および/またはそれらの注釈を受け取った後、第1画像の少なくとも一部を、第2画像の対応する部分に位置合わせして、位置合わせ画像を形成する(ステップ303)。ある実施形態では、インターマーカ位置合わせモジュール211が、第1画像(例えば、バイオマーカ画像)の少なくとも一部を第2画像(例えば、H&E画像)の対応する部分にマッピングするために使用される。このようにするとき、第1および第2画像は、共通座標系にマッピングされる。ある実施形態では、第1画像の部分とは、上流プロセスにおいて、更なる分析に適した特徴を含むものとして識別された部分である(例えば、先に注記したように、病理医によって注釈が付けられた、または自動化FOV選択プロセスによって)。ある実施形態では、インターマーカ位置合わせは、位置合わせモジュール211を使用して行われる。
つの画像を基準(基準画像または固定画像とも呼ぶ)として指定し、他の画像が基準と位置合わせするように、幾何学的変換を他の画像に適用することを伴う。幾何学的変換は、1つの画像における位置を、他の画像における新たな位置にマッピングする。正しい幾何学的変換パラメータを決定するステップは、画像位置合わせプロセスの鍵となる。各画像の基準画像に対する変換を計算する方法は、当業者にはよく知られている。例えば、"11th International Symposium on Biomedical Imaging (ISBI)(第11回国際生物医学撮像シンポジウム), 2014 IEEE, April 29 2014-May 2 2014)において、例えば、画像位置合わせアルゴリズムについて記載されている。この文献をここで引用したことにより、その内容全てが本願にも含まれるものとする。画像位置合わせ方法の詳細について、以下で概説する。
か否か選択することができる。ユーザが、精細位置合わせを実行せずに、結果を直接表示することを選択した場合、本プロセスはブロック626に進む。
[0070] 図3Aを参照して、位置合わせ画像を形成するために、第2画像の対応部分に
第1画像の少なくとも一部を位置合わせした後に、第1画像および位置合わせ画像の双方を分析し(ステップ302および304)、各画像から特徴またはメトリックを導き出す。本明細書において記されているように、導き出される特徴は、(i)H&E画像の特徴、(ii)バイオマーカ画像の特徴、および(iii)H&E画像内において識別された組織および/または細胞から計算した確率マップ画像から導き出される確率特徴(probability feature)を含む。合わせて、H&E画像の特徴、バイオマーカ画像の特徴、および確率特徴を一緒に融合して(ステップ305)、入力画像の少なくとも1つに存在する細胞核を分類する(ステップ306)および/または採点する(ステップ307)ことができる。画像分析を実行するために必要なステップについては、本明細書において説明する。
オマーカ画像および/またはH&E画像からの特徴を導き出すステップは、画像内において核を検出し、次いで検出した核から、または検出した核を取り囲む画像パッチから特徴を抽出するステップを含む(例えば、図3Cのステップ312を参照のこと)。これらの方法については、本明細書において説明する。
[0074] ある実施形態では、バイオマーカ画像および/またはH&E画像からの特徴の導出は、画像内において核を検出し、次いで検出された核から、または検出された核を取り囲む画像パッチから特徴を抽出することを含む。
[0076] ある実施形態では、核検出モジュール214によってというようにして、入力IHC画像の各々において、核を検出する。一旦核が検出されたなら、識別された核から、または核を取り囲む画像パッチから、特徴抽出モジュール215によってというようにして、特徴を導き出すことができる。
priori domain knowledge)を明示的に使用する。これを遂行するために、入力画像にお
ける色強度と共に、放射相称投票において画像勾配情報も使用し、適応セグメンテーション・プロセスと組み合わせて、細胞核を正確に検出し位置を突き止める。本明細書において使用する場合、「勾配」(gradient)は、例えば、特定の画素を取り囲む1組の画素の強度値勾配を考慮に入れることによって、前記特定の画素について計算された画素の強度勾配である。各勾配は、座標系に対して特定の「方位」を有することができ、この座標系のx-軸およびy-軸はディジタル画像の2つの直交するエッジによって定められる。実例をあげると、核シード検出は、細胞核の内側にあり、細胞核の位置を突き止めるための開始点として役割を果たすと想定される点として、シードを定義することを伴う。最初のステップは、楕円形状をなすブロブ、細胞核に類似する構造を検出するための放射相称に基づく、ロバスト性の高い手法を使用して、各細胞核と関連付けられたシード点を検出することである。放射相称手法は、カーネルに基づく投票手順を使用して、勾配画像に対して動作する。投票カーネルを通して投票を蓄積する各画素を処理することによって、投票応答行列を作成する。カーネルは、その特定の画素において計算された勾配方向、最大および最小の核サイズの予測範囲、ならびに投票カーネルの角度(通例では、[π/4、π/8]の範囲)に基づく。結果的に得られた投票空間において、既定の閾値よりも大きな投票値を有する極大値位置をシード点として保存する。無関係なシードは、後続のセグメンテーションまたは分類プロセス中において後に破棄することができる。
[0083] 核の検出に続いて、特徴抽出モジュール215によってというようにして、特徴(またはメトリック)を導き出す。通常では、特徴抽出モジュール215は、画像データを受け取り、受け取った画像データに基づいて特定のメトリックを導き出し、別個に計算された確率特徴との組み合わせのために、これらの導き出したメトリックを出力する(ステップ305)。ある実施形態では、バイオマーカ画像から、そしてH&E画像から別個のメトリクスを計算する。
[0088] 「形態的特徴」(morphology feature) とは、本明細書において使用する場合
、例えば、核の形状または寸法を示す特徴である。いかなる特定の理論によっても拘束されることは望まないが、形態的特徴は、細胞またはその核のサイズもしくは形状についての何らかの不可欠な情報を提供すると考えられる。例えば、形態的特徴は、核ブロブまたはシード内に含まれる画素、またはそれを取り囲む画素に対して種々の画像分析アルゴリ
ズムを適用することによって計算することができる。ある実施形態では、形態的特徴には、面積、単軸および長軸の長さ、輪郭、半径、硬度等が含まれる。
[0090] 画素数に関する、核ブロブのサイズを特徴として使用することができる。面積=核領域における画素の総数。
[0092] 領域と同じ正規化された第2中心モーメントを有する楕円の短軸/長軸の長さを指定するスカラー(画素単位)。一例として、識別された核またはシード点の周囲で検出された核ブロブ・マスクに基づいて、ブロブ形状を楕円で近似することができる。この楕円の短軸は、偏心パラメータ(短軸の長軸に対する比として計算される)と共に特徴として使用される。
[0094] 核領域の境界上の画素数
[0095] 形態的特徴の例(iv):半径
[0096] 核の中心から核の境界画素までの平均距離。
[0098] 同一領域内に存在する凸包内における画素の割合を指定するスカラー(面積/凸面積(Area/ConvexArea)として計算する)。
[00100] ブロブと同じ面積を有するブロブの中心を中心にして広がる円形領域を考え
、この円形領域とブロブとの間の重複領域の面積を「重複面積」(overlap area)と呼び、次いで、ブロブの緊密さの特徴を、緊密さ=重複面積/ブロブ面積として計算する。この特徴は、不規則な形状および非核形状を核から差別化するために使用される。
[00102] ある実施形態では、「ブロブ密度」特徴が、リンパ球および間質に対して非
常に差別的であると思われる。リンパ球については、細胞は、間質細胞よりも密接に詰め込まれている。また、リンパ球については、平均ブロブ・サイズが、特定のバイオマーカに対して陰性に染色する特定の核よりも小さいとして差し支えない。したがって、密度に基づく特徴は、近隣シード(nearby seed)の詰め込み密度、および近傍にあるブロブ(neighborhood blob)のサイズの分布の双方を説明するために使用される。例えば、5urnから25urnの範囲をとる半径の複数の値に対して、所与のシードを取り囲むサイズ(2×半径+1)×(2×半径+1)のウィンドウを使用して、この特徴を計算する。半径値毎に、ブロブ画素密度、ブロブ・シード密度、正規化画素密度(核ブロブの平均サイズで正規化する)、正規化シード密度特徴(Normalized Seed density feature) といった特徴を計算する。
定される長軸方向。
[00104] (B)外観的特徴から導き出されるメトリック
[00105] 「外観的特徴」(appearance feature)は、本明細書において使用する場合、
例えば、核を識別するために使用される核ブロブまたはシード内に含有される、あるいはそれを取り囲む画素の画素強度値を比較することによって、特定の核について計算された特徴であり、これによって、異なる画像チャネル(例えば、背景チャネル、バイオマーカの染色のためのチャネル等)から、比較画素強度(compared pixel intensities)が導き出
される。ある実施形態では、外観的特徴から導き出されるメトリックは、異なる画像チャネルから計算される画素強度(pixel intensities)および勾配強度(gradient magnitudes)のパーセンタイル値(例えば、10、50,および95パーセンタイル値)から計算される。例えば、最初に、対象の核を表す核ブロブ内にある複数ICの画像チャネル(例えば、3つのチャネル:HTX、DAB、輝度)の各々の画素値のX-パーセンタイル値(X=10、50、95)の数Pを特定する。外観的特徴メトリックを計算することは、有利であると言える。何故なら、導かれるメトリックは、核領域のプロパティ(例えば、PDL1バイオマーカに対する染色のコンテキストでは、濃い茶色の核、濃い青色の核、明るい青色の核等)を記述することができ、更に、例えば、膜の染色が明るい茶色、暗い茶色、または全く染色しない等の場合、核を取り囲む膜領域(この場合も、PDL1バイオマーカに対する染色のコンテキストにおいて)(リボン領域)を記述することができるからである。
[00107] 「背景特徴」(background feature)とは、例えば、細胞質における外観およ
び/または染料の存在を示す特徴、および背景特徴が画像から抽出された核を含む細胞の細胞膜の特徴である。背景特徴および対応するメトリックは、例えば、核ブロブまたは核を表すシードを識別し、識別された1組の細胞に直接隣接する画素エリア(例えば、核ブロブ境界周囲の厚さ20画素、即ち、約9ミクロンのリボン)を分析し、したがって、細胞の細胞質および膜における外観および染料の存在を、この核および細胞に直接隣接するエリアと共に、キャプチャすることによって、ディジタル画像内に描写される核および対応する細胞について計算することができる。これらのメトリックは、核の外観的特徴に似ているが、各核の境界周囲の約20画素(約9ミクロン)の厚さのリボンにおいて計算され、したがって、識別された核を有する細胞の細胞質および膜における外観および染料の存在が、この細胞に直接隣接するエリアと共に、キャプチャされる。いかなる特定の理論によっても拘束されることは望まないが、このリボン・サイズを選択したのは、核を取り囲む十分な量の背景組織エリアをキャプチャし、核の差別について有用な情報を提供するために使用することができると考えられるからである。これらの特徴は、J. Kong, et al., "A comprehensive framework for classification of nuclei in digital microscopy imaging: An application to diffuse gliomas"(ディジタル顕微鏡撮像における核の分類のための総合的フレームワーク:びまん性神経膠腫に対する応用)in ISBI, 2011, pp.2128-2131によって開示されたものと同様である。この文献をここで引用したことにより、その内容全体が本願にも含まれるものとする。尚、これらの特徴は、周囲の組織が間質かまたは上皮か判定するために使用することができると考えられる(H&E染色組織試料におけるように)。いかなる特定の理論によっても拘束されることは望まないが、これらの背景特徴は、膜染色パターンもキャプチャし、膜染色パターンは、組織試料がしかるべき膜染色剤(例えば、PDL1)によって染色されるときに有用であると考えられる。この場合も、PDL1のコンテキストでは、PD-L1バイオマーカは細胞膜を殆ど染色するので、この染色は、核の境界の外側に沿って、茶色のリボン、茶色のスポット、または双方を生み出す。
[00109] ある実施形態では、色から導き出されるメトリックには、色比率、R/(R
+G+B)、または色の主成分が含まれる。他の実施形態では、色から導き出されるメトリックには、色の各々の局所的統計(平均/中央/分散/標準偏差)、および/または局所画像ウィンドウにおける色強度相関(color intensity correlation)が含まれる。
[00111] 病理組織学的スライド画像内に表示される灰色の細胞の黒から白までの明暗
度の間で、一定の特異的プロパティ値を有する隣接細胞の一群を設定する。色特徴の相関
は、サイズ・クラスのインスタンスを定め、したがって、このようにして、これらの着色された細胞の明暗度によって、病的細胞を、その周囲にある黒い細胞のクラスタから判定する。
[00113] テクスチャ特徴の例(i):コンテキスト-テクスチャ特徴
[00114] ある実施形態では、対象核(NoI:nucleus of interest)を中心として広がる画像パッチから1組のテクスチャ特徴を計算するために、コンテキスト-テクスチャ方法を使用する。更に具体的には、コンテキスト-テクスチャ方法は、各NoIを取り囲む領域におけるテクスチャ・パターンをキャプチャすることを可能にし、この情報は、NoIが存在しているかもしれない組織の局所的型の識別において補助するために使用される(例えば、NoIを取り囲む領域はいずれも、固形腫瘍、リンパ球(免疫細胞)の集合体、間質、および/または全体的な染色応答を含む場合がある)。例えば、間質は、繊維のようなテクスチャによって特徴付けられ、一方可変サイズの複数の「ブロブ」の存在は、腫瘍領域の特徴である。繊維状テクスチャまたはブロブを取り囲む領域の画像パッチにおいてテクスチャ特徴を計算することによって、この情報は、その領域における任意の細胞または細胞核が、腫瘍組織ではなく、間質に属すると分類するとき、またはその逆であると分類するときに役立つことができる。NoIを取り囲む画像パッチからコンテキスト-テクスチャ特徴を導き出す手順は、Classifying Nuclei in Histology Images(組織学画像における核の分類)と題し、WO/2016/075096として公開された、同時係属中の特許出願において記載されている。この特許出願をここで引用したことによりその内容全体が本願にも含まれるものとする。通常では、各NoIを中心として広がる画像パッチをキャプチャすることによって、コンテキスト-テクスチャ方法を実行する。ある実施形態では、S×Sのサイズを有するパッチ・サイズを選択し、核についての豊富なコンテキスト情報を提供する、適度に大きい組織エリアを取り込む。他の実施形態では、パッチ・サイズは、任意のS×S寸法において、約50画素から約200画素の範囲を取る。更に他の実施形態では、約150画素(約70ミクロン)のパッチ・サイズを使用する。ある実施形態では、特定の組織型についてのみパッチを作成する。例えば、特定のバイオマーカに対して陽性である領域についてのみ、パッチを作成することもできる。画像パッチをキャプチャした後、各パッチ内においてテクスチャ特徴を計算する。ある実施形態では、計算するテクスチャ特徴には、強度のヒストグラム、勾配強度および勾配方位のヒストグラム、ガボール特徴(Gabor features)、ならびにハラリック特徴(Haralick features)というような特徴が含まれる。
ル画像に適用することによって、ディジタル画像から抽出されたディジタル画像の特徴である。1つ以上のガボール・フィルタは、異なる周波数および/または方位を有してもよい。ガボール・フィルタとは、例えば、エッジを検出するために、画像においてパターンを検出するために使用することができる、例えば、線形フィルタである。ガボール・フィルタの周波数および方位の表現は、人の視覚系のそれらと同様であり、これらはテクスチャの表現および差別に特に適していることがわかっている。ガボール・フィルタは、例えば、エッジ検出のために画像分析において使用されることが多い線形フィルタである。例えば、ガボール・フィルタは、正弦平面波によって変調されたガウス・カーネル関数とすることができる。
ル化する能力を有すると考えられている。ガボール・フィルタは、複数の異なる方位および異なるスケールで、対数-ガボール・フィルタによって画像を畳み込み、次いで同じスケールにおける異なる方位の応答を平均化して、回転不変特徴を得る。ガボール・フィルタの応答は、ガボール・フィルタの1組の画像画素の強度値に適用した結果である。No
Iを含む画像パッチの画素に対して計算された応答は、NoIのコンテキスト情報メトリックとして使用することができる。ある実施形態では、ガボール・フィルタは、平均、標準偏差、平均応答に対する最小-最大比率を計算するために使用され、これらはコンテキスト情報メトリックとして使用することができる。ガボール・フィルタおよびそれらの応用についてのこれ以上の情報は、Jain, A. K., Farrokhnia, F.: "Unsupervised texture segmentation using Gabor filters"(ガボール・フィルタを使用した教師なしテクスチャ・セグメンテーション), IEEE Int. Conf. System, Man., Cyber., pp. 14-19 (1990)において見ることができる。この文献をここで引用したことにより、その内容全体が本願にも含まれるものとする。この場合も、これらの特徴を分類モジュールに供給することができる。
ての情報をキャプチャすると考えられている。ハラリック・テクスチャ値は、共起行列によって計算される。この行列は、2つの画素間における角度関係および距離双方の関数であり(互いにある距離だけ分離されてもよい)、2つの指定された画素間における関係の発生回数を示す。「ハラリック・テクスチャ特徴」または「ハラリック特徴」とは、例えば、共起行列から抽出されたディジタル画像の特徴であり、互いに関して特定の位置にあるディジタル画像の画素における画像強度がどのようにして一緒に発生するかについての情報を含む。ハラリック特徴を計算するために、ディジタル画像において識別された各オブジェクト内で観察された最大および最小強度に、行列の強度レベルの根拠を置くことによって、共起行列を、例えば、正規化することができる。Haralick, Shanmugan, and Dinstein (1973)は、これを「グレー・トーン空間依存性行列」(gray-tone spatial-dependence matrix)と呼ぶ。本開示の実施形態において使用されるこれらの実施態様では、ある距離dだけ分離された画素間において4つの方向(0°、45°、90°、および135°)を考える(Haralick, R., Shanmugan, K., and Dinstein, I. "Textural Features for Image Classification"(画像分類のためのテクスチャ特徴), IEEE Transactions on Systems, Man, and Cybernetics 3, no. 6 (1973): 610-621を参照のこと。この文献をここで引用したことにより、その開示内容全体が本願にも含まれるものとする)。
チ内にある画素について計算される。実施形態によれば、共起行列は、複数の既定の方向(または「角度」)、例えば、4つの方向、0°、45°、90°、および135°の各々について計算される。生成された1つまたは複数の共起行列から、自己相関、コントラスト、相関、不同性(dissimilarity)、エネルギ、エントロピ、同質性、最大確率、分散、和平均、和分散、和エントロピ、差分散、差エントロピ、相関の2つの情報尺度、逆差、正規化逆差、および逆モーメントを含む複数の特徴を計算することができる。これらのパラメータの各々は、共起行列における異なるデータ・エントリ間の関係、例えば、「茶色チャネルにおける高強度値」という特徴と、グレー値勾配サイズに対する特定のビン値との相関を表すことができる。検討中の各チャネルからこれらの値を抽出し、各特徴画像の平均、標準偏差、およびモードを求めることによって多数の共起特徴が得られる。これらの特徴はいずれも、コンテキスト情報メトリックとして使用することができる。
よい。何故なら、共起行列は特定の細胞型または組織型のインディケータとなることができる生体情報を示すことができるからである。例えば、共起行列、およびこれから導き出されるコンテキスト情報メトリックは、どれくらいの頻度で青色画素(核内部の画素)が茶色画素(膜染色の画素)に近づくか(距離d以内に)記述することができる。
ル毎に個別に計算し、それぞれのハラリック・テクスチャ値を、各画像チャネルから別々
に導き出す。チャネル毎に個別に計算する従来のグレー・レベル共起行列(「GLCM」)に加えて、チャネル間または色共起行列(「CCM」)も計算することができる。CCMは、2つの異なる画像チャネルにおける画素強度の共起から、即ち、変位ベクトル(例えば、d=[dx;dy])を使用して、2つのチャネル(例えば、Ci;Cj)からCCMを計算するために、作成される。共起は、Ci内の位置(x;y)における画素強度、およびCj内の位置(x+dx;y+dy)における画素強度について計算される。尚、CCMは、異なる組織構造(異なるチャネルにおいて強調される)間の空間関係を、これらを明示的にセグメント化する必要なく、キャプチャする利点を提供すると考えられる。例えば、第1バイオマーカが細胞膜の外面上で表現されることがわかっており、第2バイオマーカが細胞膜の内面上で表現されることがわかっており、第1および第2バイオマーカが異なる染料によって染色され、これらの染料のシグナルが2つの異なる画像チャネルにおいてキャプチャされる場合、2つの異なるチャネルにおけるシグナルの強度値は相関する(既定のオフセットで)。何故なら、内膜のタンパク質および外膜のタンパク質は常に、または主に、互いに空間的に近接してシグナルを生成するからである。前記空間近接度は、CCM行列において、異なるチャネルにおける画素強度相関の形態でキャプチャすることができる。
徴を計算する。この場合も、CCMから計算される特徴の内任意のものをコンテキスト情報メトリックとして使用することができる。GLCM行列と同じようにまたは似たようにして、実施形態にしたがってチャネル間行列を計算する。複数の異なる角度および距離を考慮することができる。唯一の相違は、1対の画素が2つの異なるチャネルから選出される、例えば、画像チャネル1に属する画素p1および画素チャネル2に属するp2が選出されるが、これら2つの画素は同じ座標系内にあると見なされることである(これらの間の距離および角度を計算できるように)。これらの特徴も同様に、分類モジュールに供給することができる。
[00123] 「テクストン」(texton)とは、例えば、基準画素から最大距離未満だけ離れ
て位置する画素ブロブまたは1組の画素の1組の1つ以上の属性であり、これによって、前記属性が画像内において繰り返すことが観察されているか、または予測される。例えば、テクストンは、指向性線形フィルタ出力(oriented linear filter output)の頻繁に共起する組み合わせ(frequently co-occurring combination)とすることができる。画素ブロブは、例えば、核を含む細胞内に存在すると識別された核ブロブまたは画素エリアとすることができる。基準画素は、例えば、核の中心、または細胞の中心、または細胞膜にすることができる。つまり、「テクストン」を「ビジュアル・ワード」(visual word)と見なすことができ、例えば、特定のサイズまたは寸法の楕円、特定の平均強度値の円、特定の強度分布またはパターンを有する画素ブロブ等と見なすことができる。
からテクストン・マップのヒストグラムを計算する(Malik, Jitendra et al., "Textons, Contours and Regions: Cue Integration in Image Segmentation"(テクストン、輪郭、および領域:画像セグメンテーションにおけるキュー統合), s.i.: IEEE Computer Society, 1999, Proceedings of the International Conference on Computer Vision, Corfu, Greece。この文献をここで引用したことにより、その海自内容全体が本願にも含まれるものとする)。コンテキスト-テクストン特徴を導き出すための手順は、WO/2016/075096として公開された同時係属中の特許出願においても記載されている。この特許出願をここで引用したことによりその開示内容全体が本願にも含まれるものとする。
囲む領域においてテクスチャ・パターンをキャプチャすることである。しかしながら、テクスチャ特徴からコンテキスト情報メトリックを導き出す代わりに、一揃いの(bank)最大応答フィルタを、組織試料の画像上(またはそのチャネル画像に)に適用して、フィルタ応答画像のリストを得る。(Varma and Zisserman, "Classifying images of materials:
Achieving viewpoint and illumination independence"(素材の画像の分類:視点およ
び照明独立性の達成)in Computer Vision ECCV 2002, 2002, vol. 2352, pp.255-271を
参照のこと。この文献をここで引用したことにより、その内容全体が本願にも含まれるものとする。)各フィルタ応答画像は、1つ以上のフィルタ応答を含むディジタル画像である。「フィルタ応答」は、[0018]において定められているようなフィルタ応答としてもよい。訓練画像から導き出されたフィルタ応答画像、およびその中に含まれるフィルタ応答を収集し、「テクストン」と呼ばれる複数のK個のクラスタにクラスタリングする(ステップ331)。
得られたフィルタ応答の各々は、直径、強度等のような何らかのプロパティ値を有するベクトルであってもよい。前記フィルタ応答のクラスタリングによって、1組のK個のクラスタを得ることができ(provide)、これによって、クラスタ毎にクラスタ中心が、前記ク
ラスタに属する全てのフィルタ応答の平均値のベクトルとして、繰り返し計算される。つまり、各クラスタ中心は、「平均」フィルタ応答ベクトル(その値は、前記クラスタ中心に割り当てられたフィルタ応答のそれぞれ特徴ベクトルの平均値である)、または前記クラスタ中心に割り当てられたフィルタ応答から導き出される「プロトタイプ」フィルタ応答ベクトルの他の形態であってもよい。クラスタのクラスタ中心を表す前記「派生」(derivative)フィルタ応答ベクトルが、「テクストン」として使用される。例えば、各クラスタ中心は、各フィルタの特定の画像パッチに対する1組の投影を表す。前記K個の「クラスタ中心テクストン」は、繰り返し高精度化する(refine)こともできるが、K-平均クラスタリング・アルゴリズムの出力として供給することができる。このクラスタリング・アルゴリズムの判断基準は、各フィルタ応答ベクトルを最も近い中心に割り当てた後、中心からの二乗距離の合計が最小になるように、K個の「中心」を発見することである。つまり、組織試料画像に含まれる情報を処理することによって、K個のテクストンのテクストン・ボキャブラリー(texton vocabulary)が自動的に抽出される。次いで、クラスタ中心を構成するテクストンから、テクストン・マップを計算することができる。複数の訓練済みクラスタ中心に基づいて、組織試料の画像の各画素を、K個のテクストンの内の1つに割り当てる。例えば、この割り当ては、画像における各画素(または少なくともNoIを中心として広がる画像パッチ内にある各画素)が、前記マッピングされる画素を含む1組の画素に対して生成されるフィルタ出力についての特徴である、テクストンの1つに割り当てられるように、実行することができる。各画素はテクストンの内の1つに正確にマッピングされるので、画像は、異なるテクストンに割り当てられた領域に区分される(partition)。前記「区分画像」を「テクストン・マップ」と呼ぶことができる。
ける全ての画素からテクストン・ヒストグラムを計算する(ステップ333)。ある実施形態では、パッチ・サイズは、任意のS×S寸法において、約50画素から約200画素までの範囲を取る。他の実施形態では、約150画素(約70ミクロン)のパッチ・サイズが使用される。尚、前記パッチ・サイズの範囲は、細胞型についてのテクスチャ関連コンテキスト情報が予測パラメータであるときに、この細胞型を精度高く識別するのに、特に適していることが観察されている。「テクストン・ヒストグラム特徴」とは、例えば、画像または特定の画像チャネルにおいて識別されたテクストン(「ビジュアル・ワード」)の発生頻度の分布である。例えば、テクストン・ヒストグラムは、特定の型のテクストンの数を示すグラフとして表すことができる。例えば、以下の3の型式のテクストンを画像から抽出することができる。軸a1.1およびa1.2を有する「楕円1」、軸a2.1およびa2.2を有する「楕円2」、ならびに直径d1および強度値範囲=[09~110」を有する「円1」。テクストン・ヒストグラム特徴は、テクストン「楕円1」が79回発見され、テクストン「楕円2」が1.124回画像において発見され、「円1」が画像において34回発見されたことを示すヒストグラムであってもよい。
[00129] コンテキスト-CRF方法は、分類結果の均質性を高めるために、条件付き
確率場(CRF:conditional random field)モデルを採用する(J. Lafferty et al., Conditional Random Fields: Probabilistic Models for Segmenting and Labeling Sequence Data(条件付き確率場:シーケンス・データをセグメント化し標識付けするための確率モデル), ICML, pp. 282-289, 2001を参照のこと。この文献をここで引用したことにより、その開示内容全体が本願にも含まれるものとする)。CRFモデルは、本明細書におけるBoWモデルと同様、近隣核からの、予め計算されている核の特徴/メトリックおよび標識をコンテキスト情報として利用し、これによって、追加の特徴抽出を行わずに(コンテキスト・テクスチャ方法およびコンテキスト・テクストン方法と比較して)、コンテキスト情報の組み込みを可能にする。尚、CRFモデル方法は、対毎の制約(pair-wise constraints)を組み込み、同じクラスに属する隣接領域を強制する自然な方法を提供ると考えられる。また、コンテキストーCFR方法は、WO/2016/075096として公開されている同時係属中の特許出願にも記載されている。この特許出願をここで引用したことにより、その開示内容全体が本願にも含まれるものとする。
[00131] バッグ-オブ-ワーズ・モデル (bag-of-words model)は、基本ブロック(単語)の頻度に基づく、単純であるが強力な表現技法である。バッグ・オブ・ワーズ(BoW)は、広く使用されている特徴エンコーディング方法であり、画像から抽出された局所特徴が互いに独立していると仮定し、各画像内に現れる各ビジュアル「ワード」の頻度を計数するだけである。本明細書において使用する場合、「ワード」(word)とは核特徴ベクトルである。この方法は、NOIのコンテキスト情報を、その近隣の外観(たとえば、数および/または細胞型分布)によって記述できるという観察を使用する。ある実施形態では、近隣は、距離d=75画素内にある核として定められる。他の実施形態では、この距離は約25画素と約100画素との間の範囲を取る。コンテキスト-BoW方法も、WO/2016/075096として公開された同時係属中の特許出願に記載されている。この特許出願をここで引用したことにより、その内容全体が本願にも含まれるものとする。
[00133] ある実施形態では、空間的特徴は、細胞の局所密度、2つの隣接する検出細
胞間の平均距離、および/または細胞からセグメント化された領域までの距離を含む。
[00135] ある実施形態では、バイオマーカ・スライドにおいて検出された核毎に、最
初に、対応する核シード位置を対応するH&E画像において識別し、その核を取り囲むもっと大きなH&Eパッチを得る。次いで、このパッチにおいて間質細胞および腫瘍細胞分布を推定する。分布は、ピラミッド・ヒストグラム(例えば、図7参照)を使用して計算することができる。ピラミッド・ヒストグラム特徴については、更に、S. Lazebnik et al. "Beyond Bags of Features: Spatial Pyramid Matching for Recognizing Natural Scene Categories"(バッグ-オブーフィーチャを超えて:自然場面カテゴリを認識するための空間ピラミッド・マッチング), VPR '06 Proceedings of the 2006 IEEE Computer Society Conference on Computer Vision and Pattern Recognition - Volume 2, Pages 2169-2178, June 17 - 22, 2006に記載されている。
[00137] 検出された核心および関連するブロブ(IHC画像において)について、H
&E画像および/またはH&E確率画像においてマッピングされた中心および領域から、H&E特徴を計算することができる。使用することができる画像特徴のいくつかの例には、次のものがある。
えば、15×15画像矩形パッチおよび/または複数のウィンドウ)における画像強度の平均/中央/分散空間(Variancespatial)相関/テクスチャ特徴/局所統計。
[00140] (c)確率マップ画像から計算される確率の平均値/最大値/最小値
[00141] (J)核特徴から導き出されるメトリック
[00142] また、当業者には、核特徴からもメトリックを導き出せることが認められよ
う。このような核特徴の計算については、Xing et al. "Robust Nucleus/Cell Detection
and Segmentation in Digital Pathology and Microscopy Images: A Comprehensive Review"(ディジタル病理学および顕微鏡画像におけるロバストな核/細胞検出およびセグメンテーション:包括的な再検証), IEEE Rev Biomed Eng 9, 234-263, January 2016に記載されている。この文献をここで引用したことにより、その内容全体が本願にも含まれるものとする。
の基準として使用してもよい。導き出されたメトリックは、特徴またはメトリックのベクトルとして、分類モジュール216に供給される。
[00145] 確率特徴の導出は、最初に、H&E画像内において異なる組織および/また
は細胞型を識別し、その後に、識別された異なる組織および/または細胞型のいずれかに基づいて確率マップを生成し、次いでこの確率マップから確率特徴を導き出すことを必要とする。
[00147] H&E画像ホール・スライド画像を考慮すると、このH&E画像において異
なる組織型および/または細胞型を識別することができる(ここでは纏めて「セグメンテーション」または「H&E画像セグメンテーション」と呼ぶ)。ある実施形態では、腫瘍領域、リンパ球領域、間質領域、および壊死領域を含む、異なる型の領域に、H&E画像をセグメント化する。他の実施形態では、H&E画像内にある細胞を検出し、腫瘍、リンパ球、または間質細胞として分類する。H&E画像の「セグメンテーション」に続いて、識別された組織型および/または細胞型に基づいて、確率マップを生成する。
カラー・デコンボリューション(color color deconvolution)(「アンミキシング」(unmixiing)とも呼ぶ)によってというようにして、入力画像(例えば、異なるバイオマーカに対応する複数のシグナルを含む多重画像)の内任意のものに存在する異なる画像チャネルを最初に分離しなければならない。ある実施形態では、アンミキシング・モジュールが、個々の色チャネルを分離するために利用され、これはRuifrok, A. and Johnston, D., "Quantification of histochemical staining by color de- convolution"(カラー・デコンボリューションによる組織化学的染色の定量化), Analyt. Quant. Cytol. Histol. 23, 291-299 (2001)に記載されている方法に基づく。ある実施形態では、線形アンミキシングを使用して、多重画像を分離する(unmix)。線形アンミキシングは、例えば、Zimmermann "Spectral Imaging and Linear Unmixing in Light Microscopy"(光学顕微鏡におけるスペクトル撮像および線形アンミキシング), Adv Biochem Engin/Biotechnol (2005) 95:245- 265、および C. L. Lawson and R. J. Hanson, "Solving least squares Problems"(最小二乗法の問題の解決), PrenticeHall, 1974, Chapter 23, p. 161に記載されている。これらの文献をここで引用したことにより、その開示内容全体が本願にも含まれるものとする。他の実施形態では、何種類かの画像分析において、入力RGB画像、またはRGB画像からの何らかの派生画像(HSV、ClElabのような)上で直接細胞検出および分類を行うことができる。他の実施形態では、アンミキシングは、"Group Sparsity Model for Image Unmixing"(画像アンミキシングのための群希薄モデル)と題し、
2015年2月23日に出願されたWO2015/124772に記載されている方法を使用して行われる。この特許出願をここで引用したことにより、その開示内容全体が本願にも含まれるものとする。他の実施形態では、アンミキシングは、"Image Adaptive Physiologically Plausible Color Separation"(生理学的に妥当な画像適応型色分離)と題し、2014年5月28日に出願されたWO2014/195193に記載されている方法を使用して行われる。この特許出願をここで引用したことにより、その開示内容全体が本願にも含まれるものとする。概略的に、WO2014/195193は、繰り返し最適化した基準ベクトルを使用して、入力画像の成分シグナルを分離することによるアンミキシング方法について記載する。ある実施形態では、アッセイからの画像データを、アッセイの特徴に特異的な、予測結果または理想的な結果と相関付けて、品質メトリックを判定する。
所量を表す別個のチャネルに分離する(unmix)。加えて、輝度チャネル(Lab色空間の
L成分)を、H&E画像用アンミキシング・モジュールによって生成することもできる。
織画像における異なる組織構造を強調すると考えられ、したがって、これらを構造的画像チャネルと呼んでもよい。更に正確には、ヘマトキシリン・チャネルは核領域を強調し、エオシン・チャネルは好酸性構造を強調し、一方輝度チャネルは脂肪構造、内腔、および空間を強調する。したがって、これらのチャネルから抽出された特徴は、組織の任意の画像内に存在する異なる生体構造を記述するのに有用である。勿論、構造画像チャネルの選択は、セグメンテーション問題毎に調節できることは、当業者には認められよう。例えば、IHC染色画像では、構造画像チャネルは、対比染色チャネル、1つ以上の免疫組織化学染色チャネル、色相、および輝度を含むことができ、各チャネルは、IHC画像内における異なる組織および/または構造の識別を容易にする。
015年1月23日に出願され、"Adaptive Classification for Whole Slide Tissue Segmentation"(ホール・スライド組織セグメンテーションのための適応分類)と題するPCT/EP2015/051302(WO2015/113895として公開されている)に記載されている方法にしたがって実行する。この特許出願をここで引用したことにより、その内容全体が本願にも含まれるものとする。概略的に、WO2015/113895は、領域の分類に関係する処理によって、画像において腫瘍領域を他の領域からセグメント化することについて記載し、組織画像において格子点を識別するステップと、格子点を複数の組織型の1つとして分類し、組織型の既知の特性のデータベースに基づいて分類格子点を生成するステップと、分類格子点に、高信頼度得点または低信頼度得点の内少なくとも1つを割り当てるステップと、高信頼度得点が割り当てられた格子点に基づいて、組織型の既知の特性のデータベースを修正し、修正データベースを生成するステップと、修正データベースに基づいて、低信頼度得点が割り当てられた格子点を分類し直して、組織をセグメント化する(例えば、画像において組織領域を識別する)ステップとを含む。
において異なる型の細胞を検出し、これに続いて、複数の画像特徴(形態計測的特徴、強度)を計算し、次いで細胞を異なる細胞型に類別する(categorize)ために教師付き分類器を訓練する。
Review"(組織病理学論理画像分析:再検証), IEEE Rev Biomed Eng. 2009; 2: 147-171に記載されている方法にしたがって、H&Eセグメンテーションを実行する。この文献をここで引用したことにより、その開示内容全体が本願にも含まれるものとする。この文献では、著者は、種々の局所構造セグメンテーション技法、および全域的場面セグメンテーション手法について記載しており、そのいずれもが、本明細書において提示するワークフローと共に使用することができる。
メンテーションを実行することもできる。セグメンテーションの他の方法には、Kriete, A et al., Automated quantification of quantum-dot-labeled epidermal growth factor receptor internalization via multiscale image segmentation(マルチスケール画像セグメンテーションによる量子ドット標識付けされた上皮成長因子受容体インターナリゼーションの自動定量化), Journal of Microscopy, v. 222(1) 22-27 (April 2006)に記載されているようなマルチスケール手法、Kass, A. Witkin, and D. Terzopoulos. Snakes: Active contour models(動的輪郭モデル), International, Journal of Computer Vision, 1 :321-332, 1988に記載されている動的輪郭(スネーク)手法(active contour (snake) approach)、J. A. Sethian, Level Set Methods: Evolving Interfaces in Geometry, Fluid Mechanics, Computer Vision and Materials Sciences(レベル設定方法:幾何学、流体力学、コンピュータ・ビジョン、および材料科学において進化しつつあるインターフェース), Cambridge Univ. Press, 1996に記載されているレベル設定手法(level set approach)、 Mahamud, S et al, Segmentation of Multiple Salient Closed Contours from Real Images(実画像からの複数の突出閉鎖輪郭のセグメンテーション), IEEE Transactions On Pattern Analysis And Machine Intelligence, Vol. 25, No. 4, April 2003に記載されている輪郭閉鎖手法(contour closure approach)、および Vincent, L. et al, Watersheds in digital spaces(ディジタル空間における分水嶺)に記載されている分水嶺手法、没入シミュレーション(immersion simulation)に基づく効率的なアルゴリズム(IEEE Transactions on Pattern Analysis and Machine Intelligence v. 13(6) June 1991 pp. 583-598)が含まれる。また、Watershed: Roerdink, J. and Meijster A., The Watershed Transform: Definitions, Algorithms and Parallelization Strategies"(分水嶺変換:定義、アルゴリズム、および並列化戦略), Fundamenta Informatica v. 41, 2001, IOS Press pp. 187-228についての批評記事も参照のこと。以下の論文に記載されているものを含む、他の技法も使用することができる。Thouis R. Jones et al, Voroni-Based Segmentation of Cells on Image Manifolds(画像多面性に対する細胞のボロノイに基づくセグメンテーション), in CVBIA, ser. Lecture Notes in Computer Science, Y. Liu et al. Eds., vol. 3765 Springer- Verlag, 2005 pp. 535-543、Thouis R. Jones et al,のポスター用紙(poster paper)、Methods for High-Content, High-Throughput Image-Based Cell Screening(高コンテンツ、高スループットの画像に基づく細胞選別方法), Proceedings of MIAAB 2006(www.broad.mitedu/~thouis/MIAABPoster.pdf;においてオンラインで入手可能), およびGang Lin et al, A Hybrid 3D Watershed Algorithm Incorporating Gradient Cues and Object Models for Automatic Segmentation of Nuclei in Confocal Image Stacks(共焦点画像スタックにおける核の自動セグメンテ
ーションのための勾配キューおよびオブジェクト・モデルを組み込んだハイブリッド3D分水嶺アルゴリズム), Cytometry Part A, 56A:23-26 (2003)。
[00157] H&E画像セグメンテーションに続いて、確率マップを生成するが、確率マ
ップは、識別された組織型のみ、識別された細胞型のみ、または識別された組織型および識別された細胞型の双方に基づくのでもよい。ある実施形態では、確率マップは、類別されたクラスの数と同じサイズの画像のベクトルである。確率マップにおける各画素位置において、クラス確率のベクトル(ベクトル・サイズは領域数に等しい)を生成する。クラスに対するクラス確率は、画素がその特定のクラスに属する確率を与える。領域分類結果の一例では、クラスは(腫瘍、非腫瘍、リンパ球、間質、壊死領域)とすることができる。細胞分類結果の例では、クラスは、背景、および異なる型の細胞構造(腫瘍、リンパ球、間質細胞、接続された組織、背景等)とすることができる。
方法で生成することができる。一実施形態では、そして画像分析アルゴリズムの適用の副産物として、確率マップも生成される(図6B参照)。実際、注釈を付けられ分析された小画像領域(sub-image region)毎に、確率マップ画像ベクトルが出力として供給される。
率マップの画像ベクトルを計算する。画像分析結果画像は、各画素に分類標識が割り当て
られ、領域型毎に1つずつ、複数の二進画像マスクが生成される画像であると仮定する。続いて、スムージング・フィルタ(例えば、11×11ガウス・フィルタ)を画像に適用して、スムージング・バージョンを生成する。生成された複数のスムージング画像(smoothed image)(異なる領域型毎に1つずつ)から、各画素において正規化することによって、確率画像ベクトルを生成する(即ち、任意の所与の画素において、特異的確率画像における画素値を、スムージング・ガウス値を、全ての領域型からのスムージング値の和によって正規化されたものとして与える)。
[00161] ある実施形態では、H&E確率マップ画像から抽出された特徴を、IHC画
像スライドを分析するための追加の画像特徴として使用することができる(例えば、H&E画像は、IHC画像の隣接する連続組織切片に関して組織切片の変形バージョンに対応し、したがって、IHCおよびH&E画像の画素対画素、または細胞対細胞の対応でさえも不可能である)。
マップにおける各画素は、その画素が特定の領域(例えば、組織領域)に属する確率を示すk-次元ベクトルに対応する。
[00164] H&E画像の特徴、バイオマーカ画像の特徴、および確率画像の特徴を導き
出した後、これらを一緒に融合し、入力画像の少なくとも1つにおいて核を分類するために使用する。ある実施形態では、分類器を訓練し、次いで異なる細胞核または染色応答を区別するために使用する。ある実施形態では、訓練中に、当業者には知られている手順にしたがって、専門家の観察者によって与えられるグラウンド・トゥルース識別と共に、細胞例を提示する。
が一般にモノリシック・ソリューションを凌駕することが定説となっている。学習アンサンブル(learning ensemble)または複数の分類システム(以下で説明するサポート・ベク
トル・マシンまたはアダブースト(Adaboost))は、様々な同様の分類器の予測の集計によって分類精度を高め、これによって個々の分類器の偏倚または分散のいずれも低減する方法である。
M」)である。一般に、SVMは分類技法であり、統計学習理論に基づき、非線形ケースのためのカーネルによって、非線形入力データ集合を高次元線形特徴空間に変換する。いかなる特定の理論によっても拘束されることは望まないが、サポート・ベクトル・マシンは、2つの異なるクラスを表す1組の訓練データEを、カーネル関数Kによって、高次元空間に投影すると考えられている。この変換されたデータ空間では、クラス分離を最大化するようにクラスを分離するために平坦な線を生成することができるように(識別超平面)非線形データを変換する。次いで、Kによって検査データを高次元空間に投影し、超平面に関してこれらがどこに入ったかに基づいて、検査データを分類する。カーネル関数Kは、データを高次元空間に投影する方法を定める。
。アダブーストとは、多数の弱分類器を組み合わせて強分類器を生成する適応アルゴリズムである。訓練段階中に病理医によって識別された画像画素(例えば、特定の染色を有する、または特定の組織型に属する)を使用して、弱分類器と見なされる、個々のテクスチャ特徴j∈{1,...,K}に対してΦjの各々について確率密度関数を生成する。次いで、ベイズの定理を使用して弱学習機(weak learner)を構成するΦj毎に、尤度シーン(likelihood scene)Lj=(Cj,Ij∈{1....K})を生成する。これらをアダブースト・アルゴリズムによって組み合わせて、強分類器 Πj=ΣTi=1αjilji
にする。ここで、画素cj∈Cj毎に、Πj(cj)は画素cjがクラスωTに属する複合尤度であり、αjiは、特徴Φiについて訓練する間に決定される重みであり、Tは繰り返しの回数である。
[00169] PLD1の採点
[00171] 1.H&EおよびIHC組織スライドのホール・スライド走査(ER、PR
、Ki67、およびHER2等)
[00172] 2.病理医がホール・スライド・ビューア(Virtuoso、Verso
、IRIS等)上でIHC組織のホール・スライド(例えば、Ki67)を検討する。
注釈を付け、選別する(pick) 。
[00174] 4.マーカ間位置合わせアルゴリズムを使用して、IHC組織のホール・ス
ライドからの注釈付き領域を、H&E組織ホール・スライドに逆にマッピングする。
を検出するための、H&Eホール・スライドにおいてマッピングされた領域の自動画像分析。
率ヒート・マップ(即ち、リンパ球の確率、腫瘍細胞の確率等)を計算する。確率マップは、画像スムージングを使用して、H&E画像上における検出から計算する。
細胞型の細胞/確率マップを、補足特徴として、IHC組織において検出された核オブジェクト上のKi67画像から計算された特徴集合に追加し、IHC画像における核オブジェクト分類のために使用する。ここでは、H&E画像において細胞オブジェクト(対比染色された腫瘍核、リンパ球、および間質細胞)の内いくつかについての画像特徴を差別化
することが容易であるとすると、これらは、陰性および陽性に染色された腫瘍核の検出において補助することによって擬陽性を減らすことにより、核オブジェクト分類器のロバスト性を高めるのに貢献するという仮定がある。
[00179] 他のワークフロー例として、H&EおよびIHC情報の双方を組み合わせる
、コンピュータ・ベースPD-L1採点アルゴリズムを紹介する。連続切片H&EおよびIHCスライドを入力として使用することができる。2つの画像を整列するために画像位置合わせアルゴリズムを使用することができる。次いで、双方の画像に対して画像セグメンテーションを実行し、腫瘍、間質、壊死、および血管領域というような異なる領域を得ることができる。次に、セグメンテーションの結果を、双方のスライドから組み合わせて、領域マップを生成することができる。領域マップは、形態素処理、またはセグメンテーション結果からの確率の加重平均のような複数の方法で得ることができる。その場合、H&EおよびIHCスライドの双方が互いにセグメンテーションにおいて補助するように使用することができる。次に、H&EおよびIHCスライド双方においてシードを得るために、核検出方法を使用することができる。シードの周囲において、以下を含むがこれらに限定されない複数の特徴を抽出することができる。
2.H&Eの特徴:H&Eスライドからの色、強度、勾配、バッグ・オブ・ワード等、更に大きなパッチにおける間質および腫瘍細胞の分布。細胞分布の更なる詳細については以下で説明する。
[00180] 次いで、アダブースト、SVM、ランダム・フォーレスト(Random Forest)、KNN、バッギング(Bagging)、ブースティング・ツリー(Boosting tree)等のような分類アルゴリズムを使用して特徴ベクトルを分類することができる。全ての特徴にわたって分類する代わりに、アンサンブル学習をこのステップにおいて使用することができる。先に掲示したような、単純なブートストラッピングから複雑な分類アルゴリズムまでに、弱学習機を選択することができる。
[00182] 本開示のコンピュータ・システムは、組織検体に対して1つ以上の調製プロ
セスを実行することができる検体処理装置に結び付ける(tie)こともできる。調製プロセ
スは、限定ではなく検体を脱パラフィン化する、検体のコンディショニングを行う(例えば、細胞コンディショニング), 検体を染色する、抗原賦活化を実行する、免疫組織化学染色(標識付けを含む)もしくはその他の反応を実行する、および/またはインサイチュー・ハイブリダイゼーション(例えば、SISH、FISH等)染色(標識付けを含む)もしくはその他の反応を実行する、更には顕微鏡、微小分析、質量分光法、またはその他の分析方法のために検体を調製するその他のプロセスを実行することを含むことができる。
ることができる任意の液体、半固体、または固体物質(または材料)とすることができる。具体的には、組織試料は、生体組織から得られた生体試料または組織試料とすることができる。組織は、臓器内において同様の機能を実行する、相互接続された細胞の集合体とすることができる。ある例では、生体試料は、ヒトの被験者のような、動物の被験者から得られる。生体試料は、任意の生存生物から得られる、任意の生物学的組織によって排泄される、または分泌される任意の個体または流体試料であり、限定ではなく、とりわけ、バクテリア、酵母菌、原虫、およびアメーバ等の単細胞生物、多細胞生物(植物又は動物等であり、健康であるか又は見掛け上健康であるヒトの被験者あるいは癌などのように診断又は検査を行うべき状態又は病気の影響を受けているヒトの患者からの試料も含まれる)を含む。例えば、生物学的試料は、例えば、血液、血漿、血清、尿、胆汁、腹水、唾液、脳脊髄液、房水または硝子体液、あるいは任意の身体分泌物、濾出液、浸出液(例えば、膿瘍あるいは感染または炎症の任意の他の部位から得られた流体)、あるいは関節(例えば、正常な関節または疾病に冒された関節)から得られる液体から得られる生物学的体液とすることができる。また、生物学的試料は、任意の臓器または組織(腫瘍生検のような生検または検死試料を含む)から得られた試料とすることができ、あるいは細胞(初代細胞か培養細胞かは問わない)、あるいは任意の細胞、組織、または臓器によって条件付けられた培養基を含むことができる。ある例では、生物学的試料は細胞核抽出物である。ある種の例では、試料とは、開示される細胞ペレット切片試料(cell pellet section sample)の内の1つのような、品質対照試料である。他の例では、試料は検査試料である。例えば、検査試料は、被験者から得られた生体試料から調製された細胞、組織、または細胞ペレット切片である。一例では、被験者とは、特定の状態または疾病の危険があるもの、または既に罹患したものである。ある実施形態では、検体は乳癌である。
ルデヒド、例えば、ホルムアルデヒド、パラホルムアルデヒド、およびグルタルアルデヒド、ならびに非アルデヒド架橋剤のような)、酸化剤(例えば、四酸化オスミウムおよびクロム酸のような、金属イオンおよび複合体)、タンパク質変性剤(例えば、酢酸、メタノールおよびエタノール)、未知のメカニズムの定着剤(例えば、塩化第二水銀、アセトンおよびピクリン酸)、複合試薬(例えば、カルノア固定液、メタカーン、ブアン液、B5定着剤、ロスマンの液体およびジャンドルの液体)、マイクロ波および種々雑多な固定剤(例えば、体積固定および蒸気固定を除く)を含むことができる。
たは複数)を使用してこの試料を脱パラフィンすることができる。廃物除去装置が脱パラフィン液(1つまたは複数)を除去した後、任意の数の物質を連続的に検体に適用することができる。物質は、前処置(例えば、タンパク質架橋、核酸露出等)、変性、ハイブリダイゼーション、洗浄(例えば、ストリンジェンシ洗浄)、検出(例えば、視覚、またはマーカ分子をプローブにリンクする)、増幅(例えば、タンパク質、遺伝子等を増幅する)、対比染色、封入処理等のためとすることができる。
定ではなく、染料、プローブ、試薬、リンス、および/またはコンディショナを含む(以後纏めて「染料」と呼ぶ)。物質は、流体(例えば、気体、液体、または気体/液体混合物)等とすることができる。流体は、溶媒(例えば、極性溶媒、非極性溶媒等)、溶液(例えば、水溶液または他の種類の溶液)等とすることができる。試薬は、限定ではなく、染料、湿潤剤、抗体(例えば、モノクロナール抗体、ポリクロナール抗体等)、抗原回復流体(例えば、水性または非水性系抗原賦活化液(retrieval solutions)、抗原回復緩衝剤(antigen recovering buffer)等)等を含むことができる。プローブは、検出可能な標識またはレポーター分子に付着した(attached)単離核酸または単離合成オリゴヌクレオチドとすることができる。標識は、放射性同位体、酵素基質、補因子、リガンド、化学発光または蛍光剤、ハプテン、および酵素を含むことができる。
c.が販売するBENCHMARK XT計器およびSYMPHONYC計器のような、自動装置とすることができる。Ventana Medical Systems,In
c.は、自動解析を行うためのシステムおよび方法を開示する多数の米国特許の譲受人であり、米国特許第5,650,327号、第5,654,200号、第6,296,809号、第6,352,861号、第6,827,901号、および第6,943,029号、および米国公開出願第2003/0211630号および第2004/0052685号を含む。これらの特許文書をここで引用したことにより、その内容全体が本願にも含まれるものとする。あるいは、検体を手作業で処理することもできる。
ができる。ここで使用する撮像装置は、明視野撮像スライド・スキャナである。明視野撮像装置の1つに、Ventana Medical Systems,Inc.が販売するiScan HT 明視野スキャナがある。自動化された実施形態では、撮像装置は、IMAGING SYSTEM AND TECHNIQUES(撮像システムおよび技法)と題する国際特許出願第P
CT/US2010/002772号(特許公報第WO/2011/049608号)、またはIMAGING SYSTEMS, CASSETTES, AND METHODS OF USING THE SAME(撮像システム、
カセット、およびこれらの使用方法)と題する米国特許出願第61/533,114号、2011年9月9日出願に開示されるようなディジタル病理デバイスである。国際特許出願第PCT/US2010/002772号および米国特許出願第61/533,114号をここで引用したことにより、その内容が本願にも含まれるものとする。他の実施形態では、撮像装置には、顕微鏡に結合されたディジタル・カメラが含まれる。
は蛍光顕微鏡システムであってもよい。ここで使用する撮像システムはMSIである。MSIは、概略的には、画素レベルで画像のスペクトル分布を利用することによって、病理学検体の分析に、コンピュータ化した顕微鏡に基づく撮像システムを装備する。種々のマルチスペクトル撮像システムが存在するが、これらのシステムの全てに共通する動作的側面は、マルチスペクトル画像を形成する能力(capability)である。マルチスペクトル画像とは、電磁スペクトルの全域における特異的波長または特異的スペクトル帯域幅において画像データをキャプチャするものである。これらの波長は、光学フィルタによって、または例えば、赤外線(IR)のような、可視光範囲を超える波長における電磁放射線を含む、所定のスペクトル成分を選択することができるその他の機材(instrument)の使用によって、選び出す(single out)ことができる。
離散光帯域を定めるためにチューニングすることができるスペクトル選択システム(spectrally-selective system)を内蔵する。光学システムは、広帯域光源を用いて光検出器上への透過によって照明された組織試料を撮像するように構成することができる。光学撮像システムは、一実施形態では、例えば、顕微鏡のような拡大システムを含んでもよく、光学システムの1つの光学出力とほぼ空間的に整列された1本の光軸を有する。このシステムは、異なる離散スペクトル帯域において画像を取得することを確保するように、スペクトル選択システムが調節またはチューニングされる(例えば、コンピュータ・プロセッサによって)に連れて、組織の連続画像を形成する。この装置は、加えて、ディスプレイも内蔵することができ、このディスプレイにおいて、取得された連続画像からの、視覚的に認知可能な少なくとも1つの組織画像が現れる。スペクトル選択システムは、回折格子のような光学分散エレメント、薄膜干渉フィルタのような光学フィルタの集合体、あるいはユーザ入力または予めプログラミングされているプロセッサのコマンドのいずれかに応答して、光源から試料を通して検出器に向かって伝送される光のスペクトルから特定の通過帯域を選択するように構成された任意の他のシステムを含むことができる。
に対応するいくつかの光出力を定める。この種のシステムは、光学システムからの透過光
出力(transmitted light output)を吸入し(intake)、識別されたスペクトル帯域内にある試料を検出システム上に、この識別されたスペクトル帯域に対応する光路に沿って撮像するように、この光出力の少なくとも一部を、N本の空間的に異なる光路に沿って空間的にリダイレクトする。
路において、あるいはコンピュータ・ソフトウェア、ファームウェア、またはハードウェアにおいて実装することができ、本明細書において開示した構造、およびそれらの構造的均等物、またはこれらの内1つ以上の組み合わせを含む。本明細書において説明した主題の実施形態は、1つ以上のコンピュータ・プログラムとして実装することができる。即ち、データ処理装置による実行のため、またはデータ処理装置の動作を制御するために、コンピュータ記憶媒体上にエンコードされたコンピュータ・プログラム命令の1つ以上のモジュールとして実装することができる。本明細書において説明したモジュールはいずれも、プロセッサ(1つまたは複数)によって実行されるロジックを含むことができる。「ロジック」(logic)とは、本明細書において使用する場合、命令信号、および/またはプロセッサの動作に作用するために適用することができるデータの形態を有する任意の情報のことを言う。ソフトウェアはロジックの一例である。
ュータ読み取り可能記憶基板、ランダムまたはシリアル・アクセス・メモリ・アレイもしくはデバイス、あるいはこれらの内1つ以上の組み合わせとすることができ、もしくはその中に含めることができる。更に、コンピュータ記憶媒体は伝搬信号ではないが、コンピュータ記憶媒体は、人工的に生成された伝搬信号内にエンコードされたコンピュータ・プログラム命令の起点または宛先となることができる。また、コンピュータ記憶媒体は、1つ以上の別個の物理コンポーネントまたは媒体(例えば、複数のCD、ディスク、またはその他の記憶デバイス)とすることができ、あるいはその中に含めることができる。本明細書において説明した動作は、データ処理装置によって、1つ以上のコンピュータ読み取り可能記憶デバイス上に格納されたデータ、またはその他のデータ源から受信されたデータに対して実行される動作として実装することができる。
、データを処理するためのあらゆる種類の装置(apparatus)、デバイス、および機械(machine)を包含し、一例として、プログラム可能なマイクロプロセッサ、コンピュータ、1つまたは複数のシステム・オン・チップ、あるいは以上のものの組み合わせを含む。前述の装置には、特殊用途のロジック回路、例えば、FPGA(フィールド・プログラマブル・ゲート・アレイ)またはASIC(特定用途集積回路)を含むことができる。また、前述の装置には、ハードウェアに加えて、対象のコンピュータ・プログラムのための実行環境を形成するコード、例えば、プロセッサ・ファームウェア、プロトコル・スタック、データベース管理システム、オペレーティング・システム、クロスプラットフォーム・ランタイム環境、仮想機械、あるいはこれらの1つ以上の組み合わせを構成するコードを含むことができる。前述の装置および実行環境は、ウェブ・サービス、分散型コンピューティング、およびグリッド・コンピューティング・インフラストラクチャのような、種々の異なるコンピューティング・モデル・インフラストラクチャを実現することができる。
・アプリケーション、スクリプト、またはコード)は、コンパイラ型またはインタープリタ型言語、宣言型または手続き型言語を含む、任意の形式のプログラミング言語で書くことができ、更に、これを任意の形態でデプロイすることができ、単体プログラムとして、あるいはモジュール、コンポーネント、サブルーチン、オブジェクト、またはコンピューティング環境における使用に適した他のユニットとしてデプロイすることを含む。コンピ
ュータ・プログラムは、ファイル・システムにおけるファイルに対応することができるが、そうする必要はない。プログラムは、他のプログラムまたはデータ(例えば、マークアップ言語文書中に格納される1つ以上のスクリプト)を保持するファイルの一部に格納されてもよく、対象のプログラムに専用に割り当てられる1つのファイルに格納されてもよく、あるいは複数の調整されたファイル(例えば、1つ以上のモジュール、サブプログラム、またはコードの一部を格納するファイル)に格納されてもよい。コンピュータ・プログラムは、1つのコンピュータ上で、あるいは1つのサイトに位置するか、または複数のサイトにまたがって分散され、そして通信ネットワークによって相互接続される、複数のコンピュータ上で実行されるようにデプロイすることもできる。
に対して動作して出力を生成することによってアクションを実行するために1つ以上のコンピュータ・プログラムを実行する1つ以上のプログラマブル・プロセッサによって実行することができる。 また、プロセスおよびロジック・フローは、特殊用途のロジック回
路、例えば、FPGA(フィールド・プログラマブル・ゲート・アレイ)またはASIC(特定用途集積回路)によって実行することもでき、更に、装置もこうしたロジック回路として実装することができる。
び特殊用途マイクロプロセッサの双方、ならびに任意の種類のディジタル・コンピュータの任意の1つ以上のプロセッサも含まれる。一般に、プロセッサは、命令およびデータを読み取り専用メモリまたはランダム・アクセス・メモリあるいは両方から受け取る。コンピュータの必須要素は、命令にしたがって動作を実行するためのプロセッサ、ならびに命令およびデータを記憶するための1つ以上のメモリ・デバイスである。一般に、コンピュータはデータを記憶するための1つ以上の大容量記憶デバイス、例えば、磁気ディスク、光磁気ディスク、または光ディスクも含み、あるいはこのようなデバイスからデータを受け取るかまたはこのようなデバイスにデータを転送するか、あるいは双方を行うように動作可能に結合される。しかしながら、コンピュータはこのようなデバイスを有する必要はない。更に、コンピュータは、他のデバイス、例えば、移動体電話機、パーソナル・ディジタル・アシスタント(PDA)、移動体オーディオまたはビデオプレーヤ、ゲーム・コンソール、全地球測位システム(GPS)受信機、あるいは携帯用記憶デバイス(例えば、ユニバーサル・シリアル・バス(USB)フラッシュ・ドライブ)、更にはその他多くのデバイスに埋め込むことができる。コンピュータ・プログラム命令およびデータを記憶するのに適したデバイスには、すべての形式の不揮発性メモリ、媒体およびメモリ・デバイスが含まれ、一例として、半導体記憶デバイス、例えば、EPROM、EEPROM、およびフラッシュ・メモリ・デバイス、磁気ディスク、例えば、内部ハード・ディスクまたはリムーバブル・ディスク、光磁気ディスク、ならびにCD-ROMおよびDVD-ROMディスクが含まれる。プロセッサおよびメモリは、特殊用途ロジック回路によって補充すること、またはこのロジック回路に組み込むこともできる。
ができ、そしてユーザからの入力を、音響入力、音声入力、または触覚入力を含む任意の形式で受け取ることができる。加えて、コンピュータは、ユーザが使用するデバイスに文書を送り、そしてこのデバイスから文書を受け取ることによって、例えば、ウェブ・ブラウザから受けた要求に応じて、ユーザのクライアント・デバイス上のウェブ・ブラウザにウェブ・ページを送ることによって、ユーザと対話処理することができる。
うなバック・エンド・コンポーネントを含むか、あるいはミドルウェア・コンポーネント、例えば、アプリケーション・サーバを含むか、あるいはフロント・エンド・コンポーネント、例えば、ユーザが本明細書において説明した主題の実施態様と相互作用することができるグラフィカル・ユーザ・インターフェースまたはウェブ・ブラウザを有するクライアント・コンピュータを含むコンピューティング・システム、あるいは1つ以上のこのようなバックエンド、ミドルウェアまたはフロント・エンド・コンポーネントの任意の組み合わせで実現することができる。任意の形式または媒体のディジタル・データ通信、例えば、通信ネットワークによって、本システムのコンポーネントを相互接続することができる。通信ネットワークの例には、ローカル・エリア・ネットワーク(「LAN」)およびワイド・エリア・ネットワーク(「WAN」)、相互ネットワーク(例えば、インターネット)、ならびにピア・ツー・ピア・ネットワーク(例えば、アドホック・ピア・ツー・ピア・ネットワーク)が含まれる。例えば、図1のネットワーク20には、1つ以上のローカル・エリア・ネットワークを含むことができる。
含むことができる。クライアントおよびサーバは、通常互いに離れており、そして通信ネットワークを通じて相互作用するのが通例である。クライアントおよびサーバの関係は、それぞれのコンピュータ上で実行され、そして互いにクライアント-サーバ関係を有するコンピュータ・プログラムによって生じる。ある実施形態では、サーバは、データ(例えば、HTMLページ)をクライアント・デバイスに(例えば、クライアント・デバイスと対話処理するユーザにデータを表示し、そしてこのユーザからユーザ入力を受け取る目的で)送信する。クライアント・デバイスにおいて生成されるデータ(例えば、ユーザ対話処理の結果)を、サーバにおいてクライアント・デバイスから受信することができる。
Claims (9)
- 第1画像および第2画像を受け取るステップであって、前記第1画像は第1組織試料を表すバイオマーカ画像であり、前記第2画像は第2組織試料を表すH&E画像である、ステップと、
前記第1画像の少なくとも一部を前記第2画像に位置合わせして、位置合わせ画像を形成するステップと、
前記第1画像について、
一組の核を検出するステップと、
前記第1画像における前記一組の核のうちの1つの核に対して、当該核の1または複数のバイオマーカ特徴を計算するステップと、
前記位置合わせ画像について、
前記第1画像の画像領域の1または複数の注釈を前記位置合わせ画像の対応する画像領域にマッピングして、前記位置合わせ画像のマッピング領域を生成するステップと、
前記マッピング領域に対して、前記1または複数の注釈に少なくとも部分的に基づいて1または複数のH&E特徴を識別するステップと、
前記第1画像から検出された前記核の前記1または複数のバイオマーカ特徴と前記マッピング領域の前記1または複数のH&E特徴を融合して、前記第1画像の前記核に対応する1または複数の融合特徴を生成するステップと、
前記1または複数の融合特徴に基づいて前記第1画像の前記核を分類するステップと、
を含む方法。 - 前記マッピング領域の前記1または複数のH&E特徴を識別するステップは、前記マッピング領域から検出された一組の細胞を分類するステップを含む、請求項1に記載の方法。
- 前記一組の細胞を分類するステップは、
前記マッピング領域に対応する領域確率マップを生成するステップと、
前記領域確率マップに基づいて、前記一組の細胞のうちの1つの細胞を表す1または複数の画素が特定の細胞型に対応する確率を識別するステップと、
を含む、請求項2に記載の方法。 - 前記特定の細胞型は、腫瘍細胞、リンパ球、または間質細胞を含む、請求項3に記載の方法。
- 前記第1画像の前記核を分類するステップは、前記1または複数の融合特徴から導かれた特徴ベクトルに機械学習モデルを適用するステップを含む、請求項1から4のいずれか1項に記載の方法。
- 前記1または複数の融合特徴は、形態上の特徴、テクスチャ特徴、空間的特徴、またはヒストグラム特徴のうちの少なくとも1つを含む、請求項1から5のいずれか1項に記載の方法。
- 前記第1組織試料は組織ブロックの1つの組織切片に対応し、前記第2組織試料は前記組織ブロックの別の組織切片から得られ、前記別の組織切片は前記組織切片の隣に位置する、請求項1から6のいずれか1項に記載の方法。
- 1または複数のデータ・プロセッサと、
前記1または複数のデータ・プロセッサ上で実行されると前記1または複数のデータ・プロセッサに請求項1から7のいずれか1項に記載の方法を実施させる命令を格納した、非一時的コンピュータ読み取り可能記憶媒体と、
を備えるシステム。 - 1または複数のデータ・プロセッサに請求項1から7のいずれか1項に記載の方法を実施させるように構成された命令を含む、非一時的機械読み取り可能記憶媒体に有形的に実装されたコンピュータ・プログラム。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662438354P | 2016-12-22 | 2016-12-22 | |
| US62/438,354 | 2016-12-22 | ||
| PCT/EP2017/083702 WO2018115055A1 (en) | 2016-12-22 | 2017-12-20 | Computer scoring based on primary stain and immunohistochemistry images |
| JP2019534350A JP6968177B2 (ja) | 2016-12-22 | 2017-12-20 | 一次染色および免疫組織化学画像に基づくコンピュータ採点 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019534350A Division JP6968177B2 (ja) | 2016-12-22 | 2017-12-20 | 一次染色および免疫組織化学画像に基づくコンピュータ採点 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022023912A JP2022023912A (ja) | 2022-02-08 |
| JP7233506B2 true JP7233506B2 (ja) | 2023-03-06 |
Family
ID=60942997
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019534350A Active JP6968177B2 (ja) | 2016-12-22 | 2017-12-20 | 一次染色および免疫組織化学画像に基づくコンピュータ採点 |
| JP2021174267A Active JP7233506B2 (ja) | 2016-12-22 | 2021-10-26 | 一次染色および免疫組織化学画像に基づくコンピュータ採点 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019534350A Active JP6968177B2 (ja) | 2016-12-22 | 2017-12-20 | 一次染色および免疫組織化学画像に基づくコンピュータ採点 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US10977791B2 (ja) |
| EP (1) | EP3559902A1 (ja) |
| JP (2) | JP6968177B2 (ja) |
| CN (1) | CN110088804B (ja) |
| WO (1) | WO2018115055A1 (ja) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015049233A1 (en) * | 2013-10-01 | 2015-04-09 | Ventana Medical Systems, Inc. | Line-based image registration and cross-image annotation devices, systems and methods |
| CN110088804B (zh) | 2016-12-22 | 2023-06-27 | 文塔纳医疗系统公司 | 基于原色和免疫组织化学图像的计算机评分 |
| US10573003B2 (en) * | 2017-02-13 | 2020-02-25 | Amit Sethi | Systems and methods for computational pathology using points-of-interest |
| WO2018165103A1 (en) * | 2017-03-06 | 2018-09-13 | University Of Southern California | Machine learning for digital pathology |
| US11276165B2 (en) * | 2017-06-15 | 2022-03-15 | Visiopharm A/S | Method for training a deep learning model to obtain histopathological information from images |
| US11515009B2 (en) * | 2018-03-19 | 2022-11-29 | International Business Machines Corporation | Biomarker quantification in a tissue sample |
| EP3830742A1 (en) * | 2018-07-27 | 2021-06-09 | Ventana Medical Systems, Inc. | Systems for automated in situ hybridization analysis |
| JP2021535484A (ja) * | 2018-08-30 | 2021-12-16 | アプライド マテリアルズ インコーポレイテッドApplied Materials, Incorporated | 自動的な腫瘍検出及び分類のためのシステム |
| CN112655049A (zh) | 2018-09-07 | 2021-04-13 | 文塔纳医疗系统公司 | 用于缓存生物图像数据的系统和方法 |
| WO2020081463A1 (en) * | 2018-10-18 | 2020-04-23 | Verily Life Sciences Llc | Systems and methods for using image processing to generate inferences of biomarker for immunotherapy |
| US11633146B2 (en) | 2019-01-04 | 2023-04-25 | Regents Of The University Of Minnesota | Automated co-registration of prostate MRI data |
| US11631171B2 (en) * | 2019-01-10 | 2023-04-18 | Regents Of The University Of Minnesota | Automated detection and annotation of prostate cancer on histopathology slides |
| WO2020167632A1 (en) | 2019-02-13 | 2020-08-20 | Ventana Medical Systems, Inc. | Systems and methods for computing the contributions of autofluorescence in multichannel images |
| US11347965B2 (en) | 2019-03-21 | 2022-05-31 | Illumina, Inc. | Training data generation for artificial intelligence-based sequencing |
| US11210554B2 (en) * | 2019-03-21 | 2021-12-28 | Illumina, Inc. | Artificial intelligence-based generation of sequencing metadata |
| WO2020219305A1 (en) * | 2019-04-24 | 2020-10-29 | Icahn School Of Medicine At Mount Sinai | Systems and methods to label structures of interest in tissue slide images |
| US11593649B2 (en) | 2019-05-16 | 2023-02-28 | Illumina, Inc. | Base calling using convolutions |
| US11423306B2 (en) | 2019-05-16 | 2022-08-23 | Illumina, Inc. | Systems and devices for characterization and performance analysis of pixel-based sequencing |
| CN110569882B (zh) * | 2019-08-15 | 2023-05-09 | 杨春立 | 一种图像信息分类方法及装置 |
| CN110633758A (zh) * | 2019-09-20 | 2019-12-31 | 四川长虹电器股份有限公司 | 针对小样本或样本不平衡的癌症区域检测定位的方法 |
| JP7544338B2 (ja) | 2019-09-27 | 2024-09-04 | 国立大学法人 東京大学 | 情報処理装置、情報処理システム、情報処理方法及びプログラム |
| CN110853022B (zh) * | 2019-11-14 | 2020-11-06 | 腾讯科技(深圳)有限公司 | 病理切片图像的处理方法、装置、系统及存储介质 |
| WO2021127019A1 (en) * | 2019-12-17 | 2021-06-24 | Applied Materials, Inc. | System and method for acquisition and processing of multiplexed fluorescence in-situ hybridization images |
| EP4091135A1 (en) * | 2020-01-19 | 2022-11-23 | Ventana Medical Systems, Inc. | Non-tumor segmentation to support tumor detection and analysis |
| WO2021167984A1 (en) * | 2020-02-17 | 2021-08-26 | 10X Genomics, Inc. | Systems and methods for machine learning features in biological samples |
| CN115136244A (zh) | 2020-02-20 | 2022-09-30 | 因美纳有限公司 | 基于人工智能的多对多碱基判读 |
| US11947270B2 (en) * | 2020-02-26 | 2024-04-02 | Fei Company | Metrology of semiconductor devices in electron micrographs using fast marching level sets |
| US12014488B2 (en) * | 2020-03-04 | 2024-06-18 | Case Western Reserve University | Distinguishing colon cancer stages based on computationally derived morphological features of cancer nuclei |
| US20230143701A1 (en) * | 2020-03-18 | 2023-05-11 | Sanofi | Systems and methods for predicting expression levels |
| CN112233123B (zh) * | 2020-09-21 | 2024-05-14 | 广州金域医学检验中心有限公司 | 病理图片中肿瘤间质分类方法、装置、计算机设备及存储介质 |
| CN112508860B (zh) * | 2020-11-19 | 2022-09-30 | 湖南兰茜生物科技有限公司 | 一种免疫组化图像核阳性的人工智能判读方法及系统 |
| CN112270683B (zh) * | 2020-12-23 | 2021-04-02 | 宁波兰茜生物科技有限公司 | 一种ihc数字预览图识别和组织前景分割方法及系统 |
| CN112270684B (zh) * | 2020-12-25 | 2021-04-06 | 宁波兰茜生物科技有限公司 | 一种显微图像免疫组化虚拟多重标记及分析方法及系统 |
| KR102580419B1 (ko) * | 2021-02-18 | 2023-09-19 | 주식회사 루닛 | 병리 슬라이드 이미지 내의 관심 영역을 검출하기 위한 방법 및 시스템 |
| US20220336054A1 (en) | 2021-04-15 | 2022-10-20 | Illumina, Inc. | Deep Convolutional Neural Networks to Predict Variant Pathogenicity using Three-Dimensional (3D) Protein Structures |
| CN113706450A (zh) * | 2021-05-18 | 2021-11-26 | 腾讯科技(深圳)有限公司 | 图像配准方法、装置、设备及可读存储介质 |
| CN113469939B (zh) * | 2021-05-26 | 2022-05-03 | 透彻影像(北京)科技有限公司 | 一种基于特性曲线的her-2免疫组化自动判读系统 |
| CN114022472B (zh) * | 2021-11-17 | 2022-05-20 | 深圳裕策生物科技有限公司 | 一种肿瘤浸润淋巴细胞分析方法、装置和存储介质 |
| CN114596298B (zh) | 2022-03-16 | 2022-11-15 | 华东师范大学 | 基于高光谱成像的精标注数字病理数据集自动生成方法 |
| CN114708457B (zh) * | 2022-03-31 | 2024-10-29 | 南京林业大学 | 用于抗紫边识别的高光谱深度学习识别方法 |
| WO2024064338A1 (en) | 2022-09-22 | 2024-03-28 | Agilent Technologies, Inc. | Anti-human icos antibodies for use in immunohistochemistry (ihc) protocols and for diagnosing cancer |
| WO2024148067A1 (en) * | 2023-01-03 | 2024-07-11 | Trustees Of Tufts College | Localization of parts of images responsible for classification in weakly supervised problems |
| US12023817B1 (en) | 2023-11-14 | 2024-07-02 | Pramana, Inc. | System and method for a slide marking technique for target tissue extraction and downstream application |
| CN118096757B (zh) * | 2024-04-26 | 2024-07-09 | 天津市肿瘤医院(天津医科大学肿瘤医院) | 基于双染数字病理图像的图像标注方法和图像标注设备 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120226709A1 (en) | 2011-01-05 | 2012-09-06 | The Board Of Trustees Of The University Of Illinois | Automated prostate tissue referencing for cancer detection and diagnosis |
| WO2015052128A1 (en) | 2013-10-07 | 2015-04-16 | Ventana Medical Systems, Inc. | Systems and methods for comprehensive multi-assay tissue analysis |
| WO2015124777A1 (en) | 2014-02-21 | 2015-08-27 | Ventana Medical Systems, Inc. | Medical image analysis for identifying biomarker-positive tumor cells |
| WO2016087592A1 (en) | 2014-12-03 | 2016-06-09 | Ventana Medical Systems, Inc. | Systems and methods for early-stage cancer prognosis |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5595707A (en) | 1990-03-02 | 1997-01-21 | Ventana Medical Systems, Inc. | Automated biological reaction apparatus |
| CA2321836C (en) | 1998-02-27 | 2004-09-28 | Ventana Medical Systems, Inc. | Automated molecular pathology apparatus having independent slide heaters |
| US20030211630A1 (en) | 1998-02-27 | 2003-11-13 | Ventana Medical Systems, Inc. | Automated molecular pathology apparatus having independent slide heaters |
| US6582962B1 (en) | 1998-02-27 | 2003-06-24 | Ventana Medical Systems, Inc. | Automated molecular pathology apparatus having independent slide heaters |
| US8131476B2 (en) * | 2006-08-07 | 2012-03-06 | General Electric Company | System and method for co-registering multi-channel images of a tissue micro array |
| US8269827B2 (en) * | 2009-09-29 | 2012-09-18 | General Electric Company | System and methods for mapping fluorescent images into a bright field color space |
| EP2491452A4 (en) | 2009-10-19 | 2015-03-11 | Ventana Med Syst Inc | IMAGING SYSTEM AND TECHNIQUES |
| ES2711196T3 (es) * | 2010-07-30 | 2019-04-30 | Fund D Anna Sommer Champalimaud E Dr Carlos Montez Champalimaud | Sistemas y procedimientos para la segmentación y el procesamiento de imágenes de tejidos y extracción de características de estos para tratar, diagnosticar o predecir afecciones médicas |
| CN105027165B (zh) * | 2013-03-15 | 2021-02-19 | 文塔纳医疗系统公司 | 用于数字完整载片的自动化评分的基于组织对象的机器学习系统 |
| CN105283904B (zh) | 2013-06-03 | 2018-09-07 | 文塔纳医疗系统公司 | 图像自适应的生理上可信的颜色分离 |
| WO2015049233A1 (en) | 2013-10-01 | 2015-04-09 | Ventana Medical Systems, Inc. | Line-based image registration and cross-image annotation devices, systems and methods |
| CA2932892C (en) | 2014-01-28 | 2020-09-22 | Ventana Medical Systems, Inc. | Adaptive classification for whole slide tissue segmentation |
| WO2015124772A1 (en) | 2014-02-21 | 2015-08-27 | Ventana Medical Systems, Inc. | Group sparsity model for image unmixing |
| AU2015265811B2 (en) | 2014-05-30 | 2020-04-30 | Providence Health & Services - Oregon | An image processing method and system for analyzing a multi-channel image obtained from a biological tissue sample being stained by multiple stains |
| CA2965564C (en) | 2014-11-10 | 2024-01-02 | Ventana Medical Systems, Inc. | Classifying nuclei in histology images |
| WO2016120442A1 (en) | 2015-01-30 | 2016-08-04 | Ventana Medical Systems, Inc. | Foreground segmentation and nucleus ranking for scoring dual ish images |
| JP2018511036A (ja) * | 2015-01-31 | 2018-04-19 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | メソダイセクションのためのシステムおよび方法 |
| CN110088804B (zh) | 2016-12-22 | 2023-06-27 | 文塔纳医疗系统公司 | 基于原色和免疫组织化学图像的计算机评分 |
-
2017
- 2017-12-20 CN CN201780078305.6A patent/CN110088804B/zh active Active
- 2017-12-20 JP JP2019534350A patent/JP6968177B2/ja active Active
- 2017-12-20 EP EP17826220.0A patent/EP3559902A1/en active Pending
- 2017-12-20 WO PCT/EP2017/083702 patent/WO2018115055A1/en unknown
-
2019
- 2019-06-21 US US16/448,826 patent/US10977791B2/en active Active
-
2021
- 2021-03-16 US US17/202,546 patent/US11657503B2/en active Active
- 2021-10-26 JP JP2021174267A patent/JP7233506B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120226709A1 (en) | 2011-01-05 | 2012-09-06 | The Board Of Trustees Of The University Of Illinois | Automated prostate tissue referencing for cancer detection and diagnosis |
| WO2015052128A1 (en) | 2013-10-07 | 2015-04-16 | Ventana Medical Systems, Inc. | Systems and methods for comprehensive multi-assay tissue analysis |
| WO2015124777A1 (en) | 2014-02-21 | 2015-08-27 | Ventana Medical Systems, Inc. | Medical image analysis for identifying biomarker-positive tumor cells |
| WO2016087592A1 (en) | 2014-12-03 | 2016-06-09 | Ventana Medical Systems, Inc. | Systems and methods for early-stage cancer prognosis |
Non-Patent Citations (1)
| Title |
|---|
| XING, F. et al.,An Automatic Learning-Based Framework for Robust Nucleus Segmentation,IEEE TRANSACTIONS ON MEDICAL IMAGING,2016年02月01日,Vol.35/No.2,p.550-566 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20190392578A1 (en) | 2019-12-26 |
| WO2018115055A1 (en) | 2018-06-28 |
| CN110088804A (zh) | 2019-08-02 |
| US10977791B2 (en) | 2021-04-13 |
| JP2022023912A (ja) | 2022-02-08 |
| JP2020502534A (ja) | 2020-01-23 |
| US11657503B2 (en) | 2023-05-23 |
| JP6968177B2 (ja) | 2021-11-17 |
| US20210201485A1 (en) | 2021-07-01 |
| EP3559902A1 (en) | 2019-10-30 |
| CN110088804B (zh) | 2023-06-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7233506B2 (ja) | 一次染色および免疫組織化学画像に基づくコンピュータ採点 | |
| US11682192B2 (en) | Deep-learning systems and methods for joint cell and region classification in biological images | |
| US11526984B2 (en) | Method of computing tumor spatial and inter-marker heterogeneity | |
| JP7534461B2 (ja) | 細胞の分類のためのシステムおよび方法 | |
| US11990228B2 (en) | Automatic assay assessment and normalization for image processing | |
| US10628658B2 (en) | Classifying nuclei in histology images | |
| JP7558242B2 (ja) | デジタル病理学分析結果の格納および読み出し方法 | |
| US20220351860A1 (en) | Federated learning system for training machine learning algorithms and maintaining patient privacy | |
| US20220351379A1 (en) | Non-tumor segmentation to support tumor detection and analysis | |
| US11959848B2 (en) | Method of storing and retrieving digital pathology analysis results |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211026 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220901 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221201 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230127 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230221 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7233506 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |