JP7215774B2 - 多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブおよびその製造方法と使用 - Google Patents
多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブおよびその製造方法と使用 Download PDFInfo
- Publication number
- JP7215774B2 JP7215774B2 JP2021531165A JP2021531165A JP7215774B2 JP 7215774 B2 JP7215774 B2 JP 7215774B2 JP 2021531165 A JP2021531165 A JP 2021531165A JP 2021531165 A JP2021531165 A JP 2021531165A JP 7215774 B2 JP7215774 B2 JP 7215774B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- acid
- citrate
- pharmaceutically acceptable
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000002360 preparation method Methods 0.000 title claims description 11
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 title description 41
- 239000002246 antineoplastic agent Substances 0.000 title description 20
- 229940041181 antineoplastic drug Drugs 0.000 title description 17
- 150000003384 small molecules Chemical class 0.000 title description 14
- 150000001875 compounds Chemical class 0.000 claims description 63
- 239000000203 mixture Substances 0.000 claims description 38
- 206010028980 Neoplasm Diseases 0.000 claims description 32
- 239000003814 drug Substances 0.000 claims description 32
- 229940079593 drug Drugs 0.000 claims description 29
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 claims description 28
- 102100022749 Aminopeptidase N Human genes 0.000 claims description 25
- 230000002401 inhibitory effect Effects 0.000 claims description 25
- 150000003839 salts Chemical class 0.000 claims description 23
- 238000009472 formulation Methods 0.000 claims description 13
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 12
- 238000000034 method Methods 0.000 claims description 12
- 230000003287 optical effect Effects 0.000 claims description 12
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 9
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 claims description 9
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 claims description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims description 9
- 239000012453 solvate Substances 0.000 claims description 9
- 239000003112 inhibitor Substances 0.000 claims description 8
- 239000002904 solvent Substances 0.000 claims description 8
- 239000004480 active ingredient Substances 0.000 claims description 7
- 208000032839 leukemia Diseases 0.000 claims description 7
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 claims description 6
- 108010049990 CD13 Antigens Proteins 0.000 claims description 6
- 239000007924 injection Substances 0.000 claims description 6
- 238000002347 injection Methods 0.000 claims description 6
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 claims description 5
- QZDDFQLIQRYMBV-UHFFFAOYSA-N 2-[3-nitro-2-(2-nitrophenyl)-4-oxochromen-8-yl]acetic acid Chemical compound OC(=O)CC1=CC=CC(C(C=2[N+]([O-])=O)=O)=C1OC=2C1=CC=CC=C1[N+]([O-])=O QZDDFQLIQRYMBV-UHFFFAOYSA-N 0.000 claims description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 claims description 5
- 238000004519 manufacturing process Methods 0.000 claims description 5
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 5
- MOILFCKRQFQVFS-BDNRQGISSA-N (1r,3s,4r,5r)-4,6,6-trimethylbicyclo[3.1.1]heptane-3,4-diol Chemical compound C1[C@@H]2C(C)(C)[C@H]1C[C@H](O)[C@@]2(O)C MOILFCKRQFQVFS-BDNRQGISSA-N 0.000 claims description 4
- ZAZPDOYUCVFPOI-UHFFFAOYSA-N 2-methylpropylboronic acid Chemical compound CC(C)CB(O)O ZAZPDOYUCVFPOI-UHFFFAOYSA-N 0.000 claims description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 claims description 4
- BMGMQYRPZOGZFU-YFKPBYRVSA-N [(1r)-1-amino-3-methylbutyl]boronic acid Chemical compound CC(C)C[C@H](N)B(O)O BMGMQYRPZOGZFU-YFKPBYRVSA-N 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- 150000002148 esters Chemical class 0.000 claims description 4
- 201000000050 myeloid neoplasm Diseases 0.000 claims description 4
- LDSJMFGYNFIFRK-BDAKNGLRSA-N (2s,3r)-3-azaniumyl-2-hydroxy-4-phenylbutanoate Chemical compound OC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 LDSJMFGYNFIFRK-BDAKNGLRSA-N 0.000 claims description 3
- 230000009471 action Effects 0.000 claims description 3
- 238000006555 catalytic reaction Methods 0.000 claims description 3
- 150000003141 primary amines Chemical group 0.000 claims description 3
- 239000000825 pharmaceutical preparation Substances 0.000 claims 1
- 230000002265 prevention Effects 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 29
- 238000012360 testing method Methods 0.000 description 22
- 235000002639 sodium chloride Nutrition 0.000 description 20
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 18
- 239000000243 solution Substances 0.000 description 17
- 239000000543 intermediate Substances 0.000 description 15
- 229960003648 ixazomib Drugs 0.000 description 15
- MXAYKZJJDUDWDS-LBPRGKRZSA-N ixazomib Chemical compound CC(C)C[C@@H](B(O)O)NC(=O)CNC(=O)C1=CC(Cl)=CC=C1Cl MXAYKZJJDUDWDS-LBPRGKRZSA-N 0.000 description 15
- VGGGPCQERPFHOB-RDBSUJKOSA-N (2s)-2-[[(2s,3r)-3-amino-2-hydroxy-4-phenylbutanoyl]amino]-4-methylpentanoic acid Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-RDBSUJKOSA-N 0.000 description 14
- 241000699666 Mus <mouse, genus> Species 0.000 description 14
- 241000699670 Mus sp. Species 0.000 description 14
- 239000007788 liquid Substances 0.000 description 14
- 229950009811 ubenimex Drugs 0.000 description 13
- VGGGPCQERPFHOB-UHFFFAOYSA-N Bestatin Natural products CC(C)CC(C(O)=O)NC(=O)C(O)C(N)CC1=CC=CC=C1 VGGGPCQERPFHOB-UHFFFAOYSA-N 0.000 description 12
- 239000007787 solid Substances 0.000 description 12
- 241001465754 Metazoa Species 0.000 description 11
- 239000000969 carrier Substances 0.000 description 11
- 230000004083 survival effect Effects 0.000 description 11
- 201000007270 liver cancer Diseases 0.000 description 10
- 208000014018 liver neoplasm Diseases 0.000 description 10
- 239000013641 positive control Substances 0.000 description 10
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- 238000011161 development Methods 0.000 description 9
- 230000018109 developmental process Effects 0.000 description 9
- 101000757160 Homo sapiens Aminopeptidase N Proteins 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- 238000012449 Kunming mouse Methods 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 206010027476 Metastases Diseases 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- -1 acids Chemical compound 0.000 description 6
- 230000037396 body weight Effects 0.000 description 6
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 210000004072 lung Anatomy 0.000 description 6
- 210000002540 macrophage Anatomy 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 230000009401 metastasis Effects 0.000 description 6
- 230000000242 pagocytic effect Effects 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- 210000004881 tumor cell Anatomy 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- 208000034578 Multiple myelomas Diseases 0.000 description 5
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 5
- 229960001467 bortezomib Drugs 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000013642 negative control Substances 0.000 description 5
- 230000002685 pulmonary effect Effects 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- GIVUTAREGYFAON-VKJFTORMSA-N 2-[2-[(1R)-1-[[(2S,3R)-3-amino-2-hydroxy-4-phenylbutanoyl]amino]-3-methylbutyl]-4-(carboxymethyl)-5-oxo-1,3,2-dioxaborolan-4-yl]acetic acid Chemical group N[C@@H]([C@@H](C(=O)N[C@@H](CC(C)C)B1OC(C(O1)(CC(=O)O)CC(=O)O)=O)O)CC1=CC=CC=C1 GIVUTAREGYFAON-VKJFTORMSA-N 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- 206010060862 Prostate cancer Diseases 0.000 description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 4
- 229940079156 Proteasome inhibitor Drugs 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- GQGCFESSENVAMX-HKBOAZHASA-N [(1R)-1-[[(2S,3R)-2-hydroxy-4-phenyl-3-(phenylmethoxycarbonylamino)butanoyl]amino]-3-methylbutyl]boronic acid Chemical compound C(C1=CC=CC=C1)OC(=O)N[C@@H]([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)O)CC1=CC=CC=C1 GQGCFESSENVAMX-HKBOAZHASA-N 0.000 description 4
- 238000002835 absorbance Methods 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 4
- 239000006285 cell suspension Substances 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 238000011081 inoculation Methods 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 235000019198 oils Nutrition 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 239000003207 proteasome inhibitor Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- JXJYTERRLRAUSF-CVEARBPZSA-N (2s,3r)-2-hydroxy-4-phenyl-3-(phenylmethoxycarbonylamino)butanoic acid Chemical compound C([C@H]([C@H](O)C(O)=O)NC(=O)OCC=1C=CC=CC=1)C1=CC=CC=C1 JXJYTERRLRAUSF-CVEARBPZSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 206010013710 Drug interaction Diseases 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 206010057249 Phagocytosis Diseases 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- OIODFZAWXFJYPM-RDBSUJKOSA-N [(1R)-1-[[(2S,3R)-3-amino-2-hydroxy-4-phenylbutanoyl]amino]-3-methylbutyl]boronic acid Chemical compound N[C@@H]([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)O)CC1=CC=CC=C1 OIODFZAWXFJYPM-RDBSUJKOSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- GLNDAGDHSLMOKX-UHFFFAOYSA-N coumarin 120 Chemical compound C1=C(N)C=CC2=C1OC(=O)C=C2C GLNDAGDHSLMOKX-UHFFFAOYSA-N 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 150000002611 lead compounds Chemical class 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 230000008782 phagocytosis Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 210000000952 spleen Anatomy 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 210000003462 vein Anatomy 0.000 description 3
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- TYMLOMAKGOJONV-UHFFFAOYSA-N 4-nitroaniline Chemical compound NC1=CC=C([N+]([O-])=O)C=C1 TYMLOMAKGOJONV-UHFFFAOYSA-N 0.000 description 2
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 description 2
- 206010003445 Ascites Diseases 0.000 description 2
- 244000038022 Chenopodium capitatum Species 0.000 description 2
- 235000004391 Chenopodium capitatum Nutrition 0.000 description 2
- 206010059866 Drug resistance Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 235000019483 Peanut oil Nutrition 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 125000000129 anionic group Chemical group 0.000 description 2
- 230000001028 anti-proliverative effect Effects 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000003925 fat Substances 0.000 description 2
- 235000019197 fats Nutrition 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 210000003494 hepatocyte Anatomy 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 230000036737 immune function Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 230000002147 killing effect Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 description 2
- 239000000312 peanut oil Substances 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- 229960004063 propylene glycol Drugs 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 239000003642 reactive oxygen metabolite Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 238000012353 t test Methods 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- HFVMEOPYDLEHBR-UHFFFAOYSA-N (2-fluorophenyl)-phenylmethanol Chemical compound C=1C=CC=C(F)C=1C(O)C1=CC=CC=C1 HFVMEOPYDLEHBR-UHFFFAOYSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical group C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- LODHFNUFVRVKTH-ZHACJKMWSA-N 2-hydroxy-n'-[(e)-3-phenylprop-2-enoyl]benzohydrazide Chemical compound OC1=CC=CC=C1C(=O)NNC(=O)\C=C\C1=CC=CC=C1 LODHFNUFVRVKTH-ZHACJKMWSA-N 0.000 description 1
- YTXSYWAKVMZICI-PVCZSOGJSA-N 4-(carboxymethyl)-2-[(1r)-1-[[2-[(2,5-dichlorobenzoyl)amino]acetyl]amino]-3-methylbutyl]-6-oxo-1,3,2-dioxaborinane-4-carboxylic acid Chemical compound N([C@@H](CC(C)C)B1OC(CC(O)=O)(CC(=O)O1)C(O)=O)C(=O)CNC(=O)C1=CC(Cl)=CC=C1Cl YTXSYWAKVMZICI-PVCZSOGJSA-N 0.000 description 1
- WUBBRNOQWQTFEX-UHFFFAOYSA-N 4-aminosalicylic acid Chemical compound NC1=CC=C(C(O)=O)C(O)=C1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- AXZJHDNQDSVIDR-NSHDSACASA-N 4178-93-2 Chemical compound CC(C)C[C@H](N)C(=O)NC1=CC=C([N+]([O-])=O)C=C1 AXZJHDNQDSVIDR-NSHDSACASA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000056826 Gluzincins Human genes 0.000 description 1
- 108091007247 Gluzincins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- 206010029350 Neurotoxicity Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-N Salicylic acid Natural products OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 241000970901 Streptomyces olivoreticuli Species 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010044221 Toxic encephalopathy Diseases 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 210000003567 ascitic fluid Anatomy 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 239000003637 basic solution Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012867 bioactive agent Substances 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 229920003123 carboxymethyl cellulose sodium Polymers 0.000 description 1
- 229940063834 carboxymethylcellulose sodium Drugs 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 229940047120 colony stimulating factors Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 235000008504 concentrate Nutrition 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- RVAUVEOTZNLMQL-UHFFFAOYSA-N cyclohexanesulfinic acid Chemical compound OS(=O)C1CCCCC1 RVAUVEOTZNLMQL-UHFFFAOYSA-N 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000012938 design process Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 229960004756 ethanol Drugs 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000009093 first-line therapy Methods 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- UHUSDOQQWJGJQS-UHFFFAOYSA-N glycerol 1,2-dioctadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(CO)OC(=O)CCCCCCCCCCCCCCCCC UHUSDOQQWJGJQS-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 239000010440 gypsum Substances 0.000 description 1
- 229910052602 gypsum Inorganic materials 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000008975 immunomodulatory function Effects 0.000 description 1
- 230000000091 immunopotentiator Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- MCVVUJPXSBQTRZ-ARJAWSKDSA-N methyl (z)-but-2-enoate Chemical compound COC(=O)\C=C/C MCVVUJPXSBQTRZ-ARJAWSKDSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000011325 microbead Substances 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 210000004088 microvessel Anatomy 0.000 description 1
- 210000000110 microvilli Anatomy 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- 210000002200 mouth mucosa Anatomy 0.000 description 1
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- 230000007135 neurotoxicity Effects 0.000 description 1
- 231100000228 neurotoxicity Toxicity 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 210000004409 osteocyte Anatomy 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 210000002826 placenta Anatomy 0.000 description 1
- 229940068886 polyethylene glycol 300 Drugs 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- ILJOYZVVZZFIKA-UHFFFAOYSA-M sodium;1,1-dioxo-1,2-benzothiazol-3-olate;hydrate Chemical compound O.[Na+].C1=CC=C2C(=O)[N-]S(=O)(=O)C2=C1 ILJOYZVVZZFIKA-UHFFFAOYSA-M 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000012192 staining solution Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000000946 synaptic effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000007885 tablet disintegrant Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 230000004565 tumor cell growth Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 239000004034 viscosity adjusting agent Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
- C07F5/025—Boronic and borinic acid compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本発明は、薬物化学の技術分野に関し、具体的に、多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブ(Bestazomib)およびその製造方法と使用に関する。
アミノペプチダーゼN(APN/CD13)は、II型膜貫通亜鉛イオン依存性メタロプロテアーゼで、M1ファミリーのグルジンシン(Gluzincins)サブファミリーに属し、ホモ二量体の糖タンパク質の様態で細胞膜と結合する(Nucleic Acids Res.,1999,27(1):325-331)。APNは、多くの組織の細胞表面で発現され、たとえば中枢神経系シナプス細胞、滑液線維芽細胞、活性化内皮細胞、肝細胞、腸粘膜上皮細胞、胎盤、骨髄前駆細胞、単核細胞、破骨細胞など、特に腎臓や腸刷子縁細胞に大量に存在する(Haema.,2003,4(6):453-461)。また、正常細胞と比べ、APNは多くの腫瘍細胞、たとえば多発性骨髄腫、肝臓癌、メラノーマ、卵巣癌、前立腺癌、結腸癌、膵臓腺癌、乳癌、肺癌などの細胞の表面で高発現される。
上記既存技術の不足に対し、本発明の目的は、多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブ(Bestazomib Citrate)を提供することである。それはAPN/CD13にも、腫瘍のプロテアソームにも抑制活性を有する。
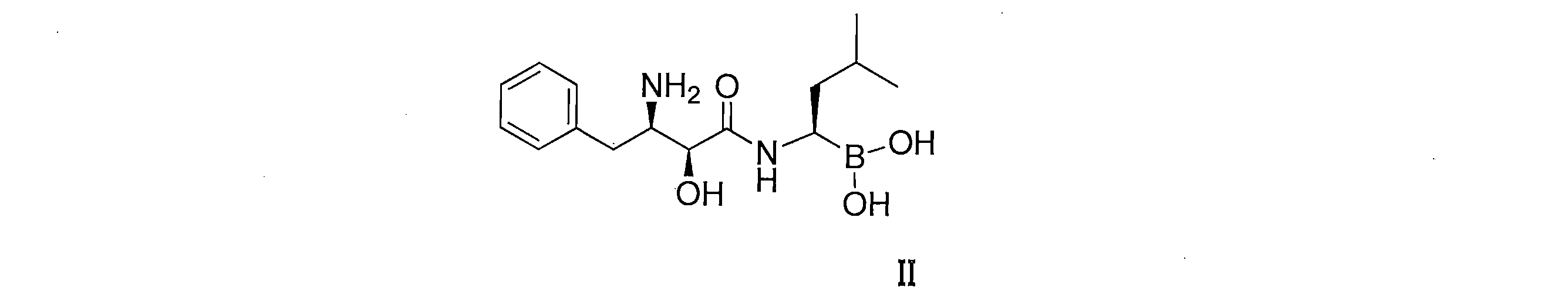
本発明の第一の側面では、式Iで表される化合物、あるいはその光学異性体、ジアステレオマー、ラセミ体または三者の混合物、あるいはその薬学的に許容される塩、あるいはその溶媒和物を提供する。
(2S,3R)-3-アミノ-2-ヒドロキシ-4-フェニル酪酸(AHPA)を原料とし、Cbzで1級アミン基を保護して中間体2を得る工程、中間体2を無水DCMにおいてEDCIとHOBtの触媒下で(R)-1-アミノ-3-メチルブチルボロン酸ピナンジオールエステルトリフルオロ酢酸塩と反応させて中間体3を得る工程、中間体3にイソブチルボロン酸の作用下で保護基を脱離させて中間体4を得る工程、中間体4をPd/Cおよび水素ガスにおいて脱Cbz保護させて中間体5を生成し、最後にクエン酸と作用させて式Iで表される化合物を得る工程を含む。
本発明の第五の側面では、活性成分が式Iで表される化合物、あるいはその光学異性体、ジアステレオマー、ラセミ体または三者の混合物、あるいはその薬学的に許容される塩、あるいはその溶媒和物である薬物組成物を提供する。
好ましくは、前記薬物組成物は経口投与製剤または注射製剤である。
本発明の第六の側面では、腫瘍疾患を治療する方法であって、腫瘍疾患のリスクに面するか、腫瘍疾患と診断された被験者に治療有効量の式Iで表される化合物またはその薬学的に許容される塩を投与する工程を含む方法を提供する。
本発明の化合物は、幅広い投与量の範囲内で有効である。実際の本発明の式Iで表される化合物の投与量は医者によって関連する状況に基づいて決められる。これらの状況は、被験者の身体状態、投与経路、年齢、体重、薬物に対する個体の反応、症状の重篤度などを含む。
(1)本発明の多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブはAPN/CD13にも、腫瘍のプロテアソームにも抑制活性を有し、悪性腫瘍の治療薬の開発に有用である。
もちろん、以下の詳細な説明はいずれも例示的なもので、本願にさらなる説明を提供するためのものである。別途に明示しない限り、本明細書で用いられるすべての技術・科学用語はいずれも本願が属する技術分野の当業者によって通常理解される意味と同様である。
「薬学的に許容される塩」とは、式Iの化合物の治療効果がありながら、毒性がない塩の形態である。任意の塩基性基(たとえばアミノ基)でカチオン塩になってもよい。本分野で既知のこのような塩の多くは、任意の塩基性基(たとえばアミノ基)に形成したアニオン塩である。これらの塩の多くは本分野で既知のものである。また、相応する酸で塩基性の形態の(I)を処理することによって簡単にアニオン塩を得ることができるが、このような酸は、無機酸、たとえば塩酸、硫酸、硝酸、リン酸など、あるいは有機酸、たとえば酢酸、トリフルオロ酢酸、プロパン酸、グリコール酸、2-ヒドロキシプロパン酸、2-オキソプロパン酸、シュウ酸、マロン酸、コハク酸、マレイン酸、フマル酸、リンゴ酸、酒石酸、2-ヒドロキシ-1,2,3-トリカルバリル酸、メタンスルホン酸、エタンスルホン酸、トルエンスルホン酸、4-メチルベンゼンスルホン酸、シクロヘキシルスルフィン酸、2-ヒドロキシ安息香酸、4-アミノ-2-ヒドロキシ安息香酸などを含む。これらの塩は、当業者に熟知のもので、当業者は本分野の知識で提供される任意の塩を製造することができる。また、当業者は溶解度、安定性、製剤の難易度などの要素からある塩を取るが、もう一つの塩を捨てることができる。これらの測定および最適化は当業者の経験の範囲内である。
光学的に単一の(2S,3R)-3-アミノ-2-ヒドロキシ-4-フェニル酪酸(AHPA)を原料とし、Cbzで1級アミン基を保護して中間体2を得る。無水DCMにおいてEDCIとHOBtの触媒下で(R)-1-アミノ-3-メチルブチルボロン酸ピナンジオールエステルトリフルオロ酢酸塩と反応させて中間体3を得る。中間体3にイソブチルボロン酸の作用下で保護基を脱離させて重要中間体4を得る。中間体4をPd/Cおよび水素ガスにおいて脱Cbz保護させて中間体5を生成し、最後にクエン酸と作用させて式Iで表される化合物6(Bestazomib Citrate)を得る。反応式は、以下の通りである。
本発明の一部の誘導体は遊離の形態または塩の形態で存在してもよい。当業者には、多くの化合物の種類の薬学的に許容される塩およびその製造方法が既知である。薬学的に許容される塩は、通常の無毒性の塩を含むが、このような化合物塩基と無機酸または有機酸で形成する4級アンモニウム塩を含む。
典型的な固体担体は、乳糖、石膏粉、ショ糖、タルク、ゲル、寒天、ペクチン、アラビアゴム、ステアリン酸マグネシウム、ステアリン酸などを含む。固体担体は、1つまたは複数の同時に矯味剤、潤滑剤、相溶剤、懸濁剤、フィラー、流動化剤、圧縮助剤、バインダーまたは錠剤-崩壊剤にもなれる物質を含んでもよく、さらにコーティング材料を含んでもよい。粉末において、担体は精細に粉砕された固体で、精細に粉砕された活性成分と混合される。錠剤において、活性成分は必要な圧縮性質を有する担体と適切な比率で混合され、必要な形状と大きさにように圧縮される。粉末および錠剤は好ましくは99%以下の活性成分を含む。適切な固体担体は、たとえば、リン酸カルシウム、ステアリン酸マグネシウム、タルク、糖、乳糖、デキストリン、デンプン、ゲル、セルロース、メチルセルロース、カルボキシメチルセルロースナトリウム、ポビドン、低融点ワックスやイオン交換樹脂を含む。
本発明の実施例で使用された、具体的に説明されていない試験材料は本分野の通常の試験材料で、いずれも市販品として購入することができる。
実施例1:(2S,3R)-3-((ベンジルオキシカルボニル)アミノ)-2-ヒドロキシ-4-フェニル酪酸(2)
AHPA(1,1.95 g,10.0 mmol)を100 mLのテトラヒドロフランと1mol/L水酸化ナトリウムの混合溶液に溶解させ、氷浴の条件でベンジルオキシカルボニルクロリド(1.88g,11.0 mmol)を滴下した。室温で6時間反応させた後、蒸発で反応液におけるテトラヒドロフランを除去し、水相を1mol/L塩酸でpH=1になるように調整し、酢酸エチルで3回抽出し、有機相を合併し、無水硫酸マグネシウムで乾燥し、蒸発で溶媒を除去して白色の固体2を得た(2.11g,64%)。
化合物2 (3.29 g, 10.0 mmol)を50 mLの無水DCMに溶解させ、氷浴の条件でHOBt (1.49 g, 11 mmol)およびEDCI(2.10 g, 11.0 mmol)を入れ、0.5 h後、(R)-1-アミノ-3-メチルブチルボロン酸ピナンジオールエステルトリフルオロ酢酸塩(4.07 g, 11.0 mmol)、1.5 mLのトリエチルアミンを入れた。氷浴を撤去し、室温で5h反応させた。反応完了後、有機層をそれぞれ水、1Mクエン酸、飽和炭酸水素ナトリウム、飽和塩化ナトリウムで洗浄した。無水硫酸マグネシウムで乾燥し、ろ過し、蒸発で溶媒を除去し、白色の固体3を得た(3.05g,53%)。1H-NMR(400 MHz DMSO-d6): 0.82 (s, 3H), 0.88-0.90 (m, 6H), 1.24-1.27 (m, 3H), 1.37 (s, 3H), 1.40-1.50 (m, 2H), 1.60-1.65 (m, 1H), 1.72 (s, 1H), 1.83 (d, J=14.88 Hz, 1H), 1.89 (s, 1H), 1.99-2.01 (m, 1H), 2.16-2.20 (m, 1H), 2.28-2.32 (m, 1H), 2.99-3.05 (m, 2H), 3.26-3.27 (m, 1H), 4.05-4.07 (m, 1H), 4.17 (s, 1H), 4.29 (d, J=14.88 Hz, 1H), 4.98-5.09 (m, 3H), 5.45 (d, J=8.28 Hz, 1H), 6.89 (s, 1H), 7.17-7.36 (m, 10H). ESI-MS m/z:577.34 (M+H)+。
化合物3(2.88 g, 5.0mmol)を50 mLの無水メタノールとn-ヘキサンの1:1の混合溶媒に溶解させ、そしてそれにイソブチルボロン酸(1.27 g, 12.5 mmol)を入れた。氷浴の条件で、1 mol/Lの塩酸溶液を入れて室温で撹拌を6h続けた。静置して分液させた後、下層に2 mol/Lの水酸化ナトリウム溶液を入れ、ジクロロメタンで3回抽出した。水相をさらに1N塩酸でpH=5になるように調整し、DCMで3回抽出し、DCM相を合併し、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥し、蒸発で溶媒を除去して白色の固体4を得た(0.77g,35%)。
化合物4(1.10 g, 2.5 mmol)を50 mLの無水メタノールに溶解させ、10%パラジウム炭素を0.1g入れ、水素ガスの雰囲気において室温で6h反応させ、ろ過後、蒸発で溶媒を除去して白色の固体5を得た(1.26g,42%)。
化合物5(0.62 g, 2.0 mmol)を20 mLの酢酸エチルに溶解させ、65℃の油浴においてクエン酸(0.38 g, 2.0 mmol)を入れた。0.5h反応させた後、室温に冷却して続いて2 h撹拌した。蒸発で溶媒を除去して粗製品を得たが、酢酸エチルで再結晶させて白色の固体6を得た(0.36g,40%)。1H-NMR(400 MHz DMSO-d6): 0.77-0.87 (m, 6H), 1.18-1.30 (m, 2H), 1.65-1.75 (m, 1H), 2.20-2.36 (m, 1H), 2.56-2.84 (m, 4H), 2.96-3.06 (m, 1H), 3.18 (s, 1H), 3.49-3.71 (m, 1H), 3.86-3.96 (m, 1H), 7.22-7.36 (m, 5H), 7.60-7.97 (m, 3H), 11.93 (s, 2H). ESI-MS m/z:465.20 (M+H)+;つまり、目的化合物6(Bestazomib Cirtate)であった。
アミノペプチダーゼNはその商品化された基質のL-ロイシル-p-ニトロアニリン(Sigma社から購入)と相互作用すると、405nmに吸収があるp-ニトロアニリンが生成し、そしてp-ニトロアニリンの濃度が酵素活性の大きさと正関連する。405nmにおいて吸収度を測定し、阻害薬群および対照群の吸収度から抑制率を計算し、そしてIC50値を算出した。実験結果は表1に示す。
20Sプロテアソーム検出キット(Calbiochems, EMD Millipore Co., USA)によって体外プロテアソーム活性試験を行った(Clinical Cancer Research,2011,17:5311-5321)。プロテアソームはその基質と相互作用すると、蛍光物質である7-アミノ-4-メチルクマリン(7-AMC)が生成し、そして7-AMCの濃度がプロテアソーム活性の大きさと正関連する。380/460nmにおいて蛍光強度を測定し、阻害薬群および対照群の吸収度から抑制率を計算し、そしてIC50値を算出した。実験結果は表1に示す。
目的化合物の体外における細胞増殖に対する抑制活性試験はMTT法を使用した。ヒト白血病K562細胞株、ヒト骨髄腫U266細胞株、ヒト肺癌A549細胞、ヒト前立腺癌PC-3 細胞株、ヒトリンパ腫U937細胞株およびヒト肝臓癌PLC/PRF/5細胞株、ヒト胚胎腎臓細胞HEK293、ヒト正常肝細胞HL7702を取り、いずれも通常の培養を使用した。実験時、いずれも対数期の細胞を使用した。上記細胞の細胞懸濁液を取って倒立顕微鏡において細胞数を計数し、培地を入れて細胞数が1×105/mLになるように調整した。96ウェル細胞培養プレートで細胞接種および薬物実験を行い、周縁のウェルを使用せず(無菌PBSを充填)、ブランク対照群、陰性対照群、陽性対照群および薬物実験群を設け、ここで、ブランク対照群では、細胞培養液のみを150μL/ウェル入れ、陰性対照群では、細胞懸濁液を100μL/ウェル接種して細胞培養液を50μL/ウェル入れ、陽性対照群では、細胞懸濁液を100μL/ウェル接種して陽性対照薬溶液を50μL/ウェル入れ、薬物実験群では、細胞懸濁液を100μL/ウェル接種して被験化合物溶液を50μL/ウェル入れ、陽性対照群および薬物実験群はそれぞれ5つの異なる薬物最終濃度:0.01、0.1、1、10、100μmol・L-1を設け、各薬物濃度に3つの平行重複ウェルを設けた。薬物添加が終了した後、96ウェル細胞培養プレートを37℃、5% CO2および飽和湿度の条件で48h培養し、各ウェルに10 μLの0.5%のMTT染色液を入れ、続いて4 hインキュベートした後、2500 rpmで30 min遠心し、さらにウェルにおける培地を捨て、各ウェルに100 μLのDMSOを入れ、シェーカーにおいて15 min振とうし、ホルマザン結晶が完全に溶解するようにした。マイクロプレートリーダーによって波長570nmにおいて各ウェルのOD値を測定し、細胞生長抑制率は以下の公式で計算された。
1.マウス移植性腫瘍モデルの構築
良好に生長した肝臓癌H22担持マウスを取り、腹水を取り出し、無菌PBS溶液を入れて濃度が2.5×107個/mLになるように希釈し、尾静脈から昆明マウスを200 μL/匹で接種した。体重が高すぎたか、低すぎた昆明マウスを除き、ランダムに分け、投与プランに従って投与を開始した。
H22腫瘍を接種された昆明マウスを、体重を測定した後、ランダムに以下の6群に7匹/群で分けた。(1) 陰性対照:PBS;(2) イキサゾミブ高投与量群:4 mg/kg/4d;(3) イキサゾミブ低投与量群:2 mg/kg/4d;(4)クエン酸ベスタゾミブ低投与量群:2.69 mg/kg/4d;(5)クエン酸ベスタゾミブ中投与量群:3.59 mg/kg/4d;(4)クエン酸ベスタゾミブ高投与量群:4.48 mg/kg/d。クエン酸ベスタゾミブは毎日1回で投与し、5日投与すると2日投与を止め、7日を1サイクルとし、計2サイクルで(投与体積:200 μL/20g/匹/回、投与形態:胃内投与)、陽性対照のイキサゾミブは4日に1回投与し、各サイクルの開始時と終了時に電子天秤でマウスの体重を測定し、平均値を求めた。接種から13日目にマウスを殺処分した。肺癌肺転移抑制率の計算式は、以下の通りである。
各群の肺結節数を図1に、肝臓癌H22の肺転移を抑制する抑制率の試験結果を図2に、各群の動物体重の変化曲線を図3に、各群の肺の器官写真および肺結節を図4に示す。
実施例10:カーボンクリアランステスト
1.実験原理
単核のマクロファージ系は非常に重要な防御システムで、強い異種粒子の貪食クリアランス能を有する。一定の濃度のカーボン粒子がマウスの尾静脈を経て体内に入った後、血液の流れで肝臓、脾臓などに連れられ、これらの器官のマクロファージがこれらのカーボン粒子をクリアランスすることができる。一定の濃度範囲内で、マクロファージのカーボン粒子に対するクリアランス速度がその投与量と指数関数関係にあり、すなわち、貪食速度が血液におけるカーボン粒子の濃度と正比例する。そのため、マウス血液におけるカーボン粒子濃度の対数値を縦座標に、時間を横座標にブロットすると、その傾きKはマクロファージの貪食速度を表すが、これは校正されていない貪食指数である。実際に、その貪食活性はさらにマウスの肝臓、脾臓の重量に関連し、重量が異なると、K値が異なるため、一般的に、校正された貪食指数αで表すが、これは単位重量の組織の貪食活性を反映する。Kおよびαの計算式は、以下の通りである。
材料:昆明マウス(雌、4-5週齢)、インディアンインク、生理食塩水、Na2CO3溶液(0.1% g/v)、UV紫外可視分光光度計。
良好に生長した肝臓癌H22担持マウスを取り、腹水を取り出し、無菌PBS溶液を入れて濃度が2.5×107個/mLになるように希釈し、昆明マウスの腹腔に200 μL/匹で接種した。5日後、ランダムに群分けして投与し、接種当日は1日目で、投与時、動物の体重を記録した。ランダムに体重を測定して以下の6群に10匹/群で分けた。 (1) 陰性対照:PBS;(2) イキサゾミブ高投与量群:4 mg/kg/4d;(3) イキサゾミブ低投与量群:2 mg/kg/4d;(4)クエン酸ベスタゾミブ低投与量群:2.69 mg/kg/4d;(5)クエン酸ベスタゾミブ中投与量群:3.59 mg/kg/4d;(6)クエン酸ベスタゾミブ高投与量群:4.48 mg/kg/d。所定の投与量でマウスに投与し、それぞれ体重を測定して記録した。
対数期にあるB16F10メラノーマ細胞を取り、無菌PBS溶液を入れて濃度が1.5×107個/mLになるように希釈し、C57マウスの皮下に150 μL/匹で接種した。5日後、ランダムに群分けして投与し、接種当日は1日目で、投与時、動物の体重を記録した。ランダムに体重を測定して以下の5群に分けた。 (1) 陰性対照:PBS;(2) イキサゾミブ高投与量群:4 mg/kg/4d;(3) クエン酸ベスタゾミブ低投与量群:4 mg/kg/4d;(4)クエン酸ベスタゾミブ中投与量群:6 mg/kg/4d;(5)クエン酸ベスタゾミブ高投与量群:9 mg/kg/4d。所定の投与量でマウスに投与し、それぞれ体重を測定して記録した。マウスの死亡を観察の終点として連続して観察し、各マウスの死亡時間を記録した。各群のマウスの死亡時間を統計した。
Origin7.5ソフトの一元配置分散分析(One-Way ANOVA)機能によって全体差を算出し、t検定でそれぞれ各投与群とブランク群を両者比較し、そして以下の式で各群の薬物の延命率を計算した。
Claims (11)
- 式Iで表される化合物の製造方法であって、
(2S,3R)-3-アミノ-2-ヒドロキシ-4-フェニル酪酸を原料とし、Cbzで1級アミン基を保護して中間体2を得る工程、中間体2を無水DCMにおいてEDCIとHOBtの触媒下で(R)-1-アミノ-3-メチルブチルボロン酸ピナンジオールエステルトリフルオロ酢酸塩と反応させて中間体3を得る工程、中間体3にイソブチルボロン酸の作用下で保護基を脱離させて中間体4を得る工程、中間体4をPd/Cおよび水素ガスにおいて脱Cbz保護させて中間体5を生成し、最後にクエン酸と作用させて式Iで表される化合物を得る工程を含むことを特徴とし、前記式Iで表される化合物は、
- 多機能標的阻害薬の製造における、請求項1に記載の式Iで表される化合物、あるいはその光学異性体、ジアステレオマー、ラセミ体または光学異性体、ジアステレオマー、ラセミ体の混合物、あるいはその薬学的に許容される塩、あるいはその溶媒和物の使用であって、
前記多機能標的阻害薬はアミノペプチダーゼNにもプロテアソームにも抑制活性を有する使用。 - 腫瘍を予防または治療する薬物の製造における、請求項1に記載の式Iで表される化合物、あるいはその光学異性体、ジアステレオマー、ラセミ体または光学異性体、ジアステレオマー、ラセミ体の混合物、あるいはその薬学的に許容される塩、あるいはその溶媒和物の使用。
- 前記腫瘍は、骨髄腫、白血病および固形腫瘍を含むことを特徴とする請求項6に記載の使用。
- 前記薬物組成物は、さらに、1つまたは複数の薬学的に許容される担体または賦形剤を含むことを特徴とする請求項8に記載の薬物組成物。
- 前記薬物組成物は経口投与製剤または注射製剤であることを特徴とする請求項8または9に記載の薬物組成物。
- 腫瘍疾患を治療する薬物製剤の製造における請求項8または9に記載の薬物組成物の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201810902222.0A CN109053782B (zh) | 2018-08-09 | 2018-08-09 | 多功能靶向免疫小分子抗癌药枸橼酸Bestazomib及其制备方法与应用 |
| CN201810902222.0 | 2018-08-09 | ||
| PCT/CN2019/099305 WO2020029925A1 (zh) | 2018-08-09 | 2019-08-05 | 多功能靶向免疫小分子抗癌药枸橼酸Bestazomib及其制备方法与应用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021534234A JP2021534234A (ja) | 2021-12-09 |
| JP7215774B2 true JP7215774B2 (ja) | 2023-01-31 |
Family
ID=64678863
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021531165A Active JP7215774B2 (ja) | 2018-08-09 | 2019-08-05 | 多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブおよびその製造方法と使用 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US12054502B2 (ja) |
| EP (1) | EP3835305B1 (ja) |
| JP (1) | JP7215774B2 (ja) |
| CN (1) | CN109053782B (ja) |
| WO (1) | WO2020029925A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109053782B (zh) | 2018-08-09 | 2020-01-17 | 潍坊博创国际生物医药研究院 | 多功能靶向免疫小分子抗癌药枸橼酸Bestazomib及其制备方法与应用 |
| CN114437119B (zh) * | 2020-10-30 | 2024-08-09 | 苏州开拓药业股份有限公司 | 一种c-Myc蛋白抑制剂及其制备方法和用途 |
| WO2024227056A1 (en) * | 2023-04-28 | 2024-10-31 | Metabolon Inc. | Cndp2 modulators and methods for their use |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105646273A (zh) | 2014-08-21 | 2016-06-08 | 江苏吴中苏药医药开发有限责任公司 | 一种乌苯美司的合成方法 |
| JP2016527202A (ja) | 2013-06-10 | 2016-09-08 | ミレニアム ファーマシューティカルズ, インコーポレイテッドMillennium Pharmaceuticals, Inc. | 癌の治療方法 |
| CN106478701A (zh) | 2015-08-28 | 2017-03-08 | 成都贝斯凯瑞生物科技有限公司 | 一种含硼化合物的制备方法 |
| CN106916177A (zh) | 2017-03-23 | 2017-07-04 | 南京师范大学 | 一种氘代的二肽硼酸或其酯类化合物及其合成方法与用途 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104271583B (zh) * | 2012-01-24 | 2017-10-24 | 米伦纽姆医药公司 | 治疗鼻咽癌的方法 |
| EP2819673B1 (en) * | 2012-03-02 | 2016-09-07 | Dr. Reddy's Laboratories Ltd. | Pharmaceutical compositions comprising boronic acid compounds |
| CZ2015233A3 (cs) * | 2015-04-03 | 2016-10-12 | Zentiva, K.S. | Způsob přípravy Ixazomib citrátu |
| CN105601705B (zh) * | 2015-12-23 | 2020-04-14 | 国药一心制药有限公司 | 一种硼替佐米的制备方法 |
| WO2018133661A1 (zh) | 2017-01-23 | 2018-07-26 | 成都奥璟生物科技有限公司 | 一种新的硼酸衍生物及其药物组合物 |
| CN109053782B (zh) | 2018-08-09 | 2020-01-17 | 潍坊博创国际生物医药研究院 | 多功能靶向免疫小分子抗癌药枸橼酸Bestazomib及其制备方法与应用 |
-
2018
- 2018-08-09 CN CN201810902222.0A patent/CN109053782B/zh not_active Expired - Fee Related
-
2019
- 2019-08-05 US US17/267,183 patent/US12054502B2/en active Active
- 2019-08-05 EP EP19847870.3A patent/EP3835305B1/en active Active
- 2019-08-05 WO PCT/CN2019/099305 patent/WO2020029925A1/zh unknown
- 2019-08-05 JP JP2021531165A patent/JP7215774B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016527202A (ja) | 2013-06-10 | 2016-09-08 | ミレニアム ファーマシューティカルズ, インコーポレイテッドMillennium Pharmaceuticals, Inc. | 癌の治療方法 |
| CN105646273A (zh) | 2014-08-21 | 2016-06-08 | 江苏吴中苏药医药开发有限责任公司 | 一种乌苯美司的合成方法 |
| CN106478701A (zh) | 2015-08-28 | 2017-03-08 | 成都贝斯凯瑞生物科技有限公司 | 一种含硼化合物的制备方法 |
| CN106916177A (zh) | 2017-03-23 | 2017-07-04 | 南京师范大学 | 一种氘代的二肽硼酸或其酯类化合物及其合成方法与用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN109053782A (zh) | 2018-12-21 |
| CN109053782B (zh) | 2020-01-17 |
| EP3835305A4 (en) | 2022-04-20 |
| WO2020029925A1 (zh) | 2020-02-13 |
| US12054502B2 (en) | 2024-08-06 |
| JP2021534234A (ja) | 2021-12-09 |
| EP3835305A1 (en) | 2021-06-16 |
| EP3835305B1 (en) | 2023-10-04 |
| US20210300949A1 (en) | 2021-09-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7215774B2 (ja) | 多機能標的免疫小分子抗癌薬のクエン酸ベスタゾミブおよびその製造方法と使用 | |
| KR20040017227A (ko) | 엔-아릴페닐아세트아미드 유도체 및 이를 함유하는약제학적 조성물 | |
| AU2007330478A1 (en) | Crystalline forms of ( 3 S ) -3- [N- (N' - (2-tert-butylphenyl) oxamyl) alaninyl] amino-5- (2 ', 3 ', 5 ', 6 ' -tetrafluorophenoxy) -4-oxopentanoic acid | |
| WO2018133661A1 (zh) | 一种新的硼酸衍生物及其药物组合物 | |
| CN101817769B (zh) | 脲基类肽氨肽酶n抑制剂及其应用 | |
| EP3097076B1 (en) | Novel cyp-eicosanoid derivatives | |
| WO2019020099A1 (zh) | 一种硼酸酯化合物、其合成方法及其用途 | |
| US20160244421A1 (en) | Derivative of Butylphthalide and Preparation Method and Use Thereof | |
| CN110903310B (zh) | 一种硼酸酯类药物及其用途 | |
| CN115894339A (zh) | 2-氟联苯-4-乙酸衍生物及其制备方法与应用 | |
| CN101538311B (zh) | α-氨基酰环酰亚胺类肽金属蛋白酶抑制剂及其应用 | |
| CN110922450B (zh) | Psma激活式抗肿瘤前药cpt-x及其制备方法和应用 | |
| WO2022105825A1 (en) | Compounds as pu. 1 inhibitors | |
| JP6850911B2 (ja) | ビニルアレーン誘導体およびその使用 | |
| CN114685496A (zh) | 基于异羟肟酸类hdac6抑制剂合成及其用途 | |
| KR20240094390A (ko) | 골질환의 예방 또는 치료용 약학 조성물 | |
| CN107163047A (zh) | 槐定胺类衍生物及其制备方法和用途 | |
| CN116120288A (zh) | 一种基于IR780衍生物的hERG钾通道抑制剂及其制备方法与应用 | |
| JP2018521142A (ja) | 化合物pac−1またはその塩及びそれらを含有する医薬組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210408 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210408 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20220519 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220524 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220824 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20221213 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230112 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7215774 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |