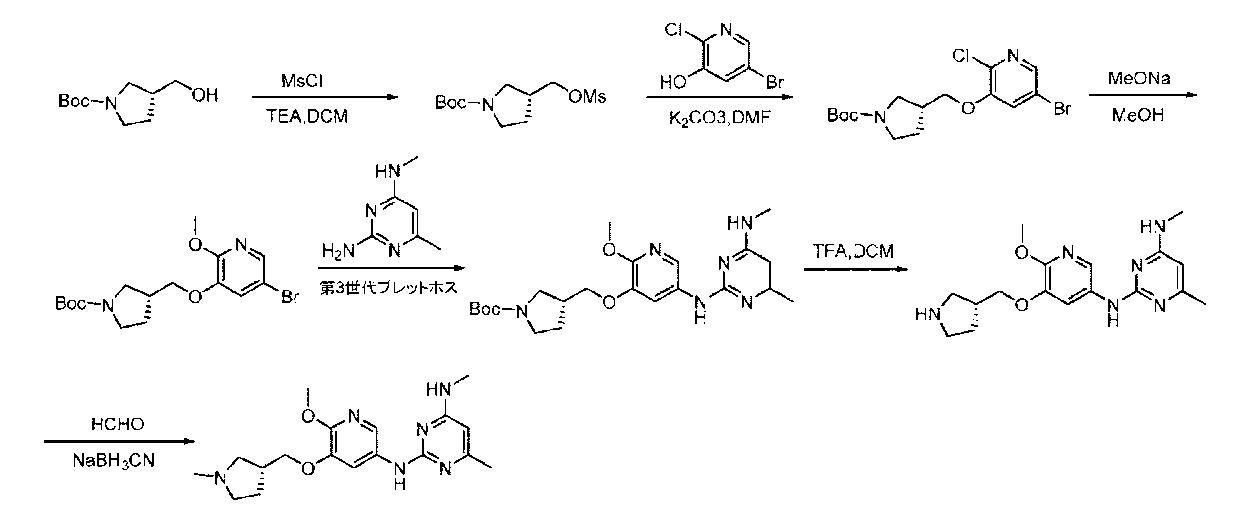
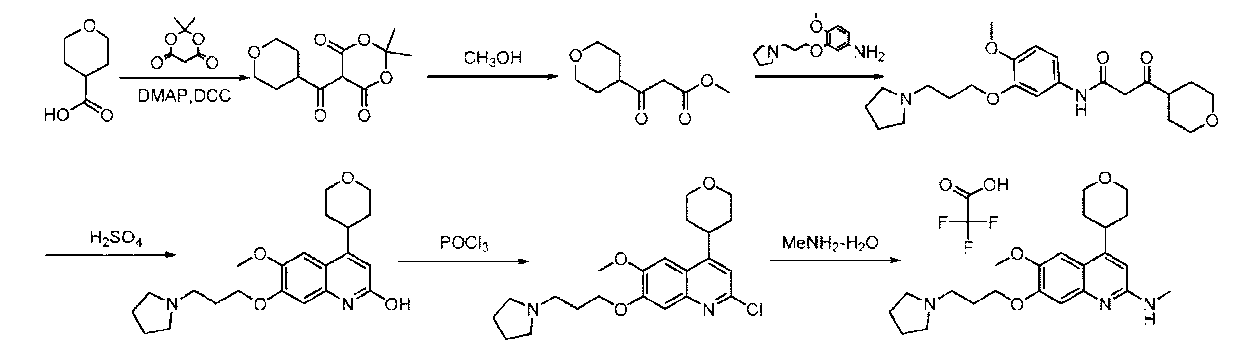
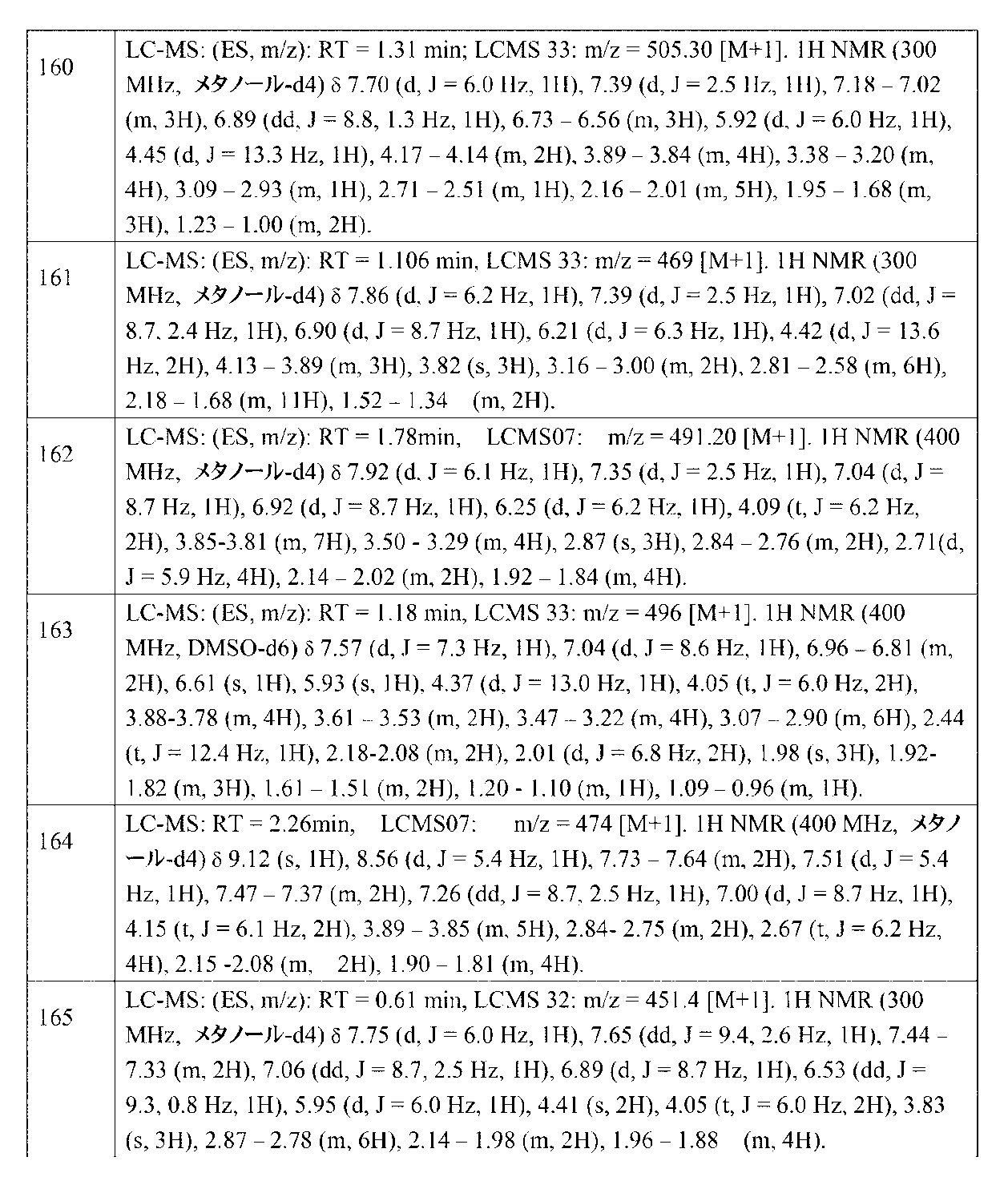
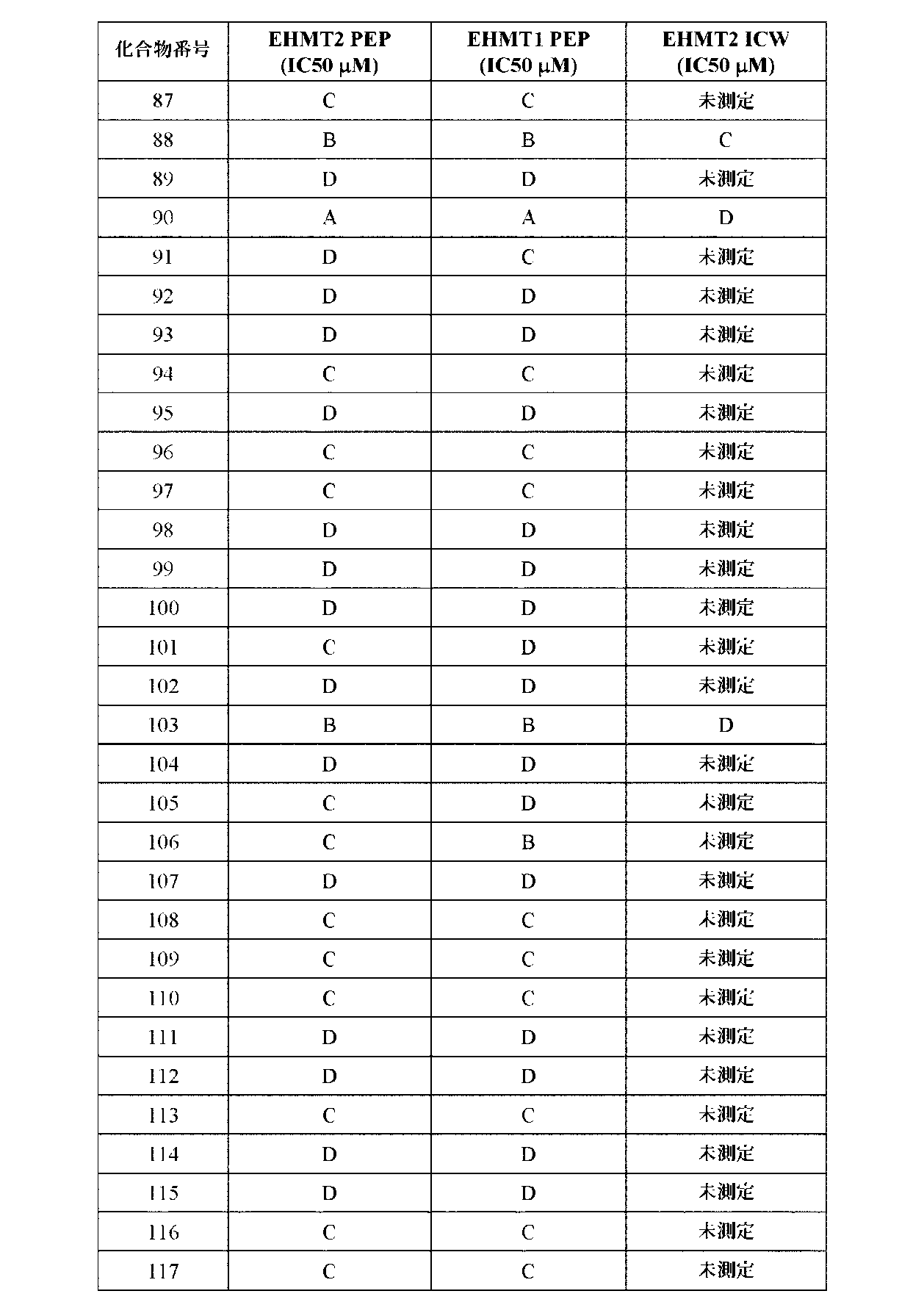
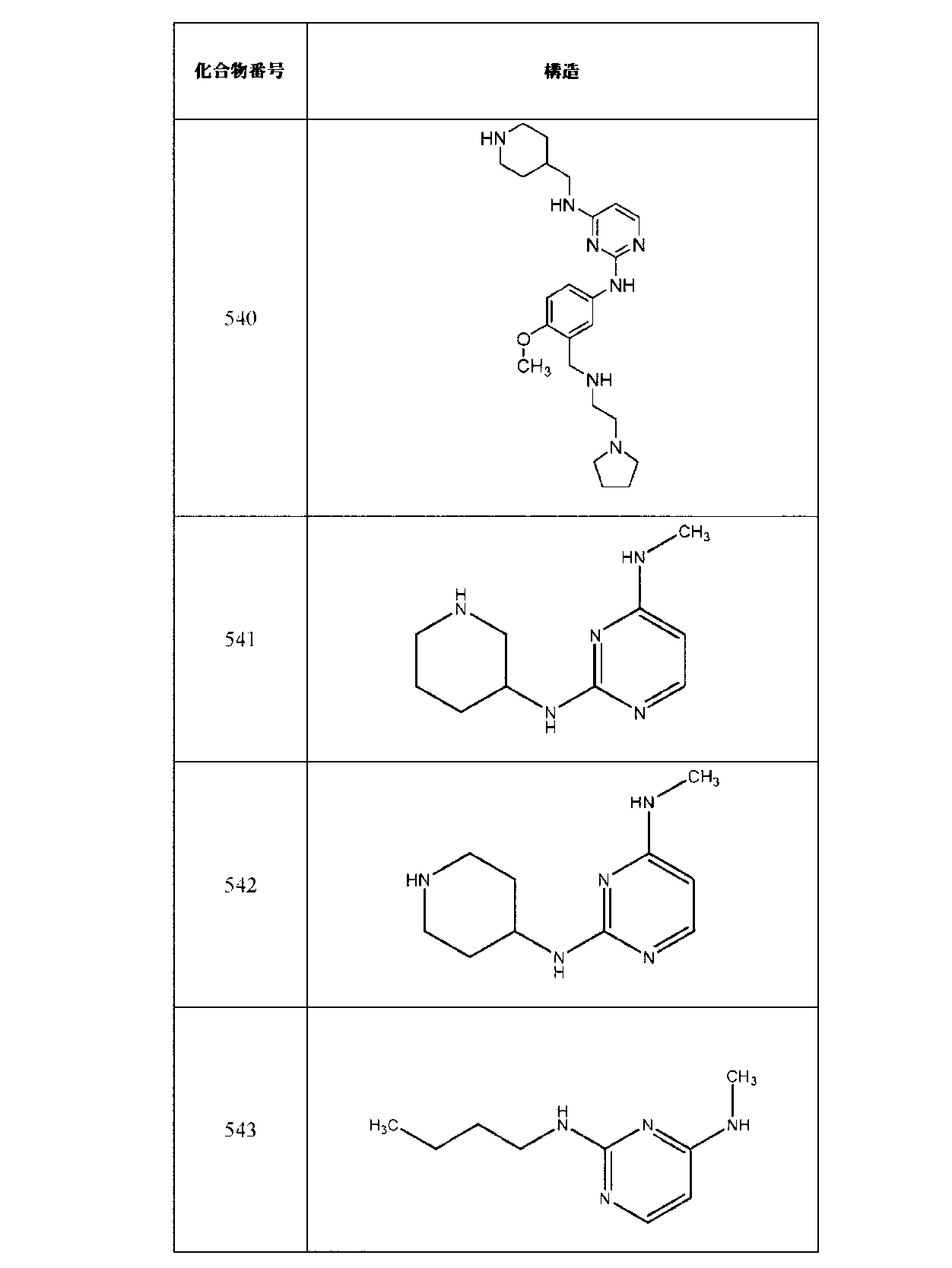
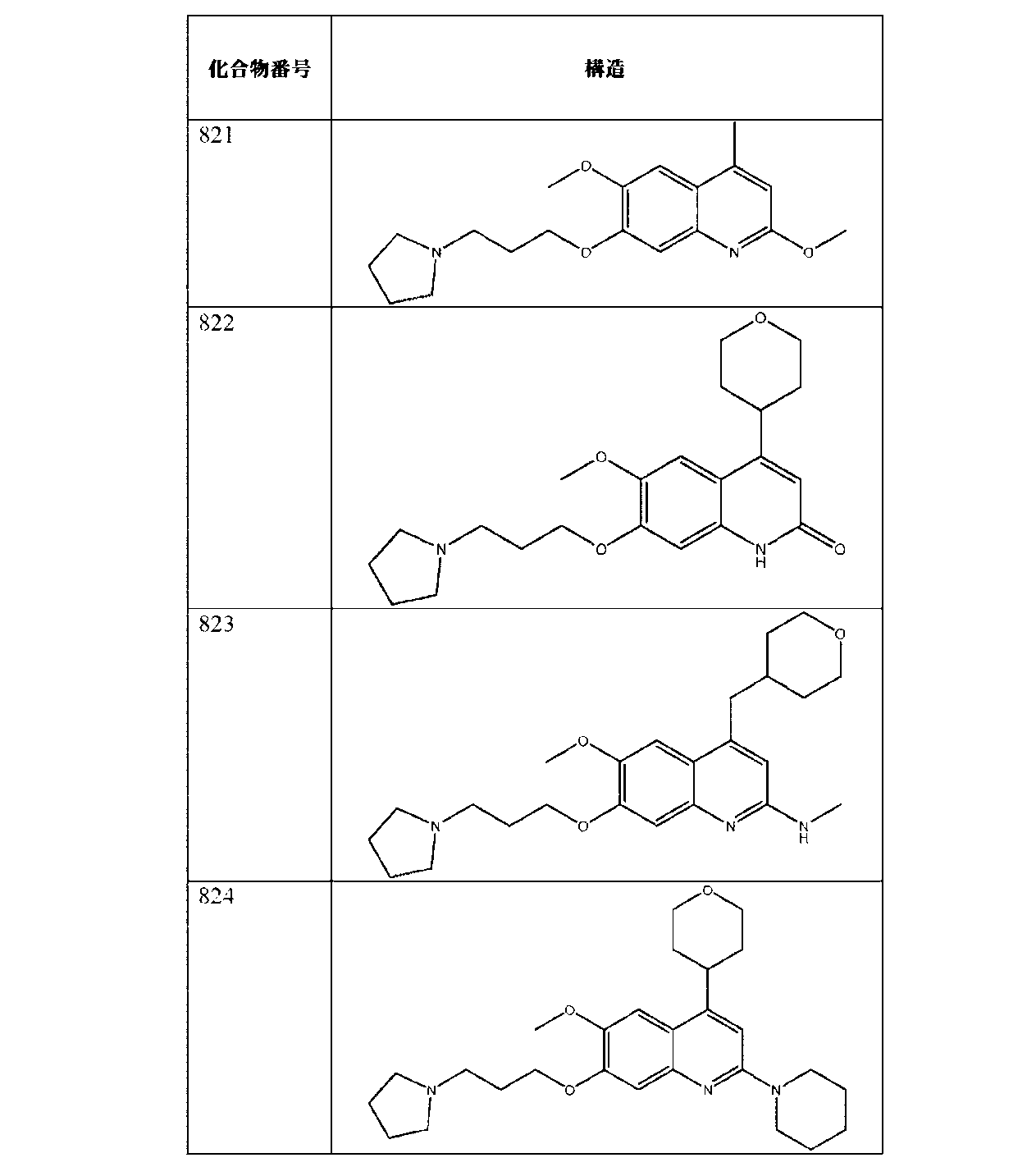
JP7041070B2 - Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 - Google Patents
Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 Download PDFInfo
- Publication number
- JP7041070B2 JP7041070B2 JP2018553876A JP2018553876A JP7041070B2 JP 7041070 B2 JP7041070 B2 JP 7041070B2 JP 2018553876 A JP2018553876 A JP 2018553876A JP 2018553876 A JP2018553876 A JP 2018553876A JP 7041070 B2 JP7041070 B2 JP 7041070B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- membered
- optionally substituted
- halo
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 125000001072 heteroaryl group Chemical group 0.000 title claims description 60
- 101000877312 Homo sapiens Histone-lysine N-methyltransferase EHMT2 Proteins 0.000 title claims description 27
- 102100035042 Histone-lysine N-methyltransferase EHMT2 Human genes 0.000 title claims description 26
- 102100035043 Histone-lysine N-methyltransferase EHMT1 Human genes 0.000 title description 10
- 101000877314 Homo sapiens Histone-lysine N-methyltransferase EHMT1 Proteins 0.000 title description 10
- 239000003112 inhibitor Substances 0.000 title description 2
- -1 cyano, hydroxyl Chemical group 0.000 claims description 391
- 150000001875 compounds Chemical class 0.000 claims description 359
- 125000005843 halogen group Chemical group 0.000 claims description 234
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 179
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 152
- 125000005842 heteroatom Chemical group 0.000 claims description 136
- 229910052739 hydrogen Inorganic materials 0.000 claims description 120
- 125000003118 aryl group Chemical group 0.000 claims description 117
- 229910052799 carbon Inorganic materials 0.000 claims description 113
- 229910052717 sulfur Inorganic materials 0.000 claims description 104
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 102
- 229910052760 oxygen Inorganic materials 0.000 claims description 100
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 91
- 150000003839 salts Chemical class 0.000 claims description 87
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 84
- 229910052757 nitrogen Inorganic materials 0.000 claims description 81
- 125000004429 atom Chemical group 0.000 claims description 76
- 125000004043 oxo group Chemical group O=* 0.000 claims description 72
- 125000000217 alkyl group Chemical group 0.000 claims description 69
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 68
- 125000003545 alkoxy group Chemical group 0.000 claims description 55
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 49
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 claims description 41
- 125000005647 linker group Chemical group 0.000 claims description 29
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 26
- 239000008194 pharmaceutical composition Substances 0.000 claims description 22
- 125000004450 alkenylene group Chemical group 0.000 claims description 16
- 208000014951 hematologic disease Diseases 0.000 claims description 13
- 208000019838 Blood disease Diseases 0.000 claims description 12
- 239000003937 drug carrier Substances 0.000 claims description 12
- 208000018706 hematopoietic system disease Diseases 0.000 claims description 12
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 12
- 208000007056 sickle cell anemia Diseases 0.000 claims description 11
- 108091000080 Phosphotransferase Proteins 0.000 claims description 10
- 125000002947 alkylene group Chemical group 0.000 claims description 10
- 102000020233 phosphotransferase Human genes 0.000 claims description 10
- 102000004190 Enzymes Human genes 0.000 claims description 8
- 108090000790 Enzymes Proteins 0.000 claims description 8
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 8
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 5
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 5
- 125000004419 alkynylene group Chemical group 0.000 claims description 5
- 201000005787 hematologic cancer Diseases 0.000 claims description 5
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 claims description 5
- 125000004474 heteroalkylene group Chemical group 0.000 claims description 5
- 230000005764 inhibitory process Effects 0.000 claims description 4
- KRQUFUKTQHISJB-YYADALCUSA-N 2-[(E)-N-[2-(4-chlorophenoxy)propoxy]-C-propylcarbonimidoyl]-3-hydroxy-5-(thian-3-yl)cyclohex-2-en-1-one Chemical compound CCC\C(=N/OCC(C)OC1=CC=C(Cl)C=C1)C1=C(O)CC(CC1=O)C1CCCSC1 KRQUFUKTQHISJB-YYADALCUSA-N 0.000 claims description 3
- 108010055196 EphA2 Receptor Proteins 0.000 claims description 3
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 claims description 3
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 claims description 3
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 claims description 3
- 101000977771 Homo sapiens Interleukin-1 receptor-associated kinase 4 Proteins 0.000 claims description 3
- 101000777293 Homo sapiens Serine/threonine-protein kinase Chk1 Proteins 0.000 claims description 3
- 101001059443 Homo sapiens Serine/threonine-protein kinase MARK1 Proteins 0.000 claims description 3
- 101000934996 Homo sapiens Tyrosine-protein kinase JAK3 Proteins 0.000 claims description 3
- 102100023533 Interleukin-1 receptor-associated kinase 4 Human genes 0.000 claims description 3
- 101150028321 Lck gene Proteins 0.000 claims description 3
- 102100033610 MAP kinase-interacting serine/threonine-protein kinase 2 Human genes 0.000 claims description 3
- 101710138999 MAP kinase-interacting serine/threonine-protein kinase 2 Proteins 0.000 claims description 3
- 229940124639 Selective inhibitor Drugs 0.000 claims description 3
- 102100031081 Serine/threonine-protein kinase Chk1 Human genes 0.000 claims description 3
- 102100028921 Serine/threonine-protein kinase MARK1 Human genes 0.000 claims description 3
- 208000018020 Sickle cell-beta-thalassemia disease syndrome Diseases 0.000 claims description 3
- 206010043391 Thalassaemia beta Diseases 0.000 claims description 3
- 102100025387 Tyrosine-protein kinase JAK3 Human genes 0.000 claims description 3
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 claims description 3
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims description 3
- 229910052794 bromium Inorganic materials 0.000 claims description 3
- 229910052731 fluorine Inorganic materials 0.000 claims description 3
- 230000006870 function Effects 0.000 claims description 3
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 3
- SWKAVEUTKGKHSR-UHFFFAOYSA-N 3-(benzylsulfamoyl)-4-bromo-n-(4-bromophenyl)benzamide Chemical compound C1=CC(Br)=CC=C1NC(=O)C1=CC=C(Br)C(S(=O)(=O)NCC=2C=CC=CC=2)=C1 SWKAVEUTKGKHSR-UHFFFAOYSA-N 0.000 claims description 2
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims 1
- 238000003786 synthesis reaction Methods 0.000 description 173
- 230000015572 biosynthetic process Effects 0.000 description 167
- 239000000243 solution Substances 0.000 description 158
- 239000000203 mixture Substances 0.000 description 141
- 239000007787 solid Substances 0.000 description 109
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 101
- 230000002829 reductive effect Effects 0.000 description 94
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 86
- 238000000034 method Methods 0.000 description 73
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 72
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 64
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-dimethylformamide Substances CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 61
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 58
- 239000003921 oil Substances 0.000 description 55
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 53
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 52
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 44
- UUEVFMOUBSLVJW-UHFFFAOYSA-N oxo-[[1-[2-[2-[2-[4-(oxoazaniumylmethylidene)pyridin-1-yl]ethoxy]ethoxy]ethyl]pyridin-4-ylidene]methyl]azanium;dibromide Chemical compound [Br-].[Br-].C1=CC(=C[NH+]=O)C=CN1CCOCCOCCN1C=CC(=C[NH+]=O)C=C1 UUEVFMOUBSLVJW-UHFFFAOYSA-N 0.000 description 41
- 206010028980 Neoplasm Diseases 0.000 description 39
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 38
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 38
- 239000000741 silica gel Substances 0.000 description 37
- 229910002027 silica gel Inorganic materials 0.000 description 37
- 239000012043 crude product Substances 0.000 description 34
- 239000012044 organic layer Substances 0.000 description 33
- 238000002953 preparative HPLC Methods 0.000 description 32
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 30
- 238000006243 chemical reaction Methods 0.000 description 30
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 30
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 29
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 29
- 208000035475 disorder Diseases 0.000 description 29
- 235000019439 ethyl acetate Nutrition 0.000 description 29
- 239000012071 phase Substances 0.000 description 29
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 28
- 230000000694 effects Effects 0.000 description 27
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 26
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 26
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N N-phenyl amine Natural products NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 25
- 125000000304 alkynyl group Chemical group 0.000 description 25
- 125000003342 alkenyl group Chemical group 0.000 description 24
- 201000010099 disease Diseases 0.000 description 24
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 24
- 125000001424 substituent group Chemical group 0.000 description 24
- DNUTZBZXLPWRJG-UHFFFAOYSA-M piperidine-1-carboxylate Chemical compound [O-]C(=O)N1CCCCC1 DNUTZBZXLPWRJG-UHFFFAOYSA-M 0.000 description 23
- 238000011282 treatment Methods 0.000 description 22
- 108010033040 Histones Proteins 0.000 description 21
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 21
- 201000011510 cancer Diseases 0.000 description 20
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 19
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 19
- 125000004432 carbon atom Chemical group C* 0.000 description 19
- 125000004076 pyridyl group Chemical group 0.000 description 19
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 18
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 18
- 239000002253 acid Substances 0.000 description 17
- 125000000623 heterocyclic group Chemical group 0.000 description 17
- 239000012453 solvate Substances 0.000 description 17
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 17
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 16
- 210000004027 cell Anatomy 0.000 description 16
- 239000003960 organic solvent Substances 0.000 description 16
- KZKRRZFCAYOXQE-UHFFFAOYSA-N 1$l^{2}-azinane Chemical group C1CC[N]CC1 KZKRRZFCAYOXQE-UHFFFAOYSA-N 0.000 description 15
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 15
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 15
- 230000008569 process Effects 0.000 description 15
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 15
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 13
- 230000011987 methylation Effects 0.000 description 13
- 238000007069 methylation reaction Methods 0.000 description 13
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 13
- 125000003386 piperidinyl group Chemical group 0.000 description 13
- YAAWASYJIRZXSZ-UHFFFAOYSA-N pyrimidine-2,4-diamine Chemical compound NC1=CC=NC(N)=N1 YAAWASYJIRZXSZ-UHFFFAOYSA-N 0.000 description 13
- HJGWMHPYCVHXCX-UHFFFAOYSA-N 4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)aniline Chemical compound COC1=CC=C(N)C=C1OCCCN1CCCC1 HJGWMHPYCVHXCX-UHFFFAOYSA-N 0.000 description 12
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 12
- 238000003556 assay Methods 0.000 description 12
- 238000003818 flash chromatography Methods 0.000 description 12
- 239000007788 liquid Substances 0.000 description 12
- 230000001404 mediated effect Effects 0.000 description 12
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 12
- 229910000027 potassium carbonate Inorganic materials 0.000 description 12
- 125000000714 pyrimidinyl group Chemical group 0.000 description 12
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 12
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- 239000002585 base Substances 0.000 description 11
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 11
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 11
- 125000002632 imidazolidinyl group Chemical group 0.000 description 11
- 125000002757 morpholinyl group Chemical group 0.000 description 11
- 125000000160 oxazolidinyl group Chemical group 0.000 description 11
- 239000003208 petroleum Substances 0.000 description 11
- 125000004193 piperazinyl group Chemical group 0.000 description 11
- 238000002360 preparation method Methods 0.000 description 11
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 10
- 125000005962 1,4-oxazepanyl group Chemical group 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 10
- 125000003282 alkyl amino group Chemical group 0.000 description 10
- 125000002393 azetidinyl group Chemical group 0.000 description 10
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 10
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 10
- 239000013078 crystal Substances 0.000 description 10
- 125000004663 dialkyl amino group Chemical group 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- BTTNYQZNBZNDOR-UHFFFAOYSA-N 2,4-dichloropyrimidine Chemical compound ClC1=CC=NC(Cl)=N1 BTTNYQZNBZNDOR-UHFFFAOYSA-N 0.000 description 9
- 125000006163 5-membered heteroaryl group Chemical group 0.000 description 9
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 9
- 125000004442 acylamino group Chemical group 0.000 description 9
- 125000001931 aliphatic group Chemical group 0.000 description 9
- 150000001448 anilines Chemical class 0.000 description 9
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- 239000001257 hydrogen Substances 0.000 description 9
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 9
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 9
- 230000002401 inhibitory effect Effects 0.000 description 9
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 9
- 125000001624 naphthyl group Chemical group 0.000 description 9
- 239000000546 pharmaceutical excipient Substances 0.000 description 9
- 108090000623 proteins and genes Proteins 0.000 description 9
- 125000003226 pyrazolyl group Chemical group 0.000 description 9
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 9
- 230000001225 therapeutic effect Effects 0.000 description 9
- 125000005960 1,4-diazepanyl group Chemical group 0.000 description 8
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 8
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 8
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 8
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 8
- 206010039491 Sarcoma Diseases 0.000 description 8
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 8
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 8
- 125000004947 alkyl aryl amino group Chemical group 0.000 description 8
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 description 8
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 8
- 125000001769 aryl amino group Chemical group 0.000 description 8
- 125000004658 aryl carbonyl amino group Chemical group 0.000 description 8
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 8
- 150000007942 carboxylates Chemical class 0.000 description 8
- LNAMMBFJMYMQTO-FNEBRGMMSA-N chloroform;(1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].ClC(Cl)Cl.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 LNAMMBFJMYMQTO-FNEBRGMMSA-N 0.000 description 8
- 229910052736 halogen Inorganic materials 0.000 description 8
- 150000002367 halogens Chemical class 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 230000037361 pathway Effects 0.000 description 8
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 8
- 125000004434 sulfur atom Chemical group 0.000 description 8
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 7
- 201000010133 Oligodendroglioma Diseases 0.000 description 7
- 229910019142 PO4 Inorganic materials 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 7
- 125000005194 alkoxycarbonyloxy group Chemical group 0.000 description 7
- 125000002877 alkyl aryl group Chemical group 0.000 description 7
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 7
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 7
- 125000004691 alkyl thio carbonyl group Chemical group 0.000 description 7
- 125000004414 alkyl thio group Chemical group 0.000 description 7
- 125000005129 aryl carbonyl group Chemical group 0.000 description 7
- 125000005199 aryl carbonyloxy group Chemical group 0.000 description 7
- 125000005110 aryl thio group Chemical group 0.000 description 7
- 125000005200 aryloxy carbonyloxy group Chemical group 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 7
- 239000010452 phosphate Substances 0.000 description 7
- 125000006239 protecting group Chemical group 0.000 description 7
- 125000003373 pyrazinyl group Chemical group 0.000 description 7
- 229920006395 saturated elastomer Polymers 0.000 description 7
- 239000000758 substrate Substances 0.000 description 7
- 229940124530 sulfonamide Drugs 0.000 description 7
- 150000003456 sulfonamides Chemical class 0.000 description 7
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 7
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 6
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 6
- 108010036115 Histone Methyltransferases Proteins 0.000 description 6
- 102000011787 Histone Methyltransferases Human genes 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 150000001450 anions Chemical class 0.000 description 6
- 239000012267 brine Substances 0.000 description 6
- 125000000524 functional group Chemical group 0.000 description 6
- 238000004128 high performance liquid chromatography Methods 0.000 description 6
- 125000002883 imidazolyl group Chemical group 0.000 description 6
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 6
- ACVYVLVWPXVTIT-UHFFFAOYSA-M phosphinate Chemical compound [O-][PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-M 0.000 description 6
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 6
- 235000018102 proteins Nutrition 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 6
- 238000003419 tautomerization reaction Methods 0.000 description 6
- KXKCTSZYNCDFFG-UHFFFAOYSA-N 2-Methoxy-5-nitrophenol Chemical compound COC1=CC=C([N+]([O-])=O)C=C1O KXKCTSZYNCDFFG-UHFFFAOYSA-N 0.000 description 5
- XNPPMKUOUGOKIF-UHFFFAOYSA-N 2-chloro-n-(oxan-4-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=NC=CC(NCC2CCOCC2)=N1 XNPPMKUOUGOKIF-UHFFFAOYSA-N 0.000 description 5
- WJNSNVIQHYHUHX-UHFFFAOYSA-N 2-chloro-n-methylpyrimidin-4-amine Chemical compound CNC1=CC=NC(Cl)=N1 WJNSNVIQHYHUHX-UHFFFAOYSA-N 0.000 description 5
- 208000005243 Chondrosarcoma Diseases 0.000 description 5
- 108010044495 Fetal Hemoglobin Proteins 0.000 description 5
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 5
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 5
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 5
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 5
- 238000010171 animal model Methods 0.000 description 5
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 5
- 239000012298 atmosphere Substances 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 5
- 229910000024 caesium carbonate Inorganic materials 0.000 description 5
- KWEDUNSJJZVRKR-UHFFFAOYSA-N carbononitridic azide Chemical compound [N-]=[N+]=NC#N KWEDUNSJJZVRKR-UHFFFAOYSA-N 0.000 description 5
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 5
- 125000004473 dialkylaminocarbonyl group Chemical group 0.000 description 5
- 230000014509 gene expression Effects 0.000 description 5
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 5
- 208000032839 leukemia Diseases 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 125000004430 oxygen atom Chemical group O* 0.000 description 5
- 125000003367 polycyclic group Chemical group 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 238000010189 synthetic method Methods 0.000 description 5
- 150000003536 tetrazoles Chemical class 0.000 description 5
- KJVFWCQSLLEDFI-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-methylpyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=N1)NC)OCCCN1CCCC1 KJVFWCQSLLEDFI-UHFFFAOYSA-N 0.000 description 4
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical compound NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- 201000009030 Carcinoma Diseases 0.000 description 4
- 108010054147 Hemoglobins Proteins 0.000 description 4
- 102000001554 Hemoglobins Human genes 0.000 description 4
- 102000006947 Histones Human genes 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241000209094 Oryza Species 0.000 description 4
- 235000007164 Oryza sativa Nutrition 0.000 description 4
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 4
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 4
- 206010060862 Prostate cancer Diseases 0.000 description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 125000002252 acyl group Chemical group 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 4
- 125000004986 diarylamino group Chemical group 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 150000002430 hydrocarbons Chemical group 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 4
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 4
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 4
- 231100000252 nontoxic Toxicity 0.000 description 4
- 230000003000 nontoxic effect Effects 0.000 description 4
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 235000009566 rice Nutrition 0.000 description 4
- 125000003003 spiro group Chemical group 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- BGHCVCJVXZWKCC-UHFFFAOYSA-N tetradecane Chemical compound CCCCCCCCCCCCCC BGHCVCJVXZWKCC-UHFFFAOYSA-N 0.000 description 4
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 4
- 229930192474 thiophene Natural products 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 150000003852 triazoles Chemical class 0.000 description 4
- YGPMDQCRXZCKCY-UHFFFAOYSA-N 1-(2-methoxy-5-nitrophenoxy)-3-pyrrolidin-1-ylpropan-2-ol Chemical compound COC1=C(OCC(O)CN2CCCC2)C=C(C=C1)[N+]([O-])=O YGPMDQCRXZCKCY-UHFFFAOYSA-N 0.000 description 3
- OZWMGESMVNTVFW-UHFFFAOYSA-N 1-(5-amino-2-methoxyphenoxy)-3-pyrrolidin-1-ylpropan-2-ol Chemical compound COC1=C(OCC(O)CN2CCCC2)C=C(N)C=C1 OZWMGESMVNTVFW-UHFFFAOYSA-N 0.000 description 3
- OGEIBYMKRQLPEI-UHFFFAOYSA-N 1-[3-(2-chloro-5-nitrophenoxy)propyl]pyrrolidine Chemical compound [O-][N+](=O)C1=CC=C(Cl)C(OCCCN2CCCC2)=C1 OGEIBYMKRQLPEI-UHFFFAOYSA-N 0.000 description 3
- SPLNCOVYEHIZGQ-UHFFFAOYSA-N 1-[3-(2-methoxy-5-nitrophenoxy)propyl]pyrrolidine Chemical compound COC1=C(OCCCN2CCCC2)C=C(C=C1)[N+](=O)[O-] SPLNCOVYEHIZGQ-UHFFFAOYSA-N 0.000 description 3
- BLIOCZQLOPIMPY-UHFFFAOYSA-N 1-[4-[(2-chloropyrimidin-4-yl)oxymethyl]piperidin-1-yl]ethanone Chemical compound CC(=O)N1CCC(COC2=CC=NC(Cl)=N2)CC1 BLIOCZQLOPIMPY-UHFFFAOYSA-N 0.000 description 3
- CNTQDLOEAGRWGJ-UHFFFAOYSA-N 1-[4-[[(4-bromopyridin-2-yl)-methylamino]methyl]piperidin-1-yl]ethanone Chemical compound CN(CC1CCN(CC1)C(C)=O)C1=NC=CC(Br)=C1 CNTQDLOEAGRWGJ-UHFFFAOYSA-N 0.000 description 3
- CAXPAYBPWACOTQ-UHFFFAOYSA-N 1-[4-[[(4-bromopyridin-2-yl)amino]methyl]piperidin-1-yl]ethanone Chemical compound CC(=O)N1CCC(CNC2=NC=CC(Br)=C2)CC1 CAXPAYBPWACOTQ-UHFFFAOYSA-N 0.000 description 3
- ICFOJUUJPXGJNE-UHFFFAOYSA-N 2-(2-methoxy-5-nitrophenyl)acetonitrile Chemical compound COC1=CC=C([N+]([O-])=O)C=C1CC#N ICFOJUUJPXGJNE-UHFFFAOYSA-N 0.000 description 3
- IYIKERYGJPPCRC-UHFFFAOYSA-N 2-(5-amino-2-methoxyphenyl)acetonitrile Chemical compound COC1=CC=C(N)C=C1CC#N IYIKERYGJPPCRC-UHFFFAOYSA-N 0.000 description 3
- SSYDSTKMOYVTMW-UHFFFAOYSA-N 2-(chloromethyl)-1-methoxy-4-nitrobenzene Chemical compound COC1=CC=C([N+]([O-])=O)C=C1CCl SSYDSTKMOYVTMW-UHFFFAOYSA-N 0.000 description 3
- KXWUKVZRKUSMSX-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-morpholin-4-ylpropoxy)phenyl]-4-N-(piperidin-4-ylmethyl)pyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=N1)NCC1CCNCC1)OCCCN1CCOCC1 KXWUKVZRKUSMSX-UHFFFAOYSA-N 0.000 description 3
- VZZQIDDTZZHSQO-UHFFFAOYSA-N 2-chloro-4-(piperidin-4-ylmethoxy)pyrimidine Chemical compound ClC1=NC=CC(OCC2CCNCC2)=N1 VZZQIDDTZZHSQO-UHFFFAOYSA-N 0.000 description 3
- ZKGAZSSNSLRYKK-UHFFFAOYSA-N 2-chloro-N-[[1-(2,2-difluoroethyl)piperidin-4-yl]methyl]pyrimidin-4-amine Chemical compound ClC1=NC=CC(=N1)NCC1CCN(CC1)CC(F)F ZKGAZSSNSLRYKK-UHFFFAOYSA-N 0.000 description 3
- WKRCEVOXEOAZEG-UHFFFAOYSA-N 2-chloro-n-(oxan-4-yl)pyrimidin-4-amine Chemical compound ClC1=NC=CC(NC2CCOCC2)=N1 WKRCEVOXEOAZEG-UHFFFAOYSA-N 0.000 description 3
- VIIOJNODMZPBCZ-UHFFFAOYSA-N 2-chloro-n-(piperidin-4-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=NC=CC(NCC2CCNCC2)=N1 VIIOJNODMZPBCZ-UHFFFAOYSA-N 0.000 description 3
- SSANBRZHHDSSSH-UHFFFAOYSA-N 2-chloro-n-methylpyrimidine-5-carboxamide Chemical compound CNC(=O)C1=CN=C(Cl)N=C1 SSANBRZHHDSSSH-UHFFFAOYSA-N 0.000 description 3
- JUYQWJULYXCBAV-UHFFFAOYSA-N 2-chloropyrimidine-5-carbonyl chloride Chemical compound ClC(=O)C1=CN=C(Cl)N=C1 JUYQWJULYXCBAV-UHFFFAOYSA-N 0.000 description 3
- FJNLCHNQVJVCPY-UHFFFAOYSA-N 2-n-methoxy-2-n-methyl-4-n,6-n-dipropyl-1,3,5-triazine-2,4,6-triamine Chemical compound CCCNC1=NC(NCCC)=NC(N(C)OC)=N1 FJNLCHNQVJVCPY-UHFFFAOYSA-N 0.000 description 3
- QTVHXSMAZYKPJH-UHFFFAOYSA-N 3-(3-pyrrolidin-1-ylpropoxy)aniline Chemical compound NC1=CC=CC(OCCCN2CCCC2)=C1 QTVHXSMAZYKPJH-UHFFFAOYSA-N 0.000 description 3
- WPTGQTCDWJTQRN-UHFFFAOYSA-N 3-[(2-methoxy-5-nitrophenoxy)methyl]-1-methylpyrrolidine Chemical compound COC1=C(OCC2CN(CC2)C)C=C(C=C1)[N+](=O)[O-] WPTGQTCDWJTQRN-UHFFFAOYSA-N 0.000 description 3
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 3
- JVFJCHXBDYBWOP-UHFFFAOYSA-N 4-[3-(2-methoxy-5-nitrophenoxy)propyl]morpholine Chemical compound COC1=CC=C([N+]([O-])=O)C=C1OCCCN1CCOCC1 JVFJCHXBDYBWOP-UHFFFAOYSA-N 0.000 description 3
- CNTYORNZJKWFDP-UHFFFAOYSA-N 4-[[5-methoxy-4-(3-pyrrolidin-1-ylpropoxy)pyridin-2-yl]amino]pyridine-2-carbonitrile Chemical compound COC=1C(=CC(=NC=1)NC1=CC(=NC=C1)C#N)OCCCN1CCCC1 CNTYORNZJKWFDP-UHFFFAOYSA-N 0.000 description 3
- FEIJYQSCZUNHQA-UHFFFAOYSA-N 4-chloro-3-(3-pyrrolidin-1-ylpropoxy)aniline Chemical compound NC1=CC=C(Cl)C(OCCCN2CCCC2)=C1 FEIJYQSCZUNHQA-UHFFFAOYSA-N 0.000 description 3
- JBJDLJZLBYHZRF-UHFFFAOYSA-N 4-methoxy-3-(3-morpholin-4-ylpropoxy)aniline Chemical compound COC1=CC=C(N)C=C1OCCCN1CCOCC1 JBJDLJZLBYHZRF-UHFFFAOYSA-N 0.000 description 3
- AAPDFEWSRJLNBJ-UHFFFAOYSA-N 4-methoxy-3-[(1-methylpyrrolidin-3-yl)methoxy]aniline Chemical compound COC1=C(C=C(N)C=C1)OCC1CN(CC1)C AAPDFEWSRJLNBJ-UHFFFAOYSA-N 0.000 description 3
- ZUJQSNDKHMBUOR-UHFFFAOYSA-N 4-methyl-2-N-[3-(3-pyrrolidin-1-ylpropoxy)phenyl]-1H-pyrimidine-2,4-diamine Chemical compound CC1(NC(=NC=C1)NC1=CC(=CC=C1)OCCCN1CCCC1)N ZUJQSNDKHMBUOR-UHFFFAOYSA-N 0.000 description 3
- SBRDIFYVMWIWJH-UHFFFAOYSA-N 6-methoxy-2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-methylpyrimidine-2,4-diamine Chemical compound COC1=CC(=NC(=N1)NC1=CC(=C(C=C1)OC)OCCCN1CCCC1)NC SBRDIFYVMWIWJH-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 3
- 244000099147 Ananas comosus Species 0.000 description 3
- 235000007119 Ananas comosus Nutrition 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 3
- JGLMVXWAHNTPRF-CMDGGOBGSA-N CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O Chemical compound CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O JGLMVXWAHNTPRF-CMDGGOBGSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 3
- 208000006168 Ewing Sarcoma Diseases 0.000 description 3
- 108010030471 Histamine N-methyltransferase Proteins 0.000 description 3
- 102100029076 Histamine N-methyltransferase Human genes 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 208000000172 Medulloblastoma Diseases 0.000 description 3
- FXZAYCTXIOQMCY-UHFFFAOYSA-N N-[2-(aminomethyl)pyridin-4-yl]-5-methoxy-4-(3-pyrrolidin-1-ylpropoxy)pyridin-2-amine Chemical compound NCC1=NC=CC(=C1)NC1=NC=C(C(=C1)OCCCN1CCCC1)OC FXZAYCTXIOQMCY-UHFFFAOYSA-N 0.000 description 3
- CJPYKHIGJHCHCM-UHFFFAOYSA-N N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-2-methylsulfanylpyrimidin-4-amine Chemical compound COC1=C(C=C(C=C1)NC1=NC(=NC=C1)SC)OCCCN1CCCC1 CJPYKHIGJHCHCM-UHFFFAOYSA-N 0.000 description 3
- IDSDRPWNJYKBPS-UHFFFAOYSA-N N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-2-methylsulfonylpyrimidin-4-amine Chemical compound COC1=C(C=C(C=C1)NC1=NC(=NC=C1)S(=O)(=O)C)OCCCN1CCCC1 IDSDRPWNJYKBPS-UHFFFAOYSA-N 0.000 description 3
- 206010061535 Ovarian neoplasm Diseases 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 3
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- 208000006994 Precancerous Conditions Diseases 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- MEFKEPWMEQBLKI-AIRLBKTGSA-N S-adenosyl-L-methioninate Chemical compound O[C@@H]1[C@H](O)[C@@H](C[S+](CC[C@H](N)C([O-])=O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 MEFKEPWMEQBLKI-AIRLBKTGSA-N 0.000 description 3
- 108010016797 Sickle Hemoglobin Proteins 0.000 description 3
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 3
- 229960000583 acetic acid Drugs 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 3
- 229960001570 ademetionine Drugs 0.000 description 3
- 125000004457 alkyl amino carbonyl group Chemical group 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 3
- 208000007502 anemia Diseases 0.000 description 3
- 235000010323 ascorbic acid Nutrition 0.000 description 3
- 239000011668 ascorbic acid Substances 0.000 description 3
- 229960005070 ascorbic acid Drugs 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- 238000004166 bioassay Methods 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 150000001735 carboxylic acids Chemical class 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 150000001768 cations Chemical class 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000012230 colorless oil Substances 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 3
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 201000003908 endometrial adenocarcinoma Diseases 0.000 description 3
- 208000029382 endometrium adenocarcinoma Diseases 0.000 description 3
- 230000030279 gene silencing Effects 0.000 description 3
- 238000012226 gene silencing method Methods 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 3
- 238000013537 high throughput screening Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 230000036244 malformation Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N methanesulfonic acid Substances CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- YWLVEBCUJRKAMO-UHFFFAOYSA-N n-tert-butyl-2-chloropyrimidin-4-amine Chemical compound CC(C)(C)NC1=CC=NC(Cl)=N1 YWLVEBCUJRKAMO-UHFFFAOYSA-N 0.000 description 3
- UFWIBTONFRDIAS-UHFFFAOYSA-N naphthalene-acid Natural products C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 3
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 3
- 239000002674 ointment Substances 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000007800 oxidant agent Substances 0.000 description 3
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 3
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 3
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 3
- 150000003141 primary amines Chemical class 0.000 description 3
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 3
- 125000000168 pyrrolyl group Chemical group 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 239000012312 sodium hydride Substances 0.000 description 3
- 229910000104 sodium hydride Inorganic materials 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 3
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 125000000335 thiazolyl group Chemical group 0.000 description 3
- 125000001425 triazolyl group Chemical group 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 2
- UUPCYQIIQHSPKR-UHFFFAOYSA-N 1-(3-chloropropyl)pyrrolidine;hydrochloride Chemical compound Cl.ClCCCN1CCCC1 UUPCYQIIQHSPKR-UHFFFAOYSA-N 0.000 description 2
- VXKGTQUYWHPZCC-UHFFFAOYSA-N 1-[3-(3-nitrophenoxy)propyl]pyrrolidine Chemical compound [N+](=O)([O-])C=1C=C(OCCCN2CCCC2)C=CC=1 VXKGTQUYWHPZCC-UHFFFAOYSA-N 0.000 description 2
- OOXOQTSYWSRBTG-UHFFFAOYSA-N 1-[4-[[(2-chloro-6-methylpyrimidin-4-yl)amino]methyl]piperidin-1-yl]ethanone Chemical compound ClC1=NC(=CC(=N1)NCC1CCN(CC1)C(C)=O)C OOXOQTSYWSRBTG-UHFFFAOYSA-N 0.000 description 2
- TZUNAHVFTXPNTG-UHFFFAOYSA-N 1-[4-[[(2-chloropyrimidin-4-yl)amino]methyl]piperidin-1-yl]ethanone Chemical compound CC(=O)N1CCC(CNC2=CC=NC(Cl)=N2)CC1 TZUNAHVFTXPNTG-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 2
- SLABGDIHDFTNKJ-UHFFFAOYSA-N 2-N-[3-[2-(cyclopentylmethylamino)ethyl]-4-methoxyphenyl]-4-N-(piperidin-4-ylmethyl)pyrimidine-2,4-diamine Chemical compound C1(CCCC1)CNCCC=1C=C(C=CC=1OC)NC1=NC=CC(=N1)NCC1CCNCC1 SLABGDIHDFTNKJ-UHFFFAOYSA-N 0.000 description 2
- HWEQZXCORSHBDW-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N,6-dimethylpyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC(=CC(=N1)NC)C)OCCCN1CCCC1 HWEQZXCORSHBDW-UHFFFAOYSA-N 0.000 description 2
- YFYLPURNPHCRFW-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-(oxan-4-ylmethyl)pyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=N1)NCC1CCOCC1)OCCCN1CCCC1 YFYLPURNPHCRFW-UHFFFAOYSA-N 0.000 description 2
- PTJZYFNLICNZJV-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-(piperidin-4-ylmethyl)pyridine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=C1)NCC1CCNCC1)OCCCN1CCCC1 PTJZYFNLICNZJV-UHFFFAOYSA-N 0.000 description 2
- IMNAFDPSECRFRH-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-(piperidin-4-ylmethyl)pyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=N1)NCC1CCNCC1)OCCCN1CCCC1 IMNAFDPSECRFRH-UHFFFAOYSA-N 0.000 description 2
- PSQQHTWGTCDDFJ-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-methylpyridine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=C1)NC)OCCCN1CCCC1 PSQQHTWGTCDDFJ-UHFFFAOYSA-N 0.000 description 2
- NDNGHJAEODHWDP-UHFFFAOYSA-N 2-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)anilino]-N-methylpyrimidine-5-carboxamide Chemical compound COC1=C(C=C(C=C1)NC1=NC=C(C=N1)C(=O)NC)OCCCN1CCCC1 NDNGHJAEODHWDP-UHFFFAOYSA-N 0.000 description 2
- SURKZMFXICWLHU-UHFFFAOYSA-N 2-bromo-4-chloropyridine Chemical compound ClC1=CC=NC(Br)=C1 SURKZMFXICWLHU-UHFFFAOYSA-N 0.000 description 2
- ATSKYIMSPYCKFF-UHFFFAOYSA-N 2-bromo-n-methylpyridin-4-amine Chemical compound CNC1=CC=NC(Br)=C1 ATSKYIMSPYCKFF-UHFFFAOYSA-N 0.000 description 2
- JNPKZDAETFQNEL-UHFFFAOYSA-N 2-butylundecanoic acid Chemical compound CCCCCCCCCC(C(O)=O)CCCC JNPKZDAETFQNEL-UHFFFAOYSA-N 0.000 description 2
- NMVPJSVLYMCYFJ-UHFFFAOYSA-N 2-chloro-N-(oxetan-3-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=NC=CC(=N1)NCC1COC1 NMVPJSVLYMCYFJ-UHFFFAOYSA-N 0.000 description 2
- RVNSQGRBRZBBLJ-UHFFFAOYSA-N 2-chloro-n-methyl-5-nitropyridin-4-amine Chemical compound CNC1=CC(Cl)=NC=C1[N+]([O-])=O RVNSQGRBRZBBLJ-UHFFFAOYSA-N 0.000 description 2
- UNCQVRBWJWWJBF-UHFFFAOYSA-N 2-chloropyrimidine Chemical compound ClC1=NC=CC=N1 UNCQVRBWJWWJBF-UHFFFAOYSA-N 0.000 description 2
- QOECJCJVIMVJGX-UHFFFAOYSA-N 2-cyclohexyl-6-methoxy-N-(1-propan-2-yl-4-piperidinyl)-7-[3-(1-pyrrolidinyl)propoxy]-4-quinazolinamine Chemical compound N1=C(C2CCCCC2)N=C2C=C(OCCCN3CCCC3)C(OC)=CC2=C1NC1CCN(C(C)C)CC1 QOECJCJVIMVJGX-UHFFFAOYSA-N 0.000 description 2
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- ZGBGPEDJXCYQPH-UHFFFAOYSA-N 3-(2-cyanopropan-2-yl)-N-[4-methyl-3-[(3-methyl-4-oxo-6-quinazolinyl)amino]phenyl]benzamide Chemical compound C1=C(NC=2C=C3C(=O)N(C)C=NC3=CC=2)C(C)=CC=C1NC(=O)C1=CC=CC(C(C)(C)C#N)=C1 ZGBGPEDJXCYQPH-UHFFFAOYSA-N 0.000 description 2
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical compound OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 2
- PGXAYGZAIAUNJP-UHFFFAOYSA-N 4-(2,4-dichloro-5-methoxyanilino)-2-[3-(2-pyrrolidin-1-ylethoxy)anilino]pyrimidine-5-carbonitrile Chemical compound C1=C(Cl)C(OC)=CC(NC=2C(=CN=C(NC=3C=C(OCCN4CCCC4)C=CC=3)N=2)C#N)=C1Cl PGXAYGZAIAUNJP-UHFFFAOYSA-N 0.000 description 2
- NWVGGIKZJGELCA-UHFFFAOYSA-N 4-(benzhydrylideneamino)pyridine-2-carbonitrile Chemical compound C1(=CC=CC=C1)C(C1=CC=CC=C1)=NC1=CC(=NC=C1)C#N NWVGGIKZJGELCA-UHFFFAOYSA-N 0.000 description 2
- VHSPGDPTVPKNQV-UHFFFAOYSA-N 4-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-2-(piperidin-4-ylmethylimino)-1,3-dihydropyridin-4-amine Chemical compound COC1=C(C=C(C=C1)C1(CC(=NC=C1)NCC1CCNCC1)N)OCCCN1CCCC1 VHSPGDPTVPKNQV-UHFFFAOYSA-N 0.000 description 2
- NRWRPXJDMPVGGX-UHFFFAOYSA-N 4-methoxy-3-[(2-methyl-2-azaspiro[3.5]nonan-7-yl)oxy]aniline Chemical compound COC1=C(C=C(N)C=C1)OC1CCC2(CN(C2)C)CC1 NRWRPXJDMPVGGX-UHFFFAOYSA-N 0.000 description 2
- CFDDREIEPRBSBX-UHFFFAOYSA-N 4-methoxy-3-[(2-methyl-2-azaspiro[4.5]decan-8-yl)oxy]aniline Chemical compound COC1=C(C=C(N)C=C1)OC1CCC2(CCN(C2)C)CC1 CFDDREIEPRBSBX-UHFFFAOYSA-N 0.000 description 2
- ZHIAEUYCDZNUTQ-UHFFFAOYSA-N 4-tert-butyl-2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-1H-pyrimidine-2,4-diamine Chemical compound C(C)(C)(C)C1(NC(=NC=C1)NC1=CC(=C(C=C1)OC)OCCCN1CCCC1)N ZHIAEUYCDZNUTQ-UHFFFAOYSA-N 0.000 description 2
- HCZKYSPHMGOMOY-UHFFFAOYSA-N 5-bromo-4-N-(4-fluorophenyl)-2-N-[4-methoxy-3-(2-pyrrolidin-1-ylethoxy)phenyl]pyrimidine-2,4-diamine Chemical compound BrC=1C(=NC(=NC=1)NC1=CC(=C(C=C1)OC)OCCN1CCCC1)NC1=CC=C(C=C1)F HCZKYSPHMGOMOY-UHFFFAOYSA-N 0.000 description 2
- OSXFATOLZGZLSK-UHFFFAOYSA-N 6,7-dimethoxy-2-(4-methyl-1,4-diazepan-1-yl)-N-[1-(phenylmethyl)-4-piperidinyl]-4-quinazolinamine Chemical compound C=12C=C(OC)C(OC)=CC2=NC(N2CCN(C)CCC2)=NC=1NC(CC1)CCN1CC1=CC=CC=C1 OSXFATOLZGZLSK-UHFFFAOYSA-N 0.000 description 2
- WQYAKZVLTOWKQB-UHFFFAOYSA-N 6-chloro-1-methylpyrazolo[3,4-b]pyridine Chemical compound C1=C(Cl)N=C2N(C)N=CC2=C1 WQYAKZVLTOWKQB-UHFFFAOYSA-N 0.000 description 2
- GNELYXQWTWDFSS-UHFFFAOYSA-N 6-chloro-4-n-methylpyridine-3,4-diamine Chemical compound CNC1=CC(Cl)=NC=C1N GNELYXQWTWDFSS-UHFFFAOYSA-N 0.000 description 2
- YFWPSSBOELOTGQ-UHFFFAOYSA-N 7-(2-methoxy-5-nitrophenoxy)-2-azaspiro[3.5]nonane Chemical compound COC1=C(OC2CCC3(CNC3)CC2)C=C(C=C1)[N+](=O)[O-] YFWPSSBOELOTGQ-UHFFFAOYSA-N 0.000 description 2
- XYZRWZLSKNSXQP-UHFFFAOYSA-N 7-(2-methoxy-5-nitrophenoxy)-2-methyl-2-azaspiro[3.5]nonane Chemical compound COC1=C(OC2CCC3(CN(C3)C)CC2)C=C(C=C1)[N+](=O)[O-] XYZRWZLSKNSXQP-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- POOASQWJLHAUPZ-UHFFFAOYSA-N 8-(2-methoxy-5-nitrophenoxy)-2-azaspiro[4.5]decane Chemical compound COC1=C(OC2CCC3(CCNC3)CC2)C=C(C=C1)[N+](=O)[O-] POOASQWJLHAUPZ-UHFFFAOYSA-N 0.000 description 2
- RPZYLRLUFVLBGG-UHFFFAOYSA-N 8-(2-methoxy-5-nitrophenoxy)-2-methyl-2-azaspiro[4.5]decane Chemical compound COC1=C(OC2CCC3(CCN(C3)C)CC2)C=C(C=C1)[N+](=O)[O-] RPZYLRLUFVLBGG-UHFFFAOYSA-N 0.000 description 2
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 2
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- JBWHPVZOUSRXQN-UHFFFAOYSA-N CCS(OC1CN(C)CC1)(=O)=O Chemical compound CCS(OC1CN(C)CC1)(=O)=O JBWHPVZOUSRXQN-UHFFFAOYSA-N 0.000 description 2
- QFDQQSFQDXLPRF-UHFFFAOYSA-N COC1=C(C=C(C=C1)C1(NC=CC(=N1)NC1=NNC(=C1)C(C)(C)CC)N)OCCN1CCCC1 Chemical compound COC1=C(C=C(C=C1)C1(NC=CC(=N1)NC1=NNC(=C1)C(C)(C)CC)N)OCCN1CCCC1 QFDQQSFQDXLPRF-UHFFFAOYSA-N 0.000 description 2
- XZPLPDLSTXYMTG-UHFFFAOYSA-N COC1=C(C=C(C=C1)C1(NC=CC(=N1)NCC1COC1)N)OCCCN1CCCC1 Chemical compound COC1=C(C=C(C=C1)C1(NC=CC(=N1)NCC1COC1)N)OCCCN1CCCC1 XZPLPDLSTXYMTG-UHFFFAOYSA-N 0.000 description 2
- AQGNHMOJWBZFQQ-UHFFFAOYSA-N CT 99021 Chemical compound CC1=CNC(C=2C(=NC(NCCNC=3N=CC(=CC=3)C#N)=NC=2)C=2C(=CC(Cl)=CC=2)Cl)=N1 AQGNHMOJWBZFQQ-UHFFFAOYSA-N 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 208000032494 Clear cell adenocarcinoma of the ovary Diseases 0.000 description 2
- 206010073140 Clear cell sarcoma of soft tissue Diseases 0.000 description 2
- 206010011703 Cyanosis Diseases 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 208000022305 Double heterozygous sickling disease Diseases 0.000 description 2
- 206010013710 Drug interaction Diseases 0.000 description 2
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 208000032612 Glial tumor Diseases 0.000 description 2
- 206010018338 Glioma Diseases 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 102100021519 Hemoglobin subunit beta Human genes 0.000 description 2
- 108091005904 Hemoglobin subunit beta Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 201000009906 Meningitis Diseases 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 102000016397 Methyltransferase Human genes 0.000 description 2
- 108060004795 Methyltransferase Proteins 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- IDYONDYEKGSZDQ-UHFFFAOYSA-N N-[[[4-(3-piperidin-1-ylpropyl)pyrimidin-2-yl]amino]methyl]benzamide Chemical compound O=C(NCNC1=NC(CCCN2CCCCC2)=CC=N1)C1=CC=CC=C1 IDYONDYEKGSZDQ-UHFFFAOYSA-N 0.000 description 2
- 150000001204 N-oxides Chemical class 0.000 description 2
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 125000003158 alcohol group Chemical group 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- CDCJKZQIJDQMGN-UHFFFAOYSA-N benzyl 8-(2-methoxy-5-nitrophenoxy)-2-azaspiro[4.5]decane-2-carboxylate Chemical compound COC1=C(OC2CCC3(CCN(C3)C(=O)OCC3=CC=CC=C3)CC2)C=C(C=C1)[N+](=O)[O-] CDCJKZQIJDQMGN-UHFFFAOYSA-N 0.000 description 2
- ZJQLBJHJYCPQCE-UHFFFAOYSA-N benzyl 8-hydroxy-2-azaspiro[4.5]decane-2-carboxylate Chemical compound OC1CCC2(CCN(C2)C(=O)OCC2=CC=CC=C2)CC1 ZJQLBJHJYCPQCE-UHFFFAOYSA-N 0.000 description 2
- NZDXSBBAYBMVDX-UHFFFAOYSA-N benzyl 8-methylsulfonyloxy-2-azaspiro[4.5]decane-2-carboxylate Chemical compound CS(=O)(=O)OC1CCC2(CCN(C2)C(=O)OCC2=CC=CC=C2)CC1 NZDXSBBAYBMVDX-UHFFFAOYSA-N 0.000 description 2
- NJWMLBARGDLXBE-UHFFFAOYSA-N benzyl 8-oxo-2-azaspiro[4.5]decane-2-carboxylate Chemical compound O=C1CCC2(CCN(C2)C(=O)OCC2=CC=CC=C2)CC1 NJWMLBARGDLXBE-UHFFFAOYSA-N 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 201000000053 blastoma Diseases 0.000 description 2
- 210000000601 blood cell Anatomy 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 201000007455 central nervous system cancer Diseases 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 201000000292 clear cell sarcoma Diseases 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 230000008094 contradictory effect Effects 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- NLUNLVTVUDIHFE-UHFFFAOYSA-N cyclooctylcyclooctane Chemical compound C1CCCCCCC1C1CCCCCCC1 NLUNLVTVUDIHFE-UHFFFAOYSA-N 0.000 description 2
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 150000004985 diamines Chemical class 0.000 description 2
- 150000004683 dihydrates Chemical class 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 201000008184 embryoma Diseases 0.000 description 2
- 238000005538 encapsulation Methods 0.000 description 2
- 201000011523 endocrine gland cancer Diseases 0.000 description 2
- 230000001973 epigenetic effect Effects 0.000 description 2
- QEWYKACRFQMRMB-UHFFFAOYSA-N fluoroacetic acid Chemical compound OC(=O)CF QEWYKACRFQMRMB-UHFFFAOYSA-N 0.000 description 2
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- 125000004404 heteroalkyl group Chemical group 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 125000000468 ketone group Chemical group 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- OSWPMRLSEDHDFF-UHFFFAOYSA-N methyl salicylate Chemical compound COC(=O)C1=CC=CC=C1O OSWPMRLSEDHDFF-UHFFFAOYSA-N 0.000 description 2
- NQMRYBIKMRVZLB-UHFFFAOYSA-N methylamine hydrochloride Chemical compound [Cl-].[NH3+]C NQMRYBIKMRVZLB-UHFFFAOYSA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- TXXHDPDFNKHHGW-UHFFFAOYSA-N muconic acid Chemical compound OC(=O)C=CC=CC(O)=O TXXHDPDFNKHHGW-UHFFFAOYSA-N 0.000 description 2
- HCUKSDBNBZMFKP-UHFFFAOYSA-N n-[(3,5-difluorophenyl)methyl]-2-(3-pyrrolidin-1-ylpropyl)pyrimidin-4-amine Chemical compound FC1=CC(F)=CC(CNC=2N=C(CCCN3CCCC3)N=CC=2)=C1 HCUKSDBNBZMFKP-UHFFFAOYSA-N 0.000 description 2
- VQQFFMMTRRTHKH-UHFFFAOYSA-N n-[2-[[2-[3-(dimethylamino)propyl]pyrimidin-4-yl]amino]ethyl]benzamide Chemical compound CN(C)CCCC1=NC=CC(NCCNC(=O)C=2C=CC=CC=2)=N1 VQQFFMMTRRTHKH-UHFFFAOYSA-N 0.000 description 2
- IHCHOVVAJBADAH-UHFFFAOYSA-N n-[2-hydroxy-4-(1h-pyrazol-4-yl)phenyl]-6-methoxy-3,4-dihydro-2h-chromene-3-carboxamide Chemical compound C1C2=CC(OC)=CC=C2OCC1C(=O)NC(C(=C1)O)=CC=C1C=1C=NNC=1 IHCHOVVAJBADAH-UHFFFAOYSA-N 0.000 description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 2
- YAABRYJGVFZZBL-UHFFFAOYSA-N n-naphthalen-2-yl-2-(piperidin-1-ylmethoxy)pyrimidin-4-amine Chemical compound N=1C=CC(NC=2C=C3C=CC=CC3=CC=2)=NC=1OCN1CCCCC1 YAABRYJGVFZZBL-UHFFFAOYSA-N 0.000 description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- IOMMMLWIABWRKL-WUTDNEBXSA-N nazartinib Chemical compound C1N(C(=O)/C=C/CN(C)C)CCCC[C@H]1N1C2=C(Cl)C=CC=C2N=C1NC(=O)C1=CC=NC(C)=C1 IOMMMLWIABWRKL-WUTDNEBXSA-N 0.000 description 2
- 208000023833 nerve sheath neoplasm Diseases 0.000 description 2
- 150000002825 nitriles Chemical class 0.000 description 2
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 201000008968 osteosarcoma Diseases 0.000 description 2
- 208000013371 ovarian adenocarcinoma Diseases 0.000 description 2
- 208000012988 ovarian serous adenocarcinoma Diseases 0.000 description 2
- 201000006588 ovary adenocarcinoma Diseases 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 125000003566 oxetanyl group Chemical group 0.000 description 2
- AHJRHEGDXFFMBM-UHFFFAOYSA-N palbociclib Chemical compound N1=C2N(C3CCCC3)C(=O)C(C(=O)C)=C(C)C2=CN=C1NC(N=C1)=CC=C1N1CCNCC1 AHJRHEGDXFFMBM-UHFFFAOYSA-N 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 2
- 230000009996 pancreatic endocrine effect Effects 0.000 description 2
- 208000003154 papilloma Diseases 0.000 description 2
- 239000008177 pharmaceutical agent Substances 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 2
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 2
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 208000016691 refractory malignant neoplasm Diseases 0.000 description 2
- 230000021448 regulation of histone methylation Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 201000010106 skin squamous cell carcinoma Diseases 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- KLKBCNDBOVRQIJ-UHFFFAOYSA-N tert-butyl 4-(aminomethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC(CN)CC1 KLKBCNDBOVRQIJ-UHFFFAOYSA-N 0.000 description 2
- DZCBACUVDGQISW-UHFFFAOYSA-N tert-butyl 4-[[(2-bromopyridin-4-yl)amino]methyl]piperidine-1-carboxylate Chemical compound BrC1=NC=CC(=C1)NCC1CCN(CC1)C(=O)OC(C)(C)C DZCBACUVDGQISW-UHFFFAOYSA-N 0.000 description 2
- FKTIOWMYNFEKGN-UHFFFAOYSA-N tert-butyl 7-(2-methoxy-5-nitrophenoxy)-2-azaspiro[3.5]nonane-2-carboxylate Chemical compound COC1=C(OC2CCC3(CN(C3)C(=O)OC(C)(C)C)CC2)C=C(C=C1)[N+](=O)[O-] FKTIOWMYNFEKGN-UHFFFAOYSA-N 0.000 description 2
- UPELAIVWMIAOKH-UHFFFAOYSA-N tert-butyl 7-methylsulfonyloxy-2-azaspiro[3.5]nonane-2-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CC21CCC(OS(C)(=O)=O)CC2 UPELAIVWMIAOKH-UHFFFAOYSA-N 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- OWIOJZLDFONFSU-UHFFFAOYSA-N tetradecan-4-one Chemical compound CCCCCCCCCCC(=O)CCC OWIOJZLDFONFSU-UHFFFAOYSA-N 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 125000002053 thietanyl group Chemical group 0.000 description 2
- 125000004001 thioalkyl group Chemical group 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 125000004306 triazinyl group Chemical group 0.000 description 2
- 125000005310 triazolidinyl group Chemical group N1(NNCC1)* 0.000 description 2
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 2
- GBXQPDCOMJJCMJ-UHFFFAOYSA-M trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;bromide Chemical compound [Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C GBXQPDCOMJJCMJ-UHFFFAOYSA-M 0.000 description 2
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 2
- NPWMWLAPRVMNBN-UHFFFAOYSA-N (1-methylpyrrolidin-3-yl)methanol Chemical compound CN1CCC(CO)C1 NPWMWLAPRVMNBN-UHFFFAOYSA-N 0.000 description 1
- SLRWNINCKZVSNU-UHFFFAOYSA-N (1-methylpyrrolidin-3-yl)methyl methanesulfonate Chemical compound CN1CCC(COS(C)(=O)=O)C1 SLRWNINCKZVSNU-UHFFFAOYSA-N 0.000 description 1
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 1
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 1
- UVNPEUJXKZFWSJ-LMTQTHQJSA-N (R)-N-[(4S)-8-[6-amino-5-[(3,3-difluoro-2-oxo-1H-pyrrolo[2,3-b]pyridin-4-yl)sulfanyl]pyrazin-2-yl]-2-oxa-8-azaspiro[4.5]decan-4-yl]-2-methylpropane-2-sulfinamide Chemical compound CC(C)(C)[S@@](=O)N[C@@H]1COCC11CCN(CC1)c1cnc(Sc2ccnc3NC(=O)C(F)(F)c23)c(N)n1 UVNPEUJXKZFWSJ-LMTQTHQJSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N (e)-2-hydroxybut-2-enedioic acid Chemical compound OC(=O)\C=C(\O)C(O)=O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- 125000004502 1,2,3-oxadiazolyl group Chemical group 0.000 description 1
- 125000004511 1,2,3-thiadiazolyl group Chemical group 0.000 description 1
- 125000001399 1,2,3-triazolyl group Chemical group N1N=NC(=C1)* 0.000 description 1
- 125000004504 1,2,4-oxadiazolyl group Chemical group 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- 125000001376 1,2,4-triazolyl group Chemical group N1N=C(N=C1)* 0.000 description 1
- 125000004506 1,2,5-oxadiazolyl group Chemical group 0.000 description 1
- 125000004517 1,2,5-thiadiazolyl group Chemical group 0.000 description 1
- PIINXYKJQGMIOZ-UHFFFAOYSA-N 1,2-dipyridin-2-ylethane-1,2-dione Chemical group C=1C=CC=NC=1C(=O)C(=O)C1=CC=CC=N1 PIINXYKJQGMIOZ-UHFFFAOYSA-N 0.000 description 1
- 125000001781 1,3,4-oxadiazolyl group Chemical group 0.000 description 1
- 125000004520 1,3,4-thiadiazolyl group Chemical group 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- VKRKCBWIVLSRBJ-UHFFFAOYSA-N 1,4-dioxaspiro[4.5]decan-8-one Chemical compound C1CC(=O)CCC21OCCO2 VKRKCBWIVLSRBJ-UHFFFAOYSA-N 0.000 description 1
- SPRTXTPFQKHSBG-UHFFFAOYSA-N 1-(3-chloropropyl)pyrrolidine Chemical compound ClCCCN1CCCC1 SPRTXTPFQKHSBG-UHFFFAOYSA-N 0.000 description 1
- TUSDEZXZIZRFGC-UHFFFAOYSA-N 1-O-galloyl-3,6-(R)-HHDP-beta-D-glucose Natural products OC1C(O2)COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC1C(O)C2OC(=O)C1=CC(O)=C(O)C(O)=C1 TUSDEZXZIZRFGC-UHFFFAOYSA-N 0.000 description 1
- DNUTZBZXLPWRJG-UHFFFAOYSA-N 1-Piperidine carboxylic acid Chemical compound OC(=O)N1CCCCC1 DNUTZBZXLPWRJG-UHFFFAOYSA-N 0.000 description 1
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 1
- NHULDSLAXOHLGR-UHFFFAOYSA-N 1-[4-(aminomethyl)piperidin-1-yl]ethanone Chemical compound CC(=O)N1CCC(CN)CC1 NHULDSLAXOHLGR-UHFFFAOYSA-N 0.000 description 1
- VLEJUJAYKJRPHY-UHFFFAOYSA-N 1-[4-(aminomethyl)piperidin-1-yl]ethanone;hydrochloride Chemical compound Cl.CC(=O)N1CCC(CN)CC1 VLEJUJAYKJRPHY-UHFFFAOYSA-N 0.000 description 1
- LDMOEFOXLIZJOW-UHFFFAOYSA-N 1-dodecanesulfonic acid Chemical compound CCCCCCCCCCCCS(O)(=O)=O LDMOEFOXLIZJOW-UHFFFAOYSA-N 0.000 description 1
- YYDNBUBMBZRNQQ-UHFFFAOYSA-N 1-methyl-4-methylsulfonylbenzene Chemical compound CC1=CC=C(S(C)(=O)=O)C=C1 YYDNBUBMBZRNQQ-UHFFFAOYSA-N 0.000 description 1
- AMMPLVWPWSYRDR-UHFFFAOYSA-N 1-methylbicyclo[2.2.2]oct-2-ene-4-carboxylic acid Chemical compound C1CC2(C(O)=O)CCC1(C)C=C2 AMMPLVWPWSYRDR-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- 125000005955 1H-indazolyl group Chemical group 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- RTMMSCJWQYWMNK-UHFFFAOYSA-N 2,2,2-trifluoroethyl trifluoromethanesulfonate Chemical compound FC(F)(F)COS(=O)(=O)C(F)(F)F RTMMSCJWQYWMNK-UHFFFAOYSA-N 0.000 description 1
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 description 1
- RZVJQUMDJUUBBF-UHFFFAOYSA-N 2,4-dichloro-5-nitropyridine Chemical compound [O-][N+](=O)C1=CN=C(Cl)C=C1Cl RZVJQUMDJUUBBF-UHFFFAOYSA-N 0.000 description 1
- ZSNZDRHTTWBNGI-UHFFFAOYSA-N 2,4-dichloro-6-methoxypyrimidine Chemical compound COC1=CC(Cl)=NC(Cl)=N1 ZSNZDRHTTWBNGI-UHFFFAOYSA-N 0.000 description 1
- BTLKROSJMNFSQZ-UHFFFAOYSA-N 2,4-dichloro-6-methylpyrimidine Chemical compound CC1=CC(Cl)=NC(Cl)=N1 BTLKROSJMNFSQZ-UHFFFAOYSA-N 0.000 description 1
- TUQSVSYUEBNNKQ-UHFFFAOYSA-N 2,4-dichloroquinazoline Chemical compound C1=CC=CC2=NC(Cl)=NC(Cl)=C21 TUQSVSYUEBNNKQ-UHFFFAOYSA-N 0.000 description 1
- FILKGCRCWDMBKA-UHFFFAOYSA-N 2,6-dichloropyridine Chemical compound ClC1=CC=CC(Cl)=N1 FILKGCRCWDMBKA-UHFFFAOYSA-N 0.000 description 1
- LXWBDOWOFHVXHD-UHFFFAOYSA-N 2-(aminomethyl)-N-phenylpyrimidin-4-amine Chemical compound NCC1=NC=CC(=N1)NC1=CC=CC=C1 LXWBDOWOFHVXHD-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- JGXAPNWQYSYIQO-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-(oxan-4-yl)pyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=N1)NC1CCOCC1)OCCCN1CCCC1 JGXAPNWQYSYIQO-UHFFFAOYSA-N 0.000 description 1
- ANHHZQNDCRJZPM-UHFFFAOYSA-N 2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-(oxetan-3-ylmethyl)pyrimidine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=NC=CC(=N1)NCC1COC1)OCCCN1CCCC1 ANHHZQNDCRJZPM-UHFFFAOYSA-N 0.000 description 1
- JSKLTRJLLKISSH-UHFFFAOYSA-N 2-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-N-methyl-1H-pyridine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)C1(NC=CC(=C1)NC)N)OCCCN1CCCC1 JSKLTRJLLKISSH-UHFFFAOYSA-N 0.000 description 1
- BBIMMYWYPIHUCS-UHFFFAOYSA-N 2-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-4-methyl-6-methylimino-1,3-dihydropyrimidin-2-amine Chemical compound COC1=C(C=C(C=C1)C1(NC(=CC(=N1)NC)C)N)OCCCN1CCCC1 BBIMMYWYPIHUCS-UHFFFAOYSA-N 0.000 description 1
- XQCZBXHVTFVIFE-UHFFFAOYSA-N 2-amino-4-hydroxypyrimidine Chemical compound NC1=NC=CC(O)=N1 XQCZBXHVTFVIFE-UHFFFAOYSA-N 0.000 description 1
- AIEATTRZKVGMBO-UHFFFAOYSA-N 2-bromo-4-fluoropyridine Chemical compound FC1=CC=NC(Br)=C1 AIEATTRZKVGMBO-UHFFFAOYSA-N 0.000 description 1
- VDSGXVUMVYUUBY-UHFFFAOYSA-N 2-bromo-5-methoxy-4-(3-pyrrolidin-1-ylpropoxy)pyridine Chemical compound BrC1=NC=C(C(=C1)OCCCN1CCCC1)OC VDSGXVUMVYUUBY-UHFFFAOYSA-N 0.000 description 1
- GNTGEMWEXKBWBX-UHFFFAOYSA-N 2-bromopyridin-4-amine Chemical compound NC1=CC=NC(Br)=C1 GNTGEMWEXKBWBX-UHFFFAOYSA-N 0.000 description 1
- FETSYNXZMUAONO-UHFFFAOYSA-N 2-chloro-1h-pyrimidin-6-one Chemical compound ClC1=NC=CC(=O)N1 FETSYNXZMUAONO-UHFFFAOYSA-N 0.000 description 1
- VAATWVRXPRDPPM-UHFFFAOYSA-N 2-chloro-4-methylsulfanylpyrimidine Chemical compound CSC1=CC=NC(Cl)=N1 VAATWVRXPRDPPM-UHFFFAOYSA-N 0.000 description 1
- BUMGQSCPTLELLS-UHFFFAOYSA-N 2-chloro-5-nitrophenol Chemical compound OC1=CC([N+]([O-])=O)=CC=C1Cl BUMGQSCPTLELLS-UHFFFAOYSA-N 0.000 description 1
- WDBAEFOJSKVJIG-UHFFFAOYSA-N 2-chloro-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]pyridin-4-amine Chemical compound ClC1=NC=CC(=C1)NC1=CC(=C(C=C1)OC)OCCCN1CCCC1 WDBAEFOJSKVJIG-UHFFFAOYSA-N 0.000 description 1
- MIRJBFZIBXQRLC-UHFFFAOYSA-N 2-chloro-n,6-dimethylpyrimidin-4-amine Chemical compound CNC1=CC(C)=NC(Cl)=N1 MIRJBFZIBXQRLC-UHFFFAOYSA-N 0.000 description 1
- WOQPXJFIZBEYCQ-UHFFFAOYSA-N 2-chloro-n-methylquinazolin-4-amine Chemical compound C1=CC=C2C(NC)=NC(Cl)=NC2=C1 WOQPXJFIZBEYCQ-UHFFFAOYSA-N 0.000 description 1
- LPBDZVNGCNTELM-UHFFFAOYSA-N 2-chloropyrimidin-4-amine Chemical compound NC1=CC=NC(Cl)=N1 LPBDZVNGCNTELM-UHFFFAOYSA-N 0.000 description 1
- DUCXUPKLVVSJKA-UHFFFAOYSA-N 2-chloropyrimidine-5-carboxylic acid Chemical compound OC(=O)C1=CN=C(Cl)N=C1 DUCXUPKLVVSJKA-UHFFFAOYSA-N 0.000 description 1
- UPHOPMSGKZNELG-UHFFFAOYSA-N 2-hydroxynaphthalene-1-carboxylic acid Chemical compound C1=CC=C2C(C(=O)O)=C(O)C=CC2=C1 UPHOPMSGKZNELG-UHFFFAOYSA-N 0.000 description 1
- JJKWHOSQTYYFAE-UHFFFAOYSA-N 2-methoxyacetyl chloride Chemical compound COCC(Cl)=O JJKWHOSQTYYFAE-UHFFFAOYSA-N 0.000 description 1
- CVASVICAGQHSAH-UHFFFAOYSA-N 2-methylsulfanyl-n-phenylpyrimidin-4-amine Chemical class CSC1=NC=CC(NC=2C=CC=CC=2)=N1 CVASVICAGQHSAH-UHFFFAOYSA-N 0.000 description 1
- PJMJABNEAAUEDW-UHFFFAOYSA-N 2-n-phenylpyridine-2,4-diamine Chemical compound NC1=CC=NC(NC=2C=CC=CC=2)=C1 PJMJABNEAAUEDW-UHFFFAOYSA-N 0.000 description 1
- IQUPABOKLQSFBK-UHFFFAOYSA-N 2-nitrophenol Chemical compound OC1=CC=CC=C1[N+]([O-])=O IQUPABOKLQSFBK-UHFFFAOYSA-N 0.000 description 1
- WLJVXDMOQOGPHL-PPJXEINESA-N 2-phenylacetic acid Chemical compound O[14C](=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-PPJXEINESA-N 0.000 description 1
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 1
- PCJFEVUKVKQSSL-UHFFFAOYSA-N 2h-1,2,4-oxadiazol-5-one Chemical compound O=C1N=CNO1 PCJFEVUKVKQSSL-UHFFFAOYSA-N 0.000 description 1
- CSOYDALHEQEMAK-UHFFFAOYSA-N 2h-pyrimidine-1-carboxylic acid Chemical compound OC(=O)N1CN=CC=C1 CSOYDALHEQEMAK-UHFFFAOYSA-N 0.000 description 1
- SFDGJDBLYNJMFI-UHFFFAOYSA-N 3,1-benzoxazin-4-one Chemical compound C1=CC=C2C(=O)OC=NC2=C1 SFDGJDBLYNJMFI-UHFFFAOYSA-N 0.000 description 1
- ZJYLQIFRISXJFL-UHFFFAOYSA-N 3,4-dihydro-2h-pyran-6-ol Chemical compound OC1=CCCCO1 ZJYLQIFRISXJFL-UHFFFAOYSA-N 0.000 description 1
- SULHOSMHDPKVSY-UHFFFAOYSA-N 3-(3-pyrrolidin-1-ylpropoxy)cyclohexan-1-amine Chemical compound C1C(N)CCCC1OCCCN1CCCC1 SULHOSMHDPKVSY-UHFFFAOYSA-N 0.000 description 1
- XLZYKTYMLBOINK-UHFFFAOYSA-N 3-(4-hydroxybenzoyl)benzoic acid Chemical compound OC(=O)C1=CC=CC(C(=O)C=2C=CC(O)=CC=2)=C1 XLZYKTYMLBOINK-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- UOQHWNPVNXSDDO-UHFFFAOYSA-N 3-bromoimidazo[1,2-a]pyridine-6-carbonitrile Chemical compound C1=CC(C#N)=CN2C(Br)=CN=C21 UOQHWNPVNXSDDO-UHFFFAOYSA-N 0.000 description 1
- ZRPLANDPDWYOMZ-UHFFFAOYSA-N 3-cyclopentylpropionic acid Chemical compound OC(=O)CCC1CCCC1 ZRPLANDPDWYOMZ-UHFFFAOYSA-N 0.000 description 1
- MCSXGCZMEPXKIW-UHFFFAOYSA-N 3-hydroxy-4-[(4-methyl-2-nitrophenyl)diazenyl]-N-(3-nitrophenyl)naphthalene-2-carboxamide Chemical compound Cc1ccc(N=Nc2c(O)c(cc3ccccc23)C(=O)Nc2cccc(c2)[N+]([O-])=O)c(c1)[N+]([O-])=O MCSXGCZMEPXKIW-UHFFFAOYSA-N 0.000 description 1
- BFJMHTOBRRZELQ-UHFFFAOYSA-N 3-iodo-2h-pyrazolo[3,4-c]pyridine Chemical compound N1=CC=C2C(I)=NNC2=C1 BFJMHTOBRRZELQ-UHFFFAOYSA-N 0.000 description 1
- RTZZCYNQPHTPPL-UHFFFAOYSA-N 3-nitrophenol Chemical compound OC1=CC=CC([N+]([O-])=O)=C1 RTZZCYNQPHTPPL-UHFFFAOYSA-N 0.000 description 1
- PEPBFCOIJRULGJ-UHFFFAOYSA-N 3h-1,2,3-benzodioxazole Chemical compound C1=CC=C2NOOC2=C1 PEPBFCOIJRULGJ-UHFFFAOYSA-N 0.000 description 1
- WDBQJSCPCGTAFG-QHCPKHFHSA-N 4,4-difluoro-N-[(1S)-3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-pyridin-3-ylpropyl]cyclohexane-1-carboxamide Chemical compound FC1(CCC(CC1)C(=O)N[C@@H](CCN1CCC(CC1)N1C(=NN=C1C)C(C)C)C=1C=NC=CC=1)F WDBQJSCPCGTAFG-QHCPKHFHSA-N 0.000 description 1
- BWGRDBSNKQABCB-UHFFFAOYSA-N 4,4-difluoro-N-[3-[3-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)-8-azabicyclo[3.2.1]octan-8-yl]-1-thiophen-2-ylpropyl]cyclohexane-1-carboxamide Chemical compound CC(C)C1=NN=C(C)N1C1CC2CCC(C1)N2CCC(NC(=O)C1CCC(F)(F)CC1)C1=CC=CS1 BWGRDBSNKQABCB-UHFFFAOYSA-N 0.000 description 1
- PQECODMSWJOUAT-UHFFFAOYSA-N 4-(3-chloropropyl)morpholine;hydrochloride Chemical compound [Cl-].ClCCC[NH+]1CCOCC1 PQECODMSWJOUAT-UHFFFAOYSA-N 0.000 description 1
- AABYOISCBFRBEK-UHFFFAOYSA-N 4-(N-phenylanilino)pyridine-2-carbonitrile Chemical compound C1(=CC=CC=C1)N(C1=CC(=NC=C1)C#N)C1=CC=CC=C1 AABYOISCBFRBEK-UHFFFAOYSA-N 0.000 description 1
- OVGFRPZCPICHCF-UHFFFAOYSA-N 4-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-2-N-(piperidin-4-ylmethyl)pyridine-2,4-diamine Chemical compound COC1=C(C=C(C=C1)NC1=CC(=NC=C1)NCC1CCNCC1)OCCCN1CCCC1 OVGFRPZCPICHCF-UHFFFAOYSA-N 0.000 description 1
- IYOKXAZMQIXJSI-UHFFFAOYSA-N 4-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-2-N-(piperidin-4-ylmethyl)pyrimidine-2,4-diamine hydrochloride Chemical compound Cl.COc1ccc(Nc2ccnc(NCC3CCNCC3)n2)cc1OCCCN1CCCC1 IYOKXAZMQIXJSI-UHFFFAOYSA-N 0.000 description 1
- UFWUJYHXTVDJPE-UHFFFAOYSA-N 4-N-tert-butyl-2-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]pyrimidine-2,4-diamine hydrochloride Chemical compound Cl.COc1ccc(Nc2nccc(NC(C)(C)C)n2)cc1OCCCN1CCCC1 UFWUJYHXTVDJPE-UHFFFAOYSA-N 0.000 description 1
- GMKRESMCPMIWGU-UHFFFAOYSA-N 4-aminopyridine-2-carbonitrile Chemical compound NC1=CC=NC(C#N)=C1 GMKRESMCPMIWGU-UHFFFAOYSA-N 0.000 description 1
- LMWRYEXTMZHOFY-UHFFFAOYSA-N 4-anilinopyrimidine-2-carbonitrile Chemical compound C1(=CC=CC=C1)NC1=NC(=NC=C1)C#N LMWRYEXTMZHOFY-UHFFFAOYSA-N 0.000 description 1
- PTPTZLXZHPPVKG-UHFFFAOYSA-N 4-bromo-2-fluoropyridine Chemical compound FC1=CC(Br)=CC=N1 PTPTZLXZHPPVKG-UHFFFAOYSA-N 0.000 description 1
- GNJKJKBURMCLOR-UHFFFAOYSA-N 4-chloro-2-fluoropyridine Chemical compound FC1=CC(Cl)=CC=N1 GNJKJKBURMCLOR-UHFFFAOYSA-N 0.000 description 1
- GYQSVFZGSCASSG-UHFFFAOYSA-N 4-chloro-6-methoxy-N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]pyrimidin-2-amine Chemical compound ClC1=NC(=NC(=C1)OC)NC1=CC(=C(C=C1)OC)OCCCN1CCCC1 GYQSVFZGSCASSG-UHFFFAOYSA-N 0.000 description 1
- RJWBTWIBUIGANW-UHFFFAOYSA-N 4-chlorobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(Cl)C=C1 RJWBTWIBUIGANW-UHFFFAOYSA-N 0.000 description 1
- RQMWVVBHJMUJNZ-UHFFFAOYSA-N 4-chloropyridin-2-amine Chemical compound NC1=CC(Cl)=CC=N1 RQMWVVBHJMUJNZ-UHFFFAOYSA-N 0.000 description 1
- DYEZRXLVZMZHQT-UHFFFAOYSA-N 4-chloropyridine-2-carbonitrile Chemical compound ClC1=CC=NC(C#N)=C1 DYEZRXLVZMZHQT-UHFFFAOYSA-N 0.000 description 1
- DBGFGNCFYUNXLD-UHFFFAOYSA-N 4-chloropyrimidin-2-amine Chemical compound NC1=NC=CC(Cl)=N1 DBGFGNCFYUNXLD-UHFFFAOYSA-N 0.000 description 1
- AKONCVZBQYODEU-UHFFFAOYSA-N 4-chloropyrimidine-2-carbonitrile Chemical compound ClC1=CC=NC(C#N)=N1 AKONCVZBQYODEU-UHFFFAOYSA-N 0.000 description 1
- GOFCVSLKIXKUBW-LNKXUWQBSA-N 4-methyl-2-[(1R,3S)-3-(3-pyrrolidin-1-ylpropoxy)cyclohexyl]imino-1,3-dihydropyrimidin-4-amine Chemical compound CC1(NC(=NC=C1)N[C@H]1C[C@H](CCC1)OCCCN1CCCC1)N GOFCVSLKIXKUBW-LNKXUWQBSA-N 0.000 description 1
- VFHOBJOOIWBXAY-UHFFFAOYSA-N 4-methyl-3-(3-pyrrolidin-1-ylpropoxy)aniline Chemical compound CC1=CC=C(N)C=C1OCCCN1CCCC1 VFHOBJOOIWBXAY-UHFFFAOYSA-N 0.000 description 1
- PJNARASVPLLKLH-UHFFFAOYSA-N 4-n-phenylpyridine-2,4-diamine Chemical compound C1=NC(N)=CC(NC=2C=CC=CC=2)=C1 PJNARASVPLLKLH-UHFFFAOYSA-N 0.000 description 1
- RFRREALVLUCVCA-UHFFFAOYSA-N 4-n-phenylpyrimidine-2,4-diamine Chemical compound NC1=NC=CC(NC=2C=CC=CC=2)=N1 RFRREALVLUCVCA-UHFFFAOYSA-N 0.000 description 1
- DMEGQEWPMXDRMO-UHFFFAOYSA-N 4-phenylpyrimidin-2-amine Chemical compound NC1=NC=CC(C=2C=CC=CC=2)=N1 DMEGQEWPMXDRMO-UHFFFAOYSA-N 0.000 description 1
- 125000005986 4-piperidonyl group Chemical group 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- NWYLBGYCSAJFCB-UHFFFAOYSA-N 6-chloro-1h-pyrazolo[3,4-b]pyridine Chemical compound ClC1=CC=C2C=NNC2=N1 NWYLBGYCSAJFCB-UHFFFAOYSA-N 0.000 description 1
- OBYJTLDIQBWBHM-UHFFFAOYSA-N 6-chloropyridin-2-amine Chemical compound NC1=CC=CC(Cl)=N1 OBYJTLDIQBWBHM-UHFFFAOYSA-N 0.000 description 1
- FCNRZONWSGOYKL-UHFFFAOYSA-N 6-n-phenylpyridine-2,6-diamine Chemical compound NC1=CC=CC(NC=2C=CC=CC=2)=N1 FCNRZONWSGOYKL-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 208000036832 Adenocarcinoma of ovary Diseases 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- 229910000013 Ammonium bicarbonate Inorganic materials 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 201000004569 Blindness Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- MCTVSZFBDOUQJI-UHFFFAOYSA-N CC(C)(C)N1CCC(CNC2=NC(NC(C=C3)=CC(CCN)=C3OC)=NC=C2)CC1 Chemical compound CC(C)(C)N1CCC(CNC2=NC(NC(C=C3)=CC(CCN)=C3OC)=NC=C2)CC1 MCTVSZFBDOUQJI-UHFFFAOYSA-N 0.000 description 1
- SGFXMNADYJIMII-UHFFFAOYSA-N COC1=C(C=C(C=C1)C1(NC=CC(=N1)NC1CCOCC1)N)OCCCN1CCCC1 Chemical compound COC1=C(C=C(C=C1)C1(NC=CC(=N1)NC1CCOCC1)N)OCCCN1CCCC1 SGFXMNADYJIMII-UHFFFAOYSA-N 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-N Caprylic acid Natural products CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 201000009047 Chordoma Diseases 0.000 description 1
- 208000016623 Choroid neoplasm Diseases 0.000 description 1
- 208000004378 Choroid plexus papilloma Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 208000022497 Cocaine-Related disease Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 229940126657 Compound 17 Drugs 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 208000037845 Cutaneous squamous cell carcinoma Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 239000001263 FEMA 3042 Substances 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 208000002375 Hand-Foot Syndrome Diseases 0.000 description 1
- 208000009336 Hemoglobin SC Disease Diseases 0.000 description 1
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 1
- LELOWRISYMNNSU-UHFFFAOYSA-N Hydrocyanic acid Natural products N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 1
- 229930194542 Keto Natural products 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 1
- 208000005230 Leg Ulcer Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 102000000717 Lysine methyltransferases Human genes 0.000 description 1
- 108050008120 Lysine methyltransferases Proteins 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000036626 Mental retardation Diseases 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- TXXHDPDFNKHHGW-CCAGOZQPSA-N Muconic acid Natural products OC(=O)\C=C/C=C\C(O)=O TXXHDPDFNKHHGW-CCAGOZQPSA-N 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- NUGPIZCTELGDOS-QHCPKHFHSA-N N-[(1S)-3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-pyridin-3-ylpropyl]cyclopentanecarboxamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CC[C@@H](C=1C=NC=CC=1)NC(=O)C1CCCC1)C NUGPIZCTELGDOS-QHCPKHFHSA-N 0.000 description 1
- LFZAGIJXANFPFN-UHFFFAOYSA-N N-[3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-thiophen-2-ylpropyl]acetamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CCC(C=1SC=CC=1)NC(C)=O)C LFZAGIJXANFPFN-UHFFFAOYSA-N 0.000 description 1
- IQFHASBWLCSOPD-UHFFFAOYSA-N N-[4-methoxy-3-(3-pyrrolidin-1-ylpropoxy)phenyl]-1-methylpyrazolo[3,4-b]pyridin-6-amine Chemical compound COC1=C(C=C(C=C1)NC1=CC=C2C(=N1)N(N=C2)C)OCCCN1CCCC1 IQFHASBWLCSOPD-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 101710167853 N-methyltransferase Proteins 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- BNUHAJGCKIQFGE-UHFFFAOYSA-N Nitroanisol Chemical compound COC1=CC=C([N+]([O-])=O)C=C1 BNUHAJGCKIQFGE-UHFFFAOYSA-N 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010061328 Ovarian epithelial cancer Diseases 0.000 description 1
- 208000037064 Papilloma of choroid plexus Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229920002230 Pectic acid Polymers 0.000 description 1
- LRBQNJMCXXYXIU-PPKXGCFTSA-N Penta-digallate-beta-D-glucose Natural products OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-PPKXGCFTSA-N 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 229920002685 Polyoxyl 35CastorOil Polymers 0.000 description 1
- NPYPAHLBTDXSSS-UHFFFAOYSA-N Potassium ion Chemical compound [K+] NPYPAHLBTDXSSS-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 208000030118 Red blood cell disease Diseases 0.000 description 1
- 206010070308 Refractory cancer Diseases 0.000 description 1
- 208000008938 Rhabdoid tumor Diseases 0.000 description 1
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 1
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 1
- 206010040943 Skin Ulcer Diseases 0.000 description 1
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 102000004357 Transferases Human genes 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical class OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102000001742 Tumor Suppressor Proteins Human genes 0.000 description 1
- 108010040002 Tumor Suppressor Proteins Proteins 0.000 description 1
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- BBAWTPDTGRXPDG-UHFFFAOYSA-N [1,3]thiazolo[4,5-b]pyridine Chemical compound C1=CC=C2SC=NC2=N1 BBAWTPDTGRXPDG-UHFFFAOYSA-N 0.000 description 1
- WREOTYWODABZMH-DTZQCDIJSA-N [[(2r,3s,4r,5r)-3,4-dihydroxy-5-[2-oxo-4-(2-phenylethoxyamino)pyrimidin-1-yl]oxolan-2-yl]methoxy-hydroxyphosphoryl] phosphono hydrogen phosphate Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O[C@H]1N(C=C\1)C(=O)NC/1=N\OCCC1=CC=CC=C1 WREOTYWODABZMH-DTZQCDIJSA-N 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- AUALQMFGWLZREY-UHFFFAOYSA-N acetonitrile;methanol Chemical compound OC.CC#N AUALQMFGWLZREY-UHFFFAOYSA-N 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 150000008043 acidic salts Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 206010051895 acute chest syndrome Diseases 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 125000005089 alkenylaminocarbonyl group Chemical group 0.000 description 1
- 125000005090 alkenylcarbonyl group Chemical group 0.000 description 1
- 125000000278 alkyl amino alkyl group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 125000005001 aminoaryl group Chemical group 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 239000001099 ammonium carbonate Substances 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000003435 aroyl group Chemical group 0.000 description 1
- 125000005125 aryl alkyl amino carbonyl group Chemical group 0.000 description 1
- 125000005099 aryl alkyl carbonyl group Chemical group 0.000 description 1
- 125000005128 aryl amino alkyl group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 150000001540 azides Chemical group 0.000 description 1
- 125000004931 azocinyl group Chemical group N1=C(C=CC=CC=C1)* 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004935 benzoxazolinyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000005512 benztetrazolyl group Chemical group 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- GONOPSZTUGRENK-UHFFFAOYSA-N benzyl(trichloro)silane Chemical compound Cl[Si](Cl)(Cl)CC1=CC=CC=C1 GONOPSZTUGRENK-UHFFFAOYSA-N 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 229940006460 bromide ion Drugs 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 125000005997 bromomethyl group Chemical group 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001728 carbonyl compounds Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 238000003570 cell viability assay Methods 0.000 description 1
- 150000001793 charged compounds Chemical class 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 238000004296 chiral HPLC Methods 0.000 description 1
- 239000012320 chlorinating reagent Substances 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 201000002588 choroid cancer Diseases 0.000 description 1
- 201000007369 choroid plexus cancer Diseases 0.000 description 1
- 125000003016 chromanyl group Chemical group O1C(CCC2=CC=CC=C12)* 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 201000006145 cocaine dependence Diseases 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 239000013065 commercial product Substances 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 229940126543 compound 14 Drugs 0.000 description 1
- 229940125758 compound 15 Drugs 0.000 description 1
- 229940126142 compound 16 Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000011443 conventional therapy Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000010779 crude oil Substances 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- XSYZCZPCBXYQTE-UHFFFAOYSA-N cyclodecylcyclodecane Chemical compound C1CCCCCCCCC1C1CCCCCCCCC1 XSYZCZPCBXYQTE-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- VELDYOPRLMJFIK-UHFFFAOYSA-N cyclopentanecarbaldehyde Chemical compound O=CC1CCCC1 VELDYOPRLMJFIK-UHFFFAOYSA-N 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 125000004856 decahydroquinolinyl group Chemical group N1(CCCC2CCCCC12)* 0.000 description 1
- 125000003493 decenyl group Chemical group [H]C([*])=C([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005070 decynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 230000016574 developmental growth Effects 0.000 description 1
- 125000005265 dialkylamine group Chemical group 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical class OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 1
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- SXZIXHOMFPUIRK-UHFFFAOYSA-N diphenylmethanimine Chemical compound C=1C=CC=CC=1C(=N)C1=CC=CC=C1 SXZIXHOMFPUIRK-UHFFFAOYSA-N 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 206010013663 drug dependence Diseases 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000002308 embryonic cell Anatomy 0.000 description 1
- 238000004945 emulsification Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000001952 enzyme assay Methods 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 208000019501 erythrocyte disease Diseases 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- 150000002169 ethanolamines Chemical class 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000004785 fluoromethoxy group Chemical group [H]C([H])(F)O* 0.000 description 1
- 201000003444 follicular lymphoma Diseases 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- IECPWNUMDGFDKC-MZJAQBGESA-N fusidic acid Chemical class O[C@@H]([C@@H]12)C[C@H]3\C(=C(/CCC=C(C)C)C(O)=O)[C@@H](OC(C)=O)C[C@]3(C)[C@@]2(C)CC[C@@H]2[C@]1(C)CC[C@@H](O)[C@H]2C IECPWNUMDGFDKC-MZJAQBGESA-N 0.000 description 1
- LRBQNJMCXXYXIU-QWKBTXIPSA-N gallotannic acid Chemical compound OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@H]2[C@@H]([C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-QWKBTXIPSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 125000004438 haloalkoxy group Chemical group 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 238000012203 high throughput assay Methods 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- DKAGJZJALZXOOV-UHFFFAOYSA-N hydrate;hydrochloride Chemical compound O.Cl DKAGJZJALZXOOV-UHFFFAOYSA-N 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000004926 indolenyl group Chemical group 0.000 description 1
- LPAGFVYQRIESJQ-UHFFFAOYSA-N indoline Chemical compound C1=CC=C2NCCC2=C1 LPAGFVYQRIESJQ-UHFFFAOYSA-N 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-M iodide Chemical compound [I-] XMBWDFGMSWQBCA-UHFFFAOYSA-M 0.000 description 1
- 229940006461 iodide ion Drugs 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000004936 isatinoyl group Chemical group N1(C(=O)C(=O)C2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003384 isochromanyl group Chemical group C1(OCCC2=CC=CC=C12)* 0.000 description 1
- 125000005438 isoindazolyl group Chemical group 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229940099563 lactobionic acid Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000002514 liquid chromatography mass spectrum Methods 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 230000006216 lysine-methylation Effects 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- BJEPYKJPYRNKOW-UWTATZPHSA-M malate ion Chemical compound [O-]C(=O)[C@H](O)CC(O)=O BJEPYKJPYRNKOW-UWTATZPHSA-M 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229940098895 maleic acid Drugs 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229940099690 malic acid Drugs 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- STZCRXQWRGQSJD-GEEYTBSJSA-M methyl orange Chemical compound [Na+].C1=CC(N(C)C)=CC=C1\N=N\C1=CC=C(S([O-])(=O)=O)C=C1 STZCRXQWRGQSJD-GEEYTBSJSA-M 0.000 description 1
- 229940012189 methyl orange Drugs 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- YKFLJYAKACCWMH-UHFFFAOYSA-N methyl piperidine-1-carboxylate Chemical compound COC(=O)N1CCCCC1 YKFLJYAKACCWMH-UHFFFAOYSA-N 0.000 description 1
- 229960001047 methyl salicylate Drugs 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 125000006578 monocyclic heterocycloalkyl group Chemical group 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 239000002324 mouth wash Substances 0.000 description 1
- 229940051866 mouthwash Drugs 0.000 description 1
- LNOPIUAQISRISI-UHFFFAOYSA-N n'-hydroxy-2-propan-2-ylsulfonylethanimidamide Chemical compound CC(C)S(=O)(=O)CC(N)=NO LNOPIUAQISRISI-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N n-hexanoic acid Natural products CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- XGXNTJHZPBRBHJ-UHFFFAOYSA-N n-phenylpyrimidin-2-amine Chemical compound N=1C=CC=NC=1NC1=CC=CC=C1 XGXNTJHZPBRBHJ-UHFFFAOYSA-N 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 239000006218 nasal suppository Substances 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 210000005170 neoplastic cell Anatomy 0.000 description 1
- 229910000069 nitrogen hydride Inorganic materials 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 125000005071 nonynyl group Chemical group C(#CCCCCCCC)* 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- OIPZNTLJVJGRCI-UHFFFAOYSA-M octadecanoyloxyaluminum;dihydrate Chemical compound O.O.CCCCCCCCCCCCCCCCCC(=O)O[Al] OIPZNTLJVJGRCI-UHFFFAOYSA-M 0.000 description 1
- 125000004930 octahydroisoquinolinyl group Chemical group C1(NCCC2CCCC=C12)* 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 206010073131 oligoastrocytoma Diseases 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 201000001649 ovarian clear cell adenocarcinoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- AHVQYHFYQWKUKB-UHFFFAOYSA-N oxan-4-amine Chemical compound NC1CCOCC1 AHVQYHFYQWKUKB-UHFFFAOYSA-N 0.000 description 1
- JMJRYTGVHCAYCT-UHFFFAOYSA-N oxan-4-one Chemical compound O=C1CCOCC1 JMJRYTGVHCAYCT-UHFFFAOYSA-N 0.000 description 1
- IPBPLHNLRKRLPJ-UHFFFAOYSA-N oxan-4-ylmethanamine Chemical compound NCC1CCOCC1 IPBPLHNLRKRLPJ-UHFFFAOYSA-N 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- DWYJHMSKXMHOAP-UHFFFAOYSA-N oxetan-2-ol Chemical compound OC1CCO1 DWYJHMSKXMHOAP-UHFFFAOYSA-N 0.000 description 1
- KTHZBRAXOLUNBN-UHFFFAOYSA-N oxetan-3-ylmethanamine Chemical compound NCC1COC1 KTHZBRAXOLUNBN-UHFFFAOYSA-N 0.000 description 1
- AHHWIHXENZJRFG-UHFFFAOYSA-N oxetane Chemical compound C1COC1 AHHWIHXENZJRFG-UHFFFAOYSA-N 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- QUANRIQJNFHVEU-UHFFFAOYSA-N oxirane;propane-1,2,3-triol Chemical compound C1CO1.OCC(O)CO QUANRIQJNFHVEU-UHFFFAOYSA-N 0.000 description 1
- YWWARDMVSMPOLR-UHFFFAOYSA-M oxolane;tetrabutylazanium;fluoride Chemical compound [F-].C1CCOC1.CCCC[N+](CCCC)(CCCC)CCCC YWWARDMVSMPOLR-UHFFFAOYSA-M 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- 210000000277 pancreatic duct Anatomy 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000004115 pentoxy group Chemical group [*]OC([H])([H])C([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 229950000688 phenothiazine Drugs 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 229940085991 phosphate ion Drugs 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- 229960004838 phosphoric acid Drugs 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000004928 piperidonyl group Chemical group 0.000 description 1
- 229960005235 piperonyl butoxide Drugs 0.000 description 1
- 125000004591 piperonyl group Chemical group C(C1=CC=2OCOC2C=C1)* 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 238000007517 polishing process Methods 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000008389 polyethoxylated castor oil Substances 0.000 description 1
- 239000010318 polygalacturonic acid Substances 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229910001414 potassium ion Inorganic materials 0.000 description 1
- WSHYKIAQCMIPTB-UHFFFAOYSA-M potassium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [K+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 WSHYKIAQCMIPTB-UHFFFAOYSA-M 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 238000012746 preparative thin layer chromatography Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- HAOKKJHTFUZWIM-UHFFFAOYSA-N pyridin-1-ium-2-amine;chloride Chemical compound Cl.NC1=CC=CC=N1 HAOKKJHTFUZWIM-UHFFFAOYSA-N 0.000 description 1
- LJXQPZWIHJMPQQ-UHFFFAOYSA-N pyrimidin-2-amine Chemical compound NC1=NC=CC=N1 LJXQPZWIHJMPQQ-UHFFFAOYSA-N 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 238000003571 reporter gene assay Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 231100000019 skin ulcer Toxicity 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- ZIQRIAYNHAKDDU-UHFFFAOYSA-N sodium;hydroiodide Chemical compound [Na].I ZIQRIAYNHAKDDU-UHFFFAOYSA-N 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 210000004500 stellate cell Anatomy 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000005415 substituted alkoxy group Chemical group 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 125000004426 substituted alkynyl group Chemical group 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000007940 sugar coated tablet Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-M sulfamate Chemical compound NS([O-])(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-M 0.000 description 1
- FDDDEECHVMSUSB-UHFFFAOYSA-N sulfanilamide Chemical compound NC1=CC=C(S(N)(=O)=O)C=C1 FDDDEECHVMSUSB-UHFFFAOYSA-N 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical group [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 235000015523 tannic acid Nutrition 0.000 description 1
- 229920002258 tannic acid Polymers 0.000 description 1
- 229940033123 tannic acid Drugs 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- IVWIMGAJPJCWHY-UHFFFAOYSA-N tert-butyl 4-(aminomethyl)cyclohexane-1-carboxylate Chemical compound CC(C)(C)OC(=O)C1CCC(CN)CC1 IVWIMGAJPJCWHY-UHFFFAOYSA-N 0.000 description 1
- CTEDVGRUGMPBHE-UHFFFAOYSA-N tert-butyl 4-(hydroxymethyl)piperidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC(CO)CC1 CTEDVGRUGMPBHE-UHFFFAOYSA-N 0.000 description 1
- ZFAVJLCPSVCDNP-UHFFFAOYSA-N tert-butyl 4-[[(2-bromopyridin-4-yl)amino]methyl]cyclohexane-1-carboxylate Chemical compound BrC1=NC=CC(=C1)NCC1CCC(CC1)C(=O)OC(C)(C)C ZFAVJLCPSVCDNP-UHFFFAOYSA-N 0.000 description 1
- ANUBPXDDAJQFTH-UHFFFAOYSA-N tert-butyl 4-[[(4-bromopyridin-2-yl)amino]methyl]piperidine-1-carboxylate Chemical compound BrC1=CC(=NC=C1)NCC1CCN(CC1)C(=O)OC(C)(C)C ANUBPXDDAJQFTH-UHFFFAOYSA-N 0.000 description 1
- NQHGYUZNWXIZID-UHFFFAOYSA-N tert-butyl 7-hydroxy-2-azaspiro[3.5]nonane-2-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CC21CCC(O)CC2 NQHGYUZNWXIZID-UHFFFAOYSA-N 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 125000002306 tributylsilyl group Chemical group C(CCC)[Si](CCCC)(CCCC)* 0.000 description 1
- 125000004784 trichloromethoxy group Chemical group ClC(O*)(Cl)Cl 0.000 description 1
- GGUBFICZYGKNTD-UHFFFAOYSA-N triethyl phosphonoacetate Chemical compound CCOC(=O)CP(=O)(OCC)OCC GGUBFICZYGKNTD-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 239000000225 tumor suppressor protein Substances 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000009777 vacuum freeze-drying Methods 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/74—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/48—Two nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/48—Two nitrogen atoms
- C07D239/49—Two nitrogen atoms with an aralkyl radical, or substituted aralkyl radical, attached in position 5, e.g. trimethoprim
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/32—Nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Hematology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Oncology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pyridine Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Hydrogenated Pyridines (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Description
本出願は、2016年4月15日に出願された米国仮特許出願第62/323,602号明細書;2016年6月10日に出願された同第62/348,837号明細書、および2016年9月30日に出願された同第62/402,997号明細書の優先権および利益を主張し;それぞれの内容全体を参照により本明細書に援用する。
環Aはフェニルまたは5員もしくは6員ヘテロアリールであり;
原子価が許容する場合、X1はN、CR2、またはNR2’であり;
原子価が許容する場合、X2はN、CR3、またはNR3’であり;
原子価が許容する場合、X3はN、CR4、またはNR4’であり;
X4はNまたはCR5であるか、または環Aが少なくとも1つのN原子を含有する5員ヘテロアリールであるように、X4は存在せず;
原子価が許容する場合、X5はCまたはNであり;
Bは存在しないか、またはC6~C10アリール、C3~C10シクロアルキル、5員~10員ヘテロアリール、およびN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択される環構造であり;
Bが存在する場合、Tは結合またはハロ、シアノ、ヒドロキシル、オキソ;もしくはC1~C6アルコキシの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり;またはBが存在しない場合、TはHであり、nは0であり;またはBが存在しない場合、Tは(R7)nで任意選択的に置換されたC1~C6アルキルであり;またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;
R1はHまたはC1~C4アルキルであり;
R2、R3、およびR4は各々独立にH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり、またはR3は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;;または環Aが少なくとも1つのN原子を含む5員ヘテロアリールである場合、R4はN、O、およびSから選択される1~4個のヘテロ原子を含むスピロ縮合4員~12員ヘテロシクロアルキルであり;
R2’、R3’およびR4’は各々独立にHまたはC1~C3アルキルであり;
R5はH、F、Br、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、ハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C6アルキル、および4員~12員ヘテロシクロアルキルで任意選択的に置換されたC2~C6アルキニルからなる群から選択され;ここで、前記C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、C(O)Ra、ORa、NRaRb、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、またはハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C4アルキルの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;
X5がNであり、環Aが6員ヘテロアリールである場合、R6は存在しないか;またはR6は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、C(O)R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、NR8R9、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;R6はNR8C(O)NR12R13ではなく;または
R6およびR2またはR3のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR6およびR2’またはR3’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシル、オキソ(=O)、C1~C3アルコキシル、または-Q1-T1の1つまたは複数で任意選択的に置換され;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、シアノ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、5員~10員ヘテロアリール、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、5員~10員ヘテロアリール、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり;R7はHまたはC(O)ORgではなく;または任意選択的に、Bが存在する場合、1つのR7およびR5は一緒に、ハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC3~C10アルキレン、C2~C10ヘテロアルキレン、C4~C10アルケニレン、C2~C10ヘテロアルケニレン、C4~C10アルキニレンまたはC2~C10ヘテロアルキニレンリンカーを形成し;
各R8は独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R8およびR9は、それらが結合している窒素原子と一緒になって、-Q5-T5の1つまたは複数で任意選択的に置換された、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、ここで、各Q5は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T5は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORe、C(O)Re、S(O)2Re、S(O)2NReRf、NReRf、C(O)NReRf、およびNReC(O)Rfからなる群から選択され、ReおよびRfは各々独立にHまたはC1~C6アルキルであり;または-Q5-T5はオキソであり;
R10はHおよびC1~C6アルキルからなる群から選択され;
R11は-Q6-T6であり、ここで、Q6は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T6はH、ハロ、ORg、NRgRh、NRgC(O)Rh、C(O)NRgRh、C(O)Rg、S(O)2Rg、またはRS3であり、ここで、RgおよびRhは各々独立にH、フェニル、C3~C8シクロアルキル、またはC3~C8シクロアルキルで任意選択的に置換されたC1~C6アルキルであり、またはRgおよびRhは、それらが結合している窒素原子と一緒に、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、RS3はC3~C8シクロアルキル、C6~C10アリール、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS3は1つまたは複数の-Q7-T7で任意選択的に置換され、ここで、各Q7は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T7は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORj、C(O)Rj、NRjRk、C(O)NRjRk、S(O)2Rj、およびNRjC(O)Rkからなる群から選択され、RjおよびRkは各々独立にHまたは1つまたは複数のハロで任意選択的に置換されたC1~C6アルキルであり;または-Q7-T7はオキソであり;または
R10およびR11は、それらが結合している窒素原子と一緒に、ハロ、C1~C6アルキル、ヒドロキシル、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し;
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
nは0、1、2、3、または4である。
5-ブロモ-N4-(4-フルオロフェニル)-N2-(4-メトキシ-3-(2-(ピロリジン-1-イル)エトキシ)フェニル)ピリミジン-2,4-ジアミン、
N2-(4-メトキシ-3-(2-(ピロリジン-1-イル)エトキシ)フェニル)-N4-(5-(tert-ペンチル)-1H-ピラゾール-3-イル)ピリミジン-2,4-ジアミン、
4-((2,4-ジクロロ-5-メトキシフェニル)アミノ)-2-((3-(2-(ピロリジン-1-イル)エトキシ)フェニル)アミノ)ピリミジン-5-カルボニトリル、
N-(ナフタレン-2-イル)-2-(ピペリジン-1-イルメトキシ)ピリミジン-4-アミン、
N-(3,5-ジフルオロベンジル)-2-(3-(ピロリジン-1-イル)プロピル)ピリミジン-4-アミン、
N-(((4-(3-(ピペリジン-1-イル)プロピル)ピリミジン-2-イル)アミノ)メチル)ベンズアミド、
N-(2-((2-(3-(ジメチルアミノ)プロピル)ピリミジン-4-イル)アミノ)エチル)ベンズアミド、
2-(ヘキサヒドロ-4-メチル-1H-1,4-ジアゼピン-1-イル)-6,7-ジメトキシ-N-[1-(フェニルメチル)-4-ピペリジニル]-4-キナゾリンアミン、
2-シクロヘキシル-6-メトキシ-N-[1-(1-メチルエチル)-4-ピペリジニル]-7-[3-(1-ピロリジニル)プロポキシ]-4-キナゾリンアミン、
3-(1-シアノ-1-メチルエチル)-N-[3-[(3,4-ジヒドロ-3-メチル-4-オキソ-6-キナゾリニル)アミノ]-4-メチルフェニル]ベンズアミド、
6-アセチル-8-シクロペンチル-5-メチル-2-[(5-ピペラジン-1-イルピリジン-2-イル)アミノ]ピリド[2,3-d]ピリミジン-7-オン、
N-[2-[[4-(ジエチルアミノ)ブチル]アミノ]-6-(3,5-ジメトキシフェニル)ピリド[2,3-d]ピリミジン-7-イル]-N’-(1,1-ジメチルエチル)尿素、または
6-[[2-[[4-(2,4-ジクロロフェニル)-5-(5-メチル-1H-イミダゾール-2-イル)-2-ピリミジニル]アミノ]エチル]アミノ]-3-ピリジンカルボニトリルでない。
式中、
環Bはフェニルまたはピリジルであり、
X1およびX2のうち一方または両方がNである一方、X3はCR4であり、X4はCR5であり、またはX1およびX3のうち一方または両方がNである一方、X2はCR3であり、X4はCR5であり;
nは1、2、または3である。
環Bはフェニルまたはピリジルであり、
X2およびX3の少なくとも1つがNであり;
nは1または2である。
環BはC3~C6シクロアルキルであり;
R20、R21、R22およびR23は各々独立にH、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルであり;
nは1または2である。
環BはC3~C6シクロアルキルであり;
R20、R21、R22およびR23は各々独立にH、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルであり;
nは1または2である。
X3はNまたはCR4であり、ここで、R4はHまたはC1~C4アルキルであり;
R1はHまたはC1~C4アルキルであり;
またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;またはBが存在しない場合、TはHであり、nは0であり;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり;R7はHまたはC(O)ORgではなく;
R5はC1~C6アルキル、C3~C8シクロアルキルおよびN、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択され、ここで、C3~C8シクロアルキルおよび4員~12員ヘテロシクロアルキルは、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、-C(O)C1~C6アルキルまたはハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルの1つまたは複数で任意選択的に置換され;
R9は-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3は、1つまたは複数の-Q4-T4で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;
nは0、1または2である。
この化合物または互変異性体の薬学的に許容される塩を含み、式中、R5およびR6は独立にC1~C6アルキルおよびNR8R9からなる群から選択され、またはR6およびR3は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成する。
この化合物または互変異性体の薬学的に許容される塩を含み、式中、
X1はNまたはCR2であり;
X2はNまたはCR3であり;
X3はNまたはCR4であり;
X4はNまたはCR5であり;
R2はH、C3~C8シクロアルキル、およびハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換されたC1~C6アルキルからなる群から選択され;
R3およびR4の各々はHであり;
R5は独立にH、C3~C8シクロアルキル、およびハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルからなる群から選択され;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;ここで、R2またはR5の少なくとも1つがHでない。
X1はNまたはCR2であり;
X2はNまたはCR3であり;
X3はNまたはCR4であり;
X4はNまたはCR5であり;
R2はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され、
R3およびR4の各々はHであり;
R5はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;ここで、R2またはR5の少なくとも1つがHでない。
X1はNまたはCR2であり;
X2はNまたはCR3であり;
X3はNまたはCR4であり;
X4はNまたはCR5であり;
R2はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され、
R3およびR4の各々はHであり;
R5はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;ここで、R2またはR5の少なくとも1つがHでない。
X6はNまたはCHであり;
X7はNまたはCHであり;
X3はNまたはCR4であり;
R4はH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;
各Q1は独立に結合またはハロ、シアノ、ヒドロキシル、オキソ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり;
各T1は独立にH、ハロ、シアノ、NR8R9、C(O)NR8R9、C(O)R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、NR8R9、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;-Q1-T1はNR8C(O)NR12R13でなく;
各R8は独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
R15aはCN、C(O)H、C(O)R18、OH、OR18、C1~C6アルキル、NHR17、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、ここで、前記C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、4員~12員ヘテロシクロアルキル、および5員~10員ヘテロアリールの各々は、1つまたは複数の-Q9-T9で任意選択的に置換され、ここで、各Q9は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T9は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q9-T9はオキソであり;
R16aは-Q11-R16であり、ここで、Q11は結合、O、NRa、ハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり;R16はH、C1~C6アルキル、C2~C6アルケニル、C2~C6アルキニル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q10-T10で任意選択的に置換され、ここで、各Q10は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T10は独立にH、ハロ、シアノ、C(O)H、C(O)R18、S(O)pR18、OH、OR18、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q10-T10はオキソであり;
R17はHまたはC1~C6アルキルであり;
各R18は独立にC1~C6アルキル、C2~C6アルケニルまたはC2~C6アルキニルであり;
pは0、1、または2であり;
vは0、1、または2である。
X6はNまたはCHであり;
X7はNまたはCHであり;
X3はNまたはCR4であり;
R4はH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
R15はC1~C6アルキル、NHR17、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、ここで、前記C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、4員~12員ヘテロシクロアルキル、および5員~10員ヘテロアリールの各々は、1つまたは複数の-Q9-T9で任意選択的に置換され、ここで、各Q9は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T9は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q9-T9はオキソであり;
R16はC1~C6アルキル、C2~C6アルケニル、C2~C6アルキニル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q10-T10で任意選択的に置換され、ここで、各Q10は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T10は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q10-T10はオキソであり;
R17はHまたはC1~C6アルキルであり;
vは0、1、または2である。
環Aはフェニルまたは5員もしくは6員ヘテロアリールであり;
原子価が許容する場合、X1はN、CR2、またはNR2’であり;
原子価が許容する場合、X2はN、CR3、またはNR3’であり;
原子価が許容する場合、X3はN、CR4、またはNR4’であり;
X4はNまたはCR5であるか、または環Aが少なくとも1つのN原子を含有する5員ヘテロアリールであるように、X4は存在せず;
原子価が許容する場合、X5はCまたはNであり;
Bは存在しないか、またはC6~C10アリール、C3~C10シクロアルキル、5員~10員ヘテロアリール、およびN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択される環構造であり;
Bが存在する場合、Tは結合またはハロ、シアノ、ヒドロキシル、オキソ;もしくはC1~C6アルコキシの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり;またはBが存在しない場合、TはHであり、nは0であり;またはBが存在しない場合、Tは(R7)nで任意選択的に置換されたC1~C6アルキルであり;またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;
R1はHまたはC1~C4アルキルであり;
R2、R3、およびR4は各々独立にH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり、またはR3は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;;または環Aが少なくとも1つのN原子を含む5員ヘテロアリールである場合、R4はN、O、およびSから選択される1~4個のヘテロ原子を含むスピロ縮合4員~12員ヘテロシクロアルキルであり;
R2’、R3’およびR4’は各々独立にHまたはC1~C3アルキルであり;
R5はH、F、Br、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、ハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C6アルキル、および4員~12員ヘテロシクロアルキルで任意選択的に置換されたC2~C6アルキニルからなる群から選択され;ここで、前記C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、C(O)Ra、ORa、NRaRb、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、またはハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C4アルキルの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;
X5がNであり、環Aが6員ヘテロアリールである場合、R6は存在しないか;またはR6は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、C(O)R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、NR8R9、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;R6はNR8C(O)NR12R13ではなく;または
R6およびR2またはR3のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR6およびR2’またはR3’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシル、オキソ(=O)、C1~C3アルコキシル、または-Q1-T1の1つまたは複数で任意選択的に置換され;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、シアノ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、5員~10員ヘテロアリール、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、5員~10員ヘテロアリール、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり;R7はHまたはC(O)ORgではなく;または任意選択的に、Bが存在する場合、1つのR7およびR5は一緒に、ハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC3~C10アルキレン、C2~C10ヘテロアルキレン、C4~C10アルケニレン、C2~C10ヘテロアルケニレン、C4~C10アルキニレンまたはC2~C10ヘテロアルキニレンリンカーを形成し;
各R8は独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R8およびR9は、それらが結合している窒素原子と一緒になって、-Q5-T5の1つまたは複数で任意選択的に置換された、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、ここで、各Q5は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T5は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORe、C(O)Re、S(O)2Re、S(O)2NReRf、NReRf、C(O)NReRf、およびNReC(O)Rfからなる群から選択され、ReおよびRfは各々独立にHまたはC1~C6アルキルであり;または-Q5-T5はオキソであり;
R10はHおよびC1~C6アルキルからなる群から選択され;
R11は-Q6-T6であり、ここで、Q6は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T6はH、ハロ、ORg、NRgRh、NRgC(O)Rh、C(O)NRgRh、C(O)Rg、S(O)2Rg、またはRS3であり、ここで、RgおよびRhは各々独立にH、フェニル、C3~C8シクロアルキル、またはC3~C8シクロアルキルで任意選択的に置換されたC1~C6アルキルであり、またはRgおよびRhは、それらが結合している窒素原子と一緒に、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、RS3はC3~C8シクロアルキル、C6~C10アリール、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS3は1つまたは複数の-Q7-T7で任意選択的に置換され、ここで、各Q7は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T7は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORj、C(O)Rj、NRjRk、C(O)NRjRk、S(O)2Rj、およびNRjC(O)Rkからなる群から選択され、RjおよびRkは各々独立にHまたは1つまたは複数のハロで任意選択的に置換されたC1~C6アルキルであり;または-Q7-T7はオキソであり;または
R10およびR11は、それらが結合している窒素原子と一緒に、ハロ、C1~C6アルキル、ヒドロキシル、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し;
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
nは0、1、2、3、または4である。
5-ブロモ-N4-(4-フルオロフェニル)-N2-(4-メトキシ-3-(2-(ピロリジン-1-イル)エトキシ)フェニル)ピリミジン-2,4-ジアミン、
N2-(4-メトキシ-3-(2-(ピロリジン-1-イル)エトキシ)フェニル)-N4-(5-(tert-ペンチル)-1H-ピラゾール-3-イル)ピリミジン-2,4-ジアミン、
4-((2,4-ジクロロ-5-メトキシフェニル)アミノ)-2-((3-(2-(ピロリジン-1-イル)エトキシ)フェニル)アミノ)ピリミジン-5-カルボニトリル、
N-(ナフタレン-2-イル)-2-(ピペリジン-1-イルメトキシ)ピリミジン-4-アミン、
N-(3,5-ジフルオロベンジル)-2-(3-(ピロリジン-1-イル)プロピル)ピリミジン-4-アミン、
N-(((4-(3-(ピペリジン-1-イル)プロピル)ピリミジン-2-イル)アミノ)メチル)ベンズアミド、
N-(2-((2-(3-(ジメチルアミノ)プロピル)ピリミジン-4-イル)アミノ)エチル)ベンズアミド、
2-(ヘキサヒドロ-4-メチル-1H-1,4-ジアゼピン-1-イル)-6,7-ジメトキシ-N-[1-(フェニルメチル)-4-ピペリジニル]-4-キナゾリンアミン、
2-シクロヘキシル-6-メトキシ-N-[1-(1-メチルエチル)-4-ピペリジニル]-7-[3-(1-ピロリジニル)プロポキシ]-4-キナゾリンアミン、
3-(1-シアノ-1-メチルエチル)-N-[3-[(3,4-ジヒドロ-3-メチル-4-オキソ-6-キナゾリニル)アミノ]-4-メチルフェニル]ベンズアミド、
6-アセチル-8-シクロペンチル-5-メチル-2-[(5-ピペラジン-1-イルピリジン-2-イル)アミノ]ピリド[2,3-d]ピリミジン-7-オン、
N-[2-[[4-(ジエチルアミノ)ブチル]アミノ]-6-(3,5-ジメトキシフェニル)ピリド[2,3-d]ピリミジン-7-イル]-N’-(1,1-ジメチルエチル)尿素、または
6-[[2-[[4-(2,4-ジクロロフェニル)-5-(5-メチル-1H-イミダゾール-2-イル)-2-ピリミジニル]アミノ]エチル]アミノ]-3-ピリジンカルボニトリルでない。
環Bはフェニルまたはピリジルであり、
X1およびX2のうち一方または両方がNである一方、X3はCR4であり、X4はCR5であり、またはX1およびX3のうち一方または両方がNである一方、X2はCR3であり、X4はCR5であり;
nは1、2、または3である。
環Bはフェニルまたはピリジルであり、
X2およびX3の少なくとも1つがNであり;
nは1または2である。
環BはC3~C6シクロアルキルであり;
R20、R21、R22およびR23は各々独立にH、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルであり;
nは1または2である。
環BはC3~C6シクロアルキルであり;
R20、R21、R22およびR23は各々独立にH、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルであり;
nは1または2である。
環Bは存在しないか、またはC3~C6シクロアルキルであり;
X3はNまたはCR4であり、ここで、R4はHまたはC1~C4アルキルであり;
R1はHまたはC1~C4アルキルであり;
またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;またはBが存在しない場合、TはHであり、nは0であり;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり;R7はHまたはC(O)ORgではなく;
R5はC1~C6アルキル、C3~C8シクロアルキルおよびN、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択され、ここで、C3~C8シクロアルキルおよび4員~12員ヘテロシクロアルキルは、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、-C(O)C1~C6アルキルまたはハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルの1つまたは複数で任意選択的に置換され;
R9は-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3は、1つまたは複数の-Q4-T4で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;
nは0、1または2である。
R1はHまたはC1~C4アルキルであり;
またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレンリンカーであり、各T2は独立にH、ハロ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、R7はHまたはC(O)ORgではなく;RxおよびRyは各々独立にHまたはC1~C6アルキルであり;またはR5は、-C(O)C1~C6アルキルまたはハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルの1つまたは複数で任意選択的に置換された、C3~C8シクロアルキルおよびN、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択され;
R9は-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレンリンカーであり、T3は、1つまたは複数の-Q4-T4で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;
nは1または2である。
環Bは存在しないか、またはC3~C6シクロアルキルであり;
R1はHまたはC1~C4アルキルであり;
またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;またはBが存在しない場合、TはHであり、nは0であり;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり;R7はHまたはC(O)ORgではなく;
R5はC1~C6アルキル、C3~C8シクロアルキルおよびN、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択され、ここで、C3~C8シクロアルキルおよび4員~12員ヘテロシクロアルキルは、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、-C(O)C1~C6アルキルまたはハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルの1つまたは複数で任意選択的に置換され;
R9は-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3は、1つまたは複数の-Q4-T4で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;
nは0、1または2である。
R5およびR6は独立にC1~C6アルキルおよびNR8R9からなる群から選択され、またはR6およびR3は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成する。
X1はNまたはCR2であり;
X2はNまたはCR3であり;
X3はNまたはCR4であり;
X4はNまたはCR5であり;
R2はH、C3~C8シクロアルキル、およびハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換されたC1~C6アルキルからなる群から選択され;
R3およびR4の各々はHであり;
R5は独立にH、C3~C8シクロアルキル、およびハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルからなる群から選択され;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;ここで、R2またはR5の少なくとも1つがHでない。
X1はNまたはCR2であり;
X2はNまたはCR3であり;
X3はNまたはCR4であり;
X4はNまたはCR5であり;
R2はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され、
R3およびR4の各々はHであり;
R5はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;ここで、R2またはR5の少なくとも1つがHでない。
X1はNまたはCR2であり;
X2はNまたはCR3であり;
X3はNまたはCR4であり;
X4はNまたはCR5であり;
R2はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され、
R3およびR4の各々はHであり;
R5はH、C3~C8シクロアルキル、およびC1~C6アルキルからなる群から選択され;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;ここで、R2またはR5の少なくとも1つがHでない。
X6はNまたはCHであり;
X7はNまたはCHであり;
X3はNまたはCR4であり;
R4はH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;
各Q1は独立に結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり;
各T1は独立にH、ハロ、シアノ、NR8R9、C(O)NR8R9、C(O)R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、NR8R9、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;-Q1-T1はNR8C(O)NR12R13でなく;
各R8は独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
R15aはCN、C(O)H、C(O)R18、OH、OR18、C1~C6アルキル、NHR17、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、ここで、前記C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、4員~12員ヘテロシクロアルキル、および5員~10員ヘテロアリールの各々は、1つまたは複数の-Q9-T9で任意選択的に置換され、ここで、各Q9は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T9は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q9-T9はオキソであり;
R16aは-Q11-R16であり、ここで、Q11は結合、O、NRa、ハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり;R16はH、C1~C6アルキル、C2~C6アルケニル、C2~C6アルキニル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q10-T10で任意選択的に置換され、ここで、各Q10は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T10は独立にH、ハロ、シアノ、C(O)H、C(O)R18、S(O)pR18、OH、OR18、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q10-T10はオキソであり;
R17はHまたはC1~C6アルキルであり;
各R18は独立にC1~C6アルキル、C2~C6アルケニルまたはC2~C6アルキニルであり;
pは0、1、または2であり;
vは0、1、または2である。
X6はNまたはCHであり;
X7はNまたはCHであり;
X3はNまたはCR4であり;
R4はH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
R15はC1~C6アルキル、NHR17、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、ここで、前記C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、4員~12員ヘテロシクロアルキル、および5員~10員ヘテロアリールの各々は、1つまたは複数の-Q9-T9で任意選択的に置換され、ここで、各Q9は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T9は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q9-T9はオキソであり;
R16はC1~C6アルキル、C2~C6アルケニル、C2~C6アルキニル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q10-T10で任意選択的に置換され、ここで、各Q10は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T10は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q10-T10はオキソであり;
R17はHまたはC1~C6アルキルであり;
vは0、1、または2である。
環Aはフェニルまたは5員もしくは6員ヘテロアリールであり;
原子価が許容する場合、X1はN、CR2、またはNR2’であり;
原子価が許容する場合、X2はN、CR3、またはNR3’であり;
原子価が許容する場合、X3はN、CR4、またはNR4’であり;
X4はNまたはCR5であるか、または環Aが少なくとも1つのN原子を含有する5員ヘテロアリールであるように、X4は存在せず;
原子価が許容する場合、X5はCまたはNであり;
Bは存在しないか、またはC6~C10アリール、C3~C10シクロアルキル、5員~10員ヘテロアリール、およびN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルからなる群から選択される環構造であり;
Bが存在する場合、Tは結合またはハロ、シアノ、ヒドロキシル、オキソ;もしくはC1~C6アルコキシの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり;またはBが存在しない場合、TはHであり、nは0であり;またはBが存在しない場合、Tは(R7)nで任意選択的に置換されたC1~C6アルキルであり;またはBが存在しない場合、TおよびR1は、それらが結合している原子と一緒に、4~7員ヘテロシクロアルキルまたは5~6員ヘテロアリールを任意選択的に形成し、その各々が(R7)nで任意選択的に置換され;
R1はHまたはC1~C4アルキルであり;
R2’、R3’およびR4’は各々独立にHまたはC1~C3アルキルであり;
R2、R3、およびR4は各々独立にH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4~7員ヘテロシクロアルキル、5~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり、またはR3は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;または環Aが少なくとも1つのN原子を含む5員ヘテロアリールである場合、R4は、N、O、およびSから選択される1~4個のヘテロ原子を含むスピロ縮合4員~12員ヘテロシクロアルキルであり;
R5はH、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、-C(O)C1~C6アルキルまたはハロもしくはORaの1つまたは複数で任意選択的に置換されたC1~C6アルキルの1つまたは複数で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、ハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換されたC1~C6アルキル、および4員~12員ヘテロシクロアルキルで任意選択的に置換されたC2~C6アルキニルからなる群から選択され;ここで、前記C3~C8シクロアルキルおよび4員~12員ヘテロシクロアルキルは、ハロ、C(O)Ra、ORa、NRaRb、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、またはハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C4アルキルの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり;または
R5およびR3またはR4のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR5およびR3’またはR4’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシルまたはC1~C3アルコキシルの1つまたは複数で任意選択的に置換され;
X5がNであり、環Aが6員ヘテロアリールである場合、R6は存在しないか;またはR6は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、C(O)R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、NR8R9、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され;R6はNR8C(O)NR12R13ではなく;または
R6およびR2またはR3のうち一方は、それらが結合している原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し;またはR6およびR2’またはR3’のうち一方は、それらが結合している原子と一緒に、5員もしくは6員ヘテロアリールを形成し、ここで、形成されたままのフェニルまたは5員もしくは6員ヘテロアリールは、ハロ、C1~C3アルキル、ヒドロキシル、オキソ(=O)、C1~C3アルコキシルまたは-Q1-T1の1つまたは複数で任意選択的に置換され;
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、シアノ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、5員~10員ヘテロアリール、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、5員~10員ヘテロアリール、C3~C8シクロアルキル、または4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり;R7はHまたはC(O)ORgではなく;または任意選択的に、Bが存在する場合、1つのR7およびR5は一緒に、ハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC3~C10アルキレン、C2~C10ヘテロアルキレン、C4~C10アルケニレン、C2~C10ヘテロアルケニレン、C4~C10アルキニレンまたはC2~C10ヘテロアルキニレンリンカーを形成し;
各R8は独立にHまたはC1~C6アルキルであり;
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはハロ、シアノ、ヒドロキシルもしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換された、C1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T3はH、ハロ、OR12、OR13、NR12R13、NR12C(O)R13、C(O)NR12R13、C(O)R13、S(O)2R13、S(O)2NR12R13、またはRS2であり、ここで、RS2はC3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS2は1つまたは複数の-Q4-T4で任意選択的に置換され、ここで、各Q4は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々が任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T4は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORc、C(O)Rc、S(O)2Rc、S(O)2NRcRd、NRcRd、C(O)NRcRd、およびNRcC(O)Rdからなる群から選択され、RcおよびRdは各々独立にHまたはC1~C6アルキルであり;または-Q4-T4はオキソであり;または
R8およびR9は、それらが結合している窒素原子と一緒になって、-Q5-T5の1つまたは複数で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、ここで、各Q5は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T5は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORe、C(O)Re、S(O)2Re、S(O)2NReRf、NReRf、C(O)NReRf、およびNReC(O)Rfからなる群から選択され、ReおよびRfは各々独立にHまたはC1~C6アルキルであり;または-Q5-T5はオキソであり;
R10はHおよびC1~C6アルキルからなる群から選択され;
R11は-Q6-T6であり、ここで、Q6は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T6はH、ハロ、ORg、NRgRh、NRgC(O)Rh、C(O)NRgRh、C(O)Rg、S(O)2Rg、またはRS3であり、ここで、RgおよびRhは各々独立にH、フェニル、C3~C8シクロアルキル、またはC3~C8シクロアルキルで任意選択的に置換されたC1~C6アルキルであり、またはRgおよびRhは、それらが結合している窒素原子と一緒に、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、RS3はC3~C8シクロアルキル、C6~C10アリール、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS3は1つまたは複数の-Q7-T7で任意選択的に置換され、ここで、各Q7は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T7は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORj、C(O)Rj、NRjRk、C(O)NRjRk、S(O)2Rj、およびNRjC(O)Rkからなる群から選択され、RjおよびRkは各々独立にHまたは1つまたは複数のハロで任意選択的に置換されたC1~C6アルキルであり;または-Q7-T7はオキソであり;または
R10およびR11は、それらが結合している窒素原子と一緒に、ハロ、C1~C6アルキル、ヒドロキシル、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換された、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し;
R12はHまたはC1~C6アルキルであり;
R13はC1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、その各々が1つまたは複数の-Q8-T8で任意選択的に置換され、ここで、各Q8は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T8は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、および5員~6員ヘテロアリールからなる群から選択され;または-Q8-T8はオキソであり;
nは0、1、2、3、または4であり、ただし、
(1)式(I)の化合物は、2-(ヘキサヒドロ-4-メチル-1H-1,4-ジアゼピン-1-イル)-6,7-ジメトキシ-N-[1-(フェニルメチル)-4-ピペリジニル]-4-キナゾリンアミン、または
2-シクロヘキシル-6-メトキシ-N-[1-(1-メチルエチル)-4-ピペリジニル]-7-[3-(1-ピロリジニル)プロポキシ]-4-キナゾリンアミンではなく;
(2)X1およびX3がNであり、X2がCR3であり、X4がCR5であり、X5がCであり、R5が1つまたは複数のC1~C6アルキルで置換された4員~12員ヘテロシクロアルキルであり、R6およびR3は、それらが結合している原子と一緒に、任意選択的に置換されたC1~C3アルコキシルの1つまたは複数で置換されたフェニルを形成する場合、Bは存在しないか、C6~C10アリール、C3~C10シクロアルキル、または5~10員ヘテロアリールであり;または
(3)X2およびX3がNであり、X1がCR2であり、X4がCR5であり、X5がCであり、R5がC3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルであり、各々が1つまたは複数のC1~C6アルキルで任意選択的に置換され、R6およびR2は、それらが結合している原子と一緒に、任意選択的に置換されたC1~C3アルコキシルの1つまたは複数で置換されたフェニルを形成する場合、Bは存在しないか、C6~C10アリール、C3~C10シクロアルキル、または5員~10員ヘテロアリールである)
の化合物、またはその互変異性体、またはこの化合物または互変異性体の薬学的に許容される塩を投与することを含む方法を提供する。
ヒドロキシル部分の場合:TBS、ベンジル、THP、Ac
カルボン酸の場合:ベンジルエステル、メチルエステル、エチルエステル、アリルエステル
アミンの場合:Cbz、BOC、DMB
ジオールの場合:Ac(×2)TBS(×2)、または一緒になる場合、アセトニド
チオールの場合:Ac
ベンズイミダゾールの場合:SEM、ベンジル、PMB、DMB
アルデヒドの場合:ジ-アルキルアセタール、例えば、ジメトキシアセタールまたはジエチルアセチル。
ACN:アセトニトリル
Ac:アセチル
AcOH:酢酸
AlCl3:塩化アルミニウム
BINAP:(2,2’-ビス(ジフェニルホスフィノ)-1,1’-ビナフチル)
t-BuOK:カリウムt-ブトキシド
tBuONaまたはt-BuONa:ナトリウムt-ブトキシド
br:ブロード
BOC:tert-ブトキシカルボニル
Cbz:ベンジルオキシカルボニル
CDCl3CHCl3:クロロホルム
CH2Cl2:ジクロロメタン
CH3CN:アセトニトリル
CsCO3:炭酸セシウム
CH3NO3:ニトロメタン
d:二重項
dd:二重項の二重項
dq:四重項の二重項
DCE:1,2ジクロロエタン
DCM:ジクロロメタン
Δ:熱
δ:化学シフト
DIEA:N,N-ジイソプロピルエチルアミン(ヒューニッヒ塩基)
DMB:2,4ジメトキシベンジル
DMF:N,N-ジメチルホルムアミド
DMSO:ジメチルスルホキシド
DMSO-d6:重水素化ジメチルスルホキシド
EAまたはEtOAc:酢酸エチル
ES:エレクトロスプレー
Et3N:トリエチルアミン
equiv:当量
g:グラム
h:時間
H2O:水
HCl:塩化水素または塩酸
HPLC:高速液体クロマトグラフィー
Hz:ヘルツ
IPA:イソプロピルアルコール
i-PrOH:イソプロピルアルコール
J:NMR結合定数
K2CO3:炭酸カリウム
HI:ヨウ化カリウム
KCN:シアン化カリウム
LCMSまたはLC-MS:液体クロマトグラフィー質量スペクトル
M:モル濃度
m:多重項
mg:ミリグラム
MHz:メガヘルツ
mL:ミリリットル
mm:ミリメートル
mmol:ミリモル
mol:モル
[M+1]:分子イオン+1つの質量単位
m/z:質量/電荷比
m-CPBA:メタ-クロロ過安息香酸
MeCN:アセトニトリル
MeOH:メタノール
MeI:ヨウ化メチル
min:分
μm:ミクロン
MsCl:塩化メシル
MW:マイクロ波照射
N:直鎖
Na2SO4:硫酸ナトリウム
NH3:アンモニア
NaBH(AcO)3:ナトリウムトリアセトキシボロヒドリド
NaI:ヨウ化ナトリウム
Na2SO4:硫酸ナトリウム
NH4Cl:塩化アンモニウム
NH4HCO3:炭酸水素アンモニウム
nm:ナノメートル
NMP:N-メチルピロリジノン
NMR:核磁気共鳴
Pd(OAc)2:酢酸パラジウム(II)
Pd/C:パラジウム炭素
Pd2(dba)3:トリス(ジベンジリデンアセトン)ジパラジウム(0)
PMB:パラメトキシベンジル
ppm:百万分率
POCl3:塩化ホスホリル
分取HPLC:分取高速液体クロマトグラフィー
PTSA:パラ-トルエンスルホン酸
p-TsOH:パラ-トルエンスルホン酸
RT:保持時間
rt:室温
s:一重項
t:三重項
t-BuXPhos:2-ジ-tert-ブチルホスフィノ-2’、4’、6’-トリイソプロピルビフェニル
TEA:トリエチルアミン
TFA:トリフルオロ酢酸
TfO:トリフレート
THP:テトラヒドロピラン
TsOH:トス酸
UV:紫外線
N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成:
50mLの丸底フラスコ中に、2,4-ジクロロピリミジン(1.1g、7.38mmol、1.00当量)、メタンアミン塩酸塩(498mg、7.38mmol、1.00当量)、炭酸カリウム(3.07g、22.21mmol、3.00当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を20℃で18時間撹拌した。得られた溶液を60mLのH2Oで希釈した。得られた溶液を3×80mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×100mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1/2)とともにシリカゲルカラム上に適用した。これにより、0.67g(63%)の2-クロロ-N-メチルピリミジン-4-アミンが白色の固体として得られた。
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(200mg、1.39mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(350mg、1.40mmol、1.00当量)、4-メチルベンゼン-1-スルホン酸(476mg、2.76mmol、2.00当量)、イソプロパノール(10mL)を入れた。得られた溶液を85℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/5)とともにシリカゲルカラム上に適用した。これにより、66.3mg(13%)の2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-メチルピリミジン-2,4-ジアミンがピンク色の固体として得られた。
N4-((1-(2,2-ジフルオロエチル)ピペリジン-4-イル)メチル)-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)ピリミジン-2,4-ジアミンの合成:
50mLの3口丸底フラスコ中に、tert-ブチル4-[[(2-クロロピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(1.1g、3.37mmol、1.00当量)、トリフルオロ酢酸(3mL)、ジクロロメタン(10mL)を入れた。得られた溶液を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/MeCN/NH4HCO3を用いたフラッシュクロマトグラフィーによって精製した。これにより、1.5g(粗製)の2-クロロ-N-(ピペリジン-4-イルメチル)ピリミジン-4-アミンがオフホワイトの固体として得られた。
100mLの3口丸底フラスコ中に、2-クロロ-N-(ピペリジン-4-イルメチル)ピリミジン-4-アミン(1.5g、6.62mmol、1.00当量)、2,2-ジフルオロエチルトリフルオロメタンスルホネート(1.56g、7.29mmol、1.10当量)、DIEA(1.7g、2.00当量)、MeCN(20mL)を入れた。得られた溶液を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をフラッシュクロマトグラフィーによって精製した。これにより、1.1g(57%)の2-クロロ-N-[[1-(2,2-ジフルオロエチル)ピペリジン-4-イル]メチル]ピリミジン-4-アミンが黄色の固体として得られた。
50mLの丸底フラスコ中に、2-クロロ-N-[[1-(2,2-ジフルオロエチル)ピペリジン-4-イル]メチル]ピリミジン-4-アミン(291mg、1.00mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(250g、998.66mmol、1.00当量)、TsOH・H2O(380mg、2.00mmol、2.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、90℃で5時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLCによって精製した。これにより、144.1mg(29%)の4-N-[[1-(2,2-ジフルオロエチル)ピペリジン-4-イル]メチル]-2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]ピリミジン-2,4-ジアミンが白色の固体として得られた。
N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンの合成:
250mLの丸底フラスコ中に、2-メトキシ-5-ニトロフェノール(10g、59.12mmol、1.00当量)、1-(3-クロロプロピル)ピロリジン塩酸塩(10.8g、58.66mmol、1.00当量)、Cs2CO3(58g、178.01mmol、3.00当量)、NaI(8.9g、1.00当量)、N,N-ジメチルホルムアミド(100mL)を入れた。得られた溶液を110℃で2時間撹拌した。得られた溶液を300mLのH2Oで希釈した。得られた溶液を3×400mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を5×400mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。これにより、14g(84%)の1-[3-(2-メトキシ-5-ニトロフェノキシ)プロピル]ピロリジンが黄色の固体として得られた。
250mLの丸底フラスコ中に、1-[3-(2-メトキシ-5-ニトロフェノキシ)プロピル]ピロリジン(14g、49.94mmol、1.00当量)、メタノール(100mL)、パラジウム炭素(2g)を入れた。混合物を、3回の水素/空気交換サイクルにかけた。得られた溶液を20℃で15時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、12.1g(97%)の4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリンが褐色の油として得られた。
25mLの丸底フラスコ中に、2,4-ジクロロピリミジン(500mg、3.36mmol、1.00当量)、オキサン-4-イルメタンアミン(389mg、3.38mmol、1.00当量)、炭酸カリウム(932mg、6.74mmol、2.00当量)、N,N-ジメチルホルムアミド(3mL)を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。残渣を、ACN/H2O(1/5)とともにシリカゲルカラム上に適用した。これにより、0.44g(58%)の2-クロロ-N-(オキサン-4-イルメチル)ピリミジン-4-アミンが白色の固体として得られた。
50mLの丸底フラスコ中に、2-クロロ-N-(オキサン-4-イルメチル)ピリミジン-4-アミン(150mg、0.66mmol、1.00当量)、1-メタンスルホニル-4-メチルベンゼン(181mg、1.06mmol、1.10当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(566mg、2.26mmol、5.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。得られた溶液を3×30mLのジクロロメタンで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。粗生成物を、以下の条件(IntelFlash-1):カラム、C18シリカゲル;移動相、CH3CN/H2O(0.05%のNH3.H2O)=17%から10分以内にCH3CN/H2O(0.05%のNH3.H2O)=30%に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、116mg(40%)の2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-(オキサン-4-イルメチル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-((1-(2,2,2-トリフルオロエチル)ピペリジン-4-イル)メチル)ピリミジン-2,4-ジアミンの合成:
N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-(テトラヒドロ-2H-ピラン-4-イル)ピリミジン-2,4-ジアミンの合成:
50mLの丸底フラスコ中に、2,4-ジクロロピリミジン(500mg、3.36mmol、1.00当量)、オキサン-4-アミン(341.2mg、3.37mmol、1.00当量)、炭酸カリウム(932.4mg、6.75mmol、2.00当量)、N,N-ジメチルホルムアミド(3mL)を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。残渣を、ジクロロメタン/メタノール(4:1)とともにシリカゲルカラム上に適用した。これにより、250mg(35%)の2-クロロ-N-(オキサン-4-イル)ピリミジン-4-アミンが白色の固体として得られた。
50mLの丸底フラスコ中に、2-クロロ-N-(オキサン-4-イル)ピリミジン-4-アミン(150mg、0.70mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(192mg、0.77mmol、1.10当量)、4-メチルベンゼン-1-スルホン酸(603mg、3.50mmol、5.00当量)、i-prOH(5mL)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。得られた溶液を3×30mLのジクロロメタンで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。粗生成物を、以下の条件:カラム:X Bridge RP、19*150mm、5um;移動相A:水/10mmolのNH4HCO3、移動相B:ACN;流量:30mL/分;勾配:10分で16%のBから45%のB;254nmを用いた分取HPLCによって精製した。これにより、51.8mg(17%)の2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-(オキサン-4-イル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
N4-(tert-ブチル)-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)ピリミジン-2,4-ジアミンの合成:
25mLの丸底フラスコ中に、2,4-ジクロロピリミジン(1g、6.71mmol、1.00当量)、2-メチルプロパン-2-アミン(496mg、6.78mmol、1.01当量)、炭酸カリウム(2.8g、20.26mmol、3.02当量)、N,N-ジメチルホルムアミド(5mL)を入れた。得られた溶液を室温で3時間撹拌した。固体をろ過して取り除いた。残渣を、ACN:水(45:100)とともにシリカゲルカラム上に適用した。これにより、600mg(48%)のN-tert-ブチル-2-クロロピリミジン-4-アミンが白色の固体として得られた。
25mLの丸底フラスコ中に、N-tert-ブチル-2-クロロピリミジン-4-アミン(200mg、1.08mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(325mg、1.30mmol、1.21当量)、TsOH(185.7mg、1.08mol、1当量)、イソプロパノール(2mL)を入れた。得られた溶液を、油浴中で、85℃で3時間撹拌した。粗生成物を、以下の条件(2#-AnalyseHPLC-SHIMADZU(HPLC-10)):カラム、XSelect CSH Prep C18 OBDカラム、5um、19*150mm;移動相、水(0.05%のHCl)およびACN(5.0%のACNから6分で15.0%まで);検出器、UV220nmを用いた分取HPLCによって精製した。これにより、82.6mg(18%)の4-N-tert-ブチル-2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]ピリミジン-2,4-ジアミン塩酸塩が褐色の固体として得られた。
tert-ブチル4-(((4-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)ピリミジン-2-イル)アミノ)メチル)ピペリジン-1-カルボキシレートの合成:
50mLの3口丸底フラスコ中に、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(1g、3.99mmol、1.00当量)、4-クロロ-2-(メチルスルファニル)ピリミジン(640mg、3.98mmol、1.00当量)、TsOH・H2O(1.52g、2.00当量)、イソプロパノール(10mL)を入れた。得られた溶液を、油浴中で、70℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/MeCNを用いたフラッシュクロマトグラフィーによって精製した。これにより、950mg(64%)のN-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-2-(メチルスルファニル)ピリミジン-4-アミンが黒色の固体として得られた。
50mLの3口丸底フラスコ中に、N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-2-(メチルスルファニル)ピリミジン-4-アミン(800mg、2.14mmol、1.00当量)、mCPBA(736mg、4.27mmol、2.00当量)、ジクロロメタン(10mL)を入れた。得られた溶液を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、MeCN/H2Oを用いたフラッシュクロマトグラフィーによって精製した。これにより、500mg(58%)の2-メタンスルホニル-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]ピリミジン-4-アミンが濃い赤色の固体として得られた。
10mLの密閉管中に、2-メタンスルホニル-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]ピリミジン-4-アミン(200mg、0.49mmol、1.00当量)、tert-ブチル4-(アミノメチル)ピペリジン-1-カルボキシレート(115.7mg、0.54mmol、1.10当量)、NMP(2mL)を入れた。得られた溶液を、油浴中で、150℃で一晩撹拌した。残渣を、H2O/MeCNを用いたフラッシュクロマトグラフィーによって精製した。これにより、130mg(49%)のtert-ブチル4-([[4-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリミジン-2-イル]アミノ]メチル)ピペリジン-1-カルボキシレートが黄色の油として得られた。
10mLの密閉管中に、tert-ブチル4-([[4-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリミジン-2-イル]アミノ]メチル)ピペリジン-1-カルボキシレート(130mg、0.24mmol、1.00当量)、塩化水素(6N、0.5mL)、メタノール(0.5mL)を入れた。得られた溶液を室温で30分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件(2#-AnalyseHPLC-SHIMADZU(HPLC-10)):カラム、XSelect CSH Prep C18 OBDカラム、5um、19*150mm;移動相、水(0.05%のHCl)およびACN(3.0%のACNから6分で15.0%まで);検出器、UV220nmを用いた分取HPLCによって精製した。これにより、9.9mg(9%)の4-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-2-N-(ピペリジン-4-イルメチル)ピリミジン-2,4-ジアミン塩酸塩がオフホワイトの固体として得られた。
1-(4-(((2-((4-クロロ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)ピリミジン-4-イル)アミノ)メチル)ピペリジン-1-イル)エタン-1-オンの合成:
50mLの丸底フラスコ中に、2-クロロ-5-ニトロフェノール(1g、5.76mmol、1.00当量)、N,N-ジメチルホルムアミド(10mL)、Cs2CO3(5.6g、17.13mmol、3.00当量)、NaI(867mg、5.78mmol、1.00当量)、1-(3-クロロプロピル)ピロリジン(1.1g、7.45mmol、1.00当量)を入れた。得られた溶液を、油浴中で、110℃で2時間撹拌した。反応を、水/氷の添加によってクエンチした。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×10mLの塩水で洗浄し、Na2SO4で乾燥させた。得られた混合物を減圧下で濃縮した。これにより、1.3g(79%)の1-[3-(2-クロロ-5-ニトロフェノキシ)プロピル]ピロリジンが黄色の固体として得られた。
100mLの丸底フラスコ中に、1-[3-(2-クロロ-5-ニトロフェノキシ)プロピル]ピロリジン(900mg、3.16mmol、1.00当量)、メタノール(20mL)、Fe(530.5mg、9.47mmol、3.00当量)、NH4Cl(502mg、9.38mmol、3.00当量)、水(1mL)を入れた。得られた溶液を、油浴中で、100℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、CH3CN/H2O(1:19)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、420mg(52%)の4-クロロ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリンが黄色の油として得られた。
10mLの密閉管中に、4-クロロ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(400mg、1.57mmol、1.00当量)、PTSA(541.7mg、3.15mmol、2.00当量)、1-(4-[(2-クロロピリミジン-4-イル)アミノ]メチルピペリジン-1-イル)エタン-1-オン(422mg、1.57mmol、1.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、85℃で10分間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(150mg)を、以下の条件(IntelFlash-1):カラム、C18シリカゲル;移動相、CH3CN/H2O(0.05%のNH3.H2O)=15%から7分以内にCH3CN/H2O(0.05%のNH3.H2O)=85%に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。78.3mgの生成物が得られた。これにより、78.3mg(10%)の1-[4-([[2-([4-クロロ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリミジン-4-イル]アミノ]メチル)ピペリジン-1-イル]エタン-1-オンが白色の固体として得られた。
2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)-N-メチルピリミジン-5-カルボキサミドの合成:
100mLの丸底フラスコ中に、2-クロロピリミジン-5-カルボン酸(1g、6.31mmol、1.00当量)、ジクロロメタン(20mL)、N,N-ジメチルホルムアミド(0.2mL)を入れた。この後、シュウ酸二塩化物(oxalic dichloride)(1.2g、9.45mmol、1.50当量)を0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、1.11g(99%)の2-クロロピリミジン-5-カルボニルクロリドが黄色の固体として得られた。
100mLの丸底フラスコ中に、メタンアミン塩酸塩(509mg、7.54mmol、1.20当量)、ジクロロメタン(20mL)、TEA(1.92g、18.97mmol、3.00当量)を入れた。この後、2-クロロピリミジン-5-カルボニルクロリド(1.11g、6.27mmol、1.00当量)を0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で2時間撹拌した。残渣を、酢酸エチル/石油エーテル(1:3)とともにシリカゲルカラム上に適用した。これにより、760mg(71%)の2-クロロ-N-メチルピリミジン-5-カルボキサミドが淡黄色の固体として得られた。
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-5-カルボキサミド(750mg、4.37mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(1.09g、4.35mmol、1.00当量)、TsOH(2.24g、13.18mmol、3.00当量)、イソプロパノール(10mL)を入れた。得られた溶液を、油浴中で、85℃で3時間撹拌した。粗生成物を、以下の条件(2#-AnalyseHPLC-SHIMADZU(HPLC-10)):カラム、XBridge Prep C18 OBDカラム、19×150mm 5um;移動相、水(0.05%のNH3H2O)およびACN(10.0%のACNから9分で35.0%まで);検出器、UV220254nmを用いた分取HPLCによって精製した。これにより、24.4mg(1%)の2-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)-N-メチルピリミジン-5-カルボキサミドがオフホワイトの固体として得られた。
N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-(ピペリジン-4-イルメチル)ピリジン-2,4-ジアミンの合成:
20mLの密閉管中に、2-ブロモ-4-クロロピリジン(1g、5.20mmol、1.00当量)、tert-ブチル4-(アミノメチル)シクロヘキサン-1-カルボキシレート(1.4g、6.56mmol、1.20当量)、TEA(1.1g、10.87mmol、2.00当量)、DMSO(10mL)を入れた。最終的な反応混合物に、120℃で1時間にわたってマイクロ波放射線を照射した。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、510mg(27%)のtert-ブチル4-[[(2-ブロモピリジン-4-イル)アミノ]メチル]シクロヘキサン-1-カルボキシレートが淡黄色の固体として得られた。
50mLの3口丸底フラスコ中に、tert-ブチル4-[[(2-ブロモピリジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(510mg、1.38mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(346mg、1.38mmol、1.00当量)、Pd2(dba)3CHCl3(127mg、0.14mmol、0.10当量)、BINAP(172mg、0.28mmol、0.20当量)、t-BuONa(265mg、2.76mmol、2.00当量)、トルエン(10mL)を入れた。得られた溶液を、油浴中で、85℃で3時間撹拌した。得られた溶液を3×50mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。残渣を、H2O/MeCNを用いたフラッシュクロマトグラフィーによって精製した。これにより、410mg(55%)のtert-ブチル4-([[2-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリジン-4-イル]アミノ]メチル)ピペリジン-1-カルボキシレートが淡黄色の固体として得られた。
50mLの丸底フラスコ中に、tert-ブチル4-([[2-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリジン-4-イル]アミノ]メチル)ピペリジン-1-カルボキシレート(390mg、0.72mmol、1.00当量)、ジオキサン(4mL)、塩化水素(2mL)を入れた。得られた溶液を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。炭酸カリウム(1mol/L)を用いて、溶液のpH値を9に調整した。粗生成物を、以下の条件(IntelFlash-1):カラム:X Bridge RP、19*150mm、5um;移動相A:水/10mmolのNH4HCO3、移動相B:ACN;流量:30mL/分;勾配:10分で10%のBから40%のB;254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、28.6mg(9%)の2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-(ピペリジン-4-イルメチル)ピリジン-2,4-ジアミンが褐色の固体として得られた。
N4-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N2-(ピペリジン-4-イルメチル)ピリジン-2,4-ジアミンの合成:
25mLの密閉管中に、tert-ブチル4-(アミノメチル)ピペリジン-1-カルボキシレート(500mg、2.33mmol、1.00当量)、4-ブロモ-2-フルオロピリジン(727mg、4.13mmol、1.00当量)、DMSO(8mL)、トリエチルアミン(687mg、6.79mmol、2.0当量)を入れた。最終的な反応混合物に、120℃で1時間にわたってマイクロ波放射線を照射した。反応混合物を20℃に冷却した。得られた溶液を30mLのH2Oで希釈した。得られた溶液を3×30mLの酢酸エチルで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、H2O/MeCN(1~0)とともにシリカゲルカラム上に適用した。これにより、400mg(47%)の2-クロロ-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]ピリジン-4-アミンが固体として得られた。
50mLの丸底フラスコ中に、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(270mg、1.08mmol、1.00当量)、tert-ブチル4-[[(4-ブロモピリジン-2-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(400mg、1.08mmol、1.00当量)、BINAP(135mg、0.22mmol、0.20当量)、t-BuONa(201mg、2.09mmol、2.00当量)、Pd2(dba)3CHCl3(112mg、0.11mmol、0.10当量)、トルエンを入れた。得られた溶液を、油浴中で、85℃で2.5時間撹拌した。反応混合物を20℃に冷却した。得られた溶液を20mLのH2Oで希釈した。得られた溶液を3×15mLのジクロロメタンで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、H2O/MeCN(3/1)とともにシリカゲルカラム上に適用した。これにより、320mg(55%)のtert-ブチル4-([[4-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリジン-2-イル]アミノ]メチル)ピペリジン-1-カルボキシレートが固体として得られた。
100mLの丸底フラスコ中に、tert-ブチル4-([[4-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリジン-2-イル]アミノ]メチル)ピペリジン-1-カルボキシレート(300mg、0.56mmol、1.00当量)、ジオキサン(15mL)、塩化水素/ジオキサン(15mL)を入れた。得られた溶液を20℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。炭酸カリウムを用いて、溶液のpH値を8~9に調整した。残渣を、H2O/MeCN(1~0)とともにシリカゲルカラム上に適用した。粗生成物(200mg)を、以下の条件(2#-AnalyseHPLC-SHIMADZU(HPLC-10)):カラム、XBridge Shield RP18 OBDカラム、5um、19*150mm;移動相、水(0.05%のNH3H2O)およびACN(3.0%のACNから6分で70.0%まで);検出器、UV254/220nmを用いた分取HPLCによって精製した。23.5。これにより、23.5mg(10%)の4-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-2-N-(ピペリジン-4-イルメチル)ピリジン-2,4-ジアミンが淡黄色の固体として得られた。
5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)-N-(2-(((テトラヒドロ-2H-ピラン-4-イル)アミノ)メチル)ピリジン-4-イル)ピリジン-2-アミンの合成:
100mLの丸底フラスコ中に、4-クロロピリジン-2-カルボニトリル(1g、7.22mmol、1.00当量)、ジフェニルメタンイミン(1.9g、10.48mmol、1.50当量)、Cs2CO3(7g、21.48mmol、3.00当量)、キサントホス(0.832g、0.20当量)、Pd(OAc)2(346mg、1.54mmol、0.10当量)、ジオキサン(30mL)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。次に、反応を、100mLの水の添加によってクエンチした。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を1×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(1.9g)を、以下の条件(IntelFlash-1):カラム、C18シリカゲル;移動相、MeCN:水=0:5から、120分以内にMeCN:水=3:1に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、1.3g(33%の収率)の4-(ジフェニルアミノ)ピリジン-2-カルボニトリルが黄色の固体として得られた。
50mLの丸底フラスコ中に、4-[(ジフェニルメチリデン)アミノ]ピリジン-2-カルボニトリル(1.23g、2.17mmol、1.00当量、50%)、塩化水素(2M)(8mL、2.00当量)、メタノール(24mL)を入れた。得られた溶液を室温で120分間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を2×10mLのジクロロメタンで抽出し、水相を組み合わせた。炭酸水素ナトリウム(飽和溶液)を用いて、水相のpH値を8に調整した。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を1×20mLの塩水で洗浄し、Na2SO4上で乾燥させ、固体をろ過して取り除いた。残渣を蒸発させ、得られた固体を、減圧下で、オーブン中で乾燥させた。これにより、0.28g(81%)の4-アミノピリジン-2-カルボニトリルが黄色の固体として得られた。
30mLの密閉管中に、2-ブロモ-5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン(314mg、1.00mmol、1.00当量)、4-アミノピリジン-2-カルボニトリル(240mg、2.01mmol、2.00当量)、Pd2(dba)3-クロロホルム(0.1g、0.10当量)、t-BuXPhos(0.085g、0.20当量)、Cs2CO3(970mg、2.97mmol、3.00当量)、ジオキサン(10mL)を入れた。得られた溶液を、油浴中で、110℃で16時間撹拌した。次に、反応を、50mLの水の添加によってクエンチした。得られた溶液を3×30mLの酢酸エチルで抽出し、有機層を組み合わせた。有機層を1×50mLの塩水で洗浄し、無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(3mL)を、以下の条件(CombiFlash-1):カラム、C18シリカゲル;移動相、MeCN:水=1:5から120分以内にMeCN:水=10:1に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。70mgの生成物が得られた。これにより、70mg(20%)の4-([5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-イル]アミノ)ピリジン-2-カルボニトリルがオフホワイトの固体として得られた。
25mLの丸底フラスコ中に、4-([5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-イル]アミノ)ピリジン-2-カルボニトリル(70mg、0.20mmol、1.00当量)、ラネーNi(0.2g)、メタノール(5mL)を入れた。混合物を、3回の水素/空気交換サイクルにかけた。得られた溶液を室温で120分間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、65mg(92%)のN-[2-(アミノメチル)ピリジン-4-イル]-5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミンがオフホワイトの固体として得られた
25mLの丸底フラスコ中に、N-[2-(アミノメチル)ピリジン-4-イル]-5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(66mg、0.18mmol、1.00当量)、1-(ナトリウムボラニル(sodioboranyl))エタン-1-オンアセチルアセテート二水和物(84mg、0.39mmol、3.50当量)、オキサン-4-オン(18mg、0.18mmol、1.00当量)、ジクロロメタン(3mL)を入れた。得られた溶液を室温で120分間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(1mL)を、以下の条件:カラム、XBride Prep C18 OBDカラム19×150mm 5umC-0013;移動相、相A:水(HCl)相B:ACN=1:1;検出器、254/220nmを用いた分取HPLCによって精製した。30.1mgの生成物が得られた。これにより、30.1mg(34%)の5-メトキシ-N-(2-[[(オキサン-4-イル)アミノ]メチル]ピリジン-4-イル)-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン塩酸塩が白色の固体として得られた。
1-(4-(((4-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)ピリジン-2-イル)(メチル)アミノ)メチル)ピペリジン-1-イル)エタン-1-オンの合成:
50mLの丸底フラスコ中に、1-[4-(アミノメチル)ピペリジン-1-イル]エタン-1-オン塩酸塩(500mg、2.59mmol、1.00当量)、4-ブロモ-2-フルオロピリジン(500mg、2.84mmol、1.10当量)、DIEA(0.546g、2.00当量)、DMSO(10mL)を入れた。得られた溶液を、油浴中で、120℃で180分間撹拌した。次に、反応を、50mLの水の添加によってクエンチした。得られた溶液を3×30mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(3mL)を、以下の条件(IntelFlash-1):カラム、C18シリカゲル;移動相、MeCN:水=1:10から60分以内にMeCN:水=10:1に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。0.34gの生成物が得られた。これにより、0.34g(40%)の1-(4-[[(4-ブロモピリジン-2-イル)アミノ]メチル]ピペリジン-1-イル)エタン-1-オンがオフホワイトの油として得られた。
25mLの丸底フラスコ中に、1-(4-[[(4-ブロモピリジン-2-イル)アミノ]メチル]ピペリジン-1-イル)エタン-1-オン(340mg、1.09mmol、1.00当量)、N,N-ジメチルホルムアミド(3mL)を入れた。混合物を0℃に冷却し、次に、水素化ナトリウム(28mg、1.20mol、1.10当量)を一度に加え、0℃で30分間撹拌し、ヨードメタン(250mg、1.76mmol、1.50当量)を滴下して加えた。得られた溶液を、水/氷浴中で、0℃で120分間撹拌した。次に、反応を、25mLの水の添加によってクエンチした。得られた溶液をジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。粗生成物(3mL)を、以下の条件(IntelFlash-1):カラム、C18シリカゲル;移動相、MeCN:水=1:10から120分以内にMeCN:水=10:1に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。0.31gの生成物が得られた。これにより、0.31g(87%)の1-(4-[[(4-ブロモピリジン-2-イル)(メチル)アミノ]メチル]ピペリジン-1-イル)エタン-1-オンが白色の固体として得られた。
100mLの丸底フラスコ中に、1-(4-[[(4-ブロモピリジン-2-イル)(メチル)アミノ]メチル]ピペリジン-1-イル)エタン-1-オン(290mg、0.89mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(440mg、1.76mmol、2.00当量)、Pd2(dba)3クロロホルム(0.092g、0.10当量)、BINAP(116mg、0.19mmol、0.20当量)、tBuONa(256mg、2.67mmol、3.00当量)、トルエン(15mL)を入れた。得られた溶液を、油浴中で、100℃で16時間撹拌した。次に、反応を、100の水の添加によってクエンチした。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を1×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(1.5mL)を、以下の条件:カラム、Xbridge Prep C18 OBDカラム19*150mm 5umC-0013;移動相、相A:水(0.05%のNH3H2O)相B:ACN勾配;検出器、254/220を用いた分取HPLCによって精製した。60.5mgの生成物が得られた。これにより、60.5mg(14%)の1-[4-([[4-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリジン-2-イル](メチル)アミノ]メチル)ピペリジン-1-イル]エタン-1-オンが白色の固体として得られた。
1-(4-(((2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)ピリミジン-4-イル)オキシ)メチル)ピペリジン-1-イル)エタン-1-オンの合成:
100mLの丸底フラスコ中に、2,4-ジクロロピリミジン(1g、6.71mmol、1.00当量)、tert-ブチル4-(ヒドロキシメチル)ピペリジン-1-カルボキシレート(1.45g、6.74mmol、1.00当量)、テトラヒドロフラン(20mL)、t-BuOK(1.51g、13.46mmol、2.00当量)を入れた。得られた溶液を20℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:1)とともにシリカゲルカラム上に適用した。これにより、1.5g(68%)のtert-ブチル4-[[(2-クロロピリミジン-4-イル)オキシ]メチル]ピペリジン-1-カルボキシレートがオフホワイトの固体として得られた。
100mLの丸底フラスコ中に、tert-ブチル4-[[(2-クロロピリミジン-4-イル)オキシ]メチル]ピペリジン-1-カルボキシレート(1.5g、4.58mmol、1.00当量)、ジクロロメタン(15mL)、トリフルオロ酢酸(5mL)を入れた。得られた溶液を20℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、以下の条件(IntelFlash-1):カラム、シリカゲル;移動相、;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、1.8mg(粗製)の2-クロロ-4-(ピペリジン-4-イルメトキシ)ピリミジンが黄色の粗製油として得られた。
100mLの3口丸底フラスコ中に、2-クロロ-4-(ピペリジン-4-イルメトキシ)ピリミジン(1.5g、6.59mmol、1.00当量)、ジクロロメタン(10mL)、TEA(2g、19.76mmol、3.00当量)を入れた。この後、塩化アセチル(780mg、9.94mmol、1.50当量)を、0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、1g(56%)の1-(4-[[(2-クロロピリミジン-4-イル)オキシ]メチル]ピペリジン-1-イル)エタン-1-オンが黄色の油として得られた。
50mLの丸底フラスコ中に、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(278.8mg、1.11mmol、1.00当量)、1-(4-[[(2-クロロピリミジン-4-イル)オキシ]メチル]ピペリジン-1-イル)エタン-1-オン(300mg、1.11mmol、1.00当量)、TosOH(568.8mg、3.35mmol、3.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。粗生成物を、以下の条件(IntelFlash-1):カラム、シリカゲル;移動相、;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、71.6mg(13%)の1-[4-([[2-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)ピリミジン-4-イル]オキシ]メチル)ピペリジン-1-イル]エタン-1-オンがピンク色の固体として得られた。
1-(2-メトキシ-5-((4-((ピペリジン-4-イルメチル)アミノ)ピリミジン-2-イル)アミノ)フェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールの合成:
100mLの3口丸底フラスコ中に、N,N-ジメチルホルムアミド(20mL)中の2-メトキシ-5-ニトロフェノール(2g、11.82mmol、1.00当量)の溶液、2-(ブロモメチル)オキシラン(2.43g、17.74mmol、1.50当量)、炭酸カリウム(3.27g、23.66mmol、2.00当量)を入れた。得られた溶液を室温で一晩撹拌した。得られた溶液を50mLのEAで希釈し、3×50mLの塩水で洗浄し、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:10~1:1)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、1.71g(64%)の2-(2-メトキシ-5-ニトロフェノキシメチル)オキシランがオフホワイトの固体として得られた。
50mLの3口丸底フラスコ中に、エタノール(8mL)中の2-(2-メトキシ-5-ニトロフェノキシメチル)オキシラン(1.4g、6.22mmol、1.00当量)の溶液、ピロリジン(1.1g、15.47mmol、2.50当量)、クロロホルム(8mL)を入れた。得られた溶液を、油浴中で、40℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ジクロロメタン/メタノール(100:~10:1)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、1.7g(92%)の1-(2-メトキシ-5-ニトロフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールが黄色の油として得られた。
100mLの丸底フラスコ中に、1-(2-メトキシ-5-ニトロフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(1.7g、5.74mmol、1.00当量)、パラジウム炭素(10%)(200mg)およびメタノール(20mL)を入れた。混合物を、3回の水素/空気交換サイクルにかけた。得られた溶液を室温で4時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.6g(105%)の1-(5-アミノ-2-メトキシフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールが暗赤色の油として得られた。
50mLの3口丸底フラスコ中に、1-(5-アミノ-2-メトキシフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(310mg、1.16mmol、1.00当量)、イソプロパノール(10mL)、tert-ブチル4-[[(2-クロロピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(381mg、1.17mmol、1.00当量)、TsOH(1H2O)(1.107g、5.83mmol、5.00当量)を入れた。得られた溶液を、油浴中で、85℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を20mLのH2Oに溶解させた。炭酸ナトリウムを用いて、pHを9に調整した。得られた溶液を3×20mLのクロロホルム/イソプロパノール(1/1)で抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、MeCN/H2O(40%)を用いたフラッシュクロマトグラフィーによって精製した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、77.9mg(15%)の1-[2-メトキシ-5-([4-((ピペリジン-4-イルメチル)アミノ]ピリミジン-2-イル)アミノ)フェノキシ]-3-(ピロリジン-1-イル)プロパン-2-オールが白色の固体として得られた。
N2-(4-メトキシ-3-(3-モルホリノプロポキシ)フェニル)-N4-(ピペリジン-4-イルメチル)ピリミジン-2,4-ジアミンの合成:
50mLの丸底フラスコ中に、2-メトキシ-5-ニトロフェノール(1.1g、6.50mmol、1.00当量)、4-(3-クロロプロピル)モルホリン塩酸塩(1.3g、6.50mmol、1.00当量)、Cs2CO3(6.39g、19.61mmol、3.00当量)、NaI(980mg、1.00当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を110℃で16時間撹拌した。得られた溶液を50mLのH2Oで希釈した。得られた溶液を100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を5×100mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。これにより、1.17g(61%)の4-[3-(2-メトキシ-5-ニトロフェノキシ)プロピル]モルホリンが黄色の固体として得られた。
50mLの丸底フラスコ中に、4-[3-(2-メトキシ-5-ニトロフェノキシ)プロピル]モルホリン(450mg、1.52mmol、1.00当量)、NH4Cl(242mg、4.52mmol、3.00当量)、エタノール(12mL)、水(3mL)、Fe(256mg、4.57mmol、3.00当量)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物を、C18 Flash:ACN/H2O(1/4)によって精製した。これにより、200mg(49%)の4-メトキシ-3-[3-(モルホリン-4-イル)プロポキシ]アニリンが黄色の油として得られた。
50mLの丸底フラスコ中に、4-メトキシ-3-[3-(モルホリン-4-イル)プロポキシ]アニリン(200mg、0.75mmol、1.00当量)、tert-ブチル4-[(2-クロロピリミジン-4-イル)アミノ]メチルピペリジン-1-カルボキシレート(184mg、0.56mmol、1.00当量)、PTSA(485mg、2.82mmol、5.00当量)、イソプロパノール(8mL)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。得られた溶液を3×30mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で濃縮した。粗生成物を、以下の条件:カラム:X Bridge RP、19*150mm、5um;移動相A:水/10mmolのNH4HCO3、移動相B:ACN;流量:30mL/分;勾配:10分で15%のBから43%のB;254nmを用いた分取HPLCによって精製した。これにより、31.1mg(9%)の2-N-[4-メトキシ-3-[3-(モルホリン-4-イル)プロポキシ]フェニル]-4-N-(ピペリジン-4-イルメチル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
N2-(3-(2-((シクロペンチルメチル)アミノ)エチル)-4-メトキシフェニル)-N4-(ピペリジン-4-イルメチル)ピリミジン-2,4-ジアミンの合成:
250mLの3口丸底フラスコ中に、1-メトキシ-4-ニトロベンゼン(12g、78.36mmol、1.00当量)、CH3NO3(100mL)、AlCl3(25.9g、2.50当量)を入れた。この後、2-メトキシアセチルクロリド(9.32g、85.88mmol、1.10当量)を、0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で5時間撹拌した。次に、反応を、100mLの水/氷の添加によってクエンチした。得られた溶液を2×120mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で濃縮した。残渣を、ジクロロメタン/石油エーテル(1/4)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、6.9g(44%)の2-(クロロメチル)-1-メトキシ-4-ニトロベンゼンがオフホワイトの固体として得られた。
250mLの丸底フラスコ中に、2-(クロロメチル)-1-メトキシ-4-ニトロベンゼン(6.9g、34.23mmol、1.00当量)、DMSO(100mL)、KCN(13.4g、205.77mmol、6.00当量)を入れた。得られた溶液を50℃で2時間撹拌した。得られた溶液を200mLのH2Oで希釈した。得られた溶液を2×200mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を4×300mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、ジクロロメタン/石油エーテル(1/1)とともにシリカゲルカラム上に適用した。これにより、4.58g(70%)の2-(2-メトキシ-5-ニトロフェニル)アセトニトリルがオフホワイトの固体として得られた。
250mLの丸底フラスコ中に、2-(2-メトキシ-5-ニトロフェニル)アセトニトリル(4.58g、23.83mmol、1.00当量)、Fe(4g、3.00当量)、NH4Cl(3.79g、70.85mmol、3.00当量)、エタノール(100mL)、水(20mL)を入れた。得られた溶液を85℃で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、3.6g(93%)の2-(5-アミノ-2-メトキシフェニル)アセトニトリルが褐色の固体として得られた。
窒素の不活性雰囲気でパージされ、維持された250mLの丸底フラスコ中に、2-(5-アミノ-2-メトキシフェニル)アセトニトリル(1.8g、11.10mmol、1.00当量)、tert-ブチル4-[[(2-クロロピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(3.62g、11.08mmol、1.00当量)、Pd(OAc)2(249mg、1.11mmol、0.10当量)、キサントホス(642mg、1.11mmol、0.20当量)、炭酸カリウム(4.6g、33.28mmol、3.00当量)、トルエン(100mL)を入れた。得られた溶液を115℃で16時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(3/2)とともにシリカゲルカラム上に適用した。これにより、2.52g(50%)のtert-ブチル4-[[(2-[[3-(シアノメチル)-4-メトキシフェニル]アミノ]ピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレートが黄色の固体として得られた。
250mLの丸底フラスコ中に、tert-ブチル4-[[(2-[[3-(シアノメチル)-4-メトキシフェニル]アミノ]ピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(2.52g、5.57mmol、1.00当量)、NH3/MeOH(20mL)、酢酸エチル(10mL)、ラネーNi(1g)を入れた。混合物を、3回の水素/空気交換サイクルにかけた。得られた溶液を20℃で18時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、2.4g(94%)のtert-ブチル4-[[(2-[[3-(2-アミノエチル)-4-メトキシフェニル]アミノ]ピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレートが褐色の油として得られた。
50mLの丸底フラスコ中に、tert-ブチル4-[[(2-[[3-(2-アミノエチル)-4-メトキシフェニル]アミノ]ピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(400mg、0.88mmol、1.00当量)、シクロペンタンカルバルデヒド(69mg、0.70mmol、0.80当量)、ジクロロメタン(20mL)を入れ、20℃で0.5時間撹拌した。この後、アセチルエタンペルオキソエートナトリウムボラニルアセテート(acetyl ethaneperoxoate sodioboranyl acetate)(1.1g、5.19mmol、6.00当量)を0℃で少しずつ加えた。得られた溶液を20℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(2/3)とともにシリカゲルカラム上に適用した。これにより、130mg(28%)のtert-ブチル4-[([2-[(3-[2-[(シクロペンチルメチル)アミノ]エチル]-4-メトキシフェニル)アミノ]ピリミジン-4-イル]アミノ)メチル]ピペリジン-1-カルボキシレートが黄色の油として得られた。
50mLの丸底フラスコ中に、tert-ブチル4-[([2-[(3-[2-[(シクロペンチルメチル)アミノ]エチル]-4-メトキシフェニル)アミノ]ピリミジン-4-イル]アミノ)メチル]ピペリジン-1-カルボキシレート(130mg、0.24mmol、1.00当量)、ジクロロメタン(10mL)、トリフルオロ酢酸(1.5mL)を入れた。得られた溶液を20℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を10mLのH2Oで希釈した。炭酸水素ナトリウムを用いて、溶液のpH値を8に調整した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/6)とともにシリカゲルカラム上に適用した。これにより、48.2mg(46%)の2-N-(3-[2-[(シクロペンチルメチル)アミノ]エチル]-4-メトキシフェニル)-4-N-(ピペリジン-4-イルメチル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
1-(4-(((2-((4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)アミノ)ピリミジン-4-イル)アミノ)メチル)ピペリジン-1-イル)エタン-1-オンの合成:
100mLの丸底フラスコ中に、(1-メチルピロリジン-3-イル)メタノール(500mg、4.34mmol、1.00当量)、TEA(1.3g、12.85mmol、3.00当量)、ジクロロメタン(20mL)を入れた。MsCl(743mg、1.50当量)を、0℃で滴下して加えた。得られた溶液を25℃で2時間撹拌した。得られた溶液を、20mLの水でクエンチし、3×100mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、700mg(83%)の(1-メチルピロリジン-3-イル)メチルメタンスルホネートが黄色の油として得られた。
50mLの丸底フラスコ中に、(1-メチルピロリジン-3-イル)メチルメタンスルホネート(150mg、0.78mmol、1.00当量)、Cs2CO3(760mg、2.33mmol、3.00当量)、N,N-ジメチルホルムアミド(10mL)、2-メトキシ-5-ニトロフェノール(132mg、0.78mmol、1.00当量)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。固体をろ過して取り除いた。残渣を10mLの水で洗浄し、3×20mLの酢酸エチルで抽出し、有機相を組み合わせて、3×50mLの塩水で洗浄し、Na2SO4上で乾燥させ、固体をろ過して取り除き、残渣を蒸発させた。粗生成物を、以下の条件(IntelFlash-1):カラム、シリカゲル;移動相、ACN/H2O=6/1;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、180mg(87%)の3-(2-メトキシ-5-ニトロフェノキシメチル)-1-メチルピロリジンが黄色の油として得られた。
100mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシメチル)-1-メチルピロリジン(250mg、0.94mmol、1.00当量)、パラジウム炭素、メタノール(30mL)を入れた。混合物を、3回の水素/空気交換サイクルにかけた。得られた溶液を25℃で4時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、200mg(90%)の4-メトキシ-3-[(1-メチルピロリジン-3-イル)メトキシ]アニリンが白色の固体として得られた。
50mLの丸底フラスコ中に、4-メトキシ-3-[(1-メチルピロリジン-3-イル)メトキシ]アニリン(150mg、0.63mmol、1.00当量)、イソプロパノール(20mL)、p-TsOH(327mg、3.00当量)、1-(4-[(2-クロロピリミジン-4-イル)アミノ]メチルピペリジン-1-イル)エタン-1-オン(170mg、0.63mmol、1.00当量)を入れた。得られた溶液を、油浴中で、85℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、以下の条件(カラム:X Select C18、19*150mm、5um):カラム;移動相、移動相A:水/0.05%のNH4HCO3、移動相B:ACN;検出器を用いた分取HPLCによって精製した。これにより、156.6mg(53%)の1-[4-([[2-([4-メトキシ-3-[(1-メチルピロリジン-2-イル)メトキシ]フェニル]アミノ)ピリミジン-4-イル]アミノ]メチル)ピペリジン-1-イル]エタン-1-オンが白色の固体として得られた。
1-(4-(((2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)-6-メチルピリミジン-4-イル)アミノ)メチル)ピペリジン-1-イル)エタン-1-オンの合成:
25mLの丸底フラスコ中に、1-[4-(アミノメチル)ピペリジン-1-イル]エタン-1-オン(300mg、1.92mmol、1.00当量)、N,N-ジメチルホルムアミド(5mL)、炭酸カリウム(651mg、4.71mmol、3.00当量)、2,4-ジクロロ-6-メチルピリミジン(251mg、1.54mmol、1.00当量)を入れた。得られた溶液を、油浴中で、60℃で7時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、H2O/MeCN(1~0)とともにシリカゲルカラム上に適用した。これにより、0.21g(48%)の1-(4-[[(2-クロロ-6-メチルピリミジン-4-イル)アミノ]メチル]ピペリジン-1-イル)エタン-1-オンが白色の固体として得られた。
25mLの丸底フラスコ中に、1-(4-[[(2-クロロ-6-メチルピリミジン-4-イル)アミノ]メチル]ピペリジン-1-イル)エタン-1-オン(200mg、0.71mmol、1.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(195mg、0.78mmol、1.10当量)、TsOH(269mg、1.42mmol、2.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、85℃で7時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をH2O/MeCN(1~0)とともにシリカゲルカラム上に適用した。これにより、61.2mg(17%)の1-[4-([[2-([4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]アミノ)-6-メチルピリミジン-4-イル]アミノ]メチル)ピペリジン-1-イル]エタン-1-オンがピンク色の固体として得られた。
化合物47:1-(4-(((2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)ピリミジン-4-イル)アミノ)メチル)ピペリジン-1-イル)エタン-1-オン
250mLの3口丸底フラスコ中に、N,N-ジメチルホルムアミド(50mL)中の2,4-ジクロロピリミジン(5.0g、33.56mmol、1当量)の溶液、tert-ブチル4-(アミノメチル)ピペリジン-1-カルボキシレート(7.18g、33.50mmol、1当量)、炭酸カリウム(9.26g、2.00当量)を入れた。得られた溶液を室温で2時間撹拌した。得られた溶液を50mLのEAで希釈し、3×50mLの塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:10~1:2)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、8.1g(74%)の表題化合物が無色油として得られた。
分析データ:(ES、m/z):RT=1.449min、LCMS 28:m/z=327[M+1].H-NMR:(400MHz、メタノール-d4)δ 8.83-8.68(m,1H)、7.26(d,J=5.8Hz、1H)、5.01-4.56(m,2H)、4.06-3.80(m,2H)、3.49(s,2H)、2.58-2.37(m,3H)、2.20(s,9H)、1.95-1.69(m,2H).
50mLの3口丸底フラスコ中に、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(764mg、3.05mmol、1当量)、tert-ブチル4-[[(2-クロロピリミジン-4-イル)アミノ]メチル]ピペリジン-1-カルボキシレート(1g、3.06mmol、1当量)、TsOH(2.9g、15.26mmol、5.00当量)、IPA(10mL)を入れた。得られた溶液を、油浴中で、85℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/10)を用いたフラッシュクロマトグラフィーによって精製した。これにより、800mg(59%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.900min、LCMS 07:m/z=441[M+1].
10mLの密閉管中に、2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-(ピペリジン-4-イルメチル)ピリミジン-2,4-ジアミン(250mg、0.57mmol、1当量)、酢酸アセチル(63.6mg、0.62mmol、1.10当量)、TEA(114.5mg、2.00当量)、ACN(3mL)を入れた。得られた溶液を室温で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/10)を用いたフラッシュクロマトグラフィーによって精製した。これにより、61.2mg(22%)の1-(4-(((2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)ピリミジン-4-イル)アミノ)メチル)ピペリジン-1-イル)エタン-1-オンが白色の固体として得られた。
化合物205:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、2-クロロ-N,6-ジメチルピリミジン-4-アミン(1.5g、9.52mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(864mg、3.45mmol、1当量)、トリフルオロ酢酸(684mg、6.05mmol、1当量)、イソプロパノール(50mL)を入れた。得られた溶液を85℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC Gによって精製した。これにより、1.295g(32%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが固体として得られた。
化合物207:N4-メチル-N2-(3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)ピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、3-ニトロフェノール(600mg、4.31mmol、1当量)、1-(3-クロロプロピル)ピロリジン塩酸塩(790mg、4.29mmol、1当量)、Cs2CO3(4.22g、12.95mmol、3.00当量)、NaI(647mg、4.31mmol、1当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を110℃で4時間撹拌した。得られた溶液を30mLのH2Oで希釈した。得られた溶液を3×60mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を4×60mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。これにより、1g(93%)の表題化合物が褐色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.975min、LCMS 53:m/z=251[M+1].
100mLの丸底フラスコ中に、1-[3-(3-ニトロフェノキシ)プロピル]ピロリジン(1g、4.00mmol、1当量)、メタノール(20mL)、Pd/C(0.5g)を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、0.7g(80%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.586min、LCMS 07:m/z=221[M+1].
50mLの丸底フラスコ中に、3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(400mg、1.82mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(259mg、1.80mmol、1当量)、4-メチルベンゼン-1-スルホン酸(464mg、2.69mmol、1.50当量)、イソプロパノール(10mL)を入れた。得られた溶液を85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/5)とともにシリカゲルカラム上に適用した。これにより、104.7mg(18%)のN4-メチル-N2-(3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物209:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリジン-2,4-ジアミンの合成
60mLの密閉管中に、2-ブロモ-4-フルオロピリジン(500mg、2.84mmol、1当量)、NH2CH3-THF(20mL)を入れた。得られた溶液を、油浴中で、80℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、480mg(90%)の表題化合物が無色油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.758min、LCMS 27:m/z=187[M+1].
窒素の不活性雰囲気でパージされ、維持された16mLの密閉管中に、2-ブロモ-N-メチルピリジン-4-アミン(400mg、2.14mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(640mg、2.56mmol、1.20当量)、t-BuONa(616mg、6.41mmol、3.00当量)、BINAP(133mg、0.21mmol、0.10当量)、Pd2(dba)3CHCl3(220mg、0.10当量)、トルエン(8mL)を入れた。得られた溶液を、油浴中で、100℃で3時間撹拌した。固体をろ過して取り除いた。粗生成物を、以下の条件(CombiFlash-1):カラム、C18シリカゲル;移動相、メタノール/H2Oから分以内にメタノール/H2O=9/1に増加する;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製し、生成物が得られた。粗生成物を、分取HPLC Hによって精製した。これにより、57.5mg(7%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリジン-2,4-ジアミンが固体として得られた。
化合物256:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-(オキセタン-3-イルメチル)ピリミジン-2,4-ジアミンの合成
20mLのバイアル中に、N,N-ジメチルホルムアミド(3mL)、2,4-ジクロロピリミジン(595mg、3.99mmol、1当量)、オキセタン-3-イルメタンアミン(350mg、4.02mmol、1.01当量)、炭酸カリウム(555mg、4.02mmol、1.01当量)を入れた。得られた溶液を20℃で2時間撹拌した。残渣を、ACN/H2O(1:9)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、570mg(71%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.84min、LCMS33:m/z=200[M+1].
20mLの丸底フラスコ中に、2-クロロ-N-(オキセタン-3-イルメチル)ピリミジン-4-アミン(200mg、1mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(251mg、1mmol、1当量)、トリフルオロ酢酸(195mg、1.73mmol、2.00当量)、プロパン-2-オール(2mL)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC Cによって精製した。これにより、20.1mg(4%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-(オキセタン-3-イルメチル)ピリミジン-2,4-ジアミンが黄色の固体として得られた。
化合物257:N-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1-メチル-1H-ピラゾロ[3,4-b]ピリジン-6-アミンの合成
100mLの丸底フラスコ中に、N,N-ジメチルホルムアミド(10mL)、水素化ナトリウム(235mg、9.79mmol、1.50当量)を入れた。この後、6-クロロ-1H-ピラゾロ[3,4-b]ピリジン(1g、6.51mmol、1当量)を0℃で加えた。得られた溶液を0℃で30分間撹拌した。上記のものに、ヨードメタン(1.02g、7.19mmol、1.10当量)を加えた。反応物を、0℃で2時間反応させた。次に、反応を、5mLの水の添加によってクエンチした。残渣を、水/ACN(7:3)とともにC18カラム上に適用した。これにより、500mg(46%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.729min、LCMS 27:m/z=168[M+1].
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、ジオキサン(10mL)、6-クロロ-1-メチル-1H-ピラゾロ[3,4-b]ピリジン(200mg、1.19mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(300mg、1.20mmol、1当量)、Pd2(dba)3CHCl3(186mg、0.18mmol、0.15当量)、キサントホス(210mg、0.36mmol、0.30当量)、Cs2CO3(780mg、2.39mmol、2.01当量)を入れた。得られた溶液を80℃で14時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC Dによって精製した。これにより、97.0mg(19%)のN-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1-メチル-1H-ピラゾロ[3,4-b]ピリジン-6-アミンが固体として得られた。
化合物258:N-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1-メチル-1H-イミダゾ[4,5-c]ピリジン-6-アミンの合成
30mLの密閉管中に、2,4-ジクロロ-5-ニトロピリジン(2g、10.36mmol、1当量)、DIEA(2.69g、20.81mmol、2.00当量)、テトラヒドロフラン(20mL)、NH2CH3-HCl(1.06g、2.00当量)を入れた。得られた溶液を25℃で12時間撹拌した。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、1.2g(62%)が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):188[M+1]、R:1.12min。
100mLの丸底フラスコ中に、2-クロロ-N-メチル-5-ニトロピリジン-4-アミン(2g、10.66mmol、1当量)、Fe(2.99g、5.00当量)、NH4Cl(5.7g、106.56mmol、10.00当量)、メタノール(20mL)、水(20mL)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、600mg(36%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):158[M+1]、R:0.982min。
100mLの丸底フラスコ中に、6-クロロ-4-N-メチルピリジン-3,4-ジアミン(500mg、3.17mmol、1当量)、トリメトキシメタン(20mL)を入れた。得られた溶液を、油浴中で、100℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、200mg(38%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):168[M+1]、R:0.841min。
30mLの密閉管中に、6-クロロ-1-メチル-1H-イミダゾ[4,5-c]ピリジン(300mg、1.79mmol、1当量)、Cs2CO3(1.76g、5.40mmol、3.00当量)、Pd2(dba)3-CHCl3(100mg)、X-phos(100mg)、1,4-ジオキサン(15mL)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(540mg、2.16mmol、1.20当量)を入れた。得られた溶液を、油浴中で、100℃で4時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC Eによって精製した。これにより、54.2mg(7%)のN-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1-メチル-1H-イミダゾ[4,5-c]ピリジン-6-アミンが黄色の固体として得られた。
化合物259:N2-(4-メトキシ-3-((2-メチル-2-アザスピロ[4.5]デカン-8-イル)オキシ)フェニル)-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、エチル2-(ジエトキシホスホリル)アセテート(14.4g、64.23mmol、1当量)、テトラヒドロフラン(150mL)、水素化ナトリウム(5.12g、213.33mmol、3.33当量)、1,4-ジオキサスピロ[4.5]デカン-8-オン(10g、64.03mmol、1当量)を入れた。得られた溶液を0℃で一晩撹拌した。次に、反応を、50mLの水の添加によってクエンチした。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:5)とともにシリカゲルカラム上に適用した。これにより、12g(83%)が黄色の液体として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 5.67(p,J=1.1Hz、1H)、4.15(q,J=7.1Hz、2H)、3.98(s,4H)、3.00(ddd,J=7.8、5.1、1.2Hz、2H)、2.44-2.32(m,2H)、1.84-1.70(m,4H)、1.28(t,J=7.1Hz、3H).
500mLの丸底フラスコ中に、エチル2-[1,4-ジオキサスピロ[4.5]デカン-8-イリデン]アセテート(12g、53.03mmol、1当量)、テトラヒドロフラン(150mL)、ニトロメタン(13g、212.98mmol、4.02当量)、TBAFテトラヒドロフラン(80mL)を入れた。得られた溶液を70℃で一晩撹拌した。得られた溶液を3×30mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×30mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:5)とともにシリカゲルカラム上に適用した。これにより、11g(72%)の表題化合物が黄色の液体として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 4.73(s,2H)、4.17(q,J=7.1Hz、2H)、3.95(s,4H)、2.57(s,2H)、1.85-1.63(m,6H)、1.35-1.18(m,3H).
500mLの丸底フラスコ中に、エチル2-[8-(ニトロメチル)-1,4-ジオキサスピロ[4.5]デカン-8-イル]アセテート(5g、17.40mmol、1当量)、メタノール(200mL)、ラネーNi(1g)、TEA(5g、49.41mmol、2.84当量)、水素(500mL)を入れた。得られた溶液を室温で一晩撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、4g(100%)の表題化合物が白色の固体として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 6.35(s,1H)、3.96(s,4H)、3.21(s,2H)、2.23(s,2H)、1.79-1.60(m,8H).
1Lの丸底フラスコ中に、1,4-ジオキサ-10-アザジスピロ[4.2.48.25]テトラデカン-11-オン(5.28g、24.99mmol、1当量)、テトラヒドロフラン(500mL)、LAH(2.85g、75.10mmol、3.00当量)を0℃で入れた。1時間後、得られた溶液を50℃で一晩撹拌した。次に、反応を、2.85gの水、2.85gの15%のNaOH、8.55gの水の添加によってクエンチした。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、3.6g(73%)の表題化合物が無色油として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 5.14(s,1H)、3.96(s,4H)、3.06(t,J=7.2Hz、2H)、2.81(s,2H)、1.65(d,J=6.2Hz、10H).
250mLの丸底フラスコ中に、1,4-ジオキサ-10-アザジスピロ[4.2.48.25]テトラデカン(3.6g、18.25mmol、1当量)、炭酸ナトリウム(7.3g、68.87mmol、3.77当量)、水(20mL)、テトラヒドロフラン(20mL)、クロロギ酸ベンジル(3.7g、21.69mmol、1.19当量)を入れた。得られた溶液を室温で一晩撹拌した。得られた溶液を3×50mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×50mLのH2Oで洗浄した。固体を、減圧下で、オーブン中で乾燥させた。残渣を、酢酸エチル/石油エーテル(2:1)とともにシリカゲルカラム上に適用した。これにより、3.5g(58%)の表題化合物が無色の液体として得られた。
1H NMR(300MHz、クロロホルム-d)δ 7.47-7.30(m,5H)、3.96(s,4H)、3.49(t,J=7.2Hz、2H)、3.28(s,2H)、1.86-1.51(m,10H).
250mLの丸底フラスコ中に、ベンジル1,4-ジオキサ-10-アザジスピロ[4.2.48.25]テトラデカン-10-カルボキシレート(2.5g、7.54mmol、1当量)、メタノール(50mL)を入れた。この後、HCl(10mL)2Nを加えた。得られた溶液を室温で一晩撹拌した。得られた溶液を3×30mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×30mLのH2Oで洗浄した。固体を、減圧下で、オーブン中で乾燥させた。これにより、2.0g(83%)の表題化合物が無色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.877min、LCMS 45、m/z=288[M+1].
100mLの丸底フラスコ中に、ベンジル8-オキソ-2-アザスピロ[4.5]デカン-2-カルボキシレート(1.77g、6.16mmol、1当量)、メタノール(30mL)、NaBH4(350mg、9.25mmol、1.50当量)を入れた。得られた溶液を室温で1時間撹拌した。次に、反応を、10mLの水の添加によってクエンチした。得られた溶液を3×20mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×20mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.6g(81%)の表題化合物が無色の液体として得られた。
LC-MS:(ES、m/z):RT=0.876min、LCMS 45、m/z=290[M+1].
250mLの丸底フラスコ中に、ベンジル8-ヒドロキシ-2-アザスピロ[4.5]デカン-2-カルボキシレート(1.87g、6.46mmol、1当量)、ジクロロメタン(50mL)、TEA(1.96g、19.37mmol、3.00当量)、MsCl(885mg)を入れた。得られた溶液を0℃で1時間撹拌した。次に、反応を、20mLの水の添加によってクエンチした。得られた溶液を3×30mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×30mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、2.0g(76%)の表題化合物が無色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.301min、LCMS 53、m/z=368[M+1].
100mLの丸底フラスコ中に、ベンジル8-(メタンスルホニルオキシ)-2-アザスピロ[4.5]デカン-2-カルボキシレート(2.5g、6.80mmol、1当量)、2-メトキシ-5-ニトロフェノール(1.27g、7.51mmol、1.10当量)、Cs2CO3(4.5g、13.81mmol、2.03当量)、N,N-ジメチルホルムアミド(25mL)を入れた。得られた溶液を80℃で5時間撹拌した。次に、反応を、50mLの水の添加によってクエンチした。得られた溶液を3×50mLのエーテルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(2:1)とともにシリカゲルカラム上に適用した。これにより、970mg(31%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.486min、LCMS 53、m/z=441[M+1].
100mLの丸底フラスコ中に、ベンジル8-(2-メトキシ-5-ニトロフェノキシ)-2-アザスピロ[4.5]デカン-2-カルボキシレート(900mg、2.04mmol、1当量)、トリフルオロ酢酸(5mL)を入れた。得られた溶液を60℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、900mg(129%)の表題化合物が黄色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.968min、LCMS 34、m/z=307[M+1].
100mLの丸底フラスコ中に、8-(2-メトキシ-5-ニトロフェノキシ)-2-アザスピロ[4.5]デカン(800mg、2.61mmol、1当量)、メタノール(20mL)、NaBH3CN(832mg、13.24mmol、5.07当量)、HCHO(780mg)を入れた。得られた溶液を室温で一晩撹拌した。次に、反応を、20mLの水の添加によってクエンチした。得られた溶液を3×50mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×50mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。粗生成物を、フラッシュ-分取HPLC A MeOHによって精製した。これにより、300mg(32%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.777min、LCMS 45、m/z=321[M+1].
100mLの丸底フラスコ中に、8-(2-メトキシ-5-ニトロフェノキシ)-2-メチル-2-アザスピロ[4.5]デカン(300mg、0.94mmol、1当量)、メタノール(20mL)、Pd/Cl(50mg)、水素(100mL)を入れた。得られた溶液を室温で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、220mg(73%)の表題化合物が明るい赤色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.773min、LCMS 28、m/z=291[M+1].
10mLの丸底フラスコ中に、4-メトキシ-3-([2-メチル-2-アザスピロ[4.5]デカン-8-イル]オキシ)アニリン(120mg、0.41mmol、1当量)、2-クロロ-N-(オキサン-4-イルメチル)ピリミジン-4-アミン(94mg、0.41mmol、1当量)、トリフルオロ酢酸(50mg、0.44mmol、1.07当量)、イソプロパノール(5mL)を入れた。得られた溶液を85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C-HClによって精製した。これにより、14.0mg(6%)のN2-(4-メトキシ-3-((2-メチル-2-アザスピロ[4.5]デカン-8-イル)オキシ)フェニル)-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物260:N2-(4-メトキシ-3-((2-メチル-2-アザスピロ[3.5]ノナン-7-イル)オキシ)フェニル)-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、tert-ブチル7-ヒドロキシ-2-アザスピロ[3.5]ノナン-2-カルボキシレート(300mg、1.24mmol、1当量)、ジクロロメタン(10mL)、トリエチルアミン(377mg、3.73mmol、3.00当量)、メタンスルホニルクロリド(286mg、2.50mmol、2.01当量)を入れた。得られた溶液を室温で2時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×50mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、350mg(88%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.279min、LCMS 31:m/z=320.45[M+1].
50mLの丸底フラスコ中に、tert-ブチル7-(メタンスルホニルオキシ)-2-アザスピロ[3.5]ノナン-2-カルボキシレート(450mg、1.41mmol、1当量)、Cs2CO3(1.38g、4.24mmol、3.01当量)、N,N-ジメチルホルムアミド(5mL)、2-メトキシ-5-ニトロフェノール(358mg、2.12mmol、1.50当量)を入れた。得られた溶液を80℃で2時間撹拌した。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC A Gradによって精製した。これにより、220mg(40%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=2.215min、LCMS 45:m/z=378.20[M+1].1H NMR(300MHz、クロロホルム-d)δ 7.90(dd,J=9.0、2.6Hz、1H)、7.74(d,J=2.7Hz、1H)、6.92(d,J=9.0Hz、1H)、4.40-4.28(m,1H)、3.95(s,3H)、3.64(d,J=7.1Hz、4H)、2.05-1.92(m,4H)、1.77-1.58(m,4H)、1.45(s,9H).
50mLの丸底フラスコ中に、tert-ブチル7-(2-メトキシ-5-ニトロフェノキシ)-2-アザスピロ[3.5]ノナン-2-カルボキシレート(220mg、0.56mmol、1当量)、トリフルオロ酢酸(5mL)、ジクロロメタン(10mL)を入れた。得られた溶液を室温で30分間撹拌した。得られた混合物を減圧下で濃縮した。これにより、150mg(92%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.864 min、LCMS 45:m/z=293.10[M+1].1H NMR(300MHz、クロロホルム-d)δ 10.24(s,1H)、7.91(dd,J=9.0、1.9Hz、1H)、7.75-7.71(m,1H)、6.93(d,J=9.0Hz、1H)、4.40-4.28(m,1H)、3.94(s,3H)、3.90-3.80(m,4H)、2.22-2.10(m,2H)、1.99-1.82(m,2H)、1.81-1.49(m,4H).
50mLの丸底フラスコ中に、7-(2-メトキシ-5-ニトロフェノキシ)-2-アザスピロ[3.5]ノナン(150mg、0.51mmol、1当量)、HCHO(23mg)、メタノール(5mL)、NaBH3CN(162mg、2.58mmol、5.02当量)を入れた。得られた溶液を室温で1時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×50mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、100mg(64%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.817min、LCMS 45:m/z=307.15[M+1].1H NMR(300MHz、クロロホルム-d)δ 8.00-7.88(m,1H)、7.76(d,J=2.7Hz、1H)、6.94(d,J=9.0Hz、1H)、4.40-4.31(m,1H)、3.96(s,3H)、3.44(d,J=5.7Hz、4H)、2.62(s,3H)、2.20-2.04(m,2H)、2.02-1.88(m,2H)、1.80-1.61(m,4H).
H2でパージされ、維持された50mLの丸底フラスコ中に、7-(2-メトキシ-5-ニトロフェノキシ)-2-メチル-2-アザスピロ[3.5]ノナン(100mg、0.33mmol、1当量)、Pd/C(20mg)、メタノール(10mL)を入れた。得られた溶液を室温で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、80mg(89%)の表題化合物が淡黄色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.734min、LCMS 15:m/z=277.10[M+1].1H NMR(300MHz、クロロホルム-d)δ 6.72(d,J=8.4Hz、1H)、6.38-6.22(m,2H)、4.19-4.08(m,1H)、3.77(s,3H)、3.31(d,J=11.4Hz、4H)、2.53(s,3H)、2.16-2.01(m,2H)、1.96-1.81(m,2H)、1.73-1.52(m,4H).
50mLの丸底フラスコ中に、4-メトキシ-3-([2-メチル-2-アザスピロ[3.5]ノナン-7-イル]オキシ)アニリン(75mg、0.27mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(62mg、0.54mmol、2.00当量)、2-クロロ-N-(オキサン-4-イルメチル)ピリミジン-4-アミン(62mg、0.27mmol、1当量)を入れた。得られた溶液を80℃で2時間撹拌した。粗生成物を、分取HPLC Fによって精製した。これにより、86.1mg(63%)のN2-(4-メトキシ-3-((2-メチル-2-アザスピロ[3.5]ノナン-7-イル)オキシ)フェニル)-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンが固体として得られた。
化合物261:6-メトキシ-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(800mg、3.20mmol、1当量)、2,4-ジクロロ-6-メトキシピリミジン(573mg、3.20mmol、1当量)、TsOH(608mg、3.20mmol、1当量)、イソプロパノール(10mL)を入れた。得られた溶液を、油浴中で、50℃で3日間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/ACN/NH4HCO3を用いたフラッシュクロマトグラフィーによって精製した。これにより、120mg(10%)が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.113min、LCMS 28:m/z=393[M+1].
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、4-クロロ-6-メトキシ-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]ピリミジン-2-アミン(350mg、0.89mmol、1当量)、テトラヒドロフラン中のメチルアミン2M(0.9mg、2.00当量)、Pd2(dba)3CHCl3(93mg、0.10当量)、BINAP(111mg、0.18mmol、0.20当量)、t-BuONa(256mg、2.66mmol、3.00当量)、トルエン(10mL)を入れた。得られた溶液を、N2(g)雰囲気下で、油浴中で、80℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。固体をろ過して取り除いた。残渣を、ACN/H2O(1/10)を用いたフラッシュクロマトグラフィーによって精製した。これにより、40.3mg(12%)の6-メトキシ-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物262aおよび262b:N4-メチル-N2-((1R,3S)-3-(3-(ピロリジン-1-イル)プロポキシ)シクロヘキシル)ピリミジン-2,4-ジアミンおよびN4-メチル-N2-((1S,3R)-3-(3-(ピロリジン-1-イル)プロポキシ)シクロヘキシル)ピリミジン-2,4-ジアミンの合成
30mLの圧力タンク反応器(60気圧)中に、3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(500mg、2.27mmol、1当量)、酢酸(15mL)、Rh/Al2O3(0.3g)、水素(1g)を入れた。得られた溶液を、油浴中で、100℃で5時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.9g(粗製)が油として得られた。
分析データ:LC-MS:(ES、m/z):MS=227[M+1].
30mLの圧力タンク反応器中に、2-クロロ-N-メチルピリミジン-4-アミン(550mg、3.83mmol、1.20当量)、3-[3-(ピロリジン-1-イル)プロポキシ]シクロヘキサン-1-アミン(720mg、3.18mmol、1当量)、PTSA(1g、5.81mmol、2.00当量)、IPA(10mL)を入れた。得られた溶液を、油浴中で、110℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A MeOHによって精製した。粗生成物120mgを、キラル-分取HPLCによって精製した。これにより、42.6mg(3%)の鏡像異性体1(無作為に割り当てられた)が黄色の油として、および32.0mg(2%)鏡像異性体2(無作為に割り当てられた)が油として得られた。
化合物263:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルキナゾリン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2,4-ジクロロキナゾリン(1g、5.02mmol、1当量)、テトラヒドロフラン(10mL)、TEA(772mg、7.63mmol、1.50当量)、CH3NH2.THF(7.5mL、3.00当量)を入れた。得られた溶液を、水/氷浴中で、0℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH3CN/H2O(1:7)とともにシリカゲルカラム上に適用した。これにより、900mg(93%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.33分、LCMS33:m/z=194[M+1].1H NMR(400MHz、メタノール-d4)δ 8.08-8.00(m,1H)、7.78(m,1H)、7.63-7.61(m,1H)、7.54-7.49(m,1H)、3.13(s,3H).
25mLの丸底フラスコ中に、2-クロロ-N-メチルキナゾリン-4-アミン(300mg、1.55mmol、1当量)、トリフルオロ酢酸(354.4mg、3.14mmol、2.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(388.6mg、1.55mmol、1当量)、プロパン-2-オール(5mL)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(300mg)を、分取HPLC Dによって精製した。これにより、64.7mg(10%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルキナゾリン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物264:7-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)-2-(2-(ピロリジン-1-イル)エチル)-3,4-ジヒドロイソキノリン-1(2H)-オンの合成
100mLの丸底フラスコ中に、7-ニトロ-2-[2-(ピロリジン-1-イル)エチル]-1,2-ジヒドロイソキノリン-1-オン(100mg、0.35mmol、1当量)、メタノール(20mL)、Pd(OH2)、水素を入れた。得られた溶液を25℃で16時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、60mg(66%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.302min、LCMS 31、m/z=260[M+1].
25mLの丸底フラスコ中に、7-アミノ-2-[2-(ピロリジン-1-イル)エチル]-1,2,3,4-テトラヒドロイソキノリン-1-オン(60mg、0.23mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(34mg、0.24mmol、1当量)、イソプロパノール(6mL)、トリフルオロ酢酸(52mg、0.46mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C TFAによって精製した。これにより、45.3mg(41%)の表題化合物が固体として得られた。
化合物265:N-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1H-インドール-4-アミンの合成
窒素の不活性雰囲気でパージされ、維持された50mLの丸底フラスコ中に、4-ブロモ-1H-インドール(200mg、1.02mmol、1当量)、第3世代ブレットホス(3rd-BrettPhos)(46mg、0.05mmol、0.05当量)、カリウムメタンペルオキソエート(283mg、2.03mmol、2.00当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(256.4mg、1.02mmol、1当量)、DMSO(5mL)を入れた。得られた溶液を、油浴中で、85℃で6時間撹拌した。得られた溶液を10mLのH2Oで希釈した。炭酸ナトリウムを用いて、溶液のpH値を8に調整した。得られた溶液を3×10mLのジクロロメタンで抽出し、有機層を組み合わせた。HCl(水溶液)を用いて、pHを4に調整した。得られた混合物を3×10mLのH2Oで洗浄した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC C TFAによって精製した。これにより、91.9mg(19%)のN-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1H-インドール-4-アミンが白色の固体として得られた。
化合物266:N-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1H-ピロロ[3,2-c]ピリジン-4-アミンの合成
20mLのバイアル中に、ジオキサン(2mL)、4-クロロ-1H-ピロロ[3,2-c]ピリジン(200mg、1.31mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(329mg、1.31mmol、1当量)、ブレットホス(230mg)、Cs2CO3(781mg、2.40mmol、1.83当量)を入れた。バイアルを、N2でパージし、維持した。得られた溶液を100℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、キラル-分取HPLC D TFAによって精製した。これにより、74.1mg(12%)のN-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-1H-ピロロ[3,2-c]ピリジン-4-アミンが固体として得られた。
化合物267:N4-メチル-N2-(6-((2-(ピロリジン-1-イル)エトキシ)メチル)ピリジン-2-イル)ピリジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、2-ブロモ-6-(ブロモメチル)ピリジン(2g、7.97mmol、1当量)、水素化ナトリウム(956mg、39.83mmol、5.00当量)、N,N-ジメチルホルムアミド(80mL)、2-(ピロリジン-1-イル)エタン-1-オール(1.1g、9.55mmol、1.20当量)を入れた。得られた溶液を、水/氷浴中で、0℃で1時間撹拌した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、910mg(40%)の表題化合物が無色油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.85min、LCMS 34:m/z=285[M+1].
250mLの丸底フラスコ中に、2-ブロモ-6-[[2-(ピロリジン-1-イル)エトキシ]メチル]ピリジン(910mg、3.19mmol、1当量)、X-phos(100mg)、Cs2CO3(3.134g、9.62mmol、3.00当量)、ジオキサン(10mL)、Pd2(dba)3.CHCl3(100mg)、アセトアミド(567mg、9.60mmol、3.00当量)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、460mg(55%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.72min、LCMS 28:m/z=264[M+1].
100mLの丸底フラスコ中に、N-(6-[[2-(ピロリジン-1-イル)エトキシ]メチル]ピリジン-2-イル)アセトアミド(460mg、1.75mmol、1当量)、ナトリウム(sodiumol)(350mg、8.75mmol、5.00当量)、メタノール(20mL)、水(20mL)を入れた。得られた溶液を70℃で12時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、230mg(59%)の表題化合物が無色油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.62min、LCMS 53:m/z=222[M+1].
50mLの丸底フラスコ中に、2-ブロモ-N-メチルピリジン-4-アミン(180mg、0.96mmol、1当量)、6-[[2-(ピロリジン-1-イル)エトキシ]メチル]ピリジン-2-アミン(255.3mg、1.15mmol、1.20当量)、Cs2CO3(939mg、2.88mmol、3.00当量)、Pd2dba3-CHCl3(10mg)、X-phos(10mg)、1,4-ジオキサン(10mL)を入れた。得られた溶液を100℃で10時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、39.3mg(11%)のN4-メチル-N2-(6-((2-(ピロリジン-1-イル)エトキシ)メチル)ピリジン-2-イル)ピリジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物268:N2-メチル-N4-(6-((2-(ピロリジン-1-イル)エトキシ)メチル)ピリジン-2-イル)ピリジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、6-[[2-(ピロリジン-1-イル)エトキシ]メチル]ピリジン-2-アミン(220mg、0.99mmol、1当量)、4-ブロモ-N-メチルピリジン-2-アミン(224mg、1.20mmol、1.20当量)、Cs2CO3(978mg、3.00mmol、3.00当量)、Pd2dba3-CHCl3(50mg)、キサントホス(50mg)、1,4-ジオキサン(10mL)を入れた。得られた溶液を100℃で4時間撹拌した。粗生成物を、以下の条件(IntelFlash-1):カラム、シリカゲル;移動相、ACN/H2O=1/1;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、56.5mg(17%)のN2-メチル-N4-(6-((2-(ピロリジン-1-イル)エトキシ)メチル)ピリジン-2-イル)ピリジン-2,4-ジアミンが固体として得られた。
化合物272:5-フルオロ-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリジン-2,4-ジアミンの化合物合成
20mLのバイアル中に、テトラヒドロフラン(8mL)、2,4-ジクロロ-5-フルオロピリジン(300mg、1.81mmol、1当量)、テトラヒドロフラン(1.82mL)中のメタンアミン(113mg、3.64mmol、2.01当量)の溶液を入れた。得られた溶液を80℃で18時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:10)とともにシリカゲルカラム上に適用した。これにより、200mg(69%)が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.469min、LCMS 32:m/z=161[M+1].
窒素の不活性雰囲気でパージされ、維持された40mLのバイアル中に、トルエン(10mL)、2-クロロ-5-フルオロ-N-メチルピリジン-4-アミン(190mg、1.18mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(327mg、1.31mmol、1.10当量)、Pd2(dba)3-CHCl3(184mg、0.18mmol、0.15当量)、BINAP(222mg、0.36mmol、0.30当量)、t-BuONa(342mg、3.56mmol、3.01当量)を入れた。得られた溶液を100℃で13時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、水(0.05%のHCl)/ACN(5:1)とともにシリカゲルカラム上に適用した。これにより、89.1mg(18%)の5-フルオロ-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物276:N2-(3-(2-フルオロ-3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの3口丸底フラスコ中に、1-(3-ニトロフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(500mg、1.88mmol、1当量)、ジクロロメタン(15mL)を入れた。この後、ジクロロメタン(3mL)中のDAST(363mg、2.25mmol、1.20当量)の溶液を、-78℃で1分間撹拌しながら滴下して加えた。得られた溶液を室温で一晩撹拌した。次に、反応を、5M/MmLの水の添加によってクエンチした。得られた溶液を3×10mLのジクロロメタンで抽出し、水層を組み合わせて、減圧下で濃縮した。これにより、400mg(71%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.950min、LCMS 31、m/z=269.0[M+1].
100mLの丸底フラスコ中に、1-[2-フルオロ-3-(3-ニトロフェノキシ)プロピル]ピロリジン(400mg、1.49mmol、1当量)、メタノール(5mL)、水素(100mL)、Pd/C(100mg)を入れた。得られた溶液を室温で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、370mg(104%)の表題化合物が黄色の液体として得られた。
LC-MS:(ES、m/z):RT=1.040 min、LCMS 34、m/z=239.0[M+1].1H NMR:(300MHz、クロロホルム-d)δ 7.08(t,J=8.0Hz、1H)、6.43-6.25(m,3H)、4.83(d,J=4.4Hz、1H)、4.75-4.63(m,1H)、4.28-4.07(m,2H)、3.69(s,2H)、3.18-2.69(m,5H)、2.01-1.77(m,4H).
8mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(120mg、0.84mmol、1当量)、3-[2-フルオロ-3-(ピロリジン-1-イル)プロポキシ]アニリン(80mg、0.34mmol、0.40当量)、トリフルオロ酢酸(0.2mL)、イソプロパノール(3mL)を入れた。得られた溶液を85℃で一晩撹拌した。粗生成物を、分取HPLC C TFAによって精製した。これにより、37.4mg(11%)のN2-(3-(2-フルオロ-3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物277:N2-(3-(2,2-ジフルオロ-3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2,2-ジフルオロプロパン-1,3-ジオール(600mg、5.35mmol、1当量)、TEA(1.4g、13.84mmol、3.00当量)、ジクロロメタン(50mL)、4-メチルベンゼン-1-スルホニルクロリド(1.02g、5.35mmol、1当量)を入れた。得られた溶液を25℃で12時間撹拌した。得られた溶液を3×100mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、500mg(35%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):R:1.19min、267[M+1].
100mLの丸底フラスコ中に、2,2-ジフルオロ-3-[[(4-メチルベンゼン)スルホニル]オキシ]プロパン-1-オール(550mg、2.07mmol、1当量)、Cs2CO3(2g、6.14mmol、3.00当量)、N,N-ジメチルホルムアミド(50mL)、3-ニトロフェノール(431mg、3.10mmol、1.50当量)を入れた。得られた溶液を、油浴中で、100℃で12時間撹拌した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、60mg(12%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):R:1.086 min、234[M+1].1H-NMR:(クロロホルム-d、ppm):δ 7.91-7.92(m,1H)、7.80(t,J=2.4Hz、1H)、7.50(t,J=8.2Hz、1H)、7.31-7.33(m,1H)、4.38(t,J=11.6Hz、2H)、4.03(t,J=12.5Hz、2H).
100mLの丸底フラスコ中に、2,2-ジフルオロ-3-(3-ニトロフェノキシ)プロパン-1-オール(50mg、0.21mmol、1当量)、MsCl(37mg、1.50当量)、TEA(65mg、0.64mmol、3.00当量)、ジクロロメタン(50mL)を入れた。得られた溶液を25℃で2時間撹拌した。得られた溶液を3×100mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、60mg(90%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):R:1.266 min、312[M+1].1H-NMR:(DMSO-d6、ppm):δ 7.96-7.85(m,2H)、7.71-7.49(m,2H)、4.82-4.57(m,4H)、3.33(s,3H).
20mLの密閉管中に、2,2-ジフルオロ-3-(3-ニトロフェノキシ)プロピルメタンスルホネート(60mg、0.19mmol、1当量)、ピロリジン(10mL)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。これにより、50mg(91%)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):287[M+1]、R:0.962min.
100mLの丸底フラスコ中に、1-[2,2-ジフルオロ-3-(3-ニトロフェノキシ)プロピル]ピロリジン(50mg、0.17mmol、1当量)、ラネーNi、水素、メタノール(10mL)を入れた。得られた溶液を25℃で4時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、40mg(89%)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):257[M+1]、R:0.734min.
50mLの丸底フラスコ中に、3-[2,2-ジフルオロ-3-(ピロリジン-1-イル)プロポキシ]アニリン(40mg、0.16mmol、1当量)、トリフルオロ酢酸(35mg、0.31mmol、2.00当量)、イソプロパノール(10mL)、2-クロロ-N-メチルピリミジン-4-アミン(27mg、0.19mmol、1.20当量)を入れた。得られた溶液を、油浴中で、80℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC F TFAによって精製した。これにより、39.2mg(53%)のN2-(3-(2,2-ジフルオロ-3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物279:N4-メチル-N2-(3-(1-(2-(ピロリジン-1-イル)エトキシ)エチル)フェニル)ピリミジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された50mLの3口丸底フラスコ中に、1-(3-ニトロフェニル)エタン-1-オール(1g、5.98mmol、1当量)、ジクロロメタン(15mL、1.50当量)、TEA(1.8g、17.79mmol、3.00当量)を入れた。この後、MsCl(1.1g)を、0℃で撹拌しながら滴下して加えた。得られた溶液を、水/氷浴中で、0℃で3時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×100mLの水および2×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.4g(95%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.801 min.1H NMR(300MHz、DMSO-d6)δ 8.36-8.15(m,2H)、8.02-7.87(m,1H)、7.79-7.65(m,1H)、5.97(q,J=6.5Hz、1H)、3.20(s,3H)、1.67(d,J=6.5Hz、3H).
窒素の不活性雰囲気でパージされ、維持された100mLの3口丸底フラスコ中に、水素化ナトリウム(1.14g、28.50mmol、7.00当量、60%)、N,N-ジメチルホルムアミド(5mL)を入れた。この後、N,N-ジメチルホルムアミド(8mL)中の2-(ピロリジン-1-イル)エタン-1-オール(2.82g、24.48mmol、6.00当量)の溶液を、-20℃で撹拌しながら滴下して加えた。得られた溶液を氷/塩浴中で、-20℃で0.5時間撹拌した。これに、N,N-ジメチルホルムアミド(7mL)中の1-(3-ニトロフェニル)エチルメタンスルホネート(1g、4.08mmol、1当量)の溶液を、-20℃で撹拌しながら滴下して加えた。得られた溶液を、氷/塩浴中で、-20℃で1時間撹拌した。次に、反応を、水/氷の添加によってクエンチした。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの水および2×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A Gradによって精製した。これにより、400mg(37%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.740min、LCMS 40、m/z=265[M+1].1H NMR(300MHz、DMSO-d6)δ 8.23-8.07(m,2H)、7.85-7.74(m,1H)、7.76-7.60(m,1H)、4.64(q,J=6.4Hz、1H)、3.55-3.39(m,1H)、3.41-3.25(m,1H)、2.68-2.30(m,6H)、1.73-1.54(m,4H)、1.37(d,J=6.5Hz、3H).
100mLの丸底フラスコ中に、1-[2-[1-(3-ニトロフェニル)エトキシ]エチル]ピロリジン(430mg、1.63mmol、1当量)、メタノール(30mL)、Pd/Cl、水素を入れた。得られた溶液を25℃で4時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、370mg(97%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.742min、LCMS 45、m/z=235[M+1].
100mLの丸底フラスコ中に、3-[1-[2-(ピロリジン-1-イル)エトキシ]エチル]アニリン(350mg、1.49mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(214mg、1.49mmol、1当量)、イソプロパノール(20mL)、トリフルオロ酢酸(341mg、3.02mmol、2.00当量)を入れた。得られた溶液を、油浴中で、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C TFAによって精製した。これにより、171.5mg(25%)のN4-メチル-N2-(3-(1-(2-(ピロリジン-1-イル)エトキシ)エチル)フェニル)ピリミジン-2,4-ジアミンが半固体として得られた。
化合物280:N2-(3-(3-(ジエチルアミノ)プロポキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
16mLの密閉管中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、NaI(100mg、1当量)、炭酸カリウム(180mg、1.30mmol、2.00当量)、ACN(8mL)、ジエチルアミン(100mg、1.37mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で3時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC D HClによって精製した。これにより、73.7mg(30%)のN2-(3-(3-(ジエチルアミノ)プロポキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物283:N2-(4-メトキシ-3-(3-(3-メトキシピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
8mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.93mmol、1当量)、3-メトキシピロリジン(303mg、3.00mmol、3.22当量)、NaI(150mg)、炭酸カリウム(414mg、3.00mmol、3.22当量)、CH3CN(5mL)を入れた。得られた溶液を70℃で一晩撹拌した。粗生成物を、分取HPLC C NH3によって精製した。これにより、59.7mg(17%)のN2-(4-メトキシ-3-(3-(3-メトキシピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物285:N2-(4-メトキシ-3-(3-(3-(トリフルオロメチル)ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.93mmol、1当量)、Cs2CO3(911mg、2.80mmol、3.00当量)、NaI(13.98mg、0.10当量)、3-(トリフルオロメチル)ピロリジン(388.5mg、2.79mmol、3.00当量)、CH3CN(6mL)を入れた。得られた溶液を、油浴中で、85℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC C TFAによって精製した。これにより、88mg(18%)のt N2-(4-メトキシ-3-(3-(3-(トリフルオロメチル)ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物286:1-(3-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)ピロリジン-3-オールの合成
20mLのバイアル中に、N,N-ジメチルホルムアミド(5mL)、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(250mg、0.77mmol、1当量)、ピロリジン-3-オール(135mg、1.55mmol、2.00当量)、Cs2CO3(506mg、1.55mmol、2.01当量)、NaI(117mg)を入れた。得られた溶液を80℃で2時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC C NH3によって精製した。これにより、64.7mg(22%)の1-(3-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)ピロリジン-3-オールが白色の固体として得られた。
化合物287:1-(3-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)ピロリジン-3-カルボニトリルの合成
20mLのバイアル中に、ACN(3mL)、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.93mmol、1当量)、ピロリジン-3-カルボニトリル(98mg、1.02mmol、1.10当量)、NaI(140mg)、炭酸カリウム(257mg、1.86mmol、2.00当量)、TBAI(34mg、0.09mmol、0.10当量)を入れた。得られた溶液を80℃で14時間撹拌した。残渣を、H2O/ACN(4:1)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。粗生成物(100mg)を、分取HPLC D HClによって精製した。これにより、43mg(11%)の1-(3-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)ピロリジン-3-カルボニトリルが白色の固体として得られた。
化合物288:N2-(4-メトキシ-3-(2-(1-メチルピロリジン-2-イル)エトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、N,N-ジメチルホルムアミド(10mL)、2-メトキシ-5-ニトロフェノール(500mg、2.96mmol、1当量)、Cs2CO3(1.93g、5.92mmol、2.00当量)、NaI(444mg、2.96mmol、1当量)、2-(2-クロロエチル)-1-メチルピロリジン(870mg、5.89mmol、1.99当量)を入れた。得られた溶液を80℃で2時間撹拌した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×10mLの水および3×10mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過によって収集した。得られた混合物を減圧下で濃縮した。これにより、540mg(65%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.836min、LCMS 27:m/z=281[M+1].
100mLの丸底フラスコ中に、メタノール(30mL)、2-[2-(2-メトキシ-5-ニトロフェノキシ)エチル]-1-メチルピロリジン(520mg、1.86mmol、1当量)、ラネーNi(100mg)を入れた。フラスコを、H2でパージし、維持した。得られた溶液を20℃で3時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、460mg(99%)の表題化合物が明るい赤色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.398min、LCMS 32:m/z=251[M+1].
100mLの丸底フラスコ中に、イソプロパノール(10mL)、2-クロロ-N-メチルピリミジン-4-アミン(252mg、1.76mmol、1当量)、4-メトキシ-3-[2-(1-メチルピロリジン-2-イル)エトキシ]アニリン(440mg、1.76mmol、1当量)、PTSA(303mg、1.76mmol、1当量)を入れた。得られた溶液を85℃で2時間撹拌した。粗生成物(600mg)を、分取HPLC D HClによって精製した。310mgの生成物が得られた。これにより、310mg(45%)のN2-(4-メトキシ-3-(2-(1-メチルピロリジン-2-イル)エトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の油として得られた。
化合物289:N2-(4-メトキシ-3-((1-メチルピロリジン-2-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、(1-メチルピロリジン-2-イル)メタノール(1g、8.68mmol、1当量)、TEA(2.66g、26.29mmol、3.00当量)、ジクロロメタン(10mL)、メタンスルホニルクロリド(1.29g、11.26mmol、1.30当量)を入れた。得られた溶液を20℃で1時間撹拌した。これにより、2g(119%)の表題化合物が黄色の油として得られた。
50mLの密閉管中に、(1-メチルピロリジン-2-イル)メチルメタンスルホネート(1g、5.17mmol、1当量)、Cs2CO3(3.75g、11.51mmol、2.00当量)、2-メトキシ-5-ニトロフェノール(876mg、5.18mmol、1当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。残渣を、H2O:CH3CN(1:5)とともにシリカゲルカラム上に適用した。これにより、500mg(36%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.73min、LCMS40:m/z=267.25[M+1].
50mLの丸底フラスコ中に、2-(2-メトキシ-5-ニトロフェノキシメチル)-1-メチルピロリジン(500mg、1.88mmol、1当量)、メタノール(20mL)、Pd/C(1g、1当量)、水素を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、350mg(79%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.39min、LCMS07:m/z=237.25[M+1].
50mLの丸底フラスコ中に、4-メトキシ-3-[(1-メチルピロリジン-2-イル)メトキシ]アニリン(350mg、1.48mmol、1当量)、トリフルオロ酢酸(338mg、2.99mmol、2.00当量)、2-クロロ-N-メチルピリミジン-4-アミン(212mg、1.48mmol、1当量)、プロパン-2-オール(10mL)を入れた。得られた溶液を、油浴中で、85℃で6時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC C NH3によって精製した。これにより、64.7mg(13%)の4-メトキシ-3-[(1-メチルピロリジン-2-イル)メトキシ]アニリンがオフホワイトの固体として得られた。
化合物290:N2-(4-メトキシ-3-(3-(2-メチルピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
25mLの丸底フラスコ中に、N,N-ジメチルホルムアミド(5mL)、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、2-メチルピロリジン(53mg、0.62mmol、1当量)、Cs2CO3(405mg、1.24mmol、2.01当量)、NaI(93mg、0.62mmol、1当量)を入れた。得られた溶液を80℃で4時間撹拌した。固体をろ過して取り除いた。粗生成物(200mg)を、分取HPLC D HClによって精製した。39.7mgの淡黄色の固体N2-(4-メトキシ-3-(3-(2-メチルピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが得られた。
化合物291:N-エチル-4-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)ピコリンアミドの合成
50mLの丸底フラスコ中に、4-ニトロピリジン-2-カルボン酸(400mg、2.38mmol、1当量)、CDI(582mg、3.59mmol、1.50当量)、N,N-ジメチルホルムアミド(10mL)、エタンアミン(1.2mL)を入れた。得られた溶液を25℃で6時間撹拌した。得られた混合物を減圧下で濃縮した。次に、反応を、10mLの水の添加によってクエンチした。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。これにより、464mg(99%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.871min、LCMS 34:m/z=195[M+1].
50mLの丸底フラスコ中に、N-エチル-4-ニトロピリジン-2-カルボキサミド(464mg、2.38mmol、1当量)、Pd/C(156.3mg)、水素を入れた。得られた溶液を25℃で4時間撹拌した。固体をろ過によって収集した。これにより、370mg(94%)の表題化合物が黄色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.684min、LCMS 34:m/z=166[M+1].
50mLの丸底フラスコ中に、4-アミノ-N-エチルピリジン-2-カルボキサミド(200mg、1.21mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(174mg、1.21mmol、1当量)、キサントホス(140.3mg、0.24mmol、0.20当量)、DBU(368.5mg、2.42mmol、2.00当量)、ジオキサン(10mL)、Pd(OAc)2(27.1mg、0.12mmol、0.10当量)を入れた。得られた溶液を、油浴中で、100℃で24時間撹拌した。得られた溶液を3×10mLの水で抽出し、有機層を組み合わせた。粗生成物を、(ACN/H2O=1/20)によって精製した。これにより、30.2mg(8%)のN-エチル-4-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)ピコリンアミドが白色の固体として得られた。
化合物293:N2-(4-メトキシ-3-(3-(3-メチルピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.93mmol、1当量)、3-メチルピロリジン塩酸塩(112.7mg、0.93mmol、1当量)、Cs2CO3(939mg、2.88mmol、3.00当量)、NaI(279.5mg、2.00当量)、CH3CN(10mL)を入れた。混合物溶液を、85℃で20時間撹拌した。得られた溶液を20mLの水で希釈し、3×30mLの酢酸エチルで抽出し、有機層を組み合わせた。粗生成物を、分取HPLC C NH4HCO3によって精製した。得られた溶液を、油浴中で、85℃で24時間撹拌した。これにより、39.3mg(11%)のN2-(4-メトキシ-3-(3-(3-メチルピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物298:N2-(3-(3-(3-アザビシクロ[3.1.0]ヘキサン-3-イル)プロポキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.93mmol、1当量)、3-アザビシクロ[3.1.0]ヘキサン塩酸塩(166.3mg、1.39mmol、1.50当量)、Cs2CO3(609mg、1.87mmol、2.00当量)、NaI(279mg、1.86mmol、2.00当量)、N,N-ジメチルホルムアミド(5mL)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC D NH3によって精製した。これにより、33.5mg(10%)のN2-(3-(3-(3-アザビシクロ[3.1.0]ヘキサン-3-イル)プロポキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物299:(R)-1-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールの合成
250mLの丸底フラスコ中に、2-メトキシ-5-ニトロフェノール(3.5g、20.69mmol、1当量)、2-(ブロモメチル)オキシラン(2.84g、20.73mmol、1当量)、炭酸カリウム(5.7g、41.24mmol、2.00当量)、N,N-ジメチルホルムアミド(80mL)を入れた。得られた溶液を25℃で16時間撹拌した。温度を油浴中で50℃に維持しながら、得られた溶液を、さらに3時間にわたって、撹拌しながら反応させた。得られた混合物を1×100mLのH2Oで洗浄した。得られた溶液を3×300mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×200mLの水および2×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、4.2g(粗製)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.02 min.1H NMR(300MHz、DMSO-d6)δ 7.93(dd,J=9.0、2.7Hz、1H)、7.78(d,J=2.7Hz、1H)、7.20(d,J=9.0Hz、1H)、4.49(dd,J=11.4、2.4Hz、1H)、3.99-3.86(m,4H)、3.43-3.28(m,1H)、2.91-2.81(m,1H)、2.78-2.68(m,1H).
50mLの丸底フラスコ中に、2-(2-メトキシ-5-ニトロフェノキシメチル)オキシラン(500mg、2.22mmol、1当量)、エタノール(10mL)、クロロホルム(10mL)、ピロリジン(394mg、5.54mmol、2.50当量)を入れた。得られた溶液を、油浴中で、60℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A DCM/MeOHによって精製した。これにより、600mg(91%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.927min、LCMS 31、m/z=297[M+1].1H NMR(400MHz、DMSO-d6)δ 7.90(dd,J=9.0、2.7Hz、1H)、7.79(d,J=2.7Hz、1H)、7.18(d,J=9.0Hz、1H)、4.99(s,1H)、4.19-4.05(m,1H)、4.04-3.87(m,5H)、2.71-2.41(m,6H)、1.76-1.61(m,4H).
100mLの丸底フラスコ中に、1-(2-メトキシ-5-ニトロフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(700mg、2.36mmol、1当量)、メタノール(40mL)、Pd/Cl、水素を入れた。得られた溶液を25℃で16時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、600mg(95%)の表題化合物が黄色の油として得られた。
LC-MS:(ES、m/z):RT=0.671min、LCMS 31、m/z=267[M+1].
50mLの丸底フラスコ中に、1-(5-アミノ-2-メトキシフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(600mg、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(324mg、2.26mmol、1当量)、イソプロパノール(10mL)、トリフルオロ酢酸(514mg、4.55mmol、2.00当量)を入れた。得られた溶液を、油浴中で、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、キラル-分取HPLC IDによって精製した。これにより、42mg(5%)の1-(5-アミノ-2-メトキシフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(600mg、1当量)、2-クロロ-N-メチルピリミジン-4-アミンが淡黄色の固体として得られた。
化合物300:(S)-1-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールの合成
50mLの丸底フラスコ中に、1-(5-アミノ-2-メトキシフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(600mg、2.25mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(324mg、2.26mmol、1当量)、イソプロパノール(10mL)、トリフルオロ酢酸(514mg、4.55mmol、2.00当量)を入れた。得られた溶液を、油浴中で、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、キラル-分取HPLC IB4によって精製した。これにより、41.1mg(5%)の(S)-1-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールが淡黄色の固体として得られた。
化合物301:N2-(3-フルオロ-4-メトキシ-5-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、1,3-ジフルオロ-2-メトキシ-5-ニトロベンゼン(1g、5.29mmol、1当量)、3-(ピロリジン-1-イル)プロパン-1-オール(683mg、5.29mmol、1当量)、t-BuOK(10.6mL、2.00当量)、テトラヒドロフラン(15mL)を入れた。得られた溶液を、水/氷浴中で、0℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(5mL)を、ACN/H2O(1/1)によって精製した。これにより、550mg(35%)が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.986min、LCMS 53:m/z=299[M+1].1H NMR(400MHz、メタノール-d4)δ 7.75(s,1H)、7.73(s,1H)、4.28-4.25(m,2H)、4.03-3.99(m,6H)、2.78-2.66(m,2H)、2.65-2.62(m,2H)、2.03-1.99(s,3H)、1.88-1.85(m,2H).
250mLの丸底フラスコ中に、1-[3-(3-フルオロ-2-メトキシ-5-ニトロフェノキシ)プロピル]ピロリジン(450mg、1.51mmol、1当量)、メタノール(10mL)、Pd/C(150mg)、水素を入れた。得られた溶液を25℃で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、350mg(86%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.803min、LCMS 34:m/z=269[M+1].
100mLの丸底フラスコ中に、3-フルオロ-4-メトキシ-5-[3-(ピロリジン-1-イル)プロポキシ]アニリン(300mg、1.12mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(176mg、1.12mmol、1当量)、トリフルオロ酢酸(255.2mg、2.26mmol、2.00当量)、イソプロパノール(15mL)を入れた。得られた溶液を、油浴中で、85℃で24時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C NH3によって精製した。これにより、9.7mg(2%)のN2-(3-フルオロ-4-メトキシ-5-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが黄色の固体として得られた。
化合物302:N2-(2-フルオロ-4-メトキシ-5-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-フルオロ-2-メトキシフェノール(1g、7.04mmol、1当量)、1-クロロ-3-ヨードプロパン(2.87g、14.04mmol、2.00当量)、炭酸カリウム(2.92g、21.13mmol、3.00当量)、ACN(15mL)を入れた。得られた溶液を85℃で14時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.5g(98%)が黄色の油として得られた。
100mLの丸底フラスコ中に、1-(3-クロロプロポキシ)-4-フルオロ-2-メトキシベンゼン(1.53g、7.00mmol、1当量)、酢酸アセチル(25mL)を入れた。この後、HNO3(2.56g、4.00当量)を0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で16時間撹拌した。次に、反応を、水/氷の添加によってクエンチした。得られた溶液を2×80mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×100mLの炭酸水素ナトリウムおよび2×100mLの塩水で洗浄した。得られた混合物を洗浄し、ろ液を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1/5)とともにシリカゲルカラム上に適用した。これにより、1.62g(88%)の表題化合物が黄色の固体として得られた。
分析データ:1H NMR(400MHz、メタノール-d4)δ 7.70(s,1H)、7.06(s,1H)、4.20(t,J=5.9Hz、2H)、3.79(t,J=6.4Hz、2H)、2.26(q,J=6.1Hz、2H)、2.03(s,3H).
100mLの丸底フラスコ中に、1-(3-クロロプロポキシ)-4-フルオロ-2-メトキシ-5-ニトロベンゼン(200mg、0.76mmol、1当量)、ラネーNi(0.1g)、メタノール(20mL)を入れた。得られた溶液を50℃で16時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、170mg(96%)の表題化合物が褐色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.032min;LCMS34:m/z=234[M+1].
50mLの丸底フラスコ中に、5-(3-クロロプロポキシ)-2-フルオロ-4-メトキシアニリン(150mg、0.64mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(101mg、0.64mmol、1当量)、トリフルオロ酢酸(125mg、1.11mmol、2.00当量)、イソプロパノール(10mL)を入れた。得られた溶液を85℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/1)とともにシリカゲルカラム上に適用した。これにより、180mg(79%)の表題化合物が褐色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.153min;LCMS34:m/z=255[M+1].
50mLの丸底フラスコ中に、2-N-[5-(3-クロロプロポキシ)-2-フルオロ-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(162mg、0.46mmol、1当量)、ピロリジン(64mg、0.90mmol、2.00当量)、NaI(69mg、0.46mmol、1当量)、Cs2CO3(298mg、0.91mmol、2.00当量)、CH3CN(10mL)を入れた。得られた溶液を85℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/1)とともにシリカゲルカラム上に適用した。これにより、46mg(26%)のN2-(2-フルオロ-4-メトキシ-5-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが固体として得られた。
化合物303:N2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された50mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(125.1mg、0.79mmol、1当量)、Cs2CO3(779.3mg、2.39mmol、3.00当量)、第3世代ブレットホス(72.2mg、0.08mmol、0.20当量)、Pd2(dba)3-CHCl3(41.2mg、0.04mmol、0.10当量)、DMSO(5mL)を入れた。得られた溶液を、油浴中で、100℃で2時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC C TFAによって精製した。これにより、133.8mg(35%)のN2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物305:N2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4-メチルピリジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(135mg、0.54mmol、1当量)、2-ブロモ-N-メチルピリジン-4-アミン(100mg、0.53mmol、1当量)、Xphos(51.2mg、0.20当量)、Cs2CO3(350.5mg、1.08mmol、2.00当量)、DMSO(5mL)、Pd2(dba)3-CHCl3(55.6mg、0.10当量)を入れた。得られた溶液を、油浴中で、100℃で24時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(120mg)を、フラッシュ-分取HPLC A Gradによって精製した。これにより、18.6mg(7%)のN2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4-メチルピリジン-2,4-ジアミンが黄色の固体として得られた。
化合物306:N4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N2,6-ジメチルピリミジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1当量)、第3世代ブレットホス(130mg、0.14mmol、0.10当量)、Cs2CO3(650mg、1.99mmol、2.00当量)、4-クロロ-N,6-ジメチルピリミジン-2-アミン(140mg、0.89mmol、1当量)、DMSO(10mL)を入れた。得られた溶液を、油浴中で、100℃で3時間撹拌した。固体をろ過して取り除いた。粗生成物を、TFA/H2O:ACN(10:1)、検出器、UV254nmとともにシリカゲルカラム上に適用した。これにより、88.6mg(22%)のN4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N2,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.83 min、LCMS 53:m/z=373.0[M+1].1H NMR(400MHz、メタノール-d4)δ 8.04(s,1H)、7.37(s,1H)、6.46(s,1H)、4.33(s,2H)、3.96(d,J=1.3Hz、3H)、3.91-3.73(m,2H)、3.48(t,J=7.3Hz、2H)、3.24-3.12(m,2H)、3.09(d,J=1.8Hz、3H)、2.38-2.35(m,5H)、2.29-2.17(m,2H)、2.10-2.09(m,2H).
化合物307:N2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4,6-ジメチルピリジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1当量)、Cs2CO3(75mg、0.23mmol、3当量)、第3世代ブレットホス(140mg、0.20当量)、2-クロロ-N,6-ジメチルピリジン-4-アミン(130mg、0.83mmol、1当量)、DMSO(15mL)を入れた。得られた溶液を、油浴中で、100℃で3時間撹拌した。固体をろ過して取り除いた。粗生成物(200mg)を、TFA/H2O:ACN(8:1)とともにシリカゲルカラム上に適用した。これにより、64.6mg(21%)のN2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4,6-ジメチルピリジン-2,4-ジアミンが白色の固体として得られた。
化合物308:N4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N2,6-ジメチルピリジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1当量)、第3世代ブレットホス(140mg、0.15mmol、0.20当量)、Cs2CO3(750mg、2.30mmol、3.00当量)、4-クロロ-N,6-ジメチルピリジン-2-アミン(130mg、0.83mmol、1当量)、DMSO(15mL)を入れた。得られた溶液を、油浴中で、100℃で3時間撹拌した。固体をろ過して取り除いた。粗生成物(300mg)を、TFA/H2O:ACN(10:1)、検出器、UV254nmとともにシリカゲルカラム上に適用した。これにより、121.9mg(30%)のN4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N2,6-ジメチルピリジン-2,4-ジアミンが白色の固体として得られた。
化合物309:5-フルオロ-N2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4,6-ジメチルピリジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、6-ブロモ-3-フルオロ-2-メチルピリジン(1g、5.26mmol、1当量)、H2O2(4mL)、トリフルオロ酢酸(10mL)を入れた。得られた溶液を70℃で20時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ジクロロメタン/メタノール(100/0)とともにシリカゲルカラム上に適用した。これにより、1.09g(101%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.714 min;LCMS40:m/z=206[M+1].1H NMR(400MHz、クロロホルム-d)δ7.61(d,J=9.1Hz、1H)、7.13(d,J=9.2Hz、1H)、2.61(s,3H).
50mLの丸底フラスコ中に、6-ブロモ-3-フルオロ-2-メチルピリジン1-オキシド(1g、4.85mmol、1当量)、硫酸(10mL)、硝酸カリウム(1.97g、4.00当量)を入れた。得られた溶液を120℃で6時間撹拌した。反応混合物を水/氷浴で冷却した。得られた溶液を2×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×50mLの炭酸水素ナトリウムで洗浄した。得られた混合物を100mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。これにより、650mg(53%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.068min;LCMS33:m/z=251[M+1].
50mLの丸底フラスコ中に、6-ブロモ-3-フルオロ-2-メチル-4-ニトロピリジン1-オキシド(600mg、2.39mmol、1当量)、酢酸(10mL)、Fe(672mg、5.00当量)を入れた。得られた溶液を100℃で1時間撹拌した。次に、反応を、水/氷の添加によってクエンチした。得られた溶液を100mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で濃縮した。残渣を、ACN/H2O(1/10)とともにシリカゲルカラム上に適用した。これにより、260mg(53%)の表題化合物がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.774 min;LCMS33:m/z=205[M+1].1H NMR(400MHz、DMSO-d6)δ 6.67(d,J=5.9Hz、1H)、6.46(s,2H)、2.24(s,3H).
50mLの丸底フラスコ中に、ジクロロメタン(10mL)中の6-ブロモ-3-フルオロ-2-メチルピリジン-4-アミン(250mg、1.22mmol、1当量)の溶液、4-ジメチルアミノピリジン(299g、2.45mol、2.00当量)、(Boc)2O(536mg、2.46mmol、2.00当量)、TEA(0.34mL)を入れた。得られた溶液を20℃で16時間撹拌した。次に、反応を、10mLの10%のNaOHの添加によってクエンチした。得られた溶液を20mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。残渣を、ジクロロメタン/石油エーテル(1/1)とともにシリカゲルカラム上に適用した。これにより、0.3g(81%)がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.458 min;LCMS53:m/z=305[M+1].1H NMR(400MHz、メタノール-d4)δ 8.19(s,1H)、2.52(s,1H)、2.42(s,3H)、1.56(d,J=2.2Hz、9H).
50mLの丸底フラスコ中に、テトラヒドロフラン(10mL)中のtert-ブチルN-(6-ブロモ-3-フルオロ-2-メチルピリジン-4-イル)カルバメート(278mg、0.91mmol、1当量)の溶液を入れた。この後、水素化ナトリウム(110mg、3.00当量)を、1時間で、0℃で少しずつ加えた。これに、CH3I(388mg、2.73mmol、3.00当量)を、0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で18時間撹拌した。次に、反応を、30mLの水の添加によってクエンチした。得られた溶液を2×50mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で濃縮した。残渣を、ジクロロメタン/石油エーテル(1/1)とともにシリカゲルカラム上に適用した。これにより、150mg(52%)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.449min;LCMS53:m/z=319[M+1].
窒素の不活性雰囲気でパージされ、維持された50mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(112mg、0.45mmol、1当量)、tert-ブチルN-(6-ブロモ-3-フルオロ-2-メチルピリジン-4-イル)-N-メチルカルバメート(140mg、0.44mmol、1当量)、第3世代ブレットホス(40mg、0.10当量)、Cs2CO3(287mg、0.88mmol、2.00当量)、DMSO(4mL)を入れた。得られた溶液を100℃で4時間撹拌した。得られた溶液を15mLのH2Oで希釈した。得られた溶液を2×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/5)とともにシリカゲルカラム上に適用した。これにより、80mg(37%)が無色の粗製油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.015min;LCMS53:m/z=490[M+1].
50mLの丸底フラスコ中に、tert-ブチルN-[3-フルオロ-6-([5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-イル]アミノ)-2-メチルピリジン-4-イル]-N-メチルカルバメート(80mg、0.16mmol、1当量)、ジクロロメタン(6mL)、トリフルオロ酢酸(1.5mL)を入れた。得られた溶液を20℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(1/5)とともにシリカゲルカラム上に適用した。これにより、33.1mg(40%)の5-フルオロ-N2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N4,6-ジメチルピリジン-2,4-ジアミンが褐色の固体として得られた。
化合物311:N2-(4-メトキシ-3-(2-メトキシエトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-メトキシ-5-ニトロフェノール(1g、5.91mmol、1当量)、Cs2CO3(3.8g、11.66mmol、2.00当量)、NaI(1.8g、12.00mmol、2.00当量)、N,N-ジメチルホルムアミド(40mL)、1-クロロ-2-メトキシエタン(850mg、8.99mmol、1.5当量)を入れた。得られた溶液を、油浴中で、100℃で2時間撹拌した。次に、反応を、50mLのNaHSO3の添加によってクエンチした。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を3×20mLの塩化ナトリウムで洗浄した。得られた混合物を減圧下で濃縮した。これにより、1.18g(86%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.21 min、LCMS 33:m/z=228.0[M+1].1H NMR(300MHz、DMSO-d6)δ 7.91(q,J=9.0Hz、1H)、7.76(d,J=2.7Hz、1H)、7.19(d,J=9.0Hz、1H)、4.27-4.17(m,2H)、3.92(s,3H)、3.76-3.65(m,2H)、3.34-3.32(s,3H).
100mLの丸底フラスコ中に、1-メトキシ-2-(2-メトキシエトキシ)-4-ニトロベンゼン(580mg、2.55mmol、1当量)、Pd/C(200mg)、メタノール(25mL)を入れた。得られた溶液を25℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、430mg(85%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.72min、LCMS 33:m/z=198.0[M+1].
100mLの丸底フラスコ中に、4-メトキシ-3-(2-メトキシエトキシ)アニリン(430mg、2.18mmol、1当量)、TsOH(825mg、4.79mmol、2.00当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(340mg、2.16mmol、1当量)、イソプロパノール(23mL)を入れた。得られた溶液を、油浴中で、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(300mg)を、NH4HCO3:ACN(1:1)、検出器、UV254nmとともにシリカゲルカラム上に適用した。75mgの生成物が得られた。これにより、75mg(11%)のN2-(4-メトキシ-3-(2-メトキシエトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが固体として得られた。
化合物312:N2-(4-メトキシ-3-(3-メトキシプロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-メトキシ-5-ニトロフェノール(1g、5.91mmol、1当量)、1-クロロ-3-メトキシプロパン(645mg、5.94mmol、1当量)、Cs2CO3(3.8g、11.66mmol、2.00当量)、NaI(1.3g、1.50当量)、N,N-ジメチルホルムアミド(20mL)を入れた。得られた溶液を、油浴中で、100℃で2時間撹拌した。得られた溶液を50mLのEAで希釈した。得られた混合物を3×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.4g(98%)が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.317min、LCMS 33:m/z=242[M+1].
50mLの丸底フラスコ中に、1-メトキシ-2-(3-メトキシプロポキシ)-4-ニトロベンゼン(500mg、2.07mmol、1当量)、Pd/C(10%)(100mg)、メタノール(10mL)を入れた。得られた溶液を、H2(g)雰囲気下で、室温で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、410mg(94%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.792min、LCMS 33:m/z=212[M+1].
50mLの丸底フラスコ中に、4-メトキシ-3-(3-メトキシプロポキシ)アニリン(350mg、1.66mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(262mg、1.66mmol、1当量)、CF3COOH(378mg、3.32mmol、2.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、80℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/NH4HCO3/ACN(41%)を用いたフラッシュクロマトグラフィーによって精製した。これにより、315.0mg(57%)のN2-(4-メトキシ-3-(3-メトキシプロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物313:N2-(4-シクロプロピル-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-ブロモ-5-ニトロフェノール(2g、9.17mmol、1当量)、1-(3-クロロプロピル)ピロリジン塩酸塩(1.69g、9.18mmol、1当量)、NaI(1.65g、1.20当量)、Cs2CO3(5.96g、18.29mmol、2.00当量)、CH3CN(30mL)を入れた。得られた溶液を、油浴中で、80℃で5時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、ACN/H2O(28%)を用いたフラッシュクロマトグラフィーによって精製した。これにより、2.4g(79%)が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.964min、LCMS33:m/z=329[M+1].
250mLの3口丸底フラスコ中に、1-[3-(2-ブロモ-5-ニトロフェノキシ)プロピル]ピロリジン(1.9g、5.77mmol、1当量)、シクロプロピルボロン酸(745mg、8.67mmol、1.50当量)、Pd(dppf)Cl2(845mg、1.15mmol、0.20当量)、炭酸カリウム(1.59g、11.50mmol、2.00当量)、水(2mL)、1,4-ジオキサン(20mL)を入れた。得られた溶液を、N2(g)雰囲気下で、油浴中で、80℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、H2O/ACN(32%)を用いたフラッシュクロマトグラフィーによって精製した。これにより、440mg(26%)が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.956min、LCMS39:m/z=291[M+1].
100mLの丸底フラスコ中に、1-[3-(2-シクロプロピル-5-ニトロフェノキシ)プロピル]ピロリジン(400mg、1.38mmol、1当量)、Fe(385mg、6.88mmol、5.00当量)、NH4Cl(368mg、6.88mmol、5.00当量)、水(6mL)、エタノール(12mL)を入れた。得られた溶液を、油浴中で、80℃で3時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.1gの表題化合物が黄色の粗製の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.794min、LCMS33:m/z=261[M+1].
5mLの丸底フラスコ中に、4-シクロプロピル-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(300mg、1.15mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(181.2mg、1.15mmol、1当量)、CF3COOH(263.1mg、2.31mmol、2.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、80℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC C NH3によって精製した。これにより、40.6mgのN2-(4-シクロプロピル-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物314:N2-(4-シクロプロピル-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-シクロプロピル-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(300mg、1.15mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(166mg、1.16mmol、1当量)、CF3COOH(263mg、2.31mmol、2.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、80℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C TFAによって精製した。これにより、21.9mgのN2-(4-シクロプロピル-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物315:N4-メチル-N2-(3-(3-(ピロリジン-1-イル)プロポキシ)-4-(トリフルオロメトキシ)フェニル)ピリミジン-2,4-ジアミンの合成
250mLの3口丸底フラスコ中に、5-ブロモ-2-(トリフルオロメトキシ)アニリン(2g、7.81mmol、1当量)、エタノール(20mL)、HCl(2mL)を入れた。この後、NaNO2(595mg、8.62mmol、1.10当量)を0℃で撹拌しながら滴下して加えた。これに、水(110mL)、硫酸(5.5mL)を加えた。得られた溶液を、水/氷浴中で、0℃で1.5時間撹拌した。温度を油浴中で100℃に維持しながら、得られた溶液を、さらに12時間にわたって、撹拌しながら反応させた。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLの炭酸水素ナトリウムで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。これにより、1g(50%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.715min、LCMS 53:m/z=257[M+1].1H NMR(400MHz、DMSO-d6)δ 13.29(s,1H)、7.96(s,1H)、7.77-7.51(m,1H)、7.44(d,J=8.5Hz、1H).
100mLの丸底フラスコ中に、5-ブロモ-2-(トリフルオロメトキシ)フェノール(1000mg、3.89mmol、1当量)、1-(3-クロロプロピル)ピロリジン塩酸塩(720mg、3.91mmol、1当量)、Cs2CO3(2550mg、7.83mmol、2.00当量)、NaI(589mg、1当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を、油浴中で、90℃で2時間撹拌した。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×30mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.4g(98%)の表題化合物が赤色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.346min、LCMS 53:m/z=368[M+1].
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、1-[3-[5-ブロモ-2-(トリフルオロメトキシ)フェノキシ]プロピル]ピロリジン(700mg、1.90mmol、1当量)、アセトアミド(228.9mg、3.88mmol、2.00当量)、Cs2CO3(1.24g、3.81mmol、2.00当量)、キサントホス(220.5mg、0.38mmol、0.20当量)、Pd2(dba)3-CHCl3(197.4mg、0.10当量)、ジオキサン(20mL)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。固体をろ過によって収集した。粗生成物を、ACN/H2O=2/5によって精製した。これにより、450mg(68%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.940min、LCMS 33:m/z=347[M+1].1H NMR(300MHz、メタノール-d4)δ 7.63(d,J=2.4Hz、1H)、7.21(d,J=8.4Hz、1H)、7.05(d,J=2.4Hz、1H)、4.14(t,J=5.9Hz、2H)、3.63(q,J=7.0Hz、1H)、2.97-2.83(m,5H)、2.19-2.09(m,4H)、1.94-1.83(m,4H)、1.21(t,J=7.1Hz、1H).
50mLの丸底フラスコ中に、N-[3-[3-(ピロリジン-1-イル)プロポキシ]-4-(トリフルオロメトキシ)フェニル]アセトアミド(450mg、1.30mmol、1当量)、エタノール(6mL)、水(2mL)、水酸化ナトリウム(208mg、5.20mmol、4.00当量)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、ACN/H2O=1/20によって精製した。これにより、350mg(89%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.930min、LCMS 31:m/z=305[M+1].
50mLの丸底フラスコ中に、3-[3-(ピロリジン-1-イル)プロポキシ]-4-(トリフルオロメトキシ)アニリン(350mg、1.15mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(164.7mg、1.15mmol、1当量)、トリフルオロ酢酸(262.5mg、2.32mmol、2.00当量)、イソプロパノール(6mL)を入れた。得られた溶液を、油浴中で、80℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(450mg)を、分取HPLC C NH3によって精製した。これにより、104mg(17%)のN4-メチル-N2-(3-(3-(ピロリジン-1-イル)プロポキシ)-4-(トリフルオロメトキシ)フェニル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物329および317:ジアステレオマー1:N2-(3-((1r,3r)-3-(ジメチルアミノ)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンおよびジアステレオマー2:N2-(3-((1s,3s)-3-(ジメチルアミノ)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された100mLの3口丸底フラスコ中に、tert-ブチルN-(3-ヒドロキシシクロブチル)カルバメート(500mg、2.67mmol、1当量)、2-メトキシ-5-ニトロフェノール(452mg、2.67mmol、1当量)、PPh3(1.541g、5.88mmol、2.20当量)、テトラヒドロフラン(20mL)を入れた。この後、テトラヒドロフラン(5mL)中のDEAD(1.188g、5.88mmol、2.20当量)の溶液を、0℃で撹拌しながら滴下して加えた。得られた溶液を0℃で10分間撹拌した。得られた溶液を25℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A EA/PEによって精製した。これにより、900mg(100%)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.707min、LCMS 40、m/z=239[M+1].1H NMR(300MHz、DMSO-d6)δ 8.98(s,1H)、8.00-7.69(m,1H)、7.62-7.47(m,1H)、7.28-7.13(m,1H)、5.01-4.46(m,1H)、3.91(d,J=3.0Hz、3H)、2.89-2.68(m,1H)、2.45-2.28(m,2H)、2.10-1.93(m,2H)、1.39(d,J=3.3Hz、9H).
50mLの丸底フラスコ中に、tert-ブチルN-[3-(2-メトキシ-5-ニトロフェノキシ)シクロブチル]カルバメート(900mg、2.66mmol、1当量)、ジクロロメタン(10mL)、トリフルオロ酢酸(5mL)を入れた。得られた溶液を25℃で30分間撹拌した。これにより、1.2g(粗製)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.557min、LCMS 30、m/z=239[M+1].1H NMR(300MHz、DMSO-d6)δ 8.17(s,2H)、8.00-7.86(m,1H)、7.64-7.42(m,2H)、5.20-4.62(m,1H)、3.93(s,3H)、3.89-3.34(m,1H)、2.97-2.57(m,2H)、2.38-2.15(m,2H).
50mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシ)シクロブタン-1-アミン;トリフルオロ酢酸(942mg、2.67mmol、1当量)、メタノール(20mL)、ホルムアルデヒド(241mg、8.03mmol、3.00当量)、NaBH3CN(843mg、13.42mmol、5.00当量)を入れた。得られた溶液を25℃で6時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A MeOH/H2Oによって精製した。これにより、330mg(46%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.901min、LCMS 15、m/z=267[M+1].1H NMR(300MHz、DMSO-d6)δ 7.92(dd,J=9.0、2.7Hz、1H)、7.63-7.42(m,1H)、7.20(dd,J=9.1、2.5Hz、1H)、4.94-4.51(m,1H)、3.92(s,3H)、2.92-2.56(m,2H)、2.46-2.12(m,2H)、2.07(d,J=6.8Hz、6H)、1.94-1.77(m,1H).
50mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシ)-N,N-ジメチルシクロブタン-1-アミン(330mg、1.24mmol、1当量)、メタノール(20mL)、Pd/C、水素を入れた。得られた溶液を25℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、285mg(97%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.261min、LCMS 31、m/z=237[M+1].1H NMR(300MHz、DMSO-d6)δ 6.64(dd,J=8.3、1.8Hz、1H)、6.25-6.00(m,2H)、4.72-4.51(m,2H)、4.36-4.14(m,1H)、3.61(d,J=2.7Hz、3H)、2.85-2.54(m,2H)、2.38-1.98(m,8H)、1.87-1.72(m,1H).
50mLの丸底フラスコ中に、3-[3-(ジメチルアミノ)シクロブトキシ]-4-メトキシアニリン(250mg、1.06mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(167mg、1.06mmol、1当量)、IPA(10mL)、トリフルオロ酢酸(242mg、2.14mmol、2.00当量)を入れた。得られた溶液を、油浴中で、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、キラル-分取HPLC IFによって精製した。粗生成物を、分取HPLC C HClによって精製した。これにより、49.6mg(12%)のN2-(3-((1r,3r)-3-(ジメチルアミノ)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンジアステレオマー1(無作為に割り当てられた)がオフホワイトの固体として、および69.4mg(17%)のN2-(3-((1s,3s)-3-(ジメチルアミノ)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンジアステレオマー2(無作為に割り当てられた)がオフホワイトの固体として得られた。
化合物318:N2-(3-((1s,3s)-3-((ジメチルアミノ)メチル)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、3-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシ)-N,N-ジメチルシクロブタン-1-カルボキサミド(200mg、0.52mmol、1当量)、LAH(78.96mg、2.08mmol、4.00当量)、オキソラン(10mL)を入れた。得られた溶液を、水/氷浴中で、0℃で2時間撹拌した。次に、反応を、200mgの水/氷の添加によってクエンチした。水酸化ナトリウム(水溶液)(10%)を用いて、溶液のpH値を8に調整した。得られた溶液を2mLのH2Oで希釈した。得られた溶液を20mLの酢酸エチルで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。粗生成物を、分取HPLC Aによって精製した。これにより、61.8mg(32%)のN2-(3-((1s,3s)-3-((ジメチルアミノ)メチル)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物319:6-エチル-5-フルオロ-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの3口丸底フラスコ中に、2,4-ジクロロ-5-フルオロピリミジン(1g、5.99mmol、1当量)、GDE(3mL)、I2(1.5g、1当量)、テトラヒドロフラン(8mL)、TEA(605mg、5.98mmol、1当量)、ブロモ(エチル)マグネシウム(1.2g、9.00mmol、1.50当量)を入れた。得られた溶液を、水/氷浴中で、0℃で1時間撹拌した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×50mLのNaHSO3で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1/10)とともにシリカゲルカラム上に適用した。これにより、600mg(51%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):195[M+1]、RT:1.38min.
50mLの丸底フラスコ中に、2,4-ジクロロ-6-エチル-5-フルオロピリミジン(300mg、1.54mmol、1当量)、CH3NH2-HCl(206mg、2.00当量)、Cs2CO3(1g、3.07mmol、2.00当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を80℃で12時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、150mg(51%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):190[M+1]、R:0.79min.
50mLの丸底フラスコ中に、2-クロロ-6-エチル-5-フルオロ-N-メチルピリミジン-4-アミン(100mg、0.53mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(198mg、0.79mmol、1.50当量)、Cs2CO3(508mg、1.56mmol、3.00当量)、Pd2(dba)3.CHCl3(50mg)、X-phos(50mg)、1,4-ジオキサン(10mL)を入れた。得られた溶液を100℃で4時間撹拌した。粗生成物を、以下の条件(IntelFlash-1):カラム、シリカゲル;移動相、ACN/H2O=1/1;検出器、UV254nmを用いたフラッシュ-min取HPLCによって精製し、生成物が得られた。これにより、44.1mg(21%)の6-エチル-5-フルオロ-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物320:6-シクロプロピル-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
窒素の不活性雰囲気でパージされ、維持された50mLの3口丸底フラスコ中に、2,4,6-トリクロロピリミジン(1g、5.45mmol、1当量)、テトラヒドロフラン(20mL)、CuI(110mg、0.58mmol、0.10当量)を入れた。この後、ブロモ(シクロプロピル)マグネシウム(5.5mL、1当量)を0℃で撹拌しながら滴下して加えた。得られた溶液を、水/氷浴中で、0℃で2時間撹拌した。得られた溶液を、25℃でさらに2時間にわたって、撹拌しながら反応させた。次に、反応を、NH4Clの添加によってクエンチした。得られた混合物を減圧下で濃縮した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×100mLの水および2×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A EA/PEによって精製した。これにより、300mg(29%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.355min、LCMS 53、m/z=189[M+1].1H NMR(300MHz、DMSO-d6)δ 7.77(s,1H)、2.27-2.13(m,1H)、1.29-1.03(m,4H).
8mLの密閉管中に、2,4-ジクロロ-6-シクロプロピルピリミジン(200mg、1.06mmol、1当量)、N,N-ジメチルホルムアミド(4mL)、炭酸カリウム(365mg、2.64mmol、2.50当量)、メタンアミン塩酸塩(72mg、1.07mmol、1当量)を入れた。得られた溶液を、水/氷浴中で、0℃で2時間撹拌した。得られた溶液を、25℃でさらに2時間にわたって、撹拌しながら反応させた。固体をろ過して取り除いた。粗生成物(4mL)を、フラッシュ-分取HPLC A Gradによって精製した。これにより、80mg(41%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.682min、LCMS 30、m/z=184[M+1].1H NMR(300MHz、DMSO-d6)δ 7.61(s,1H)、6.33(s,1H)、2.76(d,J=4.8Hz、3H)、1.91-1.85(m,1H)、0.95-0.85(m,4H).
8mLの密閉管中に、2-クロロ-6-シクロプロピル-N-メチルピリミジン-4-アミン(80mg、0.44mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(109mg、0.44mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(100mg、0.88mmol、2.00当量)を入れた。得られた溶液を、油浴中で、90℃で3時間撹拌した。得られた溶液を酢酸エチルで抽出し、有機層を組み合わせた。粗生成物(5mL)を、分取HPLC C HClによって精製した。これにより、91.9mg(49%)の6-シクロプロピル-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが固体として得られた。
化合物321:N-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)イミダゾ[1,2-a]ピリジン-3-アミンの合成
100mLの3口丸底フラスコ中に、トルエン(20mL)、3-ヨードイミダゾ[1,2-a]ピリジン(2g、8.20mmol、1当量)、ジフェニルメタンイミン(1.5g、8.28mmol、1.01当量)、Pd2(dba)3CHCl3(1.3g)、BINAP(1.5g、2.41mmol、0.29当量)、t-BuONa(2.4g、24.97mmol、3.05当量)を入れた。得られた溶液を80℃で5時間撹拌した。得られた溶液を10mLのH2Oで希釈した。3口丸底フラスコを、N2でパージし、維持した。得られた溶液を3×20mLのジクロロメタンで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.5g(62%)が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.769min、LCMS 32:m/z=297[M+1].
250mLの丸底フラスコ中に、HCl(2M)(30mL)、N-(ジフェニルメチリデン)イミダゾ[1,2-a]ピリジン-3-アミン(1.5g、5.04mmol、1当量)を入れた。得られた溶液を20℃で12時間撹拌した。得られた溶液を3×10mLのジクロロメタンで抽出し、有機層を組み合わせた。水酸化ナトリウムを用いて、溶液のpH値を10に調整した。得られた混合物を3×20mLのクロロメタン2で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、370mg(55%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.290min、LCMS 40:m/z=133[M+1].
40mLのバイアル中に、ジオキサン(20mL)、イミダゾ[1,2-a]ピリジン-3-アミン(180mg、1.35mmol、1当量)、2-ブロモ-5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン(469mg、1.49mmol、1.10当量)、Pd2(dba)3-CHCl3(1035mg)、キサントホス(247mg、0.43mmol、0.32当量)、Cs2CO3(880mg、2.70mmol、2.00当量)を入れた。バイアルを、N2でパージし、維持した。得られた溶液を80℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(300mg)を、分取HPLC C TFAによって精製した。これにより、262.2mg(40%)のN-[イミダゾ[1,2-a]ピリジン-3-イル]-5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミンが淡褐色の固体として得られた。
化合物322:N3-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N5-メチルピリダジン-3,5-ジアミンの合成
20mLの密閉管中に、3,5-ジクロロピリダジン(1g、6.71mmol、1当量)、CH3NH2-H2O(2mL)、ジオキサン(2mL)を入れた。得られた溶液を、油浴中で、50℃で2時間撹拌した。得られた溶液を2mLのメタノールで希釈した。残渣を、CH3CN:H2O(1:10)とともにシリカゲルカラム上に適用した。これにより、620mg(64%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.62min、LCMS07:m/z=144.00[M+1].
50mLの丸底フラスコ中に、6-クロロ-N-メチルピリダジン-4-アミン(300mg、2.09mmol、1当量)、トリフルオロ酢酸(604mg、5.34mmol、3.00当量)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(526.6mg、2.10mmol、1当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(300mg)を、分取HPLC Gによって精製した。これにより、83.1mg(8%)のN3-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N5-メチルピリダジン-3,5-ジアミンが白色の固体として得られた。
化合物323:N5-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N3-メチルピリダジン-3,5-ジアミンの合成
25mLの丸底フラスコ中に、3,5-ジクロロピリダジン(1g、6.71mmol、1当量)、アンモニア(8mL)、ジオキサン(2mL)を入れた。得られた溶液を100℃で一晩撹拌した。固体をろ過によって収集した。これにより、570mg(62%)の表題化合物が褐色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.434min、LCMS 53、m/z=130[M+1].
50mLの丸底フラスコ中に、6-クロロピリダジン-4-アミン(570mg、4.40mmol、1当量)、ジオキサン(20mL)、CH3NH2-H2O(4mL)を入れた。得られた溶液を140℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、320mg(59%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.187min、LCMS 45、m/z=125[M+1].
100mLの丸底フラスコ中に、3-N-メチルピリダジン-3,5-ジアミン(250mg、2.01mmol、1当量)、2-ブロモ-5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン(628mg、1.99mmol、0.99当量)、第3世代ブレットホス(181.2mg)、Cs2CO3(1.3g、3.99mmol、1.98当量)、DMSO(25mL)を入れた。得られた溶液を80℃で1時間撹拌した。粗生成物を、分取HPLC C HClによって精製した。これにより、31.2mg(4%)のN5-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N3-メチルピリダジン-3,5-ジアミンが淡黄色の固体として得られた。
化合物324:N4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N6-メチルピリミジン-4,6-ジアミンの合成
100mLの丸底フラスコ中に、N,N-ジメチルホルムアミド(10mL)、4,6-ジクロロピリミジン(1g、6.71mmol、1当量)、Cs2CO3(4.4g、13.50mmol、2.01当量)、メタンアミン塩酸塩(905mg、13.40mmol、2.00当量)を入れた。得られた溶液を80℃で14時間撹拌した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を4×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を1×10mLのH2Oで洗浄した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:1)とともにシリカゲルカラム上に適用した。これにより、750mg(78%)が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.476min、LCMS 32:m/z=144[M+1].
窒素の不活性雰囲気でパージされ、維持された40mLのバイアル中に、ジオキサン(10mL)、6-クロロ-N-メチルピリミジン-4-アミン(114mg、0.79mmol、1当量)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1当量)、Pd2(dba)3-CHCl3(123mg、0.12mmol、0.15当量)、キサントホス(138mg、0.24mmol、0.30当量)、Cs2CO3(520mg、1.60mmol、2.01当量)を入れた。得られた溶液を80℃で14時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を5mLのH2Oで希釈した。得られた溶液を3×10mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。粗生成物(200mg)を、分取HPLC D TFAによって精製した。これにより、40.6mg(11%)のN4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N6-メチルピリミジン-4,6-ジアミンが白色の固体として得られた。
化合物325:N4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N6,2-ジメチルピリミジン-4,6-ジアミンの合成
40mLのバイアル中に、N,N-ジメチルホルムアミド(10mL)、4,6-ジクロロ-2-メチルピリミジン(500mg、3.07mmol、1当量)、メタンアミン塩酸塩(411mg、6.09mmol、1.98当量)、Cs2CO3(1.9g、5.83mmol、1.90当量)を入れた。得られた溶液を80℃で12時間撹拌した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を3×20mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×10mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、450mg(93%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.763min、LCMS 07:m/z=157[M+1].
20mLのバイアル中に、ジオキサン(10mL)、6-クロロ-N,2-ジメチルピリミジン-4-アミン(114mg、0.72mmol、1当量)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1.10当量)、Pd2(dba)3-CHCl3(112mg)、キサントホス(133mg、0.23mmol、0.32当量)、Cs2CO3(472mg、1.45mmol、2.00当量)を入れた。このバイアルを、N2でパージし、維持した。得られた溶液を80℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC D TFAによって精製した。これにより、48.8mg(14%)のN4-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-N6,2-ジメチルピリミジン-4,6-ジアミンが白色の固体として得られた。
化合物409:N2-(3-((1-イソプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
化合物326:N-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-2-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミンの合成
窒素の不活性雰囲気でパージされ、維持された40mLのバイアル中に、ジオキサン(10mL)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(200mg、0.80mmol、1当量)、4-クロロ-2-メチル-7H-ピロロ[2,3-d]ピリミジン(133mg、0.79mmol、1当量)、Pd2(dba)3-CHCl3(124mg、0.12mmol、0.15当量)、キサントホス(138mg、0.24mmol、0.30当量)、Cs2CO3(519mg、1.59mmol、2.00当量)を入れた。得られた溶液を80℃で14時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC D TFAによって精製した。これにより、47.2mg(12%)のN-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-2-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミンが白色の固体として得られた。
化合物328:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6,7-ジヒドロ-5H-シクロペンタ[d]ピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2,4-ジクロロ-5H,6H,7H-シクロペンタ[d]ピリミジン(850mg、4.50mmol、1当量)、炭酸カリウム(1.87g、13.53mmol、3.01当量)、N,N-ジメチルホルムアミド(5mL)、メタンアミン塩酸塩(303mg、4.49mmol、1当量)を入れた。得られた溶液を0℃で1時間撹拌した。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC A Gradによって精製した。これにより、500mg(61%)の表題化合物がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.856 min、LCMS 45:m/z=184.0[M+1].1H NMR(300MHz、DMSO-d6)δ 8.19(s,1H)、2.86(s,3H)、2.82-2.70(m,2H)、2.63(t,J=7.5Hz、2H)、2.12-1.95(m,2H).
50mLの丸底フラスコ中に、2-クロロ-N-メチル-5H,6H,7H-シクロペンタ[d]ピリミジン-4-アミン(200mg、1.09mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(249mg、2.18mmol、2.01当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(273mg、1.09mmol、1当量)を入れた。得られた溶液を80℃で2時間撹拌した。粗生成物を、分取HPLC Aによって精製した。これにより、93.2mg(20%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6,7-ジヒドロ-5H-シクロペンタ[d]ピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物331:N2-(3-((1r,3r)-3-((ジメチルアミノ)メチル)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、3-(ベンジルオキシ)-N,N-ジメチルシクロブタン-1-カルボキサミド(3g、12.86mmol、1当量)、メタノール(100mL)、Pd/C、水素を入れた。得られた溶液を、油浴中で、50℃で3時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.8g(98%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.56min、LCMS07:m/z=144[M+1].
50mLの丸底フラスコ中に、3-ヒドロキシ-N,N-ジメチルシクロブタン-1-カルボキサミド(900mg、6.29mmol、1当量)、ジクロロメタン(10mL)、MsCl(2.1g、3.00当量)、TEA(1.9g、18.78mmol、3.00当量)を入れた。得られた溶液を20℃で2時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×10mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×10mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.5g(108%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.85min、LCMS07:m/z=222[M+1].
50mLの丸底フラスコ中に、3-(ジメチルカルバモイル)シクロブチルメタンスルホネート(1.3g、5.88mmol、1当量)、Cs2CO3(5.75g、17.59mmol、3.00当量)、2-メトキシ-5-ニトロフェノール(994mg、5.88mmol、1当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を、油浴中で、80℃で10時間撹拌した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×10mLのH2Oで洗浄した。得られた混合物を2×10mLの塩化ナトリウム(水溶液)で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。残渣を、ジクロロメタン/メタノール(10:1)とともにシリカゲルカラム上に適用した。これにより、1.2g(69%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.82min、LCMS32:m/z=295[M+1].
250mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシ)-N,N-ジメチルシクロブタン-1-カルボキサミド(600mg、2.04mmol、1当量)、メタノール(150mL)、ラネーNi、水素を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、480mg(89%)の表題化合物が青緑色の油として得られた
分析データ:LC-MS:(ES、m/z):RT=0.79min、LCMS33:m/z=265[M+1].1H NMR(400MHz、メタノール-d4)δ 6.76(dd,J=8.3、3.8Hz、1H)、6.43-6.21(m,2H)、4.78-4.54(m,1H)、3.75(d,J=8.4Hz、3H)、3.55-3.47(m,1H)、3.06-2.92(m,6H)、2.77-2.64(m,2H)、2.50-2.31(m,2H).
50mLの丸底フラスコ中に、3-(5-アミノ-2-メトキシフェノキシ)-N,N-ジメチルシクロブタン-1-カルボキサミド(467mg、1.77mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(277mg、1.76mmol、1当量)、IPA(10mL)、トリフルオロ酢酸(514.7mg、4.55mmol、3.00当量)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、967mg(>100%粗製)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.89min、LCMS07:m/z=386[M+1].
50mLの丸底フラスコ中に、3-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシ)-N,N-ジメチルシクロブタン-1-カルボキサミド(200mg、0.52mmol、1当量)、オキソラン(0mg)、LAH(78.96mg、2.08mmol、4.00当量)を入れた。得られた溶液を、水/氷浴中で、0℃で2時間撹拌した。次に、反応を、200mgの水/氷の添加によってクエンチした。水酸化ナトリウム(水溶液)(10mol/L)を用いて、溶液のpH値を8に調整した。得られた溶液を20mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で、オーブン中で乾燥させた。固体をろ過して取り除いた。粗生成物(400mg)を、分取HPLC C HClによって精製した。粗生成物(300mg)を、キラル-分取HPLC ICによって精製した。これにより、66.4mg(34%)のN2-(3-((1r,3r)-3-((ジメチルアミノ)メチル)シクロブトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物332:N2-(6-メトキシ-5-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-3-イル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、5-ブロモ-2-クロロピリジン-3-オール(1.1g、5.28mmol、1当量)、Cs2CO3(5.3g、16.27mmol、3.08当量)、N,N-ジメチルホルムアミド(10mL)、1-(3-クロロプロピル)ピロリジン塩酸塩(1g、5.43mmol、1.03当量)を入れた。得られた溶液を80℃で2時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.05g(62%)が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.827min、LCMS 45:m/z=319.00[M+1].1H-NMR:(300MHz、クロロホルム-d)δ 8.05(d,J=2.0Hz、1H)、7.41(d,J=2.0Hz、1H)、4.15(t,J=6.3Hz、2H)、2.73-2.46(m,6H)、2.17-1.93(m,2H)、1.92-1.73(m,4H).
50mLの丸底フラスコ中に、5-ブロモ-2-クロロ-3-[3-(ピロリジン-1-イル)プロポキシ]ピリジン(1g、3.13mmol、1当量)、メタノール(10mL)、メトキシナトリウム(849mg、15.72mmol、5.02当量)を入れた。得られた溶液を70℃で48時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を100mLの塩化ナトリウムで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、910mg(92%)が淡黄色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=13min、LCMS 31:m/z=315.35[M+1].1H-NMR:(300MHz、クロロホルム-d)δ 7.77(d,J=2.0Hz、1H)、7.23(d,J=2.1Hz、1H)、4.12(t,J=6.5Hz、2H)、3.98(s,3H)、2.62-2.51(m,6H)、2.15-2.02(m,2H)、1.85-1.78(m,4H).
窒素の不活性雰囲気でパージされ、維持された50mLの丸底フラスコ中に、5-ブロモ-2-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]ピリジン(870mg、2.76mmol、1当量)、Cs2CO3(2.7g、8.29mmol、3.00当量)、第3世代ブレットホス(251mg)、ジオキサン(5mL)、アセトアミド(245mg、4.15mmol、1.50当量)を入れた。得られた溶液を65℃で16時間撹拌した。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC A Gradによって精製した。これにより、200mg(25%)が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.541min、LCMS45:m/z=294.10[M+1].1H-NMR-PH-EPISOK-350-4:(300MHz、酸化重水素)δ 7.57(d,J=2.1Hz、1H)、7.33(d,J=2.1Hz、1H)、4.09-3.97(m,1H)、3.85(s,3H)、3.08-2.87(m,2H)、2.23-1.80(m,9H).
100mLの丸底フラスコ中に、N-[6-メトキシ-5-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-3-イル]アセトアミド(180mg、0.61mmol、1当量)、水酸化カリウム(172mg、3.07mmol、5.00当量)、水(5mL)、メタノール(5mL)を入れた。得られた溶液を60℃で16時間撹拌した。得られた溶液を4×50mLのジクロロメタンで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、110mg(71%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.414min、LCMS53:m/z=252.20[M+1].1H-NMR:(300MHz、メタノール-d4)δ 7.19(d,J=2.4Hz、1H)、6.81(d,J=2.3Hz、1H)、4.15-3.92(m,2H)、3.86(s,3H)、2.78-2.51(m,4H)、2.04(m,2H)、1.95-1.70(m,9H).
25mLの丸底フラスコ中に、6-メトキシ-5-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-3-アミン(100mg、0.40mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(91mg、0.80mmol、2.01当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(63mg、0.40mmol、1当量)を入れた。得られた溶液を80℃で2時間撹拌した。粗生成物を、分取HPLC C HClによって精製した。これにより、71mg(44%)のN2-(6-メトキシ-5-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-3-イル)-N4,6-ジメチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物334:N2-(3-((1-エチルアゼチジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-N-[3-(アゼチジン-3-イルメトキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(300mg、0.91mmol、1当量)、アセトアルデヒド(32.1mg、0.73mmol、0.80当量)、メタノール(15mL)、NaBH3CN(344.68mg、5.49mmol、6.00当量)、HOAC(0.002mL)を入れた。得られた溶液を25℃で20分間撹拌した。得られた溶液を、25℃でさらに2時間にわたって、撹拌しながら反応させた。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC D TFAによって精製した。これにより、32.4mg(8%)のN2-(3-((1-エチルアゼチジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物335:N-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-1H-ピロロ[2,3-b]ピリジン-4-アミンの合成
50mLの丸底フラスコ中に、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(128mg、0.51mmol、1当量)、4-ブロモ-1H-ピロロ[2,3-b]ピリジン(100mg、0.51mmol、1当量)、Cs2CO3(496mg、1.52mmol、3.00当量)、Pd2(dba)3-CHCl3(50mg)、X-phos(50mg)、1,4-ジオキサン(10mL)を入れた。得られた溶液を100℃で4時間撹拌した。粗生成物を、フラッシュ-分取A 1:1によって精製した。これにより、35.8mg(15%)のN-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-1H-ピロロ[2,3-b]ピリジン-4-アミンが白色の固体として得られた。
化合物336:N-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-6-メチル-1H-ピロロ[2,3-b]ピリジン-4-アミンの合成
50mLの丸底フラスコ中に、4-クロロ-6-メチル-1H-ピロロ[2,3-b]ピリジン(150mg、0.90mmol、1当量)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(228mg、0.91mmol、1当量)、Cs2CO3(884mg、2.71mmol、3.00当量)、Pd2(dba)3-CHCl3(50mg)、X-phos(50mg)、1,4-ジオキサン(10mL)を入れた。得られた溶液を100℃で4時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、35.9mg(9.5%)のN-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-6-メチル-1H-ピロロ[2,3-b]ピリジン-4-アミンが淡黄色の固体として得られた。
化合物388:N2-(1-(3-(ジメチルアミノ)プロピル)-1H-インダゾール-6-イル)-N4-メチルピリミジン-2,4-ジアミンの合成
40mLのバイアル中に、N,N-ジメチルホルムアミド(20mL)、6-ニトロ-1H-インダゾール(1g、6.13mmol、1当量)、(3-クロロプロピル)ジメチルアミン塩酸塩(963mg、6.09mmol、0.99当量)、Cs2CO3(4g、12.28mmol、2.00当量)、KI(1g)を入れた。得られた溶液を60℃で12時間撹拌した。得られた溶液を20mLのH2Oで希釈した。得られた溶液を3×20mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×20mLの水および3×20mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、ジクロロメタン/メタノール(50:1)とともにシリカゲルカラム上に適用した。これにより、200mg(13%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.861min、LCMS 07:m/z=249[M+1].
100mLの丸底フラスコ中に、メタノール(30mL)、ラネーNi(40mg)、ジメチル[3-(6-ニトロ-2H-インダゾール-2-イル)プロピル]アミン(200mg、0.81mmol、1当量)、水素を入れた。得られた溶液を20℃で2時間撹拌した。固体をろ過して取り除いた。フラスコを、H2でパージし、維持した。得られた混合物を減圧下で濃縮した。これにより、190mg(108%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.322min、LCMS 33:m/z=219[M+1].
20mLのバイアル中に、イソプロパノール(2mL)、2-[3-(ジメチルアミノ)プロピル]-2H-インダゾール-6-アミン(150mg、0.69mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(109mg、0.76mmol、1.10当量)、PTSA(118mg、0.69mmol、1当量)を入れた。得られた溶液を80℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(100mg)を、分取HPLC Gによって精製した。これにより、35.1mg(14%)のN2-(1-(3-(ジメチルアミノ)プロピル)-1H-インダゾール-6-イル)-N4-メチルピリミジン-2,4-ジアミンが黄色の固体として得られた。
化合物404:N2-(2-(2-(ジメチルアミノ)エチル)-2H-インダゾール-6-イル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、6-ニトロ-1H-インダゾール(1g、6.13mmol、1当量)、N,N-ジメチルホルムアミド(10mL)、Cs2CO3(8g、24.48mmol、3.99当量)、ヨードナトリウム(920mg、6.14mmol、1当量)を入れた。室温で30分間反応させた。次に、(2-クロロエチル)ジメチルアミン塩酸塩(1.75g、12.15mmol、1.98当量)を加えた。得られた溶液を60℃で16時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×mLの塩化ナトリウムで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、480mg(33%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.629min、LCMS45:m/z=235.10[M+1].
H2でパージされ、維持された100mLの丸底フラスコ中に、ジメチル[2-(6-ニトロ-2H-インダゾール-2-イル)エチル]アミン(480mg、2.05mmol、1当量)、ラネーNi(50mg)、メタノール(10mL)を入れた。得られた溶液を室温で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、380mg(91%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.373min、LCMS31:m/z=205.48[M+1].
50mLの丸底フラスコ中に、2-[2-(ジメチルアミノ)エチル]-2H-インダゾール-6-アミン(370mg、1.81mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(414mg、3.63mmol、2.00当量)、2-クロロ-N-メチルピリミジン-4-アミン(259mg、1.80mmol、1当量)を入れた。得られた溶液を80℃で2時間撹拌した。粗生成物を、分取HPLC F HClによって精製した。これにより、73mg(12%)のN2-(2-(2-(ジメチルアミノ)エチル)-2H-インダゾール-6-イル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物407:N2-(4-メトキシ-3-(((1-メチルピロリジン-3-イル)オキシ)メチル)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、1-メチルピロリジン-3-オール(900mg、8.90mmol、1.10当量)、N,N-ジメチルホルムアミド(30mL)を入れた。この後、水素化ナトリウム(1.96g、81.67mmol、6.00当量)を、0℃で数回に分けて加えた。60%。得られた溶液を、水/氷浴中で、0℃で30分間撹拌した。これに、2-(ブロモメチル)-1-メトキシ-4-ニトロベンゼン(2g、8.13mmol、1当量)を加えた。温度を油浴中で20℃に維持しながら、得られた溶液を、さらに2時間にわたって、撹拌しながら反応させた。次に、反応を、60mLの水の添加によってクエンチした。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせて、減圧下で、オーブン中で乾燥させた。これにより、740mg(34%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.923 min、LCMS34:m/z=267.2[M+1].1H NMR(300MHz、メタノール-d4)δ 8.36-8.14(m,2H)、7.17-7.07(m,1H)、4.63-4.47(m,2H)、3.99(d,J=1.2Hz、3H)、2.85-2.70(m,2H)、2.58-2.36(m,5H)、2.31-2.12(m,2H)、2.09-1.90(m,1H).
50mLの丸底フラスコ中に、3-[(2-メトキシ-5-ニトロフェニル)メトキシ]-1-メチルピロリジン(700mg、2.63mmol、1当量)、Fe(735.0mg、13.12mmol、5.00当量)、NH4Cl(714mg、13.35mmol、5.00当量)、水(3mL)、エタノール(10mL)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、1.5g(粗製)の表題化合物が粗製の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.687min、LCMS53:m/z=237.2[M+1].
50mLの丸底フラスコ中に、4-メトキシ-3-[[(1-メチルピロリジン-3-イル)オキシ]メチル]アニリン(200mg、0.85mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(121.2mg、0.84mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(193.2mg、1.71mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。粗生成物を、分取HPLC C HClによって精製した。これにより、49.0mg(15%)のN2-(4-メトキシ-3-(((1-メチルピロリジン-3-イル)オキシ)メチル)フェニル)-N4-メチルピリミジン-2,4-ジアミンが油として得られた。
化合物408:N2-(3-((1-エチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.61mmol、1当量)、メタノール(10mL)、NaBH3CN(114.9mg、1.83mmol、3.00当量)、アセトアルデヒド(26.7mg、0.61mmol、1当量)を入れた。得られた溶液を20℃で2時間撹拌した。次に、反応を、水/氷の添加によってクエンチした。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC C TFAによって精製した。これにより、29mg(12%)のN2-(3-((1-エチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物410:N2-(4-メトキシ-3-((1-(2-メトキシエチル)ピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
30mLの密閉管中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.61mmol、1当量)、N,N-ジメチルホルムアミド(10mL)、炭酸カリウム(252mg、1.82mmol、3.00当量)、1-ブロモ-2-メトキシエタン(101mg、0.73mmol、1.20当量)を入れた。得られた溶液を、油浴中で、50℃で12時間撹拌した。粗生成物を、分取HPLC C TFAによって精製した。これにより、60.9mg(20%)のN2-(4-メトキシ-3-((1-(2-メトキシエチル)ピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物411:N2-(3-((1-シクロプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
25mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N-メチルピリミジン-2,4-ジアミン(250mg、0.76mmol、1当量)、メタノール(10mL)、(1-エトキシシクロプロポキシ)トリメチルシラン(200mg、1.15mmol、1.50当量)、NaBH3CN(144mg、2.29mmol、3.00当量)、AcOH(0.2mL)を入れた。得られた溶液を、油浴中で、65℃で16時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C TFAによって精製した。これにより、95.3mg(26%)のN2-(3-((1-シクロプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物412:N2-(4-メトキシ-3-((1-メチルピペリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、(1-メチルピペリジン-3-イル)メタノール(1g、7.74mmol、1当量)、ジクロロメタン(20mL)、TEA(2.349g、23.21mmol、3.00当量)、MsCl(1.326g、11.63mmol、1.50当量)を入れた。得られた溶液を20℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、1.6g(100%)の表題化合物が黄色の固体として得られた。
50mLの丸底フラスコ中に、2-メトキシ-5-ニトロフェノール(1.09g、6.44mmol、1当量)、(1-メチルピペリジン-3-イル)メチルメタンスルホネート(1.6g、7.72mmol、1.20当量)、Cs2CO3(4.21g、12.92mmol、2.00当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を、油浴中で、90℃で24時間撹拌した。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。粗生成物を、フラッシュ-分取HPLC A Gradによって精製した。これにより、900mg(50%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.901 min、LCMS07:m/z=281.15[M+1].1H NMR(300MHz、メタノール-d4)δ 7.96-7.92(m,1H)、7.80(d,J=2.7Hz、1H)、7.13(d,J=9.0Hz、1H)、4.08-3.88(m,5H)、3.11-3.07(m,1H)、2.89-2.85(m,1H)、2.33(s,3H)、2.26-1.49(m,6H)、1.29-1.14(m,1H).
H2の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシメチル)-1-メチルピペリジン(900mg、3.21mmol、1当量)、メタノール(20mL)、Pd/C(300mg)を入れた。得られた溶液を20℃で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、800mg(100%)が暗赤色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.149min、LCMS48:m/z=281.2[M+1].
50mLの丸底フラスコ中に、4-メトキシ-3-[(1-メチルピペリジン-3-イル)メトキシ]アニリン(300mg、1.20mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(170.9mg、1.19mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(272.5mg、2.41mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。粗生成物を、分取HPLC C HClによって精製した。これにより、93.5mg(20%)のN2-(4-メトキシ-3-((1-メチルピペリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物413:N2-(4-メトキシ-3-((1-メチルピペリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-メトキシ-3-[(1-メチルピペリジン-3-イル)メトキシ]アニリン(300mg、1.20mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(187.6mg、1.19mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(272.5mg、2.41mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。粗生成物を、分取HPLC G NH4HCO3によって精製した。これにより、43.1mg(10%)のN2-(4-メトキシ-3-((1-メチルピペリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物414:1-(3-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)アゼチジン-3-オールの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、NaI(93mg)、炭酸カリウム(514mg、3.72mmol、6.00当量)、ACN(10mL)、アゼチジン-3-オール塩酸塩(203mg、1.85mmol、2.99当量)を入れた。得られた溶液を80℃で16時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC C HClによって精製した。これにより、59.3mg(24%)の1-(3-(2-メトキシ-5-((4-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)アゼチジン-3-オールが淡黄色の固体として得られた。
化合物415および416:(S)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンおよび(R)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、(1-メチルピロリジン-3-イル)メタノール(1.5g、13.02mmol、1当量)、TEA(4.0g、39.53mmol、3.00当量)、ジクロロメタン(15mL)、メタンスルホニルクロリド(2.23mg、0.02mmol、1.5当量)を入れた。得られた溶液を25℃で3時間撹拌した。次に、反応を、20mLの水の添加によってクエンチした。得られた溶液を15mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、1.78g(粗製)の表題化合物が褐色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.34min、LCMS 33:m/z=194.0[M+1].
100mLの丸底フラスコ中に、(1-メチルピロリジン-3-イル)メチルメタンスルホネート(1.78g、9.21mmol、1当量)、Cs2CO3(9g、27.62mmol、3.00当量)、2-メトキシ-5-ニトロフェノール(2.3g、13.60mmol、1.5当量)、N,N-ジメチルホルムアミド(40mL)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。得られた溶液を3×40mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×30mLの塩化ナトリウムで洗浄した。残渣を、ジクロロメタン/メタノール(20:1)とともにシリカゲルカラム上に適用した。これにより、1.46g(58%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.89 min、LCMS 07:m/z=267.0[M+1].1H NMR(300MHz、メタノール-d4)δ 7.93(q,J=2.7Hz、1H)、7.80(d,J=2.7Hz、1H)、7.12(d,J=9.0Hz、1H)、4.11-3.99(m,2H)、3.97(s,3H)、2.94-2.64(m,4H)、2.56(q,J=9.4Hz、1H)、2.43(s,3H)、2.23-2.02(m,1H)、1.72-1.69(m,1H).
100mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシメチル)-1-メチルピロリジン(1.46g、5.48mmol、1当量)、ラネーNi(300mg)、メタノール(25mL)を入れた。得られた溶液を25℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、630mg(42%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.60min、LCMS 07:m/z=237.0[M+1].
100mLの丸底フラスコ中に、4-メトキシ-3-[(1-メチルピロリジン-3-イル)メトキシ]アニリン(300mg、1.27mmol、1当量)、トリフルオロ酢酸(290mg、2.57mmol、2.00当量、98%)、2-クロロ-N-メチルピリミジン-4-アミン(182mg、1.27mmol、1当量)、イソプロパノール(15mL)を入れた。得られた溶液を、油浴中で、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、NH4HCO3:ACN(1:1)、検出器、UV254nmとともにシリカゲルカラム上に適用した。これにより、23mg(5%)の(S)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンE1(任意に割り当てられた、S)および22.7mg(5%)の(R)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンE2(任意に割り当てられた、R)が白色の固体として得られた。
化合物417および418:(S)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンおよび(R)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、4-メトキシ-3-[(1-メチルピロリジン-3-イル)メトキシ]アニリン(300mg、1.27mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(200mg、1.27mmol、1当量)、トリフルオロ酢酸(290mg、2.57mmol、2.00当量、98%)、イソプロパノール(15mL)を入れた。得られた溶液を、油浴中で、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(300mg)を、NH4HCO3:ACN(1:1)、検出器、UV254nmとともにシリカゲルカラム上に適用した。これにより、82.4mg(18%)の(S)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンE1(任意に割り当てられた、S)が白色の固体として、および49.6mg(11%)の(R)-N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンE1(任意に割り当てられた、R)が白色の固体として得られた。
化合物419:N2-(3-(((1-エチルピロリジン-3-イル)オキシ)メチル)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、tert-ブチル3-(2-メトキシ-5-ニトロフェノキシメチル)ピロリジン-1-カルボキシレート(600mg、1.70mmol、1当量)、メタノール(50mL)、ラネーNi、水素を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、496mg(90%)が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.76min、LCMS33:m/z=322[M+1].1H NMR(300MHz、メタノール-d4)δ 6.77(d,J=8.5Hz、1H)、6.47(d,J=2.6Hz、1H)、6.33(dd,J=8.5、2.5Hz、1H)、4.02-3.85(m,2H)、3.76(s,3H)、3.63-3.48(m,2H)、3.26(dd,J=20.0、11.5Hz、2H)、2.77-2.66(m,1H)、2.10(d,J=10.7Hz、1H)、1.85(dd,J=13.9、6.7Hz、1H)、1.48(s,9H).
100mLの丸底フラスコ中に、tert-ブチル3-(5-アミノ-2-メトキシフェノキシメチル)ピロリジン-1-カルボキシレート(496mg、1.54mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(242mg、1.54mmol、1当量)、トリフルオロ酢酸(445mg、3.94mmol、3.00当量)、イソプロパノール(10mL)を入れた。得られた溶液を、油浴中で、85℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH3CN/H2O(1:5)とともにシリカゲルカラム上に適用した。これにより、560mg(82%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.15min、LCMS28:m/z=444[M+1].1H NMR(300MHz、メタノール-d4)δ 7.29(s,1H)、7.13-6.99(m,2H)、5.99(d,J=1.2Hz、1H)、5.51(s,1H)、4.02(q,J=8.0、6.8Hz、2H)、3.87(s,3H)、3.68-3.38(m,3H)、3.00(s,3H)、2.73(s,1H)、2.29(s,3H)、2.12(s,1H)、1.86(s,1H)、1.48(s,9H).
50mLの丸底フラスコ中に、tert-ブチル3-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシメチル)ピロリジン-1-カルボキシレート(560mg、1.26mmol、1当量)、トリフルオロ酢酸(364mg、3.22mmol、3.00当量)、ジクロロメタン(10mL)を入れた。得られた溶液を20℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。TEAを用いて、pHを8に調整した。得られた混合物を減圧下で濃縮した。これにより、900mg(>100%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.78min、LCMS07:m/z=344[M+1].1H NMR(300MHz、メタノール-d4)δ 7.28(d,J=2.5Hz、1H)、7.19(dd,J=8.7、2.5Hz、1H)、7.04(d,J=8.7Hz、1H)、5.99(d,J=1.1Hz、1H)、4.19-4.04(m,2H)、3.88(s,3H)、3.71-3.47(m,3H)、3.01(s,5H)、2.37-2.22(m,4H)、2.12-1.94(m,1H).
50mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(300mg、0.87mmol、1当量)、NaBH3CN(165.3mg、2.63mmol、3.00当量)、アセトアルデヒド(38.5mg、0.87mmol、1当量)、メタノール(10mL)を入れた。得られた溶液を20℃で2時間撹拌した。次に、反応を、水/氷の添加によってクエンチした。得られた混合物を減圧下で濃縮した。粗生成物(300mg)を、分取HPLC C HClによって精製した。これにより、77.6mg(22%)のN2-(3-(((1-エチルピロリジン-3-イル)オキシ)メチル)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物420:N2-(4-メトキシ-3-((1-プロピルピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.91mmol、1当量)、プロパナール(60mg、1.03mmol、1.10当量)、メタノール(15mL)、NaBH3CN(172mg、2.74mmol、3.00当量)、AcOH(0.2mL)を入れた。得られた溶液を25℃で2時間撹拌した。次に、反応を、水の添加によってクエンチした。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C TFAによって精製した。これにより、144.6mg(33%)のN2-(4-メトキシ-3-((1-プロピルピロリジン-3-イル)メトキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物421:N2-(4-メトキシ-3-(((1-メチルピロリジン-3-イル)オキシ)メチル)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-メトキシ-3-[[(1-メチルピロリジン-3-イル)オキシ]メチル]アニリン(200mg、0.85mmol、1当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(133.0mg、0.84mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(193.2mg、1.71mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。粗生成物を、分取HPLC G NH4HCO3によって精製した。これにより、54.2mg(18%)のN2-(4-メトキシ-3-(((1-メチルピロリジン-3-イル)オキシ)メチル)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物422:N2-(3-((1-(シクロプロピルメチル)ピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.61mmol、1当量)、シクロプロパンカルバルデヒド(64mg、0.91mmol、1.50当量)、メタノール(10mL)を入れた。10分後、NaBH3CN(191mg、3.04mmol、5.01当量)を加えた。得られた溶液を室温で2時間撹拌した。次に、反応を、水の添加によってクエンチした。粗生成物を、分取HPLC C HClによって精製した。これにより、66.4mg(26%)のN2-(3-((1-(シクロプロピルメチル)ピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物423:N2-(4-メトキシ-3-(3-(3-メチルアゼチジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、カリウムメタンペルオキソエート(257.1mg、1.85mmol、3.00当量)、アセトニトリル(10mL)、3-メチルアゼチジン塩酸塩(132.9mg、1.24mmol、2.00当量)、ヨードナトリウム(93.2mg、0.62mmol、1当量)を入れた。得られた溶液を85℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC C TFAによって精製した。これにより、75.3mg(26%)のN2-(4-メトキシ-3-(3-(3-メチルアゼチジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物424:N2-(3-(3-((シクロプロピルメチル)(メチル)アミノ)プロポキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、炭酸カリウム(257mg、1.86mmol、3.00当量)、NaI(93mg、1当量)、CH3CN(10mL)、(シクロプロピルメチル)(メチル)アミン(150mg、1.76mmol、2.00当量)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、フラッシュ-分取HPLC Aによって精製した。これにより、41.8mg(14%)のN2-(3-(3-((シクロプロピルメチル)(メチル)アミノ)プロポキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物425:N2-(4-メトキシ-3-(3-(3-メトキシアゼチジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、3-メトキシアゼチジン塩酸塩(228mg、1.84mmol、3.00当量)、NaI(93mg、1当量)、炭酸カリウム(513mg、3.71mmol、6.00当量)、ACN(10mL)を入れた。得られた溶液を80℃で12時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、74.9mg(25%)のN2-(4-メトキシ-3-(3-(3-メトキシアゼチジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物426:N2-(3-((5-シクロプロピルイソオキサゾール-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの3口丸底フラスコ中に、テトラヒドロフラン(20mL)、LAH(1.99g、52.44mmol、4.00当量)を入れた。この後、テトラヒドロフラン(5mL)中の5-シクロプロピル-1,2-オキサゾール-3-カルボン酸(2g、13.06mmol、1当量)の溶液を、0℃で撹拌しながら滴下して加えた。得られた溶液を0℃で3時間撹拌した。次に、反応を、2mLの水の添加によってクエンチした。得られた溶液を100mLのEAで希釈した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.8g(99%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.572min、LCMS 32:m/z=140[M+1].
100mLの丸底フラスコ中に、ジクロロメタン(50mL)、(5-シクロプロピル-1,2-オキサゾール-3-イル)メタノール(1.8g、12.94mmol、1当量)、TEA(3.96g、39.13mmol、3.03当量)を入れた。この後、MsCl(1.9g、16.67mmol、1.29当量)を0℃で撹拌しながら滴下して加えた。得られた溶液を20℃で14時間撹拌した。得られた混合物を3×10mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、1.2g(43%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.834min、LCMS 07
40mLのバイアル中に、N,N-ジメチルホルムアミド(5ml)、(5-シクロプロピル-1,2-オキサゾール-3-イル)メチルメタンスルホネート(200mg、0.92mmol、1当量)、2-メトキシ-5-[[4-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノール(270mg、1.10mmol、1.19当量)、Cs2CO3(600mg、1.84mmol、2.00当量)を入れた。得られた溶液を80℃で4時間撹拌した。固体をろ過して取り除いた。粗生成物(200mg)を、分取HPLC C HClによって精製した。これにより、72.6mg(20%)のN2-(3-((5-シクロプロピルイソオキサゾール-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物428:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6-(2,2,2-トリフルオロエチル)ピリミジン-2,4-ジアミンの合成
1Lの3口丸底フラスコ中に、1,3-ジアジナン-2,4,6-トリオン(30g、234.22mmol、1当量)、N,N-ジメチルアニリン(42.54g、351.05mmol、1.50当量)、POBr3(263g、4.00当量)、トルエン(300mL)を入れた。得られた溶液を110℃で3時間撹拌した。得られた混合物を室温に冷まし、黄色の有機層をデカントして取り除いた。赤色のガムをEAで1回すすいだ。組み合わされた有機層を、3×500mLの飽和炭酸水素ナトリウム、3×500mLの塩水および2×500mLの水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、54gの表題化合物が黄色の粗製の固体として得られた。
2Lの3口丸底フラスコ中に、2,4,6-トリブロモピリミジン(54g、170.47mmol、1当量)、メタノール(500mL)、ジエチルエーテル(500mL)を入れ、MeONa/MeOH(30%)(76.7g、2.50当量)を滴下して加えた。得られた溶液を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液1LをEAで希釈した。得られた混合物を3×500mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:100~1:10)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、23g(62%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.287min、LCMS 28:m/z=219[M+1].
窒素の不活性雰囲気でパージされ、維持された1Lの3口丸底フラスコ中に、4-ブロモ-2,6-ジメトキシピリミジン(23g、105.01mmol、1当量)、テトラヒドロフラン(250mL)、ジエチルエーテル(250mL)を入れ、n-BuLi(2.5M)(46.2mg、0.72mmol、1.10当量)を-78℃で滴下して加えた。-78℃で5分間撹拌した後、2,2,2-トリフルオロ酢酸エチル(16.4g、115.43mmol、1.10当量)を滴下して加えた。-78℃で30分間撹拌した後、得られた溶液を室温で一晩撹拌した。次に、反応を、200mLの飽和NH4Clの添加によってクエンチした。炭酸ナトリウムを用いて、pHを8に調整した。得られた溶液を1LのEAで希釈した。得られた混合物を3×500mLの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:100~1:10)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、15g(56%)の表題化合物がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.739min、LCMS 32:m/z=255[M+1].
500mLの3口丸底フラスコ中に、1-(2,6-ジメトキシピリミジン-4-イル)-2,2,2-トリフルオロエタン-1,1-ジオール(15g、59.02mmol、1当量)、メタノール(150mL)を入れ、NaBH4(8.98g、237.38mmol、4.00当量)を0℃で少しずつ加えた。得られた溶液を室温で1時間撹拌した。次に、反応を、50mLの飽和NH4Clの添加によってクエンチした。得られた溶液を500mLのEAで希釈した。得られた混合物を3×500mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:100~1:10)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、14gの表題化合物がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.806 min、LCMS 32:m/z=239[M+1].1H NMR(300MHz、DMSO-d6)δ 7.14(d,J=6.4Hz、1H)、6.72(s,1H)、5.01-4.95(m,1H)、3.92(d,J=5.4Hz、6H).
500mLの3口丸底フラスコ中に、1-(2,6-ジメトキシピリミジン-4-イル)-2,2,2-トリフルオロエタン-1-オール(14g、58.78mmol、1当量)、4-ジメチルアミノピリジン(21.53g、176.23mmol、3.00当量)、ジクロロメタン(200mL)を入れた。そして、フェニルクロロメタンチオエート(10.76g、62.33mmol、1.50当量)を0℃で滴下して加えた。得られた溶液を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を200mLのEAで希釈した。得られた混合物を3×200mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、37gの表題化合物が黄色の粗製の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.806min、LCMS 32:m/z=375[M+1].
1Lの3口丸底フラスコ中に、[1-(2,6-ジメトキシピリミジン-4-イル)-2,2,2-トリフルオロエトキシ](フェノキシ)メタンチオン(37g、98.84mmol、1当量)、AIBN(3.2g、19.49mmol、0.20当量)、(n-Bu)3SnH(114.76g、4.00当量)、トルエン(500mL)を入れた。得られた溶液を、油浴中で、110℃で2時間撹拌した。得られた溶液1LをEAで希釈した。得られた混合物を3×1Lの塩水で洗浄した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:100~1:10)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、13g(59%)の表題化合物が黄色の粗製油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.271min、LCMS 28:m/z=223[M+1].
500mLの3口丸底フラスコ中に、2,4-ジメトキシ-6-(2,2,2-トリフルオロエチル)ピリミジン(11g、49.51mmol、1当量)、濃HCl(150mL)を入れた。得られた溶液を、油浴中で、105℃で6時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、7.7g(80%)の表題化合物がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.773min、LCMS 15:m/z=195[M+1].
50mLの丸底フラスコ中に、6-(2,2,2-トリフルオロエチル)ピリミジン-2,4-ジオール(2.2g、11.33mmol、1当量)、三塩化ホスホリル(5mL)を入れた。得られた溶液を、油浴中で、120℃で3時間撹拌した。得られた混合物を氷/水に注いだ。得られた溶液を2×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、760mg(29%)の表題化合物が無色油として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 7.41(s,1H)、3.63(q,J=10.2Hz、2H).
50mLの丸底フラスコ中に、2,4-ジクロロ-6-(2,2,2-トリフルオロエチル)ピリミジン(720mg、3.12mmol、1当量)、メタンアミン塩酸塩(318mg、4.71mmol、1.50当量)、炭酸カリウム(1.29g、9.33mmol、3.00当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を室温で4時間撹拌した。得られた溶液を50mLのEAで希釈した。得られた混合物を3×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:100~1:10)とともにシリカゲルカラム上に適用した。収集された画分を組み合わせて、減圧下で濃縮した。これにより、300mg(43%)の表題化合物がオフホワイトの固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.799 min、LCMS 32:m/z=226[M+1].1H NMR(400MHz、DMSO-d6)δ 8.06(d,J=5.5Hz、1H)、6.52(m,1H)、3.76-3.52(m,2H)、2.94-2.70(m,3H).
50mLの丸底フラスコ中に、2-クロロ-N-メチル-6-(2,2,2-トリフルオロエチル)ピリミジン-4-アミン(260mg、1.15mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(288mg、1.15mmol、1当量)、CF3COOH(393mg、3.45mmol、3.00当量)、イソプロパノール(5mL)を入れた。得られた溶液を、油浴中で、80℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/ACN/NH4HCO3を用いたフラッシュクロマトグラフィーによって精製した。これにより、72.6mg(14%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6-(2,2,2-トリフルオロエチル)ピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物429:N2-(4-メトキシ-3-(3-(2-メチルアゼチジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
16mLの密閉管中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(200mg、0.62mmol、1当量)、ACN(8mL)、NaI(93mg、1当量)、炭酸カリウム(214mg、1.55mmol、2.50当量)、2-メチルアゼチジン塩酸塩(100mg、0.93mmol、1.50当量)を入れた。得られた溶液を、油浴中で、80℃で3時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC C TFAによって精製した。これにより、36.7mg(13%)のN2-(4-メトキシ-3-(3-(2-メチルアゼチジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物430:N2-(4-エトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-エトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(250mg、0.95mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(135.4mg、0.94mmol、1当量)、プロパン-2-オール(5mL)、トリフルオロ酢酸(275.6mg、2.44mmol、3.00当量)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(250mg)を、分取HPLC C HClによって精製した。これにより、87.6mg(23%)のN2-(4-エトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物432:N2-(4-エトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-エトキシ-5-ニトロフェノール(1g、5.46mmol、1当量)、N,N-ジメチルホルムアミド(5mL)、Cs2CO3(5.3g、16.22mmol、3.00当量)、ヨードナトリウム(819.7mg、5.47mmol、1当量)、1-(3-クロロプロピル)ピロリジン塩酸塩(1g、5.43mmol、1当量)を入れた。得られた溶液を、油浴中で、110℃で2時間撹拌した。次に、反応を、水/氷の添加によってクエンチした。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を2×10mLの塩化ナトリウム(水溶液)で洗浄した。得られた混合物を2×10mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、1.48g(92%)の表題化合物が油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.96min、LCMS07:m/z=295.05[M+1].1H NMR(300MHz、メタノール-d4)δ 7.36(dd,J=2.5、0.9Hz、1H)、7.24-7.14(m,2H)、4.15(q,J=7.0Hz、2H)、4.05(t,J=6.1Hz、2H)、2.75-2.57(m,6H)、2.08-1.98(m,2H)、1.90-1.79(m,4H)、1.41(t,J=7.0Hz、3H).
250mLの丸底フラスコ中に、1-[3-(2-エトキシ-5-ニトロフェノキシ)プロピル]ピロリジン(800mg、2.72mmol、1当量)、ラネーNi、メタノール(100mL)を入れた。得られた溶液を20℃で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、700mg(97%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.77min、LCMS33:m/z=265.19[M+1].1H NMR:(400MHz、メタノール-d4)δ 6.72(d,J=8.7Hz、1H)、6.40(d,J=2.9Hz、1H)、6.23(dd,J=8.7、2.9Hz、1H)、4.12-3.85(m,4H)、2.70-2.56(m,6H)、2.05-1.73(m,6H)、1.40(t,J=7.0Hz、3H).
50mLの丸底フラスコ中に、4-エトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(250mg、0.95mmol、1当量)、トリフルオロ酢酸(275.6mg、2.44mmol、3.00当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(148.7mg、0.94mmol、1当量)、プロパン-2-オール(5mL)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(250mg)を、分取HPLC C HClによって精製した。これにより、111mg(28%)のN2-(4-エトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物433:N2-(3-((5-シクロプロピル-1,2,4-オキサジアゾール-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、水(20g)、2-クロロアセトニトリル(5g、66.23mmol、1当量)、ヒドロキシルアミン塩酸塩(4.6g、66.20mmol、1当量)を入れた。この後、炭酸ナトリウム(3.5g、33.02mmol、0.50当量)を少しずつ加えた。得られた溶液を20℃で2時間撹拌した。得られた溶液を4×20mLのエーテルで抽出し、有機層を組み合わせて、無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、3.9g(54%)の表題化合物が白色の固体として得られた。分析データ:LC-MS:(ES、m/z):RT=0.259min、LCMS 33:m/z=109[M+1].
250mLの丸底フラスコ中に、ジクロロメタン(100mL)、シクロプロパンカルボニルクロリド(5.5g、52.61mmol、1.50当量)、(E)-2-クロロ-N’-ヒドロキシエタンイミドアミド(3.8g、35.01mmol、1当量)を入れた。得られた溶液を20℃で30分間撹拌した。この後、TEA(3.9g、38.54mmol、1.10当量)を加えた。得られた溶液を、20℃でさらに1時間にわたって、撹拌しながら反応させた。得られた混合物を2×50mLの水および1×50mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、5.2g(84%)の表題化合物が明るい赤色の油として得られた。分析データ:LC-MS:(ES、m/z):RT=0.504min、LCMS 32:m/z=177[M+1].
20mLの密閉管中に、N,N-ジメチルホルムアミド(10mL)、(Z)-(1-アミノ-2-クロロエチリデン)アミノシクロプロパンカルボキシレート(1.5g、8.49mmol、1当量)を入れた。得られた溶液を135℃で3時間撹拌した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×10mLの水および2×10mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、550mg(41%)の表題化合物が油として得られた。分析データ:LC-MS:(ES、m/z):RT=0.775min、LCMS 32:m/z=159[M+1].
50mLの丸底フラスコ中に、N,N-ジメチルホルムアミド(5mL)、3-(クロロメチル)-5-シクロプロピル-1,2,4-オキサジアゾール(550mg、3.47mmol、4.27当量)、2-メトキシ-5-[[4-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノール(200mg、0.81mmol、1当量)、Cs2CO3(530mg、1.63mmol、2.00当量)、NaI(122mg)を入れた。得られた溶液を80℃で8時間撹拌した。固体をろ過して取り除いた。粗生成物(300mg)を、分取HPLC C NH4HCO3によって精製した。これにより、36.8mg(12%)のN2-(3-((5-シクロプロピル-1,2,4-オキサジアゾール-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物434:N2-(3-((1-シクロプロピル-1H-1,2,3-トリアゾール-4-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、メチル1H-1,2,3-トリアゾール-4-カルボキシレート(2g、15.74mmol、1当量)、Cu(OAc)2(8.6g、47.35mmol、3.00当量)、ピリジン(12.4g、156.76mmol、10.00当量)、テトラヒドロフラン(100mL)、シクロプロピルボロン酸(2.7g、31.43mmol、2.00当量)を入れた。得られた溶液を、油浴中で、55℃で72時間撹拌した。得られた溶液を3×200mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、150mg(6%)の表題化合物が黄色の固体として得られた。分析データ:LC-MS:(ES、m/z):168[M+1]、R:1.065 min.1H-NMR:(DMSO-d6、ppm):δ 8.84(s,1H)、4.06-4.08(m,1H)、3.83(s,3H)、1.31-1.06(m,4H).
100mLの丸底フラスコ中に、メチル1-シクロプロピル-1H-1,2,3-トリアゾール-4-カルボキシレート(120mg、0.72mmol、1当量)、LiAlH4(144mg、3.79mmol、5.00当量)、テトラヒドロフラン(20mL)を入れた。得られた溶液を、水/氷浴中で、0℃で1時間撹拌した。次に、反応を、水の添加によってクエンチした。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、30mg(30%)の表題化合物が白色の固体として得られた。分析データ:LC-MS:(ES、m/z):140[M+1]、R:0.856min。
100mLの丸底フラスコ中に、(1-シクロプロピル-1H-1,2,3-トリアゾール-4-イル)メタノール(20mg、0.14mmol、1当量)、三塩化ホスホリル(4mL)を入れた。得られた溶液を、油浴中で、100℃で3時間撹拌した。得られた混合物を、白色の固体としての化合物の下で濃縮した。分析データ:LC-MS:(ES、m/z):158[M+1]、R:1.267min。
50mLの丸底フラスコ中に、4-(クロロメチル)-1-シクロプロピル-1H-1,2,3-トリアゾール(100mg、0.63mmol、1当量)、Cs2CO3(619mg、1.90mmol、3.00当量)、N,N-ジメチルホルムアミド(10mL)、2-メトキシ-5-[4-(メチルアミノ)ピリミジン-2-イル]アミノフェノール(156mg、0.63mmol、1当量)を入れた。得られた溶液を、油浴中で、50℃で2時間撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC C TFAによって精製した。これにより、21.3mg(7%)のN2-(3-((1-シクロプロピル-1H-1,2,3-トリアゾール-4-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物435:N2-(4-メトキシ-3-((1-メチルピペリジン-4-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、tert-ブチル4-(ヒドロキシメチル)ピペリジン-1-カルボキシレート(500mg、2.32mmol、1当量)、メタンスルホニルクロリド(530mg、4.63mmol、2.00当量)、TEA(704mg、6.96mmol、3.00当量)、ジクロロメタン(15mL)を入れた。得られた溶液を25℃で1時間撹拌した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、550mg(81%)が淡黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.26 min、LCMS 53:m/z=294[M+1].1H-NMR:(DMSO-d6、ppm):δ 4.07(d,J=6.4Hz、2H)、3.96(d,J=13.0Hz、2H)、3.18(s,3H)、2.72(s,2H)、1.92-1.78(m,1H)、1.72-1.57(m,2H)、1.40(s,9H)、1.18-0.99(m,4H).
250mLの丸底フラスコ中に、2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノール;トリフルオロ酢酸(730mg、1.95mmol、1当量)、tert-ブチル4-[(メタンスルホニルオキシ)メチル]ピペリジン-1-カルボキシレート(720mg、2.45mmol、1.20当量)、Cs2CO3(2g、6.14mmol、3.00当量)、N,N-ジメチルホルムアミド(30mL)を入れた。得られた溶液を80℃で12時間撹拌した。得られた溶液を3×100mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物をxmLの塩化ナトリウムで洗浄した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、600mg(67%)の表題化合物が淡黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.14 min、LCMS 15:m/z=458[M+1].1H-NMR:(DMSO-d6、ppm):δ 8.78-8.71(m,1H)、7.81(s,1H)、7.19-7.09(m,1H)、6.93(s,1H)、6.80(d,J=8.7Hz、1H)、5.75(s,1H)、3.98(d,J=12.7Hz、2H)、3.79(d,J=6.4Hz、2H)、3.69(s,3H)、2.83(d,J=4.5Hz、3H)、2.74(s,2H)、2.10(s,3H)、1.97-1.87(m,1H)、1.76(d,J=13.3Hz、2H)、1.40(s,9H)、1.25-1.03(m,2H).
100mLの丸底フラスコ中に、tert-ブチル4-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシメチル)ピペリジン-1-カルボキシレート(600mg、1.31mmol、1当量)、トリフルオロ酢酸(10mL)、ジクロロメタン(20mL)を入れた。得られた溶液を25℃で1時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、420mg(90%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.14min、LCMS 15:m/z=358[M+1].
100mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピペリジン-4-イルメトキシ)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(210mg、0.59mmol、1当量)、HCHO(364mg、10.00当量)、NaBH3CN(280mg、4.46mmol、16.00当量)、メタノール(15mL)を入れた。得られた溶液を25℃で4時間撹拌した。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、94.0mg(39%)のN2-(4-メトキシ-3-((1-メチルピペリジン-4-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物436:N2-(3-((1-(シクロプロピルメチル)ピペリジン-4-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピペリジン-4-イルメトキシ)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(270mg、0.76mmol、1当量)、シクロプロパンカルバルデヒド(847mg、12.08mmol、16当量)、NaBH3CN(476g、7.57mol、10.00当量)、メタノール(15mL)、HOAC(0.5mL)を入れた。得られた溶液を25℃で2時間撹拌した。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、111.1mg(3.3%)のN2-(3-((1-(シクロプロピルメチル)ピペリジン-4-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物437:N2-(3-(アゼチジン-3-イルメトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノール(2g、7.68mmol、1当量)、tert-ブチル3-[(メタンスルホニルオキシ)メチル]アゼチジン-1-カルボキシレート(2.4g、9.05mmol、1.20当量)、Cs2CO3(5.0g、15.35mmol、2.00当量)、N,N-ジメチルホルムアミド(20mL)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、0.5g(15%)の表題化合物が淡褐色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.130min、LCMS53:m/z=430.2[M+1].
100mLの丸底フラスコ中に、tert-ブチル3-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシメチル)アゼチジン-1-カルボキシレート(500mg、1.16mmol、1当量)、ジクロロメタン(10mL)、トリフルオロ酢酸(2mL)を入れた。得られた溶液を20℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、39.4mg(10%)のN2-(3-(アゼチジン-3-イルメトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが淡褐色の固体として得られた。
化合物438および439:N2-(3-(((3S,4S)-1,4-ジメチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンおよびN2-(3-(((3R,4R)-1,4-ジメチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、ジクロロメタン(10mg、0.12mmol、0.05当量)、tert-ブチル3-(ヒドロキシメチル)-4-メチルピロリジン-1-カルボキシレート(500mg、2.32mmol、1当量)、TEA(712mg、7.04mmol、3.03当量)を入れた。この後、MsCl(345mg、3.03mmol、1.30当量)を0℃で加えた。得られた溶液を20℃で2時間撹拌した。得られた溶液を10mLのDCMで希釈した。得られた混合物を2×10mLの水および1×10mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、800mg(N/A)の表題化合物がオフホワイトの油として得られた。
分析データ:LC-MS:(ES、m/z):LCMS 32:m/z=294[M+1].
100mLの丸底フラスコ中に、N,N-ジメチルホルムアミド(20L)、tert-ブチル3-[(メタンスルホニルオキシ)メチル]-4-メチルピロリジン-1-カルボキシレート(800mg、2.73mmol、1当量)、2-メトキシ-5-[[4-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノール(739mg、3.00mmol、1.10当量)、Cs2CO3(1.78g、5.46mmol、2.00当量)を入れた。得られた溶液を80℃で4時間撹拌した。得られた溶液を20mLのH2Oで希釈した。得られた溶液を3×20mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×10mLの水および3×10mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(7:3)とともにシリカゲルカラム上に適用した。これにより、900mg(74%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.848min、LCMS 32:m/z=444[M+1].
100mLの丸底フラスコ中に、テトラヒドロフラン(20mL)、LAH(386mg、10.17mmol、5.01当量)を入れた。この後、0℃でテトラヒドロフラン(2mL)中のtert-ブチル3-(2-メトキシ-5-[[4-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシメチル)-4-メチルピロリジン-1-カルボキシレート(900mg、2.03mmol、1当量)の溶液を加えた。得られた溶液を80℃で5時間撹拌した。次に、反応を、0.4mLの水およびH2O(0.4ml)中のNaOHの溶液として0.4mLの添加によってクエンチした。得られた溶液を50mLのEAで希釈した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、440mg(61%)の表題化合物が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.589min、LCMS 32:m/z=358[M+1].
100mLの丸底フラスコ中に、2-N-[3-[(1,4-ジメチルピロリジン-3-イル)メトキシ]-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミン(450mg、1.26mmol、1当量)を入れた。これにより、48.8mg(11%)のN2-(3-(((3S,4S)-1,4-ジメチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンE1(無作為に割り当てられた)が淡黄色の固体として、および75.0mg(17%)のN2-(3-(((3R,4R)-1,4-ジメチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンE2(無作為に割り当てられた)が淡黄色の固体として得られた。
化合物440:N2-(3-(2-(シクロペンチルオキシ)エトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
20mLのバイアル中に、イソプロパノール(2mL)、3-[2-(シクロペンチルオキシ)エトキシ]-4-メトキシアニリン(150mg、0.60mmol、1当量)、2-クロロ-N-メチルピリミジン-4-アミン(103mg、0.72mmol、1.20当量)、トリフルオロ酢酸(136mg、1.20mmol、2.02当量)を入れた。得られた溶液を80℃で2時間撹拌した。粗生成物を、分取HPLC B TFAによって精製した。これにより、124.7mg(44%)のN2-(3-(2-(シクロペンチルオキシ)エトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物441:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-6-(メトキシメチル)-N4-メチルピリミジン-2,4-ジアミンの合成
20mLの丸底フラスコ中に、6-(クロロメチル)-1,2,3,4-テトラヒドロピリミジン-2,4-ジオン(2g、12.46mmol、1当量)、メタノール;メトキシナトリウム(10mL)を入れた。得られた溶液を70℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を30mLのH2Oに溶解させた。HCl(2mmol)を用いて、溶液のpH値を7に調整した。得られた溶液を3×30mLの酢酸エチルで抽出し、有機層を組み合わせた。これにより、350mg(17%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.467 min、LCMS 07、m/z=157[M+1].1H NMR(300MHz、酸化重水素)δ 5.70(d,J=1.2Hz、1H)、4.23(d,J=1.0Hz、2H)、3.33(s,3H).
100mLの丸底フラスコ中に、6-(メトキシメチル)-1,2,3,4-テトラヒドロピリミジン-2,4-ジオン(350mg、2.24mmol、1当量)、三塩化ホスホリル(5mL)を入れた。得られた溶液を120℃で5時間撹拌した。得られた混合物を減圧下で濃縮した。次に、反応を、30mLの水の添加によってクエンチした。炭酸水素ナトリウム-H2O(100%)を用いて、溶液のpH値を7に調整した。得られた溶液を3×20mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×20mLのH2Oで洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。これにより、360mg(75%)の表題化合物が淡黄色の液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.914min、LCMS07、m/z=193[M+1].
50mLの丸底フラスコ中に、2,4-ジクロロ-6-(メトキシメチル)ピリミジン(350mg、1.81mmol、1当量)、TEA(545mg、5.39mmol、2.97当量)、テトラヒドロフラン(10mL)、MeNH2-THF(2.7mL)を入れた。得られた溶液を0℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、160mg(42%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.650 min、LCMS 45、m/z=188[M+1].1H NMR(300MHz、クロロホルム-d)δ 6.44(s,1H)、4.41(s,2H)、3.51(s,3H)、3.06-2.97(m,3H).
25mLの丸底フラスコ中に、2-クロロ-6-(メトキシメチル)-N-メチルピリミジン-4-アミン(158mg、0.84mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(210mg、0.84mmol、1当量)、イソプロパノール(5mL)、トリフルオロ酢酸(287mg、2.54mmol、3.02当量)を入れた。得られた溶液を80℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C HClによって精製した。これにより、61.2mg(16%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-6-(メトキシメチル)-N4-メチルピリミジン-2,4-ジアミンが淡褐色の固体として得られた。
化合物442:N2-(4-メトキシ-3-((1-メチルアゼチジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(アゼチジン-3-イルメトキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(300mg、0.91mmol、1当量)、メタノール(10mL)、HCHO(90mg、3.00mmol、1当量)、NaBH3CN(360mg、5.73mmol、6.00当量)を入れた。得られた溶液を20℃で2時間撹拌した。粗生成物を、分取HPLC C HClによって精製した。これにより、30.4mg(9%)のN2-(4-メトキシ-3-((1-メチルアゼチジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンがオフホワイトの固体として得られた。
化合物445:N2-(3-((1-(シクロプロピルメチル)アゼチジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(アゼチジン-3-イルメトキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(300mg、0.91mmol、1当量)、メタノール(10mL)、シクロプロパンカルバルデヒド(63.8mg、0.91mmol、1当量)、NaBH3CN(361mg、5.74mmol、6.00当量)を入れた。得られた溶液を20℃で2時間撹拌した。粗生成物を、分取HPLC C TFAによって精製した。これにより、65.8mg(15%)のN2-(3-((1-(シクロプロピルメチル)アゼチジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物446:N2-(3-((1-シクロブチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
N2-(3-((1-シクロブチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンを、最後の工程でアセトアルデヒドの代わりにシクロブタノンを用いて、N2-(3-(((1-エチルピロリジン-3-イル)オキシ)メチル)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンと同様に調製した。
化合物447および448:2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)-6-メチルピリミジン-4-オールおよび4-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)-6-メチルピリミジン-2-オールの合成
100mLの丸底フラスコ中に、2-クロロ-6-メチルピリミジン-4-オール(360mg、2.49mmol、1当量)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(600mg、2.40mmol、1当量)、TsOH(900mg、5.23mmol、2.00当量、96%)、イソプロパノール(40mL)を入れた。得られた溶液を、油浴中で、85℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、NH4HCO3:ACN(1:1)、検出器、UV254nmとともにシリカゲルカラム上に適用した。これにより、84.4mg(9%)の2-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)-6-メチルピリミジン-4-オール、位置異性体1が固体として、および30.6mg(3%)の4-((4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)アミノ)-6-メチルピリミジン-2-オール、位置異性体2が固体として得られた。
化合物449:N2-(4-メトキシ-3-((1-(オキセタン-3-イル)ピロリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
N2-(4-メトキシ-3-((1-(オキセタン-3-イル)ピロリジン-3-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンを、最後の工程でアセトアルデヒドの代わりにオキセタン-3-オンを用いて、N2-(3-(((1-エチルピロリジン-3-イル)オキシ)メチル)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンと同様に調製した。
化合物450:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6-(ピロリジン-1-イル)ピリミジン-2,4-ジアミンの合成
10mLのバイアル中に、6-クロロ-2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-メチルピリミジン-2,4-ジアミン(150mg、0.38mmol、1当量)、ピロリジン(2mL)を入れた。得られた溶液を、油浴中で、100℃で3時間撹拌した。粗生成物(150mg)を、分取HPLC C HClによって精製した。これにより、96.1mg(54%)のN2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6-(ピロリジン-1-イル)ピリミジン-2,4-ジアミンが固体として得られた。
化合物451:N2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-クロロ-6-メチル-N-(オキサン-4-イルメチル)ピリミジン-4-アミン(870mg、3.60mmol、1当量)、tert-ブチル3-(5-アミノ-2-メトキシフェノキシメチル)ピロリジン-1-カルボキシレート(1.163g、3.61mmol、1当量)、TsOH(1.242g、7.21mmol、2.00当量)、イソプロパノール(20mL)を入れた。得られた溶液を、油浴中で、85℃で24時間撹拌した。粗生成物を、(CH3OH/H2O=1/10)によって精製した。これにより、1.1g(71%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.885min、LCMS28:m/z=428[M+1].
100mLの丸底フラスコ中に、N2-(4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミン(300mg、0.70mmol、1当量)を入れた。この後、HCHO(70.3mg、2.34mmol、1当量、30%水溶液)を加え、メタノール(20mL)を20℃で0.5時間撹拌した。次に、NaBH3CN(265.6mg、4.23mmol、6.00当量)、HOAC(0.2mL)を加え、25℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC D TFAによって精製した。これにより、71.2mg(18%)のN2-(4-メトキシ-3-((1-メチルピロリジン-3-イル)メトキシ)フェニル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物452:N2-(4-メトキシ-3-((テトラヒドロフラン-2-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
20mLのバイアル中に、N,N-ジメチルホルムアミド(5mL)、2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]ベンゼン-1-ペルオキソール(peroxol)(200mg、0.72mmol、1当量)、2-(ブロモメチル)オキソラン(330mg、2.00mmol、2.76当量)、Cs2CO3(330mg、1.01mmol、1.40当量)を入れた。2-(ブロモメチル)オキソランを2分毎に加えた。得られた溶液を20℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C HClによって精製した。これにより、95.4mg(35%)のN2-(4-メトキシ-3-((テトラヒドロフラン-2-イル)メトキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが淡褐色の固体として得られた。
化合物453:N2-(3-(2-シクロプロポキシエトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-(2-シクロプロポキシエトキシ)-1-メトキシ-4-ニトロベンゼン(300mg、1.18mmol、1当量)、NH4Cl(192mg、3.59mmol、3.00当量)、鉄(199mg、3.56mmol、3.00当量)、メタノール(5mL)、水(1mL)を入れた。得られた溶液を、油浴中で、90℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、メタノール/H2O(1:4)とともにシリカゲルカラム上に適用した。これにより、200mg(76%)の表題化合物が淡褐色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.82min、LCMS07:m/z=224[M+1].
50mLの丸底フラスコ中に、3-(2-シクロプロポキシエトキシ)-4-メトキシアニリン(200mg、0.90mmol、1当量)、トリフルオロ酢酸(306.7mg、2.71mmol、3.00当量)、IPA(10mL)、2-クロロ-N-メチルピリミジン-4-アミン(129mg、0.90mmol、1当量)を入れた。得られた溶液を、油浴中で、85℃で5時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC D TFAによって精製した。これにより、65mg(16%)のN2-(3-(2-シクロプロポキシエトキシ)-4-メトキシフェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物456:N2-(3-((1-シクロペンチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
N2-(3-((1-シクロペンチルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンを、最後の工程でアセトアルデヒドの代わりにシクロペンタノンを用いて、N2-(3-(((1-エチルピロリジン-3-イル)オキシ)メチル)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンと同様に調製した。
化合物458:6-シクロペンチル-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンの合成
40mLの丸底フラスコ中に、6-クロロ-2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-メチルピリミジン-2,4-ジアミン(300mg、0.77mmol、1当量)、Pd(dppf)Cl2(127mg、0.17mmol、0.23当量)、炭酸ナトリウム(245mg、2.31mmol、3.02当量)、ジオキサン(9mL)、水(3mL)、LiCl(37mg)、[シクロペンタ-1-エン-1-イル(ヨード)ボラニル]ホスファンイミン(173mg、0.69mmol、0.90当量)を入れた。得られた溶液を80℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を3×20mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で、オーブン中で乾燥させた。得られた混合物を3×50mLの1NのHCl/H2Oで洗浄した。炭酸ナトリウム(100%)を用いて、溶液のpH値を9に調整した。得られた溶液を3×50mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で、オーブン中で乾燥させた。得られた混合物を減圧下で濃縮した。これにより、500mg(粗製)が褐色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.914min、LCMS 07、m/z=424[M+1].
100mLの丸底フラスコ中に、6-(シクロペンタ-1-エン-1-イル)-2-N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-4-N-メチルピリミジン-2,4-ジアミン(500mg、1.18mmol、1当量)、Pd/C(100mg)、水素(100mL)、ジクロロメタン(20mL)を入れた。得られた溶液を室温で一晩撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC C HClによって精製した。これにより、50.9mg(9%)の6-シクロペンチル-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物459:N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6-(テトラヒドロ-2H-ピラン-4-イル)ピリミジン-2,4-ジアミンの合成
N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチル-6-(テトラヒドロ-2H-ピラン-4-イル)ピリミジン-2,4-ジアミンを、工程1において2-(シクロペンタ-1-エン-1-イル)-4,4,5,5-テトラメチル-1,3,2-ジオキサボロランの代わりに2-(3,6-ジヒドロ-2H-ピラン-4-イル)-4,4,5,5-テトラメチル-1,3,2-ジオキサボロランを用いて、6-シクロペンチル-N2-(4-メトキシ-3-(3-(ピロリジン-1-イル)プロポキシ)フェニル)-N4-メチルピリミジン-2,4-ジアミンと同様に調製した。
化合物460:N-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-6-メチル-1H-ピラゾロ[4,3-c]ピリジン-4-アミンの合成
窒素の不活性雰囲気でパージされ、維持された40mLのバイアル中に、DMSO(10mL)、4-クロロ-6-メチル-1H-ピラゾロ[4,3-c]ピリジン(100mg、0.60mmol、1当量)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(180mg、0.72mmol、1.20当量)、第3世代ブレットホス(81mg、0.09mmol、0.15当量)、Cs2CO3(390mg、1.20mmol、2.01当量)を入れた。得られた溶液を80℃で4時間撹拌した。得られた溶液を10mLのH2Oで希釈した。得られた溶液を3×10mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×10mLの水および3×10mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させた。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(100mg)を、分取HPLC D TFAによって精製した。これにより、30.4mg(10%)のN-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-6-メチル-1H-ピラゾロ[4,3-c]ピリジン-4-アミンが白色の固体として得られた。
化合物461:2-(3-((2-メトキシ-5-((4-メチル-6-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)メチル)ピロリジン-1-イル)エタン-1-オールの合成
100mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(200mg、0.58mmol、1当量)、2-ブロモエタン-1-オール(70mg、0.56mmol、1当量)、Cs2CO3(380mg、1.17mmol、2.00当量)、NaI(170mg、2.00当量)、ACN(15mL)を入れた。得られた溶液を、油浴中で、80℃で4時間撹拌した。固体をろ過して取り除いた。残渣を、TFA:ACN(5:1)とともにシリカゲルカラム上に適用した。これにより、44.2mg(15%)の2-(3-((2-メトキシ-5-((4-メチル-6-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)メチル)ピロリジン-1-イル)エタン-1-オールが固体として得られた。
化合物462:N2-(3-((1-シクロプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、3-(2-メトキシ-5-ニトロフェノキシメチル)ピロリジン(340mg、1.35mmol、1当量)、(1-エトキシシクロプロポキシ)トリメチルシラン(354mg、2.03mmol、1.50当量)、メタノール(20mL)、NaBH3CN(512mg、8.15mmol、6.00当量)、HOAc(0.02mL)を入れた。得られた溶液を25℃で30分間撹拌した。温度を油浴中で65℃に維持しながら、得られた溶液を、さらに24時間にわたって、撹拌しながら反応させた。得られた混合物を減圧下で濃縮した。粗生成物を、(H2O/ACN=1/1)によって精製した。これにより、300mg(76%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.930min、LCMS 27:m/z=293[M+1].
100mLの丸底フラスコ中に、1-シクロプロピル-3-(2-メトキシ-5-ニトロフェノキシメチル)ピロリジン(280mg、0.96mmol、1当量)、Pd/C(100mg、0.30当量)、メタノール(15mL)、水素を入れた。得られた溶液を25℃で1時間撹拌した。固体をろ過して取り除き、減圧下で濃縮した。これにより、243mg(97%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.702min、LCMS 07:m/z=263[M+1].
100mLの丸底フラスコ中に、3-[(1-シクロプロピルピロリジン-3-イル)メトキシ]-4-メトキシアニリン(200mg、0.76mmol、1当量)、TsOH(257mg、1.49mmol、2.00当量)、2-クロロ-6-メチル-N-(オキサン-4-イルメチル)ピリミジン-4-アミン(180mg、0.74mmol、1当量)、イソプロパノール(15mL)を入れた。得られた溶液を、油浴中で、85℃で4時間撹拌した。粗生成物を、(H2O/ACN=1/1)によって精製した。これにより、107.4mg(24%)のN2-(3-((1-シクロプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物463:N2-(3-(3-(シクロプロピル(メチル)アミノ)プロポキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
40mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(300mg、0.89mmol、1当量)、N-メチルシクロプロパンアミン(76mg、1.07mmol、1.20当量)、炭酸カリウム(368mg、2.66mmol、2.99当量)、CH3CN(20mL)、NaI(134mg)を入れた。得られた溶液を80℃で一晩撹拌した。固体をろ過して取り除いた。粗生成物を、分取HPLC C HClによって精製した。これにより、38.5mg(11%)のN2-(3-(3-(シクロプロピル(メチル)アミノ)プロポキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物464:N2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリジン-2,4-ジアミンの合成
20mLのバイアル中に、DMSO(10mg、0.13mmol、0.15当量)、2-クロロ-6-メチル-N-(オキサン-4-イルメチル)ピリジン-4-アミン(200mg、0.83mmol、1当量)、5-メトキシ-4-[3-(ピロリジン-1-イル)プロポキシ]ピリジン-2-アミン(250mg、0.99mmol、1.20当量)、Pd2(dba)3-CHCl3(130mg)、キサントホス(150mg、0.26mmol、0.31当量)、Cs2CO3(54mg、0.17mmol、0.20当量)を入れた。バイアルを、N2でパージし、維持した。得られた溶液を80℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/ACN(9:1)とともにシリカゲルカラム上に適用した。粗生成物を、分取HPLC D HClによって精製した。これにより、30.2mg(7%)のN2-(5-メトキシ-4-(3-(ピロリジン-1-イル)プロポキシ)ピリジン-2-イル)-6-メチル-N4-((テトラヒドロ-2H-ピラン-4-イル)メチル)ピリジン-2,4-ジアミンが白色の固体として得られた。
化合物465:1-(3-(2-メトキシ-5-((4-メチル-6-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)アゼチジン-3-オールの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(200mg、0.59mmol、1当量)、カリウムメタンペルオキソエート(246.4mg、1.77mmol、3.00当量)、アゼチジン-3-オール塩酸塩(129.8mg、1.18mmol、2.00当量)、アセトニトリル(10mL)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC D TFAによって精製した。これにより、72.5mg(25%)の1-(3-(2-メトキシ-5-((4-メチル-6-(メチルアミノ)ピリミジン-2-イル)アミノ)フェノキシ)プロピル)アゼチジン-3-オールが固体として得られた。
化合物466:N2-(3-((1-シクロプロピルピペリジン-4-イル)オキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピペリジン-4-イルオキシ)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(150mg、0.44mmol、1当量)、NaBH3CN(86mg、1.37mmol、3.00当量)、メタノール(5mL)、(1-エトキシシクロプロポキシ)トリメチルシラン(118.9mg、0.68mmol、1.50当量)、酢酸(10mg、0.17mmol、0.38当量)を入れた。得られた溶液を、油浴中で、65℃で6時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(150mg)を、分取HPLC D TFAによって精製した。これにより、55.7mg(26%)のN2-(3-((1-シクロプロピルピペリジン-4-イル)オキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物481および482:(S)-N2-(3-((1-シクロプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンおよび(R)-N2-(3-((1-シクロプロピルピロリジン-3-イル)メトキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-N-[4-メトキシ-3-(ピロリジン-3-イルメトキシ)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(400mg、1.16mmol、1当量)、(1-エトキシシクロプロポキシ)トリメチルシラン(300mg、1.72mmol、1.50当量)、AcOH(0.4mL)、メタノール(20mL)、NaBH3CN(330mg、5.25mmol、3.00当量)を入れた。得られた溶液を、油浴中で、65℃で24時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、TFA:ACN(5:1)とともにシリカゲルカラム上に適用した。これにより、31.9mg(3%)のラセミ混合物が白色の固体として得られた。
化合物498:N2-(3-(3-(5-アザスピロ[2.4]ヘプタン-5-イル)プロポキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
20mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(300mg、0.89mmol、1当量)、炭酸カリウム(300mg、2.17mmol、2.44当量)、CH3CN(5mL)、NaI(135mg)、5-アザスピロ[2.4]ヘプタン(372mg、3.83mmol、4.30当量)を入れた。得られた溶液を80℃で48時間撹拌した。粗生成物を、分取HPLC D TFAによって精製した。これにより、75.7mg(16%)のN2-(3-(3-(5-アザスピロ[2.4]ヘプタン-5-イル)プロポキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物504:N2-(4-メトキシ-3-(3-(2-メチルピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(200mg、0.59mmol、1当量)、2-メチルピロリジン(101mg、1.19mmol、2.00当量)、NaI(89mg、1当量)、炭酸カリウム(246mg、1.78mmol、3.00当量)、ACN(10mL)を入れた。得られた溶液を、油浴中で、85℃で12時間撹拌した。固体をろ過して取り除いた。粗生成物を、フラッシュ-分取HPLC A 1:1によって精製した。これにより、78.7mg(31%)のN2-(4-メトキシ-3-(3-(2-メチルピロリジン-1-イル)プロポキシ)フェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物518:4-シクロペンチル-6-メトキシ-N-メチル-7-(3-(ピロリジン-1-イル)プロポキシ)キナゾリン-2-アミンの合成
窒素の不活性雰囲気でパージされ、維持された20mLのバイアル中に、2,4-ジクロロ-6-メトキシ-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン(500mg、1.40mmol、1当量)、Pd(dppf)2(115mg、0.10当量)、2-(シクロペンタ-1-エン-1-イル)-4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン(273mg、1.41mmol、1当量)、ナトリウムメタンペルオキソエート(447.9mg、4.19mmol、3.00当量)、ジオキサン(8mL)、水(2mL)を入れた。得られた溶液を、油浴中で、60℃で4時間撹拌した。得られた溶液を5mLのH2Oで希釈した。得られた溶液を3×10mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を3×10mLのH2Oで洗浄した。得られた混合物を減圧下で濃縮した。残渣を、メタノール/H2O(10:1)とともにシリカゲルカラム上に適用した。これにより、300mg(55%)が固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.03min、m/z=388[M+1].
250mLの丸底フラスコ中に、2-クロロ-4-(シクロペンタ-1-エン-1-イル)-6-メトキシ-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン(300mg、0.77mmol、1当量)、ジクロロメタン(100mL)、ジオキソ白金(dioxoplatinum)、水素を入れた。得られた溶液を20℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。残渣を、CH3CN/H2O(1:5)とともにシリカゲルカラム上に適用した。これにより、200mg(66%)の表題化合物が褐色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.871min、m/z=390[M+1].
10mLの密閉管中に、2-クロロ-4-シクロペンチル-6-メトキシ-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン(130mg、0.33mmol、1当量)、エタノール;メタンアミン(2mL)を入れた。得られた溶液を、油浴中で、80℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(130mg)を、フラッシュ-分取HPLC A Gradによって精製した。これにより、31.2mg(19%)の4-シクロペンチル-6-メトキシ-N-メチル-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン-2-アミンが黄色の固体として得られた。
化合物523:4-シクロヘキシル-6-メトキシ-N-メチル-7-(3-(ピロリジン-1-イル)プロポキシ)キナゾリン-2-アミンの合成
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、2,4-ジクロロ-6-メトキシ-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン(300mg、0.84mmol、1当量)、(シクロヘキサ-1-エン-1-イル)ボロン酸(116mg、0.92mmol、1.1当量)、Pd(dppf)Cl2ジクロロメタン(69mg、0.10当量)、炭酸ナトリウム(179mg、1.69mmol、2.00当量)、ジオキサン(16mL)、水(4mL)を入れた。得られた溶液を、油浴中で、60℃で7時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(350mg)を、フラッシュHPLC MeOHによって精製した。これにより、220mg(64%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.08 min、LCMS 53:m/z=402.0[M+1].1H NMR(400MHz、メタノール-d4)δ 7.47(s,1H)、7.25(s,1H)、6.25-6.22(m,1H)、4.29(t,J=6.1Hz、2H)、3.98(s,3H)、2.82-2.74(m,2H)、2.67-2.60(m,4H)、2.56-2.49(m,2H)、2.39-2.20(m,2H)、2.17-2.10(m,2H)、1.97-1.78(m,8H).
100mLの丸底フラスコ中に、2-クロロ-4-(シクロヘキサ-1-エン-1-イル)-6-メトキシ-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン(220mg、0.55mmol、1当量)、PtO2(200mg)、メタノール(15mL)を入れた。得られた溶液を、H2(g)下で、25℃で12時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、218mg(87%)が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.15min、LCMS 53:m/z=404.0[M+1].
50mLの丸底フラスコ中に、2-クロロ-4-シクロヘキシル-6-メトキシ-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン(200mg、0.50mmol、1当量)、メチルアミンエタノール溶液(32%)(15mL、1当量)を入れた。得られた溶液を、油浴中で、80℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(210mg)を、フラッシュHPLC A Gradによって精製した。これにより、71.8mg(35%)の4-シクロヘキシル-6-メトキシ-N-メチル-7-[3-(ピロリジン-1-イル)プロポキシ]キナゾリン-2-アミンが黄色の固体として得られた。
化合物538:N4-メチル-N2-(4-(3-(ピロリジン-1-イル)プロポキシ)-1H-インダゾール-6-イル)ピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、4-ブロモ-2,6-ジフルオロベンゾニトリル(1g、4.59mmol、1当量)、LiHMDS(5.5mL)、テトラヒドロフラン(30mL)、3-(ピロリジン-1-イル)プロパン-1-オール(710mg、5.50mmol、1.20当量)を入れた。得られた溶液を25℃で30分間撹拌した。得られた溶液を、25℃でさらに2時間にわたって、撹拌しながら反応させた。次に、反応を、水の添加によってクエンチした。得られた溶液を2×100mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLC Aによって精製した。これにより、0.18gの表題化合物が黄色の油として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 7.13-6.95(m,2H)、4.22(t,J=6.3Hz、2H)、2.65-2.35(m,4H)、2.11-1.76(m,6H).
250mLの丸底フラスコ中に、4-ブロモ-2-フルオロ-6-[3-(ピロリジン-1-イル)プロポキシ]ベンゾニトリル(2.3g、7.03mmol、1当量)、DIBAL-H(12mL)、ジクロロメタン(50mL)を入れた。得られた溶液を25℃で1時間撹拌した。温度を油浴中で40℃に維持しながら、得られた溶液を、さらに2時間にわたって、撹拌しながら反応させた。次に、反応を、HClの添加によってクエンチした。得られた混合物を減圧下で濃縮した。粗生成物を、フラッシュ-分取HPLCによって精製し、これにより、1g(39%)の表題化合物が黄色の固体として得られた。
分析データ:1H NMR(300MHz、DMSO-d6)δ 10.29(d,J=1.4Hz、1H)、10.14(s,1H)、7.32(d,J=10.0Hz、2H)、4.28(t,J=5.8Hz、2H)、3.65-6.48(m,2H)、3.02-2.98(m,2H)、2.26-1.82(m,6H).
50mLの丸底フラスコ中に、4-ブロモ-2-フルオロ-6-[3-(ピロリジン-1-イル)プロポキシ]ベンズアルデヒド(1g、3.03mmol、1当量)、NH2NH2H2O(3mL)、エチレングリコール(5mL)を入れた。得られた溶液を、油浴中で、120℃で2時間撹拌した。得られた溶液を2×100mLのジクロロメタンで抽出し、有機層を組み合わせた。粗生成物を、フラッシュ-分取HPLCによって精製し、これにより、0.45g(41%)の表題化合物が淡黄色の固体として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 10.35(s,1H)、8.08(d,J=1.0Hz、1H)、7.26(t,J=1.2Hz、1H)、6.63(d,J=1.2Hz、1H)、4.21(t,J=6.2Hz、2H)、2.79(t,J=7.5Hz、2H)、2.70(s,4H)、2.18(p,J=6.6Hz、2H)、1.89(p,J=3.3Hz、4H).
250mLの丸底フラスコ中に、6-ブロモ-4-[3-(ピロリジン-1-イル)プロポキシ]-1H-インダゾール(400mg、1.23mmol、1当量)、水素化ナトリウム(300mg、12.50mmol、10.13当量)、テトラヒドロフラン(40mL)、SEMCl(0.6g)を入れた。得られた溶液を、水/氷浴中で、0℃で20分間撹拌した。得られた溶液を、25℃でさらに3時間にわたって、撹拌しながら反応させた。次に、反応を、水の添加によってクエンチした。得られた溶液を2×100mLのジクロロメタンで抽出し、有機層を組み合わせた。粗生成物を、フラッシュ-分取HPLCによって精製し、これにより、0.22g(39%)の表題化合物が黄色の油として得られた。
分析データ:1H NMR(300MHz、クロロホルム-d)δ 8.14-8.02(m,1H)、7.49-7.35(m,1H)、6.67-6.48(m,1H)、5.66(d,J=2.6Hz、2H)、4.25-4.15(m,2H)、3.69-3.47(m,2H)、3.08-2.48(m,6H)、2.25-2.12(m,2H)、1.27(d,J=1.6Hz、1H)、1.03-0.84(m,2H)、0.10-0.01(m,12H).
10mLの丸底フラスコ中に、4-N-メチルピリミジン-2,4-ジアミン(200mg、1.61mmol、4.07当量)、6-ブロモ-4-[3-(ピロリジン-1-イル)プロポキシ]-1-[[2-(トリメチルシリル)エトキシ]メチル]-1H-インダゾール(180mg、0.40mmol、1当量)、第3世代ブレットホス(50mg)、Cs2CO3(300mg、0.92mmol、2.32当量)、ジオキサン(5mL)を入れた。得られた溶液を、油浴中で、110℃で12時間撹拌した。得られた溶液を2×50mLのジクロロメタンで抽出し、有機層を組み合わせた。得られた混合物を1×100mLの塩水で洗浄した。混合物を無水硫酸ナトリウム上で乾燥させ、減圧下で濃縮した。これにより、0.22gの表題化合物が油として得られた。
25mLの丸底フラスコ中に、4-N-メチル-2-N-[4-[3-(ピロリジン-1-イル)プロポキシ]-1-[[2-(トリメチルシリル)エトキシ]メチル]-1H-インダゾール-6-イル]ピリミジン-2,4-ジアミン(40mg、0.08mmol、1当量)、トリフルオロ酢酸(3mL)を入れた。得られた溶液を、油浴中で、50℃で30分間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物を、分取HPLC Bによって精製した。これにより、10mg(33%)のN4-メチル-N2-(4-(3-(ピロリジン-1-イル)プロポキシ)-1H-インダゾール-6-イル)ピリミジン-2,4-ジアミンが黄色の油として得られた。
化合物541:N4-メチル-N2-(ピペリジン-3-イル)ピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(150mg、1.04mmol、1当量)、tert-ブチル3-アミノピペリジン-1-カルボキシレート(220mg、1.10mmol、1.05当量)、トリフルオロ酢酸(380mg、3.36mmol、3.00当量)、IPA(5mL)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。粗生成物を、分取HPLC C NH4HCO3によって精製した。これにより、132.4mg(61%)のN4-メチル-N2-(ピペリジン-3-イル)ピリミジン-2,4-ジアミンが白色の粉末として得られた。
化合物542:N4-メチル-N2-(ピペリジン-4-イル)ピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(150mg、1.04mmol、1当量)、トリフルオロ酢酸(480mg、4.25mmol、4.00当量)、IPA(5mL)、tert-ブチル4-アミノピペリジン-1-カルボキシレート(250mg、1.25mmol、1.19当量)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。粗生成物を、分取HPLC C NH4HCO3によって精製した。これにより、42.2mg(19%)のN4-メチル-N2-(ピペリジン-4-イル)ピリミジン-2,4-ジアミンが淡黄色の油として得られた。
化合物543:N2-ブチル-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(150mg、1.04mmol、1当量)、ブタン-1-アミン(80mg、1.09mmol、1.05当量)、トリフルオロ酢酸(380mg、3.36mmol、3.00当量)、IPA(5mL)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。粗生成物を、分取HPLC C NH4HCO3によって精製した。これにより、35.1mg(19%)のN2-ブチル-N4-メチルピリミジン-2,4-ジアミンが白色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.15 min、LCMS 07:m/z=181.1 [M+1].1H NMR(300MHz、メタノール-d4)δ 7.61(d,J=6.0Hz、1H)、5.77(d,J=6.0Hz、1H)、3.34(t,J=4.5Hz、1H)、3.32(t,J=1.5Hz、1H)、2.87(s,3H)、1.63-1.53(m,2H)、1.48-1.36(m,2H)、0.98(t,J=7.2Hz、3H).
化合物546:N4-メチル-N2-(3-メチルピペリジン-3-イル)ピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(200mg、1.39mmol、1当量)、tert-ブチル3-アミノ-3-メチルピペリジン-1-カルボキシレート(357mg、1.67mmol、1.20当量)、トリフルオロ酢酸(791mg、7.00mmol、5.02当量)、IPA(4mL)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。粗生成物を、分取HPLC C NH4HCO3によって精製した。これにより、52.4mg(17%)N4-メチル-N2-(3-メチルピペリジン-3-イル)ピリミジン-2,4-ジアミンが淡黄色の固体として得られた。
化合物547:N4-メチル-N2-(4-メチルピペリジン-4-イル)ピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(400mg、2.79mmol、1当量)、トリフルオロ酢酸(1109mg、9.81mmol、4.00当量)、IPA(10mL)、tert-ブチル4-アミノ-4-メチルピペリジン-1-カルボキシレート(573mg、2.67mmol、1.10当量)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。粗生成物を、分取HPLC C NH4HCO3によって精製した。これにより、34mg(6%)のN4-メチル-N2-(4-メチルピペリジン-4-イル)ピリミジン-2,4-ジアミンが白色の半固体として得られた。
化合物548:N2-((1R,3S)-3-アミノシクロペンチル)-N4-メチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-クロロ-N-メチルピリミジン-4-アミン(300mg、2.09mmol、1当量)、トリフルオロ酢酸(2.375g、21.01mmol、10.06当量)、IPA(5mL)、tert-ブチルN-[(1S,3R)-3-アミノシクロペンチル]カルバメート(459mg、2.29mmol、1.10当量)を入れた。得られた溶液を、油浴中で、90℃で16時間撹拌した。粗生成物を、分取HPLC C TFAによって精製した。これにより、33.2mg(5%)のN2-((1R,3S)-3-アミノシクロペンチル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の油として得られた。
化合物549:N2-(1-ブチル-3-メチルピペリジン-3-イル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-N-メチル-2-N-(3-メチルピペリジン-3-イル)ピリミジン-2,4-ジアミン(150mg、0.68mmol、1当量)、CsCO3(231mg、2.50当量)、N,N-ジメチルホルムアミド(2mL)、1-ヨードブタン(187mg、1.02mmol、1.50当量)を入れた。得られた溶液を20℃で3日間撹拌した。粗生成物を、分取HPLC C TFAによって精製した。これにより、53.6mg(20%)のN2-(1-ブチル-3-メチルピペリジン-3-イル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の油として得られた。
化合物550:N2-(1-ブチル-4-メチルピペリジン-4-イル)-N4-メチルピリミジン-2,4-ジアミンの合成
50mLの丸底フラスコ中に、4-N-メチル-2-N-(4-メチルピペリジン-4-イル)ピリミジン-2,4-ジアミン(220mg、0.99mmol、1当量)、Cs2CO3(338.5mg)、N,N-ジメチルホルムアミド(3mL)、1-ヨードブタン(275mg、1.49mmol、1.50当量)を入れた。得られた溶液を20℃で2日間撹拌した。残渣を、CH3CN/H2O(40%)とともにシリカゲルカラム上に適用した。これにより、62.1mg(23%)のN2-(1-ブチル-4-メチルピペリジン-4-イル)-N4-メチルピリミジン-2,4-ジアミンが淡黄色の油として得られた。
化合物551:N2-(3-(3-(シクロブチル(メチル)アミノ)プロポキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、2-N-[3-(3-クロロプロポキシ)-4-メトキシフェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(200mg、0.59mmol、1当量)、炭酸カリウム(246mg、1.78mmol、3.00当量)、NaI(89mg、1当量)、N-メチルシクロブタンアミン(144mg、1.69mmol、2.00当量)、CH3CN(20mL)を入れた。得られた溶液を、油浴中で、85℃で10時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、分取HPLC C HClによって精製した。これにより、82.3mg(33%)のN2-(3-(3-(シクロブチル(メチル)アミノ)プロポキシ)-4-メトキシフェニル)-N4,6-ジメチルピリミジン-2,4-ジアミンが白色の固体として得られた。
化合物642:2-N-(6-メトキシ-5-[[(3R)-1-メチルピロリジン-3-イル]メトキシ]ピリジン-3-イル)-4-N,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、tert-ブチル(3R)-3-(ヒドロキシメチル)ピロリジン-1-カルボキシレート(1g、4.97mmol、1.00当量)、ジクロロメタン(10mL)、TEA(1.5g、14.82mmol、3.00当量)、MsCl(850mg、7.46mmol、1.50当量)を入れた。得られた溶液を25℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、2g(粗製)の表題化合物が黄色の粗製油として得られた。
100mLの丸底フラスコ中に、5-ブロモ-2-クロロピリジン-3-オール(1.04g、4.99mmol、1.00当量)、tert-ブチル(3R)-3-[(メタンスルホニルオキシ)メチル]ピロリジン-1-カルボキシレート(1.4g、5.01mmol、1.00当量)、炭酸カリウム(2.06g、14.90mmol、3.00当量)、N,N-ジメチルホルムアミド(10mL)を入れた。得られた溶液を、油浴中で、80℃で12時間撹拌した。得られた溶液を3×50mLの酢酸エチルで抽出し、有機層を組み合わせた。得られた混合物を3×30mLの塩水で洗浄した。残渣を、酢酸エチル/石油エーテル(1:3)とともにシリカゲルカラム上に適用した。これにより、1.4g(72%)の表題化合物が白色の固体として得られた。
分析データ:LCMS:(ES、m/z):RT=1.469 min、LCMS15:m/z=393[M+1].1H NMR:(400MHz、メタノール-d4)δ 8.07(d,J=2.0Hz、1H)、7.75(d,J=2.0Hz、1H)、4.19-4.09(m,2H)、3.69-2.69(m,8H)、2.24-1.76(m,2H)、1.48(s,9H).
25mLの丸底フラスコ中に、tert-ブチル(3R)-3-[[(5-ブロモ-2-クロロピリジン-3-イル)オキシ]メチル]ピロリジン-1-カルボキシレート(1.4g、3.57mmol、1.00当量)、メタノール(4mL)、NaOCH3/MeOH(2mL、1.00当量)を入れた。得られた溶液を、油浴中で、70℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。得られた溶液を3×30mLの酢酸エチルで抽出し、有機層を組み合わせた。これにより、表題化合物1.4g(粗製)が無色油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.491min、LCMS28:m/z=387[M+1].
窒素の不活性雰囲気でパージされ、維持された50mLの丸底フラスコ中に、tert-ブチル(3R)-3-[[(5-ブロモ-2-メトキシピリジン-3-イル)オキシ]メチル]ピロリジン-1-カルボキシレート(500mg、1.29mmol、1.00当量)、4-N,6-ジメチルピリミジン-2,4-ジアミン(196.6mg、1.42mmol、1.10当量)、Cs2CO3(1.26g、3.87mmol、3.00当量)、第3世代ブレットホス(117.4mg、0.13mmol、0.10当量)、DMSO(5mL)を入れた。得られた溶液を、油浴中で、100℃で12時間撹拌した。固体をろ過して取り除いた。粗生成物を、以下の条件(IntelFlash-1):カラム、シリカゲル;移動相、H2O:ACN=40%;検出器、UV254nmを用いたフラッシュ-分取HPLCによって精製した。これにより、340mg(59%)の表題化合物が白色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.077min、LCMS53:m/z=445[M+1].
50mLの丸底フラスコ中に、tert-ブチル(3R)-3-[[(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]ピリジン-3-イル)オキシ]メチル]ピロリジン-1-カルボキシレート(340mg、0.76mmol、1.00当量)、ジクロロメタン(5mL)、トリフルオロ酢酸(1mL)を入れた。得られた溶液を25℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、1g(粗製)の表題化合物が黄色の粗製油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.814min、LCMS33:m/z=345[M+1].
50mLの丸底フラスコ中に、2-N-[6-メトキシ-5-[(3R)-ピロリジン-3-イルメトキシ]ピリジン-3-イル]-4-N,6-ジメチルピリミジン-2,4-ジアミン(100mg、0.29mmol、1.00当量)、メタノール(5mL)、HCHO(29mg、0.97mmol、1.00当量)、NaBH3CN(115mg、1.83mmol、6.00当量)を入れた。得られた溶液を25℃で2時間撹拌した。粗生成物を、方法C NH4HCO3を用いた分取HPLCによって精製した。これにより、55.8mg(54%)の表題化合物が白色の固体として得られた。
化合物644:2-N-[4-メトキシ-3-([[2-(ピロリジン-1-イル)エチル]アミノ]メチル)フェニル]-4-N,6-ジメチルピリミジン-2,4-ジアミンの合成
100mLの丸底フラスコ中に、メタノール(50mL)、2-メトキシ-5-ニトロベンズアルデヒド(1g、5.52mmol、1.00当量)、2-(ピロリジン-1-イル)エタン-1-アミン(630mg、5.52mmol、1.00当量)、NaBH3CN(1g、15.91mmol、2.88当量)を入れた。得られた溶液を20℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/ACN(10:1)とともにシリカゲルカラム上に適用した。これにより、240mg(16%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.861min、LCMS 69:m/z=280[M+1].
50mLの丸底フラスコ中に、ジクロロメタン(10mL)、[(2-メトキシ-5-ニトロフェニル)メチル][2-(ピロリジン-1-イル)エチル]アミン(240mg、0.86mmol、1.00当量)、Boc2O(281mg、1.29mmol、1.50当量)、TEA(261mg、2.58mmol、3.00当量)、4-ジメチルアミノピリジン(10mg、0.08mmol、0.10当量)を入れた。得られた溶液を20℃で12時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、H2O/ACN(1:1)とともにシリカゲルカラム上に適用した。これにより、170mg(52%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.76min、LCMS 45:m/z=380[M+1].
100mLの丸底フラスコ中に、酢酸エチル(10mL)、tert-ブチルN-[(2-メトキシ-5-ニトロフェニル)メチル]-N-[2-(ピロリジン-1-イル)エチル]カルバメート(170mg、0.45mmol、1.00当量)、ラネーNi(20mg)を入れた。フラスコを、H2でパージし、維持した。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、110mg(70%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.86 min、LCMS 28:m/z=350[M+1].1H NMR(300MHz、メタノール-d4)δ 6.78(d,J=8.5Hz、1H)、6.74-6.60(m,2H)、4.41(s,2H)、3.76(s,3H)、2.57(d,J=13.2Hz、7H)、1.85-1.74(m,5H)、1.48(d,J=17.1Hz、9H).
100mLの丸底フラスコ中に、イソプロパノール(10mL)、tert-ブチルN-[(5-アミノ-2-メトキシフェニル)メチル]-N-[2-(ピロリジン-1-イル)エチル]カルバメート(110mg、0.31mmol、1.00当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(49mg、0.31mmol、0.99当量)、トリフルオロ酢酸(61mg、0.54mmol、1.71当量)を入れた。得られた溶液を20℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。これにより、248mg(167%)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=1.45min、LCMS 33:m/z=471[M+1].
100mLの丸底フラスコ中に、ジクロロメタン(2mL)、tert-ブチルN-[(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェニル)メチル]-N-[2-(ピロリジン-1-イル)エチル]カルバメート(248mg、0.53mmol、1.00当量)、トリフルオロ酢酸(2mL)を入れた。得られた溶液を20℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(200mg)を、方法CTFAを用いた分取HPLCによって精製した。これにより、トリフルオロ酢酸としての70.6mg(28%)の表題化合物がオフホワイトの固体として得られた。
化合物524:6-メトキシ-N-メチル-4-(オキサン-4-イル)-7-[3-(ピロリジン-1-イル)プロポキシ]キノリン-2-アミンの合成
250mLの丸底フラスコ中に、オキサン-4-カルボン酸(6g、46.10mmol、1.00当量)、4-ジメチルアミノピリジン(8.4g、68.76mmol、1.49当量)、DCC(9.6g、46.53mmol、1.01当量)、ジクロロメタン(50mL)、2,2-ジメチル-1,3-ジオキサン-4,6-ジオン(6.6g、45.79mmol、0.99当量)を入れた。得られた溶液を0℃で一晩撹拌した。得られた溶液をジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、9.2g(78%)の表題化合物が淡黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.422min、LCMS34、m/z=255[M+1].
100mLの丸底フラスコ中に、2,2-ジメチル-5-[(オキサン-4-イル)カルボニル]-1,3-ジオキサン-4,6-ジオン(5g、19.51mmol、1.00当量)、メタノール(20mL)を入れた。得られた溶液を60℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(31/69)とともにシリカゲルカラム上に適用した。これにより、3.2g(88%)の表題化合物がオフホワイトの液体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.735 min、LCMS34、m/z=185[M-1].1H NMR:(300MHz、クロロホルム-d)δ 4.08-3.96(m,2H)、3.75(s,3H)、3.52(s,2H)、3.49-3.38(m,2H)、2.79-2.65(m,1H)、1.87-1.62(m,4H).
10mLのバイアル中に、メチル3-(オキサン-4-イル)-3-オキソプロパノエート(500mg、2.69mmol、1.00当量)、AlMe3(0.4mL、3.00当量)、トルエン(2mL)、4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]アニリン(672mg、2.68mmol、1.00当量)を入れた。得られた溶液を80℃で48時間撹拌した。得られた溶液をジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、880mg(81%)の表題化合物が褐色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.600min、LCMS45、m/z=405[M+1].
100mLの丸底フラスコ中に、N-[4-メトキシ-3-[3-(ピロリジン-1-イル)プロポキシ]フェニル]-3-(オキサン-4-イル)-3-オキソプロパンアミド(1g、2.47mmol、1.00当量)、硫酸(5mL)を入れた。得られた溶液を50℃で0.5時間撹拌した。得られた溶液をジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、960mg(98%)の表題化合物が灰色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.837min、LCMS07、m/z=387[M+1].
50mLの丸底フラスコ中に、6-メトキシ-4-(オキサン-4-イル)-7-[3-(ピロリジン-1-イル)プロポキシ]キノリン-2-オール(50mg、0.13mmol、1.00当量)、三塩化ホスホリル(2mL)を入れた。得られた溶液を110℃で2時間撹拌した。得られた溶液をジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、38mg(73%)の表題化合物が灰色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.758 min、LCMS45、m/z=405[M+1].1H NMR:(300MHz、クロロホルム-d)δ 7.39(s,1H)、7.17(d,J=13.9Hz、2H)、4.30-4.12(m,4H)、4.02(s,3H)、3.82-3.61(m,2H)、3.49-3.34(m,1H)、2.83-2.51(m,6H)、2.32-1.68(m,10H).
10mLのバイアル中に、2-クロロ-6-メトキシ-4-(オキサン-4-イル)-7-[3-(ピロリジン-1-イル)プロポキシ]キノリン(300mg、0.74mmol、1.00当量)、MeNH2-H2O(5g)を入れた。得られた溶液を100℃で48時間撹拌した。得られた混合物を減圧下で濃縮した。粗生成物(165.1mg)を、方法D TFAを用いた分取HPLCによって精製した。これにより、165.1mg(43%)の表題化合物トリフルオロ酢酸が固体として得られた。
化合物906:(2S)-1-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オールの合成
(2R)-2-(2-メトキシ-5-ニトロフェノキシメチル)オキシランから出発し、アゼチジンの代わりにピロリジンを用いた、化合物1038と同様の合成。
20mLの丸底フラスコ中に、(2R)-1-(5-アミノ-2-メトキシフェノキシ)-3-(ピロリジン-1-イル)プロパン-2-オール(267mg、1.00mmol、1.00当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(157mg、1.00mmol、0.99当量)、トリフルオロ酢酸(342mg、3.03mmol、3.02当量)、IPA(10mL)を入れた。得られた溶液を8℃で1時間撹拌した。固体をろ過によって収集した。粗生成物を、方法B TFAを用いた分取HPLCによって精製した。これにより、12.3mgの表題化合物が白色の固体として得られた。
化合物1038:(2R)-1-(アゼチジン-1-イル)-3-(2-メトキシ-5-[[4-メチル-6-(メチルアミノ)ピリミジン-2-イル]アミノ]フェノキシ)プロパン-2-オールの合成
40mLの丸底フラスコ中に、(2R)-2-(2-メトキシ-5-ニトロフェノキシメチル)オキシラン(1g、4.44mmol、1.00当量)、エタノール(10mL)、クロロホルム(10mL)、アゼチジン(507mg、8.88mmol、1.50当量)を入れた。得られた溶液を、油浴中で、75℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、酢酸エチル/石油エーテル(1:2)とともにシリカゲルカラム上に適用した。これにより、650mg(52%)の表題化合物が黄色の固体として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.84min、LCMS07:m/z=283.15[M+1].
100mLの丸底フラスコ中に、(2R)-1-(アゼチジン-1-イル)-3-(2-メトキシ-5-ニトロフェノキシ)プロパン-2-オール(600g、2.13mol、1.00当量)、酢酸エチル(50mL)、パラジウム炭素、水素を入れた。得られた溶液を20℃で1時間撹拌した。固体をろ過して取り除いた。これにより、表題化合物400mg(75%)が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.35min、LCMS15:m/z=253.15[M+1].
20mLの丸底フラスコ中に、(2R)-1-(5-アミノ-2-メトキシフェノキシ)-3-(アゼチジン-1-イル)プロパン-2-オール(400mg、1.59mmol、1.00当量)、トリフルオロ酢酸(538mg、4.76mmol、3.00当量)、IPA(8mL)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(199mg、1.26mmol、0.80当量)を入れた。得られた溶液を、油浴中で、80℃で2時間撹拌した。固体をろ過して取り除いた。得られた混合物を減圧下で濃縮した。これにより、トリフルオロ酢酸としての294.3mg(38%)の表題化合物がピンク色の固体として得られた。
化合物965:2-N-[3-([[2-(アゼチジン-1-イル)エチル]アミノ]メチル)-4-メトキシフェニル]-4-N-メチルピリミジン-2,4-ジアミンの合成
250mLの丸底フラスコ中に、DCE(50mL)中の、2-(アゼチジン-1-イル)エタン-1-アミン(500mg、4.99mmol、1.00当量)、2-メトキシ-5-ニトロベンズアルデヒド(905mg、5.00mmol、1.00当量)を入れ、25℃で15分間撹拌した。次に、NaBH(OAc)3(6.36g)を加え、25℃で2時間撹拌した。得られた溶液を3×30mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。これにより、500mg(38%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.726min、LCMS07:m/z=266[M+1].
窒素の不活性雰囲気でパージされ、維持された100mLの丸底フラスコ中に、ラネーNi(100mg)、[2-(アゼチジン-1-イル)エチル][(2-メトキシ-5-ニトロフェニル)メチル]アミン(400mg、1.51mmol、1.00当量)、メタノール(50mL)を入れた。得られた溶液を25℃で2時間撹拌した。得られた溶液をろ過し、減圧下で濃縮した。これにより、200mg(56%)の表題化合物が黄色の油として得られた。
分析データ:LC-MS:(ES、m/z):RT=0.285min、LCMS15:m/z=236[M+1].
100mLの丸底フラスコ中に、3-([[2-(アゼチジン-1-イル)エチル]アミノ]メチル)-4-メトキシアニリン(100mg、0.42mmol、1.00当量)、2-クロロ-N,6-ジメチルピリミジン-4-アミン(67mg、0.43mmol、1.00当量)、トリフルオロ酢酸(97mg、0.86mmol、2.02当量)、IPA(10mL)を入れた。得られた溶液を80℃で3時間撹拌した。得られた溶液を3×10mLのジクロロメタンで抽出し、有機層を組み合わせて、減圧下で濃縮した。粗生成物を、方法C NH4HCO3を用いた分取HPLCによって精製した。これにより、75.8mg(52%)の表題化合物が淡褐色の固体として得られた。
方法A.カラム:IntelFlash-1、C18シリカゲル;検出器、UV254nm
A.移動相、H2O/ACN
A MeOH。移動相、メタノール
A Grad。(IntelFlash-1):移動相、H2O/ACN=100/0から30分以内にH2O/ACN=30/70に増加する
A 1:1。移動相、ACN/H2O=1/1
A DCM/MeOH。移動相、DCM/MeOH
A EA/PE。移動相、EA/PE
B HCl。移動相、水(0.05%のHCl)およびACN(勾配)
B TFA。移動相、水(0.05%のTFA)およびACN(勾配)
C HCl。移動相、水(0.05%のHCl)およびACN(勾配)
C TFA。移動相、水(0.1%のTFA)およびCAN(勾配)
C NH3。移動相、水(0.05%のNH3-H2O)およびACN(勾配)
C.NH4HCO3。移動相、10mmolのNH4HCO3およびACNを含む水(勾配)
D HCl。移動相、水(0.05%のHCl)およびACN(勾配);
D TFA。移動相、水(0.06%のTFA)およびACN(勾配);検出器254nm。
D NH3。移動相、水(0.05%のNH3-H2O)およびACN(20.0%のACNから7分で60.0%まで);検出器、UV220nm
D NH4HCO3。移動相、10mmolのNH4HCO3およびCANを含む水(勾配)
F HCl。移動相 水(0.05%のHCl)およびACN(勾配)
F TFA。移動相 水(0.05%のTFA)およびACN(勾配)
G HCl 移動相、水(0.05%のHCl)およびACN(3.0%のACNから10分で10.0%まで)
G NH4HCO3。移動相、10mmolのNH4HCO3およびACNを含む水(勾配)
材料および機器:
Vivaによって合成された組み換え精製ヒトEHMT2 913-1193(55μM)を、全ての実験に使用した。ビオチン化ヒストンペプチドは、Biopeptideによって合成され、95%超の純度になるまでHPLC精製された。ストレプトアビジンフラッシュプレートおよびシールを、PerkinElmerから購入し、384ウェルV底ポリプロピレンプレートを、Greinerから購入した。3H-標識S-アデノシルメチオニン(3H-SAM)を、80 Ci/mmolの比放射能で、American Radiolabeled Chemicalsから入手した。非標識SAMおよびS-アデノシルホモシステイン(SAH)を、それぞれAmerican Radiolabeled ChemicalsおよびSigma-Aldrichから入手した。フラッシュプレートを、0.1%のTweenを含むBiotek ELx-405中で洗浄した。384ウェルフラッシュプレートおよび96ウェルフィルタ結合プレートを、TopCountマイクロプレートリーダー(PerkinElmer)で読み取った。化合物の連続希釈を、Freedom EVO(Tecan)で行い、Thermo Scientific Matrix PlateMate(Thermo Scientific)を用いてアッセイプレートにスポットした。試薬混合物を、Multidrop Combi(Thermo Scientific)によって加えた。
試験化合物の10点曲線を、2.5mMから開始して、DMSO中の連続3倍希釈を用いてFreedom EVO(Tecan)において行った(化合物の最終的な最高濃度は、50μMであり、DMSOは、2%であった)。阻害剤希釈系列の1μLのアリコートを、Thermo Scientific Matrix PlateMate(Thermo Scientific)を用いてポリプロピレン384ウェルV底プレート(Greiner)にスポットした。100%の阻害対照(inhibition control)は、1mMの最終濃度の製品阻害剤S-アデノシルホモシステイン(SAH、Sigma-Aldrich)からなっていた。化合物を、1倍アッセイバッファー(20mMのビシン[pH7.5]、0.002%のTween 20、0.005%のウシ皮膚ゼラチンおよび1mMのTCEP)中のウェル当たり40μLの0.031nMのEHMT2(組み換え精製ヒトEHMT2 913-1193、Viva)とともに30分間インキュベートした。アッセイバッファー、3H-SAM(3H-標識S-アデノシルメチオニン、American Radiolabeled Chemicals、80 Ci/mmolの比放射能)、非標識SAM(American Radiolabeled Chemicals)、およびC末端ビオチンを含むヒストンH3残基1~15を表すペプチド(C末端アミドキャッピングされたリジンに付加され、Biopeptideによって合成され、95%超の純度になるまでHPLC精製された)を含む、ウェル当たり10μLの基質混合物を加えて、反応を開始させた(両方の基質が、「平衡条件(balanced condition)」と呼ばれるアッセイフォーマットであるそれらのそれぞれのKm値で最終反応混合物中に存在していた)。反応物を、室温で60分間インキュベートし、ウェル当たり10μLの400μMの非標識SAMでクエンチし、次に、384ウェルストレプトアビジンフラッシュプレート(PerkinElmer)に移し、60分後に0.1%のTweenでBiotek ELx-405ウェルウォッシャーにおいて洗浄した。384ウェルフラッシュプレートを、TopCountマイクロプレートリーダー(PerkinElmer)で読み取った。
化合物(100nL)を、384ウェル細胞プレートに直接加えた。MDA-MB-231細胞(ATCC)を、ウェル当たり50μLで、ポリ-D-リジン被覆384ウェル細胞培養プレートへのウェル当たり3,000個の細胞の濃度で、アッセイ培地(10% v/vの熱不活性化ウシ胎仔血清および1%のペニシリン/ストレプトマイシン(Life Technologies)が補充されたRPMI/Glutamax)中に播種した。プレートを、37℃、5%のCO2で48時間にわたってインキュベートした(BD Biosciences 356697)。プレートを、室温で30分間インキュベートし、次に、37℃、5%のCO2でさらに48時間インキュベートした。インキュベーションの後、PBS中のウェル当たり50μLの8%のパラホルムアルデヒド(Electron Microscopy Sciences)をプレートに加え、室温で20分間インキュベートした。プレートを、Biotek 406プレートウォッシャーに移し、ウェル当たり100μLの洗浄緩衝液(0.3%のTriton X-100(v/v)を含む1×PBS)で2回洗浄した。次に、ウェル当たり60μLのOdysseyブロッキングバッファー(Licor Biosciences)を、各プレートに加え、室温で1時間インキュベートした。ブロッキングバッファーを除去し、0.1%のTween 20(v/v)を含むOdysseyバッファー中の1:800に希釈された20μLのモノクローナル一次抗体α-H3K9me2(Abcam)を加え、プレートを、4℃で一晩(16時間)インキュベートした。プレートを、ウェル当たり100μLの洗浄緩衝液で5回洗浄した。次に、ウェル当たり20μLの二次抗体を加え(1:500 800CWロバ抗マウスIgG(H+L)抗体(Licor Biosciences)、0.1%のTween 20(v/v)を含むOdysseyバッファー中の1:1000 DRAQ5(Cell Signaling Technology))、室温で1時間インキュベートした。プレートをウェル当たり100μLの洗浄緩衝液で5回、次に、ウェル当たり100μLの水で2回洗浄した。プレートを室温で乾燥させ、次に、700nmおよび800nmの波長で積分強度を測定するLicor Odyssey Infrared Scanner(Licor Biosciences)で撮像した。Both 700および800チャネルの両方を走査した。
以下の手順および図1A~1D、2、および3は、本明細書に定義されるEHMT2阻害剤による細胞の処理後の、胎児ヘモグロビンの誘導を表す。
末梢血単核細胞(PBMC)を、Ficoll勾配によって健常なドナーの全血から単離した。次に、CD34+細胞を、PBMC画分から磁気的に単離した。Giarratanaら(Blood 2011)によって記載される最初の2週間の3相培養方法を用いて、細胞を、14日間にわたって赤血球系統に対してインビトロで分化させた。単離後、細胞を、相1培地中1×105個の細胞/mLの密度で播種した。7日目に、細胞は、相2培地中1:5の比率で分割した。
化合物を、ジメチルスルホキシド(DMSO)に溶解させ、1μMの原液を調製し、1:3で連続希釈して、11点用量曲線を作成した。100%のDMSOを対照として用いた。化合物の希釈物を、1:1000希釈物として1日目に細胞に加えた。DMSOを、0.001%の最終濃度になるように対照細胞に同様に加えた。細胞を上述されるように分割した後、化合物の希釈物およびDMSOを、7日目に再度加えた。
14日目に、約106個の細胞を固定し、透過化し(permeabilized)、細胞表面マーカーCD235a、CD71、ヒト胎児ヘモグロビン、ヒトヒストン3、およびジ-メチル-リジン9 ヒストン3について染色した。
14日目に、約106個の細胞をペレット化した。RNAを、従来のスピンカラム法によって単離し、遺伝子発現分析を、2工程RT-qPCRによって行った。ヒトグロビンHBA、HBBおよびHBGのそれぞれをコードするプラスミドを用いて、標準曲線を作成し、それを用いて、個々のグロビンコピー数を計算した。HBBおよびHBGを加えて、総β-遺伝子座グロビンコピーを計算した。報告される結果は、%HBG/総mRNAコピーを表す。
14日目に、約106個の細胞をペレット化した。タンパク質を単離し、消化し、LC-PRM質量分析によって定量化した。グロビン特異的標識ペプチドを、個々のグロビンの定量化に使用した。HBBおよびHBGを用いて、総β-遺伝子座グロビンタンパク質レベルを計算した。報告される結果は、%HBG/総タンパク質を表す。
MV-4-11白血病細胞を、ATCCから購入した。IMDM、FBS、およびカルセイン-AMを、Invitrogenから購入した。Flat96-ウェルプレートを、Corningから購入し、ポリ-D-リジン96ウェルマイクロプレート(黒色/透明)を、BD BIOCOATから購入した。
平底96ウェルプレート中で、100μLの細胞を、1×105個の細胞/mLの密度でウェル毎に加えた(注記:内側ウェルのみを使用した。内側ウェルの蒸発を避けるために、PBSを全ての外側ウェルに入れた)。50μLの3倍化合物を、各ウェルに加えて、ウェルごとに150μLの最終体積を得た。
プレートを96時間インキュベートした。
各ウェル中で、細胞をピペットで出し入れして混合した。20μLの細胞懸濁液を、各ウェルから吸引し、V底プレートに加えた。80μLのHBSSを、V底プレートの各ウェルに加え、混合した。
プレートを72時間インキュベートした。
各ウェル中で、細胞をピペットで出し入れして混合した。20μLの細胞懸濁液を、各ウェルから吸引し、V底プレートに加えた。80μLのHBSSを、V底プレートの各ウェルに加え、混合した。
プレートを96時間インキュベートした。
各ウェル中で、細胞をピペットで出し入れして混合した。20μLの細胞懸濁液を、各ウェルから吸引し、V底プレートに加えた。80μLのHBSSを、V底プレートの各ウェルに加え、混合した。
プレートを72時間インキュベートした。
各ウェル中で、細胞をピペットで出し入れして混合した。20μLの細胞懸濁液を、各ウェルから吸引し、V底プレートに加えた。80μLのHBSSを、V底プレートの各ウェルに加え、混合した。
Claims (19)
- 式(IIa1)で表される化合物もしくはその互変異性体、または前記化合物もしくは前記互変異性体の薬学的に許容される塩。
R1はHまたはC1~C4アルキルであり、
R3は、H、ハロ、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、およびC1~C6アルキルからなる群から選択され、ここで、C1~C6アルコキシルおよびC1~C6アルキルはハロ、ORa、またはNRaRbの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり、またはR3は-Q1-T1であり、ここで、Q1は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T1はH、ハロ、シアノ、NR8R9、C(O)NR8R9、OR8、OR9、またはRS1であり、ここで、RS1はC3~C8シクロアルキル、フェニル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員もしくは6員ヘテロアリールであり、RS1はハロ、C1~C6アルキル、ヒドロキシル、オキソ、-C(O)R9、-SO2R8、-SO2N(R8)2、-NR8C(O)R9、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、
R5はH、F、Br、シアノ、C1~C6アルコキシル、C6~C10アリール、NRaRb、C(O)NRaRb、NRaC(O)Rb、C3~C8シクロアルキル、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、ハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C6アルキル、および4員~12員ヘテロシクロアルキルで任意選択的に置換されたC2~C6アルキニルからなる群から選択され、ここで、前記C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、C(O)Ra、ORa、NRaRb、4員~7員ヘテロシクロアルキル、-C1~C6アルキレン-4員~7員ヘテロシクロアルキル、またはハロ、ORaまたはNRaRbの1つまたは複数で任意選択的に置換されたC1~C4アルキルの1つまたは複数で任意選択的に置換され、ここで、RaおよびRbは各々独立にHまたはC1~C6アルキルであり、または
R5およびR3は、それらが結合している前記原子と一緒に、フェニルまたは5員もしくは6員ヘテロアリールを形成し、
各R7は独立にオキソ(=O)または-Q2-T2であり、ここで、各Q2は独立に結合またはハロ、シアノ、ヒドロキシル、アミノ、モノ-もしくはジ-アルキルアミノ、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、各T2は独立にH、ハロ、シアノ、OR10、OR11、C(O)R11、NR10R11、C(O)NR10R11、NR10C(O)R11、5員~10員ヘテロアリール、C3~C8シクロアルキル、またはN、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルであり、ここで、前記5員~10員ヘテロアリール、C3~C8シクロアルキルまたは4員~12員ヘテロシクロアルキルは、ハロ、NRxRyで任意選択的に置換されたC1~C6アルキル、ヒドロキシル、オキソ、N(R8)2、シアノ、C1~C6ハロアルキル、-SO2R8、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換され、RxおよびRyは各々独立にHまたはC1~C6アルキルであり、R7はHまたはC(O)ORgではなく、または任意選択的に、1つのR7およびR5は一緒に、ハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC3~C10アルキレン、C2~C10ヘテロアルキレン、C4~C10アルケニレン、C2~C10ヘテロアルケニレン、C4~C10アルキニレンまたはC2~C10ヘテロアルキニレンリンカーを形成し、
各R8は独立にHまたはC1~C6アルキルであり、
各R9は独立に-Q3-T3であり、ここで、Q3は結合またはC1~C6アルキレン、T3はHであり、
R10はHおよびC1~C6アルキルからなる群から選択され、
R11は-Q6-T6であり、ここで、Q6は結合またはハロ、シアノ、ヒドロキシル、オキソ、もしくはC1~C6アルコキシルの1つまたは複数で任意選択的に置換されたC1~C6アルキレン、C2~C6アルケニレン、もしくはC2~C6アルキニレンリンカーであり、T6はH、ハロ、ORg、NRgRh、NRgC(O)Rh、C(O)NRgRh、C(O)Rg、S(O)2Rg、またはRS3であり、ここで、RgおよびRhは各々独立にH、フェニル、C3~C8シクロアルキル、またはC3~C8シクロアルキルで任意選択的に置換されたC1~C6アルキルであり、またはRgおよびRhは、それらが結合している前記窒素原子と一緒に、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、RS3はC3~C8シクロアルキル、C6~C10アリール、N、OおよびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキル、または5員~10員ヘテロアリールであり、RS3は1つまたは複数の-Q7-T7で任意選択的に置換され、ここで、各Q7は独立に結合またはハロ、シアノ、ヒドロキシル、もしくはC1~C6アルコキシの1つまたは複数で各々任意選択的に置換されたC1~C3アルキレン、C2~C3アルケニレン、もしくはC2~C3アルキニレンリンカーであり、各T7は独立にH、ハロ、シアノ、C1~C6アルキル、C3~C8シクロアルキル、C6~C10アリール、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~7員ヘテロシクロアルキル、5員~6員ヘテロアリール、ORj、C(O)Rj、NRjRk、C(O)NRjRk、S(O)2Rj、およびNRjC(O)Rkからなる群から選択され、RjおよびRkは各々独立にHまたは1つまたは複数のハロで任意選択的に置換されたC1~C6アルキルであり、または-Q7-T7はオキソであり、または
R10およびR11は、それらが結合している前記窒素原子と一緒に、ハロ、C1~C6アルキル、ヒドロキシル、またはC1~C6アルコキシルの1つまたは複数で任意選択的に置換された、N、O、およびSから選択される1~4個のヘテロ原子を含む4員~12員ヘテロシクロアルキルを形成し、
nは2、3、または4であり、
少なくとも1つのR 7 は、
である。) - R3はHでない、請求項1に記載の化合物。
- R3およびR5の多くても1つがHでない、請求項1又は2に記載の化合物。
- R5はHでない、請求項1~3のいずれか一項に記載の化合物。
- nは2であり、
R 1はHまたはCH3である請求項1~4のいずれか一項に記載の化合物。 - nは2であり、前記化合物は、ハロおよびメトキシから選択されるR 7 を含む請求項1~5のいずれか一項に記載の化合物。
- R5はC1~6アルキルであり、またはR5およびR3は、それらが結合している前記原子と一緒に、フェニルまたは5員~6員ヘテロアリール環を形成する、請求項1~10のいずれか一項に記載の化合物。
- 前記化合物が、100nM以上、1μM以上、10μM以上、100μM以上、1000μM以上、1μM以上、2μM以上又は5μM以上の酵素阻害IC50値でキナーゼを阻害し、
前記キナーゼは、以下:AbI、AurA、CHK1、MAP4K、IRAK4、JAK3、EphA2、FGFR3、KDR、Lck、MARK1、MNK2、PKCb2、SIK、およびSrcのうちの1つまたは複数である請求項1~12のいずれか一項に記載の化合物。 - 請求項1~13のいずれか一項に記載の化合物またはその薬学的に許容される塩と、薬学的に許容されるキャリアとを含む医薬組成物。
- 請求項1~13のいずれか一項に記載の化合物を含む、血液疾患を予防または治療用の医薬組成物。
- 前記血液疾患が、鎌状赤血球貧血またはβ-サラセミアである、又は、血液癌である請求項15に記載の医薬組成物。
- 前記血液癌は、急性骨髄性白血病(AML)または慢性リンパ球性白血病(CLL)である請求項16に記載の医薬組成物。
- 前記化合物が、EHMT2の選択的阻害剤として機能する請求項1~13のいずれか一項に記載の化合物。
- 前記化合物が、EHMT2の選択的阻害剤として機能する請求項14~17のいずれか一項に記載の医薬組成物。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022036728A JP7420847B2 (ja) | 2016-04-15 | 2022-03-10 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
| JP2024002232A JP2024045202A (ja) | 2016-04-15 | 2024-01-11 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662323602P | 2016-04-15 | 2016-04-15 | |
| US62/323,602 | 2016-04-15 | ||
| US201662348837P | 2016-06-10 | 2016-06-10 | |
| US62/348,837 | 2016-06-10 | ||
| US201662402997P | 2016-09-30 | 2016-09-30 | |
| US62/402,997 | 2016-09-30 | ||
| PCT/US2017/027918 WO2017181177A1 (en) | 2016-04-15 | 2017-04-17 | Amine-substituted aryl or heteroaryl compounds as ehmt1 and ehmt2 inhibitors |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022036728A Division JP7420847B2 (ja) | 2016-04-15 | 2022-03-10 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019513778A JP2019513778A (ja) | 2019-05-30 |
| JP2019513778A5 JP2019513778A5 (ja) | 2020-05-28 |
| JP7041070B2 true JP7041070B2 (ja) | 2022-03-23 |
Family
ID=58664786
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018553876A Active JP7041070B2 (ja) | 2016-04-15 | 2017-04-17 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
| JP2022036728A Active JP7420847B2 (ja) | 2016-04-15 | 2022-03-10 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
| JP2024002232A Pending JP2024045202A (ja) | 2016-04-15 | 2024-01-11 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022036728A Active JP7420847B2 (ja) | 2016-04-15 | 2022-03-10 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
| JP2024002232A Pending JP2024045202A (ja) | 2016-04-15 | 2024-01-11 | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 |
Country Status (24)
| Country | Link |
|---|---|
| US (2) | US20170355712A1 (ja) |
| EP (1) | EP3442947B1 (ja) |
| JP (3) | JP7041070B2 (ja) |
| KR (2) | KR20230130747A (ja) |
| CN (1) | CN109153650A (ja) |
| AU (3) | AU2017250369A1 (ja) |
| BR (1) | BR112018071093A2 (ja) |
| CA (1) | CA3021062A1 (ja) |
| CL (2) | CL2018002928A1 (ja) |
| CO (1) | CO2018012181A2 (ja) |
| DK (1) | DK3442947T3 (ja) |
| ES (1) | ES2953512T3 (ja) |
| FI (1) | FI3442947T3 (ja) |
| HU (1) | HUE064145T2 (ja) |
| IL (3) | IL281319B2 (ja) |
| LT (1) | LT3442947T (ja) |
| MA (1) | MA44666A (ja) |
| MX (2) | MX2018012622A (ja) |
| PL (1) | PL3442947T3 (ja) |
| PT (1) | PT3442947T (ja) |
| SG (2) | SG10201913471VA (ja) |
| SI (1) | SI3442947T1 (ja) |
| TW (1) | TWI751155B (ja) |
| WO (1) | WO2017181177A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020504715A (ja) * | 2016-12-19 | 2020-02-13 | エピザイム,インコーポレイティド | Ehmt2阻害剤としてのアミン置換複素環化合物およびその使用方法 |
| JP2021500334A (ja) * | 2017-10-18 | 2021-01-07 | エピザイム,インコーポレイティド | Ehmt2阻害剤としてのアミン置換複素環化合物、その塩、及びそれらの合成方法 |
Families Citing this family (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180017013A (ko) | 2015-05-06 | 2018-02-20 | 더 리젠츠 오브 더 유니버시티 오브 캘리포니아 | K-Ras 조절제 |
| WO2016183266A1 (en) | 2015-05-13 | 2016-11-17 | Enanta Pharmaceuticals, Inc. | Ehpatitis b antiviral agents |
| JP6904970B2 (ja) | 2016-03-07 | 2021-07-21 | エナンタ ファーマシューティカルズ インコーポレイテッド | B型肝炎抗ウイルス剤 |
| HUE050217T2 (hu) | 2016-04-15 | 2020-11-30 | Abbvie Inc | Brómdomén inhibitorok |
| WO2017201199A1 (en) | 2016-05-17 | 2017-11-23 | Duke University | Compositions and methods for the treatment of prader-willi syndrome |
| US20200113901A1 (en) * | 2017-03-31 | 2020-04-16 | Epizyme, Inc. | Methods of using ehmt2 inhibitors |
| SG11201909570PA (en) * | 2017-04-20 | 2019-11-28 | Univ California | K-ras modulators |
| AU2018254577B2 (en) * | 2017-04-21 | 2024-06-13 | Epizyme, Inc. | Combination therapies with EHMT2 inhibitors |
| MX2020002191A (es) | 2017-08-28 | 2020-10-05 | Enanta Pharm Inc | Agentes antivirales contra la hepatitis b. |
| CN109467538A (zh) | 2017-09-07 | 2019-03-15 | 和记黄埔医药(上海)有限公司 | 环烯烃取代的杂芳环类化合物及其用途 |
| WO2019079485A1 (en) * | 2017-10-17 | 2019-04-25 | Epizyme, Inc. | AMINO-SUBSTITUTED HETEROCYCLIC COMPOUNDS AS EHMT2 INHIBITORS AND DERIVATIVES THEREOF |
| IL310625A (en) * | 2017-10-18 | 2024-04-01 | Epizyme Inc | Methods for using EHMT2 inhibitors in the treatment or prevention of blood disorders |
| JP2021500327A (ja) * | 2017-10-18 | 2021-01-07 | エピザイム,インコーポレイティド | 免疫療法にehmt2阻害剤を使用する方法 |
| WO2019143902A2 (en) | 2018-01-22 | 2019-07-25 | Enanta Pharmaceuticals, Inc. | Substituted heterocycles as antiviral agents |
| KR20200131246A (ko) | 2018-02-15 | 2020-11-23 | 누베이션 바이오 인크. | 키나제 억제제로서의 헤테로시클릭 화합물 |
| CN108822103A (zh) * | 2018-07-28 | 2018-11-16 | 刘凤娟 | 一种咪唑并[4,5-b]吡啶化合物及其制备方法和应用 |
| WO2020061435A1 (en) | 2018-09-21 | 2020-03-26 | Enanta Pharmaceuticals, Inc. | Functionalized heterocycles as antiviral agents |
| US11066404B2 (en) | 2018-10-11 | 2021-07-20 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| MX2021005047A (es) | 2018-10-31 | 2021-09-08 | Gilead Sciences Inc | Compuestos de 6-azabenzimidazol sustituidos como inhibidores de hpk1. |
| TW202136261A (zh) | 2018-10-31 | 2021-10-01 | 美商基利科學股份有限公司 | 經取代之6-氮雜苯并咪唑化合物 |
| BR112021009854A2 (pt) | 2018-11-21 | 2021-08-17 | Enanta Pharmaceuticals, Inc. | heterociclos funcionalizados como agentes antivirais |
| US11384083B2 (en) | 2019-02-15 | 2022-07-12 | Incyte Corporation | Substituted spiro[cyclopropane-1,5′-pyrrolo[2,3-d]pyrimidin]-6′(7′h)-ones as CDK2 inhibitors |
| US11472791B2 (en) | 2019-03-05 | 2022-10-18 | Incyte Corporation | Pyrazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| US11919904B2 (en) | 2019-03-29 | 2024-03-05 | Incyte Corporation | Sulfonylamide compounds as CDK2 inhibitors |
| WO2020223469A1 (en) | 2019-05-01 | 2020-11-05 | Incyte Corporation | N-(1-(methylsulfonyl)piperidin-4-yl)-4,5-di hydro-1h-imidazo[4,5-h]quinazolin-8-amine derivatives and related compounds as cyclin-dependent kinase 2 (cdk2) inhibitors for treating cancer |
| US11447494B2 (en) | 2019-05-01 | 2022-09-20 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| CA3138973A1 (en) * | 2019-05-05 | 2020-11-12 | Qilu Regor Therapeutics Inc. | Cdk inhibitors |
| WO2020237025A1 (en) | 2019-05-23 | 2020-11-26 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| WO2020247444A1 (en) | 2019-06-03 | 2020-12-10 | Enanta Pharmaceuticals, Inc, | Hepatitis b antiviral agents |
| US11760755B2 (en) | 2019-06-04 | 2023-09-19 | Enanta Pharmaceuticals, Inc. | Hepatitis B antiviral agents |
| WO2020247575A1 (en) | 2019-06-04 | 2020-12-10 | Enanta Pharmaceuticals, Inc. | Hepatitis b antiviral agents |
| US11738019B2 (en) | 2019-07-11 | 2023-08-29 | Enanta Pharmaceuticals, Inc. | Substituted heterocycles as antiviral agents |
| GB201910608D0 (en) * | 2019-07-24 | 2019-09-04 | Enterprise Therapeutics Ltd | Compounds |
| KR20220064369A (ko) | 2019-08-14 | 2022-05-18 | 인사이트 코포레이션 | Cdk2 저해제로서의 이미다졸릴 피리디미딘일아민 화합물 |
| WO2021055425A2 (en) | 2019-09-17 | 2021-03-25 | Enanta Pharmaceuticals, Inc. | Functionalized heterocycles as antiviral agents |
| US11851426B2 (en) | 2019-10-11 | 2023-12-26 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| US20230127046A1 (en) | 2019-11-27 | 2023-04-27 | Riken | G9a INHIBITOR |
| US11802125B2 (en) | 2020-03-16 | 2023-10-31 | Enanta Pharmaceuticals, Inc. | Functionalized heterocyclic compounds as antiviral agents |
| KR20230020983A (ko) | 2020-05-04 | 2023-02-13 | 암젠 인코포레이션 | 골수성 세포 2 작용제 상에서 발현되는 유발 수용체로서의 헤테로고리 화합물 및 사용 방법 |
| TW202208355A (zh) | 2020-05-04 | 2022-03-01 | 美商安進公司 | 作為骨髓細胞觸發受體2促效劑之雜環化合物及使用方法 |
| CN111518015A (zh) * | 2020-05-20 | 2020-08-11 | 上海合全药物研发有限公司 | 一种叔丁基-8-氧亚基-2-氮杂螺[4.5]癸烷-2-甲酸基酯的制备方法 |
| WO2022175752A1 (en) | 2021-02-19 | 2022-08-25 | Sudo Biosciences Limited | Tyk2 inhibitors and uses thereof |
| TW202246233A (zh) | 2021-02-19 | 2022-12-01 | 英商蘇多生物科學有限公司 | Tyk2抑制劑及其用途 |
| US11981671B2 (en) | 2021-06-21 | 2024-05-14 | Incyte Corporation | Bicyclic pyrazolyl amines as CDK2 inhibitors |
| AU2022366869A1 (en) * | 2021-10-15 | 2024-05-02 | Tango Therapeutics, Inc. | Novel modulators of ehmt1 and ehmt2 and therapeutic use thereof |
| US11976073B2 (en) | 2021-12-10 | 2024-05-07 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| WO2023107705A1 (en) | 2021-12-10 | 2023-06-15 | Incyte Corporation | Bicyclic amines as cdk12 inhibitors |
| WO2024019541A1 (ko) * | 2022-07-20 | 2024-01-25 | 일동제약(주) | 헤테로아릴 유도체 화합물 및 이의 용도 |
| CN115947692A (zh) * | 2022-12-28 | 2023-04-11 | 上海再启生物技术有限公司 | 一种制备2-氯-4-(甲氧基甲基)嘧啶的方法 |
| WO2024216164A1 (en) | 2023-04-13 | 2024-10-17 | Tango Therapeutics, Inc. | N2-((5-hydroxy)-2-pyridyl)-pyridine-2,4-diamine derivatives as ehmt1/2 modulators for the treatment of cancer |
Citations (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004535447A (ja) | 2001-06-26 | 2004-11-25 | ブリストル−マイヤーズ スクイブ カンパニー | TNF−α発現のN−ヘテロ環インヒビター |
| WO2006014420A1 (en) | 2004-07-06 | 2006-02-09 | Angion Biomedica Corporation | Quinazoline modulators of hepatocyte growth factor / c-met activity for the treatment of cancer |
| JP2006514989A (ja) | 2002-07-29 | 2006-05-18 | ライジェル ファーマシューティカルズ | 2,4−ピリミジンジアミン化合物による自己免疫疾患の治療および予防方法 |
| WO2007038387A3 (en) | 2005-09-23 | 2007-10-11 | Univ Yale | Compounds and methods for the treatment of viruses and cancer |
| JP2008540439A (ja) | 2005-05-05 | 2008-11-20 | サノフィ−アベンティス・ユー・エス・エルエルシー | 安定なナノ粒子処方物 |
| JP2009501164A (ja) | 2005-07-15 | 2009-01-15 | 4エスツェー アクチェンゲゼルシャフト | 2−アリールベンゾチアゾール及びその使用 |
| JP2009513703A (ja) | 2005-11-01 | 2009-04-02 | ターゲジェン インコーポレーティッド | キナーゼのビ−アリールメタ−ピリミジン阻害剤 |
| WO2009103652A1 (en) | 2008-02-22 | 2009-08-27 | F. Hoffmann-La Roche Ag | Modulators for amyloid beta |
| JP2009538833A (ja) | 2006-05-26 | 2009-11-12 | アボット・ラボラトリーズ | ポロ様キナーゼの阻害薬 |
| WO2010129802A1 (en) | 2009-05-06 | 2010-11-11 | Portola Pharmaceuticals, Inc. | Inhibitors of jak |
| JP2012501983A (ja) | 2008-09-03 | 2012-01-26 | バイエル・クロップサイエンス・アーゲー | 4−アルキル−置換ジアミノピリミジン類 |
| WO2012115479A2 (en) | 2011-02-25 | 2012-08-30 | Yuhan Corporation | Diaminopyrimidine derivatives and processes for the preparation thereof |
| WO2013033037A2 (en) | 2011-08-26 | 2013-03-07 | The Regents Of The University Of California | Novel antiprion compounds |
| WO2013054351A1 (en) | 2011-08-08 | 2013-04-18 | Cadila Healthcare Limited | Heterocyclic compounds |
| JP2013530954A (ja) | 2010-06-04 | 2013-08-01 | エフ.ホフマン−ラ ロシュ アーゲー | Lrrk2モジュレーターとしてのアミノピリミジン誘導体 |
| JP2015518039A (ja) | 2012-05-30 | 2015-06-25 | アステックス、セラピューティックス、リミテッドAstex Therapeutics Limited | Fgfr阻害剤としてのプテリジン |
| WO2015109109A1 (en) | 2014-01-15 | 2015-07-23 | Forum Pharmaceuticals Inc. | Fused morpholinopyrimidines and methods of use thereof |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4522811A (en) | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| EP0585500A1 (en) * | 1992-09-04 | 1994-03-09 | Merrell Dow Pharmaceuticals Inc. | Diaryl piperazineacetamides as antimuscarinic agents |
| GB9523675D0 (en) * | 1995-11-20 | 1996-01-24 | Celltech Therapeutics Ltd | Chemical compounds |
| US5763263A (en) | 1995-11-27 | 1998-06-09 | Dehlinger; Peter J. | Method and apparatus for producing position addressable combinatorial libraries |
| EP1453516A2 (de) * | 2001-10-17 | 2004-09-08 | Boehringer Ingelheim Pharma GmbH & Co.KG | 5-substituierte 4-amino-2-phenylamino-pyrimdinderivate und ihre verwendung als beta-amyloid modulatoren |
| MXPA06003054A (es) * | 2003-09-18 | 2006-05-31 | Novartis Ag | 2,4-di-(fenil-amino)-pirimidinas utiles en el tratamiento de trastornos proliferativos. |
| EP1746096A1 (en) * | 2005-07-15 | 2007-01-24 | 4Sc Ag | 2-Arylbenzothiazole analogues and uses thereof in the treatment of cancer |
| TW200736232A (en) * | 2006-01-26 | 2007-10-01 | Astrazeneca Ab | Pyrimidine derivatives |
| VN29259A1 (en) * | 2008-04-16 | 2012-04-25 | Portola Pharm Inc | 2, 6-diamino- pyrimidin- 5-yl-carboxamides as syk or JAK kinases inhibitors |
| KR20110053347A (ko) * | 2008-08-05 | 2011-05-20 | 탈자진 인코포레이티드 | 탈라세미아를 치료하는 방법 |
| US20130244963A1 (en) * | 2010-09-30 | 2013-09-19 | Portola Pharmaceuticals, Inc. | Combination therapy with 4-(3-(2h-1,2,3-triazol-2-yl)phenylamino)-2-((1r,2s)-2-aminocyclohexylamino)pyrimidine-5-carboxamide |
| WO2013070852A2 (en) * | 2011-11-08 | 2013-05-16 | Emory University | Compounds and compositions used to epigenetically transform cells and methods related thereto |
| KR101452235B1 (ko) * | 2012-02-03 | 2014-10-22 | 서울대학교산학협력단 | 신규한 피리미딘계 유도체 또는 이의 약학적으로 허용가능한 염, 이의 제조방법 및 이를 포함하는 rage 수용체 관련 질환의 예방 또는 치료용 약학적 조성물 |
| ES2872348T3 (es) * | 2012-03-19 | 2021-11-02 | Imperial College Innovations Ltd | Compuestos de quinazolina y su uso en terapia |
| US9676756B2 (en) * | 2012-10-08 | 2017-06-13 | Portola Pharmaceuticals, Inc. | Substituted pyrimidinyl kinase inhibitors |
| US9145412B2 (en) * | 2012-11-02 | 2015-09-29 | Acetylon Pharmaceuticals, Inc. | Selective HDAC1 and HDAC2 inhibitors |
| WO2015192981A1 (en) * | 2014-06-16 | 2015-12-23 | Fundación Para La Investigación Médica Aplicada | Novel compounds as dual inhibitors of histone methyltransferases and dna methyltransferases |
-
2017
- 2017-04-17 PT PT177209210T patent/PT3442947T/pt unknown
- 2017-04-17 ES ES17720921T patent/ES2953512T3/es active Active
- 2017-04-17 TW TW106112816A patent/TWI751155B/zh active
- 2017-04-17 LT LTEPPCT/US2017/027918T patent/LT3442947T/lt unknown
- 2017-04-17 EP EP17720921.0A patent/EP3442947B1/en active Active
- 2017-04-17 IL IL281319A patent/IL281319B2/en unknown
- 2017-04-17 CA CA3021062A patent/CA3021062A1/en active Pending
- 2017-04-17 MX MX2018012622A patent/MX2018012622A/es unknown
- 2017-04-17 JP JP2018553876A patent/JP7041070B2/ja active Active
- 2017-04-17 IL IL307931A patent/IL307931A/en unknown
- 2017-04-17 KR KR1020237028695A patent/KR20230130747A/ko not_active Application Discontinuation
- 2017-04-17 FI FIEP17720921.0T patent/FI3442947T3/fi active
- 2017-04-17 CN CN201780030129.9A patent/CN109153650A/zh active Pending
- 2017-04-17 SI SI201731402T patent/SI3442947T1/sl unknown
- 2017-04-17 MA MA044666A patent/MA44666A/fr unknown
- 2017-04-17 SG SG10201913471VA patent/SG10201913471VA/en unknown
- 2017-04-17 DK DK17720921.0T patent/DK3442947T3/da active
- 2017-04-17 HU HUE17720921A patent/HUE064145T2/hu unknown
- 2017-04-17 PL PL17720921.0T patent/PL3442947T3/pl unknown
- 2017-04-17 KR KR1020187032892A patent/KR102571679B1/ko active IP Right Grant
- 2017-04-17 AU AU2017250369A patent/AU2017250369A1/en not_active Abandoned
- 2017-04-17 SG SG11201808799SA patent/SG11201808799SA/en unknown
- 2017-04-17 WO PCT/US2017/027918 patent/WO2017181177A1/en active Application Filing
- 2017-04-17 BR BR112018071093A patent/BR112018071093A2/pt active Search and Examination
- 2017-05-22 US US15/601,888 patent/US20170355712A1/en not_active Abandoned
-
2018
- 2018-10-04 IL IL262140A patent/IL262140A/en unknown
- 2018-10-12 CL CL2018002928A patent/CL2018002928A1/es unknown
- 2018-10-15 MX MX2022010947A patent/MX2022010947A/es unknown
- 2018-11-13 CO CONC2018/0012181A patent/CO2018012181A2/es unknown
-
2019
- 2019-03-28 CL CL2019000815A patent/CL2019000815A1/es unknown
-
2020
- 2020-11-20 US US17/100,489 patent/US20210198277A1/en active Pending
-
2021
- 2021-10-07 AU AU2021245168A patent/AU2021245168B2/en active Active
-
2022
- 2022-03-10 JP JP2022036728A patent/JP7420847B2/ja active Active
-
2024
- 2024-01-11 JP JP2024002232A patent/JP2024045202A/ja active Pending
- 2024-01-25 AU AU2024200464A patent/AU2024200464A1/en active Pending
Patent Citations (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004535447A (ja) | 2001-06-26 | 2004-11-25 | ブリストル−マイヤーズ スクイブ カンパニー | TNF−α発現のN−ヘテロ環インヒビター |
| JP2006514989A (ja) | 2002-07-29 | 2006-05-18 | ライジェル ファーマシューティカルズ | 2,4−ピリミジンジアミン化合物による自己免疫疾患の治療および予防方法 |
| WO2006014420A1 (en) | 2004-07-06 | 2006-02-09 | Angion Biomedica Corporation | Quinazoline modulators of hepatocyte growth factor / c-met activity for the treatment of cancer |
| JP2008540439A (ja) | 2005-05-05 | 2008-11-20 | サノフィ−アベンティス・ユー・エス・エルエルシー | 安定なナノ粒子処方物 |
| JP2009501164A (ja) | 2005-07-15 | 2009-01-15 | 4エスツェー アクチェンゲゼルシャフト | 2−アリールベンゾチアゾール及びその使用 |
| WO2007038387A3 (en) | 2005-09-23 | 2007-10-11 | Univ Yale | Compounds and methods for the treatment of viruses and cancer |
| JP2009513703A (ja) | 2005-11-01 | 2009-04-02 | ターゲジェン インコーポレーティッド | キナーゼのビ−アリールメタ−ピリミジン阻害剤 |
| JP2009538833A (ja) | 2006-05-26 | 2009-11-12 | アボット・ラボラトリーズ | ポロ様キナーゼの阻害薬 |
| WO2009103652A1 (en) | 2008-02-22 | 2009-08-27 | F. Hoffmann-La Roche Ag | Modulators for amyloid beta |
| JP2012501983A (ja) | 2008-09-03 | 2012-01-26 | バイエル・クロップサイエンス・アーゲー | 4−アルキル−置換ジアミノピリミジン類 |
| WO2010129802A1 (en) | 2009-05-06 | 2010-11-11 | Portola Pharmaceuticals, Inc. | Inhibitors of jak |
| JP2013530954A (ja) | 2010-06-04 | 2013-08-01 | エフ.ホフマン−ラ ロシュ アーゲー | Lrrk2モジュレーターとしてのアミノピリミジン誘導体 |
| WO2012115479A2 (en) | 2011-02-25 | 2012-08-30 | Yuhan Corporation | Diaminopyrimidine derivatives and processes for the preparation thereof |
| WO2013054351A1 (en) | 2011-08-08 | 2013-04-18 | Cadila Healthcare Limited | Heterocyclic compounds |
| WO2013033037A2 (en) | 2011-08-26 | 2013-03-07 | The Regents Of The University Of California | Novel antiprion compounds |
| JP2015518039A (ja) | 2012-05-30 | 2015-06-25 | アステックス、セラピューティックス、リミテッドAstex Therapeutics Limited | Fgfr阻害剤としてのプテリジン |
| WO2015109109A1 (en) | 2014-01-15 | 2015-07-23 | Forum Pharmaceuticals Inc. | Fused morpholinopyrimidines and methods of use thereof |
Non-Patent Citations (4)
| Title |
|---|
| Arvanitis, Elena A. et al,Solid-Phase Synthesis of 2,4-Diaminopyrimidines via Lewis Acid-Mediated Aromatic Nucleophilic Substitution,Journal of Combinatorial Chemistry ,2004年,6(3),,414-419 |
| Lee, Jun A. et al,Synthesis of quinolinylaminopyrimidines and quinazolinylmethylaminopyrimidines with antiproliferative activity against melanoma cell line,Journal of Enzyme Inhibition and Medicinal Chemistry ,2015年,30(4),,607-614 |
| REGISTRY(STN)[online],2015年,CAS 登録番号:1798663-30-5; 1798641-80-1; 1798521-49-9; 1798473-53-6 |
| Wang, Jinhua et al,SnapShot: Kinase Inhibitors II,Molecular Cell ,2015年,58(4),,710-710.e1 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020504715A (ja) * | 2016-12-19 | 2020-02-13 | エピザイム,インコーポレイティド | Ehmt2阻害剤としてのアミン置換複素環化合物およびその使用方法 |
| JP2022110080A (ja) * | 2016-12-19 | 2022-07-28 | エピザイム,インコーポレイティド | Ehmt2阻害剤としてのアミン置換複素環化合物およびその使用方法 |
| JP2021500334A (ja) * | 2017-10-18 | 2021-01-07 | エピザイム,インコーポレイティド | Ehmt2阻害剤としてのアミン置換複素環化合物、その塩、及びそれらの合成方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7041070B2 (ja) | Ehmt1およびehmt2阻害剤としてのアミン置換アリールまたはヘテロアリール化合物 | |
| JP6577613B2 (ja) | キナーゼ阻害剤としての縮合環式または三環式アリールピリミジン化合物 | |
| AU2016228660B2 (en) | Substituted 2-hydrogen-pyrazole derivative serving as anticancer drug | |
| JP6430512B2 (ja) | リジン特異的デメチラーゼ−1の阻害剤 | |
| KR102693367B1 (ko) | Ehmt2 저해제로서의 아민-치환된 헤테로사이클릭 화합물 및 이의 사용 방법 | |
| EP2855459B1 (en) | Aminoquinazoline and pyridopyrimidine derivatives | |
| JP7425724B2 (ja) | Ehmt2阻害剤としてのアミン置換複素環化合物及びその誘導体 | |
| JP2019533650A (ja) | Ehmt2阻害剤としての置換された融合二環式または三環式複素環化合物 | |
| EP4310081A1 (en) | Ctla-4 small molecule degradation agent and application thereof | |
| OA19500A (en) | Amine-substituted Aryl or Heteroaryl compounds as Ehmt1 and Ehmt2 inhibitors. | |
| NZ787281A (en) | Amine-substituted aryl or heteroaryl compounds as ehmt1 and ehmt2 inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200415 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200415 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210311 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210413 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210709 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211013 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220208 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220310 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7041070 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |