JP6997866B2 - 日本脳炎ワクチン含有マイクロニードルアレイ - Google Patents
日本脳炎ワクチン含有マイクロニードルアレイ Download PDFInfo
- Publication number
- JP6997866B2 JP6997866B2 JP2020521280A JP2020521280A JP6997866B2 JP 6997866 B2 JP6997866 B2 JP 6997866B2 JP 2020521280 A JP2020521280 A JP 2020521280A JP 2020521280 A JP2020521280 A JP 2020521280A JP 6997866 B2 JP6997866 B2 JP 6997866B2
- Authority
- JP
- Japan
- Prior art keywords
- needle
- microneedle array
- mold
- japanese encephalitis
- encephalitis vaccine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M37/0015—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin by using microneedles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/20—Surgical instruments, devices or methods, e.g. tourniquets for vaccinating or cleaning the skin previous to the vaccination
- A61B17/205—Vaccinating by means of needles or other puncturing devices
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0021—Intradermal administration, e.g. through microneedle arrays, needleless injectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M37/0015—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin by using microneedles
- A61M2037/0023—Drug applicators using microneedles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M37/0015—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin by using microneedles
- A61M2037/0046—Solid microneedles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M37/0015—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin by using microneedles
- A61M2037/0053—Methods for producing microneedles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M37/0015—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin by using microneedles
- A61M2037/0061—Methods for using microneedles
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Heart & Thoracic Surgery (AREA)
- Medical Informatics (AREA)
- Biomedical Technology (AREA)
- Surgery (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Molecular Biology (AREA)
- Anesthesiology (AREA)
- Hematology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Virology (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Inorganic Chemistry (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Media Introduction/Drainage Providing Device (AREA)
Description
(1)シート部と、シート部の上面に存在する複数の針部とを有するマイクロニードルアレイであって、針部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種 、日本脳炎ワクチン、および電気的に中性である界面活性剤を含み、シート部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む、マイクロニードルアレイ。
(2)電気的に中性である界面活性剤が、ソルビタン脂肪酸エステル、ポリオキシエチレン/ポリオキシプロピレン共重合ポリマー、ポリオキシエチレン硬化ヒマシ油、またはオクチルフェノールエトキシレートである、 (1)に記載のマイクロニードルアレイ。
(3)針部に含まれる電気的に中性である水溶性高分子の重量平均分子量が5000以上 100,000以下である、(1)または(2)に記載のマイクロニードルアレイ。
(4)針部に含まれる水溶性高分子が多糖類である、(1)から(3)の何れか一項に記載のマイクロニードルアレイ。
(5)針部に含まれる水溶性高分子がヒドロキシエチルデンプンである、(1)から(4)のいずれか一項に記載のマイクロニードルアレイ。
(6)シート部に含まれる電気的に中性である水溶性高分子の重量平均分子量が5000以上100,000以下である、(1)から(5)の何れか一項に記載のマイクロニードルアレイ。
(7)シート部に含まれる水溶性高分子が多糖類である、(1)から(6)の何れか一項に記載のマイクロニードルアレイ。
(8)シート部に含まれる水溶性高分子がヒドロキシエチルデンプンである、(1)から(7)のいずれか一項に記載のマイクロニードルアレイ。
(9)針部に含まれる二糖類が、スクロースである、(1)から(8)のいずれか一項に記載のマイクロニードルアレイ。
本明細書において、「日本脳炎ワクチンを含む」とは、体表に穿刺する際に、日本脳炎ワクチンの効果が発揮される量の日本脳炎ワクチンを含むことを意味する。「日本脳炎ワクチンを含まない」とは、日本脳炎ワクチンの効果が発揮される量の日本脳炎ワクチンを含んでいないことを意味し、日本脳炎ワクチンの量の範囲が、日本脳炎ワクチンを全く含まない場合から、効果が発揮されない量までの範囲を含む。
本発明のマイクロニードルアレイは、シート部と、シート部の上面に存在する複数の針部とを有するマイクロニードルアレイであって、針部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種、日本脳炎ワクチン、および電気的に中性である界面活性剤を含み、シート部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む、マイクロニードルアレイである。
本発明のマイクロニードルアレイは、日本脳炎ワクチンを効率的に皮膚中に投与するために、シート部及び針部を少なくとも含み、針部に日本脳炎ワクチンを担持させている。
シート部の面積は、特に限定されないが、0.005~1000mm2であることが好ましく、0.05~500mm2であることがより好ましく、0.1~400mm2であることがさらに好ましい。
シート部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む。シート部には、それ以外の添加物(例えば、電荷を有する水溶性高分子など)を含んでいてもよい。なお、シート部には日本脳炎ワクチンを含まないことが好ましい。
針部の形状の例としては、円錐状、多角錐状(四角錐状など)、又は紡錘状などが挙げられる。例えば、図1~図8に示す針部112のような形状を有し、針部の全体の形状が、円錐状又は多角錐状(四角錐状など)であってもよいし、針部側面の傾き(角度)を連続的に変化させた構造であってもよい。また、針部側面の傾き(角度)が非連続的に変化する、二層又はそれ以上の多層構造をとることもできる。
本発明のマイクロニードルアレイを皮膚に適用した場合、針部が皮膚に挿入され、シート部の上面又はその一部が皮膚に接するようになることが好ましい。
針部が皮膚内に残留しても人体に支障が生じないように、電気的に中性である水溶性高分子は生体溶解性物質であることが好ましい。
上限は特に限定されないが、好ましくは、針部の全固形分の99質量%以下が電気的に中性である水溶性高分子または二糖類であり、より好ましくは、針部の全固形分の95質量%以下が電気的に中性である水溶性高分子または二糖類であり、さらに好ましくは、針部の全固形分の90質量%以下が電気的に中性である水溶性高分子または二糖類である。
針部の全固形分の50質量%以上を電気的に中性である水溶性高分子または二糖類とすることによって、良好な穿刺性及び良好な効果を得ることができる。
日本脳炎ワクチンとしては、不活化日本脳炎ウイルスを有効成分とするワクチンを使用することができる。例えば、日本脳炎ウイルスをVero細胞(アフリカミドリザル腎臓由来株化細胞)の培養液から調製したホルマリン不活化ウイルス調製物、日本脳炎ウイルスに感染したマウスの脳から調製したホルマリン不活化ウイルス調製物などを使用することができる。
マイクロニードルアレイ1枚あたりの日本脳炎ワクチンの含有量は、特に限定されないが、タンパク質含量として、好ましくは0.05~5μgであり、より好ましくは0.2~3μgである。
本発明のマイクロニードルアレイは、例えば、特開2013-153866号公報又は国際公開WO2014/077242号公報に記載の方法に準じて以下の方法により製造することができる。
図9Aから9Cは、モールド(型)の作製の工程図である。図9Aに示すように、モールドを作製するための原版を先ず作製する。この原版11の作製方法は2種類ある。
1番目の方法は、原版11にPDMS(ポリジメチルシロキサン、例えば、ダウコーニング社製のシルガード184(登録商標))に硬化剤を添加したシリコーン樹脂を流し込み、100℃で加熱処理し硬化した後に、原版11より剥離する方法である。2番目の方法は、紫外線を照射することにより硬化するUV(Ultraviolet)硬化樹脂を原版11に流し込み、窒素雰囲気中で紫外線を照射した後に、原版11より剥離する方法である。3番目の方法は、ポリスチレンやPMMA(ポリメチルメタクリレート)等のプラスチック樹脂を有機溶剤に溶解させた溶液を剥離剤の塗布された原版11に流し込み、乾燥させることにより有機溶剤を揮発させて硬化させた後に、原版11より剥離する方法である。4番目の方法は、Ni電鋳により反転品を作成する方法である。
このようなモールド複合体18を使用することで、針状凹部15に充填される溶液は透過せず、針状凹部15に存在する空気のみを針状凹部15から追い出すことができる。これにより、針状凹部15の形状を高分子に転写する転写性が良くなり、よりシャープな針部を形成することができる。
本発明においては、
(i)針部の一部である針部先端領域を形成するための、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種、日本脳炎ワクチン、および電気的に中性である界面活性剤を含む容液、並びに、
(ii)針部のうちの針部先端領域以外の針部根元領域とシート部(又は針部のうちの針部先端領域以外の針部根元領域と、錐台部と、シート部)とを形成するための、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む溶液、
を準備することが好ましい。
上記溶液中の、電気的に中性である水溶性高分子または二糖類の濃度は、使用する物質の種類によっても異なるが、一般的には1~50質量%であることが好ましい。また、溶解に用いる溶媒は、水以外であっても揮発性を有するものであればよく、メチルエチルケトン(MEK)、アルコールなどを用いることができる。
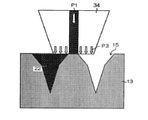
図12Aに示すように、2次元配列された針状凹部15を有するモールド13が、基台20の上に配置される。モールド13には、5×5の2次元配列された、2組の複数の針状凹部15が形成されている。日本脳炎ワクチンを含む溶液22を収容するタンク30、タンクに接続される配管32、及び、配管32の先端に接続されたノズル34、を有する液供給装置36が準備される。なお、本例では、針状凹部15が5×5で2次元配列されている場合を例示しているが、針状凹部15の個数は5×5に限定されるものではなく、M×N(M及びNはそれぞれ独立に1以上の任意の整数を示し、好ましくは2~30、より好ましくは3~25、さらに好ましくは3~20である)で2次元配列されていればよい。
好ましくは、本発明マイクロニードルアレイは、日本脳炎ワクチンを含む溶液を充填した針部形成用モールドを、乾燥することによって針部の一部を形成する工程;及び、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む溶液を、上記で形成された針部の一部の上面に充填して乾燥する工程によって製造することができる。
特に好ましくは、上記の乾燥は、日本脳炎ワクチンの活性が失われない温度以下に保ち、かつ乾燥開始後60分以上経過してから、溶液の含水率が20%以下に到達するように制御することができる。
乾燥の際の温度は、好ましくは1~45℃であり、より好ましくは1~40℃である。
乾燥の際の相対湿度は、好ましくは10~95%であり、より好ましくは20~95%であり、さらに好ましくは30~95%である。
シート部を形成する工程について、いくつかの態様を説明する。
シート部を形成する工程について、第1の態様について図16Aから図16Dを参照して説明する。モールド13の針状凹部15に日本脳炎ワクチンを含む溶液22をノズル34から充填する。次いで、図16Bに示すように、日本脳炎ワクチンを含む溶液22を乾燥固化させることで、針状凹部15内に日本脳炎ワクチンを含む層120が形成される。次いで、図16Cに示すように、日本脳炎ワクチンを含む層120が形成されたモールド13に、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む溶液24をディスペンサーにより塗布する。ディスペンサーによる塗布に加えて、バー塗布、スピン塗布、スプレーなどによる塗布などを適用することができる。日本脳炎ワクチンを含む層120は固化されているので、日本脳炎ワクチンが、上記溶液24に拡散するのを抑制することができる。次いで、図17Dに示すように、上記溶液24を乾燥固化させることで、複数の針部112、錐台部113及び、シート部116から構成されるマイクロニードルアレイ1が形成される。
マイクロニードルアレイをモールド13から剥離する方法は特に限定されない。剥離の際に針部が曲がったり折れたりしないことが好ましい。具体的には、図18に示すように、マイクロニードルアレイの上に、粘着性の粘着層が形成されているシート状の基材40を付着させた後、端部から基材40をめくるように剥離を行うことができる。ただし、この方法では針部が曲がる可能性がある。そのため、図19に示すように、マイクロニードルアレイの上の基材40に吸盤(図示せず)を設置し、エアーで吸引しながら垂直に引き上げる方法を適用することができる。なお、基材40として支持体29を使用してもよい。
HES:ヒドロキシエチルスターチ70000(Fresenius Kabi株式会社)(重量平均分子量は70000)
DEX:デキストラン70000(名糖産業株式会社)(重量平均分子量は70000)
CS:コンドロイチン硫酸ナトリウム(マルハニチロ株式会社)(重量平均分子量は90000)
スクロース:ショ糖(富士フイルム和光純薬株式会社)
PVP K25:ポリビニルピロリドン(富士フイルム和光純薬株式会社)(重量平均分子量は24000)
SDS:ドデシル硫酸ナトリウム (富士フイルム和光純薬株式会社)
Pluronic(登録商標)F-68(日油株式会社)
NIKKOL(登録商標)HCO-60(日光ケミカルズ株式会社)
Triton(登録商標)X-100 (Alfa Aesar株式会社)
L-グルタミン酸ナトリウム(富士フイルム和光純薬株式会社)
<マイクロニードルアレイの製造及び評価>
(モールドの製造)
一辺40mmの平滑なNi板の表面に、図21に示すような、底面が500μmの直径D1で、150μmの高さH1の円錐台50上に、300μmの直径D2で、500μmの高さH2の円錐52が形成された針状構造の形状部12を、1000μmのピッチL1にて四角形状に100本の針を2次元正方配列に研削加工することで、原版11を作製した。この原版11の上に、シリコンゴム(ダウ・コーニング社製SILASTIC MDX4-4210)を0.6mmの厚みで膜を形成し、膜面から原版11の円錐先端部50μmを突出させた状態で熱硬化させ、剥離した。これにより、約30μmの直径の貫通孔を有するシリコンゴムの反転品を作製した。このシリコンゴム反転品の、中央部に10列×10行の2次元配列された針状凹部が形成された、一辺30mmの平面部外を切り落としたものをモールドとして用いた。針状凹部の開口部が広い方をモールドの表面とし、30μmの直径の貫通孔(空気抜き孔)を有する面をモールドの裏面とした。
日本脳炎ワクチン原液(阪大微生物病研究会より提供)を遠心限外濾過法によって濃縮した後、水溶性高分子、スクロース(富士フイルム和光純薬株式会社)、L-グルタミン酸ナトリウム(富士フイルム和光純薬株式会社)、界面活性剤と混合した。各成分の使用量は表1に記す。
ヒドロキシエチルデンプン70000(HES、Fresenius Kabi株式会社)を水に溶解して、HESの56質量%水溶液を調製した。
図22に示す充填装置を使用した。充填装置は、モールドとノズルの相対位置座標を制御するX軸駆動部61及びZ軸駆動部62、ノズル63を取り付け可能な液供給装置64(武蔵エンジニアリング社製超微量定量ディスペンサーSMP-III)、モールド69を固定する吸引台65、モールド表面形状を測定するレーザー変位計66(パナソニック社製HL-C201A)、ノズル押し込み圧力を測定するロードセル67(共和電業製LCX-A-500N)、及び表面形状及び押し付け圧力の測定値のデータを基にZ軸を制御する制御機構68を備える。
シート部を形成する支持体としては、ポリエチレンテレフタレート(PET)シート(175μm)をクラウドリムーバー(Victor jvc社)を用いて、以下条件(使用ガス:O2、ガス圧:13Pa、高周波(RF)電力:100W、照射時間:3分、O2流量:SV250、目標真空度(CCG):2.0×10-4Pa)にて親水化プラズマ処理したものを用いる。処理を施したPET上に、シート部を形成する溶液を、表裏面を75μmの膜厚で塗布した。一方で、日本脳炎ワクチンを含む溶液を充填したモールドを吸引台に吸引固定した。シート部を形成する溶液を塗布したPETの表面側を、モールド表面を向かい合わせに配置し、更にPETとモールド間の空隙、また、PETのモールドと反対側の空間を2分間減圧した。減圧後、PETのモールドと反対側の空間のみ大気圧開放することで、シート部を形成する溶液を塗布したPETと、モールドを貼り合せた。10分間接触状態を維持した後、PETとモールドが貼り合わさって一体となったものを23℃、45%(相対湿度)の環境下で乾燥させた。
乾燥固化したマイクロニードルアレイをモールドから慎重に剥離することで、日本脳炎ワクチンを内包したマイクロニードルアレイが形成された。本マイクロニードルは、錘台部と針部から構成されており、針状凸部の長さLが約800μm、基底部の幅:約350μm、錘台部が、高さ約190μm、上底面直径約350μm、下底面直径約700μmの円錐台構造であり、針本数109本、針の間隔約1mmで配置されている。
日本脳炎ワクチンを含む水溶液およびシート部を形成する溶液の組成を表1に示す通りに変更したこと以外は、実施例1と同様にしてマイクロニードルを製造した。
表1における日本脳炎ワクチン含量および電気的に中性である界面活性剤の量は、マイクロニードルアレイ1枚当たりの量である。マイクロニードルアレイ1枚の面積は、1cm2である。なお、実施例5において、DEX/CSの比率(質量比)は70/30で作成した。
溶解液(Tween(登録商標)20を0.1%、牛血清アルブミンを0.5%含有するリン酸緩衝液)1mLでマイクロニードルアレイを丸ごと溶解し、ELISA(Enzyme-Linked ImmunoSorbent Assay)でワクチン活性を評価した。予想含量を(充填液中の日本脳炎ワクチン濃度(μg/mL)×モールドへの充填重量(mg))から算出した。上記の評価の結果を表1に示す。ELISAで検出されたワクチン含量が予想含量の80%以上をA、80%未満をBとした。
2 マイクロニードルアレイ
110 マイクロニードル
112 針部
112A 針部第1層
112B 針部第2層
113 錐台部
116 シート部
120 日本脳炎ワクチンを含む層
122 日本脳炎ワクチンを含まない層
W 直径(幅)
H 高さ
T 高さ(厚み)
11 原版
12 形状部
13 モールド
15 針状凹部
15A 入口部
15B 先端凹部
15C 空気抜き孔
D 径(直径)
18 モールド複合体
19 気体透過シート
20 基台
22 日本脳炎ワクチンを含む溶液
24 電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む溶液
29 支持体
30 タンク
32 配管
34 ノズル
34A リップ部
34B 開口部
36 液供給装置
P1 加圧力
P2 押付け力
P3 押付け力
40 基材
50 円錐台
52 円錐
D1 直径
D2 直径
L10 ピッチ
H1 高さ
H2 高さ
61 X軸駆動部
62 Z軸駆動部
63 ノズル
64 液供給装置
65 吸引台
66 レーザー変位計
67 ロードセル
68 制御機構
69 モールド
Claims (9)
- シート部と、シート部の上面に存在する複数の針部とを有するマイクロニードルアレイであって、針部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種、日本脳炎ワクチン、および電気的に中性である界面活性剤を含み、シート部は、電気的に中性である水溶性高分子および二糖類のうちの少なくとも一種を含む、マイクロニードルアレイ。
- 電気的に中性である界面活性剤が、ソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、ポリオキシエチレン/ポリオキシプロピレン共重合ポリマー、ポリオキシエチレン硬化ヒマシ油、またはオクチルフェノールエトキシレートである、請求項1に記載のマイクロニードルアレイ。
- 針部に含まれる電気的に中性である水溶性高分子の重量平均分子量が5000以上100,000以下である、請求項1または2に記載のマイクロニードルアレイ。
- 針部に含まれる水溶性高分子が多糖類である、請求項1から3の何れか一項に記載のマイクロニードルアレイ。
- 針部に含まれる水溶性高分子がヒドロキシエチルデンプンである、請求項1から4のいずれか一項に記載のマイクロニードルアレイ。
- シート部に含まれる電気的に中性である水溶性高分子の重量平均分子量が5000以上100,000以下である、請求項1から5の何れか一項に記載のマイクロニードルアレイ。
- シート部に含まれる水溶性高分子が多糖類である、請求項1から6の何れか一項に記載のマイクロニードルアレイ。
- シート部に含まれる水溶性高分子がヒドロキシエチルデンプンである、請求項1から7のいずれか一項に記載のマイクロニードルアレイ。
- 針部に含まれる二糖類が、スクロースである、請求項1から8のいずれか一項に記載のマイクロニードルアレイ。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018098810 | 2018-05-23 | ||
| JP2018098810 | 2018-05-23 | ||
| PCT/JP2019/020284 WO2019225650A1 (ja) | 2018-05-23 | 2019-05-22 | 日本脳炎ワクチン含有マイクロニードルアレイ |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2019225650A1 JPWO2019225650A1 (ja) | 2021-07-08 |
| JP6997866B2 true JP6997866B2 (ja) | 2022-01-18 |
Family
ID=68617003
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020521280A Active JP6997866B2 (ja) | 2018-05-23 | 2019-05-22 | 日本脳炎ワクチン含有マイクロニードルアレイ |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20210121674A1 (ja) |
| EP (1) | EP3797820B1 (ja) |
| JP (1) | JP6997866B2 (ja) |
| KR (1) | KR102526228B1 (ja) |
| TW (1) | TWI820135B (ja) |
| WO (1) | WO2019225650A1 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI724837B (zh) * | 2020-03-25 | 2021-04-11 | 映通股份有限公司 | 用以形成微針產品之模具結構 |
| TW202216189A (zh) * | 2020-07-17 | 2022-05-01 | 日商富士軟片股份有限公司 | 日本腦炎預防劑及日本腦炎疫苗劑 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010074239A1 (ja) | 2008-12-26 | 2010-07-01 | 久光製薬株式会社 | マイクロニードルデバイス |
| US20130287832A1 (en) | 2010-08-20 | 2013-10-31 | Theraject ,Inc. | Soluble needle arrays for delivery of influenza vaccines |
| JP2016175813A (ja) | 2015-03-20 | 2016-10-06 | アウレアワークス株式会社 | レーザ光分割装置を有する単結晶育成装置 |
| JP2017095427A (ja) | 2015-11-27 | 2017-06-01 | ライオン株式会社 | 溶解型マイクロニードル製剤 |
| WO2017179614A1 (ja) | 2016-04-15 | 2017-10-19 | 富士フイルム株式会社 | マイクロニードルアレイ |
| WO2018047596A1 (ja) | 2016-09-06 | 2018-03-15 | 富士フイルム株式会社 | マイクロニードルアレイ撮像装置及び方法、並びに、マイクロニードルアレイ検査装置及び方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5538897B2 (ja) | 1972-09-29 | 1980-10-07 | ||
| US5374243A (en) * | 1993-07-06 | 1994-12-20 | Alpha Therapeutic Corporation | Oxygen permeable bag containing oxygen-transporting perfluorochemical for providing oxygen internally to mammals |
| WO2006089056A2 (en) | 2005-02-16 | 2006-08-24 | Alza Corporation | Apparatus and method for transdermal delivery of erythropoetin-based agents |
| WO2008139648A1 (ja) * | 2007-05-15 | 2008-11-20 | Hisamitsu Pharmaceutical Co., Inc. | マイクロニードルのコーティング方法 |
| JP2013153866A (ja) | 2012-01-27 | 2013-08-15 | Fujifilm Corp | 経皮吸収シート及び経皮吸収シートの製造方法 |
| JP6038173B2 (ja) | 2012-11-13 | 2016-12-07 | 富士フイルム株式会社 | 経皮吸収シートの製造方法 |
| JP2016512754A (ja) | 2013-03-15 | 2016-05-09 | コリウム インターナショナル, インコーポレイテッド | 治療剤の送達のためのマイクロアレイ、使用方法および製造方法 |
| WO2015073919A1 (en) * | 2013-11-14 | 2015-05-21 | University Medical Pharmaceuticals Corporation | Microneedles for therapeutic agent delivery with improved mechanical properties |
| WO2015093452A1 (ja) * | 2013-12-16 | 2015-06-25 | 武田薬品工業株式会社 | マイクロニードル |
| KR102497984B1 (ko) * | 2015-03-19 | 2023-02-09 | 라이온 가부시키가이샤 | 마이크로 니들 제제 및 마이크로 니들 제제의 제조 방법 |
| JP6652352B2 (ja) * | 2015-09-04 | 2020-02-19 | 久光製薬株式会社 | マイクロニードルデバイスの製造方法 |
| WO2017179615A1 (ja) * | 2016-04-15 | 2017-10-19 | 富士フイルム株式会社 | マイクロニードルアレイ及びマイクロニードルアレイの製造方法 |
-
2019
- 2019-05-22 JP JP2020521280A patent/JP6997866B2/ja active Active
- 2019-05-22 EP EP19807065.8A patent/EP3797820B1/en active Active
- 2019-05-22 WO PCT/JP2019/020284 patent/WO2019225650A1/ja unknown
- 2019-05-22 KR KR1020207033374A patent/KR102526228B1/ko active IP Right Grant
- 2019-05-23 TW TW108117831A patent/TWI820135B/zh active
-
2020
- 2020-11-20 US US17/100,495 patent/US20210121674A1/en active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010074239A1 (ja) | 2008-12-26 | 2010-07-01 | 久光製薬株式会社 | マイクロニードルデバイス |
| US20130287832A1 (en) | 2010-08-20 | 2013-10-31 | Theraject ,Inc. | Soluble needle arrays for delivery of influenza vaccines |
| JP2016175813A (ja) | 2015-03-20 | 2016-10-06 | アウレアワークス株式会社 | レーザ光分割装置を有する単結晶育成装置 |
| JP2017095427A (ja) | 2015-11-27 | 2017-06-01 | ライオン株式会社 | 溶解型マイクロニードル製剤 |
| WO2017179614A1 (ja) | 2016-04-15 | 2017-10-19 | 富士フイルム株式会社 | マイクロニードルアレイ |
| WO2018047596A1 (ja) | 2016-09-06 | 2018-03-15 | 富士フイルム株式会社 | マイクロニードルアレイ撮像装置及び方法、並びに、マイクロニードルアレイ検査装置及び方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019225650A1 (ja) | 2019-11-28 |
| KR102526228B1 (ko) | 2023-04-26 |
| EP3797820B1 (en) | 2024-07-03 |
| US20210121674A1 (en) | 2021-04-29 |
| EP3797820A1 (en) | 2021-03-31 |
| EP3797820A4 (en) | 2021-09-15 |
| TWI820135B (zh) | 2023-11-01 |
| KR20210002582A (ko) | 2021-01-08 |
| JPWO2019225650A1 (ja) | 2021-07-08 |
| TW202003029A (zh) | 2020-01-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6736337B2 (ja) | マイクロニードルアレイ | |
| JP6285277B2 (ja) | 経皮吸収シートおよび経皮吸収シートの製造方法 | |
| JP6207459B2 (ja) | 経皮吸収シートの製造方法 | |
| KR20180038512A (ko) | 마이크로니들 어레이 | |
| JP2016030072A (ja) | マイクロニードルアレイ | |
| JP2020199290A (ja) | マイクロニードルアレイ | |
| JP6997866B2 (ja) | 日本脳炎ワクチン含有マイクロニードルアレイ | |
| US20200376247A1 (en) | Method of producing microneedle array | |
| JP2016067681A (ja) | マイクロニードルアレイ | |
| US20210378951A1 (en) | Microneedle array and method of producing microneedle array | |
| WO2017179615A1 (ja) | マイクロニードルアレイ及びマイクロニードルアレイの製造方法 | |
| JP7176100B2 (ja) | インフルエンザワクチンを含有するマイクロニードルアレイ及びマイクロニードルアレイの製造方法 | |
| JP6778296B2 (ja) | マイクロニードルアレイ | |
| WO2022014695A1 (ja) | 日本脳炎予防剤及び日本脳炎ワクチン剤 | |
| JP7205041B2 (ja) | ポリオワクチン内包マイクロニードルアレイ | |
| WO2017179613A1 (ja) | マイクロニードルアレイの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201117 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20201118 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210907 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211027 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211214 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211217 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6997866 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |