JP6647514B2 - Organic light emitting device and light emitting material and compound used therefor - Google Patents
Organic light emitting device and light emitting material and compound used therefor Download PDFInfo
- Publication number
- JP6647514B2 JP6647514B2 JP2015238066A JP2015238066A JP6647514B2 JP 6647514 B2 JP6647514 B2 JP 6647514B2 JP 2015238066 A JP2015238066 A JP 2015238066A JP 2015238066 A JP2015238066 A JP 2015238066A JP 6647514 B2 JP6647514 B2 JP 6647514B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- substituted
- cyano group
- general formula
- light emitting
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 *c(c(C#N)c1)cc(c(cc2*)c3cc2C#N)c1[n]3-c(c(-[n]1c2cc(C#N)c(*)cc2c(cc2*)c1cc2C#N)c1)cc(C#N)c1C#N Chemical compound *c(c(C#N)c1)cc(c(cc2*)c3cc2C#N)c1[n]3-c(c(-[n]1c2cc(C#N)c(*)cc2c(cc2*)c1cc2C#N)c1)cc(C#N)c1C#N 0.000 description 5
- WFFJQBODDDNVCN-UHFFFAOYSA-N Cc(c(C#N)c1)cc(c(cc2C)c3cc2C#N)c1[n]3-c(c(-[n]1c2cc(C#N)c(C)cc2c(cc2C)c1cc2C#N)c1)cc(C#N)c1C#N Chemical compound Cc(c(C#N)c1)cc(c(cc2C)c3cc2C#N)c1[n]3-c(c(-[n]1c2cc(C#N)c(C)cc2c(cc2C)c1cc2C#N)c1)cc(C#N)c1C#N WFFJQBODDDNVCN-UHFFFAOYSA-N 0.000 description 1
- RNVXNIRJGAAKOC-UHFFFAOYSA-N N#Cc(c(-c1ccccc1)c1)cc([n](c2c3)-c(cc(c(C#N)c4)C#N)c4-[n](c(c(c4c5)c6)cc(C#N)c6-c6ccccc6)c4cc(C#N)c5-c4ccccc4)c1c2cc(-c1ccccc1)c3C#N Chemical compound N#Cc(c(-c1ccccc1)c1)cc([n](c2c3)-c(cc(c(C#N)c4)C#N)c4-[n](c(c(c4c5)c6)cc(C#N)c6-c6ccccc6)c4cc(C#N)c5-c4ccccc4)c1c2cc(-c1ccccc1)c3C#N RNVXNIRJGAAKOC-UHFFFAOYSA-N 0.000 description 1
- NIQURRNGNXQFKO-UHFFFAOYSA-N N#Cc(cc1)cc2c1c(ccc(C#N)c1)c1[n]2-c(c(-[n]1c(cc(cc2)C#N)c2c(cc2)c1cc2C#N)c1)cc(C#N)c1C#N Chemical compound N#Cc(cc1)cc2c1c(ccc(C#N)c1)c1[n]2-c(c(-[n]1c(cc(cc2)C#N)c2c(cc2)c1cc2C#N)c1)cc(C#N)c1C#N NIQURRNGNXQFKO-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Electroluminescent Light Sources (AREA)
- Indole Compounds (AREA)
Description
本発明は、発光効率及び耐候性が高い有機発光素子に関する。また、その有機発光素子に用いる発光材料と化合物にも関する。 The present invention relates to an organic light emitting device having high luminous efficiency and high weather resistance. The present invention also relates to a light emitting material and a compound used for the organic light emitting device.
有機エレクトロルミネッセンス素子(有機EL素子)などの有機発光素子の発光効率を高める研究が盛んに行われている。特に、有機エレクトロルミネッセンス素子を構成する電子輸送材料、正孔輸送材料、発光材料などを新たに開発して組み合わせることにより、発光効率を高める工夫が種々なされてきている。その中には、カルバゾール構造を有するシアノベンゼン誘導体を利用した有機エレクトロルミネッセンス素子に関する研究も見受けられる。 Research for increasing the luminous efficiency of organic light-emitting devices such as organic electroluminescence devices (organic EL devices) has been actively conducted. In particular, various measures have been taken to increase the luminous efficiency by newly developing and combining an electron transporting material, a hole transporting material, a light emitting material, and the like that constitute the organic electroluminescence element. Among them, researches on organic electroluminescence devices using cyanobenzene derivatives having a carbazole structure are also found.
例えば、特許文献1には、下記一般式(3)で表されるシアノベンゼン誘導体を有機発光素子の発光材料として用いることが記載されている。ここでは、一般式(3)において、R81〜R85の1つはシアノ基であり、R81〜R85の2つは置換もしくは無置換の9−カルバゾリル基であり、その他の2つは水素原子を表すことが規定されている。また、同文献には、一般式(3)における9−カルバゾリル基や、これと並列的に記載された置換基(1,2,3,4−テトラヒドロー9−カルバゾリル基、1-インドリル基、ジアリールアミノ基)に置換しうる置換基の一例としてシアノ基が挙げられている。
For example,
上記のように、特許文献1には、カルバゾリル基を有するシアノベンゼン誘導体を有機エレクトロルミネッセンス素子の発光材料に応用することが提案されており、そのカルバゾリル基等に置換しうる置換基の一例としてシアノ基が挙げられている。しかしながら、同文献には、このシアノベンゼン誘導体のカルバゾリル基に実際にシアノ基を導入して化合物を製造したことや、その有用性を評価した結果は記載されていない。
例えば特開平7−26265号公報の段落[0021]、[0035]にも記載されているように、化合物の分子内にシアノ基を導入すると一般に耐光性が低下することがよく知られている。このため、シアノ基を分子内に導入する場合は、そのシアノ基の数を極力抑えて分子設計を行うのが通常である。特に、屋外での使用も想定される有機エレクトロルミネッセンス素子材料へのシアノ基の導入には消極的にならざるを得ない。したがって、すでに分子内に1つのシアノ基が存在することが必須とされている特許文献1の化合物において、さらに2つ目以降のシアノ基を分子内に導入することは回避しようとするのが一般的である。
As described above,
For example, as described in paragraphs [0021] and [0035] of JP-A-7-26265, it is well known that light resistance generally decreases when a cyano group is introduced into a compound molecule. Therefore, when a cyano group is introduced into a molecule, it is usual to design the molecule while minimizing the number of the cyano group. In particular, the introduction of a cyano group into an organic electroluminescent device material which is expected to be used outdoors has to be reluctant. Therefore, in the compound of
一方、本発明者らが検討したところ、特許文献1に記載の化合物は、HOMO準位とLUMO準位をさらに下げることができれば一段と有用であることが判明した。HOMO準位とLUMO準位が下がれば酸化され難くなることから、特に発光材料のLUMO準位が下がると、その発光過程で生成するラジカル種や励起子の水や酸素との反応による劣化が抑制されることが期待される。また、LUMO準位とともにHOMO準位が下がることにより、HOMO−LUMOギャップが狭くなることによる発光の長波長化が抑えられ、発光波長の短波長化を考慮しつつ耐酸化性を付与する場合に有利になる。このため、HOMO準位とLUMO準位をともに下げることにより、より有用な発光材料が実現することが期待される。しかしながら、特許文献1には、さらにHOMO準位とLUMO準位を下げる方策に関する記載はない。
本発明者らはこれらの先行技術の課題を考慮して、カルバゾリル基を有するシアノベンゼン誘導体について、HOMO準位とLUMO準位を下げつつ、耐光性を維持することを目的として検討を進めた。また、こうした特性を備え、且つ、発光材料として有用な化合物の一般式を導きだし、さらに、発光効率及び耐候性が高い有機発光素子の構成を一般化することも目的として鋭意検討を進めた。
On the other hand, the present inventors have studied and found that the compound described in
The present inventors have studied the cyanobenzene derivative having a carbazolyl group in view of these prior art problems with the aim of maintaining light fastness while lowering the HOMO level and the LUMO level. Further, the present inventors have conducted intensive studies for the purpose of deriving a general formula of a compound having such characteristics and being useful as a light emitting material, and further generalizing a configuration of an organic light emitting device having high luminous efficiency and high weather resistance.
上記の目的を達成するために鋭意検討を進めた結果、本発明者らは、カルバゾリル基を有するシアノベンゼン誘導体において、そのカルバゾリル基の2位及び7位の少なくとも一方をシアノ基で置換すると、カルバゾリル基をシアノ基で置換していないシアノベンゼン誘導体と同等の耐光性を維持したまま、HOMO準位とLUMO準位がともに下がることを見出した。そして、このように特定の位置がシアノ基で置換されたカルバゾリル基を有するシアノベンゼン誘導体が有機エレクトロルミネッセンス素子の発光材料として極めて有用であることを明らかにした。さらに、このシアノベンゼン誘導体の中に、遅延蛍光材料として有用な化合物があることを見出し、発光効率及び耐候性が高い有機発光素子を安価に提供しうることを明らかにした。本発明者らは、これらの知見に基づいて、上記の課題を解決する手段として、以下の本発明を提供するに至った。
[1] 下記一般式(1)で表される化合物を含有する発光材料。
[2] 前記2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基は、2位及び7位の両方がシアノ基で置換されていることを特徴とする[1]に記載の発光材料。
[3] 前記一般式(1)のR1がシアノ基であることを特徴とする[1]または[2]に記載の発光材料。
[4] 前記一般式(1)のR2とR3またはR3とR4が、前記2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基であることを特徴とする[1]〜[3]のいずれか1項に記載の発光材料。
[5] 前記一般式(1)のR2がシアノ基であり、R1、R3〜R5が前記2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基であることを特徴とする[1]に記載の発光材料。
[6] 前記2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基が、下記一般式(11)で表される構造を有することを特徴とする[1]に記載の発光材料。
[7] 前記一般式(11)のR27がシアノ基であることを特徴とする[6]に記載の発光材料。
[8] 前記一般式(11)のR21、R23〜R26、R28の少なくとも1つが置換もしくは無置換のカルバゾリル基であることを特徴とする[6]または[7]に記載の発光材料。
[9] 前記一般式(11)のR23が置換もしくは無置換のカルバゾリル基であることを特徴とする[8]に記載の発光材料。
[10] 前記一般式(11)のR23及びR26が置換もしくは無置換のカルバゾリル基であることを特徴とする[8]に記載の発光材料。
[11] 前記カルバゾリル基がシアノ基で置換されていることを特徴とする[8]〜[10]のいずれか1項に記載の発光材料。
[12] 一般式(1)で表される化合物の分子内に存在するカルバゾール環の数が4つ以下であることを特徴とする[1]〜[11]のいずれか1項に記載の発光材料。
As a result of intensive studies to achieve the above object, the present inventors have found that in a cyanobenzene derivative having a carbazolyl group, when at least one of the 2- and 7-positions of the carbazolyl group is substituted with a cyano group, a carbazolyl group is obtained. It has been found that both the HOMO level and the LUMO level decrease while maintaining the same light resistance as a cyanobenzene derivative in which the group is not substituted with a cyano group. And, it has been clarified that such a cyanobenzene derivative having a carbazolyl group in which a specific position is substituted with a cyano group is extremely useful as a light emitting material for an organic electroluminescence device. Furthermore, they found that among these cyanobenzene derivatives, there was a compound useful as a delayed fluorescent material, and clarified that an organic light-emitting device having high luminous efficiency and high weather resistance could be provided at low cost. Based on these findings, the present inventors have provided the following present invention as means for solving the above-mentioned problems.
[1] A luminescent material containing a compound represented by the following general formula (1).
[2] The luminescence according to [1], wherein the carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group has both the 2-position and the 7-position substituted with a cyano group. material.
[3] The luminescent material according to [1] or [2], wherein R 1 in the general formula (1) is a cyano group.
[4] In the general formula (1), R 2 and R 3 or R 3 and R 4 are a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group. ] The luminescent material according to any one of [3] to [3].
[5] R 2 in the general formula (1) is a cyano group, and R 1 and R 3 to R 5 are carbazolyl groups in which at least one of the 2-position and the 7-position is substituted with a cyano group. The luminescent material according to [1].
[6] The luminescent material according to [1], wherein the carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group has a structure represented by the following general formula (11).
[7] The luminescent material according to [6], wherein R 27 in the general formula (11) is a cyano group.
[8] The emission according to [6] or [7], wherein at least one of R 21 , R 23 to R 26 , and R 28 in the general formula (11) is a substituted or unsubstituted carbazolyl group. material.
[9] The luminescent material according to [8], wherein R 23 in the general formula (11) is a substituted or unsubstituted carbazolyl group.
[10] The light emitting material according to [8], wherein R 23 and R 26 in the general formula (11) are a substituted or unsubstituted carbazolyl group.
[11] The light emitting material according to any one of [8] to [10], wherein the carbazolyl group is substituted with a cyano group.
[12] The luminescence according to any one of [1] to [11], wherein the number of carbazole rings present in the molecule of the compound represented by the general formula (1) is four or less. material.
[13] 上記一般式(1)で表される化合物。
[14] [1]〜[12]のいずれか1項に記載の発光材料を含む発光層を基板上に有することを特徴とする有機発光素子。
[15] 遅延蛍光を放射することを特徴とする[14]に記載の有機発光素子。
[16] 有機エレクトロルミネッセンス素子であることを特徴とする[14]または[15]に記載の有機発光素子。
[17] 上記一般式(1)で表される構造を有する遅延蛍光体。
[13] A compound represented by the general formula (1).
[14] An organic light emitting device having a light emitting layer containing the light emitting material according to any one of [1] to [12] on a substrate.
[15] The organic light-emitting device according to [14], which emits delayed fluorescence.
[16] The organic light-emitting device according to [14] or [15], which is an organic electroluminescence device.
[17] A delayed phosphor having a structure represented by the general formula (1).
本発明の化合物は、良好な発光特性を有するとともに、HOMO準位とLUMO準位がともに深く、且つ、高い耐光性と高い耐熱性を有する。このため、本発明の化合物は、発光材料として極めて有用であり、有機発光素子の発光材料として用いることにより、発光特性および耐候性に優れた有機発光素子を実現することができる。また、本発明の化合物は、遅延蛍光を放射することができるため、遅延蛍光体として用いることができる。本発明の化合物からなる遅延蛍光体を有機発光素子に用いることにより、発光特性および耐候性に優れるとともに、発光効率が極めて高い有機発光素子を実現することができる。 The compound of the present invention has good light-emitting properties, a deep HOMO level and a deep LUMO level, and high light resistance and high heat resistance. Therefore, the compound of the present invention is extremely useful as a light emitting material, and by using it as a light emitting material of an organic light emitting device, an organic light emitting device having excellent light emitting characteristics and weather resistance can be realized. Further, since the compound of the present invention can emit delayed fluorescence, it can be used as a delayed fluorescent substance. By using a delayed fluorescent substance comprising the compound of the present invention in an organic light emitting device, it is possible to realize an organic light emitting device having excellent light emitting characteristics and weather resistance and extremely high luminous efficiency.
以下において、本発明の内容について詳細に説明する。以下に記載する構成要件の説明は、本発明の代表的な実施態様や具体例に基づいてなされることがあるが、本発明はそのような実施態様や具体例に限定されるものではない。なお、本明細書において「〜」を用いて表される数値範囲は、「〜」の前後に記載される数値を下限値および上限値として含む範囲を意味する。 Hereinafter, the contents of the present invention will be described in detail. The description of the components described below may be made based on typical embodiments and specific examples of the present invention, but the present invention is not limited to such embodiments and specific examples. In this specification, a numerical range represented by using “to” means a range including numerical values described before and after “to” as a lower limit and an upper limit.
[一般式(1)で表される化合物]
本発明の発光材料は、下記一般式(1)で表される化合物を含有することを特徴とする。また、本発明の有機発光素子は、下記一般式(1)で表される化合物を発光層の発光材料として含むことを特徴とする。そこで、一般式(1)で表される化合物について、まず説明する。
[Compound represented by Formula (1)]
The luminescent material of the present invention is characterized by containing a compound represented by the following general formula (1). Further, the organic light emitting device of the present invention is characterized in that a compound represented by the following general formula (1) is contained as a light emitting material of a light emitting layer. Therefore, the compound represented by the general formula (1) will be described first.
一般式(1)において、R1〜R5の少なくとも1つはシアノ基を表す。いずれか1つがシアノ基である場合は、R1〜R3のいずれであってもよい。いずれか2つがシアノ基である場合は、R1とR3の組み合わせや、R2とR4の組み合わせを例示することができる。いずれか3つがシアノ基である場合は、R1とR3とR4の組み合わせを例示することができる。これらの中で、好ましいのは、R1またはR2がシアノ基である場合であり、R1がシアノ基であることがより好ましい。 In the general formula (1), at least one of R 1 to R 5 represents a cyano group. When any one is a cyano group, it may be any of R 1 to R 3 . When any two are a cyano group, a combination of R 1 and R 3 or a combination of R 2 and R 4 can be exemplified. When any three are cyano groups, examples of combinations of R 1 , R 3, and R 4 can be given. Among these, a case where R 1 or R 2 is a cyano group is preferable, and a case where R 1 is a cyano group is more preferable.
一般式(1)において、R1〜R5の少なくとも1つは2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基(ただし、2位がシアノ基で置換されている場合は3位が無置換であるかシアノ基以外の置換基で置換されており、また、7位がシアノ基で置換されている場合は6位が無置換であるかシアノ基以外の置換基で置換されている)を表す。R1〜R5の2つ以上が、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基を表すとき、それらは同一であっても異なっていてもよいが、同一であることがより好ましい。 In the general formula (1), at least one of R 1 to R 5 is a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group (however, when the 2-position is substituted with a cyano group, 3 Position is unsubstituted or substituted with a substituent other than a cyano group, and when the 7-position is substituted with a cyano group, the 6-position is unsubstituted or substituted with a substituent other than a cyano group. Represents). When two or more of R 1 to R 5 represent a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, they may be the same or different, but must be the same. Is more preferred.
2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基は、その窒素原子または炭素原子で一般式(1)におけるベンゼン環に結合する。カルバゾリル基におけるベンゼン環への結合部位は、シアノ基で置換される2位及び7位の少なくとも一方を除いて、1〜9位のいずれの部位であってもよいが、9位の窒素原子であることが好ましい。
2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基は、2位及び7位のうち、いずれか一方のみがシアノ基で置換されていてもよいし、2位及び7位の両方がシアノ基で置換されていてもよいが、2位及び7位の両方がシアノ基で置換されていることが好ましい。
カルバゾリル基の1〜9位のうち、上記のベンゼン環への結合部位と、シアノ基で置換される2位及び7位の少なくとも一方を除いた残りの部位は、無置換であっても置換基で置換されていてもよい。置換基の好ましい範囲と具体例については、下記の一般式(11)におけるR21、R23〜R28がとりうる置換基の好ましい範囲と具体例、下記一般式(11)におけるR21、R23〜R26、R28の少なくとも1つが表すカルバゾリル基、シアノ基で置換されたカルバゾリル基の説明を参照することができる。
The carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group is bonded to the benzene ring in the general formula (1) at its nitrogen atom or carbon atom. The binding site to the benzene ring in the carbazolyl group may be any of the 1 to 9 positions except for at least one of the 2 and 7 positions substituted with a cyano group, Preferably, there is.
In the carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, only one of the 2- and 7-positions may be substituted with a cyano group, or both the 2- and 7-positions may be substituted. May be substituted with a cyano group, but it is preferred that both the 2-position and the 7-position are substituted with a cyano group.
Of the carbazolyl group's 1 to 9 positions, the above-mentioned binding site to the benzene ring and the remaining site except at least one of the 2- and 7-positions substituted with a cyano group are substituted even if they are unsubstituted. May be substituted. Regarding the preferred range and specific examples of the substituent, preferred ranges and specific examples of the substituent which R 21 and R 23 to R 28 in the following general formula (11) can take, and R 21 and R in the following general formula (11) 23 to R 26, at least one carbazolyl group representing the R 28, reference can be made to the descriptions of substituted carbazolyl group with a cyano group.
2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基は、例えば下記一般式(11)で表される構造を有するものであることが好ましい。 The carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group preferably has, for example, a structure represented by the following general formula (11).
一般式(11)において、R21、R23〜R28は、各々独立に水素原子または置換基を表し、R22はシアノ基を表す。
R21、R23〜R28の中に置換基を有するとき、いずれが置換基であってもよく、置換基の数も特に制限されない。例えば、R21、R23〜R28の中の置換基の数は0〜5個が好ましく、0〜3個がより好ましく、例えば0〜1個とすることも好ましい。R21、R23〜R28の中の2つ以上が置換基であるとき、その2つ以上の置換基は互いに同一であっても異なっていてもよいが、同一であることが好ましい。また、R21、R23〜R28の中に置換基を有する場合、R23〜R27の少なくとも1つが置換基であることが好ましい。例えば、R27が置換基である場合、R23とR26が置換基である場合、R24とR25が置換基である場合を好ましく例示することができる。
In the general formula (11), R 21 and R 23 to R 28 each independently represent a hydrogen atom or a substituent, and R 22 represents a cyano group.
When R 21 and R 23 to R 28 have a substituent, any may be a substituent and the number of substituents is not particularly limited. For example, the number of substituents in R 21 , R 23 to R 28 is preferably 0 to 5, more preferably 0 to 3, for example, 0 to 1 is also preferable. When two or more of R 21 and R 23 to R 28 are substituents, the two or more substituents may be the same or different, but are preferably the same. When R 21 and R 23 to R 28 have a substituent, at least one of R 23 to R 27 is preferably a substituent. For example, preferably, R 27 is a substituent, R 23 and R 26 are substituents, and R 24 and R 25 are substituents.
一般式(11)のR21、R23〜R28がとりうる置換基として、例えばヒドロキシ基、ハロゲン原子、シアノ基、炭素数1〜20のアルキル基、炭素数1〜20のアルコキシ基、炭素数1〜20のアルキルチオ基、炭素数1〜20のアルキル置換アミノ基、炭素数2〜20のアシル基、炭素数6〜40のアリール基、炭素数3〜40のヘテロアリール基、炭素数12〜40のジアリールアミノ基、炭素数12〜40の置換もしくは無置換のカルバゾリル基、炭素数2〜10のアルケニル基、炭素数2〜10のアルキニル基、炭素数2〜10のアルコキシカルボニル基、炭素数1〜10のアルキルスルホニル基、炭素数1〜10のハロアルキル基、アミド基、炭素数2〜10のアルキルアミド基、炭素数3〜20のトリアルキルシリル基、炭素数4〜20のトリアルキルシリルアルキル基、炭素数5〜20のトリアルキルシリルアルケニル基、炭素数5〜20のトリアルキルシリルアルキニル基およびニトロ基等が挙げられる。これらの具体例のうち、さらに置換基により置換可能なものは置換されていてもよい。より好ましい置換基は、ハロゲン原子、シアノ基、炭素数1〜20の置換もしくは無置換のアルキル基、炭素数1〜20のアルコキシ基、炭素数6〜40の置換もしくは無置換のアリール基、炭素数3〜40の置換もしくは無置換のヘテロアリール基、炭素数12〜40の置換もしくは無置換のジアリールアミノ基、炭素数12〜40の置換もしくは無置換のカルバゾリル基である。さらに好ましい置換基は、フッ素原子、塩素原子、シアノ基、炭素数1〜10の置換もしくは無置換のアルキル基、炭素数1〜10の置換もしくは無置換のアルコキシ基、炭素数1〜10の置換もしくは無置換のジアルキルアミノ基、炭素数6〜15の置換もしくは無置換のアリール基、炭素数3〜12の置換もしくは無置換のヘテロアリール基である。
中でも、一般式(11)のR23およびR26は置換基であることが好ましく、炭素数1〜20のアルキル基、炭素数6〜40のアリール基であることがより好ましく、炭素数1〜10のアルキル基、炭素数6〜15のアリール基であることがさらに好ましい。R23およびR26が置換基であれば、酸化を受けにくくなり、2量化を抑制することができるため、安定性の面で好ましい。
Examples of the substituent that R 21 and R 23 to R 28 in the general formula (11) can have include, for example, a hydroxy group, a halogen atom, a cyano group, an alkyl group having 1 to 20 carbon atoms, an alkoxy group having 1 to 20 carbon atoms, and a carbon atom. An alkylthio group having 1 to 20 carbon atoms, an alkyl-substituted amino group having 1 to 20 carbon atoms, an acyl group having 2 to 20 carbon atoms, an aryl group having 6 to 40 carbon atoms, a heteroaryl group having 3 to 40 carbon atoms, and 12 carbon atoms -40 diarylamino group, a substituted or unsubstituted carbazolyl group having 12 to 40 carbon atoms, an alkenyl group having 2 to 10 carbon atoms, an alkynyl group having 2 to 10 carbon atoms, an alkoxycarbonyl group having 2 to 10 carbon atoms, carbon An alkylsulfonyl group having 1 to 10 carbon atoms, a haloalkyl group having 1 to 10 carbon atoms, an amide group, an alkylamide group having 2 to 10 carbon atoms, a trialkylsilyl group having 3 to 20 carbon atoms, 4-20 trialkylsilyl group, the trialkylsilyl alkenyl group having 5 to 20 carbon atoms and an trialkylsilyl alkynyl group and a nitro group having 5 to 20 carbon atoms. Among these specific examples, those that can be further substituted by a substituent may be substituted. More preferred substituents include a halogen atom, a cyano group, a substituted or unsubstituted alkyl group having 1 to 20 carbon atoms, an alkoxy group having 1 to 20 carbon atoms, a substituted or unsubstituted aryl group having 6 to 40 carbon atoms, A substituted or unsubstituted heteroaryl group having 3 to 40 carbon atoms; a substituted or unsubstituted diarylamino group having 12 to 40 carbon atoms; and a substituted or unsubstituted carbazolyl group having 12 to 40 carbon atoms. More preferred substituents are a fluorine atom, a chlorine atom, a cyano group, a substituted or unsubstituted alkyl group having 1 to 10 carbon atoms, a substituted or unsubstituted alkoxy group having 1 to 10 carbon atoms, and a substituted or unsubstituted alkoxy group having 1 to 10 carbon atoms. Or an unsubstituted dialkylamino group, a substituted or unsubstituted aryl group having 6 to 15 carbon atoms, or a substituted or unsubstituted heteroaryl group having 3 to 12 carbon atoms.
Among them, R 23 and R 26 in the general formula (11) are preferably a substituent, more preferably an alkyl group having 1 to 20 carbon atoms, and an aryl group having 6 to 40 carbon atoms, and more preferably 1 to 2 carbon atoms. More preferably, it is an alkyl group having 10 or an aryl group having 6 to 15 carbon atoms. If R 23 and R 26 are substituents, they are less susceptible to oxidation and can suppress dimerization, which is preferable in terms of stability.
本明細書でいうアルキル基は、直鎖状、分枝状、環状のいずれであってもよく、より好ましくは炭素数1〜6であり、具体例としてメチル基、エチル基、プロピル基、ブチル基、t−ブチル基、ペンチル基、ヘキシル基、イソプロピル基を挙げることができる。アリール基は、単環でも融合環でもよく、具体例としてフェニル基、ナフチル基を挙げることができる。アルコキシ基は、直鎖状、分枝状、環状のいずれであってもよく、より好ましくは炭素数1〜6であり、具体例としてメトキシ基、エトキシ基、プロポキシ基、ブトキシ基、t−ブトキシ基、ペンチルオキシ基、ヘキシルオキシ基、イソプロポキシ基を挙げることができる。ジアルキルアミノ基の2つのアルキル基は、互いに同一であっても異なっていてもよいが、同一であることが好ましい。ジアルキルアミノ基の2つのアルキル基は、各々独立に直鎖状、分枝状、環状のいずれであってもよく、より好ましくは炭素数1〜6であり、具体例としてメチル基、エチル基、プロピル基、ブチル基、ペンチル基、ヘキシル基、イソプロピル基を挙げることができる。アリール基は、単環でも融合環でもよく、具体例としてフェニル基、ナフチル基を挙げることができる。ヘテロアリール基も、単環でも融合環でもよく、具体例としてピリジル基、ピリダジル基、ピリミジル基、トリアジル基、トリアゾリル基、ベンゾトリアゾリル基、カルバゾリル基を挙げることができる。これらのヘテロアリール基は、ヘテロ原子を介して結合する基であっても、ヘテロアリール環を構成する炭素原子を介して結合する基であってもよい。 The alkyl group referred to in the present specification may be linear, branched, or cyclic, and more preferably has 1 to 6 carbon atoms. Specific examples include a methyl group, an ethyl group, a propyl group, and a butyl group. Group, t-butyl group, pentyl group, hexyl group and isopropyl group. The aryl group may be a single ring or a fused ring, and specific examples include a phenyl group and a naphthyl group. The alkoxy group may be linear, branched, or cyclic, and more preferably has 1 to 6 carbon atoms. Specific examples include a methoxy group, an ethoxy group, a propoxy group, a butoxy group, and a t-butoxy group. Groups, a pentyloxy group, a hexyloxy group, and an isopropoxy group. The two alkyl groups of the dialkylamino group may be the same or different from each other, but are preferably the same. The two alkyl groups of the dialkylamino group may be each independently linear, branched, or cyclic, more preferably 1 to 6 carbon atoms, and specific examples include a methyl group, an ethyl group, Examples thereof include a propyl group, a butyl group, a pentyl group, a hexyl group, and an isopropyl group. The aryl group may be a single ring or a fused ring, and specific examples include a phenyl group and a naphthyl group. The heteroaryl group may be a single ring or a fused ring, and specific examples include a pyridyl group, a pyridazyl group, a pyrimidyl group, a triazyl group, a triazolyl group, a benzotriazolyl group, and a carbazolyl group. These heteroaryl groups may be groups bonded via a hetero atom or groups bonded via carbon atoms constituting a heteroaryl ring.
これらのうち、一般式(11)のR27はシアノ基であることが好ましい。すなわち、一般式(11)で表されるカルバゾリル基は、R22とR27の両方がシアノ基であることが好ましい。 Among them, R 27 in the general formula (11) is preferably a cyano group. That is, in the carbazolyl group represented by the general formula (11), it is preferable that both R 22 and R 27 are cyano groups.
また、R21、R23〜R26、R28の少なくとも1つはカルバゾリル基であることが好ましく、2−カルバゾリル基、3−カルバゾリル基、9−カルバゾリル基であることがより好ましい。R21、R23〜R26、R28の少なくとも1つがカルバゾリル基であることにより、一般式(1)で表される化合物のHOMO準位とLUMO準位をより深く下げることができる。R21、R23〜R26、R28の少なくとも1つがカルバゾリル基であるとき、そのカルバゾリル基は、無置換であっても置換基で置換されていてもよいが、シアノ基で置換されていることが好ましい。R21、R23〜R26、R28が表すカルバゾリル基がシアノ基で置換されている場合、そのシアノ基の置換位置は、2−カルバゾリル基では6位及び8位の少なくとも一方であることが好ましく、3−カルバゾリル基では7位であることが好ましく、9−カルバゾリル基では2位及び7位の少なくとも一方であることが好ましい。これらの中で、R21、R23〜R26、R28の少なくとも1つが表すカルバゾリル基は、6位及び8位の少なくとも一方がシアノ基で置換された2−カルバゾリル基であることがより好ましい。R21、R23〜R26、R28が表すカルバゾリル基は、3位、6位、9位が置換可能である場合は置換されていることが好ましく、その置換基は炭素数1〜20のアルキル基、炭素数6〜40のアリール基であることがより好ましく、炭素数1〜10のアルキル基、炭素数6〜15のアリール基であることがさらに好ましい。3位、6位、9位が置換されていれば、酸化を受けにくくなり、2量化を抑制することができるため、安定性の面で好ましい。また、R21、R23〜R26、R28のうちカルバゾリル基であるものは、R23〜R26の少なくとも1つであることが好ましく、R23とR26であることがより好ましい。ただし、実用性の観点から、一般式(1)で表される化合物の分子内に存在するカルバゾール環の数は4つ以下であることが好ましい。 Also, R 21, it is preferable that at least one of R 23 ~R 26, R 28 is a carbazolyl group, 2-carbazolyl group, 3-carbazolyl group, more preferably a 9-carbazolyl group. When at least one of R 21 , R 23 to R 26 , and R 28 is a carbazolyl group, the HOMO level and the LUMO level of the compound represented by the general formula (1) can be further reduced. When at least one of R 21, R 23 ~R 26, R 28 is a carbazolyl group, the carbazolyl group may be unsubstituted or may be substituted with a substituent, but is substituted by a cyano group Is preferred. When the carbazolyl group represented by R 21 , R 23 to R 26 or R 28 is substituted with a cyano group, the substitution position of the cyano group may be at least one of the 6-position and the 8-position in the 2-carbazolyl group. The 3-carbazolyl group is preferably at the 7-position, and the 9-carbazolyl group is preferably at least one of the 2- and 7-positions. Among them, the carbazolyl group represented by at least one of R 21 , R 23 to R 26 , and R 28 is more preferably a 2-carbazolyl group in which at least one of the 6-position and the 8-position is substituted with a cyano group. . The carbazolyl group represented by R 21 , R 23 to R 26 , and R 28 is preferably substituted when the 3-, 6-, and 9-positions are substitutable. It is more preferably an alkyl group or an aryl group having 6 to 40 carbon atoms, and further preferably an alkyl group having 1 to 10 carbon atoms or an aryl group having 6 to 15 carbon atoms. Substitution at the 3-, 6-, and 9-positions is preferable in terms of stability because oxidation is less likely to occur and dimerization can be suppressed. Moreover, what is carbazolyl group among R 21, R 23 ~R 26, R 28 is more preferably is preferably at least one of R 23 to R 26, a R 23 and R 26. However, from the viewpoint of practicality, the number of carbazole rings present in the molecule of the compound represented by the general formula (1) is preferably four or less.
上記のように、一般式(1)において、R1〜R5の少なくとも1つは、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である。R1〜R5のいずれか1つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合は、R1〜R3のいずれであってもよい。いずれか2つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合は、R1とR2の組み合わせ、R2とR3の組み合わせ、R3とR4の組み合わせ、R1とR3の組み合わせ、R2とR4の組み合わせ等を例示することができ、R2とR3の組み合わせ、または、R3とR4の組み合わせであることが好ましい。いずれか3つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合は、R1とR3とR4の組み合わせを例示することができる。いずれか4つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合は、R1とR3とR4とR5の組み合わせを例示することができる。 As described above, in the general formula (1), at least one of R 1 to R 5 is a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group. When any one of R 1 to R 5 is a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, it may be any of R 1 to R 3 . When any two are a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, a combination of R 1 and R 2, a combination of R 2 and R 3, a combination of R 3 and R 4 , R 1 and R 3 , R 2 and R 4 , and the like, and preferably a combination of R 2 and R 3 or a combination of R 3 and R 4 . When any three are a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, a combination of R 1 , R 3 and R 4 can be exemplified. When any four are a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, a combination of R 1 , R 3 , R 4 and R 5 can be exemplified.
2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基が結合しているベンゼン環のパラ位はシアノ基であることが好ましい。また、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基がベンゼン環に2つ以上結合している場合は、それらのうちの少なくとも2つが、各々が結合しているベンゼン環のパラ位がシアノ基であるという条件を満たしていることが好ましい。 The para-position of the benzene ring to which the carbazolyl group in which at least one of the 2-position and the 7-position is substituted by a cyano group is preferably a cyano group. Further, when two or more carbazolyl groups in which at least one of the 2-position and the 7-position is substituted with a cyano group are bonded to a benzene ring, at least two of them are bonded to the benzene ring to which each is bonded. Preferably, the condition that the para position is a cyano group is satisfied.
一般式(1)において、R1〜R5の少なくとも1つはシアノ基を表し、R1〜R5の少なくとも1つは上記2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基を表すが、残りのR1〜R5は水素原子または置換基を表す。 In the general formula (1), at least one of a cyano group, a carbazolyl group in which at least one of the at least one the 2-position and 7-position of the R 1 to R 5 is a cyano group R 1 to R 5 Wherein R 1 to R 5 represent a hydrogen atom or a substituent.
R1〜R5がとりうる好ましい置換基として、例えばヒドロキシ基、ハロゲン原子、炭素数1〜20のアルキル基、炭素数1〜20のアルコキシ基、炭素数1〜20のアルキルチオ基、炭素数1〜20のアルキル置換アミノ基、炭素数2〜20のアシル基、炭素数6〜40のアリール基、炭素数3〜40のヘテロアリール基、炭素数2〜10のアルケニル基、炭素数2〜10のアルキニル基、炭素数2〜10のアルコキシカルボニル基、炭素数1〜10のアルキルスルホニル基、アミド基、炭素数2〜10のアルキルアミド基、炭素数3〜20のトリアルキルシリル基、炭素数4〜20のトリアルキルシリルアルキル基、炭素数5〜20のトリアルキルシリルアルケニル基、炭素数5〜20のトリアルキルシリルアルキニル基およびニトロ基等が挙げられる。これらの具体例のうち、さらに置換基により置換可能なものは置換されていてもよい。より好ましい置換基は、ヒドロキシ基、ハロゲン原子、炭素数1〜20の置換もしくは無置換のアルキル基、炭素数1〜20の置換もしくは無置換のアルコキシ基、炭素数1〜20の置換もしくは無置換のジアルキルアミノ基、炭素数6〜40の置換もしくは無置換のアリール基、炭素数3〜40の置換もしくは無置換のヘテロアリール基である。さらに好ましい置換基は、ヒドロキシ基、フッ素原子、塩素原子、炭素数1〜10の置換もしくは無置換のアルキル基、炭素数1〜10の置換もしくは無置換のアルコキシ基、炭素数1〜10の置換もしくは無置換のジアルキルアミノ基、炭素数6〜15の置換もしくは無置換のアリール基、炭素数3〜12の置換もしくは無置換のヘテロアリール基である。さらになお好ましくは、ヒドロキシ基、フッ素原子、塩素原子である。 Preferred substituents that R 1 to R 5 may have include, for example, a hydroxy group, a halogen atom, an alkyl group having 1 to 20 carbon atoms, an alkoxy group having 1 to 20 carbon atoms, an alkylthio group having 1 to 20 carbon atoms, -20 alkyl-substituted amino group, C2-C20 acyl group, C6-C40 aryl group, C3-C40 heteroaryl group, C2-C10 alkenyl group, C2-C10 An alkynyl group, an alkoxycarbonyl group having 2 to 10 carbon atoms, an alkylsulfonyl group having 1 to 10 carbon atoms, an amide group, an alkylamide group having 2 to 10 carbon atoms, a trialkylsilyl group having 3 to 20 carbon atoms, and a carbon number 4-20 trialkylsilylalkyl groups, 5-20 carbon atoms trialkylsilylalkenyl groups, 5-20 carbon atoms trialkylsilylalkynyl groups and nitro groups And the like. Among these specific examples, those that can be further substituted by a substituent may be substituted. More preferred substituents are a hydroxy group, a halogen atom, a substituted or unsubstituted alkyl group having 1 to 20 carbon atoms, a substituted or unsubstituted alkoxy group having 1 to 20 carbon atoms, and a substituted or unsubstituted 1 to 20 carbon atoms. A substituted or unsubstituted aryl group having 6 to 40 carbon atoms, and a substituted or unsubstituted heteroaryl group having 3 to 40 carbon atoms. More preferred substituents are a hydroxy group, a fluorine atom, a chlorine atom, a substituted or unsubstituted alkyl group having 1 to 10 carbon atoms, a substituted or unsubstituted alkoxy group having 1 to 10 carbon atoms, and a substituted or unsubstituted alkoxy group having 1 to 10 carbon atoms. Or an unsubstituted dialkylamino group, a substituted or unsubstituted aryl group having 6 to 15 carbon atoms, or a substituted or unsubstituted heteroaryl group having 3 to 12 carbon atoms. Still more preferably, they are a hydroxy group, a fluorine atom and a chlorine atom.
また、R1〜R5がとりうる好ましい置換基の例として、下記一般式(12)〜(15)で表される基も挙げることができる。 Examples of preferable substituents that R 1 to R 5 can take also include groups represented by the following general formulas (12) to (15).
一般式(12)において、R31〜R38は、各々独立に水素原子または置換基を表す。一般式(13)〜(15)において、R41〜R46、R51〜R62およびR71〜R80は、各々独立に水素原子または置換基を表す。一般式(12)〜(15)で表される基が置換基を有するときの置換位置や置換数は特に制限されない。各基の置換数は、0〜6個が好ましく、0〜4個がより好ましく、例えば0〜2個とすることも好ましい。複数の置換基を有するとき、それらは互いに同一であっても異なっていてもよいが、同一であることがより好ましい。
一般式(12)で表される基が置換基を有する場合は、R32〜R37のいずれかが置換基であることが好ましい。例えば、R32とR37が置換基である場合、R33とR36が置換基である場合、R34とR35が置換基である場合を好ましく例示することができる。
一般式(13)で表される基が置換基を有する場合は、R42〜R46のいずれかが置換基であることが好ましい。例えば、R42が置換基である場合と、R43が置換基である場合を好ましく例示することができる。
一般式(14)で表される基が置換基を有する場合は、R52〜R60のいずれかが置換基であることが好ましい。例えば、R52〜R54のいずれかがが置換基である場合、R55〜R60のいずれかが置換基である場合を好ましく例示することができる。
一般式(15)で表される基が置換基を有する場合は、R72〜R74およびR77〜R79のいずれかが置換基であることが好ましい。例えば、R72とR79が置換基である場合、R73とR78が置換基である場合、R74とR77が置換基である場合、R72、R74、R77およびR79が置換基である場合を好ましく例示することができる。特に、R74とR77が置換基である場合、R72、R74、R77およびR79が置換基である場合をより好ましく例示することができる。このときの置換基は、各々独立に炭素数1〜20の置換もしくは無置換のアルキル基、または炭素数6〜40の置換もしくは無置換のアリール基であることが特に好ましく、炭素数1〜6の無置換のアルキル基、炭素数6〜10の無置換のアリール基、または炭素数6〜10のアリール基で置換された炭素数6〜10のアリール基であることがさらにより好ましい。
In the general formula (12), R 31 to R 38 each independently represent a hydrogen atom or a substituent. In the general formulas (13) to (15), R 41 to R 46 , R 51 to R 62 and R 71 to R 80 each independently represent a hydrogen atom or a substituent. When the groups represented by formulas (12) to (15) have a substituent, the substitution position and the number of substitution are not particularly limited. The number of substitution of each group is preferably from 0 to 6, more preferably from 0 to 4, and for example, preferably from 0 to 2. When it has a plurality of substituents, they may be the same or different, but are preferably the same.
When the group represented by the general formula (12) has a substituent, it is preferably one of R 32 to R 37 is a substituent. For example, when R32 and R37 are substituents, when R33 and R36 are substituents, and when R34 and R35 are substituents, preferred examples can be preferably given.
When the group represented by the general formula (13) has a substituent, any one of R 42 to R 46 is preferably a substituent. For example, the case where R 42 is a substituent and the case where R 43 is a substituent can be preferably exemplified.
When the group represented by the general formula (14) has a substituent, any of R 52 to R 60 is preferably a substituent. For example, when any of R 52 to R 54 is a substituent, the case where any of R 55 to R 60 is a substituent can be preferably exemplified.
When the group represented by the general formula (15) has a substituent, it is preferable that any one of R 72 to R 74 and R 77 to R 79 is a substituent. For example, when R 72 and R 79 are substituents, when R 73 and R 78 are substituents, when R 74 and R 77 are substituents, R 72 , R 74 , R 77 and R 79 are The case where it is a substituent can be preferably exemplified. In particular, when R 74 and R 77 are substituents, the case where R 72 , R 74 , R 77 and R 79 are substituents can be more preferably exemplified. The substituents at this time are particularly preferably each independently a substituted or unsubstituted alkyl group having 1 to 20 carbon atoms, or a substituted or unsubstituted aryl group having 6 to 40 carbon atoms. And further preferably an unsubstituted alkyl group, an unsubstituted aryl group having 6 to 10 carbon atoms, or an aryl group having 6 to 10 carbon atoms substituted with an aryl group having 6 to 10 carbon atoms.
一般式(12)のR31〜R38、一般式(13)のR41〜R46、一般式(14)のR51〜R62および、一般式(15)のR71〜R80がとりうる置換基の好ましい範囲と具体例については、上記の一般式(11)におけるR21、R23〜R28がとりうる置換基の好ましい範囲と具体例を参照す+ることができる。 R 31 to R 38 of the general formula (12), R 41 to R 46 of the general formula (13), R 51 to R 62 of the general formula (14), and R 71 to R 80 of the general formula (15) For preferred ranges and specific examples of the possible substituents, reference can be made to the preferred ranges and specific examples of the substituents that can be taken by R 21 and R 23 to R 28 in the general formula (11).
一般式(1)において、R1〜R5のうち水素原子であるものは3つ以下であることが好ましく、2つ以下であることがより好ましく、0であることも好ましい。 In the general formula (1), the number of hydrogen atoms out of R 1 to R 5 is preferably 3 or less, more preferably 2 or less, and even more preferably 0.
好ましい組み合わせとして、例えば、一般式(1)のR1がシアノ基であり、R3及びR4の少なくとも1つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合を挙げることができる。別の好ましい組み合わせとして、R2がシアノ基であり、R1、R3〜R5の少なくとも1つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合を挙げることもできる。より好ましい組合せとして、例えば、一般式(1)のR1がシアノ基であり、R4及びR5の両方が、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合を挙げることができる。別のより好ましい組み合わせとして、R2がシアノ基であり、R1、R3〜R5の全てが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である場合を挙げることもできる。 As a preferable combination, for example, when R 1 in the general formula (1) is a cyano group, and at least one of R 3 and R 4 is a carbazolyl group in which at least one of the 2- and 7-positions is substituted with a cyano group. Can be mentioned. Another preferred combination is that R 2 is a cyano group and at least one of R 1 , R 3 to R 5 is a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group. Can also. As a more preferable combination, for example, when R 1 in the general formula (1) is a cyano group, and both R 4 and R 5 are a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group. Can be mentioned. Another more preferred combination includes the case where R 2 is a cyano group and all of R 1 , R 3 to R 5 are carbazolyl groups in which at least one of the 2-position and the 7-position is substituted with a cyano group. Can also.
一般式(1)で表される化合物は、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基のベンゼン環への置換位置及び置換数や、該カルバゾリル基におけるベンゼン環への結合部位、そのカルバゾリル基に導入するカルバゾリル基の置換位置及び置換数や、該カルバゾリル基におけるカルバゾリル基への結合部位等の選択により、分子構造の対称性やリニア性を制御することができる。例えば、分子の対称性が高ければ、電子の遷移性が高くなるという利点がある。一方、分子がリニアである方が、分極が大きくなって量子収率が大きくなるため好ましいが、電子の遷移性は低くなる。また、シアノ基の導入は、分子の分極を大きくする方向に作用する。 The compound represented by the general formula (1) includes a carbazolyl group in which at least one of the 2-position and the 7-position is substituted with a cyano group, the substitution position and the number of substitution on the benzene ring, and the binding of the carbazolyl group to the benzene ring. The symmetry and linearity of the molecular structure can be controlled by selecting the site, the substitution position and the number of the carbazolyl group to be introduced into the carbazolyl group, the binding site of the carbazolyl group to the carbazolyl group, and the like. For example, if the symmetry of the molecule is high, there is an advantage that the electron transition property is high. On the other hand, it is preferable that the molecule is linear because polarization increases and the quantum yield increases, but electron transition properties decrease. The introduction of a cyano group acts in a direction to increase the polarization of a molecule.
以下において、一般式(1)で表される化合物の具体例を例示するが、本発明において用いることができる一般式(1)で表される化合物はこれらの具体例によって限定的に解釈されるべきものではない。 Hereinafter, specific examples of the compound represented by the general formula (1) will be exemplified, but the compound represented by the general formula (1) that can be used in the present invention is limitedly interpreted by these specific examples. It should not be.
一般式(1)で表される化合物の分子量は、例えば一般式(1)で表される化合物を含む有機層を蒸着法により製膜して利用することを意図する場合には、1500以下であることが好ましく、1200以下であることがより好ましく、1000以下であることがさらに好ましく、800以下であることがさらにより好ましい。分子量の下限値は、通常247以上であり、好ましくは290以上である。
一般式(1)で表される化合物は、分子量にかかわらず塗布法で成膜してもよい。塗布法を用いれば、分子量が比較的大きな化合物であっても成膜することが可能である。
The molecular weight of the compound represented by the general formula (1) is, for example, 1500 or less when an organic layer containing the compound represented by the general formula (1) is intended to be formed by a vapor deposition method and used. Preferably, it is not more than 1200, more preferably not more than 1,000, and even more preferably not more than 800. The lower limit of the molecular weight is usually 247 or more, preferably 290 or more.
The compound represented by the general formula (1) may be formed into a film by a coating method regardless of the molecular weight. By using a coating method, it is possible to form a film even with a compound having a relatively large molecular weight.
本発明を応用して、分子内に一般式(1)で表される構造を複数個含む化合物を、有機発光素子の発光層に用いることも考えられる。
例えば、一般式(1)で表される構造を有する重合性モノマーを重合させた重合体を、有機発光素子の発光層に用いることが考えられる。具体的には、一般式(1)のR1〜R5のいずれかに重合性官能基を有するモノマーを用意して、これを単独で重合させるか、他のモノマーとともに共重合させることにより、繰り返し単位を有する重合体を得て、その重合体を有機発光素子の発光層に用いることが考えられる。あるいは、一般式(1)で表される構造を有する化合物どうしをカップリングさせることにより、二量体や三量体を得て、それらを有機発光素子の発光層に用いることも考えられる。
By applying the present invention, it is conceivable to use a compound containing a plurality of structures represented by the general formula (1) in a molecule in a light emitting layer of an organic light emitting device.
For example, a polymer obtained by polymerizing a polymerizable monomer having a structure represented by the general formula (1) may be used for the light emitting layer of the organic light emitting device. Specifically, by preparing a monomer having a polymerizable functional group at any of R 1 to R 5 in the general formula (1), and polymerizing it alone or copolymerizing it with another monomer, It is conceivable to obtain a polymer having a repeating unit and use the polymer for a light emitting layer of an organic light emitting device. Alternatively, a dimer or a trimer may be obtained by coupling compounds having a structure represented by the general formula (1), and these may be used for a light emitting layer of an organic light emitting device.
一般式(1)で表される構造を含む重合体を構成する繰り返し単位の構造例として、一般式(1)のR1〜R5のいずれかが下記一般式(17)または(18)で表される構造であるものを挙げることができる。
一般式(17)および(18)において、L1およびL2は連結基を表す。連結基の炭素数は、好ましくは0〜20であり、より好ましくは1〜15であり、さらに好ましくは2〜10である。連結基は−X11−L11−で表される構造を有するものであることが好ましい。ここで、X11は酸素原子または硫黄原子を表し、酸素原子であることが好ましい。L11は連結基を表し、置換もしくは無置換のアルキレン基、または置換もしくは無置換のアリーレン基であることが好ましく、炭素数1〜10の置換もしくは無置換のアルキレン基、または置換もしくは無置換のフェニレン基であることがより好ましい。
一般式(17)および(18)において、R101、R102、R103およびR104は、各々独立に置換基を表す。好ましくは、炭素数1〜6の置換もしくは無置換のアルキル基、炭素数1〜6の置換もしくは無置換のアルコキシ基、ハロゲン原子であり、より好ましくは炭素数1〜3の無置換のアルキル基、炭素数1〜3の無置換のアルコキシ基、フッ素原子、塩素原子であり、さらに好ましくは炭素数1〜3の無置換のアルキル基、炭素数1〜3の無置換のアルコキシ基である。
In the general formulas (17) and (18), L 1 and L 2 represent a linking group. The number of carbon atoms in the linking group is preferably from 0 to 20, more preferably from 1 to 15, and even more preferably from 2 to 10. And preferably has a structure represented by - linking group -X 11 -L 11. Here, X 11 represents an oxygen atom or a sulfur atom, and is preferably an oxygen atom. L 11 represents a linking group, preferably a substituted or unsubstituted alkylene group, or a substituted or unsubstituted arylene group, and a substituted or unsubstituted alkylene group having 1 to 10 carbon atoms, or a substituted or unsubstituted alkylene group. More preferably, it is a phenylene group.
In the general formulas (17) and (18), R 101 , R 102 , R 103 and R 104 each independently represent a substituent. Preferably, it is a substituted or unsubstituted alkyl group having 1 to 6 carbon atoms, a substituted or unsubstituted alkoxy group having 1 to 6 carbon atoms, or a halogen atom, more preferably an unsubstituted alkyl group having 1 to 3 carbon atoms. And an unsubstituted alkoxy group having 1 to 3 carbon atoms, a fluorine atom and a chlorine atom, more preferably an unsubstituted alkyl group having 1 to 3 carbon atoms and an unsubstituted alkoxy group having 1 to 3 carbon atoms.
繰り返し単位の具体的な構造例として、一般式(1)のR1〜R5のいずれかが下記式(21)〜(24)であるものを挙げることができる。R1〜R5のうちの2つ以上が、下記式(21)〜(24)であってもよいが、好ましいのはR1〜R5のうちの1つが下記式(21)〜(24)のいずれかである場合である。
これらの式(21)〜(24)を含む繰り返し単位を有する重合体は、一般式(1)のR1〜R5の少なくとも1つをヒドロキシ基にしておき、それをリンカーとして下記化合物を反応させて重合性基を導入し、その重合性基を重合させることにより合成することができる。
分子内に一般式(1)で表される構造を含む重合体は、一般式(1)で表される構造を有する繰り返し単位のみからなる重合体であってもよいし、それ以外の構造を有する繰り返し単位を含む重合体であってもい。また、重合体の中に含まれる一般式(1)で表される構造を有する繰り返し単位は、単一種であってもよいし、2種以上であってもよい。一般式(1)で表される構造を有さない繰り返し単位としては、通常の共重合に用いられるモノマーから誘導されるものを挙げることができる。例えば、エチレン、スチレンなどのエチレン性不飽和結合を有するモノマーから誘導される繰り返し単位を挙げることができる。 The polymer having a structure represented by the general formula (1) in the molecule may be a polymer composed of only a repeating unit having the structure represented by the general formula (1), or a polymer having another structure. It may be a polymer containing a repeating unit having the same. Further, the repeating unit having the structure represented by the general formula (1) contained in the polymer may be a single type or a combination of two or more types. Examples of the repeating unit having no structure represented by the general formula (1) include those derived from a monomer used for ordinary copolymerization. For example, a repeating unit derived from a monomer having an ethylenically unsaturated bond such as ethylene and styrene can be mentioned.
[一般式(1)で表される化合物の合成方法]
上記の一般式(1)で表される化合物は新規化合物である。
一般式(1)で表される化合物の合成法は特に制限されない。一般式(1)で表される化合物の合成は、既知の合成法や条件を適宜組み合わせることにより行うことができる。
例えば、好ましい合成法として、ジフルオロジシアノベンゼンを用意して、これを2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾールと反応させる方法を挙げることができる。これによって、一般式(1)のR1〜R5のいずれか1つがシアノ基で、残りの2つが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である化合物を合成することができる。こうして合成された化合物は溶媒洗浄により簡単に精製することができる。出発物質としてテトラフルオロジシアノベンゼンを用いれば、一般式(1)のR1〜R5のいずれか1つがシアノ基で、残りが、2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基である化合物を合成することができる。さらに、シアノベンゼンにおけるシアノ基及びフルオロ基の数を、目的化合物のベンゼン環におけるシアノ基及び2位及び7位の少なくとも一方がシアノ基で置換されたカルバゾリル基の数に対応させて変更することにより、目的の一般式(1)で表される化合物を合成することができる。また、さらに水を添加して超音波照射する等の工程を実施することにより、ベンゼン環にヒドロキシ基を導入することもできる。以上に説明した合成法は、比較的簡単な工程で高い収率を得ることができるため、工業レベルでの大規模生産に適している。
上記の反応の詳細については、後述の合成例を参考にすることができる。また、一般式(1)で表される化合物は、その他の公知の合成反応を組み合わせることによっても合成することができる。
[Synthesis method of compound represented by general formula (1)]
The compound represented by the general formula (1) is a novel compound.
The method for synthesizing the compound represented by the general formula (1) is not particularly limited. The compound represented by the general formula (1) can be synthesized by appropriately combining known synthesis methods and conditions.
For example, as a preferred synthesis method, there is a method in which difluorodicyanobenzene is prepared and reacted with carbazole in which at least one of the 2-position and the 7-position is substituted with a cyano group. Thus, a compound in which one of R 1 to R 5 in the general formula (1) is a cyano group and the remaining two are carbazolyl groups in which at least one of the 2-position and the 7-position is substituted with a cyano group. can do. The compound thus synthesized can be easily purified by washing with a solvent. When tetrafluorodicyanobenzene is used as a starting material, any one of R 1 to R 5 in the general formula (1) is a cyano group, and the rest is carbazolyl in which at least one of the 2-position and the 7-position is substituted with a cyano group. Compounds that are groups can be synthesized. Further, by changing the number of cyano groups and fluoro groups in cyanobenzene in accordance with the number of cyano groups and carbazolyl groups in which at least one of the 2- and 7-positions in the benzene ring of the target compound is substituted with a cyano group. The desired compound represented by the general formula (1) can be synthesized. Further, a hydroxy group can be introduced into the benzene ring by performing a step of adding water and irradiating ultrasonic waves. The above-described synthesis method is suitable for large-scale production at an industrial level because a high yield can be obtained with relatively simple steps.
For details of the above reaction, the following Synthesis Examples can be referred to. The compound represented by the general formula (1) can also be synthesized by combining other known synthesis reactions.
[有機発光素子]
本発明の一般式(1)で表される化合物は、良好な発光特性を有し、有機発光素子の発光材料として有用である。また、一般式(1)で表される化合物は、シアノ基で置換されたベンゼン環に置換しているカルバゾリル基がシアノ基で置換されていることにより、高い熱安定性を有するとともに、HOMO準位とLUMO準位がともに深く、その発光過程で生成するラジカル種や励起子の水分や酸素との反応による劣化が抑制されると考えられる。さらに、一般式(1)で表される化合物は、上記のカルバゾリル基におけるシアノ基の置換位置が2位及び7位の少なくとも一方であることにより、カルバゾリル基がシアノ基で置換されていないシアノベンゼン誘導体と同等の高い耐光性を有する。このため、本発明の一般式(1)で表される化合物を発光層の発光材料に使用する有機発光素子は、極めて高い耐候性(耐熱性、耐酸化性及び耐光性)を有し、屋外で使用した場合でも良好は発光特性を維持することができる。
さらに、一般式(1)で表される化合物の中には、遅延蛍光を放射する遅延蛍光材料(遅延蛍光体)が含まれている。すなわち本発明は、一般式(1)で表される構造を有する遅延蛍光体の発明と、一般式(1)で表される化合物を遅延蛍光体として使用する発明と、一般式(1)で表される化合物を用いて遅延蛍光を発光させる方法の発明も提供する。そのような化合物を発光材料として用いた有機発光素子は、遅延蛍光を放射し、発光効率が高いという特徴を有する。その原理を、有機エレクトロルミネッセンス素子を例にとって説明すると以下のようになる。
[Organic light emitting device]
The compound represented by the general formula (1) of the present invention has good light emitting properties and is useful as a light emitting material of an organic light emitting device. In addition, the compound represented by the general formula (1) has high thermal stability and a high HOMO level due to the carbazolyl group substituted on the benzene ring substituted with the cyano group being substituted with the cyano group. It is considered that both the energy level and the LUMO level are deep, and the deterioration of radical species and excitons generated during the light emission process due to the reaction with moisture and oxygen is suppressed. Further, the compound represented by the general formula (1) includes a cyanobenzene in which the carbazolyl group is not substituted with a cyano group because the substitution position of the cyano group in the carbazolyl group is at least one of the 2-position and the 7-position. It has the same high light resistance as derivatives. Therefore, an organic light-emitting element using the compound represented by the general formula (1) of the present invention as a light-emitting material of a light-emitting layer has extremely high weather resistance (heat resistance, oxidation resistance, and light resistance) and can be used outdoors. Even when used, the light emission characteristics can be maintained.
Furthermore, the compound represented by the general formula (1) includes a delayed fluorescent material (delayed fluorescent material) that emits delayed fluorescent light. That is, the present invention relates to the invention of a delayed fluorescent substance having a structure represented by the general formula (1), the invention using a compound represented by the general formula (1) as a delayed fluorescent substance, There is also provided an invention of a method for emitting delayed fluorescence using the compound represented. An organic light-emitting element using such a compound as a light-emitting material has characteristics of emitting delayed fluorescence and having high luminous efficiency. The principle will be described below by taking an organic electroluminescence element as an example.
有機エレクトロルミネッセンス素子においては、正負の両電極より発光材料にキャリアを注入し、励起状態の発光材料を生成し、発光させる。通常、キャリア注入型の有機エレクトロルミネッセンス素子の場合、生成した励起子のうち、励起一重項状態に励起されるのは25%であり、残り75%は励起三重項状態に励起される。従って、励起三重項状態からの発光であるリン光を利用するほうが、エネルギーの利用効率が高い。しかしながら、励起三重項状態は寿命が長いため、励起状態の飽和や励起三重項状態の励起子との相互作用によるエネルギーの失活が起こり、一般にリン光の量子収率が高くないことが多い。一方、遅延蛍光材料は、項間交差等により励起三重項状態へとエネルギーが遷移した後、三重項−三重項消滅あるいは熱エネルギーの吸収により、励起一重項状態に逆項間交差され蛍光を放射する。有機エレクトロルミネッセンス素子においては、なかでも熱エネルギーの吸収による熱活性化型の遅延蛍光材料が特に有用であると考えられる。有機エレクトロルミネッセンス素子に遅延蛍光材料を利用した場合、励起一重項状態の励起子は通常通り蛍光を放射する。一方、励起三重項状態の励起子は、デバイスが発する熱を吸収して励起一重項へ項間交差され蛍光を放射する。このとき、励起一重項からの発光であるため蛍光と同波長での発光でありながら、励起三重項状態から励起一重項状態への逆項間交差により、生じる光の寿命(発光寿命)は通常の蛍光やりん光よりも長くなるため、これらよりも遅延した蛍光として観察される。これを遅延蛍光として定義できる。このような熱活性化型の励起子移動機構を用いれば、キャリア注入後に熱エネルギーの吸収を経ることにより、通常は25%しか生成しなかった励起一重項状態の化合物の比率を25%以上に引き上げることが可能となる。100℃未満の低い温度でも強い蛍光および遅延蛍光を発する化合物を用いれば、デバイスの熱で充分に励起三重項状態から励起一重項状態への項間交差が生じて遅延蛍光を放射するため、発光効率を飛躍的に向上させることができる。 In an organic electroluminescence element, carriers are injected into a luminescent material from both positive and negative electrodes to generate a luminescent material in an excited state and emit light. Normally, in the case of a carrier injection type organic electroluminescence device, 25% of the generated excitons are excited to an excited singlet state, and the remaining 75% are excited to an excited triplet state. Therefore, energy utilization efficiency is higher when phosphorescent light emitted from the excited triplet state is used. However, since the excited triplet state has a long lifetime, saturation of the excited state or deactivation of energy due to interaction with an exciton in the excited triplet state occurs, and the quantum yield of phosphorescence is generally not high in many cases. On the other hand, in the delayed fluorescent material, after the energy transitions to the excited triplet state due to intersystem crossing, etc., the triplet-triplet annihilation or the inverse intersystem crossing to the excited singlet state due to absorption of heat energy causes emission of fluorescence. I do. In an organic electroluminescence device, a thermally activated delayed fluorescent material due to absorption of thermal energy is considered to be particularly useful. When a delayed fluorescent material is used in an organic electroluminescence device, an exciton in an excited singlet state emits fluorescence as usual. On the other hand, the exciton in the excited triplet state absorbs heat generated by the device, intersects with the excited singlet, and emits fluorescence. At this time, although the light is emitted from the excited singlet, the light is emitted at the same wavelength as the fluorescence, but the lifetime (emission lifetime) of the light generated by the inverse intersystem crossing from the excited triplet state to the excited singlet state is usually Is longer than the fluorescence or phosphorescence of the above, and is observed as fluorescence delayed from these. This can be defined as delayed fluorescence. By using such a thermally activated exciton transfer mechanism, the ratio of the compound in the excited singlet state, which normally produces only 25%, is increased to 25% or more through thermal energy absorption after carrier injection. It can be raised. When a compound that emits strong fluorescence and delayed fluorescence even at a low temperature of less than 100 ° C. is used, the heat of the device sufficiently causes an intersystem crossing from the excited triplet state to the excited singlet state to emit delayed fluorescence, so that light emission is performed. The efficiency can be dramatically improved.
本発明の一般式(1)で表される化合物を発光層の発光材料として用いることにより、有機フォトルミネッセンス素子(有機PL素子)や有機エレクトロルミネッセンス素子(有機EL素子)などの優れた有機発光素子を提供することができる。有機フォトルミネッセンス素子は、基板上に少なくとも発光層を形成した構造を有する。また、有機エレクトロルミネッセンス素子は、少なくとも陽極、陰極、および陽極と陰極の間に有機層を形成した構造を有する。有機層は、少なくとも発光層を含むものであり、発光層のみからなるものであってもよいし、発光層の他に1層以上の有機層を有するものであってもよい。そのような他の有機層として、正孔輸送層、正孔注入層、電子阻止層、正孔阻止層、電子注入層、電子輸送層、励起子阻止層などを挙げることができる。正孔輸送層は正孔注入機能を有した正孔注入輸送層でもよく、電子輸送層は電子注入機能を有した電子注入輸送層でもよい。具体的な有機エレクトロルミネッセンス素子の構造例を図1に示す。図1において、1は基板、2は陽極、3は正孔注入層、4は正孔輸送層、5は発光層、6は電子輸送層、7は陰極を表わす。
以下において、有機エレクトロルミネッセンス素子の各部材および各層について説明する。なお、基板と発光層の説明は有機フォトルミネッセンス素子の基板と発光層にも該当する。
By using the compound represented by the general formula (1) of the present invention as a light-emitting material of a light-emitting layer, an excellent organic light-emitting element such as an organic photoluminescence element (organic PL element) or an organic electroluminescence element (organic EL element) is obtained. Can be provided. The organic photoluminescence element has a structure in which at least a light emitting layer is formed on a substrate. Further, the organic electroluminescence element has a structure in which at least an anode, a cathode, and an organic layer are formed between the anode and the cathode. The organic layer includes at least the light emitting layer, and may be composed of only the light emitting layer, or may have one or more organic layers in addition to the light emitting layer. Examples of such other organic layers include a hole transport layer, a hole injection layer, an electron blocking layer, a hole blocking layer, an electron injection layer, an electron transport layer, and an exciton blocking layer. The hole transport layer may be a hole injection transport layer having a hole injection function, and the electron transport layer may be an electron injection transport layer having an electron injection function. FIG. 1 shows a specific example of the structure of an organic electroluminescence element. In FIG. 1, 1 is a substrate, 2 is an anode, 3 is a hole injection layer, 4 is a hole transport layer, 5 is a light emitting layer, 6 is an electron transport layer, and 7 is a cathode.
Hereinafter, each member and each layer of the organic electroluminescence element will be described. Note that the description of the substrate and the light emitting layer also applies to the substrate and the light emitting layer of the organic photoluminescence element.
(基板)
本発明の有機エレクトロルミネッセンス素子は、基板に支持されていることが好ましい。この基板については、特に制限はなく、従来から有機エレクトロルミネッセンス素子に慣用されているものであればよく、例えば、ガラス、透明プラスチック、石英、シリコンなどからなるものを用いることができる。
(substrate)
The organic electroluminescence device of the present invention is preferably supported on a substrate. This substrate is not particularly limited, and may be any substrate conventionally used in organic electroluminescent elements, and for example, a substrate made of glass, transparent plastic, quartz, silicon, or the like can be used.
(陽極)
有機エレクトロルミネッセンス素子における陽極としては、仕事関数の大きい(4eV以上)金属、合金、電気伝導性化合物およびこれらの混合物を電極材料とするものが好ましく用いられる。このような電極材料の具体例としてはAu等の金属、CuI、インジウムチンオキシド(ITO)、SnO2、ZnO等の導電性透明材料が挙げられる。また、IDIXO(In2O3−ZnO)等非晶質で透明導電膜を作製可能な材料を用いてもよい。陽極はこれらの電極材料を蒸着やスパッタリング等の方法により、薄膜を形成させ、フォトリソグラフィー法で所望の形状のパターンを形成してもよく、あるいはパターン精度をあまり必要としない場合は(100μm以上程度)、上記電極材料の蒸着やスパッタリング時に所望の形状のマスクを介してパターンを形成してもよい。あるいは、有機導電性化合物のように塗布可能な材料を用いる場合には、印刷方式、コーティング方式等湿式成膜法を用いることもできる。この陽極より発光を取り出す場合には、透過率を10%より大きくすることが望ましく、また陽極としてのシート抵抗は数百Ω/□以下が好ましい。さらに膜厚は材料にもよるが、通常10〜1000nm、好ましくは10〜200nmの範囲で選ばれる。
(anode)
As the anode in the organic electroluminescence element, a material using a metal, an alloy, an electrically conductive compound, or a mixture thereof having a large work function (4 eV or more) as an electrode material is preferably used. Specific examples of such electrode materials include metals such as Au, and conductive transparent materials such as CuI, indium tin oxide (ITO), SnO 2 , and ZnO. Alternatively, a material such as IDIXO (In 2 O 3 —ZnO) that can form an amorphous and transparent conductive film may be used. The anode may be formed by forming a thin film of these electrode materials by a method such as vapor deposition or sputtering, and forming a pattern of a desired shape by a photolithography method, or when the pattern accuracy is not required so much (about 100 μm or more). ), A pattern may be formed via a mask having a desired shape at the time of vapor deposition or sputtering of the electrode material. Alternatively, when a material that can be applied such as an organic conductive compound is used, a wet film forming method such as a printing method and a coating method can be used. When light is extracted from the anode, the transmittance is desirably greater than 10%, and the sheet resistance of the anode is preferably several hundred Ω / □ or less. Further, the thickness depends on the material, but is usually selected in the range of 10 to 1000 nm, preferably 10 to 200 nm.
(陰極)
一方、陰極としては、仕事関数の小さい(4eV以下)金属(電子注入性金属と称する)、合金、電気伝導性化合物およびこれらの混合物を電極材料とするものが用いられる。このような電極材料の具体例としては、ナトリウム、ナトリウム−カリウム合金、マグネシウム、リチウム、マグネシウム/銅混合物、マグネシウム/銀混合物、マグネシウム/アルミニウム混合物、マグネシウム/インジウム混合物、アルミニウム/酸化アルミニウム(Al2O3)混合物、インジウム、リチウム/アルミニウム混合物、希土類金属等が挙げられる。これらの中で、電子注入性および酸化等に対する耐久性の点から、電子注入性金属とこれより仕事関数の値が大きく安定な金属である第二金属との混合物、例えば、マグネシウム/銀混合物、マグネシウム/アルミニウム混合物、マグネシウム/インジウム混合物、アルミニウム/酸化アルミニウム(Al2O3)混合物、リチウム/アルミニウム混合物、アルミニウム等が好適である。陰極はこれらの電極材料を蒸着やスパッタリング等の方法により薄膜を形成させることにより、作製することができる。また、陰極としてのシート抵抗は数百Ω/□以下が好ましく、膜厚は通常10nm〜5μm、好ましくは50〜200nmの範囲で選ばれる。なお、発光した光を透過させるため、有機エレクトロルミネッセンス素子の陽極または陰極のいずれか一方が、透明または半透明であれば発光輝度が向上し好都合である。
また、陽極の説明で挙げた導電性透明材料を陰極に用いることで、透明または半透明の陰極を作製することができ、これを応用することで陽極と陰極の両方が透過性を有する素子を作製することができる。
(cathode)
On the other hand, as a cathode, a metal having a small work function (4 eV or less) (referred to as an electron injecting metal), an alloy, an electrically conductive compound, and a mixture thereof are used as an electrode material. Specific examples of such an electrode material include sodium, sodium-potassium alloy, magnesium, lithium, magnesium / copper mixture, magnesium / silver mixture, magnesium / aluminum mixture, magnesium / indium mixture, aluminum / aluminum oxide (Al 2 O) 3 ) Mixtures, indium, lithium / aluminum mixtures, rare earth metals and the like. Among them, a mixture of an electron-injecting metal and a second metal which is a stable metal having a large work function value, such as a magnesium / silver mixture, from the viewpoint of durability against electron injection and oxidation. Preferred are a magnesium / aluminum mixture, a magnesium / indium mixture, an aluminum / aluminum oxide (Al 2 O 3 ) mixture, a lithium / aluminum mixture, aluminum and the like. The cathode can be manufactured by forming a thin film from these electrode materials by a method such as evaporation or sputtering. Further, the sheet resistance as the cathode is preferably several hundred Ω / □ or less, and the film thickness is usually selected in the range of 10 nm to 5 μm, preferably 50 to 200 nm. In order to transmit emitted light, if either the anode or the cathode of the organic electroluminescence element is transparent or translucent, the emission luminance is advantageously improved.
In addition, by using the conductive transparent material mentioned in the description of the anode for the cathode, a transparent or translucent cathode can be produced, and by applying this, an element in which both the anode and the cathode are transmissive can be used. Can be made.
(発光層)
発光層は、陽極および陰極のそれぞれから注入された正孔および電子が再結合することにより励起子が生成した後、発光する層であり、発光材料を単独で発光層に使用しても良いが、好ましくは発光材料とホスト材料を含む。発光材料としては、一般式(1)で表される本発明の化合物群から選ばれる1種または2種以上を用いることができる。本発明の有機エレクトロルミネッセンス素子および有機フォトルミネッセンス素子が高い発光効率を発現するためには、発光材料に生成した一重項励起子および三重項励起子を、発光材料中に閉じ込めることが重要である。従って、発光層中に発光材料に加えてホスト材料を用いることが好ましい。ホスト材料としては、励起一重項エネルギー、励起三重項エネルギーの少なくとも何れか一方が本発明の発光材料よりも高い値を有する有機化合物を用いることができる。その結果、本発明の発光材料に生成した一重項励起子および三重項励起子を、本発明の発光材料の分子中に閉じ込めることが可能となり、その発光効率を十分に引き出すことが可能となる。もっとも、一重項励起子および三重項励起子を十分に閉じ込めることができなくても、高い発光効率を得ることが可能な場合もあるため、高い発光効率を実現しうるホスト材料であれば特に制約なく本発明に用いることができる。本発明の有機発光素子または有機エレクトロルミネッセンス素子において、発光は発光層に含まれる本発明の発光材料から生じる。この発光は蛍光発光および遅延蛍光発光の両方を含む。但し、発光の一部或いは部分的にホスト材料からの発光があってもかまわない。
ホスト材料を用いる場合、発光材料である本発明の化合物が発光層中に含有される量は0.1重量%以上であることが好ましく、1重量%以上であることがより好ましく、また、50重量%以下であることが好ましく、20重量%以下であることがより好ましく、10重量%以下であることがさらに好ましい。
発光層におけるホスト材料としては、正孔輸送能、電子輸送能を有し、かつ発光の長波長化を防ぎ、なおかつ高いガラス転移温度を有する有機化合物であることが好ましい。
(Light emitting layer)
The light-emitting layer is a layer that emits light after the exciton is generated by recombination of holes and electrons injected from each of the anode and the cathode, and the light-emitting material may be used alone for the light-emitting layer. , Preferably a luminescent material and a host material. As the light emitting material, one or more selected from the group of compounds of the present invention represented by the general formula (1) can be used. In order for the organic electroluminescence device and the organic photoluminescence device of the present invention to exhibit high luminous efficiency, it is important to confine singlet and triplet excitons generated in the luminescent material in the luminescent material. Therefore, it is preferable to use a host material in the light emitting layer in addition to the light emitting material. As a host material, an organic compound in which at least one of excited singlet energy and excited triplet energy has a higher value than the light-emitting material of the present invention can be used. As a result, the singlet exciton and the triplet exciton generated in the light emitting material of the present invention can be confined in the molecules of the light emitting material of the present invention, and the luminous efficiency can be sufficiently obtained. However, even if the singlet exciton and the triplet exciton cannot be sufficiently confined, high luminous efficiency can be obtained in some cases. Therefore, a host material that can realize high luminous efficiency is particularly limited. And can be used in the present invention. In the organic light emitting device or the organic electroluminescence device of the present invention, light emission is generated from the light emitting material of the present invention contained in the light emitting layer. This emission includes both fluorescence emission and delayed fluorescence emission. Note that light emission from the host material may be partially or partially emitted.
When a host material is used, the amount of the compound of the present invention, which is a light emitting material, contained in the light emitting layer is preferably 0.1% by weight or more, more preferably 1% by weight or more, and 50% by weight or more. % By weight or less, more preferably 20% by weight or less, and even more preferably 10% by weight or less.
The host material in the light-emitting layer is preferably an organic compound having a hole-transporting ability and an electron-transporting ability, preventing a long wavelength of light emission, and having a high glass transition temperature.
(注入層)
注入層とは、駆動電圧低下や発光輝度向上のために電極と有機層間に設けられる層のことで、正孔注入層と電子注入層があり、陽極と発光層または正孔輸送層の間、および陰極と発光層または電子輸送層との間に存在させてもよい。注入層は必要に応じて設けることができる。
(Injection layer)
The injection layer is a layer provided between the electrode and the organic layer for lowering the driving voltage and improving the light emission luminance.There is a hole injection layer and an electron injection layer, and between the anode and the light emitting layer or the hole transport layer, And between the cathode and the light emitting layer or the electron transporting layer. An injection layer can be provided as needed.
(阻止層)
阻止層は、発光層中に存在する電荷(電子もしくは正孔)および/または励起子の発光層外への拡散を阻止することができる層である。電子阻止層は、発光層および正孔輸送層の間に配置されることができ、電子が正孔輸送層の方に向かって発光層を通過することを阻止する。同様に、正孔阻止層は発光層および電子輸送層の間に配置されることができ、正孔が電子輸送層の方に向かって発光層を通過することを阻止する。阻止層はまた、励起子が発光層の外側に拡散することを阻止するために用いることができる。すなわち電子阻止層、正孔阻止層はそれぞれ励起子阻止層としての機能も兼ね備えることができる。本明細書でいう電子阻止層または励起子阻止層は、一つの層で電子阻止層および励起子阻止層の機能を有する層を含む意味で使用される。
(Blocking layer)
The blocking layer is a layer that can prevent diffusion of charges (electrons or holes) and / or excitons existing in the light emitting layer out of the light emitting layer. The electron blocking layer can be disposed between the light emitting layer and the hole transport layer, and blocks electrons from passing through the light emitting layer toward the hole transport layer. Similarly, a hole blocking layer can be disposed between the light emitting layer and the electron transport layer, and blocks holes from passing through the light emitting layer toward the electron transport layer. The blocking layer can also be used to prevent excitons from diffusing out of the light emitting layer. That is, each of the electron blocking layer and the hole blocking layer can also have a function as an exciton blocking layer. The electron blocking layer or the exciton blocking layer referred to in the present specification is used in a sense that a single layer includes a layer having the functions of an electron blocking layer and an exciton blocking layer.
(正孔阻止層)
正孔阻止層とは広い意味では電子輸送層の機能を有する。正孔阻止層は電子を輸送しつつ、正孔が電子輸送層へ到達することを阻止する役割があり、これにより発光層中での電子と正孔の再結合確率を向上させることができる。正孔阻止層の材料としては、後述する電子輸送層の材料を必要に応じて用いることができる。
(Hole blocking layer)
The hole blocking layer has the function of an electron transport layer in a broad sense. The hole blocking layer has a role of preventing holes from reaching the electron transporting layer while transporting electrons, thereby improving the recombination probability of electrons and holes in the light emitting layer. As a material of the hole blocking layer, a material of an electron transport layer described later can be used as needed.
(電子阻止層)
電子阻止層とは、広い意味では正孔を輸送する機能を有する。電子阻止層は正孔を輸送しつつ、電子が正孔輸送層へ到達することを阻止する役割があり、これにより発光層中での電子と正孔が再結合する確率を向上させることができる。
(Electron blocking layer)
The electron blocking layer has a function of transporting holes in a broad sense. The electron blocking layer has a role of transporting holes and preventing electrons from reaching the hole transporting layer, thereby improving the probability of recombination of electrons and holes in the light emitting layer. .
(励起子阻止層)
励起子阻止層とは、発光層内で正孔と電子が再結合することにより生じた励起子が電荷輸送層に拡散することを阻止するための層であり、本層の挿入により励起子を効率的に発光層内に閉じ込めることが可能となり、素子の発光効率を向上させることができる。励起子阻止層は発光層に隣接して陽極側、陰極側のいずれにも挿入することができ、両方同時に挿入することも可能である。すなわち、励起子阻止層を陽極側に有する場合、正孔輸送層と発光層の間に、発光層に隣接して該層を挿入することができ、陰極側に挿入する場合、発光層と陰極との間に、発光層に隣接して該層を挿入することができる。また、陽極と、発光層の陽極側に隣接する励起子阻止層との間には、正孔注入層や電子阻止層などを有することができ、陰極と、発光層の陰極側に隣接する励起子阻止層との間には、電子注入層、電子輸送層、正孔阻止層などを有することができる。阻止層を配置する場合、阻止層として用いる材料の励起一重項エネルギーおよび励起三重項エネルギーの少なくともいずれか一方は、発光材料の励起一重項エネルギーおよび励起三重項エネルギーよりも高いことが好ましい。
(Exciton blocking layer)
The exciton blocking layer is a layer for preventing excitons generated by recombination of holes and electrons in the light emitting layer from diffusing into the charge transport layer. The light emitting layer can be efficiently confined in the light emitting layer, and the light emitting efficiency of the element can be improved. The exciton blocking layer can be inserted on either the anode side or the cathode side adjacent to the light emitting layer, or both can be inserted at the same time. That is, when the exciton blocking layer is provided on the anode side, the layer can be inserted between the hole transport layer and the light emitting layer adjacent to the light emitting layer, and when the layer is inserted on the cathode side, the light emitting layer and the cathode Can be inserted adjacent to the light emitting layer. A hole injection layer, an electron blocking layer, and the like can be provided between the anode and the exciton blocking layer adjacent to the light emitting layer on the anode side. An electron injection layer, an electron transport layer, a hole blocking layer, and the like can be provided between the electron blocking layer and the electron blocking layer. When a blocking layer is provided, it is preferable that at least one of the excited singlet energy and the excited triplet energy of the material used as the blocking layer is higher than the excited singlet energy and the excited triplet energy of the light emitting material.
(正孔輸送層)
正孔輸送層とは正孔を輸送する機能を有する正孔輸送材料からなり、正孔輸送層は単層または複数層設けることができる。
正孔輸送材料としては、正孔の注入または輸送、電子の障壁性のいずれかを有するものであり、有機物、無機物のいずれであってもよい。使用できる公知の正孔輸送材料としては例えば、トリアゾール誘導体、オキサジアゾール誘導体、イミダゾール誘導体、カルバゾール誘導体、インドロカルバゾール誘導体、ポリアリールアルカン誘導体、ピラゾリン誘導体およびピラゾロン誘導体、フェニレンジアミン誘導体、アリールアミン誘導体、アミノ置換カルコン誘導体、オキサゾール誘導体、スチリルアントラセン誘導体、フルオレノン誘導体、ヒドラゾン誘導体、スチルベン誘導体、シラザン誘導体、アニリン系共重合体、また導電性高分子オリゴマー、特にチオフェンオリゴマー等が挙げられるが、ポルフィリン化合物、芳香族第3級アミン化合物およびスチリルアミン化合物を用いることが好ましく、芳香族第3級アミン化合物を用いることがより好ましい。
(Hole transport layer)
The hole transport layer is made of a hole transport material having a function of transporting holes, and the hole transport layer can be provided as a single layer or a plurality of layers.
The hole transporting material has any of hole injection or transport and electron barrier properties, and may be any of an organic substance and an inorganic substance. Known hole transport materials that can be used include, for example, triazole derivatives, oxadiazole derivatives, imidazole derivatives, carbazole derivatives, indolocarbazole derivatives, polyarylalkane derivatives, pyrazoline derivatives and pyrazolone derivatives, phenylenediamine derivatives, arylamine derivatives, Examples include amino-substituted chalcone derivatives, oxazole derivatives, styryl anthracene derivatives, fluorenone derivatives, hydrazone derivatives, stilbene derivatives, silazane derivatives, aniline-based copolymers, and conductive polymer oligomers, particularly thiophene oligomers. It is preferable to use an aromatic tertiary amine compound and a styrylamine compound, and it is more preferable to use an aromatic tertiary amine compound.
(電子輸送層)
電子輸送層とは電子を輸送する機能を有する材料からなり、電子輸送層は単層または複数層設けることができる。
電子輸送材料(正孔阻止材料を兼ねる場合もある)としては、陰極より注入された電子を発光層に伝達する機能を有していればよい。使用できる電子輸送層としては例えば、ニトロ置換フルオレン誘導体、ジフェニルキノン誘導体、チオピランジオキシド誘導体、カルボジイミド、フレオレニリデンメタン誘導体、アントラキノジメタンおよびアントロン誘導体、オキサジアゾール誘導体等が挙げられる。さらに、上記オキサジアゾール誘導体において、オキサジアゾール環の酸素原子を硫黄原子に置換したチアジアゾール誘導体、電子吸引基として知られているキノキサリン環を有するキノキサリン誘導体も、電子輸送材料として用いることができる。さらにこれらの材料を高分子鎖に導入した、またはこれらの材料を高分子の主鎖とした高分子材料を用いることもできる。
(Electron transport layer)
The electron transport layer is made of a material having a function of transporting electrons, and the electron transport layer can be provided as a single layer or a plurality of layers.
The electron transporting material (which may also serve as a hole blocking material) may have a function of transmitting electrons injected from the cathode to the light emitting layer. Examples of usable electron transporting layers include nitro-substituted fluorene derivatives, diphenylquinone derivatives, thiopyrandioxide derivatives, carbodiimides, fluorenylidenemethane derivatives, anthraquinodimethane and anthrone derivatives, and oxadiazole derivatives. Further, in the oxadiazole derivative, a thiadiazole derivative in which an oxygen atom of the oxadiazole ring is substituted with a sulfur atom, and a quinoxaline derivative having a quinoxaline ring known as an electron withdrawing group can also be used as the electron transporting material. Further, a polymer material in which these materials are introduced into a polymer chain, or a polymer material in which these materials are used as a polymer main chain can be used.
有機エレクトロルミネッセンス素子を作製する際には、一般式(1)で表される化合物を発光層に用いるだけでなく、発光層以外の層にも用いてもよい。その際、発光層に用いる一般式(1)で表される化合物と、発光層以外の層に用いる一般式(1)で表される化合物は、同一であっても異なっていてもよい。例えば、上記の注入層、阻止層、正孔阻止層、電子阻止層、励起子阻止層、正孔輸送層、電子輸送層などにも一般式(1)で表される化合物を用いてもよい。これらの層の製膜方法は特に限定されず、ドライプロセス、ウェットプロセスのどちらで作製してもよい。 When producing an organic electroluminescence element, the compound represented by the general formula (1) may be used not only for the light emitting layer but also for layers other than the light emitting layer. At that time, the compound represented by the general formula (1) used for the light emitting layer and the compound represented by the general formula (1) used for layers other than the light emitting layer may be the same or different. For example, the compound represented by the general formula (1) may be used in the above injection layer, blocking layer, hole blocking layer, electron blocking layer, exciton blocking layer, hole transport layer, electron transport layer, and the like. . The method for forming these layers is not particularly limited, and they may be formed by either a dry process or a wet process.
以下に、有機エレクトロルミネッセンス素子に用いることができる好ましい材料を具体的に例示する。ただし、本発明において用いることができる材料は、以下の例示化合物によって限定的に解釈されることはない。また、特定の機能を有する材料として例示した化合物であっても、その他の機能を有する材料として転用することも可能である。なお、以下の例示化合物の構造式におけるR、R’、R1〜R10は、各々独立に水素原子または置換基を表す。Xは環骨格を形成する炭素原子または複素原子を表し、nは3〜5の整数を表し、Yは置換基を表し、mは0以上の整数を表す。 Hereinafter, preferable materials that can be used for the organic electroluminescence device will be specifically exemplified. However, materials that can be used in the present invention are not limited to the following exemplified compounds. Further, even a compound exemplified as a material having a specific function can be diverted as a material having another function. Incidentally, R in the structural formula of the following exemplary compounds, R ', R 1 ~R 10 each independently represent a hydrogen atom or a substituent. X represents a carbon atom or a heteroatom forming a ring skeleton, n represents an integer of 3 to 5, Y represents a substituent, and m represents an integer of 0 or more.
まず、発光層のホスト材料としても用いることができる好ましい化合物を挙げる。 First, preferable compounds that can be used as a host material of the light-emitting layer are described.
次に、正孔注入材料として用いることができる好ましい化合物例を挙げる。 Next, preferable compound examples that can be used as the hole injection material are described.
次に、正孔輸送材料として用いることができる好ましい化合物例を挙げる。 Next, preferable compound examples that can be used as a hole transport material are described.
次に、電子阻止材料として用いることができる好ましい化合物例を挙げる。 Next, preferred examples of compounds that can be used as an electron blocking material will be described.
次に、正孔阻止材料として用いることができる好ましい化合物例を挙げる。 Next, examples of preferable compounds that can be used as the hole blocking material will be described.
次に、電子輸送材料として用いることができる好ましい化合物例を挙げる。 Next, preferable compound examples that can be used as an electron transport material are described.
次に、電子注入材料として用いることができる好ましい化合物例を挙げる。 Next, examples of preferable compounds that can be used as an electron injection material are described.
さらに添加可能な材料として好ましい化合物例を挙げる。例えば、安定化材料として添加すること等が考えられる。 Preferred examples of compounds that can be further added are given below. For example, it may be added as a stabilizing material.
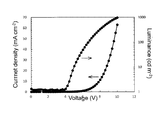
上述の方法により作製された有機エレクトロルミネッセンス素子は、得られた素子の陽極と陰極の間に電界を印加することにより発光する。このとき、励起一重項エネルギーによる発光であれば、そのエネルギーレベルに応じた波長の光が、蛍光発光および遅延蛍光発光として確認される。また、励起三重項エネルギーによる発光であれば、そのエネルギーレベルに応じた波長が、りん光として確認される。通常の蛍光は、遅延蛍光発光よりも蛍光寿命が短いため、発光寿命は蛍光と遅延蛍光で区別できる。
一方、りん光については、本発明の化合物のような通常の有機化合物では、励起三重項エネルギーは不安定で熱等に変換され、寿命が短く直ちに失活するため、室温では殆ど観測できない。通常の有機化合物の励起三重項エネルギーを測定するためには、極低温の条件での発光を観測することにより測定可能である。
The organic electroluminescence device manufactured by the above method emits light by applying an electric field between the anode and the cathode of the obtained device. At this time, if the light emission is due to the excited singlet energy, light having a wavelength corresponding to the energy level is confirmed as fluorescence emission and delayed fluorescence emission. In the case of light emission by excited triplet energy, a wavelength corresponding to the energy level is confirmed as phosphorescence. Since normal fluorescence has a shorter fluorescence lifetime than delayed fluorescence emission, the emission lifetime can be distinguished between fluorescence and delayed fluorescence.
On the other hand, phosphorescence is hardly observed at room temperature because ordinary triplet compounds such as the compound of the present invention have excited triplet energies which are unstable and are converted to heat and the like, and have a short life and are immediately deactivated. In order to measure the excited triplet energy of an ordinary organic compound, it can be measured by observing light emission at a very low temperature.
本発明の有機エレクトロルミネッセンス素子は、単一の素子、アレイ状に配置された構造からなる素子、陽極と陰極がX−Yマトリックス状に配置された構造のいずれにおいても適用することができる。本発明によれば、発光層に一般式(1)で表される化合物を含有させることにより、発光効率が大きく改善された有機発光素子が得られる。本発明の有機エレクトロルミネッセンス素子などの有機発光素子は、さらに様々な用途へ応用することが可能である。例えば、本発明の有機エレクトロルミネッセンス素子を用いて、有機エレクトロルミネッセンス表示装置を製造することが可能であり、詳細については、時任静士、安達千波矢、村田英幸共著「有機ELディスプレイ」(オーム社)を参照することができる。また、特に本発明の有機エレクトロルミネッセンス素子は、需要が大きい有機エレクトロルミネッセンス照明やバックライトに応用することもできる。 The organic electroluminescence device of the present invention can be applied to any of a single device, a device having a structure arranged in an array, and a structure in which an anode and a cathode are arranged in an XY matrix. According to the present invention, an organic light-emitting device having significantly improved luminous efficiency can be obtained by including a compound represented by the general formula (1) in a light-emitting layer. The organic light emitting device such as the organic electroluminescence device of the present invention can be further applied to various uses. For example, it is possible to manufacture an organic electroluminescence display device using the organic electroluminescence device of the present invention. ) Can be referred to. In particular, the organic electroluminescent device of the present invention can be applied to organic electroluminescent lighting and backlight, which are in great demand.
以下に合成例および実施例を挙げて本発明の特徴をさらに具体的に説明する。以下に示す材料、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す具体例により限定的に解釈されるべきものではない。なお、HOMO準位及びLUMO準位の測定は、大気中光電子分光装置 (理研計器製:AC3)およびUV/Vis/NIR分光光度計 (PerkinElmer製:LAMBDA950)を用いて行い、熱安定性の評価は、TGA−DTA (Bruker製:TG−DTA2400SA)およびDSC(NETZSCHセイ:DSC204 F1 Phoenix)を用いて行い、発光強度の経時変化の測定は、蛍光分光光度計(ホリバ製:FluoroMax−4)を用いて行い、発光特性の評価は、ソースメータ(ケースレー社製:2400シリーズ)、半導体パラメータ・アナライザ(アジレント・テクノロジー社製:E5273A)、光パワーメータ測定装置(ニューポート社製:1930C)、光学分光器(オーシャンオプティクス社製:USB2000)、分光放射計(トプコン社製:SR−3)およびストリークカメラ(浜松ホトニクス(株)製C4334型)を用いて行った。
また、本実施例において、昇華温度、分解温度は真空・常圧TGA−DTA (Bruker製:TG−DTA2400SA)により測定した。なお、昇華温度は1Paにおいて、化合物が含有する溶媒・水分等が除去され、重量が安定した後に5%重量減少が生じる温度とし、分解温度は1気圧において10%重量減少が生じる温度とした。
Hereinafter, the features of the present invention will be described more specifically with reference to Synthesis Examples and Examples. The materials, processing contents, processing procedures, and the like described below can be appropriately changed without departing from the spirit of the present invention. Therefore, the scope of the present invention should not be construed as being limited by the specific examples described below. The measurement of the HOMO level and the LUMO level was performed using an atmospheric photoelectron spectrometer (manufactured by Riken Keiki: AC3) and a UV / Vis / NIR spectrophotometer (manufactured by PerkinElmer: LAMBDA950) to evaluate the thermal stability. Was performed using TGA-DTA (manufactured by Bruker: TG-DTA2400SA) and DSC (NETZSCH Say: DSC204 F1 Phoenix), and the measurement of the change over time in the emission intensity was performed using a fluorescence spectrophotometer (manufactured by Horiba: FluoroMax-4). The light emission characteristics were evaluated using a source meter (Keisley: 2400 series), a semiconductor parameter analyzer (Agilent Technology: E5273A), an optical power meter measurement device (Newport: 1930C), and optical Spectrometer (Ocean Optics, Inc.) : USB2000), spectroradiometer (manufactured by TOPCON CORPORATION: SR-3) and a streak camera (Hamamatsu Photonics (Ltd.) C4334 type manufactured) was used.
In this example, the sublimation temperature and the decomposition temperature were measured by vacuum / normal pressure TGA-DTA (TG-DTA2400SA manufactured by Bruker). The sublimation temperature was 1 Pa, the temperature at which 5% weight loss occurred after the solvent and water, etc., contained in the compound were removed and the weight was stabilized. The decomposition temperature was the temperature at which 10% weight loss occurred at 1 atm.
(合成例1)
1Lナスフラスコに2,7−ジブロモカルバゾール(15.9g)とシアン化銅(I)(21.9g)を入れ、DMF(500mL)を加えた。150℃で24時間加熱後、放冷し、エチレンジアミン水溶液中に注いだ。析出物をろ取することで2,7−ジシアノカルバゾール(10.4g)を得た。
200mLナスフラスコに水素化ナトリウム(240mg)を入れ、ヘキサンで洗浄した。テトラヒドロフラン(75mL)、2,7−ジシアノカルバゾール(1.09g)を加え室温で1.5時間撹拌した後、4,5−ジフルオロフタロニトリル(330mg)を加え、さらに室温で22時間撹拌した。水(25mL)を加え、析出物をろ取した。ろ取物をシリカゲルカラムクロマトグラフィーに供することで精製し、化合物1(475mg、収率43%)を得た。
化合物1のDMSO−d6溶液の1H NMRスペクトルを図2に示す。
A 1 L eggplant flask was charged with 2,7-dibromocarbazole (15.9 g) and copper (I) cyanide (21.9 g), and DMF (500 mL) was added. After heating at 150 ° C. for 24 hours, the mixture was allowed to cool and poured into an aqueous solution of ethylenediamine. The precipitate was collected by filtration to obtain 2,7-dicyanocarbazole (10.4 g).
Sodium hydride (240 mg) was placed in a 200 mL eggplant flask, and washed with hexane. After adding tetrahydrofuran (75 mL) and 2,7-dicyanocarbazole (1.09 g) and stirring at room temperature for 1.5 hours, 4,5-difluorophthalonitrile (330 mg) was added and the mixture was further stirred at room temperature for 22 hours. Water (25 mL) was added, and the precipitate was collected by filtration. The filtrate was purified by subjecting it to silica gel column chromatography to obtain compound 1 (475 mg, yield 43%).
FIG. 2 shows the 1 H NMR spectrum of a DMSO-d6 solution of
(合成例2)
1Lナスフラスコに2,7−ジブロモカルバゾール(15.9g)とシアン化銅(I)(21.9g)を入れ、DMF(500mL)を加えた。150℃で24時間加熱後、放冷し、エチレンジアミン水溶液中に注いだ。析出物をろ取することで2,7−ジシアノカルバゾール(10.4g)を得た。
200mLナスフラスコに水素化ナトリウム(480mg)を入れ、ヘキサンで洗浄した。テトラヒドロフラン(150mL)、2,7−ジシアノカルバゾール(2.17g)を加え室温で1.5時間撹拌した後、テトラフルオロイソフタロニトリル(400mg)を加え、さらに室温で60時間撹拌した。反応液を濃縮後、シリカゲルカラムクロマトグラフィーに供することで精製し、化合物2(494mg、収率25%)を得た。
A 1 L eggplant flask was charged with 2,7-dibromocarbazole (15.9 g) and copper (I) cyanide (21.9 g), and DMF (500 mL) was added. After heating at 150 ° C. for 24 hours, the mixture was allowed to cool and poured into an aqueous solution of ethylenediamine. The precipitate was collected by filtration to obtain 2,7-dicyanocarbazole (10.4 g).
Sodium hydride (480 mg) was placed in a 200 mL eggplant flask, and washed with hexane. After adding tetrahydrofuran (150 mL) and 2,7-dicyanocarbazole (2.17 g) and stirring at room temperature for 1.5 hours, tetrafluoroisophthalonitrile (400 mg) was added and the mixture was further stirred at room temperature for 60 hours. After the reaction solution was concentrated, it was purified by subjecting it to silica gel column chromatography to obtain compound 2 (494 mg, yield: 25%).
[耐候性の評価]
(実施例1)
合成例1で合成した化合物1について、HOMO準位及びLUMO準位を測定した結果を表1に示し、昇華温度及び分解温度を測定した結果を表2に示す。
また、化合物1を石英ガラス上に100nm厚となるよう真空蒸着し、窒素雰囲気中または大気下で350nm励起光を連続照射し、発光強度の経時変化を測定した。窒素雰囲気中での発光強度の経時変化を図3に示し、大気下での発光強度の経時変化を図4に示す。
[Evaluation of weather resistance]
(Example 1)
Table 1 shows the results of measuring the HOMO level and the LUMO level of
Further,
(比較例1、2)
下記式で表される比較化合物1及び比較化合物2について、実施例1と同様の条件で測定したHOMO準位及びLUMO準位を表1に示し、昇華温度及び分解温度を表2に示し、350nm励起光を連続照射したときの発光強度の経時変化を図3、3に示す。
For
表1に示すように、カルバゾリル基がシアノ基で置換された化合物1および比較化合物2は、カルバゾリル基がシアノ基で置換されていない比較化合物1に比べてHOMO準位とLUMO準位がともに低いものになっている。また、表2に示すように、化合物1および比較化合物2は、比較化合物1に比べて昇華温度と分解温度が高く、熱安定性に優れている。これらの結果から、シアノベンゼンに置換しているカルバゾリル基にシアノ基を導入すると、HOMOとLUMOの準位が下がり、また、耐熱性が向上することがわかった。
一方、図3、3を見ると、シアノ基の置換位置がカルバゾリル基の2位及び7位である化合物1は、いずれの環境においても比較化合物1と同等の光安定性が得られているのに対して、シアノ基の置換位置がカルバゾリル基の3位及び6位である比較化合物2は、化合物1及び比較化合物1に比べて発光強度の経時的な低下が大きく、特に大気下において低下の程度が著しくなる。これらのことから、カルバゾリル基の3位及び6位のみへのシアノ基の導入はむしろ光安定性を低下させることが示され、カルバゾリル基の2位、7位へのシアノ基の導入により、耐光性を損なうことなく、深いHOMO/LUMO準位と高い耐熱性を達成しうることがわかった。
As shown in Table 1,
On the other hand, as shown in FIGS. 3 and 3,
[有機発光素子の作製と発光特性の評価]
(実施例2)
Ar雰囲気のグローブボックス中で化合物1のトルエン溶液(濃度10-5mol/L)を調製した。
また、石英基板上に真空蒸着法にて、真空度5x10-4Pa以下の条件にて化合物1の薄膜を100nmの厚さで形成して有機フォトルミネッセンス素子とした。
これとは別に、石英基板上に真空蒸着法にて、真空度5x10-4Pa以下の条件にて化合物1とDPEPOとを異なる蒸着源から蒸着し、化合物1の濃度が6.0質量%である薄膜を100nmの厚さで形成して有機フォトルミネッセンス素子とした。
化合物1のトルエン溶液について、330nm励起光による発光スペクトルを測定した結果を図5に示し、280nm励起光による402nm発光の過渡減衰曲線を測定した結果を図6に示す。化合物1の薄膜について、350nm励起光による発光スペクトルを測定した結果を図7に示し、340nm励起光による458nm発光の過渡減衰曲線を測定した結果を図8に示す。図6には、窒素バブリングをせずに測定した過渡減衰曲線と窒素バブリングをした後に測定した過渡減衰曲線を併せて示した。また、図6及び図8において、発光寿命の短い成分を蛍光、発光寿命が長い成分を遅延蛍光と判断した。
化合物1のトルエン溶液は、発光波長が410nmであり、フォトルミネッセンス量子効率が空気をバブリングした場合で18.0%、窒素をバブリングした場合で32.0%であった。化合物1の薄膜は、発光波長が458nmであり、フォトルミネッセンス量子効率が大気下で22.5%、窒素雰囲気下で33.5%であった。化合物1とDPEPOの薄膜は、発光波長が432nmであり、フォトルミネッセンス量子効率が大気下で34.4%、窒素雰囲気下で35.4%であった。
化合物1のトルエン溶液の発光寿命は、窒素バブリングをせずに測定した場合で、蛍光寿命τ1が8ns、遅延蛍光は観測されず、窒素バブリングをした後に測定した場合で、蛍光寿命τ1が8ns、遅延蛍光寿命τ2が43nsであった。化合物1の薄膜の蛍光寿命τ1は8.8ns、遅延蛍光寿命τ2は22.6nsであった。以上の結果から、化合物1について遅延蛍光の放射を確認することができた。
[Production of organic light-emitting device and evaluation of light-emitting characteristics]
(Example 2)
A toluene solution of Compound 1 (concentration: 10 −5 mol / L) was prepared in a glove box under an Ar atmosphere.
Further, a thin film of
Separately,
FIG. 5 shows the measurement result of the emission spectrum of the toluene solution of the
The toluene solution of the
The emission lifetime of a toluene solution of
(実施例3)
膜厚100nmのインジウム・スズ酸化物(ITO)からなる陽極が形成されたガラス基板上に、各薄膜を真空蒸着法にて、真空度4×10-4Paで積層した。まず、ITO上にNPDを40nmの厚さに形成し、この上に、mCPを10nmの厚さに形成した。次に、化合物1とUGH−3を異なる蒸着源から共蒸着し、25nmの厚さの層を形成して発光層とした。この時、化合物1の濃度は6重量%とした。次に、TPBiを50nmの厚さに形成し、この上にフッ化リチウム(LiF)を0.8nm真空蒸着し、次いでアルミニウム(Al)を100nmの厚さに蒸着することにより陰極を形成した。以上の工程により、有機エレクトロルミネッセンス素子を作製した。
作成した有機エレクトロルミネッセンス素子は500nmに発光極大波長を有しており、図9の電流密度−外部量子効率特性を示し、図10の電圧−輝度−外部量子効率特性を示した。作成した有機エレクトロルミネッセンス素子は5%を超える外部量子効率を達成しており、優れた素子であることが確認された。
(Example 3)
On a glass substrate on which an anode made of indium tin oxide (ITO) having a thickness of 100 nm was formed, each thin film was laminated at a degree of vacuum of 4 × 10 −4 Pa by a vacuum evaporation method. First, NPD was formed to a thickness of 40 nm on ITO, and mCP was formed thereon to a thickness of 10 nm. Next,
The prepared organic electroluminescence device has a light emission maximum wavelength at 500 nm, and shows current density-external quantum efficiency characteristics in FIG. 9 and voltage-luminance-external quantum efficiency characteristics in FIG. The produced organic electroluminescence device achieved an external quantum efficiency exceeding 5%, and was confirmed to be an excellent device.
本発明の化合物は、良好な発光特性を有するとともに、HOMO準位とLUMO準位がともに深く、且つ、高い耐光性と高い耐熱性を有する。このため、本発明の化合物は、有機発光素子用の発光材料として有用である。また、本発明の有機発光素子は、こうしは発光材料を含むため、高い発光効率と優れた耐候性を実現しうるものである。このため、本発明は産業上の利用可能性が高い。 The compound of the present invention has good light-emitting properties, a deep HOMO level and a deep LUMO level, and high light resistance and high heat resistance. Therefore, the compound of the present invention is useful as a light emitting material for an organic light emitting device. Further, since the organic light emitting device of the present invention contains a light emitting material, it can realize high luminous efficiency and excellent weather resistance. Therefore, the present invention has high industrial applicability.
1 基板
2 陽極
3 正孔注入層
4 正孔輸送層
5 発光層
6 電子輸送層
7 陰極
Claims (17)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015238066A JP6647514B2 (en) | 2015-12-04 | 2015-12-04 | Organic light emitting device and light emitting material and compound used therefor |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015238066A JP6647514B2 (en) | 2015-12-04 | 2015-12-04 | Organic light emitting device and light emitting material and compound used therefor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017103440A JP2017103440A (en) | 2017-06-08 |
| JP6647514B2 true JP6647514B2 (en) | 2020-02-14 |
Family
ID=59016983
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015238066A Active JP6647514B2 (en) | 2015-12-04 | 2015-12-04 | Organic light emitting device and light emitting material and compound used therefor |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6647514B2 (en) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110225906A (en) | 2016-09-09 | 2019-09-10 | 东洋纺株式会社 | Organic illuminating element, luminescent material and compound for the organic illuminating element |
| JP7165943B2 (en) * | 2017-11-01 | 2022-11-07 | 東洋紡株式会社 | Compounds having a π-electron conjugated unit and a carbazole group |
| WO2019107932A1 (en) * | 2017-11-28 | 2019-06-06 | 주식회사 엘지화학 | Compound and organic light emitting device comprising same |
| KR102160860B1 (en) * | 2017-11-28 | 2020-10-06 | 주식회사 엘지화학 | Compound and organic light-emitting device comprising the same |
| KR102181841B1 (en) * | 2017-11-28 | 2020-11-23 | 주식회사 엘지화학 | Compound and organic light-emitting device comprising the same |
| WO2019107934A1 (en) * | 2017-11-28 | 2019-06-06 | 주식회사 엘지화학 | Compound and organic light emitting device comprising same |
| KR20200057886A (en) | 2018-11-16 | 2020-05-27 | 삼성디스플레이 주식회사 | Organic electroluminescence device and compound for organic electroluminescence device |
| KR20210056495A (en) | 2019-11-08 | 2021-05-20 | 삼성디스플레이 주식회사 | Organic electroluminescence device and aromatic compound for organic electroluminescence device |
| JP2021172629A (en) * | 2020-04-28 | 2021-11-01 | 東洋紡株式会社 | Nitrogen-containing heterocyclic compound and use thereof |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5650932B2 (en) * | 2010-01-28 | 2015-01-07 | ユー・ディー・シー アイルランド リミテッド | Organic electroluminescent device and charge transport material |
| JP5898683B2 (en) * | 2011-12-05 | 2016-04-06 | 出光興産株式会社 | Material for organic electroluminescence device and organic electroluminescence device |
| JP2014135466A (en) * | 2012-04-09 | 2014-07-24 | Kyushu Univ | Organic light emitting element, and light emitting material and compound used in the same |
| JP5366106B1 (en) * | 2012-04-09 | 2013-12-11 | 国立大学法人九州大学 | ORGANIC LIGHT EMITTING ELEMENT AND LIGHT EMITTING MATERIAL AND COMPOUND USED THERE |
| JP6314974B2 (en) * | 2013-03-29 | 2018-04-25 | コニカミノルタ株式会社 | ORGANIC ELECTROLUMINESCENT ELEMENT, LIGHTING DEVICE, DISPLAY DEVICE, LIGHT EMITTING THIN FILM AND COMPOSITION AND LIGHT EMITTING METHOD |
| KR101792445B1 (en) * | 2013-08-16 | 2017-10-31 | 코니카 미놀타 가부시키가이샤 | Organic electroluminescent element, electronic device, light emitting device, and light emitting material |
| US10403825B2 (en) * | 2014-02-27 | 2019-09-03 | Universal Display Corporation | Organic electroluminescent materials and devices |
| KR102076887B1 (en) * | 2014-02-28 | 2020-02-12 | 가부시키가이샤 큐럭스 | Luminescent material, organic luminescent element, and compound |
| US10734587B2 (en) * | 2014-03-13 | 2020-08-04 | Merck Patent Gmbh | Formulations of luminescent compounds |
| EP3119770B1 (en) * | 2014-03-17 | 2018-05-02 | Idemitsu Kosan Co., Ltd | New dibenzofurans and dibenzothiophenes |
-
2015
- 2015-12-04 JP JP2015238066A patent/JP6647514B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2017103440A (en) | 2017-06-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6526625B2 (en) | Luminescent material, organic light emitting device and compound | |
| JP6383538B2 (en) | Luminescent materials, organic light emitting devices and compounds | |
| JP6263524B2 (en) | COMPOUND, LIGHT EMITTING MATERIAL AND ORGANIC LIGHT EMITTING DEVICE | |
| JP6293417B2 (en) | COMPOUND, LIGHT EMITTING MATERIAL AND ORGANIC LIGHT EMITTING DEVICE | |
| JP6284370B2 (en) | Luminescent materials, organic light emitting devices and compounds | |
| JP6326050B2 (en) | COMPOUND, LIGHT EMITTING MATERIAL AND ORGANIC LIGHT EMITTING DEVICE | |
| JP6668152B2 (en) | Compound, light emitting material and organic light emitting device | |
| JP6225111B2 (en) | Luminescent material, compound, and organic light emitting device using the same | |
| JP6367189B2 (en) | Luminescent materials, organic light emitting devices and compounds | |
| JP6647514B2 (en) | Organic light emitting device and light emitting material and compound used therefor | |
| WO2013154064A1 (en) | Organic light emitting element, and light emitting material and compound used in same | |
| WO2013161437A1 (en) | Light-emitting material and organic light-emitting element | |
| WO2015137244A1 (en) | Light emitting material, organic light emitting element and compound | |
| WO2015129714A1 (en) | Light-emitting material, organic light-emitting element, and compound | |
| JP2017119663A (en) | Compound, light-emitting material, and organic light-emitting device | |
| WO2018047948A1 (en) | Organic light-emitting element, and light-emitting material and compound for use therein | |
| WO2014126076A1 (en) | Compound, light-emitting material, and organic light-emitting element | |
| WO2018043241A1 (en) | Organic light-emitting element, and luminescent material and compound used therefor | |
| JP6783059B2 (en) | Compounds, carrier transport materials and organic light emitting devices | |
| JP6534250B2 (en) | Host material for delaying phosphor, organic light emitting device and compound | |
| JP2018111751A (en) | Light emitting material, compound and organic light emitting element | |
| JP2016084283A (en) | Compound, light-emitting material, and organic light-emitting element | |
| JP2016084284A (en) | Compound, light-emitting material, and organic light-emitting element |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20151207 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20170303 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20181204 |
|
| TRDD | Decision of grant or rejection written | ||
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20191016 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20191108 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20191108 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20191203 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20191211 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6647514 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |