JP6443060B2 - Microbe culture sheet - Google Patents
Microbe culture sheet Download PDFInfo
- Publication number
- JP6443060B2 JP6443060B2 JP2015005146A JP2015005146A JP6443060B2 JP 6443060 B2 JP6443060 B2 JP 6443060B2 JP 2015005146 A JP2015005146 A JP 2015005146A JP 2015005146 A JP2015005146 A JP 2015005146A JP 6443060 B2 JP6443060 B2 JP 6443060B2
- Authority
- JP
- Japan
- Prior art keywords
- culture
- sheet
- layer
- culture layer
- microorganism
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 244000005700 microbiome Species 0.000 claims description 118
- 239000000758 substrate Substances 0.000 claims description 81
- 102000004190 Enzymes Human genes 0.000 claims description 55
- 108090000790 Enzymes Proteins 0.000 claims description 55
- 239000001267 polyvinylpyrrolidone Substances 0.000 claims description 46
- 229920000036 polyvinylpyrrolidone Polymers 0.000 claims description 46
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 claims description 46
- 239000004014 plasticizer Substances 0.000 claims description 34
- 239000003349 gelling agent Substances 0.000 claims description 32
- 241000894006 Bacteria Species 0.000 claims description 31
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 claims description 29
- 239000002202 Polyethylene glycol Substances 0.000 claims description 26
- 229920001223 polyethylene glycol Polymers 0.000 claims description 26
- 238000000034 method Methods 0.000 claims description 25
- 102100024295 Maltase-glucoamylase Human genes 0.000 claims description 24
- 108010028144 alpha-Glucosidases Proteins 0.000 claims description 24
- 235000015097 nutrients Nutrition 0.000 claims description 22
- 102000005936 beta-Galactosidase Human genes 0.000 claims description 16
- 108010005774 beta-Galactosidase Proteins 0.000 claims description 16
- 239000003795 chemical substances by application Substances 0.000 claims description 16
- 229940058015 1,3-butylene glycol Drugs 0.000 claims description 13
- 235000019437 butane-1,3-diol Nutrition 0.000 claims description 13
- 238000012258 culturing Methods 0.000 claims description 10
- 241000191967 Staphylococcus aureus Species 0.000 claims description 9
- 229920003023 plastic Polymers 0.000 claims description 4
- 239000002985 plastic film Substances 0.000 claims description 3
- 239000010410 layer Substances 0.000 description 220
- 239000000243 solution Substances 0.000 description 50
- 239000002609 medium Substances 0.000 description 49
- 238000012360 testing method Methods 0.000 description 39
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 38
- 238000006243 chemical reaction Methods 0.000 description 32
- 238000011161 development Methods 0.000 description 25
- 230000018109 developmental process Effects 0.000 description 25
- 239000000463 material Substances 0.000 description 25
- 239000000523 sample Substances 0.000 description 23
- 239000012085 test solution Substances 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- 235000011187 glycerol Nutrition 0.000 description 19
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 18
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 15
- 229920001817 Agar Polymers 0.000 description 14
- 239000008272 agar Substances 0.000 description 14
- 230000000694 effects Effects 0.000 description 14
- -1 alginic acid salt Chemical class 0.000 description 13
- 238000001035 drying Methods 0.000 description 13
- 230000007261 regionalization Effects 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- 235000002639 sodium chloride Nutrition 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- 239000007788 liquid Substances 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 239000001888 Peptone Substances 0.000 description 10
- 108010080698 Peptones Proteins 0.000 description 10
- 238000004040 coloring Methods 0.000 description 10
- 235000019319 peptone Nutrition 0.000 description 10
- 239000011347 resin Substances 0.000 description 10
- 229920005989 resin Polymers 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- 241000588724 Escherichia coli Species 0.000 description 9
- 239000011780 sodium chloride Substances 0.000 description 9
- MIAKOEWBCMPCQR-YBXAARCKSA-N (2s,3r,4s,5r,6r)-2-(4-aminophenoxy)-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(N)=CC=C1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MIAKOEWBCMPCQR-YBXAARCKSA-N 0.000 description 8
- 239000000853 adhesive Substances 0.000 description 8
- 230000001070 adhesive effect Effects 0.000 description 8
- 239000012790 adhesive layer Substances 0.000 description 8
- 230000002209 hydrophobic effect Effects 0.000 description 8
- OPIFSICVWOWJMJ-AEOCFKNESA-N 5-bromo-4-chloro-3-indolyl beta-D-galactoside Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-AEOCFKNESA-N 0.000 description 7
- 229940041514 candida albicans extract Drugs 0.000 description 7
- 239000011248 coating agent Substances 0.000 description 7
- 238000000576 coating method Methods 0.000 description 7
- 230000000052 comparative effect Effects 0.000 description 7
- 239000010408 film Substances 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- 238000007639 printing Methods 0.000 description 7
- 239000012138 yeast extract Substances 0.000 description 7
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 6
- 229920002907 Guar gum Polymers 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- 239000003242 anti bacterial agent Substances 0.000 description 6
- 239000000284 extract Substances 0.000 description 6
- 235000012041 food component Nutrition 0.000 description 6
- 239000008103 glucose Substances 0.000 description 6
- 239000000665 guar gum Substances 0.000 description 6
- 235000010417 guar gum Nutrition 0.000 description 6
- 229960002154 guar gum Drugs 0.000 description 6
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 6
- 238000005507 spraying Methods 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000007689 inspection Methods 0.000 description 5
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 5
- 229920001282 polysaccharide Polymers 0.000 description 5
- 239000005017 polysaccharide Substances 0.000 description 5
- 150000004804 polysaccharides Chemical class 0.000 description 5
- 230000001954 sterilising effect Effects 0.000 description 5
- 238000004659 sterilization and disinfection Methods 0.000 description 5
- YUDPTGPSBJVHCN-JZYAIQKZSA-N 4-Methylumbelliferyl-alpha-D-glucopyranoside Chemical compound C1=CC=2C(C)=CC(=O)OC=2C=C1O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O YUDPTGPSBJVHCN-JZYAIQKZSA-N 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 4
- 239000002390 adhesive tape Substances 0.000 description 4
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 4
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 4
- 235000019797 dipotassium phosphate Nutrition 0.000 description 4
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 4
- 239000012137 tryptone Substances 0.000 description 4
- 108010078777 Colistin Proteins 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 210000000941 bile Anatomy 0.000 description 3
- 238000011109 contamination Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 239000000411 inducer Substances 0.000 description 3
- 238000011081 inoculation Methods 0.000 description 3
- 235000013372 meat Nutrition 0.000 description 3
- 229940054269 sodium pyruvate Drugs 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- CHRVKCMQIZYLNM-MBJXGIAVSA-N (2s,3r,4s,5r,6r)-2-[(5-bromo-6-chloro-1h-indol-3-yl)oxy]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC(Cl)=C(Br)C=C12 CHRVKCMQIZYLNM-MBJXGIAVSA-N 0.000 description 2
- KJCVRFUGPWSIIH-UHFFFAOYSA-N 1-naphthol Chemical compound C1=CC=C2C(O)=CC=CC2=C1 KJCVRFUGPWSIIH-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 102000002322 Egg Proteins Human genes 0.000 description 2
- 108010000912 Egg Proteins Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- YJQPYGGHQPGBLI-UHFFFAOYSA-N Novobiocin Natural products O1C(C)(C)C(OC)C(OC(N)=O)C(O)C1OC1=CC=C(C(O)=C(NC(=O)C=2C=C(CC=C(C)C)C(O)=CC=2)C(=O)O2)C2=C1C YJQPYGGHQPGBLI-UHFFFAOYSA-N 0.000 description 2
- 239000004820 Pressure-sensitive adhesive Substances 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 241000607598 Vibrio Species 0.000 description 2
- 239000003522 acrylic cement Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000003833 bile salt Substances 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 229960003346 colistin Drugs 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 239000013039 cover film Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 2
- KAKKHKRHCKCAGH-UHFFFAOYSA-L disodium;(4-nitrophenyl) phosphate;hexahydrate Chemical compound O.O.O.O.O.O.[Na+].[Na+].[O-][N+](=O)C1=CC=C(OP([O-])([O-])=O)C=C1 KAKKHKRHCKCAGH-UHFFFAOYSA-L 0.000 description 2
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 2
- 229940043264 dodecyl sulfate Drugs 0.000 description 2
- 235000013345 egg yolk Nutrition 0.000 description 2
- 210000002969 egg yolk Anatomy 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000007646 gravure printing Methods 0.000 description 2
- PCKPVGOLPKLUHR-UHFFFAOYSA-N indoxyl Chemical group C1=CC=C2C(O)=CNC2=C1 PCKPVGOLPKLUHR-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 238000010030 laminating Methods 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 238000009629 microbiological culture Methods 0.000 description 2
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 2
- 235000019799 monosodium phosphate Nutrition 0.000 description 2
- JORAUNFTUVJTNG-BSTBCYLQSA-N n-[(2s)-4-amino-1-[[(2s,3r)-1-[[(2s)-4-amino-1-oxo-1-[[(3s,6s,9s,12s,15r,18s,21s)-6,9,18-tris(2-aminoethyl)-3-[(1r)-1-hydroxyethyl]-12,15-bis(2-methylpropyl)-2,5,8,11,14,17,20-heptaoxo-1,4,7,10,13,16,19-heptazacyclotricos-21-yl]amino]butan-2-yl]amino]-3-h Chemical compound CC(C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@H]([C@@H](C)O)CN[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CCN)NC1=O.CCC(C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@H]([C@@H](C)O)CN[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CCN)NC1=O JORAUNFTUVJTNG-BSTBCYLQSA-N 0.000 description 2
- 229960002950 novobiocin Drugs 0.000 description 2
- YJQPYGGHQPGBLI-KGSXXDOSSA-N novobiocin Chemical compound O1C(C)(C)[C@H](OC)[C@@H](OC(N)=O)[C@@H](O)[C@@H]1OC1=CC=C(C(O)=C(NC(=O)C=2C=C(CC=C(C)C)C(O)=CC=2)C(=O)O2)C2=C1C YJQPYGGHQPGBLI-KGSXXDOSSA-N 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 238000000059 patterning Methods 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 239000000049 pigment Substances 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- XDJYMJULXQKGMM-UHFFFAOYSA-N polymyxin E1 Natural products CCC(C)CCCCC(=O)NC(CCN)C(=O)NC(C(C)O)C(=O)NC(CCN)C(=O)NC1CCNC(=O)C(C(C)O)NC(=O)C(CCN)NC(=O)C(CCN)NC(=O)C(CC(C)C)NC(=O)C(CC(C)C)NC(=O)C(CCN)NC1=O XDJYMJULXQKGMM-UHFFFAOYSA-N 0.000 description 2
- KNIWPHSUTGNZST-UHFFFAOYSA-N polymyxin E2 Natural products CC(C)CCCCC(=O)NC(CCN)C(=O)NC(C(C)O)C(=O)NC(CCN)C(=O)NC1CCNC(=O)C(C(C)O)NC(=O)C(CCN)NC(=O)C(CCN)NC(=O)C(CC(C)C)NC(=O)C(CC(C)C)NC(=O)C(CCN)NC1=O KNIWPHSUTGNZST-UHFFFAOYSA-N 0.000 description 2
- 229920000098 polyolefin Polymers 0.000 description 2
- 235000010333 potassium nitrate Nutrition 0.000 description 2
- 239000004323 potassium nitrate Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000012488 sample solution Substances 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000001974 tryptic soy broth Substances 0.000 description 2
- 108010050327 trypticase-soy broth Proteins 0.000 description 2
- ORHBXUUXSCNDEV-UHFFFAOYSA-N umbelliferone Chemical class C1=CC(=O)OC2=CC(O)=CC=C21 ORHBXUUXSCNDEV-UHFFFAOYSA-N 0.000 description 2
- LZFNFLTVAMOOPJ-PZRMXXKTSA-N (2r,3r,4s,5r,6s)-2-(hydroxymethyl)-6-methylsulfanyloxane-3,4,5-triol Chemical compound CS[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O LZFNFLTVAMOOPJ-PZRMXXKTSA-N 0.000 description 1
- NEZJDVYDSZTRFS-ZIQFBCGOSA-N (2r,3s,4s,5r,6r)-2-(hydroxymethyl)-6-phenoxyoxane-3,4,5-triol Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC1=CC=CC=C1 NEZJDVYDSZTRFS-ZIQFBCGOSA-N 0.000 description 1
- OQWBAXBVBGNSPW-RKQHYHRCSA-N (2s,3r,4s,5s,6r)-2-[(6-chloro-1h-indol-3-yl)oxy]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC(Cl)=CC=C12 OQWBAXBVBGNSPW-RKQHYHRCSA-N 0.000 description 1
- IPYWNMVPZOAFOQ-NABDTECSSA-N (6r,7r)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-(carboxymethoxyimino)acetyl]amino]-3-ethenyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid;trihydrate Chemical compound O.O.O.S1C(N)=NC(C(=N\OCC(O)=O)\C(=O)N[C@@H]2C(N3C(=C(C=C)CS[C@@H]32)C(O)=O)=O)=C1 IPYWNMVPZOAFOQ-NABDTECSSA-N 0.000 description 1
- 150000004345 1,2-dihydroxyanthraquinones Chemical class 0.000 description 1
- 150000005206 1,2-dihydroxybenzenes Chemical class 0.000 description 1
- PKDBCJSWQUOKDO-UHFFFAOYSA-M 2,3,5-triphenyltetrazolium chloride Chemical compound [Cl-].C1=CC=CC=C1C(N=[N+]1C=2C=CC=CC=2)=NN1C1=CC=CC=C1 PKDBCJSWQUOKDO-UHFFFAOYSA-M 0.000 description 1
- NCJWJQNOYLTOCG-UHFFFAOYSA-M 2-(4-methylphenyl)-3,5-diphenyltetrazol-2-ium;chloride Chemical compound [Cl-].C1=CC(C)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 NCJWJQNOYLTOCG-UHFFFAOYSA-M 0.000 description 1
- GOXQRTZXKQZDDN-UHFFFAOYSA-N 2-Ethylhexyl acrylate Chemical compound CCCCC(CC)COC(=O)C=C GOXQRTZXKQZDDN-UHFFFAOYSA-N 0.000 description 1
- IQUPABOKLQSFBK-UHFFFAOYSA-N 2-nitrophenol Chemical class OC1=CC=CC=C1[N+]([O-])=O IQUPABOKLQSFBK-UHFFFAOYSA-N 0.000 description 1
- IFBHRQDFSNCLOZ-ZIQFBCGOSA-N 4-nitrophenyl alpha-D-glucoside Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC1=CC=C([N+]([O-])=O)C=C1 IFBHRQDFSNCLOZ-ZIQFBCGOSA-N 0.000 description 1
- OPIFSICVWOWJMJ-HRNXZZBMSA-N 5-bromo-4-chloro-3-indolyl alpha-D-glucoside Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-HRNXZZBMSA-N 0.000 description 1
- QRXMUCSWCMTJGU-UHFFFAOYSA-N 5-bromo-4-chloro-3-indolyl phosphate Chemical compound C1=C(Br)C(Cl)=C2C(OP(O)(=O)O)=CNC2=C1 QRXMUCSWCMTJGU-UHFFFAOYSA-N 0.000 description 1
- RPABDKTXMKOGKI-OYTUFZPASA-N 6-methyl-n-[2-[(2s,5s,8s,11s,14s,17s,20s,23s)-8,11,14,20-tetrakis(2-aminoethyl)-5-[(1r)-1-hydroxyethyl]-17,23-bis(2-methylpropyl)-3,6,9,12,15,18,21,24-octaoxo-1,4,7,10,13,16,19,22-octazacyclotetracos-2-yl]ethyl]octanamide Chemical compound CCC(C)CCCCC(=O)NCC[C@@H]1NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H]([C@@H](C)O)NC1=O RPABDKTXMKOGKI-OYTUFZPASA-N 0.000 description 1
- CFNMUZCFSDMZPQ-GHXNOFRVSA-N 7-[(z)-3-methyl-4-(4-methyl-5-oxo-2h-furan-2-yl)but-2-enoxy]chromen-2-one Chemical compound C=1C=C2C=CC(=O)OC2=CC=1OC/C=C(/C)CC1OC(=O)C(C)=C1 CFNMUZCFSDMZPQ-GHXNOFRVSA-N 0.000 description 1
- RSWGJHLUYNHPMX-UHFFFAOYSA-N Abietic-Saeure Natural products C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 description 1
- 241000158640 Acanthodactylus aureus Species 0.000 description 1
- 229930183010 Amphotericin Natural products 0.000 description 1
- QGGFZZLFKABGNL-UHFFFAOYSA-N Amphotericin A Natural products OC1C(N)C(O)C(C)OC1OC1C=CC=CC=CC=CCCC=CC=CC(C)C(O)C(C)C(C)OC(=O)CC(O)CC(O)CCC(O)C(O)CC(O)CC(O)(CC(O)C2C(O)=O)OC2C1 QGGFZZLFKABGNL-UHFFFAOYSA-N 0.000 description 1
- WZPBZJONDBGPKJ-UHFFFAOYSA-N Antibiotic SQ 26917 Natural products O=C1N(S(O)(=O)=O)C(C)C1NC(=O)C(=NOC(C)(C)C(O)=O)C1=CSC(N)=N1 WZPBZJONDBGPKJ-UHFFFAOYSA-N 0.000 description 1
- 108010001478 Bacitracin Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 244000303965 Cyamopsis psoralioides Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 241000588747 Klebsiella pneumoniae Species 0.000 description 1
- OJMMVQQUTAEWLP-UHFFFAOYSA-N Lincomycin Natural products CN1CC(CCC)CC1C(=O)NC(C(C)O)C1C(O)C(O)C(O)C(SC)O1 OJMMVQQUTAEWLP-UHFFFAOYSA-N 0.000 description 1
- 229920000161 Locust bean gum Polymers 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 229920000877 Melamine resin Polymers 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- UBQYURCVBFRUQT-UHFFFAOYSA-N N-benzoyl-Ferrioxamine B Chemical compound CC(=O)N(O)CCCCCNC(=O)CCC(=O)N(O)CCCCCNC(=O)CCC(=O)N(O)CCCCCN UBQYURCVBFRUQT-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- TURHTASYUMWZCC-UHFFFAOYSA-N Olaquindox [BAN:INN] Chemical compound C1=CC=C2N([O-])C(C)=C(C(=O)NCCO)[N+](=O)C2=C1 TURHTASYUMWZCC-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 1
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 1
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 108010093965 Polymyxin B Proteins 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- KHPCPRHQVVSZAH-HUOMCSJISA-N Rosin Natural products O(C/C=C/c1ccccc1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 KHPCPRHQVVSZAH-HUOMCSJISA-N 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- IDCBOTIENDVCBQ-UHFFFAOYSA-N TEPP Chemical compound CCOP(=O)(OCC)OP(=O)(OCC)OCC IDCBOTIENDVCBQ-UHFFFAOYSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- XQAXGZLFSSPBMK-UHFFFAOYSA-M [7-(dimethylamino)phenothiazin-3-ylidene]-dimethylazanium;chloride;trihydrate Chemical compound O.O.O.[Cl-].C1=CC(=[N+](C)C)C=C2SC3=CC(N(C)C)=CC=C3N=C21 XQAXGZLFSSPBMK-UHFFFAOYSA-M 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000005250 alkyl acrylate group Chemical group 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229940009444 amphotericin Drugs 0.000 description 1
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- PLKYGPRDCKGEJH-UHFFFAOYSA-N azane;2-hydroxypropane-1,2,3-tricarboxylic acid;iron Chemical compound N.[Fe].OC(=O)CC(O)(C(O)=O)CC(O)=O PLKYGPRDCKGEJH-UHFFFAOYSA-N 0.000 description 1
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 1
- 229960003644 aztreonam Drugs 0.000 description 1
- 229960003071 bacitracin Drugs 0.000 description 1
- 229930184125 bacitracin Natural products 0.000 description 1
- CLKOFPXJLQSYAH-ABRJDSQDSA-N bacitracin A Chemical compound C1SC([C@@H](N)[C@@H](C)CC)=N[C@@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]1C(=O)N[C@H](CCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2N=CNC=2)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)NCCCC1 CLKOFPXJLQSYAH-ABRJDSQDSA-N 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 238000011955 best available control technology Methods 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 229960001506 brilliant green Drugs 0.000 description 1
- HXCILVUBKWANLN-UHFFFAOYSA-N brilliant green cation Chemical compound C1=CC(N(CC)CC)=CC=C1C(C=1C=CC=CC=1)=C1C=CC(=[N+](CC)CC)C=C1 HXCILVUBKWANLN-UHFFFAOYSA-N 0.000 description 1
- NUHCTOLBWMJMLX-UHFFFAOYSA-N bromothymol blue Chemical compound BrC1=C(O)C(C(C)C)=CC(C2(C3=CC=CC=C3S(=O)(=O)O2)C=2C(=C(Br)C(O)=C(C(C)C)C=2)C)=C1C NUHCTOLBWMJMLX-UHFFFAOYSA-N 0.000 description 1
- CQEYYJKEWSMYFG-UHFFFAOYSA-N butyl acrylate Chemical compound CCCCOC(=O)C=C CQEYYJKEWSMYFG-UHFFFAOYSA-N 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 229960002129 cefixime Drugs 0.000 description 1
- 229960000484 ceftazidime Drugs 0.000 description 1
- NMVPEQXCMGEDNH-TZVUEUGBSA-N ceftazidime pentahydrate Chemical compound O.O.O.O.O.S([C@@H]1[C@@H](C(N1C=1C([O-])=O)=O)NC(=O)\C(=N/OC(C)(C)C(O)=O)C=2N=C(N)SC=2)CC=1C[N+]1=CC=CC=C1 NMVPEQXCMGEDNH-TZVUEUGBSA-N 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 239000003593 chromogenic compound Substances 0.000 description 1
- 230000005757 colony formation Effects 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000007334 copolymerization reaction Methods 0.000 description 1
- 238000003851 corona treatment Methods 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 229960000958 deferoxamine Drugs 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 230000014670 detection of bacterium Effects 0.000 description 1
- 238000007607 die coating method Methods 0.000 description 1
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical class OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 1
- 238000002845 discoloration Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000004049 embossing Methods 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 229960002413 ferric citrate Drugs 0.000 description 1
- 150000002212 flavone derivatives Chemical class 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 230000005251 gamma ray Effects 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- ZTQSADJAYQOCDD-UHFFFAOYSA-N ginsenoside-Rd2 Natural products C1CC(C2(CCC3C(C)(C)C(OC4C(C(O)C(O)C(CO)O4)O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC(C(C(O)C1O)O)OC1COC1OCC(O)C(O)C1O ZTQSADJAYQOCDD-UHFFFAOYSA-N 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 150000002314 glycerols Chemical class 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229910017053 inorganic salt Inorganic materials 0.000 description 1
- NPFOYSMITVOQOS-UHFFFAOYSA-K iron(III) citrate Chemical compound [Fe+3].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NPFOYSMITVOQOS-UHFFFAOYSA-K 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 235000021374 legumes Nutrition 0.000 description 1
- 238000007644 letterpress printing Methods 0.000 description 1
- 229960005287 lincomycin Drugs 0.000 description 1
- OJMMVQQUTAEWLP-KIDUDLJLSA-N lincomycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@@H](C)O)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 OJMMVQQUTAEWLP-KIDUDLJLSA-N 0.000 description 1
- 229940073577 lithium chloride Drugs 0.000 description 1
- 235000010420 locust bean gum Nutrition 0.000 description 1
- 239000000711 locust bean gum Substances 0.000 description 1
- FDZZZRQASAIRJF-UHFFFAOYSA-M malachite green Chemical compound [Cl-].C1=CC(N(C)C)=CC=C1C(C=1C=CC=CC=1)=C1C=CC(=[N+](C)C)C=C1 FDZZZRQASAIRJF-UHFFFAOYSA-M 0.000 description 1
- 229940107698 malachite green Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 150000007974 melamines Chemical class 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229960000907 methylthioninium chloride Drugs 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229960000210 nalidixic acid Drugs 0.000 description 1
- MHWLWQUZZRMNGJ-UHFFFAOYSA-N nalidixic acid Chemical compound C1=C(C)N=C2N(CC)C=C(C(O)=O)C(=O)C2=C1 MHWLWQUZZRMNGJ-UHFFFAOYSA-N 0.000 description 1
- 150000004780 naphthols Chemical class 0.000 description 1
- 125000005184 naphthylamino group Chemical class C1(=CC=CC2=CC=CC=C12)N* 0.000 description 1
- 239000006225 natural substrate Substances 0.000 description 1
- PGSADBUBUOPOJS-UHFFFAOYSA-N neutral red Chemical compound Cl.C1=C(C)C(N)=CC2=NC3=CC(N(C)C)=CC=C3N=C21 PGSADBUBUOPOJS-UHFFFAOYSA-N 0.000 description 1
- 229950010210 olaquindox Drugs 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- FXADMRZICBQPQY-UHFFFAOYSA-N orthotelluric acid Chemical compound O[Te](O)(O)(O)(O)O FXADMRZICBQPQY-UHFFFAOYSA-N 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000007793 ph indicator Substances 0.000 description 1
- 239000005011 phenolic resin Substances 0.000 description 1
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 1
- 125000001644 phenoxazinyl group Chemical class C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 150000003021 phthalic acid derivatives Chemical class 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920006267 polyester film Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229940057847 polyethylene glycol 600 Drugs 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920000024 polymyxin B Polymers 0.000 description 1
- 229960005266 polymyxin b Drugs 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229920006316 polyvinylpyrrolidine Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000000197 pyrolysis Methods 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical class C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- HSSLDCABUXLXKM-UHFFFAOYSA-N resorufin Chemical class C1=CC(=O)C=C2OC3=CC(O)=CC=C3N=C21 HSSLDCABUXLXKM-UHFFFAOYSA-N 0.000 description 1
- JQXXHWHPUNPDRT-WLSIYKJHSA-N rifampicin Chemical compound O([C@](C1=O)(C)O/C=C/[C@@H]([C@H]([C@@H](OC(C)=O)[C@H](C)[C@H](O)[C@H](C)[C@@H](O)[C@@H](C)\C=C\C=C(C)/C(=O)NC=2C(O)=C3C([O-])=C4C)C)OC)C4=C1C3=C(O)C=2\C=N\N1CC[NH+](C)CC1 JQXXHWHPUNPDRT-WLSIYKJHSA-N 0.000 description 1
- 229960001225 rifampicin Drugs 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 229940082569 selenite Drugs 0.000 description 1
- MCAHWIHFGHIESP-UHFFFAOYSA-L selenite(2-) Chemical compound [O-][Se]([O-])=O MCAHWIHFGHIESP-UHFFFAOYSA-L 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- IFGCUJZIWBUILZ-UHFFFAOYSA-N sodium 2-[[2-[[hydroxy-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyphosphoryl]amino]-4-methylpentanoyl]amino]-3-(1H-indol-3-yl)propanoic acid Chemical compound [Na+].C=1NC2=CC=CC=C2C=1CC(C(O)=O)NC(=O)C(CC(C)C)NP(O)(=O)OC1OC(C)C(O)C(O)C1O IFGCUJZIWBUILZ-UHFFFAOYSA-N 0.000 description 1
- 229960002668 sodium chloride Drugs 0.000 description 1
- NRHMKIHPTBHXPF-TUJRSCDTSA-M sodium cholate Chemical compound [Na+].C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC([O-])=O)C)[C@@]2(C)[C@@H](O)C1 NRHMKIHPTBHXPF-TUJRSCDTSA-M 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- FHHPUSMSKHSNKW-SMOYURAASA-M sodium deoxycholate Chemical compound [Na+].C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC([O-])=O)C)[C@@]2(C)[C@@H](O)C1 FHHPUSMSKHSNKW-SMOYURAASA-M 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- DJIKQWNNMSCYPY-UHFFFAOYSA-M sodium;3,9-diethyltridecan-6-yl sulfate Chemical compound [Na+].CCCCC(CC)CCC(OS([O-])(=O)=O)CCC(CC)CC DJIKQWNNMSCYPY-UHFFFAOYSA-M 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000010345 tape casting Methods 0.000 description 1
- WBWWGRHZICKQGZ-HZAMXZRMSA-N taurocholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCS(O)(=O)=O)C)[C@@]2(C)[C@@H](O)C1 WBWWGRHZICKQGZ-HZAMXZRMSA-N 0.000 description 1
- SITVSCPRJNYAGV-UHFFFAOYSA-L tellurite Chemical compound [O-][Te]([O-])=O SITVSCPRJNYAGV-UHFFFAOYSA-L 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- MUUHXGOJWVMBDY-UHFFFAOYSA-L tetrazolium blue Chemical compound [Cl-].[Cl-].COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC=CC=2)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 MUUHXGOJWVMBDY-UHFFFAOYSA-L 0.000 description 1
- RONADMZTCCPLEF-UHFFFAOYSA-M tetrazolium violet Chemical compound [Cl-].C1=CC=CC=C1C(N=[N+]1C=2C3=CC=CC=C3C=CC=2)=NN1C1=CC=CC=C1 RONADMZTCCPLEF-UHFFFAOYSA-M 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- PRZSXZWFJHEZBJ-UHFFFAOYSA-N thymol blue Chemical compound C1=C(O)C(C(C)C)=CC(C2(C3=CC=CC=C3S(=O)(=O)O2)C=2C(=CC(O)=C(C(C)C)C=2)C)=C1C PRZSXZWFJHEZBJ-UHFFFAOYSA-N 0.000 description 1
- KHPCPRHQVVSZAH-UHFFFAOYSA-N trans-cinnamyl beta-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OCC=CC1=CC=CC=C1 KHPCPRHQVVSZAH-UHFFFAOYSA-N 0.000 description 1
- 238000010023 transfer printing Methods 0.000 description 1
- 229960004799 tryptophan Drugs 0.000 description 1
- 239000004034 viscosity adjusting agent Substances 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
Images
Landscapes
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Description
本発明は、微生物培養シートに関し、好ましくは微生物を検出するために用いられる微生物培養シートに関する。 The present invention relates to a microorganism culture sheet, and preferably relates to a microorganism culture sheet used for detecting microorganisms.
試料中の微生物の存在を確認し、又は微生物数を測定する方法としては、寒天平板混釈法がある。この寒天平板混釈法では、あらかじめ滅菌したシャーレ中に形成した寒天培地を使用するので、寒天培地を高圧蒸気滅菌するためのオートクレーブや、微生物検査を無菌的に行うための検査室が必要となる。また、微生物のサンプリング、試料液の調製、分注、培地との混釈などの操作が要求される。そこで、このような一連の操作を必要とせず、簡便に微生物検査を行うことができる乾燥培地を備える微生物培養シートが開発されている。 As a method for confirming the presence of microorganisms in a sample or measuring the number of microorganisms, there is an agar plate mixing method. In this agar plate mixing method, an agar medium formed in a pre-sterilized petri dish is used, so an autoclave for autoclaving the agar medium and an inspection room for performing microbiological examination aseptically are required. . In addition, operations such as sampling of microorganisms, preparation of sample solution, dispensing, and pour with a culture medium are required. Therefore, a microorganism culture sheet having a dry medium that can easily perform a microorganism test without requiring such a series of operations has been developed.
例えば、特許文献1には、基材シートと、前記基材シートの上に形成された培養層と、前記培養層を被覆するカバーシートと、を有する微生物培養シートが記載されている。前記培養シートは、ポリビニルピロリドンと、ゲル化剤、栄養成分、発色指示薬、選択剤及び基質からなる群から選択される少なくとも1種と、を含有する培地液がパターン形成されたものである。 For example, Patent Literature 1 describes a microorganism culture sheet having a base sheet, a culture layer formed on the base sheet, and a cover sheet that covers the culture layer. The culture sheet is formed by patterning a medium solution containing polyvinylpyrrolidone and at least one selected from the group consisting of a gelling agent, a nutritional component, a coloring indicator, a selection agent, and a substrate.
また、特許文献2でも、同様に、基材シートと、前記基材シートの上面に設けられた培養層と、前記培養層を覆うことができるカバーフィルムと、を備える微生物培養シートが開示されている。 Similarly, Patent Document 2 discloses a microorganism culture sheet comprising a base sheet, a culture layer provided on the top surface of the base sheet, and a cover film that can cover the culture layer. Yes.
特許文献1及び2に開示される微生物培養シートでは、作業の操作性及び安全性に優れ、作業効率を向上することができる。また、ポリビニルピロリドンを培地液の必須成分としているので、所定形状の培養層を安価かつ簡便にパターン形成することができる。 The microorganism culture sheets disclosed in Patent Documents 1 and 2 are excellent in work operability and safety, and work efficiency can be improved. In addition, since polyvinylpyrrolidone is an essential component of the medium solution, a culture layer having a predetermined shape can be formed in a cheap and simple pattern.
しかし、ポリビニルピロリドンを培養層に用いる場合、培養層に反りが生じる場合がある。培養層に反りが生じると、微生物培養シートにも反りが生じることになり、作業の操作性や安全性の低下に繋がる。そこで、そのような反りの発生を防ぐため、培養層に可塑剤としてのグリセリンが添加される。特許文献2の実施例でもグリセリンが添加されている。 However, when polyvinylpyrrolidone is used for the culture layer, the culture layer may be warped. If the culture layer is warped, the microorganism culture sheet is also warped, which leads to a decrease in work operability and safety. Therefore, in order to prevent the occurrence of such warpage, glycerin as a plasticizer is added to the culture layer. In the example of Patent Document 2, glycerin is also added.
ここで、従来から大腸菌群を検出するために、大腸菌群が有するβ−ガラクトシダーゼ活性を利用した発色反応試験が行われている。つまり、培養層上で増殖した大腸菌群は、β−ガラクトシダーゼによって培養層中に含まれるβ−ガラクトシダーゼにより分解される発色酵素基質(以下、β−ガラクトシダーゼ基質とも称す)を分解し、色原体化合物を遊離させ、これによってコロニーが発色する。しかしながら、上述の通り、ポリビニルピロリドンを用いた培養層では、培養層に反りが生じ易くなるため、培養層中に可塑剤としてグリセリンを添加することでその反りの発生を防いでいた。しかし、本発明者らは、意
外にも、ポリビニルピロリドン及びグリセリン等を含む培養層を用いた場合、本来β−ガラクトシダーゼ活性を有する大腸菌群の中でもβ−ガラクトシダーゼ基質による発色反応が確認できない菌が存在することを発見した。また、このような現象は、α−グルコシダーゼ活性を利用した発色反応試験でも起こることがわかった。具体的には、α−グルコシダーゼ活性を利用した発色反応試験は、例えば黄色ブドウ球菌(Staphylococcus aureus
)の検出等に利用することができるが、ポリビニルピロリドン及びグリセリン等を含む培養層を用いた場合、通常では発色反応が得られるはずの黄色ブドウ球菌においてもα−グルコシダーゼにより分解される発色酵素基質(以下、α−グルコシダーゼ基質とも称す)による発色反応が確認できない菌が存在することを発見した。目的の発色反応が得られない菌が存在すると、例えば、微生物の生菌数を測定するための試験において正確な情報を得ることができない場合や、目的微生物を検出又は同定するための試験においても正確な結果を得ることができない場合がある。
Here, conventionally, in order to detect coliforms, a color reaction test using β-galactosidase activity of the coliforms has been performed. That is, the coliform group grown on the culture layer decomposes a chromogenic enzyme substrate (hereinafter also referred to as β-galactosidase substrate) that is decomposed by β-galactosidase contained in the culture layer by β-galactosidase, thereby producing a chromogenic compound. Is released, and the colony develops color. However, as described above, in the culture layer using polyvinyl pyrrolidone, the culture layer is likely to warp. Therefore, the addition of glycerin as a plasticizer in the culture layer prevented the warpage from occurring. However, the present inventors surprisingly, when using a culture layer containing polyvinylpyrrolidone, glycerin, etc., among the Escherichia coli group originally having β-galactosidase activity, there is a bacterium that cannot confirm the color reaction by β-galactosidase substrate. I found it to be. Moreover, it has been found that such a phenomenon also occurs in a color development reaction test using α-glucosidase activity. Specifically, a color reaction test using α-glucosidase activity is performed by, for example, Staphylococcus aureus.
), But when a culture layer containing polyvinylpyrrolidone and glycerin is used, a chromogenic enzyme substrate that is degraded by α-glucosidase in Staphylococcus aureus, which should normally produce a chromogenic reaction. It has been discovered that there are bacteria that cannot confirm the color development reaction (hereinafter also referred to as α-glucosidase substrate). If there are bacteria that cannot achieve the desired color reaction, for example, when accurate information cannot be obtained in a test for measuring the number of living microorganisms, or in a test for detecting or identifying a target microorganism. In some cases, accurate results cannot be obtained.
そこで、本発明の目的は、培養層にポリビニルピロリドンを含む場合であっても、反りの発生が抑えられ、かつ発色酵素基質による発色反応が広範囲の微生物で得られる微生物培養シートを提供することである。 Accordingly, an object of the present invention is to provide a microorganism culture sheet that suppresses the occurrence of warping even when polyvinyl pyrrolidone is contained in the culture layer, and that allows a color development reaction with a chromogenic enzyme substrate to be obtained with a wide range of microorganisms. is there.
本発明者らは、意外にも、可塑剤として、グリセリンの代わりにポリエチレングリコール又は1,3−ブチレングリコールを用いることにより、β−ガラクトシダーゼ基質及びα−グルコシダーゼ基質による発色反応を得られることを見出し、本発明に至った。
本発明は以下のように表される。
The present inventors have surprisingly found that by using polyethylene glycol or 1,3-butylene glycol instead of glycerin as a plasticizer, it is possible to obtain a color developing reaction with a β-galactosidase substrate and an α-glucosidase substrate. The present invention has been reached.
The present invention is expressed as follows.
(1)基材シートと、前記基材シートの上に形成された培養層と、前記培養層を被覆するカバーシートと、を有する微生物培養シートであって、
前記培養層が、ポリビニルピロリドン、ゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤を含有し、
前記発色酵素基質が、β−ガラクトシダーゼにより分解される発色酵素基質又はα−グルコシダーゼにより分解される発色酵素基質であり、
前記可塑剤が、ポリエチレングリコール及び1,3−ブチレングリコールから選択される少なくとも1つである微生物培養シート。
(2)前記可塑剤がポリエチレングリコールである、(1)に記載の微生物培養シート。
(3)ポリエチレングリコールの平均分子量が100以上1000以下である、(2)に記載の微生物培養シート。
(4)前記可塑剤が1,3−ブチレングリコールである、(1)に記載の微生物培養シート。
(5)大腸菌群を検出するために用いられ、前記発色酵素基質がβ−ガラクトシダーゼにより分解される発色酵素基質である、(1)乃至(4)のいずれかに記載の微生物培養シート。
(6)黄色ブドウ球菌を検出するために用いられ、前記発色酵素基質がα−グルコシダーゼにより分解される発色酵素基質である、(1)乃至(4)のいずれかに記載の微生物培養シート。
(7)前記基材シート及び前記カバーシートの少なくとも一方が、透明プラスチックシートからなる、(1)乃至(6)のいずれかに記載の微生物培養シート。
(1) A microorganism culture sheet having a base sheet, a culture layer formed on the base sheet, and a cover sheet covering the culture layer,
The culture layer contains polyvinylpyrrolidone, a gelling agent, a nutrient component, a selective agent, a chromogenic enzyme substrate and a plasticizer,
The chromogenic enzyme substrate is a chromogenic enzyme substrate that is degraded by β-galactosidase or a chromogenic enzyme substrate that is degraded by α-glucosidase,
The microorganism culture sheet, wherein the plasticizer is at least one selected from polyethylene glycol and 1,3-butylene glycol.
(2) The microorganism culture sheet according to (1), wherein the plasticizer is polyethylene glycol.
(3) The microorganism culture sheet according to (2), wherein the polyethylene glycol has an average molecular weight of 100 or more and 1000 or less.
(4) The microorganism culture sheet according to (1), wherein the plasticizer is 1,3-butylene glycol.
(5) The microorganism culture sheet according to any one of (1) to (4), which is used to detect Escherichia coli, and the chromogenic enzyme substrate is a chromogenic enzyme substrate that is degraded by β-galactosidase.
(6) The microorganism culture sheet according to any one of (1) to (4), which is used to detect Staphylococcus aureus and the chromogenic enzyme substrate is a chromogenic enzyme substrate that is degraded by α-glucosidase.
(7) The microorganism culture sheet according to any one of (1) to (6), wherein at least one of the base sheet and the cover sheet is made of a transparent plastic sheet.
(8)少なくとも1種の細菌を含む試料中の大腸菌群を検出するための方法であって、
(1)乃至(7)のいずれかに記載の微生物培養シートの前記培養層に、前記試料の少なくとも一部を接種する工程と、
前記培養層上に接種された細菌を培養する工程と、
を含む方法。
(9)少なくとも1種の細菌を含む試料中の黄色ブドウ球菌を検出するための方法であって、
(1)乃至(7)のいずれかに記載の微生物培養シートの前記培養層に、前記試料の少なくとも一部を接種する工程と、
前記培養層上に接種された細菌を培養する工程と、
を含む方法。
(8) A method for detecting coliforms in a sample containing at least one bacterium,
Inoculating the culture layer of the microorganism culture sheet according to any one of (1) to (7) with at least a part of the sample;
Culturing bacteria inoculated on the culture layer;
Including methods.
(9) A method for detecting Staphylococcus aureus in a sample containing at least one kind of bacteria,
Inoculating the culture layer of the microorganism culture sheet according to any one of (1) to (7) with at least a part of the sample;
Culturing bacteria inoculated on the culture layer;
Including methods.
本発明の構成により、培養層にポリビニルピロリドンを含む場合であっても、反りの発生が抑えられ、かつ発色酵素基質による発色反応が広範囲の微生物で得られる微生物培養シートを提供することができる。 According to the configuration of the present invention, even when the culture layer contains polyvinyl pyrrolidone, it is possible to provide a microorganism culture sheet in which the occurrence of warpage is suppressed and a color development reaction with a chromogenic enzyme substrate can be obtained with a wide range of microorganisms.
本発明は、基材シートと、前記基材シートの上に形成された培養層と、前記培養層を被覆するカバーシートと、を有する微生物培養シートを対象とする。また、本発明の微生物培養シートにおいて、前記培養層は、ポリビニルピロリドン、ゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤を含有する。また、前記発色酵素基質が、β−ガラクトシダーゼにより分解される発色酵素基質又はα−グルコシダーゼにより分解される発色酵素基質である。また、前記可塑剤が、ポリエチレングリコール及び1,3−ブチレングリコールから選択される少なくとも1つである。 The present invention is directed to a microorganism culture sheet having a base sheet, a culture layer formed on the base sheet, and a cover sheet that covers the culture layer. In the microorganism culture sheet of the present invention, the culture layer contains polyvinylpyrrolidone, a gelling agent, a nutrient component, a selective agent, a chromogenic enzyme substrate, and a plasticizer. Further, the chromogenic enzyme substrate is a chromogenic enzyme substrate that is degraded by β-galactosidase or a chromogenic enzyme substrate that is degraded by α-glucosidase. The plasticizer is at least one selected from polyethylene glycol and 1,3-butylene glycol.
以下、本発明の実施形態について説明する。なお、本発明は、以下の実施形態に限定されるものではない。 Hereinafter, embodiments of the present invention will be described. In addition, this invention is not limited to the following embodiment.
[微生物培養シート]
以下、微生物培養シートの各構成要素について説明する。
(1)培養層
本発明の微生物培養シートにおいて、基材シートの上に設ける培養層は、ポリビニルピロリドン、ゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤を含有する。培養層は、これらの成分を分散又は溶解させる溶媒を含む培地液から形成することができる。
[Microbe culture sheet]
Hereinafter, each component of the microorganism culture sheet will be described.
(1) Culture layer In the microorganism culture sheet of the present invention, the culture layer provided on the base sheet contains polyvinylpyrrolidone, a gelling agent, a nutrient component, a selective agent, a chromogenic enzyme substrate, and a plasticizer. The culture layer can be formed from a medium solution containing a solvent for dispersing or dissolving these components.
(i)ポリビニルピロリドン
ポリビニルピロリドンは、培地液の粘度調整剤としての役割を有する。ポリビニルピロリドンによれば、濃度を調整することで容易に培地液の粘度調整することができるので、ゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤を均一に分散させることができる。また、培養層を必要な部分に形成することが可能となり、高価な材料の無駄が生じない。また、培地液を所定のパターンに配置した後に溶媒を除去すると、ポリビニルピロリドンの優れた皮膜性のため、ゲル化剤や栄養成分を取り込んで培養層を成膜することができる。また、基材シートとも良好な密着性を有するので、接着剤を使用しなくても培養層を形成することができる。そのため、接着剤成分による微生物の発育の影響を低減することができる。
(I) Polyvinyl pyrrolidone Polyvinyl pyrrolidone has a role as a viscosity modifier of a culture solution. According to polyvinylpyrrolidone, the viscosity of the medium solution can be easily adjusted by adjusting the concentration, so that the gelling agent, nutrient component, selective agent, chromogenic enzyme substrate and plasticizer can be uniformly dispersed. Moreover, it becomes possible to form a culture layer in a required part, and a waste of expensive material does not arise. Further, when the solvent is removed after the medium solution is arranged in a predetermined pattern, the culture layer can be formed by taking in the gelling agent and nutrient components because of the excellent film property of polyvinylpyrrolidone. Moreover, since it has favorable adhesiveness with the base material sheet, the culture layer can be formed without using an adhesive. Therefore, the influence of the growth of microorganisms due to the adhesive component can be reduced.
(ii)ゲル化剤
ゲル化剤を含有する培地液を用いて形成される培養層は、被検液を接種すると増粘若しくはゲル化するため、微生物の育成に良好な粘度を付与することができる。また、増粘後にはカバーシートに密着し得るため、培養時の培養層の乾燥を抑制することができる。
(Ii) Gelling agent Since a culture layer formed using a medium solution containing a gelling agent thickens or gels when inoculated with a test solution, it can give a good viscosity to the growth of microorganisms. it can. Moreover, since it can contact | adhere to a cover sheet after thickening, drying of the culture layer at the time of culture | cultivation can be suppressed.
ゲル化剤としては、特に制限されるものではなく、公知のゲル化剤を用いることができる。ゲル化剤としては、高分子多糖類が好ましく、カラギーナン、グアーガム、キタンサンガム、ヒドロキシエチルセルロース、カルボキシメチルセルロース、ローカストビーンガム、アルギン酸及びアルギン酸塩等を挙げることができる。これらの高分子多糖類は、被検液中に含まれる水によって増粘又はゲル化するため、微生物の発育が良好となる。また、高分子多糖類は、透明性が高いため、コロニーの視認性に優れる。さらに、高分子多糖類は、増粘してカバーシートに密着し易くなるため、培養時の乾燥を抑制することができる。高分子多糖類の中でも、グアーガムが特に好ましい。グアーガムは、低濃度で極めて高い粘度を呈するため、少量で微生物の発育に適した環境を作ることができるからである。なお、グアーガムは、一年生の豆科植物であるグアーの種子の胚乳部より製造される。 The gelling agent is not particularly limited, and a known gelling agent can be used. The gelling agent is preferably a high molecular polysaccharide, and examples thereof include carrageenan, guar gum, chitansan gum, hydroxyethyl cellulose, carboxymethyl cellulose, locust bean gum, alginic acid, and alginic acid salt. Since these high molecular polysaccharides are thickened or gelled by water contained in the test solution, the growth of microorganisms is improved. Moreover, since the high molecular polysaccharide is highly transparent, the visibility of colonies is excellent. Furthermore, since the polymer polysaccharide is thickened and easily adheres to the cover sheet, drying during culture can be suppressed. Of the high molecular polysaccharides, guar gum is particularly preferable. This is because guar gum exhibits an extremely high viscosity at a low concentration, so that an environment suitable for the growth of microorganisms can be created with a small amount. Guar gum is produced from the endosperm portion of guar seeds, which are annual legumes.
ゲル化剤の含有量は、ポリビニルピロリドン100質量部に対して100質量部以上6
00質量部以下であることが好ましい。
The content of the gelling agent is 100 parts by mass or more with respect to 100 parts by mass of polyvinylpyrrolidone.
It is preferable that it is 00 mass parts or less.
(iii)栄養成分
栄養成分としては、特に制限されるものではなく、公知の栄養成分を用いることができる。栄養成分としては、例えば、一般生菌検査用の微生物培養シートの場合、栄養成分としては、酵母エキス・ペプトン・ブドウ糖混合物、肉エキス・ペプトン混合物、又はペプトン・大豆ペプトン・ブドウ糖混合物等、あるいはこれらにリン酸二カリウム及び/又は塩化ナトリウムを加えた混合物が好ましく用いられる。大腸菌群検査用の微生物培養シートの場合、栄養成分としては、デソキシコール酸ナトリウム・ペプトン・クエン酸鉄アンモニウム・塩化ナトリウム・リン酸二カリウム・乳糖・ペプトン・乳糖・リン酸二カリウム等が好ましく用いられる。黄色ブドウ球菌検査用の微生物培養シートの場合、栄養成分としては、肉エキス・ペプトン・塩化ナトリウム・マンニット・卵黄混合物、又はペプトン・肉エキス・酵母エキス・ピルビン酸ナトリウム・グリシン・塩化リチウム・亜テルル酸卵黄液混合物等が好ましく用いられる。ビブリオ検査用の微生物培養シートの場合、栄養成分としては、酵母エキス・ペプトン・蔗糖・チオ硫酸ナトリウム・クエン酸ナトリウム・コール酸ナトリウム・クエン酸第2鉄・塩化ナトリウム・牛胆汁等が好ましく用いられる。腸球菌検査用の微生物培養シートの場合、栄養成分としては、牛脳エキス・ハートエキス・ペプトン・ブドウ糖・リン酸二カリウム・窒化ナトリウム等が好ましく用いられる。真菌検査用の微生物培養シートの場合、栄養成分としては、ペプトン・ブドウ糖混合物、酵母エキス・ブドウ糖混合物、又はポテトエキス・ブドウ糖混合物等が好ましく用いられる。これらの中から発育させようとする微生物に応じて一種又はそれ以上の栄養成分を選択して用いることができる。なお、培養層中で栄養成分が不足している場合は、被検液に不足分の栄養成分を加えてもよい。
(Iii) Nutritional component The nutritional component is not particularly limited, and a known nutritional component can be used. As a nutrient component, for example, in the case of a microorganism culture sheet for inspection of general viable bacteria, the nutrient component includes a yeast extract / pepton / glucose mixture, a meat extract / peptone mixture, or a peptone / soybean peptone / glucose mixture, or the like. A mixture of dipotassium phosphate and / or sodium chloride is preferably used. In the case of a microorganism culture sheet for coliform group inspection, sodium desoxycholate, peptone, ammonium iron citrate, sodium chloride, dipotassium phosphate, lactose, peptone, lactose, dipotassium phosphate, etc. are preferably used as nutrient components. . In the case of a microbial culture sheet for S. aureus testing, nutritional components include meat extract, peptone, sodium chloride, mannitol, egg yolk mixture, or peptone, meat extract, yeast extract, sodium pyruvate, glycine, lithium chloride, A telluric acid egg yolk mixture or the like is preferably used. In the case of a microorganism culture sheet for vibrio testing, yeast extract, peptone, sucrose, sodium thiosulfate, sodium citrate, sodium cholate, ferric citrate, sodium chloride, beef bile, etc. are preferably used as nutrient components . In the case of a microorganism culture sheet for enterococci examination, bovine brain extract, heart extract, peptone, glucose, dipotassium phosphate, sodium nitride and the like are preferably used as nutrient components. In the case of a microorganism culture sheet for fungal examination, a peptone / glucose mixture, a yeast extract / glucose mixture, a potato extract / glucose mixture, or the like is preferably used as a nutrient component. One or more nutrient components can be selected and used according to the microorganism to be developed from these. In addition, when a nutrient component is insufficient in the culture layer, an insufficient nutrient component may be added to the test solution.
(iv)選択剤
培養層は、検出目的以外の微生物の生育を抑える選択剤を含有する。このような選択剤としては、例えば、抗生物質、合成抗菌剤等の抗生剤、色素、界面活性剤、無機塩等が用いられる。抗生物質としては、メチシリン、セフタメタゾール、セフィキシム、セフタジジム、セフスロジン、バシトラシン、ポリミキシンB、リファンピシン、ノボビオシン、コリスチン、リンコマイシン、クロラムフェニコール、テトラサイクリン、又はストレプトマイシン等を挙げることができる。合成抗菌剤としては、例えば、サルファ剤、ナリジクス酸、又はオラキンドックス等を挙げることができる。また、色素としては、例えば、静菌又は殺菌作用のあるクリスタルバイオレット、ブリリアントグリーン、マラカイトグリーン、メチレンブルー等を挙げることができる。また、界面活性剤としては、例えば、Tergitol7、ドデシル硫酸塩、ラウリル硫酸塩等を挙げることができる。また、無機塩としては、例えば、亜セレン酸塩、亜テルル酸塩、亜硫酸塩、窒化ナトリウム、塩化リチウム、シュウ酸塩、又は高濃度の塩化ナトリウム等を挙げることができる。これら以外にも、例えば、タウロコール酸塩、グリシン、胆汁末、胆汁酸塩、又はデオキシコール酸塩等を挙げることができる。
(Iv) Selection agent A culture layer contains the selection agent which suppresses growth of microorganisms other than the detection objective. As such a selective agent, for example, antibiotics such as antibiotics and synthetic antibacterial agents, dyes, surfactants, inorganic salts and the like are used. Examples of antibiotics include methicillin, ceftamethazole, cefixime, ceftazidime, cefsulosin, bacitracin, polymyxin B, rifampicin, novobiocin, colistin, lincomycin, chloramphenicol, tetracycline, or streptomycin. Examples of synthetic antibacterial agents include sulfa drugs, nalidixic acid, olaquindox, and the like. Examples of the pigment include crystal violet, brilliant green, malachite green, and methylene blue that have bacteriostatic or bactericidal action. Examples of the surfactant include Tergitol 7, dodecyl sulfate, lauryl sulfate, and the like. Examples of the inorganic salt include selenite, tellurite, sulfite, sodium nitride, lithium chloride, oxalate, and high-concentration sodium chloride. In addition to these, for example, taurocholate, glycine, bile powder, bile salt, or deoxycholate can be used.
大腸菌群検査用の微生物培養シートの場合、選択剤としては、胆汁酸塩、デオキシコール等の胆汁由来物質、タージトール7、ラウリル硫酸ナトリウム(SDS)などの界面活性剤、クリスタルバイオレット等の色素類、又は、セフェキシム若しくはノボビオシン等の抗生物質等が好ましく用いられる。黄色ブドウ球菌検査用の微生物培養シートの場合、選択剤としては、塩化リチウム(LiCl)、アジ化ナトリウム(NaN3)、コリスチン、ビブリオ菌増殖阻害化合物O/129、アズトレオナム、アンフォテリシン、コリマイシン、塩化ナトリウム(NaCl)、及びデフェロキサミンから選ばれる少なくとも1種が好ましく用いられる。 In the case of a microorganism culture sheet for coliform group inspection, as a selective agent, bile salts, bile-derived substances such as deoxychol, surfactants such as tarditol 7 and sodium lauryl sulfate (SDS), pigments such as crystal violet, Alternatively, an antibiotic such as cephexime or novobiocin is preferably used. In the case of a microorganism culture sheet for S. aureus examination, as selective agents, lithium chloride (LiCl), sodium azide (NaN 3 ), colistin, Vibrio bacteria growth inhibitory compound O / 129, aztreonam, amphotericin, colimycin, sodium chloride (NaCl) and at least one selected from deferoxamine are preferably used.
(v)発色酵素基質
本発明の微生物培養シートにおいて、発色酵素基質としては、β−ガラクトシダーゼにより分解される発色酵素基質(β−ガラクトシダーゼ基質)又はα−グルコシダーゼにより分解される発色酵素基質(α−グルコシダーゼ基質)を用いる。発色酵素基質は、天然基質であってもよく、合成基質であってもよい。発色は、吸収、蛍光又は発光の変化のような光学的性質の変異によるものであることが望ましい。β−ガラクトシダーゼ基質は、β−ガラクトシダーゼ活性により加水分解され、発色を呈する任意の化合物を用いることができる。
(V) Chromogenic enzyme substrate In the microorganism culture sheet of the present invention, as the chromogenic enzyme substrate, a chromogenic enzyme substrate (β-galactosidase substrate) that is degraded by β-galactosidase or a chromogenic enzyme substrate that is degraded by α-glucosidase (α- Glucosidase substrate). The chromogenic enzyme substrate may be a natural substrate or a synthetic substrate. The color development is desirably due to a variation in optical properties such as changes in absorption, fluorescence or emission. As the β-galactosidase substrate, any compound that is hydrolyzed by β-galactosidase activity and exhibits color development can be used.
α−グルコシダーゼ基質は、α−グルコシダーゼ活性により加水分解され、発色を呈する任意の化合物を用いることができる。 As the α-glucosidase substrate, any compound that is hydrolyzed by α-glucosidase activity and develops color can be used.
発色酵素基質は、例えば、インドキシル誘導体に基く酵素基質、ウンベリフェロン誘導体に基く酵素基質、フラボン誘導体に基く酵素基質、アリザリン誘導体に基く酵素基質、ナフトールベンゼイン誘導体に基く酵素基質、ニトロフェノール誘導体に基く酵素基質、ナフトール誘導体に基く酵素基質、カテコール誘導体に基く酵素基質、ヒドロキシキノリン誘導体に基く酵素基質、クマリン誘導体に基く酵素基質、レゾルフィン誘導体に基く酵素基質、フェノキサジン誘導体に基く酵素基質、ナフトール誘導体に基く酵素基質、ナフチルアミン誘導体に基く酵素基質を挙げることができる。これらの中でも、インドキシル誘導体に基く酵素基質、又はウンベリフェロン誘導体に基く酵素基質が好ましい。 Examples of chromogenic enzyme substrates include enzyme substrates based on indoxyl derivatives, enzyme substrates based on umbelliferone derivatives, enzyme substrates based on flavone derivatives, enzyme substrates based on alizarin derivatives, enzyme substrates based on naphthol benzein derivatives, nitrophenol derivatives Enzyme substrate based on naphthol derivative, enzyme substrate based on catechol derivative, enzyme substrate based on hydroxyquinoline derivative, enzyme substrate based on coumarin derivative, enzyme substrate based on resorufin derivative, enzyme substrate based on phenoxazine derivative, naphthol Examples include enzyme substrates based on derivatives and enzyme substrates based on naphthylamine derivatives. Among these, enzyme substrates based on indoxyl derivatives or enzyme substrates based on umbelliferone derivatives are preferred.
β−ガラクトシダーゼ基質としては、例えば、5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド、5−ブロモ−6−クロロ−3−インドリル−β−D−ガラクトピラノシド、5−ブロモ−6−クロロ−3−インドリル−β−D−ガラクトピラノシド、6−クロロ−3−インドリル−β−D−ガラクトピラノシド及びオルトニトロフェニル−β−D−ガラクトピラノシド等が挙げられる。これらのうち、5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド(X−Gal)が特に好ましい。 Examples of the β-galactosidase substrate include 5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside, 5-bromo-6-chloro-3-indolyl-β-D-galactopyranoside 5-bromo-6-chloro-3-indolyl-β-D-galactopyranoside, 6-chloro-3-indolyl-β-D-galactopyranoside and orthonitrophenyl-β-D-galactopyrano Cid etc. are mentioned. Of these, 5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside (X-Gal) is particularly preferred.
α−グルコシダーゼ基質としては、例えば、4−メチルウンベリフェリル−α−D−グルコピラノシド、5−ブロモ−4−クロロ−3−インドリル−α−D−グルコピラノシド、5−ブロモ−6−クロロ−3−インドリル−α−D−グルコピラノシド、5−ブロモ−6−クロロ−3−インドリル−α−D−グルコピラノシド、6−クロロ−3−インドリル−α−D−グルコピラノシド、5−ブロモ−3−インドリル−α−D−グルコピラノシド、o−ニトロフェニル−α−D−グルコピラノシド、フェニル−α−D−グルコピラノシド、3−ニトロフェニル−α−D−グルコピラノシド、4−ニトロフェニル−α−D−グルコピラノシド、3−インドキシル−α−グルコピラノシドトリハイドレート、n−ヘプチル−α−D−グルコピラノシド、5−ブロモ−4−クロロ−3−インドキシル−2−アセトアミド−2−デオキシ−α−D−グルコピラノシド等が挙げられる。これらのうち、4−メチルウンベリフェリル−α−D−グルコピラノシドが特に好ましい。 Examples of the α-glucosidase substrate include 4-methylumbelliferyl-α-D-glucopyranoside, 5-bromo-4-chloro-3-indolyl-α-D-glucopyranoside, 5-bromo-6-chloro-3- Indolyl-α-D-glucopyranoside, 5-bromo-6-chloro-3-indolyl-α-D-glucopyranoside, 6-chloro-3-indolyl-α-D-glucopyranoside, 5-bromo-3-indolyl-α- D-glucopyranoside, o-nitrophenyl-α-D-glucopyranoside, phenyl-α-D-glucopyranoside, 3-nitrophenyl-α-D-glucopyranoside, 4-nitrophenyl-α-D-glucopyranoside, 3-indoxyl- α-glucopyranoside trihydrate, n-heptyl-α-D-glucopyranoside, 5- Romo-4-chloro-3-indoxyl-2-acetamido-2-deoxy-.alpha.-D-glucopyranoside, and the like. Of these, 4-methylumbelliferyl-α-D-glucopyranoside is particularly preferred.
発色酵素基質の培地液中の含有量は、例えば、0.01〜2.0g/lである。発色酵素基質の培地液中の含有量は、発色のコントラストの観点から、0.02〜0.2g/lであることが好ましい。 The content of the chromogenic enzyme substrate in the medium solution is, for example, 0.01 to 2.0 g / l. The content of the chromogenic enzyme substrate in the medium solution is preferably 0.02 to 0.2 g / l from the viewpoint of color contrast.
発色酵素基質は、広いpH範囲で用いることができ、例えば、pH5.5〜10、好ましくはpH6.5〜10で用いることができる。 The chromogenic enzyme substrate can be used in a wide pH range, for example, pH 5.5 to 10, preferably pH 6.5 to 10.
(vi)可塑剤
本発明の微生物培養シートにおいて、可塑剤として、ポリエチレングリコール及び1,3−ブチレングリコールから選択される少なくとも1つを用いる。
(Vi) Plasticizer In the microorganism culture sheet of the present invention, at least one selected from polyethylene glycol and 1,3-butylene glycol is used as the plasticizer.
ポリエチレングリコールの平均分子量は、100以上であることが好ましく、150以上であることがより好ましく、200以上であることがさらに好ましく、300以上であることが特に好ましい。また、ポリエチレングリコールの平均分子量は、10000以下であることが好ましく、5000以下であることがより好ましく、2000以下であることがさらに好ましく、1000以下であることが特に好ましく、800以下であることがより特に好ましい。 The average molecular weight of polyethylene glycol is preferably 100 or more, more preferably 150 or more, further preferably 200 or more, and particularly preferably 300 or more. The average molecular weight of polyethylene glycol is preferably 10,000 or less, more preferably 5000 or less, further preferably 2000 or less, particularly preferably 1000 or less, and preferably 800 or less. More particularly preferred.
ポリエチレングリコールの培養層中の含有量は、例えば、ポリビニルピロリドン100質量部に対して、30質量部以上90質量部以下である。ポリエチレングリコールの培養層中の含有量は、反りを抑制する観点から、ポリビニルピロリドン100質量部に対して、40質量部以上80質量部以下であることが好ましい。 The content of polyethylene glycol in the culture layer is, for example, from 30 parts by weight to 90 parts by weight with respect to 100 parts by weight of polyvinylpyrrolidone. The content of polyethylene glycol in the culture layer is preferably 40 parts by mass or more and 80 parts by mass or less with respect to 100 parts by mass of polyvinylpyrrolidone from the viewpoint of suppressing warpage.
1,3−ブチレングリコールの培養層中の含有量は、例えば、ポリビニルピロリドン100質量部に対して、30質量部以上90質量部以下である。1,3−ブチレングリコールの培養層中の含有量は、反りを抑制する観点から、ポリビニルピロリドン100質量部に対して、40質量部以上80質量部以下であることが好ましい。 The content of 1,3-butylene glycol in the culture layer is, for example, 30 parts by mass or more and 90 parts by mass or less with respect to 100 parts by mass of polyvinylpyrrolidone. The content of 1,3-butylene glycol in the culture layer is preferably 40 parts by mass or more and 80 parts by mass or less with respect to 100 parts by mass of polyvinylpyrrolidone from the viewpoint of suppressing warpage.
(vii)その他
培養層は、β−ガラクトシダーゼ発現誘導物質を含んでもよい。β−ガラクトシダーゼ発現誘導物質としては、例えば、イソプロピル−1−チオ−β−D−ガラクトシド(以下、IPTGとも称す)又はメチル−β−D−チオガラクトシドなどが挙げられる。IPTGについては、0.05〜0.1mM(1.2〜2.4mg/100ml)の濃度で大腸菌のβ−ガラクトシダーゼの合成を強力に誘導することが知られている。
(Vii) Others The culture layer may contain a β-galactosidase expression inducer. Examples of the β-galactosidase expression inducer include isopropyl-1-thio-β-D-galactoside (hereinafter also referred to as IPTG) and methyl-β-D-thiogalactoside. It is known that IPTG strongly induces the synthesis of β-galactosidase of E. coli at a concentration of 0.05 to 0.1 mM (1.2 to 2.4 mg / 100 ml).
培養層は、発色指示薬を含んでもよい。発色指示薬は、培養過程で発育する微生物の代謝により産出される特異物質との反応、pH変化の認識等によって発色してコロニーを着色することができ、コロニー数の計数を極めて容易にする効果を有する。発色指示薬としては、例えば、トリフェニルテトラゾリウムクロライド(以下TTCと表示)、p−トリルテトラゾリウムレッド、テトラゾリウムバイオレット、ベラトリルテトラゾリウムブルー等のテトラゾリム塩、ニュートラルレッド混合物、フェノールレッド、ブロムチモールブルー、又はチモールブルー混合物等のpH指示薬がある。 The culture layer may contain a color development indicator. The coloring indicator can color colonies by reacting with specific substances produced by metabolism of microorganisms that grow during the culture process, recognizing pH changes, etc., and has the effect of making counting the number of colonies extremely easy. Have. Examples of the color development indicator include triphenyltetrazolium chloride (hereinafter referred to as TTC), tetrazolim salts such as p-tolyltetrazolium red, tetrazolium violet, veratryl tetrazolium blue, neutral red mixture, phenol red, bromthymol blue, or thymol blue. There are pH indicators such as mixtures.
培養層は、1層で構成されてもよく、2層以上で構成されてもよい。例えば、ポリビニルピロリドン溶液(i)にゲル化剤(ii)を含有する培地液で第1培養層を形成し、その上にポリビニルピロリドン溶液(i)にゲル化剤(ii)、栄養成分(iii)、選択剤(iv)及び発色酵素基質(v)を含有する培地液で第2培養層を形成し、本発明で使用する培養層としてもよい。 The culture layer may be composed of one layer or may be composed of two or more layers. For example, a first culture layer is formed with a medium solution containing a gelling agent (ii) in a polyvinylpyrrolidone solution (i), and a gelling agent (ii) and a nutrient component (iii) are added to the polyvinylpyrrolidone solution (i) thereon. ), A selective culture agent (iv), and a culture medium containing a chromogenic enzyme substrate (v), the second culture layer may be formed to be a culture layer used in the present invention.
また、培地液中に含まれる成分によっては混合により反応を起こす場合があり、これらを別の層に含有させることで混合反応を防ぐことができる。したがって、例えば栄養成分に混合反応を起こす成分AとBとが含有される場合には、A成分を除去した第1培養層と、B成分を除去した第2培養層との2層を積層して培養層としてもよい。 Moreover, depending on the components contained in the medium solution, a reaction may occur by mixing, and the mixing reaction can be prevented by containing these in another layer. Therefore, for example, when components A and B that cause a mixed reaction in the nutrient component are contained, two layers of a first culture layer from which the A component has been removed and a second culture layer from which the B component has been removed are laminated. It may be a culture layer.
(viii)培養層の形成
培養層は、基材シートの上に培地液を所定のパターンに塗布して乾燥することにより形成することができる。培養層をパターン形成することにより、被検液の滴下後に速やかにカバーシートを被覆することで、被検液が自然に一定範囲に拡がるため、優れた操作性を提供することができる。本発明において、「パターン形成」とは、基材シートの上に、培地液を予め決められた形状に印刷、塗布、塗工、又は噴霧等によって配置することをいう。培地液を基材上に配置する方法は、特に制限されるものではない。したがって、パター
ン形成には、スクリーン印刷、グラビア印刷、凸版印刷、転写印刷、フレキソ印刷、その他の印刷、ディスペンサーやインクジェット等による塗布、バー等を使用してコーティングするバーコートやナイフコート、ダイコート等の塗工、スプレー方式等の噴霧等の方法を使用することができる。
(Viii) Formation of culture layer The culture layer can be formed by applying a medium solution in a predetermined pattern on a base sheet and drying it. By forming the culture layer in a pattern, the test liquid is naturally spread to a certain range by covering the cover sheet immediately after the test liquid is dropped, and thus excellent operability can be provided. In the present invention, “pattern formation” means that a medium solution is arranged on a base material sheet in a predetermined shape by printing, coating, coating, spraying or the like. The method for disposing the medium solution on the substrate is not particularly limited. Therefore, for pattern formation, screen printing, gravure printing, letterpress printing, transfer printing, flexographic printing, other printing, application by dispenser or inkjet, bar coating to be coated using a bar, knife coating, die coating, etc. Methods such as spraying such as coating and spraying can be used.
培地液中に含まれる成分は、粉末で添加してもよいし、また、これらを溶媒に溶解した後、例えば、前記ポリビニルピロリドンのアルコール溶液に混合し、培地液としてもよい。なお、発色指示薬の種類によっては滅菌処理時に着色が目立つものもあり、培養層に含有させず、被検液に発色指示薬を含んだものを使用して発色させてもよい。 The components contained in the medium solution may be added as a powder, or after dissolving these in a solvent, the medium solution may be mixed with the alcohol solution of polyvinyl pyrrolidone, for example. Depending on the type of coloring indicator, coloring may be conspicuous at the time of sterilization. Coloring may be performed using a sample solution containing a coloring indicator instead of being contained in the culture layer.
(2)微生物培養シートの構成
微生物培養シートの好適な態様の一例を図1(a)、(b)に示す。図1(a)は平面図であり、図1(b)は図1(a)のA−A’断面図である。
(2) Structure of microorganism culture sheet An example of a suitable aspect of the microorganism culture sheet is shown in FIGS. 1 (a) and 1 (b). 1A is a plan view, and FIG. 1B is a cross-sectional view taken along the line AA ′ in FIG.
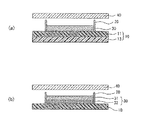
図1は、方形の基材シート10の略中央に培養層30が形成され、かつ前記培養層30を被覆するように、方形のカバーシート40が設けられている態様を示す。基材シート10に培養層30がパターン形成されている。図2(a)の断面図に示すように、基材シート10は、基材シート11と、基材シート13との2層からなる多層シートであってもよく、更に、プラスチック以外の他の層を積層する多層シートであってもよい。また、図2(b)に示すように、培養層30が2層以上の多層で構成されていてもよい。
FIG. 1 shows a mode in which a
パターン形成により調製された培養層30の形状は、図1に示す円形に限定されるものではなく、正方形、長方形、その他の多角形、不定形であってもよい。
The shape of the
微生物培養シートは、図3(a)の展開図に示すように、基材シート10とカバーシート40との双方に、培養層30と、バインダー成分及び栄養成分等のその他の成分を含有する特定成分層30’と、がそれぞれ形成されていてもよい。例えば、培養層30と、前記特定成分層30’との双方にゲル化剤が含まれている場合には、基材シート10の上の培養層30と、カバーシート40に設けられた特定成分層30’とが対向して配設されるため、例えば、基材シート10の上の培養層30に被検液を接種した後に、カバーシート40で培養層30を被覆すると、前記被検液が培養層30と特定成分層30’とに吸水され、培養層30と特定成分層30’との双方で微生物を観察することができる。また、指示薬によっては、培養層30に含有させると滅菌処理時に着色が目立つものもあり、その場合には、前記指示薬を特定成分層30’に含有させることで、滅菌処理時の着色を防止することができる。なお、図3(b)は、横断面図である。
As shown in the development view of FIG. 3A, the microorganism culture sheet contains a
また、微生物培養シートは、図4(a)の平面図及び図4(b)のA−A’線断面図に示すように、基材シート10の略中央に培養層30が形成され、前記培養層の外周に円形の枠層20が形成されたものであってもよい。枠層20によれば、培養層30に接種した被検液の吸水範囲をより確実に限定することができる。なお、枠層20の形状は円形に限定されるものではなく、方形、楕円形、多角形、不定形等いずれであってもよいが、培養層30に接種した被検液の吸水範囲が所定の面積を確保しうるように枠層が形成されていることが好ましい。また、この態様において、図5の断面図に示すように、更にカバーシート40に、基材シート10の上の培養層30と対向するように特定成分層30’が形成されていてもよい。
Moreover, as shown in the plan view of FIG. 4A and the AA ′ line cross-sectional view of FIG. 4B, the microorganism culture sheet has a
更に、図6に示すように、前記枠層20と対向するように、カバーシート40に粘着層50が形成されていてもよい。枠層20と粘着層50とが密着することで、培養層30の乾燥や汚染をより効果的に防止することができる。
Furthermore, as shown in FIG. 6, an
微生物培養シートでは、図7(a)の断面図に示すように、疎水性樹脂からなる枠層20が基材シート10の表面に形成されている場合であっても、基材シート10は、基材シート11と、基材シート13との2層からなる多層シートの態様であってもよいし、プラスチック以外の他の層を積層する多層シートであってもよい。また、図7(b)の断面図に示すように、疎水性樹脂からなる枠層20が基材シート10の表面に形成されている場合であっても、培養層30は2層以上の多層で構成されていてもよい。
In the microorganism culture sheet, as shown in the cross-sectional view of FIG. 7 (a), even when the
また、培養層30は、基材シート10の上に複数存在してもよい。複数の培養層30と、それらの外周を囲む凸形状の疎水性樹脂からなる枠層20と、前記培養層30を被覆するカバーシート40とが基材シート10の端部で固設された態様を図8(a)、(b)に示す。図8(a)は平面図であり、図8(b)は、図8(a)のA−A’断面図である。図8(b)では、カバーシート40は、培養層30を被覆し、かつ枠層20の上部に密着することができるように、2つの角部(C1,C2)が形成される態様となっている。なお、図8とは相違するが、前記基材シート10上に形成された培養層30と対向するように、カバーシート40に特定成分層30’が形成されていてもよい。
A plurality of culture layers 30 may exist on the
(3)基材シート
本発明の微生物培養シートでは、基材シートの上に培地液をパターン形成するため、基材シートは、耐溶媒性、印刷適性を有する必要がある。また、微生物培養シートとして、耐水性も要求され、培養層を形成する際の乾燥処理に耐える耐熱性を有することも要求される。基材シートは、単層でもよく、2層以上の積層シートであってもよい。
(3) Substrate sheet In the microorganism culture sheet of the present invention, since the medium solution is patterned on the substrate sheet, the substrate sheet needs to have solvent resistance and printability. Moreover, as a microorganism culture sheet, water resistance is also required, and it is also required to have heat resistance that can withstand a drying treatment when forming a culture layer. The base sheet may be a single layer or a laminated sheet having two or more layers.
(4)カバーシート
本発明の微生物培養シートでは、カバーシートは、基材シートに固設されていることが好ましい。カバーシートは、培養中の落下菌等による汚染を防止すると共に、培養層の水分蒸発を防止する作用を有する。カバーシートは、防水性、水蒸気不透過性を有すると同時に、微生物の培養後、カバーシートを通してコロニーを観察及び計数できるように、透明であることが好ましい。カバーシートとしては、例えば、前記基材シートで挙げたようなポリエチレン、ポリプロピレン等のポリオレフィン、ポリエステル、ポリアミド、ポリスチレン、ポリカーボネート、ポリ塩化ビニル等のプラスチックシートを使用することができる。微生物培養シートでは、前記基材シートとカバーフィルムとが透明であれば、微生物培養シートの背面からの投射光で観察することもでき、また、側面からの入射光で観察することもできる。すなわち、カバーシート側からも基材シート側からもコロニーを観察及び計数することができるので、観察方法及び計測方法の選択の幅が広がることとなる。なお、カバーシートの開け閉め等の作業性を考慮すると、ポリエステルフィルム、ポリオレフィンフィルムが特に好ましい。
(4) Cover sheet In the microorganism culture sheet of the present invention, the cover sheet is preferably fixed to the base sheet. The cover sheet has the effect of preventing contamination by falling bacteria during culture and preventing moisture evaporation of the culture layer. It is preferable that the cover sheet is waterproof and water vapor impermeable, and at the same time transparent so that colonies can be observed and counted through the cover sheet after culturing the microorganisms. As the cover sheet, for example, a polyolefin sheet such as polyethylene and polypropylene as exemplified in the base sheet, a plastic sheet such as polyester, polyamide, polystyrene, polycarbonate, and polyvinyl chloride can be used. In the microorganism culture sheet, if the substrate sheet and the cover film are transparent, they can be observed with the projection light from the back surface of the microorganism culture sheet, and can also be observed with the incident light from the side surface. That is, since colonies can be observed and counted from both the cover sheet side and the base sheet side, the range of selection of the observation method and the measurement method is widened. In view of workability such as opening and closing of the cover sheet, a polyester film and a polyolefin film are particularly preferable.
(5)枠層
本発明の微生物培養シートでは、前記培養層の外周に、疎水性樹脂からなる枠層が形成されていることが好ましい。枠層が形成されていると、被検液を培養層に接種し、カバーシートを被覆した場合に、被検液が枠層まで速やかに拡散されるため、培養層による被検液の吸水を待たずにカバーシートを被覆することができ、接種操作を短時間で行うことができる。また、枠層によって被検液の遺漏をより確実に防げ、接種時の作業効率を向上することできる。培養層にゲル化剤が含まれる場合には、被検液が枠層の内側にある培養層に吸水され、ゲル化剤が増粘し、培養層とカバーシートとの密着性により培養層の乾燥を防止することができる。また、培養層にゲル化剤が含まれない場合であっても、ポリビニルピロリドンが溶解し増粘するため、培養層とカバーシートとの密着性により培養層の乾燥を防止することができる。培養層とカバーシートとの密着性が優れると、カバーシートにコロニー形成のための層等を形成する必要がなく、コロニーの優れた視認性を確保することができる。
(5) Frame layer In the microorganism culture sheet of the present invention, it is preferable that a frame layer made of a hydrophobic resin is formed on the outer periphery of the culture layer. When the frame layer is formed, when the test solution is inoculated into the culture layer and covered with a cover sheet, the test solution is quickly diffused to the frame layer. The cover sheet can be covered without waiting, and the inoculation operation can be performed in a short time. In addition, leakage of the test liquid can be prevented more reliably by the frame layer, and the work efficiency at the time of inoculation can be improved. When the culture layer contains a gelling agent, the test solution is absorbed by the culture layer inside the frame layer, the gelling agent thickens, and the adhesion between the culture layer and the cover sheet causes the culture layer to Drying can be prevented. Moreover, even when the gelling agent is not contained in the culture layer, since the polyvinyl pyrrolidone dissolves and thickens, it is possible to prevent the culture layer from drying due to the adhesion between the culture layer and the cover sheet. When the adhesion between the culture layer and the cover sheet is excellent, it is not necessary to form a layer for colony formation on the cover sheet, and excellent visibility of the colonies can be ensured.
(6)粘着層
本発明の微生物培養シートでは、基材シートやカバーシートに粘着層を形成することができる。このような粘着層は、培養層を被覆したカバーシートを固定し、培養層の水分蒸発や汚染を防止する目的で配設され、基材シートを密封できればいかなる種類の粘着剤を用いてもよい。作業性を考えると基材シートとカバーシートとが再接着できる程度に、弱い粘着力を有する粘着剤が好ましい。例えば、ゴム系粘着剤やアクリル系粘着剤が好ましく、特に再剥離タイプ及び微粘着タイプのアクリル系粘着剤が好ましく用いられる。具体的には、ブチルアクリレートや2−エチルヘキシルアクリレート等のアルキルアクリレート(好ましくはアルキルの炭素数が2〜12)100質量部に対し、カルボキシル基や水酸基、アミノ基等の官能基を含有するモノマーを2〜15質量部共重合させたポリマーに、粘着付与剤としてロジン、キシレン樹脂、フェノール樹脂等を加え、メラミン類、イソシアネート類、エポキシ等で架橋したもの等を使用することができる。また、粘着層はどのような形状でもよいが、基材シートとカバーシートとの接着部分に隙間がなく接着できるように配設されることが好ましい。
(6) Adhesive layer In the microorganism culture sheet of this invention, an adhesive layer can be formed in a base material sheet or a cover sheet. Such an adhesive layer is disposed for the purpose of fixing the cover sheet covering the culture layer and preventing moisture evaporation and contamination of the culture layer, and any kind of adhesive may be used as long as the base sheet can be sealed. . In consideration of workability, a pressure-sensitive adhesive having a weak adhesive strength is preferable to the extent that the base sheet and the cover sheet can be re-bonded. For example, a rubber adhesive and an acrylic adhesive are preferable, and a re-peeling type and a slightly adhesive type acrylic adhesive are particularly preferably used. Specifically, a monomer containing a functional group such as a carboxyl group, a hydroxyl group, or an amino group with respect to 100 parts by mass of an alkyl acrylate such as butyl acrylate or 2-ethylhexyl acrylate (preferably an alkyl having 2 to 12 carbon atoms). A rosin, xylene resin, phenol resin, or the like as a tackifier may be added to a copolymer obtained by copolymerization with 2 to 15 parts by mass and crosslinked with melamines, isocyanates, epoxies, or the like. The pressure-sensitive adhesive layer may have any shape, but it is preferable that the adhesive layer is disposed so that the adhesive portion between the base sheet and the cover sheet can be bonded without a gap.
(7)格子印刷層
本発明の微生物培養シートには、格子印刷層が積層されていてもよい。格子印刷は、着色剤、樹脂、溶剤等の選択範囲が広い点でグラビア印刷等が好ましい。枡目の大きさは1cm角程度が適当である。
(7) Lattice Print Layer A lattice print layer may be laminated on the microorganism culture sheet of the present invention. For the grid printing, gravure printing or the like is preferable because it has a wide selection range of colorant, resin, solvent and the like. The size of the mesh is about 1 cm square.
(8)微生物培養キット
本発明では、前記微生物培養シートと、特定成分を含む被検液とを組み合わせて、微生物培養キットとすることができる。
被検液に、培養層に添加することが望ましい成分(例えば、発色指示薬)を添加して培養することができる。特に、滅菌処理その他の工程で変質、変色、分解等を受けやすい成分を含む場合に、有効である。
(8) Microorganism culture kit In the present invention, a microorganism culture kit can be obtained by combining the microorganism culture sheet and a test solution containing a specific component.
A component (for example, a color indicator) that is desirably added to the culture layer can be added to the test solution and cultured. It is particularly effective when it contains components that are susceptible to alteration, discoloration, decomposition, etc. during sterilization and other processes.
(9)製造方法
(i)培養層の形成
本発明の微生物培養シートにおける培養層は、上述のように、基材シートの上に培地液を所定のパターンに配置して乾燥することにより形成することができる。また、パターン形成の方法も、培地液を基材シートの予定した形状に塗布できるものであれば、特に制限はなく、印刷、塗布、塗工、噴霧等の任意の方法を用いることができる。好ましくは、ポリビニルピロリドンのアルコール溶液に、ゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤を含有させた培地液を調製し、該培地液を基材シートの上にパターン形成した後、前記培地液に含まれるアルコールを除去して培養層を形成する。
(9) Production method (i) Formation of culture layer As described above, the culture layer in the microorganism culture sheet of the present invention is formed by placing a medium solution in a predetermined pattern on a substrate sheet and drying it. be able to. Also, the pattern formation method is not particularly limited as long as the medium solution can be applied to the predetermined shape of the base material sheet, and any method such as printing, application, coating, spraying and the like can be used. Preferably, after preparing a medium solution containing a gelling agent, a nutrient component, a selective agent, a chromogenic enzyme substrate and a plasticizer in an alcohol solution of polyvinylpyrrolidone, and patterning the medium solution on a base sheet The alcohol contained in the medium solution is removed to form a culture layer.
微生物培養シートの製造方法では、基材シートと培養層との密着性、パターン形成の容易さ等の理由から、ポリビニルピロリドンのアルコール溶液を使用することが好ましい。アルコールとしては、炭素数1〜5のアルコールを好適に使用することができる。例えば、メタノール、エタノール、イソプロピルアルコール、及びブタノールから選ばれる少なくとも1種を使用することができる。これらの中でも、メタノール、エタノール、又はイソプロピルアルコールが好ましい。従来は、栄養成分を溶解するために水やトルエン等の高沸点溶媒が使用されていたが、溶媒除去のために高温で加熱する必要があり、培養層に含まれる成分や基材の熱分解を招くおそれがあった。また、溶媒除去に過剰の熱エネルギーを使用する必要があり、コスト上昇の一因となり、また、溶媒除去時間も長くなるため生産効率低下の一因ともなっていた。本実施形態では、ポリビニルピロリドンを使用し、その溶媒として、低沸点である前記アルコールを使用することで、培地液に含まれる成分や基材の熱変性を回避し、並びに生産効率を向上することができる。なお、前記趣旨を損
なわない範囲で、アルコールにクロロホルム等の副溶媒を混合した溶媒を使用することもできる。
In the method for producing a microorganism culture sheet, it is preferable to use an alcohol solution of polyvinyl pyrrolidone for reasons such as adhesion between the base sheet and the culture layer and ease of pattern formation. As alcohol, a C1-C5 alcohol can be used conveniently. For example, at least one selected from methanol, ethanol, isopropyl alcohol, and butanol can be used. Among these, methanol, ethanol, or isopropyl alcohol is preferable. Conventionally, high-boiling solvents such as water and toluene have been used to dissolve nutrients, but it is necessary to heat at a high temperature to remove the solvent, and pyrolysis of the components and substrate contained in the culture layer There was a risk of inviting. In addition, it is necessary to use excessive heat energy for solvent removal, which contributes to an increase in cost, and also causes a decrease in production efficiency because the solvent removal time becomes longer. In this embodiment, polyvinyl pyrrolidone is used, and the alcohol having a low boiling point is used as a solvent thereof, thereby avoiding thermal denaturation of components and base materials contained in the medium solution and improving production efficiency. Can do. It should be noted that a solvent in which an alcohol and a secondary solvent such as chloroform are mixed can also be used within a range not impairing the above-mentioned purpose.
ポリビニルピロリドンを培地液の必須の成分とした理由は、前記したように濃度を調整することでゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤等を均一に分散させることができ、しかも、容易に粘度を調整することができるためである。これにより、培地液を容易にパターン形成できる。なお、ポリビニルピロリドンは、優れた成膜性と基材シートに対する密着性とを有するため、接着剤を使用することなく基材シートに培養層を形成することができ、接着剤による微生物の発育阻害を回避することができる。 The reason why polyvinylpyrrolidone is an essential component of the medium solution is that the gelling agent, nutrient component, selective agent, chromogenic enzyme substrate and plasticizer can be uniformly dispersed by adjusting the concentration as described above. Moreover, the viscosity can be easily adjusted. Thereby, pattern formation of a culture solution can be performed easily. Polyvinylpyrrolidone has excellent film-forming properties and adhesion to the substrate sheet, so that a culture layer can be formed on the substrate sheet without using an adhesive. Can be avoided.
ポリビニルピロリドンに対するアルコールの量は、ポリビニルピロリドン100質量部に対して、100質量部以上10000質量部以下であることが好ましく、300質量部以上2000質量部以下であることがより好ましく、900質量部以上1400質量部以下であることが特に好ましい。 The amount of alcohol relative to polyvinylpyrrolidone is preferably 100 parts by mass or more and 10000 parts by mass or less, more preferably 300 parts by mass or more and 2000 parts by mass or less, and more preferably 900 parts by mass or more with respect to 100 parts by mass of polyvinylpyrrolidone. The amount is particularly preferably 1400 parts by mass or less.
培地液を構成するゲル化剤はパターン形成が可能であれば、ポリビニルピロリドンのアルコール溶液に溶解している必要はない。したがって、微生物培養シートの製造方法では、ゲル化剤を粉末で添加することができる。粉末で添加する場合のゲル化剤の平均粒子径は5〜500μm、より好ましくは10〜200μmである。平均粒子径が前記範囲にあれば、分散性に優れる。500μmを超えると分散性が低下し、パターン形成適性が損なわれる場合がある。ただし、これらを溶媒に溶解し、前記ポリビニルピロリドンのアルコール溶液に混合して培地液としてもよい。 The gelling agent constituting the medium solution need not be dissolved in an alcohol solution of polyvinylpyrrolidone as long as pattern formation is possible. Therefore, in the method for producing a microorganism culture sheet, the gelling agent can be added as a powder. When added as a powder, the gelling agent has an average particle size of 5 to 500 μm, more preferably 10 to 200 μm. When the average particle diameter is in the above range, the dispersibility is excellent. If it exceeds 500 μm, the dispersibility may be lowered, and the pattern formation suitability may be impaired. However, these may be dissolved in a solvent and mixed with the polyvinylpyrrolidone alcohol solution to form a medium solution.
培地液におけるゲル化剤の含有量は、ポリビニルピロリドン100質量部に対して、100質量部以上600質量部以下であることが好ましく、250質量部以上400質量部以下であることがより好ましい。ゲル化剤の含有量が前記範囲であれば、被検液滴下の際の水分によって、増粘又はゲル化し、菌の育成に良好な粘度とすることができる。 The content of the gelling agent in the culture medium is preferably 100 parts by mass or more and 600 parts by mass or less, and more preferably 250 parts by mass or more and 400 parts by mass or less with respect to 100 parts by mass of polyvinylpyrrolidone. If the content of the gelling agent is in the above range, it can be thickened or gelled by the water under the test droplet, and can have a good viscosity for growing bacteria.
なお、ポリビニルピロリドンの皮膜は硬くもろい場合があるため、本発明では可塑剤としてポリエチレングリコール又は1,3−ブチレングリコールを添加する。本発明において、本発明の効果を阻害しない限り、エーテルエステル誘導体系可塑剤、プロピレングリコールやグリコール誘導体系可塑剤、グリコールエーテル誘導体系可塑剤、ポリヒドロキシカルボン酸誘導体系可塑剤、又はフタル酸誘導体系可塑剤等の他の可塑剤を添加してもよい。グリセリンやグリセリン誘導体系可塑剤は含まないことが望ましい。 In addition, since the polyvinyl pyrrolidone film may be hard and brittle, in the present invention, polyethylene glycol or 1,3-butylene glycol is added as a plasticizer. In the present invention, an ether ester derivative plasticizer, a propylene glycol or glycol derivative plasticizer, a glycol ether derivative plasticizer, a polyhydroxycarboxylic acid derivative plasticizer, or a phthalic acid derivative system unless the effect of the present invention is inhibited. You may add other plasticizers, such as a plasticizer. It is desirable not to contain glycerin or a glycerin derivative plasticizer.
微生物培養シートの製造方法では、前記培地液を使用してパターン形成するが、特に、前記培地液を使用し、ディスペンサーによる塗布等で好適に培養層を形成することができる。 In the method for producing a microorganism culture sheet, the medium solution is used to form a pattern. In particular, the medium solution can be used to suitably form a culture layer by coating with a dispenser or the like.
前記したように培養層は、2層以上の多層であってもよい。なお、本発明では、培養層が第1培養層と第2培養層とからなる2層である場合に、異なる方法でパターン形成を行ってもよい。例えば、第1培養層をディスペンサーで塗布してパターン形成し、第2培養層のパターン形成に関しては、噴霧等その他の方法を用いてもよい。 As described above, the culture layer may be a multilayer of two or more layers. In the present invention, when the culture layer is a two-layer composed of the first culture layer and the second culture layer, pattern formation may be performed by different methods. For example, the first culture layer may be applied with a dispenser to form a pattern, and other methods such as spraying may be used for pattern formation of the second culture layer.
本実施形態では、培地液を基材シート上にパターン形成した後に、培地液に含まれるアルコールを除去する。ポリビニルピロリドンにゲル化剤等を配合した培養層を使用することで、寒天培地と同様に微生物コロニーを観察及び計数することができ、かつ極めて優れた視認性を得ることができる。なお、ゲル化剤は、水溶性であるため水溶液として調製された後に基材に塗工されることが一般的である。しかし、ゲル化剤は水の除去に高温かつ長時間の加熱処理を行う必要があり、水溶液の調製時に、高い粘度のために気泡等が混入
する場合があった。本実施形態によれば、ゲル化剤等の粉末をポリビニルピロリドンのアルコール溶液に分散させるため、気泡の混入を回避することができ、水を使用していないため、乾燥を低温かつ短時間で行うことができる。また、ゲル化剤等は、ポリビニルピロリドンのアルコール溶液に分散しているだけで溶解していないため、培地液の粘度の上昇を防止することができ、これによって円滑なパターン形成を行うことができる。しかも、得られた培養層では、前記成分がポリビニルピロリドンで被覆されているので、被検液を接種するとポリビニルピロリドンが直ちに溶解し、前記成分が溶解又は吸水する。そのため、被検液の接種後、すぐにカバーシートで被覆することができる。また、ポリビニルピロリドンが溶解したり、ゲル化剤が含まれたりする場合には、それが増粘してカバーシートに密着するため、乾燥を防止しうると共に、極めて優れた視認性を確保することができる。
In the present embodiment, after the medium solution is patterned on the base sheet, alcohol contained in the medium solution is removed. By using a culture layer in which a gelling agent or the like is blended with polyvinylpyrrolidone, microbial colonies can be observed and counted in the same manner as the agar medium, and extremely excellent visibility can be obtained. In addition, since a gelatinizer is water-soluble, it is common to apply to a base material, after preparing as aqueous solution. However, the gelling agent needs to be subjected to heat treatment for a long time at a high temperature in order to remove water, and bubbles and the like may be mixed due to high viscosity when preparing an aqueous solution. According to this embodiment, since powders such as gelling agents are dispersed in an alcohol solution of polyvinyl pyrrolidone, air bubbles can be avoided and water is not used, so drying is performed at a low temperature and in a short time. be able to. Further, since the gelling agent or the like is only dispersed in the polyvinylpyrrolidone alcohol solution but not dissolved, it is possible to prevent an increase in the viscosity of the medium solution, thereby enabling smooth pattern formation. . Moreover, in the obtained culture layer, since the above components are coated with polyvinyl pyrrolidone, when the test solution is inoculated, polyvinyl pyrrolidone dissolves immediately and the above components dissolve or absorb water. Therefore, it can be covered with a cover sheet immediately after inoculation with the test solution. Also, when polyvinylpyrrolidone dissolves or contains a gelling agent, it thickens and adheres closely to the cover sheet, thus preventing drying and ensuring extremely excellent visibility. Can do.
微生物培養シートにおいて、特定成分層は、例えば塗布方法は、全面塗布であっても、パターン形成であってもよい。パターン形成の場合には、培養層の形成と同様に、印刷、塗布、塗工、噴霧等であってもよい。 In the microorganism culture sheet, the specific component layer may be applied, for example, on the entire surface or pattern formation. In the case of pattern formation, printing, application, coating, spraying, and the like may be performed in the same manner as the formation of the culture layer.
培養層の乾燥は、培地液に含まれる前記アルコールを除去できればよく、温度、圧力等、従来公知の方法に準じて乾燥することができる。 The culture layer only needs to be able to remove the alcohol contained in the medium solution, and can be dried according to conventionally known methods such as temperature and pressure.
基材シートの上に形成する培養層の厚さは、乾燥後において50〜1000μmであることが好ましく、200〜600μmであることがより好ましい。また、塗布量は、乾燥後において5〜400g/m2であることが好ましく、100〜300g/m2であることがより好ましい。前記範囲で、菌の発育に最適な粘度の培養層とすることができる。 The thickness of the culture layer formed on the base sheet is preferably 50 to 1000 μm, more preferably 200 to 600 μm after drying. Moreover, it is preferable that it is 5-400 g / m < 2 > after drying, and, as for an application quantity, it is more preferable that it is 100-300 g / m < 2 >. Within the above range, the culture layer can have a viscosity that is optimal for the growth of bacteria.
(ii)枠層の形成
本発明の微生物培養シートは、基材シートの表面、かつ培養層の外周に枠層を形成してもよい。枠層は、疎水性樹脂を用いて形成することができる。なお、枠層の製造方法は特に問わない。あらかじめ枠層が形成された基材シートを使用することもできる。
(Ii) Formation of frame layer The microorganism culture sheet of the present invention may form a frame layer on the surface of the base material sheet and on the outer periphery of the culture layer. The frame layer can be formed using a hydrophobic resin. In addition, the manufacturing method in particular of a frame layer is not ask | required. A base sheet in which a frame layer is formed in advance can also be used.
枠層が形成された基材シートとしては、少なくとも疎水性樹脂を表面に有する基材シートであって、その疎水性樹脂の部分がエンボス加工されることにより、枠の形状に凸部が形成されたものが挙げられる。そして、前記凸部の内側に培養層を形成すれば、微生物培養シートを製造することができる。また、培養層を形成する箇所を凹状にエンボス加工し、凹部の外周に形成される凸部を枠層とすることもできる。 The base sheet on which the frame layer is formed is a base sheet having at least a hydrophobic resin on the surface, and a convex portion is formed in the shape of the frame by embossing the hydrophobic resin portion. Can be mentioned. And if a culture layer is formed inside the said convex part, a microorganisms culture sheet can be manufactured. Moreover, the location which forms a culture layer can be embossed in concave shape, and the convex part formed in the outer periphery of a recessed part can also be used as a frame layer.
(iii)カバーシートの固設
本発明の微生物培養シートは、培養層に被検液を接種した後にカバーシートで培養層を被覆し、これを培養するため、カバーシートの一部が基材シートに固設されていることが好ましい。ただし、直接スタンプや拭き取り試験等の場合、カバーシートが無いことで作業効率が向上する場合には、カバーシートを取り除いて使用してもよい。
(Iii) Fixing of the cover sheet The microorganism culture sheet of the present invention covers the culture layer with the cover sheet after inoculating the test solution on the culture layer and cultures it, so that a part of the cover sheet is a base sheet. It is preferable that it is fixed to. However, in the case of a direct stamp, a wiping test, or the like, if the work efficiency is improved by the absence of the cover sheet, the cover sheet may be removed and used.
カバーシートと基材シートとが同一部材で構成される場合には、別個に作成したカバーシートを基材シートにヒートシールやラミネート接着、その他によって固設してもよいが、カバーシートと基材シートとを同質の材料を使用し、図9(a)の展開図、図9(b)の断面図に示すように基材シート10とカバーシート40とを連設したまま基材シート10に枠層20と培養層30とを形成し、カバーシート40を折り曲げて微生物培養シートを形成してもよい。図9(c)にその断面図を示す。この方法によれば、カバーシートに特定成分層30’や粘着層50を形成する場合でも、基材シート10とカバーシート40が連設されているため、基材シート10の上の培養層30と対向する位置に正確かつ簡便に特定成分層30’を形成することができる。
When the cover sheet and the base sheet are composed of the same member, the cover sheet prepared separately may be fixed to the base sheet by heat sealing, laminating, or the like. The same material is used for the sheet, and the
また、図10及び図11の横断面図に示すように、カバーシート40と基材シート10とを異なる部材で構成し、カバーシート40と、培養層30を形成した基材シート10とを、両面接着テープ60等で張り合わせてもよい。
Moreover, as shown in the cross-sectional views of FIGS. 10 and 11, the
図12及び図13に、カバーシート40に格子印刷が形成され、カバーシート40と培養層30を形成した基材シート10とが端部で接着された微生物培養シートの外観斜視図を示す。図13では、培養層30の周囲に枠層20が形成されている。
12 and 13 are external perspective views of the microorganism culture sheet in which grid printing is formed on the
微生物培養シートは、ガンマ線照射やエチレンオキサイドガス滅菌等の滅菌を施し、微生物培養シートの製品とすることができる。微生物培養シートは、含まれる微生物栄養成分の種類や、使用する基材シート、カバーシートの通気性その他に応じて各種の微生物の培養を行うことできる。 The microorganism culture sheet can be sterilized by gamma ray irradiation or ethylene oxide gas sterilization to obtain a product of the microorganism culture sheet. The microorganism culture sheet can cultivate various microorganisms according to the type of microbial nutrients contained, the base sheet used, the air permeability of the cover sheet, and the like.
また、本発明の微生物培養シートを用いて、試料中に含まれる大腸菌群を効果的に検出することができる。すなわち、本発明の微生物培養シートは、β−ガラクトシダーゼ活性による発色反応において、大腸菌群に対して優れた検出性能を有するため、大腸菌群の検出用ツールとして有用である。また、同様に、本発明の微生物培養シートを用いて、試料中に含まれる黄色ブドウ球菌を効果的に検出することができる。すなわち、本発明の微生物培養シートは、α−グルコシダーゼ活性による発色反応において、黄色ブドウ球菌に対して優れた検出性能を有するため、黄色ブドウ球菌の検出用ツールとして有用である。 Moreover, coliform bacteria contained in a sample can be effectively detected using the microorganism culture sheet of the present invention. That is, the microorganism culture sheet of the present invention has an excellent detection performance for coliforms in a color development reaction by β-galactosidase activity, and thus is useful as a tool for detecting coliforms. Similarly, Staphylococcus aureus contained in a sample can be effectively detected using the microorganism culture sheet of the present invention. That is, since the microorganism culture sheet of the present invention has an excellent detection performance for Staphylococcus aureus in the color development reaction by α-glucosidase activity, it is useful as a tool for detecting Staphylococcus aureus.
そこで、本発明の一形態は、少なくとも1種の細菌を含む試料中の大腸菌群を検出するための方法であって、本発明の微生物培養シートの前記培養層に、前記試料の少なくとも1部を接種する工程と、前記培養層上に接種された細菌を培養する工程と、を含む方法である。 Therefore, one aspect of the present invention is a method for detecting coliform bacteria in a sample containing at least one kind of bacteria, wherein at least a part of the sample is added to the culture layer of the microorganism culture sheet of the present invention. The method includes a step of inoculating and a step of culturing bacteria inoculated on the culture layer.
また、本発明の一形態は、少なくとも1種の細菌を含む試料中の黄色ブドウ球菌を検出するための方法であって、本発明の微生物培養シートの前記培養層に、前記試料の少なくとも1部を接種する工程と、前記培養層上に接種された細菌を培養する工程と、を含む方法である。 One embodiment of the present invention is a method for detecting Staphylococcus aureus in a sample containing at least one kind of bacteria, wherein the culture layer of the microorganism culture sheet of the present invention includes at least a part of the sample. And a step of culturing bacteria inoculated on the culture layer.
次に実施例を挙げて本発明を具体的に説明するが、これらの実施例は何ら本発明を制限するものではない。 EXAMPLES Next, although an Example is given and this invention is demonstrated concretely, these Examples do not restrict | limit this invention at all.
(実施例1)
メタノール276gにポリビニルピロリドン24gを溶解し、ポリビニルピロリドンのメタノール溶液を調製した。このポリビニルピロリドンのメタノール溶液に、ゲル化剤としてのグアーガム粉末75.8g、栄養成分としてのトリプトン9.3g、酵母エキス0.9g、ピルビン酸ナトリウム0.35g、L−トリプトファン0.35g、塩化ナトリウム1.7g、リン酸二水素ナトリウム0.18g、リン酸水素二ナトリウム0.95g、硝酸カリウム0.18g、選択剤としてのラウリル硫酸ナトリウム0.04g、発色酵素基質としてのX−gal0.04g、可塑剤としてのポリエチレングリコール10g、β−ガラクトシダーゼ発現誘導物質としてのIPTG0.04gを添加して培地液を調製した。なお、使用した材料の入手先は以下の通りである。
Example 1
24 g of polyvinyl pyrrolidone was dissolved in 276 g of methanol to prepare a methanol solution of polyvinyl pyrrolidone. In this methanol solution of polyvinyl pyrrolidone, 75.8 g of guar gum powder as a gelling agent, 9.3 g of tryptone as a nutritional component, 0.9 g of yeast extract, 0.35 g of sodium pyruvate, 0.35 g of L-tryptophan, sodium chloride 1.7 g, sodium dihydrogen phosphate 0.18 g, disodium hydrogen phosphate 0.95 g, potassium nitrate 0.18 g, sodium lauryl sulfate 0.04 g as a selective agent, X-gal 0.04 g as a chromogenic enzyme substrate, plasticity A medium solution was prepared by adding 10 g of polyethylene glycol as an agent and 0.04 g of IPTG as a β-galactosidase expression inducer. In addition, the acquisition place of the used material is as follows.
・ポリビニルピロリドン(日本触媒社製、商品名「ポリビニルピロリドン K−90」)・グアーガム粉末(三晶社製、商品名「ネオビスコ G」、200メッシュタイプ)
・トリプトン(Becton,Dickinson and Company社製、商品
名「BACT TRYPTONE」)
・酵母エキス(Becton,Dickinson and Company社製、商品名「YEAST EXTRACT」)
・ピルビン酸ナトリウム(和光純薬工業社製)
・L−トリプトファン(和光純薬工業社製)
・塩化ナトリウム(和光純薬工業社製)
・リン酸二水素ナトリウム(和光純薬工業社製)
・リン酸水素二ナトリウム(和光純薬工業社製)
・硝酸カリウム(和光純薬工業社製)
・ラウリル硫酸ナトリウム(和光純薬工業社製)
・X−gal(5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド、BIOSYNTH社製)
・ポリエチレングリコール(和光純薬工業社製、ポリエチレングリコール600、和光一級)
・IPTG(和光純薬工業社製)
・ Polyvinylpyrrolidone (made by Nippon Shokubai Co., Ltd., trade name “Polyvinylpyrrolidone K-90”) ・ Guar gum powder (made by Sanki Co., Ltd., trade name “Neovisco G”, 200 mesh type)
・ Tryptone (Becton, Dickinson and Company, trade name “BACT TRYPTONE”)
-Yeast extract (Becton, Dickinson and Company, trade name “YEAST EXTRACT”)
・ Sodium pyruvate (Wako Pure Chemical Industries)
・ L-tryptophan (Wako Pure Chemical Industries)
・ Sodium chloride (Wako Pure Chemical Industries)
・ Sodium dihydrogen phosphate (Wako Pure Chemical Industries, Ltd.)
・ Disodium hydrogen phosphate (manufactured by Wako Pure Chemical Industries, Ltd.)
・ Potassium nitrate (Wako Pure Chemical Industries, Ltd.)
・ Sodium lauryl sulfate (Wako Pure Chemical Industries, Ltd.)
X-gal (5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside, manufactured by BIOSYTHH)
・ Polyethylene glycol (Wako Pure Chemical Industries, polyethylene glycol 600, Wako first grade)
・ IPTG (Wako Pure Chemical Industries)
次に、この培地液をポリエチレンテレフタラートフィルム(帝人デュポン社製、商品名「テイジンテトロンフィルム」)の上に所定のパターンに配置した後、50℃で15分間乾燥させ、培養層を形成した。乾燥後の培養層の厚さは、約250μmであった。次いで、ディスペンサーを用いて、UV硬化インク(十条ケミカル社製、商品名「レイキュアーGA 4100−2」)を幅1.0mm、高さ750μm、直径52mmの円状に塗布した。続いて、水銀ランプを用いて積算光量250mJ/cm2の紫外線を照射し、UV硬化インクを硬化させ、培養層の周りに疎水性樹脂を用いて枠層を形成した。 Next, this medium solution was placed in a predetermined pattern on a polyethylene terephthalate film (trade name “Teijin Tetron Film” manufactured by Teijin DuPont), and then dried at 50 ° C. for 15 minutes to form a culture layer. The thickness of the culture layer after drying was about 250 μm. Next, using a dispenser, UV curable ink (manufactured by Jujo Chemical Co., Ltd., trade name “Recure GA 4100-2”) was applied in a circular shape having a width of 1.0 mm, a height of 750 μm, and a diameter of 52 mm. Subsequently, an ultraviolet ray having an accumulated light amount of 250 mJ / cm 2 was irradiated using a mercury lamp to cure the UV curable ink, and a frame layer was formed using a hydrophobic resin around the culture layer.
そして、カバーシート(東セロ社製、OPPフィルム、型番「OP U−1(片面コロナ放電処理)」、厚み:40μm)を、前記ポリエチレンテレフタラートフィルムの上に積層し、端部を接着した後、γ線で滅菌して、微生物培養シート(1)を作製した。 And, after laminating a cover sheet (manufactured by Tosero Co., Ltd., OPP film, model number “OP U-1 (single-sided corona discharge treatment)”, thickness: 40 μm) on the polyethylene terephthalate film and bonding the ends, Sterilized with gamma rays to prepare a microorganism culture sheet (1).
(実施例2)
ポリエチレングリコール10gの代わりに、1,3−ブチレングリコール(和光純薬工業社製)10gを用いて培地液を調製したこと以外は、実施例1と同様にして微生物培養シート(2)を作製した。
(Example 2)
A microorganism culture sheet (2) was prepared in the same manner as in Example 1 except that 10 g of 1,3-butylene glycol (manufactured by Wako Pure Chemical Industries, Ltd.) was used instead of 10 g of polyethylene glycol. .
(比較例1)
ポリエチレングリコール10gの代わりに、グリセリン(阪本薬品工業社製)10gを用いて培地液を調製したこと以外は、実施例1と同様にして、微生物培養シート(3)を作製した。
(Comparative Example 1)
A microorganism culture sheet (3) was produced in the same manner as in Example 1, except that 10 g of glycerin (manufactured by Sakamoto Yakuhin Kogyo Co., Ltd.) was used instead of 10 g of polyethylene glycol.
「評価」
Escherichia coli(ATCC25922)又はKlebsiella
pneumoniae(ATCC13883)(両方とも大腸菌群に含まれる)を液体培地(TRYPTIC SOY BROTH)にて37℃で24時間振盪培養した。そして、得られた被検液のそれぞれを菌数が102/mlとなるように滅菌生理食塩水で希釈し、TTCを添加して、2つの培養試験用被検液をそれぞれ調製した。これらの培養試験用被検液を、微生物培養シート(1)〜(3)の培養層の上に1mlずつそれぞれ接種し、それらの上にカバーシートを乗せて、被検液を培養層全体に広げた。その後、約1分間静置してゲルを形成させ、6つの培養試験用サンプルを得た。得られた培養試験用サンプルを37℃で48時間培養した。そして、培養後に発生したコロニーについて発色の有無を確認した。培養後の培養試験用サンプルの写真を図14〜16にそれぞれ示す。なお、図14は実施例1で作製した微生物培養シート(1)を用いた培養試験用サンプルを示し
、図14(A)はE.coliの被検液を接種した培養試験用サンプル、図14(B)はK.pneumoniaeの被検液を接種した培養試験用サンプルを示す。図15は実施例2で作製した微生物培養シート(2)を用いた培養試験用サンプルを示し、図15(A)はE.coliの被検液を接種した培養試験用サンプル、図15(B)はK.pneumoniaeの被検液を接種した培養試験用サンプルを示す。図16は比較例1で作製した微生物培養シート(3)を用いた培養試験用サンプルを示し、図16(A)はE.coliの被検液を接種した培養試験用サンプル、図16(B)はK.pneumoniaeの被検液を接種した培養試験用サンプルを示す。
"Evaluation"
Escherichia coli (ATCC 25922) or Klebsiella
pneumoniae (ATCC13883) (both included in the coliform group) was cultured with shaking in a liquid medium (TRYPTIC SOY BROTH) at 37 ° C. for 24 hours. Then, each of the obtained test solutions was diluted with sterile physiological saline so that the number of bacteria was 10 2 / ml, and TTC was added to prepare two test solutions for culture test. 1 ml of each of these test liquids for culture test is inoculated on the culture layers of the microorganism culture sheets (1) to (3), and a cover sheet is placed on each of the culture layers. Spread out. Then, it left still for about 1 minute, the gel was formed, and six samples for culture tests were obtained. The obtained sample for culture test was cultured at 37 ° C. for 48 hours. And the presence or absence of color development was confirmed about the colony which generate | occur | produced after culture | cultivation. Photographs of culture test samples after culture are shown in FIGS. 14 shows a sample for culture test using the microorganism culture sheet (1) prepared in Example 1, and FIG. A culture test sample inoculated with a test solution of E. coli, FIG. The sample for culture | cultivation tests which inoculated the test liquid of pneumoniae is shown. FIG. 15 shows a culture test sample using the microorganism culture sheet (2) prepared in Example 2, and FIG. A sample for a culture test inoculated with a test solution of E. coli, FIG. The sample for culture | cultivation tests which inoculated the test liquid of pneumoniae is shown. FIG. 16 shows a sample for culture test using the microorganism culture sheet (3) prepared in Comparative Example 1, and FIG. A sample for culture test inoculated with a test solution of E. coli, FIG. The sample for culture | cultivation tests which inoculated the test liquid of pneumoniae is shown.
可塑剤としてポリエチレングリコール又は1,3−ブチレングリコールが含まれている微生物培養シート(1)又は(2)(実施例1及び2)では、図14又は15に示されるように、E.coli(ATCC25922)及びK.pneumoniae(ATCC13883)の両方でX−Galによる発色が確認された。しかし、可塑剤としてグリセリンが含まれている微生物培養シート(3)(比較例1)では、図16に示されるように、E.coli(ATCC25922)では発色が確認されるものの、K.pneumoniae(ATCC13883)では発色が確認されなかった。比較例1の結果より、グリセリンを用いると、大腸菌群の中でもβ−ガラクトシダーゼ基質による発色反応を確認できない菌がいることがわかる。そして、意外にも、グリセリンの代わりにポリエチレングリコール又は1,3−ブチレングリコールを可塑剤として用いることにより、グリセリンを用いた場合では発色が確認できない菌であっても、β−ガラクトシダーゼ基質による発色反応を確認できることがわかる。 In the microorganism culture sheet (1) or (2) (Examples 1 and 2) containing polyethylene glycol or 1,3-butylene glycol as a plasticizer, as shown in FIG. coli (ATCC 25922) and K.I. In both pneumoniae (ATCC 13883), color development by X-Gal was confirmed. However, in the microorganism culture sheet (3) (Comparative Example 1) containing glycerin as a plasticizer, as shown in FIG. Although color development is confirmed in E. coli (ATCC 25922), K. No color development was confirmed with pneumoniae (ATCC 13883). From the results of Comparative Example 1, it can be seen that when glycerin is used, there are bacteria in the E. coli group that cannot confirm the coloring reaction by the β-galactosidase substrate. Surprisingly, by using polyethylene glycol or 1,3-butylene glycol as a plasticizer instead of glycerin, even when the glycerin is used, color development reaction with β-galactosidase substrate is not possible even when the color is confirmed. You can see that.
以下の試験例では、α−グルコシダーゼ活性又はホスファターゼ活性を利用した発色反応試験において、グリセリンを含む培養層を用いた場合に発色反応が得られない菌がいるかどうか、また、グリセリンの代わりにポリエチレングリコールを用いた場合に発色反応が得られるかどうかについて、寒天培地にて簡易的に調べた。 In the following test examples, in the color reaction test using α-glucosidase activity or phosphatase activity, there is a bacterium that does not produce a color reaction when using a culture layer containing glycerin, and polyethylene glycol instead of glycerin. Whether or not a color development reaction was obtained when using was examined in a simple manner on an agar medium.
(参考例1)
トリプトンを4.0g/l、ポリエチレングリコールを18.7g/l、4−メチルウンベリフェリル−α−D−グルコピラノシドを0.1g/l、及び寒天を15.0g/l含む培地液を調製した。この培地液をオートクレーブで滅菌した後、シャーレに広げて固め、寒天培地(1)を作製した。
(Reference Example 1)
A medium solution containing tryptone 4.0 g / l, polyethylene glycol 18.7 g / l, 4-methylumbelliferyl-α-D-glucopyranoside 0.1 g / l, and agar 15.0 g / l was prepared. . This medium solution was sterilized by an autoclave and then spread and hardened in a petri dish to prepare an agar medium (1).
(参考例2)
ポリエチレングリコールを寒天培地液に添加しなかったこと以外は、参考例1と同様にして、寒天培地(2)を作製した。
(Reference Example 2)
An agar medium (2) was prepared in the same manner as in Reference Example 1 except that polyethylene glycol was not added to the agar medium solution.
(参考例3)
4−メチルウンベリフェリル−α−D−グルコピラノシド0.1g/lの代わりに、ホスファターゼの発色酵素基質である5−ブロモ−4−クロロ−3−インドキシル−ホスフェイトを0.1g/lの濃度で寒天培地液に添加し、かつポリエチレングリコール18.7g/lの代わりにグリセリンを18.7g/lの濃度で寒天培地液に添加したこと以外は、参考例1と同様にして、寒天培地(3)を作製した。
(Reference Example 3)
Instead of 0.1 g / l 4-methylumbelliferyl-α-D-glucopyranoside, 5-bromo-4-chloro-3-indoxyl-phosphate, a chromogenic enzyme substrate for phosphatase, at a concentration of 0.1 g / l In the same manner as in Reference Example 1 except that glycerin was added to the agar medium at a concentration of 18.7 g / l instead of polyethylene glycol 18.7 g / l. 3) was produced.
(比較例2)
ポリエチレングリコール18.7g/lの代わりにグリセリンを18.7g/lの濃度で寒天培地液に添加したこと以外は、参考例1と同様にして、寒天培地(4)を作製した。
(Comparative Example 2)
An agar medium (4) was prepared in the same manner as in Reference Example 1, except that glycerin was added to the agar medium solution at a concentration of 18.7 g / l instead of polyethylene glycol 18.7 g / l.
「評価」
α−グルコシダーゼ活性を有する菌として、S.aureus(ATCC25923)、S.aureus(ATCC25904)、及びS.aureus(ATCC13276)を使用した。これらの3種の菌を液体培地(TRYPTIC SOY BROTH)にて37℃で24時間振盪培養した。そして、得られた被検液を菌数が102/mlとなるように滅菌生理食塩水で希釈し、3つの培養試験用被検液をそれぞれ調製した。この培養試験用被検液を、寒天培地(1)〜(4)の上に0.1mlずつそれぞれ接種し、コンラージ棒を用いて塗抹後、培養試験用サンプルを得た。得られた培養試験用サンプルを35℃で48時間培養した。表1に発色反応の結果を示す。なお、表1において、○はα−グルコシダーゼ基質又はホスファターゼ基質による発色反応が確認されたことを示す。×はα−グルコシダーゼ基質による発色反応が確認されなかったことを示す。
"Evaluation"
As a bacterium having α-glucosidase activity, aureus (ATCC 25923), S.A. aureus (ATCC 25904), and S. aureus. aureus (ATCC 13276) was used. These three types of bacteria were cultured with shaking in a liquid medium (TRYPTIC SOY BROTH) at 37 ° C. for 24 hours. Then, the obtained test solution was diluted with sterilized physiological saline so that the number of bacteria was 10 2 / ml, and three test solutions for culture test were prepared. Each 0.1 ml of this test liquid for culture test was inoculated on each agar medium (1) to (4) and smeared using a conage bar to obtain a sample for culture test. The obtained sample for culture test was cultured at 35 ° C. for 48 hours. Table 1 shows the results of the color development reaction. In Table 1, o indicates that a color development reaction with an α-glucosidase substrate or a phosphatase substrate was confirmed. X indicates that the color development reaction by the α-glucosidase substrate was not confirmed.
比較例2では、可塑剤としてグリセリンを含む場合、α−グルコシダーゼ基質による発色反応は確認されなかった。また、可塑剤を添加しなかった参考例2では、α−グルコシダーゼ基質による発色反応が確認された。これにより、通常ではα−グルコシダーゼ基質による発色反応により検出できる菌において、グリセリンの存在により、発色反応が確認できなくなる菌が存在することがわかる。また、可塑剤としてポリエチレングリコールを用いた参考例1では、試験したすべての菌についてα−グルコシダーゼ基質による発色反応を確認できた。なお、参考例3より、可塑剤としてグリセリンを用いた場合であっても、ホスファターゼ基質による発色反応は確認された。 In Comparative Example 2, when glycerin was included as a plasticizer, a color reaction by the α-glucosidase substrate was not confirmed. Further, in Reference Example 2 in which no plasticizer was added, a coloring reaction with an α-glucosidase substrate was confirmed. As a result, it can be seen that in bacteria that can usually be detected by a color reaction with an α-glucosidase substrate, there are bacteria in which the color reaction cannot be confirmed due to the presence of glycerin. Moreover, in Reference Example 1 using polyethylene glycol as the plasticizer, it was possible to confirm the color development reaction with the α-glucosidase substrate for all the tested bacteria. In addition, from Reference Example 3, even when glycerin was used as the plasticizer, a color reaction by the phosphatase substrate was confirmed.
本発明の微生物培養シートは、例えば、菌の検出や菌数検査等に用いることができる。 The microorganism culture sheet of the present invention can be used for, for example, detection of bacteria or inspection of the number of bacteria.
10 基材シート
20 枠層
30 培養層
30’ 特定成分層
40 カバーシート
50 粘着層
60 両面接着テープ
DESCRIPTION OF
Claims (9)
前記培養層が、ポリビニルピロリドン、ゲル化剤、栄養成分、選択剤、発色酵素基質及び可塑剤を含有し、
前記発色酵素基質が、β−ガラクトシダーゼにより分解される発色酵素基質又はα−グルコシダーゼにより分解される発色酵素基質であり、
前記可塑剤が、ポリエチレングリコール及び1,3−ブチレングリコールから選択される少なくとも1つである微生物培養シート。 A microorganism culture sheet having a base sheet, a culture layer formed on the base sheet, and a cover sheet covering the culture layer,
The culture layer contains polyvinylpyrrolidone, a gelling agent, a nutrient component, a selective agent, a chromogenic enzyme substrate and a plasticizer,
The chromogenic enzyme substrate is a chromogenic enzyme substrate that is degraded by β-galactosidase or a chromogenic enzyme substrate that is degraded by α-glucosidase,
The microorganism culture sheet, wherein the plasticizer is at least one selected from polyethylene glycol and 1,3-butylene glycol.
請求項1乃至7のいずれかに記載の微生物培養シートの前記培養層に、前記試料の少なくとも一部を接種する工程と、
前記培養層上に接種された細菌を培養する工程と、
を含む方法。 A method for detecting coliforms in a sample comprising at least one bacterium, comprising:
Inoculating the culture layer of the microorganism culture sheet according to any one of claims 1 to 7 with at least a part of the sample;
Culturing bacteria inoculated on the culture layer;
Including methods.
請求項1乃至7のいずれかに記載の微生物培養シートの前記培養層に、前記試料の少なくとも一部を接種する工程と、
前記培養層上に接種された細菌を培養する工程と、
を含む方法。
A method for detecting S. aureus in a sample comprising at least one bacterium, comprising:
Inoculating the culture layer of the microorganism culture sheet according to any one of claims 1 to 7 with at least a part of the sample;
Culturing bacteria inoculated on the culture layer;
Including methods.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015005146A JP6443060B2 (en) | 2015-01-14 | 2015-01-14 | Microbe culture sheet |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015005146A JP6443060B2 (en) | 2015-01-14 | 2015-01-14 | Microbe culture sheet |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018222382A Division JP2019030337A (en) | 2018-11-28 | 2018-11-28 | Microorganism culture sheet |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016129505A JP2016129505A (en) | 2016-07-21 |
| JP6443060B2 true JP6443060B2 (en) | 2018-12-26 |
Family
ID=56414661
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015005146A Active JP6443060B2 (en) | 2015-01-14 | 2015-01-14 | Microbe culture sheet |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6443060B2 (en) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019030337A (en) * | 2018-11-28 | 2019-02-28 | 大日本印刷株式会社 | Microorganism culture sheet |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2455447B1 (en) * | 2009-07-14 | 2019-03-06 | Dai Nippon Printing Co., Ltd. | Microorganism culture sheet and manufacturing method therefor |
-
2015
- 2015-01-14 JP JP2015005146A patent/JP6443060B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016129505A (en) | 2016-07-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6460170B2 (en) | Microbial culture sheet and method for producing the same | |
| JP5803677B2 (en) | Microbe culture sheet | |
| JP5082930B2 (en) | Microbe culture sheet | |
| JP2011072279A (en) | Microorganism culture sheet | |
| JP6443060B2 (en) | Microbe culture sheet | |
| JP2009153500A (en) | Microorganism-culturing sheet | |
| EP3269822B1 (en) | Methods to detect a biological activity | |
| JP2019030337A (en) | Microorganism culture sheet | |
| JP2009153501A (en) | Microorganism culture sheet and method for producing microorganism culture sheet | |
| JP6066274B2 (en) | Microorganism culture device and microbe inspection method using microorganism culture device | |
| JP6724333B2 (en) | Microorganism culture sheet and method for detecting microorganisms | |
| US11505816B2 (en) | Medium for detecting Staphylococcus aureus, sheet for detecting S. aureus comprising same, and method for detecting S. aureus using same | |
| JP5764900B2 (en) | Microbe test cover sheet, method for manufacturing microbe test cover sheet, and microbe test kit | |
| JP2014090701A (en) | Microorganism culture device, and microorganism inspection method using the same | |
| JP7507591B2 (en) | Microbial culture sheet | |
| JP5796294B2 (en) | Microbe culture sheet | |
| JP2014150751A (en) | Microbial cultivator |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20171129 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180928 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20181030 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20181112 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6443060 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |