JP4401555B2 - 新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法。 - Google Patents
新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法。 Download PDFInfo
- Publication number
- JP4401555B2 JP4401555B2 JP2000329032A JP2000329032A JP4401555B2 JP 4401555 B2 JP4401555 B2 JP 4401555B2 JP 2000329032 A JP2000329032 A JP 2000329032A JP 2000329032 A JP2000329032 A JP 2000329032A JP 4401555 B2 JP4401555 B2 JP 4401555B2
- Authority
- JP
- Japan
- Prior art keywords
- protease
- chymotrypsin
- pna
- ala
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Meat, Egg Or Seafood Products (AREA)
- Seasonings (AREA)
- Enzymes And Modification Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
Description
【発明の属する技術分野】
本発明は、新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法に関するものである。
【0002】
【従来の技術】
キモトリプシンは脊椎動物に由来するセリンプロテアーゼであり、エンドペプチダーゼ活性を有するため、食品工業分野においてはこのキモトリプシンの性質を利用した食品の改質等が行われておりキモトリプシンの需要は今後益々増大することが予想される。
【0003】
しかし、キモトリプシンの供給源となる動物臓器の供給量には制限があり、また狂牛病等のプリオン病への懸念もあるため、キモトリプシンの需要の増大に十分対応できない虞があり、キモトリプシンと同等の基質特異性を有する量産性のある酵素の出現が強く望まれていた。
【0004】
一方、キモトリプシンと同様に食品の改質等に利用できる微生物由来の量産性のあるプロテアーゼが提供されている。例えば、バチルス・ズブチリス(Bacillus・subtilis)由来のズブチリシン(subtilisin)が工業的に広く利用されているが、ズブチリシンは基質特異性が低く特定のペプチド結合部位を特異的に切断できないため、食品を所望の特性に改質し難いという問題点があった。また、トリコデルマ(Trichoderma)属の微生物由来で塩基性アミノ酸のC末端を特異的に加水分解するトリプシン様のプロテアーゼが本出願人により報告されている(特開2000−116377号参照)が、トリプシンの基質特異性はキモトリプシンのそれとは全く異なり、改質される食品の特性も異なるため、トリプシン様プロテアーゼをキモトリプシンの代替物として利用することができなかった。
【0005】
【発明が解決しようとする課題】
本発明は、上記従来の問題点を解決するためになされたものであり、量産性のある新規なキモトリプシン様プロテアーゼ及びその製造法を提供すること並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法を提供することを課題とする。
【0006】
【課題を解決するための手段】
そこで、本発明者らは、上記課題を解決すべく鋭意検討した結果、トリコデルマ(Trichoderma)属由来の菌株がキモトリプシン様プロテアーゼをも生産することを見出し、本発明を完成するに至った。
【0007】
すなわち、本発明は、グリシニンに下記(1)〜(8)の理化学的性質を有するキモトリプシン様プロテアーゼを作用させることを特徴とする抗酸化性ペプチドの製造法を提供するものである。
(1)作用・基質特異性:キモトリプシン様のプロテアーゼ活性を有する。
アミノ酸配列がAsn―Arg−Val―Tyr−Val−His−Pro―Phe―His−Leuであるヒト[Asn1,Val5]−アンギオテンシンIに作用してチロシンとフェニルアラニンのC末端側を加水分解し、合成基質Suc−Ala―Ala―Pro―Phe―pNAに作用するが、N―t−Boc−Leu―Gly−Arg−pNA及びN−t−Boc―O―Bz―Ser−Gly−Arg―pNAには作用しない。
(Suc−:スクシニル(Succinyl)−、N−t−Boc−:N−t−ブチルオキシカルボニル(N−t−Butyloxycarbonyl)−、−pNA:−p−ニトロアニリド(p−Nitroanilide))
(2)至適pH:pH8である。
(3)至適温度:40℃である。
(4)pH安定性:pH5.0〜11.5の範囲で安定である。
(5)温度安定性:40℃まで安定である。
(6)阻害剤:セリンプロテアーゼ阻害剤のDFP(ジイソプロピルフルオロホスフェート)、PMSF(フェニルメタンスルフォニルフルオライド)及びキモトリプシン阻害剤でもあるキモスタチン(Chymostatin)で阻害される。
(7)分子量:31,000(SDS−ポリアクリルアミドゲル電気泳動)
(8)等電点:8.5である。
【0009】
さらに本発明は、タンパク質又はタンパク質含有物に、上記の理化学的性質を有するキモトリプシン様プロテアーゼを作用させ当該タンパク質を分解させることを特徴とするタンパク質分解物含有物の製造法を提供するものである。ここで、タンパク質分解物含有物とは、動物由来、植物由来を問わずタンパク質又はタンパク質を含む素材に本発明のキモトリプシン様プロテアーゼを作用させてタンパク質の一部又は全部を酵素分解させて得られる物をいう。
【0010】
【発明の実施の形態】
本発明のキモトリプシン様プロテアーゼはトリコデルマ(Trichoderma)属に属する菌株から得ることができる。トリコデルマ(Trichoderma)属に属する菌株としては、キモトリプシン様プロテアーゼ生産能を有するものであればいかなる菌株でも使用することができ、これらの菌株の変異株でも使用することができる。トリコデルマ(Trichoderma)属に属するキモトリプシン様プロテアーゼ生産能を有する菌株の具体例としては、例えば、トリコデルマ・エスピーNo.9064(Trichoderma sp.No.9064)菌株が挙げられる.本菌株の菌学的性質は次の通りである。
【0011】
1.形態
菌糸 :無色。隔壁を有す。直径1.0〜6.0μm。
分生子柄 :不規則に分岐し、各分岐にフィアライドを形成する。直径4.5〜5.5μm。
フィアライド:びん形。8〜12×3.5〜4.5μm。無色。
分生子 :フィアロ型分生子。楕円形あるいは卵形。3.5〜5.0×2.0〜3.0μm。濃緑色。フィアライドの頂端で塊状になる。
厚膜胞子 :亜球形〜洋梨形。10〜12×6〜9μm。
【0012】
2.生育状態
麦芽・イーストエキス寒天培地
形成は全面に起こる場合と不規則に点状もしくは斑状になる場合がある;裏面は白色で水溶性の黄色色素を生成する。
ポテトデキストロース寒天培地
生育は麦芽・イーストエキス寒天培地に比べやや悪いが、培養性状は殆ど同様である。
【0013】
本菌株は有性胞子を欠き、栄養体が隔壁を有する菌糸体であるから不完全菌であること、菌糸はよく発達し、出芽細胞を欠き、裸出した分生子を形成するので不完全糸状菌類である。生育は速やかで、分生子の形成により濃緑色になり、分生子柄は分岐し、びん形のフィアライドを形成し、分生子はフィアロ型、フィアライドの頂端で塊状になることから、トリコデルマ(Trichoderma)属に分類される。
【0014】
以上の性質から、この菌株をトリコデルマ(Trichoderma)属に属する菌株と同定し、トリコデルマ・エスピーNo.9064(Trichoderma sp.No.9064)と命名した。
本菌株に最も類似した性質を示すものとしてトリコデルマ ビリデ(Trichoderma viride)が挙げられる。本菌株は通商産業省工業技術院生命工学工業技術研究所に平成10年9月24日付でFERM P−17003として寄託されている。
【0015】
次に、本発明のキモトリプシン様プロテアーゼの製造法について説明する。本製造法には、トリコデルマ(Trichoderma)属に属するいずれの菌株も使用することができるが、例えば、トリコデルマ・エスピー(Trichoderma sp.)FERM P−17003が挙げられる。
【0016】
トリコデルマ(Trichoderma)属に属する菌株を用いて本製造法のキモトリプシン様プロテアーゼを生産蓄積させる培養方法としては、液体培養法、固体培養法の何れでもよい。固体培養法の培地としては、小麦ふすま単独あるいは小麦ふすまに種々の添加物、例えばきな粉、大豆粉、アンモニウム塩、硝酸塩、尿素、グルタミン酸、アスパラギン酸、ポリペプトン、コーンスティープリカー、肉エキス、酵母エキス、タンパク質加水分解物などの有機および無機の窒素化合物などを添加して用いることができ、また、適当な無機塩類を加えることもできる。
【0017】
また、液体培養法の培地としては、当該菌株が良好に生育し、当該酵素を順調に生産するために必要な炭素源、窒素源、無機塩類、必要な栄養源等を含有する合成培地または天然培地があげられる。例えば、炭素源としては、澱粉またはその組成画分、焙焼デキストリン、加工澱粉、澱粉誘導体、物理処理澱粉及びα―澱粉等の炭水化物が使用できる。具体例としては、可溶性澱粉、トウモロコシ澱粉、馬鈴薯澱粉、甘藷澱粉、デキストリン、アミロペクチン、アミロース等があげられる。
【0018】
窒素源としては、ポリペプトン、カゼイン、肉エキス、酵母エキス、コーンスティープリカーあるいは大豆または大豆粕などの抽出物等の有機窒素源物質、硫酸アンモニウム、リン酸アンモニウム等の無機塩窒素化合物、グルタミン酸等のアミノ酸類が挙げられる。
【0019】
そして、無機塩類としては、リン酸1カリウム、リン酸2カリウム等のリン酸塩、硫酸マグネシウム等のマグネシウム塩、塩化カルシウム等のカルシウム塩、炭酸ナトリウム等のナトリウム塩等が用いられる。
【0020】
固体培養の場合には、静置培養で行い、培地のpHを3〜7に調整したものに本菌株を摂取し、10〜40℃で1〜10日間培養を行う。培養後その培養抽出物からキモトリプシン様プロテアーゼをエタノール沈降などの手段により粗酵素沈殿物として得ることができる。
【0021】
そして、液体培養の場合には、培養は、振盪培養もしくは、通気攪拌培養等の好気的条件下において行い、培地をpH4〜10の範囲,好ましくはpH5〜8の範囲に調製し、温度10〜40℃の範囲、好ましくは25〜37℃で、24〜96時間培養する。培養後菌体を除去し、粗酵素液を得る。
【0022】
次に、これらの粗酵素液に公知の硫安塩析、ゲルろ過、遠心分離、疎水クロマトグラフィー、イオン交換クロマトグラフィーなどの処理を適宜組み合わせることにより、精製された高純度のキモトリプシン様プロテアーゼが得られる。
【0023】
次に、上記性質を有するキモトリプシン様プロテアーゼをタンパク質又はタンパク質含有物に作用させることにより、当該タンパク質を分解させてタンパク質分解物含有物を製造する方法について説明する。
【0024】
タンパク質とは、例えば牛、豚、馬、めん羊、山羊、家兎、家禽等の動物由来又は米、麦、トウモロコシ、大豆等の植物由来のポリペプチドをいう。タンパク質含有物とは、動物由来、植物由来の別を問わず、少なくともタンパク質を含有している物であって、タンパク質の含有量の多少に拘らず本発明のキモトリプシン様プロテアーゼを作用させることができる物をいう。従って、この条件を満たすものは全て本発明におけるタンパク質含有物に含まれるが、例えば、穀類、乳、食肉、貝類、骨ガラ等又はこれらの処理物が挙げられる。穀類には、米、麦、トウモロコシ、大豆等が含まれるが、米、大豆が好適である。乳には、牛、めん羊、山羊等の乳が含まれるが、牛乳が好適である。食肉には、牛肉、豚肉、馬肉、めん羊肉、山羊肉、家兎肉、家禽肉等が含まれるが、牛肉が好適である。貝類には、アサリ、ハマグリ、カキ、アワビ、ホタテ貝等が含まれるが、ホタテ貝が好適である。骨ガラには、牛、豚、馬、めん羊、山羊、鶏等の骨ガラが挙げられるが、鶏の骨ガラが好ましい。上記の処理物としては、ホタテ貝について言えば、その中腸腺が好ましく、牛乳について言えば、そのホエーが好ましい。これらのタンパク質含有物として好適なものは、食品素材として広範な用途を有する点で利用価値が高い。タンパク質含有物の形態は特に限定される必要はなく、固形状、半固形状、流動状、液状のいずれの形態をとるものでもよい。
【0025】
これらのタンパク質又はタンパク質含有物に本発明のキモトリプシン様プロテアーゼを作用させる際は、当該プロテアーゼの作用形態は特に制限されないが、粉末等の固形状の他、懸濁状、溶液状等の形態を、タンパク含有物の性質・形態等を考慮し、使用することができる。
【0026】
pHは、少なくとも5〜11の範囲が好ましいが、更に効率的にタンパク質の加水分解を目的とする場合はpH7〜9の範囲がより好ましい。作用温度は、タンパク質を含有する物質の性質等を考慮して適宜定めることができるが、効率的なタンパク質の加水分解が可能な点で約40℃が好ましい。
【0027】
作用時間は通常1〜48時間であるが、所望する分解の程度を考慮し適宜定めることができる。本発明のキモトリプシン様プロテアーゼの使用量は、通常、タンパク質含有物1g当たり10〜20,000単位であるが、タンパク質含有物中に含まれるタンパク質の量・性質等を考慮して適宜定めることができる。さらに、食品素材の改質に多様性を求める場合には、本発明のキモトリプシン様プロテアーゼに加えて、他のプロテアーゼを作用させることもできる。他のプロテアーゼとしては、アミノペプチダーゼ、カルボキシペプチダーゼ等が挙げられるが、酵母起源のカルボキシペプチダーゼや糸状菌起源のアミノペプチダーゼが好ましく、ペプチダーゼR(天野エンザイム株式会社製)等は市販品を容易に入手できる。アミノペプチダーゼの添加量は食品素材の材質、所望する改質等を考慮し適宜定めることができるが、通常、タンパク質含有物1g当たり40〜100,000単位である。本発明のキモトリプシン様プロテアーゼ及び/又は他のプロテアーゼの作用を終了させるためには、必要に応じ当該プロテアーゼを加熱等により失活させることができる。
【0028】
本発明のキモトリプシン様プロテアーゼを作用させて得られるタンパク質分解物含有物は、実施例に示すように、抗酸化性、呈味性の向上、低抗原性、低切断応力等の多様な特性を有し、食品素材として広範な用途が期待できるが、該タンパク質分解物含有物のこれらの特性は公知の測定手段、例えば、抗酸化性については、Active Oxygen法(油脂化学便覧:日本油化学協会編、515頁 )等、呈味性については、パネリストによる官能試験、フォルモール滴定法によるアミノ酸定量、ケルダール法による総タンパク量の定量等、抗原性については、Inhibition Elisa法(日本小児アレルギー学会誌、1,36,1987)等、切断応力については、ミートシェアー(ワーナーブラッツラー社製)を用いる方法等により確認できる。
【0029】
以上のように、本発明により得られるキモトリプシン様プロテアーゼは、蛋白質も含めて、ポリペプチドの鎖中の芳香族アミノ酸残基のカルボキシル側を切断する性質を有し、該キモトリプシン様プロテアーゼにより改質された食品素材には、自動酸化に対する抗酸化性、呈味性の向上、抗原性の低減、切断応力の低減等の効果が認められるため、各種の蛋白質を含有する食品の製造に利用することができ、例えばヨーグルト、チーズ、発酵ハム等の品質の安定化、風味の向上が図れ、また低アレルゲン食品等の製造が可能となり、食品分野においてタンパク質の性質の改変に広範に資することができる。以下に、実施例により本発明をより具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【0030】
【実施例】
実施例1(キモトリプシン様プロテアーゼの培養)
ポテトデキストロース寒天培地(極東製薬製)に30℃、5日間培養したトリコデルマ・エスピーNo.9064(Trichoderma sp.No.9064)(FERM P−17003)を、滅菌した8(w/v)%の小麦ふすま懸濁液250mLを入れた培養フラスコに接種し、30℃、40時間、140rpmの条件下振盪培養し、種培養とした。
【0031】
これを小麦ふすま850gと黄な粉150gに560mLの水を散水し滅菌した固体培地に全量接種し、30℃に68時間、静置培養してプロテアーゼを産生させた。培養後、小麦ふすまに水4200mLを加え、産生した酵素を抽出し、粗酵素液3000mLを得た。分画分子量6000の限外ろ過膜で600mLまで濃縮し、デキストリン40gを溶解させた後、冷エタノール2000mLを添加し粗酵素沈殿物を得た。粗酵素沈殿物を濾別後、減圧下(665Pa)、40℃で22時間乾燥し、60gの粗酵素粉末を得た。
【0032】
実施例2(キモトリプシン様プロテアーゼの精製)
実施例1で得られた粗酵素粉末1gを緩衝液(20mmol/Lの酢酸緩衝液、pH5.0)100mLに溶解後、遠心分離(7,000×g、5分間)を行いその上清をCM−トヨパール650Mカラムに添加した。吸着したタンパク質を60mmol/Lの酢酸緩衝液(pH5.0)のリニアグラジエントで溶出した。溶出した酵素活性画分を回収し、30%飽和となるように硫酸アンモニウム粉末を加え、30%飽和硫酸アンモニウムを含む60mmol/Lの酢酸緩衝液(pH5.0)で平衡化したフェニルセファロースファーストフロー(phenyl−Sepharose fast flow、ファルマシア製)カラムに添加した。吸着したタンパク質を30%飽和硫酸アンモニウムを含む60mmol/Lの酢酸緩衝液(pH5.0)から60mmol/Lの酢酸緩衝液(pH5.0)のリニアグラジエントで溶出した。溶出した酵素活性画分を精製酵素標品(以下、「本酵素液」という。)とした。本酵素液は、図1に示すようにSDS−PAGEで単一バンドを示した。
【0033】
酵素活性測定法(カゼイン基質)
本酵素液1mLと同量の1(w/v)%カゼイン溶液(67mmol/Lのリン酸緩衝液、pH7.0)を混合し、37℃において20分間反応する。反応後、5(w/v)%トリクロロ酢酸溶液3mLを加え、反応を停止し、30分放置後、東洋濾紙No.131で濾過し、得られた濾液の280nmの吸光度を測定した。上記反応条件下、1分間あたり280nmの吸光度を0.001上昇させる酵素量を1単位とした。
【0034】
実施例3(キモトリプシン様プロテアーゼの理化学的性質)
(1)作用・基質特異性:キモトリプシン様のプロテアーゼ活性を有する。
【0035】
ヒトアンギオテンシンIに対する基質特異性
ヒトアンギオテンシンIに対する基質特異性を以下のように検討した。
本酵素液25μLにヒトアンギオテンシンI25μLを加え、pH7.0、30℃、24時間インキュベートさせた。生じたペプチド断片を逆相HPLCによって分取し、それをPICO−TAG法によるアミノ酸組成分析を行うことにより、切断部位の推定を行った結果、ヒトアンギオテンシンIのN末端から4番目のチロシンと8番目のフェニルアラニンのC末端側を加水分解していることが分かった。この結果より、本酵素はキモトリプシン様プロテアーゼであることが推定された。
【0036】
合成基質に対する基質特異性
合成基質として、Suc−Ala―Ala―Pro―Phe―pNA、Suc−Ala―Ala―Val―Ala―pNA、Glt−Ala―Ala―Pro―Leu―pNA、t−Boc−Ala―Ala―Pro−Ala―pNA、Pyr−Phe―Leu―pNA、N−t−Boc―Leu−Gly−Arg―pNA、N−t−Boc―O―Bz―Ser−Gly−Arg―pNA、Suc−Ala―Ala―Pro―Asp―pNA、Suc−Ala―Pro−Ala―pNA、Suc−Ala―Ala−Ala―pNA、Suc−Ala−Ala―pNA、Z−Gly−Gly―Leu―pNAを用い、実施例2で得られたキモトリプシン様プロテアーゼの基質特異性を以下のように測定した。即ち、10mmol/Lの上記各ペプチジルパラニトロアニリド(peptidyl―pNA)のジメチルスルホキシド(以下、「DMSO」という。)溶液10μLと、67mmol/L、pH7.0のリン酸緩衝液700μLを混ぜ、これに本酵素液100μLを加えた。25℃で10分間反応後、1mol/L酢酸200μLを加え反応停止後、405nmの吸光度を測定した。遊離するパラニトロアニリンの吸光係数を9920/((mol/L)・cm)(25℃)として基質分解速度を算出した。本酵素液の代わりに、67mmol/L、pH7.0のリン酸緩衝液100μLで同様の操作を行ったものをコントロールとして、酵素サンプルとの差をとり活性を測定した。Suc−Ala−Ala−Pro−Phe−pNAに対する活性を100%として、相対値で表した。その結果、表1に示すように、実施例2で得られた本酵素液はSuc−Ala−Ala−Pro−Phe−pNAのパラニトロアニリドに隣接するフェニルアラニンのC末端側を良く加水分解し、特異的なキモトリプシン様のプロテアーゼ活性を示した。一方、本酵素液はパラニトロアニリドに隣接するアミノ酸残基がアルギニン残基であるN−t−Boc―Leu−Gly−Arg―pNA及びN−t−Boc―O―Bz―Ser−Gly−Arg―pNAを加水分解せず、トリプシン様プロテアーゼ活性は示さなかった。パラニトロアニリドに隣接するアミノ酸残基がアスパラギン酸残基であるSuc−Ala―Ala―Pro―Asp―pNAでは加水分解は認められなかった。パラニトロアニリドに隣接するアミノ酸残基がアラニン残基及びロイシン残基については、本酵素液による加水分解率が0〜25%であり低い活性を示すに留まった。上記結果から、本発明のプロテアーゼはキモトリプシン様プロテアーゼであって、トリプシン様活性を有するプロテアーゼと異なることが推定される。
【0037】
【表1】
【0038】
Suc:Succinyl
pNA:p―Nitroanilide
Z :Carbobenzoxy
Glt:Glutaryl
Bz :Benzoyl
t−Boc:t−Butyloxycarbonyl
Pyr:Pyroglutamyl
【0039】
(2)至適pH:pH2〜8.4の67mmol/Lクエン酸緩衝液、pH8.4〜12の67mmol/Lグリシン−水酸化ナトリウム緩衝液を用意し、各pHの緩衝液700μLと10mmol/L濃度に溶解したSuc−Ala−Ala−Pro−Phe−pNAのDMSO溶液10μLに、本酵素液100μLを加え25℃で10分間インキュベートし、1mol/L酢酸200μLを加え、反応停止後、405nmの吸光度を測定した。最も活性の高い所を基準(100%)として、各pHで相対活性を求め、至適pHを求めた。図2に示すように、至適pHは8を中心に存在した。
【0040】
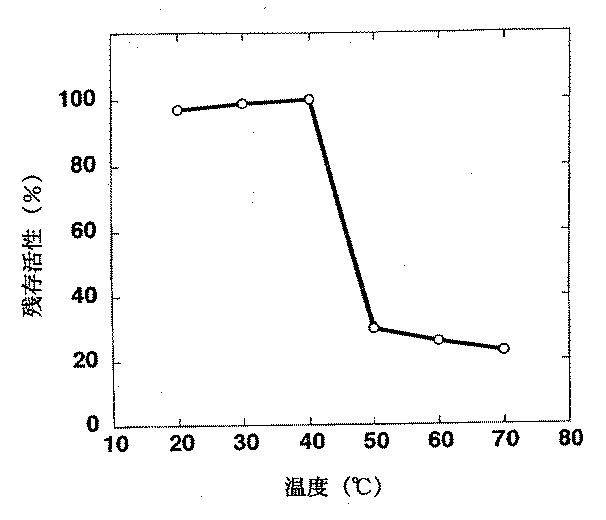
(3)至適温度:pH7.0、67mmol/Lリン酸緩衝液700μLに10mmol/L濃度に溶解したSuc−Ala―Ala―Pro―Phe―pNAのDMSO溶液10μLを20〜70℃の各温度で20分のプレインキュベーションを行った後、本酵素液100μLを加え各温度で10分間反応させた。1mol/L酢酸200μLを加え、反応停止後、405nmの吸光度を測定した。図3に示すように至適温度は40℃であった。
【0041】
(4)pH安定性:67mmol/Lのクエン酸緩衝液(pH2〜8.4)及び67mmol/Lのグリシンー水酸化ナトリウム緩衝液(pH8.4〜12.0)を用い、各pHの緩衝液200μLと本酵素液100μLを混合し、40℃に1時間放置後、pHを7.0にした後、その100μLを67mmol/Lのリン酸緩衝液(pH7.0)700μLと10mmol/L濃度に溶解したSuc−Ala―Ala―Pro―Phe―pNAのDMSO溶液10μLに加え25℃、10分間反応させた。反応後1mol/L酢酸200μLを加え反応を停止後、405nmの吸光度を測定した。その結果、図4に示すようにpH5.0〜11.5の範囲で元の活性の8割を維持していた。
【0042】
(5)温度安定性:67mmol/Lリン酸緩衝液(pH7.0)700μLに本酵素液100μLを加え各温度で20分プレインキュベートした後、25℃まで冷却し、10mmol/L濃度に溶解したSuc−Ala―Ala―Pro―Phe―pNAのDMSO溶液を加え25℃、10分間反応させた。反応後1mol/L酢酸200μLを加え反応を停止後、405nmの吸光度を測定した。その結果、図5に示すように、40℃まで安定性がみられたものの40℃を過ぎると急激な低下が認められた。
【0043】
(6)阻害剤:シグマアルドリッチジャパン株式会社製のセリンプロテアーゼ阻害剤であるDFP(ジイソプロピルフルオロホスフェート)、PMSF(フェニルメタンスルホニルフルオライド)及びSTI(大豆由来トリプシンインヒビター)、システインプロテアーゼ阻害剤であるPCMPS(パラクロロマーキュリフェニルスルホン酸)及びMIA(モノヨード酢酸)、セリンプロテアーゼ及びシステインプロテアーゼの阻害剤であるロイペプチン(Leupeptin)、アンチパイン(Antipain)及びキモトリプシン阻害剤でもあるキモスタチン(chymostatin)、アスパラギン酸プロテアーゼ阻害剤であるペプスタチン(Pepstatin)及び含金属プロテアーゼ阻害剤であるEDTA(エチレンジアミン四酢酸)を用いて実施例2で得られた本酵素液に対する阻害効果を次のように測定した。即ち、本酵素液100μLに阻害剤溶液(67mmol/Lリン酸緩衝液、pH7.0)100μLを加え30℃にて1時間プレインキュベートした後、更にSuc−Ala−Ala−Pro−Phe−pNAのDMSO溶液10μLと67mmol/Lのリン酸緩衝液(pH7.0)600μLを加えて25℃にて10分インキュベートし、1mol/L酢酸200μLを加え反応を停止した後、405nmの吸光度を測定した。基質の自己分解をコントロールとしてサンプルとの差をとり活性を定量した。阻害剤を含まない時の活性を100%として表2に示した。その結果、キモトリプシン様プロテアーゼはDFP、PMSF、キモスタチンで完全に阻害され、STI、PCMPS、MIAおよびPepstatinでは阻害されなかった。またAntipainは強度の阻害、EDTAは中等度の阻害、Leupeptinは弱い阻害をそれぞれ示した。基質特異性及び各阻害剤の阻害効果から判断して、本発明のプロテアーゼはキモトリプシン様プロテアーゼであると共にセリンプロテアーゼに属すると推定され、本出願人が既に報告(特開2000−116377号参照)したトリプシン様プロテアーゼとは異なる性質を示すことが分かった。
【0044】
【表2】
【0045】
(7)分子量:SDS−ポリアクリルアミド電気泳動(15%ゲル)はLaemmliの方法に準じて行った。標準タンパク質としては、ファルマシア製のフォスフォリラーゼb(Phosphorylase b(94,000)))、牛血清アルブミン(bovine serum albumin(67,000))、オボアルブミン(ovalalbumin(43,000))、カルボニックアンハイドラーゼ(carbonic anhydrase(30,000))、大豆トリプシンインヒビター(soybean trypsin inhibitor(20,100))、α―ラクトアルブミン(α―lactalbumin(14,400))を使用し、ゲル染色はCoomassie Brilliant Blue R−250(ファルマシア製)を用いたCBB染色を用いた。その結果、本発明のキモトリプシン様プロテアーゼの分子量は31,000と推定された。
【0046】
(8)等電点:等電点電気泳動(15%ゲル)は、スラブゲルを用いた。pH勾配の作成にはアンフォライン(Ampholine、ファルマシア製、pH3〜10)を用い、泳動は35V、6mAで行った。その結果、本発明のキモトリプシン様プロテアーゼの等電点は8.5と推定された。
【0047】
実施例4 抗酸化性ペプチドの製造法
市販大豆から単離したグリシニン3gに、水100mLを加えpH7.0に調製後、本発明の酵素をミルクカゼイン活性で500単位加え、40℃に1時間反応させた後、85℃で10分間保ち酵素を失活させた。本グリシニン分解物と、未分解グリシニンとをリノール酸の自動酸化に対する抗酸化性をActive oxygen法で測定(油脂化学便覧:日本油化学協会編、515頁)したところ、未分解グリシニンに比し8倍の抗酸化能が上昇した。本グルシニン分解物は食品の酸化防止又は酸化遅延作用を有する食品素材として利用することができる。
【0048】
実施例5 調味液の製造
5%市販脱脂大豆懸濁液1Lを、pH7.0に調整後、本発明の酵素をタンパク質1g当たり100単位と、ペプチダーゼR(天野エンザイム株式会社製)1g(420単位)を添加し、40℃に20時間攪拌しつつ反応させた。反応後、80℃に15分保ち、酵素を失活させ、遠心分離により清澄なタンパク分解液を得た。この分解液をカフェイン溶液を指標に呈味性試験をしたところ、苦みは無く、旨みが感じられた。分解液の分析値は、総窒素2.5mg/ mL、タンパク質1.5%、遊離アミノ酸0.62%、フォルモール態窒素 /総窒素 ×100は43.5%であった。本タンパク分解液は肉エキス配合調味液やスープのベースとして利用することができる。
ペプチダーゼ活性測定法
50mmol/L、pH7.0のリン酸緩衝液にロイシルグリシルグリシン(Leucyl−Glycyl−Glycine)を0.2mol/L濃度に溶解した基質液1mLに、酵素液0.1mLを加え37℃で60分間反応した。反応後、沸騰水中に5分間保ち、冷却した後、2mLのニンヒドリン溶液と0.1mLの塩化第一スズ溶液を加える。沸騰水中に20分間保った後、冷却、10mLの50(w/v)%のn−プロパノールを加え、570nmで吸光度を測定する。上記条件下、1分間当たり1マイクロモルのアミノ酸を遊離する酵素量を1単位とした。
【0049】
実施例6 低アレルゲン化ホエー蛋白分解物の製造
ホエー蛋白の水溶液2Lに、本発明の酵素を蛋白質1g当たり400単位加え、pHを7.0に調整後、40℃に10時間反応した。反応後、85℃に10分間保ち酵素を失活させ遠心分離により、不溶物を除去後、上清を常法により濃縮後、乾燥し115gの粉末を得た。得られたホエー分解物の抗原性を、Inhibition Elisa法(日本小児アレルギー学会誌、1,36,1987)に従い、β―ラクトアルブミンを対照として測定したところ、ホエー分解物の抗原性 はβ―ラクトアルブミンの抗原性の1/ 10,000未満であった。本ホエー分解物は、各種の食物アレルギー、アトピー性皮膚炎その他のアレルギー体質の消費者を対象とする食品素材として、広範に使用され得るものである。
【0050】
実施例7 低蛋白米の製造法
精白度90%の精白米3kgを、常法により洗米後、0.05%の本発明の酵素液に浸漬した。
pHを7.0に調整し、40℃に10時間処理した後、白米を分離し水洗により酵素を除去した。本発明の酵素で処理することにより、原料精白米のタンパク質を54%除去した低タンパク米を製造した。低アレルゲン化したこの低タンパク米は、各種の食物アレルギー、アトピー性皮膚炎その他のアレルギー体質の消費者を対象とする食品素材として、広範に使用され得るものである。
【0051】
実施例8 食肉の軟化
市販輸入牛のもも肉を10mm厚にスライスした。その肉質の均一な部分を20g程に成形後、本発明の酵素を振り掛け、ラップで覆った後、5℃の冷蔵庫に5時間放置した。酵素添加量は、肉1g当たり30単位である。その後、200℃のホットプレートで片面1分づつ焼成し、2cm幅の帯状にカットした後、ミートシェアー(ワーナーブラッツラー3000型、ワーナーブラッツラー社製)で切断応力を測定した。その結果、酵素無処理に比べ、酵素処理した肉の切断応力は55%低下しており、本発明の酵素が食肉の軟化に有用であることが明らかとなった。軟化した食肉は、食肉の食感に変化を与えると共に咀嚼能力の低下した高齢者に適するため、高齢化社会の進展につれて今後ますます需要の増大が期待される。
【0052】
実施例9 貝類エキスの製造
帆立貝中腸腺100gを300mLの水にケンダク後、ホモジナイザーで均質化した後、10分間95℃に保った。40℃に冷却後本発明の酵素を基質1g当たり2000単位加え、同温度に3時間分解した。反応後、85℃で15分間加熱し、酵素を失活させ、遠心分離後、限外ろ過膜(分画分子量10,000)でろ過、蛋白濃度 1.30(w/v)%、遊離アミノ酸0.71(w/v)%のエキス230mLを得た。当該エキスは、各種のスープのベース、調味液のベースとして広範に利用され得るものである。
【0053】
実施例10 チキンエキスの製造
ブロイラー首部骨ガラ100gをミンチ後、水200mLを添加し、95℃で1時間エキス抽出した。60メッシュの篩(飯田製作所製)でろ過後、残査に200mLの水と本発明の酵素500単位を加え、40℃で4時間反応後、15分間煮沸、遠心分離し、上澄をエキスとして得た。更にエバポレーター濃縮し、水分50(w/v)%、蛋白質38(w/v)%を含む呈味性に優れた、チキンエキスを得た。当該エキスは、上記貝殻エキスと同様、各種のスープのベース、調味液のベースとして広範に利用され得る。
【0054】
【発明の効果】
本発明の微生物由来のキモトリプシン様活性を有するプロテアーゼは新規であり、かつ動物由来のキモトリプシンと同様の高い基質特異性を有しており、キモトリプシンの代替プロテアーゼとなることができ有用である。
【0055】
本発明のタンパク質分解物含有物の製造法は、キモトリプシン様プロテアーゼの高い基質特異性により各種タンパク質又はタンパク質含有物の分解に使用することが可能であり、広く食品分野に適用することができる。
【図面の簡単な説明】
【図1】 本発明のキモトリプシン様プロテアーゼの分子量を測定したSDS−PAGEを示す図である。
【図2】 本発明のキモトリプシン様プロテアーゼのpH特性を示す図である。
【図3】 本発明のキモトリプシン様プロテアーゼの温度特性を示す図である。
【図4】 本発明のキモトリプシン様プロテアーゼのpH安定性を示す図である。
【図5】 本発明のキモトリプシン様プロテアーゼの温度安定性を示す図である。
Claims (1)
- グリシニンに下記(1)〜(8)の理化学的性質を有するキモトリプシン様プロテアーゼを作用させることを特徴とする抗酸化性ペプチドの製造法。
(1)作用・基質特異性:キモトリプシン様のプロテアーゼ活性を有する。
アミノ酸配列がAsn―Arg−Val―Tyr−Val−His−Pro―Phe―His−Leuであるヒト[Asn1,Val5]−アンギオテンシンIに作用してチロシンとフェニルアラニンのC末端側を加水分解し、合成基質Suc−Ala―Ala―Pro―Phe―pNAに作用するが、N―t−Boc−Leu―Gly−Arg−pNA及びN−t−Boc―O―Bz―Ser−Gly−Arg―pNAには作用しない。
(Suc−:スクシニル(Succinyl)−、N−t−Boc−:N−t−ブチルオキシカルボニル(N−t−Butyloxycarbonyl)−、−pNA:−p−ニトロアニリド(p−Nitroanilide))
(2)至適pH:pH8である。
(3)至適温度:40℃である。
(4)pH安定性:pH5.0〜11.5の範囲で安定である。
(5)温度安定性:40℃まで安定である。
(6)阻害剤:セリンプロテアーゼ阻害剤のDFP(ジイソプロピルフルオロホスフェート)、PMSF(フェニルメタンスルフォニルフルオライド)及びキモトリプシン阻害剤でもあるキモスタチン(Chymostatin)で阻害される。
(7)分子量:31,000(SDS−ポリアクリルアミドゲル電気泳動)
(8)等電点:8.5である。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000329032A JP4401555B2 (ja) | 2000-10-27 | 2000-10-27 | 新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法。 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000329032A JP4401555B2 (ja) | 2000-10-27 | 2000-10-27 | 新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法。 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2002125665A JP2002125665A (ja) | 2002-05-08 |
| JP4401555B2 true JP4401555B2 (ja) | 2010-01-20 |
Family
ID=18805782
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000329032A Expired - Fee Related JP4401555B2 (ja) | 2000-10-27 | 2000-10-27 | 新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法。 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4401555B2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013047082A1 (ja) | 2011-09-29 | 2013-04-04 | 天野エンザイム株式会社 | 外因性オピオイドペプチド分解酵素剤 |
| US9011842B2 (en) | 2010-02-02 | 2015-04-21 | Amano Enzyme Inc. | Use of proteases for gluten intolerance |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009148248A (ja) * | 2007-11-26 | 2009-07-09 | Univ Nihon | 低アレルゲン化剤 |
| JP2011211988A (ja) * | 2010-04-01 | 2011-10-27 | Ajinomoto Co Inc | 減カロリー飲食品用組成物 |
| EP2744900B1 (en) | 2011-08-19 | 2017-07-19 | Novozymes A/S | Polypeptides having protease activity |
| CN110777093A (zh) * | 2019-11-06 | 2020-02-11 | 华中农业大学 | 基于复合菌种结合胰凝乳蛋白酶的菌酶协同固态发酵剂 |
-
2000
- 2000-10-27 JP JP2000329032A patent/JP4401555B2/ja not_active Expired - Fee Related
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9011842B2 (en) | 2010-02-02 | 2015-04-21 | Amano Enzyme Inc. | Use of proteases for gluten intolerance |
| US9498520B2 (en) | 2010-02-02 | 2016-11-22 | Amano Enzyme Inc. | Use of proteases for gluten intolerance |
| WO2013047082A1 (ja) | 2011-09-29 | 2013-04-04 | 天野エンザイム株式会社 | 外因性オピオイドペプチド分解酵素剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002125665A (ja) | 2002-05-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3609648B2 (ja) | 新規蛋白質脱アミド酵素、それをコードする遺伝子、その製造法並びにその用途 | |
| JP4202748B2 (ja) | タンパク加水分解物 | |
| JP3153237B2 (ja) | タンパク質加水分解物 | |
| CA2401961A1 (en) | Cultured protein hydrolysate | |
| JPH08322471A (ja) | 食用加水分解物製品を得る方法 | |
| US20110165305A1 (en) | Method for preparing a protein hydrolysate | |
| Bao et al. | Comparison of ACE inhibitory activity in skimmed goat and cow milk hydrolyzed by alcalase, flavourzyme, neutral protease and proteinase K | |
| JPH10503659A (ja) | アスペルギルス・ニゲル由来のアミノペプチダーゼの生産 | |
| WO2009147103A2 (en) | Method for producing a wheat protein hydrolysate | |
| JP4401555B2 (ja) | 新規なキモトリプシン様プロテア−ゼ及びその製造法並びに新規なキモトリプシン様プロテアーゼを作用させるタンパク質分解物含有物の製造法。 | |
| US6767729B1 (en) | Enzyme liquor and process for producing the same enzyme preparation protease preparations and protease-producing bacterium | |
| JP3142001B2 (ja) | 酵素加水分解タン白の苦味除去方法 | |
| JP4278831B2 (ja) | 酵素液とその製造方法、酵素剤、蛋白質分解酵素剤、蛋白質分解酵素生産菌 | |
| El Soda et al. | The intracellular peptide-hydrolases of Lactobacillus plantarum. Comparison with Lactobacillus casei | |
| JP3508370B2 (ja) | 高グルタミン酸含有汎用調味料 | |
| JP2022102874A (ja) | エラスチンペプチド | |
| JP4071876B2 (ja) | 新規なセリンプロテアーゼ及びその製造法 | |
| JP2001178398A (ja) | 発酵調味料及びその製造方法 | |
| JP4347062B2 (ja) | ポリヌクレオチド、ポリペプチド、ポリペプチドの製造方法 | |
| JP3403472B2 (ja) | 蛋白質加水分解物の呈味改善方法 | |
| Fiechter | Enzyme Studies | |
| JP2022102875A (ja) | 低分子エラスチンペプチド | |
| Chunju et al. | Comparison of ACE inhibitory activity in skimmed goat and cow milk hydrolyzed by alcalase, flavourzyme, neutral protease and proteinase K. | |
| JP2001321188A (ja) | 多重に形質転換された麹菌及びそれを用いる調味料の製造法 | |
| JPS63148985A (ja) | 魚類蛋白質分解用酵素の製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20061006 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090804 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091001 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20091001 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20091023 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20091028 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121106 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |