JP4161382B2 - 2層構造粒子状組成物の製造方法 - Google Patents
2層構造粒子状組成物の製造方法 Download PDFInfo
- Publication number
- JP4161382B2 JP4161382B2 JP08429397A JP8429397A JP4161382B2 JP 4161382 B2 JP4161382 B2 JP 4161382B2 JP 08429397 A JP08429397 A JP 08429397A JP 8429397 A JP8429397 A JP 8429397A JP 4161382 B2 JP4161382 B2 JP 4161382B2
- Authority
- JP
- Japan
- Prior art keywords
- cobalt
- nickel
- lithium
- powder
- hydroxide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/485—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of mixed oxides or hydroxides for inserting or intercalating light metals, e.g. LiTi2O4 or LiTi2OxFy
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Compounds Of Heavy Metals (AREA)
- Secondary Cells (AREA)
- Battery Electrode And Active Subsutance (AREA)
Description
【発明の属する技術分野】
本発明は、リチウムイオン二次電池における正極活物質として好適に用いることができる2層構造粒子状組成物の製造方法に関する。
【0002】
【従来の技術】
リチウムニッケル複合酸化物は、高出力、高エネルギー密度電池として、例えば、ノート型パソコン、PHS、携帯電話等に使用されているリチウムイオン二次電池における正極活物質として近年注目されている材料の1つである。このリチウムニッケル複合酸化物は、例えば、「超音波噴霧熱分解法による球状LiCoO2微粉体の合成とリチウム二次電池用活物質への応用」(萩原隆、斉藤善彦、柳川昭明、小形信男、吉田幸吉、高島正之、米沢晋、水野泰晴、永田憲史、小川賢治、ジャーナル・オブ・ザ・セラミック・ソサイエティー・オブ・ジャパン(Journal of the Ceramic Society of Japan)、第101巻、第1159〜1163頁(1993年)に記載されているように、LiMO2(式中、Mは、Cr、Mn、Ni、Fe、Co又はVである。)で表わされる一群の化合物の一つであって、LiCoO2と同様に、特に、充放電電圧が高いので、正極活物質として非常に有用である。
【0003】
このようなリチウムニッケル複合酸化物をリチウムイオン二次電池の正極活物質として使用するに際して、その性能を高めるために、リチウムニッケル複合酸化物の組成を変化させたものや、リチウムニッケル複合酸化物の物理的性質を改善したものが提案されている。
【0004】
リチウムニッケル複合酸化物の組成を変化させたものとしては、特開平4−328278号公報に、LixMO2(Mは遷移金属を示す。0.05≦x<1.10)で表わされ、LiCO3含有量が0.5〜15重量%であるものが記載されている。
【0005】
また、特開平6−150929号公報には、Na、Kのうち少なくとも1種を含むLiNiO2が記載されている。特開昭62−256371号公報、特開平5−36411号公報、特開平7−307150号公報には、Co、V、Cr、Fe、P、B、Si、Mo、W等の元素を含むLiNiO2が記載されている。リチウムニッケル複合酸化物の物理的性質を改善したものとして、特開平7−10590号公報には、一次粒子が1μm以下の二次以上の集合粒子からなるLiNiO2粒子が開示されている。このLiNiO2粒子はリチウムイオン二次電池の正極活物質に用いた場合、再現性にすぐれ、高充放電量を得ることができることが記載されている。
【0006】
しかし、このようにして改善されたリチウムニッケル複合酸化物を用いて製作した電池であっても、これを高温の環境雰囲気に長時間放置した場合、例えば、真夏の日中、上記電池を搭載した携帯電話を停車している自動車に放置した場合、正極活物質のリチウムニッケル複合酸化物と非水電解液が反応して、非水電解液の一部が分解、ガス化し、電池容器内圧が上昇して、電池が破裂し、電池装着機器の破損等、火災を招き、また、環境を汚損する等の危険性がある。
【0007】
そこで、このような問題を解決するために、特開平8−138670号公報には、リチウムニッケル複合酸化物(LiNiO2)粉末の表面層をコバルトのような異種の遷移元素の濃度の高い層としたものを二次電池の正極活物質として用いる非水溶媒二次電池が提案されている。しかし、上記公報の実施例に示されているリチウムニッケル複合酸化物粉末のように、粉末粒子の表面層に存在する異種元素、例えば、コバルトの濃度が低く、異種元素のニッケルに対する原子比が0.2以下であって、上述した問題の解決は、未だ十分ではない。
【0008】
【発明が解決しようとする課題】
本発明は、従来のリチウムニッケル複合酸化物における上述したような問題を解決するためになされたものであって、酸化物を構成する金属種が相互に相違するリチウム複合酸化物からなる2層構造を有する粒子状組成物の製造方法であって、この粒子状組成物を正極活物質として用いてなるリチウムイオン二次電池を構成すれば、この電池は、高温に保持した場合にも、非水電解液の分解を最小に抑えることができるようなリチウム複合酸化物粒子状組成物の製造方法を提供することを目的とする。
【0009】
より詳細には、リチウムニッケル複合酸化物粒子を正極活物質とするリチウムイオン二次電池を高温で保持した場合、その活物質の粒子と非水電解液との界面で非水電解液の分解反応が起こって、分解ガスが発生し、電池容器内の圧力が上昇して、電池が破裂するおそれが生じる。そこで、この非水電解液の分解を抑制するためには、活物質粒子と非水電解液の界面をできるだけ小さくすればよい、即ち、活物質粒子の比表面積をできるだけ小さくすればよい。しかし、一般に、活物質粒子の比表面積を小さくするときは、充放電容量が低下すると共に、充放電の応答性が低下するという不具合も生じる。従って、これらの特性のバランスのとれた電池特性が得られる比表面積を有する活物質粒子を用いることがリチウムイオン二次電池を製作するうえで重要な要件であった。
【0010】
しかし、本発明者らは、活物質粒子の比表面積に関係なく、高温安定性にすぐれたリチウムイオン二次電池用活物質用粒子状組成物の製造方法を見出して、本発明に至ったものである。
【0011】
【課題を解決するための手段】
本発明によれば、水酸化ニッケルの粉末を水に分散したスラリーに、アンモニウムイオンの存在下、コバルト塩水溶液と苛性アルカリ水溶液を連続的に添加して反応させることによって、水酸化ニッケルの粒子の表面に水酸化コバルトを被覆してなる粒子を調製し、これに水酸化リチウムを混合して、焼成することからなる、リチウムニッケル複合酸化物からなる中心層とリチウムコバルト複合酸化物からなる表面層とを備えると共に、粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にあるリチウムイオン二次電池用正極活物質用2層構造粒子状組成物の製造方法が提供される。
【0012】
また、本発明によれば、水酸化ニッケルの粉末を水に分散したスラリーに、アンモニウムイオンの存在下、コバルト塩水溶液と苛性アルカリ水溶液を連続的に添加して反応させることによって、水酸化ニッケルの粒子の表面に水酸化コバルトを被覆してなる粒子を調製し、これを酸化して、含水酸化ニッケルコバルトを調製し、次いで、これを水分散媒中、水酸化リチウムと水熱反応を行うことからなる、リチウムニッケル複合酸化物からなる中心層とリチウムコバルト複合酸化物からなる表面層とを備えると共に、粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にあるリチウムイオン二次電池用正極活物質用2層構造粒子状組成物の製造方法が提供される。
【0014】
【発明の実施の形態】
以下に本発明による2層構造粒子状組成物について詳しく説明する。
本発明による粒子状組成物は、中心層と表面層の2層からなる粒子状組成物であって、中心層はリチウムニッケル複合酸化物からなり、表面層はリチウムコバルト複合酸化物からなる。しかし、電池特性に有害な影響を与えない範囲において、中心層と表面層は、それぞれその他の酸化物や複合酸化物を有していてもよい。
【0015】
本発明による2層構造粒子状組成物は、2層構造を有すれば、どのような形状であってもよく、例えば、リチウムニッケル複合酸化物からなる一次粒子である中心層をリチウムコバルト複合酸化物からなる表面層が被覆する構造を有するもののほか、上記中心層、表面層又はこれらの両方がそれぞれの複合酸化物からなる一次粒子の集合体でもよい。後述するように、その形状は、実質的に球状であることが好ましいが、しかし、実質的に立方体状であってもよいし、その他の形状でもよい。
【0016】
本発明による上記粒子状組成物の形状や大きさは、特に、限定されるものではないが、リチウムイオン二次電池の正極活物質として用いる場合、平均粒子径3〜100μmであって、実質的に球状であることが好ましい。このように、粒子状組成物が実質的に球状であるとき、充填性にすぐれる、即ち、充填密度を大きくすることができるので好ましい。また、その平均粒子径が3μm未満であるときは、リチウムイオン二次電池の正極活物質として用いた場合に、充填率が低いので、電池の単位容積当たりの電気容量が低くなり、他方、平均粒子径が100μmを越えるときには、その粒子が、例えば、ポリプロピレン等の重合体の多孔性フイルムからなるセパレータを貫通して、正極と負極との間に短絡を生じるおそれがあるので、好ましくない。特に、本発明による粒子状組成物の大きさは、好ましくは、3〜50μmの範囲であり、最も好ましくは、5〜30μmの範囲である。
【0017】
しかし、必要に応じて、球状以外の形状を有する上記粒子状組成物をリチウムイオン二次電池用正極活物質として用いてもよい。
本発明による粒子状組成物は、その中心層がリチウムニッケル複合酸化物からなり、好ましくは、一般式(I)
LipNi1−xAxOy
(式中、Aは、B、Mg、Al、Si、Sc、Ti、V、Cr、Mn、Fe、Co、Cu、Zn、Ga、Y、Zr、Nb、Mo、Ru、Sn、Sb、La、Ce、Pr、Nb、Hf、Ta及びPbよりなる群から選ばれる少なくとも1種の元素を示す。pは0.90〜1.10の範囲の数を示し、xは0〜0.25の範囲の数を示し、yは1.825〜2.3の範囲の数を示す。)
で表わされるリチウムニッケル複合酸化物からなる。
【0018】
他方、本発明による粒子状組成物は、その表面層がリチウムコバルト複合酸化物からなり、好ましくは、一般式(II)
LiqCo1−aZaOb
(式中、Zは、B、Mg、Al、Si、Sc、Ti、V、Cr、Mn、Fe、Ni、Cu、Zn、Ga、Y、Zr、Nb、Mo、Ru、Sn、Sb、La、Ce、Pr、Nd、Hf、Ta及びPbよりなる群から選ばれる少なくとも1種の元素を示す。qは0.90〜1.10の範囲の数を示し、aは0〜0.25の範囲の数を示し、bは1.825〜2.3の範囲の数を示す。)
で表わされるリチウムコバルト複合酸化物からなる。
【0019】
上記一般式(I)及び(II)において、x又はaが0〜0.25の範囲にあるような粒子状組成物をリチウムイオン二次電池における正極活物質として用いることによって、電池の保存特性を一層高めることができる。しかし、x又はaが0.25を越えるときは、電池の充放電容量を大きく低下させるので好ましくない。
【0020】
本発明による2層構造粒子状組成物は、上述したように、リチウムニッケル複合酸化物からなる中心層とリチウムコバルト複合酸化物からなる表面層とからなり、ここに、リチウムニッケル複合酸化物は、190mAh/g以上の高い充放電容量を有するものの、高温で非水電解液を分解しやすく、他方、リチウムコバルト複合酸化物は、充放電容量がリチウムニッケル複合酸化物よりも低く、150mAh/g程度であるが、高温に保持されても、非水電解液を分解させ難い。かくして、本発明による粒子状組成物は、2つのリチウム複合酸化物の有する利点のみを利用し、欠点を補うように組合わせてなるものである。
【0021】
即ち、本発明による上記2層構造粒子状組成物をリチウムイオン二次電池の正極活物質として用いた場合、非水電解液に接触するのは表面積層のリチウムコバルト複合酸化物のみであり、このリチウムコバルト複合酸化物は、前述したように、高温に保持された場合にも、非水電解質を分解し難いので、電池の安定性に寄与し、更に、上記2層構造粒子状組成物は、充放電容量の大きいリチウムニッケル複合酸化物を中心層として有し、従って、全体として、高い充放電容量を有する。
【0022】
かくして、本発明による2層構造粒子状組成物をリチウムイオン二次電池の正極活物質として用いるとき、高温安定性にすぐれると共に、高い充放電容量を有する二次電池を得ることができる。
【0023】
本発明において、表面層と中心層の量的比率は、特に、限定されるものではなく、充放電容量を重視する場合は、中心層の比率を多くし、高温安定性を重視する場合には、表面層の比率を多くすればよく、目的の電池特性によって、任意の比率を用いることができる。しかしながら、本発明による2層構造粒子状組成物においては、表面層のコバルト原子とZ原子の原子数の和(Co+Z)と中心層のニッケル原子とA原子の原子数の和(Ni+A)、即ち、表面層の(Co+Z)/中心層の(Ni+A)原子比は、通常、5/100〜50/100の範囲にあり、好ましくは、10/100〜30/100の範囲にある。
【0024】
本発明による2層構造粒子状組成物において、粒子の表面は、リチウムコバルト複合酸化物にて完全に被覆されていることが理想的であるが、しかし、実用上、粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にあるとき、このような組成物をリチウムイオン二次電池における正極活物質として用いることによって、目的とする電池の安定性を得ることができる。特に、本発明によれば、上記粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比は0.3〜1の範囲にあることが好ましく、更に、0.5〜1の範囲にあることが好ましい。
【0025】
更に、本発明による2層構造粒子状組成物においては、前記式(I)で表わされるリチウムニッケル複合酸化物は、通常、Ni原子とA原子の和に対するLi原子の比、即ち、Li/(Ni+A)原子比が1である化学量論的な複合酸化物である、即ち、p=1であるが、しかし、Li/(Ni+A)原子比が1でない非化学量論的な複合酸化物であってもよい。即ち、pは0.90〜1.10の範囲の数である。
【0026】
同様に、本発明による2層構造粒子状組成物においては、前記式(II)で表わされるリチウムコバルト複合酸化物は、通常、Co原子とZ原子の和に対するLi原子の比、即ち、Li/(Co+Z)原子比が1である化学量論的な複合酸化物である、即ち、q=1であるが、しかし、Li/(Co+Z)原子比が1でない非化学量論的な複合酸化物であってもよい。即ち、qは0.90〜1.10の範囲の数である。
【0027】
本発明による2層構造粒子状組成物は、例えば、次のような方法によって製造することができる。このような製造方法によれば、表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にある本発明による2層構造粒子状組成物を得ることができる。
【0028】
(1)水酸化ニッケルの粉末を水に分散したスラリーに、アンモニウムイオンの存在下、コバルト塩水溶液と苛性アルカリ水溶液を連続的に添加して反応させることによって、水酸化ニッケルの粒子の表面に水酸化コバルトを被覆してなる粒子を調製する。これに水酸化リチウムを混合し、焼成することによって、本発明による粒子状組成物を得ることができる。
【0029】
(2)上記と同様の方法にて、水酸化ニッケルの粒子の表面に水酸化コバルトを被覆してなる粒子を調製し、これを酸化して、含水酸化ニッケルコバルトを調製し、次いで、これを水分散媒中、高温高圧下に水酸化リチウムと水熱反応を行なうことによって、本発明による粒子状組成物を得ることができる。
【0030】
本発明によるリチウムイオン二次電池は、上述したような2層構造粒子状組成物を正極活物質として用いるものである。
【0031】
リチウムイオン二次電池の一例を図1に示す。正極1と負極2は、非水電解液を含浸させたセパレータ3を介して対向して電池容器4内に収容されており、上記正極1は正極集電体5を介して正極用リード線6に接続されており、また、負極2は負極集電体7を介して負極用リード線8に接続されて、電池内部で生じた化学エネルギーを上記リード線6及び8から電機エネルギーとして外部へ取り出し得るように構成されている。
【0032】
本発明による粒子状組成物は、これに導電剤、結着剤、充填剤等を配合し、混練して合剤とし、これを、例えば、ステンレスメッシュからなる正極集電体に塗布、圧着し、減圧下に加熱乾燥して、正極とする。また、上記合剤を円板状等、適宜形状に加圧成形し、必要に応じて、真空下に熱処理して、正極としてもよい。
【0033】
上記導電剤としては、リチウムイオン二次電池において化学変化を起こさない電子伝導性材料であれば特に限定されず、例えば、天然黒鉛、人工黒鉛、カーボンブラック、アセチレンブラック、ケッチェンブラック、炭素繊維、金属粉、金属繊維、ポリフェニレン誘導体等を挙げることができる。これらは、単独で使用してもよく、2種以上を併用してもよい。
【0034】
上記合剤における上記導電剤の配合量は、特に、限定されるものではないが、通常、1〜50重量%が好ましく、特に、2〜30重量%の範囲が好ましい。また、結着剤も、特に、限定されず、例えば、デンプン、ポリビニルアルコール、カルボキシメチルセルロース、ヒドロキシプロピルセルロース、再生セルロース、ジアセチルセルロース、ポリ塩化ビニル、ポリビニルピロリドン、テトラフルオロエチレン、ポリフッ化ビニリデン、ポリエチレン、ポリプロピレン、エチレン−プロピレン−ジエン共重合体(EPDM)、スルホン化EPDM、スチレン−ブタジエンゴム、ポリブタジエン、フッ素ゴム、ポリエチレンオキサイド等を挙げることができる。これらは、単独で使用してもよく、2種以上を併用してもよい。合剤における上記結着剤の配合量も、特に、限定されないが、通常、1〜50重量%の範囲であり、好ましくは、2〜30重量%の範囲である。
【0035】
充填剤は、必要に応じて、正極活物質にに配合される。充填剤としては、リチウムイオン二次電池において化学変化を起こさない繊維状材料であれば、特に限定されず、例えば、ポリプロピレン、ポリエチレン等のオレフィン系ポリマー、ガラス、炭素等の繊維等を挙げることができる。合剤におけるこれら充填剤の配合量も、特に限定されないが、通常、0〜30重量%の範囲が好ましい。
【0036】
本発明によるリチウムイオン二次電池において、負極としては、従来、リチウムイオン二次電池に用いられているものであれば、特に、限定されるものではないが、例えば、リチウム、リチウム合金、ステンレス鋼、ニッケル、銅、チタン、アルミニウム、焼成炭素等からなるシート状物や成形物を挙げることができる。
【0037】
正極及び負極は、通常、集電体上に形成される。集電体としては、特に、限定されるものではないが、通常、ステンレス鋼やそのメッシュ等が用いられる。
【0038】
また、非水電解液も、従来より知られているものであれば、いずれでもよいが、例えば、プロピレンカーボネート等のようなカーボネート類、スルホラン類、ラクトン類、1,2−ジメトキシエタン等のようなエーテル類等の有機溶媒中に過塩素酸リチウムやヘキサフルオロリン酸リチウム等の解離性リチウム塩類を溶解させたものを挙げることができる。セパレータとしては、例えば、ポリプロピレン等のような合成高分子量重合体からなる多孔性フィルム等が用いられるが、これに限定されるものではない。
【0039】
【発明の効果】
本発明による2層構造粒子状組成物は、リチウムニッケル複合酸化物からなる中心層とリチウムコバルト複合酸化物からなる表面層とを備えていると共に、粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にあり、本発明によるリチウムイオン二次電池は、このような2層構造粒子状組成物を正極活物質として用いてなるものである。
【0040】
従って、本発明によるリチウムイオン二次電池によれば、非水電解液は、高温に保持された場合にも、非水電解質を分解し難い表面層のリチウムコバルト複合酸化物のみに接触し、他方、上記粒子状組成物は、充放電容量の大きいリチウムニッケル複合酸化物を中心層として有し、ここに、上記粒子状組成物は、全体として、高い充放電容量を有する。かくして、本発明によるリチウムイオン二次電池は、高温安定性にすぐれると共に、高い充放電容量を有する。
【0041】
本発明によるリチウムイオン二次電池は、例えば、ノート型パソコン、携帯電話、コードレスフォン子機、ビデオムービー、液晶テレビ、電気シェーバー、携帯ラジオ、ヘッドホンステレオ、バックアップ電源、メモリカード等の電子機器、ペースメーカー、補聴器等の医療機器等に好適に用いることができる。
【0042】
【実施例】
以下に実施例を挙げて本発明を説明するが、本発明はこれら実施例により何ら限定されるものではない。以下の実施例において、中心層と表面層を調製するために用いたそれぞれの原料中の遷移元素の仕込み量(モル)と、それによる表面層元素量/中心層元素量モル比を表1及び表2にまとめて示す。
【0043】
実施例1
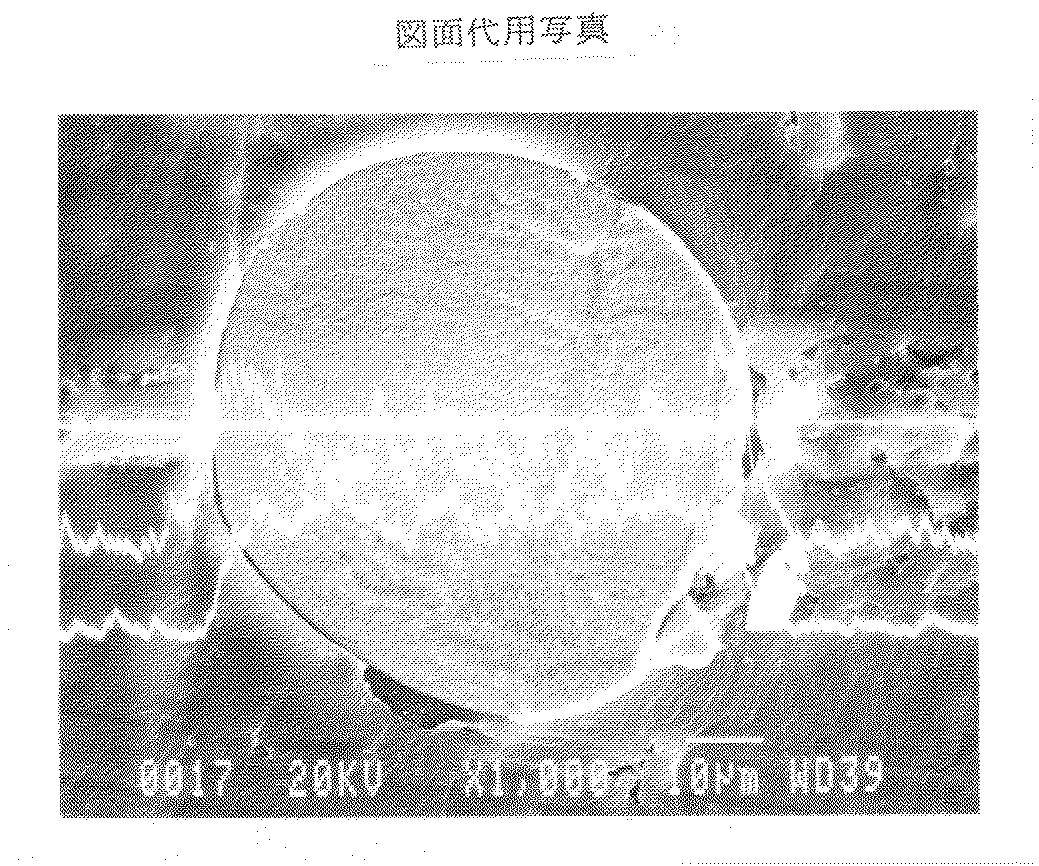
硝酸ニッケル水溶液に、アンモニウムイオン存在下、水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケルからなる二次粒子粉末を得た。この粉末は、比表面積が148m2/gであった。この粉末の走査型電子顕微鏡写真を図2に示す。
【0044】
この球状の水酸化ニッケル18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)17.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0045】
この粉末をX線回折分析したところ、図3に示すように、水酸化ニッケル(Ni(OH)2)のピークのみ確認された。また、この粉末の走査型電子顕微鏡写真を図4に示すように、実質的に球状の粒子からなるものであった。
【0046】
また、図5に示すように、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルが、また、粒子表層部にコバルトがそれぞれ偏在していることが確認された。
【0047】
以上の分析結果から、上記粉末は、中心部が結晶性の水酸化ニッケル(Ni(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)からなる実質的に球状の粒子であることが確認された。
【0048】
この粉末10.2gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0049】
実施例2
実施例1にて調製した球状の水酸化ニッケル18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)34.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.22モル/L)を定量ポンプにて1.0mL/分の割合にて8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0050】
この粉末をX線回折分析したところ、水酸化ニッケル(Ni(OH)2)のピークのみ確認され、また、この粉末は、走査型電子顕微鏡観察によれば、実質的に球状の粒子からなるものであった。更に、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルが、また、粒子表層部にコバルトがそれぞれ偏在していることが確認された。
【0051】
以上の分析結果から、上記粒子は、中心部が結晶性の水酸化ニッケル(Ni(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)からなる実質的に球状の粒子であることが確認された。
【0052】
この粉末13.37gに水酸化リチウム一水塩5.04gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、600℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0053】
実施例3
実施例1にて調製した球状の水酸化ニッケル18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)68.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.44モル/L)を定量ポンプにて1.0mL/分の割合にて8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0054】
この粉末をX線回折分析したところ、水酸化ニッケル(Ni(OH)2)のピークのみ確認され、また、この粉末は、走査型電子顕微鏡観察によれば、実質的に球状の粒子からなるものであった。更に、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルが、また、粒子表層部にコバルトがそれぞれ偏在していることが確認された。
【0055】
以上の分析結果から、上記粒子は、中心部が結晶性の水酸化ニッケル(Ni(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)からなる実質的に球状の粒子であることが確認された。
【0056】
この粉末9.28gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0057】
実施例4
実施例1にて調製した球状の水酸化ニッケル18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)61.2mLと硝酸鉄水溶液(1.2モル/L)6.8mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.44モル/L)を定量ポンプにて1.0mL/分の割合にて8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約26gを得た。
【0058】
の粉末をX線回折分析したところ、水酸化ニッケル(Ni(OH)2)のピークのみ確認され、また、この粉末は、走査型電子顕微鏡観察によれば、実質的に球状の粒子からなるものであった。更に、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルが、また、粒子表層部にコバルトと鉄がそれぞれ偏在していることが確認された。
【0059】
以上の分析結果から、上記粒子は、中心部が結晶性の水酸化ニッケル(Ni(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)と水酸化第一鉄(Fe(OH)2)からなる実質的に球状の粒子であることが確認された。
【0060】
この粉末9.27gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、700℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト、ニッケル及び鉄の線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト鉄複合酸化物(LiCo0.9Fe0.1O2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0061】
実施例5
硝酸ニッケルと硝酸コバルトをモル比85:15の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気中で水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケルコバルトからなる二次粒子粉末を得た。この粉末は、比表面積が160m2/gであった。
【0062】
この球状の水酸化ニッケルコバルト18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)68.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.44モル/L)を定量ポンプにて1.0mL/分の割合にて8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約26gを得た。
【0063】
この粉末をX線回折分析したところ、水酸化ニッケルコバルト(Ni0.85Co0.15(OH)2)のピークのみ確認され、また、この粉末は、走査型電子顕微鏡観察によれば、実質的に球状の粒子からなるものであった。更に、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルとコバルトとが、また、粒子表層部にコバルトがそれぞれ偏在していることが確認された。
【0064】
以上の分析結果から、上記粒子は、中心部が結晶性の水酸化ニッケルコバルト(Ni0.85Co0.15(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)からなる実質的に球状の粒子であることが確認された。
【0065】
この粉末9.28gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、700℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルコバルト複合酸化物(LiNi0.85Co0.15O2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0066】
実施例6
実施例1にて調製した球状の水酸化ニッケル粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)50.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.32モル/L)を定量ポンプにて1.0mL/分の割合にて8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約24gを得た。
【0067】
この粉末をX線回折分析したところ、水酸化ニッケル(Ni(OH)2)のピークのみ確認され、また、この粉末は、走査型電子顕微鏡観察によれば、実質的に球状の粒子からなるものであった。更に、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルが、また、粒子表層部にコバルトがそれぞれ偏在していることが確認された。
【0068】
以上の分析結果から、上記粒子は、中心部が結晶性の水酸化ニッケル(Ni(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)からなる実質的に球状の粒子であることが確認された。
【0069】
この粉末9.28gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、700℃で5時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0070】
実施例7
実施例1にて調製した球状の水酸化ニッケル18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)50.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.32モル/L)を定量ポンプにて1.0mL/分の割合にて8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約24gを得た。
【0071】
この粉末をX線回折分析したところ、水酸化ニッケル(Ni(OH)2)のピークのみ確認され、また、この粉末は、走査型電子顕微鏡観察によれば、実質的に球状の粒子からなるものであった。更に、粒子断面をEPMA(電子線プローブマイクロアナライザー)にて線分析したところ、粒子中心部にニッケルが、また、粒子表層部にコバルトがそれぞれ偏在していることが確認された。
【0072】
以上の分析結果から、上記粒子は、中心部が結晶性の水酸化ニッケル(Ni(OH)2)からなり、表層部が非晶質の水酸化コバルト(Co(OH)2)からなる実質的に球状の粒子であることが確認された。
【0073】
この粉末24.1gを水スラリー中、過硫酸ナトリウムで酸化した後、濾過、水洗して、オキシ水酸化ニッケルコバルトのケーキを得た。このオキシ水酸化ニッケルコバルトの全量に水酸化リチウム一水塩25.2gを混合し、得られた混合物にイオン交換水を加えて全量を400mLとした。このスラリーをオートクレーブに仕込み、温度200℃にて4時間、加熱して、水熱処理を行なった。
【0074】
反応終了後、スラリーを濾過、水洗し、固形物を100℃に加熱、乾燥させた。このようにして得られた粉末をX線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0075】
実施例8
実施例1にて得た実質的に球状の水酸化ニッケルからなる二次粒子粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)17.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0076】
この粉末9.27gに水酸化リチウム一水塩3.8gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、700℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(Li0.90NiO1.95)からなり、表層部がリチウムコバルト複合酸化物(Li0.90CoO1.95)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0077】
実施例9
実施例1にて得た実質的に球状の水酸化ニッケルからなる二次粒子粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)17.0mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0078】
この粉末9.27gに水酸化リチウム一水塩4.6gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、700℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(Li1.1NiO2.05)からなり、表層部がリチウムコバルト複合酸化物(Li1.1CoO2.05)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0079】
実施例10
実施例1にて得た実質的に球状の水酸化ニッケルからなる二次粒子粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)15.8mLと硝酸銅水溶液(1.0モル/L)1.0mLとを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0080】
この粉末9.27gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCo0.95Cu0.05O2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0081】
実施例11
実施例1にて得た実質的に球状の水酸化ニッケルからなる二次粒子粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)15.0mLと硝酸マグネシウム水溶液(1.0モル/L)2.0mLとを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0082】
この粉末9.24gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCo0.90Mg0.10O1.95)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0083】
実施例12
実施例1にて得た実質的に球状の水酸化ニッケルからなる二次粒子粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)15.8mLと硝酸アルミニウム水溶液(1.0モル/L)1.0mLとを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0084】
この粉末9.27gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCo0.95Al0.05O2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0085】
実施例13
実施例1にて得た実質的に球状の水酸化ニッケルからなる二次粒子粉末18.54gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)13.3mLと硝酸チタン水溶液(1.0モル/L)4.0mLとを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.13モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0086】
この粉末9.31gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト及びニッケルの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCo0.80Ti0.20O2.1)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0087】
実施例14
硝酸ニッケルと硝酸バナジウムとを85:15の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気下に水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケル−バナジウムからなる二次粒子粉末を得た。この粉末は、比表面積が150m2/gであった。
【0088】
上記球状の水酸化ニッケル−バナジウムからなる二次粒子粉末18.31gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)66.7mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.43モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約25gを得た。
【0089】
この粉末9.20gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト、ニッケル及びバナジウムの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルバナジウム複合酸化物(LiNi0.85V0.15O2.15)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0090】
実施例15
硝酸ニッケルと硝酸クロムとを85:15の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気下に水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケル−クロムからなる二次粒子粉末を得た。この粉末は、比表面積が156m2/gであった。
【0091】
上記球状の水酸化ニッケル−クロムからなる二次粒子粉末18.24gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)66.7mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.43モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約25gを得た。
【0092】
この粉末9.21gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト、ニッケル及びクロムの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルクロム複合酸化物(LiNi0.85Cr0.15O2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0093】
実施例16
硝酸ニッケルと硝酸マンガンとを85:15の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気下に水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケル−マンガンからなる二次粒子粉末を得た。この粉末は、比表面積が145m2/gであった。
【0094】
上記球状の水酸化ニッケル−マンガンからなる二次粒子粉末18.43gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)66.7mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.43モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約25gを得た。
【0095】
この粉末9.24gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト、ニッケル及びマンガンの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルマンガン複合酸化物(LiNi0.85Mn0.15O2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0096】
実施例17
硝酸ニッケルと硝酸ランタンとを85:15の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気下に水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケルランタンからなる二次粒子粉末を得た。この粉末は、比表面積が170m2/gであった。
【0097】
上記球状の水酸化ニッケルランタンからなる二次粒子粉末21.46gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)66.7mLを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.43モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約28gを得た。
【0098】
この粉末14.45gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト、ニッケル及びランタンの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルマンガン複合酸化物(LiNi0.85La0.15O2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0099】
実施例18
硝酸ニッケルと硝酸ガリウムとを85:15の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気下に水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケルガリウムからなる二次粒子粉末を得た。この粉末は、比表面積が150m2/gであった。
【0100】
上記球状の水酸化ニッケルガリウムからなる二次粒子粉末19.38gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)14.2mLと硝酸ニッケル水溶液(1.0モル/L)3.0mLとを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約21gを得た。
【0101】
この粉末9.65gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによるコバルト、ニッケル及びガリウムの線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルガリウム複合酸化物(LiNi0.85Ga0.15O2)からなり、表層部がリチウムコバルトニッケル複合酸化物(LiCo0.85Ni0.15O2)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0102】
実施例19
硝酸ニッケル、硝酸コバルト及び硝酸鉄とを80:15:5の化学量論比で混合した水溶液に、アンモニウムイオン存在下、窒素雰囲気下に水酸化ナトリウム水溶液を連続的に添加、中和して、一次粒子が集合した実質的に球状の水酸化ニッケルコバルト鉄からなる二次粒子粉末を得た。この粉末は、比表面積が160m2/gであった。
【0103】
上記球状の水酸化ニッケルコバルト鉄からなる二次粒子粉末18.52gを1.0L容量のガラスビーカー中の水0.1Lに分散してスラリーを得た。このスラリーに、アンモニウムイオン存在下、硝酸コバルト水溶液(1.2モル/L)15.0mLと硝酸ジルコニウム水溶液(1.0モル/L)1.0mLと硝酸イットリウム水溶液(1.0モル/L)1.0mLとを加え、ビーカーを密閉した後、攪拌しながら、窒素ガスを0.5L/分の割合にてスラリーに導入して、窒素置換を行なった。30分後、水酸化ナトリウム水溶液(0.11モル/L)を定量ポンプにて1.0mL/分の割合で8時間加えた。このようにして得られた沈澱を濾過、水洗し、電気乾燥機中、60℃で一日乾燥して、粉末約20gを得た。
【0104】
この粉末9.31gに水酸化リチウム一水塩4.2gを混合した後、アルミナ製るつぼに入れ、酸素雰囲気中、800℃で10時間焼成して、黒色の粉末を得た。この粉末は、X線回折、EPMAによる線分析、走査型電子顕微鏡観察から、中心部がリチウムニッケルコバルト鉄複合酸化物(LiNi0.85Co0.15Fe0.05O2)からなり、表層部がリチウムコバルトジルコニウムイットリウム複合酸化物(LiCo0.90Zr0.05Y0.05O2.025)からなる2層構造の球状粒子であることが確認された。更に、オージエ電子分光法にて粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比を測定したところ、0.2以上であった。
【0105】
【表1】
【0106】
【表2】
【0107】
実施例20
実施例2で調製した中心部がリチウムニッケル複合酸化物(LiNiO2)からなり、表層部がリチウムコバルト複合酸化物(LiCoO2)からなる2層構造粒子状組成物の粉末(正極活物質)、アセチレンブラック(導電剤)及びポリテトラフルオロエチレン(結着剤)を重量比87:6.5:6.5にてよく混練して、合剤を調製した。この合剤を正極集電体としての清浄なステンレスメッシュ(穴径20mm)に均一に塗布し、200kg/cm2の圧力にて圧着した後、減圧下、150℃で17時間乾燥して、正極を作製した。負極として円板状の金属リチウム箔(直径20mm、厚さ0.2mm)を用いた。また、セパレーターとしてポリピロピレンからなる多孔質フィルムを用いた。
【0108】
また、非水電解液は、過塩素酸リチウム(LiClO4)のプロピレンカーボネート溶液(1M)と1,2−ジメトキシエタンとの混合物(1:1)で、水分を20ppm以下としたものを用い、これを上記セパレーターに含浸させた。
これらの構成要素を用いて、図1に示すようなリチウムイオン二次電池を製作し、これを用いて、電流値を1.0mA/cm2の一定電流とし、電池電圧4.2〜2.0Vの間で充放電を繰り返して、電池特性を調べた。その結果、本発明によるリチウム二次電池の初期容量は182mAh/gと高く、また、50サイクル目の充放電容量は1サイクル目の90%であって、サイクル特性にもすぐれる。
【0109】
また、この電池を80℃で長時間保持したときも、電解液は、リチウムコバルト複合酸化物(LiCoO2)を正極材活物質として用いた場合と同様であって、殆ど分解しておらず、高温での安定性にすぐれることも確認された。
【図面の簡単な説明】
【図1】は、リチウムイオン二次電池の一例を示す断面図である。
【図2】は、実施例1において得られた水酸化ニッケルの二次粒子粉末の走査型電子顕微鏡写真(倍率500倍)である。
【図3】は、上記水酸化ニッケルの粒子に水酸化コバルトを被覆してなる水酸化ニッケルコバルトのX線回折図である。
【図4】は、上記水酸化ニッケルコバルトの走査型電子顕微鏡写真(倍率500倍)である。
【図5】は、上記水酸化ニッケルコバルトの粒子断面のEPMA(電子線プローブマイクロアナライザー)による線分析を示す写真(倍率1000倍)である。
【図6】は、実施例1において得られた中心部がニッケル酸リチウム(LiNiO2)からなり、表層部がコバルト酸リチウム(LiCoO2)からなる2層構造の球状粒子の断面のEPMA(電子線プローブマイクロアナライザー)による線分析を示す写真(倍率1000倍)である。
【符号の説明】
1…正極、2…負極、3…セパレータ、4…電池容器、5…正極集電体、6…正極用リード線、7…負極集電体、8…負極用リード線。
Claims (5)
- 水酸化ニッケルの粉末を水に分散したスラリーに、アンモニウムイオンの存在下、コバルト塩水溶液と苛性アルカリ水溶液を連続的に添加して反応させることによって、水酸化ニッケルの粒子の表面に水酸化コバルトを被覆してなる粒子を調製し、これに水酸化リチウムを混合して、焼成することからなる、リチウムニッケル複合酸化物からなる中心層とリチウムコバルト複合酸化物からなる表面層とを備えると共に、粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にあるリチウムイオン二次電池用正極活物質用2層構造粒子状組成物の製造方法。
- 水酸化ニッケルの粉末を水に分散したスラリーに、アンモニウムイオンの存在下、コバルト塩水溶液と苛性アルカリ水溶液を連続的に添加して反応させることによって、水酸化ニッケルの粒子の表面に水酸化コバルトを被覆してなる粒子を調製し、これを酸化して、含水酸化ニッケルコバルトを調製し、次いで、これを水分散媒中、水酸化リチウムと水熱反応を行うことからなる、リチウムニッケル複合酸化物からなる中心層とリチウムコバルト複合酸化物からなる表面層とを備えると共に、粒子表面から0.1μmの深さまでのコバルト/(ニッケル+コバルト)原子比が0.2〜1の範囲にあるリチウムイオン二次電池用正極活物質用2層構造粒子状組成物の製造方法。
- 中心層が一般式(I)
LipNi1−xAxOy
(式中、Aは、B、Mg、Al、Si、Sc、Ti、V、Cr、Mn、Fe、Co、Cu、Zn、Ga、Y、Zr、Nb、Mo、Ru、Sn、Sb、La、Ce、Pr、Nb、Hf、Ta及びPbよりなる群から選ばれる少なくとも1種の元素を示す。pは0.90〜1.10の範囲の数を示し、xは0〜0.25の範囲の数を示し、yは1.825〜2.3の範囲の数を示す。)で表わされるリチウムニッケル複合酸化物からなる請求項1又は2に記載の2層構造粒子状組成物の製造方法。 - 表面層が一般式(II)
LiqCo1−aZaOb
(式中、Zは、B、Mg、Al、Si、Sc、Ti、V、Cr、Mn、Fe、Ni、Cu、Zn、Ga、Y、Zr、Nb、Mo、Ru、Sn、Sb、La、Ce、Pr、Nd、Hf、Ta及びPbよりなる群から選ばれる少なくとも1種の元素を示す。qは0.90〜1.10の範囲の数を示し、aは0〜0.25の範囲の数を示し、bは1.825〜2.3の範囲の数を示す。)で表わされるリチウムコバルト複合酸化物からなることを特徴とする請求項1又は2に記載の2層構造粒子状組成物の製造方法。 - 平均粒子径が3〜100μmであり、実質的に球状である請求項1から4のいずれかに記載の2層構造粒子状組成物の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP08429397A JP4161382B2 (ja) | 1997-02-25 | 1997-02-25 | 2層構造粒子状組成物の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP08429397A JP4161382B2 (ja) | 1997-02-25 | 1997-02-25 | 2層構造粒子状組成物の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH10236826A JPH10236826A (ja) | 1998-09-08 |
| JP4161382B2 true JP4161382B2 (ja) | 2008-10-08 |
Family
ID=13826431
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP08429397A Expired - Fee Related JP4161382B2 (ja) | 1997-02-25 | 1997-02-25 | 2層構造粒子状組成物の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4161382B2 (ja) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4872150B2 (ja) * | 1999-10-26 | 2012-02-08 | 住友化学株式会社 | 非水二次電池用活物質およびこれを用いた非水二次電池 |
| JP4383681B2 (ja) | 2000-02-28 | 2009-12-16 | 三星エスディアイ株式会社 | リチウム二次電池用正極活物質及びその製造方法 |
| WO2001077023A1 (fr) * | 2000-04-07 | 2001-10-18 | Ishihara Sangyo Kaisha, Ltd. | Oxyde a complexe de lithium/manganese, son procede de production et pile au lithium l'utilisant |
| JP4556377B2 (ja) * | 2001-04-20 | 2010-10-06 | 株式会社Gsユアサ | 正極活物質およびその製造方法、非水電解質二次電池用正極、並びに、非水電解質二次電池 |
| JP4910243B2 (ja) * | 2001-04-20 | 2012-04-04 | パナソニック株式会社 | 非水電解質二次電池 |
| US6855461B2 (en) | 2001-06-15 | 2005-02-15 | Kureha Chemical Industry Co., Ltd. | Cathode material for lithium rechargeable batteries |
| US6921609B2 (en) * | 2001-06-15 | 2005-07-26 | Kureha Chemical Industry Co., Ltd. | Gradient cathode material for lithium rechargeable batteries |
| JP5002872B2 (ja) * | 2001-08-09 | 2012-08-15 | トヨタ自動車株式会社 | リチウム二次電池用正極活物質、リチウム二次電池用正極及びリチウム二次電池並びにリチウム二次電池用正極活物質の製造方法 |
| KR100420034B1 (ko) * | 2001-10-17 | 2004-02-25 | 삼성에스디아이 주식회사 | 리튬 이차 전지용 양극 활물질의 제조방법 |
| KR20030083476A (ko) * | 2002-04-23 | 2003-10-30 | 주식회사 엘지화학 | 수명 특성과 안전성이 우수한 리튬 금속 복합 산화물 및이의 제조 방법 |
| NZ520452A (en) * | 2002-10-31 | 2005-03-24 | Lg Chemical Ltd | Anion containing mixed hydroxide and lithium transition metal oxide with gradient of metal composition |
| CN100499220C (zh) * | 2002-11-01 | 2009-06-10 | 三洋电机株式会社 | 非水电解质二次电池 |
| JP4095499B2 (ja) | 2003-06-24 | 2008-06-04 | キヤノン株式会社 | リチウム二次電池用の電極材料、電極構造体及びリチウム二次電池 |
| US8153295B2 (en) | 2003-07-17 | 2012-04-10 | Gs Yuasa International Ltd. | Positive electrode active material and its manufacturing method, positive electrode for lithium secondary cell using same, and lithium secondary cell |
| CN100442577C (zh) * | 2003-07-17 | 2008-12-10 | 株式会社杰士汤浅 | 正极活性物质及其制造方法、以及锂二次电池的正极和锂二次电池 |
| KR100578877B1 (ko) * | 2004-03-12 | 2006-05-11 | 삼성에스디아이 주식회사 | 리튬 이차 전지 |
| US7381496B2 (en) * | 2004-05-21 | 2008-06-03 | Tiax Llc | Lithium metal oxide materials and methods of synthesis and use |
| JP4954451B2 (ja) * | 2004-07-05 | 2012-06-13 | 株式会社クレハ | リチウム二次電池用正極材およびその製造方法 |
| KR100635741B1 (ko) | 2004-11-29 | 2006-10-17 | 삼성에스디아이 주식회사 | 리튬 이차 전지용 양극 활물질 및 그 제조 방법 |
| WO2006070977A1 (en) | 2004-12-31 | 2006-07-06 | Iucf-Hyu (Industry-University Cooperation Foundation Hanyang University) | Double-layer cathode active materials for lithium secondary batteries, method for preparing the active materials, and lithium secondary batteries using the active materials |
| JP4868381B2 (ja) * | 2005-03-02 | 2012-02-01 | 日立マクセルエナジー株式会社 | 非水電解質二次電池用の電極、および非水電解質二次電池 |
| CN1855587B (zh) | 2005-04-28 | 2010-05-05 | 比亚迪股份有限公司 | 一种电池正极的制备方法和采用该正极的锂离子电池的制备方法 |
| US8445129B2 (en) | 2005-05-27 | 2013-05-21 | Sony Corporation | Cathode active material, method of manufacturing it, cathode, and battery |
| US8911903B2 (en) | 2006-07-03 | 2014-12-16 | Sony Corporation | Cathode active material, its manufacturing method, and non-aqueous electrolyte secondary battery |
| CN101855755B (zh) | 2007-11-12 | 2015-04-15 | 户田工业株式会社 | 非水电解液二次电池用Li-Ni类复合氧化物颗粒粉末及其制造方法,和非水电解质二次电池 |
| JP5087790B2 (ja) * | 2008-06-17 | 2012-12-05 | 住友金属鉱山株式会社 | アルミニウム含有水酸化ニッケル粒子の製造方法 |
| JP2010080231A (ja) * | 2008-09-25 | 2010-04-08 | Sanyo Electric Co Ltd | 正極活物質用前駆体、その製造方法、正極活物質材料、正極活物質材料の製造方法及び非水電解質二次電池 |
| JP2011140430A (ja) * | 2010-01-08 | 2011-07-21 | Sharp Corp | 複無機化合物系およびその利用、並びに、複無機化合物系の製造方法 |
| US8911902B2 (en) | 2010-07-06 | 2014-12-16 | Samsung Sdi Co., Ltd. | Nickel-based positive electrode active material, method of preparing the same, and lithium battery using the nickel-based positive electrode active material |
| JP5549437B2 (ja) * | 2010-07-08 | 2014-07-16 | ソニー株式会社 | 正極活物質、非水電解質電池および正極活物質の製造方法 |
| KR101215829B1 (ko) * | 2010-07-22 | 2012-12-27 | 주식회사 에코프로 | 리튬 이차전지용 양극활물질의 제조방법, 그에 의하여 제조된 리튬 이차전지용 양극활물질 및 그를 이용한 리튬 이차전지 |
| JP5658058B2 (ja) * | 2011-02-28 | 2015-01-21 | 株式会社日立製作所 | リチウムイオン二次電池 |
| KR102068513B1 (ko) * | 2011-08-16 | 2020-01-21 | 티악스 엘엘씨 | 다결정질 금속 산화물, 그것의 제조 방법, 및 그것을 포함하는 제품 |
| JP2015037069A (ja) * | 2013-08-16 | 2015-02-23 | 輔仁大學學校財團法人輔仁大學 | リチウムニッケルコバルト正極材料粉体 |
| CN103606671B (zh) * | 2013-12-09 | 2015-09-09 | 湖南杉杉新材料有限公司 | 一种高容量动力型富镍锂离子电池正极材料及其制备方法 |
| CN103794774A (zh) * | 2013-12-16 | 2014-05-14 | 广西科技大学 | 一种电池正极材料及其高温固相合成方法 |
| KR102065716B1 (ko) * | 2015-10-20 | 2020-02-11 | 주식회사 엘지화학 | 다층 구조의 금속 산화물들을 포함하는 양극 활물질 제조용 전구체 및 이를 사용하여 제조된 리튬 이차전지용 양극 활물질 |
| KR101982790B1 (ko) | 2015-10-20 | 2019-05-27 | 주식회사 엘지화학 | 다층 구조의 리튬 금속 산화물들을 포함하는 리튬 이차전지용 양극 활물질 및 그것을 포함하는 양극 |
| JP6922672B2 (ja) * | 2017-11-09 | 2021-08-18 | 株式会社豊田自動織機 | 炭素被覆Li5FeO4 |
| CN107946547A (zh) * | 2017-11-16 | 2018-04-20 | 燕山大学 | 一种高能量密度氢氧化钴薄膜电极的原位制备方法 |
| KR102159243B1 (ko) * | 2017-11-22 | 2020-09-23 | 주식회사 에코프로비엠 | 리튬 이차 전지용 양극활물질 |
| CN113711391A (zh) * | 2019-01-07 | 2021-11-26 | 株式会社Lg新能源 | 正极活性材料、该正极活性材料的制备方法及包含该正极活性材料的正极和锂二次电池 |
| JP7478976B2 (ja) * | 2019-04-26 | 2024-05-08 | パナソニックIpマネジメント株式会社 | 二次電池用の正極活物質、及び二次電池 |
| GB201913817D0 (en) * | 2019-09-25 | 2019-11-06 | Johnson Matthey Plc | Process |
-
1997
- 1997-02-25 JP JP08429397A patent/JP4161382B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH10236826A (ja) | 1998-09-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4161382B2 (ja) | 2層構造粒子状組成物の製造方法 | |
| KR100822012B1 (ko) | 리튬 전지용 양극 활물질, 그 제조 방법 및 그를 포함하는리튬 이차 전지 | |
| TWI487178B (zh) | 鋰離子電池正極複合材料的製備方法 | |
| JP2870741B2 (ja) | マンガン酸リチウム粒子状組成物及びその製造方法並びにリチウムイオン二次電池 | |
| US7018741B2 (en) | Particulate positive electrode active material for a lithium secondary cell | |
| US20050058588A1 (en) | Method and apparatus for preparation of spherical metal carbonates and lithium metal oxides for lithium rechargeable batteries | |
| KR20200125443A (ko) | 리튬 이차 전지용 양극 활물질, 그 제조방법 및 이를 포함한 리튬 이차 전지 | |
| KR20070117827A (ko) | 리튬 이차 전지용 양극 활물질, 이의 제조방법 및 이를포함하는 리튬 이차 전지 | |
| JPH101316A (ja) | リチウムコバルト複合酸化物及びその製造方法並びにリチウムイオン二次電池 | |
| CN113677624B (zh) | 八面体结构的锂锰基正极活性材料以及包含其的正极和锂二次电池 | |
| JPH11185753A (ja) | 非水電解質リチウム二次電池 | |
| CN110890525B (zh) | 用于锂二次电池的正极活性材料及包括其的锂二次电池 | |
| JP5884084B2 (ja) | 負極活物質、蓄電デバイス及び負極活物質の製造方法 | |
| CN111864195B (zh) | 用于可再充电锂电池的正极活性物质及其制备方法和包括其的可再充电锂电池 | |
| CN112447948A (zh) | 一种硫化物包覆的正极材料及其制备方法和锂离子电池 | |
| JP2003173775A (ja) | 非水電解質二次電池 | |
| JP4441678B2 (ja) | LiMnO2で表される斜方晶リチウムマンガン複合酸化物粒子状組成物の製造方法 | |
| JP4013327B2 (ja) | 非水二次電池 | |
| JP4156358B2 (ja) | コバルト酸リチウム複合化合物及びその製造方法並びに非水電解質ニ次電池 | |
| JP4114918B2 (ja) | コバルト酸リチウム及びその製造方法並びに非水電解質ニ次電池 | |
| CN113748541A (zh) | 二次电池用正极活性材料前体、其制备方法和正极活性材料的制备方法 | |
| KR20220040933A (ko) | 리튬 이차 전지용 양극, 그 제조 방법, 및 이를 포함한 리튬 이차 전지 | |
| JP4273568B2 (ja) | リチウムマンガン複合酸化物粒子状組成物とその製造とリチウムイオン二次電池への利用 | |
| CN116799201A (zh) | 一种卤化物基正极活性材料及其合成方法与应用 | |
| KR100565923B1 (ko) | 리튬망간 복합산화물 입자상 조성물의 제조와 이것의 리튬이온 2차전지에의 이용 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20061116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070508 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070702 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20071023 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071221 |
|
| A911 | Transfer of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20080227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080325 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080519 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080701 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080714 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110801 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110801 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110801 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110801 Year of fee payment: 3 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110801 Year of fee payment: 3 |
|
| R371 | Transfer withdrawn |
Free format text: JAPANESE INTERMEDIATE CODE: R371 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110801 Year of fee payment: 3 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120801 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120801 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120801 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130801 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130801 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |