JP2024091067A - Method for producing intermediate compound, method for producing ligand, and method for producing quaternary asymmetric carbon-containing compound - Google Patents
Method for producing intermediate compound, method for producing ligand, and method for producing quaternary asymmetric carbon-containing compound Download PDFInfo
- Publication number
- JP2024091067A JP2024091067A JP2022207352A JP2022207352A JP2024091067A JP 2024091067 A JP2024091067 A JP 2024091067A JP 2022207352 A JP2022207352 A JP 2022207352A JP 2022207352 A JP2022207352 A JP 2022207352A JP 2024091067 A JP2024091067 A JP 2024091067A
- Authority
- JP
- Japan
- Prior art keywords
- formula
- producing
- carbon atoms
- compound
- raw material
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 145
- 238000004519 manufacturing process Methods 0.000 title claims abstract description 38
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 title claims description 45
- 229910052799 carbon Inorganic materials 0.000 title claims description 45
- 239000003446 ligand Substances 0.000 title claims description 38
- 238000006243 chemical reaction Methods 0.000 claims abstract description 80
- 239000002994 raw material Substances 0.000 claims abstract description 52
- 125000004432 carbon atom Chemical group C* 0.000 claims description 53
- 239000003054 catalyst Substances 0.000 claims description 23
- 125000000217 alkyl group Chemical group 0.000 claims description 22
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 claims description 18
- 230000003287 optical effect Effects 0.000 claims description 15
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 13
- 229910052725 zinc Inorganic materials 0.000 claims description 13
- 239000011701 zinc Substances 0.000 claims description 13
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 claims description 12
- 125000003545 alkoxy group Chemical group 0.000 claims description 10
- 230000002194 synthesizing effect Effects 0.000 claims description 9
- 125000003277 amino group Chemical group 0.000 claims description 8
- 125000005843 halogen group Chemical group 0.000 claims description 8
- 239000003638 chemical reducing agent Substances 0.000 claims description 6
- 229910052987 metal hydride Inorganic materials 0.000 claims description 6
- 150000004681 metal hydrides Chemical group 0.000 claims description 6
- 150000002900 organolithium compounds Chemical class 0.000 claims description 6
- 239000006227 byproduct Substances 0.000 claims description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 150000002896 organic halogen compounds Chemical class 0.000 claims description 4
- 125000000524 functional group Chemical group 0.000 claims description 3
- 239000012279 sodium borohydride Substances 0.000 claims description 3
- 229910000033 sodium borohydride Inorganic materials 0.000 claims description 3
- DBGVGMSCBYYSLD-UHFFFAOYSA-N tributylstannane Chemical compound CCCC[SnH](CCCC)CCCC DBGVGMSCBYYSLD-UHFFFAOYSA-N 0.000 claims description 3
- 125000001183 hydrocarbyl group Chemical group 0.000 claims 3
- 239000003377 acid catalyst Substances 0.000 abstract description 4
- NINGQYMIHSFHQL-UHFFFAOYSA-N n-(piperidin-3-ylmethyl)ethanamine Chemical compound CCNCC1CCCNC1 NINGQYMIHSFHQL-UHFFFAOYSA-N 0.000 abstract description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 abstract 3
- 229910000039 hydrogen halide Inorganic materials 0.000 abstract 1
- 239000012433 hydrogen halide Substances 0.000 abstract 1
- 238000000746 purification Methods 0.000 description 22
- 239000002904 solvent Substances 0.000 description 18
- 239000000243 solution Substances 0.000 description 13
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 238000006722 reduction reaction Methods 0.000 description 11
- 238000000034 method Methods 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 9
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 9
- 238000005481 NMR spectroscopy Methods 0.000 description 8
- 150000002430 hydrocarbons Chemical group 0.000 description 8
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 125000003118 aryl group Chemical group 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 5
- 238000004821 distillation Methods 0.000 description 5
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 4
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 4
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 4
- 238000004440 column chromatography Methods 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- ZQBFAOFFOQMSGJ-UHFFFAOYSA-N hexafluorobenzene Chemical compound FC1=C(F)C(F)=C(F)C(F)=C1F ZQBFAOFFOQMSGJ-UHFFFAOYSA-N 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 125000003710 aryl alkyl group Chemical group 0.000 description 3
- 238000011914 asymmetric synthesis Methods 0.000 description 3
- HQWPLXHWEZZGKY-UHFFFAOYSA-N diethylzinc Chemical compound CC[Zn]CC HQWPLXHWEZZGKY-UHFFFAOYSA-N 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 239000001307 helium Substances 0.000 description 3
- 229910052734 helium Inorganic materials 0.000 description 3
- SWQJXJOGLNCZEY-UHFFFAOYSA-N helium atom Chemical compound [He] SWQJXJOGLNCZEY-UHFFFAOYSA-N 0.000 description 3
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 3
- 239000011261 inert gas Substances 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 125000002950 monocyclic group Chemical group 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 238000011085 pressure filtration Methods 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 238000007670 refining Methods 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 238000010183 spectrum analysis Methods 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- SJBBXFLOLUTGCW-UHFFFAOYSA-N 1,3-bis(trifluoromethyl)benzene Chemical compound FC(F)(F)C1=CC=CC(C(F)(F)F)=C1 SJBBXFLOLUTGCW-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- PDCBZHHORLHNCZ-UHFFFAOYSA-N 1,4-bis(trifluoromethyl)benzene Chemical compound FC(F)(F)C1=CC=C(C(F)(F)F)C=C1 PDCBZHHORLHNCZ-UHFFFAOYSA-N 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- LTMRRSWNXVJMBA-UHFFFAOYSA-L 2,2-diethylpropanedioate Chemical compound CCC(CC)(C([O-])=O)C([O-])=O LTMRRSWNXVJMBA-UHFFFAOYSA-L 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 125000004185 ester group Chemical group 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- HTBVGZAVHBZXMS-UHFFFAOYSA-N lithium;tris[(2-methylpropan-2-yl)oxy]alumane Chemical compound [Li].[Al+3].CC(C)(C)[O-].CC(C)(C)[O-].CC(C)(C)[O-] HTBVGZAVHBZXMS-UHFFFAOYSA-N 0.000 description 2
- IVSZLXZYQVIEFR-UHFFFAOYSA-N m-xylene Chemical compound CC1=CC=CC(C)=C1 IVSZLXZYQVIEFR-UHFFFAOYSA-N 0.000 description 2
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 2
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 238000000638 solvent extraction Methods 0.000 description 2
- 150000003613 toluenes Chemical class 0.000 description 2
- YUYCVXFAYWRXLS-UHFFFAOYSA-N trimethoxysilane Chemical compound CO[SiH](OC)OC YUYCVXFAYWRXLS-UHFFFAOYSA-N 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- DLKQHBOKULLWDQ-UHFFFAOYSA-N 1-bromonaphthalene Chemical compound C1=CC=C2C(Br)=CC=CC2=C1 DLKQHBOKULLWDQ-UHFFFAOYSA-N 0.000 description 1
- ZQXCQTAELHSNAT-UHFFFAOYSA-N 1-chloro-3-nitro-5-(trifluoromethyl)benzene Chemical compound [O-][N+](=O)C1=CC(Cl)=CC(C(F)(F)F)=C1 ZQXCQTAELHSNAT-UHFFFAOYSA-N 0.000 description 1
- COAUHYBSXMIJDK-UHFFFAOYSA-N 3,3-dichloro-1,1,1,2,2-pentafluoropropane Chemical compound FC(F)(F)C(F)(F)C(Cl)Cl COAUHYBSXMIJDK-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 1
- PVZMXULSHARAJG-UHFFFAOYSA-N N,N-diethylethanamine molecular hydrogen Chemical compound [H][H].CCN(CC)CC PVZMXULSHARAJG-UHFFFAOYSA-N 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000007809 chemical reaction catalyst Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- AXAZMDOAUQTMOW-UHFFFAOYSA-N dimethylzinc Chemical compound C[Zn]C AXAZMDOAUQTMOW-UHFFFAOYSA-N 0.000 description 1
- 239000004210 ether based solvent Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 1
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 1
- -1 hydrogen halides Chemical class 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229910000043 hydrogen iodide Inorganic materials 0.000 description 1
- 150000004694 iodide salts Chemical class 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 1
- WGOPGODQLGJZGL-UHFFFAOYSA-N lithium;butane Chemical compound [Li+].CC[CH-]C WGOPGODQLGJZGL-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- YCWSUKQGVSGXJO-NTUHNPAUSA-N nifuroxazide Chemical group C1=CC(O)=CC=C1C(=O)N\N=C\C1=CC=C([N+]([O-])=O)O1 YCWSUKQGVSGXJO-NTUHNPAUSA-N 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- QQQSFSZALRVCSZ-UHFFFAOYSA-N triethoxysilane Chemical compound CCO[SiH](OCC)OCC QQQSFSZALRVCSZ-UHFFFAOYSA-N 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Catalysts (AREA)
Abstract
Description
本発明は、中間体化合物を製造する方法に関する。また、本発明は、当該中間体化合物を用いて、触媒用の配位子を製造する方法に関する。さらに、本発明は、当該配位子を有する触媒を用いた四級不斉炭素含有化合物を製造する方法に関する。 The present invention relates to a method for producing an intermediate compound. The present invention also relates to a method for producing a ligand for a catalyst using the intermediate compound. Furthermore, the present invention also relates to a method for producing a quaternary asymmetric carbon-containing compound using a catalyst having the ligand.
従来、光学活性な化合物は、片方のエナンチオマーのみが有用あるいは有害であることがあり、光学異性体を含まないキラルな化合物として合成する必要がある。その合成方法の1種として触媒を用いた不斉合成反応があり、様々な触媒が検討されてきた。 Conventionally, optically active compounds have had to be synthesized as chiral compounds that do not contain optical isomers, because only one of the enantiomers may be useful or harmful. One method of synthesis is asymmetric synthesis using a catalyst, and various catalysts have been investigated.
また、目的の四級不斉炭素含有化合物を得るためには、化合物の光学状態を保持したままで反応工程を進めることが要求される。例えば、非特許文献1では、マロン酸ジエチル原料をトリターシャリーブトキシアルミニウムリチウム触媒で部分還元する反応方法が開示されているが、片方のエステルをアルコールに還元する際に要望する光学状態が保持できずにラセミ状態となることが報告されている。 In addition, to obtain the desired compound containing a quaternary asymmetric carbon, it is necessary to proceed with the reaction process while maintaining the optical state of the compound. For example, Non-Patent Document 1 discloses a reaction method in which diethyl malonate raw material is partially reduced with a lithium tri-tert-butoxyaluminum catalyst, but it is reported that when one of the esters is reduced to an alcohol, the desired optical state cannot be maintained and a racemic state results.
したがって、四級不斉炭素含有化合物の合成反応に使用可能な触媒用配位子およびその中間体化合物を効率的に製造する方法が求められている。 Therefore, there is a need for a method for efficiently producing catalytic ligands and intermediate compounds that can be used in the synthesis of compounds containing quaternary asymmetric carbon.
本発明者は、上記課題を解決するために鋭意検討を行った結果、特定の化合物を配位子とした触媒を用いた不斉合成反応によって、選択的かつ効率的に四級不斉炭素含有化合物を合成できることを見出した。また、当該配位子およびその中間体化合物の効率的な製造方法を見出した。本発明者は、これらの知見に基づいて本発明を完成するに至った。 As a result of intensive research conducted by the inventors to solve the above problems, they discovered that compounds containing quaternary asymmetric carbon can be selectively and efficiently synthesized by an asymmetric synthesis reaction using a catalyst with a specific compound as a ligand. They also discovered an efficient method for producing the ligand and its intermediate compound. Based on these findings, the inventors have completed the present invention.
すなわち、本発明によれば、以下の発明が提供される。
[1] 下記式(1):
R2は、炭素数1~6のアルキル基を示す。)
で表される第1の原料化合物、ハロゲン化水素、およびホルムアルデヒドを、酸触媒の存在下、20℃以上100℃以下で反応させて、
下記式(2):
Xはハロゲン原子を示す。)
で表される第2の原料化合物を合成する第1の反応工程と、
前記第2の原料化合物と、下記式(3):
で表される第3の原料化合物とを、20℃以上150℃以下で反応させて、
下記式(4):
で表される第4の原料化合物を合成する第2の反応工程と、
を含む、中間体化合物の製造方法。
[2] 前記第2の反応工程における副生成物の収率が、20%以下である、[1]に記載の中間体化合物の製造方法。
[3] 前記第4の原料化合物と、有機ハロゲン化合物とを、有機リチウム化合物の存在下で反応させて、
下記式(5):
R5およびR6は、それぞれ独立して、置換されてもよい炭素数1~12の炭化水素基を示す。)
で表される化合物を合成する第3の反応工程、
を含む、配位子の製造方法。
[4] 前記式(5)中、R3およびR4は、それぞれ独立して、置換されてもよい炭素数6~12の芳香族炭化水素基を示し、
R5およびR6は、それぞれ独立して、置換されてもよい炭素数6~12の芳香族炭化水素基を示す、[3]に記載の配位子の製造方法。
[5] 前記配位子が、亜鉛触媒用である、[3]または[4]に記載の配位子の製造方法。
[6] 前記有機リチウム化合物が、ブチルリチウムである、[3]~[5]のいずれかに記載の配位子の製造方法。
[7] 下記式(6):
R13およびR14は、それぞれ独立して、置換されてもよい炭素数1~12の炭化水素基を示し、但し、R13およびR14は同一の官能基ではない。)
で表される化合物を、請求項3に記載の式(5)で表される化合物を配位子とする亜鉛触媒および還元剤の存在下で部分還元反応を行い、
下記式(7):
で表される四級不斉炭素含有化合物を合成する反応工程を含む、四級不斉炭素含有化合物の製造方法。
[8] 前記還元剤が、金属水素化物である、[7]に記載の四級不斉炭素含有化合物の製造方法。
[9] 前記金属水素化物が、トリアルコキシシラン、水素化ホウ素ナトリウム、および水素化トリブチルスズからなる群から選択される少なくとも1種である、[7]または[8]に記載の四級不斉炭素含有化合物の製造方法。
[10] 前記四級不斉炭素含有化合物の光学純度が、80%ee以上である、[7]~[9]のいずれかに記載の四級不斉炭素含有化合物の製造方法。
That is, according to the present invention, the following inventions are provided.
[1] The following formula (1):
R2 represents an alkyl group having 1 to 6 carbon atoms.
reacting a first raw material compound represented by the formula:
The following formula (2):
X represents a halogen atom.
A first reaction step of synthesizing a second raw material compound represented by
The second raw material compound and a compound represented by the following formula (3):
and a third raw material compound represented by the formula:
The following formula (4):
A second reaction step of synthesizing a fourth raw material compound represented by
A method for producing an intermediate compound, comprising:
[2] The method for producing the intermediate compound according to [1], wherein the yield of the by-product in the second reaction step is 20% or less.
[3] The fourth raw material compound is reacted with an organic halogen compound in the presence of an organolithium compound,
The following formula (5):
R5 and R6 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted.
A third reaction step of synthesizing a compound represented by
A method for producing a ligand comprising the steps of:
[4] In the formula (5), R 3 and R 4 each independently represent an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted;
R 5 and R 6 each independently represent an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted.
[5] The method for producing a ligand according to [3] or [4], wherein the ligand is for a zinc catalyst.
[6] The method for producing a ligand according to any one of [3] to [5], wherein the organolithium compound is butyllithium.
[7] The following formula (6):
R 13 and R 14 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted, provided that R 13 and R 14 are not the same functional group.
in the presence of a zinc catalyst having a compound represented by formula (5) according to claim 3 as a ligand and a reducing agent,
The following formula (7):
A method for producing a quaternary asymmetric carbon-containing compound, comprising a reaction step of synthesizing a quaternary asymmetric carbon-containing compound represented by the following formula:
[8] The method for producing a quaternary asymmetric carbon-containing compound according to [7], wherein the reducing agent is a metal hydride.
[9] The method for producing a quaternary asymmetric carbon-containing compound according to [7] or [8], wherein the metal hydride is at least one selected from the group consisting of trialkoxysilane, sodium borohydride, and tributyltin hydride.
[10] The method for producing a quaternary asymmetric carbon-containing compound according to any one of [7] to [9], wherein the optical purity of the quaternary asymmetric carbon-containing compound is 80% ee or more.
本発明によれば、四級不斉炭素含有化合物の合成反応に使用可能な触媒用配位子およびその中間体化合物を効率的に製造する方法を提供することができる。さらに、本発明によれば、当該配位子を有する触媒を用いて、効率的から選択的に四級不斉炭素含有化合物を製造することができる。 According to the present invention, it is possible to provide a method for efficiently producing a catalytic ligand and an intermediate compound thereof that can be used in a synthesis reaction of a compound containing a quaternary asymmetric carbon. Furthermore, according to the present invention, it is possible to efficiently and selectively produce a compound containing a quaternary asymmetric carbon using a catalyst having the ligand.
[中間体化合物の製造方法]
本発明による中間体化合物の製造方法は、第1の反応工程と、第2の反応工程とを含むものである。本発明による中間体化合物の製造方法は、第1の反応工程の後に精製工程をさらに含んでもよい。以下、各工程について詳述する。
[Method for producing intermediate compounds]
The method for producing an intermediate compound according to the present invention includes a first reaction step and a second reaction step. The method for producing an intermediate compound according to the present invention may further include a purification step after the first reaction step. Each step will be described in detail below.
(第1の反応工程)
第1の反応工程では、下記式(1):
R2は、炭素数1~6のアルキル基を示す。)
で表される第1の原料化合物、ハロゲン化水素、およびホルムアルデヒドを、酸触媒の存在下で反応させて、下記式(2):
Xはハロゲン原子を示す。)
で表される第2の原料化合物を合成する。
(First reaction step)
In the first reaction step, the following formula (1):
R2 represents an alkyl group having 1 to 6 carbon atoms.
A first raw material compound represented by the following formula (2):
X represents a halogen atom.
A second raw material compound represented by the following formula is synthesized.
上記式(1)中、R1は、好ましくは炭素数1~4のアルキル基、炭素数1~4のアルコキシ基、ヒドロキシ基、アミノ基、または炭素数1~4のアルキル基で置換されたアミノ基を示す。R2は、好ましくは炭素数1~4のアルキル基を示し、より好ましくは炭素数1~2のアルキル基を示す。 In the above formula (1), R 1 preferably represents an alkyl group having 1 to 4 carbon atoms, an alkoxy group having 1 to 4 carbon atoms, a hydroxy group, an amino group, or an amino group substituted with an alkyl group having 1 to 4 carbon atoms. R 2 preferably represents an alkyl group having 1 to 4 carbon atoms, more preferably an alkyl group having 1 to 2 carbon atoms.
上記式(1)で表される第1の原料化合物の好ましい実施形態としては、以下の化合物が挙げられる。下記式中、Meはメチル基を示し、Etはエチル基を示し、tBuはターシャリーブチル基を示す(以下、他の化学式の記載においても同様である)。第1の原料化合物は、1種単独でも用いてもよいし、2種以上を併用してもよい。
Preferred embodiments of the first raw material compound represented by the above formula (1) include the following compounds. In the following formula, Me represents a methyl group, Et represents an ethyl group, and tBu represents a tertiary butyl group (the same applies to the descriptions of other chemical formulas below). The first raw material compound may be used alone or in combination of two or more kinds.
第1の反応工程で用いるハロゲン化水素としては、例えば、臭化水素、塩化水素、およびヨウ化水素等が挙げられる。これらの中でも、臭化水素を用いることが好ましい。 Examples of hydrogen halides used in the first reaction step include hydrogen bromide, hydrogen chloride, and hydrogen iodide. Among these, it is preferable to use hydrogen bromide.
第1の反応工程で用いる酸触媒としては、例えば、硫酸、塩酸等が挙げられる。これらの中でも、硫酸を用いることが好ましい。 Examples of acid catalysts used in the first reaction step include sulfuric acid and hydrochloric acid. Among these, it is preferable to use sulfuric acid.
第1の反応工程は、不活性ガス(窒素;ヘリウム、アルゴンなどの希ガスなど)雰囲気下で行ってもよい。
反応温度は、好ましくは20℃以上100℃以下であり、より好ましくは30℃以上90℃以下であり、さらに好ましくは50℃以上80℃以下である。
反応時間は、特に制限されないが、好ましくは1時間以上48時間以下、より好ましくは2時間以上36時間以下であり、さらに好ましくは3時間以上24時間以下であり、さらにより好ましくは4時間以上12時間以下である。
The first reaction step may be carried out under an inert gas (nitrogen; a rare gas such as helium or argon, etc.) atmosphere.
The reaction temperature is preferably 20°C or higher and 100°C or lower, more preferably 30°C or higher and 90°C or lower, and further preferably 50°C or higher and 80°C or lower.
The reaction time is not particularly limited, but is preferably from 1 hour to 48 hours, more preferably from 2 hours to 36 hours, even more preferably from 3 hours to 24 hours, and even more preferably from 4 hours to 12 hours.
上記式(2)中、R1およびR2の好ましい態様は、上記式(1)と同様である。
Xとしては、臭素原子、塩素原子、およびヨウ素原子が挙げられる。これらの中でも、好ましくは臭素原子である。
In the above formula (2), preferred embodiments of R 1 and R 2 are the same as those in the above formula (1).
X may be a bromine atom, a chlorine atom, or an iodine atom. Of these, a bromine atom is preferred.
上記式(2)で表される第2の原料化合物の好ましい実施形態としては、以下の化合物が挙げられる。
Preferred embodiments of the second raw material compound represented by the above formula (2) include the following compounds.
(精製工程)
精製工程では、上記の第1の反応工程で得られた上記式(2)で表される第2の原料化合物および酸触媒等を含む反応溶液を精製して、第2の原料化合物を単離する工程である。精製工程の精製手段は、特に限定されず、従来公知の精製手段を用いることができる。精製手段としては、例えば、減圧ろ過、再結晶、分液、カラムクロマト精製および溶媒留去等が挙げられる。
(Refining process)
The purification step is a step of purifying the reaction solution containing the second raw material compound represented by the above formula (2) obtained in the above first reaction step and an acid catalyst, etc., to isolate the second raw material compound. The purification means in the purification step is not particularly limited, and any conventionally known purification means can be used. Examples of the purification means include reduced pressure filtration, recrystallization, liquid separation, column chromatography purification, and solvent distillation.
(第2の反応工程)
第2の反応工程では、第1の反応工程で得られた上記式(2)で表される第2の原料化合物と、下記式(3):
で表される第3の原料化合物とを反応させて、
下記式(4):
で表される第4の原料化合物を合成する。
(Second reaction step)
In the second reaction step, the second raw material compound represented by the above formula (2) obtained in the first reaction step is reacted with a compound represented by the following formula (3):
and a third raw material compound represented by the formula:
The following formula (4):
A fourth raw material compound represented by the following formula is synthesized.
上記式(3)中、R3およびR4は、それぞれ独立して、好ましくは置換されてもよい炭素数6~12の芳香族炭化水素基を示し、より好ましくは炭素数1~4のアルコキシ基で置換されてもよい炭素数6~12の芳香族炭化水素基を示し、さらに好ましくは炭素数1~2のアルコキシ基で置換されてもよい炭素数6~12の芳香族炭化水素基を示す。芳香族炭化水素基としては、アリール基およびアラルキル基等が挙げられる。なお、アリール基には、単環芳香族炭化水素基だけでなく、多環芳香族炭化水素基も含まれる。 In the above formula (3), R 3 and R 4 each independently represent an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted, more preferably an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted with an alkoxy group having 1 to 4 carbon atoms, and even more preferably an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted with an alkoxy group having 1 to 2 carbon atoms. Examples of the aromatic hydrocarbon group include aryl groups and aralkyl groups. The aryl group includes not only monocyclic aromatic hydrocarbon groups but also polycyclic aromatic hydrocarbon groups.
上記式(3)で表される第3の原料化合物の好ましい実施形態としては、以下の化合物が挙げられる。第3の原料化合物は、1種単独でも用いてもよいし、2種以上を併用してもよい。
第2の反応工程では、反応を促進するために、炭酸塩を触媒として添加してもよい。反応触媒としては、例えば、炭酸カリウム、炭酸ナトリウム等が挙げられる。これらの中でも、炭酸カリウムを用いることが好ましい。 In the second reaction step, a carbonate may be added as a catalyst to promote the reaction. Examples of reaction catalysts include potassium carbonate and sodium carbonate. Among these, it is preferable to use potassium carbonate.
第2の反応工程では、第2の原料化合物と第3の原料化合物の物質量モル比は、好ましくは1:1~1:10であり、より好ましくは1:1.5~1:5.0であり、さらに好ましくは1:1.7~1:3.0であり、最も好ましくは1:2.0~1:2.5である。第2の原料化合物と第3の原料化合物の物質量モル比を調節することで、第2の反応工程の反応効率を向上させることができる。 In the second reaction step, the molar ratio of the second raw material compound to the third raw material compound is preferably 1:1 to 1:10, more preferably 1:1.5 to 1:5.0, even more preferably 1:1.7 to 1:3.0, and most preferably 1:2.0 to 1:2.5. By adjusting the molar ratio of the second raw material compound to the third raw material compound, the reaction efficiency of the second reaction step can be improved.
第2の反応工程は、不活性ガス(窒素;ヘリウム、アルゴンなどの希ガスなど)雰囲気下で行ってもよい。
反応温度は、好ましくは20℃以上150℃以下であり、より好ましくは20℃以上100℃以下であり、さらに好ましくは20℃以上80℃以下である。
反応時間は、特に制限されないが、好ましくは1時間以上48時間以下、より好ましくは2時間以上36時間以下であり、さらに好ましくは3時間以上24時間以下であり、さらにより好ましくは4時間以上12時間以下である。
The second reaction step may be carried out under an inert gas (nitrogen; rare gases such as helium and argon, etc.) atmosphere.
The reaction temperature is preferably 20°C or higher and 150°C or lower, more preferably 20°C or higher and 100°C or lower, and further preferably 20°C or higher and 80°C or lower.
The reaction time is not particularly limited, but is preferably from 1 hour to 48 hours, more preferably from 2 hours to 36 hours, even more preferably from 3 hours to 24 hours, and even more preferably from 4 hours to 12 hours.
上記式(4)中、R1およびR2の好ましい態様は、上記式(1)と同様であり、R3およびR4の好ましい態様は、上記式(3)と同様である。 In the above formula (4), preferred embodiments of R1 and R2 are the same as those in the above formula (1), and preferred embodiments of R3 and R4 are the same as those in the above formula (3).
上記式(4)で表される第4の原料化合物(中間体化合物)の好ましい実施形態としては、以下の化合物が挙げられる。
上記式中、Arは上記式(3)と同様である。
Preferred embodiments of the fourth raw material compound (intermediate compound) represented by the above formula (4) include the following compounds.
In the above formula, Ar is the same as in formula (3).
第2の反応工程では、第2の原料化合物の種類、第3の原料化合物の種類、およびそれらの物質量比等を調節することにより、反応効率を向上させ、副生成物の収率を抑制することができる。第2の反応工程では、第4の原料化合物(中間体化合物)の収率は、好ましくは80%以上であり、より好ましくは85%以上である。また、第2の反応工程における副生成物の収率は、好ましくは20%以下であり、より好ましくは15%以下であり、さらに好ましくは10%以下である。第2の反応工程では、原料化合物(中間体化合物)の収率を向上させながら、副生成物の収率を抑制することで、第2の反応工程の後の精製工程を簡略ないし省略することもできる。 In the second reaction step, the type of the second raw material compound, the type of the third raw material compound, and the ratio of the amounts of substances thereof can be adjusted to improve the reaction efficiency and suppress the yield of by-products. In the second reaction step, the yield of the fourth raw material compound (intermediate compound) is preferably 80% or more, more preferably 85% or more. In addition, the yield of by-products in the second reaction step is preferably 20% or less, more preferably 15% or less, and even more preferably 10% or less. In the second reaction step, the yield of the raw material compound (intermediate compound) can be improved while suppressing the yield of by-products, and the purification step after the second reaction step can be simplified or omitted.
[配位子の製造方法]
本発明による配位子の製造方法は、第3の反応工程とを含むものである。本発明による配位子の製造方法は、第3の反応工程の後に精製工程をさらに含んでもよい。以下、各工程について詳述する。
[Method for producing the ligand]
The method for producing a ligand according to the present invention includes a third reaction step. The method for producing a ligand according to the present invention may further include a purification step after the third reaction step. Each step will be described in detail below.
(第3の反応工程)
第3の反応工程では、第2の反応工程で得られた上記式(4)で表される第4の原料化合物(中間体化合物)と、有機ハロゲン化合物とを、有機リチウム化合物の存在下で反応させて、
下記式(5):
R5およびR6は、それぞれ独立して、置換されてもよい炭素数1~12の炭化水素基を示す。)
で表される化合物を合成する。
(Third reaction step)
In the third reaction step, the fourth raw material compound (intermediate compound) represented by the above formula (4) obtained in the second reaction step is reacted with an organic halogen compound in the presence of an organolithium compound,
The following formula (5):
R5 and R6 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted.
A compound represented by the following formula is synthesized.
第3の反応工程で用いる有機ハロゲン化合物としては、有機臭素化物、有機塩化物、および有機ヨウ化物等が挙げられる。有機物の構造としては、上記式(5)中、R5およびR6の化学構造を与えられる物であれば、特に限定されない。 The organic halogen compound used in the third reaction step includes organic bromides, organic chlorides, organic iodides, etc. The structure of the organic substance is not particularly limited as long as it can provide the chemical structures of R5 and R6 in the above formula (5).
第3の反応工程で用いる有機リチウム化合物としては、アルキルリチウムを用いることが好ましい。アルキルリチウムのアルキル基の炭素数は、好ましくは1~6であり、より好ましくは1~4である。アルキル基は、直鎖状および分岐鎖状のいずれであってもよい。アルキルリチウムとしては、例えば、メチルリチウム、ブチルリチウム(n-ブチルリチウム、sec-ブチルリチウム、tert-ブチルリチウム)が挙げられる。ブチルリチウムの中でも、反応性の観点から、n-ブチルリチウムを用いることが好ましい。 As the organolithium compound used in the third reaction step, it is preferable to use an alkyllithium. The number of carbon atoms in the alkyl group of the alkyllithium is preferably 1 to 6, more preferably 1 to 4. The alkyl group may be either linear or branched. Examples of alkyllithium include methyllithium and butyllithium (n-butyllithium, sec-butyllithium, tert-butyllithium). Among butyllithiums, it is preferable to use n-butyllithium from the viewpoint of reactivity.
第3の反応工程は、不活性ガス(窒素;ヘリウム、アルゴンなどの希ガスなど)雰囲気下で行ってもよい。
反応温度は、好ましくは-100℃以上100℃以下であり、より好ましくは-80℃以上90℃以下であり、さらに好ましくは0℃以上80℃以下である。
反応時間は、特に制限されないが、好ましくは10分間以上12時間以下、より好ましくは20分間以上6時間以下であり、さらに好ましくは30分間以上3時間以下である。
The third reaction step may be carried out under an inert gas (nitrogen; rare gases such as helium and argon, etc.) atmosphere.
The reaction temperature is preferably from -100°C to 100°C, more preferably from -80°C to 90°C, and further preferably from 0°C to 80°C.
The reaction time is not particularly limited, but is preferably from 10 minutes to 12 hours, more preferably from 20 minutes to 6 hours, and even more preferably from 30 minutes to 3 hours.
上記式(5)中、R3およびR4の好ましい態様は、上記式(3)と同様である。
R5およびR6は、それぞれ独立して、好ましくは置換されてもよい炭素数6~12の芳香族炭化水素基を示し、より好ましくは炭素数1~4のアルコキシ基で置換されてもよい炭素数6~12の芳香族炭化水素基を示し、さらに好ましくは炭素数1~2のアルコキシ基で置換されてもよい炭素数6~12の芳香族炭化水素基を示す。芳香族炭化水素基としては、アリール基およびアラルキル基等が挙げられる。なお、アリール基には、単環芳香族炭化水素基だけでなく、多環芳香族炭化水素基も含まれる。
In the above formula (5), preferred embodiments of R3 and R4 are the same as those in the above formula (3).
R5 and R6 each independently represent an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted, more preferably an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted with an alkoxy group having 1 to 4 carbon atoms, and even more preferably an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted with an alkoxy group having 1 to 2 carbon atoms. Examples of the aromatic hydrocarbon group include aryl groups and aralkyl groups. The aryl group includes not only monocyclic aromatic hydrocarbon groups but also polycyclic aromatic hydrocarbon groups.
上記式(5)で表される配位子の好ましい実施形態としては、以下の化合物が挙げられる。第1の原料化合物は、1種単独でも用いてもよいし、2種以上を併用してもよい。
上記式中、Arは上記式(3)と同様である。
上記式中、Ar2は下記式で表される。
In the above formula, Ar is the same as in formula (3).
In the above formula, Ar2 is represented by the following formula:
第3の反応工程では、上記式(5)で表される化合物(配位子)の収率は、好ましくは80%以上であり、より好ましくは85%以上である。第3の反応工程では、反応条件を適宜調節することで、収率を向上させることができる。 In the third reaction step, the yield of the compound (ligand) represented by the above formula (5) is preferably 80% or more, more preferably 85% or more. In the third reaction step, the yield can be improved by appropriately adjusting the reaction conditions.
(精製工程)
精製工程では、上記の第3の反応工程で得られた上記式(2)で表される第2の原料化合物および酸触媒等を含む反応溶液を精製して、第2の原料化合物を単離する工程である。精製工程の精製手段は、特に限定されず、従来公知の精製手段を用いることができる。精製手段としては、例えば、減圧ろ過、再結晶、分液、カラムクロマト精製および溶媒留去等が挙げられる。
(Refining process)
In the purification step, the reaction solution containing the second raw material compound represented by the above formula (2) obtained in the third reaction step and an acid catalyst, etc., is purified to isolate the second raw material compound. The purification means in the purification step is not particularly limited, and any conventionally known purification means can be used. Examples of the purification means include reduced pressure filtration, recrystallization, liquid separation, column chromatography purification, and solvent distillation.
本発明の製造方法により得られた配位子は、触媒用として好適であり、特に、亜鉛触媒用として好適である。 The ligand obtained by the manufacturing method of the present invention is suitable for use as a catalyst, and is particularly suitable for use as a zinc catalyst.
[四級不斉炭素含有化合物の製造方法]
本発明による四級不斉炭素含有化合物の製造方法は、四級不斉炭素を含有するエステルを部分還元反応によって光学状態を保持したままで四級不斉炭素を含有するアルコールを合成する反応工程を含む。本発明による四級不斉炭素含有化合物の製造方法は、部分還元反応工程の後に精製工程をさらに含んでもよい。以下、各工程について詳述する。
[Method of producing a compound containing a quaternary asymmetric carbon]
The method for producing a compound containing a quaternary asymmetric carbon according to the present invention includes a reaction step of synthesizing an alcohol containing a quaternary asymmetric carbon by partial reduction reaction of an ester containing a quaternary asymmetric carbon while maintaining the optical state. The method for producing a compound containing a quaternary asymmetric carbon according to the present invention may further include a purification step after the partial reduction reaction step. Each step will be described in detail below.
(部分還元反応工程)
部分還元反応工程では、下記式(6):
R13およびR14は、それぞれ独立して、置換されてもよい炭素数1~12の炭化水素基を示し、但し、R13およびR14は同一の官能基ではない。)
で表される化合物を、上記式(5)で表される化合物を配位子とする亜鉛触媒および還元剤の存在下で部分還元反応を行い、
下記式(7):
で表される四級不斉炭素含有化合物を合成する。
(Partial reduction reaction step)
In the partial reduction reaction step, the following formula (6):
R 13 and R 14 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted, provided that R 13 and R 14 are not the same functional group.
in the presence of a zinc catalyst having a compound represented by formula (5) as a ligand and a reducing agent,
The following formula (7):
A quaternary asymmetric carbon-containing compound represented by the following formula is synthesized.
上記式(6)中、R11およびR12は、それぞれ独立して、好ましくは炭素数1~4のアルキル基を示し、より好ましくは炭素数1~2のアルキル基を示す。
R13およびR14は、それぞれ独立して、好ましくはハロゲン原子、炭素数1~4のアルコキシ基、またはエステル基で置換されてもよい炭素数1~12の炭化水素基を示す。炭化水素基としては、例えば、炭素数1~4のアルキル基や、炭素数6~12の芳香族炭化水素基等が挙げられる。芳香族炭化水素基としては、アリール基およびアラルキル基が挙げられる。なお、アリール基には、フェニル基等の単環芳香族炭化水素基だけでなく、ナフチル基等の多環芳香族炭化水素基も含まれる。
本発明の好ましい実施態様としては、例えば、上記式(6)中、R13が炭素数1~4のアルキル基を示し、R14がハロゲン原子、炭素数1~4のアルコキシ基、またはエステル基で置換されてもよい炭素数6~12の芳香族炭化水素基を示す化合物が挙げられる。
In the above formula (6), R 11 and R 12 each independently represent an alkyl group having preferably 1 to 4 carbon atoms, and more preferably an alkyl group having 1 to 2 carbon atoms.
R 13 and R 14 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted with a halogen atom, an alkoxy group having 1 to 4 carbon atoms, or an ester group. Examples of the hydrocarbon group include an alkyl group having 1 to 4 carbon atoms and an aromatic hydrocarbon group having 6 to 12 carbon atoms. Examples of the aromatic hydrocarbon group include an aryl group and an aralkyl group. The aryl group includes not only monocyclic aromatic hydrocarbon groups such as a phenyl group, but also polycyclic aromatic hydrocarbon groups such as a naphthyl group.
A preferred embodiment of the present invention includes, for example, a compound in which, in the above formula (6), R 13 represents an alkyl group having 1 to 4 carbon atoms, and R 14 represents an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted with a halogen atom, an alkoxy group having 1 to 4 carbon atoms, or an ester group.
上記式(6)で表される化合物の好ましい実施形態としては、以下の化合物が挙げられる。当該化合物は、1種単独でも用いてもよいし、2種以上を併用してもよい。
Preferred embodiments of the compound represented by the above formula (6) include the following compounds. These compounds may be used alone or in combination of two or more.
部分還元反応で用いる亜鉛触媒としては、ジメチル亜鉛、ジエチル亜鉛等が挙げられる。これらの中でも、亜鉛触媒としては、ジエチル亜鉛が好ましい。 Examples of zinc catalysts used in the partial reduction reaction include dimethylzinc and diethylzinc. Among these, diethylzinc is preferred as the zinc catalyst.
部分還元反応で用いる亜鉛触媒は、亜鉛と配位子の物質量モル比は、好ましくは1:1~3:1であり、より好ましくは1.5:1~2.5:1であり、さらに好ましくは1.9:1~2.1:1である。亜鉛と配位子の物質量モル比を調節することで、生成物(四級不斉炭素含有化合物)の光学純度を向上させることができる。 The zinc catalyst used in the partial reduction reaction has a molar ratio of zinc to ligand of preferably 1:1 to 3:1, more preferably 1.5:1 to 2.5:1, and even more preferably 1.9:1 to 2.1:1. By adjusting the molar ratio of zinc to ligand, the optical purity of the product (quaternary asymmetric carbon-containing compound) can be improved.
部分還元反応で用いる還元剤は、好ましくは金属水素化物である。金属水素化物としては、トリアルコキシシラン、水素化ホウ素ナトリウム、および水素化トリブチルスズ等が挙げられる。トリアルコキシシランとしては、トリメトキシシランおよびトリエトキシシランが挙げられる。 The reducing agent used in the partial reduction reaction is preferably a metal hydride. Examples of the metal hydride include trialkoxysilane, sodium borohydride, and tributyltin hydride. Examples of the trialkoxysilane include trimethoxysilane and triethoxysilane.
上記式(7)中、R11、R13およびR14の好ましい態様は上記式(6)と同様である。 In the above formula (7), the preferred embodiments of R 11 , R 13 and R 14 are the same as those in the above formula (6).
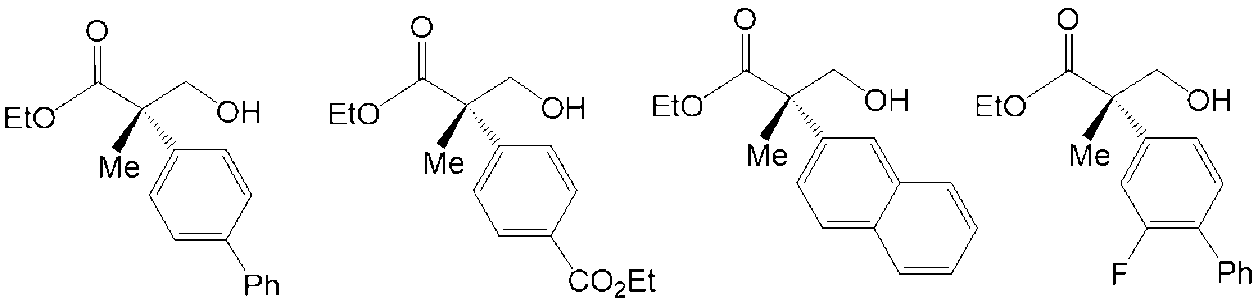
上記式(7)で表される四級不斉炭素含有化合物の好ましい実施形態としては、以下の化合物が挙げられる。
Preferred embodiments of the quaternary asymmetric carbon-containing compound represented by the above formula (7) include the following compounds.
部分還元反応では、上記式(7)で表される四級不斉炭素含有化合物の収率は、好ましくは80%以上であり、より好ましくは85%以上である。部分還元反応では、反応条件を適宜調節することで、収率を向上させることができる。 In the partial reduction reaction, the yield of the quaternary asymmetric carbon-containing compound represented by the above formula (7) is preferably 80% or more, more preferably 85% or more. In the partial reduction reaction, the yield can be improved by appropriately adjusting the reaction conditions.
部分還元反応で得られた上記式(7)で表される四級不斉炭素含有化合物の光学純度(%ee)は、好ましくは80%ee以上であり、より好ましくは85%ee以上であり、さらに好ましくは90%ee以上である。
なお、四級不斉炭素含有化合物の光学純度(%ee)は、下記式で算出することができる。
(AS-AR)/(AS+AR)×100
(式中、ASおよびARはそれぞれ、鏡像異性体(S体、R体)のモル分率である)
The optical purity (% ee) of the quaternary asymmetric carbon-containing compound represented by formula (7) obtained by the partial reduction reaction is preferably 80% ee or more, more preferably 85% ee or more, and even more preferably 90% ee or more.
The optical purity (% ee) of a compound containing a quaternary asymmetric carbon can be calculated by the following formula.
(A S −A R )/(A S +A R )×100
(In the formula, A S and A R are the mole fractions of the enantiomers (S and R), respectively.)
(精製工程)
精製工程では、上記の部分還元反応工程で得られた上記式(7)で表される四級不斉炭素含有化合物および亜鉛媒等を含む反応溶液を精製して、当該四級不斉炭素含有化合物を単離する工程である。精製工程の精製手段は、特に限定されず、従来公知の精製手段を用いることができる。精製手段としては、例えば、減圧ろ過、再結晶、分液、カラムクロマト精製および溶媒留去等が挙げられる。
(Refining process)
In the purification step, the reaction solution containing the quaternary asymmetric carbon-containing compound represented by the formula (7) obtained in the partial reduction reaction step and the zinc medium is purified to isolate the quaternary asymmetric carbon-containing compound. The purification means in the purification step is not particularly limited, and any conventionally known purification means can be used. Examples of the purification means include reduced pressure filtration, recrystallization, liquid separation, column chromatography purification, and solvent distillation.
(溶媒)
本発明における上記の各反応工程では、反応に不活性な溶媒の存在下で行ってもよい。溶媒としては、特に制限されず、慣用の有機溶媒を用いることができる。有機溶媒としては、例えば、ベンゼン、トルエン、o-,m-,p-キシレン、メシチレン等の芳香族炭化水素系溶媒;ヘキサン、シクロヘキサン等の脂肪族炭化水素系溶媒;ジクロロメタン、クロロホルム、1,2-ジクロロエタン、クロロベンゼン、o-ジクロロベンゼン等のハロゲン系溶媒;テトラヒドロフラン、ジオキサン、ジエチルエーテル、グライム、ジグライム等のエーテル系溶媒;ヘキサフルオロベンゼン、m-ビス(トリフルオロメチル)ベンゼン、p-ビス(トリフルオロメチル)ベンゼン、α,α,α-トリフルオロメチルベンゼン、ジクロロペンタフルオロプロパン等の含フッ素有機溶媒等を用いることができる。これらの中でも、ベンゼン、トルエン、o-,m-,p-キシレン、メシチレン、ジクロロメタン、クロロホルム、クロロベンゼン、o-ジクロロベンゼン、ジエチルエーテル、ジオキサン、THF(テトラヒドロフラン)、ヘキサフルオロベンゼン、m-ビス(トリフルオロメチル)ベンゼン、p-ビス(トリフルオロメチル)ベンゼン、α,α,α-トリフルオロメチルベンゼン等、及びこれらの混合物が好ましい。
(solvent)
In the above-mentioned reaction steps in the present invention, the reaction may be carried out in the presence of a solvent inert to the reaction. The solvent is not particularly limited, and a conventional organic solvent can be used. Examples of the organic solvent that can be used include aromatic hydrocarbon solvents such as benzene, toluene, o-, m-, p-xylene, and mesitylene; aliphatic hydrocarbon solvents such as hexane and cyclohexane; halogen-based solvents such as dichloromethane, chloroform, 1,2-dichloroethane, chlorobenzene, and o-dichlorobenzene; ether-based solvents such as tetrahydrofuran, dioxane, diethyl ether, glyme, and diglyme; and fluorine-containing organic solvents such as hexafluorobenzene, m-bis(trifluoromethyl)benzene, p-bis(trifluoromethyl)benzene, α,α,α-trifluoromethylbenzene, and dichloropentafluoropropane. Among these, benzene, toluene, o-, m-, and p-xylene, mesitylene, dichloromethane, chloroform, chlorobenzene, o-dichlorobenzene, diethyl ether, dioxane, THF (tetrahydrofuran), hexafluorobenzene, m-bis(trifluoromethyl)benzene, p-bis(trifluoromethyl)benzene, α,α,α-trifluoromethylbenzene, and the like, and mixtures thereof are preferred.
以下に実施例および比較例を挙げて本発明を具体的に説明するが、本発明はこれらの実施例に限定されるものではない。 The present invention will be specifically explained below with reference to examples and comparative examples, but the present invention is not limited to these examples.
<分析条件1>
下記で得られた中間体化合物および配位子の構造は以下の方法により分析した。
(1)中間体化合物および配位子の構造の分析は、後述する条件で1H-NMRを用いて行った。
(1H-NMR条件)
・NMR測定装置:BRUKER JAPAN社製
・1H-NMR測定条件:周波数400MHz、CDCl3溶媒
・中間体化合物の検出ピーク(TMS内部基準):δ10.88(s,1H),7.58(d,2H),7.50(m,1H),7.42(d,2H),7.06(s,1H),6.79(m,4H),5.29(s,1H),3.92(m,1H),3.91(s,3H),3.75(s,3H),3.71(s,3H),3.33(m,2H),2.88(m,1H),2.43(m,1H),1.92-1.47(m,4H)
・配位子の検出ピーク(TMS内部基準):δ8.70(d,0.6H),8.64(d,0.4H),8.37(m,1H),7.86(m,4H),7.38(m,7H),7.32(m,2H),7.10(m,1H),6.78(s,0.4H),6.67(m,4H),6.63(m,2H),6.59(s,0.6H),6.06(s,1H),3.83(m,1H),3.73(m,6H),3.68(s,0.4H),3.55(d,0.6H),3.32(m,1H),3.12(s,0.4H),2.85(m,0.6H),2.43(m,1H),2.04(m,1H),1.99-1.35(m,4H)
<Analysis Condition 1>
The structures of the intermediate compounds and ligands obtained below were analyzed by the following methods.
(1) The structures of the intermediate compounds and the ligands were analyzed by 1 H-NMR under the conditions described below.
( 1H -NMR conditions)
NMR measurement device: BRUKER JAPAN 1H -NMR measurement conditions: Frequency 400MHz, CDCl 3 solvent Detection peaks of intermediate compounds (TMS internal standard): δ 10.88 (s, 1H), 7.58 (d, 2H), 7.50 (m, 1H), 7.42 (d, 2H), 7.06 (s, 1H), 6.79 (m, 4H), 5.29 (s, 1H), 3.92 (m, 1H), 3.91 (s, 3H), 3.75 (s, 3H), 3.71 (s, 3H), 3.33 (m, 2H), 2.88 (m, 1H), 2.43 (m, 1H), 1.92-1.47 (m, 4H)
Ligand detection peaks (TMS internal standard): δ 8.70 (d, 0.6H), 8.64 (d, 0.4H), 8.37 (m, 1H), 7.86 (m, 4H), 7.38 (m, 7H), 7.32 (m, 2H), 7.10 (m, 1H), 6.78 (s, 0.4H), 6.67 (m, 4H), 6.63 (m, 2H), 6.59 (s, 0.6H), 6.06 (s, 1H), 3.83 (m, 1H), 3.73 (m, 6H), 3.68 (s, 0.4H), 3.55 (d, 0.6H), 3.32 (m, 1H), 3.12 (s, 0.4H), 2.85 (m, 0.6H), 2.43 (m, 1H), 2.04 (m, 1H), 1.99-1.35 (m, 4H)
<分析条件2>
下記で得られた四級不斉炭素含有化合物の構造および光学純度(%ee)は以下の方法により分析した。
(1)四級不斉炭素含有化合物の構造の分析は、後述する条件で1H-NMRおよび13C-NMRを用いて行った。
(1HNMR条件)
・NMR測定装置:BRUKER JAPAN社製
・1H-NMR測定条件(TMS内部基準):周波数400MHz、CDCl3溶媒
・四級不斉炭素含有化合物の検出ピーク:δ7.34(m,2H),7.29(m,3H),4.20(m,2H),4.05(dd,1H),3.62(dd,1H),2.53(m,1H),1.65(s,3H),1.22(t,3H)
(13C-NMR条件)
・NMR測定装置:BRUKER JAPAN社製
・13C-NMR測定条件:周波数100MHz、CDCl3溶媒
・四級不斉炭素含有化合物の検出ピーク(TMS内部基準):δ176.1,140.6,128.6,127.3,126.2,69.8,61.1,52.6,20.0,14.0
(2)四級不斉炭素含有化合物の光学純度(%ee)は、後述する条件で光学HPLCを用いて行った。
(HPLC条件)
・HPLC装置:Agilent株式会社製、型番HP1260
・カラム:ダイセル株式会社製、CHIRALPAK ID-3カラム
・流速:1.0mL/分
・移動相:10%イソプロパノール/90%ヘキサン
・温度:35℃
・検出:UV230nm
<Analysis Condition 2>
The structures and optical purities (% ee) of the quaternary asymmetric carbon-containing compounds obtained below were analyzed by the following methods.
(1) The structure of the compound containing a quaternary asymmetric carbon was analyzed by 1 H-NMR and 13 C-NMR under the conditions described below.
( 1H NMR conditions)
NMR measurement device: BRUKER JAPAN 1H -NMR measurement conditions (TMS internal standard): Frequency 400MHz, CDCl 3 solvent Detected peaks of quaternary asymmetric carbon-containing compounds: δ 7.34 (m, 2H), 7.29 (m, 3H), 4.20 (m, 2H), 4.05 (dd, 1H), 3.62 (dd, 1H), 2.53 (m, 1H), 1.65 (s, 3H), 1.22 (t, 3H)
( 13C -NMR conditions)
NMR measurement device: BRUKER JAPAN 13C -NMR measurement conditions: Frequency 100 MHz, CDCl 3 solvent Detection peaks of quaternary asymmetric carbon-containing compounds (TMS internal standard): δ 176.1, 140.6, 128.6, 127.3, 126.2, 69.8, 61.1, 52.6, 20.0, 14.0
(2) The optical purity (% ee) of the compound containing a quaternary asymmetric carbon was measured by optical HPLC under the conditions described below.
(HPLC conditions)
HPLC device: Agilent Corporation, model number HP1260
Column: CHIRALPAK ID-3 column manufactured by Daicel Corporation Flow rate: 1.0 mL/min Mobile phase: 10% isopropanol/90% hexane Temperature: 35° C.
Detection: UV 230 nm
[実施例1]
<中間体化合物の合成>
ナスフラスコの中に、5-メチルサリチル酸メチル(第1の原料化合物)4.105g(1当量)、パラホルムアルデヒド1.113g(1.5当量)、および48%臭素化水素溶液30.813g(7.4当量)を加えて、特級硫酸を滴下しながら、70℃で8時間、下記の反応を行った(第1の反応工程、反応式I)。
<Synthesis of intermediate compounds>
Into a recovery flask were added 4.105 g (1 equivalent) of methyl 5-methylsalicylate (first raw material compound), 1.113 g (1.5 equivalents) of paraformaldehyde, and 30.813 g (7.4 equivalents) of 48% hydrogen bromide solution, and the following reaction was carried out at 70° C. for 8 hours while adding special grade sulfuric acid dropwise (first reaction step, reaction formula I).
続いて、得られた反応液について室温まで冷却して、結晶を析出させた。この結晶を水でかけ洗いしながら、減圧ろ過を行って、生成物(第2の原料化合物)を得た。第2の原料化合物の収率は44%であった。 Then, the resulting reaction solution was cooled to room temperature to precipitate crystals. The crystals were washed with water while filtering under reduced pressure to obtain the product (second raw material compound). The yield of the second raw material compound was 44%.
次に、ナスフラスコの中に、上記で得られた第2の原料化合物0.259g(2.1当量)、下記式で表される第3の原料化合物0.313g(1当量)、炭酸カリウム0.552g(4当量)、および溶媒としてN,N-ジメチルホルムアミド4mLを加えて、室温(25℃)で9時間、下記の反応を行った(第2の反応工程、反応式II)。
続いて、得られた反応液に塩化アンモニウム水溶液を添加して反応を失活させた。その後、塩化メチレンを用いて溶媒抽出、次いで乾燥および溶媒留去を行って、生成物(第4の原料化合物)を得た。得られた生成物を上記の分析条件1で1H-NMR測定を行い、図1に示す1H-NMRスペクトルを得た。スペクトル解析の結果、上記式の第4の原料化合物(中間体化合物)であることを確認した。第4の原料化合物(中間体化合物)の収率は88%であった。 Subsequently, an aqueous solution of ammonium chloride was added to the obtained reaction solution to inactivate the reaction. Thereafter, solvent extraction was performed using methylene chloride, followed by drying and distillation of the solvent to obtain a product (fourth raw material compound). The obtained product was subjected to 1 H-NMR measurement under the above-mentioned analysis condition 1, and the 1 H-NMR spectrum shown in FIG. 1 was obtained. As a result of the spectrum analysis, it was confirmed that the product was the fourth raw material compound (intermediate compound) of the above formula. The yield of the fourth raw material compound (intermediate compound) was 88%.
<配位子の合成>
ナスフラスコの中に、上記で得られた第4の原料化合物0.360g(1当量)、1-ブロモナフタレン1.213g(8当量)、15%n-ブチルリチウム/ヘキサン溶液2.502g(8当量)、および溶媒としてテトラヒドロフラン15mLを加えて、-78℃から室温(25)℃まで上昇させた後、65℃で1時間、下記の反応を行った(第3の反応工程、反応式III)。
Into a recovery flask were added 0.360 g (1 equivalent) of the fourth raw material compound obtained above, 1.213 g (8 equivalents) of 1-bromonaphthalene, 2.502 g (8 equivalents) of a 15% n-butyllithium/hexane solution, and 15 mL of tetrahydrofuran as a solvent, and the temperature was raised from −78° C. to room temperature (25)° C., and then the following reaction was carried out at 65° C. for 1 hour (third reaction step, reaction formula III).
続いて、得られた反応液に塩化アンモニウム水溶液を添加して反応を失活させた。その後、酢酸エチルを用いて溶媒抽出を行って、溶媒抽出、次いで乾燥および溶媒留去を行って、生成物(配位子)を得た。得られた生成物を上記の分析条件1で1H-NMR測定を行い、図2に示す1H-NMRスペクトルを得た。スペクトル解析の結果、上記式の配位子であることを確認した。中間体化合物の収率は89%であった。 Subsequently, an aqueous solution of ammonium chloride was added to the obtained reaction solution to inactivate the reaction. Thereafter, solvent extraction was performed using ethyl acetate, followed by drying and distillation of the solvent to obtain a product (ligand). The obtained product was subjected to 1 H-NMR measurement under the above-mentioned analysis condition 1, and the 1 H-NMR spectrum shown in FIG. 2 was obtained. As a result of the spectrum analysis, it was confirmed that the product was the ligand of the above formula. The yield of the intermediate compound was 89%.
[実施例2]
<四級不斉炭素含有ジアリール化合物の合成>
まず、上記で得られた配位子21.6mg(0.1等量)、ジエチル亜鉛72.6mg(0.2等量)および脱水トルエンを混合し、触媒液を調製した。
次に、フラスコの中に、マロン酸ジエチル75.0mg(1等量)、トリメトキシシラン110.0mg(3等量)、および脱水トルエンを加えて混合した。その後、フラスコ内に上記で調製した触媒液を0℃で添加し、0℃で7時間、下記の不斉合成反応を行った。Ligandは上記で得られた配位子を示す。
<Synthesis of diaryl compounds containing quaternary asymmetric carbon>
First, 21.6 mg (0.1 equivalents) of the ligand obtained above, 72.6 mg (0.2 equivalents) of diethylzinc, and dehydrated toluene were mixed together to prepare a catalyst solution.
Next, 75.0 mg (1 equivalent) of diethyl malonate, 110.0 mg (3 equivalents) of trimethoxysilane, and dehydrated toluene were added to the flask and mixed. After that, the catalyst solution prepared above was added to the flask at 0° C., and the following asymmetric synthesis reaction was carried out at 0° C. for 7 hours. Ligand represents the ligand obtained above.
続いて、得られた反応液にトリエチルアミン・3フッ化水素を添加して反応を失活させた。その後、ジエチルエーテル溶媒で反応物を希釈してから減圧ろ過を行った。そのろ過物を濃縮した後にカラムクロマト精製(展開液はヘキサン/酢酸エチル=2/1の混合液)を行って、生成物(四級不斉炭素含有化合物)を得た。得られた生成物を上記の分析条件2で1H-NMR測定および13C-NMR測定を行い、図3に示す1H-NMRスペクトルおよび図4に示す13C-NMRスペクトルを得た。スペクトル解析の結果、上記式の四級不斉炭素含有化合物であることを確認した。四級不斉炭素含有化合物の収率は88%であった。 Subsequently, triethylamine-hydrogen trifluoride was added to the obtained reaction solution to inactivate the reaction. Thereafter, the reaction mixture was diluted with diethyl ether solvent and then filtered under reduced pressure. The filtrate was concentrated and then purified by column chromatography (developing solution was a mixture of hexane/ethyl acetate = 2/1) to obtain a product (quaternary asymmetric carbon-containing compound). The obtained product was subjected to 1 H-NMR measurement and 13 C-NMR measurement under the above analysis condition 2, and the 1 H-NMR spectrum shown in Figure 3 and the 13 C-NMR spectrum shown in Figure 4 were obtained. As a result of the spectrum analysis, it was confirmed that the compound was a quaternary asymmetric carbon-containing compound of the above formula. The yield of the quaternary asymmetric carbon-containing compound was 88%.
また、得られた四級不斉炭素含有化合物を上記の分析条件2で光学HPLC分析を行った結果、光学純度は92%eeであった。 Furthermore, the optical purity of the resulting quaternary asymmetric carbon-containing compound was 92% ee when analyzed by optical HPLC under the above analytical condition 2.
[比較例1]
実施例2において亜鉛触媒を含む触媒液の代わりにアルミニウム触媒(トリターシャリーブトキシアルミニウムリチウム)を添加し、THF溶媒下で合成を行った以外は、同様にして反応を行った。
[Comparative Example 1]
The reaction was carried out in the same manner as in Example 2, except that an aluminum catalyst (lithium tri-tert-butoxyaluminum) was added instead of the catalyst solution containing a zinc catalyst, and the synthesis was carried out in THF solvent.
得られた四級不斉炭素含有化合物を実施例2と同様に分析した結果、光学純度は0%eeであった。
The resulting quaternary asymmetric carbon-containing compound was analyzed in the same manner as in Example 2, and the optical purity was found to be 0% ee.
Claims (10)
R2は、炭素数1~6のアルキル基を示す。)
で表される第1の原料化合物、ハロゲン化水素、およびホルムアルデヒドを、酸触媒の存在下、20℃以上100℃以下で反応させて、
下記式(2):
Xはハロゲン原子を示す。)
で表される第2の原料化合物を合成する第1の反応工程と、
前記第2の原料化合物と、下記式(3):
で表される第3の原料化合物とを、20℃以上150℃以下で反応させて、
下記式(4):
で表される第4の原料化合物を合成する第2の反応工程と、
を含む、中間体化合物の製造方法。 The following formula (1):
R2 represents an alkyl group having 1 to 6 carbon atoms.
reacting a first raw material compound represented by the formula:
The following formula (2):
X represents a halogen atom.
A first reaction step of synthesizing a second raw material compound represented by
The second raw material compound and a compound represented by the following formula (3):
and a third raw material compound represented by the formula:
The following formula (4):
A second reaction step of synthesizing a fourth raw material compound represented by
A method for producing an intermediate compound, comprising:
下記式(5):
R5およびR6は、それぞれ独立して、置換されてもよい炭素数1~12の炭化水素基を示す。)
で表される化合物を合成する第3の反応工程、
を含む、配位子の製造方法。 reacting the fourth raw material compound with an organic halogen compound in the presence of an organolithium compound;
The following formula (5):
R5 and R6 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted.
A third reaction step of synthesizing a compound represented by
A method for producing a ligand comprising the steps of:
R5およびR6は、それぞれ独立して、置換されてもよい炭素数6~12の芳香族炭化水素基を示す、請求項3に記載の配位子の製造方法。 In the formula (5), R 3 and R 4 each independently represent an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted,
The method for producing a ligand according to claim 3, wherein R 5 and R 6 each independently represent an aromatic hydrocarbon group having 6 to 12 carbon atoms which may be substituted.
R13およびR14は、それぞれ独立して、置換されてもよい炭素数1~12の炭化水素基を示し、但し、R13およびR14は同一の官能基ではない。)
で表される化合物を、請求項3に記載の式(5)で表される化合物を配位子とする亜鉛触媒および還元剤の存在下で部分還元反応を行い、
下記式(7):
で表される四級不斉炭素含有化合物を合成する反応工程を含む、四級不斉炭素含有化合物の製造方法。 The following formula (6):
R 13 and R 14 each independently represent a hydrocarbon group having 1 to 12 carbon atoms which may be substituted, provided that R 13 and R 14 are not the same functional group.
in the presence of a zinc catalyst having a compound represented by formula (5) according to claim 3 as a ligand and a reducing agent,
The following formula (7):
A method for producing a quaternary asymmetric carbon-containing compound, comprising a reaction step of synthesizing a quaternary asymmetric carbon-containing compound represented by the following formula:
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022207352A JP2024091067A (en) | 2022-12-23 | 2022-12-23 | Method for producing intermediate compound, method for producing ligand, and method for producing quaternary asymmetric carbon-containing compound |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022207352A JP2024091067A (en) | 2022-12-23 | 2022-12-23 | Method for producing intermediate compound, method for producing ligand, and method for producing quaternary asymmetric carbon-containing compound |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2024091067A true JP2024091067A (en) | 2024-07-04 |
Family
ID=91715279
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022207352A Pending JP2024091067A (en) | 2022-12-23 | 2022-12-23 | Method for producing intermediate compound, method for producing ligand, and method for producing quaternary asymmetric carbon-containing compound |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2024091067A (en) |
-
2022
- 2022-12-23 JP JP2022207352A patent/JP2024091067A/en active Pending
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6389307B2 (en) | Method for producing aluminum catalyst | |
| JP2024091067A (en) | Method for producing intermediate compound, method for producing ligand, and method for producing quaternary asymmetric carbon-containing compound | |
| JPH0639468B2 (en) | Hydroquinone derivative | |
| JP4663629B2 (en) | Asymmetric reaction catalyst and method for producing optically active compound using the same | |
| US6476250B1 (en) | Optically active fluorinated binaphthol derivative | |
| JP4024059B2 (en) | Binaphthol derivative, chiral zirconium catalyst and asymmetric heterodales alder reaction method | |
| JP4020141B2 (en) | Method for producing 1-acetoxy-3- (substituted phenyl) propene compound | |
| JPH07330786A (en) | Optically active tertiary phosphine compound, transition metal complex with the same as ligand and production method using the complex | |
| JP4948030B2 (en) | Method for producing fluorine-containing alcohol derivative | |
| JP4649733B2 (en) | Method for producing acetophenone compound containing trifluoromethyl group | |
| JP2024081038A (en) | Production method of stilbene compound and production method of diaryl compound | |
| JP2024081502A (en) | Method for producing terpyridine compound | |
| WO2006051595A1 (en) | Process for producing large cyclic ketone and intermediate therefor | |
| JPH11255759A (en) | Production of optically active beta-lactone | |
| CN115260126B (en) | Chiral quaternary ammonium salt with (S) -binaphthyl, preparation method and application | |
| WO2024034666A1 (en) | Ruthenium complex, method for producing same, catalyst composition, oxidation method and method for producing oxygen-containing compound | |
| JP4617643B2 (en) | Fluorine-containing optically active quaternary ammonium salt, method for producing the same, and method for producing optically active α-amino acid derivative using the same | |
| JP5283984B2 (en) | Process for producing transition metal compound | |
| US9527862B2 (en) | Compounds of chiral aromatic spiroketal diphosphine ligands, preparation methods and uses thereof | |
| JP6641328B2 (en) | Method for producing 2,3-bisphosphinopyrazine derivative and method for producing phosphine transition metal complex | |
| JP7168161B2 (en) | Method for producing heterol multimer | |
| JPH08217775A (en) | New crown thioether and its transition metallic complex and production of optically active alcohol using the same | |
| EP1362843B1 (en) | N-cyclopropyl-2-difluoromethoxy-3-bromoaniline and intermediate used for production thereof | |
| JP4407191B2 (en) | Process for producing optically active halogenohydroxypropyl compound and glycidyl compound | |
| US8822696B2 (en) | Ligand for asymmetric synthesis catalyst, and process for production of alpha-alkenyl cyclic compound using the same |