JP2023134497A - Muc17及びcd3に向けられる二重特異性抗体コンストラクト - Google Patents
Muc17及びcd3に向けられる二重特異性抗体コンストラクト Download PDFInfo
- Publication number
- JP2023134497A JP2023134497A JP2023102462A JP2023102462A JP2023134497A JP 2023134497 A JP2023134497 A JP 2023134497A JP 2023102462 A JP2023102462 A JP 2023102462A JP 2023102462 A JP2023102462 A JP 2023102462A JP 2023134497 A JP2023134497 A JP 2023134497A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- cdr
- region
- domain
- antibody construct
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 102100023125 Mucin-17 Human genes 0.000 claims abstract description 220
- 230000027455 binding Effects 0.000 claims abstract description 190
- 241000282414 Homo sapiens Species 0.000 claims abstract description 146
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 55
- 101000623904 Homo sapiens Mucin-17 Proteins 0.000 claims abstract description 33
- 241000282553 Macaca Species 0.000 claims abstract description 29
- 108091033319 polynucleotide Proteins 0.000 claims abstract description 29
- 102000040430 polynucleotide Human genes 0.000 claims abstract description 29
- 239000002157 polynucleotide Substances 0.000 claims abstract description 29
- 239000013598 vector Substances 0.000 claims abstract description 29
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 168
- 238000000034 method Methods 0.000 claims description 129
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 96
- 229920001184 polypeptide Polymers 0.000 claims description 90
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 75
- 235000001014 amino acid Nutrition 0.000 claims description 73
- 206010028980 Neoplasm Diseases 0.000 claims description 66
- 150000001413 amino acids Chemical class 0.000 claims description 66
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 65
- 239000000178 monomer Substances 0.000 claims description 65
- 201000010099 disease Diseases 0.000 claims description 59
- 238000011282 treatment Methods 0.000 claims description 45
- 230000014509 gene expression Effects 0.000 claims description 39
- 201000011510 cancer Diseases 0.000 claims description 35
- 238000003556 assay Methods 0.000 claims description 31
- 230000003013 cytotoxicity Effects 0.000 claims description 30
- 231100000135 cytotoxicity Toxicity 0.000 claims description 30
- 239000012636 effector Substances 0.000 claims description 28
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 23
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 20
- 238000004519 manufacturing process Methods 0.000 claims description 18
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 16
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 13
- 206010017758 gastric cancer Diseases 0.000 claims description 13
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 claims description 13
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 12
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 12
- 201000002528 pancreatic cancer Diseases 0.000 claims description 12
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 12
- 201000011549 stomach cancer Diseases 0.000 claims description 12
- 208000026278 immune system disease Diseases 0.000 claims description 8
- 230000001613 neoplastic effect Effects 0.000 claims description 6
- 230000002062 proliferating effect Effects 0.000 claims description 6
- 230000002265 prevention Effects 0.000 claims description 5
- 238000012258 culturing Methods 0.000 claims description 4
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 abstract description 60
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 abstract description 60
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 abstract description 9
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 abstract description 9
- 101710155095 Mucin-17 Proteins 0.000 description 203
- 210000004027 cell Anatomy 0.000 description 194
- 108090000623 proteins and genes Proteins 0.000 description 128
- 102000004169 proteins and genes Human genes 0.000 description 109
- 235000018102 proteins Nutrition 0.000 description 102
- 239000000203 mixture Substances 0.000 description 78
- 125000005647 linker group Chemical group 0.000 description 74
- 108091007433 antigens Proteins 0.000 description 72
- 102000036639 antigens Human genes 0.000 description 72
- 239000000427 antigen Substances 0.000 description 71
- 229940024606 amino acid Drugs 0.000 description 66
- 239000003814 drug Substances 0.000 description 56
- 229940079593 drug Drugs 0.000 description 46
- 210000001744 T-lymphocyte Anatomy 0.000 description 44
- 238000009472 formulation Methods 0.000 description 44
- 238000006467 substitution reaction Methods 0.000 description 44
- 108060003951 Immunoglobulin Proteins 0.000 description 41
- 102000018358 immunoglobulin Human genes 0.000 description 41
- 239000012634 fragment Substances 0.000 description 34
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 32
- 230000000694 effects Effects 0.000 description 30
- -1 inflammation Chemical class 0.000 description 29
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 28
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 27
- 241000699666 Mus <mouse, genus> Species 0.000 description 26
- 125000000539 amino acid group Chemical group 0.000 description 25
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 23
- 150000007523 nucleic acids Chemical group 0.000 description 23
- 101710117290 Aldo-keto reductase family 1 member C4 Proteins 0.000 description 22
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 22
- 241000699670 Mus sp. Species 0.000 description 22
- 230000004048 modification Effects 0.000 description 21
- 238000012986 modification Methods 0.000 description 21
- 238000002347 injection Methods 0.000 description 20
- 239000007924 injection Substances 0.000 description 20
- 102000045938 human MUC17 Human genes 0.000 description 19
- 239000000047 product Substances 0.000 description 18
- 238000001727 in vivo Methods 0.000 description 17
- 102000039446 nucleic acids Human genes 0.000 description 17
- 108020004707 nucleic acids Proteins 0.000 description 17
- 239000003755 preservative agent Substances 0.000 description 17
- 239000003981 vehicle Substances 0.000 description 17
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 16
- 241001465754 Metazoa Species 0.000 description 16
- 238000006243 chemical reaction Methods 0.000 description 16
- 230000006870 function Effects 0.000 description 16
- 230000013595 glycosylation Effects 0.000 description 16
- 238000006206 glycosylation reaction Methods 0.000 description 16
- 238000001990 intravenous administration Methods 0.000 description 16
- 238000012360 testing method Methods 0.000 description 16
- 210000001519 tissue Anatomy 0.000 description 16
- 230000004614 tumor growth Effects 0.000 description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 15
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 14
- 210000004602 germ cell Anatomy 0.000 description 14
- 238000000338 in vitro Methods 0.000 description 14
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 13
- 238000011161 development Methods 0.000 description 13
- 230000018109 developmental process Effects 0.000 description 13
- 230000001965 increasing effect Effects 0.000 description 13
- 239000002502 liposome Substances 0.000 description 13
- 239000007788 liquid Substances 0.000 description 13
- 238000012384 transportation and delivery Methods 0.000 description 13
- 241000282567 Macaca fascicularis Species 0.000 description 12
- 229930006000 Sucrose Natural products 0.000 description 12
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 12
- 239000003963 antioxidant agent Substances 0.000 description 12
- 235000006708 antioxidants Nutrition 0.000 description 12
- 210000004369 blood Anatomy 0.000 description 12
- 239000008280 blood Substances 0.000 description 12
- 238000005516 engineering process Methods 0.000 description 12
- 239000000463 material Substances 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- 239000005720 sucrose Substances 0.000 description 12
- 235000000346 sugar Nutrition 0.000 description 12
- 108091028043 Nucleic acid sequence Proteins 0.000 description 11
- 239000002202 Polyethylene glycol Substances 0.000 description 11
- 230000004071 biological effect Effects 0.000 description 11
- 210000002381 plasma Anatomy 0.000 description 11
- 229920001223 polyethylene glycol Polymers 0.000 description 11
- 230000004044 response Effects 0.000 description 11
- 239000004094 surface-active agent Substances 0.000 description 11
- 108020004414 DNA Proteins 0.000 description 10
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 10
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 10
- 108091008874 T cell receptors Proteins 0.000 description 10
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 10
- 230000000890 antigenic effect Effects 0.000 description 10
- 150000001720 carbohydrates Chemical group 0.000 description 10
- 230000001472 cytotoxic effect Effects 0.000 description 10
- 238000011534 incubation Methods 0.000 description 10
- 230000003993 interaction Effects 0.000 description 10
- 230000035772 mutation Effects 0.000 description 10
- 239000000546 pharmaceutical excipient Substances 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- 241000282693 Cercopithecidae Species 0.000 description 9
- 206010009944 Colon cancer Diseases 0.000 description 9
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 9
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 9
- 102000015728 Mucins Human genes 0.000 description 9
- 108010063954 Mucins Proteins 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 9
- 230000009089 cytolysis Effects 0.000 description 9
- 210000004408 hybridoma Anatomy 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 125000003729 nucleotide group Chemical group 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 241000894006 Bacteria Species 0.000 description 8
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 8
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 8
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 8
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 8
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 8
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 8
- 229930195725 Mannitol Natural products 0.000 description 8
- 241000288906 Primates Species 0.000 description 8
- 241000283984 Rodentia Species 0.000 description 8
- 241000288960 Saguinus oedipus Species 0.000 description 8
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 239000000539 dimer Substances 0.000 description 8
- 230000004927 fusion Effects 0.000 description 8
- 229940072221 immunoglobulins Drugs 0.000 description 8
- 150000002500 ions Chemical class 0.000 description 8
- 239000000594 mannitol Substances 0.000 description 8
- 235000010355 mannitol Nutrition 0.000 description 8
- 239000002773 nucleotide Substances 0.000 description 8
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 8
- 229920000642 polymer Polymers 0.000 description 8
- 229920005862 polyol Polymers 0.000 description 8
- 150000003077 polyols Chemical class 0.000 description 8
- 235000004400 serine Nutrition 0.000 description 8
- 239000011780 sodium chloride Substances 0.000 description 8
- 235000010356 sorbitol Nutrition 0.000 description 8
- 239000000600 sorbitol Substances 0.000 description 8
- 241000894007 species Species 0.000 description 8
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 7
- 230000002411 adverse Effects 0.000 description 7
- 230000002776 aggregation Effects 0.000 description 7
- 238000013459 approach Methods 0.000 description 7
- 210000003719 b-lymphocyte Anatomy 0.000 description 7
- 239000011324 bead Substances 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 238000004422 calculation algorithm Methods 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 238000002784 cytotoxicity assay Methods 0.000 description 7
- 231100000263 cytotoxicity test Toxicity 0.000 description 7
- 239000003623 enhancer Substances 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 229920000136 polysorbate Polymers 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- 238000001890 transfection Methods 0.000 description 7
- 230000009466 transformation Effects 0.000 description 7
- 239000004475 Arginine Substances 0.000 description 6
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 6
- 241000196324 Embryophyta Species 0.000 description 6
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 6
- 102000002265 Human Growth Hormone Human genes 0.000 description 6
- 108010000521 Human Growth Hormone Proteins 0.000 description 6
- 239000000854 Human Growth Hormone Substances 0.000 description 6
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 6
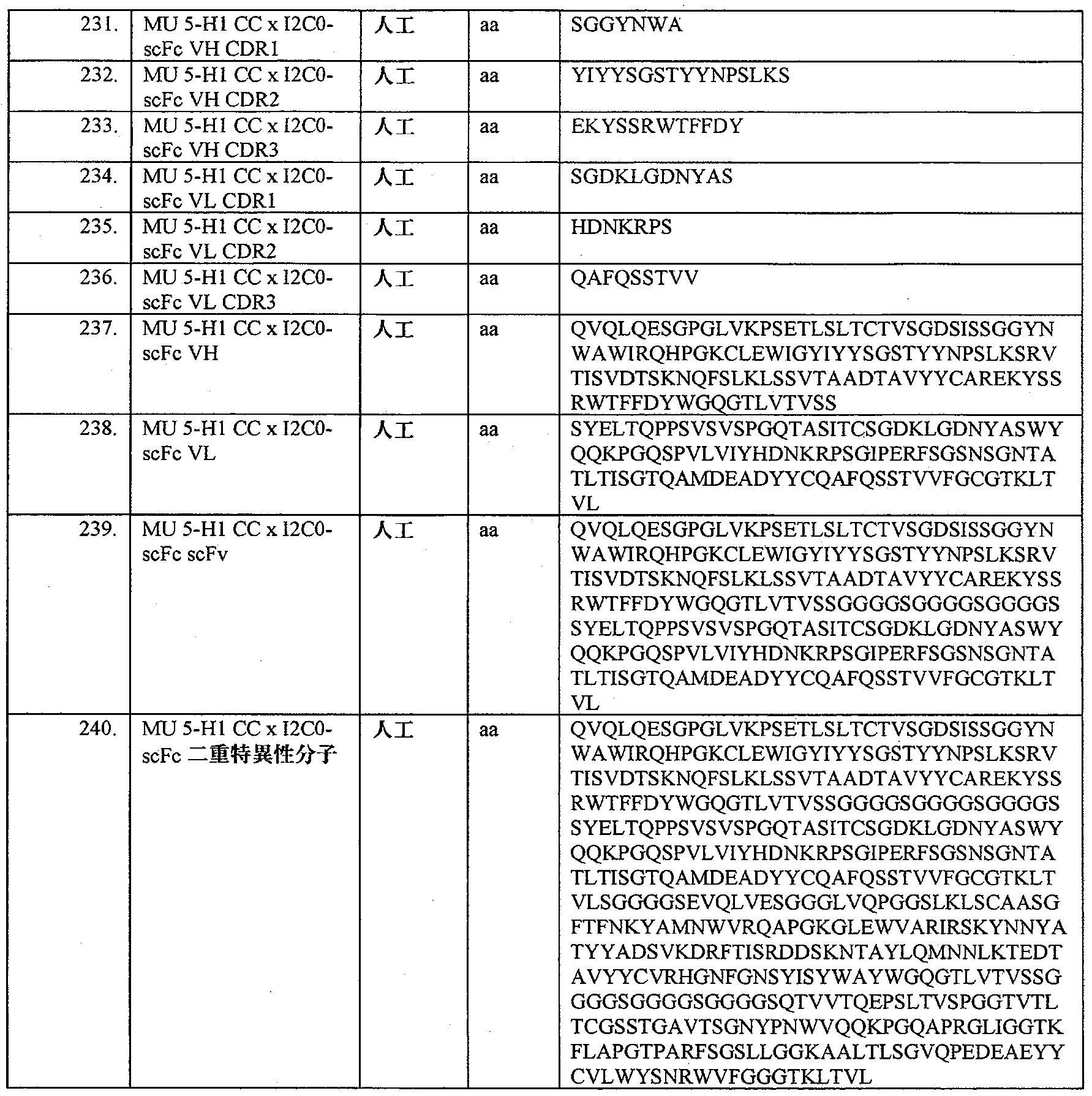
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 6
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 6
- 239000004472 Lysine Substances 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 239000004473 Threonine Substances 0.000 description 6
- 238000004220 aggregation Methods 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 6
- 235000009697 arginine Nutrition 0.000 description 6
- 229960003121 arginine Drugs 0.000 description 6
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 208000035475 disorder Diseases 0.000 description 6
- 210000003527 eukaryotic cell Anatomy 0.000 description 6
- 239000012530 fluid Substances 0.000 description 6
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 6
- 230000002496 gastric effect Effects 0.000 description 6
- 230000012010 growth Effects 0.000 description 6
- 235000018977 lysine Nutrition 0.000 description 6
- 229960003646 lysine Drugs 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 229940051875 mucins Drugs 0.000 description 6
- 238000002703 mutagenesis Methods 0.000 description 6
- 231100000350 mutagenesis Toxicity 0.000 description 6
- 210000000056 organ Anatomy 0.000 description 6
- 238000002823 phage display Methods 0.000 description 6
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 6
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 6
- 229920000053 polysorbate 80 Polymers 0.000 description 6
- 230000002335 preservative effect Effects 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 238000010561 standard procedure Methods 0.000 description 6
- 150000008163 sugars Chemical class 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 108091026890 Coding region Proteins 0.000 description 5
- 241000699800 Cricetinae Species 0.000 description 5
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 5
- 101000972284 Homo sapiens Mucin-3A Proteins 0.000 description 5
- 241001138401 Kluyveromyces lactis Species 0.000 description 5
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 5
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 5
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 5
- 241000283973 Oryctolagus cuniculus Species 0.000 description 5
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 5
- 238000011579 SCID mouse model Methods 0.000 description 5
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 5
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 5
- 235000004279 alanine Nutrition 0.000 description 5
- 238000012867 alanine scanning Methods 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- 210000000170 cell membrane Anatomy 0.000 description 5
- 235000018417 cysteine Nutrition 0.000 description 5
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 5
- 238000012377 drug delivery Methods 0.000 description 5
- 238000000684 flow cytometry Methods 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 238000002955 isolation Methods 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 108020004999 messenger RNA Proteins 0.000 description 5
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 5
- 229940068968 polysorbate 80 Drugs 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 235000013930 proline Nutrition 0.000 description 5
- 238000003753 real-time PCR Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 238000001542 size-exclusion chromatography Methods 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 239000003381 stabilizer Substances 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 150000005846 sugar alcohols Chemical class 0.000 description 5
- 238000013268 sustained release Methods 0.000 description 5
- 239000012730 sustained-release form Substances 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 235000008521 threonine Nutrition 0.000 description 5
- 231100000041 toxicology testing Toxicity 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- HKZAAJSTFUZYTO-LURJTMIESA-N (2s)-2-[[2-[[2-[[2-[(2-aminoacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]-3-hydroxypropanoic acid Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O HKZAAJSTFUZYTO-LURJTMIESA-N 0.000 description 4
- 241000288950 Callithrix jacchus Species 0.000 description 4
- 108020004705 Codon Proteins 0.000 description 4
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 4
- 239000004471 Glycine Substances 0.000 description 4
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 4
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 4
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 241001529936 Murinae Species 0.000 description 4
- 230000004989 O-glycosylation Effects 0.000 description 4
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 4
- 241000282577 Pan troglodytes Species 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- 108010076504 Protein Sorting Signals Proteins 0.000 description 4
- 108020004511 Recombinant DNA Proteins 0.000 description 4
- 241000282695 Saimiri Species 0.000 description 4
- 241000282696 Saimiri sciureus Species 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 238000012452 Xenomouse strains Methods 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 230000009824 affinity maturation Effects 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 230000006037 cell lysis Effects 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 4
- 239000003599 detergent Substances 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 230000002255 enzymatic effect Effects 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 210000002919 epithelial cell Anatomy 0.000 description 4
- 201000004101 esophageal cancer Diseases 0.000 description 4
- 238000004108 freeze drying Methods 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 4
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 4
- 230000016784 immunoglobulin production Effects 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 230000000977 initiatory effect Effects 0.000 description 4
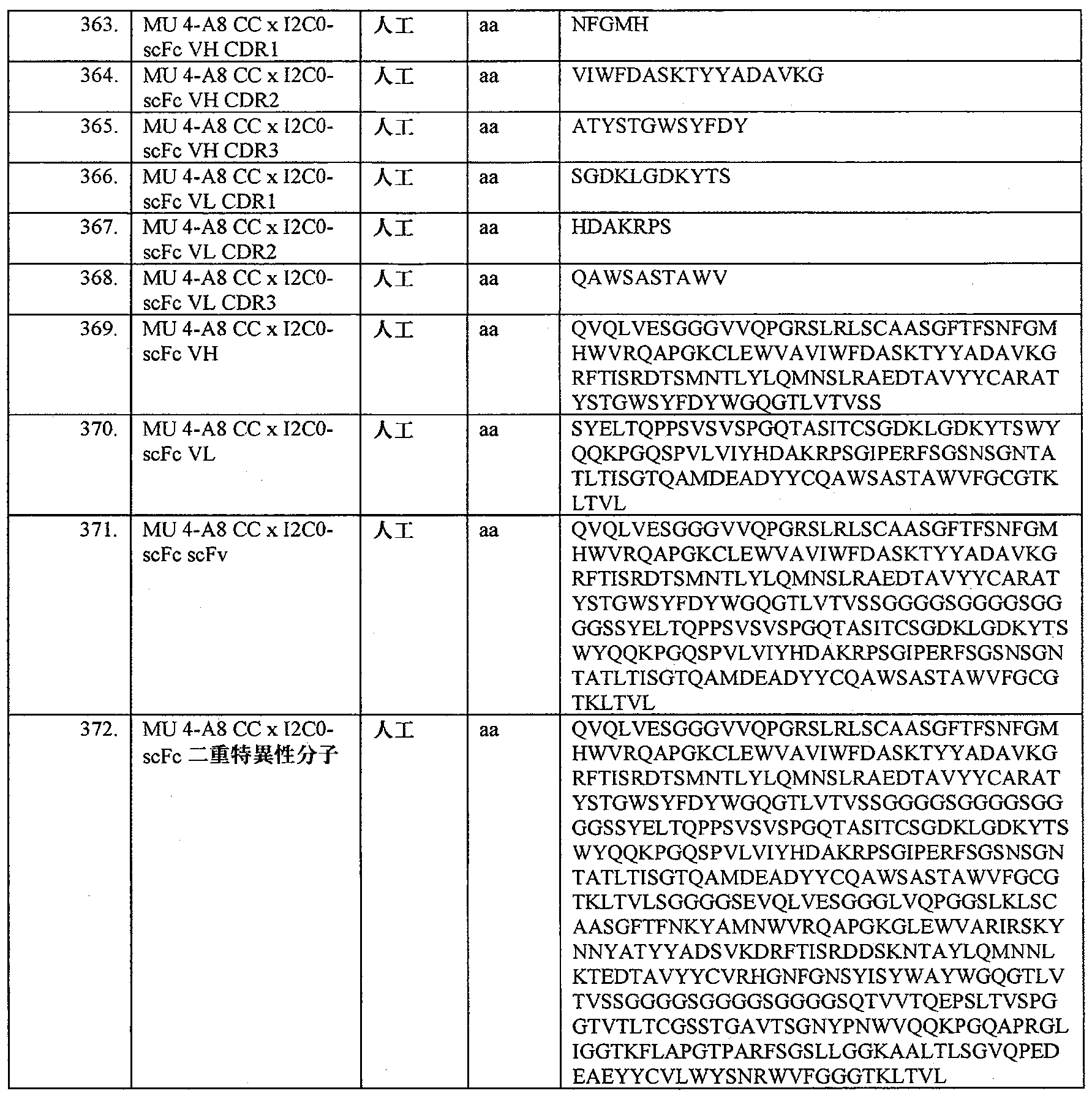
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 230000000968 intestinal effect Effects 0.000 description 4
- 210000003292 kidney cell Anatomy 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- 238000013507 mapping Methods 0.000 description 4
- 241001515942 marmosets Species 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 230000008018 melting Effects 0.000 description 4
- 238000002844 melting Methods 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- 229930182817 methionine Natural products 0.000 description 4
- 235000006109 methionine Nutrition 0.000 description 4
- 239000003094 microcapsule Substances 0.000 description 4
- 238000007911 parenteral administration Methods 0.000 description 4
- 230000001575 pathological effect Effects 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 230000004481 post-translational protein modification Effects 0.000 description 4
- 230000008707 rearrangement Effects 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 238000012216 screening Methods 0.000 description 4
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 4
- 210000003462 vein Anatomy 0.000 description 4
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
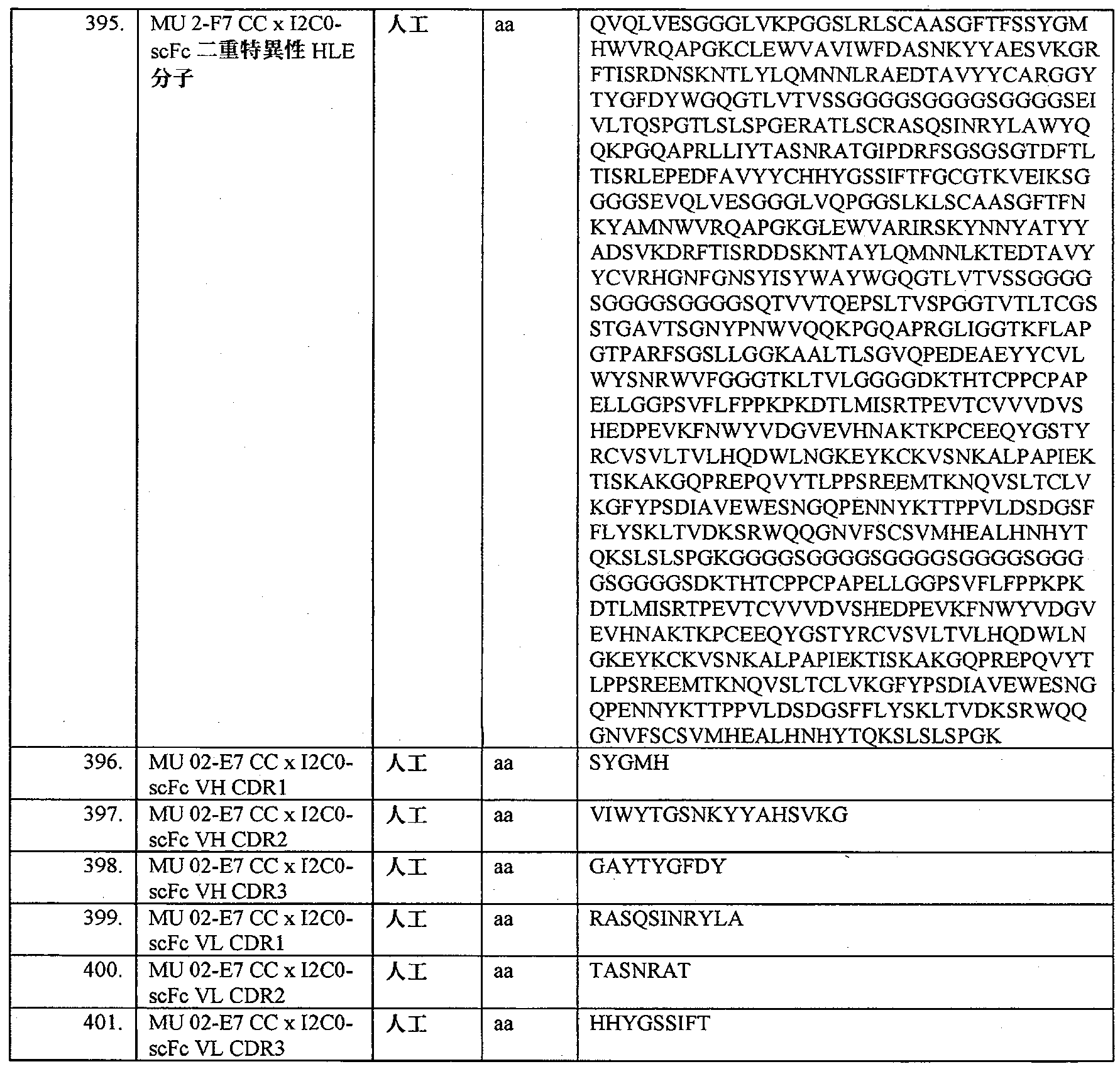
- 102000004127 Cytokines Human genes 0.000 description 3
- 206010061968 Gastric neoplasm Diseases 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 108010093488 His-His-His-His-His-His Proteins 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 206010020751 Hypersensitivity Diseases 0.000 description 3
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 3
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 3
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 3
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 3
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 3
- 244000285963 Kluyveromyces fragilis Species 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 3
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 3
- 102000043131 MHC class II family Human genes 0.000 description 3
- 108091054438 MHC class II family Proteins 0.000 description 3
- 108010029485 Protein Isoforms Proteins 0.000 description 3
- 102000001708 Protein Isoforms Human genes 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 3
- 230000006044 T cell activation Effects 0.000 description 3
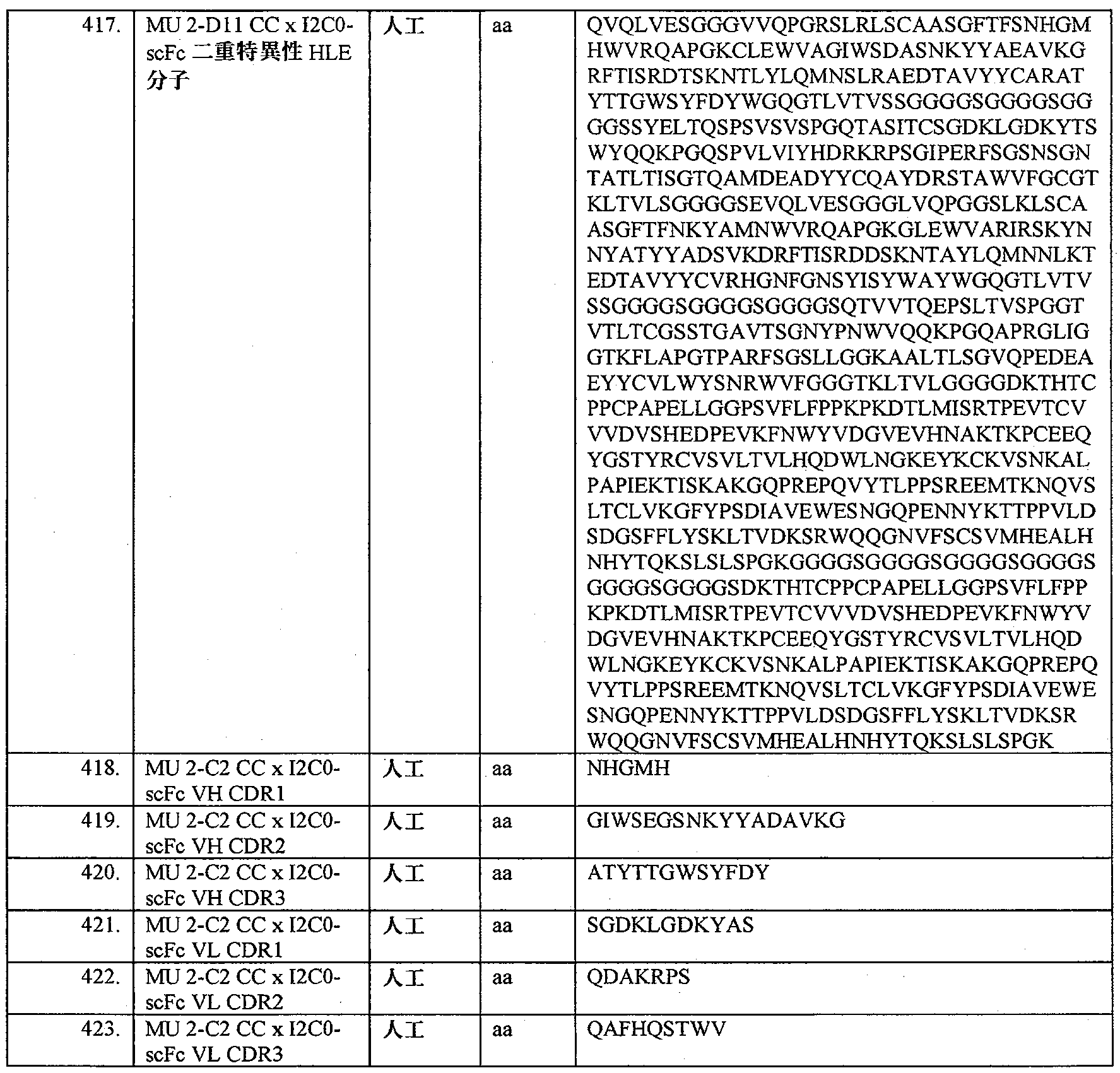
- 108700019146 Transgenes Proteins 0.000 description 3
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 238000001042 affinity chromatography Methods 0.000 description 3
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 230000009831 antigen interaction Effects 0.000 description 3
- 230000003078 antioxidant effect Effects 0.000 description 3
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 3
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
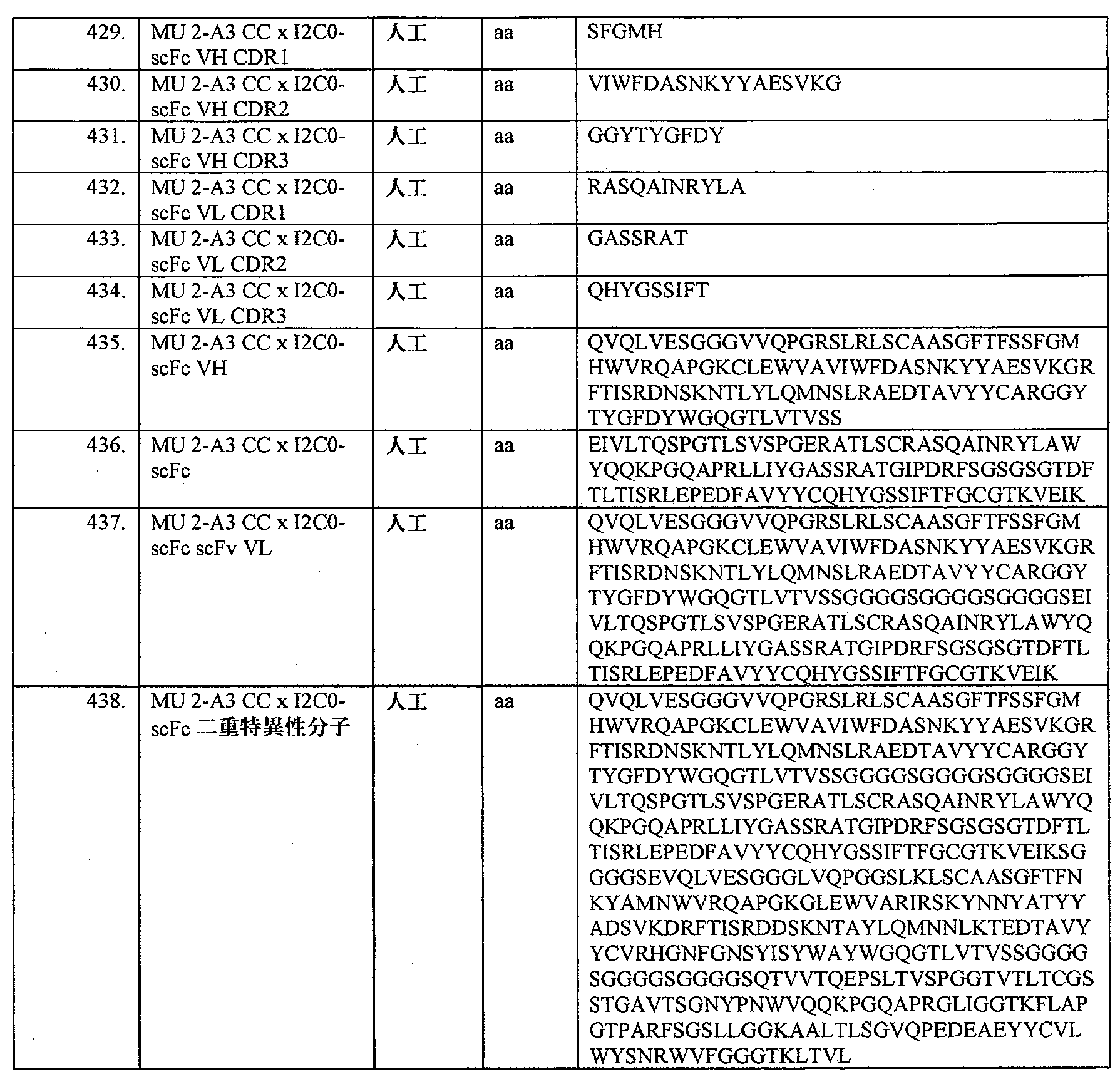
- 230000037396 body weight Effects 0.000 description 3
- 210000001185 bone marrow Anatomy 0.000 description 3
- 235000014633 carbohydrates Nutrition 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 239000002738 chelating agent Substances 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 239000011651 chromium Substances 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 230000009260 cross reactivity Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000001212 derivatisation Methods 0.000 description 3
- 239000008121 dextrose Substances 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 150000002016 disaccharides Chemical class 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- 239000012537 formulation buffer Substances 0.000 description 3
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 3
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 3
- 235000004554 glutamine Nutrition 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 239000013628 high molecular weight specie Substances 0.000 description 3
- 210000005260 human cell Anatomy 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 230000005847 immunogenicity Effects 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 210000000265 leukocyte Anatomy 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 238000012423 maintenance Methods 0.000 description 3
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 3
- 229910021645 metal ion Inorganic materials 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 239000011859 microparticle Substances 0.000 description 3
- 210000000822 natural killer cell Anatomy 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 210000003200 peritoneal cavity Anatomy 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 229920001993 poloxamer 188 Polymers 0.000 description 3
- 229940068977 polysorbate 20 Drugs 0.000 description 3
- 229940068965 polysorbates Drugs 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 102220080600 rs797046116 Human genes 0.000 description 3
- 238000005185 salting out Methods 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 210000000813 small intestine Anatomy 0.000 description 3
- 150000003384 small molecules Chemical class 0.000 description 3
- 238000001179 sorption measurement Methods 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- 229940074410 trehalose Drugs 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 239000011701 zinc Substances 0.000 description 3
- OZFAFGSSMRRTDW-UHFFFAOYSA-N (2,4-dichlorophenyl) benzenesulfonate Chemical compound ClC1=CC(Cl)=CC=C1OS(=O)(=O)C1=CC=CC=C1 OZFAFGSSMRRTDW-UHFFFAOYSA-N 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 2
- VYEWZWBILJHHCU-OMQUDAQFSA-N (e)-n-[(2s,3r,4r,5r,6r)-2-[(2r,3r,4s,5s,6s)-3-acetamido-5-amino-4-hydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[2-[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]-2-hydroxyethyl]-4,5-dihydroxyoxan-3-yl]-5-methylhex-2-enamide Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@H]2O)O)C(O)C[C@@H]2[C@H](O)[C@H](O)[C@H]([C@@H](O2)O[C@@H]2[C@@H]([C@@H](O)[C@H](N)[C@@H](CO)O2)NC(C)=O)NC(=O)/C=C/CC(C)C)C=CC(=O)NC1=O VYEWZWBILJHHCU-OMQUDAQFSA-N 0.000 description 2
- IOOMXAQUNPWDLL-UHFFFAOYSA-N 2-[6-(diethylamino)-3-(diethyliminiumyl)-3h-xanthen-9-yl]-5-sulfobenzene-1-sulfonate Chemical compound C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=C(S(O)(=O)=O)C=C1S([O-])(=O)=O IOOMXAQUNPWDLL-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- 229920000936 Agarose Polymers 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- IKYJCHYORFJFRR-UHFFFAOYSA-N Alexa Fluor 350 Chemical compound O=C1OC=2C=C(N)C(S(O)(=O)=O)=CC=2C(C)=C1CC(=O)ON1C(=O)CCC1=O IKYJCHYORFJFRR-UHFFFAOYSA-N 0.000 description 2
- WEJVZSAYICGDCK-UHFFFAOYSA-N Alexa Fluor 430 Chemical compound CC[NH+](CC)CC.CC1(C)C=C(CS([O-])(=O)=O)C2=CC=3C(C(F)(F)F)=CC(=O)OC=3C=C2N1CCCCCC(=O)ON1C(=O)CCC1=O WEJVZSAYICGDCK-UHFFFAOYSA-N 0.000 description 2
- ZAINTDRBUHCDPZ-UHFFFAOYSA-M Alexa Fluor 546 Chemical compound [H+].[Na+].CC1CC(C)(C)NC(C(=C2OC3=C(C4=NC(C)(C)CC(C)C4=CC3=3)S([O-])(=O)=O)S([O-])(=O)=O)=C1C=C2C=3C(C(=C(Cl)C=1Cl)C(O)=O)=C(Cl)C=1SCC(=O)NCCCCCC(=O)ON1C(=O)CCC1=O ZAINTDRBUHCDPZ-UHFFFAOYSA-M 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 241000351920 Aspergillus nidulans Species 0.000 description 2
- 208000023275 Autoimmune disease Diseases 0.000 description 2
- 108090001008 Avidin Proteins 0.000 description 2
- 241000255789 Bombyx mori Species 0.000 description 2
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- QSJXEFYPDANLFS-UHFFFAOYSA-N Diacetyl Chemical compound CC(=O)C(C)=O QSJXEFYPDANLFS-UHFFFAOYSA-N 0.000 description 2
- 241000255925 Diptera Species 0.000 description 2
- 241000255601 Drosophila melanogaster Species 0.000 description 2
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 2
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 2
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 206010062878 Gastrooesophageal cancer Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 2
- 108010024636 Glutathione Proteins 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 2
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 2
- 101100118545 Holotrichia diomphalia EGF-like gene Proteins 0.000 description 2
- 101000690301 Homo sapiens Aldo-keto reductase family 1 member C4 Proteins 0.000 description 2
- 101000972285 Homo sapiens Mucin-3B Proteins 0.000 description 2
- 101001116548 Homo sapiens Protein CBFA2T1 Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- 241000481961 Lachancea thermotolerans Species 0.000 description 2
- 241000235651 Lachancea waltii Species 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 101150086977 MUC17 gene Proteins 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 102100022497 Mucin-3A Human genes 0.000 description 2
- 102100022702 Mucin-3B Human genes 0.000 description 2
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 2
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 2
- 230000004988 N-glycosylation Effects 0.000 description 2
- 125000000729 N-terminal amino-acid group Chemical group 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229920002562 Polyethylene Glycol 3350 Polymers 0.000 description 2
- 229920001030 Polyethylene Glycol 4000 Polymers 0.000 description 2
- 229920001214 Polysorbate 60 Polymers 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- RADKZDMFGJYCBB-UHFFFAOYSA-N Pyridoxal Chemical compound CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 description 2
- 241000242739 Renilla Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 241000256251 Spodoptera frugiperda Species 0.000 description 2
- NYTOUQBROMCLBJ-UHFFFAOYSA-N Tetranitromethane Chemical compound [O-][N+](=O)C([N+]([O-])=O)([N+]([O-])=O)[N+]([O-])=O NYTOUQBROMCLBJ-UHFFFAOYSA-N 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- YJQCOFNZVFGCAF-UHFFFAOYSA-N Tunicamycin II Natural products O1C(CC(O)C2C(C(O)C(O2)N2C(NC(=O)C=C2)=O)O)C(O)C(O)C(NC(=O)C=CCCCCCCCCC(C)C)C1OC1OC(CO)C(O)C(O)C1NC(C)=O YJQCOFNZVFGCAF-UHFFFAOYSA-N 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000021736 acetylation Effects 0.000 description 2
- 238000006640 acetylation reaction Methods 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 2
- 230000009435 amidation Effects 0.000 description 2
- 238000007112 amidation reaction Methods 0.000 description 2
- 238000000540 analysis of variance Methods 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 239000008228 bacteriostatic water for injection Substances 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 2
- 102000005936 beta-Galactosidase Human genes 0.000 description 2
- 108010005774 beta-Galactosidase Proteins 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 229920001222 biopolymer Polymers 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- 239000007975 buffered saline Substances 0.000 description 2
- 239000006172 buffering agent Substances 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 208000035269 cancer or benign tumor Diseases 0.000 description 2
- 150000001718 carbodiimides Chemical class 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 229940107161 cholesterol Drugs 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 230000015271 coagulation Effects 0.000 description 2
- 238000005345 coagulation Methods 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 238000002591 computed tomography Methods 0.000 description 2
- 238000005094 computer simulation Methods 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 239000003431 cross linking reagent Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 230000022811 deglycosylation Effects 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 230000000368 destabilizing effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 230000006866 deterioration Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 238000006471 dimerization reaction Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 238000002296 dynamic light scattering Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 238000010579 first pass effect Methods 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 201000006974 gastroesophageal cancer Diseases 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 229940014259 gelatin Drugs 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- 229930195712 glutamate Natural products 0.000 description 2
- 229940049906 glutamate Drugs 0.000 description 2
- 229960002989 glutamic acid Drugs 0.000 description 2
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 2
- 229960003180 glutathione Drugs 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000002440 hepatic effect Effects 0.000 description 2
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 2
- 102000054751 human RUNX1T1 Human genes 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 230000036512 infertility Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 238000006317 isomerization reaction Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 235000010448 lactitol Nutrition 0.000 description 2
- 239000000832 lactitol Substances 0.000 description 2
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 description 2
- 229960003451 lactitol Drugs 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000012669 liquid formulation Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 210000005229 liver cell Anatomy 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 208000037819 metastatic cancer Diseases 0.000 description 2
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 239000004005 microsphere Substances 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 238000010525 oxidative degradation reaction Methods 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 210000001322 periplasm Anatomy 0.000 description 2
- 230000002688 persistence Effects 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- OJUGVDODNPJEEC-UHFFFAOYSA-N phenylglyoxal Chemical compound O=CC(=O)C1=CC=CC=C1 OJUGVDODNPJEEC-UHFFFAOYSA-N 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 229940044519 poloxamer 188 Drugs 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 229920000728 polyester Polymers 0.000 description 2
- 229920000570 polyether Polymers 0.000 description 2
- 229920001451 polypropylene glycol Polymers 0.000 description 2
- 229950008882 polysorbate Drugs 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 230000004845 protein aggregation Effects 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- NGVDGCNFYWLIFO-UHFFFAOYSA-N pyridoxal 5'-phosphate Chemical compound CC1=NC=C(COP(O)(O)=O)C(C=O)=C1O NGVDGCNFYWLIFO-UHFFFAOYSA-N 0.000 description 2
- 238000002708 random mutagenesis Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 2
- 229940083542 sodium Drugs 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000012430 stability testing Methods 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 231100000607 toxicokinetics Toxicity 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 102000035160 transmembrane proteins Human genes 0.000 description 2
- 108091005703 transmembrane proteins Proteins 0.000 description 2
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 2
- 239000013638 trimer Substances 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- MEYZYGMYMLNUHJ-UHFFFAOYSA-N tunicamycin Natural products CC(C)CCCCCCCCCC=CC(=O)NC1C(O)C(O)C(CC(O)C2OC(C(O)C2O)N3C=CC(=O)NC3=O)OC1OC4OC(CO)C(O)C(O)C4NC(=O)C MEYZYGMYMLNUHJ-UHFFFAOYSA-N 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 238000000108 ultra-filtration Methods 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- 239000000811 xylitol Substances 0.000 description 2
- 235000010447 xylitol Nutrition 0.000 description 2
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 2
- 229960002675 xylitol Drugs 0.000 description 2
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- DPVHGFAJLZWDOC-PVXXTIHASA-N (2r,3s,4s,5r,6r)-2-(hydroxymethyl)-6-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxane-3,4,5-triol;dihydrate Chemical compound O.O.O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 DPVHGFAJLZWDOC-PVXXTIHASA-N 0.000 description 1
- KYBXNPIASYUWLN-WUCPZUCCSA-N (2s)-5-hydroxypyrrolidine-2-carboxylic acid Chemical compound OC1CC[C@@H](C(O)=O)N1 KYBXNPIASYUWLN-WUCPZUCCSA-N 0.000 description 1
- WHBMMWSBFZVSSR-GSVOUGTGSA-N (R)-3-hydroxybutyric acid Chemical compound C[C@@H](O)CC(O)=O WHBMMWSBFZVSSR-GSVOUGTGSA-N 0.000 description 1
- AGBQKNBQESQNJD-SSDOTTSWSA-N (R)-lipoic acid Chemical compound OC(=O)CCCC[C@@H]1CCSS1 AGBQKNBQESQNJD-SSDOTTSWSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- 125000003287 1H-imidazol-4-ylmethyl group Chemical group [H]N1C([H])=NC(C([H])([H])[*])=C1[H] 0.000 description 1
- VGIRNWJSIRVFRT-UHFFFAOYSA-N 2',7'-difluorofluorescein Chemical compound OC(=O)C1=CC=CC=C1C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21 VGIRNWJSIRVFRT-UHFFFAOYSA-N 0.000 description 1
- NHJVRSWLHSJWIN-UHFFFAOYSA-N 2,4,6-trinitrobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O NHJVRSWLHSJWIN-UHFFFAOYSA-N 0.000 description 1
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 1
- BHANCCMWYDZQOR-UHFFFAOYSA-N 2-(methyldisulfanyl)pyridine Chemical compound CSSC1=CC=CC=N1 BHANCCMWYDZQOR-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 125000000979 2-amino-2-oxoethyl group Chemical group [H]C([*])([H])C(=O)N([H])[H] 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- KWTQSFXGGICVPE-UHFFFAOYSA-N 2-amino-5-(diaminomethylideneamino)pentanoic acid;hydron;chloride Chemical compound Cl.OC(=O)C(N)CCCN=C(N)N KWTQSFXGGICVPE-UHFFFAOYSA-N 0.000 description 1
- HTCSFFGLRQDZDE-UHFFFAOYSA-N 2-azaniumyl-2-phenylpropanoate Chemical compound OC(=O)C(N)(C)C1=CC=CC=C1 HTCSFFGLRQDZDE-UHFFFAOYSA-N 0.000 description 1
- FKJSFKCZZIXQIP-UHFFFAOYSA-N 2-bromo-1-(4-bromophenyl)ethanone Chemical compound BrCC(=O)C1=CC=C(Br)C=C1 FKJSFKCZZIXQIP-UHFFFAOYSA-N 0.000 description 1
- JQPFYXFVUKHERX-UHFFFAOYSA-N 2-hydroxy-2-cyclohexen-1-one Natural products OC1=CCCCC1=O JQPFYXFVUKHERX-UHFFFAOYSA-N 0.000 description 1
- QTWJRLJHJPIABL-UHFFFAOYSA-N 2-methylphenol;3-methylphenol;4-methylphenol Chemical compound CC1=CC=C(O)C=C1.CC1=CC=CC(O)=C1.CC1=CC=CC=C1O QTWJRLJHJPIABL-UHFFFAOYSA-N 0.000 description 1
- 238000005084 2D-nuclear magnetic resonance Methods 0.000 description 1
- VJINKBZUJYGZGP-UHFFFAOYSA-N 3-(1-aminopropylideneamino)propyl-trimethylazanium Chemical compound CCC(N)=NCCC[N+](C)(C)C VJINKBZUJYGZGP-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- BIGBDMFRWJRLGJ-UHFFFAOYSA-N 3-benzyl-1,5-didiazoniopenta-1,4-diene-2,4-diolate Chemical compound [N-]=[N+]=CC(=O)C(C(=O)C=[N+]=[N-])CC1=CC=CC=C1 BIGBDMFRWJRLGJ-UHFFFAOYSA-N 0.000 description 1
- ONZQYZKCUHFORE-UHFFFAOYSA-N 3-bromo-1,1,1-trifluoropropan-2-one Chemical compound FC(F)(F)C(=O)CBr ONZQYZKCUHFORE-UHFFFAOYSA-N 0.000 description 1
- VIIIJFZJKFXOGG-UHFFFAOYSA-N 3-methylchromen-2-one Chemical compound C1=CC=C2OC(=O)C(C)=CC2=C1 VIIIJFZJKFXOGG-UHFFFAOYSA-N 0.000 description 1
- QHSXWDVVFHXHHB-UHFFFAOYSA-N 3-nitro-2-[(3-nitropyridin-2-yl)disulfanyl]pyridine Chemical compound [O-][N+](=O)C1=CC=CN=C1SSC1=NC=CC=C1[N+]([O-])=O QHSXWDVVFHXHHB-UHFFFAOYSA-N 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- NLPWSMKACWGINL-UHFFFAOYSA-N 4-azido-2-hydroxybenzoic acid Chemical compound OC(=O)C1=CC=C(N=[N+]=[N-])C=C1O NLPWSMKACWGINL-UHFFFAOYSA-N 0.000 description 1
- SJQRQOKXQKVJGJ-UHFFFAOYSA-N 5-(2-aminoethylamino)naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(NCCN)=CC=CC2=C1S(O)(=O)=O SJQRQOKXQKVJGJ-UHFFFAOYSA-N 0.000 description 1
- 229940117976 5-hydroxylysine Drugs 0.000 description 1
- ZMERMCRYYFRELX-UHFFFAOYSA-N 5-{[2-(iodoacetamido)ethyl]amino}naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1NCCNC(=O)CI ZMERMCRYYFRELX-UHFFFAOYSA-N 0.000 description 1
- 101150079978 AGRN gene Proteins 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 241000256118 Aedes aegypti Species 0.000 description 1
- 241000256173 Aedes albopictus Species 0.000 description 1
- 241000243290 Aequorea Species 0.000 description 1
- 102100040026 Agrin Human genes 0.000 description 1
- 108700019743 Agrin Proteins 0.000 description 1
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- 239000012109 Alexa Fluor 568 Substances 0.000 description 1
- 239000012110 Alexa Fluor 594 Substances 0.000 description 1
- 239000012112 Alexa Fluor 633 Substances 0.000 description 1
- 239000012115 Alexa Fluor 660 Substances 0.000 description 1
- 239000012116 Alexa Fluor 680 Substances 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 241000219194 Arabidopsis Species 0.000 description 1
- 208000002109 Argyria Diseases 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000228245 Aspergillus niger Species 0.000 description 1
- 206010063836 Atrioventricular septal defect Diseases 0.000 description 1
- 241001203868 Autographa californica Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical class OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 208000031648 Body Weight Changes Diseases 0.000 description 1
- 241000409811 Bombyx mori nucleopolyhedrovirus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 1
- 108010074051 C-Reactive Protein Proteins 0.000 description 1
- 102100032752 C-reactive protein Human genes 0.000 description 1
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 1
- 101150093947 CD3E gene Proteins 0.000 description 1
- 241000288943 Callitrichinae Species 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 241000282513 Cebidae Species 0.000 description 1
- 231100000023 Cell-mediated cytotoxicity Toxicity 0.000 description 1
- 206010057250 Cell-mediated cytotoxicity Diseases 0.000 description 1
- 241000345152 Cepheus Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical compound C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 1
- 241000867607 Chlorocebus sabaeus Species 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 208000032953 Device battery issue Diseases 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 238000004435 EPR spectroscopy Methods 0.000 description 1
- 241000257465 Echinoidea Species 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102100029727 Enteropeptidase Human genes 0.000 description 1
- 108010013369 Enteropeptidase Proteins 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 239000001116 FEMA 4028 Substances 0.000 description 1
- 102000001690 Factor VIII Human genes 0.000 description 1
- 108010054218 Factor VIII Proteins 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 241000724791 Filamentous phage Species 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- 229940123457 Free radical scavenger Drugs 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 244000299507 Gossypium hirsutum Species 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- HVLSXIKZNLPZJJ-TXZCQADKSA-N HA peptide Chemical compound C([C@@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 HVLSXIKZNLPZJJ-TXZCQADKSA-N 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 238000011993 High Performance Size Exclusion Chromatography Methods 0.000 description 1
- 229910052689 Holmium Inorganic materials 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000797762 Homo sapiens C-C motif chemokine 5 Proteins 0.000 description 1
- 101000840258 Homo sapiens Immunoglobulin J chain Proteins 0.000 description 1
- 101000623897 Homo sapiens Mucin-12 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 241000282596 Hylobatidae Species 0.000 description 1
- 201000001431 Hyperuricemia Diseases 0.000 description 1
- 102000009490 IgG Receptors Human genes 0.000 description 1
- 108010073807 IgG Receptors Proteins 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 102100029571 Immunoglobulin J chain Human genes 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 238000012695 Interfacial polymerization Methods 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 241000235649 Kluyveromyces Species 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- LKDRXBCSQODPBY-AMVSKUEXSA-N L-(-)-Sorbose Chemical compound OCC1(O)OC[C@H](O)[C@@H](O)[C@@H]1O LKDRXBCSQODPBY-AMVSKUEXSA-N 0.000 description 1
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 1
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 1
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 1
- BVHLGVCQOALMSV-JEDNCBNOSA-N L-lysine hydrochloride Chemical compound Cl.NCCCC[C@H](N)C(O)=O BVHLGVCQOALMSV-JEDNCBNOSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 1
- 231100000070 MTS assay Toxicity 0.000 description 1
- 238000000719 MTS assay Methods 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 239000004907 Macro-emulsion Substances 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 1
- 102100023143 Mucin-12 Human genes 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical class ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- 241000221960 Neurospora Species 0.000 description 1
- 241000221961 Neurospora crassa Species 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 229940123973 Oxygen scavenger Drugs 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 241000282520 Papio Species 0.000 description 1
- 206010034016 Paronychia Diseases 0.000 description 1
- 241000228143 Penicillium Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 1
- 241000577979 Peromyscus spicilegus Species 0.000 description 1
- 240000007377 Petunia x hybrida Species 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920000436 Poly(lactide-co-glycolide)-block-poly(ethylene glycol)-block-poly(lactide-co-glycolide) Polymers 0.000 description 1
- 229920000805 Polyaspartic acid Polymers 0.000 description 1
- 229920002560 Polyethylene Glycol 3000 Polymers 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001219 Polysorbate 40 Polymers 0.000 description 1
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 241001343656 Ptilosarcus Species 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- JVWLUVNSQYXYBE-UHFFFAOYSA-N Ribitol Natural products OCC(C)C(O)C(O)CO JVWLUVNSQYXYBE-UHFFFAOYSA-N 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- 241000311088 Schwanniomyces Species 0.000 description 1
- 241001123650 Schwanniomyces occidentalis Species 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 240000003768 Solanum lycopersicum Species 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 101800001707 Spacer peptide Proteins 0.000 description 1
- UQZIYBXSHAGNOE-USOSMYMVSA-N Stachyose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](CO[C@@H]2[C@@H](O)[C@@H](O)[C@@H](O)[C@H](CO)O2)O1 UQZIYBXSHAGNOE-USOSMYMVSA-N 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Natural products C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 241001149964 Tolypocladium Species 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 244000000188 Vaccinium ovalifolium Species 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 231100000480 WST assay Toxicity 0.000 description 1
- 241000235013 Yarrowia Species 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 239000003070 absorption delaying agent Substances 0.000 description 1
- RRNJROHIFSLGRA-JEDNCBNOSA-N acetic acid;(2s)-2,6-diaminohexanoic acid Chemical compound CC(O)=O.NCCCC[C@H](N)C(O)=O RRNJROHIFSLGRA-JEDNCBNOSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000005054 agglomeration Methods 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229910001508 alkali metal halide Inorganic materials 0.000 description 1
- 150000008045 alkali metal halides Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- AGBQKNBQESQNJD-UHFFFAOYSA-N alpha-Lipoic acid Natural products OC(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 238000003453 ammonium sulfate precipitation method Methods 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 230000024306 antigen processing and presentation of peptide antigen Effects 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000013011 aqueous formulation Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 210000001106 artificial yeast chromosome Anatomy 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 230000005784 autoimmunity Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WHGYBXFWUBPSRW-FOUAGVGXSA-N beta-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO WHGYBXFWUBPSRW-FOUAGVGXSA-N 0.000 description 1
- 235000011175 beta-cyclodextrine Nutrition 0.000 description 1
- 229960004853 betadex Drugs 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000029918 bioluminescence Effects 0.000 description 1
- 238000005415 bioluminescence Methods 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 108091006004 biotinylated proteins Proteins 0.000 description 1
- 229960003008 blinatumomab Drugs 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 108091005948 blue fluorescent proteins Proteins 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000004579 body weight change Effects 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 230000000711 cancerogenic effect Effects 0.000 description 1
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 239000003729 cation exchange resin Substances 0.000 description 1
- 229940023913 cation exchange resins Drugs 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical group 0.000 description 1
- 230000011712 cell development Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000005890 cell-mediated cytotoxicity Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000003196 chaotropic effect Effects 0.000 description 1
- 238000010382 chemical cross-linking Methods 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 239000002962 chemical mutagen Substances 0.000 description 1
- VDQQXEISLMTGAB-UHFFFAOYSA-N chloramine T Chemical compound [Na+].CC1=CC=C(S(=O)(=O)[N-]Cl)C=C1 VDQQXEISLMTGAB-UHFFFAOYSA-N 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- VXIVSQZSERGHQP-UHFFFAOYSA-N chloroacetamide Chemical compound NC(=O)CCl VXIVSQZSERGHQP-UHFFFAOYSA-N 0.000 description 1
- FOCAUTSVDIKZOP-UHFFFAOYSA-N chloroacetic acid Chemical compound OC(=O)CCl FOCAUTSVDIKZOP-UHFFFAOYSA-N 0.000 description 1
- 229940106681 chloroacetic acid Drugs 0.000 description 1
- 238000011098 chromatofocusing Methods 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 231100000313 clinical toxicology Toxicity 0.000 description 1
- 238000009643 clonogenic assay Methods 0.000 description 1
- 231100000096 clonogenic assay Toxicity 0.000 description 1
- 238000005354 coacervation Methods 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000006854 communication Effects 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 239000008139 complexing agent Substances 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000005289 controlled pore glass Substances 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229930003836 cresol Natural products 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- 238000012866 crystallographic experiment Methods 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 1
- 150000003999 cyclitols Chemical class 0.000 description 1
- OILAIQUEIWYQPH-UHFFFAOYSA-N cyclohexane-1,2-dione Chemical compound O=C1CCCCC1=O OILAIQUEIWYQPH-UHFFFAOYSA-N 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 230000001085 cytostatic effect Effects 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000007402 cytotoxic response Effects 0.000 description 1
- 238000013523 data management Methods 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- FFYPMLJYZAEMQB-UHFFFAOYSA-N diethyl pyrocarbonate Chemical compound CCOC(=O)OC(=O)OCC FFYPMLJYZAEMQB-UHFFFAOYSA-N 0.000 description 1
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 108010067396 dornase alfa Proteins 0.000 description 1
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000001211 electron capture detection Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 210000001842 enterocyte Anatomy 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- IINNWAYUJNWZRM-UHFFFAOYSA-L erythrosin B Chemical compound [Na+].[Na+].[O-]C(=O)C1=CC=CC=C1C1=C2C=C(I)C(=O)C(I)=C2OC2=C(I)C([O-])=C(I)C=C21 IINNWAYUJNWZRM-UHFFFAOYSA-L 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000017188 evasion or tolerance of host immune response Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 229960000301 factor viii Drugs 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000013020 final formulation Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 208000010749 gastric carcinoma Diseases 0.000 description 1
- 210000005095 gastrointestinal system Anatomy 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 229940063135 genotropin Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 229940047135 glycate Drugs 0.000 description 1
- 229930182470 glycoside Natural products 0.000 description 1
- 150000002338 glycosides Chemical class 0.000 description 1
- 125000001487 glyoxylate group Chemical class O=C([O-])C(=O)[*] 0.000 description 1
- ZRALSGWEFCBTJO-UHFFFAOYSA-N guanidine group Chemical group NC(=N)N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 102000056549 human Fv Human genes 0.000 description 1
- 108700005872 human Fv Proteins 0.000 description 1
- 210000003917 human chromosome Anatomy 0.000 description 1
- 238000013415 human tumor xenograft model Methods 0.000 description 1
- 230000008348 humoral response Effects 0.000 description 1
- 235000003642 hunger Nutrition 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 229960002163 hydrogen peroxide Drugs 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 125000002349 hydroxyamino group Chemical group [H]ON([H])[*] 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 150000002463 imidates Chemical class 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Substances C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 108010023260 immunoglobulin Fv Proteins 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000012308 immunohistochemistry method Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 210000005027 intestinal barrier Anatomy 0.000 description 1
- 210000002490 intestinal epithelial cell Anatomy 0.000 description 1
- 230000004673 intestinal mucosal barrier function Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 210000003093 intracellular space Anatomy 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007919 intrasynovial administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- DLBFLQKQABVKGT-UHFFFAOYSA-L lucifer yellow dye Chemical compound [Li+].[Li+].[O-]S(=O)(=O)C1=CC(C(N(C(=O)NN)C2=O)=O)=C3C2=CC(S([O-])(=O)=O)=CC3=C1N DLBFLQKQABVKGT-UHFFFAOYSA-L 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 208000019420 lymphoid neoplasm Diseases 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 229960005357 lysine acetate Drugs 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- 230000005291 magnetic effect Effects 0.000 description 1
- 239000006249 magnetic particle Substances 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- FDZZZRQASAIRJF-UHFFFAOYSA-M malachite green Chemical compound [Cl-].C1=CC(N(C)C)=CC=C1C(C=1C=CC=CC=1)=C1C=CC(=[N+](C)C)C=C1 FDZZZRQASAIRJF-UHFFFAOYSA-M 0.000 description 1
- 229940107698 malachite green Drugs 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- YCXSYMVGMXQYNT-UHFFFAOYSA-N methyl 3-[(4-azidophenyl)disulfanyl]propanimidate Chemical compound COC(=N)CCSSC1=CC=C(N=[N+]=[N-])C=C1 YCXSYMVGMXQYNT-UHFFFAOYSA-N 0.000 description 1
- RMAHPRNLQIRHIJ-UHFFFAOYSA-N methyl carbamimidate Chemical compound COC(N)=N RMAHPRNLQIRHIJ-UHFFFAOYSA-N 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- NEGQCMNHXHSFGU-UHFFFAOYSA-N methyl pyridine-2-carboximidate Chemical compound COC(=N)C1=CC=CC=N1 NEGQCMNHXHSFGU-UHFFFAOYSA-N 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- PJUIMOJAAPLTRJ-UHFFFAOYSA-N monothioglycerol Chemical compound OCC(O)CS PJUIMOJAAPLTRJ-UHFFFAOYSA-N 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 238000002887 multiple sequence alignment Methods 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- FEMOMIGRRWSMCU-UHFFFAOYSA-N ninhydrin Chemical compound C1=CC=C2C(=O)C(O)(O)C(=O)C2=C1 FEMOMIGRRWSMCU-UHFFFAOYSA-N 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 229940063137 norditropin Drugs 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 229940063149 nutropin Drugs 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 210000002220 organoid Anatomy 0.000 description 1
- 229940043515 other immunoglobulins in atc Drugs 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 229930192851 perforin Natural products 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 1
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- HMFAQQIORZDPJG-UHFFFAOYSA-N phosphono 2-chloroacetate Chemical compound OP(O)(=O)OC(=O)CCl HMFAQQIORZDPJG-UHFFFAOYSA-N 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 108010054442 polyalanine Proteins 0.000 description 1
- 108010064470 polyaspartate Proteins 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 229920002338 polyhydroxyethylmethacrylate Polymers 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 230000037048 polymerization activity Effects 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 239000000249 polyoxyethylene sorbitan monopalmitate Substances 0.000 description 1
- 235000010483 polyoxyethylene sorbitan monopalmitate Nutrition 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229940101027 polysorbate 40 Drugs 0.000 description 1
- 229940113124 polysorbate 60 Drugs 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 238000010149 post-hoc-test Methods 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 230000029983 protein stabilization Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 238000005086 pumping Methods 0.000 description 1
- 238000013094 purity test Methods 0.000 description 1
- 229960003581 pyridoxal Drugs 0.000 description 1
- 235000008164 pyridoxal Nutrition 0.000 description 1
- 239000011674 pyridoxal Substances 0.000 description 1
- 235000007682 pyridoxal 5'-phosphate Nutrition 0.000 description 1
- 239000011589 pyridoxal 5'-phosphate Substances 0.000 description 1
- 229960001327 pyridoxal phosphate Drugs 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- HEBKCHPVOIAQTA-ZXFHETKHSA-N ribitol Chemical compound OC[C@H](O)[C@H](O)[C@H](O)CO HEBKCHPVOIAQTA-ZXFHETKHSA-N 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- XMVJITFPVVRMHC-UHFFFAOYSA-N roxarsone Chemical group OC1=CC=C([As](O)(O)=O)C=C1[N+]([O-])=O XMVJITFPVVRMHC-UHFFFAOYSA-N 0.000 description 1
- 239000012146 running buffer Substances 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 238000013391 scatchard analysis Methods 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- IHQKEDIOMGYHEB-UHFFFAOYSA-M sodium dimethylarsinate Chemical compound [Na+].C[As](C)([O-])=O IHQKEDIOMGYHEB-UHFFFAOYSA-M 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- GNBVPFITFYNRCN-UHFFFAOYSA-M sodium thioglycolate Chemical compound [Na+].[O-]C(=O)CS GNBVPFITFYNRCN-UHFFFAOYSA-M 0.000 description 1
- 229940046307 sodium thioglycolate Drugs 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- UQZIYBXSHAGNOE-XNSRJBNMSA-N stachyose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO[C@@H]3[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O3)O)O2)O)O1 UQZIYBXSHAGNOE-XNSRJBNMSA-N 0.000 description 1
- 230000037351 starvation Effects 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000011146 sterile filtration Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003890 succinate salts Chemical class 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000004114 suspension culture Methods 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 231100000378 teratogenic Toxicity 0.000 description 1
- 230000003390 teratogenic effect Effects 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- ABZLKHKQJHEPAX-UHFFFAOYSA-N tetramethylrhodamine Chemical compound C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C([O-])=O ABZLKHKQJHEPAX-UHFFFAOYSA-N 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- 229940035024 thioglycerol Drugs 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229940074409 trehalose dihydrate Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000002562 urinalysis Methods 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- KAKZBPTYRLMSJV-UHFFFAOYSA-N vinyl-ethylene Natural products C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3076—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells against structure-related tumour-associated moieties
- C07K16/3092—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells against structure-related tumour-associated moieties against tumour-associated mucins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Cell Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
Description
されたい)は、CD3ε鎖のN末端のコンテクスト非依存的なエピトープに結合する二重特異性抗体コンストラクトを提供した(国際公開第2008/119567号パンフレット)。この選出されたエピトープに結合するBiTE(登録商標)抗体コンストラクトは、ヒト及びマカク(Macaca)又はマーモセット(Callithrix jacchus)、ワタボウシタマリン(Saguinus oedipus)若しくはリスザル(Saimiri sciureus)CD3ε鎖に対する種間特異性を示さないだけでなく、(二重特異性T細胞エンゲージ分子において以前に記載されたCD3結合体のエピトープの代わりに)この特異的エピトープを認識するため、前世代のT細胞エンゲージ抗体で観察されたのと同程度にT細胞の非特異的な活性化を示さない。このT細胞活性化の低下は、患者におけるより少ない又は減少したT細胞再分布と関係し、後者は、例えば、パソツキシマブ(pasotuximab)において副作用のリスクがあると判断された。
Hansson,Nat.Rev.Immunology 2016)。様々な組織において上皮細胞によって発現される分泌タンパク質及び膜貫通タンパク質を含む、少なくとも20種類のムチンファミリーメンバーが存在する(Corfield,Biochim.Biophys.Acta 2013)。ムチンの主要な機能は、上皮細胞と環境との間に防護壁を形成する粘膜層の構造及び制御にある(Hollingsworth and Swanson,Nat.Rev.Cancer 2004;Hattrup and Gendler,Annu.Rev.Physiol.2008)。膜貫通ムチンは、増殖及びアポトーシスの制御を含む細胞性シグナル伝達及び腫瘍形成にも役割を果たす(Hollingsworth and Swanson,Nat.Rev.Cancer 2004)。ムチンの中で、ムチン17(MUC17)は、MUC3に対するその相同性によって最初に同定された膜貫通ムチンである(Gum et al.,Biochem.Biophys.Res.Comm.2002)。
unology 2016)。MUC17は、胃及び膵臓によっても発現される(Moniaux et al.,J.Biol.Chem.2006;Moehle et al.,J.Mol.Med.2006)。MUC17の生物学的機能は、粘膜修復などによる腸管の粘膜障壁の完全性の維持であると考えられる(Luu et al.,Int.J.Biochem.Cell Biol.2010;Resta-Lenert et al.,Am.J.Physiology 2011;Johanasson and Hansson,Nat.Rev.Immunology 2016)。
al.,J.Clin.Pathol.2010)。それにもかかわらず、MUC17の発現パターンは、様々な形態の悪性腫瘍の治療のための潜在的な標的となる。
・MUC17に結合する第1のドメイン、及び
・ヒト及びマカクCD3ε鎖の細胞外エピトープに結合する第2のドメイン
を含む抗体コンストラクトを提供することが想定される。
前記態様では、本発明に関連して、前記第3のドメインが、アミノからカルボキシの順に、ヒンジ-CH2-CH3-リンカー-ヒンジ-CH2-CH3を含む、抗体コンストラクトを提供することも想定される。
前記態様では、本発明に関連して、
(i)第1のドメインが、2つの抗体可変ドメインを含み、且つ第2のドメインが、2つの抗体可変ドメインを含むか;
(ii)第1のドメインが、1つの抗体可変ドメインを含み、且つ第2のドメインが、2つの抗体可変ドメインを含むか;
(iii)第1のドメインが、2つの抗体可変ドメインを含み、且つ第2のドメインが、1つの抗体可変ドメインを含むか;又は
(iv)第1のドメインが、1つの抗体可変ドメインを含み、且つ第2のドメインが、1つの抗体可変ドメインを含む、抗体コンストラクトを提供することも想定される。
(a)第1のドメイン;
(b)配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)第2のドメイン
を含む、抗体コンストラクトを提供することも想定される。
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)第3のドメインの第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)第3のドメインの第2のポリペプチド単量体
を含む、抗体コンストラクトを提供することも想定される。
530(uniprot Q685J3付番に従うaa 4131~4243)に対応するMUC17内のエピトープに結合する、抗体コンストラクトを提供することがさらに想定される。
(a)配列番号33に示されるとおりのCDR-H1、配列番号34に示されるとおりのCDR-H2及び配列番号35に示されるとおりのCDR-H3;
(b)配列番号44に示されるとおりのCDR-H1、配列番号45に示されるとおりのCDR-H2及び配列番号46に示されるとおりのCDR-H3;
(c)配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(d)配列番号66に示されるとおりのCDR-H1、配列番号67に示されるとおりのCDR-H2及び配列番号68に示されるとおりのCDR-H3;
(e)配列番号77に示されるとおりのCDR-H1、配列番号78に示されるとおりのCDR-H2及び配列番号79に示されるとおりのCDR-H3;
(f)配列番号88に示されるとおりのCDR-H1、配列番号89に示されるとおりのCDR-H2及び配列番号90に示されるとおりのCDR-H3;
(g)配列番号99に示されるとおりのCDR-H1、配列番号100に示されるとおりのCDR-H2及び配列番号101に示されるとおりのCDR-H3;
(h)配列番号110に示されるとおりのCDR-H1、配列番号111に示されるとおりのCDR-H2及び配列番号112に示されるとおりのCDR-H3;
(i)配列番号121に示されるとおりのCDR-H1、配列番号122に示されるとおりのCDR-H2及び配列番号123に示されるとおりのCDR-H3;
(j)配列番号132に示されるとおりのCDR-H1、配列番号133に示されるとおりのCDR-H2及び配列番号134に示されるとおりのCDR-H3;
(k)配列番号143に示されるとおりのCDR-H1、配列番号144に示されるとおりのCDR-H2及び配列番号145に示されるとおりのCDR-H3;
(l)配列番号154に示されるとおりのCDR-H1、配列番号155に示されるとおりのCDR-H2及び配列番号156に示されるとおりのCDR-H3;
(m)配列番号165に示されるとおりのCDR-H1、配列番号166に示されるとおりのCDR-H2及び配列番号167に示されるとおりのCDR-H3;
(n)配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(o)配列番号187に示されるとおりのCDR-H1、配列番号188に示されるとおりのCDR-H2及び配列番号189に示されるとおりのCDR-H3;
(p)配列番号198に示されるとおりのCDR-H1、配列番号199に示されるとおりのCDR-H2及び配列番号200に示されるとおりのCDR-H3;
(q)配列番号209に示されるとおりのCDR-H1、配列番号210に示されるとおりのCDR-H2及び配列番号211に示されるとおりのCDR-H3;
(r)配列番号220に示されるとおりのCDR-H1、配列番号221に示されるとおりのCDR-H2及び配列番号222に示されるとおりのCDR-H3;
(s)配列番号231に示されるとおりのCDR-H1、配列番号232に示されるとおりのCDR-H2及び配列番号233に示されるとおりのCDR-H3;
(t)配列番号242に示されるとおりのCDR-H1、配列番号243に示されるとおりのCDR-H2及び配列番号244に示されるとおりのCDR-H3;
(u)配列番号253に示されるとおりのCDR-H1、配列番号254に示されるとおりのCDR-H2及び配列番号255に示されるとおりのCDR-H3;
(v)配列番号264に示されるとおりのCDR-H1、配列番号265に示されるとおりのCDR-H2及び配列番号266に示されるとおりのCDR-H3;
(w)配列番号275に示されるとおりのCDR-H1、配列番号276に示されるとおりのCDR-H2及び配列番号276に示されるとおりのCDR-H3;
(x)配列番号286に示されるとおりのCDR-H1、配列番号287に示されるとおりのCDR-H2及び配列番号288に示されるとおりのCDR-H3;
(y)配列番号297に示されるとおりのCDR-H1、配列番号298に示されるとお
りのCDR-H2及び配列番号299に示されるとおりのCDR-H3;
(z)配列番号308に示されるとおりのCDR-H1、配列番号309に示されるとおりのCDR-H2及び配列番号310に示されるとおりのCDR-H3;
(aa)配列番号319に示されるとおりのCDR-H1、配列番号320に示されるとおりのCDR-H2及び配列番号321に示されるとおりのCDR-H3;
(ab)配列番号330に示されるとおりのCDR-H1、配列番号331に示されるとおりのCDR-H2及び配列番号332に示されるとおりのCDR-H3;
(ac)配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;
(ad)配列番号352に示されるとおりのCDR-H1、配列番号353に示されるとおりのCDR-H2及び配列番号354に示されるとおりのCDR-H3;
(ae)配列番号363に示されるとおりのCDR-H1、配列番号364に示されるとおりのCDR-H2及び配列番号365に示されるとおりのCDR-H3;
(af)配列番号374に示されるとおりのCDR-H1、配列番号375に示されるとおりのCDR-H2及び配列番号376に示されるとおりのCDR-H3;
(ag)配列番号385に示されるとおりのCDR-H1、配列番号386に示されるとおりのCDR-H2及び配列番号386に示されるとおりのCDR-H3;
(ah)配列番号396に示されるとおりのCDR-H1、配列番号397に示されるとおりのCDR-H2及び配列番号398に示されるとおりのCDR-H3;
(ai)配列番号407に示されるとおりのCDR-H1、配列番号408に示されるとおりのCDR-H2及び配列番号409に示されるとおりのCDR-H3;
(aj)配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3;
(ak)配列番号429に示されるとおりのCDR-H1、配列番号430に示されるとおりのCDR-H2及び配列番号431に示されるとおりのCDR-H3;
(al)配列番号440に示されるとおりのCDR-H1、配列番号441に示されるとおりのCDR-H2及び配列番号442に示されるとおりのCDR-H3;
(am)配列番号451に示されるとおりのCDR-H1、配列番号452に示されるとおりのCDR-H2及び配列番号453に示されるとおりのCDR-H3;
(an)配列番号462に示されるとおりのCDR-H1、配列番号463に示されるとおりのCDR-H2及び配列番号464に示されるとおりのCDR-H3;
(ao)配列番号473に示されるとおりのCDR-H1、配列番号474に示されるとおりのCDR-H2及び配列番号475に示されるとおりのCDR-H3;
(ap)配列番号484に示されるとおりのCDR-H1、配列番号485に示されるとおりのCDR-H2及び配列番号486に示されるとおりのCDR-H3;
(aq)配列番号495に示されるとおりのCDR-H1、配列番号496に示されるとおりのCDR-H2及び配列番号497に示されるとおりのCDR-H3;
(ar)配列番号506に示されるとおりのCDR-H1、配列番号507に示されるとおりのCDR-H2及び配列番号508に示されるとおりのCDR-H3;及び
(as)配列番号517に示されるとおりのCDR-H1、配列番号518に示されるとおりのCDR-H2及び配列番号519に示されるとおりのCDR-H3
から選択されるCDR-H1、CDR-H2及びCDR-H3を含むVH領域を含み;
(c)配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(n)配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(ac)配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;及び
(aj)配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3
が好ましい、抗体コンストラクトを提供することも想定される。
(a)配列番号36に示されるとおりのCDR-L1、配列番号37に示されるとおりのCDR-L2及び配列番号38に示されるとおりのCDR-L3;
(b)配列番号47に示されるとおりのCDR-L1、配列番号48に示されるとおりのCDR-L2及び配列番号49に示されるとおりのCDR-L3;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3;
(d)配列番号69に示されるとおりのCDR-L1、配列番号70に示されるとおりのCDR-L2及び配列番号71に示されるとおりのCDR-L3;
(e)配列番号80に示されるとおりのCDR-L1、配列番号81に示されるとおりのCDR-L2及び配列番号82に示されるとおりのCDR-L3;
(f)配列番号91に示されるとおりのCDR-L1、配列番号92に示されるとおりのCDR-L2及び配列番号93に示されるとおりのCDR-L3;
(g)配列番号102に示されるとおりのCDR-L1、配列番号103に示されるとおりのCDR-L2及び配列番号104に示されるとおりのCDR-L3;
(h)配列番号113に示されるとおりのCDR-L1、配列番号114に示されるとおりのCDR-L2及び配列番号115に示されるとおりのCDR-L3;
(i)配列番号124に示されるとおりのCDR-L1、配列番号125に示されるとおりのCDR-L2及び配列番号126に示されるとおりのCDR-L3;
(j)配列番号135に示されるとおりのCDR-L1、配列番号136に示されるとおりのCDR-L2及び配列番号137に示されるとおりのCDR-L3;
(k)配列番号146に示されるとおりのCDR-L1、配列番号147に示されるとおりのCDR-L2及び配列番号148に示されるとおりのCDR-L3;
(l)配列番号157に示されるとおりのCDR-L1、配列番号158に示されるとおりのCDR-L2及び配列番号159に示されるとおりのCDR-L3;
(m)配列番号168に示されるとおりのCDR-L1、配列番号169に示されるとおりのCDR-L2及び配列番号170に示されるとおりのCDR-L3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3;
(o)配列番号190に示されるとおりのCDR-L1、配列番号191に示されるとおりのCDR-L2及び配列番号192に示されるとおりのCDR-L3;
(p)配列番号201に示されるとおりのCDR-L1、配列番号202に示されるとおりのCDR-L2及び配列番号203に示されるとおりのCDR-L3;
(q)配列番号212に示されるとおりのCDR-L1、配列番号213に示されるとおりのCDR-L2及び配列番号214に示されるとおりのCDR-L3;
(r)配列番号223に示されるとおりのCDR-L1、配列番号224に示されるとおりのCDR-L2及び配列番号225に示されるとおりのCDR-L3;
(s)配列番号234に示されるとおりのCDR-L1、配列番号235に示されるとおりのCDR-L2及び配列番号236に示されるとおりのCDR-L3;
(t)配列番号245に示されるとおりのCDR-L1、配列番号246に示されるとおりのCDR-L2及び配列番号247に示されるとおりのCDR-L3;
(u)配列番号256に示されるとおりのCDR-L1、配列番号257に示されるとおりのCDR-L2及び配列番号258に示されるとおりのCDR-L3;
(v)配列番号267に示されるとおりのCDR-L1、配列番号268に示されるとおりのCDR-L2及び配列番号269に示されるとおりのCDR-L3;
(w)配列番号278に示されるとおりのCDR-L1、配列番号279に示されるとおりのCDR-L2及び配列番号280に示されるとおりのCDR-L3;
(x)配列番号289に示されるとおりのCDR-L1、配列番号290に示されるとお
りのCDR-L2及び配列番号291に示されるとおりのCDR-L3;
(y)配列番号300に示されるとおりのCDR-L1、配列番号301に示されるとおりのCDR-L2及び配列番号302に示されるとおりのCDR-L3;
(z)配列番号311に示されるとおりのCDR-L1、配列番号312に示されるとおりのCDR-L2及び配列番号313に示されるとおりのCDR-L3;
(aa)配列番号322に示されるとおりのCDR-L1、配列番号323に示されるとおりのCDR-L2及び配列番号324に示されるとおりのCDR-L3;
(ab)配列番号333に示されるとおりのCDR-L1、配列番号334に示されるとおりのCDR-L2及び配列番号335に示されるとおりのCDR-L3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3;
(ad)配列番号355に示されるとおりのCDR-L1、配列番号356に示されるとおりのCDR-L2及び配列番号357に示されるとおりのCDR-L3;
(ae)配列番号366に示されるとおりのCDR-L1、配列番号367に示されるとおりのCDR-L2及び配列番号368に示されるとおりのCDR-L3;
(af)配列番号377に示されるとおりのCDR-L1、配列番号378に示されるとおりのCDR-L2及び配列番号379に示されるとおりのCDR-L3;
(ag)配列番号388に示されるとおりのCDR-L1、配列番号389に示されるとおりのCDR-L2及び配列番号390に示されるとおりのCDR-L3;
(ah)配列番号399に示されるとおりのCDR-L1、配列番号400に示されるとおりのCDR-L2及び配列番号401に示されるとおりのCDR-L3;
(ai)配列番号410に示されるとおりのCDR-L1、配列番号411に示されるとおりのCDR-L2及び配列番号412に示されるとおりのCDR-L3;
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3;
(ak)配列番号432に示されるとおりのCDR-L1、配列番号433に示されるとおりのCDR-L2及び配列番号434に示されるとおりのCDR-L3;
(al)配列番号443に示されるとおりのCDR-L1、配列番号444に示されるとおりのCDR-L2及び配列番号445に示されるとおりのCDR-L3;
(am)配列番号454に示されるとおりのCDR-L1、配列番号455に示されるとおりのCDR-L2及び配列番号456に示されるとおりのCDR-L3;
(an)配列番号465に示されるとおりのCDR-L1、配列番号466に示されるとおりのCDR-L2及び配列番号467に示されるとおりのCDR-L3;
(ao)配列番号476に示されるとおりのCDR-L1、配列番号477に示されるとおりのCDR-L2及び配列番号478に示されるとおりのCDR-L3;
(ap)配列番号487に示されるとおりのCDR-L1、配列番号488に示されるとおりのCDR-L2及び配列番号489に示されるとおりのCDR-L3;
(aq)配列番号498に示されるとおりのCDR-L1、配列番号499に示されるとおりのCDR-L2及び配列番号500に示されるとおりのCDR-L3;
(ar)配列番号509に示されるとおりのCDR-L1、配列番号510に示されるとおりのCDR-L2及び配列番号511に示されるとおりのCDR-L3;及び
(as)配列番号520に示されるとおりのCDR-L1、配列番号521に示されるとおりのCDR-L2及び配列番号522に示されるとおりのCDR-L3
から選択されるCDR-H1、CDR-L2及びCDR-L3を含むVL領域を含み;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3;及び
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3
が好ましい、抗体コンストラクトを提供することも想定される。
(a)配列番号40に示されるとおりのVL領域及び配列番号39に示されるとおりのVH領域;
(b)配列番号51に示されるとおりのVL領域及び配列番号50に示されるとおりのVH領域;
(c)配列番号62に示されるとおりのVL領域及び配列番号61に示されるとおりのVH領域;
(d)配列番号73に示されるとおりのVL領域及び配列番号72に示されるとおりのVH領域;
(e)配列番号84に示されるとおりのVL領域及び配列番号83に示されるとおりのVH領域;
(f)配列番号95に示されるとおりのVL領域及び配列番号94に示されるとおりのVH領域;
(g)配列番号106に示されるとおりのVL領域及び配列番号105に示されるとおりのVH領域;
(h)配列番号117に示されるとおりのVL領域及び配列番号116に示されるとおりのVH領域;
(i)配列番号128に示されるとおりのVL領域及び配列番号127に示されるとおりのVH領域;
(j)配列番号139に示されるとおりのVL領域及び配列番号138に示されるとおりのVH領域;
(k)配列番号150に示されるとおりのVL領域及び配列番号149に示されるとおりのVH領域;
(l)配列番号161に示されるとおりのVL領域及び配列番号160に示されるとおりのVH領域;
(m)配列番号172に示されるとおりのVL領域及び配列番号171に示されるとおりのVH領域;
(n)配列番号183に示されるとおりのVL領域及び配列番号182に示されるとおりのVH領域;
(o)配列番号194に示されるとおりのVL領域及び配列番号193に示されるとおりのVH領域;
(p)配列番号205に示されるとおりのVL領域及び配列番号204に示されるとおりのVH領域;
(q)配列番号216に示されるとおりのVL領域及び配列番号215に示されるとおりのVH領域;
(r)配列番号227に示されるとおりのVL領域及び配列番号226に示されるとおりのVH領域;
(s)配列番号238に示されるとおりのVL領域及び配列番号237に示されるとおりのVH領域;
(t)配列番号249に示されるとおりのVL領域及び配列番号248に示されるとおりのVH領域;
(u)配列番号260に示されるとおりのVL領域及び配列番号259に示されるとおりのVH領域;
(v)配列番号271に示されるとおりのVL領域及び配列番号270に示されるとおりのVH領域;
(w)配列番号282に示されるとおりのVL領域及び配列番号281に示されるとおり
のVH領域;
(x)配列番号293に示されるとおりのVL領域及び配列番号292に示されるとおりのVH領域;
(y)配列番号304に示されるとおりのVL領域及び配列番号303に示されるとおりのVH領域;
(z)配列番号315に示されるとおりのVL領域及び配列番号314に示されるとおりのVH領域;
(aa)配列番号326に示されるとおりのVL領域及び配列番号325に示されるとおりのVH領域;
(ab)配列番号337に示されるとおりのVL領域及び配列番号336に示されるとおりのVH領域;
(ac)配列番号348に示されるとおりのVL領域及び配列番号347に示されるとおりのVH領域;
(ad)配列番号359に示されるとおりのVL領域及び配列番号358に示されるとおりのVH領域;
(ae)配列番号370に示されるとおりのVL領域及び配列番号369に示されるとおりのVH領域;
(af)配列番号381に示されるとおりのVL領域及び配列番号380に示されるとおりのVH領域;
(ag)配列番号392に示されるとおりのVL領域及び配列番号391に示されるとおりのVH領域;
(ah)配列番号403に示されるとおりのVL領域及び配列番号402に示されるとおりのVH領域;
(ai)配列番号414に示されるとおりのVL領域及び配列番号413に示されるとおりのVH領域;
(aj)配列番号425に示されるとおりのVL領域及び配列番号424に示されるとおりのVH領域;
(ak)配列番号436に示されるとおりのVL領域及び配列番号435に示されるとおりのVH領域;
(al)配列番号447に示されるとおりのVL領域及び配列番号446に示されるとおりのVH領域;
(am)配列番号458に示されるとおりのVL領域及び配列番号457に示されるとおりのVH領域;
(an)配列番号469に示されるとおりのVL領域及び配列番号468に示されるとおりのVH領域;
(ao)配列番号480に示されるとおりのVL領域及び配列番号479に示されるとおりのVH領域;
(ap)配列番号491に示されるとおりのVL領域及び配列番号490に示されるとおりのVH領域;
(aq)配列番号502に示されるとおりのVL領域及び配列番号501に示されるとおりのVH領域;
(ar)配列番号513に示されるとおりのVL領域及び配列番号512に示されるとおりのVH領域;及び
(as)配列番号524に示されるとおりのVL領域及び配列番号523に示されるとおりのVH領域
からなる群から選択されるVL領域及びVH領域を含む、抗体コンストラクトを提供することも想定される。
4、195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525のいずれかに示されるとおりのアミノ酸配列から選択される配列を含む、抗体コンストラクトを提供することがさらに想定される。
(a)配列番号41、52、63、74、85、96、107、118、129、140、151、162、173、184、195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525からなる群から選択されるアミノ酸配列を有する第1のドメイン;
(b)配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)国際公開第2008/119567号パンフレットの配列番号23、25、41、43、59、61、77、79、95、97、113、115、131、133、149、151、167、169、185若しくは187からなる群から選択されるか又は配列番号15に示されるとおりのアミノ酸配列を有する第2のドメイン;及び
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー
を含む、抗体コンストラクトを提供することも想定される。
(e)配列番号17~24からなる群から選択されるポリペプチド配列を有する第3のドメインの第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)配列番号17~24からなる群から選択されるポリペプチド配列を有する第3のドメインの第2のポリペプチド単量体
をさらに含む、抗体コンストラクトを提供することも想定される。
第3の態様では、本発明に関連して、本発明のポリヌクレオチドを含むベクターを提供することも想定される。
第5の態様では、本発明に関連して、本発明の抗体コンストラクトの作製のための方法であって、抗体コンストラクトの発現を可能にする条件下で本発明の宿主細胞を培養することと、産生された抗体コンストラクトを培養物から回収することとを含む方法を提供することも想定される。
本発明に関連して、増殖性疾患、腫瘍性疾患、癌又は免疫障害から選択される疾患の予防、治療又は改善における使用のための、本発明の抗体コンストラクト又は本発明の方法に従って作製される抗体コンストラクトを提供することがさらに想定される。
前記態様では、本発明に関連して、疾患は、胃癌であることも想定される。
本発明に関連して、二重特異性抗体コンストラクトは、安定性の向上のために標的結合体においてシステインクランプ、すなわち分子内ジスルフィド結合を有することが想定される。
道癌、食道癌、膵臓癌及び結腸直腸癌を含む胃腸癌の治療における使用を対象とすることが想定される。
4171~4296に対応する。一般に、本発明に関連して、MUC17のaa付番は、常に、MUC17のuniprot Q685J3付番を参考にして作成されるか又は作成されるように意図される。一方、MUC17のE1エピトープ、すなわちSEAドメインのエピトープN末端(図1を参照されたい)を標的化する二重特異性抗体コンストラクトは、驚くべきことに、オフターゲット活性及び最終的に副作用のリスクの増大をもたらすことになるMUC3A及びMUC3Bとの望ましくない交差反応性を示す。さらに、SEAドメインのC末端に位置するエピトープE3及びE4(図1を参照されたい)に向けられる二重特異性抗体コンストラクトは、予想外にもカニクイザルMUC17と交差反応しない。したがって、本発明による二重特異性抗体コンストラクトは、MUC17のE2エピトープに特異的且つ排他的に結合することが想定される。
、8-H8、8-D7、4-E7、8-F9、1-A6、8-H9、1-B6、8-F11及び5-H1として同定される。エピトープクラスターE2/E5A/5Bの一部及び/又はTR2/TR3に結合し、且つ約125未満のEC50:KD比率を示し、配列ファミリー(OPTライブラリ名称)1a、1c及び9に属するコンストラクトも好ましい。それらのVH/VL配置は、3ラムダ3又は「3I3」として特徴付けられる。そのようなコンストラクトは、本発明に関連して、例えば2-D11、8-E3、32-G6、2-C2、9-C2、1-B10、4-B1、4-F6、4-G4、4-A8、4-B10、4-H11及び4-H2として同定される。エピトープクラスターE2/E5Aの一部/5Bの一部及び/又はTR2/TR3の一部に結合し、且つ約1500未満、典型的には250~1450の(EC50/KD)*1000比率を示し、且つ配列ファミリー(OPTライブラリ名称)6、7及び8に属する結合体が好ましいが、前述の2つの配列ファミリーより好ましくない。それらのVH/VL配置は、2カッパ3又は「3k3」として特徴付けられる。本明細書で特に好ましいのは、コンストラクト32-G6(配列番号65);1-B6(配列番号483);2-C2(配列番号428)及び8-B7(配列番号186)である。本発明に関連して、親和性は、一般に、BiacoreB分析などのSPCによって測定され、結果は、通常、nM単位で与えられる。細胞傷害活性は、通常、MUC17標的細胞としてのNUGC-4細胞及びCD3エフェクター細胞としての未刺激のヒトPBMCを使用して決定される。
・MUC17に結合する第1のドメイン、
・ヒト及びマカクCD3ε鎖の細胞外エピトープに結合する第2のドメイン;及び任意選択的に、
・2つのポリペプチド単量体であって、それぞれヒンジ、CH2ドメイン及びCH3ドメインを含む2つのポリペプチド単量体を含み、前記2つのポリペプチド単量体は、ペプチドリンカーを介して互いに融合される、第3のドメイン
を含む抗体コンストラクトを提供する。
用語「抗体コンストラクト」は、その構造及び/又は機能が抗体、例えば全長又は完全免疫グロブリン分子の構造及び/若しくは機能に基づく分子を指す。したがって、抗体コンストラクトは、その特異的な標的又は抗原に結合することができ、且つ/又は抗体若しくはそのフラグメントの可変重鎖(VH)及び/若しくは可変軽鎖(VL)ドメインから導き出される。さらに、本発明による結合パートナーに結合するドメインは、本発明による抗体コンストラクトの結合ドメインとして本明細書で理解される。通常、本発明による結合ドメインは、標的結合を可能にする抗体の最小構造要件を含む。この最小要件は、例
えば、少なくとも3つの軽鎖CDR(すなわちVL領域のCDR1、CDR2及びCDR3)並びに/又は3つの重鎖CDR(すなわちVH領域のCDR1、CDR2及びCDR3)、好ましくは6つ全てのCDRの存在によって定義され得る。抗体の最小構造要件を定義する代替の手法は、特異的な標的の構造、それぞれエピトープ領域を構成する標的タンパク質のタンパク質ドメイン(エピトープクラスター)内での抗体のエピトープの定義であるか、又は定義された抗体のエピトープと競合する特異的な抗体を参照することによる。本発明によるコンストラクトが基づく抗体は、例えば、モノクローナル抗体、組換え抗体、キメラ抗体、脱免疫抗体、ヒト化抗体及びヒト抗体を含む。
s.Springer-Verlag,NewYork,pp.269-315(1994)においてPluckthunによって詳細に議論されている。一本鎖抗体を作製する様々な方法が知られており、米国特許第4,694,778号明細書及び同第5,260,203号明細書;国際特許出願公開国際公開第88/01649号パンフレット;Bird(1988)Science 242:423-442;Huston et al.(1988)Proc.Natl.Acad.Sci.USA 85:5879-5883;Ward et al.(1989)Nature 334:54454;Skerra et al.(1988)Science 242:1038-1041に記載されるものを含む。特定の実施形態において、一本鎖抗体は、二重特異性、多重特異性、ヒト及び/若しくはヒト化並びに/又は合成性でもあり得る。
a laboratory manual,CSHL Press(1988)及びUsing Antibodies:a laboratory manual,CSHL
Press(1999),Kontermann and Duebel,Antibody Engineering,Springer,2nd ed.2010及びLittle,Recombinant Antibodies for Immunotherapy,Cambridge University Press 2009に記載されている。
hmann,Clin.Exp.Immunol.79:315-321(1990)を参照されたい。
され得る。Biacoreシステムで採用されている表面プラズモン共鳴を使用して、標的細胞の表面抗原のエピトープにファージ抗体が結合する効率を高めることができる(Schier,Human Antibodies Hybridomas 7(1996),97-105;Malmborg,J.Immunol.Methods 183(1995),7-13)。
Genetics 7:13-21、米国特許出願公開第2003-0070185号明細書、国際公開第96/34096号パンフレット及び国際公開第96/33735号パンフレットを参照されたい。
and Duebel(2010)及び前掲のLittle(2009)を参照されたい)が挙げられる。
と、いくつかの超可変領域部位(例えば、6~7部位)は、それぞれの部位で可能な全てのアミノ酸置換が生じるように変異される。そのようにして生成された抗体バリアントは、各粒子内にパッケージされたM13の遺伝子III産物との融合体として、繊維状ファージ粒子から一価形態で提示される。次に、ファージディスプレイされたバリアントを、本明細書に開示されるとおりにそれらの生物活性(例えば、結合親和性)についてスクリーニングする。改変のための超可変領域部位候補を同定するために、アラニンスキャニング変異導入法を実施して、抗原結合に有意に寄与する超可変領域残基を同定し得る。代わりに又は加えて、結合ドメインと例えばヒトMUC17との間の接触点を同定するために、抗原-抗体複合体の結晶構造を分析することが有益な場合がある。そのような接触残基及び隣接残基は、本明細書で詳述される技術による置換の候補である。そのようなバリアントを生成してから、バリアントのパネルに対して、本明細書に記載されるとおりのスクリーニングを施し、1つ以上の関連するアッセイにおいて優れた特性を有する抗体をさらなる開発のために選択し得る。
及びTomlinson et al.(1995)EMBO J.14:14:4628-4638に開示される。V BASE総覧は、ヒト免疫グロブリン可変領域配列の包括的な総覧を提供する(Tomlinson,LA.et al.MRC Centre
for Protein Engineering,Cambridge,UKによる編集)。これらの配列をヒト配列の供給源として、例えばフレームワーク領域及びCDRに使用することができる。例えば、米国特許第6,300,064号明細書に記載されるコンセンサスヒトフレームワーク領域を使用することもできる。
08-7312,1983;Kozbor et al.,Immunology Today,4:7279,1983;Olsson et al.,Meth.Enzymol.,92:3-16,1982及び欧州特許第239400号明細書)。
可能にする抗体の最小構造要件も含む。より好ましくは、第2の結合ドメインは、少なくとも3つの軽鎖CDR(すなわちVL領域のCDR1、CDR2及びCDR3)並びに/又は3つの重鎖CDR(すなわちVH領域のCDR1、CDR2及びCDR3)を含む。第1及び/又は第2の結合ドメインは、既存の(モノクローナル)抗体由来のCDR配列をスキャフォールドに移植する以外のファージディスプレイ又はライブラリスクリーニング法によって作製されるか又は得られることが想定される。
る抗体療法の可能性を実現する上で重要なマイルストーンとなる完全ヒトモノクローナル抗体(mAb)の作製にとって理想的な供給源を得ることができるであろう。完全ヒト抗体又は抗体コンストラクトは、マウスmAb又はマウス由来mAbに固有の免疫原性及びアレルギー反応を最小化し、それによって投与される抗体/抗体コンストラクトの有効性及び安全性を増大させることが期待される。完全ヒト抗体又は抗体コンストラクトの使用により、化合物の反復投与を必要とする慢性及び再発性のヒト疾患、例えば炎症、自己免疫及び癌の治療に大幅な利点が得られるものと期待され得る。
Genetics 15:146-156(1997)及びGreen and Jakobovits J.Exp.Med.188:483-495(1998)、欧州特
許第0463151B1号明細書、国際公開第94/02602号パンフレット、国際公開第96/34096号パンフレット、国際公開第98/24893号パンフレット、国際公開第00/76310号パンフレット及び国際公開第03/47336号パンフレットも参照されたい。
は、特に慢性又は複数回用量での抗体の利用において観察されることになると予想される。したがって、HAMA若しくはHACA反応の懸念及び/又は影響をなくすために、MUC17に対するヒト結合ドメイン及びCD3εに対するヒト結合ドメインを含む抗体コンストラクトを提供することが望ましいと考えられる。
合ドメインがMUC17又はCD3以外のタンパク質又は抗原に結合せず、すなわちMUC17又はCD3のそれぞれに対する結合を100%とした場合、MUC17又はCD3以外のタンパク質又は抗原に対して30%超、好ましくは20%超、より好ましくは10%超、特に好ましくは9%、8%、7%、6%又は5%超の反応性を示さないことを意味する。
ure Analysis of Antibody Variable Domains.In:Antibody Engineering Lab Manual(Ed.:Duebel,S.and Kontermann,R.,Springer-Verlag,Heidelberg)を参照されたい。2つの残基同定技術が同一の領域ではなく重複する領域を定義する程度まで、それらを組み合わせて、ハイブリッドCDRを定義することができる。しかしながら、いわゆるKabat方式に従う付番が好ましい。
et al.,(前掲)に記載される構造的な考慮並びに抗体構造のカノニカルな側面の解釈に対するそれらの意義については、文献に記載されている。様々なクラスの免疫グロブリンのサブユニット構造及び三次元配置は、当技術分野でよく知られている。抗体構造の概説については、Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratory,eds.Harlow et al.,1988を参照されたい。
つ以上のジスルフィド結合によって互いに連結される。VHに最も近接するCHドメインは、通常、CH1と称される。定常(「C」)ドメインは、抗原結合に直接関与しないが、抗体依存性、細胞介在性の細胞傷害性及び補体活性化などの種々のエフェクター機能を示す。抗体のFc領域は、重鎖定常ドメイン内に含まれ、例えば細胞表面に位置するFc受容体と相互作用することができる。
ぞれ含むように定義され得る。ペプチドリンカーを介して互いに融合される2つのFc部分又はFc単量体は、本発明の抗体コンストラクトの第3のドメインを定義し、これは、scFcドメインとも定義され得る。
第3のドメインのポリペプチド単量体(「Fc部分」又は「Fc単量体」)が互いに融合されるペプチドリンカーは、好ましくは、少なくとも25アミノ酸残基(25、26、27、28、29、30など)を含む。より好ましくは、このペプチドリンカーは、少な
くとも30アミノ酸残基(30、31、32、33、34、35など)を含む。リンカーが最大40アミノ酸残基を含むことも好ましく、より好ましくは最大35アミノ酸残基、最も好ましくはちょうど30アミノ酸残基である。このようなペプチドリンカーの好ましい実施形態は、アミノ酸配列Gly-Gly-Gly-Gly-Ser、すなわちGly4Ser(配列番号1)又はそのポリマー、すなわち(Gly4Ser)xによって特徴付けられ、ここで、xは、5又はそれを超える整数(例えば、6、7又は8)である。好ましくは、整数は、6又は7であり、より好ましくは、整数は、6である。
Laboratory Press,Cold Spring Harbor,New
York,2001)。
の2つのドメインであるVL及びVHは、別々の遺伝子によってコードされるが、それらは、組換え法を用いて、VL及びVH領域が1価分子を形成するように対をなす単一のタンパク質鎖としてそれらが作製されることを可能にする、本明細書の上記のとおりの合成リンカーによって結合することができる;例えば、Huston et al.(1988)Proc.Natl.Acad.Sci USA 85:5879-5883を参照されたい。これらの抗体フラグメントは、当業者に知られる従来技術を用いて得られ、且つそのフラグメントは、完全又は全長抗体と同じ様式で機能について評価される。したがって、一本鎖可変フラグメント(scFv)は、通常、約10~約25アミノ酸、好ましくは約15~20アミノ酸の短いリンカーペプチドによって接続される、免疫グロブリンの重鎖の可変領域(VH)及び軽鎖の可変領域(VL)の融合タンパク質である。リンカーは、通常、可動性のためにグリシン及び溶解性のためにセリン又はスレオニンを豊富に含み、VHのN末端をVLのC末端に連結するか又はその逆のいずれかであり得る。このタンパク質は、定常領域の除去及びリンカーの導入にもかかわらず、元の免疫グロブリンの特異性を保持する。
メインを含む。最初の単一ドメイン抗体は、ラクダにおいて見出される重鎖抗体から作り出され、これらは、VHHフラグメントと呼ばれる。軟骨魚類も重鎖抗体(IgNAR)を有し、それから、VNARフラグメントと呼ばれる単一ドメイン抗体を得ることができる。代替的な手法は、例えば、ヒト又は齧歯類由来の一般的な免疫グロブリン由来の二量体可変ドメインを単量体に分割し、それによって単一ドメインAbとしてVH又はVLを得ることである。単一ドメイン抗体に関する大部分の研究は、現時点で重鎖可変ドメインに基づいているが、軽鎖由来のナノボディも標的エピトープに特異的に結合することが示されている。単一ドメイン抗体の例は、sdAb、ナノボディ又は単一可変ドメイン抗体と呼ばれる。
想定される。これは、副作用のリスクが低いことになる。
使用する場合、MUC17×CD3二重特異性抗体コンストラクトのEC50値は、好ましくは、≦5000pM又は≦4000pM(特に標的細胞がMUC17陽性ヒト細胞株である場合)、より好ましくは≦2000pM(特に標的細胞がCHO細胞などのMUC17でトランスフェクトされた細胞である場合)、より好ましくは≦1000pM又は≦500pM、さらにより好ましくは≦200pM、さらにより好ましくは≦150pM、さらにより好ましくは≦100pM及び最も好ましくは≦50pM又はそれ未満である。LnPx4119などのマカクT細胞株をエフェクター細胞として使用し、CHO細胞などのマカクMUC17でトランスフェクトされた細胞株を標的細胞株として使用する場合、MUC17×CD3二重特異性抗体コンストラクトのEC50値は、好ましくは、≦2000pM又は≦1500pM、より好ましくは≦1000pM又は≦500pM、さらにより好ましくは≦300pM又は≦250pM、さらにより好ましくは≦100pM及び最も好ましくは≦50pMである。
oreアッセイ又はスキャッチャードアッセイにおいて測定され得る。親和性を決定する他の方法も当業者によく知られている。マカクMUC17に対する第1のドメインの親和性は、好ましくは、≦15nM、より好ましくは≦10nM、さらにより好ましくは≦5nM、さらにより好ましくは≦1nM、さらにより好ましくは≦0.5nM、さらにより好ましくは≦0.1nM及び最も好ましくは≦0.05nM又はさらに≦0.01nMである。
(a)国際公開第2008/119567号パンフレットの配列番号27に示されるとおりのCDR-L1、国際公開第2008/119567号パンフレットの配列番号28に示されるとおりのCDR-L2及び国際公開第2008/119567号パンフレットの配列番号29に示されるとおりのCDR-L3;
(b)国際公開第2008/119567号パンフレットの配列番号117に示されるとおりのCDR-L1、国際公開第2008/119567号パンフレットの配列番号118に示されるとおりのCDR-L2及び国際公開第2008/119567号パンフレットの配列番号119に示されるとおりのCDR-L3;及び
(c)国際公開第2008/119567号パンフレットの配列番号153に示されるとおりのCDR-L1、国際公開第2008/119567号パンフレットの配列番号154に示されるとおりのCDR-L2及び国際公開第2008/119567号パンフレットの配列番号155に示されるとおりのCDR-L3
から選択されるCDR-L1、CDR-L2及びCDR-L3を含むVL領域を含むことが好ましい。
(a)国際公開第2008/119567号パンフレットの配列番号12に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号13に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号14に示されるとおりのCDR-H3;
(b)国際公開第2008/119567号パンフレットの配列番号30に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号31に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号32に示されるとおりのCDR-H3;
(c)国際公開第2008/119567号パンフレットの配列番号48に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号49に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号50に示されるとおりのCDR-H3;
(d)国際公開第2008/119567号パンフレットの配列番号66に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号67に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号68に示されるとおりのCDR-H3;
(e)国際公開第2008/119567号パンフレットの配列番号84に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号85に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号86に示されるとおりのCDR-H3;
(f)国際公開第2008/119567号パンフレットの配列番号102に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号103に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号104に示されるとおりのCDR-H3;
(g)国際公開第2008/119567号パンフレットの配列番号120に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号121に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号122に示されるとおりのCDR-H3;
(h)国際公開第2008/119567号パンフレットの配列番号138に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号139に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号140に示されるとおりのCDR-H3;
(i)国際公開第2008/119567号パンフレットの配列番号156に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号157に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号158に示されるとおりのCDR-H3;及び
(j)国際公開第2008/119567号パンフレットの配列番号174に示されるとおりのCDR-H1、国際公開第2008/119567号パンフレットの配列番号175に示されるとおりのCDR-H2及び国際公開第2008/119567号パンフレットの配列番号176に示されるとおりのCDR-H3
から選択されるCDR-H1、CDR-H2及びCDR-H3を含むVH領域を含む。
109、123、127、141、145、159、163、177若しくは181で示されるか又は配列番号14に示されるものからなる群から選択されるVH領域を含むことも好ましい。
(a)国際公開第2008/119567号パンフレットの配列番号17又は21に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号15又は19に示されるVH領域;
(b)国際公開第2008/119567号パンフレットの配列番号35又は39に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号33又は37に示されるVH領域;
(c)国際公開第2008/119567号パンフレットの配列番号53又は57に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号51又は55に示されるVH領域;
(d)国際公開第2008/119567号パンフレットの配列番号71又は75に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号69又は73に示されるVH領域;
(e)国際公開第2008/119567号パンフレットの配列番号89又は93に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号87又は91に示されるVH領域;
(f)国際公開第2008/119567号パンフレットの配列番号107又は111に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号105又は109に示されるVH領域;
(g)国際公開第2008/119567号パンフレットの配列番号125又は129に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号123又は127に示されるVH領域;
(h)国際公開第2008/119567号パンフレットの配列番号143又は147に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号141又は145に示されるVH領域;
(i)国際公開第2008/119567号パンフレットの配列番号161又は165に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号159又は163に示されるVH領域;及び
(j)国際公開第2008/119567号パンフレットの配列番号179又は183に示されるVL領域及び国際公開第2008/119567号パンフレットの配列番号177又は181に示されるVH領域
からなる群から選択されるVL領域及びVH領域を含むDC3に結合する第2のドメインによって特徴付けられる。
95、97、113、115、131、133、149、151、167、169、185若しくは187からなる群から選択されるアミノ酸配列又は配列番号15に示されるアミノ酸配列を含むCD3に結合する第2のドメインによって特徴付けられる。
(a)配列番号36に示されるとおりのCDR-L1、配列番号37に示されるとおりのCDR-L2及び配列番号38に示されるとおりのCDR-L3並びに配列番号33に示されるとおりのCDR-H1、配列番号34に示されるとおりのCDR-H2及び配列番号35に示されるとおりのCDR-H3;
(b)配列番号47に示されるとおりのCDR-L1、配列番号48に示されるとおりのCDR-L2及び配列番号49に示されるとおりのCDR-L3並びに配列番号44に示されるとおりのCDR-H1、配列番号45に示されるとおりのCDR-H2及び配列番号46に示されるとおりのCDR-H3;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3並びに配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(d)配列番号69に示されるとおりのCDR-L1、配列番号70に示されるとおりのCDR-L2及び配列番号71に示されるとおりのCDR-L3並びに配列番号66に示されるとおりのCDR-H1、配列番号67に示されるとおりのCDR-H2及び配列番号68に示されるとおりのCDR-H3;
(e)配列番号80に示されるとおりのCDR-L1、配列番号81に示されるとおりのCDR-L2及び配列番号82に示されるとおりのCDR-L3並びに配列番号77に示されるとおりのCDR-H1、配列番号78に示されるとおりのCDR-H2及び配列番号79に示されるとおりのCDR-H3;
(f)配列番号91に示されるとおりのCDR-L1、配列番号92に示されるとおりのCDR-L2及び配列番号93に示されるとおりのCDR-L3並びに配列番号88に示されるとおりのCDR-H1、配列番号89に示されるとおりのCDR-H2及び配列番号90に示されるとおりのCDR-H3;
(g)配列番号102に示されるとおりのCDR-L1、配列番号103に示されるとおりのCDR-L2及び配列番号104に示されるとおりのCDR-L3並びに配列番号99に示されるとおりのCDR-H1、配列番号100に示されるとおりのCDR-H2及び配列番号101に示されるとおりのCDR-H3;
(h)配列番号113に示されるとおりのCDR-L1、配列番号114に示されるとおりのCDR-L2及び配列番号115に示されるとおりのCDR-L3並びに配列番号110に示されるとおりのCDR-H1、配列番号111に示されるとおりのCDR-H2及び配列番号112に示されるとおりのCDR-H3;
(i)配列番号124に示されるとおりのCDR-L1、配列番号125に示されるとおりのCDR-L2及び配列番号126に示されるとおりのCDR-L3並びに配列番号121に示されるとおりのCDR-H1、配列番号122に示されるとおりのCDR-H2及び配列番号123に示されるとおりのCDR-H3;
(j)配列番号135に示されるとおりのCDR-L1、配列番号136に示されるとおりのCDR-L2及び配列番号137に示されるとおりのCDR-L3並びに配列番号132に示されるとおりのCDR-H1、配列番号133に示されるとおりのCDR-H2及び配列番号134に示されるとおりのCDR-H3;
(k)配列番号146に示されるとおりのCDR-L1、配列番号147に示されるとおりのCDR-L2及び配列番号148に示されるとおりのCDR-L3並びに配列番号143に示されるとおりのCDR-H1、配列番号144に示されるとおりのCDR-H2及び配列番号145に示されるとおりのCDR-H3;
(l)配列番号157に示されるとおりのCDR-L1、配列番号158に示されるとお
りのCDR-L2及び配列番号159に示されるとおりのCDR-L3並びに配列番号154に示されるとおりのCDR-H1、配列番号155に示されるとおりのCDR-H2及び配列番号156に示されるとおりのCDR-H3;
(m)配列番号168に示されるとおりのCDR-L1、配列番号169に示されるとおりのCDR-L2及び配列番号170に示されるとおりのCDR-L3並びに配列番号165に示されるとおりのCDR-H1、配列番号166に示されるとおりのCDR-H2及び配列番号167に示されるとおりのCDR-H3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3並びに配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(o)配列番号190に示されるとおりのCDR-L1、配列番号191に示されるとおりのCDR-L2及び配列番号192に示されるとおりのCDR-L3並びに配列番号187に示されるとおりのCDR-H1、配列番号188に示されるとおりのCDR-H2及び配列番号189に示されるとおりのCDR-H3;
(p)配列番号201に示されるとおりのCDR-L1、配列番号202に示されるとおりのCDR-L2及び配列番号203に示されるとおりのCDR-L3並びに配列番号198に示されるとおりのCDR-H1、配列番号199に示されるとおりのCDR-H2及び配列番号200に示されるとおりのCDR-H3;
(q)配列番号212に示されるとおりのCDR-L1、配列番号213に示されるとおりのCDR-L2及び配列番号214に示されるとおりのCDR-L3並びに配列番号209に示されるとおりのCDR-H1、配列番号210に示されるとおりのCDR-H2及び配列番号211に示されるとおりのCDR-H3;
(r)配列番号223に示されるとおりのCDR-L1、配列番号224に示されるとおりのCDR-L2及び配列番号225に示されるとおりのCDR-L3並びに配列番号220に示されるとおりのCDR-H1、配列番号221に示されるとおりのCDR-H2及び配列番号222に示されるとおりのCDR-H3;
(s)配列番号234に示されるとおりのCDR-L1、配列番号235に示されるとおりのCDR-L2及び配列番号236に示されるとおりのCDR-L3並びに配列番号231に示されるとおりのCDR-H1、配列番号232に示されるとおりのCDR-H2及び配列番号233に示されるとおりのCDR-H3;
(t)配列番号245に示されるとおりのCDR-L1、配列番号246に示されるとおりのCDR-L2及び配列番号247に示されるとおりのCDR-L3並びに配列番号242に示されるとおりのCDR-H1、配列番号243に示されるとおりのCDR-H2及び配列番号244に示されるとおりのCDR-H3;
(u)配列番号256に示されるとおりのCDR-L1、配列番号257に示されるとおりのCDR-L2及び配列番号258に示されるとおりのCDR-L3並びに配列番号253に示されるとおりのCDR-H1、配列番号254に示されるとおりのCDR-H2及び配列番号255に示されるとおりのCDR-H3;
(v)配列番号267に示されるとおりのCDR-L1、配列番号268に示されるとおりのCDR-L2及び配列番号269に示されるとおりのCDR-L3並びに配列番号264に示されるとおりのCDR-H1、配列番号265に示されるとおりのCDR-H2及び配列番号266に示されるとおりのCDR-H3;
(w)配列番号278に示されるとおりのCDR-L1、配列番号279に示されるとおりのCDR-L2及び配列番号280に示されるとおりのCDR-L3並びに配列番号275に示されるとおりのCDR-H1、配列番号276に示されるとおりのCDR-H2及び配列番号276に示されるとおりのCDR-H3;
(x)配列番号289に示されるとおりのCDR-L1、配列番号290に示されるとおりのCDR-L2及び配列番号291に示されるとおりのCDR-L3並びに配列番号286に示されるとおりのCDR-H1、配列番号287に示されるとおりのCDR-H2
及び配列番号288に示されるとおりのCDR-H3;
(y)配列番号300に示されるとおりのCDR-L1、配列番号301に示されるとおりのCDR-L2及び配列番号302に示されるとおりのCDR-L3並びに配列番号297に示されるとおりのCDR-H1、配列番号298に示されるとおりのCDR-H2及び配列番号299に示されるとおりのCDR-H3;
(z)配列番号311に示されるとおりのCDR-L1、配列番号312に示されるとおりのCDR-L2及び配列番号313に示されるとおりのCDR-L3並びに配列番号308に示されるとおりのCDR-H1、配列番号309に示されるとおりのCDR-H2及び配列番号310に示されるとおりのCDR-H3;
(aa)配列番号322に示されるとおりのCDR-L1、配列番号323に示されるとおりのCDR-L2及び配列番号324に示されるとおりのCDR-L3並びに配列番号319に示されるとおりのCDR-H1、配列番号320に示されるとおりのCDR-H2及び配列番号321に示されるとおりのCDR-H3;
(ab)配列番号333に示されるとおりのCDR-L1、配列番号334に示されるとおりのCDR-L2及び配列番号335に示されるとおりのCDR-L3並びに配列番号330に示されるとおりのCDR-H1、配列番号331に示されるとおりのCDR-H2及び配列番号332に示されるとおりのCDR-H3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3並びに配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;
(ad)配列番号355に示されるとおりのCDR-L1、配列番号356に示されるとおりのCDR-L2及び配列番号357に示されるとおりのCDR-L3並びに配列番号352に示されるとおりのCDR-H1、配列番号353に示されるとおりのCDR-H2及び配列番号354に示されるとおりのCDR-H3;
(ae)配列番号366に示されるとおりのCDR-L1、配列番号367に示されるとおりのCDR-L2及び配列番号368に示されるとおりのCDR-L3並びに配列番号363に示されるとおりのCDR-H1、配列番号364に示されるとおりのCDR-H2及び配列番号365に示されるとおりのCDR-H3;
(af)配列番号377に示されるとおりのCDR-L1、配列番号378に示されるとおりのCDR-L2及び配列番号379に示されるとおりのCDR-L3並びに配列番号374に示されるとおりのCDR-H1、配列番号375に示されるとおりのCDR-H2及び配列番号376に示されるとおりのCDR-H3;
(ag)配列番号388に示されるとおりのCDR-L1、配列番号389に示されるとおりのCDR-L2及び配列番号390に示されるとおりのCDR-L3並びに配列番号385に示されるとおりのCDR-H1、配列番号386に示されるとおりのCDR-H2及び配列番号386に示されるとおりのCDR-H3;
(ah)配列番号399に示されるとおりのCDR-L1、配列番号400に示されるとおりのCDR-L2及び配列番号401に示されるとおりのCDR-L3並びに配列番号396に示されるとおりのCDR-H1、配列番号397に示されるとおりのCDR-H2及び配列番号398に示されるとおりのCDR-H3;
(ai)配列番号410に示されるとおりのCDR-L1、配列番号411に示されるとおりのCDR-L2及び配列番号412に示されるとおりのCDR-L3並びに配列番号407に示されるとおりのCDR-H1、配列番号408に示されるとおりのCDR-H2及び配列番号409に示されるとおりのCDR-H3;
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3並びに配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3;
(ak)配列番号432に示されるとおりのCDR-L1、配列番号433に示されると
おりのCDR-L2及び配列番号434に示されるとおりのCDR-L3並びに配列番号429に示されるとおりのCDR-H1、配列番号430に示されるとおりのCDR-H2及び配列番号431に示されるとおりのCDR-H3;
(al)配列番号443に示されるとおりのCDR-L1、配列番号444に示されるとおりのCDR-L2及び配列番号445に示されるとおりのCDR-L3並びに配列番号440に示されるとおりのCDR-H1、配列番号441に示されるとおりのCDR-H2及び配列番号442に示されるとおりのCDR-H3;
(am)配列番号454に示されるとおりのCDR-L1、配列番号455に示されるとおりのCDR-L2及び配列番号456に示されるとおりのCDR-L3並びに配列番号451に示されるとおりのCDR-H1、配列番号452に示されるとおりのCDR-H2及び配列番号453に示されるとおりのCDR-H3;
(an)配列番号465に示されるとおりのCDR-L1、配列番号466に示されるとおりのCDR-L2及び配列番号467に示されるとおりのCDR-L3並びに配列番号462に示されるとおりのCDR-H1、配列番号463に示されるとおりのCDR-H2及び配列番号464に示されるとおりのCDR-H3;
(ao)配列番号476に示されるとおりのCDR-L1、配列番号477に示されるとおりのCDR-L2及び配列番号478に示されるとおりのCDR-L3並びに配列番号473に示されるとおりのCDR-H1、配列番号474に示されるとおりのCDR-H2及び配列番号475に示されるとおりのCDR-H3;
(ap)配列番号487に示されるとおりのCDR-L1、配列番号488に示されるとおりのCDR-L2及び配列番号489に示されるとおりのCDR-L3並びに配列番号484に示されるとおりのCDR-H1、配列番号485に示されるとおりのCDR-H2及び配列番号486に示されるとおりのCDR-H3;
(aq)配列番号498に示されるとおりのCDR-L1、配列番号499に示されるとおりのCDR-L2及び配列番号500に示されるとおりのCDR-L3並びに配列番号495に示されるとおりのCDR-H1、配列番号496に示されるとおりのCDR-H2及び配列番号497に示されるとおりのCDR-H3;
(ar)配列番号509に示されるとおりのCDR-L1、配列番号510に示されるとおりのCDR-L2及び配列番号511に示されるとおりのCDR-L3並びに配列番号506に示されるとおりのCDR-H1、配列番号507に示されるとおりのCDR-H2及び配列番号508に示されるとおりのCDR-H3;及び
(as)配列番号520に示されるとおりのCDR-L1、配列番号521に示されるとおりのCDR-L2及び配列番号522に示されるとおりのCDR-L3並びに配列番号517に示されるとおりのCDR-H1、配列番号518に示されるとおりのCDR-H2及び配列番号519に示されるとおりのCDR-H3
からなる群から選択されるCDR-L1、CDR-L2及びCDR-L3を含むVL領域並びにCDR-H1、CDR-H2及びCDR-H3を含むVH領域を含み;例えば、
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3並びに配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3並びに配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3並びに配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;及び
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されると
おりのCDR-L2及び配列番号423に示されるとおりのCDR-L3並びに配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3
が好ましいことも想定される。
(a)配列番号40に示されるとおりのVL領域及び配列番号39に示されるとおりのVH領域;
(b)配列番号51に示されるとおりのVL領域及び配列番号50に示されるとおりのVH領域;
(c)配列番号62に示されるとおりのVL領域及び配列番号61に示されるとおりのVH領域;
(d)配列番号73に示されるとおりのVL領域及び配列番号72に示されるとおりのVH領域;
(e)配列番号84に示されるとおりのVL領域及び配列番号83に示されるとおりのVH領域;
(f)配列番号95に示されるとおりのVL領域及び配列番号94に示されるとおりのVH領域;
(g)配列番号106に示されるとおりのVL領域及び配列番号105に示されるとおりのVH領域;
(h)配列番号117に示されるとおりのVL領域及び配列番号116に示されるとおりのVH領域;
(i)配列番号128に示されるとおりのVL領域及び配列番号127に示されるとおりのVH領域;
(j)配列番号139に示されるとおりのVL領域及び配列番号138に示されるとおりのVH領域;
(k)配列番号150に示されるとおりのVL領域及び配列番号149に示されるとおりのVH領域;
(l)配列番号161に示されるとおりのVL領域及び配列番号160に示されるとおりのVH領域;
(m)配列番号172に示されるとおりのVL領域及び配列番号171に示されるとおりのVH領域;
(n)配列番号183に示されるとおりのVL領域及び配列番号182に示されるとおりのVH領域;
(o)配列番号194に示されるとおりのVL領域及び配列番号193に示されるとおりのVH領域;
(p)配列番号205に示されるとおりのVL領域及び配列番号204に示されるとおりのVH領域;
(q)配列番号216に示されるとおりのVL領域及び配列番号215に示されるとおりのVH領域;
(r)配列番号227に示されるとおりのVL領域及び配列番号226に示されるとおりのVH領域;
(s)配列番号238に示されるとおりのVL領域及び配列番号237に示されるとおりのVH領域;
(t)配列番号249に示されるとおりのVL領域及び配列番号248に示されるとおりのVH領域;
(u)配列番号260に示されるとおりのVL領域及び配列番号259に示されるとおりのVH領域;
(v)配列番号271に示されるとおりのVL領域及び配列番号270に示されるとおりのVH領域;
(w)配列番号282に示されるとおりのVL領域及び配列番号281に示されるとおりのVH領域;
(x)配列番号293に示されるとおりのVL領域及び配列番号292に示されるとおりのVH領域;
(y)配列番号304に示されるとおりのVL領域及び配列番号303に示されるとおりのVH領域;
(z)配列番号315に示されるとおりのVL領域及び配列番号314に示されるとおりのVH領域;
(aa)配列番号326に示されるとおりのVL領域及び配列番号325に示されるとおりのVH領域;
(ab)配列番号337に示されるとおりのVL領域及び配列番号336に示されるとおりのVH領域;
(ac)配列番号348に示されるとおりのVL領域及び配列番号347に示されるとおりのVH領域;
(ad)配列番号359に示されるとおりのVL領域及び配列番号358に示されるとおりのVH領域;
(ae)配列番号370に示されるとおりのVL領域及び配列番号369に示されるとおりのVH領域;
(af)配列番号381に示されるとおりのVL領域及び配列番号380に示されるとおりのVH領域;
(ag)配列番号392に示されるとおりのVL領域及び配列番号391に示されるとおりのVH領域;
(ah)配列番号403に示されるとおりのVL領域及び配列番号402に示されるとおりのVH領域;
(ai)配列番号414に示されるとおりのVL領域及び配列番号413に示されるとおりのVH領域;
(aj)配列番号425に示されるとおりのVL領域及び配列番号424に示されるとおりのVH領域;
(ak)配列番号436に示されるとおりのVL領域及び配列番号435に示されるとおりのVH領域;
(al)配列番号447に示されるとおりのVL領域及び配列番号446に示されるとおりのVH領域;
(am)配列番号458に示されるとおりのVL領域及び配列番号457に示されるとおりのVH領域;
(an)配列番号469に示されるとおりのVL領域及び配列番号468に示されるとおりのVH領域;
(ao)配列番号480に示されるとおりのVL領域及び配列番号479に示されるとおりのVH領域;
(ap)配列番号491に示されるとおりのVL領域及び配列番号490に示されるとおりのVH領域;
(aq)配列番号502に示されるとおりのVL領域及び配列番号501に示されるとおりのVH領域;
(ar)配列番号513に示されるとおりのVL領域及び配列番号512に示されるとおりのVH領域;及び
(as)配列番号524に示されるとおりのVL領域及び配列番号523に示されるとおりのVH領域
からなる群から選択されるVH領域及びVL領域を含むことがさらに想定される。
195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525に示されるものからなる群から選択されるか又は前記配列と少なくとも90、91、92、93、94、95、96、97、98若しくは99%の同一性を有するアミノ酸配列を有するアミノ酸配列を含むことがさらに想定される。
をアルカリ条件下で実施する必要がある。さらに、これらの試薬は、リジンの基及びアルギニンイプシロン-アミノ基と反応し得る。
、糖鎖のアスパラギン残基側鎖への結合を指す。トリペプチド配列のアスパラギン-X-セリン及びアスパラギン-X-トレオニン(ここで、Xは、プロリン以外の任意のアミノ酸である)は、アスパラギン側鎖への糖鎖の酵素的結合のための認識配列である。したがって、ポリペプチド中のこれらのトリペプチド配列のいずれかの存在は、潜在的なグリコシル化部位を生成する。O結合型グリコシル化は、N-アセチルガラクトサミン、ガラクトース又はキシロースの1つの糖のヒドロキシアミノ酸への付加を指し、最も一般的にはセリン又はスレオニンであるが、5-ヒドロキシプロリン又は5-ヒドロキシリジンが使用される場合もある。
al.,1987,Meth.Enzymol.138:350によって記載されるとおりの様々なエンド-及びエキソ-グリコシダーゼの使用によって達成され得る。潜在的なグリコシル化部位でのグリコシル化は、Duskin et al.,1982,J.Biol.Chem.257:3105によって記載されるとおりの化合物ツニカマイシンの使用により妨げられ得る。ツニカマイシンは、タンパク質-N-グリコシド結合の形成を阻止する。
コポリマーを含むが、これらに限定されない。加えて、当技術分野で知られるとおり、例えば、PEGなどのポリマーの付加を容易にするために抗体コンストラクト内の様々な位置でアミノ酸置換がなされ得る。
a)放射性同位体又は放射性核種(例えば、3H、14C、15N、35S、89Zr、90Y、99Tc、111In、125I、131I)などの放射性同位体又は重同位体であり得る同位体標識
b)磁気標識(例えば、磁気粒子)
c)酸化還元活性部分
d)蛍光基(例えば、FITC、ローダミン、ランタニド蛍光体)、化学発光基及び「低分子」蛍光体又はタンパク質性蛍光体のいずれかであり得るフルオロフォアなどの光学色素(発色団、蛍光体及びフルオロフォアを含むが、これらに限定されない)
e)酵素群(例えば、西洋ワサビペルオキシダーゼ、β-ガラクトシダーゼ、ルシフェラーゼ、アルカリホスファターゼ)
f)ビオチン化基
g)二次レポーターによって認識される所定のポリペプチドエピトープ(例えば、ロイシンジッパー対配列、二次抗体の結合部位、金属結合ドメイン、エピトープタグなど)。
t al.,1996,Curr.Biol.6:178-182)、強化型黄色蛍光タンパク質(EYFP、Clontech Laboratories,Inc.)、ルシフェラーゼ(Ichiki et al.,1993,J.Immunol.150:5408-5417)、βガラクトシダーゼ(Nolan et al.,1988,Proc.Natl.Acad.Sci.U.S.A.85:2603-2607)及びRenilla(国際公開第92/15673号パンフレット、国際公開第95/07463号パンフレット、国際公開第98/14605号パンフレット、国際公開第98/26277号パンフレット、国際公開第99/49019号パンフレット、米国特許第5,292,658号明細書;同第5,418,155号明細書;同第5,683,888号明細書;同第5,741,668号明細書;同第5,777,079号明細書;同第5,804,387号明細書;同第5,874,304号明細書;同第5,876,995号明細書;同第5,925,558号明細書)も挙げられるが、これらに限定されない。
も60%又は65%、より好ましくは70%又は75%、さらにより好ましくは80%又は85%及び特に好ましくは90%又は95%同一であることが好ましい。これは、それが「置換された」配列とどの程度同一であるかがCDRの長さに依存することを意味する。例えば、5個のアミノ酸を有するCDRは、少なくとも1個の置換されたアミノ酸を有するために、その置換された配列と80%同一であることが好ましい。したがって、抗体コンストラクトのCDRは、それらの置換配列に対して異なる程度の同一性を有する場合があり、例えばCDRL1が80%を有する場合がある一方、CDRL3が90%を有する場合がある。
Adv.Appl.Math.2:482の部分配列同一性アルゴリズム、Needleman and Wunsch,1970,J.Mol.Biol.48:443の配列同一性アラインメントアルゴリズム、Pearson and Lipman,1988,Proc.Nat.Acad.Sci.U.S.A.85:2444の類似性検索法、これらのアルゴリズムのコンピュータによる実行(Wisconsin Genetics Software Package,Genetics Computer Group,575 Science Dr.,Madison,WisのGAP、BESTFIT、FASTA及びTFASTA)、Devereux et al.,1984,Nucl.Acid Res.12:387-395により記載されている、好ましくはデフォルト設定を用いたBest Fit配列プログラムを使用することにより又は目視により決定される。好ましくは、同一性パーセントは、以下のパラメータに基づいてFastDBによって算出される:ミスマッチペナルティが1;ギャップペナルティが1;ギャップサイズペナルティが0.33;及び結合ペナルティが30、「Current Methods in Sequence Comparison and Analysis」,Macromolecule Sequencing and Synthesis,Selected Methods and Applications,pp 127-149(1988),Alan R.Liss,Inc。
くは、本発明による抗体コンストラクトの単量体収量は、≧0.25mg/L上清、より好ましくは≧0.5mg/L、さらにより好ましくは≧1mg/L及び最も好ましくは≧3mg/L上清である。
観点から熱安定性パラメータを以下のように決定することができる:濃度250μg/mlの抗体溶液を単回使用のキュベットに移し、動的光散乱(DLS)装置内に置く。測定半径を常時取得しながら、0.5℃/分の加熱速度で40℃から70℃まで試料を加熱する。タンパク質の融解及び凝集を示す半径の増大を使用して、抗体の凝集温度を算出する。
(対照群2の中央値TV)としてTVを計算することによって決定される。
また、本発明の抗体コンストラクトの好ましい実施形態では、前記第3のドメインは、アミノからカルボキシルの順に、
ヒンジ-CH2-CH3-リンカー-ヒンジ-CH2-CH3
を含む。
プチド単量体は、配列番号17及び18からなる群から選択されるアミノ酸配列を有する。
(i)第1のドメインは、2つの抗体可変ドメインを含み、且つ第2のドメインは、2つの抗体可変ドメインを含むか;
(ii)第1のドメインは、1つの抗体可変ドメインを含み、且つ第2のドメインは、2つの抗体可変ドメインを含むか;
(iii)第1のドメインは、2つの抗体可変ドメインを含み、且つ第2のドメインは、1つの抗体可変ドメインを含むか;又は
(iv)第1のドメインは、1つの抗体可変ドメインを含み、且つ第2のドメインは、1つの抗体可変ドメインを含む、抗体コンストラクトを提供する。
(a)第1のドメイン;
(b)配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)第2のドメイン;
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)第3のドメインの第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)第3のドメインの第2のポリペプチド単量体
を含むことで特徴付けられる。
によって発現されるとき、MUC17に結合することが好ましい。好ましい実施形態では、第1の結合ドメインは、MUC17がBIAcore又はスキャッチャードなどのインビトロ結合アッセイにおける「標的」又は「リガンド」分子として使用されるとき、MUC17にも結合する。「標的細胞」は、その表面でMUC17を発現する任意の原核細胞又は真核細胞であり得;好ましくは、標的細胞は、特定のMUC17発現癌又は腫瘍細胞などのヒト又は動物の体の一部である細胞である。
ECDの両方に結合する。「MUC17細胞外ドメイン」又は「MUC17 ECD」は、MUC17の膜貫通及び細胞質内ドメインを本質的に含まないMUC17領域又は配列を指す。本発明のMUC17ポリペプチドに関して同定される膜貫通ドメインは、その型の疎水性ドメインを同定するための当技術分野で慣用的に用いられる基準に従って同定されることが当業者に理解されるであろう。膜貫通ドメインの正確な境界が異なる場合があるが、本明細書で具体的に言及されるドメインのいずれかの末端の約5アミノ酸以下である可能性が非常に高い。
(a)配列番号50、56、68、74、86、92、104、110、122、128、140、146、158、164、176、182、194、200、212、218、230、236、248、254、266、272、284、290、302、308、320、335、350、365、380、395、410、425、440、455、470からなる群から選択されるアミノ酸配列を有する第1のドメイン;
(b)配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)国際公開第2008/119567号パンフレットの配列番号23、25、41、43、59、61、77、79、95、97、113、115、131、133、149、151、167、169、185若しくは187からなる群から選択される又は配列番号15に示されるとおりのアミノ酸配列を有する第2のドメイン;
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)配列番号17~24からなる群から選択されるポリペプチド配列を有する第3のドメインの第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)配列番号17~24からなる群から選択されるポリペプチド配列を有する第3のドメインの第2のポリペプチド単量体
を含む。
354、366、369、381、384、396、399、411、414、426、429、441、444、456、459、471及び474からなる群から選択される配列を含む。
et al.(1992)Bio/Technology 10:790-794、Artsaenko et al.(1995)The Plant J 8:745-750及びFecker et al.(1996)Plant Mol Biol 32
:979-986を参照されたい。
CCL 2);イヌ腎臓細胞(MDCK、ATCC CCL 34);バッファローラット肝臓細胞(BRL 3A、ATCC CRL 1442);ヒト肺細胞(W138、ATCC CCL 75);ヒト肝臓細胞(Hep G2、1413 8065);マウス乳腺腫瘍(MMT 060562、ATCC CCL5 1);TRI細胞(Mather et al.,Annals N.Y Acad.Sci.(1982)383:44-68);MRC 5細胞;FS4細胞;及びヒトヘパトーマ株(Hep G2)である。
は陽イオン交換樹脂(例えば、ポリアスパラギン酸カラム)上でのクロマトグラフィー、クロマトフォーカシング、SDS-PAGE及び硫酸アンモニウム沈殿法も利用可能である。本発明の抗体コンストラクトがCH3ドメインを含む場合、Bakerbond ABX樹脂(J.T.Baker、Phillipsburg、NJ)が精製に有用である。
nyを参照されたい)。このような実施形態では、好適な製剤材料は、以下を含み得るが、これらに限定されない:
・荷電アミノ酸、好ましくはリジン、酢酸リジン、アルギニン、グルタミン酸塩及び/又はヒスチジンを含むアミノ酸、例えば、グリシン、アラニン、グルタミン、アスパラギン、スレオニン、プロリン、2-フェニルアラニン
・抗菌剤及び抗真菌剤などの抗菌薬
・アスコルビン酸、メチオニン、亜硫酸ナトリウム又は亜硫酸水素ナトリウムなどの抗酸化剤;
・生理的なpH又はそれよりわずかに低いpH、好ましくはより低い4.0~6.5のpHで組成物を維持するのに使用される緩衝液、緩衝液系及び緩衝化剤;緩衝液の例は、ホウ酸塩、炭酸水素塩、トリス-HCl、クエン酸塩、リン酸塩又は他の有機酸、コハク酸塩、リン酸塩及びヒスチジンである;例えば、約pH7.0~8.5のトリス緩衝液;
・非水性溶媒、例えばプロピレングリコール、ポリエチレングリコール、オリーブ油などの植物油及びオレイン酸エチルなどの注射可能な有機エステル;
・生理食塩水及び緩衝媒体を含む、水、アルコール/水溶液、エマルジョン又は懸濁液を含む水性担体;
・ポリエステルなどの生分解性ポリマー;
・マンニトール又はグリシンなどの充填剤;
・エチレンジアミン四酢酸(EDTA)などのキレート剤;
・等張剤及び吸収遅延剤;
・錯化剤、例えばカフェイン、ポリビニルピロリドン、β-シクロデキストリン又はヒドロキシプロピル-β-シクロデキストリン)
・注入剤;
・単糖類;二糖類;及び他の糖質(グルコース、マンノース又はデキストリンなど);糖質は非還元糖、好ましくはトレハロース、スクロース、オクタスルファート、ソルビトール又はキシリトールであり得る;
・(低分子量)タンパク質、ポリペプチド又はタンパク質性担体、例えばヒト若しくはウシ血清アルブミン、ゼラチン又は好ましくはヒト起源の免疫グロブリン;
・着色及び着香剤;
・硫黄含有還元剤、例えばグルタチオン、チオクト酸、チオグリコール酸ナトリウム、チオグリセロール、[α]-モノチオグリセロール及びチオ硫酸ナトリウム
・希釈剤;
・乳化剤;
・ポリビニルピロリドンなどの親水性ポリマー)
・ナトリウムなどの塩形成対イオン;
・抗菌薬、抗酸化剤、キレート剤、不活性ガスなどの保存剤;例は、塩化ベンザルコニウム、安息香酸、サリチル酸、チメロサール、フェネチルアルコール、メチルパラベン、プロピルパラベン、クロルヘキシジン、ソルビン酸又は過酸化水素である);
・Zn-タンパク質錯体などの金属錯体;
・溶媒及び共溶媒(グリセリン、プロピレングリコール又はポリエチレングリコールなど);
・糖及び糖アルコール、例えばトレハロース、スクロース、オクタスルファート、マンニトール、ソルビトール又はキシリトール、スタキオース、マンノース、ソルボース、キシロース、リボース、ミオイニシトース(myoinisitose)、ガラクトース、ラクチトール、リビトール、ミオイニシトール(myoinisitol)、ガラクチトール、グリセロール、シクリトール(例えば、イノシトール)、ポリエチレングリコール;及び多価糖アルコール;
・懸濁化剤;
・界面活性剤又は湿潤剤、例えばプルロニック(登録商標)、PEG、ソルビタンエステル、ポリソルベート、例えばポリソルベート20、ポリソルベート、トリトン、トロメタ
ミン、レシチン、コレステロール、チロキサポール(tyloxapal);界面活性剤は、好ましくは、>1.2KDの分子量を有する洗剤及び/又は好ましくは>3KDの分子量を有するポリエーテルであり得;好ましい洗剤の非限定的な例は、Tween 20、Tween 40、Tween 60、Tween 80及びTween 85であり;好ましいポリエーテルの非限定的な例は、PEG 3000、PEG 3350、PEG 4000及びPEG 5000である;
・スクロース又はソルビトールなどの安定性増強剤;
・等張性増強剤、例えばアルカリ金属ハロゲン化物、好ましくは塩化ナトリウム又は塩化カリウム、マンニトール、ソルビトール;
・塩化ナトリウム溶液、リンゲルデキストロース、デキストロース及び塩化ナトリウム、乳酸リンゲル液又は固定油を含む非経口送達ビヒクル;
・体液及び栄養補充液、電解質補充液(リンゲルデキストロースをベースにしたものなど)を含む静脈内送達ビヒクル。
(a)少なくとも3つのドメインを含む抗体コンストラクトであって、
・第1のドメインは、標的細胞の表面抗原に結合し、且つ4~9.5の範囲の等電点(pI)を有し;
・第2のドメインは、第2の抗原に結合し、且つ8~10、好ましくは8.5~9.0の範囲のpIを有し;且つ
・任意選択的に、第3のドメインは、2つのポリペプチド単量体であって、それぞれヒンジ、CH2ドメイン及びCH3ドメインを含む2つのポリペプチド単量体を含み、前記2つのポリペプチド単量体は、ペプチドリンカーを介して互いに融合される、抗体コンストラクト;
(b)少なくとも1種の緩衝剤;
(c)少なくとも1種の糖類;及び
(d)少なくとも1種の界面活性剤
を含み、医薬組成物のpHは、3.5~6の範囲である。
に想定される。前記1種以上の賦形剤は、0.1~15%(w/V)の濃度範囲で存在することが本発明に関連して想定される。
(a)上記のとおりの抗体コンストラクト、
(b)10mMのグルタミン酸塩又は酢酸塩、
(c)9%(m/V)のスクロース又は6%(m/V)のスクロース及び6%(m/V)のヒドロキシプロピル-β-シクロデキストリン、
(d)0.01%(m/V)のポリソルベート80
を含み、液体医薬組成物のpHは、4.2であることも本発明に関連して想定される。
きる産物の制御放出又は持続放出を提供し得る薬剤、例えば注射可能なミクロスフェア、生体内分解性粒子、ポリマー性化合物(ポリ乳酸若しくはポリグリコール酸など)、ビーズ又はリポソームと所望の分子との製剤を含み得る。ある種の実施形態では、循環中の持続期間を増進する効果を有するヒアルロン酸も使用され得る。ある種の実施形態では、移植可能な薬物送達デバイスを使用して、所望の抗体コンストラクトを導入し得る。
.,「Physical stabilization of proteins in
aqueous solution」 in:RATIONAL DESIGN OF
STABLE PROTEIN FORMULATIONS:THEORY AND PRACTICE,Carpenter and Manning,eds.Pharmaceutical Biotechnology.13:61-84(2002)及びRandolph et al.,「Surfactant-protein interactions」,Pharm Biotechnol.13:159-75(2002)、特に獣医学的及び/又はヒト医療用途のタンパク質医薬品及びプロセスに関して、特に本発明による自己緩衝性タンパク質製剤と同じ賦形剤及びプロセスに関する部分を参照されたい。
結解凍ストレスから保護するための安定化剤として好ましいものの中に含まれる。還元糖(遊離アルデヒド基又はケトン基を含有する)、例えばグルコース及びラクトースは、表面のリジン及びアルギニン残基を糖化することができる。したがって、それらは、一般に、本発明による使用のための好ましいポリオールの中に含まれない。加えて、そのような反応種を形成する糖、例えばスクロースも、酸性条件下でフルクトース及びグルコースに加水分解され、その結果糖化を生じさせる点で本発明の好ましいポリオールの中に含まれない。PEGは、タンパク質を安定化すること及び凍結保護物質として有用であり、この点に関して本発明に使用することができる。
2、Cu+2及びFe+2によって不安定化されることがあり、その凝集は、Al+3イオンによって増大し得る。
有される。Gabizon et al.J.National Cancer Inst.81(19)1484(1989)を参照されたい。
、細胞内及び細胞外空間、組織及び臓器などのような、身体の様々な区画にわたる薬物の保持度並びにこれらの区画内での薬物の分布を意味する。「血清結合の程度」は、薬物がアルブミンなどの血清タンパク質と相互作用して結合し、薬物の生物活性の低減又は消失をもたらす傾向を意味する。
・製剤:
pH6.0のリン酸カリウム、L-アルギニン塩酸塩、トレハロース二水和物、ポリソルベート80
医薬組成物の形態の本発明の抗体コンストラクトの安定性の評価の他の例は、付属の実施例4~12に提供される。それらの実施例において、本発明の抗体コンストラクトの実施形態は、異なる医薬製剤において異なるストレス条件に関して試験され、その結果が、当技術分野で知られる他の半減期延長(HLE)形式の二重特異性T細胞エンゲージ抗体コンストラクトと比較される。一般に、本発明による特定のFC様式で提供される抗体コンストラクトは、通常、異なるHLE形式とともに提供される抗体コンストラクト及びいかなるHLE形式も有しない抗体コンストラクト(例えば、「カノニカル」な抗体コンス
トラクト)の両方と比較して、温度及び光ストレスなどの広範囲のストレス条件に対してより安定であることが想定される。前述の温度安定性は、低温(凍結温度を含む室温未満)及び高温(体温までの又は体温を超える温度を含む室温超)の両方に関連し得る。当業者が認めるとおり、診療において避けるのが困難なストレスに対するそのような安定性の向上により、診療において分解産物がより少なくなるため、抗体コンストラクトがより安全になる。結果として、前述の安定性の向上は、安全性の向上を意味する。
本明細書で使用する場合、用語「免疫障害」は、この用語の一般的な定義に沿って自己免疫疾患、過敏症、免疫不全などの免疫障害を表す。
象及びその障害を予防しようとする対象を含む。必要とする対象又は「患者」は、予防的治療又は治療的治療のいずれかを受けるヒト及び他の哺乳動物対象を含む。
・局所経路(例えば、皮膚上、吸入、鼻、眼、耳介/耳、膣、粘膜);
・腸経路(例えば、経口、胃腸、舌下、唇下、頬側、直腸);及び
・非経口経路(例えば、静脈内、動脈内、骨内、筋肉内、脳内、脳室内、硬膜外、髄腔内、皮下、腹腔内、羊膜外、関節内、心臓内、皮内、病巣内、子宮内、膀胱内、硝子体内、経皮、鼻腔内、経粘膜、滑液嚢内、管腔内)
を含むが、これらに限定されない。
与され得るか、又は前記抗体コンストラクトの投与前若しくは投与後に既定の時間間隔及び用量で別々に投与され得る。
for adverse events v3.0(CTCAE)に示される、アレルギー/免疫学、血液/骨髄、心不整脈、凝固などの基準を含み得る。試験され得る検査パラメータは、例えば、血液学、臨床化学、凝固プロファイル及び尿検査並びに他の体液、例えば血清、血漿、リンパ液又は脊髄液、髄液などの検査を含む。したがって、安全性は、例えば、身体検査、画像化技術(すなわち超音波、x線、CTスキャン、磁気共鳴画像法(MRI)、技術的デバイスを用いた他の計測(すなわち心電図)、バイタルサインにより、検査パラメータを測定し、有害事象を記録することにより評価することができる。例えば、本発明による使用及び方法において、チンパンジーではない霊長類における有害事象は、組織病理学的方法及び/又は組織化学的方法により試験され得る。
ばプラスチック又はガラス)の1つ以上の容器(例えば、バイアル、アンプル、コンテナ、シリンジ、ボトル、バッグ)を含み得る。キットは、(例えば、リーフレット又は取扱説明書の形態の)使用のための指示書、本発明の抗体コンストラクトを投与するための手段、例えばシリンジ、ポンプ、インフューザーなど、本発明の抗体コンストラクトを再構成するための手段及び/又は本発明の抗体コンストラクトを希釈するための手段をさらに含み得る。
本発明は、本明細書に記載される特定の方法論、プロトコル、材料、試薬及び物質などに限定されず、そのようなものとして変動し得ることが理解されるべきである。本明細書で使用する専門用語は、特定の実施形態を説明するためのものにすぎず、本発明の範囲を限定するように意図されておらず、本発明の範囲は、特許請求の範囲によってのみ定義される。
MUC17の細胞表面レベルは、QIFIkit(Dako)を使用してフローサイトメトリーによって決定された。接着細胞は、非酵素的な細胞解離緩衝液(Cellstripper、Corning)を用いて取り除かれ、続いて抗MUC17抗体4C11で染色された。4C11抗体は、MUC17のEGF-SEA-EGF領域(aa 4131~4493)を包含するDNAコンストラクトによるB6マウスの免疫化から作製されたモノクローナル抗体である。MUC17は、FITCにコンジュゲートされた二次抗体とのインキュベーションにより検出され、フローサイトメトリーにより分析された。相対的な抗体結合能は、標準物質としてキットにおいて提供されたビーズ試料を使用してQIFIkit(Dako)によって決定された。結果は、図3(A)において示される。癌細胞株中のMUC17遺伝子の発現レベルは、Applied Biosystems/Thermo Fisherからの方法及びプローブを使用する定量的ポリメラーゼ連鎖反応(qPCR)によって決定された。RNAが癌細胞株から単離され、続いてcDNAに転写された。MUC17のcDNAは、qPCRを使用して、MUC17に特異的なプローブで増幅された。MUC17の遺伝子発現レベルは、そのような構成的に発現される遺伝子のレベルに正規化され、図3(B)に示された。
実施例2:MUC17二重特異性抗体コンストラクトのインビトロ有効性の評価
MUC17 HLE抗体コンストラクトの細胞活性は、T細胞依存性細胞傷害(TDCC)アッセイにおいて評価された。エフェクター細胞は、AllCells又はCepheus Biosciences,Inc.などの商用の供給源から得られた。ヒト汎T細胞、ヒトPBMC又はカニクイザル由来のPBMCは、ある用量範囲の抗体コンストラクトの存在下でヒト又はカニクイザルのMUC17を発現する標的細胞と10:1又は5:1でインキュベートされた。インキュベーションの48時間後、細胞傷害性は、発光アッセイ(Cell T-glo又はSteady-glo(Promega))又は細胞傷害性の読み出し情報としてのハイコンテントイメージング(Cellomics ArrayScan)を使用して評価された。結果は、図4及び5において示される。
実施例3:MUC17二重特異性抗体コンストラクトのインビボ有効性を評価する異種移植試験
異種移植試験の目的は、雌NOD/SCIDマウスにおけるヒト胃癌の進行期皮下GSU-luc異種移植モデルの静脈内投与後の半減期延長MUC17/CD3二重特異性抗
体コンストラクトの抗腫瘍活性を評価することであった。
播種のための標的細胞及びエフェクター細胞の作製
標的細胞:
ホタルルシフェラーゼ(GSU-luc)を安定的に発現するためのベクターLV417-Lucでレンチウイルスにより形質導入されたヒト胃癌腫細胞GSUは、収集され、遠心分離され、冷DPBSで洗浄され、計数され、5×107細胞/mLの濃度に調整された。合計5×106細胞/マウスは、雌NOD/SCIDマウス(供給業者:Envigo)の右背側側腹部に100μLの最終体積で皮下(SC)注射された。
エフェクター細胞:
ヒトT細胞は、健常ドナー(#0801)の新鮮な血液から単離され、汎T細胞単離キット(#130-096-535)を使用してCD3+T細胞について濃縮され、ヒトT細胞活性化/増殖キット(#130-091-441、両方ともにMiltenyi Biotec)を使用して、製造業者の指示書に従って活性化され、増殖された。
動物は、MUC17二重特異性抗体コンストラクト又は対照物品を静脈内(IV)ボーラス注射(尾静脈への)により受容した。マウスは、表4に従って治療された。
1日目:雌NOD/Scidマウスの右背側側腹部への腫瘍細胞(GSU-luc)の皮下注射(上記を参照されたい)。動物は、試験開始時に6週齢であった。
7日目:抗アシアロ処理。
残存するNK細胞/NK細胞活性を枯渇させるために、マウスをポリクローナル(ウサギ抗マウス)抗アシアロGM1抗体の単回投与により処理した。抗アシアロGM1抗体が製造業者の指示書に従って再構成され、H2Oによる50μlの1:2.5希釈物が側方の尾静脈にIV注射される。
8日目:マウスの腹膜腔へのCD3+T細胞の注射(上記を参照されたい)。
11、18及び25日目:FcR遮断。
試験物品のFc領域を変異させて、Fcγ受容体への結合を妨げた。しかしながら、NOD/ScidマウスはB細胞を欠いて、低い免疫グロブリンレベルをもたらすため、FcR遮断を実施して、抗体依存性細胞性細胞傷害によるCD3+エフェクター細胞の潜在的な減少を回避した。11、18及び25日目に、マウスは、2.4G2抗FcγR抗体(8mg/kg)及びKiovig(400mg/kg)の混合物を、1回の注射につき1マウス当たり200μlの最終体積で腹腔内ボーラス注射により受容した。
12、19及び26日目:試験物品又は対照物品による治療(表4を参照されたい)。
動物は、試験物品(MUC17/CD3二重特異性抗体コンストラクト)又は対照物品(溶媒)を表4に従って12、19及び26日目に側方の尾静脈への静脈内(IV)ボーラス注射によって受容した。用量体積は、1回の注射につき1マウス当たり合計100μlとなるように一定に保たれた。試験される物品は、10mMのL-グルタミン酸、9%(w/v)スクロース、0.01%(w/v)PS80中において、pH4.2、1.04mg/mlの原液濃度で製剤化され、溶媒(0.9%(w/v)塩化ナトリウム、pH7.0中の25mM L-リジン一塩酸塩、0.002%(w/v)ポリソルベート80)中において、決定された直近の群平均体重(BW)に従って希釈された。用量濃度(c)は、次の式を使用して計算された。
実験的調査及び計算。
試験経過中、全ての動物は、全身の外見、活性、挙動及び生存に関して毎日観察された。全ての発見及び所見は、試験ファイル中の適切なシートに記述された。体重は、試験の経過全体にわたって1週間当たり3回測定された。腫瘍増殖の進行は、外側キャリパーを使用して腫瘍の高さ及び幅の測定によって決定された。腫瘍増殖は、1週間当たり3回測定され、腫瘍体積(TV)は、式:TV=
Prismを使用して計算された。図表の結果は、群平均±平均値の標準誤差として図6において表される。データは、一元配置分散分析(ANOVA)によって分析され、腫瘍増殖に関する実験結果の相違は、対照群2に対する比較についてダネットの事後検定によって評価された。相対的な腫瘍体積(RTV)は、n日目の群平均腫瘍体積を治療開始前日(11日目)の群平均腫瘍体積で除算することによって計算された。腫瘍増殖の阻害
は、対照群における全ての動物が生きていた最後の日である20日目に関して、次の式に従って定量化された。
MUC17/CD3二重特異性抗体コンストラクト(試験物品、配列番号186)によるGSU-luc担腫瘍マウスの静脈内治療は、対照群における溶媒治療マウスと比較して、統計学的に有意且つ用量依存的な腫瘍増殖の阻害をもたらした。12日目の治療開始後、p<0.01(0.25mg/kg)又はP<0.001(2.5mg/kg)の値は、18日目及び20日目に達成された。対照群における大多数の動物(6/10)が終了されなければならなかったため、20日目以降の統計分析は、実施されなかった。20日目に観察された腫瘍増殖の阻害は、24%(0.025mg/kg)、58%(0.25mg/kg)及び77%(2.5mg/kg)であった。20日目の相対的な腫瘍体積(RTV)の比較は、溶媒治療マウスにおける腫瘍増殖が治療開始前日に対して平均4.2倍大きい体積を有した一方、試験物品で治療された群におけるRTVは、3.4(0.025mg/kg)、2.4(0.25mg/kg)及び1.0(2.5mg/kg)であったことを示す。2.5mg/kgでの治療後、29日目までRTVは、<2.0であった。2つの溶媒治療対照群の比較は、T細胞が試験物品の非存在下でGSU-luc細胞の増殖に影響を及ぼさないことを明らかにした。マウスが非該当種であるため、試験物品は、十分に耐容性を示し、薬物に関連する有害事象は、予測も観察もされなかった。要約すると、2.5又は0.25mg/kgでの本発明による二重特異性抗体コンストラクト(試験物品、配列番号186)の静脈内投与は、雌NOD/Scidマウスにおいて統計学的に有意且つ用量依存的な皮下GSU-luc腫瘍の増殖の阻害をもたらした。
実施例4:カニクイザルにおける探索性の毒性試験
MUC17 HLE BiTE抗体コンストラクト(配列番号186、コンストラクト8-B7)は、カニクイザルにおける探索性の毒性試験において評価された。3頭のサルに、試験の1日目及び8日目の静脈内注射により、100μg/kg又は1000μg/kgのいずれかのMUC17 scFc二重特異性抗体コンストラクトを投与した。MUC17 scFc二重特異性抗体コンストラクト(配列番号186)は、両方の用量で十分に耐容性を示し、関連する臨床徴候又は体重の変化を伴わなかった。体温の一過的な上昇が100μg/kg及び1000μg/kgで記録された。MUC17 scFc二重特異性抗体コンストラクト活性のいくつかの特徴(リンパ球再分布、好中球及び単球の増加、C反応性タンパク質の増加、サイトカインの若干の増加)が、MUC17 scFc二重特異性抗体コンストラクトで治療されたサルの血液試料において観察された。免疫組織化学により、検討中の探索性の毒性学試験において評価されたサルから採取された小腸の粘膜表面上でMUC17発現が確認されたが、MUC17を発現する組織における病理組織学的変化はなかった。
カニクイザルにおけるMUC17 scFc二重特異性抗体コンストラクトの毒物動態学的パラメータ
MUC17 scFc二重特異性抗体コンストラクト(配列番号186)の毒物動態学的パラメータは、探索性の毒性試験において評価されたサルから採取された血液試料において評価された。血液試料は、投与前及び各投与の0.083、4、8、24、48、96及び168時間後に回収された。MUC17 scFc二重特異性抗体コンストラクトの血清濃度は、その抗体コンストラクトを捕捉するためのMUC17に対して向けられるルテニウム化マウス抗ヒトIgG Fc 1.35.1 mAb及びそのコンストラクトを検出するためのFc部分に対して向けられる抗体を使用するイムノアッセイによって決
定された。MUC17 scFc二重特異性抗体コンストラクトの血清レベルは、最初の投与後に分析された全ての時点で検出された。データを2コンパートメントモデルにフィットさせた。図8(B)は、個々のデータ(点)及び平均値(線)を示す。全身クリアランス(CL)、コンパートメント間クリアランス(Q)、血清体積/中心コンパートメントの体積(Vp)、組織体積/組織コンパートメントの体積(Vt)、終末半減期(t1/2)並びに第2の用量1000mcg/kg用量に関して、平均最大濃度(Cmax)及び血清濃度-時間下面積(AUCinf)を含むいくつかの薬物動態パラメータが評価された。
実施例5:正常腸管細胞におけるT細胞依存性細胞傷害アッセイ
ヒト及びカニクイザルの正常腸管細胞の粘膜表面へのMUC17の局在化が、MUC17 scFc二重特異性抗体コンストラクト(配列番号186)の細胞傷害活性と隔絶されているという考えをさらに試験するために、MUC17の発現及びMUC17 scFc二重特異性抗体コンストラクトの活性がインビトロの正常細胞において評価される。MUC17の細胞表面発現は、蛍光標識細胞分取によって評価される。MUC17 scFc二重特異性抗体コンストラクトの細胞傷害活性は、T細胞依存性細胞傷害(TDCC)アッセイにおいて評価され、ここで、MUC17 scFc二重特異性抗体コンストラクトは、MUC17陽性標的細胞及びヒト又はサルのエフェクター細胞(すなわちT細胞又は末梢血単核球)とインキュベートされ、続いて細胞の生存率が評価される。これらの実験は、標準的な二次元細胞培養を使用して最初に試験される。しかしながら、粘膜表面へのMUC17の局在化をより良好に観察するために、正常細胞は、細胞外マトリックス上又はオルガノイド培養中での増殖などの上皮細胞の極性を維持する方法で培養される。MUC17 scFc二重特異性抗体コンストラクトは、正常、すなわち非癌腸管細胞に関してTDCCの有意な増加を示さなかった。
非限定的に、本発明は以下の態様を含む。
[態様1]
二重特異性抗体コンストラクトであって、
・MUC17に結合する第1のドメイン、及び
・ヒト及びマカクCD3ε鎖の細胞外エピトープに結合する第2のドメイン
を含む二重特異性抗体コンストラクト。
[態様2]
2つのポリペプチド単量体であって、それぞれヒンジ、CH2ドメイン及びCH3ドメインを含む2つのポリペプチド単量体を含む第3のドメインであって、前記2つのポリペプチド単量体は、ペプチドリンカーを介して互いに融合される、第3のドメインをさらに含む、態様1に記載の二重特異性抗体コンストラクト。
[態様3]
一本鎖抗体コンストラクトである、態様1又は2に記載の二重特異性抗体コンストラクト。
[態様4]
前記第3のドメインは、アミノからカルボキシルの順に、
ヒンジ-CH2-CH3-リンカー-ヒンジ-CH2-CH3
を含む、態様2又は3に記載の二重特異性抗体コンストラクト。
[態様5]
前記第3のドメインにおける前記ポリペプチド単量体の各々は、配列番号17~24からなる群から選択される配列と少なくとも90%同一であるアミノ酸配列を有する、態様1~4のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様6]
前記ポリペプチド単量体の各々は、配列番号17~24から選択されるアミノ酸配列を有する、態様1~5のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様7]
前記CH2ドメインは、ドメイン内システインジスルフィド架橋を含む、態様1~6のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様8]
(i)前記第1のドメインは、2つの抗体可変ドメインを含み、且つ前記第2のドメインは、2つの抗体可変ドメインを含むか;
(ii)前記第1のドメインは、1つの抗体可変ドメインを含み、且つ前記第2のドメインは、2つの抗体可変ドメインを含むか;
(iii)前記第1のドメインは、2つの抗体可変ドメインを含み、且つ前記第2のドメインは、1つの抗体可変ドメインを含むか;又は
(iv)前記第1のドメインは、1つの抗体可変ドメインを含み、且つ前記第2のドメインは、1つの抗体可変ドメインを含む、態様1~7のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様9]
前記第1のドメイン及び第2のドメインは、ペプチドリンカーを介して前記第3のドメインに融合される、態様1~8のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様10]
アミノからカルボキシルの順に、
(a)前記第1のドメイン;
(b)好ましくは配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)前記第2のドメイン
を含む、態様1~9のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様11]
アミノからカルボキシルの順に、
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)前記第3のドメインの第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)前記第3のドメインの第2のポリペプチド単量体
をさらに含む、態様10に記載の二重特異性抗体コンストラクト。
[態様12]
前記抗体コンストラクトの前記第1のドメインは、配列番号528(uniprot Q685J3付番に従うaa 4171~4296)に対応するMUC17内のエピトープに結合する、態様1~11のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様13]
前記抗体コンストラクトの前記第1のドメインは、配列番号529(uniprot Q685J3付番に従うaa 4189~4291)に対応するMUC17内のエピトープに結合する、態様1~12のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様14]
前記抗体コンストラクトの前記第1のドメインは、配列番号530(uniprot Q685J3付番に従うaa 4131~4243)に対応するMUC17内のエピトープに結合する、態様1~13のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様15]
前記抗体コンストラクトの前記第1のドメインは、配列番号531(uniprot Q685J3付番に従うaa 4244~4389)に対応するMUC17内のエピトープに結合する、態様1~14のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様16]
前記抗体コンストラクトの前記第1のドメインは、配列番号530(uniprot Q685J3付番に従うaa 4131~4243)に対応するMUC17内のエピトープに結合するが、配列番号531(uniprot Q685J3付番に従うaa 4244~4389)に対応するMUC17内のエピトープに結合しない、態様1~15のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様17]
前記抗体コンストラクトの前記第1のドメインは、配列番号532(uniprot Q685J3付番に従うaa 4171~4390)又は配列番号533(uniprot Q685J3付番に従うaa 4184~4390)に対応するMUC17内のエピトープに結合するが、配列番号534(uniprot Q685J3付番に従うaa 4291~4390)に対応するMUC17内のエピトープ又は配列番号535(uniprot Q685J3付番に従うaa 4341~4390)に対応するMUC17内のエピトープに結合しない、態様1~16のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様18]
細胞傷害性と結合親和性との間の比率(EC50/KD)*1000は、250未満であり、前記細胞傷害性は、標的細胞としてのNUGC-4細胞及びエフェクター細胞としてのhuPBMCにおいて決定され、前記結合親和性は、表面プラズモン共鳴に基づくアッセイによって決定される、態様1~17のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様19]
細胞傷害性と結合親和性との間の比率(EC50/KD)*1000は、125未満であり、前記細胞傷害性は、標的細胞としてのNUGC-4細胞及びエフェクター細胞としてのhuPBMCにおいて決定され、前記結合親和性は、表面プラズモン共鳴に基づくアッセイによって決定される、態様1~18のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様20]
細胞傷害性と結合親和性との間の比率(EC50/KD)*1000は、21未満であり、前記細胞傷害性は、標的細胞としてのNUGC-4細胞及びエフェクター細胞としてのhuPBMCにおいて決定され、前記結合親和性は、表面プラズモン共鳴に基づくアッセイによって決定される、態様1~19のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様21]
前記第1の結合ドメインは、
(a)配列番号33に示されるとおりのCDR-H1、配列番号34に示されるとおりのCDR-H2及び配列番号35に示されるとおりのCDR-H3;
(b)配列番号44に示されるとおりのCDR-H1、配列番号45に示されるとおりのCDR-H2及び配列番号46に示されるとおりのCDR-H3;
(c)配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(d)配列番号66に示されるとおりのCDR-H1、配列番号67に示されるとおりのCDR-H2及び配列番号68に示されるとおりのCDR-H3;
(e)配列番号77に示されるとおりのCDR-H1、配列番号78に示されるとおりのCDR-H2及び配列番号79に示されるとおりのCDR-H3;
(f)配列番号88に示されるとおりのCDR-H1、配列番号89に示されるとおりのCDR-H2及び配列番号90に示されるとおりのCDR-H3;
(g)配列番号99に示されるとおりのCDR-H1、配列番号100に示されるとおりのCDR-H2及び配列番号101に示されるとおりのCDR-H3;
(h)配列番号110に示されるとおりのCDR-H1、配列番号111に示されるとおりのCDR-H2及び配列番号112に示されるとおりのCDR-H3;
(i)配列番号121に示されるとおりのCDR-H1、配列番号122に示されるとおりのCDR-H2及び配列番号123に示されるとおりのCDR-H3;
(j)配列番号132に示されるとおりのCDR-H1、配列番号133に示されるとおりのCDR-H2及び配列番号134に示されるとおりのCDR-H3;
(k)配列番号143に示されるとおりのCDR-H1、配列番号144に示されるとおりのCDR-H2及び配列番号145に示されるとおりのCDR-H3;
(l)配列番号154に示されるとおりのCDR-H1、配列番号155に示されるとおりのCDR-H2及び配列番号156に示されるとおりのCDR-H3;
(m)配列番号165に示されるとおりのCDR-H1、配列番号166に示されるとおりのCDR-H2及び配列番号167に示されるとおりのCDR-H3;
(n)配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(o)配列番号187に示されるとおりのCDR-H1、配列番号188に示されるとおりのCDR-H2及び配列番号189に示されるとおりのCDR-H3;
(p)配列番号198に示されるとおりのCDR-H1、配列番号199に示されるとおりのCDR-H2及び配列番号200に示されるとおりのCDR-H3;
(q)配列番号209に示されるとおりのCDR-H1、配列番号210に示されるとおりのCDR-H2及び配列番号211に示されるとおりのCDR-H3;
(r)配列番号220に示されるとおりのCDR-H1、配列番号221に示されるとおりのCDR-H2及び配列番号222に示されるとおりのCDR-H3;
(s)配列番号231に示されるとおりのCDR-H1、配列番号232に示されるとおりのCDR-H2及び配列番号233に示されるとおりのCDR-H3;
(t)配列番号242に示されるとおりのCDR-H1、配列番号243に示されるとおりのCDR-H2及び配列番号244に示されるとおりのCDR-H3;
(u)配列番号253に示されるとおりのCDR-H1、配列番号254に示されるとおりのCDR-H2及び配列番号255に示されるとおりのCDR-H3;
(v)配列番号264に示されるとおりのCDR-H1、配列番号265に示されるとおりのCDR-H2及び配列番号266に示されるとおりのCDR-H3;
(w)配列番号275に示されるとおりのCDR-H1、配列番号276に示されるとおりのCDR-H2及び配列番号276に示されるとおりのCDR-H3;
(x)配列番号286に示されるとおりのCDR-H1、配列番号287に示されるとおりのCDR-H2及び配列番号288に示されるとおりのCDR-H3;
(y)配列番号297に示されるとおりのCDR-H1、配列番号298に示されるとおりのCDR-H2及び配列番号299に示されるとおりのCDR-H3;
(z)配列番号308に示されるとおりのCDR-H1、配列番号309に示されるとおりのCDR-H2及び配列番号310に示されるとおりのCDR-H3;
(aa)配列番号319に示されるとおりのCDR-H1、配列番号320に示されるとおりのCDR-H2及び配列番号321に示されるとおりのCDR-H3;
(ab)配列番号330に示されるとおりのCDR-H1、配列番号331に示されるとおりのCDR-H2及び配列番号332に示されるとおりのCDR-H3;
(ac)配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;
(ad)配列番号352に示されるとおりのCDR-H1、配列番号353に示されるとおりのCDR-H2及び配列番号354に示されるとおりのCDR-H3;
(ae)配列番号363に示されるとおりのCDR-H1、配列番号364に示されるとおりのCDR-H2及び配列番号365に示されるとおりのCDR-H3;
(af)配列番号374に示されるとおりのCDR-H1、配列番号375に示されるとおりのCDR-H2及び配列番号376に示されるとおりのCDR-H3;
(ag)配列番号385に示されるとおりのCDR-H1、配列番号386に示されるとおりのCDR-H2及び配列番号386に示されるとおりのCDR-H3;
(ah)配列番号396に示されるとおりのCDR-H1、配列番号397に示されるとおりのCDR-H2及び配列番号398に示されるとおりのCDR-H3;
(ai)配列番号407に示されるとおりのCDR-H1、配列番号408に示されるとおりのCDR-H2及び配列番号409に示されるとおりのCDR-H3;
(aj)配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3;
(ak)配列番号429に示されるとおりのCDR-H1、配列番号430に示されるとおりのCDR-H2及び配列番号431に示されるとおりのCDR-H3;
(al)配列番号440に示されるとおりのCDR-H1、配列番号441に示されるとおりのCDR-H2及び配列番号442に示されるとおりのCDR-H3;
(am)配列番号451に示されるとおりのCDR-H1、配列番号452に示されるとおりのCDR-H2及び配列番号453に示されるとおりのCDR-H3;
(an)配列番号462に示されるとおりのCDR-H1、配列番号463に示されるとおりのCDR-H2及び配列番号464に示されるとおりのCDR-H3;
(ao)配列番号473に示されるとおりのCDR-H1、配列番号474に示されるとおりのCDR-H2及び配列番号475に示されるとおりのCDR-H3;
(ap)配列番号484に示されるとおりのCDR-H1、配列番号485に示されるとおりのCDR-H2及び配列番号486に示されるとおりのCDR-H3;
(aq)配列番号495に示されるとおりのCDR-H1、配列番号496に示されるとおりのCDR-H2及び配列番号497に示されるとおりのCDR-H3;
(ar)配列番号506に示されるとおりのCDR-H1、配列番号507に示されるとおりのCDR-H2及び配列番号508に示されるとおりのCDR-H3;及び
(as)配列番号517に示されるとおりのCDR-H1、配列番号518に示されるとおりのCDR-H2及び配列番号519に示されるとおりのCDR-H3
から選択されるCDR-H1、CDR-H2及びCDR-H3を含むVH領域を含み;
(c)配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(n)配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(ac)配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;及び
(aj)配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3
が好ましい、態様1~20のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様22]
前記第1の結合ドメインは、
(a)配列番号36に示されるとおりのCDR-L1、配列番号37に示されるとおりのCDR-L2及び配列番号38に示されるとおりのCDR-L3;
(b)配列番号47に示されるとおりのCDR-L1、配列番号48に示されるとおりのCDR-L2及び配列番号49に示されるとおりのCDR-L3;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3;
(d)配列番号69に示されるとおりのCDR-L1、配列番号70に示されるとおりのCDR-L2及び配列番号71に示されるとおりのCDR-L3;
(e)配列番号80に示されるとおりのCDR-L1、配列番号81に示されるとおりのCDR-L2及び配列番号82に示されるとおりのCDR-L3;
(f)配列番号91に示されるとおりのCDR-L1、配列番号92に示されるとおりのCDR-L2及び配列番号93に示されるとおりのCDR-L3;
(g)配列番号102に示されるとおりのCDR-L1、配列番号103に示されるとおりのCDR-L2及び配列番号104に示されるとおりのCDR-L3;
(h)配列番号113に示されるとおりのCDR-L1、配列番号114に示されるとおりのCDR-L2及び配列番号115に示されるとおりのCDR-L3;
(i)配列番号124に示されるとおりのCDR-L1、配列番号125に示されるとおりのCDR-L2及び配列番号126に示されるとおりのCDR-L3;
(j)配列番号135に示されるとおりのCDR-L1、配列番号136に示されるとおりのCDR-L2及び配列番号137に示されるとおりのCDR-L3;
(k)配列番号146に示されるとおりのCDR-L1、配列番号147に示されるとおりのCDR-L2及び配列番号148に示されるとおりのCDR-L3;
(l)配列番号157に示されるとおりのCDR-L1、配列番号158に示されるとおりのCDR-L2及び配列番号159に示されるとおりのCDR-L3;
(m)配列番号168に示されるとおりのCDR-L1、配列番号169に示されるとおりのCDR-L2及び配列番号170に示されるとおりのCDR-L3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3;
(o)配列番号190に示されるとおりのCDR-L1、配列番号191に示されるとおりのCDR-L2及び配列番号192に示されるとおりのCDR-L3;
(p)配列番号201に示されるとおりのCDR-L1、配列番号202に示されるとおりのCDR-L2及び配列番号203に示されるとおりのCDR-L3;
(q)配列番号212に示されるとおりのCDR-L1、配列番号213に示されるとおりのCDR-L2及び配列番号214に示されるとおりのCDR-L3;
(r)配列番号223に示されるとおりのCDR-L1、配列番号224に示されるとおりのCDR-L2及び配列番号225に示されるとおりのCDR-L3;
(s)配列番号234に示されるとおりのCDR-L1、配列番号235に示されるとおりのCDR-L2及び配列番号236に示されるとおりのCDR-L3;
(t)配列番号245に示されるとおりのCDR-L1、配列番号246に示されるとおりのCDR-L2及び配列番号247に示されるとおりのCDR-L3;
(u)配列番号256に示されるとおりのCDR-L1、配列番号257に示されるとおりのCDR-L2及び配列番号258に示されるとおりのCDR-L3;
(v)配列番号267に示されるとおりのCDR-L1、配列番号268に示されるとおりのCDR-L2及び配列番号269に示されるとおりのCDR-L3;
(w)配列番号278に示されるとおりのCDR-L1、配列番号279に示されるとおりのCDR-L2及び配列番号280に示されるとおりのCDR-L3;
(x)配列番号289に示されるとおりのCDR-L1、配列番号290に示されるとおりのCDR-L2及び配列番号291に示されるとおりのCDR-L3;
(y)配列番号300に示されるとおりのCDR-L1、配列番号301に示されるとおりのCDR-L2及び配列番号302に示されるとおりのCDR-L3;
(z)配列番号311に示されるとおりのCDR-L1、配列番号312に示されるとおりのCDR-L2及び配列番号313に示されるとおりのCDR-L3;
(aa)配列番号322に示されるとおりのCDR-L1、配列番号323に示されるとおりのCDR-L2及び配列番号324に示されるとおりのCDR-L3;
(ab)配列番号333に示されるとおりのCDR-L1、配列番号334に示されるとおりのCDR-L2及び配列番号335に示されるとおりのCDR-L3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3;
(ad)配列番号355に示されるとおりのCDR-L1、配列番号356に示されるとおりのCDR-L2及び配列番号357に示されるとおりのCDR-L3;
(ae)配列番号366に示されるとおりのCDR-L1、配列番号367に示されるとおりのCDR-L2及び配列番号368に示されるとおりのCDR-L3;
(af)配列番号377に示されるとおりのCDR-L1、配列番号378に示されるとおりのCDR-L2及び配列番号379に示されるとおりのCDR-L3;
(ag)配列番号388に示されるとおりのCDR-L1、配列番号389に示されるとおりのCDR-L2及び配列番号390に示されるとおりのCDR-L3;
(ah)配列番号399に示されるとおりのCDR-L1、配列番号400に示されるとおりのCDR-L2及び配列番号401に示されるとおりのCDR-L3;
(ai)配列番号410に示されるとおりのCDR-L1、配列番号411に示されるとおりのCDR-L2及び配列番号412に示されるとおりのCDR-L3;
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3;
(ak)配列番号432に示されるとおりのCDR-L1、配列番号433に示されるとおりのCDR-L2及び配列番号434に示されるとおりのCDR-L3;
(al)配列番号443に示されるとおりのCDR-L1、配列番号444に示されるとおりのCDR-L2及び配列番号445に示されるとおりのCDR-L3;
(am)配列番号454に示されるとおりのCDR-L1、配列番号455に示されるとおりのCDR-L2及び配列番号456に示されるとおりのCDR-L3;
(an)配列番号465に示されるとおりのCDR-L1、配列番号466に示されるとおりのCDR-L2及び配列番号467に示されるとおりのCDR-L3;
(ao)配列番号476に示されるとおりのCDR-L1、配列番号477に示されるとおりのCDR-L2及び配列番号478に示されるとおりのCDR-L3;
(ap)配列番号487に示されるとおりのCDR-L1、配列番号488に示されるとおりのCDR-L2及び配列番号489に示されるとおりのCDR-L3;
(aq)配列番号498に示されるとおりのCDR-L1、配列番号499に示されるとおりのCDR-L2及び配列番号500に示されるとおりのCDR-L3;
(ar)配列番号509に示されるとおりのCDR-L1、配列番号510に示されるとおりのCDR-L2及び配列番号511に示されるとおりのCDR-L3;及び
(as)配列番号520に示されるとおりのCDR-L1、配列番号521に示されるとおりのCDR-L2及び配列番号522に示されるとおりのCDR-L3
から選択されるCDR-H1、CDR-L2及びCDR-L3を含むVL領域を含み;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3;及び
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3
が好ましい、態様1~21のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様23]
前記第1の結合ドメインは、
(a)配列番号40に示されるとおりのVL領域及び配列番号39に示されるとおりのVH領域;
(b)配列番号51に示されるとおりのVL領域及び配列番号50に示されるとおりのVH領域;
(c)配列番号62に示されるとおりのVL領域及び配列番号61に示されるとおりのVH領域;
(d)配列番号73に示されるとおりのVL領域及び配列番号72に示されるとおりのVH領域;
(e)配列番号84に示されるとおりのVL領域及び配列番号83に示されるとおりのVH領域;
(f)配列番号95に示されるとおりのVL領域及び配列番号94に示されるとおりのVH領域;
(g)配列番号106に示されるとおりのVL領域及び配列番号105に示されるとおりのVH領域;
(h)配列番号117に示されるとおりのVL領域及び配列番号116に示されるとおりのVH領域;
(i)配列番号128に示されるとおりのVL領域及び配列番号127に示されるとおりのVH領域;
(j)配列番号139に示されるとおりのVL領域及び配列番号138に示されるとおりのVH領域;
(k)配列番号150に示されるとおりのVL領域及び配列番号149に示されるとおりのVH領域;
(l)配列番号161に示されるとおりのVL領域及び配列番号160に示されるとおりのVH領域;
(m)配列番号172に示されるとおりのVL領域及び配列番号171に示されるとおりのVH領域;
(n)配列番号183に示されるとおりのVL領域及び配列番号182に示されるとおりのVH領域;
(o)配列番号194に示されるとおりのVL領域及び配列番号193に示されるとおりのVH領域;
(p)配列番号205に示されるとおりのVL領域及び配列番号204に示されるとおりのVH領域;
(q)配列番号216に示されるとおりのVL領域及び配列番号215に示されるとおりのVH領域;
(r)配列番号227に示されるとおりのVL領域及び配列番号226に示されるとおりのVH領域;
(s)配列番号238に示されるとおりのVL領域及び配列番号237に示されるとおりのVH領域;
(t)配列番号249に示されるとおりのVL領域及び配列番号248に示されるとおりのVH領域;
(u)配列番号260に示されるとおりのVL領域及び配列番号259に示されるとおりのVH領域;
(v)配列番号271に示されるとおりのVL領域及び配列番号270に示されるとおりのVH領域;
(w)配列番号282に示されるとおりのVL領域及び配列番号281に示されるとおりのVH領域;
(x)配列番号293に示されるとおりのVL領域及び配列番号292に示されるとおりのVH領域;
(y)配列番号304に示されるとおりのVL領域及び配列番号303に示されるとおりのVH領域;
(z)配列番号315に示されるとおりのVL領域及び配列番号314に示されるとおりのVH領域;
(aa)配列番号326に示されるとおりのVL領域及び配列番号325に示されるとおりのVH領域;
(ab)配列番号337に示されるとおりのVL領域及び配列番号336に示されるとおりのVH領域;
(ac)配列番号348に示されるとおりのVL領域及び配列番号347に示されるとおりのVH領域;
(ad)配列番号359に示されるとおりのVL領域及び配列番号358に示されるとおりのVH領域;
(ae)配列番号370に示されるとおりのVL領域及び配列番号369に示されるとおりのVH領域;
(af)配列番号381に示されるとおりのVL領域及び配列番号380に示されるとおりのVH領域;
(ag)配列番号392に示されるとおりのVL領域及び配列番号391に示されるとおりのVH領域;
(ah)配列番号403に示されるとおりのVL領域及び配列番号402に示されるとおりのVH領域;
(ai)配列番号414に示されるとおりのVL領域及び配列番号413に示されるとおりのVH領域;
(aj)配列番号425に示されるとおりのVL領域及び配列番号424に示されるとおりのVH領域;
(ak)配列番号436に示されるとおりのVL領域及び配列番号435に示されるとおりのVH領域;
(al)配列番号447に示されるとおりのVL領域及び配列番号446に示されるとおりのVH領域;
(am)配列番号458に示されるとおりのVL領域及び配列番号457に示されるとおりのVH領域;
(an)配列番号469に示されるとおりのVL領域及び配列番号468に示されるとおりのVH領域;
(ao)配列番号480に示されるとおりのVL領域及び配列番号479に示されるとおりのVH領域;
(ap)配列番号491に示されるとおりのVL領域及び配列番号490に示されるとおりのVH領域;
(aq)配列番号502に示されるとおりのVL領域及び配列番号501に示されるとおりのVH領域;
(ar)配列番号513に示されるとおりのVL領域及び配列番号512に示されるとおりのVH領域;及び
(as)配列番号524に示されるとおりのVL領域及び配列番号523に示されるとおりのVH領域
からなる群から選択されるVL領域及びVH領域を含む、態様1~22のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様24]
配列番号41、52、63、74、85、96、107、118、129、140、151、162、173、184、195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525のいずれかに示されるとおりのアミノ酸配列から選択される配列を含む、態様1~23のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様25]
アミノからカルボキシルの順に、
(a)配列番号41、52、63、74、85、96、107、118、129、140、151、162、173、184、195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525からなる群から選択されるアミノ酸配列を有する前記第1のドメイン;
(b)配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)国際公開第2008/119567号パンフレットの配列番号23、25、41、43、59、61、77、79、95、97、113、115、131、133、149、151、167、169、185若しくは187からなる群から選択されるか又は配列番号15において示されるとおりのアミノ酸配列を有する前記第2のドメイン
を含む、態様1~24のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様26]
アミノからカルボキシルの順に、
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)配列番号17~24からなる群から選択されるポリペプチド配列を有する前記第3のドメインの前記第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)配列番号17~24からなる群から選択されるポリペプチド配列を有する前記第3のドメインの前記第2のポリペプチド単量体
をさらに含む、態様25に記載の二重特異性抗体コンストラクト。
[態様27]
配列番号42、43、53、54、64、65、75、76、86、87、97、98、108、109、119、120、130、131、141、142、152、153、163、164、174、175、185、186、196、197、207、208、218、219、229、230、240、241、251、252、262、263、273、274、284、285、295、296、306、307、317、318、328、329、339、340、350、351、361、362、372、373、383、384、394、395、405、406、416、417、427、428、438、439、449、450、460、461、471、472、482、483、493、494、504、505、515、516、526及び527からなる群から選択されるか又は前記配列と少なくとも90、91、92、93、94、95、96、97、98若しくは99%の同一性を有するアミノ酸を有するアミノ酸配列を有する、態様1~26のいずれか一項に記載の二重特異性抗体コンストラクト。
[態様28]
態様1~27のいずれか一項に記載の抗体コンストラクトをコードするポリヌクレオチド。
[態様29]
態様28に記載のポリヌクレオチドを含むベクター。
[態様30]
態様28に記載のポリヌクレオチド又は態様29に記載のベクターで形質転換又はトランスフェクトされた宿主細胞。
[態様31]
態様1~27のいずれか一項に記載の二重特異性抗体コンストラクトの作製のための方法であって、態様1~27のいずれか一項に記載の抗体コンストラクトの発現を可能にする条件下で態様30に記載の宿主細胞を培養することと、前記産生された抗体コンストラクトを培養物から回収することとを含む方法。
[態様32]
態様1~27のいずれか一項に記載の二重特異性抗体コンストラクト又は態様31に記載の方法に従って作製される二重特異性抗体コンストラクトを含む医薬組成物。
[態様33]
約-20℃で少なくとも4週間にわたって安定である、態様32に記載の医薬組成物。
[態様34]
増殖性疾患、腫瘍性疾患、癌又は免疫障害から選択される疾患の予防、治療又は改善における使用のための、態様1~27のいずれか一項に記載の二重特異性抗体コンストラクト又は態様31の方法に従って作製される二重特異性抗体コンストラクト。
[態様35]
前記疾患は、胃腸癌又は膵臓癌である、態様34に記載の使用のための二重特異性抗体コンストラクト。
[態様36]
前記疾患は、胃癌である、態様34に記載の使用のための二重特異性抗体コンストラクト。
[態様37]
増殖性疾患、腫瘍性疾患、癌又は免疫障害の治療又は改善のための方法であって、それを必要とする対象に、態様1~27のいずれか一項に記載の二重特異性抗体コンストラクト又は態様31に記載の方法に従って作製される二重特異性抗体コンストラクトを投与する工程を含み、前記疾患は、好ましくは、胃腸癌又は膵臓癌、最も好ましくは胃癌である、方法。
[態様38]
態様1~27のいずれか一項に記載の二重特異性抗体コンストラクト若しくは態様31に記載の方法に従って作製される二重特異性抗体コンストラクト、態様28に記載のポリヌクレオチド、態様29に記載のベクター及び/又は態様30に記載の宿主細胞を含むキット
[態様39]
胃腸癌の治療又は改善のための方法であって、それを必要とする対象に、MUC17及びCD3に対して向けられる二重特異性抗体コンストラクトを投与する工程を含む方法。
[態様40]
胃腸癌の治療又は改善における使用のための、MUC17及びCD3に向けられる二重特異性抗体コンストラクト。
Claims (40)
- 二重特異性抗体コンストラクトであって、
・MUC17に結合する第1のドメイン、及び
・ヒト及びマカクCD3ε鎖の細胞外エピトープに結合する第2のドメイン
を含む二重特異性抗体コンストラクト。 - 2つのポリペプチド単量体であって、それぞれヒンジ、CH2ドメイン及びCH3ドメインを含む2つのポリペプチド単量体を含む第3のドメインであって、前記2つのポリペプチド単量体は、ペプチドリンカーを介して互いに融合される、第3のドメインをさらに含む、請求項1に記載の二重特異性抗体コンストラクト。
- 一本鎖抗体コンストラクトである、請求項1又は2に記載の二重特異性抗体コンストラクト。
- 前記第3のドメインは、アミノからカルボキシルの順に、
ヒンジ-CH2-CH3-リンカー-ヒンジ-CH2-CH3
を含む、請求項2又は3に記載の二重特異性抗体コンストラクト。 - 前記第3のドメインにおける前記ポリペプチド単量体の各々は、配列番号17~24からなる群から選択される配列と少なくとも90%同一であるアミノ酸配列を有する、請求項1~4のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記ポリペプチド単量体の各々は、配列番号17~24から選択されるアミノ酸配列を有する、請求項1~5のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記CH2ドメインは、ドメイン内システインジスルフィド架橋を含む、請求項1~6のいずれか一項に記載の二重特異性抗体コンストラクト。
- (i)前記第1のドメインは、2つの抗体可変ドメインを含み、且つ前記第2のドメインは、2つの抗体可変ドメインを含むか;
(ii)前記第1のドメインは、1つの抗体可変ドメインを含み、且つ前記第2のドメインは、2つの抗体可変ドメインを含むか;
(iii)前記第1のドメインは、2つの抗体可変ドメインを含み、且つ前記第2のドメインは、1つの抗体可変ドメインを含むか;又は
(iv)前記第1のドメインは、1つの抗体可変ドメインを含み、且つ前記第2のドメインは、1つの抗体可変ドメインを含む、請求項1~7のいずれか一項に記載の二重特異性抗体コンストラクト。 - 前記第1のドメイン及び第2のドメインは、ペプチドリンカーを介して前記第3のドメインに融合される、請求項1~8のいずれか一項に記載の二重特異性抗体コンストラクト。
- アミノからカルボキシルの順に、
(a)前記第1のドメイン;
(b)好ましくは配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)前記第2のドメイン
を含む、請求項1~9のいずれか一項に記載の二重特異性抗体コンストラクト。 - アミノからカルボキシルの順に、
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)前記第3のドメインの第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)前記第3のドメインの第2のポリペプチド単量体
をさらに含む、請求項10に記載の二重特異性抗体コンストラクト。 - 前記抗体コンストラクトの前記第1のドメインは、配列番号528(uniprot Q685J3付番に従うaa 4171~4296)に対応するMUC17内のエピトープに結合する、請求項1~11のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記抗体コンストラクトの前記第1のドメインは、配列番号529(uniprot Q685J3付番に従うaa 4189~4291)に対応するMUC17内のエピトープに結合する、請求項1~12のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記抗体コンストラクトの前記第1のドメインは、配列番号530(uniprot Q685J3付番に従うaa 4131~4243)に対応するMUC17内のエピトープに結合する、請求項1~13のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記抗体コンストラクトの前記第1のドメインは、配列番号531(uniprot Q685J3付番に従うaa 4244~4389)に対応するMUC17内のエピトープに結合する、請求項1~14のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記抗体コンストラクトの前記第1のドメインは、配列番号530(uniprot Q685J3付番に従うaa 4131~4243)に対応するMUC17内のエピトープに結合するが、配列番号531(uniprot Q685J3付番に従うaa 4244~4389)に対応するMUC17内のエピトープに結合しない、請求項1~15のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記抗体コンストラクトの前記第1のドメインは、配列番号532(uniprot Q685J3付番に従うaa 4171~4390)又は配列番号533(uniprot Q685J3付番に従うaa 4184~4390)に対応するMUC17内のエピトープに結合するが、配列番号534(uniprot Q685J3付番に従うaa 4291~4390)に対応するMUC17内のエピトープ又は配列番号535(uniprot Q685J3付番に従うaa 4341~4390)に対応するMUC17内のエピトープに結合しない、請求項1~16のいずれか一項に記載の二重特異性抗体コンストラクト。
- 細胞傷害性と結合親和性との間の比率(EC50/KD)*1000は、250未満であり、前記細胞傷害性は、標的細胞としてのNUGC-4細胞及びエフェクター細胞としてのhuPBMCにおいて決定され、前記結合親和性は、表面プラズモン共鳴に基づくアッセイによって決定される、請求項1~17のいずれか一項に記載の二重特異性抗体コンストラクト。
- 細胞傷害性と結合親和性との間の比率(EC50/KD)*1000は、125未満であり、前記細胞傷害性は、標的細胞としてのNUGC-4細胞及びエフェクター細胞としてのhuPBMCにおいて決定され、前記結合親和性は、表面プラズモン共鳴に基づくアッセイによって決定される、請求項1~18のいずれか一項に記載の二重特異性抗体コン
ストラクト。 - 細胞傷害性と結合親和性との間の比率(EC50/KD)*1000は、21未満であり、前記細胞傷害性は、標的細胞としてのNUGC-4細胞及びエフェクター細胞としてのhuPBMCにおいて決定され、前記結合親和性は、表面プラズモン共鳴に基づくアッセイによって決定される、請求項1~19のいずれか一項に記載の二重特異性抗体コンストラクト。
- 前記第1の結合ドメインは、
(a)配列番号33に示されるとおりのCDR-H1、配列番号34に示されるとおりのCDR-H2及び配列番号35に示されるとおりのCDR-H3;
(b)配列番号44に示されるとおりのCDR-H1、配列番号45に示されるとおりのCDR-H2及び配列番号46に示されるとおりのCDR-H3;
(c)配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(d)配列番号66に示されるとおりのCDR-H1、配列番号67に示されるとおりのCDR-H2及び配列番号68に示されるとおりのCDR-H3;
(e)配列番号77に示されるとおりのCDR-H1、配列番号78に示されるとおりのCDR-H2及び配列番号79に示されるとおりのCDR-H3;
(f)配列番号88に示されるとおりのCDR-H1、配列番号89に示されるとおりのCDR-H2及び配列番号90に示されるとおりのCDR-H3;
(g)配列番号99に示されるとおりのCDR-H1、配列番号100に示されるとおりのCDR-H2及び配列番号101に示されるとおりのCDR-H3;
(h)配列番号110に示されるとおりのCDR-H1、配列番号111に示されるとおりのCDR-H2及び配列番号112に示されるとおりのCDR-H3;
(i)配列番号121に示されるとおりのCDR-H1、配列番号122に示されるとおりのCDR-H2及び配列番号123に示されるとおりのCDR-H3;
(j)配列番号132に示されるとおりのCDR-H1、配列番号133に示されるとおりのCDR-H2及び配列番号134に示されるとおりのCDR-H3;
(k)配列番号143に示されるとおりのCDR-H1、配列番号144に示されるとおりのCDR-H2及び配列番号145に示されるとおりのCDR-H3;
(l)配列番号154に示されるとおりのCDR-H1、配列番号155に示されるとおりのCDR-H2及び配列番号156に示されるとおりのCDR-H3;
(m)配列番号165に示されるとおりのCDR-H1、配列番号166に示されるとおりのCDR-H2及び配列番号167に示されるとおりのCDR-H3;
(n)配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(o)配列番号187に示されるとおりのCDR-H1、配列番号188に示されるとおりのCDR-H2及び配列番号189に示されるとおりのCDR-H3;
(p)配列番号198に示されるとおりのCDR-H1、配列番号199に示されるとおりのCDR-H2及び配列番号200に示されるとおりのCDR-H3;
(q)配列番号209に示されるとおりのCDR-H1、配列番号210に示されるとおりのCDR-H2及び配列番号211に示されるとおりのCDR-H3;
(r)配列番号220に示されるとおりのCDR-H1、配列番号221に示されるとおりのCDR-H2及び配列番号222に示されるとおりのCDR-H3;
(s)配列番号231に示されるとおりのCDR-H1、配列番号232に示されるとおりのCDR-H2及び配列番号233に示されるとおりのCDR-H3;
(t)配列番号242に示されるとおりのCDR-H1、配列番号243に示されるとおりのCDR-H2及び配列番号244に示されるとおりのCDR-H3;
(u)配列番号253に示されるとおりのCDR-H1、配列番号254に示されるとお
りのCDR-H2及び配列番号255に示されるとおりのCDR-H3;
(v)配列番号264に示されるとおりのCDR-H1、配列番号265に示されるとおりのCDR-H2及び配列番号266に示されるとおりのCDR-H3;
(w)配列番号275に示されるとおりのCDR-H1、配列番号276に示されるとおりのCDR-H2及び配列番号276に示されるとおりのCDR-H3;
(x)配列番号286に示されるとおりのCDR-H1、配列番号287に示されるとおりのCDR-H2及び配列番号288に示されるとおりのCDR-H3;
(y)配列番号297に示されるとおりのCDR-H1、配列番号298に示されるとおりのCDR-H2及び配列番号299に示されるとおりのCDR-H3;
(z)配列番号308に示されるとおりのCDR-H1、配列番号309に示されるとおりのCDR-H2及び配列番号310に示されるとおりのCDR-H3;
(aa)配列番号319に示されるとおりのCDR-H1、配列番号320に示されるとおりのCDR-H2及び配列番号321に示されるとおりのCDR-H3;
(ab)配列番号330に示されるとおりのCDR-H1、配列番号331に示されるとおりのCDR-H2及び配列番号332に示されるとおりのCDR-H3;
(ac)配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;
(ad)配列番号352に示されるとおりのCDR-H1、配列番号353に示されるとおりのCDR-H2及び配列番号354に示されるとおりのCDR-H3;
(ae)配列番号363に示されるとおりのCDR-H1、配列番号364に示されるとおりのCDR-H2及び配列番号365に示されるとおりのCDR-H3;
(af)配列番号374に示されるとおりのCDR-H1、配列番号375に示されるとおりのCDR-H2及び配列番号376に示されるとおりのCDR-H3;
(ag)配列番号385に示されるとおりのCDR-H1、配列番号386に示されるとおりのCDR-H2及び配列番号386に示されるとおりのCDR-H3;
(ah)配列番号396に示されるとおりのCDR-H1、配列番号397に示されるとおりのCDR-H2及び配列番号398に示されるとおりのCDR-H3;
(ai)配列番号407に示されるとおりのCDR-H1、配列番号408に示されるとおりのCDR-H2及び配列番号409に示されるとおりのCDR-H3;
(aj)配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3;
(ak)配列番号429に示されるとおりのCDR-H1、配列番号430に示されるとおりのCDR-H2及び配列番号431に示されるとおりのCDR-H3;
(al)配列番号440に示されるとおりのCDR-H1、配列番号441に示されるとおりのCDR-H2及び配列番号442に示されるとおりのCDR-H3;
(am)配列番号451に示されるとおりのCDR-H1、配列番号452に示されるとおりのCDR-H2及び配列番号453に示されるとおりのCDR-H3;
(an)配列番号462に示されるとおりのCDR-H1、配列番号463に示されるとおりのCDR-H2及び配列番号464に示されるとおりのCDR-H3;
(ao)配列番号473に示されるとおりのCDR-H1、配列番号474に示されるとおりのCDR-H2及び配列番号475に示されるとおりのCDR-H3;
(ap)配列番号484に示されるとおりのCDR-H1、配列番号485に示されるとおりのCDR-H2及び配列番号486に示されるとおりのCDR-H3;
(aq)配列番号495に示されるとおりのCDR-H1、配列番号496に示されるとおりのCDR-H2及び配列番号497に示されるとおりのCDR-H3;
(ar)配列番号506に示されるとおりのCDR-H1、配列番号507に示されるとおりのCDR-H2及び配列番号508に示されるとおりのCDR-H3;及び
(as)配列番号517に示されるとおりのCDR-H1、配列番号518に示されるとおりのCDR-H2及び配列番号519に示されるとおりのCDR-H3
から選択されるCDR-H1、CDR-H2及びCDR-H3を含むVH領域を含み;
(c)配列番号55に示されるとおりのCDR-H1、配列番号56に示されるとおりのCDR-H2及び配列番号57に示されるとおりのCDR-H3;
(n)配列番号176に示されるとおりのCDR-H1、配列番号177に示されるとおりのCDR-H2及び配列番号178に示されるとおりのCDR-H3;
(ac)配列番号341に示されるとおりのCDR-H1、配列番号342に示されるとおりのCDR-H2及び配列番号343に示されるとおりのCDR-H3;及び
(aj)配列番号418に示されるとおりのCDR-H1、配列番号419に示されるとおりのCDR-H2及び配列番号420に示されるとおりのCDR-H3
が好ましい、請求項1~20のいずれか一項に記載の二重特異性抗体コンストラクト。 - 前記第1の結合ドメインは、
(a)配列番号36に示されるとおりのCDR-L1、配列番号37に示されるとおりのCDR-L2及び配列番号38に示されるとおりのCDR-L3;
(b)配列番号47に示されるとおりのCDR-L1、配列番号48に示されるとおりのCDR-L2及び配列番号49に示されるとおりのCDR-L3;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3;
(d)配列番号69に示されるとおりのCDR-L1、配列番号70に示されるとおりのCDR-L2及び配列番号71に示されるとおりのCDR-L3;
(e)配列番号80に示されるとおりのCDR-L1、配列番号81に示されるとおりのCDR-L2及び配列番号82に示されるとおりのCDR-L3;
(f)配列番号91に示されるとおりのCDR-L1、配列番号92に示されるとおりのCDR-L2及び配列番号93に示されるとおりのCDR-L3;
(g)配列番号102に示されるとおりのCDR-L1、配列番号103に示されるとおりのCDR-L2及び配列番号104に示されるとおりのCDR-L3;
(h)配列番号113に示されるとおりのCDR-L1、配列番号114に示されるとおりのCDR-L2及び配列番号115に示されるとおりのCDR-L3;
(i)配列番号124に示されるとおりのCDR-L1、配列番号125に示されるとおりのCDR-L2及び配列番号126に示されるとおりのCDR-L3;
(j)配列番号135に示されるとおりのCDR-L1、配列番号136に示されるとおりのCDR-L2及び配列番号137に示されるとおりのCDR-L3;
(k)配列番号146に示されるとおりのCDR-L1、配列番号147に示されるとおりのCDR-L2及び配列番号148に示されるとおりのCDR-L3;
(l)配列番号157に示されるとおりのCDR-L1、配列番号158に示されるとおりのCDR-L2及び配列番号159に示されるとおりのCDR-L3;
(m)配列番号168に示されるとおりのCDR-L1、配列番号169に示されるとおりのCDR-L2及び配列番号170に示されるとおりのCDR-L3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3;
(o)配列番号190に示されるとおりのCDR-L1、配列番号191に示されるとおりのCDR-L2及び配列番号192に示されるとおりのCDR-L3;
(p)配列番号201に示されるとおりのCDR-L1、配列番号202に示されるとおりのCDR-L2及び配列番号203に示されるとおりのCDR-L3;
(q)配列番号212に示されるとおりのCDR-L1、配列番号213に示されるとおりのCDR-L2及び配列番号214に示されるとおりのCDR-L3;
(r)配列番号223に示されるとおりのCDR-L1、配列番号224に示されるとおりのCDR-L2及び配列番号225に示されるとおりのCDR-L3;
(s)配列番号234に示されるとおりのCDR-L1、配列番号235に示されるとおりのCDR-L2及び配列番号236に示されるとおりのCDR-L3;
(t)配列番号245に示されるとおりのCDR-L1、配列番号246に示されるとお
りのCDR-L2及び配列番号247に示されるとおりのCDR-L3;
(u)配列番号256に示されるとおりのCDR-L1、配列番号257に示されるとおりのCDR-L2及び配列番号258に示されるとおりのCDR-L3;
(v)配列番号267に示されるとおりのCDR-L1、配列番号268に示されるとおりのCDR-L2及び配列番号269に示されるとおりのCDR-L3;
(w)配列番号278に示されるとおりのCDR-L1、配列番号279に示されるとおりのCDR-L2及び配列番号280に示されるとおりのCDR-L3;
(x)配列番号289に示されるとおりのCDR-L1、配列番号290に示されるとおりのCDR-L2及び配列番号291に示されるとおりのCDR-L3;
(y)配列番号300に示されるとおりのCDR-L1、配列番号301に示されるとおりのCDR-L2及び配列番号302に示されるとおりのCDR-L3;
(z)配列番号311に示されるとおりのCDR-L1、配列番号312に示されるとおりのCDR-L2及び配列番号313に示されるとおりのCDR-L3;
(aa)配列番号322に示されるとおりのCDR-L1、配列番号323に示されるとおりのCDR-L2及び配列番号324に示されるとおりのCDR-L3;
(ab)配列番号333に示されるとおりのCDR-L1、配列番号334に示されるとおりのCDR-L2及び配列番号335に示されるとおりのCDR-L3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3;
(ad)配列番号355に示されるとおりのCDR-L1、配列番号356に示されるとおりのCDR-L2及び配列番号357に示されるとおりのCDR-L3;
(ae)配列番号366に示されるとおりのCDR-L1、配列番号367に示されるとおりのCDR-L2及び配列番号368に示されるとおりのCDR-L3;
(af)配列番号377に示されるとおりのCDR-L1、配列番号378に示されるとおりのCDR-L2及び配列番号379に示されるとおりのCDR-L3;
(ag)配列番号388に示されるとおりのCDR-L1、配列番号389に示されるとおりのCDR-L2及び配列番号390に示されるとおりのCDR-L3;
(ah)配列番号399に示されるとおりのCDR-L1、配列番号400に示されるとおりのCDR-L2及び配列番号401に示されるとおりのCDR-L3;
(ai)配列番号410に示されるとおりのCDR-L1、配列番号411に示されるとおりのCDR-L2及び配列番号412に示されるとおりのCDR-L3;
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3;
(ak)配列番号432に示されるとおりのCDR-L1、配列番号433に示されるとおりのCDR-L2及び配列番号434に示されるとおりのCDR-L3;
(al)配列番号443に示されるとおりのCDR-L1、配列番号444に示されるとおりのCDR-L2及び配列番号445に示されるとおりのCDR-L3;
(am)配列番号454に示されるとおりのCDR-L1、配列番号455に示されるとおりのCDR-L2及び配列番号456に示されるとおりのCDR-L3;
(an)配列番号465に示されるとおりのCDR-L1、配列番号466に示されるとおりのCDR-L2及び配列番号467に示されるとおりのCDR-L3;
(ao)配列番号476に示されるとおりのCDR-L1、配列番号477に示されるとおりのCDR-L2及び配列番号478に示されるとおりのCDR-L3;
(ap)配列番号487に示されるとおりのCDR-L1、配列番号488に示されるとおりのCDR-L2及び配列番号489に示されるとおりのCDR-L3;
(aq)配列番号498に示されるとおりのCDR-L1、配列番号499に示されるとおりのCDR-L2及び配列番号500に示されるとおりのCDR-L3;
(ar)配列番号509に示されるとおりのCDR-L1、配列番号510に示されるとおりのCDR-L2及び配列番号511に示されるとおりのCDR-L3;及び
(as)配列番号520に示されるとおりのCDR-L1、配列番号521に示されると
おりのCDR-L2及び配列番号522に示されるとおりのCDR-L3
から選択されるCDR-H1、CDR-L2及びCDR-L3を含むVL領域を含み;
(c)配列番号58に示されるとおりのCDR-L1、配列番号59に示されるとおりのCDR-L2及び配列番号60に示されるとおりのCDR-L3;
(n)配列番号179に示されるとおりのCDR-L1、配列番号180に示されるとおりのCDR-L2及び配列番号181に示されるとおりのCDR-L3;
(ac)配列番号344に示されるとおりのCDR-L1、配列番号345に示されるとおりのCDR-L2及び配列番号346に示されるとおりのCDR-L3;及び
(aj)配列番号421に示されるとおりのCDR-L1、配列番号422に示されるとおりのCDR-L2及び配列番号423に示されるとおりのCDR-L3
が好ましい、請求項1~21のいずれか一項に記載の二重特異性抗体コンストラクト。 - 前記第1の結合ドメインは、
(a)配列番号40に示されるとおりのVL領域及び配列番号39に示されるとおりのVH領域;
(b)配列番号51に示されるとおりのVL領域及び配列番号50に示されるとおりのVH領域;
(c)配列番号62に示されるとおりのVL領域及び配列番号61に示されるとおりのVH領域;
(d)配列番号73に示されるとおりのVL領域及び配列番号72に示されるとおりのVH領域;
(e)配列番号84に示されるとおりのVL領域及び配列番号83に示されるとおりのVH領域;
(f)配列番号95に示されるとおりのVL領域及び配列番号94に示されるとおりのVH領域;
(g)配列番号106に示されるとおりのVL領域及び配列番号105に示されるとおりのVH領域;
(h)配列番号117に示されるとおりのVL領域及び配列番号116に示されるとおりのVH領域;
(i)配列番号128に示されるとおりのVL領域及び配列番号127に示されるとおりのVH領域;
(j)配列番号139に示されるとおりのVL領域及び配列番号138に示されるとおりのVH領域;
(k)配列番号150に示されるとおりのVL領域及び配列番号149に示されるとおりのVH領域;
(l)配列番号161に示されるとおりのVL領域及び配列番号160に示されるとおりのVH領域;
(m)配列番号172に示されるとおりのVL領域及び配列番号171に示されるとおりのVH領域;
(n)配列番号183に示されるとおりのVL領域及び配列番号182に示されるとおりのVH領域;
(o)配列番号194に示されるとおりのVL領域及び配列番号193に示されるとおりのVH領域;
(p)配列番号205に示されるとおりのVL領域及び配列番号204に示されるとおりのVH領域;
(q)配列番号216に示されるとおりのVL領域及び配列番号215に示されるとおりのVH領域;
(r)配列番号227に示されるとおりのVL領域及び配列番号226に示されるとおりのVH領域;
(s)配列番号238に示されるとおりのVL領域及び配列番号237に示されるとおり
のVH領域;
(t)配列番号249に示されるとおりのVL領域及び配列番号248に示されるとおりのVH領域;
(u)配列番号260に示されるとおりのVL領域及び配列番号259に示されるとおりのVH領域;
(v)配列番号271に示されるとおりのVL領域及び配列番号270に示されるとおりのVH領域;
(w)配列番号282に示されるとおりのVL領域及び配列番号281に示されるとおりのVH領域;
(x)配列番号293に示されるとおりのVL領域及び配列番号292に示されるとおりのVH領域;
(y)配列番号304に示されるとおりのVL領域及び配列番号303に示されるとおりのVH領域;
(z)配列番号315に示されるとおりのVL領域及び配列番号314に示されるとおりのVH領域;
(aa)配列番号326に示されるとおりのVL領域及び配列番号325に示されるとおりのVH領域;
(ab)配列番号337に示されるとおりのVL領域及び配列番号336に示されるとおりのVH領域;
(ac)配列番号348に示されるとおりのVL領域及び配列番号347に示されるとおりのVH領域;
(ad)配列番号359に示されるとおりのVL領域及び配列番号358に示されるとおりのVH領域;
(ae)配列番号370に示されるとおりのVL領域及び配列番号369に示されるとおりのVH領域;
(af)配列番号381に示されるとおりのVL領域及び配列番号380に示されるとおりのVH領域;
(ag)配列番号392に示されるとおりのVL領域及び配列番号391に示されるとおりのVH領域;
(ah)配列番号403に示されるとおりのVL領域及び配列番号402に示されるとおりのVH領域;
(ai)配列番号414に示されるとおりのVL領域及び配列番号413に示されるとおりのVH領域;
(aj)配列番号425に示されるとおりのVL領域及び配列番号424に示されるとおりのVH領域;
(ak)配列番号436に示されるとおりのVL領域及び配列番号435に示されるとおりのVH領域;
(al)配列番号447に示されるとおりのVL領域及び配列番号446に示されるとおりのVH領域;
(am)配列番号458に示されるとおりのVL領域及び配列番号457に示されるとおりのVH領域;
(an)配列番号469に示されるとおりのVL領域及び配列番号468に示されるとおりのVH領域;
(ao)配列番号480に示されるとおりのVL領域及び配列番号479に示されるとおりのVH領域;
(ap)配列番号491に示されるとおりのVL領域及び配列番号490に示されるとおりのVH領域;
(aq)配列番号502に示されるとおりのVL領域及び配列番号501に示されるとおりのVH領域;
(ar)配列番号513に示されるとおりのVL領域及び配列番号512に示されるとお
りのVH領域;及び
(as)配列番号524に示されるとおりのVL領域及び配列番号523に示されるとおりのVH領域
からなる群から選択されるVL領域及びVH領域を含む、請求項1~22のいずれか一項に記載の二重特異性抗体コンストラクト。 - 配列番号41、52、63、74、85、96、107、118、129、140、151、162、173、184、195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525のいずれかに示されるとおりのアミノ酸配列から選択される配列を含む、請求項1~23のいずれか一項に記載の二重特異性抗体コンストラクト。
- アミノからカルボキシルの順に、
(a)配列番号41、52、63、74、85、96、107、118、129、140、151、162、173、184、195、206、217、228、239、250、261、272、283、294、305、316、327、338、349、360、371、382、393、404、415、426、437、448、459、470、481、492、503、514及び525からなる群から選択されるアミノ酸配列を有する前記第1のドメイン;
(b)配列番号1~3からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(c)国際公開第2008/119567号パンフレットの配列番号23、25、41、43、59、61、77、79、95、97、113、115、131、133、149、151、167、169、185若しくは187からなる群から選択されるか又は配列番号15において示されるとおりのアミノ酸配列を有する前記第2のドメイン
を含む、請求項1~24のいずれか一項に記載の二重特異性抗体コンストラクト。 - アミノからカルボキシルの順に、
(d)配列番号1、2、3、9、10、11及び12からなる群から選択されるアミノ酸配列を有するペプチドリンカー;
(e)配列番号17~24からなる群から選択されるポリペプチド配列を有する前記第3のドメインの前記第1のポリペプチド単量体;
(f)配列番号5、6、7及び8からなる群から選択されるアミノ酸配列を有するペプチドリンカー;及び
(g)配列番号17~24からなる群から選択されるポリペプチド配列を有する前記第3のドメインの前記第2のポリペプチド単量体
をさらに含む、請求項25に記載の二重特異性抗体コンストラクト。 - 配列番号42、43、53、54、64、65、75、76、86、87、97、98、108、109、119、120、130、131、141、142、152、153、163、164、174、175、185、186、196、197、207、208、218、219、229、230、240、241、251、252、262、263、273、274、284、285、295、296、306、307、317、318、328、329、339、340、350、351、361、362、372、373、383、384、394、395、405、406、416、417、427、428、438、439、449、450、460、461、471、472、482、483、493、494、504、505、515、516、526及び527からなる群から選択されるか又は前記配列と少なくとも90、91、92、93、94、95、96、9
7、98若しくは99%の同一性を有するアミノ酸を有するアミノ酸配列を有する、請求項1~26のいずれか一項に記載の二重特異性抗体コンストラクト。 - 請求項1~27のいずれか一項に記載の抗体コンストラクトをコードするポリヌクレオチド。
- 請求項28に記載のポリヌクレオチドを含むベクター。
- 請求項28に記載のポリヌクレオチド又は請求項29に記載のベクターで形質転換又はトランスフェクトされた宿主細胞。
- 請求項1~27のいずれか一項に記載の二重特異性抗体コンストラクトの作製のための方法であって、請求項1~27のいずれか一項に記載の抗体コンストラクトの発現を可能にする条件下で請求項30に記載の宿主細胞を培養することと、前記産生された抗体コンストラクトを培養物から回収することとを含む方法。
- 請求項1~27のいずれか一項に記載の二重特異性抗体コンストラクト又は請求項31に記載の方法に従って作製される二重特異性抗体コンストラクトを含む医薬組成物。
- 約-20℃で少なくとも4週間にわたって安定である、請求項32に記載の医薬組成物。
- 増殖性疾患、腫瘍性疾患、癌又は免疫障害から選択される疾患の予防、治療又は改善における使用のための、請求項1~27のいずれか一項に記載の二重特異性抗体コンストラクト又は請求項31の方法に従って作製される二重特異性抗体コンストラクト。
- 前記疾患は、胃腸癌又は膵臓癌である、請求項34に記載の使用のための二重特異性抗体コンストラクト。
- 前記疾患は、胃癌である、請求項34に記載の使用のための二重特異性抗体コンストラクト。
- 増殖性疾患、腫瘍性疾患、癌又は免疫障害の治療又は改善のための方法であって、それを必要とする対象に、請求項1~27のいずれか一項に記載の二重特異性抗体コンストラクト又は請求項31に記載の方法に従って作製される二重特異性抗体コンストラクトを投与する工程を含み、前記疾患は、好ましくは、胃腸癌又は膵臓癌、最も好ましくは胃癌である、方法。
- 請求項1~27のいずれか一項に記載の二重特異性抗体コンストラクト若しくは請求項31に記載の方法に従って作製される二重特異性抗体コンストラクト、請求項28に記載のポリヌクレオチド、請求項29に記載のベクター及び/又は請求項30に記載の宿主細胞を含むキット
- 胃腸癌の治療又は改善のための方法であって、それを必要とする対象に、MUC17及びCD3に対して向けられる二重特異性抗体コンストラクトを投与する工程を含む方法。
- 胃腸癌の治療又は改善における使用のための、MUC17及びCD3に向けられる二重特異性抗体コンストラクト。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762612242P | 2017-12-29 | 2017-12-29 | |
| US62/612,242 | 2017-12-29 | ||
| US201862687063P | 2018-06-19 | 2018-06-19 | |
| US62/687,063 | 2018-06-19 | ||
| PCT/US2018/068118 WO2019133961A1 (en) | 2017-12-29 | 2018-12-31 | Bispecific antibody construct directed to muc17 and cd3 |
| JP2020535956A JP2021508465A (ja) | 2017-12-29 | 2018-12-31 | Muc17及びcd3に向けられる二重特異性抗体コンストラクト |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020535956A Division JP2021508465A (ja) | 2017-12-29 | 2018-12-31 | Muc17及びcd3に向けられる二重特異性抗体コンストラクト |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2023134497A true JP2023134497A (ja) | 2023-09-27 |
Family
ID=65139282
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020535956A Pending JP2021508465A (ja) | 2017-12-29 | 2018-12-31 | Muc17及びcd3に向けられる二重特異性抗体コンストラクト |
| JP2023102462A Pending JP2023134497A (ja) | 2017-12-29 | 2023-06-22 | Muc17及びcd3に向けられる二重特異性抗体コンストラクト |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020535956A Pending JP2021508465A (ja) | 2017-12-29 | 2018-12-31 | Muc17及びcd3に向けられる二重特異性抗体コンストラクト |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US20210130465A1 (ja) |
| EP (1) | EP3732200A1 (ja) |
| JP (2) | JP2021508465A (ja) |
| KR (1) | KR20200105493A (ja) |
| CN (2) | CN117510645A (ja) |
| AU (1) | AU2018394255A1 (ja) |
| CA (1) | CA3087151A1 (ja) |
| CL (1) | CL2020001732A1 (ja) |
| CO (1) | CO2020009034A2 (ja) |
| CR (1) | CR20200325A (ja) |
| IL (1) | IL275492A (ja) |
| JO (1) | JOP20200158A1 (ja) |
| MA (1) | MA51417A (ja) |
| MX (1) | MX2020006871A (ja) |
| PE (1) | PE20201340A1 (ja) |
| PH (1) | PH12020550841A1 (ja) |
| SG (1) | SG11202005274VA (ja) |
| TW (1) | TW201940518A (ja) |
| UA (1) | UA128330C2 (ja) |
| UY (1) | UY38041A (ja) |
| WO (1) | WO2019133961A1 (ja) |
| ZA (1) | ZA202004595B (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116096751A (zh) * | 2020-02-25 | 2023-05-09 | 璟尚生物制药公司 | 三特异性t细胞接合器 |
| JP2023516388A (ja) * | 2020-03-05 | 2023-04-19 | メモリアル スローン ケタリング キャンサー センター | 抗ccr8剤 |
| JP2023518225A (ja) | 2020-03-19 | 2023-04-28 | アムジエン・インコーポレーテツド | ムチン17に対する抗体及びその使用 |
| JP2023542257A (ja) | 2020-09-16 | 2023-10-05 | アムジェン インコーポレイテッド | 癌の治療のために二重特異性t細胞誘導分子の治療用量を投与する方法 |
| MX2023014859A (es) * | 2021-06-30 | 2024-01-17 | Amgen Inc | Metodo de reconstitucion de formulacion liofilizada. |
| WO2023088287A1 (en) * | 2021-11-17 | 2023-05-25 | Acroimmune Guangzhou Biotech Ltd | Fusion proteins comprising ai-073 core peptide and use thereof |
| WO2024160269A1 (zh) * | 2023-02-03 | 2024-08-08 | 山东先声生物制药有限公司 | 针对muc17和cd3的双特异性抗体及其应用 |
| CN118667026A (zh) * | 2023-03-15 | 2024-09-20 | 三生国健药业(上海)股份有限公司 | 抗muc17*cd3*cd28三特异性抗体 |
Family Cites Families (136)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3180193A (en) | 1963-02-25 | 1965-04-27 | Benedict David | Machines for cutting lengths of strip material |
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US3691016A (en) | 1970-04-17 | 1972-09-12 | Monsanto Co | Process for the preparation of insoluble enzymes |
| CA1023287A (en) | 1972-12-08 | 1977-12-27 | Boehringer Mannheim G.M.B.H. | Process for the preparation of carrier-bound proteins |
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| US4195128A (en) | 1976-05-03 | 1980-03-25 | Bayer Aktiengesellschaft | Polymeric carrier bound ligands |
| US4330440A (en) | 1977-02-08 | 1982-05-18 | Development Finance Corporation Of New Zealand | Activated matrix and method of activation |
| CA1093991A (en) | 1977-02-17 | 1981-01-20 | Hideo Hirohara | Enzyme immobilization with pullulan gel |
| US4229537A (en) | 1978-02-09 | 1980-10-21 | New York University | Preparation of trichloro-s-triazine activated supports for coupling ligands |
| US4263428A (en) | 1978-03-24 | 1981-04-21 | The Regents Of The University Of California | Bis-anthracycline nucleic acid function inhibitors and improved method for administering the same |
| JPS6023084B2 (ja) | 1979-07-11 | 1985-06-05 | 味の素株式会社 | 代用血液 |
| IE52535B1 (en) | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| US4475196A (en) | 1981-03-06 | 1984-10-02 | Zor Clair G | Instrument for locating faults in aircraft passenger reading light and attendant call control system |
| US4447233A (en) | 1981-04-10 | 1984-05-08 | Parker-Hannifin Corporation | Medication infusion pump |
| US4485045A (en) | 1981-07-06 | 1984-11-27 | Research Corporation | Synthetic phosphatidyl cholines useful in forming liposomes |
| US4640835A (en) | 1981-10-30 | 1987-02-03 | Nippon Chemiphar Company, Ltd. | Plasminogen activator derivatives |
| DE3374837D1 (en) | 1982-02-17 | 1988-01-21 | Ciba Geigy Ag | Lipids in the aqueous phase |
| US4439196A (en) | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4447224A (en) | 1982-09-20 | 1984-05-08 | Infusaid Corporation | Variable flow implantable infusion apparatus |
| US4487603A (en) | 1982-11-26 | 1984-12-11 | Cordis Corporation | Implantable microinfusion pump system |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4486194A (en) | 1983-06-08 | 1984-12-04 | James Ferrara | Therapeutic device for administering medicaments through the skin |
| US4544545A (en) | 1983-06-20 | 1985-10-01 | Trustees University Of Massachusetts | Liposomes containing modified cholesterol for organ targeting |
| HUT35524A (en) | 1983-08-02 | 1985-07-29 | Hoechst Ag | Process for preparing pharmaceutical compositions containing regulatory /regulative/ peptides providing for the retarded release of the active substance |
| DE3474511D1 (en) | 1983-11-01 | 1988-11-17 | Terumo Corp | Pharmaceutical composition containing urokinase |
| US4496689A (en) | 1983-12-27 | 1985-01-29 | Miles Laboratories, Inc. | Covalently attached complex of alpha-1-proteinase inhibitor with a water soluble polymer |
| US4694778A (en) | 1984-05-04 | 1987-09-22 | Anicon, Inc. | Chemical vapor deposition wafer boat |
| JPS6147500A (ja) | 1984-08-15 | 1986-03-07 | Res Dev Corp Of Japan | キメラモノクロ−ナル抗体及びその製造法 |
| EP0173494A3 (en) | 1984-08-27 | 1987-11-25 | The Board Of Trustees Of The Leland Stanford Junior University | Chimeric receptors by dna splicing and expression |
| GB8422238D0 (en) | 1984-09-03 | 1984-10-10 | Neuberger M S | Chimeric proteins |
| US4879231A (en) | 1984-10-30 | 1989-11-07 | Phillips Petroleum Company | Transformation of yeasts of the genus pichia |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| US4751180A (en) | 1985-03-28 | 1988-06-14 | Chiron Corporation | Expression using fused genes providing for protein product |
| EP0206448B1 (en) | 1985-06-19 | 1990-11-14 | Ajinomoto Co., Inc. | Hemoglobin combined with a poly(alkylene oxide) |
| US4935233A (en) | 1985-12-02 | 1990-06-19 | G. D. Searle And Company | Covalently linked polypeptide cell modulators |
| WO1987005330A1 (en) | 1986-03-07 | 1987-09-11 | Michel Louis Eugene Bergh | Method for enhancing glycoprotein stability |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| GB8610600D0 (en) | 1986-04-30 | 1986-06-04 | Novo Industri As | Transformation of trichoderma |
| US4791192A (en) | 1986-06-26 | 1988-12-13 | Takeda Chemical Industries, Ltd. | Chemically modified protein with polyethyleneglycol |
| JPH0355104Y2 (ja) | 1986-07-31 | 1991-12-06 | ||
| US5260203A (en) | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| DE3785186T2 (de) | 1986-09-02 | 1993-07-15 | Enzon Lab Inc | Bindungsmolekuele mit einzelpolypeptidkette. |
| JP3101690B2 (ja) | 1987-03-18 | 2000-10-23 | エス・ビィ・2・インコーポレイテッド | 変性抗体の、または変性抗体に関する改良 |
| DE3856559T2 (de) | 1987-05-21 | 2004-04-29 | Micromet Ag | Multifunktionelle Proteine mit vorbestimmter Zielsetzung |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| ATE108965T1 (de) | 1987-12-09 | 1994-08-15 | Omron Tateisi Electronics Co | Induktives datenübertragungssystem. |
| US5476996A (en) | 1988-06-14 | 1995-12-19 | Lidak Pharmaceuticals | Human immune system in non-human animal |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5175384A (en) | 1988-12-05 | 1992-12-29 | Genpharm International | Transgenic mice depleted in mature t-cells and methods for making transgenic mice |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| EP0402226A1 (en) | 1989-06-06 | 1990-12-12 | Institut National De La Recherche Agronomique | Transformation vectors for yeast yarrowia |
| US5683888A (en) | 1989-07-22 | 1997-11-04 | University Of Wales College Of Medicine | Modified bioluminescent proteins and their use |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US5292658A (en) | 1989-12-29 | 1994-03-08 | University Of Georgia Research Foundation, Inc. Boyd Graduate Studies Research Center | Cloning and expressions of Renilla luciferase |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6673986B1 (en) | 1990-01-12 | 2004-01-06 | Abgenix, Inc. | Generation of xenogeneic antibodies |
| ATE139258T1 (de) | 1990-01-12 | 1996-06-15 | Cell Genesys Inc | Erzeugung xenogener antikörper |
| US5877397A (en) | 1990-08-29 | 1999-03-02 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| WO1994025585A1 (en) | 1993-04-26 | 1994-11-10 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| DE69127627T2 (de) | 1990-08-29 | 1998-02-19 | Genpharm Int | Produktion und Nützung nicht-menschliche transgentiere zur Produktion heterologe Antikörper |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| US6300129B1 (en) | 1990-08-29 | 2001-10-09 | Genpharm International | Transgenic non-human animals for producing heterologous antibodies |
| US5874299A (en) | 1990-08-29 | 1999-02-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| AU664976B2 (en) | 1990-08-29 | 1995-12-14 | Gene Pharming Europe Bv | Homologous recombination in mammalian cells |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| WO1992015673A1 (en) | 1991-03-11 | 1992-09-17 | The University Of Georgia Research Foundation, Inc. | Cloning and expression of renilla luciferase |
| WO1992022670A1 (en) | 1991-06-12 | 1992-12-23 | Genpharm International, Inc. | Early detection of transgenic embryos |
| AU2235992A (en) | 1991-06-14 | 1993-01-12 | Genpharm International, Inc. | Transgenic immunodeficient non-human animals |
| EP0940468A1 (en) | 1991-06-14 | 1999-09-08 | Genentech, Inc. | Humanized antibody variable domain |
| WO1993004169A1 (en) | 1991-08-20 | 1993-03-04 | Genpharm International, Inc. | Gene targeting in animal cells using isogenic dna constructs |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| EP0746609A4 (en) | 1991-12-17 | 1997-12-17 | Genpharm Int | NON-HUMAN TRANSGENIC ANIMALS CAPABLE OF PRODUCING HETEROLOGOUS ANTIBODIES |
| NZ253943A (en) | 1992-06-18 | 1997-01-29 | Genpharm Int | Transfering polynucleotides into eukaryotic cells using co-lipofection complexes of a cationic lipid and the polynucleotide |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| ES2301158T3 (es) | 1992-07-24 | 2008-06-16 | Amgen Fremont Inc. | Produccion de anticuerpos xenogenicos. |
| US5981175A (en) | 1993-01-07 | 1999-11-09 | Genpharm Internation, Inc. | Methods for producing recombinant mammalian cells harboring a yeast artificial chromosome |
| WO1995007463A1 (en) | 1993-09-10 | 1995-03-16 | The Trustees Of Columbia University In The City Of New York | Uses of green fluorescent protein |
| US5625825A (en) | 1993-10-21 | 1997-04-29 | Lsi Logic Corporation | Random number generating apparatus for an interface unit of a carrier sense with multiple access and collision detect (CSMA/CD) ethernet data network |
| WO1995021191A1 (en) | 1994-02-04 | 1995-08-10 | William Ward | Bioluminescent indicator based upon the expression of a gene for a modified green-fluorescent protein |
| US5643763A (en) | 1994-11-04 | 1997-07-01 | Genpharm International, Inc. | Method for making recombinant yeast artificial chromosomes by minimizing diploid doubling during mating |
| US6214388B1 (en) | 1994-11-09 | 2001-04-10 | The Regents Of The University Of California | Immunoliposomes that optimize internalization into target cells |
| US5777079A (en) | 1994-11-10 | 1998-07-07 | The Regents Of The University Of California | Modified green fluorescent proteins |
| CA2761116A1 (en) | 1995-04-27 | 1996-10-31 | Amgen Fremont Inc. | Human antibodies derived from immunized xenomice |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| US5811524A (en) | 1995-06-07 | 1998-09-22 | Idec Pharmaceuticals Corporation | Neutralizing high affinity human monoclonal antibodies specific to RSV F-protein and methods for their manufacture and therapeutic use thereof |
| EP0859841B1 (en) | 1995-08-18 | 2002-06-19 | MorphoSys AG | Protein/(poly)peptide libraries |
| DK0843961T3 (da) | 1995-08-29 | 2007-05-21 | Kirin Brewery | Kimærisk mus og fremgangsmåde til at producere samme |
| US5874304A (en) | 1996-01-18 | 1999-02-23 | University Of Florida Research Foundation, Inc. | Humanized green fluorescent protein genes and methods |
| US5804387A (en) | 1996-02-01 | 1998-09-08 | The Board Of Trustees Of The Leland Stanford Junior University | FACS-optimized mutants of the green fluorescent protein (GFP) |
| US5876995A (en) | 1996-02-06 | 1999-03-02 | Bryan; Bruce | Bioluminescent novelty items |
| US5925558A (en) | 1996-07-16 | 1999-07-20 | The Regents Of The University Of California | Assays for protein kinases using fluorescent protein substrates |
| US5976796A (en) | 1996-10-04 | 1999-11-02 | Loma Linda University | Construction and expression of renilla luciferase and green fluorescent protein fusion genes |
| ATE549918T1 (de) | 1996-12-03 | 2012-04-15 | Amgen Fremont Inc | Menschliche antikörper, die ausdrücklich menschliches tnf alpha binden |
| IL129767A0 (en) | 1996-12-12 | 2000-02-29 | Prolume Ltd | Apparatus and method for detecting and identifying infectious agents |
| WO1998052976A1 (en) | 1997-05-21 | 1998-11-26 | Biovation Limited | Method for the production of non-immunogenic proteins |
| JP2002507410A (ja) | 1998-03-27 | 2002-03-12 | プロルーム・リミテッド | ルシフェラーゼ、蛍光タンパク質、ルシフェラーゼおよび蛍光タンパク質をコードする核酸および、診断、高処理スクリーニングおよび新規アイテムにおけるその使用 |
| PT1071752E (pt) | 1998-04-21 | 2003-11-28 | Micromet Ag | Polipeptidos especificos para cd19xcd3 e suas utilizacoes |
| EP1100830B1 (en) | 1998-07-28 | 2003-10-01 | Micromet AG | Heterominibodies |
| DE69934967T2 (de) | 1998-12-08 | 2007-12-06 | Biovation Ltd. | Verfahren zur verminderung der immunogenität von proteinen |
| US6833268B1 (en) | 1999-06-10 | 2004-12-21 | Abgenix, Inc. | Transgenic animals for producing specific isotypes of human antibodies via non-cognate switch regions |
| US7435871B2 (en) | 2001-11-30 | 2008-10-14 | Amgen Fremont Inc. | Transgenic animals bearing human Igλ light chain genes |
| JP4948174B2 (ja) | 2003-10-16 | 2012-06-06 | マイクロメット アクツィエン ゲゼルシャフト | 多重特異的脱免疫cd3−結合物質 |
| US7078188B2 (en) * | 2003-11-10 | 2006-07-18 | Board Of Regents Of The University Of Nebraska | MUC17 encoding nucleic acid sequences, polypeptides, antibodies and methods of use thereof |
| BRPI0611901A2 (pt) | 2005-06-14 | 2012-08-28 | Amgen, Inc | composição, liofilizado, kit, e, processo para preparar uma composição |
| US8236308B2 (en) | 2005-10-11 | 2012-08-07 | Micromet Ag | Composition comprising cross-species-specific antibodies and uses thereof |
| PL2155783T5 (pl) * | 2007-04-03 | 2023-03-13 | Amgen Research (Munich) Gmbh | Swoista międzygatunkowo domena wiążąca CD3epsilon |
| CA2691734A1 (en) * | 2007-07-04 | 2009-01-08 | Forerunner Pharma Research Co., Ltd. | Anti-muc17 antibody |
| US10981998B2 (en) | 2008-10-01 | 2021-04-20 | Amgen Research (Munich) Gmbh | Cross-species-specific single domain bispecific single chain antibody |
| PL2356153T3 (pl) | 2008-10-01 | 2016-11-30 | Swoiste międzygatunkowo dwuswoiste przeciwciało jednołańcuchowe PSMAXCD3 | |
| TWI653333B (zh) | 2010-04-01 | 2019-03-11 | 安進研究(慕尼黑)有限責任公司 | 跨物種專一性之PSMAxCD3雙專一性單鏈抗體 |
| EP2658739B1 (de) | 2010-12-30 | 2017-02-22 | Johnson Controls Metals and Mechanisms GmbH & Co. KG | Längsverstellvorrichtung eines kraftfahrzeugsitzes mit zwei schienenpaaren |
| US20130078250A1 (en) | 2011-08-23 | 2013-03-28 | Oliver Ast | Bispecific t cell activating antigen binding molecules |
| ES2659764T3 (es) | 2011-08-23 | 2018-03-19 | Roche Glycart Ag | Moléculas biespecíficas de unión a antígeno activadoras de linfocitos T |
| US20140308285A1 (en) | 2013-03-15 | 2014-10-16 | Amgen Inc. | Heterodimeric bispecific antibodies |
| US20140302037A1 (en) | 2013-03-15 | 2014-10-09 | Amgen Inc. | BISPECIFIC-Fc MOLECULES |
| CA2903258C (en) | 2013-03-15 | 2019-11-26 | Amgen Inc. | Heterodimeric bispecific antibodies |
| WO2015048272A1 (en) | 2013-09-25 | 2015-04-02 | Amgen Inc. | V-c-fc-v-c antibody |
| US9300829B2 (en) | 2014-04-04 | 2016-03-29 | Canon Kabushiki Kaisha | Image reading apparatus and correction method thereof |
| US10105142B2 (en) | 2014-09-18 | 2018-10-23 | Ethicon Llc | Surgical stapler with plurality of cutting elements |
| TWI772258B (zh) * | 2015-04-17 | 2022-08-01 | 德商安美基研究(慕尼黑)公司 | Cdh3與cd3之雙特異性抗體構築體 |
| EA039859B1 (ru) * | 2016-02-03 | 2022-03-21 | Эмджен Рисерч (Мюник) Гмбх | Биспецифические конструкты антител, связывающие egfrviii и cd3 |
-
2018
- 2018-12-28 UY UY0001038041A patent/UY38041A/es unknown
- 2018-12-28 TW TW107147698A patent/TW201940518A/zh unknown
- 2018-12-31 CA CA3087151A patent/CA3087151A1/en active Pending
- 2018-12-31 WO PCT/US2018/068118 patent/WO2019133961A1/en active Application Filing
- 2018-12-31 KR KR1020207021768A patent/KR20200105493A/ko not_active Application Discontinuation
- 2018-12-31 PE PE2020000859A patent/PE20201340A1/es unknown
- 2018-12-31 EP EP18837141.3A patent/EP3732200A1/en active Pending
- 2018-12-31 JP JP2020535956A patent/JP2021508465A/ja active Pending
- 2018-12-31 SG SG11202005274VA patent/SG11202005274VA/en unknown
- 2018-12-31 CR CR20200325A patent/CR20200325A/es unknown
- 2018-12-31 MA MA051417A patent/MA51417A/fr unknown
- 2018-12-31 UA UAA202004810A patent/UA128330C2/uk unknown
- 2018-12-31 CN CN202311579367.9A patent/CN117510645A/zh active Pending
- 2018-12-31 US US16/956,797 patent/US20210130465A1/en active Pending
- 2018-12-31 MX MX2020006871A patent/MX2020006871A/es unknown
- 2018-12-31 CN CN201880076187.XA patent/CN111630067B/zh active Active
- 2018-12-31 JO JOP/2020/0158A patent/JOP20200158A1/ar unknown
- 2018-12-31 AU AU2018394255A patent/AU2018394255A1/en active Pending
-
2020
- 2020-06-08 PH PH12020550841A patent/PH12020550841A1/en unknown
- 2020-06-18 IL IL275492A patent/IL275492A/en unknown
- 2020-06-25 CL CL2020001732A patent/CL2020001732A1/es unknown
- 2020-07-23 CO CONC2020/0009034A patent/CO2020009034A2/es unknown
- 2020-07-24 ZA ZA2020/04595A patent/ZA202004595B/en unknown
-
2023
- 2023-06-22 JP JP2023102462A patent/JP2023134497A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021508465A (ja) | 2021-03-11 |
| CR20200325A (es) | 2020-11-09 |
| ZA202004595B (en) | 2024-09-25 |
| CA3087151A1 (en) | 2019-07-04 |
| CN117510645A (zh) | 2024-02-06 |
| MX2020006871A (es) | 2020-08-24 |
| US20210130465A1 (en) | 2021-05-06 |
| IL275492A (en) | 2020-08-31 |
| EP3732200A1 (en) | 2020-11-04 |
| CL2020001732A1 (es) | 2021-02-12 |
| CO2020009034A2 (es) | 2020-07-31 |
| UY38041A (es) | 2019-06-28 |
| PE20201340A1 (es) | 2020-11-25 |
| CN111630067A (zh) | 2020-09-04 |
| WO2019133961A1 (en) | 2019-07-04 |
| SG11202005274VA (en) | 2020-07-29 |
| KR20200105493A (ko) | 2020-09-07 |
| PH12020550841A1 (en) | 2021-05-17 |
| AU2018394255A1 (en) | 2020-06-11 |
| MA51417A (fr) | 2020-11-04 |
| JOP20200158A1 (ar) | 2022-10-30 |
| TW201940518A (zh) | 2019-10-16 |
| UA128330C2 (uk) | 2024-06-12 |
| BR112020013018A2 (pt) | 2021-02-17 |
| CN111630067B (zh) | 2023-12-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7295916B2 (ja) | Psmaおよびcd3に対する二重特異性を有するt細胞エンゲージ抗体コンストラクト | |
| US20230192884A1 (en) | Bispecific t cell engaging antibody constructs | |
| KR102700015B1 (ko) | 개선된 저장 및 투여를 위한 이중특이적 항체 구축물을 포함하는 약제학적 조성물 | |
| TWI744242B (zh) | Egfrviii及cd3抗體構築體 | |
| TWI717375B (zh) | Cd70及cd3抗體構築體 | |
| EP3328893B1 (en) | Bispecific antibody constructs binding mesothelin and cd3 | |
| CN108271376B (zh) | 结合dll3和cd3的双特异性抗体构建体 | |
| CA2953530C (en) | Antibody constructs for cdh19 and cd3 | |
| JP6907124B2 (ja) | Cdh3及びcd3に対する二重特異性抗体構築物 | |
| JP2023134497A (ja) | Muc17及びcd3に向けられる二重特異性抗体コンストラクト | |
| US20210395298A1 (en) | Downstream processing of bispecific antibody constructs | |
| WO2024059675A2 (en) | Bispecific molecule stabilizing composition | |
| TWI858372B (zh) | Cdh3與cd3之雙特異性抗體構築體 | |
| JP2024518369A (ja) | 増殖性疾患で使用されるcd20及びcd22標的化抗原結合分子 | |
| BR112020013018B1 (pt) | Construto de anticorpo biespecífico, seu uso e composição farmacêutica | |
| EA046123B1 (ru) | Конструкция на основе биспецифического антитела, направленная на muc17 и cd3 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230712 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230712 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230714 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240627 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240927 |