JP2022020782A - Vegfを阻害する安定かつ可溶性の抗体 - Google Patents
Vegfを阻害する安定かつ可溶性の抗体 Download PDFInfo
- Publication number
- JP2022020782A JP2022020782A JP2021184262A JP2021184262A JP2022020782A JP 2022020782 A JP2022020782 A JP 2022020782A JP 2021184262 A JP2021184262 A JP 2021184262A JP 2021184262 A JP2021184262 A JP 2021184262A JP 2022020782 A JP2022020782 A JP 2022020782A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- vegf
- antibody
- immunobinder
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 230000002401 inhibitory effect Effects 0.000 title description 5
- 101100372758 Danio rerio vegfaa gene Proteins 0.000 title 1
- 101150030763 Vegfa gene Proteins 0.000 title 1
- 238000000034 method Methods 0.000 claims abstract description 68
- 210000004027 cell Anatomy 0.000 claims abstract description 34
- 239000013598 vector Substances 0.000 claims abstract description 16
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 14
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 13
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 13
- 210000004408 hybridoma Anatomy 0.000 claims abstract description 8
- 239000000203 mixture Substances 0.000 claims description 61
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 abstract description 128
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 abstract description 128
- 241000283973 Oryctolagus cuniculus Species 0.000 abstract description 60
- 101000808011 Homo sapiens Vascular endothelial growth factor A Proteins 0.000 abstract description 57
- 102000058223 human VEGFA Human genes 0.000 abstract description 41
- 238000011282 treatment Methods 0.000 abstract description 36
- 239000003814 drug Substances 0.000 abstract description 16
- 239000012634 fragment Substances 0.000 abstract description 15
- 230000001404 mediated effect Effects 0.000 abstract description 14
- 239000011230 binding agent Substances 0.000 abstract description 8
- 238000001727 in vivo Methods 0.000 abstract description 5
- 238000003745 diagnosis Methods 0.000 abstract description 4
- 238000002955 isolation Methods 0.000 abstract 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 121
- 125000003275 alpha amino acid group Chemical group 0.000 description 107
- 235000001014 amino acid Nutrition 0.000 description 92
- 230000027455 binding Effects 0.000 description 73
- 238000003556 assay Methods 0.000 description 48
- 238000009472 formulation Methods 0.000 description 47
- 108090000623 proteins and genes Proteins 0.000 description 42
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 40
- 108090000765 processed proteins & peptides Proteins 0.000 description 37
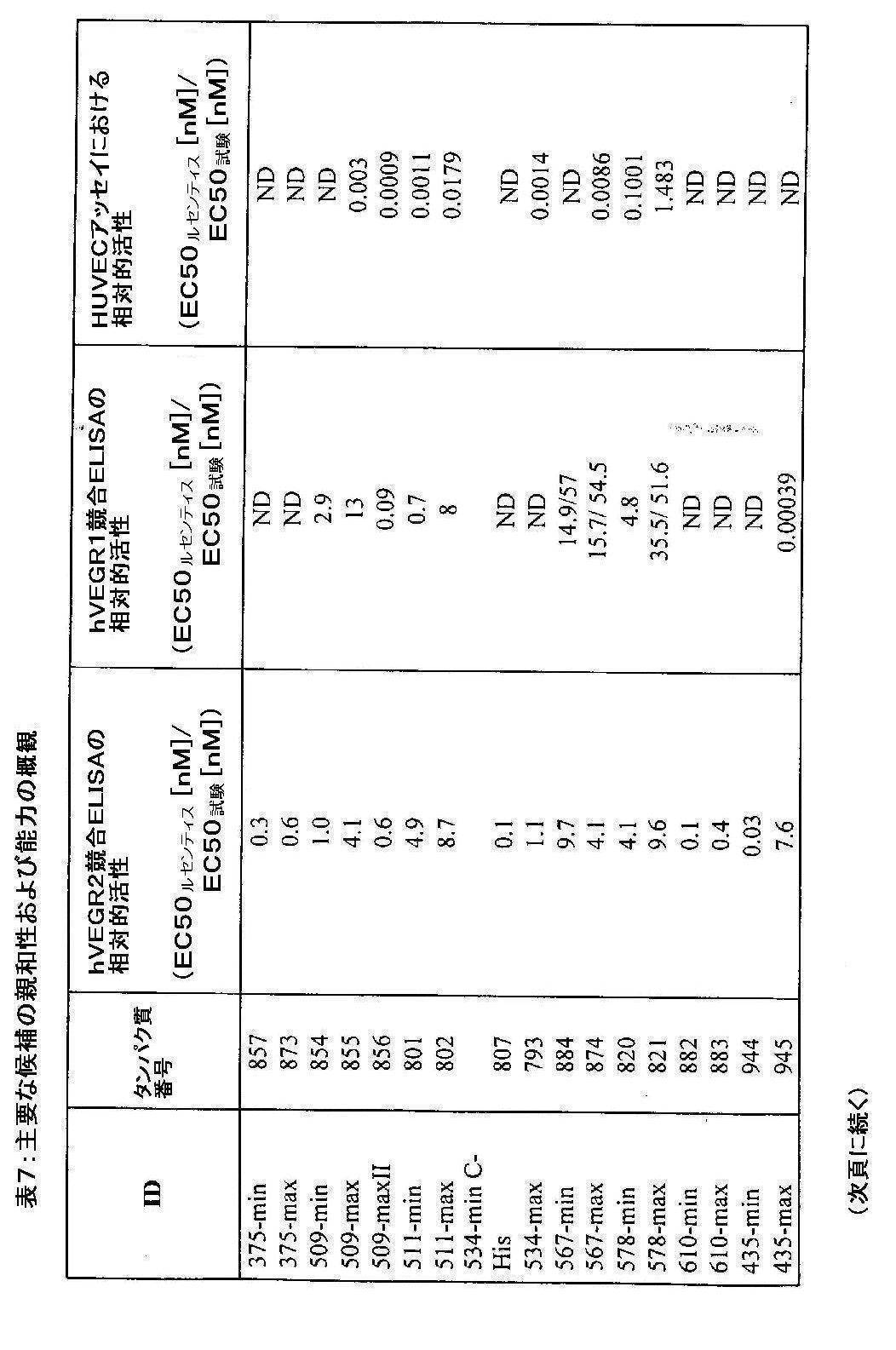
- 229940076783 lucentis Drugs 0.000 description 36
- 102000004169 proteins and genes Human genes 0.000 description 36
- 235000018102 proteins Nutrition 0.000 description 34
- 241000282414 Homo sapiens Species 0.000 description 33
- 229940024606 amino acid Drugs 0.000 description 31
- 150000001413 amino acids Chemical class 0.000 description 31
- 101000808007 Mus musculus Vascular endothelial growth factor A Proteins 0.000 description 29
- 206010028980 Neoplasm Diseases 0.000 description 28
- 101000808006 Rattus norvegicus Vascular endothelial growth factor A Proteins 0.000 description 24
- 239000000872 buffer Substances 0.000 description 22
- 208000035475 disorder Diseases 0.000 description 21
- 241000700159 Rattus Species 0.000 description 19
- 201000010099 disease Diseases 0.000 description 19
- 102000004196 processed proteins & peptides Human genes 0.000 description 19
- 238000006467 substitution reaction Methods 0.000 description 19
- 238000012360 testing method Methods 0.000 description 19
- 239000000427 antigen Substances 0.000 description 17
- 108091007433 antigens Proteins 0.000 description 17
- 102000036639 antigens Human genes 0.000 description 17
- 230000002207 retinal effect Effects 0.000 description 17
- -1 aspartin Chemical compound 0.000 description 16
- 238000002347 injection Methods 0.000 description 16
- 239000007924 injection Substances 0.000 description 16
- 125000005647 linker group Chemical group 0.000 description 16
- 239000000758 substrate Substances 0.000 description 16
- 230000001225 therapeutic effect Effects 0.000 description 16
- 238000002965 ELISA Methods 0.000 description 15
- 241000699666 Mus <mouse, genus> Species 0.000 description 15
- 201000011510 cancer Diseases 0.000 description 15
- 239000008194 pharmaceutical composition Substances 0.000 description 15
- 241000894007 species Species 0.000 description 15
- 241001465754 Metazoa Species 0.000 description 14
- 230000000694 effects Effects 0.000 description 13
- 238000002649 immunization Methods 0.000 description 13
- 229920001184 polypeptide Polymers 0.000 description 13
- MTCFGRXMJLQNBG-UHFFFAOYSA-N serine Chemical group OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 13
- 230000002792 vascular Effects 0.000 description 13
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 12
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 12
- 239000004473 Threonine Substances 0.000 description 12
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 12
- 125000000539 amino acid group Chemical group 0.000 description 12
- 230000003053 immunization Effects 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 11
- 229920005862 polyol Polymers 0.000 description 11
- 150000003077 polyols Chemical class 0.000 description 11
- 230000035755 proliferation Effects 0.000 description 11
- 235000000346 sugar Nutrition 0.000 description 11
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 10
- 230000000903 blocking effect Effects 0.000 description 10
- 238000012986 modification Methods 0.000 description 10
- 230000004048 modification Effects 0.000 description 10
- 239000003755 preservative agent Substances 0.000 description 10
- 230000000699 topical effect Effects 0.000 description 10
- 239000003981 vehicle Substances 0.000 description 10
- 108020004414 DNA Proteins 0.000 description 9
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- 230000004071 biological effect Effects 0.000 description 9
- 229940088598 enzyme Drugs 0.000 description 9
- 230000004927 fusion Effects 0.000 description 9
- 229910052739 hydrogen Inorganic materials 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 239000002953 phosphate buffered saline Substances 0.000 description 9
- 229910052720 vanadium Inorganic materials 0.000 description 9
- 241000700198 Cavia Species 0.000 description 8
- 108091035707 Consensus sequence Proteins 0.000 description 8
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 8
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 8
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 8
- 206010029113 Neovascularisation Diseases 0.000 description 8
- 108091028043 Nucleic acid sequence Proteins 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 108091008605 VEGF receptors Proteins 0.000 description 8
- 229940120638 avastin Drugs 0.000 description 8
- 230000000875 corresponding effect Effects 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 230000002163 immunogen Effects 0.000 description 8
- 229910052698 phosphorus Inorganic materials 0.000 description 8
- 238000001556 precipitation Methods 0.000 description 8
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 7
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 7
- 206010064930 age-related macular degeneration Diseases 0.000 description 7
- 235000004279 alanine Nutrition 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 230000002860 competitive effect Effects 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000010168 coupling process Methods 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- 238000004925 denaturation Methods 0.000 description 7
- 230000036425 denaturation Effects 0.000 description 7
- 239000013604 expression vector Substances 0.000 description 7
- 230000012010 growth Effects 0.000 description 7
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 7
- 229910052740 iodine Inorganic materials 0.000 description 7
- 208000002780 macular degeneration Diseases 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 230000004044 response Effects 0.000 description 7
- 238000001228 spectrum Methods 0.000 description 7
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 6
- COXVTLYNGOIATD-HVMBLDELSA-N CC1=C(C=CC(=C1)C1=CC(C)=C(C=C1)\N=N\C1=C(O)C2=C(N)C(=CC(=C2C=C1)S(O)(=O)=O)S(O)(=O)=O)\N=N\C1=CC=C2C(=CC(=C(N)C2=C1O)S(O)(=O)=O)S(O)(=O)=O Chemical compound CC1=C(C=CC(=C1)C1=CC(C)=C(C=C1)\N=N\C1=C(O)C2=C(N)C(=CC(=C2C=C1)S(O)(=O)=O)S(O)(=O)=O)\N=N\C1=CC=C2C(=CC(=C(N)C2=C1O)S(O)(=O)=O)S(O)(=O)=O COXVTLYNGOIATD-HVMBLDELSA-N 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 6
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 6
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 6
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 6
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 6
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 6
- 235000011130 ammonium sulphate Nutrition 0.000 description 6
- 239000001166 ammonium sulphate Substances 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- 238000010494 dissociation reaction Methods 0.000 description 6
- 230000005593 dissociations Effects 0.000 description 6
- 231100000673 dose–response relationship Toxicity 0.000 description 6
- 239000000975 dye Substances 0.000 description 6
- 229960003699 evans blue Drugs 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 210000004602 germ cell Anatomy 0.000 description 6
- 229940127121 immunoconjugate Drugs 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
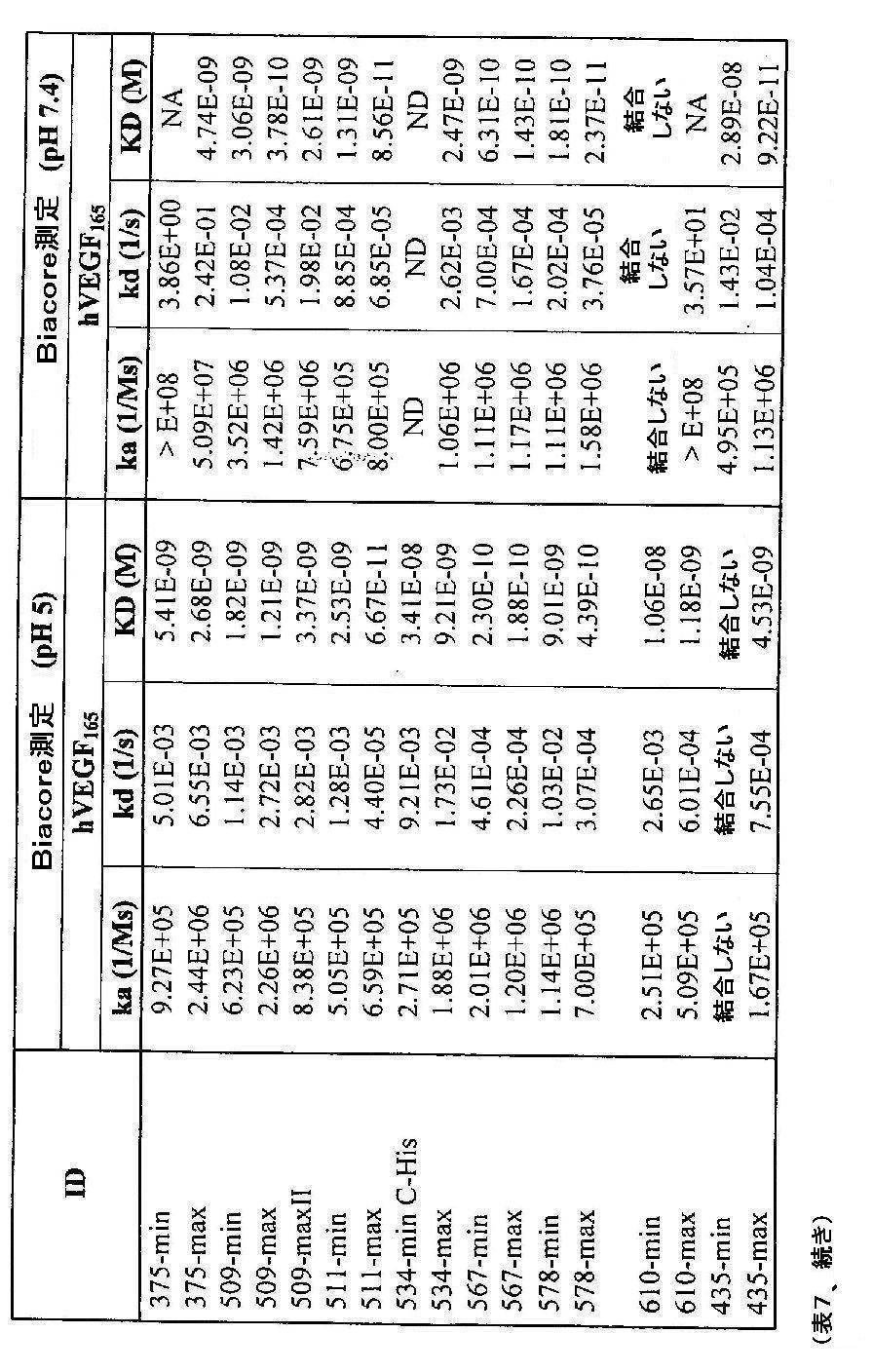
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 6
- 239000004474 valine Substances 0.000 description 6
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical group OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 5
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 5
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 description 5
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 5
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical group C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 5
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 239000004472 Lysine Substances 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 5
- 238000002835 absorbance Methods 0.000 description 5
- 230000003487 anti-permeability effect Effects 0.000 description 5
- 201000000053 blastoma Diseases 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 5
- 229940127089 cytotoxic agent Drugs 0.000 description 5
- 201000008184 embryoma Diseases 0.000 description 5
- 210000002889 endothelial cell Anatomy 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 238000011534 incubation Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 210000001322 periplasm Anatomy 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 238000003127 radioimmunoassay Methods 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 150000008163 sugars Chemical class 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 229910052727 yttrium Inorganic materials 0.000 description 5
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 241000588724 Escherichia coli Species 0.000 description 4
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 4
- 239000004471 Glycine Substances 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 4
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Natural products OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 4
- 238000007792 addition Methods 0.000 description 4
- 239000012491 analyte Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 239000001045 blue dye Substances 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 239000002254 cytotoxic agent Substances 0.000 description 4
- 231100000599 cytotoxic agent Toxicity 0.000 description 4
- 230000001472 cytotoxic effect Effects 0.000 description 4
- 231100000135 cytotoxicity Toxicity 0.000 description 4
- 230000003013 cytotoxicity Effects 0.000 description 4
- 238000012377 drug delivery Methods 0.000 description 4
- 239000003889 eye drop Substances 0.000 description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 4
- 201000011066 hemangioma Diseases 0.000 description 4
- 230000002209 hydrophobic effect Effects 0.000 description 4
- 210000003000 inclusion body Anatomy 0.000 description 4
- 238000001802 infusion Methods 0.000 description 4
- 238000007913 intrathecal administration Methods 0.000 description 4
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 4
- 229960000310 isoleucine Drugs 0.000 description 4
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 4
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 229930182817 methionine Natural products 0.000 description 4
- 238000002703 mutagenesis Methods 0.000 description 4
- 231100000350 mutagenesis Toxicity 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N phenylalanine group Chemical group N[C@@H](CC1=CC=CC=C1)C(=O)O COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 4
- 239000000049 pigment Substances 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 230000002335 preservative effect Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 229940051022 radioimmunoconjugate Drugs 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 108091008146 restriction endonucleases Proteins 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 4
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 4
- 230000008728 vascular permeability Effects 0.000 description 4
- 239000002525 vasculotropin inhibitor Substances 0.000 description 4
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 3
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- 239000004475 Arginine Substances 0.000 description 3
- 206010061692 Benign muscle neoplasm Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 241000700199 Cavia porcellus Species 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- 108010092160 Dactinomycin Proteins 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 3
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- 229930195725 Mannitol Natural products 0.000 description 3
- 201000004458 Myoma Diseases 0.000 description 3
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 108010076504 Protein Sorting Signals Proteins 0.000 description 3
- 201000004681 Psoriasis Diseases 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 208000017442 Retinal disease Diseases 0.000 description 3
- 206010038923 Retinopathy Diseases 0.000 description 3
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 3
- 101100263588 Sus scrofa VEGFA gene Proteins 0.000 description 3
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 239000013011 aqueous formulation Substances 0.000 description 3
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 3
- 235000003704 aspartic acid Nutrition 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- 102000005936 beta-Galactosidase Human genes 0.000 description 3
- 108010005774 beta-Galactosidase Proteins 0.000 description 3
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 239000007853 buffer solution Substances 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 3
- 229960000975 daunorubicin Drugs 0.000 description 3
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 3
- 238000007710 freezing Methods 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 230000008642 heat stress Effects 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- APFVFJFRJDLVQX-AHCXROLUSA-N indium-111 Chemical compound [111In] APFVFJFRJDLVQX-AHCXROLUSA-N 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 239000000594 mannitol Substances 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 230000003472 neutralizing effect Effects 0.000 description 3
- 238000011275 oncology therapy Methods 0.000 description 3
- 102000013415 peroxidase activity proteins Human genes 0.000 description 3
- 108040007629 peroxidase activity proteins Proteins 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 239000010421 standard material Substances 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- 208000011580 syndromic disease Diseases 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 102000003390 tumor necrosis factor Human genes 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 102000005600 Cathepsins Human genes 0.000 description 2
- 108010084457 Cathepsins Proteins 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 241000251730 Chondrichthyes Species 0.000 description 2
- 208000005590 Choroidal Neovascularization Diseases 0.000 description 2
- 206010060823 Choroidal neovascularisation Diseases 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 206010010071 Coma Diseases 0.000 description 2
- OCUCCJIRFHNWBP-IYEMJOQQSA-L Copper gluconate Chemical class [Cu+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O OCUCCJIRFHNWBP-IYEMJOQQSA-L 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 2
- 206010012689 Diabetic retinopathy Diseases 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 206010014733 Endometrial cancer Diseases 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 201000009273 Endometriosis Diseases 0.000 description 2
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- 201000008808 Fibrosarcoma Diseases 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 208000010412 Glaucoma Diseases 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 241000606768 Haemophilus influenzae Species 0.000 description 2
- 101100372760 Homo sapiens FLT1 gene Proteins 0.000 description 2
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 2
- 102000000589 Interleukin-1 Human genes 0.000 description 2
- 108010002352 Interleukin-1 Proteins 0.000 description 2
- 102100020873 Interleukin-2 Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 description 2
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 2
- 206010029260 Neuroblastoma Diseases 0.000 description 2
- 206010030113 Oedema Diseases 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 102000004316 Oxidoreductases Human genes 0.000 description 2
- 108090000854 Oxidoreductases Proteins 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 102100035194 Placenta growth factor Human genes 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 description 2
- VGQOVCHZGQWAOI-UHFFFAOYSA-N UNPD55612 Natural products N1C(O)C2CC(C=CC(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-UHFFFAOYSA-N 0.000 description 2
- 208000006593 Urologic Neoplasms Diseases 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 2
- 102000016548 Vascular Endothelial Growth Factor Receptor-1 Human genes 0.000 description 2
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 2
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 208000008383 Wilms tumor Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 150000001242 acetic acid derivatives Chemical class 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- VGQOVCHZGQWAOI-HYUHUPJXSA-N anthramycin Chemical compound N1[C@@H](O)[C@@H]2CC(\C=C\C(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-HYUHUPJXSA-N 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 230000009830 antibody antigen interaction Effects 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229960001950 benzethonium chloride Drugs 0.000 description 2
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 2
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- 239000001055 blue pigment Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000012876 carrier material Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 238000012412 chemical coupling Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 150000001860 citric acid derivatives Chemical class 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 238000012875 competitive assay Methods 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 238000012937 correction Methods 0.000 description 2
- 239000003431 cross linking reagent Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 229960000640 dactinomycin Drugs 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 230000002124 endocrine Effects 0.000 description 2
- 230000002357 endometrial effect Effects 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- 229940012356 eye drops Drugs 0.000 description 2
- 230000000893 fibroproliferative effect Effects 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- 238000002695 general anesthesia Methods 0.000 description 2
- 238000007429 general method Methods 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- 229960000789 guanidine hydrochloride Drugs 0.000 description 2
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- 229940047650 haemophilus influenzae Drugs 0.000 description 2
- 201000010536 head and neck cancer Diseases 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- 201000002222 hemangioblastoma Diseases 0.000 description 2
- 102000055590 human KDR Human genes 0.000 description 2
- 235000003642 hunger Nutrition 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000003018 immunoassay Methods 0.000 description 2
- 239000002596 immunotoxin Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 238000013507 mapping Methods 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- 229910052751 metal Chemical class 0.000 description 2
- 239000002184 metal Chemical class 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 201000008026 nephroblastoma Diseases 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 201000008968 osteosarcoma Diseases 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- AQIXEPGDORPWBJ-UHFFFAOYSA-N pentan-3-ol Chemical compound CCC(O)CC AQIXEPGDORPWBJ-UHFFFAOYSA-N 0.000 description 2
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000002028 premature Effects 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- 239000013643 reference control Substances 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 238000001542 size-exclusion chromatography Methods 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 229940074404 sodium succinate Drugs 0.000 description 2
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 230000037351 starvation Effects 0.000 description 2
- 210000004500 stellate cell Anatomy 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 150000003890 succinate salts Chemical class 0.000 description 2
- 150000005846 sugar alcohols Chemical class 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000012085 test solution Substances 0.000 description 2
- 201000002510 thyroid cancer Diseases 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- FLCQLSRLQIPNLM-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-acetylsulfanylacetate Chemical compound CC(=O)SCC(=O)ON1C(=O)CCC1=O FLCQLSRLQIPNLM-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- PNDPGZBMCMUPRI-HVTJNCQCSA-N 10043-66-0 Chemical compound [131I][131I] PNDPGZBMCMUPRI-HVTJNCQCSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- KGLPWQKSKUVKMJ-UHFFFAOYSA-N 2,3-dihydrophthalazine-1,4-dione Chemical compound C1=CC=C2C(=O)NNC(=O)C2=C1 KGLPWQKSKUVKMJ-UHFFFAOYSA-N 0.000 description 1
- XQDQRCRASHAZBA-UHFFFAOYSA-N 2,4-dinitro-1-thiocyanatobenzene Chemical compound [O-][N+](=O)C1=CC=C(SC#N)C([N+]([O-])=O)=C1 XQDQRCRASHAZBA-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- KIUMMUBSPKGMOY-UHFFFAOYSA-N 3,3'-Dithiobis(6-nitrobenzoic acid) Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(SSC=2C=C(C(=CC=2)[N+]([O-])=O)C(O)=O)=C1 KIUMMUBSPKGMOY-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- VXPSQDAMFATNNG-UHFFFAOYSA-N 3-[2-(2,5-dioxopyrrol-3-yl)phenyl]pyrrole-2,5-dione Chemical compound O=C1NC(=O)C(C=2C(=CC=CC=2)C=2C(NC(=O)C=2)=O)=C1 VXPSQDAMFATNNG-UHFFFAOYSA-N 0.000 description 1
- OBWSOTREAMFOCQ-UHFFFAOYSA-N 4-(4-amino-3,5-dimethylphenyl)-2,6-dimethylaniline;hydrochloride Chemical compound Cl.CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 OBWSOTREAMFOCQ-UHFFFAOYSA-N 0.000 description 1
- XZKIHKMTEMTJQX-UHFFFAOYSA-N 4-Nitrophenyl Phosphate Chemical compound OP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1 XZKIHKMTEMTJQX-UHFFFAOYSA-N 0.000 description 1
- 102100031126 6-phosphogluconolactonase Human genes 0.000 description 1
- 108010029731 6-phosphogluconolactonase Proteins 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
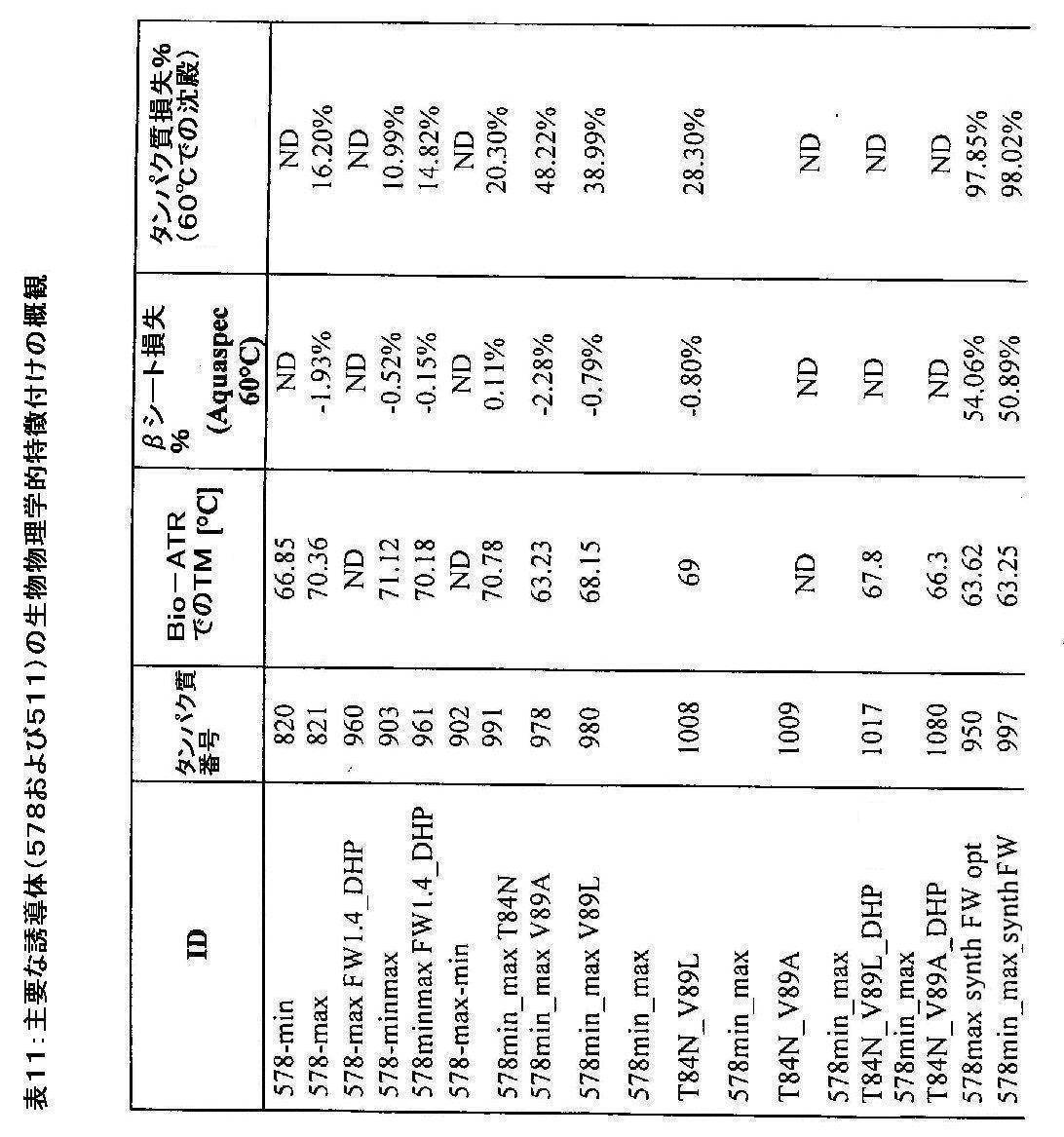
- 238000004483 ATR-FTIR spectroscopy Methods 0.000 description 1
- 108010066676 Abrin Proteins 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 108090000363 Bacterial Luciferases Proteins 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 201000004569 Blindness Diseases 0.000 description 1
- 241000282461 Canis lupus Species 0.000 description 1
- 235000002566 Capsicum Nutrition 0.000 description 1
- 240000008574 Capsicum frutescens Species 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 241000759568 Corixa Species 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- 102100021906 Cyclin-O Human genes 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- QWIZNVHXZXRPDR-UHFFFAOYSA-N D-melezitose Natural products O1C(CO)C(O)C(O)C(O)C1OC1C(O)C(CO)OC1(CO)OC1OC(CO)C(O)C(O)C1O QWIZNVHXZXRPDR-UHFFFAOYSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- UNXHWFMMPAWVPI-QWWZWVQMSA-N D-threitol Chemical compound OC[C@@H](O)[C@H](O)CO UNXHWFMMPAWVPI-QWWZWVQMSA-N 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 239000004386 Erythritol Substances 0.000 description 1
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 description 1
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- 108010015133 Galactose oxidase Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 102100022624 Glucoamylase Human genes 0.000 description 1
- 108050008938 Glucoamylases Proteins 0.000 description 1
- 108010015776 Glucose oxidase Proteins 0.000 description 1
- 239000004366 Glucose oxidase Substances 0.000 description 1
- 108010018962 Glucosephosphate Dehydrogenase Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- 108010026389 Gramicidin Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 101000897441 Homo sapiens Cyclin-O Proteins 0.000 description 1
- 101001001487 Homo sapiens Phosphatidylinositol-glycan biosynthesis class F protein Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- LKDRXBCSQODPBY-AMVSKUEXSA-N L-(-)-Sorbose Chemical compound OCC1(O)OC[C@H](O)[C@@H](O)[C@@H]1O LKDRXBCSQODPBY-AMVSKUEXSA-N 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- RGHNJXZEOKUKBD-KLVWXMOXSA-N L-gluconic acid Chemical class OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)C(O)=O RGHNJXZEOKUKBD-KLVWXMOXSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- SHZGCJCMOBCMKK-JFNONXLTSA-N L-rhamnopyranose Chemical compound C[C@@H]1OC(O)[C@H](O)[C@H](O)[C@H]1O SHZGCJCMOBCMKK-JFNONXLTSA-N 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- 108010023244 Lactoperoxidase Proteins 0.000 description 1
- 102000045576 Lactoperoxidases Human genes 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- 241000283960 Leporidae Species 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 229930126263 Maytansine Natural products 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 208000006550 Mydriasis Diseases 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- 208000022873 Ocular disease Diseases 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 201000010133 Oligodendroglioma Diseases 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 101150062285 PGF gene Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 241000025414 Pentalagus furnessi Species 0.000 description 1
- 108700020962 Peroxidase Proteins 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 description 1
- 206010034811 Pharyngeal cancer Diseases 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 101800004937 Protein C Proteins 0.000 description 1
- 102000017975 Protein C Human genes 0.000 description 1
- 229940096437 Protein S Drugs 0.000 description 1
- 102000029301 Protein S Human genes 0.000 description 1
- 108010066124 Protein S Proteins 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 208000019155 Radiation injury Diseases 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 230000010799 Receptor Interactions Effects 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 108020005091 Replication Origin Proteins 0.000 description 1
- 206010057430 Retinal injury Diseases 0.000 description 1
- 206010038934 Retinopathy proliferative Diseases 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- AUVVAXYIELKVAI-UHFFFAOYSA-N SJ000285215 Natural products N1CCC2=CC(OC)=C(OC)C=C2C1CC1CC2C3=CC(OC)=C(OC)C=C3CCN2CC1CC AUVVAXYIELKVAI-UHFFFAOYSA-N 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 101710109488 Salt stress-induced protein Proteins 0.000 description 1
- 101800001700 Saposin-D Proteins 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- 241001522306 Serinus serinus Species 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 108010092464 Urate Oxidase Proteins 0.000 description 1
- 108010046334 Urease Proteins 0.000 description 1
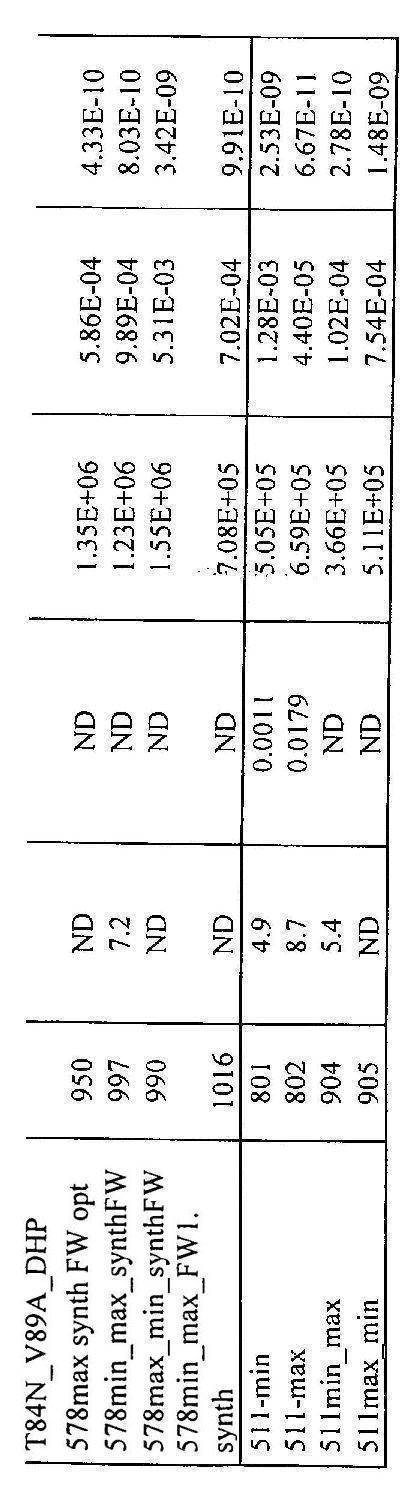
- 238000011167 VEGF-binding assay Methods 0.000 description 1
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 1
- 244000195452 Wasabia japonica Species 0.000 description 1
- 235000000760 Wasabia japonica Nutrition 0.000 description 1
- 108010093894 Xanthine oxidase Proteins 0.000 description 1
- 102100033220 Xanthine oxidase Human genes 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 238000012867 alanine scanning Methods 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- 238000011948 assay development Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 238000005102 attenuated total reflection Methods 0.000 description 1
- 108010044540 auristatin Proteins 0.000 description 1
- 238000000376 autoradiography Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- RSIHSRDYCUFFLA-DYKIIFRCSA-N boldenone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 RSIHSRDYCUFFLA-DYKIIFRCSA-N 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 235000012745 brilliant blue FCF Nutrition 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N butyl alcohol Substances CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000001390 capsicum minimum Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- NDAYQJDHGXTBJL-MWWSRJDJSA-N chembl557217 Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 NDAYQJDHGXTBJL-MWWSRJDJSA-N 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000000701 coagulant Substances 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 239000000599 controlled substance Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 125000001295 dansyl group Chemical group [H]C1=C([H])C(N(C([H])([H])[H])C([H])([H])[H])=C2C([H])=C([H])C([H])=C(C2=C1[H])S(*)(=O)=O 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- RSIHSRDYCUFFLA-UHFFFAOYSA-N dehydrotestosterone Natural products O=C1C=CC2(C)C3CCC(C)(C(CC4)O)C4C3CCC2=C1 RSIHSRDYCUFFLA-UHFFFAOYSA-N 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 229960005501 duocarmycin Drugs 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical compound COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229930184221 duocarmycin Natural products 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- AUVVAXYIELKVAI-CKBKHPSWSA-N emetine Chemical compound N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@@H]1CC AUVVAXYIELKVAI-CKBKHPSWSA-N 0.000 description 1
- 229960002694 emetine Drugs 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 description 1
- 229940009714 erythritol Drugs 0.000 description 1
- 235000019414 erythritol Nutrition 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 210000003722 extracellular fluid Anatomy 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 230000005251 gamma ray Effects 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 229960003297 gemtuzumab ozogamicin Drugs 0.000 description 1
- 210000002165 glioblast Anatomy 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 229940116332 glucose oxidase Drugs 0.000 description 1
- 235000019420 glucose oxidase Nutrition 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000001976 hemiacetal group Chemical group 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 208000006359 hepatoblastoma Diseases 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 102000049113 human PGF Human genes 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940124589 immunosuppressive drug Drugs 0.000 description 1
- 230000002637 immunotoxin Effects 0.000 description 1
- 229940051026 immunotoxin Drugs 0.000 description 1
- 231100000608 immunotoxin Toxicity 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940100601 interleukin-6 Drugs 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000007919 intrasynovial administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 229940057428 lactoperoxidase Drugs 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 229960005015 local anesthetics Drugs 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 230000000938 luteal effect Effects 0.000 description 1
- OHSVLFRHMCKCQY-NJFSPNSNSA-N lutetium-177 Chemical compound [177Lu] OHSVLFRHMCKCQY-NJFSPNSNSA-N 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 229950001474 maitansine Drugs 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 238000000816 matrix-assisted laser desorption--ionisation Methods 0.000 description 1
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 1
- QWIZNVHXZXRPDR-WSCXOGSTSA-N melezitose Chemical compound O([C@@]1(O[C@@H]([C@H]([C@@H]1O[C@@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O)CO)CO)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O QWIZNVHXZXRPDR-WSCXOGSTSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 108010029942 microperoxidase Proteins 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 210000004088 microvessel Anatomy 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 208000023833 nerve sheath neoplasm Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N p-hydroxybenzoic acid methyl ester Natural products COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 201000005528 peripheral nervous system neoplasm Diseases 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- HRGDZIGMBDGFTC-UHFFFAOYSA-N platinum(2+) Chemical compound [Pt+2] HRGDZIGMBDGFTC-UHFFFAOYSA-N 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229960000502 poloxamer Drugs 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229940044519 poloxamer 188 Drugs 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920002859 polyalkenylene Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 229960000856 protein c Drugs 0.000 description 1
- 230000006920 protein precipitation Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000012629 purifying agent Substances 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 239000012857 radioactive material Substances 0.000 description 1
- 239000012217 radiopharmaceutical Substances 0.000 description 1
- 229940121896 radiopharmaceutical Drugs 0.000 description 1
- 230000002799 radiopharmaceutical effect Effects 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 150000002910 rare earth metals Chemical class 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 108091008020 response regulators Proteins 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 210000000844 retinal pigment epithelial cell Anatomy 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- SFVFIFLLYFPGHH-UHFFFAOYSA-M stearalkonium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 SFVFIFLLYFPGHH-UHFFFAOYSA-M 0.000 description 1
- 238000011146 sterile filtration Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 210000001179 synovial fluid Anatomy 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 210000001138 tear Anatomy 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 210000003606 umbilical vein Anatomy 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 230000006444 vascular growth Effects 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N verteporfin Chemical compound C=1C([C@@]2([C@H](C(=O)OC)C(=CC=C22)C(=O)OC)C)=NC2=CC(C(=C2C=C)C)=NC2=CC(C(=C2CCC(O)=O)C)=NC2=CC2=NC=1C(C)=C2CCC(=O)OC ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N 0.000 description 1
- 229960003895 verteporfin Drugs 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/14—Ectoparasiticides, e.g. scabicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/54—F(ab')2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Ophthalmology & Optometry (AREA)
- Reproductive Health (AREA)
- Rheumatology (AREA)
- Endocrinology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Wood Science & Technology (AREA)
- Cardiology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Zoology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Dermatology (AREA)
- Gynecology & Obstetrics (AREA)
- Pregnancy & Childbirth (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
Abstract
Description
この出願は、2008年6月25日に出願されたUS61/133,212、2008年6月25日に出願されたUS61/075,697、2009年2月24日に出願されたUS61/155,041、および、2008年6月25日に出願されたUS61/075,692への優先権を主張する。
新脈管形成は、固形腫瘍、増殖性網膜症または加齢黄斑変性(AMD)などの眼内の新生血管形成症候群、慢性関節リウマチ、および乾癬を含めた様々な障害の病原に関係づけられる(非特許文献1;非特許文献2;および「Pathobiology of ocular disease. A dynamic approach.」Garner
A、Klintworth G K編集、第2版、Marcel Dekker、NY、1625~1710頁(1994)におけるGarner A、Vascular diseases)。固形腫瘍では、新脈管形成および新しい脈管構造の増殖が腫瘍を生存させ、腫瘍切片における微小血管の密度と、乳がんおよび他のがんにおける患者の生存との間に相関が実証されている(非特許文献3;非特許文献4;および非特許文献5)。
Res.、56巻、4032~4039頁(1996年);およびMelnykら、Cancer Res.、56巻、921~924頁(1996年))(Adamisら、Arch. Opthalmol.、114巻、66~71頁(1996年))。
本発明は、ウサギモノクローナル抗体からのCDRを含む、可溶性で安定な抗VEGFイムノバインダーを提供する。前記抗体は、VEGF媒介性障害の診断および/または処置のためにデザインされている。本発明の組換え抗体を発現するためのハイブリドーマ、核酸、ベクター、および宿主細胞、これらを単離するための方法、ならびに医薬における前記抗体の使用も開示する。
本発明は、例えば以下の項目を提供する。
(項目1)
可変重鎖(VH)かつ/または可変軽鎖(VL)を含む組換えイムノバインダーであって、該イムノバインダーがヒトVEGFを中和しウサギCDRを含む、イムノバインダー。
(項目2)
キメラのイムノバインダーである、項目1に記載のイムノバインダー。
(項目3)
ヒト化されている、前述の項目のいずれか一項に記載のイムノバインダー。
(項目4)
配列番号14、配列番号26、配列番号37、配列番号49、配列番号60、および配列番号71からなる群のコンセンサス配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、前述の項目のいずれか一項に記載のイムノバインダー。
(項目5)
配列番号2、配列番号3、配列番号15、配列番号27、配列番号38、配列番号50、および配列番号61からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、前述の項目のいずれか一項に記載のイムノバインダー。
(項目6)
前記VHが配列番号2、配列番号15、および配列番号27からなる群のCDRを含み、かつ/または前記VLが配列番号38、配列番号50、および配列番号61からなる群のCDRを含む、項目5に記載のイムノバインダー。
(項目7)
前記VHが配列番号3、配列番号15、および配列番号27からなる群のCDRを含み、かつ/または前記VLが配列番号38、配列番号50、および配列番号61からなる群のCDRを含む、項目5に記載のイムノバインダー。
(項目8)
配列番号4、配列番号16、配列番号28、配列番号39、配列番号51、および配列番号62からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目9)
前記VHが配列番号4、配列番号16、配列番号28からなる群のCDRを含み、かつ/または前記VLが配列番号39、配列番号51、および配列番号62からなる群のCDRを含む、項目8に記載のイムノバインダー。
(項目10)
配列番号5、配列番号17、配列番号29、配列番号40、配列番号52、および配列番号63からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目11)
前記VHが配列番号5、配列番号17、配列番号29からなる群のCDRを含み、かつ/または前記VLが配列番号40、配列番号52、および配列番号63からなる群のCDRを含む、項目10に記載のイムノバインダー。
(項目12)
配列番号6、配列番号18、配列番号30、配列番号41、配列番号53、および配列番号64からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目13)
前記VHが配列番号6、配列番号18、および配列番号30からなる群のCDRを含み、かつ/または前記VLが配列番号41、配列番号53、および配列番号64からなる群のCDRを含む、項目12に記載のイムノバインダー。
(項目14)
配列番号7、配列番号19、配列番号31、配列番号42、配列番号54、および配列番号65からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目15)
前記VHが配列番号7、配列番号19、および配列番号31からなる群のCDRを含み、かつ/または前記VLが配列番号42、配列番号54、および配列番号65からなる群のCDRを含む、項目14に記載のイムノバインダー。
(項目16)
配列番号8、配列番号20、配列番号32、配列番号43、配列番号55、および配列番号66からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目17)
前記VHが配列番号8、配列番号20、および配列番号32からなる群のCDRを含み、かつ/または前記VLが配列番号43、配列番号55、および配列番号66からなる群のCDRを含む、項目16に記載のイムノバインダー。
(項目18)
配列番号9、配列番号21、配列番号33、配列番号44、配列番号56、および配列番号67からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目19)
前記VHが配列番号9、配列番号21、および配列番号33からなる群のCDRを含み
、かつ/または前記VLが配列番号44、配列番号56、および配列番号67からなる群のCDRを含む、項目18に記載のイムノバインダー。
(項目20)
配列番号10、配列番号22、配列番号34、配列番号45、配列番号57、および配列番号68からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目21)
前記VHが配列番号10、配列番号22、および配列番号34からなる群のCDRを含み、かつ/または前記VLが配列番号45、配列番号57、および配列番号68からなる群のCDRを含む、項目20に記載のイムノバインダー。
(項目22)
配列番号11、配列番号13、配列番号23、配列番号25、配列番号35、配列番号46、配列番号58、および配列番号69からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目23)
前記VHが、(i)配列番号11、配列番号23、および配列番号35からなる群、(ii)配列番号11、配列番号25、および配列番号35からなる群、(iii)配列番号13、配列番号23、および配列番号35からなる群、または(iv)配列番号13、配列番号25、および配列番号35からなる群のCDRを含む、項目22に記載のイムノバインダー。
(項目24)
前記VLが、配列番号46、配列番号58、および配列番号69からなる群のCDRを含む、項目23に記載のイムノバインダー。
(項目25)
配列番号12、配列番号24、配列番号36、配列番号47、配列番号48、配列番号59、および配列番号70からなる群の配列に少なくとも80%の類似性を有するCDRを少なくとも1つ含む、項目1から4のいずれか一項に記載のイムノバインダー。
(項目26)
前記VHが、配列番号12、配列番号24、および配列番号36からなる群のCDRを含み、かつ/または前記VLが、(i)配列番号47、配列番号59、および配列番号70からなる群のCDR、もしくは(ii)配列番号48、配列番号59、および配列番号70からなる群のCDRを含む、項目25に記載のイムノバインダー。
(項目27)
配列番号169の配列に少なくとも80%の配列同一性を有する重鎖可変領域可変領域フレームワーク配列を含む、前述の項目のいずれか一項に記載のイムノバインダー。
(項目28)
前記重鎖可変領域フレームワークが配列番号170または配列番号171である、項目27に記載のイムノバインダー。
(項目29)
AHoナンバリングシステムによる、前記重鎖可変領域の位置1、83、または87に欠失を有する、前述の項目のいずれか一項に記載のイムノバインダー。
(項目30)
AHoナンバリングシステムによる、前記重鎖可変領域における位置2、12、24、25、46、54、55、83、84、87、89、103、105、108、または144の少なくとも1つに置換を有する、前述の項目のいずれか一項に記載のイムノバインダー。
(項目31)
前記置換が、
(a)位置2のグルタミン、
(b)位置12のセリン、
(c)位置24のスレオニン、
(d)位置25のバリン、
(e)位置46のロイシン、
(f)位置54のチロシン、
(g)位置55のイソロイシン、
(h)位置83のアラニン、
(i)位置84のアスパラギン、
(j)位置87のアラニンまたはロイシン、
(k)位置89のアラニンまたはロイシン、
(l)位置103のセリンまたはスレオニン、
(m)位置105のフェニルアラニン、
(n)位置108のアルギニン、および
(o)位置144のセリンまたはスレオニン
からなる群より選択される、項目30に記載のイムノバインダー。
(項目32)
配列番号167の配列に少なくとも85%の配列同一性を有する軽鎖可変領域フレームワーク配列を含む、前述の項目のいずれか一項に記載のイムノバインダー。
(項目33)
前記軽鎖可変領域フレームワークが配列番号167または配列番号168である、項目30に記載のイムノバインダー。
(項目34)
AHoナンバリングシステムによる、前記軽鎖可変領域の位置1、2、または15の少なくとも1つに置換を有する、前述の項目のいずれか一項に記載のイムノバインダー。
(項目35)
前記置換が、
(a)位置1のアスパラギン酸、
(b)位置2のバリン、
(c)位置15のスレオニン
からなる群より選択される、項目34に記載のイムノバインダー。
(項目36)
配列番号107に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号72に少なくとも80%類似である軽鎖可変領域を含む、項目5から7、または27から35のいずれか一項に記載のイムノバインダー。
(項目37)
配列番号109に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号73に少なくとも80%類似である軽鎖可変領域を含む、項目8から9、または27から35のいずれか一項に記載のイムノバインダー。
(項目38)
配列番号110に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号74に少なくとも80%類似である軽鎖可変領域を含む、項目10から11、または27から35のいずれか一項に記載のイムノバインダー。
(項目39)
配列番号111に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号75に少なくとも80%類似である軽鎖可変領域を含む、項目12から13、または27から35のいずれか一項に記載のイムノバインダー。
(項目40)
配列番号112に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号76に少なくとも80%類似である軽鎖可変領域を含む、項目14から15、または27から35のいずれか一項に記載のイムノバインダー。
(項目41)
配列番号113に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号77に少なくとも80%類似である軽鎖可変領域を含む、項目16から17、または27から35のいずれか一項に記載のイムノバインダー。
(項目42)
配列番号178、配列番号179、または配列番号180に少なくとも80%の同一性を有する、項目41に記載のイムノバインダー。
(項目43)
配列番号114に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号78に少なくとも80%類似である軽鎖可変領域を含む、項目18から19、または27から35のいずれか一項に記載のイムノバインダー。
(項目44)
配列番号115に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号79に少なくとも80%類似である軽鎖可変領域を含む、項目20から21、または27から35のいずれか一項に記載のイムノバインダー。
(項目45)
配列番号177に少なくとも80%の同一性を有する、項目44に記載のイムノバインダー。
(項目46)
配列番号116に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号80に少なくとも80%類似である軽鎖可変領域を含む、項目22から24、または27から35のいずれか一項に記載のイムノバインダー。
(項目47)
配列番号117に少なくとも80%類似であるアミノ酸配列を含む重鎖可変領域、および/または配列番号81に少なくとも80%類似である軽鎖可変領域を含む、項目25から26、または27から35のいずれか一項に記載のイムノバインダー。
(項目48)
配列番号176に少なくとも80%の同一性を有する、項目47に記載のイムノバインダー。
(項目49)
前述の項目のいずれか一項に記載のイムノバインダーと、ヒトVEGFに対する結合を競合するイムノバインダー。
(項目50)
前述の項目のいずれか一項に記載のイムノバインダーによって認識されるヒトVEGF上のエピトープに対して、少なくとも107M-1の親和性で結合するイムノバインダー。
(項目51)
ヒトおよびラット/マウスVEGFに特異的に結合する、前述の項目のいずれか一項に記載のイムノバインダー。
(項目52)
抗体、scFv、Fab、またはDabである、前述の項目のいずれか一項に記載のイムノバインダー。
(項目53)
前述の項目のいずれか一項に記載のイムノバインダー、および薬学的に許容される担体を含む組成物。
(項目54)
前述の項目のいずれか一項に記載のイムノバインダーをコードしている、単離された核酸分子。
(項目55)
項目54に記載の核酸分子を含む発現ベクター。
(項目56)
項目55に記載の発現ベクターを含む宿主細胞。
(項目57)
被験体がVEGF媒介性疾患について処置されるように、前述の項目のいずれか一項に記載のイムノバインダーを前記被験体に投与することを含む、被験体におけるヒトVEGF媒介性疾患を処置または予防する方法。
(項目58)
前記イムノバインダーを局所的に投与する、項目57に記載の方法。
(項目59)
前記VEGF媒介性疾患が、加齢黄斑変性、新生血管形成緑内障、糖尿病性網膜症、未熟児網膜症、水晶体後線維増殖症、乳癌、肺癌、胃癌、食道癌、直腸結腸癌、肝臓癌、卵巣癌、昏睡、卵巣男性胚細胞腫、子宮頸癌、子宮内膜癌、子宮内膜増殖症、子宮内膜症、線維肉腫、絨毛癌、頭部および頸部のがん、上咽頭癌、鼻咽腔癌、肝芽腫、カポジ肉腫、メラノーマ、皮膚癌、血管腫、海綿状血管腫、血管芽細胞腫、膵臓癌、網膜芽細胞腫、星細胞腫、膠芽腫、神経鞘腫、乏突起膠腫、髄芽腫、神経芽細胞腫、横紋筋肉腫、骨原性肉腫、平滑筋肉腫、尿路癌、甲状腺癌、ウィルムス腫、腎細胞癌、前立腺癌、母斑症に付随する異常血管増殖、浮腫(脳腫瘍に付随するものなど)、メグズ症候群、慢性関節リウマチ、乾癬、ならびにアテローム性動脈硬化症からなる群より選択される、項目57または58に記載の方法。
(項目60)
配列番号60~166、および配列番号175~180に記載するアミノ酸配列の任意の1つを含む抗体を生成するハイブリドーマ。
(項目61)
ラット/マウスおよびヒトのVEGF、またはその部分と交差反応性であるイムノバインダーを産生、または同定するのに適する免疫原。
(項目62)
配列番号1を有する、項目61に記載の免疫原。
(項目63)
ラット/マウスおよびヒトのVEGFと交差反応性であるイムノバインダーを作製する方法であって、項目61に記載の免疫原を使用する、方法。
本発明は、ウサギモノクローナル抗体からのCDRを含む、可溶性で安定な抗VEGFイムノバインダーを提供する。前記イムノバインダーは、VEGF媒介性障害の診断および/または処置のためにデザインされている。本発明の組換え抗体を発現するためのハイブリドーマ、核酸、ベクター、および宿主細胞、これらを単離するための方法、ならびに医薬における前記抗体の使用も開示する。
本発明がより容易に理解され得るために、ある種の用語を以下の通りに定義する。さらなる定義を、詳細な説明を通して記載する。
ギャップペナルティ4を用いて、ALIGNプログラム(バージョン2.0)中に組み入れられたE. MeyersおよびW. Millerのアルゴリズム(Comput.
Appl. Biosci.、4巻11~17頁(1988年))を用いてやはり決定することができる。さらに、2つのアミノ酸配列間のパーセント同一性は、Blossum 62マトリックスまたはPAM250マトリックスのいずれか、およびギャップウェイト16、14、12、10、8、6、または4、およびレングスウェイト1、2、3、4、5、または6を用いて、GCGソフトウェアパッケージ(www.gcg.comにて入手可能)においてGAPプログラム中に組み入れられた、NeedlemanおよびWunsch(J. Mol. Biol.、48巻、444~453頁(1970年))のアルゴリズムを用いて決定され得る。
置で最も高頻度に現れるアミノ酸を含む配列である。2つまたはそれを超えるアミノ酸が単一の位置で等しく現れる場合は、コンセンサス配列にはこれらのアミノ酸の両方または全てが含まれる。
のためイムノバインダーは、標的の抗原を特異的に認識する。イムノバインダーの非限定的な例としては、全長の免疫グロブリン分子およびscFv、および、これらに限定されないが、(i)VL、VH、CL、およびCH1ドメインからなる1価のフラグメントであるFabフラグメント、(ii)ヒンジ領域でジスルフィド架橋によって連結されている2つのFabフラグメントを含む2価のフラグメントであるF(ab’)2フラグメント、(iii)本質的に、ヒンジ領域の部分を有するFabである、Fab’フラグメント(Fundamental Immunology(Paul編集、第3版、1993年)を参照されたい)、(iv)VHおよびCH1ドメインからなるFdフラグメント、(v)抗体の単腕のVLおよびVHドメインからなるFvフラグメント、(vi)VHもしくはVLドメインからなるDabフラグメント(Wardら、(1989年)Nature、341巻、544~546頁)、Camelid抗体(Hamers-Castermanら、Nature、363巻、446~448頁(1993年)およびDumoulinら、Protein Science、11巻、500~515頁(2002年)を参照されたい)またはShark抗体(例えば、shark Ig-NARs Nanobodies(登録商標))などの単一ドメイン抗体、ならびに(vii)可変ドメインおよび2つの定常ドメインを含む重鎖領域であるナノボディ、を含む抗体フラグメントが挙げられる。
R-2などの1つまたは複数のVEGF受容体と相互作用するのを防ぎ、例えば、シグナル伝達の誘発を防ぐ、本発明の抗体の能力を意味する。
有するウサギ配列のコンセンサス配列であると定義される。
一態様において、本発明は、VEGFに結合し、したがってインビボでVEGFの機能をブロックするのに適するイムノバインダーを提供する。これらイムノバインダーのCDRは、ヒトVEGFおよび/またはそのフラグメント(配列番号1)で免疫化したウサギから得たウサギ抗VEGFモノクローナル抗体に由来する。本発明者らの知る限りでは、モノクローナル抗VEGF抗体をウサギから得、詳しく特徴付けたのはこれが初めてである。驚くべきことに、親和性(Kd)が並はずれて高いことが見出された。
類似性、好ましくは少なくとも75%の同一性、より好ましくは少なくとも80%、85%、90%、95%、さらにより好ましくは100%の同一性を有するCDRを少なくとも1つ含むイムノバインダーを提供する。好ましくは、前記イムノバインダーのVHは、配列番号4、配列番号16、配列番号28からなる群のCDRを含み、かつ/または前記イムノバインダーのVLのCDRは、配列番号39、配列番号51、および配列番号62からなる群のCDRを含む。
号67からなる群のCDRを含む。
のフレームワーク領域中に融合させてもよい。しかし、いわゆる「品質管理」スクリーニング(WO0148017)において同定されるフレームワークを含む抗体または抗体の誘導体は、一般的に高い安定性および/または溶解性を特徴としており、したがってヒトVEGFの中和など細胞外の適用の状況においても有用であり得ることが以前に見出されている。さらに、これらVL(可変軽鎖)およびVH(可変重鎖)の可溶かつ安定なフレームワークの1つの特定の組合せが、ウサギCDRを収容するのにとりわけ適することもさらに見出された。したがって、一実施形態において、配列番号2~72に記載するCDRを、EP1479694に開示される「品質管理」スクリーニングに由来するヒト抗体フレームワーク中に融合させる。本発明において用いるための例示的フレームワークのアミノ酸配列を、配列番号172から174に記載する。驚くべきことに、前記フレームワークまたはその誘導体中に融合させる際に、多様なウサギCDRのループコンフォメーションが、ドナーのフレームワークの配列とほとんど独立に、完全に維持され得ることが見出された。さらに、前記フレームワークまたは様々なウサギCDRを含むその誘導体は、ウサギの野生型単鎖とは反対に良好に発現され、かつ生成され、そして、依然としてオリジナルのドナーのウサギ抗体の親和性をほとんど完全に保持する。
ならびに/または配列番号72、配列番号82、および配列番号93(それぞれVL60、VL60min、VL60max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号73、配列番号83、および配列番号94(それぞれVL435、VL435min、およびVL435max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号74、配列番号84、および配列番号95(それぞれVL453、VL453min、およびVL453max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号75、配列番号85、および配列番号96(それぞれVL375、VL375min、およびVL375max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号76、配列番号86、および配列番号97(それぞれVL610、VL610min、およびVL610max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号77、配列番号87、配列番号92、配列番号98、配列番
号103、配列番号104、および配列番号105(VL578およびその改変体)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号78、配列番号88、および配列番号99(それぞれVL534、VL534min、およびVL534max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号79、配列番号89、および配列番号100(それぞれVL567、VL567min、およびVL567max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号80、配列番号90、および配列番号101(それぞれVL509、VL509min、およびVL509max)からなる群より選択される配列に少なくとも80%、より好ましくは少なくとも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ならびに/または配列番号81、配列番号91、配列番号102、および配列番号106(それぞれVL511、VL511min、VL511max、およびVL511minC41L)からなる群より選択される配列に少なくとも80%、より好ましくは少なく
とも85%、90%、95%、最も好ましくは100%の同一性を有するVLを含むイムノバインダーを提供する。
ipriyanovら(1999年)、J. Mol. Biol.、293巻、41~56頁、およびRooversら(2001年)、Cancer Immunol. lmmunother.、50巻、51~59頁によって記載されている。配置は、VL-リンカー-VHまたはVH-リンカー-VLのいずれかであってよく、前者の配向が好ましいものである。しかし、VHまたはVLの単一のドメインの抗体も企図される。Fabフラグメントの場合、選択される軽鎖可変ドメインVLがヒトIgκ鎖の定常領域に融合しており、一方、適切な重鎖可変ドメインVHがヒトIgGの最初の(N末端の)定常ドメインCH1に融合している。定常ドメインのC末端に、または可変ドメインもしくは定常ドメインの他の部位に、鎖間ジスルフィド架橋が形成することがある。あるいは、2本の鎖が柔軟なリンカーによってやはり連結され、単鎖Fab抗体を生じることもある。
別の一態様において、本発明は、配列番号2~211に記載するアミノ酸配列の任意の1つを含む抗体によって認識されるVEGF上のエピトープに結合する抗体を提供する。このような抗体は、それだけには限定されないがELISAを含む標準のVEGF結合アッセイにおいて、配列番号2~211に記載するアミノ酸配列の任意の1つまたは複数を含む抗体と交差競合(cross-compete)するその能力に基づいて同定され得る。試験抗体が、配列番号2~211に記載するアミノ酸配列の任意の1つまたは複数を含む抗体のヒトVEGFに対する結合を阻害する能力は、試験抗体が交差競合することができ、したがって配列番号2~211に記載するアミノ酸配列の任意の1つまたは複数を含む抗体としてヒトVEGF上の重複するエピトープと相互作用することを実証している。
含む抗体によって認識されるVEGF上のエピトープに結合する抗体を同定することは、十分に当該分野の技術範囲内である。
本発明の抗体を、機能特性の増強に対して、例えば、溶解性および/または安定性の増強に対してさらに最適化してよい。
(a)アミノ酸位置1のQまたはE;
(b)アミノ酸位置6のQまたはE;
(c)アミノ酸位置7の、T、S、またはA、より好ましくはTまたはA、さらにより好ましくはT;
(d)アミノ酸位置10の、A、T、P、V、またはD、より好ましくはT、P、V、ま
たはD、
(e)アミノ酸位置12の、LまたはV、より好ましくはL、
(f)アミノ酸位置13の、V、R、Q、M、またはK、より好ましくはV、R、Q、またはM;
(g)アミノ酸位置14の、R、M、E、Q、またはK、より好ましくはR、M、EまたはQ、さらにより好ましくはRまたはE;
(h)アミノ酸位置19の、LまたはV、より好ましくはL;
(i)アミノ酸位置20の、R、T、K、またはN、より好ましくはR、T、またはN、さらにより好ましくはN;
(j)アミノ酸位置21の、I、F、L、またはV、より好ましくはI、F、またはL、さらにより好ましくはIまたはL;
(k)アミノ酸位置45の、RまたはK、より好ましくはK;
(l)アミノ酸位置47の、T、P、V、AまたはR、より好ましくはT、P、V、またはR、さらにより好ましくはR;
(m)アミノ酸位置50の、K、Q、H、またはE、より好ましくはK、H、またはE、さらにより好ましくはK;
(n)アミノ酸位置55の、MまたはI、より好ましくはI;
(o)アミノ酸位置77の、KまたはR、より好ましくはK;
(p)アミノ酸位置78の、A、V、L、またはI、より好ましくはA、L、またはI、さらにより好ましくはA;
(q)アミノ酸位置82の、E、R、T、またはA、より好ましくはE、T、またはA、さらにより好ましくはE;
(r)アミノ酸位置86の、T、S、I、またはL、より好ましくはT、S、またはL、さらにより好ましくはT;
(s)アミノ酸位置87の、D、S、N、またはG、より好ましくはD、N、またはG、さらにより好ましくはN;
(t)アミノ酸位置89の、A、V、L、またはF、より好ましくはA、V、またはF、さらにより好ましくはV;
(u)アミノ酸位置90の、F、S、H、D、またはY、より好ましくはF、S、H、またはD;
(v)アミノ酸位置92の、D、Q、またはE、より好ましくはDまたはQ、さらにより好ましくはD;
(w)アミノ酸位置95の、G、N、T、またはS、より好ましくはG、N、またはT、さらにより好ましくはG;
(x)アミノ酸位置98の、T、A、P、F、またはS、より好ましくはT、A、P、またはF、さらにより好ましくはF;
(y)アミノ酸位置103の、R、Q、V、I、M、F、またはL、より好ましくはR、Q、I、M、F、またはL、さらにより好ましくはY、さらにより好ましくはL;および(z)アミノ酸位置107の、N、S、またはA、より好ましくはNまたはS、さらにより好ましくはN。
(aa)アミノ酸位置1の、Q、D、L、E、S、またはI、より好ましくはL、E、S、またはI、さらにより好ましくはLまたはE;
(bb)アミノ酸位置2の、S、A、Y、I、P、またはT、より好ましくはA、Y、I、P、またはT、さらにより好ましくはPまたはT;
(cc)アミノ酸位置3の、Q、V、T、またはI、より好ましくはV、T、またはI、さらにより好ましくはVまたはT;
(dd)アミノ酸位置4の、V、L、I、またはM、より好ましくはVまたはL;
(ee)アミノ酸位置7の、S、E、またはP、より好ましくはSまたはE、さらにより好ましくはS;
(ff)アミノ酸位置10の、TまたはI、より好ましくはI;
(gg)アミノ酸位置11の、AまたはV、より好ましくはA;
(hh)アミノ酸位置12の、SまたはY、より好ましくはY;
(ii)アミノ酸位置14の、T、S、またはA、より好ましくはTまたはS、さらにより好ましくはT;
(jj)アミノ酸位置18の、SまたはR、より好ましくはS;
(kk)アミノ酸位置20の、TまたはR、より好ましくはR;
(ll)アミノ酸位置24の、RまたはQ、より好ましくはQ;
(mm)アミノ酸位置46の、HまたはQ、より好ましくはH;
(nn)アミノ酸位置47の、K、R、またはI、より好ましくはRまたはI、さらにより好ましくはR;
(oo)アミノ酸位置50の、R、Q、K、E、T、またはM、より好ましくはQ、K、E、TまたはM;
(pp)アミノ酸位置53の、K、T、S、N、Q、またはP、より好ましくはT、S、N、Q、またはP;
(qq)アミノ酸位置56の、IまたはM、より好ましくはM;
(rr)アミノ酸位置57の、H、S、F、またはY、より好ましくはH、S、またはF;
(ss)アミノ酸位置74の、I、V、またはT、より好ましくはVまたはT、R、さらにより好ましくはT;
(tt)アミノ酸位置82の、R、Q、またはK、より好ましくはRまたはQ、さらにより好ましくはR;
(uu)アミノ酸位置91の、LまたはF、より好ましくはF;
(vv)アミノ酸位置92の、G、D、T、またはA、より好ましくはG、D、またはT、さらにより好ましくはT;
(xx)アミノ酸位置94の、SまたはN、より好ましくはN;
(yy)アミノ酸位置101の、F、Y、またはS、より好ましくはYまたはS、さらにより好ましくはS;および
(zz)アミノ酸位置103の、D、F、H、E、L、A、T、V、S、G、またはI、より好ましくはH、E、L、A、T、V、S、G、またはI、さらにより好ましくはAまたはV。
and Human Services、NIH Publication、第91~3242)にさらに記載されているKabatナンバリングシステムを用いてもよい。抗体の重鎖および軽鎖の可変領域におけるアミノ酸残基の位置を同定するのに用いられる2つの異なるナンバリングシステムのための変換表は、A. Honegger、J.Mol.Biol.、309巻(2001年)657~670頁に提供されている。
からなる重鎖アミノ酸位置の群より選択されるアミノ酸位置に溶解性を増強する変異を含んでいる。好ましい一実施形態において、イムノバインダーは、(a)重鎖アミノ酸位置12のセリン(S);(b)重鎖アミノ酸位置103のセリン(S)またはスレオニン(T);および(c)重鎖アミノ酸位置144のセリン(S)またはスレオニン(T)からなる群より選択される置換を1つまたは複数含んでいる。別の一実施形態において、イムノバインダーは、以下の置換:(a)重鎖アミノ酸位置12のセリン(S);(b)重鎖アミノ酸位置103のセリン(S)またはスレオニン(T);および(c)重鎖アミノ酸位置144のセリン(S)またはスレオニン(T)を含んでいる。
別の一態様において、本発明は、配列番号72~81、および配列番号107~117に記載するアミノ酸配列の任意の1つまたは複数を含むモノクローナル抗体を発現するハイブリドーマを提供する。ウサギB細胞からハイブリドーマを産生するための方法は当該分野では周知であり、例えば、米国特許出願第2005/0033031号に開示されている。
本発明の抗体または抗体誘導体を、組換え遺伝学の技術分野における日常的な技術を用いて産生してもよい。ポリペプチドの配列を知り、それをコードするcDNAを遺伝子合成によって産生することができる(www.genscript.com)。これらのcDNAを適切なベクタープラスミド中にクローニングすることができる。VLドメインおよび/またはVHドメインをコードするDNAを得た後は、例えば、変異誘発プライマーを用いたPCRにより、部位特異的変異誘発を行って様々な誘導体を得ることができる。最良の「開始」配列を、VLおよび/またはVH配列における所望の変化の数に応じて選択することができる。
& Russell、第3版、2001年)、およびCurrent Protocols in Molecular Biology (Ausubelら、1999年)に記載されている。
グされる。各遺伝子の前には翻訳を確実にする好適なリボゾーム結合部位が存在するよう、注意を払わなければならない。本発明の抗体は、開示した配列からなるのではなく、開示した配列を含むことが理解される。例えば、クローニングの戦略は、構築物が、N末端に1つまたは少数のさらなる残基を有する抗体から作られることを必要とし得る。具体的には、開始コドンに由来するメチオニンが翻訳後に切断されなかった場合、最終のタンパク質中に存在することがある。scFv抗体についてのほとんどの構築物は、N末端にさらなるアラニンを生じる。本発明の好ましい一実施形態において、E.coliにおけるペリプラズムの発現についての発現ベクターが選択される(Krebber、1997年)。前記ベクターは、切断可能なシグナル配列の前にプロモーターを含む。次いで、抗体ペプチドについてのコード配列を、インフレーム(in frame)で切断可能なシグナル配列に融合する。これにより、シグナル配列が切断される細菌のペリプラズムへの、発現されたポリペプチドのターゲティングが可能になる。次いで、抗体はフォールディングされる。Fabフラグメントの場合は、VL-CκおよびVH-CH1融合物のペプチドの両方が移行シグナルに連結していなければならない。ペプチドがペリプラズムに到達した後、C末端のシステインでS-S共有結合が形成される。抗体の細胞質内発現が好ましい場合、前記抗体は通常、封入体から高収率で得ることができ、封入体は他の細胞フラグメントおよびタンパク質から容易に分離され得る。この場合、封入体は、例えば塩酸グアニジン(GndHCl)などの変性剤中に可溶化され、次いで当業者には周知の復元手順によってリフォールディングされる。
別の一態様において、本発明は、本発明の抗VEGF抗体またはそのフラグメントを含む二重特異性分子を特徴としている。本発明の抗体、またはその抗原結合部分を、誘導体化し、または別のペプチドまたはタンパク質などの別の機能性分子(例えば、別の抗体もしくは受容体に対するリガンド)に連結して、少なくとも2つの異なる結合部位または標
的分子に結合する二重特異性分子を産生することができる。本発明の抗体を、誘導体化するか、または2つ以上の他の機能性分子に連結して、3つ以上の異なる結合部位および/または標的分子に結合する多重特異的分子を産生することができ、このような多重特異的分子は、本明細書で用いられる「二重特異性分子」という用語によって包含されることも意図される。本発明の二重特異性分子を作り出すには、本発明の抗体を、別の抗体、抗体フラグメント、腫瘍特異的もしくは病原体特異的な抗原、ペプチド、または結合性模倣物(binding mimetic)などの1つまたは複数の他の結合性分子に、二重特異性分子が生じるように、(例えば、化学的カップリング、遺伝子融合、非共有性の会合、またはその他によって)機能的に連結してよい。したがって、本発明は、VEGFに対する特異性を有する少なくとも1つの第1の結合性分子、および1つまたは複数のさらなる標的エピトープに対する特異性を有する第2の結合性分子を含む二重特異性分子を含む。
会合させてもよい。この方法は、二重特異性分子が、mAb×mAb、mAb×Fab、Fab×F(ab’)2、またはリガンド×Fab融合タンパク質である場合にとりわけ有用である。本発明の二重特異性分子は、1つの単鎖抗体および結合決定基を含む単鎖分子、または2つの結合決定基を含む単鎖の二重特異性分子であってよい。二重特異性分子は、少なくとも2つの単鎖分子を含んでいてよい。さらに、二重特異性分子は、第1の標的に特異的に結合するscFvであってよく、この場合、前記scFvのVHおよびVLは、第2の標的に対して特異的結合をもたらすドメインを含む柔軟なリンカーで連結されている。適切なリンカーは、米国仮出願第60/937,820号に記載されている。二重特異性分子を調製するための方法は、例えば、米国特許第5,260,203号、米国特許第5,455,030号、米国特許第4,881,175号、米国特許第5,132,405号、米国特許第5,091,513号、米国特許第5,476,786号、米国特許第5,013,653号、米国特許第5,258,498号、および米国特許第5,482,858号に記載されている。
別の一態様において、本発明は、細胞毒、薬物(例えば、免疫抑制薬)、または放射性毒などの治療用部分に結合体化している、抗VEGF抗体、またはそのフラグメントを特色としている。このような結合体を、本明細書において「イムノコンジュゲート」と呼ぶ。1つまたは複数の細胞毒を含むイムノコンジュゲートを「免疫毒素」と呼ぶ。細胞毒または細胞毒性剤には、細胞にとって有害な(例えば、死滅させる)あらゆる薬剤が含まれる。例としては、タキソール、サイトカラシンB、グラミシジンD、エチジウムブロマイド、エメチン、マイトマイシン、エトポシド、テノポシド、ビンクリスチン、ビンブラスチン、コルヒチン、ドキソルビシン、ダウノルビシン、ジヒドロキシアントラシンジオン、ミトキサントロン、ミトラマイシン、アクチノマイシンD、1-デヒドロテストステロン、グルココルチコイド、プロカイン、テトラカイン、リドカイン、プロプラノロール、およびピューロマイシン、ならびにこれらの類似体または同族体が挙げられる。治療剤としては、例えば、代謝拮抗薬(例えば、メトトレキサート、6-メルカプトプリン、6-チオグアニン、シタラビン、5-フルオロウラシル、ダカルバジン(decarbazine))、アルキル化薬(例えば、メクロレタミン、チオテパ(thioepa)、クロラムブシル、メルファラン、カルムスチン(BSNU)、およびロムスチン(CCNU)、シクロホスファミド(cyclothosphamide)、ブスルファン、ジブロモマンニトール、ストレプトゾトシン、マイトマイシンC、およびシス-ジクロロジアミン白金(II)(DDP)、シスプラチン)、アントラサイクリン(例えば、ダウノルビシ
ン(以前のダウノマイシン)およびドキソルビシン)、抗生物質(例えば、ダクチノマイシン(以前のアクチノマイシン)、ブレオマイシン、ミトラマイシン、およびアントラマイシン(AMC))、ならびに抗有糸分裂剤(例えば、ビンクリスチンおよびビンブラスチン)がやはり挙げられる。
因子が挙げられ得る。
Biological And Clinical Applications、Pincheraら(編集)、475~506頁(1985年)における、Thorpe、「Antibody Carriers Of Cytotoxic Agents In
Cancer Therapy: A Review」;Monoclonal Antibodies For Cancer Detection And Therapy、Baldwinら(編集)、303~16頁(Academic Press 1985年)における、「Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy」、およびThorpeら、「The Preparation And Cytotoxic
Properties Of Antibody-Toxin Conjugates」、Immunol. Rev.、62巻、119~58頁(1982年)を参照されたい。
治療的適用のために、本発明の抗VEGF抗体は、哺乳動物、好ましくはヒトに、局所的、眼内、筋肉内、腹腔内、脳脊髄内、皮下、関節内、滑膜内、鞘内、経口または吸入経路によって、ボーラスとしてかまたはある期間にわたる持続的注入によって、ヒトに静脈内投与できる形態を含む、本明細書で議論される形態などの、薬学的に許容される投薬形態で投与する。抗体はまた、腫瘍内、腫瘍周囲(peritumoral)、病巣内または病変周囲(perilesional)の経路によって適切に投与され、局所性および全身性治療効果をもたらす。腹腔内経路は、例えば卵巣腫瘍の処置において、特に有用であると期待される。
mproved Immunobinder Formulations And Methods For Adminstration」の米国仮出願第61/075,641号および米国仮出願第61/058,504号に記載され、本明細書に明示的に援用される。
(a)111In、99Tc、14C、131I、125I、3H、32Pまたは35Sなどの放射性同位元素。抗体は、例えばCurrent Protocols in Immunology、1および2巻、Coligenら編、Wiley-Interscience、New York、N.Y.、Pubs.(1991年)に記載の技法を用いて、放射性同位元素により標識でき、放射活性は、シンチレーション計数器を用いて測定することができる。
、色素形成基質の化学変化を触媒する。例えば、酵素は、分光光度的に測定できる、基質における色の変化を触媒することができる。あるいは、酵素は、基質の蛍光または化学発光を変えることができる。蛍光における変化を定量化するための技法は、上に記載されている。化学発光基質は、化学反応によって電子的に励起状態になり、次いで(例えば、ケミルミノメーター(chemiluminometer)を用いて)測定できる光を放射し得、または蛍光アクセプターにエネルギーを供与する。酵素標識の例としては、ルシフェラーゼ(例えば、ホタルルシフェラーゼおよび細菌ルシフェラーゼ;米国特許第4,737,456号)、ルシフェリン、2,3-ジヒドロフタラジンジオン、リンゴ酸脱水素酵素、ウレアーゼ、西洋ワサビペルオキシダーゼ(HRPO)などのペルオキシダーゼ、アルカリホスファターゼ、ベータガラクトシダーゼ、グルコアミラーゼ、リゾチーム、糖類酸化酵素(例えば、グルコース酸化酵素、ガラクトース酸化酵素およびグルコース-6-ホスフェートデヒドロゲナーゼ)、複素環酸化酵素(ウリカーゼおよびキサンチン酸化酵素など)、ラクトペルオキシダーゼ、マイクロペルオキシダーゼなどが挙げられる。酵素を抗体に結合体化するための技法は、O’Sullivanら、Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay、Methods in Enzym.(J. Langone & H. Van Vunakis編)、Academic press、New York、73巻:147~166頁(1981年)に記載されている。酵素-基質の組合せの例としては、例えば:
(i)西洋ワサビペルオキシダーゼ(HRPO)と、基質としての水素ペルオキシダーゼであり、水素ペルオキシダーゼが、色素前駆体(例えば、オルトフェニレンジアミン(OPD)または3,3’,5,5’-テトラメチルベンジジン塩酸塩(TMB))を酸化、
(ii)アルカリホスファターゼ(AP)と、色素形成基質としてのパラ-ニトロフェニルホスフェート、および
(iii)ベータ-D-ガラクトシダーゼ(ベータ-D-Gal)と色素形成基質(例えば、P-ニトロフェニル-ベータ-D-ガラクトシダーゼ)または蛍光発生基質4-メチルウンベリフェリル-ベータ-D-ガラクトシダーゼ、が挙げられる。
使用して測定することもできる(間接的サンドイッチアッセイ)。例えば、サンドイッチアッセイの1種にELISAアッセイがあり、これは検出可能な部分が酵素の場合である。
1つの態様では、本発明は、VEGF媒介性疾患の処置のための抗VEGF抗体を含む薬学的処方物を提供する。用語「薬学的処方物」とは、明白に有効である抗体または抗体誘導体の生物活性を可能にするような形態であり、処方物を投与した被験体に毒性のある追加の成分を含まない調製物をいう。「薬学的に許容される」賦形剤(ビヒクル、添加剤)とは、被験体である哺乳動物に合理的に投与し、採用する活性成分の有効用量を実現できるものである。
ズ排除クロマトグラフィー、SDS-PAGEおよび/またはマトリックス支援レーザー脱離イオン化/飛行時間型質量分析(MALDI/TOF MS)を用いて評価できる、サイズ修正(例えばクリッピング(clipping))に関わり得る。他のタイプの化学変化には、例えばイオン交換クロマトグラフィーによって評価できる電荷変化(例えば、脱アミドに起因して起こる)が挙げられる。
びベンゼトニウムクロリドが挙げられる。保存剤の他のタイプには、フェノール、ブチルおよびベンジルアルコールなどの芳香族アルコール、メチルまたはプロピルパラベンなどのアルキルパラベン、カテコール、レゾルシノール、シクロヘキサノール、3-ペンタノールならびにm-クレゾールが挙げられる。本明細書における最も好ましい保存剤は、ベンジルアルコールである。
技術を用いて調製でき、例えば、経口、直腸もしくは皮下移植によって、または所望の標的部位に移植することによって投与することができる。かかる処方物内で使用するための担体は、生体適合性を有し、生分解性も有し得て、好ましくは、処方物が比較的一定レベルのモジュレータ放出を可能にする。持続放出処方物内に含まれる抗体または抗体誘導体の量は、例えば、移植の部位、放出の速度および期待される持続期間、ならびに処置または予防する疾患/障害の特性によって決まる。
ml、好ましくは約0.5mg/mlから約40mg/ml、および最も好ましくは約10mg/mlから約20mg/mlが、処方物中の典型的な抗体濃度である。
脳脊髄内(intracerobrospinal)、皮下、関節内、滑膜内、鞘内、経口、局所または吸入経路による、ボーラスとしてかまたはある期間にわたる持続的注入による静脈内投与などの公知の方法に従って投与する。好ましい実施形態では、処方物は、眼表面への点眼薬の局所適用によって、哺乳動物に投与する。かかる目的のために、処方物は、例えば点眼薬アプリケーターを用いて適用することができる。
For Adminstration」の米国仮出願第61/075,641号に記載され、本明細書に明示的に援用される。
本発明の別の実施形態では、本発明の水性薬学的処方物を保持する容器を含む、製造品が提供され、その使用に関する説明書が場合によって提供される。適切な容器には、例えば、ボトル、小瓶、点眼薬アプリケーターおよび注射器が挙げられる。容器は、ガラスまたはプラスチックなどの様々な材料から形成することができる。典型的な容器は、3~20ccの単回使用のガラスまたはプラスチックの小瓶である。あるいは、複数用量処方物用に、容器は3~100ccのガラス小瓶であってよい。容器は処方物を保持し、容器上のラベルにより、または容器に付随したラベルにより、使用に関する指示を示すことができる。製造品は、商業および使用者の視点から望まれる他の物質をさらに含むことができ、これには、他の緩衝液、希釈液、フィルタ、針、注射器、および使用に関する説明のついた添付文書が挙げられる。
本開示を、さらに限定するものと解釈すべきではない以下の実施例によってさらに説明する。全ての図ならびにこの出願全体にわたって引用される全ての文献、特許および公開された特許出願の内容は、それらの全体が参照により本明細書に明示的に援用される。
一般的に、本発明の実施では、特に示さない限り、化学、分子生物学、組換えDNA技
術、免疫学(特に、例えば抗体技術)の従来技法、およびポリペプチド調製の標準技法を採用する。例えば、Sambrook、FritschおよびManiatis、Molecular Cloning: Cold Spring Harbor Laboratory Press(1989年);Antibody Engineering Protocols(Methods in Molecular Biology)、510、Paul, S.、Humana Pr(1996年);Antibody Engineering: A Practical Approach(Practical Approach Series、169)、McCafferty編、Irl Pr(1996年);Antibodies: A Laboratory Manual、Harlowら、C.S.H.L. Press, Pub.(1999年);およびCurrent Protocols in Molecular Biology、Ausubelら編、John Wiley & Sons(1992年)を参照されたい。
減衰全反射フーリエ変換IR(FTIR-ATR)スペクトルを、Tensor BrukerにおけるFT-IR Bio-ATRセルを使用して、様々な単鎖および誘導体分子に関して入手した。分子を、3mg/mlまで濃縮し、PBS(pH6.5)に対して4℃で一晩中透析し、緩衝液のフロースルー(flow through)をブランクとして採取した。変性プロファイルを、5℃ステップ(25から95℃)の広範な温度で分子を熱チャレンジ(challenge)することによって入手した。全てのスペクトルの操作は、OPUSソフトウェアを用いて行った。主な緩衝液および一過性の雰囲気(CO2およびH2O)のバックグラウンドは、タンパク質スペクトルから差し引いた。結果のタンパク質スペクトルを、次いでベースライン補正し、タンパク質アミドIスペクトルを、期待される領域における最大幅の分解可能なピークの幅から決定した。第2の誘導体スペクトルを、平滑関数による3次多項式関数を用いて、アミドIバンドスペクトルに関して入手した。タンパク質構造における変化を、3つの低度測定に関して0%の変性、および3つの高度測定に関して100%変性と仮定する、初期カーブフィット(curve-fit)計算についての直線検定曲線を用いて、アミドIの第2誘導体分析によって、推定した。変性プロファイルを、ボルツマンシグモイドモデル(Boltzmann sigmoidal model)に適用する変量毎の熱アンフォールディング転移(TM)の中間点を概算するのに使用した。
様々なscFv分子の相対的な溶解性を、硫酸アンモニウムの存在下でタンパク質の凝集および沈殿を増強させた後、測定した。硫酸アンモニウムを水溶液中のタンパク質に添加し、塩-タンパク質の最終混合物における飽和を5%増加させた。動的な範囲における沈殿を実験的に決定し、飽和間隔は、最終混合物において2.5%の飽和間隔までこの範囲で減少した。硫酸アンモニウムの添加後、試料を静かに混合し、6000rpmで30分遠心分離した。上清中に残ったタンパク質を、硫酸アンモニウムの飽和のパーセント毎に回収した。溶解曲線を、NanoDropTM1000 Spectrophotometerを使用するUV-VIS測定により、上清中のタンパク質濃度を測定することによって決定した。上清中に残った可溶性タンパク質の測定を正規化し、ボルツマンシグモイドモデルに適用する変量毎の相対的な溶解性の中間点を推定するのに使用した。
scFv分子を、可溶性凝集物および分解産物の存在に関して、40℃で2週間インキュベートした後、調べた。10mg/mlの濃度のタンパク質を、広範なpH(3.5、4.5、5.5、6.5、7.0、7.5および8.5)のPBSに対して4℃で一晩中透析した。標準緩衝液PBS(pH6.5)中の同じ濃度の対照分子を、2週間の間-8
0℃で保管した。SDS-PAGEによる分解のバンドの決定は、t=0およびt=14d時点で行い、可溶性凝集物をSEC-HPLCにおいて評価した。40℃で2週間後、残った活性の決定を、Biacoreを使用して行った。
(抗VEGF抗体を産生するための免疫化戦略)
この実施例では、新規の抗原性VEGF由来のペプチドを使用し、ヒト、マウスおよびウサギVEGFAを認識できる抗体を産生させた免疫化戦略を記載する。
A.コンフォメーションバインダーを得る可能性を高めるための、全長ヒトVEGFA165を用いるウサギのプレ免疫化(pre-immunization)。aa長16-K FM DV Y QRS Y CHP-28(下線:受容体相互作用、二重下線、ウサギにおける不一致、Cysは結晶構造によるジスルフィド結合に関与する)由来のペプチドでの第2追加免疫。ペプチド配列中に含まれるCysは、KLHとのカップリングに使用できるので、したがって、遊離Cysとして露出しない。最終ペプチドは、KFMDVYQRSY-Cys-KLHと思われる。
B.コンフォメーションバインダーを得る可能性を高めるための、全長VEGFA165を用いるマウスのプレ免疫化。aa長16-K FM DV Y QRS Y CHP-28(Cysは、結晶構造によるジスルフィド結合に関与する)由来のペプチドでの第2追加免疫。ペプチド配列中に含まれるCysは、KLHとのカップリングに使用できるので、したがって、遊離Cysとして露出しない。最終ペプチドは、以下と思われる:KFMDVYQRSY-Cys-KLH。
C.aa長16-K FM DV Y QRS YC HP-28(最終ペプチド:KFMDVYQR
SY-Cys-KLH)由来のペプチドを用いるウサギ/マウスのプレ免疫化。コンフォメーションバインダーを得る可能性を高めるための、全長VEGFA165を用いる第2追加免疫。
D.ウサギにおける全長VEGFA165を用いる免疫化。
(CDR融合およびモノクローナルウサギ抗VEGF抗体の機能的ヒト化)
(ウサギCDRの融合)
ヒトではないドナーの抗体と最大の配列相同性を共有するヒト抗体アクセプターのフレームワークを採用する、伝統的なヒト化方法とは異なり、ウサギCDRを、フレームワークFW1.4(配列番号172)に融合させてMin-graftをもたらしたか、または「ウサギ化」フレームワークrFW1.4(配列番号173)もしくはその改変体rFW1.4(v2)(配列番号174)に融合させてMax-graftをもたらした。両フレームワークは、所望の機能特性(溶解性および安定性)、多種多様なウサギCDRを収容する構造適合性、およびウサギの可変ドメインのコンセンサス配列との妥当な相同性に関して、第一に選択した。フレームワークrFW1.4は、FW1.4の誘導体であり、ウサギCDRの実質的に任意のセットに対して、普遍的なアクセプターのフレームワークとして役立てる狙いでさらに操作した。安定かつ可溶性フレームワーク配列FW1.4は、ウサギ抗体と高い相同性を示すが、利用できる最も相同性の高い配列ではない。
ウサギの各可変ドメイン配列に関して、最も近いウサギの生殖系列対応物を同定した。最も近い生殖系列が確立できなかった場合、配列は、サブグループのコンセンサスまたは高いパーセント値の類似性を有するウサギの配列のコンセンサスに対して比較した。稀なフレームワークの残基は、起こり得る体細胞過剰変異の結果であって、したがって抗原の結合に関与すると考えた。結果として、かかる残基は、アセプターフレームワークrFW1.4またはrFW1.4(v2)上に融合させて、Max-graftをもたらすためのものと考えた。特に、抗原の直接的な接触に潜在的に関係するか、またはVLおよびVHの配置に影響する残基を融合させた。さらにCDR構造に影響すると記載された残基を、必要であれば置換した。CDRをFW1.4(Min-graft)上に融合させたとき、フレームワークは置換しなかった。例えば、578minmaxを産出するために、rFW1.4の残基VH94(H94)を、ドナー配列中の対応する残基に変異させた。ウサギ抗体578は、H94にGlyを含み、一方、最も相同性の高い生殖系列およびウサギのコンセンサスの両方は、位置H94にArgを含む。Glyは、他のアミノ酸には見られない並外れた柔軟性(正のphi角度)を有する。これは、主鎖のねじれ角度における役割、および活性に関連するループコンフォメーションの強い影響の可能性を示唆する。本明細書で開示されるようなMax-graftを得るために融合させたフレームワークの位置のさらなる例は、rFW1.4、rFW1.4(v2)および本明細書で提供される目的のscFv配列のフレームワーク領域の配列をアラインメントすることによって同定することができる。当該分野で公知のウェブツールを、例えば前記目的のために使用することができる(例えば、http://www.ebi.ac.uk/Tools/clustalw2/index.htmlで2009年6月23日に利用できるようなClustalW、またはhttp://bioinfo.genotoul.fr/multalinで2009年6月23日に利用できるようなMultiAlin)。rFW1.4およびrFW1.4(v2)が同じ残基を含み、目的のscFvが異なる残基を明らかにする、全てのフレームワークの位置は、Max-graftを得るために融合させたフレームワークの位置である。
Min-graftの可変軽鎖を、Max-graftの可変重鎖と組み合わせて、生
物物理学的特性(溶解性および安定性)および活性に関して最適な組合せを同定した。
本明細書で記載および特徴付けされるscFvを、以下のように産生した。ヒト化VL配列(配列番号82~106)を、配列番号181のリンカーを介して、ヒト化VH配列(配列番号118~166)に連結させ、以下の配向のscFv:NH2-VL-リンカー-VH-COOHを産出した。多くの場合、様々なscFvをコードするDNA配列を、サービス会社Entelechon GmbH(www.entelechon.com)で新規に合成した。結果のDNA挿入物を、scFvのDNA配列の5’および3’末端にそれぞれ導入したNcoIおよびHindIIIの制限酵素認識部位を介して、細菌発現ベクターpGMP002にクローニングした。VLドメインのDNA配列とVHドメインのDNA配列との間に、BamHI制限酵素認識部位が位置する。いくつかの場合、scFvをコードするDNAを新規に合成せず、scFv発現構築物を、ドメインシャッフルによってクローニングした。したがって、NcoIおよびBamHI制限酵素認識部位を介して、VLドメインを切り出して新しい構築物に導入し、BamHIおよびHindIII制限酵素認識部位を介して、VHドメインを切り出して新しい構築物に導入した。他の場合、点変異を、先端技術のアッセンブルPCR(assembling PCR)方法を用いて、VHおよび/またはVLドメインに導入した。GMP002のクローニングは、WO2008006235の実施例1に記載されている。scFvの産生は、WO2008006235の実施例1に記載のESBA105に関して類似的に行った。
(抗VEGF scFvのBiacore結合分析)
この実施例では、scFvのBiacore結合能を試験し、結合親和性を、BIAcoreTM-T100による、典型的な表面プラズモン共鳴法を用いて測定した。この実施例および後の実施例において、これらのscFv候補による結合を試験したVEGFタンパク質には、精製したEscherichia coli発現の組換えヒトVEGF165(PeproTech EC Ltd.)、組換えヒトVEGF121(PeproTech EC Ltd.)、組換えヒトVEGF110(ESBATech AG)、組換えマウスVEGF164(PeproTech EC Ltd.)、組換えラットVEGF164(Biovision)、組換えウサギVEGF110(ESBATech
AG)、および組換えヒトPLGF(PeproTech EC Ltd.)が含まれる。表面プラズモン共鳴実験のために、カルボキシメチル化デキストランのバイオセンサーチップ(CM4、GE Healthcare)を、供給業者の説明書に従って、N-エチル-N’-(3-ジメチルアミノプロピル)カルボジイミドヒドロクロリドおよびN-ヒドロキシスクシンイミドを用いて活性化した。上記に例示された6つの異なる各VEGF形態を、標準的なアミンカップリング手順を用いて、CM4センサーチップ上の4つの異なるフローセルのうちの1つにカップリングさせた。カップリングおよびブロッキングの後、これらの固定化したVEGF分子により得られた応答の範囲は、hVEGF165に関しては約250~500応答単位(RU)、hVEGF110、hVEGF121、マウスVEGF164、ラットVEGF164およびウサギVEGF110に関しては約200RU、ならびにPLGFに関しては約400RUであった。タンパク質をブロッキングの前に固定化しなかったことを除き、各チップの第4のフローセルを同様に処理し、フローセルをインラインの参照として使用した。HBS-EP緩衝液(0.01MのHEPES、 pH7.4または5、0.15MのNaCl、3mMのEDTA、0.005%界面活性剤P20)中の抗VEGF scFvの様々な濃度(例えば、90nM、30nM、10nM、3.33nM、1.11nM、0.37nM、0.12nMおよび0.04nM)を、5分間、30μl/分の流速でフローセルに注入した。CM4チップ上のVEGFからの抗VEGF scFvの解離を、25℃で10分間進行させた。インライン参照のセル補正に続いて緩衝液試料を差し引いた後、センサーグラム(sensor
gram)を各抗VEGF scFv試料に関して作成した。見かけの解離速度定数(kd)、見かけの会合速度定数(ka)、および見かけの解離平衡定数(KD)を、BIAcoreT100評価ソフトウェアバージョン1.1を用いて、1対1のLangmuir結合モデル(one-to-one Langmuir binding model)を使用して計算した。
硫酸アンモニウムの様々な濃度下におけるこれらの誘導体の可溶性タンパク質のパーセントを比較した。
(VEGF受容体ブロッキングアッセイ)
本発明で開示される抗VEGF scFv候補またはそれらの誘導体に関して、実施例3におけるVEGFへのそれらの結合親和性に加えて、VEGFインヒビターとしてのそれらの能力も測定した。それらの能力を測定するための方法には、例えば、この実施例で例示されるようなVEGFR競合ELISA、およびHUVECアッセイが挙げられる(図8)。
Blue POD基質、Roche Diagnostics)を用いて検出した。450nmでの光学密度(OD 450nm)を、Sunriseマイクロプレートリーダー(Tecan)を用いて測定した。データを上記のように分析し、EC50値を、scFvの用量-応答曲線から計算した。VEGFR1受容体ブロッキングアッセイによって測定された、主要な候補の典型的な能力を、表7に列挙する。
(VEGF阻害のHUVECアッセイ)
この実施例では、開示された、VEGFインヒビターとしての抗VEGF scFv候補またはそれらの誘導体の能力を測定する別の方法として、HUVECアッセイを例示する。
(無毛モルモットにおけるhVEGF165誘導型血管性透過への抗VEGF scFvの効果)
この実施例では、ヒトVEGF165誘導型血管性透過への抗VEGF scFvの効果を、Milesアッセイを用いてモルモットにおいて評価した。1匹の動物につき30箇所の適用部位を、耐久性マーカーを用いて雄性の無毛モルモットの背側上にマークした。処置日に、全身麻酔の下、1%エバンスブルー色素溶液1mlを、各動物に静脈内投与した。色素注射して1時間後、2.61nMの組換えヒトVEGF165(PeproTech EC Ltd.)および様々な濃度の抗VEGF scFv(0nM、0.085nM、0.256nM、0.767nM、2.3nM、6.9nM、20.7nM、62.1nM;試験アイテムにつきn=7の動物)を含む試験溶液0.1mlを、背側上の
マークに3連で注射した(試験アイテムの濃度につき3注射)。PBSの注射を、全動物における負の対照として供給した。追加の対照として、6.9nMのルセンティス(Novartis)を全動物において注射した。
(ラットにおけるhVEGF165誘導型網膜血管性漏出に対する局所的抗VEGF scFv処置の効果)
この実験では、578minmaxの局所的効能を、修正したMilesアッセイを用いて実証する。これらの修正には、例えば、scFvの硝子体内注射および局所適用を用いる前混合試験が含まれる。
導型網膜血管性透過が有意に阻害された。これは、眼内疾患の処置に有用な、局所的に有効な抗体を実証する最初のものである。
前述の記載を考慮して、本発明の多くの修正および代替の実施形態が、当業者に明らかである。したがって、この記載は、単なる例示として解釈すべきであり、本発明を実施するのに最良の様式を当業者に教示するためのものである。構造の詳細は、本発明の精神から逸脱することなく実質的に変えることができ、添付の特許請求の範囲内となる全ての修正の独占的使用権を保有する。本発明は、添付の特許請求の範囲および法律の適用可能な規則によって要求される程度にのみ制限されるものであると意図する。
Claims (1)
- 明細書に記載される抗体、イムノバインダー、ハイブリドーマ、核酸、ベクターおよび宿主細胞、組成物、方法ならびに使用など。
Applications Claiming Priority (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US7569208P | 2008-06-25 | 2008-06-25 | |
| US13321208P | 2008-06-25 | 2008-06-25 | |
| US7569708P | 2008-06-25 | 2008-06-25 | |
| US61/133,212 | 2008-06-25 | ||
| US61/075,692 | 2008-06-25 | ||
| US61/075,697 | 2008-06-25 | ||
| US15504109P | 2009-02-24 | 2009-02-24 | |
| US61/155,041 | 2009-02-24 | ||
| JP2018018375A JP6821612B2 (ja) | 2008-06-25 | 2018-02-05 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2019090735A JP6978468B2 (ja) | 2008-06-25 | 2019-05-13 | Vegfを阻害する安定かつ可溶性の抗体 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019090735A Division JP6978468B2 (ja) | 2008-06-25 | 2019-05-13 | Vegfを阻害する安定かつ可溶性の抗体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2022020782A true JP2022020782A (ja) | 2022-02-01 |
| JP7171877B2 JP7171877B2 (ja) | 2022-11-15 |
| JP7171877B6 JP7171877B6 (ja) | 2024-02-06 |
Family
ID=41209803
Family Applications (7)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011515049A Active JP5956752B2 (ja) | 2008-06-25 | 2009-06-25 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2014087194A Active JP6100199B2 (ja) | 2008-06-25 | 2014-04-21 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2015037794A Pending JP2015134792A (ja) | 2008-06-25 | 2015-02-27 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2016255720A Active JP6527128B2 (ja) | 2008-06-25 | 2016-12-28 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2018018375A Active JP6821612B2 (ja) | 2008-06-25 | 2018-02-05 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2019090735A Active JP6978468B2 (ja) | 2008-06-25 | 2019-05-13 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2021184262A Active JP7171877B6 (ja) | 2008-06-25 | 2021-11-11 | Vegfを阻害する安定かつ可溶性の抗体 |
Family Applications Before (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011515049A Active JP5956752B2 (ja) | 2008-06-25 | 2009-06-25 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2014087194A Active JP6100199B2 (ja) | 2008-06-25 | 2014-04-21 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2015037794A Pending JP2015134792A (ja) | 2008-06-25 | 2015-02-27 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2016255720A Active JP6527128B2 (ja) | 2008-06-25 | 2016-12-28 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2018018375A Active JP6821612B2 (ja) | 2008-06-25 | 2018-02-05 | Vegfを阻害する安定かつ可溶性の抗体 |
| JP2019090735A Active JP6978468B2 (ja) | 2008-06-25 | 2019-05-13 | Vegfを阻害する安定かつ可溶性の抗体 |
Country Status (26)
| Country | Link |
|---|---|
| US (5) | US8349322B2 (ja) |
| EP (3) | EP2307454B1 (ja) |
| JP (7) | JP5956752B2 (ja) |
| KR (8) | KR102296443B1 (ja) |
| CN (3) | CN110372792A (ja) |
| AU (1) | AU2009264565C1 (ja) |
| BR (1) | BRPI0914251B1 (ja) |
| CA (2) | CA2727839C (ja) |
| CL (1) | CL2010001544A1 (ja) |
| CY (3) | CY1118829T1 (ja) |
| DK (2) | DK2307454T3 (ja) |
| ES (2) | ES2622470T3 (ja) |
| HK (1) | HK1150844A1 (ja) |
| HR (2) | HRP20170615T1 (ja) |
| HU (3) | HUE050230T2 (ja) |
| LT (3) | LT2307454T (ja) |
| MX (2) | MX2011000011A (ja) |
| NL (1) | NL301058I2 (ja) |
| NO (1) | NO2020021I1 (ja) |
| PH (1) | PH12015501593A1 (ja) |
| PL (2) | PL3216803T3 (ja) |
| PT (2) | PT2307454T (ja) |
| RU (6) | RU2588467C3 (ja) |
| SI (2) | SI2307454T1 (ja) |
| WO (1) | WO2009155724A2 (ja) |
| ZA (1) | ZA201008594B (ja) |
Families Citing this family (98)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2648284C (en) | 2006-04-07 | 2016-08-16 | The Procter & Gamble Company | Antibodies that bind human protein tyrosine phosphatase beta (hptpbeta) and uses thereof |
| BRPI0914663A2 (pt) | 2008-06-25 | 2015-10-20 | Esbatech Alcon Biomed Res Unit | humanização de anticorpos de coelho usando uma estrutura de anticorpo universal |
| CA2727839C (en) | 2008-06-25 | 2018-11-20 | Esbatech, An Alcon Biomedical Research Unit Llc | Stable and soluble antibodies inhibiting vegf |
| KR101893010B1 (ko) | 2008-06-25 | 2018-08-29 | 에스바테크 - 어 노바티스 컴파니 엘엘씨 | TNFα를 저해하는 안정한 가용성 항체 |
| CN102089431A (zh) | 2008-06-30 | 2011-06-08 | 艾斯巴技术,爱尔康生物医药研究装置有限责任公司 | 官能化的多肽 |
| US8268314B2 (en) | 2008-10-08 | 2012-09-18 | Hoffmann-La Roche Inc. | Bispecific anti-VEGF/anti-ANG-2 antibodies |
| WO2010096941A1 (en) | 2009-02-24 | 2010-09-02 | Esbatech, An Alcon Biomedical Research Unit Llc | Methods for identifying immunobinders of cell-surface antigens |
| AU2010270986B2 (en) | 2009-06-22 | 2014-05-22 | Amgen Inc. | Refolding proteins using a chemically controlled redox state |
| EP2445924B2 (en) | 2009-06-25 | 2023-12-13 | Amgen Inc. | Capture purification processes for proteins expressed in a non-mammalian system |
| EP2629795B1 (en) * | 2010-10-19 | 2017-12-06 | Mayo Foundation For Medical Education And Research | Human antibodies and diagnostic and therapeutic uses thereof for the treatment of neurological disease |
| AR083495A1 (es) | 2010-10-22 | 2013-02-27 | Esbatech Alcon Biomed Res Unit | Anticuerpos estables y solubles |
| US9527925B2 (en) | 2011-04-01 | 2016-12-27 | Boehringer Ingelheim International Gmbh | Bispecific binding molecules binding to VEGF and ANG2 |
| SG10201701055WA (en) * | 2011-09-16 | 2017-03-30 | Ucb Pharma Sa | Neutralising antibodies to the major exotoxins tcda and tcdb of clostridium difficile |
| AU2012323856B2 (en) | 2011-10-13 | 2017-05-25 | EyePoint Pharmaceuticals, Inc. | Methods for treating Vascular Leak Syndrome and cancer |
| EP2809344B1 (en) | 2012-02-02 | 2016-08-24 | ESBATech - a Novartis Company LLC | Antibody-containing sustained-release formulation for ocular administration |
| HRP20211641T1 (hr) | 2012-07-13 | 2022-02-04 | Roche Glycart Ag | Bispecifična protutijela anti-vegf/anti-ang-2 i njihova primjena u liječenju vaskularnih očnih bolesti |
| CN104995303A (zh) | 2012-12-18 | 2015-10-21 | 诺华股份有限公司 | 利用结合乙酰透明质酸的肽标签的组合物和方法 |
| PT2956476T (pt) | 2013-02-18 | 2020-02-21 | Vegenics Pty Ltd | Moléculas de ligação e usos destas |
| KR101541478B1 (ko) * | 2013-05-31 | 2015-08-05 | 동아쏘시오홀딩스 주식회사 | 항-vegf 항체 및 이를 포함하는 암 또는 신생혈관형성관련 질환의 예방, 진단 또는 치료용 약학 조성물 |
| CA2914829A1 (en) * | 2013-06-26 | 2014-12-31 | Numab Ag | Novel antibody frameworks |
| JP2016531901A (ja) | 2013-07-12 | 2016-10-13 | オプソテック コーポレイションOphthotech Corporation | 眼科症状を処置するまたは予防するための方法 |
| WO2015076425A1 (ja) * | 2013-11-25 | 2015-05-28 | リンク・ジェノミクス株式会社 | 新規モノクローナル抗体 |
| EP3492495A1 (en) | 2014-05-12 | 2019-06-05 | Formycon AG | Pre-filled plastic syringe containing a vegf antagonist |
| WO2015198243A2 (en) | 2014-06-25 | 2015-12-30 | Novartis Ag | Compositions and methods for long acting proteins |
| WO2015198240A2 (en) | 2014-06-25 | 2015-12-30 | Novartis Ag | Compositions and methods for long acting proteins |
| US9840553B2 (en) | 2014-06-28 | 2017-12-12 | Kodiak Sciences Inc. | Dual PDGF/VEGF antagonists |
| GB201412658D0 (en) | 2014-07-16 | 2014-08-27 | Ucb Biopharma Sprl | Molecules |
| KR102390359B1 (ko) | 2014-09-29 | 2022-04-22 | 삼성전자주식회사 | 폴리펩타이드, 이를 포함하는 항 VEGF 항체 및 항 c-Met/항 VEGF 이중 특이 항체 |
| TWI761959B (zh) * | 2014-11-07 | 2022-04-21 | 瑞士商諾華公司 | 治療眼部疾病之方法 |
| JP6929771B2 (ja) | 2014-11-10 | 2021-09-01 | ジェネンテック, インコーポレイテッド | 抗インターロイキン−33抗体及びその使用 |
| BR112017014376A2 (pt) * | 2015-01-28 | 2018-05-02 | Pfizer | formulação aquosa estável de anticorpos antifator de crescimento endotelial vascular (vegf) e uso |
| CA2982861A1 (en) | 2015-04-16 | 2016-10-20 | Alder Biopharmaceuticals, Inc. | Anti-pacap antibodies and uses thereof |
| US10851399B2 (en) * | 2015-06-25 | 2020-12-01 | Native Microbials, Inc. | Methods, apparatuses, and systems for microorganism strain analysis of complex heterogeneous communities, predicting and identifying functional relationships and interactions thereof, and selecting and synthesizing microbial ensembles based thereon |
| GB201601077D0 (en) | 2016-01-20 | 2016-03-02 | Ucb Biopharma Sprl | Antibody molecule |
| GB201601073D0 (en) | 2016-01-20 | 2016-03-02 | Ucb Biopharma Sprl | Antibodies |
| JP2018525389A (ja) | 2015-08-12 | 2018-09-06 | ノバルティス アーゲー | 眼障害を治療する方法 |
| MY196448A (en) | 2015-10-30 | 2023-04-12 | Genentech Inc | Anti-Htra1 Antibodies and Methods of use Thereof |
| JP6985572B2 (ja) * | 2015-11-09 | 2021-12-22 | 国立大学法人京都工芸繊維大学 | 単鎖抗体のスクリーニング方法及び単鎖抗体 |
| US20180326126A1 (en) | 2015-11-18 | 2018-11-15 | Formycon Ag | Pre-filled plastic syringe containing a vegf antagonist |
| KR20180105123A (ko) | 2015-11-18 | 2018-09-27 | 에스아이오2 메디컬 프로덕츠, 인크. | 안과 제제용 제약 패키지 |
| RU2734958C2 (ru) | 2015-11-18 | 2020-10-26 | Формикон Аг | Предварительно заполненная фармацевтическая упаковка, содержащая жидкий состав на основе антагониста vegf |
| GB201521382D0 (en) | 2015-12-03 | 2016-01-20 | Ucb Biopharma Sprl | Antibodies |
| GB201521389D0 (en) | 2015-12-03 | 2016-01-20 | Ucb Biopharma Sprl | Method |
| US11066465B2 (en) | 2015-12-30 | 2021-07-20 | Kodiak Sciences Inc. | Antibodies and conjugates thereof |
| WO2017119435A1 (ja) | 2016-01-06 | 2017-07-13 | 株式会社オーダーメードメディカルリサーチ | 高親和性抗vegf抗体 |
| WO2017119434A1 (ja) | 2016-01-06 | 2017-07-13 | 株式会社オーダーメードメディカルリサーチ | Vegfとnrp1との結合を阻害する抗体 |
| USD789171S1 (en) | 2016-01-21 | 2017-06-13 | Nomis Llc | Right angle drive |
| JP6953433B2 (ja) | 2016-01-26 | 2021-10-27 | フォーマイコン アーゲーFormycon Ag | Vegfアンタゴニストを含む液体医薬組成物および同医薬組成物を含有する充填済みシリンジ |
| JP2019512210A (ja) * | 2016-02-05 | 2019-05-16 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | Egfl6特異的モノクローナル抗体及びそれらの使用方法 |
| WO2017156423A2 (en) * | 2016-03-11 | 2017-09-14 | Integrated Biotherapeutics, Inc. | Broadly protective antibody cocktails for treatment of filovirus hemorrhagic fever |
| EP3222673A1 (de) * | 2016-03-23 | 2017-09-27 | LANXESS Deutschland GmbH | Metallazopigmente |
| WO2017181031A2 (en) | 2016-04-15 | 2017-10-19 | Alder Biopharmaceuticals, Inc. | Anti-pacap antibodies and uses thereof |
| TN2018000443A1 (en) | 2016-06-30 | 2020-06-15 | Celltrion Inc | Stable liquid pharmaceutical preparation |
| JP7050702B2 (ja) | 2016-07-08 | 2022-04-08 | ジェネンテック, インコーポレイテッド | Nrf2及びその遺伝子の下流標的遺伝子の発現状態及び変異状態によるがんの診断及び治療方法 |
| JP7046089B2 (ja) * | 2017-03-09 | 2022-04-01 | マブ ディスカバリー ゲゼルシャフト ミット ベシュレンクテル ハフツング | ヒトil-1r7に特異的に結合する抗体 |
| JOP20190245A1 (ar) | 2017-04-20 | 2019-10-15 | Novartis Ag | أنظمة توصيل إطلاق مستدام تتضمن روابط بلا أثر لنقطة الربط |
| KR102607655B1 (ko) | 2017-05-19 | 2023-11-28 | 카운슬 오브 사이언티픽 앤드 인더스트리얼 리서치 | 리폴딩된 재조합 인간화 라니비주맙의 제조 방법 |
| US20200171244A1 (en) | 2017-05-24 | 2020-06-04 | Sio2 Medical Products, Inc. | Sterilizable pharmaceutical package for ophthalmic formulations |
| WO2018215580A1 (en) | 2017-05-24 | 2018-11-29 | Formycon Ag | Method for sterilizing prefilled plastic syringes containing a vegf antagonist |
| WO2018217995A1 (en) | 2017-05-24 | 2018-11-29 | Formycon Ag | Sterilizable pre-filled pharmaceutical packages comprising a liquid formulation of a vegf-antagonist |
| US20200157224A1 (en) * | 2017-06-25 | 2020-05-21 | Systimmune, Inc. | Multi-specific antibodies and methods of making and using thereof |
| WO2019020777A1 (en) | 2017-07-26 | 2019-01-31 | Formycon Ag | LIQUID FORMULATION OF A VEGF ANTAGONIST |
| PT3717636T (pt) * | 2017-11-27 | 2023-05-30 | 4D Molecular Therapeutics Inc | Cápsides variantes de vírus adeno-associado e utilização para inibir a angiogénese |
| CN111511400A (zh) | 2017-12-29 | 2020-08-07 | 豪夫迈·罗氏有限公司 | 抗vegf抗体及其使用方法 |
| US11078283B2 (en) | 2018-01-17 | 2021-08-03 | Apexigen, Inc. | Anti-PD-L1 antibodies and methods of use |
| SG11202008242XA (en) | 2018-03-02 | 2020-09-29 | Kodiak Sciences Inc | Il-6 antibodies and fusion constructs and conjugates thereof |
| EP3765083A1 (en) | 2018-03-16 | 2021-01-20 | Novartis Ag | Methods for treating ocular diseases |
| JP7574079B2 (ja) * | 2018-04-06 | 2024-10-28 | イーライ リリー アンド カンパニー | 小児患者における癌の治療のためのラムシルマブ |
| US11401324B2 (en) | 2018-08-30 | 2022-08-02 | HCW Biologics, Inc. | Single-chain chimeric polypeptides and uses thereof |
| CA3109139A1 (en) | 2018-08-30 | 2020-03-05 | HCW Biologics, Inc. | Methods of treating aging-related disorders |
| JP7397874B2 (ja) | 2018-08-30 | 2023-12-13 | エイチシーダブリュー バイオロジックス インコーポレイテッド | 多鎖キメラポリペプチドおよびその使用 |
| JP7534303B2 (ja) * | 2018-09-13 | 2024-08-14 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | 新規のlilrb4抗体およびその使用 |
| CN113164597A (zh) | 2018-09-24 | 2021-07-23 | 爱尔皮奥制药公司 | 靶向HPTP-β(VE-PTP)和VEGF的多特异性抗体 |
| AR117707A1 (es) | 2018-12-18 | 2021-08-25 | Novartis Ag | Formulación de solución de proteínas que contiene una alta concentración de un anticuerpo anti-vegf |
| USD907456S1 (en) | 2019-05-21 | 2021-01-12 | Nomis Llc | Right angle drill attachment |
| USD907455S1 (en) | 2019-05-21 | 2021-01-12 | Nomis Llc | Right angle drive attachment |
| CN114269903A (zh) | 2019-06-21 | 2022-04-01 | Hcw生物科技公司 | 多链嵌合多肽和其用途 |
| AU2020347575A1 (en) | 2019-09-13 | 2022-03-17 | Novartis Ag | Methods for treating ocular diseases |
| CA3157509A1 (en) | 2019-10-10 | 2021-04-15 | Kodiak Sciences Inc. | Methods of treating an eye disorder |
| IL295077A (en) | 2020-02-11 | 2022-09-01 | Hcw Biologics Inc | Methods for treating age-related and inflammatory diseases |
| KR20220140572A (ko) | 2020-02-11 | 2022-10-18 | 에이치씨더블유 바이올로직스, 인크. | 조절 t 세포를 활성화시키는 방법 |
| EP4103600A1 (en) | 2020-02-11 | 2022-12-21 | HCW Biologics, Inc. | Chromatography resin and uses thereof |
| EP4110819A1 (en) * | 2020-02-28 | 2023-01-04 | Apexigen, Inc. | Anti-sirpa antibodies and methods of use |
| EP4118120A4 (en) * | 2020-03-12 | 2024-04-17 | Immune-ONC Therapeutics, Inc. | NOVEL ANTI-LILRB4 ANTIBODIES AND DERIVATIVE PRODUCTS |
| CA3174680A1 (en) | 2020-03-13 | 2021-09-16 | Genentech, Inc. | Anti-interleukin-33 antibodies and uses thereof |
| JP2023525495A (ja) | 2020-04-29 | 2023-06-16 | エイチシーダブリュー バイオロジックス インコーポレイテッド | 抗cd26タンパク質及びそれらの使用法 |
| WO2021247003A1 (en) | 2020-06-01 | 2021-12-09 | HCW Biologics, Inc. | Methods of treating aging-related disorders |
| US12024545B2 (en) | 2020-06-01 | 2024-07-02 | HCW Biologics, Inc. | Methods of treating aging-related disorders |
| AU2021283199A1 (en) | 2020-06-01 | 2023-01-05 | Immunitybio, Inc. | Methods of treating aging-related disorders |
| EP4182025A1 (en) | 2020-07-16 | 2023-05-24 | Novartis AG | Anti-betacellulin antibodies, fragments thereof, and multi-specific binding molecules |
| WO2022079161A1 (en) | 2020-10-15 | 2022-04-21 | F. Hoffmann-La Roche Ag | Non-covalent protein-hyaluronan conjugates for long-acting ocular delivery |
| TW202237181A (zh) | 2020-11-25 | 2022-10-01 | 瑞士商諾華公司 | 治療眼部疾病之方法 |
| WO2022201084A1 (en) | 2021-03-26 | 2022-09-29 | Novartis Ag | Methods for treating ocular diseases |
| EP4145456A1 (en) | 2021-09-06 | 2023-03-08 | Bayer AG | Prediction of a change related to a macular fluid |
| KR20230094450A (ko) | 2021-12-21 | 2023-06-28 | 한림대학교 산학협력단 | 항-cldn18.2를 포함하는 키메릭 항원 수용체를 유효성분으로 포함하는 암의 예방 또는 치료용 약학적 조성물 및 이의 제조 방법 |
| KR20240156626A (ko) | 2022-03-02 | 2024-10-30 | 이뮤니티바이오, 인크. | 췌장암의 치료 방법 |
| TW202337496A (zh) | 2022-03-17 | 2023-10-01 | 瑞士商諾華公司 | 治療新生血管性年齡相關性黃斑點退化之方法 |
| CN117820474A (zh) * | 2023-04-25 | 2024-04-05 | 南京贝思奥生物科技有限公司 | 改善眼部血管新生相关疾病的药物及其应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003527334A (ja) * | 1999-10-22 | 2003-09-16 | ルードヴィッヒ インスティテュート フォー キャンサー リサーチ | A33抗原特異的免疫グロブリン産物を用いるa33抗原を発現する癌の影響を低減する方法 |
| JP2007520991A (ja) * | 2003-08-07 | 2007-08-02 | エピトミクス インコーポレーティッド | ウサギ単クローン抗体をヒト型化する方法 |
| JP2008518619A (ja) * | 2004-11-08 | 2008-06-05 | エピトミクス インコーポレーティッド | 抗体エンジニアリングのための方法 |
Family Cites Families (70)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4376110A (en) | 1980-08-04 | 1983-03-08 | Hybritech, Incorporated | Immunometric assays using monoclonal antibodies |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5260203A (en) | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| US4881175A (en) | 1986-09-02 | 1989-11-14 | Genex Corporation | Computer based system and method for determining and displaying possible chemical structures for converting double- or multiple-chain polypeptides to single-chain polypeptides |
| US5013653A (en) | 1987-03-20 | 1991-05-07 | Creative Biomolecules, Inc. | Product and process for introduction of a hinge region into a fusion protein to facilitate cleavage |
| DE3856559T2 (de) | 1987-05-21 | 2004-04-29 | Micromet Ag | Multifunktionelle Proteine mit vorbestimmter Zielsetzung |
| US5132405A (en) | 1987-05-21 | 1992-07-21 | Creative Biomolecules, Inc. | Biosynthetic antibody binding sites |
| US5258498A (en) | 1987-05-21 | 1993-11-02 | Creative Biomolecules, Inc. | Polypeptide linkers for production of biosynthetic proteins |
| US5091513A (en) | 1987-05-21 | 1992-02-25 | Creative Biomolecules, Inc. | Biosynthetic antibody binding sites |
| JP3040121B2 (ja) | 1988-01-12 | 2000-05-08 | ジェネンテク,インコーポレイテッド | 増殖因子レセプターの機能を阻害することにより腫瘍細胞を処置する方法 |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5147638A (en) | 1988-12-30 | 1992-09-15 | Oklahoma Medical Research Foundation | Inhibition of tumor growth by blockade of the protein C system |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US6582959B2 (en) | 1991-03-29 | 2003-06-24 | Genentech, Inc. | Antibodies to vascular endothelial cell growth factor |
| OA10149A (en) | 1991-03-29 | 1996-12-18 | Genentech Inc | Vascular endothelial cell growth factor antagonists |
| EP0940468A1 (en) | 1991-06-14 | 1999-09-08 | Genentech, Inc. | Humanized antibody variable domain |
| WO1994010202A1 (en) | 1992-10-28 | 1994-05-11 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| IL117645A (en) | 1995-03-30 | 2005-08-31 | Genentech Inc | Vascular endothelial cell growth factor antagonists for use as medicaments in the treatment of age-related macular degeneration |
| US5730977A (en) | 1995-08-21 | 1998-03-24 | Mitsui Toatsu Chemicals, Inc. | Anti-VEGF human monoclonal antibody |
| PT929578E (pt) | 1996-02-09 | 2003-09-30 | Abbott Lab Bermuda Ltd | Anticorpos humanos que se ligam a tnfalfa humano |
| EP0938506B1 (en) * | 1996-07-16 | 2003-11-05 | Plückthun, Andreas, Prof. Dr. | Immunoglobulin superfamily domains and fragments with increased solubility |
| WO2000053760A2 (en) | 1999-03-12 | 2000-09-14 | Genentech, Inc. | Method of preventing the death of retinal neurons and treating ocular diseases |
| US6986890B1 (en) | 1996-11-21 | 2006-01-17 | Kyowa Hakko Kogyo Co., Ltd. | Anti-human VEGF receptor Flt-1 monoclonal antibody |
| ATE349470T1 (de) * | 1997-04-07 | 2007-01-15 | Genentech Inc | Anti-vefg antibodies |
| US7365166B2 (en) | 1997-04-07 | 2008-04-29 | Genentech, Inc. | Anti-VEGF antibodies |
| DK2301580T3 (da) * | 1997-04-07 | 2012-05-14 | Genentech Inc | Beholder med anti-VEGF-antistoffer |
| US20020032315A1 (en) | 1997-08-06 | 2002-03-14 | Manuel Baca | Anti-vegf antibodies |
| WO2000034337A1 (en) | 1998-12-10 | 2000-06-15 | Tsukuba Research Laboratory, Toagosei Co., Ltd. | Humanized monoclonal antibodies against vascular endothelial cell growth factor |
| US6703020B1 (en) | 1999-04-28 | 2004-03-09 | Board Of Regents, The University Of Texas System | Antibody conjugate methods for selectively inhibiting VEGF |
| CN101073668A (zh) | 1999-04-28 | 2007-11-21 | 德克萨斯大学董事会 | 用于通过选择性抑制vegf来治疗癌症的组合物和方法 |
| CA2396534C (en) | 1999-12-28 | 2012-10-02 | Esbatech Ag | Intrabodies with defined framework that is stable in a reducing environment and applications thereof |
| GB0013810D0 (en) | 2000-06-06 | 2000-07-26 | Celltech Chiroscience Ltd | Biological products |
| US7667004B2 (en) | 2001-04-17 | 2010-02-23 | Abmaxis, Inc. | Humanized antibodies against vascular endothelial growth factor |
| DE10201450B4 (de) | 2002-01-16 | 2004-09-02 | Infineon Technologies Ag | Carry-Skip-Addierer für verschlüsselte Daten |
| US6576941B1 (en) | 2002-02-20 | 2003-06-10 | Samsung Electronics Co., Ltd. | Ferroelectric capacitors on protruding portions of conductive plugs having a smaller cross-sectional size than base portions thereof |
| CN1187373C (zh) * | 2002-03-20 | 2005-02-02 | 上海中信国健药业有限公司 | 人源化抗血管内皮生长因子单克隆抗体及其制法和药物组合物 |
| KR100708398B1 (ko) | 2002-03-22 | 2007-04-18 | (주) 에이프로젠 | 인간화 항체 및 이의 제조방법 |
| EP2947095B1 (en) | 2002-05-22 | 2019-10-02 | ESBATech, an Alcon Biomedical Research Unit LLC | Immunoglobulin frameworks which demonstrate enhanced stability in the intracellular environment and methods of identifying same |
| JP2005535341A (ja) * | 2002-08-15 | 2005-11-24 | エピトミスク インコーポレーティッド | ヒト化ウサギ抗体 |
| ME00425B (me) | 2003-05-30 | 2011-10-10 | Genentech Inc | Liječenje sa anti-vegf antitijelima |
| US20050048578A1 (en) | 2003-06-26 | 2005-03-03 | Epitomics, Inc. | Methods of screening for monoclonal antibodies with desirable activity |
| WO2005044853A2 (en) * | 2003-11-01 | 2005-05-19 | Genentech, Inc. | Anti-vegf antibodies |
| US7758859B2 (en) | 2003-08-01 | 2010-07-20 | Genentech, Inc. | Anti-VEGF antibodies |
| US20050106667A1 (en) | 2003-08-01 | 2005-05-19 | Genentech, Inc | Binding polypeptides with restricted diversity sequences |
| PL1781321T3 (pl) | 2004-08-02 | 2014-07-31 | Zenyth Operations Pty Ltd | Sposób leczenia raka zawierający antagonistę VEGF-B |
| AU2005299701B2 (en) | 2004-10-21 | 2011-11-17 | Genentech, Inc. | Method for treating intraocular neovascular diseases |
| US7431927B2 (en) * | 2005-03-24 | 2008-10-07 | Epitomics, Inc. | TNFα-neutralizing antibodies |
| WO2007019620A1 (en) * | 2005-08-15 | 2007-02-22 | Arana Therapeutics Limited | Engineered antibodies with new world primate framework regions |
| AR059066A1 (es) | 2006-01-27 | 2008-03-12 | Amgen Inc | Combinaciones del inhibidor de la angiopoyetina -2 (ang2) y el inhibidor del factor de crecimiento endotelial vascular (vegf) |
| WO2007140534A1 (en) * | 2006-06-08 | 2007-12-13 | Csl Limited | Vegf-a cross-reactive anti- vegf-b antibodies as antagonists of vegf-a and vegf-b signalling |
| SI2046382T1 (sl) | 2006-07-10 | 2016-12-30 | ESBATech an Alcon Biomedical Research Unit LLC | Protitelesa scFv, ki prehajajo epitelijske in/ali endotelijske plasti |
| WO2008063932A2 (en) | 2006-11-10 | 2008-05-29 | Genentech, Inc. | Method for treating age-related macular degeneration |
| US7553486B2 (en) | 2006-11-13 | 2009-06-30 | Paul Theodore Finger | Anti-VEGF treatment for radiation-induced vasculopathy |
| SG10201503407WA (en) | 2006-12-19 | 2015-06-29 | Genentech Inc | Vegf-specific antagonists for adjuvant and neoadjuvant therapy and the treatment of early stage tumors |
| IN2009DN05758A (ja) | 2007-03-12 | 2015-07-24 | Esbatech Ag | |
| KR20100018040A (ko) | 2007-06-06 | 2010-02-16 | 도만티스 리미티드 | 프로테아제 내성 폴리펩티드를 선택하는 방법 |
| KR20100040840A (ko) | 2007-06-06 | 2010-04-21 | 도만티스 리미티드 | 폴리펩티드,항체 가변 도메인 및 길항제 |
| US9908945B2 (en) | 2007-06-25 | 2018-03-06 | Esbatech, An Alcon Biomedical Research Unit Llc | Sequence based engineering and optimization of single chain antibodies |
| EP2158315B1 (en) | 2007-06-25 | 2016-03-23 | ESBATech, an Alcon Biomedical Research Unit LLC | Methods of modifying antibodies, and modified antibodies with improved functional properties |
| CN103992405B (zh) * | 2008-03-26 | 2016-08-17 | 宜康公司 | 抗-vegf抗体 |
| LT2307455T (lt) | 2008-06-25 | 2017-06-26 | Esbatech, An Alcon Biomedical Research Unit Llc | Imuninių rišiklių tirpumo optimizavimas |
| CA2727839C (en) * | 2008-06-25 | 2018-11-20 | Esbatech, An Alcon Biomedical Research Unit Llc | Stable and soluble antibodies inhibiting vegf |
| BRPI0914663A2 (pt) * | 2008-06-25 | 2015-10-20 | Esbatech Alcon Biomed Res Unit | humanização de anticorpos de coelho usando uma estrutura de anticorpo universal |
| US8697074B2 (en) * | 2008-07-10 | 2014-04-15 | Esbatech, An Alcon Biomedical Research Unit Llc | Methods and compositions for enhanced delivery of macromolecules |
| EP4219545A1 (en) * | 2009-12-23 | 2023-08-02 | Novartis AG | Method for decreasing immunogenicity |
-
2009
- 2009-06-25 CA CA2727839A patent/CA2727839C/en active Active
- 2009-06-25 KR KR1020207026266A patent/KR102296443B1/ko active IP Right Grant
- 2009-06-25 KR KR1020197022648A patent/KR102157097B1/ko active Application Filing
- 2009-06-25 KR KR1020157032314A patent/KR101671886B1/ko active Protection Beyond IP Right Term
- 2009-06-25 PT PT97686935T patent/PT2307454T/pt unknown
- 2009-06-25 DK DK09768693.5T patent/DK2307454T3/en active
- 2009-06-25 RU RU2014132888A patent/RU2588467C3/ru active Protection Beyond IP Right Term
- 2009-06-25 ES ES09768693.5T patent/ES2622470T3/es active Active
- 2009-06-25 MX MX2011000011A patent/MX2011000011A/es active IP Right Grant
- 2009-06-25 AU AU2009264565A patent/AU2009264565C1/en active Active
- 2009-06-25 EP EP09768693.5A patent/EP2307454B1/en active Active
- 2009-06-25 HU HUE17151756A patent/HUE050230T2/hu unknown
- 2009-06-25 MX MX2013004871A patent/MX347972B/es unknown
- 2009-06-25 KR KR1020167030125A patent/KR101737466B1/ko active IP Right Grant
- 2009-06-25 KR KR1020177012884A patent/KR101817284B1/ko active IP Right Grant
- 2009-06-25 CN CN201910338494.7A patent/CN110372792A/zh active Pending
- 2009-06-25 EP EP20158159.2A patent/EP3722310B1/en active Active
- 2009-06-25 ES ES17151756T patent/ES2793008T3/es active Active
- 2009-06-25 KR KR1020187000324A patent/KR20180005753A/ko active IP Right Grant
- 2009-06-25 PL PL17151756T patent/PL3216803T3/pl unknown
- 2009-06-25 US US13/000,423 patent/US8349322B2/en active Active
- 2009-06-25 BR BRPI0914251-7A patent/BRPI0914251B1/pt active IP Right Grant
- 2009-06-25 KR KR1020187024733A patent/KR102095257B1/ko active Protection Beyond IP Right Term
- 2009-06-25 RU RU2011102583A patent/RU2531523C3/ru active
- 2009-06-25 CN CN200980124313.5A patent/CN102143976B/zh active Active
- 2009-06-25 CN CN201510205513.0A patent/CN104961828B/zh active Active
- 2009-06-25 DK DK17151756.8T patent/DK3216803T3/da active
- 2009-06-25 SI SI200931647A patent/SI2307454T1/sl unknown
- 2009-06-25 PL PL09768693T patent/PL2307454T3/pl unknown
- 2009-06-25 HU HUE09768693A patent/HUE032894T2/hu unknown
- 2009-06-25 EP EP17151756.8A patent/EP3216803B1/en active Active
- 2009-06-25 WO PCT/CH2009/000220 patent/WO2009155724A2/en active Application Filing
- 2009-06-25 PT PT171517568T patent/PT3216803T/pt unknown
- 2009-06-25 LT LTEP09768693.5T patent/LT2307454T/lt unknown
- 2009-06-25 LT LTEP17151756.8T patent/LT3216803T/lt unknown
- 2009-06-25 JP JP2011515049A patent/JP5956752B2/ja active Active
- 2009-06-25 CA CA3020290A patent/CA3020290A1/en active Pending
- 2009-06-25 KR KR1020117001961A patent/KR102013220B1/ko active Protection Beyond IP Right Term
- 2009-06-25 SI SI200932061T patent/SI3216803T1/sl unknown
-
2010
- 2010-11-30 ZA ZA2010/08594A patent/ZA201008594B/en unknown
- 2010-12-23 CL CL2010001544A patent/CL2010001544A1/es unknown
-
2011
- 2011-05-19 HK HK11104959.8A patent/HK1150844A1/zh unknown
-
2012
- 2012-12-07 US US13/708,575 patent/US9090684B2/en active Active
-
2013
- 2013-07-19 RU RU2013133802/10A patent/RU2013133802A/ru not_active Application Discontinuation
-
2014
- 2014-04-21 JP JP2014087194A patent/JP6100199B2/ja active Active
-
2015
- 2015-02-27 JP JP2015037794A patent/JP2015134792A/ja active Pending
- 2015-06-16 US US14/741,430 patent/US9873737B2/en active Active
- 2015-07-20 PH PH12015501593A patent/PH12015501593A1/en unknown
-
2016
- 2016-05-18 RU RU2016119152A patent/RU2648152C2/ru active
- 2016-12-28 JP JP2016255720A patent/JP6527128B2/ja active Active
-
2017
- 2017-04-12 CY CY20171100436T patent/CY1118829T1/el unknown
- 2017-04-18 HR HRP20170615TT patent/HRP20170615T1/hr unknown
- 2017-11-16 US US15/814,784 patent/US10590193B2/en active Active
-
2018
- 2018-02-05 JP JP2018018375A patent/JP6821612B2/ja active Active
- 2018-02-16 RU RU2018105866A patent/RU2696972C1/ru active
-
2019
- 2019-05-13 JP JP2019090735A patent/JP6978468B2/ja active Active
- 2019-06-27 RU RU2019120079A patent/RU2747735C3/ru active
-
2020
- 2020-01-31 US US16/779,028 patent/US20200172608A1/en not_active Abandoned
- 2020-05-19 HR HRP20200814TT patent/HRP20200814T1/hr unknown
- 2020-06-05 CY CY20201100507T patent/CY1123028T1/el unknown
- 2020-07-23 LT LTPA2020004C patent/LTC2307454I2/lt unknown
- 2020-07-27 HU HUS2000028C patent/HUS2000028I1/hu unknown
- 2020-07-28 NL NL301058C patent/NL301058I2/nl unknown
- 2020-07-30 CY CY2020026C patent/CY2020026I1/el unknown
- 2020-08-04 NO NO2020021C patent/NO2020021I1/no unknown
-
2021
- 2021-11-11 JP JP2021184262A patent/JP7171877B6/ja active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003527334A (ja) * | 1999-10-22 | 2003-09-16 | ルードヴィッヒ インスティテュート フォー キャンサー リサーチ | A33抗原特異的免疫グロブリン産物を用いるa33抗原を発現する癌の影響を低減する方法 |
| JP2007520991A (ja) * | 2003-08-07 | 2007-08-02 | エピトミクス インコーポレーティッド | ウサギ単クローン抗体をヒト型化する方法 |
| JP2008518619A (ja) * | 2004-11-08 | 2008-06-05 | エピトミクス インコーポレーティッド | 抗体エンジニアリングのための方法 |
Non-Patent Citations (7)
| Title |
|---|
| AM. J. CLIN. PATHOL., vol. 124, JPN6014000188, 2005, pages 295 - 302, ISSN: 0004905045 * |
| ANGLE ORTHOD., 2005, 75(5), PP.797-804, JPN6014000182, ISSN: 0004905042 * |
| BIOCHEM. BIOPHYS. RES. COMMUN., 2001, 281(2), PP.562-568, JPN6014000179, ISSN: 0004905041 * |
| J. BIOL. CHEM., 2000, 275(18), PP.13668-13676, JPN6014000187, ISSN: 0004905044 * |
| J. BIOL. CHEM., 2000, 275(46), PP.36073-36078, JPN6014000185, ISSN: 0004905043 * |
| J. CANCER RES. CLIN. ONCOL., 1998, 124(11), PP.615-620, JPN6014000178, ISSN: 0004905040 * |
| J. VET. DIAGN. INVEST., vol. 17, JPN6014000189, 2005, pages 346 - 350, ISSN: 0004905046 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6978468B2 (ja) | Vegfを阻害する安定かつ可溶性の抗体 | |
| RU2588467C2 (ru) | Стабильные и растворимые антитела, ингибирующие vegf | |
| AU2015203705B2 (en) | Stable and soluble antibodies inhibiting vegf |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211122 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211122 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20221025 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221102 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7171877 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |