JP2010275365A - Curable composition and cured product thereof - Google Patents
Curable composition and cured product thereof Download PDFInfo
- Publication number
- JP2010275365A JP2010275365A JP2009126825A JP2009126825A JP2010275365A JP 2010275365 A JP2010275365 A JP 2010275365A JP 2009126825 A JP2009126825 A JP 2009126825A JP 2009126825 A JP2009126825 A JP 2009126825A JP 2010275365 A JP2010275365 A JP 2010275365A
- Authority
- JP
- Japan
- Prior art keywords
- component
- isocyanurate
- diallyl
- carbon
- molecule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 63
- ZFSLODLOARCGLH-UHFFFAOYSA-N isocyanuric acid Chemical group OC1=NC(O)=NC(O)=N1 ZFSLODLOARCGLH-UHFFFAOYSA-N 0.000 claims abstract description 57
- 239000011203 carbon fibre reinforced carbon Substances 0.000 claims abstract description 53
- 150000002894 organic compounds Chemical class 0.000 claims abstract description 29
- 239000003054 catalyst Substances 0.000 claims abstract description 21
- 230000009257 reactivity Effects 0.000 claims abstract description 21
- 150000003377 silicon compounds Chemical class 0.000 claims abstract description 16
- 239000007795 chemical reaction product Substances 0.000 claims abstract description 12
- 238000006459 hydrosilylation reaction Methods 0.000 claims abstract description 12
- 150000007973 cyanuric acids Chemical class 0.000 claims abstract description 5
- PYGSKMBEVAICCR-UHFFFAOYSA-N hexa-1,5-diene Chemical group C=CCCC=C PYGSKMBEVAICCR-UHFFFAOYSA-N 0.000 claims description 40
- 239000000463 material Substances 0.000 claims description 20
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 17
- KOMNUTZXSVSERR-UHFFFAOYSA-N 1,3,5-tris(prop-2-enyl)-1,3,5-triazinane-2,4,6-trione Chemical compound C=CCN1C(=O)N(CC=C)C(=O)N(CC=C)C1=O KOMNUTZXSVSERR-UHFFFAOYSA-N 0.000 claims description 16
- UCBVELLBUAKUNE-UHFFFAOYSA-N 1,3-bis(prop-2-enyl)-1,3,5-triazinane-2,4,6-trione Chemical compound C=CCN1C(=O)NC(=O)N(CC=C)C1=O UCBVELLBUAKUNE-UHFFFAOYSA-N 0.000 claims description 16
- MYRTYDVEIRVNKP-UHFFFAOYSA-N 1,2-Divinylbenzene Chemical compound C=CC1=CC=CC=C1C=C MYRTYDVEIRVNKP-UHFFFAOYSA-N 0.000 claims description 8
- KTRQRAQRHBLCSQ-UHFFFAOYSA-N 1,2,4-tris(ethenyl)cyclohexane Chemical compound C=CC1CCC(C=C)C(C=C)C1 KTRQRAQRHBLCSQ-UHFFFAOYSA-N 0.000 claims description 7
- MPJPKEMZYOAIRN-UHFFFAOYSA-N 1,3,5-tris(2-methylprop-2-enyl)-1,3,5-triazinane-2,4,6-trione Chemical compound CC(=C)CN1C(=O)N(CC(C)=C)C(=O)N(CC(C)=C)C1=O MPJPKEMZYOAIRN-UHFFFAOYSA-N 0.000 claims description 6
- 125000004432 carbon atom Chemical group C* 0.000 claims description 6
- 125000000962 organic group Chemical group 0.000 claims description 6
- YIJYFLXQHDOQGW-UHFFFAOYSA-N 2-[2,4,6-trioxo-3,5-bis(2-prop-2-enoyloxyethyl)-1,3,5-triazinan-1-yl]ethyl prop-2-enoate Chemical compound C=CC(=O)OCCN1C(=O)N(CCOC(=O)C=C)C(=O)N(CCOC(=O)C=C)C1=O YIJYFLXQHDOQGW-UHFFFAOYSA-N 0.000 claims description 5
- VPWNQTHUCYMVMZ-UHFFFAOYSA-N 4,4'-sulfonyldiphenol Chemical compound C1=CC(O)=CC=C1S(=O)(=O)C1=CC=C(O)C=C1 VPWNQTHUCYMVMZ-UHFFFAOYSA-N 0.000 claims description 5
- IYSVFZBXZVPIFA-UHFFFAOYSA-N 1-ethenyl-4-(4-ethenylphenyl)benzene Chemical group C1=CC(C=C)=CC=C1C1=CC=C(C=C)C=C1 IYSVFZBXZVPIFA-UHFFFAOYSA-N 0.000 claims description 4
- SCZZNWQQCGSWSZ-UHFFFAOYSA-N 1-prop-2-enoxy-4-[2-(4-prop-2-enoxyphenyl)propan-2-yl]benzene Chemical compound C=1C=C(OCC=C)C=CC=1C(C)(C)C1=CC=C(OCC=C)C=C1 SCZZNWQQCGSWSZ-UHFFFAOYSA-N 0.000 claims description 4
- ATVJXMYDOSMEPO-UHFFFAOYSA-N 3-prop-2-enoxyprop-1-ene Chemical compound C=CCOCC=C ATVJXMYDOSMEPO-UHFFFAOYSA-N 0.000 claims description 4
- JQRRFDWXQOQICD-UHFFFAOYSA-N biphenylen-1-ylboronic acid Chemical compound C12=CC=CC=C2C2=C1C=CC=C2B(O)O JQRRFDWXQOQICD-UHFFFAOYSA-N 0.000 claims description 4
- SJYNFBVQFBRSIB-UHFFFAOYSA-N norbornadiene Chemical compound C1=CC2C=CC1C2 SJYNFBVQFBRSIB-UHFFFAOYSA-N 0.000 claims description 4
- SDRZFSPCVYEJTP-UHFFFAOYSA-N 1-ethenylcyclohexene Chemical compound C=CC1=CCCCC1 SDRZFSPCVYEJTP-UHFFFAOYSA-N 0.000 claims description 3
- JFNLZVQOOSMTJK-KNVOCYPGSA-N norbornene Chemical compound C1[C@@H]2CC[C@H]1C=C2 JFNLZVQOOSMTJK-KNVOCYPGSA-N 0.000 claims description 3
- 239000000047 product Substances 0.000 abstract description 24
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 54
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 40
- 150000001875 compounds Chemical class 0.000 description 36
- 238000006243 chemical reaction Methods 0.000 description 25
- -1 polysiloxane Polymers 0.000 description 21
- WZJUBBHODHNQPW-UHFFFAOYSA-N 2,4,6,8-tetramethyl-1,3,5,7,2$l^{3},4$l^{3},6$l^{3},8$l^{3}-tetraoxatetrasilocane Chemical compound C[Si]1O[Si](C)O[Si](C)O[Si](C)O1 WZJUBBHODHNQPW-UHFFFAOYSA-N 0.000 description 19
- 238000003786 synthesis reaction Methods 0.000 description 19
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 18
- 229910052697 platinum Inorganic materials 0.000 description 18
- 230000015572 biosynthetic process Effects 0.000 description 16
- 238000003860 storage Methods 0.000 description 15
- 238000005160 1H NMR spectroscopy Methods 0.000 description 14
- 239000002904 solvent Substances 0.000 description 12
- 239000010408 film Substances 0.000 description 10
- 238000000034 method Methods 0.000 description 10
- 229910052757 nitrogen Inorganic materials 0.000 description 10
- 239000000853 adhesive Substances 0.000 description 9
- 230000001070 adhesive effect Effects 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 9
- 239000007788 liquid Substances 0.000 description 9
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 8
- 238000001816 cooling Methods 0.000 description 8
- 230000003287 optical effect Effects 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- PAAZPARNPHGIKF-UHFFFAOYSA-N 1,2-dibromoethane Chemical compound BrCCBr PAAZPARNPHGIKF-UHFFFAOYSA-N 0.000 description 7
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 7
- 239000003566 sealing material Substances 0.000 description 7
- 239000008096 xylene Substances 0.000 description 7
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- 239000007789 gas Substances 0.000 description 6
- 238000003760 magnetic stirring Methods 0.000 description 6
- 125000001424 substituent group Chemical group 0.000 description 6
- 239000002253 acid Substances 0.000 description 5
- 125000005336 allyloxy group Chemical group 0.000 description 5
- 238000000576 coating method Methods 0.000 description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 5
- 229920001296 polysiloxane Polymers 0.000 description 5
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 230000003197 catalytic effect Effects 0.000 description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 4
- 239000011259 mixed solution Substances 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 238000000465 moulding Methods 0.000 description 4
- 229920005989 resin Polymers 0.000 description 4
- 239000011347 resin Substances 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- 239000004215 Carbon black (E152) Substances 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 239000002518 antifoaming agent Substances 0.000 description 3
- ZUMQLFHCCNIEAO-UHFFFAOYSA-N bis(ethenyl)-silyloxysilane platinum Chemical compound [Pt].[SiH3]O[SiH](C=C)C=C ZUMQLFHCCNIEAO-UHFFFAOYSA-N 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 239000002994 raw material Substances 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical group NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 230000004075 alteration Effects 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 238000005266 casting Methods 0.000 description 2
- 238000004040 coloring Methods 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- YSEKNCXYRGKTBJ-UHFFFAOYSA-N dimethyl 2-hydroxybutanedioate Chemical compound COC(=O)CC(O)C(=O)OC YSEKNCXYRGKTBJ-UHFFFAOYSA-N 0.000 description 2
- 239000003063 flame retardant Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000011261 inert gas Substances 0.000 description 2
- 239000011810 insulating material Substances 0.000 description 2
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 150000001451 organic peroxides Chemical class 0.000 description 2
- 229920000620 organic polymer Polymers 0.000 description 2
- 150000002898 organic sulfur compounds Chemical class 0.000 description 2
- 150000002903 organophosphorus compounds Chemical class 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 150000003058 platinum compounds Chemical class 0.000 description 2
- 238000005498 polishing Methods 0.000 description 2
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920001721 polyimide Polymers 0.000 description 2
- 238000003825 pressing Methods 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 229920001187 thermosetting polymer Polymers 0.000 description 2
- 230000008719 thickening Effects 0.000 description 2
- 238000011282 treatment Methods 0.000 description 2
- APQIUTYORBAGEZ-UHFFFAOYSA-N 1,1-dibromoethane Chemical compound CC(Br)Br APQIUTYORBAGEZ-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 1
- QYLFHLNFIHBCPR-UHFFFAOYSA-N 1-ethynylcyclohexan-1-ol Chemical compound C#CC1(O)CCCCC1 QYLFHLNFIHBCPR-UHFFFAOYSA-N 0.000 description 1
- RNFJDJUURJAICM-UHFFFAOYSA-N 2,2,4,4,6,6-hexaphenoxy-1,3,5-triaza-2$l^{5},4$l^{5},6$l^{5}-triphosphacyclohexa-1,3,5-triene Chemical compound N=1P(OC=2C=CC=CC=2)(OC=2C=CC=CC=2)=NP(OC=2C=CC=CC=2)(OC=2C=CC=CC=2)=NP=1(OC=1C=CC=CC=1)OC1=CC=CC=C1 RNFJDJUURJAICM-UHFFFAOYSA-N 0.000 description 1
- XMNIXWIUMCBBBL-UHFFFAOYSA-N 2-(2-phenylpropan-2-ylperoxy)propan-2-ylbenzene Chemical compound C=1C=CC=CC=1C(C)(C)OOC(C)(C)C1=CC=CC=C1 XMNIXWIUMCBBBL-UHFFFAOYSA-N 0.000 description 1
- CEBKHWWANWSNTI-UHFFFAOYSA-N 2-methylbut-3-yn-2-ol Chemical compound CC(C)(O)C#C CEBKHWWANWSNTI-UHFFFAOYSA-N 0.000 description 1
- XKTYXVDYIKIYJP-UHFFFAOYSA-N 3h-dioxole Chemical compound C1OOC=C1 XKTYXVDYIKIYJP-UHFFFAOYSA-N 0.000 description 1
- 239000004342 Benzoyl peroxide Substances 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- 229930185605 Bisphenol Natural products 0.000 description 1
- 0 C*(O[Si](C)(CCCN(C(N(CCC[Si](O[Si+]OC)O[Si+](C)O[S+])C(N1CCCS)=O)O)C1=O)O[S-]O*)O[S+] Chemical compound C*(O[Si](C)(CCCN(C(N(CCC[Si](O[Si+]OC)O[Si+](C)O[S+])C(N1CCCS)=O)O)C1=O)O[S-]O*)O[S+] 0.000 description 1
- SSXFWAIPROYEON-UHFFFAOYSA-M CO[SiH-]O[S+](CCCN(C(N(CC[S-])C(N1C2OCC2)=O)=O)C1=O)O[SiH](C)O[SiH-]C Chemical compound CO[SiH-]O[S+](CCCN(C(N(CC[S-])C(N1C2OCC2)=O)=O)C1=O)O[SiH](C)O[SiH-]C SSXFWAIPROYEON-UHFFFAOYSA-M 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical compound S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 208000030984 MIRAGE syndrome Diseases 0.000 description 1
- 229920003354 Modic® Polymers 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- UIEXFJVOIMVETD-UHFFFAOYSA-N P([O-])([O-])[O-].[Pt+3] Chemical compound P([O-])([O-])[O-].[Pt+3] UIEXFJVOIMVETD-UHFFFAOYSA-N 0.000 description 1
- 101150003085 Pdcl gene Proteins 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical group NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 229920006397 acrylic thermoplastic Polymers 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 150000003973 alkyl amines Chemical group 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- PEEDYJQEMCKDDX-UHFFFAOYSA-N antimony bismuth Chemical compound [Sb].[Bi] PEEDYJQEMCKDDX-UHFFFAOYSA-N 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000002216 antistatic agent Substances 0.000 description 1
- 150000004982 aromatic amines Chemical group 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- 239000004202 carbamide Chemical group 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- LDKSTCHEYCNPDS-UHFFFAOYSA-L carbon monoxide;dichloroplatinum Chemical compound O=C=[Pt](Cl)(Cl)=C=O LDKSTCHEYCNPDS-UHFFFAOYSA-L 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000006837 decompression Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- LSXWFXONGKSEMY-UHFFFAOYSA-N di-tert-butyl peroxide Chemical compound CC(C)(C)OOC(C)(C)C LSXWFXONGKSEMY-UHFFFAOYSA-N 0.000 description 1
- AFZSMODLJJCVPP-UHFFFAOYSA-N dibenzothiazol-2-yl disulfide Chemical compound C1=CC=C2SC(SSC=3SC4=CC=CC=C4N=3)=NC2=C1 AFZSMODLJJCVPP-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 1
- 239000012769 display material Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000004210 ether based solvent Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- SLGWESQGEUXWJQ-UHFFFAOYSA-N formaldehyde;phenol Chemical compound O=C.OC1=CC=CC=C1 SLGWESQGEUXWJQ-UHFFFAOYSA-N 0.000 description 1
- 230000017525 heat dissipation Effects 0.000 description 1
- 239000012760 heat stabilizer Substances 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 229910000037 hydrogen sulfide Inorganic materials 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000011229 interlayer Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 239000005453 ketone based solvent Substances 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000006078 metal deactivator Substances 0.000 description 1
- 125000005641 methacryl group Chemical group 0.000 description 1
- 125000005394 methallyl group Chemical group 0.000 description 1
- CKFGINPQOCXMAZ-UHFFFAOYSA-N methanediol Chemical compound OCO CKFGINPQOCXMAZ-UHFFFAOYSA-N 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 239000006082 mold release agent Substances 0.000 description 1
- 239000012778 molding material Substances 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000002667 nucleating agent Substances 0.000 description 1
- 239000013307 optical fiber Substances 0.000 description 1
- 239000012788 optical film Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 229920001568 phenolic resin Polymers 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- PKELYQZIUROQSI-UHFFFAOYSA-N phosphane;platinum Chemical class P.[Pt] PKELYQZIUROQSI-UHFFFAOYSA-N 0.000 description 1
- 150000004980 phosphorus peroxides Chemical class 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920001230 polyarylate Polymers 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920006289 polycarbonate film Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 238000004382 potting Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- TVLSRXXIMLFWEO-UHFFFAOYSA-N prochloraz Chemical compound C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl TVLSRXXIMLFWEO-UHFFFAOYSA-N 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229920002379 silicone rubber Polymers 0.000 description 1
- 239000004945 silicone rubber Substances 0.000 description 1
- 229910000679 solder Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 150000003464 sulfur compounds Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- GJBRNHKUVLOCEB-UHFFFAOYSA-N tert-butyl benzenecarboperoxoate Chemical compound CC(C)(C)OOC(=O)C1=CC=CC=C1 GJBRNHKUVLOCEB-UHFFFAOYSA-N 0.000 description 1
- ISXSCDLOGDJUNJ-UHFFFAOYSA-N tert-butyl prop-2-enoate Chemical compound CC(C)(C)OC(=O)C=C ISXSCDLOGDJUNJ-UHFFFAOYSA-N 0.000 description 1
- 229920005992 thermoplastic resin Polymers 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 150000003606 tin compounds Chemical class 0.000 description 1
- 238000001721 transfer moulding Methods 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Landscapes
- Compositions Of Macromolecular Compounds (AREA)
Abstract
Description
本発明はイソシアヌル酸誘導体を含有する硬化性組成物とその硬化物に関するものである。 The present invention relates to a curable composition containing an isocyanuric acid derivative and a cured product thereof.
従来、炭素−炭素二重結合を含有する化合物と、SiH基を含有する化合物と、ヒドロシリル化触媒とからなる硬化性組成物が提案されている。例えば特許文献1では、トリアリルイソシアヌレートとトリアリルイソシアヌレートに当量以上のSiH基含有ポリシロキサンを反応させたSiH基含有化合物とを用いた硬化性組成物が提案されている。また、特許文献2では、SiH基含有ポリシロキサンに当量以上の炭素−炭素二重結合を含有する化合物を反応させた有機化合物とSiH基を含有する化合物とを用いた硬化性組成物が提案されている。 Conventionally, a curable composition comprising a compound containing a carbon-carbon double bond, a compound containing a SiH group, and a hydrosilylation catalyst has been proposed. For example, Patent Document 1 proposes a curable composition using triallyl isocyanurate and a SiH group-containing compound obtained by reacting triallyl isocyanurate with an equivalent or more SiH group-containing polysiloxane. Patent Document 2 proposes a curable composition using an organic compound obtained by reacting a SiH group-containing polysiloxane with a compound containing an equivalent or more carbon-carbon double bond and a compound containing a SiH group. ing.
しかしながら、特許文献1の組成物は、硬化時の硬化収縮の抑制の点においてまだ改善の余地がある。また、特許文献2の組成物は、使用する炭素−炭素二重結合を含有する化合物とSiH基含有化合物の組み合わせによっては硬化物の耐熱性が低くなることがあった。 However, the composition of Patent Document 1 still has room for improvement in terms of suppressing curing shrinkage during curing. Moreover, the composition of patent document 2 may become low in the heat resistance of hardened | cured material depending on the combination of the compound containing the carbon-carbon double bond and SiH group containing compound to be used.
本発明は耐熱性が良好で、硬化収縮の小さい硬化物を与え得る硬化性組成物およびその硬化物を提供する。 The present invention provides a curable composition that has good heat resistance and can give a cured product with small cure shrinkage, and a cured product thereof.
上記事情に鑑み、本発明者らが鋭意検討を重ねたところ、特定の構造を有するイソシアヌル酸誘導体とSiH含有化合物との共重合体を炭素−炭素二重結合を含有する化合物として用いると耐熱性に優れた硬化物が得られ、また、硬化収縮が低減されることを見出し、本発明を完成するに至った。すなわち、本発明は、以下の構成を有するものである。 In view of the above circumstances, the present inventors have made extensive studies, and as a result, when a copolymer of an isocyanuric acid derivative having a specific structure and a SiH-containing compound is used as a compound containing a carbon-carbon double bond, heat resistance is obtained. The present invention was completed by finding that a cured product excellent in the above was obtained, and that curing shrinkage was reduced. That is, the present invention has the following configuration.
1).
(A)ヒドロシリル化触媒、(B)SiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸誘導体、(C)1分子中に少なくとも2個のSiH基を含有するケイ素化合物、を必須成分としてなる硬化性組成物であって、
(B)成分がSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸骨格からなる有機化合物(B1)と1分子中に少なくとも2個のSiH基を含有するケイ素化合物(B2)との反応物であり、
(C)成分がSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも1個含有する有機化合物(C1)と1分子中に少なくとも2個のSiH基を含有するケイ素化合物(C2)との反応物であることを特徴とする硬化性組成物。
1).
(A) hydrosilylation catalyst, (B) isocyanuric acid derivative containing at least two carbon-carbon double bonds reactive with SiH group in one molecule, (C) at least two SiH groups in one molecule A curable composition comprising, as an essential component, a silicon compound containing
(B) the component is an organic compound (B1) comprising an isocyanuric acid skeleton containing at least two carbon-carbon double bonds reactive with SiH groups in one molecule, and at least two SiH groups in one molecule. It is a reaction product with the contained silicon compound (B2),
The component (C) is an organic compound (C1) containing at least one carbon-carbon double bond reactive with SiH groups in one molecule and a silicon compound containing at least two SiH groups in one molecule ( A curable composition, which is a reaction product with C2).
2).
上記(B1)成分がトリアリルイソシアヌレート、トリメタリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレート、トリス(2−アクリロイルオキシエチル)イソシアヌレートの少なくとも一種であることを特徴とする1)に記載の硬化性組成物。
2).
The component (B1) is at least one of triallyl isocyanurate, trimethallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl monophenyl isocyanurate, tris (2-acryloyloxyethyl) isocyanurate 1) The curable composition as described in 1) above.
3).
上記(B1)成分がジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレートの少なくとも一種であることを特徴とする1)に記載の硬化性組成物。
3).
The curable composition according to 1), wherein the component (B1) is at least one of diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, and diallyl monophenyl isocyanurate.
4).
上記(B2)成分が下記一般式(I)
4).
The component (B2) is represented by the following general formula (I)
(式中、R0は炭素数1〜6の有機基を表し、nは3〜10の数を表す。)で表されることを特徴とする1)乃至3)のいずれか一に記載の硬化性組成物。 (In the formula, R 0 represents an organic group having 1 to 6 carbon atoms, and n represents a number of 3 to 10). Curable composition.
5).
上記(C1)成分がSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有する有機化合物であることを特徴とする1)乃至4)のいずれか一に記載の硬化性組成物。
5).
The component (C1) is an organic compound containing at least two carbon-carbon double bonds having reactivity with a SiH group in one molecule, according to any one of 1) to 4), Curable composition.
6).
上記(C1)成分がSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸骨格からなる有機化合物であることを特徴とする1)乃至4)のいずれか一に記載の硬化性組成物。
6).
Any of 1) to 4), wherein the component (C1) is an organic compound having an isocyanuric acid skeleton containing at least two carbon-carbon double bonds having reactivity with SiH groups in one molecule. The curable composition as described in any one.
7).
上記(C1)成分がトリアリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、1,2,4−トリビニルシクロヘキサン、ビニルシクロヘキセン、ジビニルベンゼン、ジビニルビフェニル、トリメチロールプロパンジアリルエーテル、ビスフェノールAジアリルエーテル、ビスフェノールSジアリルエーテル、ノルボルネン、ノルボルナジエン、モノアリルジグリシジルイソシアヌレートの少なくとも一種であることを特徴とする1)乃至4)のいずれか一に記載の硬化性組成物。
7).
The component (C1) is triallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate, 1,2,4-trivinylcyclohexane, vinylcyclohexene, divinylbenzene, divinylbiphenyl, trimethylolpropane diallyl ether, bisphenol A diallyl ether The curable composition according to any one of 1) to 4), which is at least one of bisphenol S diallyl ether, norbornene, norbornadiene, and monoallyl diglycidyl isocyanurate.
8).
上記(C2)成分が1,3,5,7−テトラメチルテトラシクロシロキサンであることを特徴とする1)乃至4)のいずれか一に記載の硬化性組成物。
8).
The curable composition according to any one of 1) to 4), wherein the component (C2) is 1,3,5,7-tetramethyltetracyclosiloxane.
9).
1)乃至8)のいずれか一に記載の硬化性組成物を硬化させてなる硬化物。
9).
Hardened | cured material formed by hardening | curing the curable composition as described in any one of 1) thru | or 8).
この発明により、耐熱性に優れた硬化物が得られる。また、硬化収縮が低減される。
According to the present invention, a cured product having excellent heat resistance can be obtained. Also, cure shrinkage is reduced.
以下、本発明を詳細に説明する。 Hereinafter, the present invention will be described in detail.
まず、本発明における(A)成分であるヒドロシリル化触媒について説明する。 First, the hydrosilylation catalyst which is the component (A) in the present invention will be described.
成分(A)のヒドロシリル化触媒としては、ヒドロシリル化反応の触媒活性があれば特に限定されないが、例えば、白金の単体;アルミナ、シリカ、カーボンブラック等の担体に固体白金を担持させたもの;塩化白金酸;塩化白金酸とアルコール、アルデヒド、ケトン等との錯体;白金−オレフィン錯体(例えば、Pt(CH2=CH2)2(PPh3)2、Pt(CH2=CH2)2Cl2);白金−ビニルシロキサン錯体(例えば、Pt(ViMe2SiOSiMe2Vi)a、Pt[(MeViSiO)4]b);白金−ホスフィン錯体(例えば、Pt(PPh3)4、Pt(PBu3)4);白金−ホスファイト錯体(例えば、Pt[P(OPh)3]4、Pt[P(OBu)3]4)(式中、Meはメチル基、Buはブチル基、Viはビニル基、Phはフェニル基を表し、a、bは、整数を示す。);ジカルボニルジクロロ白金;カールシュテト(Karstedt)触媒;白金−炭化水素複合体(例えばアシュビー(Ashby)の米国特許第3159601号及び第3159662号明細書中に記載された白金−炭化水素複合体);白金アルコラート触媒(例えばラモロー(Lamoreaux)の米国特許第3220972号明細書中に記載された白金アルコラート触媒)等が挙げられる。 The hydrosilylation catalyst of component (A) is not particularly limited as long as it has catalytic activity for the hydrosilylation reaction. For example, platinum alone; solid platinum supported on a carrier such as alumina, silica, carbon black; Platinum acid; complex of chloroplatinic acid and alcohol, aldehyde, ketone, etc .; platinum-olefin complex (for example, Pt (CH 2 ═CH 2 ) 2 (PPh 3 ) 2 , Pt (CH 2 ═CH 2 ) 2 Cl 2 ); Platinum-vinylsiloxane complexes (eg, Pt (ViMe 2 SiOSiMe 2 Vi) a , Pt [(MeViSiO) 4 ] b ); platinum-phosphine complexes (eg, Pt (PPh 3 ) 4 , Pt (PBu 3 ) 4 ); platinum - phosphite complex (e.g., Pt [P (OPh) 3 ] 4, Pt [P (OBu) 3] 4) ( in the formula, Me represents a methyl group, Bu a butyl group, V Represents a vinyl group, Ph represents a phenyl group, and a and b represent integers.); Dicarbonyldichloroplatinum; Karstedt catalyst; Platinum-hydrocarbon complex (eg, Ashby US Pat. No. 3,159,601) And platinum-hydrocarbon complexes described in US Pat. No. 3,159,662); platinum alcoholate catalysts (eg, platinum alcoholate catalysts described in Lamoreaux US Pat. No. 3,220,972), and the like. .
さらに、塩化白金−オレフィン複合体(例えばモディック(Modic)の米国特許第3516946号明細書中に記載された塩化白金−オレフィン複合体)も本発明において有用である。 In addition, platinum chloride-olefin complexes (eg, the platinum chloride-olefin complexes described in Modic US Pat. No. 3,516,946) are also useful in the present invention.
また、白金化合物以外の触媒の例としては、RhCl(PPh)3、RhCl3、RhAl2O3、RuCl3、IrCl3、FeCl3、AlCl3、PdCl2・2H2O、NiCl2、TiCl4等が挙げられる。 Examples of catalysts other than platinum compounds include RhCl (PPh) 3 , RhCl 3 , RhAl 2 O 3 , RuCl 3 , IrCl 3 , FeCl 3 , AlCl 3 , PdCl 2 .2H 2 O, NiCl 2 , TiCl 4. Etc.
これらの中では、触媒活性の点から、塩化白金酸、白金−オレフィン錯体、白金−ビニルシロキサン錯体等が好ましい。また、これらの触媒は単独で使用してもよく、2種以上併用してもよい。 Of these, chloroplatinic acid, platinum-olefin complexes, platinum-vinylsiloxane complexes and the like are preferable from the viewpoint of catalytic activity. Moreover, these catalysts may be used independently and may be used together 2 or more types.
成分(A)の添加量は特に限定されないが、十分な硬化性を有し、かつ硬化性組成物のコストを比較的低く抑えるため好ましい添加量の下限は、成分(C)のSiH基1モルに対して10-8モル、より好ましくは10-6モルであり、好ましい添加量の上限は成分(C)のSiH基1モルに対して10-1モル、より好ましくは10-2モルである。 The amount of the component (A) added is not particularly limited, but the lower limit of the preferred amount added is 1 mol of SiH groups in the component (C) in order to have sufficient curability and keep the cost of the curable composition relatively low. 10 -8 mol relative to, more preferably 10 -6 mole, preferable amount of the upper limit is 10 -1 moles per mole of the SiH group in component (C), more preferably 10 -2 mol .
また、上記触媒には助触媒を併用することが可能である。助触媒としては、例えば、単体の硫黄等の硫黄系化合物、トリエチルアミン等のアミン系化合物等が挙げられる。 In addition, a cocatalyst can be used in combination with the catalyst. Examples of the cocatalyst include a sulfur-based compound such as simple sulfur, and an amine-based compound such as triethylamine.
助触媒の添加量は特に限定されないが、上記ヒドロシリル化触媒1モルに対して、下限10-2モル、上限102モルの範囲が好ましく、より好ましくは下限10-1モル、上限10モルの範囲である。 The amount of the cocatalyst added is not particularly limited, but the lower limit is preferably 10 -2 mol and the upper limit is 10 2 mol, more preferably the lower limit is 10 -1 mol and the upper limit is 10 mol, relative to 1 mol of the hydrosilylation catalyst. It is.
次に(B)成分について説明する。 Next, the component (B) will be described.
(B)成分はSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸骨格からなる有機化合物(B1)と1分子中に少なくとも2個のSiH基を含有するケイ素化合物(B2)との反応物である。 The component (B) comprises an organic compound (B1) composed of an isocyanuric acid skeleton containing at least two carbon-carbon double bonds reactive with SiH groups in one molecule and at least two SiH groups in one molecule. It is a reaction product with the contained silicon compound (B2).
以下、SiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸骨格からなる有機化合物(B1)について説明する。 Hereinafter, the organic compound (B1) composed of an isocyanuric acid skeleton containing at least two carbon-carbon double bonds having reactivity with the SiH group in one molecule will be described.
本発明においては(B1)成分として下記一般式(II)で表されるイソシアヌル酸骨格を有するものを用いることができる。 In the present invention, the component (B1) having an isocyanuric acid skeleton represented by the following general formula (II) can be used.
(式中R1は炭素数1〜50の一価の有機基を表し、それぞれのR1は異なっていても同一であってもよい。)イソシアヌル酸骨格を有することにより、硬化物の耐熱性が向上する。具体的な例としては、トリアリルイソシアヌレート、トリメタリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレート、トリス(2−アクリロイルオキシエチル)イソシアヌレートなどが挙げられる。 (In the formula, R 1 represents a monovalent organic group having 1 to 50 carbon atoms, and each R 1 may be different or the same.) By having an isocyanuric acid skeleton, the heat resistance of the cured product Will improve. Specific examples include triallyl isocyanurate, trimethallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl monophenyl isocyanurate, tris (2-acryloyloxyethyl) isocyanurate and the like. Can be mentioned.
(B1)成分の炭素−炭素二重結合としてはSiH基と反応性を有するものであれば特に制限されないが、下記一般式(III)で示される炭素−炭素二重結合が反応性の点から好適である。 The carbon-carbon double bond of the component (B1) is not particularly limited as long as it has reactivity with the SiH group, but the carbon-carbon double bond represented by the following general formula (III) is reactive. Is preferred.
(式中R2は水素原子あるいはメチル基を表す。)また、原料の入手の容易さからは、R2は水素原子であることがより好ましい。
硬化物の耐熱性が高いという点からは一般式(IV)が好適である。
(Wherein R 2 is. Represents a hydrogen atom or a methyl group) In addition, from the easy availability of the raw material, more preferably R 2 is hydrogen atom.
General formula (IV) is suitable from the point that the heat resistance of hardened | cured material is high.
(式中R3は水素原子あるいはメチル基を表し、それぞれのR3は異なっていても同一であってもよい。)
また、原料の入手の容易さからは、R3は水素原子であることがより好ましい。
炭素−炭素二重結合は置換基を介して(B1)成分の骨格部分に共有結合していても良く、置換基としては、構成元素としてC、H、N、O、S、ハロゲンから選ばれる原子のみを含むものが好ましい。置換基の例としては、次のものが挙げられる。
(In the formula, R 3 represents a hydrogen atom or a methyl group, and each R 3 may be different or the same.)
Further, from the material availability viewpoint, it is more preferred R 3 is a hydrogen atom.
The carbon-carbon double bond may be covalently bonded to the skeleton of the component (B1) via a substituent, and the substituent is selected from C, H, N, O, S and halogen as constituent elements. Those containing only atoms are preferred. The following are mentioned as an example of a substituent.
また、これらの置換基の2つ以上が共有結合によりつながって置換基を構成していてもよい。 Two or more of these substituents may be connected by a covalent bond to form a substituent.
以上のような骨格部分に共有結合する基の例としては、ビニル基、アリル基、メタリル基、アクリル基、メタクリル基、2−ヒドロキシ−3−(アリルオキシ)プロピル基、2−アリルフェニル基、3−アリルフェニル基、4−アリルフェニル基、2−(アリルオキシ)フェニル基、3−(アリルオキシ)フェニル基、4−(アリルオキシ)フェニル基、2−(アリルオキシ)エチル基、2、2−ビス(アリルオキシメチル)ブチル基、3−アリルオキシ−2、2−ビス(アリルオキシメチル)プロピル基、下記に示すものが挙げられる。 Examples of the group covalently bonded to the skeleton as described above include vinyl group, allyl group, methallyl group, acrylic group, methacryl group, 2-hydroxy-3- (allyloxy) propyl group, 2-allylphenyl group, 3 -Allylphenyl group, 4-allylphenyl group, 2- (allyloxy) phenyl group, 3- (allyloxy) phenyl group, 4- (allyloxy) phenyl group, 2- (allyloxy) ethyl group, 2,2-bis (allyl) Examples include oxymethyl) butyl group, 3-allyloxy-2, 2-bis (allyloxymethyl) propyl group, and those shown below.
上記した(B1)成分としては、耐熱性をより向上し得るという観点から、SiH基と反応性を有する炭素−炭素二重結合を(B1)成分1gあたり0.001mol以上含有するものが好ましく、さらに、1gあたり0.005mol以上含有するものが好ましく、0.007mol以上含有するものが特に好ましい。 The component (B1) described above preferably contains 0.001 mol or more of a carbon-carbon double bond having reactivity with the SiH group per 1 g of the component (B1), from the viewpoint that heat resistance can be further improved. Furthermore, what contains 0.005 mol or more per 1g is preferable, and what contains 0.007 mol or more is especially preferable.
また、(B1)成分としては、複屈折率が低い、光弾性係数が低いという観点からは、芳香環の(B1)成分中の成分重量比が50wt%以下であるものが好ましく、40wt%以下のものがより好ましく、30%以下のものがさらに好ましい。最も好ましいのは芳香環を含まないものである。 Further, as the component (B1), from the viewpoint that the birefringence is low and the photoelastic coefficient is low, the component weight ratio in the component (B1) of the aromatic ring is preferably 50 wt% or less, and 40 wt% or less. Are more preferable, and those of 30% or less are more preferable. Most preferred are those that do not contain an aromatic ring.
(B1)成分のSiH基と反応性を有する炭素−炭素二重結合の数は、平均して1分子当たり少なくとも2個あればよいが、耐熱性をより向上し得るという観点から、2を越えることが好ましく、3個以上であることがより好ましい。 The number of carbon-carbon double bonds having reactivity with the SiH group of the component (B1) may be at least 2 on average per molecule, but it exceeds 2 from the viewpoint that heat resistance can be further improved. It is preferable that the number is 3 or more.
(B1)成分のSiH基と反応性を有する炭素−炭素二重結合の数は、屈折率をより向上し得るという観点からは2個であることがより好ましい。具体的な例としては、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレートなどが挙げられる。 The number of carbon-carbon double bonds having reactivity with the SiH group of the component (B1) is more preferably 2 from the viewpoint that the refractive index can be further improved. Specific examples include diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl monophenyl isocyanurate, and the like.
(B1)成分としては、他の成分との均一な混合、および良好な作業性を得るためには100℃以下の温度において流動性があるものが好ましく、線状でも枝分かれ状でもよく、分子量は特に制約はないが、50〜100,000の任意のものが好適に使用できる。分子量が100、000以上では一般に原料が高粘度となり作業性に劣るとともに、炭素−炭素二重結合とSiH基との反応による架橋の効果が発現し難い。 The component (B1) preferably has fluidity at a temperature of 100 ° C. or lower in order to obtain uniform mixing with other components and good workability, and may be linear or branched. Although there is no restriction | limiting in particular, Arbitrary things of 50-100,000 can be used conveniently. When the molecular weight is 100,000 or more, the raw material generally has a high viscosity and is inferior in workability, and the effect of crosslinking due to the reaction between the carbon-carbon double bond and the SiH group is hardly exhibited.
次に、(B)成分のもう一方の反応物である1分子中に少なくとも2個のSiH基を含有するケイ素化合物(B2)成分について説明する。 Next, the silicon compound (B2) component containing at least two SiH groups in one molecule as the other reactant of the component (B) will be described.
(B2)については1分子中に少なくとも2個のSiH基を有するケイ素化合物であればよく、例えば国際公開WO96/15194に記載される化合物で、1分子中に少なくとも2個のSiH基を有するもの等が使用でき、耐酸化劣化性の観点から、1分子中に少なくとも2個のSiH基を有する、鎖状、環状、分岐状またはかご型のポリオルガノシロキサン(B2)が好適である。 (B2) may be any silicon compound having at least two SiH groups in one molecule, for example, a compound described in International Publication WO96 / 15194 having at least two SiH groups in one molecule From the viewpoint of resistance to oxidation and deterioration, a chain, cyclic, branched or cage polyorganosiloxane (B2) having at least two SiH groups in one molecule is preferable.
これらのうち、硬化物に柔軟性が付与されるという点から、1分子中に少なくとも2個のSiH基を有する鎖状オルガノポリシロキサンが好ましい。これらの化合物の例としては次のものが挙げられる。 Among these, a chain organopolysiloxane having at least two SiH groups in one molecule is preferable from the viewpoint of imparting flexibility to the cured product. The following are mentioned as an example of these compounds.
(式中、R4、R5は炭素数1〜10の有機基を表し同一であっても異なっても良く、lは、0〜50、nは2〜50、mは0〜10の数を表す。)
またR4、R5は入手性、耐熱性の観点より特にメチル基であるものが好ましく、硬化物の強度が高くなるという観点より、特にフェニル基であるものが好ましい。
(Wherein R 4 and R 5 represent an organic group having 1 to 10 carbon atoms and may be the same or different, l is 0 to 50, n is 2 to 50, and m is a number of 0 to 10. Represents.)
R 4 and R 5 are preferably methyl groups from the viewpoints of availability and heat resistance, and are preferably phenyl groups from the viewpoint of increasing the strength of the cured product.
これらのうち、硬化物の耐熱性が高いという点からは、1分子中に少なくとも2個のSiH基を有し、分子中にTまたはQ構造を有するオルガノポリシロキサンが好ましい。これらの化合物の例としては次のものが挙げられる。 Of these, organopolysiloxane having at least two SiH groups in one molecule and having a T or Q structure in the molecule is preferable from the viewpoint of high heat resistance of the cured product. The following are mentioned as an example of these compounds.
(式中、R6、R7は炭素数1〜6の有機基を表し、nは0〜50の数を表す。)
またR6、R7は入手性、耐熱性の観点より特にメチル基であるものが好ましい。
(Wherein, R 6, R 7 represents an organic group having 1 to 6 carbon atoms, n represents a number from 0 to 50.)
R 6 and R 7 are particularly preferably methyl groups from the viewpoints of availability and heat resistance.
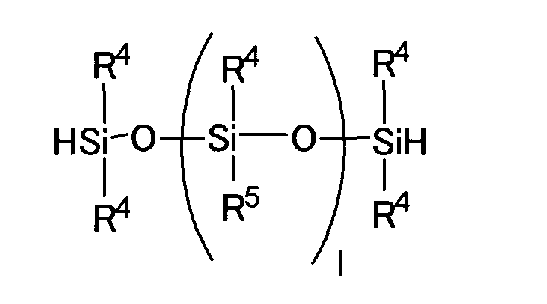
これらのうち、入手性、及び(B1)成分との反応性が良いという観点から、さらに、下記一般式(I)で表される、1分子中に少なくとも2個のSiH基を有する環状ポリオルガノシロキサンが好ましい。 Among these, from the viewpoint of availability and good reactivity with the component (B1), the cyclic polyorgano having at least two SiH groups in one molecule represented by the following general formula (I) Siloxane is preferred.
(式中、R0は炭素数1〜6の有機基を表し、nは3〜10の数を表す。)
なお、一般式(I)で表される化合物中の置換基R0は、C、H、Oから構成されるものであることが好ましく、炭化水素基であることがより好ましく、メチル基であることがさらに好ましい。
(In the formula, R 0 represents an organic group having 1 to 6 carbon atoms, and n represents a number of 3 to 10).
The substituent R 0 in the compound represented by the general formula (I) is preferably composed of C, H, O, more preferably a hydrocarbon group, and a methyl group. More preferably.
一般式(I)で表される化合物としては、入手容易性及び反応性の観点からは、1,3,5,7−テトラメチルシクロテトラシロキサンであることが好ましい。 The compound represented by the general formula (I) is preferably 1,3,5,7-tetramethylcyclotetrasiloxane from the viewpoint of availability and reactivity.
また、(B2)成分として炭素−炭素二重結合を有する有機化合物から選ばれた1種以上の化合物と鎖状、及び/又は、環状のポリオルガノシロキサンとの反応物(以降(D)成分と称する)も使用できる。この場合、反応物から未反応のシロキサン類などを脱揮などにより除去したものを用いることもできる。 In addition, as a component (B2), a reaction product of one or more compounds selected from organic compounds having a carbon-carbon double bond and a linear and / or cyclic polyorganosiloxane (hereinafter referred to as component (D)) Can also be used. In this case, a product obtained by removing unreacted siloxanes from the reaction product by devolatilization or the like can also be used.
(D)成分の有機化合物は前記(B1)成分の具体例と同じものを使用でき、(D)成分の有機化合物は、単独もしくは2種以上のものを混合して用いることが可能である。また、上記したような各種(B2)成分は単独もしくは2種以上のものを混合して用いることが可能である。 The same organic compound as the component (B1) can be used as the organic compound (D), and the organic compound (D) can be used singly or in combination of two or more. Further, the various components (B2) described above can be used alone or in combination of two or more.
(B)成分合成において、(B1)成分と(B2)成分の混合比率は1分子中に2個以上炭素−炭素二重結合が残る範囲であれば、特に限定されない。収率の観点から(B1)に含まれる炭素−炭素二重結合基と(B2)に含まれるSiH基のモル比(炭素−炭素二重結合/SiH基)は1〜100であることが好ましく、1.5〜50であることが好ましく、2〜20であることが特に好ましい。 In the component synthesis (B), the mixing ratio of the component (B1) and the component (B2) is not particularly limited as long as two or more carbon-carbon double bonds remain in one molecule. From the viewpoint of yield, the molar ratio of the carbon-carbon double bond group contained in (B1) and the SiH group contained in (B2) (carbon-carbon double bond / SiH group) is preferably 1-100. It is preferable that it is 1.5-50, and it is especially preferable that it is 2-20.
(B)成分合成においては本発明の(A)成分であるヒドロシリル化触媒を用いることができ、触媒活性の点から塩化白金酸、白金−オレフィン錯体、白金−ビニルシロキサン錯体などが好ましい。また、これらの触媒は単独で使用してもよく、2種以上併用してもよい。触媒の添加量は特に限定されないが、十分な硬化性を有し、かつ硬化性組成物のコストを比較的低く抑えるために、SiH基1モルに対して、10-1〜10-10モルの範囲が好ましく、より好ましくは、10-3〜10-7モルの範囲である。 In the synthesis of component (B), the hydrosilylation catalyst as component (A) of the present invention can be used, and chloroplatinic acid, platinum-olefin complexes, platinum-vinylsiloxane complexes and the like are preferable from the viewpoint of catalytic activity. Moreover, these catalysts may be used independently and may be used together 2 or more types. The addition amount of the catalyst is not particularly limited, but in order to have sufficient curability and keep the cost of the curable composition relatively low, it is 10 −1 to 10 −10 mol relative to 1 mol of SiH group. The range is preferable, and the range of 10 −3 to 10 −7 mol is more preferable.
(B)成分合成反応の際に溶媒を使用してもよい。使用できる溶剤はヒドロシリル化反応を阻害しない限り特に限定されるものではなく、具体的に例示すれば、ベンゼン、トルエン、ヘキサン、ヘプタン等の炭化水素系溶媒、テトラヒドロフラン、1,4−ジオキサン、1,3−ジオキソラン、ジエチルエーテル等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、クロロホルム、塩化メチレン、1,2−ジクロロエタン等のハロゲン系溶媒を好適に用いることができる。溶媒は2種類以上の混合溶媒として用いることもできる。溶媒としては、トルエン、テトラヒドロフラン、1,3−ジオキソラン、クロロホルムが好ましい。使用する溶媒量も適宜設定できる。 (B) A solvent may be used in the component synthesis reaction. Solvents that can be used are not particularly limited as long as they do not inhibit the hydrosilylation reaction. Specifically, hydrocarbon solvents such as benzene, toluene, hexane, heptane, tetrahydrofuran, 1,4-dioxane, 1, Ether solvents such as 3-dioxolane and diethyl ether, ketone solvents such as acetone and methyl ethyl ketone, and halogen solvents such as chloroform, methylene chloride and 1,2-dichloroethane can be preferably used. The solvent can also be used as a mixed solvent of two or more types. As the solvent, toluene, tetrahydrofuran, 1,3-dioxolane and chloroform are preferable. The amount of solvent to be used can also be set as appropriate.
(B)成分合成において上記の組成比の(B1)成分と(B2)成分において、(B1)成分と(A)成分の混合液に、(B2)成分を滴下することにより実施可能である。反応は室温以上であれば特に支障はないが、より反応を効果的に進行させるため50℃以上が好ましく、70℃以上が好ましく、80℃以上がさらに好ましい。 In (B) component synthesis | combination, in (B1) component and (B2) component of said composition ratio, it can implement by dripping (B2) component to the liquid mixture of (B1) component and (A) component. The reaction is not particularly restricted as long as it is at room temperature or higher, but is preferably 50 ° C. or higher, more preferably 70 ° C. or higher, and further preferably 80 ° C. or higher for allowing the reaction to proceed more effectively.
(B)成分合成時の反応後に溶媒及び/又は未反応の化合物を除去してもよい。除去する方法としては、例えば、減圧脱揮が挙げられる。減圧脱揮する場合、低温で処理することが好ましい。この場合の好ましい温度の上限は100℃であり、より好ましくは80℃である。高温で処理すると増粘等の変質を伴いやすい。また、貯蔵安定性を向上させるためには窒素、アルゴンの様な不活性ガス雰囲気下、10℃以下での保存が好ましく、0℃以下の保存が特に好ましく、−10℃以下の保存がさらに好ましい。 (B) The solvent and / or the unreacted compound may be removed after the reaction during component synthesis. Examples of the removal method include vacuum devolatilization. When devolatilizing under reduced pressure, it is preferable to treat at a low temperature. The upper limit of the preferable temperature in this case is 100 ° C, more preferably 80 ° C. When treated at high temperatures, it tends to be accompanied by alterations such as thickening. In order to improve storage stability, storage at 10 ° C. or lower is preferable in an inert gas atmosphere such as nitrogen or argon, storage at 0 ° C. or lower is particularly preferable, and storage at −10 ° C. or lower is further preferable. .
(B)成分としては、硬化物の耐熱性が高いという点から(B1)成分としてトリアリルイソシアヌレート、トリメタリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレート、トリス(2−アクリロイルオキシエチル)イソシアヌレートから選ばれる化合物、(B2)成分として1,3,5,7−テトラメチルテトラシクロシロキサンを用いた反応物であることが好ましい。 As component (B), the heat resistance of the cured product is high. As component (B1), triallyl isocyanurate, trimethallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl monophenyl A reaction product using a compound selected from isocyanurate and tris (2-acryloyloxyethyl) isocyanurate and 1,3,5,7-tetramethyltetracyclosiloxane as the component (B2) is preferable.
本発明における(C)成分について説明する。 The component (C) in the present invention will be described.
(C)成分はSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも1個含有する有機化合物(C1)と1分子中に少なくとも2個のSiH基を含有するケイ素化合物(C2)との反応物である。 Component (C) consists of an organic compound (C1) containing at least one carbon-carbon double bond having reactivity with SiH groups in one molecule and a silicon compound containing at least two SiH groups in one molecule ( It is a reaction product with C2).
以下、(C)成分の一方の反応物であるSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも1個含有する有機化合物(C1)成分について説明する。(C1)成分の骨格としては特に限定はなく、有機重合体骨格、または有機単量体骨格を用いればよい。 Hereinafter, the organic compound (C1) component containing at least one carbon-carbon double bond having reactivity with the SiH group, which is one reactant of the component (C), will be described. The skeleton of the component (C1) is not particularly limited, and an organic polymer skeleton or an organic monomer skeleton may be used.
有機重合体骨格の例としては、ポリエーテル系、ポリエステル系、ポリアリレート系、飽和炭化水素系、ポリアクリル酸エステル系、ポリアミド系、フェノール−ホルムアルデヒド系、ポリイミド系の骨格を用いることができる。また単量体骨格としては例えばフェノール系、ビスフェノール系、ベンゼン、ナフタレンなどの芳香族炭化水素系、脂肪族炭化水素系およびこれらの混合物が挙げられる。 Examples of organic polymer skeletons include polyether-based, polyester-based, polyarylate-based, saturated hydrocarbon-based, polyacrylate-based, polyamide-based, phenol-formaldehyde-based, and polyimide-based skeletons. Examples of the monomer skeleton include aromatic hydrocarbons such as phenols, bisphenols, benzene, and naphthalene, aliphatic hydrocarbons, and mixtures thereof.
(C1)成分の炭素―炭素二重結合としては上記(B1)成分で説明したものと同様のものを用いることができる。 As the carbon-carbon double bond of the component (C1), the same ones as described for the component (B1) can be used.
(C1)成分の具体的な例としては、トリアリルイソシアヌレート、トリメタリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレート、トリス(2−アクリロイルオキシエチル)イソシアヌレート、モノアリルジグリシジルイソシアヌレート、1,2,4−トリビニルシクロヘキサン、ビニルシクロヘキセン、ジビニルベンゼン、ジビニルビフェニル、トリメチロールプロパンジアリルエーテル、ビスフェノールAジアリルエーテル、ビスフェノールSジアリルエーテル、ノルボルネン、ノルボルナジエンなどが挙げられる。 Specific examples of the component (C1) include triallyl isocyanurate, trimethallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl monophenyl isocyanurate, tris (2-acryloyloxyethyl). ) Isocyanurate, monoallyl diglycidyl isocyanurate, 1,2,4-trivinylcyclohexane, vinylcyclohexene, divinylbenzene, divinylbiphenyl, trimethylolpropane diallyl ether, bisphenol A diallyl ether, bisphenol S diallyl ether, norbornene, norbornadiene, etc. Is mentioned.
硬化物の耐熱性がより高いという点からイソシアヌル酸骨格を有するものが好ましく、具体的にはトリアリルイソシアヌレート、トリメタリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレート、トリス(2−アクリロイルオキシエチル)イソシアヌレート、モノアリルジグリシジルイソシアヌレートを挙げることができる。 Those having an isocyanuric acid skeleton are preferred from the viewpoint of higher heat resistance of the cured product, specifically, triallyl isocyanurate, trimethallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl Examples thereof include monophenyl isocyanurate, tris (2-acryloyloxyethyl) isocyanurate, and monoallyl diglycidyl isocyanurate.
また、(C1)成分のSiH基と反応性を有する炭素−炭素二重結合の数は、屈折率をより向上し得るという観点からは2個以下であることがより好ましい。具体的な例としては、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレート、ジビニルベンゼン、ジビニルビフェニル、トリメチロールプロパンジアリルエーテル、ビスフェノールAジアリルエーテル、ビスフェノールSジアリルエーテル、ノルボルナジエンなどが挙げられる。さらにはイソシアヌル酸骨格を有するものが好ましい。 Further, the number of carbon-carbon double bonds reactive with the SiH group of the component (C1) is more preferably 2 or less from the viewpoint that the refractive index can be further improved. Specific examples include diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, diallyl monophenyl isocyanurate, divinylbenzene, divinylbiphenyl, trimethylolpropane diallyl ether, bisphenol A diallyl ether, bisphenol S diallyl ether, Examples include norbornadiene. Furthermore, what has an isocyanuric acid skeleton is preferable.
前記(B1)成分においてもSiH基と反応性を有する炭素−炭素二重結合の数は、屈折率をより向上し得るという観点からは2個であることがより好ましいが、(C1)成分において炭素−炭素二重結合の数が2個であることが屈折率をより向上し得ると言う点で好ましい。屈折率をより向上し得ると言う点では、(B1)、(C1)成分共に炭素−炭素二重結合の数が2個である化合物を用いる等、屈折率をより向上し得る前記手段を併用して用いることが最も好ましい。 In the component (B1), the number of carbon-carbon double bonds having reactivity with the SiH group is more preferably two from the viewpoint that the refractive index can be further improved. It is preferable that the number of carbon-carbon double bonds is two in that the refractive index can be further improved. In terms that the refractive index can be further improved, the above-mentioned means that can further improve the refractive index, such as using a compound having two carbon-carbon double bonds for both (B1) and (C1) components, are used in combination. And most preferably used.
それら(B1)成分に用いることができる化合物としては、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレート、ジアリルモノメチルイソシアヌレート、ジアリルモノフェニルイソシアヌレートを挙げることができる。 Examples of the compound that can be used for the component (B1) include diallyl isocyanurate, diallyl monoglycidyl isocyanurate, diallyl monomethyl isocyanurate, and diallyl monophenyl isocyanurate.
(C2)成分は上記で説明した(B2)成分から選択して好適に用いることが出来る。好ましい化合物、具体的化合物も上記で説明した(B2)成分の説明を適用できる。なお、(C2)成分は(B2)成分と同じものを用いることが更に好ましい。 The component (C2) can be suitably used by selecting from the component (B2) described above. The description of the component (B2) described above can also be applied to preferred compounds and specific compounds. The component (C2) is more preferably the same as the component (B2).
(C)成分合成において、(C1)成分と(C2)成分の混合比率は1分子中に2個以上SiH基が残る範囲であれば、特に限定されない。収率の観点から(C1)に含まれる炭素−炭素二重結合基と(C2)に含まれるSiH基のモル比(炭素−炭素二重結合/SiH基)は0.01〜1であることが好ましく、0.03〜0.8であることが好ましく、0.05〜0.5であることが特に好ましい。 In the synthesis of the component (C), the mixing ratio of the component (C1) and the component (C2) is not particularly limited as long as two or more SiH groups remain in one molecule. From the viewpoint of yield, the molar ratio (carbon-carbon double bond / SiH group) of the carbon-carbon double bond group contained in (C1) and the SiH group contained in (C2) should be 0.01-1. Is preferable, 0.03-0.8 is preferable, and 0.05-0.5 is particularly preferable.
(C)成分合成においては本発明の(A)成分であるヒドロシリル化触媒を用いることができ、触媒活性の点から塩化白金酸、白金−オレフィン錯体、白金−ビニルシロキサン錯体などが好ましい。また、これらの触媒は単独で使用してもよく、2種以上併用してもよい。触媒の添加量は特に限定されないが、十分な硬化性を有し、かつ硬化性組成物のコストを比較的低く抑えるために、SiH基と反応性を有する炭素−炭素二重結合1モルに対して、10-1〜10-10モルの範囲が好ましく、より好ましくは、10-3〜10-7モルの範囲である。 In the synthesis of component (C), the hydrosilylation catalyst which is component (A) of the present invention can be used, and chloroplatinic acid, platinum-olefin complexes, platinum-vinylsiloxane complexes and the like are preferable from the viewpoint of catalytic activity. Moreover, these catalysts may be used independently and may be used together 2 or more types. The addition amount of the catalyst is not particularly limited, but in order to have sufficient curability and keep the cost of the curable composition relatively low, the amount of the carbon-carbon double bond reactive with SiH group is 1 mol. The range of 10 −1 to 10 −10 mol is preferable, and the range of 10 −3 to 10 −7 mol is more preferable.
(C)成分合成反応の際に溶媒を使用してもよい。使用できる溶剤は(B)成分合成反応の際に使用できるものとして例示したものと同じである。使用する溶媒量も適宜設定できる。 (C) A solvent may be used in the component synthesis reaction. Solvents that can be used are the same as those exemplified as those that can be used in the (B) component synthesis reaction. The amount of solvent to be used can also be set as appropriate.
(C)成分合成において上記の組成比の(C1)成分と(C2)成分において、(C2)成分に(C1)成分と(A)成分をそれぞれ、又は混合して滴下することにより実施可能である。 In (C) component synthesis, in (C1) component and (C2) component of the above composition ratio, (C1) component and (A) component can be added to (C2) component or mixed and added dropwise. is there.
反応は室温以上であれば特に支障はないが、より反応を効果的に進行させるため50℃以上が好ましく、70℃以上が好ましく、90℃以上がさらに好ましい。 The reaction is not particularly hindered at room temperature or higher, but is preferably 50 ° C. or higher, more preferably 70 ° C. or higher, and still more preferably 90 ° C. or higher in order to make the reaction proceed more effectively.
(C)成分合成時の反応後に溶媒及び/又は未反応の化合物を除去してもよい。除去する方法としては、例えば、減圧脱揮が挙げられる。減圧脱揮する場合、低温で処理することが好ましい。この場合の好ましい温度の上限は100℃であり、より好ましくは90℃である。高温で処理すると増粘等の変質を伴いやすい。また、貯蔵安定性を向上させるためには窒素、アルゴンの様な不活性ガス雰囲気下、10℃以下での保存が好ましく、0℃以下の保存が特に好ましく、−10℃以下の保存がさらに好ましい。 (C) You may remove a solvent and / or an unreacted compound after reaction at the time of a component synthesis | combination. Examples of the removal method include vacuum devolatilization. When devolatilizing under reduced pressure, it is preferable to treat at a low temperature. The upper limit of the preferable temperature in this case is 100 ° C, more preferably 90 ° C. When treated at high temperatures, it tends to be accompanied by alterations such as thickening. In order to improve storage stability, storage at 10 ° C. or lower is preferable in an inert gas atmosphere such as nitrogen or argon, storage at 0 ° C. or lower is particularly preferable, and storage at −10 ° C. or lower is further preferable. .
(C)成分としては、硬化物の耐熱性が高いという点から(C1)成分としてトリアリルイソシアヌレート、ジアリルイソシアヌレート、ジアリルモノグリシジルイソシアヌレートから選ばれる化合物、(B2)成分として1,3,5,7−テトラメチルテトラシクロシロキサンを用いた反応物であることが好ましい。 As the component (C), a compound selected from triallyl isocyanurate, diallyl isocyanurate, diallyl monoglycidyl isocyanurate as the component (C1) from the point that the heat resistance of the cured product is high, and 1,3, as the component (B2) A reaction product using 5,7-tetramethyltetracyclosiloxane is preferable.
本発明の硬化性組成物の貯蔵安定性を改良する目的で貯蔵安定剤を添加することもできる。貯蔵安定剤としては、脂肪族不飽和結合を含有する化合物、有機リン化合物、有機イオウ化合物、窒素含有化合物、スズ系化合物、有機過酸化物などが挙げられ、これらを併用してもかまわない。 A storage stabilizer may be added for the purpose of improving the storage stability of the curable composition of the present invention. Examples of the storage stabilizer include a compound containing an aliphatic unsaturated bond, an organic phosphorus compound, an organic sulfur compound, a nitrogen-containing compound, a tin-based compound, and an organic peroxide, and these may be used in combination.
脂肪族不飽和結合を含有する化合物として、プロパギルアルコール類、エン−イン化合物類、マレイン酸エステル類などが例示される。有機リン化合物としては、トリオルガノフォスフィン類、ジオルガノフォスフィン類、オルガノフォスフォン類、トリオルガノフォスファイト類などが例示される。有機イオウ化合物としては、オルガノメルカプタン類、ジオルガノスルフィド類、硫化水素、ベンゾチアゾール、ベンゾチアゾールジサルファイドなどが例示される。 Examples of the compound containing an aliphatic unsaturated bond include propargyl alcohols, ene-yne compounds, maleate esters and the like. Examples of the organophosphorus compound include triorganophosphine, diorganophosphine, organophosphon, and triorganophosphite. Examples of organic sulfur compounds include organomercaptans, diorganosulfides, hydrogen sulfide, benzothiazole, benzothiazole disulfide and the like.
窒素含有化合物としては、アンモニア、1〜3級アルキルアミン類、アリールアミン類、尿素、ヒドラジンなどが例示される。スズ系化合物としては、ハロゲン化第一スズ2水和物、カルボン酸第一スズなどが例示される。有機過酸化物としては、ジ−t−ブチルペルオキシド、ジクミルペルオキシド、ベンゾイルペルオキシド、過安息香酸t−ブチルなどが例示される。 Examples of nitrogen-containing compounds include ammonia, primary to tertiary alkylamines, arylamines, urea, hydrazine and the like. Examples of tin compounds include stannous halide dihydrate and stannous carboxylate. Examples of the organic peroxide include di-t-butyl peroxide, dicumyl peroxide, benzoyl peroxide, and t-butyl perbenzoate.
これらの貯蔵安定剤のうち、貯蔵安定性が良好で原料入手性がよいという観点からは、1−エチニルシクロヘキサノール、3−ヒドロキシ−3−メチル−1−ブチン、ジメチルマレート、が好ましい。 Among these storage stabilizers, 1-ethynylcyclohexanol, 3-hydroxy-3-methyl-1-butyne, and dimethyl malate are preferable from the viewpoint of good storage stability and good raw material availability.
貯蔵安定剤の添加量は、使用するヒドロシリル化触媒1molに対し、10-1〜103モルの範囲が好ましく、より好ましくは1〜100モルの範囲である。 The addition amount of the storage stabilizer is preferably in the range of 10 −1 to 10 3 mol, more preferably in the range of 1 to 100 mol, with respect to 1 mol of the hydrosilylation catalyst used.
本発明の硬化性組成物には消泡剤を添加してもよい。消泡剤としては各種のものが用いられるが、例えばシリコーン系、ビニル系、アクリル系等が挙げられる。これらの消泡剤は単独で使用してもよく、2種以上併用してもよい。 An antifoaming agent may be added to the curable composition of the present invention. Various types of antifoaming agents are used, and examples thereof include silicones, vinyls, and acrylics. These antifoaming agents may be used alone or in combination of two or more.
本発明の硬化性組成物には、その他、着色剤、離型剤、難燃剤、難燃助剤、界面活性剤、乳化剤、レベリング剤、はじき防止剤、アンチモン−ビスマス等のイオントラップ剤、チクソ性付与剤、粘着性付与剤、保存安定改良剤、オゾン劣化防止剤、光安定剤、増粘剤、接着性改良剤、可塑剤、反応性希釈剤、酸化防止剤、熱安定化剤、導電性付与剤、帯電防止剤、放射線遮断剤、核剤、リン系過酸化物分解剤、滑剤、顔料、金属不活性化剤、熱伝導性付与剤、物性調整剤等を本発明の目的および効果を損なわない範囲において添加することができる。 The curable composition of the present invention includes other colorants, mold release agents, flame retardants, flame retardant aids, surfactants, emulsifiers, leveling agents, anti-fogging agents, ion trapping agents such as antimony-bismuth, thixo Property imparting agent, tackifier, storage stability improver, ozone degradation inhibitor, light stabilizer, thickener, adhesion improver, plasticizer, reactive diluent, antioxidant, heat stabilizer, conductivity The purpose and effect of the present invention include property imparting agents, antistatic agents, radiation shielding agents, nucleating agents, phosphorus peroxide decomposing agents, lubricants, pigments, metal deactivators, thermal conductivity imparting agents, physical property modifiers Can be added within a range that does not impair.
硬化性組成物の調製方法は特に限定されず、種々の方法で調製可能である。各種成分を硬化直前に混合調製しても良く、全成分を予め混合調製した一液の状態で低温貯蔵しておいても良い。全成分を混合した後、反応制御条件や官能基の反応性の差の利用により組成物中の官能基の一部のみを反応(Bステージ化)させてもよい。変性ポリオルガノシロキサン化合物の他に、物性改良の目的で熱可塑性樹脂等の添加剤を使用する場合は、これらの添加剤と硬化触媒である白金化合物を予め混合して貯蔵しておき、硬化直前にそれぞれの所定量を混合して調製してもよい。 The preparation method of a curable composition is not specifically limited, It can prepare with various methods. Various components may be mixed and prepared immediately before curing, or may be stored at a low temperature in a one-component state in which all components are mixed and prepared in advance. After mixing all the components, only a part of the functional groups in the composition may be reacted (B-stage) by utilizing reaction control conditions and differences in functional group reactivity. In addition to the modified polyorganosiloxane compound, when using additives such as thermoplastic resins for the purpose of improving physical properties, these additives and a platinum compound that is a curing catalyst are mixed and stored in advance and immediately before curing. The respective predetermined amounts may be mixed with each other.
成分(B)と成分(C)の比率は[(B)成分のSiH基と反応性を有する炭素−炭素二重結合のモル数/(C)成分のSiH基のモル数]の値が、下限0.05、上限10の範囲となる比率であることが好ましく、下限0.1、上限5の範囲となる比率であることがより好ましく、下限0.5、上限2であることが特に好ましい。下限値が0.05より小さい場合は炭素−炭素二重結合とSiH基との反応による架橋の効果が不十分になる傾向にあり、上限値が10より大きい場合は硬化物から未反応の(B)成分がブリードしてくる場合がある。 The ratio of the component (B) to the component (C) is the value of [number of moles of carbon-carbon double bond having reactivity with the SiH group of the component (B) / number of moles of SiH group of the component (C)] The ratio is preferably in the range of lower limit 0.05 and upper limit 10, more preferably in the ratio of lower limit 0.1 and upper limit 5, particularly preferably in lower limit 0.5 and upper limit 2. . When the lower limit value is smaller than 0.05, the effect of crosslinking due to the reaction between the carbon-carbon double bond and the SiH group tends to be insufficient, and when the upper limit value is larger than 10, the cured product is unreacted ( B) The component may bleed.
また、SiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸骨格からなる有機化合物(以降(E)成分と称する)を本発明の硬化性組成物に用いることもできる。具体的には(A1)に使用できるものとして例示したものと同じである。 In addition, an organic compound (hereinafter referred to as “component (E)”) comprising an isocyanuric acid skeleton containing at least two carbon-carbon double bonds having reactivity with SiH groups in one molecule is used as the curable composition of the present invention. It can also be used. Specifically, it is the same as what was illustrated as what can be used for (A1).
成分(E)を用いた場合、[(B)成分と(E)成分のSiH基と反応性を有する炭素−炭素二重結合のモル数/(C)成分のSiH基のモル数]の値が、下限0.05、上限10の範囲となる比率であることが好ましく、下限0.1、上限5の範囲となる比率であることがより好ましく、下限0.5、上限2であることが特に好ましい。 When component (E) is used, the value of [number of moles of carbon-carbon double bond having reactivity with SiH groups of components (B) and (E) / number of moles of SiH groups of component (C)] However, it is preferable that it is a ratio which becomes the range of the lower limit 0.05 and the upper limit 10, It is more preferable that it is a ratio which becomes the range of the lower limit 0.1 and the upper limit 5, and it is the lower limit 0.5 and the upper limit 2 Particularly preferred.
熱硬化温度としては種々設定できるが、好ましい温度の下限は30℃、より好ましくは60℃、さらに好ましくは90℃である。好ましい温度の上限は250℃、より好ましくは200℃、さらに好ましくは190℃である。反応温度が低いと十分に反応させるための反応時間が長くなる。反応温度が高いと着色や隆起することがある。 The thermosetting temperature can be variously set, but the lower limit of the preferable temperature is 30 ° C, more preferably 60 ° C, and still more preferably 90 ° C. The upper limit of the preferable temperature is 250 ° C, more preferably 200 ° C, and still more preferably 190 ° C. When the reaction temperature is low, the reaction time for sufficient reaction is prolonged. If the reaction temperature is high, coloring or bulging may occur.
硬化は一定の温度で行ってもよいが、必要に応じて多段階あるいは連続的に温度を変化させてもよい。一定の温度で行うより多段階的あるいは連続的に温度を上昇させながら反応させた方が、着色が少なく、歪の少ない硬化物が得られやすいという点において好ましい。 Curing may be performed at a constant temperature, but the temperature may be changed in multiple steps or continuously as required. It is preferable to carry out the reaction while raising the temperature in a multistage manner or continuously, rather than at a constant temperature, in that a cured product with less coloring and less distortion can be easily obtained.
反応時の圧力も必要に応じ種々設定でき、常圧、高圧、あるいは減圧状態で反応させることもできる。 The pressure during the reaction can be variously set as required, and the reaction can be carried out under normal pressure, high pressure, or reduced pressure.
硬化させて得られる硬化物の形状も用途に応じて種々とりうるので特に限定されないが、例えばレンズ状、フィルム状、シート状、チューブ状、ロッド状、塗膜状、バルク状などの形状とすることができる。 There are no particular limitations on the shape of the cured product obtained by curing, depending on the application, but there are no particular limitations. For example, the shape of the lens, film, sheet, tube, rod, coating, bulk, etc. be able to.
成形する方法も従来の熱硬化性樹脂の成形方法をはじめとして種々の方法をとることができる。例えば、キャスト法、プレス法、注型法、トランスファー成形法、コーティング法、RIM法、LIM法などの成形方法を適用することができる。成形型は研磨ガラス、硬質ステンレス研磨板、ポリカーボネート板、ポリエチレンテレフタレート板、ポリメチルメタクリレート板等を適用することができる。 Various molding methods can be used including a conventional thermosetting resin molding method. For example, a casting method, a pressing method, a casting method, a transfer molding method, a coating method, a RIM method, a LIM method, or the like can be applied. As the mold, polishing glass, hard stainless steel polishing plate, polycarbonate plate, polyethylene terephthalate plate, polymethyl methacrylate plate, or the like can be applied.
また、成形型との離型性を向上させるためポリエチレンテレフタレートフィルム、ポリカーボネートフィルム、ポリ塩化ビニルフィルム、ポリエチレンフィルム、ポリテトラフルオロエチレンフィルム、ポリプロピレンフィルム、ポリイミドフィルム、フッ素又はめっきにより表面処理された金型等を適用することができる。 In addition, in order to improve releasability from the mold, polyethylene terephthalate film, polycarbonate film, polyvinyl chloride film, polyethylene film, polytetrafluoroethylene film, polypropylene film, polyimide film, mold that has been surface treated by fluorine or plating Etc. can be applied.
成形時に必要に応じ各種処理を施すこともできる。例えば、成形時に発生するボイドの抑制のために組成物あるいは一部反応させた組成物を遠心、減圧などにより脱泡する処理、プレス時に一旦圧力を開放する処理などを適用することもできる。 Various treatments can be performed as necessary during molding. For example, a treatment for defoaming the composition or a partially reacted composition by centrifugation, decompression, or the like for releasing the pressure once during pressing may be applied to suppress voids generated during molding.
本発明で得られる硬化物は各種用途に使用できる。例えば光学材料が挙げられる。 The cured product obtained in the present invention can be used for various applications. An example is an optical material.
ここでいう光学材料とは、可視光、赤外線、紫外線、X線、レーザーなどの光をその材料中を通過させる用途に用いる材料であり、具体的には下記のようなものが例示される。 The optical material here is a material used for the purpose of allowing light such as visible light, infrared light, ultraviolet light, X-rays, and lasers to pass through the material, and specific examples thereof include the following.
例えば、(デジタル)カメラや携帯電話や車載カメラ等のカメラ用レンズ、プロジェクションレンズ、f−θレンズ、ピックアップレンズ等の光学レンズ、光学フィルム、光学シート、光学部品用接着剤、光導波路結合用光学接着剤、光導波路周辺部材固定用接着剤、DVD貼り合せ用接着剤、粘着剤、ダイシングテープ、絶縁材料(プリント基板、電線被覆等を含む)、高電圧絶縁材料、層間絶縁膜、絶縁被覆材、高放熱性接着剤、LED素子の接着剤、各種基板の接着剤、ヒートシンクの接着剤、コーティング材料(ハードコート、シート、フィルム、剥離紙用コート、光ディスク用コート、光ファイバ用コート等を含む)、成形材料(シート、フィルム、FRP等を含む)、ポッティング材料、封止材料、発光ダイオード用封止材料、光半導体封止材料、液晶シール剤、表示デバイス用シール剤、電気材料用封止材料、各種太陽電池の封止材料、高耐熱シール材、レジスト材料、液状レジスト材料、着色レジスト、ドライフィルムレジスト材料、ソルダーレジスト材料、カラーフィルター用材料、光造形、太陽電池用材料、表示材料、記録材料、複写機用感光ドラムに応用できる。
For example, camera lenses such as (digital) cameras, mobile phones, and in-vehicle cameras, projection lenses, optical lenses such as f-θ lenses, pickup lenses, optical films, optical sheets, adhesives for optical components, optical waveguide coupling optics Adhesives, adhesives for fixing optical waveguide peripheral members, adhesives for bonding DVDs, adhesives, dicing tapes, insulating materials (including printed circuit boards and wire coatings), high-voltage insulating materials, interlayer insulating films, insulating coating materials , High heat dissipation adhesive, LED element adhesive, various substrate adhesive, heat sink adhesive, coating materials (including hard coat, sheet, film, release paper coat, optical disc coat, optical fiber coat, etc. ), Molding materials (including sheets, films, FRP, etc.), potting materials, sealing materials, sealing materials for light emitting diodes, Semiconductor sealing materials, liquid crystal sealing agents, sealing materials for display devices, sealing materials for electrical materials, sealing materials for various solar cells, high heat resistant sealing materials, resist materials, liquid resist materials, colored resists, dry film resist materials, It can be applied to solder resist materials, color filter materials, stereolithography, solar cell materials, display materials, recording materials, and photosensitive drums for copying machines.
以下に、本発明の実施例および比較例を示すが、本発明は以下によって限定されるものではない。 Examples and Comparative Examples of the present invention are shown below, but the present invention is not limited to the following.
(合成例1)
1Lの四ツ口フラスコに、磁気攪拌子、冷却管、滴下漏斗をセットした。このフラスコにトリアリルイソシアヌレート(分子内二重結合数3)150g、トルエン450g及び白金ジビニルジシロキサン錯体のキシレン溶液(白金として0.03wt%含有)1gを入れ、気相部を窒素置換した後、内温90℃で加熱、攪拌した。1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)20gを1.5時間かけて滴下した。その後、内温を105℃まで上げ、6.5時間加熱攪拌した後、冷却により反応を終了した。
(Synthesis Example 1)
A magnetic stirring bar, a condenser tube, and a dropping funnel were set in a 1 L four-necked flask. After putting 150 g of triallyl isocyanurate (3 intramolecular double bonds), 450 g of toluene and 1 g of a xylene solution of platinum divinyldisiloxane complex (containing 0.03 wt% as platinum) in this flask, the gas phase part was purged with nitrogen The mixture was heated and stirred at an internal temperature of 90 ° C. 20 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) was added dropwise over 1.5 hours. Thereafter, the internal temperature was raised to 105 ° C., and heated and stirred for 6.5 hours, and then the reaction was terminated by cooling.
トルエンを60℃で2時間、80℃で2時間減圧脱揮し、無色透明の液体を得た。1H−NMRによりこのものはトリアリルイソシアヌレートのアリル基の一部が1、3、5、7−テトラメチルシクロテトラシロキサンと反応したもの((β1)と称す。(β1)は混合物であるが、主成分として1分子中に8個の炭素−炭素二重結合基を含有する以下の化合物を含有する)とトリアリルイソシアヌレートの混合物であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRにより炭素−炭素二重結合基の含有量を求めたところ、9.5mmol/g含有していることがわかった。 Toluene was devolatilized at 60 ° C. for 2 hours and 80 ° C. for 2 hours to obtain a colorless and transparent liquid. 1 The one by H-NMR is referred to as a part of the allyl group of triallyl isocyanurate was reacted with 1,3,5,7-tetramethylcyclotetrasiloxane ((β1). (Β1) is a mixture Is a mixture of triallyl isocyanurate and the following compound containing 8 carbon-carbon double bond groups in one molecule as a main component. Further, when the content of the carbon-carbon double bond group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 9.5 mmol / g.
(合成例2)
1Lの四ツ口フラスコに、磁気攪拌子、冷却管、滴下漏斗をセットした。このフラスコにジアリルモノグリシジルイソシアヌレート(分子内二重結合数2)300g、トルエン300g及び白金ジビニルジシロキサン錯体のキシレン溶液(白金として0.03wt%含有)1.2gを入れ、気相部を窒素置換した後、内温90℃で加熱、攪拌した。1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)75gを1.5時間かけて滴下した。その後、内温を105℃まで上げ、14時間加熱攪拌した後、冷却により反応を終了した。
(Synthesis Example 2)
A magnetic stirring bar, a condenser tube, and a dropping funnel were set in a 1 L four-necked flask. Into this flask, 300 g of diallyl monoglycidyl isocyanurate (intramolecular double bond number 2), 300 g of toluene and 1.2 g of a xylene solution of platinum divinyldisiloxane complex (containing 0.03 wt% as platinum) were added, and the gas phase part was nitrogen. After the replacement, the mixture was heated and stirred at an internal temperature of 90 ° C. 75 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) was added dropwise over 1.5 hours. Thereafter, the internal temperature was raised to 105 ° C., and the mixture was heated and stirred for 14 hours, and then the reaction was terminated by cooling.
トルエンを60℃で2時間、80℃2時間減圧で脱揮し、無色透明の液体を得た。1H−NMRによりこのものはアリル基の一部が1、3、5、7−テトラメチルシクロテトラシロキサンと反応したもの((β2)と称す。(β2)は混合物であるが、主成分として1分子中に4個の炭素−炭素二重結合基を含有する以下の化合物を含有する)とジアリルモノグリシジルイソシアヌレートの混合物であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRにより炭素−炭素二重結合基の含有量を求めたところ、6.5mmol/g含有していることがわかった。 Toluene was devolatilized under reduced pressure at 60 ° C. for 2 hours and 80 ° C. for 2 hours to obtain a colorless and transparent liquid. 1 The one by H-NMR is referred to as a part of the allyl group is reacted with 1,3,5,7-tetramethylcyclotetrasiloxane ((β2). (Β2) is a mixture, as a main component It was found to be a mixture of the following compounds containing four carbon-carbon double bond groups in one molecule) and diallyl monoglycidyl isocyanurate. Further, when the content of the carbon-carbon double bond group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 6.5 mmol / g.
(合成例3)
1Lの四ツ口フラスコに、磁気攪拌子、冷却管、滴下漏斗をセットした。このフラスコに1,2,4−トリビニルシクロヘキサン(分子内二重結合数3)200g、トルエン400g及び白金ジビニルジシロキサン錯体のキシレン溶液(白金として0.03wt%含有)2gを入れ、気相部を窒素置換した後、内温90℃で加熱、攪拌した。1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)40gを1時間かけて滴下した。その後、内温を105℃まで上げ、6.5時間加熱攪拌した後、冷却により反応を終了した。
(Synthesis Example 3)
A magnetic stirring bar, a condenser tube, and a dropping funnel were set in a 1 L four-necked flask. 200 g of 1,2,4-trivinylcyclohexane (3 intramolecular double bonds), 400 g of toluene, and 2 g of a xylene solution of platinum divinyldisiloxane complex (containing 0.03 wt% as platinum) were placed in this flask. After replacing with nitrogen, the mixture was heated and stirred at an internal temperature of 90 ° C. 40 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) was added dropwise over 1 hour. Thereafter, the internal temperature was raised to 105 ° C., and heated and stirred for 6.5 hours, and then the reaction was terminated by cooling.
トルエンを60℃で2時間、80℃2時間減圧で脱揮し、無色透明の液体を得た。1H−NMRによりこのものはアリル基の一部が1、3、5、7−テトラメチルシクロテトラシロキサンと反応したもの((β3)と称す。(β3)は混合物であるが、主成分として1分子中に8個の炭素−炭素二重結合基を含有する以下の化合物を含有する)と1,2,4−トリビニルシクロヘキサンの混合物であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRにより炭素−炭素二重結合基の含有量を求めたところ、10.7mmol/g含有していることがわかった。 Toluene was devolatilized under reduced pressure at 60 ° C. for 2 hours and 80 ° C. for 2 hours to obtain a colorless and transparent liquid. According to 1 H-NMR, this is called ((β3) in which a part of the allyl group reacts with 1,3,5,7-tetramethylcyclotetrasiloxane. (Β3) is a mixture, It was found to be a mixture of 1,2,4-trivinylcyclohexane containing the following compound containing 8 carbon-carbon double bond groups in one molecule. Further, when the content of the carbon-carbon double bond group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 10.7 mmol / g.
(合成例4)
2Lオートクレーブに1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)650g、トルエン600gを入れ、気相部を窒素置換した後、内温105℃で加熱、攪拌した。トリアリルイソシアヌレート(分子内二重結合数3)90g、トルエン110g及び白金ビニルシロキサン錯体のキシレン溶液(白金として0.03wt%含有)3.5gの混合溶液を10回に分けて分割添加した。滴下終了から6時間加熱撹拌した後、冷却により反応を終了した。
(Synthesis Example 4)
650 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) and 600 g of toluene were placed in a 2 L autoclave, and the gas phase portion was purged with nitrogen, and then heated and stirred at an internal temperature of 105 ° C. A mixed solution of 90 g of triallyl isocyanurate (3 intramolecular double bonds), 110 g of toluene and 3.5 g of a xylene solution of platinum vinylsiloxane complex (containing 0.03 wt% as platinum) was dividedly added in 10 portions. After stirring for 6 hours from the end of dropping, the reaction was terminated by cooling.
トルエン及び未反応の1,3,5,7−テトラメチルシクロテトラシロキサンを60℃で2時間、80℃で2時間減圧脱揮し、無色透明の液体を得た。1H−NMRによりこのものは1、3、5、7−テトラメチルシクロテトラシロキサンのSiH基の一部とトリアリルイソシアヌレートのアリル基が反応したもの((γ1)と称す。(γ1)は混合物であるが、主成分として1分子中に9個のSiH基を含有する以下の化合物を含有する)であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRによりSiH基の含有量を求めたところ、9.0mmol/g含有していることがわかった。 Toluene and unreacted 1,3,5,7-tetramethylcyclotetrasiloxane were devolatilized under reduced pressure at 60 ° C. for 2 hours and at 80 ° C. for 2 hours to obtain a colorless and transparent liquid. Referred to the ones obtained by reacting allyl group part and triallyl isocyanurate of SiH groups of 1,3,5,7-tetramethylcyclotetrasiloxane by 1 H-NMR ((γ1) . (Γ1) is Although it was a mixture, it was found that it contains the following compounds containing 9 SiH groups in one molecule as the main component). Further, when the content of SiH group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 9.0 mmol / g.
(合成例5)
2Lの四ツ口フラスコに、磁気攪拌子、冷却管、滴下漏斗をセットした。このフラスコに1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)590g、トルエン550gを入れ、気相部を窒素置換した後、内温100℃で加熱、攪拌した。ジアリルモノグリシジルイソシアヌレート(分子内二重結合数2)130g、トルエン130g及び白金ビニルシロキサン錯体のキシレン溶液(白金として0.03wt%含有)0.5gの混合溶液を10回に分けて分割添加した。滴下終了から3時間加熱撹拌した後、冷却により反応を終了した。
(Synthesis Example 5)
A magnetic stirring bar, a condenser tube, and a dropping funnel were set in a 2 L four-necked flask. Into this flask, 590 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) and 550 g of toluene were placed, and the gas phase portion was purged with nitrogen, and then heated and stirred at an internal temperature of 100 ° C. A mixed solution of 130 g of diallyl monoglycidyl isocyanurate (number of double bonds in the molecule) 130 g, toluene 130 g and platinum vinylsiloxane complex xylene solution (containing 0.03 wt% as platinum) was added in 10 divided portions. . After stirring for 3 hours from the end of dropping, the reaction was terminated by cooling.
トルエン及び未反応の1,3,5,7−テトラメチルシクロテトラシロキサンを60℃で2時間、80℃で2時間減圧脱揮し、無色透明の液体を得た。1H−NMRによりこのものは1、3、5、7−テトラメチルシクロテトラシロキサンのSiH基の一部とジアリルモノグリシジルイソシアヌレートのアリル基が反応したもの((γ2)と称す。(γ2)は混合物であるが、主成分として1分子中に6個のSiH基を含有する以下の化合物を含有する)であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRによりSiH基の含有量を求めたところ、7.7mmol/g含有していることがわかった。 Toluene and unreacted 1,3,5,7-tetramethylcyclotetrasiloxane were devolatilized under reduced pressure at 60 ° C. for 2 hours and at 80 ° C. for 2 hours to obtain a colorless and transparent liquid. Referred to as 1 this shall by H-NMR is 1,3,5,7 those allyl group part and diallyl monoglycidyl isocyanurate of SiH groups of tetramethylcyclotetrasiloxane were reacted ((γ2). (Γ2) Is a mixture but contains the following compounds containing 6 SiH groups in one molecule as a main component). Further, when the content of SiH group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 7.7 mmol / g.
(合成例6)
2Lの四ツ口フラスコに、磁気攪拌子、冷却管、滴下漏斗をセットした。このフラスコに1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)550g、トルエン300gを入れ、気相部を窒素置換した後、内温100℃で加熱、攪拌した。1,2,4−トリビニルシクロヘキサン(分子内二重結合数3)50g、トルエン40g及び白金ビニルシロキサン錯体のキシレン溶液(白金として0.03wt%含有)3gの混合溶液を10回に分けて分割添加した。滴下終了から3時間加熱撹拌した後に、冷却により反応を終了した。
(Synthesis Example 6)
A magnetic stirring bar, a condenser tube, and a dropping funnel were set in a 2 L four-necked flask. To this flask, 550 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) and 300 g of toluene were added, and the gas phase portion was purged with nitrogen, and then heated and stirred at an internal temperature of 100 ° C. Divide a mixed solution of 50 g of 1,2,4-trivinylcyclohexane (3 intramolecular double bonds), 40 g of toluene and 3 g of a xylene solution of platinum vinylsiloxane complex (containing 0.03 wt% as platinum) into 10 portions. Added. After stirring for 3 hours from the end of dropping, the reaction was terminated by cooling.
トルエン及び未反応の1,3,5,7−テトラメチルシクロテトラシロキサンを60℃で2時間、80℃で2時間減圧脱揮し、無色透明の液体を得た。1H−NMRによりこのものは1、3、5、7−テトラメチルシクロテトラシロキサンのSiH基の一部と1,2,4−トリビニルシクロヘキサンのビニル基が反応したもの((γ3)と称す。(γ3)は混合物であるが、主成分として1分子中に9個のSiH基を含有する以下の化合物を含有する)であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRによりSiH基の含有量を求めたところ、10.0mmol/g含有していることがわかった。 Toluene and unreacted 1,3,5,7-tetramethylcyclotetrasiloxane were devolatilized under reduced pressure at 60 ° C. for 2 hours and at 80 ° C. for 2 hours to obtain a colorless and transparent liquid. According to 1 H-NMR, this is a product of a part of the SiH group of 1,3,5,7-tetramethylcyclotetrasiloxane and the vinyl group of 1,2,4-trivinylcyclohexane (referred to as (γ3)). (Γ3) was a mixture, but it was found to contain the following compounds containing 9 SiH groups in one molecule as the main component). Further, when the content of SiH group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 10.0 mmol / g.
(合成例7)
2Lの四ツ口フラスコに、磁気攪拌子、冷却管、滴下漏斗をセットした。このフラスコに1,3,5,7−テトラメチルシクロテトラシロキサン(分子内SiH数4)420g、ジオキサン421gを入れ、気相部を窒素置換した後、内温110℃で加熱還流、攪拌した。ジアリルイソシアヌレート(分子内二重結合数2)75g、ジオキサン525g及び白金ビニルシロキサン錯体のキシレン溶液(白金として0.03wt%含有)16gの混合溶液を10回に分けて分割添加した。滴下終了から3時間後に冷却により反応を終了した。
(Synthesis Example 7)
A magnetic stirring bar, a condenser tube, and a dropping funnel were set in a 2 L four-necked flask. Into this flask, 420 g of 1,3,5,7-tetramethylcyclotetrasiloxane (intramolecular SiH number 4) and 421 g of dioxane were added, and the gas phase portion was purged with nitrogen, and then heated to reflux and stirred at an internal temperature of 110 ° C. A mixed solution of 75 g of diallyl isocyanurate (intramolecular double bond number 2), 525 g of dioxane and 16 g of a xylene solution of platinum vinylsiloxane complex (containing 0.03 wt% as platinum) was dividedly added in 10 portions. Reaction was complete | finished by cooling 3 hours after completion | finish of dripping.
トルエン及び未反応の1,3,5,7−テトラメチルシクロテトラシロキサンを60℃で2時間、80℃で2時間減圧脱揮し、無色透明の液体を得た。1H−NMRによりこのものは1、3、5、7−テトラメチルシクロテトラシロキサンのSiH基の一部とジアリルイソシアヌレートのアリル基が反応したもの((γ4)と称す。(γ4)は混合物であるが、主成分として1分子中に6個のSiH基を含有する以下の化合物を含有する)であることがわかった。また、1,2−ジブロモエタンを内部標準に用いて1H−NMRによりSiH基の含有量を求めたところ、6.9mmol/g含有していることがわかった。 Toluene and unreacted 1,3,5,7-tetramethylcyclotetrasiloxane were devolatilized under reduced pressure at 60 ° C. for 2 hours and at 80 ° C. for 2 hours to obtain a colorless and transparent liquid. By 1 H-NMR referred to the ones obtained by reacting allyl group part and diallyl isocyanurate of SiH groups of 1,3,5,7-tetramethylcyclotetrasiloxane ((γ4). (Γ4) a mixture However, it has been found that the following compounds containing 6 SiH groups in one molecule as a main component are contained). Further, when the content of SiH group was determined by 1 H-NMR using 1,2-dibromoethane as an internal standard, it was found to contain 6.9 mmol / g.
(実施例1〜6、比較例1、2)
表1に示される配合組成(配合量は重量部である)で硬化性組成物を調製した。さらに、硬化性組成物を2枚のガラス板に3mm厚みのシリコーンゴムシートをスペーサーとして挟み込んで作製したセルに、硬化性組成物を流し込み、60℃で6時間、続いて70℃で1時間、80℃で1時間、120℃で1時間、150℃で1時間、180℃30分間空気中にて加熱を行い、それぞれ透明硬質な硬化物を得た。
(Examples 1-6, Comparative Examples 1 and 2)
A curable composition was prepared with the composition shown in Table 1 (the amount is in parts by weight). Furthermore, the curable composition was poured into a cell prepared by sandwiching a curable composition between two glass plates and a 3 mm-thick silicone rubber sheet as a spacer, at 60 ° C. for 6 hours, and subsequently at 70 ° C. for 1 hour. Heating was performed in air at 80 ° C. for 1 hour, 120 ° C. for 1 hour, 150 ° C. for 1 hour, and 180 ° C. for 30 minutes to obtain transparent hard cured products, respectively.
(測定、試験)
(耐熱性)
硬化物を200℃のオーブンで24時間加熱し、室温に冷却後クラックの発生を目視で観察し、発生しなかったものを○、発生したものを×とした。
(Measurement, test)
(Heat-resistant)
The cured product was heated in an oven at 200 ° C. for 24 hours, and after cooling to room temperature, the occurrence of cracks was visually observed.
(屈折率)
Metricon社製プリズムカプラー 2010/Mを用い、404、594、825nmの波長での屈折率を測定し、これらの値から概算される589nmでの屈折率を屈折率とした。
(Refractive index)
The refractive index at wavelengths of 404, 594, and 825 nm was measured using a prism coupler 2010 / M manufactured by Metricon, and the refractive index at 589 nm estimated from these values was taken as the refractive index.
(硬化収縮率)
下記計算式から算出した。(1−(樹脂の密度)/(硬化物の密度))×100
樹脂の密度は23℃にて10mLメスフラスコに樹脂を入れ、重量を測定して求めた。また、硬化物の密度はMIRAGE社製ED−120Tで測定した23℃での空気中重量と水中重量から算出した。
(Curing shrinkage)
It was calculated from the following formula. (1- (resin density) / (hardened product density)) × 100
The density of the resin was determined by placing the resin in a 10 mL volumetric flask at 23 ° C. and measuring the weight. Further, the density of the cured product was calculated from the weight in air and the weight in water at 23 ° C. measured with ED-120T manufactured by MIRAGE.
(炭素−炭素二重結合基価、SiH基価)
バリアン・テクノロジーズ・ジャパン・リミテッド製、300MHz NMR装置を用いた。(B)成分、(C)成分合成での反応追跡は、反応液を重クロロホルムで1%程度まで希釈したものをNMR用チューブに加えて測定し、未反応SiH基のピークまたは未反応炭素−炭素二重結合基由来のメチレン基のピークと、反応炭素−炭素二重結合基由来のメチレン基のピークから求めた。(B)成分、(C)成分の官能基価は、ジブロモエタン換算での炭素−炭素二重結合基価(mmol/g)、SiH基価(mmol/g)を求めた。
(Carbon-carbon double bond value, SiH value)
A 300 MHz NMR apparatus manufactured by Varian Technologies Japan Limited was used. (B) component, (C) component reaction synthesis, the reaction solution diluted to about 1% with deuterated chloroform was added to an NMR tube and measured, and the peak of unreacted SiH group or unreacted carbon- It calculated | required from the peak of the methylene group derived from a carbon double bond group, and the peak of the methylene group derived from a reaction carbon-carbon double bond group. As the functional group values of the component (B) and the component (C), the carbon-carbon double bond value (mmol / g) and the SiH value (mmol / g) in terms of dibromoethane were obtained.
Claims (9)
(B)成分がSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも2個含有するイソシアヌル酸骨格からなる有機化合物(B1)と1分子中に少なくとも2個のSiH基を含有するケイ素化合物(B2)との反応物であり、
(C)成分がSiH基と反応性を有する炭素−炭素二重結合を1分子中に少なくとも1個含有する有機化合物(C1)と1分子中に少なくとも2個のSiH基を含有するケイ素化合物(C2)との反応物であることを特徴とする硬化性組成物。 (A) hydrosilylation catalyst, (B) isocyanuric acid derivative containing at least two carbon-carbon double bonds reactive with SiH group in one molecule, (C) at least two SiH groups in one molecule A curable composition comprising, as an essential component, a silicon compound containing
(B) the component is an organic compound (B1) comprising an isocyanuric acid skeleton containing at least two carbon-carbon double bonds reactive with SiH groups in one molecule, and at least two SiH groups in one molecule. It is a reaction product with the contained silicon compound (B2),
The component (C) is an organic compound (C1) containing at least one carbon-carbon double bond reactive with SiH groups in one molecule and a silicon compound containing at least two SiH groups in one molecule ( A curable composition, which is a reaction product with C2).
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009126825A JP5571326B2 (en) | 2009-05-26 | 2009-05-26 | Curable composition and cured product thereof |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009126825A JP5571326B2 (en) | 2009-05-26 | 2009-05-26 | Curable composition and cured product thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010275365A true JP2010275365A (en) | 2010-12-09 |
| JP5571326B2 JP5571326B2 (en) | 2014-08-13 |
Family
ID=43422635
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009126825A Active JP5571326B2 (en) | 2009-05-26 | 2009-05-26 | Curable composition and cured product thereof |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5571326B2 (en) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010285517A (en) * | 2009-06-10 | 2010-12-24 | Kaneka Corp | Photocurable composition, and insulating thin film and thin film transistor obtained using the same |
| JP2010285519A (en) * | 2009-06-10 | 2010-12-24 | Kaneka Corp | Photocurable composition, and insulating thin film and thin film transistor obtained using the same |
| JP2012201706A (en) * | 2011-03-23 | 2012-10-22 | Kaneka Corp | Polysiloxane-based composition |
| JP2012233117A (en) * | 2011-05-06 | 2012-11-29 | Kaneka Corp | Curable composition |
| JP2013144763A (en) * | 2012-01-16 | 2013-07-25 | Shin-Etsu Chemical Co Ltd | Thermosetting resin composition for sealing semiconductor and semiconductor device sealed by the composition |
| JP2015028179A (en) * | 2014-09-25 | 2015-02-12 | 株式会社カネカ | Photocurable composition, and insulating thin film and thin film transistor prepared using the same |
| JP2015038211A (en) * | 2014-09-25 | 2015-02-26 | 株式会社カネカ | Photocurable composition, and insulating thin film and thin film transistor obtained using the same |
| JP2015059101A (en) * | 2013-09-19 | 2015-03-30 | 四国化成工業株式会社 | Glycoluril ring-containing organosilane, glycoluril ring-containing organosiloxane, and methods for producing them |
Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57137355A (en) * | 1981-02-17 | 1982-08-24 | Shin Etsu Chem Co Ltd | Organopolysiloxane composition |
| JPH032189A (en) * | 1989-04-27 | 1991-01-08 | Siemens Ag | Organosilicon compound containing isocyanurate group and production thereof |
| JPH0314838A (en) * | 1989-03-28 | 1991-01-23 | Shin Etsu Chem Co Ltd | Silicon-modified vulcanization assistant and its preparation |
| JPH03247686A (en) * | 1990-02-27 | 1991-11-05 | Shin Etsu Chem Co Ltd | Bonding organopolysiloxane composition and cured product thereof |
| JPH06322212A (en) * | 1993-05-07 | 1994-11-22 | Shin Etsu Chem Co Ltd | Fluorubber composition |
| JP2000344895A (en) * | 1999-06-01 | 2000-12-12 | Toagosei Co Ltd | Production of curable resin |
| JP2002317048A (en) * | 2001-02-14 | 2002-10-31 | Kanegafuchi Chem Ind Co Ltd | Curing agent, curable composition, composition for optical material, optical material, method for producing the optical material and liquid crystal display and led made by using the optical material |
| JP2003073551A (en) * | 2001-09-06 | 2003-03-12 | Kanegafuchi Chem Ind Co Ltd | Curable composition, cured material and method for producing cured material |
| JP2004196958A (en) * | 2002-12-18 | 2004-07-15 | Asahi Kasei Corp | Crosslinking group-containing cage silsesquioxane |
| JP2008150506A (en) * | 2006-12-18 | 2008-07-03 | Jsr Corp | Curable resin composition and its use |
| JP2010120884A (en) * | 2008-11-20 | 2010-06-03 | Shin-Etsu Chemical Co Ltd | Organosilicon compound |
-
2009
- 2009-05-26 JP JP2009126825A patent/JP5571326B2/en active Active
Patent Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57137355A (en) * | 1981-02-17 | 1982-08-24 | Shin Etsu Chem Co Ltd | Organopolysiloxane composition |
| JPH0314838A (en) * | 1989-03-28 | 1991-01-23 | Shin Etsu Chem Co Ltd | Silicon-modified vulcanization assistant and its preparation |
| JPH032189A (en) * | 1989-04-27 | 1991-01-08 | Siemens Ag | Organosilicon compound containing isocyanurate group and production thereof |
| JPH03247686A (en) * | 1990-02-27 | 1991-11-05 | Shin Etsu Chem Co Ltd | Bonding organopolysiloxane composition and cured product thereof |
| JPH06322212A (en) * | 1993-05-07 | 1994-11-22 | Shin Etsu Chem Co Ltd | Fluorubber composition |
| JP2000344895A (en) * | 1999-06-01 | 2000-12-12 | Toagosei Co Ltd | Production of curable resin |
| JP2002317048A (en) * | 2001-02-14 | 2002-10-31 | Kanegafuchi Chem Ind Co Ltd | Curing agent, curable composition, composition for optical material, optical material, method for producing the optical material and liquid crystal display and led made by using the optical material |
| JP2003073551A (en) * | 2001-09-06 | 2003-03-12 | Kanegafuchi Chem Ind Co Ltd | Curable composition, cured material and method for producing cured material |
| JP2004196958A (en) * | 2002-12-18 | 2004-07-15 | Asahi Kasei Corp | Crosslinking group-containing cage silsesquioxane |
| JP2008150506A (en) * | 2006-12-18 | 2008-07-03 | Jsr Corp | Curable resin composition and its use |
| JP2010120884A (en) * | 2008-11-20 | 2010-06-03 | Shin-Etsu Chemical Co Ltd | Organosilicon compound |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010285517A (en) * | 2009-06-10 | 2010-12-24 | Kaneka Corp | Photocurable composition, and insulating thin film and thin film transistor obtained using the same |
| JP2010285519A (en) * | 2009-06-10 | 2010-12-24 | Kaneka Corp | Photocurable composition, and insulating thin film and thin film transistor obtained using the same |
| JP2012201706A (en) * | 2011-03-23 | 2012-10-22 | Kaneka Corp | Polysiloxane-based composition |
| JP2012233117A (en) * | 2011-05-06 | 2012-11-29 | Kaneka Corp | Curable composition |
| JP2013144763A (en) * | 2012-01-16 | 2013-07-25 | Shin-Etsu Chemical Co Ltd | Thermosetting resin composition for sealing semiconductor and semiconductor device sealed by the composition |
| JP2015059101A (en) * | 2013-09-19 | 2015-03-30 | 四国化成工業株式会社 | Glycoluril ring-containing organosilane, glycoluril ring-containing organosiloxane, and methods for producing them |
| JP2015028179A (en) * | 2014-09-25 | 2015-02-12 | 株式会社カネカ | Photocurable composition, and insulating thin film and thin film transistor prepared using the same |
| JP2015038211A (en) * | 2014-09-25 | 2015-02-26 | 株式会社カネカ | Photocurable composition, and insulating thin film and thin film transistor obtained using the same |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5571326B2 (en) | 2014-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5571326B2 (en) | Curable composition and cured product thereof | |
| JP5364267B2 (en) | Curable composition | |
| JP5519290B2 (en) | Method for producing cyclic polyorganosiloxane, curing agent, curable composition and cured product thereof | |
| JP5735423B2 (en) | Curable composition for optical materials | |
| JP5260944B2 (en) | Curable composition | |
| JP2010285507A (en) | Adhesive curable composition | |
| JP2012162666A (en) | Polysiloxane-based composition of polyhedral structure | |
| JP5367962B2 (en) | Curable composition | |
| JP2008274004A (en) | Curable resin composition and its cured material | |
| JP5539690B2 (en) | Curable composition | |
| JP2010163520A (en) | Optical material | |
| JP2012082305A (en) | Curable composition | |
| JP5646932B2 (en) | Optical adhesive and display device including the same | |
| JP2004294741A (en) | Optical lens and method for manufacturing optical lens | |
| JP2009084437A (en) | Curable composition for injection molding | |
| JP2012233118A (en) | Curable composition | |
| JP2011102348A (en) | Curable composition and cured material thereof | |
| JP2011099036A (en) | Cured product excellent in heat resistance | |
| JP2012082303A (en) | Curable composition | |
| JP2011225733A (en) | Curable composition and cured product | |
| JP2012230309A (en) | Stuck optical component | |
| JP5813357B2 (en) | Curable composition | |
| JP2010260962A (en) | Cured material, and method for producing the same | |
| JP2007224095A (en) | Curing agent, curable composition and cured product | |
| JP2011105784A (en) | Curable composition for optical material |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120321 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130321 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130423 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130617 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20130617 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140401 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140509 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140603 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140626 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5571326 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |