JP2004144532A - キャピラリー泳動分取システム及び分取方法 - Google Patents
キャピラリー泳動分取システム及び分取方法 Download PDFInfo
- Publication number
- JP2004144532A JP2004144532A JP2002307793A JP2002307793A JP2004144532A JP 2004144532 A JP2004144532 A JP 2004144532A JP 2002307793 A JP2002307793 A JP 2002307793A JP 2002307793 A JP2002307793 A JP 2002307793A JP 2004144532 A JP2004144532 A JP 2004144532A
- Authority
- JP
- Japan
- Prior art keywords
- capillary
- light
- detection
- flow cell
- capillaries
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44704—Details; Accessories
- G01N27/44717—Arrangements for investigating the separated zones, e.g. localising zones
- G01N27/44721—Arrangements for investigating the separated zones, e.g. localising zones by optical means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44704—Details; Accessories
- G01N27/44717—Arrangements for investigating the separated zones, e.g. localising zones
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Molecular Biology (AREA)
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
Abstract
【課題】キャピラリー電気泳動で、生体物質の高精度、高分離な分離が困難だった。
【解決手段】レーザー光302をフローセル3内部のキャピラリー1のキャピラリー終端2付近に直接照射して蛍光検出を行うオンカラム検出を行い、キャピラリー終端2から試料成分5が溶出後、シース液流16により試料成分5を回収点8まで移動し、試料成分5を回収する。
【効果】検出点401からキャピラリー終端2までの距離を短く出来るため、溶出時間の誤差を小さく出来、高精度な分取を行うことが出来る。
【選択図】 図3
【解決手段】レーザー光302をフローセル3内部のキャピラリー1のキャピラリー終端2付近に直接照射して蛍光検出を行うオンカラム検出を行い、キャピラリー終端2から試料成分5が溶出後、シース液流16により試料成分5を回収点8まで移動し、試料成分5を回収する。
【効果】検出点401からキャピラリー終端2までの距離を短く出来るため、溶出時間の誤差を小さく出来、高精度な分取を行うことが出来る。
【選択図】 図3
Description
【0001】
【発明の属する技術分野】
本発明はDNA、RNA、またはタンパク質等の生体物質の分析に関する。特にDNA、RNA、またはタンパク質の分離回収に有効なキャピラリー電気泳動の分取システム及び分取方法に関する。
【0002】
【従来の技術】
遺伝子の配列解析に伴い、生体物質の分析は近年ますます重要になってきている。なかでも発現遺伝子の解析は遺伝子診断や治療、創薬などに役立つと注目されている。発現遺伝子の解析は現在、スラブゲル電気泳動によりDNA試料を分離後、特定のDNA断片をゲル切り出しにより回収し、配列解析することにより行われている。しかしながらこの分離・回収といった分取作業は手間がかかり熟練を要する。またゲル切り出しに伴い、分取の精度・分離能が低くなるという問題がある。このため、キャピラリー電気泳動による分取の自動化、高速化・高分離化が望まれている。キャピラリー電気泳動の高分離能により、一塩基精度の分取が可能となれば、その後ダイレクトシーケンスなど多くの応用が広がる。
【0003】
キャピラリー電気泳動で分取を行う場合、試料を注入する側とは反対側のキャピラリー終端側に分取容器を設ける。泳動が終り、分離した試料成分がキャピラリー終端から溶出し、分取容器に達したところで試料成分を回収する。代表的な形態の主要部構成を図1に示す。キャピラリー1のキャピラリー終端2をフローセル3内に接続し、フローセル3内をシース液4で満たす。シース液4は、シース液送液チューブ9からフローセル3内に供給され、回収管6を通してフローセル3から排出される。その結果、シース液送液チューブ9、フローセル3、回収管6内にシース液流16が形成される。シース液流16の流速は時間的に精度良く一定に保たれる。電気泳動により試料はポリマー溶液104が満たされたキャピラリー1で試料成分5に分離され、検出点401にて検出される。その後キャピラリー終端2から溶出した試料成分5は、シース液流16によりフローセル3、回収管6内を通り、回収管終端すなわち回収点8より排出される。通常は回収点8には廃液容器14を設置し、回収管6から流れ出るシース液4を回収しているが、注目している試料成分5が回収点8に到達する時刻にタイミングを合わせ、回収点8に設置した廃液容器14を分取容器7に切りかえ試料成分5を回収する。タイミングの計算方法は検出点401の位置により異なり、従来以下の二つの例が報告されている。
【0004】
(a)レーザー光302をフローセル3の外部のキャピラリー1に直接照射して蛍光検出を行うオンカラム検出を行い、キャピラリー終端2から試料成分5が溶出後、シース液流16により試料成分5を回収点8まで移動し、試料成分5を回収する方式。構成は図1と同様。(Karger et al. ,Anal.Chem. 1995,67,2974−2980)。
【0005】
(b)キャピラリー終端2から試料成分5が溶出後、フローセル3内シース液4中で試料成分5をレーザー光302を照射して蛍光検出を行うシースフロー検出を行い、シース液流16により試料成分5を回収点8まで移動し、試料成分5を回収する方式。構成を図2に示す。(Irie et al. ,Electrophoresis 2000, 21, 367−374)。
【0006】
【発明が解決しようとする課題】
高分離な分取行うためには、回収点8に設置した廃液容器14を分取容器7に切りかえるタイミングを精度よく見積もる必要がある。そのためには試料成分5が検出点401から回収点8に到達するまでの到達時間を精度良く予測しなくてはならない。
【0007】
(a)の方式では到達時間は、試料成分5が検出点401からキャピラリー終端2までキャピラリー1中を電気泳動する時間である溶出時間と、キャピラリー終端2から回収点8までシース液4中を流れる時間であるシース液流時間の和として計算される。溶出時間は、検出点401からキャピラリー終端2までの距離を、測定した電気泳動速度で割ることにより求められる。電気泳動速度は、キャピラリー1の試料注入端から検出点401までのキャピラリー長である泳動距離を、試料成分5がキャピラリーの試料注入端から検出点401まで泳動されるのに要する時間である検出時間で割ることによりキャピラリー全体の平均電気泳動速度として求められる。しかしながら、電気泳動速度はポリマー溶液104の状態により変化し、経験上、測定値と±2%程度の揺らぎがある。このため溶出時間は検出点401からキャピラリー終端2の距離に比例して誤差が大きくなり、距離を短くすることは物理的な配置上難しかったため、到達時間を高精度に決めることは出来なかった。
【0008】
一方(b)の方式では到達時間は検出点401から回収点8までの距離をシース液流16の流速で割ることにより求められる。シース液流16の流速は時間的に精度良く一定に保つことができるのでシース液流時間は高精度に求まる。しかしながら、シース液流時間の間、試料成分5がシース液4中に拡散するため回収点8における分離能が低下する問題があった。シース液流16の流速を上げてシース液流時間を小さくすることにより、拡散による分離能低下を抑えることが出来るが、シース液流16の流速は感度の問題から一定以上に速くすることが出来ず、このため一塩基精度の分離能で分取を行うことは出来なかった。
【0009】
これらの理由からこれまでDNA断片を一塩基精度の高分離能で分取を行う方式はまだ確立されていない。
【0010】
【課題を解決するための手段】
上記課題を解決するために、本発明ではキャピラリー電気泳動装置のフローセル3内部を図3のような構成とした。レーザー光302をフローセル3内部のキャピラリー1に直接照射して蛍光検出を行うオンカラム検出を行い、キャピラリー終端2から試料成分5が吐出後、シース液流16により試料成分5を回収点8まで移動させ、試料成分5を回収する。
【0011】
本方式では(a)のオンカラム方式で問題であった検出点401からキャピラリー終端2までの距離を限りなく短くすることが出来るため、溶出時間の誤差を小さくすることが出来、結果として到達時間を高精度に予測することが可能である。
【0012】
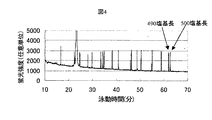
ここで、DNAを一塩基精度で分取するために必要な到達時間の予測精度を見積もる。キャピラリー1の試料注入端から検出点までの距離は360mm、温度50℃、電圧15kV、ポリマー溶液104にはPOP6、試料101にはApplied Biosystems社GeneScan 500 Roxを用い、電気泳動を行った場合の蛍光計測結果を図4に示す。490塩基長のDNA断片検出時間は61.9分であり500塩基長DNA断片検出時間は62.7分であった。これらの検出時間差は約0.8×60=48(秒)である。これより、この塩基長における一塩基あたりの検出時間間隔は48(秒)/10(塩基)=4.8(秒/一塩基)と計算できる。これを基準とすると、到達時間を一塩基精度で予測するためには、到達時間を誤差±0.5秒以下で予測できることが望ましい。
【0013】
本方式の場合、検出点401をキャピラリー終端に限りなく近づけることが出来るので、到達時間の誤差も小さく出来る。
【0014】
さらに高精度な分取を考えた場合、図5のような二点検出の方式も考えられる。図3の場合ではキャピラリー1全体の平均電気泳動速度を測定しているので、キャピラリーの位置による温度差の影響を受ける。これに対して図5のようにキャピラリー終端2近傍の二点で検出を行い、二点間の平均電気泳動速度を測定する場合(二点検出方式)、キャピラリー終端2近傍の温度がほぼ等しくなるように調整すると、キャピラリーの位置による温度差の影響はほぼなくなり、精度の高い電気泳動速度の測定が可能になる。ただし、2点検出方式でも電気泳動速度にはある程度の揺らぎが生じる。これはポリマー溶液104内のゴミ、ごく小さな気泡に起因するものと考えられており、経験上その大きさは電気泳動速度で±2%程度である。従って、二点検出の場合も検出点と終端までの距離(図5の距離X)を小さくしなければならない。
【0015】
二点検出方式の溶出時間予測誤差を考察する。図5のように、フローセル3内部のキャピラリー1に第一検出点402、第二検出点403を設ける。第二検出点403からキャピラリー終端2までの長さをx、測定した二点間平均泳動速度をv、電気泳動速度の揺らぎを±2(%)とすると、xの長さ泳動するのにかかる溶出時間の予測誤差の大きさ|Δt|は|Δt|=(1/v−1/1.02v)xと表される。
【0016】
ここで|Δt|が0.5秒以下であれば、一塩基精度の分離能でDNA断片が分取可能である。式より|Δt|を小さくするためには距離xを小さくすることが有効である。
【0017】
今500塩基長のDNA断片を分取する場合を考える。図4の電気泳動条件ではキャピラリー1の試料注入端から検出点までの距離が360mm、500塩基長の検出時間が62.7分であったので、500塩基長の電気泳動速度は360/62.7/60=0.096≒0.10(mm/秒)より、約0.10 mm/秒と測定された。図6は溶出時間予測誤差の大きさ|Δt|と溶出時間tをxの距離に対してプロットしたものである。xに比例してΔtは増加し、|Δt|を0.5秒以下とするためには、距離xは2.6 mm以下でなくてはならないことがわかる。ここでは、図5の装置を用いて説明したが、図4の装置、即ち1点検出の場合には、検出点401とキャピラリー終端2と間の長さをxとする。このときも、|Δt|を0.5秒以下とするためには、距離xは2.6 mm以下でなくてはならない。
【0018】
しかしながら、図1に示したようにフローセル3の外部でオンカラム検出を行う従来法では、検出系、容器の配置上の問題より、xを2.6 mm以下の長さにすることは難しい。ここでxは検出点401からキャピラリー終端2までの長さを表す。実際従来法(Karger et al. ,Anal.Chem.1995,67,2974−2980)ではxは10.0 (mm)であり、上記の計算に合わせて考えると溶出時間予測誤差は約±2.0秒にもなる。一塩基精度の分取に必要な予測時間精度は誤差±0.5秒であるため、従来法では一塩基の精度で溶出時間を予測することはできない。
【0019】
本方式のようにフローセル3内部のキャピラリー1上に直接照射してオンカラム検出を行うことにより、検出点401からキャピラリー終端2までの泳動距離を短くできる。その結果、溶出時間の予測誤差が小さくなり、検出点401から回収点8までの到達時間を高精度に求めることができる。また、キャピラリー1上で検出することから、シース液流16の流速を大きくしても検出感度に対する影響はないため、拡散の影響を抑えることが出来、高分離に分取を行うことが出来る。さらに検出点401を二点以上設けることにより電気泳動速度をより正確に予測し、到達時間の精度を上げることも可能である。
【0020】
なお、上記は蛍光を用いた検出について説明したが、勿論、重水素ランプや紫外線レーザーなどの紫外線光源を用いて、検出点401に紫外線を照射し、通過した紫外線の光量を計測することにより、吸収を検出しても良い。
【0021】
また、上記は、DNAの分離について説明したが、DNAの他、RNAや蛋白質でも良い。
【0022】
以上のように、本発明ではフローセル内でオンカラム検出を行うことにより、x≦2.6 mmを実現し、溶出時間予測誤差±0.5秒以下により1塩基分離の分取を可能とするシステムを提供する。これにより、その後の工程で精製する手間がなくなり、例えばDNA断片が一塩基の違いで分取できると、分取した試料を用いたダイレクトシーケンスを行うことができる。
【0023】
【発明の実施の形態】
(実施例1)
本実施例では生体物質の試料として、塩基長の異なる複数の蛍光標識DNA断片を混合したDNA試料を用い、キャピラリー電気泳動により塩基長違いで分離後、各DNA断片をそれぞれ回収することを目的とした。
【0024】
装置構成を図7に示す。装置はキャピラリー1、温調板10、シース液容器11、シース液送液チューブ9、フローセル3、回収管6、試料注入側ユニット100、終端側ユニット200、検出部ユニット300からなる。試料は試料注入側ユニット100からキャピラリー1内に注入され、キャピラリー1の両端に電圧を印加することで、キャピラリー1内を終端側ユニット200に向かって電気泳動し、電気泳動速度の違いにより試料成分5に分離する。試料成分5は検出部ユニット300により検出された後、キャピラリー終端側ユニット200で回収される。
【0025】
キャピラリー1には外径360μm、内径50μm、長さ360 mmのポリイミド被覆石英管(ポリマイクロ社)を用いた。本実施例においてはキャピラリー1として断面が丸型の石英管を用いたが、断面が四角型の石英管を用いても良い。キャピラリー1中央部は温調板10により温度を調節した。温度は50℃とした。
【0026】
試料注入側ユニット100の詳細を図8に示す。容器110上に試料101、バッファー102、純水103、ポリマー溶液104、シリンジ105を用意し、容器110はY,Z方向に移動可能な基台106に上に設置した。試料101には161塩基長、201塩基長、271塩基長、363塩基長、364塩基長、421塩基長、489塩基長、562塩基長の8種類の蛍光標識DNA断片が混合した溶液を用いた。濃度はそれぞれ10 f mol/μlであった。バッファー102にはApplied Biosystems社3700 bufferを用いた。ポリマー溶液104にはApplied Biosystems社POP6を用いた。キャピラリー1の試料注入端111近傍に負電極107を設けた。
【0027】
終端側ユニット200の詳細を図9に示す。回収管6には長さ70 mm、内径500μmであるステンレスの中空管を用い、グランド電極203と繋げた。グランド電極は電気的に常にグランドに落ちているものとする。回収管6の下には受け皿204と分取容器7を設けた。受け皿204はX,Z方向に駆動可能であり、廃液チューブ205を介して廃液容器14に繋がっている。分取容器7はX,Y,Z方向に駆動可能な分取容器台202上に設置した。分取容器7には384ウェルのタイタープレート(Applied Biosystems社384 plate)を用いた。本実施例では回収する試料成分5が8種類あり、それぞれを別のウェルに回収するよう駆動させた。
【0028】
フローセル3内の構成は図5と同様である。フローセル3は石英製とし、内部の断面積は1 mm×1 mmとした。キャピラリー1のキャピラリー終端2から10 mmの区間のポリイミド被覆を剥ぎ取り、この区間内に二点の検出点402、403をおいた。第一検出点402と第二検出点403との距離は5 mm、第二検出点403からキャピラリー終端2までの距離を2.5 mmとした。またキャピラリー終端2と回収管入り口15の距離は2 mmとした。それぞれの検出点で試料成分5の蛍光分子を励起出来るよう、第一検出点402、第二検出点403にそれぞれフローセル3とキャピラリー1を通して、第一レーザー光351、第二レーザー光352を照射した。シース液4にはAppliedBiosystems社3700 bufferを用いた。シース液4の流量は1μl / 秒とした。
【0029】
図10は正面から見た検出部ユニット300の概略図である。レーザー光源301から発したレーザー光302をミラー303により方向を調整し、ピンホール304、λ/2波長板305を通し、ウォラストンプリズム306に入射させた。分離角5°のウォラストンプリズム306によりレーザー光302を二つのレーザー光に分割し、それぞれを第一レーザー光351、第二レーザー光352とした。分割後シャッター307を通し、集光レンズ308を用いてフローセル3内部のキャピラリー1内に第一レーザー光351、第二レーザー光352をそれぞれ集光させた。ウォラストンプリズム306の中心位置と集光レンズ308との距離を集光レンズ308の焦点距離と同じとした。安全のためキャピラリー1を通過した第一レーザー光351、第二レーザー光352はレーザーストッパー309に入射させ、外部への反射、散乱がないよう留意した。レーザー光源301にはCoherent社Sapphire 488−20を用いた。レーザ光波長は488 nm、レーザー強度は20 mWであった。ウォラストンプリズム306にはシグマ光機製、分離角5°のものを用いた。集光レンズ308にはφ= 15 mm、f = 40 mmのレンズを用いた。
【0030】
図11は図10の右側方から見た検出部ユニット300の概略図である。第一検出点402、第二検出点403の二点の検出点に対し、一つの対物カメラレンズ310を用いて両検出点からの蛍光を受光する。対物カメラレンズ310にはオリンパスF 1.2、f = 50 mmのものを用いた。両検出点からの蛍光は対物カメラレンズ310により平行光束にされた後、ノッチフィルター311を透過し、結像カメラレンズ312によって、CCD検出器313上に結像された。ノッチフィルター311にはKAISER社SuperNotch−Plus 488 nm用を用いた。このノッチフィルターにより第一レーザー光351、第二レーザー光352の光を遮ることができる。またノッチフィルター311の代わりにレーザー波長をカットし、蛍光波長を透過させるロングパスフィルターを用いても良い。結像カメラレンズ312にはニコンF 1.4、f=50 mmのカメラレンズを用い、CCD検出器313にはAndor社製CCDを用いた。CCD検出器313で検出したシグナルは解析用コンピューター500に送り解析を行った。
【0031】
分取操作の手順を図12に示す。試料注入側ユニット100で、キャピラリー1の試料注入端111を試料容器110内のポリマー溶液104に浸し、シリンジ105によってポリマー溶液104を加圧し、キャピラリー1内にポリマー溶液104を充填した。充填の際にはOリング108がキャピラリー1のポリマー充填用ふた109と密着させ、加圧状態にあるポリマー溶液104を確実にキャピラリー1内に充填させた。一回のポリマー充填量は5μlとした。充填されたポリマー溶液104の余剰分はフローセル3内部のキャピラリー終端2により排出され、シース液流16により回収管6を通じて流し出した。ポリマー溶液104の充填はキャピラリー終端2から行う場合、フローセル3内を通じてポリマー溶液104を充填することになるが、フローセル3にはキャピラリー1以外に回収管6、シース液送液チューブ9が接続されており、ポリマー溶液104を加圧し、充填することが困難である。本実施例のように試料注入側からポリマー充填を行うことでポリマー溶液104を加圧し、充填することが容易となった。ポリマー充填後、キャピラリー1の試料注入端111及び負電極107を純水103に浸して洗浄し、試料101に浸した。終端側ユニット200のグランド電極203はグランドに落とし、負電極107に電圧−1kV印加することによりキャピラリー1両端に電圧を印加した。DNAは負に帯電しているので、DNA試料は試料注入側から終端側に向かって泳動し、試料はキャピラリー1内に注入される。15秒の電圧印加により試料101をキャピラリー1内に注入した。試料注入後キャピラリー1の試料注入端111、負電極107を純水103に浸した後、バッファー102に浸した。終端側ユニット200のグランド電極203はグランドに落とし、負電極107に電圧を−15 kV印加することによりキャピラリー1両端に電圧を印加して、電気泳動を行った。DNA試料は電気泳動により塩基長違いで試料成分5に分離される。
【0032】
第一検出点402、第二検出点403にそれぞれ第一レーザー光351、第二レーザー光352が照射され、試料成分5が通過する際にDNA断片に標識された蛍光分子が励起される。試料成分5からの発光蛍光はCCD検出器313で検出され、検出したシグナルは解析用コンピューター500に送られる。それぞれ検出点ごとにシグナルの時間変化を記録した。目的DNA断片が電気泳動され、第一検出点での時刻をt1、第二検出点での時刻をt2で検出された場合、二点間の平均電気泳動速度V1は検出点間の距離Δdを検出時間差(t2−t1)で割ったものであるから、V1=Δd/(t2−t1)である。第二検出点403からキャピラリー終端2までの距離をxとすると、溶出時間TaはTa=x/V1により求められる。このTaは各塩基長のDNA断片ごとに求めることが出来る。
【0033】
例えばt2=3100(秒)、t1=3050(秒)だった場合、Δd=5mmより泳動速度V1=5/(3100−3050)=0.1mm/秒となり、x=2.5mmよりTa=2.5/0.1=25(秒)となる。
【0034】
DNA断片はキャピラリー終端2から溶出した後、シース液流16によりフローセル3内を流れ、回収管6を通って回収点8に到達する。DNA断片がキャピラリー終端2から回収点8までに移動するのに要する時間をシース液流時間Tbとする。Tbはフローセル3中を流れる時間Tb1と回収管6中を通過する時間Tb2に分けることが出来る。フローセル3の内部断面積は1 mm×1 mm、シース液流16の流量は1μl/ 秒であるから、フローセル3中のシース液流16の平均流速は1 mm/秒である。キャピラリー終端2から回収管入り口15までの距離は2 mmであるのでTb1=2 (mm)/1(mm/ 秒)=2 (秒)である。
【0035】
一方、回収管の内径は500μm、流量が1μl/秒であるため、回収管6中のシース液流16の平均流速は1/(0.25×0.25×3.14)=5.1 mm/ 秒である。回収管6の長さは70 mmであるのでTb2はTb2=70/ 5.1=13.7(秒)である。
よってTb=Tb1+Tb2=2+13.7=15.7 (秒)である。
【0036】
以上より第二検出点403から回収点8までの時間、すなわち到達時間はTa+Tbで表され、Ta+Tb=25+13.7=38.7秒となる。
【0037】
なお、これらの解析は、解析部(解析用コンピュータ500)にて行われる。
【0038】
通常回収管6から流れ出るシース液4は受け皿204から廃液チューブ205を通じて外部の廃液容器14に送られる。分取を行う際は解析用コンピューター500から駆動命令を出し、目的DNA断片の到達時間に合わせて受け皿204と切りかえ、分取容器7を回収点8に設置し、目的DNA断片とともにシース液4を分取容器7の384プレートの内の一つのウェルに回収する。本実施例では受け皿204を分取容器7に切りかえてから、分取容器7を受け皿204に再び戻すまでの間の時間は5秒とした。すなわちあるDNA断片の到達時間が38.7秒とすると、第二検出点403で検出してから36.2秒後に受け皿204から分取容器7に切りかえ、41.2秒後に再び受け皿204に戻す。
【0039】
本実施例で回収した8種のDNA断片をPCRで増幅し、再びキャピラリー電気泳動を行うことによって分取精度の確認を行った。
【0040】
本実施例の特長はレーザー光をフローセル3内部でキャピラリー1上をオンカラムに照射し、検出することにより、第二検出点403とキャピラリー終端2までの距離を2.5 mmと短くでき、分取を行うためのタイミングの誤差を小さく出来ることである。また二点検出を行っていることからキャピラリー終端2付近での二点間の電気泳動速度を測定出来る。以上により正確に到達時間を予測することができ、一塩基精度の分取が可能となる。
【0041】
本実施例においては、試料成分5の二点の検出点における検出時間差から電気泳動速度を求めたが、検出点における試料成分5の分子の動きをCCD検出器により直接イメージングし、分子の電気泳動速度を求めても良い。
【0042】
また本実施例では試料にDNAを用いたが、蛍光分子を標識した蛋白質やRNAを用いても良い。また本実施例では電気泳動分離した試料成分5を蛍光検出を用いて計測したが、UV吸収検出により計測しても良い。例えば、レーザー光源301にUVレーザーを用い、試料に蛍光標識されていない生体物質を用いても良い。
(実施例2)
本実施例は検出点を一つとし、装置構成を簡易化することを目的とした。検出点をキャピラリー終端付近におくことにより、溶出時間の予測誤差を小さくすることが可能であり、到達時間を正確に予測することが出来る。
【0043】
装置構成は、実施例1の場合と検出部ユニット300の構成のみ異なり、それ以外は同等である。図13に本実施例の検出部ユニット300の構成を示す。レーザー光源301から発したレーザー光302をミラー303により方向を調整し、ピンホール304、シャッター307を通し、集光レンズ308を用いてフローセル3内部のキャピラリー1の検出点401に照射した。
【0044】
フローセル3内の構成は図3と同等である。検出点401とキャピラリー終端2の間隔を0.12 mmとした。
【0045】
分取の手順を図14に示す。検出とタイミングの計算方法以外は実施例1と同等である。異なる部分を以下に説明する。試料成分5を検出した時間をTallとし、キャピラリー1の試料注入端111から検出点401までの距離をLとすると、Lの距離の平均電気泳動速度Vallは、Vall=L/Tallにより求めることが出来る。検出点401からキャピラリー終端2までの距離をxとし、xの間の電気泳動速度がVallと同じであると仮定し、溶出時間TaをTa=x/Vallにより求める。x=0.12(mm)、L=360(mm)、Tall=3000(秒)のとき、VallはVall=360/3000=0.12(mm/秒)となり、Ta=0.12/0.12=1.0(秒)である。またシース液流16を移動する時間すなわちシース液流時間Tbは、実施例1と同様であるため15.7(秒)である。これより到達時間はTa+Tb=15.7+1.0=16.7(秒)と予想される。これらの解析は、解析部(解析用コンピュータ500)にて行われる。
【0046】
解析用コンピュータ500により到達時間にタイミングを合わせ受け皿204から分取容器7に切りかえ、目的の試料成分を回収する。
【0047】
本方式の特徴はフローセル3内部でオンカラム検出することにより、検出点とキャピラリー終端までの距離を十分短く出来、溶出時間の予測誤差を小さく出来るため、高精度に分取を行うことが出来る。
(実施例3)
本実施例では異なる複数の蛍光分子で標識された生体試料をそれぞれ識別しながら検出出来るように発光蛍光をグレーティングにより波長分散して蛍光検出を行った。
【0048】
装置構成は実施例1と同等であるが、以下に示す検出部ユニット300の構成が異なる。
【0049】
本実施例の検出部ユニット構成を図15に示す。第一検出点402、第二検出点403からの蛍光を対物カメラレンズ310、ノッチフィルター311、透過型グレーティング314を通し、結像カメラレンズ312によりCCD検出器313上に結像させる。2つの検出点それぞれからの波長分散された発光蛍光シグナルを解析用コンピューター500に送り、データを解析する。
【0050】
図16は、図15の検出部ユニット300を左側面方向から見た図である。図16に示したように、透過型グレーティング314の配置により、第一検出点402、第二検出点403からの発光蛍光の波長分散方向315、及び波長分散角θを変化させることができる。ここで、波長分散角θは、レーザー光351、352の進行方向と波長分散方向のなす角度であり、本実施例では0°<θ≦90°である。
【0051】
また、CCD検出器313の画素配列方向を波長分散方向一致させることにより、各発光の波長分散された蛍光スペクトルを容易に取得することができる。本実施例では、レーザー光の波長である488 nmの光は、ノッチフィルター311により遮断されるため、CCD検出器313に入射しない。しかし、488 nmのレーザー光によって、シース液4、及びポリマー溶液104に含まれる水のラマン散乱が584 nm付近に生じる。これらのラマン散乱光はCCD検出器313に入射し、蛍光スペクトル上に重なり、蛍光検出の際の背景光スペクトルとなる。波長分散角をθ=0°とした場合、蛍光スペクトル上には、蛍光検出点402、または403におけるキャピラリー1内部のポリマー溶液104由来のラマン散乱光だけでなく、フローセル3内部のレーザー光351、または352上のシース液4由来のラマン散乱光が重なる。この場合の背景光スペクトルを図17Aに示した。このように背景光強度が非常に高くなるため、蛍光検出の障害になり、検出感度の低下、及びダイナミックレンジの縮小を招く。そこで、本実施例では、θ=45°とすることにより、フローセル3内部のレーザー光351、または352上のシース液4由来のラマン散乱光が蛍光スペクトル上に重ならないようにした。この場合の背景光スペクトルを図17Bに示した。このように、蛍光検出点402、または403におけるキャピラリー1内部のポリマー溶液104由来のラマン散乱光だけが蛍光スペクトルに重なるため、背景光強度が図17Aと比較して10分の1程度に低減することができた。その結果、高感度、かつ広いダイナミックレンジな蛍光検出が可能になった。
【0052】
波長分散角をθ=90°(ほぼ90°)、すなわち波長分散方向315をキャピラリー1の軸方向と一致させても同様の効果が得られる。ただし、この場合、蛍光検出点402及び403からの各発光の各蛍光スペクトルがCCD検出器313の同一画素上に重なってしまう可能性がある。この可能性を回避するためには、二点の検出点の相対距離を十分に離せば良い。
【0053】
本実施例では、二点検出の場合を示したが、図13に示した一点検出の場合にも同様の検出ユニットの構成により、同様の効果が得られる。
(実施例4)
本実施例ではキャピラリー電気泳動ならびに分取操作のスループットを上げることを目的とし、複数のキャピラリーをアレイ化し、全てのキャピラリーについて電気泳動ならびに分取操作を並列して行えるようにした。レーザー光をキャピラリーアレイに対して側面入射させ、全てのキャピラリーについて同時にレーザー照射、蛍光検出する方式(特開平9−288088参照)を用いた例を示す。
【0054】
本実施例の全体の装置構成を図18に示す。操作、手順は実施例1と同等であり、それぞれのキャピラリーごとに独立して行う。
【0055】
構成要素は実施例1と同等である。キャピラリー1は4本ならべ、キャピラリーアレイとした。4本ともに均等に温度調節が出来るようキャピラリー1同士が重ならないよう配置した。キャピラリー1には外径200μm、内径100μm、長さは36 cmのポリイミド被覆石英管(ポリマイクロ社)を用いた。
【0056】
試料注入側ユニット100の詳細を図19に示す。試料容器501に試料101をキャピラリーと同じ数だけ用意し、バッファー容器502にバッファー102を入れ、純水容器503に純水103を入れ、ポリマー容器504にポリマー溶液104をいれ、シリンジ105をセットした。これらの容器をX,Z方向に駆動可能な基台106上に設置した。
【0057】
次にフローセル3内の構造を図20に示す。各キャピラリー1をレーザー光と垂直に図のように同一平面上にならべて配置した。第一レーザー光351、第二レーザー光352が各キャピラリー1の第一検出点402、第二検出点403において集光されるように、各キャピラリー1間にロッドレンズ13を配置した。ロッドレンズ13には石英製で屈折率はキャピラリー1と同じ1.46のものを用いた。またシース液の屈折率は1.33、ポリマー溶液104の屈折率は1.41のものを用いた。これらの条件により4本全てのキャピラリー内に効率的にレーザー光が集光される(Kambara et al. ,Electrophoresis 1999 20 539−546)。またフローセル内の各キャピラリー1に対向する位置にそれぞれ回収管6を配置した。回収管6にはキャピラリー1と同じポリイミド被覆石英管を使用し、その長さは70 mmとした。各回収管6の間にもそれぞれロッドレンズ13を配置した。終端側電極203はフローセル3内部のシース液4に浸しシース液4全体をグランドにした。検出部ユニットの他の構成は実施例3と同じとした。ただしθ=90°、すなわち波長分散方向315はレーザー光にほぼ垂直方向とした。このとき二つの検出点それぞれからのシグナルが波長分散した後にCCD検出器313上で重なりあわないよう二点の検出点の相対距離を十分に離した。また各回収管6は回収点8において、a=8 mm間隔で直線上に配列され、回収管全長は同一になるように各回収管6を曲げた。
【0058】
終端側にユニット構成を図21に示す。各回収管6に対応させてそれぞれの分取容器7をa=8 mm間隔で配列した。4つのキャピラリーについてそれぞれ独立に分取操作できるように、4つの分取容器台202の上に各分取容器7をそれぞれ設置し、XZ方向にそれぞれ別個に駆動できるようにした。分取の際は解析用PCで解析したデータに合わせ、受け皿204が移動し、分取容器7により目的の試料成分5を回収する。キャピラリーごとに検出し、駆動命令を発するので、それぞれの試料の分取操作を並列に行うことが出来る。
【0059】
以上複数のキャピラリーをアレイ化することにより、キャピラリーの本数分と同じだけスループットを向上することが出来た。
(実施例5)
本実施例ではキャピラリー電気泳動ならびに分取操作のスループットを上げることを目的とし、複数のキャピラリーをアレイ化し、全てのキャピラリーが電気泳動ならびに分取操作を並列して行えるようにした。レーザーをスキャンすることによって全てのキャピラリーのレーザー照射、蛍光検出を順番に行う方式(参照Anal.Chem.1992 Vol.64,No.18)を用いた例を示す。
【0060】
基本的な構成は実施例4に準ずる。手順は実施例2と同様である。検出部ユニット300が実施例4と異なる。まずフローセル3内の構造を図22に示す。4本のキャピラリー1を密着させて同一平面上にならべた。検出点は各キャピラリーについて一点とし、キャピラリー終端2より0.12 mmの位置に置いた。実施例2同様、検出点401をキャピラリー終端2に近づけ、溶出時間の予測誤差が小さくなるようにした。レーザー光は図22の紙面とほぼ垂直方向から各キャピラリー照射され、蛍光検出はレーザー光302の照射と同じ側から行う。検出部ユニット300の構造の概略図を図23に示す。レーザー光源301から出たレーザー光302は、第一ダイクロイックミラー321を通過し、ミラー303で反射され、対物レンズ322により集光され、キャピラリー1の検出点に照射される。第一ダイクロイックミラー321はレーザー光488 nmは通過し、520 nm以上の光は反射する。ミラー303と対物レンズ322は駆動ユニット320を構成し、各キャピラリー1が並んでいる配列方向と同方向に高速往復駆動することが出来る。これにより各キャピラリーをレーザー光302で次々とスキャン照射する。キャピラリー1の検出点401からの発光蛍光は同じ対物レンズ322で集光する。蛍光はミラー303で反射され、第一ダイクロイックミラー321で反射される。次に第二ダイクロイックミラーで2種類の蛍光波長に分割され、集光レンズ308を通り、ピンホール304を通過し、CCD検出器313で受光される。この構成では蛍光波長の異なる2種類の生体物質を検出できる。検出したシグナルを解析用コンピューター500に送り、データ解析を行う。他の装置構成は実施例4と同様であり、分取の手順は実施例2と同様である。
【0061】
以上アレイ化することによりキャピラリーの本数分スループットを向上することが出来た。
【0062】
【発明の効果】
本発明により高精度・高分離の分取が可能となる。これにより高精度に生体物質を分取することができる。
【図面の簡単な説明】
【図1】従来のオンカラム検出によるキャピラリー電気泳動分取システムの主要部構成を示す図。
【図2】従来のシースフロー検出によるキャピラリー電気泳動分取システムの主要部構成を示す図。
【図3】本発明のキャピラリー電気泳動分取システムの主要部構成を示す図。
【図4】キャピラリー電気泳動によるDNA長さ分離の蛍光計測結果を示す図。
【図5】二点検出方式を採用した本発明のキャピラリー電気泳動分取システムの主要部構成を示す図。
【図6】溶出時間予測誤差の大きさと検出点から終端までの距離の関係を示す図。
【図7】本発明の実施形態1における装置構成を示す図。
【図8】本発明の実施形態1における試料注入側ユニットの詳細を示す図。
【図9】本発明の実施形態1における終端側ユニットの詳細を示す図。
【図10】本発明の実施形態1における検出部ユニットを正面から見た場合の概略を示す図。
【図11】本発明の実施形態1における検出部ユニットを右側方から見た場合の概略を示す図。
【図12】本発明の実施形態1における分取操作の手順を示す図。
【図13】本発明の実施形態2における検出部ユニットの概略を示す図。
【図14】本発明の実施形態2における分取操作の手順を示す図。
【図15】本発明の実施形態3における検出部ユニットの概略を示す図。
【図16】本発明の実施形態3における主要部構成を示す図。
【図17】本発明の実施形態3におけるレーザー光の進行方向と波長分散方向のなす角度をかえた場合の背景光スペクトルの強度を示す図。
【図18】本発明の実施形態4における装置構成を示す図。
【図19】本発明の実施形態4における試料注入側ユニットの詳細を示す図。
【図20】本発明の実施形態4における主要部構成を示す図。
【図21】本発明の実施形態4における終端側ユニットの詳細を示す図。
【図22】本発明の実施形態5における主要部構成を示す図。
【図23】本発明の実施形態5における検出部ユニットの概略を示す図。
【符号の説明】
1…キャピラリー
2…キャピラリー終端
3…フローセル
4…シース液
5…試料成分
6…回収管
7…分取容器
8…回収点
9…シース液送液チューブ
10…温調板
11…シース液容器
12…キャピラリーアレイ
13…ロッドレンズ
14…廃液容器
15…回収管入り口
16…シース液流
100…試料注入側ユニット
200…終端側ユニット
300…検出部ユニット
101…試料
102…バッファー
103…純水
104…ポリマー溶液
105…シリンジ
106…基台
107…試料注入側電極
108…O−リング
109…ポリマー充填用ふた
110…試料容器
111…試料注入端
201…分取容器
202…分取容器台
203…終端側電極
204…受け皿
205…廃液チューブ
301…レーザー光源
302…レーザー光
303…ミラー
304…ピンホール
305…λ/2波長板
306…ウォラストンプリズム
307…シャッター
308…集光レンズ
309…レーザーストッパー
310…対物カメラレンズ
311…ノッチフィルター
312…結像カメラレンズ
313…CCD検出器
314…透過型グレーティング
315…波長分散方向
320…駆動ユニット
321…第一ダイクロイックミラー
322…対物レンズ
323…第二ダイクロイックミラー
351…第一レーザー光
352…第二レーザー光
401…検出点
402…第一検出点
403…第二検出点
500…解析用コンピューター
501…試料容器
502…バッファー容器
503…純水容器
504…ポリマー容器。
【発明の属する技術分野】
本発明はDNA、RNA、またはタンパク質等の生体物質の分析に関する。特にDNA、RNA、またはタンパク質の分離回収に有効なキャピラリー電気泳動の分取システム及び分取方法に関する。
【0002】
【従来の技術】
遺伝子の配列解析に伴い、生体物質の分析は近年ますます重要になってきている。なかでも発現遺伝子の解析は遺伝子診断や治療、創薬などに役立つと注目されている。発現遺伝子の解析は現在、スラブゲル電気泳動によりDNA試料を分離後、特定のDNA断片をゲル切り出しにより回収し、配列解析することにより行われている。しかしながらこの分離・回収といった分取作業は手間がかかり熟練を要する。またゲル切り出しに伴い、分取の精度・分離能が低くなるという問題がある。このため、キャピラリー電気泳動による分取の自動化、高速化・高分離化が望まれている。キャピラリー電気泳動の高分離能により、一塩基精度の分取が可能となれば、その後ダイレクトシーケンスなど多くの応用が広がる。
【0003】
キャピラリー電気泳動で分取を行う場合、試料を注入する側とは反対側のキャピラリー終端側に分取容器を設ける。泳動が終り、分離した試料成分がキャピラリー終端から溶出し、分取容器に達したところで試料成分を回収する。代表的な形態の主要部構成を図1に示す。キャピラリー1のキャピラリー終端2をフローセル3内に接続し、フローセル3内をシース液4で満たす。シース液4は、シース液送液チューブ9からフローセル3内に供給され、回収管6を通してフローセル3から排出される。その結果、シース液送液チューブ9、フローセル3、回収管6内にシース液流16が形成される。シース液流16の流速は時間的に精度良く一定に保たれる。電気泳動により試料はポリマー溶液104が満たされたキャピラリー1で試料成分5に分離され、検出点401にて検出される。その後キャピラリー終端2から溶出した試料成分5は、シース液流16によりフローセル3、回収管6内を通り、回収管終端すなわち回収点8より排出される。通常は回収点8には廃液容器14を設置し、回収管6から流れ出るシース液4を回収しているが、注目している試料成分5が回収点8に到達する時刻にタイミングを合わせ、回収点8に設置した廃液容器14を分取容器7に切りかえ試料成分5を回収する。タイミングの計算方法は検出点401の位置により異なり、従来以下の二つの例が報告されている。
【0004】
(a)レーザー光302をフローセル3の外部のキャピラリー1に直接照射して蛍光検出を行うオンカラム検出を行い、キャピラリー終端2から試料成分5が溶出後、シース液流16により試料成分5を回収点8まで移動し、試料成分5を回収する方式。構成は図1と同様。(Karger et al. ,Anal.Chem. 1995,67,2974−2980)。
【0005】
(b)キャピラリー終端2から試料成分5が溶出後、フローセル3内シース液4中で試料成分5をレーザー光302を照射して蛍光検出を行うシースフロー検出を行い、シース液流16により試料成分5を回収点8まで移動し、試料成分5を回収する方式。構成を図2に示す。(Irie et al. ,Electrophoresis 2000, 21, 367−374)。
【0006】
【発明が解決しようとする課題】
高分離な分取行うためには、回収点8に設置した廃液容器14を分取容器7に切りかえるタイミングを精度よく見積もる必要がある。そのためには試料成分5が検出点401から回収点8に到達するまでの到達時間を精度良く予測しなくてはならない。
【0007】
(a)の方式では到達時間は、試料成分5が検出点401からキャピラリー終端2までキャピラリー1中を電気泳動する時間である溶出時間と、キャピラリー終端2から回収点8までシース液4中を流れる時間であるシース液流時間の和として計算される。溶出時間は、検出点401からキャピラリー終端2までの距離を、測定した電気泳動速度で割ることにより求められる。電気泳動速度は、キャピラリー1の試料注入端から検出点401までのキャピラリー長である泳動距離を、試料成分5がキャピラリーの試料注入端から検出点401まで泳動されるのに要する時間である検出時間で割ることによりキャピラリー全体の平均電気泳動速度として求められる。しかしながら、電気泳動速度はポリマー溶液104の状態により変化し、経験上、測定値と±2%程度の揺らぎがある。このため溶出時間は検出点401からキャピラリー終端2の距離に比例して誤差が大きくなり、距離を短くすることは物理的な配置上難しかったため、到達時間を高精度に決めることは出来なかった。
【0008】
一方(b)の方式では到達時間は検出点401から回収点8までの距離をシース液流16の流速で割ることにより求められる。シース液流16の流速は時間的に精度良く一定に保つことができるのでシース液流時間は高精度に求まる。しかしながら、シース液流時間の間、試料成分5がシース液4中に拡散するため回収点8における分離能が低下する問題があった。シース液流16の流速を上げてシース液流時間を小さくすることにより、拡散による分離能低下を抑えることが出来るが、シース液流16の流速は感度の問題から一定以上に速くすることが出来ず、このため一塩基精度の分離能で分取を行うことは出来なかった。
【0009】
これらの理由からこれまでDNA断片を一塩基精度の高分離能で分取を行う方式はまだ確立されていない。
【0010】
【課題を解決するための手段】
上記課題を解決するために、本発明ではキャピラリー電気泳動装置のフローセル3内部を図3のような構成とした。レーザー光302をフローセル3内部のキャピラリー1に直接照射して蛍光検出を行うオンカラム検出を行い、キャピラリー終端2から試料成分5が吐出後、シース液流16により試料成分5を回収点8まで移動させ、試料成分5を回収する。
【0011】
本方式では(a)のオンカラム方式で問題であった検出点401からキャピラリー終端2までの距離を限りなく短くすることが出来るため、溶出時間の誤差を小さくすることが出来、結果として到達時間を高精度に予測することが可能である。
【0012】
ここで、DNAを一塩基精度で分取するために必要な到達時間の予測精度を見積もる。キャピラリー1の試料注入端から検出点までの距離は360mm、温度50℃、電圧15kV、ポリマー溶液104にはPOP6、試料101にはApplied Biosystems社GeneScan 500 Roxを用い、電気泳動を行った場合の蛍光計測結果を図4に示す。490塩基長のDNA断片検出時間は61.9分であり500塩基長DNA断片検出時間は62.7分であった。これらの検出時間差は約0.8×60=48(秒)である。これより、この塩基長における一塩基あたりの検出時間間隔は48(秒)/10(塩基)=4.8(秒/一塩基)と計算できる。これを基準とすると、到達時間を一塩基精度で予測するためには、到達時間を誤差±0.5秒以下で予測できることが望ましい。
【0013】
本方式の場合、検出点401をキャピラリー終端に限りなく近づけることが出来るので、到達時間の誤差も小さく出来る。
【0014】
さらに高精度な分取を考えた場合、図5のような二点検出の方式も考えられる。図3の場合ではキャピラリー1全体の平均電気泳動速度を測定しているので、キャピラリーの位置による温度差の影響を受ける。これに対して図5のようにキャピラリー終端2近傍の二点で検出を行い、二点間の平均電気泳動速度を測定する場合(二点検出方式)、キャピラリー終端2近傍の温度がほぼ等しくなるように調整すると、キャピラリーの位置による温度差の影響はほぼなくなり、精度の高い電気泳動速度の測定が可能になる。ただし、2点検出方式でも電気泳動速度にはある程度の揺らぎが生じる。これはポリマー溶液104内のゴミ、ごく小さな気泡に起因するものと考えられており、経験上その大きさは電気泳動速度で±2%程度である。従って、二点検出の場合も検出点と終端までの距離(図5の距離X)を小さくしなければならない。
【0015】
二点検出方式の溶出時間予測誤差を考察する。図5のように、フローセル3内部のキャピラリー1に第一検出点402、第二検出点403を設ける。第二検出点403からキャピラリー終端2までの長さをx、測定した二点間平均泳動速度をv、電気泳動速度の揺らぎを±2(%)とすると、xの長さ泳動するのにかかる溶出時間の予測誤差の大きさ|Δt|は|Δt|=(1/v−1/1.02v)xと表される。
【0016】
ここで|Δt|が0.5秒以下であれば、一塩基精度の分離能でDNA断片が分取可能である。式より|Δt|を小さくするためには距離xを小さくすることが有効である。
【0017】
今500塩基長のDNA断片を分取する場合を考える。図4の電気泳動条件ではキャピラリー1の試料注入端から検出点までの距離が360mm、500塩基長の検出時間が62.7分であったので、500塩基長の電気泳動速度は360/62.7/60=0.096≒0.10(mm/秒)より、約0.10 mm/秒と測定された。図6は溶出時間予測誤差の大きさ|Δt|と溶出時間tをxの距離に対してプロットしたものである。xに比例してΔtは増加し、|Δt|を0.5秒以下とするためには、距離xは2.6 mm以下でなくてはならないことがわかる。ここでは、図5の装置を用いて説明したが、図4の装置、即ち1点検出の場合には、検出点401とキャピラリー終端2と間の長さをxとする。このときも、|Δt|を0.5秒以下とするためには、距離xは2.6 mm以下でなくてはならない。
【0018】
しかしながら、図1に示したようにフローセル3の外部でオンカラム検出を行う従来法では、検出系、容器の配置上の問題より、xを2.6 mm以下の長さにすることは難しい。ここでxは検出点401からキャピラリー終端2までの長さを表す。実際従来法(Karger et al. ,Anal.Chem.1995,67,2974−2980)ではxは10.0 (mm)であり、上記の計算に合わせて考えると溶出時間予測誤差は約±2.0秒にもなる。一塩基精度の分取に必要な予測時間精度は誤差±0.5秒であるため、従来法では一塩基の精度で溶出時間を予測することはできない。
【0019】
本方式のようにフローセル3内部のキャピラリー1上に直接照射してオンカラム検出を行うことにより、検出点401からキャピラリー終端2までの泳動距離を短くできる。その結果、溶出時間の予測誤差が小さくなり、検出点401から回収点8までの到達時間を高精度に求めることができる。また、キャピラリー1上で検出することから、シース液流16の流速を大きくしても検出感度に対する影響はないため、拡散の影響を抑えることが出来、高分離に分取を行うことが出来る。さらに検出点401を二点以上設けることにより電気泳動速度をより正確に予測し、到達時間の精度を上げることも可能である。
【0020】
なお、上記は蛍光を用いた検出について説明したが、勿論、重水素ランプや紫外線レーザーなどの紫外線光源を用いて、検出点401に紫外線を照射し、通過した紫外線の光量を計測することにより、吸収を検出しても良い。
【0021】
また、上記は、DNAの分離について説明したが、DNAの他、RNAや蛋白質でも良い。
【0022】
以上のように、本発明ではフローセル内でオンカラム検出を行うことにより、x≦2.6 mmを実現し、溶出時間予測誤差±0.5秒以下により1塩基分離の分取を可能とするシステムを提供する。これにより、その後の工程で精製する手間がなくなり、例えばDNA断片が一塩基の違いで分取できると、分取した試料を用いたダイレクトシーケンスを行うことができる。
【0023】
【発明の実施の形態】
(実施例1)
本実施例では生体物質の試料として、塩基長の異なる複数の蛍光標識DNA断片を混合したDNA試料を用い、キャピラリー電気泳動により塩基長違いで分離後、各DNA断片をそれぞれ回収することを目的とした。
【0024】
装置構成を図7に示す。装置はキャピラリー1、温調板10、シース液容器11、シース液送液チューブ9、フローセル3、回収管6、試料注入側ユニット100、終端側ユニット200、検出部ユニット300からなる。試料は試料注入側ユニット100からキャピラリー1内に注入され、キャピラリー1の両端に電圧を印加することで、キャピラリー1内を終端側ユニット200に向かって電気泳動し、電気泳動速度の違いにより試料成分5に分離する。試料成分5は検出部ユニット300により検出された後、キャピラリー終端側ユニット200で回収される。
【0025】
キャピラリー1には外径360μm、内径50μm、長さ360 mmのポリイミド被覆石英管(ポリマイクロ社)を用いた。本実施例においてはキャピラリー1として断面が丸型の石英管を用いたが、断面が四角型の石英管を用いても良い。キャピラリー1中央部は温調板10により温度を調節した。温度は50℃とした。
【0026】
試料注入側ユニット100の詳細を図8に示す。容器110上に試料101、バッファー102、純水103、ポリマー溶液104、シリンジ105を用意し、容器110はY,Z方向に移動可能な基台106に上に設置した。試料101には161塩基長、201塩基長、271塩基長、363塩基長、364塩基長、421塩基長、489塩基長、562塩基長の8種類の蛍光標識DNA断片が混合した溶液を用いた。濃度はそれぞれ10 f mol/μlであった。バッファー102にはApplied Biosystems社3700 bufferを用いた。ポリマー溶液104にはApplied Biosystems社POP6を用いた。キャピラリー1の試料注入端111近傍に負電極107を設けた。
【0027】
終端側ユニット200の詳細を図9に示す。回収管6には長さ70 mm、内径500μmであるステンレスの中空管を用い、グランド電極203と繋げた。グランド電極は電気的に常にグランドに落ちているものとする。回収管6の下には受け皿204と分取容器7を設けた。受け皿204はX,Z方向に駆動可能であり、廃液チューブ205を介して廃液容器14に繋がっている。分取容器7はX,Y,Z方向に駆動可能な分取容器台202上に設置した。分取容器7には384ウェルのタイタープレート(Applied Biosystems社384 plate)を用いた。本実施例では回収する試料成分5が8種類あり、それぞれを別のウェルに回収するよう駆動させた。
【0028】
フローセル3内の構成は図5と同様である。フローセル3は石英製とし、内部の断面積は1 mm×1 mmとした。キャピラリー1のキャピラリー終端2から10 mmの区間のポリイミド被覆を剥ぎ取り、この区間内に二点の検出点402、403をおいた。第一検出点402と第二検出点403との距離は5 mm、第二検出点403からキャピラリー終端2までの距離を2.5 mmとした。またキャピラリー終端2と回収管入り口15の距離は2 mmとした。それぞれの検出点で試料成分5の蛍光分子を励起出来るよう、第一検出点402、第二検出点403にそれぞれフローセル3とキャピラリー1を通して、第一レーザー光351、第二レーザー光352を照射した。シース液4にはAppliedBiosystems社3700 bufferを用いた。シース液4の流量は1μl / 秒とした。
【0029】
図10は正面から見た検出部ユニット300の概略図である。レーザー光源301から発したレーザー光302をミラー303により方向を調整し、ピンホール304、λ/2波長板305を通し、ウォラストンプリズム306に入射させた。分離角5°のウォラストンプリズム306によりレーザー光302を二つのレーザー光に分割し、それぞれを第一レーザー光351、第二レーザー光352とした。分割後シャッター307を通し、集光レンズ308を用いてフローセル3内部のキャピラリー1内に第一レーザー光351、第二レーザー光352をそれぞれ集光させた。ウォラストンプリズム306の中心位置と集光レンズ308との距離を集光レンズ308の焦点距離と同じとした。安全のためキャピラリー1を通過した第一レーザー光351、第二レーザー光352はレーザーストッパー309に入射させ、外部への反射、散乱がないよう留意した。レーザー光源301にはCoherent社Sapphire 488−20を用いた。レーザ光波長は488 nm、レーザー強度は20 mWであった。ウォラストンプリズム306にはシグマ光機製、分離角5°のものを用いた。集光レンズ308にはφ= 15 mm、f = 40 mmのレンズを用いた。
【0030】
図11は図10の右側方から見た検出部ユニット300の概略図である。第一検出点402、第二検出点403の二点の検出点に対し、一つの対物カメラレンズ310を用いて両検出点からの蛍光を受光する。対物カメラレンズ310にはオリンパスF 1.2、f = 50 mmのものを用いた。両検出点からの蛍光は対物カメラレンズ310により平行光束にされた後、ノッチフィルター311を透過し、結像カメラレンズ312によって、CCD検出器313上に結像された。ノッチフィルター311にはKAISER社SuperNotch−Plus 488 nm用を用いた。このノッチフィルターにより第一レーザー光351、第二レーザー光352の光を遮ることができる。またノッチフィルター311の代わりにレーザー波長をカットし、蛍光波長を透過させるロングパスフィルターを用いても良い。結像カメラレンズ312にはニコンF 1.4、f=50 mmのカメラレンズを用い、CCD検出器313にはAndor社製CCDを用いた。CCD検出器313で検出したシグナルは解析用コンピューター500に送り解析を行った。
【0031】
分取操作の手順を図12に示す。試料注入側ユニット100で、キャピラリー1の試料注入端111を試料容器110内のポリマー溶液104に浸し、シリンジ105によってポリマー溶液104を加圧し、キャピラリー1内にポリマー溶液104を充填した。充填の際にはOリング108がキャピラリー1のポリマー充填用ふた109と密着させ、加圧状態にあるポリマー溶液104を確実にキャピラリー1内に充填させた。一回のポリマー充填量は5μlとした。充填されたポリマー溶液104の余剰分はフローセル3内部のキャピラリー終端2により排出され、シース液流16により回収管6を通じて流し出した。ポリマー溶液104の充填はキャピラリー終端2から行う場合、フローセル3内を通じてポリマー溶液104を充填することになるが、フローセル3にはキャピラリー1以外に回収管6、シース液送液チューブ9が接続されており、ポリマー溶液104を加圧し、充填することが困難である。本実施例のように試料注入側からポリマー充填を行うことでポリマー溶液104を加圧し、充填することが容易となった。ポリマー充填後、キャピラリー1の試料注入端111及び負電極107を純水103に浸して洗浄し、試料101に浸した。終端側ユニット200のグランド電極203はグランドに落とし、負電極107に電圧−1kV印加することによりキャピラリー1両端に電圧を印加した。DNAは負に帯電しているので、DNA試料は試料注入側から終端側に向かって泳動し、試料はキャピラリー1内に注入される。15秒の電圧印加により試料101をキャピラリー1内に注入した。試料注入後キャピラリー1の試料注入端111、負電極107を純水103に浸した後、バッファー102に浸した。終端側ユニット200のグランド電極203はグランドに落とし、負電極107に電圧を−15 kV印加することによりキャピラリー1両端に電圧を印加して、電気泳動を行った。DNA試料は電気泳動により塩基長違いで試料成分5に分離される。
【0032】
第一検出点402、第二検出点403にそれぞれ第一レーザー光351、第二レーザー光352が照射され、試料成分5が通過する際にDNA断片に標識された蛍光分子が励起される。試料成分5からの発光蛍光はCCD検出器313で検出され、検出したシグナルは解析用コンピューター500に送られる。それぞれ検出点ごとにシグナルの時間変化を記録した。目的DNA断片が電気泳動され、第一検出点での時刻をt1、第二検出点での時刻をt2で検出された場合、二点間の平均電気泳動速度V1は検出点間の距離Δdを検出時間差(t2−t1)で割ったものであるから、V1=Δd/(t2−t1)である。第二検出点403からキャピラリー終端2までの距離をxとすると、溶出時間TaはTa=x/V1により求められる。このTaは各塩基長のDNA断片ごとに求めることが出来る。
【0033】
例えばt2=3100(秒)、t1=3050(秒)だった場合、Δd=5mmより泳動速度V1=5/(3100−3050)=0.1mm/秒となり、x=2.5mmよりTa=2.5/0.1=25(秒)となる。
【0034】
DNA断片はキャピラリー終端2から溶出した後、シース液流16によりフローセル3内を流れ、回収管6を通って回収点8に到達する。DNA断片がキャピラリー終端2から回収点8までに移動するのに要する時間をシース液流時間Tbとする。Tbはフローセル3中を流れる時間Tb1と回収管6中を通過する時間Tb2に分けることが出来る。フローセル3の内部断面積は1 mm×1 mm、シース液流16の流量は1μl/ 秒であるから、フローセル3中のシース液流16の平均流速は1 mm/秒である。キャピラリー終端2から回収管入り口15までの距離は2 mmであるのでTb1=2 (mm)/1(mm/ 秒)=2 (秒)である。
【0035】
一方、回収管の内径は500μm、流量が1μl/秒であるため、回収管6中のシース液流16の平均流速は1/(0.25×0.25×3.14)=5.1 mm/ 秒である。回収管6の長さは70 mmであるのでTb2はTb2=70/ 5.1=13.7(秒)である。
よってTb=Tb1+Tb2=2+13.7=15.7 (秒)である。
【0036】
以上より第二検出点403から回収点8までの時間、すなわち到達時間はTa+Tbで表され、Ta+Tb=25+13.7=38.7秒となる。
【0037】
なお、これらの解析は、解析部(解析用コンピュータ500)にて行われる。
【0038】
通常回収管6から流れ出るシース液4は受け皿204から廃液チューブ205を通じて外部の廃液容器14に送られる。分取を行う際は解析用コンピューター500から駆動命令を出し、目的DNA断片の到達時間に合わせて受け皿204と切りかえ、分取容器7を回収点8に設置し、目的DNA断片とともにシース液4を分取容器7の384プレートの内の一つのウェルに回収する。本実施例では受け皿204を分取容器7に切りかえてから、分取容器7を受け皿204に再び戻すまでの間の時間は5秒とした。すなわちあるDNA断片の到達時間が38.7秒とすると、第二検出点403で検出してから36.2秒後に受け皿204から分取容器7に切りかえ、41.2秒後に再び受け皿204に戻す。
【0039】
本実施例で回収した8種のDNA断片をPCRで増幅し、再びキャピラリー電気泳動を行うことによって分取精度の確認を行った。
【0040】
本実施例の特長はレーザー光をフローセル3内部でキャピラリー1上をオンカラムに照射し、検出することにより、第二検出点403とキャピラリー終端2までの距離を2.5 mmと短くでき、分取を行うためのタイミングの誤差を小さく出来ることである。また二点検出を行っていることからキャピラリー終端2付近での二点間の電気泳動速度を測定出来る。以上により正確に到達時間を予測することができ、一塩基精度の分取が可能となる。
【0041】
本実施例においては、試料成分5の二点の検出点における検出時間差から電気泳動速度を求めたが、検出点における試料成分5の分子の動きをCCD検出器により直接イメージングし、分子の電気泳動速度を求めても良い。
【0042】
また本実施例では試料にDNAを用いたが、蛍光分子を標識した蛋白質やRNAを用いても良い。また本実施例では電気泳動分離した試料成分5を蛍光検出を用いて計測したが、UV吸収検出により計測しても良い。例えば、レーザー光源301にUVレーザーを用い、試料に蛍光標識されていない生体物質を用いても良い。
(実施例2)
本実施例は検出点を一つとし、装置構成を簡易化することを目的とした。検出点をキャピラリー終端付近におくことにより、溶出時間の予測誤差を小さくすることが可能であり、到達時間を正確に予測することが出来る。
【0043】
装置構成は、実施例1の場合と検出部ユニット300の構成のみ異なり、それ以外は同等である。図13に本実施例の検出部ユニット300の構成を示す。レーザー光源301から発したレーザー光302をミラー303により方向を調整し、ピンホール304、シャッター307を通し、集光レンズ308を用いてフローセル3内部のキャピラリー1の検出点401に照射した。
【0044】
フローセル3内の構成は図3と同等である。検出点401とキャピラリー終端2の間隔を0.12 mmとした。
【0045】
分取の手順を図14に示す。検出とタイミングの計算方法以外は実施例1と同等である。異なる部分を以下に説明する。試料成分5を検出した時間をTallとし、キャピラリー1の試料注入端111から検出点401までの距離をLとすると、Lの距離の平均電気泳動速度Vallは、Vall=L/Tallにより求めることが出来る。検出点401からキャピラリー終端2までの距離をxとし、xの間の電気泳動速度がVallと同じであると仮定し、溶出時間TaをTa=x/Vallにより求める。x=0.12(mm)、L=360(mm)、Tall=3000(秒)のとき、VallはVall=360/3000=0.12(mm/秒)となり、Ta=0.12/0.12=1.0(秒)である。またシース液流16を移動する時間すなわちシース液流時間Tbは、実施例1と同様であるため15.7(秒)である。これより到達時間はTa+Tb=15.7+1.0=16.7(秒)と予想される。これらの解析は、解析部(解析用コンピュータ500)にて行われる。
【0046】
解析用コンピュータ500により到達時間にタイミングを合わせ受け皿204から分取容器7に切りかえ、目的の試料成分を回収する。
【0047】
本方式の特徴はフローセル3内部でオンカラム検出することにより、検出点とキャピラリー終端までの距離を十分短く出来、溶出時間の予測誤差を小さく出来るため、高精度に分取を行うことが出来る。
(実施例3)
本実施例では異なる複数の蛍光分子で標識された生体試料をそれぞれ識別しながら検出出来るように発光蛍光をグレーティングにより波長分散して蛍光検出を行った。
【0048】
装置構成は実施例1と同等であるが、以下に示す検出部ユニット300の構成が異なる。
【0049】
本実施例の検出部ユニット構成を図15に示す。第一検出点402、第二検出点403からの蛍光を対物カメラレンズ310、ノッチフィルター311、透過型グレーティング314を通し、結像カメラレンズ312によりCCD検出器313上に結像させる。2つの検出点それぞれからの波長分散された発光蛍光シグナルを解析用コンピューター500に送り、データを解析する。
【0050】
図16は、図15の検出部ユニット300を左側面方向から見た図である。図16に示したように、透過型グレーティング314の配置により、第一検出点402、第二検出点403からの発光蛍光の波長分散方向315、及び波長分散角θを変化させることができる。ここで、波長分散角θは、レーザー光351、352の進行方向と波長分散方向のなす角度であり、本実施例では0°<θ≦90°である。
【0051】
また、CCD検出器313の画素配列方向を波長分散方向一致させることにより、各発光の波長分散された蛍光スペクトルを容易に取得することができる。本実施例では、レーザー光の波長である488 nmの光は、ノッチフィルター311により遮断されるため、CCD検出器313に入射しない。しかし、488 nmのレーザー光によって、シース液4、及びポリマー溶液104に含まれる水のラマン散乱が584 nm付近に生じる。これらのラマン散乱光はCCD検出器313に入射し、蛍光スペクトル上に重なり、蛍光検出の際の背景光スペクトルとなる。波長分散角をθ=0°とした場合、蛍光スペクトル上には、蛍光検出点402、または403におけるキャピラリー1内部のポリマー溶液104由来のラマン散乱光だけでなく、フローセル3内部のレーザー光351、または352上のシース液4由来のラマン散乱光が重なる。この場合の背景光スペクトルを図17Aに示した。このように背景光強度が非常に高くなるため、蛍光検出の障害になり、検出感度の低下、及びダイナミックレンジの縮小を招く。そこで、本実施例では、θ=45°とすることにより、フローセル3内部のレーザー光351、または352上のシース液4由来のラマン散乱光が蛍光スペクトル上に重ならないようにした。この場合の背景光スペクトルを図17Bに示した。このように、蛍光検出点402、または403におけるキャピラリー1内部のポリマー溶液104由来のラマン散乱光だけが蛍光スペクトルに重なるため、背景光強度が図17Aと比較して10分の1程度に低減することができた。その結果、高感度、かつ広いダイナミックレンジな蛍光検出が可能になった。
【0052】
波長分散角をθ=90°(ほぼ90°)、すなわち波長分散方向315をキャピラリー1の軸方向と一致させても同様の効果が得られる。ただし、この場合、蛍光検出点402及び403からの各発光の各蛍光スペクトルがCCD検出器313の同一画素上に重なってしまう可能性がある。この可能性を回避するためには、二点の検出点の相対距離を十分に離せば良い。
【0053】
本実施例では、二点検出の場合を示したが、図13に示した一点検出の場合にも同様の検出ユニットの構成により、同様の効果が得られる。
(実施例4)
本実施例ではキャピラリー電気泳動ならびに分取操作のスループットを上げることを目的とし、複数のキャピラリーをアレイ化し、全てのキャピラリーについて電気泳動ならびに分取操作を並列して行えるようにした。レーザー光をキャピラリーアレイに対して側面入射させ、全てのキャピラリーについて同時にレーザー照射、蛍光検出する方式(特開平9−288088参照)を用いた例を示す。
【0054】
本実施例の全体の装置構成を図18に示す。操作、手順は実施例1と同等であり、それぞれのキャピラリーごとに独立して行う。
【0055】
構成要素は実施例1と同等である。キャピラリー1は4本ならべ、キャピラリーアレイとした。4本ともに均等に温度調節が出来るようキャピラリー1同士が重ならないよう配置した。キャピラリー1には外径200μm、内径100μm、長さは36 cmのポリイミド被覆石英管(ポリマイクロ社)を用いた。
【0056】
試料注入側ユニット100の詳細を図19に示す。試料容器501に試料101をキャピラリーと同じ数だけ用意し、バッファー容器502にバッファー102を入れ、純水容器503に純水103を入れ、ポリマー容器504にポリマー溶液104をいれ、シリンジ105をセットした。これらの容器をX,Z方向に駆動可能な基台106上に設置した。
【0057】
次にフローセル3内の構造を図20に示す。各キャピラリー1をレーザー光と垂直に図のように同一平面上にならべて配置した。第一レーザー光351、第二レーザー光352が各キャピラリー1の第一検出点402、第二検出点403において集光されるように、各キャピラリー1間にロッドレンズ13を配置した。ロッドレンズ13には石英製で屈折率はキャピラリー1と同じ1.46のものを用いた。またシース液の屈折率は1.33、ポリマー溶液104の屈折率は1.41のものを用いた。これらの条件により4本全てのキャピラリー内に効率的にレーザー光が集光される(Kambara et al. ,Electrophoresis 1999 20 539−546)。またフローセル内の各キャピラリー1に対向する位置にそれぞれ回収管6を配置した。回収管6にはキャピラリー1と同じポリイミド被覆石英管を使用し、その長さは70 mmとした。各回収管6の間にもそれぞれロッドレンズ13を配置した。終端側電極203はフローセル3内部のシース液4に浸しシース液4全体をグランドにした。検出部ユニットの他の構成は実施例3と同じとした。ただしθ=90°、すなわち波長分散方向315はレーザー光にほぼ垂直方向とした。このとき二つの検出点それぞれからのシグナルが波長分散した後にCCD検出器313上で重なりあわないよう二点の検出点の相対距離を十分に離した。また各回収管6は回収点8において、a=8 mm間隔で直線上に配列され、回収管全長は同一になるように各回収管6を曲げた。
【0058】
終端側にユニット構成を図21に示す。各回収管6に対応させてそれぞれの分取容器7をa=8 mm間隔で配列した。4つのキャピラリーについてそれぞれ独立に分取操作できるように、4つの分取容器台202の上に各分取容器7をそれぞれ設置し、XZ方向にそれぞれ別個に駆動できるようにした。分取の際は解析用PCで解析したデータに合わせ、受け皿204が移動し、分取容器7により目的の試料成分5を回収する。キャピラリーごとに検出し、駆動命令を発するので、それぞれの試料の分取操作を並列に行うことが出来る。
【0059】
以上複数のキャピラリーをアレイ化することにより、キャピラリーの本数分と同じだけスループットを向上することが出来た。
(実施例5)
本実施例ではキャピラリー電気泳動ならびに分取操作のスループットを上げることを目的とし、複数のキャピラリーをアレイ化し、全てのキャピラリーが電気泳動ならびに分取操作を並列して行えるようにした。レーザーをスキャンすることによって全てのキャピラリーのレーザー照射、蛍光検出を順番に行う方式(参照Anal.Chem.1992 Vol.64,No.18)を用いた例を示す。
【0060】
基本的な構成は実施例4に準ずる。手順は実施例2と同様である。検出部ユニット300が実施例4と異なる。まずフローセル3内の構造を図22に示す。4本のキャピラリー1を密着させて同一平面上にならべた。検出点は各キャピラリーについて一点とし、キャピラリー終端2より0.12 mmの位置に置いた。実施例2同様、検出点401をキャピラリー終端2に近づけ、溶出時間の予測誤差が小さくなるようにした。レーザー光は図22の紙面とほぼ垂直方向から各キャピラリー照射され、蛍光検出はレーザー光302の照射と同じ側から行う。検出部ユニット300の構造の概略図を図23に示す。レーザー光源301から出たレーザー光302は、第一ダイクロイックミラー321を通過し、ミラー303で反射され、対物レンズ322により集光され、キャピラリー1の検出点に照射される。第一ダイクロイックミラー321はレーザー光488 nmは通過し、520 nm以上の光は反射する。ミラー303と対物レンズ322は駆動ユニット320を構成し、各キャピラリー1が並んでいる配列方向と同方向に高速往復駆動することが出来る。これにより各キャピラリーをレーザー光302で次々とスキャン照射する。キャピラリー1の検出点401からの発光蛍光は同じ対物レンズ322で集光する。蛍光はミラー303で反射され、第一ダイクロイックミラー321で反射される。次に第二ダイクロイックミラーで2種類の蛍光波長に分割され、集光レンズ308を通り、ピンホール304を通過し、CCD検出器313で受光される。この構成では蛍光波長の異なる2種類の生体物質を検出できる。検出したシグナルを解析用コンピューター500に送り、データ解析を行う。他の装置構成は実施例4と同様であり、分取の手順は実施例2と同様である。
【0061】
以上アレイ化することによりキャピラリーの本数分スループットを向上することが出来た。
【0062】
【発明の効果】
本発明により高精度・高分離の分取が可能となる。これにより高精度に生体物質を分取することができる。
【図面の簡単な説明】
【図1】従来のオンカラム検出によるキャピラリー電気泳動分取システムの主要部構成を示す図。
【図2】従来のシースフロー検出によるキャピラリー電気泳動分取システムの主要部構成を示す図。
【図3】本発明のキャピラリー電気泳動分取システムの主要部構成を示す図。
【図4】キャピラリー電気泳動によるDNA長さ分離の蛍光計測結果を示す図。
【図5】二点検出方式を採用した本発明のキャピラリー電気泳動分取システムの主要部構成を示す図。
【図6】溶出時間予測誤差の大きさと検出点から終端までの距離の関係を示す図。
【図7】本発明の実施形態1における装置構成を示す図。
【図8】本発明の実施形態1における試料注入側ユニットの詳細を示す図。
【図9】本発明の実施形態1における終端側ユニットの詳細を示す図。
【図10】本発明の実施形態1における検出部ユニットを正面から見た場合の概略を示す図。
【図11】本発明の実施形態1における検出部ユニットを右側方から見た場合の概略を示す図。
【図12】本発明の実施形態1における分取操作の手順を示す図。
【図13】本発明の実施形態2における検出部ユニットの概略を示す図。
【図14】本発明の実施形態2における分取操作の手順を示す図。
【図15】本発明の実施形態3における検出部ユニットの概略を示す図。
【図16】本発明の実施形態3における主要部構成を示す図。
【図17】本発明の実施形態3におけるレーザー光の進行方向と波長分散方向のなす角度をかえた場合の背景光スペクトルの強度を示す図。
【図18】本発明の実施形態4における装置構成を示す図。
【図19】本発明の実施形態4における試料注入側ユニットの詳細を示す図。
【図20】本発明の実施形態4における主要部構成を示す図。
【図21】本発明の実施形態4における終端側ユニットの詳細を示す図。
【図22】本発明の実施形態5における主要部構成を示す図。
【図23】本発明の実施形態5における検出部ユニットの概略を示す図。
【符号の説明】
1…キャピラリー
2…キャピラリー終端
3…フローセル
4…シース液
5…試料成分
6…回収管
7…分取容器
8…回収点
9…シース液送液チューブ
10…温調板
11…シース液容器
12…キャピラリーアレイ
13…ロッドレンズ
14…廃液容器
15…回収管入り口
16…シース液流
100…試料注入側ユニット
200…終端側ユニット
300…検出部ユニット
101…試料
102…バッファー
103…純水
104…ポリマー溶液
105…シリンジ
106…基台
107…試料注入側電極
108…O−リング
109…ポリマー充填用ふた
110…試料容器
111…試料注入端
201…分取容器
202…分取容器台
203…終端側電極
204…受け皿
205…廃液チューブ
301…レーザー光源
302…レーザー光
303…ミラー
304…ピンホール
305…λ/2波長板
306…ウォラストンプリズム
307…シャッター
308…集光レンズ
309…レーザーストッパー
310…対物カメラレンズ
311…ノッチフィルター
312…結像カメラレンズ
313…CCD検出器
314…透過型グレーティング
315…波長分散方向
320…駆動ユニット
321…第一ダイクロイックミラー
322…対物レンズ
323…第二ダイクロイックミラー
351…第一レーザー光
352…第二レーザー光
401…検出点
402…第一検出点
403…第二検出点
500…解析用コンピューター
501…試料容器
502…バッファー容器
503…純水容器
504…ポリマー容器。
Claims (18)
- 生体物質を泳動分離するためのキャピラリーと、
前記キャピラリーの終端から吐出する、前記生体物質の分離成分を、容器に流すための、前記キャピラリーの終端の周囲に設けられたフローセルと、
前記キャピラリー及び前記フローセルに、光を照射する照射器と、
前記キャピラリーからの光を検出する検出器とを有することを特徴とするキャピラリー泳動分取システム。 - 前記生体物質は、DNA、RNA、またはタンパク質であることを特徴とする請求項1に記載のキャピラリー電気泳動システム。
- 前記キャピラリーと前記光の交点と、前記終端の距離は、2.6mm以下であることを特徴とする請求項1記載のキャピラリー泳動分取システム。
- 前記キャピラリー泳動分取システムは、更に解析部を有し、前記光は、1の検出点で、前記キャピラリー及び前記フローセルに照射され、前記解析部は、分離する生体物質の平均泳動速度を求める手段と、前記平均泳動速度から前記検出点から前記終端までの溶出時間Taと、前記フローセル内に流れるシース液流の流速から前記終端から前記生体物質の回収点に要する時間Tbとを求める手段と、前記TaとTbの和から前記検出点から前記回収点までの到達時間を予測する手段とを有し、
前記解析部で前記予測した到達時間をもとに、前記容器を駆動させる駆動手段と、を有することを特徴とする請求項1記載のキャピラリー泳動分取システム。 - 前記光は、2の検出点で、前記キャピラリー及び前記フローセルに照射されるように構成されたことを特徴とする請求項1記載のキャピラリー泳動分取システム。
- 前記2の検出点のうち、前記終端に近い側の検出点と、前記終端との距離は、2.6mm以下であることを特徴とする請求項5記載のキャピラリー泳動分取システム。
- 前記キャピラリー泳動分取システムは、更に解析部を有し、
前記解析部は、前記2の検出点から分離する生体物質の平均泳動速度を求める手段と、前記平均泳動速度から前記2の検出点のうち前記終端に近い側の検出点から前記終端までの溶出時間Taと、前記フローセル内に流れるシース液流の流速から前記終端から前記生体物質の回収点に要する時間Tbとを求める手段と、前記TaとTbの和から前記終端に近い側の検出点から前記回収点までの到達時間を予測する手段とを有し、
前記解析部で前記予測した到達時間をもとに、前記容器を駆動させる駆動手段と、を有することを特徴とする請求項5記載のキャピラリー泳動分取システム。 - 前記生体物質には、蛍光が付されており、
前記検出器にて、前記蛍光によって励起された光を検出することを特徴とする請求項1記載のキャピラリー泳動分取システム。 - 前記照射器は紫外光を照射するものであり、
前記検出器は、前記分離成分の前記紫外光の吸収を検出するものであることを特徴とする請求項1記載のキャピラリー泳動分取システム。 - 前記キャピラリーは複数備えられ、前記照射、前記検出、及び前記分離成分の回収を、前記複数のキャピラリー毎に行うことを特徴とする請求項1に記載のキャピラリー電気泳動システム。
- 前記キャピラリーは複数備えられ、前記フローセル内部で同一平面上に配列されており、前記光を前記平面の側面方向より導入し、前記複数のキャピラリーを一括して照射するように構成されたことを特徴とする請求項1に記載のキャピラリー電気泳動システム。
- 前記キャピラリーは複数備えられ、前記キャピラリーは、前記フローセル内部で、集光手段と交互に同一平面上に配列され、前記光を前記平面の側面方向より導入して前記複数のキャピラリーを一括して照射するように構成されたことを特徴とする請求項1に記載のキャピラリー電気泳動システム。
- 前記集光手段がガラス製のロッドレンズであることを特徴とする請求項12に記載のキャピラリー電気泳動システム。
- 前記キャピラリーは複数備えられ、前記キャピラリーは前記フローセル内部で同一平面上に配列され、前記光及び前記検出器を前記配列方向に走査する手段を有することを特徴とする請求項1に記載のキャピラリー電気泳動システム。
- 前記光は前記キャピラリーに対してほぼ垂直方向から照射され、
前記光の検出は、前記キャピラリーに対してほぼ垂直方向から行われ、
更に、前記光の波長分散手段を備え、前記検出器が波長分散された前記光を検出し、前記キャピラリーに照射される前記光が進行する方向と前記波長分散の方向のなす角度θが0°<θ≦90°であることを特徴とする請求項1に記載のキャピラリー電気泳動システム。 - 前記レーザー光は前記キャピラリーに対してほぼ垂直方向から照射され、
前記光の検出は、前記キャピラリーに対してほぼ垂直方向から行われ、
更に、前記光の波長分散手段を備え、前記検出器が波長分散された前記発光を検出し、前記複数のキャピラリーに照射される前記光が進行する方向と前記波長分散の方向のなす角度θがほぼ90°であることを特徴とする請求項1に記載のキャピラリー電気泳動システム。 - キャピラリーで、生体物質を泳動分離し、
前記キャピラリーの終端から吐出した、前記泳動分離された生体物質を、前記キャピラリーの終端の周囲に設けられたフローセルにシース液を流すことによって、前記フローセルから流出させ、
前記キャピラリー及び前記フローセルに光を照射し、前記キャピラリーからの光を検出し、前記検出結果をもとに、前記フローセルから流出した前記生体物質を、各容器に分取することを特徴とする分取方法。 - 前記キャピラリーの始端より電解質溶液は、導入され、その後前記キャピラリーで前記生体物質を泳動分離することを特徴とする請求項17に記載の分取方法。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002307793A JP2004144532A (ja) | 2002-10-23 | 2002-10-23 | キャピラリー泳動分取システム及び分取方法 |
| US10/443,991 US20040079639A1 (en) | 2002-10-23 | 2003-05-23 | System and method for biological fraction collection for capillary electrophoresis |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002307793A JP2004144532A (ja) | 2002-10-23 | 2002-10-23 | キャピラリー泳動分取システム及び分取方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004144532A true JP2004144532A (ja) | 2004-05-20 |
Family
ID=32105225
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002307793A Pending JP2004144532A (ja) | 2002-10-23 | 2002-10-23 | キャピラリー泳動分取システム及び分取方法 |
Country Status (2)
| Country | Link |
|---|---|
| US (1) | US20040079639A1 (ja) |
| JP (1) | JP2004144532A (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009180745A (ja) * | 2009-05-18 | 2009-08-13 | Hitachi High-Technologies Corp | 蛍光検出方法、検出装置及び蛍光検出プログラム |
| JP2010515923A (ja) * | 2007-01-12 | 2010-05-13 | ボード オブ リージェンツ, ザ ユニバーシティ オブ テキサス システム | 接続型低フロー分離技術 |
| JP2014517314A (ja) * | 2011-06-16 | 2014-07-17 | ブリティッシュ コロンビア キャンサー エイジェンシー ブランチ | 核酸の自動サイズ選択 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060192940A1 (en) * | 2005-01-20 | 2006-08-31 | Phi-Wilson Janette T | Modular flow cytometry system |
| WO2008073168A2 (en) * | 2006-08-25 | 2008-06-19 | The Trustees Of Columbia University In The City Of New York | Systems and methods for high-throughput radiation biodosimetry |
| WO2009046526A1 (en) * | 2007-10-09 | 2009-04-16 | Dalhousie University | Apparatus for purifying molecules |
-
2002
- 2002-10-23 JP JP2002307793A patent/JP2004144532A/ja active Pending
-
2003
- 2003-05-23 US US10/443,991 patent/US20040079639A1/en not_active Abandoned
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010515923A (ja) * | 2007-01-12 | 2010-05-13 | ボード オブ リージェンツ, ザ ユニバーシティ オブ テキサス システム | 接続型低フロー分離技術 |
| JP2013130586A (ja) * | 2007-01-12 | 2013-07-04 | Board Of Regents The Univ Of Texas System | 接続型低フロー分離技術 |
| KR101553679B1 (ko) * | 2007-01-12 | 2015-09-17 | 보오드 오브 리젠츠, 더 유니버시티 오브 텍사스 시스템 | 저-흐름 분리 기법들의 인터페이스 연결 |
| JP2009180745A (ja) * | 2009-05-18 | 2009-08-13 | Hitachi High-Technologies Corp | 蛍光検出方法、検出装置及び蛍光検出プログラム |
| JP2014517314A (ja) * | 2011-06-16 | 2014-07-17 | ブリティッシュ コロンビア キャンサー エイジェンシー ブランチ | 核酸の自動サイズ選択 |
| US9952176B2 (en) | 2011-06-16 | 2018-04-24 | British Columbia Cancer Agency Branch | Automated size selection of nucleic acids |
Also Published As
| Publication number | Publication date |
|---|---|
| US20040079639A1 (en) | 2004-04-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2539172B2 (ja) | 細管列共焦蛍光スキャナ―及び方法 | |
| JP3127238B2 (ja) | 分離プロセスのための方法および検出器 | |
| Camilleri | Capillary electrophoresis: theory and practice | |
| Takahashi et al. | Multiple sheath-flow gel capillary-array electrophoresis for multicolor fluorescent DNA detection | |
| US6017765A (en) | Fluorescence detection capillary array electrophoresis analyzer | |
| JP3467995B2 (ja) | キャピラリー電気泳動装置 | |
| Shortreed et al. | High-throughput single-molecule DNA screening based on electrophoresis | |
| JPH09288088A (ja) | キャピラリーアレー電気泳動装置 | |
| JP3713970B2 (ja) | 特異的遺伝子断片の分離採取装置 | |
| JP3613032B2 (ja) | キャピラリーアレイ電気泳動装置 | |
| JP2002540401A (ja) | 生物学的及びその他の試料の自動化2次元分析 | |
| US8012327B2 (en) | Capillary electrophoresis apparatus and electrophoresis method | |
| JPH08504277A (ja) | 液体中のタンパク質成分の濃度および全タンパク質の濃度を定量するための毛管電気泳動の使用 | |
| EP1597571A1 (en) | Two-dimensional protein separations using chromatofocusing and multiplexed capillary gel electrophoresis | |
| US20040070758A1 (en) | Multiplexed, absorbance-based capillary electrophoresis system and method | |
| JP2004144532A (ja) | キャピラリー泳動分取システム及び分取方法 | |
| JP3456070B2 (ja) | キャピラリーアレイ電気泳動装置 | |
| JP3539014B2 (ja) | キャピラリーアレイ電気泳動装置 | |
| JPH11108889A (ja) | キャピラリー電気泳動装置 | |
| JP3654290B2 (ja) | キャピラリーアレイ電気泳動装置 | |
| JP3722131B2 (ja) | キャピラリーアレイ電気泳動装置 | |
| JP3570425B2 (ja) | キャピラリー電気泳動装置 | |
| Kamahori et al. | Capillary array electrophoresis analyzer | |
| JP3750663B2 (ja) | キャピラリーアレイ電気泳動装置 | |
| JP4078324B2 (ja) | 電気泳動装置およびキャピラリーアレイ |