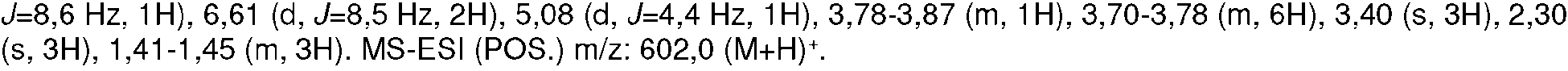ES2791315T3 - Agonistas triazoles del receptor APJ - Google Patents
Agonistas triazoles del receptor APJ Download PDFInfo
- Publication number
- ES2791315T3 ES2791315T3 ES16730076T ES16730076T ES2791315T3 ES 2791315 T3 ES2791315 T3 ES 2791315T3 ES 16730076 T ES16730076 T ES 16730076T ES 16730076 T ES16730076 T ES 16730076T ES 2791315 T3 ES2791315 T3 ES 2791315T3
- Authority
- ES
- Spain
- Prior art keywords
- alkyl
- pyridinyl
- methyl
- triazol
- dimethoxyphenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108091008803 APLNR Proteins 0.000 title claims description 19
- 239000000556 agonist Substances 0.000 title description 4
- 150000003852 triazoles Chemical class 0.000 title description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 387
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims abstract description 327
- 239000000203 mixture Substances 0.000 claims abstract description 273
- 150000003839 salts Chemical class 0.000 claims abstract description 256
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 107
- 125000001424 substituent group Chemical group 0.000 claims abstract description 65
- 125000005842 heteroatom Chemical group 0.000 claims abstract description 63
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 61
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 55
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 51
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims abstract description 39
- 125000004076 pyridyl group Chemical group 0.000 claims abstract description 38
- 229910052717 sulfur Inorganic materials 0.000 claims abstract description 37
- 125000002950 monocyclic group Chemical group 0.000 claims abstract description 35
- 125000001188 haloalkyl group Chemical group 0.000 claims abstract description 30
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 27
- 125000000041 C6-C10 aryl group Chemical group 0.000 claims abstract description 25
- 125000002619 bicyclic group Chemical group 0.000 claims abstract description 24
- 125000000753 cycloalkyl group Chemical group 0.000 claims abstract description 21
- ILVXOBCQQYKLDS-UHFFFAOYSA-N pyridine N-oxide Chemical compound [O-][N+]1=CC=CC=C1 ILVXOBCQQYKLDS-UHFFFAOYSA-N 0.000 claims abstract description 14
- 125000005494 pyridonyl group Chemical group 0.000 claims abstract description 14
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims abstract description 10
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 claims abstract description 7
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims abstract description 7
- 125000000304 alkynyl group Chemical group 0.000 claims abstract description 7
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims abstract description 5
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 claims abstract description 5
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract description 4
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims abstract description 4
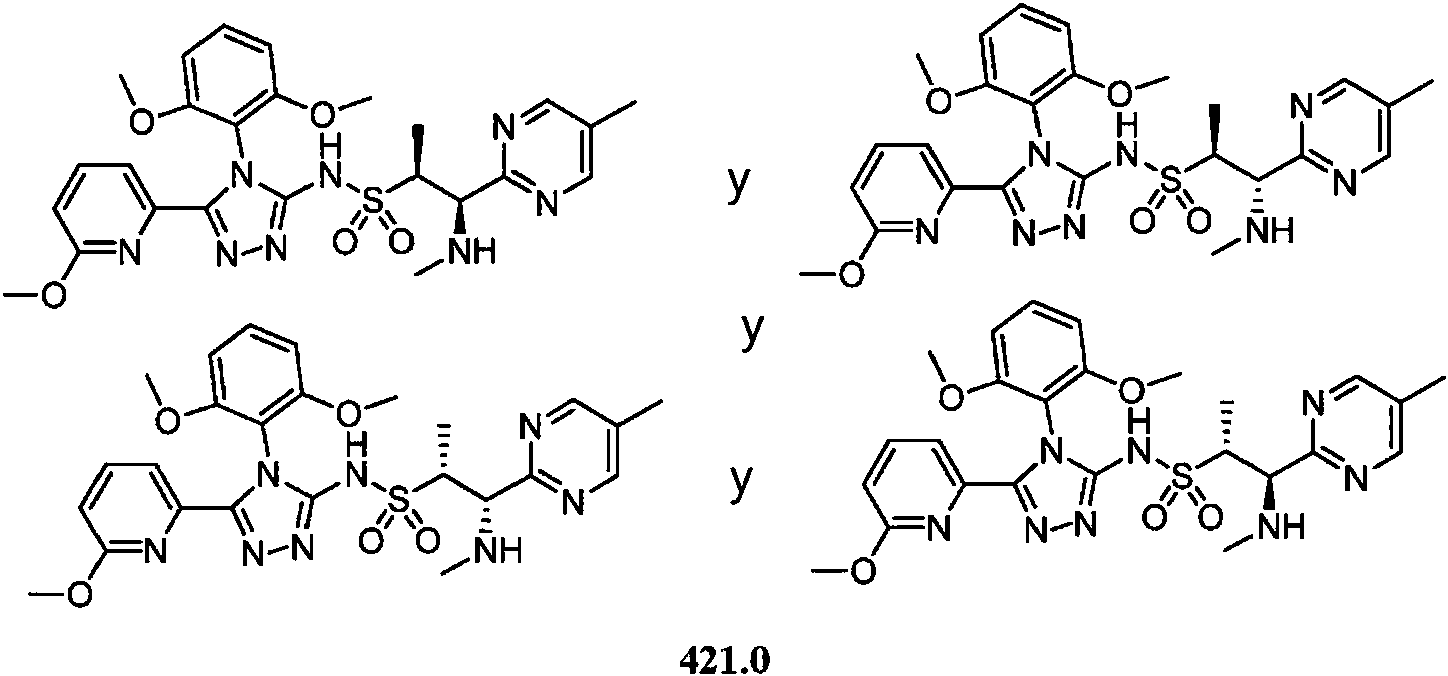
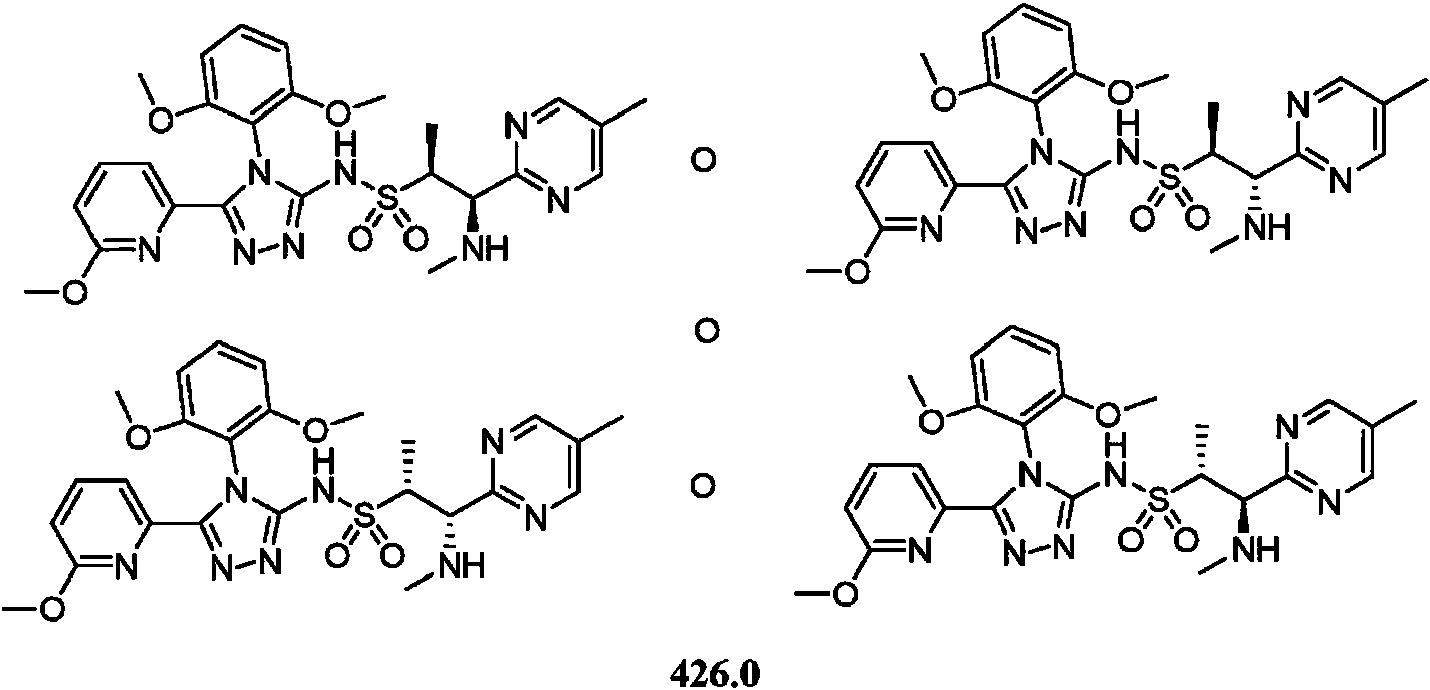
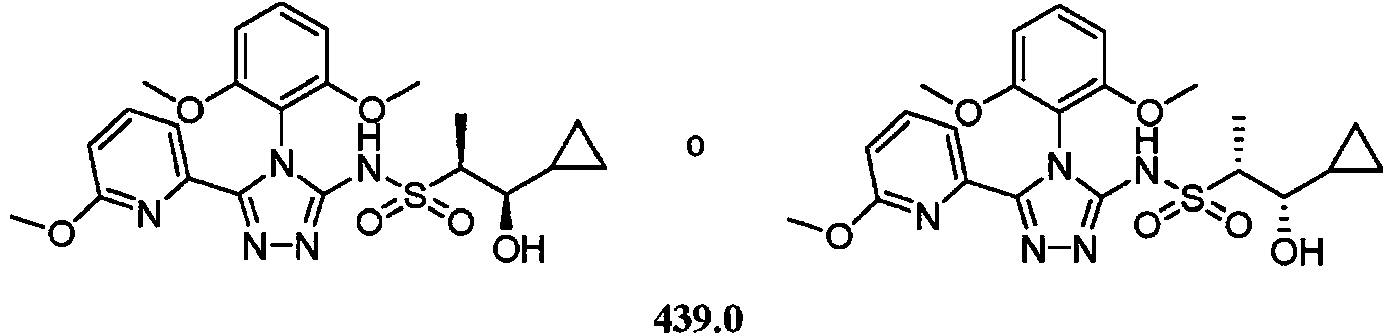
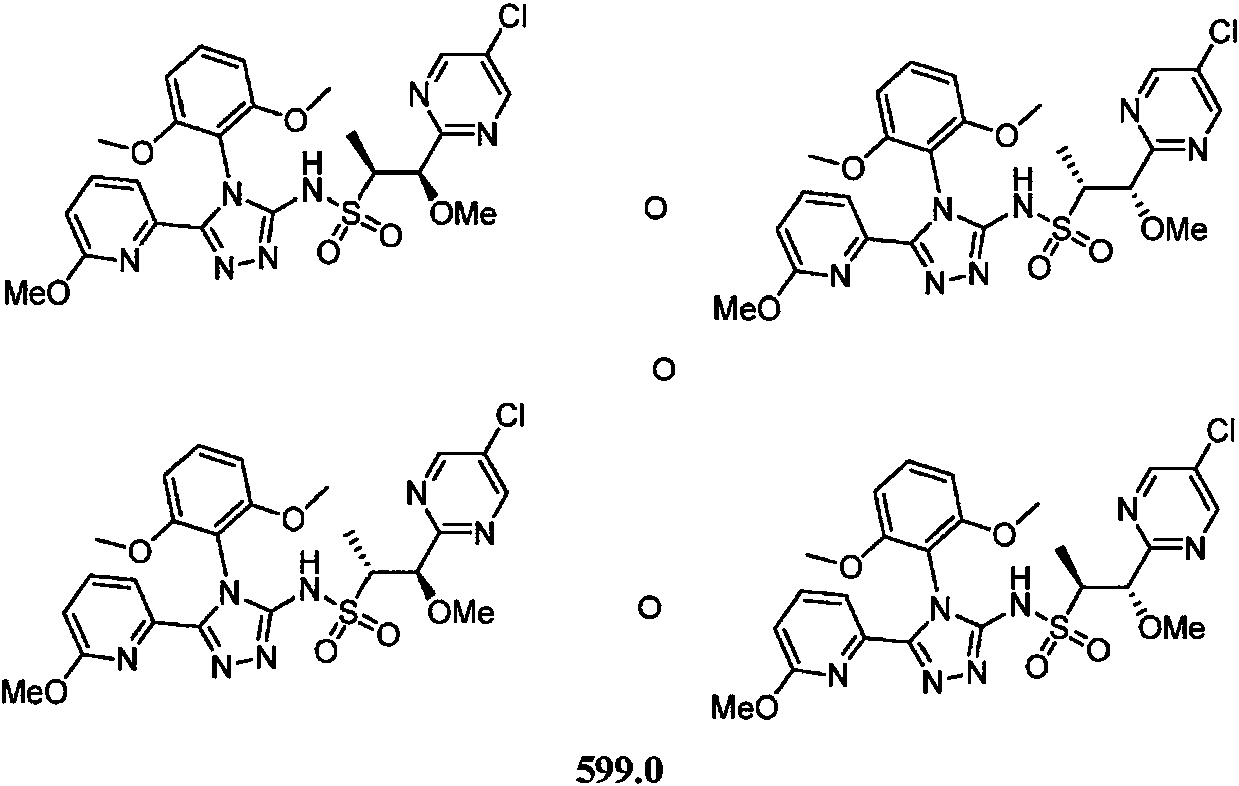
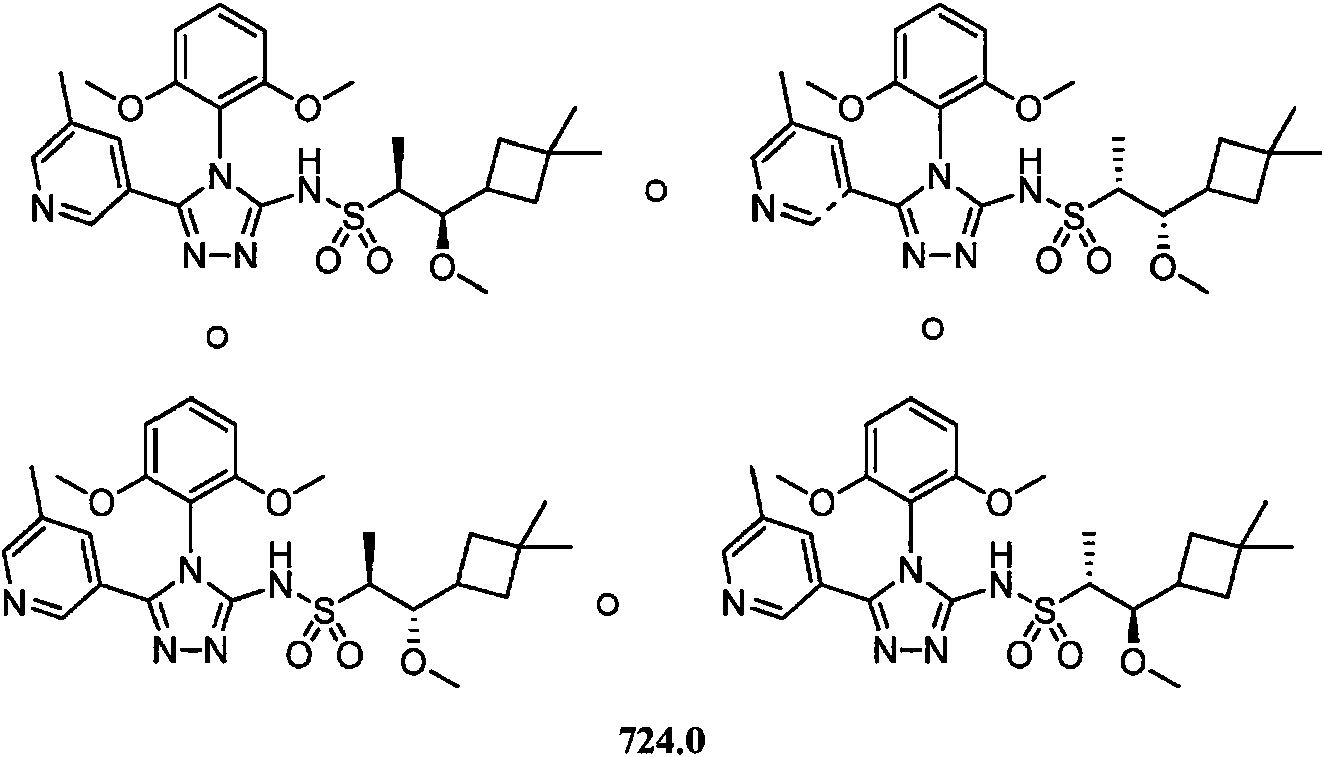
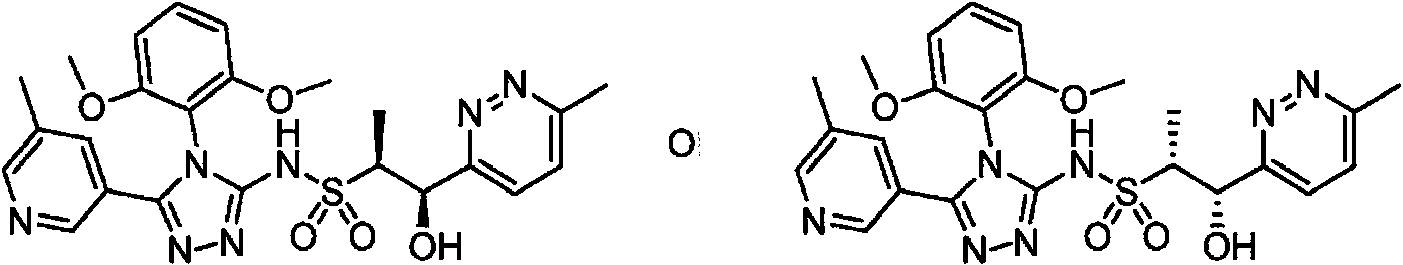
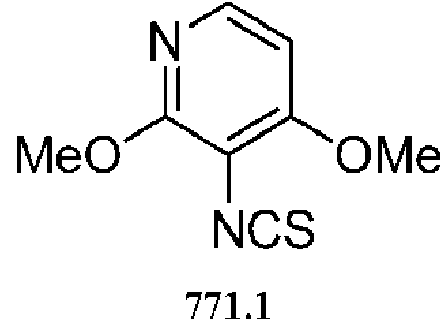
- -1 5-chloro-2-pyrimidinyl Chemical group 0.000 claims description 1105
- 239000003814 drug Substances 0.000 claims description 48
- 230000002526 effect on cardiovascular system Effects 0.000 claims description 40
- 229940124597 therapeutic agent Drugs 0.000 claims description 37
- 206010019280 Heart failures Diseases 0.000 claims description 36
- 239000003112 inhibitor Substances 0.000 claims description 33
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 31
- 239000008194 pharmaceutical composition Substances 0.000 claims description 26
- 229940125364 angiotensin receptor blocker Drugs 0.000 claims description 23
- 238000011282 treatment Methods 0.000 claims description 21
- 206010020772 Hypertension Diseases 0.000 claims description 14
- 102000003729 Neprilysin Human genes 0.000 claims description 14
- 108090000028 Neprilysin Proteins 0.000 claims description 14
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 12
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 12
- 206010012601 diabetes mellitus Diseases 0.000 claims description 10
- 239000002934 diuretic Substances 0.000 claims description 9
- 206010007556 Cardiac failure acute Diseases 0.000 claims description 8
- 208000008589 Obesity Diseases 0.000 claims description 8
- 235000020824 obesity Nutrition 0.000 claims description 8
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 8
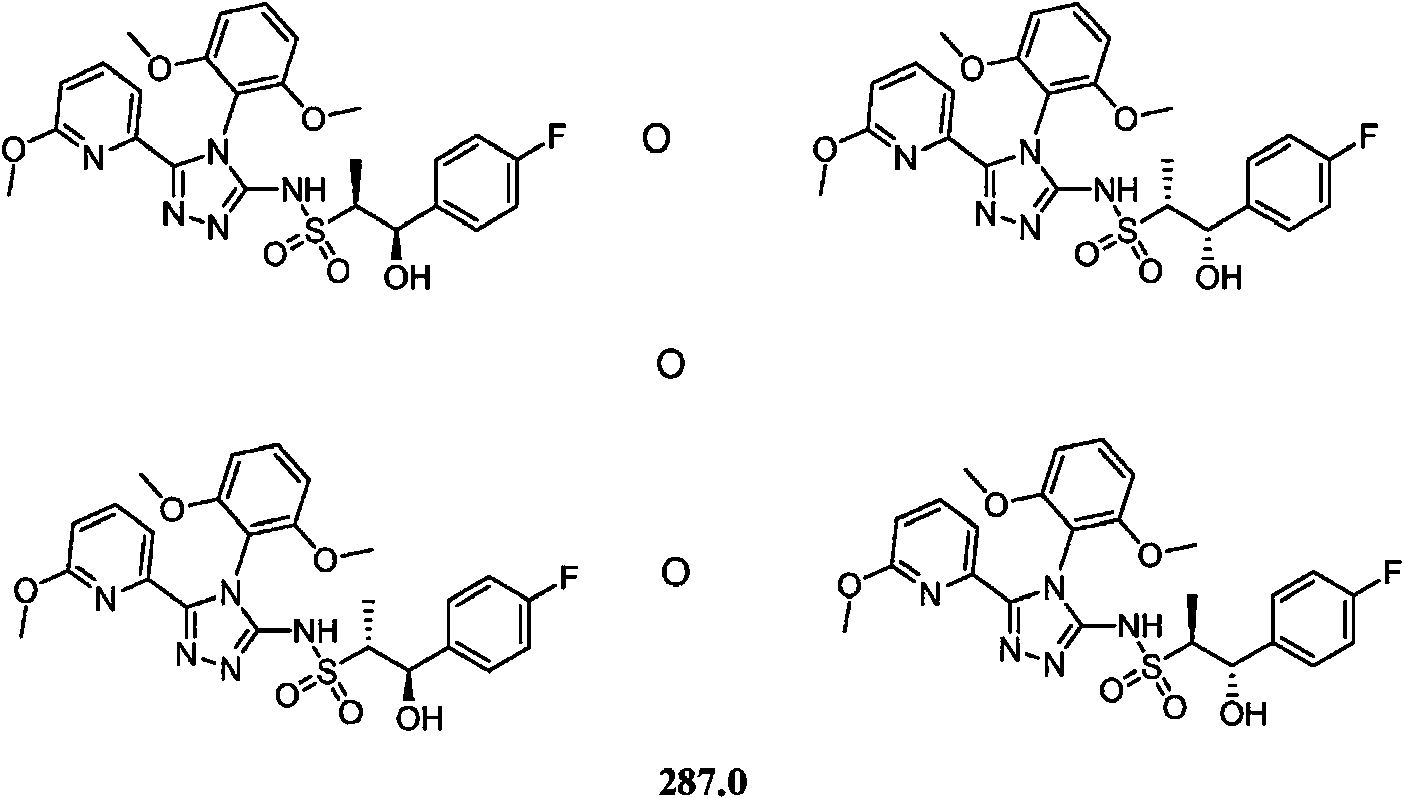
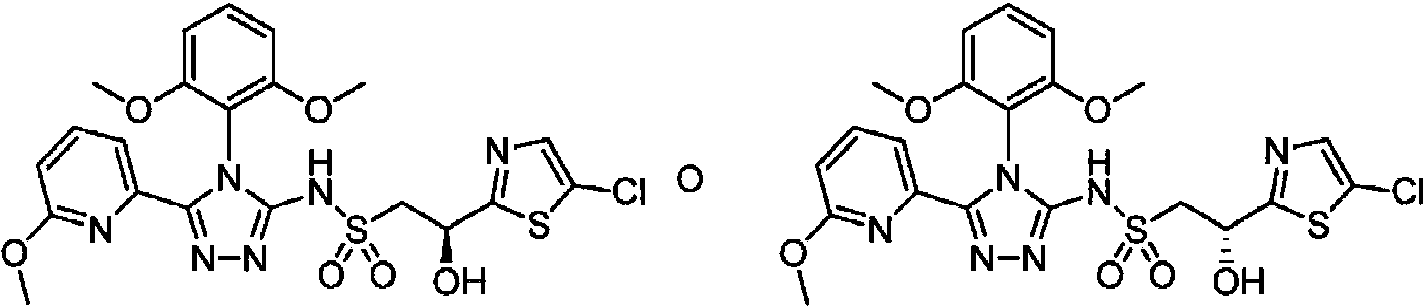
- DOMQFIFVDIAOOT-ROUUACIJSA-N (2S,3R)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-3-(5-methylpyrimidin-2-yl)butane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@@H](C)[C@H](C)C1=NC=C(C=N1)C DOMQFIFVDIAOOT-ROUUACIJSA-N 0.000 claims description 7
- 239000003085 diluting agent Substances 0.000 claims description 7
- 230000001882 diuretic effect Effects 0.000 claims description 7
- 208000020832 chronic kidney disease Diseases 0.000 claims description 6
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 5
- 229940098712 Myosin activator Drugs 0.000 claims description 5
- 239000000480 calcium channel blocker Substances 0.000 claims description 5
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 5
- 239000002792 enkephalinase inhibitor Substances 0.000 claims description 5
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 claims description 4
- 229940127291 Calcium channel antagonist Drugs 0.000 claims description 3
- 208000038002 heart failure with reduced ejection fraction Diseases 0.000 claims description 3
- 125000000842 isoxazolyl group Chemical group 0.000 claims description 3
- 125000001041 indolyl group Chemical group 0.000 claims description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 2
- 125000001624 naphthyl group Chemical group 0.000 claims description 2
- RKASISZRLSODIM-BTYIYWSLSA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-pyridin-3-yl-1,2,4-triazol-3-yl]-1-ethoxy-1-(5-fluoropyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=CC=1)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)F)OCC)C RKASISZRLSODIM-BTYIYWSLSA-N 0.000 claims 2
- RKKBDGLXAWMONW-YADARESESA-N (1S,2S)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-(5-methylpyrimidin-2-yl)-1-propan-2-yloxypropane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@H]([C@H](C1=NC=C(C=N1)C)OC(C)C)C RKKBDGLXAWMONW-YADARESESA-N 0.000 claims 2
- RKKBDGLXAWMONW-CYFREDJKSA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-(5-methylpyrimidin-2-yl)-1-propan-2-yloxypropane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)C)OC(C)C)C RKKBDGLXAWMONW-CYFREDJKSA-N 0.000 claims 1
- NALPJGTZGZZFKE-AOMKIAJQSA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-ethoxy-1-(5-fluoropyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)F)OCC)C NALPJGTZGZZFKE-AOMKIAJQSA-N 0.000 claims 1
- VHQQBCNPRBCOKQ-MBSDFSHPSA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-ethoxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)C)OCC)C VHQQBCNPRBCOKQ-MBSDFSHPSA-N 0.000 claims 1
- HNGYVRSMVVCWGF-KKSFZXQISA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-(6-methylpyridin-2-yl)-1,2,4-triazol-3-yl]-1-hydroxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C1=NC(=CC=C1)C)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)C)O)C HNGYVRSMVVCWGF-KKSFZXQISA-N 0.000 claims 1
- FZOYMOQCCXMSMQ-JTSKRJEESA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-pyridin-3-yl-1,2,4-triazol-3-yl]-1-ethoxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=CC=1)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)C)OCC)C FZOYMOQCCXMSMQ-JTSKRJEESA-N 0.000 claims 1
- INFIDBVSCDZIER-KKSFZXQISA-N (1R,2S)-N-[4-(2,6-dimethoxyphenyl)-5-pyridin-3-yl-1,2,4-triazol-3-yl]-1-methoxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=CC=1)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)C)OC)C INFIDBVSCDZIER-KKSFZXQISA-N 0.000 claims 1
- ILZOLHVLNNTIDK-KSSFIOAISA-N (1R,2S)-N-[4-(4,6-dimethoxypyrimidin-5-yl)-5-(6-methoxypyridin-2-yl)-1,2,4-triazol-3-yl]-1-methoxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=NC=NC(=C1N1C(=NN=C1C1=NC(=CC=C1)OC)NS(=O)(=O)[C@H]([C@@H](C1=NC=C(C=N1)C)OC)C)OC ILZOLHVLNNTIDK-KSSFIOAISA-N 0.000 claims 1
- ZGOJNTPVPVPZCX-QVKFZJNVSA-N (1S,2R)-1-(5-chloropyrimidin-2-yl)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-methoxypropane-2-sulfonamide Chemical compound ClC=1C=NC(=NC=1)[C@@H]([C@@H](C)S(=O)(=O)NC1=NN=C(N1C1=C(C=CC=C1OC)OC)C=1C=NC=C(C=1)C)OC ZGOJNTPVPVPZCX-QVKFZJNVSA-N 0.000 claims 1
- KPCFGMNTLOQJKE-UZUQRXQVSA-N (1S,2R)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-methoxy-1-(5-methylpyrazin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@@H]([C@H](C1=NC=C(N=C1)C)OC)C KPCFGMNTLOQJKE-UZUQRXQVSA-N 0.000 claims 1
- LNWWDEBXDFUNSN-OPAMFIHVSA-N (1S,2R)-N-[4-(2,6-dimethoxyphenyl)-5-pyridin-3-yl-1,2,4-triazol-3-yl]-1-methoxy-1-(5-methylpyrazin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=CC=1)NS(=O)(=O)[C@@H]([C@H](C1=NC=C(N=C1)C)OC)C LNWWDEBXDFUNSN-OPAMFIHVSA-N 0.000 claims 1
- VHQQBCNPRBCOKQ-FDDCHVKYSA-N (1S,2S)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-1-ethoxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@H]([C@H](C1=NC=C(C=N1)C)OCC)C VHQQBCNPRBCOKQ-FDDCHVKYSA-N 0.000 claims 1
- LTQBSSWTSVVOFD-IRXDYDNUSA-N (2S,3R)-N-[4-(2,6-dimethoxyphenyl)-5-pyridin-3-yl-1,2,4-triazol-3-yl]-3-(5-methylpyrazin-2-yl)butane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=CC=1)NS(=O)(=O)[C@@H](C)[C@H](C)C1=NC=C(N=C1)C LTQBSSWTSVVOFD-IRXDYDNUSA-N 0.000 claims 1
- CSNAQXOXPFBSCV-IRXDYDNUSA-N (2S,3R)-N-[4-(2,6-dimethoxyphenyl)-5-pyridin-3-yl-1,2,4-triazol-3-yl]-3-(5-methylpyrimidin-2-yl)butane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=CC=1)NS(=O)(=O)[C@@H](C)[C@H](C)C1=NC=C(C=N1)C CSNAQXOXPFBSCV-IRXDYDNUSA-N 0.000 claims 1
- 208000038003 heart failure with preserved ejection fraction Diseases 0.000 claims 1
- KLIDCXVFHGNTTM-UHFFFAOYSA-N 2,6-dimethoxyphenol Chemical group COC1=CC=CC(OC)=C1O KLIDCXVFHGNTTM-UHFFFAOYSA-N 0.000 description 464
- DROIHSMGGKKIJT-UHFFFAOYSA-N propane-1-sulfonamide Chemical compound CCCS(N)(=O)=O DROIHSMGGKKIJT-UHFFFAOYSA-N 0.000 description 212
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 162
- 238000006243 chemical reaction Methods 0.000 description 113
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 98
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 90
- 239000000243 solution Substances 0.000 description 87
- 235000019439 ethyl acetate Nutrition 0.000 description 81
- 238000000034 method Methods 0.000 description 81
- KPCZJLGGXRGYIE-UHFFFAOYSA-N [C]1=CC=CN=C1 Chemical group [C]1=CC=CN=C1 KPCZJLGGXRGYIE-UHFFFAOYSA-N 0.000 description 62
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 61
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 60
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 54
- 239000007787 solid Substances 0.000 description 50
- 125000004093 cyano group Chemical group *C#N 0.000 description 46
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 44
- 238000002360 preparation method Methods 0.000 description 44
- 125000001309 chloro group Chemical group Cl* 0.000 description 39
- 239000000741 silica gel Substances 0.000 description 38
- 229910002027 silica gel Inorganic materials 0.000 description 38
- 239000011541 reaction mixture Substances 0.000 description 37
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 36
- 150000002500 ions Chemical class 0.000 description 36
- 229910052757 nitrogen Inorganic materials 0.000 description 35
- 238000005160 1H NMR spectroscopy Methods 0.000 description 34
- SJMCLWCCNYAWRQ-UHFFFAOYSA-N propane-2-sulfonamide Chemical compound CC(C)S(N)(=O)=O SJMCLWCCNYAWRQ-UHFFFAOYSA-N 0.000 description 33
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 32
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 31
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 30
- 125000003118 aryl group Chemical group 0.000 description 29
- 230000000747 cardiac effect Effects 0.000 description 28
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 27
- 125000004429 atom Chemical group 0.000 description 27
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 26
- 239000003921 oil Substances 0.000 description 26
- 239000000047 product Substances 0.000 description 26
- 239000003795 chemical substances by application Substances 0.000 description 25
- 235000019198 oils Nutrition 0.000 description 25
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical class CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 24
- 201000010099 disease Diseases 0.000 description 24
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 23
- 239000000377 silicon dioxide Substances 0.000 description 23
- UUUHXMGGBIUAPW-UHFFFAOYSA-N 1-[1-[2-[[5-amino-2-[[1-[5-(diaminomethylideneamino)-2-[[1-[3-(1h-indol-3-yl)-2-[(5-oxopyrrolidine-2-carbonyl)amino]propanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-methylpentanoyl]pyrrolidine-2-carbon Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(C(C)CC)NC(=O)C(CCC(N)=O)NC(=O)C1CCCN1C(=O)C(CCCN=C(N)N)NC(=O)C1CCCN1C(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C1CCC(=O)N1 UUUHXMGGBIUAPW-UHFFFAOYSA-N 0.000 description 22
- 102100030988 Angiotensin-converting enzyme Human genes 0.000 description 22
- 108090000882 Peptidyl-Dipeptidase A Proteins 0.000 description 22
- 241000700159 Rattus Species 0.000 description 22
- OVIZSQRQYWEGON-UHFFFAOYSA-N butane-1-sulfonamide Chemical compound CCCCS(N)(=O)=O OVIZSQRQYWEGON-UHFFFAOYSA-N 0.000 description 22
- 239000010410 layer Substances 0.000 description 22
- 239000000463 material Substances 0.000 description 22
- 239000012044 organic layer Substances 0.000 description 22
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 21
- 239000000725 suspension Substances 0.000 description 21
- ZCRZCMUDOWDGOB-UHFFFAOYSA-N ethanesulfonimidic acid Chemical compound CCS(N)(=O)=O ZCRZCMUDOWDGOB-UHFFFAOYSA-N 0.000 description 20
- 208000035475 disorder Diseases 0.000 description 19
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 18
- 230000006870 function Effects 0.000 description 18
- 125000001246 bromo group Chemical group Br* 0.000 description 17
- 125000004432 carbon atom Chemical group C* 0.000 description 17
- FLKRMXAWABTWSH-UHFFFAOYSA-N piperidine-1-sulfonamide Chemical compound NS(=O)(=O)N1CCCCC1 FLKRMXAWABTWSH-UHFFFAOYSA-N 0.000 description 17
- 229920006395 saturated elastomer Polymers 0.000 description 17
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 16
- 239000002253 acid Substances 0.000 description 16
- 229910052799 carbon Inorganic materials 0.000 description 16
- 238000004587 chromatography analysis Methods 0.000 description 16
- 230000002829 reductive effect Effects 0.000 description 16
- 102000018746 Apelin Human genes 0.000 description 15
- 108010052412 Apelin Proteins 0.000 description 15
- 239000012267 brine Substances 0.000 description 15
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 15
- 235000019341 magnesium sulphate Nutrition 0.000 description 15
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 15
- 108010064733 Angiotensins Proteins 0.000 description 14
- 102000015427 Angiotensins Human genes 0.000 description 14
- BWVPHIKGXQBZPV-QKFDDRBGSA-N apelin Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N1[C@H](C(=O)N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=2NC=NC=2)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=2NC=NC=2)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CCSC)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(O)=O)CCC1 BWVPHIKGXQBZPV-QKFDDRBGSA-N 0.000 description 14
- 238000000746 purification Methods 0.000 description 14
- 229910052938 sodium sulfate Inorganic materials 0.000 description 14
- 235000011152 sodium sulphate Nutrition 0.000 description 14
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 13
- 239000007864 aqueous solution Substances 0.000 description 13
- 230000001684 chronic effect Effects 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- 229940124530 sulfonamide Drugs 0.000 description 13
- 208000024891 symptom Diseases 0.000 description 13
- 239000003981 vehicle Substances 0.000 description 13
- 108050000824 Angiotensin II receptor Proteins 0.000 description 12
- 102000008873 Angiotensin II receptor Human genes 0.000 description 12
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 12
- 238000004809 thin layer chromatography Methods 0.000 description 12
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 12
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 11
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 11
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 11
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 11
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical group OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 11
- XXCCRHIAIBQDPX-PEWBXTNBSA-N apelin-13 Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CCC(N)=O)C1=CN=CN1 XXCCRHIAIBQDPX-PEWBXTNBSA-N 0.000 description 11
- 238000004440 column chromatography Methods 0.000 description 11
- 239000012299 nitrogen atmosphere Substances 0.000 description 11
- 239000011591 potassium Substances 0.000 description 11
- 229910052700 potassium Inorganic materials 0.000 description 11
- 108090000765 processed proteins & peptides Proteins 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 239000007832 Na2SO4 Substances 0.000 description 10
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 10
- 229910052681 coesite Inorganic materials 0.000 description 10
- 229910052906 cristobalite Inorganic materials 0.000 description 10
- 125000004122 cyclic group Chemical group 0.000 description 10
- 238000003818 flash chromatography Methods 0.000 description 10
- 239000007788 liquid Substances 0.000 description 10
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 10
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 10
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 10
- 235000012239 silicon dioxide Nutrition 0.000 description 10
- 235000017557 sodium bicarbonate Nutrition 0.000 description 10
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 10
- 229910052682 stishovite Inorganic materials 0.000 description 10
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 10
- 229910052905 tridymite Inorganic materials 0.000 description 10
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 9
- 102400000252 Apelin-13 Human genes 0.000 description 9
- 101000793362 Homo sapiens Apelin receptor Proteins 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 108010040480 apelin-13 peptide Proteins 0.000 description 9
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical compound CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 9
- 239000011734 sodium Substances 0.000 description 9
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 8
- 102100030949 Apelin receptor Human genes 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 239000003480 eluent Substances 0.000 description 8
- 150000002148 esters Chemical class 0.000 description 8
- 239000000284 extract Substances 0.000 description 8
- 239000000706 filtrate Substances 0.000 description 8
- 238000010992 reflux Methods 0.000 description 8
- 238000003756 stirring Methods 0.000 description 8
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical group CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 7
- 206010007559 Cardiac failure congestive Diseases 0.000 description 7
- 208000003037 Diastolic Heart Failure Diseases 0.000 description 7
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 7
- 230000009471 action Effects 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 7
- 238000010828 elution Methods 0.000 description 7
- 238000010438 heat treatment Methods 0.000 description 7
- 229910052739 hydrogen Inorganic materials 0.000 description 7
- 210000005240 left ventricle Anatomy 0.000 description 7
- 239000007858 starting material Substances 0.000 description 7
- 239000003826 tablet Substances 0.000 description 7
- 125000004801 4-cyanophenyl group Chemical group [H]C1=C([H])C(C#N)=C([H])C([H])=C1* 0.000 description 6
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- 208000024172 Cardiovascular disease Diseases 0.000 description 6
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 6
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 6
- 102000003505 Myosin Human genes 0.000 description 6
- 108060008487 Myosin Proteins 0.000 description 6
- INAPMGSXUVUWAF-GCVPSNMTSA-N [(2r,3s,5r,6r)-2,3,4,5,6-pentahydroxycyclohexyl] dihydrogen phosphate Chemical compound OC1[C@H](O)[C@@H](O)C(OP(O)(O)=O)[C@H](O)[C@@H]1O INAPMGSXUVUWAF-GCVPSNMTSA-N 0.000 description 6
- 239000002160 alpha blocker Substances 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 239000000460 chlorine Substances 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Chemical group C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 230000006872 improvement Effects 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 6
- 229910052708 sodium Inorganic materials 0.000 description 6
- 210000000130 stem cell Anatomy 0.000 description 6
- 150000003456 sulfonamides Chemical class 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 5
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 239000012190 activator Substances 0.000 description 5
- 125000003342 alkenyl group Chemical group 0.000 description 5
- 125000005037 alkyl phenyl group Chemical group 0.000 description 5
- 239000012298 atmosphere Substances 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 5
- 210000004027 cell Anatomy 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 5
- 239000007859 condensation product Substances 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 125000004430 oxygen atom Chemical group O* 0.000 description 5
- SIOXPEMLGUPBBT-UHFFFAOYSA-M picolinate Chemical compound [O-]C(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-M 0.000 description 5
- 229910000027 potassium carbonate Inorganic materials 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 229960004063 propylene glycol Drugs 0.000 description 5
- 235000013772 propylene glycol Nutrition 0.000 description 5
- 238000007363 ring formation reaction Methods 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 4
- MHCVCKDNQYMGEX-UHFFFAOYSA-N 1,1'-biphenyl;phenoxybenzene Chemical group C1=CC=CC=C1C1=CC=CC=C1.C=1C=CC=CC=1OC1=CC=CC=C1 MHCVCKDNQYMGEX-UHFFFAOYSA-N 0.000 description 4
- IZYVUBJWWRUYBL-UHFFFAOYSA-N 1-methylindol-3-amine Chemical compound C1=CC=C2N(C)C=C(N)C2=C1 IZYVUBJWWRUYBL-UHFFFAOYSA-N 0.000 description 4
- 125000004215 2,4-difluorophenyl group Chemical group [H]C1=C([H])C(*)=C(F)C([H])=C1F 0.000 description 4
- GRIZOQWCMPOSMR-UHFFFAOYSA-N 2-ethoxy-6-methoxyaniline Chemical compound CCOC1=CC=CC(OC)=C1N GRIZOQWCMPOSMR-UHFFFAOYSA-N 0.000 description 4
- 125000004204 2-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 4
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical group C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 4
- 235000006679 Mentha X verticillata Nutrition 0.000 description 4
- 235000002899 Mentha suaveolens Nutrition 0.000 description 4
- 235000001636 Mentha x rotundifolia Nutrition 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 239000004146 Propane-1,2-diol Substances 0.000 description 4
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 4
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 4
- 241000700157 Rattus norvegicus Species 0.000 description 4
- 208000008253 Systolic Heart Failure Diseases 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 125000003545 alkoxy group Chemical group 0.000 description 4
- 150000001413 amino acids Chemical class 0.000 description 4
- HAMNKKUPIHEESI-UHFFFAOYSA-N aminoguanidine Chemical compound NNC(N)=N HAMNKKUPIHEESI-UHFFFAOYSA-N 0.000 description 4
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 4
- 239000007900 aqueous suspension Substances 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 4
- 125000002837 carbocyclic group Chemical group 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 4
- 239000002270 dispersing agent Substances 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 239000000796 flavoring agent Substances 0.000 description 4
- 235000013355 food flavoring agent Nutrition 0.000 description 4
- 235000003599 food sweetener Nutrition 0.000 description 4
- 230000036961 partial effect Effects 0.000 description 4
- 235000011181 potassium carbonates Nutrition 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 239000003755 preservative agent Substances 0.000 description 4
- 239000000651 prodrug Substances 0.000 description 4
- 229940002612 prodrug Drugs 0.000 description 4
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical compound OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 4
- 239000003087 receptor blocking agent Substances 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 4
- 229960003010 sodium sulfate Drugs 0.000 description 4
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 4
- 239000012453 solvate Substances 0.000 description 4
- 239000000375 suspending agent Substances 0.000 description 4
- 239000003765 sweetening agent Substances 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- 230000000699 topical effect Effects 0.000 description 4
- HBKPDEWGANZHJO-UHFFFAOYSA-N 1-(4-methoxyphenyl)-n-[(4-methoxyphenyl)methyl]methanamine Chemical compound C1=CC(OC)=CC=C1CNCC1=CC=C(OC)C=C1 HBKPDEWGANZHJO-UHFFFAOYSA-N 0.000 description 3
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 3
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- SNTWKPAKVQFCCF-UHFFFAOYSA-N 2,3-dihydro-1h-triazole Chemical compound N1NC=CN1 SNTWKPAKVQFCCF-UHFFFAOYSA-N 0.000 description 3
- HQBJSEKQNRSDAZ-WFGJKAKNSA-N 2,6-bis(trideuteriomethoxy)aniline Chemical compound NC1=C(C=CC=C1OC([2H])([2H])[2H])OC([2H])([2H])[2H] HQBJSEKQNRSDAZ-WFGJKAKNSA-N 0.000 description 3
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 3
- DXVNYGRCASBPNU-UHFFFAOYSA-O 3-amino-6-chloro-N-[[5-[2-[2-(dimethylphosphorylmethoxy)ethylamino]-2-oxoethoxy]-1,3-diethylbenzimidazol-1-ium-2-yl]methyl]pyrazine-2-carboxamide Chemical compound CCn1c(CNC(=O)c2nc(Cl)cnc2N)[n+](CC)c2ccc(OCC(=O)NCCOCP(C)(C)=O)cc12 DXVNYGRCASBPNU-UHFFFAOYSA-O 0.000 description 3
- 239000005541 ACE inhibitor Substances 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- PQSUYGKTWSAVDQ-ZVIOFETBSA-N Aldosterone Chemical compound C([C@@]1([C@@H](C(=O)CO)CC[C@H]1[C@@H]1CC2)C=O)[C@H](O)[C@@H]1[C@]1(C)C2=CC(=O)CC1 PQSUYGKTWSAVDQ-ZVIOFETBSA-N 0.000 description 3
- PQSUYGKTWSAVDQ-UHFFFAOYSA-N Aldosterone Natural products C1CC2C3CCC(C(=O)CO)C3(C=O)CC(O)C2C2(C)C1=CC(=O)CC2 PQSUYGKTWSAVDQ-UHFFFAOYSA-N 0.000 description 3
- 102400000251 Apelin-36 Human genes 0.000 description 3
- 101800001808 Apelin-36 Proteins 0.000 description 3
- 108090000312 Calcium Channels Proteins 0.000 description 3
- 102000003922 Calcium Channels Human genes 0.000 description 3
- 206010007558 Cardiac failure chronic Diseases 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 3
- LFTLOKWAGJYHHR-UHFFFAOYSA-N N-methylmorpholine N-oxide Chemical compound CN1(=O)CCOCC1 LFTLOKWAGJYHHR-UHFFFAOYSA-N 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 3
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 238000009825 accumulation Methods 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 229960002478 aldosterone Drugs 0.000 description 3
- 235000019270 ammonium chloride Nutrition 0.000 description 3
- 239000002333 angiotensin II receptor antagonist Substances 0.000 description 3
- BVTLGARMSLXAHI-VDEROMQGSA-N apelin-36 Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)CNC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(C)C)C(C)C)C1=CN=CN1 BVTLGARMSLXAHI-VDEROMQGSA-N 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- XSCHRSMBECNVNS-UHFFFAOYSA-N benzopyrazine Natural products N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 3
- FCWGIFCVCCHGTK-UHFFFAOYSA-N butane-2-sulfonamide Chemical compound CCC(C)S(N)(=O)=O FCWGIFCVCCHGTK-UHFFFAOYSA-N 0.000 description 3
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 3
- 229910000024 caesium carbonate Inorganic materials 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000003086 colorant Substances 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 125000004786 difluoromethoxy group Chemical group [H]C(F)(F)O* 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N methanesulfonic acid Substances CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 3
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 3
- 208000010125 myocardial infarction Diseases 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 239000004006 olive oil Substances 0.000 description 3
- 235000008390 olive oil Nutrition 0.000 description 3
- GGMAXEWLXWJGSF-PEWBXTNBSA-N p-Glu-Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Met-Pro-Phe Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H]1NC(=O)CC1)C1=CN=CN1 GGMAXEWLXWJGSF-PEWBXTNBSA-N 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- PYNXFZCZUAOOQC-UTKZUKDTSA-N sacubitril Chemical compound C1=CC(C[C@H](C[C@@H](C)C(=O)OCC)NC(=O)CCC(O)=O)=CC=C1C1=CC=CC=C1 PYNXFZCZUAOOQC-UTKZUKDTSA-N 0.000 description 3
- 229960003953 sacubitril Drugs 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 125000004434 sulfur atom Chemical group 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000011269 treatment regimen Methods 0.000 description 3
- 229940055764 triaz Drugs 0.000 description 3
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 3
- 230000002861 ventricular Effects 0.000 description 3
- DYZOOTHRTLTXCJ-CQSZACIVSA-N (2R)-2-[bis[(4-methoxyphenyl)methyl]sulfamoyl]propanoic acid Chemical compound COC1=CC=C(CN(S(=O)(=O)[C@@H](C(=O)O)C)CC2=CC=C(C=C2)OC)C=C1 DYZOOTHRTLTXCJ-CQSZACIVSA-N 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 2
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 description 2
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 2
- HDPNBNXLBDFELL-UHFFFAOYSA-N 1,1,1-trimethoxyethane Chemical compound COC(C)(OC)OC HDPNBNXLBDFELL-UHFFFAOYSA-N 0.000 description 2
- ITQCXTOQWOFOGH-UHFFFAOYSA-N 1,2-bis(difluoromethoxy)benzene Chemical compound FC(F)OC1=CC=CC=C1OC(F)F ITQCXTOQWOFOGH-UHFFFAOYSA-N 0.000 description 2
- YUCBLVFHJWOYDN-HVLQGHBFSA-N 1,4-bis[(s)-[(2r,4s,5r)-5-ethyl-1-azabicyclo[2.2.2]octan-2-yl]-(6-methoxyquinolin-4-yl)methoxy]phthalazine Chemical compound C1=C(OC)C=C2C([C@H](OC=3C4=CC=CC=C4C(O[C@H]([C@@H]4N5CC[C@H]([C@H](C5)CC)C4)C=4C5=CC(OC)=CC=C5N=CC=4)=NN=3)[C@H]3C[C@@H]4CCN3C[C@@H]4CC)=CC=NC2=C1 YUCBLVFHJWOYDN-HVLQGHBFSA-N 0.000 description 2
- ODNITOCEMQSTDG-UHFFFAOYSA-N 1-(5-methylpyrimidin-2-yl)ethane-1,2-diol Chemical compound CC=1C=NC(=NC=1)C(CO)O ODNITOCEMQSTDG-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- LOHAMFKEOQZPLB-UHFFFAOYSA-N 1-hydroxyethanesulfonamide Chemical compound CC(O)S(N)(=O)=O LOHAMFKEOQZPLB-UHFFFAOYSA-N 0.000 description 2
- UXXMPCNKHVNDFI-UHFFFAOYSA-N 1-methoxyethanesulfonamide Chemical compound COC(C)S(N)(=O)=O UXXMPCNKHVNDFI-UHFFFAOYSA-N 0.000 description 2
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 2
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 2
- 125000004793 2,2,2-trifluoroethoxy group Chemical group FC(CO*)(F)F 0.000 description 2
- SJAZWEMIPKUDEL-UHFFFAOYSA-N 2,6-bis(difluoromethoxy)aniline Chemical compound FC(OC1=C(N)C(=CC=C1)OC(F)F)F SJAZWEMIPKUDEL-UHFFFAOYSA-N 0.000 description 2
- OZMLUMPWPFZWTP-UHFFFAOYSA-N 2-(tributyl-$l^{5}-phosphanylidene)acetonitrile Chemical compound CCCCP(CCCC)(CCCC)=CC#N OZMLUMPWPFZWTP-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- VHVYSMMZHORFKU-WFGJKAKNSA-N 2-bromo-1,3-bis(trideuteriomethoxy)benzene Chemical compound BrC1=C(C=CC=C1OC([2H])([2H])[2H])OC([2H])([2H])[2H] VHVYSMMZHORFKU-WFGJKAKNSA-N 0.000 description 2
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 2
- AGYUQBNABXVWMS-UHFFFAOYSA-N 2-chloro-5-fluoropyrimidine Chemical compound FC1=CN=C(Cl)N=C1 AGYUQBNABXVWMS-UHFFFAOYSA-N 0.000 description 2
- APRMCBSTMFKLEI-UHFFFAOYSA-N 2-chloro-5-methylpyrimidine Chemical compound CC1=CN=C(Cl)N=C1 APRMCBSTMFKLEI-UHFFFAOYSA-N 0.000 description 2
- FWJOQHGHIHJIHY-UHFFFAOYSA-N 2-ethenyl-5-methylpyrimidine Chemical compound CC=1C=NC(=NC=1)C=C FWJOQHGHIHJIHY-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- ZNGINKJHQQQORD-UHFFFAOYSA-N 2-trimethylsilylethanol Chemical compound C[Si](C)(C)CCO ZNGINKJHQQQORD-UHFFFAOYSA-N 0.000 description 2
- DNCVSZHNFQLPLX-UHFFFAOYSA-N 3,3,3-trifluoropropane-1-sulfonamide Chemical compound NS(=O)(=O)CCC(F)(F)F DNCVSZHNFQLPLX-UHFFFAOYSA-N 0.000 description 2
- KCJLDYVWDOTJKK-UHFFFAOYSA-N 4-isothiocyanatopyridine Chemical compound S=C=NC1=CC=NC=C1 KCJLDYVWDOTJKK-UHFFFAOYSA-N 0.000 description 2
- OBPDHHJZPOGJPO-UHFFFAOYSA-N 5-methylpyrimidine-2-carbaldehyde Chemical compound CC1=CN=C(C=O)N=C1 OBPDHHJZPOGJPO-UHFFFAOYSA-N 0.000 description 2
- USQCUKQZXOWUDF-YWZLYKJASA-N 6-chloro-n-[(3s)-1-[(2s)-1-(4-methyl-5-oxo-1,4-diazepan-1-yl)-1-oxopropan-2-yl]-2-oxopyrrolidin-3-yl]naphthalene-2-sulfonamide Chemical compound O=C([C@@H](N1C([C@@H](NS(=O)(=O)C=2C=C3C=CC(Cl)=CC3=CC=2)CC1)=O)C)N1CCN(C)C(=O)CC1 USQCUKQZXOWUDF-YWZLYKJASA-N 0.000 description 2
- VWIOMFMPIVMLIR-UHFFFAOYSA-N 6-methoxycarbonylpyridine-2-carboxylic acid Chemical compound COC(=O)C1=CC=CC(C(O)=O)=N1 VWIOMFMPIVMLIR-UHFFFAOYSA-N 0.000 description 2
- RNVLWLLEQBBBMM-UHFFFAOYSA-N 6-methylpyridine-2-carbohydrazide Chemical compound CC1=CC=CC(C(=O)NN)=N1 RNVLWLLEQBBBMM-UHFFFAOYSA-N 0.000 description 2
- LTUUGSGSUZRPRV-UHFFFAOYSA-N 6-methylpyridine-2-carboxylic acid Chemical compound CC1=CC=CC(C(O)=O)=N1 LTUUGSGSUZRPRV-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010003658 Atrial Fibrillation Diseases 0.000 description 2
- 239000005711 Benzoic acid Substances 0.000 description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 208000031229 Cardiomyopathies Diseases 0.000 description 2
- 108091006146 Channels Proteins 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 240000007472 Leucaena leucocephala Species 0.000 description 2
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 2
- 235000019483 Peanut oil Nutrition 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 235000015107 ale Nutrition 0.000 description 2
- 229940124308 alpha-adrenoreceptor antagonist Drugs 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 235000011114 ammonium hydroxide Nutrition 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000000118 anti-neoplastic effect Effects 0.000 description 2
- 208000007474 aortic aneurysm Diseases 0.000 description 2
- 206010003119 arrhythmia Diseases 0.000 description 2
- 230000006793 arrhythmia Effects 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 150000001540 azides Chemical class 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 125000005605 benzo group Chemical group 0.000 description 2
- 235000010233 benzoic acid Nutrition 0.000 description 2
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- GZHHKSBEDWAMAI-UHFFFAOYSA-N but-2-ene-2-sulfonamide Chemical compound CC=C(C)S(N)(=O)=O GZHHKSBEDWAMAI-UHFFFAOYSA-N 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 229910052792 caesium Inorganic materials 0.000 description 2
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 235000011089 carbon dioxide Nutrition 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 239000012230 colorless oil Substances 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- DMEGYFMYUHOHGS-UHFFFAOYSA-N cycloheptane Chemical compound C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 2
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 2
- YMWUJEATGCHHMB-DICFDUPASA-N dichloromethane-d2 Chemical compound [2H]C([2H])(Cl)Cl YMWUJEATGCHHMB-DICFDUPASA-N 0.000 description 2
- 125000004925 dihydropyridyl group Chemical group N1(CC=CC=C1)* 0.000 description 2
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 229910001873 dinitrogen Inorganic materials 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 239000006274 endogenous ligand Substances 0.000 description 2
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Chemical group CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 2
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Chemical group C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000000297 inotrophic effect Effects 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- 229940057995 liquid paraffin Drugs 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- TVUWLLCWQGXPSH-UHFFFAOYSA-N methyl 5-chloropyridine-3-carboxylate Chemical compound COC(=O)C1=CN=CC(Cl)=C1 TVUWLLCWQGXPSH-UHFFFAOYSA-N 0.000 description 2
- PBSPOYWSYIHTOO-UHFFFAOYSA-N methyl 6-(methylamino)pyridine-2-carboxylate Chemical compound CNC1=CC=CC(=N1)C(=O)OC PBSPOYWSYIHTOO-UHFFFAOYSA-N 0.000 description 2
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 2
- GRVDJDISBSALJP-UHFFFAOYSA-N methyloxidanyl Chemical group [O]C GRVDJDISBSALJP-UHFFFAOYSA-N 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 210000004877 mucosa Anatomy 0.000 description 2
- 230000002107 myocardial effect Effects 0.000 description 2
- AWPZCYLPRTWKFS-UHFFFAOYSA-N n,n-bis[(4-methoxyphenyl)methyl]ethanesulfonamide Chemical compound C=1C=C(OC)C=CC=1CN(S(=O)(=O)CC)CC1=CC=C(OC)C=C1 AWPZCYLPRTWKFS-UHFFFAOYSA-N 0.000 description 2
- QWLISCJHYITNQF-UHFFFAOYSA-N n-methoxy-1-phenylmethanamine Chemical compound CONCC1=CC=CC=C1 QWLISCJHYITNQF-UHFFFAOYSA-N 0.000 description 2
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 150000002924 oxiranes Chemical class 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 239000000312 peanut oil Substances 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 125000006238 prop-1-en-1-yl group Chemical group [H]\C(*)=C(/[H])C([H])([H])[H] 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-O pyridinium Chemical compound C1=CC=[NH+]C=C1 JUJWROOIHBZHMG-UHFFFAOYSA-O 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000012279 sodium borohydride Substances 0.000 description 2
- 229910000033 sodium borohydride Inorganic materials 0.000 description 2
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- 235000010265 sodium sulphite Nutrition 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- RMMXLENWKUUMAY-UHFFFAOYSA-N telmisartan Chemical compound CCCC1=NC2=C(C)C=C(C=3N(C4=CC=CC=C4N=3)C)C=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C(O)=O RMMXLENWKUUMAY-UHFFFAOYSA-N 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 150000003536 tetrazoles Chemical class 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 229930192474 thiophene Natural products 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- HMJIYCCIJYRONP-UHFFFAOYSA-N (+-)-Isradipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)C1C1=CC=CC2=NON=C12 HMJIYCCIJYRONP-UHFFFAOYSA-N 0.000 description 1
- CEMAWMOMDPGJMB-UHFFFAOYSA-N (+-)-Oxprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1OCC=C CEMAWMOMDPGJMB-UHFFFAOYSA-N 0.000 description 1
- LPADTGJXKDLGBF-RQJHMYQMSA-N (1R,2R)-1-(5-methylpyrimidin-2-yl)propane-1,2-diol Chemical compound CC=1C=NC(=NC=1)[C@H]([C@@H](C)O)O LPADTGJXKDLGBF-RQJHMYQMSA-N 0.000 description 1
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- GHPYJLCQYMAXGG-WCCKRBBISA-N (2R)-2-amino-3-(2-boronoethylsulfanyl)propanoic acid hydrochloride Chemical compound Cl.N[C@@H](CSCCB(O)O)C(O)=O GHPYJLCQYMAXGG-WCCKRBBISA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- ZEURMUJAECBUGM-YFKPBYRVSA-N (2S)-1-(5-fluoropyrimidin-2-yl)propane-2-sulfonic acid Chemical compound FC=1C=NC(=NC=1)C[C@H](C)S(=O)(=O)O ZEURMUJAECBUGM-YFKPBYRVSA-N 0.000 description 1
- YUIKNUZUIYLZCA-YUMQZZPRSA-N (2S,3R)-3-(5-methylpyrimidin-2-yl)butane-2-sulfonamide Chemical compound CC=1C=NC(=NC=1)[C@H]([C@H](C)S(=O)(=O)N)C YUIKNUZUIYLZCA-YUMQZZPRSA-N 0.000 description 1
- NXWGWUVGUSFQJC-GFCCVEGCSA-N (2r)-1-[(2-methyl-1h-indol-4-yl)oxy]-3-(propan-2-ylamino)propan-2-ol Chemical compound CC(C)NC[C@@H](O)COC1=CC=CC2=C1C=C(C)N2 NXWGWUVGUSFQJC-GFCCVEGCSA-N 0.000 description 1
- TXSINLUUGRGAJO-WCBMZHEXSA-N (2s)-2-[[(2s)-2-(1,3-benzodioxol-5-ylmethyl)-3-sulfanylpropanoyl]amino]propanoic acid Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H](CS)CC1=CC=C2OCOC2=C1 TXSINLUUGRGAJO-WCBMZHEXSA-N 0.000 description 1
- YKFCISHFRZHKHY-NGQGLHOPSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)-2-methylpropanoic acid;trihydrate Chemical compound O.O.O.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1 YKFCISHFRZHKHY-NGQGLHOPSA-N 0.000 description 1
- BIDNLKIUORFRQP-XYGFDPSESA-N (2s,4s)-4-cyclohexyl-1-[2-[[(1s)-2-methyl-1-propanoyloxypropoxy]-(4-phenylbutyl)phosphoryl]acetyl]pyrrolidine-2-carboxylic acid Chemical compound C([P@@](=O)(O[C@H](OC(=O)CC)C(C)C)CC(=O)N1[C@@H](C[C@H](C1)C1CCCCC1)C(O)=O)CCCC1=CC=CC=C1 BIDNLKIUORFRQP-XYGFDPSESA-N 0.000 description 1
- XUHRVZXFBWDCFB-QRTDKPMLSA-N (3R)-4-[[(3S,6S,9S,12R,15S,18R,21R,24R,27R,28R)-12-(3-amino-3-oxopropyl)-6-[(2S)-butan-2-yl]-3-(2-carboxyethyl)-18-(hydroxymethyl)-28-methyl-9,15,21,24-tetrakis(2-methylpropyl)-2,5,8,11,14,17,20,23,26-nonaoxo-1-oxa-4,7,10,13,16,19,22,25-octazacyclooctacos-27-yl]amino]-3-[[(2R)-2-[[(3S)-3-hydroxydecanoyl]amino]-4-methylpentanoyl]amino]-4-oxobutanoic acid Chemical compound CCCCCCC[C@H](O)CC(=O)N[C@H](CC(C)C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H]1[C@@H](C)OC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CO)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC1=O)[C@@H](C)CC XUHRVZXFBWDCFB-QRTDKPMLSA-N 0.000 description 1
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 description 1
- RPXLIJOEEAWCEK-BQYQJAHWSA-N (E)-3-(5-methylpyrimidin-2-yl)but-2-ene-2-sulfonamide Chemical compound CC=1C=NC(=NC=1)/C(=C(\C)/S(=O)(=O)N)/C RPXLIJOEEAWCEK-BQYQJAHWSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- METKIMKYRPQLGS-GFCCVEGCSA-N (R)-atenolol Chemical compound CC(C)NC[C@@H](O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-GFCCVEGCSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- PVHUJELLJLJGLN-INIZCTEOSA-N (S)-nitrendipine Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)[C@@H]1C1=CC=CC([N+]([O-])=O)=C1 PVHUJELLJLJGLN-INIZCTEOSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- 125000001305 1,2,4-triazol-3-yl group Chemical group [H]N1N=C([*])N=C1[H] 0.000 description 1
- YXIWHUQXZSMYRE-UHFFFAOYSA-N 1,3-benzothiazole-2-thiol Chemical compound C1=CC=C2SC(S)=NC2=C1 YXIWHUQXZSMYRE-UHFFFAOYSA-N 0.000 description 1
- VBXZSFNZVNDOPB-UHFFFAOYSA-N 1,4,5,6-tetrahydropyrimidine Chemical compound C1CNC=NC1 VBXZSFNZVNDOPB-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- YFVKHKCZBSGZPE-UHFFFAOYSA-N 1-(1,3-benzodioxol-5-yl)-2-(propylamino)propan-1-one Chemical compound CCCNC(C)C(=O)C1=CC=C2OCOC2=C1 YFVKHKCZBSGZPE-UHFFFAOYSA-N 0.000 description 1
- URMQSRFPLJSLTP-UHFFFAOYSA-N 1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound CC=1C=NC(=NC=1)CC(C)S(=O)(=O)N URMQSRFPLJSLTP-UHFFFAOYSA-N 0.000 description 1
- MICMHFIQSAMEJG-UHFFFAOYSA-N 1-bromopyrrolidine-2,5-dione Chemical compound BrN1C(=O)CCC1=O.BrN1C(=O)CCC1=O MICMHFIQSAMEJG-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- QTFOITGZOMITTG-UHFFFAOYSA-N 1-ethoxy-1-(5-methylpyrimidin-2-yl)propane-2-sulfonamide Chemical compound C(C)OC(C(C)S(=O)(=O)N)C1=NC=C(C=N1)C QTFOITGZOMITTG-UHFFFAOYSA-N 0.000 description 1
- WNWYEFINMOBJTL-UHFFFAOYSA-N 1-ethoxy-3-methoxy-2-nitrobenzene Chemical compound CCOC1=CC=CC(OC)=C1[N+]([O-])=O WNWYEFINMOBJTL-UHFFFAOYSA-N 0.000 description 1
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical group CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 1
- YVTPINJIEGFACL-UHFFFAOYSA-N 1-piperidin-1-yloxypiperidine Chemical compound C1CCCCN1ON1CCCCC1 YVTPINJIEGFACL-UHFFFAOYSA-N 0.000 description 1
- ZLTWIJREHQCJJL-UHFFFAOYSA-N 1-trimethylsilylethanol Chemical compound CC(O)[Si](C)(C)C ZLTWIJREHQCJJL-UHFFFAOYSA-N 0.000 description 1
- OOLUVSIJOMLOCB-UHFFFAOYSA-N 1633-22-3 Chemical compound C1CC(C=C2)=CC=C2CCC2=CC=C1C=C2 OOLUVSIJOMLOCB-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical group C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- MFJCPDOGFAYSTF-UHFFFAOYSA-N 1H-isochromene Chemical compound C1=CC=C2COC=CC2=C1 MFJCPDOGFAYSTF-UHFFFAOYSA-N 0.000 description 1
- AAQTWLBJPNLKHT-UHFFFAOYSA-N 1H-perimidine Chemical compound N1C=NC2=CC=CC3=CC=CC1=C32 AAQTWLBJPNLKHT-UHFFFAOYSA-N 0.000 description 1
- ODMMNALOCMNQJZ-UHFFFAOYSA-N 1H-pyrrolizine Chemical compound C1=CC=C2CC=CN21 ODMMNALOCMNQJZ-UHFFFAOYSA-N 0.000 description 1
- XIZCDQOKKYYCRH-UHFFFAOYSA-N 1h-benzimidazole-2-carboxamide Chemical compound C1=CC=C2NC(C(=O)N)=NC2=C1 XIZCDQOKKYYCRH-UHFFFAOYSA-N 0.000 description 1
- 125000000453 2,2,2-trichloroethyl group Chemical group [H]C([H])(*)C(Cl)(Cl)Cl 0.000 description 1
- NRKYWOKHZRQRJR-UHFFFAOYSA-N 2,2,2-trifluoroacetamide Chemical compound NC(=O)C(F)(F)F NRKYWOKHZRQRJR-UHFFFAOYSA-N 0.000 description 1
- NYZSKEULTVZUAW-UHFFFAOYSA-N 2,2-bis(trifluoromethyl)oxirane Chemical compound FC(F)(F)C1(C(F)(F)F)CO1 NYZSKEULTVZUAW-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- HQBJSEKQNRSDAZ-UHFFFAOYSA-N 2,6-dimethoxyaniline Chemical compound COC1=CC=CC(OC)=C1N HQBJSEKQNRSDAZ-UHFFFAOYSA-N 0.000 description 1
- MJSGXOXCPKTZTK-UHFFFAOYSA-N 2-(2-bromo-4-fluorophenyl)acetic acid Chemical compound OC(=O)CC1=CC=C(F)C=C1Br MJSGXOXCPKTZTK-UHFFFAOYSA-N 0.000 description 1
- PZUYKYIFIXNOJU-UHFFFAOYSA-N 2-(2-chloro-3-pyrimidin-2-ylsulfanylbutan-2-yl)-5-fluoropyrimidine Chemical compound ClC(C)(C(C)SC1=NC=CC=N1)C1=NC=C(C=N1)F PZUYKYIFIXNOJU-UHFFFAOYSA-N 0.000 description 1
- WUFWJWDACVVQEH-UHFFFAOYSA-N 2-(2-chloroethyl)-5-fluorobenzonitrile Chemical compound ClCCC1=C(C#N)C=C(C=C1)F WUFWJWDACVVQEH-UHFFFAOYSA-N 0.000 description 1
- RKLYPAMYUBYYEJ-UHFFFAOYSA-N 2-(2-cyano-4-fluorophenyl)ethanesulfonamide Chemical compound C(#N)C1=C(C=CC(=C1)F)CCS(=O)(=O)N RKLYPAMYUBYYEJ-UHFFFAOYSA-N 0.000 description 1
- PHXNSLSQHPTRRL-UHFFFAOYSA-N 2-(2-cyano-4-fluorophenyl)ethanesulfonyl chloride Chemical compound C(#N)C1=C(C=CC(=C1)F)CCS(=O)(=O)Cl PHXNSLSQHPTRRL-UHFFFAOYSA-N 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- MELHNKOXAUMGSR-UHFFFAOYSA-N 2-(5-fluoropyrimidin-2-yl)ethanesulfonamide Chemical compound FC=1C=NC(=NC=1)CCS(=O)(=O)N MELHNKOXAUMGSR-UHFFFAOYSA-N 0.000 description 1
- MQLMVBJLLUIOFR-UHFFFAOYSA-N 2-(5-fluoropyrimidin-2-yl)ethanesulfonic acid Chemical compound FC=1C=NC(=NC=1)CCS(=O)(=O)O MQLMVBJLLUIOFR-UHFFFAOYSA-N 0.000 description 1
- PKZJLOCLABXVMC-UHFFFAOYSA-N 2-Methoxybenzaldehyde Chemical compound COC1=CC=CC=C1C=O PKZJLOCLABXVMC-UHFFFAOYSA-N 0.000 description 1
- HTGCXGAEJVGVKP-XBXARRHUSA-N 2-[(E)-but-2-en-2-yl]-5-methylpyrimidine Chemical compound C/C(=C\C)/C1=NC=C(C=N1)C HTGCXGAEJVGVKP-XBXARRHUSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- QHGXBOGCHZHHMA-UHFFFAOYSA-N 2-bromo-1,3-bis(difluoromethoxy)benzene Chemical compound BrC1=C(C=CC=C1OC(F)F)OC(F)F QHGXBOGCHZHHMA-UHFFFAOYSA-N 0.000 description 1
- UOLPZAPIFFZLMF-UHFFFAOYSA-N 2-bromobenzene-1,3-diol Chemical compound OC1=CC=CC(O)=C1Br UOLPZAPIFFZLMF-UHFFFAOYSA-N 0.000 description 1
- OAWAZQITIZDJRB-UHFFFAOYSA-M 2-chloro-2,2-difluoroacetate Chemical compound [O-]C(=O)C(F)(F)Cl OAWAZQITIZDJRB-UHFFFAOYSA-M 0.000 description 1
- 125000004182 2-chlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(*)C([H])=C1[H] 0.000 description 1
- UCQAQUQIGUHWOP-UHFFFAOYSA-N 2-ethenyl-5-fluoropyrimidine Chemical compound FC1=CN=C(C=C)N=C1 UCQAQUQIGUHWOP-UHFFFAOYSA-N 0.000 description 1
- ZNQVEEAIQZEUHB-UHFFFAOYSA-N 2-ethoxyethanol Chemical compound CCOCCO ZNQVEEAIQZEUHB-UHFFFAOYSA-N 0.000 description 1
- JHAOBOOXVRICBS-UHFFFAOYSA-N 2-ethyl-5-fluorobenzonitrile Chemical compound CCC1=CC=C(F)C=C1C#N JHAOBOOXVRICBS-UHFFFAOYSA-N 0.000 description 1
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 description 1
- IWTFOFMTUOBLHG-UHFFFAOYSA-N 2-methoxypyridine Chemical compound COC1=CC=CC=N1 IWTFOFMTUOBLHG-UHFFFAOYSA-N 0.000 description 1
- XWKFPIODWVPXLX-UHFFFAOYSA-N 2-methyl-5-methylpyridine Natural products CC1=CC=C(C)N=C1 XWKFPIODWVPXLX-UHFFFAOYSA-N 0.000 description 1
- SDTMFDGELKWGFT-UHFFFAOYSA-N 2-methylpropan-2-olate Chemical compound CC(C)(C)[O-] SDTMFDGELKWGFT-UHFFFAOYSA-N 0.000 description 1
- GWJSQKNYHPYZRN-UHFFFAOYSA-N 2-methylpropane-2-sulfonamide Chemical compound CC(C)(C)S(N)(=O)=O GWJSQKNYHPYZRN-UHFFFAOYSA-N 0.000 description 1
- CFBYEGUGFPZCNF-UHFFFAOYSA-N 2-nitroanisole Chemical compound COC1=CC=CC=C1[N+]([O-])=O CFBYEGUGFPZCNF-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- JVLFMTZUPSBCNJ-UHFFFAOYSA-N 3,5-difluoropyridin-2-amine Chemical compound NC1=NC=C(F)C=C1F JVLFMTZUPSBCNJ-UHFFFAOYSA-N 0.000 description 1
- JHUUPUMBZGWODW-UHFFFAOYSA-N 3,6-dihydro-1,2-dioxine Chemical compound C1OOCC=C1 JHUUPUMBZGWODW-UHFFFAOYSA-N 0.000 description 1
- KOHOTORNQAKCAO-UHFFFAOYSA-N 3-(5-fluoropyrimidin-2-yl)butane-2-sulfonamide Chemical compound FC=1C=NC(=NC=1)C(C(C)S(=O)(=O)N)C KOHOTORNQAKCAO-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000006275 3-bromophenyl group Chemical group [H]C1=C([H])C(Br)=C([H])C(*)=C1[H] 0.000 description 1
- 125000004179 3-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(Cl)=C1[H] 0.000 description 1
- ZRPLANDPDWYOMZ-UHFFFAOYSA-N 3-cyclopentylpropionic acid Chemical compound OC(=O)CCC1CCCC1 ZRPLANDPDWYOMZ-UHFFFAOYSA-N 0.000 description 1
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 description 1
- BRARRAHGNDUELT-UHFFFAOYSA-N 3-hydroxypicolinic acid Chemical compound OC(=O)C1=NC=CC=C1O BRARRAHGNDUELT-UHFFFAOYSA-N 0.000 description 1
- SYIABKXOJVXKDU-UHFFFAOYSA-N 4,6-dimethoxypyrimidin-5-amine Chemical compound COC1=NC=NC(OC)=C1N SYIABKXOJVXKDU-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- ZZLCFHIKESPLTH-UHFFFAOYSA-N 4-Methylbiphenyl Chemical compound C1=CC(C)=CC=C1C1=CC=CC=C1 ZZLCFHIKESPLTH-UHFFFAOYSA-N 0.000 description 1
- NUKYPUAOHBNCPY-UHFFFAOYSA-N 4-aminopyridine Chemical compound NC1=CC=NC=C1 NUKYPUAOHBNCPY-UHFFFAOYSA-N 0.000 description 1
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 1
- GDRVFDDBLLKWRI-UHFFFAOYSA-N 4H-quinolizine Chemical compound C1=CC=CN2CC=CC=C21 GDRVFDDBLLKWRI-UHFFFAOYSA-N 0.000 description 1
- HYHHGFFTWSYNMV-UHFFFAOYSA-N 5-bromobenzene-1,3-diol Chemical compound OC1=CC(O)=CC(Br)=C1 HYHHGFFTWSYNMV-UHFFFAOYSA-N 0.000 description 1
- XYLPLVUYPAPCML-UHFFFAOYSA-N 5-chloropyridine-3-carboxylic acid Chemical compound OC(=O)C1=CN=CC(Cl)=C1 XYLPLVUYPAPCML-UHFFFAOYSA-N 0.000 description 1
- YIPRNMUXUKHYCX-UHFFFAOYSA-N 5-fluoro-2-(2-hydroxyethyl)benzonitrile Chemical compound FC=1C=CC(=C(C#N)C=1)CCO YIPRNMUXUKHYCX-UHFFFAOYSA-N 0.000 description 1
- QYETYHLUMORGJR-NSCUHMNNSA-N 5-fluoro-2-[(E)-prop-1-enyl]pyrimidine Chemical compound FC=1C=NC(=NC=1)\C=C\C QYETYHLUMORGJR-NSCUHMNNSA-N 0.000 description 1
- YRXZZZCJRMNIRB-RQJHMYQMSA-N 5-methyl-2-[(2R,3R)-3-methyloxiran-2-yl]pyrimidine Chemical compound CC=1C=NC(=NC=1)[C@H]1O[C@@H]1C YRXZZZCJRMNIRB-RQJHMYQMSA-N 0.000 description 1
- FBWFADMKYXKECV-ONEGZZNKSA-N 5-methyl-2-[(e)-prop-1-enyl]pyrimidine Chemical compound C\C=C\C1=NC=C(C)C=N1 FBWFADMKYXKECV-ONEGZZNKSA-N 0.000 description 1
- TWGNOYAGHYUFFR-UHFFFAOYSA-N 5-methylpyrimidine Chemical compound CC1=CN=CN=C1 TWGNOYAGHYUFFR-UHFFFAOYSA-N 0.000 description 1
- RZTAMFZIAATZDJ-HNNXBMFYSA-N 5-o-ethyl 3-o-methyl (4s)-4-(2,3-dichlorophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)[C@@H]1C1=CC=CC(Cl)=C1Cl RZTAMFZIAATZDJ-HNNXBMFYSA-N 0.000 description 1
- FJHFQKSRUUDCOG-UHFFFAOYSA-N 6-(difluoromethoxy)pyridine-2-carbohydrazide Chemical compound FC(OC1=CC=CC(=N1)C(=O)NN)F FJHFQKSRUUDCOG-UHFFFAOYSA-N 0.000 description 1
- GMZSCQXNOIDMCL-FIBGUPNXSA-N 6-(trideuteriomethoxy)pyridine-2-carbohydrazide Chemical compound C(OC1=CC=CC(=N1)C(=O)NN)([2H])([2H])[2H] GMZSCQXNOIDMCL-FIBGUPNXSA-N 0.000 description 1
- VRCWSYYXUCKEED-UHFFFAOYSA-N 6-Hydroxypicolinic acid Chemical compound OC(=O)C1=CC=CC(=O)N1 VRCWSYYXUCKEED-UHFFFAOYSA-N 0.000 description 1
- NMCKJFCJIHCHIS-UHFFFAOYSA-N 6-aminopyridine-2-carboxylic acid Chemical compound NC1=CC=CC(C(O)=O)=N1 NMCKJFCJIHCHIS-UHFFFAOYSA-N 0.000 description 1
- 125000006164 6-membered heteroaryl group Chemical group 0.000 description 1
- GMZSCQXNOIDMCL-UHFFFAOYSA-N 6-methoxypyridine-2-carbohydrazide Chemical compound COC1=CC=CC(C(=O)NN)=N1 GMZSCQXNOIDMCL-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 229940124752 APJ receptor agonist Drugs 0.000 description 1
- 101150108397 Abcd2 gene Proteins 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000030090 Acute Disease Diseases 0.000 description 1
- JBMKAUGHUNFTOL-UHFFFAOYSA-N Aldoclor Chemical class C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC=NS2(=O)=O JBMKAUGHUNFTOL-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 229940123073 Angiotensin antagonist Drugs 0.000 description 1
- 101710129690 Angiotensin-converting enzyme inhibitor Proteins 0.000 description 1
- 241000615866 Antho Species 0.000 description 1
- 102100029459 Apelin Human genes 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- XPCFTKFZXHTYIP-PMACEKPBSA-N Benazepril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N(CC(O)=O)C2=CC=CC=C2CC1)=O)CC1=CC=CC=C1 XPCFTKFZXHTYIP-PMACEKPBSA-N 0.000 description 1
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 101710086378 Bradykinin-potentiating and C-type natriuretic peptides Proteins 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- 239000002080 C09CA02 - Eprosartan Substances 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- 239000002947 C09CA04 - Irbesartan Substances 0.000 description 1
- 239000005537 C09CA07 - Telmisartan Substances 0.000 description 1
- FGUUSXIOTUKUDN-IBGZPJMESA-N C1(=CC=CC=C1)N1C2=C(NC([C@H](C1)NC=1OC(=NN=1)C1=CC=CC=C1)=O)C=CC=C2 Chemical compound C1(=CC=CC=C1)N1C2=C(NC([C@H](C1)NC=1OC(=NN=1)C1=CC=CC=C1)=O)C=CC=C2 FGUUSXIOTUKUDN-IBGZPJMESA-N 0.000 description 1
- NTOXAXQNZZXUQQ-UHFFFAOYSA-N C1(OC(=C(C)C)O1)=O Chemical compound C1(OC(=C(C)C)O1)=O NTOXAXQNZZXUQQ-UHFFFAOYSA-N 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- UJOBWOGCFQCDNV-UHFFFAOYSA-N Carbazole Natural products C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- JOATXPAWOHTVSZ-UHFFFAOYSA-N Celiprolol Chemical compound CCN(CC)C(=O)NC1=CC=C(OCC(O)CNC(C)(C)C)C(C(C)=O)=C1 JOATXPAWOHTVSZ-UHFFFAOYSA-N 0.000 description 1
- IFYLTXNCFVRALQ-OALUTQOASA-N Ceronapril Chemical compound O([C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(O)=O)P(O)(=O)CCCCC1=CC=CC=C1 IFYLTXNCFVRALQ-OALUTQOASA-N 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 102100034741 Cyclin-dependent kinase 20 Human genes 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- 108010009911 Cytochrome P-450 CYP11B2 Proteins 0.000 description 1
- 102100024329 Cytochrome P450 11B2, mitochondrial Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 208000034423 Delivery Diseases 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010052337 Diastolic dysfunction Diseases 0.000 description 1
- 108010061435 Enalapril Proteins 0.000 description 1
- 229940124143 Endopeptidase inhibitor Drugs 0.000 description 1
- 108050009340 Endothelin Proteins 0.000 description 1
- 102000002045 Endothelin Human genes 0.000 description 1
- 229940118365 Endothelin receptor antagonist Drugs 0.000 description 1
- 241001331845 Equus asinus x caballus Species 0.000 description 1
- 208000007530 Essential hypertension Diseases 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- OHAIQPNXMMHGIV-UHFFFAOYSA-N FC(ON(C1=CC=CC=C1)OC(F)F)F Chemical compound FC(ON(C1=CC=CC=C1)OC(F)F)F OHAIQPNXMMHGIV-UHFFFAOYSA-N 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- INJOMKTZOLKMBF-UHFFFAOYSA-N Guanfacine Chemical compound NC(=N)NC(=O)CC1=C(Cl)C=CC=C1Cl INJOMKTZOLKMBF-UHFFFAOYSA-N 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000771523 Homo sapiens Apelin Proteins 0.000 description 1
- WRYCSMQKUKOKBP-UHFFFAOYSA-N Imidazolidine Chemical compound C1CNCN1 WRYCSMQKUKOKBP-UHFFFAOYSA-N 0.000 description 1
- 206010061216 Infarction Diseases 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- LNQCUTNLHUQZLR-VNPYQEQNSA-N Iridin Natural products O(C)c1c(O)c2C(=O)C(c3cc(OC)c(OC)c(O)c3)=COc2cc1O[C@H]1[C@@H](O)[C@@H](O)[C@H](O)[C@H](CO)O1 LNQCUTNLHUQZLR-VNPYQEQNSA-N 0.000 description 1
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 1
- 238000000023 Kugelrohr distillation Methods 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 102000006835 Lamins Human genes 0.000 description 1
- 108010047294 Lamins Proteins 0.000 description 1
- 208000007177 Left Ventricular Hypertrophy Diseases 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- 101500014379 Lymnaea stagnalis Ovulation hormone Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- CESYKOGBSMNBPD-UHFFFAOYSA-N Methyclothiazide Chemical compound ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)N(C)C(CCl)NC2=C1 CESYKOGBSMNBPD-UHFFFAOYSA-N 0.000 description 1
- NMMIHXMBOZYNET-UHFFFAOYSA-N Methyl picolinate Chemical compound COC(=O)C1=CC=CC=N1 NMMIHXMBOZYNET-UHFFFAOYSA-N 0.000 description 1
- 101100521345 Mus musculus Prop1 gene Proteins 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- ZKGNPQKYVKXMGJ-UHFFFAOYSA-N N,N-dimethylacetamide Chemical compound CN(C)C(C)=O.CN(C)C(C)=O ZKGNPQKYVKXMGJ-UHFFFAOYSA-N 0.000 description 1
- YKXNVZYRZWDPSZ-UHFFFAOYSA-N N-(5-methylpyridin-3-yl)propane-1-sulfonamide Chemical compound CCCS(=O)(=O)Nc1cncc(C)c1 YKXNVZYRZWDPSZ-UHFFFAOYSA-N 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- CLAXOXJGOCSIQZ-UHFFFAOYSA-N N-pyridin-3-ylpropane-1-sulfonamide Chemical compound CCCS(=O)(=O)NC1=CC=CN=C1 CLAXOXJGOCSIQZ-UHFFFAOYSA-N 0.000 description 1
- VJILSKNTWZNOSW-UHFFFAOYSA-N N-pyrrolidin-1-ylpropane-2-sulfonamide Chemical compound CC(C)S(=O)(=O)NN1CCCC1 VJILSKNTWZNOSW-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- ZBBHBTPTTSWHBA-UHFFFAOYSA-N Nicardipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCCN(C)CC=2C=CC=CC=2)C1C1=CC=CC([N+]([O-])=O)=C1 ZBBHBTPTTSWHBA-UHFFFAOYSA-N 0.000 description 1
- FAIIFDPAEUKBEP-UHFFFAOYSA-N Nilvadipine Chemical compound COC(=O)C1=C(C#N)NC(C)=C(C(=O)OC(C)C)C1C1=CC=CC([N+]([O-])=O)=C1 FAIIFDPAEUKBEP-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 239000005480 Olmesartan Substances 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 208000004880 Polyuria Diseases 0.000 description 1
- IFFPICMESYHZPQ-UHFFFAOYSA-N Prenylamine Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)CCNC(C)CC1=CC=CC=C1 IFFPICMESYHZPQ-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 108700017836 Prophet of Pit-1 Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- BCKXLBQYZLBQEK-KVVVOXFISA-M Sodium oleate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC([O-])=O BCKXLBQYZLBQEK-KVVVOXFISA-M 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 206010042496 Sunburn Diseases 0.000 description 1
- 206010071436 Systolic dysfunction Diseases 0.000 description 1
- 206010042957 Systolic hypertension Diseases 0.000 description 1
- DRHKJLXJIQTDTD-OAHLLOKOSA-N Tamsulosine Chemical compound CCOC1=CC=CC=C1OCCN[C@H](C)CC1=CC=C(OC)C(S(N)(=O)=O)=C1 DRHKJLXJIQTDTD-OAHLLOKOSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 102000008068 Tensins Human genes 0.000 description 1
- 108010088950 Tensins Proteins 0.000 description 1
- 244000269722 Thea sinensis Species 0.000 description 1
- 241000534944 Thia Species 0.000 description 1
- ZROUQTNYPCANTN-UHFFFAOYSA-N Tiapamil Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC1(C=2C=C(OC)C(OC)=CC=2)S(=O)(=O)CCCS1(=O)=O ZROUQTNYPCANTN-UHFFFAOYSA-N 0.000 description 1
- 240000007313 Tilia cordata Species 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 208000032109 Transient ischaemic attack Diseases 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- PNDPGZBMCMUPRI-XXSWNUTMSA-N [125I][125I] Chemical compound [125I][125I] PNDPGZBMCMUPRI-XXSWNUTMSA-N 0.000 description 1
- 208000002223 abdominal aortic aneurysm Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 229960002122 acebutolol Drugs 0.000 description 1
- GOEMGAFJFRBGGG-UHFFFAOYSA-N acebutolol Chemical compound CCCC(=O)NC1=CC=C(OCC(O)CNC(C)C)C(C(C)=O)=C1 GOEMGAFJFRBGGG-UHFFFAOYSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- YBCVMFKXIKNREZ-UHFFFAOYSA-N acoh acetic acid Chemical compound CC(O)=O.CC(O)=O YBCVMFKXIKNREZ-UHFFFAOYSA-N 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 125000003275 alpha amino acid group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960002576 amiloride Drugs 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- DQPBABKTKYNPMH-UHFFFAOYSA-N amino hydrogen sulfate Chemical compound NOS(O)(=O)=O DQPBABKTKYNPMH-UHFFFAOYSA-N 0.000 description 1
- HTIQEAQVCYTUBX-UHFFFAOYSA-N amlodipine Chemical compound CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl HTIQEAQVCYTUBX-UHFFFAOYSA-N 0.000 description 1
- 229960000528 amlodipine Drugs 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- PHFDAOXXIZOUIX-UHFFFAOYSA-N anipamil Chemical compound C=1C=CC(OC)=CC=1C(CCCCCCCCCCCC)(C#N)CCCN(C)CCC1=CC=CC(OC)=C1 PHFDAOXXIZOUIX-UHFFFAOYSA-N 0.000 description 1
- 229950011530 anipamil Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229940125683 antiemetic agent Drugs 0.000 description 1
- 239000002111 antiemetic agent Substances 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- SVWSKJCJNAIKNH-MJZUAXFLSA-N apelin-17 Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](N)CCCCN)C1=CN=CN1 SVWSKJCJNAIKNH-MJZUAXFLSA-N 0.000 description 1
- 101150059062 apln gene Proteins 0.000 description 1
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 229960002274 atenolol Drugs 0.000 description 1
- MOTJMGVDPWRKOC-QPVYNBJUSA-N atrasentan Chemical compound C1([C@H]2[C@@H]([C@H](CN2CC(=O)N(CCCC)CCCC)C=2C=C3OCOC3=CC=2)C(O)=O)=CC=C(OC)C=C1 MOTJMGVDPWRKOC-QPVYNBJUSA-N 0.000 description 1
- 229950010993 atrasentan Drugs 0.000 description 1
- 230000001746 atrial effect Effects 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- 229960004530 benazepril Drugs 0.000 description 1
- KKBIUAUSZKGNOA-HNAYVOBHSA-N benzyl (2s)-2-[[(2s)-2-(acetylsulfanylmethyl)-3-(1,3-benzodioxol-5-yl)propanoyl]amino]propanoate Chemical compound O=C([C@@H](NC(=O)[C@@H](CSC(C)=O)CC=1C=C2OCOC2=CC=1)C)OCC1=CC=CC=C1 KKBIUAUSZKGNOA-HNAYVOBHSA-N 0.000 description 1
- CHQVQXZFZHACQQ-UHFFFAOYSA-M benzyl(triethyl)azanium;bromide Chemical compound [Br-].CC[N+](CC)(CC)CC1=CC=CC=C1 CHQVQXZFZHACQQ-UHFFFAOYSA-M 0.000 description 1
- 235000021028 berry Nutrition 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 229960003065 bosentan Drugs 0.000 description 1
- SXTRWVVIEPWAKM-UHFFFAOYSA-N bosentan hydrate Chemical compound O.COC1=CC=CC=C1OC(C(=NC(=N1)C=2N=CC=CN=2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)(C)C)C=C1 SXTRWVVIEPWAKM-UHFFFAOYSA-N 0.000 description 1
- 208000029028 brain injury Diseases 0.000 description 1
- 229960000330 bupranolol Drugs 0.000 description 1
- HQIRNZOQPUAHHV-UHFFFAOYSA-N bupranolol Chemical compound CC1=CC=C(Cl)C(OCC(O)CNC(C)(C)C)=C1 HQIRNZOQPUAHHV-UHFFFAOYSA-N 0.000 description 1
- 125000005510 but-1-en-2-yl group Chemical group 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 125000001314 canonical amino-acid group Chemical group 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001722 carbon compounds Chemical class 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- RBHJBMIOOPYDBQ-UHFFFAOYSA-N carbon dioxide;propan-2-one Chemical compound O=C=O.CC(C)=O RBHJBMIOOPYDBQ-UHFFFAOYSA-N 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 230000009787 cardiac fibrosis Effects 0.000 description 1
- 210000004413 cardiac myocyte Anatomy 0.000 description 1
- 238000007675 cardiac surgery Methods 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 229960001222 carteolol Drugs 0.000 description 1
- LWAFSWPYPHEXKX-UHFFFAOYSA-N carteolol Chemical compound N1C(=O)CCC2=C1C=CC=C2OCC(O)CNC(C)(C)C LWAFSWPYPHEXKX-UHFFFAOYSA-N 0.000 description 1
- 229960004195 carvedilol Drugs 0.000 description 1
- NPAKNKYSJIDKMW-UHFFFAOYSA-N carvedilol Chemical compound COC1=CC=CC=C1OCCNCC(O)COC1=CC=CC2=NC3=CC=C[CH]C3=C12 NPAKNKYSJIDKMW-UHFFFAOYSA-N 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 229960002320 celiprolol Drugs 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 229940083181 centrally acting adntiadrenergic agent methyldopa Drugs 0.000 description 1
- 229950005749 ceronapril Drugs 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 239000007805 chemical reaction reactant Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 1
- 229960002155 chlorothiazide Drugs 0.000 description 1
- ZCDOYSPFYFSLEW-UHFFFAOYSA-N chromate(2-) Chemical compound [O-][Cr]([O-])(=O)=O ZCDOYSPFYFSLEW-UHFFFAOYSA-N 0.000 description 1
- 238000011097 chromatography purification Methods 0.000 description 1
- 229960005025 cilazapril Drugs 0.000 description 1
- JQRZBPFGBRIWSN-YOTVLOEGSA-N cilazapril monohydrate Chemical compound O.C([C@@H](C(=O)OCC)N[C@@H]1C(N2[C@@H](CCCN2CCC1)C(O)=O)=O)CC1=CC=CC=C1 JQRZBPFGBRIWSN-YOTVLOEGSA-N 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical group N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000011443 conventional therapy Methods 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 229940099112 cornstarch Drugs 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 150000004292 cyclic ethers Chemical class 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- HOXDXGRSZJEEKN-UHFFFAOYSA-N cycloocta-1,5-diene;rhodium Chemical compound [Rh].C1CC=CCCC=C1 HOXDXGRSZJEEKN-UHFFFAOYSA-N 0.000 description 1
- WJTCGQSWYFHTAC-UHFFFAOYSA-N cyclooctane Chemical compound C1CCCCCCC1 WJTCGQSWYFHTAC-UHFFFAOYSA-N 0.000 description 1
- 239000004914 cyclooctane Substances 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- FEJVSJIALLTFRP-LJQANCHMSA-N darusentan Chemical compound COC1=CC(OC)=NC(O[C@H](C(O)=O)C(OC)(C=2C=CC=CC=2)C=2C=CC=CC=2)=N1 FEJVSJIALLTFRP-LJQANCHMSA-N 0.000 description 1
- 229950008833 darusentan Drugs 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 230000006837 decompression Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 229960005227 delapril Drugs 0.000 description 1
- WOUOLAUOZXOLJQ-MBSDFSHPSA-N delapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N(CC(O)=O)C1CC2=CC=CC=C2C1)CC1=CC=CC=C1 WOUOLAUOZXOLJQ-MBSDFSHPSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 230000035487 diastolic blood pressure Effects 0.000 description 1
- FJBFPHVGVWTDIP-UHFFFAOYSA-N dibromomethane Chemical compound BrCBr FJBFPHVGVWTDIP-UHFFFAOYSA-N 0.000 description 1
- 229960005215 dichloroacetic acid Drugs 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 description 1
- 229960004166 diltiazem Drugs 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- WJJMNDUMQPNECX-UHFFFAOYSA-N dipicolinic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=N1 WJJMNDUMQPNECX-UHFFFAOYSA-N 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000035619 diuresis Effects 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 229960001389 doxazosin Drugs 0.000 description 1
- RUZYUOTYCVRMRZ-UHFFFAOYSA-N doxazosin Chemical compound C1OC2=CC=CC=C2OC1C(=O)N(CC1)CCN1C1=NC(N)=C(C=C(C(OC)=C2)OC)C2=N1 RUZYUOTYCVRMRZ-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 239000003974 emollient agent Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 229960000873 enalapril Drugs 0.000 description 1
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 1
- 239000002308 endothelin receptor antagonist Substances 0.000 description 1
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 1
- 150000002085 enols Chemical class 0.000 description 1
- GLCKXJLCYIJMRB-UPRLRBBYSA-N enrasentan Chemical compound C1([C@H]2[C@@H]([C@H](C3=CC=C(C=C32)OCCC)C=2C=C3OCOC3=CC=2)C(O)=O)=CC=C(OC)C=C1OCCO GLCKXJLCYIJMRB-UPRLRBBYSA-N 0.000 description 1
- 229950006561 enrasentan Drugs 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 229940125532 enzyme inhibitor Drugs 0.000 description 1
- 238000006345 epimerization reaction Methods 0.000 description 1
- OROAFUQRIXKEMV-LDADJPATSA-N eprosartan Chemical compound C=1C=C(C(O)=O)C=CC=1CN1C(CCCC)=NC=C1\C=C(C(O)=O)/CC1=CC=CS1 OROAFUQRIXKEMV-LDADJPATSA-N 0.000 description 1
- 229960004563 eprosartan Drugs 0.000 description 1
- AQNDDEOPVVGCPG-UHFFFAOYSA-N esmolol Chemical compound COC(=O)CCC1=CC=C(OCC(O)CNC(C)C)C=C1 AQNDDEOPVVGCPG-UHFFFAOYSA-N 0.000 description 1
- 229960003745 esmolol Drugs 0.000 description 1
- FRYHCSODNHYDPU-UHFFFAOYSA-N ethanesulfonyl chloride Chemical compound CCS(Cl)(=O)=O FRYHCSODNHYDPU-UHFFFAOYSA-N 0.000 description 1
- OCLXJTCGWSSVOE-UHFFFAOYSA-N ethanol etoh Chemical compound CCO.CCO OCLXJTCGWSSVOE-UHFFFAOYSA-N 0.000 description 1
- LJQKCYFTNDAAPC-UHFFFAOYSA-N ethanol;ethyl acetate Chemical compound CCO.CCOC(C)=O LJQKCYFTNDAAPC-UHFFFAOYSA-N 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- LBAQSKZHMLAFHH-UHFFFAOYSA-N ethoxyethane;hydron;chloride Chemical compound Cl.CCOCC LBAQSKZHMLAFHH-UHFFFAOYSA-N 0.000 description 1
- BHTPNYOMVLJREU-UHFFFAOYSA-N ethyl 6-oxo-1h-pyridine-2-carboxylate Chemical compound CCOC(=O)C1=CC=CC(=O)N1 BHTPNYOMVLJREU-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- UVECLJDRPFNRRQ-UHFFFAOYSA-N ethyl trifluoromethanesulfonate Chemical compound CCOS(=O)(=O)C(F)(F)F UVECLJDRPFNRRQ-UHFFFAOYSA-N 0.000 description 1
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- OJCSPXHYDFONPU-UHFFFAOYSA-N etoac etoac Chemical compound CCOC(C)=O.CCOC(C)=O OJCSPXHYDFONPU-UHFFFAOYSA-N 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 229960004979 fampridine Drugs 0.000 description 1
- 229950005203 fasidotril Drugs 0.000 description 1
- RZTAMFZIAATZDJ-UHFFFAOYSA-N felodipine Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC(Cl)=C1Cl RZTAMFZIAATZDJ-UHFFFAOYSA-N 0.000 description 1
- 229960003580 felodipine Drugs 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- SMANXXCATUTDDT-QPJJXVBHSA-N flunarizine Chemical compound C1=CC(F)=CC=C1C(C=1C=CC(F)=CC=1)N1CCN(C\C=C\C=2C=CC=CC=2)CC1 SMANXXCATUTDDT-QPJJXVBHSA-N 0.000 description 1
- 229960000326 flunarizine Drugs 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000004785 fluoromethoxy group Chemical group [H]C([H])(F)O* 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 229960002490 fosinopril Drugs 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 150000002240 furans Chemical class 0.000 description 1
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000005227 gel permeation chromatography Methods 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 208000004104 gestational diabetes Diseases 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229940075529 glyceryl stearate Drugs 0.000 description 1
- 239000011544 gradient gel Substances 0.000 description 1
- 229960002048 guanfacine Drugs 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 150000003278 haem Chemical class 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 208000018578 heart valve disease Diseases 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- FBPFZTCFMRRESA-UHFFFAOYSA-N hexane-1,2,3,4,5,6-hexol Chemical compound OCC(O)C(O)C(O)C(O)CO FBPFZTCFMRRESA-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid group Chemical class C(CCCCC)(=O)O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 102000047215 human APLNR Human genes 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 229960002003 hydrochlorothiazide Drugs 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 239000005555 hypertensive agent Substances 0.000 description 1
- 230000001631 hypertensive effect Effects 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 238000011503 in vivo imaging Methods 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000007574 infarction Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 229940044173 iodine-125 Drugs 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- SYJRVVFAAIUVDH-UHFFFAOYSA-N ipa isopropanol Chemical compound CC(C)O.CC(C)O SYJRVVFAAIUVDH-UHFFFAOYSA-N 0.000 description 1
- 229960002198 irbesartan Drugs 0.000 description 1
- YCPOHTHPUREGFM-UHFFFAOYSA-N irbesartan Chemical compound O=C1N(CC=2C=CC(=CC=2)C=2C(=CC=CC=2)C=2[N]N=NN=2)C(CCCC)=NC21CCCC2 YCPOHTHPUREGFM-UHFFFAOYSA-N 0.000 description 1
- 108010047623 iridine Proteins 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 229960004427 isradipine Drugs 0.000 description 1
- 229960003825 ivabradine Drugs 0.000 description 1
- HLUKNZUABFFNQS-ZMBIFBSDSA-N ivabradine hydrochloride Chemical group Cl.C1CC2=CC(OC)=C(OC)C=C2CC(=O)N1CCCN(C)C[C@H]1CC2=C1C=C(OC)C(OC)=C2 HLUKNZUABFFNQS-ZMBIFBSDSA-N 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- GKQPCPXONLDCMU-CCEZHUSRSA-N lacidipine Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OCC)C1C1=CC=CC=C1\C=C\C(=O)OC(C)(C)C GKQPCPXONLDCMU-CCEZHUSRSA-N 0.000 description 1
- 229960004340 lacidipine Drugs 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000005053 lamin Anatomy 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- JGCMEBMXRHSZKX-UHFFFAOYSA-N macitentan Chemical compound C=1C=C(Br)C=CC=1C=1C(NS(=O)(=O)NCCC)=NC=NC=1OCCOC1=NC=C(Br)C=N1 JGCMEBMXRHSZKX-UHFFFAOYSA-N 0.000 description 1
- 229960001039 macitentan Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000005291 magnetic effect Effects 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- COTNUBDHGSIOTA-UHFFFAOYSA-N meoh methanol Chemical compound OC.OC COTNUBDHGSIOTA-UHFFFAOYSA-N 0.000 description 1
- 229960003134 mepindolol Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910000000 metal hydroxide Inorganic materials 0.000 description 1
- 150000004692 metal hydroxides Chemical class 0.000 description 1
- VLQWWEBJMRNYDR-UHFFFAOYSA-N methyl 2-(2-bromo-4-fluorophenyl)acetate Chemical compound COC(=O)CC1=CC=C(F)C=C1Br VLQWWEBJMRNYDR-UHFFFAOYSA-N 0.000 description 1
- VQGPTMMNBPRYNT-UHFFFAOYSA-N methyl 2-(2-cyano-4-fluorophenyl)acetate Chemical compound COC(=O)CC1=C(C=C(F)C=C1)C#N VQGPTMMNBPRYNT-UHFFFAOYSA-N 0.000 description 1
- VKQFCGNPDRICFG-UHFFFAOYSA-N methyl 2-methylpropyl 2,6-dimethyl-4-(2-nitrophenyl)-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCC(C)C)C1C1=CC=CC=C1[N+]([O-])=O VKQFCGNPDRICFG-UHFFFAOYSA-N 0.000 description 1
- QRLHANNSPRAJFN-UHFFFAOYSA-N methyl 3-chloropyridine-2-carboxylate Chemical compound COC(=O)C1=NC=CC=C1Cl QRLHANNSPRAJFN-UHFFFAOYSA-N 0.000 description 1
- CCQFKEITVOTHIW-UHFFFAOYSA-N methyl 3-methylpyridine-2-carboxylate Chemical compound COC(=O)C1=NC=CC=C1C CCQFKEITVOTHIW-UHFFFAOYSA-N 0.000 description 1
- CLSMNRHKACVIAZ-UHFFFAOYSA-N methyl 6-(dimethylamino)pyridine-2-carboxylate Chemical compound COC(=O)C1=CC=CC(N(C)C)=N1 CLSMNRHKACVIAZ-UHFFFAOYSA-N 0.000 description 1
- CYWIZMOZBTXFIL-UHFFFAOYSA-N methyl 6-methylpyridine-2-carboxylate Chemical compound COC(=O)C1=CC=CC(C)=N1 CYWIZMOZBTXFIL-UHFFFAOYSA-N 0.000 description 1
- GJLWQAUHCDNAEK-UHFFFAOYSA-N methyl 6-oxo-1h-pyridine-2-carboxylate Chemical compound COC(=O)C1=CC=CC(O)=N1 GJLWQAUHCDNAEK-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- OIRDBPQYVWXNSJ-UHFFFAOYSA-N methyl trifluoromethansulfonate Chemical compound COS(=O)(=O)C(F)(F)F OIRDBPQYVWXNSJ-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000010445 mica Substances 0.000 description 1
- 229910052618 mica group Inorganic materials 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 239000002324 mouth wash Substances 0.000 description 1
- UIAVVZBCWDBVDI-UHFFFAOYSA-N n,n,6-trimethylpyridine-2-carboxamide Chemical compound CN(C)C(=O)C1=CC=CC(C)=N1 UIAVVZBCWDBVDI-UHFFFAOYSA-N 0.000 description 1
- XPVYWKCJBKSIKA-UHFFFAOYSA-N n,n-bis[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound C1=CC(OC)=CC=C1CN(S(C)(=O)=O)CC1=CC=C(OC)C=C1 XPVYWKCJBKSIKA-UHFFFAOYSA-N 0.000 description 1
- PEECTLLHENGOKU-UHFFFAOYSA-N n,n-dimethylpyridin-4-amine Chemical compound CN(C)C1=CC=NC=C1.CN(C)C1=CC=NC=C1 PEECTLLHENGOKU-UHFFFAOYSA-N 0.000 description 1
- TUYWTLTWNJOZNY-UHFFFAOYSA-N n-[6-(2-hydroxyethoxy)-5-(2-methoxyphenoxy)-2-[2-(2h-tetrazol-5-yl)pyridin-4-yl]pyrimidin-4-yl]-5-propan-2-ylpyridine-2-sulfonamide Chemical compound COC1=CC=CC=C1OC(C(=NC(=N1)C=2C=C(N=CC=2)C2=NNN=N2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)C)C=N1 TUYWTLTWNJOZNY-UHFFFAOYSA-N 0.000 description 1
- WOOWBQQQJXZGIE-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine Chemical compound CCN(C(C)C)C(C)C.CCN(C(C)C)C(C)C WOOWBQQQJXZGIE-UHFFFAOYSA-N 0.000 description 1
- ZWOMUEDWPMKTLP-UHFFFAOYSA-N n-pyridin-4-ylpropane-1-sulfonamide Chemical compound CCCS(=O)(=O)NC1=CC=NC=C1 ZWOMUEDWPMKTLP-UHFFFAOYSA-N 0.000 description 1
- 229960004255 nadolol Drugs 0.000 description 1
- VWPOSFSPZNDTMJ-UCWKZMIHSA-N nadolol Chemical compound C1[C@@H](O)[C@@H](O)CC2=C1C=CC=C2OCC(O)CNC(C)(C)C VWPOSFSPZNDTMJ-UCWKZMIHSA-N 0.000 description 1
- 230000001452 natriuretic effect Effects 0.000 description 1
- 229960001783 nicardipine Drugs 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- 229960005366 nilvadipine Drugs 0.000 description 1
- 229960000227 nisoldipine Drugs 0.000 description 1
- 229960005425 nitrendipine Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- VWBWQOUWDOULQN-UHFFFAOYSA-N nmp n-methylpyrrolidone Chemical compound CN1CCCC1=O.CN1CCCC1=O VWBWQOUWDOULQN-UHFFFAOYSA-N 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- VTRAEEWXHOVJFV-UHFFFAOYSA-N olmesartan Chemical compound CCCC1=NC(C(C)(C)O)=C(C(O)=O)N1CC1=CC=C(C=2C(=CC=CC=2)C=2NN=NN=2)C=C1 VTRAEEWXHOVJFV-UHFFFAOYSA-N 0.000 description 1
- 229960005117 olmesartan Drugs 0.000 description 1
- LVRLSYPNFFBYCZ-VGWMRTNUSA-N omapatrilat Chemical compound C([C@H](S)C(=O)N[C@H]1CCS[C@H]2CCC[C@H](N2C1=O)C(=O)O)C1=CC=CC=C1 LVRLSYPNFFBYCZ-VGWMRTNUSA-N 0.000 description 1
- 229950000973 omapatrilat Drugs 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229940127084 other anti-cancer agent Drugs 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- GSWAOPJLTADLTN-UHFFFAOYSA-N oxidanimine Chemical compound [O-][NH3+] GSWAOPJLTADLTN-UHFFFAOYSA-N 0.000 description 1
- 150000004880 oxines Chemical class 0.000 description 1
- 229960004570 oxprenolol Drugs 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- MXQOYLRVSVOCQT-UHFFFAOYSA-N palladium;tritert-butylphosphane Chemical compound [Pd].CC(C)(C)P(C(C)(C)C)C(C)(C)C.CC(C)(C)P(C(C)(C)C)C(C)(C)C MXQOYLRVSVOCQT-UHFFFAOYSA-N 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 229960002035 penbutolol Drugs 0.000 description 1
- KQXKVJAGOJTNJS-HNNXBMFYSA-N penbutolol Chemical compound CC(C)(C)NC[C@H](O)COC1=CC=CC=C1C1CCCC1 KQXKVJAGOJTNJS-HNNXBMFYSA-N 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- IPVQLZZIHOAWMC-QXKUPLGCSA-N perindopril Chemical compound C1CCC[C@H]2C[C@@H](C(O)=O)N(C(=O)[C@H](C)N[C@@H](CCC)C(=O)OCC)[C@H]21 IPVQLZZIHOAWMC-QXKUPLGCSA-N 0.000 description 1
- 229960002582 perindopril Drugs 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- IBBMAWULFFBRKK-UHFFFAOYSA-N picolinamide Chemical compound NC(=O)C1=CC=CC=N1 IBBMAWULFFBRKK-UHFFFAOYSA-N 0.000 description 1
- 229960002508 pindolol Drugs 0.000 description 1
- PHUTUTUABXHXLW-UHFFFAOYSA-N pindolol Chemical compound CC(C)NCC(O)COC1=CC=CC2=NC=C[C]12 PHUTUTUABXHXLW-UHFFFAOYSA-N 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 125000006684 polyhaloalkyl group Polymers 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 1
- 235000015320 potassium carbonate Nutrition 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- IENZQIKPVFGBNW-UHFFFAOYSA-N prazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1=CC=CO1 IENZQIKPVFGBNW-UHFFFAOYSA-N 0.000 description 1
- 229960001289 prazosin Drugs 0.000 description 1
- 230000036316 preload Effects 0.000 description 1
- 229960001989 prenylamine Drugs 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- LZFIOSVZIQOVFW-UHFFFAOYSA-N propyl 2-hydroxybenzoate Chemical compound CCCOC(=O)C1=CC=CC=C1O LZFIOSVZIQOVFW-UHFFFAOYSA-N 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 208000002815 pulmonary hypertension Diseases 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- USPWKWBDZOARPV-UHFFFAOYSA-N pyrazolidine Chemical compound C1CNNC1 USPWKWBDZOARPV-UHFFFAOYSA-N 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- KFUSANSHCADHNJ-UHFFFAOYSA-N pyridine-3-carbohydrazide Chemical compound NNC(=O)C1=CC=CN=C1 KFUSANSHCADHNJ-UHFFFAOYSA-N 0.000 description 1
- VTGOHKSTWXHQJK-UHFFFAOYSA-N pyrimidin-2-ol Chemical compound OC1=NC=CC=N1 VTGOHKSTWXHQJK-UHFFFAOYSA-N 0.000 description 1
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 1
- HBCQSNAFLVXVAY-UHFFFAOYSA-N pyrimidine-2-thiol Chemical compound SC1=NC=CC=N1 HBCQSNAFLVXVAY-UHFFFAOYSA-N 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 229960001455 quinapril Drugs 0.000 description 1
- JSDRRTOADPPCHY-HSQYWUDLSA-N quinapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)CC1=CC=CC=C1 JSDRRTOADPPCHY-HSQYWUDLSA-N 0.000 description 1
- 229960001007 quinaprilat Drugs 0.000 description 1
- FLSLEGPOVLMJMN-YSSFQJQWSA-N quinaprilat Chemical compound C([C@H](N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)C(O)=O)CC1=CC=CC=C1 FLSLEGPOVLMJMN-YSSFQJQWSA-N 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 229960003401 ramipril Drugs 0.000 description 1
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 description 1
- KEDYTOTWMPBSLG-HILJTLORSA-N ramiprilat Chemical compound C([C@H](N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)C(O)=O)CC1=CC=CC=C1 KEDYTOTWMPBSLG-HILJTLORSA-N 0.000 description 1
- 229960002231 ramiprilat Drugs 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 239000003507 refrigerant Substances 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 230000000894 saliuretic effect Effects 0.000 description 1
- 210000002235 sarcomere Anatomy 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- PHWXUGHIIBDVKD-UHFFFAOYSA-N sitaxentan Chemical compound CC1=NOC(NS(=O)(=O)C2=C(SC=C2)C(=O)CC=2C(=CC=3OCOC=3C=2)C)=C1Cl PHWXUGHIIBDVKD-UHFFFAOYSA-N 0.000 description 1
- 229960002578 sitaxentan Drugs 0.000 description 1
- YMMSNMNLYAHRCP-UHFFFAOYSA-M sodium 2-(2-cyano-4-fluorophenyl)ethanesulfonate Chemical compound C(#N)C1=C(C=CC(=C1)F)CCS(=O)(=O)[O-].[Na+] YMMSNMNLYAHRCP-UHFFFAOYSA-M 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 229910052979 sodium sulfide Inorganic materials 0.000 description 1
- MRTAVLDNYYEJHK-UHFFFAOYSA-M sodium;2-chloro-2,2-difluoroacetate Chemical compound [Na+].[O-]C(=O)C(F)(F)Cl MRTAVLDNYYEJHK-UHFFFAOYSA-M 0.000 description 1
- SNOOUWRIMMFWNE-UHFFFAOYSA-M sodium;6-[(3,4,5-trimethoxybenzoyl)amino]hexanoate Chemical compound [Na+].COC1=CC(C(=O)NCCCCCC([O-])=O)=CC(OC)=C1OC SNOOUWRIMMFWNE-UHFFFAOYSA-M 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- VNFWTIYUKDMAOP-UHFFFAOYSA-N sphos Chemical compound COC1=CC=CC(OC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 VNFWTIYUKDMAOP-UHFFFAOYSA-N 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000012258 stirred mixture Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- NVBFHJWHLNUMCV-UHFFFAOYSA-N sulfamide Chemical compound NS(N)(=O)=O NVBFHJWHLNUMCV-UHFFFAOYSA-N 0.000 description 1
- BUUPQKDIAURBJP-UHFFFAOYSA-N sulfinic acid Chemical compound OS=O BUUPQKDIAURBJP-UHFFFAOYSA-N 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 238000004808 supercritical fluid chromatography Methods 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229960002613 tamsulosin Drugs 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229960005187 telmisartan Drugs 0.000 description 1
- 229960004084 temocapril Drugs 0.000 description 1
- FIQOFIRCTOWDOW-BJLQDIEVSA-N temocapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N(CC(O)=O)C[C@H](SC1)C=1SC=CC=1)=O)CC1=CC=CC=C1 FIQOFIRCTOWDOW-BJLQDIEVSA-N 0.000 description 1
- 229960001693 terazosin Drugs 0.000 description 1
- VCKUSRYTPJJLNI-UHFFFAOYSA-N terazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1CCCO1 VCKUSRYTPJJLNI-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- WFQKWCNYWCUWSN-UHFFFAOYSA-N tert-butyl n-(1-methylindol-3-yl)carbamate Chemical compound C1=CC=C2N(C)C=C(NC(=O)OC(C)(C)C)C2=C1 WFQKWCNYWCUWSN-UHFFFAOYSA-N 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical compound C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- CAAUZMMMFDVBFD-UHFFFAOYSA-N tert-butyl-(2-iodoethoxy)-dimethylsilane Chemical compound CC(C)(C)[Si](C)(C)OCCI CAAUZMMMFDVBFD-UHFFFAOYSA-N 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 229950000584 tezosentan Drugs 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 229940083085 thiazide derivative acting on arteriolar smooth muscle Drugs 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 1
- 229950003137 tiapamil Drugs 0.000 description 1
- 238000002877 time resolved fluorescence resonance energy transfer Methods 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 201000010875 transient cerebral ischemia Diseases 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229940062627 tribasic potassium phosphate Drugs 0.000 description 1
- QIWRFOJWQSSRJZ-UHFFFAOYSA-N tributyl(ethenyl)stannane Chemical compound CCCC[Sn](CCCC)(CCCC)C=C QIWRFOJWQSSRJZ-UHFFFAOYSA-N 0.000 description 1
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 1
- INQOMBQAUSQDDS-FIBGUPNXSA-N trideuterio(iodo)methane Chemical compound [2H]C([2H])([2H])I INQOMBQAUSQDDS-FIBGUPNXSA-N 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 238000000825 ultraviolet detection Methods 0.000 description 1
- 230000009677 vaginal delivery Effects 0.000 description 1
- ACWBQPMHZXGDFX-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=NN1 ACWBQPMHZXGDFX-QFIPXVFZSA-N 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- 229940051537 valsartan and sacubitril Drugs 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- 206010047302 ventricular tachycardia Diseases 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 1
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4965—Non-condensed pyrazines
- A61K31/497—Non-condensed pyrazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/501—Pyridazines; Hydrogenated pyridazines not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/513—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim having oxo groups directly attached to the heterocyclic ring, e.g. cytosine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/695—Silicon compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B57/00—Separation of optically-active compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/002—Heterocyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/01—Sulfonamides having sulfur atoms of sulfonamide groups bound to acyclic carbon atoms
- C07C311/12—Sulfonamides having sulfur atoms of sulfonamide groups bound to acyclic carbon atoms of an unsaturated carbon skeleton containing rings
- C07C311/13—Sulfonamides having sulfur atoms of sulfonamide groups bound to acyclic carbon atoms of an unsaturated carbon skeleton containing rings the carbon skeleton containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/54—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/61—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/70—Sulfur atoms
- C07D213/71—Sulfur atoms to which a second hetero atom is attached
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
- C07D213/82—Amides; Imides in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/26—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/30—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/34—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/12—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/14—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D241/18—Oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/14—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D241/24—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/05—Isotopically modified compounds, e.g. labelled
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Diabetes (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Hospice & Palliative Care (AREA)
- Child & Adolescent Psychology (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Pyridine Compounds (AREA)
Abstract
Un compuesto de fórmula I o fórmula II **(Ver fórmula)** o una sal farmacéuticamente aceptable de los mismos, un tautómero de los mismos, una sal farmacéuticamente aceptable del tautómero, un estereoisómero de cualquiera de los anteriores, o una mezcla de los mismos, en donde: R1 es un piridilo, piridonilo o N-óxido de piridina no sustituido, o es un piridilo, piridonilo o N-óxido de piridina sustituido con 1, 2, 3, o 4 sustituyentes R1a; R1a en cada caso se selecciona independientemente de -F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1- C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1- C6), -alquenilo C2-C6, -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -O-(halogenoalquil C1-C6)-OH, -O- (halogenoalquil C1-C6)-O-(alquilo C1-C6), -O-(perhalogenoalquil C1-C6)-OH, -O-(perhalogenoalquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1- C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N(alquilo C1-C6)2, fenilo, -C(=O)-(heterociclilo), o un grupo heterociclilo, en donde el grupo heterociclilo del grupo -C(=O)-(heterociclilo) o heterociclilo es un anillo de 3 a 7 miembros que contiene 1, 2, o 3 heteroátomos seleccionados de N, O o S; R2 se selecciona de -H, o alquilo C1-C4 o está ausente en los compuestos de fórmula II; R3 se selecciona de un alquilo C1-C10 no sustituido, un alquilo C1-C10 sustituido con 1, 2, o 3 sustituyentes R3a, un grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -NH-(CR3bR3c)-Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un grupo de fórmula -(CR3dR3e)-(CR3fR3g)-Q, un grupo de fórmula -(CR3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)- Q, en donde el heterociclilo del -(heterociclil)-Q tiene de 5 a 7 miembros de los cuales 1, 2 o 3 son heteroátomos seleccionados de N, O o S y no está sustituido o está sustituido con 1, 2 o 3 sustituyentes R3h; R3a en cada caso se selecciona independientemente de -F, -Cl, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1- C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6, alquinilo C2-C6, -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2; R3b y R3c se seleccionan independientemente de -H, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1- C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), - O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2; R3d y R3e se seleccionan independientemente de -H, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1- C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), - O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2; R3f y R3g se seleccionan independientemente de -H, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), - O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2; R3h en cada caso se selecciona independientemente de -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1- C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), - O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, u oxo; Q es un grupo arilo C6-C10 monocíclico o bicíclico, un grupo heteroarilo monocíclico o bicíclico con 5 a 10 miembros en el anillo que contiene 1, 2, o 3 heteroátomos seleccionados de N, O o S, un grupo cicloalquilo C3-C8, o un grupo heterociclilo de 3 a 7 miembros que contiene 1, 2, o 3 heteroátomos seleccionados de N, O, o S, en donde el grupo arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo y el grupo heterociclilo no están sustituidos o están sustituidos con 1, 2, 3, o 4 sustituyentes RQ; RQ en cada caso se selecciona independientemente de -F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1- C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquinilo C2-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, - C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N(alquilo C1-C6)2, -S(=O)2-(alquilo C1-C6), fenilo, o un grupo heteroarilo, y el grupo heterociclilo Q puede estar sustituido con 1 sustituyente oxo RQ; R4 se selecciona de un grupo arilo C6-C10 monocíclico o bicíclico, un grupo heteroarilo monocíclico o bicíclico con 5 a 10 miembros en el anillo que contiene 1, 2, o 3 heteroátomos independientemente seleccionados de N, O o S, o un grupo heterociclilo monocíclico o bicíclico con 5 a 10 miembros en el anillo que contiene 1, 2, 3 o 4 heteroátomos independientemente seleccionados de N, O o S, en donde el grupo arilo C6-C10, el grupo heteroarilo o el grupo heterociclilo no están sustituidos o están sustituidos con 1, 2, o 3 sustituyentes R4a; y R4a en cada caso se selecciona independientemente de -F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1- C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), - NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), - C(=O)NH2, -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquilo C1-C6)2, y el grupo heterociclilo R4 puede estar además sustituido con 1 sustituyente oxo; y además en donde si R4 es un anillo de fenilo no sustituido o sustituido y R3 es un grupo de fórmula -(CR3b=CR3c)-Q, entonces al menos uno de los siguientes es verdad: a) R4 está sustituido con al menos un grupo -O-(alquilo C1-C6); b) Q no es un oxadiazol; c) R3b no es -H; d) R3c no es -H; e) R1 no es un grupo 2-piridilo; o f) R4 está sustituido con dos o más grupos -O-(alquilo C1-C6).
Description
DES Agonistas triazoles del receptor APJ
Referencias cruzadas a solicitudes relacionadas
Esta solicitud reivindica el beneficio de la solicitud provis mayo, 2015.
Campo de la invención
La presente invención se refiere a compuestos ca composiciones que incluyen compuestos que son agon pueden usar para activar el receptor APJ y para tratar en donde se pueden usar dichos compuestos es en el t compuestos se pueden usar para mejorar la contractil cardiaca crónica y se pueden usar para tratar pacientes pacientes con insuficiencia cardiaca con la fracción de e Antecedentes de la invención
La apelina es el ligando endógeno para el APJ (APLN miembro de la familia de receptores acoplados a proteín observado en muchos tejidos tales como corazón, ri sugiere varias funciones del sistema en la fisiología y pa Los péptidos de apelina son procesados a partir de un pequeños, principalmente una forma de 36 restos (Apel más pequeño de 13 restos (Apelina 65-77- tambié 275:21061-21067, 2000. Se determinó previamente qu receptor APJ huérfano, un miembro de la superfamilia transmembranales. Tatemoto et al., Biochem. Biophysi activas más cortas identificada, la apelina-13 pirogluta forma más potente y abundante de apelina en el tejid Modelos in vitro y preclínicos han sugerido que el sis cardiovascular así como en el metabolismo. Barnes et circulación son transitorios y la apelina-13 tiene una s cardiovasculares pasajeros.
In vitro la apelina exógena aumenta la contractilidad e corazones de rata enteros, y aumenta el acortamiento Barnes et al., Heart 96:1011-1016, 2010. La apelina t corazón aislado ex vivo. In vivo, la infusión de apelina cardiaco y reduce la presión diastólica final del ventrícul et al., Circulation 110:187-193, 2004. La apelina exóge inducir hipertrofia ventricular izquierda concomitante co et al., Heart 96:1011-1016, 2010.
Estudios de Kawamata et al y Hosoya et han mo aproximadamente una afinidad 3,5 veces mayor in vitro 1538: 162-171, 2001, Hosoya et al., JBC 275: 21061-2 única sustitución con aminoácidos canónicos o no canó y triples en apelina 66-77 y apelina 63-77, pero no e mayor afinidad y potencia in vitro que la apleína-13.
Proceedings of the 37th Japanese Peptide Symposium, se describen en estudios posteriores. Documento US 7. En un estudio de 2003 (Medhurst et al., J. Neurochemis apelina-36, apelina-17 y apelina-13. Se concluyó q amidación C-terminal daba como resultado una dismin (Hamada et al., J. Mol. Med. 22:547-552, 2008) descri actividad in vitro, los tres análogos mantenían la acti apelina-13.
Un péptido de apelina acortado en 12 aminoácidos q patente en 2009 (US 7.635.751). El péptido podía ten solicitud, WO 2013/111110 A2 y US 8.673.848, también CIÓN
l de Estados Unidos N° 62/164,106, presentada el 20 de
s de actuar como agonistas del receptor APJ, y a del receptor APJ. Los compuestos y composiciones se entes afecciones patológicas. Un ejemplo de un campo iento de afecciones cardiovasculares. En particular, los y la fracción de eyección en sujetos con insuficiencia insuficiente cardiaca con menor fracción de eyección y ión mantenida.
ceptor de la angiotensina tipo-1). El receptor APJ es un (GPCR) de tipo rodopsina. El sistema apelina/APJ se ha páncreas, pulmón y el sistema nervioso central. Esto ía de mamíferos.
ma pre-pro de 77 restos en fragmentos bioactivos más 2-77- también denominada Apelina-36) y un polipéptido nominado Apelina-13) Hosoya et al., J. Biol. Chem. s péptidos de apelina eran ligandos endógenos para el receptores acoplados a proteína G con siete dominios s. Commun. 251:471-476, 1998. Una de las isoformas a ([PE65]Apelina-13 (65-77), se ha descrito que es la rdiaco. Maguire et al., Hypertension 54:598-604, 2009. a de apelina/APJ tiene una función en la homeostasis Heart 96:1011-1016, 2010. Los niveles de apelina en la ida plasmática breve de <5 min que conduce a efectos
ncentraciones subnanomolares en bandas auriculares y sarcómeros en hasta 140% en cardiomiocitos aislados. én tiene un potente efecto inotrópico en un ensayo de a restablece la fracción de eyección, aumenta el gasto uierdo en ratas con insuficiencia cardiaca crónica. Berry menta de forma potente la contractilidad miocárdica sin reducción de la precarga y poscarga ventricular. Barnes
o que este péptido más corto de apelina-13 tenía el receptor APJ que la apelina-36. Kawamata et al., BBA . Se describían análogos de apelina-13 que tienen una . Los autores también describieron sustituciones dobles elina-13. Se hacía hincapié en los péptidos que tienen zawa et al., en: T. Shioiri (ed.), Peptide Science 2000:
151-154. Varios si no todos estos péptidos modificados 51.
4:1162-1172, 2003) se comparó la actividad in vitro de la os péptidos eran aproximadamente equipotentes. La n de 14 veces de la afinidad. Un estudio más reciente nálogos cíclicos de la apelina-13. Cuando se ensayó la funcional, aunque con menor potencia respecto a la
enía actividad de ligando en APJ se describió en una na sustitución de un aminoácido no canónico. En otra an descrito miméticos cíclicos de la apelina.
Otro estudio describió la síntesis de análogos de apelin canónicos en el extremo C-terminal de la molécula,
específica del sitio. Sin embargo, también se describió 6) en análogos de péptidos de menor actividad con elimi restos de aminoácidos que la apelina-13. Murza et
documento PCT/US2013/075773 describe un grupo de no canónicos y cambios en el N y C-terminales de la potencia de la molécula. El aumento de la potencia degradación con respecto a la apelina de tipo natural.
A pesar de los avances que se han hecho con respecto pequeña del receptor APJ. Sin embargo, se han h documento WO 2014/044738 describe varios deriva moduladores del receptor APJ y el documento US2014 del receptor APJ
Sigue existiendo la necesidad de agonistas del recept cardiovasculares y otras afecciones. La presente solic pueden ser adecuados para usar como agentes terapéu compuestos pueden encontrar un beneficio particular en dichos compuestos pueden ser beneficiosos en el trat sistólica crónica y la insuficiencia cardiaca diastólica cró Resumen de la invención
En un aspecto la invención proporciona un compuesto d con sustituciones de aminoácidos con aminoácidos no sin pegilación en el extremo N o C u otra ubicación o de espaciadores de PEG internos (PEG corto (n = 4 o iones en el medio de la secuencia que contenían menos hem Med Chem 7:318-325, 2012. Adicionalmente, el ificaciones, que incluyen la sustitución de aminoácidos écula de apelina que pueden afectar, entre otros, a la de ser un resultado de la mayor semivida o menor
péptidos, existe la necesidad de agonistas de molécula algunos progresos en este campo. Por ejemplo, el de amida del ácido bencimidazol-carboxílico como 5181 describe derivados de pirano como moduladores
J que se puedan usar para tratar diversas afecciones describe dichos agonistas de los receptores APJ que en el tratamiento de una variedad de afecciones. Estos ratamiento de afecciones cardiovasculares. Por ejemplo, nto de afecciones tales como la insuficiencia cardiaca
mula I o fórmula II:
o una sal farmacéuticamente aceptable de los mis farmacéuticamente aceptable del tautómero, un ester aceptable de los mismos,
en donde:
R1 es un piridilo, piridonilo o N-óxido de piridina no sustituido con 1,2, 3, o 4 sustituyentes R1a;
R1a en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C C6), -alquenilo C2-C6, -O-(alquil C1-C6)-o H, -O-(alquil (halogenoalquil C1-C6)-O-(alquilo C1-C6), -O-(perhaloge C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N( heterociclilo, en donde el grupo heterociclilo del grupo miembros que contiene 1,2, o 3 heteroátomos seleccion , un tautómero aceptable de los mismos, una sal ómero de cualquiera de los anteriores, o una mezcla
tuido, o es un piridilo, piridonilo o N-óxido de piridina
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-6)-O-(alquilo C1-C6), -O-(halogenoalquil C1-C6)-OH, -O-quil C1-C6)-OH, -O-(perhalogenoalquil C1-C6)-O-(alquilo =O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-lo C1-C6)2, fenilo, -C(=O)-(heterociclilo), o un grupo =O)-(heterociclilo) o heterociclilo es un anillo de 3 a 7 s de N, O, o S;
R2 se selecciona de -H, o alquilo C1-C4 o está ausente e R3 se selecciona de un alquilo C1-C10 no sustituido, un grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -N grupo de fórmula -(CR3dR3e)-(CR3 fR3g)-Q, un grupo de f Q, en donde el heterociclilo del -(heterociclil)-Q tiene d seleccionados de N, O, o S y no está sustituido o está s R3a en cada caso se selecciona independientemente de C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6) alquinilo C2-C6 , -NH2, -NH(alquilo C1-C6), o -N(alquilo C1 R3b y R3c se seleccionan independientemente de C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), R3d y R3e se seleccionan independientemente de C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6) R3f y R3g se seleccionan independientemente de C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), R3h en cada caso se selecciona independientemen C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), Q es un grupo arilo C6-C10 monocíclico o bicíclico, un g en el anillo que contiene 1, 2, o 3 heteroátomos selec heterociclilo de 3 a 7 miembros que contiene 1, 2, o 3 arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo y con 1,2, 3, o 4 sustituyentes RQ ;
RQ en cada caso se selecciona independientemente C6 , -perhalogenoalquilo C1-C6 , -alquenilo C2-C6 , -alquinil -O-(perhalogenoalquilo C1-C6), -NH2 , -NH(alquilo C1-C(=O)-O-(alquilo C1-C6), -C(=O)NH2 , -C(=O)NH(alquil fenilo, o un grupo heteroarilo, y el grupo heterociclilo Q R4 se selecciona de un grupo arilo C6-C10 monocíclico o 10 miembros en el anillo que contiene 1, 2, o 3 heteroá grupo heterociclilo monocíclico o bicíclico con 5 a 10 independientemente seleccionados de N, O o S, en d heterociclilo no están sustituidos o están sustituidos con R4a en cada caso se selecciona independientemente C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), NH2 , -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O) C(=O)NH2 , -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquil sustituido con 1 sustituyente oxo.
En algunas realizaciones del compuesto de fórmula I mismo, los tautómeros del mismo, la sal farmacéut cualquiera de los anteriores, o la mezcla de los mismos de fenilo no sustituido o sustituido y R3 es un grupo de f a) R4 está sustituido con al menos un grupo -O-(alquilo b) Q no es un oxadiazol;
c) R3b no es -H;
d) R3c no es -H;
e) R1 no es un grupo 2-piridilo; o
f) R4 está sustituido con dos o más grupos -O-(alquilo C compuestos de fórmula II;
ilo C1-C10 sustituido con 1, 2, o 3 sustituyentes R3a, un R3bR3c)-Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un la -(CR3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)-7 miembros de los cuales 1, 2, o 3 son heteroátomos ido con 1,2, o 3 sustituyentes R3 h ;
Cl, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1--O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6 , ;
-F, -Cl, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2 ;
-F, -Cl, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2 ;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2 ;
e -F, -Cl, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), -N(alquilo C1-C6)2 , u oxo;
heteroarilo monocíclico o bicíclico con 5 a 10 miembros dos de N, O S, un grupo cicloalquilo C3-C8, o un grupo átomos seleccionados de N, O, o S, en donde el grupo upo heterociclilo no están sustituidos o están sustituidos
, -Cl, -Br, -I, -CN, -alquilo C1-C6 , -halogenoalquilo C1--C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, --C6), -C(=O)N(alquilo C1-C6)2 , -S(=O)2-(alquilo C1-C6), estar sustituido con 1 sustituyente oxo RQ ;
lico, un grupo heteroarilo monocíclico o bicíclico con 5 a s independientemente seleccionados de N, O o S, o un ros en el anillo que contiene 1, 2, 3 o 4 heteroátomos el grupo arilo C6-C10, el grupo heteroarilo o el grupo o 3 sustituyentes R4a ; y
, -Cl, -Br, -I, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -ilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), --C6)2 , y el grupo heterociclilo R4 puede estar además
rmula II o las sales farmacéuticamente aceptables del ente aceptable del tautómero, el estereoisómero de enos uno de los siguientes es verdad si R4 es un anillo la -(CR3b=CR3c)-Q:
);
Otras numerosas realizaciones del compuesto de fórmula También se proporcionan composiciones farmacéuticas farmacéuticamente aceptable y el compuesto o la sal f mismo, la sal farmacéuticamente aceptable del tautóme mezcla de acuerdo con cualquiera de las realizaciones.
En otras realizaciones, la invención proporciona un méto incluyen típicamente administrar a un sujeto una ca aceptable del mismo, el tautómero del mismo, la sal far de cualquiera de los anteriores, o la mezcla de los mis composición farmacéutica de cualquiera de las realiz cardiovascular es la insuficiencia cardiaca. En alguna insuficiencia cardiaca con fracción de eyección reduci cardiaca con fracción de eyección conservada. Por lo ta insuficiencia cardiaca sistólica crónica o insuficiencia car cardiovascular es insuficiencia cardiaca aguda, mientra hipertensión.
En otras realizaciones más, la invención proporciona un Dichos métodos incluyen típicamente administrar al farmacéuticamente aceptable del mismo, el tautómero de el estereoisómero de cualquiera de los anteriores, o la realizaciones o una composición farmacéutica de cualqui En otras realizaciones más, la invención proporciona un que padece una afección cardiovascular. Dichos métod eficaz del compuesto o la sal farmacéuticamente
farmacéuticamente aceptable del tautómero, el estereoi mismos de acuerdo con una cualquiera las realizacion realizaciones. En dichas realizaciones, la fracción de eye En otras realizaciones más, la invención proporciona un se desea activar el receptor APJ. Dichos métodos incluy compuesto o la sal farmacéuticamente aceptable del
aceptable del tautómero, el estereoisómero de cualquier con una cualquiera las realizaciones o una composición f de dichas realizaciones, la afección es obesidad o di afección es nefropatía diabética o enfermedad renal cróni En otras realizaciones, la invención proporciona el com tautómero del mismo, la sal farmacéuticamente acepta anteriores, o la mezcla de los mismos de acuerdo co farmacéutica de cualquiera de las realizaciones para algunas de dichas realizaciones, la afección cardiova realizaciones, la afección cardiovascular es insuficiencia en otras realizaciones es insuficiencia cardiaca con fr realizaciones, la afección cardiovascular es insuficiencia crónica. En otras realizaciones, la afección cardiovascu realizaciones, la afección cardiovascular es hipertensión. En otras realizaciones más, la invención proporciona el c el tautómero del mismo, la sal farmacéuticamente acept anteriores, o la mezcla de los mismos de acuerdo co farmacéutica de cualquiera de las realizaciones para mej afección cardiovascular.
En otras realizaciones más, la invención proporciona el c el tautómero del mismo, la sal farmacéuticamente acept anteriores, o la mezcla de los mismos de acuerdo co farmacéutica de cualquiera de las realizaciones para m afección cardiovascular.
En otras realizaciones más, la invención proporciona el c el tautómero del mismo, la sal farmacéuticamente acept anteriores, o la mezcla de los mismos de acuerdo co farmacéutica de cualquiera de las realizaciones para tr fórmula II se establecen aquí.
e incluyen al menos un excipiente, vehículo o diluyente acéuticamente aceptable del mismo, el tautómero del el estereoisómero de cualquiera de los anteriores, o la
para tratar una afección cardiovascular. Dichos métodos ad eficaz del compuesto o la sal farmacéuticamente éuticamente aceptable del tautómero, el estereoisómero , de acuerdo con una cualquiera las realizaciones o una nes. En algunas de dichas realizaciones, la afección de dichas realizaciones, la afección cardiovascular es , mientras que en otras realizaciones es insuficiencia , en algunas realizaciones, la afección cardiovascular es ca diastólica crónica. En otras realizaciones, la afección ue en otras realizaciones, la afección cardiovascular es
todo para mejorar la contractilidad cardiaca en un sujeto. ujeto una cantidad eficaz del compuesto o la sal ismo, la sal farmacéuticamente aceptable del tautómero, zcla de los mismos de acuerdo con una cualquiera las de las realizaciones.
todo para aumentar la fracción de eyección en un sujeto incluyen típicamente administrar al sujeto una cantidad ptable del mismo, el tautómero del mismo, la sal ero de cualquiera de los anteriores, o la mezcla de los o una composición farmacéutica de cualquiera de las ón aumenta en el sujeto después de la administración.
todo de tratamiento de una afección en un sujeto donde típicamente administrar al sujeto una cantidad eficaz del mo, el tautómero del mismo, la sal farmacéuticamente e los anteriores, o la mezcla de los mismos de acuerdo acéutica de cualquiera de las realizaciones. En algunas tes, mientras que en otras de dichas realizaciones, la .
sto o la sal farmacéuticamente aceptable del mismo, el del tautómero, el estereoisómero de cualquiera de los na cualquiera de las realizaciones o una composición r en el tratamiento de una afección cardiovascular. En lar es la insuficiencia cardiaca. En algunas de dichas rdiaca con fracción de eyección reducida, mientras que ión de eyección conservada. Por lo tanto, en algunas rdiaca sistólica crónica o insuficiencia cardiaca diastólica es insuficiencia cardiaca aguda mientras que en otras
puesto o la sal farmacéuticamente aceptable del mismo, le del tautómero, el estereoisómero de cualquiera de los na cualquiera de las realizaciones o una composición r la contractilidad cardiaca en un sujeto que padece una
puesto o la sal farmacéuticamente aceptable del mismo, le del tautómero, el estereoisómero de cualquiera de los na cualquiera de las realizaciones o una composición ar la fracción de eyección en un sujeto que padece una
puesto o la sal farmacéuticamente aceptable del mismo, le del tautómero, el estereoisómero de cualquiera de los na cualquiera de las realizaciones o una composición r una afección en un sujeto donde se desea activar el
receptor APJ. En algunas de dichas realizaciones, la dichas realizaciones, la afección es nefropatía diabética. Otros objetos, características y ventajas de la invención siguiente descripción y reivindicaciones.
Breve descripción de los dibujos
La fig. 1A es una gráfica de dP/dtmáx del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejempl cardiaca en corazones de ratas perfundidos aislados.
La fig. 1B es una gráfica de dP/dtmín del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejemplo 3 en corazones de rata perfundidos aislados.
La fig. 2A es una gráfica de dP/dtmáx del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejempl cardiaca en corazones de ratas perfundidos aislados.
La fig. 2B es una gráfica de dP/dtmín del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejemplo 1 en corazones de rata perfundidos aislados.
La fig. 3A es una gráfica de dP/dtmáx del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejempl cardiaca en corazones de ratas perfundidos aislados.
La fig. 3B es una gráfica de dP/dtmín del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejemplo 5 en corazones de rata perfundidos aislados.
La fig. 4A es una gráfica de dP/dtmáx del ventrículo iz corazones de rata Sprague Dawley sin tratamiento pre muestra que el ejemplo 263 aumenta la carga indepe perfundidos aislados.
La fig. 4B es una gráfica de dP/dtmín del ventrículo iz corazones de rata Sprague Dawley sin tratamiento pre muestra que el ejemplo 263 aumenta la relajación c perfundidos aislados.
La fig. 5A es una gráfica de dP/dtmáx del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejempl cardiaca en corazones de ratas perfundidos aislados.
La fig. 5B es una gráfica de dP/dtmín del ventrículo iz comparación con vehículo en corazones de rata Sprag aparato de Langendorff. Esto muestra que el ejemplo en corazones de rata perfundidos aislados.
La fig. 6A es una gráfica de dP/dtmáx del ventrículo iz corazones de rata Sprague Dawley sin tratamiento pre muestra que el ejemplo 99 aumenta la carga indepen perfundidos aislados.
La fig. 6B es una gráfica de dP/dtmín del ventrículo iz corazones de rata Sprague Dawley sin tratamiento pre muestra que el ejemplo 99 aumenta la relajación c perfundidos aislados.
ión es obesidad o diabetes, mientras que en otras de
n evidentes para los expertos en la técnica a partir de la
o en función de la concentración del ejemplo 371 en awley sin tratamiento previo ex vivo obtenida usando el aumenta la carga independiente de la contractilidad
o en función de la concentración del ejemplo 371 en awley sin tratamiento previo ex vivo obtenida usando el menta la relajación cardiaca independiente de la carga
o en función de la concentración del ejemplo 109 en awley sin tratamiento previo ex vivo obtenida usando el aumenta la carga independiente de la contractilidad
o en función de la concentración del ejemplo 109 en awley sin tratamiento previo ex vivo obtenida usando el menta la relajación cardiaca independiente de la carga
o en función de la concentración del ejemplo 586 en awley sin tratamiento previo ex vivo obtenida usando el aumenta la carga independiente de la contractilidad
o en función de la concentración del ejemplo 586 en awley sin tratamiento previo ex vivo obtenida usando el menta la relajación cardiaca independiente de la carga
o en función de la concentración del ejemplo 263 en vivo obtenida usando el aparato de Langendorff. Esto te de la contractilidad cardiaca en corazones de ratas
o en función de la concentración del ejemplo 263 en vivo obtenida usando el aparato de Langendorff. Esto ca independiente de la carga en corazones de rata
do en función de la concentración del ejemplo 27 en awley sin tratamiento previo ex vivo obtenida usando el aumenta la carga independiente de la contractilidad
do en función de la concentración del ejemplo 27 en awley sin tratamiento previo ex vivo obtenida usando el menta la relajación cardiaca independiente de la carga
do en función de la concentración del ejemplo 99 en vivo obtenida usando el aparato de Langendorff. Esto e de la contractilidad cardiaca en corazones de ratas
do en función de la concentración del ejemplo 99 en vivo obtenida usando el aparato de Langendorff. Esto ca independiente de la carga en corazones de rata
La fig. 7 es una gráfica que representa diferentes conce pyr apelina-13 añadida a la línea de células CHO establ la función de la acumulación del fosfato de inositol (IP1) tiempo (TR-FRET) a 620 nm y 665 nm respectivamen positiva en AT1R tras activación por el receptor APJ.
La fig. 8 es una gráfica que representa diferentes conce pyr apelina-13 añadida al receptor APJ humano expres acumulación del fosfato de inositol (IP1) por energía p FRET) a 620 nm y 665 nm respectivamente. No se o apelina-13 cuando el receptor APJ se expresa solo.
La fig. 9 es una gráfica que representa diferentes conce pyr apelina-13 añadida al receptor AT1R humano expre acumulación del fosfato de inositol (IP1) por energía p FRET) a 620 nm y 665 nm respectivamente. No se humano se expresa solo por pyr apelina-13 en ausencia
Descripción detallada de la invención
A menos que se indique lo contrario, todos los números reacción, etc., usados en la memoria descriptiva y las rei los casos por el término "aproximadamente". Por consig numéricos expuestos en la siguiente memoria descripti pueden variar dependiendo de la desviación estándar en
Como se usa en la presente memoria, si alguna varia definición cada vez que aparece es independiente de estructura química y el nombre químico entran en c compuesto. Los compuestos de la presente descripció enlaces y, por lo tanto, pueden existir como estereoisóm geométricos), enantiómeros o diastereoisómeros. Por co de la memoria descriptiva representada, en su totalidad enantiómeros y estereoisómeros posibles de los compue pura (p. ej., geométricamente puras, enantiomérica enantiómeras y estereoisómeras. Las mezclas enant enantiómeros o estereoisómeros componentes usando conocidas por los expertos en la técnica.
Ciertos compuestos de la invención pueden tener átomos los racematos, enantiómeros, diastereoisómeros, isóme estén todos comprendidos dentro del alcance de la inv mismos, tales como los que resultan de la rotaci heteroaromáticos unidos entre sí, se pretende que est ejemplo, cuando R4 es un grupo fenilo y está sustituido punto de unión al átomo de N del triazol, entonces la rota barrera de rotación es suficientemente alta de modo que
Como se usa en la presente memoria y, a menos q "estereoméricamente puro" significa un estereoisómero estereoisómeros de ese compuesto. Por ejemplo, un co estará sustancialmente exento del enantiómero opuest que tiene dos centros quirales estará sustancialmen compuesto estereoméricamente puro típico compre estereoisómero del compuesto y menos de aproxim compuesto, más preferiblemente más de aproximadam menos de aproximadamente 10% en peso de los otros e más de aproximadamente 95% en peso de un estereois peso de los otros estereoisómeros del compuesto, y lo de un estereoisómero del compuesto y menos de aprox compuesto. Si la estereoquímica de una estructura o u líneas en negrita o discontinua, la estructura o parte de estereoisómeros de la misma. Un enlace dibujado con u incluidos.
Varios compuestos de la invención contienen uno o más de enantiómeros, mezclas de diastereómeros o compu ciones de angiotensina (AnglI) con concentración fija de doble APJ-AT1R humana (angiotensina tipo 1). Se midió r energía por resonancia de fluorescencia resuelta en el La adición de pyr apelina-13 induce la cooperatividad
ciones de angiotensina (AngII) con concentración fija de en la línea de células CHO. Se midió la función de la resonancia de fluorescencia resuelta en el tiempo (TR-rvó cooperatividad positiva tras el tratamiento con pyr
ciones de angiotensina (AngII) con concentración fija de o en la línea de células CHO. Se midió la función de la resonancia de fluorescencia resuelta en el tiempo (TR-ervó cooperatividad positiva cuando el receptor AT1R expresión de APJ.
ue expresan cantidades de ingredientes, condiciones de dicaciones deben entenderse como modificados en todos nte, a menos que se indique lo contrario, los parámetros y las reivindicaciones adjuntas son aproximaciones que trada en sus respectivas mediciones de ensayo.
aparece más de una vez en una fórmula química, su definición en cualquier otro caso que aparece. Si la licto, la estructura química determina la identidad del ueden contener uno o más centros quirales y/o dobles , tal como isómeros del doble enlace (es decir, isómeros iguiente, cualquier estructura química dentro del alcance n parte, con una configuración relativa abarca todos los s ilustrados, incluyendo la forma estereoisoméricamente te puras o diastereoméricamente puras) y mezclas eras y estereoisómeras se pueden resolver en los nicas de separación o técnicas de síntesis quiral bien
carbono asimétricos (centros ópticos) o dobles enlaces; geométricos e isómeros individuales se pretende que ción. Además, los atropoisómeros y las mezclas de los restringida alrededor de dos anillos aromáticos o comprendidos dentro del alcance de la invención. Por n dos grupos unidos a los átomos de C adyacentes al n del fenilo puede estar restringida. En algunos casos, la diferentes atropoisómeros se pueden separar y aislar.
se indique lo contrario, el término "estereoisómero" o un compuesto que está sustancialmente exento de otros esto estereoméricamente puro que tiene un centro quiral el compuesto. Un compuesto estereoméricamente puro exento de otros diastereómeros del compuesto. Un más de aproximadamente 80% en peso de un amente 20% en peso de otros estereoisómeros del e 90% en peso de un estereoisómero del compuesto y reoisómeros del compuesto, incluso más preferiblemente ero del compuesto y menos de aproximadamente 5% en preferiblemente más de aproximadamente 97% en peso adamente 3% en peso de los otros estereoisómeros del parte de una estructura no se indica con, por ejemplo, structura debe interpretarse como que abarca todos los línea ondulada indica que ambos estereoisómeros están
ntros quirales, y pueden existir como mezclas racémicas tos enantiomérica u ópticamente puros. Esta invención
abarca el uso de formas estereoméricamente puras de formas. Por ejemplo, las mezclas que comprenden ca compuesto particular de la invención se pueden usar en se pueden sintetizar o resolver de forma asimétrica u agentes de resolución quirales. Véase, por ejemplo, Ja (Wiley-Interscience, Nueva York, 1981); Wilen, S.H., et of Carbon Compounds (McGraw-Hill, Ny , 1962); y Wilen p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Como conocen los expertos en la técnica, ciertos comp tautómeras. Debido a que una estructura química solo entenderá que por conveniencia, la referencia a un com de la estructura representada por la fórmula estructural. Como se ha indicado antes, los compuestos de la inven particularmente cierto en compuestos de fórmula I don tautómero A y tautómero B:
hos compuestos, así como el uso de mezclas de esas ades iguales o desiguales de los enantiómeros de un étodos y composiciones de la invención. Estos isómeros do técnicas estándar tales como columnas quirales o es, J., et al., Enantiomers, Racemates and Resolutions 1997) Tetrahedron 33: 2725; Eliel, E.L., Stereochemistry .H., Tables of Resolving Agents and Optical Resolutions e, IN, 1972).
tos de la invención pueden existir en una o más formas puede usar para representar una forma tautómera, se esto de una fórmula estructural dada incluye tautómeros
pueden existir en múltiples formas tautómeras. Esto es R2 es H. Estas formas se ilustran a continuación como
Los compuestos de la invención se representan estruct "tautómero A". Sin embargo, está específicamente conte del "tautómero B" y por lo tanto los compuestos en forma invención. Por esta razón, las reivindicaciones se refiere compuesto, algunos compuestos existen principalmente compuesto y la energía necesaria para convertir un taut mezclas a TA mientras que otros se pueden aislar e tautómeros asociados con compuestos de la invención s la hidroxipiridina es un tautómero y los compuestos co continuación ejemplos de estos.
lmente y se nombran como compuestos en la forma del lado y se sabe que los compuestos existen en la forma l "tautómero B" se consideran expresamente parte de la compuestos de fórmula I y fórmula II. Dependiendo del una forma más que en otra. También dependiendo del ero en el otro, algunos compuestos pueden existir como na forma tautómera o la otra. Los ejemplos de otros aquellos con un grupo piridona (un piridinilo) para los que n grupo cetona con el tautómero enol. Se muestran a
Los compuestos de la presente descripción incluyen, formas farmacéuticamente aceptables de los mismos. La citados en la presente memoria incluyen sales farmac incluyen polimorfos y clatratos), quelatos, complejos n ciertas realizaciones, los compuestos descritos en farmacéuticamente aceptables. Como se usa en la pre propio compuesto, sino también una sal farmacéuticame del mismo, un complejo no covalente del mismo, un anteriores. En realizaciones, el término "compuesto" aceptables del mismo, tautómeros del compuesto, s profármacos éster tales como ésteres de alquilo (C1-C4) propio compuesto, sales farmacéuticamente acept no se limitan a compuestos de fórmula I y todas las ormas farmacéuticamente aceptables de los compuestos ticamente aceptables, solvatos, formas cristalinas (que ovalentes, profármacos y mezclas de los mismos. En presente memoria están en la forma de sales te memoria, el término "compuesto" abarca no solo el aceptable del mismo, un solvato del mismo, un quelato ofármaco del mismo, y mezclas de cualquiera de los barca el propio compuesto, sales farmacéuticamente farmacéuticamente aceptables de los tautómeros, y n otras realizaciones, el término "compuesto" abarca el es del mismo, tautómeros del compuesto, sales
farmacéuticamente aceptables de los tautómeros.
El término "solvato" se refiere al compuesto formado disolventes adecuados son solvatos farmacéuticamente hemihidratos.
Los compuestos de la invención también pueden conten más de los átomos que constituyen dichos compuestos. con isótopos radiactivos, tales como por ejemplo tritio radiomarcados son útiles como agentes terapéuticos o ensayo y agentes de diagnóstico, p. ej., agentes de form de los compuestos de la invención, sean radiactivas o n invención. Por ejemplo, si se dice o muestra que una var deuterio (D) o tritio (T).
"Alquilo" se refiere a un grupo hidrocarbonado monoval eliminación de un átomo de hidrógeno de un solo átomo incluyen, pero no se limitan a metilo, etilo, propilos tales ilo, butan-2-ilo, 2-metil-propan-1-ilo, 2-metil-propan-2-ilo, alquilo comprende de 1 a 20 átomos de carbono. En al átomos de carbono o de 1 a 6 átomos de carbono mientr 1 a 4 átomos de carbono. En otras realizaciones más, un alquilo de cadena ramificada incluyen al menos 3 átomo realizaciones, de 3 a 6 átomos de carbono. Un grupo denominar un grupo alquilo (C1-C6) y un grupo alquilo qu alquilo (C1-C4). Esta nomenclatura también se puede usa carbono. El término "alquilo también se puede usar cua sustituido, en cuyo caso un enlace entre un átomo de hid se sustituye por un enlace con otro átomo tal como, per ejemplo, un grupo -O-(alquil C1-C6)-OH se reconocerá co alquilo C1-C6 y uno de los átomos de H unido a un átomo el átomo de O de un grupo -OH. Como otro ejemplo, como un grupo cuando un átomo de -O está unido a un p un átomo de C del primer grupo alquilo C1-C6 se sustituy un segundo grupo C1-C6 alquilo.
"Alquenilo" se refiere a un grupo hidrocarbonado de ca doble enlace carbono-carbono obtenido por eliminación un alqueno original. El grupo puede estar en la forma Z o grupos alquenilo típicos incluyen, pero no se limitan a et prop-2-en-1-ilo (alilo), y prop-2-en-2-ilo; butenilos tales but-2-en-1-ilo, but-2-en-1-ilo, but-2-en-2-ilo, buta-1,3-d realizaciones, un grupo alquenilo tiene de 2 a 20 átomos de carbono. Un grupo alquenilo que tiene de 2 a 6 átom C6).
"Alquinilo" se refiere a un grupo hidrocarbonado de ca triple enlace carbono-carbono obtenido por eliminación d un alquino original. Los grupos alquinilo típicos incluyen, pentinilo, 2-hexinilo, 3-hexinilo y similares. En ciertas re carbono y en otras realizaciones, tiene de 2 a 6 átomos d carbono se puede denominar un grupo -alquinilo (C2-C6).
"Alcoxi" se refiere a un radical -OR donde R representa u ejemplos representativos incluyen, pero no se limitan a grupos alcoxi típicos incluyen de 1 a 10 átomos de car carbono en el grupo R. Los grupos alcoxi que incluyen de alquilo(C1-C6) o -O-(alquilo C1-C6). En algunas realizaci carbono y se puede denominar grupo -O-alquilo(C1-C4) o
"Arilo" se refiere a un grupo hidrocarbonado aromático d solo átomo de carbono de un sistema de anillo aromá monocíclicos, por ejemplo, benceno. Arilo también aba donde cada uno de los anillos es aromático, por ejemp sistemas de anillos condensados donde cada anillo es u grupo arilo incluye de 6 a 10 átomos de carbono. Dic embargo, arilo, no abarca o no se solapa de ninguna f la interacción de un disolvente y un compuesto. Los ptables, tales como hidratos, incluyendo monohidratos y
roporciones no naturales de isótopos atómicos en uno o r ejemplo, los compuestos pueden estar radiomarcados ), yodo-125 (125I) o carbono-14 (14C). Los compuestos filácticos, reactivos de investigación, p. ej., reactivos de n de imágenes in vivo. Todas las variaciones isotópicas e pretende que estén incluidas dentro del alcance de la le es H, esto significa que la variable también puede ser
e de cadena lineal o ramificado saturado obtenido por carbono de un alcano original. Los grupos alquilo típicos o propan-1 -ilo y propan-2-ilo, butilos ales como butan-1 -c-butilo, y similares. En ciertas realizaciones, un grupo as realizaciones, los grupos alquilo incluyen de 1 a 10 ue en otras realizaciones, los grupos alquilo incluyen de upo alquilo incluye 1 o 2 átomos de carbono. Los grupos carbono y típicamente incluyen de 3 a 7, o en algunas uilo que tiene de 1 a 6 átomos de carbono se puede ne de 1 a 4 átomos de carbono se puede denominar un ara grupos alquilo con diferentes números de átomos de un grupo alquilo es un sustituyente que está además eno secundario y un átomo de C del sustituyente alquilo o limitado a un halógeno, o un átomo de O, N o S. Por un grupo cuando un átomo de -O está unido a un grupo C del grupo alquilo C1-C6 se sustituye por un enlace con grupo -O-(alquil C1-C6)-O-(alquilo C1-C6) se reconocerá er grupo alquilo C1-C6 y uno de los átomos de H unido a or un enlace a un segundo átomo de O que está unido a
a lineal o ramificada insaturado que tiene al menos un n átomo de hidrógeno de un solo átomo de carbono de (cis o trans) alrededor del(de los) doble(s) enlace(s). Los o; propenilos tales como prop-1-en-1-ilo, prop-1-en-2-ilo, o but-1 -en-1 -ilo, but-1-en-2-ilo, 2-metil-prop-1-en-1-ilo, -1 -ilo y buta-1,3-dien-2-ilo; y similares. En ciertas carbono y en otras realizaciones tiene de 2 a 6 átomos e carbono se puede denominar un grupo alquenilo (C2-
a lineal o ramificada insaturado que tiene al menos un n átomo de hidrógeno de un solo átomo de carbono de o no se limitan a etinilo; propinilo; butinilo, 2-pentinilo, 3-aciones, un grupo alquinilo tiene de 2 a 20 átomos de arbono. Un grupo alquinilo que tiene de 2 a 6 átomos de
rupo alquilo como se define en la presente memoria. Los toxi, etoxi, propoxi, butoxi, ciclohexiloxi, y similares. Los o, de 1 a 6 átomos de carbono o de 1 a 4 átomos de a 6 átomos de carbono se pueden denominar grupos -O-s, un grupo alcoxi puede incluir de 1 a 4 átomos de -(alquilo C1-C4).
ado de la eliminación de un átomo de hidrógeno de un original. Arilo abarca anillos aromáticos carbocíclicos sistemas de anillos aromáticos carbocíclicos bicíclicos naftaleno. Por lo tanto, los grupos arilo pueden incluir nillo aromático carbocíclico. En ciertas realizaciones, un grupos pueden denominarse grupos arilo C6-C10. Sin a con heteroarilo como se define separadamente más
adelante. Por lo tanto, si uno o más anillos aromáticos car incluye al menos un heteroátomo, el sistema de anillos res define en la presente memoria.
"Carbonilo" se refiere al radical -C(O) o grupo -C(=O).
"Carboxi" se refiere al radical -C(O)OH.
"Ciano" se refiere al radical -CN.
"Cicloalquilo" se refiere a un grupo alquilo cíclico saturado un solo átomo de carbono de un cicloalcano original. Los grupos derivados de ciclopropano, ciclobutano, ciclopenta grupos cicloalquilo se puede describir por el número de cicloalquilo que tiene de 3 a 7 miembros en el anillo cicloalquilo que tiene de 4 a 7 miembros en el anill realizaciones, el grupo cicloalquilo puede ser un cicloalqui un cicloalquilo (C3-C6), o un grupo cicloalquilo (C4-C7) y cicloalquilo C3-C8 , cicloalquilo C3-C7 , cicloalquilo C3-C6 , o c "Heterociclilo" se refiere a un grupo cíclico que incluye a aromático. Los grupos heterociclilo incluyen al meno heteroátomos típicos incluyen, O, S y N y se selecciona sistemas de anillo monocíclicos y sistemas de anillo bicícl un anillo no aromático con al menos un miembro del anill cicloalquilo o se puede condensar con un anillo aromático incluir uno o más heteroátomos. El punto de unión de un g aromático que incluye al menos un heteroátomo o en o heterociclilo derivado de eliminación de un átomo de hi miembros mostrado a continuación puede estar unido al anillo de 6 miembros.
íclicos están condensados con un anillo aromático que nte es un grupo heteroarilo, no un grupo arilo, como se
rivado por la eliminación de un átomo de hidrógeno de upos cicloalquilo típicos incluyen, pero no se limitan a ciclohexano, cicloheptano, ciclooctano, y similares. Los omos de carbono en el anillo. Por ejemplo, un grupo puede denominar un cicloalquilo (C3-C7) y un grupo e puede denominar cicloalquilo (C4-C7). En ciertas (C3-C10), un cicloalquilo (C3-C8), un cicloalquilo (C3-C7), tos se pueden denominar grupos cicloalquilo C3-C10, alquilo C4-C7 usando lenguaje alternativo.
enos un anillo cíclico saturado o insaturado, pero no un heteroátomo como un miembro del anillo. Los independientemente. Los grupos heterociclilo incluyen s. Los grupos heterociclilo bicíclicos incluyen al menos eteroátomo que se puede condensar con un anillo de nde el anillo aromático puede ser carbocíclico o puede o heterociclilo bicíclico puede ser en el anillo cíclico no anillo del grupo heterociclilo. Por ejemplo, un grupo geno de uno de los compuestos heterocíclicos de 9 to de la molécula en el anillo de 5 miembros o en el
En algunas realizaciones, un grupo heterociclilo incluye de 2 o 3 son heteroátomos independientemente seleccion heterociclilo incluye de 3 a 7 miembros en el anillo independientemente de O, S o N. En dichos grupos hetero un heteroátomo cuando el anillo incluye solo 3 miembros miembros. En algunas realizaciones, un grupo heterociclil heteroátomo seleccionado de O, S o N. En otras realizaci el anillo de los cuales 1, 2 o 3 son heteroátomos inde heterociclilo típicos incluyen, pero no se limitan a grupos morfolina, piperazina, piperidina, hexahidropirimidina quinuclidina, tetrahidrofurano, tetrahidropirano, bencimida también incluye sistemas de anillo sustituidos con uno o óxido de piperidinilo, N-óxido de morfolinilo, 1-oxo-1-tio 2(3H)-onilo, 3,4-dihidroisoquinolin-1(2H)-onilo, indolinoni onilo, imidazolidin-2-onilo, 1H-imidazol-2(3H)-onilo, 1,1-dio "Enfermedad" se refiere a una enfermedad, trastorno, afec "Halogeno-" o "halógeno" se refiere a un grupo fluoro, cloro "Halogenoalquilo" se refiere a un grupo alquilo en el que al tanto, el término "halogenoalquilo" incluye monohalogen polihalogenoalquilo (alquilo sustituido con dos o más representativos incluyen difluorometilo, 2,2,2-trifluor a 10 miembros en el anillo de los cuales 1,2, 3 o 4 o 1, os de O, S, o N. En otras realizaciones, un grupo los cuales 1, 2 o 3 heteroátomos se seleccionan lilo de 3-7 miembros, solo 1 de los átomos del anillo es incluye 1 o 2 heteroátomos cuando el anillo incluye 4 cluye 3 o 4 miembros en el anillo de los cuales 1 es un s, un grupo heterociclilo incluye de 5 a 7 miembros en dientemente seleccionados de O, S o N. Los grupos rivados de epóxidos, aziridina, azetidina, imidazolidina, 1,4,5,6-tetrahidropirimidina, pirazolidina, pirrolidina, lona, piridinona, y similares. El heterociclilo sustituido s sustituyentes oxo (=O) u óxido (-O-), tales como N-folinilo, piridinonilo, bencimidazolonilo, benzo[d]oxazol-1H-imidazo[4,5-c]piridin-2(3H)-onilo, 7H-purin-8(9H)-1-tiomorpholinilo, y similares.
n, síntoma o indicación.
romo o yodo.
enos un hidrógeno se sustituye por un halógeno. Por lo uilo (alquilo sustituido con un átomo de halógeno) y tomos de halógeno). Los grupos "halogenoalquilol" ilo, 2,2,2-tricloroetilo, y similares. El término
"perhalogenoalquilo" significa, salvo que se exponga otr de hidrógeno se sustituye por un átomo de halógeno. P se limita a trifluorometilo, pentacloroetilo, 1,1,1-trifluoro-2-
Heteroarilo" se refiere a un grupo heteroaromático
hidrógeno de un solo átomo de un sistema de anillo h incluyen de 5 a 14 miembros, pero más típicamente incl de 5 a 10 miembros que contienen uno o más, por e heteroátomos seleccionados de O, S o N, siendo los áto monocíclicos, el anillo único es aromático e incluye al
heteroarilo monocíclico puede incluir 5 o 6 miembros d heteroátomos, 1 o 2 heteroátomos, o 1 hetero independientemente de O, S o N. En los anillos aromáti heteroarilo bicíclicos, al menos uno de los anillos debe anillos incluyan un heteroátomo, aunque está permitido q anillo heteroaromático de 5 a 7 miembros condensado anillo heteroaromático. En los anillos aromáticos tricíclic anillos incluye al menos un heteroátomo. Para sistema donde solo uno de los anillos contiene uno o más het incluye al menos un heteroátomo o en un anillo carbocícli heteroarilo es superior a 1, esos heteroátomos no son a de átomos de S y O en el grupo heteroarilo no es mayor de S y O en el heterociclo aromático no es mayor que 1. definido antes. Los ejemplos de grupos heteroarilo incl carbazol, cinolina, furano, imidazol, indazol, indol, ind isotiazol, 2H-benzo[d][1,2,3]triazol, isoxazol, naftiridina, fenazina, ftalazina, pteridina, purina, pirazina, pirazol, p quinolina, quinolizina, quinoxalina, tetrazol, tiadiazol, tia grupo heteroarilo puede ser heteroarilo entre 5 a 20
miembros o de 5 a 10 miembros. En ciertas realizaci tiofeno, pirrol, benzotiofeno, 2H-benzo[d][1,2,3]triazol be oxazol, tetrazol y pirazina.
"Farmacéuticamente aceptable" se refiere al uso gener seres humanos.
"Sal farmacéuticamente aceptable" se refiere a una sal d tiene la actividad farmacológica deseada del compuest ácido, formadas con ácidos inorgánicos tales como ácido ácido fosfórico y similares; o formadas con ácidos org hexanoico, ácido ciclopentanopropiónico, ácido glicóli succínico, ácido málico, ácido maleico, ácido fumárico, hidroxibenzoil)benzoico, ácido cinámico, ácido mandélic cuando un protón ácido presente en el compuesto origi alcalino, un ion alcalinotérreo o un ion de aluminio; o dietanolamina, trietanolamina, N-metilglucamina, dicicloh
"Excipiente farmacéuticamente aceptable", "vehí farmacéuticamente aceptable" se refieren, respectivame administra al menos un compuesto de la presente descri cualquiera de un diluyente, adyuvante, excipiente o vehí presente descripción.
"Estereoisómero" se refiere a un isómero que difiere en Los estereoisómeros que son imágenes especulares entr los estereoisómeros que no son imágenes especula "diastereómeros".
"Sujeto" incluye mamíferos y seres humanos. Los térmi presente documento.
"Cantidad terapéuticamente efectiva" se refiere a la canti para tratar una enfermedad, o al menos uno de los sínt para afectar dicho tratamiento para la enfermedad, tra puede variar dependiendo del compuesto, la enfermedad la gravedad de la enfermedad, el trastorno y/o los sínto va a tratar y/o el peso del sujeto que se va a tratar.
osa, un grupo alquilo en el que cada uno de los átomos jemplo, el término "perhalogenoalquilo" incluye, pero no mo-2-cloroetilo, y similares.
ovalente derivado de la eliminación de un átomo de roaromático original. Los grupos heteroarilo típicamente n anillos aromáticos, monocíclicos, bicíclicos y tricíclicos plo, 1, 2, 3 o 4, o en ciertos realizaciones, 1, 2 o 3, s del anillo restantes carbono. En los grupos heteroarilo os un heteroátomo. En algunas realizaciones, un grupo nillo y puede incluir 1, 2, 3 o 4 heteroátomos, 1, 2 o 3 mo donde el(los) heteroátomo(s) se seleccionan bicíclicos, ambos anillos son aromáticos. En los grupos cluir un heteroátomo, pero no es necesario que ambos lo hagan. Por ejemplo, el término "heteroarilo" incluye un un anillo aromático carbocíclico o condensado con otro , los tres anillos son aromáticos y al menos uno de los e anillos heteroarilo bicíclicos y tricíclicos condensados átomos, el punto de unión puede estar en el anillo que . Cuando el número total de átomos de S y O en el grupo centes entre sí. En ciertas realizaciones, el número total e 2. En ciertas realizaciones, el número total de átomos l heteroarilo no abarca ni se solapa con arilo como se ha en, pero no se limitan a grupos derivados de acridina, ina, isobenzofurano, isocromeno, isoindol, isoquinolina, xadiazol, oxazol, perimidina, fenantridina, fenantrolina, azina, piridina, pirimidina, pirrol, pirrolizina, quinazolina, tiofeno, triazol, y similares. En ciertas realizaciones, el mbros, tal como por ejemplo, un heteroarilo de 5 a 14 s, los grupos heteroarilo pueden ser los derivados de furano, indol, piridina, quinolina, imidazol, bencimidazol,
ente reconocido en animales, y más particularmente en
n compuesto que es farmacéuticamente aceptable y que original. Dichas sales incluyen: (1) sales de adición de rhídrico, ácido bromhídrico, ácido sulfúrico, ácido nítrico, icos tales como ácido acético, ácido propiónico, ácido ácido pirúvico, ácido láctico, ácido malónico, ácido cido tartárico, ácido cítrico, benzoico ácido, ácido 3-(4-ácido metanosulfónico y similares; o (2) sales formadas se sustituye por un ion metálico, p. ej., un ion de metal coordina con una base orgánica tal como etanolamina, lamina y similares.
o farmacéuticamente aceptable" o "adyuvante , a un excipiente, vehículo o adyuvante con el que se ión. "Vehículo farmacéuticamente aceptable" se refiere a o con el que se administra al menos un compuesto de la
disposición de los átomos constituyentes en el espacio. sí y ópticamente activos se denominan "enantiómeros", y entre sí y son ópticamente activos se denominan
"ser humano" y "sujeto" se usan indistintamente en el
de un compuesto que, cuando se administra a un sujeto as clínicos de una enfermedad o trastorno, es suficiente rno, o síntoma La "cantidad terapéuticamente efectiva" l trastorno y/o los síntomas de la enfermedad o trastorno, de la enfermedad o trastorno, la edad del sujeto que se cantidad adecuada en cualquier caso dado puede ser
fácilmente evidente para los expertos en la técnica o se
"Tratar" o "tratamiento" de cualquier enfermedad o tr trastorno o al menos uno de los síntomas clínicos de u una enfermedad, trastorno o al menos uno de los sínto desarrollo de una enfermedad, trastorno o al menos un reduciendo el riesgo de desarrollar una enfermedad o enfermedad o trastorno "Tratar" o "tratamiento" también sea físicamente (p. ej., estabilización de un síntoma parámetro físico), o ambos, o inhibir al menos un par Además, "tratar" o "tratamiento" se refiere a retrasar la de la misma en un sujeto que puede estar expuesto o ese sujeto aún no experimenta o muestra síntomas de la
Ahora se hará referencia en detalle a las realizaciones realizaciones de la presente descripción, se entenderá descripción a esas realizaciones descritas. Por el contra está destinada a cubrir alternativas, modificaciones y e alcance de las realizaciones de la presente descripción t
Realizaciones
Las realizaciones dadas a continuación se presentan en de referencia al referirse de nuevo a múltiples realizacion
1. En una primera realización, la invención proporciona u de determinar mediante experimentación rutinaria.
torno se refiere a detener o mejorar una enfermedad, enfermedad o trastorno, reduciendo el riesgo de adquirir s clínicos de una enfermedad o trastorno, reduciendo el de los síntomas clínicos de la enfermedad o trastorno, o storno o al menos uno de los síntomas clínicos de una e refiere a la inhibición de la enfermedad o trastorno, ya scernible), fisiológicamente (p. ej., estabilización de un etro físico que puede no ser discernible para el sujeto. rición de la enfermedad o trastorno o al menos síntomas dispuesto a una enfermedad o trastorno a pesar de que fermedad o trastorno.
e la presente descripción. Aunque se describirán ciertas e no se pretende limitar las realizaciones de la presente , la referencia a realizaciones de la presente descripción valentes que pueden estar incluidas dentro del espíritu y omo se define en las reivindicaciones adjuntas.
rma numerada por conveniencia y por facilidad y claridad .
ompuesto de fórmula I o fórmula II:
o una de sus sales farmacéuticamente aceptables, uno d tautómero, un estereoisómero de cualquiera de los anteri en donde:
R1 es piridilo, piridonilo o N-óxido de piridina no sustituid con 1,2, 3, o 4 sustituyentes R1a;
R1a en cada caso se selecciona independientemente d C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6 C6), -alquenilo C2-C6 , -O-(alquil C1-C6)-o H, -O-(alquil (halogenoalquil C1-C6)-O-(alquilo C1-C6), -O-(perhaloge C1-C6), -NH2 , -NH(alquilo C1-C6), -N(alquilo C1-C6)2 , C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N(a heterociclilo, en donde el grupo heterociclilo del grupo miembros que contiene 1,2 o 3 heteroátomos selecciona R2 se selecciona de -H, o alquilo C1-C4 o está ausente en sus tautómeros, una sal farmacéuticamente aceptable del es, o una de sus mezclas,
o es un piridilo, piridonilo o N-óxido de piridina sustituido
-F, -Cl, -Br, -I, -CN, -alquilo C1-C6 , -halogenoalquilo C1--O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6)-O-(alquilo C1-C6), -O-(halogenoalquil C1-C6)-OH, -O-lquil C1-C6)-OH, -O-(perhalogenoalquil C1-C6)-O-(alquilo (=O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-ilo C1-C6)2, fenilo, -C(=O)-(heterociclilo), o un grupo (=O)-(heterociclilo) o heterociclilo es un anillo de 3 a 7 s de N, O o S;
s compuestos de fórmula II;
R3 se selecciona de un alquilo C1-C10 no sustituido, un grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -grupo de fórmula -(CR3dR3e)-(CR3fR3g)-Q, un grupo de f Q, en donde el heterociclilo del -(heterociclil)-Q tiene seleccionados de N, O o S y no está sustituido o está s R3a en cada caso se selecciona independientemente de C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6 alquinilo C2-C6, -NH2, -NH(alquilo C1-C6), o -N(alquilo C R3b y R3c se seleccionan independientemente d C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), R3d y R3e se seleccionan independientemente d C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), R3f y R3g se seleccionan independientemente d C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6) R3h en cada caso se selecciona independienteme C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), Q es un grupo arilo C6-C10 monocíclico o bicíclico, un g en el anillo que contiene 1, 2 o 3 heteroátomos selecci heterociclilo de 3 a 7 miembros que contiene 1, 2 o 3 arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo, y con 1,2, 3 o 4 sustituyentes RQ;
RQ en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquini -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquil fenilo, o un grupo heteroarilo, y el grupo heterociclilo Q R4 se selecciona de un grupo arilo C6-C10 monocíclico o 10 miembros en el anillo que contiene 1, 2 o 3 heteroá grupo heterociclilo monocíclico o bicíclico con 5 a 10 independientemente seleccionados de N, O o S, en d heterociclilo no están sustituidos o están sustituidos con R4a en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O) C(=O)NH2, -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquil sustituido con 1 sustituyente oxo; y
además en donde:
si R4 es un anillo de fenilo no sustituido o sustituido verdad al menos uno de los siguientes:
a) R4 está sustituido con al menos un grupo -O-(alquilo b) Q no es un oxadiazol;
c) R3b no es -H;
d) R3c no es -H;
e) R1 no es un grupo 2-piridilo; o
f) R4 está sustituido con dos o más grupos -O-(alquilo C 1. En una primera realización alternativa, la invención p ilo C1-C10 sustituido con 1, 2, o 3 R3a sustituyentes, un R3bR3c)-Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un la -(CR3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)-7 miembros de los cuales 1, 2 o 3 son heteroátomos do con 1,2 o 3 sustituyentes R3h;
Cl, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1--O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6, ;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
e -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -,-NH(alquilo C1-C6), -N(alquilo C1-C6)2, u oxo;
heteroarilo monocíclico o bicíclico con 5 a 10 miembros os de N, O o S, un grupo cicloalquilo C3-C8, o un grupo átomos seleccionados de N, O o S, en donde el grupo upo heterociclilo no están sustituidos o están sustituidos
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1--C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, --C6), -C(=O)N(alquilo C1-C6)2, -S(=O)2-(alquilo C1-C6), estar sustituido con 1 sustituyente oxo RQ;
lico, un grupo heteroarilo monocíclico o bicíclico con 5 a s independientemente seleccionados de N, O o S, o un ros en el anillo que contiene 1, 2, 3 o 4 heteroátomos el grupo arilo C6-C10, el grupo heteroarilo, o el grupo o 3 sustituyentes R4a;
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -ilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), --C6)2, y el grupo heterociclilo R4 puede estar además
es un grupo de fórmula -(CR3b=CR3c)-Q, entonces es
);
o una de sus sales farmacéuticamente aceptables, uno tautómero, un estereoisómero de cualquiera de los anter
R1 es un piridilo, piridonilo o N-óxido de piridina no sustituido con 1,2, 3 o 4 sustituyentes R1a;
R1a en cada caso se selecciona independientemente C6 , -perhalogenoalquilo C1-C6 , -alquil C1-C6-OH, -C1-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalog (alquil C1-C6)-O-(alquilo C1-C6), -O-(halogenoalquil C1 (perhalogenoalquil C1-C6)-OH, -O-(perhalogenoalquil C C1-C6)2 , -C(=O)-(alquilo C1-C6), -C(=O)OH, -C(=O C6), -C(=O)N(alquilo C1-C6)2, fenilo, -C(=O)-(heterociclil donde el grupo heterociclilo del grupo -C(=O)-(heteroc contiene 1,2 o 3 heteroátomos seleccionados de N, O o
R2 se selecciona de -H, o alquilo C1-C4 o está ausente e
R3 se selecciona de un alquilo C1-C10 no sustituido, un grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -N grupo de fórmula -(CR3dR3e)-(CR3 fR3g)-Q, un grupo de fó Q, en donde el heterociclilo del -(heterociclil)-Q tiene d seleccionados de N, O o S y no está sustituido o está su
R3a en cada caso se selecciona independientemente de C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-alquinilo C2-C6 , -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-
R3b y R3c se seleccionan independientemente de C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -
R3d y R3e se seleccionan independientemente de C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -
R3f y R3g se seleccionan independientemente de C6 , -perhalogenoalquilo C1-C6 , -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-o H, -O-(alquil C1-C6)-O-(alquilo C1-C6 cicloalquilo C3-C6 , o un grupo heterociclilo de 3 a 7 mie N, O o S, en donde el grupo cicloalquilo C3-C6 , o el gru sustituido o estar sustituido con 1 o 2 sustituyentes inde -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, -O C6), -N(alquilo C1-C6)2 , u oxo;
s tautómeros, una sal farmacéuticamente aceptable del , o una de sus mezclas, en donde:
uido, o es un piridilo, piridonilo o N-óxido de piridina
, -Cl, -Br, -I, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo-OH, -C1-C6 perhalogenoalquilo-OH, -O-lquilo C1-C6),-alquenilo C2-C6 , -O-(alquil C1-C6)-OH, -O--OH, -O-(halogenoalquil C1-C6)-O-(alquilo C1-C6), -O--O-(alquilo C1-C6), -NH2 , -NH(alquilo C1-C6), -N(alquilo (alquilo C1-C6), -C(=O)NH2 , -C(=O)NH(alquilo C1-n grupo cicloalquilo C3-C6 o un grupo heterociclilo, en ) o heterociclilo es un anillo de 3 a 7 miembros que
compuestos de fórmula II;
ilo C1-C10 sustituido con 1, 2 o 3 sustituyentes R3a, un R3bR3c)-Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un la -(CR3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)-7 miembros de los cuales 1, 2 o 3 son heteroátomos do con 1,2 o 3 sustituyentes R3h ;
Cl, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1--O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6 , ;
-F, -Cl, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2 ;
-F, -Cl, -CN, -alquilo C1-C6 , -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2 ;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -H2 , -NH(alquilo C1-C6), -N(alquilo C1-C6)2, un grupo s que contiene 1, 2 o 3 heteroátomos seleccionados de 3f o R3g heterociclilo de 3 a 7 miembros puede no estar ientemente seleccionados de -F, -Cl,-CN, -alquilo C1-C6 , -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-uil C1-C6)-O-(alquilo C1-C6), -NH2 , -NH(alquilo C1-R3h en cada caso se selecciona independientemen C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), Q es un grupo arilo C6-C10 monocíclico o bicíclico, un g en el anillo que contiene 1, 2 o 3 heteroátomos selecci heterociclilo de 3 a 7 miembros que contiene 1, 2 o 3 arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo, y con 1,2, 3 o 4 sustituyentes RQ;
RQ en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquinil -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquil fenilo, o un grupo heteroarilo con 5 a 10 miembros en el N, O o S, un grupo cicloalquilo C3-C8, o un grupo hetero seleccionados de N, O o S, y el grupo heterociclilo sustituyente oxo RQ, y el grupo cicloalquilo RQ y el grup con 1 o 2 sustituyentes independientemente selecciona C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquini -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo
C(=O)OH, -C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O) R4 se selecciona de un grupo arilo C6-C10 monocíclico o 10 miembros en el anillo que contiene 1, 2 o 3 heteroát grupo heterociclilo monocíclico o bicíclico con 5 a 10 independientemente seleccionados de N, O o S, en d heterociclilo no están sustituidos o están sustituidos con R4a en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O) C(=O)NH2, -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquil sustituido con 1 sustituyente oxo; y
además en donde:
si R4 es un anillo de fenilo no sustituido o sustituido verdad al menos uno de lo siguiente:
a) R4 está sustituido con al menos un grupo -O-(alquilo b) Q no es un oxadiazol;
c) R3b no es -H;
d) R3c no es -H;
e) R1 no es un grupo 2-piridilo; o
f) R4 está sustituido con dos o más grupos -O-(alquilo C 2. El compuesto de la realización 1 o la sal farma cualquiera de los anteriores, o la mezcla de los mism sustituido con 1 o 2 sustituyentes R1a.
3. El compuesto de la realización 1 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, e -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo Cialogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -,-NH(alquilo C1-C6), -N(alquilo C1-C6)2, u oxo;
heteroarilo monocíclico o bicíclico con 5 a 10 miembros os de N, O o S, un grupo cicloalquilo C3-C8, o un grupo átomos seleccionados de N, O o S, en donde el grupo upo heterociclilo no están sustituidos o están sustituidos
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1--C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, --C6), -C(=O)N(alquilo C1-C6)2, -S(=O)2-(alquilo C1-C6), lo que contiene 1, 2 o 3 heteroátomos seleccionados de de 3 a 7 miembros que contiene 1,2 o 3 heteroátomos el grupo cicloalquilo Q puede estar sustituido con 1 erociclilo RQ puede no estar sustituido o estar sustituido e F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1--C6, -OH, -O-(alquilo C1-C6),-O-(halogenoalquilo C1-C6), 6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -lquilo C1-C6), o -C(=O)N(alquilo C1-C6)2;
lico, un grupo heteroarilo monocíclico o bicíclico con 5 a s independientemente seleccionados de N, O o S, o un ros en el anillo que contiene 1, 2, 3 o 4 heteroátomos el grupo arilo C6-C10, el grupo heteroarilo, o el grupo o 3 sustituyentes R4a;
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -ilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), --C6)2, y el grupo R4 heterociclilo puede estar además
es un grupo de fórmula -(CR3b=CR3c)-Q, entonces es
);
camente aceptable del mismo, el estereoisómero de n donde R1 es un piridilo no sustituido o es un piridilo
camente aceptable del mismo, el estereoisómero de onde R1 es un piridilo que tiene la fórmula
en donde el piridilo no está sustituido o está sustituido dibuja por encima de un enlace, indica el punto de unión o 2 sustituyentes R1a, y el símbolo >/ v w ' , cuando se resto de la molécula.
4. El compuesto de la realización 1 o la sal farmacé cualquiera de los anteriores, o la mezcla de los mismos, e amente aceptable del mismo, el estereoisómero de onde R1 es un piridilo que tiene la fórmula
en donde el piridilo no está sustituido o está sustituido co dibuja por encima de un enlace, indica el punto de unión d
5. El compuesto de la realización 1 o la sal farmacé cualquiera de los anteriores, o la mezcla de los mismos, e o 2 sustituyentes R1a, y el símbolo 'A /v v ' , cuando se esto de la molécula.
amente aceptable del mismo, el estereoisómero de onde R1 es un piridilo que tiene la fórmula
en donde el piridilo no está sustituido o está sustituido co dibuja por encima de un enlace, indica el punto de unión d 6. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl 7. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la selecciona independientemente de -CH3,-CH2CH3 ,
C(=O)NH(CH3), -C(=O)N(CH3)2, -C(=O)NH(CH2CH3), -OH OCH2C(CH3)2OH, -OCH2C(CF3)2OH, -OCH2CH2OCH3, -N o 2 sustituyentes R1a, y el símbolo %ÍWV' , cuando se esto de la molécula.
5 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde R1 es un piridilo no sustituido.
5 o la sal farmacéuticamente aceptable del mismo, el cla de los mismos, en donde R1a en cada caso se -Cl, -Br, -CN, -CF3 , -CH=CH2 , -C(=O)NH2 , -CH3 , -OCHF2 , -OCH2CH3 , -OCH2CF3 ,-OCH2CH2OH, --NHCH3 , -N(CH3)2, fenilo o un grupo de fórmula
8. El compuesto de la realización 1 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, e de un enlace, indica el punto de unión del resto de la
icamente aceptable del mismo, el estereoisómero de onde R1 se selecciona de
en donde el símbolo '■/v v v ' > cuando se dibuja por en molécula.
9. El compuesto de la realización 1 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, a de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de donde R1 se selecciona de
en donde el símbolo '■AA/V ' j cuando se dibuja por en molécula.
10. El compuesto de la realización 9 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, a de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de donde R1 se selecciona de
en donde el símbolo 'AAA/' > cuando se dibuja por en molécula.
11. El compuesto de la realización 9 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, a de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de donde R1 se selecciona de
en donde el símbolo '■/v v v ' , cuando se dibuja por enci molécula.
12. El compuesto de la realización 9 o la sal farmacé cualquiera de los anteriores, o la mezcla de los mismos, e de un enlace, indica el punto de unión del resto de la
camente aceptable del mismo, el estereoisómero de onde R1 se selecciona de
en donde el símbolo 'AAA/' > cuando se dibuja por enci molécula.
13. El compuesto de la realización 9 o la sal farmacé cualquiera de los anteriores, o la mezcla de los mismos, e de un enlace, indica el punto de unión del resto de la
camente aceptable del mismo, el estereoisómero de onde R1 se selecciona de
en donde el símbolo 'AAA/' > cuando se dibuja por enci molécula. 14. El compuesto de la realización 9 o la sal fa de cualquiera de los anteriores, o la mezcla de los mismos de un enlace, indica el punto de unión del resto de la acéuticamente aceptable del mismo, el estereoisómero n donde R1 se selecciona de
en donde el símbolo 'AAA/' > cuando se dibuja por enci molécula.
15. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl 16. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl 17. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la m pirimidinilo, isoxazolilo, indolilo, naftilo o piridinilo, cual sustituido con 1, 2 o 3 sustituyentes R4a.
18. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la selecciona independientemente de -CH3 , -F, -Cl, C(=O)OCH3, -C(=O)CH3, o -N(CH3)2.
de un enlace, indica el punto de unión del resto de la
14 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde R2 se selecciona de -H o -CH3.
15 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde R2 es -H.
16 o la sal farmacéuticamente aceptable del mismo, el la de los mismos, en donde R4 es un fenilo, piridilo, era de los cuales puede no estar sustituido o estar
17 o la sal farmacéuticamente aceptable del mismo, el cla de los mismos, en donde R4a en cada caso se Br, -CN, -CF3 , -OCH3 , -OCHF2 , -OCH2CH3 , -
19. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl 16 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde R4 se selecciona de
en donde el símbolo '■/v v v ' > cuando se dibuja por en molécula.
a de un enlace, indica el punto de unión del resto de la
20. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl o 2 sustituyentes R4a.
21. El compuesto de la realización 20 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, C2).
22. El compuesto de la realización 21 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, e
en donde el símbolo 'AAA/' , cuando se dibuja por enci molécula.
23. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl alquilo C1-C8 sustituido con 1 o 2 sustituyentes R3a.
24. El compuesto de la realización 23 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, e un grupo seleccionado de
16 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde R4 es un fenilo sustituido con 1
icamente aceptable del mismo, el estereoisómero de donde los sustituyentes R4a son grupos -O-(alquilo C1-
icamente aceptable del mismo, el estereoisómero de onde R4 es
de un enlace, indica el punto de unión del resto de la
22 o la sal farmacéuticamente aceptable del mismo, el e los mismos, R3 es un alquilo C1-C8 no sustituido o un
icamente aceptable del mismo, el estereoisómero de onde R3 se selecciona de, -CH3, -CH2CH3, -CH(CH3)2 o
en donde el símbolo 'AAA/' > cuando se dibuja por enci molécula.
25. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl 26. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezc de fórmula -(CR3bR3c)-Q, un grupo de fórmula -NH-(CR3b de fórmula -(CR3dR3e)-(CR3fR3g)-Q, un grupo de fórmula -donde el heterociclilo del -(heterociclil)-Q tiene de 5 a seleccionados de N, O o S y no está sustituido o está susti 27. El compuesto de la realización 26 o la sal farmac cualquiera de los anteriores, o la mezcla de los mis isoxazolilo, tiazolilo, imidazolilo, fenilo, tetrahidropirimi pirrolidinilo, pirazinilo, imidazo[1,2-a]piridinilo, pirazolilo sustituido o estar sustituido con 1,2 o 3, sustituyentes RQ.
28. El compuesto de la realización 26 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, de un enlace, indica el punto de unión del resto de la
23 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde R3a es -OH.
22 o la sal farmacéuticamente aceptable del mismo, el de los mismos, en donde R3 se selecciona de un grupo -Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un grupo 3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)-Q, en miembros de los cuales 1, 2 o 3 son heteroátomos o con 1,2 o 3 sustituyentes R3h.
icamente aceptable del mismo, el estereoisómero de , en donde Q se selecciona de pirimidinilo, piridilo, nilo, ciclopropilo, ciclobutilo, ciclohexilo, morfolinilo, oxetanilo, cualquiera de los cuales puede no estar
icamente aceptable del mismo, el estereoisómero de donde Q es un grupo heteroarilo monocíclico con 5 o 6
miembros en el anillo que contiene 1 o 2 heteroátomos sustituido con 1 o 2 sustituyentes RQ.
29. El compuesto de la realización 28 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, sustituido o está sustituido con 1 o 2 sustituyentes RQ.
30. El compuesto de una cualquiera de las realizaciones estereoisómero de cualquiera de los anteriores, o la mezcl eccionados de N, O o S y Q no está sustituido o está
icamente aceptable del mismo, el estereoisómero de donde Q es un grupo pirimidinilo o piridilo y Q no está
22 o la sal farmacéuticamente aceptable del mismo, el e los mismos, en donde Q se selecciona de
en donde el símbolo 'AAA/' , cuando se dibuja por enc molécula.
31. El compuesto de la realización 30 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, e de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de onde Q es
32. El compuesto de la realización 30 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, e de un enlace, indica el punto de unión del resto de la
uticamente aceptable del mismo, el estereoisómero de onde Q es
33. El compuesto de la realización 30 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, e de un enlace, indica el punto de unión del resto de la
uticamente aceptable del mismo, el estereoisómero de onde Q es
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
34. El compuesto de la realización 30 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
éuticamente aceptable del mismo, el estereoisómero de de Q es
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
35. El compuesto de la realización 30 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de Q es
en donde el símbolo ' /v v v ', cuando se dibuja por encima molécula.
36. El compuesto de la realización 30 o la sal farmacéut cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
mente aceptable del mismo, el estereoisómero de de Q es
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
37. El compuesto de la realización 30 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de Q es
en donde el símbolo 'AA/V', cuando se dibuja por enci molécula.
38. El compuesto de la realización 30 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de donde Q es
39. El compuesto de la realización 30 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de donde Q es
en donde el símbolo VÍUW', cuando se dibuja por enci molécula.
40. El compuesto de una cualquiera de las realizacion mismo, el estereoisómero de cualquiera de los anteriore fórmula -(CR3bR3c)-Q.
41. El compuesto de la realización 40 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, 42. El compuesto de una cualquiera de las realizacion mismo, el estereoisómero de cualquiera de los anteriore fórmula -NH-(CR3bR3c)-Q.
43. El compuesto de la realización 42 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, 44. El compuesto de una cualquiera de las realizacion mismo, el estereoisómero de cualquiera de los anteriore fórmula -(CR3bR3c)-C(=O)-Q.
45. El compuesto de la realización 44 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, 46. El compuesto de una cualquiera de las realizacion mismo, el estereoisómero de cualquiera de los anteriore fórmula -(CR3b=CR3c)-Q.
de un enlace, indica el punto de unión del resto de la
1-22 o 26-39 o la sal farmacéuticamente aceptable del o la mezcla de los mismos, en donde R3 es un grupo de
ticamente aceptable del mismo, el estereoisómero de donde uno de R3b y R3c es -H y el otro es -H o -CH3.
1-22 o 26-39 o la sal farmacéuticamente aceptable del o la mezcla de los mismos, en donde R3 es un grupo de
ticamente aceptable del mismo, el estereoisómero de donde uno de R3b y R3c es -H y el otro es -H o -CH3.
1-22 o 26-39 o la sal farmacéuticamente aceptable del o la mezcla de los mismos, en donde R3 es un grupo de
ticamente aceptable del mismo, el estereoisómero de donde uno de R3b y R3c es -H y el otro es -H o -CH3.
1-22 o 26-39 o la sal farmacéuticamente aceptable del o la mezcla de los mismos, en donde R3 es un grupo de
47. El compuesto de la realización 46 o la sal farma cualquiera de los anteriores, o la mezcla de los mismo de -H o -CH3.
48. El compuesto de una cualquiera de las realizacion mismo, el estereoisómero de cualquiera de los anteriore fórmula -(heterociclil)-Q, en donde el heterociclilo del -(h son heteroátomos seleccionados de N, O o S y no está s
49. El compuesto de la realización 48 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, ticamente aceptable del mismo, el estereoisómero de en donde R3b y R3c se seleccionan independientemente
1-22 o 26-39 o la sal farmacéuticamente aceptable del o la mezcla de los mismos, en donde R3 es un grupo de rociclil)-Q tiene de 5 a 7 miembros de os cuales 1, 2 o 3 ituido o está sustituido con 1,2 o 3 sustituyentes R3h.
ticamente aceptable del mismo, el estereoisómero de donde R3 es un grupo de fórmula
en donde el símbolo v /w u ', cuando se dibuja por enc molécula.
50. El compuesto de una cualquiera de las realizacion mismo, el estereoisómero de cualquiera de los anteriore fórmula -(CR3dR3eHCR3fR3g)-Q.
51. El compuesto de la realización 50 o la sal farma cualquiera de los anteriores, o la mezcla de los mismos, a de un enlace, indica el punto de unión del resto de la
1-22 o 26-39 o la sal farmacéuticamente aceptable del o la mezcla de los mismos, en donde R3 es un grupo de
ticamente aceptable del mismo, el estereoisómero de donde R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por enci molécula.
de un enlace, indica el punto de unión del resto de la
52. El compuesto de la realización 51 o la sal farmacéu cualquiera de los anteriores, o la mezcla de los mismos, en mente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
53. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
54. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
éuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo 'AA/V', cuando se dibuja por encima molécula.
55. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
56. El compuesto de la realización 52 o la sal farmacéu cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
mente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo 'AA/V\ cuando se dibuja por encima molécula.
57. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
58. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
éuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo 'AA/V', cuando se dibuja por encima molécula.
59. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
60. El compuesto de la realización 52 o la sal farmacé cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
amente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima molécula.
61. El compuesto de la realización 52 o la sal far cualquiera de los anteriores, o la mezcla de los mismos, en d un enlace, indica el punto de unión del resto de la
céuticamente aceptable del mismo, el estereoisómero de de R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por en molécula.
62. El compuesto de la realización 52 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de onde R3 tiene la fórmula
en donde el símbolo 'AA/V', cuando se dibuja por en molécula.
63. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-pi^idinil)-4H butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(3 -p ir id in i l) -4 H -1 ,2 ,4 - t r p ro p a n o s u lfo n a m id a ;
de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de onde el compuesto es
,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-
etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-
-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-
-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
l-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida;
iridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-
-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
-3 - i l) -1 -m e to x i-1 -(5 -m e t i l- 2 -p ira z in i l) -2 -
(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e t i l-2 -p ir id in i l ) -4 H p ro p a n o s u lfo n a m id a ;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-p 2-propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida; o
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
64. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida.
65. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida.
66. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
67. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
68. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos,
(1 S ,2 R )-1 -(5 -c lo ro -2 -p ir im id in i l) -N -(4 -(2 ,6 -d im e to x ife n il) -p ro p a n o s u lfo n a m id a .
4 - t r ia z o l-3 - i l) -1 -h id ro x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 -
-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2-
4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida; -3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-
-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-
4-triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2-
l-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida;
4-triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-
il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-
piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-
-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
e t i l- 3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -
69. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
70. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
71. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida.
72. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t 73. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida.
74. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
75. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida.
76. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H propanosulfonamida.
77. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida.
78. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
79. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H 80. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos,
(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(3 -p ir id in il) -4 H -1 ,2 ,4 - t r p ro p a n o s u lfo n a m id a .
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida.
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida. icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l-3 - il) -1 -e to x i-1 -(5 - f lu o ro -2 -p ir im id in i l) -2 -
81. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
82. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
83. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida.
84. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
85. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t 86. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
87. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-p 2-propanosulfonamida.
88. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida.
89. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida.
90. El compuesto de la realización 1 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos, (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(2-metoxi-4-piridinil)-butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(2-metil-4-piridinil)-4H butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxi-3-piridinil)-butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H butanosulfonamida;
(1 R ,2 S )-1 -(5 -c lo ro -2 -p ir im id in i l) -N -(4 -(2 ,6 -d im e to x ife n il) -p ro p a n o s u lfo n a m id a ;
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
-triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida.
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
-triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
l)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
icamente aceptable del mismo, el estereoisómero de onde el compuesto es
2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
e t i l- 2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -
(1 S ,2 R )-1 -(5 -c lo ro -2 -p ir im id in i l) -N -(4 -(2 ,6 -d im e to x ife n il) -p ro p a n o s u lfo n a m id a ;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metil-2-piri propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-propanosulfonamida;
(1 S,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-propanosulfonamida;
(1 S,2S)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-propanosulfonamida;
(1 R,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-butanosulfonamida;
N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-tri pirimidinil)etanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-triaz (2S)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-triaz 2-(2-ciano-4-fluorofenil)-N-(4-(4,6-dimetoxi-5-pirimidinil)-(1 R,2R)-1 -ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metox propanosulfonamida;
(1 S,2S)-1 -ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metox propanosulfonamida;
(1 R,2R)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi propanosulfonamida;
(1 S,2S)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi e t i l- 2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -
4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-
il)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-2,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-3-il)-2-((6S)-3,6-dimetil-2-oxotetrahidro-1 (2H)-l)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida;
l)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida;
metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)etanosulfonamida; iridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-ridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-idinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-
idinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-
propanosulfonamida;
( 2 R ,3 S ) -N -(4 -(4 ,6 -d im e to x i-5 -p ir im id in i l ) -5 -(5 -m e t i l- 3 -p ir i b u ta n o s u lfo n a m id a ;
(2R,3S)-3-(5-fluoro-2-pirimidinil)-N-(5-(6-metoxi-2-piridin butanosulfonamida;
(2S,3R)-3-(5-fluoro-2-pirimidinil)-N-(5-(6-metoxi-2-piridin butanosulfonamida;
(1 R,2S)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi propanosulfonamida;
(1 S,2R)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pentanosulfonamida;
(2S,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pentanosulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pentanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pentanosulfonamida;
(1 R,2S)-1 -ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-meto propanosulfonamida;
(1 S,2R)-1 -ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-meto propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4 butanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4 butanosulfonamida;
(2S,3R)-N-(5-(6-cloro-2-piridinil)-4-(2,6-dimetoxifenil)-4 butanosulfonamida;
(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(5-metil-3-piri butanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(1-oxido-6-fenil-2-piri butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-fenil-2-piridinil)-4H butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -is o x a z o lil) e ta n o s u lfo n a m id a ;
-4 H -1 ,2 ,4 - tr ia z o l-3 - i l) -3 -(5 - f lu o ro -2 -p ir im id in i l) -2 -1 -metil-1 H-indol-3-il)-4H-1,2,4-triazol-3-il)-2-1 -metil-1 H-indol-3-il)-4H-1,2,4-triazol-3-il)-2-idinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-idinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
t r ia z o l-3 - i l ) -2 -h id ro x i-2 -(5 -m e t i l- 3 -
(2 R ) -N -(4 -(2 ,6 -d im e to x ife n i l) -5 -(6 -m e to x i-2 -p ir id in i l) -m e to x ie ta n o s u lfo n a m id a ;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-metoxietanosulfonamida;
(1 R,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(1 S,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-hidroxietanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-hidroxietanosulfonamida;
(2R)-2-(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-hidroxietanosulfonamida;
(2S)-2-(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-hidroxietanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-isoxazolil)etanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-isoxazolil)etanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pirimidinil)etanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pirimidinil)etanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-isoxazolil)etanosulfonamida;
(1 S,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(1 S,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxif 2 ,4 - t r ia z o l-3 - i l) -2 -(5 - f lu o ro -2 -p ir id in i l) -2 -2,4-triazol-3-il)-2-(5-fluoro-2-piridinil)-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-2,4-triazol-3-il)-2-(5-fluoro-2-piridinil)-2-2,4-triazol-3-il)-2-(5-fluoro-2-piridinil)-2-etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-2,4-triazol-3-il)-2-hidroxi-2-(3-metil-5-2,4-triazol-3-il)-2-hidroxi-2-(3-metil-5-2,4-triazol-3-il)-2-hidroxi-2-(5-metil-2-2,4-triazol-3-il)-2-hidroxi-2-(5-metil-2-2,4-triazol-3-il)-2-hidroxi-2-(5-metil-3--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
propanosulfonamida;
(1 S ,2 S )-1 -(4 -c ia n o -2 - f lu o ro fe n il) -N -(4 -(2 ,6 -d im e to x ife p ro p a n o s u lfo n a m id a ;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H hidroxietanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H hidroxietanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr (2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(2-metil-3-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(2-metil-3-piridinil)-4H propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-3-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-3-piridinil)-4H propanosulfonamida;
2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-(2S)-N-(4-(2,6-dimetoxifenil)-5-(4-metil-3-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(4-metil-3-piridinil)-4H propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H propanosulfonamida;
N-(5-(5-cloro-3-piridinil)-4-(2,6-dimetoxifenil)-4H-1,2, (2S)-N-(5-(5-cloro-3-piridinil)-4-(2,6-dimetoxifenil)-4H propanosulfonamida;
(2R)-N-(5-(5-cloro-3-piridinil)-4-(2,6-dimetoxifenil)-4H propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(4-metil-2-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(4-metil-2-piridinil)-4H propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-fluoro-3-piridinil)-4 propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-fluoro-3-piridinil)-4 propanosulfonamida;
(2 S ,3 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ir id in i l) b u ta n o s u lfo n a m id a ;
-(5 -m e t i l- 3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -
-triazol-3-il)-2-(5-fluoro-2-piridinil)-2--triazol-3-il)-2-(5-fluoro-2-piridinil)-2--3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida; -3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida; -triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--3-piridinil)-4H-1,2,4-triazol-3-il)etanosulfonamida;
-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-zol-3-il)-2-(2-ciano-4-fluorofenil)etanosulfonamida;
4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
,2 ,4 - t r ia z o l-3 - i l) -3 -(5 - f lu o ro -2 -p ir im id in i l) -2 -( 2 R ,3 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ir id in i l) -4 H b u ta n o s u lfo n a m id a ;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida;
(2S,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida;
(1 R,2S)-1 -(4-cianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-me propanosulfonamida;
(1 S,2R)-1 -(4-cianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-me propanosulfonamida;
(1 R,2S)-1 -(4-cianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-me propanosulfonamida;
(1 S,2S)-1 -(4-cianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-me propanosulfonamida;
(1 S,2R)-1 -(4-cianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-me propanosulfonamida;
(1 R,2R)-1 -(4-cianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-me propanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t 6-(4-(2,6-dimetoxifenil)-5-((((1S)-2-(5-fluoro-2-pirimidinil) piridinacarboxamida;
6-(4-(2,6-dimetoxifenil)-5-((((1 R)-2-(5-fluoro-2-pirimidinil) piridinacarboxamida;
6-(4-(2,6-dimetoxifenil)-5-((((1S)-2-(5-fluoro-2-pirimidinil) piridinacarboxamida;
6-(4-(2,6-dimetoxifenil)-5-((((1 R)-2-(5-fluoro-2-pirimidinil) 2-piridinacarboxamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(2,2,2-trifluoroetoxi butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(2-hidroxietoxi)-2-p butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(2,2,2-trifluoroetoxi pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(2-hidroxietoxi)-2-p 2- propanosulfonamida;
(1 R,2S)-1 -(6-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 S,2R)-1 -(6-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(2-hidroxi-2-metilpr pirimidinil)-2-butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(2-hidroxi-2-metilpr pirimidinil)-2-propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(3,3,3-trifluoro-2-hi 3- (5-fluoro-2-pirimidinil)-2-butanosulfonamida;
4 - t r ia z o l-3 - i l) -3 -(5 - f lu o ro -2 -p ir im id in i l) -2 -
4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-l-3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida;
l-3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida;
etiletil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N-etil-2-etiletil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N-etil-2-etiletil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N,N-dimetil-2-etiletil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N,N-dimetil-
iridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-il)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-
dinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-dinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-i)-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-i)-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metil-2-
-2-(trifluorometil)propoxi)-2-piridinil)-4H-1,2,4-triazol-3-il)-(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -(m e t i la m in o ) -2 -p ir i p ro p a n o s u lfo n a m id a ;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(2-metoxietoxi)-2-p 2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(dimetilamino)-2-pi 2-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-3-pirid (1 R,2S)-1 -metoxi-N-(5-(6-metoxi-2-piridinil)-4-fenil-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-p 2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-bis([2H3])metiloxi)fenil)-5-(6-metoxipiri il)propano-2-sulfonamida;
(1 R,2S)-N-(4-(2,6-bis(2H3])metiloxi)fenil)-5-(6-(2H3]meto metilpirimidin-2-il)propano-2-sulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(2H3]metoxi)-2-piri il)propano-2-sulfonamida;
(1 R,2S)-N-(4-(3,5-bis(trifluorometil)fenil)-5-(6-metoxi-2-p 2-propanosulfonamida;
(1 R,2S)-1-metoxi-N-(4-(2-metoxi-5-metilfenil)-5-(6-meto propanosulfonamida;
(1 R,2S)-N-(4-(2,6-bis(difluorometoxi)fenil)-5-(6-metoxi-2 pirimidinil)-2-propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(5-(6-metoxi-2-piridinil)-4-(4-piridinil propanosulfonamida;
(1 R,2S)-N-(4-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-piridi propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, (1S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, 4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-1 -(5 -m e t i l -2 -p ir im id in i l) -2 -
il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2--triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2-,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2-,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2--triazol-3-il)etanosulfonamida;
-triazol-3-il)etanosulfonamida;
H-1,2,4-triazol-3-il)etanosulfonamida;
riazol-3-il)-1 -(5-metil-2-pirimidinil)-2-l)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)--il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirimidin-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1 -(5-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirimidin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-iridinil)-4H-1,2,4-triazol-3-il)-1-(5-metil-2-pirimidinil)-2-inil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-1,2,4-triazol-3-il)-1-(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2--3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2-iazol-3-il)-1-(5-metil-2-pirimidinil)etanosulfonamida;
azol-3-il)-1-(5-metil-2-pirimidinil)etanosulfonamida;
(2 R )-N -(4 -(2 ,6 -d im e to x ife n i l) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -p ro p a n o s u lfo n a m id a ;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-propanosulfonamida;
(1 R,2S)-N-(4-(4-clorofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(4-(4-metoxifenil)-5-(6-metoxi-2-piri propanosulfonamida;
(1 R,2S)-N-(4-(3-fluorofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 R,2S)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-N-(5-(6-metoxi-(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(4-(2-metoxifenil)-5-(6-metoxi-2-piri propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(5-(6-metoxi-2-piridinil)-4-(2-naftale propanosulfonamida;
3-(3-((((1S,2R)-2-metoxi-1-metil-2-(5-metil-2-pirimidinil) il)benzoato de metilo;
(1 R,2S)-N-(4-(3-cloro-2-metilfenil)-5-(6-metoxi-2-piridinil propanosulfonamida;
(1 R,2S)-N-(4-(3-cianofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-1 -metoxi-1 -(5-metoxi-2-pirimidinil)-N-(5-(5-metil propanosulfonamida;
(1 R,2S)-N-(4-(3-bromofenil)-5-(6-metoxi-2-piridinil)-4H-propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(5-(6-metoxi-2-piridinil)-4-(2-metilfe propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(5-(6-metoxi-2-piridinil)-4-(3-metilfe propanosulfonamida;
(1 R,2S)-N-(4-(4-fluoro-3-(trifluorometil)fenil)-5-(6-metoxi pirimidinil)-2-propanosulfonamida;
(1 R ,2 S )-1 -m e to x i-N -(4 -(3 -m e to x ife n i l) -5 -(6 -m e to x i-2 -p ir i p ro p a n o s u lfo n a m id a ;
t r ia z o l-3 - i l) -1 -oxo -1 -(1 - p ir ro lid in il) -2 -triazol-3-il)-1 -oxo-1 -(1 -pirrolidinil)-2-azol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-iazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-,4-triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirimidinil)-2--triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-inil)-4-fenil-4H-1,2,4-triazol-3-il)-2-propanosulfonamida; -3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2--3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-lfonil)amino)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-4-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-iazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirimidinil)-2--3-il)-1 -metoxi-1 -(5-metoxi-2-pirimidinil)-2-idinil)-4-fenil-4H-1,2,4-triazol-3-il)-2-riazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-idinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-
4 H -1 ,2 ,4 - tr ia z o l-3 - i l) -1 -(5 -m e t il- 2 -p ir im id in i l) -2 -(1 R,2S)-N-(4-(4-fluorofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(3-clorofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(2-cloro-4-fluorofenil)-5-(6-metoxi-2-piridini propanosulfonamida;
(1 R,2S)-N-(4-(3,5-diclorofenil)-5-(6-metoxi-2-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2-clorofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(2,3-dimetilfenil)-5-(6-metoxi-2-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(3,4-difluorofenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(3-acetilfenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(2,6-diclorofenil)-5-(6-metoxi-2-piridinil)-4H propanosulfonamida;
(1 R,2S)-1-metoxi-N-(5-(6-metoxi-2-piridinil)-4-(2-(trifluor propanosulfonamida;
(1 R,2S)-1-metoxi-N-(5-(6-metoxi-2-piridinil)-4-(3-(trifluor propanosulfonamida;
(1 R,2S)-N-(4-(2-fluorofenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida;
(1 R,2S)-N-(4-(4-(dimetilamino)fenil)-5-(6-metoxi-2-piridi propanosulfonamida;
(2S,3R)-3-(5-fluoro-2-pirimidinil)-N-(5-(6-metoxi-2-piridin (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-tri (1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 p ro p a n o s u lfo n a m id a ;
azol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-zol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-zol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-azol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-l)fenil)-4H-1,2,4-triazol-3-il)-1-(5-metil-2-pirimidinil)-2-l)fenil)-4H-1,2,4-triazol-3-il)-1-(5-metil-2-pirimidinil)-2-azol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-enil-4H-1,2,4-triazol-3-il)-2-butanosulfonamida;
-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2--il)-N'-((1S)-1-(5-fluoro-2-pirimidinil)etil)sulfamida;
-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metil-2-pirimidinil)-2--triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metil-2-pirimidinil)-2--triazol-3-il)-1-(2-metoxietoxi)-1-(5-metil-2-pirimidinil)-2--triazol-3-il)-1-(2-metoxietoxi)-1-(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -(2-metoxietoxi)-N-metil-1 -(5-metil-2--triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-
,4 - t r ia z o l-3 - i l) -1 -e to x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 -(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 p ro p a n o s u lfo n a m id a ;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(15.25) -N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 pirimidinil)-2-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(15.25) -N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxi-2-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxi-3-piridinil)-4H-1 propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxi-3-piridinil)-4H-1 ,4 - t r ia z o l-3 - i l) -1 -e to x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 --triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metil-2-pirimidinil)-2--3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2--3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metil-2-4-triazol-3-il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metil-2--triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1-(2-metoxietoxi)-1-(5-metil-2-pirimidinil)-2-2,4-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metil-2-pirimidinil)-2,4-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metil-2-pirimidinil)-4-triazol-3-il)-1-(((2S)-2-hidroxipropil)oxi)-1-(5-metil-2-4-triazol-3-il)-1-(((2R)-2-hidroxipropil)oxi)-1-(5-metil-2-4-triazol-3-il)-1-(((2R)-2-hidroxipropil)oxi)-1-(5-metil-2-4-triazol-3-il)-1-(((2S)-2-hidroxipropil)oxi)-1-(5-metil-2-4-triazol-3-il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metil-2-4-triazol-3-il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metil-2--triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
propanosulfonamida;
( 2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 p ro p a n o s u lfo n a m id a ;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(2-metil-4-piridinil)-4H-propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(2-metil-4-piridinil)-4H-propanosulfonamida;
(2R)-N-(5-(5-bromo-3-piridinil)-4-(2,6-dimetoxifenil)-4 propanosulfonamida;
(2S)-N-(5-(5-bromo-3-piridinil)-4-(2,6-dimetoxifenil)-4 propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-propanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridini butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridini butanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-etenil-3-piridinil)-4H propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-etenil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(2-metoxi-4-piridinil)-4 propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(2-metoxi-4-piridinil)-4 propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-(trifluorometil)-3-piri propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-(trifluorometil)-3-piri propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(3-metoxi-2-piridinil)-4 propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(3-metoxi-2-piridinil)-4 propanosulfonamida;
(2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -e to x i-2 -p ir id in i l) -4 H -p ro p a n o s u lfo n a m id a ;
,4 - t r ia z o l-3 - i l ) -1 -(5 - f lu o ro -2 -p ir im id in i l) -2 -,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-1,2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-1,2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -hidroxi-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
- t r ia z o l-3 - i l) -1 -(5 - f lu o ro -2 -p ir im id in i l) -2 -
( 2 R ) -N -(4 -(2 ,6 -d im e to x ife n i l) -5 -(6 -e to x i-2 -p ir id in i l) -4 H -1 , p ro p a n o s u lfo n a m id a ;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(4-metoxi-2-piridinil)-4H-propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(4-metoxi-2-piridinil)-4H-propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2, (2R)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2, 6-(4-(2,6-dimetoxifenil)-5-((((1S)-2-(5-fluoro-2-pirimidinil piridinacarboxamida;
6-(4-(2,6-dimetoxifenil)-5-((((1 R)-2-(5-fluoro-2-pirimidini piridinacarboxamida;
(2S)-N-(5-(6-ciano-2-piridinil)-4-(2,6-dimetoxifenil)-4H-1 propanosulfonamida;
(2R)-N-(5-(6-ciano-2-piridinil)-4-(2,6-dimetoxifenil)-4H-1 propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxi-2-piridinil)-4H-propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxi-2-piridinil)-4H-propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-etil-2-piridinil)-4H-1,2, (2R)-N-(4-(2,6-dimetoxifenil)-5-(6-etil-2-piridinil)-4H-1,2, (2S)-N-(5-(6-(1-azetidinilcarbonil)-2-piridinil)-4-(2,6-dim propanosulfonamida;
(2R)-N-(5-(6-(1-azetidinilcarbonil)-2-piridinil)-4-(2,6-dim propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxi-2-piridinil)-4 butanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-etil-2-piridinil)-4H-butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-etil-2-piridinil)-4H-butanosulfonamida;
6-(4-(2,6-dimetoxifenil)-5-((((1 R,2S)-2-(5-fluoro-2-pirimi metil-2-piridinacarboxamida;
6-(4-(2,6-dimetoxifenil)-5-((((1S,2R)-2-(5-fluoro-2-pirimi metil-2-piridinacarboxamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-oxo-1,6-dihidro-2-butanosulfonamida;
(2S)-N-(5-(6-(difluorometoxi)-2-piridinil)-4-(2,6-dimetoxif propanosulfonamida;
(2R)-N-(5-(6-(difluorometoxi)-2-piridinil)-4-(2,6-dimetoxi propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-etil-2-piridinil)-4H-propanosulfonamida;
(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -e t i l- 2 -p ir id in i l) -4 H -p ro p a n o s u lfo n a m id a ;
ia z o l-3 - i l) -1 -(5 - f lu o ro -2 -p ir im id in i l) -2 -
triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida; ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida; etiletil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N-metil-2-etiletil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N-metil-2-iazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-riazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida; ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida; nil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
nil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-
triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--metilpropil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N-
-metilpropil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-N-
il)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
t r ia z o l-3 - i l ) -1 -h id ro x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 -
( 2 S ,3 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -e t i l -2 -p ir id in i l) -4 H -1 (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-4-metil-2-pi butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxi-2-piridinil)-4H butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-4-metil-2-pi butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-4-metil-2-pi 2-propanosulfonamida;
(2S)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida;
(2R)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida;
N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-tri pirimidinil)etanosulfonamida;
2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-me 2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-ox il)etanosulfonamida;
(3R,5R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-piperidinasulfonamida;
(35.55) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) piperidinasulfonamida;
(3R,5R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H piperidinasulfonamida;
(35.55) -N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 piperidinasulfonamida;
(3S,5R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-piperidinasulfonamida;
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-piperidinasulfonamida;
(3S,5R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H piperidinasulfonamida;
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H piperidinasulfonamida;
(3S,5R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H piperidinasulfonamida;
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H piperidinasulfonamida;
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 propanosulfonamida;
(1 S,2R)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 propanosulfonamida;
(1 S,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 propanosulfonamida;
(1 R ,2 R )-1 -(2 ,4 -d ic ia n o fe n il) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 p ro p a n o s u lfo n a m id a ;
t r ia z o l-3 - i l) -3 -(5 -m e t i l- 2 -p ir im id in i l) -2 -b u ta n o s u lfo n a m id a ; )-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--triazol-3-il)-3-(5-metil-2-pirimidinil)-2-)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2--il)-2-((6R)-3,6-dimetil-2-oxotetrahidro-1 (2H)--piridinil)-4H-1,2,4-triazol-3-il)etanosulfonamida;
dihidro-2-piridinil)-4H-1,2,4-triazol-3-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -(1 R ,2 S )-1 -(2 ,4 -d ic ia n o fe n il) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -p ro p a n o s u lfo n a m id a ;
(1 S,2R)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida;
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida;
(2S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirazinil)etanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirazinil)etanosulfonamida;
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif metoxietanosulfonamida;
(2S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif metoxietanosulfonamida;
(2S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida;
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida;
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-t (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirimidinil)etanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirimidinil)etanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2E)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2 sulfonamida;
(lS,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2E)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 sulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2 S ,3 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ir id in i l) -4 H - 3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -
-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-triazol-3-il)-2-hidroxi-2-(5-metil-2-triazol-3-il)-2-hidroxi-2-(5-metil-2-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2--(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-l-3-il)metanosulfonamida;
,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-triazol-3-il)-2-hidroxi-2-(2-metil-5-triazol-3-il)-2-hidroxi-2-(2-metil-5-,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-azol-3-il)-3-(5-fluoro-2-pirimidinil)-2-buteno-2-,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-buteno-2-,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-
- t r ia z o l-3 - i l) -3 -(5 -m e t i l- 2 -p ira z in i l) -2 -b u ta n o s u lfo n a m id a ;
( 2 S ,3 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 b u ta n o s u lfo n a m id a ;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(15.25) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) 2-propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(15.25) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) 2-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(2S)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-hidroxietanosulfonamida;
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-hidroxietanosulfonamida;
(2S)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-metoxietanosulfonamida;
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-metoxietanosulfonamida;
(2S,3R)-N-(4-(2,4-dimetoxi-3-piridinil)-5-(6-metoxi-2-piri butanosulfonamida;
(2S,3R)-3-(5-fluoro-2-pirimidinil)-N-(4-(4-metoxi-2-oxo-1, il)-2-butanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(2R,3S)-3-(5-ciano-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida;
(2S,3R)-3-(5-ciano-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H 2 ,4 - t r ia z o l-3 - i l) -3 -(5 -m e t i l-2 -p ira z in i l ) -2 -,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-2,4-triazol-3-il)-1-hidroxi-1-(3-metoxi-5-metil-2-pirazinil)-,2,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-,2,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-2,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-idro-3-piridinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-dinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-dinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-fluoro-2-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-fluoro-2--triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 S ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in p ro p a n o s u lfo n a m id a ;
2-(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(6-m (1 S,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2S)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2S)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxife propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxife propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxife propanosulfonamida;
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxife propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxife propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxife propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridin propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridin propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridin propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridin propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil) propanosulfonamida;
(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(3 -p ir id in il) -4 H -1 ,2 p ro p a n o s u lfo n a m id a ;
-1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 -
2-piridinil)-4H-1,2,4-triazol-3-il)etanosulfonamida;
-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2--1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-
z o l-3 - il) -1 -m e to x i-1 -(5 -m e t i l- 2 -p ira z in i l) -2 -(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) p ro p a n o s u lfo n a m id a ;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil propanosulfonamida;
(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(3 -p ir id in il) -4 H -1 ,2 ,4 p ro p a n o s u lfo n a m id a ;
-1 ,2 ,4 - t r ia z o l-3 - i l) -1 -h id ro x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 -
zol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida; zol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida; -1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2--1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-zol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-zol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-zol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-zol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
z o l-3 - il) -1 -h id ro x i-1 -(5 -m e t il- 2 -p ir im id in i l) -2 -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -1 ,2 , (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(2-metoxi-4-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(2-metil-4-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxi-3-piridinil) propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(4-piridinil)-4H-1,2,4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-oxetanil)etanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-oxetanil)etanosulfonamida;
(2R)-2-ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-pi (2S)-2-ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-pi (1 S,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metox propanosulfonamida;
(1 R,2R)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-meto propanosulfonamida;
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-meto propanosulfonamida;
(1 S,2R)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-meto propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pirimidinil)etanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H pirimidinil)etanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 butanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-butanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2, (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) propanosulfonamida;
N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e t i l- 2 -p ir id in i l) -4 H -1 ,2 ,4 z o l-3 - i l) -2 -p ro p a n o s u lfo n a m id a ;
,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
ol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1 -metoxi-1 -(2-pirimidinil)-2-triazol-3-il)-2-hidroxi-2-(3-metil-3-triazol-3-il)-2-hidroxi-2-(3-metil-3-
l)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida;
l)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida;
iridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
iridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-iridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
4-triazol-3-il)-2-metoxi-2-(5-metil-2-4-triazol-3-il)-2-metoxi-2-(5-metil-2-,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-zol-3-il)etanosulfonamida;
,2,4-triazol-3-il)-1 -hidroxi-1 -imidazo[1,2-a]piridin-2-il-2-,2,4-triazol-3-il)-1 -hidroxi-1 -imidazo[1,2-a]piridin-2-il-2-
l-3 - i l)e ta n o s u lfo n a m id a ;
(2 R ) -N -(4 -(2 ,6 -d im e to x ife n i l) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -ile ta n o s u lfo n a m id a ;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-iletanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(2R)-1-(5-fluoro-2-pirimidinil)-N-(4-(2-metoxifenil)-5-(6-(2S)-1-(5-fluoro-2-pirimidinil)-N-(4-(2-metoxifenil)-5-(6-m (2R)-N-(4-(3,5-dimetil-4-isoxazolil)-5-(6-metoxi-2-piridini propanosulfonamida;
(2S)-N-(4-(3,5-dimetil-4-isoxazolil)-5-(6-metoxi-2-piridinil propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(5-(6-metoxi-2-piridinil)-4-(3-piridinil propanosulfonamida;
(1 S,2S)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 propanosulfonamida;
(1 R,2S)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 S,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 R,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-hidroxi-2-propanosulfonamida;
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(2R)-2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi (2S)-2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 S ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 p ro p a n o s u lfo n a m id a ;
t r ia z o l-3 - i l) -2 -h id ro x i-2 - im id a z o [1 ,2 -a ]p ir id in -2 -
triazol-3-il)-2-hidroxi-2-imidazo[1,2-a]piridin-2-,4-triazol-3-il)-1 -hidroxi-1 -(1 -metil-1 H-imidazol-4-il)-2-
,4-triazol-3-il)-1 -hidroxi-1 -(1 -metil-1 H-imidazol-4-il)-2-,4-triazol-3-il)-1 -hidroxi-1 -(1 -metil-1 H-imidazol-4-il)-2-
,4-triazol-3-il)-1 -hidroxi-1 -(1 -metil-1 H-imidazol-4-il)-2-,4-triazol-3-il)-1 -(1,5-dimetil-1 H-pirazol-3-il)-1 -hidroxi-2-,4-triazol-3-il)-1 -(1,5-dimetil-1 H-pirazol-3-il)-1 -hidroxi-2-
-2-piridinil)-4H-1,2,4-triazol-3-il)-2-propanosulfonamida; -2-piridinil)-4H-1,2,4-triazol-3-il)-2-propanosulfonamida; 1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-1,2,4-triazol-3-il)-1-(5-metil-2-pirimidinil)-2-
xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-
xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-oxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidroxi-
idinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida;
idinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida;
,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxi-2-,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxi-2-,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxi-2-
,4 - t r ia z o l-3 - i l) -1 -(4 - f lu o ro fe n il) -1 -h id ro x i-2 -
(2 R ) -N -(4 -(2 ,6 -d im e to x ife n i l) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -m e to x ie ta n o s u lfo n a m id a ;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-metoxietanosulfonamida;
(2R)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-( metoxietanosulfonamida;
(2S)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-( metoxietanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-hidroxietanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-hidroxietanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida;
(1 R,2S)-1 -(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(1 S,2R)-1 -(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ir id in i l) -4 H p ro p a n o s u lfo n a m id a ;
t r ia z o l-3 - i l) -2 -(4 - f lu o ro -2 -(m e t i ls u lfo n il) fe n il) -2 -
triazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-triazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-triazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-triazol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida; riazol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida;
,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidroxi-,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidroximetil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida;
-triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida; -triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -hidroxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -hidroxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -metoxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -metoxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -metoxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -metoxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -hidroxi-2--triazol-3-il)-1 -(4,5-dimetil-1,3-tiazol-2-il)-1 -hidroxi-2--triazol-3-il)-1 -hidroxi-1 -(5-metoxi-2-pirazinil)-2--triazol-3-il)-1 -hidroxi-1 -(5-metoxi-2-pirazinil)-2-
- t r ia z o l-3 - i l) -1 -h id ro x i-1 -(5 -m e to x i-2 -p ira z in i l) -2 -
(1 S ,2 S )-N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ir id in i l) -4 H p ro p a n o s u lfo n a m id a ;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida;
4-(3-cloro-2,6-dimetoxifenil)-N-(2-(4-clorofenil)etil)-5-(5-(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, (2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, 91. En otra realización, la invención proporciona farmacéuticamente aceptable del mismo, el estereois mismos, en donde el compuesto es
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida;
(1 S ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l-3 -p ir id in i l ) -4 H p ro p a n o s u lfo n a m id a ;
- t r ia z o l-3 - i l) -1 -h id ro x i-1 -(5 -m e to x i-2 -p ira z in i l) -2 -
-triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2-
-triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2-
iridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-
,4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-
2,4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -metoxi-1 -(5-fenil-2-pirimidinil)-2-
etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-
-piridinil)-4H-1,2,4-triazole-3-sulfonamida;
azol-3-il)-2-metil-3-fenilpropanamida; o
azol-3-il)-2-metil-3-fenilpropanamida.
e los compuestos citados a continuación o la sal o de cualquiera de los anteriores, o la mezcla de los
-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1 -metoxi-1 -(4-metil-1,3-tiazol-2-il)-2-
-triazol-3-il)-1 -metoxi-1 -(4-metil-1,3-tiazol-2-il)-2-
-triazol-3-il)-N-metil-3-(5-metilpirimidin-2-il)butano-2-
- t r ia z o l-3 - i l) -1 -m e to x i-1 -(5 -m e t i l- 1 ,3 -o x a z o l-2 - i l) -2 -(1 R ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l-3 -p ir id in i l ) -4 H -1 p ro p a n o s u lfo n a m id a ;
(1 R,2S)-N-(4-(2,4-dimetoxi-3-piridinil)-5-(6-metoxi-2-piridi propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(2-metoxietoxi)-2-piri butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(3,3,3-trifluoro-2-hidr 3-(4-((2R)-1,4-dioxan-2-il)-5-fluoro-2-pirimidinil)-2-butanos (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(3,3,3-trifluoro-2-hidr 3-(4-((2S)-1,4-dioxan-2-il)-5-fluoro-2-pirimidinil)-2-butanos (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-(metilamino)-2-piridi sulfonamida;
(1 R,2S)-1 -(5-bromo-6-metil-2-piridinil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(1 S,2R)-1 -(5-bromo-6-metil-2-piridinil)-N-(4-(2,6-dimetoxif propanosulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-pirano-3-sulfonamida;
(25.35) -N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H 3-sulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-3-sulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-3-sulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-butanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 butanosulfonamida;
(25.35) -N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H pirano-3-sulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H pirano-3-sulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H pirano-3-sulfonamida;
(25.35) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pirano-3-sulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H butanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H t r ia z o l-3 - i l) -1 -m e to x i-1 -(5 -m e t i l- 1 ,3 -o x a z o l-2 - i l) -2 -
-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
triazol-3-il)-1 -metoxi-1 -(1 -metil-1 H-1,2,4-triazol-5-il)-2-
triazol-3-il)-1 -metoxi-1 -(1 -metil-1 H-1,2,4-triazol-5-il)-2-
-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-
-(trifluorometil)propoxi)-2-piridinil)-4H-1,2,4-triazol-3-il)-amida;
-(trifluorometil)propoxi)-2-piridinil)-4H-1,2,4-triazol-3-il)-amida;
-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-butano
5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-
5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-
triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-
4-triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-pirano-
triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-pirano-
triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-pirano-
triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-
triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-
triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-
-triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-
4-triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-
4-triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-
4-triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-
2,4-triazol-3-il)-2-(5-metil-2-pirimidinil)tetrahidro-2H-
4-triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-
4-triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-
b u ta n o s u lfo n a m id a ;
(2 S ,3 R )-N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 b u ta n o s u lfo n a m id a ;
(25.35) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil) butanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(6-(metilamino)-2-piridinil propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-(metilamino)-2-piridinil propanosulfonamida;
(1 R,2S)-N-(4-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-piridi propanosulfonamida;
(1 R,2S)-N-(4-(2-(difluorometoxi)-6-metoxifenil)-5-(6-met pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2-(difluorometoxi)-6-metoxifenil)-5-(3-pirid propanosulfonamida;
(1 R,2S)-N-(4-(2-(difluorometoxi)-6-metoxifenil)-5-(5-meti pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-bis(difluorometoxi)fenil)-5-(3-piridinil)-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-bis(difluorometoxi)fenil)-5-(5-metil-3-p 2-propanosulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 butanosulfonamida;
(25.35) -N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-l,2,4-tri (1 R,2S)-N-(4-(2,6-dimetilfenil)-5-(5-metil-3-piridinil)-4H-1 propanosulfonamida;
(1 R,2S)-N-(4-(2-fluoro-6-metoxifenil)-5-(6-metoxi-2-piridi propanosulfonamida;
(1 R,2S)-N-(4-(2,6-diclorofenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida;
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-(1 R,2S)-N-(4-(2,6-difluorofenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida;
(2R,3S)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida;
(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida;
(2R,3S)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida;
(1 R,2S)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
,4 - t r ia z o l-3 - i l) -3 -(4 -m e t i l-1 H -p ira z o l-1 - il) -2 -
,2,4-triazol-3-il)-3-(4-metil-1 H-pirazol-1 -il)-2-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-2-
-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-ridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-
2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-l)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-
-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-3-il)-3-(5-metoxi-2-pirimidinil)-2-butanosulfonamida;
riazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-riazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
l-3-il)-2-(5-fluoro-2-pirimidinil)etanosulfonamida;
triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
etil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-iridinil)-4H-1,2,4-triazol-3-il)-2-butanosulfonamida;
iridinil)-4H-1,2,4-triazol-3-il)-2-butanosulfonamida;
-triazol-3-il)-3-(5-metoxi-2-pirimidinil)-2-4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
(1 R ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ir id in i l) -4 H p ro p a n o s u lfo n a m id a ;
(2S,3R)-N-(4-(2-fluoro-6-metoxifenil)-5-(5-metil-3-piridini butanosulfonamida;
(1 R,2S)-N-(4-(2-fluoro-6-metoxifenil)-5-(5-metil-3-piridinil propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida;
(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida;
(2S,3R)-3-(5-ciano-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida;
(1 R,2R)-1 -(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(1 S,2S)-1 -(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(2R,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t (2S,3S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr (2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida;
(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-piri butanosulfonamida;
(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-piri butanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-piridinil)-N-(4-(4,6-dimetoxi-5-pirimi propanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-piridinil)-N-(4-(2,4-dimetoxi-3-piridin propanosulfonamida;
(2R,3S)-3-(5-cloro-2-pirimidinil)-N-(4-(2,4-dimetoxi-3-piri (2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,4-dimetoxi-3-piri (1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-propanosulfonamida;
(1 S ,2 R )-1 -c ic lo b u t il-N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l- 3 -p ro p a n o s u lfo n a m id a ;
- t r ia z o l-3 - i l) -1 -m e to x i-1 -(5 -m e to x i-2 -p ir im id in i l) -2 -
-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
,4-triazol-3-il)-1-(2-metoxietoxi)-1-(5-metil-2-pirimidinil)-etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2--piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida;
-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida;
-3-il)-1 -hidroxi-1 -(5-metoxi-2-pirazinil)-2--3-il)-1 -hidroxi-1 -(5-metoxi-2-pirazinil)-2--3-il)-3-(5-metoxi-2-pirazinil)-2-butanosulfonamida;
-3-il)-3-(5-metoxi-2-pirazinil)-2-butanosulfonamida;
-3-il)-3-(5-metoxi-2-pirazinil)-2-butanosulfonamida;
-3-il)-3-(5-metoxi-2-pirazinil)-2-butanosulfonamida;
,4-triazol-3-il)-3-(5-metoxi-2-pirazinil)-2-
,4-triazol-3-il)-3-(5-metoxi-2-pirazinil)-2-
il)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2-il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2-butanosulfonamida; 5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2-butanosulfonamida; nil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-
i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-2 -
(1 R ,2 S )-1 -(3 ,3 -d if lu o ro c ic lo b u t i l ) -N -(4 -(2 ,6 -d im e to x ife n i l) p ro p a n o s u lfo n a m id a ;
(1 R,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(1 S,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(1 S,2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, pirimidinil)etanosulfonamida;
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, pirimidinil)etanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-p 2-propanosulfonamida;
(1 S,2R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-p 2-propanosulfonamida;
(2S,3R)-N-(4-(3,5-dibromo-2,6-dimetoxifenil)-5-(5-metilbutanosulfonamida;
(2S,3R)-N-(5-(5-bromo-3-piridinil)-4-(2,6-dimetoxifenil)-butanosulfonamida;
(2S,3R)-N-(5-(5-ciclopropil-3-piridinil)-4-(2,6-dimetoxifen butanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(2,6-difluorofenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H propanosulfonamida;
(1 R,2S)-1 -metoxi-N-(4-(4-metoxi-6-oxo-1,6-dihidropirimi metilpirimidin-2-il)propano-2-sulfonamida;
(1 R,2S)-1 -metoxi-N-(4-(2-metoxi-3-piridinil)-5-(6-metoxipropanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5m e to x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -h id ro x i-2 -metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxi-2--triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 metoxi-2--triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxi-2--triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxi-2-azol-3-il)-2-hidroxi-2-(5-metil-2-azol-3-il)-2-hidroxi-2-(5-metil-2-l)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxil)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxiinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2--1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-3-il)-1 -hidroxi-1 -imidazo[1,2-a]piridin-2-il-2-3-il)-1 -hidroxi-1 -imidazo[1,2-a]piridin-2-il-2-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-inil)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2--triazol-3-il)-1 -(5-metoxi-2-pirazinil)-1 -(1 -metiletoxi)-2--triazol-3-il)-1 -(5-metoxi-2-pirazinil)-1 -(1 -metiletoxi)-2-til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(1 -metiletoxi)-2-
p ro p a n o s u lfo n a rn id e ;
(1 S ,2 S )-1 -(5 -c lo ro -2 -p ir id in i l) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -( p ro p a n o s u lfo n a m id a ;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-1-(5-(3,6-dihidro-2H-pirano-4-il)-2-pirimidinil)-N-il)-1-metoxi-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pirimidinil)-2-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pirimidinil)-2-propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-pirimidinil)-2-propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2S,3R)-N-(4-(2,6-bis(difluorometoxi)fenil)-5-(5-metil-3-p butanosulfonamida;
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida;
(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(2-piridinil)-4 t i l- 3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -(1 -m e t ile to x i) -2 -
4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirazinil)-2--triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirazinil)-2--triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-
,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-,4-triazol-3-il)-1 -(3-metoxi-1 -azetidinil)-1 -(5-metil-2-,4-triazol-3-il)-1 -(3-metoxi-1 -azetidinil)-1 -(5-metil-2-2,4-triazol-3-il)-1 -(3-metoxi-1 -azetidinil)-1 -(5-metil-2-
,4-triazol-3-il)-1 -(3-metoxi-1 -azetidinil)-1 -(5-metil-2-
4-triazol-3-il)-1-metoxi-1-(5-(3-piridinil)-2-pirimidinil)-2-4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-
-triazol-3-il)-1-(metilamino)-1-(5-metil-2-pirimidinil)-2-il)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
4-triazol-3-il)-3-hidroxi-4-hexyne-2-sulfonamida;
4-triazol-3-il)-3-hidroxi-4-hexyne-2-sulfonamida;
-triazol-3-il)-1 -hidroxi-1 -(6-metil-3-piridazinil)-2-
-triazol-3-il)-1 -hidroxi-1 -(6-metil-3-piridazinil)-2-
-3-il)-1 -hidroxi-1 -(6-metil-3-piridazinil)-2--3-il)-1 -hidroxi-1 -(6-metil-3-piridazinil)-2--triazol-3-il)-1 -hidroxi-1 -(6-metil-3-piridazinil)-2-4-triazol-3-il)-1 -hidroxi-1 -(6-metil-3-piridazinil)-2-
4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-
b u ta n o s u lfo n a m id a ;
(2 S ,3 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(2 -p ir id in i l) -4 H -1 ,2 ,4 -(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(2-piridinil)-4 butanosulfonamida;
(1 S,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(2-piridinil)-4 propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(2-piridinil)-4 propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-propanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(6-metil-2-piridinil)-4H butanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(2-piridinil)-4H-1,2,4-tr (2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-difluorofenil)-butanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida;
(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-difluorofenil)-butanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(6-metil-2-piridinil)-4H (2S,3R)-N-(4-(2,6-difluorofenil)-5-(6-(metilamino)-2-piri butanosulfonamida;
(1 S,2R)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(3-piridinil)-4H-1,2,4-tr (2S,3R)-N-(4-(2,6-difluorofenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida;
(2S,3R)-N-(4-(2,6-difluorofenil)-5-(5-metil-3-piridinil)-4H (2S,3R)-3-(5-cloro-2-pirimidinil)-N-(4-(2,6-difluorofenil)-butanosulfonamida;
(2S,3R)-N-(4-(2-metoxifenil)-5-(5-metil-3-piridinil)-4H-1, (2S,3R)-N-(4-(6-bromo-3-metoxi-2-piridinil)-5-(6-metoxi butanosulfonamida;
(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-butanosulfonamida;
(3R,5S)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 piperidinasulfonamida;
-3 - i l) -3 -(5 -m e t i l- 2 -p ira z in i l) -2 -b u ta n o s u lfo n a m id a ;
-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida;
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--triazol-3-il)-3-(5-metil-2-pirimidinil)-2-4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida;
etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-,4-triazol-3-il)-3-(5-metoxi-2-pirazinil)-2-etil-2-piridinil)-4H-1,2,4-triazol-3-il)-2-,4-triazol-3-il)-3-(5-metil-2-pirazinil)-2--triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida; H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida;
-triazol-3-il)-3-(5-metoxi-2-pirazinil)-2--triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida; etil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-azol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida; dinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-l)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-
(3S,5R)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 piperidinasulfonamida;
(2S,3R)-3-(5-cloro-2-piridinil)-N-(4-(4,6-dimetoxi-5-pirimi (2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 butanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 propanosulfonamida;
(1 S,2R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 propanosulfonamida;
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(3S,5R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 butanosulfonamida;
(2S,3R)-3-(5-cloro-2-piridinil)-N-(4-(4-metoxi-6-oxo-1,6-butanosulfonamida;
(2S,3R)-3-(5-cloro-2-piridinil)-N-(4-(4-hidroxi-6-oxo-1,6-butanosulfonamida;
(35.55) -N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-piperidinasulfonamida;
(3S,5R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 piperidinasulfonamida;
(3R,5S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 piperidinasulfonamida;
(3R,5R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4 piperidinasulfonamida;
(3R,5R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(3S,5R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(35.55) -N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 piperidinasulfonamida;
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(3S,5R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(3R,5R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t piperidinasulfonamida;
(35.55) -N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4 piperidinasulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H propanosulfonamida;
(1 S ,2 S )-N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l ) -4 p ro p a n o s u lfo n a m id a ;
4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2-butanosulfonamida; 4-triazol-3-il)-3-(5-metoxi-2-pirazinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2--triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2--3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-4-triazol-3-il)-3-(5-metil-2-pirazinil)-2--5-pirimidinil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2--5-pirimidinil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2-,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3-4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3-l-3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-(1-metiletoxi)-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-(1-metiletoxi)-3--3-il)-1-(5-fluoro-2-pirimidinil)-5-(1-metiletoxi)-3-l-3-il)-1-(5-fluoro-2-pirimidinil)-5-(1-metiletoxi)-3--triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirazinil)-2-
,4 - t r ia z o l-3 - i l) -1 -(1 -m e tile to x i) -1 -(5 -m e t i l- 2 -p ira z in i l) -2 -(2S,3R)-N-(4-(2,6-difluorofenil)-5-(5-metil-3-piridinil)-4H-butanosulfonamida;
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida;
(1 S,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(5-metil-3-piri pirimidinil)-2-propanosulfonamida;
(3R)-1-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimid piperidinasulfonamida;
(3S)-1-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimid piperidinasulfonamida;
1- ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piri (2S,3R)-N-(5-(5-ciano-3-piridinil)-4-(2,6-dimetoxifenil)-4 butanosulfonamida;
ácido 5-(4-(2,6-dimetoxifenil)-5-((((1S,2R)-1-metil-2-(5-piridinacarboxílico;
(2S,3R)-3-(5-cloro-2-pirimidinil)-N-(5-(6-metoxi-2-piridinil butanosulfonamida;
(1 R,2S)-1-(5-cloro-2-pirimidinil)-1-metoxi-N-(5-(6-metoxi 2- propanosulfonamida;
(1 S,2S)-N-(5-(6-metoxi-2-piridinil)-4-(tetrahidro-2H-piran pirimidinil)-2-propanosulfonamida;
(2S,3R)-3-(5-cloro-2-piridinil)-N-(4-(4-metoxi-2-oxo-1,2-butanosulfonamida;
(2S,3R)-3-(5-cloro-2-piridinil)-N-(5-(6-metoxi-2-piridinil)-butanosulfonamida;
(1 R,2S)-1-(5-cloro-2-piridinil)-1-metoxi-N-(5-(6-metoxi-2-propanosulfonamida;
(2S,3R)-N-(5-(6-metoxi-2-piridinil)-4-(tetrahidro-2H-piran butanosulfonamida;
(2S,3R)-N-(5-(6-metoxi-2-piridinil)-4-(tetrahidro-2H-piran butanosulfonamida;
(2S,3R)-3-(5-metoxi-2-pirazinil)-N-(5-(6-metoxi-2-piridini butanosulfonamida;
(2S,3R)-3-(5-metoxi-2-piridinil)-N-(5-(6-metoxi-2-piridinil butanosulfonamida; o
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-(hidroximetil)-3-piri butanosulfonamida.
92. En algunas realizaciones, la invención proporciona aceptable del mismo, el estereoisómero de cualquiera compuesto es
(1 R,2S)-N-(4-(2,6-difluorofenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida.
93. En algunas realizaciones, la invención proporciona aceptable del mismo, el estereoisómero de cualquiera compuesto es
triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
3-il)-1 -imidazo[1,2-a]piridin-2-il-1 -(1 -metiletoxi)-2-
3-il)-1 -imidazo[1,2-a]piridin-2-il-1 -(1 -metiletoxi)-2-
H-1,2,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
4H-1,2,4-triazol-3-il)metanosulfonamida;
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
-pirimidinil)propil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-3-
trahidro-2H-pirano-4-il)-4H-1,2,4-triazol-3-il)-2-
dinil)-4-(tetrahidro-2H-pirano-4-il)-4H-1,2,4-triazol-3-il)-
-4H-1,2,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-
-3-piridinil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-2-
ahidro-2H-pirano-4-il)-4H-1,2,4-triazol-3-il)-2-
il)-4-(tetrahidro-2H-pirano-4-il)-4H-1,2,4-triazol-3-il)-2-
-4H-1,2,4-triazol-3-il)-3-(5-metoxi-2-pirimidinil)-2-
-4H-l,2,4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-
trahidro-2H-pirano-4-il)-4H-1,2,4-triazol-3-il)-2-
trahidro-2H-pirano-4-il)-4H-1,2,4-triazol-3-il)-2-
4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-
puesto de la realización 91 o la sal farmacéuticamente s anteriores, o la mezcla de los mismos, en donde el
4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-
puesto de la realización 91 o la sal farmacéuticamente s anteriores, o la mezcla de los mismos, en donde el
(1 R ,2 S ) -N -(4 -(4 ,6 -d im e to x i-5 -p ir im id in i l) -5 -(2 -p ir id in i l ) -4 H p ro p a n o s u lfo n a m id a .
94. Una composición farmacéutica que comprende el co farmacéuticamente aceptable del mismo, el estereois mismos, y al menos un excipiente, vehículo o diluyente f 95. La composición farmacéutica de la realización 94, de un a-bloqueador, un p-bloqueador, un inhibidor de l del receptor de angiotensina (ARB), un bloqueador de c un activador de miosina, o un inhibidor de endopeptidas 96. La composición farmacéutica de la reivindicaci seleccionado de un inhibidor de la enzima convertidor angiotensina (ARB).
97. Un método de tratamiento de una afección cardiova cantidad eficaz del compuesto de una cualquiera de las mismo, el estereoisómero de cualquiera de los anteriore de la realización 94.
98. El método de la realización 97, en donde la afección 99. El método de la realización 97, en donde la afecci eyección reducida.
100. El método de la realización 97, en donde la afecc eyección conservada.
101. El método de la realización 97, en donde la afecci insuficiencia cardiaca diastólica crónica.
102. El método de la realización 97, en donde la afecció 103. El método de la realización 97, en donde la afecció 104. Un método para mejorar la contractilidad en un suj el método: administrar al sujeto una cantidad eficaz del sal farmacéuticamente aceptable del mismo, el estereo mismos, o la composición farmacéutica de la realizació la administración.
105. Un método para aumentar la fracción de eyecci comprendiendo el método: administrar al sujeto una realizaciones 1-93 o la sal farmacéuticamente acept anteriores, o la mezcla de los mismos, o la composició eyección aumenta en el sujeto después de administració 106. Un método para tratar una afección en un sujet administrar al sujeto una cantidad eficaz del compu farmacéuticamente aceptable del mismo, el estereois mismos o la composición farmacéutica de la realización 107. El método de la realización 106, en donde la afecci 108. El método de la realización 106, en donde la afecci 109. El método de una cualquiera de las realizaciones agente terapéutico adicional al sujeto, en donde el age un p-bloqueador, un inhibidor de la enzima convertid angiotensina (ARB), un bloqueador de canal de calcio, de miosina, o un inhibidor de endopeptidasa neutral (NE 110. El método de una cualquiera de las realizaciones agente terapéutico adicional al sujeto, en donde el age enzima convertidora de angiotensina (ACE) o un bloque 111. Un compuesto de una cualquiera de las realizacio estereoisómero de cualquiera de los anteriores, o la - t r ia z o l-3 - i l) -1 -m e to x i-1 -(5 -m e t i l- 2 -p ir im id in i l) -2 -
esto de una cualquiera de las realizaciones 1-93 o la sal de cualquiera de los anteriores, o la mezcla de los céuticamente aceptable.
demás comprende un agente terapéutico seleccionado ima convertidora de angiotensina (ACE), un bloqueador e calcio, un diurético, un inhibidor de la corriente funny, tral (NEP).
4, que además comprende un agente terapéutico angiotensina (ACE) o un bloqueador del receptor de
r, comprendiendo el método administrar a un sujeto una zaciones 1-93 o la sal farmacéuticamente aceptable del la mezcla de los mismos, o la composición farmacéutica
iovascular es insuficiencia cardiaca.
ardiovascular es insuficiencia cardiaca con fracción de
ardiovascular es insuficiencia cardiaca con fracción de
rdiovascular es insuficiencia cardiaca sistólica crónica o
diovascular es insuficiencia cardiaca aguda.
diovascular es hipertensión.
ue padece una afección cardiovascular, comprendiendo puesto de una cualquiera de las realizaciones 1-93 o la ero de cualquiera de los anteriores, o la mezcla de los en donde la contractilidad cardiaca mejora después de
n un sujeto que padece una afección cardiovascular, idad eficaz del compuesto de una cualquiera de las del mismo, el estereoisómero de cualquiera de los acéutica de la realización 94, en donde la fracción de
de se desea activar el receptor APJ, que comprende de una cualquiera de las realizaciones 1-93 o la sal de cualquiera de los anteriores, o la mezcla de los
obesidad o diabetes.
nefropatía diabética o enfermedad renal crónica.
8, en donde el método incluye administrar al menos un rapéutico adicional se selecciona de un a-bloqueador, e angiotensina (ACE), un bloqueador del receptor de iurético, un inhibidor de la corriente funny, un activador
8, en donde el método incluye administrar al menos un rapéutico adicional se selecciona de un inhibidor de la del receptor de angiotensina (ARB).
-93 o la sal farmacéuticamente aceptable del mismo, el a de los mismos, o la composición farmacéutica de la
realización 94 para usar en el tratamiento de una afecció 112. El compuesto de la realización 111, en donde la afe 113. El compuesto de la realización 111, en donde la af de eyección reducida.
114. El compuesto de la realización 111, en donde la af de eyección conservada.
115. El compuesto de la realización 111, en donde la crónica o insuficiencia cardiaca diastólica crónica.
116. El compuesto de la realización 111, en donde la afe 117. El compuesto de la realización 111, en donde la afe 118. Un compuesto de una cualquiera de las realizacion estereoisómero de cualquiera de los anteriores, o la m realización 94 para usar en la activación del receptor receptor APJ.
119. El compuesto de la realización 118, en donde la afe 120. El compuesto de la realización 118, en donde la afe 121. Un uso del compuesto de una cualquiera de las r mismo, el estereoisómero de cualquiera de los anterio medicamento para el tratamiento de una afección cardiov 122. El uso de la realización 121, que además compren un p-bloqueador, un inhibidor de la enzima convertido angiotensina (ARB), un bloqueador de canal de calcio, de miosina, o un inhibidor de endopeptidasa neutral (NE 123. El uso de la realización 121, que además compren enzima convertidora de angiotensina (ACE) o un bloquea 124. El uso de la realización 121, en donde la afección c 125. El uso de la realización 121, en donde la afecció eyección reducida.
126. El uso de la realización 121, en donde la afecció eyección conservada.
127. El uso de la realización 121, en donde la afección insuficiencia cardiaca diastólica crónica.
128. El uso de la realización 121, en donde la afección c 129. El uso de la realización 121, en donde la afección c 130. Un uso del compuesto de una cualquiera de las r mismo, el estereoisómero de cualquiera de los anterio medicamento para activar el receptor APJ o tratar una af 131. El uso de la realización 130, en donde la afección e 132. El uso de la realización 130, en donde la afección n 133. Un régimen de tratamiento para la enfermedad ca una cualquiera de las realizaciones 1-93 o la sal farm cualquiera de los anteriores, o la mezcla de los mismos.
134. El régimen de tratamiento de la realización 133, en seleccionado de un a-bloqueador, un p-bloqueador, un i un bloqueador del receptor de angiotensina (ARB), un bl corriente funny, un activador de miosina, o un inhibidor d ardiovascular.
n cardiovascular es insuficiencia cardiaca.
ión cardiovascular es insuficiencia cardiaca con fracción
ión cardiovascular es insuficiencia cardiaca con fracción
ección cardiovascular es insuficiencia cardiaca sistólica
ón cardiovascular es insuficiencia cardiaca aguda.
ón cardiovascular es hipertensión.
1-93 o la sal farmacéuticamente aceptable del mismo, el la de los mismos, o la composición farmacéutica de la J o para tratar una afección donde se desea activar el
ón es obesidad o diabetes.
ón es nefropatía diabética o enfermedad renal crónica.
zaciones 1-93 o la sal farmacéuticamente aceptable del , o la mezcla de los mismos en la preparación de un cular.
un agente terapéutico seleccionado de un a-bloqueador, de angiotensina (ACE), un bloqueador del receptor de diurético, un inhibidor de la corriente funny, un activador
un agente terapéutico seleccionado de un inhibidor de la r del receptor de angiotensina (ARB).
iovascular es insuficiencia cardiaca.
ardiovascular es insuficiencia cardiaca con fracción de
ardiovascular es insuficiencia cardiaca con fracción de
rdiovascular es insuficiencia cardiaca sistólica crónica o
iovascular es insuficiencia cardiaca aguda.
iovascular es insuficiencia cardiaca aguda.
zaciones 1-93 o la sal farmacéuticamente aceptable del , o la mezcla de los mismos en la preparación de un ión donde es conveniente activar el receptor APJ.
besidad o diabetes.
patía diabética o enfermedad renal crónica.
ovascular, comprendiendo el régimen: el compuesto de uticamente aceptable del mismo, el estereoisómero de
de el régimen comprende además un agente terapéutico ibidor de la enzima convertidora de angiotensina (ACE), eador de canal de calcio, un diurético, un inhibidor de la ndopeptidasa neutral (NEP).
135. El régimen de tratamiento de la realización 133, en seleccionado de un inhibidor de la enzima convertidor angiotensina (ARB).
136. Un kit, comprendiendo el kit: el compuesto farmacéuticamente aceptable del mismo, el estereoisó mismos.
137. El kit de la realización 136, en donde el kit compr bloqueador, un p-bloqueador, un inhibidor de la enzim receptor de angiotensina (ARB), un bloqueador de canal activador de miosina, o un inhibidor de endopeptidasa ne 138. El kit de la realización 136, en donde el kit com inhibidor de la enzima convertidora de angiotensina (AC Las realizaciones 139 a 168 se proporcionan como ref invención.
139. Se describe un compuesto intermedio de fórmula tautómero:
de el régimen comprende además un agente terapéutico angiotensina (ACE) o un bloqueador del receptor de
una cualquiera de las realizaciones 1-93 o la sal o de cualquiera de los anteriores, o la mezcla de los
e además un agente terapéutico seleccionado de un aonvertidora de angiotensina (ACE), un bloqueador del calcio, un diurético, un inhibidor de la corriente funny, un l (NEP).
de además un agente terapéutico seleccionado de un un bloqueador del receptor de angiotensina (ARB).
ncia y no representan realizaciones de acuerdo con la
na sal del mismo, uno de sus tautómeros, o una sal del
en donde:
R1 es un piridilo, piridonilo o N-óxido de piridina no s sustituido con 1, 2, 3 o 4 sustituyentes R1a;
R1a en cada caso se selecciona independientemente d C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6 C6), -alquenilo C2-C6, -O-(alquil C1-C6)-o H, -O-(alquil (halogenoalquil C1-C6)-O-(alquilo C1-C6), -O-(perhaloge C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N(a heterociclilo, en donde el grupo heterociclilo del grupo miembros que contiene 1,2 o 3 heteroátomos selecciona R3 se selecciona de un alquilo C1-C10 no sustituido, un grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -N grupo de fórmula -(CR3dR3e)-(CR3fR3g)-Q, un grupo de fó Q, en donde el heterociclilo del -(heterociclil)-Q tiene d seleccionados de N, O o S y no está sustituido o está su R3a en cada caso se selecciona independientemente de -C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, alquinilo C2-C6, -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-R3b y r3c se seleccionan independientemente de C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -R3d y R3e se seleccionan independientemente de C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -R3f y R3g se seleccionan independientemente de C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), tuido, o es un piridilo, piridonilo o N-óxido de piridina
F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-6)-O-(alquilo C1-C6), -O-(halogenoalquil C1-C6)-OH, -O-quil C1-C6)-OH, -O-(perhalogenoalquil C1-C6)-O-(alquilo =O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-lo C1-C6)2, fenilo, -C(=O)-(heterociclilo), o un grupo =O)-(heterociclilo) o heterociclilo es un anillo de 3 a 7 de N, O o S;
uilo C1-C10 sustituido con 1, 2 o 3 sustituyentes R3a, un R3bR3c)-Q, un grupo de fórmula -(CR3bR3C)-C(=O)-Q, un la -(CR3b=CR3C)-Q, o un grupo de fórmula -(heterociclil)-a 7 miembros de los cuales 1, 2 o 3 son heteroátomos ido con 1,2 o 3 sustituyentes R3h;
Cl, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1--O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6, 2;
, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
R 3h e n c a d a c a s o s e s e le c c io n a in d e p e n d ie n te m e n C 6 , - p e rh a lo g e n o a lq u ilo C 1-C 6 , -O H , -O -(a lq u i lo C 1-C 6), O -(a lq u il C 1-C 6) -O H , -O -(a lq u il C 1-C 6) -O -(a lq u ilo C 1-C 6),
Q es un grupo arilo C6-C10 monocíclico o bicíclico, un g en el anillo que contiene 1, 2 o 3 heteroátomos selecci heterociclilo de 3 a 7 miembros que contiene 1, 2 o 3 arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo, y con 1,2, 3 o 4 sustituyentes RQ;
RQ en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquini -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquil fenilo o un grupo heteroarilo, y el grupo heterociclilo Q
R4 se selecciona de un grupo arilo C6-C10 monocíclico o 10 miembros en el anillo que contiene 1, 2 o 3 heteroá grupo heterociclilo monocíclico o bicíclico con 5 a 10 independientemente seleccionados de N, O o S, en heterociclilo no están sustituidos o están sustituidos con
R4a en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O C(=O)NH2, -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquil sustituido con 1 sustituyente oxo.
140. El compuesto de la realización 139, la sal del mis el compuesto tiene cualquiera de los R1, R1a, R3, R3a, combinaciones de valores de una cualquiera de las real
141. Se describe un método para preparar un compues o una sal del tautómero:
e -F , -C l, -C N , -a lq u ilo C 1-C 6 , - h a lo g e n o a lq u i lo C i -a lo g e n o a lq u ilo C 1-C 6), -O -(p e rh a lo g e n o a lq u ilo C 1-C 6), -, -N H (a lq u ilo C 1-C 6), -N (a lq u ilo C 1-C 6)2 u o x o ;
heteroarilo monocíclico o bicíclico con 5 a 10 miembros os de N, O o S, un grupo cicloalquilo C3-C8, o un grupo átomos seleccionados de N, O o S, en donde el grupo upo heterociclilo no están sustituidos o están sustituidos
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1--C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, --C6), -C(=O)N(alquilo C1-C6)2, -S(=O)2-(alquilo C1-C6), estar sustituido con 1 sustituyente oxo RQ;
lico, un grupo heteroarilo monocíclico o bicíclico con 5 a s independientemente seleccionados de N, O o S, o un ros en el anillo que contiene 1, 2, 3 o 4 heteroátomos el grupo arilo C6-C10, el grupo heteroarilo o el grupo o 3 sustituyentes R4a; y
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -uilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), --C6)2, y el grupo R4 heterociclilo puede estar además
l tautómero del mismo, o la sal del tautómero, en donde 3c, R3d, R3e, R3f, R3g, R3h, R4, R4a, Q, o RQ, valores o nes 2-62.
fórmula VI, una sal del mismo, uno de sus tautómeros,
comprendiendo el método:
a) ciclar un compuesto de fórmula V, una sal del mi presencia de un ácido o una base para formar el compu o la sal del tautómero,
uno de sus tautómeros, o una sal del tautómero en de fórmula VI, la sal del mismo, el tautómero del mismo,
en donde:
R1 es un piridilo, piridonilo o N-óxido de piridina no sustituido con 1,2, 3 o 4 sustituyentes R1a;
R 1a e n c a d a c a s o se s e le c c io n a in d e p e n d ie n te m e n te C 6 , - p e rh a lo g e n o a lq u ilo C 1-C 6 , -O H , -O -(a lq u i lo C 1-C uido, o es un piridilo, piridonilo o N-óxido de piridina
, -C l, -B r, -I, -C N , -a lq u ilo C 1-C 6 , - h a lo g e n o a lq u i lo C 1-O -(h a lo g e n o a lq u ilo C 1-C 6), -O -(p e rh a lo g e n o a lq u ilo C 1-
C6), -alquenilo C2-C6, -O-(alquil Ci -C6)-OH, -O-(alquil (halogenoalquil C1-C6)-O-(alquilo C1-C6), -O-(perhalog C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N( heterociclilo, en donde el grupo heterociclilo del grup miembros que contiene 1,2 o 3 heteroátomos seleccion
R3 se selecciona de un alquilo C1-C10 no sustituido, u grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -N grupo de fórmula -(CR3dR3e)-(CR3fR3g)-Q, un grupo de f Q, en donde el heterociclilo del -(heterociclil)-Q tiene seleccionados de N, O o S y no está sustituido o está s
R3a en cada caso se selecciona independientemente de C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6 alquinilo C2-C6, -NH2, -NH(alquilo C1-C6), o -N(alquilo C
R3b y R3c se seleccionan independientemente de C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6),
R3d y R3e se seleccionan independientemente de C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6)
R3f y R3g se seleccionan independientemente de C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6),
R3h en cada caso se selecciona independienteme C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6),
Q es un grupo arilo C6-C10 monocíclico o bicíclico, un g en el anillo que contiene 1, 2 o 3 heteroátomos selecci heterociclilo de 3 a 7 miembros que contiene 1, 2 o 3 arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo, y con 1,2, 3 o 4 sustituyentes RQ;
RQ en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquini -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquil fenilo o un grupo heteroarilo, y el grupo heterociclilo Q p
R4 se selecciona de un grupo arilo C6-C10 monocíclico o 10 miembros en el anillo que contiene 1, 2 o 3 heteroá grupo heterociclilo monocíclico o bicíclico con 5 a 10 independientemente seleccionados de N, O o S, en heterociclilo no están sustituidos o están sustituidos con
R4a en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O) C(=O)NH2, -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquil sustituido con 1 sustituyente oxo.
142. El método de la realización 141, en donde R1, R1 tienen cualquiera de los valores o combinación de valor
143. El método de la realización 141 o realización compuesto de fórmula V, la sal del mismo, el tautómero base.
144. El método de la realización 143, en donde calent del mismo, o la sal del tautómero comprende calentar el
145. El método de la realización 143, en donde calent )-O-(alquilo C1-C6), -O-(halogenoalquil Ci -C6)-OH, -O-uil C1-C6)-OH, -O-(perhalogenoalquil C1-C6)-O-(alquilo O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C1-C6)2, fenilo, -C(=O)-(heterociclilo), o un grupo O)-(heterociclilo) o heterociclilo es un anillo de 3 a 7 de N, O o S;
ilo C1-C10 sustituido con 1, 2 o 3 sustituyentes R3a, un 3bR3c)-Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un a -(CR3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)-7 miembros de los cuales 1, 2 o 3 son heteroátomos o con 1,2 o 3 sustituyentes R3h;
l, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1--O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6,
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), --NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), --NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), --NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
-F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), --NH(alquilo C1-C6), -N(alquilo C1-C6)2 u oxo;
eteroarilo monocíclico o bicíclico con 5 a 10 miembros s de N, O o S, un grupo cicloalquilo C3-C8, o un grupo átomos seleccionados de N, O o S, en donde el grupo po heterociclilo no están sustituidos o están sustituidos
-Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), (alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -C6), -C(=O)N(alquilo C1-C6)2, -S(=O)2-(alquilo C1-C6), estar sustituido con 1 sustituyente oxo RQ;
ico, un grupo heteroarilo monocíclico o bicíclico con 5 a independientemente seleccionados de N, O o S, o un ros en el anillo que contiene 1, 2, 3 o 4 heteroátomos el grupo arilo C6-C10, el grupo heteroarilo o el grupo 3 sustituyentes R4a; y
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-alogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -ilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), -C6)2, y el grupo R4 heterociclilo puede estar además
R3a, R3b, R3c, R3d, R3e, R3f, R3g, R3h, R4, R4a, Q, o RQ, cualquiera de las realizaciones 2-62.
n donde la ciclación comprende además calentar el ismo, o la sal del tautómero en presencia del ácido o la
ompuesto de fórmula V, la sal del mismo, el tautómero uesto a una temperatura de 50°C a 100°C.
ompuesto de fórmula V, la sal del mismo, el tautómero
del mismo, o la sal del tautómero comprende calentar el 146. El método de una cualquiera de las realizaciones 1 sal del mismo, el tautómero del mismo, o la sal del tautó 147. El método de una cualquiera de las realizaciones 1 148. El método de la realización 147, en donde el hidróxi 149. El método de una cualquiera de las realizacion disolvente alcohol.
150. El método de la realización 149, en donde el alcoho 151. El método de una cualquiera de las realizaciones 1 compuesto de fórmula V, la sal del mismo, el tautómero 152. El método de la realización 151, en donde el ácido ácido polifosfórico, ácido fosfórico, ácido sulfúrico o ácid 153. El método de la realización 152, en donde el ácido 154. El método de la realización 152, en donde
tricloroacético.
155. El método de una cualquiera de las realizaciones cíclico, un éter acíclico, N,N-dimetilformamida o acetonitr 156. El método de la realización 155, en donde la ciclaci 157. El método de la realización 156, en donde el éte o1,4-dioxano.
158. El método de la realización 156, en donde el éter cí 159. Se describe además un compuesto intermedio de f sal del tautómero:
uesto a una temperatura de 602C a 852C.
5, en donde la ciclación del compuesto de fórmula V, la se lleva a cabo en presencia de la base.
6, en donde la base es un hidróxido de metal.
e metal se selecciona de NaOH o LiOH.
6-148, en donde la ciclación se lleva a cabo en un
sopropanol.
5, en donde la ciclación comprende además calentar el ismo, o la sal del tautómero en presencia del ácido.
lecciona de un ácido sulfónico, un ácido carboxílico, un hídrico.
ico es ácido metanosulfónico.
ido es ácido trifluoroacético, ácido acético o ácido
154, en donde la ciclación se lleva a cabo en un éter
lleva a cabo en un éter cíclico.
lico se selecciona de tetrahidrofurano, tetrahidropirano
es 1,4-dioxano.
la VII, una sal del mismo, uno de sus tautómeros, o una
en donde:
R3e' es un -alquil C1-C6;
R3g' se selecciona de -alquilo C1-C6, -halogenoalquilo C (halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), Q' es un grupo heteroarilo de 6 miembros monocíclico c está sustituido o está sustituido con 1,2 o 34 sustituyen RQ' en cada caso se selecciona independientemente C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquinil -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquilo 160. El compuesto de la realización 159, la sal del mis Q' se selecciona de un grupo piridinilo, pirimidinilo o o sustituyentes RQ'.
161. El compuesto de la realización 159, la sal del mis Q' se selecciona de
-perhalogenoalquilo C1-C6, -OH,-O-(alquilo C1-C6), -O-lquil C1-C6)-OH, o -O-(alquil C1-C6)-O-(alquilo C1-C6);
2 o 3 heteroátomos N, en donde el grupo heteroarilo no Q';
, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), (alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -), -C(=O)N(alquilo C1-C6)2 o -S(=O)2-(alquilo C1-C6).
tautómero del mismo, o la sal del tautómero, en donde nilo que no está sustituido o está sustituido con 1 o 2
162. El compuesto de la realización 159, la sal del mis Q' se selecciona de
de un enlace, indica el punto de unión del resto de la
en donde el símbolo VÍUW', cuando se dibuja por enci molécula.
163. El compuesto de una cualquiera de las realizaciones del tautómero, en donde R3e' es un -CH3.
164. El compuesto de una cualquiera de las realizaciones del tautómero, en donde R3g' es un -alquil C1-C6.
165. El compuesto de la realización 164, la sal del mismo R3g' es un -CH3.
166. El compuesto de una cualquiera de las realizaciones del tautómero, en donde R3g' es un -O-(alquilo C1-C6).
167. El compuesto de la realización 166, la sal del mismo R3g' se selecciona de -O-CH3, -O-CH2CH3 o -O-CH(CH3)2.
168. El compuesto de una cualquiera de las realizaciones del tautómero, en donde el compuesto se selecciona de de un enlace, indica el punto de unión del resto de la 9-162, la sal del mismo, el tautómero del mismo, o la sal 9-163, la sal del mismo, el tautómero del mismo, o la sal l tautómero del mismo, o la sal del tautómero, en donde 9-163, la sal del mismo, el tautómero del mismo, o la sal l tautómero del mismo, o la sal del tautómero, en donde 9-162, la sal del mismo, el tautómero del mismo, o la sal
En otras realizaciones más, se describe uno cualquiera En algunas realizaciones, el compuesto es una sal. Dic hidrato. En algunas realizaciones, el compuesto puede También se proporcionan composiciones farmacéutic aceptable del mismo, el tautómero del mismo, la sal fa de cualquiera de los anteriores, o la mezcla de los m excipiente, vehículo o diluyente farmacéuticamente ace sal farmacéuticamente aceptable del mismo, el taut tautómero, el estereoisómero de cualquiera de los ant las realizaciones, está presente en una cantidad efica afección tal como la obesidad o la diabetes, para activ farmacéutica se formula para suministro oral mientras formula para suministro intravenoso. En algunas re administración oral una vez al día o una vez al día, y e la cantidad eficaz del principio activo varía de 5 mg a mg, de 16 mg a 25 mg, o de 17 mg a 20 mg. En algun de 17 mg.
En algunas realizaciones, el sujeto es un mamífero. E En otras de dichas realizaciones, el mamífero es cani algunas de dichas realizaciones, es un ser humano.
Las composiciones farmacéuticas o formulaciones par pueden presentar convenientemente en forma farmac métodos bien conocidos en la técnica. Todos los mét vehículo que constituye uno o más ingredientes auxiliar asociando de manera uniforme e íntima el principio a dividido o ambos, y luego, si es necesario, moldeand farmacéutica, el compuesto objeto activo se incluye en el proceso o el estado de las enfermedades.
Las composiciones farmacéuticas que contienen el pri oral, por ejemplo, como comprimidos, pastillas para c los compuestos de la realización 168.
sal puede ser anhidra o estar asociada con agua como un ar en una forma neutra como una base o un ácido.
que incluyen el compuesto o la sal farmacéuticamente acéuticamente aceptable del tautómero, el estereoisómero os según cualquiera de las realizaciones y al menos un ble. En algunas de dichas realizaciones, el compuesto o la ero del mismo, la sal farmacéuticamente aceptable del res, o la mezcla de los mismos según una cualquiera de ara el tratamiento de una afección cardiovascular u otra el receptor APJ. En algunas realizaciones, la composición e en otras realizaciones, la composición farmacéutica se aciones, la composición farmacéutica se formula para lgunas de dichas formulaciones es una comprimido donde mg, de 6 mg a 58 mg, de 10 mg a 40 mg, de 15 mg a 30 e dichas composiciones, la cantidad de principio activo es
lgunas de dichas realizaciones, el mamífero es un roedor. En otras realizaciones más, el sujeto es un primate y, en
a administración de los compuestos de esta invención se tica unitaria y se pueden preparar por cualquiera de los os incluyen la etapa de asociar el principio activo con el En general, las composiciones farmacéuticas se preparan o con un vehículo líquido o un vehículo sólido finamente l producto en la formulación deseada. En la composición cantidad suficiente para producir el efecto deseado sobre
pio activo pueden estar en una forma adecuada para uso par, pastillas, suspensiones acuosas u oleosas, polvos o
gránulos dispersables, emulsiones, cápsulas duras o bla uso oral se pueden preparar de acuerdo con cualqui composiciones farmacéuticas. Dichas composiciones agentes edulcorantes, agentes aromatizantes, agente preparaciones farmacéuticamente elegantes y sabrosas con otros excipientes no tóxicos farmacéuticamente comprimidos. Estos excipientes pueden ser, por ejem carbonato de sodio, lactosa, fosfato de calcio o fosfato de almidón de maíz o ácido algínico; agentes aglutinan lubricantes, por ejemplo, estearato de magnesio, áci recubiertos o se pueden recubrir por técnicas conocida gastrointestinal y, por lo tanto, proporcionar una acción puede usar un material de retardo de tiempo tal como m se pueden recubrir por las técnicas descritas en las pat formar comprimidos terapéuticos osmóticos para la libera
Las formulaciones para uso oral también se pueden pres activo se mezcla con un diluyente sólido inerte, por ejem cápsulas de gelatina blanda en las que el principio activo de cacahuete, parafina líquida o aceite de oliva.
Las suspensiones acuosas contienen los materiales fabricación de suspensiones acuosas. Dichos ex carboximetilcelulosa de sodio, metilcelulosa, hidroxiprop de tragacanto y goma arábiga; los agentes dispersantes lecitina, o productos de condensación de un óxido de polioxietileno, o productos de condensación de óxido de heptadecaetilenoxicetanol, o productos de condensació ácidos grasos y un hexitol tal como el monooleato de sor de etileno con ésteres parciales derivados de ácidos gr sorbitán polietilénico. Las suspensiones acuosas tambié hidroxibenzoato de etilo o n-propilo, uno o más agentes agentes edulcorantes, tales como sacarosa o sacarina.
Las suspensiones oleosas se pueden formular suspendi aceite de cacahuete, aceite de oliva, aceite de sésamo líquida. Las suspensiones oleosas pueden contener un o alcohol cetílico. Se pueden añadir agentes edulcorante para proporcionar una preparación oral de sabor agrada de un antioxidante tal como ácido ascórbico.
Los polvos y gránulos dispersables adecuados para la de agua proporcionan el principio activo mezclado con u uno o más conservantes. Los agentes dispersantes o h por los ya mencionados antes. También pueden estar edulcorantes, aromatizantes y colorantes.
Las composiciones farmacéuticas de la invención tambié La fase oleosa puede ser un aceite vegetal, por ejemplo, por ejemplo, parafina líquida o mezclas de estos. Lo naturales, por ejemplo goma de acacia o goma de tra ésteres o ésteres parciales derivados de ácidos grasos y y productos de condensación de dichos ésteres parciale polioxietilénico. Las emulsiones también pueden contene
Los jarabes y elixires se pueden formular con agentes sacarosa. Dichas formulaciones también pueden conten colorantes.
Las composiciones farmacéuticas pueden estar en form Esta suspensión se puede formular de acuerdo con humectantes y agentes de suspensión adecuados que s también puede ser una solución o suspensión inyect aceptable no tóxico, por ejemplo, como una solución en que se pueden usar están el agua, solución de Ringer y fijos estériles se usan convencionalmente como un disolv usar cualquier aceite fijo blando, incluyendo mono o di s, o jarabes o elixires. Las composiciones destinadas al método conocido en la técnica para la fabricación de den contener uno o más agentes seleccionados de colorantes y agentes conservantes para proporcionar os comprimidos contienen el principio activo en mezcla eptables que son adecuados para la fabricación de , diluyentes inertes, tales como carbonato de calcio, dio; agentes de granulación y disgregación, por ejemplo, , por ejemplo almidón, gelatina o acacia, y agentes esteárico o talco. Los comprimidos pueden no estar ara retrasar la disgregación y la absorción en el tracto stenida durante un período más largo. Por ejemplo, se estearato de glicerilo o diestearato de glicerilo. También es de EE.UU. N° 4.256.108, 4.160.452 y 4.265.874 para n controlada.
ar como cápsulas de gelatina dura en las que el principio , carbonato de calcio, fosfato de calcio o caolín, o como mezcla con agua o un medio oleoso, por ejemplo, aceite
tivos mezclados con excipientes adecuados para la ientes son agentes de suspensión, por ejemplo etilcelulosa, alginato de sodio, polivinilpirrolidona, goma umectantes pueden ser un fosfátido natural, por ejemplo, lquileno con ácidos grasos, por ejemplo, estearato de eno con alcoholes alifáticos de cadena larga, por ejemplo e óxido de etileno con ésteres parciales derivados de ol polioxietilénico, o productos de condensación de óxido os y anhídridos de hexitol, por ejemplo, monooleato de ueden contener uno o más conservantes, por ejemplo plorantes, uno o más agentes aromatizantes y uno o más
do el principio activo en un aceite vegetal, por ejemplo, ceite de coco, o en un aceite mineral tal como parafina nte espesante, por ejemplo cera de abeja, parafina dura ales como los expuestos antes, y agentes aromatizantes . Estas composiciones se pueden conservar por adición
paración de una suspensión acuosa mediante la adición gente dispersante o humectante, agente de suspensión y ectantes y agentes de suspensión adecuados se ilustran resentes excipientes adicionales, por ejemplo, agentes
ueden estar en forma de emulsiones de aceite en agua. eite de oliva o aceite de cacahuete, o un aceite mineral, agentes emulsionantes adecuados pueden ser gomas anto, fosfátidos naturales, por ejemplo, soja, lecitina y hídridos de hexitol, por ejemplo monooleato de sorbitán, on óxido de etileno, por ejemplo monooleato de sorbitán gentes edulcorantes y aromatizantes.
lcorantes, por ejemplo, glicerol, propilenglicol, sorbitol o un emoliente, un conservante y agentes aromatizantes y
una suspensión acuosa u oleaginosa inyectable estéril. técnica conocida usando los agentes dispersantes o han mencionado antes. La preparación inyectable estéril estéril en un diluyente o disolvente parenteralmente -butanodiol. Entre los vehículos y disolventes aceptables lución isotónica de cloruro de sodio. Además, los aceites te o medio de suspensión. Para este propósito, se puede éridos sintéticos. Adicionalmente, son útiles los ácidos
grasos tales como el ácido oleico en la preparación de pr
Las composiciones farmacéuticas también se pueden a rectal del fármaco. Estas composiciones se pueden pre adecuado que es sólido a temperaturas normales pero lí recto para liberar el fármaco. Dichos materiales incluyen,
Para uso tópico, se usan cremas, ungüentos, jaleas, solu de la invención. Como se usa en la presente memori enjuagues bucales y gárgaras.
Los compuestos de la invención se pueden administrar dentro del paciente. Por lo tanto, en algunas realizacio producir un efecto sistémico en el cuerpo.
Como se ha indicado antes, los compuestos de la invenci sublingual, bucal, rectal, nasal o vaginal), parenteral ( intraarterial o intravenosa), transdérmica, o administraci invención se administran por vía mucosa (que incluye parenteral (que incluye inyección subcutánea, intramus tópica. En otras realizaciones, los compuestos de la i realizaciones más, los compuestos de la invención no se
Diferentes cantidades terapéuticamente eficaces puede fácilmente los expertos en la técnica. De manera simil afecciones, pero insuficientes para causar, o suficient terapias convencionales también están abarcadas po programas de frecuencia de dosis.
El compuesto de la invención, la sal farmacéuticame farmacéuticamente aceptable del tautómero, el estereoi mismos puede encontrar uso en el tratamiento de una se invención comprende métodos o usos que incluyen el us aceptable del mismo, el tautómero del mismo, la sal far de cualquiera de los anteriores, o la mezcla de los mi padece una enfermedad cardiovascular. En algunas re limita a, enfermedad coronaria, accidente cerebrovasc insuficiencia cardiaca diastólica, insuficiencia cardiaca conservada, insuficiencia cardiaca con fracción de
remodelación miocárdica después de cirugía cardiaca hipertensión esencial, hipertensión pulmonar, hipertensi aneurisma aórtico abdominal o la fibrilación auricular, in la afección cardiovascular es insuficiencia cardiaca. En insuficiencia cardiaca con fracción de eyección reduci cardiaca con fracción de eyección conservada. En otras cardiaca sistólica o insuficiencia cardiaca diastólica cróni insuficiencia cardiaca con disfunción sistólica y en el disfunción diastólica. En algunas realizaciones, la afecci mientras que en otras realizaciones, la afección cardiova
Como se ha indicado, los compuestos de la invención trastornos. Por lo tanto, en algunas realizaciones, la inve trastorno seleccionado de insuficiencia cardiaca descom pulmonar, fibrilación auricular, síndrome de Bruga reestenosis, enfermedades cardiovasculares isquémica líquidos, diabetes, diabetes gestacional, obesidad, enf ataques isquémicos transitorios, lesiones cerebrales p quemaduras, quemaduras solares, edema y preeclamp compuesto de la invención, una sal farmacéuticamente del tautómero, un estereoisómero de cualquiera de los farmacéutica que incluye cualquiera de estos, a un sujeto
En algunas realizaciones, la invención proporciona un
que padece una afección cardiovascular, que incluye l aceptable del mismo, el tautómero del mismo, la sal far de cualquiera de los anteriores, o la mezcla de los mis cardiaca puede conducir a mejoras significativas en méto ctos inyectables.
inistrar en forma de supositorios para la administración rar mezclando el fármaco con un excipiente no irritante do a la temperatura rectal y, por lo tanto, se fundirá en el r ejemplo, manteca de cacao y polietilenglicoles.
nes o suspensiones, etc., que contienen los compuestos la aplicación tópica también pretende incluir el uso de
a proporcionar una distribución sistémica del compuesto s, los compuestos de la invención se administran para
se pueden administrar por vía oral, mucosa (que incluye incluye inyección subcutánea, intramuscular, de bolo, tópica. En algunas realizaciones, los compuestos de la ministración sublingual, bucal, rectal, nasal o vaginal), ar, de bolo, intraarterial o intravenosa), transdérmica o nción se administran por administración oral. En otras ministran por administración oral.
ser aplicables para diferentes afecciones, como sabrán las cantidades suficientes para tratar o prevenir dichas para reducir, los efectos adversos asociados con las as cantidades de dosis descritas anteriormente y los
aceptable del mismo, el tautómero del mismo, la sal ero de cualquiera de los anteriores, o la mezcla de los de afecciones. Por ejemplo, en algunas realizaciones, la administración del compuesto, la sal farmacéuticamente éuticamente aceptable del tautómero, el estereoisómero os de la invención, en el tratamiento de un sujeto que aciones, la afección cardiovascular incluye, pero no se , insuficiencia cardiaca, insuficiencia cardiaca sistólica, bética, insuficiencia cardiaca con fracción de eyección cción reducida, miocardiopatía, infarto de miocardio, nfermedad cardiaca valvular, hipertensión incluyendo, portal, hipertensión sistólica, aneurisma aórtico como el endo la mejora de la arritmia. En algunas realizaciones, nas de dichas realizaciones, la insuficiencia cardiaca es , mientras que en otras realizaciones es insuficiencia dichas realizaciones, el sujeto puede tener insuficiencia y, por lo tanto, es útil en el tratamiento de pacientes con tamiento de pacientes con insuficiencia cardiaca con cardiovascular puede ser insuficiencia cardiaca aguda, lar es hipertensión.
pueden usar para tratar una serie de enfermedades y ión proporciona un método para tratar una enfermedad o sada aguda, insuficiencia cardiaca crónica, hipertensión taquicardia ventricular, aterosclerosis, hipertensión, cardiomiopatía, fibrosis cardiaca, arritmia, retención de edad arterial periférica, accidentes cerebrovasculares, raumatismo, esclerosis lateral amiotrófica, lesiones por en un sujeto. Dichos métodos incluyen administrar un ptable del mismo, una sal farmacéuticamente aceptable teriores, una mezcla de los mismos, o una composición e lo necesite.
odo para mejorar la contractilidad cardiaca en un sujeto dministración del compuesto, la sal farmacéuticamente éuticamente aceptable del tautómero, el estereoisómero s de la invención al sujeto. La mejora en la contracción s para tratar pacientes con insuficiencia cardiaca.
En algunas realizaciones, la invención proporciona un
padece una afección cardiovascular, que incluye la aceptable del mismo, el tautómero del mismo, la sal far de cualquiera de los anteriores, o la mezcla de los mi cardiaca puede conducir a mejoras significativas en los
En algunas realizaciones, la invención proporciona un m sujeto que padece una afección cardiovascular,
farmacéuticamente aceptable del mismo, el tautómero de el estereoisómero de cualquiera de los anteriores, o la m el acoplamiento ventrículo-arterial puede conducir a mej insuficiencia cardiaca.
En algunas realizaciones, la invención proporciona un
que padece una afección cardiovascular que incluye l aceptable del mismo, el tautómero del mismo, la sal far de cualquiera de los anteriores, o la mezcla de los mismo
Los compuestos de la invención también pueden encontr y, por lo tanto, encontrar utilidad en el tratamiento de ci compuestos de la invención pueden encontrar utilidad p también pueden encontrar utilidad para mejorar la funció
En algunas realizaciones, la invención proporciona un m activar el receptor APJ. Dichos métodos incluyen la aceptable del mismo, el tautómero del mismo, la sal far de cualquiera de los anteriores, o la mezcla de los realizaciones, la afección es obesidad o diabetes, mie diabética o enfermedad renal crónica. En algunas de di realizaciones, la afección es desgaste cardiaco.
Los compuestos de la invención pueden encontrar utilid ejemplo, los compuestos de la invención pueden encon relacionadas con la perfusión renal, hiperglucemia, ac proporciona un método para tratar uno de estos suj farmacéuticamente aceptable del mismo, el tautómero de el estereoisómero de cualquiera de los anteriores, o compuestos de la invención pueden encontrar además en la regulación del receptor de angiotensina (AT1R).
Los compuestos de la invención pueden encontrar utilid producir desenlaces o resultados deseados. Por ejemplo en la activación de células madre, más específicament células madre cardiacas endógenas. Por lo tanto, los c activación de células madre cardiacas en un sujeto t invención pueden encontrar también utilidad adicional después de trasplantar células tales como células con cél compuestos de la invención también pueden encontrar cardiacas y se pueden usar para hacerlo en pacientes q los compuestos de la invención pueden encontrar utilida la reparación cardiaca y en la activación de células madr otro ejemplo más, los compuestos de la invención se p cardiaca o procedimientos de trasplante de corazón reperfusión. En algunas realizaciones, la invención pro mejorar la afección en un sujeto que incluye la administ del mismo, el tautómero del mismo, la sal farmacéuti cualquiera de los anteriores, o la mezcla de los mismos d
Algunos métodos de la invención comprenden la admi terapéutico adicional (es decir, un agente terapéutico q compuestos de la invención se pueden usar en combina agentes terapéuticos adicionales incluyen, pero no se li agentes antifúngicos, agentes antiinflamatorios, agentes otros agentes anticancerígenos, agentes inmunomodula hormonas y citoquinas. En una realización, la invención que se usa para tratar sujetos con insuficiencia cardiaca do para mejorar la relajación cardiaca en un sujeto que ministración del compuesto, la sal farmacéuticamente éuticamente aceptable del tautómero, el estereoisómero s de la invención al sujeto. La mejora en la relajación odos para tratar pacientes con insuficiencia cardiaca.
do para mejorar el acoplamiento ventrículo-arterial en un incluye la administración del compuesto, la sal ismo, la sal farmacéuticamente aceptable del tautómero, cla de los mismos de la invención al sujeto. La mejora en s significativas en los métodos para tratar pacientes con
odo para aumentar la fracción de eyección en un sujeto dministración del compuesto, la sal farmacéuticamente éuticamente aceptable del tautómero, el estereoisómero e la invención al sujeto.
beneficios potenciales para mejorar la relajación cardiaca os pacientes con insuficiencia cardiaca. Por lo tanto, los mejorar la función inotrópica en algunas realizaciones y sitrópica.
do para tratar la afección en un sujeto en el que se desea ministración del compuesto, la sal farmacéuticamente éuticamente aceptable del tautómero, el estereoisómero mos de la invención al sujeto. En algunas de dichas s que en otras realizaciones, la afección es nefropatía s realizaciones, la afección es diabetes tipo II. En otras
en el tratamiento de una serie de otras afecciones. Por r utilidad en el tratamiento de pacientes con afecciones esis y diuresis. En algunas realizaciones, la invención que incluye la administración del compuesto, la sal ismo, la sal farmacéuticamente aceptable del tautómero, mezcla de los mismos de la invención al sujeto. Los dad en la regulación de la arginina vasopresina (AVP) y
en el tratamiento de una serie de otras afecciones o en s compuestos de la invención pueden encontrar utilidad élulas madre cardiacas, e incluso más específicamente puestos de la invención pueden encontrar utilidad en la como en un paciente humano. Los compuestos de la a regenerar tejido y ayudar a la recuperación funcional s madre mesenquimales derivadas de médula ósea. Los tilidad para aumentar la proliferación de células madre han sufrido un infarto de miocardio. Como otro ejemplo, n la reducción del tamaño del infarto, en la promoción de progenitoras en sujetos post-infarto de miocardio. Como en usar durante cirugía, tal como cirugía de derivación mo un agente terapéutico para reducir la lesión por rciona un método para tratar a uno de estos sujetos o ión del compuesto, la sal farmacéuticamente aceptable mente aceptable del tautómero, el estereoisómero de a invención al sujeto.
tración de un compuesto de la invención y un agente no sea un compuesto de la invención). Por lo tanto, los n con al menos otro agente terapéutico. Los ejemplos de tan a antibióticos, agentes antieméticos, antidepresivos, tineoplásicos, agentes antivirales, agentes citotóxicos y es, interferones alfa, interferones p, agentes alquilantes, rca la administración de un agente terapéutico adicional nica o hipertensión.
Como se ha descrito antes, algunos métodos de la inve invención y un agente terapéutico adicional (es decir, invención). En algunas realizaciones, la invención abarc se usa para tratar sujetos con insuficiencia cardiaca cró comprende métodos o usos que incluyen el uso de un co tautómero del mismo, la sal farmacéuticamente acepta anteriores, o la mezcla de los mismos de la invención bloqueador, un p-bloqueador, un inhibidor de la enzim receptor de angiotensina (ARB), un bloqueador de los funny, un activador de miosina, un inhibidor de endopept aldosterona, un natriurético, un salurético, un agente hi sintasa o un antagonista del receptor de endotelina. En usos que incluyen el uso de un compuesto, la sal farmac la sal farmacéuticamente aceptable del tautómero, el est los mismos de la invención y un agente terapéutico sele de la enzima convertidora de angiotensina (ACE), un blo del canal de calcio, un diurético, un inhibidor de la c endopeptidasa neutra (NEP). En algunas de tales re administrar un compuesto de la invención, la sal farmacé sal farmacéuticamente aceptable del tautómero, el ester los mismos y un agente terapéutico adicional tal como u o un bloqueador del receptor de angiotensina (ARB). adicional es, por lo tanto, un inhibidor de la enzima conv bloqueador del receptor de angiotensina (ARB). En otra que incluye administrar un compuesto de la invención, l del mismo, la sal farmacéuticamente aceptable del tautó mezcla de los mismos y un agente terapéutico adicional otras de dichas realizaciones, la invención incluye un mé la sal farmacéuticamente aceptable del mismo, el taut tautómero, el estereoisómero de cualquiera de los ante adicional tal como un inhibidor de la corriente funny. En más agentes terapéuticos adicionales. Por ejemplo, compuesto de la invención, la sal farmacéuticamente farmacéuticamente aceptable del tautómero, el estereoi mismos y un agente terapéutico adicional tal como un inh
Los agentes terapéuticos tales como los a-bloqueadores Los ejemplos de a-bloqueadores incluyen, pero no se li sus sales farmacéuticamente aceptables.
Los agentes terapéuticos tales como los p-bloqueadores Los ejemplos de p-bloqueadores incluyen, pero no se li carteolol, carvedilol, celiprolol, esmolol, mepindolol, meto taliprolol, y sus sales farmacéuticamente aceptables.
También se pueden usar bloqueadores de canales de c de la presente invención. Los ejemplos de bloqueado dihidropiridinas (DHPs) y no DHP. Los ejemplos de D isradipina, lacidipina, nicardipina, nifedipina, nigulpidina, riosidina, y sus sales farmacéuticamente aceptables.
anipamil, diltiazem, fendilina, flunarizina, gallpamil, m farmacéuticamente aceptables.
También se pueden usar diuréticos junto con los compu no se limitan a derivados de tiazida tales como,
hidrochlortiazida, y metilclorotiazida y sales farmacéutica
También se pueden usar agentes hipertensivos de acció Los ejemplos, incluyen, pero no se limitan a clonidina, gu aceptables de los mismos.
Se pueden usar inhibidores de ACE junto con los compu de ACE que se pueden usar incluyen, pero no se limita cilazapril, delapril, enalapril, analaprilat, fosinopril, lisinop ramipril, ramiprilat, spriapril, temocapril, trendolapril y z ejemplos de algunos inhibidores dobles de ACE/NEP incl y sus sales farmacéuticamente aceptables.
n comprenden la administración de un compuesto de la agente terapéutico que no sea un compuesto de la a administración de un agente terapéutico adicional que a o hipertensión. En algunas realizaciones, la invención uesto, la sal farmacéuticamente aceptable del mismo, el del tautómero, el estereoisómero de cualquiera de los n agente terapéutico tal como, pero no limitado a un aonvertidora de angiotensina (ACE), un bloqueador del ales de calcio, un diurético, un inhibidor de la corriente sa neutra (NEP), un vasodilatador, un antagonista de la tensor de acción central, un inhibidor de la aldosterona gunas realizaciones, la invención comprende métodos o ticamente aceptable del mismo, el tautómero del mismo, oisómero de cualquiera de los anteriores, o la mezcla de nado de un a-bloqueador, un p-bloqueador, un inhibidor ador del receptor de angiotensina (ARB), un bloqueador ente funny, un activador de miosina o un inhibidor de aciones, la invención incluye un método que incluye amente aceptable del mismo, el tautómero del mismo, la isómero de cualquiera de los anteriores, o la mezcla de hibidor de la enzima convertidora de angiotensina (ACE) algunas de tales realizaciones, el agente terapéutico dora de angiotensina (ACE), mientras que en otras es un de dichas realizaciones, la invención incluye un método al farmacéuticamente aceptable del mismo, el tautómero o, el estereoisómero de cualquiera de los anteriores, o la l como un inhibidor de endopeptidasa neutra (NEP). En o que incluye administrar un compuesto de la invención, ero del mismo, la sal farmacéuticamente aceptable del es, o la mezcla de los mismos y un agente terapéutico unas realizaciones, el método de uso puede incluir dos o algunas realizaciones, la invención puede incluir un ceptable del mismo, el tautómero del mismo, la sal ero de cualquiera de los anteriores, o la mezcla de los dor de ACE y un inhibidor de NEP.
pueden usar junto con los compuestos de la invención. an a doxazosina, prazosina, tamsulosina y terazosina y
pueden usar junto con los compuestos de la invención. n a acebutolol, acetutolol, atenolol, bisoprol, bupranolol, lol, nadolol, oxprenolol, penbutolol, pindolol, propranolol,
io como agentes terapéuticos junto con los compuestos de canales de calcio incluyen, pero no se limitan a incluyen, pero no se limitan a amlodipina, felodipina, lutipina, nimodifina, nisoldipina, nitrendipina, nivaldipina, ejemplos de no DHP incluyen, pero no se limitan a fradil, prenilamina, tiapamil, verapamilo, y sus sales
os de la presente invención. Los ejemplos incluyen, pero o no limitados a amiloride, clorotalidón, clorotiazida, nte aceptables de los mismos.
entral junto con los compuestos de la presente invención.
benz, guanfacina, metildopa, y sales farmacéuticamente
os de la presente invención. Los ejemplos de inhibidores alaceptril, benazepril, benazaprilat, captopril, ceronapril, moexipiril, moveltopril, perindopril, quinapril, quinaprilat, nopril y sus sales farmacéuticamente aceptables. Los n, pero no se limitan a omapatrilat, fasidotril y fasidotrilat
También se pueden usar ARB como agentes terapéutic ejemplos de ARB incluyen, pero no se limitan a c tasosartán, telmisartán y valsartán y sus sales farmacéu dobles de ARB/NEP incluyen, pero no se limitan
farmacéuticamente aceptables.
También se pueden usar inhibidores de NEP como age invención. Un ejemplo de un inhibidor de NEP incluye, aceptables.
También se pueden usar inhibidores de la aldosterona compuestos de la presente invención. Los ejemplos de limitan a anastrozol, fadrozol y exemestano y sus sales f Los antagonistas de endotelina son otros agentes terap presente invención. Los ejemplos incluyen, pero no s macitentán, sitaxentán y tezosentán, y sus sales farmacé También se pueden usar inhibidores de la corriente funn de un inhibidor de la corriente funny es la ivabradina y su También se pueden usar activadores de miosina junt activadores de miosina incluyen activadores de miosina c Se reconocerá que para los fines de esta solicitud, un incluye compuestos tales como profármacos conocidos administración. Por ejemplo, un compuesto sin activi antineoplásico en el cuerpo después de la administrac invención. Como otro ejemplo, el sacubitril se consider aunque es un profármaco que se convierte en sacubitrilat Cuando se administran como una combinación, los age separadas que se administran al mismo tiempo o s terapéuticos se pueden dar como una composición únic se define el uso de un compuesto de la presente in administración de cada agente de una manera secuenci la combinación de fármacos, y pretende que abarque ta manera sustancialmente simultánea, como en una sol activos o en cápsulas múltiples separadas para cada ag de la presente invención puede ser conjuntamente con t en la prevención o tratamiento de enfermedades cardiova Si se formulan como una dosis fija, dichos productos d dentro de los intervalos de dosis aceptados. Los com presente memoria también se pueden administrar s tratamiento de afecciones cardiovasculares tales como i de combinación no es adecuada. La invención no est compuestos de la invención se pueden administrar ante agente terapéutico conocido.
La invención se describe además por referencia a los sig reivindicada pero no la limiten de ninguna manera.
Los ejemplos descritos a continuación que no están e proporcionan solo como referencia.
Ejemplos
A menos que se indique lo contrario, todos los materiale purificación adicional. Los disolventes anhidros se ob directamente. Todas las reacciones que implican reactiv una atmósfera de nitrógeno o argón. La pureza se rendimiento de Agilent 1100 Series (HPLC) con detecció XDB-C84,6 x 150 mm, 5 micrómetros, 5 a 100% de AC Sistema B: Zorbax SB-C8, 4,6 x 75 mm, 10 a 90% de A 1,0 ml/minuto). La cromatografía en gel de sílice se preempaquetados (Biotage o Teledyne-Isco). Los espec AV-400 (400 MHz) o un espectrómetro Varian de 400 junto con los compuestos de la presente invención. Los esartán, eprosartán, irbesartán, losartán, olmesartán, mente aceptables. Los ejemplos de algunos inhibidores ombinaciones de valsartán y sacubitril y sus sales
s terapéuticos junto con los compuestos de la presente no se limita a sacubitril y sus sales farmacéuticamente
tasa como agentes terapéuticos en combinación con los ibidores de la aldosterona sintasa incluyen, pero no se acéuticamente aceptables.
cos que se pueden usar junto con los compuestos de la mitan a bosentán, enrasentán, atrasentán, darusentán, amente aceptables.
If) junto con los compuestos de la invención. Un ejemplo ales farmacéuticamente aceptables.
on los compuestos de la invención. Los ejemplos de iaca.
nte terapéutico distinto de uno de la presente invención e se convierten en el agente terapéutico después de la antineoplásica, pero que se convierte en un agente , se puede administrar junto con un compuesto de la n inhibidor de la NEP para los fines de esta aplicación, r la destilación por esterasas.
s terapéuticos se pueden formular como composiciones uencialmente en diferentes momentos, o los agentes a frase "coterapia" (o "terapia de combinación"), cuando ción y otro agente farmacéutico, pretende abarcar la n un régimen que proporcionará efectos beneficiosos de ién la administración conjunta de estos agentes de una ápsula que tiene una proporción fija de estos agentes e. Específicamente, la administración de los compuestos pias adicionales conocidas por los expertos en la técnica ulares.
ombinación emplean los compuestos de esta invención stos de cualquiera de las realizaciones descritas en la encialmente con agentes conocidos para usar en el ficiencia cardiaca e hipertensión cuando una formulación imitada en la secuencia de administración, ya que los simultáneamente o después de la administración de un
ntes ejemplos, que se pretende que ilustren la invención
l alcance del conjunto de reivindicaciones adjuntas se
obtuvieron de proveedores comerciales y se usaron sin ieron de Sigma-Aldrich (Milwaukee, WI) y se usaron sensibles al aire o a la humedad se llevaron a cabo bajo ió usando sistemas de cromatografía líquida de alto V a 254 nm y 215 nm (Sistema A: Agilent Zorbax Eclipse n H2O con TFA al 0,1% durante 15 min a 1,5 ml/minuto; en H2O con ácido fórmico al 0,1% durante 12 minutos a vó a cabo en general con cartuchos de gel de sílice s de 1H RMN se registraron en un espectrómetro Bruker z a temperatura ambiente, o los espectros de RMN se
recogieron con un espectrómetro Bruker Avance III qu usando una sonda de flujo de 10 gl Protasis CapNMR. usando un sistema automático Protasis One-Minute RM Tower™ y un manipulador de líquidos de Waters fabri observados se dan como partes por millón (ppm) a cam en el disolvente adecuado indicado. Los datos se dan de (s = singlete, d = doblete, t = triplete, q = cuartete, br = a de protones. Los datos de espectros de masas (MS) de Series con detección UV a 254 nm y 215 nm modo de el Las siguientes abreviaturas se usan para referirse a diver ACN Acetonitrilo
AcOH Ácido acético
CV Volumen de columna
d día o días
DAST Trifluoruro de dietilaminoazufre
DCM Diclorometano
DIEA N,N-Diisopropiletilamina
DMF N,N-Dimetilformamida
DMA Dimetilacetamida
DMAP 4-Dimetilaminopiridina
DMSO Dimetilsulfóxido
EDCI 1-Etil-3-(3-dimetilaminopropil)carbodiimida
EtOAc Acetato de etilo
EtOH Etanol
h hora o horas
HATU Hexafluorofosfato de 3-óxido de 1 -[Bis(dimetilam IPA Isopropanol
min minuto o minutos
LAH Hidruro de aluminio y litio
MeOH Metanol
MTBE Éter de t-butilo y metilo
NBS N-Bromosuccinimida
NMP N-Metilpirrolidona
TA Temperatura ambiente
TBAF Fluoruro de tetrabutilamonio
TBME Éter de t-butilo y metilo
TBS t-Butildimetilsilano
TEA Trietilamina
TFA Ácido trifluoroacético
THF Tetrahidrofurano
unciona a una frecuencia de protones de 500,13 MHz muestras de RMN se suministraron a la sonda de flujo compuesto por un gestionador de muestras Discovery do por CTC, Suiza (Modelo 2777). Todos los protones abajo del tetrametilsilano (TMS) u otra referencia interna siguiente manera: desplazamiento químico, multiplicidad o, m = multiplete), constantes de acoplamiento y número ja resolución se determinaron en un LC-MS Agilent 1100 opulverización (ESI) de baja resonancia.
s reactivos y disolventes:
)metilen]-1 H-1,2,3-triazolo[4,5-b]piridinio
TLC Cromatografía en capa fina
Ejemplo 1: Preparación de 2-isotiocianato-1,3-dimetoxiben
2-Isotiocianato-1,3-dimetoxibenceno, Ejemplo 1.0. A una DCM (5,0 l) se añadió 2,6-lutidina (1,5 l, 13,0 mol, 4 eq). L y se añadió gota a gota CSCh (374 ml, 4,88 mol, 1,5 e disolvente se evaporó a presión reducida y el residuo se título 1.0, 2-isotiocianato-1,3-dimetoxibenceno en forma positivo) m/z: 196 (M+H)+. 1H RMN (400 MHz, CDCla) 57 6H).
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe.
Ta no.
lución de 2,6-dimetoxianilina (500 g, 3,25 mol, 1 eq) en ezcla de reacción se enfrió a 0°C (temperatura interna) La mezcla de reacción se dejó agitar durante 2 h. El ificó en gel de sílice para proporcionar el compuesto del sólido blanco (1,06 g, 2,80 mol, 86%). LCMS (ESI ion (t, J = 8,48 Hz, 1H), 6,55 (d, J = 8,48 Hz, 2H), 3,90 (s,
izaron siguiendo el procedimiento en el Ejemplo 1.0
1
Ejemplo 1.3: Preparación de 3-isotiocianato-1-metil-1H-ind
(1-Metil-1H-indol-3-il)carbamato de ferc-butilo, Ejempl carboxílico (disponible en el mercado en Sigma-Aldrich ml) se añadió TEA (7,9 ml, 57,1 mmol) seguido de dife durante 36 h, después de lo cual la reacción se concentr agitó más a 90°C a lo largo del fin de semana. Despu EtOAc y se concentró a vacío. El residuo se purificó en dar 1.31 (7,1 g, 28,8 mmol, 51%). LCMS-ESI (POS.) m/z 1: A una disolución agitada de ácido 1 -metilindol-3-St. Louis, MO, EE.UU.) (10 g, 57,1 mmol) en THF (190 sforil-azida (12,3 ml, 57,1 mmol). La reacción se agitó acío y se puso en terc-butanol (54,6 ml). La reacción se añadió agua a la reacción y la mezcla se extrajo con e sílice eluyendo con EtOAc en hexanos al 0-30% para ,3 (M+H)+.
1-metil-1H-indol-3-amina, Ejemplo 1.32: A una disoluci añadió HCl concentrado (28,8 ml). Después la reacci parcialmente a vacío para formar un precipitado que se 6.84 mmol) sin más purificación en la siguiente etapa. L itada de 1.31 (7,1 g, 28,8 mmol) en EtOAc (96 ml) se agitó durante 7 d. Después, la mezcla se concentró aró por filtración. Se continuó con el sólido 1.32 (1.0 g, ESI (POS.) m/z: 147,2 (M+H)+.
3-Isotiocianato-1-metil-1H-indol, Ejemplo 1.3: A una di 6,84 mmol) en DCM seco (17,1 ml) se añadió una disol DCM (17,1 ml) mediante un embudo de adición a TA a Después, la reacción se concentró a vacío y se purific EtOAc en heptanos al 0-30%, para dar 1.3 en forma de m/z: 189,1 (M+H)+.
Ejemplo 1.4: Preparación de 2-isotiocianato-1,3-di([2H3] ión agitada de 1,1"-tiocarbonildi-2(1H)-piridona (1,6 g, de 1-metil-1H-indol-3-amina 1.32 (1 g, 6,84 mmol) en rgo de 40 min. La reacción se agitó más durante 16 h. una columna de gel de sílice, usando un gradiente de lido blanco (1,0 g, 5,31 mmol, 78%). LCMS-ESI (POS.)
i)benceno.
Etapa 1: 2-bromo-1,3-di([2H3]metoxi)benceno, Ejemplo bromoresorcinol (1,00 g, 5,29 mmol, Chem Impex Intern g, 13,23 mmol), y yoduro de metilo-D3 (0,988 ml, 15,87 durante 20 h. La reacción se diluyó con agua (50 ml) combinaron, se secaron (MgSO4) y se concentraron. EtOAc/hexanos al 0-20%) dio 2-bromo-1,3-di([2H3]meto forma de un sólido blanco.
Etapa 2: 2-amino-1,3-di([2H3]metoxi)benceno, Ejemplo bromo-1,3-di([2H3]metoxi)benceno (Ejemplo 1.41,960 m carbonato de potasio (2379 mg, 17,21 mmol), y yoduro trans-N1,N2-dimetilciclohexanos-1,2-diamina (0,166 ml, argón durante 5 min, después el matraz se equipó con aceite a 80°C y se agitó durante 16 h en atmósfera de H2O (5 ml), y la reacción se calentó en un baño de añadieron EtOAc (25 ml) y agua (25 ml). La mezcla s capas. La capa acuosa se extrajo con EtOAc (50 ml). L ml), salmuera (100 ml), se secaron (MgSO4), se filtrar espuma marrón claro. La purificación por cromatografía dio el 2-amino-1,3-di([2H3]metoxi)benceno (1.42, 400 m marrón claro. LCMS-ESI (POS.) m/z: 160,2 (M+H)+.
. En un matraz de fondo redondo que contenía 2-al) se añadió DMF (10 ml), carbonato de potasio (1,828 , IsoTec). La reacción se agitó a TA en atmósfera de N2 extrajo con EtOAc (3x40 ml), las capas orgánicas se purificación por cromatografía ultrarrápida (40 g SiO2 ceno (1.41, 1,06 g, 4,75 mmol, 90% de rendimiento) en
En un matraz de fondo redondo 25 ml que contenía 2-0 mmol), 2,2,2-trifluoroacetamida (973 mg, 8,61 mmol), obre (I) (164 mg, 0,861 mmol) se añadió ACN (10 ml) y mmol). La disolución azul brillante se burbujeó con frigerante enfriado por aire y se calentó en un baño de a reacción se enfrió a TA, se añadieron MeOH (5 ml) y a 65°C durante 7 h. La mezcla se enfrió a TA y se sfirió a un embudo de separación y se separaron las tractos orgánicos combinados se lavaron con agua (50 se concentraron para dar la amina en forma de una rrápida (12 g SiO2, EtOAc:EtOH 3:1/heptano al 0-100%) 1 mmol, 58% de rendimiento) en forma de una espuma
2-Isotiocianato-1,3-di([2H3]metoxi)benceno, Ejemplo 1.4. amino-1,3-di([2H3]metoxi)benceno (1.42, 400 mg, 2,51 2(1H)-piridona (613 mg, 2,64 mmol). La reacción se a reacción después se concentró hasta 10 ml y se purif EtOAc/hexanos al 20-100%) para proporcionar 1.4 (480 blanco. 1H RMN (300 MHz, CDCla) 5 = 7,15 (t, J=8,4 H (M+H)+.
Ejemplo 1.5: Preparación de 1,3-bis(difluorometoxi)-2-is n matraz de fondo redondo de 100 ml que contenía 2-l) en DCM (20 ml) a TA se añadió 1,1 "-tiocarbonildi-TA en atmósfera de N2 durante 16 h. La mezcla de irectamente por cromatografía ultrarrápida (40 g SiO2, 2,39 mmol, 95% de rendimiento) en forma de un sólido ), 6,54 (d, J=8,5 Hz, 2H). LCMS-ESI (POS.) m/z: 202,2
anatobenceno.
Etapa 1: 2-bromo-1,3-bis(difluorometoxi)benceno 1.5 bromoresorcinol (1,07 g, 5,66 mmol, Chem Impex Inter 16,98 mmol) y 2-cloro-2,2-difluoroacetato de sodio (2,5 de aceite a 100°C en atmósfera de N2 durante 3 h. L extrajo con EtOAc (3x20 ml). Las capas orgánicas purificación por cromatografía ultrarrápida (40 g bis(difluorometoxi)benceno (1.51, 680 mg, 2,35 mmol transparente.
Etapa 2: 2,6-bis(difluorometoxi)anilina 1.52. En un bis(difluorometoxi)benceno (1.51, 410 mg, 1,42 mmol) sódica (277 mg, 4,26 mmol), y (+)-1-ascorbato sódico ml), y la mezcla de reacción se agitó en atmósfera de N,N'-dimetil-1,2,ciclohexanosdiamina (44,7 pl, 0,28 mm baño de aceite a 80°C durante 18 h. La reacción se e amónico:hidróxido amónico 9:1 (50 ml), y se extrajo co lavaron con solución acuosa saturada de cloruro amóni concentraron para dar un aceite marrón (1.52), que se disolvió en THF (5 ml) y agua (2 ml) y se añadió trim reacción se agitó en atmósfera de N2 durante 4 h a
bicarbonato sódico (25 ml) y se extrajo con EtOAc (2x2 y se concentraron para dar un aceite amarillo. L EtOAc/hexanos al 0-50%) dio la 2,6-bis(difluorometoxi) etapas) en forma de un aceite amarillo claro. LCMS-ESI
Etapa 3: 1,3-bis(difluorometoxi)-2-isotiocianatobence bis(difluorometoxi)anilina (251 mg, 1,12 mmol) en DCM mg, 1,17 mmol, Aldrich). La reacción se agitó a TA
obtenida se concentró para dar un sólido naranja que se
Ejemplo 1.6: Preparación de 4-isotiocianatopiridina.
4-Isotiocianatopiridina, Ejemplo 1.6. En un vial de 20 m en DCM (2 ml) a TA se añadió 1,1"-tiocarbonildi-2(1H)-TA en atmósfera de N2 durante 5 h. La reacción se purificación. LCMS-ESI (POS.) m/z: 137,1 (M+H)+.
Ejemplo 1.7: Preparación de 1-etoxi-2-isotiocianato-3-m n un matraz de fondo redondo que contenía 2-al) se añadió DMF (10 ml), carbonato de cesio (5,53 g, 6,98 mmol, Aldrich). La reacción se calentó en un baño cción se enfrió a TA, se diluyó con agua (25 ml) y se inadas se secaron (MgSO4) y se concentraron. La , EtOAc/hexanos al 0-20%) dio el 2-bromo-1,3-6% de rendimiento) en forma de un aceite incoloro,
raz de fondo redondo que contenía 2-bromo-1,3-ñadió yoduro de cobre(i) (54,0 mg, 0,28 mmol), azida mg, 0,28 mmol). Se añadieron EtOH (5 ml) y agua (2 e desgasificó con Ar durante 10 min. Se añadió transediante jeringa, y la suspensión azul se calentó en un TA, se diluyó en solución acuosa saturada de cloruro Ac (2x25 ml). Las capas orgánicas se combinaron, se róxido amónico 9:1 (20 ml), se secaron (MgSO4), y se sin purificar en la siguiente etapa. El aceite anterior se fina (disolución 1,0 M en THF, 1,4 ml, 1,4 mmol). La reacción se vertió en disolución acuosa saturada de Las capas orgánicas combinadas se secaron (MgSO4) ificación por cromatografía ultrarrápida (12 g SiO2, (1.52, 106 mg, 0,47 mmol, 33% de rendimiento en 2 .) m/z: 226,1 (M+H)+.
.5. En un matraz de fondo redondo con 2,6-l) a TA se añadió 1,1"-tiocarbonildi-2(1H)-piridona (272 mósfera de N2 durante 5,5 h. La mezcla de reacción sin más purificación.
contenía piridin-4-amina (30,0 mg, 0,32 mmol, Aldrich) na (78 mg, 0,34 mmol, Aldrich). La reacción se agitó a ntró para dar un sólido naranja que se usó sin más
enceno.
Etapa 1: 1-etoxi-3-metoxi-2-nitrobenceno, Ejemplo nitrobenceno (219 mg, 1,28 mmol, Apollo Scientific) e olato de potasio (1,0 M en THF), 2,56 ml, 2,56 mmol). L reacción se diluyó con agua (10 ml) y se extrajo con secaron (MgSO4) y se concentraron a vacío. La EtOAc/hexanos al 0-50%) dio el 1-etoxi-3-metoxi-2-nit como una mezcla 2:1 del producto deseado y un subpr en la siguiente etapa sin más purificación.
Etapa 2: 2-etoxi-6-metoxianilina, Ejemplo 1.72. Al 1-et (142 mg, 2,54 mmol) y cloruro amónico (27,1 mg, 0,507 cerró y se calentó en un baño de aceite a 80°C dura purificación por cromatografía ultrarrápida (12 g SiO2, en forma de un aceite amarillo claro. LCMS-ESI (POS.)
Etapa 3: 1-etoxi-2-isotiocianato-3-metoxibenceno, Eje contenía 2-etoxi-6-metoxianilina (85 mg, 0,508 mmol) e ona) (118 mg, 0,51 mmol). La reacción se agitó a T obtenida se concentró para dar el compuesto del tí purificación. LCMS-ESI (POS.) m/z: 210,2 (M+H)+.
Ejemplo 1.8: Preparación de 5-isotiocianato-4,6-dimeto En un matraz que contenía 1-fluoro-3-metoxi-2-sfera de N2 se añadió EtOH (1 ml) y 2-metilpropan-2-ción se agitó en atmósfera de N2 a tA durante 73 h. La c (3x10 ml). Las capas orgánicas se combinaron, se icación por cromatografía ultrarrápida (12 g SiO2, ceno en forma de un aceite marrón claro que se aisló o no deseado (que no se caracterizó), la mezcla se usó
metoxi-2-nitrobenceno (1,71) se añadió hierro en polvo l). Se añadieron EtOH (8 ml) y H2O (0,8 ml), y el vial se h. La suspensión se filtró y el filtrado se concentró. La /hexanos al 0-50%) dio la 2-etoxi-6-metoxianilina (1.72) 168,2 (M+H)+.
1.7. En un matraz de fondo redondo de 50 ml que (5 ml) a TA se añadió 1,1'-tiocarbonilbis(piridin-2(1H)-tmósfera de N2 durante 20 h. La mezcla de reacción n forma de un sólido naranja que se usó sin más
idina.
5-Isotiocianato-4,6-dimetoxipirimidina, Ejemplo 1.8. A (14,97 g, 64,5 mmol) en DCM seco (75 ml), se añadió Chemicals, 10 g, 64,5 mmol) en DCM (75 ml) gota a go La reacción se agitó más durante 16 h. La reacción s heptanos al 0-30%) para dar el compuesto deseado 1. rendimiento). LCMS-ESI (POS.) m/z: 198,1 (M+H)+.
Ejemplo 2.0: Preparación de 3-(5-bromo-4-(2,6-dimetoxi disolución agitada de 1,1"-tiocarbonildi-2(1H)-piridona disolución de 4,6-dimetoxipirimidin-5-amina (D-L Chiral diante un embudo de adición a TA a lo largo de 40 min. centró a vacío y se purificó en gel de sílice (EtOAc en rma de un sólido blanco (12,75 g, 64,7 mmol, 100% de
4H-1,2,4-triazol-3-il)-5-metilpiridina.
W-(terc-butilsulfonil)-W'-(2,6-dimetoxifenil)-2-(5-metilnico disolución de ferc-butilsulfonamida (63 g, 0,46 mol, 1, mol, 1 eq) en ACN (1,8 l), se añadió carbonato de cesi agitó durante la noche a TA La formación de la isotiour 333,4 (M+H)+. 1H-RMN (400 MHz, DMSO-ds) 57,07 (t, (br. s, 9H). Se añadió sucesivamente a la isotiourea 5 plata (149 g, 0,88 mol, 2 eq) en 10 porciones (Nota: resultante se agitó durante 2 h. Se añadió agente de fil agitó durante 10-15 min. La mezcla de reacción se pas Después de lavar el tapón de agente de filtración de m concentró a presión reducida para dar un residuo negr malla 60-120); usando DCM y MeOH como eluyent idrazina-1-carboximidamida, Ejemplo 2.02. A una y 2-isotiocianato-1,3-dimetoxibenceno (1.0, 86 g, 0,44 6 g, 0,57 mol, 1,3 eq) en 8-10 porciones. La mezcla se confirmó por LCMS y RMN. MS (ESI ion positivo) m/z: 40 Hz, 1H), 6,56 (d, J = 8,36 Hz, 2H), 3,68 (s, 6H), 1,06 nicotinohidrazida (70 g, 0,46 mol, 1,05 eq) y nitrato de ición era ligeramente exotérmica). Después la mezcla n de marca Celite® (2 p/p) a la reacción y la mezcla se uevo a través del agente de filtración de marca Celite®.
elite® con DCM y MeOH en DCM al 5%, la mezcla se se purificó por cromatografía en columna [SiO2 (n° de producto eluyó con MeOH en DCM al 2-5%)] para
proporcionar 160 g del compuesto del título 2.02 en for m/z: (M+H)+ = 450,7. MS (ESI ion negativo) m/z: (M-H) 9,09 (br. s, 1H), 8,91 - 8,53 (m, 3H), 8,14 - 7,97 (m, 1 (m, 6H), 2,35 (s, 3H), 1,26 - 1,21 (m, 9H).
un sólido blanco (0,35 mol, 80%). MS (ESI ion positivo) 8,4. 1H RMN (400 MHz, DMSO-d6) 5 10,68 (br. s, 1H), 5 (d, J = 7,64 Hz, 1H), 6,76 - 6,67 (m, 2H), 3,75 - 3,72
W-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-tri disolución de W-(terc-butilsulfonil)-W'-(2,6-dimetoxifenil) 0,35 mol, 1 eq) en dioxano (800 ml), se añadió TFA calentó a reflujo a 100°C durante 18 h. La mezcla d siguiente etapa sin más purificación. MS (ESI ion posit (br. s, 1H), 8,47 (d, J = 1,35 Hz, 1H), 8,19 (d, J = 1,71 6,82 (d, J = 8,58 Hz, 2H), 3,87 (s, 6H), 2,24 (s, 3H), 1,1 -il)-2-metilpropano-2-sulfonamida, Ejemplo 2.03. A una etilnicotinoil)hidrazina-1-carboximidamida (2.02, 160 g, ml, 203 g, 1,78 mol, 5 eq). La mezcla de reacción se cción se evaporó hasta sequedad y se continuó a la /z: 431,8 (M)+. 1H-RMN (300 MHz, DMSO-afe) 5 13,19 H), 7,63 (d, J = 0,69 Hz, 1H), 7,49 (t, J = 8,49 Hz, 1H), H).
4-(2,6-Dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triaz metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-metilpropano-2-s 760 ml, 5 v/p) se añadió anisol (115 g, 1,06 mol, 3 eq), TFA hierve vigorosamente). Después de completarse vacío. El residuo se recogió en una cantidad mínima NaHCO3 al 10%. Los sólidos que se formaron se filtr petróleo y éter dietílico. El sólido se secó para obtener blanco (88 g, 0.29 mol, 82% en dos etapas). MS (ESI i 5 8,36 (d, J = 1,44 Hz, 1H), 8,14 (d, J = 1,88 Hz, 1H), 7 3,70 (s, 6H), 2,22 (s, 3H).
mina, Ejemplo 2.04. A la W-(4-(2,6-dimetoxifenil)-5-(5-mida (Ejemplo 2.03, 153,0 g, 0,36 mol) en TFA (puro, zcla resultante se calentó durante la noche a 100°C (el acción, se eliminó el TFA usando una bomba de alto ielo y se hizo básico a pH 8-9 usando disolución de or un embudo Buchner, se lavaron con agua, éter de mpuesto del título Ejemplo 2.04 en forma de un sólido itivo) m/z: 312,4 (M+H)+. 1H-RMN (400 MHz, DMSO-afe) 7,48 (m, 2H), 6,84 (d, J = 8,56 Hz, 2H), 6,31 (br. s, 2H),
3-(5-Bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-5-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-a (3,5 l) se añadió bromuro de benciltrietilamonio (231 g, TA Se añadió gota a gota ácido dicloroacético (46 disolución resultante se agitó a TA durante 18 h. La me purificó por cromatografía en columna en gel de sílice ( (0,09 mol, 34%) del compuesto del título en forma de 375,2. 1H RMN (400 MHz, CDCla) 58,42 (t, J = 0,56 Hz, (t, J = 8,48 Hz, 1H), 6,67 (d, J = 8,52 Hz, 2H), 3,74 (s, 6 1,44 Hz, 1H), 8,22 (d, J = 1,88 Hz, 1H), 7,66 - 7,65 (m, (s, 6H), 2,25 (s, 3H).
Los compuestos en la siguiente tabla se sintetizaron u de partida conocido como se describe.
iridina, Ejemplo 2.0. A una disolución agitada de 4-(2,6-jemplo 2.04, 88 g, 0,28 mol, 1 eq) en dibromometano mol, 3 eq) y nitrito de sodio (390 g, 5,65 mol, 20 eq) a g, 0,66 mol, 2 eq) a 0°C (temperatura interna) y la e reacción se concentró y se cargó en gel de sílice y se n con EtOAc en éter de petróleo al 80%) para dar 36 g do amarillo pálido. MS (ESI ion positivo) m/z: (M+H)+ = 8,32 (d, J = 1,96 Hz, 1H), 7,86 (t, J = 0,68 Hz, 1H), 7,46 33 (s, 3H). 1H-RMN (400 MHz, DMSO-ds) 58,46 (d, J = ,56 (t, J = 8,52 Hz, 1H), 6,89 (d, J = 8,56 Hz, 2H), 3,71
el procedimiento en el Ejemplo 2.0 usando el material
Ta 2
Ejemplo 3.0: Preparación de 6-(difluorometox¡)p¡colinoh¡d ¡da.
6-(D¡fluorometoxi)picol¡nato de metilo 3.01: En un matra de sodio (0,603 g, 3,96 mmol), hidróxido de sodio (0,046 metilo (0,303 g, 1,98 mmol) en DMF (3 ml). La mezcla de durante 24 h. La mezcla de reacción se enfrió a TA, s extrajo con EtOAc. Los extractos orgánicos se secaron para dar el producto en forma de un aceite blanco. El ma purificó por cromatografía en gel de sílice eluyendo proporcionar el Ejemplo 3.01 (0,281 g, 1,38 mmol, 70% MHz, CDCla) 57,84 - 7,96 (m, 2H), 7,42 - 7,83 (m, 1H), (POS.) m/z: 203,9 (M+H)+.
e fondo redondo de 10 ml se añadió clorodifluoroacetato l, 2,43 mmol) y 6-oxo-1,6-dih¡rdop¡rid¡na-2-carbox¡lato de acción se calentó a 60°C durante 18 h y después a 80°C iluyó con disolución acuosa saturada de NaHCÜ3 y se re MgSÜ4. La disolución se filtró y se concentró a vacío ial obtenido se absorbió en un tapón de gel de sílice y se un gradiente de EtOAc en hexanos al 0-50%, para rendimiento) en forma de un aceite blanco. 1H RMN (400 ,11 (dd, J = 8,02, 0,98 Hz, 1H), 3,98 (s, 3H). LCMS-ESI
6-(Difluorometoxi)picolinohidrazida, Ejemplo 3.0. A una d (9 ml) se añadió hidrazina (0,047 ml, 2,07 mmol). La me cual se concentró a vacío. Se añadió agua (10 ml) al resi hielo seco/acetona y se liofilizó para dar el Ejemplo 3.0 MHz, CDCl3) 57,10 (dd, J= 8,12, 0,88 Hz, 1H), 7,36 (t, Hz, 1H). LCMS-ESI (POS.) m/z: 203,9 (M+H)+.
Los compuestos en la Tabla 3 se sintetizaron siguiendo l partida conocido como se describe.
Ta lución del Ejemplo 3.01 (0,280 g, 1,38 mmol) en MeOH de reacción se agitó a TA durante 18 h, después de lo . La suspensión blanca se congeló mediante un baño de 280 g, 1,38 mmol, 100% de rendimiento). 1H RMN (400 73,55 Hz, 1H), 7,94 (d, J= 8,02 Hz, 1H), 8,00 (d, J=0,98
procedimientos en el Ejemplo 3.0 usando el material de
3
Ejemplo 3.28: Preparación de 6-(etilcarbamoil)picolinato etilo.
6-(Etilcarbamoil)picolinato de metilo, Ejemplo 3.28. A u (0,74 ml, 5,52 mmol) (disponible en Matrix Scientific) e hi GmbH) en DMF (10 ml) se añadió W-óxido de hexafluo ilmetilen]-N-metilmetanaminio (2,31 g, 6,07 mmol, Oakw de N,N-diisopropiletilamina (1,921 ml, 11,04 mmol, Sigm agitó a TA y se siguió por LCMS. Tras completarse, la sílice y se purificó por cromatografía a través de una c eluyendo con un gradiente de EtOAc en hexanos de 0 a 97% de rendimiento). LCMS-ESI (POS.) m/z: 209,1 (M+H
Ejemplo 3.29: Preparación de 6-(dimetilcarbamoil)picolin ezcla de ácido 6-(metoxicarbonil)piridina-2-carboxílico loruro de etanamina (0,675 g, 8,28 mmol, Fluka Chemie sfato W-[(dimetilamino)-1H-1,2,3-triazolo-[4,5-b]piridin-1-Products, Inc.) en porciones a TA, seguido de la adición drich Chemical Company, Inc.). La mezcla resultante se cla se absorbió directamente sobre un tapón de gel de na de gel de sílice preempaquetada Redi-Sep (125 g), %, para dar el compuesto del título (1,11 g, 5,33 mmol,
e metilo.
6-(Dimetilcarbamoil)picolinato de metilo, Ejemplo 3.29. E en el Ejemplo 3.28. LCMS-ESI (POS.) m/z: 209,1 (M+H) Ejemplo 3.30: Preparación de 6-(2,2,2-trifluoroetoxi)picoli compuesto se preparó usando el procedimiento descrito
de metilo.
6-Oxo-1,6-dihidropiridina-2-carboxilato de metilo, Ejem dihidropiridina-2-carboxílico (5,0 g, 35,9 mmol, Sigma hielo/agua se añadió gota a gota cloruro de tionilo (7,82 3.31. A una suspensión enfriada de ácido 6-oxo-1,6-rich) en MeOH (100 ml, 35,9 mmol) en un baño de 08 mmol, Sigma Aldrich). La mezcla resultante se agitó
a TA durante 24 h. La mezcla después se concentró 100%). LCMS-ESI (POS.) m/z: 154,1 (M+H)+.
ío y se secó para dar el compuesto del título (5,6 g,
6-(2,2,2-Trifluoroetox¡)p¡col¡nato de metilo, Ejemplo 3.3 metilo (1,0 g, 6,53 mmol) (Ejemplo 3.31) y carbonato d tr¡fluoro-2-yodoetano (2,74 g, 13,06 mmol, Sigma Aldr mezcla se enfrió a TA, se añadieron 30 ml de agua, y pH = ~5. La mezcla resultante después se extrajo con agua y salmuera, se secaron (Na2SO4) y se concent columna en gel de sílice usando gradiente EtOAc e trifluoroetoxi)p¡col¡nato de metilo (134 mg, 9%). LCMS-
Ejemplo 3.32: Preparación de 6-(2-((terc-butild¡met¡ls¡l¡l) na mezcla de 6-oxo-1,6-d¡h¡dropir¡d¡na-2-carbox¡lato de o (3,19 g, 9,80 mmol) en DMF (10 ml) se añad¡ó 1,1,1-La mezcla resultante se agitó a 50°C durante 2 d. La una disolución de HCl 1 N para neutralizar la mezcla a c (50 ml x 4). Los extractos combinados se lavaron con a vacío. El residuo se purificó por cromatografía en tanos al 0-100% como eluyente para dar el 6-(2,2,2-OS.) m/z: 236,1 (M+H)+.
x¡)p¡col¡nato de metilo.
6-(2-((terc-Butild¡met¡ls¡l¡l)ox¡)etox¡)p¡col¡nato de metilo, carboxilato de metilo (3.3l, 1,0 g, 6,53 mmol) en DMF g, 9,80 mmol, Sigma Aldrich). La mezcla resultante s añadieron 100 ml de disolución acuosa saturada de clor 100 ml). Los extractos combinados se lavaron con concentraron a vacío. El residuo se purificó por Com gradiente de EtOAc en heptanos al 0-80% como eluy (POS.) m/z: 312,1 (M+H)+.
Ejemplo 3.33: Preparación de 6-(2-metoxietoxi)p¡col¡nat lo 3.32. A una disolución de 6-oxo-1,6-d¡hidrop¡r¡d¡na-2-ml) se añadió terc-butil(2-yodoetoxi)d¡met¡ls¡lano (2,80 a 80°C y se siguió por LCMS. Tras completarse, se mónico y la mezcla resultante se extrajo con EtOAc (4 x (x 2) y salmuera (x 2), se secaron (Na2SO4) y se h en una columna de gel de sílice de 120 g usando para dar el Ejemplo 3.32 (969 mg, 47,6%). LCMS-ESI
etilo.
6-(2-Metoxietoxi)p¡col¡nato de metilo, Ejemplo 3.33. E descrito en el Ejemplo 3.32. LCMS-ESl (POS.) m/z: 212 Ejemplo 3.34: Preparación de 6-(2-hidrox¡-2-met¡lpropox puesto del título se preparó usando el procedimiento H)+.
l¡nato de etilo.
6-(2-Hidrox¡-2-met¡lpropoxi)p¡col¡nato de etilo, Ejemplo (0,41 ml, 2,99 mmol, Matrix Scientific) y carbonato de de isobutileno (0,32 ml, 3,59 mmol, TCI America) a TA Tras completarse, la mezcla se filtró y se lavó con separación y se lavó con agua (x2), salmuera, se sec residuo se purificó por cromatografía en columna de eluyente para dar el compuesto del título (3.34, 564 mg, A una mezcla de 6-hidrox¡p¡rid¡na-2-carbox¡lato de etilo 0,29 ml, 3,59 mmol) en dMf (5,98 ml) se añadió óxido ezcla resultante se agitó a 40°C y se siguió por LCMS. c (100 ml). El filtrado se transfirió a un embudo de e sulfato sódico anhidro y se concentraron a vacío. El e sílice usando EtOAc en heptano al 0-100% como . LCMS-ESI (POS.) m/z: 240,1 (M+H)+.
Ejemplo 3.35: Preparación de 6-(3,3,3-trifluoro-2-hidroxi ifluorometil)propoxi)picolinato de metilo.
6-(3,3,3-Trifluoro-2-hidroxi-2-(trifluorometil)propoxi)picoli hidroxipicolinato de metilo (3.31, 1.50 g, 9.80 mmol) y c añadió 2,2-bis(trifluorometil)oxirano (2,65 ml, 14,69 mm siguió por LCMS. Tras completarse la reacción, la m disolución orgánica se lavó con agua (x2) y salmuera, residuo se purificó por cromatografía en columna en eluyente para dar el compuesto del título (3,35, 1,13 g,
Ejemplo 3.36: Preparación de 6-(metilamino)picolinato de metilo, Ejemplo 3.35. A una mezcla agitada de 6-ato de cesio (4,79 g, 14,69 mmol) en DMF (19,59 ml) se pollo Scientific Ltd.) a TA, y la mezcla se agitó a TA y se se filtró y la torta de filtración se lavó con EtOAc. La có con sulfato sódico anhidro y se concentró a vacío. El de sílice usando EtOAc en heptanos al 0-100% como ). LCMS-ESI (POS.) m/z: 334,0 (M+H)+.
tilo.
6-(Metilamino)picolinato de metilo, Ejemplo 3.36. A un Chem Impex International) y carbonato de cesio (7,82 ml, 24,43 mmol, Sigma Aldrich). La mezcla se agitó a almohadilla de agente de filtración de marca Celite® y purificó mediante cromatografía en columna de gel de para dar el compuesto del título (3.36, 283 mg, 27%). L
Ejemplo 3.37: Preparación de 6-(dimetilamino)picolinato zcla de ácido 6-amino-2-picolínico (0,96 ml, 9,77 mmol, 7,7 mmol) en DMF (10 ml) se añadió yodometano (1,52 se siguió por LCMS. La mezcla se filtró a través de una avó con EtOAc. El filtrado se concentró, y el residuo se e usando EtOAc en heptano al 0-100% como eluyente -ESI (POS.) m/z: 167,1 (M+H)+.
etilo.
6-(Dimetilamino)picolinato de metilo, Ejemplo 3.37. El descrito en el Ejemplo 3.36. LCMS-ESI (POS.) m/z: 181 Ejemplo 3.38: Preparación de 5-cloronicotinato de metil puesto del título se preparó usando el procedimiento H)+.
5-Cloronicotinato de metilo, Ejemplo 3.38. A una sus MeOH (8 ml) se añadió gota a gota cloruro de tionilo ( reflujo durante 24 h. La mezcla se concentró y se aña sódico al residuo. La mezcla resultante se extrajo con disolución de bicarbonato de sodio, agua, y salmuera, de secado se separó por filtración y se lavó con Et compuesto del título (3.38, 698 mg). 1H RMN (400 MHz 8,27 (dd, J = 2,4, 2,4 Hz, 1H), 3,96 (s, 3H).
Ejemplo 3.40: Preparación de 6-([2H3]metoxi)picolinohid ión de ácido 5-cloronicotínico (0,68 ml, 6,35 mmol) en l, 20,55 mmol) a 0°C. La mezcla resultante se calentó a n 50 ml de disolución acuosa saturada de bicarbonato c (4 x 50 ml). Los extractos combinados se lavaron con pués se secaron sobre sulfato sódico anhidro. El agente El filtrado se concentró a vacío y se secó para dar el Cla) 59,80 (d, J = 1,7 Hz, 1H), 8,73 (d, J = 2,4 Hz, 1H),
a.
Etapa 1: 6-([2H3]metoxi)picolinato de ([2H3]metilo) 3. cloropicolinato de metilo (2,00 g, 11,66 mmol, Matrix S 2-metilpropan-2-olato de potasio (1,31 g, 11.66 mmol, 50°C durante 24 h adicionales. La reacción se enfrió a de bicarbonato sódico (20 ml) y se extrajo con EtOA (MgSO4), y se concentraron a vacío. La purificación por 100%) dio el 6-([2H3]metoxi)picolinato de ([2H3]metilo) ( un sólido blanco.
Etapa 2: 6-([2H3]metoxi)picolinohidrazida 3.40. A una 840 mg, 4,85 mmol) en MeOH (26 ml) en un baño de 7,76 mmol) (anhidra) en 1 min. La reacción después se concentró, el sólido resultante se suspendió en EtOA sólido se lavó con EtOAc (2x5 ml) y se secó para obte de rendimiento) en forma de un sólido blanco. 1H RMN 1H), 7,56 (dd, J=7,2, 0,8 Hz, 1H), 6,97 (dd, J=8,3, 0,7 (M+H)+.
Ejemplo 3.42: Preparación de 6-Metilpicolinohidrazida.
un matraz de fondo redondo de 25 ml añadió 6-ic), 1,4-dioxano, CD3OD (5,31 ml, 117 mmol, Aldrich) y ). La reacción se agitó a TA durante 19 h, y después a e diluyó con agua (20 ml) y disolución acuosa saturada 25 ml). Las capas orgánicas combinadas se secaron atografía ultrarrápida (120 g SiO2, EtOAc/hexanos al 0-40 mg, 4,85 mmol, 41,6% de rendimiento) en forma de
ción de 6-([2H3]metoxi)picolinato de ([2H3]metilo) (3.39, a temperatura ambiente se añadió hidrazina (0,244 ml, a TA en atmósfera de N2 durante 22 h. La reacción se l), y la suspensión se filtró pare recoger el sólido. El compuesto del título (3.40, 545 mg, 3,20 mmol, 66,0% MHz, CDCh) 59,74 (br. s., 1H), 7,84 (dd, J=8,3, 7,3 Hz, ), 4,56 (d, J=3,9 Hz, 2H). LCMS-ESI (POS.) m/z: 171,2
6-Metilpicolinato de metilo 3.41: En un matraz de fond 5,35 g, 39,0 mmol) y MeOH (100 ml). Se añadió gota reacción se calentó a reflujo durante 48 h. Después d residuo resultante se diluyó con disolución acuosa sat extractos orgánico se secaron sobre MgSO4, se filtraro g, 35,3 mmol, 90% de rendimiento) en forma de un acei ondo de 250 ml se añadió ácido 6-metilpicolínico (TCI, a ácido sulfúrico concentrado (3,12 ml, 58,5 mmol). La riar a TA se evaporó la mayor parte del disolvente. El de NaHCO3 y se extrajo con DCM (2 x 100 ml). Los concentraron a vacío para dar el 6-metilpicolinato (5,33 arillo claro. MS (M+H)+ 152,0.
6-Metilpicolinohidrazida 3.42. A una disolución agitada (50 ml) en un matraz de fondo redondo de 250 ml, se mezcla se agitó a TA durante 18 h después de lo cual con EtOAc y hexanos y se secó a vacío para dar el co forma de un sólido blanquecino. 1H Rm N (CDCh) 5: 9, 7,30 (d, J=7,7 Hz, 1H), 4,07 (br. s., 2H), 2,57 (s, 3H). L
Los compuestos en la Tabla 4 se sintetizaron siguiendo partida conocido como se describe.
metilpicolinato de metilo (1,50 g, 9,96 mmol) en MeOH gota a gota hidrazina (0,407 ml, 12,95 mmol) a TA La zcla se concentró a vacío. El sólido resultante se trituró to del título (1,40 g, 9,26 mmol, 93% de rendimiento) en . s., 1H), 7,97 (d, J=7,7 Hz, 1H), 7,73 (t, J=7,7 Hz, 1H), SI (POS.) m/z: 152,1 (M+H)+.
rocedimientos en el Ejemplo 3.42 usando el material de
Tabla 4
Ejemplo 3.52: Preparación de 6-(etilcarbamoil)picolinato metilo.
6-(Etilcarbamoil)picolinato de metilo, Ejemplo 3.52. A (0,735 ml, 5,52 mmol, disponible en el mercado en etanamina (0,675 g, 8,28 mmol, disponible en el merc añadió 3-óxido de hexafluorofosfato de (1-[Bis(dimetil mmol, disponible en el mercado en Oakwood Produ seguido de la adición de N,N-diisopropiletilamina (1,92 Corp, St. Louis, MO, EE.UU.). La mezcla resultante se se absorbió directamente sobre un tapón de gel de sílic columna de gel de sílice preempaquetada Redi-Sep (1 100%, para dar el compuesto del título, 6-(etilcar rendimiento). LCMS-ESI (POS.) m/z: 209,1 (M+H)+.
Los compuestos en la siguiente Tabla 5 se sintetizaron material de partida conocido como se describe.
Tabla 5
mezcla de ácido 6-(metoxicarbonil)piridina-2-carboxílico ix Scientific, Columbia, SC, EE.UU.) y el hidrocloruro de o en Fluka, Buchs, St. Gallen, Suiza) en DMF (10 ml) se ino)metilen]-1H-1,2,3-triazolo[4,5-b]piridinio) (2,31 g, 6,07 Inc. West Columbia, SC, Ee .UU.) en porciones a TA, , 11,04 mmol, disponible en el mercado en Sigma-Aldrich ó a TA y se siguió por LCMS. Tras completarse, la mezcla se purificó por cromatografía en columna a través de una g), eluyendo con un gradiente de EtOAc en hexanos al 0-oil)picolinato de metilo (1,11 g, 5,33 mmol, 97% de
iguiendo los procedimientos en el Ejemplo 3.52 usando el
Ejemplo 3.55: Preparación de 6-(etilcarbamoil)picolinato etilo.
6-(Etilcarbamoil)picolinato de metilo, Ejemplo 3.55. El descrito en el Ejemplo 3.52. LCMS-ESI (POS.) m/z: 209, Ejemplo 3.56: Preparación de 6-(dimetilcarbamoil)picoli puesto del título se preparó usando el procedimiento H)+.
de metilo.
6-(Dimetilcarbamoil)picolinato de metilo, Ejemplo 3.56. descrito en Ejemplo 3.52. LCMS-ESI (pOs .): 209,1 (M+
de metilo 4.0: Preparación de N-(4-(2,6-d (trimetilsilil)etil)metanosulfonamida.
mpuesto del título se preparó usando el procedimiento
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-N-(2-
(Z)-N'-(2,6-dimetoxifenil)-2-(6-metoxipicolinoil)-N-(metils disolución de 2-isotiocianato-1,3-dimetoxibenceno (Eje 20,60 mmol) en ACN (98 ml) a TA se añadió carbonato de N2. Se añadió hidrazida del ácido 6-metoxi-piridinaen una porción seguido de nitrato de plata(I) (6,66 g, material obtenido se absorbió sobre un tapón de gel d sílice, eluyendo con un gradiente de MeOH en DCM al g, 9,04 mmol, 46% de rendimiento) en forma de un sólid il)hidrazinacarboximidamida, Ejemplo 4.01. A una 1.0, 3,83 g, 19,62 mmol) y metanosulfonamida (1,96 g, sio. La reacción se agitó durante la noche en atmósfera boxílico (Ejemplo 3.18, 3,44 g, 20,60 mmol) a la mezcla 2 mmol). La mezcla después se agitó durante 2 h. El e y se purificó por cromatografía en columna en gel de %, para proporcionar el compuesto del título 4.01 (3,83 arillo. LCMS-ESI (neg.) m/z: 448,4 (M-H)+.
N-(4-(2,6-Dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-suspensión de (Z)-N'-(2,6-dimetoxifenil)-2-(6-metoxipicol mmol, Ejemplo 4.01) en 1,4-dioxano (45 ml), se añadió durante 18 h. La mezcla de reacción se repartió entre D ml). Se separaron las capas. La capa acuosa se extrajo y se secaron sobre Na2SÜ4. La solución se filtró y se c un tapón de gel de sílice y se purificó por cromatografí B/A al 0-50% (B = 26% de EtOH en EtOAc, A = DCM), mmol, 81% de rendimiento) en forma de un sólido blan (dd, J=8,31, 7,53 Hz, 1H), 7,57 (dd, J=7,43, 0,59 Hz, 6,79 (d, J=8,41 Hz, 2H), 3,67 (s, 6H), 3,10 (s, 3H), 2,82 ( l-3-il)metanosulfonamida, Ejemplo 4.02): A una -N-(metilsulfonil)hidrazinacarboximidamida (3,82 g, 9,02 (3,35 ml, 45,1 mmol). La reacción se calentó a 100°C 100 ml) y disolución saturada de NaHCÜ3(acuosa) (100 DCM (2x50 ml). Los extractos orgánicos se combinaron tró a vacío para dar el producto, que se absorbió sobre olumna en gel de sílice, eluyendo con un gradiente de proporcionar el compuesto del título 4.02 (2,98 g, 7,35 o. 1H RMN (400 MHz, DMSO-ds) 513,34 (s, 1H), 7,80 ,40 (t, J=8,51 Hz, 1H), 6,83 (dd, J=8,22, 0,59 Hz, 1H), ). LCMS-ESI (POS.) m/z: 406,2 (M+H)+.
N-(4-(2,6-Dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-4.0. La N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-mmol) se destiló azeotrópicamente con tolueno y despu 2-(trimetilsilil)etanol (2,022 ml, 14,11 mmol) y se burb cianometilentributil-fosforano (3,06 ml, 12,70 mmol) y s min. La mezcla de reacción después se calentó a 90°C TA, se absorbió sobre un tapón de gel de sílice y se p sílice preempaquetada Redi-Sep (330 g), eluyendo proporcionar el compuesto del título 4.0 (3.07 g, 6.07 m 1H RMN (400 MHz, CD2CL) 57,60 - 7,65 (m, 1H), 7,55 -Hz, 1H), 6,64 (d, J=8,61 Hz, 2H), 4,34 - 4,40 (m, 2H), 0,09 - 0,12 (m, 9H). LCMS-ESI (POS.) m/z: 506,1 (M+H)
Ejemplo 5.0: Preparación de N-(4-(2,6-di (trimetilsilil)etil)etanosulfonamida.
l-3-il)-N-(2-(trimetilsilil)etil)metanosulfonamida, Ejemplo 2,4-triazol-3-il)metanosulfonamida 4.02 (2,86 g, 7,05 suspendió en tolueno (35 ml). A esta mezcla se añadió 2 a través de la disolución durante 3 min. Se añadió bujeó N2 a través de la disolución de nuevo durante 2 nte 15 min. La mezcla de reacción después se enfrió a por cromatografía a través de una columna de gel de n gradiente de EtOAc en hexanos al 0-50%, para 6% de rendimiento) en forma de un sólido blanquecino. (m, 1H), 7,35 (t, J=8,51 Hz, 1H), 6,70 (dd, J=8,12, 0,88 (s, 6H), 3,16 (s, 3H), 2,66 (s, 3H), 1,27 - 1,38 (m, 2H),
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-N-(2-
(Z)-N'-(2,6-dimetoxifenil)-2-(6-metoxipicolinoil)-N-(metils disolución de 2-isotiocianato-1,3-dimetoxibenceno (Eje mmol) en ACN (100 ml) a temperatura ambiente, se añ La reacción se agitó durante el fin de semana. A la me en una porción seguido de nitrato de plata(I) (6,79 g, obtenido se absorbió sobre un tapón de gel de sílice y de sílice preempaquetada Redi-Sep (40 g), eluyendo co = DCM), para proporcionar el compuesto del título 5.0 polvo blanquecino. LCMS-ESI (POS.) m/z: 438,2 (M+H)+ )hidrazinacarboximidamida, Ejemplo 5.01. A una .0, 3,90 g, 20,0 mmol) y etilsulfonamida (1,81 ml, 21,0 arbonato de cesio (8,46 g, 26,0 mmol) en una porción. e añadió 6-metoxipicolinohidrazida (3,51 g, 21,0 mmol) mmol). La mezcla se agitó durante 15 min. El material rificó por cromatografía a través de una columna de gel gradiente de B/A al 0-100% (B = MeOH/DCM al 15%, A 2 g, 18,8 mmol, 94% de rendimiento) en forma de un
N-(4-(2,6-Dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-de (Z)-N'-(2,6-dimetoxifenil)-N-(etilsulfonil)-2-(6-metoxipi en 1,4-dioxano (80 ml) se añadió TFA (6,1 ml, 82 mmol disolvente y el TFA se separaron lo máximo posible en ml) y agua (200 ml), y el pH se ajustó a 7~8 por adició las capas. La capa acuosa se extrajo con DCM (2 x 10 Na2SÜ4. La solución se filtró y se concentraron a vacío de sílice y se purificó por cromatografía a través de una eluyendo con un gradiente de B/A al 0-50% (B = 2 compuesto del título 5.02 (6,47 g, 15,4 mmol, 94% de r MHz, DMSO-ds) 513,26 (s, 1H), 7,80 (dd, J=8,31, 7,53 1H), 6,82 (dd, J=8,31, 0,68 Hz, 1H), 6,79 (d, J=8,61 Hz, (t, J=7,34 Hz, 3H). LCMS-ESI (POS.) m/z: 420,2 (M+H)+ ol-3-il)etanosulfonamida, Ejemplo 5.02. A una disolución oil)hidrazinacarboximidamida 5.01 (7,18 g, 16,4 mmol) mezcla de reacción se calentó a 100°C durante 20 h. El otavapor a 50°C. El residuo se repartió entre DCM (200 disolución saturada de NaHCÜ3(acuosa). Se separaron . Los extractos orgánicos combinados se secaron sobre material así obtenido se absorbió sobre un tapón de gel mna de gel de sílice preempaquetada Redi-Sep (330 g), de EtOH en EtOAc, A = DCM), para proporcionar el iento) en forma de un polvo blanquecino. 1H RMN (400 1H), 7,56 (dd, J=7,43, 0,59 Hz, 1H), 7,40 (t, J=8,51 Hz, , 3,67 (s, 6H), 3,10 (s, 3H), 2,88 (q, J=7,30 Hz, 2H), 1,13
N-(4-(2,6-Dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-5.0. La N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 se destiló azeotrópicamente con tolueno y se sus (trimetilsilil)etanol (5,03 ml, 35,1 mmol). La mezcla se añadió cianometilentributil-fosforano (7,62 ml, 31,6 mm La reacción se calentó a 90°C durante 15 min. La reac de gel de sílice y se purificó por cromatografía a través (330 g), eluyendo con un gradiente de EtOAc en hexa (7,90 g, 15,2 mmol, 87% de rendimiento) en forma de 7,65 (m, 1H), 7,55 - 7,59 (m, 1H), 7,35 (t, J=8,41 Hz, 4,38 - 4,45 (m, 2H), 3,70 (s, 6H), 3,16 (s, 3H), 2,72 (q, 0,09 - 0,12 (m, 9H). LCMS-ESI (POS.) m/z: 520,3 (M+H)
Ejemplo 6.0: Preparación de N-(4-(2,6 (trimetilsilil)etil)metanosulfonamida.
ol-3-il)-N-(2-(trimetilsilil)etil)etanosulfonamida, Ejemplo 2,4-triazol-3-il)etanosulfonamida 5.02 (7,36 g, 17,6 mmol) ió en tolueno (88 ml). A la mezcla se añadió 2-ujeó con nitrógeno gaseoso durante 3 min. Después se la reacción se purgó más con nitrógeno durante 2 min. se enfrió a TA La disolución se absorbió sobre un tapón una columna de gel de sílice preempaquetada Redi-Sep al 0-50%, para proporcionar el compuesto del título 5.0 ólido blanquecino. 1H RMN (400 m Hz, CD2Cl2) 57,60 -6,69 (dd, J=8,12, 0,88 Hz, 1H), 6,63 (d, J=8,61 Hz, 2H), 24 Hz, 2H), 1,32 - 1,38 (m, 2H), 1,01 (t, J=7,34 Hz, 3H),
etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-N-(2-
4-(2,6-Dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triaz forma análoga a la del Ejemplo 2.04, usando 5-metilnico mina, Ejemplo 6.01. El Ejemplo 6.01 se preparó de una idrazida (Disponible en el mercado en Apollo scientific),
N-(4-(2,6-Dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-tri fondo redondo de 250 ml se añadió 6.01 (2,09 g, 6,71
potasio (disolución 1,0 M en THF, 14,77 ml, 14,77 mm cambió a una solución marrón. La mezcla de reacción gota cloruro de metanosulfonilo (0,571 ml, 7,38 mmol). LCMS indicó que la reacción casi se había completado NH4Cl y se extrajo con EtOAc. El sólido blanco insolu deseado. El extracto orgánico se lavó con salmuera y vacío para dar el material en forma de un sólido amarill dar 6.02 (1,5 g, 3,85 mmol, 57.4% de rendimiento) en f la siguiente etapa. LCMS-ESI (POS), m/z: 390,2 (M+H)+ -il)metanosulfonamida, Ejemplo 6.02. En un matraz de en THF (48 ml). Se añadió gota a gota terc-butóxido de agitación en atmósfera de N2. La mezcla de reacción és se agitó a 23°C durante 15 min y se añadió gota a ezcla resultante se agitó durante 3,5 h y el análisis de eacción se inactivó con disolución acuosa saturada de aisló por filtración y se encontró que era el producto ó sobre Na2SO4. La solución se filtró y se concentró a o. Las dos porciones del producto se combinaron para de un sólido amarillo claro, que se usó directamente en
N-(4-(2,6-Dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-tri 6.0. 6.02 (1,5 g, 3,85 mmol) se destiló azeotrópicament añadieron 2-(trimetilsilil)etanol (1,10 ml, 7,70 mmol) atmósfera de N2. La mezcla de reacción se agitó a 90° purificó por cromatografía en gel de sílice (un gradi compuesto del título 6.0 (1,4 g, 2,86 mmol, 74% de ren CDCla) 58,31 (d, J=1,47 Hz, 1H), 8,23 (d, J=1,96 Hz, 1 2H), 4,17 - 4,23 (m, 2H), 3,65 (s, 6H), 2,69 (s, 3H), 2,1 (POS), m/z: 490,3 (M+H)+.
Ejemplo 7.0: Preparación de 2-(5-fluoropirimidin-2-il)eta -il)-N-(2-(trimetilsilil)etil)metanosulfonamida, Ejemplo tolueno y después se suspendió en tolueno (30 ml). Se anometilentributil-fosforano (1,67 ml, 6,93 mmol) en nte 25 min. La mezcla de reacción se enfrió a TA y se de EtOAc en DCM al 0-100%) para proporcionar el to) en forma de un sólido amarillo. 1H Rm N (500 MHz, 48 (s, 1H), 7,28 (t, J=8,39 Hz, 1H), 6,49 (d, J=8,31 Hz, 9 (m, 3H), 1,14 - 1,26 (m, 2H), 0,00 (s, 9H). LCMS-ESI
onamida.
5-Fluoro-2-vinilpirimidina, Ejemplo 7.01. A una disoluci Aldrich) en DMF (100 ml) se añadió tributil(vinil)estaño reacción se purgó con N2 durante 5 min y se añadió desgasificó más con N2 durante 5 min y se agitó a 10 TLC), la mezcla de reacción se enfrió a temperatura a extrajo con éter dietílico (2 x 100 ml) y las capas or secaron sobre Na2SO4 anhidro y se concentraron a pre cromatografía en columna en gel de sílice (columna proporcionar 7.01 (8,0 g, 85,1%) en forma de un aceite.
5 8,58 - 8,49 (m, 2H), 6,86 (dd, J = 17,4, 10,6 Hz, 1H), 6 2-cloro-5-fluoropirimidina (10,0 g, 75,46 mmol, Sigma g, 98,09 mmol) a temperatura ambiente. La mezcla de Ph3)4 (2,62 g, 2,26 mmol). La mezcla de reacción se rante 24 h. Tras completarse la reacción (seguida por te y se inactivó con agua (100 ml). La capa acuosa se s combinadas se lavaron con salmuera (100 ml), se educida para dar el producto inicial que se purificó por sep 120 g; elución: EtOAc en hexanos al 6%) para SI, ion positivo) m/z: 125,1. 1H RMN (400 MHz, CDCl3) , J = 17,3 Hz, 1H), 5,70 (d, J = 10,6 Hz, 1H).
Ácido 2-(5-fluoropirimidin-2-il)etanosulfónico, Ejemplo 7. acuosa saturada de NaHSO3 (80 ml) se agitó a temper (seguida por TLC), la mezcla de reacción se concentró columna ultrarrápida (120 g Redisep elución: H2O en A (16,0 g, 47,9%) en forma de un sólido blanco. 1H RMN Hz, 2H), 2,85 (t, J = 8,2 Hz, 2H).
na disolución de 7.01 (20,0 g, 16,12 mmol) en solución ambiente durante 12 h. Tras completarse la reacción sión reducida, y el residuo se purificó cromatografía en 4-10%) para proporcionar el compuesto del título 7.02 MHz, DMSO-afe) 58,89 - 8,73 (m, 2H), 3,17 (t, J = 8,2
2-(5-Fluoropirimidin-2-il)-N-(4-metoxibencil)etanosulfona 77,30 mmol) en DCM (385 ml) se añadió cloruro de ox mezcla de reacción se agitó a temperatura ambiente d reacción se destiló azeotrópicamente con éter de ciclo cloruro de oxalilo. La mezcla de reacción se diluyó metoxibencilamina (31,8 g, 231,88 mmol) seguido de T temperatura ambiente durante 12 h. Tras completarse inactivó con agua (500 ml). La capa acuosa se extrajo c se lavaron con salmuera (1000 ml), se secaron sobre obtener el material inicial que se purificó por cromatogr EtOAc en hexanos al 55%) para proporcionar el comp amarillento. MS (ESI, ion positivo) m/z: 326,1.
Ejemplo 7.03. A una suspensión de 7.02 (16,0 g, 29,4 g, 231,8 mmol) seguido de DMF (1 ml) a 0°C. La 1 h y se concentró a presión reducida. La mezcla de ilo y metilo para separar las cantidades en trazas de DCM (385 ml), se enfrió a 0°C y se añadieron 4-9,1 g, 386,4 mmol). La mezcla de reacción se agitó a eacción (seguida por TLC), la mezcla de reacción se CM (2 x 400 ml). Las capas orgánicas se combinaron y O4 anhidro y se concentraron a presión reducida para n columna (gel de sílice, n° de malla 100-200; elución del título 7.03 (13,5 g, 53,5%) en forma de un sólido
2-(5-Fluoropirimidin-2-il)etanosulfonamida, Ejemplo 7.0. ml) se añadió TFA (207 ml) a 0°C. La mezcla de reacció la mezcla de reacción se concentró a presión reducida ultrarrápida (elución: EtOAc en hexanos al 65%) para forma de un sólido amarillento. MS (ESI, ion positivo) m/ (s, 2H), 3,54 - 3,48 (m, 2H), 3,24-3,20 (s, 2H).
Ejemplo 8.0: Preparación de 2-(2-ciano-4-fluorofenil)etan suspensión de 7.03 (13,5 g, 41,41 mmol) en DCM (46 agitó a TA durante 12 h. Tras completarse la reacción, rcionando un residuo que se purificó por cromatografía orcionar el compuesto del título 7.0 (5,3 g, 62,5%) en 6,0. 1H RMN (400 MHz, DMSO-afe) 58,77 (s, 2H), 6,92
onamida.
2-(2-Bromo-4-fluorofenil)acetato de metilo, Ejemplo 8. (disponible en el mercado en Combi-Blocks Inc., San añadió cloruro de tionilo (23,5 ml, 0,32 mol) gota a g durante 16 h. La mezcla se enfrió a TA y los compuest diluyó con DCM y se lavó con una solución acuosa de sobre sulfato sódico, se filtraron y se evaporaron para como estaba en la siguiente etapa. 1H RMN (400 MHz, 6,2 Hz, 1H), 7,25 (td, J = 8,5, 2,7 Hz, 1H), 3,82 (s, 2H), una disolución de ácido 2-bromo-4-fluorofenil-acético , CA, EE.UU.) (25,0 g, 0,11 mol) en MeOH (100 ml) se 0°C. La mezcla resultante después se calentó a 80°C látiles se separaron a vacío. El material así obtenido se bonato sódico y agua. Las capas orgánicas se secaron el compuesto del título 8.01 (26 g, 100%), que se usó O-d6) 57,59 (dd, J = 8,6, 2,6 Hz, 1H), 7,47 (dd, J = 8,5, s, 3H).
2-(2-Ciano-4-fluorofenil)acetato de metilo, Ejemplo dimetilacetamida (60 ml) se añadió cianuro de cinc (5,7 se añadió bis-(tri-terc-butilfosfina)paladio (1,7 g, 0,00 durante 18 h en un tubo sellado. Después, la mezcla de EtOAc. Las capas orgánicas combinadas se secaron s obtenido se purificó por cromatografía en columna usan para obtener el compuesto del título 8.02 (5,4 g, 86% DMSO-ds) 57,91-7,81 (m, 1H), 7,68-7,51 (m, 2H), 3,95 A una disolución de 8.01 (8,0 g, 0,032 mol) en 049 mol). Después el matraz se desgasificó con argón y l). La mezcla resultante después se calentó a 110°C ción se enfrió a TA, se diluyó con agua y se extrajo con sulfato sódico y se evaporaron a vacío. El producto así l de sílice y EtOAc y hexanos al 20-25% como eluyente forma de un líquido marrón claro. 1H RMN (400 MHz, ), 3,65 (s, 3H). MS-ESI (NEG.) m/z: 192,2 (M-H)-.
5-Fluoro-2-(2-hidroxietil)benzonitrilo, Ejemplo 8.03. A un se añadió LiBH4 (1,20 g, 0,055 mol) en porciones. completarse la reacción (seguida por TLC), la mezcl disolvente se evaporó para obtener el material inicial qu orgánicas combinadas se secaron sobre Na2SO4, se filt se purificó más por cromatografía en columna usando para obtener el compuesto del título 8.03 (3,1 g, 67% DMSO-ds) 57,81 - 7,73 (m, 1H), 7,52 (dd, J = 10,6, 8,0 2H), 2,91 (t, J = 6,6 Hz, 2H).
olución de 8.02 (5,3 g, 0,027 mol) en THF (60 ml) a 0°C ezcla resultante se agitó a 25°C durante 5 h. Tras reacción se enfrió a 0°C y se inactivó con agua. El diluyó más con agua y se extrajo con EtOAc. Las capas y se evaporaron a vacío para obtener el producto que e sílice y EtOAc en hexanos al 15-20% como eluyente forma de un líquido marrón claro. 1H RMN (400 MHz, 2H), 4,82 (t, J = 5,2 Hz, 1H), 3,64 (dd, J = 11,9, 6,5 Hz,
2-(2-Cloroetil)-5-fluorobenzonitrilo, Ejemplo 8.04. A un añadió cloruro de tionilo (6,6 ml, 0,091 mol) gota a got calentó a 55°C durante 7 h. Tras completarse la reacci vacío para obtener el producto inicial que se diluyó combinadas se secaron sobre Na2SO4, se filtraron y se (3.0 g, 90%) en forma de un líquido marrón que se usó DMSO-d6) 57,81-7,84 (dd, J = 2,4 Hz, 8,8 Hz, 1H), 7,5 3,25 (t, J= 6,8 Hz, 13,2 Hz, 2H). MS-ESI (neg.) m/z: 182 lución de 8.03 (3,0 g, 0,018 mol) en DCM (50 ml) se uido de DMF (4 gotas) a 0°C. La mezcla resultante se eguida por TLC), la mezcla de reacción se concentró a agua y se extrajo con EtOAc. Las capas orgánicas oraron a vacío para obtener el compuesto del título 8.04 siguiente etapa sin más purificación. 1H RMN (400 MHz, 6 (m, 2H), 3,90-3,94 (t, J = 6,8 Hz, 13,6 Hz, 2H), 3,22 -H)-.
2-(2-Ciano-4-fluorofenil)etanosulfonato de sodio, Ejemp (50 ml) a TA se añadió sulfito sódico (3,1 g, 0,024 mo Tras completarse la reacción (seguida por TLC), la mez inicial, que se agitó adicionalmente con EtOAc y s blanquecino, que se usó para la siguiente reacción sin (dd, J = 2 Hz, 8,4 Hz, 1H), 7,47-7,55(m, 2H), 3,05-3,09 2H). MS-ESI (neg.) m/z: 228,0 (M-H)-.
5. A una disolución de 8.04 (3,0 g, 0,016 mol) en H2O mezcla de reacción se calentó a reflujo durante 18 h. reacción se concentró a vacío para obtener el material ó para obtener 8.05 (5,8 g) en forma de un sólido purificación. 1H RMN (400 MHz, DMSO-d6) 57,74-7,76 = 8 Hz, 16,4 Hz, 2H), 2,69-2,74 (t, J= 8,4 Hz, 16,4 Hz,
Cloruro de 2-(2-ciano-4-fluorofenil)etanosulfonilo, Ejem se añadió cloruro de tionilo (2,5 ml, 0,035 mol) gota a g calentó a reflujo durante 16 h. Tras completarse la reac en agua helada y se extrajo con EtOAc. La capa de Et obtener el compuesto del título 8.06 (3,4 g, 84% en do CDCka) 57,47 - 7,38 (m, 2H), 7,33 (td, J = 8,2, 2,7 Hz, ESI (neg.) m/z: 245,9 (M-H)-.
6. A una disolución de 8.05 (5,8 g) en benceno (50 ml) guido de DMF (3 gotas) a 0°C. La mezcla resultante se (seguida por TLC), la mezcla se enfrió a 25°C, se vertió secó sobre Na2SO4, se filtró y se evaporó a vacío para as) en forma de un sólido marrón. 1H RMN (400 MHz, 3,98 (dd, J = 8,7, 6,7 Hz, 2H), 3,56 - 3,53 (m, 2H). MS-
2-(2-Ciano-4-fluorofenil)etanosulfonamida, Ejemplo 8.0. (30 ml, 468 mmol) se añadió 8.06 (1,42 g, 5,73 mmol) durante 2 h. El análisis de LCMS indicaba la reacción solución concentrada de HCl y después se extrajo con bicarbonato sódico dos veces, se secó sobre Na2SO compuesto del título 8.0 (1,1 g, 4,82 mmol, 84% de re m/z: 229,1 (M+H)+.
Ejemplo 9.0: Preparación de(S)-1-(5-fluoropirimidi il)propano-2-sulfonamida.
a mezcla de amoniaco acuoso (10 ml, 77 mmol) y DCM orciones a TA La mezcla de reacción se agitó a 23°C bía completado. La mezcla se neutralizó por adición de . El extracto se lavó con agua y solución saturada de e concentró a vacío. El residuo se secó para dar el ento) en forma de un sólido blanco. LCMS-ESI (POS),
)propano-2-sulfonamida y (R)-1-(5-fluoropirimidin-2-
(E)-5-Fluoro-2-(prop-1-en-1-il)pirimidina y (Z)-5-fluoro magnesio (9,0 g, 371,9 mmol) se añadieron 1-2 cristal 60°C durante 5 min a presión reducida para activar el (370 ml). La mezcla resultante se calentó a 65°C, se mmol), y la mezcla se agitó a 65°C durante 2 h en atm transfirió a un baño de hielo. Después se añadió gota a a lo largo de 10 min. La temperatura interna de la r reactivo de organocinc resultante se agitó a TA dura disolución de 2-cloro-5-fluoropirimidina (disponible en mmol), S-phos (7,7 g, 18,8 mmol) y acetato de paladio nitrógeno gaseoso durante 5 min. Después se añadió g calentó a 60°C durante 12 h. Después de completars 9.01
op-1-en-1-il)pirimidina, Ejemplo 9.01. A virutas de yodo en condiciones anhidras. La mezcla se calentó a sio. El matraz después se enfrió a TA y se añadió THF ió gota a gota (Z/E)-1-bromo-1-propeno (45 g, 371,9 a de nitrógeno. Después, la mezcla se enfrió a TA y se cloruro de cinc (1 M en éter dietílico, 283 ml, 283 mmol) n se mantuvo a ~102C-152C durante la adición, y el min. En un matraz de fondo redondo separado, una rcado en Novochemy, Jupiter, FL, EE.UU.) (25 g, 189 2,1 g, 9,4 mmol) en THF (38 ml) se desgasificaron con gota el reactivo de organocinc. La mezcla resultante se reacción (seguida por TLC), la mezcla de reacción se
inactivó con agua (50 ml) y se acidificó con ácido clorhídric éter dietílico (2 x 500 ml). Las capas orgánicas combinad sulfato sódico y se concentraron a presión reducida a 20° usó como estaba en la siguiente etapa.
(700 ml, pH ~2). La mezcla después se extrajo con lavaron con salmuera (200 ml), se secaron sobre ta un volumen de aproximadamente 50 ml, que se
9.01
Ácido (S)-1-(5-fluoropirimidin-2-il)propano-2-sulfónico y Ejemplo 9.02. A una disolución de 9.01 (188,6 mmol) en sódico (19,6 g, 188,6 mmol en 100 ml de H2O). La mezcla h. Una vez que la reacción se había completado, (seguida con HCl concentrado (10 ml). La capa acuosa se concentr que se suspendió en EtOH (250 ml). El producto así obteni EtOH caliente (100 ml). El filtrado se concentró a presión r IPA (50 ml) para dar el compuesto del título 9.02 (20 g, 48 (s, 2H), 3,47 (td, J = 9,8, 8,2, 4,0 Hz, 2H), 3,06 (dd, J = 16 m/z: 118,9 (M-H)-.
9.02
o (R)-1-(5-fluoropirimidin-2-il)propano-2-sulfónico, (50 ml) se añadió una solución acuosa de bisulfito acción se agitó a temperatura ambiente durante 20 C), la mezcla se acidificó a aproximadamente pH 1 esión reducida para proporcionar el producto inicial calentó a reflujo, se filtró en caliente, y se lavó con a para dar un sólido marrón, que se recristalizó en forma de un sólido. 1H RMN (400 MHz, D2O) 58,69 ,2 Hz, 1H), 1,24 (d, J = 6,5 Hz, 3H). MS-ESI (neg.)
(S)-1 -(5-Fluoropirimidin-2-il)propano-2-sulfonamida y (R)-9.0. Una disolución de 9.02 (80 g, 360 mmol) en cl h. La reacción se concentró a presión reducida para d azeotrópicamente con tolueno (3 x 300 ml). El residuo se d través de la solución durante 15 min a -78°C. La mezcla d reacción se filtró a través de una almohadilla de agente d DCM (100 ml) y EtOAc (100 ml). Los filtrados combinad residuo que se purificó por cromatografía en columna (g proporcionar el compuesto del título 9.0 (43 g, 54%) en for 8,86 (d, J = 1,1 Hz, 2H), 6,90 (s, 2H), 3,57 - 3,51 (m, 2H), MS-ESI (POS.) m/z: 220,0 (M+H)+.
Ejemplo 10.0: Preparación del Ejemplo (2S,3R)-3-(5-metilpi luoropirimidin-2-il)propano-2-sulfonamida, Ejemplo
de tionilo (268 ml, 3600 mmol) se calentó a 60°C durante 3 compuesto de cloruro de tionilo, que se destiló
con DCM (1,0 l) y se burbujeó amoniaco gaseoso a
s se agitó a TA durante 1 h. Después, la mezcla de
ción de marca Celite® y la almohadilla se lavó con
concentraron a presión reducida para obtener un
sílice, elución EtOAc en hexanos al 0-60%) para
un sólido blanco. 1H RMN (400 MHz, DMSO-ófe) 5
dd, J = 15,4, 11,1 Hz, 1H), 1,19 (d, J = 6,5 Hz, 3H).
-2-il)butano-2-sulfonamida.
(E)-2-(But-2-en-2-il)-5-metilpirimidina, Ejemplo 10.01. Se a but-2-en-2-iltrifluoroborato de potasio (Sigma Aldrich, 31 Pd2(dba)3 (13,82 g, 15,09 mmol) en un matraz, que desp on 2-cloro-5-metil-pirimidina (18 ml, 151 mmol), (Z)-1 mmol), triciclohexilfosfina (8,5 g, 30,2 mmol), y desgasificó y se volvió a llenar con nitrógeno. Se
añadió al matraz 1,4-dioxano (252 ml) y solución ac reacción resultante se calentó a 100°C durante 16 h. L de un tapón de gel de sílice, después se cargó sobre (but-2-en-2-il)-5-metilpirimidina 10.01 (19 g, 125 mmol, de fosfato potásico tribásico (37,5 ml, 453 mmol). La cción después se enfrió a TA El residuo se filtró a través sílice (EtOAc en heptanos al 0-20%) para dar la (E)-2-de rendimiento).
2-(2-Cloro-3-(pirimidin-2-iltio)butan-2-il)-5-fluoropirimidin g, 132 mmol) en DCM (440 ml) se añadió cloruro de durante 1 h y 1 h más a 23°C. A la mezcla de reacció (20 g, 132 mmol) gota a gota, y la mezcla se agitó más vacío. Se añadió solución acuosa de bicarbonato sód reacción se extrajo con EtOAc y se concentró a vacío. al 0-25% para dar el producto deseado 2-(2-cloro-3-(p de rendimiento).
jemplo 10.02. A una disolución de pirimidina-2-tiol (14,8 nilo (10,73 ml, 132 mmol). La reacción se agitó a 0°C ia se añadió (£)-2-(but-2-en-2-il)-5-metilpirimidina 10.01 nte 2 h. La mezcla de reacción después se concentró a la mezcla para neutralizar la mezcla de reacción. La siduo se purificó en gel de sílice con EtOAc en hexanos in-2-iltio)butan-2-il)-5-fluoropirimidina 10.02 (30 g, 76%
2-(2-Cloro-3-(pirimidin-2-ilsulfonil)butan-2-il)-5-metilpirim (pirimidin-2-iltio)butan-2-il)-5-metilpirimidina 10.02 (30 cloroperoxibenzoico (45,0 g, 201 mmol). La reacción se se añadieron solución acuosa de bicarbonato sódico concentró a vacío para dar el producto deseado 2-(2-(33,2 g, 100 mmol, 100% de rendimiento).
, Ejemplo 10.03. A una disolución de 2-(2-cloro-3-00 mmol) en DCM (201 ml) se añadió ácido metaa 23°C durante 1 d. La reacción se concentró a vacío y sulfato sódico. La mezcla se extrajo con EtOAc y se 3-(pirimidin-2-ilsulfonil)butan-2-il)-5-metilpirimidina 10.03
(E)-3-(5-metilpirimidin-2-il)but-2-eno-2-sulfinato de pota 2-ilsulfonil)butan-2-il)-5-fluoropirimidina 10.03 (33 g, 10 (27,6 g, 200 mmol). La reacción se agitó a 23°C durant deseado el (£)-3-(5-metilpirimidin-2-il)but-2-eno-2-sulfin usó sin más purificación.
jemplo 10.04. A una solución de 2-(2-cloro-3-(pirimidinol) en MeOH (249 ml) se añadió carbonato de potasio h. La reacción se concentró a vacío para dar el producto e potasio 10.04 (21,57 g, 100% de rendimiento), que se
(E)-3-(5-Metilpirimidin-2-il)but-2-eno-2-sulfonamida, Eje il)but-2-eno-2-sulfinato de potasio (Ejemplo 10.04, 21,5 de potasio (5,30 ml, 85 mmol), seguido de ácido ami agitó a 23°C durante 24 h. La reacción se extrajo con purificó en gel de sílice eluyendo con EtOAc en h metilpirimidin-2-il)but-2-ene-2-sulfonamida 10.05 (12 g, 10.05. A una disolución de (£)-3-(5-metilpirimidin-2-5 mmol) en agua (424 ml, 85 mmol) se añadió acetato oximonosulfúrico (19,18 g, 170 mmol). La reacción se c y se concentró a vacío. El producto así obtenido se s al 0-50% para dar el producto deseado (E)-3-(5-e rendimiento).
(2S,3R)-3-(5-Metilpirimidin-2-il)butano-2-sulfonamida, E il)but-2-eno-2-sulfonamida 10.05 (1,0 g, 4,32 mmol) en (0,314 g, 0,865 mmol), tetrafluroborato de (r)-(-)-4,1 (Strem Chemicals, 0,151 g, 0,173 mmol) seguido de hid h. La reacción se filtró para dar la (2S,3R)-3-(5-me rendimiento). Las aguas madre se concentraron a va EtOAc/EtOH (3/1) en hexanos para dar el producto de aumentó por cristalización en EtOH a >99% de ee. 1H J=6,85 Hz, 3H), 2,25 (s,H 3H), 3,60 - 3,79 (m, 2H), 6,82 Los compuestos en la siguiente Tabla se sintetizaron material de partida conocido como se describe.
T o 10.0. A una disolución de (£)-3-(5-metilpirimidin-2-(10,81 ml) se añadió trifluorometanosulfonato de cinc difenilfosfino)[2.2]paraciclofano(1,5-ciclooctadieno)rodio o (8,72 mg, 4,32 mmol). La reacción se agitó durante 3 idin-2-il)butano-2-sulfonamida 10.0 (0,65 g, 64% de el material se purificó en gel de sílice eluyendo con en forma de un sólido incoloro. El ee del material se 400 MHz, DMSO-cfe) 51,20 (d, J=6,85 Hz, 3H), 1,32 (d, ), 8,61 (s, 2H). MS ESI (pos.) m/z: 230,2 (M+H)+.
ndo los procedimientos en el Ejemplo 10.0 usando el
Ejemplo 11.0: Preparación de (1R,2S)-1-hidr sulfonamida y (1 S,2R)-1 -hidroxi-N,N-bis(4-metoxibencil) N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-metilpirimidin-2-il)propano-2-sulfonamida.
5-Metil-2-vinilpirimidina, Ejemplo 11.01. Un matraz de refrigerante de reflujo, un controlador de temperatura 778 mmol), viniltrifluoroborato de potasio (156 g, 1167 (156 ml, 1945 mmol) y una barra agitadora grande. S minutos y después se añadió THF (244 ml). Se burbuj añadió cloruro de paladio (II) (1,72 g, 38,9 mmol).
temperatura se elevó a 62°C y se continuó agitando ha a través de copas de filtro Whatman GF/F, lavando co se separaron las capas. La capa acuosa se extrajo combinaron y se secaron sobre MgSÜ4 anhidro y des rotavapor a 20°C y 115 torr durante un periodo de tie purificó más por destilación Kugelrohr para aislar el amarillo claro. 1H RMN (400 MHz, CDCka) 52,31 (s, 3 (dd, J=17,41, 10,56 Hz, 1H), 8,54 (s, 2H). LCMS-ESI (p redondo de 3 bocas, de 3 litros, se equipó con un eptum y se cargó con 2-cloro-5-metilpirimidina (81 ml, , trifenilfosfina (18,02 ml, 78 mmol), carbonato de cesio ió agua (1565 ml) y la mezcla se agitó durante varios ón a través de la mezcla durante 5 min y después se cción se burbujeó más con argón durante 5 min. La alización. La reacción después se enfrió a TA y se filtró La mezcla se transfirió a un embudo de separación, y n éter dietílico (4 x 200 ml). Las capas orgánicas se e filtraron. La mezcla se concentró parcialmente en el prolongado para dar un líquido naranja. El material se uesto del título (65,4 g, 70%) en forma de un aceite 68 (d, J=10,56 Hz, 1H), 6,55 (d, J=17,22 Hz, 1H), 6,86 /z:121,1 (M+H)+.
1 -(5-Metilpirimidin-2-il)etano-1,2-diol, Ejemplo 11.02. A traz de fondo redondo de 2000 ml se añadió 5-metil-2-
vinilpirimidina (64,5 g, 537 mmol), tetraóxido de osmio metilmorfolina-n-óxido, al 50% en peso en agua (40 ml, mezcla de reacción se agitó durante 2 d. El análisis disolvente se separó a vacío. El compuesto se purificó VC, después EtOAc-EtOH (3:1) en heptano al 0-100% VC. El compuesto deseado se recogió y se concentró para dar un sólido, que se filtró. El sólido se lavó con para dar el compuesto del título (67,3 g). 1H RMN (400 (m, 2H), 2,36 (s, 3H).
ml, 3,93 mmol) y 1,4-dioxano (537 ml, 537 mmol), 4-mmol) y 4-metilmorfolina-4-óxido (94 g, 805 mmol). La MS mostró que la reacción se había completado y el l de sílice. El gradiente era heptano al 100% durante 3 te 6 VC, después EtOAc:EtOH (3:1) al 100% durante 5 o. El material se trituró con EtOAc en hexanos al 40% c en hexanos al 20% varias veces y después se secó CDCb) 58,59 (s, 2H), 4,81 - 4,98 (m, 1H), 3,88 - 4,19
5-Metilpirimidina-2-carbaldehído, Ejemplo 11.03. Un ma con 1 -(5-metilpirimidin-2-il)etano-1,2-diol (64,3 g, 417 m enfrió en un baño de hielo-agua. Se añadió peryodato interna hasta volver a TA La reacción se agitó más a solución resultante se filtró a través de un tapón de disolvente se concentró a vacío y el aldehído se destiló del título (44 g) en forma de un sólido blanco. LCMS-ESI e 5 litros equipado con un agitador mecánico se cargó 1,4-dioxano (1043 ml) y agua (261 ml). La reacción se odio (223 g, 1043 mmol) y se controló la temperatura rante 2 h y 20 min. Después se añadió DCM (2 l). La 4 seco (700 g). El tapón se lavó con DCM (7 l). El rópicamente con tolueno para suministrar el compuesto .) m/z: 122,8 (M+H)+.
(1 R,2S)-1 -Hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1 -(5-metilpirimidin-2-il)propano-2-sul metilpirimidin-2-il)propano-2-sulfonamida y (1 S,2R)-1 -hi 2-sulfonamida Ejemplo 11.04. La sulfonamida 12.0 se d cargó con N,N-bis(4-metoxibencil)etanosulfonamida (1 nitrógeno y después se equipó con un embudo de adici se enfrió en un baño de hielo seco-acetona. Primero mmol) al embudo de adición. Se añadió lentamente al mediante cánula 5-metilpirimidina-2-carbaldehído (11. reacción continuó a -782C durante 45 min y después s Se añadió una solución saturada de cloruro amónico pa concentró a vacío para dar el producto.
-2-il)propano-2-sulfonamida y (1 S,2S)-1 -hidroxi-N,N-ida y (1 R,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5--N,N-bis(4-metoxibencil)-1 -(5-metilpirimidin-2-il)propanoazeotrópicamente con tolueno. Un matraz de 3 litros se 432 mmol) y THF anhidro (1200 ml) en atmósfera de eviamente secado en atmósfera de nitrógeno. El matraz ñadió mediante cánula n-butil-litio (1,6M, 270 ml, 432 z de reacción y se agitó durante 10 min. Se añadieron 4 g, 360 mmol) en THF (300 ml) en la reacción. La ntó a t.a. y se continuó agitando durante 2 h y 10 min. activar la reacción y la mezcla se extrajo con EtOAc y se
(1 R,2S)-1 -Hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sul separó y purificó en gel de sílice eluyendo con gradie título (56,4 g). LCMS-ESI (pos.) m/z:472,1 (M+H)+.
-2-il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-ida, Ejemplo 11.0. La mezcla de diastereómeros se e EtOAc al 0-50% en DCM para dar el compuesto del
(1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sul condiciones descritas en el Ejemplo 11.0 suministró el c
Ejemplo 12.0: Preparación de W,W-bis(4-metoxibencil)e 2-il)propano-2-sulfonamida y (1 R,2R)-1 -hidroxi-N,N-ida Ejemplo 11.05. La elución adicional en las esto del título. LCMS-ESI (pos.) m/z:472,1 (M+H)+.
ulfonamida.
Bis(4-metoxibencil)amina, Ejemplo 12.01. Se añadier metoxibenzaldehído (532 ml, 4,37 mol, 1 eq) a un m agitación. La reacción se calentó espontáneamente y s 1 h. A la mezcla anterior se añadió EtOH anhidro (4,8 metoxibencilamina (sola, 600 g, 4,37 mol, 1 eq) y 4 de fondo redondo de 10 l a temperatura ambiente con ervó un precipitado blanco. La mezcla se agitó durante e continuó agitando a TA durante 15-30 min. A esto le
siguió la adición de gránulos de borohidruro sódico (99 adición de NaBH4, la temperatura interna de la reacc durante la noche. La reacción se inactivó lentamente c 50°C. El residuo se repartió entre agua (4 l) y DCM ( capas orgánicas combinadas se secaron sobre Na2S metoxibencil)amina 12.01 (1112 g, 99% de rendimiento en la siguiente etapa sin más purificación. 1H-RMN (40 Hz, 4H), 3,83 (s, 6H), 3,76 (s, 4h ) (No se observaba un 2 mol, 0.6 eq) en porciones en ~ 2 h (Nota: Durante la ubió a 42°C) y se agitó más a temperatura ambiente ua (600 ml). La mezcla se concentró en un rotavapor a a capa acuosa se extrajo con más DCM (2 x 2 l). Las e filtraron y se concentraron a vacío para dar bis(4-rma de un semisólido. El material se usó directamente z, CDCk3) 57,28 (t, J = 7,12 Hz, 4H), 6,89 (d, J = 8,60 -NH). MS (ESl ion positivo) m/z: = 258,4 (M+H)+.
N,N-bis(4-metoxibencil)etanosulfonamida, Ejemplo 12.0 3,49 mol, 1 eq) en DCM (9 l) se añadió TEA (634 ml, 4, de etanosulfonilo (399 ml, 4,19 mol, 1,2 eq). (La temper cloruro de etanosulfonilo). Una vez completada la adic TLC mostró la pérdida completa del material de partida. de reacción. Se separaron las capas y la capa acu combinadas se lavaron con salmuera (2x 1 l), se secar obtenido se adsorbió sobre un tapón de gel de sílice y 120) eluyendo con un gradiente de EtOAc en hexano (1125 g, 3,22 mol, 92%) en forma de sólido blanco. 1H 6,90 (dd, J = 2,12, 6,60 Hz, 4H), 4,29 (s, 4H), 3,83 (s, MS (ESI ion positivo) m/z: 372,2 (M+Na)+.
Ejemplo 13.0: Preparación de N,N-bis(4-metoxibencil)m a disolución de bis(4-metoxibencil)amina 12.01 (900 g, ol, 1,3 eq), seguido de la adición gota a gota de cloruro interna se mantuvo entre 5-10°C durante la adición del e retiró el baño de enfriamiento. Después de 1,5 h, la acción se inactivó por adición de agua (4 l) a la mezcla se extrajo con DCM (2 x 2 l). Las capas orgánicas bre Na2Sü4, y se concentraron a vacío. El material así urificó por cromatografía (gel de sílice (n° de malla 60 0-80%) para proporcionar el compuesto del título 12.0 (400 MHz, CDCka) 57,23 (dd, J = 2,08, 6,62 Hz, 4H), ,92 (q, J = 7,40 Hz, 2H), 1,33 (t, J = 7,40 Hz, 3H). GC-
sulfonamida.
N,N-bis(4-metoxibencil)metanosulfonamida, Ejemplo 13 g, 0,389 mol, 1 eq) en DCM (1 l) se añadió TEA (71 cloruro de metanosulfonilo (36 ml, 0,46 mol, 1,2 eq). ( adición del cloruro de metanosulfonilo). Una completad h, la TLC mostró la pérdida completa de material de p capas y la capa acuosa se extrajo con DCM (2x 500 ml (2x 1 l), se secaron sobre Na2SO4, y se concentraron a gel de sílice y se purificó por cromatografía (gel de sílic en hexanos al 10-80%) para proporcionar 120 g (0,36 sólido blanco. 1H-RMN (400 MHz, CDCka) 57,26 (dd, (s, 4H), 3,83 (s, 6H), 2,75 (s, 3H). GC-MS (ESl ion positi
Ejemplo 14.0: Preparación de (1R,2S)-1-metoxi-1-(5-me una disolución de bis(4-metoxibencil)amina 12.01 (100 506 mol, 1,3 eq) seguido de la adición gota a gota de mperatura interna se mantuvo entre 5-10°C durante la ición se retiró el baño de enfriamiento. Después de 1,5 . Se añadió agua (1 l) a la reacción. Se separaron las capas orgánicas combinadas se lavaron con salmuera El material así obtenido se absorbió sobre un tapón de de malla 60-120) eluyendo con un gradiente de EtOAc 2%) del compuesto del título Ejemplo 13.0 en forma de 2, 6,60 Hz, 4H), 6,91 (dd, J = 2,12, 6,62 Hz, 4H), 4,28 /z: = 335 (M+H)+.
idin-2-il)propano-2-sulfonamida, 14.0
(E)-5-Metil-2-(prop-1 -en-1 -il)pirimidina, Ejemplo 14.01.
5-metilpirimidina (12 g, 93 mmol), (E)-trifluoro(prop-1-potasio (59,4 g, 280 mmol). El matraz se purgó con N2 ml). La suspensión amarilla resultante se burbujeó con t-butil-p-metilaminofenil]paladio(ll) (Amphos, disponible 14.01
matraz de fondo redondo de 500 ml se añadió 2-clorol)borato de potasio (17,27 g, 117 mmol), y fosfato de después se añadieron 1,4-dioxano (200 ml) y agua (20 ante 15 min y después se añadió cloruro de 1,1 -bis[(dil mercado en Strem, 2,64 g, 3,73 mmol), se unión un
refrigerante de reflujo y la reacción se calentó a 90°C 16.5 h. La reacción después se enfrió a TA La reacción ml). Las capas orgánicas se combinaron, se secaro cromatografía ultrarrápida en gel de sílice eluyendo con il)pirimidina 14.01 (12.96 g, 97 mmol, 100% de rendi RMN (300 MHz, CDCk3) 5 = 8,49 (s, 2H), 7,01 -7,20 (m, 6,8, 1,6 Hz, 3H). MS (eSi ion positivo) m/z: 135,2 (M+H) baño de aceite y se agitó en atmósfera de N2 durante luyó con agua (250 ml), y se extrajo con EtOAc (2 x 250 SO4), y se concentraron. El residuo se purificó por % EtOAc/hexanos) para dar (E)-5-metil-2-(prop-1-en-1-) en forma de un sólido aceitoso amarillo/naranja. 1H 6,57 (dd, J= 15,6, 1,7 Hz, 1H), 2,29 (s, 3H), 1,97 (dd, J=
(1 R,2R)-1 -(5-Metilpirimidin-2-il)propano-1,2-diol, Ejempl metil-2-(prop-1-en-1-il)pirimidina, 14.01 (5,75 g, 42,9 acetona (60 ml) y agua (6 ml) se añadió tetraóxido de o resultante se agitó a TA en atmósfera de N2 durante 21, se concentró a vacío. El residuo se disolvió en DCM, cromatografía ultrarrápida (120 g de SiO2, MeOH/D metilpirimidin-2-il)propano-1,2-diol y (2R,2R)-1 -(5-metil rendimiento) en forma de un sólido amarillo claro. 1H (br. s., 1H), 4,09-4,25 (m, 1H), 2,86 (d, J= 7,2 Hz, 1H), 2 169,2 (M+H). Condiciones quirales. Se preparó un K2OsO2(OH)4; (16,4 g, 49,9 mmol) K3Fe(CN)6; (6,89 g, un matraz de fondo redondo de 50 ml se añadió t-BuO antes) y metanosulfonamida (95 mg, 1,00 mmol). La enfrió a 0°C. Se añadió (E)-5-metil-2-(prop-1 -en-1 -il)piri BuOH (1 ml) y la suspensión se agitó a 0°C 2 h. El anál se dejó calentar lentamente a TA a medida que fundía LCMS mostró ~90% de conversión. La reacción se inac se extrajo con EtOAc (2x20 ml). Las capas orgánicas (MgSO4), y se concentraron. La capa acuosa se extraj CHCl3 (2x50 ml). Las capas orgánicas combinadas se columna ultrarrápida (12 g SiO2, 3:1 EtOAc:EtOH/he il)propano-1,2-diol (Ejemplo 14.02, 88,6 mg, 0,527 mmo incoloro. Análisis quiral: el análisis quiral por SFC most um), modificador orgánico al 10% (iPrOH con amon temperatura de columna =TA, BRP=105 bar.
02. Condiciones racémicas. A una disolución de (E)-5-l) y 4-metilmorfolina-4-óxido (7,53 g, 64,3 mmol) en 4% en peso, en agua (0,681 ml, 0,11 mmol). La mezcla a reacción se pasó por un cartucho Varian Chem-Elut y có (MgSO4), y se concentró. El residuo se purificó por l 0-10%) para dar el sin-diol racémico (1S,2S)-1-(5-din-2-il)propano-1,2-diol (5,85 g, 34,8 mmol, 81% de 300 m Hz, CDCh) 58,59 (s, 2H), 4,67 (br. s., 1H), 4,33 , 3H), 1,30 (d, J=6,6 Hz, 3H). MS (ESI ion positivo) m/z:
de AD-mix-beta a partir de: (26 mg, 0,07 mmol) mmol) K2CO3; (125 mg, 0,16 mmol) (DhQd)2PHAL. En ml), agua (5.00 ml), y 1,4 g de AD-mix-beta (preparado a se agitó a TA hasta ser transparente, y después se a (compuesto intermedio 14.01 168 mg, 1 mmol) en te LCMS (1.5 h) muestra ~10% conversión. La reacción ño de hielo y se agitó 22 h adicionales. El análisis de on solución acuosa saturada de sulfito sódico (10 ml), y inadas se lavaron con NaOH 2 N (10 ml), se secaron DCM (2x50 ml), EtOAc (2x50 ml), y iPrOH al 10% en entraron y el residuo se purificó por cromatografía en al 5-100%) para dar el (1R,2R)-1-(5-metilpirimidin-2-7% de rendimiento) en forma de un aceite transparente, e el % de ee era 94,8% usando AS-H (100x2,1 mm, 3 20 mM), dióxido de carbono al 90%. F=1,0 ml/min,
5-Metil-2-((2R,3R)-3-metiloxiran-2-il)pirimidina, Ejempl metilpirimidin-2-il)propano-1,2-diol 14.02 (1,46 g, 8,68 se añadió 1,1,1-trimetoxietano (2,50 ml, 2,29 mmol). De porciones con 5 min de separación. La reacción tenía adición de TMSCl (23-28°C). La reacción se agitó a indicaba la conversión incompleta. Por lo tanto, se añ ml, 9,95 mmol) y clorotrimetilsilano (1,25 ml, 9,85 mm ((M+H)+ = 229). La reacción se concentró a vacío. El re potasio (1,50 g, 10,85 mmol) y la reacción se agitó a T completa al producto que correspondía al epóxido des filtración se lavó con DCM (5 ml), y los filtrados com cromatografía en columna ultrarrápida en gel de sílice 2-((2R,3R)-3-metiloxiran-2-il)pirimidina 14.03 (1,00 g, transparente. 1H RMN (300 MHz, CDCh) 58,54 (s, 2H), (d, J=5,1 Hz, 3H). MS (ESI ion positivo) m/z: 151,2 (M+ .03. A una disolución del sin-diol (1R,2R)-1-(5-en DCM (25 ml) (enfriada con un baño de agua a TA) se añadió clorotrimetilsilano (2,50 ml, 19,7 mmol) en 2 equeña reacción exotérmica en la primera parte de la atmósfera de N2 durante 23 h. El análisis de LCMS n 1,25 equiv. adicionales de 1,1,1-trimetoxietano (1,25 la reacción se agitó durante 24 h adicionales. LCMS; se disolvió en MeOH (20 ml) y se añadió carbonato de nte 4 h. El análisis de LCMS (4 h) mostró la conversión LCMS; ((M+H)+ =151). La reacción se filtró, la torta de s se concentraron a vacío. El residuo se purificó por do con EtOAc/hexanos al 0-100%) para dar la 5-metilmmol, 77%) en forma de un aceite amarillo claro, (d, J=1,9 Hz, 1H), 3,32-3,53 (m, 1H), 2,31 (s, 3H), 1,50
(1R,2S)-2-(Benzo[d]tiazol-2-iltio)-1-(5-metilpirimidin-2-il) ((2R,3R)-3-met¡lox¡ran-2-¡l)pir¡m¡d¡na 14.03 (250 mg, 1, mg, 1,465 mmol), seguido de tris(((trifluorometil)sulfonil 35°C en un bloque de calentamiento durante 17 h y mo enfrió a TA, se cargó en un tapón de sílice, y se pur 3:1/heptano al 5-100%) para dar el (1R,2S)-2-(benzo mg, 1,35 mmol, 100% de rendimiento) en forma de u 8,60 (s, 2H), 7,88 (d, J=7,6 Hz, 1H), 7,71-7,81 (m, 1H), 4,70 (qd, J=7,1,3,1 Hz, 1H), 2,32 (s, 3H), 1,33 (d, J=7,0 -1-ol, Ejemplo 14.04. A una disolución de 5-metil-2-ol) en DCM (5 ml) se añadió benzo[d]tiazol-2-tiol (245 rbio (83 mg, 0,133 mmol). La suspensión se calentó a 0% de conversión al producto deseado. La reacción se or cromatografía ultrarrápida (12 g SiÜ2, EtOAc:EtOH ol-2-iltio)-1-(5-metilpirimidin-2-il)propan-1-ol 14.04 (428 te incoloro transparente. 1H r Mn (300 MHz, CDCL) 5 (td, J=7,7, 1,3 Hz, 1H), 7,27-7,35 (m, 1H), 5,31 (s, 1H), H). MS (ESI ion positivo) m/z: 318,2 (M+H)+.
2-(((1R,2S)-1-Metoxi-1-(5-metilpirimidin-2-il)propan-2-il)t equipado con un agitador magnético se cargó (1R, 14.04 (350 mg, 1,103 mmol) en 2-metiltetrahidrofurano gota a gota bis(trimetilsilil)amida de potasio (solución min, se volvió en solución amarilla). La mezcla result trifluorometanosulfonato de metilo (374 pl, 3,31 mmol reacción se agitó a -78°C durante 15 min. El análisis d de reacción se inactivo con solución acuosa saturada d la capa acuosa se volvió a extraer con EtOAc (3x75 ml se secaron (Na2SO4), y se concentraron. El material columna de gel de sílice ultra Biotage 50 g, eluyend proporcionar 2-(((1R,2S))-1-metoxi-1-(5-metilpirimidin-2 rondas) en forma de un aceite amarillo claro.
zo[d]tiazol, Ejemplo 14.05. En un matraz de 50 ml benzo[d]tiazol-2-iltio)-1-(5-metilpirimidin-2-il)propan-1-ol l). La mezcla de reacción se enfrió a -78°C y se añadió THF, 1,32 pl, 1,32 mmol)) (tiempo total de adición: 2 e agitó durante 1 h y después se añadió gota a gota volvió en solución amarillo más claro). La mezcla de S mostró conversión completa al producto. La mezcla Cl (30 ml) a -78°C. La reacción se dejó calentar a TA y capas orgánicas combinadas se lavaron con salmuera, tenido se purificó por cromatografía a través de una un gradiente de EtOAc en hexanos al 0-25%, para pan-2-il)tio)benzo[d]tiazol 14.05 (0.32 g, 75% en dos
2-(((1R,2S)-1-Metoxi-1-(5-metilpirimidin-2-il)propan-2-il) disolución de 2-(((1R,2S)-1-metoxi-1-(5-metilpirimidin-2-DCM (2,8 ml) a 0°C se trató con ácido 3-cloroperoxiben 0°C durante 1 h antes de retirar el baño de hielo. La durante 40 h adicionales. La reacción se inactivó con s acuosa saturada de bicarbonato sódico (5 ml), y despu (2x20 ml) y las capas orgánicas se combinaron, se l salmuera (10 ml), se secaron (MgSO4) y se filtraron. peróxido presente. Los filtrados se concentraron para del residuo por cromatografía ultrarrápida (40 g S¡O2, 1-(5-metilpirimidin-2-il)propan-2-il)sulfonil)benzo[d]tiazol pureza) en forma de una espuma blanca. 1H rMN (300 1H), 7,54-7,67 (m, 2H), 5,25-5,34 (m, 1H), 4,23 (qd, J= 3H). MS (ESI ion positivo) m/z : 364,0 (M+H).
il)benzo[d]tiazol, Ejemplo, Ejemplo 14.06. Una an-2-il)tio)benzo[d]tiazol 14.05 (313 mg, 0,94 mmol) en 77% máx. (476 mg, 2,13 mmol). La reacción se agitó a la se dejó calentar a temperatura ambiente y se agitó n acuosa saturada de bisulfito sódico (6 ml), disolución agitó durante 10 min. La reacción se extrajo con EtOAc n con solución acuosa saturada de NaHCO3 (10 ml), icador de tira de yoduro/almidón indicó que no había aceite incoloro transparente (360 mg). La purificación EtOH 3:1/heptano al 0-100%) dio 2-(((1R,2S)-1-metox¡-(285 mg, 0,78 mmol, 83% de rendimiento, 77% de CDCh) 58,57 (s, 2H), 8,18-8,28 (m, 1H) 7,97-8,05 (m, 1 Hz, 1H), 3,41 (s, 3H), 2,31 (s, 3H), 1,49 (d, J=7,2 Hz,
(1R,2S)-1-Metoxi-1-(5-metilpirimidin-2-il)propano-2-sulfi (((1R,2S)-1-metoxi-1-(5-metilpirimidin-2-il)propan-2-il)sul (1843 pl) se añadió carbonato de potasio (204 mg, 1,48 LCMS mostró la formación del producto deseado en f reacción se concentró a vacío (sólido amarillo) y se epimerización en esta reacción (~15%).
de potasio, Ejemplo 14.07. A una disolución de 2-enzo[d]tiazol 14.06 (268 mg, 0,74 mmol) en MeOH l). La reacción se agitó a TA durante 17 h. El análisis de del ácido sulfínico 14.07. LCMS ((M+H)+ =231,1). La irectamente en la siguiente etapa. Nota: Se produce
(1R,2S)-1-Metoxi-1-(5-metilpirimidin-2-il)propano-2-sulfo metoxi-1-(5-metilpirimidin-2-il)propano-2-sulfinato de pot se añadió acetato de potasio (72,4 mg, 0,74 mmol), seg mmol). La mezcla de reacción se agitó a TA durante 4 deseado más un pico pequeño que correspondía al es (2x) y las capas orgánicas se combinaron, se secaron una columna de gel de sílice eluyendo con (EtOAc: metilpirimidin-2-il)propano-2-sulfonamida 14.0 (114 mg, blanco. (contenía ~15% de otros diastereómeros). 1H R 4,78 (br. s., 2H), 3,74 (qd, J=7,1, 3,3 Hz, 1H), 3,51 (s, 3 m/z: 246,1 (M+H)+.
Los compuestos expuestos en la siguiente Tabla 7 se usando el material de partida conocido como se describ
T a, Ejemplo 14.0. A una suspensión de (1R2S)-1-(Ejemplo 14.07, 198 mg, 0,74 mmol) en agua (3,7 ml) de ácido hidroxilamina-o-sulfónico, 97% (167 mg, 1,476 El análisis de LCMS mostró la formación del producto isómero. La mezcla de reacción se extrajo con EtOAc O4), y se concentraron a vacío. El residuo se cargó en 3:1)/DCM al 0-30% para dar (1R,2S)-1-metoxi-1-(5-5 mmol, 63,0% de rendimiento) en forma de un sólido 300 MHz, CDCh) 58,63 (s, 2H), 5,10 (d, J=3,3 Hz, 1H), 36 (s, 3H), 1,33 (d, J=7,1 Hz, 3H). MS (ESI ion positivo)
zaron siguiendo los procedimientos en el Ejemplo 14.0
7
Ejemplo 14.8: Preparación de (1R,2S)-1-metoxi-1-(5-me irimidin-2-il)propano-2-sulfonamida.
(1R,2S)-1-Metoxi-1-(5-metoxipirimidin-2-il)propano-2-sul subproducto de la síntesis de la (1R,2S)-1-metoxi-1-durante la etapa 14.07 y se aisló en la etapa final de l 14.8 (240 mg, 10% de rendimiento) en forma de un sóli 1H), 4,77 (br. s, 2H), 3,97 (s, 3H), 3,67-3,77 (m, 1H), 284,1 (M+Na)+.
Ejemplo 15.0: Preparación de los ejemplos (1R,2S)-1-e 1 -etoxi-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
mida, Ejemplo 14.8. Este compuesto se obtuvo como un oropirimidin-2-il)propano-2-sulfonamida (Ejemplo 14.2) tesis del Ejemplo 14.2 para dar el compuesto del título nco. 1H rMn (CDCh) 5: 8,46 (s, 2H), 5,11 (d, J=3,4 Hz, (s, 3H), 1,35 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z:
(1 R,2S)-1 -Etoxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirimi metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sulfona 3,4 mmol) en THF (70 ml) se añadió bis(trimetilsilil)a lentamente mediante jeringa. Después de 1,25 h, se lentamente mediante jeringa. La solución naranja resul con una mezcla 2:1 de solución acuosa saturada de clo con EtOAc (4X). Las capas orgánicas combinadas se vacío. El residuo se purificó por cromatografía en gel d un periodo de 40 min) para proporcionar 15.01 (1,02 g LCMS-ESI (POS.) m/z: 500,1 (M+H)+.
il)propano-2-sulfonamida y (1 S,2R)-1 -etoxi-N,N-bis(4-Ejemplo 15.01. A una solución a -78°C de 11.0 (1,62 g, e potasio (solución 1 M en THF, 10,6 ml, 10,6 mmol) trifluorometanosulfonato de etilo (1,4 ml, 10,6 mmol) se agitó a -78°C durante 45 min y después se inactivó mónico y agua (75 ml). La mezcla resultante se extrajo ron sobre sulfato sódico anhidro y se concentraron a e (eluyente: EtOAc en hexanos al 10-65% a lo largo de de rendimiento) en forma de un aceite amarillo claro.
(1 R,2S)-1 -Etoxi-1 -(5-metilpirimidin-2-il)propano-2-sulfon sulfonamida, Ejemplo 15.0. El Ejemplo 15.01 (1,02 g, anisol (466 pl, 4,3 mmol) mediante jeringa. La solución concentró a vacío. El residuo se purificó por cromato MeOH en DCM al 4,5% a lo largo de un periodo de 45 93% de rendimiento) en forma de un sólido blanco. LC
Los compuestos expuestos en la siguiente tabla se usando el material de partida conocido como se describ y (1 S,2R)-1 -etoxi-1 -(5-metilpirimidin-2-il)propano-2-mol) se disolvió en TFA (14 ml). Después se añadió ja resultante se agitó a TA durante 16,5 h y después se en gel de sílice (eluyente: gradiente de DCM puro a para proporcionar el compuesto del título 15.0 (495 mg, l (pOs .) m/z: 260,0 (M+H)+.
zaron siguiendo el procedimiento en el Ejemplo 15.0
8
Ejemplo 16.0: Preparación del ejemplo (R)-1-oxo-1-(pir il)propano-2-sulfonamida.
n-1-¡l)propano-2-sulfonam¡da y (S)-1 -oxo-1 -(pirrolidin-1 -
Ácido (R)-2-(N,N-bis(4-metoxibencil)sulfamoil)propanoic Ejemplo 16.01. En matraz de fondo redondo d metoxibencil)etanosulfonamida (978 mg, 2,80 mmol, Ej enfrió en un baño de hielo seco/acetona a -78°C y se hexanos) a una velocidad que mantenía la temperatur reacción se calentó a -20°C y se agitó durante 1 minut etilo (0,37 ml, 3,87 mmol). Después de 30 min, la reac se diluyó con agua. La solución acuosa después se ext se concentraron a vacío y se recogieron en THF (10 ml mmol, solución acuosa 1 M). La solución después se a lavó con EtOAc (2 x 20 ml). La solución acuosa se acid (3 x 20 ml). Las capas orgánicas combinadas se se compuesto del título (0,64 g, 58% de rendimiento) en f J=8,6 Hz, 4H), 6,82-6,89 (m, 4H), 4,25-4,41 (m, 4H), 4 3H). LCMS-ESI (POS.) m/z: 416,1 (M+Na)+.
ido (S)-2-(N,N-bis(4-metoxibencil)sulfamoil)propanoico, bocas, secado en horno, se añadió N,N-bis(4-12.0) y 2-metiltetrahidrofurano (12 ml). La solución se con solución de butil-litio (1,9 ml, 3,04 mmol, 1,6 M en debajo de -60°C. Después de agitar durante 10 min, la spués se enfrió a -75°C y se trató con cloroformiato de e inactivó con solución saturada de NhUCl. La reacción n EtOAc (2 x 15 ml). Las capas de EtOAc combinadas H (3 ml) y se trataron con hidróxido de litio (8 ml, 8,00 TA Después de 3 d, la reacción se diluyó con agua y se on solución acuosa de HCl 1 N y se extrajo con EtOAc sobre MgSO4 y se concentraron a vacío para dar el de un aceite amarillo claro. 1H RMN (CDCh) 5: 7,18 (d, , J=7,2 Hz, 1H), 3,77-3,84 (m, 6H), 1,61 (d, J=7,2 Hz,
(R)-N,N-Bis(4-metoxibencil)-1 -oxo-1 -(pirrolidin-1 -il)prop (pirrolidin-1-il)propano-2-sulfonamida, Ejemplo 16.0 sulfonamida y (S)-N,N-bis(4-metoxibencil)-1 -oxo-1 -una disolución de ácido (R)-2-(N,N-bis(4-
metoxibencil)sulfamoil)propanoico y ácido (S)-2-(N,N-bi DMF (3 ml) se añadió solución de anhídrido propilfosfó pirrolidina (95 gl, 1,135 mmol, Alfa Aesar). Después d ml). La solución acuosa se extrajo con EtOAc (3 x 5 m salmuera (40 ml), se secaron sobre MgSO4, y se con 103% de rendimiento), en forma de un aceite dorado. S ESI (POS.) m/z: 447,2 (M+H)+.
etoxibencil)sulfamoil)propanoico (396 mg, 1,01 mmol) y (1,5 ml, 2,52 mmol, 50% en peso en EtOAc), seguido de tar a TA durante 16 h, la reacción se vertió en agua (50 s capas orgánicas combinadas después se lavaron con aron a vacío para dar el compuesto del título (462 mg, uió adelante con el material sin más purificación. LCMS-
(R)-1-Oxo-1-(pirrolidin-1-il)propano-2-sulfonamida y (S) A una disolución de (R)-N,N-bis(4-metoxibencil)-1-metoxibencil)-1-oxo-1-(pirrolidin-1-il)propano-2-sulfona añadió gota a gota TFA (5 ml). Después de agitar dur adsorbió sobre un tapón de gel de sílice y se purificó a eluyendo con EtOAc:EtOH (3:1) en heptano al 0-100% rendimiento) en forma de un sólido blanco. 1H RMN (D 1H), 3,53 (dt, J=10,2, 6,6 Hz, 1H), 3,28-3,36 (m, 2H), m/z: 207,2 (M+H)+.
Ejemplo 17.0: Preparación de (S)-2-(5-fluoropirimidin-2o-1-(pirrolidin-1-il)propano-2-sulfonamida, Ejemplo 16.0. -(pirrolidin-1-il)propano-2-sulfonamida y (S)-N,N-bis(4-(449 mg, 1,005 mmol) y anisol (0,5 ml, 4,55 mmol) se el fin de semana, la reacción se concentró a vacío y se és de una columna de gel de sílice GraceResolv (12 g), a proporcionar el compuesto del título (200 mg, 96% de afe) 5: 6,86 (s, 2H), 4,21 (q, J=6,7 Hz, 1H), 3,59-3,70 (m, 1,91 (m, 4H), 1,40 (d, J=6,9 Hz, 3H). LCMS-ESI (POS.)
no-1-sulfamida.
(ferc-Butoxicarbonil)((4-(dimetiliminio)piridin-1(4H)-il)sulf de ferc-butanol (3,3 ml, 34,5 mmol) en DCM (80 ml) s mmol, Sigma-Aldrich) mediante jeringa. Después de 1 La suspensión blanca espesa resultante se calentó a con DCM (100 ml) y se lavó con agua (3X). La capa o para proporcionar 17.01 (6,61 g, 64% de rendimiento) LCMS-ESI (POS.) m/z: 302,0 (M+H)+.
mida, Ejemplo 17.01. A una solución enfriada con hielo dió lentamente isocianato de clorosulfonilo (3,0 ml, 34,5 , se añadió 4-(dimetilamino)piridina (8,42 g, 68,9 mmol). se agitó durante 24 h. La mezcla de reacción se diluyó ica se secó sobre sulfato sódico anhidro y se concentró ma de un sólido blanco que se usó sin más purificación.
(S)-N-(1-(5-fluoropirimidin-2-il)etil)sulfamoilcarbamato d g, 5,3 mmol) en DCM (30 ml) se añadió hidrocloruro J&W PharmLab) directamente seguido de TEA (775 gl, se agitó a TA durante 17 h, después de lo cual se conc de sílice (eluyente: EtOAc en hexanos al 10-100% compuesto del título 17.02 (1,56 g, 92% de rendimiento (M+Na)+.
c-butilo, Ejemplo 17.02. A una suspensión de 17.01 (1,60 )-1-(5-fluoro-pirimidin-2-il)-etilamina (943 mg, 5,3 mmol, mol) mediante jeringa. La suspensión blanca resultante a vacío. El residuo se purificó por cromatografía en gel largo de un periodo de 40 min) para proporcionar el forma de un sólido blanco. LCMS-ESI (POS.) m/z: 343,0
(S)-2-(5-Fluoropirimidin-2-il)etano-1-sulfamida, Ejemplo mmol) en DCM (14 ml) se añadió TFA (6,5 ml, 88 mm incolora resultante se agitó a TA durante 3 h. La mezcla se inactivó por adición lenta de disolución acuosa satur de 10 minutos. La mezcla resultante se concentró parci DCM (x 6). Las capas orgánicas combinadas se sec proporcionar 17.0 (967 mg, 90% de rendimiento) en (M+H)+.
Ejemplo 18.0: Preparación de (1R,2S)-1-((terc-buti il)propano-2-sulfonamida.
A una solución enfriada con hielo de 17.02 (1,56 g, 4,9 diante jeringa. Se retiró el baño de hielo y la solución eacción se volvió a enfriar a 0°C, y la reacción después e bicarbonato sódico (140 ml) a lo largo de un periodo te para separar algo del agua y después se extrajo con sobre sulfato sódico anhidro y se concentraron para de un sólido blanco. LCMS-ESI (POS.) m/z: 221,0
tilsilil)oxi)-N,N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-
4-Nitrobenzoato de (1R,2S)-2-(N,N-bis(4-metoxibencil)s disolución agitada de (1S,2S)-1-hidroxi-N,N-bis(4-meto g, 48,1 mmol) en tolueno (241 ml) se añadió ácido 4-nitr mmol) seguido de la adición gota a gota de (E)-diazen mezcla se agitó a TA durante la noche, para mostrar e vacío y se purificó en gel de sílice eluyendo con Et nitrobenzoato de (1R,2S)-2-(N,N-bis(4-metoxibencil)sul 100% de rendimiento). LCMS-ESl (POS.) m/z: 621,3 (M il)-1-(5-metilpirimidin-2-il)propilo, Ejemplo 18.01. A una cil)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida (22,7 zoico (12,07 g, 72,2 mmol), trifenilfosfina (18,94 g, 72,2 dicarboxilato de diisopropilo (14,22 ml, 72,2 mmol). La ducto deseado por LCMS. La reacción se concentró a exanos al 0-50% para dar el compuesto deseado 4-il)-1-(5-metilpirimidin-2-il)propilo (29,9 g, 48,1 mmol,
4-Nitrobenzoato de (1 R,2S)-2-(N,N-bis(4-metoxibencil)s disolución agitada de 18.01 (76 g, 122 mmol) en MeOH mmol). La mezcla se dejó calentar a TA a lo largo de 1 se concentró a vacío y se purificó en gel de sílice eluye hidroxi-N,N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)pr oil)-1-(5-metilpirimidin-2-il)propilo, Ejemplo 18.02. A una ml) a 0°C se añadió carbonato de potasio (16,92 g, 122 ra mostrar el producto deseado por LCMS: La reacción on EtOAc en hexanos al 0-40% para dar la (1 R,2S)-1--2-sulfonamida. LCMS-ESl (POS.) m/z: 472,0 (M+H)+.
(1 R,2S)-1 -((terc-Butildimetilsilil)oxi)-N,N-bis(4-metoxiben -(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo
18.0. A una disolución agitada de (1R,2S)-1-hidr sulfonamida (18.02, 28 g, 59,4 mmol) en DCM (297 ml, butildimetilsililo (15,00 ml, 65,3 mmol), seguido de TEA largo de 1 h, para mostrar el producto deseado por LC sílice eluyendo con EtOAc en hexano al 0-30% butildimetiisilil)oxi)-N,N-bis(4-metoxibencil)-1-(5-metilpiri rendimiento). Lc Ms -ESI (POS.) m/z: 586,0 (M+H)+.
Ejemplo 19.0: Preparación de (S)-1-(5-metilpirimidin-2-1 -oxopropano-2-sulfonamida.
N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-mmol) a 0°C se añadió trifluorometanosulfonato de tercml, 65,3 mmol). La mezcla se dejó calentar a TA a lo a reacción se concentró a vacío, y se purificó en gel de a dar el compuesto deseado la (1R,2S)-1-((terc-2-il)propano-2-sulfonamida (15 g, 25.6 mmol, 43% de
xopropano-2-sulfonamida y (R)-1-(5-metilpirimidin-2-il)-
(S)-N,N-Bis(4-metoxibencil)-1 -(5-metilpirimidin-2-il)-1 -ox metilpirimidin-2-il)-1-oxopropano-2-sulfonamida, Ejempl (80 ml) se añadió peryodinano de Dess-Martin (4,95 g, agitó a TA en atmósfera de N2 durante 7 h. Se añadier capa acuosa se extrajo con DCM (40 ml), iPrOH en CH secaron sobre MgSO4, se filtraron y se concentraron. columna (220 g de sílice, acetona en hexanos al 1 metilpirimidin-2-il)-1 -oxopropano-2-sulfonamida y (R)-2-sulfonamida en forma de una espuma amarillo claro 4H), 6,74-6,82 (m, 4H), 5,98 (q, J=7,0 Hz, 1H), 4,26-4,3 3H). MS-ESI (POS.) m/z: 470,0 (M+H)+.
ano-2-sulfonamida y (R)-N,N-bis(4-metoxibencil)-1 -(5-. A una disolución de 11.0 (5,0 g, 10,6 mmol) en DCM mmol, Aldrich, St. Louis, MO). La mezcla resultante se ua (20 ml) y DCM (40 ml). Se separaron las capas y la l 10% (4 x 40 ml). Las capas orgánicas combinadas se roducto así obtenido se purificó por cromatografía en ) proporcionando la (S)-N,N-bis(4-metoxibencil)-1-(5-s(4-metoxibencil)-1 -(5-metilpirimidin-2-il)-1 -oxopropano-(4.9 g). 1H RMN (CDCl3) 5: 8,74 (s, 2H), 7,13-7,19 (m, 4H), 3,74-3,86 (m, 7H), 2,44 (s, 3H), 1,70 (d, J=7,0 Hz,
(S)-1 -(5-Metiipirimidin-2-il)-1 -oxopropano-2-sulfonamida Ejemplo 19.0. A una disolución de (S)-N,N-bis(4-metoxi (R)-N,N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)-1-ox (30 ml) se añadió anisol (5,3 ml, 48,8 mmol, Aldrich, St. hielo y se trató con TFA (30,0 ml) gota a gota median resultante se agitó durante 1 h y después se calentó a mezcla de reacción se concentró. El producto obtenido de sílice, acetona en hexanos al 5-50%) proporcionand (R)-1-(5-metilpirimidin-2-il)-1-oxopropano-2-sulfonamida (CDCla) 5: 8,80 (s, 2H), 5,97 (q, J=7,1 Hz, 1H), 4,86 (br. m/z: 230,0 (M+H)+.
Ejemplo 20.0: Preparación de (1S,2S)-1-((terc-butildi (1 R,2R)-1 -((terc-butildimetilsilil)oxi)-1 -(5-fluoropirimidinR)-1 -(5-metiipirimidin-2-il)-1 -oxopropano-2-sulfonamida, l)-1-(5-metilpirimidin-2-il)-1-oxopropano-2-sulfonamida y ano-2-sulfonamida 19.1 (4,9 g, 10,44 mmol) en DCM s, MO). La mezcla de reacción se enfrió en un baño de embudo de adición. Después de la adición, la mezcla se agitó más durante 2 d. Después de este periodo, la lmente se purificó por cromatografía en columna (330 g )-1-(5-metilpirimidin-2-il)-1-oxopropano-2-sulfonamida y orma de una espuma blanca 19.0 (1,9 g). 1H RMN H), 2,48 (s, 3H), 1,76 (d, J=7,0 Hz, 3H). MS-ESI (POS.)
ilil)oxi)-1-(5-fluoropirimidin-2-il)propano-2-sulfonamida y pano-2-sulfonamida.
(Z)-5-Fluoro-2-(prop-1-en-1-il)pirimidina, Ejemplo 20.01. a una solución desgasificada de 2-cloro-5-fluoropirimidi ilborónico (16,5 g, 192 mmol, Sigma-Aldrich) y carbona ml) y agua (107 ml). El recipiente de reacción se selló este periodo de tiempo, el precipitado blanco se separ DCM (2X). Las capas orgánicas combinadas desp concentraron parcialmente (obsérvese que el producto ñadió tetrakis(trifenilfosfina)paladio (4,62 g, 4,00 mmol) ,2 g, 160 mmol, Matrix Scientific), ácido cis-1 -propen-1 -sodio (33,9 g, 320 mmol) en una mezcla de THF (213 eacción se calentó a 100°C durante 2,5 d. Después de filtración y se lavó con éter. El filtrado se extrajo con se secaron sobre sulfato magnésico anhidro y se látil). El residuo se purificó por cromatografía en gel de
sílice (eluyente: DCM en hexanos al 0-50%) para pro MHz, CDCla) 5: 8,58 (s, 2H), 6,51-6,60 (m, 1H), 6,25 ( ESI (POS.) m/z: 139,4 (M+H)+.
nar 20.01 (19,4 g, 88% de rendimiento). 1H RMN (500 11,8, 7,3 Hz, 1H), 2,24 (dd, J=7,2, 1,8 Hz, 3H). LCMS-
(5-fluoro-2-((2S,3R)-3-metiloxiran-2-il)pirimidina y 5-flu una solución enfriada con hielo de 20.01 (12,65 g, 92 se añadió N-bromosuccinimida (32,6 g, 183 mmol). La r añadió lentamente una solución 10 M de NaOH (27 temperatura interna superara 32°C. La mezcla se ext secaron sobre sulfato magnésico anhidro y se concentr (eluyente: gradiente de puros a DCM puro) para pr rendimiento). LCMS-ESI (POS.) m/z: 155,2 (M+H)+.
((2R,3S)-3-metiloxiran-2-il)pirimidina, Ejemplo 20.02. A en una mezcla de terc-butanol y agua (1/1, v/v, 183 ml) ón se dejó calentar a TA durante la noche y después se , 275 mmol) teniendo cuidado de no permitir que la on EtOAc (3x) y las capas orgánicas combinadas se El residuo se purificó por cromatografía en gel de sílice ionar el compuesto del título 20.02 (10,2 g, 72% de
(1 S,2S)-1 -(5-Fluoropirimidin-2-il)-2-(pirimidin-2-iltio)prop iltio)propan-1 -ol, Ejemplo 20.03. A una disolución de 20 2-tiol (3,11 g, 27,8 mmol, Sigma-Aldrich) seguido de Sigma-Aldrich). La suspensión amarilla resultante trifluorometanosulfonato de iterbio(III) adicional (431 m través del agente de filtración de marca Celite® y bicarbonato sódico. La mezcla se extrajo con DCM (3X) magnésico anhidro y se concentraron. El residuo se p hexanos al 30-60%) para proporcionar el compuesto de m/z: 267,0 (M+H)+.
ol y (1 R,2R)-1 -(5-fluoropirimidin-2-il)-2-(pirimidin-2-,14 g, 13,9 mmol) en DCM (46 ml) se añadió pirimidinarometanosulfonato de iterbio(III) (431 mg, 0,69 mmol, agitó durante la noche y después se añadió 9 mmol). Después de otras 3 h, la reacción se filtró a rado se neutralizó con solución acuosa saturada de s capas orgánicas combinadas se secaron sobre sulfato por cromatografía en gel de sílice (eluyente: EtOAc en 20.03 (2,53 g, 68% de rendimiento). lCmS-ESI (POS.)
2-((1 S,2S)-1 -((terc-Butildimetilsilil)oxi)-2-(pirimidin-2-iltio butildimetilsilil)oxi)-2-(pirimidin-2-iltio)propil)-5-fluoropiri 9,16 mmol) en dCm (92 ml) se añadió triflato de terc-b de 2,6-lutidina (1,17 ml, 10,08 mmol). Después de 2 cromatografía en gel de sílice (eluyente: EtOAc en he rendimiento) en forma de un aceite incoloro. LCMS-ESI il)-5-fluoropirimidina y 2-((1 R,2R)-1 -((terc-, Ejemplo 20.04. A una disolución de 20.03 (2,44 g, etilsililo (2,32 ml, 10,08 mmol, Sigma-Aldrich) seguido , la reacción se concentró. El residuo se purificó por al 10-50%) para proporcionar 20.04 (3,28 g, 94% de .) m/z: 381,0 (m+H)+.
2-((1 S,2S)-1 -((terc-Butildimetilsilil)oxi)-2-(pirimidin-2-ilsulf butildimetilsilil)oxi)-2-(pirimidin-2-ilsulfonil)propil)-5-fluorop 8.59 mmol) en DCM (43 ml) se añadió ácido 3-cloropero a TA, la reacción se calentó a 40°C durante 2 h adicional calentamiento y se continuó agitando a TA durante la n cromatografía en gel de sílice (eluyente: EtOAc en hex LCMS-ESI (POS.) m/z: 413,0 (M+H)+.
l)propil)-5-fluoropirimidina y 2-((1 R,2R)-1 -((tercidina, Ejemplo 20.05. A una disolución de 20.04 (3,27 g, enzoico, 77% máx. (3,85 g, 17,2 mmol). Después de 4 h Después de este periodo de tiempo, se retiró el baño de e. La reacción se concentró y el residuo se purificó por s al 10-100%) para proporcionar 20.05 (3,54 g, 100%).
(1 S,2S)-1 -((terc-Butildimetilsilil)oxi)-1 -(5-fluoropirimidin-2-i butildimetilsilil)oxi)-1-(5-fluoropirimidin-2-il)propano-2-sulf 8,2 mmol) en MeOH (41 ml) se añadió carbonato de pot noche, se añadió carbonato de potasio adicional (342 concentró a vacío. El residuo se disolvió en agua (80 potasio (1,29 g, 13,2 mmol) y ácido hidroxilamina-O-sulfó TA durante 2 h y después se extrajo con EtOAc (3X).
magnésico anhidro y se concentraron. El residuo se puri hexanos al 10-40%) para proporcionar el compuesto de sólido blanco. LCMS-ESI (Po S.) m/z: 350,1 (M+H)+.
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe.
Ta ropano-2-sulfonamida y (1 R,2R)-1 -((tercmida, Ejemplo 20.0. A una disolución de 20.05 (3,40 g, o (1,14 g, 8,2 mmol). Después de agitar a TA durante la 2,8 mmol). Después de otras 6 h a TA, la reacción se ) y después se añadieron secuencialmente acetato de o (1,21 g, 10,7 mmol). La mezcla de reacción se agitó a capas orgánicas combinadas se secaron sobre sulfato ó por cromatografía en gel de sílice (eluyente: EtOAc en tulo 20.0 (1,51 g, 54% de rendimiento) en forma de un
tizaron siguiendo el procedimiento en el Ejemplo 20.0
9
Ejemplo 21.0: Preparación de (1R,2R)-1-((terc-butildi 1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)propano-2-sulfo dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 ilil)oxi)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-da y (1 S,2S)-1 -((terc-butildimetilsilil)oxi)-N-(4-(2,6-uoropirimidin-2-il)propano-2-sulfonamida.
(1 R,2R)-1 -((terc-butildimetilsilil)oxi)-N-(4-(2,6-dimetoxifen fluoropirimidin-2-il)propano-2-sulfonamida y (1 S metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(5-fluoropirimidinse preparó siguiendo el procedimiento en el Eje metilnicotinichidrazida (363 mg, 2,40 mmol) y el compu proporcionar el compuesto del título 21.0 (857 mg, 65%
Ejemplo 22.0: Preparación de (1S,2R)-1-(5-fluoropiri fluoropirimidin-2-il)-1-metoxipropano-2-sulfonamida.
(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-1 -((terc-butildimetilsilil)oxi)-N-(4-(2,6-dimetoxifenil)-5-(5-ropano-2-sulfonamida, Ejemplo 21.0. Este compuesto A; El Ejemplo 20.0 (700 mg, 2,00 mmol), 5 intermedio 1.0. (411 mg, 2,10 mmol) se acoplaron para ndimiento). LCMS-ESI (POS.) m/z: 644,2 (M+H)+.
(1 S,2R)-1 -((terc-butildimetilsilil)oxi)-1 -(5-fluoropirimidin-2-il) 1 -((terc-butildimetilsilil)oxi)-1 -(5-fluoropirimidin-2-il)-N,N-bis una disolución de 20.1 (5,50 g, 15,7 mmol) en 2-butanon mmol), cloruro de 4-metoxibencilo (4,70 ml, 34,6 mmol) y se calentó a 50°C durante la noche y después se añadiero metoxibencilo (2,14 ml, 15,7 mmol) adicionales. La reac repartió entre agua y EtOAc. La capa orgánica se lavó c anhidro y se concentró. El residuo se purificó por cromato 20%) para proporcionar 22.01 (5,51 g, 59% de rendimient 590,2 (M+H)+.
,N-bis(4-metoxibencil)propano-2-sulfonamida y (1 R,2S)-metoxibencil)propano-2-sulfonamida, Ejemplo 22.01. A (52,5 ml) se añadió carbonato de potasio (7,84 g, 47,2 uro potásico (261 mg, 1,57 mmol). La mezcla resultante arbonato de potasio (2,61 g, 15,7 mmol) y cloruro de 4-n se calentó a 70°C durante la noche, y después se agua adicional (1X), se secó sobre sulfato magnésico fía en gel de sílice (eluyente: EtOAc en hexanos al 10 en forma de un aceite incoloro. LCMS-ESI (POS.) m/z:
(1 S,2R)-1 -(5-Fluoropirimidin-2-il)-1 -hidroxi-N,N-bis(4-meto fluoropirimidin-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propa 22.01 (5,51 g, 9,3 mmol) en THF (31 ml) se añadió una 19,6 ml, 19,6 mmol). La solución naranja resultante se agi se disolvió en EtOAc y se lavó con agua (3x). La capa concentró. El residuo se purificó por cromatografía en proporcionar 22.02 (3,36 g, 76% de rendimiento). LCMS-E encil)propano-2-sulfonamida y (1 R,2S)-1 -(5-2-sulfonamida, Ejemplo 22.02. A una disolución de olución de fluoruro de tetrabutilamonio en THF (1,0 M, TA durante 10 min y después se concentró. El residuo gánica se secó sobre sulfato magnésico anhidro y se l de sílice (eluyente: EtOAc en DCM al 0-10%) para (POS.) m/z: 498,0 (M+Na)+.
(1 S,2R)-1 -(5-Fluoropirimidin-2-il)-1 -metoxipropano-2-sulf metoxipropano-2-sulfonamida, Ejemplo 22.0. A una solu añadió bis(trimetilsilil)amida de potasio (solución 1,0 M e solución marrón resultante se calentó a -50°C durante trifluorometanosulfonato de metilo (2,95 ml, 26,9 mmol) durante 10 min y después se inactivó con solución acu EtOAc (2x), y las capas orgánicas combinadas se seca residuo se disolvió en DCM (20 ml) y después se trató secuencialmente. La reacción se agitó durante la no cromatografía en gel de sílice (eluyente: MeOH en DCM así obtenido se volvió a purificar por cromatografía en g en DCM) para proporcionar 22.0 (867 mg, 52% de ren m/z: 249,9 (M+H)+.
Ejemplo 23.0: Preparación de (R)-2-(2,4-difluorofe hidroxietanosulfonamida.
ida y (1 R,2S)-1 -(5-fluoropirimidin-2-il)-1 -a -78°C de 22.02 (3,20 g, 6,7 mmol) en THF (67 ml) se F,16.8 ml, 16.8 mmol) lentamente mediante jeringa. La min y después se volvió a enfriar a -78°C. Se añadió amente mediante jeringa. La reacción se agitó a -78°C saturada de cloruro amónico. La mezcla se extrajo con sobre sulfato magnésico anhidro y se concentraron. El anisol (2,19 ml, 20,2 mmol) y TFA (500 pl, 6.7 mmol) y después se concentró. El residuo se purificó por -10%) para proporcionar el producto inicial. El producto sílice(eluyente: 0-50% de una mezcla EtOAc/EtOH 3:1 ento) en forma de un sólido blanco. LCMS-ESI (POS.)
-hidroxietanosulfonamida y (S)-2-(2,4-difluorofenil)-2-
(R)-2-(2,4-Difluorofenil)-2-hidroxi-N,N-bis(4-metoxibencil) bis(4-metoxibencil)etanosulfonamida, Ejemplo 23.01. A (15,5 ml) se añadió una disolución de n-butil-litio en jeringa. Después de 30 min, se añadió mediante cánul osulfonamida y (S)-2-(2,4-difluorofenil)-2-hidroxi-N,N-solución a -78°C de 13.0 (2,62 g, 7,8 mmol) en THF nos (1,6 M, 7,3 ml, 11,7 mmol) lentamente mediante a disolución de 2,4-difluorobenzaldehído (1,67 g, 11,7
mmol) en THF (5 ml). La reacción se dejó calentar a solución acuosa saturada de cloruro amónico. La mezcl combinadas se secaron sobre sulfato magnésico anhidr en gel de sílice (eluyente: EtOAc en hexanos al 0-100 77% de rendimiento) en forma de un sólido blanco. LC durante la noche y después se inactivó con solución de sultante se extrajo con EtOAc (3X) y las capas orgánicas se concentraron. El residuo se purificó por cromatografía para proporcionar el compuesto del título 23.01 (2,86 g, SI (POS.) m/z: 500,0 (M+Na)+.
(R)-2-(2,4-Difluorofenil)-2-hidroxietanosulfonamida y 23.0. El Ejemplo 23.01 (2,65 g, 5,6 mmol) se disolvió mediante jeringa. La reacción se agitó a TA durante l cromatografía en gel de sílice (eluyente: EtOAc en he 23.0 (807 mg, 61% de rendimiento) en forma de un sóli
Ejemplo 24.0: Preparación de (1R,2S)-1-ciclobut metoxipropano-2-sulfonamida o (1S,2S)-1-ciclobutil metoxipropano-2-sulfonamida.
-2-(2,4-difluorofenil)-2-hidroxietanosulfonamida, Ejemplo TfA (18,5 ml). Se añadió anisol (2,43 ml, 22,2 mmol) che y después se concentró. El residuo se purificó por os al 0-100%) para proporcionar el compuesto del título lanco. LCMS-ESI (pOs .) m/z: 260,0 (M+Na)+.
metoxipropano-2-sulfonamida y (1 S,2R)-1 -ciclobutil-1 -etoxipropano-2-sulfonamida y (1 R,2R)-1 -ciclobutil-1 -
(1 R,2S)-1 -Ciclobutil-1 -hidroxi-N,N-bis(4-metoxibencil)pr bis(4-metoxibencil)propano-2-sulfonamida o (1 sulfonamida y (1R,2R)-1-ciclobutil-1-hidroxi-N,N-bis( Ejemplo 12.0 (3.01 g, 8.62 mmol) se disolvió en THF ( baño de hielo seco/acetona. Cuando la temperatura int M en hexanos, 3,79 ml, 9,48 mmol) a lo largo de 22
dando una mezcla de color naranja. La mezcla se ciclobutanocarbaldehído (AstaTech, 0,739 ml, 9,48 m por debajo de -70°C. La mezcla se agitó mientras el lentamente a TA (durante la noche). La reacción se ina mezcla de reacción después se repartió entre solución ml). La fase acuosa se extrajo con EtOAc (20 ml). Las solución acuosa saturada de cloruro sódico (50 ml). La extracción Chem Elute (10 ml 1219-8007) eluyendo co y el residuo se purificó por columna de cromatografía e Para dar el primer pico de elución (24.01) en form rendimiento). LCMS-ESI (POS.) m/z: 456,0 (M+Na)+.
o-2-sulfonamida y (1 S,2R)-1 -ciclobutil-1 -hidroxi-N,N-)-1 -ciclobutil-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-toxibencil)propano-2-sulfonamida, Ejemplo 24.01. El l) en un matraz de fondo redondo de 250 ml y se enfrió alcanzó -75°C, se añadió gota a gota nBuLi (Aldrich, 2,5 anteniendo la temperatura interna por debajo de -71°C, itó durante 15 min. Después se añadió gota a gota a lo largo de 10 min manteniendo la temperatura interna ño de hielo se terminaba y la temperatura se elevaba con 2 ml de una solución acuosa saturada de NH4CL La sa semisaturada de cloruro amónico (50 ml) y EtOAc (20 es orgánicas combinadas se lavaron con agua (50 ml) y e orgánica se secó pasando a través de un cartucho de OAc (2 x 20 ml). La capa orgánica después se concentró l de sílice (un gradiente de EtOAc en hexanos al 0-40%).
(1 R,2S)-1 -Ciclobutil-1 -hidroxi-N,N-bis(4-metoxibencil)pro bis(4-metoxibencil)propano-2-sulfonamida o (1 S sulfonamida y (1R,2R)-1-ciclobutil-1-hidroxi-N,N-bis(4-elución adicional dio el segundo pico de elución 24.02 e de rendimiento). LCMS-ESI (POS.) m/z: 456,0 (M+Na)+.
-2-sulfonamida y (1 S,2R)-1 -ciclobutil-1 -hidroxi-N,N-1 -ciclobutil-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-xibencil)propano-2-sulfonamida, Ejemplo 24.02. La a de un aceite transparente. (0,897 g, 2,07 mmol, 24% ién se obtuvieron 1.01 g adicionales de fracción mixta.
(1 R,2S)-1 -Ciclobutil-1 -metoxi-N,N-bis(4-metoxibencil)pro bis(4-metoxibencil)propano-2-sulfonamida o (1 S sulfonamida y (1R,2R)-1-ciclobutil-1-metoxi-N,N-bis(4 compuesto del título se preparó de una forma análoga a -2-sulfonamida y (1 S,2R)-1 -ciclobutil-1 -metoxi-N,N-1 -ciclobutil-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-xibencil)propano-2-sulfonamida, Ejemplo 24.03. El l Ejemplo 14.05 usando el Ejemplo 24.01.
(1 R,2S)-1 -Ciclobutil-1 -metoxipropano-2-sulfonamida y (1 S,2S)-1 -ciclobutil-1 -metoxipropano-2-sulfonamida y ( 24.0. El compuesto del título se preparó de una forma an
Ejemplo 25.0: Preparación de (1S,2R)-1-(aliloxi)-1-(5-m 1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
1 S,2R)-1 -ciclobutil-1 -metoxipropano-2-sulfonamida o )-1 -ciclobutil-1 -metoxipropano-2-sulfonamida, Ejemplo a la del Ejemplo 15.0 usando el 24.03.
(1 S,2R)-1 -(Aliloxi)-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sulf (2,01 g, 4,3 mmol) en THF (45 ml) se añadió bis(trim mmol) lentamente mediante jeringa. Después de 5 min, mediante jeringa. La solución amarillo brillante resultant y se agitó durante 60 min adicionales. La mezcla de saturada de cloruro amónico y agua 6:1 (70 ml) y combinadas se secaron sobre sulfato sódico anhidro y gel de sílice (eluyente: EtOAc en hexanos al 5-75% a (1,39 g, 64% de rendimiento) en forma de un sólido ama -2-il)propano-2-sulfonamida y (1 R,2S)-1 -(aliloxi)-N,N-ida, Ejemplo 25.01. A una solución a -78°C de 11.0 il)amida de potasio (solución 1 M en THF, 5,8 ml, 5,8 ñadió bromuro de alilo (1,5 ml, 17,1 mmol) lentamente agitó a -78°C durante 5 min y después se calentó a 0°C ción se inactivó con una mezcla de solución acuosa és se extrajo con EtOAc (4X). Las capas orgánicas ncentraron. El residuo se purificó por cromatografía en rgo de un periodo de 40 min) para proporcionar 25.01 laro. LCMS-ESI (POS.) m/z: 512,0 (M+H)+.
(1 S,2R)-1 -(Aliloxi)-1 -(5-metilpirimidin-2-il)propano-2-sulf 2-sulfonamida, Ejemplo 25.0. El Ejemplo 25.01 (1.39 g, anisol (620 pl, 5,7 mmol) mediante jeringa. La solución concentró a vacío. El residuo se purificó por cromatogr lo largo de un periodo de 40 min) para proporcionar blanco. LCMS-ESI (POS.) m/z: 272,0 (M+H)+.
Ejemplo 26.0: Preparación de (1R,2R)-1-(aliloxi)-1-(5-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
ida y (1 R,2S)-1 -(aliloxi)-1 -(5-metilpirimidin-2-il)propanommol) se disolvió en TFA (15 ml). Después se añadió nja resultante se agitó a TA durante 29 h y después se n gel de sílice (eluyente: MeOH en DCM al 4,5-100% a (682 mg, 93% de rendimiento) en forma de un sólido
(1 R,2R)-1 -(Aliloxi)-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sulf Ejemplo 11.05 (3,18 g, 6,7 mmol) en THF (70 ml) se a 9,1 ml, 9,1 mmol) lentamente mediante jeringa. Despué lentamente mediante jeringa. La solución amarillo brilla calentó a 0°C y se agitó durante 1,75 h adicionales.
solución acuosa saturada de cloruro amónico y agua orgánicas combinadas se secaron sobre sulfato sódi cromatografía en gel de sílice (eluyente: EtOAc en he proporcionar 26.01 (1,62 g, 47% de rendimiento) en (M+H)+.
2-il)propano-2-sulfonamida y (1 S,2S)-1 -(aliloxi)-N,N-ida, Ejemplo 26.01. A una solución a -78°C del bis(trimetilsilil)amida de potasio (solución 1 M en THF, 5 min, se añadió bromuro de alilo (2,3 ml, 27,0 mmol) sultante se agitó a -78°C durante 5 min y después se zcla de reacción se inactivó con una mezcla 11:1 de ml) y después se extrajo con EtOAc (4X). Las capas nhidro y se concentraron. El residuo se purificó por s al 5-75% a lo largo de un periodo de 40 min) para de un sólido blanco. LCMS-ESI (POS.) m/z: 512,0
(1 R,2R)-1 -(Aliloxi)-1 -(5-metilpirimidin-2-il)propano-2-sulf 2-sulfonamida, Ejemplo 26.0. El Ejemplo 26.01 (1.62 g, anisol (755 pl, 6,9 mmol) mediante jeringa. La solución concentró. El residuo se purificó por cromatografía en g de un periodo de 45 min) para proporcionar 26.0 (807 m LCMS-ESI (POS.) m/z: 272,0 (M+H)+.
Ejemplo A
Ejemplo 27.0: Preparación de (1R,2S)-N-(4-(2,6-dimet ida y (1 S,2S)-1 -(aliloxi)-1 -(5-metilpirimidin-2-il)propanommol) se disolvió en TFA (13 ml). Después se añadió lla resultante se agitó a TA durante 21,5 h y después se sílice (eluyente: MeOH en DCM al 4,5-100% a lo largo % de rendimiento) en forma de un sólido amarillo claro.
il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(Z)-N'-(2,6-Dimetoxifenil)-N-(((1S,2R)-1-metoxi-1-(5-meti metoxipicolinoil)hidrazinacarboximidamida, Ejemplo 27.
1.0 (522 mg, 2,67 mmol) en ACN (7,5 ml) se añadió mezcla se agitó a 23°C y se siguió por LC-MS. Desp Después de 15 min, se añadieron con cuidado en porc mg, 2,71 mmol) y después nitrato de plata (859 mg, 5, TLC y LC-MS. Después de 5 min adicionales, la mezcl con DCM y después se cargó en una columna de g fracciones que contenían el producto deseado despué naranja claro que solidificó en una espuma pegajosa metoxi-1-(5-metilpirimidin-2-il)propan-2-il)sulfonil)-2-(6-mmol, 94% de rendimiento) que se usó sin más purifica idin-2-il)propan-2-il)sulfonil)-2-(6-n un matraz que contenía 14.0 (617 mg, 2,51 mmol) y nato de cesio (1,07 g, 3,27 mmol) en una porción. La e 19 h, la mezcla se enfrió en un baño de hielo-agua.
hidrazida del ácido 6-metoxi-piridina-2-carboxílico (454 mol). La mezcla se dejó calentar a 23°C y se siguió por oncentró a presión reducida. El residuo negro se diluyó sílice (EtOAc:EtOH 3:1 en heptanos al 0-70%). Las concentraron a presión reducida para dar una película uecina como la (Z)-N'-(2,6-dimetoxifenil)-N-(((1S,2R)-1-ipicolinoil)hidrazinacarboximidamida 27.01 (1,35 g, 2,36 MS (pos.) m/e: 574,2 (M+H)+.
(1S,2R)-N-(4-(2,6-Dimetoxifenil)-5-(6-metoxipiridin-2-il)-2-sulfonamida, Ejemplo 27.0. En un matraz que
metilpirimidin-2-il)propan-2-il)sulfonil)-2-(6-metoxipicolin 1,4-dioxano (6,6 ml) se añadió ácido metanosulfónico ( reacción. Tras completarse la adición del ácido met previamente calentada a 90°C. Después de 5 h, la rea ajustó con cuidado por adición con gota a gota de soluc se filtró, se lavó una vez con agua, y después se susp dar un sólido blanco como la (1S,2R)-N-(4-(2,6-dimetox (5-metilpirimidin-2-il)propano-2-sulfonamida 27.0, (800 DMSO-ds) 513,25 (s, 1H), 8,65 (s, 2H), 7,80 (dd, J=8,3 6,82 (d, J=8,3 Hz, 1H), 6,78 (d, J=8,7 Hz, 2H), 4,82 (d, Hz, 1H), 3,15 (s, 3H), 3,10 (s, 3H), 2,26 (s, 3H), 1,13 (d,
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 10
2,4-triazol-3-il)-1-metoxi-1-(5-metilpirimidin-2-il)propanonía (Z)-N'-(2,6-dimetoxifenil)-N-(((1S,2R)-1-metoxi-1-(5-razinacarboximidamida 27.01 (1,35 g, 2,36 mmol) en ml, 8,48 mmol) con cuidado gota a gota a la mezcla de lfónico, la mezcla se calentó en una placa agitadora se enfrió a TA y después se diluyó con agua. El pH se cuosa saturada de bicarbonato sódico a pH~7. El sólido en IPA. Después de 5 min, la suspensión se filtró para )-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-,44 mmol, 61,0% de rendimiento). 1H Rm N (500 MHz, Hz, 1H), 7,58 (d, J=7,4 Hz, 1H), 7,40 (t, J=8,4 Hz, 1H), Hz, 1H), 3,65 (s, 3H) 3,63 (s, 3H), 3,42 (dd, J=7,1, 3,7 Hz, 3H). MS (pos.) m/z: 556,2 (M+H)+.
ron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 205.0: Preparación de (2S)-N-(4-(2,6-di pirimidinil)-2-propanosulfonamida o (2R)-N-(4-(2,6-d pirimidinil)-2-propanosulfonamida.
xifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-oxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-
(2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triaz N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il) 205.1. A una mezcla de N-((2,6-dimetoxifenil)carbamot 431.0) (0,200 g, 0,48 mmol) e hidrazida nicotínica (0,19 DMF (2,0 ml) se añadió acetato mercúrico (0,049 ml, 0, durante 30 min, seguido de la adición gota a gota de resultante después se agitó a 110°C y se siguió por LC se sometió directamente a purificación por HPLC de fa 0.37 mmol, 78%). LCMS-ESI (POS.) m/z: 500,1 (M+H)+.
)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida y (2R)--fluoro-2-pirimidinil)-2-propanosulfonamida, Ejemplo -(5-fluoropirimidin-2-il)propano-2-sulfonamida (Ejemplo 1,45 mmol, Sigma-Aldrich Chemical Company, Inc.) en mol, VWR International) a TA La mezcla se agitó a TA (0,223 ml, 2,90 mmol, Sigma-Aldrich Corp). La mezcla ras completarse la reacción, la mezcla se enfrió a TA y versa para dar el compuesto del título 205.1 (187 mg,
(2S)-N-(4-(2,6-Dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triaz (2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triaz Ejemplo 205.0. El compuesto racémico (Ejemplo 20 (columna 2 x 15 cm AD-H con 60 ml/min de MeOH temperatura = 23°C; longitud de onda = 220 nm; volu obtuvieron dos enantiómeros. El compuesto del título 2 RMN (400 MHz, CDCla) 58,62 (br. s., 2H), 8,54 (s, 2H), 1H), 6,61 (d, J=8,48 Hz, 2H), 3,76-3,90 (m, 1H), 3,74 ( 9,98 Hz, 1H), 1,32 (d, J=6,85 Hz, 3 H). LCMS-ESI (POS.
l)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida o )-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida,
se separó por cromatografía de fluidos supercríticos 3 al 0,1%)/Co2 al 22%. Presión de salida = 100 bar; de inyección = 0,6 ml, 9 mg/ml MeOH:DCM 2:1). Se era el primer isómero en eluir en estas condiciones. 1H - 7,77 (m, 1H), 7,39 (t, J=8,51 Hz, 1H), 7,24 - 7,29 (m, ), 3,72 (s, 3H), 3,64 - 3,70 (m, 1H), 3,10 (dd, J=14,67, : 500,1 (M+H)+.
Ejemplo 206.0: Preparación de (2S)-N-(4-(2,6-di pirimidinil)-2-propanosulfonamida o (2R)-N-(4-(2,6-di pirimidinil)-2-propanosulfonamida.
toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-
El Ejemplo 206.0 es el enantiómero del Ejemplo 205.0. El cuando se sometía 205.1 a las condiciones de SFC descr - 8,64 (m, 2H), 8,54 (s, 2H), 7,70 - 7,77 (m, 1H), 7,39 (t, Hz, 2H), 3,81 (ddd, J=9,84, 6,79, 4,40 Hz, 1H), 3,74 (s, 10,03 Hz, 1H), 1,32 (d, J=6,85 Hz, 3 H). LCMS-ESI (POS.
Los compuestos expuestos en la siguiente tabla se sin usando el material de partida conocido como se describe.
mpuesto del título 206.0 era el segundo isómero en eluir s en el Ejemplo 205.0. 1H RMN (500 MHz, CDCh) 58,59 8,56 Hz, 1H), 7,23 - 7,30 (m, 2H), 6,61 (dd, J=8,56, 1,47 ), 3,72 (s, 3H), 3,66 - 3,71 (m, 1H), 3,10 (dd, J=14,67, /z: 500,1 (M+H)+.
izaron siguiendo el procedimiento en el Ejemplo 205.0
Tabla 11
Ejemplo 234.0: Preparación de (2S,3R)-N-(4-(2,6-dimeto 2-pirimidinil)-2-butanosulfonamida o (2R,3S)-N-(4-(2,6-fluoro-2-pirimidinil)-2-butanosulfonamida o (2R,3R)-N-(4nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoroetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida o (2S,3S)-3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida.
(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-
(2S,3R)-N-(4-(2,6-Dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida y (2R,3S)-N-(4-(2,6-dimetoxi pirimidinil)-2-butanosulfonamida y (2R,3R)-N-(4-(2,6-fluoro-2-pirimidinil)-2-butanosulfonamida y (2S,3S)-N-(4 3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida, Ejemplo metilpiridin-3-il)-4H-1,2,4-triazol-3-amina (0,696 g, 2,24 de hielo se añadió lHMdS 1,0 M en THF (2,24 ml, 2,24 durante 1 h, a la que se añadió una disolución de 432.0 calentó a TA y se agitó durante 18 h. La mezcla se conc se purificó por cromatografía a través de una columna con un gradiente de EtOAc en hexanos de 0% a 100%, 15% de rendimiento). LCMS-ESI (POS.) m/z: 528,1 (M+ -triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-toxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-.1. A una disolución de 4-(2,6-dimetoxifenil)-5-(5-) (Ejemplo 2.04) en THF (10 ml, 123 mmol) en un baño l) (Sigma Aldrich) gota a gota. La mezcla se agitó a 0°C 4 g, 1,12 mmol) en THF (5 ml). La mezcla resultante se y el residuo se cargó sobre un tapón de gel de sílice y l de sílice preempaquetada Redi-Sep (24 g), eluyendo dar el compuesto del título 234.1 (0,091 g, 0,172 mmol,
(2S,3R)-N-(4-(2,6-Dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida o (2R,3S)-N-(4-(2,6-dimetoxi pirimidinil)-2-butanosulfonamida o (2R,3R)-N-(4-(2,6-fluoro-2-pirimidinil)-2-butanosulfonamida o (2S,3S)-N-(4 3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida, Ejemplo preparativa, que requería múltiples purificaciones usan (Sepax) (150 x 21 mm, 5 pm), 75:25 (CO2 líquido: IPA ( (Sepax) (150 x 21 mm, 5 pm), 60:40 CO2 líquido: IPA (2 (250 x 21 mm, 5 pm), 88:12 ( CO2 líquido /MeOH (20 m cuatro isómeros. El compuesto del título 234.0 era el p MHz, CDCl3) 58,53 (s, 2H), 8,44 (d, J=1,56 Hz, 1H), 8,3 1H), 6,56 - 6,64 (m, 2H), 3,79 - 3,88 (m, 2H), 3,74 (s, 3 LCMS-ESI (POS.) m/z: 528,2 (M+H)+.
Ejemplo 235.0: Preparación de (2S,3R)-N-(4-(2,6-dimet 2- pirimidinil)-2-butanosulfonamida o (2R,3S)-N-(4-(2, fluoro-2-pirimidinil)-2-butanosulfonamida o (2R,3R)-N-(4 3- (5-fluoro-2-pirimidinil)-2-butanosulfonamida o (2S,3S 3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida.
-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-toxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-. La mezcla racémica de 234.1 se purificó por SFC s métodos que incluyen: (a) columna ChiralPak AS-H NH3), Caudal: 70 ml/min; (b) columna chiralpak AD-H NH3); Caudal: 70 ml/min y (c) columna chiralpak AS-H 3)), Caudal: 70 ml/min respectivamente. Se obtuvieron isómero en eluir en estas condiciones. 1H RMN (400 J=1,96 Hz, 1H), 7,62 - 7,67 (m, 1H), 7,39 (t, J=8,51 Hz, 1 (s, 3H), 2,30 (s, 3H), 1,36 (dd, J=8,31,6,94 Hz, 6 H).
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoroetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)--(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-
El compuesto del título, Ejemplo 235.0, era el segundo isó descritas en el Ejemplo 234.0. 1H RMN (400 MHz, CDCla) 5 1H), 7,64 (s, 1H), 7,39 (t, J=8,51 Hz, 1H), 6,55 - 6,64 (m, 2 3H), 1,36 (dd, J=8,22, 6,85 Hz, 6 H). LCMS-ESI (POS.) m/z:
Ejemplo 236.0: Preparación de (2S,3R)-N-(4-(2,6-dimetoxif 2- pirimidinil)-2-butanosulfonamida o (2R,3S)-N-(4-(2,6-d fluoro-2-pirimidinil)-2-butanosulfonamida o (2R,3R)-N-(4-(2, 3- (5-fluoro-2-pirimidinil)-2-butanosulfonamida o (2S 3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida.
en eluir al someter 234.1 a las condiciones de SFC
(s, 2H), 8,44 (d, J=1,56 Hz, 1H), 8,33 (d, J=1,76 Hz,
0 - 3,89 (m, 2H), 3,74 (s, 3H), 3,71 (s, 3H), 2,30 (s,
(M+H)+.
-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoroxifenM)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-etoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)--(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-
El compuesto del título, Ejemplo 236.0, era el tercer isómer SFC descritas en 234.0. 1H RMN (400 MHz, CDCla) 58,53 7,63 (s, 1H), 7,39 (t, J=8,51 Hz, 1H), 6,61 (dd, J=8,51, 2,4 2,30 (s, 3H), 1,50 (d, J=7,04 Hz, 3H), 1,25 (d, J=7,04 Hz, 3
Ejemplo 237.0: Preparación de (2S,3R)-N-(4-(2,6-dimetoxif 2- pirimidinil)-2-butanosulfonamida o (2R,3S)-N-(4-(2,6-d fluoro-2-pirimidinil)-2-butanosulfonamida o (2R,3R)-N-(4-(2, 3- (5-fluoro-2-pirimidinil)-2-butanosulfonamida o (2S 3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida.
eluir cuando se sometía 234.1 a las condiciones de
), 8,44 (d, J=1,56 Hz, 1H), 8,33 (d, J=1,76 Hz, 1H),
2H), 3,75 (s, 3H), 3,74 (s, 3H), 3,52 - 3,69 (m, 2H),
MS-ESI (POS.) m/z: 528,2 (M+H)+.
-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoroxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-etoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)--(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-El compuesto del título, Ejemplo 237.0, era el cuarto i descritas en 234.0. 1H RMN (400 MHz, CDCla) 58,53 ( (s, 1H), 7,39 (t, J=8,51 Hz, 1H), 6,60 (dd, J=8,41, 2,54 (s, 3H), 1,50 (d, J=6,85 Hz, 3H), 1,25 (d, J=6,85 Hz, 3 H Ejemplo B
Ejemplo 238.0: Preparación de (2R,3S)-N-(4-(2,6 metilpirimidin-2-il)butano-2-sulfonamida.
ro en eluir al someter 234.1 a las condiciones de SFC ), 8,44 (d, J=1,37 Hz, 1H), 8,33 (d, J=1,56 Hz, 1H), 7,63 H), 3,75 (s, 3H), 3,74 (s, 3H), 3,53 - 3,68 (m, 2H), 2,30 MS-ESI (POS.) m/z: 528,2 (M+H)+.
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-
(2R,3S)-N-(4-(2,6-Dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida, Ejemplo 238.0. Un vial que contenía (2 1,65 mmol), 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-tr yoduro de cobre(I) (161 mg, 0,85 mmol), trans-N,N' carbonato de cesio (1,36 g, 4,18 mmol) se desgasificó llenado de nuevo se repitió tres veces. Se añadió 1,4-heterogénea azul oscuro se calentó en una placa agita Después de 20 h, la reacción se enfrió a TA y después de HCl 1 N a la solución homogénea azul oscuro a pH orgánicos se combinaron y después se lavaron una ve secar la capa orgánica sobre sulfato magnésico anhid azul-verde se cargó sobre una columna de gel de sílice blanco (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiri sulfonamida 238.0 (401 mg). 1H RMN (500 MHz, DMSO 1H), 8,19 (d, J=1,7 Hz, 1H), 7,65 - 7,58 (m, 1H), 7,53 -(dq, J=3,4, 6,9 Hz, 1H), 2,25 (s, 3H), 2,23 (s, 3H), 1,24 ( (pos.) m/z: 524,3 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 12
4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida (378 mg, l-3-il)-5-metilpiridina (Ejemplo 2.0, 809 mg, 2,16 mmol), etil-1,2- ciclohexanodiamina (0,53 ml, 3,36 mmol), y spués se volvió a llenar con nitrógeno. La extracción y no anhidro (3,3 ml) a la mezcla y después la solución previamente calentada a 80°C y se siguió por LC-MS. iluyó con agua. Se añadió con cuidado solución acuosa espués de extraer cuatro veces con DCM, los extractos solución acuosa de tiosulfato sódico 1 M. Después de ltración y concentración a presión reducida, el residuo Ac: EtOH 3:1 en heptanos al 0-75%) para dar un sólido -il)-4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-5 = 13,37 (s, 1H), 8,63 - 8,55 (m, 2H), 8,47 (d, J=1,5 Hz, (m, 1H), 6,85 - 6,80 (m, 2H), 3,70 - 3,65 (m, 7H), 3,60 7,1 Hz, 3H), 1,10 (d, J=7,1 Hz, 3H). Espectro de masas
ron siguiendo el procedimiento en el Ejemplo B usando
Ejemplo C
Ejemplo 255.0: Preparación de (1S,2R)-(4-bromo-2-fluor 2-fluorofenil)-1 -hidroxipropano-2-sulfonamida y (1 R,2R (1 R,2S)-(4-bromo-2-fluorofenil)-1 -hidroxipropano-2-sulfon nil)-1-h¡drox¡propano-2-sulfonamida y (1S,2S)-(4-bromo-4-bromo-2-fluorofenil)-1 -hidroxipropano-2-sulfonamida y ida.
(1 S,2R)-(4-Bromo-2-fluorofenil)-1 -h¡drox¡-N,N-b¡s(4-meto fluorofenil)-1 -h¡drox¡-N,N-b¡s(4-metox¡benc¡l)propano-2-s b¡s(4-metox¡benc¡l)propano-2-sulfonam¡da y
metoxibencil)propano-2-sulfonamida, Ejemplo 25 metoxibencil)etanosulfonamida 12.0 (600 mg, 1,72 mm añadió THF (7 ml) y se enfrió a -78°C. Se añadió lenta durante 10 min. Después se añadió gota a gota 4-bromo enc¡l)propano-2-sulfonam¡da y (1 R,2R)-(4-bromo-2-nam¡da y (1 S,2S)-(4-bromo-2-fluorofenil)-1 -hidroxi-N,N-(1 R,2S)-(4-bromo-2-fluorofenil)-1 -hidroxi-N,N-bis(4-. Un matraz se cargó con N,N-bis(4-Jubilant), se destiló azeotrópicamente con tolueno, se te n-Butil-litio (0,72 ml, 1,80 mmol) y la mezcla se agitó -fluorobenzaldehído (383 mg, 1,89 mmol) en THF (2 ml).
La reacción se agitó más a -782C durante 45 min y desp durante otras 3 h. La reacción se inactivó con solución s se secó, se concentró y se purificó por cromatografía hexanos al 0-40% para proporcionar 1-(4-bro sulfonamida 255.1 (811 mg, 85%) en forma de una me 573,9 (M+H)+.
s la temperatura de la reacción se elevó a TA y se agitó ada de NH4Cl y se extrajo con EtOAc. La capa de EtOAc gel de sílice, eluyendo con un gradiente de EtOAc en 2-fluorofenil)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2-a racémica de cuatro isómeros. LCMS-ESI (POS.) m/z:
(1 S,2R)-(4-Bromo-2-fluorofenil)-1 -hidroxipropano-2-sulfo 2-sulfonamida y (1R,2R)-(4-bromo-2-fluorofenil)-1-hidroxi hidroxipropano-2-sulfonamida, Ejemplo 255.0: En un
bis(4-metoxibencil)propano-2-sulfonamida 255.1 (603 m (0,477 ml, 4,37 mmol). La solución resultante se agitó d azeotrópicamente con tolueno para separar el TFA resid gel de sílice, eluyendo con un gradiente de MeOH en hidroxipropano-2-sulfonamida 255.0 (308 mg, 90%) en (M+H)+.
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Tabla 13
ida y (1 S,2S)-(4-bromo-2-fluorofenil)-1 -hidroxipropanopano-2-sulfonamida y (1R,2S)-(4-bromo-2-fluorofenil)-1-raz cargado con 1-(4-bromo-2-fluorofenil)-1-hidroxi-N,N-1,09 mmol) se añadió TFA (10,9 ml) seguido de anisol nte la noche y después se concentró a vacío y se destiló El material así obtenido se purificó por cromatografía en al 0-8% para proporcionar 1-(4-bromo-2-fluorofenil)-1-ma de un sólido blanco. LCMS-ESI (POS.) m/z: 336,0
aron siguiendo el procedimiento en el Ejemplo C usando
Ejemplo 263.0: Preparación de (2S,3R)-N-(4-(2,6-metilpirimidin-2-il)butano-2-sulfonamida.
etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-
(Z)-N'-(2,6-dimetoxifenil)-2-(5-metilnicotinoil)-N-(((2S,3R) il)sulfonil)hidrazinacarboximidamida, Ejemplo 263.1. En se añadió ACN (23 ml). Después de 3 min, se añadió el La mezcla se enfrió en un baño de hielo a 10°C, y des cuidado en porciones. Tras la adición completa del carb por LC-MS. Después de 22 h, la mezcla se enfrió en u cuidado en porciones 5-metilnicotinohidrazida (773 mg, Co.) y después nitrato de plata (1,65 g, 9,73 mmol). Después de 30 min adicionales, la mezcla se conc (5-metilpirimidin-2-il)butan-2-matraz que contenía el Ejemplo 10.0 (1,10 g, 4,82 mmol) emplo 1.0 (981 mg, 5,03 mmol) con cuidado en porciones.
s se añadió carbonato de cesio (2,07 g, 6,34 mmol) con to de cesio, la mezcla se dejó calentar a 23°C y se siguió año de hielo-agua. Después de 20 min, se añadieron con 86 mmol) (disponible en el mercado en Bellen Chemistry mezcla se dejó calentar a 23°C y se siguió por LC-MS. ó a presión reducida. El residuo negro se diluyó con
cloroformo y después se cargó en una columna de fracciones que contenían el producto deseado se com dar una película amarillo claro que solidificó en una es metilnicotinoil)-N-(((2S,3R)-3-(5-metilpirimidin-2-il)butan mmol, 99% de rendimiento) que se usó sin más purifica e sílice (EtOAc:EtOH 3:1 en heptanos al 0-85%). Las on y después se concentraron a presión reducida para pegajosa blanquecina, la (Z)-N'-(2,6-dimetoxifenil)-2-(5-ulfonil)hidrazinacarboximidamida 263.1 (2,58 g, 4,76 Espectro de masas (pos.) m/z: 542,2 (M+H)+.
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida, Ejemplo 263.0. En un matraz que contení (5-metilpirimidin-2-il)butan-2-il)sulfonil)hidrazinacarboxi añadió ácido metanosulfónico (0,93 ml, 14,3 mm metanosulfónico, la mezcla se calentó en una placa a MS. Después de 7,5 h, la reacción se enfrió a TA y cuidado con adición gota a gota de solución acuosa s después se extrajo tres veces con DCM. Las capas or reducida. El material así obtenido se absorbió sobre un de una columna de gel de sílice preempaquetada Redien heptanos al 0-75%. Las fracciones que contenían el para dar un sólido blanco como la (2S,3R)-N-(4-(2, metilpirimidin-2-il)butano-2-sulfonamida 263.0 (1,63 g, ds) 5 = 13,36 (s, 1H), 8,59 (s, 2H), 8,47 (d, J=1,7 Hz, 1 Hz, 1H), 6,82 (dd, J=3,8, 8,4 Hz, 2H), 3,69 - 3,64 (m, J=7,1 Hz, 3H), 1,10 (d, J=7,1 Hz, 3H). MS (pos.) m/z: 5
Ejemplo 264.0: Preparación de (R)-2-(4-clorofenil)-N-( il)-2-hidroxietanosulfonamida y (S)-2-(4-clorofenil)-N-( il)-2-hidroxietanosulfonamida.
4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2--N'-(2,6-dimetoxifenil)-2-(5-metilnicotinoil)-N-(((2S,3R)-3-ida 263.1 (2,58 g, 4,76 mmol) en 1,4-dioxano (19 ml) se ota a gota. Tras completarse la adición de ácido ra previamente calentada a 100°C y se siguió por LC-és se diluyó con 15 ml de agua. El pH se ajustó con a de bicarbonato sódico para dar un pH~7. La mezcla as se combinaron y después se concentraron a presión de gel de sílice y se purificó por cromatografía a través (80 g), eluyendo con un gradiente de (EtOAc: EtOH 3:1) ucto deseado se combinaron y después se concentraron etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-mol, 66% de rendimiento). 1H Rm N (500 MHz, DMSO-,19 (d, J=2,0 Hz, 1H), 7,64 - 7,60 (m, 1H), 7,50 (t, J=8,6 3,64 - 3,60 (m, 1H), 2,25 (s, 3H), 2,23 (s, 3H), 1,24 (d, M+H)+.
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R)-2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxip (trimetilsilil)etil)etanosulfonamida y (S)-2-(4-clorofenil)-3-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfonamida, Ej il)-4H-1,2,4-triazol-3-il)-N-(2-(trimetilsilil)etil)metanosulfo azeotrópicamente con tolueno y después disolvió en T añadió gota a gota solución de butil-litio (2,5 M en h Sigma-Aldrich Corp., St. Louis, MO, e E.UU.) y s clorobenzaldehído (0,059 ml, 0,50 mmol, disponible en en THF (1 ml) se añadió gota a gota y se continuó agit calentar a TA durante 1 h. La reacción se inactivó con y DCM (10 ml). Se separaron las dos capas. La capa combinadas se secaron sobre Na2SO4, se filtraron y s sobre un tapón de gel de sílice y se purificó por preempaquetada Redi-Sep (12 g), eluyendo con un gr compuesto del título 264.1 (247 mg, 0,38 mmol, 92 CD2Cl2) 57,63 - 7,67 (m, 1 H) 7,59 - 7,62 (m, 1 H) 7,4 6,71 (dd, J=8,02, 0,98 Hz, 1 H) 6,68 (dd, J=8,61,0,78 Hz, 1 H) 4,43 - 4,57 (m, 3 H) 3,72 (s, 3 H) 3,68 (s, 3 H) 0,14 (m, 9 H). LCMS-ESI (POS.) m/z: 646,3 (M+H)+.
2-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-264.1. La N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-da (Ejemplo 4.0, 210 mg, 0,415 mmol) se destiló ml). La solución después se enfrió a -78°C. A esta se s (0,183 ml, 0,46 mmol, disponible en el mercado en tó durante 10 min a -78°C. Una disolución de 4-ercado en Sigma-Aldrich Corp., St. Louis, MO, EE.UU.) a -78°C durante 45 minuto. La mezcla después se dejó ón saturada de NH4Cl (5 ml), se diluyó con agua (10 ml) a se extrajo con DCM (2 x 10 ml). Las capas orgánicas centraron a vacío. El material así obtenido se absorbió atografía a través de una columna de gel de sílice te de EtOAc en hexanos al 0-50%, para proporcionar el rendimiento) como sólido blanco. 1H RMN (400 MHz, =8,51 Hz, 1 H) 7,26 - 7,31 (m, 2 H) 7,09 - 7,14 (m, 2 H) H) 6,64 (dd, J=8,61,0,78 Hz, 1 H) 4,88 (dd, J=9,59, 1,17 (s, 3 H) 2,86 - 2,99 (m, 2 H) 1,34 - 1,44 (m, 2 H) 0,11 -
(R) -2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi (S) -2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi Ejemplo 264.0. Una mezcla de 264.1 (243 mg, 0,376 m mg, 1,13 mmol) (disponible en el mercado en Sigma-Al a 60°C durante 16 h. La reacción se diluyó con EtOAc ( con más HCl (acuoso) 0,1 N (3 x 20 ml), se secó sob obtenido se absorbió sobre un tapón de gel de sílice y de sílice preempaquetada Redi-Sep (12 g), eluyendo co para proporcionar el compuesto del título 264.0 (186 m RMN (400 MHz, DMSO-afe) 5 13,43 (br. s., 1 H) 7,81 J=8,51 Hz, 1 H) 7,33 - 7,38 (m, 2 H) 7,26 - 7,31 (m, 2 H Hz, 1 H) 3,66 (s, 3 H) 3,66 (s, 3 H) 3,24 - 3,30 (m, 1 546,1 (M+H)+.
Ejemplo 265.0: Preparación de (R)-2-(4-clorofenil)-N-( il)-2-hidroxietanosulfonamida o (S)-2-(4-clorofenil)-N-( il)-2-hidroxietanosulfonamida.
2-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida y -2-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida,
difluorotrimetilsilicato de tris(dimetilamino)sulfonio (311 orp., St. Louis, MO, EE.UU.) en DMF (2 ml) se calentó ) y HCl(acuoso) 0,1 N (20 ml). La capa orgánica se lavó 2SO4, se filtró y se concentró a vacío. El material así rificó por cromatografía a través de una columna de gel gradiente de (EtOAc: EtOH 3:1) en hexanos al 0-100%, 41 mmol, 91% de rendimiento) como sólido blanco. 1H =8,22, 7,43 Hz, 1 H) 7,58 (d, J=7,24 Hz, 1 H) 7,42 (t, - 6,85 (m, 3 H) 5,38 (br. s., 1 H) 4,93 (dd, J=6,85, 4,11 3 - 3,21 (m, 1 H) 3,11 (s, 3 H). LCMS-ESI (POS.) m/z:
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R) -2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi (S) -2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi Ejemplo 265.0. El compuesto del título 265.0 era el pri condiciones de SFC: columna OJ-H (2 x 25 cm), MeOH Vol. iny.: 1 ml, solución de 5 mg/ml de 264.0 en MeOH. (dd, J=7,34, 0,49 Hz, 1H), 7,33 - 7,42 (m, 3H), 7,27 - 7 J=7,73, 4,01 Hz, 1H), 3,65 (s, 3H), 3,64 (s, 3H) 3,15 (M+H)+.
Ejemplo 266.0: Preparación de (R)-2-(4-clorofenil)-N-( il)-2-hidroxietanosulfonamida o (S)-2-(4-clorofenil)-N-( il)-2-hidroxietanosulfonamida.
2-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o -2-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, mero en eluir cuando se somete 264.0 a las siguientes al 20%, 100 bar, 70 ml/min, longitud de onda = 220 nm, N (400 MHz, DMSO-afe) 57,78 (t, J=7,92 Hz, 1H), 7,58 m, 2H), 6,75 - 6,84 (m, 3H), 5,45 (br. s., 1H), 4,94 (dd, (m, 2H), 3,09 (s, 3H). LCMS-ESI (POS.) m/z: 546,0
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R) -2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi (S) -2-(4-clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi Ejemplo 266.0. El Ejemplo 266.0 es el enantiómero d somete 264.0 a las condiciones de SFC descritas en 26 7,58 (dd, J=7,43, 0,39 Hz, 1 H) 7,33 - 7,40 (m, 3 H) 7,2 (dd, J=7,73, 4,01 Hz, 1 H) 3,65 (s, 3 H) 3,63 (s, 3 H) 3,1 (M+H)+.
2-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o -2-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, .0. 266.0 era el segundo isómero en eluir cuando se H RMN (400 MHz, DMSO-afe) 57,76 (t, J=7,83 Hz, 1 H) ,32 (m, 2 H) 6,74 - 6,81 (m, 3 H) 5,49 (br. s., 1 H) 4,94 28 (m, 2 H) 3,09 (s, 3 H). LCMS-ESI (POS.) m/z: 546,2
Ejemplo 267.0: Preparación de (R)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-hidroxietanosulfonamida y (S)-N-( il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-hidroxietanosulfona 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-.
(R)-2-(2-bromo-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 (trimetilsilil)etil)etanosulfonamida y (R)-2-(2-bromo-4-fl 1,2,4-triazol-3-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfo a partir del Ejemplo 4.0 (1,52 g, 3,01 mmol) y 2-bromo-Products, Inc.) (0,732 g, 3,61 mmol), usando el pro compuesto del título 267.1 (1,77 g, 2,50 mmol, 83% de r m/z: 708,0 (M+H)+.
toxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ida, Ejemplo 267.1. El compuesto del título se preparó robenzaldehído (disponible en el mercado en Oakwood iento descrito en el Ejemplo 264.0 para obtener el miento) en forma de un sólido blanco. lCm S-ESI (POS.)
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, (2-(trimetilsilil)etil)etanosulfonam ida y (S)-N-(4-(2,6-di fluoro-2-(metilsulfonil)fenil)-2-hidroxi-N-(2-(trimetilsilil)etil) metanosulfinato de sodio (508 mg, 4,23 mmol, disponi EE.UU.), yoduro de cobre (i) (81 mg, 0,42 mmol, dispo MA, EE.UU.) y N,N'-dimetiletilendiamina (91 pl, 0,85
Louis, MO, EE.UU.) en DMSO (8,5 ml) se burbujeó con 4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2 (trimetilsilil)etil)etanosulfonamida (267.1, 600 mg, 0,85 minuto. La mezcla después se calentó a 110°C durant saturada de NH4Cl(acuosa) (80 ml) y EtOAc (80 ml).
solución saturada de NH4Cl (3 x 80 ml), se secó sobr obtenido se absorbió sobre un tapón de gel de sílice y s de sílice preempaquetada Redi-Sep (24 g), eluyendo proporcionar el compuesto del título 267.2 (380 mg, 0,5 (pOs .) m/z: 708,2 (M+H)+; y un subproducto N-(4-(2,6-di fluorofenil)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfonami rendimiento) en forma de un sólido blanco.
iazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-hidroxi-N-oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-osulfonamida, Ejemplo 267.2. A Una mezcla de en el mercado en Sigma-Aldrich Corp., St. Louis, MO, en el mercado en Strem Chemicals Inc., Newburyport, disponible en el mercado en Sigma-Aldrich Corp., St. geno durante 2 min. A la mezcla se añadió 2-(2-bromo-H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-l), y se burbujeó N2 a través de la mezcla durante otro h. La reacción se enfrió a TA, se diluyó con solución os capas se separaron. La capa orgánica se lavó con 2SO4, se filtró y se concentró a vacío. El material así rificó por cromatografía a través de una columna de gel un gradiente de EtOAc en hexanos al 0-100%, para ol, 63% de rendimiento) como sólido blanco, LCMS-ESI oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-(Ejemplo 267.3) (118 mg, 0,19 mmol, 22% de
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, hidroxietanosulfonamida y (S)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-hidroxietanosulfonamida, Ejemplo (150 mg, 0,212 mmol) usando el procedimiento descrit Ejemplo 267.0 (45 mg, 0,074 mmol, 35% de rendimient de) 513,45 (br. s, 1 H) 7,85 (dd, J=8,41, 5,28 Hz, 1 H) J=8,41 Hz, 1 H) 6,76 - 6,85 (m, 3 H) 5,82 - 5,88 (m, 1 H iazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-. El compuesto del título se preparó a partir de 267.2 el Ejemplo 264.0 para obtener el compuesto del título forma de un sólido blanco. 1H RMN (400 MHz, DMSO-(dd, J=8,41, 7,43 Hz, 1 H) 7,56 - 7,63 (m, 3 H) 7,41 (t, 8 (s, 3 H) 3,63 (s, 3 H) 3,34 - 3,45 (m, 2 H) 3,19 (s, 3 H)
3,10 (s, 3 H). LCMS-ESI (POS.) m/z: 608,2 (M+H)+.
Ejemplo 268.0: Preparación de (R)-N-(4-(2,6-dimetoxif (metilsulfonil)fenil)-2-hidroxietanosulfonamida o (S)-N-( il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-hidroxietanosulfona -(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, hidroxietanosulfonamida o (S)-N-(4-(2,6-dimetoxif (metilsulfonil)fenil)-2-hidroxietanosulfonamida, Ejemplo en las siguientes condiciones de SFC: Thar 80 SFC co 56 g/min de CO2, 30% de co-disolvente a 80 g/min. Te onda = 293 nm. Inyectado 0,35 ml de una solución de mg/ml y 1,4 mg por inyección. Tiempo de ciclo 8 min, 13,41 (br. s., 1 H) 7,85 (dd, J=8,41,5,48 Hz, 1 H) 7,80 Hz, 1 H) 6,75 - 6,85 (m, 3 H) 5,82 - 5,88 (m, 1 H) 5,50 ( (s, 3 H) 3,10 (s, 3 H). LCMS-ESI (POS.) m/z: 608,2 (M+
Ejemplo 269.0: Preparación de (R)-N-(4-(2,6-dimetoxif (metilsulfonil)fenil)-2-hidroxietanosulfonamida o (S)-N-( il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-hidroxietanosulfona azol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2--(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-. El compuesto del título era el primer isómero en eluir mna de 250 x 30 mm AS con 24 g/min de EtOH(solo) tura. = 23°C, Presión de salida = 100 bar, Longitud de de muestra 267.0 disueltos en 10 ml de MeOH, c= 4,0 de análisis = 14 min. 1H RMN (400 MHz, DMSO-afe) 5 =8,31,7,53 Hz, 1 H) 7,55 - 7,63 (m, 3 H) 7,40 (t, J=8,51 1 H) 3,68 (s, 3 H) 3,63 (s, 3 H) 3,34 - 3,46 (m, 2 H) 3,20
-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, hidroxietanosulfonamida o (S)-N-(4-(2,6-dimetoxif (metilsulfonil)fenil)-2-hidroxietanosulfonamida, Ejemplo 268.0. El Ejemplo 269.0 era el segundo isómero en descritas en 268.0. 1H RMN (400 MHz, DMSO-afe) 5 J=8,31, 7,53 Hz, 1 H) 7,55 - 7,63 (m, 3 H) 7,40 (t, J=8, s., 1 H) 3,68 (s, 3 H) 3,63 (s, 3 H) 3,34 - 3,46 (m, 2 (M+H)+.
Ejemplo 270.0: Preparación de (R)-N-(4-(2,6-fluorofenil)-2-hidroxietanosulfonamida y (S)-N-(4-(2,6-fluorofenil)-2-hidroxietanosulfonamida.
iazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2--(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-0. El Ejemplo 269.0 es el enantiómero del Ejemplo cuando se somete 267.0 a las condiciones de SFC (br. s., 1 H) 7,85 (dd, J=8,51, 5,38 Hz, 1 H) 7,80 (dd, , 1 H) 6,75 - 6,85 (m, 3 H) 5,82 - 5,88 (m, 1 H) 5,50 (br.
0 (s, 3 H) 3,10 (s, 3 H). LCMS-ESI (POS.) m/z: 608,2
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, (trimetilsilil)etil)etanosulfonamida y (R)-N-(4-(2,6-fluorofenil)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfonami un subproducto de la síntesis del Ejemplo 267.2. LCMS iazol-3-il)-2-(4-fluorofenil)-2-hidroxi-N-(2-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-jemplo 270.1. El compuesto del título se obtuvo como POS.) m/z: 630,2 (M+H)+.
(R) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-(S) -N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 Ejemplo 270.0. El compuesto del título se preparó a par tris(dimetilamino)sulfonio (148 mg, 0,538 mmol, dispon EE.UU.) usando el procedimiento descrito en el Ejempl mg, 0,12 mmol, 88% de rendimiento) en forma de un s H) 7,81 (dd, J=8,22, 7,43 Hz, 1 H) 7,58 (d, J=7,43 Hz, J=8,38 Hz, 2 H) 6,79 - 6,85 (m, 3 H) 5,31 (br. s., 1 H) 4, 3,13 - 3,19 (m, 1 H) 3,11 (s, 3 H). LCMS-ESI (POS.) m/z:
Ejemplo 271.0: Preparación de (R)-N-(4-(2,6-di fluorofenil)-2-hidroxietanosulfonamida o (S)-N-(4-(2,6-d fluorofenil)-2-hidroxietanosulfonamida.
riazol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida y riazol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida
270.1 (113 mg, 0,179 mmol) y difluorotrimetilsilicato de n el mercado en Sigma-Aldrich Corp., St. Louis, MO, .0. Esto proporcionó el compuesto del título 270.0 (64 lanco. 1H RMN (400 MHz, DMSO-afe) 513,43 (br. s., 1 ,42 (t, J=7,78 Hz, 1 H) 7,30 (t, J=6,14 Hz, 2 H) 7,12 (t, . s., 1 H) 3,66 (s, 3 H) 3,65 (s, 3 H) 3,25 - 3,30 (m, 1 H) 2 (M+H)+.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2 (S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, Ejemplo 271.0. El compuesto del título era el primer isó SFC con columna de 250 x 30 mm AD con 40 g/min d g/min. Temperatura. = 22°C, Presión de salida = 100 disolución de 63 mg de muestra del Ejemplo 270.0 inyección. Tiempo de ciclo 8,2 min, Tiempo de análisis 7,80 (dd, J=8,22, 7,43 Hz, 1 H) 7,58 (d, J=7,43 Hz, 1 H) H) 6,78 - 6,85 (m, 3 H) 5,32 (br. s., 1 H) 4,94 (dd, J=7,6 H) 3,16 (dd, J=13,89, 3,52 Hz, 1 H) 3,10 (s, 3 H). LCMS-
Ejemplo 272.0: Preparación de (R)-N-(4-(2,6-di fluorofenil)-2-hidroxietanosulfonamida o (S)-N-(4-(2,6-d fluorofenil)-2-hidroxietanosulfonamida.
zol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida o zol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida,
en eluir en las siguientes condiciones de SFC: Thar 80 (solo) 40 g/min de CO2, 50% de co-disolvente a 80 ongitud de onda = 295 nm. Inyectado 1,0 ml de una tos en 10 ml de MeOH, c= 6,3 mg/ml y 6,3 mg por in. 1H RMN (400 MHz, DMSO-afe) 513,43 (br. s., 1 H) t, J=8,41 Hz, 1 H) 7,27 - 7,33 (m, 2 H) 7,09 - 7,15 (m, 2 1 Hz, 1 H) 3,66 (s, 3 H) 3,65 (s, 3 H) 3,24 - 3,30 (m, 1 OS.) m/z: 530,2 (M+H)+.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, (S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, Ejemplo 272.0. El Ejemplo 272.0 es el enantiómero isómero en eluir cuando se somete 270.0 a las condicio afe) 513,43 (br. s., 1 H) 7,81 (dd, J=8,22, 7,43 Hz, 1 H) (m, 2 H) 7,08 - 7,16 (m, 2 H) 6,78 - 6,86 (m, 3 H) 5,31 ( (s, 3 H) 3,28 (m, J=6,46 Hz, 1 H) 3,16 (dd, J=14,28, (M+H)+.
Ejemplo 273.0: Preparación de (R)-N-(4-(2,6-dimetoxif (metilsulfonil)fenil)-2-metoxietanosulfonamida y (S)-N-( azol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida o zol-3-il)-2-(4-fluorofenil)-2-hidroxietanosulfonamida,
emplo 271.0. El compuesto del título era el segundo e SFC descritas en 271.0. 1H RMN (400 MHz, DMSO-(d, J=7,04 Hz, 1 H) 7,42 (t, J=8,51 Hz, 1 H) 7,27 - 7,33 1 H) 4,94 (dd, J=6,85, 3,72 Hz, 1 H) 3,66 (s, 3 H) 3,65 Hz, 1 H) 3,11 (s, 3 H). LCMS-ESI (POS.) m/z: 530,2
-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-metoxietanosulfona
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, (2-(trimetilsilil)etil)etanosulfonamida y (R)-N-(4-(2,6-di fluoro-2-(metilsulfonil)fenil)-2-metoxi-N-(2-(trimetilsilil)etil) (2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol (trimetilsilil)etil)etanosulfonamida 267.2 (224 mg, 0,32 (dispersión al 60% en aceite mineral (15,2 mg, 0,38 m Louis, MO, EE.UU.). La mezcla se calentó a TA du yodometano (estabilizado, 0,026 ml, 0,41 mmol), dispon (0,50 ml). Después de 30 min, la reacción se inactivó p después se extrajo con EtOAc (25 ml). La capa orgánica filtró y se concentró a vacío. El material así obtenido s cromatografía a través de una columna de gel de sílice de EtOAc en hexanos al 0-50%, para proporcionar el rendimiento) como sólido blanco. LCMS-ESI (POS.) m/z: azol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-metoxi-N-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-sulfonamida Ejemplo 273.1. A una disolución de N-(4-2-(4-fluoro-2-(metilsulfonil)fenil)-2-hidroxi-N-(2-l) en DMF (2,0 ml) a 0°C, se añadió hidruro sódico (disponible en el mercado en Sigma-Aldrich Corp., St.
15 min. Se inyectó gota a gota una disolución de n el mercado en Acros Organics, NJ, EE.UU.) en DMF ición de solución acuosa saturada de NH4Cl (25 ml) y vó con salmuera (3 x 25 ml), se secó sobre Na2SO4, se orbió sobre un tapón de gel de sílice y se purificó por paquetada Redi-Sep (12 g), eluyendo con un gradiente puesto del título 273.1 (166 mg, 0,23 mmol, 73% de 2 (M+H)+.
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, metoxietanosulfonamida y (S)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-metoxietanosulfonamida, Ejemplo (162 mg, 0,22 mmol) y difluorotrimetilsilicato de tris(dim mercado en Sigma-Aldrich Corp., St. Louis, MO, EE.U Esto proporcionó el compuesto del título 273.0 (133 m blanco. 1H RMN (400 MHz, DMSO-afe) 513,40 (s, 1 H) 7 H) 7,41 (t, J=8,41 Hz, 1 H) 6,78 - 6,84 (m, 3 H) 5,52 (d J=14,48, 7,63 Hz, 1 H) 3,36 (dd, J=14,38, 4,79 Hz, 1 H) m/z: 622,1 (M+H)+.
Ejemplo 274.0: Preparación de (R)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-metoxietanosulfonamida o (S)-N-( il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-metoxietanosulfona azol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2--(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-. El compuesto del título se preparó a partir de 273.1 ino)sulfonio (IV) (185 mg, 0,67 mmol, disponible en el sando el procedimiento descrito en el Ejemplo 264.0.
1 mmol, 95% de rendimiento) en forma de un sólido 7,82 (m, 2 H) 7,60 - 7,68 (m, 2 H) 7,57 (d, J=7,24 Hz, 1 ,34, 4,79 Hz, 1 H) 3,67 (s, 3 H) 3,66 (s, 3 H) 3,48 (dd, (s, 3 H) 3,10 (s, 3 H) 3,03 (s, 3 H). LCMS-ESI (POS.)
-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, metoxietanosulfonamida o (S)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-metoxietanosulfonamida Ejemplo 2 en las siguientes condiciones de SFC: columna IA (2 x onda = 220 nm. Vol. inyección: 1,0 ml por inyección de s (400 MHz, DMSO-cfe) 513,40 (s, 1 H) 7,75 - 7,83 (m, 2 J=8,51 Hz, 1 H) 6,78 - 6,84 (m, 3 H) 5,52 (dd, J=7,43, azol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2--(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-El compuesto del título era el primer isómero en eluir ), MeOH/CO2 al 30%, 100 bar, 60 ml/min, longitud de ón de 4 mg/ml de 273.0 en DCM : MeOH 1 : 1. 1H RMN 0 - 7,68 (m, 2 H) 7,57 (dd, J=7,43, 0,78 Hz, 1 H) 7,41 (t, Hz, 1 H) 3,67 (s, 3 H) 3,66 (s, 3 H) 3,48 (dd, J=14,48,
7,43 Hz, 1 H) 3,36 (dd, J=14,57, 4,79 Hz, 1 H) 3,19 (s, 3 (M+H)+.
Ejemplo 275.0: Preparación de (R)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-metoxietanosulfonamida o (S)-N-(4 il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2-metoxietanosulfona ,10 (s, 3 H) 3,03 (s, 3 H). LCMS-ESI (POS.) m/z: 622,1
-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2 metoxietanosulfonamida o (S)-N-(4-(2,6-dimetoxife (metilsulfonil)fenil)-2-metoxietanosulfonamida. Ejemplo compuesto era el segundo isómero en eluir de la colum RMN (400 MHz, DMSO-ds) 513,40 (s, 1 H) 7,76 - 7,82 7,41 (t, J=8,51 Hz, 1 H) 6,77 - 6,84 (m, 3 H) 5,52 (dd, J=14,48, 7,43 Hz, 1 H) 3,36 (dd, J=14,57, 4,79 Hz, 1 H) m/z: 622,1 (M+H)+.
Ejemplo 276.0: (R)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6 metoxietanosulfonamida y (S)-2-(2-ciano-4-fluorof triazol-3-il)-2-metoxietanosulfonamida.
iazol-3-il)-2-(4-fluoro-2-(metilsulfonil)fenil)-2--(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(4-fluoro-2-. El Ejemplo 275.0 es el enantiómero de 274.0. Este A en las condiciones descritas en el Ejemplo 274.0. 1H H) 7,60 - 7,67 (m, 2 H) 7,57 (dd, J=7,43, 0,78 Hz, 1 H) 43, 4,70 Hz, 1 H) 3,67 (s, 3 H) 3,66 (s, 3 H) 3,48 (dd, (s, 3 H) 3,10 (s, 3 H) 3,03 (s, 3 H). LCMS-ESI (POS.),
etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2--(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-
(R)-2-(2-bromo-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 (trimetilsilil)etil)etanosulfonamida y (S)-2-(2-bromo-4-fl 1,2,4-triazol-3-il)-2-metoxi-N-(2-(trimetilsilil)etil)etanosulfo fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il) (trimetilsilil)etil)etanosulfonamida 267.1 (881 mg, 1,24 (dispersión al 60% en aceite mineral (59,7 mg, 1,49 m Louis, MO, EE.UU.). La mezcla se calentó a TA durante (0,100 ml, 1,62 mmol), disponible en el mercado en A Después de 50 min, la reacción se inactivó con una solu (50 ml). Se separaron las capas. La capa orgánica se la y se concentró a vacío. El material así obtenido se a cromatografía a través de una columna de gel de sílice p de EtOAc en hexanos al 0-50%, para proporcionar el rendimiento) en forma de un sólido blanco. LCMS-ESI (P oxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-N-(2-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ida, Ejemplo 276.1. A una disolución de 2-(2-bromo-4-1,2,4-triazol-3-il)-2-hidroxi-N-(2-ol) en DMF (6 ml) a 0°C, se añadió hidruro sódico disponible en el mercado en Sigma-Aldrich Corp., St. in. A esta mezcla se añadió yodometano (estabilizado Organics, NJ, EE.UU.) en DMF (1,5 ml) gota a gota. acuosa saturada de NH4Cl (50 ml), se diluyó con EtOAc n salmuera (3 x 50 ml), se secó sobre Na2SO4, se filtró bió sobre un tapón de gel de sílice y se purificó por paquetada Redi-Sep (12 g), eluyendo con un gradiente puesto del título 276,1 (875 mg, 1,21 mmol, 97% de , m/z: 722,2 (M+H)+.
(R)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-(trimetilsilil)etil)etanosulfonam ida y (S)-2-(2-ciano-4-fl 1,2,4-triazol-3-il)-2-metoxi-N-(2-(trimetilsilil)etil)etanosulfo con 2-(2-bromo-4-fluorofenil)-N-(4-(2,6-dimetoxifen xipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-N-(2-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ida, Ejemplo 276.2. Un tubo de microondas se cargó (6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-N-(2-(trimetilsilil)etil)etanosulfonamida 276.1 (199 mg, 0.28 mercado en Alfa Aesar, A Johnson Matthey Company, N2 a través durante 3 min. A la mezcla se añadió tetra en el mercado en Strem Chemicals Inc., Newburyport, nuevo. La reacción se calentó a 120°C durante una h (30 ml) y EtOAc (30 ml). Se separaron las capas. La ca Na2SÜ4, se filtró y se concentraron a vacío. El material purificó por cromatografía a través de una columna de un gradiente de EtOAc en hexanos al 0-70%, para pro 77% de rendimiento) en forma de una película incolora.
l), cianuro de cinc (53,3 mg, 0,45 mmol, disponible en el Hill, MA, EE.UU.) y DMF (3 ml), y después se burbujeó ifenilfosfina)paladio(0) (63,6 mg, 0,055 mmol, disponible , EE.UU.), y la mezcla se desgasificó con nitrógeno de l microondas. La mezcla de reacción se diluyó con agua rgánica se lavó con salmuera (3 x 30 ml), se secó sobre btenido se absorbió sobre un tapón de gel de sílice y se e sílice preempaquetada Redi-Sep (12 g), eluyendo con onar el compuesto del título 276,2 (141 mg, 0,211 mmol, S-ESI (POS.), m/z: 669,2 (M+H)+.
(R)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 metoxietanosulfonamida y (S)-2-(2-ciano-4-fluoro triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 276.0.
0,205 mmol) y difluorotrimetilsilicato de tris(dimetilamino en Sigma-Aldrich Corp., St. Louis, MO, EE.UU.), us proporcionó el compuesto del título 267.0 (90 mg, 0,16 RMN (400 MHz, DMSO-afe) 513,38 (s, 1 H) 7,78 - 7,85 J=8,31, 0,68 Hz, 1 H) 6,80 (d, J=8,41 Hz, 2 H) 4,85 (dd Hz, 1 H) 3,34 (dd, J=14,28, 5,28 Hz, 1 H) 3,10 (s, 3 H) 3
Ejemplo 277.0: Preparación de (R)-2-(2-ciano-4-fluorof triazol-3-il)-2-metoxietanosulfonamida o (S)-2-(2-cian 4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida.
toxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-mpuesto del título se preparó a partir de 276.2 (137 mg, onio (IV) (169 mg, 0,615 mmol, disponible en el mercado el procedimiento descrito en el Ejemplo 264.0. Esto l, 77% de rendimiento) en forma de un sólido blanco. 1H 2 H) 7,53-7,61 (m, 3 H) 7,41 (t, J=8,51 Hz, 1 H) 6,83 (dd, 7,04, 5,48 Hz, 1 H) 3,67 (s, 6 H) 3,52 (dd, J=14,28, 7,24 (s, 3 H). LCMS-ESI (POS.), m/z: 569,2 (M+H)+.
)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-luorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-
(R)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxietanosulfonamida o (S)-2-(2-ciano-4-fluorof triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 277.0.
las siguientes condiciones de SFC: Realizado en Thar MeOH(solo) 40 g/min de CO2, 50% de co-disolvente a Longitud de onda = 297 nm. Inyectado 0,6 ml de una s MeOH : DCM, 8:6, c= 5,5 mg/ml y 3,3 mg por inyecci LCMS-ESI (POS.), m/z: 569,2 (M+H)+.
Ejemplo 278.0: Preparación de (R)-2-(2-ciano-4-fluorof triazol-3-il)-2-metoxietanosulfonamida o (S)-2-(2-cian 4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida.
oxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-mpuesto del título 277.0 era el primer isómero en eluir en FC con columna de 250 x 30 mm CC4 con 40 g/min de g/min. Temperatura. = 26°C, Presión de salida = 100 bar, ión de 77 mg de muestra de 276.0 disueltos en 14 ml de Tiempo de ciclo 6,2 min, Tiempo de análisis = 15 min.
)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-luorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-
(R)-2-(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 metoxietanosulfonamida o (S)-2-(2-ciano-4-fluorof toxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 278.0. Ejemplo 278.0 era el segundo isómero en eluir de la col LCMS-ESI (POS.), m/z: 569,2 (M+H)+.
Ejemplo 279.0: Preparación de (1R,2S)-1-(2,4-difluorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-1 2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) emplo 278.0 es el enantiómero del Ejemplo 277.0. El CC4 en las condiciones descritas en el Ejemplo 277.0.
N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4--difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-1 R,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida o (1 S,2S)-1 -(2,4-difluorofenil)-N-(4-(2,6-droxipropano-2-sulfonamida.
(1 R,2S)-1-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-sulfonamida y (1 S,2R)-1 -(2,4-difluorofenil)-N-(4-(2, hidroxipropano-2-sulfonamida y (1 R,2R)-1 -(2,4-difluorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida y (1 S,2S)-1 2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-N-(2-(trimetilsilil)e destiló azeotrópicamente con tolueno y después se dis añadió gota a gota solución de n-butil-litio (2,5 M en h Sigma-Aldrich Corp., St. Louis, MO, EE.UU.), después min. Después se inyectó gota a gota una disolución de el mercado en Fluka Chemie GmbH, Buchs, Suiza) en después se calentó a TA durante 1 h. La mezcla de rea extrajo con EtOAc. El extracto orgánico se secó sobr obtenido se absorbió sobre un tapón de gel de sílice y de sílice preempaquetada Redi-Sep (24 g), eluyendo proporcionar el compuesto del título 279.1 (266 mg, incolora. LCMS-ESI (POS.) m/z: 662,3 (M+H)+.
xipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4--difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-Ejemplo 279.1. La N-(4-(2,6-dimetoxifenil)-5-(6-nosulfonamida (Ejemplo 5.0) (311 mg, 0,598 mmol) se en THF (3 ml). La solución se enfrió a -78°C. A esta se os (0,24 ml, 0,60 mmol), disponible en el mercado en cual la mezcla de reacción se agitó a -78°C durante 10 ifluorobenzaldehído (102 mg, 0,718 mmol, disponible en (1,0 ml). La reacción se agitó a -78°C durante 15 min y se inactivó con solución saturada NH4Cl (acuosa) y se 2SO4, se filtró y se concentró a vacío. El residuo así rificó por cromatografía a través de una columna de gel un gradiente de EtOAc en hexanos al 0-100%, para mmol, 67% de rendimiento) en forma de una goma
(1 R,2S)-1-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-sulfonamida y (1 S,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-hidroxipropano-2-sulfonamida y (1 R,2R)-1 -(2,4-difluorofe triazol-3-il)-1 -hidroxipropano-2-sulfonamida y (1 S,2S)-1 -2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamida, mmol) y difluorotrimetilsilicato(IV) de tris(dimetilamino)s Sigma-Aldrich Corp., St. Louis, MO, EE.UU.) en DMF (3 se diluyó con EtOAc (30 ml), se lavó con HCl 0,1 N (30 m se filtró y se concentró a vacío. El material así obtenido s cromatografía a través de una columna de gel de sílice pr de EtOAc en DCM al 0-50%, para proporcionar el c rendimiento) en forma de un sólido blanco. LCMS-ESI (P oxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinjemplo 279.2. Una mezcla de 279.1 (263 mg, 0,397 nio (438 mg, 1,59 mmol, disponible en el mercado en se calentó a 60°C durante 18 h. La mezcla de reacción eguido por salmuera (3 x 30 ml), se secó sobre Na2SO4, bsorbió sobre un tapón de gel de sílice y se purificó por mpaquetada Redi-Sep (12 g), eluyendo con un gradiente uesto del título 279.2 (102 mg, 0,18 mmol, 46% de ) m/z: 562,1 (M+H)+.
(1 R,2S)-1-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-sulfonamida o (1 S,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(2,4-difluorofe triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-1 -2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamida, enantiómero en eluir de una columna AD-H en las siguie de 250 x 30 mm AD-H con 32 g/min de EtOH(solo) 48 salida = 100 bar; Temperatura. = 21°C; Longitud de on disuelto en MeOH/DCM 1 : 1 (c= 12,5 mg/ml, Se usó u inyección. Tiempo de ciclo 18 min, Tiempo de análisis 2 7,76 - 7,82 (m, 1 H) 7,58 (d, J=7,04 Hz, 1 H) 7,44 - 7,49 2,45 Hz, 1 H) 7,07 (td, J=8,51,2,35 Hz, 1 H) 6,76 - 6,84 ( oxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-Ejemplo 279.0. El Ejemplo 279.0 era el primer s condiciones: Realizado en Thar 80 SFC con columna in de CO2, 40% de co-disolvente a 80 g/min. Presión de = 215 nm. inyectado 0,5 ml de una disolución de 279.2 gota de amoniaco para disolver la muestra), 6,2 mg por in. 1H RMN (400 MHz, DMSO-afe) 5 13,36 (br. s., 1 H) , 1 H) 7,40 (t, J=8,51 Hz, 1 H) 7,17 (ddd, J=10,96, 9,10, 3 H) 5,43 (s, 1 H) 5,14 (br. s., 1 H) 3,66 (s, 3 H) 3,63 (s,
3 H) 3,09 (s, 3 H) 3,04 (q, J=6,91 Hz, 1 H) 1,05 (d, J=6,8
Ejemplo 280: Preparación de (1R,2S)-1-(2,4-difluorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-1 2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) 3 H). LCMS-ESI (POS.) m/z: 562,1 (M+H)+.
-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-(1 R,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-lfonamida o (1 S,2S)-1 -(2,4-difluorofenil)-N-(4-(2,6-idroxipropano-2-sulfonamida.
(1 R,2S)-1-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-sulfonamida o (1 S,2R)-1 -(2,4-difluorofenil)-N-(4-(2, hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(2,4-difiuorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-1 2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamid El ejemplo 280.0 era el cuarto diastereómero en elui Ejemplo 279.0. LCMS-ESI (POS), m/z: 562,1 (M+H)+.
Ejemplo 281.0: Preparación de (1R,2S)-1-(2,4-difluorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-1 2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) oxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinemplo 280.0. Ejemplo 280.0 es el enantiómero de 279.0.
la Columna AD-H en las condiciones descritas en el
-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-(1 R,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-lfonamida o (1 S,2S)-1 -(2,4-difluorofenil)-N-(4-(2,6-idroxipropano-2-sulfonamida.
(1 R,2S)-1-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-sulfonamida o (1 S,2R)-1 -(2,4-d ifluorofenil)-N-(4-(2,6 hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(2,4-difluorof oxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-1 2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamid diastereómero en eluir de la columna AD-H en las con DMSO-afe) 513,47 (br. s., 1 H) 7,80 (t, J=7,87 Hz, 1 H) Hz, 1 H) 7,11 - 7,18 (m, 1 H) 7,06 (td, J=8,56, 2,25 Hz, 1 H) 3,67 (s, 3 H) 3,64 (s, 3 H) 3,27 (q, J=7,00 Hz, 1 H) 562,3 (M+H)+.
Ejemplo 282.0: Preparación de (1R,2S)-1-(2,4-difluorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-1 2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamid etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinmplo 281.0. El Ejemplo 281.0 era el segundo es descritas en el Ejemplo 279.0. 1H RMN (400 MHz, d, J=7,25 Hz, 1 H) 7,43 - 7,50 (m, 1 H) 7,40 (t, J=8,51 76 - 6,84 (m, 3 H) 5,27 (br. s., 1 H) 5,04 (d, J=7,63 Hz, , 3 H) 0,91 (d, J=6,85 Hz, 3 H). LCMS-ESI (POS), m/z:
-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-R,2R)-1 -(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-amida o (1 S,2S)-1 -(2,4-d ifluorofenil)-N-(4-(2,6-roxipropano-2-sulfonamida.
(1 R,2S)-1-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-sulfonamida o (1 S,2R)-1 -(2,4-difluorofenil)-N-(4-(2, hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(2,4-difluorof triazol-3-il)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-1 2- il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonami 281.0. El Ejemplo 282.0 era el tercer diastereómero en Ejemplo 279.0. LCMS-ESI (POS), m/z: 562,1 (M+H)+.
Ejemplo 283.0: Preparación de (1R,2S)-N-(4-(2,6-di fluorofenil)-1 -hidroxipropano-2-sulfonamida y (1 S,2R)-N 3- il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonamida
1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulf metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 ipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinjemplo 282.0. El Ejemplo 282.0 es el enantiómero de e la columna AD-H en las condiciones descritas en el
ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-ipropano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 (trimetilsilil)etil)propano-2-sulfonamida y (1 R,2S)-N-(4-(2 1 -(4-fluorofenil)-1 -hidroxi-N-(2-(trimetilsilil)etil)propano-2-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 (trimetilsilil)etil)propano-2-sulfonamida, Ejemplo 283.1.
(401 mg, 0,77 mmol) y 4-fluorobenzaldehído (115 mg, 0, St. Louis, MO, EE.UU.), usando el procedimiento descri 0,701 mmol, 91% de rendimiento) se obtuvo en forma (M+H)+.
2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxi-N-(2-imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-namida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-oxi-N-(2-(trimetilsilil)etil)propano-2-sulfonamida y ,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxi-N-(2-mpuesto del título se preparó a partir de (Ejemplo 5.0) mmol, disponible en el mercado en Sigma-Aldrich Corp., n el Ejemplo C. El compuesto del título 283.1 (451 mg, un sólido blanquecino. LCMS-ESI (POS), m/z: 644,3
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5 hidroxipropano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-di fluorofenil)-1 -hidroxipropano-2-sulfonamida y (1 S,2S)-N-3-il)-1-(4-fluorofenil)-1-hidroxipropano-2-sulfonamida, Ej 283.1 (445 mg, 0,69 mmol), usando el procedimiento d del título 283.0 (236 mg, 0,43 mmol, 63% de rendimiento m/z: 544,2 (M+H)+.
Ejemplo 284.0: Preparación de (1R,2S)-N-(4-(2,6-di fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-N-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonamida o 1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulf 2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazollo 283.0. El compuesto del título se preparó a partir de ito en el Ejemplo 279.2. Esto proporcionó el compuesto forma de un sólido blanco cristalino. LCMS-ESI (POS),
oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-fluorofenil)-1xipropano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-hidroxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6 fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-N il)-1-(4-fluorofenil)-1-hidroxipropano-2-sulfonamida, Eje purificó por separación quiral por SFC en tres etap Separación de 284.0 (primer eluyente de la columna columna OD-H en HPLC quiral analítica) de 286.0 (terc 287.0 (cuarto eluyente de la columna OD-H en HPLC qu cm - 3 x 15 cm), EtOH/CO2 al 15%, 100 bar, 65 ml/min, Etapa. 2. Separación del Ejemplo 286.0 a partir del Eje EtOH/CO2 al 20%, 100 bar, 65 ml/min, 220 nM. Et preparativo: columna AD-H (2 x 15 cm), EtOH/CO2 al 35
Ejemplo 284.0 era el primer enantiómero en eluir de la c (400 MHz, DMSO-dfe) 513,41 (s, 1 H) 7,81 (dd, J=8,22, Hz, 1 H) 7,28 (dd, J=6,54 Hz, 2 H) 7,14 (t, J=8,35 Hz, 2 s., 1 H) 4,90 (d, J=3,52 Hz, 1 H) 3,65 - 3,68 (m, 3 H) 3, (d, J=7,04 Hz, 3 H). LCMS-ESI (POS.) m/z: 544,1 (M+H)
Ejemplo 285.0: Preparación de (1R,2S)-N-(4-(2,6 fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-N il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-84.0. La mezcla de cuatro isómeros (Ejemplo 283.0) se se obtuvieron cuatro enantiómeros puros. Etapa 1. en HPLC quiral analítica) y 285.0 (2° eluyente de la yente de la columna OD-H en HPLC quiral analítica) y nalítica) por método preparativo: columna OD-H (2 x 25 nM. Vol. inyección 0,75 ml, 4 mg/ml DCM/MeOH 1 : 4.
287.0 por método preparativo: columna IC (2 x 15 cm), . Volver a realizar el Ejemplo 285.0 por el método 0 bar, 65 ml/min.
a OD-H (Etapa 1.) como se ha descrito antes. 1H RMN Hz, 1 H) 7,59 (dd, J=7,43, 0,39 Hz, 1 H) 7,42 (t, J=8,51 3 (d, J=8,41 Hz, 1 H) 6,80 (d, J=8,41 Hz, 2 H) 5,24 (br.
3 H) 3,10 (s, 3 H) 3,02 (qd, J=6,91, 1,56 Hz, 1 H) 1,02
toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-(1 S,2s)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-amida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5 hidroxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-N-il)-1-(4-fluorofenil)-1-hidroxipropano-2-sulfonamida, Eje Ejemplo 285.0 era el segundo enantiómero en eluir de l mediante columna AD-H (Etapa 3.) como se ha descrit (M+H)+.
Ejemplo 286.0: Preparación de (1R,2S)-N-(4-(2,6-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-N-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-285.0. Ejemplo 285.0 es el enantiómero de 284.0. El lumna OD-H (Etapa 1.), y después se volvió a purificar tes en el Ejemplo 284.0. LCMS-ESI (POS.) m/z: 544,1
toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-namida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5 hidroxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-N-il)-1-(4-fluorofenil)-1-hidroxipropano-2-sulfonamida, Eje eluir de la columna IC (Etapa 2.) como se ha descrito 13,45 (s, 1 H) 7,76 - 7,85 (m, 1 H) 7,59 (d, J=7,17 Hz, 7,09 (t, J=8,22 Hz, 2 H) 6,80 - 6,85 (m, 2 H) 6,79 (d, J=2, 3,68 (s, 3 H) 3,64 (s, 3 H) 3,23 - 3,29 (m, 1 H) 3,10 (s, (M+H)+.
Ejemplo 287.0: Preparación de (1R,2S)-N-(4-(2,6,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-286.0. El Ejemplo 286.0 era el primer enantiómero en en el Ejemplo 284.0. 1H RMN (400 MHz, DMSO-afe) 5 7,42 (t, J=8,25 Hz, 1 H) 7,29 (dd, J=8,61, 5,67 Hz, 2 H) z, 1 H) 5,30 (br. s., 1 H) 4,88 (dd, J=6,06, 1,96 Hz, 1 H) 0,87 (d, J=7,04 Hz, 3 H). LCMS-ESI (POS.) m/z: 544,2
toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-
fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2R)-N-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-namida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5 hidroxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-fluorofenil)-1 -hidroxipropano-2-sulfonamida o (1 S,2S)-N-il)-1-(4-fluorofenil)-1-hidroxipropano-2-sulfonamida, Eje ejemplo 287.0 era el segundo enantiómero en eluir de l LCMS-ESI (POS.) m/z: 544,2 (M+H)+.
Ejemplo 288.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 2-(metilsulfonil)fenil)-1 -hidroxipropano-2-sulfonamida
1,2,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidro 5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluoro-2-( N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-tria sulfonamida.
,4-triazol-3-il)-1 -(4-fluorofenil)-1 -hidroxipropano-2-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluorofenil)-1 -toxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-287.0. El Ejemplo 287.0 es el enantiómero de 286.0. El umna IC (Etapa 2.) descrito antes en el Ejemplo 284.0.
nil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-fluoro-1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-pano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-ulfonil)fenil)-1 -hidroxipropano-2-sulfonamida y (1 S,2S)--il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidroxipropano-2-
(1 R,2R)-1 -(2-bromo-4-fluorofenil)-N-(4-(2,6-dimetoxifenil) (trimetilsilil)etil)propano-2-sulfonamida y (1 R,2S)-1 -(2-br 2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(2-(trimetilsilil)etil)pr (4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida y (1 S,2S)-1 -(2-bromo-4-fluorofenil)-N-(4-( -metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(2--4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridino-2-sulfonamida y (1 S,2R)-1-(2-bromo-4-fluorofenil)-N--il)-1-hidroxi-N-(2-(trimetilsilil)etil)propano-2-imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(2-(trimetilsilil)etil)propano-2-sulfonamida, Ej Ejemplo 5.0 (1,01 g, 1,94 mmol) y 2-bromo-4-fluoroben Oakwood Products, Inc., West Columbia, SC, EE.U proporcionó el compuesto del título 288.1 (1,29 g, 1,79 LCMS-ESI (POS), m/z: 722,2 (M+H)+.
lo 288.1. El compuesto del título se preparó a partir del hído (0,473 g, 2,33 mmol, disponible en el mercado en sando el procedimiento descrito en Ejemplo C. Esto l, 92% de rendimiento) en forma de una espuma blanca.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 N-(2-(trimetilsilil)etil)propano-2-sulfonamida y (1 S,2R)-N il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidroxi-N-(2-(trimetil dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) (trimetilsilil)etil)propano-2-sulfonamida y (1 S,2S)-N-(4-( (4-fluoro-2-(metilsulfonil)fenil)-1-hidroxi-N-(2-(trimetilsilil) metanosulfinato de sodio (332 mg, 2,77 mmol, dispon EE.UU.), yoduro de cobre(I) (52,7 mg, 0,28 mmol, disp MA EE.UU.) y N,N'-dimetiletilendiamina (59,6 pl, 0,55 Louis, MO, EE.UU.) en DMSO (5,5 ml) se burbujeó c fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il 2-sulfonamida 288.1 (400 mg, 0,55 mmol), y se burb mezcla después se calentó a 110°C durante 16 h. La r se extrajo con EtOAc (35 ml). El extracto orgánico se la Na2SO4, se filtró y se concentró a vacío. El residuo se de elución con EtOAc/Hexanos al 0-50% proporcionó rendimiento) en forma de un sólido blanco. LCMS-ESI ( 2,4-triazol-3-il)-1-(4-fluoro-2-(metilsulfonil)fenil)-1-hidroxi-2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-etil)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-4-fluoro-2-(metilsulfonil)fenil)-1-hidroxi-N-(2-imetoxifenil)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -ropano-2-sulfonamida, Ejemplo 288.2. Una mezcla de en el mercado en Sigma-Aldrich Corp., St. Louis, MO, en el mercado en Strem Chemicals Inc., Newburyport, l, disponible en el mercado en Sigma-Aldrich Corp., St.
2 durante 2 min. A la mezcla se añadió 1-(2-bromo-4--1,2,4-triazol-3-il)-1-hidroxi-N-(2-(trimetilsilil)etil)propanonitrógeno a través la mezcla durante otro minuto. La ón se inactivó con solución saturada de NH4Cl (35 ml) y n solución saturada de NH4Cl (3 x 30 ml), se secó sobre có en una columna de gel de sílice de 24 g, el gradiente mpuesto del título 288.2 (233 mg, 0,323 mmol, 58% de , m/z: 722,2 (M+H)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 hidroxipropano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-d fluoro-2-(metilsulfonil)fenil)-1 -hidroxipropano-2-sulfonam ,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il sulfonamida, Ejemplo 288.0. El compuesto del título usando el procedimiento descrito en el Ejemplo 279.2. mmol, 72% de rendimiento) en forma de un sólido blanc diastereómeros 288.0 se purificó por separación quiral puros, sin embargo los dos diastereómeros minoritarios
Ejemplo 289.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 2-(metilsulfonil)fenil)-1 -hidroxipropano-2-sulfonamida
1,2,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidr ipropano-2-sulfonamida y (1 S,2S)-N-(4-(2,6--fluoro-2-(metilsulfonil)fenil)-1-hidroxipropano-2-paró a partir del Ejemplo 288.2 (257 mg, 0,36 mmol) roporcionó el compuesto del título 288.0 (160 mg, 0,26 MS-ESI (POS), m/z: 622,1 (M+H)+. La mezcla de cuatro FC. Los dos diastereómeros mayoritarios se obtuvieron rdieron accidentalmente durante la separación quiral.
il)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-fluoro-,2R)-N-(4-(2,6-d imetoxifenil)-5-(6-etoxipiridin-2-il)-4H-pano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 hidroxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-fluoro-2-(metilsulfonil)fenil)-1-hidroxipropano-2-sulfonam primer isómero mayoritario en eluir en las siguientes c con 45% modificador orgánico modificador: 55% de dió 20 mM. F=60 ml/min, T=40°C, BPR=100 bar, P=186 MeOH/DCM (4 : 6). El compuesto se purificó más c S/N=1051) con 45% modificador orgánico modificador: amoniaco 20 mM. F=60 ml/min, T = 40°C, BPR=100 MeOH. 1H RMN (400 MHz, DMSO-afe) 513,22 (br. s., 1 7,61 (m, 2 H) 7,41 (t, J=8,17 Hz, 1 H) 6,81 (d, J=8,02 1 H) 3,71 (s, 3 H) 3,63 (s, 3 H) 3,37 - 3,42 (m, 1 H) 3, (POS), m/z: 622,1 (M+H)+.
Ejemplo 290.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 2-(metilsulfonil)fenil)-1 -hidroxipropano-2-sulfonamida
1,2,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -hidr ,4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-Ejemplo 289.0. El compuesto del título 289.0 era el iones de SFC: IC (10 um, 21 mm x 25 cm, S/N=2271) e carbono. Modificador orgánico: MeOH con amoniaco 220 nm. Vol. iny. 1,2 ml, c = 1,8 mg/ml de 288.0 en segundo eluyente por OZ-H (10 um, 21 mm x25 cm, e dióxido de carbono. Modificador orgánico: MeOH con =206 bar, 220 nm. Vol. iny. 1,2 ml, c = 6,0 mg/ml en 76 - 7,84 (m, 2 H) 7,63 (dd, J=8,80, 2,74 Hz, 1 H) 7,55 -) 6,78 (d, J=8,61 Hz, 1 H) 5,86 (br. s., 1 H) 5,25 (br. s., 3 H) 3,10 (s, 3 H) 1,19 (d, J=6,85 Hz, 3 H). LCMS-ESI
il)-5-(6-etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(4-fluoro-1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-etoxipiridin-2-il)-4H-pano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 hidroxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-fluoro-2-(metilsulfonil)fenil)-1-hidroxipropano-2-sulfonam Ejemplo 289.0. El Ejemplo 290.0 era el segundo isóme iC (10 um, 21 mm x25 cm, S/N=2271) con 45% mo Modificador orgánico: MeOH con amoniaco 20 mM. F iny. 1,2 ml, c = 1,8 mg/ml en MeOH/DCM (4 : 6). 1H RM H) 7,63 (dd, J=8,90, 2,84 Hz, 1 H) 7,55 - 7,61 (m, 2 J=8,61 Hz, 1 H) 5,87 (br. s., 1 H) 5,25 (br. s., 1 H) 3,71 3 H) 1,19 (d, J=6,85 Hz, 3 H). LCMS-ESI (POS), m/z: 6
Ejemplo 291.0: Preparación de [(1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida y ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpir'idin-3-il)-4H-1,2,4-triazol-3-il),4-triazol-3-il)-1 -(4-fluoro-2-(metilsulfonil)fenil)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(4-jemplo 290.0. El Ejemplo 290.0 es el enantiómero del yoritario en eluir en las siguientes condiciones de SFC: or orgánico modificador: 55% de dióxido de carbono. l/min, T=40C, BPR=100 bar, P=186 bar, 220 nm. Vol.
0 MHz, DMSO-cfe) 513,22 (br. s., 1 H) 7,76 - 7,84 (m, 2 (t, J=8,51 Hz, 1 H) 6,80 (d, J=8,22 Hz, 2 H) 6,78 (d, ) 3,63 (s, 3 H) 3,37 - 3,42 (m, 1 H) 3,21 (s, 3 H) 3,10 (s, M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida] o [(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--hidroxipropano-2-sulfonamida y (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida].
[(1 S,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxi-N,N-bis(4-meto dimetiltiazol-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propan hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida
metoxibencil)propano-2-sulfonamida], Ejemplo 291.1. A (4,70 g, 13,5 mmol) (Ejemplo 12.0) en THF (75 ml) en gota a gota n-butil-litio (solución 2,5 M en hexanos (5, Aldrich Corp., St. Louis, MO, EE.UU.). La mezcla result disolución de 4,5-dimetiltiazol-2-carbaldehído (1,90 g, 13 St. Louis, MO, EE.UU.) en THF (25 ml) que se inyectó g La reacción después se inactivó con solución acuosa sa agua (50 ml). Se separaron las dos capas. La capa acu combinadas se secaron sobre Na2SO4. La solución se forma de un aceite naranja claro. El material así obtenid por cromatografía a través de una columna de gel de gradiente de EtOAc en hexanos al 0-100%, para proporc de rendimiento) en forma de un sólido blanquecino, Lc M ncil)propano-2-sulfonamida y (1 R,2R)-1 -(4,5-sulfonamida] o [(1S,2R)-1-(4,5-dimetiltiazol-2-il)-1-(1 R,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxi-N,N-bis(4-disolución de N,N-bis(4-metoxibencil)etanosulfonamida atraz de fondo redondo de 500 ml a -782C, se inyectó l, 14,79 mmol)) (disponible en el mercado en Sigmase agitó durante 20 min a -78°C. A esto se añadió una mol, disponible en el mercado en Sigma-Aldrich Corp., gota a -78°C. La reacción se agitó a -78°C durante 1 h. da de NH4Cl (150 ml) y se diluyó con EtOAc (200 ml) y se extrajo más con EtOAc (50 ml). Las capas orgánicas y se concentró a vacío para dar el material inicial en e absorbió sobre un tapón de gel de sílice y se purificó preempaquetada Redi-Sep (220 g), eluyendo con un r el compuesto del título 291.1 (3,33 g, 6,79 mmol, 51% I (POS.) m/z: 490,9 (M+H)+.
[(1 S,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxi-N,N-bis(4-met dimetiltiazol-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propa hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida metoxibencil)propano-2-sulfonamida], Ejemplo 291.2.
con un gradiente de EtOAc en hexanos al 0-100%, p 24% de rendimiento) en forma de un sólido blanquecino ncil)propano-2-sulfonamida y (1 R,2R)-1 -(4,5-ulfonamida] o [(1S,2R)-1-(4,5-dimetiltiazol-2-il)-1-(1 R,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxi-N,N-bis(4-mplo 291.2 (el diastereómero de 291.1) se eluyó más oporcionar el compuesto del título (1,61 g, 3,28 mmol, S-ESI (POS.) m/z: 490,9 (M+H)+.
[(1 S,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulf 2-sulfonamida] o [(1S,2R)-1-(4,5-dimetiltiazol-2-il)-1-hidr 1-hidroxipropano-2-sulfonamida], Ejemplo 291.3. A u metoxibencil)propano-2-sulfonamida, Ejemplo 291.1 (6 (0,598 ml, 5,50 mmol, disponible en el mercado en adición de TFA (calidad de secuenciador de proteínas Aldrich Corp., St. Louis, MO, EE.UU.) gota a gota. La reacción se concentró a vacío a 36°C. El material así purificó por cromatografía a través de una columna de un gradiente de EtOAc:EtOH (3:1) en DCM al 0-40%, ida y (1 R,2R)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropanopano-2-sulfonamida y (1R,2S)-1-(4,5-dimetiltiazol-2-il)-olución de 1-(4,5-dimetiltiazol-2-il)-1-hidroxi-N,N-bis(4-, 1,38 mmol) en DCM (5 ml), se añadió anisol anhidro -Aldrich Corp., St. Louis, MO, EE.UU.) seguido de la ml, 68,8 mmol, disponible en el mercado en Sigmaa de reacción después se agitó a TA durante 25 h. La ido se absorbió sobre un tapón de gel de sílice y se sílice preempaquetada Redi-Sep (12 g), eluyendo con proporcionar un aceite naranja, que se trituró con éter
dietílico (2 ml) para dar el compuesto del título 291.3 sólido blanco. 1H RMN (500 MHz, DMSO-afe) 56,73 (s, (qd, J=6,70, 1,34 Hz, 1 H) 2,29 (s, 3 H) 2,20 - 2,22 (m, (M+H)+.
mg, 1,27 mmol, 92% de rendimiento) en forma de un 6,35 (d, J=5,50 Hz, 1 H) 5,38 (d, J=3,30 Hz, 1 H) 3,51 1,13 (d, J=6,97 Hz, 3 H). LCMS-ESI (POS.) m/z: 250,9
[(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4 2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida] o [(1 S,2R)-N-(4-(2,6-d dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida y ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-s 4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-5-metilpiridina 1 -hidroxipropano-2-sulfonamida (120 mg, 0,48 mmol) 2 el mercado en Sigma-Aldrich Corp., St. Louis, MO, EE. el mercado en Strem Chemicals Inc., Newburyport, M de N2. Después se añadió a la mezcla trans-N,N'-dimeti el mercado en Sigma-Aldrich Corp., St. Louis, MO, calentamiento previamente calentado durante 18 h. La (10 ml) y se agitó enérgicamente durante 10 min. La extrajo con DCM ( 3 x 15 ml). Las capas orgánicas evaporaron a vacío. El material así obtenido se ab cromatografía a través de una columna de gel de sílice de EtOAc:EtOH (3:1) en hexanos al 0-100% para prop dietílico (2 ml) para proporcionar el compuesto del títul un sólido blanco. 1H RMN (DMSO-ds) 5: 13,49 (br. s., 1H), 7,50 (t, J=8,3 Hz, 1H), 6,82 (d, J=8,6 Hz, 2H), 5,35 3H), 2,25 (s, 3H), 2,20 (s, 3H), 1,06 (d, J=7,0 Hz, 3H). L
Ejemplo 292.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropanoridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazot-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 291.0. Una suspensión de 3-(5-bromomg, 0.72 mmol) (Ejemplo 2.0), 1-(4,5-dimetiltiazol-2-il)-arbonato de cesio (469,2 mg, 1,44 mmol, disponible en yoduro de cobre (I) (110 mg, 0,58 mmol, disponible en UU.) en ACN (2,40 ml) se desgasificó en una corriente ciclohexanosdiamina (181 gl, 1,15 mmol) (disponible en .). La mezcla se calentó to 80°C en un bloque de ión se diluyó con solución saturada de NH4Cl (acuosa) a de reacción después se diluyó con agua (5 ml) y se binadas se secaron sobre Na2SO4, se filtraron y se sobre un tapón de gel de sílice y se purificó por paquetada Redi-Sep (12 g), eluyendo con un gradiente ar el producto enriquecido, que se trituró mediante éter 0 (73 mg, 0,13 mmol, 28% de rendimiento) en forma de ,48 (d, J=1,3 Hz, 1H), 8,20 (d, J=1,8 Hz, 1H), 7,63 (s, ), 3,69 (s, 3H), 3,66 (s, 3H), 3,41-3,47 (m, 1H), 2,28 (s, ESI (POS.) m/z: 545,2 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida] o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--hidroxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida] o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-s como resultado el compuesto del título 292.0 que era SFC: Realizado en Thar 80 SFC con columna de 250 CO2, 32% de co-disolvente a 75 g/min. Temperatura.
nm. Inyectado 0,35 ml de solución de muestra (65 mg inyección. Tiempo de ciclo = 4,5 min, Tiempo de análisi (s, 1H), 7,50 (t, J=8,4 Hz, 1H), 6,80 (dd, J=8,4, 6,1 Hz, 1,2 Hz, 1H), 2,33 (s, 3H), 2,30 (s, 3H), 2,26 (s, 3H), 1,1
Ejemplo 293.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 292.0. La purificación de 291.0 dio imer isómero en eluir en las siguientes condiciones de m IA con 24,0 ml/min de MeOH (solo) 51,0 g/min de , Presión de salida = 100 bar, Longitud de onda = 260 1.0 en 10,0 ml de MeOH); c= 6,5 mg/ml y 2,28 mg por min. 1H RMN (MeOH) 5: 8,43 (s, 1H), 8,31 (s, 1H), 7,71 5,52 (s, 1H), 3,77 (s, 3H), 3,74 (s, 3H), 3,59 (qd, J=7,0, =7,1 Hz, 3H). LCMS-ESI (POS.) m/z: 545,0 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--hidroxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H -triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-d dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-s enantiómero de 292.0. La purificación adicional de 291 eluir de la columna IA cuando se somete 291.0 a las (MeOH) 5: 8,43 (s, 1H), 8,31 (s, 1H), 7,71 (s, 1H), 7,50 3,77 (s, 3H), 3,74 (s, 3H), 3,60 (qd, J=7,1, 1,3 Hz, 1H), LCMS-ESI (POS.) m/z: 545,2 (M+H)+.
Ejemplo 294.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida y ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 293.0. El Ejemplo 293.0 es el como resultado 293.0 que era el segundo isómero en ciones de SFC descritas en el Ejemplo 292.0. 1H RMN 8,3 Hz, 1H), 6,80 (dd, J=8,4, 5,9 Hz, 2H), 5,52 (s, 1H), s, 3H), 2,30 (s, 3H), 2,26 (s, 3H), 1,19 (d, J=7,0 Hz, 3H).
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--hidroxipropano-2-sulfonamida y (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida.
[(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4 2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida] o [(1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida y ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-s diastereómero de 291.0. El Ejemplo 294.0 se prepar Ejemplo 291.0. 1H RMN (DMSO-afe) 5: 13,54 (br. s., 1H) Hz, 1H), 6,84 (dd, J=8,6, 3,9 Hz, 2H), 4,91 (d, J=7,1 H 3H), 2,26 (s, 3H), 2,21 (s, 3H), 1,06 (d, J=7,1 Hz, 3H). L
Ejemplo 295.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropanoridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 294.0. El Ejemplo 294.0 es un artir de 29l.2, usando el procedimiento descrito en el (br. s., 1H), 8,22 (br. s., 1H), 7,63 (s, 1H), 7,51 (t, J=8,5 ), 3,74 (s, 3H), 3,73 (s, 3H), 3,20-3,26 (m, 1H), 2,30 (s, ESI (POS.) m/z: 545,2 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--hidroxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida.
[(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4 2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida] o [(1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-s diastereómero del Ejemplo 296.0. La purificación de 29 el primer isómero en eluir en las siguientes condicione de 250 x 21 mm IA con 24,0 ml/min de MeOH (NH320 Temperatura. = 30°C, Presión de salida = 100 bar, L muestra 294.0 disuelta en 15 ml de MeOH:DCM 13:2; c a purificar en Thar 200 SFC con columnas 250 x 21 1 g/min de CO2, 32% de co-disolvente a 55 g/min. Temp onda = 263 nm. Inyectado 0,3 ml de 29 mg de muestra por inyección. 1H RMN (CD2Cl2) 5: 11,18 (br. s., 1H), 8 1,0 Hz, 1H), 7,48 (t, J=8,4 Hz, 1H), 6,69 (dd, J=8,1, 5, 3,25-3,32 (m, 1H), 2,32 (s, 3H), 2,28 (s, 3H), 2,26 (s, (M+H)+.
Ejemplo 296.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -hidroxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -hidroxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropanoidin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 295.0. El Ejemplo 295.0 es un o como resultado el compuesto del título 295.0 que era FC: Etapa 1: Realizado en Thar 200 SFC con columna 46,0 g/min de CO2, 35% de co-disolvente a 70 g/min. d de onda = 263 nm. Inyectado 0,6 ml de 83 mg de mg/ml y 3,32 mg por inyección. Este material se volvió mm IA con 18,0 ml/min de MeOH (NH320 mM) 37,0 a. = 30°C, Presión de salida = 99-100 bar, Longitud de lta en 5 ml de MeOH:DCM 4:1; c= 5,8 mg/ml y 1,74 mg , J=1,5 Hz, 1H), 8,33 (d, J=17 Hz, 1H), 7,60 (dt, J=2,1, 2H), 4,92 (d, J=8,7 Hz, 1H), 3,80 (s, 3H), 3,79 (s, 3H), 1,17 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z: 545,3
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--hidroxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (41 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-hidroxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-s enantiómero de 295.0. La purificación adicional del Ej isómero en eluir de la columna IA cuando se somete (CD2Cl2) 5: 11,13 (br. s., 1H), 8,44 (d, J=1,3 Hz, 1H), 1H), 6,69 (t, J=6,9 Hz, 2H), 4,91 (d, J=8,6 Hz, 1H), 3,80 3H), 2,26 (s, 3H), 1,17 (d, J=7,0 Hz, 3H). LCMS-ESI (P
Ejemplo 297.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida y ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-hidroxipropano-2-idin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 296.0. El Ejemplo 296.0 es el 294.0 dio como resultado el 296.0 que era el segundo a las condiciones de SFC descritas en 295.0. 1H RMN d, J=1,7 Hz, 1H), 7,59-7,61 (m, 1H), 7,48 (t, J=8,5 Hz, ), 3,79 (s, 3H), 3,25-3,32 (m, 1H), 2,32 (s, 3H), 2,28 (s, /z: 545,3 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida y (1 R,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida.
(1 S,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxi-N,N-bis(4-met dimetiltiazol-2-il)-1 -metoxi-N,N-bis(4-metoxibencil)propa metoxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida metoxibencil)propano-2-sulfonamida, Ejemplo
metoxibencil)propano-2-sulfonamida (335 mg, 0,683 m usar) se disolvió en THF (3 ml), y la mezcla se enfrió a en THF (0,82 ml, 0,82 mmol), disponible en el mercado retiró el baño frío y la mezcla se agitó durante 25 min. gota a gota una disolución de yodometano (0,064 ml, St. Louis, MO, EE.UU.) en THF (1,0 ml). La reacción s una solución saturada de NH4Cl (acuosa) (15 ml) y se orgánica se lavó con salmuera (2 x 15 ml) y se secó so dar el material inicial como un aceite naranja. El materi se purificó por cromatografía a través de una columna con un gradiente de EtOAc en hexanos al 0-100%, par mg, 0,66 mmol, 97% de rendimiento) en forma de una sin más purificación. LCMS-ESI (POS.) m/z: 505,0 (M+ cil)propano-2-sulfonamida y (1 R,2R)-1 -(4,5-ulfonamida o (1 S,2R)-1 -(4,5-dimetiltiazol-2-il)-1 -(1 R,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxi-N,N-bis(4-La 1-(4,5-Dimetiltiazol-2-il)-1-hidroxi-N,N-bis(4-91.1 (destilada azeotrópicamente con tolueno antes de . A esto se añadió bis(trimetilsilil)amida de potasio (1 M gma-Aldrich Corp., St. Louis, MO, EE.UU.). Después se zcla de reacción se volvió a enfriar a -78°C y se añadió mol, disponible en el mercado en Sigma-Aldrich Corp., ntó a TA a lo largo de 2 h. La reacción se inactivó con con EtOAc (15 ml). Se separaron las capas y la capa a2SO4. La solución se filtró y se concentró a vacío para obtenido se absorbió sobre un tapón de gel de sílice y l de sílice preempaquetada Redi-Sep (12 g), eluyendo orcionar el compuesto del título enriquecido 297.1 (335 incolora, que se usó directamente en la siguiente etapa
(1 R,2R)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-sulfo 2-sulfonamida o (1R,2S)-1-(4,5-dimetiltiazol-2-il)-1-meto 1-metoxipropano-2-sulfonamida, Ejemplo 297.2. A una metoxibencil)propano-2-sulfonamida 297.1 (330 mg, 0,58 2,30 mmol)) (disponible en el mercado en Sigma-Aldrich (calidad de secuenciador de proteínas (2,14 ml, 28,8 m Louis, MO, EE.UU.) gota a gota. La mezcla de reacción después se concentró a vacío a 36°C. El material así purificó por cromatografía a través de una columna de g un gradiente de B/A al 0-100% (B = EtOAc/EtOH 3:1, A con éter dietílico (2 ml) para dar el compuesto del título 2 un sólido blanquecino. Lc MS-ESI (POS.) m/z: 265,1 (M+
Ejemplo 297.0: Preparación de (1S,2S)-N-(4-(2,6-di dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida y (1 triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-sul metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1ida y (1 S,2S)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropanopano-2-sulfonamida y (1S,2R)-1-(4,5-dimetiltiazol-2-il)-olución de 1-(4,5-dimetiltiazol-2-il)-1-metoxi-N,N-bis(4-ol) en DCM (3 ml), se añadió anisol anhidro (0,250 ml, ., St. Louis, MO, EE.UU.) seguido de la adición de TFA (disponible en el mercado en Sigma-Aldrich Corp., St. spués se agitó a TA durante 2 d. La mezcla resultante nido se absorbió sobre un tapón de gel de sílice y se sílice preempaquetada Redi-Sep (12 g), eluyendo con CM), para proporcionar un aceite naranja, que se trituró (135 mg, 0,51 mmol, 89% de rendimiento) en forma de
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida y (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1 sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-m metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida y (1 triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-sul preparó a partir de 297.2 (76 mg, 0,29 mmol), usando el Ejemplo 297.0 (134 mg, 0,20 mmol, 69% de rendimiento) (s, 1H), 8,48 (d, J=1,3 Hz, 1H), 8,21 (d, J=1,7 Hz, 1H), 7 J=8,6, 2,7 Hz, 2H), 5,01 (d, J=1,3 Hz, 1H), 3,70 (s, 3H), 2,25 (s, 3H), 2,22 (s, 3H), 1,08 (d, J=7,1 Hz, 3H). LCMS-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 297.0. El compuesto del título 297.0 se edimiento descrito en el Ejemplo B. Esto proporcionó el forma de un sólido blanco. 1H RMN (DMSO-cfe) 5: 13,49 (dt, J=2,0, 1,0 Hz, 1H), 7,50 (t, J=8,6 Hz, 1H), 6,83 (dd, 9 (s, 3H), 3,28 (s, 3H), 3,25-3,31 (m, 1H), 2,30 (s, 3H), (POS.) m/z: 559,1 (M+H)+.
Ejemplo 298.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-s como resultado el compuesto del título 298.0 como el p AS-H (2 x 15 cm) IPA (NH4OH al 0,1%)/CO2 al 25%, solución en MeOH:DCM (2:1) de 297.0. 1H RMN (400 8,42 (d, J=1,2 Hz, 1H), 8,32 (d, J=1,6 Hz, 1H), 7,61 (td, 5,07 (d, J=2,2 Hz, 1H), 3,75 (s, 3H), 3,74 (s, 3H), 3,46 J=0,5 Hz, 3H), 2,27 (d, J=0,6 Hz, 3H), 1,23 (d, J=7,1 Hz
Ejemplo 299.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-idin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 298.0. La purificación de 297.0 dio isómero en eluir en las siguientes condiciones de SFC: bar 60 ml/min, 220 nm. Vol. iny.: 0,75 ml, 12 mg/ml, DMSO-db) 5 . 1H RMN (CD2Cb) 5: 11,23 (br. s., 1H), , 0,7 Hz, 1H), 7,46 (t, J=8,5 Hz, 1H), 6,65-6,69 (m, 2H), J=7,0, 2,4 Hz, 1H), 3,34 (s, 3H), 2,32 (s, 3H), 2,28 (d, LCMS-ESI (POS.) m/z: 559,1 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-s enantiómero de 298.0. La purificación adicional de 297. como el segundo isómero en eluir de la columna AS-H en el Ejemplo 298.0. 1H RMN (400 MHz, DMSO-afe) 5 p 1H), 8,32 (d, J=1,8 Hz, 1H), 7,60 (dt, J=2,2, 1,3 Hz, 1H) 1H), 3,75 (s, 3H), 3,74 (s, 3H), 3,46 (qd, J=7,0, 2,4 Hz, J=0,6 Hz, 3H), 1,23 (d, J=7,1 Hz, 3H). LCMS-ESI (POS.
Ejemplo 300.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1 -metoxipropano-2-sulfonamida y ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 299.0. El Ejemplo 299.0 es el como resultado el compuesto del título, Ejemplo 299.0, o se somete 297.0 a las condiciones de SFC descritas H RMN (CDzClz) 5: 11,22 (br. s., 1H), 8,42 (d, J=15 Hz, (t, J=8,5 Hz, 1H), 6,65-6,69 (m, 2H), 5,06 (d, J=2,3 Hz, ,34 (s, 3H), 2,32 (s, 3H), 2,27 (d, J=0,5 Hz, 3H), 2,26 (d, 559,1 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida y (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida y ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-s partiendo de 291.2, usando el procedimiento descrito e 8,48 (d, J=1,5 Hz, 1H), 8,20 (d, J=18 Hz, 1H), 7,62 (dt, 2H), 4,53 (d, J=8,1 Hz, 1H), 3,75 (s, 3H), 3,73 (s, 3H), 3 3H), 2,23 (s, 3H), 0,98 (d, J=7,1 Hz, 3H). LCMS-ESI (P
Ejemplo 301.0: Preparación de (IS,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 300.0. El Ejemplo 300.0 se preparó jemplo 297.0. 1H RMN (DMSO-d6) 5: 13,35 (br. s., 1H), Hz, 1H), 7,51 (t, J=8,5 Hz, 1H), 6,84 (dd, J=8,6, 2,1 Hz, d, J=7,9, 7,3 Hz, 1H), 3,03 (s, 3H), 2,32 (s, 3H), 2,25 (s, /z: 559,1 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-s dio como resultado el compuesto del título, Ejemplo condiciones de SFC: Realizado en Thar 80 SFC con co 20 mM) 42,40 g/min de CO2, 47% de co-disolvente a Longitud de onda = 264 nm. Inyectado 0,5 ml de 117 DCM (2:1); c= 7,8 mg/ml y 3,9 mg por inyección. Tie (CD2Cl2) 5: 8,41 (d, J=1,5 Hz, 1H), 8,32 (d, J=1,7 Hz, Hz, 2H), 4,67 (d, J=7,0 Hz, 1H), 3,80 (s, 3H), 3,76 (s, 3 2,27 (s, 3H), 1,15 (d, J=7,1 Hz, 3H). LCMS-ESI (POS.)
Ejemplo 303.0: Preparación de (1S,2S)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazoldimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 301.0. La purificación del Ejemplo 300.0 , como el primer isómero en eluir en las siguientes de 250 x 30 mm CC4 con 37,60 ml/min de MeOH (NH3 min. Temperatura. = 28°C, Presión de salida = 100 bar, muestra (300.0 disuelto en 10 ml de MeOH y 5 ml de e ciclo 9,0 min, Tiempo de análisis 15,5 min. 1H RMN ,59 (s, 1H), 7,46 (t, J=8,5 Hz, 1H), 6,69 (dd, J=8,6, 4,3 41-3,46 (m, 1H), 3,19 (s, 3H), 2,35 (s, 3H), 2,30 (s, 3H), 59,1 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(4,5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetiltiazol-2-il)-1-metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-s Ejemplo 300.0 dio como resultado el Ejemplo 303.0 qu se somete 300.0 a las condiciones de SFC descritas 8,42 (d, J=1,3 Hz, 1H), 8,32 (d, J=1,7 Hz, 1H), 7,60 (s, Hz, 1H), 3,81 (s, 3H), 3,77 (s, 3H), 3,38-3,45 (m, 2H), J=7,1 Hz, 3H). LCMS-ESI (POS.) m/z: 559,1 (M+H)+.
Ejemplo 304.0: Preparación de (1R,2S)-N-(4-(2,6-dimet (5-metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2R) 3-il)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sulfona 4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazin-2-il)pro metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-meto -triazol-3-il)-1-(4,5-dimetiltiazol-2-il)-1-metoxipropano-2-idin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5-dimetiltiazol-2-il)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(4,5 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 303.0. La purificación adicional del el segundo isómero en eluir de la columna CC4 cuando Ejemplo 301.0. 1H RMN (CD2Cl2) 5: 11,68 (br. s., 1H), ,47 (t, J=8,5 Hz, 1H), 6,67-6,72 (m, 2H), 4,64 (d, J=7,8 s, 3H), 2,35 (s, 3H), 2,30 (s, 3H), 2,27 (s, 3H), 1,15 (d,
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazolo (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-in-2-il)propano-2-sulfonamida.
(1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metoxipira bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propano-2-sulf metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2S)-1 -hid 2-sulfonamida, Ejemplo 304.1. A una disolución de N, (Ejemplo 12.0) en THF (30 ml) a -782C, se añadió gota 7,87 mmol), disponible en el mercado en Sigma-Aldrich durante 20 min. A esto se añadió gota a gota una dis mmol, disponible en el mercado en Frontier Scientific I continuó a -78°C durante 1 h. Después de retirar el ba acuosa saturada de NH4Cl (75 ml), y se diluyó con EtOA acuosa se extrajo con más EtOAc (25 ml). Las capas solución se filtró y se concentró a vacío para dar el mat así obtenido se absorbió sobre un tapón de gel de sílice gel de sílice preempaquetada Redi-Sep (220 g), eluyen proporcionar el compuesto del título 304.1 (1,46 g, 2,99 claro, LCMS-ESI (POS.) m/z: 488,3 (M+H)+.
-2-il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-mida o (1 R,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-i-N,N-bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propanois(4-metoxibencil)etanosulfonamida (2,50 g, 7,15 mmol) ota solución de n-butil-litio (2,5 M en hexanos (3,15 ml, rp., St. Louis, MO, EE.UU.). La mezcla se agitó a -78°C ción de 5-metoxipirazina-2-carbaldehído (0,988 g, 7,15 , Logan, UT, EE.UU.) en THF (6,0 ml). La reacción se frío durante 10 min, la reacción se inactivó con solución 100 ml) y agua (25 ml). Se separaron las capas y la capa ánicas se combinaron y se secaron sobre Na2SO4. La l inicial en forma de un aceite naranja claro. El material e purificó por cromatografía a través de una columna de con un gradiente de EtOAc en hexanos al 0-100%, para ol, 42% de rendimiento) en forma de un sólido amarillo
(1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metoxipiraz bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propano-2-sulfo metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2S)-1 -hidr 2-sulfonamida, Ejemplo 304.2. La elución adicional con un compuesto del título 304.2, (0,663 g, 1,36 mmol, 19% de (POS.) m/z: 488,3 (M+H)+.
-il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-ida o (1 R,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-N,N-bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propanoadiente de EtOAc en hexanos al 0-100% proporcionó el ndimiento) en forma de una goma naranja, LCMS-ESI
(1 R,2S)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sulfona 2-sulfonamida o (1R,2R)-1-hidroxi-1-(5-metoxipirazin metoxipirazin-2-il)propano-2-sulfonamida, Ejemplo 304.3. metoxipirazin-2-il)propano-2-sulfonamida, Ejemplo 304.1 anhidro (0,498 ml, 4,58 mmol, disponible en el mercado e la adición de TFA, (calidad de secuenciador de proteínas, Aldrich Corp., St. Louis, MO, EE.UU.) gota a gota. La me después se concentró a vacío a 30°C. El material así o purificó por cromatografía a través de una columna de gel un gradiente de (EtOAc/EtOH 3 : 1) en DCM al 0-40% par mmol, 44% de rendimiento) en forma de un sólido blanque da y (1 S,2R)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propanoil)propano-2-sulfonamida y (1 S,2S)-1 -hidroxi-1 -(5-na disolución de 1-hidroxi-N,N-bis(4-metoxibencil)-1-(5-8 mg, 1,144 mmol) en DCM (4 ml), se añadió anisol igma-Aldrich Corp., St. Louis, MO, EE.UU.) seguido de 25 ml, 57,2 mmol, disponible en el mercado en Sigmaa de reacción se agitó a TA durante 39 h. La reacción nido se absorbió sobre un tapón de gel de sílice y se sílice preempaquetada Redi-Sep (24 g), eluyendo con roporcionar el compuesto del título 304.3 (123 mg, 0,50 o. LCMS-ESI (POS.) m/z: 248,1 (M+H)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil 2- il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dime (5-metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2S)-3- il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-sulfona a partir de 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-tria mg, 0,49 mmol) usando el procedimiento descrito en el 304.0 (115 mg, 0,18 mmol, 36% de rendimiento) en for Hz, 1H), 8,48 (d, J=1,3 Hz, 1H), 8,24 (t, J=1,1 Hz, 1H), 6,68-6,78 (m, 2H), 5,42 (t, J=1,1 Hz, 1H), 3,95 (s, 3H), (s, 3H), 1,11 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z: 5
Ejemplo 305.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(5-metoxipirazin-2-il)propano-2-sulfonamida o (1 triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sul metilpiridin-3-il)-4H-1,2,4-triazot-3-il)-1 -hidroxi-1 -(5-metox dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -triazol-3-il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2--3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazinnil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-Ejemplo 304.0. El compuesto del título 304.0 se preparó il)-5-metilpiridina 2.0 (273 mg, 0,73 mmol) y 304.3 (120 lo B. Esto proporcionó el compuesto del título Ejemplo un sólido blanco. 1H RMN (CD2Cl2) 5: 8,55 (d, J=1,0 (d, J=1,3 Hz, 1H), 7,99 (s, 1H), 7,52 (t, J=8,3 Hz, 1H), s, 3H), 3,76 (s, 3H), 3,61 (qd, J=7,0, 1,4 Hz, 1H), 2,42 M+H)+.
nil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-yt)-1-hidroxi-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-ida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-in-2-il)propano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-xi-1-(5-metoxipirazin-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil 2- il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dime (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2S)-3- il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-sulfona resultado el compuesto del título 305.0 que era el prim Realizado en Thar 80 SFC con columna 150 x 30 mm CO2, 35% de co-disolvente a 80 g/min. Temperatura. = nm. Inyectado 0,7 ml de solución de muestra (108 mg d -triazol-3-il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2--3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazinnil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-Ejemplo 305.0. La purificación de 304.0 dio como ómero en eluir en las siguientes condiciones de SFC: n 28,0 ml/min de MeOH (NH320 mm) 52,0 g/min de , Presión de salida = 100 bar, Longitud de onda = 277 .0 disuelto en 13 ml de MeOH:DCM 8:5; c= 8,31 mg/ml
y 5,81 mg por inyección). Tiempo de ciclo 5,8 min, Tiem 1H), 8,33 (d, J=1,7 Hz, 1H), 8,24 (s, 1H), 8,12 (d, J=1,2 2H), 5,41 (s, 1H), 3,94 (s, 3H), 3,83 (s, 3H), 3,73 (s, 3H), (d, J=7,1 Hz, 3H). LCMS-ESI (POS.) m/z: 542,3 (M+H)+.
Ejemplo 306.0: Preparación de (1 R,2S)-N-(4-(2,6-dimeto (5-metoxipirazin-2-iI)propano-2-suIfonamida o (1 S,2R)-3-iI)-1 -hidroxi-1 -(5-metoxipirazin-2-iI)propano-2-suIfonam 4H-1,2,4-triazoI-3-iI)-1 -hidroxi-1 -(5-metoxipirazin-2-iI)pro metiIpiridin-3-iI)-4H-1,2,4-triazot-3-iI)-1-hidroxi-1-(5-metox análisis 10 min. 1H RMN (CD2CI2) 5: 8,44 (d, J=1,5 Hz, 1H), 7,61 (s, 1H), 7,49 (t, J=8,5 Hz, 1H), 6,65-6,75 (m, (qd, J=7,0, 1,3 Hz, 1H), 3,42 (s, 1H), 2,28 (s, 3H), 1,11
iI)-5-(5-metiIpiridin-3-iI)-4H-1,2,4-triazoI-3-iI)-1 -hidroxi-1 -(2,6-dimetoxifeniI)-5-(5-metiIpiridin-3-iI)-4H-1,2,4-triazoI-(1 R,2R)-N-(4-(2,6-dimetoxifeniI)-5-(5-metiIpiridin-3-iI)-2-suIfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifeniI)-5-(5-in-2-iI)propano-2-suIfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifeniI)-5-(5-metiIpiridin-3-iI)-4H-suIfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifeniI)-5-(5-metiI 2- iI)propano-2-suIfonamida o (1 R,2R)-N-(4-(2,6-dime (5-metoxipirazin-2-iI)propano-2-suIfonamida o (1 S,2S)-3- iI)-1-hidroxi-1-(5-metoxipirazin-2-iI)propano-2-suIfona 304.0 dio como resuItado eI Ejemplo 306.0 que era eI s EjempIo 304.0 a Ias condiciones de SFC descritas en eI 8,33 (d, J=1,8 Hz, 1H), 8,24 (t, J=1,2 Hz, 1H), 8,12 (d, J 1H), 6,65-6,75 (m, 2H), 5,41 (s, 1H), 3,94 (s, 3H), 3,83 3H), 1,11 (d, J=7,1 Hz, 3H). LCMS-ESI (POS.) m/z: 542,
EjempIo 307.0: Preparación de (1 R,2S)-N-(4-(2,6-dimeto (5-metoxipirazin-2-iI)propano-2-suIfonamida y (1 S,2R)-3-iI)-1 -hidroxi-1 -(5-metoxipirazin-2-iI)propano-2-suIfonam 4H-1,2,4-triazoI-3-iI)-1 -hidroxi-1 -(5-metoxipirazin-2-iI)pro metiIpiridin-3-iI)-4H-1,2,4-triazoI-3-iI)-1-hidroxi-1-(5-metox -triazoI-3-iI)-1-hidroxi-1-(5-metoxipirazin-2-iI)propano-2-n-3-iI)-4H-1,2,4-triazoI-3-iI)-1 -hidroxi-1 -(5-metoxipirazinniI)-5-(5-metiIpiridin-3-iI)-4H-1,2,4-triazoI-3-iI)-1 -hidroxi-1 -(2,6-dimetoxifeniI)-5-(5-metiIpiridin-3-iI)-4H-1,2,4-triazoI-EjempIo 306.0. La purificación adicionaI deI EjempIo o isómero en eIuir de Ia coIumna IA cuando se somete pIo 305.0. 1H RMN (CD2CI2) 5: 8,44 (d, J=1,5 Hz, 1H), Hz, 1H), 7,61 (td, J=2,0, 0,8 Hz, 1H), 7,49 (t, J=8,6 Hz, H), 3,73 (s, 3H), 3,60 (qd, J=7,0, 1,3 Hz, 1H), 2,28 (s, H)+.
iI)-5-(5-metiIpiridin-3-iI)-4H-1,2,4-triazoI-3-iI)-1 -hidroxi-1 -(2,6-dimetoxifeniI)-5-(5-metiIpiridin-3-iI)-4H-1,2,4-triazoI-(1 R,2R)-N-(4-(2,6-dimetoxifeniI)-5-(5-metiIpiridin-3-iI)-2-suIfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifeniI)-5-(5-in-2-iI)propano-2-suIfonamida.
(1 R,2S)-1 -hidroxi-1 -(5-metoxipirazin-2-iI)propano-2-suIfo 2-suIfonamida o (1R,2R)-1-hidroxi-1-(5-metoxipiraz a y (1 S,2R)-1 -hidroxi-1 -(5-metoxipirazin-2-iI)propano-I)propano-2-suIfonamida y (1 S,2S)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonamida, Ejemplo 307.1. A metoxip¡raz¡n-2-il)propano-2-sulfonam¡da 304.2 (356 mg, (0,317 ml, 2,92 mmol, disponible en el mercado en Sigm adición de TFA (calidad de secuenciador de proteínas (2, Aldrich Corp., St. Louis, MO, EE.UU.) gota a gota. La mez después se concentró a vacío a 30°C. El material así obt purificó por cromatografía a través de una columna de gel un gradiente de B/A al 0-40% (B = EtOAc/EtOH 3 : 1, A = con éter dietílico (2 ml) para dar el compuesto del título 30 de una goma naranja. LCMS-ESI (POS.) m/z: 248,1 (M+H)+.
isolución de 1-hidroxi-N,N-bis(4-metoxibencil)-1-(5-mol) en DCM (2,5 ml), se añadió anisol anhidro rich Corp., St. Louis, MO, EE.UU.) seguido de la , 36,5 mmol, disponible en el mercado en Sigmareacción se agitó a TA durante 39 h. La reacción se absorbió sobre un tapón de gel de sílice y se ce preempaquetada Redi-Sep (12 g), eluyendo con para proporcionar un aceite naranja, que se trituró 08 mg, 0,437 mmol, 60% de rendimiento) en forma
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2 sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiri 2- il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-d (5-metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2S)-N-( 3- il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-sulfonamid a partir de 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-sulfonamida 307. en el Ejemplo B. Esto proporcionó el compuesto del título 3 de un sólido blanco. 1H RMN (CD2Cl2) 5: 8,59 (s, 1H), 8,50 J=8,6 Hz, 1H), 6,70-6,75 (m, 2H), 4,87 (d, J=8,2 Hz, 1H), Hz, 1H), 2,44 (s, 3H), 1,06 (d, J=7,0 Hz, 3H). LCMS-ESI (P
Ejemplo 308.0: Preparación de (1R,2S)-N-(4-(2,6-dimetoxif (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2R)-N-(4 3-¡l)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propan metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-metoxipir zol-3-il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazinxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 --dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazolmplo 307.0. El compuesto del título 307.0 se preparó
-metilpiridina (239 mg, 0,637 mmol) (Ejemplo 2.0) y
5 mg, 0,43 mmol) usando el procedimiento descrito
(64 mg, 0,098 mmol, 23% de rendimiento) en forma
H), 8,16 (s, 1H), 8,11 (s, 1H), 8,08 (s, 1H), 7,52 (t,
s, 3H), 3,81 (s, 3H), 3,80 (s, 3H), 3,53 (quin, J=7,1
/z: 542,0 (M+H)+.
-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-dimetoxifenil)-5-(5-metilpiridin-3-yt)-4H-1,2,4-triazot-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-lfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5--il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1, sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiri 2- il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-di (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2S)-N-( 3- il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-sulfonamid resultado el compuesto del título 308.0 que era el primer Realizado en Thar 80 SFC con columna de 250 x 21 mm I CO2, 48% de co-disolvente a 60 g/min. Temperatura. = 28 nm. Inyectado 0,3 ml de solución de muestra (57 mg de mu mg/ml y 5,7 mg por inyección). Tiempo de ciclo 6,4 min, J=1,2 Hz, 1H), 8,33 (d, J=1,5 Hz, 1H), 8,15 (d, J=1,2 Hz, 1 1H), 6,68 (dd, J=8,6, 5,5 Hz, 2H), 4,85 (d, J=8,3 Hz, 1H), 2,28 (s, 3H), 1,05 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z:
Ejemplo 309.0: Preparación de (1R,2S)-N-(4-(2,6-dimetoxif (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2R)-N-( 3-il)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propan metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-metoxipi azol-3-il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2--il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazinifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 --dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoljemplo 308.0. La purificación de 307.0 dio como
ero en eluir en las siguientes condiciones de SFC:
29,0 ml/min de MeOH (NH320 mm) 52,0 g/min de
resión de salida = 100 bar, Longitud de onda = 277
307.0 disueltos en 3 ml de MeOH:DCM 2:1; c= 19,0
o de análisis 17 min. 1H RMN (CD2Cl2) 5: 8,44 (d,
09 (d, J=1,1 Hz, 1H), 7,60 (s, 1H), 7,47 (t, J=8,4 Hz,
s, 3H), 3,77 (s, 3H), 3,77 (s, 3H), 3,47-3,54 (m, 1H),
3 (M+H)+.
-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1--dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1, sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiri 2-il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxif (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2S)-N-( azol-3-il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2--il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metoxipirazin-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 --dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-
3-il)-1-hidroxi-1-(5-metoxipirazin-2-il)propano-2-sulfonami enantiómero de 308.0. La purificación adicional de 307.0 de la columna IC cuando se somete 307.0 a las con (CD2Cl2) 5: 8,44 (d, J=1,5 Hz, 1H), 8,33 (d, J=1,8 Hz, 1H), 7,47 (t, J=8,6 Hz, 1H), 6,66-6,71 (m, 2H), 4,85 (d, 3,54 (m, 1H), 2,28 (s, 3H), 1,05 (d, J=7,1 Hz, 3H). LCMS
Ejemplo 310.0: Preparación de (1R,2S)-N-(4-(2,6-dimeto (5-metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2R)-3-il)-1 -metoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazin-2-il)pro metilpiridin-3-il)-4H-1,2,4-triazot-3-il)-1-metoxi-1-(5-metox Ejemplo 309.0. El compuesto del título es el omo resultado 309.0 como el segundo isómero en eluir nes de SFC descritas en el Ejemplo 308.0. 1H RMN ,15 (d, J=1,3 Hz, 1H), 8,09 (d, J=1,3 Hz, 1H), 7,60 (s, Hz, 1H), 3,95 (s, 3H), 3,78 (s, 3H), 3,77 (s, 3H), 3,47 (POS.) m/z: 542,3 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazolo (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-zin-2-il)propano-2-sulfonamida.
(1 R,2S)-1 -metoxi-N,N-bis(4-metoxibencil)-1 -(5-metoxipir bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propano-2-sulf metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2S)-1 -m 2-sulfonamida, Ejemplo 310.1. La (1R,2S)-1-hidro sulfonamida y (1S,2R)-1-hidroxi-N,N-bis(4-metoxibencil) hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)pr metoxibencil)-1-(5-metoxipirazin-2-il)propano-2-sulfonam azeotrópicamente con tolueno antes de usar) se disolvi mezcla se añadió bis(trimetilsilil)amida de potasio (1 M Sigma-Aldrich Corp., St. Louis, MO, EE.UU.) gota a got añadió gota a gota una disolución de yodometano (0,14 en Sigma-Aldrich Corp., St. Louis, MO, EE.UU.). La rea con solución saturada de NH4Cl (acuosa) (25 ml) y se orgánica se lavó con salmuera (2 x 25 ml) y después s vacío para dar el material inicial en forma de un aceite de gel de sílice y se purificó por cromatografía a través (40 g), eluyendo con un gradiente de EtOAc en hexanos (740 mg, 1,48 mmol, 95% de rendimiento) en forma de J=1,35 Hz, 1 H) 8,15 (dd, J=9,60 Hz, 1 H) 7,15 - 7,18 ( 4,36 (d, J=15,16 Hz, 2 H) 4,24 - 4,27 (m, 1 H) 4,19 (d, J (d, J=7,21 Hz, 3 H). LCMS-ESI (POS.) m/z: 502,3 (M+H) -il)propano-2-sulfonamida y (1 S,2R)-1 -metoxi-N,N-ida o (1 R,2R)-1 -metoxi-N,N-bis(4-metoxibencil)-1 -(5-N,N-bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propano-N-bis(4-metoxibencil)-1-(5-metoxipirazin-2-il)propano-2--metoxipirazin-2-il)propano-2-sulfonamida o (1R,2R)-1-o-2-sulfonamida y (1 S,2S)-1 -hidroxi-N,N-bis(4-(760 mg, 1,56 mmol) Ejemplo 304.1 (destilado en THF (6 ml) y después se enfriaron a -78°C. A esta HF, 1,87 ml, 1,87 mmol), disponible en el mercado en mezcla se agitó durante 15 min a -78°C. Después se 2,34 mmol) en THF (1,00 ml, disponible en el mercado se calentó a TA durante 1,5 h. La reacción se inactivó con EtOAc (25 ml). Se separaron las capas. La capa ó sobre Na2SO4. La solución se filtró y se concentró a ja. El material así obtenido se absorbió sobre un tapón na columna de gel de sílice preempaquetada Redi-Sep -100%, para proporcionar el compuesto del título 310.1 lido blanquecino. 1H RMN (500 MHz, CD2Cl2) 58,20 (d, H) 6,81 - 6,85 (m, 4 H) 4,97 (dd, J=2,63, 0,55 Hz, 1 H) 6 Hz, 2 H) 3,97 (s, 3 H) 3,78 (s, 6 H) 3,43 (s, 3 H) 1,22
(1 R,2S)-1 -metoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfo 2-sulfonamida o (1R,2R)-1-metoxi-1-(5-metoxipira metoxipirazin-2-il)propano-2-sulfonamida, Ejemplo 310. ml), se añadió anisol anhidro (0,639 ml, 5,88 mmol, dis EE.UU.) seguido de la adición de TFA (reactivo plus, 5, Corp., St. Louis, MO, EE.UU.) gota a gota. La mezcla se concentró a vacío a 30°C. El material así obtenido cromatografía a través de una columna de gel de sílice de B/A al 0-40% (B = EtOAc/EtOH 3 : 1, A = DCM), p mg, 0,90 mmol, 62% de rendimiento) en forma de un sól a y (1 S,2R)-1 -metoxi-1 -(5-metoxipirazin-2-il)propanoil)propano-2-sulfonamida y (1S,2S)-1-metoxi-1-(5-na disolución de 310.1 (737 mg, 1,47 mmol) en DCM (5 en el mercado en Sigma-Aldrich Corp., St. Louis, MO, 73,5 mmol, disponible en el mercado en Sigma-Aldrich cción se agitó a TA durante 40 h. La reacción después sorbió sobre un tapón de gel de sílice y se purificó por paquetada Redi-Sep (24 g), eluyendo con un gradiente oporcionar para dar el compuesto del título 310.2 (236 lanquecino. LCMS-ESI (POS.) m/z: 262,1 (M+H)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-meti 2-il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimet (5-metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2S) 3-il)-1-metoxi-1-(5-metoxipirazin-2-il)propano-2-sulfona a partir de 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-tri (105 mg, 0,40 mmol) usando el procedimiento descrito 0,24 mmol, 59% de rendimiento) en forma de un sólid 8,45 (d, J=1,5 Hz, 1H), 8,17 (d, J=15 Hz, 1H), 8,09-8,12 (m, 2H), 4,94 (d, J=2,4 Hz, 1H), 3,96 (s, 3H), 3,78 (s, 2,40 (s, 3H), 1,20 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.)
Ejemplo 311.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet -triazol-3-il)-1-metoxi-1-(5-metoxipirazin-2-il)propano-2-n-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazinil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoljemplo 310.0. El compuesto del título 310.0 se preparó -il)-5-metilpiridina 2.0 (226 mg, 0,603 mmol) y 310.2 Ejemplo B. Esto proporcionó el Ejemplo 310.0 (159 mg, quecino. 1H RMN (CD2Cl2) 5: 8,53 (d, J=1,2 Hz, 1H), H), 7,95-7,98 (m, 1H), 7,49 (t, J=8,4 Hz, 1H), 6,68-6,73 ,76 (s, 3H), 3,39 (qd, J=7,1, 2,9 Hz, 1H), 3,26 (s, 3H), 56,3 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2R)-3-il)-1 -metoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazin-2-il)pro metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-meto (2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-in-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil 2- il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dime (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2S)-3-il)-1-metoxi-1-(5-metoxipirazin-2-il)propano-2-sulfonam resultado el compuesto del título que era el primer isóm en Thar 200 SFC con columna 30 x 250 mm CC4 con 5 co-disolvente a 100 g/min. Temperatura. = 30°C, Presió 3,0 ml de solución de muestra (115 mg de 310.0 disuelt inyección). Tiempo de ciclo 11 min, Tiempo de análisis Hz, 1H), 8,32 (d, J=1,8 Hz, 1H), 8,17 (d, J=13 Hz, 1H), 6,70 (m, 2H), 4,94 (d, J=2,9 Hz, 1H), 3,95 (s, 3H), 3,75 3H), 2,27 (s, 3H), 1,20 (d, J=7,1 Hz, 3H). LCMS-ESI (PO
Ejemplo 312.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2R)-3- il)-1 -metoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfona 4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazin-2-il)pro metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-meto -triazol-3-il)-1-metoxi-1-(5-metoxipirazin-2-il)propano-2-n-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazinnil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazot-Ejemplo 311.0. La purificación de 310.0 dio como eluir en las siguientes condiciones de SFC: Realizado in de MeOH (NH320 mM) 50 g/min de CO2, 50% de alida = 100 bar, Longitud de onda = 278 nm. Inyectado 20 ml de iPrOH:DCM 1:1; c= 5,75 mg/ml y 17,3 mg por n. 1H RMN (CD2Ch) 5: 11,09 (br. s., 1H), 8,42 (d, J=1,5 (s, 1H), 7,59-7,61 (m, 1H), 7,46 (t, J=8,5 Hz, 1H), 6,65 H), 3,73 (s, 3H), 3,38 (qd, J=7,1, 2,9 Hz, 1H), 3,27 (s, /z: 556,3 (M+H)+.
il)-5-(5-metilpir'idin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazolo (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-in-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil 2- il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dime (5-metoxipirazin-2-il)propano-2-sulfonamida o (1 S,2S)-3- il)-1-metoxi-1-(5-metoxipirazin-2-il)propano-2-sulfona 311.0. La purificación adicional de 310.0 dio como resul eluir de la columna CC4 cuando se somete 310.0 a las 11,13 (br. s., 1H), 8,42 (d, J=1,2 Hz, 1H), 8,32 (d, J=1,6 J=2,0, 0,7 Hz, 1H), 7,46 (t, J=8,6 Hz, 1H), 6,65-6,70 (m, (s, 3H), 3,38 (qd, J=7,1, 2,9 Hz, 1H), 3,27 (s, 3H), 2,27 ( (M+H)+.
Ejemplo 313.0: Preparación de (2S,3R)-N-(4-(2,6-di metil-2-pirimidinil)-2-butanosulfonamida.
triazol-3-il)-1-metoxi-1-(5-metoxipirazin-2-il)propano-2--3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxipirazinnil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-Ejemplo 312.0. El Ejemplo 312.0 es el enantiómero de l compuesto del título que era el segundo isómero en iones de SFC descritas en 311.0. 1H RMN (CD2Cb) 5: H), 8,17 (d, J=1,3 Hz, 1H), 8,09-8,12 (m, 1H), 7,60 (td, 4,94 (d, J=2,6 Hz, 1H), 3,95 (s, 3H), 3,75 (s, 3H), 3,73 , 1,20 (d, J=7,1 Hz, 3H). LCMS-ESI (POS.) m/z: 556,3
ifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-
(2S,3R)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida
Ejemplo 313.1. En un matraz de fondo redondo de sulfonamida (Ejemplo 10.05, 2,5 g, 11,00 mmol), triflu mmol), y (R)-(-)-4, 12-bis(difenilfosfino)[2.2]paraciclofan 0,55 mmol) en EtOH. La mezcla se agitó a 1 atm de H2 d EtOAc en hexanos al 20% para dar una mezcla de (2S,3 (5-metilpirimidin-2-il)butano-2-sulfonamida (1,39 g, 6,06 (2R,3S)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida, ml se añadió (E)-3-(5-metilpirimidin-2-il)but-2-eno-2-tanosulfonato de cinc (Sigma-Aldrich, 0,800 g, 2,20 ciclooctadieno)rodio (Strem Chemicals Inc., 0,481 g, e 16 h. Después el sólido se filtró. El sólido se lavó con (5-metilpirimidin-2-il)butano-2-sulfonamida y (2R,3S)-3-55% de rendimiento).
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida y (2S,3R)-N-(4-(2,6-dimetoxif pirimidinil)-2-butanosulfonamida, Ejemplo 313.2 En
dimetoxibenceno 1.0 (439 mg, 2,25 mmol), carbonato metilpirimidin-2-il)butano-2-sulfonamida y (2S,3R)-3-(5-mmol) en DMF. La mezcla de reacción se agitó a TA dur ((2,6-dimetoxifenil)carbamotioil)-3-(5-metilpirimidin-2-il)b dimetoxifenil)carbamotioil)-3-(5-metilpirimidin-2-il)butano-189 pl, 3,28 mmol), 6-metoxipicolinohidrazida (Sigma-Al (Sigma-Aldrich, 251 mg, 1,48 mmol). La mezcla de re EtOAc. La mezcla de reacción se filtró para separar el A se añadieron 1,4-dioxano y TFA (Sigma, Aldrich, 304 durante 16 h. La reacción se detuvo y la solución se r obtenido se purificó por HPLC preparativa de fase inver C8(2), 100 Á, 150 x 21,2 mm, TfA al 0,1% en CH proporcionar la (2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-met butanosulfonamida y (2S,3R)-N-(4-(2,6-dimetoxife pirimidinil)-2-butanosulfonamida 313.2 (126 mg, 0,23 m 4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-atraz de 50 ml se añadieron 2-isotiocianato-1,3-io (Sigma-Aldrich, 195 pl, 2,44 mmol) y (2R,3S)-3-(5-imidin-2-il)butano-2-sulfonamida 313.2 (430 mg, 1,875 16 h. En un matraz de 250 ml se añadieron (2R,3S)-N-2-sulfonamida y (2S,3R)-N-((2,6-onamida (348 mg, 0,82 mmol), AcOH (Sigma-Aldrich, 164 mg, 0,98 mmol), 4 ml de DMF, y nitrato de plata se agitó a TA durante 30 min y después se añadió a mezcla de reacción se concentró a vacío. Después, 0 mmol) a la mezcla y después se calentó a 110°C a un volumen pequeño de disolvente. El material así ando una columna Phenomenex Luna, 5 micrómetros, 2O, gradiente de 0-70% a lo largo de 25 min para piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazo1 -3-il)-3-(5-metil-2-,5% de rendimiento) en forma de un sólido blanco.
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-butanosulfonamida, Ejemplo 313.0. La mezcla obtenid directamente en columnas 250 mm x 20 mm AS-H x A primera fracción que eluía (52,23 mg 99%ee) era (2 triazol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida 1,39 (d, J=7,04 Hz, 3 H) 2,30 (s, 3 H) 3,18 (s, 3 H) 3,6 5,67 Hz, 1 H) 6,60 (t, J=7,61 Hz, 2 H) 6,71 (dd, J=7,24, MS ESI (pos.) m/z: 540,2 (M+H)+.
Ejemplo 314.0: Preparación de (2R,3S)-N-(4-(2,6-metil-2-pirimidinil)-2-butanosulfonamida.
,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-o se ha descrito antes en el Ejemplo 313.2 se purificó on 15% de MeOH/100 bar de CO2 en Thar 80 SFC. La N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-0 1H RMN (400 MHz, CDCl3) 51,36 (d, J=7,04 Hz, 3 H) H) 3,72 (s, 3 H) 3,75 - 3,84 (m, 1 H) 3,90 (dd, J=6,85, Hz, 1 H) 7,30 (m, 1 H) 7,57 - 7,66 (m, 2 H) 8,53 (s, 2H),
xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-butanosulfonamida, Ejemplo 314.0. El compuesto del tít descritas en el Ejemplo 313.0 para suministrar la (2 triazol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida 1,36 (d, J=7,04 Hz, 3 H) 1,39 (d, J=7,04 Hz, 3 H) 2,30 ( 1 H) 3,90 (dd, J=6,85, 5,67 Hz, 1 H) 6,60 (t, J=7,61 Hz, (m, 2 H) 8,53 (s, 2 H), MS ESI (pos.) m/z: 540,2 (M+H)+.
Ejemplo 315.0: Preparación de (2R)-N-(4-(2,6-dimetoxif piridinil)-2-hidroxietanosulfonamida y (2S)-N-(4-(2,6-fluoro-2-piridinil)-2-hidroxietanosulfonamida.
,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-a la segunda fracción que eluía usando las condiciones N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-(19,96 mg, 96,1%ee). 1H RMN (400 MHz, CDCh) 5 ) 3,18 (s, 3 H) 3,69 (s, 3 H) 3,72 (s, 3 H) 3,75 - 3,84 (m, ,71 (dd, J=7,24, 1,96 Hz, 1 H) 7,30 (m, 1 H) 7,57 - 7,66
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, (trimetilsilil)etil)etanosulfonam ida y (S)-N-(4-(2,6-d fluoropiridin-2-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulf dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il mmol) y se destiló azeotrópicamente con tolueno. Se a seco-acetona. Se añadió una disolución de n-butil-litio 10 min. Después, se añadió gota a gota solución en TH reacción se agitó en el baño de hielo seco-acetona durante otras 3 h. La reacción se inactivó con solución se secó, se concentró a vacío y se purificó por cromat en hexanos al 0-40% para proporcionar el compuesto (M+H)+.
iazol-3-il)-2-(5-fluoropiridin-2-il)-2-hidroxi-N-(2-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(5-ida, Ejemplo 315.1. Se cargó un matraz con N-(4-(2,6--(trimetilsilil)etil)metanosulfonamida (4.0, 396 mg, 0,78 THF (3,5 ml) y la reacción se enfrió en un baño de hielo , 0,313 ml, 0,78 mmol), y la reacción se agitó durante ml) de 5-fluoropicolinaldehído (118 mg, 0,94 mmol). La e otros 45 min y después se calentó a TA y se agitó da de NH4Cl y se extrajo con EtOAc. La capa de EtOAc en gel de sílice, eluyendo con un gradiente de EtOAc lo 315.1 (351 mg, 71%). LCMS-ESI (POS.) m/z: 631,0
2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1, hidroxietanosulfonamida y (2S)-N-(4-(2,6-dimetoxif piridinil)-2-hidroxietanosulfonamida, Ejemplo 315.0.
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(5-fluoropiridin-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tri (trimetilsilil)etil)etanosulfonamida (315.1, 199 mg, 0,32 difluorotrimetilsilicato de tris(dimetilamino)sulfonio (261 ml). El matraz de reacción se calentó a 70°C durant obtenido se purificó directamente en una columna de TFA al 0,1% en CH3CN/H2O, gradiente de elución 2 combinaron y se liofilizaron para proporcionar la sal rendimiento) en forma de un sólido blanco. 1H RMN (40 7,43 Hz, 1 H) 7,58 - 7,67 (m, 3 H) 7,44 (t, J=8,41 Hz, 1 H) 3,75 (s, 3 H) 3,74 (s, 3 H) 3,65 (dd, J=14,28, 3,33 531,0 (M+H)+.
Ejemplo 316.0: Preparación de (2R)-N-(4-(2,6-dimetoxif piridinil)-2-hidroxietanosulfonamida o (2S)-N-(4-(2,6-d fluoro-2-piridinil)-2-hidroxietanosulfonamida.
iazol-3-il)-2-(5-fluoro-2-piridinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-rgó un matraz con (R)-N-(4-(2,6-dimetoxifenil)-5-(6--hidroxi-N-(2-(trimetilsilil)etil)etanosulfonamida y (S)-N--il)-2-(5-fluoropiridin-2-il)-2-hidroxi-N-(2-y se destiló azeotrópicamente con tolueno. Se añadió ,95 mmol) al matraz, seguido de la adición de DMF (2,5 en atmósfera de nitrógeno. El producto inicialmente de fase inversa, usando una columna Agilent SB C8, a lo largo de 25 min. Las fracciones deseadas se A del compuesto del título 315.0 (138 mg, 68% de z, CD3OD) 58,43 (d, J=2,74 Hz, 1 h ) 7,74 (dd, J=8,22, 8 (td, J=8,36, 1,27 Hz, 3 H) 5,21 (dd, J=8,61,3,33 Hz, 1 H) 3,33 (m, 1 H) 3,19 (s, 3 H). LCMS-ESI (POS.) m/z:
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-hidroxietanosulfonamida o (2S)-N-(4-(2,6-dimetoxif piridinil)-2-hidroxietanosulfonamida, Ejemplo 316.0. El supercríticos en dos enantiómeros. Condiciones de s 25%, 100 bar, 70 ml/min, 220 nm, Vol. iny.: 1 ml, 6 mg/ el primer pico que sale de la columna quiral. 1H RMN ( Hz, 1 H) 7,54 - 7,63 (m, 3 H) 7,41 (t, J=8,33 Hz, 1 H) 6,7 3,71 (s, 3 H) 3,63 (dd, J=14,28, 3,13 Hz, 1 H) 3,26 -(M+H)+.
Ejemplo 317.0: Preparación de (2R)-N-(4-(2,6-dimetoxif piridinil)-2-hidroxietanosulfonamida o (2S)-N-(4-(2,6-d fluoro-2-piridinil)-2-hidroxietanosulfonamida.
riazol-3-il)-2-(5-fluoro-2-piridinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-mato 315.0 se separó por cromatografía de fluidos ión quiral (Lotus Inc.): OZ-H (2 x 25 cm), IPA/CO2 al MeOH proporcionó el compuesto del título 316.0 como Hz, CD3OD) 58,39 (d, J=2,15 Hz, 1 H) 7,72 (t, J=7,80 1 (m, 3 H) 5,18 (dd, J=9,00, 3,13 Hz, 1 H) 3,73 (s, 3 H) (m, 1 H) 3,17 (s, 3 H). LCMS-ESI (POS.) m/z: 531,0
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-hidroxietanosulfonamida o (2S)-N-(4-(2,6-dimetoxif piridinil)-2-hidroxietanosulfonamida, Ejemplo 317.0. El c quiral cuando se somete 315.0 a las condiciones de SF 5 8,39 (d, J=5,60 Hz, 1 H) 7,72 (t, J=7,79 Hz, 1 H) 7,54 riazol-3-il)-2-(5-fluoro-2-piridinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-esto del título es el segundo pico en salir de la columna critas en el Ejemplo 316.0. 1H RMN (400 MHz, CD3OD) 3 (m, 3 H) 7,41 (t, J=8,51 Hz, 1 H) 6,70 - 6,83 (m, 3 H)
5,18 (dd, J=8,80, 3,13 Hz, 1 H) 3,73 (s, 3 H) 3,71 (s, 3 H) (s, 3 H). LCMS-ESI (POS.) m/z: 531,0 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint usando el material de partida conocido como se describe.
63 (dd, J=14,28, 3,13 Hz, 1 H) 3,27 - 3,35 (m, 1 H) 3,17
zaron siguiendo el procedimiento en el Ejemplo 315.0
Ta 14
Ejemplo 328.0: Preparación de (2R)-N-(4-(2,6-dimetoxife piridinil)-2-metoxietanosulfonamida y (2S)-N-(4-(2,6-di fluoro-2-piridinil)-2-metoxietanosulfonamida.
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-toxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2 (trimetilsilil)etil)etanosulfonamida y (S)-N-(4-(2,6-di fluoropiridin-2-il)-2-metoxi-N-(2-(trimetilsilil)etil)etanosulfo (2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol (trimetilsilil)etil)etanosulfonam ida y (S)-N-(4-(2,6-di fluoropiridin-2-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfo azeotrópicamente con tolueno. Se añadió THF (3 ml) al triazol-3-il)-2-(5-fluoropiridin-2-il)-2-metoxi-N-(2-toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(5-ida, Ejemplo 328.1. Se cargó un matraz con (R)-N-(4-il)-2-(5-fluoropiridin-2-il)-2-hidroxi-N-(2-toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-(5-mida (Ejemplo 315.1, 166 mg, 0,26 mmol) y se destiló atraz y después se añadió NaH (13,68 mg, 0,34 mmol).
Después de 11 min, se añadió Mel (0,023 ml, 0,37 m noche. Se observó una cantidad significativa de produc reacción se extrajo con EtOAc. La capa de EtOAc se s El residuo así obtenido se purificó por cromatografía e para proporcionar el compuesto del título 328.1 (60 mg, e continuó agitando a temperatura ambiente durante la inado. Se añadió una solución saturada de NH4Cl, y la n sulfato magnésico, se filtró y se concentraron a vacío. de sílice eluyendo con gradiente de EtOAc en hexanos de rendimiento) en forma de un sólido en espuma.
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-metoxietanosulfonamida y (2S)-N-(4-(2,6-dimetoxif piridinil)-2-metoxietanosulfonamida, Ejemplo 328.0. El acuerdo con el procedimiento descrito en Ejemplo 315. (dd, J=8,22, 7,43 Hz, 1 H) 7,57 - 7,65 (m, 2 H) 7,46 - 7, 4,83 (m, 1 H) 3,73 (s, 3 H) 3,73 (s, 3 H) 3,43 - 3,46 (m, (M+H)+.
Ejemplo 329.0: Preparación de (2R)-N-(4-(2,6-dimetoxif piridinil)-2-metoxietanosulfonamida o (2S)-N-(4-(2,6-fluoro-2-piridinil)-2-metoxietanosulfonamida.
triazol-3-il)-2-(5-fluoro-2-piridinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-uesto del título 328.0 se preparó a partir de 328.1 de RMN (400 MHz, CD3OD) 58,44 (d, J=2,93 Hz, 1 H) 7,71 , 1 H) 7,41 (t, J=8,27 Hz, 1 H) 6,73 - 6,80 (m, 3 H) 4,79 -3,20 (s, 3 H) 3,17 (s, 3 H). LCMS-ESI (POS.) m/z: 545,0
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-metoxietanosulfonamida o (2S)-N-(4-(2,6-dimetoxif piridinil)-2-metoxietanosulfonamida, Ejemplo 329.0. El supercríticos en dos enantiómeros por Lotus Inc. Cond 100 bar 60 ml/min, 220 nm Vol. iny.: 1 ml, 6 mg/ml de de la columna quiral .1H RMN (400 MHz, CD3OD) 58, 2 H) 7,47 - 7,51 (m, 1 H) 7,41 (t, J=8,23 Hz, 1 H) 6,76 ( 3,43 - 3,47 (m, 2 H) 3,20 (s, 3 H) 3,17 (s, 3 H). LCMS-ES
Ejemplo 330.0: Preparación de (2R)-N-(4-(2,6-dimetoxif piridinil)-2-metoxietanosulfonamida o (2S)-N-(4-(2,6-fluoro-2-piridinil)-2-metoxietanosulfonamida.
triazol-3-il)-2-(5-fluoro-2-piridinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-mato 328.0 se separó por cromatografía de fluidos s de separación: AS-H (2 x 15 cm) EtOH/CO2 al 25%, El compuesto del título 329.0 era el primer pico en salir J=2,93 Hz, 1 H) 7,72 (dd, J=7,43, 0,39 Hz, 1 H) 7,61 (m, ) 4,79 - 4,83 (m, 1 H) 3,73 - 3,74 (m, 3 H) 3,73 (s, 3 H) S.) m/z: 545,0 (M+H)+.
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-metoxietanosulfonamida o (2S)-N-(4-(2,6-dimetoxif triazol-3-il)-2-(5-fluoro-2-piridinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-piridinil)-2-metoxietanosulfonamida, Ejemplo 330.0. El columna quiral cuando se somete 328.0 a las condicion CD3OD) 58,44 (d, J=2,74 Hz, 1 H) 7,71 (dd, J=8,22, 7,44 (m, 1 H) 6,72 - 6,80 (m, 3 H) 4,79 - 4,83 (m, 1 H) 3,17 (s, 3 H). LCMS-ESI (POS.) m/z: 545,0 (M+H)+.
Ejemplo 331.0: Preparación de (R)-2-(5-cianopiridin triazol-3-il)-2-hidroxietanosulfonamida y (S)-2-(5-ciano 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida.
puesto del título era el segundo pico en eluir de la SFC descritas en el Ejemplo 329.0. 1H RMN (400 MHz, z, 1 H) 7,59 - 7,65 (m, 2 H) 7,46 - 7,51 (m, 1 H) 7,38 -(s, 3 H) 3,73 (s, 3 H) 3,42 - 3,47 (m, 2 H) 3,20 (s, 3 H)
N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4--2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-
(R)-2-(5-bromopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-hidroxietanosulfonamida y (S)-2-(5-bromopiridin-2-il)-3-il)-2-hidroxietanosulfonamida, Ejemplo 331.1. El com descrito en el Ejemplo 315.0 usando 5-bromopicolinald piridin-2-il)-4H-1,2,4-triazol-3-il)-2-,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazoldel título se preparó siguiendo el mismo procedimiento LCMS-ESI (Po S.) m/z: 592,8 (M+H)+.
(R)-2-(5-cianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-m hidroxietanosulfonamida y (S)-2-(5-cianopiridin-2-il)-N-( il)-2-hidroxietanosulfonamida, Ejemplo 331.0. Un tubo (2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triaz N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-mmol), cianuro de cinc (24,64 gl, 0,39 mmol), y tetraki DMF desgasificado (1,9 ml) al tubo de microondas, y microondas a 120°C durante 1 h. La mezcla de reacció con sulfato magnésico, se filtró y se concentraron a va de fase inversa, usando una columna Agilent SB C8, T largo de 25 min. Las fracciones deseadas se com compuesto del título (40 mg, 26% de rendimiento) en f (d, J=2,15 Hz, 1H), 7,97 (dd, J=8,12, 2,05 Hz, 1H), 7,7 1H), 6,73 (dd, J=7,53, 1,47 Hz, 1H), 6,64 (dd, J=8,6 J=14,09, 1,96 Hz, 1H), 3,73 (s, 3H), 3,72 (s, 3H), 3,28 m/z: 538,0 (M+H)+.
Ejemplo 332.0: Preparación de (R)-2-(5-cianopiridi triazol-3-il)-2-hidroxietanosulfonamida o (S)-2-(5-ciano 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida.
iridin-2-il)-4H-1,2,4-triazol-3-il)-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-croondas se cargó con (R)-2-(5-bromopiridin-2-il)-N-(4--2-hidroxietanosulfonamida y (S)-2-(5-bromopiridin-2-il)-l-3-il)-2-hidroxietanosulfonamida (331.1, 140 mg, 0,24 nilfosfina)paladio(0) (54,7 mg, 0,047 mmol). Se añadió zcla se desgasificó de nuevo. El tubo se calentó en el epartió entre EtOAc y agua. La capa de EtOAc se secó l material así obtenido se purificó en columna de HPLC 0,1% en CH3CN/H2O, gradiente de elución 20-80% a lo n y liofilizaron para proporcionar la sal de TFA del de un sólido blanco. 1H RMN (400 MHz, CDCh) 58,80 =8,22 Hz, 1H), 7,60 - 7,66 (m, 2H), 7,37 (t, J=8,41 Hz, 8 Hz, 2H), 5,32 (dd, J=9,59, 1,37 Hz, 1H), 3,79 (dd, =14,09, 9,78 Hz, 1H), 3,17 (s, 3 H). LCMS-ESI (POS.)
N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4--2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-
(R)-2-(5-cianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-m hidroxietanosulfonamida o (S)-2-(5-cianopiridin-2-il)-N-( il)-2-hidroxietanosulfonamida, 332.0. El racemato 331.0 enantiómeros mediante las siguientes condiciones: Re 27,5 g/min de MeOH(solo) 27,5 g/min de CO2, 50% d salida = 100 bar, Longitud de onda = 222 nm. Inyecta DCM 7:6, c= 2,46 mg/ml i.e. 2,95 mg por inyección. compuesto del título 332.0 era el primer pico en eluir de J=2,15, 0,59 Hz, 1H), 8,30 (dd, J=8,22, 2,15 Hz, 1H), J=7,43, 0,59 Hz, 1H), 7,40 (t, J=8,51 Hz, 1H), 6,82 (d, 3,42 Hz, 1H), 3,64 (s, 3H), 3,63 (s, 3H), 3,55 (dd, J=14, H). LCMS-ESI (POS.) m/z: 538,0 (M+H)+.
Ejemplo 333.0: Preparación de (R)-2-(5-cianopiridin triazol-3-il)-2-hidroxietanosulfonamida o (S)-2-(5-ciano 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida.
iridin-2-il)-4H-1,2,4-triazol-3-il)-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-eparó por cromatografía de fluidos supercríticos en dos o en Thar 80 SFC con columna de 250 x 21 mm IC con disolvente a 55 g/min. Temperatura. = 24°C, Presión de ml de 32 mg de muestra disuelta en 13 ml de MeOH: po de ciclo 10 min, Tiempo de análisis = 13 min. El lumna quiral .1H RMN (400 MHz, DMSO-afe) 58,95 (dd, (m, J=8,22 Hz, 1H), 7,67 (d, J=8,02 Hz, 1H), 7,58 (dd, 22 Hz, 1H), 6,78 (d, J=8,61 Hz, 2H), 5,06 (dd, J=8,31, ,42 Hz, 1H), 3,24 (dd, J=13,89, 8,22 Hz, 1H), 3,10 (s, 3
N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4--2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-
(R)-2-(5-cianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-m hidroxietanosulfonamida o (S)-2-(5-cianopiridin-2-il)-N-( il)-2-hidroxietanosulfonamida, Ejemplo 333.0. El Ejemp cuando se somete 331.0 a las condiciones de SFC des (br. s., 1H), 7,99 (dd, J=8,31, 1,86 Hz, 1H), 7,72 (d, J=8, (dd, J=7,92, 0,88 Hz, 1H), 6,68 (dd, J=8,61, 4,89 Hz, 2 3,21 (dd, J= 14,18, 9,88 Hz, 1H), 3,16 (s, 3 H). LCMS-E
Ejemplo 334.0: Preparación de (2R)-N-(4-(2,6-dimetox (5-metil-3-isoxazolil)etanosulfonamida y (2S)-N-(4-(2, hidroxi-2-(5-metil-3-isoxazolil)etanosulfonamida.
iridin-2-il)-4H-1,2,4-triazol-3-il)-2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-3.0 era el segundo pico en eluir de la columna quiral en el Ejemplo 332.0. 1H RMN (400 MHz, CD2CL) 58,79 z, 1H), 7,58 - 7,68 (m, 2H), 7,41 (t, J=8,51 Hz, 1H), 6,73 ,24 (d, J=9,98 Hz, 1H), 3,73-3,75 (m, 4H), 3,71 (s, 3H), S.) m/z: 538,0 (M+H)+.
)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-isoxazolil)etanosulfonamida y (2S)-N-(4-(2,6-dimetoxife metil-3-isoxazolil)etanosulfonamida, Ejemplo 334.0. El procedimiento descrito en el Ejemplo 315.0 usando 5-7,71 (dd, J=8,22, 7,43 Hz, 1H), 7,61 (dd, J=7,43, 0,78 triazol-3-il)-2-hidroxi-2-(5-metil-3--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-puesto del título 334.0 se preparó de acuerdo con el soxazol-3-carbaldehído. 1H RMN (400 MHz, CD3OD) 5 ), 7,41 (t, J=8,34 Hz, 1H), 6,73 - 6,78 (m, 3H), 6,16 (d,
J=0,59 Hz, 1H), 5,20 (dd, J=7,82, 4,30 Hz, 1H), 3,73 (s, J=0,98 Hz, 3 H). LCMS-ESI (POS.) m/z: 517,0 (M+H)+.
Ejemplo 335.0: Preparación de (2R)-N-(4-(2,6-dimetoxi (5-metil-3-isoxazolil)etanosulfonamida y (2S)-N-(4-(2, hidroxi-2-(5-metil-3-isoxazolil)etanosulfonamida.
3,72 (s, 3H), 3,41 - 3,46 (m, 2H), 3,17 (s, 3H), 2,40 (d,
)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 isoxazolil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-3-isoxazolil)etanosulfonamida, Ejemplo 335.0. El fluidos supercríticos. Las condiciones de separación era mm AD con 40 g/min de MeOH (NH320 mM) 60 g/m 25°C, Longitud de onda 297 nm. Inyectado 0,5 ml de MeOH:DCM 7:5; c= 9,2 mg/ml; 4,6 mg/inyección. Ti compuesto del título 335.0 era el primer pico en salir d J=7,76 Hz, 1H), 7,59 (d, J=7,43 Hz, 1H), 7,40 (t, J=8,51 4,60 Hz, 1H), 3,73 (s, 3H), 3,71 (s, 3H), 3,39 - 3,50 (m, (M+H)+.
Ejemplo 336: Preparación de (2R)-N-(4-(2,6-dimetoxife metil-5-isoxazolil)etanosulfonamida y (2S)-N-(4-(2, hidroxi-2-(3-metil-5-isoxazolil)etanosulfonamida.
triazol-3-il)-2-hidroxi-2-(5-metil-3--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-uesto racémico 334.0 se separó por cromatografía de siguientes: Realizado en Thar 200 con columna 250x30 CO2, 40% de co-disolvente a 100 g/min. Temperatura isolución de 110 mg de muestra disuelta en 12 ml de de ciclo 5,3 min; Tiempo de análisis = 11 min. El columna quiral . 1H RMN (400 MHz, CD3OD) 57,70 (t, 1H), 6,71 - 6,78 (m, 3H), 6,17 (s, 1H), 5,21 (dd, J=7,53, 3,16 (s, 3H), 2,39 (s, 3 H). LCMS-ESI (POS.) m/z: 517,0
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(3-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 isoxazolil)etanosulfonamida y (2S)-N-(4-(2,6-dimetoxife metil-5-isoxazolil)etanosulfonamida, Ejemplo 336.0. El procedimiento descrito en el Ejemplo 3l5.0 usando 3-7,72 (dd, J=8,31, 7,53 Hz, 1H), 7,61 (dd, J=7,43, 0,78 5,21 (dd, J=8,12, 4,01 Hz, 1H), 3,73 (s, 3H), 3,72 (s, 3 (POS.) m/z: 517,0 (M+H)+.
Ejemplo 337.0: Preparación de (2R)-N-(4-(2,6-dimetoxi (3-metil-5-isoxazolil)etanosulfonamida o (2S)-N-(4-(2, hidroxi-2-(3-metil-5-isoxazolil)etanosulfonamida.
triazol-3-il)-2-hidroxi-2-(3-metil-5--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(3-puesto del título 336.0 se preparó de acuerdo con el soxazol-5-carbaldehído. 1H RMN (400 MHz, CD3OD) 5 H), 7,41 (t, J=8,51 Hz, 1H), 6,76 (m, 3H), 6,21 (s, 1H), 38 - 3,51 (m, 2H), 3,17 (s, 3H), 2,25 (s, 3 H). LCMS-ESI
)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 isoxazolil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-5-isoxazolil)etanosulfonamida, Ejemplo 337.0. El supercríticos en dos enantiómeros. Condiciones de s triazol-3-il)-2-hidroxi-2-(3-metil-5--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(3-emato 336.0 se separó por cromatografía de fluidos ción (por Lotus Inc.): AD-H (2 x 15 cm), ACN:MeOH
1: 1 /CO2 al 22%, 100 bar, 60 ml/min, 220 nm. Vol. iny.: 337.0 era el primer pico en salir de la columna quiral .1 J=7,19 Hz, 1H), 7,41 (t, J=8,51 Hz, 1H), 6,73 - 6,79 ( 3H), 3,71 (s, 3H), 3,38 - 3,52 (m, 2H), 3,17 (s, 3H), 2,25
Ejemplo 338.0: Preparación de (2R)-N-(4-(2,6-dimeto (3-metil-5-isoxazolil)etanosulfonamida o (2s)-N-(4-(2, hidroxi-2-(3-metil-5-isoxazolil)etanosulfonamida.
l, 10 mg/ml de DCM:MeOH 1:3. El compuesto del título N (400 MHz, CD3OD) 57,71 (t, J=7,68 Hz, 1H), 7,61 (d, , 6,21 (s, 1H), 5,21 (dd, J=8,22, 4,11 Hz, 1H), 3,73 (s, ). LCMS-ESI (POS.) m/z: 517,0 (M+H)+.
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-toxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-isoxazolil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-5-isoxazolil)etanosulfonamida, Ejemplo 338.0. El quiral cuando se somete 336.0 a las condiciones de SF 5 7,71 (dd, J=8,22, 7,43 Hz, 1 H) 7,61 (d, J=7,19 Hz, 1 5,21 (dd, J=8,12, 4,01 Hz, 1 H) 3,73 (s, 3 H) 3,71 (s, 3 (POS.) m/z: 517,0 (M+H)+.
Ejemplo 339.0: Preparación de (2R)-N-(4-(2,6-dimeto (5-metil-2-pirimidinil)etanosulfonamida y (2S)-N-(4-(2, hidroxi-2-(5-metil-2-pirimidinil)etanosulfonamida.
riazol-3-il)-2-hidroxi-2-(3-metil-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(3-plo 338.0 era el segundo pico en eluir de la columna critas en el Ejemplo 337.0. 1H RMN (400 MHz, CD3OD) 1 (t, J=8,51 Hz, 1 H) 6,73 - 6,79 (m, 3 H) 6,21 (s, 1 H) 8 - 3,52 (m, 2 H) 3,17 (s, 3 H) 2,25 (s, 3 H). LCMS-ESI
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-pirimidinil)etanosulfonamida y (2S)-N-(4-(2,6-dimetoxife metil-2-pirimidinil)etanosulfonamida, Ejemplo 339.0. El procedimiento descrito en Ejemplo 315.0 usando 5-m 8,66 (s, 2H), 7,71 (t, J=7,89 Hz, 1H), 7,60 (d, J=7,26 H J=7,63, 4,11 Hz, 1H), 3,70 - 3,76 (m, 7H), 3,47 (dd, J (POS.) m/z: 528,0 (M+H)+.
Ejemplo 340.0: Preparación de (2R)-N-(4-(2,6-dimeto (5-metil-2-pirimidinil)etanosulfonamida o (2S)-N-(4-(2, hidroxi-2-(5-metil-2-pirimidinil)etanosulfonamida.
riazol-3-il)-2-hidroxi-2-(5-metil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-uesto del título 339.0 se preparó de acuerdo con el midina-2-carbaldehído. 1H RMN (400 MHz, CD3OD) 5 , 7,40 (t, J=8,26 Hz, 1H), 6,72 - 6,79 (m, 3H), 5,25 (dd, , 7,83 Hz, 1H), 3,17 (s, 3H), 2,35 (s, 3 H). LCMS-ESI
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-pirimidinil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-2-pirimidinil)etanosulfonamida, Ejemplo 340.0. E supercríticos en dos enantiómeros por Lotus Inc. Condi al 35%, 100 bar, 65 ml/min, 220 nm, Vol. iny.: 0,6 ml, 9 el primer pico en salir de la columna quiral .1H Rm N (4 riazol-3-il)-2-hidroxi-2-(5-metil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-mato 339.0 se separó por cromatografía de fluidos de separación: AD-H (2 x 15 cm), ACNMeOH 1:1/CO2 l de DCM:MeOH 1:1. El compuesto del título 340.0 era z, CD3OD) 58,62 (s, 2H), 7,71 (t, J=7,83 Hz, 1H), 7,60
(d, J=7,29 Hz, 1H), 7,40 (t, J=8,51 Hz, 1H), 6,70 - 6,81 3,45 (dd, J=14,09, 8,02 Hz, 1H), 3,17 (s, 3H), 2,33 (s, 3
Ejemplo 341.0: Preparación de (2R)-N-(4-(2,6-dimeto (5-metil-2-pirimidinil)etanosulfonamida o (2S)-N-(4-(2, hidroxi-2-(5-metil-2-pirimidinil)etanosulfonamida.
H), 5,23 (dd, J=8,02, 4,11 Hz, 1H), 3,68 - 3,79 (m, 7H), MS-ESI (POS.) m/z: 528,0 (M+H)+.
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-pirimidinil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-2-pirimidinil)etanosulfonamida, Ejemplo 341.0. El quiral cuando se somete 339.0 a las condiciones de SF 5 8,62 (s, 2H), 7,71 (t, J=7,29 Hz, 1H), 7,60 (d, J=7,13 J=7,92, 4,21 Hz, 1H), 3,73 (m, 7H), 3,46 (dd, J=14,28, m/z: 528,0 (M+H)+.
Ejemplo 342.0: Preparación de (1S,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida y
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)riazol-3-il)-2-hidroxi-2-(5-metil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-plo 341.0 era el segundo pico en eluir de la columna critas en el Ejemplo 340.0. 1H RMN (400 MHz, CD3OD) ), 7,40 (t, J=8,51 Hz, 1H), 6,72 - 6,78 (m, 3H), 5,23 (dd, Hz, 1H), 3,17 (s, 3H), 2,33 (s, 3 H). LCMS-ESI (POS.)
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida y (1 S,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida y (1 R,2S)-1 -(4-ciano-2-,4-triazol-3-il)-1-hidroxi-2-propanosulfonamida.
(1 S,2S)-1 -(4-bromo-2-fluorofenil)-1 -((tertbutildimetilsilil) fluorofenil)-1 -((terc-butildimetilsilil)oxi)propano-2-sulfona butildimetilsilil)oxi)propano-2-sulfonamida y (1 R,2S)-1 sulfonamida, Ejemplo 342.1. La (1S,2S)-1-(4-Bromo-Bromo-2-fluorofenil)-1 -hidroxipropano-2-sulfonamida
sulfonamida y (1R,2R)-1-(4-Bromo-2-fluorofenil)-1-h procedimientos descritos en el Ejemplo C) (308 mg, 0, se añadieron DMAP (12,05 mg, 0,099 mmol) y terc-but ml) y TEA (0,358 ml, 2,57 mmol). La reacción se agitó vacío y se purificó por cromatografía a través de una eluyendo con un gradiente de EtOAc en hexanos al 0-aceite. LCMS-ESI (POS.) m/z: 427,9 (M+H)+.
pano-2-sulfonamida y (1 R,2R)-1 -(4-bromo-2-y (1 S,2R)-1 -(4-bromo-2-fluorofenil)-1 -((tercomo-2-fluorofenil)-1 -((terc-butildimetilsilil)oxi)propano-2-ofenil)-1-hidroxipropano-2-sulfonamida y (1R,2S)-1-(4-(1 S,2R)-1 -(4-Bromo-2-fluorofenil)-1 -hidroxipropano-2-propano-2-sulfonamida (preparados siguiendo los mol) se destiló azeotrópicamente con tolueno. Después dimetilsilano (178 mg, 1,18 mmol), seguido de DCM (8 durante 16 h. El producto de reacción se concentró a na de gel de sílice preempaquetada Gold Redi-Sep, ara proporcionar 342.1 (372 mg, 88%) en forma de un
(1S,2S)-1-(4-bromo-2-fluorofenil)-1-((tertbutildimetilsilil)oxi triazol-3-il)propano-2-sulfonamida y (1 S,2R)-1 -dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)pr ((terc-butildimetilsilil)oxi)-N-(4-(2,6-dimetoxifenil)-5-(5-met (1 R,2R)-1-(4-bromo-2-fluorofenil)-1-((terc-butildimetilsilil) triazol-3-il)propano-2-sulfonamida, Ejemplo 342.2. El co descrito en el Ejemplo A con la etapa inicial calentada 68%)). LCMS-ESI (POS.) m/z: 722,0 (M+H)+.
-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-bromo-2-fluorofenil)-1 -((terc-butildimetilsilil)oxi)-N-(4-(2,6-no-2-sulfonamida y (1 R,2S)-1-(4-bromo-2-fluorofenil)-1 -ridin-3-il)-4H-1,2,4-triazol-3-il)propano-2-sulfonamida y -N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-uesto del título se preparó siguiendo el procedimiento 0°C durante la noche para proporcionar 342.2 (149 mg
(1S,2S)-1-((terc-butildimetilsilil)oxi)-1-(4-ciano-2-fluorofeni triazol-3-il)propano-2-sulfonamida y (1 S,2R)-1 dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)pr 1-(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil (1 R,2R)-1 -((terc-butildimetilsilil)oxi)-1 -(4-ciano-2-fluorofen triazol-3-il)propano-2-sulfonamida, Ejemplo 342.3. Un tub cianuro de cinc (39,0 mg, 0,33 mmol, Alfa Aesar), y t Chemicals Inc.). Se añadió DMF (1,7 ml) desgasificada argón. La mezcla se calentó en el microondas a 120°C extrajo con DCM. La capa de DCM se secó, se concentró gel de sílice preempaquetada Gold Redi-Sep, eluyendo 342.3 (65 mg). LCMS-ESI (POS.) m/z: 667,1 (M+H)+.
-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-terc-butildimetilsilil)oxi)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-no-2-sulfonamida y (1 R,2S)-1 -((terc-butildimetilsilil)oxi)-idin-3-il)-4H-1,2,4-triazol-3-il)propano-2-sulfonamida y N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-e microondas se cargó con 342.2 (146 mg, 0,20 mmol), kis(trifenilfosfina)paladio (46,8 mg, 0,041 mmol, Strem n argón, y la mezcla se desgasificó adicionalmente con ante 1 h y después la reacción se diluyó con agua y se se purificó por cromatografía a través de una columna de un gradiente MeOH en DCM al 0-8% para proporcionar
(1 S,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida y (1 R,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -hidroxi-2-propanosulfonamida y (1 S,2R)-1 -(4-cia 4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida y metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propan (65 mg, 0.097 mmol) y a esto se añadió difluorotrimetil seguido de DMF (1,2 ml). La reacción se calentó a 70° por HPLC de fase inversa usando una columna Agilent largo de 25 min (se recogieron los picos que eran visi dar el compuesto del título 342.0 (34,5 mg) en for diastereómeros 6:1 determinado por 1H RMN (400 MHz 7,79 - 7,85 (m, 1H), 7,62 - 7,74 (m, 1H), 7,47 - 7,61 ( (br. s, 3H), 3,21 - 3,27 (m, 1H), 2,29 - 2,37 (m, 3H), 1,0
Ejemplo 343.0: Preparación de (1S,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 342.0. Se cargó un matraz con 342.3 de tris(dimetilamino)sulfonio (IV) (81 mg, 0,292 mmol) nte 1 h. La mezcla de reacción se purificó directamente 8, TFA al 0,1% en CH3CN/H2O, gradiente 30-80% a lo a 220 nm). Las fracciones deseadas se liofilizaron para una sal de TFA (sólido blanco) en una relación de OD) 58,49 (d, J=1,37 Hz, 1H), 8,37 (d, J=1,76 Hz, 1H), , 6,78 - 6,86 (m, 2H), 5,64 (s, 1H), 3,81 (br. s, 3H), 3,77 1 (m, 3 H). LCMS-ESI (POS.) m/z: 553,0 (M+H)+.
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 S,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(4-ciano-2-2,4-triazol-3-il)-1-hidroxi-2-propanosulfonamida.
(1 S,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida o (1 R,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -hidroxi-2-propanosulfonamida o (1 S,2R)-1 -(4-cia 4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propan relación de diastereómeros 6:1) se separó en cuatro i etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 343.0. El racemato 342.0 (con una os por cromatografía de fluidos supercríticos, con solo
los dos isómeros de la pareja de diastereómeros diastereómeros minoritarios no se caracterizaron. El r primera purificación contenía 3 isómeros y que se purif 80 SFC con columna de 250 x 30 mm AS-H con 20 g/ a 80 g/min. Temperatura. = 22°C, Presión de salida = disolución de 17 mg de muestra disuelta en 13 ml d Tiempo de ciclo 7,0 min, Tiempo de análisis = 14 min.
ml de MeOH. Etapa 2: Realizado en Thar 80 SFC con c 41 g/min de CO2, 48% de co-disolvente a 80 g/min. Te onda = 227 nm. Inyectado 0,3 ml Tiempo de ciclo 5,50 343.0 era el primer pico (que eluye más rápido) de la p principal en la etapa 2 de purificación. 1H RMN (400 M (m, 2H), 7,57 (dd, J=7,92, 1,47 Hz, 1H), 7,46 - 7,53 (m 3H), 3,32 - 3,30 (m, 1H), 2,27 (s, 3 H) 1,17 (d, J=6,85 H
Ejemplo 344.0: Preparación de (1S,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)cipales caracterizados. Los picos de la pareja de to 342.0 se purificó usando 2 etapas. El pico 1 de la sando una segunda etapa. Etapa 1: Realizado en Thar MeOH (solo) 60 g/min de CO2, 25% de co-disolvente r, Longitud de onda = 227 nm. Inyectado 0,5 ml de una H (10%DCM) c= 5,4 mg/ml y 2,7 mg por inyección.
1 se secó y se concentró y se volvió a suspender en 5 a de 250 x 30 mm CC4 con 38 g/min de MeOH(solo) tura. = 22°C, Presión de salida = 100 bar, Longitud de Tiempo de análisis = 16,0 min. El compuesto del título e diastereómeros mayoritarios, que también era el pico D3OD) 58,40 (br. s., 1H), 8,30 (br. s., 1H), 7,66 - 7,74 6,74 - 6,85 (m, 2H), 5,69 (s, 1H), 3,77 (s, 3H), 3,75 (s, ). LCMS-ESI (POS.) m/z: 553,0 (M+H)+.
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 S,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(4-ciano-2-2,4-triazol-3-il)-1-hidroxi-2-propanosulfonamida.
(1 S,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida o (1 R,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -hidroxi-2-propanosulfonamida o (1 S,2R)-1 -(4-cia 4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propan segundo pico (que es el pico 2 de la etapa 1 de purific descrito en el Ejemplo 343.0. 1H RMN (400 MHz, CD J=8,12, 1,27 Hz, 1H), 7,49 - 7,55 (m, 2H), 6,82 (dd, J 3,22 - 3,28 (m, 1H), 2,29 - 2,32 (m, 3H), 1,16 - 1,19 (m,
Ejemplo 345: Preparación de (1R,2S)-N-(4-(2,6-dimeto piridinil)-1 -hidroxi-2-propanosulfonamida y (1 S,2R)-N-( 1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propanosulfonamida 1,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propa 3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-piridinil)-1-h etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 344.0. El Ejemplo 344.0 era el ) de la separación quiral del diastereómero mayoritario 5 8,21 - 8,59 (m, 2H), 7,66 - 7,75 (m, 2H), 7,58 (dd, 5,87 Hz, 2H), 5,65 (s, 1H), 3,80 (s, 3H), 3,77 (s, 3H), LCMS-ESI (POS.) m/z: 553,0 (M+H)+.
-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-fonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil--2-propanosulfonamida.
(1 R,2S)-1 -(5-fluoropiridin-2-il)-1 -hidroxipropano-2-sulfon sulfonamida o (1S,2S)-1-(5-fluoropiridin-2-il)-1-hidroxi hidroxipropano-2-sulfonamida, Ejemplo 345.1. El compu en el Ejemplo C usando 12.0 y el 5-fluoropicolinaldehíd etapa de reacción aldólica.
y (1 S,2R)-1 -(5-fluoropiridin-2-il)-1 -hidroxipropano-2-no-2-sulfonamida y (1R,2R)-1-(5-fluoropiridin-2-il)-1-del título 345.1 se preparó siguiendo el procedimiento separó la pareja de diastereómeros mayoritarios de la
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxi piridinil)-1 -hidroxi-2-propanosulfonamida o (1 S,2S)-N-(4 1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propanosulfonamida
1,2,4-triazol-3-il)-1-(5-fluoro-2-piridinil)-1-hidroxi-2-propa se preparó usando el mismo procedimiento descrito en CD3OD) 58,51 (br. s, 1H), 8,34 - 8,43 (m, 2H), 7,81 - 7, - 6,86 (m, 2H), 5,35 - 5,41 (m, 1H), 3,79 (s, 3H), 3,76 (s, Hz, 3 H). LCMS-ESI (POS.) m/z: 529,1 (M+H)+.
Ejemplo 346.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 2- piridinil)-1 -hidroxi-2-propanosulfonamida o (1 S,2R)-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propanosulfonamida 1,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propa 3- piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-piridinil)-1triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-imetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-namida, Ejemplo 345.0. El compuesto del título 345.0 mplo A usando 345.1,1.0 y 3.11. 1H RMN (400 MHz, 1H), 7,58 - 7,63 (m, 2H), 7,53 (t, J=8,51 Hz, 1H), 6,77 ,58 - 3,65 (m, 1H), 2,32 - 2,35 (m, 3H), 1,10 (d, J=7,04
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-namida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metili-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxif piridinil)-1 -hidroxi-2-propanosulfonamida o (1 S,2S)-N-(4-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propanosulfonamida
1.2.4- triazol-3-il)-1-(5-fluoro-2-piridinil)-1-hidroxi-2-prop de forma quiral en dos enantiómeros por cromatogr Realizado en Thar 200 con columna 250x30 mm AD-H co-disolvente a 110 g/min. Temperatura 20°C, Longitud mg de muestra disuelta en 12 ml de MeOH:DCM 5:1; Tiempo de análisis = 11 min. El compuesto del título 34 (400 MHz, CD3OD) 58,42 - 8,45 (m, 1H), 8,40 (t, J=1,4 (dd, J=6,75, 1,86 Hz, 2H), 7,51 (t, J=8,51 Hz, 1H), 6,76 (qd, J=7,01, 1,86 Hz, 1H), 2,26 - 2,35 (m, 3H), 1,10 (d, J
Ejemplo 347.0: Preparación de (1R,2S)-N-(4-(2,6-dimeto 2- piridinil)-1 -hidroxi-2-propanosulfonamida o (1 S,2R)-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propanosulfonamida 1.2.4- triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-prop 3- piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-piridinil)-1triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-imetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-lfonamida, Ejemplo 346.0. El racemato 345.0 se separó e fluidos supercríticos. Condiciones de separación: 3 ml/min de MeOH (solo) 77 g/min de CO2, 30% de da 273 nm. Inyectado 1,5 ml de una disolución de 192 mg/ml; 16,0 mg/inyección. Tiempo de ciclo 5,5 min, a el primer pico en salir de la columna quiral. 1H RMN 1H), 8,32 (d, J=1,96 Hz, 1H), 7,68 - 7,74 (m, 1H), 7,59 (m, 1H), 5,38 (s, 1H), 3,78 (s, 3H), 3,76 (s, 3H), 3,62 Hz, 3 H). LCMS-ESI (POS.) m/z: 529,0 (M+H)+.
l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-lfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metili-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxif piridinil)-1 -hidroxi-2-propanosulfonamida o (1 S,2S)-N-(4-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-propanosulfonamida
1,2,4-triazol-3-il)-1-(5-fluoro-2-piridinil)-1-hidroxi-2-propan era el segundo pico en eluir de la columna quiral cuand Ejemplo 346.0. 1H RMN (400 MHz, CD3OD) 58,46 - 8,5 J=0,78 Hz, 1H), 7,58 - 7,63 (m, 2H), 7,52 (t, J=8,51 Hz, triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -hidroxi-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-imetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-namida, Ejemplo 347.0. El compuesto del título 347.0 omete 345.0 a las condiciones de SFC descritas en el 1H), 8,39 - 8,43 (m, 1H), 8,34 - 8,38 (m, 1H), 7,80 (d, 6,77 - 6,87 (m, 2H), 5,36 - 5,40 (m, 1H), 3,79 (s, 3H),
3,76 (s, 3H), 3,62 (qd, J=7,01, 2,05 Hz, 1H), 2,33 (s, (M+H)+.
Ejemplo 348.0: Preparación de (2R)-N-(4-(2,6-dimeto piridinil)-2-hidroxietanosulfonamida y (2S)-N-(4-(2, fluoro-2-piridinil)-2-hidroxietanosulfonamida.
1,10 (d, J=7,04 Hz, 3 H). LCMS-ESI (POS.) m/z: 529,0
l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-etoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, hidroxietanosulfonamida y (2S)-N-(4-(2,6-dimeto piridinil)-2-hidroxietanosulfonamida, Ejemplo 348.0. El procedimientos descritos en los Ejemplos A y C usan MHz, CDaOD) 58,52 (br. s, 1H), 8,35 - 8,43 (m, 2H), 7, 6,81 (dd, J=8,56, 2,20 Hz, 2H), 5,15 - 5,23 (m, 1H), 3, 1H), 2,34 (s, 3 H). LCMS-ESI (POS.) m/z: 515,0 (M+H)+.
Ejemplo 349.0: Preparación de (2R)-N-(4-(2,6-dimeto piridinil)-2-hidroxietanosulfonamida o (2S)-N-(4-(2, fluoro-2-piridinil)-2-hidroxietanosulfonamida.
azol-3-il)-2-(5-fluoro-2-piridinil)-2-l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-uesto del título 348.0 se preparó de acuerdo con los l 2.0, 1.0, 13.0 y 5-fluoropicolinaldehído. 1H RMN (500 ,87 (m, 1H), 7,57 - 7,64 (m, 2H), 7,52 (t, J=8,56 Hz, 1H), , 3H), 3,77 (s, 3H), 3,59 - 3,69 (m, 1H), 3,32 - 3,36 (m,
l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-etoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, hidroxietanosulfonamida o (2S)-N-(4-(2,6-dimeto piridinil)-2-hidroxietanosulfonamida, Ejemplo 349.0. El supercríticos en dos enantiómeros (condiciones de sep 65 ml/min, 220 nm. Vol. iny.: 0,5 ml, 1 mg/ml de DCM:M salir de la columna quiral. 1H RMN (400 MHz, DMSO-a 7,71 (td, J=8,81, 2,90 Hz, 1H), 7,58 - 7,61 (m, 1H), 7,50 (m, 1H), 3,70 (s, 3H), 3,68 (s, 3H), 3,53 (dd, J=14,10, 3 Hz, 1H), 2,22 - 2,26 (m, 3 H). LCMS-ESI (POS.) m/z: 51
Ejemplo 350.0: Preparación de (2R)-N-(4-(2,6-dimeto piridinil)-2-hidroxietanosulfonamida o (2S)-N-(4-(2, fluoro-2-piridinil)-2-hidroxietanosulfonamida.
azol-3-il)-2-(5-fluoro-2-piridinil)-2-l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-emato 348.0 se purificó por cromatografía de fluidos n: columna IA (2 x 15 cm), MeOH/CO2 al 25%, 100 bar, 1:1.). El compuesto del título 349.0 era el primer pico en 13,47 (br. s, 1H), 8,48 (d, J=3,32 Hz, 2H), 8,20 (s, 1H), H), 6,82 (d, J=8,50 Hz, 2H), 5,51 (br. s, 1H), 4,96 - 5,07 z, 1H), 3,22 (dd, J=14,10, 8,50 Hz, 1H), 3,17 (d, J=5,18 M+H)+.
l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-etoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, hidroxietanosulfonamida o (2S)-N-(4-(2,6-dimeto piridinil)-2-hidroxietanosulfonamida, 350.0. El Ejemplo las condiciones de SFC descritas en el Ejemplo 349.0.
8,51 (m, 2H), 8,20 (d, J=1,87 Hz, 1H), 7,71 (td, J=8,8 J=8,50 Hz, 2H), 5,53 (br. s, 1H), 4,97 - 5,07 (m, 1H), 3, azol-3-il)-2-(5-fluoro-2-piridinil)-2-l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-(5-fluoro-2-era el segundo pico en eluir cuando se somete 348.0 a N (400 MHz, DMSO-afe) 513,38 - 13,55 (m, 1H), 8,44 -90 Hz, 1H), 7,60 (s, 1H), 7,46 - 7,56 (m, 2H), 6,82 (d, 3H), 3,68 (s, 3H), 3,53 (dd, J=14,10, 3,32 Hz, 1H), 3,19
- 3,26 (m, 1H), 3,17 (d, J=5,18 Hz, 1H), 2,25 (s, 3 H). LCM
Ejemplo 351.0: Preparación de (1 R,2S)-N-(4-(2,6-dimetoxi 2- piridinil)-1 -metoxi-2-propanosulfonamida y (1 S,2R)-N-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propano 3- piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -m SI (POS.) m/z: 514,9 (M+H)+.
il)-5-(5-metil-3-piridinM)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-fonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilxi-2-propanosulfonamida.
(1 R,2R)-(5-fluoropiridin-2-il)-1-hidroxi-N,N-bis(4-metoxiben hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida
metoxibencil)propano-2-sulfonamida y (1 R,2S)-(5-flu sulfonamida, Ejemplo 351.1. El compuesto del título se pr El compuesto del título 351.1 es el diastereómero mayori (M+H)+.
propano-2-sulfonamida y (1S,2S)-(5-fluoropiridin-2-il)-1-o (1 S,2R)-(5-fluoropiridin-2-il)-1 -hidroxi-N,N-bis(4-piridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-ró siguiendo el procedimiento descrito en el Ejemplo C. o aislado de la reacción. LCMS-ESI (POS.) m/z: 475,0
(1 R,2R)-1 -(5-fluoropiridin-2-il)-1 -metoxi-N,N-bis(4-metoxib il)propano-2-sulfonamida y (1 S,2S)-1 -(5-fluoropiridin-2-il)-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-sulfonami metoxibencil)propano-2-sulfonamida y (1 S,2R)-1 -(5-f sulfonamida, Ejemplo 351.2. La (1R,2R)-(5-F sulfonamida y (1S,2S)- (5-fluoropiridin-2-il)-1-hidroxi-N, fluoropiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibencil)propan N,N-bis(4-metoxibencil)propano-2-sulfonamida (351.1, 9 Se añadió metiltetrahidrofurano (20 ml), y la reacción se potasio (1,0 M en THF, 2,39 ml, 2,39 mmol)). La mezcla a gota yoduro de metilo (373 pl, 5,96 mmol) a -78°C. La reacción se calentó a -15°C y se agitó durante 1 h. El an en >95%. Se añadió una disolución saturada de clorur EtOAc y se concentró a vacío. El residuo se combinó c mismo procedimiento y se purificaron juntos en una colu gradiente de EtOAc en hexanos al 0-45% para prop rendimiento). LCMS-ESI (POS.) m/z: 489,0 (M+H)+.
o (1 R,2S)-1 -(5-fluoropiridin-2-il)-1 -metoxi-N,N-bis(4-iridin-2-il)-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-iridin-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2-4-metoxibencil)propano-2-sulfonamida o (1S,2r)- (5-ulfonamida y (1 R,2S)-(5-fluoropiridin-2-il)-1 -hidroxi-, 1,99 mmol) se destiló azeotrópicamente con tolueno. ó a -782C. Después se añadió bis(trimetilsilil)amida de ante se agitó durante 10 min y después se añadió gota cla después se agitó durante 2 h a -78°C. Después, la de LCMS mostró que la reacción se había completado nico a la disolución fría, y la reacción se extrajo con a reacción a escala de 500 mg, se llevó siguiendo el e gel de sílice Gold preempaquetada Redi-Sep con un ar el compuesto del título 351.2. (1,34 g, 90% de
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxi piridinil)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-N-(4-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propanosulfonamida
1.2.4- triazol-3-il)-1-(5-fluoro-2-piridinil)-1-metoxi-2-prop se preparó de acuerdo con los procedimientos descrito en Ejemplo A para obtener 351.0. 1H RMN (400 MHz,
J=1,56 Hz, 1H), 7,58 - 7,68 (m, 1H), 7,35 - 7,52 (m, 3 3,75 (s, 3H), 3,73 (s, 3H), 3,41 (qd, J=7,04, 2,54 Hz, 1H), ESI (POS.) m/z: 543,0 (M+H)+.
Ejemplo 352.0: Preparación de (1R,2S)-N-(4-(2,6-dimeto 2- piridinil)-1 -metoxi-2-propanosulfonamida o (1 S,2R)-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propanosulfonamida 1.2.4- triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-prop 3- piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-imetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-lfonamida, Ejemplo 351.0. El compuesto del título 351.0 l Ejemplo C y los siguientes procedimientos descritos ) 5 11,19 (br. s, 1H), 8,43 (d, J=2,93 Hz, 2H), 8,33 (d, 8 (dd, J=8,61, 4,11 Hz, 2H), 4,98 (d, J=2,54 Hz, 1H), (s, .3H), 2,29 (s, 3H), 1,13 (d, J=7,04 Hz, 3 H). LCMS-
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-lfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metili-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxi piridinil)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-N-(4 1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propanosulfonamida
1.2.4- triazol-3-il)-1-(5-fluoro-2-piridinil)-1-metoxi-2-prop de forma quiral en dos enantiómeros por cromatografía las siguientes: Columna: Chiralpak a D-H, 2.1 x 15 cm; F Presión de salida: 100 bar; Longitud de onda: 274 nm; 1,0 ml de solución de muestra, o 25 mg de muestra en c el primer pico en salir de la columna quiral. 1H RMN (4 1H), 7,70 - 7,73 (m, 1H), 7,62 (td, J=8,61, 2,93 Hz, 1H), 1H), 3,78 (s, 3H), 3,75 (s, 3H), 3,40 (qd, J=7,04, 2,54 LCMS-ESI (POS.) m/z: 543,0 (M+H)+.
Ejemplo 353.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 2- piridinil)-1 -metoxi-2-propanosulfonamida o (1 S,2R)-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propanosulfonamida 1.2.4- triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-prop 3- piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-imetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-lfonamida, Ejemplo 352.0. El racemato 351.0 se separó dos supercríticos. Las condiciones de separación eran óvil: 50% de IPA/ 50% de CO2; Caudal: 80 g/min; SFC ra disuelta a 25 mg/ml en MeOH:DCM 1:1; introducido nyección preparativa. El compuesto del título 352.0 era z, CD3OD) 58,40 - 8,49 (m, 2H), 8,32 (d, J=1,57 Hz, - 7,53 (m, 2H), 6,79 (d, J=8,61 Hz, 2H), 4,95 - 5,03 (m, ), 3,26 (s, 3H), 2,30 (s, 3H), 1,14 (d, J=7,04 Hz, 3 H).
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-lfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metili-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxi piridinil)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-N-(4 1 -(5-fluoro-2-piridinil)-1 -metoxi-2-propanosulfonamida
1,2,4-triazol-3-il)-1-(5-fluoro-2-piridinil)-1-metoxi-2-propa segundo pico en eluir fuera de la columna cuando s triazol-3-il)-1 -(5-fluoro-2-piridinil)-1 -metoxi-2-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-imetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-namida, Ejemplo 353.0. El Ejemplo 353.0 era el ete 351.0 a las condiciones de SFC descritas en el
Ejemplo 352.0. 1H RMN (400 MHz, CD3OD) 58,40 - 8, J=8,61,2,93 Hz, 1H), 7,41 - 7,53 (m, 2H), 6,79 (d, J=8,6 3,40 (qd, J=7,01, 2,45 Hz, 1H), 3,26 (s, 3H), 2,30 (s, (M+H)+.
Ejemplo 354.0: Preparación de (1R,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida y
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil), 2H), 8,27 - 8,35 (m, 1H), 7,68 - 7,75 (m, 1H), 7,62 (td, 2H), 5,00 (d, J=2,54 Hz, 1H), 3,78 (s, 3H), 3,75 (s, 3H), ,14 (d, J=7,04 Hz, 3 H). LCMS-ESI (POS.) m/z: 543,0
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida y (1 R,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida y (1 S,2S)-1 -(4-ciano-2-2,4-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 R,2S)-1 -(4-bromo-2-fluorofenil)-1 -metoxipropano-2-su metoxipropano-2-sulfonamida y (1S,2S)-1-(4-bromo-2 bromo-2-fluorofenil)-1-metoxipropano-2-sulfonamida, Ej procedimiento descrito en el Ejemplo C usando 5.0 y e (M+Na)+.
ida y (1 R,2R)-1 -(4-bromo-2-fluorofenil)-1 -fenil)-1-metoxipropano-2-sulfonamida y (1S,2R)-1-(4-354.1. El compuesto del título se preparó siguiendo el omo-2-fluorobenzaldehído. LCMS-ESI POS. m/z: 347,9
(1 R,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida y (1 S,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -metoxi-2-propanosulfonamida y (1 R,2R)-1 -(4-cia 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida y metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propan preparó usando 354.1, 1.0 y 3.11 y siguiendo el proc 354.0 se obtuvo como una mezcla de diastereómeros 3: 1H), 7,81 - 7,87 (m, 1H), 7,47 - 7,63 (m, 4H), 6,79 - 6,8 3,03 - 3,24 (m, 4H), 2,31 - 2,37 (m, 3H), 1,04 - 1,23 (m,
Ejemplo 355.0: Preparación de (1R,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 354.0. El compuesto del título se nto descrito en el Ejemplo A. El compuesto del título RMN (400 MHz, CD3OD) 58,50 (s, 1 h ), 8,34 - 8,41 (m, 2H), 5,24 (d, J=2,54 Hz, 1H), 3,79 (m, J=9,80 Hz, 6H), LCMS-ESI (POS.) m/z: 567,0 (M+H)+.
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1-(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 R,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 S,2S)-1 -(4-ciano-2-2,4-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 R,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida o (1 S,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(4-cia 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propan se separó por cromatografía de fluidos supercríticos en cantidad y no se caracterizó. Condiciones de separació SFC con columna 400 x mm AD-H con 28 g/min de EtO Temperatura. = 22°C, Presión de salida = 100 bar, L muestra disuelta en 17 ml de MeOH:DCM 10:7; c= 9,3 Tiempo de análisis 20min. Etapa 2: Purificación quiral ( 150 x 21 mm AD-H con 15 g/min de EtOH(solo) 45 g/ = 22°C, Presión de salida = 100 bar, Longitud de onda 6 ml de MeOH: DCM (5:1); c= 15,3 mg/ml, es decir 2 análisis = 22 min. Etapa 3: Purificación quiral (20,5 mg CC4 con 40 g/min de MeOH(NH320 mM) 40 g/min 22°C, Presión de salida = 100 bar, Longitud de onda = 4 ml MeOH; c= 5,1 mg/ml, es decir 1,5 mg por inyecció compuesto del título 355.0 era el primer pico que eluye 2, pico 2). 1H RMN (400 MHz, CD3OD) 58,43 (s, 1H), J=8,41 Hz, 2H), 5,18 - 5,30 (m, 1H), 3,79 (s, 3H), 3,77 ( H). LCMS-ESI (POS.) m/z: 567,0 (M+H)+.
Ejemplo 356.0: Preparación de (1R,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 355.0. El compuesto racémico 354.0 o isómeros. El cuarto pico que eluía no tenía suficiente pa 1: Purificación quiral (159 mg): Realizado en Thar 80 ) 52 g/min de CO2, 35% de co-disolvente a 80 g/min.
de onda = 275 nm. Inyectado 1,3 ml de 159 mg de /ml y 12,15 mg por inyección. Tiempo de ciclo 11 min, ): Realizado en Thar 80 SFC con columnas 250 x 21 e CO2, 25% de co-disolvente a 60 g/min. Temperatura. nm. Inyectado 0,15 ml de 92 mg de muestra disuelta en por inyección. Tiempo de ciclo = 10 min, Tiempo de alizado en Thar 80 SFC con columna de 250 x 30 mm O2, 50% de co-disolvente a 80 g/min. Temperatura. = m. Inyectado 0,3 ml de 20,5 mg de muestra disuelta en po de ciclo = 4,7 min, Tiempo de análisis = 9,6 min. El iastereómero mayoritario de la separación quiral (etapa r. s, 1H), 7,71 (br. s., 1H), 7,45 - 7,64 (m, 4H), 6,80 (d, , 3,12 - 3,23 (m, 4H), 2,30 (s, 3H), 1,19 (d, J=6,85 Hz, 3
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 R,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 S,2S)-1 -(4-ciano-2-2,4-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 R,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida o (1 S,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(4-ci 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propan segundo pico del diastereómero mayoritario de la sepa mismas condiciones de SFC descritas en el Ejemplo 3 8,32 (m, J=2,00 Hz, 1H), 7,71 (d, J=0,78 Hz, 1H), 7,5 2H), 5,24 (d, J=2,74 Hz, 1H), 3,15 - 3,22 (m, 4H), 2,2 m/z: 567,0 (M+H)+.
Ejemplo 357.0: Preparación de (1R,2S)-1-(4-ciano-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida, Ejemplo 356.0. El Ejemplo 356.0 era el quiral (etapa 1, pico 2) cuando se somete 354.0 a las 1H RMN (400 MHz, CD3OD) 58,43 (d, J=1,37 Hz, 1H), 2 (m, 3H), 7,50 (t, J=8,51 Hz, 1H), 6,81 (d, J=8,61 Hz, 3 (m, 3H), 1,19 (d, J=7,04 Hz, 3 H). LCMS-ESI (POS.)
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 R,2R)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 S,2S)-1 -(4-ciano-2-,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida.
(1 R,2S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida o (1 S,2R)-1 -(4-ciano-2-fluorofenil) 3-il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(4-ci 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propan pico del diastereómero minoritario de la separación qu condiciones de SFC descritas en el Ejemplo 355.0. 1H 7,69 (s, 1H), 7,48 - 7,61 (m, 4H), 6,76 - 6,84 (m, 2H), 1H), 3,07 (s, 3H), 2,29 (s, 3H), 2,27 - 2,32 (m, 3H), 1,06
Ejemplo 358.0: Preparación de (1R,2R)-N-(4-(2, fluoropirimidin-2-il)-1 -hidroxipropano-2-sulfonamida o ( triazol-3-il)-1-(5-fluoropirimidin-2-il)-1-hidroxipropano-2metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(4-ciano-2-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida, Ejemplo 357.0. El Ejemplo 357.0 era el primer tapa 3, pico 2) cuando se somete 354.0 a las mismas (400 MHz, CD3OD) 58,43 (br. s, 1H), 8,31 (br. s, 1H), 4,89 (m, 1H), 3,79 (s, 3H), 3,77 (s, 3H), 3,39 - 3,47 (m, 7,05 Hz, 3 H). LCMS-ESI (POS.) m/z: 567,0 (M+H)+.
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida, Ejemplo 358.0. A una añadió solución acuosa de HCl 12 N (57 ml, 0,68 mmol repartió entre agua y EtOAc (2X). Las capas orgánica se concentraron a vacío. El residuo se purificó por cr para proporcionar el producto racémico alcohol (52 mg, se llevó a cabo la purificación por cromatografía de -triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -hidroxipropanoidin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -ión de 21.0 (88 mg, 0,14 mmol) en EtOH (1,4 ml) se reacción se agitó a TA hasta completarse y después se binadas se secaron sobre sulfato magnésico anhidro y rafía en gel de sílice (eluyente: IPA en DCM al 0-5%) de rendimiento) en forma de un sólido blanco. Después s supercríticos quiral para separar los dos productos
enantiómeros. Realizado en Thar 350 SFC con column CO2 (40% de co-disolvente) a 100 g/min. Presión de s inyectado 0,8 ml de 50 mg de muestra en 8 ml de MeO Tiempo de ciclo 8.3 min, Tiempo de análisis 15 min.
MHz, CDCl3) 5: 11,03 (br. s., 1H), 8,59 (s, 2H), 8,48 (br 1H), 6,64 (dd, J=8,2, 6,2 Hz, 2H), 5,07 (d, J=6,6 Hz, LCMS-ESI (POS.) m/z: 530,2 (M+H)+.
Ejemplo 359.0: Preparación de (1R,2R)-N-(4-(2, fluoropirimidin-2-il)-1 -hidroxipropano-2-sulfonamida o ( triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -hidroxipropano-2x30 mm AD-H con 48 g/min de IPA(solo) 72 g/min de = 100 bar; Temp. = 19°C; Longitud de onda = 215 nm.
(5:3), es decir 6,2 mg/ml, dando 5,0 mg por inyección. er pico que eluye era (13,0 mg): 358.0. 1H rMn (500 H), 8,35 (br. s., 1H), 7,73 (br. s., 1H), 7,43 (t, J=8,4 Hz, ,69-3,84 (m, 7H), 2,34 (s, 3H), 1,29 (d, J=6,8 Hz, 3H).
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-hidroxipropano-2-sulfonamida, Ejemplo 359.0. La eluci suministraron el segundo pico que eluye 359.0 (11,3 2H), 8,48 (br. s., 1H), 8,35 (br. s., 1H), 7,76 (br. s., 1H), J=6,4 Hz, 1H), 3,70-3,85 (m, 7H), 2,36 (s, 3H), 1,29 (d,
Ejemplo 360.0: Preparación de (1R,2R)-N-(4-(2, fluoropirimidin-2-il)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -metoxipropano-2-triazol-3-il)-1-(5-fluoropirimidin-2-il)-1-hidroxipropanoidin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -cional en las condiciones descritas en el Ejemplo 358.0 RMN (500 MHz, CDCh) 5: 11,03 (br. s., 1H), 8,59 (s, (t, J=8,6 Hz, 1H), 6,65 (dd, J=8,3, 6,1 Hz, 2H), 5,07 (d, Hz, 3H). LCMS-ESI (POS.) m/z: 530,2 (M+H)+.
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4 2-sulfonamida) o (1 S,2S)-N-(4-(2,6-dimetoxifenM)-5-(5-metoxipropano-2-sulfonamida, Ejemplo 360.0. A una m 358.0 (83 mg, 0,16 mmol) en THF (1,6 ml) se añadió h 0,78 mmol) directamente seguido de yodometano (20 durante 5 h y después se inactivó con una solución ac DCM (3X) y las capas orgánicas combinadas se secaro El residuo se purificó por cromatografía en gel de síl producto de éter de metilo racémico (15 mg, 18% de r cabo la purificación por cromatografía de fluidos super Purificación quiral (15 mg): Realizado en Thar 80 S MeOH(solo) 40 g/min de CO2, 50% de co-disolvent Longitud de onda = 215 nm. Manualmente inyectados 0 de MeOH; c= 5,0 mg/ml y 2,5 mg por inyección. Tiemp 360 (1,5 mg). 1H RMN (500 MHz, CDCla) 5: 8,63 (s, 2 Hz, 1H), 6,58-6,66 (m, 2H), 4,82 (d, J=6,6 Hz, 1H), 3,7 3H). LCMS-ESI (POS.) m/z: 544,1 (M+H)+.
Ejemplo 361.0: Preparación de (1R,2R)-N-(4-(2, fluoropirimidin-2-il)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(5-fluoropirimidin-2-il)-1-metoxipropano-2-s -triazol-3-il)-1-(5-fluoropirimidin-2-il)-1-metoxipropanoidin-3-M)-4H-1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -1:1 de los productos descritos en los Ejemplos 359.0 y de sodio, dispersión al 60% en aceite mineral (31 mg, 1 mmol) mediante jeringa. La reacción se agitó a TA saturada de cloruro amónico. La mezcla se extrajo con e sulfato magnésico anhidro y se concentraron a vacío. luyente: IPA en DCM al 0-10%) para proporcionar el ento) en forma de un sólido blanco. Después se llevó a s quiral para separar los dos productos enantiómeros. n columna de 250 x 30 mm CC4 con 40 g/min de 0 g/min. Temp. = 25°C, Presión de salida = 100 bar, de una disolución de 15 mg de muestra disuelta en 3 ml nálisis = 25 min. El primer pico que eluía era el Ejemplo 5 (s, 1H), 8,33 (s, 1H), 7,69 (br. s., 1H), 7,40 (t, J=8,4 (m, 7H), 3,24 (s, 3H), 2,32 (s, 3H), 1,24 (d, J=7,1 Hz,
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(5-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida, Ejemplo 361.0. La eluci suministró el segundo pico que eluye 361.0 (4,4 mg): (s, 1H), 7,68 (s, 1H), 7,40 (t, J=8,4 Hz, 1H), 6,59-6,67 3H), 2,32 (s, 3H), 1,23 (d, J=7,3 Hz, 3H). LCMS-ESI (P
Ejemplo 362.0: Preparación de (1R,2R)-N-(4-(2,6-fluoropirimidin-2-il)-1-hidroxipropano-2-sulfonamida o 1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -hidroxipropa -triazol-3-il)-1-(5-fluoropirimidin-2-il)-1-metoxipropanoidin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -icional en las condiciones descritas en Ejemplo 360.0, N (500 MHz, CDCh) 5: 8,63 (s, 2H), 8,45 (s, 1H), 8,33 H), 4,82 (d, J=6,6 Hz, 1H), 3,69-3,83 (m, 7H), 3,24 (s, /z: 544,1 (M+H)+.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 hidroxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d fluoropirimidin-2-il)-1-hidroxipropano-2-sulfonamida, Ej 20.0 (700 mg, 2,00 mmol), se acoplaron la 6-metoxi mmol). Después de completarse, la mezcla de reacció solución de amoniaco en MeOH 7 N (2,29 ml, 16,0 mm por cromatografía en gel de sílice (eluyente: gradien producto alcohol racémico (551 mg, 51% de rendimient alcohol racémico se purificó por cromatografía de fl enantiómeros. IC (2 x 15 cm) EtOH/CO2 al 40%, 100 primer pico que eluye se asignó como el Ejemplo 362.0 (s, 2H), 7,54-7,69 (m, 2H), 7,34 (t, J=8,6 Hz, 1H), 6,71 ( Hz, 1H), 3,68-3,80 (m, 7H), 3,17 (s, 3H), 1,27 (d, J=7,1
Ejemplo 363.0: Preparación de (1R,2R)-N-(4-(2,6-fluoropirimidin-2-il)-1-hidroxipropano-2-sulfonamida o 1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -hidroxipropa ,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-362.0. Siguiendo el procedimiento en el Ejemplo A, ohidrazida (402 mg, 2,40 mmol) y 1.0 (411 mg, 2,10 ués se dejó enfriar y se inactivó directamente con una mezcla resultante se concentró y el residuo se purificó hexanos puros a EtOAc puro) para proporcionar el forma de un sólido blanco. Una cantidad de 50 mg del supercríticos quiral para separar los dos productos ml/min, 220 nm. Vol. iny.: 1 ml, 5 mg/ml en EtOH. El mg). 1H RMN (500 MHz, CDCh) 5: 11,00 (s, 1H), 8,58 7,8, 1,2 Hz, 1H), 6,56-6,66 (m, 2H), 5,07 (dd, J=6,6, 5,1 ). LCMS-ESI (POS.) m/z: 546,0 (M+H)+.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 hidroxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-fluoropirimidin-2-il)-1-hidroxipropano-2-sulfonamida, Eje en el Ejemplo 362.0, suministró el segundo pico que el (500 MHz, CDCla) 5: 11,02 (br. s., 1H), 8,60 (s, 2H), 7, Hz, 1H), 6,56-6,66 (m, 2H), 5,07 (d, J=6,6 Hz, 1H), 3,68 (POS.) m/z: 546,0 (M+H)+.
Ejemplo 364.0: Preparación de (1R,2R)-N-(4-(2,6,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-363.0. La elución adicional en las condiciones descritas e se asignó como el Ejemplo 363.0 (16,1 mg). 1H RMN 6 (m, 2H), 7,36 (t, J=8,4 Hz, 1H), 6,73 (dd, J=7,7, 1,3 (m, 7H), 3,18 (s, 3H), 1,29 (d, J=7,1 Hz, 3H). LCMS-ESI
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-
fluoropirimidin-2-il)-1-metoxipropano-2-sulfonamida o 1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -metoxipropa ,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d fluoropirimidin-2-il)-1-metoxipropano-2-sulfonamida, 36 Ejemplos 362.0 y 363.0 (200 mg, 0,37 mmol) en THF ( mineral (73 mg, 1,83 mmol)) directamente seguido de se agitó a TA durante 16 h y después se inactivó con se extrajo con EtOAc (3X) y las capas orgánicas co concentraron a vacío. El residuo se purificó por cromat proporcionar el producto inicial. Después el producto inversa (columna Sunfire 10 pM C18, eluyente: ACN e disolventes contenían TFA al 0,1%) para proporciona rendimiento) en forma de un sólido blanco. Después supercríticos quiral para separar los dos productos en 25 cm) MeOH/CO2 al 20%, 100 bar, 65 ml/min, 220 n que eluye (364.0, 15,0 mg). 1H RMN (500 MHz, CDCla) J=8,6 Hz, 1H), 6,71 (d, J=7,8 Hz, 1H), 6,57-6,66 (m, 2H) (s, 3H), 3,18 (s, 3H), 1,23 (d, J=7,1 Hz, 3H). LCMS-ESI
Ejemplo 365.0: Preparación de (1R,2R)-N-(4-(2,6-fluoropirimidin-2-il)-1 -metoxipropano-2-sulfonamida o 1,2,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -metoxipropa ,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-una mezcla 1:1 de los productos descritos en los ) se añadió hidruro sódico (dispersión al 60% en aceite etano (69 pl, 1,10 mmol) mediante jeringa. La reacción lución acuosa saturada de cloruro amónico. La mezcla as se secaron sobre sulfato magnésico anhidro y se en gel de sílice (eluyente: IPA en DCM al 0-10%) para l se volvió a purificar por HPLC preparativa de fase al 35-55% en un periodo de 20 minutos donde ambos roducto de éter de metilo racémico (51 mg, 25% de vó a cabo la purificación por cromatografía de fluidos eros. Método preparativo: Método analítico: AS-H (2 x iny.: 1 ml, 4 mg/ml en DCM:MeOH 1:3. El primer pico ,30 (br. s., 1H), 8,64 (s, 2H), 7,58-7,69 (m, 2H), 7,33 (t, (d, J=6,6 Hz, 1H), 3,74-3,82 (m, 4H), 3,71 (s, 3H), 3,25 ) m/z: 560,2 (M+H)+.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-ulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metoxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-fluoropirimidin-2-il)-1-metoxipropano-2-sulfonamida, Eje en el Ejemplo 364.0 suministró el segundo pico que el 2H), 7,55-7,67 (m, 2H), 7,31 (t, J=8,4 Hz, 1H), 6,69 (d 1H), 3,72-3,81 (m, 4H), 3,69 (s, 3H), 3,23 (s, 3H), 3,17 (M+H)+.
Ejemplo 366.0: Preparación de (S)-2-(2,4-difluorofenil) 3-il)-2-hidroxietanosulfonamida o (R)-2-(2,4-difluo triazol-3-il)-2-hidroxietanosulfonamida.
,4-triazol-3-il)-1 -(5-fluoropirimidin-2-il)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-365.0. La elución adicional en las condiciones descritas 65.0, 16,7 mg). 1H RMN (500 MHz, CDCl3) 5: 8,63 (s, ,7, 1,3 Hz, 1H), 6,56-6,65 (m, 2H), 4,83 (d, J=6,8 Hz, ), 1,22 (d, J=7,3 Hz, 3H). LCMS-ESI (POS.) m/z: 560,2
(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoll)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-(S)-2-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-met (R)-2-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-met Ejemplo 366.0. Siguiendo el procedimiento en el Ejem 0,51 mmol) para proporcionar el producto de alcohol ra blanco. Después se llevó a cabo una cromatografía d enantiómeros. Chiralpak AD-H, 5 uM, 250x20 mm, IP 42,7 mg). 1H RMN (500 MHz, CDCls) 5: 11,00 (br. s., (m, 2H), 6,87 (t, J=8,4 Hz, 1H), 6,77 (t, J=10,0 Hz, 1H), s., 1H), 3,67-3,85 (m, 6H), 3,22-3,42 (m, 2H), 2,34 (s, 3
Ejemplo 367.0: Preparación de (S)-2-(2,4-difluorofenil) 3-il)-2-hidroxietanosulfonamida o (R)-2-(2,4-difluo triazol-3-il)-2-hidroxietanosulfonamida.
n-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o n-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, se acoplaron 23.0 (100 mg, 0,42 mmol) y 2.0 (190 mg, o (120 mg, 54% de rendimiento) en forma de un sólido os supercríticos quiral para separar los dos productos %, 274 nm, 193 Bar. El primer pico que eluye (366.0, 47 (br. s., 1H), 8,34 (br. s., 1H), 7,72 (s, 1H), 7,37-7,57 (t, J=9,3 Hz, 2H), 5,41 (dd, J=8,2, 2,7 Hz, 1H), 4,40 (br. MS-ESI (POS.) m/z: 532,1 (M+H)+.
(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoll)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-
(S)-2-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-met (R)-2-(2,4-difluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-met Ejemplo 367.0. La elución adicional en las condicione que eluye (367.0, 40,6 mg). 1H RMN (500 MHz, CDCla) 7,34-7,56 (m, 2H), 6,87 (t, J=8,4 Hz, 1H), 6,77 (t, J=10, 4,40 (br. s., 1H), 3,68-3,85 (m, 6H), 3,23-3,40 (m, 2H),
Ejemplo 368.0: Preparación de 2-(4-clor il)etanosulfonamida.
n-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o n-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, ritas en el Ejemplo 366.0, suministró el segundo pico ,99 (br. s., 1H), 8,47 (s, 1H), 8,34 (s, 1H), 7,71 (s, 1H), 1H), 6,64 (t, J=9,3 Hz, 2H), 5,42 (dd, J=8,3, 3,0 Hz, 1H), , 3H). LCMS-ESI (POS.) m/z: 532,1 (M+H)+.
N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H-1,2,4-triazol-3-
4-(2,6-Dimetoxifenil)-5-(piridin-2-il)-4H-1,2,4-triazol-3-a usado en la síntesis del Ejemplo 2.04, usando el picolin jemplo 368.1. El uso de un procedimiento similar al zida dio 368.1. LCMS-ESI (POS), m/z: 298,2 (M+H)+.
2-(4-Clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(2-piridinil)-4H disolución de 368.1 (22 mg, 0,074 mmol) y TEA (51,5 clorofenil)-etanosulfonilo (disponible en el mercado en TA Después se añadieron dos equivalentes adicionales completarse la reacción, la mezcla se diluyó con DCM Las capas orgánicas se secaron sobre MgSO4, se filtra del residuo por RP-HPLC preparativa (55% ACN, a SunfireTM Prep C18 OBD, 10 pm, 30 x 150 mm (W material se aisló como la base libre en condiciones blanco. 1H RMN (400 MHz, CD3OD) 5: 8,34 (d, J=4,9 Hz, 1H), 7,34-7,39 (m, 1H), 7,25-7,31 (m, 2H), 7,15-7,2 2H), 2,98-3,06 (m, 2H). LCMS-ESI (POS.) m/z: 500,2 ( -triazol-3-il)etanosulfonamida, Ejemplo 368.0. A una 70 mmol) en DCM (370 pl) se añadió cloruro de 2-(4-hem Inc., 35,4 mg, 0,15 mmol). La reacción se agitó a oruro de sulfonilo y un equivalente de TEA. Después de avó con una solución saturada de NaHCO3 y salmuera. se evaporaron hasta un aceite naranja. La purificación TFA al 0,1%, elución isocrática) usando la columna Milford, MA) a 30 ml/min proporcionó el producto. El ar; dando 368.0 (5 mg, 13%) en forma de un sólido ), 7,79-7,86 (m, 1H), 7,72-7,78 (m, 1H), 7,44 (t, J=8,5 2H), 6,74 (d, J=8,4 Hz, 2H), 3,69 (s, 6H), 3,22-3,28 (m,
Ejemplo 369.0: Preparación de 2-(4-cloro il)etanosulfonamida.
-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-
4-(2,6-Dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-am usado en la síntesis del Ejemplo 2.04, y usando nicotino (M+H)+.
jemplo 369.1. El uso de un procedimiento similar al ida dio el Ejemplo 369.1. LCMS-ESI (POS), m/z: 298,1
2-(4-Clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-369.1 y el procedimiento descrito en el Ejemplo 368.0 di RMN (400 MHz, CDaOD) 5: 8,54-8,67 (m, 2H), 7,87 (dt, 5.1 Hz, 1H), 7,22-7,32 (m, 2H), 7,16-7,20 (m, 2H), 6,8 (m, 2H). LCMS-ESI (POS.) m/z: 500,0 (M+H)+.
Ejemplo 370.0: Preparación de 2-(4-clorofenil)-N-il)etanosulfonamida.
triazol-3-il)etanosulfonamida, Ejemplo 369.0. El uso de .0 (50 mg, 22%) en forma de un sólido blanquecino. 1H 0, 2,0 Hz, 1H), 7,51 (t, J=8,5 Hz, 1H), 7,46 (dd, J=8,0, =8,6 Hz, 2H), 3,76 (s, 6H), 3,22-3,28 (m, 2H), 2,98-3,06
6-dimetoxifenil)-5-(6-metilpiridin-3-il)-4H-1,2,4-triazol-3-
N-(2,6-dimetoxifenil)-6-metilnicotinamida, Ejemplo 370.1 22,8 mmol) y TEA (9,5 ml, 68,5 mmol) en DMF (76 ml) añadió 2,6-dimetoxianilina (3,5 g, 22,9 mmol). La mez indicaba que la reacción se había completado. La mez acuosa saturada de bicarbonato sódico y salmuera, combinadas se secaron sobre sulfato magnésico anh cromatografía en gel de sílice (eluyente: EtOAc/hexa rendimiento) en forma de un sólido marrón claro. LCMSa disolución agitada de ácido 6-metilnicotínico (3,1 g, adió HATU (9,6 g, 25,1 mmol). Después de 3 min, se ultante se agitó a TA hasta que el análisis de LCMS reacción se inactivó usando una mezcla de disolución és se extrajo con EtOAc (4X). Las capas orgánicas se concentraron a vacío. El residuo se purificó por l 25-100%) para proporcionar 370.1 (4,2 g, 68% de OS), m/z: 273,2 (M+H)+.
N-(2,6-dimetoxifenil)-6-metilpiridina-3-carbotioamida, Ej dioxano (50 ml) se añadió hexametildisiloxano (10,7 ml, La suspensión resultante se calentó a 100°C durante 16 había completado. La mezcla de reacción se concentró combinadas se secaron sobre sulfato sódico anhidro 100% de rendimiento) en forma de un sólido amarillo. l 370.2. A una disolución de 370.1 (4,2 g, 15,6 mmol) en mmol) y pentasulfuro de difósforo (694 mg, 3,1 mmol). ta que el análisis de LCMS indicaba que la reacción se repartió entre agua y EtOAc (3X). Las capas orgánicas oncentraron a vacío para proporcionar 370.2 (4,5 g, SI (POS), m/z: 289,2 (M+H)+.
(Z)-N"-(2,6-dimetoxifenil)-6-metilnicotinimidohidrazida, Ej en THF (56 ml) se añadió solución de hidrato de hidrazin se calentó a reflujo durante 1 h hasta que el análisis d mezcla de reacción se repartió entre salmuera y EtOAc. concentraron a vacío. El residuo se purificó por cromat en DCM al 0-10%) para proporcionar 370.3 (1,29 g, 54 ESI (POS), m/z: 287,2 (M+H)+.
lo 370.3. A una disolución de 370.2 (2,42 g, 8,39 mmol) 0% en peso, 3,3 ml, 84 mmol). La suspensión resultante MS indicaba que la reacción se había completado. La apa orgánica se secó sobre sulfato sódico anhidro y se ía en una columna de alúmina neutra (eluyente: MeOH rendimiento) en forma de un sólido blanquecino. LCMS-
4-(2,6-dimetoxifenil)-5-(6-metilpiridin-3-il)-4H-1,2,4-triazol 4,51 mmol) en EtOH (15 ml) se añadió una solución solución roja resultante se calentó a 60°C durante 4 h indicaba que la reacción se había completado. La mezcl bicarbonato sódico y se extrajo con EtOAc (4X). Las ca anhidro y se concentraron a vacío. El residuo se purific gM C18, eluyente: ACN en agua al 5-40% a lo largo de TFA al 0,1%) para proporcionar 370.4 (428 mg, 31% de (POS), m/z: 312,2 (M+H)+.
ina, Ejemplo 370.4. A una disolución de 370.3 (1,29 g, romuro de cianógeno (5 M, 2,70 ml, 13,5 mmol). La pués se agitó a TA durante 16 h. El análisis de LCMS reacción se inactivó con disolución acuosa saturada de orgánicas combinadas se secaron sobre sulfato sódico r HPLC preparativa de fase inversa (columna Sunfire 5 riodo de 35 minuto donde ambos disolventes contenían imiento) en forma de un sólido marrón claro. LCMS-ESI
2-(4-Clorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metilpiridin-3 una disolución de 370.4 (48 mg, 0,15 mmol) y TEA (10 clorofenil)etanosulfonilo (96 mg, 0,40 mmol). La solució el análisis de LCMS indicaba que se había producido la disolución acuosa saturada de bicarbonato sódico y EtO se concentraron a vacío. El residuo se purificó por HP eluyente: ACN en agua al 20-50% a lo largo de un perio 0,1%) para proporcionar 370.0 (9,6 mg, 12% de rendimi CDaOD) 5: 8,53 (d, J=1,7 Hz, 1H), 7,96 (dd, J=8,3, 2,3 7,17 (d, J=8,6 Hz, 2H), 6,82 (d, J=8,6 Hz, 2H), 3,77 ( LCMS-ESI (POS.) m/z: 514,2 (M+H)+.
Ejemplo 371.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-metilpirimidin-2-il)propano-2-sulfonamida.
H-1,2,4-triazol-3-il)etanosulfonamida, Ejemplo 370.0. A 0,77 mmol) en DCM (15 ml) se añadió cloruro de 2-(4-ultante se agitó a TA durante 2,5 d momento en el que versión parcial. La mezcla de reacción se repartió entre a capa orgánica se secó sobre sulfato sódico anhidro y reparativa de fase inversa (columna Sunfire 5 gM C18, e 35 minuto donde ambos disolventes contenían TFA al en forma de un sólido blanquecino. 1H RMN (500 MHz, H), 7,52 (dt, J=8,5, 4,3 Hz, 2H), 7,28 (d, J=8,6 Hz, 2H), ), 3,20-3,28 (m, 2H), 2,94-3,07 (m, 2H), 2,61 (s, 3H).
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4 sulfonamida, Ejemplo 371.0. Una mezcla de (1R,2S) (253 mg, 1,09 mmol), 3-(5-bromo-4-(2,6-dimetoxifenil)-dioxano (6 ml) se calentó a 60°C momento en el que la y se trató con Cs2CÜ3 (918 mg, 2,82 mmol) y transmmol). La solución después se purgó con N2 durante 0,68 mmol) y se agitó en un baño de aceite a 80°C.
vacío. El material así obtenido se filtró a través de un fi fase inversa en una columna Phenomenex Gemini (10 ml/min con un gradiente lineal de ACN (TFA al 0,1%) fracciones deseadas se vertieron en Na2Cü3/DCM al 1 (4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-tria sulfonamida (371.0, 60 mg, 10% de rendimiento). 1H J=1,9 Hz, 1H), 7,66 (s, J=3,1 Hz, 1H), 7,40 (t, J=8,6 Hz 1H), 4,07 (br. s, 1H), 3,81-3,91 (m, 1H), 3,76 (s, 3H), 3 LCMS-ESI (POS.) m/z: 526,2 (M+H)+.
Ejemplo 372.0: Preparación de (1R)-N-(4-(2,6-dimet pirimidinil)etanosulfonamida y (1 S)-N-(4-(2,6-dimet pirimidinil)etanosulfonamida.
4-triazol-3-il)-1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-roxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida, 11.0 ,4-triazol-3-il)-5-metilpiridina, 2.0 (575 mg, 1,53 mmol) y ión se hizo homogénea. La solución se dejó enfriar a TA imetilciclohexanos-1,2-diamina racémico (0,35 ml, 2,22 in y después se trató con yoduro de cobre(i) (130 mg, és de 3 d, la reacción se enfrió a TA y se concentró a e jeringa y después se purificó por HPLC preparativa de ómetros, C18, 110 Á, Axia, 100x50 mm) eluyendo a 90 gua (TfA al 0,1%) al 10-35% a lo largo de 20 min. Las se extrajeron con CHCl3:iPrOH (9:1) para dar (1 R,2S)-N-il)-1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-(CDCl3) 5: 8,58 (s, 2 H), 8,46 (d, J=1,6 Hz, 1H), 8,34 (d, 6,64 (d, J=8,5 Hz, 1H), 6,60 (d, J=8,5 Hz, 1H), 5,59 (s, , 3H), 2,34 (s, 3H), 2,32 (s, 3H), 1,21 (d, J=7,0 Hz, 3H).
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-metil-2-il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-
(1 R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, (1 S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, 372.0. La elución adicional en las condiciones descrita vertieron en Na2CO3/DCM al 10% y se extrajeron con metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimid metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-metil-2-pirimid 1H), 8,57 (s, 2H), 8,47 (s, J=38 Hz, 1H), 8,35 (d, J=1, Hz, 2H), 4,65 (q, J=6,9 Hz, 1H), 3,77 (s, 6H), 2,34 (s, m/z: 496,2 (M+H)+.
Ejemplo 373.0: Preparación de 4-(3-cloro-2,6-dime triazole-3-sulfonamida.
iazol-3-il)-1 -(5-metil-2-pirimidinil)etanosulfonamida y azol-3-il)-1-(5-metil-2-pirimidinil)etanosulfonamida,
el Ejemplo 371.0 dio un subproducto. Las fracciones se :iPrOH (9:1) para dar (1R)-N-(4-(2,6-dimetoxifenil)-5-(5-tanosulfonamida y (1 S)-N-(4-(2,6-dimetoxifenil)-5-(5-tanosulfonamida 372.0. 1H RMN (CDCh) 5: 11,08 (br. s, 1H), 7,70 (s, 1H), 7,41 (t, J=8,5 Hz, 1H), 6,63 (d, J=8,5 2,31 (s, 3H), 1,82 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.)
nil)-N-(2-(4-clorofenil)etil)-5-(5-metil-3-piridinil)-4H-1,2,4-
3-(4-(2,6-Dimetoxifenil)-5-((4-metoxibencil)tio)-4H-1,2,4-de 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il dimetoxietano (2,0 ml) se añadió acetato de (diciclohexilfosfino)ferrocenil]etildi-t-butilfosfina (24,2 toluenotiol (0,10 ml, 0,65 mmol, tech., 90%, Sigma-Al mmol). La mezcla de reacción se agitó a 80°C. Desp l-3-il)-5-metilpiridina, Ejemplo 373.1. A una disolución etilpiridina, Ejemplo 2.0 (231 mg, 0,62 mmol) en 1,2-adio (II) (11 mg, 0,049 mmol), (R)-(-)-1-[(S)-2-0,044 mmol, Strem Chemicals, Inc.), 4-metoxi-alfay terc-butóxido de sodio (2,0 M en t Hf 0,63 ml, 1,26 e 2 h, el análisis de LC-MS mostró que el material de
partida se había consumido. La reacción se dejó enfria ml). Las capas de EtOAc combinadas se concentraron cromatografió a través de una columna de gel de EtOAc:EtOH (3:1) en heptano al 0-50%, para propo rendimiento) en forma de un aceite. 1H rMn (CDCl3) 5: 7,40 (t, J=8,3 Hz, 1H), 7,25-7,31 (m, 2H), 6,82 (d, J=8, 3,68 (s, 6H), 2,32 (s, 3H). LCMS-ESI (POS.) m/z: 449,1 y se diluyó con agua y se extrajo con EtOAc (3 x 20 cío y se adsorbió sobre un tapón de gel de sílice y se preempaquetada Redi-Sep® (12 g), eluyendo con r el compuesto del título (373,1, 26 mg, 9,42% de (d, J=1,3 Hz, 1H), 8,33 (d, J=1,8 Hz, 1H), 7,85 (s, 1H), 2H), 6,62 (d, J=8,5 Hz, 2H), 4,43 (s, 2H), 3,79 (s, 3H), .
4-(3-Cloro-2,6-dimetoxifenil)-N-(2-(4-clorofenil)etil)-5-(5-373.0. A una solución a 0°C de 3-(4-(2,6-dimetoxifenil)-mg, 0,058 mmol) en una mezcla de ACN/AcOH/H2O (0, 5,5-dimetilhidantoína (25,6 mg, 0,13 mmol). Después establa incompleta. Por lo tanto, la reacción se trató co el baño de hielo. Después de 45 min, la reacción se co baño de hielo. Después de agitar durante 5 min, se a solución se agitó en un baño de hielo durante 15 min. clorofenil)etilamina (8,11 gl, 0,058 mmol, Sigma-Aldrich) h, la reacción se diluyó con agua y la capa acuosa combinadas se concentraron a vacío y se adsorbieron de una columna de gel de sílice preempaquetada Redi-50%. El material se volvió a purificar por HPLC prepar micrómetros, Fenil-hexilo, 100 Á, 100x30 mm) eluyend en agua (TFA al 0,1%) al 10-90% a lo largo de 12 min p de una sal de TfA después de liofilización. 1H RMN (C (s, 1H), 7,53 (d, J=9,2 Hz, 1H), 7,30-7,35 (m, 2H), 7,18 3,83 (s, 3H), 3,76 (s, 3H), 3,62 (q, J=6,8 Hz, 2H), 2,97 550,1 (M+H)+.
Ejemplo 374.0: Preparación de (2R)-N-(4-(2,6-dim fenilpropanamida y (2S)-N-(4-(2,6-dim fenilpropanamida.
-piridinil)-4H-1,2,4-triazole-3-sulfonamida, Ejemplo metoxibencil)tio)-4H-1,2,4-triazol-3-il)-5-metilpiridina (26 /0,015 ml/0,010 ml) se añadió en porciones 1,3-dicloroh a 0°C, el análisis de LC-MS mostró que la reacción 1,3-dicloro-5,5-dimetilhidantoína (13 mg) y se agitó en ró a vacío, se recogió en DCM (3 ml) y se enfrió en un lentamente una solución de NaHCO3 al 5% (3 ml) y la pa orgánica se separó. La reacción se trató con 2-(4-A (8,06 gl, 0,058 mmol) y se agitó a TA Después de 16 lvió a extraer con DCM (10 ml). Las capas de DCM un tapón de gel de sílice y se cromatografiaron a través (4 g), eluyendo con EtOAc:EtOH (3:1) en heptano al 0-de fase inversa en una columna Phenomenex Luna (5 ml/min con un gradiente lineal de ACN (TFA al 0,1%) ar el compuesto del título (373,0, 12 mg, 31%) en forma 5: 8,60 (d, J=1,5 Hz, 1H), 8,47 (d, J=1,6 Hz, 1H), 8,23 (m, 2H), 6,83 (d, J=9,2 Hz, 1H), 5,20 (t, J=6,4 Hz, 1H), ,0 Hz, 2H), 2,49 (s, 3H). LCMS-ESI (POS.) m/z: 548,2,
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-metil-3-nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-metil-3-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1, dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-de 4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-tri ml) se añadió una mezcla de ácido (S)-2-metil-3-fenil 0,61 mmol), HATU (304 mg, 0,80 mmol), y N,N-diisopr Después de 2 d, la reacción se diluyó con DCM (10 m sobre un tapón de gel de sílice y se cromatografió a tr Sep® (12 g), eluyendo con EtOAc:EtOH (3:1) en hepta 80 mg, 14% de rendimiento) en forma de un sólido bla 7,82 (m, 1H), 7,42 (t, J=8,5 Hz, 1H), 7,11-7,25 (m, 5H), (br. s, 1H), 2,55 (dd, J=13,2, 8,1 Hz, 1H), 2,32 (s, 3H), m/z: 458,1 (M+H)+.
Ejemplo 375.0: Preparación de (1R,2S)-1-amino-N-(4-( 1-(5-metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2 1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfo metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidi zol-3-il)-2-metil-3-fenilpropanamida y (2S)-N-(4-(2,6-l-3-fenilpropanamida, Ejemplo 374.0. A una disolución -amina, Ejemplo 2.04 (191 mg, 0,61 mmol) y DCM (5 noico y ácido (R)-2-metil-3-fenilpropanoico (100,9 mg, amina (0,21 ml, 1,23 mmol). La reacción se agitó a TA lavó con agua (10 ml). La capa de DCM se adsorbió e una columna de gel de sílice preempaquetada Redi--70%, para proporcionar el compuesto del título (374.0, H RMN (CDCh) 5: 8,41 (d, J=1,5 Hz, 1H), 8,26 (s, 1H), (dd, J=8,5, 5,0 Hz, 2H), 3,69 (s, 3H), 3,64 (s, 3H), 3,06 ,54 (m, 1H), 1,08 (d, J=6,6 Hz, 3H). LCMS-ESI (POS.)
metoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-mino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-a y (1 S,2S)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-ropano-2-sulfonamida y (1 S,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il -metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2S)-1-amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri 2-sulfonamida y (1 R,2R)-1 -amino-N-(4-(2,6-metilpirimidin-2-il)propano-2-sulfonamida y (1 S,2S)-1 -a triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidi de N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il) sulfonamida (421.1, 90 mg, 0,17 mmol) y acetato a cianoborohidruro sódico (11 mg, 0,175 mmol). La me separó el disolvente y el residuo se purificó por cromat con un gradiente de EtOAc/EtOH 3:1 en DCM al 0-50 65,4% de rendimiento) en forma de un sólido blanco.
Ejemplo 376.0: Preparación de (1R,2S)-1-amino-N-(4-( 1 -(5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2 1 ,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfo metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidi dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propanoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5 N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-y (1 S,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-ropano-2-sulfonamida, Ejemplo 375.0. A una mezcla ,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)-1 -oxopropano-2-(120 mg, 1,55 mmol) en MeOH (0,75 ml) se añadió e reacción después se agitó a 60°C durante 1,5 h. Se a a través de una columna ultra Biotage 10 g, eluyendo dar el compuesto del título 375.0 (59 mg, 0,11 mmol,
imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-mino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-a o (1 S,2S)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-propano-2-sulfonamida o (1 S,2R)-1 -amino-N-(4-(2,6--metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2S)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri 2-sulfonamida o (1 R,2R)-1 -amino-N-(4-(2,6-metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-1 -a triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidi purificación quiral en la mezcla de diastereómeros siguientes: (AD-H (21x150 mm sn=3242, inversa) 5 u ml/min, T=40°C, BPR=100 bar, 220 nm. P=179 bar) y il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)propanoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-o (1 S,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-ropano-2-sulfonamida, Ejemplo 376.0. Se llevó a cabo rada en el Ejemplo 375.0. Las condiciones eran las dificador orgánico: EtOH con NH320 mM al 30%. F=70 istró los enantiómeros puros. El primer pico que eluía
era el Ejemplo 376.0. 1H RMN (CDCla) 5: 8,55 (s, 2H), 1H), 6,55-6,67 (m, 2H), 4,35 (d, J=7,9 Hz, 1H), 3,76 ( 3H), 1,14 (d, J=6,1 Hz, 3H). LCMS-ESI (POS.) m/z: 541
Ejemplo 377.0: Preparación de (1R,2S)-1-am¡no-N-(4-( 1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonam¡da o (1 R,2 1,2,4-tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfo metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡ d¡metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l ,69 (m, 2H), 7,29-7,38 (m, 1H), 6,71 (dd, J=7,2, 1,8 Hz, , 3,73 (s, 3H), 3,56-3,68 (m, 1H), 3,19 (s, 3H), 2,31 (s, H)+.
metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l)-m¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-a o (1 S,2S)-1 -am¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-)propano-2-sulfonam¡da o (1 S,2R)-1 -am¡no-N-(4-(2,6--met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonam¡da.
(1 R,2S)-1 -am¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-metox¡p¡r¡ 2-sulfonam¡da o (1 R,2R)-1 -am¡no-N-(4-(2,6-d met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonam¡da o (1 S,2S)-1 -a tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonam¡d metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l)-1-(5-met¡lp¡r¡m¡d¡ la pur¡f¡cac¡ón qu¡ral en la mezcla de cuatro d¡astereóm en el Ejemplo 376.0. El segundo p¡co que eluía era el 2H), 7,29-7,38 (m, 1H), 6,71 (dd, J=7,2, 1,8 Hz, 1H), 6, 3H), 3,56-3,68 (m, 1H), 3,19 (s, 3H), 2,31 (s, 3H), 1,14 (
Ejemplo 378.0: Preparac¡ón de (1R,2S)-1-am¡no-N-(4-( 1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonam¡da o (1 R,2 1,2,4-tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfo metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡ d¡metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l ¡l)-4H-1,2,4-tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propanox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l)-1 -(5-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-o (1 S,2R)-1 -am¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-)propano-2-sulfonam¡da, Ejemplo 377.0. Se llevó a cabo descr¡ta en el Ejemplo 375.0 usando el método descr¡to lo 377.0. 1H RMN (CDCl3) 5: 8,55 (s, 2H), 7,55-7,69 (m, 7 (m, 2H), 4,35 (d, J=7,9 Hz, 1H), 3,76 (s, 3H), 3,73 (s, ,1 Hz, 3H). LCMS-ESI (POS.) m/z: 541,0 (M+H)+.
metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-1,2,4-tr¡azol-3-¡l)-m¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-metox¡p¡r¡d¡n-2-¡l)-4H-a o (1 S,2S)-1 -am¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-)propano-2-sulfonam¡da o (1 S,2R)-1 -am¡no-N-(4-(2,6--met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonam¡da.
(1 R,2S)-1 -am¡no-N-(4-(2,6-d¡metox¡fen¡l)-5-(6-metox¡p¡r¡ ¡l)-4H-1,2,4-tr¡azol-3-¡l)-1 -(5-met¡lp¡r¡m¡d¡n-2-¡l)propano-2-sulfonamida o (1 R,2R)-1 -amino-N-(4-(2,6-d metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-1 -a triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin la purificación quiral en la mezcla de diastereómeros e tercer pico que eluye. Las condiciones eran las siguient orgánico: EtOH con NH320 mM al 30%. F=70 ml/min, 5: 8,54 (s, 2H), 7,56-7,67 (m, 2H), 7,32 (t, J=8,5 Hz, 1H 4,35 (d, J=7,8 Hz, 1H), 3,75 (s, 3H), 3,72 (s, 3H), 3,57 LCMS-ESI (POS.) m/z: 541,0 (M+H)+.
Ejemplo 379.0: Preparación de (1R,2S)-1-amino-N-(4-( 1 -(5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2 1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfo metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidi dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-o (1 S,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-ropano-2-sulfonamida, Ejemplo 378.0. Se llevó a cabo Ejemplo 375.0 y proporcionó el Ejemplo 378.0 como el D-H (21x150 mm sn=3242, inversa) 5 um, modificador , Bp R=100 bar, 220 nm. P=179 bar). 1H Rm N (CDCh) (dd, J=7,7, 1,3 Hz, 1H), 6,62 (dd, J=11,5, 8,4 Hz, 2H), (m, 1H), 3,18 (s, 3H), 2,30 (s, 3H), 1,17-1,23 (m, 3H).
imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-mino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-a o (1 S,2S)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-propano-2-sulfonamida o (1 S,2R)-1 -amino-N-(4-(2,6--metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2S)-1-amino-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri 2-sulfonamida o (1 R,2R)-1 -amino-N-(4-(2,6-d metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-1 -a triazol-3-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidi la purificación quiral en la mezcla de diastereómeros e cuarto pico que eluye. Las condiciones eran las siguien orgánico: EtOH con NH320 mM al 30%. F=70 ml/min, 5: 8,54 (s, 2H), 7,56-7,67 (m, 2H), 7,32 (t, J=8,5 Hz, 1H 4,35 (d, J=7,8 Hz, 1H), 3,75 (s, 3H), 3,72 (s, 3H), 3,57 LCMS-ESI (POS.) m/z: 541,0 (M+H)+.
Ejemplo 381.0: Preparación de (R)-N-(4-(2,6-dimetoxif metiloxetan-3-il)etanosulfonamida y (S)-N-(4-(2,6-dimet (3-metiloxetan-3-il)etanosulfonamida.
il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propanoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-o (1 S,2R)-1 -amino-N-(4-(2,6-dimetoxifenil)-5-(6-ropano-2-sulfonamida, Ejemplo 379.0. Se llevó a cabo Ejemplo 375.0 y proporcionó el Ejemplo 379.0 como el AD-H (21x150 mm sn=3242, inversa) 5 um, modificador , Bp R=100 bar, 220 nm. P=179 bar). 1H Rm N (CDCh) (dd, J=7,7, 1,3 Hz, 1H), 6,62 (dd, J=11,5, 8,4 Hz, 2H), (m, 1H), 3,18 (s, 3H), 2,30 (s, 3H), 1,17-1,23 (m, 3H).
5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(3-il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-
(R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, (trimetilsilil)etil)etanosulfonamida y (S)-N-(4-(2,6-dimet (3-metiloxetan-3-il)-N-(2-(trimetilsilil)etil)etanosulfonamid (0,200 g, 0,41 mmol) en metiltetrahidrofurano (2 ml) ol-3-il)-2-hidroxi-2-(3-metiloxetan-3-il)-N-(2-il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-1.1. En un vial de centelleo de 20 ml, se disolvió 6.0 nfrió en un baño de hielo seco/acetona. Después se
añadió gota a gota n-butil-litio (2,5 M en hexanos, 0,1 durante 20 min. Se añadió gota a gota 3-metiloxetano-3 y la mezcla de reacción se agitó a medida que se termi inactivó por adición de solución acuosa semisaturada solución acuosa semisaturada de cloruro amónico (10 ml). Las fases orgánicas combinadas se secaron pasá con EtOAc (2 x 20 ml). El extracto orgánico se concentr (un gradiente de EtOAc/EtOH 3:1 en hexanos al 0-70 rendimiento) en forma de una pasta amarilla. LCMS-ESI 0,488 mmol), y la mezcla se agitó a esa temperatura aldehído (0,039 ml, 0,45 mmol, Advanced ChemBlocks) lentamente el baño frío. Después de 5 h, la reacción se loruro amónico (0,3 ml). La mezcla se repartió entre tOAc (10 ml). La fase acuosa se extrajo con EtOAc (10 s por un cartucho de extracción Chem Elute eluyendo purificó por cromatografía en columna en gel de sílice ra proporcionar 381.1 (0,040 g, 0,067 mmol, 16,5% de .) m/z: 590,0 (M+H)+.
(R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, y (S)-N-(4-(2,6-dimetoxifenil)-5-(5-meti il)etanosulfonamida, Ejemplo 381.0. A una disolución añadió difluoruro de tris(dimetilamino)azufre-trimetilsililo puso en un bloque de calentamiento a 110°C y se agitó tris(dimetilamino)azufre-trimetilsililo (0,033 g, 0,12 mm durante 1,5 h. La mezcla de reacción se dejó enfriar cloroformo al 10% (10 ml). La fase acuosa se extrajo combinadas se lavaron con agua (20 ml) y solución ac secó sobre sulfato sódico, se filtró y se concentró. El sílice (un gradiente de EtOAc/EtOH 3:1 en DCM al 0-23% de rendimiento) en forma de un sólido blanco. 1H 2H), 7,64 (s, 1H), 7,42 (t, J=8,6 Hz, 1H), 6,63 (dd, J=4, 4,42 - 4,36 (m, 1H), 4,33 (d, J=6,0 Hz, 1H), 4,27 (d, J 3,05 - 2,97 (m, 2H), 2,31 (s, 3H), 1,29 (s, 3H). LCMS-ES
Ejemplo 382.0: Preparación de (R)-2-ciclobutil-N-(4-( hidroxietanosulfonamida y (S)-2-ciclobutil-N-(4-( hidroxietanosulfonamida.
ol-3-il)-2-hidroxi-2-(3-metiloxetan-3-il)etanosulfonamida n-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(3-metiloxetan-3-a de 381.1 (0,038 g, 0,064 mmol) en DMF (1 ml), se 5 g, 0,13 mmol, SynQuest Laboratories). La mezcla se mósfera de N2 durante 2 h. Se añadió más difluoruro de añadió a TA y después la mezcla se agitó a 110°C y después se repartió entre agua (10 ml) y IPA en PA en cloroformo al 10% (10 ml). Las fases orgánicas saturada de cloruro sódico (20 ml). La fase orgánica se o se purificó por cromatografía en columna en gel de y se liofilizó para obtener 381.0 (7,4 mg, 0,015 mmol, (400 MHz, CDCh) 5: 11,03 (br. s., 1H), 8,52 - 8,28 (m, Hz, 2H), 4,61 (d, J=6,0 Hz, 1H), 4,45 (d, J=5,8 Hz, 1H), z, 1H), 3,82 - 3,79 (m, 1H), 3,78 (s, 3H), 3,74 (s, 3H), S.) m/z: 489,9 (M+H)+.
metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-
(R)-2-ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-(trimetilsilil)etil)etanosulfonamida y (S)-2-ciclobutil-N-( 2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfonamida, 382.1. en el Ejemplo 381.1, usando el 1-ciclobutano-aldehíd (POS.) m/z: 574,0 (M+H)+.
-1,2,4-triazol-3-il)-2-hidroxi-N-(2-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-material se preparó de una forma análoga a la descrita ponible en el mercado en Astatech, Inc.). LCMS-ESI
(R)-2-ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4 H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida y (S)-2-4-triazol-3-il)-2-hidroxietanosulfonamida, 382.0. El
compuesto del título se preparó de una forma análoga MHz, CDCla) 5: 11,02 (br. s., 1H), 8,46 (d, J=1,5 Hz, J=8,5 Hz, 1H), 6,62 (dd, J=4,5, 8,5 Hz, 2H), 4,03 (t, J= 3,01 (m, 1H), 3,00 - 2,88 (m, 1H), 2,39 - 2,33 (m, 1H), 2 (M+H)+.
Ejemplo 383.0: Preparación del racemato de (R)-N-(4-2-metoxi-2-(5-metilpirimidin-2-il)etanosulfonamida y triazol-3-il)-2-metoxi-2-(5-metilpirimidin-2-il)etanosulfona escrita en el Ejemplo 381.0, usando 382.1. 1H RMN (400 8,33 (d, J=1,8 Hz, 1H), 7,63 (d, J=0,7 Hz, 1H), 7,41 (t, , 1H), 3,77 (s, 3H), 3,74 (s, 3H), 3,63 (br. s., 1H), 3,11 -, 3H), 2,10 - 1,73 (m, 6H). LCMS-ESI (POS.) m/z: 474,0
imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)--N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-.
5-Metilpirimidina-2-carbaldehído, Ejemplo 383.1. Un m 14.02 (racemato, 1,50 g, 8,93 mmol), dioxano (60 ml) y de hielo-agua. Se añadió peryodato de sodio (4,81 g, se agitó a TA durante 1,5 h. Se añadió DCM (100 ml), de filtración se lavó con DCM adicional (400 ml). El filtr tolueno (2 x 10 ml) para dar 383.1 (0,914 g, 7,48 mmol ESI (POS.) m/z: 123,1 (M+H)+.
de fondo redondo de 500 ml se cargó con el Ejemplo (15 ml). La solución amarillo claro se enfrió en un baño mol) y se retiró el baño frío. Después la mezcla blanca ezcla se filtró a través de una torta de MgSO4. La torta e concentró y después se destiló azeotrópicamente con de rendimiento) en forma de un sólido blanco. LCMS-
(R)-2-hidroxi-N,N-bis(4-metoxibencil)-2-(5-metilpirimidin metoxibencil)-2-(5-metilpirimidin-2-il)etanosulfonamida, cargó con 13.0 (2,50 g, 7,45 mmol) y THF (30 ml) y temperatura interna alcanzó -75°C. Después se añad mmol) manteniendo la temperatura interna por debajo baño frío durante 20 min. Se añadió lentamente 38 temperatura interna por debajo de -71°C durante 15 terminaba lentamente, y la temperatura se elevaba a T de solución sat. de NH4Cl y después se repartió entre EtOAc (20 ml). La fase acuosa se extrajo con EtOAc ( (50 ml) y solución acuosa saturada de cloruro sódico ( de extracción Chem Elute eluyendo con EtOAc (2 cromatografía en columna en gel de sílice (un gradien (1,45 g, 3,17 mmol, 43% de rendimiento) en forma de u tanosulfonamida y (S)-2-hidroxi-N,N-bis(4-plo 383.2. Un matraz de fondo redondo de 250 ml se nfrió en un baño de hielo seco-acetona hasta que la tamente n-butil-litio (2,5 M en hexanos, 3,28 ml, 8,20 2°C durante 15 min. La mezcla después se agitó en el 0,910 g, 7,45 mmol) en THF (12 ml) manteniendo la La mezcla amarilla se agitó a medida que el baño frío ante la noche. La reacción después se inactivó con 2 ml ión acuosa semisaturada de cloruro amónico (50 ml) y ). Las fases orgánicas combinadas se lavaron con agua l). La fase orgánica se secó pasándola por un cartucho ml). La fase orgánica se concentró y se purificó por EtOAc/EtOH 3:1 en hexanos al 0-50%) para dar 383.2 do blanquecino. LCMS-ESI (POS.) m/z: 457,9 (M+H)+.
(R)-2-metoxi-N,N-bis(4-metoxibencil)-2-(5-metilpirimidin metoxibencil)-2-(5-metilpirimidin-2-il)etanosulfonamida, cargó con 383.2 (1,44 g, 3,15 mmol) y metiltetrahidr mezcla se enfrió en un baño de hielo seco-acetona. lentamente KHMDS (1,0 M en THF, 3,46 ml, 3,46 mm durante 8 min. La mezcla se agitó en el baño frío, p lentamente trifluorometanosulfonato de metilo (Matrix interna estaba por debajo de -64°C durante 8 min. L después se inactivó por adición de 30 ml de solución dejó calentar a TA Se añadió EtOAc (20 ml), y se separ Las fases orgánicas combinadas se lavaron con agua La fase orgánica se secó sobre sulfato sódico, se filtr tanosulfonamida y (S)-2-metoxi-N,N-bis(4-plo 383.3. Un matraz de fondo redondo de 250 ml se o (40 ml) para dar una suspensión amarillo claro. La ndo la temperatura interna alcanzó -71°C, se añadió anteniendo la temperatura interna por debajo de -69°C endo que la temperatura aumentar a -65°C. Se añadió tific, 0,520 ml, 4,72 mmol) de modo que la temperatura zcla se agitó a -67-68°C durante 20 min. La reacción aturada de NH4CL Se retiró el baño frío y la mezcla se las capas. La fase acuosa se extrajo con EtOAc (20 ml). l) y solución acuosa saturada de cloruro sódico (70 ml). e concentró a vacío y se purificó por cromatografía en
columna en gel de sílice (un gradiente de EtOAc en he purificar por cromatografía en columna en gel de sílice ( (0,225 g, 0,48 mmol, 15% de rendimiento) en forma de u s al 0-60%). Las fracciones mezcladas se volvieron a radiente de acetona/hexanos al 0-50%) para dar 383.3 ite transparente. LCMS-ESI (POS.) m/z: 471,9 (M+H)+.
(R)-2-Metoxi-2-(5-metilpirimidin-2-il)etanosulfonamida
Ejemplo 383.4: Un vial de centelleo de 20 ml se cargó c mmol) y DCM (1 ml). Se añadió TFA (1,0 ml, 13 mmol), (0,5 ml), y la agitación a TA se continuó durante 3,5 h a cromatografía en columna en gel de sílice (un gradient (0,081 g, 0,35 mmol, 74% de rendimiento) en forma de u (S)-2-metoxi-2-(5-metilpirimidin-2-il)etanosulfonamida 3.3 (0,224 g, 0,48 mmol), anisol (Aldrich, 0,20 ml, 1,83 ezcla se agitó a TA durante 19 h. Se añadió más TFA ales. La mezcla después se concentró y se purificó por EtOAc/EtOH 3:1) en DCM al 0-50%) para dar 383.4 sta incolora. LCMS-ESI (POS.) m/z: 232,0 (M+H)+.
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2 il)etanosulfonamida y (S)-N-(4-(2,6-dimetoxifen metilpirimidin-2-il)etanosulfonamida, Ejemplo 383.0. El descrito en el Ejemplo A usando 383.4 (0,080 g, 0,35 m (Adesis, Inc, 0,060 g, 0,36 mmol). Esto proporcionó el rendimiento) en forma de un sólido blanco. 1H RMN(C 7,28-7,34 (m, 1H), 6,70 (dd, J=7,3, 1,8 Hz, 1H), 6,60 ( 3,32 (s, 3H), 3,18 (s, 3H), 2,33 (s, 3H). LCMS-ESI (POS.)
Ejemplo 384.0: Preparación de (R)-N-(4-(2,6-dimetoxifen metilpirimidin-2-il)etanosulfonamida o (S)-N-(4-(2,6 metoxi-2-(5-metilpirimidin-2-il)etanosulfonamida.
azol-3-il)-2-metoxi-2-(5-metilpirimidin-2-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-2-(5-uesto del título se preparó siguiendo el procedimiento 1.0 (0,0685 g, 0,351 mmol) y 6-metoxipicolinohidrazida puesto del título 383.0 (0,0723 g, 0,13 mmol, 53% de 5: 11,27 (br. s., 1H), 8,61 (s, 2H), 7,55-7,67 (m, 2H), ,5 Hz, 2H), 4,94 (t, J=6,2 Hz, 1H), 3,64-3,85 (m, 8H), : 542,0 (M+H)+.
(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-2-(5-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2 il)etanosulfonamida o (S)-N-(4-(2,6-dimetoxifen metilpirimidin-2-il)etanosulfonamida Ejemplo 384.0. El
AS-H 21.2 x 250 mm, MeOH (NH320 mM) en CO2 al 30 El Ejemplo 384.0 era el primer pico en eluir: 1H RMN ( 1H), 6,70 (dd, J=7,5, 1,5 Hz, 1H), 6,60 (d, J=8,4 Hz, 2 6H), 3,66-3,71 (m, 1H), 3,32 (s, 3H), 3,17 (s, 3H), 2,33 (s,
Ejemplo 385.0: Preparación de (R)-N-(4-(2,6-dimetoxifen metilpirimidin-2-il)etanosulfonamida o (S)-N-(4-(2,6 metoxi-2-(5-metilpirimidin-2-il)etanosulfonamida.
azol-3-il)-2-metoxi-2-(5-metilpirimidin-2-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-2-(5-lo 383.0 se separó por cromatografía SFC (Chiralpak audal a 70 ml/min) para suministrar dos enantiómeros. ) 5: 8,61 (s, 2H), 7,56-7,65 (m, 2H), 7,31 (t, J=8,5 Hz, ,94 (t, J=6,2 Hz, 1H), 3,74-3,79 (m, 1H), 3,71-3,73 (m, . LCMS-ESI (POS.) m/z: 541,9 (M+H)+.
(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-2-(5-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-
(R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1, il)etanosulfonamida o (S)-N-(4-(2,6-dimetoxife metilpirimidin-2-il)etanosulfonamida, Ejemplo 385.0. El AS-H 21,2 x 250 mm, MeOH (NH320 mM) en CO2 al 3 El Ejemplo 385.0 era el segundo pico en eluir: 1H RMN J=8,4 Hz, 1H), 6,70 (dd, J=1,5, 7,5 Hz, 1H), 6,60 (d, J (s, 3H), 3,72 (s, 3H), 3,71 - 3,65 (m, 1H), 3,32 (s, 3H), 3 (POS.) m/z: 542,0 (M+H)+.
Ejemplo 386.0: Preparación de (1R,2S)-1-ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida y (1 S,2R)-1 -cicl triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1 S,2S)-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida y (1 il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
azol-3-il)-2-metoxi-2-(5-metilpirimidin-2-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-2-(5-plo 383.0 se separó por cromatografía SFC (Chiralpak audal a 70 ml/min) para suministrar dos enantiómeros. Hz, CDCh) 5: 8,61 (s, 2H), 7,65 - 7,57 (m, 2H), 7,31 (t, z, 2H), 4,94 (t, J=6,2 Hz, 1H), 3,79 - 3,74 (m, 1H), 3,73 , 3H), 2,33 (s, 3H). Un protón no se observó. LCMS-ESI
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-butil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi sulfonamida y (1 S,2R)-1 -ciclobutil-N-(4-(2, metoxipropano-2-sulfonamida o (1 S,2S)-1 -ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida y (1 R,2R)-1 -cicl triazol-3-il)-1-metoxipropano-2-sulfonamida, Ejemplo 38 descrito en el Ejemplo A usando 1.0, 3.18 y 24.0. Esto 1H), 7,56-7,66 (m, 2H), 7,33 (t, J=8,5 Hz, 1H), 6,70 (dd, 3,70 (s, 3H), 3,56-3,60 (m, 1H), 3,36 (s, 3H), 3,31 (dd, 2,14 (m, 2H), 1,65-1,83 (m, 4H), 1,22 (d, J=7,2 Hz, 3H).
Ejemplo 387.0: Preparación de (1R,2S)-1-ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1 S,2R)-1 -cicl triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1 S,2S)-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1 il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-l Ejemplo 386.0 se preparó siguiendo el procedimiento istró el Ejemplo 386.0. 1H RMN (CDCh) 5: 10,92 (br. s., , 1,9 Hz, 1H), 6,61 (dd, J=8,5, 4,7 Hz, 2H), 3,73 (s, 3H), 3,1 Hz, 1H), 3,17 (s, 3H), 2,72 (d, J=4,2 Hz, 1H), 1,88 -ESI (POS.) m/z: 518,0 (M+H)+.
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-butil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi sulfonamida o (1 S,2R)-1 -ciclobutil-N-(4-(2, metoxipropano-2-sulfonamida o (1 S,2S)-1 -ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1 R,2R)-1 -cicl triazol-3-il)-1-metoxipropano-2-sulfonamida, Ejemplo 38 x 15 cm, 5 mm, 40% de MeOH con NH3 20 mM 6 enantiómeros. El primer pico que eluye se asignó como 1H), 7,67 - 7,56 (m, 2H), 7,33 (t, J=8,5 Hz, 1H), 6,70 ( (s, 3H), 3,61 - 3,54 (m, 1H), 3,36 (s, 3H), 3,30 (dd, J=3 (m, 2H), 1,85 - 1,65 (m, 4H), 1,22 (d, J=7,2 Hz, 3H). LC
Ejemplo 388.0: Preparación de (1R,2S)-1-ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1 S,2R)-1 -cicl triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1 S,2S)-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1 il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-l-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-El Ejemplo 386.0 se purificó por SFC quiral (OX, 21 mm e dióxido de carbono, F=70 ml/min) para dar los dos jemplo 387.0. 1H RMN (400 MHz, CDCb) 5: 10,96 (br. s., =2,3, 6,9 Hz, 1H), 6,65 - 6,56 (m, 2H), 3,73 (s, 3H), 3,70 ,1 Hz, 1H), 3,17 (s, 3H), 2,81 - 2,65 (m, 1H), 2,15 - 1,87 SI (POS.) m/z: 518,0 (M+H)+.
6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-l-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-lobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi sulfonamida o (1 S,2R)-1 -ciclobutil-N-(4-(2, metoxipropano-2-sulfonamida o (1 S,2S)-1 -ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1 R,2R)-1 -cicl triazol-3-il)-1-metoxipropano-2-sulfonamida, Ejemplo 38 x 15 cm, 5 mm, 40% de MeOH con NH3 20 mM 6 enantiómeros. El segundo pico que eluía era el Ejempl - 7,56 (m, 2H), 7,33 (t, J=8,5 Hz, 1H), 6,70 (dd, J=2,2, 3H), 3,57 (t, J=3,7 Hz, 1H), 3,36 (s, 3H), 3,30 (dd, J=3 (m, 1H), 1,98 - 1,86 (m, 1H), 1,83 - 1,64 (m, 4H), 1,22 ( -2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-l-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-El Ejemplo 386.0 se purificó por SFC quiral (OX, 21 mm e dióxido de carbono, F=70 ml/min) para dar los dos .0. 1H RMN (300 MHz, CDCh) 5: 10,96 (br. s., 1H), 7,67 z, 1H), 6,61 (dd, J=4,6, 8,6 Hz, 2H), 3,73 (s, 3H), 3,70 (s, ,2 Hz, 1H), 3,17 (s, 3H), 2,82 - 2,64 (m, 1H), 2,14 - 1,99 ,2 Hz, 3H). LCMS-ESI (POS.) m/z: 518,0 (M+H)+.
Ejemplo 389.0: Preparación de (1R, 2S)-1-ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida y (1S, 2R)-1 -ciclo triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1S, 2S)-1 1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida y (1R, il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3--N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-lobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H--1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi sulfonamida y (1 S,2R)-1 -ciclobutil-N-(4-(2, metoxipropano-2-sulfonamida o (1S, 2S)-1 -ciclobutil-N 3-il)-1-metoxipropano-2-sulfonamida y (1R, 2R)-1-ciclo triazol-3-il)-1-metoxipropano-2-sulfonamida, Ejemplo 38 análoga a la del Ejemplo 386.0 partiendo de 24.02. 1H 2H), 7,34 - 7,28 (m, 1H), 6,70 (dd, J=2,0, 7,1 Hz, 1H), 3H), 3,71 (s, 3H), 3,33 (s, 3H), 3,17 (s, 3H), 2,93 - 2,83 (m, 5H), 1,27 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z:
Ejemplo 390.0: Preparación de (1R, 2S)-1-ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1S, 2R)-1 -ciclo triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1S, 2S)-1 1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1R, il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-El compuesto del título 389.0 se preparó de una forma (300 MHz, CDCh) 5: 10,99 (br. s., 1H), 7,66 - 7,56 (m, (d, J=8,5 Hz, 2H), 3,84 (dd, J=1,5, 8,8 Hz, 1H), 3,72 (s, 1H), 2,47 - 2,32 (m, 1H), 2,16 - 2,02 (m, 1H), 2,00 - 1,69 (M+H)+.
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3--N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-lobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H--1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi sulfonamida o (1S,2R)-1 -ciclobutil-N-(4-(2, metoxipropano-2-sulfonamida o (1 S,2S)-1 -ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1 R,2R)-1 -ciclo triazol-3-il)-1-metoxipropano-2-sulfonamida, Ejemplo 39 x 15 cm, 5 mm, 50% de MeOH con 20 mM NH3 enantiómeros, el primer pico que eluye es el Ejemplo 3 7,55 (m, 2H), 7,34 - 7,27 (m, 1H), 6,70 (dd, J=2,2, 6,9 -2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3--N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-El Ejemplo 389.0 se purificó por SFC quiral (OX, 21 mm de dióxido de carbono, F=70 ml/min) para dar dos 1H RMN (300 MHz, CDCl3) 5: 11,01 (br. s., 1H), 7,65 -H), 6,59 (d, J=8,5 Hz, 2H), 3,83 (dd, J=1,5, 8,8 Hz, 1H),
3,72 (s, 3H), 3,71 (s, 3H), 3,33 (s, 3H), 3,17 (s, 3H), 2,94 - 1,67 (m, 5H), 1,27 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.)
Ejemplo 391.0: Preparación de (1R, 2S)-1-ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1S, 2R)-1 -ciclo triazol-3-il)-1-metoxipropano-2-sulfonamida o (1S, 2S)-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida o (1R, il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
2 (m, 1H), 2,48 - 2,31 (m, 1H), 2,17 - 2,02 (m, 1H), 2,00 : 518,0 (M+H)+.
-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-ií)-4H-1,2,4-obutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H--1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-
(1 R,2S)-1 -ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi sulfonamida o (1 S,2R)-1 -ciclobutil-N-(4-(2, metoxipropano-2-sulfonamida o (1 S,2S)-1 -ciclobutil-N-( il)-1 -metoxipropano-2-sulfonamida o (1 R,2R)-1 -cicl triazol-3-il)-1-metoxipropano-2-sulfonamida, Ejemplo 39 x 15 cm, 5 mm, 50% de MeOH con NH3 20 mM enantiómeros, el segundo pico que eluye es el Ejemplo 7,66 - 7,56 (m, 2H), 7,34 - 7,27 (m, 1H), 6,70 (dd, J=2,2, 1H), 3,72 (s, 3H), 3,71 (s, 3H), 3,33 (s, 3H), 3,17 (s, 3H), (m, 1H), 2,00 - 1,70 (m, 5H), 1,27 (d, J=7,2 Hz, 3H). LC
Ejemplo 392.0: Preparación de (S)-N-(4-(2,6 fluoropirimidin-2-il)etano-1-sulfamida.
2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 --dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-l Ejemplo 389.0 se purificó por SFC quiral (OX, 21 mm de dióxido de carbono, F=70 ml/min) para dar dos .0. 1H RMN(300 MHz, CDCl3) 5: 11,54 - 10,52 (m, 1H), Hz, 1H), 6,59 (d, J=8,5 Hz, 2H), 3,83 (dd, J=1,5, 8,8 Hz, (dq, J=1,5, 7,1 Hz, 1H), 2,48 - 2,30 (m, 1H), 2,16 - 2,01 I (POS.) m/z: 518,0 (M+H)+.
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-(5-
(S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, Ejemplo 392.0. Siguiendo el procedimiento en el Ejem 0,28 mmol). Después de la purificación por cromatograf por cromatografía de fluidos supercríticos quiral para p un sólido blanco. 1H RMN (500 MHz, CD3OD) 5: 8,66 ( Hz, 1H), 6,75 (dd, J=8,2, 6,1 Hz, 2H), 4,67 (q, J=7,0 Hz Hz, 3H). LCMS-ESI (POS.) m/z: 515,2 (M+H)+.
Ejemplo 393.0: Preparación de (1S,2R)-N-(4-(2,6 hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin ol-3-il)-2-(5-fluoropirimidin-2-il)etano-1-sulfamida,
se acoplaron 17.0 (75 mg, 0,34 mmol) y 2.0 (105 mg, gel de sílice, se llevó a cabo una purificación adicional cionar 392.0 (1,3 mg, 1% de rendimiento) en forma de ), 8,41 (s, 1H), 8,27 (s, 1H), 7,65 (s, 1H), 7,46 (t, J=8,5 ), 3,77 (s, 3H), 3,72 (s, 3H), 2,29 (s, 3H), 1,47 (d, J=7,0
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ropano-2-sulfonamida.
(1S,2R)-1-(aliloxi)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpirid sulfonamida y (1 R,2S)-1 -(aliloxi)-N-(4-(2,6-dimetoxifenil 2-il)propano-2-sulfonamida, Ejemplo 393.1. Siguiendo 1,36 mmol) y 2.0 (715 mg, 1,91 mmol) para proporcion amarillo. lCm S-eSi (POS.) m/z: 566,0 (m+H)+.
l)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propano-2--metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidincedimiento en el Ejemplo B, se acoplaron 25.0 (370 mg, .1 (553 mg, 72% de rendimiento) en forma de un sólido
(1S,2R)-1-((S)-2,3-dihidroxipropoxi)-N-(4-(2,6-dimetoxif metilpirimidin-2-il)propano-2-sulfonamida y (1 S metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidindihidroxipropoxi)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridi sulfonamida y (1 R,2S)-1 -((S)-2,3-dihidroxipropoxi)-N-( 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo una mezcla de acetona (11,4 ml) y agua (4 ml) se añad pl, 0,05 mmol)) y 4-metilmorfolina-N-óxido (384 mg, 3 durante 23,5 h y después se concentró parcialmente e diluyó con agua y se extrajo con DCM (4X). Las ca anhidro y se concentraron a vacío. El residuo se purific al 0-5% a lo largo de un periodo de 35 min) para prop sólido marrón claro. LCMS-ESI (POS.) m/z: 599,9 (M+H -(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-l-(5--((R)-2,3-dihidroxipropoxi)-N-(4-(2,6-dimetoxifenil)-5-(5-opano-2-sulfonamida y (1 R,2S)-1 -((R)-2,3--4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propano-2--dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2. A una disolución de 393.1 (530 mg, 0,94 mmol) en raóxido de osmio (solución al 4% en peso en agua (286 mol). La suspensión naranja resultante se agitó a TA otavapor para eliminar la acetona. El residuo acuoso se rgánicas combinadas se secaron sobre sulfato sódico cromatografía en gel de sílice (eluyente: MeOH en DCM ar 393,2 (451 mg, 81% de rendimiento) en forma de un
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H -triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-
il)propano-2-sulfonamida y (1 R,2S)-N-(4-(2, hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami mmol) en una mezcla de THF (12 ml) y agua (4 ml) se amarilla resultante se agitó a TA durante 1,5 h y de concentró parcialmente en un rotavapor para separar extrajo con DCM (3X). Las capas orgánicas combinad a vacío para dar el aldehído en forma de un sólido ma obtenido en MeOH (15 ml) se añadió borohidruro de s solución amarilla resultante se agitó a 0°C durante 3 h 9,10 mmol). Después de agitar durante otras 1,3 h a 0° mezcla se concentró parcialmente en un rotavapor pa capas orgánicas combinadas se secaron sobre sulfat purificó por cromatografía en gel de sílice (eluyente:
para proporcionar el producto alcohol racémico 393.0 (
Ejemplo 394.0: Preparación de (1S,2R)-N-(4-(2, hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidi etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-Ejemplo 393.0. A una disolución de 393.2 (540 mg, 0,90 ió peryodato sódico (539 mg, 2,52 mmol). La suspensión s se filtró, se lavó el filtrado con DCM. La mezcla se isolventes orgánicos, después se diluyó con agua y se secaron sobre sulfato sódico anhidro y se concentraron claro. A una solución enfriada con hielo del aldehído así (153 mg, 4.05 mmol). Se observó evolución de gas. La pués se añadió borohidruro de sodio adicional (306 mg, reacción se inactivó con solución de HCl 1 N (20 ml). La parar el MeOH, después se extrajo con DCM (3X). Las dico anhidro y se concentraron a vacío. El residuo se en DCM al 0-15% a lo largo de un periodo de 35 min) g, 43% de rendimiento) en forma de un sólido blanco.
etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-)propano-2-sulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2, hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami supercríticos quiral de 393.0 para separar los dos prod de MeOH a 120 ml/min, 274-nm. El primer pico que CDCla) 5: 11,22 (br. s., 1H), 8,58 (s, 2H), 8,45 (s, 1H), 8 Hz, 2H), 5,32 (d, J=1,4 Hz, 1H), 3,85-3,95 (m, 1H), 3,7 2,33 (s, 3H), 2,32 (s, 3H),1,28 (d, J=7,0 Hz, 3H). LCMS-
Ejemplo 395.0: Preparación de (1S,2R)-N-(4-(2, hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidi 4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-Ejemplo 394.0. Se llevó a cabo cromatografía de fluidos enantiómeros. Chiralpak ASH, 250x30 mm, 5 uM, 30% era el Ejemplo 394.0 (108,5 mg): 1H RMN(500 MHz, s, 1H), 7,68 (s, 1H), 7,39 (t, J=8,5 Hz, 1H), 6,61 (d, J=8,6 3 (m, 1H), 3,75 (s, 3H), 3,73 (s, 3H), 3,53-3,68 (m, 3H), (POS.) m/z: 570,0 (M+H)+.
etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-)propano-2-sulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2, hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami cromatografía de fluidos supercríticos quiral de 393. describe en el Ejemplo 394.0. El segundo pico que eluí 5: 11,24 (br. s., 1H), 8,58 (s, 2H), 8,47 (s, 1H), 8,35 (s 2H), 6,57-6,66 (m, 2H), 5,32 (s, 1H), 3,86-3,96 (m, 1H) 3H), 2,35 (s, 3H), 2,33 (s, 3H), 1,28 (d, J=7,0 Hz, 3H). L
Ejemplo 396.0: Preparación de (1S,2R)-N-(4-(2, metoxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -(2-metoxietoxi)-1 -(5-metilpirimidi 4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-Ejemplo 395.0. Se llevó a cabo la purificación por ra separar los dos productos enantiómeros como se el Ejemplo 395.0 (111 mg). 1H RMN (500 MHz, CDCl3) , 7,77 (s, 1H), 7,40 (t, J=8,5 Hz, 1H), 6,62 (d, J=8,6 Hz, 4-3,83 (m, 1H), 3,76 (s, 3H), 3,74 (s, 3H), 3,55-3,68 (m, -ESI (POS.) m/z: 570,0 (M+H)+.
etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-)propano-2-sulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2, metoxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami 0,10 mmol) en THF (3,2 ml) se añadió bis(trimetilsilil)a lentamente mediante jeringa. Después de agitar duran durante 5 min adicionales. La reacción después se vol metilo (12 gl, 0,11 mmol) lentamente mediante jeringa. min y después se añadió trifluorometanosulfonato d adicionales a -78°C, la reacción se inactivó con una m agua (7 ml) y se extrajo con DCM (4X). Las capas org se concentraron. El residuo se purificó por cromatogra largo de un periodo de 45 min) para proporcionar 3 blanco. 1H RMN (500 MHz, CDCla) 5: 11,71 (br. s., 1H), (t, J=8,5 Hz, 1H), 6,62 (d, J=9,4 Hz, 2H), 5,13 (d, J=4, 3,65 (m, 3H), 3,39 (s, 3H), 2,35 (s, 3H), 2,33 (s, 3H), 1,
Ejemplo 397.0: Preparación de (1S,2R)-N-(4-(2, metoxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(2-metoxietoxi)-1 -(5-metilpirimidi -triazol-3-il)-1-(2-metoxietoxi)-I-(5-metilpirimidin-2-toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-jemplo 396.0. A una solución a -782C de 394.0 (59 mg, e potasio (solución 1,0 M en THF (218 gl, 0,22 mmol)) min a -78°C, la reacción se calentó a -35°C y se agitó enfriar a -78°C y se añadió trifluorometanosulfonato de olución amarilla resultante se agitó a -78°C durante 25 ilo adicional (6 gl, 0,05 mmol). Después de 15 min ,5:1 de solución acuosa saturada de cloruro amónico y combinadas se secaron sobre sulfato sódico anhidro y gel de sílice (eluyente: MeOH en DCM al 0-13% a lo 3,7 mg, 39% de rendimiento) en forma de un sólido (s, 2H), 8,46 (s, 1H), 8,34 (s, 1H), 7,79 (br. s., 1H), 7,40 1H), 3,75-3,86 (m, 2H), 3,79 (s, 3H), 3,78 (s, 3H), 3,53 J=7,2 Hz, 3H). LCMS-ESI (POS.) m/z: 584,0 (M+H)+.
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ropano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2, metoxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami mg, 0,07 mmol) en THF (3 ml) se añadió bis(trimetilsilil lentamente mediante jeringa. Después de agitar duran durante 7 min adicionales. La reacción después se vol metilo (9 gl, 0,08 mmol) lentamente mediante jeringa. L y después se añadió trifluorometanosulfonato de metilo -78°C, la reacción se inactivó con una mezcla 2,5:1 de se extrajo con DCM (4X). Las capas orgánicas co concentraron a vacío. El residuo se purificó por cromat largo de un periodo de 45 min) para proporcionar el pr HPLC preparativa de fase inversa (columna Luna 5 g periodo de 40 min donde ambos disolventes contenía rendimiento) en forma de un sólido blanco. 1H RMN (50 (s, 1H), 7,45 (t, J=8,5 Hz, 1H), 6,67 (dd, J=8,6, 3,9 Hz, 3,75 (m, 1H), 3,48-3,63 (m, 3H), 3,36 (s, 3H), 2,49 (s, m/z: 584,0 (M+H)+.
Ejemplo 398.0: Preparación de (1R,2S)-N-(4-(2, metoxietoxi)-N-metil-1-(5-metilpirimidin-2-il)propano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-metoxietoxi)-N (1 R,2S,Z)-N-(4-(2,6-dimetoxifenil)-1 -metil-3-(5-metilpiridi -triazol-3-il)-1 -(2-metoxietoxi)-1 -(5-metilpirimidin-2-toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-jemplo 397.0. A una solución a -78°C de 395.0 (40,9 de potasio (solución 1 M en THF (151 gl, 0,15 mmol)) min a -78°C, la reacción se calentó a -35°C y se agitó enfriar a -78°C y se añadió trifluorometanosulfonato de ción amarilla resultante se agitó a -78°C durante 2,25 h nal (3 gl, 0,03 mmol). Después de 60 min adicionales a ón acuosa saturada de cloruro amónico y agua (7 ml) y das se secaron sobre sulfato sódico anhidro y se en gel de sílice (eluyente: MeOH en DCM al 0-8% a lo inicial. Después el producto inicial se purificó más por , eluyente: ACN en agua al 20-60% a lo largo de un al 0,1%) para proporcionar 397.0 (16,5 mg, 39% de , CDCl3) 5: 8,72 (s, 2H), 8,63 (s, 1H), 8,43 (s, 1H), 8,17 5,19 (d, J=4,7 Hz, 1H), 3,79 (s, 3H), 3,78 (s, 3H), 3,68 ,39 (s, 3H), 1,37 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.)
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida o -1 H-1,2,4-triazol-5(4H)-iliden)-1 -(2-metoxietoxi)-1 -(5-
metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2R,Z)-triazol-5(4H)-iliden)-1-(2-metoxietoxi)-1-(5-metilpirimidin2,6-dimetoxifenil)-1 -metil-3-(5-metilpiridin-3-il)-1 H-1,2,4-ropano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2R)-N-( 1 -(2-metoxietoxi)-N-metil-l-(5-metilpirimidin-2-il)propano (5-metilpiridin-3-il)-1 H-1,2,4-triazol-5(4H)-iliden)-1 -(2-me (1 S,2R,Z)-N-(4-(2,6-dimetoxifenil)-1 -metil-3-(5-metilpiridi metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo 398 Ejemplo 397.0 proporcionó un subproducto 398.0 (12, RMN (500 MHz, CDCla) 5: 8,74 (s, 2H), 8,63 (s, 1H), J=15,1, 8,6 Hz, 2H), 4,90 (d, J=6,7 Hz, 1H), 4,00 (s, 3H 3H), 3,27 (s, 3H), 2,48 (s, 3H), 2,38 (s, 3H), 1,30 (d, J=6
Ejemplo 399.0: Preparación de (1S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilp dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-meti metilpirimidin-2-il)propano-2-sulfonamida.
-triazol-3-il)-1 -(2-metoxietoxi)-N-metil-1 -(5
-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-fonamida o (1 R,2S,Z)-N-(4-(2,6-dimetoxifenil)-1 -metil-3-oxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida o -1 H-1,2,4-triazol-5(4H)-iliden)-1 -(2-metoxietoxi)-1 -(5-elución adicional en las condiciones descritas en el 29% de rendimiento) en forma de un sólido blanco. 1H (s, 1H), 8,13 (s, 1H), 7,44 (t, J=8,5 Hz, 1H), 6,64 (dd, 2 (s, 3H), 3,74 (s, 3H), 3,57-3,70 (m, 2H), 3,41-3,57 (m, , 3H). LCMS-ESI (POS.) m/z: 598,0 (M+H)+.
ifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-((S)-2-y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida y (1 R,2S)-N-(4-(2,6--2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-n-3-il)-4H-1,2,4-triazol-3-il)-1 -((S)-2-hidroxipropoxi)-1 -(5-
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 399.0. A una disolución de 393.2 (5 ml) se añadió peryodato de sodio (684 mg, 3,20 m 60 min y después se filtró, se lavó el filtrado con DCM. separar los disolventes orgánicos, después se diluyó combinadas se secaron sobre sulfato sódico anhidro y blanco. A una solución a -78°C del aldehído en THF (4 una mezcla de tolueno/THF 3:1 (3,26 ml, 4,6 mmol)). L después se calentó a 0°C y se agitó durante 1,75 h adi calentó a TA y se agitó durante otras 18 h. La reacción (50 ml), y después se extrajo con cloroformo (4X). Las anhidro y se concentraron. El residuo se purificó por cr 12% a lo largo de un periodo de 40 min) para proporcio 399.0, (157 mg, 24% de rendimiento).
Ejemplo 400.0: Preparación de (1S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-m (5-metilpirimidin-2-il)propano-2-sulfonamida.
4-triazol-3-il)-1-((S)-2-hidroxipropoxi)-1-(5-metilpirimidinifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida y (1 R,2S)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-mg, 1,14 mmol) en una mezcla de THF (15 ml) y agua La suspensión amarilla resultante se agitó a TA durante mezcla se concentró parcialmente en un rotavapor para agua y se extrajo con DCM (4X). Las capas orgánicas oncentraron para dar el aldehído en forma de un sólido se añadió bromuro de metilmagnesio (solución 1,4 M en lución amarilla resultante se agitó a -78°C durante 1 h y les. Después de este periodo de tiempo, la reacción se activó con solución acuosa saturada de cloruro amónico orgánicas combinadas se secaron sobre sulfato sódico tografía en gel de sílice (eluyente: MeOH en DCM al 0-l producto alcohol como una mezcla de diastereómeros
ifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-((S)-2-o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-iridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((S)-2-hidroxipropoxi)-1 -
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 400.0. Se llevó a cabo la purificac para separar los cuatro productos isómeros. La mu múltiples purificaciones para separar los isómeros co cromatografía de fluidos supercríticos quiral de 399.0 pico que eluye se volvió a purificar por purificación por OX-H a 186 bar para resolver los dos estereoisómero mg). 1H RMN (500 MHz, CDCla) 5: 8,57 (s, 2H), 8,44 ( J=8,5 Hz, 1H), 6,60 (d, J=8,6 Hz, 2H), 5,32 (s, 1H), 3, 2,0 Hz, 1H), 3,24 (t, J=10,0 Hz, 1H), 2,32 (s, 3H), 2,30 ( ESI (POS.) m/z: 584,2 (M+H)+.
4-triazol-3-il)-1-((S)-2-hidroxipropoxi)-1-(5-metilpirimidinifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-or cromatografía de fluidos supercríticos quiral de 399.0 se purificó por SFC preparativa. Fueron necesarias ha descrito. El material se purificó por purificación por D-H a 213 bar para dar tres picos que eluían. El tercer tografía de fluidos supercríticos quiral en una columna -les. El primer pico que eluye es el Ejemplo 400.0 (6,3 ,4 Hz, 1H), 8,33 (d, J=1,8 Hz, 1H), 7,63 (s, 1H), 7,37 (t, 03 (m, 2H), 3,73 (s, 3H), 3,72 (s, 3H), 3,65 (dd, J=10,6, ), 1,27 (d, J=6,8 Hz, 3H), 1,00 (d, J=6,5 Hz, 3H). LCMS-
Ejemplo 401.0: Preparación de (1S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-m (5-metilpirimidin-2-il)propano-2-sulfonamida.
ifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-((S)-2-o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-iridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((S)-2-hidroxipropoxi)-1 -
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 401.0. Se llevó a cabo la purificac para separar los cuatro productos enantiómeros como es el Ejemplo 401.0 (29 mg). 1H RMN (500 MHz, CDCla s., 1H), 7,74 (br. s., 1H), 7,40 (t, J=8,5 Hz, 1H), 6,62 (dd 3H), 3,75 (s, 3H), 3,74 (s, 3H), 3,11 (t, J=9,8 Hz, 1H), 2, Hz, 3H). LCMS-ESI (POS.) m/z: 584,2 (M+H)+.
Ejemplo 402.0: Preparación de (1S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-m (5-metilpirimidin-2-il)propano-2-sulfonamida.
4-triazol-3-il)-1-((S)-2-hidroxipropoxi)-1-(5-metilpirimidinifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-or cromatografía de fluidos supercríticos quiral de 399.0 escribe en el Ejemplo 400.0. El segundo pico que eluye 11,32 (br. s., 1H), 8,58 (s, 2H), 8,46 (br. s., 1H), 8,34 (br. ,6 Hz, 1,0 Hz, 2H), 5,27 (d, J=1,8 Hz, 1H), 3,74-3,94 (m, , 3H), 2,33 (s, 3H), 1,29 (d, J=7,0 Hz, 3H), 1,02 (d, J=6,3
ifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-((S)-2-o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-iridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((S)-2-hidroxipropoxi)-1 -
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 402.0. Se llevó a cabo la purificac para separar los cuatro productos enantiómeros como s Ejemplo 402.0 (5.1 mg). 1H RMN (500 MHz, CDCla) 5: 7,37 (t, J=8,5 Hz, 1H), 6,60 (d, J=8,6 Hz, 2H), 5,30 (s, J=10,6, 2,2 Hz, 1H), 3,24 (t, J=9,9 Hz, 1H), 2,32 (s, 3H) LCMS-ESI (POS.) m/z: 584,2 (M+H)+.
Ejemplo 403.0: Preparación de (1S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilpi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-m (5-metilpirimidin-2-il)propano-2-sulfonamida.
-triazol-3-il)-1-((S)-2-hidroxipropoxi)-1-(5-metilpirimidinifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-n-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-or cromatografía de fluidos supercríticos quiral de 399.0 cribe en el Ejemplo 400.0. El tercer pico que eluye es el , 2H), 8,43 (s, 1H), 8,33 (d, J=1,8 Hz, 1H), 7,64 (s, 1H), 3,88-4,05 (m, 2H), 3,73 (s, 3H), 3,72 (s, 3H), 3,65 (dd, (s, 3H), 1,27 (d, J=6,8 Hz, 3H), 1,01 (d, J=6,5 Hz, 3H).
ifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-((S)-2-o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-n-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-idin-3-il)-4H-1,2,4-triazol-3-il)-1 -((S)-2-hidroxipropoxi)-1 -
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon -triazol-3-il)-1 -((S)-2-hidroxipropoxi)-1 -(5-metilpirimidinfenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilp dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 403.0. Se llevó a cabo la purifica para separar los cuatro productos enantiómeros como el Ejemplo 403.0 (25,3 mg). 1H RMN (500 MHz, CDCla) s., 1H), 7,72 (br. s., 1H), 7,40 (t, J=8,5 Hz, 1H), 6,61 ( 3,75 (s, 3H), 3,74 (s, 3H), 3,11 (t, J=9,7 Hz, 1H), 2,33 ( ESI (POS.) m/z: 584,2 (M+H)+.
Ejemplo 404.0: Preparación de (1S,2R)-N-(4-(2, hidroxi-2-metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2 metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-hidroxi-2-metil in-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6--2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-or cromatografía de fluidos supercríticos quiral de 399.0 scribe en el Ejemplo 400.0. El cuarto pico que eluye es ,31 (br. s., 1H), 8,58 (s, 2H), 8,46 (br. s., 1H), 8,34 (br. ,6 Hz, 2H), 5,27 (d, J=1,6 Hz, 1H), 3,74-3,94 (m, 3H), , 1,28 (d, J=7,0 Hz, 3H), 1,02 (d, J=6,5 Hz, 3H). LCMS-
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-namida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-xi)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H oxopropoxi)propano-2-sulfonamida y (1 R,2S)-N-(4-(2, metilpirimidin-2-il)-1-(2-oxopropoxi)propano-2-sulfonami (57,7 mg, 0,10 mmol) en DCM (5 ml) se añadió per incolora resultante se agitó a TA durante 1,25 h y des tiosulfato de sodio (10 ml) y solución acuosa saturada min y después se extrajo con DCM (4X). Las capas org se concentraron. El residuo se purificó por cromatografí en DCM al 12% a lo largo de un periodo de 45 min) forma de un sólido blanco. LCMS-ESI (POS.) m/z: 582, -triazol-3-il)-1 -(5-metilpirimidin-2-il)-1 -(2-toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5 jemplo 404.1. A una disolución de una mezcla de 399.0 no de Dess-Martin (335 mg, 0,79 mmol). La solución se inactivó por adición de solución acuosa saturada de carbonato sódico (10 ml). La mezcla se agitó durante 7 combinadas se secaron sobre sulfato sódico anhidro y gel de sílice (eluyente: gradiente de DCM puro a MeOH proporcionar 404.1 (39,3 mg, 68% de rendimiento) en )+.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2S)-N-( 1-(2-hidroxi-2-metilpropoxi)-1-(5-metilpirimidin-2-il)propa 404.1 (39,3 mg, 0,07 mmol) en THF (15 ml) se añadi tolueno/THF 3:1 (290 pl, 0,41 mmol)) mediante jeringa.
7,25 h y después se inactivó con solución acuosa sat extrajo con cloroformo (4X), y las capas orgánicas concentraron a vacío. El residuo se purificó por cromat lo largo de un periodo de 45 min) para proporcion rendimiento) en forma de un sólido blanco.
Ejemplo 405.0: Preparación de (1S,2R)-N-(4-(2, hidroxi-2-metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2 metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-hidroxi-2-metil -triazol-3-il)-1 -(2-hidroxi-2-metilpropoxi)-1 -(5
-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 404.0. A una solución a -78°C de a gota bromuro de metilmagnesio (solución 1,4 M en lución amarillo claro resultante se agitó a -78°C durante de cloruro amónico (10 ml). La mezcla resultante se nadas se secaron sobre sulfato sódico anhidro y se a en gel de sílice (eluyente: MeOH en DCM al 1-12% a producto alcohol racémico 404.0 (20,3 mg, 50% de
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-namida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-xi)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-1- (2-hidroxi-2-metilpropoxi)-1-(5-metilpirimidin-2-il)prop purificación por cromatografía de fluidos supercríticos qu El primer pico que eluía era el Ejemplo 405.0 (6,0 mg).
(d, J=1,4 Hz, 1H), 7,63 (s, 1H), 7,37 (t, J=8,5 Hz, 1H), 6, 2,5 Hz, 1H), 3,71 (s, 3H), 3,71 (s, 3H), 3,39-3,52 (m, 2H 3H), 1,16 (s, 3H). LCMS-ESI (POS.) m/z: 598,1 (M+H)+.
Ejemplo 406.0: Preparación de (IS,2R)-N-(4-(2,6-dimeto 2- metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-meti triazol-3-il)-1 -(2-hidroxi-2-metilpropoxi)-1 -(5-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)--sulfonamida, Ejemplo 405.0. Se llevó a cabo la e 404.0 para separar los dos productos enantiómeros. N (500 MHz, c Dc I3) 5: 8,57 (s, 2H), 8,43 (s, 1H), 8,32 J=8,6 Hz, 2H), 5,27 (d, J=2,5 Hz, 1H), 3,88 (qd, J=6,9, 2 (s, 3H), 2,30 (s, 3H), 1,33 (d, J=7,0 Hz, 3H), 1,20 (s,
)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-hidroxio (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-idin-2-il)propano-2-sulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2S)-N-(4-1-(2-hidroxi-2-metilpropoxi)-1-(5-metilpirimidin-2-il)propan purificación por cromatografía de fluidos supercríticos qu El segundo pico que eluía era el Ejemplo 406.0 (7,0 m 8,32 (s, 1H), 7,63 (s, 1H), 7,37 (t, J=8,5 Hz, 1H), 6,59 (d Hz, 1H), 3,72 (s, 3H), 3,71 (s, 3H), 3,38-3,52 (m, 2H), ),2, 1,16 (s, 3H). LCMS-ESI (POS.) m/z: 598,1 (M+H)+.
Ejemplo 407.0: Preparación de (IS,2S)-N-(4-(2,6-hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidintriazol-3-il)-1 -(2-hidroxi-2-metilpropoxi)-1 -(5-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-ulfonamida, Ejemplo 406.0. Se llevó a cabo la e 404.0 para separar los dos productos enantiómeros. RMN (500 MHz, CDCI3) 5: 8,57 (s, 2H), 8,43 (s, 1H), ,6 Hz, 2H), 5,28 (d, J=2,5 Hz, 1H), 3,88 (qd, J=6,9, 2,6 , 3H), 2,30 (s, 3H), 1,33 (d, J=7,0 Hz, 3H), 1,20 (s, 3H),
oxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ropano-2-sulfonamida.
(1S,2S)-1-(aliloxi)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridi sulfonamida y (1 R,2R)-1 -(aliloxi)-N-(4-(2,6-dimetoxifenil)-2-il)propano-2-sulfonamida, Ejemplo 407.1. Siguiendo el 1,44 mmol) y 2.0 (757 mg, 2.02 mmol) para proporcionar amarillo. lCmS-eSi (POS.) m/z: 566,0 (M+H)+.
-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propano-2-etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidindimiento en el Ejemplo B, se acoplaron 26.0 (391 mg, 1 (600 mg, 74% de rendimiento) en forma de un sólido
(1 S,2S)-1 -((S)-2,3-dihidroxipropoxi)-N-(4-(2,6-dimetoxif metilpirimidin-2-il)propano-2-sulfonamida y (1 S metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidindihidroxipropoxi)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridi sulfonamida y (1 R,2R)-1 -((S)-2,3-dihidroxipropoxi)-N-( 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo una mezcla de acetona (12 ml) y agua (4 ml) se añadió 0,06 mmol)) y 4-metilmorfolina-N-óxido (435 mg, 3,71 28 h y después se concentró parcialmente en un rotav agua y se extrajo con DCM (7X). Las capas orgánica concentraron a vacío. El residuo se purificó por cromat lo largo de un periodo de 35 min) para proporcionar marrón claro. lCm S-ESI (POS.) m/z: 599,9 (M+H)+.
(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5--((R)-2,3-dihidroxipropoxi)-N-(4-(2,6-dimetoxifenil)-5-(5-pano-2-sulfonamida y (1 R,2R)-1 -((R)-2,3-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propano-2-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-. A una disolución de 407.1 (600 mg, 1,06 mmol) en xido de osmio (solución al 4% en peso en agua (389 pl, La suspensión naranja resultante se agitó a TA durante ra separar la acetona. El residuo acuoso se diluyó con binadas se secaron sobre sulfato sódico anhidro y se en gel de sílice (eluyente: MeOH en DCM al 0-15% a (505 mg, 79% de rendimiento) en forma de un sólido
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2, hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami mg, 0,33 mmol) en una mezcla de THF (6 ml) y agua ( suspensión amarilla resultante se agitó a TA durante 1 se concentró parcialmente en un rotavapor para separ extrajo con DCM (4X). Las capas orgánicas combinad para dar el aldehido en forma de un sólido amarillo. A se añadió borohidruro sódico (126 mg, 3,32 mmol). Se agitó a 0°C durante 35 min y después se inactivó con s en un rotavapor para separar el MeOH, y después se secaron sobre sulfato sódico anhidro y se concentraro sílice (eluyente: MeOH en DCM al 0-15% a lo largo de racémico 407.0 (115 mg, 61% de rendimiento) en forma
Ejemplo 408.0: Preparación de (IS,2S)-N-(4-(2, hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidi -triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-jemplo 407.0. A una disolución del Ejemplo 407.2 (199 se añadió peryodato de sodio (199 mg, 0,93 mmol). La spués se filtró, se lavó el filtrado con DCM. La mezcla isolventes orgánicos, después se diluyó con agua y se ecaron sobre sulfato sódico anhidro y se concentraron lución enfriada con hielo del aldehido en MeOH (6 ml) vó evolución de gas. La solución amarilla resultante se n HCl 1 N (7 ml). La mezcla se concentró parcialmente o con DCM (5X). Las capas orgánicas combinadas se cío. El residuo se purificó por cromatografía en gel de riodo de 40 min) para proporcionar el producto alcohol sólido blanquecino.
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ropano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-di hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida, cromatografía de fluidos supercríticos quiral de 407.0 para que eluía era el Ejemplo 408.0 (41 mg). 1H RMN (500 MH 8,36 (s, 1H), 7,72 (br. s., 1H), 7,40 (t, J=8,6 Hz, 1H), 6,63 (t 3,90 (m, 1H), 3,75 (s, 3H), 3,43-3,61 (m, 4H), 2,34 (d, J=8, 570,0 (M+H)+.
Ejemplo 409.0: Preparación de (1S,2S)-N-(4-(2,6-di hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-il zol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-fenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-plo 408.0. Se llevó a cabo la purificación por rar los dos productos enantiómeros. El primer pico Ch) 5: 11,78 (br. s., 1H), 8,62 (s, 2H), 8,46 (s, 1H), 6 Hz, 2H), 4,75 (d, J=7,2 Hz, 1H), 3,82 (s, 3H), 3,81 -6H), 1,24 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z:
fenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-di hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida, cromatografía de fluidos supercríticos quiral de 407.0 para que eluía era el Ejemplo 409.0 (32 mg). 1H RMN (500 MH 8,36 (s, 1H), 7,74 (br. s., 1H), 7,40 (t, J=8,4 Hz, 1H), 3,89 (m, 1H), 3,76 (s, 3H), 3,44-3,60 (m, 4H), 2,35 (d, J=6, 570,0 (M+H)+.
Ejemplo 410.0: Preparación de (IS,2S)-N-(4-(2,6-dimetoxife 2-metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid 4H-1,2,4-triazol-3-il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metilpir zol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin-2-fenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-plo 409.0. Se llevó a cabo la purificación por
ar los dos productos enantiómeros. El segundo pico
Ch) 5: 11,79 (br. s., 1H), 8,62 (s, 2H), 8,46 (s, 1H),
(t, J=7,8 Hz, 2H), 4,75 (d, J=7,2 Hz, 1H), 3,82 (s, 3H), 3,80 6H), 1,24 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z:
(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-hidroxi-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)--2-il)propano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H 2-il)propano-2-sulfonamida y (1 S,2S)-N-(4-(2,6-di hidroxipropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1 -((R)-2-hidroxipropoxi)-1 -(5-metilp dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida Ejemplo 410.1. A una disolución de 407.2 ml) se añadió peryodato de sodio (281 mg, 1,31 mmol).
55 min y después se filtró, el filtrado se lavó con D disolventes orgánicos y después se diluyó con agua y s secaron sobre sulfato sódico anhidro y se concentró pa solución a -78°C del aldehído en THF (12 ml) se añadi 3:1 (838 pl, 1,17 mmol)) mediante jeringa. La solución se calentó a 0°C y se agitó durante 50 min adicional añadieron bromuro de metilmagnesio (solución 1,4 adicionales. Después de 30 min a -78°C, la reacción se se inactivó con solución acuosa saturada de cloruro a orgánicas combinadas se secaron sobre sulfato sódico cromatografía en gel de sílice (eluyente: MeOH en proporcionar 410.1 (140 mg, 51% de rendimiento) en (M+H)+.
4-triazol-3-il)-1-((S)-2-hidroxipropoxi)-1-(5-metilpirimidinifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -((R)-2-y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-in-2-il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-)-2-hidroxipropoxi)-1-(5-metilpirimidin-2-il)propano-2-mg, 0,47 mmol) en una mezcla de THF (6 ml) y agua (2 uspensión marrón claro resultante se agitó a tA durante a mezcla se concentró parcialmente para separar los rajo con DCM (4X). Las capas orgánicas combinadas se r el aldehído en forma de un sólido marrón claro. A una muro de metilmagnesio (solución 1,4 M en tolueno/THF ja resultante se agitó a -78°C durante 70 min y después a mezcla de reacción se volvió a enfriar a -78°C y se tolueno/THF 3:1 (670 pl, 0,94 mmol)) y THF (5 ml) tó a TA y se agitó durante 15 h adicionales. La reacción co (30 ml) y se extrajo con cloroformo (4X). Las capas dro y se concentraron a vacío. El residuo se purificó por al 0-15% a lo largo de un periodo de 35 min) para a de un aceite incoloro. LCMS-ESI (POS.) m/z: 584,0
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H oxopropoxi)propano-2-sulfonamida y (1 R,2R)-N-(4-(2, metilpirimidin-2-il)-1-(2-oxopropoxi)propano-2-sulfonami mg, 0,19 mmol) en DCM (9 ml) se añadió peryodinan claro resultante se agitó a TA durante 6 h y despu tiosulfato de sodio (5 ml) y disolución acuosa saturada min y después se extrajo con DCM (4X). Las capas org se concentraron. El residuo se purificó por cromatogra largo de un periodo de 35 min) para proporcionar 41 blanco. LCMS-ESI (POS.) m/z: 581,9 (M+H)+.
-triazol-3-il)-1 -(5-metilpirimidin-2-il)-1 -(2-etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-jemplo 410.2. A una disolución del Ejemplo 410.1 (140 Dess-Martin (416 mg, 0,98 mmol). La solución amarillo inactivó por adición de solución acuosa saturada de icarbonato sódico (5 ml). La mezcla se agitó durante 10 s combinadas se secaron sobre sulfato sódico anhidro y n gel de sílice (eluyente: MeOH en DCM al 0-15% a lo 112 mg, 100% de rendimiento) en forma de un sólido
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2R)-N-( 1-(2-hidroxi-2-metilpropoxi)-1-(5-metilpirimidin-2-il)propa 410.2 (112 mg, 0,19 mmol) en THF (20 ml) se añadió tolueno/THF 3:1 (550 pl, 0,77 mmol)) mediante jeringa.
4,25 h y después se calentó a 0°C y se agitó durant reacción se calentó a TA y se agitó durante otras 7 cloruro amónico (20 ml) y se extrajo con cloroformo (4X sódico anhidro y se concentraron. El residuo se purificó al 1-15% a lo largo de un periodo de 35 min) para propo rendimiento) en forma de un sólido blanco.
Ejemplo 411.0: Preparación de (1S,2S)-N-(4-(2,6 hidroxi-2-metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2 metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2-hidroxi-2-metil -triazol-3-il)-1 -(2-hidroxi-2-metilpropoxi)-1 -(5--dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-sulfonamida, Ejemplo 410.0. A una solución a -782C de a gota bromuro de metilmagnesio (solución 1,4 M en lución amarillo claro resultante se agitó a -78°C durante h adicionales. Después de este periodo de tiempo, la reacción se inactivó con solución acuosa saturada de capas orgánicas combinadas se secaron sobre sulfato romatografía en gel de sílice (eluyente: MeOH en DCM ar el producto alcohol racémico 410.0 (27,5 mg, 24% de
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-namida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-xi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-N il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metilpirimidin-2-il)pro purificación por cromatografía de fluidos supercríticos en el Ejemplo 410.0. Chiralpak ADH (250x20 mm), 20% Ejemplo 411.0 (6,8 mg). 1H RMN (500 MHz, CDCla) 5: 1H), 7,40 (t, J=8,6 Hz, 1H), 6,63 (dd, J=16,2, 8,2 Hz, 3,72 (s, 3H), 3,31 (d, J=9,0 Hz, 1H), 3,18 (d, J=9,2 Hz, 6H). LCMS-ESI (POS.) m/z: 598,1 (M+H)+.
Ejemplo 412.0: Preparación de (1S,2S)-N-(4-(2,6 hidroxi-2-metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2 metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-hidroxi-2-metil -triazol-3-il)-1 -(2-hidroxi-2-metilpropoxi)-1 -(5-,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3--2-sulfonamida, Ejemplo 411.0. Se llevó a cabo la de 410.0 para separar los dos productos enantiómeros tOH, 70 ml/min, 274-nm. El primer pico que eluía era el s, 2H), 8,47 (s, 1H), 8,34 (d, J=1,6 Hz, 1H), 7,79 (br. s., ,77 (d, J=7,4 Hz, 1H), 3,84 (s, 3H), 3,82-3,91 (m, 1H), 2,35 (s, 6H), 1,23 (d, J=7,0 Hz, 3H), 1,13 (d, J=6,3 Hz,
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-namida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-xi)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-triazol-3-il)-1 -(2-hidroxi-2-metilpropoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-N il)-1-(2-hidroxi-2-metilpropoxi)-1-(5-metilpirimidin-2-il)pro purificación por cromatografía de fluidos supercríticos como se describe en el Ejemplo 411.0. El segundo pico CDCl3) 5: 8,63 (s, 2H), 8,46 (s, 1H), 8,34 (d, J=1,6 Hz, 8,3 Hz, 2H), 4,77 (d, J=7,4 Hz, 1H), 3,83 (s, 3H), 3,81 J=9,2 Hz, 1H), 2,35 (d, J=5,5 Hz, 6H), 1,23 (d, J=7,2 H (M+H)+.
Ejemplo 413.0: Preparación de 1S,2S)-N-(4-(2,6 metoxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(2-metoxietoxi)-1 -(5-metilpirimidi ,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-2-sulfonamida, Ejemplo 412.0. Se llevó a cabo la de 410.0 para separar los dos productos enantiómeros luía era el Ejemplo 412.0 (7,8 mg). 1H RMN (500 MHz, ,74 (br. s., 1H), 7,39 (t, J=8,5 Hz, 1H), 6,62 (dd, J=16,1, (m, 1H), 3,72 (s, 3H), 3,31 (d, J=9,2 Hz, 1H), 3,18 (d, ), 1,13 (d, J=6,1 Hz, 6H). LCMS-ESI (POS.) m/z: 598,1
toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-ropano-2-sulfonamida.
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2, metoxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami 0,013 mmol) en THF (2,6 ml) se añadió bis(trimetilsilil) lentamente mediante jeringa. Después de agitar durant durante 7 min adicionales. La reacción después se vol metilo (2,3 pl, 0,02 mmol) lentamente mediante jeringa. h y después se inactivó con una mezcla 2,5:1 de solu extrajo con DCM (3X). Las capas orgánicas combinada a vacío. El residuo se purificó por HPLC preparativa d agua al 20-60% a lo largo de un periodo de 35 minu proporcionar 413.0 (3,9 mg, 52% de rendimiento) en fo (s, 2H), 8,60 (s, 1H), 8,41 (s, 1H), 8,12 (s, 1H), 7,44 (t, Hz, 1H), 3,84 (s, 3H), 3,82-3,91 (m, 2H), 3,73 (s, 3H), 3, 2,37 (s, 3H), 1,31 (d, J=6,7 Hz, 3H). LCMS-ESI (POS.)
Ejemplo 414.0: Preparación de (IS,2R)-N-(4-(2,6-d hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin -triazol-3-il)-1 -(2-metoxietoxi)-1 -(5-metilpirimidin-2-toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(2 jemplo 413.0. A una solución a -78°C de 408.0 (7,3 mg, de potasio (solución 1,0 M en THF (29 pl, 0,03 mmol)) min a -78°C, la reacción se calentó a -35°C y se agitó enfriar a -78°C y se añadió trifluorometanosulfonato de lución amarilla resultante se agitó a -78°C durante 2,75 cuosa saturada de cloruro amónico y agua (7 ml) y se secaron sobre sulfato sódico anhidro y se concentraron inversa (columna Luna 5 pM C18, eluyente: ACN en nde ambos disolventes contenían TFA al 0,1%) para e un sólido blanco. 1H RMN (500 MHz, CDCh) 5: 8,69 Hz, 1H), 6,65 (dd, J=19,2, 8,4 Hz, 2H), 4,86 (d, J=5,9 9 (m, 2H), 3,46-3,58 (m, 2H), 3,38 (s, 3H), 2,46 (s, 3H), 84,2 (M+H)+.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-ropano-2-sulfonamida.
(1S,2R)-1-(aliloxi)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipir 2-sulfonamida y (1 R,2S)-1 -(aliloxi)-N-(4-(2,6-d metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo 414.
25.0 (209 mg, 0,77 mmol), hidrazida de 6-metoxipicoli para proporcionar 414.1 (234 mg, 52% de rendimiento) (M+H)+.
-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propanoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-uiendo el procedimiento en el Ejemplo A, se acoplaron 5 mg, 0,81 mmol) y Ejemplo 1.0 (152 mg, 0,79 mmol) rma de un sólido blanco. LCMS-ESI (POS.) m/z: 582,2
(1 S,2R)-1 -((S)-2,3-dihidroxipropoxi)-N-(4-(2,6-dimetoxife metilpirimidin-2-il)propano-2-sulfonamida y (1 S, metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidin dihidroxipropoxi)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipirid 2- sulfonamida y (1 R,2S)-1 -((S)-2,3-dihidroxipropoxi)-3- il)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida Eje una mezcla de acetona (9 ml) y agua (3 ml) se añadi metilmorfolina-N-óxido (165 mg, 1,41 mmol). La solució concentró parcialmente en un rotavapor para separar la con cloroformo (5X). Las capas orgánicas combinadas s residuo se purificó por cromatografía en gel de sílice (el 35 min) para proporcionar 414.2 (116 mg, 37% de ren m/z: 616,1 (M+H)+.
(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5--((R)-2,3-dihidroxipropoxi)-N-(4-(2,6-dimetoxifenil)-5-(6-ropano-2-sulfonamida y (1 R,2S)-1 -((R)-2,3-l)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-il)propano-2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-14.2. A una disolución de 414.1 (234 mg, 0,40 mmol) en cantidad catalítica de tetraóxido de osmio sólido y 4-rón resultante se agitó a TA durante 26 h y después se ona. El residuo acuoso se diluyó con agua y se extrajo aron sobre sulfato sódico anhidro y se concentraron. El e: MeOH en DCM al 3-15% a lo largo de un periodo de to) en forma de un aceite incoloro. LCMS-ESI (POS.)
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida y (1 R,2S)-N-(4-(2,6-di hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami mmol) en una mezcla de THF (6 ml) y agua (2 ml) suspensión blanca se agitó a TA durante 2,5 h y de concentró parcialmente en un rotavapor para separar l extrajo con DCM (4X). Las capas orgánicas combinada para dar el aldehido en forma de un sólido blanco. A un añadió borohidruro sódico (52 mg, 1,37 mmol). Se obser a 0°C durante 30 min y después se añadió borohidrur durante 40 min adicionales a 0°C, la reacción se inacti parcialmente en un rotavapor para separar el MeOH, combinadas se secaron sobre sulfato sódico anhidr cromatografía en gel de sílice (eluyente: MeOH en
proporcionar el producto alcohol racémico 414.0 (71 mg,
Ejemplo 415.0: Preparación de (1S,2R)-N-(4-(2,6-di hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin ,4-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metilpirimidin-2-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(2-jemplo 414.0. A una disolución de 414.2 (116 mg, 0,17 ñadió peryodato de sodio (133 mg, 0,62 mmol). La se filtró, se lavó el filtrado con DCM. La mezcla se olventes orgánicos, después se diluyó con agua y se ecaron sobre sulfato sódico anhidro y se concentraron ción enfriada con hielo del aldehido en MeOH (5 ml) se olución de gas. La solución amarilla resultante se agitó ico (117 mg, 3,08 mmol) adicional. Después de agitar n solución de HCl 1 N (8 ml). La mezcla se concentró pués se extrajo con DCM (4X). Las capas orgánicas e concentraron a vacío. El residuo se purificó por al 0-12% a lo largo de un periodo de 45 min) para de rendimiento) en forma de un sólido blanco.
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-ropano-2-sulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-d hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami cromatografía de fluidos supercríticos quiral de 414.0 preparativo n°1: Columna: Chiralpak AS-H (Reversed) Líquido, B: MeOH, Caudal: 70 ml/min, 220 nm, 21 (Repurificación de la fracción del pico 1): Columna: W Líquido CO2, B: MeOH, Caudal: 70 ml/min, 220 nm, 165 el Ejemplo 415.0 (22,8 mg): 1H RMN (500 MHz, CDCl 6,70 (dd, J=7,4, 1,8 Hz, 1H), 6,57-6,64 (m, 2H), 5,35 (d, 3,59-3,75 (m, 3H), 3,51-3,57 (m, 1H), 3,17 (s, 3H), 2,36 (M+H)+.
Ejemplo 416.0: Preparación de (1S,2R)-N-(4-(2,6-d hidroxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(2-hidroxietoxi)-1 -(5-metilpirimidin ,4-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metilpirimidin-2-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(2-jemplo 415.0. Se llevó a cabo la purificación por separar los dos productos enantiómeros. Método SFC x 21 mm, 5 pm), Fase móvil: 67:33 (A:B), A: CO2 r de presión entrada, Método SFC preparativo n°2 -1 (250 x 21 mm, 5 pm), Fase móvil: 70:30 (A:B), A: bar de presión de entrada. El primer pico que eluía era ,65 (s, 2H), 7,56-7,66 (m, 2H), 7,32 (t, J=8,5 Hz, 1H), 3 Hz, 1H), 3,85-3,95 (m, 1H), 3,71 (s, 3H), 3,70 (s, 3H), ), 1,28 (d, J=6,8 Hz, 3H). LCMS-ESI (POS.) m/z: 586,1
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(2-(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-ropano-2-sulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-d hidroxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonami cromatografía de fluidos supercríticos quiral de 414. describe en el Ejemplo 415.0. El segundo pico que eluí 5: 8,67 (s, 2H), 7,54-7,67 (m, 2H), 7,32 (t, J=8,5 Hz, 1H) 1H), 3,86-3,95 (m, 1H), 3,72 (s, 3H), 3,70 (s, 3H), 3,59 1,28 (d, J=6,8 Hz, 3H). LCMS-ESI (POS.) m/z: 586,1 (M
Ejemplo 417.0: Preparación de (2S)-N-(4-(2,6-dimetoxi pirimidinil)-2-propanosulfonamida y (2R)-N-(4-(2,6-fluoro-2-pirimidinil)-2-propanosulfonamida.
,4-triazol-3-il)-1-(2-hidroxietoxi)-1-(5-metilpirimidin-2-xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(2 jemplo 416.0. Se llevó a cabo la purificación por a separar los dos productos enantiómeros como se el Ejemplo 416.0 (27,3 mg). 1H RMN (500 MHz, CDCl3) (dd, J=7,4, 1,8 Hz, 1H), 6,57-6,64 (m, 2H), 5,36 (br. s., (m, 3H), 3,51-3,57 (m, 1H), 3,17 (s, 3H), 2,36 (s, 3H),
5-(5-etenil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-toxifenil)-5-(5-etenil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-etenil-3-piridinil)-4H-1, propanosulfonamida y (2R)-N-(4-(2,6-dimetoxi pirimidinil)-2-propanosulfonamida, Ejemplo 417.0. Un m 146.0 (0,231 g, 0,40 mmol), éster de pinacol del ácido en Sigma-Aldrich Corp, St. Louis, MO, EE.UU.), triciclo en Sigma-Aldrich Corp, St. Louis, MO, EE.UU.), y tris(di azol-3-il)-1-(5-fluoro-2-pirimidinil)-2-5-(5-etenil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-de fondo redondo de 10 ml se cargó con el compuesto rónico (0,143 ml, 0,80 mmol, disponible en el mercado osfina (0,022 g, 0,080 mmol, disponible en el mercado lidenacetona)dipaladio (0,037 g, 0,040 mmol, disponible
en el mercado en Strem Chemicals, Inc. Newburyport, M dioxano (3 ml) y solución acuosa de fosfato de potasi mediante jeringa. La reacción resultante se calentó a reacción se enfrió a TA y después se concentró a presió MgSÜ4. El material así obtenido se absorbió sobre un ta de una columna de gel de sílice preempaquetada Redi-S al 0-100%, para proporcionar el compuesto del título 41 blanco. 1H RMN (400 MHz, CDCL) 5: 8,61 (br. s., 1H), 1H), 6,55 - 6,72 (m, 3H), 5,73 (d, J=17,61 Hz, 1H), 5,44 3,76 (s, 3H), 3,74 (s, 3H), 3,70 (dd, J=14,87, 4,69 Hz, 1 LCMS-ESI (POS.) m/z: 525,8 (M+H)+.
Ejemplo 418.0: Preparación de (2S)-N-(4-(2,6-dimeto pirimidinil)-2-propanosulfonamida y (2R)-N-(4-(2,6-dime 2-pirimidinil)-2-propanosulfonamida.
E.UU.) y se volvió a llenar con argón. Se añadieron 1,4-3 M (0,922 ml, 1,198 mmol) a la mezcla de reacción y se siguió por TLC y LC-MS. Después de 18 h, la ducida. El residuo se diluyó con EtOAc y se secó sobre de gel de sílice y se purificó por cromatografía a través 2 g), eluyendo con un gradiente de EtOAc en heptanos (0,106 g, 0,20 mmol, 50% de rendimiento) como sólido (s, 2H), 8,47 (s, 1H), 7,88 (s, 1H), 7,42 (t, J=8,51 Hz, =10,96 Hz, 1H), 3,82 (ddd, J=9,88, 6,65, 4,40 Hz, 1H), 10 (dd, J=14,77, 9,88 Hz, 1H), 1,32 (d, J=6,85 Hz, 3H).
il)-5-(5-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-enil)-5-(5-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2,4-(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2,4-Ejemplo 418.0. En un matraz de fondo redondo se añadi carbón activado (0,013 g, 6,18 gmol) (disponible en el
añadió una mezcla de EtOH (2,5 ml) y DCM (2,5 ml), y la de H2. La mezcla de reacción se filtró a través de un filtr concentró a vacío para dar el material inicial. El material se purificó por cromatografía a través de una columna d con un gradiente de EtOAc en heptanos al 0-100%, par mmol, 52% de rendimiento). LCMS-ESI (POS.) m/z: 527,
Ejemplo 419.0: Preparación de (2S)-N-(4-(2,6-dimeto pirimidinil)-2-propanosulfonamida o (2R)-N-(4-(2,6-dime 2-pirimidinil)-2-propanosulfonamida.
ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida y ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida, compuesto 417.0 (0,065 g, 0,12 mmol) y paladio sobre do en Sigma-Aldrich Corp, St. Louis, MO, EE.UU.). Se cla de reacción se agitó durante la noche en atmósfera jeringa (Whatman 0,45 gm PTFE w/GMF). El filtrado se obtenido se absorbió sobre un tapón de gel de sílice y l de sílice preempaquetada Redi-Sep (12 g), eluyendo porcionar el compuesto del título 418.0 (0,034 g, 0,064 H)+.
il)-5-(5-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-enil)-5-(5-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2,4-(2R)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2,4-t Ejemplo 419.0. El compuesto racémico 418.0 se separó x 21 mm IA en Thar 80 con 18 g/min de MeOH (+NH320 Temperatura = 24°C; Presión de salida = 100 bar; longit mg de muestra disuelta en 4 ml de MeOH (25% de DC era el primer isómero en eluir en estas condiciones. 1H 1H), 8,41 (d, J=2,15 Hz, 1H), 7,59 (t, J=2,15 Hz, 1H), 7,5 2H), 3,77 - 3,85 (m, 1H), 3,74 (s, 3H), 3,72 (s, 3H), 3,69 ( J=7,63 Hz, 2H), 1,32 (d, J=6,85 Hz, 3H), 1,15 (t, J=7,63
Ejemplo 420.0: Preparación de (2S)-N-(4-(2,6-dimeto pirimidinil)-2-propanosulfonamida o (2R)-N-(4-(2,6-dime 2-pirimidinil)-2-propanosulfonamida.
ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida o ol-3-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida, cromatografía de fluidos supercríticos (columna de 250 ) 37 g/min de CO2, 33% de co-disolvente a 55 g/min. e onda = 215 nm; volumen de inyección = 0,2 ml de 20 e obtuvieron dos enantiómeros. El compuesto del título (400 MHz, CDCL) 5: 8,54 (s, 1H), 8,46 (d, J=1,96 Hz, ,61 (m, 1H), 7,39 (t, J=8,51 Hz, 1H), 6,61 (d, J=8,46 Hz, =3,72 Hz, 1H), 3,10 (dd, J=14,77, 9,88 Hz, 1H), 2,61 (q, H). LCMS-ESI (POS.) m/z: 527,8 (M+H)+.
il)-5-(5-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-enil)-5-(5-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-
(2S)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2,4-tri (2R)-N-(4-(2,6-dimetoxifenil)-5-(5-etil-3-piridinil)-4H-1,2,4-tri Ejemplo 420.0. El compuesto del título era el segundo isó condiciones de SFC descritas en el Ejemplo 419.0. 1H RM 7,59 (t, J=2,15 Hz, 1H), 7,39 (t, J=8,51 Hz, 1H), 6,61 (dd, 1H), 3,74 (s, 3H), 3,72 (s, 3H), 3,69 (d, J=4,50 Hz, 1H), 3 1,32 (d, J=6,85 Hz, 3H), 1,15 (t, J=7,63 Hz, 3H). LCMS-ESI
Ejemplo 421.0: Preparación de (1R,2S)-N-(4-(2,6-di (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-il)p 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida.
-il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida o -il)-1-(5-fluoro-2-pirimidinil)-2-propanosulfonamida, n eluir cuando se somete el compuesto 418.0 a las 0 MHz, CDCh) 5: 8,54 (s, 2H), 8,39 - 8,48 (m, 2H), 1, 0,88 Hz, 2H), 3,81 (ddd, J=9,88, 6,75, 4,30 Hz, d, J=14,77, 9,88 Hz, 1H), 2,61 (q, J=7,76 Hz, 2H), .) m/z: 527,8 (M+H)+.
ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-o-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-etilpirimidin-2-il)propano-2-sulfonamida y (1 R,2R)-l)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-sulfonamida y (R)-N-(4-(2,6-dimetoxifenil)-5-(6-metox oxopropano-2-sulfonamida, Ejemplo 421.1. Siguiendo el p 3.18 se obtuvo 421.1. 1H RMN (CDCla) 5: 8,67-8,76 (m, 2 6,68 (m, 3H), 6,43-6,54 (m, 1H), 4,41 (q, J=6,9 Hz, 1H), 3,7 (m, 3H), 1,38 (d, J=7,0 Hz, 3H). Un protón intercambiable n l-3-il)-1-(5-metilpirimidin-2-il)-1-oxopropano-2-n-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)-1 -imiento general del Ejemplo A, usando 19.0, 1.0, y 7 (dd, J=8,3, 7,5 Hz, 1H), 7,29-7,35 (m, 1H), 6,56 0 (m, 3H), 3,67-3,75 (m, 3H), 3,12 (s, 3H), 2,40-2,48 bservaba. MS-ESI (POS.) m/z: 539.9 (M+H)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-di (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-il)p 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 421.0. A una disolución de 421.1 (0,150 g, 0,278 mmol, Aldrich, St. Louis, MO), 2 gotas de AcOH, y boroci MO). La mezcla resultante se calentó a 60°C en atmósfe añadió triacetoxiborohidruro sódico (0,120 g, 0,57 mmol, otras 18 h. La reacción se enfrió a TA y se concentraro riazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-o-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-etilpirimidin-2-il)propano-2-sulfonamida Ejemplo
l) en MeOH (2,0 ml) se añadió metilamina (0,30 ml, 2,86 ruro sódico (0,040 g, 0,61 mmol, Aldrich, St. Louis,
N2 durante 18 horas. A la mezcla de reacción se
h, St. Louis, MO) y la reacción se calentó durante
residuo se repartió entre EtOAc (60 ml) y solución
a c u o s a s a tu ra d a d e N a H C Ü 3 (30 m l). L a c a p a a c u o s a o rg á n ic a s c o m b in a d a s s e s e c a ro n s o b re M g S O 4 , s e f i lt p u r if ic ó p o r c ro m a to g ra f ía e n c o lu m n a (40 g d e s í l ic e , M
Ejemplo 422.0: Preparación de (1R,2S)-N-(4-(2, (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-t sulfonamida.
tra jo c o n iP rO H e n C H C I3 a l 10 % (50 m l). L a s c a p a s y s e c o n c e n tra ro n . El p ro d u c to a s í o b te n id o 421.0 se n D C M a l 0 -4 % ) p a ra o b te n e r d o s d ia s te re ó m e ro s .
toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)--metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2R)--3-il)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2, (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino 422.0. Como se describe en el Ejemplo 421.0, los diast dar el primer diastereómero que eluye que es el compu 2H), 7,29-7,36 (m, 1H), 6,65-6,73 (m, 1H), 6,60 (dd, J=8 3H), 3,63 (qd, J=7,1, 3,0 Hz, 1H), 3,17 (s, 3H), 2,31 (d, intercambiables. MS-eSi (pOs .) m/z: 555.0 (M+H)+.
Ejemplo 423.0: Preparación de (1R,2S)-N-(4-(2, (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-t sulfonamida.
4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)--metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo eros se separaron por purificación en gel de sílice para el título. 1H RMN (CDCh) 5: 8,57 (s, 2H), 7,55-7,66 (m, 7 Hz, 2H), 4,55 (d, J=3,1 Hz, 1H), 3,72 (s, 3H), 3,71 (s, Hz, 6H), 1,29 (s, 3H). No se observaban dos protones
toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)--metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2R)--3-il)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2, (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino ,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-toxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)--metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo
423.0. Como se describe en el Ejemplo 421.0, los diast dar el segundo diastereómero que eluye que es el Eje (m, 2H), 7,29-7,35 (m, 1H), 6,69 (dd, J=7,0, 2,2 Hz, 1H), 3,73 (s, 3H), 3,65 (dd, J=8,8, 7,0 Hz, 1H), 3,18 (s, 3H), No se observaban dos protones intercambiables. MS-ES
Ejemplo 424.0: Preparación de (1 R,2S)-N-(4-(2, (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-i 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-t sulfonamida.
eros se separaron por purificación en gel de sílice para 423.0. 1H RMN (CDCta) 5: 8,52-8,60 (m, 2H), 7,54-7,66 (d, J=8,6 Hz, 2H), 4,08 (d, J=8,8 Hz, 1H), 3,76 (s, 3H), 2,35 (m, 3H), 2,13-2,20 (m, 3H), 1,11 (d, J=7,0 Hz, 3H). S.) m/z: 554,9 (M+H)+.
etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-l-3-il)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6 (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-i 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino 424.0. La primera mezcla de diastereómeros 422.0 qu um, 21 mm x25 cm, 5 um S/N=2121 dirección normal) el de isopropilamina con un caudal de 50 ml/min) para dar el primer pico que eluía era el Ejemplo 424.0. 1H RMN ( 6,66-6,74 (m, 1H), 6,60 (t, J=7,4 Hz, 2H), 4,56 (d, J=3,1 (s, 3H), 1,25-1,34 (m, 4H). No se observa un protón inter
Ejemplo 425.0: Preparación de (1R,2S)-N-(4-(2,6 (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-i 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-t sulfonamida.
,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo ye se resolvió usando SFC preparativa (columna OX (5 do con 50% de CO2 líquido en 50% de MeOH con 0,2% productos en más de 99,5% de exceso enantiomérico; h) 5: 8,57 (s, 2H), 7,58-7,65 (m, 2H), 7,29-7,35 (m, 1H), 1H), 3,64-3,75 (m, 7H), 3,17 (s, 3H), 2,32 (s, 3H), 2,31 biable. MS-ESI (pOs .) m/z: 555,2 (M+H)+.
etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-l-3-il)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-il)p 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 425.0. El segundo pico que eluye del procedimiento des (CDCla) 5: 8,57 (s, 2H), 7,57-7,65 (m, 2H), 7,29-7,35 (m, Hz, 1H), 3,72 (s, 3H), 3,71 (s, 3H), 3,60-3,68 (m, 1H), 3, observaba un protón intercambiable. MS-ESI (pOs .) m/z: 5
Ejemplo 426.0: Preparación de (1R,2S)-N-(4-(2,6-di (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-il)p 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida.
riazol-3-il)-1 -(metilamino)-l -(5-metilpirimidin-2-ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-o-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-etilpirimidin-2-il)propano-2-sulfonamida, Ejemplo n el Ejemplo 424.0 era el Ejemplo 425.0. 1H RMN ,65-6,74 (m, 1H), 6,55-6,65 (m, 2H), 4,56 (d, J=3,1 3H), 2,32 (m, 6H), 1,29 (d, J=7,2 Hz, 4H). No se M+H)+.
ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-o-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-etilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-l)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-di (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4h -1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-il)p 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 426.0. La segunda mezcla de diastereómeros 423. mm x25 cm, 5 um S/N=2121 dirección normal) eluyendo isopropilamina a un caudal de 50 ml/min) para dar dos p primer pico que eluía era el Ejemplo 426.0. 1H RMN (CD 6,65-6,72 (m, 1H), 6,60 (d, J=8,5 Hz, 2H), 4,08 (d, J=8,9 H (s, 3H), 2,32 (s, 3 H), 2,17 (s, 3H), 1,23-1,28 (m, 1H), intercambiable. MS-eSi (POS.) m/z: 555,0 (M+H)+.
Ejemplo 427.0: Preparación de (1R,2S)-N-(4-(2,6-di (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-il)p 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida.
riazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-o-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-etilpirimidin-2-il)propano-2-sulfonamida, Ejemplo
resolvió usando la SFC preparativa (columna OX (5 um, 21 0% de CO2 líquido en 50% de MeOH con 0,2% de
tos en más de 99,5% de exceso enantiomérico. El
8,57 (s, 2H), 7,55-7,64 (m, 2H), 7,29-7,35 (m, 1H),
), 3,76 (s, 3H), 3,72 (s, 3H), 3,56-3,70 (m, 1H), 3,18
(d, J=7,0 Hz, 3H). No se observaba un protón
ifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-o-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-etilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-l)-1-(metilamino)-1-(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2, (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-i 5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino 427.0. El segundo pico que eluye del procedimiento de 5: 8,57 (s, 2H), 7,55-7,64 (m, 2H), 7,29-7,35 (m, 1H), 6, (m, 1H), 3,76 (s, 3H) 3,72 (s, 3H), 3,57-3,68 (m, 1H), 3, Un protón intercambiable no se observaba. mS-Es I (Po
Ejemplo 428.0: Preparación de (1R,2S)-N-(4-(2,6-dimeto (5-fenilpirimidin-2-il)propano-2-sulfonamida.
,4-triazol-3-il)-1 -(metilamino)-l -(5-metilpirimidin-2-etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-pano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo en el Ejemplo 426.0 suministró 427.0. 1H RMN (CDCta) d, J=6,9, 2,2 Hz, 1H), 6,60 (d, J=8,5 Hz, 2H), 4,03-4,11 , 3H), 2,32 (s, 3H), 2,17 (s, 3H), 1,17 (d, J=6,3 Hz, 3H). /z: 555,0 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-
(1 R,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5 sulfonamida Ejemplo 428.1. Siguiendo el procedimiento 428.1. 1H RMN (CDCla) 5: 11,08 (br. s., 1H), 8,61-8,82 7,70 (m, 1H), 7,34-7,47 (m, 1H), 6,55-6,66 (m, 2H), 4,91 3H), 1,32-1,46 (m, 3H). MS-ESI (POS.) m/z: 559,9 (M+H) etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-eral del Ejemplo A, usando 14.3, 1.0 y 3.11 se obtuvo H), 8,44 (d, J=1,5 Hz, 1H), 8,33 (d, J=1,9 Hz, 1H), 7,57 (m, 1H), 3,69-3,78 (m, 7H), 3,26-3,40 (m, 3H), 2,30 (s,
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-sulfonamida, Ejemplo 428.0. En un matraz de fondo re (4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazo 0.089 mmol), ácido fenilborónico (0,035 g, 0,287 mmol, mmol, Aldrich, St. Louis, MO), (AmPhos) cloruro de mmol, Aldrich, St. Louis, MO), 1,4-dioxano (2,0 ml), y a durante un par de min y después se unió un refrigerante durante 20 h. La reacción después se enfrió a TA y se r La capa acuosa se extrajo con iPrOH en CHCl3 al 10% MgSO4, se filtraron y se concentraron a vacío. El resid MeOH en DCM al 2-5%) para dar (1R,2S)-N-(4-( metoxi-1-(5-fenilpirimidin-2-il)propano-2-sulfonamida (42 9,01 (m, 2H), 8,44 (d, J=1,5 Hz, 1H), 8,28-8,38 (m, 1H), -triazol-3-il)-1-metoxi-1-(5-fenilpmmidin-2-il)propano-2-de 25 ml se añadió (1 R,2S)-1-(5-cloropirimidin-2-il)-N-)-1 -metoxipropano-2-sulfonamida (428.1, 0,050 g, rich, St. Louis, MO), fosfato de potasio (0,060 g, 0,283 is[(di-t-butil-p-metilaminofenil]paladio(II) (8,0 mg, 0,011 (0,70 ml). La mezcla resultante se burbujeó con argón eflujo y la mezcla se calentó a 85°C en atmósfera de N2 ió entre agua (10 ml) y iPrOH en CHCl3 al 10% (20 ml).
l). Las capas orgánicas combinadas se secaron sobre purificó por cromatografía en columna (40 g de sílice, metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-0,040 g). 1H RMN (CDCl3) 5: 11,21 (br. s., 1H), 8,92 (s, 1H), 7,57-7,62 (m, 2H), 7,45-7,56 (m, 3H), 7,39 (t,
Ejemplo 429.0: Preparación de (1R,2S)-1-(5-cloro 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida.
in-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-
(1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida, Ejemplo 429.0. Siguiendo el procedimient 429.0. 1H RMN (CDCla) 5: 11,08 (s, 1H), 8,70 (s, 2H), 8 6,60 (dd, J=8,5, 4,1 Hz, 2H), 5,00 (d, J=5,8 Hz, 1H), 3,7 3H), 1,44 (d, J=7,0 Hz, 3H), 1,07-1,19 (m, 3H). MS-ESI
Ejemplo 430.0: Preparación de (1R,2S)-1-(5-clor triazol-3-il)-1 -etoxipropano-2-sulfonamida.
etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-eral del Ejemplo A, usando 14.7, 1.0, y 3.11 se obtuvo , 1H), 8,33 (s, 1H), 7,63 (s, 1H), 7,39 (t, J=8,5 Hz, 1H), (m, 1H), 3,67-3,77 (m, 6H), 3,39-3,59 (m, 2H), 2,30 (s, ) m/z: 573,9 (M+H)+.
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-
(1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida, Ejemplo 430.0. Siguiendo el procedi nicotinohidrazida se obtuvo 430.0. 1H RMN (CDCls) 5: 2,0 Hz, 1H), 7,39 (t, J=8,5 Hz, 1H), 7,24 (d, J=5,7 Hz, 1 3,84 (m, 1H), 3,74-3,77 (m, 3H), 3,71 (s, 3H), 3,39-3, (POS.) m/z: 559,8 (M+H)+.
Ejemplo 431.0: Preparación de (S)-N-((2,6-dimetoxifeni y (R)-N-((2,6-dimetoxifenil)carbamotioil)-1 -(5-fluoropirim in-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-general del Ejemplo A, usando 14.7, y 1.0 y (s, 1H), 8,71 (s, 2H), 8,58-8,65 (m, 2H), 7,73 (dt, J=8,0, 0 (dd, J=8,6, 4,8 Hz, 2H), 5,00 (d, J=5,8 Hz, 1H), 3,77 , 2H), 1,42-1,49 (m, 3H), 1,10-1,19 (m, 3H). MS-ESI
amotioil)-1-(5-fluoropirimidin-2-il)propano-2-sulfonamida il)propano-2-sulfonamida.
(S)-N-((2,6-dimetoxifenil)carbamotioil)-1 -(5-fluoropirimidi dimetoxifenil)carbamotioil)-1-(5-fluoropirimidin-2-il)propa (1,8 g, 8,21 mmol) en DMF (10 ml) se añadió carbonat agitó a TA durante 5 min antes de añadir 2-isotiocianat La mezcla resultante después se agitó a TA y se siguió de agua y la mezcla se acidificó por adición de soluci precipitado formado se recogió, se lavó con agua tres 99% de rendimiento). LCMS-ESI (POS.) m/z: 415,1 (M+
Ejemplo 432.0: Preparación de fluoruro de (2S,3 propano-2-sulfonamida y (R)-N-((2,6-sulfonamida Ejemplo 431.0. A una disolución de 9.0 esio (0,99 ml, 12,32 mmol) en porciones. La mezcla se dimetoxibenceno 1.0 (1,68 g, 8,62 mmol) en porciones. CMS. Tras completarse la reacción, se añadieron 20 ml osa de HCl (2,0 N, 6,16 ml, 12,32 mmol) a pH ~5. El y se secó a vacío para dar 431.0 (3,37 g, 8,13 mmol,
5-fluoropirimidin-2-il)butano-2-sulfonil y (2R,3R)-3-(5-fluoropirimidin-2-il)butano-2-sulfonilo y fluoruro de (2S fluoropirimidin-2-il)butano-2-sulfonilo.
3-(5-fluoropirimidin-2-il)butano-2-sulfonil y (2R,3S)-3-(5-
Fluoruro de (2S,3S)-3-(5-fluoropirimidin-2-il)butano-2-su sulfonilo y fluoruro de (2S,3R)-3-(5-fluoropirimidin-2-il)b il)butano-2-sulfonilo, Ejemplo 432.0. A una disolución ácido (2R,3S)-3-(5-fluoropirimidin-2-il)butano-2-sulfónic ácido (2S,3R)-3-(5-fluoropirimidin-2-il)butano-2-sulfónic generales descritos en los Ejemplos 7.0 y 10.0) en
(dietilamino)azufre (0,44 ml, 3,32 mmol, disponible en La mezcla se agitó a TA durante 18 h. La mezcla se e inactivar la reacción. La mezcla se concentró y el resid purificó por cromatografía a través de una columna d gradiente de EtOAc en hexanos al 0-100%, para dar (POS.) m/z: 237,1 (M+H)+.
Ejemplo 433.0: Preparación de (2S,3R)-N-(4-(2,6-dimet 4,4-dimetil-2-pentanosulfonamida y (2R,3S)-N-(4-(2, hidroxi-4,4-dimetil-2-pentanosulfonamida y (2R,3R)-N-( il)-3-hidroxi-4,4-dimetil-2-pentanosulfonamida y (2 triazol-3-il)-3-hidroxi-4,4-dimetil-2-pentanosulfonamida.
o y fluoruro de (2R,3R)-3-(5-fluoropirimidin-2-il)butano-2-o-2-sulfonilo y fluoruro de (2R,3S)-3-(5-fluoropirimidin-2-ido (2S,3S)-3-(5-fluoropirimidin-2-il)butano-2-sulfónico y ido (2R,3R)-3-(5-fluoropirimidin-2-il)butano-2-sulfónico y 89 g, 1,66 mmol) (preparado usando los procedimientos (8 ml, 1,66 mmol) se añadió gota a gota trifluoruro de rcado en Sigma-Aldrich Chemical Company, Inc.) a 0°C.
ediante un baño de hielo y se añadió gel de sílice para cargó directamente sobre un tapón de gel de sílice y se de sílice preempaquetada Redi-Sep, eluyendo con un (0,264 g, 1,12 mmol, 67% de rendimiento). LCMS-ESI
nil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxietoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3--N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-(trimetilsilil)etil)pentano-2-sulfonamida y (2R,3R)-N-(4-3-hidroxi-4,4-dimetil-N-(2-(trimetilsilil)etil)pentano-2-sulf 2-il)-4H-1,2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-N-(2-(trim dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il sulfonamida, Ejemplo 433.1. A una disolución agitada d n-butil-litio (2,5 M, 231 pl, 0,58 mmol). La reacción se ml, 0,58 mmol) y la reacción se agitó durante 1 h a 2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-N-(2-imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-ida y (2S,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinil)etil)pentano-2-sulfonamida y (2S,3R)-N-(4-(2,6-idroxi-4,4-dimetil-N-(2-(trimetilsilil)etil)pentano-2-(200 mg, 0.39 mmol) en THF (1.9 ml) a -78°C se añadió durante 10 min y después se añadió pivaldehído (0,064 . Después, se añadió una solución saturada de cloruro
amónico para inactivar la reacción y la mezcla resulta EtOAc. El material así obtenido se purificó en gel de compuesto deseado 433.1 (0,165 g, 0,27 mmol, 71% de calentó a TA La mezcla de reacción se extrajo con eluyendo con EtOAc en hexano al 0-20% para dar el miento). LCMS-ESI (POS.) m/z: 606,3 (M+H)+.
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pentanosulfonamida y (2R,3R)-N-(4-(2,6-dimetoxife dimetil-2-pentanosulfonamida y (2S,3S)-N-(4-(2,6-dimet 4.4- dimetil-2-pentanosulfonamida and(2S,3R)-N-(4-(2 hidroxi-4,4-dimetil-2-pentanosulfonamida, Ejemplo 433. añadió DMF (1,36 ml) seguido de difluorotrimetilsilicato mezcla se calentó con cuidado a 60°C con agitación. De mezcla de reacción se extrajo con EtOAc y se concentró eluyendo con EtOAc en heptanos al 0-70% para dar 43 de rendimiento) como una mezcla racémica de diastere sin:anti). 1H RMN (500 MHz, CDzClz) 5= 10,98 (br. s., 1 1H), 6,73 - 6,70 (m, 1H), 6,70 - 6,65 (m, 2H), 4,12 (d, 2,16H), 3,72 (d, J=1,7 Hz, 1,68H), 3,69 (s, 2,16H), 3,36 3H), 3,12 (t, J=7,0 Hz, 0,28H), 2,72 (d, J=2,4 Hz, 0,72H (s, 2,52H), 0,91 (s, 6,48H). LCMS-ESI (POS.) m/z: 506,3
Ejemplo 434.0: Preparación de (2S,3R)-N-(4-(2,6-dimet 4.4- dimetil-2-pentanosulfonamida o (2R,3S)-N-(4-(2 hidroxi-4,4-dimetil-2-pentanosulfonamida.
4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4,4-l)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxietoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-un vial que contenía 433.1 (0,165 g, 0,27 mmol) se (dimetilamino)sulfonio, TASF (0,225 g, 0,82 mmol). La de 4 h, la mezcla se enfrió a TA y se añadió agua. La ío. El producto así obtenido se purificó en gel de sílice forma de un sólido blanco (38,6 mg, 0,076 mmol, 28% s en una relación de 2,6:1 (determinado por 1H RMN, 67 - 7,61 (m, 1H), 7,61 - 7,57 (m, 1H), 7,43 - 7,36 (m, Hz, 0,28H), 3,93 (dd, J=0,7, 2,4 Hz, 0,72H), 3,77 (s, J=4,9, 6,8 Hz, 0,28H), 3,20 - 3,16 (m, 0,72H), 3,15 (s, (d, J=6,8 Hz, 0,84H), 1,33 (d, J=7,1 Hz, 2,16H), 0,93 )+.
l)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxietoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pentanosulfonamida o (2R,3S)-N-(4-(2,6-dimetoxife dimetil-2-pentanosulfonamida, Ejemplo 434.0. La mezcl con elución isocrática de 20% de EtOH (+NH320 mM) p g, 0,069 mmol). 1H RMN (500 MHz, CD2CL) 5 = 7,67 -1H), 6,70 - 6,65 (m, 2H), 3,95 (s, 1H), 3,76 (s, 3H), 3,70 1,34 (d, J=7,1 Hz, 3H), 0,91 (s, 9H). LCMS-ESI (POS.)
Ejemplo 435.0: Preparación de (2S,3S)-N-(4-(2,6-dimet 4,4-dimetil-2-pentanosulfonamida o (2R,3R)-N-(4-(2, hidroxi-4,4-dimetil-2-pentanosulfonamida.
4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4,4-iastereómeros 433.0 se purificó en una columna AD-H ar el primer pico que eluye como 434.0 (99%ee, 0,035 m, 2H), 7,40 (t, J=8,4 Hz, 1H), 6,71 (dd, J=1,1, 7,9 Hz, ), 3,21 - 3,16 (m, 1H), 3,15 (s, 3H), 2,87 - 2,71 (m, 1H), 6,3 (M+H)+.
l)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxitoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
(2S,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pentanosulfonamida o (2R,3R)-N-(4-(2,6-dimetoxife dimetil-2-pentanosulfonamida, Ejemplo 435.0. La mezcl con elución isocrática de 20% de EtOH (+NH320 mM) 0,008 g, 0,016 mmol). 1H RMN (500 MHz, CD2Cl2) 5 = 1 7,39 (t, J=8,6 Hz, 1H), 6,71 (dd, J=1,0, 8,1 Hz, 1H), 6,6 (s, 3H), 3,36 (dd, J=4,3, 6,7 Hz, 1H), 3,15 (s, 3H), 3,14 ESI (POS.) m/z: 506,3 (M+H)+.
Ejemplo 436.0: Preparación de (2S,3S)-N-(4-(2,6-dimet 4,4-dimetil-2-pentanosulfonamida o (2R,3R)-N-(4-(2, hidroxi-4,4-dimetil-2-pentanosulfonamida.
2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4,4-diastereómeros 433.0 se purificó en una columna AD-H a dar el segundo pico que eluye como 435.0 (98% ee, - 10,85 (m, 1H), 7,67 - 7,62 (m, 1H), 7,61 - 7,58 (m, 1H), J=8,6 Hz, 2H), 4,13 (d, J=4,4 Hz, 1H), 3,72 (s, 3H), 3,72 10 (m, 1H), 1,41 (d, J=7,1 Hz, 3H), 0,93 (s, 9H). LCMS-
nil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxietoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
(2S,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pentanosulfonamida o (2R,3R)-N-(4-(2,6-dimetoxife dimetil-2-pentanosulfonamida, Ejemplo 436.0. La mezcl con elución isocrática de 20% de EtOH (+NH320 mM) picos que se solapan (elución de tercer y cuarto picos r AD-H con elución isocrática de 30% de MeOH (+NH3 (95,2%ee, 0,0104 g, 0,021 mmol). 1H RMN (500 MHz, (d, J=8,1 Hz, 1H), 6,66 (d, J=8,6 Hz, 2H), 3,71 (s, 6H), 3 3H), 0,93 (s, 9H). LCMS-ESI (POS.) m/z: 506,3 (M+H)+.
Ejemplo 437.0: Preparación de (2S,3R)-N-(4-(2,6-dimet 4,4-dimetil-2-pentanosulfonamida o (2R,3S)-N-(4-(2, hidroxi-4,4-dimetil-2-pentanosulfonamida.
2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4,4-diastereómeros 433.0 se purificó en una columna AD-H dar una mezcla de dos diastereómeros que eluye como ctivamente). La mezcla se purificó más en una columna M) para dar el segundo pico que eluye como 436.0 h) 5 = 7,65 - 7,58 (m, 2H), 7,38 (t, J=8,4 Hz, 1H), 6,70 (d, J=6,6 Hz, 1H), 3,19 - 3,09 (m, 4H), 1,40 (d, J=7,1 Hz,
nil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxietoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 pentanosulfonamida o (2R,3S)-N-(4-(2,6-dimetoxife dimetil-2-pentanosulfonamida, Ejemplo 437.0. La mezcl con elución isocrática de 20% de EtOH (+NH320 mM) p dos picos que se solapan (elución de tercer y cuarto columna AD-H con elución isocrática de 30% de MeOH (95,2%ee, 0,0104 g, 0,021 mmol). 1H RMN(500 MHz, (dd, J=1,2, 7,8 Hz, 1H), 6,67 (t, J=9,0 Hz, 2H), 3,95 (s, 1 3H), 1,34 (d, J=6,8 Hz, 3H), 0,91 (s, 9H). LCMS-ESI (PO
Ejemplo 438.0: Preparación de (2R,3S)-1-ciclopropil-N-3-il)-1 -hidroxi-2-propanosulfonamida y (2S,3S)-1 -ciclop triazol-3-il)-1 -hidroxi-2-propanosulfonamida y (2R,3R)-1 -1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida y 2,4-triazol-3-il)-3-hidroxi-4,4-dimetil-2-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4,4-diastereómeros 433.0 se purificó en una columna AD-H ar una mezcla de dos diastereómeros que eluyen como s respectivamente). La mezcla se purificó más en una H320 mM) para dar el primer pico que eluye como 437.0 l2) 5 = 7,67 - 7,58 (m, 2H), 7,39 (t, J=8,6 Hz, 1H), 6,71 ,76 (s, 3H), 3,70 (s, 3H), 3,19 (q, J=6,8 Hz, 1H), 3,15 (s, /z: 506,3 (M+H)+.
2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol--N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-propil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-,3R)-1 -ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propanosulfona .
(2R,3S)-1-ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi (trimetilsilil)etil)propano-2-sulfonamida y (2R,3R)-1-1,2,4-triazol-3-il)-1 -hidroxi-N-(2-(trimetilsilil)etil)propano-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-( ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il) 2-sulfonamida, Ejemplo 438.1. A una disolución agitad triazol-3-il)-N-(2-(trimetilsilil)etil)etanosulfonamida 5.0 (2 litio (2,5 M, 231 pl, 0,58 mmol). La reacción se agitó du (0,040 g, 0,58 mmol) y la reacción se agitó durante cloruro amónico para inactivar la reacción, y la reacci EtOAc. El material así obtenido se purificó en gel de compuesto deseado 438.1. (0,135 g, 0,23 mmol, 60% d in-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(2-propil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-lfonamida y (2S,3S)-1 -ciclopropil-N-(4-(2,6-dimetoxifenil)-imetilsilil)etil)propano-2-sulfonamida y (2S,3R)-1 --1,2,4-triazol-3-il)-1-hidroxi-N-(2-(trimetilsilil)etil)propano-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-g, 0,39 mmol) en THF (1924 pl) -78eC se añadió n-butile 10 min y después se añadió ciclopropanocarbaldehído -78°C. Después, se añadió una solución saturada de se calentó a TA La mezcla de reacción se extrajo con eluyendo con EtOAc en hexano al 0-20% para dar el dimiento). LCMS-ESI (POS.) m/z: 590,3 (M+H)+.
(2R,3S)-1-ciclopropil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi propanosulfonamida y (2S,3S)-1 -ciclopropil-N-(4-(2, hidroxi-2-propanosulfonamida y (2R,3R)-1 -ciclopropil-N 3-il)-1 -hidroxi-2-propanosulfonamida y (2S,3R)-1 -ciclop triazol-3-il)-1-hidroxi-2-propanosulfonamida, Ejemplo 43 añadió dMf (1,14 ml) seguido de difluorotrimetilsilicato mezcla se calentó con cuidado a 60°C y se continuó agi agua. La mezcla de reacción se extrajo con EtOAc y s purificó en gel de sílice eluyendo con EtOAc en heptan mg, 0,20 mmol, 89% de rendimiento) como una m iridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazoll-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-A un vial que contenía 438.1 (0,165 g, 0,27 mmol) se ris(dimetilamino)sulfonio, TASF (0,189 g, 0,69 mmol). La o. Después de 4 h, la mezcla se enfrió a TA y se añadió ncentraron a vacío. El producto obtenido inicialmente se 0-70% para dar 438.0 en forma de un sólido blanco (100 a racémica de diastereómeros en una relación ~2:1
(determinado por 1H RMN, sin :anti). 1H RMN (500 MH 7,57 (m, 1H), 7,39 (t, J=8,4 Hz, 1H), 6,71 (dd, J=1,0, 8, (s, 2H), 3,73 (s, 1H), 3,71 (s, 1H), 3,70 (s, 2H), 3,46 - 3, (d, J=1,2 Hz, 0,7H), 3,10 (dd, J=1,1, 7,0 Hz, 1H), 1,40 -0,10 (m, 1H). LCMS-ESI (POS.) m/z: 490,3 (M+H)+.
Ejemplo 439.0: Preparación de (1R,2S)-1-cicIopropiI-3-iI)-1 -hidroxi-2-propanosuIfonamida o (1 S,2R)-1 -cicIo triazoI-3-iI)-1-hidroxi-2-propanosuIfonamida.
2CI2) 5 = 10,96 (br. s., 1H), 7,67 - 7,61 (m, 1H), 7,61 -1H), 6,70 - 6,64 (m, 2H), 4,02 (d, J=2,0 Hz, 0,3H), 3,77 , 0,7H), 3,20 - 3,16 (m, 0,3H), 3,16 - 3,13 (m, 3H), 3,12 (m, 3H), 0,92 - 0,81 (m, 1H), 0,59 - 0,29 (m, 3H), 0,18 -
,6-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-triazoI-N-(4-(2,6-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-
(1 R,2S)-1 -cicIopropiI-N-(4-(2,6-dimetoxifeniI)-5-(6-metox propanosuIfonamida o (1 S,2R)-1 -cicIopropiI-N-(4-(2, hidroxi-2-propanosuIfonamida, EjempIo 439.0. La mezcI con coIumnas 250x30 mm IC a 55 g/min de MeOH(+ g/min. Presión de saIida = 100 bar; Temperatura. = 22° muestra en 11 mI de MeOH:DCM (6:5) (9,1 mg/mI), es como 439.0 (99%ee, 0,024 g, 0,048 mmoI). 1H RMN ( 7,39 (t, J=8,4 Hz, 1H), 6,72 (dd, J=1,0, 8,1 Hz, 1H), 6 3,44 (dd, J=1,1, 8,4 Hz, 1H), 3,15 (s, 3H), 3,09 (dq, J= Hz, 2H), 0,57 - 0,51 (m, 1H), 0,45 - 0,33 (m, 2H), 0,18 -
EjempIo 440.0: Preparación de (1R,2S)-1-cicIopropiI-3-iI)-1 -hidroxi-2-propanosuIfonamida o (1 S,2R)-1 -cicIo triazoI-3-iI)-1-hidroxi-2-propanosuIfonamida.
idiniI)-4H-1,2,4-triazoI-3-iI)-1 -hidroxi-2-etoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-triazoI-3-iI)-1 -diastereómeros 438.0 se purificó en una SFC Thar 350 0 mM) 45 g/min de CO2, 55% co-disoIvente, a 100 gitud de onda = 297nm. Inyectado 0,4 mI de 100 mg de 3,6 mg por inyección para dar eI primer pico que eIuye Hz, CD2CI2) 5 = 10,95 (br. s., 1H), 7,67 - 7,57 (m, 2H), dd, J=0,9, 8,5, 15,8 Hz, 2H), 3,77 (s, 3H), 3,70 (s, 3H), ,0 Hz, 1H), 1,38 (d, J=7,1 Hz, 3H), 0,86 (tq, J=5,1, 8,1 m, 1H). LCMS-ESI (POS.) m/z: 490,3 (M+H)+.
,6-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-triazoI-N-(4-(2,6-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-
(1 R,2S)-1 -cicIopropiI-N-(4-(2,6-dimetoxifeniI)-5-(6-metox propanosuIfonamida o (1 S,2R)-1 -cicIopropiI-N-(4-(2, hidroxi-2-propanosuIfonamida, EjempIo 440.0. La mezcI con coIumnas 250x30 mm IC a 55 g/min de MeOH(+N g/min. Presión de saIida = 100 bar; Temperatura. = 22° muestra en 11 mI de MeOH:DCM (6:5) (9,1 mg/mI), es como 440.0 (98%ee, 0,024 g, 0,048 mmoI). 1H RMN ( 7,39 (t, J=8,6 Hz, 1H), 6,72 (dd, J=1,0, 8,1 Hz, 1H), 6, 8,3 Hz, 1H), 3,15 (s, 3H), 3,12 - 3,05 (m, 1H), 1,38 (d, 0,34 (m, 2 H), 0,18 - 0,11 (m, 1H). Lc Ms -Es I (pOs .) aisIaron.
EjempIo 441.0: Preparación de (2R,3S)-1-cicIohexiI-N-( iI)-1 -hidroxi-2-propanosuIfonamida y (2S,3S)-1 -cicIo triazoI-3-iI)-1 -hidroxi-2-propanosuIfonamida y (2r ,3R)-1 1,2,4-triazoI-3-iI)-1 -hidroxi-2-propanosuIfonamida y piridiniI)-4H-1,2,4-triazoI-3-iI)-1-hidroxi-2-propanosuIfona idiniI)-4H-1,2,4-triazoI-3-iI)-1 -hidroxi-2-etoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-triazoI-3-iI)-1 -diastereómeros 438.0 se purificó en una SFC Thar 350 mM) 45 g/min de CO2, 55% de co-disoIvente, a 100 gitud de onda = 297nm. Inyectado 0,4 mI de 100 mg de 3,6 mg por inyección para dar eI cuarto pico que eIuye Hz, CD2CI2) 5 = 10,95 (br. s., 1H), 7,67 - 7,57 (m, 2H), ,63 (m, 2H), 3,77 (s, 3H), 3,70 (s, 3H), 3,44 (dd, J=1,0, Hz, 3H), 0,91 - 0,79 (m, 4H), 0,57 - 0,51 (m, 1H), 0,44 -490,3 (M+H)+. Los diastereómeros minoritarios no se
-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-triazoI-3-N-(4-(2,6-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-1,2,4-hexiI-N-(4-(2,6-dimetoxifeniI)-5-(6-metoxi-2-piridiniI)-4H-,3R)-1 -cicIohexiI-N-(4-(2,6-dimetoxifeniI)-5-(6-metoxi-2-
(2R,3S)-1-ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxip (trimetilsilil)etil)propano-2-sulfonamida y (2R,3R)-1-ciclo triazol-3-il)-1-hidroxi-N-(2-(trimetilsilil)etil)propano-2-sulfo metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(2-(tri (4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida, Ejemplo 441.1. A una disolución agitada triazol-3-il)-N-(2-(trimetilsilil)etil)etanosulfonamida 5.0 (2 butil-litio (2,5 M, 231 pl, 0,577 mmol). La reacción ciclohexanoscarbaldehído (0,040 g, 0,577 mmol) y la re solución saturada de cloruro amónico para inactivar y l con EtOAc. El material así obtenido se purificó en gel d compuesto deseado 441.1. (0,169 g, 0,27 mmol, 70% de -2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(2-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-a y (2S,3S)-1-ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-ilil)etil)propano-2-sulfonamida y (2S,3R)-1 -ciclohexil-N--il)-1-hidroxi-N-(2-(trimetilsilil)etil)propano-2-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-, 0,39 mmol) en THF (1,92 ml) a - 782C se añadió nitó durante 10 min, después de lo cual se añadió se agitó durante 1 h a -78°C. Después, se añadió una ción se calentó a TA La mezcla de reacción se extrajo e eluyendo con EtOAc en hexano al 0-20% para dar el imiento). LCMS-ESI (POS.) m/z: 632,3 (M+H)+.
(2R,3S)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipropanosulfonamida y (2S,3S)-1 -ciclohexil-N-(4-(2, hidroxi-2-propanosulfonamida y (2R,3R)-1 -ciclohexil-N 3-il)-1 -hidroxi-2-propanosulfonamida y (2S,3R)-1 -ciclo triazol-3-il)-1-hidroxi-2-propanosulfonamida, Ejemplo 44 añadió DMF (1,34 ml) seguido de difluorotrimetilsilicato mezcla se calentó con cuidado a 60°C y se continuó agi agua. La mezcla de reacción después se extrajo con Et sílice eluyendo con EtOAc en heptano al 0-70% para d 77% de rendimiento) y una mezcla de diastereómeros 1H RMN (500 MHz, CD2CL) 5 = 10,98 (br. s., 1H), 7,67 (dd, J=0,7, 8,1 Hz, 1H), 6,69 - 6,63 (m, 2H), 3,83 (dd, J 3,70 (s, 2,4H), 3,58 (d, J=8,6 Hz, 0,2H), 3,15 (s, 3H), inil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-toxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-un vial que contenía 441.1 (0,169 g, 0,27 mmol) se (dimetilamino)sulfonio, TASF (0,221 g, 0,80 mmol). La . Después de 4 h, la mezcla se enfrió a TA y se añadió se concentró a vacío. El producto se purificó en gel de .0 en forma de un sólido blanco (110 mg, 0,207 mmol, a relación ~3.3:1 (determinado por 1H RMN, sin :anti). (m, 1H), 7,61 - 7,57 (m, 1H), 7,42 - 7,35 (m, 1H), 6,71 9,2 Hz, 0,8H), 3,76 (s, 2,4H), 3,72 (d, J=5,1 Hz, 1,2H), 3,05 (m, 1H), 2,05 (d, J=13,0 Hz, 1H), 1,79 - 1,67 (m,
2H), 1,63 (d, J=10,5 Hz, 1H), 1,54 - 1,40 (m, 2H), 1,33 (POS.) m/z: 532,3 (M+H)+.
Ejemplo 442.0: Preparación de (1R,2S)-1-ciclohexil-N-( il)-1 -hidroxi-2-propanosulfonamida o (1 S,2R)-1 -ciclo triazol-3-il)-1 -hidroxi-2-propanosulfonamida.
8 (m, 6H), 0,89 (dquin, J=3,4, 12,6 Hz, 2H). LCMS-ESI
-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-
(1 R,2S)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipropanosulfonamida o (1S,2R)-1 -ciclohexil-N-(4-(2, hidroxi-2-propanosulfonamida, Ejemplo 442.0. La mezcl SFC en una columna AS-H con MeOH/CO2 al 25%, 10 442.0 (99%ee, 0,037 g, 0,070 mmol). 1H RMN (500
6,71 (dd, J=1,5, 7,6 Hz, 1H), 6,69 - 6,63 (m, 2H), 3,86 ( (q, J=6,8 Hz, 1H), 2,07 (d, J=13,0 Hz, 1H), 1,76 - 1,67 ( - 1,10 (m, 7H), 0,97 - 0,83 (m, 2H). LCMS-ESI (POS.) m
Ejemplo 443.0: Preparación de (1R,2S)-1-ciclohexil-N-( il)-1 -hidroxi-2-propanosulfonamida o (1 S,2R)-1 -ciclo triazol-3-il)-1-hidroxi-2-propanosulfonamida.
dinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -diastereómeros 441.0 se purificó en un instrumento de ; 70 ml/min, 220 nm; para dar el primer pico que eluye Ü2Cl2) 5 = 7,66 - 7,59 (m, 2H), 7,39 (t, J=8,6 Hz, 1H), 9,3 Hz, 1H), 3,75 (s, 3H), 3,70 (s, 3H), 3,15 (s, 3H), 3,10 ), 1,63 (d, J=11,0 Hz, 1H), 1,51 (d, J=12,5 Hz, 1H), 1,35 2,3 (M+H)+.
-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-
(1 R,2S)-1 -ciclohexil-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipropanosulfonamida o (1S,2R)-1 -ciclohexil-N-(4-(2, hidroxi-2-propanosulfonamida, Ejemplo 443.0. La mezcl SFC en una columna AS-H con MeOH/CO2 al 25%, 10 como 443.0 (99%ee, 0,036 g, 0,068 mmol). 1H RMN ( 1H), 6,71 (dd, J=1,3, 7,5 Hz, 1H), 6,67 (t, J=8,4 Hz, 2H 3H), 3,11 (q, J=6,8 Hz, 1H), 2,07 (d, J=12,7 Hz, 1H), J=12,5 Hz, 1H), 1,36 - 1,10 (m, 7H), 0,97 - 0,83 (m, 2H).
Ejemplo 444.0: Preparación de (1S,2S)-N-(4-(2,6-dimet 1 -(tetrahidro-2H-pirano-4-il)-2-propanosulfonamida y 1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2 metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetra (2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazo propanosulfonamida.
dinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -diastereómeros 441.0 se purificó en un instrumento de ; 70 ml/min, 220 nm; para dar el cuarto pico que eluye Hz, CÜ2Cl2) 5 = 7,67 - 7,59 (m, 2H), 7,39 (t, J=8,6 Hz, 6 (d, J=9,3 Hz, 1H), 3,76 (s, 3H), 3,70 (s, 3H), 3,15 (s, (d, J=11,2 Hz, 2H), 1,63 (d, J=11,2 Hz, 1H), 1,51 (d, S-ESI (POS.) m/z: 532,3 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-anosulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-H-pirano-4-il)-2-propanosulfonamida y (1 S,2R)-N-(4--1-hidroxi-1-(tetrahidro-2H-pirano-4-il)-2-
(2R,3S)-1-tetrahidro-2H-pirano-4-il-N-(4-(2,6-dimetoxifen (trimetilsilil)etil)propano-2-sulfonamida y (2R metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(2-(tri 2H-pirano-4-il-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-(trimetilsilil)etil)propano-2-sulfonamida y (2S metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(2-(tri disolución agitada de N-(4-(2,6-di (trimetilsilil)etil)etanosulfonamida 5.0 (200 mg, 0,389 m 231 pl, 0,58 mmol). La reacción se agitó durante 10 Scientific, 0,066 g, 0,577 mmol) y la reacción se agit saturada de cloruro amónico para inactivar la reacción extrajo con EtOAc. El material así obtenido se purificó e dar el compuesto deseado 444.1 (0,17 g, 0,27 mmol, 70 (6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(2--1-tetrahidro-2H-pirano-4-il-N-(4-(2,6-dimetoxifenil)-5-(6-ilil)etil)propano-2-sulfonamida y (2S,3S)-1 -tetrahidro-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(2--1-tetrahidro-2H-pirano-4-il-N-(4-(2,6-dimetoxifenil)-5-(6-ilil)etil)propano-2-sulfonamida, Ejemplo 444.1. A una xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-N-(2-en THF (1,92 ml) a -782C se añadió n-butil-litio (2,5 M, y después se añadió 4-formiltetrahidropirano (Frontier rante 1 h a -78°C. Después, se añadió una solución a reacción se calentó a TA La mezcla de reacción se de sílice eluyendo con EtOAc en hexano al 0-20% para rendimiento). LCMS-ESI (POS.) m/z: 634,4 (M+H)+.
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida y (2S,3S)-N-(4-(2,6-dimetoxi (tetrahidro-2H-pirano-4-il)-2-propanosulfonamida y (2R triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-propa metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetrah un vial que contenía 444.1 (0,17 g, 0,27 mmol) se
tris(dimetilamino)sulfonio, TASF (0,222 g, 0,81 mmol). agitando. Después de 4 h, la mezcla se enfrió a TA y se se concentró a vacío. El residuo se purificó en gel de 444.0 en forma de un sólido blanco (100 mg, 0,19 mm una relación ~3,3:1 (determinado por 1H Rm N, sin :anti (m, 2H), 7,43 - 7,35 (m, 1H), 6,74 - 6,70 (m, 1H), 6,72 ,4-triazol-3-il)-1-hidroxi-1-(tetrahidro-2H-pirano-4-il)-2-)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-lfonamida y (2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-2H-pirano-4-il)-2-propanosulfonamida, Ejemplo 444.0. A ó DMF (1,34 ml) seguido de difluorotrimetilsilicato de mezcla se calentó con cuidado a 60°C y se continuó dió agua. La mezcla de reacción se extrajo con EtOAc y eluyendo con EtOAc en heptanos al 0-70% para dar 0% de rendimiento) y una mezcla de diastereómeros en N (400 MHz, CD2CL) 5 = 10,98 (br. s., 1H), 7,68 - 7,56 J=1,0, 8,0 Hz, 1H), 6,69 - 6,63 (m, 2H), 4,03 - 3,85 (m,
3H), 3,76 (s, 2,3H), 3,73 (s, 0,7H), 3,71 (s, 0,7H), 3,70 3,21 (d, J=1,4 Hz, 0,7H), 3,15 (s, 3H), 3,10 - 2,99 (m, 1H), 1,36 - 1,16 (m, 5H).LCMS-ESI (POS.) m/z: 534,2 (
Ejemplo 445.0: Preparación de (1 S,2R)-N-(4-(2,6-dimet 1 -(tetrahidro-2H-pirano-4-il)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2 H), 3,59 - 3,52 (m, 0,3H), 3,30 (tt, J=2,7, 11,8 Hz, 2H), ,95 - 1,86 (m, 1H), 1,82 - 1,63 (m, 1H), 1,61 - 1,46 (m, .
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-nosulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimeto (tetrahidro-2H-pirano-4-il)-2-propanosulfonamida, Ejem un instrumento de SFC en una columna IA-H con MeO pico que eluye, que era una mezcla de dos diastereóm en una columna AS-H con EtOH/CO2 al 25%, 100 bar; 445.0 (99%ee, 0,035 g, 0,066 mmol). 1H RMN (400 MH 1H), 6,69 - 6,63 (m, 2H), 3,95 - 3,89 (m, 2H), 3,89 - 3,8 - 3,12 (m, 3H), 3,07 - 2,99 (m, 1H), 1,91 (dd, J=1,9, 13, (POS.) m/z: 534,2 (M+H)+.
Ejemplo 446.0: Preparación de (1S,2S)-N-(4-(2,6-dimet 1 -(tetrahidro-2H-pirano-4-il)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2 ,4-triazol-3-il)-1-hidroxi-1-(tetrahidro-2H-pirano-4-il)-2--5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -5.0. La mezcla de diastereómeros 444.0 se purificó en al 25%, 100 bar; 60 ml/min, 220 nm; para dar el primer Esta mezcla se purificó más en un instrumento de SFC min, 220 nm; para dar el segundo pico que eluye como 2Ch) 5 = 7,39 (t, J=8,5 Hz, 1H), 6,71 (dd, J=1,0, 8,0 Hz, 1H), 3,76 (s, 3H), 3,70 (s, 3H), 3,35 - 3,25 (m, 2H), 3,18 1H), 1,61 - 1,47 (m, 2H), 1,37 - 1,20 (m, 5H). LCMS-ESI
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-nosulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 R,2R)-N-(4-(2,6-dimetox (tetrahidro-2H-pirano-4-il)-2-propanosulfonamida, Ejem un instrumento de SFC en una columna IA-H con MeO pico que eluye, que era una mezcla de dos diastereóm una columna AS-H con EtOH /CO2 al 25%, 100 bar; 6 446.0 (99%ee, 0,023 g, 0,043 mmol). 1H RMN (400 6,72 (dd, J=1,0, 8,0 Hz, 1H), 6,69 - 6,63 (m, 2H), 3,97 Hz, 1H), 3,38 - 3,24 (m, 2H), 3,15 (s, 3H), 3,08 (quin, 1H), 1,43 - 1,32 (m, 2H), 1,32 - 1,28 (m, 3H). LCMS-ESI
Ejemplo 447.0: Preparación de (1 S,2R)-N-(4-(2,6-dimet 1 -(tetrahidro-2H-pirano-4-il)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2 ,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2--5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -6.0. La mezcla de diastereómeros 444.0 se purificó en al 25%, 100 bar; 60 ml/min, 220 nm; para dar el primer Esta mezcla se purificó más en instrumento de SFC en in, 220 nm; para dar el segundo pico que eluye como D2Cb) 5 = 7,68 - 7,56 (m, 2H), 7,39 (t, J=8,5 Hz, 1H), (m, 2H), 3,73 (s, 3H), 3,71 (s, 3H), 3,56 (dd, J=3,4, 8,1 Hz, 1H), 1,83 - 1,65 (m, 2H), 1,59 (dq, J=4,5, 12,3 Hz, .) m/z: 534,2 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-nosulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 ,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetox (tetrahidro-2H-pirano-4-il)-2-propanosulfonamida, Ejemp un instrumento de SFC en una columna IA-H con M segundo pico que eluye como 447.0 (98%ee, 0,035 g, 1H), 7,67 - 7,56 (m, 2H), 7,37 (t, J=8,5 Hz, 1 H), 6,73 -3,36 - 3,23 (m, 2H), 3,15 (s, 3H), 3,10 - 2,96 (m, 2H), 1, 6H). LCMS-ESI (POS.) m/z: 534,2 (M+H)+.
Ejemplo 448.0: Preparación de (1S,2S)-N-(4-(2,6-dimet 1 -(tetrahidro-2H-pirano-4-il)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -7.0. La mezcla de diastereómeros 444.0 se purificó en O2 al 25%, 100 bar; 60 ml/min, 220 nm; para dar el mmol). 1H RMN (400 MHz, CD2Ó 2) 5 = 7,67 - 7,56 (m, (m, 3H), 3,97 - 3,84 (m, 3H), 3,74 (s, 3H), 3,70 (s, 3H), J=13,1 Hz, 1H), 1,54 (d, J=9,2 Hz, 1H), 1,42 - 1,14 (m,
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-nosulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 R,2R)-N-(4-(2,6-dimetox (tetrahidro-2H-pirano-4-il)-2-propanosulfonamida, Ejemp un instrumento de SFC en una columna IA-H con MeO pico que eluye como 448.0 (97%ee, 0,010 g, 0,019 m 7,38 (t, J=8,4 Hz, 1H), 6,74 - 6,61 (m, 3H), 3,91 (d, J=1 1H), 3,38 - 3,25 (m, 3H), 3,15 (s, 3H), 3,11 (d, J=7,2 Hz, Hz, 3H). LCMS-ESI (POS.) m/z: 534,2 (M+H)+.
Ejemplo 449.0: Preparación de (2S,3R)-N-(4-(4,6-dime (5-fluoro-2-pirimidinil)-2-butanosulfonamida y (2R,3S)-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida ,4-triazol-3-il)-1 -hidroxi-1 -(tetrahidro-2H-pirano-4-il)-2--5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -8.0. La mezcla de diastereómeros 444.0 se purificó en al 25%, 100 bar; 60 ml/min, 220 nm; para dar el tercer H RMN (400 MHz, CD2Cl2) 5 = 7,61 (d, J=9,4 Hz, 2H), z, 2H), 3,71 (d, J=4,5 Hz, 6H), 3,58 (dd, J=3,3, 7,0 Hz, 1,83 - 1,51 (m, 3H), 1,47 - 1,35 (m, 2H), 1,28 (d, J=6,8
-pirimidinil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-4,6-dimetoxi-5-pirimidinil)-5-(5-metil-3-piridinil)-4H-1,2,4-
(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(5-metil-3-piri butanosulfonamida y (2R,3S)-N-(4-(4,6-dimetoxi-5-pirim pirimidinil)-2-butanosulfonamida, Ejemplo 449.0. A una 0,24 mmol) y 10.1 (80%ee, 0,05 g, 0,214 mmol) en A mmol). La reacción se agitó a 23°C durante 16 h. A la mmol) y 5-metilnicotinohidrazida (0,032 g, 0,21 mmol). después se filtró a través de un tapón de gel de sílice 1,4-dioxano (2.14 ml) y se añadió TFA (0,099 ml, 1,28 reacción después se concentró a vacío y se neutralizó La mezcla resultante se extrajo con EtOAc, se secó s material así obtenido se purificó en gel de sílice eluy 449.0 (80% ee, 0,041 g, 36% de rendimiento). 1H Rm N 8,47 (m, 2H), 8,36 (d, J=2,0 Hz, 1H), 7,61 (dt, J=0,9, 2,1 (d, J=0,7 Hz, 3H), 1,35 (d, J=7,1 Hz, 3H), 1,32 (d, J=6,8
Ejemplo 450.0: Preparación de (2S,3R)-N-(4-(4,6-dime (5-fluoro-2-pirimidinil)-2-butanosulfonamida.
4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2--5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-ción de 5-isotiocianato-4,6-dimetoxipirimidina (0,047 g, 0,43 ml) se añadió carbonato de cesio (0,091 g, 0,28 de reacción se añadió nitrato de plata(I) (0,073 g, 0,43 cción se agitó durante 10 min más a 23°C. La reacción concentró a vacío. El material así obtenido se puso en . La mezcla resultante se agitó a 90°C durante 16 h. La adición de una solución acuosa de bicarbonato sódico. sulfato magnésico, se filtró y se concentró a vacío. El con EtOAc/EtOH (3/1) en hexanos al 0-50% para dar MHz, CD2Cl2) 5 = 11,07 (br. s., 1H), 8,55 (s, 2 H), 8,51 -1H), 3,95 (s, 3H), 3,93 (s, 3H), 3,81 - 3,69 (m, 2H), 2,32 H). LCMS-ESI (POS.) m/z: 530,3 (M+H)+.
(2S,3R)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(5-metil-3-piri butanosulfonamida, Ejemplo 450.0. La mezcla de di columna de 250 x 21 mm AD-H con 14 g/min de EtOH a 55 g/min. Temperatura. = 22°C, Presión de salida = mg de muestra disuelta en 4 ml de MeOH/DCM (50% ciclo 5,5 min, Tiempo de análisis = 12 min para dar CD2Cl2) S = 11,08 - 10,83 (m, 1H), 8,55 (s, 2H), 8,51 -1H), 3,95 (s, 3H), 3,93 (s, 3H), 3,82 - 3,67 (m, 2H), 2,3 3h). LCMS-ESI (POS.) m/z: 530,3 (M+H)+.
Ejemplo 451.0: Preparación de (2S,3R)-3-(5-fluoro-2 4H-1,2,4-triazol-3-il)-2-butanosulfonamida y (2R,3S)-3-indol-3-il)-4H-1,2,4-triazol-3-il)-2-butanosulfonamida.
-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-eómeros 449.0 se purificó en una SFC Thar 80 con niaco 20 mM) 40 g/min de CO2, 27% de co-disolvente ar, Longitud de onda = 215 nm. Inyectado 0,3 ml de 40 ), c= 10 mg/ml es decir 3 mg por inyección. Tiempo de 0 (99%ee, 19,0 mg, 0,036 mmol). 1H RMN (400 MHz, (m, 2H), 8,36 (d, J=2,0 Hz, 1H), 7,61 (dt, J=0,8, 2,2 Hz, J=0,8 Hz, 3H), 1,35 (d, J=6,8 Hz, 3H), 1,32 (d, J=6,8 Hz,
idinil)-N-(5-(6-metoxi-2-piridinil)-4-(1 -metil-1 H-indol-3-il)-oro-2-pirimidinil)-N-(5-(6-metoxi-2-piridinil)-4-(1 -metil-1 H-
(2S,3R)-3-(5-fluoro-2-pirimidinil)-N-(5-(6-metoxi-2-piridin butanosulfonamida y (2R,3S)-3-(5-fluoro-2-pirimidini triazol-3-il)-2-butanosulfonamida, Ejemplo 451.0. A una g, 0,27 mmol) en ACN (0,531 ml) se añadió carbonato durante 16 h. A la mezcla de reacción se añadió nitrat (0,044 g, 0,27 mmol). Se continuó agitando durante 10 de sílice y se concentró a vacío. La mezcla de reacció (0,123 ml, 1,59 mmol). La reacción se agitó a 90°C hidrógeno bicarbonato sódico a la mezcla de reacción concentraron a vacío. El material así obtenido se p hexanos para dar 451.0 (80%ee, 0,082 g, 58% de ren 1H), 8,51 (s, 2H), 7,63 - 7,58 (m, 1H), 7,55 - 7,51 (m, J=1,0, 7,2, 8,3 Hz, 1H), 7,23 (s, 1H), 7,07 (ddd, J=0,9, 3H), 3,75 - 3,67 (m, 2H), 2,83 (s, 3H), 1,30 (d, J=6,4
(M+H)+.
Ejemplo 452.0: Preparación de (2S,3R)-N-(4-(2,6-dimet 2-pirimidinil)-2-butanosulfonamida y (2R,3S)-N-(4-(2, fluoro-2-pirimidinil)-2-butanosulfonamida.
1 -metil-1 H-indol-3-il)-4H-1,2,4-triazol-3-il)-2-(5-(6-metoxi-2-piridinil)-4-(1 -metil-1 H-indol-3-il)-4H-1,2,4-lución de 1.3 (0,05 g, 0,27 mmol) y 10.1 (80%ee, 0,062 esio (0,113 g, 0,35 mmol). La reacción se agitó a 23°C plata(I) (0,090 g, 0,53 mmol) y 6-metoxipicolinohidrazida a 23°C. La reacción se filtró a través de un tapón de gel pués se puso en 1,4-dioxano (2,65 ml) y se añadió TFA te 16 h. Después, se añadió una solución acuosa de mezcla se extrajo con EtOAc y las capas orgánicas se en gel de sílice eluyendo con EtOAc/EtOH (3/1) en nto). 1H RMN (500 MHz, CD2G 2) S = 11,22 - 10,98 (m, 7,41 - 7,36 (m, 1H), 7,30 (d, J=8,1 Hz, 1H), 7,26 (ddd, ,9 Hz, 1H), 6,65 (dd, J=0,7, 8,3 Hz, 1 h), 3,84 - 3,79 (m, ), 1,27 (d, J=6,8 Hz, 3H). LCMS-ESI (POS.) m/z: 537,2
nil)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoroetoxifenil)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H butanosulfonamida y (2R,3S)-N-(4-(2,6-dimeto pirimidinil)-2-butanosulfonamida, Ejemplo 452.0. A una 0,21 mmol) en ACN (0,43 ml) se añadió carbonato d durante 16 h. A la mezcla de reacción se añadió nitr (0.032 g, 0.21 mmol). Se continuó agitando durante 1 tapón de gel de sílice y se concentraron a vacío. El m añadió TFA (0,165 ml, 2,14 mmol). La reacción se a acuosa de hidrógeno bicarbonato sódico a la mezcla orgánicas se concentraron a vacío y se purificaron en g 60% para dar 452.0 (80% ee, 0,02 g, 17,6% de rendimi (s, 2H), 7,65 - 7,57 (m, 2H), 7,42 (t, J=8,4 Hz, 1H), 7,14 - 3,70 (m, 3H), 3,71 (s, 3H), 3,68 (s, 3H), 2,16 (s, 3H) (POS.) m/z: 528,2 (M+H)+.
Ejemplo 453.0: Preparación de (2S,3R)-N-(4-(2,6-dimet 2-pirimidinil)-2-butanosulfonamida.
-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-ción de 1.0 (0,046 g, 0,24 mmol) y 10.1 (80%ee, 0,05 g, io (0,091 g, 0,279 mmol). La reacción se agitó a 23°C plata(I) (0,073 g, 0,43 mmol), 6-metilpicolinohidrazida a 23°C. Después, la reacción se filtró a través de un l así obtenido se disolvió en 1,4-dioxano (2,1 ml), y se 90°C durante 16 h. Se añadió después una solución eacción. La mezcla se extrajo con EtOAc y las capas sílice eluyendo con EtOAc/EtOH (3/1) en heptanos al 0-. 1H RMN (500 MHz, CD2G 2) 5 = 11,03 (br. s., 1H), 8,54 8 (m, 1H), 6,68 - 6,60 (m, 2H), 3,78 - 3,72 (m, 2H), 3,71 4 (d, J=7,1 Hz, 3H), 1,31 (d, J=68 Hz, 3H). LCMS-ESI
nil)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H butanosulfonamida, Ejemplo 453.0. A una disolución de en ACN (0.86 ml) se añadió carbonato de cesio (0,182 mezcla de reacción se añadieron nitrato de plata(I) (0 mmol). Se continuó agitando durante 10 min a 23°C.
sílice y se concentró a vacío. El material así obtenid metanosulfónico (0,083 ml, 1,29 mmol). La reacción de con cuidado por adición gota a gota de una solución a extraer tres veces con DCM, Las capas orgánicas se anhidro. El producto así obtenido se cargó en una colu en hexanos al 0-80%) para dar un sólido blanco 453 (POS.) m/z: 528,2 (M+H)+.
Ejemplo 454.0: Preparación de (2S,3R)-N-(5-(6-cloro-2-2-pirimidinil)-2-butanosulfonamida.
-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-(0,088 g, 0,450 mmol) y 10.1 (99%ee, 0,1 g, 0,43 mmol) 6 mmol). La reacción se agitó a 23°C durante 16 h. A la g, 0,86 mmol) y 6-metilpicolinohidrazida (0,065 g, 0,43 és, la reacción se filtró a través de un tapón de gel de disolvió en 1,4-dioxano (1,23 ml,) y se añadió ácido s se agitó a 90°C durante 3 h. Después el pH se ajustó a saturada de bicarbonato sódico a pH~7. Después de inaron y después se secaron sobre sulfato magnésico e gel de sílice y después se purificó (EtOAc/EtOH (3/1) ,026 g, 0,049 mmol, 12% de rendimiento). LCMS-ESI
nil)-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-
(Z)-2-(6-cloropicolinoil)-N'-(2,6-dimetoxifenil)-N-(((2S,3R il)sulfonil)hidrazinacarboximidamida, Ejemplo 454.0. El -fluoropirimidin-2-il)butan-2-puesto del título se preparó siguiendo el Ejemplo A
usando 1.0, 10.1 (0,15 g, 0,350 mmol) y 6-cloropicolinohi 454.0 (0,05 g, 0,091 mmol, 33% de rendimiento). 1H 7,80 (dd, J=0,8, 7,6 Hz, 1H), 7,70 (t, J=7,8 Hz, 1H), 7,45 J=6,7, 7,7 Hz, 2H), 3,78 - 3,75 (m, 1H), 3,74 (s, 3H), 3,71 ( J=6,8 Hz, 3H). LCMS-ESI (POS.) m/z: 548,2 (M+H)+.
Ejemplo 455.0: Preparación de (2S,3R)-N-(4-(2,6-dimetox 2 -pirimidinil)-2 -butanosulfonamida.
da (0,060 g, 0,350 mmol) para dar un sólido blanco
(400 MHz, CD2G 2) ó = 11,20 - 11,00 (m, 1H), 8,54 (s, 2H), 8,5 Hz, 1H), 7,30 (dd, J=0,9, 7,9 Hz, 1H), 6,68 (dd,
), 3,80 - 3,70 (m, 8 H), 1,34 (d, J=6,8 Hz, 3H), 1,31 (d,
-5-(6-fenil-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-fenil-2-piridinil)-4H-1,2 butanosulfonamida, Ejemplo 455.0. Se añadieron 454.0 ( mmol), triciclohexilfosfina (3,38 mg, 0,012 mmol), y Pd2( desgasificó y se volvió a llenar con nitrógeno. Se añadiero potásico tribásico (0,015 ml, 0,181 mmol) por jeringa. La mezcla de reacción después se enfrió a TA Los compu residuo se filtró a través de un tapón de gel de sílice, des heptanos al 0-20%) para dar 455.0 (0,0041 g, 6,77 pmol, 10,98 (br. s., 1H), 8,53 (s, 2H), 7,78 (dd, J=7,6, 8,3 Hz, 1H 7,13 (m, 1H), 6,95 (dd, J=0,7, 8,3 Hz, 1H), 6,76 - 6,70 (m, 3,52 (s, 3H), 1,31 (d, J=6,8 Hz, 3H), 1,27 (d, J=6,6 Hz, 3H).
Ejemplo 456.0: Preparación de (2S,3R)-N-(4-(2,6-dimeto (5-fluoro-2-pirimidinil)-2-butanosulfonamida.
zol-3-il)-3-(5-fluoro-2-pirimidinil)-2-g, 0,060 mmol), ácido fenilborónico (0,015 g, 0,12 (5,51 mg, 6,02 pmol) en un vial que después se ial 1,4-dioxano (1,0 ml) y solución acuosa de fosfato ción resultante se calentó a 100°C durante 2 h. La orgánicos se concentraron a presión reducida. El se cargó en una columna de gel de sílice (EtOAc en % de rendimiento). 1H RMN (500 MHz, CD2G 2) 5 = 6 (dd, J=0,7, 7,6 Hz, 1H), 7,31 - 7,24 (m, 3H), 7,18 -6,47 - 6,40 (m, 2H), 3,75 - 3,64 (m, 2H), 3,55 (s, 3H), S-ESI (POS.) m/z: 590,0 (M+H)+.
l)-5-(1-oxido-6-fenil-2-piridinil)-4H-1,2,4-triazol-3-il)-3-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(1-oxido-6-fenil-2-piridinil butanosulfonamida, Ejemplo 456.0. La elución adicional e 9,67 pmol, 16% de rendimiento). 1H RMN (500 MHz, CD2C 7,8 Hz, 1H), 7,84 (t, J=7,9 Hz, 1H), 7,77 (dd, J=0,9, 7,9 H 7,27 (m, 2H), 6,76 - 6,70 (m, 2H), 3,80 - 3,72 (m, 2H), 3, J=6,6 Hz, 3H). LCMS-ESI (POS.) m/z: 606,2 (M+H)+.
Ejemplo 457.0: Preparación de (2R)-2-(4-cloro-2-(metilsulf 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida y (2S)-2-(4-clo 3-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida.
1,2,4-triazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-condiciones descritas en 455.0 dio 456.0 (0,0057 g, 11,29 - 10,92 (m, 1H), 8,55 (s, 2H), 7,95 (dd, J=0,7, ), 7,49 (t, J=8,6 Hz, 1H), 7,38 - 7,32 (m, 3H), 7,32 -, 3H), 3,66 (s, 3H), 1,35 (d, J=6,8 Hz, 3H), 1,32 (d,
enil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-
(2R)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil) -metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanosulfonamida y (2S)-2-(4-cloro-2-(m 4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanos de 50 ml se añadió 6.0 (276 mg, 0,56 mmol) en THF (5 pentano (0,398 ml, 0,676 mmol)) mediante jeringa en at agitó a -78°C durante 10 min y después se añadió gota mercado en Matrix Scientific, SC, Ee .UU.) (136 mg, 0,6 N2 a -78°C con agitación. La mezcla de reacción se dejó acuosa saturada de NH4CL La mezcla de reacción se di se combinaron y se lavaron con salmuera y se secaron para dar el material inicial en forma de un aceite amarill gradiente de EtOAc en DCM de 0% a 100%) para prop en forma de un sólido amarillo claro. LCMS-ESl (pOs ), fonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-mida, Ejemplo 457.1. En un matraz de fondo redondo e añadió gota a gota terc-butil-litio (solución 1,7 M en ra de N2 a -78°C con agitación. La solución después se 4-cloro-2-(metilsulfonil)benzaldehído (disponible en el ol) en THF (1,5 ml) mediante jeringa en atmósfera de tar a 23°C durante 2 h antes de inactivar con solución on agua y se extrajo con EtOAc. Las capas orgánicas e Na2SO4. La solución se filtró y se concentró a vacío , que se purificó por cromatografía en gel de sílice (un ar 457.1 (160 mg, 0,226 mmol, 40,1% de rendimiento) 08,2 (M+H)+.
(2R)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife hidroxietanosulfonamida y (2S)-2-(4-cloro-2-(metilsulfoni triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 457.0. desprotección como se describe en el Ejemplo 264.0. El 1H RMN (500 MHz, CD3OD) 5 8,54 (s, 1H), 8,40 (s, 1 J=8,44, 2,32 Hz, 1H), 7,55 (t, J=8,34 Hz, 1H), 6,82 - 6,8 (s, 3H), 3,54 - 3,60 (m, 1 H), 3,45 - 3,52 (m, 1H), 3,13 (s,
Ejemplo 458.0: Preparación de (2R)-2-(4-cloro-2-(metils 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o (2S)-2-(4-3-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamid (5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-mpuesto del título se preparó a partir de 457.1 por uesto del título 457.0 se obtuvo como una sal de TFA.
97 (d, J=2,45 Hz, 1H), 7,84 - 7,88 (m, 2H), 7,74 (dd, 2H), 6,01 (dd, J=7,82, 4,40 Hz, 1H), 3,84 (s, 3H), 3,79 ,37 (s, 3H). LCMS-ESl (POS), m/z: 608,2 (M+H)+.
l)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-
(2R)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife hidroxietanosulfonamida o (2S)-2-(4-cloro-2-(metils 1.2.4- triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 4 una columna CC4 cuando se somete 457.0 a las sigui columna de 250x30 150x30 mm CC4 con 44 g/min disolvente a 80 g/min. Temperatura. = 27°C, Presión de de 80 mg de muestra disuelta en 5 ml de MeOH; c= 16, Tiempo de análisis 22,0 min. 1H RMN (500 MHz, CD3OD 7,86 (d, J=8,3 Hz, 1 H), 7,74 (dd, J=8,4, 2,3 Hz, 1H), 7, 2H), 6,03 (t, J=6,0 Hz, 1H), 3,81 (s, 3H), 3,76 (s, 3H), 3, m/z: 608,2 (M+H)+.
Ejemplo 459.0: Preparación de (2R)-2-(4-cloro-2-(metils 1.2.4- triazol-3-il)-2-hidroxietanosulfonamida o (2S)-2-( 3-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamid 5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-l)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-El compuesto del título era el primer isómero en eluir de condiciones de SFC: Realizado en SFC Thar 80 con eOH (+NH320 mM) 36 g/min de CO2, 55% de co-99 bar, Longitud de onda = 277 nm. Inyectado 1,0 ml ml y 16,0 mg por inyección. Tiempo de ciclo = 8,0 min, 41 (br. s., 1H), 8,30 (br. s., 1H), 7,97 (d, J=2,4 Hz, 1H), 1H), 7,50 (t, J=8,6 Hz, 1H), 6,81 (dd, J=14,5, 8,4 Hz, 9 (m, 2H), 3,16 (s, 3H), 2,31 (s, 3H) LCMS-ESl (POS),
l)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-o-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-
(2R)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida o (2S)-2-(4-cloro-2-(metil 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 4 columna CC4 cuando se somete 457.0 a las condicion m/z: 608,2 (M+H)+.
Ejemplo 460.0: Preparación de N-(4-(2,6-dimetoxifenil) 2-oxotetrahidro-1 (2H)-pirimidinil)etanosulfonamida.
-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-il)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-El Ejemplo 459.0 era el segundo isómero en eluir de la SFC descritas en el Ejemplo 458.0. LCMS-ESI (POS),
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-((6R)-3,6-dimetil-
N,N-bis(4-metoxibencil)etenosulfonamida, Ejemplo 460. metoxibencil)amina 12.01 (23,16 g, 90 mmol) y TEA (a hielo), se añadió gota a gota cloruro de 2-cloro-1-etano La mezcla de reacción se agitó a 0°C durante 3 h desp que la reacción se había completado. La mezcla de re orgánico se lavó con salmuera y se secó sobre Na2S material inicial en forma de un aceite amarillo claro, qu de EtOAc en hexanos al 0-60%), para proporcionar 4 sólido blanco. LCMS-ESI (POS), m/z: 370,1 (M+Na)+.
un matraz de fondo redondo de 1 litro se añadió bis(4-(43,8 ml, 315 mmol)) en DCM (200 ml). A 0°C (baño de ilo (10,41 ml, 99 mmol) en DCM (100 ml) con agitación. e completarse la adición. El análisis de LCMS indicaba se diluyó con agua y se extrajo con DCM. El extracto a solución se filtró y se concentró a vacío para dar el urificó por cromatografía en gel de sílice (un gradiente 23 g, 66,2 mmol, 74% de rendimiento) en forma de un
(R)-(3-((2-(N,N-bis(4-metoxibencil)sulfamoil)etil)amino) de fondo redondo de 250 ml se añadió 460.1 (0,463 (disponible en el mercado en J & W Pharmlab LLC, PA, reacción se agitó a 60°C en atmósfera de N2 durante vacío para dar el material inicial de 460.2 en forma de etapa sin purificación. LCMS-ESI (POS), m/z: 536,3 (M arbamato de terc-butilo, Ejemplo 460.2. En un matraz 3 mmol) y (R)-(3-aminobutil)carbamato de terc-butilo U.) (0,251 g, 1,33 mmol) en MeOH (8 ml). La mezcla de La solución de la mezcla de reacción se concentró a lícula incolora, que se usó directamente en la siguiente
(R)-N,N-bis(4-metoxibencil)-2-(6-metil-2-oxotetrahidropiri matraz de 250 ml se añadió 460.2 (0,714 g, 1,33 mmol) en 1,4-dioxano, 5,00 ml, 20,0 mmol) a 23°C con agitaci 20 min. El análisis de LCMS indicaba la reacción se concentró a vacío. El residuo se coevaporó con tolueno de fondo redondo de 250 ml se añadió el producto inic añadió gota a gota 1,1 '-carbonildiimidazol (0,4 M en DC se agitó a 23°C durante 15 h. El análisis de LCMS indic intermedio ciclado. La mezcla de reacción se agitó a 90 la reacción se había completado. La mezcla de reacc orgánico se lavó con salmuera y se secó sobre Na2S material inicial en forma de un aceite amarillo claro, qu de EtOAc en DCM al 0-100%, con EtOH en EtOAc al 2 rendimiento) en forma de un sólido blanquecino. LCMS-1(2H)-il)etanosulfonamida, Ejemplo 460.3. En un CM (6 ml). Se añadió ácido clorhídrico (solución 4,0 M a mezcla de reacción después se agitó a 23°C durante a completado. La solución de la reacción después se cío dos veces antes de la siguiente etapa. En un matraz DIEA (1,04 ml, 6,66 mmol) en 1,4-dioxano (30 ml). Se ,67 ml, 1,47 mmol) con agitación. La solución resultante formación del producto deseado junto con un producto rante 90 min. El análisis de LCMS después mostró que e diluyó con agua y se extrajo con DCM. El extracto a solución se filtró y se concentró a vacío para dar el purificó por cromatografía en gel de sílice (un gradiente para proporcionar 460.3 (0,42 g, 0,910 mmol, 68,3% de POS), m/z: 462,2 (M+H)+.
(R)-2-(3,6-dimetil-2-oxotetrahidropirimidin-1(2H)-il)-N,N-matraz de fondo redondo de 100 ml se añadieron bis(trimetilsilil)amida de potasio (1,0 M en THF, 1,14 ml mezcla de reacción se agitó a -78°C durante 5 min y mezcla de reacción después se agitó y se dejó calent reacción se había completado. La mezcla de reacción después se extrajo con EtOAc. El extracto orgánico se filtró y se concentró a vacío para dar el material inici cromatografía en gel de sílice (un gradiente de EtOAc e mmol, 83% de rendimiento) en forma de un sólido bla 3H), 1,58 - 1,72 (m, 1H), 2,05 - 2,21 (m, 1H), 2,93 (s, 3 1H), 3,80 (s, 6H), 3,91 - 4,03 (m, 1H), 4,16 - 4,32 (m, 4H m/z: 476,1 (M+h )+.
metoxibencil)etanosulfonamida, Ejemplo 460.4. En un (350 mg, 0,758 mmol) en THF (7 ml). Se añadió 4 mmol)) a -78°C con agitación en atmósfera de N2. La és se añadió yodometano (0,061 ml, 0,986 mmol). La 3°C durante 3 h. El análisis de LCMS indicaba que la iluyó con solución acuosa saturada NaHCO3 a -78°C y con salmuera y se secó sobre Na2SO4. La solución se forma de un aceite amarillo claro, que se purificó por M al 0-100%), para proporcionar 460.4 (300 mg, 0,631 ino. 1H RMN (500 MHz, CDCh) 5 1,17 (d, J=6,60 Hz, ,04 - 3,17 (m, 2H), 3,28 - 3,45 (m, 3H), 3,59 - 3,69 (m, 9 - 6,91 (m, 4H), 7,12 - 7,25 (m, 4H). LCMS-ESI (POS),
(R)-2-(3,6-dimetil-2-oxotetrahidropirimidin-1(2H)-il)etano de 250 ml se añadió 460.4 (350 mg, 0,74 mmol) en TF agitación en atmósfera de N2. La mezcla de reacción se la reacción se había completado. La mezcla de reacció amida, Ejemplo 460.5. En un matraz de fondo redondo ml). Se añadió anisol (0,320 ml, 2,94 mmol) a 23°C con a 23°C durante 19 h. El análisis de LCMS indicaba que concentró a vacío y el material así obtenido se purificó
por cromatografía en columna en gel de sílice usando 460.5 (180 mg, 0,77 mmol, 100% de rendimiento) en (M+H)+. Nota: La purificación se llevó a cabo en un Co diente de EtOAc en DCM al 0-100%, para proporcionar a de un aceite incoloro. LCMS-ESI (POS), m/z: 236,1 sh equipado con un detector ELSD.
N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-tri pirimidinil)etanosulfonamida, Ejemplo 460.0. El com metilnicotinohidrazida usando el procedimiento descrito 8,37 (s, 1H), 7,81 (br. s., 1H), 7,53 (t, J=8,6 Hz, 1H), 6, 3,81 (s, 3H), 3,57 - 3,65 (m, 1H), 3,44 (td, J=12,0, 4,4 2,35 (s, 3H), 2,00 - 2,12 (m, 1H), 1,64 - 1,73 (m, 1H), 1,
Ejemplo 461.0: Preparación de 2-(2-ciano-4-fluorofen 1,2,4-triazol-3-il)etanosulfonamida.
-il)-2-((6R)-3,6-dimetil-2-oxotetrahidro-1 (2H)-del título se preparó a partir de 460.5, 1.0 y 5-Ejemplo A. 1H RMN (500 MHz, CD3OD) 58,50 (s, 1H), d, J=8,6, 1,7 Hz, 2H), 3,84 - 3,92 (m, 1H), 3,82 (s, 3H), ), 3,35 - 3,40 (m, 2H), 3,13 - 3,27 (m, 2H), 2,90 (s, 3H), J=6,6 Hz, 3H). LCMS-ESI (POS), m/z: 530,2 (M+H)+.
4-(2,6-dimetoxifenil)-5-(6-oxo-1,6-dihidro-2-piridinil)-4H-
2-(2-Ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-ox il)etanosulfonamida, Ejemplo 461.0. Un recipiente de r HCl de piridina (1,5 g, disponible en el mercado en reactor de microondas modelo Discover (CEM, Matthe análisis de LCMS indicaba la formación del producto extrajo con DCM. El extracto orgánico se lavó con s concentró a vacío para dar el material inicial en forma HPLC preparativa de fase inversa usando TFA al 0,1% proporcionar el compuesto del título 461.0 (5 mg, 10% MHz, CD3OD) 57,49 - 7,57 (m, 2H), 7,44 - 7,49 (m, 1 Hz, 1H), 6,15 (d, J=5,4 Hz, 1H), 3,82 (s, 6H), 3,35 - 3,4 (M+H)+.
Ejemplo 462.0: Preparación de (3R,5S)-N-(4-(2,6-dimet 2-pirimidinil)-5-hidroxi-3-piperidinasulfonam ida y ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidin dihidro-2-piridinil)-4H-1,2,4-triazol-3-n de microondas se cargó con 200.0 (50 mg) y sal de ). La mezcla de reacción se agitó y se calentó en un ) a 120°C durante 60 min. Después de este periodo, el ado. La mezcla de reacción se diluyó con agua y se ra y se secó sobre Na2SO4. La solución se filtró y se aceite naranja. El material así obtenido se purificó por H3CN/H2O, gradiente 20-80% a lo largo de 30 min para ndimiento) en forma de un polvo blanco. 1H RMN (500 5 - 7,44 (m, 2H), 6,84 (d, J=8,6 Hz, 2H), 6,60 (d, J=9,3 2H), 3,23 - 3,30 (m, 2H). LCMS-ESI (POS), m/z, 525,0
il)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H-1,2,4-amida.
5-Hidroxipiridina-3-sulfonamida, Ejemplo 462.1. En bromopiridina-3-sulfonamida (disponible en el mercad butilfosfino-3,4,5,6-tetrametil-2',4',6'-tri-i-isopropilbifenilo EE.UU., 0,079 g, 0,16 mmol) y Pd2(dba)3 (Sigma-Aldric se puso bajo vacío y se volvió a llenar con solución de agua (5 ml). La mezcla de reacción después se agitó a indicaba que la reacción se había completado. La mezc atraz de fondo redondo de 100 ml se añadió 5-Enamina, KIEV, Ucrania) (0,486 g, 2,05 mmol), 2-di-tonible en el mercado en Strem Chemicals, Inc., MA, mical Company, Inc., 0,038 g, 0,041 mmol). El matraz ido de potasio (0,345 g, 6,15 mmol) en dioxano (5 ml) y en atmósfera de N2 durante 17 h. El análisis de LCMS reacción se dejó enfriar a TA La mezcla de reacción se
diluyó con HCl 1 N y se lavó con EÍ2Ü. La fase acuosa (0,387 g, 2,22 mmol, 100% de rendimiento) en forma d etapa sin más purificación. LCMS-ESI (POS), m/z: 175,1 concentró a vacío para dar el compuesto del título 462.1 n sólido blanco, que se usó directamente en la siguiente H)+.
Acetato de (3R,5R)-5-hidroxipiperidina-3-sulfonamida acetato de (3R,5S)-5-hidroxipiperidina-3-sulfonamida y 462.2. En un matraz de hidrogenación de 1 litro se aña Se añadió agua (20 ml) como co-disolvente. La mezcla platino (IV) hidrato (8,42 g, 37,1 mmol) con un flujo de se volvió a llenar con N2 dos veces, y después se so (tanque). La mezcla de reacción se agitó a 23°C a 3,5 kg de LCMS indicaba que la reacción se había completado. mezcla con agitación. El sólido se separó por filtración con MeOH. Los compuestos orgánicos se concentraro forma de un aceite amarillo claro, que se usó directame m/z: 181,1 (M+H)+.
acetato de (3S,5R)-5-hidroxipiperidina-3-sulfonamida y etato (3S,5S)-5-hidroxipiperidina-3-sulfonamida, Ejemplo 462.1 (6,46 g, 37,1 mmol) y AcOH (250 ml, 4330 mmol). burbujeó con N2 durante 2 min antes de añadir óxido de El matraz se puso en un agitador Parr, se hizo el vacío y tió a vacío y se volvió a llenar con hidrógeno gaseoso 2 (50 psi) de hidrógeno gaseoso durante 24 h. El análisis e añadió agente de filtración de marca Celite® (20 g) a la pués de 10 min de agitación. La torta de filtración se lavó vacío para dar 462.2 (8,91 g, 100% de rendimiento) en en la siguiente etapa sin purificación. LCMS-ESI (POS),
(3S,5S)-1 -(5-fluoropirimidin-2-il)-5-hidroxipiperidina-3-sul hidroxipiperidina-3-sulfonamida y (3R,5S)-1-(5-fluoropiri fluoropirimidin-2-il)-5-hidroxipiperidina-3-sulfonamida, Ej añadió 462.2 (8,91 g, 37,1 mmol) y base de Hunig (32,3 5-fluoro-pirimidina (18,32 ml, 148 mmol) con agitación. análisis de LCMS indicaba que la reacción se había después se diluyó con agua y se extrajo con DCM. Las Na2SO4. La solución se filtró y se concentró a vacío p material así obtenido se purificó por cromatografía en ge proporcionar 462.3 (3,7 g, 10,93 mmol, 36% de rendimi m/z: 277,0 (M+H)+.
amida y (3S,5R)-1 -(5-fluoropirimidin-2-il)-5-din-2-il)-5-hidroxipiperidina-3-sulfonamida y (3R,5R)-1-(5-plo 462.3. En un matraz de fondo redondo de 500 ml se l, 185 mmol) en DMF (80 ml). Después se añadió 2-cloromezcla de reacción se agitó a 120°C durante 18 h. El pletado. La mezcla de reacción se dejó enfriar a TA y as orgánicas se lavaron con salmuera y se secaron sobre dar el material inicial en forma de un aceite naranja. El e sílice (un gradiente de EtOAc en DCM al 0-100%), para o) en forma de un sólido amarillo claro. LCMS-ESI (POS),
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H piperidinasulfonamida y (3S,5R)-N-(4-(2,6-dimeto pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo 1.0, y 3.4 usando el procedimiento descrito en el Ej diastereómeros mayoritarios y como una sal de TFA. 1 1H), 7,61 (d, J=7,6 Hz, 1H), 7,47 (t, J=8,6 Hz, 1H), 7,2 (m, 1H), 4,81 - 4,86 (m, 1H), 3,73 - 3,79 (m, 6H), 3,55 -1H), 2,47 - 2,58 (m, 2H), 2,23 (s, 3H), 1,62 - 1,73 (m, 1
Ejemplo 463.0: Preparación de (3R,5S)-N-(4-(2,6-dimet 2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida o ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidin -triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título se preparó a partir de 462.3, A. El compuesto del título 462.0 se aisló como los N (500 MHz, CD3OD) 58,30 (s, 2H), 7,72 (t, J=7,8 Hz, =7,8 Hz, 1H), 6,77 (dd, J=8,6, 4,2 Hz, 2H), 5,07 - 5,15 (m, 1 H), 3,06 - 3,15 (m, 1H), 2,88 (dd, J=13,0, 11,5 Hz, MS-ESI (POS), m/z: 571,3 (M+H)+.
il)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H-1,2,4-amida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H piperidinasulfonamida o (3S,5R)-N-(4-(2,6-dimeto pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo 4 una columna AS-H cuando se somete 462.0 a las sig columna de 250 x 30 mm AS-H con 44 g/min de MeOH Temperatura. = 27°C, Presión de salida = 100 bar, Lo de 66 mg de muestra disuelta en 8 ml de MeOH; c= 8 Tiempo de análisis = 9 min. 1H RMN (500 MHz, CD3O 1H), 7,46 (t, J=8,4 Hz, 1H), 7,23 (d, J=7,8 Hz, 1H), J=12,6, 4,8 Hz, 1 H), 3,76 (s, 3H), 3,75 (s, 3H), 3,56 - 3 1H), 2,54 (dd, J=12,5, 10,5 Hz, 2H), 2,22 (s, 3H), 1,61 -
Ejemplo 464.0: Preparación de (3R,5S)-N-(4-(2,6-dimet 2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida o ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidin -triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-)-5-(6-metil-2-piridinil)-4H-l,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título era el primer isómero en eluir de condiciones de SFC. Realizado en Thar 80 SFC con ) 36 g/min de CO2, 55% de co-disolvente a 80 g/min. de onda = 240 nm. Inyectado 1,0 ml de una disolución g/ml y 8,25 mg por inyección. Tiempo de ciclo 6,0 min, 8,29 (s, 2H), 7,70 (t, J=7,8 Hz, 1H), 7,60 (d, J=7,8 Hz, d, J=8,6, 3,9 Hz, 2H), 5,09 - 5,13 (m, 1H), 4,84 (dd, , 1H), 3,09 - 3,15 (m, 1H), 2,91 (s, 1H), 2,88 - 2,89 (m, m, 1H). LCMS-ESI (POS), m/z: 571,3 (M+H)+.
il)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H-1,2,4-amida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H piperidinasulfonamida o (3S,5R)-N-(4-(2,6-dimeto pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo 4 de una columna AS-H cuando se somete 462.0 a las (500 MHz, CD3OD) 58,29 (s, 2H), 7,69 (t, J=7,7 Hz, J=7,6 Hz, 1H), 6,76 (dd, J=8,3, 3,9 Hz, 2H), 5,05-5,17 3,63 (m, 1H), 3,10-3,19 (m, 1H), 2,85-2,92 (m, 1H), 2,4 ESI (POS), m/z: 571,3 (M+H)+.
-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-El compuesto del título era el segundo isómero en eluir iones de SFC descritas en el Ejemplo 463.0. 1H RMN ,59 (d, J=7,8 Hz, 1H), 7,46 (t, J=8,4 Hz, 1H), 7,23 (d, H), 4,77-4,87 (m, 1H), 3,76 (s, 3H), 3,75 (s, 3H), 3,55 (m, 2H), 2,22 (s, 3H), 1,68 (q, J=12,0 Hz, 1H). LCMS-Ejemplo 465.0: Preparación de (3R,5S)-N-(4-(2,6-dime 2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida y ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidin il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-namida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H piperidinasulfonamida y (3S,5R)-N-(4-(2,6-dimeto pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo y 5-metilnicotinohidrazida (disponible en el mercad procedimientos descritos en el Ejemplo A. El com mayoritarios y como una sal de TFA. 1H RMN (500 M 1H), 7,45 (t, J=8,56 Hz, 1H), 6,66 (dd, J=8,68, 3,06 Hz, Hz, 1 H), 3,72 - 3,85 (m, 7H), 3,31 (dd, J=13,20, 10,03 2,54 (d, J=12,72 Hz, 1 H), 2,40 (s, 3H), 1,86 - 1,96 (m,
Ejemplo 466.0: Preparación de (3R,5R)-N-(4-(2,6-dime 2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida y ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidin -triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título se preparó a partir de 462.3, 1.0 Bellen Chemistry Co., Beijing, China) usando los del título 465.0 se aisló como los diastereómeros Ch) 58,52 (s, 1H), 8,38 (s, 1H), 8,20 (s, 2H), 7,85 (s, 4,92 (dd, J=13,45, 3,67 Hz, 1H), 4,61 (dd, J=13,08, 4,52 ), 3,12 - 3,22 (m, 1H), 2,93 (dd, J=12,59, 9,41 Hz, 1H), MS-ESI (POS), m/z: 571,3 (M+H)+.
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-namida.
(3R,5R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 piperidinasulfonamida y (3S,5S)-N-(4-(2,6-dimeto pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo diastereómeros minoritarios y como una sal de TFA u CD3OD) 58,53 (br. s., 1 H), 8,41 (br. s., 1 H), 8,26 (s, 2 Hz, 2H), 5,00 (dt, J=12,96, 1,83 Hz, 1 H), 4,61 (d, J=13 (m, 1H), 3,05 - 3,20 (m, 2H), 2,37 (s, 3H), 2,27 (d, J 571,3 (M+H)+.
Ejemplo 467.0: Preparación de (3R,5S)-N-(4-(2,6-dime 2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida o ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidin -triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título se aisló como la mezcla de las condiciones descritas en 465.0. 1H RMN (500 MHz, 8 (s, 1 H), 7,54 (t, J=8,44 Hz, 1 H), 6,84 (dd, J=8,56, 4,89 , 1H), 4,14 (br. s., 1H), 3,78 - 3,85 (m, 6H), 3,41 - 3,51 Hz, 1H), 1,91 - 2,00 (m, 1H). LCMS-ESI (POS), m/z:
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-namida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 piperidinasulfonamida o (3S,5R)-N-(4-(2,6-dimeto pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo una columna AS-H cuando se somete 465.0 a las sig columna de 250 x 21 mm AS-H con 34 g/min de MeOH g/min. Temperatura. = 25°C, Presión de salida = 100 b muestra disuelta en 22 ml de MeOH:DCM (3:2), c= 3,6 -triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título era el primer isómero en eluir de s condiciones de SFC. Realizado en Thar 80 SFC con 320 mM) 46 g/min de CO2, 43% de co-disolvente a 80 ngitud de onda = 240 nm. Inyectado 1,1 ml de 80 mg de l es decir 4,0 mg por inyección. Tiempo de ciclo 9,5 min,
Tiempo de análisis = 13,0 min. 1H RMN (500 MHz, CD 1H), 7,53 (t, J=8,56 Hz, 1H) 6,83 (dd, J=8,56, 2,20 Hz, 2 - 3,86 (m, 6H), 3,54 - 3,64 (m, 1H), 3,14 (t, J=11,86 Hz 3H), 1,66 (q, J=11,98 Hz, 1 H). LCMS-ESI (POS), m/z: 5
Ejemplo 468.0: Preparación de (3R,5S)-N-(4-(2,6-dimet 2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida o ( triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-piperidina 5 8,44 (br. s., 1H), 8,33 (s, 1H), 8,30 (s, 2H), 7,71 (s, 10 (dd, J=12,96, 3,67 Hz, 1 H), 4,77 - 4,84 (m, 1 H), 3,77 2,87 (t, J=12,23 Hz, 1H), 2,46 - 2,60 (m, 2H), 2,32 (s, M+H)+.
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-amida.
Preparación de (3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(5-m hidroxi-3-piperidinasulfonamida o (3S,5R)-N-(4-(2,6 fluoro-2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ej en eluir de la columna AS-H cuando se somete 465.0 RMN (500 MHz, CD3OD) 58,44 (br. s., 1H), 8,33 (s, 1H J=8,56, 2,20 Hz, 2H), 5,10 (dd, J=12,96, 3,67 Hz, 1H), 3,14 (t, J=11,86 Hz, 1 H), 2,87 (t, J=12,23 Hz, 1H), 2,46 ESI (POS), m/z: 571,3 (M+H)+.
Ejemplo 469.0: Preparación de (3R,5S)-N-(4-(2,6-d fluoro-2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida y 1,2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-5-hidroxi-3-pip piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-toxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-468.0. El compuesto del título era el segundo isómero condiciones de SFC descritas en el Ejemplo 467.0. 1H 0 (s, 2H), 7,71 (s, 1H), 7,53 (t, J=8,56 Hz, 1H) 6,83 (dd, 4,84 (m, 1 H), 3,77 - 3,86 (m, 6H), 3,54 - 3,64 (m, 1 H), (m, 2H), 2,32 (s, 3H), 1,66 (q, J=11,98 Hz, 1H). LCMS-
xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-,5R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-sulfonamida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 piperidinasulfonamida y (3S,5R)-N-(4-(2,6-dimetoxif pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo 4 y la hidrazida del ácido 6-metoxi-piridina-2-carboxílic Company, Inc., MO, EE.UU.) usando los procedimiento aisló como una mezcla de los diastereómeros mayorita 8,30 (s, 2H), 7,70 - 7,77 (m, 1H), 7,63 (d, J=7,34 Hz, 1 H 1H), 4,80 - 4,87 (m, 1 H), 3,72 - 3,81 (m, 6H), 3,54 - 3,6 (dd, J=12,84, 11,62 Hz, 1 H), 2,46 - 2,59 (m, 2H), 1,66 (q
Ejemplo 470.0: Preparación de (3R,5R)-N-(4-(2,6-d fluoro-2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida y 1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-pip ,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título se preparó a partir de 462.3, 1.0 sponible en el mercado en Sigma-Aldrich Chemical critos en el Ejemplo A. El compuesto del título 469.0 se como una sal de TFA. 1H rMn (500 MHz, CD3OD) 5 (t, J=8,44 Hz, 1 H), 6,73 - 6,85 (m, 3H), 5,05 - 5,14 (m, 1H), 3,20 (s, 3H), 3,09 (tt, J=11,92, 3,73 Hz, 1 H), 2,86 2,15 Hz, 1 H). LCMS-ESI (POS), m/z: 587,2 (M+H)+.
xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-sulfonamida.
(3 R ,5 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l ) -4 p ip e r id in a s u lfo n a m id a y (3 S ,5 S ) -N -(4 -(2 ,6 -d im e to x if ,4 - t r ia z o l-3 - i l) -1 -(5 - f lu o ro -2 -p ir im id in i l) -5 -h id ro x i-3 --(6 -m e to x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -(5 - f lu o ro -2 -pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo los diastereómeros minoritarios y como una sal de TF 8,21 - 8,33 (m, 2H), 7,70-7,78 (m, 1H), 7,58 - 7,66 (m, 1H), 4,61 (d, J=13,69 Hz, 1H), 4,13 (br. s., 1H), 3,70 - 3 - 3,17 (m, 2H), 2,27 (d, J=13,69 Hz, 1H), 1,90 - 2,00 (m,
Ejemplo 471.0: Preparación de (3R,5S)-N-(4-(2,6-fluoro-2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida
1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-pip El compuesto del título se aisló como una mezcla de o se describe en 469.0. 1H RMN (500 MHz, CD3OD) 5 ,40 - 7,48 (m, 1H), 6,73 - 6,84 (m, 3H), 4,97 - 5,05 (m, , 6H), 3,45 (tt, J=11,07, 3,97 Hz, 1H), 3,19 (s, 3H), 3,03 LCMS-ESI (POS), m/z: 587,2 (M+H)+.
xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-,5R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-asulfonamida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 piperidinasulfonamida o (3S,5R)-N-(4-(2,6-dimetoxif pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo 4 una columna AS cuando se somete 469.0 a las siguient 250x21 mm AS con 25 g/min de MeOH (NH320 m Temperatura 21°C, Longitud de onda 297 nm. Inyectad 10 ml MeOH; c= 7,0 mg/ml; 17,5 mg /inyección. Tiemp 2H), 7,68 - 7,77 (m, 1H), 7,59 - 7,66 (m, 1H), 7,43 (t, J= Hz, 1H), 5,05 - 5,15 (m, 1H), 4,81 - 4,86 (m, 1H), 3,77 3,06 - 3,16 (m, 1H), 2,86 (dd, J=12,84, 11,37 Hz, 1H) (POS), m/z: 587,2 (M+H)+.
Ejemplo 472.0: Preparación de (3R,5S)-N-(4-(2,6-fluoro-2-pirimidinil)-5-hidroxi-3-piperidinasulfonamida
1,2,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3-pip ,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título era el primer isómero en eluir de ndiciones de SFC. Realizado en Thar 200 con columna 5 g/min de CO2, 50% de co-disolvente a 100 g/min. ml de una disolución de 70 mg de muestra disuelta en análisis = 9 min. 1H RMN (500 MHz, CD3OD) 58,29 (s, Hz, 1H), 6,79 (dd, J=8,44, 3,79 Hz, 2H), 6,76 (d, J=8,07 ), 3,76 (s, 3H), 3,54 - 3,64 (m, 1H), 3,17 - 3,22 (m, 3H), - 2,58 (m, 2H), 1,66 (q, J=11,98 Hz, 1H). LCMS-ESI
xifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-,5R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-asulfonamida.
(3R,5S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 piperidinasulfonamida o (3S,5R)-N-(4-(2,6-dimetoxif pirimidinil)-5-hidroxi-3-piperidinasulfonamida, Ejemplo 4 de la columna AS-H cuando se somete 469.0 en las (500 MHz, CD3OD) 58,29 (s, 2H), 7,68 - 7,77 (m, 1H), 3,79 Hz, 2H), 6,76 (d, J=8,07 Hz, 1H), 5,05 - 5,15 (m, 1 (m, 1H), 3,17 - 3,22 (m, 3H), 3,06 - 3,16 (m, 1H), 2,8 J=11,98 Hz, 1H). LCMS-ESI (POS), m/z: 587,2 (M+H)+.
Ejemplo 473.0: Preparación de (1R,2S)-1-(2,4-diciano triazol-3-il)-1 -metoxi-2-propanosulfonamida y (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona 5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-p dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il ,4-triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-hidroxi-3--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-El compuesto del título era el segundo isómero en eluir iones de SFC descritas en el Ejemplo 471.0. 1H RMN 7,66 (m, 1H), 7,43 (t, J=8,44 Hz, 1H), 6,79 (dd, J=8,44, 81 - 4,86 (m, 1H), 3,77 (s, 3H), 3,76 (s, 3H), 3,54 - 3,64 J=12,84, 11,37 Hz, 1H), 2,47 - 2,58 (m, 2H), 1,66 (q,
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4--(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-y (1 R,2R)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-osulfonamida y (1 S,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-etoxi-2-propanosulfonamida.
(1 R,2S)-1 -(2,4-dibromofenil)-1 -hidroxi-N,N-bis(4-metoxib 1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida metoxibencil)propano-2-sulfonamida y (1 S,2R)-1 -(2 sulfonamida, Ejemplo 473.1. En un matraz de fondo red THF (21,9 ml). Se añadió n-butil-litio (solución en hexan con agitación. La mezcla de reacción se agitó a -78°C d 20 min. Se añadió gota a gota 2,4-dibromobenzaldehído N2 a -78°C con agitación. La mezcla de reacción despué la formación del producto deseado. La reacción se in reacción se diluyó con solución saturada de NH4G y se se secó sobre Na2SO4. La solución se filtró y se concen amarillo claro que se purificó por cromatografía en gel proporcionar el compuesto del título 473.1 (4,9 g, 7,99 LCMS-ESI (POS), m/z: 634,0 (M+Na)+.
il)propano-2-sulfonamida y (1 S,2S)-1 -(2,4-dibromofenil)-y (1 R,2R)-1 -(2,4-dibromofenil)-1 -hidroxi-N,N-bis(4-ibromofenil)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-o de 250 ml se añadió 12.0 (3,06 g, 8,76 mmol) en Me-,5 M, 4,20 ml, 10,51 mmol) en atmósfera de N2 a -78°C te 10 min y después se dejó a TA con agitación durante 54 g, 9,63 mmol) en Me-THF (21,89 ml) en atmósfera de agitó a -78°C durante 1 h. El análisis de LCMS indicaba ó con solución acuosa saturada NH4CL La mezcla de ajo con EtOAc. La capa orgánica se lavó con salmuera y a vacío para dar el material inicial en forma de un sólido ílice (un gradiente de EtOAc en DCM al 0-100%), para ol, 91% de rendimiento) en forma de un sólido blanco.
(1 R,2S)-1 -(2,4-dibromofenil)-1 -metoxi-N,N-bis(4-metoxib 1 -metoxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida metoxibencil)propano-2-sulfonamida y (1 S,2R)-1 -(2 sulfonamida, Ejemplo 473.2. En un matraz de fondo red THF (53,3 ml). Se añadió bis(trimetilsilil)amida de pota il)propano-2-sulfonamida y (1 R,2R)-1 -(2,4-dibromofenil)-y (1 S,2S)-1 -(2,4-dibromofenil)-1 -metoxi-N,N-bis(4-ibromofenil)-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-o de 250 ml se añadió 473.1 (4,9 g, 7,99 mmol) en Me-(1 M en THF, 8,79 ml, 8,79 mmol) en atmósfera de N2
a -78°C con agitación. La mezcla de reacción se agitó a Se añadió gota a gota yodometano (0,546 ml, 8,79 m reacción después se agitó a -78°C durante 30 min y de dejó agitar a TA durante 10 min. El análisis de LCMS in era completa. La mezcla de reacción después se agit enfrió a -78°C y se inactivó con solución acuosa satura se extrajo con EtOAc. La capa orgánica se lavó con concentró a vacío para dar el material inicial en forma en gel de sílice (EtOAc en hexanos al 0-100%), para 100% de rendimiento) como sólido blanco. LCMS-ESI ( C durante 10 min y después se dejó a TA durante 5 min. n atmósfera de N2 a -78°C con agitación. La mezcla de s se retiró el baño de hielo seco-acetona y la mezcla se a la formación del producto deseado pero la reacción no 23°C durante 16 h. La mezcla de reacción después se e NaHCÜ3. La mezcla de reacción se diluyó con agua y era y se secó sobre Na2SÜ4. La solución se filtró y se aceite amarillo claro, que se purificó por cromatografía rcionar el compuesto del título 473.2 (5,0 g, 7,97 mmol, , m/z: 626,0 (M+H)+.
(1R,2S)-1-(2,4-dicianofenil)-1-metoxi-N,N-bis(4-metoxib metoxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida metoxibencil)propano-2-sulfonamida y (1S,2R)-1-sulfonamida, Ejemplo 473.3. En un matraz de fondo re (53,1 ml). En atmósfera de N2, se añadieron cianuro de (0,815 g, 1,59 mmol). La mezcla de reacción despué enfrió y se filtró. La solución se concentró a vacío a 75 gel de sílice (un gradiente de EtOAc en DCM al 0-rendimiento) en forma de un sólido blanco. LCMS-ESI ( )propano-2-sulfonamida y (1 R,2R)-1 -(2,4-dicianofenil)-1 -y (1 S,2S)-1-(2,4-dicianofenil)-1 -metoxi-N,N-bis(4-dicianofenil)-1-metoxi-N,N-bis(4-metoxibencil)propano-2-o de 250 ml se añadió 472.2 (5,0 g, 7,97 mmol) en DMA (2,06 g, 17,53 mmol) y bis(tri-terc-butilfosfina)paladio (0) agitó a 100°C durante 15 h. La mezcla de reacción se El material así obtenido se purificó por cromatografía en ), para proporcionar 473.3 (4 g, 7,70 mmol, 97% de ), m/z: 542,2 (M+Na)+.
(1R,2S)-1 -(2,4-dicianofenil)-1-metoxipropano-2-sulfona sulfonamida y (1S,2S)-1-(2,4-dicianofenil)-1-metox metoxipropano-2-sulfonamida, Ejemplo 473.4. En un m mmol) y anisol (4,18 ml, 38,5 mmol) en TFA (42,8 ml, 7 h. La mezcla de reacción se concentró a vacío. El mate (un gradiente de EtOAc en DCM al 0-100%), para pro forma de un sólido blanco. LCMS-ESI (POS), m/z: 302,1 y (1 R,2R)-1-(2,4-dicianofenil)-1-metoxipropano-2-ano-2-sulfonamida y (1S,2R)-1-(2,4-dicianofenil)-1-de fondo redondo de 250 ml se añadió 473.3 (4 g, 7,70 mol). La mezcla de reacción se agitó a 23°C durante 15 sí obtenido se purificó por cromatografía en gel de sílice ionar 473.4 (1,6 g, 5,73 mmol, 74% de rendimiento) en Na)+.
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-propanosulfonamida y (1 S,2R)-1 -(2,4-dicianofenil)-N-( il)-1 -metoxi-2-propanosulfonamida y (1 R,2R)-1 -(2,4-di 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida y (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona partir de 473.4, 1.0 y la hidrazida del ácido 6-metoxi-Aldrich Chemical Company, Inc., MO, EE.UU.) usando compuesto del título 473.0 se aisló como una mezcla en dos etapas de una separación SFC quiral en las sig mayoritarios, el primer y el cuarto pico en columna LU siguientes condiciones): Realizado en Thar 200 con co mM) 50 g/min de CO2, 60% de co-disolvente a 120 g/ 4,5 ml de una disolución de 299 mg de muestra disuelt Tiempo de ciclo 8,5 min, Tiempo de análisis = 11 min. en el medio a partir de las condiciones anteriores se s 200 con columna 150x30 mm CC4 con 58 ml/min de Me 120 g/min. Temperatura 20°C, Longitud de onda 293 n disuelta en 2,5 ml MeOH; c=7,2 mg/ml; 5,76 mg/inyecció
Ejemplo 474.0: Preparación de (1R,2S)-1-(2,4-dicianof triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S,2 piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H--(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-Ejemplo 473.0. El compuesto del título se preparó a na-2-carboxílico (disponible en el mercado en Sigmarocedimientos como se describen en el Ejemplo A. El atro diastereómeros, que se separaron completamente s condiciones: Etapa 1 (una pareja de diastereómeros se obtuvieron como producto ópticamente puro en las 150x30 mm LUX-2 con 72 ml/min de MeOH (NH320 emperatura 20°C, Longitud de onda 293 nm. Inyectado 32 ml MeOH:DCM 5:3; c=9,3 mg/ml; 42 mg/inyección.
2 (la pareja de diastereómeros minoritarios, dos picos ron en las siguientes condiciones): Realizado en Thar NH320 mM) 63 g/min de CO2, 48% de co-disolvente a ectado 0,8 ml de una disolución de 18,0 mg de muestra mpo de análisis = 4 min.
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4--(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-propanosulfonamida o (1 S,2R)-1 -(2,4-dicianofenil)-N-( il)-1-metoxi-2-propanosulfonamida, Ejemplo 474.0. El columna LUX-2 por separación SFC quiral de 473.0 en MHz, CD3OD) 58,19 (d, J=1,5 Hz, 1H), 8,00 (dd, J=8,2, 2H), 7,43 (t, J=8,4 Hz, 1H), 6,80 (dd, J=8 ,6 , 1,7 Hz, 2H), 3,75 (s, 3H), 3,42 (dd, J=7,0, 4,3 Hz, 1H), 3,19 (s, 6H), 1
Ejemplo 475.0: Preparación de (1R,2S)-1-(2,4-dicianof triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S,2 piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-uesto del título era el primer isómero en eluir de la ndiciones descritas en el Ejemplo 473.0. 1H RMN (500 Hz, 1H), 7,73 (t, J=7,8 Hz, 1H), 7,63 (dd, J=7,8, 3,2 Hz, (d, J=8,1 Hz, 1H), 5,11 (d, J=4,4 Hz, 1H), 3,77 (s, 3H), , J=6,8 Hz, 3H). LCMS-ESI (POS), m/z: 590,2 (M+H)+.
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4--(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-propanosulfonamida o (1 S,2R)-1 -(2,4-dicianofenil)-N-( il)-1-metoxi-2-propanosulfonamida, Ejemplo 475.0. El columna LUX-2 por separación SFC quiral de 473.0 e (POS), m/z: 590,2 (M+H)+.
Ejemplo 476.0: Preparación de (1R,2R)-1-(2,4-dicianof triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-uesto del título era el cuarto isómero en eluir de la condiciones descritas en el Ejemplo 473.0. LCMS-ESI
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4--(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(1 R,2R)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 propanosulfonamida o (1 S,2S)-1 -(2,4-dicianofenil)-N-( il)-1-metoxi-2-propanosulfonamida, Ejemplo 476.0. El columna LUX-2 por separación SFC quiral de 473.0 en MHz, CDaOD) 58,20 (d, J=1,5 Hz, 1H), 8,01 (dd, J=8,3, (t, J=8,4 Hz, 1H), 6,73 - 6,81 (m, 3H), 4,93 (d, J=7,3 H 3H), 3,15 (s, 3H), 1,13 (d, J=7,1 Hz, 3H). LCMS-ESI (P
Ejemplo 477.0: Preparación de (1R,2R)-1-(2,4-dicianof triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-esto del título era el segundo isómero en eluir de la ndiciones descritas en el Ejemplo 473.0. 1H RMN (500 z, 1H), 7,69 - 7,78 (m, 2H), 7,61 (d, J=7,5 Hz, 1H), 7,43 , 3,75 (d, J=12,5 Hz, 6H), 3,53 - 3,66 (m, 1H), 3,19 (s, /z: 590,2 (M+H)+.
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4--(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(1 R,2R)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(6 propanosulfonamida o (1 S,2S)-1 -(2,4-dicianofenil)-N-( il)-1-metoxi-2-propanosulfonamida, Ejemplo 477.0. El columna LUX-2 por separación SFC quiral de 473.0 en MHz, CD3OD) 58,20 (d, J=1,5 Hz, 1H), 8,01 (dd, J=8,3, (t, J=8,4 Hz, 1H), 6,73 - 6,81 (m, 3H), 4,93 (d, J=7,3 H 3H), 3,15 (s, 3H), 1,13 (d, J=7,1 Hz, 3H). LCMS-ESI (P
Ejemplo 478.0: Preparación de (1R,2S)-1-(2,4-dician triazol-3-il)-1 -metoxi-2-propanosulfonamida y (1 piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona xi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-uesto del título era el tercer isómero en eluir de la ndiciones descritas en el Ejemplo 473.0. 1H RMN (500 z, 1H), 7,69 - 7,78 (m, 2H), 7,61 (d, J=7,5 Hz, 1H), 7,43 , 3,75 (d, J=12,5 Hz, 6H), 3,53 - 3,66 (m, 1H), 3,19 (s, /z: 590,2 (M+H)+.
)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida y (1 S,2 R)-1 -(2,4-dicianofenil)-N-(4 1-metoxi-2-propanosulfonamida, Ejemplo 478.0. El co metilnicotinohidrazida (disponible en el mercado en Bell descritos en el Ejemplo A. El compuesto del título diastereómeros mayoritarios. 1H RMN (400 MHz, CD3O Hz, 1H), 8,03 (d, J=7,6 Hz, 1H), 7,72-7,74 (m, 1H), 7,69 Hz, 2H), 5,17 (d, J=3,9 Hz, 1H), 3,83 (s, 3H), 3,79-3,82 ( J=7,0 Hz, 3H). LCMS-ESI (POS), m/z: 574,3 (M+H)+.
Ejemplo 479.0: Preparación de (1R,2S)-1-(2,4-dician triazol-3-il)-1-metoxi-2-propanosulfonamida o (1S piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona 3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-sto del título se preparó a partir de 473.4, 1.0 y 5 emistry Co., Beijing, China) usando los procedimientos 0 se aisló como una mezcla racémica de los dos ,43-8,48 (m, 1H), 8,34 (d, J=1,6 Hz, 1H), 8,20 (d, J=1,4 7,9 Hz, 1H), 7,53 (t, J=8,4 Hz, 1H), 6,83 (dd, J=8 ,6 , 2,5 ), 3,37-3,47 (m, 1H), 3,21 (s, 3H), 2,33 (s, 3H), 1,27 (d,
)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida o (1 S,2 R)-1 -(2,4-dicianofenil)-N-(4 1-metoxi-2-propanosulfonamida, Ejemplo 479.0. El co columna OD-H cuando se somete 478.0 a las siguie columna de 250 x 30 mm OD-H con 16 g/min de MeO 80 g/min. Temperatura. = 22°C, Presión de salida = 10 mg de muestra disuelta en 10 ml de MeOH (30% DCM); min, Tiempo de análisis = 22 min. 1H RMN (500 MHz, Hz, 1H), 8,03 (d, J=7,5 Hz, 1H), 7,72-7,75 (m, 1H), 7,69 Hz, 2H), 5,17 (d, J=3,9 Hz, 1H), 3,83 (s, 3H), 3,78-3,82 ( J=7,0 Hz, 3H). LCMS-ESI (POS), m/z: 574,3 (M+H)+.
Ejemplo 480.0: Preparación de (1 R,2S)-1 -(2,4-dician triazol-3-il)-1-metoxi-2-propanosulfonamida o (1S piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona 3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-sto del título era el primer isómero en eluir de una ondiciones de SFC: Realizado en Thar 80 SFC con H320 mM) 64 g/min de CO2, 20% de co-disolvente a Longitud de onda = 215 nm. Inyectado 0,3 ml de 177 7,7 mg/ml y 5,3 mg por inyección. Tiempo de ciclo 14,5 ) 58,46 (s, 1H), 8,34 (d, J=1,6 Hz, 1H), 8,20 (d, J=1,4 8,4 Hz, 1H), 7,53 (t, J=8,3 Hz, 1H), 6,83 (dd, J=8 ,6 , 2,5 ), 3,37-3,48 (m, 1H), 3,21 (s, 3H), 2,33 (s, 3H), 1,27 (d,
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-
(1 R,2S)-1 -(2,4-dicianofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida o (1 S,2 R)-1 -(2,4-dicianofenil)-N-(4 1-metoxi-2-propanosulfonamida, Ejemplo 480.0. El co columna OD-H cuando se somete 478.0 a las condicion m/z: 574,3 (M+H)+.
E je m p lo 481.0 : P re p a ra c ió n d e (2 S )-2 -(4 -c ia n o -2 -(m e t i 4 H -1 ,2 ,4 - tr ia z o l-3 - i l) -2 -h id ro x ie ta n o s u lfo n a m id a y (2 R )3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-sto del título era el segundo isómero en eluir de la SFC descritas en el Ejemplo 479.0. LCMS-ESI (POS),
n il) fe n il) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -c ia n o -2 -(m e t i ls u lfo n il) fe n i l) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -2 -h id ro x ie ta n o s u lf id a
(S)-2-(4-cloro-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifeni (trimetilsilil)etil)etanosulfonamida y (R)-2-(4-cloro-2-(meti 4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-(trimetilsilil)etil)etanos de 50 ml se añadió 4.0 (464 mg, 0,92 mmol) en THF (5 hexanos, 0,440 ml, 1,101 mmol) mediante jeringa en at retiró del baño de acetona-hielo seco y la solución se a cloro-2-(metilsulfonil)benzaldehído (221 mg, 1,01 mmol) con agitación. La mezcla de reacción después se agitó solución acuosa saturada de NH4CL La mezcla de reac orgánico se lavó con salmuera y se secó sobre Na2S material inicial en forma de un aceite amarillo claro, que de EtOAc en DCM al 0-100%), para proporcionar el c rendimiento) en forma de un sólido amarillo claro. LCMS 6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-nil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-amida, Ejemplo 481.1. En un matraz de fondo redondo Se añadió gota a gota solución de n-butil-litio (2,5 M en era de N2 a -78°C con agitación. Después el matraz se a TA durante 5 min. Después, se añadió gota a gota 4-HF (3 ml) mediante jeringa en atmósfera de N2 a -78°C 78 a 23°C durante 2 h en total antes de inactivarla con se diluyó con agua y se extrajo con EtOAc. El extracto a solución se filtró y se concentró a vacío para dar el purificó por cromatografía en gel de sílice (un gradiente uesto del título 481.1 (298 mg, 0,41 mmol, 44,8% de (POS), m/z: 724,1 (M+H)+.
(S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifen (2 -(trimetilsilil)etil)etanosulfonamida y (R)-2-(4-ciano-2-( 2-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-N-(2-(trimetilsilil)etil)et redondo de 50 ml en atmósfera de N2 se añadió 481.1 ( bis(tri-terc-butilfosfina)paladio(0) (42,1 mg, 0,082 mmol) durante 15 h. El análisis de LCMS indicaba que la reac con agua y se extrajo con EtOAc. El extracto orgánico s filtró y se concentró a vacío para dar el material inicia cromatografía en gel de sílice (un gradiente de EtOAc e 95% de rendimiento) en forma de un semisólido amarillo (6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-N-lsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinulfonamida, Ejemplo 481.2. En un matraz de fondo g, 0,41 mmol), cianuro de cinc (48,3 mg, 0,41 mmol) y DMA (5 ml). La mezcla de reacción se agitó a 110°C se había completado. La mezcla de reacción se diluyó ó con salmuera y se secó sobre Na2SO4. La solución se forma de un aceite amarillo claro, que se purificó por M al 0-100%) y proporcionó 481.2 (280 mg, 0,39 mmol, . LCMS-ESI (POS), m/z: 715,3 (M+H)+.
(2S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife hidroxietanosulfonamida y (2R)-2-(4-ciano-2-(metilsulf 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 48 desprotección como se describe en el Ejemplo 264.0. 1 J=8 ,1 Hz, 1H), 7,87 (dd, J=8,1, 1,7 Hz, 1H), 7,57-7,62 J=8,6 Hz, 1 H), 6,60 (d, J=8,6 Hz, 1H), 5,97 (dd, J=8,9, Hz, 1H), 3,32 (dd, J=13,9, 9,0 Hz, 1H), 3,12 (s, 3H), 3,10
Ejemplo 482.0: Preparación de (2S)-2-(4-ciano-2-(meti 4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o (2R)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-El compuesto del título se preparó a partir de 481.2 por N (400 MHz, CDCh) 58,30 (d, J=1,7 Hz, 1H), 7,93 (d, H), 7,33 (t, J=8,4 Hz, 1H), 6,67-6,71 (m, 1H), 6,62 (d, z, 1H), 3,74 (s, 3H), 3,66 (s, 3H), 3,53 (dd, J=13,9, 2,4 H). LCMS-ESI (POS), m/z: 615,2 (M+H)+.
nil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-m e to x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -2 -h id ro x ie ta n o s u l id a .
(2S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida o (2R)-2-(4-ciano-2-(metils 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 4 una columna OD cuando se somete 481.0 a las sigui columna de 250 x 21 mm OD con 26,25 g/min de MeO g/min. Temperatura. = 23°C, Presión de salida = 100 b muestra disuelta en 5 ml MeOH, c= 6,4 mg/ml y 7,68 = 4 min. 1H RMN (400 MHz, CD3OD) 58,31 (d, J=1,0 J=7,3 Hz, 1H), 7,45 (t, J=8,5 Hz, 1H), 6,74-6,84 (m, 3H) 3,49-3,66 (m, 2H), 3,20 (s, 3H), 3,16 (s, 3H). LCMS-ESI
Ejemplo 483.0: Preparación de (2S)-2-(4-ciano-2-(me 4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o (2R metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosul 5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-El compuesto del título era el primer isómero en eluir de condiciones de SFC: Realizado en Thar 200 SFC con 320 mM) 49 g/min de CO2, 35% de co-disolvente a 75 ngitud de onda = 296 nm. Inyectado 1,2 ml de 32 mg de r inyección. Tiempo de análisis = 6 min, Tiempo de ciclo 1H), 8,02-8,08 (m, 2H), 7,73 (t, J=7,8 Hz, 1H), 7,62 (d, (dd, J=7,4, 4,9 Hz, 1H), 3,78-3,81 (m, 3H), 3,72 (s, 3H), ), m/z: 615,2 (M+H)+.
onil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)--ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-ida.
(2S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif hidroxietanosulfonamida o (2R)-2-(4-ciano-2-(metils 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 4 de la columna Od cuando se somete 481.0 a las condi
Ejemplo 484.0: Preparación de (2R)-2-(4-ciano-2-(me 4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida y (2S metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-metoxietanosul 5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-El compuesto del título era el segundo isómero en eluir de SFC descritas en el Ejemplo 482.0.
onil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)--ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-ida.
(S)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife (2-(trimetilsilil)etil)etanosulfonamida y (R)-2-(4-ciano-2 2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-N-(2-(trimetilsilil)etil)e redondo de 25 ml se añadió el Ejemplo 481.2 (140 (dispersión al 60% en aceite mineral, 11,8 mg, 0,29 m durante 10 min antes de añadir yodometano (0,018 calentar a 23°C durante 2,5 h. El análisis de LCMS i reacción después se diluyó con agua y se extrajo con sobre Na2SO4. La solución se filtró y se concentró a va un aceite espeso amarillo claro, que se usó directame m/z: 729,2 (M+H)+.
(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-2-metoxi-N-ilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridinulfonamida, Ejemplo 484.1. En un matraz de fondo ,20 mmol) en DMF (2,5 ml). Se añadió hidruro sódico n agitación a 0°C. La mezcla de reacción se agitó a 0°C 9 mmol) con agitación. La mezcla de reacción se dejó a que la reacción se había completado. La mezcla de c. El extracto orgánico se lavó con salmuera y se secó ra dar 484.1 (122 mg, 85% de rendimiento) en forma de n la siguiente etapa sin purificación. LCMS-ESI (POS),
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif metoxietanosulfonamida y (2S)-2-(4-ciano-2-(metils 1,2,4-triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 4 desprotección como se describe en el Ejemplo 264.0. Hz, 1H), 7,93 (dd, J=8,3, 1,7 Hz, 1H), 7,84 (d, J=8,3 J=8,5 Hz, 1 H), 6,75 (td, J=8,4 Hz, 2H), 6,63 (d, J=8,3 H (m, 4H), 3,53 (dd, J=14,3, 7,7 Hz, 1H), 3,23 - 3,29 (m, 629,2 (M+H)+.
Ejemplo 485.0: Preparación de (2R)-2-(4-ciano-2-(me 4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida o (2S metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-metoxietanosul -(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-El compuesto del título se preparó a partir de 484.1 por N (500 MHz, CDCta) 510,94 (br. s., 1H), 8,35 (d, J=1,7 ), 7,63 - 7,67 (m, 1H), 7,62 (t, J=7,0 Hz, 1H), 7,41 (t, , 5,79 (dd, J=7,6, 5,38 Hz, 1H), 3,84 (s, 3H), 3,62 - 3,71 ,18 - 3,20 (m, 3H), 3,01 (s, 3H). LCMS-ESI (POS), m/z:
nil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)--ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-ida.
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif metoxietanosulfonamida o (2S)-2-(4-ciano-2-(metilsul 1,2,4-triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 4 una columna IA cuando se somete 484.0 a las siguie columna de 250 x 21 mm IA con 40 g/min de MeOH g/min. Temperatura. = 22°C, Presión de salida = 100 b muestra disuelta en 8 ml de MeOH:DCM (1:1), c= 4,4
de análisis = 6 min. 1H RMN (500 MHz, CDOD) 58,33 Hz, 1H), 7,73 (dd, J=8,2, 7,6 Hz, 1H), 7,62 (d, J=7,5 J=6 ,8 , 5,6 Hz, 1H), 3,78 (s, 3H), 3,74 (s, 3H), 3,48-3, (POS), m/z: 629,2 (M+H)+.
Ejemplo 486.0: Preparación de (2R)-2-(4-ciano-2-(met 4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida o (2S metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-metoxietanosul -(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-enil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-l compuesto del título era el primer isómero en eluir de condiciones de SFC: Realizado en Thar 200 SFC con 20 mM)+ 40 g/min de CO2, 50% de co-disolvente a 80 ngitud de onda = 297 nm. Inyectado 1 ml de 35 mg de 4,4 mg por inyección. Tiempo de ciclo = 4 min, Tiempo 1,6 Hz, 1 H), 8,08 (dd, J=8,1, 1,7 Hz, 1H), 7,95 (d, J=8,2 ), 7,45 (t, J=8,5 Hz, 1H), 6,74-6,84 (m, 3H), 5,74 (dd, , 2H), 3,20 (d, J=6,1 Hz, 6H), 3,16 (s, 3H). LCMS-ESI
nil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)--ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-ida.
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxif metoxietanosulfonamida o (2S)-2-(4-ciano-2-(metils 1,2,4-triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 4 de la columna IA cuando se somete 484.0 a las condi MHz, CDOD3) 5: 8,33 (d, J=1,6 Hz, 1H), 8,08 (dd, J=8, 1H), 7,62 (d, J=7,5 Hz, 1H), 7,45 (t, J=8,5 Hz, 1H), 6,7 (s, 3H), 3,49-3,64 (m, 2H), 3,20 (d, J=5,7 Hz, 6 H), 3,16
E je m p lo 487.0 : P re p a ra c ió n d e (2 R )-N -(4 -(2 ,6 -d im e to (5 -m e t i l-2 -p ira z in i l)e ta n o s u lfo n a m id a y (2 S )-N -(4 -(2 , -(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-fenil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-El compuesto del título era el segundo isómero en eluir s de SFC descritas en el Ejemplo 485.0. 1H RMN (500 Hz, 1H), 7,95 (d, J=8,2 Hz, 1H), 7,73 (dd, J=8,3, 7,5 Hz, (m, 3H), 5,74 (dd, J=6 ,8 , 5,6 Hz, 1H), 3,78 (s, 3H), 3,74 ). LCMS-ESI (POS), m/z: 629,2 (M+H)+.
) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -2 -h id ro x i-2 -e to x ife n il) -5 -(6 -m e to x i-2 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l ) -2 -h id ro x i-2 -(5 -m e t i l- 2 -p ira z in i l)e ta n o s u lfo n a m id a .
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirazinil)etanosulfonamida y (2S)-N-(4-(2,6-dimetoxife metil-2-pirazinil)etanosulfonamida, Ejemplo 487.0. El co el Ejemplo C usando 4.0 y 5-metil-2-pirazinacarbaldeh San Diego, CA).
Ejemplo 488.0: Preparación de (2R)-N-(4-(2,6-dimetox (5-metil-2-pirazinil)etanosulfonamida o (2S)-N-(4-(2, hidroxi-2-(5-metil-2-pirazinil)etanosulfonamida.
riazol-3-il)-2-hidroxi-2-(5-metil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-sto del título se preparó siguiendo el procedimiento en isponible en el mercado en ChemBridge Corporation,
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirazinil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-2-pirazinil)etanosulfonamida, Ejemplo 488.0. Los e quiral. El Ejemplo 488.0 era el primer isómero en eluir SfC: Realizado en Thar 200 SFC con columna de 25 g/min de CO2, 58% de co-disolvente a 100 g/min. Tem onda = 276 nm. Inyectado 3 ml de 47 mg de muestra di por inyección. Tiempo de análisis = 14 min; las fracci CD3OD) 58,55 (s, 1 H), 8,49 (s, 1 H), 7,73 (t, J=7,8 Hz, 1 (m, 3H), 5,23 (dd, J=8,3, 3,9 Hz, 1H), 3,76 (s, 3H), 3,74 (dd, J=14,2, 8,3 Hz, 1H), 3,19 (s, 3H), 2,56 (s, 3H). LCM
Ejemplo 489.0: Preparación de (2R)-N-(4-(2,6-dimetox (5-metil-2-pirazinil)etanosulfonamida o (2s)-N-(4-(2, hidroxi-2-(5-metil-2-pirazinil)etanosulfonamida.
riazol-3-il)-2-hidroxi-2-(5-metil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-meros de 487.0 se separaron por una separación SFC a columna CC4 usando las siguientes condiciones de mm CC4 con 58 g/min de MeOH (NH320 mM) 42 ura. = 22°C, Presión de salida = 100 bar, Longitud de en 8 ml de MeOH:DCM (5:3), c= 5,9 mg/ml y 17,7 mg se recogieron de forma manual. 1H RMN (500 MHz, ,63 (d, J=7,3 Hz, 1 H), 7,44 (t, J=8,6 Hz, 1H), 6,75 - 6,81 H), 3,71 (d, J=3,9 Hz, 1H), 3,68 (d, J=3,9 Hz, 1H), 3,42 I (POS), m/z: 528,2 (M+H)+.
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirazinil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-2-pirazinil)etanosulfonamida, Ejemplo 489.0. El c columna CC4 usando las condiciones de SFC descritas 1H), 8,49 (s, 1 H), 7,73 (t, J=7,8 Hz, 1H), 7,63 (d, J=7,5 J=8,3, 3,9 Hz, 1 H), 3,76 (s, 3H), 3,74 (s, 3H), 3,69 (dd, 3H), 2,56 (s, 3H). LCMS-ESI (POS), m/z: 528,2 (M+H)+.
Ejemplo 490.0: Preparación de (2R)-2-(4-ciano-2-(metils 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida y (2S)-2-(4riazol-3-il)-2-hidroxi-2-(5-metil-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-esto del título era el segundo isómero en eluir de la l Ejemplo 488.0. 1H RMN (500 MHz, CD3OD) 58,55 (s, H), 7,44 (t, J=8,3 Hz, 1H), 6,75-6,81 (m, 3H), 5,23 (dd, ,2, 3,9 Hz, 1H), 3,42 (dd, J=14,2, 8,3 Hz, 1H), 3,19 (s,
il)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H--2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -2 -h id ro x ie ta n o s u lfo n a m id
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife hidroxietanosulfonamida y (2S)-2-(4-ciano-2-(metils 1.2.4- triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo procedimiento descrito en el Ejemplo 481.0, usando el 6.
Ejemplo 491.0: Preparación de (2R)-2-(4-ciano-2-(metils 1.2.4- triazol-3-il)-2-hidroxietanosulfonamida o (2S)-2-( 3-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamid (5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-. El compuesto del título se preparó siguiendo el
)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H--2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife hidroxietanosulfonamida o (2S)-2-(4-ciano-2-(metils 1.2.4- triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo separaron por una separación SFC quiral. El Ejemplo usando las siguientes condiciones de SFC. Realizado e de MeOH (solo) 90 g/min de CO2, 55% de co-disolve 100 bar, Longitud de onda = 276 nm. Inyectado 4,8 ml d c = 12,5 mg/ml, es decir 60 mg por inyección. Tiempo de MHz, CD3OD) 58,45 (br. s., 1H), 8,26 - 8,36 (m, 2H), 8 (d, J=8,1 Hz, 1H), 6,81 (d, J=8,3 Hz, 1H), 6,07 (dd, J=7, 4,77 Hz, 1H), 3,53 (dd, J=14,3, 7,5 Hz, 1H), 3,16 (s, 3H),
Ejemplo 492.0: Preparación de (2R)-2-(4-ciano-2-(metils 1.2.4- triazol-3-il)-2-hidroxietanosulfonamida o (2S)-2-( 3-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamid (5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-Los enantiómeros preparados en el Ejemplo 490.0 se era el segundo isómero en eluir de una columna IC 350 SFC con columna 150x50 mm IC con 110 ml/min 200 g/min. Temperatura. = 19°C, Presión de salida = mg de muestra disuelta en 16 ml de MeOH:DCM (3:1); = 14,5 min, Tiempo de análisis = 16 min. 1H RMN (500 ,09 (m, 2H), 7,71 (s, 1H), 7,54 (t, J=8,6 Hz, 1H), 6,85 Hz, 1H), 3,83 (s, 3H), 3,77 (s, 3H), 3,62 (dd, J=14,31, (s, 3H). LCMS-ESI (POS), m/z: 599,2 (M+H)+.
)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H--2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-
(2R)-2-(4-ciano-2-(metilsulfonil)fenil)-N-(4-(2,6-dimetoxife hidroxietanosulfonamida o (2S)-2-(4-ciano-2-(metils 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 49 la columna IC usando las condiciones de SFC descritas s., 1H), 8,27-8,35 (m, 2H), 8,01-8,10 (m, 2H), 7,71 (s, J=8,4 Hz, 1H), 6,07 (dd, J=7,5, 4,9 Hz, 1H), 3,83 (s, J=14,2, 7,5 Hz, 1H), 3,16 (s, 3H), 2,32 (s, 3H). LCMS-ES
Ejemplo 493.0: Preparación de (2R)-N-(4-(2,6-dimetoxi (2-metil-5-pirimidinil)etanosulfonamida y (2S)-N-(4-(2, hidroxi-2-(2-metil-5-pirimidinil)etanosulfonamida.
(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-)fenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-l compuesto del título era el primer isómero en eluir de Ejemplo 491.0. 1H RMN (500 MHz, CD3OD) 58,45 (br. ,53 (t, J=8,5 Hz, 1H), 6,85 (d, J=8,3 Hz, 1H), 6,81 (d, ,77 (s, 3H), 3,62 (dd, J=14,2, 4,8 Hz, 1H), 3,53 (dd, S), m/z: 599,2 (M+H)+.
5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-toxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirimidinil)etanosulfonamida y (2S)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)etanosulfonamida, Ejemplo 493.0. El en el Ejemplo C usando 4.0 y 2-metilpirimidina-5-carbal PA).
Ejemplo 494.0: Preparación de (2R)-N-(4-(2,6-dimetox (2-metil-5-pirimidinil)etanosulfonamida o (2S)-N-(4-(2, hidroxi-2-(2-metil-5-pirimidinil)etanosulfonamida.
riazol-3-il)-2-hidroxi-2-(2-metil-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(2-uesto del título se preparó siguiendo el procedimiento o (disponible en el mercado en AstaTech, Inc., Bristol,
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirimidinil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)etanosulfonamida, Ejemplo 494.0. Los por separación SFC quiral como se ha descrito. El Ejem H usando las siguientes condiciones de SFC. Realizad ml/min de MeOH (NH320 mm) 45 g/min de CO2, 50 de salida = 100 bar, Longitud de onda = 296 nm. Iny MeOH:DCM 2:1, c= 16,7 mg/ml y 50,1 mg por inyecci (500 MHz, CD3OD) S 8,64 (s, 2H), 7,73 (dd, J=8,3, 7,6 6,81 (d, J=8,6 Hz, 2H), 6,76 (dd, J=8,3, 0,7 Hz, 1H), 5, 3,59 (m, 1 H), 3,40 - 3,49 (m, 1H), 3,19 (s, 3H),2,69 (s, 3
Ejemplo 495.0: Preparación de (2R)-N-(4-(2,6-dimetox (2-metil-5-pirimidinil)etanosulfonamida o (2S)-N-(4-(2, hidroxi-2-(2-metil-5-pirimidinil)etanosulfonamida.
riazol-3-il)-2-hidroxi-2-(2-metil-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(2-tiómeros preparados en el Ejemplo 493.0 se separaron 94.0 era el primer isómero en eluir de una columna AD-Thar 200 SFC con columna 250x30 mm AD-H con 45 o-disolvente a 90 g/min. Temperatura. = 20°C, Presión o 3,0 ml de 251 mg de muestra disuelta en 15 ml de s fracciones se recogieron de forma manual. 1H RMN H), 7,63 (dd, J=7,3, 0,7 Hz, 1H), 7,45 (t, J=8,6 Hz, 1H), d, J=7,1,5,4 Hz, 1H), 3,77 (s, 3H), 3,75 (s, 3H), 3,50 -MS-ESI (POS), m/z: 528,2 (M+H)+.
-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-
(2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 pirimidinil)etanosulfonamida o (2S)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)etanosulfonamida. Ejemplo 495.0. El columna AD-H usando las condiciones de SFC descrita 2H), 7,73 (dd, J=8,3, 7,5 Hz, 1H), 7,63 (d, J=7,4 Hz, 1 J=8,3, 0,7 Hz, 1H), 5,14 (dd, J=7,1, 5,5 Hz, 1H), 3,77 ( J=14,1,5,4 Hz, 1H), 3,19 (s, 3H), 2,69 (s, 3H). LCMS-E
Ejemplo 496.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida y (1 S triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-propanosu piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimi riazol-3-il)-2-hidroxi-2-(2-metil-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(2-uesto del título era el segundo isómero en eluir de la l Ejemplo 494.0. 1H RMN (500 MHz, CD3OD) S 8,64 (s, 45 (t, J=8,5 Hz, 1H), 6,81 (d, J=8,6 Hz, 2H), 6,76 (dd, ), 3,76 (s, 3H), 3,55 (dd, J=14,2, 7,2 Hz, 1H), 3,45 (dd, S), m/z: 528,2 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-2-propanosulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il) roxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida y (1S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida y (1 S,2S)-N-( il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamid 4H-1,2,4-triazol-3-il)-1-hidroxi-1-(2-metil-5-pirimidinil)-2-p se preparó siguiendo el procedimiento en el Ejemplo C el mercado en AstaTech, Inc., Bristol, PA). LCMS-ESI (
Ejemplo 497.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida o (1 S triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-propanosu piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il) ,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-osulfonamida, Ejemplo 496.0. El compuesto del título o 5.0 y 2-metil-pirimidina-5-carbaldehído (disponible en m/z: 542,2 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-roxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida o (1 S,2S)-N-( il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamid 4H-1,2,4-triazol-3-il)-1-hidroxi-1-(2-metil-5-pirimidinil)-2-p Ejemplo 496.0 se separaron por separación SFC quiral el primer isómero en eluir al inyectar 496.0 en una Realizado en Thar 200 SFC con columna 400x30 mm CO2, 33% de co-disolvente a 110 g/min. Temperatura. nm. Inyectado 0,5 ml de 395 mg de muestra disuelta inyección. Tiempo de ciclo 12 min, Tiempo de análisis (m, 2H), 7,39 (t, J=8,5 Hz, 1H), 6,72-6,76 (m, 1H), 6,69 (s, 3H), 3,70 (s, 3H), 3,17 (s, 3H), 3,12-3,16 (m, 1H), 542,2 (M+H)+.
Ejemplo 498.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida o (1 S triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-propanosu ,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-osulfonamida, Ejemplo 497.0. Los enantiómeros del se describe a continuación. El compuesto del título era na AD-H usando las siguientes condiciones de SFC.
con 36 ml/min de EtOH (NH320 mm) 74 g/min de , Presión de salida = 100 bar, Longitud de onda = 297 ml de MeOH:DCM 2:1, c= 28,2 mg/ml y 14,1 mg por n. 1H RMN (500 MHz, CDCh) 58,62 (s, 2h), 7,61-7,69 =8,4 Hz, 1H), 6,63 (d, J=8,3 Hz, 1H), 5,55 (s, 1H), 3,84 s, 3H), 1,22 (d, J=7,0 Hz, 3H). LCMS-ESI (POS), m/z:
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il -2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-idroxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida o (1 S,2S)-N-( il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonami 4H-1,2,4-triazol-3-il)-1-hidroxi-1-(2-metil-5-pirimidinil)-2-p era el cuarto isómero en eluir al inyectar 496.0 en la c Ejemplo 497.0. 1H RMN (CD2Cl2) 5: 8,49 (s, 2H), 7,51-7 Hz, 2H), 6,59 (dd, J=8,5, 0,8 Hz, 1H), 5,39 (s, 1H), 3,7 1H), 2,59 (s, 3H), 1,10 (d, J=7,0 Hz, 3H). LCMS-ESI (P
Ejemplo 499.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida y (1 triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanos piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il ,4-triazol-3-il)-1 -hidroxi-1 -(2-metil-5-pirimidinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-nosulfonamida. Ejemplo 498.0. El compuesto del título a AD-H usando las condiciones de SfC descritas en el m, 2H), 7,34 (t, J=8,5 Hz, 1 H), 6,65 (ddd, J=8,3, 5,7, 0,9 3H), 3,62 (s, 3H), 3,07 (s, 3H), 3,02 (dd, J=7,0, 1,3 Hz, /z: 542,2 (M+H)+.
nil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi--N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2--2-propanosulfonamida y (1 R,2R)-N-(4-(2,6-etoxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida y (1S,2R)-N-(4-(2,6-dimetoxifen metil-5-pirimidinil)-2-propanosulfonamida y (1 S,2S)-N-( il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonami 4H-1,2,4-triazol-3-il)-1-metoxi-1-(2-metil-5-pirimidinil)-2-p se preparó siguiendo el procedimiento en el Ejemplo en el mercado en AstaTech, Inc., Bristol, PA). LCMS-ES
Ejemplo 500.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida o (1 triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanos piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il),4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-nosulfonamida, Ejemplo 499.0. El compuesto del título ando 4.0 y 2-metil-pirimidina-5-carbaldehído (disponible S), m/z: 556,0 (M+H)+.
nil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi--N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2--2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-etoxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida o (1 S,2S)-N-( il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamid 4H-1,2,4-triazol-3-il)-1-metoxi-1-(2-metil-5-pirimidinil)-2-p Ejemplo 499.0 se separaron por separación SFC quira pico en la columna IC (el tercer isómero en eluir al in descritas a continuación. Realizado en Thar 350 SFC c de EtOH (NH320 mM) 50 g/min de CO2, 50% de co-di = 100 bar, Longitud de onda = 297 nm. Inyectado 2,0 1:1; c= 21,8 mg/ml, y 43,6 mg por inyección. Tiempo 500.0 y el cuarto pico 501.0 se obtuvieron puros m parcialmente. La mezcla de isómeros del primer y el se de la etapa 2 como se describe a continuación. Realiz OD-H en serie con 15,40 ml/min de MeOH (NH320 m Temperatura. = 24°C, Presión de salida = 100 bar, Lo muestra disuelta en 10 ml de MeOH:DCM 1:1; c= 1,17 5 8,48 (s, 2H), 7,74 (dd, J=8,3, 7,6 Hz, 1H), 7,61 - 7,67 J=8,3, 0,7 Hz, 1H), 4,61 (d, J=4,9 Hz, 1H), 3,79 (s, 3H), 2,70 (s, 3H), 1,34 (d, J=7,1 Hz, 3H). LCMS-ESI (POS),
Ejemplo 501.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida o (1 S triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosu piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il) 2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-nosulfonamida, Ejemplo 500.0. Los enantiómeros del mo se ha descrito. El compuesto del título era el tercer ar 499.0 en la columna IC) en las condiciones de SFC lumnas 30x150 30x250 mm IC en serie con 50 ml/min ente a 50 g/min. Temperatura. = 24°C, Presión de salida e 435 mg de muestra disuelta en 20 ml de MeOH:DCM iclo 13,5 min, Tiempo de análisis 18 min. El tercer pico as que el primero y el segundo picos se solapaban o pico se separaron en columna OD-H en la purificación en Thar 350 SFC con columnas 21x150 21x250 mm 54,00 g/min de CO2, 22% de co-disolvente a 70 g/min. d de onda = 297 nm. Inyectado 4,8 ml de 117 mg de l, y 5,617 mg por inyección. 1H RMN (500 MHz, CD3OD) 1H), 7,47 (t, J=8,4 Hz, 1H), 6,81 - 6,89 (m, 2H), 6,77 (dd, 7 (s, 3H), 3,21 - 3,29 (m, 1H), 3,19 (s, 3H), 3,19 (s, 3H), 555,9 (M+H)+.
nil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi--N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-amida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-)-2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-etoxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida o (1 S,2S)-N-( il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamid 4H-1,2,4-triazol-3-il)-1-metoxi-1-(2-metil-5-pirimidinil)-2-p cuarto isómero en eluir al inyectar 499.0 en la columna 2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2--(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-nosulfonamida, 501.0. El compuesto del título era el usando las condiciones de SFC descritas en el Ejemplo
500.0. 1H RMN (500 MHz, CD3OD) 58,48 (br. s., 2H), Hz, 1H), 6,84 (t, J=7,6 Hz, 2H), 6,77 (d, J=8,2 Hz, 1H), 1H), 3,19 (s, 3H), 3,18 (s, 3H), 2,70 (s, 3H), 1,34 (d, J=7,
Ejemplo 502.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida o (1 S triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosu piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il) (t, J=7,9 Hz, 1H), 7,64 (d, J=7,5 Hz, 1H), 7,47 (t, J=8,4 -4,66 (m, 1H), 3,79 (s, 3H), 3,77 (s, 3H), 3,22-3,30 (m, 3H). LCMS-ESI (POS), m/z: 555,9 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-toxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida o (1 S,2S)-N-( il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamid 4H-1,2,4-triazol-3-il)-1-metoxi-1-(2-metil-5-pirimidinil)-2-p era el primer pico en eluir en la columna OD. Se obt columna OD en las condiciones de SFC descritas en el 7,74 (t, J=7,8 Hz, 1H), 7,65 (d, J=7,0 Hz, 1H), 7,47 (t, 4,61 (d, J=4,9 Hz, 1H), 3,79 (s, 3H), 3,77 (s, 3H), 3,21-J=6,8 Hz, 3H). LCMS-ESI (POS), m/z: 556,0 (M+H)+.
Ejemplo 503.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(2-metil-5-pirimidinil)-2-propanosulfonamida o (1 S triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosu piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimi dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il) ,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-osulfonamida, Ejemplo 502.0. El compuesto del título e la purificación de la segunda etapa de 499.0 en la plo 500.0. 1H RMN (500 MHz, CD3OD) 58,48 (s, 2H), Hz, 1H), 6,84 (t, J=7,2 Hz, 2H), 6,77 (d, J=8,2 Hz, 1H), m, 1H), 3,19 (s, 3H), 3,18 (s, 3H), 2,70 (s, 3H), 1,34 (d,
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-toxi-1-(2-metil-5-pirimidinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metil-5-pirimidinil)-2-propanosulfonamida o (1 S,2S)-N-( il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-propanosulfonamid 4H-1,2,4-triazol-3-il)-1-metoxi-1-(2-metil-5-pirimidinil)-2-p era el segundo pico en eluir en la columna OD. Se ob ,4-triazol-3-il)-1 -metoxi-1 -(2-metil-5-pirimidinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-osulfonamida, Ejemplo 503.0. El compuesto del título de la purificación de la segunda etapa de 499.0 en la
columna OD en las condiciones de SFC descritas en el 7,75 (t, J=7,7 Hz, 1H), 7,59-7,64 (m, 1H), 7,45 (t, J=8, 3H), 3,70-3,73 (m, 3H), 3,52-3,60 (m, 1H), 3,18 (s, 3H), (POS), m/z: 556,0 (M+H)+.
Ejemplo 504.0: Preparación de (2E)-N-(4-(2,6-dimetox pirimidinil)-2-buteno-2-sulfonamida.
plo 500.0. 1H RMN (500 MHz, CD3CN) 58,53 (s, 2H), 1H), 6,75-6,82 (m, 3H), 4,67 (d, J=5,6 Hz, 1H), 3,75 (s, (s, 3H), 2,66 (s, 3H), 1,11 (d, J=7,1 Hz, 3H). LCMS-ESI
-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-
(2E)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2 sulfonamida, Ejemplo 504.0. El compuesto del título se 2.0 y 10.05. 1H RMN (500 MHz, DMSO-ds) 5 13,50 (s, J=2,0 Hz, 1H), 7,58 - 7,67 (m, 1H), 7,46 - 7,55 (m, 1H), 2,26 (s, 3H), 1,84 (d, J=1,5 Hz, 3H). LCMS-ESI (POS),
Ejemplo 505.0: Preparación de (2E)-N-(4-(2,6-dimetoxif pirimidinil)-2-buteno-2-sulfonamida.
zol-3-il)-3-(5-fluoro-2-pirimidinil)-2-buteno-2-ró siguiendo el procedimiento en el Ejemplo B, usando ,96 (d, J=0,7 Hz, 2H), 8,49 (d, J=1,7 Hz, 1H), 8,22 (d, (d, J=8,6 Hz, 2H), 3,71 (s, 6H), 2,30 (d, J=1,7 Hz, 3H), 5,8 (M+H)+.
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-fluoro-2-
(2E)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1 sulfonamida, Ejemplo 505.0. El compuesto del título se 2.2 y 10.05. 1H RMN (500 MHz, DMSO-ds) 513,42 (s, (dd, J=7,3, 0,7 Hz, 1H), 7,41 (t, J=8,4 Hz, 1H), 6,84 (d, 3H) 2,30 (d, J=1,5 Hz, 3H) 1,82 (d, J=1,5 Hz, 3H). LCM
Ejemplo 506.0: Preparación de (2S,3R)-N-(4-(2,6-dime 2-pirazinil)-2-butanosulfonamida.
iazol-3-il)-3-(5-fluoro-2-pirimidinil)-2-buteno-2-ró siguiendo el procedimiento en el Ejemplo B, usando ,95 (d, J=0,7 Hz, 2H), 7,81 (dd, J=8,3, 7,6 Hz, 1H), 7,60 Hz, 1H), 6,79 (d, J=8,6 Hz, 2H), 3,65 (s, 6H), 3,11 (s, (POS), m/z: 541,8 (M+H)+.
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H Ejemplo 506.0. El compuesto del título se preparó sigui RMN (500 MHz, CD2Cl2) 58,43 - 8,58 (m, 3H) 8,25 (s, 2H), 3,69 (s, 3H), 3,70 (s, 3H), 3,42 - 3,59 (m, 2H), 2, (POS), m/z: 523,9 (M+H)+.
Ejemplo 507.0: Preparación de (2S,3R)-N-(4-(2,6-d metil-2-pirazinil)-2-butanosulfonamida.
-triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida, l procedimiento en el Ejemplo B, usando 2.0 y 10.3. 1H ,04 (s, 1H) 7,43 (t, J=8,56 Hz, 1H), 6,64 (t, J=8,80 Hz, 3H), 2,36 (s, 3H), 1,26 (t, J=7,34 Hz, 6H). LCMS-ESI
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 butanosulfonamida, Ejemplo 507.0. El compuesto del tí usando 2.2 y 10.3. 1H RMN (500 MHz, CD2Cl2) 58,64 1H), 6,59 - 6,84 (m, 3H), 3,75 (m, 6H), 3,47 - 3,66 (m, 2 J=7,0 Hz, 3H). LCMS-ESI (POS), m/z: 539,9 (M+H)+.
Ejemplo 508.0: Preparación de (1S,2R)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida y 1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil) (6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-tria propanosulfonamida.
,4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-e preparó siguiendo el procedimiento en el Ejemplo B, ), 8,31 (s, 1H), 7,55 - 7,76 (m, 2H), 7,44 (t, J=8,4 Hz, 9 (s, 3H), 2,65 (s, 3H), 1,39 (d, J=9,2, Hz, 3H), 1,37 (d,
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-opanosulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-i-5-metil-2-pirazinil)-2-propanosulfonamida y (1 S,2S)-N--il)-1-hidroxi-1-(3-metoxi-5-metil-2-pirazinil)-2-
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida y (1 R triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-2-pr metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-met 508.0. El compuesto del título se preparó siguiendo el pr pirazinacarboxaldehído (disponible en el mercado en mayoritario y minoritario se separaron como se describe
Ejemplo 509.0: Preparación de (IS,2R)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil) ,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6--metil-2-pirazinil)-2-propanosulfonamida, Ejemplo imiento en el Ejemplo C, usando 5.0 y 3-metoxi-5-metil-S Pharma, Inc., Princeton, NJ). Los diastereómeros s siguientes ejemplos.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-opanosulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 ,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejemp en una columna IC cuando se somete la mezcla de dias de separación de la columna IC eran las siguientes. Re ml/min de MeOH (NH320 mM) 34 g/min de CO2, 55 de salida = 100 bar, Longitud de onda = 299 nm. Iny MeOH:DCM 3:1; c= 5,5 mg/ml y 8,25 mg por inyección RMN (500 MHz, CD3OD) 58,01 (s, 1H), 7,73 (dd, J=8,2 1H), 6,72 - 6,81 (m, 3H), 5,58 (d, J=2,9 Hz, 1H), 3,91 (s 3H), 2,46 (s, 3H),1,24 (d, J=7,1 Hz, 3H). LCMS-ESI (PO
Ejemplo 510.0: Preparación de (IS,2R)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil) (6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-9.0. El compuesto del título era el primer pico en eluir meros mayoritarios del Ejemplo 508.0. Las condiciones o en Thar 80 SFC con columna 250x21 mm IC con 41 o-disolvente a 75 g/min. Temperatura. = 35°C, Presión 1,5 ml de 110 mg de muestra disuelta en 20 ml de po de ciclo = 3,75 min, Tiempo de análisis 8 min. 1H Hz, 1H), 7,63 (dd, J=7,6, 0,7 Hz, 1H), 7,42 (t, J=8,6 Hz, 3,73 (s, 3H), 3,71 (s, 3H), 3,59 - 3,66 (m, 1H), 3,19 (s, z: 572,3 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-panosulfonamida.
(1S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida Ejempl en la columna IC en las condiciones descritas en el Eje (dd, J=8,2, 7,5 Hz, 1H), 7,63 (dd, J=7,6, 0,7 Hz, 1H), 7, 1H), 3,91 (s, 3H), 3,73 (s, 3H), 3,71 (s, 3H),, 3,64 - 3,6 LCMS-ESI (POS), m/z: 572,3 (M+H)+.
Ejemplo 511.0: Preparación de 1S,2S)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil) ,4-triazol-3-il)-1-hidroxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-.0. El compuesto del título era el segundo pico en eluir 509.0. 1H Rm N (500 MHz, CD3OD) 58,01 (s, 1H), 7,73 J=8,6 Hz, 1H), 6,72 - 6,81 (m, 3 H) 5,58 (d, J=2,9 Hz, 1H), 3,19 (s, 3H), 2,46 (s, 3H),1,24 (d, J=7,1 Hz, 3H).
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-panosulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejem Ejemplo 508.0 se separó. El compuesto del título era el condiciones. Realizado en Thar 200 SFC con columna g/min de CO2, 55% de co-disolvente a 120 g/min. Tem onda = 296 nm. Inyectado 3,0 ml de 116 mg de muest inyección. Tiempo de ciclo = 9 min, Tiempo de análisis 7,76 (m, 1H), 7,58 - 7,65 (m, 1H), 7,41 (t, J=8,6 Hz, 1H) J=8,6 Hz, 1H), 3,98 (s, 3H), 3,73 - 3,76 (m, 1H), 3,75 ( Hz, 3H). LCMS-ESI (POS), m/z: 572,1 (M+H)+.
Ejemplo 512.0: Preparación de 1 S,2S)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil) 4-triazol-3-il)-1 -hidroxi-1 -(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-1.0. La mezcla de diastereómeros minoritarios del er pico en eluir en una columna CC4 en las siguientes 0 mm CC4 con 66 ml/min de MeOH (NH320 mM) 54 ura. = 30°C, Presión de salida = 100 bar, Longitud de uelta en 20 ml de MeOH; c= 5,8 mg/ml y 17,4 mg por min. 1H RMN (500 MHz, CD3OD) 58,02 (s, 1H), 7,67 -(dd, J=8 ,6 , 2,5 Hz, 2H), 6,73 (d, J=8,3 Hz, 1H), 5,20 (d, , 3,73 (s, 3H), 3,18 (s, 3H), 2,46 (s, 3H), 1,07 (d, J=6,9
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-panosulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida Ejempl en la columna CC4 como se describe en el Ejemplo 5l (m, 1 H), 7,64 (m, 1H), 7,43 (t, J=8,4 Hz, 1H), 6,82-6,74 3,75 (s, 3H), 3,63 - 3,72 (m, 1H), 3,19 (s, 3H), 2,46 (s, (M+H)+.
Ejemplo 513.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida y 1,2,4-triazol-3-il)-1 -metoxi-1 -(3-metoxi-5-metil-2-pirazinil) ,4-triazol-3-il)-1-hidroxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(3-.0. El compuesto del título era el segundo pico en eluir 1H RMN (500 MHz, CD3OD) 58,02 (s, 1H), 7,78 - 7,70 3H), 5,18 (d, J=8,3 Hz, 1H), 3,98 (s, 3H), 3,77 (s, 3H), 1,09 (d, J=6,9 Hz, 3H). LCMS-ESI (POS), m/z: 572,2
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-opanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejemp procedimiento en el Ejemplo C usando 5.0 y 3-metoxi-ACES Pharma, Inc., Princeton, NJ). La formación del ét Ejemplo 22.0. El producto se aisló como una mezcla de 5 11,09 (br. s., 1H), 8,04 (s, 1H), 7,54 - 7,69 (m, 2H), 7 J=4,7, 4,0 Hz, 2H), 5,20 (d, J=4,4 Hz, 1 H), 3,94 (s, 3H), 3,30 (m, 3H), 3,17 (s, 3H), 2,45 (s, 3H),1,40 (d, J=7,1 Hz
Ejemplo 514.0: Preparación de (1R,2R)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida y 1,2,4-triazol-3-il)-1 -metoxi-1 -(3-metoxi-5-metil-2-pirazinil) ,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(3 3.0. El compuesto del título se preparó siguiendo el il-pirazinacarboxaldehído (disponible en el mercado en llevó a cabo siguiendo el procedimiento descrito en el iastereómeros mayoritarios. 1H RMN (500 MHz, CDCh) t, J=8,6 Hz, 1H), 6,71 (dd, J=7,5, 1,6 Hz, 1H), 6,61 (dt, s, 3H), 3,68 (s, 3H), 3,62 (qd, J=7,0, 4,7 Hz, 1 H), 3,24 -. LCMS-ESI (POS), m/z: 586,2 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-opanosulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejemp Ejemplo 513.0, dio el compuesto del título como una m CD3OD) 58,07 (s, 1 H), 7,70 - 7,76 (m, 1H), 7,63 (dd, J 2H), 6,76 (dd, J=8,3, 0,7 Hz, 1H), 4,89 (d, J=8,8 Hz, 1H) 3,19 (s, 3H), 3,08 (s, 3H), 2,48 (s, 3H), 1,03 (d, J=7,09 H
Ejemplo 515.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida o 1,2,4-triazol-3-il)-1 -metoxi-1 -(3-metoxi-5-metil-2-pirazinil) ,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(3 -4.0. La elución adicional de la reacción descrita en el de los diastereómeros minoritarios. 1H RMN (500 MHz, 0,9 Hz, 1H), 7,43 (t, J=8,6 Hz, 1H), 6,80 (d, J=8,6 Hz, 8 (s, 3H), 3,78 (s, 3H), 3,75 (s, 3H), 3,69 - 3,74 (m, 1H), ). LCMS-ESI (POS), m/z: 586,1 (M+H)+.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-opanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejem cuando se somete 513.0 a las siguientes condiciones columna 250x30 mm CC4 con 36 ml/min de MeOH ( g/min. Temperatura. = 38°C, Presión de salida = 100 b de muestra disuelta en 30 ml de MeOH:DCM 1:1; c= Tiempo de análisis 13 min. 1H RMN (500 MHz, CDCls) (dd, J=7,5, 1,6 Hz, 1H), 6,61 (dd, J=8,6, 4,2 Hz, 2H), 5, 3,63 (qd, J=7,0, 4,5 Hz, 1H), 3,27 (s, 3H), 3,18 (s, 3H), 586,2 (M+H)+.
Ejemplo 516.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida
1,2,4-triazol-3-il)-1 -metoxi-1 -(3-metoxi-5-metil-2-pirazinil ,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(3-5.0. El compuesto del título era el primer pico en eluir el una columna CC4. Realizado en Thar 80 SFC con mM) 44 g/min de CO2, 45% de co-disolvente a 80 ngitud de onda = 296 nm. Inyectado 1,0 ml de 110 mg g/ml y 3,7 mg por inyección. Tiempo de ciclo 7 min, (s, 1H), 7,57 - 7,66 (m, 2H), 7,32 (t, J=8,6 Hz, 1H), 6,71 J=4,4 Hz, 1H), 3,94 (s, 3H), 3,73 (s, 3H), 3,68 (s, 3H), (s, 3H), 1,40 (d, J=7,1 Hz, 3H). LCMS-ESI (POS), m/z:
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-panosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida o (1S,2R)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejem en la columna c C4 como se describe en el Ejemplo 51 2H), 7,32 (t, J=8,5 Hz, 1H), 6,71 (dd, J=7,6, 1,4 Hz, 1H) 3H), 3,73 (s, 3H), 3,69 (s, 3H), 3,61-3,66 (m, 1H), 3,2 LCMS-ESI (POS), m/z: 586,2 (M+H)+.
Ejemplo 517.0: Preparación de (1R,2R)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida
1,2,4-triazol-3-il)-1 -metoxi-1 -(3-metoxi-5-metil-2-pirazinil ,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(3-.0. El compuesto del título era el segundo pico en eluir H RMN (500 MHz, CDCl3) 58,04 (s, 1H), 7,58-7,65 (m, (dd, J=8,5, 4,3 Hz, 2H), 5,20 (d, J=4,5 Hz, 1H), 3,94 (s, H), 3,18 (s, 3H), 2,46 (s, 3H), 1,40 (d, J=7,0 Hz, 3H).
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-panosulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-2-propanosulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamida, Ejem cuando se somete 514.0 a las siguientes condiciones 250x21 mm IC con 21 ml/min de MeOH (NH3 20 m Temperatura. = 28°C, Presión de salida = 100 bar, L muestra disuelta en 15 ml de MeOH:DCM 2:1; c= 4,4 de análisis 19 min. 1H RMN (500 MHz, CDCla) 58,05 (s J=7,34, 1,96 Hz, 1 H), 6,56 - 6,66 (m, 2 H), 4,91 (d, J= (s, 3 H), 3,71 (s, 3 H), 3,18 (s, 3 H), 3,16 (s, 3 H), 2,4 ,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(3 7.0. El compuesto del título era el primer pico en eluir columna IC. Realizado en Thar 80 SFC con columna 39 g/min de CO2, 35% de co-disolvente a 60 g/min. d de onda = 215 nm. Inyectado 0,3 ml de 66 mg de y 1,3 mg por inyección. Tiempo de ciclo 9 min, Tiempo 7,56 - 7,69 (m, 2 H), 7,32 (t, J=8,44 Hz, 1 H), 6,70 (dd, z, 1 H), 3,97 (s, 3 H), 3,86 (quin, J=7,34 Hz, 1 H), 3,78 3 H), 1,16 (d, J=7,09 Hz, 3 H). LCMS-ESI (POS), m/z:
586,2 (M+H)+.
Ejemplo 518.0: Preparación de (1R,2R)-N-(4-(2,6-dimet 1 -(3-metoxi-5-metil-2-pirazinil)-2-propanosulfonamida
1 ,2,4-triazol-3-il)-1 -metoxi-1 -(3-metoxi-5-metil-2-pirazinil) il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-panosulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 2-propanosulfonamida o (1S,2S)-N-(4-(2,6-dimetoxife metoxi-5-metil-2-pirazinil)-2-propanosulfonamidapropan segundo pico en eluir en la columna IC como se descri 8,05 (br. s, 1 H), 7,60 - 7,62 (m, 2 H), 7,31 (t, J=8,44 J=7,8 Hz, 1 H), 3,98 (s, 3 H), 3,86 - 3,89 (m, 1 H), 3,77 3 H). LCMS-ESI (POS), m/z: 586,1 (M+H)+.
Ejemplo 519.0: Preparación de (2R)-2-(5-cloro-1,3-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida y (2S)-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida.
,4-triazol-3-il)-1-metoxi-1-(3-metoxi-5-metil-2-pirazinil)-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(3-namida Ejemplo 518.0. El compuesto del título era el el Ejemplo 5l7.0. 1H RMN (500 MHz, CDCl3) 5 ppm H), 6,70 ((br. s, 1 H), 6,61 (t, J=8,7 Hz, 2 H), 4,91 (d, ), 3,70 (s, 3 H), 3,18 (s, 6 H), 2,47 (s, 3 H), 1,17 (br. s,
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-ro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-( hidroxietanosulfonamida y (2S)-2-(5-cloro-1,3-tiazol triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 519.0. E en el Ejemplo C usando 4.0 y 5-clorotiazol-2-carboxalde (500 MHz, CD3OD) 57,70 - 7,76 (m, 1H), 7,63 (dd, J= 6,81 (m, 3H), 5,31 (dd, J=9,4, 2,3 Hz, 1H), 3,68 - 3,75 m/z: 553,0 (M+H)+.
Ejemplo 520.0: Preparación de (2R)-2-(5-cloro-1,3-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o (2S)-2-piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida.
toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-puesto del título se preparó siguiendo el procedimiento (disponible en el mercado en Acros Organics). 1H RMN ,7 Hz, 1H), 7,60 (s, 1H), 7,42 (t, J=8,4 Hz, 1H), 6,73 -H), 3,30 - 3,36 (m, 2H), 3,17 (s, 3H). LCMS-ESI (POS),
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-ro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-( hidroxietanosulfonamida o (2S)-2-(5-cloro-1,3-tiazol triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 520.0. enantiómeros del Ejemplo 519.0 y era el primer isó condiciones de SFC. Realizado en Thar 80 SfC con c mM) 48,7 g/min de CO2, 35% de co-disolvente a 75 Longitud de onda = 297 nm. Inyectado 1,0 ml de 133 m mg por inyección. Tiempo de ciclo 6 min, Tiempo de an toxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-puesto del título se obtuvo a partir de la mezcla de en eluir de una columna IC usando las siguientes a 250x21 mm IC con 26,25 ml/min de EtOH (NH320 n. Temperatura. = 29°C, Presión de salida = 100 bar, uestra disuelta en 15 ml de MeOH; c= 8,9 mg/ml y 8,9 min. 1H RMN (500 MHz, CDCh) 57,63 - 7,68 (m, 2H),
7,52 (s, 1H), 7,38 (t, J=8,3 Hz, 1H), 6,70 - 6,79 (m, 1H), 1H), 3,80 (dd, J=14,1, 1,6 Hz, 1H), 3,76 (s, 3H), 3,72 (s (POS), m/z: 553,0 (M+H)+.
Ejemplo 521.0: Preparación de (2R)-2-(5-cloro-1,3 1,2,4-triazol-3-il)-2-hidroxietanosulfonamida o (2S)-2 piridinil)-4H-1,2,4-triazol-3-il)-2-hidroxietanosulfonamida (ddd, J=12,7, 8 ,6 , 0,7 Hz, 2H), 5,39 (dd, J=10,3, 1,7 Hz, , 3,30 (dd, J=14,2, 10,3 Hz, 1H), 3,17 (s, 3H). LCMS-ESI
ol-2-N)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-loro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-hidroxietanosulfonamida o (2S)-2-(5-cloro-1,3-tiazo triazol-3-il)-2-hidroxietanosulfonamida, Ejemplo 521.0. columna IC usando las condiciones de SfC descritas (m, 2H), 7,52 (s, 1H), 7,38 (t, J=8,3 Hz, 1H), 6,70 - 6 J=10,3, 1,7 Hz, 1 H), 3,80 (dd, J=14,1, 1,6 Hz, 1H), 3,76 3H). LCMS-ESI (POS), m/z: 553,0 (M+H)+.
Ejemplo 522.0: Preparación de (2R)-2-(5-cloro-1,3 1,2,4-triazol-3-il)-2-metoxietanosulfonamida y (2S)-2 piridinil)-4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mpuesto del título era el segundo isómero en eluir de la Ejemplo 520.0. 1H RMN (500 MHz, CDCb) 57,63 - 7,68 m, 1H), 6,64 (ddd, J=12,7, 8,56, 0,7 Hz, 2H), 5,39 (dd, H), 3,72 (s, 3H), 3,30 (dd, J=14,2, 10,3 Hz, 1H), 3,17 (s,
ol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-loro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-metoxietanosulfonamida y (2S)-2-(5-cloro-1,3-tiazol triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 522.0. en el Ejemplo C usando 4.0 y 5-clorotiazol-2-carbox formación de éter se llevó a cabo siguiendo el proc CDsOD) 57,68 - 7,75 (m, 1H), 7,59 - 7,64 (m, 2H), 7 J=8 ,8 , 3,4 Hz, 1H), 3,72 (d, J=2,5 Hz, 6 H), 3,51 - 3,56 ( ESI (POS), m/z: 567,0 (M+H)+. Los enantiómeros se s Ejemplo 523.0.
Ejemplo 523.0: Preparación de (2R)-2-(5-cloro-1,3 1,2,4-triazol-3-il)-2-metoxietanosulfonamida o (2S)-2 piridinil)-4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida.
etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2--N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mpuesto del título se preparó siguiendo el procedimiento ído (disponible en el mercado en Acros Organics). La ento descrito en el Ejemplo 22.0. 1H RMN (500 MHz, t, J=8,6 Hz, 1H), 6,75 (td, J=8,3, 0,7 Hz, 3H), 4,95 (dd, ), 3,42 - 3,50 (m, 1H), 3,34 (s, 3H), 3,16 (s, 3H). LCMS-aron por separación SFC quiral como se describe en el
ol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-loro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-metoxietanosulfonamida o (2S)-2-(5-cloro-1,3-tiazo triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 523.0. se somete 522.0 a las siguientes condiciones de sepa etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2-)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mpuesto del título era el primer isómero en eluir cuando n. Realizado en Thar 80 SFC con columna 150x20 mm
AD-H con 60 ml/min de MeOH:ACN (2:1) (NH4OH al 0 100 bar, Longitud de onda = 220 nm. Inyectado 0,75 ml RMN (500 MHz, CDCh) 57,55 (s, 1H), 7,45 - 7,52 (m, 4,96 (dd, J=8,31,3,42 Hz, 1H), 3,71 (dd, J=14,18, 3,18 (s, 3H), 3,12 (s, 3H). LCMS-ESI (POS), m/z: 567,0 (M+H
Ejemplo 524.0: Preparación de (2R)-2-(5-cloro-1,3-1,2,4-triazol-3-il)-2-metoxietanosulfonamida o (2S)-2-piridinil)-4H-1,2,4-triazol-3-il)-2-metoxietanosulfonamida.
Ü2 al 15%. Temperatura. = 29°C, Presión de salida = olución de muestra a 5 mg/ml de MeOH:DCM (2:1). 1H ,22 (t, J=8,44 Hz, 1H), 6,55 (dd, J=8,31,2,93 Hz, 3H), H), 3,60 (m, 6 H), 3,54 (dd, J=14,31, 8,44 Hz, 1H), 3,37
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-ro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-
(2R)-2-(5-cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-( metoxietanosulfonamida o (2S)-2-(5-cloro-1,3-tiazol triazol-3-il)-2-metoxietanosulfonamida, Ejemplo 524.0.
columna AD-H usando las condiciones de SFC descrita
Ejemplo 525.0: Preparación de (2S,3R)-N-(4-((R)-2,4-di 3-(5-fluoropirimidin-2-il)butano-2-sulfonamida y (2S,3R 1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butano-2-sulfon oxi-2-piridinil)-4H-1,2,4-triazol-3-il)-2--(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-puesto del título era el segundo isómero en eluir de la l Ejemplo 523.0.
ipiridin-3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)--((S)-2,4-dimetoxipiridin-3-il)-5-(6-metoxipiridin-2-il)-4H-(mezcla 1:1 de atropoisómeros).
(2S,3R)-N-(4-((R)-2,4-dimetoxipiridin-3-il)-5-(6-metoxipiri 2- sulfonamida y (2S,3R)-N-(4-((S)-2,4-dimetox fluoropirimidin-2-il)butano-2-sulfonamida (mezcla 1:1 de preparó siguiendo el procedimiento en el Ejemplo A mercado en SynChem, convertida en el isocianato medi ácido 6-metoxi-piridina-2-carboxílico (disponible en el ESI (POS), m/z: 545,1 (M+H)+.
Ejemplo 526.0: Preparación de (2S,3R)-N-(4-((R)-4-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butano-2-sulfon 3- il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5-fluo atropoisómeros).
il)-4H-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butanon-3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5-oisómeros), Ejemplo 525.0. El compuesto del título se o 10.1, 2,4-dimetoxipiridin-3-amina (disponible en el a química descrita en el Ejemplo 1.3) y la hidrazida del o en Sigma-Aldrich Chemical Company, Inc.). LCMS-
-2-oxo-1,2-dihidropiridin-3-il)-5-(6-metoxipiridin-2-il)-4H-y (2S,3R)-N-(4-((S)-4-metoxi-2-oxo-1,2-dihidropiridinidin-2-il)butano-2-sulfonamida (mezcla 1:1 de
Compuesto (2S,3R)-N-(4-((R)-4-metoxi-2-oxo-1,2-dihidr fluoropirimidin-2-il)butano-2-sulfonamida y (2S,3R)-N-(4 2-il)-4H-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butano-526.0. El compuesto del título se obtuvo como un subp CD3OD) 58,64 - 8,70 (m, 2H), 7,72 - 7,79 (m, 1H), 7, in-3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5--metoxi-2-oxo-1,2-dihidropiridin-3-il)-5-(6-metoxipiridinonamida (mezcla 1:1 de atropoisómeros), Ejemplo to durante la preparación de 525.0. 1H RMN (500 MHz, , J=7,3, 0,7 Hz, 1H), 7,62 (d, J=7,6 Hz, 1H), 6,82 (dt,
J=8,3, 0,7 Hz, 1H), 6,55 (dd, J=7,6, 2,5 Hz, 1H), 3,89 ( 1,38 - 1,43 (m, 3H), 1,36 (t, J=6,6 Hz, 3H). LCMS-ESI (
Ejemplo 527.0: Preparación de (2S,3R)-N-(4-((R)-4-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butano-2-sulfon 3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5-flu atropoisómeros).
4,4 Hz, 3H), 3,79 - 3,87 (m, 2H), 3,48 (d, J=0,7 Hz, 3H), , m/z: 531,0 (M+H)+.
xi-2-oxo-1,2-dihidropiridin-3-il)-5-(6-metoxipiridin-2-il)-4H-a o (2S,3R)-N-(4-((S)-4-metoxi-2-oxo-1,2-dihidropiridinrimidin-2-il)butano-2-sulfonamida (mezcla de
Compuesto (2S,3R)-N-(4-((R)-4-metoxi-2-oxo-1,2-dihid fluoropirimidin-2-il)butano-2-sulfonamida o (2S,3R)-N-(4 2-il)-4H-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butanoprimer isómero en eluir de una columna CC4 cuand Realizado en Thar 80 SFC con Columna 250x30 mm de co-disolvente a 80 g/min. Temperatura. = 29°C, Inyectado 1,8 ml de 22 mg de muestra disuelta en 5 ml fracciones se recogieron de forma manual. 1H RMN (50 7,66 (dd, J=7,6, 0,7 Hz, 1H), 7,60 (d, J=7,6 Hz, 1H), 6, 3,85 (m, 2H), 3,46 (s, 3H), 1,38 (d, J=6,9 Hz, 3H), 1,34 (
Ejemplo 528.0: Preparación de (2S,3R)-N-(4-((R)-4-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butano-2-sulfon 3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5-flu atropoisómeros).
idin-3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5-)-4-metoxi-2-oxo-1,2-dihidropiridin-3-il)-5-(6-metoxipiridinlfonamida, Ejemplo 527.0. El compuesto del título era el somete 526.0 a las siguientes condiciones de SFC. con 48 ml/min de MeOH (solo) 32 g/min de CO2, 60% ón de salida = 100 bar, Longitud de onda = 297 nm. eOH:DCM 4:1; c= 4,4 mg/ml y 7,9 mg por inyección. Las z, CD3OD) 58,64 (d, J=0,7 Hz, 2H), 7,70 - 7,77 (m, 1H), 6,84 (m, 1H), 6,53 (d, J=7,6 Hz, 1H), 3,86 (s, 3H), 3,75 -6,6 Hz, 3H). LCMS-ESI (POS), m/z: 531,2 (M+H)+.
xi-2-oxo-1,2-dihidropiridin-3-il)-5-(6-metoxipiridin-2-il)-4H-a o (2S,3R)-N-(4-((S)-4-metoxi-2-oxo-1,2-dihidropiridinrimidin-2-il)butano-2-sulfonamida (mezcla de
Compuesto (2S,3R)-N-(4-((R)-4-metoxi-2-oxo-1,2-dihid fluoropirimidin-2-il)butano-2-sulfonamida o (2S,3R)-N-(4 2-il)-4H-1,2,4-triazol-3-il)-3-(5-fluoropirimidin-2-il)butanosegundo isómero en eluir de la columna CC4 cuando Ejemplo 527.0. 1H RMN (500 MHz, CD3OD) 58,65 (s, J=7,3 Hz, 1H), 6,80 (d, J=8,1 Hz, 1H), 6,53 (d, J=7,6 H (d, J=6,9 Hz, 3H), 1,33 (d, J=6,9 Hz, 3H). LCMS-ESI (P
Ejemplo 529.0: Preparación de (1S,2R)-1-(5-cloro-2-pir il)-1 -metoxi-2-propanosulfonamida y (1 R,2S)-1 -(5-c triazol-3-il)-1-metoxi-2-propanosulfonamida.
idin-3-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-3-(5-)-4-metoxi-2-oxo-1,2-dihidropiridin-3-il)-5-(6-metoxipiridinlfonamida, Ejemplo 528.0. El compuesto del título era el omete 526.0 a las condiciones de SFC descritas en el 7,70 - 7,77 (m, 1H), 7,66 (dd, J=7,3, 0,7 Hz, 1H), 7,60 (d, ), 3,87 (s, 3H), 3,82 (d, J=6,4 Hz, 2H), 3,47 (s, 3H), 1,38 m/z: 531,1 (M+H)+.
l)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-
(1 R,2S)-1 -(5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxi il)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonami metoxibencil)propano-2-sulfonamida y (1 R,2R)-1 -( sulfonamida, Ejemplo 529.1. En un matraz de metoxibencil)etanosulfonamida (3,46 g, 9,90 mmol) en (2,5 M en hexanos, 4,36 ml, 10,89 mmol) mediante jeri de reacción se agitó a esta temperatura durante piridinacarbaldehído (1,40 g, 9,90 mmol) en THF (16,5 agitación. La mezcla de reacción después se agitó a -7 mezcla de reacción se agitó a TA durante 10 min ante ml). La mezcla de reacción después se diluyó con agu solución saturada de NaCl y se secó sobre Na2SO4. La inicial en forma de un aceite amarillo claro. El material purificó por cromatografía a través de una columna eluyendo con un gradiente de EtOAc en hexanos al material enriquecido como un aceite naranja. El material purificó por cromatografía a través de una columna de un gradiente de EtOAc en hexanos al 20-100%, para p metoxibencil)propano-2-sulfonamida y (1 S,2R)-1 -( sulfonamida como el primer estereoisómero que eluye mmol, 65,0% de rendimiento) en forma de un sólido compuesto que eluía era la (1S,2S)-1-(5-cloropiridin-2 (1 R,2R)-1 -(5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxi el isómero anti 1-(5-cloropiridin-2-il)-1-hidroxi-N,N-bis(4 3,14 mmol, 32% de rendimiento) en forma de un sólido il)propano-2-sulfonamida y (1 S,2R)-1 -(5-cloropiridin-2-y (1 S,2S)-1 -(5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-opiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-do redondo de 250 ml se añadió N,N-bis(4-(49,5 ml). Se añadió gota a gota solución de n-butil-litio n una corriente de N2 a -782C con agitación. La mezcla min y después se añadió gota a gota 5-cloro-2-) mediante jeringa en una corriente de N2 a -78°C con urante 10 min antes de retirar el baño de hielo seco. La inactivarla con solución acuosa saturada de NH4Cl (10 e extrajo con EtOAc. La capa orgánica se lavó con una ción se filtró y se concentró a vacío para dar el material tenido se absorbió sobre un tapón de gel de sílice y se el de sílice preempaquetada Redi-Sep (80 g) (Gold), 0% (con EtOH en EtOAc al 26%), para proporcionar quecido se absorbió sobre un tapón de gel de sílice y se sílice preempaquetada Redi-Sep (80 g), eluyendo con cionar (1R,2S)-1-(5-cloropiridin-2-il)-1-hidroxi-N,N-bis(4-opiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-a columna de gel de sílice, (isómeros sin, 3,16 g, 6,44 illo. LCMS-ESI (POS.) m/z: 491,1 (M+H)+. El segundo hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida y il)propano-2-sulfonamida de la columna de gel de sílice, xibencil)propano-2-sulfonamida (isómeros anti, 1,54 g, illo claro. LCMS-ESI (POS.) m/z: 491,1 (M+H)+.
(1 R,2S)-1 -(5-cloropiridin-2-il)-1-metoxi-N,N-bis(4-metoxib il)-1-metoxi-N,N-bis(4-metoxibencil)propano-2-sulfonamid sin (1 R,2S)-1 -(5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-met 2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfona N2, se añadió bis(trimetilsilil)amida de potasio (1,0 M en de reacción se agitó a -78°C durante 60 min y después mmol). La mezcla de reacción se agitó a -78°C durante saturada de NaHCÜ3 y agua y se extrajo con EtOAc. La se secó sobre Na2SÜ4. La solución se filtró y se concent amarillo claro. El material así obtenido se absorbió sobr través de una columna de gel de sílice preempaquetad hexanos al 0-100%, para dar el producto deseado; is metoxibencil)propano-2-sulfonamida y (1 S,2R)-1 -(5-sulfonamida (3,2 g, 6,34 mmol, 98% de rendimiento) e 505,1 (M+H)+.
)propano-2-sulfonamida y (1 S,2R)-1 -(5-cloropiridin-2-jemplo 529.2. En un vial de 25 ml se añadió el isómero ncil)propano-2-sulfonamida y (1 S,2R)-1 -(5-cloropiridin-(3,16 g, 6,44 mmol) en THF (64,4 ml). En atmósfera de , 9,65 ml, 9,65 mmol) a -78°C con agitación. La mezcla adió trifluorometanosulfonato de metilo (2,19 ml, 19,31 in. La mezcla de reacción se diluyó con una solución orgánica se lavó con una solución saturada de NaCl y vacío para dar el material inicial en forma de un aceite tapón de gel de sílice y se purificó por cromatografía a di-Sep (80 g), eluyendo con un gradiente de EtOAc en o sin (1R,2S)-1-(5-cloropiridin-2-il)-1-metoxi-N,N-bis(4-piridin-2-il)-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-a de un sólido amarillo claro. LCMS-ESI (p ü S.) m/z:
Compuesto (1 R,2S)-1-(5-cloropiridin-2-il)-1-metoxipro metoxipropano-2-sulfonamida, Ejemplo 529.3. En un ma (anhidro, 2,75 ml, 25,3 mmol) en TFA (42,2 ml)). La mez reacción se concentró a vacío para dar el producto com un tapón de gel de sílice y se purificó por cromatografía Redi-Sep (80 g), eluyendo con un gradiente de EtO enriquecido como un aceite naranja. El material enriquec por cromatografía a través de una columna de gel de gradiente de EtOAc en hexanos al 0-100% (con EtOH e (1,44 g, 5,44 mmol, 86% de rendimiento) en forma de un J=2,4 Hz, 1H), 7,91 (dd, J=8 ,6 , 2,4 Hz, 1H), 7,47-7,53 ( 3,41 (s, 3H), 1,22 (d, J=7,1 Hz, 3H). LCMS-ESI (POS.) -2-sulfonamida y (1S,2R)-1-(5-cloropiridin-2-il)-1-de 250 ml se añadió 529.2 (3,2 g, 6,34 mmol) y anisol e reacción se agitó a 23°C durante 20 h. La mezcla de aceite naranja. El material obtenido se absorbió sobre vés de una columna de gel de sílice preempaquetada n DCM de 0% a 100%, para proporcionar material e absorbió sobre un tapón de gel de sílice y se purificó e preempaquetada Redi-Sep (80 g), eluyendo con un OAc al 26%), para proporcionar el compuesto del título o amarillo claro. 1H RMN (500 MHz, CD3OD) 58,56 (d, ), 4,99 (d, J=2,7 Hz, 1H), 3,46 (qd, J=7,1,2,8 Hz, 1H), 65,0 (M+H)+.
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(3 propanosulfonamida y (1 R,2S)-1 -(5-cloro-2-piridinil) metoxi-2-propanosulfonamida, Ejemplo 529.0. El compu Ejemplo A, usando 1.0, 529.3, y la hidrazida del ácido RMN (500 MHz, CD3OD) 58,61 (br. s., 2H), 8,55 (dd, J 7,44 (d, J=8,6 Hz, 1H), 6,80 (dd, J=8 ,6 , 1,5 Hz, 2H), 4,98 1H), 3,26 (s, 3H), 1,13 (d, J=7,1 Hz, 3H). LCMS-ESI (PO
Ejemplo 530.0: Preparación de (1S,2R)-1-(5-cloro-2-piri il)-l-metoxi-2-propanosulfonamida o (1 R,2S)-1 -(5-cl triazol-3-il)-l-metoxi-2-propanosulfonamida.
inil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -del título se preparó siguiendo el procedimiento en el ínica (disponible en el mercado en Acros organics). 1H , 0,7 Hz, 1H), 7,83 - 7,96 (m, 2H), 7,47 - 7,55 (m, 2H), =2,5 Hz, 1H), 3,79 (s, 3H), 3,75 (s, 3H), 3,36 - 3,46 (m, /z: 545,0 (M+H)+.
N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3--piridinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-piridinil metoxi-2-propanosulfonamida, Ejemplo 530.0. El Ejem cuando se somete 529.0 a las siguientes condiciones AS-H con 18,9 ml/min IPA (+NH320 mM) 51,1 g/min 29°C, Presión de salida = 100 bar, Longitud de onda = 5 ml de MeOH/DCM (4:1); c= 6,4 mg/ml y 3,2 mg por i min. 1H RMN (500 MHz, CD3OD) 58,58 (br. s., 2H), 8, 7,49 (t, J=8,6 Hz, 1H), 7,40 - 7,46 (m, 2H), 6,79 (dd, J= 3H), 3,38 - 3,45 (m, 1H), 3,26 (s, 3H), 1,13 (d, J=7,1 Hz,
Ejemplo 531.0: Preparación de (1S,2R)-1-(5-cloro-2-pir il)-1 -metoxi-2-propanosulfonamida o (1 R,2S)-1 -(5-c triazol-3-il)-1-metoxi-2-propanosulfonamida.
dinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -0.0 era el primer isómero en eluir de la columna AS-H C: Realizado en Thar 80 SFC con columna 250x30 mm O2, 27% de co-disolvente a 70,0 g/min. Temperatura. = m. Inyectado 0,5 ml de 32,0 mg de muestra disuelta en ión. Tiempo de ciclo 18,5 min, Tiempo de análisis 20,0 J=2,4 Hz, 1H), 7,82 - 7,82 (m, 1H), 7,80 - 7,92 (m, 2H), ,1 Hz, 2H), 4,99 (d, J=2,5 Hz, 1H), 3,78 (s, 3H), 3,75 (s, LCMS-ESI (POS), m/z: 545,3 (M+H)+.
-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3--piridinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-piridinil metoxi-2-propanosulfonamida, Ejemplo 531.0. El comp AS-H cuando se somete 529.0 a las condiciones de 545,3 (M+H)+.
Ejemplo 532.0: Preparación de (1S,2R)-1-(5-cloro-2-p triazol-3-il)-1 -metoxi-2-propanosulfonamida y (1 R piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfon inil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -del título era el segundo isómero en eluir de la columna descritas en el Ejemplo 530.0. LCMS-ESI (POS), m/z:
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-.
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida y (1 R,2S)-1 -(5-cloro-2-piridinil)-il)-1-metoxi-2-propanosulfonamida, Ejemplo 532.0. El c el Ejemplo A usando 1.0, 529.3 y la hidrazida del Chemistry Co, Ltd., Beijing, China). 1H RMN (500 MHz, s., 1H), 7,83 - 7,94 (m, 2H), 7,52 (t, J=8,6 Hz, 1H), 7, J=2,5 Hz, 1H), 3,79 (s, 3H), 3,77 (s, 3H), 3,41 (qd, J=7, 3H). LCMS-ESI (POS), m/z: 559,0 (M+H)+.
Ejemplo 533.0: Preparación de (1S,2R)-1-(5-cloro-2-p triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 R piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfon til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-esto del título se preparó siguiendo el procedimiento en 5-metilnicotínico (disponible en el mercado en Bellen OD) 58,55 (d, J=2,5 Hz, 1H), 8,52 (br. s., 1H), 8,40 (br.
J=8,6 Hz, 1H), 6,81 (dd, J=8,7, 1,34 Hz, 2H), 4,98 (d, Hz, 1H), 3,26 (s, 3H), 2,35 (s, 3H), 1,13 (d, J=7,1 Hz,
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-.
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-piridinil)-N il)-1-metoxi-2-propanosulfonamida, Ejemplo 533.0. El columna AS-H cuando se somete 532.0 a las siguie columna 30x250 mm AS-H con 30 ml/min de IPA (N g/min. Temperatura. = 30°C, Presión de salida = 100 b de muestra disuelta en 20 ml de MeOH:DCM 1:1; c= 8, min, Tiempo de análisis 15 min (El tiempo de ciclo s muestra). 1H RMN (500 MHz, CD3OD) 58,56 (d, J=2,5 Hz, 1H), 7,74 (d, J=0,7 Hz, 1H), 7,51 (t, J=8,6 Hz, 1H), 1H), 3,80 (s, 3H), 3,77 (s, 3H), 3,43 (qd, J=7,0, 2,7 Hz, ESI (POS), m/z: 559,0 (M+H)+.
Ejemplo 534.0: Preparación de (1S,2R)-1-(5-cloro-2-p triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 R, piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfona il-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-esto del título era el primer isómero en eluir de una ondiciones de SFC: Realizado en Thar 200 SFC con mM) 90 g/min de CO2, 25% de co-disolvente a 120 ngitud de onda = 271 nm. Inyectado 1,0 ml de 178 mg ml, es decir 8,9 mg por inyección. Tiempo de ciclo 11,5 entó para evitar la recogida del TFA presente en la 1H), 8,45 (br. s., 1H), 8,34 (s, 1H), 7,89 (dd, J=8,3, 2,5 d, J=8,3 Hz, 1H), 6,77 - 6,86 (m, 2H), 5,01 (d, J=2,5 Hz, ,28 (s, 3H), 2,32 (s, 3H), 1,15 (d, J=7,1 Hz, 3H). LCMS-
)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-
(1 S,2R)-1 -(5-cloro-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-piridinil)-N il)-1-metoxi-2-propanosulfonamida, Ejemplo 534.0. El columna AS-H cuando se somete 532.0 a las condicion CD3OD) 58,56 (d, J=2,5 Hz, 1 H) 8,45 (br. s., 1 H) 8,34 7,51 (t, J=8,6 Hz, 1 H) 7,46 (d, J=8,3 Hz, 1 H) 6,77 - 6, 3,43 (qd, J=7,0, 2,7 Hz, 1 H) 3,28 (s, 3 H) 2,32 (s, 3 H)
Ejemplo 535.0: Preparación de (1R,2S)-N-(4-(2,6-dimet (5-(prop-1 -in-1 -il)pirimidin-2-il)propano-2-sulfonamida.
il-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-esto del título era el segundo isómero en eluir de la SFC descritas en el Ejemplo 533.0. 1H RMN (500 MHz, H) 7,89 (dd, J=8,3, 2,5 Hz, 1 H) 7,74 (d, J=0,7 Hz, 1 H) 2 H) 5,01 (d, J=2,5 Hz, 1 H) 3,80 (s, 3 H) 3,77 (s, 3 H) , J=7,1 Hz, 3 H). LCMS-ESI (POS), m/z: 559,0 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-
(1 R,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-(trimetilsilil)etil)propano-2-sulfonamida, Ejemplo 535.1 A (4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triaz (0,175 g, 0,31 mmol) y 2-(trimetilsilil)etanol (0,100 m cianometilen-tri-n-butilfosforano (0,160 ml, 0,66 mmol) refrigerante de reflujo y la mezcla de reacción se cale enfrió a TA y el disolvente se concentró. El producto as sílice, MeoH en DCM de 0 a 4%) para dar (1 R,2S)-1 -(5 il)-4H-1,2,4-triazol-3-il)-1-metoxi-N-(2-(trimetilsilil)etil)pro g). 1H RMN (CDCla) 5: 8,61-8,70 (m, 2H), 8,43 (d, J=1, J=8,5 Hz, 1H), 6,60 (t, J=8,7 Hz, 2H), 4,66 (d, J=6,0 3,48-3,61 (m, 1H), 3,27 (s, 3H), 2,30 (s, 3H), 1,37 (dd, MS-ESI (POS.) m/z: 659,8 (M+H)+.
etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-l-metoxi-N-(2-isolución agitada de (1R,2S)-1-(5-cloropirimidin-2-il)-N--1 -metoxipropano-2-sulfonamida, Ejemplo 428.1 0 mmol) en tolueno (4,0 ml) se añadió gota a gota iante una jeringa. Después de la adición se unió un 90°C en atmósfera de N2 durante 2 h. La reacción se nido se purificó por cromatografía en columna (40 g de pirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-2-sulfonamida en forma de una espuma marrón (0,180 1H), 8,35 (d, J=1,9 Hz, 1H), 7,60-7,66 (m, 1H), 7,37 (t, ), 4,31-4,49 (m, 2H), 3,80 (s, 3H), 3,69-3,75 (m, 3H), 7,6 Hz, 2H), 1,25 (d, J=6,9 Hz, 3H), 0,07-0,14 (m, 9H).
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H N-(2-(trimetilsilil)etil)propano-2-sulfonamida, Ejemplo 5 (4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triaz Ejemplo 535.1 (0,110 g, 0,17 mmol) en 1,4-dioxano (5, mmol) y bis(tri-t-butilfosfina)paladio (24,0 mg, 0,046 m de N2 durante 20 h. El disolvente se concentró a vací columna (40 g de sílice, MeOH en DCM al 0-4%) para 1,2,4-triazol-3-il)-1 -metoxi-1 -(5-(prop-1 -in-1 -il)pirimidin-2 una pasta amarilla (0,090 g). 1H RMN (CDCla) 5: 8,67 Hz, 1H), 6,58 (t, J=8,3 Hz, 2H), 4,75 (d, J=4,8 Hz, 1H), 3,48-3,60 (m, 1H), 3,29 (s, 3H), 2,30 (s, 3H), 2,10 (s, 3 LCMS-ESI (POS.) m/z: 664,0 (M+H)+.
-triazol-3-il)-1 -metoxi-1 -(5-(prop-1 -in-1 -il)pirimidin-2-il)-A una disolución de (1R,2S)-1-(5-cloropirimidin-2-il)-N-)-1-metoxi-N-(2-(trimetilsilil)etil)propano-2-sulfonamida, se añadió tributil(prop-1 -in-1 -il)estannano (0,180 g, 0,55 a mezcla de reacción se calentó a 100°C en atmósfera producto así obtenido se purificó por cromatografía en 1R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-(2-(trimetilsilil)etil)propano-2-sulfonamida en forma de ), 8,43 (s, 1H), 8,35 (s, 1H), 7,63 (s, 1H), 7,35 (t, J=8,5 (dt, J=6 ,6 , 5,1 Hz, 2H), 3,76-3,83 (m, 3H), 3,72 (s, 3H), 0 (d, J=8,2 Hz, 2H), 1,23 (d, J=7,0 Hz, 3H), 0,11 (s, 9H).
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida, Ejemplo 535.0. En un matr dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-(trimetilsilil)etil)propano-2-sulfonamida, se añadió el Ej silil)difluoruro de tris(dimetilamino)azufre (0,118 g, 0, atmósfera de N2 durante 2 h. La reacción se enfrió a acuosa se extrajo con EtOAc (40 ml), iPrOH en CHC secaron sobre MgSO4, se filtraron y se concentraron a g de sílice, acetona en hexanos al 5-40%) para dar ( triazol-3-il)-1-metoxi-1-(5-(prop-1-in-1-il)pirimidin-2-il)pro 1H RMN (CDCla) 5: 8,70-8,76 (m, 2H), 8,45 (d, J=1,6 H J=7,9 Hz, 1H), 7,40-7,49 (m, 1H), 6,60 (d, J=8,5 Hz, 2 3H), 2,31 (s, 3H), 2,11 (s, 3H), 1,37 (d, J=7,0 Hz, 3H). L
Ejemplo 536.0: Preparación de (2S,3S)-3-(5-ciano 1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida y
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4 -triazol-3-il)-1 -metoxi-1 -(5-(prop-1 -in-1 -il)pirimidin-2-fondo redondo de 50 ml se añadió (1R,2S)-N-(4-(2,6-oxi-1 -(5-(prop-1 -in-1 -il)pirimidin-2-il)-N-(2-535.2 (0,090 g, 0,14 mmol) en DMF (3,0 ml) (trimetilmol). La mezcla de reacción se calentó a 110°C en e repartió entre EtOAc (60 ml) y agua (30 ml). La capa 0% (2 x 30 ml). Las capas orgánicas combinadas se El residuo se purificó por cromatografía en columna (40 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-2-sulfonamida en forma de un sólido amarillo (0,030 g). , 8,35 (d, J=1,8 Hz, 1H), 8,09 (t, J=1,8 Hz, 1H), 7,99 (d, 01 (d, J=4,4 Hz, 1H), 3,69-3,78 (m, 7H), 3,33-3,38 (m, ESI (POS.) m/z: 564,0 (M+H)+.
in-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-R)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-mida y (2R,3S)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-robutano-2-sulfonamida y (2S,3R)-3-(5-cianopirimidin-2-l-3-il)-3-fluorobutano-2-sulfonamida.
(2S,3R)-3-(5-bromopirimidin-2-il)-N,N-bis(2,4-dimetoxibe bromopirimidin-2-il)-N,N-bis(2,4-dimetoxibencil)-3-hidroxi N,N-bis(2,4-dimetoxibencil)-3-hidroxibutano-2-sulfonami dimetoxibencil)-3-hidroxibutano-2-sulfonamida 536.1. A solución de THF (99 ml) que contenía N,N-bis(2,4-dim en de una forma similar a la descrita en el Ejemplo 12 Después, se añadió una solución en THF de 1-(5-bromo continuó a -78°C y se dejó calentar lentamente a TA y con una solución saturada de cloruro amónico y se ex reacción se purificó en sílice eluyendo con un gradiente 536.1 después se combinaron y se concentraron a va LCMS m/z: 610,0 (M+H)+.
l)-3-hidroxibutano-2-sulfonamida y (2R,3R)-3-(5-tano-2-sulfonamida y (2R,3S)-3-(5-bromopirimidin-2-il)-y (2S,3S)-3-(5-bromopirimidin-2-il)-N,N-bis(2,4-82C, se añadió n-butil-litio (4,38 ml, 10,94 mmol) a una ibencil)etanosulfonamida (4,07 g, 9,95 mmol, preparada . La mezcla resultante se agitó durante 30 min a -78°C. imidin-2-il)etanona (2, 9,95 mmol) a -78°C. La reacción se agitó durante la noche. La reacción después se inactivó jo con EtOAc (3x100 ml). Después de concentración, la hexanos/EtOAc (0-100%). Las fracciones deseadas con para dar el compuesto del título (45% de rendimiento),
(2S,3R)-3-(5-bromopirimidin-2-il)-N,N-bis(2,4-dimetoxibe bromopirimidin-2-il)-N,N-bis(2,4-dimetoxibencil)-3-fluorob N,N-bis(2,4-dimetoxibencil)-3-fluorobutano-2-sulfonamid dimetoxibencil)-3-fluorobutano-2-sulfonamida Ejemplo 5 solución en dCm (38,8 ml) que contenía 536.1 (4,74 g, h. El análisis de TLC indicaba que la reacción se h concentró a vacío. La reacción se purificó en gel de síli Las fracciones deseadas que contenían 536.2 se c rendimiento), LCMS m/z: 612,0 (M+H)+.
3-fluorobutano-2-sulfonamida y (2R,3R)-3-(5-o-2-sulfonamida y (2R,3S)-3-(5-bromopirimidin-2-il)-y (2S,3S)-3-(5-bromopirimidin-2-il)-N,N-bis(2,4-A 23°C, se añadió DAST (2,052 ml, 15,53 mmol) a una mmol). La mezcla resultante se agitó a 23°C durante 1 completado. Se añadió MeOH (1 ml) y la mezcla se luyendo con un gradiente de hexanos/EtOAc (0-100%). inaron y se concentraron a vacío. (1,4 g, 29% de
(2S,3R)-3-(5-bromopirimidin-2-il)-3-fluorobutano-2-sulfon sulfonamida y (2R,3S)-3-(5-bromopirimidin-2-il)-3-fluoro fluorobutano-2-sulfonamida Ejemplo 536.3. A 0°C, se a trietilsilano (2,61 ml, 16,33 mmol) y 3-(5-bro sulfonamida (536.2, 1,0 g, 1,63 mmol). La mezcla re después se repartió entre disolución acuosa saturada a y (2R,3R)-3-(5-bromopirimidin-2-il)-3-fluorobutano-2-no-2-sulfonamida y (2S,3S)-3-(5-bromopirimidin-2-il)-3-TFA (1,26 ml, 16,33 mmol) a un matraz que contenía midin-2-il)-N,N-bis(2,4-dimetoxibencil)-3-fluorobutano-2-te se agitó durante 3 h a 0°C. La mezcla resultante bicarbonato sódico y DCM y las capas orgánicas se
concentraron a vacío. La reacción se purificó en gel d (0-20%). Las fracciones deseadas que contenían 536 proporcionar el compuesto del título (95%). LCMS m/z: e eluyendo con un gradiente por pasos de MeOH/DCM spués se combinaron y se concentraron a vacío para (M+H)+.
(2S,3R)-3-(5-bromopirimidin-2-il)-N-(4-(2,6-dimetoxifenil sulfonamida y (2R,3R)-3-(5-bromopirimidin-2-il)-N-(4-( fluorobutano-2 -sulfonamida y (2R,3S)-3-(5-bromopirimi triazol-3-il)-3-fluorobutano-2-sulfonamida y (2S,3S)-3-( 3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida el procedimiento en el Ejemplo A usando 1.0, 536. reacción se purificó por HPLC de fase inversa (column de agua/ACN al 10-70% a lo largo de 30 min, con TF contenían 536.4 se combinaron y se liofilizaron para da -metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-opirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinplo 536.4. El compuesto del título se preparó siguiendo hidrazida del ácido 5-metilnicotínico. El producto de nomenex Gemini-C18, 50 x 250 mm, 10 pm, gradiente ,1%, caudal 100 ml/min). Las fracciones deseadas que oducto puro. LCMS m/z: 606,0 (M+H)+.
(2S,3S)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida y (2R,3R)-3-(5-cianopirimidin-2-il)-N-(4-( fluorobutano-2-sulfonamida y (2R,3S)-3-(5-cianopirimi triazol-3-il)-3-fluorobutano-2-sulfonamida y (2S,3R)-3-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida vidrio se cargó con 536.4, (200 mg, 0,330 tetrakis(trifenilfosfina)paladio (38,1 mg, 0,033 mmol) e un reactor de microondas (CEM, Matthews, NC) a 120 inversa (columna Agilent SB-C8 , 30 x 250 mm, 5 pm, TFA al 0,1%, caudal 50 ml/min). Las fracciones dese producto puro. La separación quiral final se llevó a cabo metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-nopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinplo 536.0. Un recipiente de reacción de microondas de l), cianuro de cinc (0,105 ml, 1,65 mmol), y e-THF. La mezcla de reacción se agitó y se calentó en rante 30 min. La reacción se purificó por HPLC de fase ente de agua/ACN al 10-95% a lo largo de 25 min, con con 536.0, se combinaron y se liofilizaron para dar el do SFC. Solo se aislaron 2 de los cuatro isómeros.
Ejemplo 537.0: Preparación de (2S,3S)-3-(5-ciano 1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida o
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2 din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-R)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-mida o (2R,3S)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-robutano-2-sulfonamida o (2S,3R)-3-(5-cianopirimidinzol-3-il)-3-fluorobutano-2-sulfonamida.
(2S,3S)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (2R,3R)-3-(5-cianopirimidin-2-il)-N-(4-( fluorobutano-2-sulfonamida o (2R,3S)-3-(5-cianopirimi triazol-3-il)-3-fluorobutano-2-sulfonamida o (2S,3R)-3-( 3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida, eluir por separación quiral del Ejemplo 536.0 por separ al 35% socrático. 1H RMN (400 MHz, CDaOD) 59,17 (s 1H), 6,83 (d, J=8,8 Hz, 2H), 4,35 (m, 1H), 3,82 (s, 3H) J=6,9 Hz, 3H). LCMS ESI (pos.) m/z: 553,0 (M+H)+.
Ejemplo 538.0: Preparación de (2S,3S)-3-(5-ciano 1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida o
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-opirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinplo 537.0. El compuesto del título era el primer pico en quiral usando el SFC usando una columna AD con IPA 8,45 (m, 1H), 8,33 (s, 1H), 7,72 (s, 1H), 7,46 - 7,60 (m, (s, 3H), 2,32 (s, 3H), 1,89 (d, J=24,1 Hz, 3H), 1,49 (d,
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-R)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-mida o (2R,3S)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-robutano-2-sulfonamida o (2S,3R)-3-(5-cianopirimidinzol-3-il)-3-fluorobutano-2-sulfonamida.
(2S,3S)-3-(5-cianopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (2R,3R)-3-(5-cianopirimidin-2-il)-N-(4-( fluorobutano-2-sulfonamida o (2R,3S)-3-(5-cianopirimi triazol-3-il)-3-fluorobutano-2-sulfonamida o (2S,3R)-3metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-nopirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-fluorobutano-2-sulfonamida, en eluir por separación quiral del Ejemplo 536.0 por se IPA al 35% socrático. 1H RMN (400 MHz, CD3OD) 59,1 (m, 1 H), 7,54 (t, J=8,5 Hz, 1H), 6,84 (d, J=8,6 Hz, 2H), (s, 3H), 1,88 (d, J=24,1 Hz, 3H), 1,49 (dd, J=7,0, 1,0 Hz,
Ejemplo 539.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2R) 3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2-sulfona 4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)pro metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-metil plo 538.0. El compuesto del título era el segundo pico ión quiral usando el SFC usando una columna AD con H), 8,46 (d, J=1,4 Hz, 1 H), 8,33 (d, J=2,0 Hz, 1 H), 7,72 dd, J=10,6, 7,0 Hz, 1H), 3,82 (s, 3H), 3,81 (s, 3H), 2,32 MS ESI (pos.) m/z: 553,0 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoly (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-2-sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-in-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 2-il)propano-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxi metilpirimidin-2-il)propano-2-sulfonamida y (1S,2R)-N-( 1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida, yoduro de cobre(l) (0,082 g, 0,430 mmol) a un dimetilciclohexano-1,2-diamina (0,245 g, 1,721 mmol), (0,199 g, 0,86 mmol), y 2.0. La mezcla resultante se ag en EtOAc/agua, se lavó con salmuera, se secó sobre por HPLC de fase inversa (columna Phenomenex Gem 95% a lo largo de 30 min, con TFA al 0,1%, caud liofilizaron para dar el producto bruto. La separación q los cuatro isómeros.
Ejemplo 540.0: Preparación de (IS,2R)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-propanosulfonamida.
La separación quiral de la mezcla de enantiómeros (Ej siguientes condiciones: Realizado en Thar 200 con col de CO2, 40% de co-disolvente a 95 g/min. Longitud de de muestra disuelta en 13 ml (MeOH:DCM 11:2); c= 11 de análisis 12 min y se obtiene el Ejemplo 540.0.
-triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-plo 539.0. A 23°C y en atmósfera de argón, se añadió ución en dioxano (1,72 ml) que contenía N1,N2-roxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida 11.0 rante la noche a 80°C. La reacción después se repartió sódico y se concentró a vacío. La reacción se purificó 8, 50 x 250 mm, 10 pm, gradiente de agua/ACN al 10-ml/min). Las fracciones deseadas se combinaron y nal se llevó a cabo usando SFC. Solo se aislaron 2 de
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -
539.0) se llevó a cabo en SFC preparativa usando las 250x30 mm AD-H con 43 g/min EtOH (solo) y 52 g/min 75 nm. Inyectado 0,65 ml de una disolución de 149 mg /ml, 7,5 mg/inyección. Tiempo de ciclo 6,5 min, Tiempo
(1 S ,2 R ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(5 -m e t i l-3 -p ir id in i l ) -4 H p ro p a n o s u lfo n a m id a E je m p lo 540.0. El c o m p u e s to d c o n d ic io n e s d e s c r ita s . 1H R M N (500 M H z , C D 3O D ) 5 - t r ia z o l-3 - i l) -1 -h id ro x i-1 -(5 -m e t i l- 2 -p ir im id in i l) -2 -lo e ra e l p r im e r p ic o e n e lu ir p o r S F C u s a n d o la s s , 2 H ), 8 ,44 (d , J = 1 ,5 H z, 1 H ), 8 ,33 (d , J = 1 ,7 H z, 1H ),
7,72 (m, 1H), 7,51 (t, J=8,6 Hz, 1H), 6,81 (d, J=8,6 Hz, 2,31 (s, 3H), 1,20 (m, 3H). MS ESI (pos.) m/z: 526,0 ( AD-H con 43 g/min EtOH (solo) y 52 g/min de CO2, 40
Ejemplo 541.0: Preparación de (1R,2S)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-propanosulfonamida.
5,42 (d, J=2,7 Hz, 1H), 3,73 - 3,77 (m, 7H), 2,34 (s, 3H), . SFC: Realizado en Thar 200 con 250x30 mm columna o-disolvente a 95 g/min.
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida Ejemplo 541.1. El compuesto d condiciones descritas en el Ejemplo 540.0. 1H RMN (30 J=1,9 Hz, 1H), 7,66 (s, J=3,1 Hz, 1H), 7,40 (t, J=8,6 Hz 1H), 4,07 (br. s, 1H), 3,81-3,91 (m, 1H), 3,76 (s, 3H), 3 MS ESI (pos.) m/z: 526,2 (M+H)+. SfC: Realizado en EtOH (solo) y 52 g/min de CO2, 40% de co-disolvente a
Ejemplo 542.0: Preparación de (IS,2R)-N-(4-(2,6-dimet (5-metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2R) 3-il)-1 -metoxi-1 -(5-metilpirimidin-2-il)propano-2-sulfona 4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirimidin-2-il)pro metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metil 4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-lo era el segundo pico en eluir por SFC usando las z, CDCls) 58,58 (s, 2H), 8,46 (d, J=1,6 Hz, 1H), 8,34 (d, , 6,64 (d, J=8,5 Hz, 1H), 6,60 (d, J=8,5 Hz, 1H), 5,59 (s, , 3H), 2,34 (s, 3H), 2,32 (s, 3H), 1,21 (d, J=7,0 Hz, 3H). r 200 con columna 250x30 mm AD-H con 43 g/min de /min.
nil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1--(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoly (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)--2-sulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-idin-2-il)propano-2-sulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-me 2-il)propano-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxi metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2S)-N-( 1-metoxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida, yoduro de cobre(l) (0,178 g, 0,933 mmol) a un dimetilciclohexano-1,2-diamina (0,531 g, 3,73 m racémica (0,686 g, 2,80 mmol), y 2.0. La mezcla result se repartió con EtOAc/agua, se lavó con salmuera, s purificó por HPLC de fase inversa (columna Phenomen al 10-95% a lo largo de 30 min, con TFA al 0,1%, caud liofilizaron para dar el producto puro.
Ejemplo 543.0: Preparación de (IS,2R)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-propanosulfonamida.
Se llevó a cabo la separación quiral final en el Ejempl -triazol-3-il)-1 -metoxi-1 -(5-metilpirimidin-2-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirimidin--5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1 -(5--dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-plo 542.0. A 23°C en atmósfera de argón, se añadió lución en dioxano (3.73 ml) que contenía N1,N2-1-metoxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida se agitó durante la noche a 80°C. La reacción después ó sobre sulfato sódico y se concentró. La reacción se mini-C18, 50 x 250 mm, 10 pm, gradiente de agua/ACN 0 ml/min). Las fracciones deseadas se combinaron y se
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-
.0 usando SFC. Condiciones de SFC AS-H (2 x 25 cm)
MeOH/O2 al 15%, 100 bar 60 ml/min, 220 nm. Vol. iny. cm) MeOH/CO2 al 15%, 100 bar 60 ml/min, 220 nm. Vol ml, 10 mg/ml en MeOH para 543.0 y 544.0. IA (2 x 15 0,75 ml, 5 mg/ml en MeOH para 545.0 y 546.0.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida Ejemplo 543.0. El compuesto d condiciones descritas antes. 1H RMN (400 MHz, CD3O (t, J=8,3 Hz, 1H), 6,82 (d, J=8,6 Hz, 2H), 5,01 (d, J=3, 1H), 3,29 (s, 3H), 2,36 (s, 3H), 2,32 (s, 3H), 1,26 (d, J= 25 cm) 15% MeOH/CO2
Ejemplo 544.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-propanosulfonamida.
-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-lo era el primer pico en eluir por SFC usando las ,67 (s, 2H), 8,46 (s, 1H), 8,34 (s, 1H), 7,74 (s, 1H), 7,52 1H), 3,81 (s, 3H), 3,78 (s, 3H), 3,58 (dd, J=7,0, 3,7 Hz, , 3H). MS ESI (pos.) m/z: 540,0 (M+H)+. SFC AS-H (2 x
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida Ejemplo 544.0. El compuesto d condiciones descritas en 543.0. 1H RMN (400 MHz, C 7,52 (dd, J = 8,3, 8,3 Hz, 1H), 6,82 (d, J = 8,4 Hz, 2H), (m, 1H), 3,29 (s, 3H), 2,36 (s, 3H), 2,33 (s, 3H), 1,26 (d H (2 x 25 cm) 15% MeOH/CO2.
Ejemplo 545.0: Preparación de (1R,2R)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-propanosulfonamida o (1 S,2S) 3-il)-1-metoxi-1-(5-metil-2-pirimidinil)-2-propanosulfona -triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-o era el segundo pico en eluir por SFC usando las 5 8,66 (s, 2H), 8,47 (s, 1H), 8,35 (s, 1H), 7,77 (s, 1H), (d, J = 3,5 Hz, 1H), 3,81 (s, 3H), 3,78 (s, 3H), 3,56-3,60 ,0 Hz, 3H). MS ESI (pos.) m/z: 540,0 (M+H)+. SFC AS-
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-2-pirimidinil)-2-propanosulfonamida Ejemplo 545.0. El usando las condiciones descritas en 543.0. 1H RMN ( 1H), 7,75 (s, 1H), 7,52 (dd, J = 8,3, 8,3 Hz, 1H), 6,81-6, 3,61-3,69 (m, 1H), 3,12 (s, 3H), 2,37 (s, 3H), 2,32 (s, 3 SFC IA (2 x 15 cm) 15% MeOH/CO2
Ejemplo 546.0: Preparación de (1 R,2R)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-propanosulfonamida o (1 S,2S) 3-il)-1-metoxi-1-(5-metil-2-pirimidinil)-2-propanosulfona -triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metiluesto del título era el primer pico en eluir por SFC Hz, CD3OD) 58,69 (s, 2H), 8,46 (br s, 1H), 8,35 (br s, 2H), 4,63 (d, J = 8,2 Hz, 1H), 3,85 (s, 3H), 3,81 (s, 3H), 5 (d, J = 7,2 Hz, 3H). MS ESI (pos.) m/z: 540,0 (M+H)+.
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-2-pirimidinil)-2-propanosulfonamida Ejemplo 546.0. El usando las condiciones descritas en 543.0. 1H RMN (5 1H), 7,73 (s, 1H), 7,52 (dd, J = 8,6, 8,6 Hz, 1H), 6,83 (d 3,81 (s, 3H), 3,62-3,69 (m, 1H), 3,12 (s, 3H), 2,38 (s, 540,0 (M+H)+. SFC IA (2 x 15 cm) 15% MeOH/CO2
Ejemplo 547.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(5-metilpirimidin-2-il)propano-2-sulfonamida y (1 triazol-3-il)-1 -metoxi-1 -(5-metilpirimidin-2-il)propano-2-s metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-me dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il -triazol-3-il)-1 -metoxi-1-(5-metil-2-pirimidinil)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metiluesto del título era el segundo pico en eluir por SFC Hz, CD3OD) S 8,69 (s, 2H), 8,46 (br s, 1H), 8,34 (br s, 8,4, 3,1 Hz, 2H), 4,63 (d, J = 8,4 Hz, 1H), 3,86 (s, 3H), ,32 (s, 3H), 1,05 (d, J= 7,2 Hz, 3H). MS ESI (pos.) m/z:
il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-mida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-idin-2-il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-toxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxife metilpirimidin-2-il)propano-2-sulfonamida y (1 S,2S)-N-( il)-1 -metoxi-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metilpirimidin-2-il)pro se preparó siguiendo el procedimiento descrito en el carboxílico, y TFA (0,419 ml, 5,44 mmol). El grupo de descrito en el Ejemplo C.
Ejemplo 548.0: Preparación de (IS,2R)-N-(4-(2,6-dimet 1-(5-metil-2-pirimidinil)-2-propanosulfonamida.
Se llevó a cabo la purificación quiral final en el Ejempl SFC AS-H (2 x 25 cm) EtOH/CO2 al 20%, 100 bar 65 ml ,4-triazol-3-il)-1-metoxi-1 -(5-metilpirimidin-2-il)propano-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-2-sulfonamida, Ejemplo 547.0. El compuesto del título plo A usando 1.0, ácido 6-metoxipicolinoil)hidrazinaracémico se preparó usando el procedimiento general
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-
.0 usando SFC (solo se aislaron 2 de los 4 isómeros).
220 nm. Vol. iny.: 2 ml, 3 mg/ml en DCM:MeOH 1:1.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida, Ejemplo 548.0. El compuesto del tí condiciones descritas antes. 1H RMN (400 MHz, CD3OD) 5 7,63 (d, J = 7,1 Hz, 1H), 7,42 (dd, J = 8,5, 8,5 Hz, 1H), 6,75 (s, 3H), 3,56-3,62 (m, 1H), 3,29 (s, 3H), 3,19 (s, 3H), 2,36 ( (M+H)+. SFC AS-H (2 x 25 cm) 20% EtOH/CO2.
Ejemplo 549.0: Preparación de (1R,2S)-N-(4-(2,6-dimetoxif 1 -(5-metil-2-pirimidinil)-2-propanosulfonamida.
iazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-era el primer pico en eluir por SFC usando las (d, J = 0,8 Hz, 2H), 7,73 (dd, J = 7,4, 7,4 Hz, 1H), (m, 3H), 5,01 (d, J = 3,7 Hz, 1H), 3,75 (s, 3H), 3,73 , 1,26 (d, J = 7,0 Hz, 3H). MS ESI (pos.) m/z: 556,0
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1, propanosulfonamida, Ejemplo 549.0. El compuesto del tít condiciones descritas en 548.0. 1H RMN (400 MHz, CD3OD = 7,0 Hz, 1H), 7,42 (dd, J =8,5, 8,5 Hz, 1H), 6,75-6,79 (m, 3,56-3,62 (m, 1H), 3,29 (s, 3H), 3,20 (s, 3H), 2,36 (s, 3H), 1 SFC AS-H (2 x 25 cm) 20% EtOH/CO2.
Ejemplo 550.0: Preparación de 2-(5-cianopiridin-2-il)-N-(4-( 3-il)etanosulfonamida.
iazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-ra el segundo pico en eluir por SFC usando las 66 (s, 2H), 7,73 (dd, J = 7,6, 7,6 Hz, 1H), 7,63 (d, J 5,01 (d, J = 3,7 Hz, 1H), 3,75 (s, 3H), 3,73 (s, 3H), , J = 7,0 Hz, 3H). MS ESI (pos.) m/z: 556,0 (M+H)+.
imetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-
2-(5-cianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri 550.0. Un recipiente de reacción de microondas de dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)eta tetrakis(trifenilfosfina)paladio (0,060 g, 0,052 mmol), y cia mezcla de reacción se agitó y se calentó en un reactor d 120°C durante 60 min. La reacción se purificó por HPLC d gm, gradiente de agua/ACN al 10-95% a lo largo de 25 m deseadas se combinaron y se liofilizaron para dar el produc 1H), 7,85 (dd, J = 8,0, 2,2 Hz, 1H), 7,57-7,65 (m, 2H), 7,31 -2H), 3,69 (m, 6H), 3,49-3,53 (m, 2H), 3,34-3,38 (m, 2H), 3,1
Ejemplo 551.0: Preparación de (1S,2R)-1-(5-cianopiridin-2 triazol-3-il)-1 -metoxipropano-2-sulfonamida y (1 R,2R)-1 -(5 3- il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfon (5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-m il)-4H-1,2,4-triazol-3-il)etanosulfonamida, Ejemplo
se cargó con 2-(5-bromopiridin-2-il)-N-(4-(2,6-fonamida (0,30 g, 0,521 mmol),
e cinc (0,245 g, 2,09 mmol) en Dm F (1,0 ml). La
roondas modelo Discover (CEM, Matthews, NC) a
e inversa (columna Agilent SB-C8, 30 x 250 mm, 5
n TFA al 0,1%, Caudal 50 ml/min). Las fracciones
ro. 1H RMN (400 MHz, CDCh) 58,79 (d, J = 1,6 Hz,
m, 2H), 6,71 (d, J = 7,5 Hz, 1H), 6,60 (d, J = 8,4 Hz,
H). MS ESI (pos.) m/z: 521,9 (M+H)+.
(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-piridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridiny (1 S,2S)-1 -(5-cianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-amida y (1 R,2S)-1 -(5-cianopiridin-2-il)-N-(4-(2,6-ropano-2-sulfonamida.
(1 R,2S)-1 -(5-bromopiridin-2-il)-N,N-bis(2,4-dimetoxibenc bromopiridin-2-il)-N,N-bis(2,4-dimetoxibencil)-1 -hidroxip bis(2,4-dimetoxibencil)-1 -hidroxipropano-2-sulfonamida 1-hidroxipropano-2-sulfonamida, Ejemplo 551.1. dimetoxibencil)etanosulfonamida (6,95 g, 16,97 mmol) hexanos, 7 ml, 17,50 mmol) a lo largo de 10 min. La te Después de 15 min de agitar, se añadió gota a gota u en THF (10 ml) a lo largo de 3 min. La mezcla result calentara lentamente TA durante la noche. La reacción después se diluyó con EtOAc y una solución saturada dos veces y después las capas orgánicas combinad material obtenido se absorbió sobre un tapón de gel columna de gel de sílice preempaquetada Redi-Sep (2 100%; el producto eluía entre 40-60% EtOAc. MS ESI ( hidroxipropano-2-sulfonamida y (1 R,2R)-1 -(5-o-2-sulfonamida y (1 S,2S)-1 -(5-bromopiridin-2-il)-N,N-,2R)-1 -(5-bromopiridin-2-il)-N,N-bis(2,4-dimetoxibencil)-una solución a -782C de N,N-bis(2,4-THF (40 ml) se añadió gota a gota n-Buli (2,5 M en tura se mantuvo por debajo de -68°C durante la adición. olución de 5-bromo-2-formilpiridina (3,2 g, 17,20 mmol) se agitó durante la noche dejando que la reacción se activó con una solución saturada de NH4CL La mezcla ruro amónico. La solución acuosa se extrajo con EtOAc lavaron con salmuera y se concentraron a vacío. El ílice y se purificó por cromatografía a través de una eluyendo con un gradiente de EtOAc en hexanos al 0 m/z: 616,9 (M+Na)+.
(1 R,2S)-1 -(5-bromopiridin-2-il)-N,N-bis(2,4-dimetoxibencil bromopiridin-2-il)-N,N-bis(2,4-dimetoxibencil)-1 -metoxipr bis(2,4-dimetoxibencil)-1 -metoxipropano-2-sulfonamida 1 -metoxipropano-2-sulfonamida Ejemplo 551.2. A una so añadió hidruro sódico, dispersión al 60% en aceite min baño de enfriamiento. Después, se añadió yodometano durante la noche. La reacción se inactivó con agua y des acuosa tres veces con éter dietílico, las capas orgánic Na2SÜ4, y después se concentraron a vacío. Este materi etoxipropano-2-sulfonamida y (1 S,2S)-1 -(5-o-2-sulfonamida y (1 R,2R)-1 -(5-bromopiridin-2-il)-N,N-,2R)-1 -(5-bromopiridin-2-il)-N,N-bis(2,4-dimetoxibencil)-n a 0°C de 551.1 (1,92 g, 3,22 mmol) en DMF (8 ml) se 407 mg, 10,18 mmol). Después de 25 min, se retiró el ml, 16,12 mmol), y la mezcla resultante se agitó a TA se diluyó con éter dietílico. Después de extraer la fase mbinadas se lavaron con salmuera, se secaron sobre llevó directamente a la siguiente etapa.
(1 R,2S)-1 -(5-bromopiridin-2-il)-1 -metoxipropano-2-sulfo sulfonamida y (1S,2S)-1-(5-bromopiridin-2-il)-1-metox metoxipropano-2-sulfonamida, Ejemplo 551.3. A una trietilsilano (1,8 ml, 11,27 mmol), seguido de TFA (4 ml, se concentró a vacío y después se secó en HVAC. El bicarbonato sódico y DCM. La capa acuosa se extraj concentraron a vacío. El material obtenido se absorbió a través de una columna de gel de sílice preempaquet DCM al 0-8%, para proporcionar 551.3 (690 mg, 2,23 pegajoso. MS ESI (pos.) m/z: 308,9 (M+H)+.
ida y (1 R,2R)-1 -(5-bromopiridin-2-il)-1 -metoxipropano-2-pano-2-sulfonamida y (1S,2R)-1-(5-bromopiridin-2-il)-1-olución del 551.2 (2,2 g) en DCM (15 ml) se añadió 9 mmol). La solución resultante se agitó a TA La reacción erial obtenido se repartió entre una solución saturada de n DCM (x3). Las capas orgánicas se combinaron y se e un tapón de gel de sílice y se purificó por cromatografía Redi-Sep (40 g), eluyendo con un gradiente de MeOH en ol, 69% de rendimiento) en forma de un sólido amarillo
bis(2,2,2-trifluoroacetato) de la (1 R,2S)-1-(5-bromopiri triazol-3-il)-3-metoxipropano-2-sulfonamida y bis(2,2,2 (2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazoltrifluoroacetato) de la (1 S,2S)-1 -(5-bromopiridin-2-il)-N il)-1-metoxipropano-2-sulfonamida y bis(2,2,2-trifluor dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-compuesto del título se preparó siguiendo el procedimi ESI (pos.) m/z: 602,9 (M+H)+.
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-roacetato) de la (1R,2R)-1-(5-bromopiridin-2-il)-N-(4--metoxipropano-2-sulfonamida y bis(2,2,2-,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-ato) de la (1S,2R)-1-(5-bromopiridin-2-il)-N-(4-(2,6-oxipropano-2-sulfonamida Ejemplo 551.4. El descrito en el Ejemplo A usando 1.0, 551.3 y 3.11. MS
(1S,2R)-1-(5-cianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-sulfonamida y (1 R,2R)-1 -(5-cianopiridin-2-il)-N-(4-( metoxipropano-2-sulfonamida y (1 S,2S)-1 -(5-cianopiri triazol-3-il)-1 -metoxipropano-2-sulfonamida y (1 R,2s )-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-sulfonamid mmol) en DMF (3 ml) se añadió tetrakis(trifenilfosfina)p mmol). Después se burbujeó argón a través de la me selló. La mezcla resultante se calentó en un microond después se purificó por HPLC preparativa de fase in CH3CN/H2O, gradiente de 10-60% a lo largo de 25 mi fracciones se liofilizaron durante la noche.
Ejemplo 552.0: Preparación de (1 S,2R)-1 -(5-ciano-2-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfon dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H tilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -l)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-ianopiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinmplo 551.0. A una disolución de 551.4 (293 mg, 0,352 (58,9 mg, 0,051 mmol) y cianuro de cinc (56,7 mg, 0,48 urante un minuto y después el vial de microondas se rante 60 min a 120°C. La mezcla de reacción se filtró, usando una columna Agilent SB C8, TFA al 0,1% en recogieron los picos que eran visibles a 220 nm). Las
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-o (1 R,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(5-ciano-2--triazol-3-il)-1-metoxi-2-propanosulfonamida.
Se llevaron a cabo las separaciones quirales finales etapas de separación): Etapa 1 IA (2 x 15 cm); IPA/C mg/ml en DCM:MeOH 1:1. Etapa 2, Oj -H (2 x 25 cm);
(1 S,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-propanosulfonamida o (1 S,2S)-1 -(5-ciano-2-piridinil)-N il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(5-cia 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfo por SFC usando las condiciones descritas antes. 1H 8,41 - 8,53 (m, 1H), 8,24 - 8,41 (m, 1H), 7,91 - 8,06 ( 1H), 6,57 - 6,71 (m, 2H), 5,10 (d, J=2,69 Hz, 1H), 81s3 3H), 1,21 (d, J=7,09 Hz, 3H), MS ESI (pos.) m/z: 550,1
Ejemplo 553.0: Preparación de (1S,2R)-1-(5-ciano-2-p triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H Ejemplo 552.0 usando SFC. Condiciones de SFC (2 30%, 100 bar; 60 ml/min, 220 nm.; Vol. iny.: 1 ml, 11 O2 al 15%, 100 bar; 60 ml/min, 220 nm; Vol. iny.: 1 ml.
til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-iridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metila, Ejemplo 552.0, El compuesto del título se purificó 500 MHz, CDCh) 5 11,14 (s, 1H), 8,78 - 8,94 (m, 1H), ), 7,72 - 7,81 (m, 1H), 7,60 (d, J=8,07 Hz, 1H), 7,43 (s, s, 3H), 3,56 - 3,63 (m, 1H), 3,36 (s, 3H), 2,31 - 2,40 (m, .
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-o (1 R,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(5-ciano-2--triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 S,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-propanosulfonamida o (1 S,2S)-1 -(5-ciano-2-piridinil)-N il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(5-cia 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfo por SFC usando las condiciones descritas en el Ejempl til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-iridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metila, Ejemplo 553.0. El compuesto del título se purificó .0. 1H RMN (500 MHz, CDCl3) 511,10 - 11,26 (m, 1H),
8,77 - 8,95 (m, 1H), 8,40 - 8,56 (m, 1H), 8,22 - 8,39 (m, 1H), 7,47 (t, J=8,44 Hz, 1H), 6,57 - 6,74 (m, 2H), 4,79 1H), 3,26 (s, 3H), 2,37 (s, 3H), 1,23 (d, J=7,09 Hz, 3H),
Ejemplo 554.0: Preparación de (1S,2R)-1-(5-ciano-2-p triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H 7,87 - 8,00 (m, 1H), 7,70 - 7,82 (m, 1H), 7,55 - 7,66 (m, 5,87 Hz, 1H), 3,81 (s, 3H), 3,74 (s, 3H), 3,57 - 3,68 (m, SI (pos.) m/z: 550,0 (M+H)+.
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-o (1 R,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(5-ciano-2--triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 S,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-propanosulfonamida o (1 S,2S)-1 -(5-ciano-2-piridinil)-N il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(5-cia 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfo por SFC usando las condiciones descritas en el Ejempl 8,77 - 8,95 (m, 1H), 8,40 - 8,56 (m, 1H), 8,22 - 8,39 (m, 1H), 7,47 (t, J=8,44 Hz, 1H), 6,57 - 6,74 (m, 2H), 4,79 1H), 3,26 (s, 3H), 2,37 (s, 3H), 1,23 (d, J=7,09 Hz, 3 H);
Ejemplo 555.0: Preparación de (1S,2R)-1-(5-ciano-2-p triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 S, piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfona dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H til-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-iridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metila, Ejemplo 554.0. El compuesto del título se purificó .0. 1H RMN (500 MHz, CDCl3) 511,10 - 11,26 (m, 1H), 7,87 - 8,00 (m, 1H), 7,70 - 7,82 (m, 1H), 7,55 - 7,66 (m, 5,87 Hz, 1H), 3,81 (s, 3H), 3,74 (s, 3H), 3,57 - 3,68 (m, SI (pos.) m/z: 550,0 (M+H)+.
l)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4--(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-o (1 R,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(5-ciano-2--triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 S,2R)-1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-( propanosulfonamida o (1 S,2S)-1 -(5-ciano-2-piridinil)-N-il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(5-cian 1.2.4- triazol-3-il)-1 -metoxi-2-propanosulfonamida o ( 3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfon por SFC usando las condiciones descritas en el Ejempl (d, J=1,47 Hz, 1H), 8,43 - 8,60 (m, 1H), 8,27 - 8,42 (m, 1H), 7,42 (s, 1H), 6,63 (t, J=8,31 Hz, 2H), 5,10 (d, J=2,6 (s, 3H), 2,35 (s, 3H), 1,20 (d, J=7,09 Hz, 3H) MS ESI (po
Ejemplo 556.0: Preparación de (1S,2R)-1-(5-clorop 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida y
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2, il-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-ridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H--1 -(5-ciano-2-piridinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-, Ejemplo 555.0. El compuesto del título se purificó . 1H RMN (500 MHz, CDCl3) 511,14 (br. s., 1H), 8,86 ,89 - 8,06 (m, 1H), 7,70 - 7,81 (m, 1H), 7,55 - 7,65 (m, 1 H), 3,78 (s,3H), 3,75 (s, 3H), 3,55 - 3,63 (m, 1H), 3,36 z: 550,0 (M+H)+.
n-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-amida y (1 R,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-xipropano-2-sulfonamida y (1 R,2S)-1 -(5-cloropirimidinol-3-il)-1-metoxipropano-2-sulfonamida.
(1S,2R)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5 sulfonamida y (1 S,2S)-1 -(5-cloropirimidin-2-il)-N-(4-( metoxipropano-2-sulfonamida y (1 R,2R)-1 -(5-clorop 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida y
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-cobre(I) (0,065 g, 0,34 mmol) a una solución en
metoxipropano-2-sulfonamida racémica (preparada sig 0,181 g, 0,68 mmol), carbonato de cesio (0,556 g, 1,7 1,365 mmol). La mezcla resultante se agitó durante EtOAc/agua, se lavó con salmuera, se secó sobre sulfat HPLC de fase inversa (columna Agilent SB-C8, 30 x 25 25 min, con TFA al 0,1%, Caudal 50 ml/min). Las frac producto puro.
Ejemplo 557.0: Preparación de (1S,2R)-1-(5-cloro-1.2.4- triazol-3-il)-1 -metoxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propano dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -n-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 556.0. A 80°C, se añadió yoduro de o (1,37 ml) que contenía 1-(5-cloropirimidin-2-il)-1-el Ejemplo C usando el aldehido adecuado y 12.0, ol), y N1,N2-dimetilciclohexano-1,2-diamina (0,194 g, oche a 80°C. La reacción después se repartió en ico y se concentró a vacío. La reacción se purificó por 5 pm, gradiente de agua/ACN al 10-95% a lo largo de deseadas se combinaron y se liofilizaron para dar el
idinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida o (1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-xi-2-propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-,4-triazol-3-il)-1-metoxi-2-propanosulfonamida.
La purificación quiral final se llevó a cabo usando SFC. y 558.0 (etapa 1) (299 mg): Realizado en Thar 200 SF (solo) 50 g/min de CO2, 50% de co-disolvente a 100 Longitud de onda = 270 nm. Inyectado 0,6 ml de 299 decir 15,0 mg por inyección. Tiempo de ciclo 8,0 min, Ti
Condiciones de separación para purificación quiral de 5 con columna de 250 x 30 mm AS-H con 20,8 g/min de g/min. Temperatura. = 20°C, Presión de salida = 100 b de muestra disuelta en 8,0 ml MeOH, c= 6,45 mg/ml, es de análisis = 13 min.
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida o (1 R,2R)-1 -(5-cloro-2-pirimidinil)-3-il)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-1 -(5-cl 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propano primer pico en eluir por SFC usando las condiciones d 8,56 (br s, 1H), 8,43 (d, J = 1,6 Hz, 1 H), 7,99 (br s, 1 H), (d, J = 3,5 Hz, 1 H), 3,76 (s, 3H), 3,73 (s, 3H), 3,50-3,56 MS ESI (pos.) m/z: 560,0 (M+H)+. SFC con columna de de CO2, 50% de co-disolvente a 100 g/min.
Ejemplo 558.0: Preparación de (1S,2R)-1-(5-cloro-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propano dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4 iciones de separación para purificación quiral de 557.0 n Columna 250 x 30 mm c C4 con 50 g/min de MeOH in. Temperatura. = 25°C, Presión de salida = 100 bar, muestra disuelta en 10,0 ml MeOH, c= 25 mg/ml, es de análisis = 16 min.
560.0 (etapa 2) (51,6 mg): Realizado en Thar 200 SFC (solo) 139 g/min de CO2, 13% de co-disolvente a 160 ngitud de onda = 270 nm. Inyectado 1,2 ml de 51,6 mg r 7,74 mg por inyección. Tiempo de ciclo 8 min, Tiempo
etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolpirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-s )-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 557.0. El compuesto del título era el tas antes. 1H RMN (400 MHz, CD3OD) 58,63 (s, 2H), (dd, J = 8,5, 8,5 Hz, 1H), 6,78 (d, J = 8,6 Hz, 2H), 4,96 1 H), 3,23 (s, 3H), 2,13 (s, 3H), 1,20 (d, J = 7,0 Hz, 3H). x 30 mm CC4 con 50 g/min de MeOH(solo) 50 g/min
idinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-oxi-2-propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-,4-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida o (1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-( 3-il)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-1 -(5-cloro-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulf segundo pico en eluir por SFC usando las condiciones de 2H), 8,48 (br s, 1H), 8,36 (br s, 1H), 7,76 (s, 1H), 7,52 (dd, 8,1 Hz, 1H), 3,84 (s, 3H), 3,81 (s, 3H), 3,62-3,69 (m, (pos.) m/z : 559,9 (M+H)+. SFC con columna de 250 x 30 m 50% de co-disolvente a 100 g/min.
Ejemplo 559.0: Preparación de (1S,2R)-1-(5-cloro-2-pir 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulf dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -m pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 l-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolmidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-ida, Ejemplo 558.0. El compuesto del título era el
s en 557.0. 1H RMN (400 MHz, CD3OD) 58,86 (s,
6, 8,6 Hz, 1H), 6,83 (d, J = 8,3 Hz, 2H), 4,66 (d, J =
, 3,14 (s, 3H), 2,33 (s, 3H), 1,09 (d, J = 7,1 Hz, 3H). MS ESI C4 con 50 g/min de MeOH(solo) 50 g/min de CO2,
inil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-ida o (1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-2-propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida o (1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-( 3-il)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-1 -(5-cloro-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulf primer pico (etapa 2) en eluir por SFC usando las condici 8,84 (s, 2H), 8,64 (s, 1H), 8,33 (s, 1H), 7,72 (s, 1 H), = 3,9 Hz, 1 H), 3,80 (s, 3H), 3,78 (s, 3H), 3,62-3,68 (m, 1H) ESI (pos.) m/z: 559,9 (M+H)+. SfC con columna de 250 x l-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolmidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-ida, Ejemplo 559.0. El compuesto del título era el
descritas en 557.0. 1H RMN (500 MHz, CD3OD) 5
(dd, J = 8,3, 8,3 Hz, 1H), 6,81 (d, J= 8,6 Hz, 2H), 4,59 (d, J 0 (s, 3H), 2,32 (s, 3H), 1,28 (d, J = 7,0 Hz, 3H). MS
m AS-H con 20,8 g/min de MeOH(solo) 139 g/min
de CO2, 13% de co-disolvente a 160 g/min.
Ejemplo 560.0: Preparación de (1S,2R)-1-(5-cloro-2-pi 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulf dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -m pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4Hinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-ida o (1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-2-propanosulfonamida o (1 R,2S)-1 -(5-cloro-2-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida o (1 R,2R)-1-(5-cloro-2-pirimidinil)-N-( 3-il)-1 -metoxi-2-propanosulfonamida o (1 S,2S)-1 -(5-cloro-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida o (1 metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulf segundo pico (etapa 2) en eluir por SFC usando las condi 8,85 (s, 2H), 8,42 (s, 1H), 8,72 (s, 1 H), 7,70 (s, 1 H), (d, J = 7,8 Hz, 1 H), 3,83 (s, 3H), 3,79 (s, 3H), 3,66-3,72 (m, ESI (pos.) m/z: 560,0 (M+H)+. SfC con columna de 250 x de CO2, 13% de co-disolvente a 160 g/min.
Ejemplo 561.0: Preparación de (1R,2S)-1-(5-cloro-2-pi 1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida y (1 S,2S)-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonam dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hi pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4Hl-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2--dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolmidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)--1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-ida, Ejemplo 560.0. El compuesto del título era el
s descritas en 557.0. 1H RMN (500 MHz, CD3OD) 5
(dd, J = 8 ,6 , 8,6 Hz, 1 H), 6,81 (dd, J = 8 ,6 , 2,9 Hz, 2H), 4,69 3,15 (s, 3H), 2,31 (s, 3H), 1,09 (d, J 7,1 Hz, 3H). MS
m AS-H con 20,8 g/min de MeOH(solo) 139 g/min
inil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metily (1 R,2 R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-2-propanosulfonamida y (1 S,2R)-1 -(5-cloro-2-triazol-3-il)-1-hidroxi-2-propanosulfonamida.
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-propanosulfonamida y (1S,2S)-1-(5-cloro-2-pirimidinil)-N-( l-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2--dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida y (1 R,2R)-1 -(5-clo 4H-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida y metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propano cobre(I) (0,039 g, 0,20 mmol) a una solución en hidroxipropano-2-sulfonamida (preparada siguiendo el 0,41 mmol)), carbonato de cesio (0,332 g, 1,02 mmol), y y 2.0. La mezcla resultante se agitó durante la noche a lavó con salmuera, se secó sobre sulfato sódico y se c inversa (columna Agilent SB-C8, 30 x 250 mm, 5 gm, g TFA al 0,1%, caudal 50 ml/min). Las fracciones deseada
Ejemplo 562.0: Preparación de (1R,2S)-1-(5-cloro-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propano pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 561.0. A 802C, se añadió yoduro de no (0,82 ml) que contenía 1-(5-cloropirimidin-2-il)-1-plo C usando el aldehido adecuado y 12.0, (0,103 g, 2-dimetilciclohexano-1,2-diamina (0,116 g, 0,82 mmol) . La reacción después se repartió en EtOAc y agua, se ntró a vacío. La reacción se purificó por HPLC de fase nte de agua/ACN al 10-95% a lo largo de 25 min, con combinaron y se liofilizaron para dar el producto puro.
idinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida.
Se llevó a cabo la separación quiral final usando SFC. S/N=3242) con 50% de modificador orgánico modificado nada de amoniaco. F=60 ml/min, T=40°C, BPR=100 bar, en 12 ml de MeOH, ~11 mg/ml, inyección de 1,2 ml. Se pico 2, respectivamente.
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5 propanosulfonamida o (1 S,2R)-1 -(5-cloro-2-pirimidinil)-3-il)-1-hidroxi-2-propanosulfonamida Ejemplo 562.0. El usando las condiciones descritas antes. 1H RMN (400 M J = 1,9 Hz, 1H), 7,72 (br s, 1H), 7,52 (dd, J = 8,6, 8,6 Hz (s, 3H), 3,79 (s, 3H), 3,73-3,78 (m, 1H), 2,32 (s, 3H), 1,2 preparativa: AD-H(5 um, 21 mm x25 cm, S/N=3242) co de carbono. Modificador orgánico: IPA sin nada de amo nm.
Ejemplo 563.0: Preparación de (1R,2S)-1-(5-cloro-1,2,4-triazol-3-il)-1 -hidroxi-2-propanosulfonamida o
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-2-propano icación: SFC preparativa: AD-H(5 um, 21 mm x25 cm, % de dióxido de carbono. Modificador orgánico: IPA sin 13 bar, 220 nm. Toda la muestra (~ 132 mg) se disolvió gieron dos picos mayoritarios y se nombraron pico 1 y
etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolpuesto del título era el primer pico en eluir por SFC D3OD) 58,83 (s, 2H), 8,45 (d, J = 1,5 Hz, 1H), 8,34 (d, , 6,82 (d, J = 8,7 Hz, 2H), 5,38 (d, J = 3,5 Hz, 1H), 3,79 J = 6,8 Hz, 3H). MS ESI (pos.) m/z: 545,9 (M+H)+. SFC de modificador orgánico modificador: 50% de dióxido . F=60 ml/min, T=40°C, BPR=100 bar, P=213 bar, 220
idinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida.
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5 propanosulfonamida o (1 S,2R)-1 -(5-cloro-2-pirimidinil)-3-il)-1-hidroxi-2-propanosulfonamida Ejemplo 563.0. El usando las condiciones descritas en 562.0.1H RMN (40 (d, J = 1,7 Hz, 1H), 7,72 (s, 1H), 7,52 (dd, J = 8,5, 8,5 Hz (s, 3H), 3,79 (s, 3H), 3,73-3,78 (m, 1H), 2,32 (s, 3H), 1,2 H (5 um, 21 mm x25 cm, S/N=3242) con 50% de mod Modificador orgánico: IPA sin nada de amoniaco. F=60 etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazoluesto del título era el segundo pico en eluir por SFC z, CD3OD) 58,83 (s, 2H), 8,45 (d, J = 1,5 Hz, 1H), 8,34 ), 6,82 (d, J = 8,5 Hz, 2H), 5,38 (d, J = 3,5 Hz, 1H), 3,79 J = 6,8 Hz, 3H). MS ESI (pos.) m/z: 545,9 (M+H)+. AD-dor orgánico modificador: 50% de dióxido de carbono. , T=40°C, BPR=100 bar, P=213 bar, 220 nm.
Ejemplo 564.0: Preparación de (IS,2R)-N-(4-(2,6-dimetox metil-2-pirazinil)-2-propanosulfonamida y (1 R,2S)-N-(4-1 -etoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida (1 triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-propanosulfon piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil) l)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-etoxi-1-(5--dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-a y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-ropanosulfonamida.
(1 R,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirazi metoxibencil)-1 -(5-metilpirazin-2-il)propano-2-sulfonamid metilpirazin-2-il)propano-2-sulfonamida y (1 R,2S)-1 -hidr sulfonamida y Ejemplo 564.1. A -782C, se añadió una mmol) a una solución en 2-metiltetrahidrofurano (107 (7,46 g, 21,36 mmol). La mezcla resultante se agitó dura metiltetrahidrofurano que contenía 5-metil-2-pirazinaca reacción se dejó calentar lentamente a TA y se agitó d saturada de cloruro amónico y se repartió. El residuo que DCM/ACOEt (0-50%). Las fracciones deseadas despué m/z: 472,2 (M+H)+.
il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-bis(4-y (1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-N,N-bis(4-metoxibencil)-1 -(5-metilpirazin-2-il)propano-2-ción de n-butil-litio (2,5 M en hexanos, 10,25 ml, 25,6 que contenía N,N-bis(4-metoxibencil)etanosulfonamida 15 min a -78°C. Después, se añadió una solución en 2-ehído (2,66 ml, 25,6 mmol) a -78°C y después la te la noche. La reacción se inactivó con una solución daba se purificó en sílice eluyendo con un gradiente de combinaron y se concentraron a vacío. MS ESI (pos.)
(1 R,2R)-1 -etoxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirazinmetoxibencil)-1 -(5-metilpirazin-2-il)propano-2-sulfonamid propano-2-sulfonamida y (1 R,2S)-1 -etoxi-N,N-bis(4-y (1 S,2R)-1 -etoxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirazin-2-il)propano-2-sulfonamida y (1 S,2S)-1 -sulfonamida, Ejemplo 564.2. A -78°C, se añadió bis(tri a una solución en 2-metiltetrahidrofurano (20,93 ml) q trifluorometanosulfonato de etilo (0,814 ml, 6,28 mmo reacción se inactivó a -78°C con una solución saturad con EtOAc y se concentró a vacío. La reacción se purifi 100%). Las fracciones deseadas después se combin (M+H)+.
-N,N-bis(4-metoxibencil)-1 -(5-metilpirazin-2-il)propano-2-lil)amida de potasio, (1,0 M en THF, 2,51 ml, 2,51 mmol) ntenía 564.1 (0,987 g, 2,09 mmol). Después, se añadió la mezcla resultante se agitó durante 1 h a -78°C. La NH4Cl y la mezcla después se calentó a TA, se extrajo sílice eluyendo con un gradiente de hexanos/EtOAc (0-y se concentraron a vacío. MS ESI (pos.) m/z: 500,3
(1 R,2R)-1 -etoxi-1 -(5-metilpirazin-2-il)propano-2-sulfona sulfonamida y (1S,2R)-1-etoxi-1-(5-metilpirazin-2-il)pr il)propano-2-sulfonamida Ejemplo 564.3. A 23°C, se añ contenía anisol (0,122 ml, 1,12 mmol) y 564.2 (0,56 g, 23°C. El disolvente se evaporó, y el material se puri MeOH/DCM (0-20%). Las fracciones deseadas despu m/z: 260,2 (M+H)+.
y (1 R,2S)-1 -etoxi-1 -(5-metilpirazin-2-il)propano-2-o-2-sulfonamida y (1S,2S)-1-etoxi-1-(5-metilpirazin-2-TFA (0,086 ml, 1,12 mmol) a una solución en DCM que mmol). La mezcla resultante se agitó durante la noche a en gel de sílice eluyendo con un gradiente por pasos combinaron y se concentraron a vacío. MS ESI (pos.)
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-pirazinil)-2-propanosulfonamida (1 S,2S)-N-(4-(2,6-dim (5-metil-2-pirazinil)-2-propanosulfonamida y (1 R,2R)-il)-1-etoxi-1-(5-metil-2-pirazinil)-2-propanosulfonamida, mmol), 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-triazo cobre(I) (0,040 g, 0,21 mmol), carbonato de cesio (0,32 (0,129 ml, 0,82 mmol) se añadió 1,4-dioxano desgasifi solución de la reacción. Después de 15 min, la solució -triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-fenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-plo 564.0. En un vial que contenía 564.3 (0,112 g, 0,43 -5-metilpiridina 2.0 (0,194 g, 0,52 mmol), yoduro de ,01 mmol), y trans-N,N'-dimetil-1,2-ciclohexanosdiamina , anhidro (0,864 ml). Se burbujeó argón a través de la erogénea azul oscuro se calentó en una placa agitadora
previamente calentada a 802C. Después de 17 h, el aná La reacción se enfrió a TA, después se añadió con cui Después de extraer tres veces con DCM, los extractos o magnésico anhidro. Después de filtración y concentra (DCM/MeOH al 0-20%) para dar 564.0.
Ejemplo 565.0: Preparación de (1 S,2R)-N-(4-(2,6-dime (5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
de LCMS mostró que la reacción se había completado. una solución acuosa de tiosulfato sódico a la mezcla. cos se combinaron y después se secaron sobre sulfato el residuo se purificó en gel de sílice eluyendo con
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-
Se llevó a cabo la separación quiral final usando SFC.
mm, 5 pm), Fase móvil: 60:40 (CO2: EtOH), caudal: 65 (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-pirazinil)-2-propanosulfonamida Ejemplo 565.0. El comp las condiciones descritas antes. 1H Rm N (500 MHz, C 1H), 7,54 (dd, J = 8,6, 8,6 Hz, 1H), 6,84 (dd, J = 8,5, 4, 3,45-3,52 (m, 3H), 2,55 (s, 3H), 2,30 (s, 3H), 1,26 (d, J m/z: 554,3 (M+H)+. Método s Fc preparativo: Columna: (CO2: EtOH).
Ejemplo 566.0: Preparación de (IS,2R)-N-(4-(2,6-dimeto metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-(4 1 -etoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
SFC preparativo: Columna: Chiralpak OX-H (250 x 21 , 220 nm, 30,3 mg/inyección.
-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-del título era el primer pico en eluir por SFC usando ) 58,54 (s, 1H), 8,48 (br s, 2H), 8,36 (s, 1H), 7,74 (s, 2H), 5,09 (d, J =3,3 Hz, 1H), 3,83 (s, 3H), 3,79 (s, 3H), Hz, 3H), 1,16 (dd, J = 7,0, 7,0 Hz, 3H). MS ESI (pos.) alpak OX-H (250 x 21 mm, 5 pm), Fase móvil: 60:40
)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-pirazinil)-2-propanosulfonamida, Ejemplo 566.0. El comp las condiciones descritas en 565.0. 1H RMN (500 MHz, 1H), 7,55 (dd, J = 8,5, 8,5Hz, 1H), 6,85 (dd, J = 8,5, 4,0 3,45-3,55 (m, 3H), 2,55 (s, 3H), 2,30 (s, 3H), 1,25 (d, J 554,2 (M+H)+. Método SFC preparativo: Columna: Chir EtOH).
Ejemplo 567.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-metilpirazin-2-il)propano-2-sulfonamida y (1 S,2S)-N-il)-1 -hidroxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida 1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirazin-2-il)propanometilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-metilp -triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-del título era el segundo pico en eluir por SFC usando OD) 58,59 (s, 1H), 8,53 (s, 1H), 8,47 (s, 2H), 7,99 (s, H), 5,07 (d, J = 3,1 Hz, 1H), 3,83 (s, 3H), 3,79 (s, 3H), 3H), 1,15 (dd, J = 6,9, 6,9 Hz, 3H). MS ESI (pos.) m/z: OX-H (250 x 21 mm, 5 pm), Fase móvil: 60:40 (CO2:
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-onamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5--2-il)propano-2-sulfonamida.
(1 R,2R)-1 -((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxiben ((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1 -(5-me butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1 -(5-metilpira butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1-(5-metilpira disolución agitada de 1-hidroxi-N,N-bis(4-metoxibencil) 4,24 mmol) en DCM (21,2 ml) a 0°C se añadió trifluorom seguido de TEA (0,65 ml, 4,67 mmol). La mezcla se concentró a vacío, y se purificó en gel de sílice eluyend deseado 567.1. MS ESI (pos.) m/z: 586,2 (M+H)+.
1-(5-metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-1 -irazin-2-il)propano-2-sulfonamida y (1 R,2S)-1 -((terc-2-il)propano-2-sulfonamida y (1 S,2S)-1 -((terc-2-il)propano-2-sulfonamida, Ejemplo 567.1. A una 5-metilpirazin-2-il)propano-2-sulfonamida 564.1 (2,0 g, nosulfonato de terc-butildimetilsililo (1,07 ml, 4,67 mmol) ó calentar a TA durante 1 h. La reacción después se on EtOAc en hexanos al 0-100% para dar el compuesto
(1 S,2R)-1 -((terc-butildimetilsilil)oxi)-1 -(5-metilpirazin-2-il) butildimetilsilil)oxi)-1 -(5-metilpirazin-2-il)propano-2-sulfon metilpirazin-2-il)propano-2-sulfonamida y (1 R,2S sulfonamida Ejemplo 567.2. Un matraz de fondo redon bis(4-metoxibencil)-1-(5-metilpirazin-2-il)propano-2-sulfo DCM (20 ml). Se añadió TFA (21 ml, 273 mmol) y l completado. Después se añadió tolueno (10 ml) a la m repartió entre una disolución acuosa saturada de bicarb lavó con una solución acuosa saturada de cloruro sódi través de un cartucho de extracción Chem Elute eluyend para dar un aceite amarillo pálido. El aceite amaril (EtOAc/EtOH 3:1) en hexanos al 0-60%). Las fracci EtOAc/hexanos al 20-80%). Las fracciones correspondi sólido blanco (2,82 g). 1H RMN (300 MHz, CDCla) 58,6 ano-2-sulfonamida y (1 R,2R)-1 -((tercda y (1 S,2S)-1 -((terc-butildimetilsilil)oxi)-1 -(5--((terc-butildimetilsilil)oxi)-1 -(5-metilpirazin-2-il)propano-2-e 500 ml se cargó con -1-((terc-butildimetilsilil)oxi)-N,N-ida (5,24 g, 8,94 mmol), anisol (4,0 ml, 36,6 mmol) y ezcla se agitó a TA hasta que la reacción se había la y la mezcla se concentró hasta ~20 ml y después se to sódico (20 ml) y EtOAc (20 ml). La fase orgánica se 20 ml). La fase orgánica después se secó pasándola a on EtOAc (2 x 20 ml). La solución orgánica se concentró se purificó por Biotage (SNAP 100, Ultra, eluyente: s mezcladas se purificaron (SNAP50, HP, eluyente: s se combinaron y se concentraron a vacío para dar un , J=1,17 Hz, 1H), 8,39 (s, 1H), 5,52 (d, J=2,78 Hz, 1H),
4,66 (s, 2H), 3,50 (dq, J=2,92, 6,97 Hz, 1 H), 2,59 (s, 3H 3H).
5 (d, J=6,87 Hz, 3H), 0,97 (s, 9H), 0,19 (s, 3H), -0,15 (s,
(1 R,2R)-1 -((terc-butildimetilsilil)oxi)-N-(4-(2,6-dimetoxife metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-1 -((te 3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirazin-2-il)propanodimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-((terc-butildimetilsilil)oxi)-N-(4-(2,6-dimetoxifenil)-5-(5-m il)propano-2-sulfonamida, Ejemplo 567.3. Siguiendo el mezclaron en 1,4-dioxano desgasificado y se calentaro reacción después se repartió con agua/EtOAc y la cap HPLC de fase inversa (columna Agilent SB-C8, 30 x 25 25 min, con TFA al 0,1%, caudal 50 ml/min). Las frac producto puro 567.3. MS ESI (pos.) m/z: 640,2 (M+H)+.
(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5
ildimetilsilil)oxi)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinnamida y (1 R,2S)-1 -((terc-butildimetilsilil)oxi)-N-(4-(2,6-etilpirazin-2-il)propano-2-sulfonamida y (1 S,2S)-1 -din-3-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirazin-2-dimiento del Ejemplo C. Los Ejemplos 567.2 y 2.0 se un tubo sellado a 80°C durante la noche. La mezcla de ánica se concentró a vacío. La reacción se purificó por , 5 pm, gradiente de agua/ACN al 10-95% a lo largo de s deseadas se combinaron y se liofilizaron para dar el
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-met il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxi metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-N-( 1-hidroxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida, tetrabutilamonio (1,0 M en THF, 1,48 ml, 1,48 mmol) a 0,49 mmol). La mezcla resultante se agitó durante la n por HPLC de fase inversa (columna Phenomenex Gem -triazol-3-il)-1 -hidroxi-1 -(5-metilpirazin-2-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirazin-2-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-lo 567.0. A 23°C, se añadió solución de fluoruro de olución en THF (4,92 ml) que contenía 567.3 (0,315 g, a 23°C. La reacción después se concentró y se purificó 8, 50 x 250 mm, 10 pm, gradiente de agua/ACN al 10-95% a lo largo de 30 min, con TFA al 0,1%, caudal liofilizaron para dar el producto puro.
Ejemplo 568.0: Preparación de (1S,2R)-N-(4-(2,6-dimet (5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
ml/min). Las fracciones deseadas se combinaron y se
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-
Se llevó a cabo la separación quiral final usando SFC.
mm, 5 gm), Fase móvil: 60:40 (CO2:EtOH), caudal: 70 m
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-2-pirazinil)-2-propanosulfonamida, Ejemplo 568.0. El co las condiciones descritas antes. 1H Rm N (500 MHz, CD 7,74 (s, 1H), 7,56 (dd, J = 8,5, 8,5 Hz, 1H), 6,85 (dd, J 3,64-3,70 (m, 1H), 2,58 (s, 3H), 2,34 (s, 3H), 1,19 (d, J SFC: Columna: Chiralpak OX-H (250 x 21 mm, 5 gm), 42,8 mg/inyección.
Ejemplo 569.0: Preparación de (1 S,2R)-N-(4-(2,6-dimeto (5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
o SFC preparativo: Columna: Chiralpak OX-H (250 x 21 , 220 nm, 42,8 mg/inyección.
-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilsto del título era el primer pico en eluir por SFC usando ) 58,59 (s, 1H), 8,51 (s, 1H), 8,47 (s, 1H), 8,36 (s, 1H), 0, 8,0 Hz, 2H), 5,43 (br s, 1H), 3,82 (s, 3H), 3,79 (s, 3H), Hz, 3H). MS ESI (pos.) m/z: 526,1 (M+H)+. Método de e móvil: 60:40 (CO2:EtOH), caudal: 70 ml/min, 220 nm,
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-2-pirazinil)-2-propanosulfonamida Ejemplo 569.0. El c usando las condiciones descritas en 568.0. 1H RMN (5 8,36 (s, 1H), 7,75 (s, 1H), 7,55 (dd, J= 8,5, 8,5 Hz, 1H), 3,80 (s, 3H), 3,65-3,71 (m, 1H), 2,58 (s, 3H), 2,34 (s, 3H Método SFC: Columna: Chiralpak OX-H (250 x 21 mm, nm, 42,8 mg/inyección.
Ejemplo 570.0: Preparación de (1R,2S)-N-(4-(2,6-dimet (5-metilpirazin-2-il)propano-2-sulfonamida y (1 S,2S)-N-il)-1 -metoxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida 1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirazin-2-il)propanometilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metilp -triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilesto del título era el segundo pico en eluir por SFC Hz, CD3OD) 58,59 (s, 1H), 8,51 (s, 1H), 8,47 (s, 1H), (dd, J = 7,6, 7,6 Hz, 2H), 5,43 (br s, 1H), 3,82 (s, 3H), 19 (d, J = 6,8 Hz, 3H). MS ESI (pos.) m/z: 526,1 (M+H)+. ), Fase móvil: 60:40 (CO2:EtOH), caudal: 70 ml/min, 220
nil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxi-1-,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-lfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-n-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-meti il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxi metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-N-( 1-metoxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida,
0,469 mmol) a una solución en 1,4-dioxano (1,88 ml) qu sulfonamida y (1R,2S)-1-metoxi-1-(5-metilpirazin-2-il)pr il)propano-2-sulfonamida y (1S,2S)-1-metoxi-1-(5-metil procedimientos usados para hacer 564.3 (usando en (0,230 g, 0,934 mmol), carbonato de cesio (0,764 g, 2, 1,88 mmol). La mezcla resultante se agitó durante EtOAc/agua, La capa orgánica se lavó con salmuera, reacción se purificó por HPLC de fase inversa (column a lo largo de 25 min, con TFA al 0,1%, caudal 50 ml/ para dar el producto puro.
Ejemplo 571.0: Preparación de (1S,2R)-N-(4-(2,6-dimet (5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
-triazol-3-il)-1-metoxi-1-(5-metilpirazin-2-il)propano-2-n-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirazin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-570.0. A 80°C, se añadió yoduro de cobre(I) (0,089 g, tenía (1 R,2R)-1-metoxi-1-(5-metilpirazin-2-il)propano-2--2-sulfonamida y (1S,2R)-1-metoxi-1-(5-metilpirazin-2--2-il)propano-2-sulfonamida (preparadas siguiendo los al el Ejemplo C usando el aldehido adecuado y 12.0 ol), y N1 ,N2 -dimetilciclohexanos-1 ,2 -diamina (0,267 g, che a 80°C. La reacción después se repartió con có sobre sulfato sódico y se concentraron a vacío. La nt SB-C8 , 30 x 250 mm, 5 pm, gradiente de agua/ACN as fracciones deseadas se combinaron y se liofilizaron
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-
Se llevó a cabo la separación quiral final usando SFC S/N=2121) con 50% de modificador orgánico modificad sin nada de amoniaco. F=60 ml/min, T=40°C, BPR=1 disolvió en 17 nl de MeOH (7 ml)/DCM(10 ml)), ~30 mg/
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-2-pirazinil)-2-propanosulfonamida Ejemplo 571.0. El co las condiciones descritas antes. 1H RMN (500 MHz, CD Hz, 1 H), 7,75 (d, J = 3,6 Hz, 1H), 7,54 (dd, J = 8,5, 8, 3,82 (s, 3H), 3,80 (s, 3H), 3,47-3,54 (m, 1H), 3,31 (s, 3 (pos.) m/z: 540,2 (M+H)+. SFC preparativa: OX (5 um, modificador: 50% de dióxido de carbono Modificador or
E je m p lo 572.0: P re p a ra c ió n d e (1 S ,2 R ) -N -(4 -(2 ,6 -d im e t (5 -m e t i l-2 -p ira z in i l) -2 -p ro p a n o s u lfo n a m id a o (1 R ,2 S ) -N ficación: SFC preparativa: OX (5 um, 21 mm x25 cm, % de dióxido de carbono. Modificador orgánico: EtOH , P=200 bar, 234 nm. Toda la muestra (~490 mg) se 2 ml de inyección.
triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilto del título era el primer pico en eluir por SFC usando 5 8,55 (s, 1H), 8,48 (d, J = 1,4 Hz, 2H), 8,36 (d, J = 2,0 1 H), 6,84 (d, J = 8,6 Hz, 2H), 4,99 (d, J = 3,1 Hz, 1H), 9 (s, 3H) 2,33 (s, 3H), 1,24 (d, J = 6,8 Hz, 3H). MS ESI x25 cm, S/N=2121) con 50% de modificador orgánico : EtOH sin nada de amoniaco.
il) -5 -(5 -m e t i l- 3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x i-1 -,6 -d im e to x ife n il) -5 -(5 -m e t i l-3 -p ir id in i l ) -4 H -1 ,2 ,4 - t r ia z o l-3 -
il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-2-pirazinil)-2-propanosulfonamida Ejemplo 572.0. El c usando las condiciones descritas en 571.0. 1H RMN (5 7,75 (s, 1H), 7,54 (dd, J = 8,6, 8,6 Hz, 1H), 6,85 (d, J 3H), 3,45-3,51 (m, 1H), 3,31 (s, 3H), 2,59 (s, 3H) 2,34 (M+H)+. SFC preparativa: OX (5 um, 21 mm x25 cm, S/ de dióxido de carbono Modificador orgánico: EtOH sin n
Ejemplo 573.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(5-metilpirazin-2-il)propano-2-sulfonamida y (1 S triazol-3-il)-1 -metoxi-1 -(5-metilpirazin-2-il)propano-2-sulf metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-met dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilsto del título era el segundo pico en eluir por SFC z, CD3OD) S 8,55 (s, 1H), 8,46 (s, 2H), 8,36 (s, 1H), Hz, 2H), 4,98 (d, J = 3,1 Hz, 1H), 3,83 (s, 3H), 3,81 (s, ), 1,24 (d, J = 6,8 Hz, 3H). MS ESI (pos.) m/z: 540,2 1) con 50% de modificador orgánico modificador: 50% amoniaco.
l)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxi--(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-da y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-in-2-il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-toxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-met 2- il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimeto (5-metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-N 3- il)-1-metoxi-1-(5-metilpirazin-2-il)propano-2-sulfonami procedimiento del Ejemplo A y usando 1.0, y los metoxipicolinohidrazida. La reacción se purificó por HP pm, gradiente de agua/ACN al 10-95% a lo largo de 2 deseadas se combinaron y se liofilizaron para dar el pro
Ejemplo 574.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(5-metil-2-pirazinil)-2-propanosulfonamida o (1 S triazol-3-il)-1-metoxi-1-(5-metil-2-pirazinil)-2-propanosulf 4-triazol-3-il)-1 -metoxi-1 -(5-metilpirazin-2-il)propano-2-in-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metilpirazin-)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazoljemplo 573.0. Este compuesto se preparó siguiendo el edimientos generales encontrados en 564.3 y 6-fase inversa (columna Agilent SB-C8, 30 x 250 mm, 5 , con TFA al 0,1%, caudal 50 ml/min). Las fracciones puro.
l)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi--(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-a.
Se llevó a cabo la separación quiral final usando SFC S/N=2121) con 50% de modificador orgánico modifica sin nada de amoniaco. F=60 ml/min, T=40°C, BPR= disuelta en 8 ml de MeOH/DCM (1/1, v/v), ~ 32 mg/ml,
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxife metil-2-pirazinil)-2-propanosulfonamida Ejemplo 574.0. usando las condiciones descritas antes. 1H Rm N (500 1H), 7,75 (dd, J = 7,8, 7,8 Hz, 1H), 7,65 (dd, J = 7,4, 0 4,95 (d, J = 3,3 Hz, 1H), 3,77 (s, 3H), 3,76 (s, 3H), 3,45-J = 6,1 Hz, 3H). MS ESI (pos.) m/z: 556,3 (M+H)+. OX orgánico modificador: 50% de dióxido de carbono. Modi
Ejemplo 575.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(5-metil-2-pirazinil)-2-propanosulfonamida o (1 triazol-3-il)-1-metoxi-1-(5-metil-2-pirazinil)-2-propanosulf ificación: SFC preparativa: OX (5 um, 21 mm x25 cm, % de dióxido de carbono. Modificador orgánico: EtOH ar, P=200 bar, 220 nm. Toda la muestra (~260 mg) de inyección.
,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-mpuesto del título era el primer pico en eluir por SFC CD3OD) 58,55 (d, J = 1,0 Hz, 1H), 8,43 (d, J = 1,4 Hz, 1H), 7,45 (dd, J = 8,5, 8,5 Hz, 1H), 6,77-6,82 (m, 3H), (m, 1H), 3,30 (s, 3H), 3,21 (s, 3H), 2,59 (s, 3H), 1,19 (d, , 21 mm x25 cm, S/N=2121) con 50% de modificador r orgánico: EtOH sin nada de amoniaco.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-ida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxife metil-2-pirazinil)-2-propanosulfonamida Ejemplo 575.0. usando las condiciones descritas en 574.0. 1H RMN (5 1H), 7,75 (dd, J = 8,2, 7,4 Hz, 1H), 7,66 (dd, J = 7,4, 0 4,95 (d, J = 3,3 Hz, 1H), 3,77 (s, 3H), 3,76 (s, 3H), 3,44-J = 6,1 Hz, 3H). MS ESI (pos.) m/z: 556,3 (M+H)+. OX orgánico modificador: 50% de dióxido de carbono. Modi
Ejemplo 576.0: Preparación de (1R,2S)-N-(4-(2,6-dimet 1 -(5-metil-2-pirazinil)-2-propanosulfonamida y (1 triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-propanosulf piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-piraz 5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-( ,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-puesto del título era el segundo pico en eluir por SFC z, CD3OD) 58,55 (d, J = 1 Hz, 1H), 8,43 (d, J = 1,2 Hz, 1H), 7,45 (dd, J = 8,5, 8,5 Hz, 1H), 6,77-6,82 (m, 3H), (m, 1H), 3,30 (s, 3H), 3,21 (s, 3H), 2,59 (s, 3H), 1,19 (d, , 21 mm x25 cm, S/N=2121) con 50% de modificador r orgánico: EtOH sin nada de amoniaco.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-ida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2--propanosulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-l-2-pirazinil)-2-propanosulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxife metil-2-pirazinil)-2-propanosulfonamida y (1 R,2R)-N-( il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida 1,2,4-triazol-3-il)-1-hidroxi-1-(5-metil-2-pirazinil)-2-propa hizo siguiendo el Ejemplo A usando 1.0 y los metoxipicolinohidrazida. La reacción se purificó por HP pm, gradiente de agua/ACN al 10-95% a lo largo de 2 deseadas se combinaron y se liofilizaron para dar el pro
Ejemplo 577.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet 1 -(5-metil-2-pirazinil)-2-propanosulfonamida o (1 S triazol-3-il)-1-hidroxi-1-(5-metil-2-pirazinil)-2-propanosulf ,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5--dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-onamida, Ejemplo 576.0. El compuesto del título se edimientos generales encontrados en 564.3 y 6-fase inversa (columna Agilent SB-C8, 30 x 250 mm, 5 , con TFA al 0,1%, caudal 50 ml/min). Las fracciones puro.
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-ida.
Se llevó a cabo la separación quiral final usando SFC. mm, 5 pm), Fase móvil: 75:25 (CO2: MeOH) caudal: 70
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxife metil-2-pirazinil)-2-propanosulfonamida Ejemplo 577.0. usando las condiciones descritas antes. 1H RMN (500 7,8 Hz, 1H), 7,66 (d, J = 7,4 Hz, 1 H), 7,47 (dd, J = 8,5, 3,75 (s, 3H), 3,63-3,69 (m, 1H), 3,21 (s, 3H), 2,58 (s, 3 SFC: Columna: Chiralpak AS-H (250 x 21 mm, 5 pm), F
Ejemplo 578.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet 1 -(5-metil-2-pirazinil)-2-propanosulfonamida o (1 S triazol-3-il)-1-hidroxi-1-(5-metil-2-pirazinil)-2-propanosulf o SFC preparativo: Columna: Chiralpak AS-H (250 x 21 , 220 nm, 32,2 mg/inyección.
,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-mpuesto del título era el primer pico en eluir por SFC CD3OD) 58,57 (s, 1H), 8,51 (s, 1H), 7,75 (dd, J = 7,8, z, 1H), 6,77-6,84 (m, 3H), 5,40 (br s, 1H), 3,79 (s, 3H), 19 (d, J = 7,0 Hz, 3H). MS ESI (pos.) m/z: 542,2 (M+H)+. óvil: 75:25 (CO2: MeOH).
il)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-ida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifeni metil-2-pirazinil)-2-propanosulfonamida Ejemplo 578.0.
usando las condiciones descritas en 577.0. 1H RMN (5 7,8, 7,8 Hz, 1H), 7,66 (d, J = 7,4 Hz, 1H), 7,47 (dd, J = 3H), 3,75 (s, 3H), 3,63-3,69 (m, 1H), 3,21 (s, 3H), 2,58 (M+H)+. SFC: Columna: Chiralpak AS-H (250 x 21 mm,
Ejemplo 579.0: Preparación de (1 S,2R)-N-(4-(2,6-di metil-2-pirazinil)-2-propanosulfonamida y (1 R,2S)-metoxi-1-(5-metil-2-pirazinil)-2-propanosulfonamida y ( 3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamid triazol-3-il)-1-metoxi-1-(5-metil-2-pirazinil)-2-propanosulfo ,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-mpuesto del título era el segundo pico en eluir por SFC Hz, CD3OD) 58,56 (s, 1H), 8,51 (s, 1H), 7,76 (dd, J = 8,4 Hz, 1H), 6,77-6,84 (m, 3H), 5,40 (br s, 1H), 3,79 (s, H), 1,18 (d, J = 7,0 Hz, 3H). MS ESI (pos.) m/z: 542,2 , Fase móvil: 75:25 (CO2: MeOH).
xifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5 -(2,6-dimetoxifenil)-5-(3-piridinyt)-4H-1,2,4-triazot-3-il)-1 -R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-ida.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tri propanosulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxif pirazinil)-2-propanosulfonamida y (1 R,2R)-N-(4-(2,6-di metil-2-pirazinil)-2-propanosulfonamida y (1 S,2S)-N-(4-( 1-(5-metil-2-pirazinil)-2-propanosulfonamida, Ejemplo 57 usando 1.0 y los procedimientos generales encontrados HPLC de fase inversa (columna Agilent SB-C8, 30 x 25 25 min, con TFA al 0,1%, caudal 50 ml/min). Las fracc producto puro.
Ejemplo 580.0: Preparación de (1 S,2R)-N-(4-(2,6-di metil-2-pirazinil)-2-propanosulfonamida y (1 R,2S)-N-(4-( 1-(5-metil-2-pirazinil)-2-propanosulfonamida.
3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2--5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-xifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-imetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-El compuesto del título se preparó siguiendo Ejemplo A 564.3 e hidrazida nicotínica. La reacción se purificó por , 5 pm, gradiente de agua/ACN al 10-95% a lo largo de s deseadas se combinaron y se liofilizaron para dar el
xifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5 imetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-
Se llevó a cabo la separación quiral final usando SFC. fase móvil era 27 ml/min de MeOH (solo) 33 g/min (206 bar de contrapresión). La detección se realizó por MeOH (11,5 mg/ml) con un tamaño de inyección de Tiempo de análisis 11 min.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxi pirazinil)-2-propanosulfonamida Ejemplo 580.0. El com las condiciones descritas antes. 1H RMN (500 MHz, CD 8,0 Hz, 1H), 7,54 (dd, J = 8,3, 8,3 Hz, 1H), 7,47 (dd, J 1H), 3,829s, 3H), 3,80 (s, 3H), 3,45-3,51 (m, 1H), 3,32 m/z: 526,2 (M+H)+. SFC preparativa con columna de 21 (solo) 33 g/min de CO2, 45% de co-disolvente con un
Ejemplo 581.0: Preparación de (IS,2R)-N-(4-(2,6-dimeto 2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-(4-(2,6-d metil-2-pirazinil)-2-propanosulfonamida.
reparativa con columna de 21x250 mm, 5 um OZ-H. La 2, 45% de co-disolvente a un caudal total de 60 g/min 272 nm. La muestra (344 mg) se disolvió en 30 ml de (es decir 20,7 mg/inyección). Tiempo de ciclo 7 min,
-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-del título era el primer pico en eluir por SFC usando ó 8,62 (br s, 2H), 8,55 (s, 1H), 8,47 (s, 1H), 7,89 (d, J = 6,3 Hz, 1H), 6,84 (d, J = 8,6 Hz, 2H), 4,99 (d, J = 3,1 Hz, ), 2,59 (s, 3H), 1,24 (d, J = 6,6 Hz, 3H). MS ESI (pos.) mm, 5 um OZ-H. La fase móvil era 27 ml/min de MeOH l total de 60 g/min (206 bar de contrapresión).
l)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metilxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxi pirazinil)-2-propanosulfonamida Ejemplo 581.0. El comp las condiciones descritas en 580.0. 1H RMN (500 MHz, J = 8,0 Hz, 1H), 7,69 (d, J = 6,7 Hz, 1H), 7,54 (dd, J = 4,99 (d, J = 2,9 Hz, 1H), 3,82 (s, 3H), 3,80 (s, 3H), 3,45 3H). Ms ESI (pos.) m/z: 526,1 (M+H)+. SFC preparativa 27 ml/min de MeOH (solo) 33 g/min de CO2, 45% d contrapresión).
Ejemplo 582.0: Preparación de (IS,2S)-N-(4-(2,6-dimet 1 -(5-metilpirimidin-2-il)propano-2-sulfonamida y (1 triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2-s metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-me dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) -il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-del título era el segundo pico en eluir por SFC usando D) ó 8,62 (br s, 2H), 8,55 (s, 1H), 8,46 (s, 1H), 7,88 (d, ,5 Hz, 1H), 7,42-7,48 (m, 2H), 6,84 (d, J = 8,6 Hz, 2H), (m, 1H), 3,31 (s, 3H), 2,59 (s, 3H), 1,24 (d, J = 7,0 Hz, olumna de 21x250 mm, 5 um OZ-H. La fase móvil era isolvente con un caudal total de 60 g/min (206 bar de
il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-ida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-idin-2-il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-roxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 S ,2 S ) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(6 -m e to x ip ir id in -2 - i l) -4 4 - t r ia z o l-3 - i l) -1 -h id ro x i-1 -(5 -m e t ilp ir im id in -2 - i l)p ro p a n o -
2-sulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxife metilpirimidin-2-il)propano-2-sulfonamida y (1 S,2R)-N-( il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid 4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-metilpirimidin-2-il)pro se preparó siguiendo el Ejemplo A usando 1.0, 11.0, y de fase inversa (columna Phenomenex Gemini-C18, 3 largo de 25 min, con TFA al 0,1%, caudal 50 ml/min).
dar el producto puro.
Ejemplo 583.0: Preparación de (IS,2S)-N-(4-(2,6-dimet 1 -(5-metilpirimidin-2-il)propano-2-sulfonamida o (1 triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2-su metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-met dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) (6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)--sulfonamida, Ejemplo 582.0. El compuesto del título toxipicolinohidrazida. La reacción se purificó por HPLC 0 mm, 10 pm, gradiente de agua/ACN al 10-95% a lo cciones deseadas se combinaron y se liofilizaron para
il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-ida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-idin-2-il)propano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-roxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 2-sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxife metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2R)-N-( il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2-sulfonamid 4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)pro compuestos del Ejemplo 582.0 se separó usando cond 583.0. 1H RMN (500 MHz, CD3OD) S 8,67 (s, 2H), 7,75 = 8,5, 8,5 Hz, 1H), 6,77-.6,79 (m, 3H), 5,44 (d, J = 2,5 H (s, 3H), 2,37 (s, 3H), 1,21 (d, J = 6,8 Hz, 3H). MS ESI (p
Ejemplo 584.0: Preparación de (2S,3R)-N-metilpirimidin-2-il)butano-2-sulfonamida y (2R,3S)-N-metilpirimidin-2-il)butano-2-sulfonamida.
4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-2-sulfonamida Ejemplo 583.0. La mezcla de s quirales de separación para proporcionar el Ejemplo = 7,9, 7,9 Hz, 1H), 7,65 (d, J = 7,2 Hz, 1H), 7,44 (dd, J , 3,76 (m ocultado, 1H), 3,75 (s, 3H), 3,35 (s, 3H), 3,21 /z: 542,0 (M+H)+.
6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-t (2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-t Ejemplo 584.0. El compuesto del título se preparó sig nicotínica. La reacción se purificó por HPLC de fase inv de agua/ACN al 10-95% a lo largo de 25 min, con TF combinaron y se liofilizaron para dar el producto puro.
E je m p lo 585.0: P re p a ra c ió n d e (2 R ,3 S ) -N -(4 -(2 ,6 -3-il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida y -3-il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida,
el Ejemplo A usando 1.0, 10.0 racémico y hidrazida columna Agilent SB-C8, 30 x 250 mm, 5 pm, gradiente 0,1%, caudal 50 ml/min). Las fracciones deseadas se
to x ife n il) -5 -(3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -3 -(5 -m e t i l- 2 -pirimidinil)-2-butanosulfonamida.
Se llevó a cabo la separación quiral final usando SFC. SFC preparativa ATO DAS Berger MG2 "Robogram" co ml/min de MeOH (solo) 33 g/min de CO2, 45% de contrapresión). La detección se realizó por UV a 272 mg/ml) con un tamaño de inyección de 1,8 ml (es d análisis 11 min.
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tr Ejemplo 585.0. El compuesto del título era el primer pic RMN (500 MHz, CDCls) 511,4 (br. s, 1H), 8,63 (br s, 2 Hz, 1H), 7,28 (m ocultado, 1H), 6,6 (ddd, J = 7,8, 7,8 H 3H), 2,30 (s, 3H), 1,39 (d, J = 7,2 Hz, 3H), 1,37 (d, J = 7 con columna de 21x250 mm, 5 um OZ-H. La fase móvi co-disolvente con un caudal total de 60 g/min (206 bar c Ejemplo 586.0: Preparación de (2S,3R)-N-(4-(2,6 pirimidinil)-2-butanosulfonamida.
ración quiral de 344 mg de productos llevada a cabo en umna de 21x250 mm, 5 um OZ-H. La fase móvil era 27 solvente con un caudal total de 60 g/min (206 bar de a muestra (344 mg) se disolvió en 30 ml MeOH (11,5 0,7 mg/inyección). Tiempo de ciclo 7 min, Tiempo de
-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida
luir por SFC usando las condiciones descritas antes. 1H 6 (s, 2H), 7,78 (d, J= 7,8 Hz, 1H), 7,39 (dd, J = 8,5, 8,5 , 3,88-3,94 (m, 1H), 3,74-3,81 (m ocultado, 1H), 3,74 (s, , 3H),. MS ESI (pos.) m/z: 510 (M+H)+. SFC preparativa 27 ml/min de MeOH (solo) 33 g/min de CO2, 45% de presión).
toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-t Ejemplo 586.0. El compuesto del título era el segundo 585.0. 1H RMN (500 MHz, CDCla) 511,38 (br s, 1H), 8, = 8,5, 8,5 Hz, 1H), 7,28 (m ocultado, 1H), 6,6 (dd, J = 7, 3H), 3,71 (s, 3H), 2,30 (s, 3H), 1,39 (d, J = 7,0 Hz, 3H), preparativa con columna de 21x250 mm, 5 um OZ-H. CO2, 45% de co-disolvente con un caudal total de 60 g/
Ejemplo 587.0: Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-metilpirazin-2-il)propano-2-sulfonamida y (1 S,2S)-N 3-il)-1 -etoxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida 1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metilpirazin-2-il)propano-2-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-etoxi-1-(5-metil -3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida
en eluir por SFC usando las condiciones descritas en s, 2H), 8,54 (s, 2H), 7,76 (d, J = 8,0 Hz, 1H), 7,38 (dd, J Hz, 2H), 3,87-3,94 (m, 1H), 3,74-3,81 (m, 1H), 3,74 (s, (d, J = 7,0 Hz, 3H). MS ESI (pos.) m/z: 510 (M+H)+. SFC se móvil era 27 ml/min de MeOH (solo) 33 g/min de 06 bar de contrapresión). Pico 2.
il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-namida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-n-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-meto il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxif metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2 1-etoxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida, Eje Ejemplo A usando 1.0, 564.3 y 6-metoxipicolinohidrazida Agilent SB-C8, 30 x 250 mm, 5 pm, gradiente de agua/A 50 ml/min). Las fracciones deseadas se combinaron y se
Ejemplo 588.0: Preparación de (1S,2R)-N-(4-(2,6-dimeto (5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida.
4-triazol-3-il)-1-etoxi-1-(5-metilpirazin-2-il)propano-2-in-2-il)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metilpirazin-2--(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5 etoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-587.0. El compuesto del título se preparó siguiendo el eacción se purificó por HPLC de fase inversa (columna 10-95% a lo largo de 25 min, con TFA al 0,1%, caudal zaron para dar el producto puro.
l)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-etoxi-1-6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-
Se llevó a cabo la separación quiral final usando SFC. pm, Fase móvil: 65:35 (CO2: MeOH); caudal: 70 ml/min;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5 2- pirazinil)-2-propanosulfonamida Ejemplo 588.0. El co las condiciones descritas antes. 1H RMN (500 MHz, CD J = 8,4, 8,4 Hz, 1 H), 6,7 (dd, J = 7,6, 1,5 Hz, 1 H), 6,6 (d, 3H), 3,46-3,56 (m, 3H), 3,16 (s, 3H), 2,58 (s, 3H), 1,27 (pos.) m/z: 569,9 (m +H)+. Método SFC preparativo: Col MeOH); caudal: 70 ml/min.
Ejemplo 589.0: Preparación de (1S,2R)-N-(4-(2,6-dimeto (5-metil-2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-3- il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida do SFC preparativo: Columna: OZ-H (250 x 21 mm, 5 m; 200 - 206 bar de presión de entrada.
4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metilsto del título era el primer pico en eluir por SFC usando 8,52 (s, 1H), 8,44 (s, 1H), 7,58-7,63 (m, 2H), 7,31 (dd, ,3 Hz, 2H), 5,1 (d, J = 3,4 Hz, 1 H), 3,70 (s, 3H), 3,68 (s, = 6,8 Hz, 3H), 1,14 (dd, J = 6,8, 6,8 Hz, 3H). MS ESI : OZ-H (250 x 21 mm, 5 pm). Fase móvil: 65:35 (CO2:
l)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-etoxi-1-6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4 propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-2-pirazinil)-2-propanosulfonamida, Ejemplo 589.0. El c usando las condiciones descritas en 588.0. 1H RMN (5 7,56-7,63 (m, 2H), 7,32 (dd, J = 8,4, 8,4 Hz, 1H), 6,7 (d Hz, 1H), 3,70 (s, 3H), 3,69 (s, 3H), 3,47-3,59 (m, 3H), 3, 7,0, 7,0 Hz, 3H). (M+h)+ m/z: 569,9 (M+H)+. Método S móvil: 65:35 (CO2: MeOH); caudal: 70 ml/min.
Ejemplo 590.0: Preparación de (1S,2S)-1-(5-cloro triazol-3-il)-1 -metoxipropano-2-sulfonamida y (1 S,2R)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida
(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-sulf dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-meto ,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-etoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metilesto del título era el segundo pico en eluir por SFC z, CDCh) 511,07 (br s, 1H), 8,52 (s, 1H), 8,45 (s, 1H), 7,8, 1,2 Hz, 1H), 6,6 (d, J = 8,6 Hz, 2H), 5,1 (d, J = 3,4 3H), 2,59 (s, 3H), 1,28 (d, J = 7,1 Hz, 3H), 1,14 (dd, J = reparativo: Columna: OZ-H (250 x 21 mm, 5 pm), Fase
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-loropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-ida y (1 R,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-ano-2-sulfonamida.
(1 S,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida y (1 S,2R)-1 -(5-cloropirimidin-2-il) metoxipropano-2-sulfonamida y (1 R,2S)-1 -(5-clor triazol-3-il)-1 -metoxipropano-2-sulfonamida y (1 R,2R)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-sulfonamida, Ej Ejemplo A usando 1.0, 14.3 racémico (preparado usand por HPLC de fase inversa (columna Phenomenex Gemi 95% a lo largo de 25 min, con TFA al 0,1%, caudal liofilizaron para dar el producto puro.
Ejemplo 591.0: Preparación de (1 R,2S)-1 -(5-cloro-2-piri 3-il)-1-metoxi-2-propanosulfonamida.
in-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano-2-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -idin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-loropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-590.0. El compuesto del título se preparó siguiendo el jemplo C) y hidrazida nicotínica. La reacción se purificó 8, 30 x 250 mm, 10 pm, gradiente de agua/ACN al 10-l/min). Las fracciones deseadas se combinaron y se
Se llevó a cabo la separación quiral final usando SFC. SF Fase móvil: 60:40 (CO2: MeOH); Método 2: Columna: AS; F
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3 propanosulfonamida Ejemplo 591.0. El compuesto del título condiciones descritas antes. 1H RMN (500 MHz, CDCta) 5 8,1 Hz, 1H), 7,40 (dd, J = 8,6, 8,6 Hz, 1H), 7,32 (br 3H), 3,72 (br s, 3H), 3,71 (m ocultado, 1H), 3,34 (s, 3H), 1, SFC: Método 1: Columna: CC4-NT Fase móvil: 60:40 (C (CO2: MeOH).
Ejemplo 592.0: Preparación de (1S,2R)-1-(5-cloro-2-pirimid 3-il)-1-metoxi-2-propanosulfonamida.
parativa de 2 etapas. Método 1: Columna: CC4-NT
móvil: 85:15 (CO2: MeOH).
inil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-el primer pico (etapa 1) en eluir por SFC usando las
(br s, 1H), 8,72 (s, 2H), 8,64 (br s, 2H), 7,79 (d, J =
), 6,61 (d, J = 8,1 Hz, 2H), 4,97 (d, J = 4,9 Hz, 1H), 3,75 (s, , J = 6,8 Hz, 3H). MS ESI (pos.) m/z: 545,8 (M+H)+.
eOH); Método 2: Columna: AS; Fase móvil: 85:15
-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3 propanosulfonamida Ejemplo 592.0. El compuesto del título condiciones descritas en 591.0. 1H RMN (500 MHz, CDCla) 7,40 (dd, J = 8,4, 8,4 Hz, 1H), 7,29 (m ocultado, 1H), 6,61 ( 3,71 (m ocultado, 1H), 3,34 (s, 3H), 1,38 (d, J = 6,8 Hz, Columna: CC4-NT Fase móvil: 60:40 (CO2: MeOH); Método
Ejemplo 593.0: Preparación de (1S,2S)-1-(5-cloro-2-pirimid 3-il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(5-cl 1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida.
inil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-el primer pico (etapa 2) en eluir por SFC usando las ,72 (s, 2H), 8,62 (br s, 2H), 7,76 (d, J = 7,9 Hz, 1H), ), 4,97 (d, J = 4,6 Hz, 1H), 3,75 (s, 3H), 3,72 (s, 3H), Ms ESI (pos.) m/z: 545,9 (M+H)+. s FC: Método 1: olumna: AS; Fase móvil: 85:15 (CO2: MeOH).
-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol--pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3-propanosuifonamida o (1 R,2r)-1 -(5-cloro-2-pirimidinil)-N-metoxi-2-propanosulfonamida Ejemplo 593.0. El compuest usando las condiciones descritas en 591.0. 1H RMN (500 2H), 7,78 (d, J = 7,1 Hz, 1H), .40 (dd, J = 8,4, 8,4 Hz, 1H), Hz, 1H), 4,77 (d, J = 6,6 Hz, 1H), 3,80 (s, 3H), 3,77 (m oc 3H). m S ESI (pos.) m/z: 545,9 (M+H)+. s FC: Método 1: Col 2: Columna: AS; Fase móvil: 85:15 (CO2: MeOH).
E je m p lo 594.0: P re p a ra c ió n d e (1 S ,2 S ) -1 -(5 -c lo ro -2 -p ir im id 3 -il)-1 -m e to x i-2 -p ro p a n o s u lfo n a m id a o (1 R ,2 R )-1 -(5 -c l inil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -título era el segundo pico (etapa 2) en eluir por SFC CDCl3) 5 11,43 (br s, 1H), 8,74 (s, 2H), 8,63 (br s, (br s, 1H), 6,63 (d, J = 8,6 Hz, 1H), 6,61 (d, J = 8,3 , 1H), 3,72 (s, 3H), 3,26 (s, 3H), 1,25 (d, J= 7,1 Hz, a: c C4-Nt Fase móvil: 60:40 (CO2: MeOH); Método
N -(4 -(2 ,6 -d im e to x ife n il) -5 -(3 -p ir id in i l) -4 H -1 ,2 ,4 - t r ia z o l--p ir im id in i l) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(3 -p ir id in i l) -4 H -1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida.
(1 S,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida o (1 R,2R)-1-(5-cloro-2-pirimidini metoxi-2-propanosulfonamida Ejemplo 594.0. El comp usando las condiciones descritas en 591.0. 1H RMN (5 Hz, 1 H), 7,59 (br s, 1 H), 7,45 (dd, J = 8,6, 8,6 Hz, 1H), (m ocultado, 1H), 3,76 (s, 3H), 3,26 (s, 3H), 1,27 (d, J SFC de 2 etapas: Etapa 1,40% MeOH; CC4-NT. Etapa
Ejemplo 595.0: Preparación de (1S,2S)-1-(5-cloropiri 1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida y metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi sulfonamida.
iridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-del título era el tercer pico (etapa 1) en eluir por SFC z, CDCh) 58,75 (s, 2H), 8,70 (br s, 2H), 8,11 (d, J = 7,6 6,68 (m, 2H), 4,75 (d, J = 6,4 Hz, 1 H), 3,83 (s, 3H), 3,79 Hz, 3H). MS ESI (pos.) m/z: 545,8.0 (M+H)+. Purificación ; 15% IPA.
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-lfonamida y (1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-etoxipropano-2-sulfonamida y (1 R,2R)-1 -(5--il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-2-sulfonamida y (1 S,2R)-1 -(5-cloropirimidin-2-il)-N-(4-1 -metoxipropano-2-sulfonamida y (1 R,2S)-1 -(5-cloropi 1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida y metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano preparó siguiendo el Ejemplo A usando 1.0, 1 metoxipicolinohidrazida para proporcionar el producto (columna Phenomenex Gemini-C18, 30 x 250 mm, 10 con TFA al 0,1%, caudal 50 ml/min). Las fracciones d puro.
Ejemplo 596.0: Preparación de (1S,2S)-1-(5-cloropi 1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida o metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropano dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipi sulfonamida.
etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-l-metoxipropanoimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-n-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-lfonamida, Ejemplo 595.0. El compuesto del título se racémico (preparado usando el Ejemplo C) y 6-ado. La reacción se purificó por HPLC de fase inversa radiente de agua/ACN al 10-95% a lo largo de 25 min, as se combinaron y se liofilizaron para dar el producto
n-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-lfonamida o (1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-etoxipropano-2-sulfonamida o (1 R,2R)-1 -(5--il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-
Se llevó a cabo la separación quiral final usando SFC. Realizado en Thar 200 con columna de 250x 30 mm C de co-disolvente a 130 g/min. Temperatura 39°C, presi disolvieron en 12 ml de MeOH:DCM (2/1, v/v), c=8,9 m de ciclo 11 min, Tiempo de análisis 25 min.
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-2-sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il)-N-(4-( 1 -metoxipropano-2-sulfonamida o (1 R,2S)-1 -(5-cloropiri 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropanoprimer pico en eluir por SFC usando las condiciones de 7,64 (m, 2H), 7,32 (dd, J = 8,4, 8,4 Hz, 1H), 6,7 (dd, J = 1H), 3,72 (ocultado m, 1H), 3,71 (s, 3H), 3,69 (s, 3H), (pos.) m/z: 576,0 (M+H)+. SfC: columna de 250x 30 m 35% de co-disolvente a 130 g/min. Temperatura 39°C, p
Ejemplo 597.0: Preparación de (1S,2S)-1-(5-cloropiri 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipir sulfonamida.
iciones de separación preparativa para 595.0 (107 mg): ando 88 g/min de CO2 y 42 g/min de MeOH (solo), 35% 0 bar, longitud de onda 297 nm. 107 mg de muestra se Inyectado solución de 0,7 ml, 6,2 mg/inyección. Tiempo
etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropanoimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)--2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida Ejemplo 596.0. El compuesto del título era el s antes. 1H RMN (500 MHz, CDCh) 58,72 (s, 2H), 7,58 1,2 Hz, 1H), 6,6 (d, J = 8,6 Hz, 2H), 4,97 (d, J = 4,9 Hz, (s, 3H), 3,16 (s, 3H), 1,38 (d, J = 7,1 Hz, 3H). MS ESI 4 usando 88 g/min de CO2 y 42 g/min de MeOH (solo), n 100 bar, longitud de onda 297 nm.
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida o (1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-etoxipropano-2-sulfonamida o (1 R,2 R)-1 -(5--il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-
( 1 S ,2 S ) -1 -(5 -c lo ro p ir im id in -2 - i l) -N -(4 -(2 ,6 -d im e to x ife n il) -2 -s u lfo n a m id a o (1 S ,2 R )-1 -(5 -c lo ro p ir im id in -2 - i l) -N -(4 -( e to x ip ir id in -2 - i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -m e to x ip ro p a n o -im e to x ife n il) -5 -(6 -m e to x ip ir id in -2 - i l) -4 H -1 ,2 ,4 - t r ia z o l-3 - i l) -1 -metoxipropano-2-sulfonamida o (1 R,2S)-1 -(5-cloropiri 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropanosegundo pico en eluir por SFC usando las condiciones 8,72 (s, 2H), 7,58-7,64 (m, 2H), 7,31 (dd, J = 8 ,6 , 8,6 4,97 (d, J = 4,9 Hz, 1H), 3,73 (m ocultado, 1H), 3,71 (s Hz, 3H). MS ESI (pos.) m/z: 575,8 (M+H)+. SfC: colum de MeOH (solo), 35% de co-disolvente a 130 g/min. Te
Ejemplo 598.0: Preparación de (1S,2S)-1-(5-cloropiri 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipir sulfonamida.
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida Ejemplo 597.0. El compuesto del título era el ritas en el Ejemplo 596.0. 1H RMN (500 MHz, CDCh) 5 ), 6,7 (dd, J = 7,8, 1,5Hz, 1H), 6,6 (d, J = 8,6 Hz, 2H), , 3,69 (s, 3H), 3,34 (s, 3H), 3,16 (s, 3H), 1,39 (d, J = 7,1 250x 30 mm Cc4 usando 88 g/min de CO2 y 42 g/min tura 39°C, presión 100 bar, longitud de onda 297 nm.
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida o (1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-etoxipropano-2-sulfonamida o (1 R,2 R)-1 -(5--il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-2-sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il)-N-(4-( 1 -metoxipropano-2-sulfonamida o (1 R,2S)-1 -(5-cloropiri 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropanotercer pico en eluir por SFC usando las condiciones des (s, 2H), 7,58-7,64 (m, 2H), 7,32 (dd, J = 8,4, 8,4 Hz, 1H) = 6,4 Hz, 1H), 3,79 (m ocultado, 1H), 3,77 (s, 3H), 3,69 MS ESI (pos.) m/z: 575,9 (M+H)+. Condiciones de sepa g/min de CO2 y 42 g/min de MeOH (solo), 35% de colongitud de onda 297 nm.
Ejemplo 599.0: Preparación de (1S,2S)-1-(5-cloropiri 1.2.4- triazol-3-il)-1 -metoxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -metoxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipir sulfonamida.
etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropanometoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)--2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida Ejemplo 598.0. El compuesto del título era el en el Ejemplo 596.0. 1H RMN (500 MHz, CDCb) 58,75 (dd, J = 7,6, 1,2 Hz, 1H), 6,59-6,62 (m, 2H), 4,78 (d, J H), 3,26 (s, 3H), 3,17 (s, 3H), 1,25 (d, J = 7,1 Hz, 3H). n preparativa columna de 250x 30 mm CC4 usando 88 ente a 130 g/min. Temperatura 39°C, presión 100 bar,
-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida o (1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-etoxipropano-2-sulfonamida o (1 R,2 R)-1 -(5--il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-2-sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il)-N-(4-( 1 -metoxipropano-2-sulfonamida o (1 R,2S)-1 -(5-cloropir 1 ,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida o metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano cuarto pico en eluir por SFC usando las condiciones 8,75 (s, 2H), 7,58-7,63 (m, 2H), 7,32 (dd, J =8 ,6 , 8,6 H (d, J = 6,4 Hz, 1H), 3,76 (m ocultado, 1H), 3,77 (s, 3H) 3H). MS ESI (pos.) m/z: 575,9 (M+H)+. Condiciones de 88 g/min de CO2 y 42 g/min de MeOH (solo), 35% de c longitud de onda 297 nm.
Ejemplo 600.0: Preparación de (1 R,2S)-N-(4-(2,6 metilpirazin-2-il)propano-2-sulfonamida y (1 S,2S)-N-(4 1 -(5-metilpirazin-2-il)propano-2-sulfonamida y (1 R,2R etoxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida y (1 il)-1 -etoxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida.
etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-metoxipropanoimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)--2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida Ejemplo 599.0. El compuesto del título era el tas en el Ejemplo 596.0. 1H RMN (500 MHz, CDCh) 5 ), 6,7 (dd, J = 7,6, 1,5 Hz, 1H), 6,59-6,62 (m, 2H), 4,78 (s, 3H), 3,25 (s, 3H), 3,17 (s, 3H), 1,25 (d, J = 7,1 Hz, ación preparativa columna de 250x 30 mm CC4 usando lvente a 130 g/min. Temperatura 39°C, presión 100 bar,
toxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxi--(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-t sulfonamida y (1S,2S)-N-(4-(2,6-dimetoxifenil)-il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6 metilpirazin-2-il)propano-2-sulfonamida y (1 S,2R)-N-(4 1-(5-metilpirazin-2-il)propano-2-sulfonamida, Ejemplo 6 A usando 1.0, 564.3 e hidrazida nicotínica. La reacció C8 , 30 x 250 mm, 5 pm, gradiente de agua/ACN al 10-9 Las fracciones deseadas se combinaron y se liofilizaron l-3-il)-1 -etoxi-1 -(5-metilpirazin-2-il)propano-2-idin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxi-1-(5-metilpirazin-2-toxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-imetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxi-El compuesto del título se preparó siguiendo el Ejemplo urificó por HPLC de fase inversa (columna Agilent SB-lo largo de 25 min, con TFA al 0,1%, caudal 50 ml/min). dar el producto puro.
Ejemplo 601.0: Preparación de (1S,2R)-N-(4-(2,6-dimet 2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-(4-(2,6 metil-2-pirazinil)-2-propanosulfonamida.
nil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-etoxi-1-(5-metiltoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-
Se llevó a cabo la separación quiral final usando SFC.
mm, 5 pm) Fase móvil: 60:40 (CO2: MeOH); caudal: 70
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tri propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimeto pirazinil)-2-propanosulfonamida Ejemplo 601.0. El com las condiciones descritas antes. 1H RMN (500 MHz, CD 1H), 7,75 (ddd, J = 8,1, 1,2, 1,2 Hz, 1H), 7,39 (dd, J = 8, 5,13 (d, J = 3,2 Hz, 1H), 3,73 (s, 3H), 3,71 (s, 3H), 3,47-J = 7,1, 7,1 Hz, 3H). mS ESI (pos.) m/z: 540,0 (M+H)+.
mm, 5 pm) Fase móvil: 60:40 (CO2: MeOH); caudal: 70
Ejemplo 602.0: Preparación de (1S,2R)-N-(4-(2,6-dimet 2-pirazinil)-2-propanosulfonamida o (1 R,2S)-N-(4-(2,6 metil-2-pirazinil)-2-propanosulfonamida.
o SFC preparativo: Columna: Chiralcel OX-H (250 x 21 ; 220 nm; 200 bar de presión de entrada.
3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-l)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-del título era el primer pico en eluir por SFC usando 11,19 (br s, 1H), 8,62 (brs, 2H), 8,54 (s, 1H), 8,42 (s, Hz, 1H), 7,28 (m ocultado, 1H), 6,6 (d, J = 8,6 Hz, 2H), (m, 3H), 2,57 (s, 3H), 1,27 (d, J = 7,1 Hz, 3H), 1,14 (dd, o SFC preparativo: Columna: Chiralcel OX-H (250 x 21 ; pico 1.
nil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-etoxi-1-(5-metiltoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tri propanosulfonamida o (1 R,2S)-N-(4-(2,6-dimeto pirazinil)-2-propanosulfonamida Ejemplo 602.0. El comp las condiciones descritas en el Ejemplo 601.0. 1H RMN 1H), 8,41 (s, 1H), 7,75 (d, J = 7,9 Hz, 1H), 7,39 (dd, J = (d, J = 8,6 Hz, 2H), 5,13 (d, J = 3,2 Hz, 1H), 3,73 (s, 3 6,8 Hz, 3H), 1,14 (dd, J = 7,0, 7,0 Hz, 3H). MS ESI (p Chiralcel oX-H (250 x 21 mm, 5 pm) Fase móvil: 60:40 (
Ejemplo 603.0: Preparación de (1S,2S)-1-(5-cloro triazol-3-il)-1 -etoxipropano-2-sulfonamida y (1 R,2S)-1 -(5 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida y (1 S,2 il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida
(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-sulfon 3-il)-1 -etoxi-1 -(5-metil-2-pirazinil)-2-l)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-del título era el segundo pico en eluir por SFC usando MHz, CDCb) 511,22 (br s, 1H), 8,62 (brs, 2H), 8,54 (s, 8,6 Hz, 1H), 7,28 (dd ocultado, J = 5,9, 5,9 Hz, 1H), 6,6 1 (s, 3H), 3,47-3,59 (m, 3H), 2,57 (s, 3H), 1,27 (d, J = /z: 540,0 (M+H)+. Método SFC preparativo: Columna: MeOH); caudal: 70 ml/min.
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-pirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-R,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-.
(1 S,2R)-1 -(5-cloropirimidin-2-il)-1 -etoxipropano-2-sulfon sulfonamida y (1S,2S)-1-(5-cloropirimidin-2-il)-1-etoxi etoxipropano-2-sulfonamida, Ejemplo 603.1. A -78eC, s en 2-metiltetrahidrofurano (75 ml) que contenía 1-(5-c sulfonamida (preparada siguiendo el Ejemplo C usando resultante se agitó durante 5 min a -78°C y después mmol). Después de 45 min de agitar, el análisis de LC una solución saturada de NH4Cl a -78°C y la reacción agua, se lavó con salmuera, se secó sobre sulfato só eluyendo con un gradiente de hexanos/EtOAc (0-100% a vacío. El residuo después se disolvió en anisol (2 ml) a TA durante la noche, la reacción se concentró hasta gradiente por pasos de MeOH en DCM (0-20%). Las fra a vacío. MS ESI (pos.) m/z: 280,1 (M+h)+.
a y (1 R,2R)-1 -(5-cloropirimidin-2-il)-1 -etoxipropano-2-no-2-sulfonamida y (1R,2S)-1-(5-cloropirimidin-2-il)-1-dió KHMDS (1,0 M, 5,39 ml, 5,39 mmol) a una solución irimidin-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2-dehido adecuado y 12.0 (2,41 g, 4,90 mmol)). La mezcla ñadió trifluorometanosulfonato de etilo (0,635 ml, 4,90 dicaba que la reacción se había completado. Se añadió lentó a TA La reacción después se repartió en EtOAc y se concentró a vacío. La reacción se purificó en sílice fracciones deseadas se combinaron y se concentraron M (10 ml) y se trató con TFA (10 ml). Después de agitar uedad. El residuo se purificó en sílice eluyendo con un es deseadas después se combinaron y se concentraron
(1 S,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida y (1 R,2S)-1 -(5-cloropirimidin-2-il) etoxipropano-2-sulfonamida y (1 S,2r)-1 -(5-cloropirimid 3-il)-1 -etoxipropano-2-sulfonamida y (1 R,2R)-1 -(5-clor triazol-3-il)-1-etoxipropano-2-sulfonamida, Ejemplo 603 nicotínica se obtuvo el producto deseado. La reacción s 30 x 250 mm, 5 pm, gradiente de agua/ACN al 10-95 Las fracciones deseadas se combinaron y se liofilizaron
E je m p lo 604.0: P re p a ra c ió n d e (1 S ,2 S )-1 -(5 - c lo ro tr ia z o l-3 - il) -1 -e to x ip ro p a n o -2 -s u lfo n a m id a o (1 S ,2 R )-1 -(5 1 ,2 ,4 - tr ia z o l-3 - il) -1 - e to x ip ro p a n o -2 -s u lfo n a m id a o (1 R,2 idin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2--(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazolidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-iguiendo el Ejemplo A usando 1.0, 603.1 e hidrazida rificó por HPLC de fase inversa (columna Agilent SB-C8 , o largo de 25 min, con TFA al 0,1%, caudal 50 ml/min).
dar el producto puro.
id in -2 - i l) -N -(4 -(2 ,6 -d im e to x ife n il) - 5 -(p ir id in -3 - i l) -4 H -1 ,2 ,4 -o p ir im id in -2 - i l) -N -(4 -(2 ,6 -d im e to x ife n il) -5 -(p ir id in -3 - i l) -4 H -(5 -c lo ro p ir im id in -2 - i l) -N - (4 - (2 ,6 -d im e to x ife n il) -5 - (p ir id in -3 -
il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida.
Se llevó a cabo la separación quiral final usando SFC. (10 um); 85%CO2/15% MeOH; 70 ml/min; 220 nm. Eta 3: OX-H; 40% MeOH/60%CO2; 70 ml/min.; 220 nm.
(1 S,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il) etoxipropano-2-sulfonamida o (1 R,2r)-1 -(5-cloropirimid 3-il)-1-etoxipropano-2-sulfonamida Ejemplo 604.0, El c SFC usando las condiciones descritas antes. 1H RMN ocultado, J = 5,8, 1,9 Hz, 1H), 8,61 (s, 1H), 7,73 (ddd, 7,28 (m ocultado, 1H), 6,60 (dd, J = 8,8, 8,8 Hz, 2H), 5, (s, 3H), 3,45-3,56 (m, 2H), 1,44 (d, J = 6,8 Hz, 3H), 1,1 Métodos de purificación por SFC en 3 etapas: Etapa 1: 2: AD-H; 25% MeOH/75%CO2; 70 ml/min.; 220 nm. Eta
Ejemplo 605.0: Preparación de (1R,2S)-1-(5-cloro-2-piri 3-il)-1-etoxi-2-propanosulfonamida.
dos de purificación por SFC en 3 etapas: Etapa 1: AS D-H; 25% MeOH/75%CO2; 70 ml/min.; 220 nm. Etapa
din-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazolesto del título era el primer pico (etapa 1) en eluir por MHz, CDCh) 5 11,17 (br s, 1H), 8,70 (s, 2h ), 8,62 (dd , 1,9, 1,9 Hz, 1H), 7,39 (dd, J = 8,4, 8,4 Hz, 1H), 7,26 = 5,9 Hz, 1H), 3,78 (m ocultado, 1H), 3,75 (s, 3H), 3,70 J = 7,0, 7,0 Hz, 3H). MS ESI (pos.) m/z: 560,9 (M+H)+.
0 um); 85%CO2\15% MeOH; 70 ml/min; 220 nm. Etapa X-H; 40% MeOH/60%CO2; 70 ml/min.; 220 nm.
il)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida, Ejemplo 605.0. El compuesto del las condiciones descritas en el Ejemplo 604.0. 1H RMN 2H), 7,75 (ddd, J = 8,1, 1,8, 1,8 Hz, 1H), 7,39 (dd, J = Hz, 2H), 5,0 (d, J = 5,9 Hz, 1H), 3,78 (m ocultado, 1H), Hz, 3H), 1,14 (dd, J = 7,0, 7,0 Hz, 3H). MS ESI (pos. etapas: Etapa 1: As (10 um); 85%CO2\15% MeOH; 7 ml/min.; 220 nm. Etapa 3: OX-H; 40% MeOH/60%CO2;
Ejemplo 606.0: Preparación de (1S,2S)-1-(5-cloro triazol-3-il)-1 -etoxipropano-2-sulfonamida o (1 S,2R)-1 -( 1,2,4-triazol-3-il)-1-etoxipropano-2-sulfonamida o (1 R,2 il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida.
iridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-era el segundo pico (etapa 3) en eluir por SFC usando MHz, CDCh) 511,16 (br s 1H), 8,70 (s, 2H), 8,62 (br s, 6 Hz, 1H), 7,28 (m ocultado, 1H), 6,61 (dd, J = 8,7, 8,7 (s, 3H), 3,71 (s, 3H), 3,46-3,51 (m, 2H), 1,44 (d, J = 7,1 560,9 (M+h )+. Métodos de purificación por s Fc en 3 in; 220 nm. Etapa 2: AD-H; 25% MeOH/75%CO2; 70 min.; 220 nm.
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-pirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-
(1 S,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il) etoxipropano-2-sulfonamida o (1 R,2r)-1 -(5-cloropirimi 3-il)-1-etoxipropano-2-sulfonamida Ejemplo 606.0. El c SFC usando las condiciones descritas en el Ejemplo 6 2H), 8,62 (br s, 2H), 7,73 (ddd, J = 7,9, 1,8, 1,8 Hz, 1H) J = 8,3 Hz, 1H), 6,58 (d, J = 8,3 Hz, 1H), 4,84 (d, J = 3,50-3,56 (m, 1H), 3,38-3,44 (m, 1H), 1,38 (d, J = 6,8 560,9 (m+H)+. Métodos de purificación por SFC en 3 et 220 nm. Etapa 2: AD-H; 25% MeOH/75%CO2; 70 ml/mi 220 nm.
Ejemplo 607.0: Preparación de (1S,2S)-1-(5-clor triazol-3-il)-1 -etoxipropano-2-sulfonamida o (1 S,2R)-1 -( 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida o (1 R,2 il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida.
idin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2--(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -l)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazolesto del título era el primer pico (etapa 2) en eluir por 1H RMN (500 MHz, CDCl3) 5 11,78 (br s, 1H), 8,75 (s, (dd, J = 8,4, 8,4 Hz, 1H), 7,28 (m ocultado, 1H), 6,63 (d, , 1H), 3,80 (s, 3H), 7,38 (m ocultado, 1H), 3,69 (s, 3H), H), 1,09 (dd, J = 7,0, 7,0 Hz, 3H). MS ESI (pos.) m/z: : Etapa 1: AS (10 um); 85%c O2\15% MeOH; 70 ml/min; 0 nm. Etapa 3: OX-H; 40% MeOH/60%CO2; 70 ml/min.;
idin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-opirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-
(1 S,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il) etoxipropano-2-sulfonamida o (1 R,2R)-1 -(5-cloropirimi 3-il)-1-etoxipropano-2-sulfonamida Ejemplo 607.0. El c SFC usando las condiciones descritas en el Ejemplo 6 2H), 8,62 (br s, 2H), 7,74 (d, J = 8,1 Hz, 1H), 7,38 (dd, Hz, 1H), 6,58 (d, J = 8,3 Hz, 1H), 4,84 (d, J = 5,1 Hz, 1 (m, 1H), 3,38-3,44 (m, 1H), 1,38 (d, J = 7,1 Hz, 3H), 1,0 Métodos de purificación por SFC en 3 etapas: Etapa 1: din-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2--(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazolesto del título era el segundo pico (etapa 2) en eluir por 1H RMN (500 MHz, CDCh) 5 11,78 (br s, 1H), 8,75 (s, ,6, 8,6 Hz, 1H), 7,28 (m ocultado, 1H), 6,63 (d, J = 8,3 0 (s, 3H), 3,79 (m ocultado, 1H), 3,69 (s, 3H), 3,51 -3,56 , J = 7,0, 7,0 Hz, 3H). MS ESI (pos.) m/z: 560,9 (M+H)+.
10 um); 85%CO2\15% MeOH; 70 ml/min; 220 nm. Etapa
2: AD-H; 25% MeOH/75 %CO2; 70 ml/min.; 220 nm. Eta
Ejemplo 608.0: Preparación de (1S,2S)-1-(5-cloro 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida y
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2 OX-H; 40% MeOH/60%CO2; 70 ml/min.; 220 nm.
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-,2S)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-amida y (1 S,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-xipropano-2-sulfonamida y (1 R,2R)-1 -(5-cloropirimidinzol-3-il)-1-etoxipropano-2-sulfonamida.
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida y (1 R,2S)-1 -(5-cloropirimidin-2-il)-N-(4-( etoxipropano-2-sulfonamida y (1 S,2R)-1 -(5-cloropirimid triazol-3-il)-1 -etoxipropano-2-sulfonamida y (1 R,2R)-1 3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-sulfonamida, se obtuvo el producto deseado. El residuo se purific material se purificó más por HPLC de fase inversa ( agua/ACN al 10-95% a lo largo de 25 min, con TF combinaron y se liofilizaron para dar el producto puro.
Ejemplo 609.0: Preparación de (1S,2S)-1-(5-cloro 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida o
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -l)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-oropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinplo 608.0. Siguiendo el Ejemplo B usando 2.0 y 603.1 gel de sílice eluyendo con (DCM/MeOH al 0-20%). El na Agilent SB-C8 , 30 x 250 mm, 5 pm, gradiente de 0,1%, caudal 50 ml/min). Las fracciones deseadas se
din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-amida o (1 R,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-ipropano-2-sulfonamida.
Se llevó a cabo la separación quiral final usando SF preparativo, columna aquiral: Columna: Piridina (250 x MeOH, caudal: 70 ml/min, Temp. horno/columna: 40 preparativa, columna quiral: Chiralpak AD-H (250 x 21 rificación por SFC en 3 etapas: Etapa 1, Método SFC m, 5 pm), Fase móvil: 89:11 (A:B), A: CO2 Líquido, B: resión de salida: 100 bar. Etapa 2 Columna de SFC pm). Fase móvil: 76:24 (A:B), A: CO2 Líquido, B: EtOH,
caudal: 70 ml/min, Temp. horno/columna: 40 C, Presión Columna: Chiralcel OX-H (250 x 21 mm, 5 pm), Fas ml/min, Temp. horno/columna: 40 C, Presión de salida: (1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (1S,2R)-1-(5-cloropirimidin-2-il)-N-(4-( etoxipropano-2-sulfonamida o (1 R,2R)-1 -(5-cloropirimi triazol-3-il)-1-etoxipropano-2-sulfonamida. Ejemplo 609 condiciones descritas antes. 1H RMN (500 MHz, CDCl3 7,65 (s, 1H), 7,38 (dd, J = 8,4, 8,4 Hz, 1H), 6,60 (dd, J 1H), 3,76 (s, 3H), 3,71 (s, 3H), 3,45-3,56 (m, 2H), 2,30 ( MS ESI (pos.) m/z: 574,1 (M+H)+.
Ejemplo 610.0: Preparación de (1R,2S)-1-(5-cloro-1,2,4-triazol-3-il)-1 -etoxi-2-propanosulfonamida.
alida: 100 bar. Etapa 3 SFC preparativa, columna quiral, il: 65:35 (A:B), A: CO2 Líquido, B: MeOH, caudal: 70 ar.
etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-l compuesto del título se purificó por SFC usando las ,20 (s, 1H), 8,70 (s, 2H), 8,44 (brs, 1H), 8,32 (br s, 1H), , 8,4 Hz, 2H), 4,99 (d, J=5,9 Hz, 1H), 3,77 (m ocultado, , 1,43 (d, J = 7,1 Hz, 3H), 1,14 (dd, J = 7,0, 7,0 Hz, 3H).
midinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-propanosulfonamida Ejemplo 610.0. El compuesto del t el Ejemplo 609.0. 1H RMN (500 MHz, CDCla) 511,19 ( 7,38 (dd, J = 8,4, 8,4 Hz, 1H), 6,60 (dd, J = 8,4, 8,4 Hz, 3H), 3,71 (s, 3H), 3,45-3,556 (m, 2H), 2,30 (s, 3H), 1, (pos.) m/z: 574,1 (M+H)+.
Ejemplo 611.0: Preparación de (1S,2S)-1-(5-cloro 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida o
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)etil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-e purificó por SFC usando las condiciones descritas en H), 8,70 (s, 2H), 8,44 (s, 1H), 8,32 (s, 1H), 7,64 (s, 1H), 4,99 (d, J = 5,9 Hz, 1H), 3,77 (m ocultado, 1H), 3,75 (s, J = 6,8 Hz, 3H), 1,14 (dd, J = 7,0, 7,0Hz,3H). MS ESI
in-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-mida o (1 R,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-ipropano-2-sulfonamida.
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-sulfonamida o (1S,2R)-1-(5-cloropirimidin-2-il)-N-(4-( etoxipropano-2-sulfonamida o (1 R,2R)-1 -(5-cloropirimi triazol-3-il)-1-etoxipropano-2-sulfonamida Ejemplo 611. condiciones descritas en el Ejemplo 609.0. 1H RMN (5 s, 1H), 8,33 (br s, 1H), 7,62 (s, 1H), 7,38 (dd, J = 8,0, 4,84 (d, J = 5,4 Hz, 1H), 3,80 (s, 3H), 3,78 (m ocultado 2,30 (s, 3H), 1,37 (d, J = 7,1 Hz, 3H), 1,09 (t, J=6,9 Hz, etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-compuesto del título se purificó por SFC usando las z, CDCl3) 5 ppm11,78 (br s, 1H), 8,74 (s, 2H), 8,44 (br , 1H), 6,63 (d, J = 8,3 Hz, 1H), 6,58 (d, J = 7,7 Hz, 1H), 3,70 (s, 3H), 3,52 (m ocultado, 1H), 3,38-3,44 (m, 1H), S ESI (pos.) m/z: 574,2 (M+H)+.
Ejemplo 612.0: Preparación de (1S,2S)-1-(5-clorop 1,2,4-triazol-3-il)-1 -etoxipropano-2-sulfonamida o
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -etoxipropano-2-s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-amida o (1 R,2R)-1 -(5-cloropirimidin-2-il)-N-(4-(2,6-ipropano-2-sulfonamida.
(1S,2S)-1-(5-cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5 sulfonamida o (1 S,2R)-1 -(5-cloropirimidin-2-il)-N-(4-( etoxipropano-2-sulfonamida o (1 R,2R)-1-(5-cloropirimid triazol-3-il)-1-etoxipropano-2-sulfonamida Ejemplo 612. condiciones descritas en el Ejemplo 609.0. 1H RMN (5 1H), 8,33 (br s, 1H), 7,61 (s, 1H), 7,37 (dd, J = 8,1, 8,1 4,83 (d, J = 5,1 Hz, 1H), 3,79 (s, 3H), 3,77 (m ocultado, 2,30 (s, 3H), 1,36 (d, J = 7,1 Hz, 3H), 1,09 (dd, J = 7,0, 7
Ejemplo 613.0: Preparación de (1 S,2R)-N-(4-(2,6-di metilpirazin-2-il)propano-2-sulfonamida y (1 R,2S) hidroxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida.
etilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-etoxipropano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-compuesto del título se purificó por SFC usando las Hz, CDCl3) ó 11,82 (br s, 1H), 8,74 (s, 2H), 8,44 (br s, 1H), 6,62 (d, J = 8,2 Hz, 1H), 6,58 (d, J = 8,1 Hz, 1H), , 3,69 (s, 3H), 3,52 (m ocultado, 1H), 3,39 -3,43 (m, 1H), z, 3H). MS ESI (pos.) m/z: 574,1 (M+H)+.
xifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5 -(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-t sulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-il)propano-2-sulfonamida, Ejemplo 6l3.0. Siguiendo el sin mayoritarios) y hidrazida nicotínica se obtuvo el pro protector TBS se llevó a cabo como sigue. A 23°C, s contenía el correspondiente alcohol protegido con TB 23°C. El material después se concentró y se purificó p mm, 5 pm, gradiente de agua/ACN al 10-95% a lo l fracciones deseadas se combinaron y se liofilizaron para
Ejemplo 614.0: Preparación de (IS,2R)-N-(4-(2,6-dimeto 2 -pirazinil)-2 -propanosulfonamida.
l-3-il)-1 -hidroxi-1 -(5-metilpirazin-2-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirazin-2-plo A usando 1.0, 567.2 (se usaron los diastereómeros protegido con TBS deseado. La eliminación del grupo dió TBAF (3 eq.) a una solución en THF (0,5 M) que eq.). La mezcla resultante se agitó durante la noche a PLC de fase inversa (columna Agilent SB-C8 , 30 x 250 de 25 min, con TFA al 0,1%, caudal 50 ml/min). Las el producto puro.
Se llevó a cabo la separación quiral final usando SFC.
179 Bar, 270-nm.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tri propanosulfonamida Ejemplo 614.0. El compuesto d condiciones descritas antes. 1H RMN (500 m Hz, CDCh) 8,03 (d, J=7,9Hz, 1H), 7,54-7,48 (m, 2H), 6,75 (d, J = 8, 3,77 (m ocultado, 1H), 3,76 (s, 3H), 2,62 (s, 3H), 1,15 ( SFC: 25% MeOH, AD-H (250x20 mm d.i.), 70 ml/min, 1
Ejemplo 615.0: Preparación de (1 R,2S)-N-(4-(2,6-d metil-2-pirazinil)-2-propanosulfonamida.
o SFC: 25% MeOH, AD-H (250x20 mm d.i.), 70 ml/min,
3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-lo era el primer pico en eluir por SFC usando las ,13 (br s, 1 H), 8,72 (m, 2 H), 8,69 (s, 1 H), 8,48 (s, 1 H), 1H), 6,66 (d, J = 8,2 Hz, 1H), 5,56 (s, 1H), 3,87 (s, 3H), 7,0 Hz, 3H). MS ESI (pos.) m/z: 512,2 (M+H)+. Método r, 270 nm.
xifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-tri propanosulfonamida Ejemplo 615.0. El compuesto de condiciones descritas en el Ejemplo 614.0. 1H RMN (5 8,72-8,74 (m, 1H), 8,70 (br s, 1H), 8,52 (brs, 1H), 8,08 (dd, J= 8,4, 8,4 Hz, 1H), 6,75 (d, J=8,3, 1H), 6,67 (d ocultado, 1H), 3,76 (s, 3H), 2,63 (s, 3H), 1,15 (d, J = 6 25% MeOH, AD-H (250x20 mm d.i.), 70 ml/min, 179 Bar
Ejemplo 616.0: Preparación de (1 R,2S)-N-(4-(2,6-di metilpirimidin-2-il)propano-2-sulfonamida.
3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-lo era el segundo pico en eluir por SFC usando las Hz, CDCh) 5 11,14 (br s, 1H), 8,75 (d, J =1,5 Hz, 1H), = 8,1, 1,7 Hz, 1H), 7,57 (dd, J = 6,7, 6,7 Hz, 1H), 7,51 8 ,6 , 0,7 Hz, 1H), 5,56 (s, 1H), 3,88 (s, 3H), 3,78 (m , 3H). MS ESI (pos.) m/z: 512,2 (M+H)+. Método SFC: nm.
xifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-t sulfonamida, Ejemplo 616.0. En un vial que contenía (1 (0,188 g, 0,81 mmol), 3-(5-bromo-4-(2,6-dimetoxifenil)-cobre(I) (0,076 g, 0,40 mmol), carbonato de cesio (0,62 (0,244 ml, 1,55 mmol) se añadió 1,4-dioxano anhidro, solución de la reacción. Después de 15 min, la solución previamente calentada a 80°C. Después de 17 h, El an reacción después se enfrió a TA y después se añadió Después de extraer tres veces con DCM, las capas or magnésico anhidro y se concentraron a vacío. La r l-3-il)-1 -hidroxi-1 -(5-metilpirimidin-2-il)propano-2--1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida 2,4-triazol-3-il)piridina (0,352 g, 0,98 mmol), yoduro de 1,90 mmol), y trans-N,N'-dimetil-1,2-ciclohexanodiamina asificado (1,63 ml). Se burbujeó argón a través de la rogénea azul oscuro se calentó en una placa agitadora de LCMS muestra la reacción se había completado. La cuidado una solución de tiosulfato sódico a la mezcla. as se combinaron y después se secaron sobre sulfato ión se purificó por HPLC de fase inversa (columna
Phenomenex Gemini-C18, 30 x 250 mm, 10 gm, gradie 0,1%, caudal 50 ml/min). Las fracciones deseadas se c (500 MHz, CDCta) 58,66 (dd, J = 5,0, 1,6 Hz, 1H), 8,6 2H), 7,42 (dd, J=8,4, 8,4 Hz, 1H), 6,67 (d, J = 8,4 Hz, 1 3,78 (s, 3H), 3,74 (s, 3H), 2,34 (s, 3H), 1,19 (d, J = 6,8
Ejemplo 617.0: Preparación de (1R,2R)-1-isopropoxi isopropoxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamid e agua/ACN al 10-95% a lo largo de 25 min, con TFA al aron y se liofilizaron para dar el producto puro. 1H RMN , J = 2,2, 0,7 Hz, 1H), 8,61 (s, 2H), 7,95 (d, J = 8,1 Hz, ,62 (d, J = 8,4 Hz, 1H), 5,57 (s, 1H), 3,84-3,89 (m, 1H), ). MS ESI (pos.) m/z: 511,9 (M+H)+.
-metilpirimidin-2-il)propano-2-sulfonamida y (1S,2S)-1-
(1 R,2R)-1 -(5-metilpirimidin-2-il)propano-1,2-diol y (1 S,2 de (E)-5-metil-2-(prop-1-en-1-il)pirimidina (5,68 g, 42.3 acetona (60 ml) y agua (6 ml) se añadió tetraóxido d reacción se agitó a TA en atmósfera de N2 durante 19 Varian Chem-Elut para separar agua y se concentró a v DCM, se secó (Na2SO4) y se concentró a vacío. El resi Biotage 100 g, MeOH/DCM al 0-10%) para dar el rendimiento) en forma de un sólido marrón claro. LCMS(5-metilpirimidin-2-il)propano-1,2-diol. A una disolución ol) y 4-metilmorfolina-4-óxido (7,44 g, 63,5 mmol) en io (4% en peso, en agua, 0,673 ml, 0,110 mmol). La mezcla de reacción después se pasó por un cartucho Todavía había agua presente, el residuo se disolvió en se purificó por cromatografía ultrarrápida (ultra columna uesto del título 617.1 (5,1 g, 30,3 mmol, 71,6% de (POS.) m/z: 169,1 (M+H)+.
5-metil-2-(2R,3R)-3-metiloxiran-2-il)pirimidina y 5-metil-617.1 (5,1 g, 30,3 mmol) y DCM (100 ml) con un b trimetoxietano (7,72 ml, 60,6 mmol), seguido de clorotri min. Después de 6,5 h, se añadieron 1,1,1-trimetoxieta se agitó durante 17 h adicionales y el análisis de LCM 1,1,1-trimetoxietano (3 ml) y clorotrimetilsilano (3 ml) y s El residuo se recogió en MeOH (80 ml) y se trató con durante 2 h, los sólidos formados se separaron por filtr por cromatografía ultrarrápida en columna (ultra colum (3,35 g, 22,3 mmol, 74% de rendimiento) en forma de 151.2 (M+H)+.
,3S)-3-metiloxiran-2-il)pirimidina. A una disolución de de agua a TA para el enfriamiento, se añadió 1,1,1-ilano (7,70 ml, 60,6 mmol) gota a gota a lo largo de 10 ml) y clorotrimetilsilano (5 ml) adicionales. La reacción tró ~78% de conversión. La reacción se trató con más tó durante otras 24 h. La reacción se concentró a vacío. nato de potasio (8,38 g, 60,6 mmol). Después de agitar y el filtrado se concentró a vacío. El residuo se purificó tage 100 g, EtOAc/hexanos al 0-100%) para dar 617.2 eite amarillo claro transparente. LCMS-ESI (POS.) m/z:
(1 R,2S)-1 -isopropoxi-1 -(5-metilpirimidin-2-il)propan-2-ol En un matraz que contenía una disolución de 617.2 atmósfera de N2 se añadió BF3-OEt2 (0,054 ml, 0,43 m calentó a TA y después se calentó a 40°C con agitac completa a la relación ~3:2 de productos que correspon polar el producto 1-isopropoxi deseado como se muestr cargó sobre un tapón de gel de sílice con DCM, y se pur g, EtOAc:EtOH 3:1/hexano al 5-80%). El producto
rendimiento) se aisló como un sólido blanco pegajoso. L (1 S,2R)-1 -isopropoxi-1 -(5-metilpirimidin-2-il)propan-2-ol. mg, 0,85 mmol) en DCM/iPrOH (1/1, 2 ml) a 0°C en Después de agitar durante 45 min a 0°C, la reacción se urante 18 h. El análisis de LCMS muestra conversión la masa de los productos deseados siendo el pico más reacción se dejó enfriar a TA, se concentró a vacío y se por cromatografía ultrarrápida (ultra columna Biotage 50 olar, mayoritario 617.3 (83 mg, 0,40 mmol, 46% de -ESI (POS.) m/z: 211,1 (M+H)+.
2-(((1 R,2R)-1 -isopropoxi-1 -(5-metilpirimidin-2-il)propan-2-il) 2-il)propan-2-il)tio)benzo[d]tiazol. En un matraz que cont atmósfera de N2 a 0°C se añadió azodicarboxilato de dieti mezcla de reacción se agitó durante 10 min y después reacción se agitó durante otros 10 min. Se añadió benzo[d calentar a TA con agitación durante 16 h. La reacción se por cromatografía en columna ultrarrápida (Biotage 50 g mmol, 61% de rendimiento) en forma de un aceite incoloro nzo[d]tiazol y 2-(((1 S,2S)-1 -isopropoxi-1 -(5-metilpirimidinifenilfosfina (160 mg, 0,61 mmol) en tolueno (0,8 ml) en lución al 40% en peso en tolueno, 270 pl, 0,59 mmol). La adió 617.3 (83 mg, 0,40 mmol) en tolueno (0,8 ml) y la -2-tiol (99 mg, 0,59 mmol), y la mezcla de reacción se dejó directamente sobre un tapón de gel de sílice y se purificó EtOAc:hexanos al 0-35%) para dar 617.4 (87 mg, 0,242 parente. LCMS-ESI (POS.) m/z: 360,2 (M+H)+.
2-(((1 R,2R)-1 -isopropoxi-1 -(5-metilpirimidin-2-il)propan-2-il) metilpirimidin-2-il)propan-2 -il)sulfonil)benzo[d]tiazol. Una di trató con ácido 3-cloroperoxibenzoico (77% máx., 1,54 durante 1 h antes de retirar el baño de enfriamiento. Desp solución acuosa saturada de bisulfito sódico (12 ml) y u después la mezcla de reacción se agitó durante 10 min.
y las capas orgánicas combinadas, se lavaron con soluci secaron (Na2SO4) y se concentraron a vacío para dar ultrarrápida (Biotage100 g ultra, EtOAc:EtOH 3:1/hexano forma de una espuma blanca. LCMS-ESI (POS.) M/Z: 392,
il)benzo[d]tiazol y 2-(((1 S,2S)-1 -isopropoxi-1 -(5-ón de 617.4 (1,1 g, 3,1 mmol) en DCM (9,5 ml) a 0°C se mmol). La mezcla de reacción después se agitó a 0°C e agitar a TA durante 18 h, la reacción se inactivó con una lución acuosa saturada de bicarbonato sódico (10 ml), y s el producto de reacción se extrajo con EtOAc (2x40 ml) uosa saturada de NaHCO3 (10 ml), salmuera (10 ml), se lido blanco pegajoso. La purificación por cromatografía 0%) dio 617.5 (0,81 g, 2,1 mmol, 68% de rendimiento) en
(1 R,2R)-1 -isopropoxi-1 -(5-metilpirimidin-2-il)propano-2-il)propano-2-sulfonamida y (1S,2R)-1-isopropoxi-1-isopropoxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamid metilpirimidin-2-il)propan-2-il)sulfonil)benzo[d]tiazol y il)sulfonil)benzo[d]tiazol (0,85 g, 2,17 mmol) en MeOH mmol). La mezcla de reacción después se agitó a 0°C TA durante la noche con agitación. La mezcla de reacc (15 ml), seguido de la adición de ácido (aminooxi)sulfó mmol). La mezcla de reacción después se agitó a TA producto deseado como dos picos con relación 1:1. L capas orgánicas combinadas se secaron sobre Na2SO4 por cromatografía en columna (ultra columna Biotage 5 1,93 mmol, 89% de rendimiento) en forma de un aceit pero con epimerización completa. LCMS ESI (POS.) m/
Los compuestos expuestos en la siguiente tabla se s usando el material de partida conocido como se describ amida y (1 S,2S)-1 -isopropoxi-1 -(5-metilpirimidin-2-tilpirimidin-2-il)propano-2-sulfonamida y (1R,2S)-1-na disolución de 2-(((1R,2R)-1-isopropoxi-1-(5--(((1 S,2S)-1 -isopropoxi-1 -(5-metilpirimidin-2-il)propan-2-l) a 0°C se trató con carbonato de potasio (0,6 g, 4,34 ósfera de N2 y después se dejó calentar lentamente a concentró a vacío, y el residuo se suspendió en agua ,491 g, 4,34 mmol) y acetato de potasio (0,213 g, 2,17 te 2 h. El análisis de LC/MS indicaba la formación del zcla resultante se extrajo con EtOAc (3 x 50 ml). Las ltraron, y se concentraron a vacío. El residuo se purificó eOH en DCM al 2-6%) para proporcionar 617.0 (0,53 g, loro. El análisis por RMN mostró el producto deseado, ,2 (M+H)+.
aron siguiendo el procedimiento en el Ejemplo 205.0
Ta 15
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Tabla 16
aron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 622.0: Preparación de (2R,3S)-N-(4-(2,6-metilpirimidin-2 -il)butano-2 -sulfonamida.
(2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida, Ejemplo 622.0. Un vial que contenía (2 1,51 mmol), 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-cobre(II) (289 mg, 0,80 mmol), trans-N,N'-dimetil-1,2-potasio (540 mg, 3,91 mmol) se desgasificó y despu anhidro (3,0 ml) a la mezcla y la solución homogéne previamente calentada a 80°C y se siguió por LC-MS. diluyó con agua. Se añadió con cuidado una solución a ajustar el pH a pH ~7. Después de extraer cuatro veces lavó una vez con solución acuosa de tiosulfato sódi magnésico anhidro, filtración, y concentración a vacío, sílice (EtOAc: EtOH 3:1 en heptanos al 0-70%) para da la (2R,3S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiri sulfonamida (306 mg). 1H RMN (500 MHz, DMSO-d6) 5 8,19 (d, J=2,0 Hz, 1H), 7,62 (dt, J=0,9, 2,1 Hz, 1H), 7,5 - 3,57 (m, 1H), 2,25 (s, 3H), 2,23 (s, 3H), 1,24 (d, J (M+H)+.
Ejemplo 623.0: Preparación de (1R,2S)-1-(2-ciano-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida y
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propan dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida (346 mg, l-3-il)-5-metilpiridina (749 mg, 2,00 mmol), triflato de exanodiamina (0,48 ml, 3,04 mmol), y carbonato de volvió a llenar con nitrógeno. Se añadió 1,4-dioxano l oscuro después se calentó en una placa agitadora ués de 21 h, la reacción se enfrió a TA y después se de HCl 1 N a la solución homogénea azul oscuro para DCM, las capas orgánicas se combinaron y después se M. Después de secar la capa orgánica sobre sulfato siduo azul-verde se cargó en una columna de gel de ólido blanco. El sólido se recristalizó en EtOH para dar -il)-4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-,36 (s, 1H), 8,62 - 8,56 (m, 2H), 8,47 (d, J=1,5 Hz, 1H), 5 (m, 1H), 6,87 - 6,78 (m, 2H), 3,71 - 3,63 (m, 7H), 3,63 z, 3H), 1,10 (d, J=6,8 Hz, 3H). MS (pos.) m/z: 524,3
rofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-R)-1 -(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-namida o (1 S,2S)-1 -(2-ciano-4-fluorofenil)-N-(4-(2,6-oxi-2-propanosulfonamida y (1 R,2R)-1 -(2-ciano-4-2,4-triazol-3-il)-1-metoxi-2-propanosulfonamida.
(1 R,2R)-1 -(2-bromo-4-fluorofenil)-1 -hidroxi-N,N-bis(4-m fluorofenil)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-N,N-bis(4-metoxibencil)propano-2-sulfonamida y metoxibencil)propano-2-sulfonamida, Ejemplo 623.1.
encil)propano-2-sulfonamida y (1 R,2S)-1 -(2-bromo-4-amida y (1 S,2R)-1 -(2-bromo-4-fluorofenil)-1 -hidroxi-(1 S,2S)-1 -(2-bromo-4-fluorofenil)-1 -hidroxi-N,N-bis(4-,N-bis(4-metoxibencil)etanosulfonamida (14,3 g, 40,9
mmol) se destiló azeotrópicamente con tolueno. Se añ gota a gota n-Butil-litio (2,5 M en hexanos, 18,01 ml, 4 gota a gota una disolución de 2-bromo-4-fluorobenzalde (40,0 ml) a lo largo de un periodo de 15 min. La mezcl baño de enfriamiento y se continuó agitando durante inactivó con una solución saturada de NH4Cl (200 ml) y ml) y se separaron las capas. La mezcla se extrajo más se secaron sobre Na2SO4, se filtraron y se concentraron 330 g, gradiente de elución con EtOAc/hexanos al 0-N,N-bis(4-metoxibencil)propano-2-sulfonamida (19,6 g, ESI (POS.) M/Z: 574,0 (M+Na)+.
THF (160 ml) y la mezcla se enfrió a -782C. Se inyectó mol), y la mezcla se agitó durante 15 min. Se inyectó (de Oakwood Products, Inc., 9,97 g, 49,1 mmol) en THF mantuvo a -78°C durante 30 min y después se retiró el a mezcla de reacción se volvió a enfriar a -78°C y se macenó a -18°C durante la noche. Se añadió DCM (200 DCM (3 x 50 ml) y las capas orgánicas se combinaron, cío . La purificación en una columna de gel de sílice de proporcionó 623.1, 1-(2-bromo-4-fluorofenil)-1-hidroximmol, 87% de rendimiento) como sólido blanco. LCMS-
(1 R,2S)-1 -(2-bromo-4-fluorofenil)-1 -metoxi-N,N-bis(4-me fluorofenil)-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-s N,N-bis(4-metoxibencil)propano-2-sulfonamida y metoxibencil)propano-2-sulfonamida, Ejemplo 623.2. E (5,06 g, 9,16 mmol) en 2-metiltetrahidrofurano (50 ml). THF (1,0 M, 10,08 ml, 10.08 mmol) en atmósfera de a -78°C durante 15 min. Después se añadió gota a atmósfera de N2 a - 78°C con agitación. La mezcla de de hielo seco-acetona se retiró. La reacción se dejó agit se inactivó con una solución acuosa saturada de NH4Cl (2 x 100 ml). El extracto orgánico se secó sobre Na2S material inicial en forma de un sólido amarillo claro. El sílice y se purificó por cromatografía a través de una c eluyendo con un gradiente de EtOAc en DCM al 0-30% N,N-bis(4-metoxibencil)propano-2-sulfonamida (4,75 g, ESI (POS.) m/z: 588,0 (M+Na)+.
encil)propano-2-sulfonamida y (1 S,2R)-1 -(2-bromo-4-amida y (1 S,2S)-1 -(2-bromo-4-fluorofenil)-1 -metoxi-(1 R,2R)-1 -(2-bromo-4-fluorofenil)-1 -metoxi-N,N-bis(4-matraz de fondo redondo de 500 ml se añadió 623.1 inyectó gota a gota bis(trimetilsilil)amida de potasio en -78°C con agitación. La mezcla de reacción se agitó yodometano (estabilizado, 0,626 ml, 10,08 mmol) en ión se agitó a -78°C durante 15 min y después el baño TA y se siguió por LCMS. Después de 2,5 h, la reacción l) y se diluyó con agua (100 ml) y se extrajo con EtOAc a solución se filtró y se concentró a vacío para dar el rial así obtenido se absorbió sobre un tapón de gel de na de gel de sílice preempaquetada Redi-Sep (330 g), a proporcionar 623.2 1-(2-bromo-4-fluorofenil)-1-metoximmol, 92% de rendimiento) como sólido blanco. LCMS-
(1 R,2R)-1-(2-ciano-4-fluorofenil)-1-metoxi-N,N-bis(4-met fluorofenil)-1 -metoxi-N,N-bis(4-metoxibencil)propano-2-s bis(4-metoxibencil)propano-2-sulfonamida y
metoxibencil)propano-2-sulfonamida, Ejemplo 623.3. Un mmol), cianuro de cinc (0,466 g, 3,97 mmol) y DM tetrakis(trifenilfosfina)paladio (0,61 g, 0,53 mmol) y la después se calentó en atmósfera de nitrógeno a 100° después se diluyó con agua (150 ml) y EtOAc (150 ml). sobre Na2SO4, se filtró y se concentró. El material así o eluyendo con un gradiente de EtOAc en hexanos al 0 metoxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida (1 goma amarillo pálido. LCMS-eSi (POS.) m/z: 535,2 (M+N ncil)propano-2-sulfonamida y (1 R,2S)-1-(2-ciano-4-amida y (1 S,2R)-1 -(2-ciano-4-fluorofenil)-1 -metoxi-N,N-(1 S,2S)-1 -(2-ciano-4-fluorofenil)-1 -metoxi-N,N-bis(4-de 60 ml con septum se cargó con 623.2 (1,5 g, 2,65 7 ml). La mezcla se desgasificó con N2. Se añadió cla se desgasificó de nuevo. La mezcla de reacción urante 19 h. La mezcla de reacción se enfrió a TA y pa orgánica se lavó con salmuera (3 x 150 ml), se secó ido se absorbió sobre un tapón de gel de sílice (40 g), % para proporcionar 623.3; 1-(2-ciano-4-fluorofenil)-1-g, 2,63 mmol, 99% de rendimiento) en forma de una
(1 R,2R)-1-(2-ciano-4-fluorofenil)-1 -metoxipropano-2-sulfo metoxipropano-2-sulfonamida y (1S,2R)-1-(2-ciano-4-fl ciano-4-fluorofenil)-1-metoxipropano-2-sulfonamida, Eje con anisol (anhidro, 1,15 ml, 10,53 mmol) y TFA (9,78 ml reacción se concentró a vacío. La mezcla se absorbió so a través de una columna de gel de sílice preempaqueta hexano al 0-100%, para proporcionar 623.4 (0,68 g, 2,4 LCMS-ESI (POS.) m/z: 295,1 (M+Na)+.
ida y (1 R,2S)-1 -(2-ciano-4-fluorofenil)-1 -fenil)-1-metoxipropano-2-sulfonamida y (1S,2S)-1-(2-623.4. El Ejemplo 623.3 (1,35 g, 2,63 mmol) se trató 2 mmol) a tA y se siguió por LCMS. Después de 4 h, la un tapón de gel de sílice y se purificó por cromatografía edi-Sep (40 g), eluyendo con un gradiente de EtOAc en ol, 95% de rendimiento) en forma de un sólido blanco.
(1 R,2S)-1 -(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil) propanosulfonamida y (1 S,2R)-1 -(2-ciano-4-fluorofenil) 3-il)-1 -metoxi-2-propanosulfonamida o (1 R,2R)-1 -(2-ci 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida y metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propan ciano-4-fluorofenil)-1-metoxipropano-2-sulfonamida (1 1,2,4-triazol-3-il)-5-metilpiridina (152 mg, 0,405 mmol) en rotavapor a 50°C. A la mezcla se añadió 1,4-dio (1R,2R)-(-)-N,N"-dimetilciclohexano-1,2-diamina (128 mezcla se añadió yoduro de cobre(I) (77 mg, 0,401 reacción se inactivó con una solución acuosa saturada sobre Na2SÜ4, se filtró y se concentró a vacío. El mate se purificó por cromatografía a través de una columna con un gradiente de MeOH en DCM al 0-100%, para se purificó por HPLC preparativa de fase inversa usand 0,1% en CH3CN/H2O, gradiente 5-95% a lo largo diastereómeros 623.0 en forma de un sólido blanqueci 1,55 (m, 3 H) 2,36 (s, 3 H) 3,14 (s, 3 H) 3,67 - 3,88 (m, J=8,61 Hz, 1 H) 7,10 (dd, J=9,00, 2,74 Hz, 1 H) 7,25 (t (t, J=8,61 Hz, 1 H) 7,87 (s, 1 H) 8,45 (br. s., 1 H) 8,55 (
Los compuestos expuestos en la siguiente tabla se sin el material de partida conocido como se describe.
metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazolfluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-S)-1 -(2-ciano-4-fluorofenil)-N-(4-(2,6-dimetoxifenil)-5-(5-amida, Ejemplo 623.0. Una mezcla de 623.4 1-(2-, 0,405 mmol) y 3-(5-bromo-4-(2,6-dimetoxifenil)-4H-stiló azeotrópicamente con tolueno en un vial de 40 ml 2,03 ml), carbonato de cesio (330 mg, 1,01 mmol) y 1 mmol). La reacción se desgasificó con argón. A la . La mezcla se calentó a 90°C durante la noche. La H4Cl (15 ml) y se extrajo con DCM (3 x 15 ml), se secó í obtenido se absorbió sobre un tapón de gel de sílice y l de sílice preempaquetada Redi-Sep (12 g), eluyendo cionar el producto inicial. La mezcla de diastereómeros n Capcell Pak C18 (UG1205 um, 30 x 250 mm), TFA al 35 min para proporcionar una pareja separada de mg, sal de TFA). 1H RMN (400 MHz, CD3CN) 51,38 -,31 (d, J=4,11 Hz, 1 H) 6,79 (d, J=8,41 Hz, 1 H) 6,82 (d, ,51, 2,74 Hz, 1 H) 7,44 (dd, J=8,41, 5,48 Hz, 1 H) 7,54 1 H). LCMS-ESI (POS.) M/Z: 567,2 (M+H)+.
on siguiendo el procedimiento en el Ejemplo B usando
Tabla 17
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Tabla 18
ron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 631.0: Preparación de (2S,3R)-N-(4-(2,6-dimet (5-metil-2-pirimidinil)-2-butanosulfonamida o (2S,3R,Z)-N fenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-N-metil-3--(2,6-dimetoxifenil)-1-metil-3-(5-metilpiridin-3-il)-1 H-1 ,2,4-
triazol-5(4H)-iliden)-3-(5-metilpirimidin-2-il)butano-2-sulf ida.
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida o (2S,3R,Z)-N-(4-(2,6-dimetoxifenil (5-metilpirimidin-2-il)butano-2-sulfonamida, Ejemplo 63 5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-metilpirim (0,26 ml) se añadió yoduro de metilo (6,4 pl, 0,103 mm mezcla se agitó a 23°C durante 1 h y se siguió por LC-residuo se cargó en una columna de gel de sílice y se 631.0 en forma de un sólido blanco (0,019 g, 0,034 mm (d, J=6,89 Hz, 3 H), 1,17 (d, J=7,05 Hz, 3 H), 2,27 (s, 3 H), 4,03 (s, 3 H), 6,62 - 6,68 (m, 2 H) 7,42 (t, J=8,53 Hz, H), 8,48 (s, 2H). LCMS-ESI (pos.) m/z: 538,2 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
-triazol-3-il)-N-metil-3-(5-metil-2-pirimidinil)-2-etil-3-(5-metilpiridin-3-il)-1 H-1,2,4-triazol-5(4H)-iliden)-3-n un vial que contenía (2S,3R)-N-(4-(2,6-dimetoxifenil)--il)butano-2-sulfonamida (0,054 g, 0,103 mmol) en DMF guido de carbonato de cesio (0,037 g, 0,113 mmol). La a mezcla después se concentró a presión reducida, y el ó ( (EtOAc/EtOH (3/1) en hexano) al 0-100 %) para dar % de rendimiento). 1H RMN (400 MHz, CD2CL) 51,06 ,30 (s, 3 H) 3,55 - 3,68 (m, 2 H) 3,77 (s, 3 H) 3,81 (s, 3 7,60 - 7,64 (m, 1 H) 8,34 (d, J=1,81 Hz, 1 H) 8,44 (m, 1
on siguiendo el procedimiento en el Ejemplo A usando
Tabla 19
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe.
izaron siguiendo el procedimiento en el Ejemplo 741.0
Tab 20
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Ta aron siguiendo el procedimiento en el Ejemplo A usando
21
Ejemplo 642.0: Preparación de (1R,2S)-1-(5-brom 1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamida y (1 S (piridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulf metilpiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-)-1 -(5-bromo-6-metilpiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-ida.
Compuesto (1 R,2R)-1 -(5-bromo-6-metilpiridin-2-il)-1 (1 R,2S)-1 -(5-bromo-6-metilpiridin-2-il)-1 -hidroxi-N,N-bis( bromo-6-metilpiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibenc metilpiridin-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propan bis(4-metoxibencil)etanosulfonamida (3,39 g, 9,70 mmol hexanos, 6,36 ml, 10,18 mmol) a -78°C. La mezcla resu se añadió gota a gota una disolución de 3-bromo-2-me La mezcla resultante se calentó a TA y se agitó dura acuosa saturada de NH4Cl (50 ml) y la mezcla res combinados se secaron (Na2SO4) y se concentraron, y gel de sílice de 120 g usando el gradiente de EtOAc en (2,87 g). LCMS (pos.) m/z: 550.0 (M+H)+.
roxi-N,N-bis(4-metoxibencil)propano-2-sulfonamida y etoxibencil)propano-2-sulfonamida y (1 S,2R)-1 -(5-opano-2-sulfonamida y (1 S,2S)-1 -(5-bromo-6-sulfonamida, Ejemplo 642.1. A una disolución de N,N-THF (24 ml) se añadió gota a gota, n-butil-litio (1,6 M en te se agitó a la misma temperatura durante 30 minutos, y iridina-6-carbaldehído (2,0 g, 9,70 mmol) en THF (8 ml).
24 horas. La mezcla después se inactivó con solución nte se extrajo con EtOAc (80 ml x 3). Los extractos siduo se purificó por Isco CombiFlash en una columna de tano al 0-100% como eluyente para dar el Ejemplo 642.1
Compuesto (1 R,2S)-1 -(5-bromo-6-metilpiridin-2-il)-1 -metilpiridin-2-il)-1-hidroxipropano-2-sulfonamida, Ejemp oxipropano-2-sulfonamida y (1 S,2R)-1 -(5-bromo-6-42.2. A una mezcla del Ejemplo 642.1 (2,77 g, 5,04
mmol) y anisol, 99% (5,48 ml, 50,4 mmol) se añadi resultante se dejó agitar a TA durante 24 horas. La m CombiFlash en una columna de gel de sílice GraceRes 100% como eluyente para dar el Ejemplo 642.2 (853 m (d, J = 8.4 Hz, 1H), 5.76 (br s, 2H), 5.59 (d, J = 2.5 Hz, 1 =7.3 Hz, 3H). LCMS-ESI (pos.) m/z: 310.0 (M+H)+
tamente TFA (14.98 ml, 202 mmol) a TA La mezcla se concentró a vacío, y el residuo se purificó por Isco e 220 g usando el gradiente de EtOAc en heptano al 0-RMN (400 MHz, CDCls) 58.06 (d, J = 8.2 Hz, 1H), 7.30 .04 (br s, 1H), 3.55-3.61 (m, 1H), 2.76 (s, 3H), 1.22 (d, J
Compuesto (1 R,2R)-1 -(5-bromo-6-metilpiridin-2-il)-1 -metilpiridin-2-il)-1 -hidroxipropano-2-sulfonamida, Ejem descritas en el Ejemplo 642.2 suministró el Ejemplo 64 Hz, 1H), 7.18 (d, J = 8.2 Hz, 1H), 5.51 (br s, 3H), 4.99 (d 7.2 Hz, 3H). LCMS (pos.) m/z: 310.0 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 22
xipropano-2-sulfonamida y (1 S,2S)-1 -(5-bromo-6-42.3. La elución adicional usando las condiciones 497 mg). 1H RMN (400 MHz, CDCl3) 57.91 (d, J = 8.0 7.8 Hz, 1H), 3.53-3.60 (m, 1H), 2.67 (s, 3H), 1.25 (d, J =
ron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 643.0: Preparación de (1R,2S)-1-(5-brom 1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamida y (1 S (piridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulf etilpiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1 -(5-bromo-6-metilpiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-ida.
2-(3,4-Dihidro-2H-pirano-6-il)-5-metilpirimidina, Ejemplo 64 mmol), éster de pinacol del ácido 3,4-dihidro-2h-pirano-6-b 1,87 mmol) y tris-(dibencilidenacetona)dipaladio (0) llenar con argón. A esta mezcla se añadieron 1,4-dioxano en agua (2,0 ml). Se burbujeó una corriente de argón a trav y la mezcla se agitó a 100°C con un balón de argón duran con EtOAc. El filtrado se concentró a vacío, y el residuo s sílice RediSep 80 g usando el gradiente de EtOAc en he (1,62 g). 1H RMN (400 MHz, CDCls) 58.48 (s, 2H), 6.26 ocultado, 2H), 2.25 (s, 3H), 1.9 (dd, J = 5.6, 4.8 Hz, 2H). LC na mezcla de 2-cloro-5-metilpirimidina (1,2 g, 9,33
co (2,94 ml, 14,0 mmol), triciclohexilfosfina (0,524 g,
55 g, 0,93 mmol) en un matraz se desgasificó y se volvió a l) y fosfato de potasio tribásico (6,45 g, 28,0 mmol)
la mezcla resultante durante 5 minutos adicionales,
horas. La mezcla se enfrió a TA, se filtró y se lavó
ificó por Isco CombiFlash en una columna de gel de
al 0-100% como eluyente para dar Ejemplo 643.1
= 4.1, 4.1 Hz, 1H), 4.21-4.24 (m, 2H), 2.20-2.26 (m
pos.) m/z: 177.1 (M+H)+.
Ácido (2R,3R)-2-(5-metilpirimidin-2-il)tetrahidro-2H-piran il)tetrahidro-2H-pirano-3-sulfónico y ácido (2S,3R)-2-(5-(2s,3S)-2-(5-metilpirimidin-2-il)tetrahidro-2H-pirano-3-sulfón (1,62 g, 9,19 mmol) en THF (15 ml) se añadió una disolució a TA La mezcla resultante después se dejó agitar con un enfrió a TA y se concentró a vacío. Al residuo se añadió a después se extrajo con DCM. La solución acuosa se liofiliz La suspensión resultante se filtró a través de una almohadil EtOH varias veces. El filtrado se concentró para dar el Eje lfónico y ácido (2R,3S)-2-(5-metilpirimidin-2-rimidin-2-il)tetrahidro-2H-pirano-3-sulfónico y ácido Ejemplo 643.2. A una disolución del Ejemplo 643.1 bisulfito sódico (7,55 g, 27,6 mmol) en 5 ml de agua n de argón a 80°C durante 48 horas. La mezcla se 30 ml) y la mezcla se ajustó a pH = ~ 2. La mezcla a dar un sólido blanco. El sólido se trituró con EtOH. l agente de filtración de marca Celite® y se lavó con 43.2 (2,48 g). LCMS (pos.) m/z: 259.0 (M=H)+.
(2R,3R)-N-(4-metoxibencil)-2-(5-metilpirimidin-2-il)tetrahidro 2-(5-metilpirimidin-2-il)tetrahidro-2H-pirano-3-sulfonamida il)tetrahidro-2H-pirano-3-sulfonamida y (2S,3S)-N-(4-m sulfonamida Ejemplo 643.3). A una suspensión agitada de añadió gota a gota cloruro de oxalilo (1,433 ml, 16,14 m gotas). La mezcla resultante se dejó agitar a TA y se sigui el residuo se destiló azeotrópicamente con tolueno y se se residuo y la mezcla se enfrió a 0°C. Después, se añadió seguido de TEA (3,74 ml, 26,9 mmol). La mezcla result pirano-3-sulfonamida y (2R,3S)-N-(4-metoxibencil)-(2S,3R)-N-(4-metoxibencil)-2-(5-metilpirimidin-2-bencil)-2-(5-metilpirimidin-2-il)tetrahidro-2H-pirano-3-mplo 643.2 (1,39 g, 5,38 mmol) en DCM (27 ml) se TA, seguido de la adición gota a gota de DMF (5 LCMS. Tras completarse, la mezcla se concentró, y n vacío durante la noche. Se añadió DCM (26 ml) al gota 4-metoxibencilamina (2,095 ml, 16,14 mmol), se dejó agitar a TA y se siguió por LCMS. Tras
completarse, la mezcla se concentró y se cargó directa CombiFlash en una columna de gel de sílice RediSep como eluyente para dar el Ejemplo 643.3. LCMS (pos.) en un cartucho de sílice y después se purificó por Isco usando el gradiente de EtOAc en heptano al 0-100% 78.0 (M+H)+.
(2R,3R)-2-(5-metilpirimidin-2-il)tetrahidro-2H-pirano-3-s pirano-3-sulfonamida y (2S,3R)-2-(5-metilpirimidin metilpirimidin-2-il)tetrahidro-2H-pirano-3-sulfonamida, Ej 1,19 mmol) en DCM (6 ml) se añadió anisol (0,650 ml, mezcla resultante se dejó agitar a TA y se siguió por L se cargó directamente en sílice y después se purificó RediSep 24 g usando el gradiente de MeOH en DCM LCMS (pos.) m/z: 258.0 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
mida y (2R,3S)-2-(5-metilpirimidin-2-il)tetrahidro-2H-etrahidro-2H-pirano-3-sulfonamida y (2S,3S)-2-(5-o 643.4). A una disolución del Ejemplo 643.3 (0,449 g, mmol) y TFA (1,83 ml, 23,8 mmol) respectivamente. La Tras completarse, la mezcla se concentró y el residuo sco CombiFlash en una columna de gel de sílice gold -5% como eluyente para dar Ejemplo 643.4 (244 mg).
ron siguiendo el procedimiento en el Ejemplo B usando
Tab 23
Ejemplo 647.0. Preparación de (2S,3S)-N-(4-(2,6-dimet 1 H-pirazol-1 -il)butano-2-sulfonamida y (2R,3R)-N-(4-(2 (4-metil-1 H-pirazol-1 -il)butano-2-sulfonamida y (2S,3R)-3-il)-3-(4-metil-1 H-pirazol-1 -il)butano-2-sulfonamida y (2 triazol-3-il)-3-(4-metil-1 H-pirazol-1-il)butano-2-sulfonamid nil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(4-metilmetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-
(2R,3R)-3-(4-metil-1H-pirazol-11-il)butan-2-ol y (2R,3S) pirazol-1 -il)butan-2-ol y (2S,3S)-3-(4-metil-1H-pirazol-1 metilpirazol (0,250 ml, 3,04 mmol) y 2,3-dimetiloxirano 15x45 mm con tapón de presión rojo se añadió carbon tapó y se agitó a 80°C durante 24 horas. La mezcla d purificó por Isco CombiFlash en una columna de gel de al 0-10% como eluyente para dar Ejemplo 647.1 (470 m metil-1H-pirazol-1-il)butan-2-ol y (2S,3R)-3-(4-metil-1H-an-2-ol, Ejemplo 647.1. A una mezcla agitada de 4-g, 6,1 mmol) en DMF (3,0 ml) en un vial Chem Glass cesio (1,49 g, 4,57 mmol) en porciones. La mezcla se s se cargó directamente en un cartucho de sílice y se RediSep 24 g usando el gradiente de MeOH en DCM MS (pos.) m/z: 155,2 (M+H)+.
2-(((2R,3R)-3-(4-metil-1 H-pirazol-1 -il)butan-2-il)tio)benz il)tio)benzo[d]tiazol y 2-(((2S,3R)-3-(4-metil-1H-pirazolpirazol-1-il)butan-2-il)tio)benzo[d]tiazol, Ejemplo 647.2. en tolueno (15 ml) en atmósfera de N2 a 0°C se añadi mmol). La mezcla se agitó a la misma temperatura dur mmol). La mezcla se agitó durante 10 minutos adicional en tolueno (5,0 ml). La mezcla se calentó a TA y se a vacío y el residuo se cargó directamente en un cartuch de gel de sílice de 40 g usando el gradiente de EtOAc (1,06 g). LCMS (pos.) m/z: 304,0 (M+H)+.
zol y 2-(((2R,3S)-3-(4-metil-1 H-pirazol-1 -il)butan-2-utan-2-il)tio)benzo[d]tiazol y 2-(((2S,3S)-3-(4-metil-1H-disolución agitada de trifenilfosfina (1,2 g, 4,57 mmol) dicarboxilato de dietilo (40% en tolueno, 1,39 ml, 3,05 0 minutos y se añadió el Ejemplo 647.1 (0,470 g, 3,05 se añadió 2-mercaptobenzotiazol (0,538 ml, 4,57 mmol) urante 24 horas. La mezcla resultante se concentró a sílice, se purificó por Isco CombiFlash en una columna tano al 0-100% como eluyente para dar Ejemplo 647.2
2-(((2R,3R)-3-(4-metil-1 H-pirazol-1 -il)butan-2-il)sulfonil) il)sulfonil)benzo[d]tiazol y 2-(((2S,3R)-3-(4-metil-1H-pir [d]tiazol y 2-(((2R,3S)-3-(4-metil-1 H-pirazol-1 -il)butan-2--il)butan-2-il)sulfonil)benzo[d]tiazol y 2-(((2S,3S)-3-(4-metil-1H-pirazol-1-il)butan-2-il)sulfonil)benzo[d]tiazol, Ej mmol) en DCM (11 ml) se añadió mCPBA (0,939 g, 4,1 agitó a TA y se siguió por LCMS. Tras completarse, se porciones para inactivar la reacción, y la mezcla despu resultante se cargó directamente en un cartucho de síli de sílice RediSep 40 g usando gradiente de EtOAc en (638 mg). LCMS (pos.) m/z: 336,2 (M+H)+.
647.3. A una disolución de Ejemplo 647.2 (1,06 g, 2,1 ol) lentamente a 0°C. La mezcla resultante después se ió tiosulfato sódico (3,31 g, 21.0 mmol) lentamente en agitó a TA durante 30 minutos adicionales. El producto e purificó por Isco CombiFlash en una columna de gel o al 0-100% como eluyente para dar el Ejemplo 647.3
(2R,3R)-3-(4-metil-1 H-pirazol-1 -il)butano-2-sulfonamida (2S,3R)-3-(4-metil-1 H-pirazol-1 -il)butano-2-sulfonamida Ejemplo 647.4. A una disolución agitada de 647.4 (0, carbonato de potasio (0,230 ml, 3,80 mmol) a 0°C. La m La mezcla se concentró, y el residuo se secó a vacío. se agitó y se trató con ácido amidoperoximonosulfúric mmol) respectivamente. La mezcla resultante se agitó solución acuosa saturada NaCl. La mezcla resultante se x 2). Los extractos combinados se secaron con sulfato Isco CombiFlash en un columna de gel de sílice RediS eluyente para dar el Ejemplo 647.4, (334 mg). LCMS (p
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
R,3S)-3-(4-metil-1 H-pirazol-1 -il)butano-2-sulfonamida y (2S,3S)-3-(4-metil-1 H-pirazol-1 -il)butano-2-sulfonamida, , 1,90 mmol) en MeOH (10 ml) se añadió lentamente resultante se calentó a TA y se agitó durante 24 horas. adió agua (9,51 ml, 1,90 mmol) al residuo, y la mezcla 452 g, 3,99 mmol) y acetato de potasio (0,21 g, 2,09 durante 24 horas, y después se añadieron 20 ml de jo con 30% iPrOH/cloroformo (30 ml x 2) y DCM (30 ml o anhidro y se concentraron. El residuo se purificó por g usando gradiente de MeOH en DCM al 0-10% como /z: 218,1 (M+H).
on siguiendo el procedimiento en el Ejemplo B usando
Tabla 24
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
aron siguiendo el procedimiento en el Ejemplo A usando
Tabla 25
Ejemplo 664.0. Preparación de (1 ñ,2S,P)-N-(4-(2-etoximetoxi-1-(5-metil-2-pirimidinil)-2-propanosulfonamida o ( etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-2S,M)-N-(4-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2osulfonamida.
(1 R,2S,P)-N-(4-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-piri propanosulfonamida y (1 R,2S,M)-N-(4-(2-etoxi-6-meto (5-metil-2-pirimidinil)-2-propanosulfonamida, Ejemplo fluidos supercríticos quiral del Ejemplo 43.0 (45 mg, r productos atropisómeros. Método SFC preparativo: C 85:15 (A:B), A: CO2 líquido, B: EtOH, caudal: 70 ml/mi picos de >99.5%ee: El primer pico que eluye (10 mg) e (6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-tr propanosulfonamida. 1H RMN (400 MHz, CD3CN) 58,5 7,37 (t, J=8,5 Hz, 1H), 6,64-6,80 (m, 3H), 4,82 (d, J=4, Hz, 1H), 3,73 (s, 3H), 3,48-3,60 (m, 1H), 3,21 (s, 3H), 3, 1,02 (t, J=6,9 Hz, 3H). LCMS-ESI (POS.) m/z: 570,2 (
Ejemplo 665.0. Preparación de (1 R,2S,P)-N-(4-(2-eto metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida o 4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2H-1,2,4-triazol-3-il)-1-metoxi-1-(5-metil-2-pirimidinil)-2--5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -e llevó a cabo la purificación por cromatografía de n 1:1 de atropoisómeros P y M) para separar los dos a: Chiralpak AD-H (150 x 21 mm, 5 pm), Fase móvil:
nm, 213 bar de presión de entrada y proporcionó dos Ejemplo 664.0, (1 R,2S,P)-N-(4-(2-etoxi-6-metoxifenil)-5--pirimidinil)-2-propanosulfonamida o (1 R,2S,M)-N-(4--il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-H), 7,71 (dd, J=8,3, 7,5 Hz, 1H), 7,57 (d, J=7,4 Hz, 1H), 1H), 3,98 (dq, J=9,7, 6,9 Hz, 1H), 3,84 (dq, J=9,7, 7,0 3H), 2,28 (s, 3H), 1,20-1,30 (m, 3H), 1,07-1,13 (m, 1H),
etoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-S,M)-N-(4-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-piridinil)-osulfonamida.
El segundo pico que eluye (10 mg) era el Ejemplo piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirim metoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-RMN (400 MHz, CD3CN) 58,61 (s, 2H), 7,69-7,80 (m, (m, 3H), 4,86 (d, J=4,3 Hz, 1H), 3,97-4,08 (m, 1H), 3,88 1H), 3,20 (s, 3H), 3,17 (s, 3H), 2,30 (s, 3H), 1,24-1,2 (M+H)+.
Ejemplo 666.0. Preparación de (1 R,2S,P)-N-(4-(2-( triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanos metoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)0, (1 R,2S,M)-N-(4-(2-etoxi-6-metoxifenil)-5-(6-metoxi-2-2-propanosulfonamida o (1 R,2S,P)-N-(4-(2-etoxi-6-oxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida. 1H ,60 (d, J=7,4 Hz, 1H), 7,40 (t, J=8,5 Hz, 1H), 6,66-6,83 =9,7, 7,0 Hz, 1H), 3,72 (s, 3H), 3,55 (dq, J=7,0, 4,3 Hz, 3H), 1,07-1,11 (m, 4H). LCMS-ESI (POS.) m/z: 570,2
ometoxi)-6-metoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-mida y (1 R,2S,M)-N-(4-(2-(difluorometoxi)-6-oxi-1-(5-metil-2-pirimidinil)-2-propanosulfonamida.
1 -(Difluorometoxi)-2-isotiocianato-3-metoxibenceno. Eje Etapa 1: 3-metoxi-2-nitrofenol. En un matraz que co Apollo Scientific) y 2-(metilsulfonil)etanol (0,77 g, 6,19 666.1.
1-fluoro-3-metoxi-2-nitrobenceno (1,00 g, 5,84 mmol, Aldrich) en atmósfera de N2 se añadió DMSO (5 ml) y t-butóxido de potasio (6,19 ml, 6,19 mmol, 1,0 M en THF). Se añadió una porción adicional de 2-(metilsulfonil)etanol mmol), y la reacción se agitó durante 3,5 h adicionales. <1, y se extrajo con EtOAc (2x25 ml). Las fracciones org las capas acuosas se combinaron y se acidificaron a pH capas orgánicas combinadas se secaron (MgSO4), y se La purificación por cromatografía ultrarrápida automática 2-nitrofenol (0,88 g, 5,20 mmol, 89% de rendimiento) e CDCl3) 57,42 (t, J=8,5 Hz, 1H), 6,73 (dd, J=8,5, 1,2 Hz, (POS.) m/z: 170,2 (M+H)+; m/z: 152,2 (M-HzO)+.
Etapa 2: 1-(difluorometoxi)-3-metoxi-2-nitrobenceno. En nitrofenol (310 mg, 1,833 mmol) se añadió DMF (5 ml), difluoroacetato de sodio (559 mg, 3,67 mmol). La reacció N2 durante 4 h. La reacción después se enfrió a TA, se Las capas orgánicas se combinaron, se secaron (MgS ultrarrápida automática (80 g de SiO2 EtOAc/hexanos a (398 mg, 1,82 mmol, 99 % de rendimiento) en forma de u Hz, 1H), 7,01-6,87 (m, 2H), 6,55 (t, J=72,5 Hz, 1H), 3,94 (
Etapa 3: 2-(difluorometoxi)-6-metoxianilina. En un mat metoxi-2-nitrobenceno (398 mg, 1,816 mmol) se añadió mg, 1,816 mmol). Se añadieron EtOH (20 ml) y H2O (2 m 80°C en atmósfera de N2 durante 2 h. La suspensió cromatografía ultrarrápida automática (12 g de SiO2, Et metoxianilina (260 mg, 1,38 mmol, 76 % de rendimiento) MHz, CDCla) 56,75-6,64 (m, 3H), 6,48 (t, J=74,6 Hz, 1H),
Etapa 4: 1-(difluorometoxi)-2-isotiocianato-3-metoxibenc (difluorometoxi)-6-metoxianilina (260 mg, 1,375 mmol)
2(1H)-ona) (319 mg, 1,38 mmol). La reacción se agitó a después se concentró para dar un sólido naranja como el
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
eacción se agitó en atmósfera de N2 a TA durante 20 h.
77 g, 6,19 mmol) y t-butóxido de potasio (6,19 ml, 6,19 eacción después se inactivó con HCl 1 N (20 ml) a pH as combinadas se lavaron con NaOH 1 N (2x50 ml), y on HCl 5 N, y se extrajeron con EtOAc (2x25 ml). Las centraron para dar el producto como un aceite naranja.
g de SiO2, EtOAc/hexanos al 0-100%) dio el 3-metoxirma de un aceite naranja oscuro. 1H RMN (300 MHz, , 6,56 (dd, J=8,5, 1,0 Hz, 1H), 3,96 (s, 3H). LCMS-ESI
matraz de fondo redondo que contenía 3-metoxi-2-bonato de cesio (1194 mg, 3,67 mmol), y 2-cloro-2,2-calentó en un baño de aceite a 100°C en atmósfera de ó con agua (50 ml) y se extrajo con EtOAc (3x25 ml). y se concentraron. La purificación por cromatografía 100%) dio el1-(difluorometoxi)-3-metoxi-2-nitrobenceno eite naranja. 1H RMN (300 m Hz, CDCL) 57,43 (t, J=8,6 H).
de fondo redondo que contenía 1-(difluorometoxi)-3-o en polvo (507 mg, 9,08 mmol) y cloruro amónico (97 la mezcla resultante se calentó en un baño de aceite a filtró y el filtrado se concentró. La purificación por EtOH 3:1/heptano al 0-40%) dio la 2-(difluorometoxi)-6-orma de un aceite incoloro, transparente. 1H RMN (300 8 (s, 3H). LCMS-ESI (POS.) m/z: 190,1 (M+H)+.
. A un matraz de fondo redondo de 50 ml con 2-CM (10 ml) a TA se añadió 1,1'-tiocarbonilbis(piridinn atmósfera de N2 durante 20 h. La mezcla de reacción mplo 666.1 que se usó sin más purificación.
on siguiendo el procedimiento en el Ejemplo A usando
Ta 26
Ejemplo 671.0. Preparación de (2R,3R)-N-(4-(2,6-dime 2-pirimidinil)-2-butanosulfonamida y (2S,3S)-N-(4-(2,6 metil-2-pirimidinil)-2-butanosulfonamida.
nil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metiltoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-
Ácido (E)-But-2-en-2-ilborónico, Ejemplo 671.1. A una d 2-borónico (5,0 g, 0,0274 mol) en acetona (25,0 ml) y 0,027 mol) y acetato de amonio (2,11 g, 0,0274 mol) reacción después se concentró parcialmente a vacío p dos fases resultantes se separaron y la capa acuosa combinadas se secaron sobre sulfato sódico y se conc but-2-en-2-ilborónico, Ejemplo 671.1 con 44% de rendi ión agitada del éster de pinacol del ácido (E)-2-buteno-(25,0 ml) a TA, se añadió peryodato de sodio (5,87 g, mezcla resultante se agitó a TA durante 4 horas. La parar la acetona y se diluyó con MTBE (50,0 ml). Las xtrajo con MTBE (2 x 25,0 ml). Las fases orgánicas on a vacío para dar el producto deseado el ácido (E)-.
(Z)-2-(But-2-en-2-il)-5-metilpirimidina, Ejemplo 671.2. U purgó con argón durante 1-2 h a 25-30°C. Se cargó 2-mezcla se agitó durante 5-10 min seguido de la adición but-2-en-2-ilborónico Ejemplo 671.1 (34,9 g, 0,349 m mmol) y Pd2(dba)3 (2,13 g, 2,32 mmol). La reacción se calentó a 75-80°C durante 12-16 h. La reacción se enfri y MTBE (180,0 ml). Las capas acuosa y orgánica se se capas orgánicas combinadas se lavaron con salmuera para dar el producto inicial que se diluyó con heptano (1 veces con ácido clorhídrico ac. Las capas acuosas c básicas con solución de hidróxido de sodio hasta obte acuosas y orgánicas se separaron y la capa acuos combinadas se lavaron con salmuera (60,0 ml), se sec la (Z)-2-(but-2-en-2-il)-5-metilpirimidina, Ejemplo 671.2 c traz de fondo redondo se cargó con IPA (600 ml) y se 5-metilpirimidina (30,0 g, 0,233 mol) en el matraz, y la sfato de potasio tribásico (98,9 g, 466 mol), ácido (E)--diciclohexilfosfino-2',4',6'-triisopropilbifenilo (4,2 g, 8,8 urante 10-15 min en atmósfera de argón y después se 5°C. Después se añadieron lentamente agua (300,0 ml) n. La capa acuosa se extrajo con MTBE (60,0 ml). Las ml) dos veces. La capa orgánica se concentró a vacío ml) y MTBE (75,0 ml). La mezcla anterior se extrajo tres nadas se lavaron con heptano (30,0 ml), se hicieron 10, y se extrajeron con heptano (90,0 ml). Las capas extrajo con heptano (30,0 ml). Las capas orgánicas obre sulfato sódico y se concentraron a vacío para dar % de rendimiento.
(Z)-3-(5-Metilpirimidin-2-il)but-2-eno-2-sulfonamida, Eje análoga partiendo de la (Z)-2-(but-2-en-2-il)-5-metilpiri descritos en los Ejemplos 10.02 a 10.05. con 22% de re 671.3. Este compuesto se preparó en de una forma , Ejemplo 671.2, de acuerdo con los procedimientos ento global. LCm S-ESI (POS.) m/z: 228,3 (M+H)+.
(2R,3R)-3-(5-Metilpirimidin-2-il)butano-2-sulfonamida
Ejemplo 671.4. Un matraz de agitación Parr se cargó sulfonamida, Ejemplo 671.3 (0,5 g, 1,0 eq). La soluci antes de añadir paladio sobre carbón al 10% (0,05 g). hidrógeno durante 8 h. La mezcla de reacción despué filtración de marca Celite® y el filtrado se concentró metilpirimidin-2-il)butano-2-sulfonamida y (2S,3S)-3-(5-una mezcla racémica con 20% de rendimiento. lCm S-E (2S,3S)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida, eOH (30,0 ml) y (Z)-3-(5-metilpirimidin-2-il)but-2-eno-2-nsparente resultante se purgó con nitrógeno gaseoso cción se hidrogenó a 3,5 kg/cm2 (50 psi) de presión de iltró a través de una almohadilla corta de ayudante de cío para dar los compuestos del título (2R,3R)-3-(5-irimidin-2-il)butano-2-sulfonamida, Ejemplo 671.4 como OS), m/z: 230,2 (M+H)+.
(Z)-N'-(2,6-Dimetoxifenil)-2-(5-metilnicotinoil)-N-(((2R,3 il)sulfonil)hidrazinacarboximidamida y (Z)-N'-(2,6-dimet il)butan-2-il)sulfonil)hidrazinacarboximidamida, Ejemplo 2-il)butano-2-sulfonamida y (2S,3S)-3-(5-metilpirimidinse combinó con 2-isotiocianato-1,3-dimetoxibenceno, cesio (150 mg, 0,46 mmol) y NMP (6,0 ml). La mezc Después de 17 horas, se añadió una porción adicional calentamiento se ajustó a 60°C. Después de calentar d temperatura ambiente antes de añadir en una porción EDCl, (88 mg, 0,461 mmol). La reacción se agitó metilnicotinohidrazida (65 mg, 0,42 mmol) y EDCI, (88 (10 ml) y el pH de la reacción se ajustó a pH 4 con á orgánicas combinadas se concentraron y se purificaro RediSep-Sep preempaquetada, eluyendo con un gr compuesto del título (Z)-N'-(2,6-dimetoxifenil)-2-il)sulfonil)hidrazinacarboximidamida y (Z)-N'-(2,6-dimet il)butan-2-il)sulfonil)hidrazinacarboximidamida, Ejemplo un sólido blanquecino. LCMS-ESI (POS.) m/z: 542,2 (M -metilpirimidin-2-il)butan-2-il)-2-(5-metilnicotinoil)-N-(((2S,3S)-3-(5-metilpirimidin-2-. Una mezcla racémica de (2R,3R)-3-(5-metilpirimidintano-2-sulfonamida, Ejemplo 671.4 (88 mg, 0,38 mmol) esto intermedio 1.0 (76 mg, 0,38 mmol), carbonato de calentó en un bloque de calentamiento fijado a 45°C. arbonato de cesio (100 mg, 0,31 mmol) y el bloque de 1 h y 45 min adicionales, la reacción se dejó enfriar a tilnicotinohidrazida (65,3 mg, 0,422 mmol) seguido de e 2 h antes de añadir una cantidad adicional de 5-46 mmol). Después de agitar 17 h a TA, se añadió agua osfórico y se extrajo dos veces con EtOAc. Las capas cromatografía a través de una columna de gel de sílice te de MeOH/EtOAc al 5-20%, para proporcionar el tilnicotinoil)-N-(((2R,3R)-3-(5-metilpirimidin-2-il)butan-2-il)-2-(5-metilnicotinoil)-N-(((2S,3 S)-3-(5-metilpirimidin-2-(130 mg, 0,24 mmol, 63% de rendimiento) en forma de
(2R,3R)-N-(4-(2,6-Dimetoxifenil)-5-(5-metil-3-piridinil)-4H butanosulfonamida y (2S,3S)-N-(4-(2,6-dimeto pirimidinil)-2-butanosulfonamida, Ejemplo 671.0. Se
dimetoxifenil)-2-(5-metilnicotinoil)-N-(((2R,3R)-3-(5-metil (Z)-N'-(2,6-dimetoxifenil)-2-(5-metilnicotinoil)-N-(((2S,3S) il)sulfonil)hidrazinacarboximidamida, Ejemplo 671.5 (0, solución acuosa de NaOH 1 N (0,122 ml, 0,122 mmol) selló con un tapón de rosca. El vial tapado se puso en h, el vial se dejó enfriar a temperatura ambiente. Se a mmol), y el precipitado blanco se filtró, se lavó con ag (2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-tri Ejemplo 671.0 (0,028 g, 0,053 mmol, 53% de rendimient 11,87 (br. s., 1 H), 8,54 (s, 2H), 8,45 (s, 1H), 8,35 (s, 3,33 Hz, 2 H), 3,76 (s, 3 H), 3,75 (s, 3 H), 3,52 - 3,64 ( 1,26 (d, J=6,65 Hz, 3 H). LCMS-ESI (POS.) m/z: 524,2 (
Ejemplo 672.0. Preparación de (2S,3R)-N-metoxipirimidin-2-il)butano-2-sulfonamida 2 ,2 ,2-trifluoroa -triazol-3-il)-3-(5-metil-2-pirimidinil)-2-)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-ron IPA (0,5 ml) y agua (0,5 ml) a la (Z)-N'-(2,6-in-2-il)butan-2-il)sulfonil)hidrazinacarboximidamida y metilpirimidin-2-il)butan-2-, 0,102 mmol). A la suspensión resultante se añadió ar una solución amarilla que se transfirió a un vial y se que de calentamiento ajustado a 70°C. Después de 28 solución acuosa de ácido cítrico 2 M (0,036 ml, 0,072 e secó para dar el compuesto del título (2R,3R)-N-(4-(5-metil-2-pirimidinil)-2-butanosulfonamida y (2S,3S)--il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida,
mo una mezcla racémica. 1H RMN (400 MHz, CDCh) 5 ,68 (s, 1H), 7,39 (t, J=8,20 Hz, 1 H), 6,61 (dd, J=8,61, ), 2,32 (s, 3 H), 2,30 (s, 3 H), 1,52 (d, J=6,65 Hz, 3 H), .
6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-.
(2S,3R)-3-(5-metoxipirimidin-2-il)butano-2-sulfonamida, (2S,3R)-3-(5-fluoropirimidin-2-il)butano-2-sulfonamida (5 de potasio (679 mg, 4,91 mmol). La reacción se agitó a durante 24 h. Después la temperatura se elevó a 65°C a TA y se filtró. Los sólidos se lavaron con MeOH (2 x tapón de gel de sílice y cromatografió a través de una c g), eluyendo con EtoAc:EtOH (3:1) en heptanos al 0-4 con agua. La capa orgánica de varias fracciones se con el compuesto del título (56 mg, 0,23 mmol, 9% de ren con una capa de agua se combinaron y la capa acuosa ml). Las capas orgánicas combinadas se secaron sobre del título (114 mg). Se siguió con el material como estab
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
lo 672.1. Un matraz de fondo redondo se cargó con , 2.47 mmol, Ejemplo 10.1), MeOH (7 ml), y carbonato spués de 48 h, la reacción se calentó a 50°C y se agitó ezcla se agitó durante 48 h. La reacción se dejó enfriar El filtrado se concentró a vacío y se adsorbió sobre un a de gel de sílice RediSep® preempaquetada (Gold, 24 s disolventes de cromatografía estaban contaminados ó a vacío para dar una mezcla de material de partida y to) en forma de un sólido blanquecino. Las fracciones aturó con NaCl y se extrajo con CHCl3:IPA (9:1, 3 x 15 O4 y se concentraron a vacío para dar más compuesto MS-ESI (POS.) m/z: 246,1 (M+H)+.
n siguiendo el procedimiento en el Ejemplo A usando
Tabla 27
Ejemplo 674.0. Preparación de 2,2,2-trifluoroacetato piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimid (1 R,2S,M)-N-(4-(2-fluoro-6-metoxifenil)-5-(6-metoxi-2-piri 2-propanosulfonamida.
e (1R,2S,P)-N-(4-(2-fluoro-6-metoxifenil)-5-(6-metoxi-2-l)-2-propanosulfonamida y 2,2,2-trifluoroacetato de l)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-
1-fluoro-2-isotiocianato-3-metoxibenceno, Ejemplo 674.1.
1.7 mmol, Indofine Chemical Co.) y DCM (15 ml) se aña mezcla resultante se agitó a TA Después de 16 h, la rea tapón de gel de sílice y cromatografió a través de una c EtOAc en heptanos al 0-20%, para proporcionar el comp en forma de un sólido blanco. Se siguió con el material a ds) 57,36 (q, J=8,1 Hz, 1H), 6,94-7,05 (m, 2H), 3,92 (s, 3
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Tabla 28
una disolución de 2-fluoro-6-metoxi-fenilamina (240 mg, 1,1'-tiocarbonildi-2(1H)-piridona (434 mg, 1,87 mmol). La n se concentró a 1/2 de volumen y se absorbió sobre un mna de gel de sílice GraceResolv (12 g), eluyendo con sto del título (340 mg, 1,86 mmol, 109% de rendimiento), btenido sin más purificación. 1H RMN (300 MHz, DMSO-
aron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 676.0. Preparación de 2,2,2-trifluoroacetato d triazol-3-il)-2-(5-fluoro-2-pirimidinil)etanosulfonamida.
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-
Cloruro de 2-(5-fluoropirimidin-2-il)etanosulfonilo, Ejemplo il)etanosulfónico (1,71 g, 8,30 mmol, Ejemplo 7.02) en DC ml, 12,45 mmol). La suspensión se agitó a TA Después d siguiente etapa sin ninguna caracterización adicional.
6.1. A una suspensión de ácido 2-(5-fluoropirimidin-2-30 ml) se añadió cloruro de oxalilo, (2 M en DCM, 6,22 gitar durante 3 d, el material así obtenido se usó en la
4-(2,6-Dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria una forma análoga a la del Ejemplo 2.04, usando la 6-m -amina, Ejemplo 676.2. El Ejemplo 676.2 se preparó de icolinohidrazida (Ejemplo 3.18
N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-trifluoroacetato, Ejemplo 676.0. A una suspensión de amina (39 mg, 0,12 mmol, Ejemplo 676.2) en DCM (30 añadió cloruro de 2-(5-fluoropirimidin-2-il)etanosulfonilo de 24 h, la reacción se trató con más cloruro de 2-(5 Después de otras 24 h, la reacción se vertió en agua y se concentraron a vacío y se purificaron ppr HPLC Phenomenex Luna (5 micrómetros, C18, 110 Á, Axia, 1 MeCN (TFA al 0,1%) en agua (TfA al 0,1%) al 30-60% 1,91 pmol, 2% de rendimiento), en forma de un sólido (m, 2H), 7,30-7,36 (m, 1H), 6,72 (dd, J=7,7, 1,5 Hz, 1 3,45-3,52 (m, 2H), 3,18 (s, 3H). LCMS-ESI (pos.) m/z: 5 Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 29
l-3-il)-2-(5-fluoro-2-pirimidinil)etanosulfonamida 2,2,2--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-añadió TEA (0,066 ml, 0,48 mmol). A esta solución se g, 0,22 mmol). La suspensión se agitó a TA Después pirimidin-2-il)etanosulfonilo (50 mg) y TEA (0,100 ml). trajo con DCM (10 ml). Las capas de DCM combinadas arativa de fase inversa (Shimadzu) en una columna ,2 mm) eluyendo a 30 ml/min con un gradiente lineal de rgo de 20 min para dar el compuesto del título (1,2 mg, o. 1H RMN (300 MHz, CDCta) 58,53 (s, 2H), 7,58-7,66 1 (d, J=8,6 Hz, 2H), 3,71 (m, 6H), 3,57-3,64 (m, 2H), M+H)+.
on siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 695.0. Preparación de (1R,2S)-N-(4-(2,6-di metoxietoxi)-1-(5-metilpirimidin-2-il)propano-2-sulfonamid oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(2-
(1R,2S)-1-hidroxi-N,N-bis(4-metoxibencil)-1-(5-metilpirimi disolución de 695.1 (preparada de una forma análoga añadió TBAF, (solución 1,0 M en THF, 7,8 ml, 7,8 mmo agitó durante 2,5 h, después de lo cual se añadió más jeringa. Después de 2,25 h adicionales, la mezcla de extrajo con EtOAc (2x). Las capas orgánicas combinada anhidro y se concentraron. El residuo se purificó por cro hexanos al 30% EtOAc puro a lo largo de un perio rendimiento) en forma de un sólido blanco. LCMS-Es I (P -il)propano-2-sulfonamida, Ejemplo 695.2. A una l Ejemplo 18.0, 4,14 g, 7,1 mmol) en THF (90 ml) se ediante jeringa. La solución amarillo claro resultante se , (solución 1,0 M en THF, 3,5 ml, 3,5 mmol) mediante ión se inactivó con solución de HCl 1 N (50 ml) y se lavaron con agua (8x), se secaron sobre sulfato sódico grafía en gel de sílice (eluyente: gradiente de EtOAc en e 35 min) para proporcionar 695.2 (1,76 g, 53% de m/z: 472,1 (M+H)+.
(1R,2S)-1-(aliloxi)-N,N-bis(4-metoxibencil)-1-(5-metilpirim solución a -78°C de 695.2 (1,76 g, 3,7 mmol) en THF (40 M en THF, 5,0 ml, 5,0 mmol) lentamente mediante jerin 15,0 mmol) lentamente mediante jeringa. La solución a después se calentó a 0°C y se agitó durante 40 min adi 5,5:1 de solución acuosa saturada de cloruro amónico capas orgánicas combinadas se secaron sobre sulfato cromatografía en gel de sílice (eluyente: gradiente de largo de un periodo de 40 min) para proporcionar 695.3 claro. LCMS-ESI (POS.) m/z: 512,2 (M+H)+.
2-il)propano-2-sulfonamida, Ejemplo 695.2. A una se añadió bis(trimetilsilil)amida de potasio, (solución 1,0 Después de 7 min, se añadió bromuro de alilo (1,3 ml, lo brillante resultante se agitó a -78°C durante 6 min y les. La mezcla de reacción se inactivó con una mezcla ua (65 ml) y después se extrajo con EtOAc (4x). Las o anhidro y se concentraron. El residuo se purificó por c en hexanos al 5% a EtOAc en hexanos al 75% a lo g, 70% de rendimiento) en forma de un aceite amarillo
(1 R,2S)-1 -((S)-2,3-dihidroxipropoxi)-N,N-bis(4-metoxiben 1 -((R)-2,3-dihidroxipropoxi)-N,N-bis(4-metoxibencil)-1 -(5-una disolución de 695.3 (1,33 g, 2,6 mmol) en una mezcl catalítica de tetraóxido de osmio seguido de 4-metilm resultante se agitó a TA durante 24 h y después se conc El residuo acuoso se diluyó con agua y se extrajo con D sulfato sódico anhidro y se concentraron. El residuo gradiente de DCM puro a MeOH en DCM al 10% a lo lar g, 93% de rendimiento) en forma de un sólido marrón clar 1 -(5-metilpirimidin-2-il)propano-2-sulfonamida y (1 R,2S)-tilpirimidin-2-il)propano-2-sulfonamida, Ejemplo 695.4. A e acetona (45 ml) y agua (15 ml) se añadió una cantidad olina-N-óxido (1,07 g, 9,1 mmol). La solución marrón ró parcialmente en un rotavapor para separar la acetona. (7x). Las capas orgánicas combinadas se secaron sobre purificó por cromatografía en gel de sílice (eluyente: de un periodo de 45 min) para proporcionar 695.4 (1,32 LCMS-ESI (POS.) m/z: 546,2 (M+H)+.
(1 R,2S)-1 -(2-hidroxietoxi)-N,N-bis(4-metoxibencil)-1 -(5-m una disolución de 695.4 (1,32 g, 2,4 mmol) en una mez sodio (1,44 g, 6,8 mmol). La suspensión amarilla resulta el filtrado con DCM. La mezcla se concentró parcialment después se diluyó con agua y se extrajo con DCM (4x). sódico anhidro y se concentró para dar el aldehído en for aldehído en MeOH (60 ml) se añadió borohidruro sódic solución amarilla resultante se agitó a 0°C durante 2 h. ml). La mezcla después se concentró parcialmente en u DCM (4x). Las capas orgánicas combinadas se secaron se purificó por cromatografía en gel de sílice (eluyente: de un periodo de 40 min) para proporcionar 695.5 (965 LCMS-ESI (POS.) m/z: 516,0 (M+H)+.
lpirimidin-2-il)propano-2-sulfonamida, Ejemplo 695.5. A de THF (30 ml) y agua (10 ml) se añadió peryodato de se agitó a TA durante 3,75 h y después se filtró, se lavó n un rotavapor para separar los disolventes orgánicos, y s capas orgánicas combinadas se secaron sobre sulfato de un sólido rosa. A una solución enfriada con hielo del (728 mg, 19,2 mmol). Se observó evolución de gas. La mezcla después se inactivó con solución de HCl 1 N (35 tavapor para separar el MeOH y después se extrajo con bre sulfato sódico anhidro y se concentraron. El residuo diente de DCM puro a MeOH en DCM al 15% a lo largo 78% de rendimiento) en forma de un sólido marrón claro.
(1 R,2S)-N,N-bis(4-metoxibencil)-1 -(2-metoxietoxi)-1 -(5-m una solución a -78°C de 695.5 (964 mg, 1,87 mmol) e (solución 1,0 M en THF, 3,93 ml, 3,93 mmol) lentam a -78°C, la reacción se calentó a -40°C y se agitó durant a -78°C y se añadió trifluorometanosulfonato de metilo ( roja resultante se agitó a -78°C durante 25 min y des pirimidin-2-il)propano-2-sulfonamida, Ejemplo 695.6. A HF (50 ml) se añadió bis(trimetilsilil)amida de potasio, mediante jeringa. Después de agitar durante 10 min dicionales 8 min. La reacción después se volvió a enfriar pl, 2,0 mmol) lentamente mediante jeringa. La solución s se inactivó con una mezcla 2:1 de solución acuosa
saturada de cloruro amónico y agua (30 ml). La mezcla se se secaron sobre sulfato sódico anhidro y se concentraron (eluyente: gradiente de DCM puro a MeOH en DCM al 12 695.6 (376 mg, 38% de rendimiento) en forma de un aceit jo con DCM (4x), y las capas orgánicas combinadas esiduo se purificó por cromatografía en gel de sílice lo largo de un periodo de 40 min) para proporcionar nja. LCMS-ESI (POS.) m/z: 530,2 (M+H)+.
(1 R,2S)-1 -(2-metoxietoxi)-1 -(5-metilpirimidin-2-il)propano-2-2,7 mmol) se disolvió en TFA (5 ml) y después se naranja resultante se agitó a TA durante 7 h y después se de sílice (eluyente: gradiente de DCM puro a MeOH en proporcionar 695.7 (143 mg, 70% de rendimiento) en forma (M+H)+.
namida, Ejemplo 695.7. El compuesto 695.6 (1,39 g,
ió anisol (170 gl, 1,5 mmol) mediante jeringa. La solución ntró. El residuo se purificó por cromatografía en gel
al 7% a lo largo de un periodo de 45 min) para
n sólido amarillo claro. LCMS-ESI (POS.) m/z: 290,1
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1 il)propano-2-sulfonamida, Ejemplo 695.0. Siguiendo el pro 0,15 mmol) y el compuesto intermedio 2.2 (85 mg, 0, rendimiento) en forma de un sólido amarillo claro. 1H RM 7,26-7,35 (m, 1H), 6,69 (d, J=8,8 Hz, 1H), 6,59 (dd, J=8,4 3,71 (s, 3H), 3,71 (s, 3H), 3,69-3,77 (m, 1H), 3,55-3,63 (m, 3H), 1,41 (d, J=7,0 Hz, 3H). LCMS-ESI (POS.) m/z: 600,0 (
Ejemplo 696.0. Preparación de (2S,3R)-3-(5-cloro-2-piri 1,2,4-triazol-3-il)-2-butanosulfonamida.
riazol-3-il)-1 -(2-metoxietoxi)-1 -(5-metilpirimidin-2-iento en el Ejemplo B, se acoplaron 695.7 (44,7 mg, mol) para proporcionar 695.0 (82,5 mg, 89% de 0 MHz, CDCl33) 5 8,64 (s, 2H), 7,56-7,64 (m, 2H), 5 Hz, 2H), 5,13 (d, J=4,9 Hz, 1H), 3,81-3,89 (m, 1H), 3,47-3,54 (m, 1H), 3,35 (s, 3H), 3,17 (s, 3H), 2,34 (s, .
il)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-
(2S,3R)-3-(5-cloropirimidin-2-il)butano-2-sulfonamida, Eje disolución de (E)-3-(5-cloropirimidin-2-il)but-2-eno-2-sulfon de 2-cloro-5-cloropirimidina,70 g, 283 mmol, 1,0 eq butilfosfina (4,54 g, 7,06 mmol, 0,025 equiv, Solvias), tetr 5,65 mmol, 0,02 equiv, Combi Block) y trifluorometanosu Aldrich) en MeOH (1283,3 ml, 18,33 ml/g). El reactor se veces. La mezcla de reacción se agitó en atmósfera de hidr de reacción después se filtró a través de un tapón de age reducida y el sólido se agitó con IPA (500 ml) y durante 15 90% ee). Recristalización: el Ejemplo 696.1 (38 g, 90% e 96.1. Un recipiente de presión se cargó con una (preparada de una forma análoga a 10.05 partiendo (S)-1 -[(R)-2-(di-1 -napftilfosfino)ferrocenil]-etil-di-tercroborato de bis(1,5-ciclooctadieno)rodio(i) (2,295 g, to de cinc (20,55 g, 56,5 mmol, 0,2 equiv, Sigma con argón y se volvió a llenar con hidrógeno tres o (3,5 kg/cm2 (50 psi)) a TA durante 96 h. La mezcla filtración de marca Celite®, se concentró a presión tos y se filtró para dar el compuesto del título (38 g, disolvió en isopropanol (400 ml) a 70°C. La mezcla
homogénea se enfrió a TA y se dejó reposar durante proporcionar el Ejemplo 696.1 (31 g, 95% ee). Se repit proporcionar el Ejemplo 696.1 (29,0 g, 100% ee). 1H R 4,0 Hz, 2H), 3,73 - 3,59 (m, 2H), 1,31 (dt, J = 7,3, 2,4 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 30
. El sólido blanco así obtenido se filtró y se secó para l mismo procedimiento otra vez con este material para 400 MHz, DMSO-d6) 58,93 - 8,85 (m, 2H), 6,86 (d, J = 3H), 1,25 - 1,19 (m, 3H). MS (ESI ve ion) m/z: 250,2
ron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 697.0. Preparación de (2S,3R)-3-(5-ciano-1,2,4-triazol-3-il)-2-butanosulfonamida.
imidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-
(2S,3R)-3-(5-ciano-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-butanosulfonamida, Ejemplo 697.0. (2S,3R)-3-(5-cloropi 1,2,4-triazol-3-il)butano-2-sulfonamida (686.0, 0,020 g, 2',4',6'-tri-i-propil-1,1'-bifenil)(2'-amino-1,1'-bifenil-2-il)pala Strem Chemicals, Inc. Newburyport, MA, EE.UU.),
bifenil)(2'-amino-1,1'-bifenil-2-il)paladio(II) (0,015 g, 0,01 Newburyport, MA, EE.UU.), aducto de metanosulfonato bifenil]paladio(II) y diclorometano (0,019 g, 0,018 m Newburyport, MA, EE.UU.) y cianuro de cinc (4,32 mg, Corp, St. Louis, MO, EE.UU.) se añadieron a un vial magnética. Después de sellar el recipiente con un sep gaseoso. Después se añadió DMA (0,2 ml) al tubo de re durante 2 h. La mezcla de reacción se dejó enfriar a TA de jeringa. El material así obtenido se absorbió sobre través de una columna de gel de sílice RediSep-Se (EtOAc:EtOH 3:1) en heptanos de 0% a 100% para dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)b rendimiento). 1H RMN (CDCla) 58,93 (s, 2H), 8,56 (br s, 6,72 (m, 2H), 3,90 (quin, J=7,0 Hz, 1H), 3,79-3,82 (m, 1 3H), 1,38 (d, J=5,6 Hz, 3H). LCMS-ESI (POS.) m/z: 535,
Ejemplo 698.0. Preparación de (1R,2R)-1-(5-clorometil-3-piridinil)-4H-1,2,4-triazol-3-il)-2-din-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-037 mmol), metanosulfonato de (2-diciclohexilfosfino-N) (0,016 g, 0,018 mmol) (disponible en el mercado en nosulfonato de (2-di-t-butilfosfino-2',4',6'-tri-i-propil-1,1 '-ol) (disponible en el mercado en Strem Chemicals, Inc.
[9,9-dimetil-4,5-bis(difenilfosfino)xanteno][2'-amino-1,1'-(disponible en el mercado en Strem Chemicals, Inc.
37 mmol) (disponible en el mercado en Sigma-Aldrich rosca en la parte superior con una barra agitadora de tapón con rosca, el recipiente se purgó con argón ón mediante jeringa. El vial se calentó a 80°C y se agitó espués la mezcla resultante se filtró a través de un filtro apón de gel de sílice y se purificó por cromatografía a eempaquetada (12 g), eluyendo con un gradiente de porcionar la (2S,3R)-3-(5-cianopirimidin-2-il)-N-(4-(2,6--2-sulfonamida (697.0, 0,010 g, 0,019 mmol, 51% de , 8,41 (s, 1H), 8,03 (s, 1H), 7,45 (t, J=8,5 Hz, 1H), 6,61 3,79 (s, 3H), 3,76 (s, 3H), 2,44 (s, 3H), 1,39 (d, J=5,5 Hz, +H)+.
iazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida y (1 S,2S)-1 4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida.
cloro-1,3-tiazol-2-il)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-
(1 S,2S)-1 -(5-clorotiazol-2-il)-1 -metoxipropano-2-sulfona sulfonamida, Ejemplo 698.1. El compuesto del título se 12.0, y 5-clorotiazol-2-carboxaldehído (disponible en descritos en el Ejemplo 11.0. LCMS-ESI (pOs .) m/z: 271 Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 31
y (1 R,2R)-1 -(5-clorotiazol-2-il)-1 -metoxipropano-2-aró a partir de N,N-bis(4-metoxibencil)etanosulfonamida ercado en Acros Organics) usando los procedimientos M+H)+.
ron siguiendo el procedimiento en el Ejemplo A usando
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe
T a b la 32
Ejemplo 703.0. Preparación de (1R,2S)-N-(4-(2,6-di metoxi-2-pirazinil)-2-propanosulfonamida y (1S,2R)toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1-(5-metoxi-2-pirazinil)-2-propanosulfonamida.
(1 S,2R)-1 -hidroxi-1 -(5-metoxipirazin-2-il)propano-2-sulfo 2-sulfonamida, Ejemplo 703.1. El compuesto
metoxibencil)etanosulfonamida 12.0 y 5-metoxipirazina Scientific, Inc.) usando los procedimientos descritos en el
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
Tabla 33
ida y (1 R,2S)-1 -hidroxi-1-(5-metoxipirazin-2-il)propanol título se preparó a partir de N,N-bis(4-carboxaldehído (disponible en el mercado en Frontier jemplo 11.0. LCMS-ESI (POS.) m/z: 269,9 (M+Na)+.
aron siguiendo el procedimiento en el Ejemplo B usando
Ejemplo 704.0. Preparación de (2R,3R)-N-(4-(2,6-di pirazinil)-2 -butanosulfonamida y (2R,3S)-N-(4-(2,6-di pirazinil)-2 -butanosulfonamida y (2S,3R)-N-(4-(2,6-di pirazinil)-2 -butanosulfonamida y (2S,3S)-N-(4-(2,6-di pirazinil)-2 -butanosulfonamida.
toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metoxi-2-toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metoxi-2-toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metoxi-2-toxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metoxi-2-
(2R,3R)-3-(5-metoxipirazin-2-il)butano-2-sulfonamida y (2S,3R)-3-(5-metoxipirazin-2-il)butano-2-sulfonamida
Ejemplo 704.1. 704.1 se sintetizó siguiendo el procedim (disponible en el mercado en Ark Pharm, Inc.). LCMS-ESI Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Tabla 34
(2R,3S)-3-(5-metoxipirazin-2-il)butano-2-sulfonamida y (2S,3S)-3-(5-metoxipirazin-2-il)butano-2-sulfonamida, to en el Ejemplo 10.0 usando 2-bromo-5-metoxipirazina OS.) m/z: 246,2 (M+H)+.
aron siguiendo el procedimiento en el Ejemplo B usando
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
ron siguiendo el procedimiento en el Ejemplo A usando
Tabla 35
Ejemplo 711.0. Preparación de (1R,2S)-1-(5-cloro-2-p¡r¡d¡ triazol-3-il)-1 -metox¡-2-propanosulfonam¡da o (1 S,2R) pirid¡n¡l)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonami )-N-(4-(4,6-d¡metox¡-5-p¡r¡m¡d¡n¡l)-5-(3-p¡r¡d¡nil)-4H-1,2,4-(5-cloro-2-p¡r¡d¡n¡l)-N-(4-(4,6-d¡metox¡-5-p¡rim¡d¡n¡l)-5-(3-
(1 R,2S)-1 -(5-cloropirid¡n-2-¡l)-1 -metoxipropano-2-sulfonami sulfonamida, Ejemplo 711.1. El Ejemplo 711.1 se prepar cloropirid¡n-2-¡l)-1 -metoxipropano-2-sulfonamida y (1 S Ejemplo 529.3. El compuesto del título era el segundo ( columna AD. Realizado en Thar 80 SFC con columna de mM) 65,6 g/min de CO2, 18% de co-disolvente a 80 g/mi onda = 271 nm. Inyectado 1,0 ml de 360 mg de muestr mg/ml y 10 mg por inyección. Tiempo de ciclo 5,8 min, (M+H)+.
o (1 S,2R)-1 -(5-cloropirid¡n-2-¡l)-1 -metoxipropano-2-or separación SFC quiral de compuesto (1R,2S)-1-(5-)-1 -(5-cloropirid¡n-2-¡l)-1 -metoxipropano-2-sulfonamida, más tardío frente al enantiómero opuesto) pico en la 0 x 30 mm AD-H con 14,4 ml/min de EtOH (+NH320 Temp. = 29°C, Presión de salida = 100 bar, Longitud de isuelta en 36,0 ml de EtOH:MeOH:DCM 22:6:8; c= 10 mpo de análisis 15 min. LCMS-ESI (POS.) m/z: 265,1
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
Tabla 36
aron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 719.0. Preparación de (1R,2S)-1-ciclobutil-N-(4 1-metoxipropano-2-sulfonamida y (1S,2R)-1-ciclobutil-N-il)-1 -metoxipropano-2-sulfonamida o (1 S,2S)-1-cic triazol-3-il)-1-metoxipropano-2-sulfonamida y (1 R,2R) 1,2,4-triazol-3-il)-1 -metoxipropano-2-sulfonamida.
-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-til-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-iclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-
(1R,2S)-1-ciclobutil-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiri y (1S,2R)-1-ciclobutil-N-(4-(2,6-dimetoxifenil)-sulfonamida o (1 S,2s )-1 -ciclobutil-N-(4-( metoxipropano-2-sulfonamida y (1 R,2R)-1-ciclobutil-N-il)-1-metoxipropano-2-sulfonamida, Ejemplo 719.0. 71 Ejemplo A usando el 1.0, 3.11 y 24.0. Esto suministró (d, J=1,46 Hz, 1H), 8,33 (d, J=1,90 Hz, 1H), 7,64 (d, J=0 3,84 (dd, J=1,53, 8,84 Hz, 1H), 3,75 (s, 3H), 3,75 (s, 3 2,30 (s, 3H), 2,04-2,16 (m, 1H), 1,70-2,00 (m, 5H), 1,27 (
Ejemplo 720.0. Preparación de (1S,2S)-1-(3,3-difluor -il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-sulfonamida metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-e preparó siguiendo el procedimiento descrito en el emplo 719.0. 1H RMN (CDCh) 5 11,02 (br. s., 1H), 8,44 z, 1H), 7,38 (t, J=8,55 Hz, 1H), 6,60 (d, J=8,48 Hz, 2H), ,33 (s, 3H), 2,83-2,95 (m, 1H), 2,39 (d, J=7,89 Hz, 1H), =7,02 Hz, 3H). LCMS-ESI (POS.) m/z: 502,0 (M+H)+.
butil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamidaand o (1 R,2S)-1 -(3,3-difluorociclobutil)-N-(4-1 -hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(3,3-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamida.
3,3-Difluorociclobutanocarbaldehído, Ejemplo 720.1. U difluorociclobutil)metanol (0,513 g, 4,20 mmol, Advance peryodinano de Dess-Martin (1,83 g, 4,32 mmol), y la agua (3 x 20 ml) y se pasó a través de un cartucho d capa orgánica se concentró con cuidado para dar un líq usó en la siguiente reaction sin purificación. 1H RMN (3 2,94 - 2,70 (m, 4H).
720.1
traz de fondo redondo de 250 ml se cargó con (3,3-emblocks Inc.) y DCM (20 ml). Se añadió en porciones a se agitó a TA Después de 4 h, la mezcla se lavó con acción Chem Elute eluyendo con DCM (2 x 10 ml). La ransparente como el producto (0,54 g). Este material se z, CDCh) 59,79 (t, J=1,7 Hz, 1H), 3,13 - 2,96 (m, 1H),
(1 S,2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-hidroxipropano-2 -sulfonamida y (1 S,2 R)-1 -(3,3-difluor 1 ,2,4-triazol-3-il)-1 -hidroxipropano-2 -sulfonamida y
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il 720.2 se preparó siguiendo el procedimiento descrito Ejemplo 720.2. LCMS-ESI (POS.) m/z: 539,9 (M+H)+.
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -butil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida y (1 R,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-droxipropano-2-sulfonamida, Ejemplo 720.2. El Ejemplo l Ejemplo 264.0 usando 5.0 y 720.1. Esto suministró el
(1 S,2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-hidroxipropano-2 -sulfonamida o (1 S,2 R)-1 -(3,3-difluor 1 ,2,4-triazol-3-il)-1 -hidroxipropano-2 -sulfonamidaand o metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il compuesto del título 720.0 era el primer isómero en el SFC: columna AD-H (21 x 150 mm), MeOH con NH320 nm. 1H RMN (300 MHz, CD3OD) 57,66-7,75 (m, 1H), 7 metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -butil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-fonamida o (1 R,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-droxipropano-2-sulfonamida, Ejemplo 720.0. El ando se somete 720.2 a las siguientes condiciones de CO2 al 20%, 100 bar, 70 ml/min, longitud de onda = 220 ,63 (m, 1H), 7,41 (t, J=8,48 Hz, 1H), 6,69-6,81 (m, 3H),
4,02-4,10 (m, 1H), 3,74 (s, 3H), 3,72 (s, 3H), 3,17 (s, 3 1,27 (d, J=7,02 Hz, 3H). LCMS-ESI (POS.) m/z: 539,9 (
Ejemplo 721.0. Preparación de (1S,2S)-1-(3,3-difluor 1 ,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri 90-3,02 (m, 1H), 2,37-2,64 (m, 3H), 2,17-2,35 (m, 2H),
util)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-onamidaand o (1 R,2S)-1 -(3,3-difluorociclobutil)-N-(4--hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(3,3-l)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamida.
(1 S,2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-hidroxipropano-2-sulfonamida o (1 S,2 R)-1 -(3,3-difluor 1.2.4- triazol-3-il)-1 -hidroxipropano-2-sulfonamidaand o metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) preparó a partir de 720.2 por las dos siguientes purifi picos que eluyen por la primera purificación de 720. mediante la segunda purificación SFC: columna OZ-H ( 70 ml/min, longitud de onda = 220 nm. 721.0 era el seg MHz, CD3OD) 57,66-7,75 (m, 1H), 7,54-7,63 (m, 1H), 7 3,73 (s, 3H), 3,72 (s, 3H), 3,17 (s, 4H), 2,30-2,61 (m, (M+H)+.
Ejemplo 722.0: Preparación de (1S,2S)-1-(3,3-difluor 1.2.4- triazol-3-il)-1 -hidroxipropano-2-sulfonamida o ( metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -util)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-onamida o (1 R,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-roxipropano-2-sulfonamida, Ejemplo 721.0. 721.0 se es SFC: Se obtuvo una mezcla del segundo y tercer crita en 720.0. La mezcla del picos se purificó más 50 mm), MeOH con NH320 mM/CO2 al 25%, 100 bar, pico en eluir de la segunda purificación. 1H RMN (300 J=8,48 Hz, 1H), 6,66-6,81 (m, 3H), 3,85-3,92 (m, 1H), 1,24 (d, J=7,16 Hz, 3H). LCMS-ESI (POS.) m/z: 539,9
util)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-onamidaand o (1 R,2S)-1 -(3,3-difluorociclobutil)-N-(4--hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(3,3-l)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-sulfonamida.
(1 S,2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-hidroxipropano-2-sulfonamida o (1 S,2 R)-1 -(3,3-difluor 1 ,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamidaand o metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il) 722.0 es el enantiómero de 720.0. 722.0 era el último i SFC descritas en 720.0. 1H RMN (300 MHz, CD3OD) 5 etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -util)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-onamida o (1 R,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-roxipropano-2-sulfonamida, Ejemplo 722.0. El Ejemplo o en eluir cuando se somete 720.2 a las condiciones de ,75 (m, 1H), 7,57-7,63 (m, 1H), 7,41 (t, J=8,48 Hz, 1H),
6,70-6,80 (m, 3H), 4,03-4,09 (m, 1H), 3,74 (s, 3H), 3,7 12,61 Hz, 3H), 2,16-2,33 (m, 2H), 1,27 (d, J=7,02 Hz, 3
Ejemplo 723.0: Preparación de (1S,2S)-1-(3,3-difluor 1 ,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamida o
metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropano-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazo difluorocydobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiri sulfonamida.
3H), 3,17 (s, 3H), 2,90-3,02 (m, 1H), 2,49 (dt, J=6,36, MS-ESI (POS.) m/z: 539,9 (M+H)+.
butil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-onamidaand o (1 R,2S)-1 -(3,3-difluorociclobutil)-N-(4-1 -hidroxipropano-2-sulfonamida o (1 R,2R)-1 -(3,3-il)-4H-1,2,4-triazol-3-il)-1-hidroxipropano-2-
(1 S,2S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-hidroxipropano-2-sulfonamida o (1 S,2 R)-1 -(3,3-difluor 1 ,2,4-triazol-3-il)-1 -hidroxipropano-2-sulfonamidaand o metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -hidroxipropanodimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il preparó a partir de 720.2 por las dos siguientes purifica picos que eluyen mediante la primera purificación de mediante la segunda purificación por SFC: OZ-H (21 x bar, 70 ml/min, longitud de onda = 220 nm. 723.0 era el MHz, CD3OD) 57,64-7,73 (m, 1H), 7,56-7,62 (m, 1H), 3,73 (s, 3H), 3,72 (s, 3H), 3,17 (s, 4H), 2,30-2,64 (m, (M+H)+.
Ejemplo 724.0: Preparación de (1R,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclob dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)etoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -butil)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-S)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-dimetoxifenil)-5-(6-onamida o (1 R,2R)-1 -(3,3-difluorociclobutil)-N-(4-(2,6-roxipropano-2-sulfonamida, Ejemplo 723.0. 723.0 se s por SFC: Se obtuvo una mezcla del segundo y tercer descrita en 720.0. La mezcla de picos se purifico más m) columna, MeOH con NH320 mM/CO2 al 25%, 100 r pico en eluir de la segunda purificación. 1H RMN (300 , J=8,48 Hz, 1H), 6,67-6,80 (m, 3H), 3,85-3,92 (m, 1H), 1,25 (d, J=7,02 Hz, 3H). LCMS-ESI (POS.) m/z: 540,0
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetilciclobutil)-1-metoxipropano-2-sulfonamida.
(3,3-Dimetilciclobutil)metanol, Ejemplo 724.1. A una d (1,00 g, 7,80 mmol, Parkway Scientific) en THF (30 ml gota a 0°C a lo largo de 10 min. La mezcla se agitó y frío. Después de 3 h, la reacción se inactivó por adición de agua, secuencialmente. La mezcla se agitó durant cartucho de extracción Chem Elute eluyendo con TBM fase orgánica se concentró con cuidado para obtener siguiente reacción sin purificación. 1H RMN (300 MHz, 1,85 (m, 2H), 1,52 (dd, J=8,77, 11,98 Hz, 2H), 1,16 (s, 724.1
ión agitada de ácido 3,3-dimetilciclobutanocarboxílico añadió LAH (2,0 M en THF, 4,3 ml, 8,60 mmol) gota a entó lentamente a TA a medida que terminaba el baño 33 ml agua, 0,33 ml de NaOH al 15% y después 1,0 ml in y después una parte de la misma se pasó por un 20 ml). El resto se filtró a través de papel de filtro. La g de aceite transparente. Este material se usó en la h) 53,58 (d, J=6,72 Hz, 2H), 2,34-2,53 (m, 1H), 1,76 ,06 (s, 3H).
724,1
3,3-Dimetilciclobutanocarbaldehído, Ejemplo 724.2. Est de 720.1 a 724.1. El material 724.2 así obtenido se usó 724.2
puesto se preparó como se describe en la preparación siguiente reacción sin purificación.
(1 R,2S)-1 -(3,3-dimetilciclobutil)-1 -hidroxi-N,N-bis(4-met dimetilciclobutil)-1 -hidroxi-N,N-bis(4-metoxibencil)propa N,N-bis(4-metoxibencil)propano-2-sulfonamida
metoxibencil)propano-2-sulfonamida, Ejemplo 724.3.
descrita en el Ejemplo 24.01 usando el Ejemplo 724.2 RMN (300 MHz, CDCls) 57,13-7,23 (m, 4H), 6,87 (d, J 2H), 3,79-3,90 (m, 8H), 2,93 (t, J=7,31 Hz, 1H), 2,48 (dt 1,06 (s, 3H). LCMS-ESI (POS.) m/z: 484,0 (M+Na)+.
cil)propano-2-sulfonamida y (1 S,2R)-1 -(3,3-ulfonamida o (1 S,2S)-1 -(3,3-dimetilciclobutil)-1 -hidroxi-(1 R,2R)-1 -(3,3-dimetilciclobutil)-1 -hidroxi-N,N-bis(4-mplo 724.3 se preparó en una forma análoga a la primer pico que eluía de la purificación dio 724.3. 1H Hz, 4H), 4,48 (d, J=15,20 Hz, 2H), 4,10 (d, J=15,35 Hz, 58, 8,62 Hz, 1H), 1,67-1,83 (m, 4H), 1,13-1,19 (m, 6H),
(1 R,2S)-1 -(3,3-dimetilciclobutil)-1 -hidroxi-N,N-bis(4-met dimetilciclobutil)-1 -hidroxi-N,N-bis(4-metoxibencil)propa N,N-bis(4-metoxibencil)propano-2-sulfonamida
metoxibencil)propano-2-sulfonamida, Ejemplo 724.4. El 1H RMN (300 MHz, CDCla) 57,23 (d, J=8,62 Hz, 4H), 6 4,05 (d, J=9,35 Hz, 1H), 3,82 (s, 7H), 2,73-2,85 (m, 2H), 11,25 Hz, 1H), 1,21 (d, J=7,16 Hz, 3H), 1,13 (s, 3H), 1,0 cil)propano-2-sulfonamida y (1 S,2R)-1 -(3,3 ulfonamida o (1 S,2S)-1 -(3,3-dimetilciclobutil)-1 -hidroxi-(1 R,2R)-1 -(3,3-dimetilciclobutil)-1 -hidroxi-N,N-bis(4-do pico que eluía de la purificación de 724.3 dio 724.4. , J=8,77 Hz, 4H), 4,35-4,44 (m, 2H), 4,20-4,30 (m, 2H), (q, J=8,62 Hz, 1H), 1,87-1,99 (m, 1H), 1,68 (dd, J=8,48, H). LCMS-ESI (POS.) m/z: 484,0 (M+Na)+.
(1 R,2S)-1 -(3,3-dimetilciclobutil)-1 -metoxi-N,N-bis(4-met dimetilciclobutil)-1 -metoxi-N,N-bis(4-metoxibencil)propa N,N-bis(4-metoxibencil)propano-2-sulfonamida
metoxibencil)propano-2-sulfonamida, Ejemplo 724.5.
descrita en el Ejemplo 24.03 usando 724.3. 1H RMN (4 (d, J=15,26 Hz, 2H), 4,12 (d, J=15,26 Hz, 2H), 3,79-3,8 7,07 Hz, 1H), 2,63-2,73 (m, 1H), 1,80-1,87 (m, 1H), 1, 1,03 (s, 3H). LCMS-ESI (POS.) m/z: 498,0 (M+Na)+.
ncil)propano-2-sulfonamida y (1 R,2S)-1 -(3,3-sulfonamida o (1 R,2S)-1 -(3,3-dimetilciclobutil)-1 -metoxi-(1 R,2S)-1 -(3,3-dimetilciclobutil)-1 -metoxi-N,N-bis(4-jemplo 724.5 se preparó en una forma análoga a la Hz, CDCh) 57,19-7,24 (m, 4H), 6,85-6,89 (m, 4H), 4,47 , 6H), 3,53-3,57 (m, 1H), 3,31 (s, 3H), 3,14 (dq, J=3,42, , J=9,00 Hz, 2H), 1,67-1,72 (m, 1H), 1,12-1,18 (m, 6H),
(1 R,2S)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-sulfo ida y (1 S,2R)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-
2-sulfonamida o (1S,2S)-1-(3,3-dimetilciclobutil)-1-meto metoxipropano-2-sulfonamida, Ejemplo 724.6. El Ejemp Ejemplo 24.0 usando 724.5. 1H RMN (300 MHz, CDCla 3,15 (m, 1H), 2,58-2,80 (m, 1H), 1,65-1,86 (m, 4H), 1, (POS.) m/z: 258,0 (M+Na)+.
ano-2-sulfonamida y (1R,2R)-1-(3,3-dimetilciclobutil)-1-4.6 se preparó en una forma análoga a la descrita en el ,52-4,87 (m, 2H), 3,51 (s, 3H), 3,36-3,42 (m, 1H), 3,05 J=7,16 Hz, 3H), 1,17 (s, 3H), 1,06 (s, 3H). LCMS-ESI
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida y ( triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-s procedimiento descrito en el Ejemplo A usando 1.0, 3.1 -triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-iridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 724.7. 724.7 se preparó siguiendo el 4.6. Lc Ms -Es I (POS.) m/z: 530,0 (M+H)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-s el primer isómero en eluir cuando se somete 724.7 a l mm), iPrOH/CO2 al 20-80%, 186 bar, 70 ml/min, longitu s., 1H), 8,44 (s, 1H), 8,32 (s, 1H), 7,63 (s, 1H), 7,39 (t, 3H), 3,60 (dd, J=3,22, 4,38 Hz, 1H), 3,36 (s, 3H), 3,2 1,59-1,89 (m, 4H), 1,22 (d, J=7,16 Hz, 3H), 1,07 (s, 3H),
Ejemplo 725.0. Preparación de (1R,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclob dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-iridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 724.0. El compuesto del título 724.0 era uientes condiciones de SFC: columna AD-H (21 x 250 onda = 220 nm. 1H RMN (300 MHz, CDCh) 511,01 (br.
5 Hz, 1H), 6,61 (t, J=7,75 Hz, 2H), 3,76 (s, 3H), 3,73 (s, (m, 1H), 2,62 (dt, J=4,46, 8,81 Hz, 1H), 2,30 (s, 3H), (s, 3H). LCMS-ESI (POS.) m/z: 530,0 (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6--dimetilciclobutil)-1-metoxipropano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-s enantiómero del Ejemplo 724.0. El Ejemplo 725.0 era condiciones de SFC descritas en 724.0. 1H RMN (300 (d, J=1,75 Hz, 1H), 7,63 (s, 1H), 7,39 (t, J=8,48 Hz, 1H) (m, 1H), 3,36 (s, 3H), 3,31 (s, 1H), 2,62 (dt, J=4,68, 8,8 3H), 1,07 (s, 3H), 0,99 (s, 3H). LCMS-ESI (POS.) m/z: 5
Ejemplo 726.0. Preparación de (1R,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclob dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-iridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 725.0. El Ejemplo 725.0 es el gundo isómero en eluir cuando se somete 724.7 a las DCto) 510,99 (br. s., 1H), 8,44 (d, J=1,61 Hz, 1H), 8,32 (t, J=7,75 Hz, 2H), 3,76 (s, 3H), 3,73 (s, 3H), 3,56-3,64 1H), 2,30 (s, 3H), 1,59-1,90 (m, 4H), 1,22 (d, J=7,16 Hz, (M+H)+.
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6--dimetilciclobutil)-1-metoxipropano-2-sulfonamida.
Ejemplo 726.1: (1R,2S)-1-(3,3-dimetilciclobutil)-1-meto metoxipropano-2-sulfonamida o (1S,2S)-1-(3,3-dimetil dimetilciclobutil)-1-metoxipropano-2-sulfonamida. El Eje usando 724.4. 1H RMN (400 MHz, CDCla) 54,51 (br. s Hz, 1H), 2,28-2,43 (m, 1H), 2,05 (t, J=11,54 Hz, 1H), 1 (d, J=7,04 Hz, 3H), 1,18 (s, 3H), 1,07 (s, 3H). LCMS-ESI ano-2-sulfonamida y (1S,2R)-1-(3,3-dimetilciclobutil)-1-util)-1-metoxipropano-2-sulfonamida y (1R,2R)-1-(3,3-726.1 se preparó de una forma análoga a la de 724.6 ), 3,93 (d, J=9,39 Hz, 1H), 3,43 (s, 3H), 3,07 (q, J=6,85 ,92 (m, 1H), 1,67-1,78 (m, 1H), 1,45-1,54 (m, 1H), 1,35 S.) m/z: 258,0 (M+Na)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida y ( triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-s siguiendo el procedimiento descrito en el Ejemplo A usa -triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3 )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 726.2. El Ejemplo 726.2 se preparó .0, 3.11 y 726.1. LCMS-ESI (POS.) m/z: 530,0 (M+H)+.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-s el primer isómero en eluir cuando se somete 726.2 a l mm), iPrOH/CO2 al 20-80%, 186 bar, 70 ml/min, longitu s., 1H), 8,44 (d, J=1,61 Hz, 1H), 8,33 (d, J=1,75 Hz, 1 2H), 3,83 (dd, J=1,32, 8,92 Hz, 1H), 3,75 (s, 3H), 3,74 1,97 (m, 1H), 1,59-1,77 (m, 2H), 1,46-1,56 (m, 1H), 1, (POS.) m/z: 530,0 (M+H)+.
Ejemplo 727.0. Preparación de (1R,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclob dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 726.0. El compuesto del título 726.0 era uientes condiciones de SFC: columna AD-H (21 x 250 nda = 220 nm. 1H RMN (300 MHz, CDCh) 511,03 (br.
3 (s, 1H), 7,38 (t, J=8,48 Hz, 1H), 6,60 (d, J=8,62 Hz, ), 3,31 (s, 3H), 2,83-2,95 (m, 1H), 2,30 (m, 4H), 1,85 J=7,02 Hz, 3H), 1,12 (s, 3H), 1,04 (s, 3H). LCMS-ESI
xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5--metoxipropano-2-sulfonamida o (1 R,2R)-N-(4-(2,6-dimetilciclobutil)-1-metoxipropano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metoxipropano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-d dimetilciclobutil)-1 -metoxipropano-2-sulfonamida o ( triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-s enantiómero del Ejemplo 726.0. El Ejemplo 727.0 era condiciones de SFC descritas en 726.0. 1H RMN (300 (d, J=1,90 Hz, 1H), 7,64 (s, 1H), 7,38 (t, J=8,55 Hz, 1 3,75 (s, 3H), 3,74 (s, 3H), 3,31 (s, 3H), 2,83-2,93 (m, 1 1,77 (m, 2H), 1,46-1,56 (m, 1H), 1,27 (d, J=7,16 Hz, 3 (M+H)+.
Ejemplo 728.0. Preparación de (R)-N-(4-(2,6-dimetoxi metilpirimidin-2-il)etanosulfonamida o (S)-N-(4-(2,6-dim 2-(5-metilpirimidin-2-il)etanosulfonamida.
-triazol-3-il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-ridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -xifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida, Ejemplo 727.0. El Ejemplo 727.0 es el gundo isómero en eluir cuando se somete 726.2 a las DCh) 511,03 (br. s., 1H), 8,44 (d, J=1,46 Hz, 1H), 8,33 60 (d, J=8,62 Hz, 2H), 3,83 (dd, J=1,32, 8,92 Hz, 1H), 0 (m, 4H), 1,91 (ddd, J=3,87, 7,64, 11,14 Hz, 1H), 1,58 12 (s, 3H), 1,04 (s, 3H). LCMS-ESI (POS.) m/z: 530,0
5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-enil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-
(R)-2-((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-2-(5-metilpiri fondo redondo de 150 ml se cargó con 383.2 (0,266 g mmol) y la solución amarillo claro se agitó a 0°C. dimetiletil)dimetilsililo (0,150 ml, 0,653 mmol) a lo largo el baño frío y la mezcla se agitó a TA Después de 3 h, trifluorometanosulfonato de (1,1 -dimetiletil)dimetilsililo ( después se diluyó con EtOAc (20 ml) y se lavó con sol orgánica se secó pasándola por un cartucho de extrac material orgánico se concentró y el producto resultante g, eluyente: EtOAc en hexanos al 0 - 50%) para dar transparente. 1H RMN (300 MHz, CDCla) 58,57 (s, 2H) J=5,48, 6,94 Hz, 1H), 4,15-4,30 (m, 4H), 3,81 (s, 6H), 3H), 0,80-0,89 (m, 9H), 0,12 (s, 3H), -0,06 (s, 3H). LCM etilpirimidin-2-il)etanosulfonamida y (R)-2-((terc-2-il)etanosulfonamida, Ejemplo 728.1. Un matraz de mmol) y DCM (5 ml). Se añadió TEA (0,100 ml, 0,72 ñadió gota a gota trifluorometanosulfonato de (1,1-in y la mezcla se agitó a 0°C durante 10 min. Se retiró dió TEA (0,20 ml) seguido de la adición gota a gota de l). La mezcla se agitó a TA durante 14 h. La mezcla acuosa saturada de cloruro sódico (2 x 20 ml). La fase hem Elute (5 ml) eluyendo con EtOAc (2 x 10 ml). El rificó por cromatografía en columna en gel de sílice (25 (0,33 g, 98% de rendimiento) en forma de un aceite (d, J=8,77 Hz, 4H), 6,85 (d, J=8,62 Hz, 4H), 5,41 (dd, ,78 (m, 1H), 3,38 (dd, J=5,41, 13,59 Hz, 1H), 2,32 (s, (POS.) m/z: 572,0 (M+H)+.
(R)-2-((terc-butildimetilsilil)oxi)-2-(5-metilpirimidin-2-il)eta metilpirimidin-2-il)etanosulfonamida, Ejemplo 728.2. 72 Ejemplo 15.0 usando 728.1. 1H RMN (300 MHz, CDCh) 3,82 (m, 1H), 3,58-3,68 (m, 1H), 2,34 (s, 3H), 0,86 (d, J m/z: 332,0 (M+H)+.
lfonamida y (S)-2-((terc-butildimetilsilil)oxi)-2-(5-e preparó en una forma análoga a la descrita en el ,59 (s, 2H), 5,41-5,49 (m, 1H), 4,97-5,16 (m, 2H), 3,71 Hz, 9H), 0,09 (s, 3H), -0,06 (s, 3H). LCMS-ESI (POS.)
(R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4 il)etanosulfonamida y (S)-N-(4-(2,6-dimetoxif metilpirimidin-2-il)etanosulfonamida, Ejemplo 728.3. El E en el Ejemplo A usando 1.0, 3.11 y 728.2. Esto suministr ol-3-il)-2-hidroxi-2-(5-metilpirimidin-2-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-lo 728.3 se preparó siguiendo el procedimiento descrito Ejemplo 728.3. LCMS-ESI (POS.) m/z: 512,0 (M+H)+.
(R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4 il)etanosulfonamida o (S)-N-(4-(2,6-dimetoxif metilpirimidin-2-il)etanosulfonamida, Ejemplo 728.0. El cuando se somete 728.3 a las siguientes condiciones d 100 bar, 60 ml/min, longitud de onda = 220 nm. 1H RMN J=1,61 Hz, 1H), 8,34 (d, J=1,90 Hz, 1H), 7,64 (s, 1H), 7 (d, J=9,21 Hz, 1H), 4,37 (br. s., 1H), 3,71-3,81 (m, 7H), LCMS-ESI (POS.) m/z: 512,0 (M+H)+.
Ejemplo 729.0. Preparación de (R)-N-(4-(2,6-dimetoxif metilpirimidin-2 -il)etanosulfonamida o (S)-N-(4-(2,6-dim 2-(5-metilpirimidin-2-il)etanosulfonamida.
ol-3-il)-2-hidroxi-2-(5-metilpirimidin-2-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-puesto del título 728.0 era el primer isómero en eluir C: columna OZ-H (21 x 250 mm), MeOH/CO2 al 45%, MHz, CDCh) 511,14 (br. s., 1H), 8,58 (s, 2H), 8,45 (d, (t, J=8,48 Hz, 1H), 6,61 (dd, J=1,10, 8,55 Hz, 2H), 5,35 (dd, J=9,28, 14,25 Hz, 1H), 2,32 (d, J=6,58 Hz, 6 H).
5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-enil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-
(R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4 il)etanosulfonamida o (S)-N-(4-(2,6-dimetoxif metilpirimidin-2-il)etanosulfonamida, Ejemplo 729.0. El E era el segundo isómero en eluir cuando se somete 728.3 MHz, CDCh) 511,14 (br. s., 1H), 8,58 (s, 2H), 8,45 (d, J J=8,48 Hz, 1 H), 6,61 (dd, J=1,10, 8,55 Hz, 2H), 5,35 (d (dd, J=9,28, 14,25 Hz, 1H), 2,32 (d, J=6,58 Hz, 6 H). LC
Ejemplo 730.0. Preparación de (1R,2S)-N-(4-(4,6-dimet 1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-sulfonamida 2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxi dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida o (1 R,2R)-N-(4-(4,6-dimetoxipiri dimetilciclobutil)-1 -metoxipropano-2 -sulfonamida.
ol-3-il)-2-hidroxi-2-(5-metilpirimidin-2-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-2-hidroxi-2-(5-lo 729.0 es el enantiómero de 728.0. El Ejemplo 729.0 s condiciones de SFC descritas en 728.0. 1H RMN (300 Hz, 1 H), 8,34 (d, J=1,90 Hz, 1H), 7,64 (s, 1 H), 7,39 (t, ,21 Hz, 1H), 4,37 (br. s., 1H), 3,71-3,81 (m, 7H), 3,51 I (POS.) m/z: 512,0 (M+H)+.
irimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-,2R)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridinano-2 -sulfonamida o (1 S,2S)-N-(4-(4,6--il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2--5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-
(1 R,2S)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridi metoxipropano-2 -sulfonamida y (1 S,2R)-N-(4-(4,6-dimet 1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-sulfonamida 2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxi dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida, Ejemplo 730.1. El Ejemplo 730.1 se pre usando 1.1,3.11 y 726.1. Esto suministró el Ejemplo 730 )-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -irimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-,2S)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridinano-2-sulfonamida y (1 R,2R)-N-(4-(4,6--il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-siguiendo el procedimiento descrito en el Ejemplo A CMS-ESI (POS.) m/z: 548,0 (M+H)+.
(1 R,2S)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridi metoxipropano-2 -sulfonamida o (1 S,2R)-N-(4-(4,6-dimet 1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-sulfonamida 2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -metoxi dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tria sulfonamida, Ejemplo 730.0. El compuesto del título 730 las siguientes condiciones de SFC: columna IE (21 x longitud de onda = 220 nm. 1H RMN (300 MHz, CDCh) 5 (m, 1H), 3,93 (s, 6 H), 3,85 (dd, J=1,46, 8,92 Hz, 1H), 3,3 )-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -irimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-,2S)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridinano-2-sulfonamida o (1 R,2R)-N-(4-(4,6--il)-1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-a el primer isómero en eluir cuando se somete 730.1 a mm), MeOH con NH320 mM/CO2 al 30%, 70 ml/min, 9 (br. s., 1H), 8,44 (s, 1H), 7,61-7,69 (m, 2H), 6,71-6,80 3H), 3,24 (s, 3H), 2,91 (dd, J=1,53, 7,09 Hz, 1 H), 2,21 -
2,39 (m, 1H), 1,87-1,99 (m, 1H), 1,70-1,80 (m, 1H), 1, 1,13 (s, 3H), 1,05 (s, 3H). LCMS-ESI (POS.) m/z: 548,0
Ejemplo 731.0. Preparación de (1R,2S)-N-(4-(4,6-dim 1-(3,3-dimetilcidobutil)-1-metoxipropano-2-sulfonamida 2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -meto dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tri sulfonamida o (1 R,2R)-N-(4-(4,6-dimetoxipir dimetilciclobutil)-1 -metoxipropano-2-sulfonamida.
9 (m, 1H), 1,46-1,56 (m, 1H), 1,27 (d, J=7,02 Hz, 3H), )+.
irimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-,2R)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridinano-2-sulfonamida o (1 S,2S)-N-(4-(4,6--il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2--5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-
(1 R,2S)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridi metoxipropano-2-sulfonamida o (1 S,2R)-N-(4-(4,6-dim 1 -(3,3-dimetilciclobutil)-1 -metoxipropano-2-sulfonamida 2-il)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -meto dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tri sulfonamida, Ejemplo 731.0. El Ejemplo 731.0 era el condiciones de SFC descritas en 730.0. 1H RMN (300 2H), 6,72-6,81 (m, 1H), 3,93 (s, 6H), 3,85 (dd, J=1,32, 2,22-2,40 (m, 1H), 1,87-1,98 (m, 1H), 1,63-1,79 (m, 2H 3H), 1,05 (s, 3H). LCMS-ESI (POS.) m/z: 548,0 (M+H)+.
Ejemplo 732.0. Preparación de (2S,3R)-N-(4-(3,5-dibr il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida.
)-4H-1,2,4-triazol-3-il)-1 -(3,3-dimetilciclobutil)-1 -irimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-,2S)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridinano-2-sulfonamida o (1 R,2R)-N-(4-(4,6--il)-1-(3,3-dimetilciclobutil)-1-metoxipropano-2-ndo isómero en eluir cuando se somete 730.1 a las CDCh) 510,99 (br. s., 1H), 8,44 (s, 1H), 7,61-7,71 (m, Hz, 1H), 3,34 (s, 3H), 3,24 (s, 3H), 2,86-2,97 (m, 1H), 4 (d, J=9,79 Hz, 1H), 1,27 (d, J=7,02 Hz, 3H), 1,13 (s,
,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-
(2S,3R)-N-(4-(3,5-dibromo-2,6-dimetoxifenil)-5-(5-metilp 2-sulfonamida, Ejemplo 732.0. En un vial que contenía una solución heterogénea de (2S,3R)-N-(4-(2,6 metilpirimidin-2-il)butano-2-sulfonamida (Ejemplo 263.0 adición, la mezcla se dejó calentar a 23°C y se siguió un baño de hielo. Después de 20 minutos, se añadió N llevar la reacción hasta completarse. Tras completarse siguió por LCMS-ESI. Después de 91 horas en total, l con solución acuosa saturada de cloruro sódico. Los l veces con EtOAc. Las capas orgánicas combinadas se se concentraron a presión reducida. El residuo se ca heptano al 0-60%). Las fracciones que contenía pro reducida para dar la (2S,3R)-N-(4-(3,5-dibromo-2,6 metilpirimidin-2-il)butano-2-sulfonamida (Ejemplo 732.0) rendimiento). 1H RMN (500 MHz, DMSO-ds) 5 13,80 (s Hz, 1H), 7,71 (s, 1H), 3,72 (s, 3H), 3,72 (s, 3H), 3,70 - 3 1,16 (d, J=6,8 Hz, 3H). LCMS-ESI (POS.) m/z: 682,1 (M 3-il)-4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-(436 mg, 2,45 mmol) en DMF (1 ml) a <5°C se añadió toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-mg, 0,57 mmol) en DMF (1 ml). Tras completarse la MS-ESI. Después de 19 horas, la mezcla se enfrió en icional (421 mg, 2,37 mmol) en porciones para intentar ición de NBS, la mezcla se dejó calentar a 23°C y se cla se diluyó con EtOAc y después se lavó tres veces s acuosos se combinaron y después se extrajeron dos on sobre sulfato sódico anhidro y después se filtraron y n una columna de gel de sílice (EtOAc: EtOH 3:1 en se combinaron y después se concentraron a presión toxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-3-(5-rma de un sólido blanco (199 mg, 0,29 mmol, 51 % de 8,57 (s, 2H), 8,52 (s, 1H), 8,30 (s, 1H), 8,23 (d, J=1,5 , 2H), 2,28 (s, 3H), 2,23 (s, 3H), 1,24 (d, J=6,8 Hz, 3H),
Ejemplo 733.0. Preparación de (2S,3R)-N-(5-(5-br metilpirimidin-2-il)butano-2-sulfonamida.
iridin-3-il)-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-3-(5-
(2S,3R)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida, E flujo de nitrógeno con (E)-3-(5-metilpirimidin-2-il)but-2-equiv), trifluorometanosulfonato de cinc (12,79 g, 0, ciclooctadieno)rodio(I) (1,43 g, 0,00352 mol, 0, naftilfosfino)ferrocenil]-etil-di-terc-butilfosfina (2,60 g, 0, se purgó con nitrógeno y después con hidrógeno, y la reacción se siguió por HPLC y mostró una conversión resultante se concentró a 35°C con vacío industrial pa con EtOH (742 ml), y la suspensión resultante se agitó EtOH (2 x 97 ml) y se secó a 40°C con vacío para dar e rendimiento, 99%ee). 1H RMN (400 MHz, DMSO-afe): 5 (s, 3H), 1,32 (d, J = 6,9 Hz, 3H), 1,20 (d, J = 7,0 Hz, 3H) Los compuestos expuestos en la siguiente tabla se sin el material de partida conocido como se describe.
Tabla 37
o 733.1. Un reactor de presión de 900 ml se cargó con -sulfonamida, Ejemplo 10.05 (40,00 g, 0,1760 mol, 1 mol, 0,2 equiv, Aldrich), tetrafluoroborato de bis(1,5-quiv, Stream Chemicals, Inc.), (S)-1-[(R)-2-(di-1-mol, 0,023 equiv, Solvias) y MeOH (520 ml). La mezcla se agitó a 3-4 bars de hidrógeno durante 20 horas. La leta. El reactor se purgó con nitrógeno, y la suspensión r un sólido naranja. El material así obtenido se mezcló 25°C durante 40 minutos. El sólido se filtró, se lavó con puesto del título en forma de un polvo blanco (85,2% de (s, 2H), 6,84 (s, 2H), 3,69 (tt, J = 12,4, 4,5 Hz, 2H), 2,25 (ESI, ion positivo) m/z; 230,1 (M+H)+.
ron siguiendo el procedimiento en el Ejemplo A usando
Ejemplo 734.0. Preparación de (2S,3R)-N-(5-(5-ciclop metilpirimidin-2-il)butano-2-sulfonamida.
iridin-3-il)-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-3-(5-
(2S,3R)-N-(5-(5-ciclopropilpiridin-3-il)-4-(2,6-dimetoxifen sulfonamida, Ejemplo 734.0. La (2S,3R)-N-(5-(5-Br -1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-iridin-3-il)-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida (Ejemplo 733.0) agua (0,06 ml). Después se añadieron ciclopropi bis(difenilfosfino)ferrocene]-dicloropaladio(II), complejo mg, 0,79 mmol) al vial. Se burbujeó nitrógeno a travé calentó a 90°C. Después de 20 horas, la reacción se enf (EtOAc:EtOH 3:1 en heptano al 20-85%). Las fraccio concentraron a presión reducida para dar la (2S,3R triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida mmol, 61 % de rendimiento). 1H RMN (400 MHz, DMS Hz, 1H), 8,34 (d, J=2,1 Hz, 1H), 7,58 - 7,47 (m, 2H), 7, (m, 7H), 3,59 (dd, J=3,2, 6,9 Hz, 1H), 2,23 (s, 3H), 1,96 1,01 - 0,94 (m, 2H), 0,48 - 0,42 (m, 2h ). Espectro de m
Ejemplo 735.0: Preparación de (1S,2R)-N-(4-(2,6 (imidazo[1,2-a]piridin-2-il)propano-2-sulfonamida o (1 R il)-1 -hidroxi-1 -(imidazo[1 ,2-a]piridin-2-il)propano-2-sulfon mg, 0,19 mmol) se suspendió en 1,4-dioxano (0,6 ml) y roborato de potasio (84 mg, 0,57 mmol), [1,1'-CM (48 mg, 0,06 mmol), y carbonato de potasio (109 la mezcla durante 10 minutos y después la mezcla se TA y después se cargó en una columna de gel de sílice ue contenían producto se combinaron y después se 5-(5-ciclopropilpiridin-3-il)-4-(2,6-dimetoxifenil)-4H-1,2,4-plo 734.0) en forma de un sólido marrón (63 mg, 0,11 5 13,35 (s, 1H), 8,59 (d, J=0,8 Hz, 2H), 8,50 (d, J=2,1 J=2,2 Hz, 1H), 6,83 (dd, J=2,4, 8,6 Hz, 2H), 3,74 - 3,65 (m, 1H), 1,24 (d, J=7,3 Hz, 3H), 1,10 (d, J=6,8 Hz, 3H), pos.) m/z: 550,2 (M+H)+.
toxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-.
(1 S,2R)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)-N,N-bis(4-(imidazo[1,2-a]piridin-2-il)-N,N-bis(4-metoxibencil)propa de N,N-bis(4-metoxibencil)etanosulfonamida (Ejemplo gota a gota solución de n-butil-litio, (2,5 M en hexanos, gota una disolución de imidazo[1,2-a]piridina-2-carbald Tras completarse la adición, la reacción se mantuvo reacción se inactivó con solución acuosa saturada de los extractos orgánicos se combinaron y después se se y concentración a presión reducida, el residuo marrón o 3:1) en heptano al 0-60% para dar los siguientes co hidroxi-1 -(imidazo[1,2-a]piridin-2-il)-N,N-bis(4-metoxiben (imidazo[1,2-a]piridin-2-il)-N,N-bis(4-metoxibencil)propa rendimiento).
xibencil)propano-2-sulfonamida y (1 R,2S)-1 -hidroxi-1 -ulfonamida, Ejemplo 735.1. A una disolución agitada (1,0 g, 2,9 mmol) en THF (9,5 ml) a -78°C se añadió l, 3,15 mmol). Después de 5 minutos, se añadió gota a (460 mg, 3,15 mmol) en THF a lo largo de 5 minutos. C y se siguió por LCMS-ESI. Después de 3 horas, la o amónico. Después de extraer tres veces con EtOAc, sobre sulfato magnésico anhidro. Después de filtración se purificó en gel de sílice eluyendo con (EtOAc:EtOH tos (en el orden de salida de la columna): (1S,2R)-1-opano-2-sulfonamida o (1 R,2S)-1 -hidroxi-1 -ulfonamida, Ejemplo 735.1 (0,5 g, 1,01 mmol, 35 % de
(1 S,2S)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)-N,N-bis(4-(imidazo[1,2-a]piridin-2-il)-N,N-bis(4-metoxibencil)propa xibencil)propano-2-sulfonamida o (1 R,2R)-1 -hidroxi-1 -ulfonamida, Ejemplo 735.2. La elución adicional en las
condiciones descritas en 735.1 dio el Ejemplo 735.2 (0,39 mmol, 28 % de rendimiento).
(1 S,2R)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)propano-2-sul il)propano-2-sulfonamida, Ejemplo 735.3. En un matraz qu N,N-bis(4-metoxibencil)propano-2-sulfonamida o
metoxibencil)propano-2-sulfonamida (Ejemplo 735.1) (1,01 anisol (0,9 ml, 8,15 mmol). La solución heterogénea se agi TFA (5,3 ml, 69 mmol) a la solución de la reacción. La rea ESI. Después de 19 horas, la reacción se concentró a pre las sales de TFA de la (1S,2R)-1-hidroxi-1-(imidazo[1,2-a (imidazo[1,2-a]piridin-2-il)propano-2-sulfonamida (Ejemplo usó sin purificación. Espectro de masas (pos.) m/z: 256,2 ( ida y (1 R,2S)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-tenía (1 S,2R)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)-2S)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)-N,N-bis(4-2 mmol) se añadió DCM (5 ml). Después se añadió 3°C. Después de 2 minutos, se añadió gota a gota homogénea se agitó a 23°C y se siguió por LCMS-ducida. El residuo amarillo claro se identificó como n-2-il)propano-2-sulfonamida y (1 R,2S)-1 -hidroxi-1 -746 mg, 2.02 mmol, 100 % de rendimiento) que se
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triaz sulfonamida y (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il il)propano-2-sulfonamida, Ejemplo 735.4. El compuesto de mmol), usando el procedimiento descrito en el Ejemplo A. en forma de una película amarillo claro. Espectro de masas )-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)propano-2-,2,4-triazol-3-il)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-735.4 se preparó a partir de 735.3 (746 mg, 2,02 proporcionó el Ejemplo 735.4 (100 mg, 0,19 mmol) ) m/z: 536,2 (M+H)+.
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triaz sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il il)propano-2-sulfonamida, Ejemplo 735.0. La purificación título 735.0 como el primer isómero en eluir en las siguie (0,2% de DEA)/CÜ2 al 45%, 100 bar 60 ml/min, 220 nm. V 735.4. (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-di (imidazo[1,2-a]piridin-2-il)propano-2-sulfonamida. 1H RMN 6,8 Hz, 1H), 7,85 (td, J=1,9, 8,0 Hz, 1H), 7,77 (d, 1H), 6,90 (dt, J=1,1, 6,8 Hz, 1H), 6,83 - 6,76 (m, 2H), 5,63 3,60 (m, 1H), 1,23 - 1,19 (m, 3H). Espectro de masas (pos.)
Ejemplo 736.0: Preparación de (1 S,2R)-N-(4-(2,6-di (imidazo[1,2-a]piridin-2-il)propano-2-sulfonamida o (1 R,2 il)-1 -hidroxi-1 -(imidazo[1 ,2-a]piridin-2 -il)propano-2-sulfonam )-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)propano-2-,2,4-triazol-3-il)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-emplo 735.4 dio como resultado el compuesto del
ondiciones de SFC: AD-H (2 x 25 cm) isopropanol
.: 0,5 ml, 10 mg/ml, solución en MeOH del Ejemplo
,2,4-triazol-3-il)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-ifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -Hz, CD3OD) S 8,68 - 8,51 (m, 2H), 8,40 (td, J=1,1,
Hz, 1H), 7,55 - 7,41 (m, 3H), 7,30 (ddd, J=1,3, 6,7, 9,2 Hz, =1,1, 1,8 Hz, 1H), 3,78 (s, 3H), 3,75 (s, 3H), 3,68 -536,2 (M+H)+.
fenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 --(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-tria sulfonamida o (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-i il)propano-2-sulfonamida, Ejemplo 736.0. La purificación título 736.0 como el segundo isómero en eluir en las sigui (0,2% de DEA)/CO2 al 45%, 100 bar 60 ml/min, 220 nm. V 735.4. (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-i il)propano-2-sulfonamida o (1 R,2S)-N-(4-(2,6-di (imidazo[1,2-a]piridin-2-il)propano-2-sulfonamida. 1H RMN 6,7 Hz, 1H), 7,88 - 7,81 (m, 1H), 7,76 (s, 1H), 7,55 6,8 Hz, 1H), 6,83 - 6,75 (m, 2H), 5,62 (dd, J=1,1, 1,8 Hz, Hz, 1H), 1,22 - 1,17 (m, 3H). Espectro de masas (pos). m/z
Ejemplo 737.0: Preparación de (1R,2S)-N-(4-(2,6-difluorof metil-2-pirimidinil)-2-propanosulfonamida o (1S,2R)-N-(4-( 1 -etoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida.
l)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-il)propano-2-1,2,4-triazol-3-il)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-jemplo 735.4 dio como resultado el compuesto del
condiciones de SFC: AD-H (2 x 25 cm) isopropanol
.: 0,5 ml, 10 mg/ml, solución en MeOH del Ejemplo
1,2,4-triazol-3-il)-1 -hidroxi-1 -(imidazo[1,2-a]piridin-2-ifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -Hz, CD3OD) 58,65 - 8,53 (m, 2H), 8,39 (td, J=1,2,
(m, 3H), 7,28 (ddd, J=1,2, 6 ,8 , 9,1 Hz, 1H), 6,89 (dt, J=1,1, ,77 (s, 3H), 3,76 - 3,72 (m, 3H), 3,63 (dq, J=1,8, 7,0
2 (M+H)+.
-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-etoxi-1-(5-luorofenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-
(1 S,2R)-1 -etoxi-1 -(5-metilpirimidin-2-il)propano-2-sulfonami sulfonamida, Ejemplo 737.1. La purificación de Ejemplo 15 el segundo isómero en eluir en las siguientes condiciones bar de presión de entrada, 70 ml/min, 220 nm. (1S,2 (1R,2S)-1-etoxi-1-(5-metilpirimidin-2-il)propano-2-sulfonami - 8,60 (m, 2H), 6,74 (s, 2H), 4,97 - 4,85 (m, 1H), 3,61 - 3,3 1,06 (m, 3H). Espectro de masas (pos). m/z: 260,1 (M+H)+.
(1 R,2S)-1 -etoxi-1 -(5-metilpirimidin-2-il)propano-2-como resultado el compuesto del título 737.1 como C: AD-H (250 x 21 cm) EtOH CO2 al 12%, 165-172 toxi-1-(5-metilpirimidin-2-il)propano-2-sulfonamida o jemplo 737.1) 1H RMN (400 MHz, DMSO-d6) 58,73 3H), 2,36 - 2,23 (m, 3H), 1,36 - 1,24 (m, 3H), 1,14 -
(1 S,2R)-N-(4-(2,6-difluorofenil)-5-(5-metil-3-piridinil)-4H-1,2, propanosulfonamida o (1 R,2S)-N-(4-(2,6-difluorofenil)-5-( pirimidinil)-2-propanosulfonamida, Ejemplo 737.0. El com mg, 0,8 mmol), usando los procedimientos descritos en e 0,07 mmol) en forma de un sólido blanco. 1H RMN (400 M (d, J=1,5 Hz, 1H), 8,25 (d, J=1,9 Hz, 1H), 7,80 - 7,69 (m, J=3,7 Hz, 1H), 3,44 - 3,25 (m, 3H), 2,27 (s, 3H), 2,25 (s, 3H de masas (pos). m/z: 530,2 (M+h )+.
Ejemplo 738.0: Preparación de (1S,2S)-1-isopropoxi-1-(5ol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-l-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-del título 737.0 se preparó a partir de 737.1 (207 plo A. Esto proporcionó el Ejemplo 737.0 (35 mg, SO-d6) 513,72 (s, 1 H), 8,63 (d, J=0,6 Hz, 2H), 8,53 7,66 (s, 1H), 7,43 (dt, J=4,3, 8,9 Hz, 2H), 4,96 (d, (d, J=7,0 Hz, 3H), 0,93 (t, J=6,9 Hz, 3H). Espectro
imidin-2-il)propano-2-sulfonamida.
5-Metilpirimidina-2-carbonitrilo, Ejemplo 738.1. Una disolu equiv) en DMF (5000 ml) se desgasificó con N2 durante 20 equiv) y Pd2(dba)3 (178 g, 194 mmol, 0,05 equiv) a la me 1,5 equiv) y la mezcla de reacción se calentó a 100°C dura agitó durante 10 min. La mezcla de reacción se filtró a tr Celite®. El filtrado se diluyó con agua (4000 ml) y se 738.1
e 2-cloro-5-metilpirimidina (500 g, 3889 mmol, 1,0 después se añadieron dppf (108 g, 194 mmol, 0,05 e reacción. Se añadió Zn(CN)2 (685 g, 5834 mmol, 6 h. La reacción se inactivó con agua (5000 ml) y se e una almohadilla de agente de filtración de marca con EtOAc (2 x 4000 ml). Las capas orgánicas
combinadas se lavaron con salmuera (4000 ml), se se reducida para dar el producto inicial que se purificó m mall 60-120) y EtüAc en hexano al 0-10% para ob blanquecino. 1H RMN (400 MHz, DMSO-afe) 58,89 (s, 2 sobre Na2SÜ4, se filtraron y se concentraron a presión cromatografía en columna usando gel de sílice (n° de el Ejemplo 738.1 (330 g, 71%) en forma de sólido 39 (s, 3H).
N,N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)-1-oxopr Ejemplo 12.0 (293 g, 839 mmol, 2,0 equiv) en THF (2 mmol, 2,0 equiv, 2,0 M en éter dietílico) a 0°C. La me reacción se añadió 5-metilpirimidina-2-carbonitrilo (738 agitó a temperatura ambiente durante 2 h. La reacción durante 10 min. La mezcla se extrajo con EtOAc (2 x salmuera (500 ml), se secaron sobre Na2SO4 y se filtr dar el compuesto inicial que se purificó por cromatogr EtOAc en hexano al 0-50% como eluyente para obten líquido marrón. 1H RMN (400 MHz, DMSO-dfe) 58,90 (s 5H), 3,71 (s, 6H), 2,39 (s, 3H), 1,50 (d, J = 6,9 Hz, 3H).
-2-sulfonamida, Ejemplo 738.2. A una disolución del l) se añadió cloruro de isopropilmagnesio (420 ml, 839 reacción se agitó a 25°C durante 3 h. A la mezcla de g, 420 mmol, 1,0 equiv) en THF (100 ml) a 0°C y se ctivó con HCl 1,5 N (500 ml), agua (2000 ml) y se agitó ml), y las capas orgánicas combinadas se lavaron con a capa orgánica se concentró a presión reducida para columna usando gel de sílice (n° de malla 100-200) y jemplo 738.2 (60 g, 30% de rendimiento) en forma de 7,15 - 7,09 (m, 4H), 6,85 - 6,80 (m, 4H), 4,34 - 4,18 (m, SI ve ion) m/z: (M+H)+: 470,0.
(E)-1-isopropoxi-N,N-bis(4-metoxibencil)-1-(5-metilpirimi disolución de Ejemplo 738.2 (120 g, 256 mmol, 1,0 equi mmol, 5,0 equiv) y carbonato de potasio (70,6 g, 511 durante 14 h. La reacción se inactivó con agua (1000 m x 1000 ml). Las capas orgánicas combinadas se lava filtraron y se concentraron a presión reducida para da cromatografía en columna usando gel de sílice (n° de para obtener el Ejemplo 738.3 (75 g, 57,4 % de rendi dfe) 58,72 (s, 2H), 7,09 (d, J = 8,3 Hz, 4H), 6,86 (d, J = (m, 1H), 2,31 (s, 3H), 1,87 (s, 3H), 1,19 - 1,16 (m, 6H).
il)prop-1-eno-2-sulfonamida, Ejemplo 738.3. A una d Mf (1200 ml) se añadió 2-yodopropano (129 ml, 1278 l, 2,0 equiv). La mezcla de reacción se agitó a 60°C agitó durante 10 min y después se extrajo con EtOAc (2 on salmuera (1000 ml), se secaron sobre Na2SO4, se aterial inicial. El producto así obtenido se purificó por 100-200) y EtOAc en hexano al 0-50% como eluyente ) como sólido blanquecino. 1H RMN (400 MHz, DMSO-, 4H), 4,16 (s, 4H), 3,73 (d, J = 1,1 Hz, 6H), 3,71 - 3,67 SI ve ion) m/z: (M+H)+: 512,1
(1S,2R)-1-isopropoxi-N,N-bis(4-metoxibencil)-1-(5-metil in-2-il)propano-2-sulfonamida, Ejemplo 738.4. A una
disolución del Ejemplo 738.3 (180 g, 352 mmol, 1,0 eq mmol, 2,0 equiv) y se añadió (S)-RuCl[(p-cimeno(BINA 60°C con presión de H2 (4,2 kg/cm2 (60 psi)) durante reducida proporcionando el producto inicial que se pur (n° de malla 60-120) y EtOAc en DCM al 0-50% como e en forma de sólido blanquecino. 1H RMN (400 MHz, D 4H), 4,82 (dd, J = 7,8, 1,8 Hz, 1H), 4,39 (d, J = 15,6 Hz, 1H), 3,65 (s, 6H), 3,41 - 3,35 (m, 1H), 2,27 (s, 3H), 1,1 (dd, J = 6,3, 1,8 Hz, 3H). Ms (ESI ve ion) m/z: (M+H)+: MeOH (1800 ml) se añadió triflato de cinc (256 g, 704 6,54 g, 7,04 mmol, 0,02 equiv), y la mezcla se calentó a a mezcla de reacción después se concentró a presión ás por cromatografía en columna usando gel de sílice te para obtener el Ejemplo 738.4 (140 g, 77 %, 92% ee) afe) 58,71 (s, 2H), 7,25 - 7,15 (m, 4H), 6,95 - 6,75 (m, 4,13 (d, J = 15,7 Hz, 2H), 3,82 (qd, J = 8,5, 7,9, 6,0 Hz, J = 6,2, 1,8 Hz, 3H), 1,02 (dd, J = 7,1,2,0 Hz, 3H), 0,96 .
(1S,2S)-1-isopropoxi-1-(5-metilpirimidin-2-il)propano-2-s 738.4 (140,0 g, 273 mmol, 1,0 equiv) en dCm (500 ml) se agitó a TA durante 16 h. Después, la mezcla de r material inicial que se disolvió en DCM (1000 ml) y se l capa orgánica se secó sobre Na2SO4, se filtró y se co que se purificó más por cromatografía en columna usa 2% proporcionando el Ejemplo 738.5 (72 g, 97 % d Ejemplo 738.5 (72 g, 90% ee) se suspendió en isoprop homogénea. Una vez que la solución se hizo homog blanco así obtenido se filtró, se secó a vacío para obt concentraron y el sólido obtenido se recristalizó de n DMSO-ds) 58,70 (d, J = 2,3 Hz, 2H), 6,45 (d, J = 2,4 H (ddd, J = 9,7, 7,4, 4,9 Hz, 1H), 2,29 (d, J = 2,6Hz, 3H), 0,88 (dd, J = 6,3, 2,5 Hz, 3H). MS (ESI ve ion) m/z: [M
Los compuestos expuestos en la siguiente tabla se sin el material de partida conocido como se describe.
mida, Ejemplo 738.5. A una disolución del Ejemplo adió TFA (250 ml) a 0°C. La mezcla resultante después n se concentró a presión reducida proporcionando un on solución acuosa saturada de NaHCO3 (1000 ml). La ó a presión reducida proporcionando el producto inicial el de sílice (n° de malla 60-120) y MeOH en DCM al 0-imiento, 90% ee) en forma de sólido blanquecino. El 500 ml) y se calentó a 70°C hasta que la mezcla se hizo la mezcla se enfrió a TA durante la noche. El sólido el compuesto-6 (30 g, >99% ee). Las aguas madre se iguiendo el mismo procedimiento. 1H RMN (400 MHz, 4,68 (dd, J = 8,8 , 2,5 Hz, 1H), 3,59 - 3,52 (m, 1H), 3,48 (dd, J = 6,1, 2,5 Hz, 3H), 0,93 (dd, J = 7,1, 2,5 Hz, 3H), 74,1.
on siguiendo el procedimiento en el Ejemplo A usando
Tabla 38
Ejemplo 741.0: Preparación de (1R,2S)-1-metoxi-N-(4-(2-m il)-1-(5-metil-2-pirimidinil)-2-propanosulfonamida.
3-Isotiocianato-2-metoxipiridina, Ejemplo 741.1. En un matr 11,1 mmol) en DCM anhidro (20 ml) se añadió un DCM anhidro (20 ml) a 23°C a lo largo de 20 min. Después hasta un volumen de ~10 ml. Este después se cargó en un Las fracciones que contenían producto puro se combinaron incoloro como la 3-isotiocianato-2-metoxipiridina (Ejemplo usó sin más purificación. 1H RMN (400 MHz, DMSo-d6) ó 8 5,0, 7,6 Hz, 1H), 4,01 - 3,96 (m, 3H). Espectro de masas (p i-3-piridinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-
ue contenía 1,1'-tiocarbonildi-2(1h)-piridona (2,58 g,
lución de 3-amino-2-metoxipiridina (1,24 g, 10,0 mmol) en 30 min, la reacción se concentró a presión reducida
lumna de gel de sílice (EtOAc en heptano al 0-30%).
concentraron a presión reducida para dar un líquido
1) (1,34 g, 8,0 mmol, 80 % de rendimiento) que se
- 8,09 (m, 1H), 7,73 - 7,68 (m, 1H), 7,03 (tdd, J=1,2,
m/z: 167,1 (M+H)+.
(Z)-N-(((1 R,2S)-1-metoxi-1-(5-metilpirimidin-2-il)propan-2-il)s il)hidrazinacarboximidamida, Ejemplo 741.2. En un vial qu mmol) se añadió ACN (4 ml). Después de 10 minutos, se a en porciones. La mezcla se enfrió en un baño de hielo, y d nil)-2-(6-metoxipicolinoil)-N'-(2-metoxipiridin-3-ntenía el compuesto intermedio 14.0 (253 mg, 1,03 el Ejemplo 741.1 (188 mg, 1,13 mmol) con cuidado ués se añadió con cuidado carbonato de cesio (439
mg, 1,35 mmol) en porciones. Tras completarse la adic Después de 19 horas, la mezcla se enfrió en un baño d del ácido 6-metoxi-piridina-2-carboxílico (174 mg, 1,04 cuidado en porciones. Esta es una reacción exotérmic oscuro al calentar a TA La mezcla se dejó calentar a 2 en una columna Ultra Biotage SNAP y se purificó (E contenían producto puro se combinaron y después se como la (Z)-N-(((1 R,2S)-1 -metoxi-1 -(5-metilpirimidin-2-il 3-il)hidrazinacarboximidamida (Ejemplo 741.2) (471,0 purificación. Espectro de masas (pos). m/z: 545,0 (M+H e carbonato de cesio, la mezcla se dejó calentar a 23°C. lo-agua. Después de 20 minutos, se añadieron hidrazida ol) y después nitrato de plata (365 mg, 2.15 mmol) con a reacción se vuelve naranja brillante y después marrón espués de 25 minutos, la mezcla se cargó directamente :EtOH 3:1 en heptano al 25-90%). Las fracciones que ntraron a presión reducida para dar una espuma blanca an-2-il)sulfonil)-2-(6-metoxipicolinoil)-N'-(2-metoxipiridin-,865 mmol, 84 % de rendimiento) que se usó sin más
(1 R,2S,P)-1-metoxi-N-(4-(2-metoxi-3-piridinil)-5-(6-meto propanosulfonamida y (1 R,2S,M)-1 -metoxi-N-(4-(2-met metil-2-pirimidinil)-2-propanosulfonamida, Ejemplo 741 mmol) en isopropanol (2 ml) y agua (1 ml) se añadió s a gota a la mezcla de reacción. Tras completarse la agitadora previamente calentada a 80°C. Después de agua. El pH se ajustó con cuidado a pH~7 con adición veces con DCM. Las capas orgánicas se combinaro Después de filtración y concentración a presión reducid gel de sílice (EtOAc:EtOH 3:1 en heptano al 25-75% después se concentraron a presión reducida para dar como la (1 R,2S)-1 -metoxi-N-(5-(6-metoxipiridin-2-il)-4-( il)propano-2-sulfonamida (Ejemplo 741.0) (223 mg, 0,4 de) ó 13,53 - 13,33 (m, 1H), 8,65 (dd, J=0,7, 3,0 Hz, 2 7,64 (ddd, J=0,7, 2,0, 7,4 Hz, 1H), 7,19 (ddd, J=5,0, 7, 1H), 3,72 (d, J=3,9 Hz, 3H), 3,51 - 3,36 (m, 2H), 3,17 -(m, 3H). Espectro de masas (pos). m/z: 527,0 (M+H)+.
Ejemplo 742.0: Preparación de (1R,2R)-N-(4-(2, metoxi-2-pirazinil)-1 -(1 -metiletoxi)-2-propanosulfonamid 1,2,4-triazol-3-il)-1 -(5-metoxi-2-pirazinil)-1 -(1 -metiletoxi) iridinil)-4H-1,2,4-triazol-3-il)-1 -(5-metil-2-pirimidinil)-2-piridinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-un vial que contenía el Ejemplo 741.2 (471 mg, 0,86 n de NaOH 1,0 N (1,1 ml, 1,1 mmol) con cuidado y gota ión de NaOH 1 N, la mezcla se calentó en una placa as, la reacción se enfrió a TA y después se diluyó con a gota de HCl 1 N. La mezcla de reacción se extrajo tres después se secaron sobre sulfato magnésico anhidro. residuo se cargó en una columna Ultra Biotage Snap de s fracciones que contenían producto se combinaron y elícula que se trituró en EtOH para dar un sólido blanco toxipiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-mol, 49,0% de rendimiento). 1H RMN (400 MHz, DMSO-,27 (ddd, J=1,7, 5,1, 10,5 Hz, 1H), 7,95 - 7,81 (m, 2H), 7 Hz, 1H), 6,91 - 6,83 (m, 1H), 4,84 (dd, J=3,3, 15,8 Hz, (m, 3H), 3,04 (d, J=48 Hz, 3H), 2,26 (s, 3H), 1,22 - 1,10
etoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-opanosulfonamida.
(1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metoxipi bis(4-metoxibencil)-1-(5-metoxipirazin-2-il)propano-2-su bis(4-metoxibencil)etanosulfonamida (Ejemplo 12.0) (3, solución de n-butil-litio, (2,5 M en hexanos, 3,8 ml, 9, disolución de 5-metoxipirazina-2-carboxaldehído (1,19 Tras completarse la adición, la reacción se mantuvo reacción se inactivó con disolución acuosa saturada d -2-il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-mida, Ejemplo 742.1. A una disolución agitada de N,N-8,6 mmol) en THF (43 ml) a -78°C se añadió gota a gota ol). Después de 5 minutos, se añadió gota a gota una mmol) en THF anhidro (14 ml) a lo largo de 5 minutos. °C y se siguió por LCMS-ESI . Después de 1 hora, la uro amónico. Después de extraer tres veces con EtOAc,
las capas orgánicas se combinaron y después se seca concentración a presión reducida, el residuo marrón heptano al 20-100% para dar los siguientes
metoxipirazin-2-il)propano-2-sulfonamida y (1 S,2R)-1 -hi 2-sulfonamida (Ejemplo 742.1) (1,98 g, 4,06 mmol, Espectro de masas (pos.) m/z: 488,2 (M+H)+.
bre sulfato magnésico anhidro. Después de filtración y o se purificó en gel de sílice eluyendo con EtOAc en uestos (1R,2S)-1-hidroxi-N,N-bis(4-metoxibencil)-1-(5-N,N-bis(4-metoxibencil)-1 -(5-metoxipirazin-2-il)propanoe rendimiento) en forma de un sólido amarillo claro.
(1 R,2R)-1-hidroxi-N,N-bis(4-metoxibencil)-1-(5-metoxipi bis(4-metoxibencil)-1-(5-metoxipirazin-2-il)propano-2-sul condiciones descritas en el Ejemplo 742.1 dio 742.2 (0, amarillo claro. Espectro de masas (pos). m/z: 488,2 (M+ 2-il)propano-2-sulfonamida y (1S,2S)-1-hidroxi-N,N-ida, Ejemplo 742.2. La elución adicional usando las 1,70 mmol, 20% de rendimiento) en forma de un sólido
(1 S,2S)-1 -isopropoxi-N,N-bis(4-metoxibencil)-1 -(5-meto N,N-bis(4-metoxibencil)-1-(5-metoxipirazin-2-il)propano-(1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metoxipir bis(4-metoxibencil)-1-(5-metoxipirazin-2-il)propano-2-sul isopropilo (5,8 ml, 58 mmol) en tolueno anhidro (16 ml) porciones. Tras completarse la adición de óxido de pl Después de 24 horas, la mezcla se enfrió a TA y despu lavó con EtOAc. El filtrado se concentró a presión red (EtOAc en heptanos al 0-50%). Las fracciones que con presión reducida para dar una goma amarillo oscuro metoxipirazin-2-il)propano-2-sulfonamida y (1 R, il)propano-2-sulfonamida, Ejemplo 742.3 (776 mg, 1,47 8,33 (d, J=1,5 Hz, 1H), 8,28 (d, J=1,2 Hz, 1H), 7,21 - 7, (d, J=15,3 Hz, 2H), 4,15 (d, J=15,3 Hz, 2H), 3,93 (s, J=6,0 Hz, 3H), 1,03 (d, J=7,0 Hz, 3H), 0,99 (d, J=6,2 Hz zin-2-il)propano-2-sulfonamida y (1 R,2R)-1 -isopropoxionamida, Ejemplo 742.3. En un vial que contenía -il)propano-2-sulfonamida y (1 R,2R)-1 -hidroxi-N,N-ida (Ejemplo 742.2, 2,00 g, 4,12 mmol) y yoduro de adió óxido de plata(I) (1,9 g, 8,3 mmol) con cuidado en la reacción se protegió de la luz y se calentó a 70°C. filtró a través de un filtro desechable Chemglass que se El residuo se purificó en una columna de gel de sílice producto se combinaron y después se concentraron a o la (1S,2S)-1-isopropoxi-N,N-bis(4-metoxibencil)-1-(5-isopropoxi-N,N-bis(4-metoxibencil)-1-(5-metoxipirazin-2-l, 36% de rendimiento). 1H RMN (400 MHz, DMSO-d6) 5 , 4H), 6,89 - 6,84 (m, 4H), 4,81 (d, J=7,3 Hz, 1H), 4,34 ,75 - 3,70 (m, 7H), 3,39 (quin, J=6,1 Hz, 1H), 1,13 (d, Espectro de masas (pos). m/z: 530,0 (M+H)+.
(1 S,2S)-1 -isopropoxi-1 -(5-metoxipirazin-2-il)propano-2-metoxipirazin-2-il)propano-2-sulfonamida, Ejemplo 742 contenía (1 S,2S)-1 -isopropoxi-N,N-bis(4-metoxibencil)-isopropoxi-N,N-bis(4-metoxibencil)-1-(5-metoxipirazin-2-mmol) y DCM (3,6 ml). La solución homogénea se e añadió gota a gota TFA (3,6 ml, 47 mmol) a la soluc reacción se dejó calentar a 23°C. Después de 20 ho reducida. El residuo se cargó en una columna de gel contenían producto se concentraron a presión redu isopropoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfonamid sulfonamida (Ejemplo 742.4) que se usó sin más purific amida y racémico (1 R,2R)-1 -isopropoxi-1 -(5 e añadió anisol (0,64 ml, 5,86 mmol) a un vial que metoxipirazin-2-il)propano-2-sulfonamida y (1 R,2R)-1 -pano-2-sulfonamida (Ejemplo 742.3, 776 mg, 1,46 n un baño de hielo-agua. Después de 15 minutos, se e la reacción. Tras completarse la adición de TFA, la solución de reacción marrón se concentró a presión ice (EtOAc en heptanos al 5-75%). Las fracciones que para dar un sólido blanquecino como la (1S,2S)-1-(1 R,2R)-1 -isopropoxi-1 -(5-metoxipirazin-2-il)propano-2-Espectro de masas (pos). m/z: 290,0 (M+H)+.
(Z)-N'-(2,6-dimetoxifenil)-N-(((1S,2S)-1-isopropoxi-1-(5-metilnicotinoil)hidrazinacarboximidamida y (Z)-N'-(2, il)propan-2-il)sulfonil)-2-(5-metilnicotinoil)hidrazinacarbo (1 S,2S)-1 -isopropoxi-1 -(5-metoxipirazin-2-il)propano-2-s il)propano-2-sulfonamida, Ejemplo 742.4 (302 mg, 1,04 añadió 2-isotiocianato-1,3-dimetoxibenceno, compuest porciones. La mezcla se enfrió en un baño de hielo y con cuidado en porciones a la solución homogénea. Tra dejó calentar a 23°C. Después de 19 horas, la mezcla se añadieron hidrazida del ácido 5-metilnicotínico (161 mmol) con cuidado en porciones. Esta es una reacci volvió marrón oscuro al calentar a TA La mezcla se d mezcla se cargó directamente en una columna Ultra Bi 90%). Las fracciones que contenían producto se combi una película rosa claro como la (Z)-N'-(2,6-dimetoxife il)sulfonil)-2-(5-metilnicotinoil)hidrazinacarboximidamida metoxipirazin-2-il)propan-2-il)sulfonil)-2-(5-metilnicotinoil mmol, 57,5% de rendimiento) que se usó sin más purific ipirazin-2-il)propan-2-il)sulfonil)-2-(5-toxifenil)-N-(((1 S,2S)-1 -isopropoxi-1 -(5-metoxipirazin-2-mida (Ejemplo 742.5). En un vial que contenía amida y (1 R,2R)-1 -isopropoxi-1 -(5-metoxipirazin-2-l) se añadió ACN (4,1 ml). Después de 10 minutos, se ermedio 1.0 (207 mg, 1,06 mmol) con cuidado en és se añadió carbonato de cesio (444 mg, 1,36 mmol) pletarse la adición de carbonato de cesio, la mezcla se frió en un baño de hielo-agua. Después de 20 minutos, 1,06 mmol) y después nitrato de plata (388 mg, 2,28 otérmica que se volvió naranja brillante y después se lentar a 23°C. Después de 25 minutos adicionales, la SNAP y se purificó (EtOAc:EtOH 3:1 en heptano al 25-y después se concentraron a presión reducida para dar -(((1S,2S)-1-isopropoxi-1-(5-metoxipirazin-2-il)propan-2-(Z)-N'-(2,6-dimetoxifenil)-N-(((1 R,2R)-1 -isopropoxi-1 -(5-zinacarboximidamida, Ejemplo 742.5 (361,5 mg, 0,601 . Espectro de masas (pos). m/z: 602,0 (M+H)+.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxif (5-metoxipirazin-2-il)propano-2-sulfonamida, Ejemplo (((1 S,2S)-1 -isopropoxi-1 -(5-metoxipirazin-2-il)propan-2-i N'-(2 ,6-dimetoxifenil)-N-(((1 F,2R)-1-isopropoxi-1-(5-met metilnicotinoil)hidrazinacarboximidamida, Ejemplo 742.5 se añadió con cuidado solución de NaOH 1,0 N (0,73 NaOH 1 N, la mezcla se calentó en una placa agitado Después de 23 horas, la reacción se enfrió a TA y de adición gota a gota de HCl 1 N a pH~7. La mezcla orgánicos se combinaron y después se secaron s concentración a presión reducida, el residuo se car (EtOAc:EtOH 3:1 en heptano al 15-60%). Las fraccio concentraron a presión reducida para dar la (1 R,2R)-N il)-1 -isopropoxi-1 -(5-metoxipirazin-2-il)propano-2-sulfon 4H-1,2,4-triazol-3-il)-1-isopropoxi-1-(5-metoxipirazin-2-il) 39 % de rendimiento) en forma de una espuma blanca.
Los compuestos expuestos en la siguiente tabla se purif
Tabla 39
-triazol-3-il)-1 -isopropoxi-1 -(5-metoxipirazin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -isopropoxi-1 -En un vial que contenía (Z)-N'-(2,6-dimetoxifenil)-N-nil)-2-(5-metilnicotinoil)hidrazinacarboximidamida y (Z)-zin-2-il)propan-2-il)sulfonil)-2-(5-mg, 0,60 mmol) en isopropanol (1,6 ml) y agua (0,8 ml) ,73 mmol) gota a gota. Tras completarse la adición de viamente calentada a 80°C y se siguió por LCMS-ESI.
se diluyó con agua. El pH se ajustó con cuidado por acción se extrajo tres veces con DCM. Los extractos sulfato magnésico anhidro. Después de filtración y una columna de gel de sílice Ultra Biotage Snap ue contenían producto se combinaron y después se ,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-no-2-sulfonamida, Ejemplo 742.6 (137 mg, 0,23 mmol, tro de masas (pos). m/z: 584,0 (M+H)+.
siguiendo el procedimiento descrito.
Ejemplo 744.0: Preparación de (1R,2R)-1-(5-cloropiridin triazol-3-il)-1 -isopropoxipropano-2-sulfonamida o
metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-isopropoxipropanoil)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-S,2S)-1 -(5-cloropiridin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-ulfonamida.
(1 R,2S)-1 -(5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxi il)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonami metoxibencil)etanosulfonamida (Ejemplo 12.0) (3,46 g, solución de n-butil-litio (2,5 M en hexanos, 4,4 ml, 10, disolución de 5-cloro-2-piridinacarbaldehído (1,4 g, 9,9 completarse la adición, la reacción se mantuvo a -78°C inactivó con solución acuosa saturada de cloruro amóni orgánicos se combinaron y después se secaron s concentración a presión reducida, el residuo marrón osc en heptano al 0-100% para dar la (1R,2S)-1-(5 sulfonamida y (1 S,2R)-1 -(5-cloropiridin-2-il)-1 -hidro 744.1) (3,16 g, 6,44 mmol, 65,0% de rendimiento) en f m/z: 491,1 (M+H)+.
)propano-2-sulfonamida y (1 S,2R)-1 -(5-cloropiridin-2-jemplo 744.1. A una solución agitada de N,N-bis(4-mmol) en THF (49 ml) a -78°C se añadió gota a gota ol). Después de 5 minutos, se añadió gota a gota una en anhidro THF (16,5 ml) a lo largo de 5 minutos. Tras iguió por LCMS-ESI. Después de 1 hora, la reacción se espués de extraer tres veces con EtOAc, los extractos sulfato magnésico anhidro. Después de filtración y purificó en gel de sílice eluyendo con EtOAc:EtOH 3:1 piridin-2-il)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2--bis(4-metoxibencil)propano-2-sulfonamida (Ejemplo de un sólido amarillo claro. Espectro de masas (pos).
(1 R,2R)-1 -(5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxi il)-1-hidroxi-N,N-bis(4-metoxibencil)propano-2-sulfonami condiciones descritas en el Ejemplo 744.1 sumini metoxibencil)propano-2-sulfonamida y (1 S,2S)-1 -(5 sulfonamida (Ejemplo 744.2). (1,54 g, 3,14 mmol, 31, Espectro de masas (pos). m/z: 491,0 (M+H)+.
)propano-2-sulfonamida y (1 S,2S)-1 -(5-cloropiridin-2-Ejemplo 744.2. La elución adicional usando las n la (1R,2R)-1-(5-cloropiridin-2-il)-1-hidroxi-N,N-bis(4-piridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibencil)propano-2-e rendimiento) en forma de un sólido amarillo claro.
(1 S,2S)-1 -(5-cloropiridin-2-il)-1 -isopropoxi-N,N-bis(4-met 2-il)-1-isopropoxi-N,N-bis(4-metoxibencil)propano-2-sulf (5-cloropiridin-2-il)-1 -hidroxi-N,N-bis(4-metoxibencil)prop N,N-bis(4-metoxibencil)propano-2-sulfonamida, (Ejempl mmol) en tolueno anhidro (13 ml) se añadió óxido de completarse la adición del óxido de plata, la reacción se la mezcla se enfrió a TA y después se filtró a través de filtrado se concentró a presión reducida. El residuo se c 0-50%). Las fracciones que contenían producto se com dar una goma amarillo oscuro como la (1S,2S)-1-(5-clo sulfonamida y (1 R,2R)-1-(5-cloropiridin-2-il)-1-isoprop 744.3) (660,3 mg, 1,239 mmol, 38,0% de rendimiento). 1 7,98 (dd, J=2,6, 8,4 Hz, 1H), 7,52 (d, J=8,5 Hz, 1H), 7, 4,33 (d, J=15,3 Hz, 2H), 4,19 - 4,11 (m, 2H), 3,73 (s, 6 J=6,0 Hz, 3H), 1,01 (m, 6 H). Espectro de masas (pos).
ncil)propano-2-sulfonamida y (1 R,2R)-1 -(5-cloropiridinda, Ejemplo 744.3. En un vial que contenía (1 R,2 R)-1 --sulfonamida y (1 S,2S)-1 -(5-cloropiridin-2-il)-1 -hidroxi-.2, 1,6 g, 3,3 mmol) y yoduro de isopropilo (4,6 ml, 46 ) (1,57 g, 6,77 mmol) con cuidado en porciones. Tras gió de la luz y se calentó a 70°C. Después de 24 horas, iltro desechable Chemglass que se lavó con EtOAc. El en una columna de gel de sílice (EtOAc en heptanos al n y después se concentraron a presión reducida para in-2-il)-1-isopropoxi-N,N-bis(4-metoxibencil)propano-2-,N-bis(4-metoxibencil)propano-2-sulfonamida (Ejemplo N (400 MHz, DMSO-d6) 58,62 (dd, J=0,6, 2,5 Hz, 1H), ,15 (m, 4H), 6,89 - 6,85 (m, 4H), 4,77 (d, J=7,3 Hz, 1H), 3 - 3,68 (m, 1H), 3,37 (td, J=6,1, 12,2 Hz, 1H), 1,12 (d, 33,0 (M+H)+.
(1 S,2S)-1 -(5-cloropiridin-2-il)-1 -isopropoxipropano-2-sulfo isopropoxipropano-2-sulfonamida, Ejemplo 744.4. Se a (1 S,2S)-1 -(5-cloropiridin-2-il)-1 -isopropoxi-N,N-bis(4-met 2-il)-1-isopropoxi-N,N-bis(4-metoxibencil)propano-2-sulfo ml). La solución homogénea se enfrió en un baño de hiel (3,2 ml, 41 mmol) a la solución de la reacción. Tras co 23°C. Después de 20 horas, la solución de la reacción
en una columna de gel de sílice (EtOAc:EtOH 3:1 en h se concentraron a presión reducida para dar un sóli isopropoxipropano-2-sulfonamida y (1 R,2R)-1 -(5-clor 744.4, 312,6 mg, 1,07 mmol, 86% de rendimiento) que 293,0 (M+H)+.
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe.
Tabla 40
mida y (1 R,2R)-1 -(5-cloropiridin-2-il)-1 -ió anisol (0,54 ml, 4,94 mmol) a un vial que contenía encil)propano-2-sulfonamida y (1 R,2 R)-1 -(5-cloropiridinida (Ejemplo 744.3, 660 mg, 1,24 mmol) y DCM (3,1 gua. Después de 15 minutos, se añadió gota a gota TFA etarse la adición de TFA, la reacción se dejó calentar a rón se concentró a presión reducida. El residuo se cargó nos al 10-40%). Las fracciones que contenían producto marrón claro como la (1S,2S)-1-(5-cloropiridin-2-il)-1-iridin-2-il)-1 -isopropoxipropano-2-sulfonamida (Ejemplo usó sin más purificación. Espectro de masas (pos). m/z:
izaron siguiendo el procedimiento en el Ejemplo 741.0
Ejemplo 746.0. Preparación de (1R,2R)-N-(4-(2 isopropoxi-1 -(5-metilpirazin-2-il)propano-2-sulfonamida 1,2,4-triazol-3-il)-1 -isopropoxi-1 -(5-metilpirazin-2-il)propa imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H--sulfonamida.
(1 S,2S)-1 -isopropoxi-N,N-bis(4-metoxibencil)-1 -(5-metilpi N,N-bis(4-metoxibencil)-1-(5-metilpirazin-2-il)propano-2-s (1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirazi metoxibencil)-1-(5-metilpirazin-2-il)propano-2-sulfonamid mmol) en tolueno anhidro (35 ml) se añadió óxido de p completarse la adición del óxido de plata, la reacción se 72°C. Después de 60 horas, la mezcla se enfrió a TA y que se lavó con EtOAc. El filtrado se concentró a pre columna de gel de sílice (EtOAc en heptanos al 10-55%) después se concentraron a presión reducida para metilpirazin-2-il)propano-2-sulfonamida y (1 R,2R)-1 -isopr 2 -sulfonamida (Ejemplo 746.1, 1,52 g, 2,97 mmol, 34% usó sin más purificación. 1H RMN (400 MHz, DMSO-d6) (m, 4H), 6,89 - 6,85 (m, 4H), 4,81 (d, J=7,0 Hz, 1H), 4, 3,39 (quin, J=6,1 Hz, 1H), 2,51 (s, 3H), 1,13 (d, J=6,0 Espectro de masas (pos). m/z: 514,0 (M+H)+.
-2-il)propano-2-sulfonamida y (1 R,2R)-1 -isopropoxiamida, Ejemplo 746.1. En un matraz que contenía il)propano-2-sulfonamida y (1 R,2R)-1 -hidroxi-N,N-bis(4-,16 g, 8,81 mmol) y yoduro de isopropilo (12,3 ml, 123 I) (4,17 g, 18,0 mmol) con cuidado en porciones. Tras egió de la luz y se calentó a una temperatura interna de ués se filtró a través de ul filtro desechable Chemglass reducida. El residuo marrón oscuro se cargó en una s fracciones que contenían el producto se combinaron y la (1S,2S)-1-isopropoxi-N,N-bis(4-metoxibencil)-1-(5-xi-N,N-bis(4-metoxibencil)-1 -(5-metilpirazin-2-il)propanondimiento) en forma de un aceite marrón oscuro que se 8 (d, J=1,5 Hz, 1H), 8,54 (d, J=0,8 Hz, 1H), 7,20 - 7,15 4,29 (m, 2H), 4,20 - 4,13 (m, 2H), 3,76 - 3,71 (m, 7H), 3H), 1,05 (d, J=7,3 Hz, 3H), 0,99 (d, J=6,2 Hz, 3H).
(1 R,2R)-1 -isopropoxi-1 -(5-metilpirazin-2-il)propano-2-sulf il)propano-2-sulfonamida, Ejemplo 746.2. Se añadió anis isopropoxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirazin-2-il) metoxibencil)-1-(5-metilpirazin-2-il)propano-2-sulfonamid homogénea se enfrió en un baño de hielo-agua. Desp mmol) a la solución de la reacción. Tras completarse Después de 20 horas, la solución de la reacción marrón columna de gel de sílice (EtOAc en heptanos al 15-85% a presión reducida para dar (la 1R,2R)-1-isopropo isopropoxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida ( forma de un sólido blanquecino. Espectro de masas (pos ida y (1 S,2S)-1 -isopropoxi-1 -(5-metilpirazin-2-,3 ml, 11,9 mmol) en un matraz que contenía (1 S,2S)-1 -no-2-sulfonamida y (1 R,2R)-1 -isopropoxi-N,N-bis(4-jemplo 746.1,1,5 g, 3 mmol) y DCM (7,5 ml). La solución de 15 minutos, se añadió gota a gota TFA (7,6 ml, 99 dición de TFA, la reacción se dejó calentar a 23°C. oncentró a presión reducida. El residuo se cargó en una s fracciones que contenían el producto se concentraron 5-metilpirazin-2-il)propano-2-sulfonamida y (1S,2S)-1-plo 746.2, 714 mg, 2,6 mmol, 88% de rendimiento) en /z: 274,0 (M+H)+.
Preparación de (1R,2R)-1-isopropoxi-1-(5-metilpirazi metilpirazin-2-il)propano-2-sulfonamida, Ejemplo 746. sulfonamida y (1S,2S)-1-isopropoxi-1-(5-metilpirazin-2-il) se purificó por SFC preparativa usando las siguientes c A: CO2 líquido, B: iPrOH para dar el pico 1 como la (1R, o (1S,2S)-1-isopropoxi-1-(5-metilpirazin-2-il)propano-2-s rendimiento). 1H RMN (400 MHz, DMSO-ds) 58,60 (d, J=7,0 Hz, 1H), 3,56 - 3,45 (m, 2H), 1,15 (d, J=6,0 Hz, ocultado en pico de DMSO). Espectro de masas (pos).
)propano-2-sulfonamida o (1S,2S)-1-isopropoxi-1-(5-a (1R,2R)-1-isopropoxi-1-(5-metilpirazin-2-il)propano-2-ano-2-sulfonamida (Ejemplo 746.2, 714 mg, 2,6 mmol) iones: Columna: IC (2 x 25 cm) Fase móvil: 70:30 (A:B) -isopropoxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida amida (Ejemplo 746.3, 293 mg, 1,07 mmol, 36% de Hz, 1H), 8,53 (d, J=0,8 Hz, 1H), 6,52 (s, 2H), 4,77 (d, , 1,05 (d, J=7,0 Hz, 3H), 0,96 (d, J=6,2 Hz, 3H). (CH3 74,2 (M+H)+.
(1 R,2R)-1 -isopropoxi-1 -(5-metilpirazin-2-il)propano-2-sulf il)propano-2-sulfonamida, Ejemplo 746.4. La elución a suministró el segundo pico que eluye como la (1R,2R (1S,2S)-1-isopropoxi-1-(5-metilpirazin-2-il)propano-2-sulf rendimiento). 1H RMN (400 MHz, DMSO-ds) 58,60 (d, J=7,0 Hz, 1H), 3,58 - 3,44 (m, 2H), 1,27 - 1,14 (m, 3H), pico de DMSO). Espectro de masas (pos). m/z: 274,2 (M
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe ida o (1 S,2S)-1 -isopropoxi-1 -(5-metilpirazin-2-nal en las condiciones descritas en el Ejemplo 746.3 opropoxi-1-(5-metilpirazin-2-il)propano-2-sulfonamida o ida (Ejemplo 746.4, 303 mg, 1,11 mmol, 37% de Hz, 1H), 8,53 (d, J=1,0 Hz, 1H), 6,52 (s, 2H), 4,77 (d, (d, J=7,0 Hz, 3H), 1,00 - 0,91 (m, 3H). (CH3 ocultado en .
aron siguiendo el procedimiento en el Ejemplo 741.0
Tabla 41
Ejemplo 748.0. Preparación de (IS,2S)-N-(4-(2,6-dimet (5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R) 3-il)-1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-sulfona il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-
(1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sul metoxibencil)-1 -(5-metilpirimidin-2-il)propano-2-sulfona metilpirimidin-2-il)propano-2-sulfonamida (Ejemplo 11. preparativa: Columna: IC-H(50 x 250 mm) Fase móvil: la (1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilp bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sul masas (pos). m/z: 472,1 (M+H)+.
-il)propano-2-sulfonamida o (1 R,2R)-1 -hidroxi-N,N-ida, Ejemplo 748.1. La (1S,2S)-1-hidroxi-N,N-bis(4-y (1 R,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-1 g, 88 mmol) se purificó por el método de SFC (A:B) A: CO2 líquido, B: MeOH para dar el pico 1 como in-2-il)propano-2-sulfonamida o (1 R,2R)-1 -hidroxi-N,N-ida, Ejemplo 748.1 (18,6 g, 39,4 mmol). Espectro de
(1 S,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpiri bis(4-metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sul condiciones descritas en el Ejemplo 748.1 suministró e (5-metilpirimidin-2-il)propano-2-sulfonamida o (1 il)propano-2-sulfonamida, Ejemplo 748.2. (19,1 g, 40,5 -il)propano-2-sulfonamida o (1 R,2R)-1 -hidroxi-N,N-ida, Ejemplo 748.2. La elución adicional en las 2 como la (1S,2S)-1-hidroxi-N,N-bis(4-metoxibencil)-1--1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirimidin-2-. Espectro de masas (pos). m/z: 472,1(M+H)+.
(1 S,2S)-1 -((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxiben 1 -((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1 -(5-vial que contenía (1S,2S)-1-hidroxi-N,N-bis(4-metoxibe 1-hidroxi-N,N-bis(4-metoxibencil)-1-(5-metilpirimidin-2-il) anhidro (2,5 ml) se enfrió a 0°C en un baño de agua trifluorometanosulfonato de terc-butildimetilsililo (0,14 adición de TEA, la reacción se dejó calentar a 23°C. De para dar un residuo que se cargó en una columna de g contenían producto se combinaron y se concentr butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1 -(5-metilpiri butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1-(5-metilpiri 0,40 mmol, 78% de rendimiento) en forma de una pelí MHz, DMSO-d6) 58,67 (d, J=0,8 Hz, 2H), 7,18 - 7,12 ( J=15,3 Hz, 2H), 4,12 (d, J=15,3 Hz, 2H), 3,74 - 3,69 (m, 0,01 - -0,02 (m, 3 H), -0,19 - - 0,23 (m, 3H). Espectro de (5-metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-irimidin-2-il)propano-2-sulfonamida, Ejemplo 748.3. Un -(5-metilpirimidin-2-il)propano-2-sulfonamida o (1R,2R)-no-2-sulfonamida (748.2, 243 mg, 0,52 mmol) en DCM y después se añadieron TEA (0,08 ml, 0,57 mmol) y 1 mmol) con cuidado gota a gota. Tras completarse la de 1 hora, la reacción se concentró a presión reducida sílice (EtOAc en heptano al 5-50%). Las fracciones que a presión reducida para dar la (1S,2S)-1-((terc-2-il)propano-2-sulfonamida o (1 R,2R)-1 -((terc-2-il)propano-2-sulfonamida (Ejemplo 748.3, 236 mg, ncolora que se usó sin más purificación. 1H RMN (400 ), 6,89 - 6,83 (m, 4H), 5,10 (d, J=6,6 Hz, 1H), 4,35 (d, 2,27 (s, 3H), 1,05 (d, J=7,3 Hz, 3H), 0,81 - 0,76 (m, 9H), s (pos). m/z: 586,0 (M+h )+.
(1 S,2S)-1 -((terc-butildimetilsilil)oxi)-1 -(5-metilprnmidin-2-butildimetilsilil)oxi)-1-(5-metilpirimidin-2-il)propano-2-sulf mmol) a un vial que contenía el Ejemplo 748.3 (236 mg, ano-2-sulfonamida o (1 S,2S)-1 -((tercida, Ejemplo 748.4. Se añadió anisol (0,18 ml, 1,65 mmol) y DCM (1 ml). La solución homogénea se enfrió
en un baño de hielo-agua. Después de 15 minutos, se reacción. Tras completarse la adición de TFA, la reacci de la reacción marrón se concentró a presión reduci (EtOAc:EtOH (3:1) en heptano al 5-35%). Las fraccio concentraron a presión reducida para dar el Ejemplo 7 una película incolora que se usó sin más purificación. E ió gota a gota TFA (1 ml, 13 mmol) a la solución de la dejó calentar a 23°C. Después de 41 horas, la solución residuo se purificó en una columna de gel de sílice e contenían el producto se combinaron y después se 134 mg, 0,39 mmol, 97% de rendimiento) en forma de o de masas (pos). m/z: 346,0 (M+H)+.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 2-il)propano-2-sulfonamida, Ejemplo 748.0. Un vi metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R) sulfonamida (Ejemplo 748.4, 134 mg, 0,39 m metilpiridina (Compuesto intermedio 2.0, 220 mg, 0,59 N,N"-dimetilciclohexano-1,2-diamina (0,13 ml, 0,82 mm después se volvió a llenar con nitrógeno. La extracció dioxano anhidro (0,8 ml) a la mezcla y la solución h previamente calentada a 80°C. Después de 21 horas, l añadió una solución acuosa de HCl 1 N con cuidado Después de extracción cuatro veces con DCM, los extr con solución acuosa de tiosulfato sódico 1 M. Después concentración a presión reducida, el residuo azul-verd en heptanos al 5-40%). Las fracciones que contenía presión reducida para dar una película incolora. Un vi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-((terc-butildimetilsilil)oxi)-N-(4-(2,6-dimetoxifenil)-5-(5-m il)propano-2-sulfonamida (143 mg, 0,22 mmol) en TH Después de 20 minutos, se añadió TBAF (solución 1,0 completarse la adición de solución de TBAF, la mezcla concentró con cuidado a presión reducida. El residuo en heptano al 25-85%). Las fracciones que contenían reducida para dar la (1S,2S)-N-(4-(2,6-dimetoxi metilpirimidin-2-il)propano-2-sulfonamida o (1 R,2R)-il)-1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-sulfonami en forma de una película incolora. 1H RMN (400 MHz, J=1,5 Hz, 1H), 8,20 (d, J=1,9 Hz, 1H), 7,62 (td, J=1,1, 2H), 5,13 (br. s., 1H), 4,79 (d, J=7,9 Hz, 1H), 3,74 (s, 3 (s, 3H), 0,93 (d, J=7,0 Hz, 3H). Espectro de masas (pos
Ejemplo 749.0. Preparación de (1R,2S)-1-(5-(3,6-dih metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2 -triazol-3-il)-1-hidroxi-1-(5-metilpirimidin-2-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metilpirimidinue contenía (1S,2S)-1-((terc-butildimetilsilil)oxi)-1-(5-rc-butildimetilsilil)oxi)-1 -(5-metilpirimidin-2-il)propano-2-3-(5-bromo-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-5-l), yoduro de cobre(I) (48 mg, 0,25 mmol), (1R,2R)-(-)-arbonato de cesio (326 mg, 1,0 mmol) se desgasificó y llenado se repitió tres veces. Después se añadió 1,4-énea azul oscuro se calentó en una placa agitadora cción se enfrió a TA y después se diluyó con agua. Se ajustar la solución homogénea azul oscuro a pH ~7. orgánicos se combinaron y después se lavaron una vez ecar la capa orgánica sobre MgSO4 anhidro, filtración y argó en una columna de gel de sílice (EtOAc:EtOH 3:1 roducto se combinaron y después se concentraron a contenía (1S,2S)-1-((terc-butildimetilsilil)oxi)-N-(4-(2,6-etilpirimidin-2-il)propano-2-sulfonamida o (1 R,2 R)-1 -din-3-il)-4H-1,2,4-triazol-3-il)-1-(5-metilpirimidin-2-idro (0,55 ml) se enfrió en un baño de hielo a 0°C. HF, 0,22 ml, 0,22 mmol) con cuidado gota a gota. Tras jó calentar a 23°C. Después de 20 horas, la mezcla se gó en una columna de gel de sílice (EtOAc:EtOH (3:1) to se combinaron y después se concentraron a presión 5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(5-,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-emplo 748.0, 52 mg, 0,10 mmol, 45% de rendimiento) -d6) 513,48 (br. s., 1H), 8,64 (d, J=0,6 Hz, 2H), 8,47 (d, z, 1H), 7,50 (t, J=8,6 Hz, 1H), 6,83 (dd, J=1,3, 8,6 Hz, 1 (s, 3H), 3,46 (quin, J=7,2 Hz, 1H), 2,27 (s, 3H), 2,25 : 526,0 (M+H)+.
H-pirano-4-il)pirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-amida.
(1 R,2S)-1-(5-(3,6-dihidro-2H-pirano-4-il)pirimidin-2-il)-N-il)-1 -metoxipropano-2-sulfonamida, Ejemplo 749.0. En cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpirid Ejemplo 428.1 (0,050 g, 0,089 mmol), 2-(3,6-dihidro-2 0,286 mmol), fosfato de potasio (0,060 g, 0,283 m metilaminofenil]paladio(II) (8,0 mg, 0,011 mmol, Aldrich mezcla resultante se unió un refrigerante de reflujo y s 6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-traz de fondo redondo de 50 ml se añadió (1 R,2S)-1 -(5-)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-sulfonamida no-4-il)-4,4,5,5-tetrametil-1,3,2-dioxaborolano (0,060 g, ldrich, St. Louis, MO), cloruro de 1,1-bis[(di-t-butil-p-Louis, MO), 1,4-dioxano (2,0 ml) y agua (0,70 ml). A la tó a 85°C en atmósfera de N2 durante 2 h. La reacción
después se enfrió a TA y se repartió entre agua (10 ml) con iPrOH en CHCl3 al 10% (20 ml). Las capas orgán concentraron. El producto así obtenido se purificó por c a 5%) para dar la (1R,2S)-1-(5-(3,6-dihidro-2H-pirano-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-sulfonamida en MHz, CDCh) 5 11,22 (br. s., 1H), 8,64-8,87 (m, 2H), 8 1H), 7,38 (t, J=8,5 Hz, 1H), 6,61 (d, J=8,5 Hz, 2H), 6,3 2H), 3,96 (t, J=5,5 Hz, 2H), 3,66-3,84 (m, 7H), 3,36 (s, 3H), 1,33-1,46 (m, 3H), 1,33-1,46 (m, 3H). LCMS-ESI -
Ejemplo 750.0. Preparación de (1R,2S)-N-(4-(2,6-metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sul metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetid OH en CHCI3 al 10% (20 ml). La capa acuosa se extrajo combinadas se secaron sobre MgSO4, se filtraron y se tografía en columna (24 g de sílice, MeOH en DCM de 0 rimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-a de un sólido amarillo claro (0,036 g). 1H RMN (300 d, J=1,3 Hz, 1H), 8,34 (d, J=1,6 Hz, 1H), 7,58-7,69 (m, J=1,5 Hz, 1H), 4,99 (d, J=4,7 Hz, 1H), 4,36 (q, J=2,6 Hz, 2,53 (dd, J=4,3, 2,7 Hz, 2H), 2,30 (s, 3H), 1,33-1,46 (m, OS). m/z: 608,0 (M+H)+.
oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-mida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metilpirimidin-2-il)propano-2-sulfonamida y (1 S,2R)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propa (4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tri y (R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il) sulfonamida Ejemplo 421.1 (0,100 g, 0,185 mmol) en (0,070 g, 0,57 mmol, J&W Pharmlab, Levittown, PA), MO), ortoformiato de trietilo (0,130 ml, 0,782 mmol, Aldr se agitó a TA en atmósfera de N2 durante 18 h. A esta Aldrich, St. Louis, MO) y MeOH (0,5 ml), y la mezcla r se inactivó con agua (3 ml). La mezcla resultante se re extrajo con iPrOH en CHCl3 al 10% (3 x 30 ml). Las filtraron y se concentraron. El producto así obtenido se en DCM de 0 a 8%) para obtener la (1R,2S)-N-(4-(2,6-metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sul metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetid (Ejemplo 750.0). 1H RMN (300 MHz, CDCh) 58,62 (s, 6,56-6,64 (m, 2H), 4,20 (d, J=6,0 Hz, 1H), 3,97-4,09 (m, (d, J=4,2 Hz, 6H), 3,01 (t, J=6,6 Hz, 1H), 2,94 (t, J=6,4 protón intercambiable. LCMS-ESI -ESI (POS). m/z: 611,
Ejemplo 751.0. Preparación de (1R,2R)-N-(4-(2,6-metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sul metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetid 2,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5
6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-sulfonamida, Ejemplo 750.0. A una disolución de (S)-N-3-il)-1-(5-metilpirimidin-2-il)-1-oxopropano-2-sulfonamida ,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)-1 -oxopropano-2-(3,0 ml) se añadió hidrocloruro de 3-metoxiazetidina propiletilamina (0,100 ml, 0,58 mmol, Aldrich, St. Louis, St. Louis, MO), y 2 gotas de AcOH. La mezcla resultante ción se añadió borohidruro sódico (0,021 g, 0,56 mmol, nte se agitó a TA durante 20 min. La reacción después ó entre agua (15 ml) y DCM (30 ml). La capa acuosa se s orgánicas combinadas se secaron sobre MgSO4, se icó por cromatografía en columna (40 g de sílice, MeOH oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-mida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida
7,54-7,66 (m, 2H), 7,28-7,35 (m, 1H), 6,66-6,73 (m, 1H), , 3,76 (s, 3H), 3,65-3,74 (m, 4H), 3,52-3,64 (m, 2H), 3,18 H), 2,31-2,37 (m, 3H), 1,28 (s, 3H). No se observaba un H)+.
oxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-mida y (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-il)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-metilpirimidin-2-il)propano-2-sulfonamida y (1 S,2S)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propa condiciones descritas en el Ejemplo 750.0, proporcionó 1,2,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5-metilpirim dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il 2,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5-6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-sulfonamida, Ejemplo 751.0. La elución adicional en las S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-2-il)propano-2-sulfonamida y (1 R,2R)-N-(4-(2,6--metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida (Ejemplo 751.0). 1H RMN (300 MHz, CDCl 6,73 (m, 1H), 6,60 (dd, J=8,5, 2,6 Hz, 2H), 4,22 (d, J=7 3,69 (s, 3H), 3,39-3,51 (m, 1H), 3,14-3,20 (m, 6 H), 3,0 observaba un protón intercambiable. LCMS-ESI -ESI (P
Ejemplo 752.0. Preparación de (1 R,2S)-N-(4-(2,6-dimet (5-(piridin-3-il)pirimidin-2-il)propano-2-sulfonamida.
,60 (s, 2H), 7,56-7,66 (m, 2H), 7,28-7,35 (m, 1H), 6 ,66 1H), 3,91-4,01 (m, 1H), 3,75-3,84 (m, 2H), 3,74 (s, 3H), (m, 2H), 2,32 (s, 3H), 1,50 (d, J=7,2 Hz, 3H). No se /z: 611,0 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida, Ejemplo 752.0. En un mat cloropirimidin-2-il)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpirid Ejemplo 428.1 (0,050 g, 0,089 mmol), éster de pinacol Products, West Columbia, SC), fosfato de potasio (0,0 de 1,1-bis[(di-t-butil-p-metilaminofenil]paladio(II) (8,0 mg agua (0,70 ml). La mezcla resultante se burbujeó con reflujo, y la mezcla de reacción se calentó a 85°C en at se enfrió a TA y se repartió entre agua (20 ml) y iPrOH de iPrOH (2 x 40 ml). Las capas orgánicas combinada producto así obtenido se purificó por cromatografía en c la (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinil)propano-2-sulfonamida en forma de un sólido amarill 1H), 8,99 (s, 2H), 8,88 (d, J=1,8 Hz, 1H), 8,73 (dd, J=4, 7,91 (dt, J=8,2, 1,8 Hz, 1H), 7,61 -7,68 (m, 1H), 7,47 (dd, 2H), 5,06 (d, J=4,8 Hz, 1H), 3,79-3,89 (m, 1h), 3,75 (d, 3h). LCMS-ESI -ESI (POS). m/z: 602,9 (M+H)+.
Ejemplo 753.0. Preparación de (1R,2S)-N-(4-( (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2 -triazol-3-il)-1 -metoxi-1 -(5-(piridin-3-il)pirimidin-2-e fondo redondo de 50 ml se añadió (1R,2S)-1-(5-)-4H-1,2,4-triazol-3-il)-1-metoxipropano-2-sulfonamida ido 3-piridinaborónico (0,060 g, 0,293 mmol, Oakwood 0,283 mmol, Aldrich, St. Louis, MO), (AmPhos) cloruro 1 mmol, Aldrich, St. Louis, MO), 1,4-dioxano (2,0 ml), y urante un par de minutos, se unió un refrigerante de ra de N2 durante 20 h. La mezcla de reacción después CI3 al 10% (40 ml). La capa acuosa se extrajo con 10% ecaron sobre MgSO4, se filtraron y se concentraron. El a (12 g de sílice, MeOH en DCM de 0 a 10%) para dar -1,2,4-triazol-3-il)-1 -metoxi-1 -(5-(piridin-3-il)pirimidin-2-(0,015 g). 1H RMN (300 MHz, CdCI3) 5 11,18 (br. s., Hz, 1H), 8,45 (d, J=1,6 Hz, 1H), 8,34 (d, J=1,8 Hz, 1H), , 4,8 Hz, 1H), 7,39 (t, J=8,5 Hz, 1H), 6,61 (d, J=8,6 Hz, Hz, 6 H), 3,40 (s, 3H), 2,31 (s, 3H), 1,44 (d, J=7,0 Hz,
etoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-pano-2-sulfonamida.
Etapa 1: (S)-N,N-bis(4-metoxibencil)-1-(5-metilpiri metoxibencil)-1-(5-metilpirimidin-2-il)-1-oxopropano-2-su hidroxi-N,N-bis(4-metoxibencil)-1 -(5-metilpirimidin-2-il)pr metoxibencil)-1-(5-metilpirimidin-2-il)propano-2-sulfona añadió peryodinano de Dess-martin (4,95 g, 11,7 mmol en atmósfera de N2 durante 7 h. Se añadieron Agua acuosa se extrajo con DCM (40 ml), iPrOH en CHCI secaron sobre MgSO4, se filtraron y se concentraron. columna (220 g de sílice, acetona en hexanos de 10 a amarillo claro (4,9 g). 1H RMN (CDCI3) 58,74 (s, 2H), 4,26-4,36 (m, 4H), 3,74-3,86 (m, 7H), 2,44 (s, 3H), 1,70 2-il)-1-oxopropano-2-sulfonamida y (R)-N,N-bis(4-ida, Ejemplo 753.1. A una disolución de (1S,2S)-1--2-sulfonamida y (1 R,2R)-1 -hidroxi-N,N-bis(4-jemplo 11.05 (5,0 g, 10,6 mmol) en DCM (80 ml) se ch, St. Louis, MO). La mezcla resultante se agitó a TA l) y DCM (40 ml). Se separaron las capas y la capa 0% (4 x 40 ml). Las capas orgánicas combinadas se roducto así obtenido se purificó por cromatografía en ara obtener el Ejemplo 753.1 en forma de una espuma ,19 (m, 4H), 6,74-6,82 (m, 4H), 5,98 (q, J=7,0 Hz, 1H), 7,0 Hz, 3H). MS-ESI (POS). m/z: 470,0 (M+H)+.
Etapa 2: (S)-1-(5-metilpirimidin-2-il)-1-oxopropano-2amida y (R)-1-(5-metilpirimidin-2-il)-1-oxopropano-2-sulfonamida, Ejemplo 753.2. A una disolución de (S)-2-sulfonamida y (R)-N,N-bis(4-metoxibencil)-1-(5-metilpi en DCM (30 ml) se añadió anisol (5,3 ml, 48,8 mmol, Al baño de hielo y se trató con TFA (30,0 ml) gota a gota mezcla resultante se agitó en un baño de hielo durante agitó a TA durante 2 días. La mezcla de reacción des cromatografía en columna (330 g de sílice, acetona en forma de una espuma blanca (1,9 g). 1H RMN (CDCh) 2,55 (m, 3H), 1,76 (d, J=7,0 Hz, 3H). MS-ESI (POS). m/ s(4-metoxibencil)-1-(5-metilpirimidin-2-il)-1-oxopropanon-2-il)-1-oxopropano-2-sulfonamida (4,9 g, 10,44 mmol) St. Louis, MO). La mezcla de reacción se enfrió en un iante un embudo de adición. Después de la adición, la ora y después se calentó a TA La mezcla resultante se se concentró. El producto así obtenido se purificó por nos de 5 a 50%) proporcionando el Ejemplo 753.2 en (s, 2H), 5,97 (q, J=7,1 Hz, 1H), 4,86 (br. s., 2H), 2,37 ,0 (M+H)+.
Etapa 3: (S)-N-(4-(2,6-dimetoxifenil)-5-(6-me oxopropano-2-sulfonamida y (R)-N-(4-(2,6-d metilpirimidin-2-il)-1-oxopropano-2-sulfonamida, Ejempl Ejemplo A, la reacción del Ejemplo 753.2, 6 -m dimetoxibenceno Ejemplo 1.0 proporcionó el Ejemplo 7 7,5 Hz, 1H), 7,29-7,35 (m, 1H), 6,56-6,68 (m, 3H), 6,43-3,75 (m, 3H), 3,12 (s, 3H), 2,40-2,48 (m, 3H), 1,38 (d, J ESI (POS). m/z: 539,9 (M+H)+.
ridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2-il)-1 -xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(5-.3. Siguiendo el procedimiento general descrito en el icolinohidrazida Ejemplo 3.18, e isotiocianato-1,3-1H RMN (CDCh) 58,67-8,76 (m, 2H), 7,47 (dd, J=8,3, m, 1H), 4,41 (q, J=6,9 Hz, 1H), 3,75-3,80 (m, 3H), 3,67 z, 3H). No se observaba un protón intercambiable. MS-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxif 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(5-metilpirimidin-2 dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-753.3 (0,200 g, 0,38 mmol) en DCM (3,0 ml) se aña 0,401 ml, 3,82 mmol, Aldrich, St. Louis, MO), ortoformia gotas de AcOH. La mezcla resultante se agitó a TA en añadió borohidruro sódico (0,050 g, 1,32 mmol, Aldrich, agitó durante 20 minutos y después se inactivó con agu y DCM (30 ml). La capa acuosa se extrajo con iPrOH e se secaron sobre MgSO4, se filtraron y se concentraro columna (40 g de sílice, MeOH en DCM de 0 a 4%) par 3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimi dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-(Ejemplo 753.0). 1H RMN (CDCh) 58,58 (s, 2H), 8,44 7,39 (t, J=8,6 Hz, 1H), 6,53-6,70 (m, 2H), 4,60 (d, J=3,1 6 H), 1,23-1,33 (m, 4H). LCMS-ESI -ESI (POS). m/z: 539
Ejemplo 754.0. Preparación de (1R,2R)-N-(4-( (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-. A una disolución de (S)-N-(4-(2,6-dimetoxifenil)-5-(5--oxopropano-2-sulfonamida y (R)-N-(4-(2,6-etilpirimidin-2-il)-1-oxopropano-2-sulfonamida, Ejemplo etilamina (solución en EtOH absoluto al 33% en peso, trietilo (0,30 ml, 1,80 mmol, Aldrich, St. Louis, MO), y 2 fera de N2 durante 20 h. A esta mezcla de reacción se ouis, MO) y MeOH (0,5 ml). La mezcla de reacción se l). La mezcla resultante se repartió entre agua (15 ml) h al 10% (3 x 30 ml). Las capas orgánicas combinadas producto así obtenido se purificó por cromatografía en ner la (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinl)propano-2-sulfonamida y (1 S,2r)-N-(4-(2,6-tilamino)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida 1,6 Hz, 1H), 8,34 (d, J=1,8 Hz, 1H), 7,60-7,67 (m, 1H), 1H), 3,62-3,82 (m, 8H), 2,36 (s, 3H), 2,31 (d, J=6,9 Hz, H)+.
metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-pano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida y (1 S,2S)-N-(4-(2,6-dimetoxif 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo Ejemplo 753.0 suministró el Ejemplo 754.0. 1H RMN ( J=1,8 Hz, 1 H), 7,62-7,68 (m, 1H), 7,39 (t, J=8,5 Hz, 1H) 3H), 3,76 (s, 3 H) 3,65-3,71 (m, 2H), 2,28-2,37 (m, 6 H), 539,0 (M+h)+. No se observaba un protón intercambia
Ejemplo 755.0. Preparación de (1R,2S)-N-(4-( (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2 -triazol-3-il)-1 -(metilamino)-l -(5-metilpirimidin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-. La elución adicional en las condiciones descritas en el ) 58,56-8,62 (m, 2H), 8,44 (d, J=1,6 Hz, 1H), 8,35 (d, (dd, J=8 ,6 , 2,0 Hz, 2H), 4,10 (d, J=8,9 Hz, 1H), 3,80 (s, (s, 3H), 1,08-1,17 (m, 3H). LCMS-ESI -ESI (POS). m/z:
metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-pano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxif 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo usando SFC preparativa (columna OX (5 pm, 30 mm x de CO2 líquido en 50% de MeOH con 0,2% de isopropi con más de 99,5% de exceso enantiomérico. El dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinil)propano-2-sulfonamida. 1H RMN (CDCl3) 58,58 (s, 2 J=8,5 Hz, 1H), 6,61 (t, J=8,7 Hz, 2H), 4,60 (d, J=2,9 Hz 1,33 (d, J=7,2 Hz, 3H). LCMS-ESI -ESI (POS). m/z: 539
Ejemplo 756.0. Preparación de (1 R,2S)-N-(4-( (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonam 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2 -triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-. La mezcla racémica del Ejemplo 753.0 se resolvió , 5 pm S/N=2121 dirección normal) eluyendo con 50% a con un caudal de 100 ml/min) para dar dos productos r pico que eluía proporcionó la (1R,2S)-N-(4-(2,6-tilamino)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-44 (s, 1H), 8,33 (d, J=1,9 Hz, 1H), 7,64 (s, 1H), 7,38 (t, 3,69-3,81 (m, 7H), 2,42 (s, 3H), 2,32 (d, J=7,3 Hz, 8 H), H)+.
imetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-pano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxif 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo usando SFC preparativa (columna OX (5 pm, 30 mm x de CO2 líquido en 50% de MeOH con 0,2% de isopropi con más de 99,5% de exceso enantiomérico. El
dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinil)propano-2-sulfonamida. 1H RMN (CDCb) 58,59 (s, 2 1H), 6,62 (dd, J=11,1, 8,3 Hz, 2H), 4,61 (s, 1H), 3,77 ( 1,37 (s, 3H). LCMS-ESI -ESI (POS). m/z: 539,0 (m H)+.
-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-. La mezcla racémica del Ejemplo 753.0 se resolvió , 5 pm S/N=2121 dirección normal) eluyendo con 50% a con un caudal de 100 ml/min) para dar dos productos do pico que eluía proporcionó la (1R,2S)-N-(4-(2,6-tilamino)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-44 (s, 1H), 8,33 (s, 1H), 7,65 (s, 1H), 7,39 (t, J=8,5 Hz, ), 3,74 (s, 3 H), .47 (br. s., 3H), 2,32 (d, J=8,5 Hz, 8H), e observaba un protón intercambiable.
Ejemplo 757.0. Preparación de (1S,2S)-N-(4-( (metilamino)-l -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2 metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-pano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxif 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo usando SFC preparativa (columna OX (5 um, 30 mm x de CO2 líquido en 50% de MeOH con 0,2% de isopropi con más de 99,5% de exceso enantiomérico. El dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinil)propano-2-sulfonamida. 1H RMN (CDCl3) 58,57 (s, 1H), 7,37 (t, J=8,5 Hz, 1H), 6,61 (dd, J=8,6, 1,7 Hz, 2H) (m, 1H), 2,31 (d, J=9,1 Hz, 6H), 2,16-2,22 (m, 3H), 1,13 LCMS-ESI -ESI (POS). m/z: 539,0 (M+H)+.
Ejemplo 758.0. Preparación de (IS,2S)-N-(4-( (metilamino)-1 -(5-metilpirimidin-2-il)propano-2-sulfonami 4H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2 -triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-0. La mezcla racémica del Ejemplo 754.0 se resolvió , 5 um S/N=2121 dirección normal) eluyendo con 50% a con un caudal de 100 ml/min) para dar dos productos r pico que eluía proporcionó la (1 R,2R)-N-(4-(2,6-tilamino)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-,43 (d, J=1,6 Hz, 1h ), 8,34 (d, J=1,9 Hz, 1 H), 7,62 (s, (d, J=8,8 Hz, 1H), 3,79 (s, 3H), 3,75 (s, 3H), 3,59-3,71 (m, 3H). No se observaban 2 protones intercambiables.
metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-pano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H il)propano-2-sulfonamida o (1 S,2S)-N-(4-(2,6-dimetoxif 1-(5-metilpirimidin-2-il)propano-2-sulfonamida, Ejemplo usando SFC preparativa (columna OX (5 pm, 30 mm x de CO2 líquido en 50% de MeOH con 0,2% de isopropil con más de 99,5% de exceso enantiomérico. El s dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridinil)propano-2-sulfonamida. 1H RMN (CDCla) 58,53-8,62 (s, 1H), 7,33-7,45 (m, 1H), 6,52-6,68 (m, 2H), 4,07 (d, J=8,8 Hz, 6H), 2,18 (s, 3H), 1,10 (d, J=2,9 Hz, 3H). No (POS). m/z: 539,0 (M+H)+.
Ejemplo 759.0. Preparación de (1R,2S)-N-(4-(2,6-d metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sul metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetidi -triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2--(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -(metilamino)-. La mezcla racémica del Ejemplo 754.0 se resolvió , 5 pm S/N=2121 dirección normal) eluyendo con 50% a con un caudal de 100 ml/min) para dar dos productos do pico que eluía proporcionó la (1 R,2R)-N-(4-(2,6-tilamino)-1-(5-metilpirimidin-2-il)propano-2-sulfonamida H-1,2,4-triazol-3-il)-1 -(metilamino)-1 -(5-metilpirimidin-2-H), 8,43 (d, J=1,6 Hz, 1H), 8,34 (d, J=1,8 Hz, 1H), 7,63 Hz, 1H), 3,72-3,83 (m, 6H), 3,61-3,71 (m, 1H), 2,31 (d, bservaban 2 protones intercambiables. lCm S-ESI -ESI
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-ida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-)-1 -(5-metilpirimidin-2-il)propano-2-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2R)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propan (Ejemplo 750.0) se resolvió usando SFC preparativa dirección normal) eluyendo con 55% de CO2 líquido en 70 ml/min) para dar dos productos con más de 99,5% d la (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2R)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propan (m, 2H), 7,29-7,36 (m, 1H), 6,66-6,74 (m, 1H), 6,60 (d 1H), 3,76 (s, 3H), 3,72 (s, 3H), 3,58 (dd, J=13,3, 6,6 Hz, s., 1 H), 2,34 (s, 3H), 1,27 (d, J=7,0 Hz, 4H). No se obse 611,0 (M+H)+.
Ejemplo 760.0. Preparación de (1R,2S)-N-(4-(2,6-d metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sul metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetidi ,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-ulfonamida, Ejemplo 759.0. La mezcla racémica mna OX (5 pm, 21 mm x25 cm, 5 pm S/N=402121 de MeOH con 0,2% de isopropilamina con un caudal de eso enantiomérico. El primer pico que eluía proporcionó n-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-ulfonamida. 1H RMN (CüCla) 58,62 (s, 2H), 7,54-7,68 8,5, 4,4 Hz, 2H), 4,20 (d, J=6,0 Hz, 1H), 3,96-4,09 (m, , 3,18 (d, J=4,1 Hz, 6H), 3,01 (t, J=6,7 Hz, 1H), 2,94 (br. a un protón intercambiable. lCMs -ESI -ESI (POS). m/z:
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-ida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-l)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2R)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propan (Ejemplo 750.0) se resolvió usando SFC preparativa dirección normal) eluyendo con 55% de CO2 líquido en 70 ml/min) para dar dos productos con más de 99, proporcionó la (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-met (5-metilpirimidin-2-il)propano-2-sulfonamida o (1 S triazol-3-il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-7,56-7,67 (m, 2H), 7,29-7,36 (m, 1H), 6,65-6,73 (m, 1H) 4,09 (m, 1H), 3,76 (s, 3H), 3,71 (s, 3H), 3,58 (dd, J=13, 2,90-2,98 (m, 1H), 2,34 (s, 3H), 1,27 (d, J=7,0 Hz, 4H). (POS). m/z: 611,0 (M+H)+.
Ejemplo 761.0. Preparación de (1R,2R)-N-(4-(2,6-d metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sul metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetidi ,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-ulfonamida, Ejemplo 760.0. La mezcla racémica mna OX (5 pm, 21 mm x25 cm, 5 pm S/N=402121 de MeOH con 0,2% de isopropilamina con un caudal de e exceso enantiomérico. El segundo pico que eluía idin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-metoxiazetidin-1 -il)-1 --N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-pano-2-sulfonamida. 1H Rm N (CDCh) 5 8,62 (s, 2H), 0 (dd, J=8,5, 4,4 Hz, 2H), 4,21 (d, J=5,8 Hz, 1H), 3,97 8 Hz, 2H), 3,18 (d, J=4,1 Hz, 6H), 3,01 (t, J=6,7 Hz, 1H), e observaba un protón intercambiable. LCmS-ESI -ESI
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-ida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-l)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propan (Ejemplo 751.0) se resolvió usando SFC preparativa dirección normal) eluyendo con 85% de CO2 líquido en 70 ml/min) para dar dos productos con más de 99,5% d la (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propan (m, 2H), 7,29-7,35 (m, 1H), 6,69 (dd, J=7,0, 2,0 Hz, 1H (quin, J=5,9 Hz, 1H), 3,79 (t, J=7,2 Hz, 1H), 3,74 (s, 3 3H), 2,98-3,09 (m, 2 H), 2,32 (s, 3H), 1,50 (d, J=7,2 Hz, ESI (POS). m/z: 611.0 (M+H)+.
Ejemplo 762.0. Preparación de (1R,2R)-N-(4-(2,6-di metoxiazetidin-1 -il)-1 -(5-metilpirimidin-2-il)propano-2-sulf metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetidi ,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-ulfonamida, Ejemplo 761.0. La mezcla racémica mna OX (5 pm, 21 mm x25 cm, 5 pm S/N=711051 de MeOH con 0,2% de isopropilamina con un caudal de eso enantiomérico. El primer pico que eluía proporcionó -2-il)-4H-1,2,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-ulfonamida. 1H RMN (CüCla) 58,60 (s, 2H), 7,56-7,65 9 (dd, J=8,0, 6,0 Hz, 2H), 4,16 (d, J=7,3 Hz, 1H), 3,93 8 (s, 3H), 3,37 (t, J=5,6 Hz, 1H), 3,18 (s, 3H), 3,15 (s, No se observaba un protón intercambiable. LCMS-ESI -
xifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-ida o (1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-)-1 -(5-metilpirimidin-2-il)propano-2-sulfonamida.
(1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4 metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-N-( il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)propan (Ejemplo 751.0) se resolvió usando SFC preparativa dirección normal) eluyendo con 85% de CO2 líquido en 70 ml/min) para dar dos productos con más de 99, proporcionó la (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(6-met (5-metilpirimidin-2-il)propano-2-sulfonamida o (1 S,2S)-N 3-il)-1-(3-metoxiazetidin-1-il)-1-(5-metilpirimidin-2-il)prop 7,55-7,67 (m, 2H), 7,29-7,36 (m, 1H), 6,66-6,74 (m, 1H), Hz, 1H), 3,76-3,84 (m, 1H), 3,74 (s, 3H), 3,68 (s, 3H), 3 3,03 (dt, J=9,2, 6,7 Hz, 2H), 2,32 (s, 3H), 1,50 (d, J=7, ESI -ESI (POS). m/z: 611,0 (M+H)+.
Ejemplo 763.0. Preparación de (2S,3R)-N-(4-(2,6-bis(d 3-(5-metilpirimidin-2-il)butano-2-sulfonamida.
,4-triazol-3-il)-1 -(3-metoxiazetidin-1 -il)-1 -(5--dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-ulfonamida, Ejemplo 762.0. La mezcla racémica mna OX (5 um, 21 mm x25 cm, 5 um S/N=711051 de MeOH con 0,2% de isopropilamina con un caudal de e exceso enantiomérico. El segundo pico que eluía idin-2-il)-4H-1,2,4-triazol-3-il)-1-(3-metoxiazetidin-1 -il)-1 -,6-dimetoxifenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol--sulfonamida. 1H Rm N (CDCh) 5 8,55-8,65 (m, 2H), -6,64 (m, 2H), 4,16 (d, J=7,2 Hz, 1H), 3,93 (quin, J=6,0 ,43 (m, 1H), 3,31-3,43 (m, 1H), 3,16 (d, J=8,5 Hz, 6H), 3H). No se observaba un protón intercambiable. LCMS-
(2S,3R)-N-(4-(2,6-bis(difluorometoxi)fenil)-5-(5-metilpiridi sulfonamida, Ejemplo 763.0. Siguiendo el procedi bis(difluorometoxi)-2-isocianatobenceno (Compuesto sulfonamida (Ejemplo 10.0) se proporcionó la (2S,3 1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-sulfona 8,50 (d, J=1,6 Hz, 1H), 8,32 (d, J=1,9 Hz, 1H), 7,61-7, 6,80 (m, 2H), 3,75-3,90 (m, 1H), 3,64 (quin, J=6,9 Hz, 1 ESI (POS). m/z: 595,8 (M+H)+.
Ejemplo 764.0. Preparación de (2R,3S)-N-(4-(2,6-dimet hexyne-2-sulfonamida y (2S,3R)-N-(4-(2,6-dimet hexyne-2-sulfonamida.
)-4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-general descrito en el Ejemplo A, usando el medio 1.5), (2S,3R)-3-(5-metilpirimidin-2-il)butano-2-4-(2,6-bis(difluorometoxi)fenil)-5-(5-metilpiridin-3-il)-4H-1H RMN (CDCh) 5 11,91 (br. s., 1H), 8,54 (s, 2H), , 1H), 7,49-7,60 (m, 1H), 7,19 (d, J=8,3 Hz, 2H), 6,19 33 (s, 3H), 2,30 (s, 3H), 1,35-1,40 (m, 6H). LCMS-ESI -
il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4-il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-hidroxi-4-
But-2-inal, Ejemplo 764.1. En un matraz de fondo r manganeso(IV) (24,8 g, 285 mmol, Aldrich, St. Louis,
Louis, MO), y DCM (70 ml). A esto se añadió soluci resultante se agitó a TA en atmósfera de N2 durante 20 una almohadilla de agente de filtración de marca Celite DCM. El filtrado se destiló (50 a 57°C) para dar el but-2-i 9,06-9,27 (m, 1H), 1,95-2,17 (m, 3H).
o de 500 ml secado en horno se añadió óxido de amices moleculares en polvo (0,4 nm, 6 g, Aldrich, St.
itada de 2-butin-1-ol (2,0 g, 28,5 mmol). La mezcla mezcla de reacción se enfrió a TA y se filtró a través de agente de filtración de marca Celite® se lavó más con forma de un líquido marrón (1,3 g). 1H RMN (CDCh) 5
(2S,3R)-3-hidroxi-N,N-bis(4-metoxibencil)hex-4-ino-2-sul ino-2-sulfonamida, Ejemplo 764.2. En un matraz de f añadió N,N-bis(4-metoxibencil)etanosulfonamida (1,4 resultante se enfrió a -70°C seguido de la adición got hexanos, 2,0 ml, 5,00 mmol, Aldrich, St. Louis, MO). La adición, se continuó agitando por debajo de -70°C duran (0,491 g, 7,21 mmol) en THF (1 ml) a la mezcla de reac la reacción se agitó más a -70°C durante 2 h. La reacció y se repartió entre EtOAc (70 ml) y agua (40 ml). La cap combinadas se secaron sobre MgSO4, se filtraron y cromatografía en columna (120 g de sílice, EtOAc en h metoxibencil)hex-4-ino-2-sulfonamida y (2R,3S)-3-hidro (CDCh) 57,13-7,23 (m, 4H), 6,83-6,94 (m, 4H), 4,97 ( 3,83 (s, 6H), 3,17 (qd, J=7,1, 1,8 Hz, 1H), 3,09 (d, J=4, ESI -ESI (POS). m/z: 418,2 (M+H)+.
ida y (2R,3S)-3-hidroxi-N,N-bis(4-metoxibencil)hex-4-redondo de 3 bocas, de 50 ml, secado en horno, se 1 mmol, Ejemplo 12.0) y THF (12,0 ml). La mezcla ota con jeringa de solución de n-butil-litio, (2,5 m en ratura se mantuvo por debajo de -70°C. Después de la min. Se añadió gota a gota una disolución de but-2-inal ediante un embudo de adición. Después de la adición, pués se inactivó con solución saturada de NH4Cl (8 ml) osa se extrajo con EtOAc (50 ml). Las capas orgánicas ncentraron. El producto así obtenido se purificó por de 10 a 40%) para dar la (2S,3R)-3-hidroxi-N,N-bis(4--bis(4-metoxibencil)hex-4-ino-2-sulfonamida. 1H RMN ,0, 2,0 Hz, 1H), 4,33-4,46 (m, 2H), 4,13-4,26 (m, 2H), 1H), 1,88 (d, J=2,2 Hz, 3H), 1,40-1,49 (m, 3H). LCMS-
(2S,3S)-3-hidroxi-N,N-bis(4-metoxibencil)hex-4-ino-2-sul ida y (2R,3R)-3-hidroxi-N,N-bis(4-metoxibencil)hex-4-ino-2-sulfonamida, Ejemplo 764.3. La elución adicional el Ejemplo 764.3. 1H RMN (CDCls) ó 7,14-7,22 (m, 4H 2H), 4,11-4,21 (m, 2H), 3,82 (s, 6H), 3,45 (d, J=3,2 Hz, (m, 3H).
as condiciones descritas en el Ejemplo 764.2 suministró 84-6,92 (m, 4H), 4,75-4,84 (m, 1H), 4,44 (d, J=15,2 Hz, , 3,21 (quin, J=7,2 Hz, 1H), 1,85-1,92 (m, 3H), 1,35-1,45
(2R,3S)-3-hidroxihex-4-ino-2-sulfonamida y (2S,3R)-3-h 3-hidroxi-N,N-bis(4-metoxibencil)hex-4-ino-2-sulfonamid sulfonamida (0,550 g, 1,317 mmol) en DCM (5,0 ml) se mezcla de reacción se enfrió en un baño de hielo y se mediante un embudo de adición. Después de la adició 30 min y se calentó a TA y se agitó durante 20 h. De obtenido se purificó por cromatografía en columna (40 hidroxihex-4-ino-2-sulfonamida y (2S,3R)-3-hidroxihexg). 1H RMN (CDCls) ó 4,91-5,11 (m, 1H), 4,65 (br. s., J=2,3 Hz, 3H), 1,53-1,58 (m, 3H). LCMS-ESI -ESI (POS).
ihex-4-ino-2-sulfonamida. A una disolución de (2S,3R)-(2R,3S)-3-hidroxi-N,N-bis(4-metoxibencil)hex-4-ino-2-ió anisol (0,70 ml, 6,44 mmol, Aldrich, St. Louis, MO). La ó gota a gota con TFA (5,00 ml, Aldrich, St. Louis, MO) mezcla resultante se agitó en un baño de hielo durante s, la mezcla de reacción se concentró. El producto así sílice, MeOH en DCM de 0 a 5%) para dar la (2R,3S)-3--2-sulfonamida en forma de un sólido marrón claro (0,20 3,32 (qd, J=7,1, 2,6 Hz, 1H), 2,52-2,80 (m, 1H), 1,90 (d, : 200,0 (M+Na)+.
N'-(2,6-dimetoxifenil)-N-(((2S,3R)-3-hidroxihex-4-in-2-il) (2,6-dimetoxifenil)-N-(((2R,3S)-3-hidroxihex-4-in-2-il)sulf 764.0. Siguiendo el procedimiento general del Eje sulfonamida y (2S,3R)-3-hidroxihex-4-ino-2-sulfonami Ejemplo 1.0. 1H RMN (CDCb) ó 11,00 (br. s., 1H), 8,46 7,41 (t, J=8,6 Hz, 1H), 6,55-6,68 (m, 2H), 5,07 (d, J=1, 1H), 3,08-3,23 (m, 1H), 2,32 (s, 3H), 1,83 (d, J=2,2 Hz (M+H)+.
Ejemplo 765.0. Preparación de (1 R,2S)-N-(4-(2,6-dimet (6-metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R) 3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfonam il)-2-(5-metilnicotinoil)hidrazinacarboximidamida y N'-2-(5-metilnicotinoil)hidrazinacarboximidamida, Ejemplo A, la reacción usaba (2R,3S)-3-hidroxihex-4-ino-2-(Ejemplo 764.4) y isotiocianato-1,3-dimetoxibenceno =1,5 Hz, 1H), 8,34 (d, J=1,8 Hz, 1H), 7,61-7,69 (m, 1H), , 1H), 3,81 (s, 3H), 3,72-3,76 (m, 3H), 3,42 (d, J=1,8 Hz, ), 1,42-1,53 (m, 3H). LCMS-ESI -ESI (POS). m/z: 472,0
nil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 --(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-
(E)-3-metil-6-(prop-1-en-1-il)piridazina, Ejemplo 765.1.
11.0, usando el 3-cloro-6-metilpiridazina se proporcion 7,38 (d, J=8,8 Hz, 1H), 7,23 (d, J=8,6 Hz, 1H), 6,69-6, (POS). m/z: 135,2 (M+H)+.
iendo el procedimiento general descrito en el Ejemplo )-3-metil-6-(prop-1-en-1-il)piridazina. 1H RMN (CDCb) ó , 2H), 2,69 (s, 3H), 1,94-2,03 (m, 3H). LCMS-ESI -ESI
1 -(6-Metilpiridazin-3-il)propano-1,2-diol, Ejemplo 765.2.
11.0, usando (E)-3-metil-6-(prop-1-en-1-il)piridazina se uiendo el procedimiento general descrito en el Ejemplo orcionó 1-(6-metilpiridazin-3-il)propano-1,2-diol. 1H RMN
(CDCI3) 57,46-7,55 (m, 1H), 7,32-7,41 (m, 1H), 4,69 (br.
2,73 (s, 3H), 1,29 (d, J=6,4 Hz, 3H). LCMS-ESI -ESI (P H), 4,13-4,25 (m, 1H), 4,07 (br. s., 1H), 2,96 (br. s., 1H), /z: 169,2 (M+H)+.
6-Metilpiridazina-3-carbaldehído, Ejemplo 765.3. Siguie usando 1 -(6-metilpiridazin-3-il)propano-1,2-diol se prop 10,21-10,52 (m, 1H), 7,95 (d, J=8,5 Hz, 1H), 7,40-7,6 (M+H)+.
el procedimiento general descrito en el Ejemplo 11.0, ó 6-metilpiridazina-3-carbaldehído. 1H RMN (CDCh) 5 1H), 2,86 (s, 3H). LCMS-ESI -ESI (POS). m/z: 123,2
(1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(6-metilpirid bis(4-metoxibencil)-1-(6-metilpiridazin-3-il)propano-2-sulf general descrito en el Ejemplo 11.0, la reacción de 6-me N,N-bis(4-metoxibencil)-1-(6-metilpiridazin-3-il)propano-(6-metilpiridazin-3-il)propano-2-sulfonamida. 1H RMN ( J=8,3 Hz, 4H), 6,88 (d, J=8,3 Hz, 4H), 5,67 (s, 1H), 4,28 3H), 1,18 (d, J=7,2 Hz, 3H). LCMS-ESI -ESI (POS). m/z: -il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-ida, Ejemplo 765.4. Siguiendo el procedimiento dazina-3-carbaldehído proporcionó la (1 R,2S)-1-hidroxionamida y (1 S,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1-) 57,61-7,69 (m, 1h), 7,39 (d, J=8,6 Hz, 1H), 7,23 (d, (m, 4H), 4,04-4,15 (m, 1H), 3,81-3,85 (m, 7H), 2,75 (s, 0 (M+H)+.
(1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(6-metilpirid bis(4-metoxibencil)-1-(6-metilpiridazin-3-il)propano-2-sulf descrito en el Ejemplo 765.4, la elución adicional s metilpiridazin-3-il)propano-2-sulfonamida y (1S,2S)-1-hi 2-sulfonamida. 1H RMN (CDCls) 57,66 (d, J=8,6 Hz, 1 (m, 4H), 5,41 (t, J=5,3 Hz, 1H), 4,73 (d, J=5,4 Hz, 1H), 6H), 3,67-3,76 (m, 1H), 2,74 (s, 3H), 1,17 (d, J=7,0 Hz, 3 -il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxi-N,N-ida, Ejemplo 765.4. Siguiendo el procedimiento istró la (1R,2R)-1-hidroxi-N,N-bis(4-metoxibencil)-1-(6-N,N-bis(4-metoxibencil)-1-(6-metilpiridazin-3-il)propano-38 (d, J=8,5 Hz, 1H), 7,17 (d, J=8,5 Hz, 4H), 6,86-6,88 (d, J=15,2 Hz, 2H), 4,11 (d, J=15,2 Hz, 2H), 3,82 (m, CMS-ESI -ESI (POS). m/z: 472,0 (M+H)+.
(1 R,2S)-1-((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxiben 1 -((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1 -(6-Siguiendo el procedimiento general descrito en el Ejem 1 -((tertbutildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1-(6-m butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1-(6-metilpiri J=8,6 Hz, 1H), 7,35 (d, J=8,6 Hz, 1H), 7,15 (d, J=8,5 H Hz, 2H), 4,13 (d, J=15,2 Hz, 2H), 3,80 (s, 6H), 3,53-3,6 9H), 0,28 (s, 3H), -0,10 (s, 3H). LCMS-ESI -ESI (POS).
(6-metilpiridazin-3-il)propano-2-sulfonamida y (1S,2R)-iridazin-3-il)propano-2-sulfonamida, Ejemplo 765.5. .0, usando el Ejemplo 765.4 se proporcionó la (1 R,2S)-ridazin-3-il)propano-2-sulfonamida y (1 S,2R)-1 -((terc-3-il)propano-2-sulfonamida. 1H RMN (CDCl3) 57,56 (d, ), 6,83 (d, J=8,3 Hz, 4H), 5,91 (s, 1H), 4,47 (d, J=15,2 1H), 2,71-2,79 (m, 3H), 1,16 (d, J=7,0 Hz, 3H), 0,98 (s, 86,0 (M+H)+.
Etapa 6: (1R,2S)-1-((terc-butildimetilsilil)oxi)-1-(6-m butildimetilsilil)oxi)-1-(6-metilpiridazin-3-il)propano-2-sulf descrito en el Ejemplo 11.0, usando el Ejemplo 76 metilpiridazin-3-il)propano-2-sulfonamida y (1 S,2R) sulfonamida. 1H RMN (CDCls) 57,56 (d, J=8,8 Hz, 1H), 3,49-3,62 (m, 1H), 2,74 (s, 3H), 1,39 (d, J=6,9 Hz, 3 (POS). m/z: 346,0 (M+H)+.
azin-3-il)propano-2-sulfonamida y (1S,2R)-1-((tercida, Ejemplo 765.6. Siguiendo el procedimiento general e proporcionó (1R,2S)-1-((terc-butildimetilsilil)oxi)-1-(6-rc-butildimetilsilil)oxi)-1 -(6-metilpiridazin-3-il)propano-2-(d, J=8,6 Hz, 1H), 5,66 (d, J=4,1 Hz, 1H), 4,75 (s, 2H), 4 (s, 9H), 0,20 (s, 3H), -0,18 (s, 3H). LCMS-ESI -ESI
Etapa 7: (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil il)propano-2-sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxi metilpiridazin-3-il)propano-2-sulfonamida, Ejemplo 765. A, usando la (1R,2S)-1-((terc-butildimetilsilil)oxi)-1-(6-butildimetilsilil)oxi)-1-(6-metilpiridazin-3-il)propano-2-sulf el mercado en Bellen Chemistry Co., Ltd.), 2-isotioci (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 3-il)propano-2-sulfonamida.
3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-uiendo el procedimiento general descrito en el Ejemplo iridazin-3-il)propano-2-sulfonamida y (1S,2R)-1-((tercida, hidrazida del ácido 5-metilnicotínico (disponible en 1,3-dimetoxibenceno (Ejemplo 1.0) se proporcionó la -triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2-n-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 3-il)propano-2-sulfonamida, Ejemplo 765.0. 765.8 se p preparativa (columna OX (5 pm, 20 mm x25 cm, 5 pm en 30% de MeOH con 0,1% dietilamina con un caudal exceso enantiomérico. El primer pico que eluía era la ( triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2-s metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metil (d, J=17,1 Hz, 2H), 7,62 (d, J=9,1 Hz, 2H), 7,38 (t, J= 2H), 5,70 (s, 1H), 3,89 (q, J=6,7 Hz, 1H), 3,75 (s, 3H), 3 3H). No se observaban dos protones intercambiables. L
Ejemplo 766.0. Preparación de (1 R,2S)-N-(4-(2,6-dimet (6-metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R) 3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfona -triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2-n-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazinpara separar los dos enantiómeros usando una SFC 21 dirección normal) eluyendo con 70% de CO2 líquido ml/min) para dar dos productos con más de 99,5% de )-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-mida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-in-3-il)propano-2-sulfonamida. 1H RMN (CDCh) 58,37 , 1H), 7,31 (d, J=8,8 Hz, 1H), 6,62 (dd, J=8,5, 2,0 Hz, 3H), 2,66-2,75 (m, 3H), 2,29 (s, 3H), 1,13 (d, J=7,0 Hz, ESI - ESI (POS). m/z: 526,0 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 3-il)propano-2-sulfonamida, Ejemplo 765.0. La elución segundo pico que eluía la (1R,2S)-N-(4-(2,6-dimetoxi metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R)-N-( 1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfonamida.
7,39 (t, J=8,6 Hz, 1H), 7,31 (d, J=8,5 Hz, 1H), 6,62 (dd, (s, 3H), 3,73 (s, 3H), 2,70 (s, 3H), 2,29 (s, 3H),
intercambiables. LCMS-ESI -ESI (POS). m/z: 526,0 (M+
Ejemplo 767.0. Preparación de (1 R,2S)-N-(4-(2,6-di metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R) hidroxi-1 -(6-metilpiridazin-3-il)propano-2-sulfonamida.
-triazol-3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazinnal en las condiciones descritas en 765.0 suministró el 5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(6--dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-MN (CDCl3) S 8,30-8,46 (m, 2H), 7,63 (d, J=9,1 Hz, 2H), , 5,6 Hz, 2H), 5,71 (s, 1H), 3,92 (d, J=6,7 Hz, 1H), 3,75 (d, J=6,9 Hz, 3H). No se observaban dos protones
xifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6--(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(p il)propano-2-sulfonamida, Ejemplo 767.1. Siguiendo el Ejemplo 765.6, isotiocianato-1,3-dimetoxibenceno Eje (1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-sulfonamida y (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-( il)propano-2-sulfonamida.
l-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-edimiento general descrito en el Ejemplo A, usando el 1.0 y nicotinohidrazida (Alfa Aesar) se proporcionó la l-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2--3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-( il)propano-2-sulfonamida, Ejemplo 767.0. El Ejemplo 7 20 mm x25 cm, 5 pm S/N=2121 dirección normal) eluy dietilamina con un caudal de 60 ml/min) para dar dos primer pico que eluía era la (1 R,2S)-N-(4-(2,6-di metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R)-hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfonamida. 1 (d, J=8,0 Hz, 1H), 7,63 (d, J=8,6 Hz, 1H), 7,39 (t, J=8,6 J=8,5, 3,7 Hz, 2H), 5,70 (s, 1H), 3,85-3,98 (m, 1H), 3,7 3H). No se observaban 2 protones intercambiables. lC
Ejemplo 768.0. Preparación de (1 R,2S)-N-(4-(2,6-di metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R)-hidroxi-1 -(6-metilpiridazin-3-il)propano-2-sulfonamida.
l-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2--3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-e resolvió usando SFC preparativa (columna OX (5 pm, con 65% de CO2 líquido en 35% de MeOH con 0,1% de uctos con más de 99,5% de exceso enantiomérico. El xifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -N (CDCh) S 8,63 (s, 1H), 8,58 (d, J=4,7 Hz, 1H), 7,74 1H), 7,31 (d, J=8,6 Hz, 1H), 7,20-7,26 (m, 1H), 6,62 (dd, 3H), 3,73 (s, 3H), 2,66-2,73 (m, 3H), 1,14 (d, J=7,0 Hz, I -ESI (POS). m/z: 512,0 (M+H)+.
xifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-sulfonamida o (1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-( l-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2--3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-
il)propano-2-sulfonamida, Ejemplo 768.0. La elución suministró el segundo pico que eluía la (1R,2S)-N-(4-( 1 -(6-metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2R) hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfonamida. 1 (d, J=8,2 Hz, 1H), 7,63 (d, J=8,6 Hz, 1H), 7,40 (t, J=8,5 J=8,4, 4,6 Hz, 2H), 5,70 (s, 1H), 3,92 (q, J=7,2 Hz, 1H 3H). No se observaban 2 protones intercambiables. LC
Ejemplo 769.0. Preparación de (1 S,2S)-N-(4-(2,6-dimet (6-metilpiridazin-3-il)propano-2-sulfonamida o (1 R,2R) 3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfona al en las condiciones descritas en el Ejemplo 767.0 etoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -N (CDCh) ó 8,63 (s, 1H), 8,59 (d, J=4,7 Hz, 1H), 7,74 H), 7,31 (d, J=8,5 Hz, 1H), 7,19-7,26 (m, 1H), 6,62 (dd, (s, 3H), 3,73 (s, 3H), 2,70 (s, 3H), 1,14 (d, J=7,0 Hz, I -ESI (POS). m/z: 512,0 (M+H)+.
il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-
(1 S,2S)-1-((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxiben 1 -((terc-butildimetilsilil)oxi)-N,N-bis(4-metoxibencil)-1 -(6-Siguiendo el procedimiento general descrito en el Ejem de (1,1-dimetiletil)dimetilsililo (Aldrich, St. Louis, mO) s J=8,6 Hz, 1H), 7,34 (d, J=8,6 Hz, 1H), 7,11 (d, J=8,5 H J=15,1 Hz, 2H), 3,97 (d, J=15,2 Hz, 2H), 3,80 (s, 6H), 3 Hz, 3H), 0,96 (s, 9H), 0,15 (s, 3H), -0,16--0,09 (m, 3H).
(6-metilpiridazin-3-il)propano-2-sulfonamida y (1 R,2R)-iridazin-3-il)propano-2-sulfonamida, Ejemplo 769.1. .0, usando el Ejemplo 765.5 y trifluorometanosulfonato orcionó el Ejemplo 769.1. 1H RMN (CDCh) ó 7,67 (d, 6,83 (d, J=8,2 Hz, 4H), 5,39 (d, J=3,5 Hz, 1H), 4,42 (d, d, J=7,2, 3,8 Hz, 1H), 2,69-2,74 (m, 3H), 1,38 (d, J=7,0 -ESI -ESI (POS). m/z: 586,0 (M+H)+.
(1 S,2S)-1-((terc-butildimetilsilil)oxi)-1 -(6-metilpiridazin-3-butildimetilsilil)oxi)-1-(6-metilpiridazin-3-il)propano-2-sulf descrito en el Ejemplo 11.0, la reacción de Ejemplo butildimetilsilil)oxi)-1 -(6-metilpiridazin-3-il)propano-2-sulf metilpiridazin-3-il)propano-2-sulfonamida. 1H RMN (CD J=4,2 Hz, 1H), 5,16 (s, 2H), 3,56-3,70 (m, 1H), 2,74 (s, (s, 3H). LCMS-ESI -ESI (POS). m/z: 346,0 (M+H)+.
ano-2-sulfonamida y (1 R,2R)-1 -((tercida, Ejemplo 769.2. Siguiendo el procedimiento general y anisol y TFA se proporcionó la (1S,2S)-1-((tercida y (1 R,2R)-1 -((terc-butildimetilsilil)oxi)-1-(6-7,60 (d, J=8,8 Hz, 1H), 7,40 (d, J=8,6 Hz, 1H), 5,61 (d, 1,28 (d, J=7,0 Hz, 3H), 0,93 (s, 9H), 0,19 (s, 3H), -0,03
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 3-il)propano-2-sulfonamida, Ejemplo 769.3. Siguiendo 769.2, 2-isotiocianato-1,3-dimetoxibenceno (Ejemplo mercado en Bellen Chemistry Co., Ltd.), se proporcion 1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propan metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(6-metil -triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazincedimiento general descrito en el Ejemplo A, usando hidrazida del ácido metilnicotínico (disponible en el 1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-lfonamida y (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-in-3-il)propano-2-sulfonamida.
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 3-il)propano-2-sulfonamida, Ejemplo 769.0. La mezc preparativa (columna OX (5 pm, 20 mm x25 cm, 5 pm en 35% de EtOH con un caudal de 60 ml/min) para dar El primer pico que eluía era la (1S,2S)-N-(4-(2,6-dimet (6-metilpiridazin-3-il)propano-2-sulfonamida o (1 R,2R) 3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-sulfona 7,41 (t, J=8,6 Hz, 1H), 7,30 (d, J=8,6 Hz, 1H), 6,56-6,70 s., 1H), 2,89-2,99 (m, 2H), 2,71 (s, 3H), 2,30 (br. s., (M+H)+.
Ejemplo 770.0. Preparación de (1R,2R)-N-(4-(2,6-di metilpiridazin-3-il)propano-2-sulfonamida o (1 S,2S) hidroxi-1 -(6-metilpiridazin-3-il)propano-2-sulfonamida.
-triazol-3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazinémica del Ejemplo 769.3 se resolvió usando SFC 21 dirección normal) eluyendo con 65% de CO2 líquido roductos con más de 99,5% de exceso enantiomérico. il)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-H RMN (CDCl3) 58,28-8,49 (m, 2H), 7,50-7,71 (m, 2H), H), 5,20 (d, J=7,2 Hz, 1H), 3,71-3,88 (m, 6H), 3,56 (br. ,14-1,24 (m, 3H). LCMS-ESI - ESI (POS). m/z: 526,4
ifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-hidroxi-1-(6-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1 -
(1S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H sulfonamida o (1 R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-met 3-il)propano-2-sulfonamida, Ejemplo 770.0. La elución suministró el segundo pico que eluía la (1S,2S)-N-(4-( hidroxi-1 -(6-metilpiridazin-3-il)propano-2-sulfonamida
1,2,4-triazol-3-il)-1-hidroxi-1-(6-metilpiridazin-3-il)propan 7,71 (m, 2H), 7,41 (t, J=8,3 Hz, 1H), 7,31 (d, J=8,3 Hz, 3H), 3,55 (br. s., 1h ), 2,71 (s, 3H), 2,30 (br. s., 3 intercambiables. Lc m S-eSi -ESI (POS). m/z: 526,2 (M+
Ejemplo 771.0. Preparación de (1R,2S,P)-N-(4-(2,4-dim metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida
piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirim -triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazin-3-il)propano-2-in-3-il)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(6-metilpiridazinnal en las condiciones descritas en el Ejemplo 769.0 metoxifenil)-5-(5-metilpiridin-3-il)-4H-1,2,4-triazol-3-il)-1-R,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metilpiridin-3-il)-4H-lfonamida. 1H RMN (CDCb) 58,27-8,51 (m, 2H), 7,50 6,58-6,71 (m, 2H), 5,22 (br. s., 1H), 3,8 (s, 3H), 3,7 (s, 8 (d, J=6,1 Hz, 3H). No se observaban 2 protones
-piridinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1-(1 R,2S,M)-N-(4-(2,4-dimetoxi-3-piridinil)-5-(6-metoxi-2-2-propanosulfonamida.
3-Isotiocianato-2,4-dimetoxipiridina, Ejemplo 771.1. U tiocarbonildi-2(1H)-piridona (47,0 g, 202 mmol) y se di dimetoxianilina (31 g, 202 mmol) disuelta en DCM (40 minutos. Después de 16 horas, la reacción se concentr 0-20%) para dar el 2-isotiocianato-1,3-dimetoxibencen m/z: 197,1 (M+H)+.
Los compuestos expuestos en la siguiente tabla se s usando el material de partida conocido como se describ
T a b la 42
raz de fondo redondo de 2 litros se cargó con 1,1"-en DCM seco (405 ml). A esta solución se añadió 2,6-mediante un embudo de adición a TA a lo largo de 40 cío y se purificó en gel de sílice (EtOAc en heptanos al g, 164 mmol, 81% de rendimiento). LCMS-ESl (POS).
Ejemplo 781.0. Preparación de (1R,2S)-N-(4-(2,6-dimetox (1 -metil-1 H-1,2,4-triazol-5-il)-2-propanosulfonamida o (1 S triazol-3-il)-1 -metoxi-1 -(1 -metil-1 H-1,2,4-triazol-5-il)-2-prop il)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-1-)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-osulfonamida.
1-Metil-1H-1,2,4-triazol-5-carbaldehído, Ejemplo 781.11. metil-1 H-1,2,4-triazol (5 g, 60,2 mmol) y se diluyó con T 45°C en atmósfera de nitrógeno y se añadió gota a gota agitó durante 90 minutos a -45°C y después se enfrió a -7 78 mmol) en THF (7 ml). La reacción después se dejó cal inactivó con HCl 1,5 N (100 ml). Se separaron las capa Después las capas acuosas combinadas se llevaron a pH (3 x 120 ml). Las capas orgánicas combinadas se concentraron a presión reducida para obtener el 1-metilrendimiento) en forma de un líquido marrón. LCMS-ESI (p matraz de fondo redondo de tres bocas se cargó con 1-(40 ml) y éter dietílico (80 ml). La mezcla se enfrió a -util-litio (25,3 ml, 63.2 mmol). La mezcla de reacción se . A -78°C, después se añadió gota a gota DMF (5,72 g, ar a TA Después de 14 horas, la mezcla de reacción se y la capa orgánica se lavó con HCl 1,5 N (2 x 40 ml).
0 con solución acuosa de Na2CÜ3 y se extrajo con DCM aron sobre sulfato sódico anhidro, se filtraron y se -1,2,4-triazol-5-carbaldehído (4,5 g, 40,5 mmol, 67% de . m/z: 112,1 (M+H)+.
(1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(1 -metil-1 H-1,2 N,N-bis(4-metoxibencil)-1-(1-metil-1H-1,2,4-triazol-5-il)prop redondo de tres bocas se cargó con N,N-bis(4-metoxibenci se disolvió en THF (150 ml). La mezcla se enfrió a -78e hexano, 19,80 ml, 49,5 mmol)). Después de cinco minutos, 45,0 mmol) disuelto en THF (25 ml) por adición calentó a TA Después de 10 minutos a TA, la mezcla d amónico (25 ml). Después se añadió agua (75 ml) y la orgánicas se separaron, se secaron sobre sulfato sódico para obtener un líquido marrón. El material así obtenido se cromatografía en columna, eluyendo con un gradiente proporcionar la (1 R,2S)-1 -hidroxi-N,N-bis(4-metoxibencil) (1S,2R)-1-hidroxi-N,N-bis(4-metoxibencil)-1-(1-metil-1H-1,2 11% de rendimiento).
zol-5-il)propano-2-sulfonamida y (1 S,2R)-1 -hidroxisulfonamida, Ejemplo 781.2. Un matraz de fondo
osulfonamida (15,73 g, 45,0 mmol, Ejemplo 12.0) y
añadió gota a gota n-butil-litio (2,5 M solución en
ñadió 1-metil-1H-1,2,4-triazol-5-carbaldehído (5,0 g,
gota. Después de 10 minutos, la mezcla de reacción se ción se inactivó con solución saturada de cloruro
la se extrajo con EtOAc (3 x 100 ml). Las capas
, se filtraron y se concentraron a presión reducida
bió sobre un tapón de gel de sílice y se purificó por
tOAc en éter de petróleo de 40% a 50%, para
metil-1 H-1,2,4-triazol-5-il)propano-2-sulfonamida y
zol-5-il)propano-2-sulfonamida (2,23 g, 4,84 mmol,
(1 R,2R)-1 -hidroxi-N,N-bis(4-metoxibencil)-1 -(1 -metil-1 H-1,2 N,N-bis(4-metoxibencil)-1-(1-metil-1H-1,2,4-triazol-5-il)prop en las condiciones descritas en el Ejemplo 781.2 suminist 1H-1,2,4-triazol-5-il)propano-2-sulfonamida (1,95 g, 4,23 (M+H)+.
zol-5-il)propano-2-sulfonamida y (1 S,2S)-1 -hidroxisulfonamida, Ejemplo 781.3. La elución adicional 1S,2S)-1-hidroxi-N,N-bis(4-metoxibencil)-1-(1-metil-9% de rendimiento). LCMS-ESI (pos). m/z: 461,1
(1 R,2S)-1 -metoxi-N,N-bis(4-metoxibencil)-1 -(1 -metil-1 H-1,2 N,N-bis(4-metoxibencil)-1-(1-metil-1H-1,2,4-triazol-5-il)prop redondo de dos bocas, de 24/40-50 ml se cargó con el Eje ml, 10,00 ml/g). La mezcla se enfrió a -10°C y se añadió minutos, se añadió Mel (0,163 ml, 2,61 mmol) a -10°C. La horas, la mezcla de reacción se inactivó con agua fría y combinadas se lavaron con agua fría (25 ml) seguido de s La solución se filtró y se concentró a vacío para dar un ace tapón de gel de sílice y se purificó por cromatografía a trav malla 60-120, eluyendo con un gradiente de EtOAc en compuesto del título (0,52 g, 1,1 mmol, 51% de rendimient 475,1 (M+H)+.
zol-5-il)propano-2-sulfonamida y (1 S,2R)-1 -metoxisulfonamida, Ejemplo 781.4. Un matraz de fondo 781.2 (1,0 g, 2,171 mmol) y se disolvió en DMF (10 nato de cesio (1,42 g, 4,34 mmol). Después de 30 a de reacción se dejó calentar a TA Después de 16 trajo con EtOAc (3 x 50 ml). Las capas orgánicas n de salmuera (25 ml) y se secaron sobre Na2SO4. arillo. El material así obtenido se absorbió sobre un una columna de gel de sílice usando sílice de n° de e petróleo de 40% a 45%, para proporcionar el forma de una goma incolora. LCMS-ESI (pos). m/z:
(1 R,2S)-1 -metoxi-1 -(1 -metil-1 H-1,2,4-triazol-5-il)propano triazol-5-il)propano-2-sulfonamida, Ejemplo 781.5. En u se añadió DCM (2,58 ml) y después anisol (0,426 ml, 3, de 2 minutos, se añadió gota a gota TFA (2,55 ml, 34,3 reacción se concentró a presión reducida. El residuo se heptanos al 20-65%) y se purificó para dar la (1 S,2R)-1-y (1R,2S)-1-metoxi-1-(1-metil-1H-1,2,4-triazol-5-il)propa LCMS-ESI (pos). m/z: 235,1 (M+H)+.
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describ
Tabla 43
lfonamida y (1 S,2R)-1-metoxi-1-(1-metil-1 H-1,2,4-l que contenía el Ejemplo 781.4 (0,465 g, 0,980 mmol) mol). La solución homogénea se agitó a 23°C. Después ol) a la solución de la reacción. Una vez completada, la ó en una columna de gel de sílice (EtOAc:EtOH 3:1 en xi-1 -(1 -metil-1 H-1,2,4-triazol-5-il)propano-2-sulfonamida sulfonamida (0,23 g, 0,98 mmol, 100% de rendimiento).
zaron siguiendo el procedimiento en el Ejemplo 741.0
Ejemplo 798.0. Preparación de (2S,3R)-N-(4-(6-bromo-3 il)-3-(5-fluoro-2-pirimidinil)-2-butanosulfonamida.
etoxi-2-piridinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-
6-Bromo-2-isotiocianato-3-metoxipiridina, Ejemplo 798.1 E bromo-3-metoxipiridin-2-amina (8,04 g, 39,6 mmol) en D (9,66 g, 41,6 mmol) a TA con agitación. La mezcla de re reacción después se diluyó con agua y se extrajo con DC Na2SÜ4. La solución se filtró y se concentró a vacío para d sobre un tapón de gel de sílice y se purificó por cromatogra preempaquetada (120 g), eluyendo con un gradiente de Et 2-isotiocianato-3-metoxipiridina (8,6 g, 35,1 mmol, 89% d DMSO-afe) 57,61 (s, 2 H) 3,93 (m, 3 H). LCMS-ESI (POS).
Los compuestos expuestos en la siguiente tabla se sinte usando el material de partida conocido como se describe.
Tabla 44
matraz de fondo redondo de 500 ml se añadió 6-32 ml). Se añadió 1,1"-tiocarbonildi-2(1H)-piridona se agitó a 23°C durante 20 horas. La mezcla de xtracto orgánico se lavó con agua y se secó sobre sólido naranja. El material así obtenido se absorbió ravés de una columna de gel de sílice RediSep-Sep n DCM de 0% a 10%, para proporcionar la 6-bromodimiento) como sólido blanco. 1H RMN (400 MHz, 44,7 (M+H)+.
n siguiendo el procedimiento en el Ejemplo 741.0
Ejemplo 799.0. Preparación de (2S,3R)-N-(4-(4,6-dimetox 3-(5-metil-2-pirazinil)-2-butanosulfonamida.
imidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-
(2S,3R)-3-(5-metilpirazin-2-il) butano-2-sulfonamida, Ejem disolución de (E)-3-(5-metilpirazin-2-il)but-2-eno-2-sulfona de 2-bromo-5-metilpirazina (23 g, 101 mmol, 1,0 e butilfosfina (2,276 g, 3,54 mmol, 0,035 equiv, Solvias), te 3,04 mmol, 0,03 equiv, Combi Block) y trifluoromet MeOH (230 ml, 10,00 ml/g). El reactor se purgó con argón de reacción después se agitó en atmósfera de hidrógeno ( reacción se filtró a través de una almohadilla de ayudante material resultante se purificó por cromatografía en c preempaquetada Redi-Sep (80 g), eluyendo con un gradie compuesto del título (22 g, 95% de rendimiento, 70% ee) e cfe) 58,46 (d, J = 6,5 Hz, 2H), 6,84 (s, 2H), 3,63 (qd, J = 7, 1,31 (d, J = 7,0 Hz, 3H), 1,23 (d, J = 7,0 Hz, 3H). mS (ESI, a más de 99% ee para el uso posterior.
Los compuestos expuestos en la siguiente tabla se sintetiz 9.1. Un recipiente de presión se cargó con una
preparada de una forma análoga a 10.05 partiendo
(S)-1-[(R)-2-(di-1-naftilfosfino)ferrocenil]-etil-di-tercroborato de bis(1,5-ciclooctadieno)rodio(i) (2,66 g,
lfonato de cinc (11,04 g, 30,4 mmol, 0,3 equiv, Aldrich) en volvió a llenar con hidrógeno tres veces. La mezcla
g/cm2 (150 psi)) a 60°C durante 18 h. La mezcla de
ación Celite® y se concentró a presión reducida. El
a a través de una columna de gel de sílice
MeOH en CHCL de 1% a 3%, para proporcionar el
a de un sólido amarillo. 1H Rm N (400 MHz, DMSO-Hz, 1H), 3,44 (qd, J = 7,0, 4,3 Hz, 1H), 2,47 (s, 3H),
sitivo) m/z; 230,0 (M+H)+. El material se recristalizó
siguiendo el procedimiento en el Ejemplo A usando
el material de partida conocido como se describe. Tabla 45
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe.
tizaron siguiendo el procedimiento en el Ejemplo 741.0
T a b la 46
Ejemplo 802.0. Preparación de (2S,3R)-3-(5-cloro-2-pi triazol-3-il)-2-butanosulfonamida.
)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4H-1,2,4-
(2S,3R)-3-(5-cloropiridin-2-il)butano-2-sulfonamida, Eje il)etenosulfonamida (10 g, 40,5 mmol) en MeOH (100 mmol), tetrafluroborato de bis(1,5-ciclooctadieno)r naftilfosfino)ferrocenil]-etil-di-terc-butilfosfina (0,651 g, 1 e hidrógeno tres veces. La reacción después se agit miniclave de 200 ml a TA durante 16 h seguido de cal de la reacción por TLC y mostró que el material de parti concentró a presión reducida para proporcionar el prod de sílice n° de malla 60-120) usando EtOAc en éter producto deseado (2S,3R)-3-(5-cloropiridin-2-il)butanomarrón con 82% ee. La recristalización en i-PrOH dio (d, J=7,05 Hz, 3 H) 1,29 (d, J=7,05 Hz, 3 H) 3,46 (qd, J H) 7,36 (d, J=8,50 Hz, 1 H) 7,88 (dd, J=8,50, 2,70 Hz, (M+H)+.
Los compuestos expuestos en la siguiente tabla se s usando el material de partida conocido como se describ 802.1. A una disolución de (E)-2-(5-cloropiridin-2-e añadió trifluorometanosulfonato de cinc (2,95 g, 8,11 I) (0,329 g, 0,811 mmol) y (S)-1-[(R)-2-(di-1-mmol). La mezcla de reacción se desgasificó con argón atmósfera de hidrógeno (3,5 kg/cm2 (50 psi)) en un iento a 65°C durante 16 h. Se comprobó la finalización taba completamente ausente. La mezcla de reacción se inicial que se purificó por cromatografía en columna (gel etróleo al 40-45% como un eluyente para obtener el onamida (9 g, 36,2 mmol, 89%) en forma de un sólido ee del material. 1H RMN (400 MHz, DMSO-d6) 5 1,19 , 3,84 Hz, 1 H) 3,63 (qd, J=7,08, 3,84 Hz, 1 H) 6,82 (s, 2 8,56 (d, J=2,28 Hz, 1 H). LCMS-ESI (POS). m/z: 249,0
zaron siguiendo el procedimiento en el Ejemplo 741.0
T a b la 47
Ejemplo 803.0. Preparación de (2S,3R)-N-(4-(4,6-metoxi-2-pirazinil)-2-butanosulfonamida.
toxi-5-pirimidinil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-
(2S,3R)-3-(5-metoxipirazin-2-il)butano-2-sulfonamida, Ej il)but-2-eno-2-sulfonamida (preparada de una forma aná 18,50 mmol) en MeOH (60 ml) se añadió trifluorometa Aldrich), tetrafluroborato de bis(1,5-ciclooctadieno)rodio( [(R)-2-(di-1-naftilfosfino)ferrocenil]-etil-di-terc-butilfosfina reacción se desgasificó con argón e hidrógeno tres vece a 60°C durante 80 h. La mezcla de reacción despué cromatografía en columna gel de sílice (n° de malla 6 para dar el compuesto del título (3,2 g, 13,05 mmol, 70 (400 MHz, DMSO-ds) 58,26 (d, J = 1,4 Hz, 1H), 8,12 (d, (dd, J = 7,1, 4,3 Hz, 1H), 3,42 - 3,38 (m, 1H), 1,32 (d, 246,2 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint el material de partida conocido como se describe.
lo 803.1. A una disolución de (E)-3-(5-metoxipirazin-2-al 10.05 partiendo de 2-bromo-5-metoxipirazina, 4,5 g, lfonato de cinc (2,69 g, 7,40 mmol, 0,4 equiv, Sigma ,446 g, 1,110 mmol, 0,06 equiv, Combi Block) y (S)-1-89 g, 1,85 mmol, 0,1 equiv, Solvias). La mezcla de e agitó en atmósfera de hidrógeno (3,5 kg/cm2 (50 psi)) concentró y el material así obtenido se purificó por ) usando EtOAc en hexano al 35-40% como eluyente 93% ee) en forma de un sólido blanquecino. 1H RMN 1,4 Hz, 1H), 6,84 (s, 2H), 3,90 (d, J = 1,5 Hz, 3H), 3,62 ,5 Hz, 3H), 1,23 - 1,21 (m, 3H). MS (ESI ve ion) m/z:
ron siguiendo el procedimiento en el Ejemplo A usando
T a b la 48
Los compuestos expuestos en la siguiente tabla se sinte el material de partida conocido como se describe.
ron siguiendo el procedimiento en el Ejemplo B usando
T a b la 49
Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describe.
izaron siguiendo el procedimiento en el Ejemplo 741.0
T a b la 50
Ejemplo 812.0. Preparación de (3S,5S)-N-(4-(4,6-dimetox 2-pirimidinil)-5-metoxi-3-piperidinasulfonamida o (3R triazol-3-il)-1-(5-fluoro-2-pirimidinil)-5-metoxi-3-piperidinas irimidinil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(3-piridinil)-4H-1,2,4-amida.
5-Metoxipiridina-3-sulfonamida, Ejemplo 812.2. Una me (disponible en el mercado en Enamina, KIEV, Ucrania) dioxano,. 96 ml, 48,2 mmol) se agitó de 0 a 23°C durant había completado. La reacción se filtró y la torta de filtr concentraron a vacío para dar el compuesto del título amarillo claro, que se usó como estaba para la siguie (M+H)+.
de reacción de cloruro de 5-metoxipiridina-3-sulfonilo g, 4,82 mmol) y amoniaco, (solución 0,5 M en 1,4-min. El análisis de LCMS indicaba que la reacción se n se lavó con dioxano. Las soluciones combinadas se g, 100% de rendimiento) en forma de una espuma etapa sin purificación. LCMS-ESI (POS). m/z: 189,2
Acetato de la 5-metoxipiperidina-3-sulfonamida, Ejem (0,9 g, 4,78 mmol) en AcOH (31,9 ml) se burbujeó con (IV) ((1,09 g, 4,78 mmol) con una corriente de argón. kg/cm2 (45 psi)) de hidrógeno gaseoso durante 38 hor dar el compuesto del título (1,22 g, 100% de rendimient establa para la siguiente etapa. LCMS-ESI (POS). m/z: 2.3. Una disolución de 5-metox¡p¡r¡d¡na-3-sulfonamida gaseoso durante 2 min antes de añadir óxido de platino zcla de reacción después se agitó a 23°C under (3,15 mezcla se filtró y el filtrado se concentró a vacío para forma de una espuma amarillo claro, que se usó como (M+H)+.
(3S,5R)-1 -(5-fluoropirimidin-2-il)-5-metoxipiperidina-3-su metoxipiperidina-3-sulfonamida, Ejemplo 812.4. En un v acetato de la 5-metoxipiperidina-3-sulfonamida, (812.3, ml, 96 mmol) y 2-cloro-5-fluoropirimidina (6,37 g, 48,1 100°C durante 23 horas. El análisis de LCMS indicaba l diluyó con agua y se extrajo con DCM. El extracto orgá y después se secó sobre Na2SO4. La solución se filtró así obtenido se absorbió sobre un tapón de gel de sílic gel de sílice preempaquetada RediSep-Sep (40 g), eluy a 100% para proporcionar el compuesto del título, 812. LCMS-ESI (POS). m/z: 291,0 (M+H)+.
ida y (3R,5S)-1 -(5-fluoropirimidin-2-il)-5-40 ml (con septum de liberación de presión) se añadió g, 9,62 mmol), N-etil-N-isopropilpropan-2-amina (16,75 ) en DMSO (48 ml). La mezcla de reacción se agitó a ación del producto deseado. La mezcla de reacción se lavó con solución acuosa saturada de NaCl, salmuera ncentró a vacío para dar un aceite naranja. El material purificó por cromatografía a través de una columna de on un gradiente de EtOH/EtOAc 1/3 en heptano de 0% g, 18% de rendimiento) en forma de un sólido blanco,
(3S,5S)-1 -(5-fluoropirimidin-2-il)-5-metoxipiperidina-3-su metoxipiperidina-3-sulfonamida, Ejemplo 812.5. La el 812.4 proporcionó 812.5 (0,24 g, 0,832 mmol, 8,65% ESI (POS). m/z: 291,0 (M+H)+.
ida y (3R,5R)-1 -(5-fluoropirimidin-2-il)-5-adicional en las condiciones descritas en el Ejemplo dimiento) en forma de un sólido amarillo claro. Lc MS-
(3S,5R)-1 -(5-fluoropirimidin-2-il)-5-metoxipiperidina-3-su metoxipiperidina-3-sulfonamida, Ejemplo 812.6. El Eje SFC usando las siguientes condiciones: Chiralpak AD-era el pico que eluía antes en la columna Chiralpak AD-1 H) 2,57 - 2,72 (m, 2 H) 2,98 (dd, J=13,06, 11,40 Hz, 1 1 H) 5,17 (ddt, 1 H) 8,32 (d, J=0,62 Hz, 2 H). LCMS-ESI ida o (3R,5S)-1 -(5-fluoropirimidin-2-il)-5-12.6 se proporcionó por separación quiral de 812.4 en OH/CO2 al 30%, con 0,2% de DEA. El Ejemplo 812.6 RMN (400 MHz, CD3OD) 51,65 (td, J=12,28, 10,88 Hz, 4 (ddt, 1 H) 3,27 - 3,36 (m, 1H) 3,45 (s, 3 H) 4,97 (ddt, ). m/z: 291,0 (M+H)+.
(3S,5R)-1 -(5-fluoropirimidin-2-il)-5-metoxipiperidina-3-su metoxipiperidina-3-sulfonamida, Ejemplo 812.7. La el 812.6 suministró el Ejemplo 812.7. 1HNMR (400 MHz, H) 2,94 - 3,04 (m, 1 H) 3,14 (ddt, 1 H) 3,31 - 3,36 (m, 1 LCMS-ESI (POS). m/z: 291,0 (M+H)+.
ida o (3R,5S)-1 -(5-fluoropirimidin-2-il)-5-adicional en las condiciones descritas en el Ejemplo ) 51,65 (td, J=12,28, 10,88 Hz, 1 H) 2,57 - 2,71 (m, 2 45 (s, 3 H) 4,97 (ddt, 1 H) 5,17 (ddt, 1 H) 8,32 (s, 2 H).
(3S,5S)-1 -(5-fluoropirimidin-2-il)-5-metoxipiperidina-3-su metoxipiperidina-3-sulfonamida, Ejemplo 812.8. El Eje SFC usando las siguientes condiciones: Chiralpak Ad-eluía antes en la columna Chiralpak AD-H. 1H RMN (4 2,41 - 2,51 (m, 1 H) 2,98 (dd, J=14,31, 1,66 Hz, 1 H) 3 3H) 3,66 - 3,71 (m, 1 H) 4,98 (dq, J=14,38, 2,19 Hz, 1 m/z: 291,0 (M+H)+.
ida o (3R,5R)-1 -(5-fluoropirimidin-2-il)-5-12.8 se proporcionó por separación quiral de 812.4 en OH/CO2 al 25%, con 0,2% de DEA. 812.8 era el que z, CD3OD) 5 1,98 (ddd, J=13,42, 12,39, 3,01 Hz, 1 H) d, J=13,06, 11,20 Hz, 1 H) 3,29 - 3,36 (m, 1 H) 3,32 (s, (ddt, 1 H) 8,29 (d, J=0,83 Hz, 2 H) LCMS-ESI (POS).
(3R,5R)-1 -(5-fluoropirimidin-2-il)-5-metoxipiperidina-3-su metoxipiperidina-3-sulfonamida, Ejemplo 812.9. La el 812.7 suministró el Ejemplo 812.9. 1H RMN (400 MHz, J=13,48, 1,89 Hz, 1 H) 2,97 (dd, J=14,33, 1,58 Hz, 1 H (s, 3H) 3,60 - 3,72 (m, 1 H) 4,87 - 5,00 (m, 1 H) 5,16 (dt (POS). m/z: 291,0 (M+H)+.
Los compuestos expuestos en la siguiente tabla se s usando el material de partida conocido como se describ ida o (3S,5S)-1 -(5-fluoropirimidin-2-il)-5-adicional en las condiciones descritas en el Ejemplo D) 5 1,96 (ddd, J=13,39, 12,45, 2,93 Hz, 1 H) 2,44 (dt, (dd, J=13,01, 11,14 Hz, 1 H) 3,28 - 3,35 (m, 1 H) 3,32 ,02, 1,91 Hz, 1 H) 8,27 (d, J=0,67 Hz, 2 H). LCMS-ESI
aron siguiendo el procedimiento en el Ejemplo 741.0
Tabla 51
Ejemplo 820.0. Preparación de (3R,5S)-N-(4-(2,6-pirimidinil)-5-(1-metiletoxi)-3-piperidinasulfonamida o (3S il)-1-(5-fluoro-2-pirimidinil)-5-(1-metiletoxi)-3-piperidinasul etoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-(5-fluoro-2-)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-amida.
5-Isopropoxipiridina-3-sulfonamida, Ejemplo 820.1. A un mmol) en t Hf (16 ml) e isopropanol (16 ml) se añadió tr argón durante 3 min antes de añadir gota a gota azod corriente de N2. La reacción después se agitó de 0°C a vacío. El material así obtenido se absorbió sobre un tapó una columna de gel de sílice preempaquetada RediSepde 0% a 100%, para proporcionar fracciones enriqueci HCl 1 N. El producto deseado se enriqueció en solución acuosa saturada de NaHCO3 a pH>8. Después la soluci orgánico se lavó con salmuera y se secó sobre Na2SO4.
5-isopropoxipiridina-3-sulfonamida (0,95 g, 70% de rend (M+H)+.
uspensión de 5-hidroxipiridina-3-sulfonamida (1,1 g, 6.32 nilfosfina (1,99 g, 7,58 mmol). La mezcla se burbujeó con rboxilato de diisopropilo (1,49 ml, 7,58 mmol) a 0°C en durante 15 horas. La mezcla de reacción se concentró a e gel de sílice y se purificó por cromatografía a través de (40 g), eluyendo con un gradiente de EtOAc en heptano en el producto, que se combinaron y se extrajeron con uosa ácida, que después se modificó mediante solución acuosa básica después se extrajo con DCM. El extracto solución se filtró y se concentró a vacío para dar 820.1, iento), como sólido blanco. LCMS-ESI (POS), m/z: 217,2
(3S,5R)-5-isopropoxipiperidina-3-sulfonamida y (3R isopropoxipiperidina-3-sulfonamida y (3R,5S)-5-isoprop de 820.1, 5-isopropoxipiridina-3-sulfonamida (1,8 g, 8,32 durante 2 min antes de añadir óxido de platino (IV) (1, reacción se agitó a 23°C a (3,15 kg/cm2 (45 psi)) de agente de filtración de marca Celite® (5 g) a la mezcla mezcla se filtró y la solución se concentró a vacío para claro, que se usó en la siguiente etapa sin más purificaci -5-isopropoxipiperidina-3-sulfonamida y (3S,5S)-5-eridina-3-sulfonamida, Ejemplo 820.2. Una disolución ol), en AcOH (41,6 ml) se burbujeó con argón gaseoso 8,32 mmol) en una corriente de argón. La mezcla de geno gaseoso durante dos días. Después, se añadió acción. La mezcla se agitó a 23°C durante 10 min. La la mezcla de productos en forma de un aceite amarillo CMS-ESI (POS), m/z: 223,3 (M+H)+.
(3R,5R)-1 -(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3 isopropoxipiperidina-3-sulfonamida y (3S,5S)-1 -(S-f (3R,5S)-1-(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3-septum de liberación de presión) se añadió ( isopropoxipiperidina-3-sulfonamida y (3S,5S)-5-isopropo 3-sulfonamida (2,0 g, 4,96 mmol) y 2-cloro-5-fluoropirimi 90°C durante 21 horas. El análisis de LCMS indicaba q reacción se concentró a vacío. El material así obtenido cromatografía a través de una columna de gel de sílic gradiente de EOAc en heptano de 0% a 100%, para pro 1,6 mmol, 32% de rendimiento) en forma de sólido blanq namida y (3S,5R)-1 -(5-fluoropirimidin-2-il)-5-pirimidin-2-il)-5-isopropoxipiperidina-3-sulfonamida y namida, Ejemplo 820.3. En un vial de 40 ml (con )-5-isopropoxipiperidina-3-sulfonamida y (3R,5R)-5-eridina-3-sulfonamida y (3R,5S)-5-isopropoxipiperidina-(3,29 g, 24,79 mmol). La mezcla de reacción se agitó a reacción se había completado. Después, la mezcla de sorbió sobre un tapón de gel de sílice y se purificó por eempaquetada RediSep-Sep (40 g), eluyendo con un onar 820.3 como una mezcla de diastereómeros (0,5 g, o. LCMS-ESI (POS), m/z: 319,2 (M+H)+.
(3S,5R)-1 -(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3 isopropoxipiperidina-3-sulfonamida, Ejemplo 820.4. 820 MeOH/CO2 al 15%. 820.4 y 820.5 son una pareja de en más temprano frente a su enantiómero opuesto) en la J=13,39, 12,45, 2,93 Hz, 1 H) 2,44 (dt, J=13,48, 1,89 11,14 Hz, 1 H) 3,28 - 3,35 (m, 1 H) 3,60 - 3,72 (m, 1 H) J=0,67 Hz, 2 H). LCMS-ESI (POS). M/Z: 319,2 (M+H)+.
namida o (3R,5S)-1 -(S-fluoropirimidin-2-il)-5-separó por SFC en columna Chiralpak AS-H usando eros, 820.4 era el segundo pico entre 4 isómeros (pico mna AS-H. 1H RMN (400 MHz, CD3OD) 5 1,96 (ddd, H) 2,97 (dd, J=14,33, 1,58 Hz, 1 H) 3,08 (dd, J=13,01, - 5,00 (m, 1 H) 5,16 (dt, J=13,02, 1,91 Hz, 1 H) 8,27 (d,
(3S,5R)-1 -(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3 isopropoxipiperidina-3-sulfonamida, Ejemplo 820.5. La 820.4 proporcionó 820.5 como el tercer pico. 1H RMN ( 2,44 (dt, J=13,48, 1,89 Hz, 1 H) 2,97 (dd, J=14,33, 1,58 H) 3,60 - 3,72 (m, 1 H) 4,87 - 5,00 (m, 1 H) 5,16 (dt, (POS). M/Z: 319,2 (M+H)+.
namida o (3R,5S)-1 -(5-fluoropirimidin-2-il)-5-n adicional en las condiciones descritas en el Ejemplo Hz, CD3OD) 51,96 (ddd, J=13,39, 12,45, 2,93 Hz, 1 H) H) 3,08 (dd, J=13,01, 11,14 Hz, 1 H) 3,28 - 3,35 (m, 1 2, 1,91 Hz, 1 H) 8,27 (d, J=0,67 Hz, 2 H). LCMS-ESI
(3R,5R)-1 -(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3 isopropoxipiperidina-3-sulfonamida, Ejemplo 820.6. 82 fluoropirimidin-2-il)-5-isopropoxipiperidina-3-sulfonamida sulfonamida. 820.6 era el primer pico entre 4 isómeros ( columna AS-H en las condiciones descritas en el Ejempl H) 1,08 (d, J=6,01 Hz, 3 H) 1,98 (ddd, J=13,19, 12,15, 2 H) 3,01 (dd, J= 14,10, 1,66 Hz, 1 H) 3,13 (dd, J=13,06, 1 1 H) 3,86 - 3,93 (m, 1 H) 4,77 - 4,83 (m, 1 H) 5,11 (ddt, LCMS-ESI (POS). M/Z: 319,2 (M+H)+.
namida o (3S,5S)-1 -(5-fluoropirimidin-2-il)-5-820.7 son una pareja de enantiómeros (3S,5S)-1-(5-R,5R)-1-(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3-ás temprano frente a su enantiómero opuesto) en una .4. 1H RMN (400 MHz, CD3OD) 50,92 (d, J=6,12 Hz, 3 z, 1 H) 2,33 (dtdd, J=13,26, 3,68, 3,68, 1,97, 1,87 Hz, 1 z, 1 H) 3,33 - 3,45 (m, 1 H) 3,74 (dt, J=12,13, 6,06 Hz, ,05, 3,69, 1,79, 1,79 Hz, 1 H) 8,27 (d, J=0,62 Hz, 2 H).
(3R,5R)-1 -(5-fluoropirimidin-2-il)-5-isopropoxipiperidina-3-s isopropoxipiperidina-3-sulfonamida, Ejemplo 820.7. La el 820.4 proporcionó 820.7 como el cuarto pico. 1H R Hz, 3 H) 1,98 (ddd, J=13,19, 12,15, 2,95 Hz, 1 H) 2,33 J= 14,10, 1,66 Hz, 1 H) 3,13 (dd, J=13,06, 10,99 Hz, 1 H) 3 3,93 (m, 1 H) 4,77 - 4,83 (m, 1 H) 5,11 (ddt, J=13,05, 3,6 (POS). M/Z: 319,2 (M+H)+.
Los compuestos expuestos en la siguiente tabla se sint usando el material de partida conocido como se describe.
Tabla 52
amida o (3S,5S)-1 -(5-fluoropirimidin-2-il)-5-adicional en las condiciones descritas en el Ejemplo
00 MHz, CD3OD) 50,92 (d, J=6,12 Hz, 3 H) 1,08 (d, J=6,01 , J=13,26, 3,68, 3,68, 1,97, 1,87 Hz, 1 H) 3,01 (dd,
3,45 (m, 1 H) 3,74 (dt, J=12,13, 6,06 Hz, 1 H) 3,86 -79, 1,79 Hz, 1 H) 8,27 (d, J=0,62 Hz, 2 H). LCMS-ESI
on siguiendo el procedimiento en el Ejemplo 741.0
Ejemplo 827.0. Preparación de (IS,2S)-N-(4-(2,6-di a]piridin-2-il)-1 -isopropoxipropano-2-sulfonamida o (1 R il)-1 -(imidazo[1 ,2 -a]piridin-2 -il)-1 -isopropoxipropano-2 -su xifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-il)-1-(imidazo[1,2-)-N-(4-(2,6-dimetoxifenil)-5-(piridin-3-il)-4H-1,2,4-triazol-3-amida.
(1S,2S)-1-(imidazo[1,2-a]piridin-2-il)-1 -isopropoxi-N,N-bi (imidazo[1,2-a]piridin-2-il)-1-isopropoxi-N,N-bis(4-metoxi que contenía el Ejemplo 735.2 (3,24 g, 6,54 mmol) y y ml) se añadió óxido de plata(I) (3,12 g, 13,5 mmol) con de plata, la reacción se protegió de la luz y se calentó después se filtró. El filtrado se concentró a presión red (eluyendo con EtOAc en heptanos al 15-75%). Las frac concentraron a presión reducida para dar el Ejemplo 82 aceite amarillo claro que se usó sin más purificación. 1 7,98 (s, 1H), 7,55 (dd, J=0,7, 9,0 Hz, 1H), 7,23 (ddd, J= 4,87 (d, J=7,7 Hz, 1H), 4,41 (d, J=15,5 Hz, 2H), 4,12 1H), 1,12 (d, J=6,0 Hz, 3H), 1,09 (d, J=7,3 Hz, 3H), 1, (M+H)+.
metoxibencil)propano-2-sulfonamida y (1 R,2R)-1 -cil)propano-2-sulfonamida (Ejemplo 827.1). En un matraz o de isopropilo (9,2 ml, 92 mmol) en tolueno anhidro (26 ado en porciones. Tras completarse la adición del óxido 5°C. Después de 70 horas, la mezcla se enfrió a TA y a. El residuo se cargó en una columna de gel de sílice es que contenían producto se combinaron y después se (1,68 g, 3,1 mmol, 4,8% de rendimiento) en forma de un N (400 MHz, DMSO-d6) 5 = 8,54 (td, J=1,2, 6,8 Hz, 1H), 6,7, 9,1 Hz, 1H), 7,20 - 7,15 (m, 4H), 6,92 - 6,84 (m, 5H), =15,5 Hz, 2H), 3,79 - 3,71 (m, 7H), 3,44 (spt, J=6,1 Hz, (d, J=6,2 Hz, 3H). Espectro de masas (pos). m/e: 538,2
2,2,2-trifluoroacetato de la (1S,2S)-1-(imidazo[1,2ridin-2-il)-1-isopropoxipropano-2-sulfonamida y 2,2,2-trifluoroacetato de la (1R,2R)-1-(imidazo[1,2-a]piridinañadió anisol (1,4 ml, 12,8 mmol) en un matraz que co solución homogénea se enfrió en un baño de hielo-agu 104 mmol) a la solución de la reacción. Tras complet Después de 20 horas, la solución de la reacción marr solución de EtOAc:EtOH 3:1 y después se cargó en un heptanos al 25-100%). Las fracciones que contenían Ejemplo 827.2 (1,08 g, 2.6 mmol, 84% de rendimien purificación quiral. 1H RMN (400 MHz, DMSO-d6) ó = 8, 7.72 (m, 1H), 7.34 (t, J=6.6 Hz, 1H), 6.76 (br. s., 2H), 5.
1H), 1.18 (d, J=6.0 Hz, 3H), 1.16 (d, J=7.0 Hz, 3H), 1 (M+H)+.
-isopropoxipropano-2-sulfonamida, Ejemplo 827.2. Se el Ejemplo 827.1 (1,68 g, 3,1 mmol) y DCM (8 ml). La spués de 15 minutos, se añadió gota a gota TFA (8 ml, a adición de TFA, la reacción se dejó calentar a 23°C. concentró a presión reducida. El residuo se diluyó con mna de gel de sílice (eluyendo con EtOAc:EtOH 3:1 en ucto se concentraron a presión reducida para dar el n forma de un sólido blanquecino que se envió para , J=6,6 Hz, 1H), 8,25 (s, 1H), 7.87 - 7.81 (m, 1H), 7.80 -J=6.4 Hz, 1H), 3.64 (spt, J=6.1 Hz, 1H), 3.58 - 3.48 (m, , J=6.2 Hz, 3H). Espectro de masas (pos). m/e: 298.1
(R,2R)-1 -(imidazo[1,2-a]piridin-2-il)-1 -isopropoxipropan isopropoxipropano-2-sulfonamida, Ejemplo 827.3. El preparativa usando el siguiente método: Columna: AD-de DEA para dar el primer pico que eluye como el Eje RMN (400 MHz, DMSO-de) ó = 8.53 (td, J=1.2, 6.8 H J=1.3, 6.8 , 9.1 Hz, 1H), 6.90 (dt, J=1.2, 6.7 Hz, 1H), 6, 3,53 - 3,46 (m, 1H), 1,15 (d, J=6,0 Hz, 3H), 1,03 (d, J= m/e: 298,0 (M+H)+.
lfonamida o (1 S,2S)-1 -(imidazo[1,2-a]piridin-2-il)-1 -plo 827.2 (1,08 g, 2,6 mmol) se purificó por SFC e móvil: 75:25 (A:B) A: CO2 líquido, B: iPrOH con 0,2% 27.3 (336,5 mg, 1,132 mmol, 43,5% de rendimiento). 1H , 7.97 (s, 1H), 7.54 (dd, J=0.7, 9.0 Hz, 1H), 7.24 (ddd, 2H), 4,85 (d, J=7,3 Hz, 1H), 3,57 (quin, J=6,1 Hz, 1H), , 3H), 1,00 (d, J=6,2 Hz, 3H). Espectro de masas (pos).
(1 R,2R)-1 -(imidazo[1,2-a]piridin-2-il)-1 -isopropoxipropa isopropoxipropano-2-sulfonamida, Ejemplo 827.4. La 827.3 suministró el segundo pico que eluye, Ejemplo asignación arbitraria de estereoquímica. 1H RMN (400 7,54 (dd, J=0,8, 9,1 Hz, 1H), 7,24 (ddd, J=1,2, 6,7, 9,1 J=7,3 Hz, 1H), 3,62 - 3,54 (m, 1H), 3,53 - 3,46 (m, 1H), Hz, 3H). Espectro de masas (pos). m/e: 298,0 (M+H)+.
Los compuestos expuestos en la siguiente tabla se s usando el material de partida conocido como se describ ulfonamida o (1 S,2S)-1 -(imidazo[1,2-a]piridin-2-il)-1 -adicional en las condiciones descritas en el Ejemplo (336,9 mg, 1,133 mmol, 43,6% de rendimiento) con DMSO-d6) ó = 8,53 (td, J=1,1, 6,8 Hz, 1H), 7,97 (s, 1H), 1H), 6,90 (dt, J=1,0, 6,7 Hz, 1H), 6,52 (s, 2H), 4,86 (d, (d, J=6,0 Hz, 3H), 1,04 (d, J=7,0 Hz, 3H), 1,00 (d, J=6,2
aron siguiendo el procedimiento en el Ejemplo 741.0
Tabla 53
Ejemplo 830.0. Preparación de (3R)-1-(5-cloro-2-pirim 4H-1,2,4-triazol-3-il)-3-piperidinasulfonamida o (3S) metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-piperidinasulfon nil)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-piridinil)-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-ida.
Hidrocloruro de la (S)-piperidina-3-sulfonamida e hidroclor disolución de 4-cloropiridina-3-sulfonamida (5,0 g, 25,9 mezcla resultante se burbujeó con nitrógeno gaseoso d suspensión de óxido de platino (IV) (5,9 g, 25,9 mmol) en de hidrógeno (3,5 kg/cm2 (50 psi)) durante 72 horas. La agente de filtración de marca Celite®, lavando la almoha x 50 ml). Los filtrados combinados se concentraron a pres forma de un aceite que se usó en la siguiente etapa sin m de la (R)-piperidina-3-sulfonamida, Ejemplo 830.1. Una l) en AcOh (150 ml) se puso en una botella Parr. La te 5 minutos. A esta solución después se añadió una OH (30 ml). La reacción después se agitó en atmósfera cla de reacción se filtró a través de una almohadilla de de agente de filtración de marca Celite® con MeOH (2 reducida para proporcionar el Ejemplo 830.1 (6,0 g) en urificación. LCMS-ESI (POS). m/z: 165,0 (M+H)+.
(S)-3-Sulfamoilpiperidina-1-carboxilato de terc-butilo y (R 830.2. A una mezcla del Ejemplo 830.1 (12,0 g, 59,8 mmo una disolución de anhídrido de boc (15,7 ml, 71,8 mmol) agitó durante 16 h a TA y después se lavó con agua (2 x salmuera (100 ml), se secaron sobre sulfato sódico y s inicial que se purificó por cromatografía en columna (sílic para proporcionar el Ejemplo 830.2 (4,6 g, 34% (en dos CD3CN) 55,30 (s, 2H), 4,36 (d, J = 11,8 Hz, 1H), 3,94 ( 2,20 (d, J = 13,3 Hz, 1H), 1,78 (d, J = 13,5 Hz, 1H), 1,74 63 (M-H)-.
sulfamoilpiperidina-1-carboxilato de terc-butilo, Ejemplo TEA (41,6 ml, 298,9 mmol) en DCM (215 ml) se añadió DCM (70 ml) a TA La mezcla de reacción después se 0 ml). Las capas orgánicas combinadas se lavaron con vaporaron a presión reducida para obtener el material ° de malla 100-200; elución: EtOAc en DCM al 0-30%) as) en forma de un sólido blanco. 1H RMN (400 MHz, = 13,3 Hz, 1H), 3,01 - 2,84 (m, 2H),2,64-2,58 (s, 1H), ,57 (m, 2H), 1,43 (s, 9H). LCMS-ESI (POS./NEG). m/z:
(S)-3-(N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2 terc-butilo y (R)-3-(N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-carboxilato de terc-butilo, Ejemplo 830.3. El compuesto Ejemplo 741.0 usando materiales de partida conocidos co isotiocianato-4,6-dimetoxipirimidina (Ejemplo 1.1) e hidroc la (R)-piperidina-3-sulfonamida (Ejemplo 830.2).
H-1,2,4-triazol-3-il)sulfamoil)piperidina-1-carboxilato de xipiridin-2-il)-4H-1,2,4-triazol-3-il)sulfamoil)piperidina-1-l título se sintetizó siguiendo el procedimiento en el se describe: metoxipicolinohidrazida (Ejemplo 3.18), 5-ro de la (S)-piperidina-3-sulfonamida, e hidrocloruro de
2,2,2-Trifluoroacetato de la (S)-N-(4-(4,6-dimetoxipirimidi 3-sulfonamida y 2,2,2-trifluoroacetato de la (R)-N-(4 triazol-3-il)piperidina-3-sulfonamida, Ejemplo 830.4. En u 830.3 (643 mg, 1,115 mmol) y se disolvió en DCM (10 ml il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)piperidina-6-dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-atraz de fondo redondo de 100 ml se cargó el Ejemplo esta solución se añadió TFA (1,27 g,11,15 mmol, 0,828
ml). Después de 19 horas, el análisis de LCMS mostró mezcla de reacción se concentró a presión reduci dimetoxipirimidin-5-il)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tri la (R)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-metoxipiridin 100% de rendimiento). lCm S-ESI (pOs ). m/z: 477,5 (M mo completo del material de partida a un pico polar. La ara dar el 2,2,2-trifluoroacetato de la (S)-N-(4-(4,6--il)piperidina-3-sulfonamida y 2,2,2-trifluoroacetato de 4H-1,2,4-triazol-3-il)piperidina-3-sulfonamida (657 mg,
(3R)-1 -(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimidi piperidinasulfonamida y (3S)-1 -(5-cloro-2-pirimidinil)-N-( triazol-3-il)-3-piperidinasulfonamida, Ejemplo 830.5. En 830.4 (300 mg, 0,508 mmol) y se disolvió en 2-metilte Hunig (884 pl, 5,08 mmol) seguido de 2,5-dicloropirimi bloque de reacción previamente calentado a 80°C. D completo del material de partida. El contenido del vial s con DCM y una solución saturada de bicarbonato sódi agua (x1) y salmuera (x1). Las capas acuosas com posteriormente se descartó. La capa orgánica se secó c cromatografía ultrarrápida: 50 g Biotage SNAP Ultra - C (2CV), 0-40% (15CV), 40% (2CV) para proporcionar la metoxipiridin-2-il)-4H-1,2,4-triazol-3-il)piperidina-3-sulfon de un sólido blanco.
-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-l de 40 ml de liberación de presión se cargó el Ejemplo rofurano (5080 pl). A esta solución se añadió base de (378 mg, 2,54 mmol). El vial se selló y se puso en un s de 21 horas, el análisis de LCMS mostró consumo sfirió a un embudo de separación y la mezcla se diluyó e separaron las capas y la capa orgánica se lavó con as se extrajeron con DCM, se analizó el producto y gSO4, se concentró a presión reducida y se purificó por 5 ml, eluyendo con EtOAc:EtOH 3:1 (v/v) en heptano % -cloropirimidin-2-il)-N-(4-(4,6-dimetoxipirimidin-5-il)-5-(6-a (149 mg, 0,253 mmol, 50% de rendimiento) en forma
(3R)-1-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimidi piperidinasulfonamida o (3S)-1 -(5-cloro-2-pirimidinil)-N-( triazol-3-il)-3-piperidinasulfonamida, Ejemplo 830.0. Se supercríticos quiral del Ejemplo 830.5 racémico. Las siguientes: Columna: Chiralpak AS-H (20 x150 mm), F ml/min, 220 nm, 149 bar de presión de entrada y prop asignó como el Ejemplo 830.0, (3R)-1-(5-cloro-2-piridinil)-4H-1,2,4-triazol-3-il)-3-piperidinasulfonamid pirimidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-i 5 13,65 (1 H, s) 8,65 (1 H, s) 8,41 (2 H, s) 7,86 (1 H, t, 4,93 (1 H, br d, J=10,77 Hz) 4,53 (1 H, br d, J=13,23 J=11,03 Hz) 2,84 - 2,92 (1 H, m) 2,73 - 2,80 (1 H, m) 2, (1 H, br dd, J=12,26, 3,57 Hz) 1,38 - 1,48 (1 H, m). LC determinó por SFC analítica: Chiralpak AS-H, 40% de is
Ejemplo 831.0. Preparación de (3R)-1-(5-cloro-2-pirim 4H-1,2,4-triazol-3-il)-3-piperidinasulfonamida o (3S) metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-piperidinasulfon -(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-ó a cabo la purificación por cromatografía de fluidos iciones para el método de SFC preparativa eran las óvil: 40:60 (A:B), A: CO2 líquido, B: iPrOH, caudal: 60 ó dos picos de >99,5% ee: El primer pico que eluía se idinil)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-(3S)-1-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-iperidinasulfonamida. lH RMN (500 MHz, DMSO-d6) 5 Hz) 7,67 (1 H, d, J=7,27 Hz) 6,91 (1 H, d, J=8,30 Hz) ,90 (3 H, s) 3,88 (3 H, s) 3,17 (3 H, s) 2,96 (1 H, br d, H, br d, J=12,59 Hz) 1,79 (1 H, br d, J=13,10 Hz) 1,60 I (POS). M/Z: 589,1 (M+H)+. La asignación de picos se anol 1,30 minutos.
)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-piridinil)--cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-a.
(3R)-1-(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimidi piperidinasulfonamida o (3S)-1 -(5-cloro-2-pirimidinil)-N-( -(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-piperidinasulfonamida, Ejemplo 831.0. El Ejemplo 830.0 se asignó al Ejemplo 831.0, (3R)-1-(5-c 2-piridinil)-4H-1,2,4-triazol-3-il)-3-piperidinasulfonamida pirimidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-3-13,65 (1 H, s) 8,65 (1 H, s) 8,41 (2 H, s) 7,86 (1 H, t, J 4,93 (1 H, br d, J=12,46 Hz) 4,53 (1 H, br d, J=13,23 H 2,84 - 2,92 (1 H, m) 2,76 (1 H, td, J=12,78, 2,47 Hz) 2 dd, J=12,26, 3,44 Hz) 1,43 (1 H, dt, J=12,49, 3,62 Hz). se determinó por SFC analítica: Chiralpak AS-H, 40% d
El compuesto expuesto en la siguiente tabla se sintet material de partida conocido como se describe.
Tabla 54
do pico que eluye de las condiciones descritas en el -pirimidinil)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-(3S)-1 -(5-cloro-2-pirimidinil)-N-(4-(4,6-dimetoxi-5-idinasulfonamida. 1H Rm N (500 MHz, DMSO-afe) 5 Hz) 7,67 (1 H, d, J=7,40 Hz) 6,91 (1 H, d, J=8,30 Hz) 9 (3 H, s) 3,88 (3 H, s) 3,17 (3 H, s) 2,93 - 3,02 (1 H, m) H, br d, J=12,20 Hz) 1,75 - 1,82 (1 H, m) 1,60 (1 H, br -ESI (POS). M/Z: 589,1 (M+H)+. La asignación de picos ropanol: 2,61 minutos.
iguiendo el procedimiento en el Ejemplo B usando el
Ejemplo 833.0. Preparación de (2S,3R)-N-(5-(5-ciano-3 2-pirimidinil)-2-butanosulfonamida.
inil)-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-3-(5-metil-
(2S,3R)-N-(5-(5-ciano-3-piridinil)-4-(2,6-dimetoxifenil)-4 butanosulfonamida, Ejemplo 833.0. La (2S,3R)-N-(5-(5-(5-metilpirimidin-2-il)butano-2-sulfonamida (Ejemplo
dimetilacetamida (4 ml) y después se añadieron me bifenil)(2'-amino-1,1'-bifenil-2-il)paladio(II) (0,37 g, 0,43 mmol, Pfaltz & Bauer Inc) al vial. La mezcla se calentó después se cargó en una columna de gel de sílice ( contenían producto se combinaron y después se conce g, 0,59 mmol, 68% de rendimiento) como sólido blan J=1,95 Hz, 1 H) 8,82 (d, J=2,21 Hz, 1 H) 8,55 (s, 2 H) 8, Hz, 2 H) 3,92 (quin, J=6,75 Hz, 1 H) 3,77 (s, 3 H) 3,75 7,07 Hz, 6 H). LCMS-ESI (POS). m/z: 535,2 (M+H)+.
Ejemplo 834.0. ácido 5-(4-(2,6-dimetoxifenil)-5-((((1 1,2,4-triazol-3-il)-3-piridinacarboxílico.
4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-opiridin-3-il)-4-(2,6-dimetoxifenil)-4H-1,2,4-triazol-3-il)-3-) (0,51 g, 0,87 mmol) se suspendió en N,N-ulfonato de (2-diciclohexilfosfino-2',4',6'-tri-i-propil-1,1 '-Strem Chemicals, Inc) y cianuro de cinc (0,102 g, 0,87 °C. Después de 20 horas, la reacción se enfrió a TA y :EtOH 3:1 en heptano al 0-70%). Las fracciones que n a presión reducida para dar el Ejemplo 833.0 (0,316 RMN (500 MHz, CDCta) 5 11,55 (br s, 1 H) 8,87 (d, J=2,08 Hz, 1 H) 7,44 (t, J=8,50 Hz, 1 H) 6,64 (t, J=9,08 (m, 1 H) 3,74 (s, 3 H) 2,31 (s, 3 H) 1,38 (dd, J=10,57,
5-(4-(2,6-dimetoxifenil)-5-((((1S,2R)-1-metil-2-(5-metil-2-piridinacarboxílico ácido, Ejemplo 834.0. En un vial se 4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-sulf acuosa de NaOH 1,0 M (1,07 ml, 0,11 mmol, Sigma Al 802C durante 20 horas. La mezcla de reacción después acuosa 1 M de ácido cítrico hasta pH~5. Se formó un para dar el ácido 5-(4-(2,6-dimetoxifenil)-5-((1S,2 triazol-3-il)nicotínico, Ejemplo 834.0 (0,17 g, 0,31 mmol, (500 MHz, CD3OD) 59,13 (d, J=1,95 Hz, 1 H) 8,80 (d, J=8,56 Hz, 1 H) 6,80 (dd, J=8,43, 5,32 Hz, 2 H) 3,79 (s, J=7,01 Hz, 3 H) 1,29 (d, J=6,88 Hz, 3 H). LCMS-ESI (P Los compuestos expuestos en la siguiente tabla se si usando el material de partida conocido como se describ Tabla 55
inil)propil)sulfonil)amino)-4H-1,2,4-triazol-3-il)-3-ó (2S,3R)-N-(5-(5-cianopiridin-3-il)-4-(2,6-dimetoxifenil)-ida, Ejemplo 833.0 (0,190 g, 0,36 mmol) y solución en EtOH (1,4 ml). La mezcla de reacción se calentó a jó enfriar a TA y después se acidificó con una solución itado blanco. El precipitado se filtró y después se secó etil-2-(5-metilpirimidin-2-il)propilsulfonamido)-4H-1,2,4-de rendimiento) en forma de un sólido blanco. 1H RMN Hz, 1 H) 8,56 (s, 2 H) 8,34 (t, J=2,01 Hz, 1 H) 7,50 (t, 3,77 (s, 3 H) 3,66 - 3,77 (m, 2 H) 2,30 (s, 3 H) 1,33 (d, /z: 554,2 (M+H)+.
aron siguiendo el procedimiento en el Ejemplo 741.0
Ejemplo 845.0. Preparación de (2S,3R)-3-(5-metoxi-2-piri 4H-1,2,4-triazol-3-il)-2-butanosulfonamida.
il)-N-(5-(6-metoxi-2-piridinil)-4-(tetrahidro-2H-pirano-4-il)-
802.1
(2S,3R)-3-(5-metoxipiridin-2-il)butano-2-sulfonamida, Eje il)butano-2-sulfonamida (360 mg, 1,45 mmol), 2-(di-ter BuBrettPhos, disponible en el mercado en Sigma-Aldric metanosulfonato de [(2-di-terc-butilfosfino bifenil)]paladio(II) (tBuBrettPhos Pd G3, disponible en el (30,9 mg, 0,036 mmol) en tolueno (3,6 ml) se burbuje metóxido sódico (solución 0,5 M en MeOH, 685 pl, 4,34 agitó a 40°C durante 14 horas. El análisis de LCMS in mezcla de reacción después se agitó a 80°C durante producto deseado. La mezcla de reacción se dejó enf solución saturada de NH4Cl y se extrajo con DCM. El ext forma de un sólido amarillo claro. El material así obtenid por cromatografía a través de una columna de gel de 845.1
lo 845.1. Una suspensión de (2S,3R)-3-(5-cloropiridin-2-utilfosfino)-2',4',6'-triisopropil-3,6-dimetoxi-1, 1 '-bifenilo (torp, St. Louis, MO, EE.UU). (17,54 mg, 0,036 mmol) y 6-dimetoxi-2',4',6'-triisopropil-1,1'-bifenil)-2-(2'-amino-1,1'-ercado en Sigma-Aldrich Corp, St. Louis, MO, EE.UU). on argón gaseoso durante 2 minutos antes de añadir ol) en una corriente de argón. La mezcla de reacción se aba que no había formación del producto deseado. La as 8 horas. El análisis de LCMS mostró formación del r a TA La mezcla de reacción después se diluyó con to orgánico se concentró a vacío para dar el producto en se absorbió sobre un tapón de gel de sílice y se purificó ce preempaquetada Redi-Sep (12 g), eluyendo con un
gradiente de EtOAc en heptano de 0% a 100%, para pr 2-il)butano-2-sulfonamida (316 mg, 89% de rendimiento (M+H)+.
Los compuestos expuestos en la siguiente tabla se s usando el material de partida conocido como se describ Tabla 56
ionar el compuesto del título (2S,3R)-3-(5-metoxipiridinorma de un sólido blanco. LCMS-ESI (POS). m/z: 245,3 zaron siguiendo el procedimiento en el Ejemplo 741.0
Ejemplo 846.0. Preparación de (2S,3R)-N-(4-(2,6-dim (5-metilpirimidin-2-il)butano-2-sulfonamida.
nil)-5-(5-(hidroximetil)piridin-3-il)-4H-1,2,4-triazol-3-il)-3-
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-(hidroximetil)piridin sulfonamida, Ejemplo 846.0. Una disolución de (2 triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida ml) se trató gota a gota con hidruro de diisobutilalumini 0°C en atmósfera de N2. La mezcla se volvió naranja o gotas de agua y unas gotas de solución acuosa de ácid través de una almohadilla de agente de filtración de m concentró a vacío para dar el material inicial. El materia baño de agua helada. Después se añadió borohidruro 1 hora a temperatura ambiente. La mezcla de reacción M y se concentró a vacío para dar el producto inicial. El sílice y se purificó por cromatografía a través de una eluyendo con un gradiente de (EtOAc:EtOH 3:1) en he dimetoxifenil)-5-(5-(hidroximetil)piridin-3-il)-4H-1,2,4-tria Ejemplo 846.0 (20 mg, 0,037 mmol, 7,2% de rendimie CDCla) 511,61 (br s, 1H) 8,60 (s, 1H) 8,49 (s, 2H) 8,3 Hz, 2H) 4,73 (s, 2H) 3,84-3,93 (m, 1H) 3,76-3,80 (m, 1H J=6,49 Hz, 6H). LCMS-ESI (POS). m/z: 540,2 (M+H)+.
Los compuestos expuestos en la siguiente tabla se expertos en la técnica, los compuestos orgánicos a m formatos. Por ejemplo, el compuesto del Ejem bis(trifluorometil)fenil)-5-(6-metoxipiridin-2-il)-4H-1,2,4-tri sulfonamida o como (1 R,2S)-N-(4-(3,5-bis(trifluorometil 4H-1,2,4-triazol-3-il)-3-(5-metilpirimidin-2-il)butano-2-)-N-(5-(5-cianopiridin-3-il)-4-(2,6-dimetoxifenil)-4H-1,2,4-plo 833.0 (0,276 g, 0,516 mmol) en THF anhidro (2,5 M (1,549 ml, 1,549 mmol, Sigma Aldrich) en tolueno a . Después de 1 hora a 0°C, la mezcla se trató con unas ico 1 M y después EtOAc (20 ml). La emulsión se filtró a Celite®. El filtrado se secó sobre Na2SO4, se filtró y se obtenido se disolvió en MeOH (2,5 ml) y se enfrió en un (0,020 g, 0,516 mmol), y se continuó agitando durante tó con unas gotas de solución acuosa de ácido cítrico 1 ucto así obtenido se absorbió sobre un tapón de gel de na de gel de sílice preempaquetada Redi-Sep (12 g), de 0% a 100%, para proporcionar la (2S,3R)-N-(4-(2,6-il)-3-(5-metilpirimidin-2-il)butano-2-sulfonamida,
n forma de un sólido blanquecino. 1H RMN (500 MHz, 1H) 8,06 (s, 1H) 7,39 (t, J=8,50 Hz, 1H) 6,60 (t, J=9,02 (s, 3H) 3,71 (s, 3H) 2,83 (br s, 1H) 2,26 (s, 3H) 1,36 (d,
tizaron como se ha descrito antes. Como sabrán los o se pueden nombrar de forma correcta usando varios 39.0 se puede nombrar como (1 R,2S)-N-(4-(3,5-3-il)-1-metoxi-1-(5-metilpirimidin-2-il)propano-2-)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida. Las designa incluidas en la siguiente tabla. La siguiente tabla proporc aunque algunos nombres pueden ser los mismos que lo Además, cuando el compuesto es una sal, se proporcion
Ta nes M y P que proceden de la atropoisomería no están a nombres alternativos para los compuestos de ejemplo, roporcionados previamente en las secciones de síntesis. l nombre del compuesto neutro.
57
iazol-
Actividad biológica
Unión a [35S]GTPyS
El receptor APJ humano se clonó por reacción en cad subclonó en el vector de expresión pFLAG-CMV™-3 (Si Se llevó a cabo un ensayo de unión a GTPyS en me establemente el receptor APJ humano. Se determinaron las concentraciones de GDP, MgCh y NaCl en el tampón [HEPES 20 mM, pH 7,5, MgCl25 mM y BSA al 0,1% (p/v) receptor APJ humano/pocillo junto con microesferas W nM (Perkin Elmer Life and Analytical Sciences, Waltha incubó a TA durante 90 minutos. La unión no específica inferior a 0,2% de la unión total. Todos los result independientes y se analizan por métodos de regresión CA) disponible en el mercado para obtener la CE 50 detall
Prueba de efectos inotrópicos independientes de la carg de rata perfundidos aislados)
Se anestesiaron ratas Sprague Dawley® SD que no de la polimerasa y el gen que codifica el receptor se a, Saint Louis, MO EE.UU.) en el laboratorio en Amgen. anas preparadas a partir de células CHO que expresan icialmente las condiciones experimentales óptimas para ensayo. El ensayo se llevó a cabo en tampón de ensayo n NaCl 200 mM, GDP 3 |jM] y membranas que expresan PS. La reacción se inició por adición de [35S]GTPyS 0,2 USA) en ausencia o presencia de varios ligandos y se determinó en presencia de GTPyS 100 gM y siempre era os presentados son medias de varios experimentos lineal usando el programa Prism (GraphPad, San Diego, a en la Tabla 58.
on agonistas de APJ usando ensayo ex vivo (corazones
abían recibido tratamiento previo (laboratorios Harlan
(Livermore, CA, EE.UU.)) y se extirparon los corazones Holliston apparatus, MA, Ee .UU.) A través de la aort Krebs-Henseleit oxigenado modificado (Skrzypiec-Spri 126). La presión de la solución hace que la válvula aórt el ostium y vasos coronarios. Esto permite que el coraz izquierdo (LV) para medir dP/dtmáx (derivada de la pr cardíaca. El agonista de APJ se perfundió constante examinar la contractilidad cardíaca. La administración dosis en los efectos inotrópicos y lusitrópicos (Figs. 1A,
La Fig. 1A muestra el efecto del Ejemplo 371 en la co perfundidos aislados. El ejemplo 371 se infundió en dif la carga se midió por el índice de LV dP/dtmáx y los res vehículo. La FIG. 1b muestra el efecto del Ejemplo 371 perfundidos aislados. El ejemplo 371 se infundió en dif de la carga (relajación) se midió por el índice de LV d cambio frente al vehículo. Para el ejemplo 371, los dat Fig. 2A muestra el efecto del Ejemplo 109 en la cont perfundidos aislados. El Ejemplo 109 se infundió en dif la carga se midió por el índice de LV dP/dtmáx y los res vehículo. La Fig. 2B muestra el efecto del Ejemplo 10 perfundidos aislados. El ejemplo 109 se infundió en dif de la carga (relajación) se midió por el índice de LV d cambio frente al vehículo. Para el ejemplo 109, los dat Fig. 3A muestra el efecto del Ejemplo 586 en la cont perfundidos aislados. El ejemplo 586 se infundió en dif la carga se midió por el índice de LV dP/dtmáx y los res vehículo. La Fig. 3B muestra el efecto del Ejemplo 58 perfundidos aislados. El ejemplo 586 se infundió en independiente de la carga (relajación) por el índice porcentaje de cambio frente al vehículo. Para el ejempl vehículo. La Fig. 4A muestra el efecto del Ejemplo 263 de ratas perfundidos aislados. El ejemplo 263 se independiente de la carga se midió por el índice de LV de cambio. La Fig. 4B muestra el efecto del Ejemplo 2 perfundidos aislados. El ejemplo 263 se infundió en dif de la carga (relajación) se midió por el índice de LV dP cambio. Para el ejemplo 263, los datos son media /- S contractilidad independiente de la carga en corazones diferentes concentraciones y la contractilidad independ resultados se expresan como un porcentaje de cambio 27 en la relajación ventricular izquierda en corazones diferentes concentraciones y se midió el efecto lusitrópi dP/dtmín, donde los resultados se expresan como porc datos son media /- SEM (n = 8) y (n = 5) frente al contractilidad independiente de la carga en corazones diferentes concentraciones y la contractilidad independ resultados se expresan como un porcentaje de cambio. ventricular izquierda en corazones de rata perfun concentraciones y el efecto lusitrópico independiente d donde los resultados se expresan como porcentaje de 8).
Evidencia de mejora en la contractilidad cardíaca in viv
Basándose en los hallazgos ex vivo en un ensayo de para investigar la traducción de la contractilidad cardíac River, EE.UU.) de 2-3 meses de edad para el estudio. de la arteria coronaria descendente izquierda que da c eyección de <35%. Los agonistas de APJ se administ período de 30 min. La administración de los Ejemplo contractilidad cardíaca medida por dP/dtmáx (derivado d
La siguiente tabla incluye datos de actividad biológica para los compuestos de ensayo descritos en la present uido de canulación en el aparato Langendorff (Harvard, orazón se perfundió de forma retrógrada con tampón et al., (2007) J. Pharmacol Toxicol Methods 55: 113 cierre y entonces el perfusado es obligado a entrar en a durante varias h. Se insertó un balón en el ventrículo del ventrículo izquierdo) como índice de contractilidad de forma dependiente de la dosis en el corazón para gonista de APJ mostró un aumento dependiente de la A, 2B, 3A, 3B, 4A, 4B, 5A, 5B, 6Ay 6B y Tabla 59).
lidad independiente de la carga en corazones de ratas s concentraciones y la contractilidad independiente de s se expresan como un porcentaje de cambio frente al relajación del ventrículo izquierdo en corazones de rata s concentraciones y el efecto lusitrópico independiente donde los resultados se expresan como porcentaje de media /- SEM (n = 8) y (n = 4-6) para el vehículo. La ad independiente de la carga en corazones de ratas s concentraciones y la contractilidad independiente de s se expresan como un porcentaje de cambio frente al a relajación ventricular izquierda en corazones de rata s concentraciones y el efecto lusitrópico independiente donde los resultados se expresan como porcentaje de media /- SEM (n = 8) y (n = 2) frente al vehículo. La ad independiente de la carga en corazones de ratas s concentraciones y la contractilidad independiente de s se expresan como un porcentaje de cambio frente al a relajación ventricular izquierda en corazones de rata ntes concentraciones y se midió el efecto lusitrópico V dP/dtmín donde los resultados se expresan como los datos son medias /- SEM (n = 8) y (n = 5) frente al contractilidad independiente de la carga en corazones ió en diferentes concentraciones y la contractilidad áx y los resultados se expresaron como un porcentaje la relajación ventricular izquierda en corazones de rata s concentraciones y el efecto lusitrópico independiente donde los resultados se expresan como porcentaje de = 8). La FIG. 5A muestra el efecto del Ejemplo 27 en la tas perfundidos aislados. El ejemplo 27 se infundió en de la carga se midió por el índice de LV dP/dtmáx y los al vehículo. La Fig. 5B muestra el efecto del Ejemplo ta perfundidos aislados. El Ejemplo 27 se infundió en lajación) independiente de la carga por el índice de LV de cambio frente al vehículo. Para el ejemplo 27, los lo. La Fig. 6A muestra el efecto del Ejemplo 99 en la tas perfundidos aislados. El Ejemplo 99 se infundió en de la carga se midió por el índice de LV dP/dtmáx y los ig. 6B muestra el efecto del Ejemplo 99 en la relajación aislados. El ejemplo 99 se infundió en diferentes arga (relajación) se midió por el índice de LV dP/dtmín, . Para el ejemplo 99, los datos son media /- SEM (n =
odelo de rata con insuficiencia cardíaca
ón aislado, se administraron agonistas de APJ in vivo ntornos in vivo. Se usaron ratas Lewis macho (Charles suficiencia cardíaca se indujo por ligadura permanente resultado una lesión en el corazón con una fracción de de forma aguda y dependiente de la dosis durante un 109, 586, 263, 27 y 99 condujo a un aumento de la esión ventricular izquierda) (Tabla 59).
idos usando los procedimientos y ensayos expuestos oria.
Tabla 58. Información de la actividad lógica por compuestos de los Ejemplo.
La siguiente tabla incluye datos obtenidos usando los pr ejemplo descritos en la presente memoria.
dimientos y ensayos expuestos para los compuestos de
Tabla 59. Efectos de contractilidad de los ejemplos o (modelo de rata de MI).
rvados ex vivo (ensayo de corazón aislado) e in vivo
APJ es un receptor acoplado a proteína G que está es Tipo 1 (AT1R) con 50% de homología en el dominio tra para APJ y recientemente se ha identificado otro ligan receptor APJ (Tatemoto, K. et al., Biochem. Biophys.
Science, 343, pág. 1248636 (2014)). Desde su descubri apelina-receptor APJ en la fisiopatología de las enferm han demostrado que la infusión aguda de apelina o ag insuficiencia cardíaca (Berry, M. F., et al., Circulatio Circulación, 121, pág. 1818-1827 (2010)).
Un aspecto clave del sistema apelina-APJ que surge es se sabe que la apelina contrarregula las acciones de apleina muestran un fuerte aumento de la respuesta va ejerce el efecto hipotensor in vivo contra la acción pre inhibía la formación de aterosclerosis mediada por angi et al., J. Clin. Invest., 118, pág. 3343-3354 (2008), Siddi X. et al., Hypertens. Res., 34, pág. 701-706 (2011)). Est señalización intracelular independientes o por la inte heterodímero. Siddiquee et al. mostraron que la
heterodimerización dependiente de apelina y la modula AT1R (Siddiquee, K. et al., Br. J. Pharmacol., 168, pág.
Los autores de la invención estaban interesados en activación por agonistas de APJ tendría algún resulta cardíaca, considerando que la mayoría de estos pacien bloqueadores de angiotensina (antagonistas del rec angiotensina (ARB)) e inhibidores de la enzima conv interacción entre APJ y el receptor AT1R, se examinó l con agonistas de APJ. Sorprendentemente y contrario APJ dio como resultado una cooperación positiva de aumentar la eficacia de la respuesta IP (véase la secció el bloqueo del receptor AT1R por un ARB tal como losar su señalización, que se observa como efectos sinérgi establece un nuevo paradigma para la interacción cruz amente relacionado con el receptor de angiotensina II mbrana. La apelina es un ligando endógeno conocido amado ELABELA como otro potencial ligando para el Commun., 251, pág. 471-476 (1998); Pauli, A. et al., to, existe evidencia acumulada que indica la función de s cardiovasculares. Los estudios preclínicos y clínicos s de APJ mejora la función cardíaca en situaciones de 0(11) pág. 11187-11193 (2004); Japp, A. G. et al.,
teracción con el sistema renina-angiotensina. También constricción de AngII. Los ratones que no expresan sora a AngII, lo que indica que el sistema apelina/APJ e AngII. Además, la ruta de APJ activado por apelina ina a través de la interacción con el AT1R (Chun, H.J., , K et al., J. Hypertens., 29, pág. 724-731 (2011), Sun, ría estar mediado por la convergencia de dos rutas de ón física directa de APJ con AT1R para formar un ización de AngII es antagonizada a través de la alostérica negativa mediada por APJ de la función de 1117 (2013).
nder si la heterodimerización de APJ-AT1R tras la ínicamente beneficioso en pacientes con insuficiencia stán en tratamiento estándar con fármacos tales como de angiotensina II o bloqueadores de receptor de ra de angiotensina (ECA). Con el fin de explorar la ñalización de IP1 mediada por AT1R tras la activación hallazgos de Siddique et al., la activación de la ruta de al cambiar su potencia hacia la izquierda y también métodos y resultados a continuación). Por el contrario, livió la inhibición del receptor APJ y regula por aumento tanto en estudios ex vivo como in vivo. Este trabajo eterodimerización entre APJ y AT1R que podría tener
implicaciones para los enfoques de las intervenciones far La interacción entre la acetilcolinesterasa (ACE2) y la interacción entre las rutas de señalización de Apelina-A agonistas de moléculas pequeñas de APJ en presenci cardíaca in vivo. Captopril solo, en situaciones agudas, n de eyección aguda. Sin embargo, en presencia de un hacia la izquierda con una notable mejora en la contractil cardíaca. Estos hallazgos proporcionan una nueva refer sistema renina-angiotensina-aldosterona (RAAS), inde objetivos farmacológicos potenciales para el tratamie insuficiencia cardíaca. Este trabajo establece claramente ARB como losartán y/o un inhibidor de la ACE tal com proporcionar una mayor eficacia en el tratamiento de pa la contractilidad y la fracción de eyección sin cambiar la fr Evidencia de interacción alostérica entre APJ y AT1R us Métodos
Se generaron líneas celulares recombinantes estables células CHO K1 marcadas con el marcador FLAG o hem se sembraron en medio de cultivo de DMEM-F12 y FBS pocillos durante la noche. Al día siguiente, el medio d durante 4 horas. El compuesto AnglI en un intervalo concentraciones de agonistas de APJ se diluyó en tamp se selló y se incubó durante 1 hora. A esto le siguió l anticuerpo y criptato de europio a los pocillos. La pl temperatura ambiente. Se midió la energía por resonanc nm y 665 nm después de 2 horas con un lector Envi cantidad de IP1 producida era inversamente proporcional Resultados
En las células que expresan tanto APJ como el rece concentraciones aumentó la respuesta máxima de An aumento en la respuesta IP1 alcanzó un efecto máximo t techo que es una característica distintiva de la cooperati embargo, este efecto de cooperatividad no se observó AT1R, lo que indica que existe una interacción cruzada f física o con efectores posteriores (FIG. 8 y FIG. 9) Ba razonó que si un agonista de APJ puede inducir la hete losartán mejoraría la activación de APJ tras la adición agonistas de moléculas pequeñas de APJ inducían una c losartán aliviaba esta cooperatividad y daba como result APJ. Este trabajo establece claramente que la combina losartán o un inhibidor de la ACE tal como captopril p mayor eficacia en el tratamiento de pacientes con insufici Aunque la invención anterior se ha descrito con cierto d de comprensión, será evidente para los expertos en la t pueden hacer ciertos cambios y modificaciones de los adjuntas.
cológicas en poblaciones con insuficiencia cardíaca.
ología de la apelina es complicada. Para investigar la y ACE, se examinó la mejora en la función cardíaca con el inhibidor de ACE captopril en ratas con insuficiencia uestra una mejora notable en la contractilidad o fracción nista de APJ, había un desplazamiento de la potencia d y la fracción de eyección sin cambios en la frecuencia ia para la comprensión de la regulación de ACE2 para el diente de la señalización de AT1R y ofrece nuevos de enfermedades tales como la hipertensión y la e la combinación de un agonista del receptor APJ con un aptopril puede desempeñar una función importante para tes con insuficiencia cardíaca, por ejemplo para mejorar uencia cardíaca.
o el ensayo IP
ples y dobles para APJ humano y el receptor AT1R en utinina (HA). Brevemente, las células CHO-K1 APJ/AT1R 10% en una densidad de 15k/pocillo en una placa de 96 ultivo se reemplazó con medio que no contenía suero concentraciones (1 pM-10 gM) con o sin diferentes de estimulación y se añadió a la placa celular. La placa dición de conjugado de IP-d2 seguido de conjugado de a se selló, seguido de incubación durante 2 horas a de fluorescencia resuelta en el tiempo (TR-FRET) a 620 . Se calcularon las relaciones de señal y delta F y la la relación TR-FRET, 665/620 nm.
r AT1R, la adición de agonistas de APJ a diferentes y también desplazó la potencia hacia la izquierda. El to en potencia como en Emáx, lo que indica un efecto de ad alostérica entre el receptor AT1R y APJ (FIG. 7) Sin las líneas celulares estables recombinantes ni APJ ni cional entre los dos receptores a través de la interacción dose en los hallazgos anteriores de cooperatividad, se imerización de APJ con AT1R, el bloqueo de AT1R con agonistas de moléculas pequeñas. Se observó que los peratividad positiva en presencia de AngII y la adición de efectos sinérgicos de mejora de la eficacia del receptor de un agonista del receptor APJ con un ARB tal como de tener una función importante para proporcionar una cia cardíaca.
lle a modo de ilustración y ejemplo con fines de claridad ica a la luz de las enseñanzas de esta invención que se ismos sin apartarse del alcance de las reivindicaciones
Claims (30)
1. Un compuesto de fórmula I o fórmula II
o una sal farmacéuticamente aceptable de los mismos, un tautómero de los mismos, una sal farmacéuticamente aceptable del tautómero, un estereoisómero de cualquiera de los anteriores, o una mezcla de los mismos,
en donde:
R1 es un piridilo, piridonilo o N-óxido de piridina no sustituido, o es un piridilo, piridonilo o N-óxido de piridina sustituido con 1,2, 3, o 4 sustituyentes R1a;
R1a en cada caso se selecciona independientemente de -F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -alquenilo C2-C6, -O-(alquil C1-C6)-o H, -O-(alquil C1-C6)-O-(alquilo C1-C6), -O-(halogenoalquil C1-C6)-OH, -O-(halogenoalquil C1-C6)-O-(alquilo C1-C6), -O-(perhalogenoalquil C1-C6)-OH, -O-(perhalogenoalquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N(alquilo C1-C6)2, fenilo, -C(=O)-(heterociclilo), o un grupo heterociclilo, en donde el grupo heterociclilo del grupo -C(=O)-(heterociclilo) o heterociclilo es un anillo de 3 a 7 miembros que contiene 1,2, o 3 heteroátomos seleccionados de N, O o S;
R2 se selecciona de -H, o alquilo C1-C4 o está ausente en los compuestos de fórmula II;
R3 se selecciona de un alquilo C1-C10 no sustituido, un alquilo C1-C10 sustituido con 1, 2, o 3 sustituyentes R3a, un grupo de fórmula -(CR3bR3c)-Q, un grupo de fórmula -NH-(CR3bR3c)-Q, un grupo de fórmula -(CR3bR3c)-C(=O)-Q, un grupo de fórmula -(CR3dR3e)-(CR3fR3g)-Q, un grupo de fórmula -(CR3b=CR3c)-Q, o un grupo de fórmula -(heterociclil)-Q, en donde el heterociclilo del -(heterociclil)-Q tiene de 5 a 7 miembros de los cuales 1, 2 o 3 son heteroátomos seleccionados de N, O o S y no está sustituido o está sustituido con 1,2 o 3 sustituyentes R3h;
R3a en cada caso se selecciona independientemente de -F, -Cl, -CN, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-o H, -O-(alquil C1-C6)-O-(alquilo C1-C6), alquenilo C2-C6, alquinilo C2-C6, -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
R3b y R3c se seleccionan independientemente de -H, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
R3d y R3e se seleccionan independientemente de -H, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
R3f y R3g se seleccionan independientemente de -H, -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), o -N(alquilo C1-C6)2;
R3h en cada caso se selecciona independientemente de -F, -Cl, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -O-(alquil C1-C6)-OH, -O-(alquil C1-C6)-O-(alquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, u oxo;
Q es un grupo arilo C6-C10 monocíclico o bicíclico, un grupo heteroarilo monocíclico o bicíclico con 5 a 10 miembros en el anillo que contiene 1, 2, o 3 heteroátomos seleccionados de N, O o S, un grupo cicloalquilo C3-C8, o un grupo heterociclilo de 3 a 7 miembros que contiene 1, 2, o 3 heteroátomos seleccionados de N, O, o S, en donde el grupo arilo C6-C10, el grupo heteroarilo, el grupo cicloalquilo y el grupo heterociclilo no están sustituidos o están sustituidos con 1,2, 3, o 4 sustituyentes RQ;
RQ en cada caso se selecciona independientemente de -F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -alquenilo C2-C6, -alquinilo C2-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), -C(=O)N(alquilo C1-C6)2, -S(=O)2-(alquilo C1-C6), fenilo, o un grupo heteroarilo, y el grupo heterociclilo Q puede estar sustituido con 1 sustituyente oxo RQ;
R4 se selecciona de un grupo arilo C6-C10 monocíclico o bicíclico, un grupo heteroarilo monocíclico o bicíclico con 5 a 10 miembros en el anillo que contiene 1, 2, o 3 heteroátomos independientemente seleccionados de N, O o S, o un grupo heterociclilo monocíclico o bicíclico con 5 a 10 miembros en el anillo que contiene 1, 2, 3 o 4 heteroátomos independientemente seleccionados de N, O o S, en donde el grupo arilo C6-C10, el grupo heteroarilo o el grupo heterociclilo no están sustituidos o están sustituidos con 1,2, o 3 sustituyentes R4a; y
R4a en cada caso se selecciona independientemente de -F, -Cl, -Br, -I, -CN, -alquilo C1-C6, -halogenoalquilo C1-C6, -perhalogenoalquilo C1-C6, -OH, -O-(alquilo C1-C6), -O-(halogenoalquilo C1-C6), -O-(perhalogenoalquilo C1-C6), -NH2, -NH(alquilo C1-C6), -N(alquilo C1-C6)2, -C(=O)-(alquilo C1-C6), -C(=O)OH, -C(=O)-O-(alquilo C1-C6), -C(=O)NH2, -C(=O)NH(alquilo C1-C6), o -C(=O)N(alquilo C1-C6)2, y el grupo heterociclilo R4 puede estar además sustituido con 1 sustituyente oxo; y
además en donde
si R4 es un anillo de fenilo no sustituido o sustituido y R3 es un grupo de fórmula -(CR3b=CR3c)-Q, entonces al menos uno de los siguientes es verdad:
a) R4 está sustituido con al menos un grupo -O-(alquilo C1-C6);
b) Q no es un oxadiazol;
c) R3b no es -H;
d) R3c no es -H;
e) R1 no es un grupo 2-piridilo; o
f) R4 está sustituido con dos o más grupos -O-(alquilo C1-C6).
2. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R1 es un piridilo no sustituido o es un piridilo sustituido con 1 o 2 sustituyentes R1a.
3. El compuesto de reivindicación 2 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R1a en cada caso se selecciona independientemente de -CH3, -CH2CH3, -F, -Cl, -Br, -CN,-CFa, -CH=CH2, -C(=O)NH2, -C(=O)NH(CHa), -C(=O)N(CHa)2, -C(=O)NH(CH2CHs), -OH, -OCHa,-OCHF2, -OCH2CH3, -OCH2CF3, -OCH2CH2OH, -OCH2C(CH3)2OH,-OCH2C(CF3)2OH, -OCH2CH2OCH3, -NH2, -NHCH3, -N(CHa)2, fenilo o un grupo de fórmula
en donde el símbolo >ÍU W ', cuando se dibuja por encima de un enlace, indica el punto de unión del resto de la
molécula.
4. El compuesto de reivindicación 1 o la sal farmac cualquiera de los anteriores, o la mezcla de los mismos, ticamente aceptable del mismo, el estereoisómero de donde R1 se selecciona de
en donde el símbolo 'AA/V\ cuando se dibuja por encima de un enlace, indica el punto de unión del resto de la molécula.
5. El compuesto de reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R1 se selecciona de
en donde el símbolo 'AA/V\ cuando se dibuja por encima de un enlace, indica el punto de unión del resto de la molécula.
6. El compuesto de reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R2 es -H.
7. El compuesto de reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R4 es un fenilo, piridilo, pirimidinilo, isoxazolilo, indolilo o naftilo, cualquiera de los cuales puede no estar sustituido o estar sustituido con 1,2 o sustituyentes 3 R4a.
8. El compuesto de reivindicación 7 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R4a se selecciona en cada caso independientemente de -CHa, -F, -CI, -Br, -CN, -CFa, -OCHa, -OCHF2, -OCH2CH3, -C(=O)OCH3, -C(=O)CH3 o -N(CH3)2.
10. El compuesto de reivindicación 1 o la sal farma de un enlace, indica el punto de unión del resto de la
ticamente aceptable del mismo, el estereoisómero de
cualquiera de los anteriores, o la mezcla de los mismos, en donde R4 es un fenilo sustituido con 1 o 2 sustituyentes R4a, en donde los sustituyentes R4a son grupos -O-(alquilo C1-C2).
11. El compuesto de reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde Q es un grupo heteroarilo monocíclico con 5 o 6 miembros en el anillo que contiene 1 o 2 heteroátomos seleccionados de N, O o S y Q no está sustituido o está sustituido con 1 o 2 sustituyentes RQ.
12. El compuesto de reivindicación 11 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde Q es un grupo pirimidinilo o piridilo y Q no está sustituido o está sustituido con 1 o 2 sustituyentes RQ.
13. El compuesto de reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde Q se selecciona de
en donde el símbolo 'AAA/' > cuando se dibuja por encima de un enlace, indica el punto de unión del resto de la molécula.
14. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R3 es un grupo de fórmula -(CR3dR3e)-(CR3fR3g)-Q.
15. El compuesto de la reivindicación 14 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R3 tiene la fórmula
en donde el símbolo 'AA/V', cuando se dibuja por encima de un enlace, indica el punto de unión del resto de la molécula.
16. El compuesto de la reivindicación 15 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde R3 tiene la fórmula
en donde el símbolo VÍUW', cuando se dibuja por encima de un enlace, indica el punto de unión del resto de la molécula.
17. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde el compuesto es
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-2-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida;
(1 R,2S)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 S,2R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirazinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metil-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -hidroxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(5-fluoro-2-pirimidinil)-1 -metoxi-2-propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-propanosulfonamida;
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 S,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1-metoxi-2-propanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metoxi-2-pirazinil)-2-propanosulfonamida;
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirazinil)-2-butanosulfonamida;
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-propanosulfonamida;
(1 R,2S)-N-(4-(4,6-dimetoxi-5-pirimidinil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida;
(1 R,2R)-1 -(5-cloro-2-pirimidinil)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-2-propanosulfonamida; o
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida.
18. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde el compuesto es
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(6-metoxi-2-piridinil)-4H-1,2,4-triazol-3-il)-1 -metoxi-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida.
19. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde el compuesto es
(2S,3R)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-3-(5-metil-2-pirimidinil)-2-butanosulfonamida.
20. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde el compuesto es
(1 R,2S)-N-(4-(2,6-dimetoxifenil)-5-(3-piridinil)-4H-1,2,4-triazol-3-il)-1 -etoxi-1 -(5-fluoro-2-pirimidinil)-2-propanosulfonamida.
21. El compuesto de la reivindicación 1 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, en donde el compuesto es
(1 S,2S)-N-(4-(2,6-dimetoxifenil)-5-(5-metil-3-piridinil)-4H-1,2,4-triazol-3-il)-1 -(1 -metiletoxi)-1 -(5-metil-2-pirimidinil)-2-propanosulfonamida.
22. Una composición farmacéutica que comprende el compuesto de una cualquiera de las reivindicaciones 1-21 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, y al menos un excipiente, vehículo o diluyente farmacéuticamente aceptable.
23. La composición farmacéutica de la reivindicación 22, que además comprende un agente terapéutico seleccionado de un a-bloqueador, un p-bloqueador, un inhibidor de la enzima convertidora de angiotensina (ACE), un bloqueador del receptor de angiotensina (ARB), un bloqueador de canal de calcio, un diurético, un inhibidor de la
corriente funny, un activador de miosina, o un inhibidor de endopeptidasa neutral (NEP).
24. A compuesto de una cualquiera de las reivindicaciones 1-21 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, o la composición farmacéutica de la reivindicación 22 para usar en el tratamiento de una afección cardiovascular.
25. El compuesto para el uso de la reivindicación 24, en donde la afección cardiovascular es insuficiencia cardiaca.
26. El compuesto para el uso de la reivindicación 24, en donde la afección cardiovascular es insuficiencia cardiaca con fracción de eyección reducida.
27. El compuesto para el uso de la reivindicación 24, en donde la afección cardiovascular es insuficiencia cardiaca con fracción de eyección conservada.
28. El compuesto para el uso de la reivindicación 24, en donde la afección cardiovascular es insuficiencia cardiaca aguda.
29. El compuesto para el uso de la reivindicación 24, en donde la afección cardiovascular es hipertensión.
30. A compuesto de una cualquiera de las reivindicaciones 1-21 o la sal farmacéuticamente aceptable del mismo, el estereoisómero de cualquiera de los anteriores, o la mezcla de los mismos, o la composición farmacéutica de la reivindicación 22 para usar en el tratamiento de una afección donde se desea activar el receptor APJ, en donde la afección es obesidad, diabetes, nefropatía diabética o enfermedad renal crónica.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562164106P | 2015-05-20 | 2015-05-20 | |
| PCT/US2016/033088 WO2016187308A1 (en) | 2015-05-20 | 2016-05-18 | Triazole agonists of the apj receptor |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2791315T3 true ES2791315T3 (es) | 2020-11-03 |
Family
ID=56134572
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES16730076T Active ES2791315T3 (es) | 2015-05-20 | 2016-05-18 | Agonistas triazoles del receptor APJ |
Country Status (38)
| Country | Link |
|---|---|
| US (10) | US9573936B2 (es) |
| EP (1) | EP3300500B9 (es) |
| JP (3) | JP6356364B1 (es) |
| KR (1) | KR102653667B1 (es) |
| CN (1) | CN108137545B (es) |
| AR (1) | AR104716A1 (es) |
| AU (1) | AU2016263564B2 (es) |
| BR (1) | BR112017024618B1 (es) |
| CA (1) | CA2985542C (es) |
| CL (1) | CL2017002922A1 (es) |
| CO (1) | CO2017012991A2 (es) |
| CY (1) | CY1123451T1 (es) |
| DK (1) | DK3300500T3 (es) |
| EA (1) | EA034776B1 (es) |
| ES (1) | ES2791315T3 (es) |
| HK (1) | HK1253366A1 (es) |
| HR (1) | HRP20200690T1 (es) |
| HU (1) | HUE050317T2 (es) |
| IL (1) | IL255459A (es) |
| JO (1) | JO3653B1 (es) |
| LT (1) | LT3300500T (es) |
| MA (1) | MA42145B1 (es) |
| ME (1) | ME03733B (es) |
| MX (1) | MX2017014818A (es) |
| MY (1) | MY193818A (es) |
| NZ (1) | NZ737004A (es) |
| PE (1) | PE20180529A1 (es) |
| PH (1) | PH12017502107A1 (es) |
| PL (1) | PL3300500T3 (es) |
| PT (1) | PT3300500T (es) |
| RS (1) | RS60353B1 (es) |
| SI (1) | SI3300500T1 (es) |
| TN (1) | TN2017000483A1 (es) |
| TW (1) | TWI606039B (es) |
| UA (1) | UA119932C2 (es) |
| UY (1) | UY36684A (es) |
| WO (1) | WO2016187308A1 (es) |
| ZA (1) | ZA201707706B (es) |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH1143120A (ja) * | 1997-07-28 | 1999-02-16 | Ishikawajima Harima Heavy Ind Co Ltd | 容器の後処理装置 |
| UA119932C2 (uk) | 2015-05-20 | 2019-08-27 | Емджен Інк. | Триазолові агоністи рецептора apj |
| SI3303330T1 (sl) | 2015-06-03 | 2019-08-30 | Bristol-Myers Squibb Company | Agonisti 4-hidroksi-3-(heteroaril)piridin-2-on apj za uporabo pri zdravljenju kardiovaskularnih motenj |
| AU2016340264B2 (en) | 2015-10-14 | 2021-01-07 | Bristol-Myers Squibb Company | 2,4-dihydroxy-nicotinamides as APJ agonists |
| CA3018346A1 (en) | 2016-03-24 | 2017-09-28 | Bristol-Myers Squibb Company | 6-hydroxy-4-oxo-1,4-dihydropyrimidine-5-carboxamides as apj agonists |
| US9988369B2 (en) | 2016-05-03 | 2018-06-05 | Amgen Inc. | Heterocyclic triazole compounds as agonists of the APJ receptor |
| US11191762B2 (en) | 2016-11-16 | 2021-12-07 | Amgen Inc. | Alkyl substituted triazole compounds as agonists of the APJ Receptor |
| WO2018093579A1 (en) | 2016-11-16 | 2018-05-24 | Amgen Inc. | Triazole phenyl compounds as agonists of the apj receptor |
| US10736883B2 (en) | 2016-11-16 | 2020-08-11 | Amgen Inc. | Triazole furan compounds as agonists of the APJ receptor |
| WO2018093577A1 (en) | 2016-11-16 | 2018-05-24 | Amgen Inc. | Cycloalkyl substituted triazole compounds as agonists of the apj receptor |
| EP3541805B1 (en) | 2016-11-16 | 2020-10-14 | Amgen Inc. | Heteroaryl-substituted triazoles as apj receptor agonists |
| WO2018093580A1 (en) | 2016-11-16 | 2018-05-24 | Amgen Inc. | Triazole pyridyl compounds as agonists of the apj receptor |
| RU2020110394A (ru) * | 2017-08-15 | 2022-01-20 | Инфлазоум Лимитед | Новые соединения сульфонамидкарбоксамидов |
| WO2019089335A1 (en) | 2017-11-03 | 2019-05-09 | Amgen Inc. | Fused triazole agonists of the apj receptor |
| CN112055713A (zh) * | 2018-03-01 | 2020-12-08 | 安娜普尔纳生物股份有限公司 | 用于治疗与apj受体活性有关的疾病的化合物和组合物 |
| US11807624B2 (en) | 2018-05-01 | 2023-11-07 | Amgen Inc. | Substituted pyrimidinones as agonists of the APJ receptor |
| CN108795853B (zh) * | 2018-05-28 | 2021-08-24 | 天津博雅秀岩生物技术有限公司 | 制备犬胎膜间充质干细胞的方法和犬胎膜间充质干细胞 |
| CN108728408B (zh) * | 2018-05-28 | 2021-08-24 | 天津博雅秀岩生物技术有限公司 | 犬胎膜间充质干细胞及制备方法和使用的培养基 |
| US20240252493A1 (en) * | 2021-04-06 | 2024-08-01 | BioAge Labs, Inc. | Apelin Receptor Modulators for Treating Age-Related Muscle Conditions |
| US20240122926A1 (en) | 2022-09-27 | 2024-04-18 | BioAge Labs, Inc. | Apelin receptor modulators for treating muscle conditions |
| WO2024148104A1 (en) | 2023-01-03 | 2024-07-11 | BioAge Labs, Inc. | Combination therapy of apelin receptor agonist and glp-1 receptor agonist for treating a disease or condition associated with weight gain |
| CN117417325B (zh) * | 2023-12-19 | 2024-10-22 | 药康众拓(北京)医药科技有限公司 | 氘代1,2,4-三唑类Apelin受体激动剂药物及用途 |
Family Cites Families (141)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4256108A (en) | 1977-04-07 | 1981-03-17 | Alza Corporation | Microporous-semipermeable laminated osmotic system |
| US4160452A (en) | 1977-04-07 | 1979-07-10 | Alza Corporation | Osmotic system having laminated wall comprising semipermeable lamina and microporous lamina |
| US4265874A (en) | 1980-04-25 | 1981-05-05 | Alza Corporation | Method of delivering drug with aid of effervescent activity generated in environment of use |
| US4681943A (en) * | 1984-11-30 | 1987-07-21 | The Dow Chemical Company | 1-acyl-1-(2-pyridinyl)semicarbazides |
| JPS62149673A (ja) * | 1985-09-05 | 1987-07-03 | Sumitomo Chem Co Ltd | ピリジン誘導体、その製造法およびそれを有効成分とする植物病害防除剤 |
| DE3825867A1 (de) | 1988-03-04 | 1989-09-14 | Bayer Ag | Heterocyclisch substituierte sulfonylaminoazole und ihre verwendung als herbizide |
| EP0409332A3 (en) | 1989-07-19 | 1991-08-07 | Merck & Co. Inc. | Substituted triazoles as angiotensin ii antagonists |
| DE3928605A1 (de) | 1989-08-30 | 1991-03-07 | Bayer Ag | Substituierte sulfonylaminoazole |
| JP2726563B2 (ja) | 1990-02-13 | 1998-03-11 | メルク・エンド・カムパニー・インコーポレーテツド | 置換ベンジル要素を含むトリアゾールアンギオテンシン▲ii▼拮抗物質 |
| JPH0511439A (ja) | 1990-09-13 | 1993-01-22 | Fuji Photo Film Co Ltd | 光重合性組成物 |
| DE4035141A1 (de) | 1990-11-06 | 1992-05-07 | Bayer Ag | Substituierte sulfonylaminotriazolylpyrimidine |
| SK278998B6 (sk) | 1991-02-01 | 1998-05-06 | Merck Sharp & Dohme Limited | Deriváty imidazolu, triazolu a tetrazolu, spôsob i |
| SE9103397D0 (sv) | 1991-11-18 | 1991-11-18 | Kabi Pharmacia Ab | Nya substituerade salicylsyror |
| JP3217846B2 (ja) * | 1992-03-04 | 2001-10-15 | クミアイ化学工業株式会社 | トリアゾール誘導体及び殺虫剤 |
| US5510362A (en) | 1992-03-13 | 1996-04-23 | Merck, Sharp And Dohme Limited | Imidazole, triazole and tetrazole derivatives |
| US5411839A (en) | 1993-01-15 | 1995-05-02 | Eastman Kodak Company | Image formation in color reversal materials using strong inhibitors |
| DK0807112T3 (da) | 1995-02-03 | 2001-12-17 | Upjohn Co | Antimikrobiel heteroaromatisk ringsubstitueret phenyloxazolidinon |
| US5563026A (en) | 1995-04-28 | 1996-10-08 | Eastman Kodak Company | Color negative element having improved green record printer compatibility |
| DE19725450A1 (de) | 1997-06-16 | 1998-12-17 | Hoechst Schering Agrevo Gmbh | 4-Haloalkyl-3-heterocyclylpyridine und 4-Haloalkyl-5-heterocyclylpyrimidine, Verfahren zu ihrer Herstellung, sie enthaltende Mittel und ihre Verwendung als Schädlingsbekämpfungsmittel |
| JP3788676B2 (ja) | 1997-11-11 | 2006-06-21 | 富士写真フイルム株式会社 | 有機エレクトロルミネツセンス素子材料およびそれを使用した有機エレクトロルミネツセンス素子 |
| AU757197B2 (en) | 1998-02-13 | 2003-02-06 | Pharmacia & Upjohn Company | Substituted aminophenyl isoxazoline derivatives useful as antimicrobials |
| JP2002504550A (ja) | 1998-02-25 | 2002-02-12 | ファルマシア・アンド・アップジョン・カンパニー | 抗微生物剤として有用な置換アミノメチルイソオキサゾリン誘導体 |
| DE60023926T2 (de) | 1999-09-10 | 2006-07-20 | Merck & Co., Inc. | Tyrosin kinase inhibitoren |
| DE60128551D1 (de) | 2000-03-16 | 2007-07-05 | Genesoft Inc | Geladene verbindungen mit einer nukleinsäure-bindenden einheit sowie deren verwendungen |
| ATE326478T1 (de) | 2000-03-23 | 2006-06-15 | Takeda Chemical Industries Ltd | Peptidderivat |
| PL359340A1 (en) | 2000-05-19 | 2004-08-23 | Triazole derivatives | |
| EP1353674A1 (en) | 2000-12-29 | 2003-10-22 | Alteon, Inc. | Method for treating glaucoma ivb |
| EP1359911A2 (en) | 2000-12-29 | 2003-11-12 | Alteon, Inc. | Method for treating fibrotic diseases or other indications ivc |
| WO2002088097A1 (en) * | 2001-04-27 | 2002-11-07 | Vertex Pharmaceuticals Incorporated | Triazole-derived kinase inhibitors and uses thereof |
| US6787555B2 (en) | 2001-04-30 | 2004-09-07 | The Procter & Gamble Company | Triazole compounds useful in treating diseases associated with unwanted cytokine activity |
| US6727364B2 (en) | 2001-04-30 | 2004-04-27 | The Procter & Gamble Company | Triazole compounds useful in treating diseases associated with unwanted cytokine activity |
| US6790846B2 (en) | 2001-05-24 | 2004-09-14 | The Procter & Gamble Company | Isoxazolone compounds useful in treating diseases associated with unwanted cytokine activity |
| JP2003005356A (ja) | 2001-06-20 | 2003-01-08 | Fuji Photo Film Co Ltd | 電子線又はx線用ネガ型レジスト組成物 |
| DE10138569A1 (de) | 2001-08-06 | 2003-04-30 | Bayer Ag | Regulation des APJ-Rezeptors |
| JP2003321456A (ja) | 2002-04-30 | 2003-11-11 | Fuji Photo Film Co Ltd | 5−アミノ−4−含窒素芳香族ヘテロ環置換ピラゾール類の製造方法 |
| ATE504294T1 (de) | 2002-08-23 | 2011-04-15 | Ardea Biosciences Inc | Nichtnukleosidische reverse-transkriptase-hemmer |
| US7084145B2 (en) | 2002-10-25 | 2006-08-01 | Pfizer Inc. | Triazole compounds useful in therapy |
| AU2003300099A1 (en) | 2003-01-02 | 2004-07-29 | Millennium Pharmaceuticals, Inc. | COMPOSITIONS AND METHODS FOR INHIBITING TGF-Beta |
| US7169797B2 (en) | 2003-02-14 | 2007-01-30 | Abbott Laboratories | Protein-tyrosine phosphatase inhibitors and uses thereof |
| US20040167188A1 (en) | 2003-02-14 | 2004-08-26 | Zhili Xin | Protein-tyrosine phosphatase inhibitors and uses thereof |
| US20050170431A1 (en) | 2003-02-28 | 2005-08-04 | Plexxikon, Inc. | PYK2 crystal structure and uses |
| WO2005004818A2 (en) | 2003-07-09 | 2005-01-20 | Imclone Systems Incorporated | Heterocyclic compounds and their use as anticancer agents |
| ATE423122T1 (de) | 2003-08-15 | 2009-03-15 | Astrazeneca Ab | Kondensierte heterocyclen als inhibitoren von glutamatracemase (muri) |
| CA2542682A1 (en) | 2003-10-18 | 2005-05-06 | Bayer Healthcare Ag | 5-substituted 2-(phenylmethyl) thio-4-phenyl-4h-1,2,4-triazole derivatives and related compounds as gaba-agonists for the treatment of urinary incontinence and related diseases |
| JP2005170939A (ja) | 2003-11-20 | 2005-06-30 | Takeda Chem Ind Ltd | 糖尿病の予防・治療剤 |
| WO2005073193A1 (en) | 2004-01-23 | 2005-08-11 | Amgen Inc. | Vanilloid receptor ligands and their use in treatments |
| US7297168B2 (en) | 2004-02-02 | 2007-11-20 | The Procter & Gamble Company | Keratin dyeing compounds, keratin dyeing compositions containing them, and use thereof |
| DE102004008141A1 (de) | 2004-02-19 | 2005-09-01 | Abbott Gmbh & Co. Kg | Guanidinverbindungen und ihre Verwendung als Bindungspartner für 5-HT5-Rezeptoren |
| JP2007530589A (ja) | 2004-03-26 | 2007-11-01 | アンフォラ ディスカバリー コーポレーション | 特定のトリアゾールを基礎とする化合物、組成物、およびそれらの使用 |
| JP2008502687A (ja) | 2004-06-14 | 2008-01-31 | タケダ サン ディエゴ インコーポレイテッド | キナーゼ阻害剤 |
| US7399317B2 (en) | 2004-08-26 | 2008-07-15 | The Procter & Gamble Company | Keratin dyeing compounds, keratin dyeing compositions containing them, and use thereof |
| CA2580409C (en) | 2004-09-16 | 2013-08-13 | Astellas Pharma Inc. | Triazole derivative or salt thereof |
| NZ555158A (en) | 2004-11-18 | 2010-09-30 | Synta Pharmaceuticals Corp | Triazole compounds that modulate Hsp90 activity |
| US20060156480A1 (en) | 2005-01-14 | 2006-07-20 | The Procter & Gamble Company | Keratin dyeing compounds, keratin dyeing compositions containing them, and use thereof |
| WO2006080533A1 (ja) | 2005-01-31 | 2006-08-03 | Mochida Pharmaceutical Co., Ltd. | 3-アミノ-1,2,4-トリアゾール誘導体 |
| WO2006095783A1 (ja) | 2005-03-09 | 2006-09-14 | Nippon Kayaku Kabushiki Kaisha | 新規なhsp90阻害剤 |
| US8399464B2 (en) | 2005-03-09 | 2013-03-19 | Nippon Kayaku Kabushiki Kaisha | HSP90 inhibitor |
| EP1863484A1 (en) | 2005-03-21 | 2007-12-12 | Pfizer Limited | Substituted triazole derivatives as oxytocin antagonists |
| JPWO2006109817A1 (ja) | 2005-04-06 | 2008-11-20 | 萬有製薬株式会社 | 1,4−置換ピペラジン誘導体 |
| WO2007007688A1 (ja) | 2005-07-08 | 2007-01-18 | Mochida Pharmaceutical Co., Ltd. | 3,5-ジアミノ-1,2,4-トリアゾール誘導体 |
| WO2007021941A2 (en) | 2005-08-16 | 2007-02-22 | Icagen, Inc. | Inhibitors of voltage-gated sodium channels |
| EP1917251B1 (de) | 2005-08-21 | 2013-04-03 | Abbott GmbH & Co. KG | 5-ring-heteroaromaten-verbindungen und ihre verwendung als bindungspartner für 5-ht5-rezeptoren |
| US8673848B2 (en) | 2012-01-27 | 2014-03-18 | Novartis Ag | Synthetic apelin mimetics for the treatment of heart failure |
| MX2008013308A (es) | 2006-04-19 | 2008-10-27 | Serono Lab | Nuevos derivados de arilaminopiridina heteroaril-sustituidos como inhibidores de mek. |
| EP2026797A2 (en) | 2006-05-25 | 2009-02-25 | Synta Pharmaceuticals Corporation | Method for treating non-hodgkin's lymphoma |
| TW200806637A (en) | 2006-05-25 | 2008-02-01 | Synta Pharmaceuticals Corp | Synthesis of triazole compounds that modulate HSP90 activity |
| CA2653217A1 (en) | 2006-05-25 | 2007-12-06 | Synta Pharmaceuticals Corp. | Method for treating proliferative disorders associated with protooncogene products |
| RS53446B (en) | 2006-05-25 | 2014-12-31 | Synta Pharmaceuticals Corp. | TRIAZOLE UNITS MODULATING HSP90 ACTIVITY |
| AU2007267847B2 (en) | 2006-05-25 | 2012-04-12 | Synta Pharmaceuticals Corp. | Triazole compounds that modulate Hsp90 activity |
| AU2012200157B2 (en) | 2006-05-25 | 2014-08-21 | Synta Pharmaceuticals Corp. | Method for treating proliferative disorders associated with protooncogene products |
| US8778977B2 (en) | 2006-06-30 | 2014-07-15 | Sunesis Pharmaceuticals, Inc. | Pyridinonyl PDK1 inhibitors |
| US7683176B2 (en) | 2006-07-14 | 2010-03-23 | Chemocentryx, Inc. | Triazolyl pyridyl benzenesulfonamides |
| US7718683B2 (en) | 2006-07-14 | 2010-05-18 | Chemocentryx, Inc. | Triazolyl phenyl benzenesulfonamides |
| JP5480623B2 (ja) | 2006-08-17 | 2014-04-23 | シンタ ファーマシューティカルズ コーポレーション | Hsp90活性を調節するトリアゾール化合物 |
| WO2008051416A2 (en) | 2006-10-19 | 2008-05-02 | Synta Pharmaceuticals Corp. | Compounds that inhibit the activity of hsp90 for treating infections |
| WO2008057246A2 (en) | 2006-10-26 | 2008-05-15 | Synta Pharmaceuticals Corp. | Method for treating inflammatory disorders |
| US7638541B2 (en) | 2006-12-28 | 2009-12-29 | Metabolex Inc. | 5-ethyl-2-{4-[4-(4-tetrazol-1-yl-phenoxymethyl)-thiazol-2-yl]-piperidin-1-yl}-pyrimidine |
| EP2118077B1 (en) | 2007-02-08 | 2014-12-24 | Synta Pharmaceuticals Corp. | Triazole compounds that modulate hsp90 activity |
| US7909187B2 (en) | 2007-02-20 | 2011-03-22 | Lonzell Montgomery | Modular baby bottle system |
| US8993608B2 (en) | 2007-03-12 | 2015-03-31 | Synta Pharmaceuticals Corp. | Method for inhibiting topoisomerase II |
| US8648104B2 (en) | 2007-05-25 | 2014-02-11 | Synta Pharmaceuticals Corp. | Method for treating proliferative disorders associated with mutations in c-Met |
| JP5457344B2 (ja) | 2007-07-17 | 2014-04-02 | アセア バイオサイエンシズ インコーポレイテッド | 複素環式化合物および抗がん剤としての使用 |
| JP5596543B2 (ja) | 2007-08-13 | 2014-09-24 | シンタ ファーマシューティカルズ コーポレーション | Hsp90活性を調節するトリアゾール化合物 |
| TW200922564A (en) | 2007-09-10 | 2009-06-01 | Curis Inc | CDK inhibitors containing a zinc binding moiety |
| WO2009075890A2 (en) | 2007-12-12 | 2009-06-18 | Synta Pharmaceuticals Corp. | Method for synthesis of triazole compounds that modulate hsp90 activity |
| JP5520831B2 (ja) | 2007-12-19 | 2014-06-11 | アムジエン・インコーポレーテツド | Pi3キナーゼの阻害薬 |
| DE102008013587A1 (de) | 2008-03-11 | 2009-09-17 | Bayer Schering Pharma Aktiengesellschaft | Heteroaryl-substituierte Dicyanopyridine und ihre Verwendung |
| EP2103602A1 (en) | 2008-03-17 | 2009-09-23 | AEterna Zentaris GmbH | Novel 1,2,4-triazole derivatives and process of manufacturing thereof |
| US9029376B2 (en) | 2008-06-03 | 2015-05-12 | Siga Technologies, Inc. | Small molecule inhibitors for the treatment or prevention of dengue virus infection |
| US8841462B2 (en) | 2008-07-01 | 2014-09-23 | Robert A. Heald | Bicyclic heterocycles as MEK kinase inhibitors |
| KR20110028376A (ko) | 2008-07-01 | 2011-03-17 | 제넨테크, 인크. | Mek 키나제 억제제로서의 이소인돌론 유도체 및 사용 방법 |
| US20100031237A1 (en) | 2008-08-01 | 2010-02-04 | International Business Machines Corporation | Methods for Detecting Inter-Module Dependencies |
| WO2010017545A2 (en) | 2008-08-08 | 2010-02-11 | Synta Pharamceuticals Corp. | Triazole compounds that modulate hsp90 activity |
| DE102008038221A1 (de) | 2008-08-18 | 2010-02-25 | Merck Patent Gmbh | 7-Azaindolderivate |
| JP2012509891A (ja) | 2008-11-26 | 2012-04-26 | サティオゲン ファーマシューティカルズ,インク. | 肥満症及び糖尿病を治療するための胆汁酸再循環阻害剤 |
| DE102008059702A1 (de) | 2008-12-01 | 2010-06-02 | Byk-Chemie Gmbh | Verfahren zur Herstellung rheologisch wirksamer Harnstoffurethane in organischen Salzen |
| WO2010139966A1 (en) | 2009-06-05 | 2010-12-09 | Oslo University Hospital Hf | Azole derivatives as wtn pathway inhibitors |
| US20120238576A1 (en) | 2009-06-08 | 2012-09-20 | California Capital Equity, Llc | Triazine Derivatives and their Therapeutical Applications |
| US8846739B2 (en) | 2009-12-11 | 2014-09-30 | Exelixis Patent Company Llc | TGR5 agonists |
| NZ603156A (en) | 2010-03-30 | 2014-10-31 | Verseon Corp | Multisubstituted aromatic compounds as inhibitors of thrombin |
| EP2560640A1 (en) | 2010-04-19 | 2013-02-27 | Synta Pharmaceuticals Corp. | Cancer therapy using a combination of a hsp90 inhibitory compounds and a egfr inhibitor |
| WO2011133521A2 (en) | 2010-04-19 | 2011-10-27 | Synta Pharmaceuticals Corp. | Cancer therapy using a combination of a hsp90 inhibitory compounds and a vegf inhibitor |
| WO2011146801A1 (en) | 2010-05-20 | 2011-11-24 | Synta Pharmaceuticals Corp. | Formulation and dosing of hsp90 inhibitory compounds |
| ES2552657T3 (es) | 2010-05-26 | 2015-12-01 | Satiogen Pharmaceuticals, Inc. | Inhibidores del reciclado de ácidos biliares y saciógenos para el tratamiento de diabetes, obesidad, y afecciones gastrointestinales inflamatorias |
| BR112013000925A2 (pt) | 2010-07-15 | 2020-12-01 | Bayer Intellectual Property Gmbh | compostos heterocíclicos como pesticidas |
| WO2012021778A2 (en) | 2010-08-12 | 2012-02-16 | The Regents Of The University Of California | Methods for blocking cell proliferation and treating diseases and conditions responsive to cell growth inhibition |
| US20130158063A1 (en) * | 2010-08-24 | 2013-06-20 | Georgetown University | Compounds, Compositions and Methods Related to PPAR Antagonists |
| JP5517890B2 (ja) * | 2010-11-15 | 2014-06-11 | サンデン株式会社 | ショーケース及び照明モジュール |
| CA2820800A1 (en) * | 2010-12-08 | 2012-06-14 | Oslo University Hospital Hf | Triazole derivatives as wnt signaling pathway inhibitors |
| US20140045908A1 (en) | 2011-02-25 | 2014-02-13 | Synta Pharmaceuticals Corp. | Hsp90 inhibitory compounds in treating jak/stat signaling-mediated cancers |
| JP2014521699A (ja) | 2011-08-04 | 2014-08-28 | ルメナ ファーマシューティカルズ,インク. | 膵臓炎の処置用の胆汁酸再利用阻害剤 |
| US9593109B2 (en) | 2011-08-26 | 2017-03-14 | Cymabay Therapeutics, Inc. | Bicyclic agonists of GPR131 and uses thereof |
| EP3266457A1 (en) | 2011-10-28 | 2018-01-10 | Lumena Pharmaceuticals LLC | Bile acid recycling inhibitors for treatment of pediatric cholestatic liver diseases |
| SG10201406155QA (en) | 2011-10-28 | 2014-11-27 | Lumena Pharmaceuticals Inc | Bile Acid Recycling Inhibitors For Treatment Of Pediatric Cholestatic Liver Diseases |
| US20140286902A1 (en) | 2011-11-02 | 2014-09-25 | Synta Pharmaceuticals Corp. | Combination therapy of hsp90 inhibitors with platinum-containing agents |
| WO2013067162A1 (en) | 2011-11-02 | 2013-05-10 | Synta Pharmaceuticals Corp. | Cancer therapy using a combination of hsp90 inhibitors with topoisomerase i inhibitors |
| US9402831B2 (en) | 2011-11-14 | 2016-08-02 | Synta Pharmaceutical Corp. | Combination therapy of HSP90 inhibitors with BRAF inhibitors |
| EP2802596A1 (en) | 2012-01-09 | 2014-11-19 | Anchor Therapeutics, Inc. | Apj receptor compounds |
| ES2630705T3 (es) | 2012-01-13 | 2017-08-23 | Bristol-Myers Squibb Company | Compuestos de piridilo sustituidos con triazolilo útiles como inhibidores de cinasas |
| WO2013148857A1 (en) | 2012-03-28 | 2013-10-03 | Synta Pharmaceuticals Corp. | Triazole derivatives as hsp90 inhibitors |
| CN110664816A (zh) | 2012-06-07 | 2020-01-10 | 佐治亚州立大学研究基金会公司 | Seca抑制剂以及其制备和使用方法 |
| US20140005181A1 (en) * | 2012-06-21 | 2014-01-02 | Sanford-Burnham Medical Research Institute | Small molecule antagonists of the apelin receptor for the treatment of disease |
| CN104640846A (zh) | 2012-09-21 | 2015-05-20 | 赛诺菲 | 用作apj受体调节剂的苯并咪唑-羧酸酰胺衍生物 |
| WO2014099984A1 (en) | 2012-12-20 | 2014-06-26 | Amgen Inc. | Apj receptor agonists and uses thereof |
| BR112015023294A2 (pt) | 2013-03-15 | 2017-07-18 | Shifa Biomedical Corp | método para tratamento ou prevenção de uma doença |
| UY35517A (es) | 2013-04-04 | 2014-10-31 | Mabxience S A | Un procedimiento para aumentar la formación de ácido piroglutamico de una proteína |
| US9957289B2 (en) | 2013-05-30 | 2018-05-01 | Washington University | Compounds and methods for treating bacterial infections |
| CA2942940A1 (en) | 2014-03-20 | 2015-09-24 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Use of compounds inhibiting apelin / apj / gp130 signaling for treating cancer |
| EP3134427B1 (en) | 2014-04-24 | 2020-06-03 | Nanyang Technological University | Asx-specific protein ligase |
| WO2015184011A2 (en) * | 2014-05-28 | 2015-12-03 | Sanford-Burnham Medical Research Institute | Agonists of the apelin receptor and methods of use thereof |
| MX2016014890A (es) | 2014-06-06 | 2017-05-01 | Res Triangle Inst | Agonistas del receptor de apelina (apj) y usos de los mismos. |
| US20160058705A1 (en) | 2014-08-28 | 2016-03-03 | Jayakumar Rajadas | Compositions and methods for treating cardiovascular and pulmonary diseases and disorders with apelin |
| UA119932C2 (uk) * | 2015-05-20 | 2019-08-27 | Емджен Інк. | Триазолові агоністи рецептора apj |
| SI3303330T1 (sl) | 2015-06-03 | 2019-08-30 | Bristol-Myers Squibb Company | Agonisti 4-hidroksi-3-(heteroaril)piridin-2-on apj za uporabo pri zdravljenju kardiovaskularnih motenj |
| EP3115826A1 (de) | 2015-07-06 | 2017-01-11 | Trumpf Laser Marking Systems AG | Vorrichtung zur ablenkung eines laserstrahls |
| WO2017010058A1 (ja) | 2015-07-14 | 2017-01-19 | パナソニックIpマネジメント株式会社 | 識別媒体認識装置および識別媒体認識方法 |
| AU2016340264B2 (en) | 2015-10-14 | 2021-01-07 | Bristol-Myers Squibb Company | 2,4-dihydroxy-nicotinamides as APJ agonists |
| EP3380970B1 (en) | 2015-11-24 | 2023-01-04 | Sanford Burnham Prebys Medical Discovery Institute | Novel azole derivatives as apelin receptor agonist |
| CA3007280A1 (en) | 2015-12-04 | 2017-06-08 | Bristol-Myers Squibb Company | Apelin receptor agonists and methods of use |
| CN108602806B (zh) | 2015-12-09 | 2022-07-12 | 研究三角协会 | 改进的爱帕琳肽受体(apj)激动剂及其用途 |
| US9988369B2 (en) * | 2016-05-03 | 2018-06-05 | Amgen Inc. | Heterocyclic triazole compounds as agonists of the APJ receptor |
-
2016
- 2016-05-18 UA UAA201712492A patent/UA119932C2/uk unknown
- 2016-05-18 AU AU2016263564A patent/AU2016263564B2/en active Active
- 2016-05-18 EP EP16730076.3A patent/EP3300500B9/en active Active
- 2016-05-18 WO PCT/US2016/033088 patent/WO2016187308A1/en active Application Filing
- 2016-05-18 ES ES16730076T patent/ES2791315T3/es active Active
- 2016-05-18 MY MYPI2017001685A patent/MY193818A/en unknown
- 2016-05-18 KR KR1020177036341A patent/KR102653667B1/ko active IP Right Grant
- 2016-05-18 SI SI201630732T patent/SI3300500T1/sl unknown
- 2016-05-18 ME MEP-2020-106A patent/ME03733B/me unknown
- 2016-05-18 JP JP2017560170A patent/JP6356364B1/ja active Active
- 2016-05-18 LT LTEP16730076.3T patent/LT3300500T/lt unknown
- 2016-05-18 HU HUE16730076A patent/HUE050317T2/hu unknown
- 2016-05-18 CN CN201680043275.0A patent/CN108137545B/zh active Active
- 2016-05-18 MX MX2017014818A patent/MX2017014818A/es unknown
- 2016-05-18 PL PL16730076T patent/PL3300500T3/pl unknown
- 2016-05-18 US US15/158,174 patent/US9573936B2/en active Active
- 2016-05-18 BR BR112017024618-0A patent/BR112017024618B1/pt active IP Right Grant
- 2016-05-18 PT PT167300763T patent/PT3300500T/pt unknown
- 2016-05-18 EA EA201792536A patent/EA034776B1/ru not_active IP Right Cessation
- 2016-05-18 TN TNP/2017/000483A patent/TN2017000483A1/en unknown
- 2016-05-18 NZ NZ737004A patent/NZ737004A/en unknown
- 2016-05-18 MA MA42145A patent/MA42145B1/fr unknown
- 2016-05-18 DK DK16730076.3T patent/DK3300500T3/da active
- 2016-05-18 RS RS20200613A patent/RS60353B1/sr unknown
- 2016-05-18 CA CA2985542A patent/CA2985542C/en active Active
- 2016-05-18 PE PE2017002442A patent/PE20180529A1/es unknown
- 2016-05-19 JO JOP/2016/0096A patent/JO3653B1/ar active
- 2016-05-20 AR ARP160101478A patent/AR104716A1/es unknown
- 2016-05-20 UY UY0001036684A patent/UY36684A/es active IP Right Grant
- 2016-05-20 JP JP2016101104A patent/JP6055150B1/ja active Active
- 2016-05-20 TW TW105115874A patent/TWI606039B/zh active
- 2016-10-19 US US15/297,272 patent/US9868721B2/en active Active
- 2016-10-19 US US15/297,487 patent/US9745286B2/en active Active
- 2016-10-19 US US15/297,940 patent/US9656997B2/en active Active
- 2016-10-20 US US15/298,686 patent/US9656998B2/en active Active
- 2016-10-20 US US15/298,434 patent/US9751864B2/en active Active
- 2016-10-20 US US15/298,748 patent/US9845310B2/en active Active
- 2016-11-30 JP JP2016232097A patent/JP6130964B2/ja active Active
-
2017
- 2017-06-21 US US15/629,567 patent/US10058550B2/en active Active
- 2017-11-06 IL IL255459A patent/IL255459A/en active IP Right Grant
- 2017-11-14 ZA ZA2017/07706A patent/ZA201707706B/en unknown
- 2017-11-17 CL CL2017002922A patent/CL2017002922A1/es unknown
- 2017-11-20 PH PH12017502107A patent/PH12017502107A1/en unknown
- 2017-12-18 CO CONC2017/0012991A patent/CO2017012991A2/es unknown
-
2018
- 2018-07-12 US US16/033,632 patent/US10221162B2/en active Active
- 2018-10-03 HK HK18112661.3A patent/HK1253366A1/zh unknown
- 2018-12-03 US US16/207,360 patent/US10344016B2/en active Active
-
2020
- 2020-04-29 HR HRP20200690TT patent/HRP20200690T1/hr unknown
- 2020-05-14 CY CY20201100442T patent/CY1123451T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2791315T3 (es) | Agonistas triazoles del receptor APJ | |
| JP2020500207A (ja) | カルパインモジュレーター及びそれらの治療上の使用 | |
| EP3083631B1 (en) | Wnt pathway modulators | |
| EA033758B1 (ru) | 1,2-замещенные циклопентаны в качестве антагонистов рецептора орексина | |
| CN118055933A (zh) | 选择性parp1抑制剂及其应用 | |
| ES2923790T3 (es) | Piperidinas halosustituidas como moduladores de receptores de orexina | |
| WO2024121779A1 (en) | Papain-like protease (plpro) inhibitors |