ES2733534T3 - Polvo de coleóptero - Google Patents
Polvo de coleóptero Download PDFInfo
- Publication number
- ES2733534T3 ES2733534T3 ES15830828T ES15830828T ES2733534T3 ES 2733534 T3 ES2733534 T3 ES 2733534T3 ES 15830828 T ES15830828 T ES 15830828T ES 15830828 T ES15830828 T ES 15830828T ES 2733534 T3 ES2733534 T3 ES 2733534T3
- Authority
- ES
- Spain
- Prior art keywords
- weight
- press cake
- beetle
- beetles
- press
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 241000254173 Coleoptera Species 0.000 title claims description 126
- 239000000428 dust Substances 0.000 title description 21
- 239000000843 powder Substances 0.000 claims abstract description 78
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 51
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 51
- 229920002101 Chitin Polymers 0.000 claims abstract description 20
- 238000000034 method Methods 0.000 claims description 62
- 238000003825 pressing Methods 0.000 claims description 35
- 238000000227 grinding Methods 0.000 claims description 19
- 235000019621 digestibility Nutrition 0.000 claims description 17
- 239000002245 particle Substances 0.000 claims description 16
- 238000001035 drying Methods 0.000 claims description 10
- 239000002956 ash Substances 0.000 claims description 9
- 235000012054 meals Nutrition 0.000 claims description 3
- 235000002918 Fraxinus excelsior Nutrition 0.000 claims description 2
- 235000019728 animal nutrition Nutrition 0.000 claims description 2
- 235000018102 proteins Nutrition 0.000 description 44
- 235000005911 diet Nutrition 0.000 description 35
- 230000037213 diet Effects 0.000 description 35
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 34
- 241000251468 Actinopterygii Species 0.000 description 30
- 241000238631 Hexapoda Species 0.000 description 26
- 239000000203 mixture Substances 0.000 description 22
- 235000013305 food Nutrition 0.000 description 19
- 238000004458 analytical method Methods 0.000 description 18
- 235000019750 Crude protein Nutrition 0.000 description 13
- 235000019733 Fish meal Nutrition 0.000 description 13
- 239000004467 fishmeal Substances 0.000 description 13
- 235000013312 flour Nutrition 0.000 description 12
- 238000011282 treatment Methods 0.000 description 12
- 230000037396 body weight Effects 0.000 description 11
- 238000002360 preparation method Methods 0.000 description 11
- 239000003921 oil Substances 0.000 description 10
- 241000254109 Tenebrio molitor Species 0.000 description 9
- 230000033228 biological regulation Effects 0.000 description 9
- 235000015097 nutrients Nutrition 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 8
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 239000003925 fat Substances 0.000 description 8
- 150000002632 lipids Chemical class 0.000 description 8
- 230000014759 maintenance of location Effects 0.000 description 8
- 229910052698 phosphorus Inorganic materials 0.000 description 8
- 239000011574 phosphorus Substances 0.000 description 8
- 241000277275 Oncorhynchus mykiss Species 0.000 description 7
- 241000277331 Salmonidae Species 0.000 description 7
- 238000009360 aquaculture Methods 0.000 description 7
- 244000144974 aquaculture Species 0.000 description 7
- 238000009835 boiling Methods 0.000 description 7
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 150000001413 amino acids Chemical class 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- 238000006460 hydrolysis reaction Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 102000057297 Pepsin A Human genes 0.000 description 4
- 108090000284 Pepsin A Proteins 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 210000003608 fece Anatomy 0.000 description 4
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 229940111202 pepsin Drugs 0.000 description 4
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 241000698776 Duma Species 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000002485 combustion reaction Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 238000001125 extrusion Methods 0.000 description 3
- 238000004817 gas chromatography Methods 0.000 description 3
- 238000007731 hot pressing Methods 0.000 description 3
- 230000000366 juvenile effect Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000003801 milling Methods 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 238000001542 size-exclusion chromatography Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000238366 Cephalopoda Species 0.000 description 2
- 241000238424 Crustacea Species 0.000 description 2
- 241000239366 Euphausiacea Species 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- 108010068370 Glutens Proteins 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 2
- 241000607142 Salmonella Species 0.000 description 2
- 238000000540 analysis of variance Methods 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000009395 breeding Methods 0.000 description 2
- 230000001488 breeding effect Effects 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 235000013330 chicken meat Nutrition 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 235000012631 food intake Nutrition 0.000 description 2
- 230000037406 food intake Effects 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 235000021312 gluten Nutrition 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 238000009616 inductively coupled plasma Methods 0.000 description 2
- 238000003760 magnetic stirring Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 235000021049 nutrient content Nutrition 0.000 description 2
- SIWVEOZUMHYXCS-UHFFFAOYSA-N oxo(oxoyttriooxy)yttrium Chemical compound O=[Y]O[Y]=O SIWVEOZUMHYXCS-UHFFFAOYSA-N 0.000 description 2
- 235000019629 palatability Nutrition 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000003307 slaughter Methods 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 235000021195 test diet Nutrition 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- 230000004584 weight gain Effects 0.000 description 2
- 235000019786 weight gain Nutrition 0.000 description 2
- 208000035404 Autolysis Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000501044 Buprestidae Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000131329 Carabidae Species 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 241001481710 Cerambycidae Species 0.000 description 1
- 241000254068 Cetoniinae Species 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 241000255749 Coccinellidae Species 0.000 description 1
- 241000938605 Crocodylia Species 0.000 description 1
- 241000131287 Dermestidae Species 0.000 description 1
- 241001534137 Dryophthorinae Species 0.000 description 1
- 241000305071 Enterobacterales Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 206010065042 Immune reconstitution inflammatory syndrome Diseases 0.000 description 1
- 241000500891 Insecta Species 0.000 description 1
- 238000007696 Kjeldahl method Methods 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000254043 Melolonthinae Species 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical group CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 241001078693 Rhynchophorus ferrugineus Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000282849 Ruminantia Species 0.000 description 1
- 235000019764 Soybean Meal Nutrition 0.000 description 1
- 108010073771 Soybean Proteins Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241001124191 Tenebrio obscurus Species 0.000 description 1
- 241000254107 Tenebrionidae Species 0.000 description 1
- 241000254113 Tribolium castaneum Species 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- 241000255737 Zophobas atratus Species 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 235000021120 animal protein Nutrition 0.000 description 1
- 230000000433 anti-nutritional effect Effects 0.000 description 1
- MSWZFWKMSRAUBD-QZABAPFNSA-N beta-D-glucosamine Chemical group N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-QZABAPFNSA-N 0.000 description 1
- YYRMJZQKEFZXMX-UHFFFAOYSA-L calcium bis(dihydrogenphosphate) Chemical compound [Ca+2].OP(O)([O-])=O.OP(O)([O-])=O YYRMJZQKEFZXMX-UHFFFAOYSA-L 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 231100000517 death Toxicity 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 235000021050 feed intake Nutrition 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000011152 fibreglass Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 239000013505 freshwater Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 238000001033 granulometry Methods 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000002354 inductively-coupled plasma atomic emission spectroscopy Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 229910000150 monocalcium phosphate Inorganic materials 0.000 description 1
- 235000019691 monocalcium phosphate Nutrition 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 235000006286 nutrient intake Nutrition 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 235000006180 nutrition needs Nutrition 0.000 description 1
- 238000011056 performance test Methods 0.000 description 1
- 239000008055 phosphate buffer solution Substances 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 238000011020 pilot scale process Methods 0.000 description 1
- 238000009372 pisciculture Methods 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 235000013594 poultry meat Nutrition 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 235000021075 protein intake Nutrition 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000036186 satiety Effects 0.000 description 1
- 235000019627 satiety Nutrition 0.000 description 1
- 230000028043 self proteolysis Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 229940001941 soy protein Drugs 0.000 description 1
- 239000004455 soybean meal Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000000528 statistical test Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 238000000357 thermal conductivity detection Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 230000002747 voluntary effect Effects 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K20/00—Accessory food factors for animal feeding-stuffs
- A23K20/10—Organic substances
- A23K20/142—Amino acids; Derivatives thereof
- A23K20/147—Polymeric derivatives, e.g. peptides or proteins
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/17—Amino acids, peptides or proteins
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K10/00—Animal feeding-stuffs
- A23K10/20—Animal feeding-stuffs from material of animal origin
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K20/00—Accessory food factors for animal feeding-stuffs
- A23K20/10—Organic substances
- A23K20/163—Sugars; Polysaccharides
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K50/00—Feeding-stuffs specially adapted for particular animals
- A23K50/80—Feeding-stuffs specially adapted for particular animals for aquatic animals, e.g. fish, crustaceans or molluscs
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L35/00—Food or foodstuffs not provided for in groups A23L5/00 – A23L33/00; Preparation or treatment thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/0006—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid
- C08B37/0024—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid beta-D-Glucans; (beta-1,3)-D-Glucans, e.g. paramylon, coriolan, sclerotan, pachyman, callose, scleroglucan, schizophyllan, laminaran, lentinan or curdlan; (beta-1,6)-D-Glucans, e.g. pustulan; (beta-1,4)-D-Glucans; (beta-1,3)(beta-1,4)-D-Glucans, e.g. lichenan; Derivatives thereof
- C08B37/0027—2-Acetamido-2-deoxy-beta-glucans; Derivatives thereof
- C08B37/003—Chitin, i.e. 2-acetamido-2-deoxy-(beta-1,4)-D-glucan or N-acetyl-beta-1,4-D-glucosamine; Chitosan, i.e. deacetylated product of chitin or (beta-1,4)-D-glucosamine; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L89/00—Compositions of proteins; Compositions of derivatives thereof
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2200/00—Function of food ingredients
- A23V2200/12—Replacer
- A23V2200/13—Protein replacer
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2250/00—Food ingredients
- A23V2250/50—Polysaccharides, gums
- A23V2250/51—Polysaccharide
- A23V2250/511—Chitin, chitosan
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2300/00—Processes
- A23V2300/31—Mechanical treatment
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Polymers & Plastics (AREA)
- Engineering & Computer Science (AREA)
- Health & Medical Sciences (AREA)
- Food Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Animal Husbandry (AREA)
- Zoology (AREA)
- Nutrition Science (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Mycology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Molecular Biology (AREA)
- Insects & Arthropods (AREA)
- Marine Sciences & Fisheries (AREA)
- Birds (AREA)
- Biochemistry (AREA)
- Materials Engineering (AREA)
- General Health & Medical Sciences (AREA)
- Physiology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Fodder In General (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
- Feed For Specific Animals (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
Polvo de coleóptero que comprende al menos el 67 % en peso de proteínas y al menos el 5 % en peso de quitina, los porcentajes en peso se dan en relación con el peso total de polvo de coleóptero.
Description
DESCRIPCIÓN
Polvo de coleóptero
La presente invención se refiere a un insecto en polvo. También se refiere a un método para la preparación de este polvo y su uso en el consumo humano o animal, y más en particular en piensos para peces.
La acuicultura es ahora uno de los sectores más dinámicos en la industria alimentaria. La alta demanda de peces ha dado como resultado un aumento significativo en el precio de los piensos destinados a la cría de peces.
Uno de los productos más utilizados en la alimentación de peces es la harina de pescado. La harina de pescado es una de las principales fuentes de proteínas en los alimentos para acuicultura. Es una harina muy rica en proteínas animales (ricas en aminoácidos de tipo lisina y metionina) que son fáciles de digerir. Una demanda creciente acompañada por una oferta limitada ha resultado en un aumento significativo en su precio, creando un riesgo para el crecimiento sostenible de la acuicultura. Por lo tanto, existe una gran demanda de fuentes alternativas de proteínas de alta calidad y, en la medida de lo posible, renovables para la acuicultura.
Las harinas para insectos ofrecen fuentes de proteínas de reemplazo natural y la posibilidad de ser producidas en masa con una huella ecológica mínima. En particular, ciertos coleópteros, como el Tenebrio molitor, tienen la ventaja de ser adecuados para la producción en masa intensiva.
Sin embargo, los resultados de las pruebas de sustitución de harina de pescado por varias harinas de insectos han sido dispares. En caso de que la sustitución sea posible, generalmente no excede el 50 %; más allá de este contenido se observan efectos perjudiciales para el crecimiento de los peces.
El documento XP002757230; "Des insectes dans la farine", JDD París, 19-12-2012, página 1, se refiere al posible uso de harina de insectos como las harinas de Tenebrio molitor, que es un coleóptero, en la industria alimentaria. El trabajo de los inventores ha hecho posible demostrar que un polvo de insecto específico podría usarse ventajosamente para reemplazar una harina de pescado en la alimentación acuícola.
Por lo tanto, la presente invención se refiere a un polvo de coleópteros que comprende al menos un 67 % en peso de proteínas y al menos un 5 % en peso de quitina, dándose los porcentajes en peso con respecto al peso total de polvo de coleóptero.
Se observará que en el contexto de la presente solicitud, y a menos que se estipule lo contrario, se entiende que los rangos de valores indicados son inclusivos.
Por "polvo de coleóptero" se entiende una composición, en forma de partículas, preparada únicamente a partir de coleópteros y, opcionalmente, agua.
El contenido de humedad residual del polvo de coleóptero está comprendido entre el 2 y el 15 %, preferiblemente entre el 5 y el 10 %, más preferiblemente entre el 4 y el 8 %. Este contenido de humedad puede determinarse, por ejemplo, de acuerdo con el método del Reglamento 152/2009 de la CE de 27 de enero de 2009 (103 °C/4 h).
A lo largo de la solicitud, cuando no se especifica una fecha para un reglamento, una norma o una directiva, se refiere a la regulación, norma o directiva vigente en la fecha de presentación.
Cuando el polvo de coleóptero se muele a un tamaño de partícula aceptable para el consumo humano o animal, este último se puede denominar "harina de coleópteros". Por "tamaño de partícula aceptable para el consumo humano o animal" se entiende un tamaño de partícula comprendido entre 100 |jm y 1,5 mm, preferiblemente comprendido entre 300 jm y 1 mm, más preferiblemente entre 500 y 800 jm.
Preferiblemente, los coleópteros preferidos de acuerdo con la invención pertenecen a las familias de Tenebrionidae, Melolonthidae, Dermestidae, Coccinellidae, Cerambycidae, Carabidae, Buprestidae, Cetoniidae, Dryophthoridae, o sus mezclas.
Más preferiblemente, son los siguientes coleópteros: Tenebrio molitor, Aiphitobius diaperinus, Zophobas morio, Tenebrio obscurus, Tribolium castaneum y Rhynchophorus ferrugineus, o sus mezclas.
Por "proteínas", se entiende la cantidad de proteínas brutas. La cuantificación de proteínas brutas es bien conocida por los expertos en la materia. A modo de ejemplo, se puede mencionar el método Dumas o el método Kjeldahl. Preferiblemente, se utiliza el método Dumas, correspondiente a la norma NF EN ISO 16634-1 (2008).
Preferiblemente, el polvo de coleóptero comprende un 68 % en peso de proteínas brutas, más preferiblemente un 70 % en peso de proteínas brutas, dándose los porcentajes en peso con respecto al peso total de polvo de
coleóptero.
De acuerdo con la invención, por "quitina" se entiende cualquier tipo de derivado de quitina, es decir, cualquier tipo de derivado de polisacárido que comprende unidades de N-acetil-glucosamina y unidades de D-glucosamina, en particular los copolímeros de quitina-polipéptido (a veces denominados "compuesto de quitina-polipéptido"). Estos copolímeros también pueden combinarse con pigmentos, a menudo del tipo melanina.
La quitina sería el segundo polímero más sintetizado en el mundo vivo después de la celulosa. De hecho, la quitina es sintetizada por numerosas especies del mundo vivo: constituye parte del exoesqueleto de los crustáceos e insectos y de la pared lateral que rodea y protege a los hongos. Más en particular, en insectos, la quitina constituye así del 3 al 60 % de su exoesqueleto.
El contenido de quitina se determina por extracción de la misma. Dicho método puede ser el método AOAC 991.43 descrito en el Ejemplo 2, y es un método preferido para esta determinación.
Preferiblemente, el polvo comprende entre el 5 y el 16 % en peso de quitina, más preferiblemente entre el 8 y el 14 % de quitina, dándose los porcentajes en peso con respecto al peso total de polvo de coleóptero.
El polvo de coleóptero de acuerdo con la invención comprende un alto contenido de proteínas brutas. Dicho contenido generalmente se obtiene solo por un método de tratamiento de coleópteros que comprende una etapa de hidrólisis. Sin embargo, una etapa de hidrólisis tiene el efecto de reducir el contenido de quitina a un nivel del orden del 5 % en peso, tal como menos del 5 % en peso, con respecto al peso total de la composición.
Sin embargo, la quitina a menudo se considera como un tipo de factor antinutricional porque es difícil de digerir. Esto explica por qué para las aplicaciones en el sector agroalimentario, las composiciones a base de insectos se desquitinizan, es decir, se lleva a cabo una etapa para eliminar la quitina. El trabajo de los inventores también permitió demostrar que, contrariamente a la creencia popular, la quitina no tuvo impacto en el crecimiento de peces alimentados con un polvo de coleóptero de acuerdo con la invención que comprende un contenido significativo de quitina (ver el Ejemplo 4 a continuación). Por el contrario, el polvo de coleóptero de acuerdo con la invención puede reemplazar ventajosamente no solo una parte, sino toda la harina de pescado en un pienso para acuicultura. De hecho, el polvo de coleóptero de acuerdo con la invención hace posible mejorar el crecimiento de animales alimentados con este polvo.
Además, durante el proceso de fabricación de alimentos, la introducción del polvo de coleóptero de acuerdo con la invención también tiene ciertas ventajas: reducir las pérdidas de vitaminas solubles en agua durante los tratamientos térmicos opcionales y reducir la energía requerida durante una etapa de extrusión opcional.
Ventajosamente, el polvo de coleóptero de acuerdo con la invención tiene un contenido de ceniza inferior o igual al 4 % en peso con respecto al peso total del polvo de coleóptero, e incluso más ventajosamente inferior o igual al 3,5 %.
La ceniza constituye el residuo resultante de la combustión de la composición de acuerdo con la invención.
El método para determinar el contenido de cenizas es bien conocido por los expertos en la materia. Preferiblemente, el contenido de cenizas se determinó de acuerdo con el método establecido por el reglamento 152/2009 de la CE de 27 de enero de 2009.
El contenido de grasa del polvo de coleóptero de acuerdo con la invención está comprendido preferiblemente entre el 5 y el 20 % en peso con respecto al peso total de polvo de coleóptero, más preferiblemente entre el 9 y el 17 %. Los métodos para determinar el contenido de grasa son bien conocidos por los expertos en la materia. A modo de ejemplo y de manera preferida, este contenido se determinará de acuerdo con el método del reglamento 152/2009 de la CE.
Ventajosamente, las proteínas del polvo de coleóptero de acuerdo con la invención tienen una digestibilidad mayor o igual al 85 % en peso con respecto al peso total de proteínas brutas.
La digestibilidad es una digestibilidad de pepsina medida por el método descrito en la Directiva 72/199/CE.
Preferiblemente, la digestibilidad es mayor o igual al 86 %, más preferiblemente mayor o igual al 88 %.
Ventajosamente, el polvo de coleóptero de acuerdo con la invención comprende entre el 35 y el 65 % en peso de proteínas solubles con respecto al peso total de proteínas, y al menos el 50 % de las proteínas solubles tienen un tamaño inferior o igual a 12.400 g/mol.
Por "peso total de proteínas" se entiende el peso de proteínas brutas presentes en el polvo de coleóptero de
acuerdo con la invención.
Por "proteínas solubles" se entiende, entre las proteínas brutas, aquellas que son solubles en una solución acuosa cuyo pH está comprendido entre 6 y 8, ventajosamente entre 7,2 y 7,6.
Preferiblemente, la solución acuosa es una solución tampón cuyo pH está comprendido entre 6 y 8, ventajosamente entre 7,2 y 7,6. Preferiblemente, la solución tampón es una solución tampón de fosfato de NaCl, cuyo pH es igual a 7,4 ± 0,2.
La digestibilidad de las proteínas en seres humanos y animales está muy determinada por el tamaño de las proteínas. En el consumo animal, es común reducir el tamaño de las proteínas para facilitar la digestión de los animales. Esta reducción en el tamaño de las proteínas generalmente se lleva a cabo mediante procesos de hidrólisis (por ejemplo, enzimáticos), cuya implementación es particularmente costosa.
El polvo de coleóptero de acuerdo con la invención, obtenido mediante un método que no implica hidrólisis, comprende una gran cantidad de proteínas solubles cuyo tamaño se reduce suficientemente para facilitar la digestión de los animales. El polvo de coleóptero de acuerdo con la invención también tiene la ventaja de poder prepararse a un menor coste.
Ventajosamente, el polvo de coleóptero de acuerdo con la invención comprende entre el 38 y el 60 % en peso, preferiblemente entre el 43 y el 55 % en peso de proteínas solubles con respecto al peso total de proteínas.
Preferiblemente, al menos el 60 %, preferiblemente al menos el 70 % de las proteínas solubles tienen un tamaño inferior o igual a 12.400 g/mol.
Más en particular, las proteínas solubles tienen un tamaño comprendido entre 6500 y 12.400 g/mol.
Ventajosamente, menos del 10 %, preferiblemente menos del 8 %, más preferiblemente menos del 6 % de proteínas solubles tienen un tamaño mayor o igual a 29.000 g/mol.
A modo de ejemplo, el análisis por cromatografía de exclusión por tamaños de las proteínas solubles de un polvo de coleóptero de acuerdo con la invención se presenta en el Ejemplo 6.
La invención también describe un método para la preparación de un polvo de coleóptero de acuerdo con la invención.
El método para la preparación del polvo de coleóptero de acuerdo con la invención comprende una etapa de prensado de los coleópteros.
El objetivo del prensado es desaceitar los coleópteros y así obtener una torta de prensa con un contenido de aceite (o grasa) inferior o igual al 20 % en peso con respecto al peso seco de la torta de prensa, preferiblemente inferior o igual al 17 %.
La etapa de prensado se describe más detalladamente en la etapa 2 del método de preparación detallado a continuación.
En particular, es posible realizar prensado en caliente o en frío. Preferiblemente, se utiliza una prensa de un solo tornillo.
Más en particular, el método de preparación de acuerdo con la invención comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa, y
iii) moler la torta de prensa.
Los coleópteros pueden matarse mediante ebullición o escaldado, como se describe más detalladamente a continuación en la etapa 1 del método detallado.
De manera similar, la molienda se describe más detalladamente en la etapa 4 del método detallado.
Finalmente, el método de preparación de acuerdo con la invención también puede comprender una etapa de secado de la torta de prensa.
La etapa de secado se lleva a cabo ventajosamente después de la etapa de prensado y antes de la etapa de molienda.
El secado se describe más detalladamente en la etapa 3 del método detallado.
Método detallado para la preparación del polvo de coleóptero de acuerdo con la invención
Etapa 1: Matar los insectos
Esta etapa 1 de sacrificio puede llevarse a cabo ventajosamente mediante ebullición o escaldado. Esta etapa 1 hace posible matar los insectos mientras reduce la carga microbiana (reduciendo el riesgo de deterioro y riesgo para la salud) y desactivando las enzimas internas de los insectos que pueden provocar la autolisis, y por lo tanto un rápido oscurecimiento de los mismos.
Para la ebullición, los insectos, preferiblemente las larvas, se bullen con agua durante 2 a 20 min, preferiblemente de 5 a 15 min. Preferiblemente, el agua está a una temperatura comprendida entre 95 y 100 °C, preferiblemente a 100 °C.
La cantidad de agua introducida durante la ebullición se determina de la siguiente manera: la relación del volumen de agua en ml al peso en g de insecto está comprendida preferiblemente entre 0,3 y 10, más preferiblemente entre 0,5 y 5, incluso más preferiblemente entre 0,7 y 3, incluso más preferentemente es del orden de 1.
Para el escaldado, los insectos, preferiblemente las larvas, se escaldan con vapor (boquillas o lecho de vapor) a una temperatura comprendida entre 80 y 130°C, preferiblemente entre 90 y 120 °C, más preferiblemente entre 95 y 105 °C, incluso más preferiblemente a 98 °C o con agua a una temperatura comprendida entre 95 y 100 °C, preferiblemente a 100 °C (mediante boquillas de aspersión) o en modo mixto (agua vapor) a una temperatura comprendida entre 80 y 130 °C, preferiblemente entre 90 y 120 °C, más preferiblemente entre 95 y 105 °C, incluso más preferiblemente a 98 °C. El tiempo de residencia en la cámara de escaldado está comprendido entre 1 y 15 minutos, preferiblemente entre 3 y 7 min.
• Etapa (opcional): Molienda
Los insectos se retiran del tanque de ebullición o de la cámara de escaldado, a continuación se tamizan (o escurren) y se ponen en un molinillo, como un molino de cuchillos, lo que hace posible reducir los insectos a partículas.
Para facilitar la molienda, se puede añadir una cantidad de agua. Esta cantidad de agua es similar a la introducida durante la etapa de ebullición 1: la relación del volumen de agua en ml al peso en g de insecto está comprendida preferiblemente entre 0,3 y 10, más preferiblemente entre 0,5 y 5, incluso más preferiblemente entre 0,7 y 3, incluso más preferiblemente es del orden de 1. También es posible mantener el agua hirviendo y/o el agua resultante del escaldado para llevar a cabo esta etapa.
Preferiblemente, al finalizar la molienda, el tamaño de las partículas de insecto es inferior a 1 cm (el mayor tamaño de partícula observable usando un microscopio), preferiblemente inferior a 0,5 cm. Preferiblemente, el tamaño de las partículas está comprendido entre 300 |jm y 3 mm, más preferiblemente entre 500 |jm y 1 mm. No es necesario reducir excesivamente el tamaño de las partículas, por ejemplo a un tamaño inferior a 250 jm.
• Etapa 2: Prensado
Los insectos que se obtienen en la etapa 1 de sacrificio, o la torta húmeda que se obtiene en la etapa de molienda opcional, se ponen en una prensa de acuerdo con un procedimiento que permite prensar y separar un jugo que comprende tanto una fracción grasa como una fracción proteica.
Preferiblemente, la etapa de prensado hace posible obtener una torta de prensa que comprende un contenido de aceite inferior o igual al 20 % en peso con respecto al peso seco de la torta de prensa, preferiblemente, inferior o igual al 17 %, más preferiblemente inferior a o igual al 15 %.
De manera similar, la etapa de prensado hace posible obtener una torta de prensa que tiene un contenido de materia seca comprendido entre el 30 % y el 60 %, preferiblemente comprendido entre el 40 % y el 55 %, y más preferiblemente comprendido entre el 45 % y el 55 %.
Se puede utilizar cualquier sistema de prensado para llevar a cabo la etapa de prensado, como, por ejemplo, una prensa de un solo tornillo o de dos tornillos (prensa de dos tornillos de tipo Angel), una prensa de filtro (filtro de prensa de tipo Choquenet), una prensa de platina, etc. Estos sistemas son bien conocidos por un experto en la materia que puede determinar las condiciones de presión para obtener los contenidos de aceite y/o agua mencionados anteriormente.
En particular, es posible realizar el prensado en caliente o en frío. Ventajosamente, el prensado se realizará en caliente, lo que hace posible aumentar la eliminación de aceite de la torta de prensado. En particular, el prensado en caliente hace posible obtener una torta de prensa que comprende un contenido de aceite inferior o igual al 17 % en
peso con respecto al peso seco de la torta de prensa, preferiblemente inferior o igual al 15 %.
• Etapa 3: Secado
La torta de prensa se seca a continuación mediante las tecnologías convencionales conocidas por un experto en la materia. El secado puede ser directo o indirecto (secador de capa fina, "secador de paletas", "secador de tubos", "secador de discos", etc.) a una temperatura comprendida entre 60 °C y 260 °C, durante un período de 15 min a 24 h. A modo de ejemplo, la torta de prensa puede disponerse y secarse en aire ventilado/agitado a una temperatura comprendida entre 80 y 100 °C, preferiblemente a 90 °C durante un tiempo comprendido entre 3 y 7 horas, preferiblemente 5 horas.
El objetivo de esta etapa de secado es obtener una torta de prensa con un contenido de humedad comprendido entre el 2 y el 15 %, preferiblemente entre el 5 y el 10 %, incluso más preferiblemente entre el 4 y el 8 %.
• Etapa 4: Molienda final
La torta de prensa seca se pone a continuación en un molino, como un molino de martillos, lo que hace posible reducir la torta de prensa a partículas.
Ventajosamente, al completar esta molienda final, el tamaño de las partículas de insecto es inferior a 0,5 cm (el mayor tamaño de partícula observable usando un microscopio), preferiblemente del orden de 1 mm. Más en particular, el tamaño de partícula está comprendido entre 300 |jm y 1 mm, incluso más preferiblemente entre 500 y 800 jm.
La sucesión de estas cuatro etapas hace posible obtener un polvo de coleóptero de acuerdo con la invención, que comprende un alto contenido de proteínas brutas mientras se mantiene un contenido de quitina del orden de al menos 5 % en peso con respecto al peso total de la composición.
Como se ha indicado anteriormente, la etapa de prensado se puede realizar en frío o en caliente.
A modo de ejemplo de un método para obtener el polvo de coleóptero de acuerdo con la invención, que implica un prensado en frío:
Las larvas, por ejemplo de T. molitor, se introducen en un vaso de precipitados que contiene 200 ml de agua que se lleva a ebullición de antemano, y se matan escaldándolas en un baño de agua a 100 °C. Las larvas se escurren y a continuación se mezclan con un volumen de agua de 200 ml. El líquido así obtenido se pasa a una prensa de doble tornillo. La torta de prensa así obtenida se seca durante 24 horas en un horno a 70 °C, a continuación se muele a 250 |jm.
A modo de ejemplo de un método para obtener el polvo de coleóptero de acuerdo con la invención, que implica el prensado en caliente:
Las larvas, por ejemplo de T. molitor, se introducen en una cámara de escaldado y se escaldan en vapor durante 5 minutos a 100 °C. Las larvas así escaldadas se introducen a continuación en una prensa de tipo "secado" adecuada para productos cargados de agua. La torta de prensa así obtenida se seca durante 5 horas en un horno a 90 °C, y a continuación se muele en un molino de martillos a 1 mm.
Preferiblemente, el método para la preparación de un polvo de coleóptero de acuerdo con la invención comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa.
De acuerdo con una primera realización del método de acuerdo con la invención, la etapa de prensado está precedida por una etapa de molienda de los coleópteros.
La invención se refiere así a un método para la preparación de un polvo de coleóptero de acuerdo con la invención que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa,
en la que la etapa de prensado está precedida por una etapa de molienda de los coleópteros.
Una ventaja de la etapa de molienda de los coleópteros antes del prensado se describe más detalladamente en el Ejemplo 5.
De acuerdo con una segunda realización del método de acuerdo con la invención, la etapa de prensado de los coleópteros se lleva a cabo en caliente.
La invención se refiere así a un método para la preparación de un polvo de coleóptero de acuerdo con la invención que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa,
en la que la etapa de prensado se realiza en caliente.
Como se ha indicado anteriormente, el prensado en caliente hace posible obtener una torta de prensa que comprende un contenido de aceite inferior o igual al 17 % en peso con respecto al peso seco de la torta de prensa, preferiblemente inferior o igual al 15 %.
De acuerdo con una tercera realización del método de acuerdo con la invención, la etapa de molienda de la torta de prensa se lleva a cabo hasta un tamaño de partícula comprendido entre 300 |jm y 1 mm, preferiblemente entre 500 y 800 jm.
La invención se refiere así a un método para la preparación de un polvo de coleóptero de acuerdo con la invención que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa,
en la que la etapa de molienda de la torta de prensa se lleva a cabo hasta un tamaño de partícula comprendido entre 300 jm y 1 mm.
Más en particular, en esta tercera realización del método de acuerdo con la invención, la etapa de prensado de los coleópteros puede llevarse a cabo en caliente. Alternativamente, la etapa de prensado puede ir precedida por una etapa de molienda de los coleópteros.
La invención finalmente se refiere al uso del polvo de coleóptero de acuerdo con la invención en nutrición humana o animal.
Ventajosamente, el polvo de coleóptero de acuerdo con la invención se puede usar en alimentos para mascotas tales como perros, gatos, aves, peces, reptiles y roedores.
Más en particular, el polvo de coleóptero de acuerdo con la invención se puede usar en acuicultura (peces, crustáceos), piensos para aves de corral (pollos), cerdos, rumiantes (vacas, ovejas, cabras, caballos) y visones. Finalmente, el polvo de coleóptero de acuerdo con la invención se puede usar ventajosamente para reemplazar la harina de proteína.
Por harina de proteína se entiende, más en particular, una harina de pescado, leche en polvo o lactoserum en polvo, harina de soja concentrada ("CSP"), harina de carne, como por ejemplo harina de pollo.
El reemplazo puede ser parcial o total.
Preferiblemente, el polvo de coleóptero de acuerdo con la invención se usa para el reemplazo parcial o total de una harina de pescado, tal como un reemplazo del 50 o el 100 %.
Otras características y ventajas de la invención se harán evidentes a partir de los siguientes ejemplos, dados a modo de ilustración, con referencia a:
- la Fig. 1, que es un diagrama que ilustra las variaciones en las temperaturas del agua y los niveles de oxígeno disuelto en los tanques donde se criaron truchas alimentadas con diferentes dosis de polvo de coleóptero de acuerdo con la invención,
- la Fig. 2, que comprende dos diagramas que ilustran el impacto en el peso corporal final (Fig. 2A) y el índice de
consumo (Fig. 2B) de truchas alimentadas con diferentes dosis de polvo de coleóptero de acuerdo con la invención,
- la Fig. 3, que ilustra la distribución de los lípidos que se obtienen del insecto que se encuentra en el jugo y la torta de prensa obtenida por un método que comprende una etapa de prensado o una etapa de molienda y a continuación prensado,
- la Fig. 4, que es un diagrama que representa el análisis por cromatografía de exclusión por tamaños de las proteínas del polvo de coleóptero de acuerdo con la invención.
Ejemplo 1: Método para la preparación de un polvo de coleóptero de acuerdo con la invención
Los coleópteros utilizados para preparar el polvo de coleóptero son larvas de Tenebrio molitor. Al recibir las larvas, pueden almacenarse a 4 °C durante 0 a 15 días en sus tanques de cría sin mayor degradación antes de ser sacrificadas. El peso (edad) de las larvas utilizadas es variable y, como resultado, su composición puede variar, como se ilustra en la Tabla 1 a continuación:
• Etapa 1: Escaldado de los insectos
Las larvas vivas (+4 °C a 25 °C) se transportan en capas con un espesor comprendido entre 2 y 10 cm, en una cinta transportadora perforada (1 mm) a una cámara de escaldado. De este modo, los insectos se escaldan en vapor (boquillas o lecho de vapor) a 98 °C o en agua a 100 °C (boquillas de pulverización) o en modo mixto (agua vapor). El tiempo de residencia en la cámara de escaldado está comprendido entre 1 y 15 minutos, idealmente 5 min.
La temperatura de las larvas después del escaldado está comprendida entre 75 °C y 98 °C.
• Etapa 2: Prensado
Las larvas, una vez escaldadas, se transportan a la tolva de alimentación de una prensa continua de un solo tornillo. Mientras pasan a la prensa, las larvas se mantienen a una temperatura superior a 70 °C para aumentar los rendimientos de eliminación de aceite. El principio de la eliminación de aceite es presurizar el material dentro de una jaula cilíndrica mediante una disposición de tornillos y anillos dispuestos en el eje central. La jaula está forrada en el interior con barras distribuidas en secciones y separadas por espacios de diferentes espesores según el área de trabajo. Los intersticios así dispuestos permiten el flujo de una fracción de aceite/grasa al tiempo que limitan el paso de la denominada materia "seca", la fracción de proteína, que se denomina "torta de prensa", participa así en el prensado.
Los rendimientos de prensado obtenidos están comprendidos entre 48 y 55 %.
Rtorta = (masatorta/masajugo + masatorta)
La torta de prensa obtenida contiene del 35 al 40 % de materia seca, del 67 al 75 % de proteínas y del 13 al 17 % de grasas, los porcentajes en peso se dan en relación con el peso seco de la torta de prensa.
• Etapa 3: Secado
La torta de prensa se pone a continuación en una bandeja en una capa delgada (aproximadamente 2 cm) y se seca en aire ventilado/agitado a 90 °C durante 5 horas para obtener una torta de prensa con un contenido de materia seca superior al 92 %.
Esta etapa permite prevenir cualquier contaminación que haya ocurrido desde el sacrificio.
La Aw (actividad de agua) después del secado es de 0,35. Los resultados microbiológicos muestran una ausencia de especies de Salmonella (método: IRIS Salmonella BKR 23/07-10/11) y valores de Enterobacterias inferiores a 10 UFC/g (método: NF ISO 2128-2, diciembre de 2004, 30 °C y 37 °C).
• Etapa 4: Molienda
La torta de prensado seca, que comprende principalmente proteínas, se muele finalmente con un molino de martillo continuo (6 partes móviles reversibles, espesor 8 mm). El molino es alimentado por una tolva con una tapa de control de caudal (180 kg/h). La parrilla perforada utilizada para controlar la granulometría de salida es de 0,8 mm. La velocidad de rotación del motor es de 3000 rpm (motorización eléctrica, potencia absorbida 4 kW (5,5 CV)). Ejemplo 2: Caracterización del polvo de coleóptero de acuerdo con la invención
Se caracterizó el polvo de coleóptero preparado en el Ejemplo 1.
1. Análisis
1.1 Determinación del contenido de humedad
El contenido de humedad se determina de acuerdo con el método que se obtiene en el Reglamento CE 152/2009 de 27 de enero de 2009 (103 °C/4 h).
1.2 Determinación de la cantidad de proteínas brutas
Las proteínas brutas se determinan de acuerdo con el método denominado de Dumas y corresponden a la norma NF EN ISO 16634-1 (2008).
1.3 Determinación de la cantidad de quitina
Las fibras alimentarias en la harina de insectos están compuestas esencialmente de quitina, esta última se analizó por lo tanto de acuerdo con el método AOAC 991.43. Los valores así obtenidos se sobreestiman ligeramente como consecuencia.
1.4 Determinación de la cantidad de grasa
La grasa se determinó de acuerdo con el método del Reglamento CE 152/2009.
1.5 Determinación de la cantidad de ceniza
La ceniza bruta se determinó de acuerdo con el método según el Reglamento CE 152/2009 de 27 de enero de 2009.
1.6 Determinación de la cantidad de fósforo
El fósforo se analiza mediante ICP ("plasma acoplado inductivamente") con calibración interna.
1.7 Determinación de la energía
El valor energético se obtiene con los coeficientes del Reglamento 1169/2011 de la UE.
1.8 Determinación de las cantidades de aminoácidos y ácidos grasos
Esta determinación se llevó a cabo mediante cromatografía de gases después de hidrólisis y derivatización de los aminoácidos y ácidos grasos, respectivamente.
1.9 Determinación de la digestibilidad de la pepsina
La digestibilidad de la pepsina se mide mediante el método descrito en la Directiva 72/199/CE.
2. Resultados
La composición de este polvo de coleóptero se presenta en la Tabla 2 a continuación.
* Los porcentajes en peso se expresan en relación con el peso total del polvo.
Tabla 2: Composición del polvo de coleóptero
Además, se obtiene una digestibilidad de pepsina del 90 ± 2 %.
Ejemplo 3: Método alternativo para la preparación de un polvo de coleóptero de acuerdo con la invención
Se introducen 200 g de larvas de T. molitor en un vaso de precipitados, se ponen en un baño de agua a 100 °C y que contiene 200 ml de agua que se lleva previamente a ebullición. Después de 5 minutos, el vaso de precipitados se retira del baño de agua, las larvas se escurren y a continuación se mezclan con un volumen de agua de 200 ml. El líquido así obtenido se pasa a una prensa de tipo de doble tornillo. La torta de prensa así obtenida se seca durante 24 horas en un horno a 70 °C, y a continuación se muele a 250 |jm. Se obtiene así un polvo de coleóptero. Ejemplo 4: Introducción del polvo de coleóptero de acuerdo con la invención en la alimentación de peces
En el presente ejemplo, se estudió el efecto de incluir un polvo de coleóptero en la alimentación sobre el crecimiento, el aporte de alimento, la conversión alimentaria, la composición corporal y la digestibilidad aparente de los nutrientes en la trucha arco iris.
1. Material y métodos
1.1. Polvo de coleóptero
El polvo de coleóptero utilizado en este ejemplo es el que se obtiene de acuerdo con el Ejemplo 1 y se describe más detalladamente en el Ejemplo 2.
1.2. Dietas experimentales
Se formuló una dieta a base de harina de pescado (CTRL) con ingredientes convenientes para satisfacer las necesidades nutricionales conocidas de la trucha arco iris juvenil. Esta dieta CTRL está compuesta por un 25 % de harina de pescado, 8 % de otras fuentes de proteínas de origen marino (harina de calamar y harina de krill), mientras que las fuentes de proteínas restantes fueron un concentrado de proteína de soja, gluten de trigo y gluten de maíz. Sobre la base de esta formulación, se formularon cuatro dietas de prueba (Y5, Y7,5, Y15 e Y25), en las cuales la
harina de pescado se reemplazó con polvo de coleóptero en contenidos respectivos de 20, 30, 60 y 100% (ver Tabla 3 a continuación).
T l : F rm l i n m i i n i x rim n l
Los niveles de harina de calamar y de krill se mantuvieron constantes en todas las dietas para garantizar una alta palatabilidad. Se hicieron ajustes menores a la formulación de las dietas probadas para mantener las condiciones isonitrogenadas (proteína bruta, 48,5 % de MS), condiciones isolipídicas (22,7 % de MS) y condiciones isoenergéticas (energía bruta, 23,2 MJ/kg MS). Los niveles de suplementación con metionina y fosfato monocálcico en las dietas probadas se ajustaron para corresponder a los encontrados en la alimentación de CTRL.
Las dietas se produjeron por extrusión (tamaños de gránulos: 1,2 y 2,0 mm) utilizando una extrusora de doble tornillo CLEXTRAL BC45 en una escala piloto con un diámetro de tornillo de 55,5 mm y un rango de temperatura de 119 a 123 °C. Los lotes de alimentos extruidos se secaron en un secador de lecho fluidizado vibrante (modelo DR100, TGC Extrusion, Francia). Después de enfriar los gránulos, los aceites se añadieron mediante recubrimiento al vacío (modelo PG-10VCLAB, Dinnisen, Países Bajos). A lo largo de la duración de la prueba, los alimentos experimentales se almacenaron a temperatura ambiente, pero en un lugar fresco y bien ventilado. Se tomaron muestras representativas de cada dieta para su análisis (Tablas 4-5).
1.3. Prueba de rendimiento de crecimiento
Se alimentaron grupos triplicados de 35 truchas arco iris (Oncorhynchus mykiss), con un peso corporal inicial (PCI) de 5,01 ± 0,1 g con una de las cinco dietas experimentales durante 90 días. Los peces crecieron en tanques circulares de fibra de vidrio (volumen: 250 l) suministrados con un flujo continuo de agua dulce a temperaturas comprendidas entre 14,1 ± 0,3 °C y niveles de oxígeno disuelto por encima de 7,4 mg/l (véase Fig. 1). Los peces fueron sometidos a condiciones veraniegas con cambios de fotoperíodo naturales (mayo-julio). Los peces fueron alimentados a mano hasta la saciedad aparente, tres veces al día (9h00, 14h00 y 18h00) durante la semana y dos veces al día los fines de semana (10h00 y 16h00), teniendo el mayor cuidado para evitar el desperdicio de la alimentación. La alimentación distribuida se cuantificó a lo largo del estudio. Los peces anestesiados se pesaron individualmente al inicio y al final del estudio y el grupo se pesó el día 28 y el día 60. Al comienzo, se tomaron muestras de 15 peces del mismo stock inicial y se almacenaron a -20 °C para el análisis posterior de toda la composición corporal. Después de 90 días de alimentación experimental, se tomaron muestras de 6 peces de cada tanque con el mismo propósito.
1.4. Medida de digestibilidad aparente
Al final de la prueba de crecimiento y siguiendo todas las muestras asociadas, se utilizaron 12 peces (peso corporal: 45 g) de cada tanque de réplica para determinar la digestibilidad aparente de la materia seca, proteínas, lípidos, energía y fósforo, por el método indirecto con dietas idénticas que contienen óxido de itrio (200 mg/kg) como
marcador inerte. Los peces se almacenaron en tanques cilindricos (volumen: 60 l; caudal de agua: 3,7 l/min; niveles de oxígeno disuelto superiores a 6,4 mg/l), a una temperatura constante del agua de 14 °C. Los peces se adaptaron a las condiciones de cultivo y a las dietas experimentales durante 10 días. A continuación, los peces fueron alimentados a mano una vez al día (10h00) en ligero exceso. Después de la limpieza profunda de los tanques de cría para eliminar todos los residuos de alimentación, la materia fecal se recolectó diariamente durante los siguientes 8 días utilizando el sistema de filtración de agua de salida continua (sistema Choubert-INRA). Después de la recolección diaria, la materia fecal se congeló a -20 °C. La materia fecal mezclada que se obtiene en cada grupo de peces se liofilizó antes del análisis. Cada dieta fue probada por triplicado.
Los coeficientes de digestibilidad aparente (CDA) de los nutrientes y de la energía de alimentación en las dietas experimentales se calcularon de acuerdo con la fórmula:
1.5. Métodos analíticos
Los ingredientes del ensayo, las dietas y la materia fecal liofilizada se molieron antes del análisis. Las muestras de todo el cuerpo se cortaron, se mezclaron y una muestra representativa se liofilizó y homogeneizó con un molino de laboratorio antes del análisis. El análisis de la composición química del ingrediente, las dietas, la materia fecal y el pez entero se realizó mediante los siguientes procedimientos: materia seca después de secar a 105 °C durante 24 h; ceniza por combustión a 550 °C durante 12 h; proteína bruta (N * 6,25) mediante una técnica de combustión instantánea seguida de separación por cromatografía de gases y detección de conductividad térmica (LECO FP428); la grasa por extracción con diclorometano (Soxhlet); el fósforo total según el método ISO/DIS 6491 que usa reactivo vanadomolíbdico; La energía bruta en una bomba calorimétrica adiabática. El óxido de itrio en alimentos y heces se determinó mediante el método ICP-AES.
Para los análisis de los aminoácidos totales, los ingredientes de prueba y las dietas de prueba se hidrolizaron (HCl 6 M a 116 °C durante 22 h en matraces de vidrio enjuagados con nitrógeno), y a continuación se derivaron con un reactivo de flúor AccQ (6-aminoquinolil-N-hidroxisuccinimidilo) según el método Tag AccQ (Waters, EE. UU.). Los análisis se llevaron a cabo mediante cromatografía líquida de alto rendimiento (HPLC) en un sistema de análisis de aminoácidos de fase inversa, utilizando norvalina como patrón interno. El triptófano no se determinó, ya que resulta parcialmente destruido por hidrólisis ácida. Los picos resultantes se analizaron con el software EMPOWER (Waters, EE. UU.). Para el análisis de los ácidos grasos, los lípidos se extrajeron de acuerdo con el método de Folch et al. (1957) y posteriormente, se determinó la composición de ácidos grasos de los filetes mediante el análisis de los ésteres metílicos mediante cromatografía de gases, según el procedimiento de Lepage y Roy (1986).
1.6. Criterio para evaluar el crecimiento y uso de los nutrientes
PCI (g): Peso corporal inicial.
PCF (g): Peso corporal final.
Tasa de crecimiento específica, TCE (%/día): (Ln PCF - Ln PCI) * 100/días.
Índice de consumo, IC:relación alimentaria bruta/aumento de peso.
Aporte voluntario de alimento, IVA (% PC/día): (relación alimentaria bruta/(PCI PCF)/2/días) * 100.
Coeficiente de eficiencia proteica CEP: ganancia de peso húmedo/aporte de proteína bruta.
Retención (% de aporte): 100 * (PCF * contenido final de nutrientes en el cadáver - PCI * contenido inicial de nutrientes en el cadáver)/aporte de nutrientes.
1.7. Análisis estadístico
Los datos se presentan por el promedio de tres repeticiones ± la desviación típica. Los datos fueron sometidos a análisis de varianza de un factor. Antes de ANOVA, los valores expresados en % se sometieron a una transformación de raíz cuadrada de arcoseno. La significación estadística fue probada a un nivel de probabilidad de 0,05. Todas las pruebas estadísticas se realizaron con el software IBM SPSS V21.
2. Resultados
2.1. Rendimiento de crecimiento
Los datos sobre los rendimientos de crecimiento, conversión de alimento y eficiencia proteica de la trucha arco iris alimentada con dietas experimentales durante 28, 60 y 90 días se presentan en las Tablas 6-8 y la Fig. 2. No se produjeron muertes durante la prueba.
T l : R n imi n r imi n l í 2
Después de 28 días de alimentación experimental (Tabla 6), los peces han más que triplicado su peso corporal inicial. El aporte de alimento fue alto (3,22-3,31 % PCM/día) y no se vio afectado (P> 0,05) por las dosis crecientes de polvo de coleóptero incorporado. Esta observación sugiere que el polvo de coleóptero no tuvo un efecto negativo en la palatabilidad, e incluso que podría compensar la eliminación total de la harina de pescado sin comprometer el aporte de alimento. La tasa de crecimiento varió del 4,19 al 4,50 %/día. En comparación con el tratamiento con CTRL, mientras que las dietas Y5 e Y7,5 no afectaron al PCF y la TCE, las dietas Y15 e Y25 llevaron a un aumento significativo (P <0,05) en el PCF y la TCE. Los valores del índice de consumo varían entre 0,81 y 0,87. En comparación con el CTRL, la inclusión de polvo de coleóptero al 5 y al 7,5 % (dietas Y5 e Y7,5 %) no afectó al IC. Sin embargo, los altos niveles de inclusión de polvo de coleóptero (dietas Y15 e Y25) llevaron a una reducción significativa en el IC (P <0,05). El coeficiente de eficiencia proteica (CEP) varió entre 2,55 y 2,72. Los peces alimentados con una dieta Y25 mostraron un aumento significativo en el CEP, en comparación con aquellos alimentados con las dietas CTRL, Y5 e Y7,5.
T l 7: R n imi n r imi n l í
Después de 60 días de alimentación experimental (Tabla 7), los peces que se sometieron al tratamiento más efectivo mostraron un aumento de 8 veces el peso corporal inicial. El nivel de crecimiento varió del 3,00 al 3,57 %/día. En comparación con el tratamiento con CTRL, todas las dietas con el polvo de coleóptero mostraron un aumento significativo (P <0,05) en la TCE. Los valores del IC variaron entre 0,85 y 1,10 y, en comparación con el CTRL, la inclusión del polvo de coleóptero en todas las dosis probadas llevó a una reducción significativa del IC (P <0,05). El coeficiente de eficiencia proteica (CEP) varió entre 2,01 y 2,56. El valor de CEP más bajo se encontró en los peces alimentados con una dieta CTRL, mientras que una mejora en el CEP se asoció estrechamente con el aumento de las dosis del polvo de coleóptero
T l : R n imi n r imi n l í .
Al final de la prueba, 90 días de alimentación experimental (Tabla 8), los peces que se sometieron al tratamiento más efectivo mostraron un aumento de 11 veces el peso corporal inicial. En comparación con los peces CTRL, aquellos alimentados con dietas ricas en insectos mostraron un aumento significativo en el peso corporal final (P <0,05). Este aumento estuvo relacionado con la dosis, con un aumento moderado para la dieta Y5, intermedio para
Y7,5 e Y15, y más alto para Y25. La tasa de crecimiento específica (TCE) varió entre 2,39 y 2,67 %/día, con un valor mínimo encontrado en los peces alimentados con una dieta CTRL, mientras que aquellos alimentados con alimentos que contienen polvo de coleóptero mostraron valores de TCE significativamente más altos (p <0,05). Independientemente del nivel de incorporación, el polvo de coleóptero condujo a una reducción significativa en el IC (P <0,05). En comparación con el tratamiento CTRL, todas las dietas de comida de insectos llevaron a un aumento significativo en los valores de CEP (P <0.05).
2.2. Composición de todo el cuerpo.
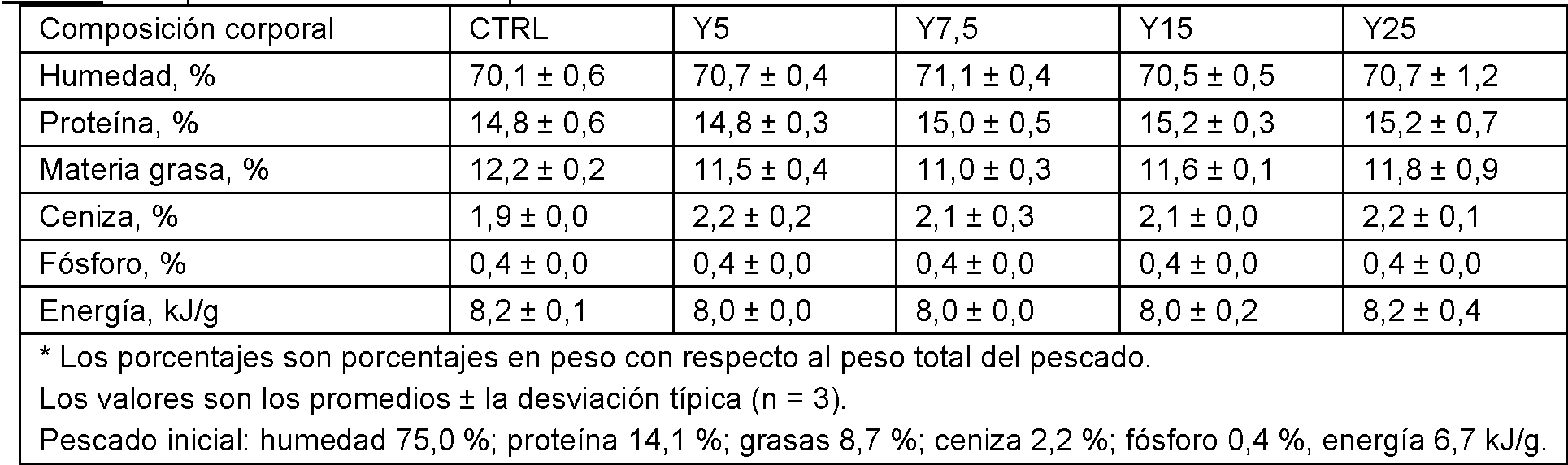
Los datos sobre la composición de todo el cuerpo de la trucha al final de la prueba se presentan en la Tabla 9. Los tratamientos de alimentación no tuvieron efecto (P> 0,05) sobre los niveles de humedad, proteínas, lípidos, cenizas, fósforo y energía del pez entero.
T l : m ii n l r l r h limn n l ivr r mi n limn ri .
2.3. Retención de nutrientes
Los valores de nutrientes y de retención de energía (expresados en porcentaje de aporte) se presentan en la Tabla 10. En comparación con el tratamiento con CTRL, los peces alimentados con dietas ricas en polvo de coleópteros mostraron un aumento significativo en proteínas y la retención de energía (P <0,05). De manera similar, las dietas Y7,5, Y15 e Y25 mostraron una retención de P significativamente mayor que la CTRL (P <0,05). La retención de grasa no se vio afectada por las dietas (P> 0,05).
Tabla 10: Nutrientes retención de enería en la trucha alimentada con los diversos tratamientos alimentarios
2.4. Digestibilidad aparente
La composición de la materia fecal recolectada de la trucha alimentada con los diversos tratamientos de alimentación se presenta en la Tabla 11.
T l 11: m ii n l m ri f l l r h lim n n l ivr r mi n limn ri .
Los coeficientes de digestibilidad aparente (% CDA) para los diferentes nutrientes y energía se presentan en la
Tabla 12. El aumento en las dosis de polvo de coleóptero incorporado no tuvo un efecto significativo (P> 0,05) sobre la digestibilidad aparente de la materia seca, proteínas, grasa, fósforo y energía.
T l 12: Di ili r n l n ri n n r í n l r h
3. Conclusión
Al final de los 90 días de alimentación experimental, el rendimiento general del crecimiento puede considerarse muy satisfactorio y en un rango más alto para la trucha arco iris juvenil, con valores de TCE para la duración total de la prueba que varía entre 2,4 y 2,7 %/día. En los tratamientos más efectivos, los peces mostraron un aumento de 11 veces su peso corporal inicial. La tasa de conversión de alimento entre los tratamientos varió entre 0,79 y 0,93, lo que sugiere una buena adecuación nutricional de los alimentos y buenas prácticas de alimentación.
Los datos experimentales generados en este ejemplo permiten afirmar que:
■ La incorporación de dosis crecientes de polvo de coleóptero (5, 7,5, 15 y 25%) con una reducción concomitante en la harina de pescado se relacionó progresivamente con un aumento significativo en el peso corporal de los peces.
■ Todas las dietas que contenían el polvo de coleóptero mostraron una mejora significativa en la TCE, IC y CEP.
■ El aumento de las dosis de coleóptero en polvo incorporado no tuvo ningún efecto sobre la composición de todo el cuerpo de la trucha.
■ El aumento de las dosis de coleóptero en polvo incorporado no tuvo ningún efecto sobre la digestibilidad aparente de la materia seca, proteínas, lípidos, fósforo y energía en las diferentes dietas experimentales.
■ Las proteínas, el fósforo y la retención de energía aumentaron en truchas alimentadas con alimentos que comprenden polvo de coleóptero.
En general, el polvo de coleóptero utilizado en este ejemplo podría reemplazar efectivamente el 100 % de la harina de pescado en la dieta de la trucha arco iris juvenil con efectos positivos en el IC y en el rendimiento general del crecimiento.
Ejemplo 5: Métodos con o sin molienda antes de prensar
Método de solo prensado
Se introducen 200 g de larvas de T. molitor en un vaso de precipitados, se ponen en un baño de agua a 100 °C y que contiene 200 ml de agua que se lleva previamente a ebullición. Después de 5 minutos, el vaso de precipitados se retira del baño de agua, las larvas se escurren y a continuación se pasan a una prensa de tipo doble tornillo. Se obtiene así una torta de prensa.
Método con molienda seguido de prensado
Se introducen 200 g de larvas de T. molitor en un vaso de precipitados, se ponen en un baño de agua a 100 °C y que contiene 200 ml de agua que se lleva previamente a ebullición. Después de 5 minutos, el vaso de precipitados se retira del baño de agua, las larvas se escurren y a continuación se mezclan con un volumen de agua de 200 ml. El líquido así obtenido se pasa a una prensa de doble tornillo. Se obtiene así una torta de prensa.
Medición del contenido de lípidos
Se pusieron 2 g de muestra en un vaso de precipitados al que se añadieron 0,2 g de Na2 SO4 y 15 ml de CHCh/MeOH (2/1 v/v). La mezcla se pone bajo agitación magnética durante 20 minutos, a continuación la solución se filtra, el residuo se pone nuevamente en el vaso con 10 ml de CHCl3/MeOH (2/1 v/v). La mezcla se pone bajo agitación magnética durante 15 minutos, a continuación la solución se filtra, las fases del disolvente se combinan y se evaporan a peso constante. El contenido de lípidos se determina como un porcentaje en peso después de la extracción-evaporación en relación con el peso inicial de la muestra (2 g).
Conclusión
Se estudió la importancia de la molienda corriente arriba del prensado (Fig. 3). Por lo tanto, es claramente evidente que la distribución de los lípidos entre la torta de prensa y el jugo de prensa es mucho más efectiva, 12,9 frente a 87,1 en lugar de 42,7 frente a 57,3, cuando la molienda se realizó de antemano.
Ejemplo 6: Análisis del tamaño de las proteínas solubles del polvo de coleóptero de acuerdo con la invención Se puso una muestra de 100 mg del polvo de coleóptero preparado en el Ejemplo 1 en 10 ml de tampón fosfato de NaCl (pH 7,4, 0,137 mM). La muestra se agitó durante 1 minuto (vórtice), y a continuación se centrifugó a 900 g durante 1 minuto. Después de la centrifugación, la muestra se filtró a través de una membrana de 0,45 |jm. El análisis del tamaño de las proteínas solubles se llevó a cabo utilizando un sistema de cromatografía de exclusión por tamaños con una columna Nucleogel GFC-300. Como eluyente se usó un tampón fosfato de NaCl (pH 7,4, 0,137 mM). El caudal fue de 1,0 ml/min. La detección se llevó a cabo con un detector de UV a 280 nm.
Los resultados del análisis se presentan en la Fig. 4 y resumido en la Tabla 13 a continuación.
Tabla 13: Distribución de los tamaños de las proteínas solubles contenidas en el polvo de coleóptero preparado en el E m l 1
Los resultados muestran que aproximadamente el 74,4 % de las proteínas solubles presentes en el polvo de coleóptero de acuerdo con la invención tienen una masa molar de menos de 12.400 g/mol (o Da, Daltons).
Claims (13)
1. Polvo de coleóptero que comprende al menos el 67 % en peso de proteínas y al menos el 5 % en peso de quitina, los porcentajes en peso se dan en relación con el peso total de polvo de coleóptero.
2. Polvo de coleóptero de acuerdo con la reivindicación 1, que comprende cenizas en un contenido inferior o igual al 4 % en peso con respecto al peso total de polvo de coleóptero.
3. Polvo de coleóptero de acuerdo con la reivindicación 1 o 2, que comprende materia grasa en un contenido comprendido entre el 5 y el 20 % en peso con respecto al peso total de polvo de coleóptero.
4. Polvo de coleóptero según cualquiera de las reivindicaciones 1 a 3, cuyas proteínas exhiben una digestibilidad mayor o igual al 85 %.
5. Polvo de coleóptero según cualquiera de las reivindicaciones 1 a 4, cuyo contenido de humedad residual está comprendido entre el 2 y el 15 %.
6. Polvo de coleóptero según cualquiera de las reivindicaciones 1 a 5, que comprende entre el 40 y el 60 % en peso de proteínas solubles con respecto al peso total de proteínas, en el que al menos el 50 % de las proteínas solubles tienen un tamaño inferior o igual a 12.400 g/mol.
7. Método para la preparación de un polvo de coleóptero de acuerdo con cualquiera de las reivindicaciones 1 a 6, que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa, y
iii) moler la torta de prensa.
8. Método de acuerdo con la reivindicación 7, comprendiendo también una etapa de secado de la torta de prensa.
9. Método de acuerdo con la reivindicación 8, que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa,
en el que la etapa de prensado está precedida por una etapa de molienda de los coleópteros.
10. Método de acuerdo con la reivindicación 8, que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa,
en el que la etapa de prensado se realiza en caliente.
11. Método de acuerdo con la reivindicación 8, que comprende las siguientes etapas:
i) matar los coleópteros,
ii) prensar los coleópteros para obtener una torta de prensa,
iii) secar la torta de prensa, y
iv) moler la torta de prensa,
en el que la etapa de molienda de la torta de prensa se lleva a cabo a un tamaño de partícula comprendido entre 300 |jm y 1 mm.
12. Uso del polvo de coleóptero de acuerdo con cualquiera de las reivindicaciones 1 a 6, en nutrición humana o animal.
13. Uso de acuerdo con la reivindicación 12, en el que se utiliza el polvo de coleóptero para reemplazar una harina proteica.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR1463512A FR3031113B1 (fr) | 2014-12-31 | 2014-12-31 | Procede de production de produit(s) d'interet a partir d'insecte par hydrolyse enzymatique |
| FR1560012 | 2015-10-20 | ||
| PCT/FR2015/053785 WO2016108037A1 (fr) | 2014-12-31 | 2015-12-30 | Poudre de coléoptères |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2733534T3 true ES2733534T3 (es) | 2019-11-29 |
Family
ID=55272512
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES15830828T Active ES2733534T3 (es) | 2014-12-31 | 2015-12-30 | Polvo de coleóptero |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US11432568B2 (es) |
| EP (1) | EP3240905B9 (es) |
| JP (1) | JP6730992B2 (es) |
| KR (1) | KR102675040B1 (es) |
| CN (1) | CN107404928A (es) |
| AU (1) | AU2015373267B2 (es) |
| BR (1) | BR112017014346A2 (es) |
| CA (1) | CA2970724C (es) |
| CL (1) | CL2017001750A1 (es) |
| DK (1) | DK3240905T3 (es) |
| EC (1) | ECSP17043316A (es) |
| ES (1) | ES2733534T3 (es) |
| HK (1) | HK1246359B (es) |
| MX (1) | MX2017008813A (es) |
| PT (1) | PT3240905T (es) |
| WO (1) | WO2016108037A1 (es) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10638788B2 (en) * | 2016-05-04 | 2020-05-05 | Aspire Food Group USA Inc. | Method and system for spray drying insects |
| WO2018122352A1 (fr) | 2016-12-28 | 2018-07-05 | Ynsect | Procede de traitement d'insectes comprenant la separation des cuticules de la partie molle des insectes puis la separation de la partie molle en trois fractions |
| WO2018122353A1 (fr) | 2016-12-28 | 2018-07-05 | Ynsect | Procede de traitement d'insectes comprenant la separation des cuticules de la partie molle des insectes a l'aide d'un separateur a bande |
| FR3060946B1 (fr) | 2016-12-28 | 2021-12-31 | Ynsect | Procede de traitement d'insectes comprenant la separation des cuticules de la partie molle des insectes a l'aide d'un separateur a bande |
| FR3060947A1 (fr) * | 2016-12-28 | 2018-06-29 | Ynsect | Procede de traitement d'insectes comprenant la separation des cuticules de la partie molle des insectes puis la separation de la partie molle en trois fractions |
| FR3061856B1 (fr) * | 2017-01-18 | 2021-04-02 | Ynsect | Utilisations therapeutiques d'une poudre d'insectes |
| FR3070577B1 (fr) * | 2017-09-06 | 2021-07-30 | Ynsect | Poudre d'insectes pour prevenir ou reduire le stress des poissons pendant l'elevage |
| CA3077625A1 (en) * | 2017-10-26 | 2019-05-02 | Gea Food Solutions Bakel B.V. | Treatment of insects |
| GB201804794D0 (en) * | 2018-03-26 | 2018-05-09 | Givaudan Sa | Flavor and consummable compositions |
| FR3081288A1 (fr) * | 2018-05-28 | 2019-11-29 | Nutri'earth | Elevage de coleopteres pour la preparation d'une poudre comprenant la mise a disposition d'un support alimentaire absorbant imbibe notamment d'un liquide nutritif d'origine vegetale |
| FR3081287B1 (fr) * | 2018-05-28 | 2020-05-01 | Nutri'earth | Poudre de coleopteres et procede d'elevage des coleopteres comprenant un traitement ultraviolet pour la preparation d'une telle poudre |
| FR3087092B1 (fr) * | 2018-10-12 | 2020-11-13 | Ynsect | Poudre d'insectes pour eviter une deformation squelettique d'un poisson et/ou renforcer la solidite d'une arete de poisson pendant l'elevage |
| CA3151371A1 (en) * | 2019-07-22 | 2021-01-28 | Genufeed Ltd. | Complete food for aquaculture animals formed from insect larvae |
| DE102019219928A1 (de) * | 2019-12-17 | 2021-06-17 | Deutsches Institut Für Lebensmitteltechnik E.V. | Verfahren zur Herstellung von Proteinmasse |
| JPWO2021251016A1 (es) * | 2020-06-10 | 2021-12-16 | ||
| FR3115182A1 (fr) * | 2020-10-16 | 2022-04-22 | Nutri'earth | Traitement ultraviolet sur de l’huile de larves de coleopteres pour un enrichissement en vitamine d3 |
| JP2023546430A (ja) * | 2020-10-16 | 2023-11-02 | ヌートリ’アース | ビタミンd3強化のための甲虫類幼虫油の紫外線処理 |
| FR3119512A1 (fr) * | 2021-02-08 | 2022-08-12 | Nutri'earth | Traitement ultraviolet sur de l’huile de larves de coleopteres pour un enrichissement en vitamine d3 |
| CN113198590A (zh) * | 2021-04-30 | 2021-08-03 | 青岛新农康源生物工程有限公司 | 一种低温生产脱脂黄粉虫蛋白粉的方法 |
| FR3124928A1 (fr) * | 2021-07-08 | 2023-01-13 | Nutri'earth | Amelioration de l’enrichissement en vitamine d3 des larves de coleopteres transformees par un traitement ultraviolet et poudre alimentaire associee |
| KR102536078B1 (ko) * | 2021-12-02 | 2023-05-30 | 농업회사법인 푸디웜 주식회사 | 증숙 공정을 이용한 동애등에 유충 가공방법 |
| FR3131181A1 (fr) | 2021-12-24 | 2023-06-30 | Innovafeed | Procede de traitement industriel de larves d’arthropodes, et notamment de larves d’insectes vivantes |
| FR3144492A1 (fr) * | 2022-12-30 | 2024-07-05 | Ynsect | Utilisation d’une composition obtenue a partir d’insectes destinee a ameliorer la consistance des feces |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1230719B (it) | 1988-04-19 | 1991-10-29 | Eimei Co Ltd | Procedimento per la produzione di polvere di lombrichi secca e preparazioni anti iperlipemiche, anti diabetiche, anti ipertensive ed anti ipotensive contenenti, come ingrediente attivo, polvere secca di lombrichi. |
| CN1100490C (zh) * | 1999-12-01 | 2003-02-05 | 中国科学院动物研究所 | 一种资源昆虫有效成份的分离、提取方法 |
| US20030233982A1 (en) | 2002-06-25 | 2003-12-25 | Mao Zhang | Raising fly larvae as the space food for crew |
| CN1195067C (zh) | 2002-11-20 | 2005-03-30 | 江南大学 | 一种用酶水解法从蝇蛆中提取蛋白质的方法 |
| DK175501B1 (da) | 2002-12-02 | 2004-11-15 | Green Earth | Anlæg og fremgangsmåde til kontinuerlig hydrolyse af et proteinholdigt animalsk eller vegetabilsk råmateriale |
| RU2345139C2 (ru) | 2006-07-26 | 2009-01-27 | Общество с ограниченной ответственностью "МУСКА" | Способ переработки личинок синантропной мухи |
| CN101116471B (zh) * | 2006-08-01 | 2012-08-08 | 西安市轻工业研究所 | 一种食用昆虫蛋白粉及其生产方法和应用 |
| US20080075818A1 (en) | 2006-09-27 | 2008-03-27 | Papadoyianis Ernest D | Production and processing of insects for transformation into protein meal for fish and animal diets |
| CN101078023B (zh) | 2007-05-18 | 2010-10-13 | 重庆百奥帝克微生态科技有限公司 | 一种从蚕蛹、蝇蛆的皮壳中制取甲壳素/壳聚糖的方法 |
| CN101124936A (zh) | 2007-08-06 | 2008-02-20 | 杨琳 | 黄粉虫蛋白的制备方法 |
| CN101117613A (zh) | 2007-09-04 | 2008-02-06 | 张均康 | 黄粉虫油的提取方法 |
| CN101144097B (zh) | 2007-09-18 | 2010-12-01 | 重庆百奥帝克微生态科技有限公司 | 一种制备甲壳素及其壳聚糖和壳寡糖的方法 |
| JP4384249B2 (ja) | 2008-03-28 | 2009-12-16 | 株式会社シンギー | 蜂の子加工飲食品の製造方法、及び蜂の子加工飲食品 |
| CN101292737A (zh) | 2008-06-02 | 2008-10-29 | 张均康 | 一种分离黄粉虫干品制取超微黄粉虫蛋白粉与壳物质的方法 |
| KR20110054692A (ko) * | 2009-11-18 | 2011-05-25 | 경상대학교산학협력단 | 갈색거저리를 함유한 사료첨가제 및 이를 이용한 기능성 사료 |
| CN101880591A (zh) | 2010-06-13 | 2010-11-10 | 中山大学 | 家蝇蛆作为油料昆虫的应用 |
| CN101940270A (zh) * | 2010-09-27 | 2011-01-12 | 中国农业科学院植物保护研究所 | 一种天敌昆虫的人工饲料 |
| US20120148712A1 (en) | 2010-12-14 | 2012-06-14 | Dianne Lee Guilfoyle | Phylum arthropoda based nutritional supplement |
| FR2975706B1 (fr) | 2011-05-26 | 2017-07-21 | Ifremer (Institut Francais De Rech Pour L'exploitation De La Mer) | Extraction de chitines en une seule etape par hydrolyse enzymatique en milieu acide |
| CN102178119A (zh) | 2011-05-26 | 2011-09-14 | 山西大学 | 一种虾蟹类饲料及其制备方法 |
| CN103045349A (zh) | 2011-10-12 | 2013-04-17 | 康建国 | 一种大麦虫榨取油脂的方法 |
| CN102578361B (zh) | 2012-03-28 | 2013-09-11 | 常熟市汇康食品厂 | 一种蛆复合蛋白粉 |
| NL2009044C2 (en) | 2012-06-21 | 2013-12-24 | Protix Biosystems B V | Method to convert insects or worms into nutrient streams and compositions obtained thereby. |
| CN103070314A (zh) | 2013-02-01 | 2013-05-01 | 南昌精彩实业有限公司 | 红椒粉观赏鱼增色增艳饲料 |
| NL2010268C2 (en) | 2013-02-07 | 2014-08-11 | Protix Biosystems B V | Method to convert insects or worms into nutrient streams and compositions obtained thereby. |
| CN103478724B (zh) | 2013-10-11 | 2015-01-07 | 中国农业科学院饲料研究所 | 富有机铬大麦虫虫粉及其制备方法 |
| CN103694372A (zh) | 2013-12-06 | 2014-04-02 | 中山奈德生物科技有限公司 | 利用昆虫制备几丁质的方法 |
| CN103725742B (zh) | 2013-12-31 | 2016-07-06 | 北京博肽未名生物技术有限公司 | 一种酶解法制备蜂王胚胎肽的方法 |
| PL3240436T3 (pl) | 2014-12-31 | 2020-12-28 | Ynsect | Kompozycja zawierająca chitynę i lekkostrawne białka |
-
2015
- 2015-12-30 ES ES15830828T patent/ES2733534T3/es active Active
- 2015-12-30 PT PT15830828T patent/PT3240905T/pt unknown
- 2015-12-30 EP EP15830828.8A patent/EP3240905B9/fr active Active
- 2015-12-30 JP JP2017535684A patent/JP6730992B2/ja active Active
- 2015-12-30 KR KR1020177020950A patent/KR102675040B1/ko active IP Right Grant
- 2015-12-30 CN CN201580077205.2A patent/CN107404928A/zh active Pending
- 2015-12-30 BR BR112017014346-1A patent/BR112017014346A2/pt not_active Application Discontinuation
- 2015-12-30 US US15/541,140 patent/US11432568B2/en active Active
- 2015-12-30 MX MX2017008813A patent/MX2017008813A/es unknown
- 2015-12-30 AU AU2015373267A patent/AU2015373267B2/en active Active
- 2015-12-30 CA CA2970724A patent/CA2970724C/fr active Active
- 2015-12-30 WO PCT/FR2015/053785 patent/WO2016108037A1/fr active Application Filing
- 2015-12-30 DK DK15830828.8T patent/DK3240905T3/da active
-
2017
- 2017-06-30 CL CL2017001750A patent/CL2017001750A1/es unknown
- 2017-07-06 EC ECIEPI201743316A patent/ECSP17043316A/es unknown
-
2018
- 2018-05-07 HK HK18105881.1A patent/HK1246359B/zh not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| WO2016108037A1 (fr) | 2016-07-07 |
| KR102675040B1 (ko) | 2024-06-12 |
| PT3240905T (pt) | 2019-07-11 |
| HK1246359B (zh) | 2020-05-08 |
| JP6730992B2 (ja) | 2020-07-29 |
| BR112017014346A2 (pt) | 2018-01-02 |
| CL2017001750A1 (es) | 2018-03-23 |
| EP3240905A1 (fr) | 2017-11-08 |
| EP3240905B1 (fr) | 2019-04-03 |
| US20180000121A1 (en) | 2018-01-04 |
| DK3240905T3 (da) | 2019-07-08 |
| KR20170105023A (ko) | 2017-09-18 |
| ECSP17043316A (es) | 2017-09-29 |
| CN107404928A (zh) | 2017-11-28 |
| CA2970724C (fr) | 2023-01-24 |
| WO2016108037A9 (fr) | 2019-10-17 |
| US11432568B2 (en) | 2022-09-06 |
| JP2018506273A (ja) | 2018-03-08 |
| AU2015373267B2 (en) | 2019-08-22 |
| EP3240905B9 (fr) | 2020-01-08 |
| AU2015373267A1 (en) | 2017-08-03 |
| CA2970724A1 (fr) | 2016-07-07 |
| MX2017008813A (es) | 2018-02-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2733534T3 (es) | Polvo de coleóptero | |
| ES2806145T3 (es) | Composición que comprende quitina y proteínas digestibles | |
| Jia et al. | Protein-sourced feedstuffs for aquatic animals in nutrition research and aquaculture | |
| Martínez-Alvarez et al. | Protein hydrolysates from animal processing by-products as a source of bioactive molecules with interest in animal feeding: A review | |
| Rosenfeld et al. | The effect of using different levels of shrimp meal in broiler diets | |
| Barrows et al. | Evaluation of the nutritional quality of co-products from the nut industry, algae and an invertebrate meal for rainbow trout, Oncorhynchus mykiss | |
| US20220338506A1 (en) | Method of increasing the productivity of a non-ruminant animal | |
| CN111511200A (zh) | 用于水产养殖的组合物及方法 | |
| ES2613519T3 (es) | Hidrolizados de proteínas de crustáceo para mantener y/o estimular la salud intestinal de peces de cultivo | |
| ES2870009T3 (es) | Conservación de vitaminas hidrosolubles | |
| Alofa Cayen et al. | Effect of replacement of fish meal with broiler chicken viscera on growth, feed utilization and production of African catfish Clarias gariepinus (Burchell, 1822) | |
| EA014382B1 (ru) | Сухой экструдированный корм для домашних животных и способ производства корма | |
| Mikołajczak et al. | Black soldier fly full-fat meal in atlantic salmon nutrition–Part B: effects on growth Performance, feed utilization, selected nutriPhysiological traits and Production sustainaBility in Pre-smolts | |
| Rachmawati et al. | Phytase Enzyme Ameliorates Growth Performance, Mineral Digestibility, Amino Acid Digestibility and Body Chemical Composition of the Common Carp (Cyprinus carpio L.) at Rearing Stage. | |
| EP4166003A1 (en) | Feed for aquatic animals | |
| Kamei et al. | Use of fish silage based blended protein source for replacement of fish meal in thai-pangas diet | |
| Ochi et al. | Effect of moringa (Moringa oleifera lam) seeds on the performance and carcass characteristics of broiler chickens: an observational study | |
| Mohamadsalehi et al. | Replacement of fish meal with poultry by-product meal on body composition in practical diets for beluga sturgeon (Huso huso) | |
| WO2024185528A1 (ja) | 昆虫を原料とする食料用組成物、及び動物用食料 | |
| CN114568598A (zh) | 一种生骨肉配方主食冻干猫粮营养配方及制备方法 | |
| Wojno | Improved diet utilization of intensively cultured fish to address environmental sustainability-amino acid requirement in carp (Cyprinus carpio) | |
| Tsado et al. | Performance of Weaner Rabbits (Oryctolagus Cunniculus) Fed Different Levels of Processed Foetid Cassia (Cassia tora) Seed Diets Supplemented with Tridax (Tridax procumbens) Forage | |
| Khadka et al. | Utilization of Hatchery by-products as Feed ingredients in Broiler Chicken Feed. | |
| Mahmoud | THE EFFECT OF DIFFERENT LEVELS OF DATE SEEDS MEAL ON NEW ZEALAND RABBITS PERFORMANCE |