CN1886380A - 苯并咪唑化合物 - Google Patents
苯并咪唑化合物 Download PDFInfo
- Publication number
- CN1886380A CN1886380A CNA2004800354157A CN200480035415A CN1886380A CN 1886380 A CN1886380 A CN 1886380A CN A2004800354157 A CNA2004800354157 A CN A2004800354157A CN 200480035415 A CN200480035415 A CN 200480035415A CN 1886380 A CN1886380 A CN 1886380A
- Authority
- CN
- China
- Prior art keywords
- methyl
- benzoglyoxaline
- chloro
- propoxy
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
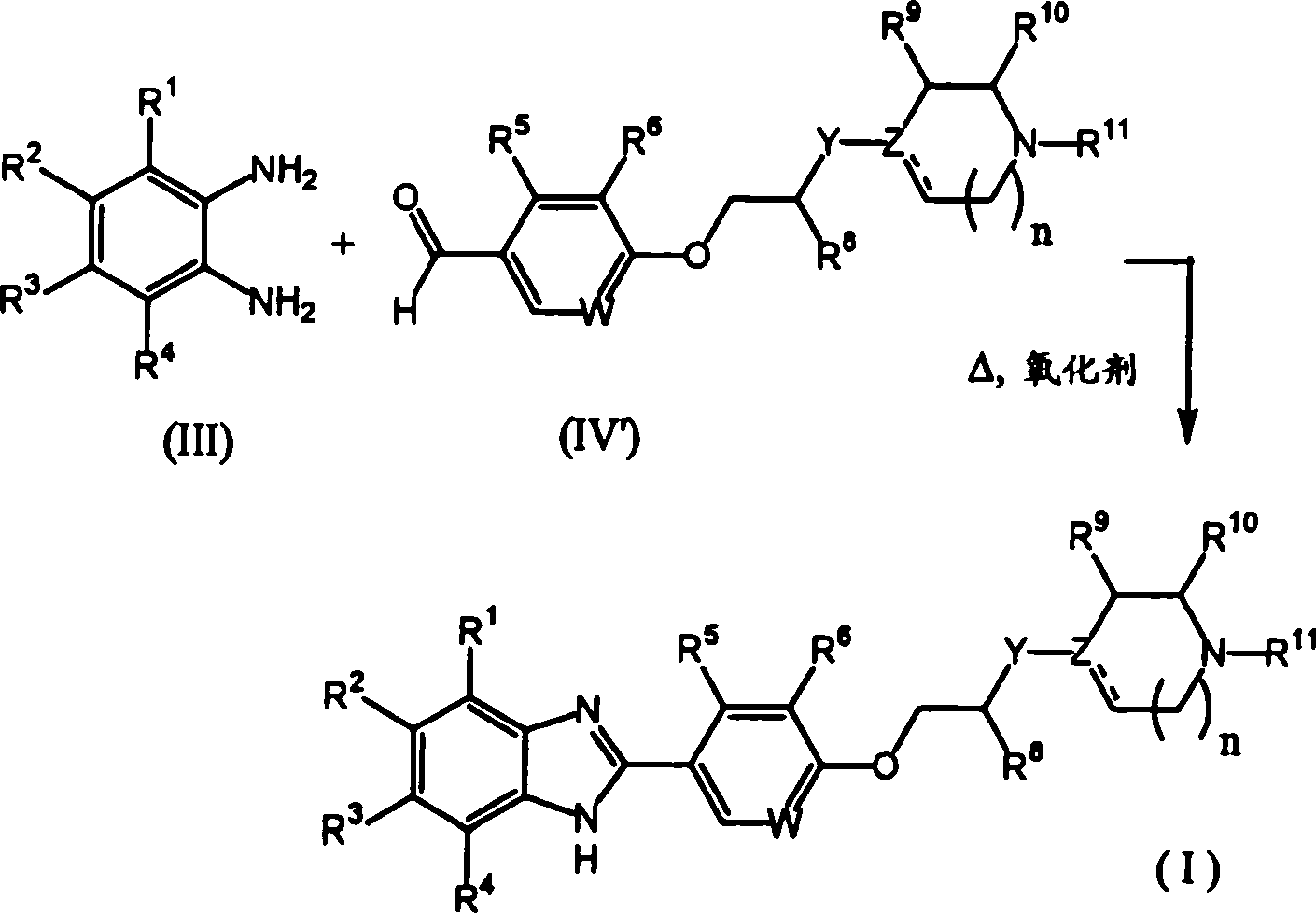
- 125000003785 benzimidazolyl group Chemical class N1=C(NC2=C1C=CC=C2)* 0.000 title abstract 2
- 238000000034 method Methods 0.000 claims abstract description 216
- 239000000203 mixture Substances 0.000 claims abstract description 198
- 238000011282 treatment Methods 0.000 claims abstract description 123
- 210000000265 leukocyte Anatomy 0.000 claims abstract description 69
- 230000007115 recruitment Effects 0.000 claims abstract description 68
- 206010061218 Inflammation Diseases 0.000 claims abstract description 34
- 230000004054 inflammatory process Effects 0.000 claims abstract description 34
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 26
- 150000001875 compounds Chemical class 0.000 claims description 406
- 239000008194 pharmaceutical composition Substances 0.000 claims description 92
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical class OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 88
- -1 styroyl Chemical group 0.000 claims description 77
- 230000003110 anti-inflammatory effect Effects 0.000 claims description 70
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 claims description 63
- 150000003839 salts Chemical class 0.000 claims description 44
- 239000003112 inhibitor Substances 0.000 claims description 39
- 230000028709 inflammatory response Effects 0.000 claims description 38
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 38
- 229910052801 chlorine Inorganic materials 0.000 claims description 37
- 229910052799 carbon Inorganic materials 0.000 claims description 36
- 230000002265 prevention Effects 0.000 claims description 34
- 150000002148 esters Chemical class 0.000 claims description 32
- 229910052739 hydrogen Inorganic materials 0.000 claims description 32
- 150000001408 amides Chemical class 0.000 claims description 30
- 229910052731 fluorine Inorganic materials 0.000 claims description 28
- 230000004048 modification Effects 0.000 claims description 26
- 238000012986 modification Methods 0.000 claims description 26
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 24
- 201000010099 disease Diseases 0.000 claims description 23
- 239000003795 chemical substances by application Substances 0.000 claims description 15
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 15
- 229910052794 bromium Inorganic materials 0.000 claims description 14
- 230000005784 autoimmunity Effects 0.000 claims description 13
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 13
- 125000000623 heterocyclic group Chemical group 0.000 claims description 13
- 125000003545 alkoxy group Chemical group 0.000 claims description 12
- 229910052757 nitrogen Inorganic materials 0.000 claims description 12
- 239000000126 substance Substances 0.000 claims description 12
- 125000000217 alkyl group Chemical group 0.000 claims description 11
- 125000003118 aryl group Chemical group 0.000 claims description 10
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 10
- 125000002837 carbocyclic group Chemical group 0.000 claims description 10
- 208000023275 Autoimmune disease Diseases 0.000 claims description 9
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 9
- 206010039085 Rhinitis allergic Diseases 0.000 claims description 9
- 201000010105 allergic rhinitis Diseases 0.000 claims description 9
- 208000006673 asthma Diseases 0.000 claims description 9
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 9
- 229910052736 halogen Inorganic materials 0.000 claims description 9
- 150000002367 halogens Chemical class 0.000 claims description 9
- 239000003396 histamine H4 receptor antagonist Substances 0.000 claims description 9
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 9
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 claims description 8
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 8
- 201000001119 neuropathy Diseases 0.000 claims description 8
- 230000007823 neuropathy Effects 0.000 claims description 8
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 8
- 230000000638 stimulation Effects 0.000 claims description 8
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 7
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 7
- 229910052717 sulfur Inorganic materials 0.000 claims description 7
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 6
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 6
- 150000002460 imidazoles Chemical class 0.000 claims description 6
- 230000003308 immunostimulating effect Effects 0.000 claims description 6
- 230000002757 inflammatory effect Effects 0.000 claims description 6
- 229910052760 oxygen Inorganic materials 0.000 claims description 6
- QQVIHTHCMHWDBS-UHFFFAOYSA-N perisophthalic acid Natural products OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 claims description 6
- 208000011580 syndromic disease Diseases 0.000 claims description 6
- 208000006045 Spondylarthropathies Diseases 0.000 claims description 5
- 206010047115 Vasculitis Diseases 0.000 claims description 5
- 150000001721 carbon Chemical group 0.000 claims description 5
- 125000001072 heteroaryl group Chemical group 0.000 claims description 5
- 208000027866 inflammatory disease Diseases 0.000 claims description 5
- AIDQCFHFXWPAFG-UHFFFAOYSA-N n-formylformamide Chemical compound O=CNC=O AIDQCFHFXWPAFG-UHFFFAOYSA-N 0.000 claims description 5
- 201000005671 spondyloarthropathy Diseases 0.000 claims description 5
- 201000001320 Atherosclerosis Diseases 0.000 claims description 4
- 208000038016 acute inflammation Diseases 0.000 claims description 4
- 230000006022 acute inflammation Effects 0.000 claims description 4
- 239000000556 agonist Substances 0.000 claims description 4
- 230000002052 anaphylactic effect Effects 0.000 claims description 4
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 4
- 208000037976 chronic inflammation Diseases 0.000 claims description 4
- 230000003750 conditioning effect Effects 0.000 claims description 4
- 229910052740 iodine Inorganic materials 0.000 claims description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 4
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical class C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 claims description 3
- XKTYXVDYIKIYJP-UHFFFAOYSA-N 3h-dioxole Chemical compound C1OOC=C1 XKTYXVDYIKIYJP-UHFFFAOYSA-N 0.000 claims description 3
- 206010002556 Ankylosing Spondylitis Diseases 0.000 claims description 3
- 206010003827 Autoimmune hepatitis Diseases 0.000 claims description 3
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 claims description 3
- 208000033222 Biliary cirrhosis primary Diseases 0.000 claims description 3
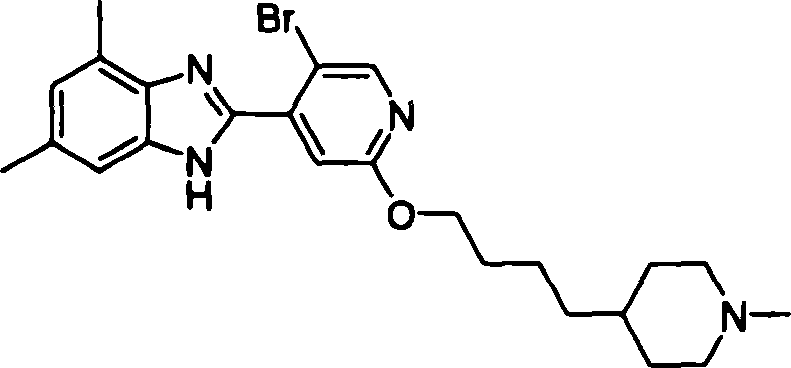
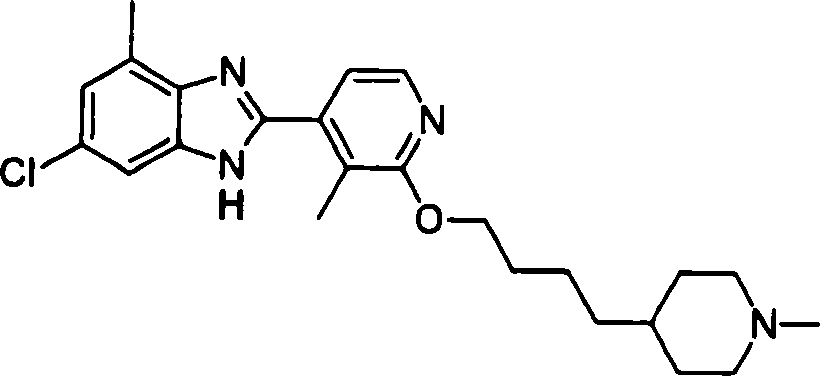
- AQURPQHVCTVTRE-UHFFFAOYSA-N BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C(=CC(=C1C(=O)O)C)Cl Chemical compound BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C(=CC(=C1C(=O)O)C)Cl AQURPQHVCTVTRE-UHFFFAOYSA-N 0.000 claims description 3
- QERLGGFIYWIKFV-UHFFFAOYSA-N BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)Cl Chemical compound BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)Cl QERLGGFIYWIKFV-UHFFFAOYSA-N 0.000 claims description 3
- AJEAZTJVXSZLGO-UHFFFAOYSA-N BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)F Chemical compound BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)F AJEAZTJVXSZLGO-UHFFFAOYSA-N 0.000 claims description 3
- OLLAOVHAIPAKNT-UHFFFAOYSA-N BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=CC(=C1C(=O)O)C Chemical compound BrC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=CC(=C1C(=O)O)C OLLAOVHAIPAKNT-UHFFFAOYSA-N 0.000 claims description 3
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 3
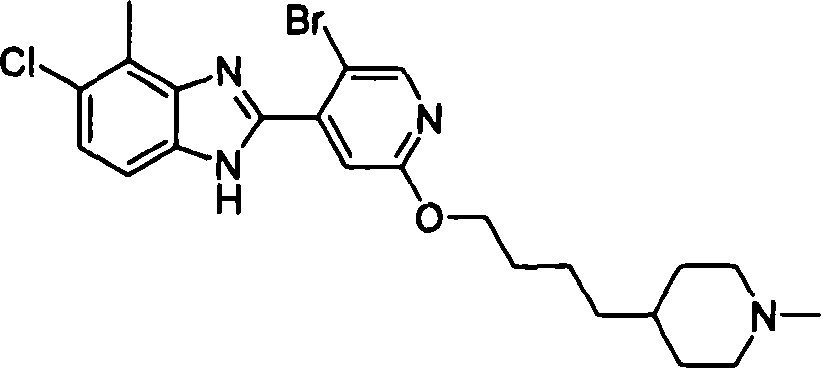
- GKAZOJYJKASJCE-UHFFFAOYSA-N ClC1=CC(=C(C(=C1C(=O)O)C1=C(C(=NC=C1)OCCCCC1CCN(CC1)C)Cl)C(=O)O)C Chemical compound ClC1=CC(=C(C(=C1C(=O)O)C1=C(C(=NC=C1)OCCCCC1CCN(CC1)C)Cl)C(=O)O)C GKAZOJYJKASJCE-UHFFFAOYSA-N 0.000 claims description 3
- DQVFXENZEYMPPN-UHFFFAOYSA-N ClC=1C(=C(C(=C(C(=O)O)C1)C1=C(C(=NC=C1)OCCCCC1CCN(CC1)C)Cl)C(=O)O)C Chemical compound ClC=1C(=C(C(=C(C(=O)O)C1)C1=C(C(=NC=C1)OCCCCC1CCN(CC1)C)Cl)C(=O)O)C DQVFXENZEYMPPN-UHFFFAOYSA-N 0.000 claims description 3
- GXLLMUVWVRQFQT-UHFFFAOYSA-N ClC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)F Chemical compound ClC=1C(=CC(=NC1)OCCCCC1CCN(CC1)C)C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)F GXLLMUVWVRQFQT-UHFFFAOYSA-N 0.000 claims description 3
- NYSTYZBXLZSROY-UHFFFAOYSA-N ClC=1C(=NC=CC1C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)F)OCCCCC1CCN(CC1)C Chemical compound ClC=1C(=NC=CC1C1=C(C(=O)O)C=C(C(=C1C(=O)O)C)F)OCCCCC1CCN(CC1)C NYSTYZBXLZSROY-UHFFFAOYSA-N 0.000 claims description 3
- JPKPYMDFNYHZHF-UHFFFAOYSA-N ClC=1C(=NC=CC1C1=C(C(=O)O)C=CC(=C1C(=O)O)C)OCCCCC1CCN(CC1)C Chemical compound ClC=1C(=NC=CC1C1=C(C(=O)O)C=CC(=C1C(=O)O)C)OCCCCC1CCN(CC1)C JPKPYMDFNYHZHF-UHFFFAOYSA-N 0.000 claims description 3
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 3
- 208000011231 Crohn disease Diseases 0.000 claims description 3
- 206010012468 Dermatitis herpetiformis Diseases 0.000 claims description 3
- 206010048768 Dermatosis Diseases 0.000 claims description 3
- 208000007465 Giant cell arteritis Diseases 0.000 claims description 3
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 claims description 3
- 208000018501 Lymphatic disease Diseases 0.000 claims description 3
- 201000011152 Pemphigus Diseases 0.000 claims description 3
- 208000031845 Pernicious anaemia Diseases 0.000 claims description 3
- 208000012654 Primary biliary cholangitis Diseases 0.000 claims description 3
- 201000004681 Psoriasis Diseases 0.000 claims description 3
- 206010039710 Scleroderma Diseases 0.000 claims description 3
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 3
- 206010046851 Uveitis Diseases 0.000 claims description 3
- 230000001919 adrenal effect Effects 0.000 claims description 3
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 claims description 3
- 208000006424 autoimmune oophoritis Diseases 0.000 claims description 3
- 208000010928 autoimmune thyroid disease Diseases 0.000 claims description 3
- RWCCWEUUXYIKHB-UHFFFAOYSA-N benzophenone Chemical compound C=1C=CC=CC=1C(=O)C1=CC=CC=C1 RWCCWEUUXYIKHB-UHFFFAOYSA-N 0.000 claims description 3
- 238000002512 chemotherapy Methods 0.000 claims description 3
- 208000037893 chronic inflammatory disorder Diseases 0.000 claims description 3
- 201000001981 dermatomyositis Diseases 0.000 claims description 3
- 125000005842 heteroatom Chemical group 0.000 claims description 3
- 208000033065 inborn errors of immunity Diseases 0.000 claims description 3
- 206010025135 lupus erythematosus Diseases 0.000 claims description 3
- 208000018555 lymphatic system disease Diseases 0.000 claims description 3
- 201000006417 multiple sclerosis Diseases 0.000 claims description 3
- 206010028417 myasthenia gravis Diseases 0.000 claims description 3
- 201000001976 pemphigus vulgaris Diseases 0.000 claims description 3
- 208000005987 polymyositis Diseases 0.000 claims description 3
- 208000028529 primary immunodeficiency disease Diseases 0.000 claims description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 3
- 208000017520 skin disease Diseases 0.000 claims description 3
- 206010043207 temporal arteritis Diseases 0.000 claims description 3
- 206010043554 thrombocytopenia Diseases 0.000 claims description 3
- 206010020751 Hypersensitivity Diseases 0.000 claims description 2
- RAHZWNYVWXNFOC-UHFFFAOYSA-N Sulphur dioxide Chemical group O=S=O RAHZWNYVWXNFOC-UHFFFAOYSA-N 0.000 claims description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 2
- 208000026935 allergic disease Diseases 0.000 claims description 2
- 230000007815 allergy Effects 0.000 claims description 2
- 201000005737 orchitis Diseases 0.000 claims description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 2
- 125000006264 diethylaminomethyl group Chemical group [H]C([H])([H])C([H])([H])N(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 claims 1
- 230000005764 inhibitory process Effects 0.000 abstract description 4
- 230000001404 mediated effect Effects 0.000 abstract description 4
- 208000035475 disorder Diseases 0.000 abstract 3
- 239000007921 spray Substances 0.000 description 196
- 238000005160 1H NMR spectroscopy Methods 0.000 description 155
- 239000000243 solution Substances 0.000 description 134
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 98
- 239000011734 sodium Substances 0.000 description 94
- 238000003756 stirring Methods 0.000 description 89
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 84
- 238000000605 extraction Methods 0.000 description 78
- 239000012141 concentrate Substances 0.000 description 66
- 235000008504 concentrate Nutrition 0.000 description 66
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 65
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 63
- 239000007788 liquid Substances 0.000 description 61
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 58
- 229920006395 saturated elastomer Polymers 0.000 description 57
- 238000001035 drying Methods 0.000 description 47
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 47
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 47
- 239000007864 aqueous solution Substances 0.000 description 44
- 239000000460 chlorine Substances 0.000 description 42
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 42
- 238000004128 high performance liquid chromatography Methods 0.000 description 35
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 33
- 239000002585 base Substances 0.000 description 33
- 229960001340 histamine Drugs 0.000 description 33
- 150000002825 nitriles Chemical class 0.000 description 33
- 239000011541 reaction mixture Substances 0.000 description 32
- 210000004027 cell Anatomy 0.000 description 31
- 210000003630 histaminocyte Anatomy 0.000 description 26
- 239000000741 silica gel Substances 0.000 description 26
- 229910002027 silica gel Inorganic materials 0.000 description 26
- 229960001866 silicon dioxide Drugs 0.000 description 26
- 235000019504 cigarettes Nutrition 0.000 description 25
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 24
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 24
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 21
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 21
- 238000006243 chemical reaction Methods 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N EtOH Substances CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- WSFSSNUMVMOOMR-UHFFFAOYSA-N formaldehyde Substances O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 20
- 210000000222 eosinocyte Anatomy 0.000 description 18
- 239000000284 extract Substances 0.000 description 18
- 230000008569 process Effects 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
- 238000010790 dilution Methods 0.000 description 16
- 239000012895 dilution Substances 0.000 description 16
- 238000003810 ethyl acetate extraction Methods 0.000 description 15
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 14
- 150000001299 aldehydes Chemical class 0.000 description 14
- SIPUZPBQZHNSDW-UHFFFAOYSA-N diisobutylaluminium hydride Substances CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 14
- 239000003921 oil Substances 0.000 description 14
- 235000019198 oils Nutrition 0.000 description 14
- 239000012312 sodium hydride Substances 0.000 description 14
- 229910000104 sodium hydride Inorganic materials 0.000 description 14
- 239000007787 solid Substances 0.000 description 14
- 238000005406 washing Methods 0.000 description 14
- 238000004440 column chromatography Methods 0.000 description 13
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 12
- 239000012043 crude product Substances 0.000 description 12
- 239000003814 drug Substances 0.000 description 12
- 238000010438 heat treatment Methods 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- HELHAJAZNSDZJO-UHFFFAOYSA-L sodium tartrate Chemical compound [Na+].[Na+].[O-]C(=O)C(O)C(O)C([O-])=O HELHAJAZNSDZJO-UHFFFAOYSA-L 0.000 description 12
- 230000000694 effects Effects 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 10
- 239000002253 acid Substances 0.000 description 10
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 239000012299 nitrogen atmosphere Substances 0.000 description 10
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 239000005557 antagonist Substances 0.000 description 9
- 238000001816 cooling Methods 0.000 description 9
- 239000003937 drug carrier Substances 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 239000000706 filtrate Substances 0.000 description 8
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical group IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 7
- 239000006185 dispersion Substances 0.000 description 7
- 230000003203 everyday effect Effects 0.000 description 7
- 238000001556 precipitation Methods 0.000 description 7
- 239000000651 prodrug Substances 0.000 description 7
- 229940002612 prodrug Drugs 0.000 description 7
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- OHCQJHSOBUTRHG-KGGHGJDLSA-N FORSKOLIN Chemical compound O=C([C@@]12O)C[C@](C)(C=C)O[C@]1(C)[C@@H](OC(=O)C)[C@@H](O)[C@@H]1[C@]2(C)[C@@H](O)CCC1(C)C OHCQJHSOBUTRHG-KGGHGJDLSA-N 0.000 description 6
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 6
- 235000011114 ammonium hydroxide Nutrition 0.000 description 6
- 230000005587 bubbling Effects 0.000 description 6
- 230000035605 chemotaxis Effects 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 238000001914 filtration Methods 0.000 description 6
- VHHHONWQHHHLTI-UHFFFAOYSA-N hexachloroethane Chemical compound ClC(Cl)(Cl)C(Cl)(Cl)Cl VHHHONWQHHHLTI-UHFFFAOYSA-N 0.000 description 6
- OVEHNNQXLPJPPL-UHFFFAOYSA-N lithium;n-propan-2-ylpropan-2-amine Chemical compound [Li].CC(C)NC(C)C OVEHNNQXLPJPPL-UHFFFAOYSA-N 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 238000006386 neutralization reaction Methods 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 6
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 6
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 5
- DMEPVFSJYHJGCD-UHFFFAOYSA-N 3,5-dimethylbenzene-1,2-diamine Chemical class CC1=CC(C)=C(N)C(N)=C1 DMEPVFSJYHJGCD-UHFFFAOYSA-N 0.000 description 5
- PSGAKWLMABPVAC-UHFFFAOYSA-N 4-fluoro-3-methylbenzene-1,2-diamine Chemical class CC1=C(F)C=CC(N)=C1N PSGAKWLMABPVAC-UHFFFAOYSA-N 0.000 description 5
- WLOSFXSXVXTKBU-UHFFFAOYSA-N 4-tert-butylbenzene-1,2-diamine Chemical class CC(C)(C)C1=CC=C(N)C(N)=C1 WLOSFXSXVXTKBU-UHFFFAOYSA-N 0.000 description 5
- 102000000543 Histamine Receptors Human genes 0.000 description 5
- 108010002059 Histamine Receptors Proteins 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 229920000392 Zymosan Polymers 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 201000009961 allergic asthma Diseases 0.000 description 5
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Substances N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 5
- FFBHFFJDDLITSX-UHFFFAOYSA-N benzyl N-[2-hydroxy-4-(3-oxomorpholin-4-yl)phenyl]carbamate Chemical compound OC1=C(NC(=O)OCC2=CC=CC=C2)C=CC(=C1)N1CCOCC1=O FFBHFFJDDLITSX-UHFFFAOYSA-N 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 230000004224 protection Effects 0.000 description 5
- 239000002464 receptor antagonist Substances 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 125000001424 substituent group Chemical group 0.000 description 5
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 5
- IAVREABSGIHHMO-UHFFFAOYSA-N 3-hydroxybenzaldehyde Chemical compound OC1=CC=CC(C=O)=C1 IAVREABSGIHHMO-UHFFFAOYSA-N 0.000 description 4
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 4
- 206010002198 Anaphylactic reaction Diseases 0.000 description 4
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- 210000001744 T-lymphocyte Anatomy 0.000 description 4
- 230000009285 allergic inflammation Effects 0.000 description 4
- 230000036783 anaphylactic response Effects 0.000 description 4
- 208000003455 anaphylaxis Diseases 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 210000004443 dendritic cell Anatomy 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 229940044551 receptor antagonist Drugs 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 239000012279 sodium borohydride Substances 0.000 description 4
- 229910000033 sodium borohydride Inorganic materials 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
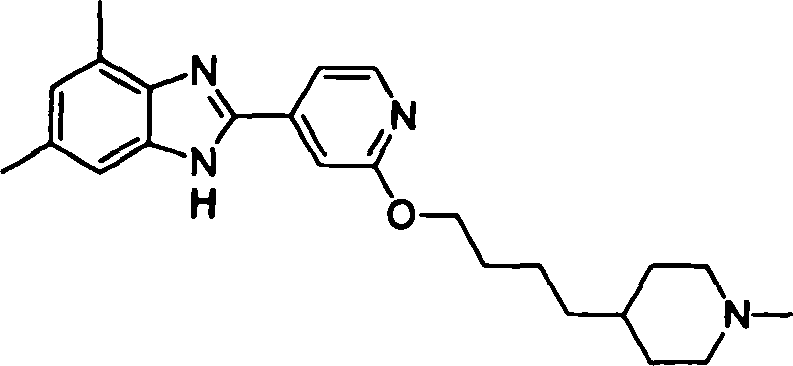
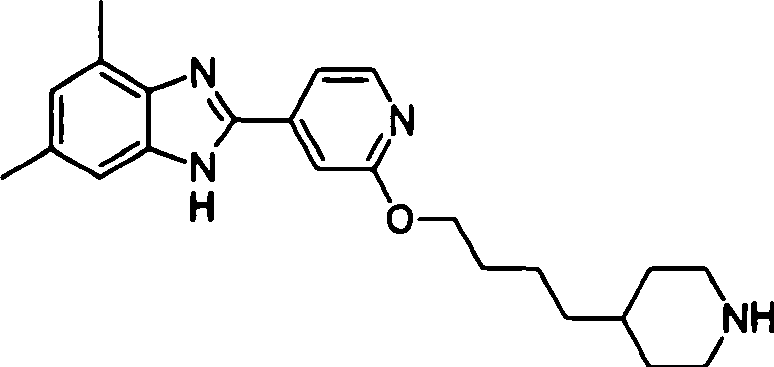
- HPTKWZUJABFYEQ-UHFFFAOYSA-N 2-(4-piperidin-4-ylbutoxy)pyridine-4-carbaldehyde Chemical compound O=CC1=CC=NC(OCCCCC2CCNCC2)=C1 HPTKWZUJABFYEQ-UHFFFAOYSA-N 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- RGHHSNMVTDWUBI-UHFFFAOYSA-N 4-hydroxybenzaldehyde Chemical compound OC1=CC=C(C=O)C=C1 RGHHSNMVTDWUBI-UHFFFAOYSA-N 0.000 description 3
- JCNVBPMFGXBWOI-UHFFFAOYSA-N 5-chloro-3-methylbenzene-1,2-diamine Chemical class CC1=CC(Cl)=CC(N)=C1N JCNVBPMFGXBWOI-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 3
- SUZLHDUTVMZSEV-UHFFFAOYSA-N Deoxycoleonol Natural products C12C(=O)CC(C)(C=C)OC2(C)C(OC(=O)C)C(O)C2C1(C)C(O)CCC2(C)C SUZLHDUTVMZSEV-UHFFFAOYSA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 3
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 238000009825 accumulation Methods 0.000 description 3
- 239000003513 alkali Substances 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 3
- 229910000024 caesium carbonate Inorganic materials 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- OHCQJHSOBUTRHG-UHFFFAOYSA-N colforsin Natural products OC12C(=O)CC(C)(C=C)OC1(C)C(OC(=O)C)C(O)C1C2(C)C(O)CCC1(C)C OHCQJHSOBUTRHG-UHFFFAOYSA-N 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 229940125425 inverse agonist Drugs 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 229910052744 lithium Inorganic materials 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 3
- 210000000440 neutrophil Anatomy 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 206010034674 peritonitis Diseases 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 239000012266 salt solution Substances 0.000 description 3
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- XNQIOISZPFVUFG-RXMQYKEDSA-N (R)-alpha-methylhistamine Chemical compound C[C@@H](N)CC1=CN=CN1 XNQIOISZPFVUFG-RXMQYKEDSA-N 0.000 description 2
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 2
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 2
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 2
- FEWLNYSYJNLUOO-UHFFFAOYSA-N 1-Piperidinecarboxaldehyde Chemical compound O=CN1CCCCC1 FEWLNYSYJNLUOO-UHFFFAOYSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- RKMGAJGJIURJSJ-UHFFFAOYSA-N 2,2,6,6-tetramethylpiperidine Chemical compound CC1(C)CCCC(C)(C)N1 RKMGAJGJIURJSJ-UHFFFAOYSA-N 0.000 description 2
- ZFFMLCVRJBZUDZ-UHFFFAOYSA-N 2,3-dimethylbutane Chemical group CC(C)C(C)C ZFFMLCVRJBZUDZ-UHFFFAOYSA-N 0.000 description 2
- ZMOMCILMBYEGLD-UHFFFAOYSA-N 2-chloro-4-hydroxybenzaldehyde Chemical compound OC1=CC=C(C=O)C(Cl)=C1 ZMOMCILMBYEGLD-UHFFFAOYSA-N 0.000 description 2
- MHQULXYNBKWNDF-UHFFFAOYSA-N 3,4-dimethylbenzene-1,2-diamine Chemical class CC1=CC=C(N)C(N)=C1C MHQULXYNBKWNDF-UHFFFAOYSA-N 0.000 description 2
- AXNUJYHFQHQZBE-UHFFFAOYSA-N 3-methylbenzene-1,2-diamine Chemical class CC1=CC=CC(N)=C1N AXNUJYHFQHQZBE-UHFFFAOYSA-N 0.000 description 2
- QPLKMRXNRMPSGI-UHFFFAOYSA-N 4-[2-[2-(4-fluorophenyl)-3h-imidazo[1,2-a]benzimidazol-4-ium-4-yl]ethyl]morpholin-4-ium;dichloride Chemical compound [Cl-].[Cl-].C1=CC(F)=CC=C1C(N1)=CN2C1=[N+](CC[NH+]1CCOCC1)C1=CC=CC=C12 QPLKMRXNRMPSGI-UHFFFAOYSA-N 0.000 description 2
- ZOJBOFJPDLZFEG-UHFFFAOYSA-N 4-bromo-3-[(dimethylamino)methyl]phenol Chemical compound CN(C)CC1=CC(O)=CC=C1Br ZOJBOFJPDLZFEG-UHFFFAOYSA-N 0.000 description 2
- XYQGXUVZWIXALT-UHFFFAOYSA-N 5-bromo-2-[4-(1-methylpiperidin-4-yl)butoxy]pyridine Chemical compound C1CN(C)CCC1CCCCOC1=CC=C(Br)C=N1 XYQGXUVZWIXALT-UHFFFAOYSA-N 0.000 description 2
- LGMPJRVDCVRQRW-UHFFFAOYSA-N 5-bromo-4-(dimethoxymethyl)-2-[4-(1-methylpiperidin-4-yl)butoxy]pyridine Chemical compound C1=C(Br)C(C(OC)OC)=CC(OCCCCC2CCN(C)CC2)=N1 LGMPJRVDCVRQRW-UHFFFAOYSA-N 0.000 description 2
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 229940122236 Histamine receptor antagonist Drugs 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- MFESCIUQSIBMSM-UHFFFAOYSA-N I-BCP Chemical compound ClCCCBr MFESCIUQSIBMSM-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- QKDDJDBFONZGBW-UHFFFAOYSA-N N-Cyclohexy-4-(imidazol-4-yl)-1-piperidinecarbothioamide Chemical compound C1CC(C=2NC=NC=2)CCN1C(=S)NC1CCCCC1 QKDDJDBFONZGBW-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- 235000019502 Orange oil Nutrition 0.000 description 2
- 108010058846 Ovalbumin Proteins 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 101100221606 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) COS7 gene Proteins 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 150000003851 azoles Chemical class 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 210000003651 basophil Anatomy 0.000 description 2
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- ANUZKYYBDVLEEI-UHFFFAOYSA-N butane;hexane;lithium Chemical compound [Li]CCCC.CCCCCC ANUZKYYBDVLEEI-UHFFFAOYSA-N 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 238000005352 clarification Methods 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 230000002354 daily effect Effects 0.000 description 2
- 238000013016 damping Methods 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 230000027119 gastric acid secretion Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 210000000224 granular leucocyte Anatomy 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- 230000018981 granulocyte chemotaxis Effects 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 125000001183 hydrocarbyl group Chemical group 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical group COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000012434 nucleophilic reagent Substances 0.000 description 2
- BTFQKIATRPGRBS-UHFFFAOYSA-N o-methyl-benzaldehyde Natural products CC1=CC=CC=C1C=O BTFQKIATRPGRBS-UHFFFAOYSA-N 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 239000010502 orange oil Substances 0.000 description 2
- PXQPEWDEAKTCGB-UHFFFAOYSA-N orotic acid Chemical compound OC(=O)C1=CC(=O)NC(=O)N1 PXQPEWDEAKTCGB-UHFFFAOYSA-N 0.000 description 2
- 229940092253 ovalbumin Drugs 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- CFHIDWOYWUOIHU-UHFFFAOYSA-N oxomethyl Chemical compound O=[CH] CFHIDWOYWUOIHU-UHFFFAOYSA-N 0.000 description 2
- QCXJEYYXVJIFCE-UHFFFAOYSA-N para-acetamidobenzoic acid Natural products CC(=O)NC1=CC=C(C(O)=O)C=C1 QCXJEYYXVJIFCE-UHFFFAOYSA-N 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- 229940023488 pill Drugs 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 125000004193 piperazinyl group Chemical group 0.000 description 2
- 125000005936 piperidyl group Chemical group 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical compound OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 2
- 150000003335 secondary amines Chemical class 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 229940095064 tartrate Drugs 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 230000008719 thickening Effects 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N thiocyanic acid Chemical compound SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 238000003828 vacuum filtration Methods 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- 125000006705 (C5-C7) cycloalkyl group Chemical group 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- NQBWNECTZUOWID-UHFFFAOYSA-N (E)-cinnamyl (E)-cinnamate Natural products C=1C=CC=CC=1C=CC(=O)OCC=CC1=CC=CC=C1 NQBWNECTZUOWID-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- GETTZEONDQJALK-UHFFFAOYSA-N (trifluoromethyl)benzene Chemical compound FC(F)(F)C1=CC=CC=C1 GETTZEONDQJALK-UHFFFAOYSA-N 0.000 description 1
- PAAZPARNPHGIKF-UHFFFAOYSA-N 1,2-dibromoethane Chemical compound BrCCBr PAAZPARNPHGIKF-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- FRASJONUBLZVQX-UHFFFAOYSA-N 1,4-naphthoquinone Chemical compound C1=CC=C2C(=O)C=CC(=O)C2=C1 FRASJONUBLZVQX-UHFFFAOYSA-N 0.000 description 1
- TUSDEZXZIZRFGC-UHFFFAOYSA-N 1-O-galloyl-3,6-(R)-HHDP-beta-D-glucose Natural products OC1C(O2)COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC1C(O)C2OC(=O)C1=CC(O)=C(O)C(O)=C1 TUSDEZXZIZRFGC-UHFFFAOYSA-N 0.000 description 1
- NIDSRGCVYOEDFW-UHFFFAOYSA-N 1-bromo-4-chlorobutane Chemical compound ClCCCCBr NIDSRGCVYOEDFW-UHFFFAOYSA-N 0.000 description 1
- VNBFUGOVQMFIRN-UHFFFAOYSA-N 1-chlorobutan-2-ol Chemical compound CCC(O)CCl VNBFUGOVQMFIRN-UHFFFAOYSA-N 0.000 description 1
- SJJCQDRGABAVBB-UHFFFAOYSA-N 1-hydroxy-2-naphthoic acid Chemical compound C1=CC=CC2=C(O)C(C(=O)O)=CC=C21 SJJCQDRGABAVBB-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- 125000004806 1-methylethylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 125000004484 1-methylpiperidin-4-yl group Chemical group CN1CCC(CC1)* 0.000 description 1
- FRPZMMHWLSIFAZ-UHFFFAOYSA-N 10-undecenoic acid Chemical compound OC(=O)CCCCCCCCC=C FRPZMMHWLSIFAZ-UHFFFAOYSA-N 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-N 1H-imidazole Chemical class C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- WXTMDXOMEHJXQO-UHFFFAOYSA-N 2,5-dihydroxybenzoic acid Chemical compound OC(=O)C1=CC(O)=CC=C1O WXTMDXOMEHJXQO-UHFFFAOYSA-N 0.000 description 1
- KKFDCBRMNNSAAW-UHFFFAOYSA-N 2-(morpholin-4-yl)ethanol Chemical compound OCCN1CCOCC1 KKFDCBRMNNSAAW-UHFFFAOYSA-N 0.000 description 1
- WKAVKKUXZAWHDM-UHFFFAOYSA-N 2-acetamidopentanedioic acid;2-(dimethylamino)ethanol Chemical compound CN(C)CCO.CC(=O)NC(C(O)=O)CCC(O)=O WKAVKKUXZAWHDM-UHFFFAOYSA-N 0.000 description 1
- SPCKHVPPRJWQRZ-UHFFFAOYSA-N 2-benzhydryloxy-n,n-dimethylethanamine;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 SPCKHVPPRJWQRZ-UHFFFAOYSA-N 0.000 description 1
- DSCUFZSWIGAJKM-UHFFFAOYSA-N 2-chloro-2-hydroxypropanoic acid Chemical class CC(O)(Cl)C(O)=O DSCUFZSWIGAJKM-UHFFFAOYSA-N 0.000 description 1
- OKDGRDCXVWSXDC-UHFFFAOYSA-N 2-chloropyridine Chemical compound ClC1=CC=CC=N1 OKDGRDCXVWSXDC-UHFFFAOYSA-N 0.000 description 1
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 1
- KPGXRSRHYNQIFN-UHFFFAOYSA-N 2-oxoglutaric acid Chemical compound OC(=O)CCC(=O)C(O)=O KPGXRSRHYNQIFN-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- PHKMEQDWLGKHKN-UHFFFAOYSA-N 3-[4-(1-methylpiperidin-4-yl)butoxy]benzonitrile Chemical compound C1CN(C)CCC1CCCCOC1=CC=CC(C#N)=C1 PHKMEQDWLGKHKN-UHFFFAOYSA-N 0.000 description 1
- HDYNIWBNWMFBDO-UHFFFAOYSA-N 3-bromo-2-chloropyridine Chemical compound ClC1=NC=CC=C1Br HDYNIWBNWMFBDO-UHFFFAOYSA-N 0.000 description 1
- UOQHWNPVNXSDDO-UHFFFAOYSA-N 3-bromoimidazo[1,2-a]pyridine-6-carbonitrile Chemical compound C1=CC(C#N)=CN2C(Br)=CN=C21 UOQHWNPVNXSDDO-UHFFFAOYSA-N 0.000 description 1
- SGHBRHKBCLLVCI-UHFFFAOYSA-N 3-hydroxybenzonitrile Chemical compound OC1=CC=CC(C#N)=C1 SGHBRHKBCLLVCI-UHFFFAOYSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- PIOKGAUSPFWRMD-UHFFFAOYSA-N 4-(trifluoromethoxy)benzene-1,2-diamine Chemical class NC1=CC=C(OC(F)(F)F)C=C1N PIOKGAUSPFWRMD-UHFFFAOYSA-N 0.000 description 1
- BSMPRJISGCTCDC-UHFFFAOYSA-N 4-chloro-5-fluorobenzene-1,2-diamine Chemical class NC1=CC(F)=C(Cl)C=C1N BSMPRJISGCTCDC-UHFFFAOYSA-N 0.000 description 1
- HOFKXNBVTNUDSH-UHFFFAOYSA-N 4-chloro-5-methylbenzene-1,2-diamine Chemical class CC1=CC(N)=C(N)C=C1Cl HOFKXNBVTNUDSH-UHFFFAOYSA-N 0.000 description 1
- JDWWIEFMFPWBST-UHFFFAOYSA-N 4-hydroxy-2-methylbenzaldehyde Chemical compound CC1=CC(O)=CC=C1C=O JDWWIEFMFPWBST-UHFFFAOYSA-N 0.000 description 1
- 229940090248 4-hydroxybenzoic acid Drugs 0.000 description 1
- DGRGLKZMKWPMOH-UHFFFAOYSA-N 4-methylbenzene-1,2-diamine Chemical class CC1=CC=C(N)C(N)=C1 DGRGLKZMKWPMOH-UHFFFAOYSA-N 0.000 description 1
- HGQGLXPNASSRMU-UHFFFAOYSA-N 5,5-difluoro-6-methylcyclohexa-1,3-diene-1,2-diamine Chemical class CC1C(N)=C(N)C=CC1(F)F HGQGLXPNASSRMU-UHFFFAOYSA-N 0.000 description 1
- PEECXPQMVXSFPH-UHFFFAOYSA-N 5-bromo-2-[3-(1-methylpiperidin-4-yl)propoxy]pyridine Chemical compound C1CN(C)CCC1CCCOC1=CC=C(Br)C=N1 PEECXPQMVXSFPH-UHFFFAOYSA-N 0.000 description 1
- FCRBJGVXRJYDAK-UHFFFAOYSA-N 5-bromo-2-[4-(1-methylpiperidin-4-yl)butoxy]pyridine-4-carbaldehyde Chemical compound C1CN(C)CCC1CCCCOC1=CC(C=O)=C(Br)C=N1 FCRBJGVXRJYDAK-UHFFFAOYSA-N 0.000 description 1
- NLWTZLOTHNSPOF-UHFFFAOYSA-N 5-chloro-2-[4-(1-methylpiperidin-4-yl)butoxy]pyridine Chemical compound C1CN(C)CCC1CCCCOC1=CC=C(Cl)C=N1 NLWTZLOTHNSPOF-UHFFFAOYSA-N 0.000 description 1
- LMVJPBGDCGAEET-UHFFFAOYSA-N 5-methyl-2-[4-(1-methylpiperidin-4-yl)butoxy]pyridine-4-carbaldehyde Chemical compound C1CN(C)CCC1CCCCOC1=CC(C=O)=C(C)C=N1 LMVJPBGDCGAEET-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- AWTVZZRCCPNRGQ-UHFFFAOYSA-N CN1CCC([O])CC1 Chemical compound CN1CCC([O])CC1 AWTVZZRCCPNRGQ-UHFFFAOYSA-N 0.000 description 1
- 239000005632 Capric acid (CAS 334-48-5) Substances 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 229940123069 Cyclic AMP stimulant Drugs 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UHFFFAOYSA-N D-OH-Asp Natural products OC(=O)C(N)CC(O)=O CKLJMWTZIZZHCS-UHFFFAOYSA-N 0.000 description 1
- DSLZVSRJTYRBFB-LLEIAEIESA-N D-glucaric acid Chemical compound OC(=O)[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O DSLZVSRJTYRBFB-LLEIAEIESA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 239000004278 EU approved seasoning Substances 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- KGWDUNBJIMUFAP-KVVVOXFISA-N Ethanolamine Oleate Chemical compound NCCO.CCCCCCCC\C=C/CCCCCCCC(O)=O KGWDUNBJIMUFAP-KVVVOXFISA-N 0.000 description 1
- 239000001263 FEMA 3042 Substances 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- 238000002738 Giemsa staining Methods 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- CKLJMWTZIZZHCS-UWTATZPHSA-N L-Aspartic acid Natural products OC(=O)[C@H](N)CC(O)=O CKLJMWTZIZZHCS-UWTATZPHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 229930195722 L-methionine Natural products 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 241001597008 Nomeidae Species 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- LRBQNJMCXXYXIU-PPKXGCFTSA-N Penta-digallate-beta-D-glucose Natural products OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-PPKXGCFTSA-N 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- KDCGOANMDULRCW-UHFFFAOYSA-N Purine Natural products N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- CWHJIJJSDGEHNS-MYLFLSLOSA-N Senegenin Chemical compound C1[C@H](O)[C@H](O)[C@@](C)(C(O)=O)[C@@H]2CC[C@@]3(C)C(CC[C@]4(CCC(C[C@H]44)(C)C)C(O)=O)=C4[C@@H](CCl)C[C@@H]3[C@]21C CWHJIJJSDGEHNS-MYLFLSLOSA-N 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- NSOXQYCFHDMMGV-UHFFFAOYSA-N Tetrakis(2-hydroxypropyl)ethylenediamine Chemical compound CC(O)CN(CC(C)O)CCN(CC(C)O)CC(C)O NSOXQYCFHDMMGV-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 241000405217 Viola <butterfly> Species 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- MIOPJNTWMNEORI-OMNKOJBGSA-N [(4s)-7,7-dimethyl-3-oxo-4-bicyclo[2.2.1]heptanyl]methanesulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-OMNKOJBGSA-N 0.000 description 1
- DPDMMXDBJGCCQC-UHFFFAOYSA-N [Na].[Cl] Chemical compound [Na].[Cl] DPDMMXDBJGCCQC-UHFFFAOYSA-N 0.000 description 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- AEMOLEFTQBMNLQ-WAXACMCWSA-N alpha-D-glucuronic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-WAXACMCWSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229940037003 alum Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 150000008378 aryl ethers Chemical class 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 230000036523 atherogenesis Effects 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- UPABQMWFWCMOFV-UHFFFAOYSA-N benethamine Chemical compound C=1C=CC=CC=1CNCCC1=CC=CC=C1 UPABQMWFWCMOFV-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- CUBCNYWQJHBXIY-UHFFFAOYSA-N benzoic acid;2-hydroxybenzoic acid Chemical compound OC(=O)C1=CC=CC=C1.OC(=O)C1=CC=CC=C1O CUBCNYWQJHBXIY-UHFFFAOYSA-N 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- BVGLIYRKPOITBQ-ANPZCEIESA-N benzylpenicillin benzathine Chemical compound C=1C=CC=CC=1C[NH2+]CC[NH2+]CC1=CC=CC=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C([O-])=O)(C)C)C(=O)CC1=CC=CC=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C([O-])=O)(C)C)C(=O)CC1=CC=CC=C1 BVGLIYRKPOITBQ-ANPZCEIESA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000036983 biotransformation Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004979 bone marrow derived macrophage Anatomy 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- 150000007516 brønsted-lowry acids Chemical class 0.000 description 1
- 150000007528 brønsted-lowry bases Chemical class 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- IAQRGUVFOMOMEM-UHFFFAOYSA-N butene Natural products CC=CC IAQRGUVFOMOMEM-UHFFFAOYSA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 229940095643 calcium hydroxide Drugs 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- KHAVLLBUVKBTBG-UHFFFAOYSA-N caproleic acid Natural products OC(=O)CCCCCCCC=C KHAVLLBUVKBTBG-UHFFFAOYSA-N 0.000 description 1
- 229960001631 carbomer Drugs 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 230000003399 chemotactic effect Effects 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 238000013375 chromatographic separation Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- NQBWNECTZUOWID-QSYVVUFSSA-N cinnamyl cinnamate Chemical compound C=1C=CC=CC=1\C=C/C(=O)OC\C=C\C1=CC=CC=C1 NQBWNECTZUOWID-QSYVVUFSSA-N 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000013170 computed tomography imaging Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 239000000625 cyclamic acid and its Na and Ca salt Substances 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 229960002887 deanol Drugs 0.000 description 1
- DIOQZVSQGTUSAI-NJFSPNSNSA-N decane Chemical compound CCCCCCCCC[14CH3] DIOQZVSQGTUSAI-NJFSPNSNSA-N 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 230000004041 dendritic cell maturation Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 1
- 229960000520 diphenhydramine Drugs 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical compound CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- PQLFROTZSIMBKR-UHFFFAOYSA-N ethenyl carbonochloridate Chemical compound ClC(=O)OC=C PQLFROTZSIMBKR-UHFFFAOYSA-N 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- HCPOCMMGKBZWSJ-UHFFFAOYSA-N ethyl 3-hydrazinyl-3-oxopropanoate Chemical compound CCOC(=O)CC(=O)NN HCPOCMMGKBZWSJ-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229940043351 ethyl-p-hydroxybenzoate Drugs 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 235000011194 food seasoning agent Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- LRBQNJMCXXYXIU-QWKBTXIPSA-N gallotannic acid Chemical compound OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@H]2[C@@H]([C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-QWKBTXIPSA-N 0.000 description 1
- 229960005219 gentisic acid Drugs 0.000 description 1
- 229950006191 gluconic acid Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- UHUSDOQQWJGJQS-UHFFFAOYSA-N glycerol 1,2-dioctadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(CO)OC(=O)CCCCCCCCCCCCCCCCC UHUSDOQQWJGJQS-UHFFFAOYSA-N 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 239000003979 granulating agent Substances 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 230000004957 immunoregulator effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 230000007803 itching Effects 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 1
- 229940099563 lactobionic acid Drugs 0.000 description 1
- 230000002045 lasting effect Effects 0.000 description 1
- 235000012204 lemonade/lime carbonate Nutrition 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- JCIVHYBIFRUGKO-UHFFFAOYSA-N lithium;2,2,6,6-tetramethylpiperidine Chemical compound [Li].CC1(C)CCCC(C)(C)N1 JCIVHYBIFRUGKO-UHFFFAOYSA-N 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical class O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 230000002969 morbid Effects 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- XRYGCVVVDCEPRL-UHFFFAOYSA-N n,1-dimethylpiperidin-4-amine Chemical compound CNC1CCN(C)CC1 XRYGCVVVDCEPRL-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- DIOQZVSQGTUSAI-UHFFFAOYSA-N n-butylhexane Natural products CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000003957 neurotransmitter release Effects 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229940074355 nitric acid Drugs 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 1
- 239000007764 o/w emulsion Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 229960002969 oleic acid Drugs 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 229940100691 oral capsule Drugs 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 229960005010 orotic acid Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229940116315 oxalic acid Drugs 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- DIVDFFZHCJEHGG-UHFFFAOYSA-N oxidopamine Chemical compound NCCC1=CC(O)=C(O)C=C1O DIVDFFZHCJEHGG-UHFFFAOYSA-N 0.000 description 1
- 235000019629 palatability Nutrition 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006201 parenteral dosage form Substances 0.000 description 1
- 239000003182 parenteral nutrition solution Substances 0.000 description 1
- 239000004031 partial agonist Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 235000019371 penicillin G benzathine Nutrition 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000004115 pentoxy group Chemical group [*]OC([H])([H])C([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 230000008447 perception Effects 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 210000003024 peritoneal macrophage Anatomy 0.000 description 1
- RLLPVAHGXHCWKJ-UHFFFAOYSA-N permethrin Chemical compound CC1(C)C(C=C(Cl)Cl)C1C(=O)OCC1=CC=CC(OC=2C=CC=CC=2)=C1 RLLPVAHGXHCWKJ-UHFFFAOYSA-N 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 150000004804 polysaccharides Chemical class 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- NTTOTNSKUYCDAV-UHFFFAOYSA-N potassium hydride Chemical compound [KH] NTTOTNSKUYCDAV-UHFFFAOYSA-N 0.000 description 1
- 229910000105 potassium hydride Inorganic materials 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- WSHYKIAQCMIPTB-UHFFFAOYSA-M potassium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [K+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 WSHYKIAQCMIPTB-UHFFFAOYSA-M 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000004237 preparative chromatography Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 238000010298 pulverizing process Methods 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 238000012207 quantitative assay Methods 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- VMXUWOKSQNHOCA-LCYFTJDESA-N ranitidine Chemical compound [O-][N+](=O)/C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 VMXUWOKSQNHOCA-LCYFTJDESA-N 0.000 description 1
- 229960000620 ranitidine Drugs 0.000 description 1
- GGWBHVILAJZWKJ-KJEVSKRMSA-N ranitidine hydrochloride Chemical compound [H+].[Cl-].[O-][N+](=O)\C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 GGWBHVILAJZWKJ-KJEVSKRMSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000009711 regulatory function Effects 0.000 description 1
- 230000027425 release of sequestered calcium ion into cytosol Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000002594 sorbent Substances 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 229910052567 struvite Inorganic materials 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229920002258 tannic acid Polymers 0.000 description 1
- 229940033123 tannic acid Drugs 0.000 description 1
- 235000015523 tannic acid Nutrition 0.000 description 1
- 239000009871 tenuigenin Substances 0.000 description 1
- FMLPQHJYUZTHQS-UHFFFAOYSA-N tert-butyl 3-methylpiperazine-1-carboxylate Chemical compound CC1CN(C(=O)OC(C)(C)C)CCN1 FMLPQHJYUZTHQS-UHFFFAOYSA-N 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 229950003937 tolonium Drugs 0.000 description 1
- HNONEKILPDHFOL-UHFFFAOYSA-M tolonium chloride Chemical compound [Cl-].C1=C(C)C(N)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 HNONEKILPDHFOL-UHFFFAOYSA-M 0.000 description 1
- IAQRGUVFOMOMEM-ONEGZZNKSA-N trans-but-2-ene Chemical compound C\C=C\C IAQRGUVFOMOMEM-ONEGZZNKSA-N 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 229960004418 trolamine Drugs 0.000 description 1
- 229960002703 undecylenic acid Drugs 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 229940099259 vaseline Drugs 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- MECHNRXZTMCUDQ-RKHKHRCZSA-N vitamin D2 Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)/C=C/[C@H](C)C(C)C)=C\C=C1\C[C@@H](O)CCC1=C MECHNRXZTMCUDQ-RKHKHRCZSA-N 0.000 description 1
- 235000001892 vitamin D2 Nutrition 0.000 description 1
- 239000011653 vitamin D2 Substances 0.000 description 1
- 239000007762 w/o emulsion Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- UGZADUVQMDAIAO-UHFFFAOYSA-L zinc hydroxide Chemical compound [OH-].[OH-].[Zn+2] UGZADUVQMDAIAO-UHFFFAOYSA-L 0.000 description 1
- 229940007718 zinc hydroxide Drugs 0.000 description 1
- 229910021511 zinc hydroxide Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/18—Benzimidazoles; Hydrogenated benzimidazoles with aryl radicals directly attached in position 2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C04—CEMENTS; CONCRETE; ARTIFICIAL STONE; CERAMICS; REFRACTORIES
- C04B—LIME, MAGNESIA; SLAG; CEMENTS; COMPOSITIONS THEREOF, e.g. MORTARS, CONCRETE OR LIKE BUILDING MATERIALS; ARTIFICIAL STONE; CERAMICS; REFRACTORIES; TREATMENT OF NATURAL STONE
- C04B35/00—Shaped ceramic products characterised by their composition; Ceramics compositions; Processing powders of inorganic compounds preparatory to the manufacturing of ceramic products
- C04B35/622—Forming processes; Processing powders of inorganic compounds preparatory to the manufacturing of ceramic products
- C04B35/626—Preparing or treating the powders individually or as batches ; preparing or treating macroscopic reinforcing agents for ceramic products, e.g. fibres; mechanical aspects section B
- C04B35/63—Preparing or treating the powders individually or as batches ; preparing or treating macroscopic reinforcing agents for ceramic products, e.g. fibres; mechanical aspects section B using additives specially adapted for forming the products, e.g.. binder binders
- C04B35/632—Organic additives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2318/00—Antibody mimetics or scaffolds
- C07K2318/10—Immunoglobulin or domain(s) thereof as scaffolds for inserted non-Ig peptide sequences, e.g. for vaccination purposes
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Manufacturing & Machinery (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Ceramic Engineering (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Materials Engineering (AREA)
- Structural Engineering (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Inorganic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Pulmonology (AREA)
- Oncology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
Abstract
苯并咪唑化合物,组合物,以及它们在白细胞募集抑制中,在调节H4受体中以及在治疗病症如炎症、H4受体介导的病症和相关病症中的用法。
Description
发明领域
本发明涉及新的药学活性的稠合杂环化合物,更具体地说,苯并咪唑化合物,以及使用它们治疗或预防由组胺H4受体介导的疾病和病症的方法。
发明背景
组胺起初被确认为是一种激素(G.Barger and H.H.Dale,J.Physiol.(London)1910,41:19-59),其后它表明在许多生理学过程中起重要的作用,包括经由H1受体的炎症性″三重反应″(A.S.F.Ash and H.O.Schild,Br.J.Pharmac.Chemother.1966,27:427-439),经由H2受体的胃酸分泌(J.W.Black et al.,Nature 1972,236:385-390),以及经由H3受体的中枢神经系统中的神经递质释放(J.-M.Arrang et al.,Nature 1983,302:832-837)(评述参见S.J.Hill et al.,Pharmacol.Rev.1997,49(3):253-278)。所有三种组胺受体亚型已经表明是G蛋白-偶联受体超家族的成员(I.Gantz et al.,Proc.Natl.Acad.Sci.U.S.A.1991,88:429-433;T.W.Lovenberg et al.,Mol.Pharmacol.1999,55(6):1101-1107;M.Yamashitaet al.Proc.Natl.Acad.Sci.U.S.A.1991,88:11515-11519)。然而,还报道了组胺的其它功能,对此没有受体被识别。例如,在1994年,Raible等证实:组胺和R-α-甲基组胺可以激活人嗜酸性细胞中的钙动员(D.G.Raible et al.,Am.J.Respir.Crit.Care Med.1994,149:1506-1511)。这些应答被H3-受体拮抗剂噻普酰胺阻滞。然而,R-α-甲基组胺明显比组胺具有更低的效力,其与包含已知H3受体亚型的不一致。因此,Raible等人猜测在嗜酸性粒细胞上存在non-H1、non-H2和non-H3的新组胺受体。最近,一些研究(T.Oda et al.,J.Biol.Chem.2000,275(47):36781-36786;C.Liu et al.,Mol.Pharmacol.2001,59(3):420-426;T.Nguyen etal.,Mol.Pharmacol.2001,59(3):427-433;Y.Zhu et al.,Mol.Pharmacol.2001,59(3):434-441;K.L.Morse et al.,J.Pharmacol.Exp.Ther.2001,296(3):1058-1066)已经确定和表征了第四种组胺受体亚型,H4受体。这种受体是一种390氨基酸、7-横跨膜、G蛋白-偶联受体,其与组胺H3受体具有约40%的同源性。与H3受体主要位于脑内相反,H4受体在嗜酸性粒细胞、肥大细胞以及其它细胞中有更大程度的表达,正如Liu等(参见上面)和C.L.Hofstra等报道的那样(J.Pharmacol.Exp.Ther.2003,305(3):1212-1221)。由于它在免疫活性细胞上的优先表达,在免疫应答期间,这种H4受体与组胺的调节功能密切相关。
在免疫学和自身免疫病的范围内,组胺的生物学活性与过敏反应及其有害作用如炎症密切相关。引起炎症应答的情况包括物理刺激(包括创伤)、化学刺激、感染和异物侵入。炎症应答的特征为疼痛、体温升高、发红、肿胀、功能降低或这些的综合。
肥大细胞脱颗粒作用(细胞脱粒作用)释放组胺并引起炎症应答,该炎症应答的最初特征可能在于组胺调节的风团潮红反应。各式各样的免疫刺激(例如,过敏原或抗体)和非免疫(例如,化学品)刺激可以造成肥大细胞的激活、募集和脱颗粒。肥大细胞激活引发过敏性(H1)炎性反应,其反过来引起进一步促进炎症应答的其它效应细胞的募集。所述的组胺H2受体调节胃酸分泌,以及所述的组胺H3受体在中枢神经系统中影响神经递质释放。
H4受体调节控制炎症介质的释放并抑制白细胞募集,由此能够预防和/或治疗H4-调节的疾病和病症,包括过敏性反应的有害作用如炎症。本发明的化合物具有H4受体调节性质。本发明的化合物具有白细胞募集抑制性质。本发明的化合物具有抗炎性质。
涉及炎症的教科书的例子包括J.I.Gallin and R.Snyderman,Inflammation:Basic Principles and Clinical Correlates,3rdEdition,(Lippincott Williams & Wilkins,Philadelphia,1999);V.Stvrtinova,J.Jakubovsky and I.Hulin,″Inflammation and Fever″,Pathophysiology Principles of Diseases(Textbook for Medical Students,Academic Press,1995);Cecil et al.,Textbook Of Medicine,18thEdition(W.B.Saunders Company,1988);and Steadmans MedicalDictionary。
有关炎症以及与炎症有关的病症的背景技术和评论材料例如可以在下面的文章中找到:C.Nathan,Points of control in inflammation,Nature 2002,420:846-852;K.J.Tracey,The inflammatory reflex,Nature 2002,420:853-859;L.M.Coussens and Z.Werb,Inflammationand cancer,Nature 2002,420:860-867;P.Libby,Inflammation inatherosclerosis,Nature 2002,420:868-874;C.Benoist and D.Mathis,Mast cells in autoimmune disease,Nature 2002,420:875-878;H.L.Weiner and D.J.Selkoe,Inflammation and therapeutic vaccination inCNS diseases,Nature 2002,420:879-884;J.Cohen,Theimmunopathogenesis of sepsis,Nature 2002,420:885-891;D.Steinberg,Atherogenesis in perspective:Hypercholesterolemia and inflammation aspartners in crime,Nature Medicine 2002,8(11):1211-1217。
在此所述的炎症是指由于组胺释放形成的应答,其反过来由至少一种刺激引起。这些刺激的例子是免疫刺激和非免疫刺激。
炎症是由于许多病症的任何一种所引起的,这些病症例如是过敏反应、哮喘、慢性阻塞性肺病(COPD)、动脉粥样硬化、类风湿性关节炎、多发性硬化、炎性肠病(包括克罗恩氏病和溃疡性结肠炎)、牛皮癣、过敏性鼻炎、硬皮病、自身免疫性甲状腺病、免疫调节的(亦称1型)韦利斯氏病和狼疮,其特征为在该疾病的某一阶段出现过度和持续炎症。其它引起炎症的自身免疫性疾病包括重症肌无力、自身免疫性神经病如格-巴二氏神经病、自身免疫性葡萄膜炎、自身免疫性溶血性贫血、恶性贫血、自身免疫性血小板减少、颞动脉炎、抗磷脂综合症、血管炎如眶坏死性肉芽肿病、贝切特氏病、疱疹样皮炎、寻常天疱疮、白斑病、原发性胆汁性肝硬变、自身免疫性肝炎、自身免疫性卵巢炎和睾丸炎、肾上腺的自身免疫性疾病、多发性肌炎、皮肌炎、脊椎关节病如强直性脊柱炎、以及舍格伦综合症。关心炎症、炎性疾病或炎症调节的疾病或病症的发作和进展包括,但不局限于,急性炎症、过敏性炎症和慢性炎症。
引用的文献在此引入作为参考。
发明概述
本发明提供式(I)或(II)的化合物:
其中的符号具有下述定义(不论是作为单元,还是作为取代基):
W独立地是N或CR7;
X独立地是N或CH;
Y独立地是O、NR12或CR12R13;
Z独立地是N或CR14,在这样情况下,式(I)和(II)任何一个中的实线/虚线符号()是单键;或Z是C,在这样情况下,式(I)和(II)任何一个中的实线/虚线符号()是双键;
n独立地是0、1或2;
每个R1-4独立地是H、C1-4烷基、C2-5链烯基、C2-5炔基、C3-6环烷基、-C1-4烷氧基、-C1-4烷基氨基、-C1-4烷硫基、-C1-4烷基磺酰基、-OC3-6环烷基、-OCH2Ph、氰基、-CF3、F、Cl、Br、I、硝基、-OCF3、-SCF3、-ORc、-SRc、-S(O)Rc、-SO2Rc、-C(O)Rc、苯基、苄基、苯乙基、-C(O)NRaRb、-C(O)ORc、-NRaRb、-CH2NRaRb或-CH2ORc;其中每个Ra、Rb和Rc独立地选自H、C1-4烷基、C3-6环烷基、苯基、(C3-6环烷基)C1-2烷基-、苄基和苯乙基,或Ra和Rb与它们相连的氮一起形成一个4-7元杂环HetCyc1,其中所述的环HetCyc1具有0或1个其它的选自O、S、>NH和>NC1-6烷基的杂原子,以及其中在任何所述的R1-4、Ra、Rb、Rc和所述环HetCyc1中,任何苯基、苯乙基、苄基、烷基或环烷基部分任选独立地被1、2或3个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;
每个R5-7独立地是H、C1-6烷基、F、Cl、Br、I、-CF3、-OCF3、-ORc、-C1-3烷基ORc、-C1-3烷基SRc、-SRc、-S(O)Rc、-SO2Rc、C1-4烷氧基、氰基、硝基、-C(O)NRaRb、-NRaRb、-C1-3烷基NRaRb、-C(O)苯基、-C(O)C1-6烷基、-S(O)C1-4烷基或-SO2C1-4烷基;或对于式(I)化合物,R5和R6与它们相连的碳原子一起形成选自芳基、杂芳基、5-或6-元碳环和具有1或2个杂原子的5-或6-元杂环的环结构Cyc1,其中所述的环结构Cyc1独立地被0、1或2个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;或对于式(II)化合物,R7和R6与它们相连的碳原子一起形成选自芳基、杂芳基、5-或6-元碳环和具有1或2个杂原子的5-或6-元杂环的环结构Cyc2,其中所述的环结构Cyc2独立地被0、1或2个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;
R8独立地是H、C1-6烷基、C1-4烷氧基或OH;
每个R9和R10独立地是H或C1-6烷基,或R9和R10一起形成5-6元环状结构Cyc3,其中所述的环状结构Cyc3是5-或6-元碳环或具有1或2个杂原子的5-或6-元杂环,以及其中所述的环结构Cyc3独立地被0、1或2个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;
R11独立地是H或C1-4烷基;
每个R12和R13独立地是H或C1-4烷基;或者,当Y是CR12R13时,R12和R13与它们相连的碳一起形成任选取代的环结构Cyc4,其中所述的环结构Cyc4是3-至6-元碳环或具有0或1个其它杂原子的3-至6-元杂环,或者CR12R13是C=O;
R14独立地是H、C1-4烷基、OH或C1-4烷氧基;
其对映异构体、非对映异构体、外消旋体,或其药学上可接受的盐、酰胺或酯;
条件是:
当Y是O或NR12时,那么Z是CR14以及R8不是OH或C1-4烷氧基;当Z是N时,Y是CR12R13;以及
R1-4中没有一个是C(O)NH2。
本发明包括式(I)和(II)化合物的异构体形式以及它们药学上可接受的盐、酰胺和酯,在此所提及的这些异构体形式之一是指这些异构体形式中的至少一种。本领域普通熟练技术人员知道,本发明的化合物例如可以以单一异构形式存在,而其它化合物可以以区域异构体混合物的形式存在。
无论在说明书和权利要求的任何部分中是否已经明确说明,可以理解,除非另有说明,在本发明上下文中的每个取代基和元彼此是相互独立的。例如在取代基术语上的第一个例子,如果取代基S1 例子是S1和S2之一,以及取代基S2 例子是S3和S4之一,那么这些赋值是指本发明的实施方案,其根据所述选择S1 例子是S1和S2 例子是S3;S1 例子是S1和S2 例子是S4;S1 例子是S2和S2 例子是S3;S1 例子是S2和S2 例子是S4;以及这些选择的每一种的等同物。因此,在此使用的更短的术语″S1 例子是S1和S2之一,以及S2 例子是S3和S4之一″是为了简明起见,但决不是对其构成限制。前述在取代基术语上的第一个例子,其以一般术语表示,是指用于说明在此所述的各种取代基R的赋值。在此所给出的对于取代基的前面规定,当适用时,延伸至单元如X、Y、Z和W,以及指数n。
此外,当不止一个赋值给予任何单元或取代基时,本发明的实施方案包含各种可以从所列赋值及其等同物中得出的各种组合。例如在取代基术语上的第二个例子,如果在此所述的取代基S例子是S1、S2和S3之一,那么这种列举是指本发明的实施方案其中S例子是S1;S例子是S2;S例子是S3;S例子是S1和S2之一;S例子是是S1和S3之一;S例子是S2和S3之一;S例子是S1、S2和S3之一;以及S例子是这些选择的每一个的任何等同物。因此,为简便起见,在此使用更短的术语″S例子是S1、S2和S3之一″,但决不是对其构成限制。在取代基术语上的前述第二个例子,其以一般术语表示,是说明在此所述的各种取代基R赋值。在此所给出的对于取代基的前面规定,当适用时,延伸至单元如X、Y、Z和W以及指数n。
术语″Ci-j″其中j>i当在此用于一类取代基时,是指从i到j(包括i和j)个众多碳原子中的每一个本发明的实施方案都能实现。例如,术语C1-3独立地是指具有一个碳单元(C1)的实施方案,具有两个碳单元(C2)的实施方案和具有三个碳单元(C3)的实施方案。
当关于取代基、化合物单元或指数的任何变量出现一次以上时,每次出现时都适用全部范围的数值,并且该全部范围数值不受这些变量在其他任何地方出现时所指定的具体赋值的限制。
根据上述对赋值和术语的解释性考虑,可以理解,在此明确地指出一组赋值,其中化学上是有意义的以及除非另有说明,暗示着独立地指这组的实施方案,并且还指该明确指出的一组的亚组的每一可能的实施方案。
本发明还提供一种在患者中用于治疗或预防H4受体-介导的病症的药物组合物,其中该药物组合物包含治疗有效量的至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的H4受体调节剂。此外,本发明提供一种在患者中用于抑制白细胞募集的药物组合物,其中该药物组合物包含治疗有效量的至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的白细胞募集抑制剂。此外,本发明提供一种抗炎药物组合物,其中该药物组合物包含治疗有效量的至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的抗炎化合物。
本发明提供在患者中用于治疗或预防炎症的方法,该方法包括给予与炎症应答有关的患者一种药物组合物,其中该药物组合物包含治疗有效量的至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的抗炎化合物。本发明还提供在患者中用于治疗或预防H4受体-介导的病症的方法,包括给予所述患者一种药物组合物,其中该药物组合物包含治疗有效量的至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的H4受体调节剂。此外,本发明提供调节H4受体的方法,包括将H4受体暴露于至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的化合物中。此外,本发明提供在患者中用于抑制白细胞募集的方法,包括给予所述患者一种药物组合物,其中该药物组合物包含治疗有效量的至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的白细胞募集抑制剂。
发明详述
本发明涉及如在此所定义的式(I)或(II)的化合物、其对映异构体、非对映异构体、外消旋体、药学上可接受的盐、酰胺和酯,含有至少一种这些化合物的药物组合物,使用方法,包括用于治疗和/或预防病症如通过H4受体介导的那些病症,以及这些药物组合物的制备方法。
下面对下列术语作出定义,这些术语也在整个公开内容中通过其应用加以定义。
″烷基″包括至少一个氢被除去以生成一个基团的直链和支链烃。烷基包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、1-甲基丙基、戊基、异戊基、仲戊基、己基、庚基、辛基等。烷基不包括环烷基。
″链烯基″包括含有至少一个碳-碳双键(sp2)的如上所述的直链和支链烃基。除非用表示碳成员的数目的前缀另加说明,链烯基包括乙烯基、丙-1-烯基、丙-2-烯基(或烯丙基)、异丙烯基(或1-甲基乙烯基)、丁-1-烯基、丁-2-烯基、丁二烯基、戊烯基、己-2,4-二烯基等。
″炔基″包括至少一个碳-碳三键(sp)的如上所述的直链和支链烃基。除非用表示碳成员的数目的前缀另加说明,炔基包括乙炔基、丙炔基、丁炔基和戊炔基。同时具有双键和三键的烃基,如2-戊烯-4-炔基,在此归于炔基的范围中。
″烷氧基″包括具有未端氧的直链或支链烷基,其中烷基通过氧与分子的其余部分相连。烷氧基包括甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、叔丁氧基、戊氧基等。
″氨基烷基″、″烷硫基″和″磺酰烷基″类似于烷氧基,烷氧基的末端氧原子分别被NH(或NR)、S和SO2替换。
除非用表示碳成员的数目的前缀另加说明,″环烷基″包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。
除非用表示环状结构中环原子的数目的前缀另加说明,″杂环基″、″杂环的″或″杂环″是3-至8-元芳香族的、饱和的或部分饱和的单一或稠合环系,其包含碳原子和选自N、O和S的杂原子。杂环基的例子包括噻唑基、呋喃基、吡喃基、异苯并呋喃基、吡咯基、咪唑基、吡唑基、异噻唑基、异唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、中氮茚基、异吲哚基、吲哚基、吲唑基、嘌呤基、喹啉基、呋咱基、吡咯烷基、吡咯啉基、咪唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、哌啶基、哌嗪基、二氢吲哚基和吗啉基。例如,优选的杂环基包括吗啉基、哌嗪基、吡咯烷基、吡啶基、环己基亚氨基、环庚基亚氨基,更优选是哌啶基。
碳环是没有苯并
的环烷基或部分饱和的环烷基。
″芳基″包括苯基、萘基、联苯基、四氢萘基等,它们任何一个可以被任选取代。芳基还包括芳烷基如苄基、苯乙基和苯丙基。芳基包括含任选取代的6-元碳环芳环的环系,所述体系可以是二环、桥连和/或稠合。所述体系可以包括芳香族的、或部分或全部饱和的环。环系的例子包括茚基、pentalenyl、1-4-二氢萘基、茚满基、苯并咪唑基、苯并噻吩基、吲哚基、苯并呋喃基、异喹啉基等。杂芳基的说明性例子是噻吩基、呋喃基、吡咯基、咪唑基、唑基、噻唑基、苯并噻吩基、苯并呋喃基、苯并咪唑基、苯并唑基、苯并噻唑基。
″卤素″包括氟、氯、溴和碘,并且优选是氟或氯。
如同在标准化学命名法中,基团苯基在此被称为″苯基″或″Ph″。
″患者″或″受试者″包括需要观察、实验、治疗或预防与相关疾病或病症有关的哺乳动物如人和动物(例如,狗、猫、马、大鼠、兔、小鼠、非人灵长目动物)。优选地,所述的患者是人。
″组合物″包括一种产物,其包含指定数量(包括有效量)的指定组分,以及任何产物,其直接或间接通过指定数量的指定组分的组合产生效果。
″治疗有效量″或″有效量″以及语法相关的术语是指活性化合物或药物的数量,这种数量在被研究人员、兽医、医生或其它临床医生所调查的组织系统、动物或人中引起生物学或药学应答,所述的生物学或药学应答包括所治疗疾病或障碍的症状的减轻。
缩写表
| 术语 | 缩写 |
| 四氢呋喃 | THF |
| N,N-二甲基甲酰胺 | DMF |
| N,N-二甲基乙酰胺 | DMA |
| 二甲亚砜 | DMSO |
| 叔丁氨基羰基 | BOC |
| 牛血清白蛋白 | BSA |
| 高压液相色谱 | HPLC |
| 薄层色谱 | TLC |
本发明特别优选的化合物包括式(I)或(II)的苯并咪唑化合物或其对映异构体、非对映异构体、外消旋体或其药学上可接受的盐、酰胺或酯,其中R1-14、X、Y、Z、W和n具有上文定义的任何含义及其同等物,或至少一种下列规定及其同等物。如果合适的话,这些规定可以在此定义的任何定义、权利要求或实施方案中使用:
优选地,W是N或CR7。
优选地,X是N或CH。
优选地,Y是CR12R13。
更优选地,Y是CH2。
优选地,Z是N或CH。
优选地,n=1或2。
更优选地,n=1。
优选地,R1选自H、甲基、乙基、异丙基、环丙基、F、Cl、Br、氰基、苯基、羧甲基、二甲酰胺基或CH2OMe。
更优选地,R1是H、甲基、F或Cl。
优选地,R2独立地选自H、甲基、乙基、异丙基、叔丁基、环丙基、CF3、OCF3、F、Cl、Br、氰基、苯基、羧甲基、二甲酰胺基或苯甲酰基。
更优选地,R2是H、F、Cl、甲基、CF3、OCF3或叔丁基。
优选地,R3独立地选自H、甲基、乙基、异丙基、叔丁基、环丙基、CF3、OCF3、F、Cl、Br、氰基、苯基、羧甲基、二甲酰胺基或苯甲酰基。
更优选地,R3是H、F、Cl、甲基、CF3、OCF3或叔丁基。
优选地,R4选自H、甲基、乙基、异丙基、环丙基、R、Cl、Br、氰基、苯基、羧甲基、二甲酰胺基或CH2OMe。
更优选地,R4是H、甲基、F或Cl。
最优选地,R1-4中的一个或两个不是H。
优选地,R5是H、F、Cl、甲基或乙基。
更优选地,R5是F、Cl、甲基、羟甲基、羟乙基、吡咯烷基甲基或二乙氨基甲基。
更优选地,R6是H、F、Cl或甲基。
更优选地,R7是H、F、Cl或甲基。
最优选地,R5是Cl、甲基或羟甲基。
优选地,R8是H、甲基或OH。
更优选地,R8是H。
优选地,R9和R10独立地选自
a)H,
b)甲基、乙基、丙基、异丙基,和
c)三氟甲基。
最优选地,R9和R10独立地是H或甲基。
优选地,R11是H、甲基或乙基。
更优选地,R11是甲基。
式(I)或(II)的化合物还包括化合物,该化合物满足在此给出的定义及其同等物的任何一种组合。
可以理解,在此所指的一些化合物是手性的和/或具有几何异构中心,例如E-和Z-异构体。本发明包括所有这些具有本发明化合物特征活性的光学异构体,包括立体异构体和外消旋混合物、非对映异构体和几何异构体。此外,在此所述的某些化合物可以以溶剂合物和非溶剂合物的形式存在。可以理解,本发明包括所有这些具有本发明化合物所表现出的活性的溶剂合物和非溶剂合物的形式。本发明的化合物,其为了被某些分析技术所检测而进行了修饰,也包括在本发明的范围内。这些化合物的例子是同位素标记的化合物,例如18F同位素标记的化合物,其在检测和/或成像技术中如电子发射断层扫描(PET)和单光子发射计算层析成象(SPECT)中可用作探针。这些化合物的另一个例子是同位素标记的化合物,例如氘和/或氚标记的化合物,它们可以用于反应动力学研究。
可以理解,在此所述的取代和取代的组合,不管是否已经明确说明,是指与被取代的成员的化合价一致的取代。例如,碳上的取代是指四价的C;氮上的取代是指三价的N;四价的氮通常用正电荷表征。化合价所允许的选择是本领域常规技术的一部分。
″其药学上可接受的盐、酰胺和/或酯″是指对药物化学家来说显而易见的本发明化合物的盐、酰胺和酯形式,即,无毒的并且将有利地影响本发明所述化合物的药理学性质的那些。具有有利的药理学性质的那些化合物对药物化学家来说是显而易见的,即,无毒的并且具有这样的药理学性质以提供足够的适口性、吸收、分布、代谢和排泄。其它因素,在本质上更实际,其在原材料的选择和成本、所得成批药物的结晶容易性、收率、稳定性、吸湿性和流动性中同样重要。
可用于制备药学上可接受的盐的代表性的酸和碱包括下列:酸包括乙酸、2,2-二氯乳酸、酰化氨基酸、己二酸、褐藻酸、抗坏血酸、L-天冬氨酸、苯磺酸、苯甲酸、4-乙酰胺基苯甲酸、(+)-樟脑酸、樟脑磺酸、(+)-(1S)-樟脑-10-磺酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、2-羟基-乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸、D-葡糖酸、D-葡糖醛酸、L-谷氨酸、α-氧代-戊二酸、羟基乙酸、hipuric acid、氢溴酸、盐酸、(+)-1-乳酸、(±)-DL-乳酸、乳糖酸、马来酸、(-)-1-苹果酸、丙二酸、(±)-DL-扁桃酸、甲磺酸、萘-2-磺酸、萘-1,5-二磺酸、1-羟基-2-萘酸、烟酸、硝酸、油酸、乳清酸、草酸、棕榈酸、扑酸、磷酸、L-焦谷氨酸、水杨酸、4-氨基-水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、鞣酸、(+)-1-酒石酸、硫氰酸、对甲苯磺酸和十一碳烯酸;以及碱包括氨水、L-精氨酸、benethamine、苄星青霉素G、氢氧化钙、胆碱、丹醇、二乙醇胺、二乙胺、2-(二乙氨基)-乙醇、乙醇胺、乙二胺、N-甲基-葡糖胺、哈胺、1H-咪唑、L-赖氨酸、氢氧化镁、4-(2-羟基乙基)-吗啉、哌嗪、氢氧化钾、1-(2-羟基乙基)-吡咯烷、仲胺、氢氧化钠、三乙醇胺、氨基丁三醇和氢氧化锌。
参见,例如,S.M.Berge等″Pharmaceutical Salts″,J.Pharm.Sci.1977,66:1-19,其在此引入作为参考。合适酯的例子包括C1-7烷基、C5-7环烷基、苯基、取代苯基和苯基C1-6烷基的酯。优选的酯包括甲酯。
本发明包括本发明化合物的前药。通常,这些前药是本发明化合物的功能性衍生物,其在体内很容易转化为所需的化合物。因此,在本发明的治疗方法中,术语″给药″应包括用在此具体公开的化合物或没有具体公开的但在给予患者后在体内转化为具体化合物的化合物治疗各种疾病。类似地,当提及到本发明的化合物时,除式(I)或(II)的具体化合物外,术语″化合物″应该包括给药后在体内转换为具体公开化合物的化合物(或前药),即使这种前药没有在此明确公开。选择和制备合适的前药衍生物的常规方法例如描述在″Design of Prodrugs″,ed.H.Bundgaard,Elsevier,1985中。
W是CR7的化合物根据方案1和2中所列的合成方法进行制备,这些化合物的例子如下所示:
实施例 化合物
1 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑;
2 2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
3 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲氧基-1H-苯并咪唑;
4 5-叔丁基-2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5 5-叔丁基-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
6 4,5-二甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
7 5-叔丁基-2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
8 5-叔丁基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
9 (1-{3-[4-(5-叔丁基-1H-苯并咪唑-2-基)-2-氯-苯氧基]-丙基}-吡咯烷-3-基)-二甲胺;
10 5-氯-2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-6-甲基-1H-苯并咪唑;
11 2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
12 5-甲基-2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-萘-1-基}-1H-苯并咪唑;
13 4-[3-(5-叔丁基-1H-苯并咪唑-2-基)-苯氧基]-1-(4-甲基-哌嗪-1-基)-丁烷-1-酮;
14 5-氯-2-[3-氯-4-(3-哌嗪-1-基-丙氧基)-苯基]-6-氟-1H-苯并咪唑;
15 5-叔丁基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
16 2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑;
17 2-{2-氯-4-[2-甲基-3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
18 5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-甲基-1H-苯并咪唑;
19 6-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
20 5-叔丁基-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
21 5-氯-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
22 2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑;
23 5-氯-6-甲基-2-[3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
24 5-氯-6-氟-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
25 2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑;
26 5,6-二氟-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
27 2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
28 2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑;
29 5,6-二甲基-2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
30 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑;
31 2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
32 5-叔丁基-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
33 2-{3-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
34 5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑;
35 5,6-二氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
36 5-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
37 5-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑;
38 5-氯-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
39 2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑;
40 5,6-二氯-2-{3-氯-4-{3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
41 5-氯-6-甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
42 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑;
43 5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
44 2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
45 5-氯-6-氟-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
46 5-甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
47 2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
48 2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
49 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
50 5-氯-6-氟-2-{3-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
51 2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基1-苯基}-5-甲氧基-1H-苯并咪唑;
52 5-叔丁基-2-{3,5-二溴-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
53 2-{2-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
54 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
55 2-{3-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
56 (2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑-5-基)苯基-甲酮;
57 6-氯-2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
58 5-叔丁基-2-{3-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
59 2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑;
60 5-氯-6-甲基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
61 5-氯-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
62 5-氯-6-氟-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
63 5-叔丁基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
64 5-甲基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
65 2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
66 6-氯-2-{2-氟-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
67 5-氟-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
68 4-氯-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
69 6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
70 5-氯-2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑;
71 2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-3H-萘并[1,2-d]咪唑;
72 4,6-二甲基-2-{2-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
73 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
74 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-氟-4-甲基-1H-苯并咪唑;
75 2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基)-3H-萘并[1,2-d]咪唑;
76 6-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5H-[1,3]二氧杂环戊烯并[4′,5′:4,5]苯并[1,2-d]咪唑;
77 6-氯-2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
78 2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
79 4,6-二甲基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
80 5-氯-2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
81 2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
82 {2-(6-氯-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺;
83 {2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺;
84 4-(3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-[1,4]二氮杂环庚烷-5-酮;
85 4-{3-[4-(5-叔丁基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-1-甲基-[1,4]二氮杂环庚烷-5-酮;
86 5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
87 5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
88 6-氯-4-甲基-2-[2-甲基-4-(3-哌啶-4-基-丙氧基)-苯基]-1H-苯并咪唑;
89 5-氟-4-甲基-2-[2-甲基-4-(3-哌啶-4-基-丙氧基)-苯基]-1H-苯并咪唑;
90 6-氯-2-{4-[3-(1-乙基-哌啶-4-基)-丙氧基]-2-甲基-苯基}-4-甲基-1H-苯并咪唑;
91 {2-[3-氯-4-(4-甲基-1H-苯并咪唑-2-基)-苯氧基]-乙基}-甲基-(1-甲基-哌啶-4-基)-胺;
92 6-氯-4-甲基-2-{2-甲基-4-[2-(1-甲基-哌啶-4-基氧基)-乙氧基]-苯基}-1H-苯并咪唑;
93 6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
94 5-氟-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基}-苯基}-1H-苯并咪唑;
95 6-氟-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
96 7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
97 6,7-二甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
98 5-氯-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
99 5,7-二甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
100 5-氯-7-甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
101 6-氟-7-甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
102 6-氟-7-甲基-2-{3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯基}-1H-苯并咪唑;和
176 {2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)丙氧基]苯基}甲醇。
其中W是N的化合物按照合成路线1-6的合成方法制备,并且这类化合物的实例列述如下:
实例 化合物
103 6-氯-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
104 4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
105 5-氟-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
106 4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
107 4,5-二甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
108 4-氯-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
109 6-氯-4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
110 4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
111 5-氟-4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
112 4,5-二甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
113 4,6-二甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
114 4-氯-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
115 2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-5-氟-4-甲基-1H-苯并咪唑;
116 2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
117 6-氯-2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
118 2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4,6-二甲基-1H-苯并咪唑;
119 2-{4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
120 5-氟-2-{4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
121 5-氟-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
122 4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
123 6-氯-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
124 4,5-二甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
125 4,6-二甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
126 5-氯-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
127 5-氟-4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-4-吡咯烷-1-基甲基-吡啶-3-基}-1H-苯并咪唑;
128 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
129 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑;
130 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-6-氯-4-甲基-1H-苯并咪唑;
131 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑;
132 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
133 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-4-甲基-1H-苯并咪唑;
134 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-叔丁基-1H-苯并咪唑;
135 5-叔丁基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
136 2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑;
137 2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
138 4,6-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
139 4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
140 4,5-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
141 5-氟-4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
142 6-氯-4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
143 5-氟-4-甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
144 4,5-二甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
145 4,6-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
146 4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
147 5-氟-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
148 4-氯-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
149 4,5-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
150 6-氯-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
151 5-氯-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
152 5-叔丁基-2-[2-(4-哌啶-4-基-丁氧基)-吡啶-4-基]-1H-苯并咪唑;
153 4,6-二甲基-2-[2-(4-哌啶-4-基-丁氧基)-吡啶-4-基]-1H-苯并咪唑;
154 2-{2-[4-(1-乙基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
155 4,6-二甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
156 4-甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
157 6-氯-4-甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
158 2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
159 2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
160 4-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
161 2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑;
162 2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑;
163 6-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
164 5-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
165 5-氟-4-甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
166 5-氯-6-氟-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
167 5-叔丁基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
168 4,5-二甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
169 2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑;
170 5-氯-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
171 5-氯-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-6-氟-1H-苯并咪唑;
172 5-叔丁基-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
173 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-氯-1H-苯并咪唑;
174 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-6-氟-1H-苯并咪唑;
175 2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-1H-苯并咪唑;和
177 {4-(4,6-二甲基-1H-苯并咪唑-2-基)-6-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-3-基}-甲醇。
本发明化合物的药物组合物和使用方法的实施方案通过药物组合物及使用方法提供,药物组合物包含在此所述的任何化合物及其组合。
用于在患者中治疗或预防H4受体-介导的病症的药物组合物的实施方案包含治疗有效量的至少一种H4受体调节剂以及包含药学上可接受的载体,所述的至少一种H4受体调节剂选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯。
用于在患者中抑制白细胞募集的药物组合物的实施方案包含治疗有效量的至少一种白细胞募集抑制剂以及药学上可接受的载体,所述的至少一种白细胞募集抑制剂选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯。
抗炎组合物的实施方案包含治疗有效量的至少一种抗炎化合物以及药学上可接受的载体,所述的至少一种抗炎化合物选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯。
在患者中用于治疗或预防炎症的方法包括给予与炎症应答有关的患者一种药物组合物,所述的药物组合物包含治疗有效量至少一种抗炎化合物,所述的至少一种抗炎化合物选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯,该方法的实施方案包括下述方法:其中所述的炎症应答是对至少一种下面病症的应答:炎性疾病、过敏性疾病、皮肤疾病、自身免疫疾病、淋巴疾病、皮肤骚痒和免疫缺陷疾病。
在患者中用于治疗或预防炎症的方法包括给予与炎症应答有关的患者一种药物组合物,所述的药物组合物包含治疗有效量至少一种抗炎化合物,所述的至少一种抗炎化合物选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯,该方法的实施方案包括其中所述炎症应答是对化疗应答的方法。
在患者中用于治疗或预防炎症的方法包括给予与炎症应答有关的患者一种药物组合物,所述的药物组合物包含治疗有效量的至少一种抗炎化合物,所述的至少一种抗炎化合物选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯,该方法的实施方案包括下述方法:其中满足下面的至少一种:所述的炎症应答是对物理刺激的应答;所述的炎症应答是对化学刺激的应答;所述的炎症应答是对感染的应答;所述的炎症应答是对与所述患者无关的物体的侵入的应答;所述的炎症应答是对免疫刺激的应答;所述的炎症应答是对非免疫刺激的应答;所述的炎症应答是对至少一种下列病症的应答:过敏、哮喘、慢性阻塞性肺病(COPD)、动脉粥样硬化、类风湿性关节炎、多发性硬化、炎性肠病(更具体地说,其中所述的炎性肠病是克罗恩氏病和溃疡性结肠炎中的至少一种)、牛皮癣、过敏性鼻炎、硬皮病、自身免疫性甲状腺病、免疫介导的糖尿病和狼疮;所述的炎症应答是对至少一种下列病症的应答:重症肌无力、自身免疫性神经病(更具体地说,其中所述的自身免疫性神经病是格-巴二氏神经病)、自身免疫性葡萄膜炎、自身免疫性溶血性贫血、恶性贫血、自身免疫性血小板减少、颞动脉炎、抗磷脂综合症、血管炎(具体地说,其中所述的血管炎是眶坏死性肉芽肿病)、贝切特氏病、疱疹样皮炎、寻常天疱疮、白斑病、原发性胆汁性肝硬变、自身免疫性肝炎、自身免疫性卵巢炎、自身免疫性睾丸炎、肾上腺的自身免疫性疾病、多发性肌炎、皮肌炎、脊椎关节病(更具体地说,其中所述的脊椎关节病是强直性脊柱炎)和斯耶格伦氏综合征;所述的炎症应答是急性炎;所述的炎症应答是过敏性炎症;以及所述的炎症应答是慢性炎症。与本发明的炎症应答有关的给药包括在检测到炎症之前、出现炎症时以及炎症之后中的至少一个时间给药。
调节H4受体的方法包括将H4受体暴露于至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的化合物中,该方法的实施方案包括其中满足下列至少一种的方法:所述的至少一种调节H4受体的化合物作为受体拮抗剂,以及所述的至少一种调节H4受体的化合物作为受体部分激动剂。
如果给予一种以上的活性剂,例如式(I)或(II)的化合物,那么所述的治疗有效量可以是共同有效量。
本发明的一个实例是一种药物组合物,其通过将至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物与药学上可接受的载体混合而制备。本发明的一个实例是一种制备药物组合物的方法,其包括将至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物与药学上可接受的载体混合。
本发明的另一实例是组合物在制备用于治疗在此所述任何一种疾病的药物中的用途,该组合物包含至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物,这些疾病中的一种是炎症。本发明的另一实例是组合物在制备用于治疗或预防在此所述任何一种疾病的药物中的用途,该组合物包含至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物,这些疾病中的一种是炎症。
本发明的化合物可以根据本领域熟练技术人员已知的方法和/或本发明的方法进行制备,例如在下面方案和实施例中所述的那些以及通过母体或组合方法。为了获得在此所述的各种化合物,可以使用携带最终所需取代基的起始物质,虽然视情况而定反应流程有或者没有保护。起始物质可以从商业来源处获得或通过本领域熟练技术人员已知的方法合成。或者,有可能必须使用合适的基团以代替最终所需的取代基,该合适的基团可以在所述反应流程中被携带并且视情况用所需的取代基代替。通过常规技术可以将含手性中心的任何产物分离成它的对映异构体。本领域常规熟练技术人员将能够修饰和改变在此所提供的指导以制备本发明的化合物。
在此所述的方法的实施方案包括,当化学上有意义时,一种或多种步骤如水解、卤化、保护和脱保护。这些步骤可以根据在此所提供的教导并由本领域普通熟练技术人员完成。
在制备本发明化合物的任何方法中,必须的和/或希望的在所涉及的任何分子上保护敏感基团或活性基团。此外,本发明的化合物可以通过使用保护基修饰;这些化合物、前体或前药也在本发明的范围内。这可以通过常规保护基实现,例如在″Protective Groups in OrganicChemistry″,ed.J.F.W.McOmie,Plenum Press,1973;和T.W.Greene &P.G.M.Wuts,″Protective Groups in Organic Synthesis″,3rd ed.,JohnWiley & Sons,1999中所述的那些。所述的保护基可以在适当的随后步骤中使用本领域已知的方法除去。
流程1
流程2
关于流程1和2,公开了下列注解和补充。流程1和2中如下所述步骤的起始物质是市场上可买到的或很容易由本领域熟练技术人员获得。
式(I)或(II)的化合物通过如下制备:将合适取代的二氨基苯(III)与合适取代的苯甲醛(IV′)或(IV″)在氧化条件下缩合,当苯甲醛(IV′)相对于醛基具有对位醚取代时生成式(I)的化合物(流程1),或当苯甲醛(IV″)相对于醛基具有间位醚取代时生成式(II)的化合物(流程2)。用于此步骤的合适氧化剂包括空气、Na2S2O5、臭氧和具有类似氧化能力的化学上相容的氧化剂以及它们的混合物。
这种缩合反应优选在加热介质中在化学相容的溶剂中进行。反应介质的温度优选在约40℃-约150℃的范围内,更优选在约80℃-约100℃的范围内。可用于此反应的溶剂包括二烷、THF、三氟甲苯、甲苯、1,2-二氯乙烷、DMA和DMSO,优选DMF及其混合物。
合适取代的苯甲醛(IV′)和(IV″)可以根据本领域已知的方法制得。在一种制备方法中,合适取代的羟基苯甲醛与合适取代的部分反应,以在化合物(IV′)和(IV″)中形成醚键。与合适取代的4-羟基苯甲醛的反应导致生成化合物(IV′),与合适取代的3-羟基苯甲醛的反应导致生成化合物(IV″)。
关于下列流程3-6,如下所述步骤中的起始物质是市场上可买到的或很容易由本领域熟练技术人员获得。
流程3
特定醛(IV′)可以如流程3所示进行制备。合适的伯醇(V)用碱如氢化钠、氢化钾、叔丁醇钾或二异丙基氨基锂(LDA)在极性溶剂如DMF或THF中处理。优选的条件包括氢化钠在DMF中。然后,将所得醇盐用任选取代的6-氯烟腈处理,生成式(VII)的芳基醚。该反应在没有加热下进行或在加热至约60℃下进行。当R5是H时,式(VII)的化合物可以进一步反应,以在那个位置设置一个非氢取代基。式(VII)的化合物用强碱如LDA、2,2,6,6-四甲基哌啶锂(LTMP)或二(三甲基甲硅烷基)胺基锂(LHMDS)在约-78℃至约-50℃的温度下在溶剂如THF、乙醚或甲苯中进行处理。优选的条件包括在THF中使用LDA或LTMP。所得锂化物质用合适的亲电试剂在约-78℃至室温的温度范围内进行处理。优选的亲电试剂是甲基碘和六氯乙烷。当R5是氯化物时,那么可以在那个位置上使用亲核取代引入其它的取代基。合适的亲核试剂包括C1-3醇盐以及伯胺和仲胺。在一种具体实施方案中,所述的优选亲核试剂是甲醇盐。一旦所需的取代基在位置上,那么式(VII)化合物的腈官能团用合适的还原剂如二异丁基氢化铝在溶剂如甲苯或THF中还原,生成式(IV′)的醛其中W是N。
流程4
关于流程4,式(VIII)的合适伯醇与合适取代的式(IX)的2-氯吡啶反应,生成式(X)的吡啶基醚,如流程3所示。优选的反应条件是在DMF中使用氢化钠。当R5是氢时,通过式(X)的醚与强受阻碱反应,接着与如流程3中所述的合适亲电试剂反应,可以在那个位置上引入其它的取代基。优选的亲电试剂包括甲基碘和六氯乙烷。一旦所需的取代基在位置上,通过如流程3中所述那样还原氰基,式(X)的腈可以被还原成式(IV″)的醛,其中W是N。优选的还原剂包括二异丁基氢化铝。
流程5
关于流程5,式(XI)的二卤代吡啶,其中Hal是Cl或Br,与式(V)或(VIII)的伯醇使用上述条件反应,生成式(XII)的吡啶基醚。然后,通过用合适的烷基锂试剂在合适的溶剂如THF或乙醚中进行卤素-金属交换,接着用甲酰基同等物如DMF、N-甲酰基哌啶或氯甲酸乙酯淬灭,可以将所得的3-卤代吡啶转化为相应的式(XIII)的3-甲酰基吡啶。优选的条件是在THF中使用正丁基锂或叔丁基锂,并且优选的亲电试剂是DMF。或者,根据流程3和4中所述的直接锂化和甲酰基截留步骤,式(XH)的3-卤代吡啶可以转化为式(XIV)的醛。式(XIV)的醛,其中Hal是Br,可以进一步通过三步工序处理得到式(XV)的醛。为此,将该醛首先以合适的基团保护,例如以缩醛的形式保护。然后,该溴化物可以使用烷基锂试剂和亲电截留,如上面本流程中所述通过卤素-金属交换引入取代基E。优选的亲电试剂包括甲基碘和六氯乙烷,分别制备式(XV)的化合物,其中E是甲基或氯。然后,如上面流程1和2所示,式(XIII)、(XIV)和(XV)的醛可以加工成本发明的化合物。
流程6
关于流程6,通过在合适的溶剂如1,2-二氯乙烷或甲醇中使用合适的还原剂如NaCNBH3或Na(OAc3)BH进行还原性胺化反应,式(XIV)的醛可以转化为式(XVI)的氨基甲基类似物。任选的添加剂可以包括乙酸或路易斯酸如氯化锌。然后,通过进行如上所述的卤素-金属交换反应和猝灭步骤,式(XVI)的胺可以转化为式(XVII)的醛。根据流程1,可以将式(XVII)的醛加工成本发明的化合物。
当本发明化合物的制备方法生成立体异构体的混合物时,这些异构体可以通过常规技术如拆分进行分离,例如形成非对映体盐,包括其变体的动力学拆分方法,例如动态拆分、优先结晶、生物转化、酶催化转化和制备色谱技术。所述的化合物可以以外消旋的形式被制备,或者通过对映专一性合成或拆分的方法可以制得单独的对映异构体。所述的化合物例如可以通过标准技术拆分为它们的对映异构体,例如通过与光学活性的酸如(-)-二-对甲苯酰基-D-酒石酸和/或(+)-二-对甲苯酰基-1-酒石酸形成盐,接着分级结晶并再生游离碱,可以制得一对非对映体。所述的化合物还可以通过如下方法拆分:形成非对映体的酯或酰胺,接着色谱分离并除去手性助剂。或者,所述的化合物可以使用手性HPLC柱进行分离。
为便于提供更简明的说明,在此给出的一些定量表达式没有用术语″约″来限制。可以理解,不管术语″约″是否已明确使用,在此所给出的每一数量是指实际的给定值,同时它还指本领域普通熟练技术人员在合理推断的基础上获得的这些给定值的近似值,包括由于这些给定值的实验和/或测量条件所导致的近似值。
H4受体在免疫细胞(包括某些白细胞和肥大细胞)中的表达使其成为介入治疗一系列免疫和炎性疾病(例如过敏性、慢性或急性炎症)的重要靶点。具体地说,H4受体配体可用于治疗或预防各种哺乳动物的疾病状态。
因此,本发明公开的化合物(H4受体的部分激动剂或拮抗剂)和组合物用于改善与下列疾病有关的症状以及用于治疗和预防下列疾病:炎性疾病、过敏性疾病、皮肤疾病、自身免疫疾病、淋巴疾病和免疫缺陷疾病(包括上面所给出的更具体的疾病)。所公开的化合物在化疗中或在治疗皮肤骚痒中还可用作佐剂。
本发明的一个方面包括(a)包含选自式(I)和(II)化合物、其对映异构体、非对映异构体和外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物(优选的化合物如在此所述)以及药学上可接受的载体的药物组合物;(b)包装药物,该包装药物包含(1)包含选自式(I)和(II)化合物、其对映异构体、非对映异构体和外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物,或一种或多种优选的化合物(如在此所述)以及药学上可接受的载体的药物组合物,和(2)给予所述组合物用于治疗或预防H4-介导的疾病的使用说明书。
本发明的实施方案提供在患者中治疗H4-介导的病症的方法,所述方法包括给予该患者药学有效量的一种组合物,该组合物包含至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物以及其它公开的或优选的化合物。在这些病症中,涉及H4受体的作用。例如,本发明提供一种在患者中治疗H4-介导的病症的方法,所述方法包括给予该患者药学上有效的H4-拮抗量的一种组合物,该组合物包含至少一种选自式(I)和(II)的化合物、其对映异构体、非对映异构体、外消旋体以及其药学上可接受的盐、酰胺和酯的苯并咪唑化合物。在此所使用的术语″治疗″疾病以及其语法有关的术语是指消除或改善其原因和/或作用。在此所使用的术语″抑制″疾病或现象的发生,及其语法上有关的术语,术语″预防″疾病或病症以及其语法上有关的术语,是指预防、延迟或减少这种发病的可能性。
拮抗剂的作用还可由反激动剂产生。反激动描述了化合物有效地关闭显示构成型活性的受体的性质。构成型活性可在被迫过度表达人H4受体的细胞中发现。用cAMP-刺激剂如毛喉素处理后,可通过检测cAMP水平或通过测定对cAMP水平敏感的报道基因,测定构成型活性。毛喉素处理后,过度表达H4受体的细胞显示的cAMP水平比不表达细胞的要低。起H4激动剂作用的化合物在H4-表达细胞中剂量依赖性降低毛喉素刺激后的cAMP水平。起H4反激动剂作用的化合物在H4-表达细胞中剂量依赖性刺激cAMP水平。起H4拮抗剂作用的化合物将阻断H4激动剂诱发的cAMP抑制或H4反激动剂诱发的cAMP升高。
本发明的其它实施方案包括公开的化合物,所述公开的化合物是哺乳动物组胺H4受体功能抑制剂、体内或体外炎症或炎性反应抑制剂、哺乳动物组胺H4受体蛋白表达调节剂、体内或体外多形核白细胞激活抑制剂或上述的组合,以及使用公开的化合物进行治疗、预防和诊断的相应方法。
在此使用的术语″单位剂量″以及它们语法上的等同形式是指物理上分散的适合作为人患者以及其它动物单一剂量形式的单位,其中每一单位含有预定药理学有效量的活性组分以产生所需的药理学作用。本发明的新单位剂型的规格由活性组分的特性确定并直接取决于该活性组分的特性,并且受混合这样一种活性组分的领域的限制,其中这种活性组分是用于人和其它动物治疗用途的。
所述的药物组合物可以使用常规的药物赋形剂以及混合技术进行制备。合适的单位剂型的例子是片剂、胶囊、丸剂、粉剂、粉状品袋、粒剂、糯米纸等,任何单位剂型以及液体溶液和悬浮液的分离倍数。一些液体形式是含水的,而液体形式的其它实施方案是非水的。口服剂型可以是酏剂、糖浆、胶囊、片剂等。固体载体的例子包括在制备丸剂或片剂过程中通常使用的那些物质,例如乳糖、淀粉、葡萄糖、甲基纤维素、硬脂酸镁、磷酸氢钙、甘露醇等,增稠剂例如西黄蓍胶和甲基纤维素USP、精细粉碎的SiO2、聚乙烯吡咯烷酮、硬脂酸镁等。典型的液体口服赋形剂包括乙醇、甘油、水等。如果需要,所有赋形剂可以与稀释剂(例如,碳酸钠和碳酸钙,磷酸钠和磷酸钙,以及乳糖),崩解剂(例如,玉米淀粉和褐藻酸),造粒剂,润滑剂(例如,硬脂酸镁、硬脂酸和滑石粉),粘合剂(例如,淀粉和明胶),增稠剂(例如,石蜡、蜡类和凡士林),调味剂,着色剂,防腐剂等通过制备剂型的本领域普通数量技术人员已知的那些常规技术进行混合。可以存在包衣,并且包衣例如包括单硬脂酸甘油酯和/或二硬脂酸甘油酯。口服胶囊包括硬胶囊,其中活性成分与固体稀释剂混合,和软胶囊,其中活性成分与水或油如花生油、液体石蜡或橄榄油混合。
使用水或另外的无菌载体可以制备肠胃外剂型。肠胃外溶液可以包装在适合于再分成单独剂量的容器中。对于肌内、腹膜内、皮下和静脉内给药方法,本发明的化合物通常以无菌水溶液或悬浮液的形式提供,使用时缓冲成合适的pH和等渗性。合适的含水赋形剂包括林格溶液和等渗氯化钠。含水悬浮液可包含悬浮剂如纤维素衍生物、海藻酸钠、聚乙烯吡咯烷酮、黄蓍胶和润湿剂(例如卵磷脂)。含水悬浮液的合适防腐剂包括对羟基苯甲酸乙酯和对羟基苯甲酸正丙酯。肠胃外制剂包括药学上可接受的含水或非水溶液、分散液、悬浮液、乳液以及用于制备它们的无菌粉剂。载体的例子包括水、乙醇、多元醇(丙二醇、聚乙二醇)、植物油和可注射有机酯如油酸乙酯。通过使用包衣如卵磷脂、表面活性剂或保持合适的粒径,可以保持流动性。固体剂型的载体包括(a)填料或膨胀剂,(b)粘合剂,(c)润湿剂,(d)崩解剂,(e)溶液缓凝剂,(f)吸收促进剂,(g)吸附剂,(h)润滑剂,(i)缓冲剂和(j)气雾剂基质。
组合物还可以含有佐剂如防腐剂、润湿剂、乳化剂和分散剂;抗菌剂例如对羟苯甲酸酯、氯丁醇、苯酚和山梨酸;等渗剂如糖或氯化钠;吸收延缓剂如单硬脂酸铝和明胶;以及吸收促进剂。
生理上可接受的载体在本领域中是公知的。液体载体的例子是溶液其中本发明的化合物形成溶液、乳液和分散液。相容的抗氧化剂,例如对羟基苯甲酸甲酯和对羟基苯甲酸丙酯,可以在固体和/或液体组合物中存在,还可以存在甜味剂。
本发明的药物组合物可以包括典型地在乳剂组合物中使用的合适乳化剂。这样的乳化剂例如描绘在标准出版物H.P.Fiedler,1989,Lexikon der Hilfsstoffe fur Pharmazie,Kosmetic und agrenzendeGebiete,Cantor ed.,Aulendorf,Germany、Handbook of PharmaceuticalExcipients,1986,American Pharmaceutical Association,Washington,DC,and the Pharmaceutical Society of Great Britain,London,UK中,这些文献在此引入作为参考。胶凝剂也可以加入到本发明的组合物中。胶凝剂的例子是聚丙烯酸衍生物,例如卡波姆,更特别地,各种类型的卡波泊尔,其用量典型地在约0.2%-约2%之间。悬浮液可以制备成乳剂、软膏,包括无水软膏、油包水乳剂、水包油乳剂、乳剂凝胶或凝胶。
可以预料,本发明的化合物可以通过口服或肠胃外途径给予,包括静脉内、肌内、腹膜内、皮下、直肠、脑池内、阴道内、膀胱内、局部给药以及通过吸入(口腔或鼻内,优选以喷雾剂的形式)。对于口服给药,本发明的化合物通常以片剂、胶囊或溶液或悬浮液的形式提供。给药的其它方法包括控释制剂,例如皮下植入物和经皮贴片。
本发明化合物的有效剂量可以通过常规方法确定。任何具体患者所需的具体剂量水平将取决于许多因素,包括病症的严重程度、需要治疗症状的类型、给药途径、患者的体重、年龄和一般情况、以及其它药物的给予。
通常,可以预料,日剂量(不管以单次剂量给药还是以分开剂量给药)将在约0.01mg至约1000mg每日的范围内,更通常在约1mg至约500mg每日的范围内,以及最通常在约10mg至约200mg每日的范围内。以每单位体重剂量的形式表示,预计典型的剂量将在约0.0001mg/kg至约15mg/kg之间,尤其是在约0.01mg/kg至约7mg/kg之间,以及最尤其是在约0.15mg/kg至2.5mg/kg之间。
预计的口服剂量在约0.01至500mg/kg每日的范围内,更优选在约0.05至约100mg/kg每日的范围内,并且可以以1-4次的分剂量给药。本发明的一些化合物可以以约0.05至约50mg/kg每日的剂量范围口服给药,而本发明其它的化合物可以以0.05至约20mg/kg每日的剂量范围口服给药。灌注剂量可以在约1.0至约1.0×104μg/(kg.min)抑制剂的范围内,该抑制剂与药物载体混合在一起使用,灌注时间可以持续数分钟至几天。对于局部给药,本发明的化合物可以与药物载体混合在一起,其中相对于赋形剂,药物的浓度为约0.1至约10%。胶囊、片剂或其它制剂(如液体和薄膜包衣片剂)可以在0.5至200mg之间,例如1、3、5、10、15、25、35、50、60和100mg并且可以根据己知方法给药。对于正常体重的成年人来说,日剂量例如在10mg至5000mg之间。
实施例
常规实验
NMR光谱在Bruker model DPX400(400MHz)或DPX500(500MHz)光谱仪上获得。下面的1H NMR数据的形式是:相对于四甲基硅烷对照以ppm为单位的低场化学位移(多重性,耦合常数J以Hz为单位,积分)。
质谱在Hewlett Packard(Agilent)series 1100 MSD上使用电喷雾电离(ESI)以所示的阳极模式或阴极模式获得。分子式的″计算质量″是指化合物的单种同位素质量。
提纯方法1:反相HPLC
HPLC停留时间以分钟为单位,使用下面所述的方法和条件。
仪器:Agilent HP-1100
溶剂:乙腈(0.05%TFA)/H2O(0.05%TFA)
流速:0.75mL/min
梯度:1min以1%H2O;7min线性斜坡至99%H2O;4min在99%H2O时。
柱子:Zorbax Eclipse XDB-C8(5μm,4.6×150mm)
温度:35℃
波长:在220nM和254nM二波长检测
提纯方法2:正相色谱
2-芳基苯并咪唑通过硅胶色谱进行提纯,使用二氯甲烷,然后含10%甲醇的二氯甲烷,随后含10%(2.0M氯水在甲醇中)的二氯甲烷进行洗脱。将反应混合物没有后处理的情况下就装载到硅胶上。
实施例1
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑。
一般步骤1。
A.2-氯-4-(3-氯-丙氧基)-苯甲醛。将1-溴-3-氯丙烷(2.55g,16.2mmol,1.0当量)加入到2-氯-4-羟基苯甲醛(2.54g,16.2mmol,1.0当量)和K2CO3(4.48g,32.4mmol,2.0当量)在乙腈(41mL)中的溶液中。将混合物在65℃加热18h,然后冷却至室温(室温),接着通过硅藻土过滤。滤液在减压下浓缩,得到粗产物,其用柱色谱(硅胶,含5%乙酸乙酯的己烷)提纯,得到3.19g无色油(66%)。
1H NMR(400MHz,CD3OD):10.3(s,1H),7.87(d,J=8.0Hz,1H),7.10(d,J=4.0Hz,1H),7.03(dd,J=8.0,4.0Hz,1H),4.23(t,J=8.0Hz,2H),3.76(t,J=8.0Hz,2H),2.31-2.22(m,2H).
一般步骤2。
B.2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯甲醛.N-甲基哌嗪(2.16g,21.5mmol,2.0当量)、2-氯-4-(3-氯-丙氧基)-苯甲醛(3.19g,10.8mmol,1.0当量)、K2CO3(4.46g,32.3mmol,3.0当量)和KI(1.02g,5.38mmol,0.5当量)在正丁醇(22mL)中在90℃搅拌18h。反应混合物用水稀释,然后用乙酸乙酯萃取三次。将合并的萃取液干燥(Na2SO4),过滤,接着浓缩,得到粗产物,其用方法2提纯,得到2.04g(63%)橙色油。
1H NMR(400MHz,CD3OD):10.3(s,1H),7.86(d,J=8.0Hz,1H),7.08(d,J=2.0Hz,1H),7.00(dd,J=8.0,2.0Hz,1H),4.15(t,J=8.0Hz,2H),3.00-2.30(br s,10H),2.29(s,3H),2.05-1.90(m,2H).
一般步骤3.
C.2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑。2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯甲醛(91.5mg,0.31mmol,1.0当量)和3,4-二甲基-苯-1,2-二胺(42mg,0.31mmol,1.0当量)与Na2S2O5(76mg,0.40mmol,1.3当量)在DMF(0.25M)中在90℃搅拌12h。将反应混合物直接装填在硅胶上,根据方法2进行提纯,得到98mg(76%)标题化合物。
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.1H NMR(400MHz,CD3OD):7.68(br s,1H),7.33(br s,1H),7.15(d,J=2.5Hz,1H),7.07(d,J=8.7,2.5Hz,1H),7.03(dd,J=8.7,2.5Hz,1H),4.13(t,J=6.1Hz,2H),2.60-2.39(m,13H),2.39(s,3H),2.30(s,3H),2.05-1.95(m,2H).
实施例2
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑。
A.3-(1-甲基-哌啶-4-基)-丙-1-醇.向1N氢化铝锂在THF(40mmol)中的回流溶液中滴加N-BOC-4-哌啶丙酸(3.0g,11.6mmol)在THF(30mL)中的溶液。将反应混合物加热3h,然后冷却至室温.紧接着进一步冷却至0℃,缓慢地加入水(1.5mL),接着在15min内将反应混合物温热至室温.将混合物再次冷却至0℃,接着缓慢地加入10%NaOH(1.5mL)。紧接着在15min内温热至室温,混合物再次冷却至0℃并加入更多的水(4.5mL)。在18h内将所得混合物温热至室温,然后通过硅藻土垫过滤.将滤液在减压下浓缩,残余物用方法2提纯,得到黄色油形式的1.9g(100%)3-(1-甲基-哌啶-4-基)-丙-1-醇。
MS(电喷雾):计算分子量C9H19NO,157.15;m/z实测值,158.1[M+H]+.1H NMR(400MHz,CD3OD):3.45-3.41(m,2H),2.77-2.74(m,2H),1.89-1.85(m,2H),1.64-1.61(m,2H),1.47-1.43(m,2H),1.21-1.12(m,5H).
B.2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛.向冰冷却下的2-氯-4-羟基苯甲醛(507mg,3.2mmol,1.0当量)、三苯膦(1.02g,3.9mmol,1.2当量)和3-(1-甲基-哌啶-4-基)-丙-1-醇(508mg,3.9mmol,1.2当量)在THF(15mL)中的溶液中加入偶氮二乙酸二乙酯(DEAD;0.6mL,3.2mmol,1.0当量)。将反应混合物温热至室温接着搅拌16h。反应混合物用水稀释,然后用乙酸乙酯萃取三次。将合并的萃取液干燥(Na2SO4),接着浓缩。通过方法2提纯,得到768mg(80%)所需的醛。
MS(电喷雾):计算分子量C15H23NO2,261.17;m/z实测值,262.2[M+H]+.1H NMR(400MHz,CDCl3):9.85(s,1H),7.80(d,J=8.6Hz,2H),6.97(d,J=8.6Hz,2H),4.01(t,J=6.4Hz,2H),2.84-2.82(m,2H),2.25(s,3H),1.92-1.78(m,4H),1.71-1.69(m,2H),1.41-1.37(m,2H),1.29-1.26(m,3H).
C.2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛和3-甲基-苯-1,2-二胺与Na2S2O5在DMF中在90℃搅拌12h。反应混合物通过方法2提纯,得到129mg(73%)标题化合物。
MS(电喷雾):计算分子量C23H28ClN3O,397.19;m/z实测值,398.4[M+H]+.1H NMR(400MHz,CD3OD):7.69(d,J=8.5Hz,1H),7.46-7.35(m,1H),7.17-7.13(m,2H),7.06-7.01(m,2H),4.06(t,J=6.4Hz,2H),2.95-2.85(m,2H),2.59(s,3H),2.27(s,3H),2.10-1.95(m,2H),1.86-1.76(m,4H),1.50-1.49(m,2H),1.32-1.25(m,3H).
实施例3
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲氧基-1H-苯并咪唑.
本化合物通过一般步骤3中所述的方法使用2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯甲醛(200mg,0.68mmol,1.0当量)、4-三氟甲氧基-苯-1,2-二胺(119mg,0.62mmol,0.92当量)和Na2S2O5(167mg,0.88mmol,1.3当量)进行制备。通过方法2提纯,得到72mg(23%)标题化合物。
MS(电喷雾):计算分子量C22H24ClF3N4O2,468.15;m/z实测值,469.4[M+H]+.1HNMR(400MHz,CD3OD):7.82(d,J=8.7Hz,1H),7.69(d,J=8.8Hz,1H),7.55(s,1H),7.23(d,J=8.5Hz,1H),7.21(d,J=1.6Hz,1H),7.1(dd,J=8.6,2.2Hz,1H),4.17(t,J=5.7Hz,2H),2.88-2.38(m,10H),2.32(s,3H),2.10-1.95(m,2H).
实施例4
5-叔丁基-2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
本化合物通过实施例1中所述的方法,使用3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯甲醛(62mg,0.20mmol,1.0当量)、4-叔丁基-苯-1,2-二胺(33mg,0.20mmol,1.0当量)和Na2S2O5(50mg,0.26mmol,1.3当量)按一般步骤3进行制备。通过方法2提纯,得到31mg(34%)标题化合物。
MS(电喷雾):计算分子量C26H35ClN4O,454.25;m/z实测值,455.3[M+H]+.1H NMR(400MHz,CD3OD):8.12(d,J=2.2Hz,1H),7.98(dd,J=8.6,2.3Hz,1H),7.6(s,1H),7.52(d,J=8.5Hz,1H),7.37(dd,J=8.6,1.8Hz,1H),7.22(d,J=8.7Hz,1H),4.19(t,J=6.0Hz,2H),2.84-2.74(m,10H),2.40(s,3H),2.08-1.97(m,2H),1.90-1.83(m,2H),1.41(s,9H).
实施例5
5-叔丁基-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
本化合物通过实施例2中所述的方法使用3-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛(98.6mg,0.36mmol,1.0当量)、4-叔丁基-苯-1,2-二胺(59mg,0.36mmol,1.0当量)和Na2S2O5(89mg,0.47mmol,1.3当量)按步骤C进行制备。通过方法2提纯,得到116mg(77%)标题化合物。
MS(电喷雾):计算分子量C27H37N3O,419.29;m/z实测值,420.2[M+H]+.1H NMR(400MHz,CD3OD):7.90-7.82(m,2H),7.60-7.50(m,1H),7.52-7.40(m,1H),7.33(dd,J=8.5,1.8Hz,1H),7.02(d,J=9.1Hz,1H),4.07(t,J=6.2Hz,2H),2.92-2.85(m,2H),2.30(s,3H),2.28(s,3H),2.10-2.00(m,2H),1.90-1.80(m,2H),1.80-1.70(m,2H),1.55-1.45(m,2H),1.49(s,9H),1.49-1.26(m,3H).
实施例6
4,5-二甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
本化合物通过实施例1中所述的方法使用3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯甲醛(180mg,0.65mmol,1.0当量),3,4-二甲基-苯-1,2-二胺(89mg,0.65mmol,1.0当量),和Na2S2O5(161mg,0.85mmol,1.3当量)按一般步骤3进行制备。通过方法2提纯,得到192mg(75%)标题化合物。
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.5[M+H]+.1H NMR(400MHz,CD3OD):7.95-7.85(m,2H),7.35-7.23(m,1H),7.08-7.00(m,2H),4.12(t,J=6.0Hz,2H),2.64-2.37(m,16H),2.29(s,6H),2.10-2.00(m,2H).
实施例7
5-叔丁基-2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑.
本化合物通过实施例1中所述的方法使用3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯甲醛(53mg,0.19mmol,1.0当量)、4-叔丁基-苯-1,2-二胺(32mg,0.19mmol,1.0当量)和Na2S2O5(48mg,0.25mmol,1.3当量)按一般步骤3进行制备。通过方法2提纯,得到75mg(92%)标题化合物。
MS(电喷雾):计算分子量C26H36N4O,420.29;m/z实测值,421.2[M+H]+.1H NMR(400MHz,CD3OD):7.68-7.56(m,3H),7.54(br d,J=8.2Hz,1H),7.44-7.36(m,2H),7.02(dd,J=8.2,2.2Hz,1H),4.07(t,J=6.1Hz,2H),3.00-2.26(m,10H),2.26(s,3H),1.85-1.75(m,2H),1.75-1.65(m,2H),1.40(s,9H).
实施例8
5-叔丁基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑.
A.3-(4-氯-丁氧基)-苯甲醛.本中间体通过一般步骤1中所述的方法使用3-羟基苯甲醛(2.0g,16.4mmol,1.0当量)、1-溴-4-氯丁烷(1.62mL,16.4mmol,1.0当量)和K2CO3(4.53g,33mmol,1.0当量)进行制备。提纯,得到2.57g(79%)所需产物。
1H NMR(400MHz,CDCl3):9.98(s,1H),7.47-7.43(m,2H),7.40-7.37(m,1H),7.27-7.25(m,1H),4.09-4.03(m,2H),3.66-3.58(m,2H),2.03-1.93(m,4H).
B.5-叔丁基-2-[3-(4-氯-丁氧基)苯基]-1H-苯并咪唑.本中间体通过一般步骤3中所述的方法使用3-(4-氯-丁氧基)-苯甲醛(500mg,2.52mmol,1.0当量)、4-叔丁基-苯-1,2-二胺(414mg,2.52mmol,1.0当量)和Na2S2O5(622mg,3.3mmol,1.3当量)进行制备。将反应混合物加载到硅胶柱上,用快速色谱法提纯(25%乙酸乙酯在己烷中),得到348mg(40%)所需产物。
1H NMR(400MHz,CDCl3):7.72-7.48(m,4H),7.47-7.35(m,2H),7.08-7.03(m,1H),4.17-4.10(m,2H),3.70-3.64(m,2H),2.03-1.96(m,4H),1.41(s,9H).
C.5-叔丁基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑.本化合物通过一般步骤2中所述的方法使用5-叔丁基-2-[3-(4-氯-丁氧基)苯基]-1H-苯并咪唑(51.2mg,0.15mmol,1.0当量)、N-甲基-高哌嗪(19μL,0.15mmol,1.0当量)、K2CO3(40mg,0.30mmol,2.0当量)和KI(12mg,0.08mmol,0.5当量)进行制备。通过方法2提纯,得到19mg(23%)标题化合物。
MS(电喷雾):计算分子量C27H38N4O,434.30;m/z实测值,435.3[M+H]+。1H NMR(400MHz,CD3OD):7.66-7.62(m,3H),7.52(d,J=8.6Hz,1H),7.45-7.35(m,1H),7.37(dd,J=8.6,1.8Hz,1H),7.06-7.02(m,1H),4.11(t,J=6.2Hz,2H),2.78-2.75(m,4H),2.69-2.65(m,4H),2.60-2.55(m,2H),2.32(s,3H),1.85-1.79(m,4H),1.75-1.68(m,2H),1.40(s,9H).
实施例9
(1-{3-[4-(5-叔丁基-1H-苯并咪唑-2-基)-2-氯-苯氧基]-丙基}-吡咯烷-3-基)-二甲胺.
本化合物通过实施例1中所述的方法使用一般步骤3、用5-叔丁基-2-[3-(4-氯-丁氧基)-苯基]-1H-苯并咪唑(206mg,0.55mmol,1.0当量),二甲基-吡咯烷-3-基-胺(125mg,1.09mmol,2.0当量),K2CO3(227mg,1.64mmoll,3.0当量)和KI(46mg,0.27mmol,0.5当量)进行制备。通过方法2提纯,得到137mg(55%)标题化合物。
MS(电喷雾):计算分子量C26H35ClN4O,454.25;m/z实测值,455.5[M+H]+.1H NMR(400MHz,CD3OD):8.11(d,J=2.2Hz,1H),7.97(dd,J=8.6,2.2Hz,1H),7.58(br s,1H),7.65-7.45(m,1H),7.36(dd,J=8.6,1.7Hz,1H),7.24(d,J=8.7Hz,1H),4.21(t,J=6.0Hz,2H),3.04-2.99(m,1H),2.91-2.65(m,4H),2.56-2.49(m,1H),2.36-2.29(m,1H),2.24(s,6H),2.10-1.99(m,3H),1.79-1.70(m,1H),1.40(s,9H).
实施例10
5-氯-2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-6-甲基-1H-苯并咪唑。
本化合物通过实施例1中所述的方法使用一般步骤3、用3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯甲醛(61mg,0.20mmol,1.0当量),4-氯-5-甲基-苯-1,2-二胺(31mg,0.20mmol,1.0当量)和Na2S2O5(48mg,0.25mmol,1.3当量)进行制备。通过方法2提纯,得到7.1mg(8%)标题化合物。
MS(电喷雾):计算分子量C23H28Cl2N4O,446.16;m/z实测值,447.3[M+H]+.1H NMR(400MHz,CD3OD):7.96(d,J=2.2Hz,1H),7.83(dd,J=8.6,2.2Hz,1H),7.45(s,1H),7.34(s,1H),7.10(d,J=8.7Hz,1H),4.08(t,J=6.0Hz,2H),2.76-2.64(m,10H),2.36(s,3H),2.30(s,3H),1.96-1.88(m,2H),1.80-1.73(m,2H).
实施例11
2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
本化合物通过实施例1中所述的方法在一般步骤3中使用3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯甲醛(94mg,0.34mmol,1.0当量),3-甲基-苯-1,2-二胺(42mg,0.34mmol,1.0当量)和Na2S2O5(84mg,0.44mmol,1.3当量)进行制备。通过方法2提纯,得到130mg(100%)标题化合物。
MS(电喷雾):计算分子量C22H27FN4O,382.22;m/z实测值,383.2[M+H]+.1H NMR(400MHz,CD3OD):7.86-7.78(m,2H),7.40-7.37(m,1H),7.12-6.97(m,3H),3.99(t,J=6.1Hz,2H),3.00-2.30(m,13H),2.25(s,3H),1.94-1.90(m,2H).
实施例12
5-甲基-2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-萘-1-基}-1H-苯并咪唑。本化合物通过实施例1中所述的方法在一般步骤3中使用4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-萘-1-甲醛(63mg,0.20mmol,1.0当量),4-甲基-苯-1,2-二胺(24mg,0.20mmol,1.0当量)和Na2S2O5(49mg,0.26mmol,1.3当量)进行制备。使用方法1将所需产物从反应混合物中分离出来,接着通过方法2进行再提纯,得到54.6mg(66%)标题化合物。
MS(电喷雾):计算分子量C26H30N4O,414.24;m/z实测值,415.62[M+H]+.1H NMR(400MHz,CD3OD):8.48(d,J=8.0Hz,1H),8.10(d,J=8.4Hz,1H),8.0(d,J=8.2Hz,1H),7.78-7.65(m,4H),7.50(d,J=8.4Hz,1H),7.21(d,J=8.2Hz,1H),4.43(t,J=6.0Hz,2H),3.40(br s,4H),3.30-3.00(m,6H),2.88(s,3H),2.59(s,3H),2.36-2.30(m,2H).
实施例13
4-[3-(5-叔丁基-1H-苯并咪唑-2-基)-苯氧基]-1-(4-甲基-哌嗪-1-基)-丁烷-1-酮.
A.3-[4-(4-甲基-哌嗪-1-基)-4-氧代-丁氧基]-苯甲醛.在0℃下,向4-(3-甲酰基-苯氧基)-丁酸(981mg,4.72mmol,1.0当量)和N-甲基哌嗪(576mg,5.19mmol,1.1当量)在二氯甲烷中的溶液中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDCI;1.18g,6.14mmol,1.3当量)和1-羟基苯并三唑水合物(HOBT,701mg,5.19mmol,1.1当量)。将反应混合物温热至室温,接着在室温下搅拌2.0h,然后倒入到水中。此混合物用乙酸乙酯萃取3次。将合并的萃取液干燥(Na2SO4),过滤,接着在减压下浓缩。粗残余物用柱色谱(硅胶,含5%MeOH的二氯甲烷)提纯,得到847mg(62%)所需产物。
1H NMR(400MHz,CD3OD):9.72(s,1H),7.29-7.23(m,2H),7.22-7.19(m,1H),7.05-6.98(m,1H),3.87(t,J=6.1Hz,2H),3.43-3.31(m,4H),2.39(t,J=7.2Hz,2H),2.27-2.17(m,4H),2.08(s,3H),1.92-1.80(m,2H).
B.4-[3-(5-叔丁基-1H-苯并咪唑-2-基)-苯氧基]-1-(4-甲基-哌嗪-1-基)-丁烷-1-酮.本化合物通过一般步骤3中所述的方法,使用3-[4-(4-甲基-哌嗪-1-基)-4-氧代-丁氧基]-苯甲醛(81.2mg,0.28mmol,1.0当量),4-叔丁基-苯-1,2-二胺(46mg,0.28mmol,1.0当量)和Na2S2O5(69mg,0.36mmol,1.3当量)进行制备。通过方法2提纯,得到77mg(64%)标题化合物。
MS(电喷雾):计算分子量C26H34N4O2,434.27;m/z实测值,435.0[M+H]+.1H NMR(400MHz,CD3OD):7.69-7.62(m,3H),7.54(d,J=8.6Hz,1H),7.45-7.37(m,2H),7.06(dd,J=8.2,2.2Hz,1H),4.13(t,J=6.1Hz,2H),3.70-3.50(m,4H),2.62(t,J=7.3Hz,2H),2.49-2.40(m,4H),2.32(s,3H),2.16-2.09(m,2H),1.41(s,9H).
实施例14
5-氯-2-[3-氯-4-(3-哌嗪-1-基-丙氧基)-苯基]-6-氟-1H-苯并咪唑.
A.4-{3-[2-氯-4-(5-氯-6-氟-1H-苯并咪唑-2-基)-苯氧基]-丙基}-哌嗪-1-羧酸叔丁酯。本化合物通过实施例1中所述的方法,在一般步骤3中使用4-[3-(2-氯-4-甲酰基-苯氧基)-丙基]-哌嗪-1-羧酸叔丁酯(1.0g,2.6mmol,1.0当量),4-氯-5-氟-苯-1,2-二胺(421mg,2.6mmol,1.0当量)和Na2S2O5(648mg,3.4mmol,1.3当量)进行制备。通过方法2提纯,得到256mg(15%)标题化合物。
MS(电喷雾):计算分子量C25H29Cl2FN4O3,522.16;m/z实测值,545.3[M+Na]+.
B.5-氯-2-[3-氯-4-(3-哌嗪-1-基-丙氧基)-苯基]-6-氟-1H-苯并咪唑.在室温下,向4-{3-[2-氯-4-(5-氯-6-氟-1H-苯并咪唑-2-基)-苯氧基]-丙基}-哌嗪-1-羧酸叔丁酯(52.7mg,0.10mmol)在二氯甲烷(1.0mL)中的悬浮液中加入TFA(1.0mL),将反应混合物搅拌50min。混合物在减压下浓缩,固体残余物用二氯甲烷洗涤4次。以定量收率获得TFA盐形式的标题化合物。
MS(电喷雾):计算分子量C20H21Cl2FN4O,422.11;m/z实测值,423.2[M+H]+.1H NMR(400MHz,CD3OD):8.17(d,J=2.3Hz,1H),8.03(dd,J=8.7,2.3Hz,1H),7.81(d,J=6.4Hz,1H),7.59(d,J=8.7Hz,1H),7.36(d,J=8.8Hz,1H),4.33(t,J=5.8Hz,2H),3.50-3.47(m,4H),3.36(br s,4H),3.25(t,J=7.4Hz,2H),2.33-2.26(m,2H).
实施例15
5-叔丁基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
本化合物通过实施例1中所述的方法,在一般步骤3中使用3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯甲醛(516mg,1.87mmol,1.0当量),4-叔丁基-苯-1,2-二胺(307mg,1.87mmol,1.0当量)和Na2S2O5(461mg,2.43mmol,1.3当量)进行制备。通过方法2提纯,得到633mg(81%)标题化合物。
MS(电喷雾):计算分子量C26H36N4O,420.29;m/z实测值,421.5[M+H]+.1H NMR(400MHz,CD3OD):7.90-7.85(m,2H),7.65-7.40(m,2H),7.33(d,J=8.5Hz,1H),7.04(d,J=8.1Hz,1H),4.14-4.11(m,2H),2.90-2.28(m,16H),2.06-2.03(m,2H),1.39(s,9H).
实施例16
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑。
本化合物通过实施例2中所述的方法,步骤C中使用2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛(106mg,0.36mmol,1.0当量),3,5-二甲基-苯-1,2-二胺(49mg,0.36mmol,1.0当量)和Na2S2O5(88mg,0.47mmol,1.3当量)进行制备。通过方法2提纯,得到128mg(87%)标题化合物。
MS(电喷雾):计算分子量C24H30ClN3O,411.21;m/z实测值,412.4[M+H]+.1H NMR(400MHz,CD3OD):7.68(d,J=8.5Hz,1H),7.21(br s,1H),7.12(d,J=2.4Hz,1H),7.01(dd,J=8.7,2.5Hz,1H),6.90(s,1H),4.05(t,J=6.3Hz,2H),2.92-2.88(m,2H),2.54(s,3H),2.43(s,3H),2.29(s,3H),2.09-2.03(m,2H),1.85-1.76(m,4H),1.47-1.11(m,5H).
实施例17-56中的下列化合物使用一般步骤1、2和3如上面所述进行制备。
实施例17
2-{2-氯-4-[2-甲基-3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑。
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.2[M+H]+.1H NMR(400MHz,CD3OD):7.75-7.65(m,1H),7.50-7.35(m,1H),7.20-7.13(m,2H),7.15-7.02(m,2H),4.06(dd,J=9.2,4.5Hz,1H),3.94(dd,J=9.2,6.0Hz,1H),2.80-2.35(m,13H),2.35-2.20(m,4H),2.28(d,J=4.5Hz,3H).
实施例18
5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-甲基-1H-苯并咪唑。
MS(电喷雾):计算分子量C22H26Cl2N4O,432.15;m/z实测值,432.8[M+H]+.1H NMR(400MHz,CD3OD):8.19(d,J=2.2Hz,1H),8.05(dd,J=8.6,2.2Hz,1H),7.66(br s,1H),7.55(br s,1H),7.32(d,J=8.7Hz,1H),4.30(t,J=6.0Hz,2H),3.00-2.43(m,13H),2.42(s,3H),2.18-2.14(m,2H).
实施例19
6-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26Cl2N4O,432.15;m/z实测值,433.1[M+H]+.1H NMR(400MHz,CD3OD):7.70(br s,1H),7.42(br s,1H),7.17(d,J=2.4Hz,1H),7.08(br s,1H),7.05(dd,J=8.7,2.5Hz,1H),4.13(t,J=6.14Hz,2H),3.00-2.40(m,13H),2.30(s,3H),2.03-1.98(m,2H).
实施例20
5-叔丁基-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C25H33ClN4O,440.23;m/z实测值,441.0[M+H]+.1H NMR(400MHz,CD3OD):8.31(d,J=2.2Hz,1H),8.17(dd,J=8.6,2.2Hz,1H),7.78(brs,1H),7.69(br s,1H),7.55(dd,J=8.6,1.7Hz,1H),7.42(d,J=8.7Hz,1H),4.40(t,J=6.0Hz,2H),3.00-2.55(m,10H),2.51(s,3H),2.35-2.22(m,2H),1.59(s,9H).
实施例21
5-氯-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。MS(电喷雾):计算分子量C21H24ClFN4O,402.16;m/z实测值,403.2[M+H]+.1H NMR(400MHz,CD3OD):7.86-7.83(m,2H),7.64(d,J=1.9Hz,1H),7.60(d,J=8.7Hz,1H),7.39(dd,J=8.7,1.9Hz,1H),7.33-7.29(m,1H),4.21(t,J=5.9Hz,2H),3.20-2.77(m,10H),2.76(s,3H),2.10-2.03(m,2H).
实施例22
2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31ClN4O,426.22;m/z实测值,427.2[M+H]+.1H NMR(400MHz,CD3OD):7.58(d,J=8.6Hz,1H),7.11(s,1H),7.03(d,J=2.5Hz,1H),6.91(dd,J=8.7,2.5Hz,1H),6.80(s,1H),3.99(t,J=6.1Hz,2H),2.75-2.58(m,10H),2.45(s,3H),2.32(s,3H),2.30(s,3H),1.89-1.85(m,2H),1.78-1.74(m,2H).
实施例23
5-氯-6-甲基-2-[3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.1[M+H]+.1H NMR(400MHz,CD3OD):7.60-7.56(m,3H),7.44-7.37(m,2H),7.03-7.00(m,1H),4.05(t,J=6.1Hz,2H),3.00-2.30(m,13H),2.27(s,3H),1.82-1.73(m,2H),1.72-1.67(m,2H).13C NMR(TFA salt,100MHz,CD3OD):161.0,154.0,138.5,131.9,131.7,131.3,130.2,120.0,118.2,116.7,116.2,113.4,68.7,58.0,54.2,51.7,44.2,27.8,23.5,20.8.
实施例24
5-氯-6-氟-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C21H23ClF2N4O,420.15;m/z实测值,421.2[M+H]+.1H NMR(400MHz,CD3OD):7.80-7.75(m,2H),7.66(d,J=6.4Hz,1H),7.45(d,J=8.9Hz,1H),7.27(t,J=9.3Hz,1H),4.21(t,J=8.0Hz,2H),3.25(br s,4H),3.02(br s,4H),2.90(t,J=7.8Hz,2H),2.81(s,3H),2.12-2.05(m,2H).
实施例25
2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H27FN4O,382.22;m/z实测值,383.3[M+H]+.1H NMR(400MHz,CD3OD):7.85-7.80(m,2H),7.57(d,J=8.4Hz,1H),7.49(s,1H),7.38-7.34(m,2H),4.22(t,J=5.9Hz,2H),3.24(br s,4H),2.95(br s,4H),2.84(t,J=7.2Hz,2H),2.77(s,3H),2.46(s,3H),2.12-2.05(m,2H).
实施例26
5,6-二氟-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C21H23F3N4O,404.18;m/z实测值,405.2[M+H]+.1H NMR(400MHz,CD3OD):7.79-7.73(m,2H),7.50-7.45(m,2H),7.28-7.22(m,1H),4.18(t,J=5.9Hz,2H),3.04-2.83(m,10H),2.76(s,3H),2.10-2.03(m,2H).
实施例27
2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C21H25FN4O,368.20;m/z实测值,369.3[M+H]+.1H NMR(400MHz,CD3OD):7.88-7.81(m,2H),7.71-7.66(m,2H),7.52-7.48(m,2H),7.37(t,J=8.8Hz,1H),4.22(t,J=6.0Hz,2H),3.04-2.76(m,13H),2.10-2.03(m,2H).
实施例28
2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31ClN4O,426.22;m/z实测值,427.2[M+H]+.1H NMR(400MHz,CD3OD):7.75-7.65(m,1H),7.40-7.25(m,1H),7.15(d,J=2.5Hz,1H),7.07(d,J=8.2Hz,1H),7.04(dd,J=8.6,2.5Hz,1H),4.13(t,J=6.1Hz,1H),2.85-2.70(m,10H),2.51(br s,3H),2.42(s,3H),2.40(s,3H),2.02-1.96(m,2H),1.88-1.86(m,2H).13C NMR(100MHz,CD3OD):13.7,19.4,24.2,26.9,45.0,50.9,54.7,55.4,55.9,56.6,67.4,112.2,115.2,117.7,118.9,123.7,128.8,133.6,134.5,134.7,135.2,135.5,148.9,163.5.
实施例29
5,6-二甲基-2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=5.96.MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.3[M+H]+.1H NMR(400MHz,CD3OD):7.57-7.50(m,3H),7.48(s,2H),7.23-7.20(m,1H),4.08(t,J=5.8Hz,2H),3.16(br s,4H),3.01(br s,4H),2.82-2.79(m,2H),2.71(s,3H),2.38(s,6H),1.85-1.74(m,4H).
实施例30
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.1H NMR(400MHz,CD3OD):7.68(d,J=8.5Hz,1H),7.21(br s,1H),7.15(d,J=2.5Hz,1H),7.03(dd,J=8.7,2.5Hz,1H),6.90(s,1H),4.13(t,J=6.2Hz,2H),2.70-2.40(m,16H),2.96(s,3H),2.06-1.98(m,2H).
实施例31
2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑。
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.1H NMR(400MHz,CD3OD):7.72-7.69(m,1H),7.50-7.35(m,1H),7.18-7.13(m,2H),7.06-7.03(m,2H),4.14(t,J=6.1Hz,2H),2.85-2.70(m,10H),2.59(s,3H),2.40(s,3H),2.02-1.96(m,2H),1.89-1.85(m,2H).
实施例32
5-叔丁基-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C25H33ClN4O,440.23;m/z实测值,441.5[M+H]+.1H NMR(400MHz,CD3OD):7.76(d,J=8.7Hz,1H),7.62-7.53(m,2H),7.38(dd,J=8.6,2.0Hz,1H),7.15(d,J=2.5Hz,1H),7.04(dd,J=8.7,2.5Hz,1H),4.13(t,J=6.1Hz,2H),2.80-2.20(m,13H),2.06-1.96(m,2H),1.40(s,9H)
实施例33
2-{3-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑。
HPLC:Rt=6.30.MS(电喷雾):计算分子量C23H27F3N4O2,448.21;m/z实测值,449.2[M+H]+.1H NMR(500MHz,CD3OD):7.93(s,1H),7.79(d,J=8.6Hz,1H),7.69-7.66(m,3H),7.11(d,J=9.0Hz,1H),4.16(t,J=5.6Hz,2H),3.90(s,3H),3.45-3.39(m,7H),3.21-3.18(m,3H),3.18(s,3H),2.21-2.17(m,2H).
实施例34
5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑。
HPLC:Rt=6.41.MS(电喷雾):计算分子量C21H23Cl2FN4O,436.12;m/z实测值,437.2[M+H]+.1H NMR(400MHz,CD3OD):7.98(d,J=2.3Hz,1H),7.87(dd,J=8.7,2.3Hz,1H),7.63(d,J=6.4Hz,1H),7.41(d,J=8.8Hz,1H),7.17(d,J=8.7Hz,1H),4.19(t,J=5.7Hz,2H),3.39(br s,4H),3.25-3.20(m,4H),3.09(t,J=7.3Hz,2H),2.83(s,3H),2.19-2.15(m,2H).
实施例35
5,6-二氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。
HPLC:Rt=6.64.MS(电喷雾):计算分子量C21H23Cl3N4O,452.09;m/z实测值,453.2[M+H]+.1H NMR(400MHz,CD3OD):7.74(s,2H),7.60(d,J=8.8Hz,1H),7.08(d,J=2.4Hz,1H),6.94(dd,J=8.8,2.4Hz,1H),4.00(t,J=5.8Hz,2H),3.43(br s,7H),3.19(t,J=7.7Hz,2H),3.05-3.04(m,1H),2.74(s,3H),2.10-2.02(m,2H).
实施例36
5-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.09.MS(电喷雾):计算分子量C21H24Cl2N4O,418.13;m/z实测值,419.2[M+H]+.1H NMR(500MHz,CD3OD):7.76(d,J=8.8Hz,1H),7.73(dd,J=1.9,0.4Hz,1H),7.69(dd,J=8.8,0.4Hz,1H),7.47(dd,J=8.8,1.9Hz,1H),7.23(d,J=2.5Hz,1H),7.09(dd,J=8.8,2.5Hz,1H),4.15(t,J=5.9Hz,2H),3.45(br s,4H),3.34(br s,4H),3.16-3.12(m,2H),2.85(s,3H),2.18-2.12(m,2H).
实施例37
5-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑。
HPLC:Rt=6.36.MS(电喷雾):计算分子量C21H23Cl2FN4O,436.12;m/z实测值,437.2[M+H]+.1H NMR(400MHz,CD3OD):7.78(d,J=6.4Hz,1H),7.73(d,J=8.8Hz,1H),7.55(d,J=8.7Hz,1H),7.19(d,J=2.5Hz,1H),7.06(dd,J=8.8,2.5Hz,1H),4.14(t,J=5.8Hz,2H),3.46(br s,4H),3.37(br s,3H),3.22-3.20(m,1H),3.18-3.14(m,2H),2.86(s,3H),2.19-2.13(m,2H).
实施例38
5-氯-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。
HPLC:Rt=6.20.MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,399.2[M+H]+.1H NMR(500MHz,CD3OD):7.88(dd,J=8.7,2.3Hz,1H),7.83-7.82(m,1H),7.68(d,J=1.6Hz,1H),7.63(d,J=8.9Hz,1H),7.46(dd,J=8.7,1.9Hz,1H),7.14(d,J=8.7Hz,1H),4.16(t,J=6.0Hz,2H),3.24(br s,4H),2.95(br s,4H),2.88-2.85(m,2H),2.77(s,3H),2.26(s,3H),2.11-2.05(m,2H).
实施例39
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑.
HPLC:Rt=5.93.MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,399.3[M+H]+.1H NMR(500MHz,CD3OD):8.10(d,J=2.4Hz,1H),7.97(dd,J=8.7,2.4Hz,1H),7.56(d,J=8.4Hz,1H),7.48(s,1H),7.34(d,J=8.4Hz,1H),7.31(d,J=8.8Hz,1H),4.24(t,J=5.8Hz,2H),3.34(brs,4H),3.14(br s,4H),3.02-2.99(m,2H),2.80(s,3H),2.45(s,3H),2.18-2.12(m,2H).
实施例40
5,6-二氯-2-{3-氯-4-{3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.69.MS(电喷雾):计算分子量C21H23Cl3N4O,452.09;m/z实测值,453.2[M+H]+.1H NMR(400MHz,CD3OD):8.08(d,J=2.3Hz,1H),7.95(dd,J=8.7,2.3Hz,1H),7.81(s,2H),7.26(d,J=8.8Hz,1H),4.25(t,J=5.7Hz,2H),3.55(br s,8H),3.36-3.32(m,2H),2.90(s,3H),2.31-2.25(m,2H).
实施例41
5-氯-6-甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.40.MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.2[M+H]+.1H NMR(500MHz,CD3OD):7.87(dd,J=8.6,2.5Hz,1H),7.82-7.81(m,1H),7.69(s,1H),7.58(s,1H),7.14(d,J=8.7Hz,1H),4.15(t,J=6.0Hz,2H),3.20(br s,4H),2.85(br s,4H),2.83-2.79(m,2H),2.75(s,3H),2.46(s,3H),2.26(s,3H),2.08-2.03(m,2H).
实施例42
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑.
HPLC:Rt=5.92.MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,399.3[M+H]+.1H NMR(500MHz,CD3OD):7.87(d,J=8.8Hz,1H),7.72(d,J=8.5Hz,1H),7.64(s,1H),7.48(d,J=8.5Hz,1H),7.36(d,J=2.4Hz,1H),7.23(dd,J=8.8,2.4Hz,1H),4.26(1,J=5.8Hz,2H),3.60(br s,4H),3.51(br s,4H),3.31-3.27(m,2H),2.98(s,3H),2.58(s,3H),2.31-2.26(m,2H).
实施例43
5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.15.MS(电喷雾):计算分子量C21H24Cl2N4O,418.13;m/z实测值,419.2[M+H]+.1H NMR(500MHz,CD3OD):8.07(d,J=2.3Hz,1H),7.94(dd,J=8.7,2.3Hz,1H),7.63(d,J=1.7Hz,1H),7.59(d,J=8.7Hz,1H),7.38(dd,J=8.7,1.9Hz,1H),7.24(d,J=8.8Hz,1H),4.22(t,J=5.8Hz,2H),3.42(br s,4H),3.29(br s.4H),3.15-3.10(m,2H),2.84(s,3H),2.21-2.15(m,2H).
实施例44
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑.
HPLC:Rt=6.53.MS(电喷雾):计算分子量C22H24ClF3N4O,452.16;m/z实测值,453.2[M+H]+.1H NMR(500MHz,CD3OD):8.12(d,J=2.3Hz,1H),7.99(dd,J=8.7,2.3Hz,1H),7.90(s,1H),7.75(d,J=8.5Hz,1H),7.61(d,J=8.6Hz,1H),7.26(d,J=8.8Hz,1H),4.22(t,J=5.8Hz,2H),3.37(br s,4H),3.21(br s,4H),3.08-3.05(m,2H),2.82(s,3H),2.19-2.14(m,2H).
实施例45
5-氯-6-氟-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.34.MS(电喷雾):计算分子量C22H28ClFN4O,416.18;m/z实测值,417.1[M+H]+.1H NMR(500MHz,CD3OD):7.85(dd,J=8.6,2.3Hz,1H),7.80-7.79(m,1H),7.72(d,J=6.3Hz,1H),7.51(d,J=8.6Hz,1H),7.10(d,J=8.7Hz,1H),4.14(t,J=6.0Hz,2H),3.20(br s,8H),2.85-2.81(m,2H),2.76(s,3H),2.25(s,3H),2.09-2.04(m,2H).
实施例46
5-甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.13.MS(电喷雾):计算分子量C23H30N4O,378.24;m/z实测值,379.2[M+H]+.1H NMR(500MHz,CD3OD):7.87(d,J=8.6Hz,1H),7.82-7.81(m,1H),7.54(d,J=8.4Hz,1H),7.46(s,1H),7.32(d,J=8.4Hz,1H),7.14(d,J=8.6Hz,1H),4.16(t,J=6.0Hz,2H),3.29(br s,4H),3.06(br s,4H),2.96-2.93(m,2H),2.79(s,3H),2.46(s,3H),2.26(s,3H),2.14-2.08(m,2H).
实施例47
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。HPLC:Rt=5.70.MS(电喷雾):计算分子量C21H25ClN4O,384.17;m/z实测值,385.2[M+H]+.1H NMR(500MHz,CD3OD):8.13(d,J=2.3Hz,1H),8.00(dd,J=8.7,2.3Hz,1H),7.72-7.67(m,2H),7.53=7.48(m,2H),7.33(d,J=8.8Hz,1H),4.25(t,J=5.9Hz,2H),3.30(br s,4H),3.06(br s,4H),2.96-2.92(m,2H),2.79(s,3H),2.15-2.10(m,2H).
实施例48
2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=5.89.MS(电喷雾):计算分子量C22H28N4O,364.23;m/z实测值,365.2[M+H]+.1H NMR(500MHz,CD3OD):7.90(dd,J=8.5,2.5Hz,1H),7.85-7.84(m,1H),7.70-7.66(m,2H),7.52-7.47(m,2H),7.15(d,J=8.6Hz,1H),4.16(t,J=6.0Hz,2H),3.23(br s,4H),2.96(br s,4H),2.87-2.84(m,2H),2.77(s,3H),2.27(s,3H),2.11-2.05(m,2H).
实施例49
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑。HPLC:Rt=5.68.MS(电喷雾):计算分子量C21H25ClN4O,384.17;m/z实测值,385.3[M+H]+.1H NMR(500MHz,CD3OD):7.78(d,J=8.8Hz,1H),7.77-7.74(m,2H),7.56-7.53(m,2H),7.27(d,J=2.4Hz,1H),7.12(dd,J=8.8,2.4Hz,1H),4.16(t,J=5.9Hz,2H),3.44(br s,4H),3.32(br s,4H),3.14-3.11(m,2H),2.84(s,3H),2.18-2.12(m,2H).
实施例50
5-氯-6-氟-2-{3-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:R4=6.15.MS(电喷雾):计算分子量C22H26ClFN4O2,432.17;m/z实测值,433.2[M+H]+.1H NMR(400MHz,CD3OD):7.75-7.73(m,1H),7.61-7.58(m,2H),7.52(d,J=8.5Hz,1H),7.09-7.07(m,1H),4.16(t,J=5.6Hz,2H),3.88(s,3H),3.48(br s,8H),3.25-3.22(m,2H),2.86(s,3H),2.22-2.19(m,2H).
实施例51
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲氧基-1H-苯并咪唑。
HPLC:Rt=5.85.MS(电喷雾):计算分子量C22H27ClN4O2,414.18;m/z实测值,415.2[M+H]+.1H NMR(400MHz,CD3OD):8.08(d,J=2.3Hz,1H),7.94(dd,J=8.7,2.3Hz,1H),7.56(d,J=8.9Hz,1H),7.30(d,J=8.8Hz,1H),7.14(d,J=2.0Hz,1H),7.10(dd,J=9.0,2.3Hz,1H),4.26(t,J=5.7Hz,2H),3.82(s,3H),3.52(br s,8H),3.30-3.26(m,2H),2.88(s,3H),2.29-2.22(m,2H).
实施例52
5-叔丁基-2-{3,5-二溴-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.81.MS(电喷雾):计算分子量C25H32Br2N4O,562.09;m/z实测值,563.1[M+H]+.1H NMR(500MHz,CD3OD):8.31(s,2H),7.70-7.62(m,3H),4.17(t,J=5.8Hz,2H),3.37(br s,4H),3.20(br s,4H),3.18-3.15(m,2H),2.82(s,3H),2.22-2.16(m,2H),1.34(s,9H).
实施例53
2-{2-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑.
HPLC:Rt=6.34.MS(电喷雾):计算分子量C23H27F3N4O2,448.21;m/z实测值,449.3[M+H]+.1H NMR(500MHz,CD3OD):8.11-8.08(m,2H),7.96(d,J=8.6Hz,1H),7.83(d,J=8.6Hz,1H),6.89-6.87(m,2H),4.28(t,J=5.8Hz,2H),4.17(s,3H),3.58(br s,4H),3.49(br s,4H),3.30-3.27(m,2H),2.97(s,3H),2.31-2.25(m,2H).
实施例54
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑.
HPLC:Rt=6.47.MS(电喷雾):计算分子量C22H24ClF3N4O,452.16;m/z实测值,453.2[M+H]+.1H NMR(400MHz,CD3OD):8.09(s,1H),7.93(d,J=8.7Hz,1H),7.85-7.80(m,2H),7.29(d,J=2.3Hz,1H),7.15(dd,J=8.8,2.5Hz,1H),4.20(t,J=5.8Hz,2H),3.62(br s,8H),3.40-3.36(m,2H),2.93(s,3H),2.29-2.20(m,2H).
实施例55
2-{3-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=5.51.MS(电喷雾):计算分子量C21H26N4O,350.21;m/z实测值,351.2[M+H]+.1H NMR(400MHz,CD3OD):7.75-7.72(m,2H),7.70-7.60(m,2H),7.54-7.51(m,3H),7.26-7.24(m,1H),4.16(t,J=6.0Hz,2H),3.35(br s,4H),3.19(br s,4H),3.05-3.01(m,2H),2.81(s,3H),2.14-2.10(m,2H).
实施例56
(2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑-5-基)苯基-甲酮.
HPLC:Rt=6.36.MS(电喷雾):计算分子量C29H32N4O2,468.25;m/z实测值,469.3[M+H]+.1H NMR(400MHz,CD3OD):8.11(s,1H),7.90-7.77(m,4H),7.72-7.65(m,3H),7.58-7.52(m,3H),7.23-7.20(m,1H),4.15(t,J=5.7Hz,2H),3.57(br s,8H),3.26-3.21(m,2H),2.95(s,3H),1.96-1.93(m,4H).
实施例57-71中的下列化合物根据实施例2中所述的方法进行制备。
实施例57
6-氯-2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H27Cl2N3O,431.15;m/z实测值,432.1[M+H]+.1H NMR(400MHz,CD3OD):7.69(d,J=8.0Hz,1H),7.42(br s,1H),7.14(d,J=4.0Hz,1H),7.07-7.05(m,1H),7.02(dd,J=8.0,4.0Hz,1H),4.04(t,J=8.0Hz,2H),2.95-2.85(m,2H),2.58(s,3H),2.28(s,3H),2.10-2.00(m,2H),1.84-1.75(m,4H),1.46-1.41(m,2H),1.22-1.35(m,3H).
实施例58
5-叔丁基-2-{3-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C26H34ClN3O,439.24;m/z实测值,440.2[M+H]+.1H NMR(400MHz,CD3OD):8.10(d,J=2.2Hz,1H),7.97(dd,J=8.6,2.2Hz,1H),7.58(br s,1H),7.52-7.45(m,1H),7.36(dd,J=8.6,1.7Hz,1H),7.21(d,J=8.7Hz,1H),4.14(t,J=6.2Hz,2H),2.93-2.85(m,2H),2.28(s,3H),2.11-2.00(m,2H),1.92-1.83(m,2H),1.82-1.74(m,2H),1.52-1.45(m,2H),1.42-1.20(m,12H).
实施例59
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H30ClN3O,411.21;m/z实测值,412.4[M+H]+.1H NMR(400MHz,CD3OD):7.73-7.63(m,1H),7.31(br s,1H),7.13(d,J=2.5Hz,1H),7.07(d,J=8.2Hz,1H),7.02(dd,J=8.7,2.5Hz,1H),4.06(t,J=6.3Hz,2H),2.93-2.89(m,2H),2.51(s,3H),2.40(s,3H),2.29(s,3H),2.00-2.15(m,2H),1.86-1.77(m,4H),1.48-1.42(m,2H),1.35-1.24(m,3H).
实施例60
5-氯-6-甲基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.84.MS(电喷雾):计算分子量C23H28ClN3O,397.19;m/z实测值,398.5[M+H]+.1H NMR(500MHz,CD3OD):7.95(d,J=9.0Hz,2H),7.67(s,1H),7.57(s,1H),7.12(d,J=9.0Hz,2H),4.05(t,J=6.3Hz,2H),3.42(d,J=10.4Hz,2H),2.92-2.86(m,2H),2.89(s,3H),2.45(s,3H),1.96-1.93(m,2H),1.82-1.77(m,2H),1.60-1.52(m,1H),1.45-1.30(m,4H).
实施例61
5-氯-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.62.MS(电喷雾):计算分子量C22H22ClN3O,383.18;m/z实测值,384.5[M+H]+.1H NMR(500MHz,CD3OD):7.96(d,J=9.0Hz,2H),7.66(d,J=2.0Hz,1H),7.61(d,J=8.7Hz,1H),7.42(dd,J=8.7,1.9Hz,1H),7.12(d,J=9.0Hz,2H),4.05(t,J=6.3Hz,2H),3.43-3.40(m,2H),2.92-2.86(m,2H),2.76(s,3H),1.96-1.93(m,2H),1.82-1.76(m,2H),1.60-1.51(m,1H),1.46-1.30(m,4H).
实施例62
5-氯-6-氟-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.80.MS(电喷雾):计算分子量C22H25ClFN3O,401.17;m/z实测值,402.5[M+H]+.1H NMR(500MHz,CD3OD):7.93(d,J=9.0Hz,2H),7.71(d,J=6.3Hz,1H),7.49(d,J=8.6Hz,1H),7.08(d,J=9.0Hz,2H),4.03(t,J=6.3Hz,2H),3.44-3.40(m,2H),2.92-2.86(m,2H),2.76(s,3H),1.96-1.93(m,2H),1.82-1.76(m,2H),1.60-1.51(m,1H),1.43-1.29(m,4H).
实施例63
5-叔丁基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑。HPLC:Rt=7.16.MS(电喷雾):计算分子量C26H35N3O,405.28;m/z实测值,406.6[M+H]+.1H NMR(500MHz,CD3OD):8.09(d,J=9.0Hz,2H),7.70(s,1H),7.71(s,2H),7.25(d,J=9.0Hz,2H),4.16(t,J=6.3Hz,2H),3.58-3.52(m,2H),3.03-2.97(m,2H),2.87(s,3H),2.06-2.03(m,2H),1.93-1.87(m,2H),1.71-1.63(m,1H),1.57-1.49(m,4H),1.44(s,9H).
实施例64
5-甲基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.HPLC:Rt=6.53.MS(电喷雾):计算分子量C23H29N3O,363.23;m/z实测值,364.5[M+H]+.1H NMR(500MHz,CD3OD):7.96(d,J=9.0Hz,2H),7.53(d,J=8.4Hz,1H),7.47(s,1H),7.33(d,J=8.4Hz,1H),7.14(d,J=9.0Hz,2H),4.05(t,J=6.2Hz,2H),3.44-3.41(m,2H),2.92-2.86(m,2H),2.76(s,3H),2.45(s,3H),1.96-1.92(m,2H),1.82-1.76(m,2H),1.60-1.50(m,1H),1.45-1.33(m,4H).
实施例65
2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
HPLC:Rt=6.28.MS(电喷雾):计算分子量C22H27N3O,349.22;m/z实测值,350.5[M+H]+.1H NMR(500MHz,CD3OD):8.00(d,J=8.9Hz,2H),7.70-7.66(m,2H),7.51-7.47(m,2H),7.15(d,J=8.9Hz,2H),4.06(t,J=6.2Hz,2H),3.43-3.40(m,2H),2.92-2.85(m,2H),2.76(s,3H),1.96-1.93(m,2H),1.82-1.77(m,2H),1.60-1.50(m,1H),1.45-1.33(m,4H).
实施例66
6-氯-2-{2-氟-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H27ClFN3O,415.18;m/z实测值,416.3[M+H]+.1H NMR(400MHz,CD3OD):8.02(s,1H),7.41(s,1H),7.07-7.02(m,1H),6.96-6.85(m,2H),4.06(t,J=6.3Hz,2H),2.93-2.83(m,2H),2.60(s,3H),2.26(s,3H),2.07-1.97(m,2H),1.89-1.71(m,4H),1.49-1.40(m,2H),1.38-1.22(m,3H).
实施例67
5-氟-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28FN3O,381.22;m/z实测值,382.3[M+H]+.1H NMR(400MHz,CD3OD):7.61-7.52(m,2H),7.29(dd,J=9.1,2.3Hz,1H),7.09-7.01(m,1H),6.96-6.86(m,2H),4.04(t,J=6.4Hz,2H),2.95-2.82(m,2H),2.52(s,3H),2.28(s,3H),2.08-1.96(m,2H),1.88-1.72(m,4H),1.51-1.40(m,2H),1.38-1.19(m,3H).
实施例68
4-氯-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28ClN3O,397.19;m/z实测值,398.3[M+H]+.1H NMR(400MHz,CD3OD):7.56(d,J=8.5Hz,1H),7.54(d,J=7.7Hz,1H),7.31-7.20(m,2H),6.93(d,J=2.3Hz,1H),7.90(dd,J=8.5,2.5Hz,1H),4.04(t,J=6.3Hz,2H),2.94-2.84(m,2H),2.51(s,3H),2.28(s,3H),2.09-1.97(m,2H),1.89-1.72(m,4H),1.52-1.40(m,2H),1.37-1.21(m,3H).
实施例69
6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H30ClN3O,411.21;m/z实测值,412.4[M+H]+.1H NMR(400MHz,CD3OD):7.54(d,J=8.4Hz,1H),7.42(br s,1H),7.09-7.05(m,1H),6.94(d,J=2.3H z,1H),6.90(dd,J=8.4,2.4Hz,1H),4.06(t,J=6.3Hz,2H),2.96-2.86(m,2H),2.59(s,3H),2.49(s,3H),2.29(s,3H),2.10-2.00(m,2H),1.90-1.75(m,4H),1.52-1.43(m,2H),1.38-1.23(m,3H).
实施例70
5-氯-2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑。
MS(电喷雾):计算分子量C22H24Cl2FN3O,435.13;m/z实测值,436.3[M+H]+.1H NMR(400MHz,CD3OD):7.78(d,J=8.7Hz,1H),7.70(d,J=6.6Hz,1H),7.46(d,J=9.3Hz,1H),7.14(d,J=2.4Hz,1H),7.04(dd,J=8.7,2.5Hz,1H),4.06(t,J=6.4Hz,2H),2.93-2.84(m,2H),2.28(s,3H),2.09-1.96(m,2H),1.87-1.71(m,4H),1.49-1.39(m,2H),1.35-1.22(m,3H).
实施例71
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-3H-萘并[1,2-d]咪唑。
MS(电喷雾):计算分子量C26H28ClN3O,433.19;m/z实测值,434.3[M+H]+.1H NMR(400MHz,CD3OD):8.52-8.44(m,1H),7.97(d,J=8.2Hz,1H),7.78(d,J=8.6Hz,1H),7.74(s,2H),7.64-7.57(m,1H),7.53-7.47(m,1H),7.15(d,J=2.5Hz,1H),7.02(dd,J=8.6,2.5Hz,1H),4.01(t,J=6.3Hz,2H),2.89-2.78(m,2H),2.25(s,3H),2.03-1.90(m,2H),1.83-1.64(m,4H),1.43-1.33(m,2H),1.33-1.18(m,3H).
实施例72-81中的下列化合物根据实施例1中所述的方法进行制备.
实施例72
4,6-二甲基-2-{2-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.3[M+H]+.1H NMR(400MHz,CD3OD):7.51(d,J=8.5Hz,1H),7.20(s,1H),6.92-6.70(m,3H),4.07(t,J=6.1Hz,2H),2.72-2.40(m,19H),2.30(s,3H),2.02-1.98(m,2H).
实施例73
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,399.4[M+H]+.1H NMR(400MHz,CD3OD):7.72-7.67(m,1H),7.41(s,1H),7.18-7.13(m,2H),7.07-7.02(m,2H),4.13(t,J=6.1Hz,2H),2.80-2.40(m,13H),2.30(s,3H),2.05-1.98(m,2H).
实施例74
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-氟-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26ClFN4O,416.18;m/z实测值,417.1[M+H]+.1H NMR(400MHz,CD3OD):7.76-7.65(br s,1H),7.47-7.33(brs,1H),7.17(d,J=2.5Hz,1H),7.07-7.00(m,2H),4.13(t,J=6.1Hz,2H),2.68-2.40(m,13H),2.32(s,3H),2.08-1.97(m,2H).
实施例75
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基)-3H-萘并[1,2-d]咪唑.
MS(电喷雾):计算分子量C25H27ClN4O,434.19;m/z实测值,435.2[M+H]+.1H NMR(400MHz,CD3OD):8.49(s,1H),7.93(d,J=8.1Hz,1H),7.74-7.68(m,3H),7.60-7.55(m,1H),7.48-7.43(m,1H),7.07(d,J=2.5Hz,1H),6.90(dd,J=8.7,2.5Hz,1H),3.92(t,J=6.1Hz,2H),2.62-2.30(m,10H),2.22(s,3H),1.89-1.81(m,2H).
实施例76
6-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5H-[1,3]二氧杂环戊烯并[4′,5′:4,5]苯并[1,2-d]咪唑.
MS(电喷雾):计算分子量C22H25ClN4O3,428.16;m/z实测值,429.2[M+H]+.1H NMR(400MHz,CD3OD):7.74(d,J=8.7Hz,1H),7.13(d,J=2.5Hz,1H),7.07-6.97(m,3H),5.98(s,2H),4.11(t,J=6.2Hz,2H),2.74-2.36(m,10H),2.31(s,3H),2.07-1.96(m,2H).
实施例77
6-氯-2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28Cl2N4O,446.16;m/z实测值,447.1[M+H]+.1H NMR(400MHz,CD3OD):7.72(d,J=8.6Hz,1H),7.44(br s,1H),7.18(d,J=2.5Hz,1H),7.10-7.08(m,1H),7.05(dd,J=8.7,2.5Hz,1H),4.14(t,J=6.1Hz,2H),2.83-2.78(m,4H),2.75-2.69(m,6H),2.60(s,3H),2.39(s,3H),2.04-1.96(m,2H),1.90-1.84(m,2H).
实施例78
2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.2[M+H]+.1H NMR(400MHz,CD3OD):8.19(d,J=2.2Hz,1H),8.04(dd,J=8.6,2.2Hz,1H),7.42(d,J=7.9Hz,1H),7.22(d,J=8.7Hz,1H),7.18-7.11(m,1H),7.04(d,J=7.2Hz,1H),4.19(t,J=6.0Hz,2H),2.84-2.66(m,10H),2.62(s,3H),2.36(s,3H),2.08-1.98(m,2H),1.89-1.82(m,2H).
实施例79
4,6-二甲基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C25H34N4O,406.27;m/z实测值,407.2[M+H]+.1H NMR(400MHz,CD3OD):7.75-7.70(m,1H),7.69-7.64(d,J=7.7Hz,1H),7.46-7.40(m,1H),7.23(br s,1H),7.04(m,1H),6.90(br s,1H),4.12(t,J=6.2Hz,2H),2.83-2.75(m,4H),2.73-2.65(m,4H),2.63-2.54(m,5H),2.44(s,3H),2.35(s,3H),1.89-1.79(m,4H),1.76-1.68(m,2H).
实施例80
5-氯-2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
实施例81
2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
实施例82
{2-(6-氯-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺。
A.4-溴-3-二甲氨基甲基-苯酚.在室温下,将2-溴-5-羟基-苯甲醛(5.0g,24.9mmol,1.0当量)和2.0M二甲胺的THF溶液(31mL,62mmol,2.5当量)在二氯乙烷(50mL)中搅拌1.0h.加入三乙酰氧基硼氢化钠(15.8g,75mmol,3.0当量),混合物搅拌3.0h,然后倒入到饱和NaHCO3水溶液中。含水混合物用氯仿萃取3次,将合并的萃取液干燥(Na2SO4),过滤,接着在减压下浓缩。残余物用方法2提纯,得到2.12g(38%)标题化合物。
1H NMR(400MHz,CD3OD):7.36(dd,J=8.6,1.8Hz,1H),6.91-6.90(m,1H),6.67-6.62(m,1H),3.53(d,J=1.3Hz,1H),2.30(m,6H).
B.{2-溴-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺.在0℃下,向3-(1-甲基-哌啶-4-基)-丙烷-1-醇(989mg,6.3mmol,1.0当量)和甲磺酰氯(683μL,8.8mmol,1.4当量)在二氯甲烷(12mL)中的溶液中加入三乙胺(1.57mL,11.3mmol,1.8当量)。将反应混合物温热至室温,接着在室温下搅拌12h,然后倒入到饱和NaHCO3水溶液中。含水混合物用含10%2-丙醇的氯仿萃取3次,将萃取液干燥(Na2SO4),过滤,接着在减压下浓缩。将残余物溶于乙腈(21mL)中,接着加入4-溴-3-二甲氨基甲基-苯酚(1.44g,6.3mmol,1.0当量)和碳酸铯(4.1g,12.6mmol,2.0当量)。混合物在室温下搅拌12h,然后温热至40℃2.0h,然后50℃1.0h,最后65℃1.5h。将混合物倒入到饱和NaHCO3水溶液中并用乙酸乙酯萃取两次,接着用氯仿萃取一次。将合并的萃取液干燥(Na2SO4),过滤,接着在减压下浓缩。通过方法2提纯,得到814mg(40%)标题化合物。
1H NMR(400MHz,CD3OD):7.45(d,J=8.8Hz,1H),7.05(d,J=3.1Hz,1H),6.78(dd,J=8.8,3.1Hz,1H),3.98(t,J=6.4Hz,2H),3.58(s,2H),2.93-2.86(m,2H),2.31(s,6H),2.29(s,3H),2.10-1.98(m,2H),1.86-1.73(m,4H),1.49-1.22(m,5H).
C.{2-(6-氯-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺.在-78℃下,向{2-溴-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺(801mg,2.2mmol,1.0当量)在THF(10mL)中的溶液中加入1.7M叔丁基锂的戊烷溶液(3.83mL,6.5mmol,3.0当量),将所述溶液搅拌15min。然后,将该溶液温热至0℃,搅拌5min,然后再冷却至-78℃。加入DMF(1.68mL,21.7mmol,10.0当量),将混合物搅拌30min。加入水(1.0mL),将混合物倒入到饱和NaHCO3水溶液中。含水混合物用乙酸乙酯萃取3次,将合并的萃取液干燥(Na2SO4),过滤,接着在减压下浓缩。将残余物通过方法2进行部分提纯,得到221mg 2-二甲氨基甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛和数种其它未识别产物的混合物。将该粗二甲氨基甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛(110mg)溶于DMF中,加入5-氯-3-甲基-苯-1,2-二胺(54mg,0.34mmol)和Na2S2O5(85mg,0.45mmo1)。将混合物温热至90℃,搅拌3h。反应混合物通过方法2提纯,得到15.2mg标题化合物。
MS(电喷雾):计算分子量C26H35ClN4O,454.25;m/z实测值,455.5[M+H]+.1H NMR(400MHz,CD3OD):8.07(d,J=8.6Hz,1H),7.47-7.42(m,1H),7.07-6.97(m,3H),4.04(t,J=6.4Hz,2H),3.58(s,2H),2.93-2.82(m,2H),2.56(s,3H),2.43(s,6H),2.27(s,3H),2.06-1.93(m,2H),1.87-1.70(m,4H),1.49-1.40(m,2H),1.36-1.21(m,3H).
实施例83
{2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺.
标题化合物如实施例77中所述那样进行制备。
MS(电喷雾):计算分子量C26H35FN4O,438.28;m/z实测值,439.5[M+H]+.1H NMR(400MHz,CD3OD):8.06(d,J=8.6Hz,1H),7.43-7.40(m,1H),7.06(dd,J=8.6,2.6Hz,1H),7.03-6.95(m,2H),4.06(t,J=6.4Hz,2H),3.59(s,2H),2.89-2.86(m,2H),2.49(s,3H),2.44(s,6H),2.27(s,3H),2.07-1.96(m,2H),1.89-1.72(m,4H),1.51-1.41(m,2H),1.39-1.22(m,3H).
实施例84
4-{3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-[1,4]二氮杂环庚烷-5-酮.
A.4-(3-碘-丙氧基)-2-甲基-苯甲醛.将1-溴-3-氯丙烷(5.03g,32.0mmol,1.0当量)加入到2-甲基-4-羟基苯甲醛(4.35g,32.0mmol,1.0当量)和K2CO3(8.8g,64.0mmol,2.0当量)在乙腈(75mL)中的溶液中。将混合物在65℃加热16h,然后冷却至室温,通过硅藻土过滤。将滤液浓缩,残余物通过柱色谱提纯(硅胶,含10%乙酸乙酯的己烷),得到5.58g(82%)4-(3-氯-丙氧基)-2-甲基-苯甲醛。在3天(d)内,向回流下的4-(3-氯-丙氧基)-2-甲基-苯甲醛在丙酮(100mL)中的溶液中分批加入KI(58g)。将混合物冷却至室温,接着加入水。含水混合物用乙酸乙酯萃取3次,将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。粗残余物用柱色谱(硅胶,含5%乙酸乙酯的己烷)提纯,得到6.13g(77%)标题化合物。
1H NMR(400MHz,CD3OD):10.1(s,1H),7.75(d,J=8.6Hz,1H),6.84(dd,J=8.6,2.5Hz,1H),6.74(d,J=2.2Hz,1H),4.11(t,J=5.8Hz,2H),3.36(t,J=6.7Hz,2H),2.65(s,3H),2.29(m,2H).
B.4-{3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-[1,4]二氮杂环庚烷-5-酮.在室温下,向搅拌下的5-氧代-[1,4]二氮杂环庚烷-1-羧酸叔丁酯(3.0g,14.0mmol,1.0当量)在DMF(45mL)中的溶液中加入60%的氢化钠(560mg,14.0mmol,1.0当量)。搅拌30min后,加入4-(3-碘-丙氧基)-2-甲基-苯甲醛(4.26g,14.0mmol,1.0当量)在DMF(5mL)中的溶液。将混合物搅拌16h,然后倒入到水中,接着用乙酸乙酯萃取。将合并的萃取物干燥(Na2SO4),过滤,浓缩。残余物通过柱色谱(硅胶,含5-50%乙酸乙酯的己烷)进行部分提纯,得到4-[3-(4-甲酰基-3-甲基-苯氧基)-丙基]-5-氧代-[1,4]二氮杂环庚烷-1-羧酸叔丁酯和数种未识别产品的混合物。将此不纯的混合物(200mg)、5-氯-3-甲基-苯-1,2-二胺(80.1mg)和Na2S2O5(97mg)在DMF(1.0mL)中在90℃搅拌3h。冷却至室温后,将反应混合物装载到硅胶上,通过方法2提纯,得到4-{3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-5-氧代-[1,4]二氮杂环庚烷-1-羧酸叔丁酯和数种未识别产物的混合物。将此混合物溶于二氯甲烷(1.0mL)和TFA(1.0mL)中,接着在室温下搅拌1h。将该反应混合物装载到硅胶上,通过方法2提纯,得到91.0mg(42%)标题化合物。
MS(电喷雾):计算分子量C23H27ClN4O2,426.18;m/z实测值,427.4[M+H]+.1H NMR(400MHz,CD3OD):7.55(d,J=8.5Hz,1H),7.42(br s,1H),7.09-7.06(m,1H),6.97(d,J=2.4Hz,1H),6.93(dd,J=8.5,2.5Hz,1H),4.10(t,J=6.1Hz,2H),3.67-3.56(m,4H),2.98-2.89(m,4H),2.72-2.66(m,2H),2.59(s,3H),2.50(s,3H),2.12-2.01(m,2H).
实施例85
4-{3-[4-(5-叔丁基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-1-甲基-[1,4]二氮杂环庚烷-5-酮。
4-{3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-[1,4]二氮杂环庚烷-5-酮(95mg,0.22mmol,1.0当量)和37%的甲醛水溶液(35μL,0.44mmol,2.0当量)在二氯乙烷中在室温下搅拌1.0h。加入三乙酰氧基硼氢化钠(139mg,0.66mmol,3.0当量),接着将混合物搅拌1.0h,然后倒入到饱和NaHCO3水溶液中。含水混合物用乙酸乙酯萃取3次,将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。残余物用方法2提纯,得到34mg(35%)标题化合物。
MS(电喷雾):计算分子量C27H36N4O2,448.28;m/z实测值,449.4[M+H]+.1H NMR(400MHz,CD3OD):7.62(br s,1H),7.56(d,J=8.4Hz,1H),7.53(d,J=8.5Hz,1H),7.38(dd,J=8.6,1.7Hz,1H),6.95(d,J=2.3Hz,1H),6.92(dd,J=8.5,2.5Hz,1H),4.09(t,J=6.0Hz,2H),3.65-3.59(m,4H),2.73-2.59(m,6H),2.52(s,3H),2.38(s,3H),2.11-2.02(m,2H).1.43(s,9H).
实施例86
5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
标题化合物如实施例84中所述那样进行制备,用3-甲基-哌嗪-1-羧酸叔丁酯代替5-氧代-[1,4]二氮杂环庚烷-1-羧酸叔丁酯。
MS(电喷雾):计算分子量C26H36N4O,420.29;m/z实测值,421.5[M+H]+.1H NMR(400MHz,CD3OD):7.66-7.49(m,3H),7.38(dd,J=8.6,1.8Hz,1H),6.95(d,J=2.2Hz,1H),6.91(dd,J=8.4,2.5Hz,1H),4.12(t,J=6.2Hz,2H),3.10-2.82(m,5H),2.60-2.32(m,7H),2.09-1.89(m,2H),1.43(s,9H),1.10(d,J=6.0Hz,3H).
实施例87
5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑.
标题化合物由5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑根据实施例85中所述的方法进行制备。
MS(电喷雾):计算分子量C27H38N4O,434.30;m/z实测值,435.5[M+H]+.1H NMR(400MHz,CD3OD):7.69-7.47(m,3H),7.38(dd,J=8.6,1.9Hz,1H),6.95(d,J=2.3Hz,1H),6.91(dd,J=8.5,2.4Hz,1H),4.11(t,J=6.2Hz,2H),3.10-2.94(m,2H),2.84-2.70(m,2H),2.56-2.39(m,6H),2.31-2.19(m,4H),2.09-1.88(m,3H),1.43(s,9H),1.12(d,J=6.3Hz,3H).
实施例88
6-氯-4-甲基-2-[2-甲基-4-(3-哌啶-4-基-丙氧基)-苯基]-1H-苯并咪唑。
在0℃下,向(3-羟基-丙基)-哌啶-1-羧酸叔丁酯(4.00g,16.4mmol,1.0当量)和三乙胺(3.40mL,24.6mmol,1.5当量)在二氯甲烷中的溶液中加入甲磺酰氯(1.53mL,19.7mmol,1.2当量)。将溶液温热至室温,接着搅拌1.0h,然后倒入到饱和NaHCO3水溶液中。含水混合物用氯仿萃取3次,将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。残余物通过柱色谱(硅胶,含10%甲醇的二氯甲烷)提纯。部分提纯的4-(3-甲磺酰氧基-丙基)-哌啶-1-羧酸叔丁酯(500mg,1.56mmol,1.0当量)与4-羟基-2-甲基-苯甲醛(212mg,1.56mmol,1.0当量)和碳酸铯(1.01g,3.12mmol,2.0当量)在乙腈中在室温下搅拌4天(d)。混合物通过硅藻土过滤,接着将滤液浓缩。粗物质通过柱色谱(硅胶,含25%乙酸乙酯的己烷)部分提纯。将4-[3-(4-甲酰基-3-甲基-苯氧基)-丙基]-哌啶-1-羧酸叔丁酯(146mg,0.41mmol,1.0当量)、5-氯-3-甲基-苯-1,2-二胺(63mg,0.41mmol,1.0当量)和Na2S2O5(100mg,0.53mmol,1.3当量)在90℃下在DMF中搅拌2.5h。将混合物冷却至室温,加入水(75mL),生成浅褐色沉淀。过滤收集固体4-{3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-哌啶-1-羧酸叔丁酯,将其溶于二氯甲烷(2.0mL)和三氟乙酸1.0mL)的溶液中,接着在室温下搅拌1.5h。将反应混合物直接装载到硅胶上,根据方法2提纯,得到52.1mg标题化合物。
MS(电喷雾):计算分子量C23H28ClN3O,397.19;m/z实测值,398.3[M+H]+.1H NMR(400MHz,CD3OD):7.55(d,J=8.4Hz,1H),7.42(br s,1H),7.10-7.07(m,1H),6.96-6.95(m,1H),6.91(dd,J=8.5,2.4Hz,1H),4.09(t,J=6.2Hz,2H),3.45-3.39(m,2H),3.06-2.96(m,2H),2.59(s,3H),2.50(s,3H),2.07-1.99(m,2H),1.93-1.84(m,2H),1.76-1.64(m,1H),1.59-1.50(m,2H),1.48-1.36(m,2H).
实施例89
5-氟-4-甲基-2-[2-甲基-4-(3-哌啶-4-基-丙氧基)-苯基]-1H-苯并咪唑。标题化合物如实施例88中所述那样进行制备。
MS(电喷雾):计算分子量C23H28FN3O,381.22;m/z实测值,382.4[M+H]+.1H NMR(400MHz,CD3OD):7.56(d,J=8.5Hz,1H),7.44-7.38(m,1H),7.09-7.02(m,1H),6.96(d,J=2.3Hz,1H),6.91(dd,J=8.4,2.5Hz,1H),4.09(t,J=6.2Hz,2H),3.44-3.36(m,2H),3.06-2.95(m,2H),2.52(d,J=1.6Hz,3H),2.50(s,3H),2.08-1.98(m,2H),1.94-1.83(m,2H),1.77-1.65(m,1H),1.59-1.50(m,2H),1.48-1.35(m,2H).
实施例90
6-氯-2-{4-[3-(1-乙基-哌啶-4-基)-丙氧基]-2-甲基-苯基}-4-甲基-1H-苯并咪唑.
标题化合物如实施例85中所述那样进行制备,用乙醛代替甲醛水溶液。
MS(电喷雾):计算分子量C25H32ClN3O,425.22;m/z实测值,426.4[M+H]+.1H NMR(400MHz,CD3OD):7.53(d,J=8.5Hz,1H),7.41(br s,1H),7.09-7.04(m,1H),6.93(d,J=2.2Hz,1H),6.89(dd,J=8.4,2.4Hz,1H),4.04(t,J=6.3Hz,2H),3.05-2.94(m,2H),2.59(s,3H),2.49(s,3H),2.45(q,J=7.2Hz,2H),2.05-1.94(m,2H),1.89-1.74(m,4H),1.50-1.21(m,5H),1.13(t,J=7.2Hz,3H).
实施例91
{2-[3-氯-4-(4-甲基-1H-苯并咪唑-2-基)-苯氧基]-乙基}-甲基-(1-甲基-哌啶-4-基)-胺.
A.4-(2-溴-乙氧基)-2-氯-苯甲醛.将1,2-二溴乙烷(5.5mL,64.0mmol,5.0当量)加入到2-氯-4-羟基-苯甲醛(2.0g,12.8mmol,1.0当量)和K2CO3(4.0g,29.0mmol,2.25当量)在乙腈(13mL)中的混合物中。混合物加热回流16h,冷却至室温,接着通过硅藻土过滤。滤液浓缩,得到粗产物,该粗产物用柱色谱(硅胶,含5%乙酸乙酯的己烷)提纯,得到2.28g(72%)标题化合物。
1H NMR(400MHz,CD3OD):10.3(d,J=0.7Hz,1H),7.90(d,J=8.8Hz,1H),7.13(d,J=2.4Hz,1H),7.06(ddd,J=8.8,2.5,0.7Hz,1H),4.48-4.42(m,2H),3.78-3.74(m,2H).
B.2-氯-4-{2-[甲基-(1-甲基-哌啶-4-基)-氨基]-乙氧基}-苯甲醛.向4-(2-溴-乙氧基)-2-氯-苯甲醛(1.24g,5.0mmol,1.0当量)和甲基-(1-甲基-哌啶-4-基)-胺(1.28g,10.0mmol,2.0当量)在1-丁醇中的溶液中加入K2CO3(2.10g,15mmol,3.0当量),接着将溶液温热至90℃。搅拌16h后,将混合物倒入到水中,用乙酸乙酯萃取两次。合并的萃取液干燥(Na2SO4),过滤,浓缩。残余物通过方法2提纯,得到467mg(30%)标题化合物。
1H NMR(400MHz,CD3OD):10.3(s,1H),7.89(d,J=8.8Hz,1H),7.13(d,J=2.4Hz,1H),7.05(dd,J=8.8,2.4Hz,1H),4.21(t,J=5.5Hz,2H),3.00-2.88(m,4H),2.57-2.47(m,1H),2.41(s,3H),2.29(s,3H),2.11-2.01(m,2H),1.91-1.82(m,2H),1.68-1.58(m,2H).
C.{2-[3-氯-4-(4-甲基-1H-苯并咪唑-2-基)-苯氧基]-乙基}-甲基-(1-甲基-哌啶-4-基)-胺。此化合物通过一般步骤3中所述的方法,使用2-氯-4-{2-[甲基-(1-甲基-哌啶-4-基)-氨基]-乙氧基}-苯甲醛(62.2mg,0.20mmol,1.0当量)、3-甲基-苯-1,2-二胺(26mg,0.20mmol,1.0当量)和Na2S2O5(50mg,0.26mmol,1.3当量)进行制备。通过方法2提纯,得到29mg(35%)标题化合物。
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.1H NMR(400MHz,CD3OD):7.73(d,J=8.6Hz,1H),7.49-7.40(m,1H),7.22-7.14(m,2H),7.11-7.04(m,2H),4.18(t,J=5.5Hz,2H),3.00-2.92(m,4H),2.62(s,3H),2.56-2.48(m,1H),2.41(s,3H),2.28(s,3H),2.11-1.99(m,2H),1.92-1.81(m,2H),1.70-1.55(m,2H).
实施例92
6-氯-4-甲基-2-{2-甲基-4-[2-(1-甲基-哌啶-4-基氧基)-乙氧基]-苯基}-1H-苯并咪唑.
A.4-[2-(4-甲酰基-3-甲基-苯氧基)-乙氧基]-1-甲基-哌啶甲苯-4-磺酸盐.在0℃下,向1,4-二氧杂-8-氮杂-螺[4.5]癸烷(1.0g,7.0mmol,1.0当量)在甲苯(20mL)中的溶液中加入1.0M二异丁基氢化铝的己烷溶液(20mL,20mmol,2.9当量)。将该溶液温热至80℃并搅拌12h。加入甲醇(20mL)、饱和酒石酸钾钠水溶液(20mL)和含10%2-丙醇的氯仿(100mL),接着将混合物搅拌30min。分出氯仿层,含水混合物用含10%2-丙醇的氯仿(25mL)萃取5次。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到白色固体形式的粗2-(哌啶-4-基氧基)-乙醇。将该固体溶于二氯乙烷(20mL)中,接着加入37%的甲醛水溶液(0.60mL,6.9mmol)。搅拌30min后,加入乙酰氧基硼氢化钠(2.04g,9.6mmol),接着将混合物搅拌1.5h。反应混合物用饱和NaHCO3水溶液(20mL)稀释,接着用含10%2-丙醇的氯仿(80mL)萃取6次。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到2-(1-甲基-哌啶-4-基氧基)-乙醇。将残余物溶于二氯甲烷中,冷却至0℃,接着加入吡啶(463μL,5.7mmol)和对甲苯磺酰氯(1.1g,5.7mmol)。将溶液温热至室温并搅拌16h。反应混合物在减压下浓缩,残余物用方法2部分提纯。将所得物质,甲苯-4-磺酸2-(1-甲基-哌啶-4-基氧基)-乙酯加入到4-羟基-2-甲基-苯甲醛(275mg,2.0mmol)和K2CO3(699mg,5.1mmol)在DMF中的混合物中。将混合物加热至100℃,接着搅拌16h。冷却至室温后,将混合物倒入到水中,接着用乙酸乙酯萃取三次。将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。粗产物用方法2提纯,得到409mg标题化合物。
1H NMR(400MHz,CD3OD):10.10(s,1H),7.80(d,J=8.6Hz,1H),7.72(d,J=8.2Hz,2H),7.26(d,J=7.9Hz,2H),6.96(dd,J=8.6,2.4Hz,1H),6.88(d,J=2.1Hz,1H),4.27-4.22(m,2H),3.90-3.85(m,2H),3.75-3.65(m,1H),3.19-3.07(m,2H),3.03-2.86(m,2H),2.67(s,3H),2.65(s,3H),2.39(s,3H),2.07-1.83(m,4H).
B.6-氯-4-甲基-2-{2-甲基-4-[2-(1-甲基-哌啶-4-基氧基)-乙氧基]-苯基}-1H-苯并咪唑.本化合物通过一般步骤3所述的方法使用4-[2-(4-甲酰基-3-甲基-苯氧基)-乙氧基]-1-甲基-哌啶甲苯-4-磺酸盐(47.5mg,0.11mmol,1.0当量)、5-氯-3-甲基-苯-1,2-二胺(27mg,0.17mmol,1.6当量)和Na2S2O5(42mg,0.22mmol,2.1当量)进行制备。通过方法2提纯,得到20mg(46%)标题化合物。
MS(电喷雾):计算分子量C23H28ClN3O2,413.19;m/z实测值,414.3[M+H]+.1H NMR(400MHz,CD3OD):7.55(d,J=8.5Hz,1H),7.42(brs,1H),7.08-7.05(m,1H),6.98(d,J=2.3Hz,1H),6.93(dd,J=8.5,2.5Hz,1H),4.21-4.17(m,2H),3.88-3.83(m,2H),3.57-3.47(m,1H),2.81-2.67(m,2H),2.59(s,3H),2.50(s,3H),2.33-2.20(m,5H),2.02-1.90(m,2H),1.76-1.60(m,2H).
实施例93
6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.
A.3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙烷-1-醇.在0℃下,向4-(3-羟基-丙基)-1-甲基-吡啶碘化物(28g,100.4mmol,1.0当量)在乙醇(200mL)中的溶液中加入硼氢化钠(5.7g,151mmol,1.5当量)。将反应混合物温热至室温,接着搅拌30min,然后倒入到水中。所述的含水溶液用乙酸乙酯萃取,接着将萃取液干燥(Na2SO4),过滤,浓缩,得到15.2g(97%)标题化合物。
1H NMR(400MHz,CD3OD):5.46-5.41(m,1H),3.56(t,J=6.6Hz,2H),2.98-2.91(m,2H),2.60(t,J=5.9Hz,2H),2.35(s,3H),2.21-2.14(m,2H),2.12-2.04(m,2H),1.71-1.62(m,2H).
B.2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯甲醛.在0℃下,向3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙烷-1-醇(2.24g,14.5mmol,1.0当量)和吡啶(1.64mL,20.2mmol,1.4当量)在二氯甲烷(50mL)中的溶液中加入对甲苯磺酰氯(3.85g,20.2mmol,1.4当量)。将反应混合物温热至室温,接着搅拌12h,然后倒入到水中。含水混合物用二氯甲烷萃取,接着将萃取液干燥(Na2SO4),过滤,浓缩。残余物进行硅胶柱色谱(含10%甲醇的二氯甲烷)提纯,接着将所得油加入到4-羟基-2-甲基-苯甲醛(639mg,4.69mmol)和K2CO3(1.62g,11.7mmol)在DMF中的混合物中并加热至100℃。搅拌16h后,将混合物冷却至室温,通过硅藻土垫过滤。该硅藻土用乙酸乙酯冲洗,接着将滤液浓缩。残余物通过方法2提纯,得到356mg(9%)标题化合物。
1H NMR(400MHz,CD3OD):10.1(s,1H),7.78(d,J=8.6Hz,1H),6.92(dd,J=8.6,2.4Hz,1H),6.84(d,J=2.1Hz,1H),5.49-5.43(m,1H),4.09(t,J=6.3Hz,2H),2.97-2.91(m,2H),2.65-2.57(m,5H),2.35(s,3H),2.25-2.16(m,4H),1.99-1.88(m,2H).
C.6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑.本化合物通过一般步骤3中所述的方法使用2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯甲醛(50mg,0.18mmol,1.0当量)、5-氯-3-甲基-苯-1,2-二胺(29mg,0.18mmol,1.0当量)和Na2S2O5(45.2mg,0.24mmol,1.3当量)进行制备。通过方法2提纯,得到15.7mg(21%)标题化合物。
MS(电喷雾):计算分子量C24H28ClN3O,409.19;m/z实测值,410.4[M+H]+.1H NMR(400MHz,CD3OD):7.53(d,J=8.5Hz,1H),7.41(br s,1H),7.08-7.04(m,1H),6.93(d,J=2.3Hz,1H),6.89(dd,J=8.5,2.5Hz,1H),5.49-5.44(m,1H),4.04(t,J=6.3Hz,2H),2.96-2.91(m,2H),2.64-2.56(m,5H),2.49(s,3H),2.35(s,3H),2.28-2.16(m,4H),1.96-1.88(m,2H).
实施例94
5-氟-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑。
标题化合物如实施例93中所述那样进行制备。
MS(电喷雾):计算分子量C24H28FN3O,393.22;m/z实测值,394.4[M+H]+.1H NMR(400MHz,CD3OD):7.54(d,J=8.5Hz,1H),7.39(br s,1H),7.05-6.95(m,1H),6.94(d,J=2.4Hz,1H),6.90(dd,J=8.5,2.5Hz,1H),5.50-5.46(m,1H),4.06(t,J=6.3Hz,2H),2.99-2.94(m,2H),2.65-2.59(m,2H),2.53-2.47(m,6H),2.36(s,3H),2.27-2.18(m,4H),1.98-1.90(m,2H).
实施例95
6-氟-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑。
A.3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苄腈.将4-(1-甲基-哌啶-4-基)-丁烷-1-醇(0.747g,4.37mmol,1.0当量)、3-羟基-苄腈(0.52g,4.37mmol,1.0当量)和聚合物负载的三苯膦(2.3g,8.73mmol,2.0当量)悬浮在THF(40mL)中。将混合物在N2下搅拌并冷却至0℃。通过注射器滴加偶氮二羧酸二异丙酯(1.72mL,8.73mmol,2.0当量)。6h后,将混合物过滤并浓缩。所得粗油通过方法2提纯,得到0.84g(71%)标题化合物。
MS(电喷雾):计算分子量C17H24N2O,272.19;m/z实测值,273.4[M+H]+.1H NMR(400MHz,CDCl3):7.38-7.33(m,1H),7.24-7.20(m,1H),7.14-7.09(m,2H),3.96(t,J=6.4Hz,2H),2.88-2.80(m,2H),2.26(s,3H),1.94-1.84(m,2H),1.82-1.73(m,2H),1.72-1.64(m,2H),1.52-1.42(m,2H),1.34-1.17(m,5H).
B.3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯甲醛.在0℃下,向搅拌下的3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苄腈(0.84g,3.09mmol,1.0当量)在甲苯(5.0mL)中的溶液中加入1.5M二异丁基氢化铝的甲苯溶液(4.63mL,4.63mmol,1.5当量)。3h后,滴加甲醇(9.0mL)和1.0M H2SO4(10mL)。搅拌30min后,加入1.0M NaOH(10mL),接着加入饱和酒石酸钾钠水溶液(40mL)和二氯甲烷(100mL)。该溶液用氯仿(50mL)萃取3次,将合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。所得粗油用方法2提纯,得到0.56g(66%)标题化合物。
1H NMR(400MHz,CDCl3):9.97(s,1H),7.46-7.43(m,2H),7.39-7.37(m,1H),7.19-7.15(m,1H),4.02(t,J=6.6Hz,2H),2.86-2.80(m,2H),2.25(s,3H),1.92-1.83(m,2H),1.83-1.75(m,2H),1.73-1.63(m,2H),1.54-1.44(m,2H),1.34-1.18(m,5H).
C.6-氟-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑.本化合物通过一般步骤3中所述的方法使用3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯甲醛(20mg,0.07mmol,1.0当量)、4-氟-3-甲基-苯-1,2-二胺(12mg,0.09mmol,1.0当量)和Na2S2O5(18mg,0.10mmol,1.3当量)进行制备。通过方法2提纯,得到28.7mg(54%)标题化合物。
MS(电喷雾):计算分子量C24H30FN3O,395.24;m/z实测值,396.4[M+H]+.1H NMR(400MHz,CD3OD):7.72-7.62(m,2H),7.47-7.32(m,2H),7.08-6.94(m,2H),4.07(t,J=6.3Hz,2H),2.90-2.80(m,2H),2.53(s,3H),2.24(s,3H),2.04-1.92(m,2H),1.85-1.66(m,4H),1.59-1.47(m,2H),1.39-1.17(m,5H).
实施例96-101中的下列化合物根据实施例95中所述的方法进行制备。
实施例96
7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑.MS(电喷雾):计算分子量C24H31N3O,377.25;m/z实测值,378.4[M+H]+.1H NMR(400MHz,CD3OD):7.86-7.71(m,2H),7.44(br s,1H),7.29-7.22(m,1H),7.26-7.09(m,1H),7.02(d,J=7.3Hz,1H),6.89(dd,J=8.2,1.8Hz,1H),3.59(t,J=6.4Hz,2H),2.82(m,2H),2.52(br s,3H),2.25(s,3H),1.89(m,2H),1.63-1.47(m,4H),1.28-1.07(m,7H).
实施例97
6,7-二甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C25H33N3O,391.56;m/z实测值,392.5[M+H]+.1H NMR(400MHz,CD3OD):7.73-7.61(m,2H),7.46-7.36(m,1H),7.36-7.25(m,1H),7.09-6.98(m,2H),4.08(t,J=6.3Hz,2H),2.93-2.82(m,2H),2.53(s,3H),2.38(s,3H),2.26(s,3H),2.08-1.97(m,2H),1.86-1.68(m,4H),1.60-1.47(m,2H),1.39-1.17(m,5H).
实施例98
5-氯-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C24H30ClN3O,411.21;m/z实测值,412.4[M+H]+.1H NMR(400MHz,CD3OD):7.73-7.62(m,2H),7.47-7.38(m,2H),7.09-7.02(m,2H),4.09(t,J=6.3Hz,2H),2.91-2.81(m,2H),2.68(s,3H),2.24(s,3H),2.05-1.93(m,2H),1.87-1.67(m,4H),1.60-1.48(m,2H),1.39-1.18(m,5H).
实施例99
5,7-二甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C26H35N3O,405.28;m/z实测值,406.4[M+H]+.1H NMR(400MHz,CD3OD):7.30-7.23(m,1H),7.19(s,1H),7.16-7.11(m,1H),7.07-7.01(m,1H),6.89(s,1H),4.04(t,J=6.4Hz,2H),2.89-2.80(m,2H),2.54(s,3H),2.43(s,3H),2.29(s,3H),2.23(s,3H),2.04-1.91(m,2H),1.88-1.77(m,2H),1.77-1.68(m,2H),1.61-1.49(m,2H),1.40-1.17(m,5H).
实施例100
5-氯-7-甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C25H32ClN3O,425.22;m/z实测值,426.4[M+H]+.1H NMR(400MHz,CD3OD):7.40(s,1H),7.33-7.24(m,1H),7.17-7.10(m,1H),7.10-7.02(m,2H),4.04(t,J=5.6Hz,2H),2.91-2.80(m,2H),2.56(s,3H),2.28(s,3H),2.24(s,3H),2.04-1.92(m,2H),1.89-1.65(m,4H),1.63-1.48(m,2H),1.41-1.16(m,5H).
实施例101
6-氟-7-甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C25H32FN3O,409.25;m/z实测值,410.4[M+H]+.1H NMR(400MHz,CD3OD):7.43-7.33(s,1H),7.30(t,J=7.8Hz,1H),7.16-7.10(s,1H),7.10-6.96(m,2H),4.05(t,J=5.4Hz,2H),2.91-2.81(m,2H),2.49(s,3H),2.29(s,3H),2.25(s,3H),2.07-1.94(m,2H),1.89-1.67(m,4H),1.63-1.49(m,2H),1.41-1.16(m,5H).
实施例102
6-氟-7-甲基-2-{3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯基}-1H-苯并咪唑。
A.3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苄腈.在0℃下,向3-(1-甲基-哌啶-4-基氧基)-丙烷-1-醇(295mg,1.7mmol,1.0当量)和聚合物负载的三苯膦(1.14g,3.41mmol,2.0当量)在THF(40mL)中的混合物中通过注射器滴加偶氮二羧酸二异丙酯(0.67mL,3.41mmol,2.0当量)。6h后,混合物通过玻璃料过滤,接着将滤液浓缩。粗油用方法2提纯,得到187mg(40%)标题化合物。
MS(电喷雾):计算分子量C16H22N2O2,274.17;m/z实测值,275.4[M+H]+.1H NMR(400MHz,CDCl3):7.40-7.33(m,1H),7.25-7.21(m,1H),7.17-7.10(m,2H),4.09(t,J=6.2Hz,2H),3.61(t,J=6.2Hz,2H),3.34-3.25(m,1H),2.73-2.61(m,2H),2.26(s,3H),2.17-2.00(m,4H),1.94-1.84(m,2H),1.68-1.55(m,2H).
B.6-氟-7-甲基-2-{3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯基}-1H-苯并咪唑。在0℃下,向搅拌下的3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苄腈(0.187g,0.68mmol,1.0当量)在甲苯(5.0mL)中的溶液中加入1.5M二异丁基氢化铝的甲苯溶液(1.02mL,1.02mmol,1.5当量)。3h后,加入甲醇(9mL)和1M H2SO4(10mL)。将混合物搅拌30min,然后加入1.0M的NaOH(10mL),接着加入饱和酒石酸钾钠水溶液(40mL)和二氯甲烷(100mL)。搅拌30min后,混合物用氯仿(50mL)萃取3次,合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。残余物用方法2部分提纯,得到106mg 3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯甲醛和若干其它不明产物的混合物。将粗3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯甲醛(53mg)、4-氟-3-甲基-苯-1,2-二胺(27mg)和Na2S2O5在DMF中的溶液在90℃下搅拌18h。将反应混合物直接装载到硅胶上,根据方法2提纯,得到28.7mg标题化合物。
MS(电喷雾):计算分子量C23H28FN3O2,397.22;m/z实测值,398.4[M+H]+.1H NMR(400MHz,CD3OD):7.64-7.53(m,2H),7.38-7.25(m,2H),7.00-6.85(m,2H),4.06(t,J=6.1Hz,2H),3.60-3.52(m,2H),3.33-3.19(br s,1H),2.58(br s,2H),2.42(s,3H),2.17-2.03(m,5H),2.01-1.90(m,2H),1.86-1.72(m,2H),1.60-1.42(m,2H).
实施例103
6-氯-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑。
A.6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-烟腈.在氮气氛中,向搅拌下的3-(4-甲基-哌嗪-1-基)-丙烷-1-醇(1.0g,6.32mmol,1.0当量)在DMF(60mL)中的溶液中分批加入60%的氢化钠(379mg,9.48mmol,1.5当量)。一旦最初的冒泡平息,将混合物在60℃加热1h,然后冷却至室温。然后,加入6-氯烟腈(876mg,6.32mmol,1.0当量)在DMF(5mL)中的溶液,接着将混合物搅拌16h。将反应混合物在饱和NaHCO3水溶液(30mL)和氯仿(60mL)之间进行分配。将有机层干燥(Na2SO4),过滤,浓缩,得到粗混合物,其用柱色谱(硅胶,含0-10%(2.0M氨水的甲醇溶液)的二氯甲烷)提纯,得到776mg 47%)米黄色固体。
MS(电喷雾):计算分子量C14H20N4O,260.16;m/z实测值,261.3[M+H]+.1H NMR(400MHz,CDCl3):8.47(dd,J=2.3,0.8Hz,1H),7.77(dd,J=8.6,2.3Hz,1H),6.80(dd,J=8.6,0.8Hz,1H),4.41(t,J=6.6Hz,2H),2.76-2.35(m,10H),2.29(s,3H),2.01-1.95(m,2H).
B.6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-甲醛.在氮气氛中,向冷却(0℃)下的6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-烟腈(486mg,1.86mmol,1.0当量)在甲苯(20mL)中的溶液中滴加1M二异丁基氢化铝的己烷溶液(2.79mL,2.79mmol,1.5当量)。将混合物温热至室温,接着搅拌2h。加入甲醇(5mL),接着加入1M的H2SO4(10mL)。搅拌30min后,该溶液用饱和NaHCO3水溶液中和,用饱和酒石酸钾钠水溶液(10mL)稀释,接着再搅拌30min或直到澄清为止。混合物用氯仿(3×50mL)萃取,将合并的萃取液干燥(Na2SO4),浓缩,得到粗产物,该粗产物用柱色谱(硅胶,含0-10%(2M氨水的甲醇溶液)的二氯甲烷)提纯,得到225mg(46%)无色残余物。
MS(电喷雾):计算分子量C14H21N3O2,263.16;m/z实测值,264.2[M+H]+.1H NMR(400MHz,CDCl3):1H NMR(400MHz,CDCl3):9.94(1H,s),8.61(d,J=2.3Hz,1H),8.06(dd,J=8.6,2.3Hz,1H),6.82(d,J=8.6Hz,1H),4.46(t,J=6.6Hz,2H),2.64-2.33(m,10H),2.29(s,3H),2.03-1.96(m,2H).
C.6-氯-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.此化合物通过一般步骤3中所述的方法使用6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-甲醛(49mg,0.17mmol,1.0当量)、5-氯-3-甲基-苯-1,2-二胺(27mg,0.17mmol,1.0当量)和Na2S2O5(42mg,0.22mmol,1.3当量)进行制备。通过方法2提纯,得到54mg(79%)标题化合物。
MS(电喷雾):计算分子量C21H26ClN5O,399.18;m/z实测值,400.3[M+H]+.1H NMR(400MHz,CDCl3):8.75(s,1H),8.25(dd,J=8.2,2.4Hz,1H),7.49-7.32(m,1H),6.91(s,1H),6.71(d,J=8.7Hz,1H),4.28(t,J=6.7Hz,2H),2.67-2.31(m,13H),2.26(s,3H),1.98-1.87(m,2H).
实施例104-105中的下列化合物根据实施例103中所述的方法进行制备。
实施例104
4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C21H27N5O,365.47;m/z实测值,366.2[M+H]+.
实施例105
5-氟-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C21H26FN5O,383.46;m/z实测值,384.2[M+H]+.
实施例106
4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
A.6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈.在氮气氛中,向搅拌下的3-(1-甲基-哌啶-4-基)-丙烷-1-醇(5.0g,31.7mmol,1.1当量)在DMF(200mL)中的溶液中分批加入60%的氢化钠(1.73g,43.3mmol,1.5当量)。一旦最初的冒泡平息,将混合物在60℃加热1h,然后冷却至室温。然后加入6-氯烟腈(4.0g,28.9mmol,1.0当量)在DMF(20mL)中的溶液,接着将混合物搅拌16h。反应用饱和NaHCO3水溶液(50mL)和盐水(50mL)淬灭。生成沉淀并通过真空过滤收集该沉淀,得到3.67g所需产物。将滤液浓缩至一半体积,收集第二茬沉淀,合并得到5.64g(76%)橙色固体,其没有提纯就使用。
MS(电喷雾):计算分子量C15H21N3O,259.17;m/z实测值,260.4[M+H]+.1H NMR(400MHz,CDCl3):8.46(dd,J=2.3,0.8Hz,1H),7.77(dd,J=8.6,2.3Hz,1H),6.80(dd,J=8.6,0.8Hz,1H),4.34(t,J=6.6Hz,2H),2.96-2.82(m,2H),2.25(s,3H),1.92-1.68(m,7H),1.37-1.34(m,2H),0.89-0.81(m,2H).
B.6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-甲醛.在氮气氛中,向冷却(0℃)下的6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(640mg,2.47mmol,1.0当量)在甲苯(20mL)中的溶液中滴加1M二异丁基氢化铝己烷溶液(3.70mL,3.70mmol,1.5当量)。将混合物温热至室温并搅拌2h。加入甲醇(5mL),接着加入1M的H2SO4(10mL)。搅拌30min后,该溶液用饱和NaHCO3水溶液中和,用饱和酒石酸钾钠水溶液(10mL)稀释,接着再搅拌30min或直到澄清为止。混合物用氯仿(3×50mL)萃取,接着将合并的萃取液干燥(Na2SO4),过滤并浓缩。粗产物用柱色谱(硅胶,0-10%(2M氨水在甲醇中)在二氯甲烷中)提纯,得到598mg(92%)无色油。
MS(电喷雾):计算分子量C15H22N2O2,262.17;m/z实测值,263.1[M+H]+.1H NMR(400MHz,CDCl3):1H NMR(400MHz,CDCl3):9.87(br s,1H),8.53(d,J=2.3Hz,1H),7.98(dd,J=8.6,2.3Hz,1H),6.74(d,J=8.6Hz,1H),4.34(t,J=6.6Hz,2H),2.78-2.26(m,2H),2.19(s,3H),1.85-1.62(m,7H),1.35-1.16(m,4H).
C.4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.本化合物通过一般步骤3中所述的方法使用6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-甲醛(100mg,0.38mmol,1.0当量)、3-甲基-苯-1,2-二胺(46mg,0.38mmol,1.0当量)和Na2S2O5(94mg,0.50mmol,1.3当量)进行制备,通过方法2提纯,得到35mg(25%)标题化合物。
MS(电喷雾):计算分子量C22H28N4O,364.23;m/z实测值,365.4[M+H]+.1H NMR(400MHz,CD3OD):8.77(s,1H),8.23(dd,J=8.7,2.3Hz,1H),7.25(m,1H),7.12(t,J=7.5Hz,1H),7.04-6.98(m,1H),6.74(d,J=8.7Hz,1H),4.34(t,J=6.6Hz,2H),2.84-2.76(m,2H),2.73-2.34(br s,3H),2.23(s,3H),1.92-1.83(m,2H),1.81-1.62(m,4H),1.39-1.17(m,5H).
实施例107-108中的下列化合物根据实施例106中所述的方法进行制备.
实施例107
4,5-二甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H30N4O,378.24;m/z实测值,379.4[M+H]+.
实施例108
4-氯-2-{6-[3-(1-甲基-哌啶-4-基)]-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C21H25ClN4O,384.17;m/z实测值,385.3[M+H]+.
实施例109
6-氯-4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
A.4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈。在-78℃下,向搅拌下的2,2,6,6-四甲基-哌啶(0.20mL,1.16mmol,1.5当量)在THF(3mL)中的溶液中加入2.5M正丁基锂己烷溶液(0.46mL,1.16mmol,1.5当量)。10min后,将反应混合物温热至0℃45min,接着再冷却至-78℃。然后加入6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(200mg,0.77mmol,1.0当量)在THF(3mL)中的溶液。在-78℃下冷却1h后,将混合物用甲基碘(0.05mL,0.84mmol,1.1当量)处理,继续搅拌1.5小时,然后在-78℃下用饱和NaHCO3水溶液(5mL)处理。将混合物温热至室温并用氯仿(2×10mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗残余物,该粗残余物用方法2提纯,得到120mg(57%)标题化合物。
MS(电喷雾):计算分子量C16H23N3O,273.18;m/z实测值,274.4[M+H]+.1H NMR(400MHz,CDCl3):8.39(s,1H),6.67(s,1H),4.31(t,J=6.7Hz,2H),2.90-2.79(m,2H),2.48(s,3H),2.28(s,3H),1.95-1.63(m,6H),1.40-1.20(m,5H).
B.4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-甲醛.在0℃下,向4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(260mg,0.95mmol,1.0当量)在甲苯(10mL)中的溶液中加入1.5M二异丁基氢化铝甲苯溶液(1.26mL,1.90mmol,2.0当量)。将混合物温热至室温并搅拌2h。加入甲醇(2mL),接着加入1.0M的H2SO4(3mL)。搅拌30min后,该溶液用饱和NaHCO3水溶液中和,用饱和酒石酸钾钠水溶液(10mL)稀释,接着再搅拌30min或直到澄清为止。混合物用氯仿(3×15mL)萃取,合并的萃取液干燥(Na2SO4),过滤,浓缩,得到200mg粗产物,该粗产物没有提纯就使用。
1H NMR(400MHz,CDCl3):10.0(s,1H),8.47(s,1H),6.57(s,1H),4.35(t,J=6.7Hz,2H),2.86-2.80(m,2H),2.59(s,3H),2.25(s,3H),1.92-1.66(m,6H),1.43-1.22(m,5H).
C.4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.本化合物通过一般步骤3中所述的方法使用4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-甲醛(60mg,0.22mmol,1.0当量),5-氯-3-甲基苯-1,2-二胺(34mg,0.22mmol,1.0当量)和Na2S2O5(54mg,0.29mmol,1.3当量)进行制备,通过方法2提纯,得到27mg(30%)标题化合物。
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.1H NMR(400MHz,CD3OD):8.77(s,1H),8.23(dd,J=8.7,2.3Hz,1H),7.25(m,1H),7.12(t,J=7.5Hz,1H),7.04-6.98(m,1H),6.74(d,J=8.7Hz,1H),4.34(t,J=6.6Hz,2H),2.84-2.76(m,2H),2.73-2.34(br s,3H),2.23(s,3H),1.92-1.83(m,2H),1.81-1.62(m,4H),1.39-1.17(m,4H).
实施例110-114中的下列化合物根据实施例109中所述的方法进行制备。
实施例110
4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H30N4O,378.24;m/z实测值,379.5[M+H]+.
实施例111
5-氟-4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29FN4O,396.23;m/z实测值,397.4[M+H]+.
实施例112
4,5-二甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.5[M+H]+.
实施例113
4,6-二甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.5[M+H]+.
实施例114
4-氯-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,399.3[M+H]+.
实施例115
2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-5-氟-4-甲基-1H-苯并咪唑.
A.4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈.在-78℃下,向搅拌下的2,2,6,6-四甲基-哌啶(0.31mL,2.32mmol,1.2当量)在THF(10mL)中的溶液中加入1.6M正丁基锂己烷溶液(1.45mL,2.32mmol,1.2当量)。10min后,将反应混合物温热至0℃45min,接着再冷却至-78℃。然后加入6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(500mg,1.93mmol,1.0当量)在THF(10mL)中的溶液。在-78℃下搅拌1h后,混合物用在THF(2mL)中的六氯乙烷(0.05mL,0.84mmol,1.1当量)处理,接着将其温热至0℃。继续搅拌1.5h,接着在0℃下碳酸氢钠(10mL)猝灭。将混合物温热至室温,接着用氯仿(2×20mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗残余物,该粗残余物用方法2提纯,得到380mg(67%)标题化合物。
MS(电喷雾):计算分子量C15H20ClN3O,293.13;m/z实测值,294.5[M+H]+.1H NMR(400MHz,CDCl3):8.43(s,1H),6.87(s,1H),4.35(t,J=6.7Hz,2H),2.97-2.88(m,2H),2.33(s,3H),2.05-1.94(m,2H),1.83-1.67(m,5H),1.43-1.23(m,4H).
B.2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-5-氟-4-甲基-1H-苯并咪唑.在0℃下,向4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(380mg,1.30mmol,1.0当量)在甲苯(10mL)中的溶液中加入1.5M二异丁基氢化铝的甲苯溶液(1.72mL,2.60mmol,2.0当量)。将混合物温热至室温并搅拌2h。加入甲醇(5mL),接着加入1.0M的H2SO4(5mL)。搅拌30min后,该溶液用饱和NaHCO3水溶液中和,用饱和酒石酸钾钠水溶液(10mL)稀释,接着再搅拌30min或直到澄清为止。混合物用氯仿(3×15mL)萃取,合并的萃取液干燥(Na2SO4),过滤,浓缩,得到132mg粗产物,该粗产物没有提纯就使用。此粗混合物(33mg,0.11mmol,1.0当量)与4-氟-3-甲基-苯-1,2-二胺(16mg,0.11mmol,1.0当量)和Na2S2O5(27mg,0.14mmol,1.3当量)一起如一般步骤3中所述那样使用。通过方法2提纯,得到12mg(26%)的油状残余物。
MS(电喷雾):计算分子量for C22H26ClFN4O,416.18;m/z实测值,417.3[M+H]+.1H NMR(400MHz,CD3OD):8.48(s,1H),7.41(dd,J=8.7,4.3Hz,1H),7.46-6.99(m,2H),4.36(t,J=6.6Hz,2H),2.91-2.82(m,2H),2.50(s,3H),2.25(s,3H),2.06-1.95(m,2H),1.88-1.69(m,4H),1.47-1.18(m,5H).
实施例116-118中的下列化合物根据实施例115中所述的方法进行制备。
实施例116
2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,399.3[M+H]+.
实施例117
6-氯-2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26Cl2N4O,432.15;m/z实测值,433.3[M+H]+.
实施例118
2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4,6-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.
实施例119
2-{4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑.
将4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(实施例115)在甲醇中的溶液(0.2M)在回流温度下用甲醇钠(4当量)处理4h。将混合物冷却至室温,用饱和NaHCO3水溶液稀释,接着用氯仿萃取。将有机萃取液干燥(Na2SO4),过滤,浓缩,得到4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-烟腈(100%)。将此中间体根据实施例115转化为标题化合物。
MS(电喷雾):计算分子量C23H30ClN4O2,394.24;m/z实测值,395.4[M+H]+.
实施例120
5-氟-2-{4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑。
标题化合物根据实施例119中所述的步骤进行制备。
MS(电喷雾):计算分子量C23H29FN4O2,412.23;
m/z实测值,413.4[M+H]+.
实施例121
5-氟-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
A.6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-烟腈.在氮气氛下,向搅拌下的3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙烷-1-醇(1.23g,7.94mmol,1.1当量)在DMF(50mL)中的溶液中分批加入60%的氢化钠(433mg,10.8mmol,1.5当量)。一旦最初的冒泡平息,将混合物在60℃加热1h,然后冷却至室温。然后加入6-氯烟腈(1.0g,7.21mmol,1.0当量)在DMF(5mL)中的溶液,接着将混合物搅拌16h。反应用饱和NaHCO3水溶液(10mL)和盐水(10mL)淬灭。混合物用氯仿(2×50mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗残余物,该粗残余物用方法2提纯,得到1.43g(77%)标题化合物。
MS(电喷雾):计算分子量C15H19N3O,257.15;m/z实测值,258.3[M+H]+.1H NMR(400MHz,CDCl3):8.46(dd,J=2.4,0.6Hz,1H),7.76(dd,J=8.7,2.4Hz,1H),6.80(dd,J=8.7,0.6Hz,1H),5.44-5.39(m,1H),4.35(t,J=6.6Hz,2H),2.92-2.87(m,2H),2.51(t,J=5.8Hz,2H),2.34(s,3H),2.18-2.08(m,4H),1.96-1.83(m,2H).
B.6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-甲醛.在氮气氛下,向冷却(0℃)下的6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-烟腈(1.42mg,5.56mmol,1.0当量)在甲苯(40mL)中的溶液中滴入1.0M的二异丁基氢化铝的己烷溶液(8.34mL,8.34mmol,1.5当量)。将混合物温热至室温并搅拌2h。加入甲醇(5mL),接着加入1.0M的H2SO4(10mL)。搅拌30min后,该溶液用饱和NaHCO3水溶液中和,用饱和酒石酸钾钠水溶液(25mL)稀释,接着再搅拌30min或直到澄清为止。混合物用氯仿(3×50mL)萃取,合并的萃取液干燥(Na2SO4),过滤,浓缩,得到1.29g产物,该产物没有提纯就使用。
1H NMR(400MHz,CDCl3):9.93(s,1H),8.60(d,J=2.3Hz,1H),8.05(dd,J=8.7,2.3Hz,1H),6.81(d,J=8.7Hz,1H),5.45-5.39(m,1H),4.40(t,J=6.6Hz,2H),2.92-2.86(m,2H),2.54-2.48(m,2H),2.30(s,3H),2.18-2.09(m,4H),2.98-1.84(m,2H).
C.5-氟-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑。本化合物通过一般步骤3中所述的方法使用6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-甲醛(100mg,0.39mmol,1.0当量)、4-氟-3-甲基-苯-1,2-二胺(66mg,0.39mmol,1.0当量)和Na2S2O5(96mg,0.51mmol,1.3当量)进行制备。通过方法2提纯,得到24mg(16%)标题化合物。
MS(电喷雾):计算分子量
C22H25FN4O,380.20;m/z实测值,381.4[M+H]+.1H NMR(400MHz,CDCl3):11.8-10.8(br s,1H),8.86-8.58(m,1H),8.24(dd,J=8.7,2.5Hz,1H),7.58-7.36(m,0.5H),7.21-7.03(m,0.5H),6.93(t,J=9.9Hz,1H),6.73(d,J=8.7Hz,1H),5.42-5.33(m,1H),4.29(t,J=6.7Hz,2H),2.92-2.81(m,2H),2.58-2.44(m,4H),2.36-2.26(m,4H),2.18-2.02(m,4H),1.93-1.82(m,2H).
实施例122-126中的下列化合物根据实施例121中所述的方法进行制备。
实施例122
4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C22H28N4O,362.21;m/z实测值,363.4[M+H]+.
实施例123
6-氯-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H25ClN4O,396.17;m/z实测值,397.4[M+H]+.
实施例124
4,5-二甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28N4O,376.23;m/z实测值,377.4[M+H]+.
实施例125
4,6-二甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28N4O,376.23;m/z实测值,377.4[M+H]+.
实施例126
5-氯-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H25ClN4O,396.17;m/z实测值,397.4[M+H]+.
实施例127
5-氟-4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-4-吡咯烷-1-基甲基-吡啶-3-基}-1H-苯并咪唑.
A.5-溴-2-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶.在氮气氛下,向搅拌下的3-(1-甲基-哌啶-4-基)-丙烷-1-醇(2.0g,12.7mmol,1.0当量)在DMF(100mL)中的溶液中分批加入60%的氢化钠(764mg,19.1mmol,1.5当量)。一旦最初的冒泡平息,将混合物在60℃加热1h,然后冷却至室温。然后加入2,5-二溴吡啶(3.0g,12.7mmol,1.0当量)在DMF(7mL)中的溶液,接着将混合物搅拌16h。所述反应用饱和NaHCO3水溶液(25mL)和盐水(25mL)淬灭。所述混合物用氯仿(2×30mL)萃取。将有机萃取液干燥(Na2SO4),过滤,浓缩,得到粗残余物,该粗残余物用方法2提纯,得到3.31g(88%)标题化合物。
1H NMR(400MHz,CDCl3):8.18-8.13(m,1H),7.65-7.58(m,1H),6.65-6.60(m,1H),4.21(t,J=6.7Hz,2H),2.87-2.80(m,2H),2.26(s,3H),1.94-1.62(m,6H),1.43-1.17(m,5H).
B.5-溴-2-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-4-甲醛.向2.0MLDA在庚烷/THF(4.05mL,8.07mmol,2.0当量)在THF(20mL)中的冷却溶液(-78℃)中滴加在THF(15mL)中的5-溴-2-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶(1.2g,3.85mmol,1.0当量)。30min后,滴加DMF(1.49mL,19.2mmol,5.0当量),所述混合物在-78℃下再搅拌20min,然后温热至0℃,并用饱和NaHCO3水溶液(5mL)淬灭。将混合物温热至室温,接着用氯仿(2×30mL)萃取。合并的萃取液干燥(Na2SO4),过滤,浓缩,得到1.10g粗油,其没有提纯就使用。
1H NMR(400MHz,CDCl3):10.3(s,1H),8.39(s,1H),7.15(s,1H),4.31(t,J=6.7Hz,2H),2.87-2.75(m,2H),2.28(s,3H),1.97-1.60(m,6H),1.43-1.15(m,5H).
C.5-溴-2-[3-(1-甲基-哌啶-4-基)-丙氧基]-4-吡咯烷-1-基甲基-吡啶.向5-溴-2-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-4-甲醛(85mg,0.25mmol,1.0当量)和吡咯烷(0.05mL,0.62mmol,2.5当量)在二氯乙烷(5mL)中的混合物中加入三乙酰氧基硼氢化钠(156mg,0.74mmol,3.0当量)。24h后,混合物用饱和NaHCO3水溶液中和,接着用氯仿(2×15mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗油产物,该粗油产物用方法2提纯,得到38mg白色固体。
1H NMR(400MHz,CDCl3):8.15(s,1H),6.90(s,1H),4.24(t,J=6.7Hz,2H),3.65(s,2H),2.87-2.77(m,2H),2.64-2.53(m,4H),2.25(s,3H),1.95-1.62(m,10H),1.42-1.20(m,5H).
D.5-氟-4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-4-吡咯烷-1-基甲基-吡啶-3-基}-1H-苯并咪唑.在氮气氛下,向冷却(-78℃)下的5-溴-2-[3-(1-甲基-哌啶-4-基)-丙氧基]-4-吡咯烷-1-基甲基-吡啶(38mg,0.10mmol,1.0当量)在干燥THF(2mL)中的溶液中滴加正丁基锂(2.75M在己烷中,0.04mL,0.11mmol,1.1当量)。10min后,加入DMF(0.07mL,1.00mmol,10.0当量)。将溶液温热至0℃,用饱和NaHCO3水溶液(2mL)淬灭,接着用氯仿(2×10mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗残余物。将这种残余物立即溶于DMF(2mL)中,并用4-氟-4-氟-3-甲基-苯-1,2-二胺(15mg,0.11mmol,1.1当量)和Na2S2O5(25mg,0.13mmol,1.3当量)根据一般步骤3进行处理。通过方法2提纯,得到10mg(22%)标题化合物。
MS(电喷雾):计算分子量C27H36FN5O,465.26;m/z实测值,466.5[M+H]+.1H NMR(400MHz,CD3OD):8.81(s,1H),7.42(dd,J=8.7,4.3Hz,1H),7.01(dd,J=10.3,8.8Hz,1H),6.95(s,1H),4.40(t,J=6.6Hz,2H),3.79(s,3H),2.94-2.81(m,2H),2.77-2.66(m,4H),2.51(s,3H),2.25(s,3H),2.00-1.92(m,6H),1.89-1.70(m,4H),1.46-1.19(m,5H).
实施例128
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑.
A.5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶.在氮气氛下,向搅拌下的4-(1-甲基-哌啶-4-基)-丁烷-1-醇(3.98g,623mmol,1.1当量)在DMF(100mL)中的溶液中分批加入60%氢化钠(1.26mg,6.81mmol,1.5当量)。一旦最初的冒泡平息,将混合物在60℃加热1h,然后冷却至室温。然后加入2,5-二溴吡啶(5mg,21.1mmol,1.0当量)在DMF(50mL)中的溶液,接着将混合物搅拌16h。将混合物在饱和NaHCO3水溶液(100mL)和氯仿(200mL)之间进行分配。将氯仿层干燥(Na2SO4),过滤,浓缩,得到粗混合物,其用柱色谱(硅胶,0-10%(2M氨水在甲醇中)在二氯甲烷中)提纯,得到2.73g(40%)白色固体。
MS(电喷雾):计算分子量C15H23BrN2O,326.1;m/z实测值,327.3[M+H]+.1H NMR(400MHz,CDCl3):8.17(d,J=2.5Hz,1H),7.63(dd,J=7.6,2.5Hz,1H),6.63(d,J=8.8Hz,1H),4.24(t,J=6.6Hz,2H),2.91-2.80(m,2H),2.27(s,3H),1.98-1.88(m,2H),1.79-1.63(m,4H),1.49-1.38(m,2H),1.34-1.20(m,5H).
B.5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛.向冷却(-78℃)下的2.0M LDA在庚烷/THF(3.47mL,6.94mmol,2.0当量)中在THF(10ML)中的溶液中滴加5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶(1.13g,3.47mmol,1.0当量)在THF(15mL)中的溶液。30min后,滴加DMF(1.07mL,13.9mmol,4.0当量),混合物在-78℃下再搅拌20min。将混合物温热至0℃并加入饱和NaHCO3水溶液(5mL)。温热至室温后,混合物用氯仿(2×20mL)萃取。合并的萃取液干燥(Na2SO4),过滤,浓缩,得到1.34g粗橙色油,其没有提纯就使用。
1H NMR(400MHz,CDCl3):10.3(s,1H),8.39(s,1H),7.14(s,1H),4.31(t,J=6.7Hz,2H),2.89-2.79(m,2H),2.28(s,3H),1.96-1.63(m,9H),1.43-1.20(m,4H).
C.2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑.本化合物通过一般步骤3中所述的方法使用5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛(100mg,0.28mmol,1.0当量)、3-甲基-苯-1,2-二胺(38mg,0.31mmol,1.1当量)和Na2S2O5(70mg,0.37mmol,1.3当量)进行制备。通过方法2提纯,得到25mg(20%)标题化合物。
MS(电喷雾):计算分子量C23H29BrN4O,456.15;m/z实测值,466.5[M+H]+.1H NMR(400MHz,CDCl3):10.6-10.3(br s,1H),8.45-8.28(m,1H),7.76-7.62(m,2H),7.25-7.21(m,1H),7.19-7.07(m,1H),4.29(t,J=6.7Hz,2H),2.87-2.77(m,2H),2.76-2.63(m,3H),2.25(s,3H),1.95-1.61(m,7H),1.53-1.39(m,2H),1.35-1.15(m,4H).
实施例129-135中的下列化合物根据实施例128中所述的方法进行制备。
实施例129
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28BrFN5O,474.14;m/z实测值,477.4[M+H]+.
实施例130
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-6-氯-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28BrClN5O,490.1;m/z实测值,493.4[M+H]+.
实施例131
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31BrN4O,470.17;m/z实测值,471.4[M+H]+.
实施例132
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31BrN4O,470.17;m/z实测值,471.4[M+H]+.
实施例133
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31BrN4O,470.17m/z实测值,471.4[M+H]+.MS(电喷雾):计算分子量C23H28BrClN4O,490.11;m/z实测值,493.4[M+H]+.
实施例134
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-叔丁基-1H-苯并咪唑.
MS(电喷雾):计算分子量C26H35BrN4O,498.20;m/z实测值,501.4[M+H]+.
实施例135
5-叔丁基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C26H36N4O,420.29;m/z实测值,421.5[M+H]+.
实施例136
2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑.
A.5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶.在氮气氛下,向搅拌下的4-(1-甲基-哌啶-4-基)-丁烷-1-醇(1.5g,8.77mmol,1.0当量)在DMF(10mL)中的溶液中分批加入60%的氢化钠(573mg,14.3mmol,1.5当量)。一旦最初的冒泡平息,将混合物在60℃加热1h,然后冷却至室温。然后加入2,5-二氯吡啶(1.42mg,9.55mmol,1.1当量)在DMF(10mL)中的溶液,接着将混合物搅拌4h。将混合物在饱和NaHCO3水溶液(20mL)和氯仿(40mL)之间进行分配。将氯仿层干燥(Na2SO4),过滤,浓缩,得到粗混合物,其用柱色谱(硅胶,0-10%(2M氨水在甲醇中)在二氯甲烷中)提纯,得到1.62g(65%)白色固体。
1H NMR(400MHz,CDCl3):8.07(dd,J=2.5,0.4Hz,1H),7.51(dd,J=8.8,2.7Hz,1H),6.67(dd,J=8.8,0.4Hz,1H),4.27(t,J=6.6Hz,2H),2.86-2.78(m,2H),2.26(s,3H),1.94-1.60(m,7H),1.52-1.37(m,2H),1.35-1.14(m,4H).
B.5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛.向2.0MLDA在庚烷/THF(5.74mL,11.5mmol,2.0当量)在THF(10mL)中的冷却溶液(-78℃)中滴加在THF(15mL)中的5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶(1.62g,5.74mmol,1.0当量)。30min后,滴加DMF(2.22mL,28.7mmol,5.0当量),混合物在-78℃下再搅拌20min。将混合物温热至0℃并用饱和NaHCO3水溶液(5mL)淬灭。将混合物温热至室温,接着用氯仿(2×20mL)萃取。合并的萃取液干燥(Na2SO4),过滤,浓缩,得到968mg粗残余物,其没有提纯就使用。
1H NMR(400MHz,CDCl3):10.4(s,1H),8.26(s,1H),7.13(s,1H),4.31(t,J=6.6Hz,2H),2.87-2.80(m,2H),2.25(s,3H),1.99-1.60(m,7H),1.51-1.38(m,2H),1.43-1.20(m,4H).
C.2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑.本化合物通过一般步骤3中所述的方法使用5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛(45mg,0.15mmol,1.0当量)、4-氟-3-甲基-苯-1,2-二胺(23mg,0.17mmol,1.1当量)和Na2S2O5(37mg,0.20mmol,1.3当量)进行制备。通过方法2提纯,得到12mg(18%)标题化合物。
MS(电喷雾):计算分子量C23H28ClFN4O,430.19;m/z实测值,431.4[M+H]+.1H NMR(400MHz,CD3OD):8.30(s,1H),7.45(dd,J=8.9,4.5Hz,1H),7.22-7.19(m,1H),7.07(dd,J=10.2,8.9Hz1H),4.31(t,J=6.6Hz,2H),2.88-2.81(m,2H),2.53(s,3H),2.24(s,3H),2.05-1.90(m,2H),1.84-1.66(m,4H),1.55-1.42(m,2H),1.37-1.15(m,5H).
实施例137
2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑。
标题化合物根据实施例136中所述的方法进行制备。
MS(电喷雾):计算分子量C24H31ClN4O,426.22;/z实测值,427.4[M+H]+.
实施例138
4,6-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
A.2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-异烟腈.左0℃下,向4-(4-甲基-哌嗪-1-基)-丁烷-1-醇(2.5g,14.5mmol,1.0当量)在DMF(25mL)中的溶液中加入氢化钠(60%在油中的分散体,0.70g,17.4mmol,1.2当量)。将混合物温热至室温并搅拌1h,接着再冷却至0℃。滴加2-氯-异烟腈(2.01g,14.5mmol,1.0当量)在DMF(12mL)中的溶液。混合物在室温下搅拌18h。所述反应用水(5mL)稀释并加入饱和NaHCO3水溶液(25mL)。混合物用氯仿(3×25mL)萃取,接着将合并的萃取液浓缩。通过方法2提纯,得到1.07g不纯的化合物。
计算分子量C15H22N4O,274.18;m/z实测值,275.4[M+H]+.
B.4,6-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.在0℃下,向搅拌下的2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-异烟腈)在甲苯(5.0mL)中的溶液中加入1.5M的二异丁基氢化铝的甲苯溶液(3.9mL,5.86mmol,1.5当量)。3h后,加入甲醇(9mL)和1.0MH2SO4。将混合物搅拌30min,然后加入1.0M的NaOH(10mL),接着加入饱和酒石酸钾钠水溶液(40mL)和二氯甲烷(100mL)。搅拌30min后,混合物用氯仿(3×50mL)萃取,合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。残余物通过方法2部分提纯,得到240mg3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]苯甲醛以及若干其它未鉴定产物的混合物。将一部分粗3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯甲醛(40mg)、3,5-二甲基-苯-1,2-二胺(17.6mg)和Na2S2O5(32mg)在DMF(4mL)中在90℃搅拌18h。将反应混合物直接装载到硅胶上,通过方法2提纯,得到19mg标题化合物。
MS(电喷雾):计算分子量C23H31N5O,393.25;m/z实测值,394.5[M+H]+.1H NMR(400MHz,CD3OD):8.26(d,J=5.4Hz,1H),7.63(d,J=5.5Hz,1H),7.49(s,1H),7.25(br s,1H),6.95(s,1H),4.38(t,J=6.3Hz,2H),2.76-2.33(m,16H),2.32-2.24(s,3H),1.92-1.79(m,2H),1.79-1.66(m,2H).
实施例139-142中的下列化合物根据实施例138中所述的方法进行制备。
实施例139
4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C22H29N5O,379.24;m/z实测值,380.4[M+H]+.
实施例140
4,5-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C23H31N5O,393.25;m/z实测值,394.5[M+H]+.
实施例141
5-氟-4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H28FN5O,397.23;m/z实测值,398.4[M+H]+.
实施例142
6-氯-4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C22H28ClN5O,413.20;m/z实测值,414.4[M+H]+.
实施例143
5-氟-4-甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
A.2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-异烟腈.向1-甲基-[1,4]二氮杂环庚烷(21.3g,185mmol,2.0当量)和4-氯-丁烷-1-醇(10.0g,92.6mmol,1.0当量)在1-丁醇(200mL)中的溶液中加入K2CO3(38.0g,278mmol,3.0当量)和NaI(13.9g,92.6mmol,1.0当量)。将混合物温热至95℃并搅拌36h。然后将该混合物冷却至室温,用水稀释,接着用氯仿(3×100mL)萃取。合并的萃取液用盐水洗涤,干燥(MgSO4),过滤,接着浓缩。通过方法2提纯,得到9.3g带少量未鉴别杂质的4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁-1-醇。将一部分所述不纯的醇(5.0g)溶于DMF(50mL)中并冷却至0℃。加入氢化钠(60%的在油中的分散体,1.29g,32.2mmol,1.2当量)。将混合物温热至室温,搅拌1h,接着再冷却至0℃。滴加2-氯-异烟腈(3.72g,26.8mmol,1.0当量)在DMF(25mL)中的溶液。将混合物在室温下搅拌18h,然后用水(25mL)和饱和NaHCO3水溶液(100mL)稀释,接着用氯仿(3×100mL)萃取。将合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。通过方法2提纯,得到标题化合物(1.0g)。
MS(电喷雾):计算分子量C16H24N4O,288.20;m/z实测值,289.4[M+H]+.1H NMR(400MHz,CDCl3):8.28(dd,J=4.4Hz,0.8Hz,1H),7.05(dd,J=3.9,1.1Hz,1H)6.96(s,1H),4.33(t,J=6.6Hz,2H),2.75-2.68(m,4H),2.65-2.57(m,4H),2.56-2.49(m,2H),2.35(s,3H),1.84-1.74(m,4H),1.66-1.55(m,2H).
B.5-氟-4-甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.0℃下,向搅拌下的2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-异烟腈(1.0g,3.47mmol,1.0当量)在甲苯(5.0mL)中的溶液中加入1.0M的二异丁基氢化铝的甲苯溶液(5.2mL,5.2mmol,1.5当量)。3h后,加入甲醇(9mL)和1.0M H2SO4(10mL)。将混合物搅拌30min,然后加入1.0M的NaOH(10mL),接着加入饱和酒石酸钾钠水溶液(40mL)和二氯甲烷(100mL)。搅拌30min后,混合物用氯仿(3×50mL)萃取,合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。残余物用方法2部分提纯,得到268mg 2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-甲醛和若干其它未鉴别产物的混合物。将一部分该不纯的2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-甲醛(63mg)、4-氟-3-甲基-苯-1,2-二胺(30.3mg)和Na2S2O5(53.4mg)在DMF(3mL)中在90℃搅拌18h。将反应混合物直接装载到硅胶上,用方法2提纯,得到5.0mg标题化合物。
MS(电喷雾):计算分子量C23H30FN5O,411.24;m/z实测值,412.5[M+H]+.1H NMR(400MHz,CD3OD):8.27(dd,J=4.8,0.5Hz,1H),7.63(dd,J=4.0,1.4Hz,1H),7.52-7.40(m,2H),7.10-7.01(m,1H),4.27(t,J=6.3Hz,2H),2.86-2.77(m,4H),2.77-2.68(m,4H),2.65-2.57(m,2H),2.53(s,3H),2.37(s,3H),1.90-1.66(m,6H).
实施例144
4,5-二甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
本化合物根据实施例143中所述的方法进行制备。
MS(电喷雾):计算分子量C24H33N5O,407.27;m/z实测值,408.5[M+H]+.
实施例145
4,6-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑。
A.2-[4-(1-甲基-哌啶-4-基)-丁氧基]-异烟腈.在0℃下,向4-(1-甲基-哌啶-4-基)-丁烷-1-醇(1.0g,5.85mmol,1.0当量)在DMF(25mL)中的溶液中加入氢化钠(60%在油中的分散体,0.28g,7.02mmol,1.2当量)。将混合物温热至室温并搅拌1h。然后,将混合物再冷却至0℃并滴加2-氯-异烟腈(0.81g,5.85mmol,1.0当量)在DMF(10mL)中的溶液。将混合物在室温下搅拌18h,然后用水(25mL)和饱和NaHCO3水溶液(100mL)稀释。混合物用氯仿(3×100mL)萃取,接着将合并的萃取液浓缩。通过方法2提纯,得到0.44g(28%)标题化合物。
MS(电喷雾):计算分子量C16H23N3O,273.18;m/z实测值,274.4[M+H]+.1H NMR(400MHz,CD3OD):8.28(dd,J=5.2,0.7Hz,1H),7.05(dd,J=5.2,1.3Hz,1H),6.99-6.95(m,1H),4.21(t,J=6.6Hz,2H),2.88-2.79(m,2H),2.26(s,3H),1.95-1.83(m,2H),1.81-1.59(m,4H),1.51-1.38(m,2H),1.34-1.16(m,5H).
B.4,6-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.在0℃下,向搅拌下的2-[4-(1-甲基-哌啶-4-基)-丁氧基]-异烟腈(440mg,1.61mmol,1.0当量)在甲苯(5.0mL)中的溶液中加入1.0M的二异丁基氢化铝的甲苯溶液(2.41mL,2.41mmol,1.5当量)。3h后,加入甲醇(8mL)和1.0M H2SO4(5mL)。将混合物搅拌30min,然后加入1.0M的NaOH(10mL),接着加入饱和酒石酸钾钠水溶液(40mL)和二氯甲烷(100mL)。搅拌30min后,混合物用氯仿(3×50mL)萃取,合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。残余物通过方法2部分提纯,得到318mg 2-(4-哌啶-4-基-丁氧基)-吡啶-4-甲醛以及若干其它未鉴定产物的混合物。将一部分该粗2-(4-哌啶-4-基-丁氧基)-吡啶-4-甲醛(100mg)、3,5-二甲基-苯-1,2-二胺(70mg)和Na2S2O5(93mg)在DMF(3mL)中在90℃搅拌18h。将反应混合物直接装载到硅胶上,根据方法2提纯,得到38mg标题化合物。
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.4[M+H]+.1H NMR(400MHz,CD3OD):8.25(d,J=5.3Hz,1H),7.62(dd,J=4.5,1.0Hz,1H),7.48(s,1H),7.24(s,1H),6.95(s,1H),4.34(t,J=6.6Hz,2H),2.91-2.83(m,2H),2.58(s,3H),2.43(s,3H),2.25(s,3H),2.07-1.95(m,2H),1.86-1.69(m,5H),1.57-1.18(m,6H).
实施例146-151中的下列化合物根据实施例145中所述的方法进行制备.
实施例146
4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H30N4O,378.24;m/z实测值,379.4[M+H]+.
实施例147
5-氟-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29FN4O,396.23;m/z实测值,387.4[M+H]+.
实施例148
4-氯-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H27ClN4O,398.19;m/z实测值,398.4[M+H]+.
实施例149
4,5-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑。
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.5[M+H]+.
实施例150
6-氯-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29ClN4O,412.20m/z实测值,413.4[M+H]+.
实施例151
5-氯-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H29ClN4O,412.24;m/z实测值,413.4[M+H]+.
实施例152
5-叔丁基-2-[2-(4-哌啶-4-基-丁氧基)-吡啶-4-基]-1H-苯并咪唑.
标题化合物根据实施例145中所述的方法进行制备,用4-(4-羟基-丁基)-哌啶-1-羧酸叔丁酯代替4-(1-甲基-哌啶-4-基)-丁烷-1-醇,得到4-{4-[4-(5-叔丁基-1H-苯并咪唑-2-基)-吡啶-2-基氧基]-丁基}-哌啶-1-羧酸叔丁酯。然后,将此中间体如实施例14中所述转化为标题化合物。
MS(电喷雾):计算分子量C25H34N4O,406.27;m/z实测值407.5[M+H]+.
实施例153
4,6-二甲基-2-[2-(4-哌啶-4-基-丁氧基)-吡啶-4-基]-1H-苯并咪唑。标题化合物根据实施例152中所述的步骤进行制备。
MS(电喷雾):计算分子量C23H30N4O,378.24;m/z实测值,379.5[M+H]+.
实施例154
2-{2-[4-(1-乙基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑.
标题化合物根据实施例90中所述的方法进行制备。
MS(电喷雾):计算分子量C25H34N4O,406.27;m/z实测值,407.4[M+H]+.
实施例155
4,6-二甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
A.3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-异烟腈.在N2下,向烘干的烧瓶中加入2,2,6,6-四甲基哌啶(2.13mL,12.6mmol 1.5当量)和THF(50mL)。将该烧瓶冷却至-78℃并加入正丁基锂(2.5M的己烷溶液,5.03mL,12.6mmol,1.5当量)。将混合物温热至0℃1h,然后再冷却至-78℃。滴加2-[4-(1-甲基-哌啶-4-基)-丁氧基]-异烟腈(2.3g,8.38mmol,1.0当量)在THF(15mL)中的溶液,所得混合物在-78℃下搅拌1h。滴加在THF(10mL)中的甲基碘(1.30g,9.22mmol,1.1当量)。1h后,反应用饱和NaHCO3水溶液淬灭,温热至室温,用氯仿稀释,接着用饱和NaHCO3水溶液洗涤。将有机层干燥(Na2SO4),过滤,浓缩。通过方法2提纯,得到405mg 3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-异烟腈以及其它未鉴定产物的混合物。
MS(电喷雾):计算分子量C17H25N3O,287.20;m/z实测值,288.4[M+H]+.
B.4,6-二甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.在0℃下,向搅拌下不纯的3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-异烟腈(283mg)的溶液中加入1.5M的二异丁基氢化铝的甲苯溶液(1.32mL)。3h后,加入甲醇(8mL)和1.0M H2SO4(5mL)。将混合物搅拌30min,然后加入1.0M的NaOH(10mL),接着加入饱和酒石酸钾钠水溶液(40mL)和二氯甲烷(100mL)。搅拌30min后,混合物用氯仿(3×50mL)萃取,合并的萃取液用盐水洗涤,干燥(Na2SO4),过滤,接着浓缩。残余物通过方法2部分提纯,得到180mg2-(4-哌啶-4-基-丁氧基)-吡啶-4-甲醛以及若干其它未鉴定产物的混合物。将一部分不纯的2-(4-哌啶-4-基-丁氧基)-吡啶-4-甲醛(19.5mg)、3,5-二甲基-苯-1,2-二胺(9.2mg)和Na2S2O5(16.6mg)在DMF(3mL)中在90℃下搅拌18h。将反应混合物装载到硅胶硅胶上,通过方法2提纯,得到9.4mg标题化合物。
MS(电喷雾):计算分子量C25H34N4O,406.27;m/z实测值,407.5[M+H]+.1H NMR(400MHz,CD3OD):8.06(dd,J=5.3,0.4Hz,1H),7.23(s,1H),7.13(d,J=5.3Hz,1H),6.94(s,1H),4.36(t,J=6.4Hz,2H),2.92-2.81(m,2H),2.56(s,3H),2.43(s,3H),2.33(s,3H),2.24(s,3H),2.07-1.94(m,2H),1.87-1.67(m,4H),1.60-1.46(m,2H),1.40-1.15(m,5H).
实施例156-157中的下列化合物根据实施例155中所述的方法进行制备。
实施例156
4-甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H32N4O,392.26;m/z实测值,393.4[M+H]+.
实施例157
6-氯-4-甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31ClN4O,426.22;m/z实测值,427.4[M+H]+.
实施例158
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑.
标题化合物如实施例155中所述那样进行制备,用六氯乙烷代替甲基碘。
MS(电喷雾):计算分子量C23H29ClN4O,412.20;m/z实测值,413.4[M+H]+.
实施例159-164中的下列化合物根据实施例158中所述的方法进行制备。
实施例159
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31ClN4O,426.22;m/z实测值,427.4[M+H]+.
实施例160
4-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26Cl2N4O,432.15;m/z实测值,433.3[M+H]+.
实施例161
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28ClFN4O,430.19;m/z实测值,431.4[M+H]+.
实施例162
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C24H31ClN4O,426.22;m/z实测值427.4[M+H]+.
实施例163
6-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28Cl2N4O,446.16;m/z实测值,446.4[M+H]+.
实施例164
5-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28Cl2N4O,446.16;m/z实测值,446.4[M+H]+.
实施例165
5-氟-4-甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
A.5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶.在0℃下,向4-(1-甲基-哌啶-4-基)-丁烷-1-醇(14.9g,86.9mmol,1.0当量)在DMF(180mL)中的溶液中加入氢化钠(60%在油中的分散体,4.86g,122mmol,1.4当量)。将混合物温热至室温1h,然后再冷却至0℃。滴加5-溴-2-氯-吡啶(20.6g,86.9mmol,1.0当量)在DMF(20mL)中的溶液。将混合物在室温下搅拌18h,然后用水(100mL)和饱和NaHCO3水溶液(250mL)稀释。混合物用氯仿(3×100mL)萃取,接着将合并的萃取液浓缩。通过方法2提纯,得到8.82g 5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶和若干未识别杂质的混合物。
MS(电喷雾):计算分子量C15H23BrN2O,326.10;m/z实测值,327.3[M+H]+.
B.5-氟-4-甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基-吡啶-4-基}-1H-苯并咪唑.在-78℃下,向在烘干的100mL圆底烧瓶中LDA(2.0M在THF中,18.2mL,36.4mmol,2.2当量)的溶液中滴加5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶(5.40g,16.6mmol,1.0当量)在THF(20mL)中的溶液。所得溶液在-78℃下搅拌45min,然后滴加DMF(6.05mL,82.8mmol,5.0当量)。所得溶液用饱和NaHCO3水溶液(25mL)淬灭,接着用氯仿(3×50mL)萃取。合并的萃取液用盐水洗涤,接着浓缩。粗残余物用乙醇(5mL)稀释,接着用亚硫酸氢钠(2.1g)处理。真空过滤收集形成的沉淀,接着用乙醚洗涤。该固体用氯仿(50mL)稀释,接着用饱和NaHCO3水溶液(50mL)洗涤。将有机层干燥(Na2SO4),过滤,浓缩,得到5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛与若干其它未鉴定产物的混合物。将这种粗混合物在甲醇(15mL)中的溶液用浓H2SO4(1mL)处理,接着将所得溶液搅拌14h。混合物用饱和NaHCO3水混合物(25mL)稀释,接着用氯仿(3×25mL)萃取。将合并的萃取液浓缩,得到5-溴-4-二甲氧基甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶。吡啶(2.0g,5.0mmol,1.0当量)在THF(50mL)中的-78℃溶液用正丁基锂(2.5M在己烷中,2.2mL,5.5mmol,1.1当量)处理。将该溶液搅拌30min,然后加入甲基碘(0.312g,5.0mmol,1.0当量)。30min后,反应用饱和NaHCO3水溶液(10mL)淬灭,接着用氯仿(3×25mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗混合物形式的4-二甲氧基甲基-5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶。4-二甲氧基甲基-5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶(0.64mg)在THF(100mL)中的溶液用1.0M HCl(20mL)处理,接着将混合物搅拌4h。混合物用饱和NaHCO3水溶液稀释,接着用氯仿(3×100mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛。将此甲醛的一部分(110mg)、4-氟-3-甲基-苯-1,2-二胺(60mg)和Na2S2O5(100mg)在DMF(2mL)中在90℃下搅拌36h。反应混合物浓缩,接着用反相HPLC提纯,得到标题化合物。
MS(电喷雾):计算分子量C24H31FN4O,410.25;m/z实测值,411.5[M+H]+.1H NMR(400MHz,CD3OD):8.17(s,1H),7.54-7.43(m,1H),7.19-7.05(m,2H),4.34(t,J=6.4Hz,2H),3.53-3.43(m,2H),3.04-2.89(m,2H),2.84(s,3H),2.53(s,3H),2.43(s,3H),2.06-1.95(m,2H),1.85-1.76(m,2H),1.64-1.29(m,7H).
实施例166-168中的下列化合物根据实施例165中所述的方法进行制备。
实施例166
5-氯-6-氟-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C23H28ClFN4O,430.19;m/z实测值,431.4[M+H]+.
实施例167
5-叔丁基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C27H38N4O,434.30;m/z实测值,435.5[M+H]+.
实施例168
4,5-二甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C25H34N4O,406.27;m/z实测值,407.5[M+H]+.
实施例169
2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑.
标题化合物如实施例165中所述那样进行制备,用六氯乙烷代替甲基碘.
MS(电喷雾):计算分子量C24H31ClN4O,426.22;m/z实测值,427.4[M+H]+.
实施例170-172中的下列化合物根据实施例169中所述的方法进行制备.
实施例170
5-氯-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26Cl2N4O,432.15;m/z实测值433.3[M+H]+.
实施例171
5-氯-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-6-氟-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H25Cl2FN4O,450.14;m/z实测值451.3[M+H]+.
实施例172
5-叔丁基-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑.
MS(电喷雾):计算分子量C26H35ClN4O,454.25;m/z实测值455.5[M+H]+.
实施例173-175中的下列化合物根据实施例128中所述的方法进行制备.
实施例173
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-氯-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26BrClN4O,476.10;m/z实测值477.3[M+H]+.
实施例174
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-6-氟-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H25BrClFN4O,494.09;m/z实测值495.3[M+H]+.
实施例175
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-1H-苯并咪唑.
MS(电喷雾):计算分子量C22H26BrClN4O,476.10;m/z实测值477.3[M+H]+.
实施例176
{2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)丙氧基]-苯基}-甲醇.
A.4-[3-(4-溴-3-[1,3]二烷-2-基-苯氧基)-丙基]-1-甲基-哌啶.在0℃下,向3-(1-甲基-哌啶-4-基)-丙烷-1-醇(7.07g,45mmol,1.0当量)和甲磺酰氯(4.18mL,54mmol,1.2当量)在二氯甲烷(100mL)中的溶液中加入三乙胺(9.41mL,68mmol,1.5当量)。将反应混合物冷却至室温,搅拌30mmin,然后倒入到饱和NaHCO3水溶液中。将含水混合物用氯仿萃取,然后用乙酸乙酯萃取。将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。将残余物溶于乙腈(100mL)中,接着加入4-溴-3-[1,3]二烷-2-基-苯酚(11.7g,45mmol,1.0当量)和碳酸铯(29.2mg,90mmol,2.0当量)。将混合物在室温下搅拌12h,然后温热至50℃1.0h。将混合物倒入到饱和NaHCO3水溶液中,接着用乙酸乙酯(2x)和氯仿萃取。将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。通过方法2提纯,得到4.82(27%)标题化合物。
1H NMR(400MHz,CD3OD):7.43(d,J=B.8Hz,1H),7.19(d,J=3.1Hz,1H),6.83(dd,J=8.8,3.1Hz,1H),5.72(s,1H),4.27-4.19(m,2H),4.10-4.00(m,2H),3.97(t,J=6.4Hz,2H),2.93-2.85(m,2H),2.28(s,3H),2.25-2.11(m,1H),2.07-1.97(m,2H),1.85-1.72(m,4H),1.52-1.21(m,6H).
B.2-{2-[1,3]二烷-2-基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-5-氟-4-甲基-1H-苯并咪唑.在-78℃下,向搅拌下4-[3-(4-溴-3-[1,3]二烷-2-基-苯氧基)-丙基]-1-甲基-哌啶(4.82g,12.4mmol,1.0当量)在THF(62mL)中的溶液中加入2.5M的正丁基锂的己烷溶液(22mL,55mmol,4.4当量)。将所得橙色溶液搅拌30min,然后加入DMF(9.6mL,124mmol,10.0当量)。将溶液温热至室温并搅拌1.0h,然后再冷却至-78℃并加入饱和NaHCO3水溶液。将混合物温热至室温,倒入到水中,并用乙酸乙酯萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩。粗残余物用方法2部分提纯。所得的2-[1,3]二烷-2-基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯甲醛(491mg,1.41mmol,1.0当量)与4-氟-3-甲基-苯-1,2-二胺(198mg,1.41mmol,1.0当量)和Na2S2O5(350mg,1.84mmol,1.3当量)一起在DMF(7.0mL)中在90℃搅拌2h。将混合物装载到硅胶上,通过方法2提纯,得到509mg(77%)标题化合物。
MS(电喷雾):计算分子量C27H34FN3O3,467.26;m/z实测值,468.4[M+H]+.1H NMR(400MHz,CD3OD):7.62(d,J=8.5Hz,1H),7.44-7.37(m,1H),7.35(d,J=2.7Hz,1H),7.09-6.99(m,2H),5.97(s,1H),4.19-4.13(m,2H),4.09(t,J=6.4Hz,2H),3.95-3.86(m,2H),2.95-2.87(m,2H),2.53(s,3H),2.30(s,3H),2.22-1.99(m,3H),1.93-1.76(m,4H),1.51-1.22(m,6H).
C.{2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-甲醇.将2-{2-[1,3]二烷-2-基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-5-氟-4-甲基-1H-苯并咪唑(401mg)和对甲苯磺酸(1.0g)在丙酮(10mL)和水(1.0mL)的溶液中在回流下搅拌16h。将溶液倒入到饱和NaHCO3水溶液中,并用乙酸乙酯萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩。将一部分粗残余物(43.3mg)溶于乙醇(2.0mL)中,接着加入硼氢化钠(300mg)。将混合物搅拌1.0h,然后倒入到饱和NaHCO3水溶液中。含水混合物用乙酸乙酯萃取,将合并的萃取液干燥(Na2SO4),过滤,接着浓缩。残余物用方法2提纯,得到6.0mg标题化合物。
MS(电喷雾):计算分子量C24H30FN3O2,411.23;m/z实测值,412.4[M+H]+.1H NMR(400MHz,CD3OD):7.82(d,J=8.6Hz,1H),7.43-7.33(m,1H),7.14-7.10(m,1H),7.06-6.97(m,2H),4.72(s,2H),4.09(t,J=6.3Hz,2H),2.94-2.86(m,2H),2.52(s,3H),2.29(s,3H),2.11-1.99(m,2H),1.91-1.74(m,4H),1.52-1.42(m,2H),1.41-1.21(m,4H).
实施例177
{4-(4,6-二甲基-1H-苯并咪唑-2-基)-6-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-3-基}-甲醇.
将5-溴-4-二甲氧基甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶(0.5g,1.25mmol,1.0当量)溶于THF(6mL)中,接着冷却至-78℃。滴加2.5M的正丁基锂的己烷溶液(0.6mL,1.5mmol,1.2当量)。将该溶液搅拌45min,然后加入DMF(0.55mL,1.25mmol,1.0当量)。1h后,加入硼氢化钠(38mg,1.36mmol 1.1当量)。将混合物温热至-40℃30min,然后用饱和NaHCO3水溶液(10mL)淬灭。该混合物用氯仿(3×30mL)萃取,接着将合并的萃取液干燥(Na2SO4),过滤,浓缩,得到粗混合物形式的{4-二甲氧基甲基-6-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-3-基}-甲醇。将此粗物质(88mg)溶于THF(3mL)中,在3h内在60℃下分批加入1.0M HCl(3mL)。将该混合物冷却,加入饱和NaHCO3水溶液,接着该混合物用氯仿(3×30mL)萃取。将合并的萃取液干燥(Na2SO4),过滤,浓缩。将一部分所得粗5-羟基甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-甲醛(33mg)、3,5-二甲基-苯-1,2-二胺(22mg)和Na2S2O5(36mg)在DMF(2mL)中在90℃下搅拌36h。反应混合物通过方法2提纯,得到5.3mg标题化合物。
MS(电喷雾):计算分子量C25H34N4O2,422.27;m/z实测值,423.5[M+H]+.1H NMR(400MHz,CD3OD):8.21(s,1H),7.30(s,1H),7.23(br s,1H),6.95(br s,1H),4.68(s,2H),4.34(t,J=6.4Hz,2H),2.95-2.82(m,2H),2.57(s,3H),2.44(s,3H),2.27(s,3H),2.11-1.98(m,2H),1.86-1.68(m,4H),1.57-1.44(m,2H),1.39-1.15(m,5H).
生物学实施例
对重组人组胺H4受体的结合试验
SK-N-MC细胞或COS7细胞用pH4R瞬时转染,在150cm2的组织培养皿中培养。细胞用盐水溶液洗涤,用细胞刮棒刮取细胞,离心收集(1000rpm,5min)。细胞沉淀在20mM Tris-HCl中用poltron组织匀浆器高速均浆10秒,制备细胞膜。均浆在4℃下于1000rpm离心5min。然后,收集上清液并在4℃下以20,000x g离心25min。最终沉淀再悬浮于50mM Tris-HCl中。细胞膜与3H-组胺(5-70nM)一起在存在或不存在过量组胺(10,000nM)的情况下进行共培养。培养在室温下进行45min。用Whatman GF/C过滤器快速过滤,收集细胞膜,用冰冷的50mM Tris-HCl洗涤4次。然后将过滤器干燥,与闪烁液混合,对放射性进行计数。表达人组胺H4受体的SK-N-MC或COS7细胞用来测定其它化合物的结合亲和力,以及通过在各种浓度的抑制剂或测试化合物存在下培养上述反应,测定它们置换3H-配体结合的能力。对于使用3H-组胺的竞争性结合研究,基于实验测得的5nM的KD值和5nM的配体浓度,根据Y.-C.Cheng和W.H.Prusoff(Biochem.Pharmacol.1973,22(23):3099-3108):Ki=(IC50)/(1+([L]/(KD))的方法计算Ki值。
结合试验结果
表
| 实施例 | Ki(nM) | 实施例 | Ki(nM) | 实施例 | Ki(nM) | 实施例 | Ki(nM) |
| 1234567891011121314151617 | 469212643616613825089592242574972216136 | 4546474849505152535455565758596061 | 1101131291541731872786418723020332417101863949 | 8990919293949596979899100101102103104105 | 120736331137134125283841553214126685 | 134135136137138139140141142143144145146147148149150 | 1174713466914460736835817419 |
| 181920212223242526272829303132333435363738394041424344 | 641865841103109119142749326229938111228353665667478798287 | 626364656667686970717273747576777879808182838485868788 | 515712115732156202656922281214211412815023161267391036152 | 106107108109110111112113114115116117118119120121122123124125126127128129130131132133 | 1226316621641141254519460716786774277733553512 | 151152153154155156157158159160161162163164165166167168169170171172173174175176177 | 2111717911113202821195320151273646151212131644 |
肥大细胞趋化性试验
肥大细胞在粘膜上皮细胞中积累是过敏性鼻炎和哮喘众所周知的特征。此外,肥大细胞数目在许多炎性病症中增加也是已知的。其中一些是由于肥大细胞对炎症部位的趋化性。这种对特定药物的趋化性可以在体外进行模拟。将孔径8μm的Transwells(Costar,Cambridge,MA)用100μL 100ng/mL的人纤维结合蛋白(Sigma)在室温下涂铺2h。除去纤维结合蛋白后,在10μM组胺存在下,将含5%BSA的600μLRPMI加入到底室中。为了试验各种组胺受体(HR)拮抗剂,将10μM和/或1μM的测试化合物溶液加入到顶室和底室中。将肥大细胞(2×105/孔)加入到顶室中。将所述平板在37℃培养3h。除去Transwells,使用流式细胞仪对底室中的细胞计数六十秒。由此获得HR抑制数据。
H4表达的细胞类型分布
RNA由不同的细胞用RNeasy试剂盒(Qiagen,Valencia,CA)根据厂家指示进行制备。总RNA从纯化人细胞中用RNeasy试剂盒(Qiagen,Valencia,CA)提取并用RT反应试剂盒(Invitrogen)根据厂家指示逆转录成cDNA。H4受体RNA通过RT-PCR技术用人H4受体-特异性引物5′-ATGCCAGATACTAATAGCACA和5′-CAGTCGGTCAGTATCTTCT进行检测。H4受体的扩增PCR带是1170bp。
结果
RT-PCR结果表明:H4受体在肥大细胞、树状细胞、嗜碱性白细胞和嗜酸性粒细胞上表达。这些阳性结果与发表的文献一致(例如Oda等,Nguyen等,以及Morse等,参见发明背景部分)。肥大细胞和嗜酸性粒细胞在受影响组织中的积累是过敏性鼻炎和哮喘的主要特征之一。由于在这些细胞类型中找到H4受体表达,因此H4受体信号很可能介导肥大细胞和嗜酸性粒细胞渗入对组胺的应答。下表给出了通过RT-PCR H4表达的细胞类型分布。
| 物种 | 细胞类型 | H4 |
| 人 | 嗜酸性粒细胞不成熟的树状细胞成熟的树状细胞肥大细胞嗜碱性白细胞CD14+单核细胞 | +++++- |
| CD4+T细胞CD8+T细胞B细胞嗜中性白细胞 | +--- | |
| 小鼠/(大鼠) | 嗜酸性粒细胞腹膜肥大细胞(大鼠)骨髓衍生肥大细胞不成熟的树状细胞成熟的树状细胞骨髓衍生巨噬细胞腹膜巨噬细胞CD4+T细胞CD8+T细胞B细胞 | +++++----- |
通过组胺H4受体拮抗剂抑制嗜酸性粒细胞形变
嗜酸性粒细胞在过敏反应部位的积累是过敏性鼻炎和哮喘众所周知的特征。这个例子表明,组胺H4受体拮抗剂在人嗜酸性粒细胞中可以阻断对组胺的形变应答。形变是嗜酸性粒细胞趋化性前的细胞特征。
方法
通过菲可梯度从人血中分离人粒细胞。红细胞用5-10X Qiagen裂解缓冲液在室温下裂解5-7min。收获粒细胞并用FACS缓冲液洗涤一次。将所述细胞以2×106细胞/mL的密度再悬浮在反应缓冲液中。为了测试对特异性组胺受体拮抗剂的抑制,将90μL细胞悬液(~2×105细胞)与10μM各种测试化合物溶液中的一种进行共培养。30min后,加入11μL一种浓度的组胺。10min后,将细胞转入到冰上并用250μL冰冷的固定缓冲液(2%甲醛)固定1min。用门控自发荧光前向角散射试验(GAFS)测定形变(S.A.Bryan et al.,Am.J.Respir.Crit.Care Med.2002,165(12):1602-1609)。
结果-组胺通过H4受体介导嗜酸性粒细胞形变
嗜酸性粒细胞形变是由于趋化性之前的细胞骨架变化引起的并由此是测量趋化性的尺度。下表中的数据表明,组胺在嗜酸性粒细胞中诱导剂量依赖性形变。选出组胺受体(HR)拮抗剂,其中这种组胺受体是造成该形变的原因。对组胺H1受体特异性的拮抗剂(苯海拉明)或对组胺H2受体特异性的拮抗剂(雷尼替丁)不改变组胺诱发的形变。然而,H3/H4双重拮抗剂(噻普酰胺)和特异性组胺H4受体拮抗剂((5-氯-1H-吲哚-2-基)-(4-甲基-哌嗪-1-基)-甲酮,Ki=5nM)抑制组胺诱发的嗜酸性粒细胞形变,其IC50分别是1.5μM和0.27μM。
| 倍数变化 | |||||
| 组胺(μM) | 10 | 1 | 0.1 | 0.01 | 0 |
| 无HR拮抗剂10μM H4拮抗剂10μM噻普酰胺10μM苯海拉明10μM雷尼替丁 | 1.341.091.081.631.64 | 1.311.051.051.501.49 | 1.211.051.011.181.21 | 1.011.011.041.031.04 | 1.001.001.001.001.00 |
通过组胺H4受体拮抗剂抑制嗜酸性粒细胞趋化性
嗜酸性粒细胞在过敏反应的部位积累是过敏性鼻炎和哮喘的一个众所周知的特征。嗜酸性粒细胞从人血液中用标准方法进行提纯。使用孔径5/μm的transwells(Costar,Cambridge,MA)进行趋化性试验,其中该transwells在室温下用100μL 100ng/mL的人纤维结合蛋白(Sigma)涂铺2h。除去纤维结合蛋白后,在组胺(1.25-20μM)存在下将含5%BSA的600μL RPMI加入到底室中。为了测试各种组胺受体拮抗剂,可以将10μM测试化合物加入到顶室和底室中。将嗜酸性粒细胞加入到顶室中,而将组胺或趋化因子放在底室中。将所述板在37℃培养3h。除去Transwells,使用流式细胞仪对底室中的细胞数目进行计数,或者可以通过使用吉姆萨染色进行定量测定。
通过组胺H4受体拮抗剂抑制小鼠中酵母聚糖诱发的腹膜炎
现已表明,组胺H4受体拮抗剂可以阻碍由酵母聚糖诱发的腹膜炎,其中酵母聚糖是酿酒酵母细胞壁上的不溶性多糖组分。这通常用于在小鼠中诱发腹膜炎并且似乎是以一种肥大细胞依赖性方式起作用。可以在这样一种模型中测试本发明的化合物以证明它们作为抗炎药的用途。在0时间,小鼠以s.c.或p.o.方式给予化合物或PBS,十五min后,每只小鼠通过i.p.接受1mg的酵母聚糖A(Sigma),4小时后处死小鼠,腹膜腔用3mL含3mM EDTA的PBS洗涤。采洗出液的等分试样(100μL)并用1:10的特克溶液(含0.01%结晶紫的3%乙酸)稀释,测定迁移白细胞的数目。然后,将样品涡流,然后将10μL染色细胞溶液放在诺伊博尔血细胞计数器中。使用光学显微镜(Olympus B061)进行差别细胞计数。由于它们的彩色特征以及它们的核和细胞质外观,可以很容易地识别多形核白细胞(PMN;>95%嗜中性白细胞)。用酵母聚糖处理增加了嗜中性白细胞的数目,其表示一种炎症应答。用H4受体拮抗剂处理阻碍了这种增加。
在哮喘和过敏性鼻炎的动物模型中H4受体拮抗剂抑制肥大细胞趋化性
动物模型用来测试所述观察,即肥大细胞随过敏性炎症累积,其中这种过敏性炎症可以被H4受体拮抗剂阻滞。可以在此模型中对本发明的化合物进行测试,以表明本发明的化合物可以用于治疗过敏性鼻炎或哮喘。在第0天和第14天,小鼠通过腹膜内注射卵清蛋白/明矾(10μg在0.2ml Al(OH)3中,2%)致敏。在第21至23天,小鼠用PBS或卵清蛋白攻击,在第24天,在最后一次攻击后24h处死小鼠。移去部分气管并固定在福尔马林中。进行气管的石蜡包埋和纵切面,接着用甲苯胺蓝对肥大细胞染色。或者,气管坐在OCT中冻结以进行冻结切片,肥大细胞通过IgE染色识别。根据它们在每个气管部分内的位置,将肥大细胞确定为粘膜下肥大细胞或上皮下肥大细胞。暴露于过敏原中应增加上皮下肥大细胞的数目,并且这种作用被H4受体拮抗剂阻滞。
本发明的特征和优点对本领域普通熟练技术人员来说是显而易见的。基于本发明的内容,包括发明概述、发明详述、背景技术、实施例和权利要求书,本领域普通熟练技术人员能够根据各种情况和用途做出改变和修改。在此所述的出版物将它们整个引入作为参考。这些其它的实施方案也在本发明的范围内。
Claims (137)
1.式(I)或(II)的化合物:
其中
W是N或CR7;
X是N或CH;
Y是O、NR12或CR12R13;
Z是N或CR14;
n是0、1或2;
每个R1-4独立地是H、C1-4烷基、C2-5链烯基、C2-5炔基、C3-6环烷基、-C1-4烷氧基、-C1-4烷基氨基、-C1-4烷硫基、-C1-4烷基磺酰基、-OC3-6环烷基、-OCH2Ph、氰基、-CF3、F、Cl、Br、I、硝基、-OCF3、-SCF3、-ORc、-SRc、-S(O)Rc、-SO2Rc、-C(O)Rc、苯基、苄基、苯乙基、-C(O)NRaRb、-C(O)ORc、-NRaRb、-CH2NRaRb或-CH2ORc;其中每个Ra、Rb和Rc独立地选自H、C1-4烷基、C3-6环烷基、苯基、(C3-6环烷基)C1-2烷基-、苄基和苯乙基,或Ra和Rb与它们相连的氮一起形成一个4-7元杂环HetCyc1,其中所述的环HetCyc1具有0或1个其它的选自O、S、>NH和>NC1-6烷基的杂原子,以及其中在任何所述的R1-4、Ra、Rb、Rc和所述环HetCyc1中,任何苯基、苯乙基、苄基、烷基或环烷基部分任选独立地被1、2或3个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;
每个R5-7独立地是H、C1-6烷基、F、Cl、Br、I、-CF3、-OCF3、-ORc、-SRc、-S(O)Rc、-SO2Rc、C1-4烷氧基、氰基、硝基、-C(O)NRaRb、-C(O)苯基、-C(O)C1-6烷基、-S(O)C1-4烷基或-SO2C1-4烷基;或对于式(I)化合物,R5和R6与它们相连的碳原子一起形成选自芳基、杂芳基、5-或6-元碳环和具有1或2个杂原子的5-或6-元杂环的环结构Cyc1,其中所述的环结构Cyc1独立地被0、1或2个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;或对于式(II)化合物,R7和R6与它们相连的碳原子一起形成选自芳基、杂芳基、5-或6-元碳环和具有1或2个杂原子的5-或6-元杂环的环结构Cyc2,其中所述的环结构Cyc2独立地被0、1或2个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;
R8是H、C1-6烷基、C1-4烷氧基或OH;
每个R9和R10独立地是H或C1-6烷基,或R9和R10一起形成5-6元环状结构Cyc3,其中所述的环状结构Cyc3是5-或6-元碳环或具有1或2个杂原子的5-或6-元杂环,以及其中所述的环结构Cyc3独立地被0、1或2个选自C1-3烷基、卤素、羟基、氨基和C1-3烷氧基的取代基所取代;
R11是H,C1-4烷基;
每个R12和R13独立地是H或C1-4烷基;或者,当Y是CR12R13时,R12和R13与它们相连的碳一起形成任选取代的环结构Cyc4,其中所述的环结构Cyc4是3-至6-元碳环或具有0或1个其它杂原子的3-至6-元杂环,或者CR12R13是C=O;
R14是H、C1-4烷基、OH或C1-4烷氧基;
其对映异构体、非对映异构体、外消旋体,或其药学上可接受的盐、酰胺或酯;
条件是:
当Y是O或NR12时,那么Z是CR14以及R8不是OH或C1-4烷氧基;当Z是N时,Y是CR12R13;以及
R1和R4都不是C(O)NH2。
2.权利要求1的化合物,其中W是N或CR7。
3.权利要求1的化合物,其中X是N或CH。
4.权利要求1的化合物,其中Y是CR12R13。
5.权利要求1的化合物,其中Y是CH2。
6.权利要求1的化合物,其中Z是N或CH。
7.权利要求1的化合物,其中n=1或2。
8.权利要求1的化合物,其中n=1。
9.权利要求1的化合物,其中R1选自H、甲基、乙基、异丙基、环丙基、F、Cl、Br、氰基、苯基、羧甲基、二甲酰胺基和CH2OMe。
10.权利要求1的化合物,其中R1是H、甲基、F或Cl。
11.权利要求1的化合物,其中R2选自H、甲基、乙基、异丙基、叔丁基、环丙基、CF3、OCF3、F、Cl、Br、氰基、苯基、羧甲基、二甲基甲酰胺基和苯甲酰基。
12.权利要求1的化合物,其中R2是H、F、Cl、甲基、CF3、OCF3或叔丁基。
13.权利要求1的化合物,其中R3选自H、甲基、乙基、异丙基、叔丁基、环丙基、CF3、OCF3、F、Cl、Br、氰基、苯基、羧甲基、二甲基甲酰胺基和苯甲酰基。
14.权利要求1的化合物,其中R3是H、F、Cl、甲基、CF3、OCF3或叔丁基。
15.权利要求1的化合物,其中R4选自H、甲基、乙基、异丙基、环丙基、R、Cl、Br、氰基、苯基、羧甲基、二甲基甲酰胺基和CH2OMe。
16.权利要求1的化合物,其中R4是H、甲基、F或Cl。
17.权利要求1的化合物,其中R1-4中的一个或两个不是H。
18.权利要求1的化合物,其中R5是H、F、Cl、甲基或乙基。
19.权利要求1的化合物,其中R5是F、Cl、甲基、羟甲基、羟乙基、吡咯烷基甲基或二乙基氨基甲基。
20.权利要求1的化合物,其中R6是H、F、Cl或甲基。
21.权利要求1的化合物,其中R7是H、F、Cl或甲基。
22.权利要求1的化合物,其中R5是Cl、甲基或羟甲基。
23.权利要求1的化合物,其中R8是H、甲基或OH。
24.权利要求1的化合物,其中R8是H。
25.权利要求1的化合物,其中R9和R10独立地选自
a)H,
b)甲基、乙基、丙基、异丙基,和
c)三氟甲基。
26.权利要求1的化合物,其中R9和R10每个独立地是H或甲基。
27.权利要求1的化合物,其中R11是H、甲基或乙基。
28.权利要求1的化合物,其中R11是甲基。
29.化合物,选自:
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑;
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲氧基-1H-苯并咪唑;
5-叔丁基-2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-叔丁基-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
4,5-二甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-叔丁基-2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
5-叔丁基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
(1-{3-[4-(5-叔丁基-1H-苯并咪唑-2-基)-2-氯-苯氧基]-丙基}-吡咯烷-3-基)-二甲胺;
5-氯-2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-6-甲基-1H-苯并咪唑;
2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
5-甲基-2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-萘-1-基}-1H-苯并咪唑;
4-[3-(5-叔丁基-1H-苯并咪唑-2-基)-苯氧基]-1-(4-甲基-哌嗪-1-基)-丁烷-1-酮;
5-氯-2-[3-氯-4-(3-哌嗪-1-基-丙氧基)-苯基]-6-氟-1H-苯并咪唑;
5-叔丁基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑;
2-{2-氯-4-[2-甲基-3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-甲基-1H-苯并咪唑;
6-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
5-叔丁基-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑;
5-氯-6-甲基-2-[3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
5-氯-6-氟-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑;
5,6-二氟-2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-氟-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑;
5,6-二甲基-2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4,6-二甲基-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
5-叔丁基-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑;
5,6-二氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑;
5-氯-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑;
5,6-二氯-2-{3-氯-4-{3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-6-甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲基-1H-苯并咪唑;
5-氯-2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
5-氯-6-氟-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-甲基-2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-6-氟-2-{3-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{3-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-甲氧基-1H-苯并咪唑;
5-叔丁基-2-{3,5-二溴-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-甲氧基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-三氟甲基-1H-苯并咪唑;
2-{3-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
(2-{3-[4-(4-甲基-哌嗪-1-基)-丁氧基]-苯基}-1H-苯并咪唑-5-基)苯基-甲酮;
6-氯-2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
5-叔丁基-2-{3-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4,5-二甲基-1H-苯并咪唑;
5-氯-6-甲基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-6-氟-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-叔丁基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-甲基-2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
6-氯-2-{2-氟-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
5-氟-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
4-氯-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氯-2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-6-氟-1H-苯并咪唑;
2-{2-氯-4-[3-(1-甲基-哌啶-4-基)-丙氧基]-苯基}-3H-萘并[1,2-d]咪唑;
4,6-二甲基-2-{2-甲基-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5-氟-4-甲基-1H-苯并咪唑;
2-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基)-3H-萘并[1,2-d]咪唑;
6-{2-氯-4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-5H-[1,3]二氧杂环戊烯并[4′,5′:4,5]苯并[1,2-d]咪唑;
6-氯-2-{2-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
2-{3-氯-4-[3-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丙氧基]-苯基}-4-甲基-1H-苯并咪唑;
4,6-二甲基-2-{3-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-苯基}-1H-苯并咪唑;
5-氯-2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
2-{4-[3-(4-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
{2-(6-氯-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺;
{2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)-丙氧基]-苄基}-二甲基-胺;
4-{3-[4-(6-氯-4-甲基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-[1,4]二氮杂环庚烷-5-酮;
4-{3-[4-(5-叔丁基-1H-苯并咪唑-2-基)-3-甲基-苯氧基]-丙基}-1-甲基-[1,4]二氮杂环庚烷-5-酮;
5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-叔丁基-2-{2-甲基-4-[3-(2-甲基-哌嗪-1-基)-丙氧基]-苯基}-1H-苯并咪唑;
6-氯-4-甲基-2-[2-甲基-4-(3-哌啶-4-基-丙氧基)-苯基]-1H-苯并咪唑;
5-氟-4-甲基-2-[2-甲基-4-(3-哌啶-4-基-丙氧基)-苯基]-1H-苯并咪唑;
6-氯-2-{4-[3-(1-乙基-哌啶-4-基)-丙氧基]-2-甲基-苯基}-4-甲基-1H-苯并咪唑;
{2-[3-氯-4-(4-甲基-1H-苯并咪唑-2-基)-苯氧基]-乙基}-甲基-(1-甲基-哌啶-4-基)-胺;
6-氯-4-甲基-2-{2-甲基-4-[2-(1-甲基-哌啶-4-基氧基)-乙氧基]-苯基}-1H-苯并咪唑;
6-氯-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
5-氟-4-甲基-2-{2-甲基-4-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-苯基}-1H-苯并咪唑;
6-氟-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
6,7-二甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
5-氯-7-甲基-2-{3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
5,7-二甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
5-氯-7-甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
6-氟-7-甲基-2-{2-甲基-3-[4-(1-甲基-哌啶-4-基)-丁氧基]-苯基}-1H-苯并咪唑;
6-氟-7-甲基-2-{3-[3-(1-甲基-哌啶-4-基氧基)-丙氧基]-苯基}-1H-苯并咪唑;和
{2-(5-氟-4-甲基-1H-苯并咪唑-2-基)-5-[3-(1-甲基-哌啶-4-基)丙氧基]-苯基}-甲醇。
30.化合物,选自:
6-氯-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
5-氟-4-甲基-2-{6-[3-(4-甲基-哌嗪-1-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4,5-二甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4-氯-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
6-氯-4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
5-氟-4-甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4,5-二甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4,6-二甲基-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4-氯-2-{4-甲基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-5-氟-4-甲基-1H-苯并咪唑;
2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
6-氯-2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
2-{4-氯-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4,6-二甲基-1H-苯并咪唑;
2-{4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
5-氟-2-{4-甲氧基-6-[3-(1-甲基-哌啶-4-基)-丙氧基]-吡啶-3-基}-4-甲基-1H-苯并咪唑;
5-氟-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
6-氯-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4,5-二甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
4,6-二甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
5-氯-4-甲基-2-{6-[3-(1-甲基-1,2,3,6-四氢-吡啶-4-基)-丙氧基]-吡啶-3-基}-1H-苯并咪唑;
5-氟-4-甲基-2-{6-[3-(1-甲基-哌啶-4-基)-丙氧基]-4-吡咯烷-1-基甲基-吡啶-3-基}-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-6-氯-4-甲基-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-4-甲基-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-叔丁基-1H-苯并咪唑;
5-叔丁基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑;
2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
4,6-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4,5-二甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-氟-4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
6-氯-4-甲基-2-{2-[4-(4-甲基-哌嗪-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-氟-4-甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4,5-二甲基-2-{2-[4-(4-甲基-[1,4]二氮杂环庚烷-1-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4,6-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-氟-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4-氯-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4,5-二甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
6-氯-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-氯-4-甲基-2-{2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-叔丁基-2-[2-(4-哌啶-4-基-丁氧基)-吡啶-4-基]-1H-苯并咪唑;
4,6-二甲基-2-[2-(4-哌啶-4-基-丁氧基)-吡啶-4-基]-1H-苯并咪唑;
2-{2-[4-(1-乙基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
4,6-二甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4-甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
6-氯-4-甲基-2-{3-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,5-二甲基-1H-苯并咪唑;
4-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氟-4-甲基-1H-苯并咪唑;
2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑;
6-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
5-氯-2-{3-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-甲基-1H-苯并咪唑;
5-氟-4-甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-氯-6-氟-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-叔丁基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
4,5-二甲基-2-{5-甲基-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4,6-二甲基-1H-苯并咪唑;
5-氯-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
5-氯-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-6-氟-1H-苯并咪唑;
5-叔丁基-2-{5-氯-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-4-氯-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-6-氟-1H-苯并咪唑;
2-{5-溴-2-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-4-基}-5-氯-1H-苯并咪唑;和
{4-(4,6-二甲基-1H-苯并咪唑-2-基)-6-[4-(1-甲基-哌啶-4-基)-丁氧基]-吡啶-3-基}-甲醇。
31.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求1所述化合物的H4受体调节剂。
32.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求2所述化合物的H4受体调节剂。
33.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求3所述化合物的H4受体调节剂。
34.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求4所述化合物的H4受体调节剂。
35.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求5所述化合物的H4受体调节剂。
36.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求6所述化合物的H4受体调节剂。
37.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求7所述化合物的H4受体调节剂。
38.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求8所述化合物的H4受体调节剂。
39.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求9所述化合物的H4受体调节剂。
40.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求10所述化合物的H4受体调节剂。
41.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求11所述化合物的H4受体调节剂。
42.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求12所述化合物的H4受体调节剂。
43.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求13所述化合物的H4受体调节剂。
44.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求14所述化合物的H4受体调节剂。
45.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求15所述化合物的H4受体调节剂。
46.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求16所述化合物的H4受体调节剂。
47.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求17所述化合物的H4受体调节剂。
48.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求18所述化合物的H4受体调节剂。
49.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求19所述化合物的H4受体调节剂。
50.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求20所述化合物的H4受体调节剂。
51.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求21所述化合物的H4受体调节剂。
52.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求22所述化合物的H4受体调节剂。
53.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求23所述化合物的H4受体调节剂。
54.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求24所述化合物的H4受体调节剂。
55.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求25所述化合物的H4受体调节剂。
56.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求26所述化合物的H4受体调节剂。
57.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求27所述化合物的H4受体调节剂。
58.用于在患者中治疗或预防H4受体-介导的病症的药物组合物,包含治疗有效量的至少一种选自权利要求28所述化合物的H4受体调节剂。
59.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的至少一种选自权利要求1所述化合物的白细胞募集抑制剂。
60.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求2所述化合物的白细胞募集抑制剂。
61.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的至少一种选自权利要求3所述化合物的白细胞募集抑制剂。
62.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的至少一种选自权利要求4所述化合物的白细胞募集抑制剂。
63.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求5所述化合物的白细胞募集抑制剂。
64.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求6所述化合物的白细胞募集抑制剂。
65.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求7所述化合物的白细胞募集抑制剂。
66.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求8所述化合物的白细胞募集抑制剂。
67.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求9所述化合物的白细胞募集抑制剂。
68.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求10所述化合物的白细胞募集抑制剂。
69.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求11所述化合物的白细胞募集抑制剂。
70.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求12所述化合物的白细胞募集抑制剂。
71.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求13所述化合物的白细胞募集抑制剂。
72.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求14所述化合物的白细胞募集抑制剂。
73.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求15所述化合物的白细胞募集抑制剂。
74.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求16所述化合物的白细胞募集抑制剂。
75.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求17所述化合物的白细胞募集抑制剂。
76.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求18所述化合物的白细胞募集抑制剂。
77.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求19所述化合物的白细胞募集抑制剂。
78.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求20所述化合物的白细胞募集抑制剂。
79.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求21所述化合物的白细胞募集抑制剂。
80.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求22所述化合物的白细胞募集抑制剂。
81.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求23所述化合物的白细胞募集抑制剂。
82.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求24所述化合物的白细胞募集抑制剂。
83.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求25所述化合物的白细胞募集抑制剂。
84.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求26所述化合物的白细胞募集抑制剂。
85.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求27所述化合物的白细胞募集抑制剂。
86.在患者中用于抑制白细胞募集的药物组合物,包含治疗有效量的的至少一种选自权利要求28所述化合物的白细胞募集抑制剂。
87.抗炎组合物,包含治疗有效量的至少一种选自权利要求1所述化合物的抗炎化合物。
88.抗炎组合物,包含治疗有效量的至少一种选自权利要求2所述化合物的抗炎化合物。
89.抗炎组合物,包含治疗有效量的至少一种选自权利要求3所述化合物的抗炎化合物。
90.抗炎组合物,包含治疗有效量的至少一种选自权利要求4所述化合物的抗炎化合物。
91.抗炎组合物,包含治疗有效量的至少一种选自权利要求5所述化合物的抗炎化合物。
92.抗炎组合物,包含治疗有效量的至少一种选自权利要求6所述化合物的抗炎化合物。
93.抗炎组合物,包含治疗有效量的至少一种选自权利要求7所述化合物的抗炎化合物。
94.抗炎组合物,包含治疗有效量的至少一种选自权利要求8所述化合物的抗炎化合物。
95.抗炎组合物,包含治疗有效量的至少一种选自权利要求9所述化合物的抗炎化合物。
96.抗炎组合物,包含治疗有效量的至少一种选自权利要求10所述化合物的抗炎化合物。
97.抗炎组合物,包含治疗有效量的至少一种选自权利要求11所述化合物的抗炎化合物。
98.抗炎组合物,包含治疗有效量的至少一种选自权利要求12所述化合物的抗炎化合物。
99.抗炎组合物,包含治疗有效量的至少一种选自权利要求13所述化合物的抗炎化合物。
100.抗炎组合物,包含治疗有效量的至少一种选自权利要求14所述化合物的抗炎化合物。
101.抗炎组合物,包含治疗有效量的至少一种选自权利要求15所述化合物的抗炎化合物。
102.抗炎组合物,包含治疗有效量的至少一种选自权利要求16所述化合物的抗炎化合物。
103.抗炎组合物,包含治疗有效量的至少一种选自权利要求17所述化合物的抗炎化合物。
104.抗炎组合物,包含治疗有效量的至少一种选自权利要求18所述化合物的抗炎化合物。
105.抗炎组合物,包含治疗有效量的至少一种选自权利要求19所述化合物的抗炎化合物。
106.抗炎组合物,包含治疗有效量的至少一种选自权利要求20所述化合物的抗炎化合物。
107.抗炎组合物,包含治疗有效量的至少一种选自权利要求21所述化合物的抗炎化合物。
108.抗炎组合物,包含治疗有效量的至少一种选自权利要求22所述化合物的抗炎化合物。
109.抗炎组合物,包含治疗有效量的至少一种选自权利要求23所述化合物的抗炎化合物。
110.抗炎组合物,包含治疗有效量的至少一种选自权利要求24所述化合物的抗炎化合物。
111.抗炎组合物,包含治疗有效量的至少一种选自权利要求25所述化合物的抗炎化合物。
112.抗炎组合物,包含治疗有效量的至少一种选自权利要求26所述化合物的抗炎化合物。
113.抗炎组合物,包含治疗有效量的至少一种选自权利要求27所述化合物的抗炎化合物。
114.抗炎组合物,包含治疗有效量的至少一种选自权利要求28所述化合物的抗炎化合物。
115.一种用于在患者中治疗或预防炎症的方法,包括给予与炎症应答有关的患者一种药物组合物,所述的药物组合物包含治疗有效量的至少一种选自权利要求1所述化合物的抗炎化合物。
116.权利要求115所述的方法,其中所述的炎症应答是对至少一种下面病症的应答:炎性疾病、过敏性疾病、皮肤疾病、自身免疫疾病、淋巴疾病、皮肤骚痒和免疫缺陷疾病。
117.权利要求115所述的方法,其中所述的炎症应答是对化疗的应答。
118.权利要求115所述的方法,其中所述的炎症应答是对物理刺激应答和对化学刺激应答中的至少一种的应答。
119.权利要求115所述的方法,其中所述的炎症应答是对感染的应答。
120.权利要求115所述的方法,其中所述的炎症应答是对由与所述患者无关的物体的侵入的应答。
121.权利要求115所述的方法,其中所述的炎症应答是对免疫刺激的应答。
122.权利要求115所述的方法,其中所述的炎症应答是对至少一种下面病症的应答:过敏、哮喘、慢性阻塞性肺病(COPD)、动脉粥样硬化、类风湿性关节炎、多发性硬化和炎性肠病。
123.权利要求122所述的方法,其中所述的炎性肠病是克罗恩氏病和溃疡性结肠炎中的至少一种。
124.权利要求115的方法,其中所述的炎症应答是对牛皮癣、过敏性鼻炎、硬皮病、自身免疫性甲状腺病、免疫介导的糖尿病和狼疮中的至少一种的应答。
125.权利要求115所述的方法,其中所述的炎症应答是对重症肌无力和自身免疫性神经病中的至少一种的应答。
126.权利要求125所述的方法,其中所述的自身免疫性神经病是格-巴二氏神经病。
127.权利要求115所述的方法,其中所述的炎症应答是对至少一种下面病症的应答:自身免疫性葡萄膜炎、自身免疫性溶血性贫血、恶性贫血、自身免疫性血小板减少、颞动脉炎、抗磷脂综合症和血管炎。
128.权利要求127的方法,其中所述的血管炎是眶坏死性肉芽肿病。
129.权利要求115的方法,其中所述的炎症应答是对至少一种下面病症的应答:贝切特氏病、疱疹样皮炎、寻常天疱疮、白斑病、原发性胆汁性肝硬变、自身免疫性肝炎、自身免疫性卵巢炎、自身免疫性睾丸炎、肾上腺的自身免疫性疾病、多发性肌炎、皮肌炎、脊椎关节病。
130.权利要求129的方法,其中所述的脊椎关节病是强直性脊柱炎。
131.权利要求115的方法,其中所述的炎症应答是对至少舍格伦综合症的应答。
132.权利要求115的方法,其中所述的炎症应答是急性炎症、变应性炎症和慢性炎症中的至少一种。
133.用于在患者中治疗或预防H4受体-介导的病症的方法,包含给予该患者一种药物组合物,所述的药物组合物包含治疗有效量的至少一种选自权利要求1所述化合物的H4受体调节剂。
134.调节H4受体的方法,包括将H4受体暴露于至少一种选自权利要求1所述化合物的调节剂中。
135.权利要求134的方法,其中所述的调节剂是H4受体拮抗剂。
136.权利要求134的方法,其中所述的调节剂是H4受体部分激动剂。
137.在患者中用于抑制白细胞募集的方法,包括给予所述患者一种药物组合物,所述的药物组合物包含治疗有效量的至少一种选自权利要求1所述化合物的白细胞募集抑制剂。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US50723603P | 2003-09-30 | 2003-09-30 | |
| US60/507,231 | 2003-09-30 | ||
| PCT/US2004/031855 WO2005044807A2 (en) | 2003-09-30 | 2004-09-29 | Benzoimidazole compounds |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1886380A true CN1886380A (zh) | 2006-12-27 |
| CN1886380B CN1886380B (zh) | 2010-12-22 |
Family
ID=38952593
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2004800354157A Expired - Fee Related CN1886380B (zh) | 2003-09-30 | 2004-09-29 | 苯并咪唑化合物 |
Country Status (21)
| Country | Link |
|---|---|
| US (10) | US7432378B2 (zh) |
| EP (1) | EP1673348B1 (zh) |
| JP (1) | JP2007508011A (zh) |
| KR (1) | KR20060097024A (zh) |
| CN (1) | CN1886380B (zh) |
| AR (1) | AR045955A1 (zh) |
| AT (1) | ATE427303T1 (zh) |
| AU (1) | AU2004286933B2 (zh) |
| BR (1) | BRPI0414918A (zh) |
| CA (1) | CA2540704A1 (zh) |
| DE (1) | DE602004020364D1 (zh) |
| ES (1) | ES2323178T3 (zh) |
| HR (1) | HRP20060126A2 (zh) |
| IL (1) | IL174677A0 (zh) |
| NO (1) | NO20061950L (zh) |
| NZ (1) | NZ546259A (zh) |
| PT (1) | PT1673348E (zh) |
| RU (1) | RU2006110561A (zh) |
| TW (1) | TW200526637A (zh) |
| WO (1) | WO2005044807A2 (zh) |
| ZA (1) | ZA200603411B (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112119069A (zh) * | 2018-05-22 | 2020-12-22 | 日本农药株式会社 | 苯并咪唑化合物或其盐类和含有该化合物的用于农业园艺的杀虫杀螨剂以及其使用方法 |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2323178T3 (es) * | 2003-09-30 | 2009-07-08 | Janssen Pharmaceutica Nv | Compuestos de benzoimidazol. |
| JP5162236B2 (ja) * | 2004-03-25 | 2013-03-13 | ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ | イミダゾール化合物 |
| US7250427B2 (en) | 2004-06-30 | 2007-07-31 | Janssen Pharmaceutica, N.V. | Aryl-substituted benzimidazole and imidazopyridine ethers |
| CN101248051B (zh) | 2005-05-26 | 2013-07-17 | 泰博特克药品有限公司 | 制备4-[(1,6-二氢-6-氧代-2-嘧啶基)氨基]苯基氰的方法 |
| EP2308840A1 (en) * | 2005-06-30 | 2011-04-13 | Prosidion Limited | GPCR agonists |
| EP1954287B2 (en) † | 2005-10-31 | 2016-02-24 | Merck Sharp & Dohme Corp. | Cetp inhibitors |
| GB0525068D0 (en) | 2005-12-08 | 2006-01-18 | Novartis Ag | Organic compounds |
| JPWO2007069565A1 (ja) * | 2005-12-12 | 2009-05-21 | 小野薬品工業株式会社 | 二環式複素環化合物 |
| ES2348829T3 (es) * | 2006-03-31 | 2010-12-15 | Janssen Pharmaceutica Nv | Benzimidazol-2-il-pirimidinas y pirazinas moduladoras del receptor h4 de histamina. |
| ES2349237T3 (es) * | 2006-03-31 | 2010-12-29 | Janssen Pharmaceutica Nv | Benzoimidazol-2-il pirimidinas como moduladores del receptor de histamina h4. |
| WO2007120690A2 (en) * | 2006-04-10 | 2007-10-25 | Janssen Pharmaceutica N.V. | Combination histamine h1r and h4r antagonist therapy for treating pruritus |
| FR2903311B1 (fr) * | 2006-07-10 | 2012-06-15 | Centre Nat Rech Scient | Utilisation de ligands du recepteur h4 de l'histamine pour proteger les progeniteurs hematopoietiques contre la toxicite hematologique des agents chimiotherapeutiques |
| US7985745B2 (en) | 2006-10-02 | 2011-07-26 | Abbott Laboratories | Method for pain treatment |
| US8084466B2 (en) | 2007-12-18 | 2011-12-27 | Janssen Pharmaceutica Nv | Bicyclic heteroaryl-substituted imidazoles as modulators of the histamine H4 receptor |
| EP2077263A1 (en) | 2008-01-02 | 2009-07-08 | Vereniging voor christelijk hoger onderwijs, wetenschappelijk onderzoek en patiëntenzorg | Quinazolines and related heterocyclic compounds and their therapeutic use |
| AU2009257486B2 (en) | 2008-06-12 | 2015-01-22 | Janssen Pharmaceutica Nv | Use of histamine H4 antagonist for the treatment of post-operative adhesions |
| KR20110022721A (ko) | 2008-06-30 | 2011-03-07 | 얀센 파마슈티카 엔.브이. | 벤조이미다졸-2-일 피리미딘 유도체의 제조 방법 |
| US9371311B2 (en) | 2008-06-30 | 2016-06-21 | Janssen Pharmaceutica Nv | Benzoimidazol-2-yl pyrimidine derivatives |
| EP2350032B1 (en) | 2008-09-26 | 2016-05-25 | Eisai R&D Management Co., Ltd. | Benzoxazole compounds and methods of use |
| BRPI0919816A2 (pt) * | 2008-09-26 | 2019-09-24 | Eisai R&D Man Co Ltd | uso compostos benzoxazólicos no tratamento de malária |
| EP2201982A1 (en) | 2008-12-24 | 2010-06-30 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Histamine H4 receptor antagonists for the treatment of vestibular disorders |
| US8349852B2 (en) | 2009-01-13 | 2013-01-08 | Novartis Ag | Quinazolinone derivatives useful as vanilloid antagonists |
| IT1395137B1 (it) * | 2009-08-05 | 2012-09-05 | Spider Biotech S R L | Nuovi peptidi antipatogeni |
| TW201111378A (en) | 2009-09-11 | 2011-04-01 | Bayer Schering Pharma Ag | Substituted (heteroarylmethyl) thiohydantoins |
| AR080056A1 (es) | 2010-02-01 | 2012-03-07 | Novartis Ag | Derivados de ciclohexil-amida como antagonistas de los receptores de crf |
| US20120295942A1 (en) | 2010-02-01 | 2012-11-22 | Nicholas James Devereux | Pyrazolo[5,1b]oxazole Derivatives as CRF-1 Receptor Antagonists |
| CN102753527B (zh) | 2010-02-02 | 2014-12-24 | 诺华股份有限公司 | 用作crf受体拮抗剂的环己基酰胺衍生物 |
| EP2447263A1 (en) | 2010-09-27 | 2012-05-02 | Bioprojet | Benzazole derivatives as histamine H4 receptor ligands |
| AR086554A1 (es) | 2011-05-27 | 2014-01-08 | Novartis Ag | Derivados de la piperidina 3-espirociclica como agonistas de receptores de la ghrelina |
| DE102011122420B4 (de) | 2011-12-24 | 2016-07-28 | Volkswagen Aktiengesellschaft | Verfahren zur Feststellung der Spannungsfreiheit in einem elektrischen Hochvolt-System und ein elektrisches Hochvolt-System |
| KR20150003771A (ko) | 2012-05-03 | 2015-01-09 | 노파르티스 아게 | 그렐린 수용체 효능제로서의 2,7-디아자-스피로[4.5]데스-7-일 유도체의 l-말레이트 염 및 그의 결정질 형태 |
| EP2671870A1 (en) * | 2012-06-05 | 2013-12-11 | Bioprojet | Novel (aza)benzhydryl ether derivatives, their process of preparation and their use as H4-receptor ligands for therapeutical applications |
| US9688989B2 (en) | 2012-06-08 | 2017-06-27 | Sensorion | H4 receptor inhibitors for treating tinnitus |
| ES2773543T3 (es) | 2013-03-06 | 2020-07-13 | Janssen Pharmaceutica Nv | Benzoimidazol-2-ilpirimidinas moduladores del receptor de histamina H4 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2587029B1 (fr) * | 1985-09-11 | 1987-10-30 | Synthelabo | Derives de benzimidazole, leur preparation et leur application en therapeutique |
| AU4054197A (en) * | 1996-08-14 | 1998-03-06 | Warner-Lambert Company | 2-phenyl benzimidazole derivatives as mcp-1 antagonists |
| KR20010100977A (ko) * | 1998-11-03 | 2001-11-14 | 스타르크, 카르크 | 치환된 2-페닐벤즈이미다졸, 그의 제조 및 그의 용도 |
| DE19920936A1 (de) * | 1999-05-07 | 2000-11-09 | Basf Ag | Heterozyklisch substituierte Benzimidazole, deren Herstellung und Anwendung |
| EP1373204B1 (en) | 2001-03-09 | 2016-10-26 | Janssen Pharmaceuticals, Inc. | Heterocyclic compounds |
| ES2323178T3 (es) * | 2003-09-30 | 2009-07-08 | Janssen Pharmaceutica Nv | Compuestos de benzoimidazol. |
-
2004
- 2004-09-29 ES ES04816894T patent/ES2323178T3/es not_active Expired - Lifetime
- 2004-09-29 AR ARP040103534A patent/AR045955A1/es not_active Application Discontinuation
- 2004-09-29 WO PCT/US2004/031855 patent/WO2005044807A2/en active Application Filing
- 2004-09-29 PT PT04816894T patent/PT1673348E/pt unknown
- 2004-09-29 DE DE602004020364T patent/DE602004020364D1/de not_active Expired - Lifetime
- 2004-09-29 CN CN2004800354157A patent/CN1886380B/zh not_active Expired - Fee Related
- 2004-09-29 AT AT04816894T patent/ATE427303T1/de not_active IP Right Cessation
- 2004-09-29 TW TW093129453A patent/TW200526637A/zh unknown
- 2004-09-29 EP EP04816894A patent/EP1673348B1/en not_active Expired - Lifetime
- 2004-09-29 CA CA002540704A patent/CA2540704A1/en not_active Abandoned
- 2004-09-29 AU AU2004286933A patent/AU2004286933B2/en not_active Ceased
- 2004-09-29 US US10/952,989 patent/US7432378B2/en active Active
- 2004-09-29 KR KR1020067008435A patent/KR20060097024A/ko not_active Application Discontinuation
- 2004-09-29 BR BRPI0414918-1A patent/BRPI0414918A/pt not_active IP Right Cessation
- 2004-09-29 JP JP2006534031A patent/JP2007508011A/ja active Pending
- 2004-09-29 RU RU2006110561/04A patent/RU2006110561A/ru not_active Application Discontinuation
- 2004-09-29 NZ NZ546259A patent/NZ546259A/en unknown
-
2006
- 2006-03-30 IL IL174677A patent/IL174677A0/en unknown
- 2006-03-30 HR HR20060126A patent/HRP20060126A2/xx not_active Application Discontinuation
- 2006-04-28 ZA ZA200603411A patent/ZA200603411B/en unknown
- 2006-05-02 NO NO20061950A patent/NO20061950L/no not_active Application Discontinuation
-
2008
- 2008-08-26 US US12/229,886 patent/US7723527B2/en not_active Expired - Lifetime
- 2008-08-26 US US12/229,781 patent/US7723526B2/en not_active Expired - Lifetime
- 2008-08-26 US US12/229,890 patent/US7723359B2/en not_active Expired - Lifetime
- 2008-08-26 US US12/229,888 patent/US7705143B2/en not_active Expired - Lifetime
- 2008-08-26 US US12/229,891 patent/US20090281307A1/en not_active Abandoned
- 2008-08-26 US US12/229,892 patent/US7662966B2/en not_active Expired - Lifetime
- 2008-08-26 US US12/229,779 patent/US20090270611A1/en not_active Abandoned
- 2008-08-26 US US12/229,882 patent/US7705149B2/en not_active Expired - Lifetime
- 2008-10-23 US US12/257,362 patent/US20090247508A1/en not_active Abandoned
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112119069A (zh) * | 2018-05-22 | 2020-12-22 | 日本农药株式会社 | 苯并咪唑化合物或其盐类和含有该化合物的用于农业园艺的杀虫杀螨剂以及其使用方法 |
| CN112119069B (zh) * | 2018-05-22 | 2023-10-03 | 日本农药株式会社 | 苯并咪唑化合物或其盐类和含有该化合物的用于农业园艺的杀虫杀螨剂以及其使用方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1886380A (zh) | 苯并咪唑化合物 | |
| CN1230431C (zh) | 用作类胰蛋白酶抑制剂的芳基甲胺衍生物 | |
| CN1240699C (zh) | 与趋化因子有关的疾病的治疗或预防药物 | |
| CN1239485C (zh) | 作为IL-1β和TNF-α抑制剂的二苯酮类 | |
| CN1229343C (zh) | 趋化因子受体活性调节剂 | |
| CN1161352C (zh) | 喹唑啉衍生物 | |
| CN1144786C (zh) | 作为蛋白质酪氨酸激酶抑制剂的取代的3-氰基喹啉 | |
| CN1167422C (zh) | 用作血管生成抑制剂的喹唑啉衍生物 | |
| CN1668610A (zh) | 苯基-[4-(3-苯基-1h-吡唑-4-基)-嘧啶-2-基]-胺衍生物 | |
| CN1350534A (zh) | 作为整联蛋白拮抗剂的取代双环杂芳基化合物 | |
| CN1309720C (zh) | 哌嗪化合物 | |
| CN1993349A (zh) | 作为erbb受体酪氨酸激酶的喹唑啉衍生物 | |
| CN1909907A (zh) | 喹啉衍生物及其作为分枝杆菌抑制剂的用途 | |
| CN101031559A (zh) | 氨基环脲衍生物和其制法及作为激酶抑制剂的医药用途 | |
| CN1553899A (zh) | 抑制肝细胞生长因子受体自磷酸化的喹啉衍生物和喹唑啉衍生物以及含有这些化合物的药物组合物 | |
| CN1856476A (zh) | 异喹啉酮钾通道抑制剂 | |
| CN1660815A (zh) | 环胺衍生物及其作为药物的用途 | |
| CN1633294A (zh) | 2,4,5-三取代噻唑衍生物和它们的抗炎活性 | |
| CN1930144A (zh) | 可用作细胞因子产生抑制剂用于治疗慢性炎性疾病的3,4’-杂环基-1,2,3-三唑-1-基-n-芳基苯甲酰胺 | |
| CN1993347A (zh) | 钾通道抑制剂 | |
| CN1246856A (zh) | 芳基和杂芳基取代的稠合吡咯抗炎药 | |
| CN1741999A (zh) | 用作GSK-3β抑制剂的哒嗪酮衍生物 | |
| CN1930126A (zh) | 吡啶酮衍生物 | |
| CN1444573A (zh) | 甲酰胺化合物及其作为人11cby受体拮抗剂的用途 | |
| CN1248259A (zh) | 稠合的哒嗪衍生物、其生产方法和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20101222 Termination date: 20210929 |