CN1813059A - 固相细胞裂解和捕获平台 - Google Patents
固相细胞裂解和捕获平台 Download PDFInfo
- Publication number
- CN1813059A CN1813059A CNA2004800181938A CN200480018193A CN1813059A CN 1813059 A CN1813059 A CN 1813059A CN A2004800181938 A CNA2004800181938 A CN A2004800181938A CN 200480018193 A CN200480018193 A CN 200480018193A CN 1813059 A CN1813059 A CN 1813059A
- Authority
- CN
- China
- Prior art keywords
- container
- host cell
- lytic reagent
- capture ligands
- internal surface
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/06—Lysis of microorganisms
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M1/00—Apparatus for enzymology or microbiology
- C12M1/40—Apparatus specially designed for the use of free, immobilised, or carrier-bound enzymes, e.g. apparatus containing a fluidised bed of immobilised enzymes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/36—Extraction; Separation; Purification by a combination of two or more processes of different types
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M1/00—Apparatus for enzymology or microbiology
- C12M1/26—Inoculator or sampler
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M47/00—Means for after-treatment of the produced biomass or of the fermentation or metabolic products, e.g. storage of biomass
- C12M47/06—Hydrolysis; Cell lysis; Extraction of intracellular or cell wall material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
- C12N15/1006—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor by means of a solid support carrier, e.g. particles, polymers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
- C12N15/1017—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor by filtration, e.g. using filters, frits, membranes
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Analytical Chemistry (AREA)
- Plant Pathology (AREA)
- Medicinal Chemistry (AREA)
- Crystallography & Structural Chemistry (AREA)
- Physics & Mathematics (AREA)
- Sustainable Development (AREA)
- Mycology (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
本发明提供了涉及从宿主细胞提取或提取和分离细胞组分的容器、方法和试剂盒。更具体地,本发明容器包含口、包含侧壁结构和底部的内表面、体积、裂解试剂;和在一些情况中,受支持的捕获配体。还提供了使用本文描述的容器从宿主细胞提取或提取和分离细胞组分的方法和试剂盒。
Description
发明背景
本发明涉及从宿主细胞分离细胞组分,如多肽和核酸。
重组DNA技术的最近进展使得可能在宿主细胞中产生大量肽。然而,从宿主细胞提取和分离靶肽、蛋白质、核酸或者其他细胞组分到目前仍然是多步骤方法,包括首先裂解,然后一个或多个随后步骤用以从其他细胞组分分离靶产物。
多种技术已经用于裂解细胞,每种技术都具有某些优点和缺点。例如,已经使用了超声处理、弗氏压碎器、匀浆、研磨、冷冻-解冻裂解,和多种其他物理或机械裂解细胞的方法;参见,例如,Bollag & Edelstein,ProteinExtraction,Protein Methods,27-43(1993);Schutte & Kula,Biotech.andApp.Biochem.,12:559-620(1990);和Hughes,等人,Methods inMicrobiology,5B:1-54(1969)。然而,机械裂解需要可能不易得到的专门设备,此外,超声处理也产生热,其对于某些蛋白质是有害的。酶和去污剂也已经用于酶促或化学地裂解细胞;见,例如,Hughes,等人,Methodsin Microbiology,5B:1-54;Andrews & Asenjo,Trends in Biotech.,5:273-77(1987);Wiseman,Process Biochem.,63-65(1969);和Wolska-Mitaszko,等人,Analytical Biochem.,116:241-47(1981)。
然而,酶或者去污剂溶液的加入导致含有待裂解细胞的溶液的稀释,此外,所希望的产物必须仍然与所得膜碎片、不希望的蛋白质和其他细胞残渣分离。
类似地,多种亲和捕获方法已经用于纯化肽、蛋白质和核酸。美国专利号4,569,794、5,310,663和5,594,115描述了包括组氨酸残基的金属螯合肽的用途,和所述肽在蛋白质纯化中的用途。美国专利号4,703,004、4,851,341、5,011,912和6,461,154描述了抗原性FLAG肽,和含有所述肽的蛋白质的纯化。美国专利号5,654,176描述了谷胱甘肽-S-转移酶用于纯化蛋白质的用途。美国专利号5,998,155描述了抗生物素蛋白/生物素捕获系统的用途。在每一种这些实例中,靶产物上的亲和标记或者序列与相应配体的相互作用导致靶产物的“捕获”。然后可以洗除未结合的组分和其他细胞残渣,留下结合到标记-或者序列-特异配体的靶产物。然后用特定洗脱剂释放结合的靶产物,导致纯化的靶产物。
不利地,与首先裂解宿主细胞然后纯化靶产物有关的多个步骤增加了分离产物,特别是高通量应用中分离产物所需的成本和时间。
发明概述
因此,在本发明的多个方面,提供了裂解细胞和捕获肽、蛋白质、核酸或者其他细胞组分的相对快速、有效的方法。有利地,本发明的方法和容器不需要离心细胞溶液以除去可溶的材料、在额外的去污剂裂解液体或者酶抑制剂中吹吸(pipette)(从而稀释原来的含有细胞的溶液),或者进行随后的纯化步骤。
因此,简言之,本发明涉及从宿主细胞提取细胞组分的容器。所述容器含有口、内表面,和至少一部分内表面上裂解试剂的涂层(coating),其中当含有宿主细胞的液体悬浮物导入容器中时,涂层中裂解试剂的量足够形成能够裂解宿主细胞的裂解溶液。在一个实施方案中,经涂布的内表面的面积与容器的体积之比小于约4mm2/μl。
另一方面,本发明涉及用于从宿主细胞提取和分离细胞组分的容器。该容器含有口、内表面、体积、裂解试剂和受支持的捕获配体。口作为向容器导入液体的入口和从容器除去液体的出口,捕获配体在容器中的一个位置受到支持,当含有完整宿主细胞或者固体细胞组分的液体悬浮物通过容器口导入容器时,所述位置允许捕获配体接触完整宿主细胞或者从其来源的固体细胞组分。
另一方面,本发明涉及用于从宿主细胞提取细胞组分的多孔板,其中多孔板的至少一个孔含有裂解试剂。裂解试剂(i)涂在孔的至少一部分内表面上,或者(ii)为孔中所含的材料块的形式。
另一方面,本发明涉及从宿主细胞提取细胞组分的方法。该方法包括(a)将含有宿主细胞的液体悬浮物导入容器,所述容器具有口、内表面、体积、至少一部分内表面上的裂解试剂涂层,经涂布的内表面的面积与容器的体积之比小于约4mm2/μl,和(b)裂解容器中的宿主细胞以释放细胞组分和形成细胞残渣。
另一方面,本发明涉及从宿主细胞提取和分离细胞组分的方法。该方法包括(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积、裂解试剂,和受支持的捕获配体,其中口作为导入液体的入口和从容器除去液体的出口,(b)裂解容器中的宿主细胞以释放细胞组分和形成固态细胞残渣;和(c)在固态细胞残渣存在下用捕获配体捕获细胞组分。
在另一方面,本发明涉及从宿主细胞提取和分离细胞组分的方法。该方法包括(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积、裂解试剂,和受支持的捕获配体,其中口作为向容器导入液体的入口,(b)裂解容器中的宿主细胞以释放细胞组分和形成固态细胞残渣;(c)在固态细胞残渣存在下用捕获配体捕获细胞组分;(d)从捕获配体释放细胞组分,和(e)回收释放的细胞组分。
另一方面,本发明涉及用于从宿主细胞提取和分离细胞组分的试剂盒。该试剂盒包含本发明的容器,和从宿主细胞提取和分离细胞组分的使用说明。在另一实施方案中,该试剂盒还含有用于从宿主细胞提取和/或分离细胞组分的额外试剂,和/或用于测定或检测捕获的细胞组分的试剂。
另一方面,本发明涉及制备用于从宿主细胞提取细胞组分的容器的方法,该方法包括将容器的内表面与含有裂解试剂的液体接触并干燥液体以在容器的内表面上形成裂解试剂的吸附层。
本发明的其他目标和特征将部分在下文中是显然的,部分在下文中指出。
附图简述
图1描绘了从HIS-SelectTM高容量板洗脱的物质的SDS-PAGE凝胶图像。裂解试剂在板的表面上干燥并加入0.1ml细胞。每个泳道的含量在表1中描述。该图表明在粗裂解细胞的存在下蛋白质可以结合到板。在这些条件下可以结合增量蛋白质并用不同试剂洗脱。
图2描绘了从HIS-SelectTM高容量板洗脱的物质的SDS-PAGE凝胶图像。将裂解试剂(0.05ml)在板表面上干燥,并向每孔加入0.1ml细胞或者纯蛋白质。表3中描述了每个泳道的含量。该图表明存在和不存在粗裂解细胞时可以结合蛋白质。可以在这些条件下结合和洗脱增量蛋白质。
图3描绘了从HIS-SelectTM高容量板洗脱的物质的SDS-PAGE凝胶图像。将裂解试剂(0.1ml)在板表面上干燥,并向每孔加入0.1ml细胞或者纯蛋白质。表3中描述了每个泳道的含量。该图表明存在和不存在粗裂解细胞时可以结合蛋白质。可以在这些条件下结合和洗脱增量蛋白质。
图4描绘了使用ANTI-FLAGM2高灵敏性板,来自酶免疫检测测定的校正吸收(A450)读数。图上具条纹的条形代表具有DYKDDDDK(SEQ.ID.NO.1)标记的蛋白质的结果;具有水平线的条形代表具有DYKDDDDK(SEQ.ID.NO.1)/his标记的蛋白质的结果;白色条形代表具有his-标记的蛋白质的结果。所用的裂解试剂在实施例4中描述,并通过字母A-H在图上表示。
图5描绘了使用HIS-SelectTM高容量板,来自酶免疫检测测定的校正吸收(A450)读数。图上具条纹的条形代表具有DYKDDDDK(SEQ.ID.NO.1)标记的蛋白质的结果;具有水平线的条形代表具有DYKDDDDK(SEQ.ID.NO.1)/his标记的蛋白质的结果;白色条形代表具有his-标记的蛋白质的结果。所用的裂解试剂在实施例4中描述,并通过字母A-H在图上表示。
图6描绘从HIS-SelectTM容量板洗脱的物质的SDS-PAGE凝胶图像。将裂解试剂、处理试剂和酶的多种组合在HIS-SelectTM高容量板表面上干燥,并加入含有靶蛋白的细胞。表6中描述了每个泳道的含量。该图表明多种裂解试剂能够裂解细胞,并且从HIS-SelectTM高容量板成功捕获和洗脱靶蛋白。
图7描绘了本发明的容器。
优选实施方案的详细描述
1.容器
通常,本发明的容器适于容纳液体,该容器包含底部、口和侧壁结构(sidewall formation)。在一个实施方案中,侧壁结构可以具有任意多种几何形状;例如,在本实施方案中,侧壁结构可以是圆柱状、多边形、锥形或者凹形(例如,半球形)。类似地,在一个实施方案中,底部可以具有任意多种几何形状,例如,在本实施方案中,底部可以是平的、曲线形或者甚至含有一个点(例如,倒置圆锥的最低点)。口作为开口,液体可以通过其导入容器;在一个实施方案中,口和底部可以是侧壁结构的相反末端,口由侧壁结构顶部的开口定义。因此,在其多种实施方案中,容器可以是圆柱、烧瓶、罐、杯、管瓶、瓶子、柱形或者甚至表面凹陷状。此外,所述容器可以是一个独立式的容器,或者其可以是许多物理上结合的容器之一。因此,在一个实施方案中,容器为单一多孔板的一个孔,所述多孔板为诸如48孔、96孔、384孔、1536孔等多孔板。而且,容器可以具有永久密闭的底部或者底部可以包含带阀门或者有盖的开口,液体可以任选通过所述开口除去。
用于提取或提取和亲和捕获肽、蛋白质、核酸或者其他细胞组分的容器可以为多种尺寸并且不需要含有大体积液体。通常,容器将容纳小于50L的体积。在一个实施方案中,容器将容纳不多于1L但是不小于1.0μl的体积。在另一实施方案中,容器将容纳约10μl到约100ml体积。
包含侧壁结构和底部的容器的内表面限定了容器的液体容量。在一个实施方案中,容器的内表面限定的表面积与内表面限定的体积之比小于约4mm2/μl。在另一实施方案中,容器的内表面限定的表面积和体积的比不超过约3mm2/μl。在另一实施方案中,容器的内表面限定的表面积和体积的比不超过约2mm2/μl。在另一实施方案中,容器的内表面限定的表面积和体积的比不超过约1mm2/μl。
根据计划的用途和操作人员的偏爱,容器可以任选密封。因此,在一个实施方案中,容器含有盖子和帽子,其套在口上以将容器的内含物与周围环境隔离。在另一实施方案中,容器的顶部对环境是开放的。从而,例如,当容器是多孔板形式时,(i)每个孔可以由单独的盖子(例如,塑料盖包装材料)密封,(ii)可以通过共同的盖子密封一部分和多个孔,留下剩余部分的孔对周围环境开放,(iii)通过共同的盖子密封所有孔,或者(iv)所有孔都可以对周围环境开放。此外,盖子可以含有用于向容器导入液体的单个口,或者其可以含有用于向容器导入或者导入和除去液体的多个口。在另一实施方案中,当容器的底部含有开口,通过该开口可以任选除去容器中的液体时,容器的口和底部可以都任选加盖。
通常,可以从多种天然或合成材料形成容器。例如,容器可以是塑料、硅、玻璃、金属、陶瓷、磁体、聚酯、聚苯乙烯、聚丙烯、聚乙烯、尼龙、聚丙烯酰胺、纤维素、硝酸纤维素、乳胶,等等。
2.捕获配体和产物纯化
一旦已经裂解宿主细胞,可以通过使用固定在容器中支持材料上的捕获配体从其他细胞残渣分离细胞组分。通过容器的内表面或者通过置于容器内、附着到容器或者其他方式保持在容器中的珠子或者其他支持体直接或间接支持捕获配体。在一个实施方案中,捕获配体位于容器的底部上面。在另一实施方案中,捕获配体位于侧壁结构上。在另一实施方案中,捕获配体位于容器的底部和侧壁结构上。在另一实施方案中,受支持的捕获配体位于容器中某一位置,该位置允许捕获配体暴露于可以存在于容器中的完整宿主细胞或者从其来源的固体细胞组分。
有利地,本发明的试剂、组分和方法允许使用一系列捕获配体。在一个优选实施方案中,捕获配体能够分离含有细胞残渣的液体悬浮物中的细胞组分。
用于纯化蛋白质、肽、DNA、RNA或其他细胞组分的多种技术是本领域熟知的,并且可以与本文描述的容器和方法联合使用。见,例如,Becker,等人,Biotech.Advs.,1:247-61(1983)。在一个实施方案中,可以使用任意捕获方法,只要裂解试剂的存在不干扰结合。例如,蛋白质纯化的常用方法包括产生融合蛋白质,其含有靶蛋白和能够以高特异性结合亲和基质的亲和标记。从而,一方面,本发明的容器含有受支持的捕获配体,其能够以高特异性结合靶蛋白或者肽的亲和标记,从而导致靶蛋白或肽与其他蛋白质或者细胞残渣的分离。在一些情况中,靶蛋白或者肽天然地含有能够结合相应捕获配体的序列。在该情况中,蛋白质不必是重组的,只要存在能够结合靶蛋白或者肽的捕获配体。可以用于捕获蛋白质或者肽的熟知的亲和捕获系统的一些特定实例包括(i)金属螯合层析(例如,镍或者钴与组氨酸标记相互作用),(ii)免疫原性捕获系统,如使用抗原-抗体相互作用的捕获系统(例如,FLAG肽、c-myc标记、HA标记,等等),(iii)谷胱甘肽-S-转移酶(GST)捕获系统,和(iv)生物素-抗生物素蛋白/链霉抗生物素蛋白捕获系统。其他技术包括离子交换层析,包括阴离子和阳离子交换,以及疏水层析,和亲硫层析。也可以使用这些多种捕获方法的组合,如使用混合模式的层析。这些技术是常用于纯化蛋白质的一些技术。疏水层析、离子交换层析、和多种杂交技术,如利用对靶DNA或RNA特异的核苷酸序列的杂交技术,也通常用于纯化DNA和RNA。另一种常用的RNA捕获方法是聚(dT)。因为这些和其他捕获系统是本领域熟知的,所有它们仅在本文中简要描述。
固定化金属亲和层析(“IMAC”)使用蛋白质内某些残基对金属离子的亲和性纯化蛋白质。在IMAC中,将金属离子固定在固相支持体上,并用于捕获含有金属螯合肽的蛋白质。金属螯合肽可以在蛋白质中天然发生,或者蛋白质可以是重组蛋白质,其具有含有金属螯合肽的亲和标记。一些最常用的金属离子包括镍(Ni2+)、锌(Zn2+)、铜(Cu2+)、铁(Fe3+)、钴(Co2+)、钙(Ca2+)、铝(Al3+)、镁(Mg2+)、锰(Mn2+)和镓(Ga3+)。从而,在一个实施方案中,容器和/或支持体含有固定在其表面或者部分表面上的金属离子,其中金属离子选自镍(Ni2+)、锌(Zn2+)、铜(Cu2+)、铁(Fe3+)、钴(Co2+)、钙(Ca2+)、铝(Al3+)、镁(Mg2+)、锰(Mn2+)和镓(Ga3+)。优选地,金属离子是镍、铜、钴、或者锌。最优选地,金属离子是镍。
以这种方法可以纯化含有金属螯合肽的多种蛋白质。在一个实施方案中,金属螯合肽可以具有式His-X,其中X选自Gly、His、Tyr、Trp、Val、Leu、Ser、Lys、Phe、Met、Ala、Glu、Ile、Thr、Asp、Asn、Gln、Arg、Cys、和Pro,如在Smith,等人(1986)美国专利号4,569,794中更完整描述,将所述专利并入本文作为参考。金属螯合肽还可以具有式(His-X)n,其中X选自Asp、Pro、Glu、Ala、Gly、Val、Ser、Leu、Ile或Thr,n为3到6,如在Sharma,等人(1997)美国专利号5,594,115中更完整描述,将所述专利并入本文作为参考。在另一个实施方案中,金属螯合肽包括式(His)y的聚(His)标记,其中y为至少2-6,如在Dobeli,等人(1994)美国专利号5,310,663中更完整描述,将所述专利并入本文作为参考。金属螯合肽的其他实例将是本领域技术人员公知的。
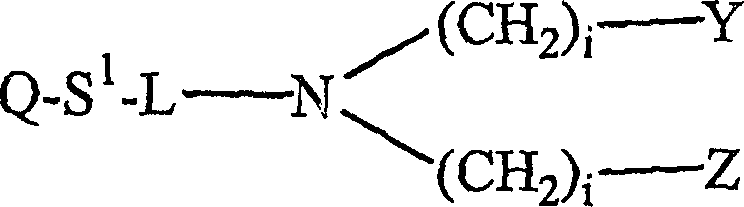
在一个实施方案中,捕获配体是如WO 01/81365中描述的金属螯合物。更具体地,在该实施方案中,捕获配体是来源于金属螯合物成分(1)的金属螯合物:
(I)
其中
Q是载体;
S1是间隔区(spacer);
L是-A-T-CH(X)-或-C(=O)-;
A是醚、硫醚、硒醚或者酰胺键;
T是键或者经取代或未经取代的烷基或者链烯基;
X是-(CH2)kCH3、-(CH2)kCOOH、-(CH2)kSO3H、-(CH2)kPO3H2、-(CH2)kN(J)2、或-(CH2)kP(J)2、优选-(CH2)kCOOH或-(CH2)kSO3H;
k为0到2的整数;
J为烃基或者取代烃基;
Y为-COOH、-H、-SO3H、-PO3H2、-N(J)2、或-P(J)2,优选-COOH;
Z为-COOH、-H、-SO3H、-PO3H2、-N(J)2或-P(J)2,优选-COOH;和
i为0到4的整数,优选1或2。
通常,载体Q可以包含能够衍生化以偶联的任意固态或者可溶材料或者化合物。固体(或者不可溶)载体可以选自琼脂糖、纤维素、异丁烯酸共聚物、聚苯乙烯、聚丙烯、纸、聚酰胺、聚丙烯腈、聚乙二烯、聚砜、硝酸纤维素、聚酯、聚乙烯、硅、玻璃、乳胶、塑料、金、氧化铁和聚丙烯酰胺,但是也可以是能够衍生化以允许组分的剩余部分偶联到载体Q的任意不溶或者固体化合物。可溶性载体包括蛋白质、核酸,包括DNA和RNA,和寡核苷酸、脂类、脂质体、合成的可溶性聚合物、蛋白质、聚氨基酸、白蛋白、抗体、酶、链霉抗生物素蛋白、肽、激素、生色染料、荧光染料、荧光染料或任意其他检测分子、药物、小有机化合物、多糖和任意其他可溶化合物,这些可溶性载体能够衍生化以允许组分的剩余部分偶联到载体Q。在一个实施方案中,载体Q是本发明的容器。在另一实施方案中,载体Q是本发明的容器内提供的物体。
载体侧翼的间隔区S1含有原子链,其可以是饱和或不饱和的,经取代或未取代的、线性或环状的、或者直链或分枝的。通常,限定间隔区S1的原子链由不超过约25个原子组成;换句话说,间隔区的主链由不超过25个原子组成。更优选地,限定间隔区S1的原子链由不超过约15个原子,更优选不超过约12个原子组成。限定间隔区S1的链原子通常选自碳、氧、氮、硫、硒、硅和磷,优选选自碳、氧、氮、硫和硒。此外,链原子可以用不同于氢的原子,如羟基、酮基(=O)或者酰基,如乙酰基取代或者是未取代的。从而,链可以任选包括烃基或者取代烃基区之间的一个或多个醚、硫醚、硒醚、酰胺或者胺键。代表性间隔区S1包括亚甲基、亚烷基氧基(-(CH2)aO-)、亚烷基硫醚(-(CH2)aS-)、亚烷基硒醚(-(CH2)aSe-)、亚烷基酰胺(-(CH2)aNR1C(=O)-)、亚烷基羰基(-(CH2)aC(=O)-),和它们的组合,其中a通常为1到约20,R1为氢或者烃基,优选烷基。在一个实施方案中,间隔区S1是亲水的中性结构并且不含有任何酰胺键或者取代基或者在多肽的纯化期间可以带电的其他键或者取代基。
如上面提到的,接头L可以是-A-T-CH(X)-或-C(=O)-。当L是-A-T-CH(X)-时,螯合成分相应于式:
其中Q、S1、A、T、X、Y和Z如前面定义。在该实施方案中,醚(-O-)、硫醚(-S-)、硒醚(-Se-)或酰胺(-NR1C(=O)-)或(-C(=O)NR1-)其中R1是氢或烃基)键通过取代或未取代的烷基或链烯基区与分子的螯合部分分开。如果T不是键,那么T优选是取代或未取代的C1到C6烷基或者取代或未取代的C2到C6链烯基。更优选地,A为-S-、T为-(CH2)n-,n为0到6,通常0到4的整数,更通常0、1或2。当L为-C(=O)-时,螯合成分相应于式:
其中Q、S1、i、Y和Z如前面定义。
在优选实施方案中,序列-S1-L-联合是不超过约35个原子的链,所述原子选自碳、氧、硫、硒、氮、硅和磷,更优选仅碳、氧、硫和氮,更优选仅碳、氧和硫。为了减小非特异结合的可能性,当存在氮时,其优选为酰胺部分形式。此外。如果碳链原子用氢之外的任何其他原子取代,它们优选用羟基或者酮基取代。在优选实施方案中,L含有来自氨基酸或者其酯如甲酯或乙酯的部分(有时称作片段或残基),所述氨基酸为例如,胱氨酸、同型胱氨酸、半胱氨酸、同型半胱氨酸、天冬氨酸、半胱磺酸。
代表性螯合物成分包括下面的:
其中Q为载体,Ac为乙酰基。
在另一实施方案中,捕获配体为美国专利号5,047,513中描述类型的金属螯合物。更具体地,在该实施方案中,捕获配体为式:
NH2-(CH2)x-CH(COOH)-N(CH2COOH)2
的氨三乙酸衍生物的金属螯合物。
其中x为2、3或4。在该实施方案中,氨三乙酸衍生物固定在任一种前述载体Q上。
在其中捕获配体为WO 01/81365或美国专利号5,047,513中描述的金属螯合物的这些实施方案中,金属螯合物优选含有选自镍(Ni2+)、锌(Zn2+)、铜(Cu2+)、铁(Fe3+)、钴(Co2+)、钙(Ca2+)、铝(Al3+)、镁(Mg2+)、锰(Mn2+)的金属离子。在尤其优选的实施方案中,金属螯合物含有镍(Ni2+)。
可用于本发明上下文中的另一种常规纯化技术是使用免疫原性捕获系统。在此类系统中,蛋白质或者肽上的表位标记允许基于表位标记对支持体上固定的相应配体(例如,抗体)的亲和力纯化附着的蛋白质。此类标记的一个实例是序列Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys或DYKDDDDK(SEQ.ID.NO.1);对该序列具有特异性的抗体由Sigma-Aldrich(St.Louis,MO)以FLAG商标出售;此类标记的另一个实例是序列Asp-Leu-Tyr-Asp-Asp-Asp-Asp-Lys,或DLYDDDDK(SEQ.ID.NO.2);对该序列具有特异性的抗体由Invitrogen(Carlsbad,CA)出售。此类标记的另一实例是3X FLAG序列Met-Asp-Tyr-Lys-Asp-His-Asp-Gly-Asp-Tyr-Lys-Asp-His-Asp-Ile-Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys(SEQ.ID.NO.3);对该序列具有特异性的抗体由Sigma-Aldrich(St.Louis,MO)出售。从而,在一个实施方案中,容器含有对SEQ.ID.NO.1具有特异性的固定化抗体;在另一实施方案中,容器含有对SEQ.ID.NO.2具有特异性的固定化抗体。在另一实施方案中,容器含有对SEQ.ID.NO.3具有特异性的固定化抗体。例如,在另一实施方案中,由Sigma-Aldrich(St.Louis,MO)出售的ANTI-FLAGM1、M2或M5抗体固定在该容器的内表面或者其一部分上,和/或容器内的珠子或者其他支持体上。
其他标记也可以基于它们对附着到基底的相应配体的亲和性用于纯化重组蛋白质。此类其他标记的一些实例包括c-myc、麦芽糖结合蛋白(MBP)、A型流感病毒血细胞凝集素(HA)和β-半乳糖苷酶等等。通过相应配体附着到本发明的容器和/或支持体,可以从其他蛋白质和细胞残渣纯化含有这些亲和标记的重组蛋白质,如本文描述。通过将对蛋白质或者肽序列或者该序列的部分具有亲和性的配体附着到本发明的容器和/或支持体,可以以类似方式纯化非重组蛋白质。适宜配体的选择在本领域技术人员能力之内。
在另一实施方案中,通过将含有谷胱甘肽-S-转移酶(GST)的蛋白质与固定化谷胱甘肽接触可以纯化所述蛋白质。由于GST对其底物的亲和力,蛋白质得到纯化。此类系统更完整地在例如,美国专利号5,654,176中描述,将所述专利并入本文作为参考。从而,在另一实施方案中,谷胱甘肽固定在该容器的内表面或者其一部分上,和/或容器内的珠子或者其他支持体上。
通过使用生物素或生物素类似物联合抗生物素蛋白、链霉抗生物素蛋白或者抗生物素蛋白或链霉抗生物素蛋白的衍生物也可以纯化蛋白质。例如,在一个实施方案中,当链霉抗生物素蛋白固定在本发明的容器和/或支持体上时,可以基于生物素对链霉抗生物素蛋白的亲和性纯化生物素标记的蛋白质。类似地,如美国专利号5,506,121(并入本文作为参考)描述的含有链霉抗生物素蛋白标记的蛋白质可以基于标记对链霉抗生物素蛋白的亲和性纯化。在另一实施方案中,当生物素固定在本发明的容器和/或固体支持体上时,可以基于生物素对抗生物素蛋白或链霉抗生物素蛋白的亲和性纯化含有抗生物素蛋白或链霉抗生物素蛋白标记的蛋白质。抗生物素蛋白/生物素或生物素/链霉抗生物素蛋白亲和纯化技术的使用是本领域熟知的,并且描述于例如,Sambrook和Russell,Molecular Cloning:A LaboratoryManual,第三版,Cold Spring Harbor Laboratory Press,Cold SpringHarbor,New York,2001。
使用离子交换层析或者疏水层析也可以纯化蛋白质和DNA或RNA。在离子交换层析中,固定在固相支持体上的带电颗粒可逆结合具有表面电荷的蛋白质或者DNA。例如,离子交换捕获配体可以含有氮基、羧基、磷酸基,或者磺酸基团。离子交换捕获配体的实例包括二乙基氨基乙基(DEAE)、二乙基[2-羟基丙基]氨基乙基(QAE)、羧基甲基(CM)和磺基丙基(SP)和磷酰基。在疏水层析中,基于与固定在固相支持体上的不可溶疏水基团的疏水相互作用纯化在表面具有疏水基团的蛋白质或者DNA。疏水配体的实例为硅、苯基、己基、辛基和C18基团。从而,在一个实施方案中,带电颗粒固定在本发明的容器和/或支持体的表面上。在另一实施方案中,不溶性疏水基团固定在本发明的容器和/或支持体的表面上。
其他适宜的捕获配体包括例如,激素、氨基酸、蛋白质、肽、多肽、凝集素、酶、酶底物、酶抑制剂、辅因子、核苷酸、寡核苷酸(例如,寡脱氧胸苷酸)、多核苷酸、糖、糖类、寡糖、药物和染料。
多种其他纯化技术是本领域公知的并且可以与本发明的容器和方法联合使用。一些此类技术在例如,Kenney & Fowell,Methods in MolecularBiology,卷11,Practical Protein Chromatography(1992);Hanson &Ryden,Protein Purification:Principles,High Resolution Methods,andApplications(1989);Dean,等人,Affinity Chromatography:A PracticalApproach(1987);Hermanson,等人,Immobilized Affinity LigandTechniques(1992);和Jakoby & Wilchek,Affinity Techniques,EnzymePurification,Part B,in Methods in Enzymology,卷34(1974)中描述。
一旦细胞组分结合到捕获配体,可以例如,通过使用水或缓冲液洗除细胞残渣。洗涤后,结合的细胞组分可以从其与捕获配体的结合释放并且除去用于表征或定量。靶细胞组分的释放可以使用多种洗脱技术完成,所述技术包括改变pH或温度,或者通过竞争结合。特定洗脱技术将根据所用的捕获系统而变,但是将对于本领域技术人员是显而易见的。备选地,当捕获的组分仍然附着到固定化配体时可以检测所述组分。多种分析技术是公知的,包括,例如,ELISA、酶分析,和蛋白质检测等等。
3.聚合物涂层
在一个实施方案中,捕获配体直接结合容器的内表面。备选地,捕获配体可以结合覆盖容器表面的聚合物基质。换句话说,捕获配体可以直接结合聚合物基质,其又结合或固定到容器的内表面上。例如,捕获配体可以是金属螯合成分,其结合到衍生化葡聚糖聚合物基质,所述基质覆盖聚苯乙烯或者其他塑料底质。从而,聚合物基质可以用于增加有效表面积(通过具有比下面的底质呈现更大表面积的基质),从而使得捕获配体的密度增加。备选地,或者额外地,聚合物基质可以比容器壁具有更大或更小疏水性从而呈现比基底的天然表面具有更大(或备选地更小)疏水性的表面。
通过多种方法可以形成或应用聚合物涂层。例如,通过原位聚合可以形成聚合物涂层;在该方法中,单体混合物溶于含有引发剂的溶剂中,激活后,在容器壁的表面上进行聚合。备选地,可以将完全生长的聚合物固定在容器壁的表面上。此类方法在例如,Sundberg等人,美国专利号5,624,711中描述。
在其中应用聚合物涂层的优选实施方案中,聚合物涂层来源于结合容器壁的两种聚合物的混合物。通常,一种或两种此类聚合物含有反应基,其受到活化时将含有此类反应基的聚合物分子化学地结合到容器壁和/或所述分子自身交联或与其他聚合物分子交联。此外,一种或两种此类聚合物可以含有可活化基团,其提供本文描述的捕获配体的附着点。此类聚合物涂层和它们的形成方法一般在美国专利申请公开号2003/0032013 A1中描述。
通过选择所用的具体聚合物和反应基的量可以控制基底上聚合物基质的密度。可以选择和调节反应基的数目和类型和捕获配体的数目和分子量,如下文详细描述。聚合物基质可以附着到基底的全部或者仅基底的一部分。例如,可以为容器壁的仅一部分或者多孔板壁的仅一部分孔提供聚合物基质。
从聚合物混合物形成的聚合物基质
通过将容器基底与含有具有重复单位的多种聚合物分子的聚合物组合物接触可以制备含有聚合物基质的容器,其中至少一些聚合物分子具有共价连接该分子的至少一种反应基,其中至少一些聚合物分子具有共价连接该分子的至少一种捕获配体(或者可激活基团),其中聚合物分子具有至少100kDa的平均分子量,并且其中至少25%的聚合物分子具有至少一种反应基和共价连接到所述分子的至少一种捕获配体。反应基经激活而将至少一些聚合物分子直接共价结合到容器基底和诱导聚合物分子之间交联形成附着到容器基底的聚合物基质。
通常,聚合物基质可以包括天然聚合物(或者其衍生物)、合成聚合物(或者其衍生物)、天然聚合物(或者其衍生物)的混合物、合成聚合物(或者其衍生物)的混合物、或者一种或多种天然聚合物(或者其衍生物)与一种或多种合成聚合物(或者其衍生物)的混合物。通常,天然聚合物是在生物系统中产生的分枝或线性聚合物。天然聚合物的实例包括,但不限于,寡糖、多糖、肽、蛋白质、糖原、葡聚糖、肝素、支链淀粉、直链淀粉、果胶、果胶多糖、淀粉、DNA、RNA和纤维素。可以使用的具体经修饰的天然聚合物为使用高碘酸氧化和还原性胺化或者本领域技术人员公知的其他方法将赖氨酸共价插入到葡聚糖分子的可变线性位置产生的葡聚糖-赖氨酸衍生物。相比,合成聚合物是人造分枝或者线性聚合物。合成聚合物的实例包括加成、缩合或者催化剂驱动的聚合反应,即缩合聚合产生的塑料、高弹体和粘合剂、寡聚物、均聚物和共聚物。不管是天然的或合成的,聚合物都可以通过氧化、或者共价附着光反应基、亲和配体、离子交换配体、疏水配体、其他天然或者合成聚合物,或者间隔区分子进行衍生或修饰。
从而,聚合物基质可以含有几种不同的聚合物类型的一种或多种。代表性聚合物包括,但不限于,基于纤维素的产物,如羟基乙基纤维素、羟基丙基纤维素、羧基甲基纤维素、乙酸纤维素和丁酸纤维素;丙烯酸类产物,如从丙烯酸羟基乙酯、异丁烯酸羟基乙酯、丙烯酸甘油酯、异丁烯酸甘油酯、丙烯酸、异丁烯酸、丙烯酰胺和甲基丙烯酰胺聚合的产物;基于乙烯基的产物,如聚乙烯吡咯烷酮和聚乙烯醇;尼龙,如聚己内酰胺、聚十二烷基内酰胺、聚己二酰己二胺和聚己二酰十二碳二胺;聚氨基甲酸酯;聚乳酸;线性多糖,如直链淀粉、葡聚糖、壳聚糖、肝素和透明质酸;和支链多糖,如支链淀粉、透明质酸和半纤维素。可以使用两种和多种不同聚合物分子的混合物。例如,在一个实施方案中,聚合物分子是葡聚糖和肝素的混合物。在另一实施方案中,葡聚糖与聚Lys-Gly(每20个甘氨酸一个赖氨酸)混合。
通常,聚合物分子优选具有至少100kDa的平均分子量(聚合物的总分子量,包括共价连接的官能团)。在一些实施方案中,聚合物分子具有300kDa到6,000kDa的平均分子量。在一些实施方案中,聚合物分子具有400kDa到3,000kDa的平均分子量。在另一实施方案中,聚合物分子具有500kDa到2,000kDa的平均分子量,其中平均分子量是使用多角度光散射和折射率检测,通过凝胶过滤层析测量的聚合物的重量平均摩尔质量(Mw)值。存在的所有链长度的聚合物分布的平均Mw基于通过折射率测量的峰的选择,开始和结束峰选择标准为折射率基线三倍的折射率值。如通过实例所示,优选的聚合物可以具有1,117kDa的Mw,分子量范围为112kDa到19,220kDa。
在一个实施方案中,通过固定化聚合物的混合物形成聚合物基质,其中混合物中的一部分聚合物分子含有捕获配体或者可活化基团,使得能够随后共价连接捕获配体,混合物中不同部分的聚合物分子具有共价连接到所述聚合物分子的至少一个反应基(用于将聚合物附着到容器壁和如前所述的交联)。聚合物分子之间反应基的相互作用使得形成三维基底。反应基热化学或光化学地反应(含有光反应基的聚合物称作被光标记)。
当聚合物分子具有共价连接的捕获配体(或者可活化基团)时,捕获配体(或者可活化基团)与聚合物重复单位的比优选分别为约1∶1捕获到约1∶100。例如,在一个实施方案中,捕获配体(或者可活化基团)与聚合物重复单位的比优选分别为约1∶1捕获到约1∶20。当聚合物分子具有共价连接的反应基时,反应基与聚合物重复单位的比优选小于约1∶600,更优选地,反应基与聚合物重复单位的比优选小于约1∶200。
代表性反应基包括,但不限于,用于制备层析介质的反应基,其包括:环氧化物、环氧乙烷、N-羟基琥珀酰亚胺、醛、肼、马来酰亚胺、硫醇、氨基、卤代烷、异硫氰酸酯、碳二亚胺、重氮化合物、tresyl chloride、甲苯磺酰氯,和三氯-S-三嗪。优选的反应基为α,β不饱和酮光反应性基团。代表性光反应性基团包括芳基叠氮化物、diazarenes、β-羰基重氮和二苯酮。反应性种类为氮宾、卡宾和基。这些反应性种类通常能形成共价键。优选的光反应基为光可激活的不饱和酮,如苯乙酮、二苯酮和它们的衍生物。光反应基当与光接触时能够被活化,并且能够共价连接到固体基底的表面。例如,通过暴露于约3焦耳/cm2到约6焦耳/cm2的紫外线可以活化光反应基,这取决于光的强度和暴露时间的长度。根据光源的强度,暴露时间可以为低至0.5秒/cm2到约32分钟/cm2。在优选实施方案中,光反应基通过暴露于约1000毫瓦/cm2到约5000毫瓦/cm2,或约1000毫瓦/cm2到约3000毫瓦/cm2,或约1500毫瓦/cm2到约2500毫瓦/cm2的光下0.5秒/cm2到约5秒/cm2受到激活。
在一个实施方案中,捕获配体和/或反应基通过间隔区共价附着到聚合物分子。当与聚合物基质的形成结合使用时,间隔区是分子或者共价结合的分子的组合,所述分子连接聚合物分子和一个或多个捕获配体或者反应基。间隔区可以与聚合物、聚合物组合物或者聚合物基质相同或不同。本领域技术人员将知道可以利用许多类型的间隔区并且其选择和用途取决于聚合物基质的计划的应用,例如,赖氨酸分子或者氨基己酸分子。
间隔区可以通过许多不同的化学(包括酰胺形成)共价附着到光反应基。例如,烃间隔区的使用极大地增强了聚合物基质稳定性性能。具有间隔区的光反应基可以通过酰胺键以相对于总单体——葡萄糖的受控制的比例偶联到优选的聚合物葡聚糖的伯胺部分。具有间隔区的光反应基的实例包括,但不限于,苯并苯甲酸氨基己酸、N-琥珀酰亚胺基-N’-(4-叠氮基-水杨基)-6-氨基己酸、N-琥珀酰亚胺基-(4-叠氮基-2-硝基苯基)-氨基丁酸,和N-琥珀酰亚胺基-(4-叠氮基-2-硝基苯基)-6-氨基己酸。这些具有间隔区的光反应基可以与聚合物反应产生包括赖氨酸的间隔区和附着到光反应基的最初间隔区。在附着含有或者不含有额外的间隔区的光反应基之前,通过掺入多种分子,如赖氨酸和氨基己酸也可以生产间隔区。共价附着聚合物分子的反应基的实例是含有通过损失氨基的活性氢结合到反应基的一个或多个化学实体的赖氨酸部分或残基的间隔区。在一个实施方案中,赖氨酸间隔区贡献的伯胺的密度代表所希望的捕获配体和反应基的密度。通过本领域公知的方法可以产生含有伯胺或者其他部分的经修饰的聚合物,所述其他部分为例如每1到100个聚合物重复单位1个部分的间隔区。修饰这些部分以选择性掺入目的量的反应基也是公知的。例如,赖氨酸间隔区贡献的伯胺的密度平均对于葡聚糖聚合物的每12个重复葡萄糖单位为1。该密度相对于光反应基的所希望的掺入是非常高的,所述所希望的掺入为例如,每200个重复单体小于1个光反应基。聚合物生产期间溶液中伯胺的浓度可以为4.5微摩尔/ml,而光反应基的所希望的掺入将代表0.09微摩尔/ml。因此,在该情况中,对于通过活性酯的所希望的光反应基掺入将有50倍过量伯胺。在胺的该浓度下,通过活性酯以所希望的掺入水平加入光反应基导致90%以上的掺入效率。通过改变含有活性酯的光反应基的量,可以始终如一地实现每200个单体小于1个反应基的任意掺入水平。将每个剩余间隔区部分或者胺有效转化成捕获配体附着点所需的方法是本领域公知的。数倍过量胺活性(例如活性酯)衍生试剂用于直接一步或者通过几步附着捕获配体。在一些情况中,衍生试剂将给出额外的反应基,其取决于其反应性,将支配随后的捕获配体附着的化学计量。当希望较低的配体密度时,将相应降低最初的胺活性衍生试剂。在一些情况中,将通常通过乙酰化衍生选择性修饰后剩余的游离胺。
涂布基底表面的第一步是将聚合物组合物与所要涂布的基底表面接触。用于将聚合物组合物与容器表面接触的方法取决于待涂布表面的尺寸和形状。可以从多种天然和合成材料,如上面列出的材料制备容器。容器表面可以在涂布前衍生。通过本领域技术人员公知的任意方法可以进行预衍生,所述方法包括硅石和玻璃的硅烷化和聚苯乙烯或聚丙烯的等离子体处理以掺入胺、羧基、醇、醛和其他反应基或者通过表面的化学修饰以改变其化学组成。
如果需要,可以化学修饰基底的表面以促进与聚合物分子上携带的反应基的共价结合。此类修饰包括用烃处理基底表面,或者用等离子体处理表面。化学修饰的阐明性实例是玻璃的硅烷化。在优选实施方案中,将MALDI板浸入1mg/mL石蜡膜(parafilm)溶于氯仿的1mg/ml溶液中并干燥。
当涂布大于0.1mm2的多孔板、管或者其表面或部分时,通过将聚合物组合物倒入、微量移液或者转移到待涂布的容器或者板的部分,例如孔中,可以将聚合物组合物与容器表面接触。备选地,通过将表面的部分浸入聚合物组合物的溶液中从而使容器表面与聚合物组合物接触,也可以涂布大于2mm2的待涂布板、管、容器表面或者支持体的部分。
通过改变加入基底的聚合物组合物浓度和体积可以调节或控制附着到容器表面的聚合物的量。一旦聚合物组合物与表面接触,可以在激活反应基前干燥容器表面上的聚合物组合物,例如,通过在黑暗中20-50℃下与气流孵育蒸发至干燥。通过使用冻干或者任意其他干燥方法,包括风干也可以蒸发聚合物组合物以除去溶剂。可以使用多种干燥方法,条件是干燥步骤不导致反应基的过早激活。当目测不到水分时认为基底足够干燥。干燥期间,聚合物组合物的聚合物分子自身定向以便与基底表面结合或者相互作用以促进与聚合物组合物的其他聚合物之间或者内部交联。
然后处理干燥的经涂布的固体表面以诱导反应基共价结合基底。对于光反应基,它们可以通过照射激活。激活是应用外部刺激导致反应基结合基底。具体地,在基底和反应基之间形成共价键,例如,碳-碳键形成。
有许多紫外照射系统能够递送光活化聚合物与富含烃的基底结合所需的总能量(以焦耳测量的剂量)。通过水银灯可以提供照射,水银灯具有明显和公知的照射波长模式。照射的强度需要焦耳在3-6焦耳/cm2内。焦耳测量包括时间因子(1焦耳=瓦×秒)。在一个实施方案中,通过无电极的水银灯提供照射,该水银灯通过微波辐射供能。一个六英寸的500瓦/英寸灯具有2,500毫瓦/cm2的额定功率输出,其在灯与基底约2英寸距离下在UVA范围内测量。该灯可以以80%功率或者约2,000毫瓦/cm2成功运行。用标准低强度UV照射盒制备的样品板具有测量为约9.0毫瓦/cm2的照射强度(UVA/UVB,约250到350nm),并且需要大于10焦耳/cm2(10,000毫焦耳)的总能量来提供良好的结合。这需要样品板在照射盒中孵育20分钟以上。使用无电极水银灯(2,000毫瓦/cm2)照射系统处理的板对于3.5焦耳/cm2的总能量剂量仅需要1.75秒/cm2。更高强度的照射更有效地激活光活性基并因此需要更低的总能量剂量。
在一个实施方案中,可以用9.0毫瓦/cm2的UVA/UVB光照射约30分钟,总能量约15,000毫焦耳/cm2进行激活。在优选实施方案中,可以用2,000毫瓦/cm2的UVA/UVB光照射至总能量约3焦耳/cm2到约3焦耳/cm2进行激活。孵育时间量和所用的总能量可以根据结合聚合物的光反应基而变。在最优选的实施方案中,通过使用Fusion UV Conveyor System使用水银无电极灯以2,000毫瓦/cm2,以运输带设置为8英尺/分钟和400瓦/英寸的灯功率可以通过光照射进行激活。辐射计IL290 Light Bug通过传输带运行以证实所希望的能量为3000到4000毫焦耳/cm2范围内。多孔板例如,以约800个板/小时或者约1个板/4到5秒进行光照射。
通过改变每毫升溶剂总聚合物的量可以调节聚合物组合物的浓度。对于较高浓度的聚合物组合物或者聚合物基质/cm2是有利的情况,可以用较少溶剂溶剂化本发明的聚合物分子。对于较低浓度的聚合物组合物或者聚合物基质/cm2是有利的情况,可以用较多溶剂溶剂化本发明的聚合物分子。换句话说,调节聚合物组合物的浓度为0.02到1.0mg/ml溶剂并涂布固体表面,如多孔板,将产生具有可选范围的总结合聚合物基质的表面。聚合物组合物可以完全可溶或者含有悬浮的不溶聚合物。可以用于制备聚合物组合物的溶剂包括水、醇、酮和任意或所有这些的混合物。溶剂优选与所用的基底相容。因为组合物的聚合物可以相互交联,所以组合物的流体样溶液可以变成凝胶。备选地,可以以淤浆的形式产生溶液。可以用于所述组合物的溶剂的实例包括水、醇、酮和任意或所有这些的混合物。
通过在适宜的溶液中孵育以溶解和除去未结合的聚合物可以除去未结合的聚合物。例如,可以将多孔板与MOPS缓冲液在25℃过夜孵育,用MPTS缓冲液和蒸馏水每一种洗涤三次,用洗必太(hibitane)溶液洗涤、风干、包装并在低于室温(2-8℃)下保存。剩余的聚合物形成聚合物基质。
所得聚合物涂布的基底优选含有密度为至少2μg/cm2,更优选密度为4μg/cm2到30μg/cm2,在一些实施方案中,密度为6μg/cm2到15μg/cm2的聚合物基质。从而通过控制共价连接聚合物分子的捕获配体的数目和/或分子量可以控制聚合物基质中捕获配体(或者可活化基团)的密度。通常,聚合物基质中捕获配体(或者可活化基团)的密度优选为至少1纳摩尔/cm2。在一些实施方案中,捕获配体(或者可活化基团)的密度为约1.2纳摩尔/cm2到约185纳摩尔/cm2。在另一实施方案中,捕获配体(或者可活化基团)的密度为约1.5纳摩尔/cm2到约90纳摩尔/cm2,或约1.8纳摩尔/cm2到约15纳摩尔/cm2。结果,聚合物基质可以使得以至少1纳摩尔/cm2的量结合具有小于3.5kDa的分子量的靶分子。
在优选实施方案中,与容器基底接触的聚合物分子具有共价附着到所述聚合物分子的至少一个捕获配体(或者可活化基团)并且至少一些聚合物分子没有共价附着的反应基。具有附着的反应基和共价捕获配体的聚合物分子的百分数可以为25%到80%。在另一实施方案中,附着的反应基和捕获配体的百分数可以为40%到75%。在再一实施方案中,附着的反应基和捕获配体的百分数可以为50%到60%。在优选实施方案中,具有共价附着的反应基和捕获配体的聚合物分子的百分数可以为约50%。有和没有反应基的聚合物分子混合物的使用增强了三维聚合物基质的高功能形成。
如果希望,所形成的聚合物基质中捕获配体可以例如,通过非共价或共价附着捕获配体衍生化,所述附着捕获配体可以通过加入不同的捕获配体或者对现有捕获配体的化学修饰来实现,从而进一步使得高能力捕获更多种的靶分子。
在一个实施方案中,容器是多孔聚苯乙烯板,聚合物涂层来自葡聚糖聚合物的混合物,捕获配体是镍螯合物,并且聚合物基质具有1.5纳摩尔/cm2到7.5纳摩尔/cm2的捕获配体密度。在其他实施方案中,捕获配体是镓或者铁螯合物或者捕获配体是谷胱甘肽。
在另一个实施方案中,容器是多孔聚丙烯板,聚合物涂层来自葡聚糖聚合物的混合物,捕获配体是寡核苷酸。
在再一个实施方案中,容器是多孔聚苯乙烯板,聚合物涂层来自葡聚糖聚合物的混合物,捕获配体是链霉抗生物素蛋白,并且聚合物基质具有1.5μg/cm2到7.5μg/cm2的捕获配体密度。
此外,在另一个实施方案中,容器是多孔聚苯乙烯板,聚合物涂层来自葡聚糖聚合物的混合物,捕获配体选自蛋白质A、蛋白质G、蛋白质L或者它们的混合物,并且聚合物基质具有1.5μg/cm2到7.5μg/cm2的捕获配体密度。
在另一个实施方案中,容器是聚丙烯柱,聚合物涂层来自葡聚糖聚合物的混合物,捕获配体是镍螯合物。
含有聚合物基质的容器可以与本文别处更详细描述的裂解试剂联合使用以裂解细胞和从所得溶液分离靶细胞组分。可以以任意适宜的方式,如下文描述的方式在容器中提供裂解试剂。在一个实施方案中,裂解试剂吸附到至少一部分聚合物基质上。在另一个实施方案中,裂解试剂保持在容器中作为聚合物基质顶部的自由流动的粉末。然后可以将含有宿主细胞的溶液加入到含有聚合物基质和裂解试剂的容器。一旦通过裂解试剂从宿主细胞释放一些或者所有细胞组分,就可以通过聚合物基质中存在的捕获配体从细胞溶液分离靶细胞组分。
可以构建聚合物基质使得以0.5μg/cm2到20μg/cm2的量结合分子量为3.5kDa到500kDa的靶分子,以1μg/cm2到20μg/cm2的量结合分子量为10kDa到500kDa的靶分子,以2μg/cm2到20μg/cm2的量结合分子量为10kDa到350kDa的靶分子,以3μg/cm2到15μg/cm2的量结合分子量为10kDa到350kDa的靶分子。在一些实施方案中,聚合物基质能够以至少2μg/cm2聚合物基质的量结合分子量高达350kDa的多肽靶分子。
4.裂解试剂
为了帮助从宿主细胞提取或者提取和分离细胞组分,如肽、蛋白质或核酸,本发明的容器含有裂解试剂。在一个实施方案中,裂解试剂是组合物的裂解试剂并且其浓度导致宿主细胞的膜破裂并向含有裂解试剂的溶液释放细胞内含物。在另一个实施方案中,裂解试剂仅仅使得膜足够可渗透以释放一些但不是所有其细胞组分。
可以通过多种方式在容器中提供裂解试剂。在一个实施方案中,裂解试剂(作为干燥组合物)吸附到容器的内表面(或者备选地,吸附到覆盖容器表面的聚合物涂层(如果存在))。在一个此类实施方案中,例如,裂解试剂吸附到容器的至少一部分侧壁结构。在另一个实施方案中,裂解试剂吸附到容器的至少一部分底部。在另一个实施方案中,裂解试剂吸附到容器的底部和侧壁结构每一种的至少一部分。任选地,如果容器含有聚合物基质,那么裂解试剂可以吸附到聚合物基质的至少一部分表面。在另一个实施方案中,裂解试剂吸附到另一种物体,例如,支持体,如珠子、棒、网孔(如滤器)或者其他多孔物体,所述物体松散地包含在容器的体积内或者固定到容器的内表面。此类支持体以及容器自身可以由例如,聚苯乙烯、聚丙烯、聚乙烯、玻璃、尼龙、聚丙烯酰胺、纤维素、硝酸纤维素、其他塑性聚合物、金属、磁体或者其他合成物质组成。在另一个实施方案中,裂解试剂吸附到容器内表面的至少一部分和吸附到物体,例如,支持体,如如珠子、棒、网孔(如滤器)或者其他多孔物体,所述物体松散地包含在容器的体积内或者固定到容器的内表面。
根据本发明的一方面,可以控制用裂解试剂涂布的表面的表面积比(即,经涂布的内表面的表面积和/或容器体积内包含的经涂布的物体的表面积之和)。在一个实施方案中,表面积与体积比SA∶V小于约4mm2/μl,其中SA是容器的经涂布的内表面和容器的体积内含有的任何经涂布的物体的表面积,V是容器的体积。在另一个实施方案中,表面积与体积比不超过约3mm2/μl。在另一个实施方案中,表面积与体积比不超过约2mm2/μl。在另一个实施方案中,表面积与体积比不超过约1mm2/μl。
容器的内表面和/或容器体积内所含物体上裂解试剂的涂层将通常作为干物质(例如,水分含量不超过约5wt.%的组合物)吸附。备选地,可以以凝胶或者糊,即粘度大于约10,000厘泊的物质的形式提供裂解试剂,其涂布在容器的内表面或者内表面的一部分,或者还涂布在容器所包括的物体上。
在一个备选实施方案中,提供并作为大块材料保持在容器内而不是作为容器内表面或者容器体积内所含物体的吸附涂层的裂解试剂,所述大块材料为例如,基质、颗粒、片、或者自由流动的粉末。从而,例如,裂解试剂可以是冻干的基质或者冻干的粉末,其独立于捕获配体置于容器内;在一个实施方案中,一块冻干裂解试剂置于一层树脂上,所述树脂具有结合该树脂的捕获配体。通常,更细小的颗粒倾向于比更大颗粒更快地溶解。为了使裂解试剂的损失和/或污染的危险最小,优选在容器口上提供盖子。
在另一备选实施方案中,裂解试剂可以作为溶解或者淤浆状组分存在于容器中。为了避免含有宿主细胞的任何容器或者悬浮液的不希望的稀释,在该实施方案中,溶解或者淤浆化裂解试剂的液体优选含有高浓度裂解试剂,例如,按重量计大于约10%的裂解试剂。在另一个实施方案中,裂解试剂的浓度按重量计大于约20%。再次,为了使裂解试剂的损失和/或污染的危险最小,优选用盖子覆盖容器。
通常,裂解试剂可以是任意组合物或者组合物的组合,它们可以化学地或者酶促地导致宿主细胞释放靶细胞组分。此外,裂解试剂可以任选提供对该组分的保护,例如,保护免于降解。从而,裂解试剂可以含有去污剂、分解酶、离液试剂、或者它们的组合。裂解试剂可以还含有缓冲剂、消泡剂、膨胀剂、底物结合酶、酶抑制剂或者帮助提取和分离细胞组分的其他添加剂,所述细胞组分为例如,肽、蛋白质、或者核酸。
在一个实施方案中,裂解试剂包含去污剂。本文可以使用多种去污剂,包括阴离子去污剂、阳离子去污剂、非离子去污剂和两性离子去污剂。代表性去污剂包括鹅脱氧胆酸;鹅脱氧胆酸钠盐;胆酸;脱氢胆酸;脱氧胆酸;脱氧胆酸甲酯;毛地黄皂苷;洋地黄毒苷;N,N-二甲基十二烷基氧化胺;多库酯钠盐;甘氨鹅脱氧胆酸(glycochenodeoxycholic acid)钠盐;甘氨胆酸水合物;甘氨胆酸钠盐水合物;甘氨脱氧胆酸一水合物;甘氨脱氧胆酸钠盐;甘氨石胆酸(glycolithocholic acid)3-硫酸二钠盐;甘氨石胆酸乙酯;N-月桂酰肌氨酸钠盐;N-月桂酰肌氨酸;十二烷基硫酸锂;鲁戈氏溶液;4型Niaproof 4(即,7-乙基-2-甲基4-十一基硫酸钠盐;7-乙基-2-甲基-4-十一基硫酸钠);1-辛烷磺酸钠盐;1-丁烷磺酸钠;1-癸烷磺酸钠;1-十二烷磺酸钠;无水1-庚烷磺酸钠;1-壬烷磺酸钠;一水合1-丙烷磺酸钠;2-溴乙烷磺酸钠;水合胆酸钠;络胆酸钠;脱氧胆酸钠;一水合脱氧胆酸钠;十二烷基硫酸钠;无水己烷磺酸钠;辛基硫酸钠;无水戊烷磺酸钠;牛磺胆酸钠;牛磺脱氧胆酸钠;牛磺鹅脱氧胆酸(saurochenodeoxycholic acid)钠盐;一水合牛磺脱氧胆酸钠盐;水合牛磺脱氧胆酸钠盐;牛磺石胆酸3-硫酸二钠盐;牛磺熊去氧胆酸钠盐;Trizma十二烷基硫酸盐(即,三(羟基甲基)氨基甲烷月桂基硫酸盐);熊去氧胆酸,烷基三甲基溴化铵;苯扎氯铵;苄基二甲基十六烷基氯化铵;苄基二甲基肉豆蔻基氯化铵;苄基十二烷基二甲基溴化铵;苄基三甲基四氯碘酸铵;十六烷基三甲基溴化铵;二甲基二(十八烷基)溴化铵;十二烷基乙基二甲基溴化铵;十二烷基三甲基溴化铵;乙基十六烷基二甲基溴化铵;Girard′s试剂T;十六烷基三甲基溴化铵;N,N′,N′-聚氧乙烯(10)-N-动物脂-1,3-二氨基丙烷;铵溴通佐;三甲基(肉豆蔻基)溴化铵,BigCHAP(即,N,N-二[3-(D-葡糖酰胺基)丙基]胆酰胺);二(聚乙二醇二[咪唑基羰基]);聚氧乙烯醇,如Brij30(聚氧乙烯(4)月桂基醚)、Brij35(聚氧乙烯(23)月桂基醚)、Brij35P、Brij52(聚氧乙烯2十六烷基醚)、Brij56(聚氧乙烯10十六烷基醚)、Brij58(聚氧乙烯20十六烷基醚)、Brij72(聚氧乙烯2硬脂酰基醚)、Brij76(聚氧乙烯10硬脂酰基醚)、Brij78(聚氧乙烯20硬脂酰基醚)、Brij78P、Brij92(聚氧乙烯2油烯基醚);Brij92V(聚氧乙烯2油烯基醚)、Brij96V、Brij97(聚氧乙烯10油烯基醚)、Brij98(聚氧乙烯(20)油烯基醚)、Brij58P、和Brij700(聚氧乙烯(100)硬脂酰基醚);CremophorEL(即聚氧乙烯甘油三蓖麻醇酸酯35;polyoxyl 35蓖麻油);十甘醇单十二烷基醚;十甘醇单十六烷基醚;十甘醇单十三烷基醚;N-癸酰基-N-甲基葡糖胺;正癸基α-D-吡喃葡糖苷;癸基β-D-吡喃麦芽糖苷;毛地黄皂苷;正-十二烷酰基-N-甲基葡糖胺;正-十二烷基α-D-麦芽糖苷;正-十二烷基β-D-麦芽糖苷;七甘醇单癸基醚;七甘醇单十二烷基醚;七甘醇单肉豆蔻基醚;正-十六烷基β-D-麦芽糖苷;六甘醇单十二烷基醚;六甘醇单十六烷基醚;六甘醇单十八烷基醚;六甘醇单肉豆蔻基醚;IgepalCA-630(即,壬基苯基聚乙二醇,(辛基苯氧基)聚乙氧基乙醇,辛基苯氧基-聚乙二醇);甲基-6-O-(N-庚基氨甲酰基)-α-D-吡喃葡糖苷;九甘醇单十二烷基醚;N-壬酰基-N-甲基葡糖胺;八甘醇单癸基醚;八甘醇单十二烷基醚;八甘醇单十六烷基醚;八甘醇单十八烷基醚;八甘醇单肉豆蔻基醚;辛基-β-D-吡喃葡糖苷;五甘醇单癸基醚;五甘醇单十二烷基醚;五甘醇单十六烷基醚;五甘醇单己基醚;五甘醇单十八烷基醚;五甘醇单辛基醚;聚乙二醇二缩水甘油基醚;聚乙二醇醚W-1;聚氧乙烯10三癸基醚;聚氧乙烯100硬脂酸酯;聚氧乙烯20异十六烷基醚;聚氧乙烯20油烯基醚;聚氧乙烯40硬脂酸酯;聚氧乙烯50硬脂酸酯;聚氧乙烯8硬脂酸酯;聚氧乙烯二(咪唑基羰基);聚氧乙烯25丙二醇硬脂酸酯;来源于皂树树皮的皂角苷;脂肪酸脱水山梨醇酯,如Span20(失水山梨糖醇单月桂酸酯)、Span40(失水山梨糖醇单棕榈酸酯)、Span60(失水山梨糖醇单硬脂酸酯)、Span65(失水山梨糖醇三硬脂酸酯)、Span80(失水山梨糖醇单油酸酯)和Span85(失水山梨糖醇三油酸酯);聚乙二醇的多种烷基醚,如Tergitol型15-S-12、Tergitol型15-S-30、Tergitol型15-S-5、Tergitol型15-S-7、Tergitol型15-S-9、Tergitol型NP-10(壬基酚乙氧基化物)、Tergitol型NP-4、Tergitol型NP-40、Tergitol型NP-7、Tergitol型NP-9(壬基酚聚乙二醇醚)、TergitolMIN FOAM 1x、TergitolMIN FOAM 2x、Tergitol型TMN-10(聚乙二醇三甲基壬基醚)、Tergitol型TMN-6(聚乙二醇三甲基壬基醚)、Triton770、TritonCF-10(苄基-聚乙二醇叔-辛基苯基醚)、TritonCF-21、TritonCF-32、TritonDF-12、TritonDF-16、TritonGR-5M、TritonN-42、TritonN-57、TritonN-60、TritonN-101(即,聚乙二醇壬基苯基醚;聚氧乙烯支链壬基苯基醚)、TritonQS-15、TritonQS-44、TritonRW-75(即,聚乙二醇260单(十六烷基/十八烷基)醚和1-十八醇)、TritonSP-135、TritonSP-190、TritonW-30、TritonX-15、TritonX-45(即,聚乙二醇4-叔辛基苯基醚;4-(1,1,3,3-四甲基丁基)苯基-聚乙二醇)、TritonX-100(叔-辛基苯氧基聚乙氧基乙醇;聚乙二醇叔辛基苯基醚);4-(1,1,3,3-四甲基丁基)苯基-聚乙二醇)、TritonX-102、TritonX-114(聚乙二醇叔辛基苯基醚;(1,1,3,3-四甲基丁基)苯基-聚乙二醇)、TritonX-165、TritonX-305、TritonX-405(即,聚氧乙烯(40)异辛基环己基醚;聚乙二醇叔辛基苯基醚)、TritonX-705-70、TritonX-151、TritonX-200、TritonX-207、TritonX-301、TritonXL-80N和TritonXQS-20;肉豆蔻基-β-D-麦芽糖苷;四甘醇单癸基醚;四甘醇单十二烷基醚;四甘醇单肉豆蔻基醚;三甘醇单癸基醚;三甘醇单十二烷基醚;三甘醇单十六烷基醚;三甘醇单辛基醚;三甘醇单肉豆蔻基醚;聚氧乙烯失水山梨糖醇脂肪酸酯,如TWEEN20(聚乙二醇失水山梨糖醇单月桂酸酯)、TWEEN20(聚氧乙烯(20)失水山梨糖醇单月桂酸酯)、TWEEN21(聚氧乙烯(4)失水山梨糖醇单月桂酸酯)、TWEEN40(聚氧乙烯(20)失水山梨糖醇单棕榈酸酯)、TWEEN60(聚乙二醇失水山梨糖醇单硬脂酸酯;聚氧乙烯(20)失水山梨糖醇单硬脂酸酯)、TWEEN61(聚氧乙烯(4)失水山梨糖醇单硬脂酸酯)、TWEEN65(聚氧乙烯(20)失水山梨糖醇三硬脂酸酯)、TWEEN80(聚乙二醇失水山梨糖醇单油酸酯;聚氧乙烯(20)失水山梨糖醇单油酸酯)、TWEEN81(聚氧乙烯(5)失水山梨糖醇单油酸酯)、和TWEEN85(聚氧乙烯(20)失水山梨糖醇三油酸酯);四丁酚醛;正-十一烷基β-D-吡喃葡糖苷、CHAPS(即,3-[(3-胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐);CHAPSO(即,3-[(3-胆酰氨基丙基)二甲基铵基]-2-羟基-1-丙烷磺酸盐);N-十二烷基麦芽糖苷;α-十二烷基-麦芽糖苷;β-十二烷基-麦芽糖苷;3-(癸基二甲基铵基)丙烷磺酸内盐(即,SB3-10);3-(十二烷基二甲基铵基)丙烷磺酸内盐(即,SB3-12);3-(N,N-二甲基肉豆蔻基铵基)丙烷磺酸盐(即,SB3-14);3-(N,N-二甲基十八烷基铵基)丙烷磺酸盐(即,SB3-18);3-(N,N-二甲基辛基铵基)丙烷磺酸内盐(即,SB3-8);3-(N,N-二甲基棕榈基铵基)丙烷磺酸盐(即,SB3-16);MEGA-8;MEGA-9;MEGA-10;甲基庚基氨甲酰基吡喃葡糖苷;N-壬醇N-甲基葡糖胺;辛基-吡喃葡糖苷;辛基-硫代吡喃葡糖苷;辛基-β-硫代吡喃葡糖苷;3-(4-庚基)苯基3-羟基丙基)二甲基铵基丙烷磺酸盐(即,C7BzO);3-[N,N-二甲基(3-肉豆蔻酰氨基丙基)铵基]丙烷磺酸盐(即,ASB-14);和脱氧胆酸(deoxycholatic acid),和它们的多种组合。
在一个实施方案中,裂解试剂将是选自CHAPS(3-[3-(胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐、辛基-β-硫代吡喃葡糖苷、辛基-吡喃葡糖苷、C7BzO(3-(4-庚基)苯基3-羟基丙基)二甲基铵基丙烷磺酸盐)、ABS-14(3-[N,N-二甲基(3-肉豆蔻酰基氨基丙基)铵基]丙烷磺酸盐)、TritonX-100、α-十二烷基-麦芽糖苷、β-十二烷基-麦芽糖苷、十甘醇单十六烷基醚、十甘醇单三癸基醚、脱氧胆酸、十二烷基硫酸钠、IgepalCA-630、溴化十六碳烷基三甲铵、SB3-10(3-(十二烷基二甲基铵基)丙烷磺酸内盐)、SB3-12(3-(癸基二甲基铵基)丙烷磺酸内盐)、SB3-14(为3-(N,N-二甲基肉豆蔻基铵基)丙烷磺酸盐)、和正-十二烷基α-D-麦芽糖苷的一种或多种试剂。
在另一实施方案中,裂解试剂将是选自3-[3-(胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐、辛基-β-硫代吡喃葡糖苷、辛基-吡喃葡糖苷、3-(4-庚基)苯基3-羟基丙基)二甲基铵基丙烷磺酸盐、3-[N,N-二甲基(3-肉豆蔻酰基氨基丙基)铵基]丙烷磺酸盐、3-(癸基二甲基铵基)丙烷磺酸内盐、3-(十二烷基二甲基铵基)丙烷磺酸内盐、3-(N,N-二甲基肉豆蔻基铵基)丙烷磺酸盐和正-十二烷基α-D-麦芽糖苷的一种或多种试剂。
在另一实施方案中,裂解试剂含有分解酶。本文中可以使用多种酶。代表性酶包括β葡糖醛酸糖苷酶、葡聚糖酶、蜗牛酶、溶菌酶、溶细胞酶、甘露聚糖酶、变溶菌素、消解酶、纤维素酶、几丁质酶、溶葡萄球菌素、果胶酶(pectolyase)、链球菌溶血素O,和它们的多种组合。见,例如,Wolska-Mitaszko,等人,Analytical Biochem.,116:241-47(1981);Wiseman,Process Biochem.,63-65(1969);和Andrews & Asenjo,Trends in Biotech.,5:273-77(1987)。
所裂解的细胞类型可以影响酶的选择。见,Coakley,等人,Adv.Microb.Physio,16:279-341(1977)。例如,对于蛋白质或者肽,当宿主细胞是植物细胞时,几丁质酶、β葡糖醛酸糖苷酶、甘露聚糖酶和果胶酶都可以使用。酵母细胞难以破裂,因为其细胞壁可以形成被膜或者抗性孢子。通过使用裂解性酶,如溶细胞酶、几丁质酶、消解酶和gluculase诱导部分原生质球形成;原生质球随后裂解而释放DNA,可以从酵母提取DNA。溶细胞酶优选消化酵母的细胞壁并从真菌产生用于转化的原生质球。溶细胞酶水解聚(β-1,3-葡萄糖),如酵母细胞壁葡聚糖。
当宿主细胞是细菌细胞时,溶菌酶和变溶菌素是有用的。溶菌酶水解肽聚糖的多糖主链中N-乙酰基葡萄糖胺和N-乙酰基胞壁酸之间的β1-4糖苷键。它通过水解细菌细胞壁中存在的肽聚糖而有效裂解细菌。
在另一实施方案中,裂解试剂含有离液剂。在某些情况中,仅离液剂就足够裂解宿主细胞。具体地,当细胞组分是RNA时使用离液剂。可以用于本文的离液剂的实例包括尿素、盐酸胍、硫氰酸胍、硫代硫酸胍和硫脲。离液剂还可以与去污剂、缓冲剂、消泡剂和本文描述的其他添加剂联合使用。
除了主要负责裂解宿主细胞的去污剂、分解酶或者离液剂之外,裂解试剂还可以含有用于控制pH的一种或多种缓冲剂、防止过量起泡或者发泡的消泡剂、膨胀剂、酶抑制剂,和帮助纯化细胞组分的其他底物结合酶。代表性缓冲剂包括TRIS、TRIS-HCl、HEPES和磷酸盐。代表性消泡剂包括Antifoam 204;Antifoam A Concentrate;Antifoam A Emulsion;Antifoam B Emulsion;和Antifoam C Emulsion。代表性膨胀剂包括氯化钠、氯化钾和聚乙烯吡咯烷酮(PVP)。底物结合酶和酶抑制剂包括核酸酶,如Benzonase内切核酸酶;脱氧核糖核酸酶(例如,脱氧核糖核酸酶I);RNA酶(例如,RNA酶A);蛋白酶,如蛋白酶K;核酸酶抑制剂;蛋白酶抑制剂,如膦酰二肽、胃酶抑制剂A、苯丁抑制素、E-64、牛胰蛋白酶抑制剂、抑蛋白酶醛肽、1,10-菲咯啉、抗蛋白酶、盐酸苯甲醚、胰凝乳蛋白酶抑制剂、EDTA、e-氨基己酸、胰蛋白酶抑制剂,和盐酸4-(2-氨基乙基)苯磺酰氟;和磷酸酶抑制剂,如斑蝥素、溴代四咪唑、微囊藻素LR、原钒酸钠、钼酸钠、酒石酸钠和咪唑;等等。象分解酶一样,底物结合酶和酶抑制剂的选择也随几种因素而变,所述因素包括待提取的材料的类型(例如,肽、蛋白质、核酸等等),以及待裂解的细胞的类型(例如,植物、酵母、细菌、真菌、哺乳动物、昆虫,等等)。例如,核酸酶水解或降解核酸。当细胞组分是蛋白质或肽时,而细胞组分不是核酸时,将希望裂解试剂含有核酸酶。同样,蛋白酶分解或降解蛋白质。从而当细胞组分是核酸,但是细胞组分不是蛋白质时,将希望裂解试剂含有蛋白酶。当选择其他酶或者抑制剂时可以应用类似的推理。从而,通常,当细胞组分是核酸时,通常可以使用诸如蛋白酶、核酸酶抑制剂和溶菌酶的酶或者抑制剂。当细胞组分是蛋白质或者肽时,可以使用其他酶或抑制剂,如Benzonase内切核酸酶、蛋白酶抑制剂、磷酸酶抑制剂、脱氧核糖核酸酶、RNA酶或者其他核酸酶。对于核酸,RNA酶A可以用于提取细菌和哺乳动物DNA。脱氧核糖核酸酶I可以用于提取细菌RNA、酵母RNA、动物细胞和组织的RNA,和生物液体的RNA。蛋白酶,如蛋白酶K,可以用于从所有细胞类型提取DNA。
当宿主细胞是细菌或者动物细胞,或者细胞组分是蛋白质或者DNA时,裂解试剂将通常含有去污剂。当宿主细胞是酵母细胞时,裂解试剂将通常含有去污剂,或者能够裂解酵母细胞的酶,如溶细胞酶、酶解酶或者其他分解酶,如前面列出的那些分解酶。
作为另一实例,当细胞组分是蛋白质或肽时,裂解试剂优选含有一种或多种去污剂、溶菌酶、核酸酶、Benzonase内切核酸酶、缓冲剂、蛋白酶抑制剂、磷酸酶抑制剂或者离液试剂,或者它们的多种组合。在另一实施方案中,当细胞组分是DNA时,裂解试剂优选含有一种或多种去污剂、溶菌酶、核酸酶抑制剂、RNA酶、缓冲剂或者蛋白酶,或者它们的多种组合。
在另一实施方案中,当细胞组分是RNA时,裂解试剂优选含有一种或多种去污剂、离液试剂、或者缓冲剂,或者它们的多种组合。该应用中通常不使用酶,因为离液剂将使它们失活。
在一个实施方案中,裂解试剂含有3-[(3-胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐、溶菌酶、Tris-HCl,和脱氧核糖核酸酶I。
在另一实施方案中,裂解试剂含有辛基-硫代吡喃葡糖苷、蛋白酶抑制剂、溶菌酶、Benzonase内切核酸酶。
从而,裂解试剂可以含有去污剂、酶、抑制剂、离液剂、缓冲剂、消泡剂、膨胀剂和/或帮助提取和分离细胞组分的其他添加剂的多种不同的组合。这些裂解试剂和/或组分可以是天然的、重组的或者任意修饰的或活性形式。本领域技术人员可以基于细胞组分和宿主细胞的类型容易确定优选的裂解试剂所含的成分。
裂解试剂的量和其每种组分的相对比例将根据宿主细胞的类型、所选的裂解试剂的类别和希望在确定的时间段内的细胞渗透程度而变。从而,在一个实施方案中,任何一种去污剂的浓度为约0.01%到约5%(w/v),更优选约0.1%到约2%。在另一实施方案中,每种分解酶的浓度为约0.01mg/ml到约0.2mg/ml。在再一个实施方案中,缓冲剂的浓度使得在发生提取或者提取和分离的时间期间内细胞溶液的pH保持在约pH3到约pH12。在另一实施方案中,蛋白酶抑制剂的浓度为约10nM到约10mM。在另一实施方案中,磷酸酶抑制剂的浓度为约0.01nM到约10mM。
不管是否裂解试剂作为被吸附的、自由流动的、溶解的或者淤浆状的组分存在于溶剂中,当向容器加入含有宿主细胞的溶液和悬浮液时,裂解试剂将被含有宿主细胞的悬浮液溶解和稀释,并且宿主细胞被裂解。如果裂解试剂含有裂解所需的所有试剂,那么不需要进行多次移液步骤以确保存在所有需要的裂解试剂。此外,如上面指出的,裂解试剂不必为了有效而完全溶解宿主细胞。而是,宿主细胞仅需要被裂解到将部分和所有靶产物释放到溶液的程度。此外,裂解试剂不必为了有效而裂解任何具体细胞悬浮液中的所有宿主细胞,只要裂解一些宿主细胞即可。
5.试剂盒
有利地,本发明的容器可以与使用说明书,和用于从宿主细胞提取和/或分离细胞组分的试剂,和/或分析或检测被捕获的细胞组分的试剂,和/或处理缓冲液或者对照联合,其中所有这些都包装在一起并且作为试剂盒分配。在一个实施方案中,试剂盒将含有一个容器,或者备选地,包含多个容器的多孔板;通常,将封闭试剂盒。总之,包括裂解试剂,和任选地,还可以包括捕获配体。
如本文所述,裂解试剂和/或捕获配体可以以多种不同的方式在本发明的容器中提供。例如,裂解试剂可以涂布在容器的一部分、容器的底部、容器的侧壁结构或者容器的底部和侧壁结构上,或者可以以自由流动的粉末形式存在。同样,受支持的捕获配体可以位于容器的一部分、容器的底部、容器的侧壁结构或者容器的底部和侧壁结构上。在一个实施方案中,容器还包含额外的支持体,如珠子或者网孔,支持体上可以涂布裂解试剂和/或放置受支持的捕获配体。备选地,容器可以是高容量平台,其含有三维聚合物基质、捕获配体或者可活化基团,和裂解试剂。
在一个实施方案中,容器将含有提取或者提取和分离细胞组分(例如,多肽、蛋白质、RNA或者DNA产物)所需的所有试剂。试剂盒可以还包含用于从受支持的捕获配体或者三维基质释放或稀释被捕获的产物的其他试剂和设备,以及多种处理缓冲剂。
6.方法
通常,本发明的方法涉及从宿主细胞提取或提取和分离细胞组分,如肽、蛋白质、核酸、或者其他细胞组分。从而,一方面,本发明涉及从宿主细胞提取细胞组分的方法,该方法包括(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积V,和至少一部分内表面上的裂解试剂涂层,所述内表面包括侧壁结构和底部,经涂布的内表面的面积与体积V的比小于约4mm2/μl,和(b)裂解容器中的宿主细胞以释放细胞组分和形成细胞残渣。裂解试剂导致宿主细胞释放其内含物。裂解可以是完全的,即所有细胞组分(例如,肽、蛋白质或核酸)从宿主细胞释放,或者是部分的,即,从宿主细胞释放部分细胞组分。
另一方面,本发明涉及从宿主细胞提取和分离细胞组分的方法。一方面,该方法包括(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积V、裂解试剂和受支持的捕获配体,所述内表面包括侧壁结构和底部,侧壁结构在底部和口之间,口作为向容器导入液体的入口和从容器除去液体的出口,(b)裂解容器中的宿主细胞以释放细胞组分和形成固态细胞残渣;和(c)在固态细胞残渣的存在下用捕获配体捕获细胞组分。在一个实施方案中,通过容器的内表面支持捕获配体。在另一实施方案中,捕获配体附着到容器的内表面上涂布的聚合物基质。
另一方面,所述方法包括(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积V、裂解试剂和受支持的捕获配体,所述内表面包括侧壁结构和底部,侧壁结构在底部和口之间,口作为向容器导入液体的入口,(b)裂解容器中的宿主细胞以释放细胞组分和形成固态细胞残渣;和(c)在固态细胞残渣的存在下用捕获配体捕获细胞组分,(d)从捕获配体释放细胞组分,和(e)回收释放的细胞组分。在一个实施方案中,通过容器的内表面支持捕获配体。在另一实施方案中,捕获配体附着到容器的内表面上涂布的聚合物基质。
裂解可以是完全的,即所有细胞组分从宿主细胞释放,或者是部分的,即,从宿主细胞释放部分细胞组分。在一个实施方案中,洗除细胞残渣和其他未结合的细胞成分,留下结合到捕获配体的细胞组分。然后在被捕获的产物仍然结合捕获配体时可以检测所述捕获的产物。此类检测方法是本领域熟知的,并且包括ELISA、蛋白质检测和酶分析,等等。在另一实施方案中,通过使用诸如盐的试剂,或者通过其他试剂与捕获配体的竞争性结合从捕获配体释放或者洗脱被捕获的细胞组分可以回收被捕获的组分。
现在参考图7,将在含有裂解试剂和捕获配体的容器的背景下描述本发明的方法。通常称作10的该容器为柱或者管,其通常具有柱状轴12,其限定了内腔,和口13(其可以被上面的帽14覆盖)、出口15(其可以被下面的帽16覆盖)。在一般的柱状轴12限定的腔内是树脂床18,其结合有捕获配体,和覆盖树脂床18的一块裂解试剂20。为了支持腔内的树脂床,容器10可以还含有多孔聚乙烯釉料(约20μm孔大小)。在操作中,除去上面的帽14并将含有宿主细胞的液体悬浮物通过口13倒入柱中。通过液体悬浮物溶解裂解试剂20,从而使得释放宿主细胞的所有或部分细胞组分并通过结合树脂床18的捕获配体捕获细胞组分。捕获细胞组分后,通过出口15从容器排出细胞残渣和液体悬浮物的其他组分;有利地,釉料或者其他支持方法防止树脂18排出腔但是允许细胞残渣和液体悬浮物的其他组分排出。在优选实施方案中,柱子具有9.1cm内部柱长(或者当在底部和口加帽时长12.3cm);在底部开口约1cm的直径、在口开口约1.7cm的直径;和约7.5ml的总体积。在一个实施方案中,捕获配体是共价附着琼脂糖树脂床的镍螯合物并且裂解试剂含有CHAPS(即,3-[3-胆酰氨基丙基]二甲基铵基)-1-丙烷磺酸盐)的自由流动的粉末、溶菌酶、Tris-HCl和脱氧核糖核酸酶I。
在另一实施方案中,上述方法可以在多孔板(如96多孔板)的一个或多个孔中进行,所述多孔板可以含有裂解试剂和聚合物基质涂层。例如,在一个实施方案中,用前述衍生自葡聚糖聚合物的聚合物基质涂布孔,所述聚合物基质连接捕获配体。在优选实施方案中,聚合物基质衍生自葡聚糖聚合物的混合物,并且捕获配体是镍螯合剂。在一个实施方案中,裂解试剂含有辛基-硫代吡喃葡萄糖苷(OTG)、蛋白酶抑制剂、溶菌酶、和Benzonase内切核酸酶。更具体地,裂解试剂可以含有2%OTG、1%蛋白酶抑制剂、2%溶菌酶、和0.02%Benzonase内切核酸酶。在一个实施方案中,裂解试剂涂布在聚合物基质的至少一部分表面和/或孔的侧壁上。备选地,或者额外地,裂解试剂可以以孔内冻干基质或者其他物质(例如,自由流动的粉末)的形式存在。当向孔中加入含有宿主细胞的液体悬浮物时,裂解试剂被溶解,并且宿主细胞被裂解,如前述。然后捕获配体结合靶细胞组分。使用本领域公知和前面描述的技术可以任选释放和回收被捕获的靶细胞组分。
另一方面,本发明涉及制备用于从宿主细胞提取细胞组分的多孔板的方法。该方法包括将多孔板的多个孔的内表面与含有裂解试剂的液体接触,并干燥液体以在孔的内表面上形成裂解试剂的吸附层。本文描述的任意裂解试剂可以以该方式使用。如前面描述的,裂解试剂的量可以改变,但是应该是足够的,从而所吸附的裂解试剂的量将提供所希望水平的提取。通过风干,使用培养箱,或者本领域公知的其他技术可以实现干燥。
可以以类似方式制备用于从宿主细胞提取和分离细胞组分的容器。例如,在一个实施方案中,含有受支持的捕获配体的孔的内表面可以与含有裂解试剂的液体接触,并且干燥液体以在孔的内表面上形成裂解试剂的吸附层。在另一实施方案中,含有所结合的聚合物基质的孔(例如,上述多孔板的一个或多个孔)的内表面可以与含有裂解试剂的液体接触,并且干燥液体以在孔的聚合物基质和/或侧壁的表面上形成裂解试剂的吸附层。在另一实施方案中,柱(如含有附着捕获配体树脂的柱,如上述)的内表面可以与含有裂解试剂的液体接触,并且干燥液体以在柱的树脂和/或侧壁的表面上形成裂解试剂的吸附层。
本申请引用的所有出版物、专利、专利申请和其他参考文献在此处完整并入本文作为参考,就像每种单独的出版物、专利、专利申请和其他参考文献特别并单独指出并入本文作为参考一样。
7.定义
术语“捕获配体”指可以或者被固定或支持在容器或支持物上并且用于将细胞组分与细胞残渣分离的任何部分、分子、受体或者层。可以用于本发明的捕获配体的一些非限制性实例包括:生物素、链霉抗生物素蛋白、多种金属螯合离子、抗体、多种带电颗粒,如用于离子交换层析的那些颗粒、染料、多种亲和层析支持体,和用于疏水层析的多种疏水基团。
术语“细胞残渣”和“细胞的残渣”在本文可以互换使用,用以描述由于细胞裂解从宿主细胞释放的不同于靶产物的膜碎片、细胞器或者任意其他可溶或不可溶细胞组分。
术语“提取”指由于细胞裂解,从宿主细胞释放其表达的至少一些靶产物。
术语“宿主细胞”指表达或者含有靶产物的任意原核或真核细胞。宿主细胞包括,例如,细菌细胞,如大肠杆菌(E.coli);真菌细胞,如酵母细胞;植物细胞;动物细胞,如哺乳动物细胞;和昆虫细胞。
术语“分离”或“纯化”指从至少部分细胞残渣除去或分离至少部分靶产物。
术语“裂解”指破坏细胞的细胞壁和/或细胞膜从而释放靶产物。裂解可以是完全或部分的(即,使得细胞壁和/或细胞膜足够可渗透的以释放一些但不是全部细胞组分)。
术语“靶产物”指任意细胞组分,如多肽、蛋白质、蛋白质片段、DNA、RNA、其他核苷酸序列、糖、脂质、胆固醇、激酶或者其他细胞组分,所述任意细胞组分将从表达或包含所述组分的宿主细胞提取或者提取和分离(例如,“靶蛋白”、“靶DNA”、“靶RNA”、“靶细胞组分”等等)出来。靶产物可以在宿主细胞中天然发生,或者可以是非天然发生的,例如,重组蛋白质。
由于可以对上面的产物和方法进行多种改变而不背离本发明的范围,所以上面描述和下面给出的实施例中所含的所有内容将解释为阐明性的而不是限制性的。
实施例
实施例1
使用his-标记的重组蛋白质通过HIS-SelectTM高容量板进行去污剂裂解和纯化
在该实施例中,裂解含有包含重组his标记的蛋白质的细菌,并且在一步中纯化靶蛋白。将重组蛋白质以不同的量掺加(spike)到大肠杆菌(E.coli)中以确定细胞裂解时蛋白质能否被捕获。除非另外指出,从Sigma-Aldrich Corporation,St.Louis,MO得到所有材料。
干燥裂解支持体。用HIS-SelectTM高容量(HC)板(Sigma S5563)进行靶蛋白的纯化。将这些96孔多孔板用如上述的高密度、镍螯合物聚合物基质涂布。这些板用于纯化his-标记的重组蛋白质,并且可以每孔结合4μg以上蛋白质。主要裂解组分是20mM Tris-Cl(pH 7.5)中的1%辛基-硫代葡萄糖吡喃糖苷(OTG)。将多种处理试剂和酶加入到缓冲的去污剂:i)1%(v/v)蛋白酶抑制剂(Sigma P8849)、2%溶菌酶(Sigma,10mg/ml溶液L3790),和0.02%Benzonase内切核酸酶(Sigma E1014);ii)1%蛋白酶抑制剂和2%溶菌酶;和iii)1%蛋白酶抑制剂和0.02%Benzonase内切核酸酶。将溶液分散到96孔HIS-SelectTMHC板的不同孔中,每个孔含有缓冲去污剂加(i)、(ii)或(iii)的0.1ml溶液。在培养箱中47℃下对板上方吹干燥空气使溶液在培养箱中板孔上干燥。干燥后,用去污剂加(i)、(ii)或(iii)涂布的每个孔的表面积为约134.7mm2。
细胞生长。向3个15-ml圆底管的每一个加入5ml无菌terrific肉汤(TB)培养基。向每个管加入氨苄青霉素至终浓度为0.1mg/ml。向每个管加入非表达性大肠杆菌的一个菌落。以250转/分钟摇动下在37℃过夜孵育培养物。
大肠杆菌样品。用无菌TB培养基将含有序列His-Asn-His-Arg-His-Lys-His(SEQ.ID.NO.4)的组氨酸标记的纯化的重组28kDa蛋白质稀释到1mg/ml。通过将特定量的靶蛋白掺加到非表达性大肠杆菌培养物制备蛋白质样品。向含有经干燥的裂解试剂的每孔加入100μl等分试样。非表达性大肠杆菌培养基用作对照。温和摇动下在室温孵育样品2小时。
SDS-PAGE分析。使用BioMek板洗涤器将板用Tris缓冲盐水与0.05%Tween 20(TBST),pH 8.0洗涤4次。所选的孔在室温下用50μl含有50mM磷酸钠,pH8,300mM氯化钠,和250mM咪唑的溶液洗脱。样品以1∶1与Laemmli样品缓冲液混合,并通过1x Tris-甘氨酸-SDS缓冲液中的4-20%tris-甘氨酸凝胶(Invitrogen)对20μl样品电泳。凝胶用EZBlue染色试剂(Sigma G1041)染色,然后用银染(Sigma#Prot-sill)染色。结果在图1中给出。
结果和讨论。表1指出用于图1的每个泳道的裂解试剂和样品组分。在其中加入靶蛋白的每个孔中,蛋白质受到捕获并洗脱。更高量的蛋白质导致更高量的被捕获的靶蛋白。处理辅助剂对于结合的靶蛋白的量是有益的,除了去污剂还存在溶菌酶时尤其有益。
表1用于SDS-PAGE分析的裂解试剂和样品组分
| 泳道号 | 板中干燥的裂解试剂 | 样品组分用咪唑从板洗脱后装入凝胶中的20μl样品 |
| 1 | N/A | 分子量标记 |
| (Colorburst SigmaC4105) | ||
| 2 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | Terrific肉汤(TB)中的3μg纯his-标记的靶蛋白 |
| 3 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | TB中的非表达性大肠杆菌 |
| 4 | 1%OTG,20mM Tris-Cl pH 7.5 | 掺加Terrific肉汤(TB)中的3μg纯his-标记的靶蛋白的非表达性大肠杆菌 |
| 5 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | TB中的非表达性大肠杆菌 |
| 6 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | 掺加Terrific肉汤(TB)中的lμg纯his-标记的靶蛋白的非表达性大肠杆菌 |
| 7 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂 | 掺加Terrific肉汤(TB)中的2μg纯his-标记的 |
| 混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | 靶蛋白的非表达性大肠杆菌 | |
| 8 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | 掺加Terrific肉汤(TB)中的3μg纯his-标记的靶蛋白的非表达性大肠杆菌 |
| 9 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | 掺加Terrific肉汤(TB)中的4μg纯his-标记的靶蛋白的非表达性大肠杆菌 |
| 10 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(SigmaE1014) | 掺加Terrific肉汤(TB)中的5μg纯his-标记的靶蛋白的非表达性大肠杆菌 |
| 11 | 1%OTG,20mM Tris-Cl pH 7.5,2%10mg/ml溶菌酶,1%v/v蛋白酶抑制剂混合物(Sigma,P8849) | 掺加Terrific肉汤(TB)中的3μg纯his-标记的靶蛋白的非表达性大肠杆菌 |
| 12 | 1%OTG,20mM Tris-Cl pH 7.5,1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(Sigma E1014) | 掺加Terrific肉汤(TB)中的3μg纯his-标记的靶蛋白的非表达性大肠杆菌 |
实施例2通过HIS-SelectTM高容量板使用重组大肠杆菌进行去污剂裂解、捕获和纯化
在该步骤中,使用多种去污剂联合处理辅助剂裂解含有重组his-标记的蛋白质的细菌,并且在一步中纯化靶蛋白。除非另外指出,所有材料都从Sigma-Aldrich Corporation,St.Louis,MO得到。
干燥裂解支持体。用去污剂和处理试剂和酶的多种组合检查一系列裂解试剂。100μl 2%OTG、2%CHAPS、4%CHAPS、2%C7BzO或者2%ASB-14在96孔HIS-SelectTM高容量板(Sigma S5563)上干燥。还制备含有这些去污剂和其他处理试剂的溶液。每种去污剂与i)2%(v/v)蛋白酶抑制剂混合物(Sigma P8849);ii)2%蛋白酶抑制剂混合物(Sigma P8849)和0.01%Benzonase内切核酸酶(Sigma E1014);iii)2%蛋白酶抑制剂混合物(Sigma P8849)和0.04%溶菌酶;iv)2%蛋白酶抑制剂混合物(SigmaP8849),0.01%Benzonase内切核酸酶(Sigma E1014),和0.04%溶菌酶组合。还制备了额外的溶液,它们含有i)2%OTG或2%CHAPS和0.04%溶菌酶;ii)2%OTG或2%CHAPS和0.01%Benzonase内切核酸酶(Sigma E1014);和iii)2%OTG或2%CHAPS和0.04%Benzonase内切核酸酶(Sigma E1014)和0.04%溶菌酶。将这些溶液的每一种分配到HIS-SelectTM高容量板(Sigma S5563)的2-3个孔中,每孔含有100μl溶液。在烘箱中47℃下对板上方吹干燥空气过夜干燥裂解试剂。
细胞生长。在15ml圆底管中加入5ml无菌TB培养基。向管中加入氨苄青霉素至终浓度为0.1mg/ml。向管加入表达his-标记的靶蛋白的大肠杆菌BL21G的一个菌落。以250转/分钟摇动下在37℃过夜孵育培养物。来自起始培养物的1ml细胞用于接种500ml高压灭菌的terrific肉汤(TB)。向管中加入氨苄青霉素至终浓度为0.1mg/ml。以250转/分钟摇动下在37℃孵育培养物3.5小时。3.5小时后,600nm处的OD为0.5。向培养物加入终浓度1mM的异丙基β-D-1-硫代吡喃半乳糖苷(IPTG)以诱导靶蛋白表达。以250转/分钟摇动下在37℃再孵育培养物1.5小时。
大肠杆菌样品。向含有干燥裂解试剂的半数孔中以200μl等分试样加入表达his标记的蛋白质的大肠杆菌(如用于实施例1中)。空孔用作对照。温和摇动下在室温孵育样品1小时。
Bicinchoninic Acid(BCA)蛋白质测定。使用BioMek板洗涤器用TBST,pH 8.0洗涤孔四次。1mg/ml牛血清白蛋白(BSA)用于标准曲线。向每孔加入200μl BCA工作试剂。将板在37℃孵育30分钟并在562nm下在平板读出器上读数。结果在表2中给出。
结果和讨论。BCA蛋白质测定表明在HIS-SelectTM高容量板上成功捕获了靶蛋白。多种去污剂制剂能够裂解细胞,允许捕获蛋白质。非离子去污剂OTG,以及两性离子去污剂CHAPS、C7BzO和ASB-14工作良好。加入处理辅助剂,特别是溶菌酶,有助于增加结合到板的蛋白质的量。
表2通过BCA测定法测定的蛋白质量(μg/孔)
| 去污剂 | 无加入 | Lys. | Benz. | Pr.Inh. | Lys.,Benz. | Lys.,Pr.Inh. | Benz.,Pr.Inh. | Lys.,Benz.,Pr.Inh. |
| 2%OTG | 2.771 | 4.045 | 2.607 | 2.607 | 4.946 | 4.912 | 2.953 | 6.523 |
| 2%CHAPS | 2.026 | 4.704 | 2.208 | 2.156 | 5.31 | 4.253 | 1.792 | 6.593 |
| 4%CHAPS | 1.908 | 2.052 | 4.201 | 1.896 | 5.38 | |||
| 2%C7BzO | 2.133 | 3.352 | 6.939 | 2.763 | 9.921 | |||
| 2%ASB-14 | 2.771 | 3.109 | 5.362 | 2.815 | 9.539 |
表2显示了对于BCA蛋白质测定,对于测试的每种裂解试剂,每孔的蛋白质平均量(μg)。第1列指出所用的去污剂。第2列概述了当仅使用去污剂时的结果。第3-9列概述除了去污剂,还使用溶菌酶(“Lys”)、Benzonase内切核酸酶(“Benz”)、蛋白酶抑制剂混合物(“Pr.inh.”)或者它们的多种组合时的结果。
实施例3用大肠杆菌与重组的his-标记的蛋白质和2%OTG与HIS-SelectTM高容量板进行裂解、捕获和纯化
在该实施例中,用2%OTG裂解包含含有重组his-标记的蛋白质的细菌,并在一步中纯化靶蛋白。
除非另外指出,所有材料都从Sigma-Aldrich Corporation,St.Louis,MO得到。
干燥裂解支持体。用HIS-SelectTM高容量板(Sigma 85563)纯化靶蛋白。这些96孔多孔板用于纯化his标记的重组蛋白质并且可以每孔结合4μg以上蛋白质。制备裂解溶液,其含有20mM Tris-Cl pH 7.5中的2%辛基-硫代吡喃葡萄糖苷(OTG)、1%(v/v)蛋白酶抑制剂(Sigma P8849)、2%溶菌酶(Sigma,10mg/ml溶液L3790),和0.02%Benzonase内切核酸酶(SigmaE1014)。将50μl或100μl该溶液分配到96孔HIS-SelectTM高容量板的孔中。在培养箱中47℃下对板上方吹干燥空气过夜干燥板孔上的溶液。
细胞生长。在15ml圆底管中,加入5ml无菌TB培养基。向管中加入表达his-标记的靶蛋白的非氨苄青霉素抗性大肠杆菌的一个菌落。250转/分钟摇动下在37℃过夜孵育培养物。
大肠杆菌样品。用无菌TB培养基将含有组氨酸标记(如实施例1中描述)的纯化的重组28kD蛋白质稀释到1mg/ml。通过向非表达性大肠杆菌培养基掺加特定量的靶蛋白制备蛋白质样品。对照样品含有仅纯化的靶蛋白或者非表达性大肠杆菌培养物。向含有干燥的裂解试剂的每个孔中加入100μl等分试样。温和摇动下在室温孵育样品2小时。
SDS-PAGE分析。孵育后,使用BioMek板洗涤器将板用TBST pH 8.0洗涤4次。一些孔在室温下用50μl含有50mM磷酸钠,pH8,300mM氯化钠,和250mM咪唑的溶液洗脱。样品以1∶1与Laemmli样品缓冲液混合,并通过1x Tris-甘氨酸-SDS缓冲液中的4-20%tris-甘氨酸凝胶(Invitrogen)对20μl样品电泳。凝胶用EZBlue染色试剂染色,然后用银染染色。结果在图2和3和表3中给出。
Bradford蛋白质测定。1mg/ml BSA用于标准曲线。向每孔加入250μl Bradford试剂。将板在室温孵育15分钟并在595nm下在平板读出器上读数。结果在表5中给出。
光散射。将细胞培养物的100μl等分试样用无菌培养基以1∶10稀释以在550nm测定OD后裂解。对于含有8μg靶蛋白掺加的细胞样品,裂解后在550nm读出一式两份的等分试样。结果在表4中给出。
结果和讨论。SDS-PAGE样品表明细胞被裂解,并且捕获和成功地洗脱靶蛋白。所捕获的靶蛋白的量随着加入细胞的靶蛋白的量增加而增加。光散射数据表明对于裂解后样品,在550nm处的吸收下降,表明细胞被裂解。对样品进行的Bradford蛋白质测定数据表明存在结合板的靶蛋白。非表达性细胞的裂解显示了背景蛋白质水平,但是靶蛋白的增加量给出了高于该背景水平的蛋白质数。
表3用于SDS-PAGE分析的样品组分
| 泳道编号 | 样品的组分用咪唑从板洗脱后加入凝胶中的20μl样品 |
| 1 | 分子量标记(Colorburst Sigma C4105) |
| 2 | TB中非表达性大肠杆菌细胞 |
| 3 | TB中非表达性大肠杆菌细胞 |
| 4 | Terrific肉汤(TB)中掺加2μg纯his-标记的靶蛋白的非表达性大肠杆菌细胞 |
| 5 | Terrific肉汤(TB)中掺加4μg纯his-标记的靶蛋白的非表达性大肠杆菌细胞 |
| 6 | Terrific肉汤(TB)中掺加6μg纯his-标记的靶蛋白的非表达性大肠杆茵细胞 |
| 7 | Terrific肉汤(TB)中掺加8μg纯his-标记的靶蛋白的非表达性大肠杆菌细胞 |
| 8 | Terrific肉汤(TB)中掺加10μg纯his-标记的靶蛋白的非表达性大肠杆菌细胞 |
| 9 | Terrific肉汤(TB) |
| 1O | Terrific肉汤(TB)中2μg纯his-标记的靶蛋白 |
| 11 | Terrific肉汤(TB)中4μg纯his-标记的靶蛋白 |
| 12 | Terrific肉汤(TB)中6μg纯his-标记的靶蛋白 |
| 13 | Terrific肉汤(TB)中8μg纯his-标记的靶蛋白 |
| 14 | Terrific肉汤(TB)中10μg纯his-标记的靶蛋白 |
表3指出了图2和3的每个泳道的样品组成。所有样品都应用于HIS-SelectTM HC板(Sigma S5563),其含有50μl(图2)或100μl(图3)2%OTG、20mM Tris-Cl pH 7.5、2%10mg/ml溶菌酶、1%v/v蛋白酶抑制剂混合物(Sigma,P8849)和0.02%Benzonase内切核酸酶(Sigma E1014)的干燥溶液。
表4光散射结果
| 样品 | 550nm下吸收 |
| 未裂解的 | 0.3774 |
| 裂解后样品 | 0.0463 |
| 裂解后样品 | 0.0458 |
表5通过Bradford测定直接在孔中测定的每孔结合HIS-SelectTM HC板的蛋白质量
| 每孔装入的靶蛋白的量(μg) | 使用Bradford蛋白质测定每孔中结合的蛋白质的量(μg/孔) | |||||
| 每孔中干燥的50μl溶液 | 每孔中干燥的100μl溶液 | |||||
| 靶蛋白加上粗品大肠杆菌 | 仅靶蛋白 | 仅大肠杆菌 | 靶蛋白加上粗品大肠杆菌 | 仅靶蛋白 | 仅大肠杆菌 | |
| 0 | 1.2 | 1.4 | 1.4 | 1.2 | 1.6 | 1.6 |
| 2 | 3.2 | 2.9 | ---- | 3.2 | 3.1 | --- |
| 4 | 4.3 | 3.6 | ---- | 4.2 | 4.3 | --- |
| 6 | 4.2 | 4.5 | ---- | 4.6 | 4.8 | --- |
| 8 | 5.3 | 4.7 | ----- | 4.8 | 4.8 | --- |
| 10 | 4.9 | 5.7 | ----- | 5.2 | 5.6 | --- |
实施例4使用高容量和高灵敏度HIS-SelectTM和ANTI-FLAGM2板进行去污剂裂解、重组蛋白质的捕获和纯化
在该实施例中,用多种去污剂联合处理辅助剂裂解表达具有DYKDDDDK(SEQ.ID.NO.1)和/或his标记的靶蛋白的细菌细胞,并一步纯化靶蛋白。
除非另外指出,所有材料都从Sigma-Aldrich Corporation,St.Louis,MO得到。
干燥裂解支持体。去污剂、处理试剂和酶的多种组合用于检查一系列裂解条件。制备含有下面成分的去污剂裂解溶液:
a)2%SB3-10,0.2%C7BzO,0.2%正十二烷基α-D-麦芽糖苷,0.2%TritonX-100
b)2%CHAPS,1%ASB-14
c)2%SB3-14,0.2%C7BzO
d)2%CHAPS,1%正辛基葡糖苷
e)2%SB3-12,0.2%C7BzO
f)2%SB3-14,0.2%ASB-14
g)1%正辛基葡糖苷,1%CHAPS,0.2%正十二烷基α-D-麦芽糖苷
h)8%CHAPS
去污剂CHAPS为3-[3-(胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐;SB3-10为3-(十二烷基二甲基铵基)丙烷磺酸内盐;SB3-12为3-(癸基二甲基铵基)丙烷磺酸内盐;SB3-14为3-(N,N-二甲基肉豆蔻基铵基)丙烷磺酸盐;C7BzO为3-(4-庚基)苯基3-羟基丙基)二甲基铵基丙烷磺酸盐;ASB-14为3-[N,N-二甲基(3-肉豆蔻酰基氨基丙基)铵基]丙烷磺酸盐。前7种去污剂溶液(a-g)还含有40mM Tris-HCl,pH 7.4,0.04%溶菌酶(Sigma L3790),和0.01%Benzonase内切核酸酶(Sigma E1014)。8%CHAPS溶液(h)还含有80mM Tris-HCl,pH 8.0,0.04%溶菌酶(Sigma L6876),和0.01%脱氧核糖核酸酶I(Sigma D4527)。将这些去污剂溶液的每一种100μl分配到HIS-SelectTM高容量板(Sigma M5563)、HIS-SelectTM高灵敏板(SigmaS5688)、ANTI-FLAGM2高容量板和ANTI-FLAGM2高灵敏板(SigmaP2983)的6个孔(半排)中。在培养箱中通过环境空气在板上方流动过夜干燥裂解试剂。
细胞生长。向三只15ml圆底管的每一只加入5ml无菌terrific肉汤(TB)。向每管加入终浓度为0.1mg/ml的氨苄青霉素。向第一管加入表达具有DYKDDDDK(SEQ.ID.NO.1)标记的靶蛋白的BL21大肠杆菌的甘油贮存液的20μl等分试样。向第二管加入表达具有DYKDDDDK(SEQ.ID.NO.1)/his标记的靶蛋白的BL21大肠杆菌的甘油贮存液的20μl等分试样。向第三管加入表达具有his标记(如实施例1中描述)的靶蛋白的BL21大肠杆菌的甘油贮存液的20μl等分试样。以275转/分钟摇动下在37℃下过夜孵育培养物。
过夜生长的起始培养物用于接种三个500ml高压灭菌的terrific肉汤样品。向每瓶加入终浓度0.1mg/ml的氨苄青霉素。以275转/分钟摇动下在37℃下孵育培养物4小时。向培养物加入终浓度1mM的异丙基β-D-1-硫代吡喃半乳糖苷(IPTG)以诱导靶蛋白表达。以275转/分钟摇动下在37℃再孵育培养物3小时。
大肠杆菌样品。向用裂解试剂的200μl等分试样涂布的每个板的两列加入生长在500ml摇瓶中的表达重组蛋白质的大肠杆菌。空孔用作对照。温和摇动下在室温下孵育样品2小时。
高灵敏板的酶免疫检测测定。使用BioTek板洗涤器,将孔用TBS-T,pH 8.0洗涤4次,然后用去离子水洗涤4次。向每孔加入缀合辣根过氧化物酶(HRP)的对靶蛋白特异的抗体200μl。向四个不含有蛋白质的其他孔中也加入这些缀合物,所述孔用作空白。在室温下用抗体孵育板45分钟,然后用TBS-T,pH 8.0洗涤4次。向每孔加入100μl TMB底物(SigmaT0440)并对板显影,直到颜色明显(约3-5分钟)。此时,通过向每孔加入100μl 1M HCl终止反应。在450nm得到吸收读数,并扣除空白以确定校正的A450。
高容量板的TCA沉淀。使用BioTek板洗涤器,将孔用TBS-T,pH 8.0洗涤4次,然后用去离子水洗涤4次。向HIS-SelectTM高容量板的每孔等分加入50mM磷酸钠,pH 8.0,300mM NaCl和250mM咪唑的100μl溶液。将100μl 0.1M甘氨酸(pH 3.0)等分到ANTI-FLAGM2的高容量板的每孔中。在37℃孵育板20分钟以洗脱靶蛋白。从板除去洗脱的样品并置于清洁管中。每个样品用0.2%脱氧胆酸钠溶液(Sigma D3691)稀释到终体积500μl。将样品快速涡旋并在室温孵育10分钟。向每个样品加入50μl 100%三氯乙酸溶液(TCA)(Sigma T6323),将它们短暂涡旋并置于冰上孵育15分钟。在室温以15,000×g离心样品10分钟,并倒出上清液。向每管加入500μl 25%丙酮溶液(Sigma A5351)。将样品短暂涡旋并以15,000×g离心5分钟。倒出上清液并在SpeedVac中30℃干燥蛋白质沉淀20分钟。
SDS-PAGE分析。每种蛋白质重悬浮在10μl Laemmli样品缓冲液(Sigma S3401)中,用1M NaOH滴定到碱性pH。整个样品通过10-20%Tris-甘氨酸凝胶(BioRad目录号345-0044)电泳。凝胶用EZ BlueTM(SigmaG1041)凝胶染色试剂染色1小时,用去离子水过夜脱色。
结果和讨论。来自酶免疫检测测定法的校正的A450读数表明在HIS-SelectTM和ANTI-FLAGM2高灵敏板上成功地捕获靶蛋白。多种去污剂制剂能够裂解细胞,允许捕获蛋白质。图4描绘了来自ANTI-FLAGM2高灵敏板测定的校正的吸收值,其表明具有DYKDDDDK(SEQ.ID.NO.1)标记的那些蛋白质被捕获,而没有DYKDDDDK(SEQ.ID.NO.1)标记的那些蛋白质未被捕获。图5包含来自HIS-SelectTM高灵敏板免疫检测测定的校正的吸收值,并且表明板能够选择性捕获his-标记的靶蛋白,而不捕获无his-标记的蛋白质。类似地,图6中的SDS-PAGE结果表明靶蛋白被成功捕获并从HIS-SelectTM高容量板洗脱。从ANTI-FLAGM2高容量板得到类似结果。表6指出了用于图6的每个泳道的所用试剂和样品的组成。
表6用于SDS-PAGE分析的裂解试剂和样品组成
| 泳道编号 | 板中的裂解试剂 | 样品的组成 |
| 1 | N/A | 分子量标记(Sigma产品M3913) |
| 2 | N/A | 10μl表达~60kDa his标记蛋白质的大肠杆菌细胞 |
| 3 | 1%SB 3-10,0.1%C7BzO,0.1%正十二烷基α-D-麦芽糖苷,0.1%Triton X-100,20mM Tris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 4 | 10%CHAPS,0.5%ASB-14,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 5 | 1%SB 3-14,0.1%C7BzO,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 6 | 1%CHAPS,0.5%正-辛基葡糖苷,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 7 | 1%SB 3-12,0.1%C7BzO,20mM | 用咪唑从HIS-SelectTM |
| Tris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 高容量板洗脱的样品 | |
| 8 | 1%SB 3-14,0.1%ABS-14,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 9 | 0.5%正-辛基葡糖苷,0.5%CHAPS,0.1%正十二烷基α-D-麦芽糖苷,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 10 | 4%CHAPS,40mM Tris-HCl,pH8.0,0.02%溶菌酶,0.005%脱氧核糖核酸酶I(Sigma D4527) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 11 | N/A | 分子量标记(Sigma产品M3913) |
| 12 | N/A | 10μl表达~24kDa his标记蛋白质的大肠杆菌细胞 |
| 13 | 1%SB 3-10,0.1%C7BzO,0.1%正十二烷基α-D-麦芽糖苷,0.1%Triton X-100,20mM Tris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 14 | 10%CHAPS,0.5%ASB-14,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(Sigma | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| E1014) | ||
| 15 | 1%SB 3-14,0.1%C7BzO,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 16 | 1%CHAPS,0.5%正-辛基葡糖苷,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 17 | 1%SB 3-12,0.1%C7BzO,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 18 | 1%SB 3-14,0.1%ABS-14,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 19 | 0.5%正-辛基葡糖苷,0.5%CHAPS,0.1%正十二烷基α-D-麦芽糖苷,20mMTris-HCl,pH7.4,0.02%溶菌酶,0.005%Benzonase内切核酸酶(SigmaE1014) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 20 | 4%CHAPS,40mM Tris-HCl,pH8.0,0.02%溶菌酶,0.005%脱氧核糖核酸酶I(Sigma D4527) | 用咪唑从HIS-SelectTM高容量板洗脱的样品 |
| 21 | N/A | 分子量标记(Sigma产品M3913) |
Claims (28)
1.用于从宿主细胞提取细胞组分的容器,所述容器具有口、内表面、体积V和至少一部分内表面上裂解试剂的涂层,所述内表面包含侧壁结构和底部,当含有宿主细胞的液体悬浮物导入容器时,涂层中裂解试剂的量足够形成能够裂解宿主细胞的裂解溶液,经涂布的内表面的面积SA与体积V的比值小于约4mm2/μl。
2.用于从宿主细胞提取和分离细胞组分的容器,该容器具有口、内表面、体积V、裂解试剂和受支持的捕获配体,侧壁结构在底部和口之间,口作为向容器导入液体的入口和从容器除去液体的出口,所述内表面包含侧壁结构和底部,其中捕获配体在容器中的一个位置受到支持,当含有完整宿主细胞或者固体细胞组分的液体悬浮物通过容器口导入容器时,所述位置允许捕获配体接触完整宿主细胞或者从其来源的固体细胞组分。
3.用于从宿主细胞提取细胞组分的多孔板,所述多孔板的至少一个孔含有裂解试剂,其中裂解试剂(i)涂在孔的至少一部分内表面上,或者(ii)为孔中所含的材料块的形式。
4.权利要求3的多孔板,其中孔还包含细胞组分的捕获配体。
5.权利要求1或2的容器或者权利要求3的多孔板,其中裂解试剂选自去污剂、分解酶、离液剂和它们的组合。
6.权利要求5的容器或多孔板,其中裂解试剂是去污剂并且该去污剂选自3-[3-(胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐、辛基-β-硫代吡喃葡糖苷、辛基-吡喃葡糖苷、3-(4-庚基)苯基3-羟基丙基)二甲基铵基丙烷磺酸盐、3-[N,N-二甲基(3-肉豆蔻酰基氨基丙基)铵基]丙烷磺酸盐、3-(癸基二甲基铵基)丙烷磺酸内盐、3-(十二烷基二甲基铵基)丙烷磺酸内盐、3-(N,N-二甲基肉豆蔻基铵基)丙烷磺酸盐、正-十二烷基α-D-麦芽糖苷和它们的组合。
7.权利要求5的容器或多孔板,其中裂解试剂是分解酶并且分解酶选自β葡糖醛酸糖苷酶、葡聚糖酶、蜗牛酶、溶菌酶、溶细胞酶、甘露聚糖酶、变溶菌素、消解酶、纤维素酶、溶葡萄球菌素、果胶酶、链球菌溶血素O,和它们的多种组合。
8.权利要求5的容器或多孔板,其中裂解试剂是离液剂并且所述离液剂选自尿素、盐酸胍、硫氰酸胍、硫代硫酸胍和硫脲,或它们的任意组合。
9.权利要求5的容器或多孔板,其中裂解试剂还包含缓冲剂、消泡剂、膨胀剂、底物结合酶,或者酶抑制剂,或者它们的任意组合。
10.权利要求2的容器或者权利要求4的多孔板,其中捕获配体是金属螯合物、谷胱甘肽、生物素、链霉抗生物素蛋白、抗体、带电颗粒,或者不溶性疏水基团。
11.权利要求10的容器或多孔板,其中捕获配体是对SEQ.ID.NO.1、SEQ.ID.NO.2或SEQ.ID.NO.3特异的抗体。
12.权利要求10的容器或多孔板,其中捕获配体是金属螯合物,其来源于相应于下式的成分:
其中
Q是载体;
S1是间隔区;
L是-A-T-CH(X)-或-C(=O)-;
A是醚、硫醚、硒醚或者酰胺键;
T是键或者经取代或未经取代的烷基或者链烯基;
X是-(CH2)kCH3、-(CH2)kCOOH、-(CH2)kSO3H、-(CH2)kPO3H2、-(CH2)kN(J)2、或-(CH2)kP(J)2、优选-(CH2)kCOOH或-(CH2)kSO3H;
k为0到2的整数;
J为烃基或者取代烃基;
Y为-COOH、-H、-SO3H、-PO3H2、-N(J)2、或-P(J)2、优选-COOH;
Z为-COOH、-H、-SO3H、-PO3H2、-N(J)2或-P(J)2、优选-COOH;
和
i为0到4的整数,优选1或2。
13.权利要求12的容器或多孔板,其中金属螯合物来源于选自下面的组分:
和
其中Q为载体。
14.从宿主细胞提取细胞组分的方法,该方法包含:(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积V,和至少一部分内表面上的裂解试剂涂层,所述内表面包含侧壁结构和底部,经涂布的内表面的面积SA与体积V的比值小于约4mm2/μl,和(b)裂解容器中的宿主细胞以释放细胞组分和形成细胞残渣。
15.从宿主细胞提取和分离细胞组分的方法,该方法包含(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积V、裂解试剂和受支持的捕获配体,所述内表面包含侧壁结构和底部,侧壁结构在底部和口之间,口作为向容器导入液体的入口和从容器除去液体的出口,(b)裂解容器中的宿主细胞以释放细胞组分和形成固态细胞残渣;和(c)在固态细胞残渣的存在下用捕获配体捕获细胞组分。
16.制备用于从宿主细胞提取细胞组分的容器或多孔板的方法,所述方法包含将容器或者多孔板的多个孔的内表面与含有裂解试剂的液体接触并干燥液体以在容器或者孔的内表面上形成裂解试剂的吸附层。
17.权利要求14、15或16的方法,其中裂解试剂选自去污剂、分解酶、离液剂和它们的组合。
18.权利要求17的方法,其中裂解试剂是去污剂并且去污剂选自3-[3-(胆酰氨基丙基)二甲基铵基]-1-丙烷磺酸盐、辛基-β-硫代吡喃葡糖苷、辛基-吡喃葡糖苷、3-(4-庚基)苯基3-羟基丙基)二甲基铵基丙烷磺酸盐、3-[N,N-二甲基(3-肉豆蔻酰基氨基丙基)铵基]丙烷磺酸盐、3-(癸基二甲基铵基)丙烷磺酸内盐、3-(十二烷基二甲基铵基)丙烷磺酸内盐、3-(N,N-二甲基肉豆蔻基铵基)丙烷磺酸盐、正-十二烷基α-D-麦芽糖苷和它们的组合。
19.权利要求17的方法,其中裂解试剂是分解酶并且所述分解酶选自β葡糖醛酸糖苷酶、葡聚糖酶、蜗牛酶、溶菌酶、溶细胞酶、甘露聚糖酶、变溶菌素、消解酶、纤维素酶、溶葡萄球菌素、果胶酶、链球菌溶血素O,和它们的多种组合。
20.权利要求17的方法,其中裂解试剂是离液剂并且所述离液剂选自尿素、盐酸胍、硫氰酸胍、硫代硫酸胍和硫脲,或它们的任意组合。
21.权利要求17的方法,其中裂解试剂还包含缓冲剂、消泡剂、膨胀剂、底物结合酶,或者酶抑制剂,或者它们的任意组合。
22.权利要求15的方法,其中捕获配体是金属螯合物、谷胱甘肽、生物素、链霉抗生物素蛋白、抗体、带电颗粒,或者不溶性疏水基团。
23.权利要求22的方法,其中捕获配体是对SEQ.ID.NO.1、SEQ.ID.NO.2或SEQ.ID.NO.3特异的抗体。
24.权利要求22的方法,其中捕获配体是金属螯合物,其来源于相应于下式的成分:
其中
Q是载体;
S1是间隔区;
L是-A-T-CH(X)-或-C(=O)-;
A是醚、硫醚、硒醚或者酰胺键;
T是键或者经取代或未经取代的烷基或者链烯基;
X是-(CH2)kCH3、-(CH2)kCOOH、-(CH2)kSO3H、-(CH2)kPO3H2、-(CH2)kN(J)2、或-(CH2)kP(J)2、优选-(CH2)kCOOH或-(CH2)kSO3H;
k为0到2的整数;
J为烃基或者取代烃基;
Y为-COOH、-H、-SO3H、-PO3H2、-N(J)2、或-P(J)2、优选-COOH;
Z为-COOH、-H、-SO3H、-PO3H2、-N(J)2或-P(J)2、优选-COOH;
和
i为0到4的整数,优选1或2。
25.从宿主细胞提取和分离细胞组分的方法,该方法包含(a)将含有宿主细胞的液体悬浮物导入容器,该容器具有口、内表面、体积V、裂解试剂和受支持的捕获配体,所述内表面包含侧壁结构和底部,侧壁结构在底部和口之间,口作为向容器导入液体的入口,(b)裂解容器中的宿主细胞以释放细胞组分和形成固态细胞残渣;和(c)在固态细胞残渣的存在下用捕获配体捕获细胞组分,(d)从捕获配体释放细胞组分,和(e)回收释放的细胞组分。
26.用于从宿主细胞提取和分离细胞组分的试剂盒,所述试剂盒包含权利要求1或2的容器或者权利要求3的多孔板和从宿主细胞提取和分离细胞组分的使用说明书。
27.权利要求26的试剂盒,其还包含用于测定或检测被捕获的细胞组分的试剂。
28.权利要求2的容器,其中该容器包含具有内腔的柱,所述腔包含结合有捕获配体的树脂床和包含裂解试剂的冻干块。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US46767903P | 2003-05-02 | 2003-05-02 | |
| US60/467,679 | 2003-05-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1813059A true CN1813059A (zh) | 2006-08-02 |
Family
ID=33435104
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA2004800181938A Pending CN1813059A (zh) | 2003-05-02 | 2004-05-03 | 固相细胞裂解和捕获平台 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20040259162A1 (zh) |
| EP (1) | EP1656443A4 (zh) |
| JP (1) | JP2006525807A (zh) |
| KR (1) | KR20060036901A (zh) |
| CN (1) | CN1813059A (zh) |
| AU (1) | AU2004236740A1 (zh) |
| CA (1) | CA2524393A1 (zh) |
| WO (1) | WO2004099384A2 (zh) |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102317424A (zh) * | 2009-02-11 | 2012-01-11 | Cg生物技术有限公司 | 用于处理源自人/动物的移植用组织的清洗组合物 |
| CN102796726A (zh) * | 2011-05-24 | 2012-11-28 | 博奥生物有限公司 | 混合微生物核酸的提取方法 |
| CN102796727A (zh) * | 2011-05-24 | 2012-11-28 | 博奥生物有限公司 | 革兰氏阳性细菌核酸提取方法 |
| CN103890176A (zh) * | 2011-09-06 | 2014-06-25 | 西北大学 | 制备生物材料的方法 |
| CN104053992A (zh) * | 2012-01-16 | 2014-09-17 | 皇家飞利浦有限公司 | 确定包括细胞的体液中的靶分子的存在 |
| CN104185661A (zh) * | 2012-01-18 | 2014-12-03 | 苏尔莫迪克斯公司 | 低微粒的润滑性医疗装置涂层 |
| CN108265105A (zh) * | 2018-03-26 | 2018-07-10 | 郑州安图生物工程股份有限公司 | 用于快速进行核酸检测的痰液前处理方法 |
| CN109694809A (zh) * | 2018-11-19 | 2019-04-30 | 昆山汇先医药技术有限公司 | 用于捕获生物分子、细胞或细菌的捕获筛及其制备方法 |
| CN113186102A (zh) * | 2021-04-09 | 2021-07-30 | 湖南中晟全肽生化有限公司 | 一种新型的细菌裂解的方法 |
| CN113227344A (zh) * | 2018-12-31 | 2021-08-06 | 美国圣戈班性能塑料公司 | 含有可降解载体的容器 |
| CN114019160A (zh) * | 2022-01-05 | 2022-02-08 | 广州科方生物技术股份有限公司 | 一种用于冠状病毒释放n蛋白的释放剂及其制备方法和应用 |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040067532A1 (en) | 2002-08-12 | 2004-04-08 | Genetastix Corporation | High throughput generation and affinity maturation of humanized antibody |
| CA2526409A1 (en) * | 2003-05-19 | 2004-12-02 | Brandeis University | Nucleic acid processing methods, kits and devices |
| EP1664295A4 (en) * | 2003-09-09 | 2007-12-05 | Fujifilm Corp | PROCESS FOR INSULATING AND PURIFYING NUCLEIC ACID |
| WO2006026248A1 (en) * | 2004-08-25 | 2006-03-09 | Sigma-Aldrich Co. | Compositions and methods employing zwitterionic detergent combinations |
| US20060199203A1 (en) * | 2005-02-18 | 2006-09-07 | Atom Sciences | Extraction of high-purity DNA and RNA |
| JP2007006799A (ja) * | 2005-06-30 | 2007-01-18 | Tokyo Institute Of Technology | プラスミドdnaの精製方法及びプラスミドdna精製用キット |
| US7923054B2 (en) * | 2006-04-19 | 2011-04-12 | Gore Enterprise Holdings, Inc. | Functional porous substrates for attaching biomolecules |
| WO2008134472A1 (en) * | 2007-04-25 | 2008-11-06 | 3M Innovative Properties Company | Compositions, methods, and devices for isolating biological materials |
| WO2008150826A1 (en) * | 2007-05-31 | 2008-12-11 | Ge Healthcare Uk Limited | Modified spin column for simple and rapid plasmid dna extraction |
| MX2010002661A (es) | 2007-09-14 | 2010-05-20 | Adimab Inc | Bancos de anticuerpos sinteticos, designados racionalmente y usos para los mismos. |
| US8877688B2 (en) | 2007-09-14 | 2014-11-04 | Adimab, Llc | Rationally designed, synthetic antibody libraries and uses therefor |
| US20110044968A1 (en) * | 2008-03-10 | 2011-02-24 | Pharmal N Corporation | Compositions for treatment with metallopeptidases, methods of making and using the same |
| DE102008026058A1 (de) * | 2008-05-30 | 2009-12-03 | Qiagen Gmbh | Lyse, Binde- und/oder Waschreagenz verwendbar zur Isolierung und/oder Reinigung von Nukleinsäuren |
| US9034277B2 (en) * | 2008-10-24 | 2015-05-19 | Honeywell International Inc. | Surface preparation for a microfluidic channel |
| US20120264137A1 (en) * | 2011-04-18 | 2012-10-18 | Indian Institute Of Science | Techniques for bufferless lysing of cells and separation of cellular components using modified membranes |
| CN103889562B (zh) * | 2011-05-27 | 2017-09-08 | 康奈尔大学 | 纳米粒子官能化的膜及其制备方法和用途 |
| ES2937410T3 (es) | 2011-09-26 | 2023-03-28 | Qiagen Gmbh | Método rápido para aislar ácidos nucleicos extracelulares |
| EP2888363B1 (en) * | 2012-08-21 | 2018-06-06 | Qiagen GmbH | Method for isolating nucleic acids from a formaldehyde releaser stabilized sample |
| JP6433075B2 (ja) * | 2012-11-07 | 2018-12-05 | キアゲン ゲーエムベーハー | 診断アッセイのための制御 |
| US9555016B2 (en) | 2013-06-10 | 2017-01-31 | Covidien Lp | Lytic agents for use in treating intravascular clots |
| DE102013113130B4 (de) | 2013-11-27 | 2022-01-27 | Välinge Innovation AB | Verfahren zur Herstellung einer Fußbodendiele |
| WO2016023009A1 (en) * | 2014-08-07 | 2016-02-11 | Wake Forest University Health Sciences | Compositions and methods for clearing a biological sample |
| ES2872549T3 (es) | 2015-06-10 | 2021-11-02 | Qiagen Gmbh | Método para aislar ácidos nucleicos extracelulares usando partículas de intercambio aniónico |
| CA2995204A1 (en) | 2015-08-10 | 2017-02-16 | Essenlix Corp. | Bio/chemical assay devices and methods for simplified steps, small samples, accelerated speed, and ease-of-use |
| CA2998587C (en) | 2015-09-14 | 2023-01-10 | Essenlix Corp. | Device and system for analyzing a sample, particularly blood, as well as methods of using the same |
| WO2017048881A1 (en) | 2015-09-14 | 2017-03-23 | Essenlix Corporation | Device and system for collecting and analyzing vapor condensate, particularly exhaled breath condensate, as well as method of using the same |
| EP3558121B1 (en) | 2016-12-21 | 2022-06-08 | Essenlix Corporation | Devices and methods for authenticating a sample and use of the same |
| EP3579981A4 (en) | 2017-02-07 | 2021-03-31 | Essenlix Corporation | COMPRESSED OPEN FLOW TEST AND USE |
| CN111936837B (zh) | 2017-02-08 | 2024-06-07 | 上海宜晟生物科技有限公司 | Qmax测定及应用 |
| CN111656155B (zh) | 2017-02-08 | 2024-05-31 | 上海宜晟生物科技有限公司 | 用于延迟分析的样品采集和操作 |
| CN111316096B (zh) | 2017-02-08 | 2023-08-11 | Essenlix公司 | 生物/化学材料提取和测定 |
| WO2018148461A1 (en) | 2017-02-09 | 2018-08-16 | Essenlix Corp. | Assay with amplification |
| US11883824B2 (en) | 2017-02-09 | 2024-01-30 | Essenlix Corporation | Assay using different spacing heights |
| CN110770572B (zh) | 2017-02-09 | 2023-08-18 | Essenlix公司 | 比色测定 |
| US11523752B2 (en) | 2017-02-16 | 2022-12-13 | Essenlix Corporation | Assay for vapor condensates |
| US11243201B2 (en) | 2017-08-01 | 2022-02-08 | Essenlix Corporation | Sample collection, holding and assaying |
| US11280706B2 (en) | 2017-08-01 | 2022-03-22 | Essenlix Corporation | Dilution calibration |
| WO2019028133A1 (en) | 2017-08-01 | 2019-02-07 | Essenlix Corporation | DEVICES AND METHODS FOR EXAMINING THE EFFECTS OF MEDICINE ON MICROORGANISMS |
| US11393561B2 (en) | 2017-10-13 | 2022-07-19 | Essenlix Corporation | Devices and methods for authenticating a medical test and use of the same |
| US10807095B2 (en) | 2017-10-26 | 2020-10-20 | Essenlix Corporation | Making and tracking assay card |
| US11237113B2 (en) | 2017-10-26 | 2022-02-01 | Essenlix Corporation | Rapid pH measurement |
| US11609224B2 (en) | 2017-10-26 | 2023-03-21 | Essenlix Corporation | Devices and methods for white blood cell analyses |
| WO2019118652A1 (en) | 2017-12-12 | 2019-06-20 | Essenlix Corporation | Sample manipulation and assay with rapid temperature change |
| US11510608B2 (en) | 2017-12-14 | 2022-11-29 | Essenlix Corporation | Devices, systems, and methods for monitoring hair |
| US11156606B2 (en) | 2018-01-11 | 2021-10-26 | Essenlix Corporation | Homogeneous assay (II) |
| US11885952B2 (en) | 2018-07-30 | 2024-01-30 | Essenlix Corporation | Optics, device, and system for assaying and imaging |
| EP3847130A4 (en) | 2018-09-07 | 2022-06-22 | Kremenak Nanotech, Inc. | PROCESS FOR THE MANUFACTURE OF FUNCTIONALIZED POWDER PARTICLES |
| US11725202B2 (en) * | 2018-10-19 | 2023-08-15 | WinField Solutions. LLC | Soil-based DNA extraction |
| CN109679823B (zh) * | 2018-11-19 | 2022-03-15 | 江苏汇先医药技术有限公司 | 一种用于生物分子、细胞或细菌的捕获材料及捕获筛 |
| CN113924363B (zh) * | 2019-09-05 | 2024-01-19 | 中国石油大学(北京) | 提取稠油基因组脱氧核糖核酸的方法及试剂盒和应用 |
| JP2023516808A (ja) * | 2020-03-09 | 2023-04-20 | アイデックス ラボラトリーズ インコーポレイテッド | 液体サンプルの干渉成分を化学試薬検査スライドへの適用前に除去するための方法 |
| JP2023516807A (ja) * | 2020-03-09 | 2023-04-20 | アイデックス ラボラトリーズ インコーポレイテッド | 液体サンプルの成分を除去するために使用されるマトリックスならびに関連のサンプルカップまたは混合カップ |
| WO2024162396A1 (ja) * | 2023-02-02 | 2024-08-08 | 国立大学法人北海道大学 | 免疫介在性疾患の自己抗原の検出方法および免疫介在性疾患の自己抗原を検出するためのキット |
Family Cites Families (66)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL33640A (en) * | 1969-01-16 | 1973-05-31 | Kabi Ab | Test strip packaged-unit |
| US4032663A (en) * | 1971-12-14 | 1977-06-28 | Kumiai Chemical Industry Co., Ltd. | Process for using cell wall-lysing enzymes |
| US4503143A (en) * | 1982-08-20 | 1985-03-05 | Btc Diagnostics Limited Partnership | Enzyme immunoassay with two-part solution of tetramethylbenzidine as chromogen |
| US4554248A (en) * | 1982-11-08 | 1985-11-19 | American Home Products Corporation | Composition and method for detecting Antistreptolysin O |
| US4525452A (en) * | 1983-01-24 | 1985-06-25 | Btc Diagnostics Limited Partnership | Enzyme immunoassay with step of immersing sample in deionized water |
| US4703004A (en) * | 1984-01-24 | 1987-10-27 | Immunex Corporation | Synthesis of protein with an identification peptide |
| US4569794A (en) * | 1984-12-05 | 1986-02-11 | Eli Lilly And Company | Process for purifying proteins and compounds useful in such process |
| US5047513A (en) * | 1986-07-10 | 1991-09-10 | Hoffmann-La Roche Inc. | Metal chelate resins |
| US4859613A (en) * | 1986-11-12 | 1989-08-22 | Lawrence David A | Immunoassays for glutathione and antibodies useful therein |
| US4851341A (en) * | 1986-12-19 | 1989-07-25 | Immunex Corporation | Immunoaffinity purification system |
| US5011912A (en) * | 1986-12-19 | 1991-04-30 | Immunex Corporation | Hybridoma and monoclonal antibody for use in an immunoaffinity purification system |
| CA1340522C (en) * | 1987-03-10 | 1999-05-04 | Heinz Dobeli | Fusion proteins containing neighbouring histidines for improved purification |
| US4741619A (en) * | 1987-05-05 | 1988-05-03 | Molecular Devices Corporation | Hydrophilic microplates for vertical beam photometry |
| US5654176A (en) * | 1987-05-28 | 1997-08-05 | Amrad Corporation Limited | Fusion proteins containing glutathione-s-transferase |
| US5232833A (en) * | 1988-09-14 | 1993-08-03 | Stressgen Biotechnologies Corporation | Accumulation of heat shock proteins for evaluating biological damage due to chronic exposure of an organism to sublethal levels of pollutants |
| US5104789A (en) * | 1989-05-15 | 1992-04-14 | The United States Of America, As Represented By The Secretary Of Agriculture | Monoclonal antibodies which discriminate between strains of citrus tristeza virus |
| US5594115A (en) * | 1990-04-09 | 1997-01-14 | Pharmacia & Upjohn Company | Process of purifying recombinant proteins and compounds useful in such process |
| DE4139664A1 (de) * | 1991-12-02 | 1993-06-03 | Diagen Inst Molekularbio | Vorrichtung und verfahren zur isolierung und reinigung von nukleinsaeuren |
| DE4237113B4 (de) * | 1992-11-03 | 2006-10-12 | "Iba Gmbh" | Peptide und deren Fusionsproteine, Expressionsvektor und Verfahren zur Herstellung eines Fusionsproteins |
| US5416003A (en) * | 1993-04-14 | 1995-05-16 | Litmus Concepts, Inc. | Reporter enzyme release technology: methods of assaying for the presence of aspartic proteases and other hydrolytic enzyme activities |
| ES2062955B1 (es) * | 1993-04-29 | 1995-06-16 | Repsol Quimica Sa | Procedimiento para la extraccion de polihidroxialcanoatos de bacterias halofilas que lo contienen. |
| AU8132894A (en) * | 1993-11-12 | 1995-05-29 | Procter & Gamble Company, The | Liquid hard surface detergent compositions containing amphoteric detergent surfactant and perfume |
| DE59503891D1 (de) * | 1994-03-09 | 1998-11-19 | Clariant Gmbh | Fluorhaltige Carboxylbetaine und Alkylsulfobetaine sowie deren Mischungen mit gesättigten Fluoralkyaminen |
| US5837529A (en) * | 1994-10-17 | 1998-11-17 | Genzyme Corporation | Method for lysing cells |
| JPH08178926A (ja) * | 1994-10-25 | 1996-07-12 | Sumitomo Pharmaceut Co Ltd | イムノアッセイプレートおよびその用途 |
| US6174729B1 (en) * | 1995-01-10 | 2001-01-16 | Aftab Alam | Method, and kit for total protein assay |
| DK0805855T3 (da) * | 1995-01-27 | 2007-06-25 | Genencor Int | Overfladeaktivt middel-baseret enzymekstraktionsproces |
| US6344343B1 (en) * | 1995-03-21 | 2002-02-05 | The Regents Of The University Of Colorado | Product and process for membrane and soluble polypeptide segregation |
| US5922534A (en) * | 1995-03-28 | 1999-07-13 | Hewlett-Packard Company | Dry biochemical assay plate and method for making the same |
| US5624711A (en) * | 1995-04-27 | 1997-04-29 | Affymax Technologies, N.V. | Derivatization of solid supports and methods for oligomer synthesis |
| WO1996041810A1 (en) * | 1995-06-08 | 1996-12-27 | Progen Industries Limited | Method and apparatus for dna extraction |
| US5691152A (en) * | 1995-11-09 | 1997-11-25 | E. R. Squibb & Sons, Inc. | Stable avidin composition |
| US6090620A (en) * | 1995-12-29 | 2000-07-18 | University Of Washington | Genes and gene products related to Werner's syndrome |
| US20030139578A1 (en) * | 1996-03-25 | 2003-07-24 | Incyte Genomics, Inc. | Antibodies specifically binding PDE8A and PDE8B |
| US5985593A (en) * | 1996-10-11 | 1999-11-16 | Integrated Research Technology, L.L.C. | Compositions and methods for enzymatic decontamination |
| EP0943094A2 (en) * | 1996-12-05 | 1999-09-22 | Idego ApS | Sensor laminates and multi-sectioned fluid delivery devices for detecting by immunoassay target molecules in biological fluids |
| US6383810B2 (en) * | 1997-02-14 | 2002-05-07 | Invitrogen Corporation | Dry powder cells and cell culture reagents and methods of production thereof |
| EP0863402B1 (en) * | 1997-03-03 | 2005-09-14 | Amersham Biosciences UK Limited | In-situ cell extraction and assay method |
| CA2285384C (en) * | 1997-03-28 | 2012-10-16 | Epitope, Inc. | Simultaneous collection of dna and non-nucleic analytes from oral fluids |
| US6348318B1 (en) * | 1997-04-04 | 2002-02-19 | Biosite Diagnostics | Methods for concentrating ligands using magnetic particles |
| US6106779A (en) * | 1997-10-02 | 2000-08-22 | Biosite Diagnostics, Inc. | Lysis chamber for use in an assay device |
| US6040182A (en) * | 1997-11-12 | 2000-03-21 | Becton Dickinson And Company | Method and materials for efficiency protein immobilization on tissue culture treated assay plates |
| US6596532B1 (en) * | 1997-12-12 | 2003-07-22 | BIOMéRIEUX, INC. | Device for isolation and surface culture of microorganisms from bulk fluids |
| US5948227A (en) * | 1997-12-17 | 1999-09-07 | Caliper Technologies Corp. | Methods and systems for performing electrophoretic molecular separations |
| AU3454899A (en) * | 1998-03-30 | 1999-10-18 | Cell Therapeutics, Inc. | Methods of separation and detection |
| US6268191B1 (en) * | 1998-09-21 | 2001-07-31 | Robert K. Prud'homme | Enzyme immobilization by imbibing an enzyme solution into dehydrated hydrocolloid gel beads |
| US6746841B1 (en) * | 1999-04-14 | 2004-06-08 | Whatman Inc. | FTA- coated media for use as a molecular diagnostic tool |
| AU778153B2 (en) * | 1998-12-08 | 2004-11-18 | Gene Logic, Inc. | Process for attaching organic molecules to silicon |
| US6174704B1 (en) * | 1998-12-23 | 2001-01-16 | Pierce Chemical Company | Method for recovery of proteins prepared by recombinant DNA procedures |
| EP1069131B1 (en) * | 1999-07-15 | 2006-03-15 | Qiagen GmbH | Methods for separating particulate substrates from solution while minimizing particle loss |
| CA2386239A1 (en) * | 1999-10-04 | 2001-04-12 | University Of Medicine And Dentistry Of New Jersey | Methods for identifying rna binding compounds |
| US6406840B1 (en) * | 1999-12-17 | 2002-06-18 | Biomosaic Systems, Inc. | Cell arrays and the uses thereof |
| US20020061599A1 (en) * | 1999-12-30 | 2002-05-23 | Elling Christian E. | Method of identifying ligands of biological target molecules |
| DE50107945D1 (de) * | 2000-04-11 | 2005-12-15 | Maerz Ofenbau | Verfahren zum Brennen von karbonathaltigem Material |
| US6623655B1 (en) * | 2000-04-24 | 2003-09-23 | Sigma-Aldrich Co. | Metal chelating compositions |
| AU2001273432A1 (en) * | 2000-07-13 | 2002-01-30 | Invitrogen Corporation | Methods and compositions for rapid protein and peptide extraction and isolation using a lysis matrix |
| WO2002030562A1 (en) * | 2000-10-10 | 2002-04-18 | Aviva Biosciences Corporation | An integrated biochip system for sample preparation and analysis |
| WO2002065125A1 (en) * | 2001-02-13 | 2002-08-22 | Invitrogen Corporation | Methods and compositions for isolation of biological macromolecules |
| JP4651868B2 (ja) * | 2001-03-28 | 2011-03-16 | 株式会社ジーシー | 唾液の前処理用キット及びこれを用いた唾液の前処理方法 |
| US6825032B2 (en) * | 2001-05-14 | 2004-11-30 | Sigma-Aldrich Co. | High capacity assay platforms |
| AUPR703601A0 (en) * | 2001-08-15 | 2001-09-06 | Peter Maccallum Cancer Institute, The | Identification and isolation of somatic stem cells and uses thereof |
| AU2003274972A1 (en) * | 2002-09-13 | 2004-04-30 | Inhibitex, Inc. | Bioinformatic method for identifying surface-anchored proteins from gram-positive bacteria and proteins obtained thereby |
| US20040180445A1 (en) * | 2003-03-12 | 2004-09-16 | Domanico Michael J. | Methods and compositions for purification of nucleic acid from a host cell |
| US9018145B2 (en) * | 2003-12-23 | 2015-04-28 | Lubrizol Oilfield Solutions, Inc. | Foamer composition and methods for making and using same |
| US7094742B2 (en) * | 2004-04-23 | 2006-08-22 | Jelmar, Llc | Hard surface cleaning compositions containing a sultaine and a mixture of organic acids |
| WO2006026248A1 (en) * | 2004-08-25 | 2006-03-09 | Sigma-Aldrich Co. | Compositions and methods employing zwitterionic detergent combinations |
-
2004
- 2004-05-03 AU AU2004236740A patent/AU2004236740A1/en not_active Abandoned
- 2004-05-03 JP JP2006514258A patent/JP2006525807A/ja active Pending
- 2004-05-03 EP EP04751252A patent/EP1656443A4/en not_active Withdrawn
- 2004-05-03 KR KR1020057020839A patent/KR20060036901A/ko not_active Application Discontinuation
- 2004-05-03 CA CA002524393A patent/CA2524393A1/en not_active Abandoned
- 2004-05-03 CN CNA2004800181938A patent/CN1813059A/zh active Pending
- 2004-05-03 US US10/837,776 patent/US20040259162A1/en not_active Abandoned
- 2004-05-03 WO PCT/US2004/013767 patent/WO2004099384A2/en not_active Application Discontinuation
Cited By (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102317424B (zh) * | 2009-02-11 | 2013-06-12 | Cg生物技术有限公司 | 用于处理源自人/动物的移植用组织的清洗组合物 |
| CN102317424A (zh) * | 2009-02-11 | 2012-01-11 | Cg生物技术有限公司 | 用于处理源自人/动物的移植用组织的清洗组合物 |
| CN102796726A (zh) * | 2011-05-24 | 2012-11-28 | 博奥生物有限公司 | 混合微生物核酸的提取方法 |
| CN102796727A (zh) * | 2011-05-24 | 2012-11-28 | 博奥生物有限公司 | 革兰氏阳性细菌核酸提取方法 |
| CN102796727B (zh) * | 2011-05-24 | 2014-06-18 | 博奥生物有限公司 | 革兰氏阳性细菌核酸提取方法 |
| CN103890176B (zh) * | 2011-09-06 | 2016-10-26 | 西北大学 | 制备生物材料的方法 |
| CN103890176A (zh) * | 2011-09-06 | 2014-06-25 | 西北大学 | 制备生物材料的方法 |
| CN104053992A (zh) * | 2012-01-16 | 2014-09-17 | 皇家飞利浦有限公司 | 确定包括细胞的体液中的靶分子的存在 |
| CN104053992B (zh) * | 2012-01-16 | 2016-12-14 | 皇家飞利浦有限公司 | 确定包括细胞的体液中的靶分子的存在 |
| CN104185661B (zh) * | 2012-01-18 | 2016-08-17 | 苏尔莫迪克斯公司 | 低微粒的润滑性医疗装置涂层 |
| CN104185661A (zh) * | 2012-01-18 | 2014-12-03 | 苏尔莫迪克斯公司 | 低微粒的润滑性医疗装置涂层 |
| CN108265105A (zh) * | 2018-03-26 | 2018-07-10 | 郑州安图生物工程股份有限公司 | 用于快速进行核酸检测的痰液前处理方法 |
| CN109694809A (zh) * | 2018-11-19 | 2019-04-30 | 昆山汇先医药技术有限公司 | 用于捕获生物分子、细胞或细菌的捕获筛及其制备方法 |
| CN109694809B (zh) * | 2018-11-19 | 2022-05-10 | 江苏汇先医药技术有限公司 | 用于捕获生物分子、细胞或细菌的捕获筛及其制备方法 |
| CN113227344A (zh) * | 2018-12-31 | 2021-08-06 | 美国圣戈班性能塑料公司 | 含有可降解载体的容器 |
| CN113186102A (zh) * | 2021-04-09 | 2021-07-30 | 湖南中晟全肽生化有限公司 | 一种新型的细菌裂解的方法 |
| CN114019160A (zh) * | 2022-01-05 | 2022-02-08 | 广州科方生物技术股份有限公司 | 一种用于冠状病毒释放n蛋白的释放剂及其制备方法和应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006525807A (ja) | 2006-11-16 |
| EP1656443A4 (en) | 2007-06-06 |
| AU2004236740A1 (en) | 2004-11-18 |
| US20040259162A1 (en) | 2004-12-23 |
| WO2004099384A2 (en) | 2004-11-18 |
| CA2524393A1 (en) | 2004-11-18 |
| EP1656443A2 (en) | 2006-05-17 |
| WO2004099384A3 (en) | 2005-03-24 |
| KR20060036901A (ko) | 2006-05-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1813059A (zh) | 固相细胞裂解和捕获平台 | |
| US7897376B2 (en) | Method for extracting a target product from a host cell employing zwitterionic detergent combinations | |
| EP3647398B1 (en) | Cleaning compositions containing dispersins v | |
| CN1310938C (zh) | 在核酸固相上的吸附 | |
| EP3704219B1 (en) | Polypeptides and compositions comprising such polypeptides | |
| EP3647397A1 (en) | Cleaning compositions containing dispersins iv | |
| US20200347324A1 (en) | Cleaning compositions containing dispersins iii | |
| KR20200071134A (ko) | 디스페르신 ii를 함유하는 세정 조성물 | |
| EP3704240A1 (en) | Polypeptides and compositions comprising such polypeptides | |
| WO2020070249A1 (en) | Cleaning compositions | |
| KR20200071135A (ko) | 디스페르신 i을 함유하는 세정 조성물 | |
| CN1196094A (zh) | 除垢剂酶活性的噬菌体显示 | |
| US20200190437A1 (en) | Cleaning compositions and uses thereof | |
| EP3607060A1 (en) | Detergent compositions and uses thereof | |
| BR112018008454B1 (pt) | Composição detergente que compreende variantes de amilase e protease, seu uso e métodos para lavar | |
| WO2017046232A1 (en) | Detergent compositions comprising polypeptides having xanthan degrading activity | |
| EP3737737A1 (en) | Use of enzyme in removing airborne particulate matter from textile | |
| EP4281531A1 (en) | Liquid enzyme composition with sulfite scavenger | |
| KR20220121235A (ko) | 디스페르신 및 카르보히드라제를 포함하는 세정 조성물 | |
| CN101319009A (zh) | 迟缓爱德华氏菌疫苗抗原及其制备方法 | |
| WO2023194204A1 (en) | Hexosaminidase variants and compositions | |
| CN113366103A (zh) | 具有肽聚糖降解活性的多肽以及编码其的多核苷酸 | |
| FI114921B (fi) | Pesuainekoostumus | |
| Zilda et al. | Identification of protease-producing bacteria isolated from Banyuwedang, Bali, and characterization of its protease | |
| WO2021118814A1 (en) | A detergent composition comprising a polymer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |