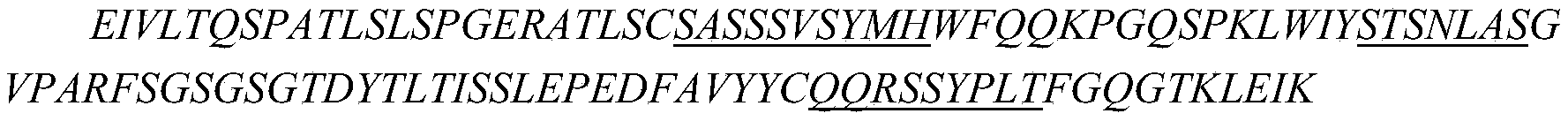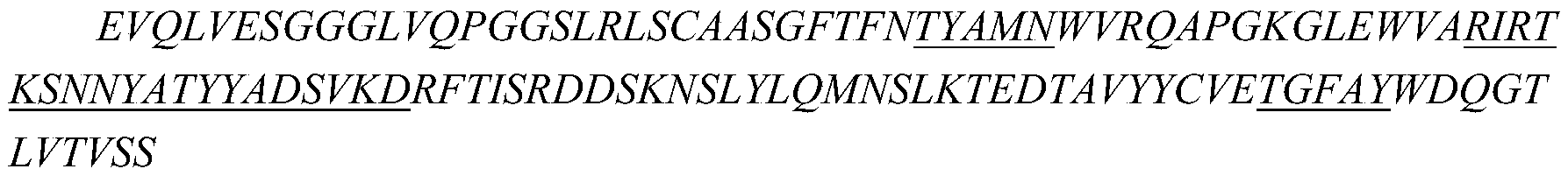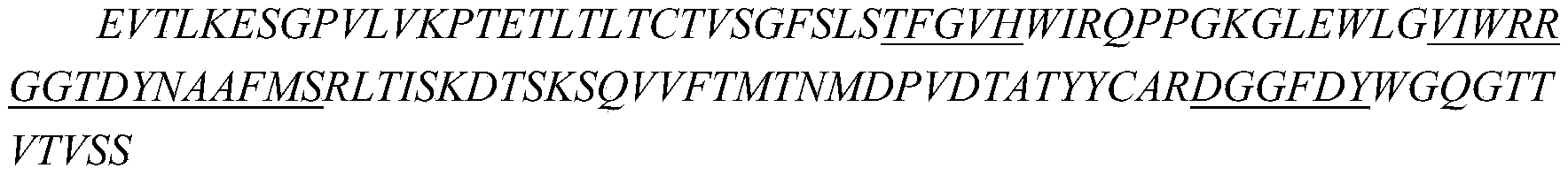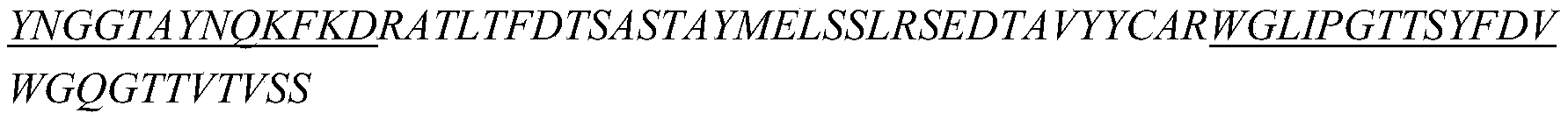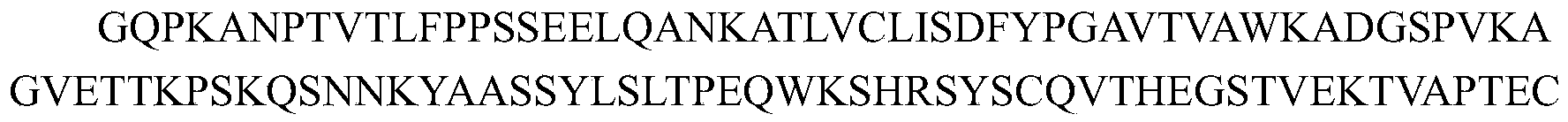CN116391041A - 一种含抗结缔组织生长因子抗体的药物组合物 - Google Patents
一种含抗结缔组织生长因子抗体的药物组合物 Download PDFInfo
- Publication number
- CN116391041A CN116391041A CN202180069825.7A CN202180069825A CN116391041A CN 116391041 A CN116391041 A CN 116391041A CN 202180069825 A CN202180069825 A CN 202180069825A CN 116391041 A CN116391041 A CN 116391041A
- Authority
- CN
- China
- Prior art keywords
- seq
- variable region
- pharmaceutical composition
- chain variable
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 148
- 239000003102 growth factor Substances 0.000 title abstract description 4
- 230000008467 tissue growth Effects 0.000 title abstract description 4
- 239000000872 buffer Substances 0.000 claims description 72
- 239000000243 solution Substances 0.000 claims description 46
- 229930006000 Sucrose Natural products 0.000 claims description 44
- 239000005720 sucrose Substances 0.000 claims description 44
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 43
- 239000000203 mixture Substances 0.000 claims description 39
- QZNNVYOVQUKYSC-JEDNCBNOSA-N (2s)-2-amino-3-(1h-imidazol-5-yl)propanoic acid;hydron;chloride Chemical compound Cl.OC(=O)[C@@H](N)CC1=CN=CN1 QZNNVYOVQUKYSC-JEDNCBNOSA-N 0.000 claims description 29
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 29
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 28
- 229920000053 polysorbate 80 Polymers 0.000 claims description 28
- 229940068968 polysorbate 80 Drugs 0.000 claims description 28
- 238000000034 method Methods 0.000 claims description 27
- 201000010099 disease Diseases 0.000 claims description 24
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 24
- 206010028980 Neoplasm Diseases 0.000 claims description 23
- 101000777550 Homo sapiens CCN family member 2 Proteins 0.000 claims description 22
- 235000000346 sugar Nutrition 0.000 claims description 22
- 150000001413 amino acids Chemical group 0.000 claims description 21
- 238000009472 formulation Methods 0.000 claims description 20
- 239000004094 surface-active agent Substances 0.000 claims description 20
- 239000012931 lyophilized formulation Substances 0.000 claims description 19
- 239000003381 stabilizer Substances 0.000 claims description 13
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 claims description 10
- 239000008351 acetate buffer Substances 0.000 claims description 10
- 238000007912 intraperitoneal administration Methods 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 208000005069 pulmonary fibrosis Diseases 0.000 claims description 9
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 8
- 229920001213 Polysorbate 20 Polymers 0.000 claims description 8
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 8
- 201000002528 pancreatic cancer Diseases 0.000 claims description 8
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 8
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 claims description 8
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 claims description 8
- 229920000136 polysorbate Polymers 0.000 claims description 8
- 229950008882 polysorbate Drugs 0.000 claims description 8
- 239000004475 Arginine Substances 0.000 claims description 7
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 claims description 7
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 7
- 201000011510 cancer Diseases 0.000 claims description 6
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 5
- 229930195725 Mannitol Natural products 0.000 claims description 5
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims description 5
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims description 5
- 238000004108 freeze drying Methods 0.000 claims description 5
- 239000000594 mannitol Substances 0.000 claims description 5
- 235000010355 mannitol Nutrition 0.000 claims description 5
- 229920001993 poloxamer 188 Polymers 0.000 claims description 5
- 229940044519 poloxamer 188 Drugs 0.000 claims description 5
- 210000002808 connective tissue Anatomy 0.000 claims description 4
- 230000003176 fibrotic effect Effects 0.000 claims description 4
- 238000001990 intravenous administration Methods 0.000 claims description 4
- 229940068977 polysorbate 20 Drugs 0.000 claims description 4
- 230000002792 vascular Effects 0.000 claims description 4
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 3
- 206010012689 Diabetic retinopathy Diseases 0.000 claims description 3
- 208000010412 Glaucoma Diseases 0.000 claims description 3
- 206010020772 Hypertension Diseases 0.000 claims description 3
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 claims description 3
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 3
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 3
- 208000010125 myocardial infarction Diseases 0.000 claims description 3
- 230000002062 proliferating effect Effects 0.000 claims description 3
- 230000002269 spontaneous effect Effects 0.000 claims description 3
- 238000007920 subcutaneous administration Methods 0.000 claims description 3
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 2
- 201000001320 Atherosclerosis Diseases 0.000 claims description 2
- 206010061692 Benign muscle neoplasm Diseases 0.000 claims description 2
- 206010006187 Breast cancer Diseases 0.000 claims description 2
- 208000026310 Breast neoplasm Diseases 0.000 claims description 2
- 206010007558 Cardiac failure chronic Diseases 0.000 claims description 2
- 206010009944 Colon cancer Diseases 0.000 claims description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 2
- 206010016654 Fibrosis Diseases 0.000 claims description 2
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 2
- 206010023421 Kidney fibrosis Diseases 0.000 claims description 2
- 206010024612 Lipoma Diseases 0.000 claims description 2
- 201000004458 Myoma Diseases 0.000 claims description 2
- 206010033128 Ovarian cancer Diseases 0.000 claims description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 2
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 2
- 206010060862 Prostate cancer Diseases 0.000 claims description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 2
- 206010039710 Scleroderma Diseases 0.000 claims description 2
- 206010003246 arthritis Diseases 0.000 claims description 2
- 230000007882 cirrhosis Effects 0.000 claims description 2
- 206010012601 diabetes mellitus Diseases 0.000 claims description 2
- 206010016629 fibroma Diseases 0.000 claims description 2
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 claims description 2
- 201000007270 liver cancer Diseases 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- 201000008482 osteoarthritis Diseases 0.000 claims description 2
- 229920001983 poloxamer Polymers 0.000 claims description 2
- 229960000502 poloxamer Drugs 0.000 claims description 2
- 102100031168 CCN family member 2 Human genes 0.000 claims 3
- 150000002411 histidines Chemical class 0.000 claims 2
- 238000007918 intramuscular administration Methods 0.000 claims 1
- 102000015225 Connective Tissue Growth Factor Human genes 0.000 description 89
- 108010039419 Connective Tissue Growth Factor Proteins 0.000 description 89
- 108090000623 proteins and genes Proteins 0.000 description 62
- 125000003275 alpha amino acid group Chemical group 0.000 description 57
- 102000004169 proteins and genes Human genes 0.000 description 45
- 210000004027 cell Anatomy 0.000 description 44
- 235000018102 proteins Nutrition 0.000 description 43
- 230000035772 mutation Effects 0.000 description 40
- 230000027455 binding Effects 0.000 description 39
- 238000002474 experimental method Methods 0.000 description 30
- 235000001014 amino acid Nutrition 0.000 description 24
- 239000000427 antigen Substances 0.000 description 24
- 108091007433 antigens Proteins 0.000 description 24
- 102000036639 antigens Human genes 0.000 description 24
- 241001529936 Murinae Species 0.000 description 23
- 239000000523 sample Substances 0.000 description 23
- 230000005764 inhibitory process Effects 0.000 description 20
- 210000004408 hybridoma Anatomy 0.000 description 19
- 102000047612 human CCN2 Human genes 0.000 description 18
- 230000000903 blocking effect Effects 0.000 description 17
- 239000002609 medium Substances 0.000 description 17
- 238000002360 preparation method Methods 0.000 description 17
- 101100219978 Mus musculus Ccn2 gene Proteins 0.000 description 16
- 238000002965 ELISA Methods 0.000 description 15
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 15
- 238000001542 size-exclusion chromatography Methods 0.000 description 15
- 239000006228 supernatant Substances 0.000 description 15
- 241000699670 Mus sp. Species 0.000 description 14
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 14
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 13
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 13
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 12
- 239000003814 drug Substances 0.000 description 12
- 239000007788 liquid Substances 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- 238000000338 in vitro Methods 0.000 description 11
- 238000011534 incubation Methods 0.000 description 11
- 238000012360 testing method Methods 0.000 description 11
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- 238000001514 detection method Methods 0.000 description 10
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 10
- 239000012634 fragment Substances 0.000 description 10
- 238000011282 treatment Methods 0.000 description 10
- 238000003556 assay Methods 0.000 description 9
- 238000011160 research Methods 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 208000024891 symptom Diseases 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 8
- 239000002202 Polyethylene glycol Substances 0.000 description 8
- 210000004899 c-terminal region Anatomy 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 238000005406 washing Methods 0.000 description 8
- 230000004071 biological effect Effects 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 238000010494 dissociation reaction Methods 0.000 description 7
- 230000005593 dissociations Effects 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 238000010828 elution Methods 0.000 description 7
- 210000004602 germ cell Anatomy 0.000 description 7
- 230000003053 immunization Effects 0.000 description 7
- -1 linoleyl-sarcosine Chemical compound 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 230000004048 modification Effects 0.000 description 7
- 238000012986 modification Methods 0.000 description 7
- 238000000746 purification Methods 0.000 description 7
- 238000012216 screening Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 6
- 241000283707 Capra Species 0.000 description 6
- 108091026890 Coding region Proteins 0.000 description 6
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 241000282567 Macaca fascicularis Species 0.000 description 6
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 6
- 108010076504 Protein Sorting Signals Proteins 0.000 description 6
- 239000007853 buffer solution Substances 0.000 description 6
- 238000007710 freezing Methods 0.000 description 6
- 230000008014 freezing Effects 0.000 description 6
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 6
- 238000002649 immunization Methods 0.000 description 6
- 230000005012 migration Effects 0.000 description 6
- 238000013508 migration Methods 0.000 description 6
- 239000012898 sample dilution Substances 0.000 description 6
- 238000003860 storage Methods 0.000 description 6
- 210000003437 trachea Anatomy 0.000 description 6
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 5
- 108010019160 Pancreatin Proteins 0.000 description 5
- 238000002835 absorbance Methods 0.000 description 5
- 238000001042 affinity chromatography Methods 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 239000007979 citrate buffer Substances 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 150000002410 histidine derivatives Chemical class 0.000 description 5
- 239000007928 intraperitoneal injection Substances 0.000 description 5
- 230000007774 longterm Effects 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 229940055695 pancreatin Drugs 0.000 description 5
- 239000008363 phosphate buffer Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 239000008362 succinate buffer Substances 0.000 description 5
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 5
- 238000012286 ELISA Assay Methods 0.000 description 4
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 4
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 4
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 4
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 238000006073 displacement reaction Methods 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 238000001962 electrophoresis Methods 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 230000007717 exclusion Effects 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 238000011049 filling Methods 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 239000012669 liquid formulation Substances 0.000 description 4
- 230000007935 neutral effect Effects 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 238000010254 subcutaneous injection Methods 0.000 description 4
- 239000007929 subcutaneous injection Substances 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- LEAHFJQFYSDGGP-UHFFFAOYSA-K trisodium;dihydrogen phosphate;hydrogen phosphate Chemical compound [Na+].[Na+].[Na+].OP(O)([O-])=O.OP([O-])([O-])=O LEAHFJQFYSDGGP-UHFFFAOYSA-K 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- 229920001817 Agar Polymers 0.000 description 3
- 108010006654 Bleomycin Proteins 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 229920002562 Polyethylene Glycol 3350 Polymers 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000008272 agar Substances 0.000 description 3
- 238000013357 binding ELISA Methods 0.000 description 3
- 229960001561 bleomycin Drugs 0.000 description 3
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 230000007910 cell fusion Effects 0.000 description 3
- 239000003593 chromogenic compound Substances 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 229960000789 guanidine hydrochloride Drugs 0.000 description 3
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 239000012535 impurity Substances 0.000 description 3
- 238000010255 intramuscular injection Methods 0.000 description 3
- 239000007927 intramuscular injection Substances 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 235000013336 milk Nutrition 0.000 description 3
- 239000008267 milk Substances 0.000 description 3
- 210000004080 milk Anatomy 0.000 description 3
- 229910052759 nickel Inorganic materials 0.000 description 3
- 238000001543 one-way ANOVA Methods 0.000 description 3
- 238000005457 optimization Methods 0.000 description 3
- 230000003204 osmotic effect Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 235000020183 skimmed milk Nutrition 0.000 description 3
- 239000001632 sodium acetate Substances 0.000 description 3
- 235000017281 sodium acetate Nutrition 0.000 description 3
- BHZOKUMUHVTPBX-UHFFFAOYSA-M sodium acetic acid acetate Chemical compound [Na+].CC(O)=O.CC([O-])=O BHZOKUMUHVTPBX-UHFFFAOYSA-M 0.000 description 3
- 238000004611 spectroscopical analysis Methods 0.000 description 3
- 210000004989 spleen cell Anatomy 0.000 description 3
- 150000005846 sugar alcohols Chemical class 0.000 description 3
- 238000007492 two-way ANOVA Methods 0.000 description 3
- 238000000825 ultraviolet detection Methods 0.000 description 3
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 2
- NVKAWKQGWWIWPM-ABEVXSGRSA-N 17-β-hydroxy-5-α-Androstan-3-one Chemical compound C1C(=O)CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 NVKAWKQGWWIWPM-ABEVXSGRSA-N 0.000 description 2
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 101500025614 Homo sapiens Transforming growth factor beta-1 Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 208000032056 Radiation Fibrosis Syndrome Diseases 0.000 description 2
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000004075 alteration Effects 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 230000009830 antibody antigen interaction Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 2
- 239000013060 biological fluid Substances 0.000 description 2
- 239000006172 buffering agent Substances 0.000 description 2
- 238000000533 capillary isoelectric focusing Methods 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 230000035605 chemotaxis Effects 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000011033 desalting Methods 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 238000002296 dynamic light scattering Methods 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N ethylene glycol Natural products OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 238000005227 gel permeation chromatography Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- YMAWOPBAYDPSLA-UHFFFAOYSA-N glycylglycine Chemical compound [NH3+]CC(=O)NCC([O-])=O YMAWOPBAYDPSLA-UHFFFAOYSA-N 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000000703 high-speed centrifugation Methods 0.000 description 2
- 238000002744 homologous recombination Methods 0.000 description 2
- 230000006801 homologous recombination Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 102000028416 insulin-like growth factor binding Human genes 0.000 description 2
- 108091022911 insulin-like growth factor binding Proteins 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000002663 nebulization Methods 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000005180 public health Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 238000010839 reverse transcription Methods 0.000 description 2
- 230000037390 scarring Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 229940074404 sodium succinate Drugs 0.000 description 2
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 2
- VBGUQBPWJMPQBI-UHFFFAOYSA-M sodium;butanedioic acid;4-hydroxy-4-oxobutanoate Chemical group [Na+].OC(=O)CCC(O)=O.OC(=O)CCC([O-])=O VBGUQBPWJMPQBI-UHFFFAOYSA-M 0.000 description 2
- DAJSVUQLFFJUSX-UHFFFAOYSA-M sodium;dodecane-1-sulfonate Chemical compound [Na+].CCCCCCCCCCCCS([O-])(=O)=O DAJSVUQLFFJUSX-UHFFFAOYSA-M 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- 238000013112 stability test Methods 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000013595 supernatant sample Substances 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- XPFJYKARVSSRHE-UHFFFAOYSA-K trisodium;2-hydroxypropane-1,2,3-tricarboxylate;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [Na+].[Na+].[Na+].OC(=O)CC(O)(C(O)=O)CC(O)=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O XPFJYKARVSSRHE-UHFFFAOYSA-K 0.000 description 2
- 239000013598 vector Substances 0.000 description 2
- 108010047303 von Willebrand Factor Proteins 0.000 description 2
- 102100036537 von Willebrand factor Human genes 0.000 description 2
- 229960001134 von willebrand factor Drugs 0.000 description 2
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- SERLAGPUMNYUCK-DCUALPFSSA-N 1-O-alpha-D-glucopyranosyl-D-mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O SERLAGPUMNYUCK-DCUALPFSSA-N 0.000 description 1
- OTKWLUKIHNEGIG-UHFFFAOYSA-N 2-[3-(hexadecanoylamino)propyl-dimethylazaniumyl]acetate Chemical compound CCCCCCCCCCCCCCCC(=O)NCCC[N+](C)(C)CC([O-])=O OTKWLUKIHNEGIG-UHFFFAOYSA-N 0.000 description 1
- KKMIHKCGXQMFEU-UHFFFAOYSA-N 2-[dimethyl(tetradecyl)azaniumyl]acetate Chemical compound CCCCCCCCCCCCCC[N+](C)(C)CC([O-])=O KKMIHKCGXQMFEU-UHFFFAOYSA-N 0.000 description 1
- DIHXSRXTECMMJY-MURFETPASA-N 2-[dimethyl-[(9z,12z)-octadeca-9,12-dienyl]azaniumyl]acetate Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC[N+](C)(C)CC([O-])=O DIHXSRXTECMMJY-MURFETPASA-N 0.000 description 1
- LMVGXBRDRZOPHA-UHFFFAOYSA-N 2-[dimethyl-[3-(16-methylheptadecanoylamino)propyl]azaniumyl]acetate Chemical compound CC(C)CCCCCCCCCCCCCCC(=O)NCCC[N+](C)(C)CC([O-])=O LMVGXBRDRZOPHA-UHFFFAOYSA-N 0.000 description 1
- ZKWJQNCOTNUNMF-QXMHVHEDSA-N 2-[dimethyl-[3-[[(z)-octadec-9-enoyl]amino]propyl]azaniumyl]acetate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)NCCC[N+](C)(C)CC([O-])=O ZKWJQNCOTNUNMF-QXMHVHEDSA-N 0.000 description 1
- BMYCCWYAFNPAQC-UHFFFAOYSA-N 2-[dodecyl(methyl)azaniumyl]acetate Chemical compound CCCCCCCCCCCCN(C)CC(O)=O BMYCCWYAFNPAQC-UHFFFAOYSA-N 0.000 description 1
- TYIOVYZMKITKRO-UHFFFAOYSA-N 2-[hexadecyl(dimethyl)azaniumyl]acetate Chemical compound CCCCCCCCCCCCCCCC[N+](C)(C)CC([O-])=O TYIOVYZMKITKRO-UHFFFAOYSA-N 0.000 description 1
- SNQVCAOGQHOSEN-UHFFFAOYSA-N 2-[methyl(octadecyl)amino]acetic acid Chemical compound CCCCCCCCCCCCCCCCCCN(C)CC(O)=O SNQVCAOGQHOSEN-UHFFFAOYSA-N 0.000 description 1
- QFJVDSDGRBUNKZ-UHFFFAOYSA-N 2-[methyl(tetradecyl)azaniumyl]acetate Chemical compound CCCCCCCCCCCCCCN(C)CC(O)=O QFJVDSDGRBUNKZ-UHFFFAOYSA-N 0.000 description 1
- IVLXQGJVBGMLRR-UHFFFAOYSA-N 2-aminoacetic acid;hydron;chloride Chemical compound Cl.NCC(O)=O IVLXQGJVBGMLRR-UHFFFAOYSA-N 0.000 description 1
- YLZOPXRUQYQQID-UHFFFAOYSA-N 3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-1-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]propan-1-one Chemical compound N1N=NC=2CN(CCC=21)CCC(=O)N1CCN(CC1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F YLZOPXRUQYQQID-UHFFFAOYSA-N 0.000 description 1
- BRMWTNUJHUMWMS-UHFFFAOYSA-N 3-Methylhistidine Natural products CN1C=NC(CC(N)C(O)=O)=C1 BRMWTNUJHUMWMS-UHFFFAOYSA-N 0.000 description 1
- DIROHOMJLWMERM-UHFFFAOYSA-N 3-[dimethyl(octadecyl)azaniumyl]propane-1-sulfonate Chemical compound CCCCCCCCCCCCCCCCCC[N+](C)(C)CCCS([O-])(=O)=O DIROHOMJLWMERM-UHFFFAOYSA-N 0.000 description 1
- 229940117976 5-hydroxylysine Drugs 0.000 description 1
- 108010059616 Activins Proteins 0.000 description 1
- 102000005606 Activins Human genes 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 102400000345 Angiotensin-2 Human genes 0.000 description 1
- 101800000733 Angiotensin-2 Proteins 0.000 description 1
- 206010006458 Bronchitis chronic Diseases 0.000 description 1
- HHNJQTAVFGQHBP-UHFFFAOYSA-L C(C)(=O)O.C(C)(=O)[O-].[Mg+2].C(C)(=O)[O-] Chemical compound C(C)(=O)O.C(C)(=O)[O-].[Mg+2].C(C)(=O)[O-] HHNJQTAVFGQHBP-UHFFFAOYSA-L 0.000 description 1
- BMCZJPYYEFQOCO-UHFFFAOYSA-H C(CC(O)(C(=O)[O-])CC(=O)[O-])(=O)[O-].[Mg+2].C(CC(O)(C(=O)O)CC(=O)O)(=O)O.C(CC(O)(C(=O)[O-])CC(=O)[O-])(=O)[O-].[Mg+2].[Mg+2] Chemical compound C(CC(O)(C(=O)[O-])CC(=O)[O-])(=O)[O-].[Mg+2].C(CC(O)(C(=O)O)CC(=O)O)(=O)O.C(CC(O)(C(=O)[O-])CC(=O)[O-])(=O)[O-].[Mg+2].[Mg+2] BMCZJPYYEFQOCO-UHFFFAOYSA-H 0.000 description 1
- 101150042405 CCN1 gene Proteins 0.000 description 1
- 208000002177 Cataract Diseases 0.000 description 1
- 101150091877 Ccn2 gene Proteins 0.000 description 1
- 102100025175 Cellular communication network factor 6 Human genes 0.000 description 1
- 101710118748 Cellular communication network factor 6 Proteins 0.000 description 1
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 1
- 208000005590 Choroidal Neovascularization Diseases 0.000 description 1
- 206010060823 Choroidal neovascularisation Diseases 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 208000006069 Corneal Opacity Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- HEBKCHPVOIAQTA-QWWZWVQMSA-N D-arabinitol Chemical compound OC[C@@H](O)C(O)[C@H](O)CO HEBKCHPVOIAQTA-QWWZWVQMSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- QWIZNVHXZXRPDR-UHFFFAOYSA-N D-melezitose Natural products O1C(CO)C(O)C(O)C(O)C1OC1C(O)C(CO)OC1(CO)OC1OC(CO)C(O)C(O)C1O QWIZNVHXZXRPDR-UHFFFAOYSA-N 0.000 description 1
- 238000000018 DNA microarray Methods 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 239000004386 Erythritol Substances 0.000 description 1
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Natural products NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010008488 Glycylglycine Proteins 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 101001079285 Homo sapiens Immunoglobulin heavy joining 1 Proteins 0.000 description 1
- 101000998952 Homo sapiens Immunoglobulin heavy variable 1-3 Proteins 0.000 description 1
- 101001037152 Homo sapiens Immunoglobulin heavy variable 2-26 Proteins 0.000 description 1
- 101000839659 Homo sapiens Immunoglobulin heavy variable 3-72 Proteins 0.000 description 1
- 101000839684 Homo sapiens Immunoglobulin heavy variable 4-31 Proteins 0.000 description 1
- 101001138089 Homo sapiens Immunoglobulin kappa variable 1-39 Proteins 0.000 description 1
- 101001047617 Homo sapiens Immunoglobulin kappa variable 3-11 Proteins 0.000 description 1
- 101001047619 Homo sapiens Immunoglobulin kappa variable 3-20 Proteins 0.000 description 1
- 101001054843 Homo sapiens Immunoglobulin lambda variable 1-40 Proteins 0.000 description 1
- 101000978132 Homo sapiens Immunoglobulin lambda variable 7-43 Proteins 0.000 description 1
- 101000978126 Homo sapiens Immunoglobulin lambda variable 8-61 Proteins 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 description 1
- 208000010159 IgA glomerulonephritis Diseases 0.000 description 1
- 206010021263 IgA nephropathy Diseases 0.000 description 1
- CZGUSIXMZVURDU-JZXHSEFVSA-N Ile(5)-angiotensin II Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C([O-])=O)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=[NH2+])NC(=O)[C@@H]([NH3+])CC([O-])=O)C(C)C)C1=CC=C(O)C=C1 CZGUSIXMZVURDU-JZXHSEFVSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108700002232 Immediate-Early Genes Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102100028078 Immunoglobulin heavy joining 1 Human genes 0.000 description 1
- 102100036886 Immunoglobulin heavy variable 1-3 Human genes 0.000 description 1
- 102100040230 Immunoglobulin heavy variable 2-26 Human genes 0.000 description 1
- 102100027820 Immunoglobulin heavy variable 3-72 Human genes 0.000 description 1
- 102100028310 Immunoglobulin heavy variable 4-31 Human genes 0.000 description 1
- 102100020910 Immunoglobulin kappa variable 1-39 Human genes 0.000 description 1
- 102100022955 Immunoglobulin kappa variable 3-11 Human genes 0.000 description 1
- 102100022964 Immunoglobulin kappa variable 3-20 Human genes 0.000 description 1
- 102100026911 Immunoglobulin lambda variable 1-40 Human genes 0.000 description 1
- 102100023746 Immunoglobulin lambda variable 7-43 Human genes 0.000 description 1
- 102100023752 Immunoglobulin lambda variable 8-61 Human genes 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 238000001265 Jonckheere trend test Methods 0.000 description 1
- 238000012313 Kruskal-Wallis test Methods 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- NBGXQZRRLOGAJF-UHFFFAOYSA-N Maltulose Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)(CO)OCC1O NBGXQZRRLOGAJF-UHFFFAOYSA-N 0.000 description 1
- 101000777548 Mus musculus CCN family member 2 Proteins 0.000 description 1
- QGCUAFIULMNFPJ-UHFFFAOYSA-N Myristamidopropyl betaine Chemical compound CCCCCCCCCCCCCC(=O)NCCC[N+](C)(C)CC([O-])=O QGCUAFIULMNFPJ-UHFFFAOYSA-N 0.000 description 1
- JDHILDINMRGULE-LURJTMIESA-N N(pros)-methyl-L-histidine Chemical compound CN1C=NC=C1C[C@H](N)C(O)=O JDHILDINMRGULE-LURJTMIESA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- QGMRQYFBGABWDR-UHFFFAOYSA-M Pentobarbital sodium Chemical compound [Na+].CCCC(C)C1(CC)C(=O)NC(=O)[N-]C1=O QGMRQYFBGABWDR-UHFFFAOYSA-M 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 229920001030 Polyethylene Glycol 4000 Polymers 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 208000002158 Proliferative Vitreoretinopathy Diseases 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 206010038848 Retinal detachment Diseases 0.000 description 1
- 206010038934 Retinopathy proliferative Diseases 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 239000012505 Superdex™ Substances 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 102000002938 Thrombospondin Human genes 0.000 description 1
- 108060008245 Thrombospondin Proteins 0.000 description 1
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 1
- 102000011117 Transforming Growth Factor beta2 Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 1
- 101800000304 Transforming growth factor beta-2 Proteins 0.000 description 1
- 102000056172 Transforming growth factor beta-3 Human genes 0.000 description 1
- 108090000097 Transforming growth factor beta-3 Proteins 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 208000005475 Vascular calcification Diseases 0.000 description 1
- 238000001793 Wilcoxon signed-rank test Methods 0.000 description 1
- 102000013814 Wnt Human genes 0.000 description 1
- 108050003627 Wnt Proteins 0.000 description 1
- BHATUINFZWUDIX-UHFFFAOYSA-N Zwittergent 3-14 Chemical compound CCCCCCCCCCCCCC[N+](C)(C)CCCS([O-])(=O)=O BHATUINFZWUDIX-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000488 activin Substances 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 229950006323 angiotensin ii Drugs 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- DLRVVLDZNNYCBX-ZZFZYMBESA-N beta-melibiose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](O)O1 DLRVVLDZNNYCBX-ZZFZYMBESA-N 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 238000009530 blood pressure measurement Methods 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- VSGNNIFQASZAOI-UHFFFAOYSA-L calcium acetate Chemical compound [Ca+2].CC([O-])=O.CC([O-])=O VSGNNIFQASZAOI-UHFFFAOYSA-L 0.000 description 1
- 239000001639 calcium acetate Substances 0.000 description 1
- 229960005147 calcium acetate Drugs 0.000 description 1
- 235000011092 calcium acetate Nutrition 0.000 description 1
- PBUBJNYXWIDFMU-UHFFFAOYSA-L calcium;butanedioate Chemical compound [Ca+2].[O-]C(=O)CCC([O-])=O PBUBJNYXWIDFMU-UHFFFAOYSA-L 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 238000013368 capillary electrophoresis sodium dodecyl sulfate analysis Methods 0.000 description 1
- 238000001818 capillary gel electrophoresis Methods 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- MRUAUOIMASANKQ-UHFFFAOYSA-O carboxymethyl-[3-(dodecanoylamino)propyl]-dimethylazanium Chemical compound CCCCCCCCCCCC(=O)NCCC[N+](C)(C)CC(O)=O MRUAUOIMASANKQ-UHFFFAOYSA-O 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 238000000546 chi-square test Methods 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 208000007451 chronic bronchitis Diseases 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- MRUAUOIMASANKQ-UHFFFAOYSA-N cocamidopropyl betaine Chemical compound CCCCCCCCCCCC(=O)NCCC[N+](C)(C)CC([O-])=O MRUAUOIMASANKQ-UHFFFAOYSA-N 0.000 description 1
- 229940073507 cocamidopropyl betaine Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- CVOQYKPWIVSMDC-UHFFFAOYSA-L dipotassium;butanedioate Chemical compound [K+].[K+].[O-]C(=O)CCC([O-])=O CVOQYKPWIVSMDC-UHFFFAOYSA-L 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- CBMPTFJVXNIWHP-UHFFFAOYSA-L disodium;hydrogen phosphate;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [Na+].[Na+].OP([O-])([O-])=O.OC(=O)CC(O)(C(O)=O)CC(O)=O CBMPTFJVXNIWHP-UHFFFAOYSA-L 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 235000019414 erythritol Nutrition 0.000 description 1
- 229940009714 erythritol Drugs 0.000 description 1
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 238000001506 fluorescence spectroscopy Methods 0.000 description 1
- 239000012537 formulation buffer Substances 0.000 description 1
- 239000013022 formulation composition Substances 0.000 description 1
- 229940050411 fumarate Drugs 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 206010061989 glomerulosclerosis Diseases 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- 229940043257 glycylglycine Drugs 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000009422 growth inhibiting effect Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 238000007131 hydrochloric acid regeneration reaction Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 208000036971 interstitial lung disease 2 Diseases 0.000 description 1
- 239000000905 isomalt Substances 0.000 description 1
- 235000010439 isomalt Nutrition 0.000 description 1
- HPIGCVXMBGOWTF-UHFFFAOYSA-N isomaltol Natural products CC(=O)C=1OC=CC=1O HPIGCVXMBGOWTF-UHFFFAOYSA-N 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 239000000832 lactitol Substances 0.000 description 1
- 235000010448 lactitol Nutrition 0.000 description 1
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 description 1
- 229960003451 lactitol Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- JCQLYHFGKNRPGE-FCVZTGTOSA-N lactulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-FCVZTGTOSA-N 0.000 description 1
- 229960000511 lactulose Drugs 0.000 description 1
- PFCRQPBOOFTZGQ-UHFFFAOYSA-N lactulose keto form Natural products OCC(=O)C(O)C(C(O)CO)OC1OC(CO)C(O)C(O)C1O PFCRQPBOOFTZGQ-UHFFFAOYSA-N 0.000 description 1
- 229940075468 lauramidopropyl betaine Drugs 0.000 description 1
- IZWSFJTYBVKZNK-UHFFFAOYSA-N lauryl sulfobetaine Chemical compound CCCCCCCCCCCC[N+](C)(C)CCCS([O-])(=O)=O IZWSFJTYBVKZNK-UHFFFAOYSA-N 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 239000000845 maltitol Substances 0.000 description 1
- 235000010449 maltitol Nutrition 0.000 description 1
- VQHSOMBJVWLPSR-WUJBLJFYSA-N maltitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-WUJBLJFYSA-N 0.000 description 1
- 229940035436 maltitol Drugs 0.000 description 1
- JCQLYHFGKNRPGE-HFZVAGMNSA-N maltulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-HFZVAGMNSA-N 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 238000000816 matrix-assisted laser desorption--ionisation Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- QWIZNVHXZXRPDR-WSCXOGSTSA-N melezitose Chemical compound O([C@@]1(O[C@@H]([C@H]([C@@H]1O[C@@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O)CO)CO)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O QWIZNVHXZXRPDR-WSCXOGSTSA-N 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 230000000921 morphogenic effect Effects 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000003098 myoblast Anatomy 0.000 description 1
- NZXVYLJKFYSEPO-UHFFFAOYSA-N n-[3-(dimethylamino)propyl]-16-methylheptadecanamide Chemical compound CC(C)CCCCCCCCCCCCCCC(=O)NCCCN(C)C NZXVYLJKFYSEPO-UHFFFAOYSA-N 0.000 description 1
- BDHJUCZXTYXGCZ-UHFFFAOYSA-N n-[3-(dimethylamino)propyl]hexadecanamide Chemical compound CCCCCCCCCCCCCCCC(=O)NCCCN(C)C BDHJUCZXTYXGCZ-UHFFFAOYSA-N 0.000 description 1
- IFYDWYVPVAMGRO-UHFFFAOYSA-N n-[3-(dimethylamino)propyl]tetradecanamide Chemical compound CCCCCCCCCCCCCC(=O)NCCCN(C)C IFYDWYVPVAMGRO-UHFFFAOYSA-N 0.000 description 1
- 208000021971 neovascular inflammatory vitreoretinopathy Diseases 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- HEGSGKPQLMEBJL-RKQHYHRCSA-N octyl beta-D-glucopyranoside Chemical compound CCCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HEGSGKPQLMEBJL-RKQHYHRCSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 239000002357 osmotic agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229950003481 pamrevlumab Drugs 0.000 description 1
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 1
- 229960002275 pentobarbital sodium Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- FHUOTRMCFQTSOA-UHFFFAOYSA-M potassium;acetic acid;acetate Chemical compound [K+].CC(O)=O.CC([O-])=O FHUOTRMCFQTSOA-UHFFFAOYSA-M 0.000 description 1
- BUCIWTBCUUHRHZ-UHFFFAOYSA-K potassium;disodium;dihydrogen phosphate;hydrogen phosphate Chemical compound [Na+].[Na+].[K+].OP(O)([O-])=O.OP([O-])([O-])=O BUCIWTBCUUHRHZ-UHFFFAOYSA-K 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000006785 proliferative vitreoretinopathy Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 238000002818 protein evolution Methods 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000005086 pumping Methods 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000005057 refrigeration Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 239000012557 regeneration buffer Substances 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 201000002793 renal fibrosis Diseases 0.000 description 1
- 230000000754 repressing effect Effects 0.000 description 1
- 230000004264 retinal detachment Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- IZWPGJFSBABFGL-GMFCBQQYSA-M sodium;2-[methyl-[(z)-octadec-9-enoyl]amino]ethanesulfonate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC(=O)N(C)CCS([O-])(=O)=O IZWPGJFSBABFGL-GMFCBQQYSA-M 0.000 description 1
- HSFQBFMEWSTNOW-UHFFFAOYSA-N sodium;carbanide Chemical group [CH3-].[Na+] HSFQBFMEWSTNOW-UHFFFAOYSA-N 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000000528 statistical test Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 125000000185 sucrose group Chemical group 0.000 description 1
- 229940117986 sulfobetaine Drugs 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- SYSWJPSVYLUKCH-UHFFFAOYSA-H tricalcium;2-hydroxypropane-1,2,3-tricarboxylate;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [Ca+2].[Ca+2].[Ca+2].OC(=O)CC(O)(C(O)=O)CC(O)=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O SYSWJPSVYLUKCH-UHFFFAOYSA-H 0.000 description 1
- SPRBJFWIUVWXBT-UHFFFAOYSA-K tripotassium 2-hydroxypropane-1,2,3-tricarboxylate 2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [K+].[K+].[K+].OC(=O)CC(O)(C(O)=O)CC(O)=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O SPRBJFWIUVWXBT-UHFFFAOYSA-K 0.000 description 1
- 150000004043 trisaccharides Chemical class 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 101150060219 tsp-1 gene Proteins 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 230000005740 tumor formation Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 210000003606 umbilical vein Anatomy 0.000 description 1
- 238000009777 vacuum freeze-drying Methods 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Physical Education & Sports Medicine (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
Abstract
提供了一种含抗结缔组织生长因子抗体的药物组合物,另一方面,还提供了所述含抗结缔组织生长因子抗体的药物组合物的用途。
Description
本披露属于药物制剂领域,具体涉及一种包含抗体的药物组合物,以及其作为药物的用途。
这里的陈述仅提供与本披露有关的背景信息,而不必然地构成现有技术。
结缔组织生长因子(CTGF)的表达由转化生长因子β(TGFβ)超家族的成员诱导。该超家族包括TGFβ-1、-2、和-3、骨形态发生蛋白(BMP)-2和活化素。许多调节剂包括地塞米松、凝血酶、血管内皮生长因子(VEGF)和血管紧张肽II;以及环境刺激包括高血糖和高血压也诱导CTGF的表达。
TGFβ对CTGF表达的刺激是快速且长期的,无需持久施加TGFβ。TGFβ通过CTGF启动子中的DNA调控元件进行的转录激活,导致CTGF的表达增强。在肾小球性肾炎、IgA肾病、间灶性和节段性肾小球硬化症和糖尿病性肾病中,CTGF的表达被上调。在慢性肾小管间质(tubulointerstitial)损伤部位也观察到表达CTGF的细胞数增加,并且CTGF水平与损伤程度相关。另外,在与肾实质瘢痕化和硬化相关的各种肾病中,CTGF在肾小球和肾小管间质中的表达也增加。CTGF的升高水平也与肝纤维化、心肌梗死和肺纤维化相关。例如,在患有自发性肺纤维化(IPF)患者中,在生物活检和支气管肺泡灌洗液细胞中,CTGF被强烈上调。因此,在如上所述的疾病中,CTGF是一种有效的治疗靶。
发明内容
本披露提供一种含抗CTGF抗体的药物组合物。该组合物具有稳定性好,冻干形态好等优势。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含重链可变区和轻链可变区,其中:
i)所述重链可变区包含与如SEQ ID NO:6所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:7所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3;或
ii)所述重链可变区包含与如SEQ ID NO:8所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:9所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含重链可变区和轻链可变区,其中:
ii-i)所述重链可变区包含与如SEQ ID NO:69所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:70所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3;或
ii-ii)所述重链可变区包含与如SEQ ID NO:85所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:70所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含重链可变区和轻链可变区,其中:
iii)所述重链可变区包含分别如SEQ ID NO:10、SEQ ID NO:11和SEQ ID NO:12所示的HCDR1、HCDR2和HCDR3,所述轻链可变区包含分别如SEQ ID NO:13、SEQ ID NO:14和SEQ ID NO:15所示的LCDR1、LCDR2和LCDR3;或
iv)所述重链可变区包含分别如SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18所示的HCDR1、HCDR2和HCDR3,所述轻链可变区包含分别如SEQ ID NO:19、SEQ ID NO:20和SEQ ID NO:21所示的LCDR1、LCDR2和LCDR3。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含重链可变区和轻链可变区,其中:
iv-i)所述重链可变区包含分别如SEQ ID NO:71、SEQ ID NO:72和SEQ ID NO:73所示的HCDR1、HCDR2和HCDR3,所述轻链可变区包含分别如SEQ ID NO:74、SEQ ID NO:75和SEQ ID NO:76所示的LCDR1、LCDR2和LCDR3;或
iv-ii)所述重链可变区包含分别如SEQ ID NO:102、SEQ ID NO:103和SEQ ID NO:104所示的HCDR1、HCDR2和HCDR3,所述轻链可变区包含分别如SEQ ID NO:74、SEQ ID NO:75和SEQ ID NO:76所示的LCDR1、LCDR2和LCDR3。
在一些实施方案中,如前任一项中所述的抗CTGF抗体是鼠源抗体、嵌合抗体或人源化抗体。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含重链可变区和轻链可变区,其中:
(v-1)所述重链可变区,其氨基酸序列与SEQ ID NO:6、27、28或29具有至少90%的序列同一性,和所述轻链可变区,其氨基酸序列与SEQ ID NO:7、22、23、24、25或26具有至少90%的序列同一性:
(vi-1)所述重链可变区,其氨基酸序列与SEQ ID NO:8、33、34、35或36具有至少90%的序列同一性,和所述轻链可变区,其氨基酸序列与SEQ ID NO:9、30、31或32具有至少90%的序列同一性;或
(vi-i)所述重链可变区,其氨基酸序列与SEQ ID NO:69、81、82、83、84或85具有至少90%的序列同一性,和所述轻链可变区,其氨基酸序列与SEQ ID NO:70、77、78、79或80具有至少90%的序列同一性。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗 体包含重链可变区和轻链可变区,其中:
(v)所述重链可变区与SEQ ID NO:6、27、28或29中所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:7、22、23、24、25或26中所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;或
(vi)所述重链可变区与SEQ ID NO:8、33、34、35或36所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:9、30、31或32所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;或
所述重链可变区与SEQ ID NO:6中所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:7中所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;
所述重链可变区与SEQ ID NO:27、28或29中所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:22、23、24、25或26中所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;
所述重链可变区与SEQ ID NO:8所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:9所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;
所述重链可变区与SEQ ID NO:33、34、35或36所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:30、31或32所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含重链可变区和轻链可变区,其中:
(vi-ii)所述重链可变区与SEQ ID NO:69、81、82、83、84或85中所示的重链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,和所述轻链可变区与SEQ ID NO:70、77、78、79或80中所示的轻链可变区具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗 体中所述抗CTGF抗体为人源化抗体,所述人源化抗体包含人抗体的框架区或其框架区变体,所述框架区变体在人抗体的轻链框架区和/或重链框架区上分别具有至多10个的回复突变;
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含如下所述的重链可变区和轻链可变区:
(a)所述轻链可变区,其包含分别如SEQ ID NO:13、SEQ ID NO:14和SEQ ID NO:15所示的LCDR1、LCDR2和LCDR3,并且包含选自4L、36F、43S、45K、47W、58V或71Y中的一个或更多个氨基酸回复突变,和/或所述重链可变区,其包含序列分别如SEQ ID NO:10、SEQ ID NO:11和SEQ ID NO:12所示的HCDR1、HCDR2和HCDR3,并且包含选自28S、30N、49A、75E、76S、93V、94E或104D中的一个或更多个氨基酸回复突变;或
(b)所述轻链可变区,其包含分别如SEQ ID NO:19、SEQ ID NO:20和SEQ ID NO:21所示的LCDR1、LCDR2和LCDR3的轻链可变区中包含选自36V、44F、46G或49G中的一个或更多个回复突变,和/或所述重链可变区,其包含序列分别如SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18所示的HCDR1、HCDR2和HCDR3,并且包含44G、49G、27F、48L、67L、71K、78V或80F中的一个或更多个回复突变。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含如下所述的重链可变区和轻链可变区:
(b-i)轻链可变区,其包含分别如SEQ ID NO:74、SEQ ID NO:75和SEQ ID NO:76所示的LCDR1、LCDR2和LCDR3,以及选自45P、46W、48Y、69S或70Y中的一个或更多个回复突变,和重链可变区,其包含分别如SEQ ID NO:71、SEQ ID NO:72和SEQ ID NO:73所示的HCDR1、HCDR2和HCDR3,以及27F、38K、48I、67K、68A、70L或72F中的一个或更多个回复突变;或
(b-ii)轻链可变区,其包含分别如SEQ ID NO:74、SEQ ID NO:75和SEQ ID NO:76所示的LCDR1、LCDR2和LCDR3,且包含选自45P、46W、48Y、69S或70Y中的一个或更多个回复突变,和重链可变区,其包含分别如SEQ ID NO:102、SEQ ID NO:103和SEQ ID NO:104所示的HCDR1、HCDR2和HCDR3,且包含27F、38K、48I、67K、68A、70L或72F中的一个或更多个回复突变。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含如下所示的重链可变区和轻链可变区:
(vii)所述重链可变区序列如SEQ ID NO:6所示和所述轻链可变区序列如SEQ ID NO:7所示;
(viii)所述重链可变区序列如SEQ ID NO:27、28或29所示和所述轻链可变区序列如SEQ ID NO:22、23、24、25或26所示;
(ix)所述重链可变区序列如SEQ ID NO:8所示和所述轻链可变区序列如 SEQ ID NO:9所示;或
(x)所述重链可变区序列如SEQ ID NO:33、34、35或36所示和所述轻链可变区序列如SEQ ID NO:30、31或32所示。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含如下所示的重链可变区和轻链可变区:
(xi)所述重链可变区,其氨基酸序列如SEQ ID NO:69所示;和所述轻链可变区,其氨基酸序列如SEQ ID NO:70所示;或
(xii)所述重链可变区,其氨基酸序列如SEQ ID NO:81、82、83、84或85所示;和所述轻链可变区,其氨基酸序列如SEQ ID NO:77、78、79或80所示。
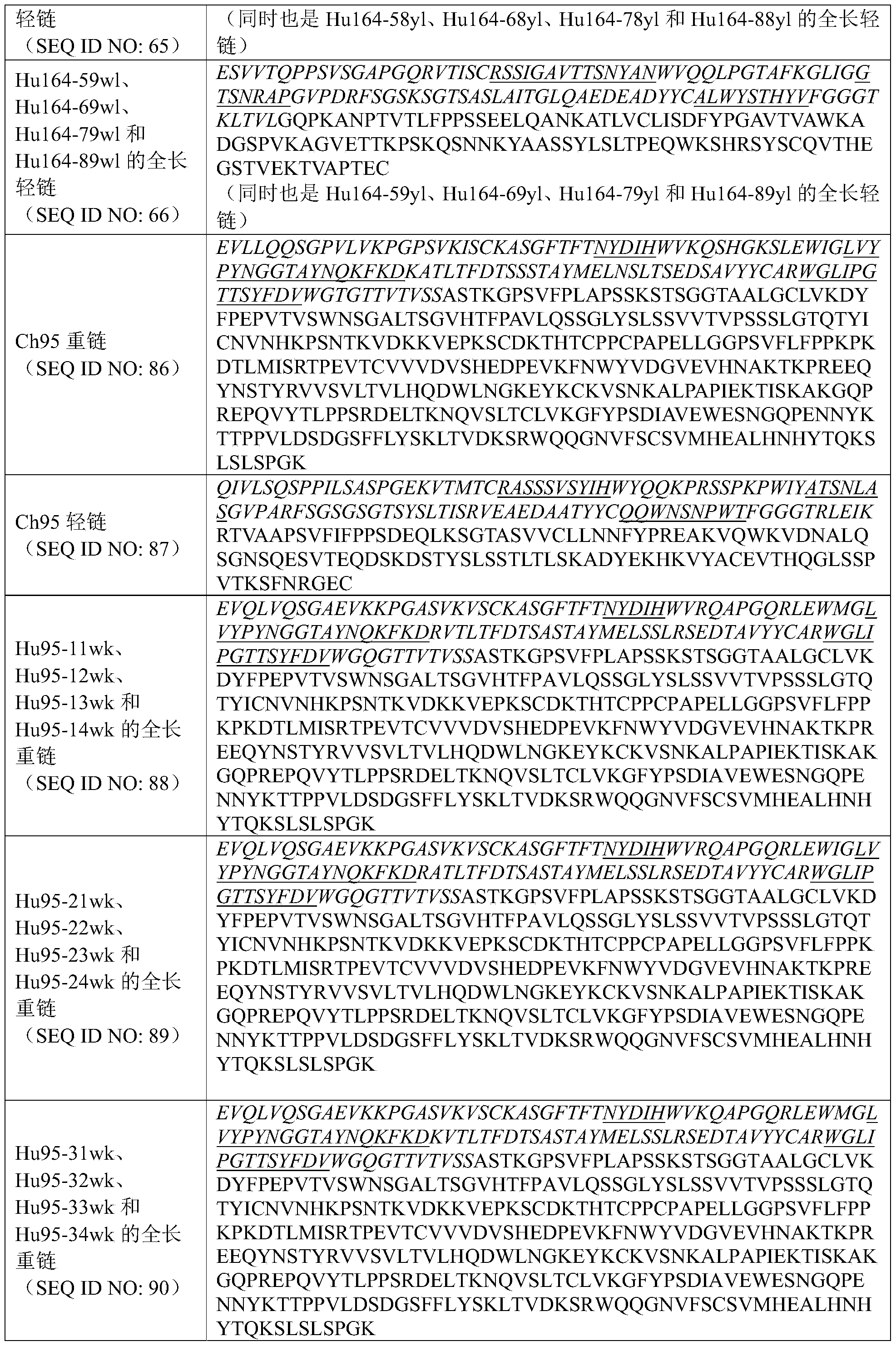
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含如下表1、表2和表3所示的重链可变区和轻链可变区:
表1:mab147来源的人源化抗体轻链可变区和重链可变区组合
表2:mab164人源化抗体轻链可变区和重链可变区组合
表3:mab95人源化抗体轻链可变区和重链可变区组合
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含如下所示的重链可变区和轻链可变区:
(xiii)所述重链可变区,其氨基酸序列如SEQ ID NO:27所示;和所述轻链可变区,其氨基酸序列如SEQ ID NO:22所示;
(xiv)所述重链可变区,其氨基酸序列如SEQ ID NO:34所示;和所述轻链可变区,其氨基酸序列如SEQ ID NO:30所示;或
(xv)所述重链可变区,其氨基酸序列如SEQ ID NO:85所示;和所述轻链可变区,其氨基酸序列如SEQ ID NO:77所示。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体中所述抗体进一步包含抗体重链恒定区和轻链恒定区;优选地,所述重链恒定区选自人IgG1、IgG2、IgG3和IgG4恒定区及其常规变体,所述轻链恒定区选自人抗体κ和λ链恒定区及其常规变体;更优选地,所述抗体包含序列如SEQ ID NO:37或38所示的重链恒定区和序列如SEQ ID NO:39或40所示的轻链恒定区。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含:
(c)与序列如SEQ ID NO:41、43、44、45、46、47或48所示的重链具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的重链和与序列如SEQ ID NO:42、49、50、51、52或53所示的轻链具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的轻链;
(d)与序列如SEQ ID NO:54、56、57、58、59、60、61、62或63所示的重链具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的重链和与序列如SEQ ID NO:55、64、65或66所示的轻链具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的轻链;
(e)序列如SEQ ID NO:41、43、44、45、46、47或48所示的重链和序列如SEQ ID NO:42、49、50、51、52或53所示的轻链;或
(f)序列如SEQ ID NO:54、56、57、58、59、60、61、62或63所示的重链 和序列如SEQ ID NO:55、64、65或66所示的轻链。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含:
(g)与SEQ ID NO:86、88、89、90、91、92、93、94、95、96或97具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链,和与SEQ ID NO:87、98、99、100或101具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链;或
(h)如SEQ ID NO:86、88、89、90、91、92、93、94、95、96或97所示的重链和如SEQ ID NO:87、98、99、100或101所示的轻链。
在一些实施方案中,如上任一项所述的药物组合物,其中所述的抗CTGF抗体包含:
(j)如SEQ ID NO:46所示的重链和如SEQ ID NO:49所示的轻链;
(k)如SEQ ID NO:61所示的重链和如SEQ ID NO:64所示的轻链;或
(l)如SEQ ID NO:97所示的重链和如SEQ ID NO:98所示的轻链。
在一些实施方案中,如上任一项所述的药物组合物,其中所述药物组合物中还包含缓冲剂。在一些实施方案中,所述的缓冲剂是组氨酸盐缓冲剂、醋酸盐缓冲剂、枸橼酸盐缓冲剂、琥铂酸盐缓冲剂或磷酸盐缓冲剂。在一些实施方案中,所述的缓冲剂是组氨酸-盐酸盐缓冲剂或组氨酸-醋酸盐缓冲剂。在一些实施方案中,所述的缓冲剂是组氨酸-盐酸盐缓冲剂。
在一些实施方案中,如上任一项所述的药物组合物,其中所述药物组合物的pH为约5.0-约6.5。在一些实施方案中,所述药物组合物的pH为约5.0-约6.0。在一些实施方案中,所述药物组合物的pH为约5.0、约5.1、约5.2、约5.3、约5.4、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4或约5.5。在一些实施方案中,所述药物组合物的pH为5.0-6.5。在一些实施方案中,所述药物组合物的pH为5.0-6.0。在一些实施方案中,所述药物组合物的pH为5.5-5.7。在一些实施方案中,所述药物组合物的pH为5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4或6.5,或者为这些点值之间的任意范围。
在一些实施方案中,如上任一项所述的药物组合物,其中所述抗CTGF抗体的浓度为约100mg/mL至约200mg/mL。在一些实施方案中,所述抗CTGF抗体的浓度为约150mg/mL至约200mg/mL。在一些实施方案中,所述抗CTGF抗体的浓度为约100mg/mL、约110mg/mL、约120mg/mL、约130mg/mL、约140mg/mL、约150mg/mL、约160mg/mL、约170mg/mL、约180mg/mL、约190mg/mL或约200mg/mL。在一些实施方案中,所述抗CTGF抗体的浓度为100mg/mL至200mg/mL。在一些实施方案中,所述抗CTGF抗体的浓度为150mg/mL至200 mg/mL。在一些实施方案中,所述抗CTGF抗体的浓度为100mg/mL、110mg/mL、120mg/mL、130mg/mL、140mg/mL、150mg/mL、160mg/mL、170mg/mL、180mg/mL、190mg/mL或200mg/mL,或者为这些点值之间的任意范围。
在一些实施方案中,如上任一项所述的药物组合物,其中所述药物组合物还包含表面活性剂。在一些实施方案中,所述表面活性剂是非离子表面活性剂。在一些实施方案中,所述表面活性剂选自聚山梨酯、聚山梨酯20、聚山梨酯80、聚羟亚烃、Triton、十二烷基磺酸钠、月桂基磺酸钠、辛基糖甙钠、月桂基-磺基甜菜碱、肉豆蔻基-磺基甜菜碱、亚油基-磺基甜菜碱、硬脂基-磺基甜菜碱、月桂基-肌氨酸、肉豆蔻基-肌氨酸、亚油基-肌氨酸、硬脂基-肌氨酸、亚油基-甜菜碱、肉豆蔻基-甜菜碱、鲸蜡基-甜菜碱、月桂酰胺基丙基-甜菜碱、柯卡酰胺基丙基-甜菜碱、亚油酰胺基丙基-甜菜碱、肉豆蔻酰胺基丙基-甜菜碱、棕榈酰胺基丙基-甜菜碱、异硬脂酰胺基丙基-甜菜碱、肉豆蔻酰胺基丙基-二甲基胺、棕榈酰胺基丙基-二甲基胺、异硬脂酰胺基丙基-二甲基胺、甲基可可酰基钠、甲基油基牛磺酸钠、聚乙二醇、聚丙二醇、乙烯与丙烯二醇的共聚物等。在一些实施方案中,所述表面活性剂为聚山梨酯或泊洛沙姆。在一些实施方案中,所述表面活性剂为聚山梨酯80、聚山梨酯20或泊洛沙姆188。在一些实施方案中,所述表面活性剂为聚山梨酯80。
在一些实施方案中,如上任一项所述的药物组合物,其中所述表面活性剂浓度为约0.05mg/mL至约1.0mg/mL。在一些实施方案中,所述表面活性剂浓度为约0.2mg/mL至约0.6mg/mL。在一些实施方案中,所述表面活性剂浓度为约0.05mg/mL、约0.1mg/mL、约0.2mg/mL、约0.3mg/mL、约0.4mg/mL、约0.5mg/mL、约0.6mg/mL、约0.7mg/mL、约0.8mg/mL、约0.9mg/mL或约1.0mg/mL。在一些实施方案中,所述表面活性剂浓度为0.05mg/mL至1.0mg/mL。在一些实施方案中,所述表面活性剂浓度为0.2mg/mL至0.6mg/mL。在一些实施方案中,所述表面活性剂浓度为0.05mg/mL、0.1mg/mL、0.2mg/mL、0.3mg/mL、0.4mg/mL、0.5mg/mL、0.6mg/mL、0.7mg/mL、0.8mg/mL、0.9mg/mL或1.0mg/mL,或者为这些点值之间的任意范围。
在一些实施方案中,如上任一项所述的药物组合物,其中所述药物组合物还包含糖。在一些实施方案中,所述糖选自常规组合物(CH
2O)
n及其衍生物,包括单糖,二糖,三糖,多糖,糖醇,还原性糖,非还原性糖等等。所述的糖可选自葡萄糖,蔗糖,海藻糖,乳糖,果糖,麦芽糖,右旋糖苷,甘油,赤藻糖醇,丙三醇,阿拉伯糖醇,sylitol,山梨糖醇,甘露醇,密里二糖,松三糖,蜜三糖,甘露三糖,水苏糖,麦芽糖,乳果糖,麦芽酮糖,山梨醇,麦芽糖醇,乳糖醇,异-麦芽酮糖等。在一些实施方案中,所述糖选自蔗糖、甘露醇和海藻糖中的一种或多种。在一些实施方案中,所述糖为蔗糖。
在一些实施方案中,如上任一项所述的药物组合物,其中所述糖的浓度为约20mg/mL至约100mg/mL。在一些实施方案中,所述糖的浓度为约40mg/mL至 约80mg/mL。在一些实施方案中,所述糖的浓度为约60mg/mL至约80mg/mL。在一些实施方案中,所述糖的浓度为约20mg/mL、约30mg/mL、约40mg/mL、约50mg/mL、约60mg/mL、约70mg/mL、约80mg/mL、约90mg/mL或约100mg/mL。在一些实施方案中,所述糖的浓度为20mg/mL至100mg/mL。在一些实施方案中,所述糖的浓度为40mg/mL至80mg/mL。在一些实施方案中,所述糖的浓度60mg/mL至80mg/mL。在一些实施方案中,所述糖的浓度为20mg/mL、30mg/mL、40mg/mL、50mg/mL、60mg/mL、70mg/mL、80mg/mL、90mg/mL或100mg/mL,或者为这些点值之间的任意范围。
在一些实施方案中,如上任一项所述的药物组合物,其中所述缓冲剂的浓度为约5mM至约100mM。在一些实施方案中,所述缓冲剂的浓度为约30mM至约70mM。在一些实施方案中,所述缓冲剂的浓度为约5mM、约10mM、约20mM、约30mM、约40mM、约50mM、约60mM、约70mM、约80mM、约90mM或约100mM。在一些实施方案中,所述缓冲剂的浓度为5mM至100mM。在一些实施方案中,所述缓冲剂的浓度为30mM至70mM。在一些实施方案中,所述缓冲剂的浓度为5mM、10mM、20mM、30mM、40mM、50mM、60mM、70mM、80mM、90mM或100mM,或者为这些点值之间的任意范围。
在一些实施方案中,如上任一项所述的药物组合物,其中所述药物组合物还包含额外的稳定剂。在一些实施方案中,所述额外的稳定剂是任选的盐、糖醇、表面活性剂、聚醚类、氨基酸或螯合剂等。在一些实施方案中,所述额外的稳定剂选自PEG(聚乙二醇)、精氨酸和EDTA。在一些实施方案中,所述PEG是PEG3350或PEG 4000。在一些实施方案中,所述PEG的浓度为10mg/mL至50mg/mL。在一些实施方案中,所述PEG的浓度为10mg/mL、20mg/mL、30mg/mL、40mg/mL或50mg/mL。在一些实施方案中,所述精氨酸的浓度为10mM至100mM。在一些实施方案中,所述精氨酸的浓度为10mM、20mM、30mM、40mM、50mM、60mM、70mM、80mM、90mM或100mM。在一些实施方案中,所述EDTA的浓度为0.5mM至10mM。在一些实施方案中,所述EDTA的浓度为0.5mM、1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM,或者为这些点值之间的任意范围。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)约100mg/mL至约200mg/mL的所述抗CTGF抗体,(b)约0.05mg/mL至约1mg/mL的表面活性剂,(c)约20mg/mL至约100mg/mL的糖,和(d)约5mM至约100mM的组氨酸盐缓冲剂;所述药物组合物的pH为约5.0至约6.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)约150mg/mL至约200mg/mL的所述抗CTGF抗体,(b)约0.2mg/mL至约0.6mg/mL的聚山梨酯,(c)约40mg/mL至约80mg/mL的糖,和(d)约30mM至约70mM的组氨酸盐缓冲剂;所述药物组合物的pH为约5.0-约6.0。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)约150mg/mL的所述抗CTGF抗体,(b)约0.4mg/mL的聚山梨酯80,(c)约70mg/mL的蔗糖,和(d)约50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为约5.5至约5.7。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)约150mg/mL的所述抗CTGF抗体,(b)约0.4mg/mL的聚山梨酯80,(c)约70mg/mL的蔗糖,和(d)约50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为约5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5至5.7。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)200mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的醋酸盐缓冲剂;所述药物组合物的pH为5.0-5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)200mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-醋酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)200mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的琥珀酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)200mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的柠檬酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)200mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5-6.5。在一些实施方案中,所述药物组合物的pH为5.5、6.0或6.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)200mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的磷酸盐缓冲剂;所述药物组合物的pH为6.0-6.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体、(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为6.0。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.6mg/mL的聚山梨酯20,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.2mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.6mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的泊洛沙姆188,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的泊洛沙姆188,(c)70mg/mL的蔗糖,和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,(d)50mM的组氨酸-盐酸盐缓冲剂和(e)2%PEG 3350;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,(d)50mM的组氨酸-盐酸盐缓冲剂和(e)50mM精氨酸;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,(d)50mM的组氨酸-盐酸盐缓冲剂和(e)1%甘露醇;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的蔗糖,(d)50mM的组氨酸-盐酸盐缓冲剂和(e)0.5-10mM EDTA;所述药物组合物的pH为5.5。在一些实施方案中,所述EDTA的浓度为0.5mM、5mM、10mM。
在一些实施方案中,如上任一项所述的药物组合物,其包含如下组分:
(a)150mg/mL的所述抗CTGF抗体,(b)0.4mg/mL的聚山梨酯80,(c)70mg/mL的海藻糖和(d)50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为5.5。
在一些实施方案中,如上任一项所述的药物组合物,所述药物组合物是液体制剂。在一些实施方案中,所述液体制剂的溶剂是水。
本披露还提供一种的冻干制剂,其特征在于所述冻干制剂复溶后可形成如上任一项所述的药物组合物。
本披露还提供一种制备冻干制剂的方法,其中包括将如上任一项所述的药物组合物进行冷冻干燥的步骤。
本披露还提供一种冻干制剂,所述制剂通过将如上任一项所述的药物组合物经冷冻干燥获得。在一些实施方案中,如上任一项所述冷冻干燥依次包括预冻、一次干燥和二次干燥的步骤。在一些实施方案中,该冻干制剂于40℃稳定至少7天,至少14天或至少28天。
本披露还提供一种复溶溶液,其特征在于所述复溶溶液是通过将如上任一项所述的冻干制剂经复溶制备获得,任选地,所述复溶溶液通过将如上任一项所述的冻干制剂在生理上可接受的溶剂中复溶获得,所述生理上可接受的溶剂包括但不限于注射用水、生理盐水、缓冲剂。
在一些实施方案中,如上所述的复溶溶液包含:
(a)约150mg/mL至约200mg/mL的所述抗CTGF抗体,(b)约0.2mg/mL至约0.6mg/mL的聚山梨酯,(c)约40mg/mL至约80mg/mL的糖,和(d)约30mM至约70mM的组氨酸盐缓冲剂;所述药物组合物的pH为约5.0至约6.0。
在一些实施方案中,如上所述的复溶溶液包含:
(a)约150mg/mL的所述抗CTGF抗体,(b)约0.4mg/mL的聚山梨酯80,(c)约70mg/mL的蔗糖,和(d)约50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为约5.5至约5.7。
在一些实施方案中,如上所述的复溶溶液包含:
(a)约150mg/mL的所述抗CTGF抗体,(b)约0.4mg/mL的聚山梨酯80,(c)约70mg/mL的蔗糖,和(d)约50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为约5.5。
在一些实施方案中,如上任一项所述的药物组合物或复溶溶液,其为静脉注 射制剂、皮下注射制剂、腹腔注射制剂或肌肉注射制剂;在一些实施方案中,如上任一项所述的药物组合物或复溶溶液,其为静脉注射制剂。在一些实施方案中,如上任一项所述的药物组合物或复溶溶液,其适于静脉注射、皮下注射、腹腔注射或肌肉注射。在一些实施方案中,如上任一项所述的药物组合物或复溶溶液或冻干制剂,其用于制备静脉注射、皮下注射、腹腔注射或肌肉注射的药物。
本披露还提供一种制品,其包括容器,该容器中装有如上任一项所述的药物组合物、如上任一项所述的冻干制剂或如上任一项所述的复溶溶液。
在一些实施方案中,本披露还提供如上任一项所述的药物组合物、如上任一项的冻干制剂、如上任一项的复溶溶液或如上任一项所述的制品在制备治疗CTGF相关的疾病的药物中的用途。
本披露还提供一种治疗或预防与CTGF相关的疾病的方法,包括给予患者有效量的如上任一项所述的药物组合物、如上任一项的冻干制剂、如上任一项的复溶溶液或如上任一项所述的制品。
在一些实施方案中,本披露还提供如上任一项所述的药物组合物、如上任一项的冻干制剂、如上任一项的复溶溶液或如上任一项所述的制品,其用于治疗CTGF相关的疾病。
在一些实施方案中,所述与CTGF相关的疾病为纤维性疾病、高血压、糖尿病、心肌梗死、关节炎、CTGF相关细胞增殖性疾病、动脉粥样硬化、青光眼或癌症。在一些实施方案中,所述纤维性疾病选自:自发性肺纤维化、糖尿病性肾病、糖尿病性视网膜病骨关节炎、硬皮病、慢性心力衰竭、肝硬化或肾纤维化。在一些实施方案中,所述癌症选自:急性淋巴母细胞性白血病、皮肤纤维瘤、乳腺癌、血管脂肪瘤、血管平滑肌瘤、结缔组织生成性癌症、前列腺癌、卵巢癌、结肠直肠癌、胰腺癌、胃肠道癌症或肝癌。
图1:通过ELISA检测,源自mab164的人源化抗体与人CTGF的亲和力。
图2:源自mab147或源自mab164的人源化抗体对SU86.86小鼠移植瘤的抑制实验结果。
术语
为了更容易理解本披露,以下具体定义了某些技术和科学术语。除非在本文中另有明确定义,本文使用的所有其它技术和科学术语都具有本披露所属领域的一般技术人员通常理解的含义。
本披露所用氨基酸三字母代码和单字母代码如J.biol.chem,243,p3558(1968)中所述。
结缔组织生长因子(Connective Tissue Growth Factor,CTGF)是一种最初分离自人脐静脉内皮细胞的36kD富含半胱氨酸的肝素结合分泌糖蛋白。CTGF属于蛋白质CCN(CTGF,Cyr61,Nov)家族(分泌糖蛋白),该家族包括血清诱导的立即早期基因产物Cyr61、推断的癌基因Nov、ECM相关蛋白FISP-12、src诱导的基因CEF-10、Wnt诱导的分泌蛋白WISP-3以及抗增殖蛋白HICP/rCOP。CCN蛋白的特征在于保守的38个半胱氨酸残基,该38个半胱氨酸残基占总氨基酸含量10%以上并且形成具有N-末端和C-末端结构域的模块结构(modular structure)。CTGF模块结构包括在N-末端结构域的针对胰岛素样生长因子结合蛋白(IGF-BP)和von Willebrand因子(VWC)的保守基序,以及在C-末端结构域的血小板反应蛋白(TSP1)和半胱氨酸结基序。本披露的CTGF包含任意来源的野生型蛋白或保留其功能的变体。
本披露的术语“抗体”以最广义使用,其涵盖各种抗体结构,包括但不限于单克隆抗体,多克隆抗体,多特异性抗体(例如双特异性抗体),全长抗体或其抗原结合片段(也称“抗原结合部分”),鼠源抗体,嵌合抗体或人源化抗体,亲和力成熟的抗体,只要它们展现出期望的抗原结合活性。天然抗体指天然存在的免疫球蛋白分子。例如,天然IgG抗体是约150,000道尔顿的异四聚糖蛋白,由二硫键结合的两条相同轻链和两条相同重链构成。从N至C端,每条重链具有一个可变区(VH),又称作可变重域或重链可变域,接着是三个恒定域(CH1、CH2和CH3)。类似地,从N至C端,每条轻链具有一个可变区(VL),又称作可变轻域,或轻链可变域,接着是一个恒定轻(CL)域。“全长抗体”、“完整抗体”和“全抗体”在本文可互换使用,指具有与天然抗体结构基本类似的结构或具有含有如本文所限定的Fc区的重链的抗体。在一些实施方案中,本披露的全长抗体包括由表1、表2和表3中轻重链可变区组合中的轻链可变区与轻链恒定区连接和重链可变区与重链恒定区连接后所形成的全长抗体。本领域技术人员可以根据实际需要选择不同的抗体来源的轻链恒定区、重链恒定区,例如人抗体来源的轻链恒定区和重链恒定区。
“可变区”或“可变域”指抗体重链或轻链中涉及抗体结合抗原的域。VH和VL各包含四个保守的框架区(FR)和三个互补决定区(CDR)。其中,术语“互补决定区”、“CDR”指可变结构域内主要促成抗原结合的区域;“框架”或“FR”是指除CDR残基之外的可变结构域残基。VH包含3个CDR区:HCDR1、HCDR2和HCDR3;VL包含3个CDR区:LCDR1、LCDR2、和LCDR3。每个VH和VL由从氨基末端排到羧基末端按以下顺序排列的三个CDR和四个FR构成:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。单个VH或VL可能足以赋予抗原结合特异性。
可以采用各种公知的方案来确定CDR的氨基酸序列边界,例如:“Kabat”编号规则(参见Kabat等,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD,1991、“Chothia”编号规则、“AbM”编号规则、“contact”编号规则(参见Martin,ACR.Protein Sequence and Structure Analysis of Antibody Variable Domains[J].2001)和ImMunoGenTics(IMGT)编号规则(参见Lefranc M.P.,Dev.Comp.Immunol.,27,55-77(2003))等。包括例如Kabat编号和IMGT编号系统等在内的编号系统之间的关系是本领域技术人员熟知的,并且如下表4中所示。
表4.CDR编号系统之间的关系
| IMGT | Kabat | AbM | Chothia | Contact | |
| HCDR1 | 27-38 | 31-35 | 26-35 | 26-32 | 30-35 |
| HCDR2 | 50-65 | 50-65 | 50-58 | 52-56 | 47-58 |
| HCDR3 | 105-117 | 95-102 | 95-102 | 95-102 | 93-101 |
| LCDR1 | 27-38 | 24-34 | 24-34 | 24-34 | 30-36 |
| LCDR2 | 50-65 | 50-56 | 50-56 | 50-56 | 46-55 |
| LCDR3 | 105-117 | 89-97 | 89-97 | 89-97 | 89-96 |
抗体的“类”指其重链拥有的恒定区的类型。根据其恒定区氨基酸序列,抗体轻链包括两种类型,卡帕(κ)和拉姆达(λ)。根据抗体重链恒定区的氨基酸组成和排列顺序不同,可将抗体分为五类,或称为抗体同种型,即IgM、IgD、IgG、IgA和IgE,其相应的重链分别为μ链、δ链、γ链、α链、和ε链。同一类Ig根据其铰链区氨基酸组成和重链二硫键的数目和位置的差别,又可分为不同的亚类,如IgG可分为IgG
1、IgG
2、IgG
3、IgG
4。五类Ig中每类Ig都可以有κ链或λ链。本披露中所述人抗体重链恒定区和人抗体轻链恒定区的“常规变体”是指现有技术已公开的来源于人的不改变抗体可变区结构和功能的重链恒定区或轻链恒定区的变体,示例性变体包括对重链恒定区进行定点改造和氨基酸替换的IgG
1、IgG
2、IgG
3、IgG
4重链恒定区变体。在一些实施方案中,所述替换是YTE突变(M252Y/S254T/T256E),L234A和/或L235A突变,S228P突变,和/或获得杵臼(knob-into-hole)结构的突变。这些突变已被证实使得抗体具有新的性能,但不改变抗体可变区的功能。在一些实施方案中,抗体是IgG
1同种型的,具有铰链区中的P329、P234和P235突变以降低效应子功能。在一些实施方案中,抗体是IgG
2同种型。在一些实施方案中,抗体是IgG
4同种型的,具有铰链区中的S228P突变以改善IgG
4抗体的稳定性。
“抗体片段”指不同于完整抗体的分子,其包含完整抗体的部分,所述部分与完整抗体所结合的抗原相结合。抗体片段的实例包括但不限于Fv、Fab、Fab’、Fab’-SH、F(ab′)
2、单域抗体、双抗体、线性抗体、单链抗体分子(例如scFv);以及由抗体片段形成的多特异性抗体。
“Fc区”或“片段可结晶区”用于定义抗体重链的C末端区域,包括天然序列Fc区和变体Fc区。在一些实施方式中,人IgG重链的Fc区定义为从Cys226位置处的氨基酸残基或从Pro230延伸至其羧基末端。抗体重链的Fc区的边界还可 以变化,例如缺失Fc区的C末端赖氨酸(根据EU编号系统的残基447)或缺失Fc区的C末端甘氨酸和赖氨酸(根据EU编号系统的残基446和447)。因此,在一些实施方式中,完整抗体的组合物可以包括去除了所有K447残基和/或G446+K447残基的抗体群体。在一些实施方式中,完整抗体的组合物可以包括没有去除K447残基和/或G446+K447残基的抗体群体。在一些实施方式中,完整抗体的组合物具有带有和不带有K447残基和/或G446+K447残基的抗体混合物的抗体群体。用于本文所述抗体的合适天然序列Fc区包括人IgG1、IgG2(IgG2A、IgG2B)、IgG3和IgG4。除非本文中另有规定,Fc区或恒定区中的氨基酸残基的编号方式依照EU编号系统,又称作EU索引,如记载于Kabat等,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD,1991。
“鼠源抗体”在本披露中为根据本领域知识和技能制备的针对人CTGF的来源与鼠的单克隆抗体。制备时用CTGF抗原注射试验对象,然后分离表达具有所需序列或功能特性的抗体的杂交瘤。在本披露一个优选的实施方案中,所述的鼠源抗CTGF抗体或其抗原结合片段,可进一步包含鼠源κ、λ链或其变体的轻链恒定区,或进一步包含鼠源IgG
1、IgG
2、IgG
3或其变体的重链恒定区。
“嵌合抗体(chimeric antibody)”,是将鼠源性抗体的可变区与人抗体的恒定区融合而成的抗体,可以减轻鼠源性抗体诱发的免疫应答反应。建立嵌合抗体,要先建立分泌鼠源性特异性单抗的杂交瘤,然后从鼠杂交瘤细胞中克隆可变区基因,再根据需要克隆人抗体的恒定区基因,将鼠可变区基因与人恒定区基因连接成嵌合基因后插入表达载体中,最后在真核系统或原核系统中表达嵌合抗体分子。在本披露一个优选的实施方案中,所述嵌合抗体的抗体轻链进一步包含人源κ、λ链或其变体的轻链恒定区。所述的CTGF嵌合抗体的抗体重链进一步包含人源IgG1、IgG2、IgG3、IgG4或其变体的重链恒定区,优选包含人源IgG1、IgG2或IgG4重链恒定区,或者使用氨基酸突变(例如L234A和/或L235A突变,和/或S228P突变)的IgG1、IgG2或IgG4变体。
“人源化抗体(humanized antibody)”,也称为CDR移植抗体(CDR-grafted antibody),是指将鼠的CDR序列移植到人的抗体可变区框架,即不同类型的人种系抗体框架序列中产生的抗体。可以克服嵌合抗体由于携带大量鼠蛋白成分,从而诱导的异源性反应。此类构架序列可以从包括种系抗体基因序列的公共DNA数据库或公开的参考文献获得。如人重链和轻链可变区基因的种系DNA序列可以在“VBase”人种系序列数据库以及在Kabat,E.A.等人,1991 Sequences of Proteins of Immunological Interest,第5版中找到。为避免免疫原性下降的同时,引起的活性下降,可对所述的人抗体可变区框架序列进行最少反向突变或回复突变,以保持或增强活性。本披露的人源化抗体也包括进一步由酵母菌展示对CDR进行亲和力成熟突变后的人源化抗体。
“亲和力”是指分子(例如,抗体)的单个结合部位与其结合配体(例如,抗原)之间非共价相互作用的总体的强度。除非另外指明,如本文所用,“结合亲和力”是指内部结合亲和力,其反映出结合对(例如,抗体与抗原)的成员之间1:1相互作用。分子X对其配体Y的亲和力通常可以由解离常数(KD)表示。亲和力可以通过本领域已知的常规方法(包括本文所述的那些)测量。下面描述了用于测量结合亲和力的具体说明性和示例性实施例。
“kassoc”或“ka”指特定抗体-抗原相互作用的缔合速率,而如本文所使用的术语“kdis”或“kd”意在是指特定抗体-抗原相互作用的解离速率。如本文所使用的,术语“KD”指解离常数,其获得自kd与ka的比率(即kd/ka)并且表示为摩尔浓度(M)。可以使用本领域公知的方法测定抗体的KD值。用于测定抗体KD的方法包括使用生物传感系统例如系统测量表面等离子体共振,或通过溶液平衡滴定法(SET)测量溶液中的亲和力。
“亲和力成熟的”抗体指在抗体的一个或多个CDR中具有一处或多处改变、导致该抗体对抗原的亲和力与没有这些改变的亲本抗体相比有所改进的抗体。优选的在一些实施方式中,亲和力成熟的抗体将具有纳摩尔或甚至皮摩尔量级的对靶抗原的亲和力。亲和力成熟的抗体可通过本领域已知规程来生成。
“氨基酸突变”涵盖氨基酸替代,缺失,插入和修饰。可以进行取代、缺失、插入和修饰的任意组合来实现最终构建体,只要最终构建体拥有期望的特性。氨基酸序列缺失和插入包括氨基和/或羧基端缺失和氨基酸插入。具体的氨基酸突变可以是氨基酸替代。在一个实施方式中,氨基酸突变是非保守性的氨基酸替代,即将一个氨基酸用具有不同结构和/或化学特性的另一种氨基酸替换。氨基酸替代包括由非天然存在的氨基酸或由20种天然氨基酸的衍生物(例如4-羟脯氨酸、3-甲基组氨酸、鸟氨酸、高丝氨酸、5-羟赖氨酸)替换。可以使用本领域中公知的遗传或化学方法生成氨基酸突变。遗传方法可以包括定点诱变、PCR,基因合成等。预计基因工程以外的改变氨基酸侧链基团的方法,如化学修饰也可能是可用的。本文中可使用各种名称来指示同一氨基酸突变。
“约”是指处于如本领域的普通技术人员所确定的特定值的可接受误差范围之内,其将部分取决于所述值是如何测量或测定的,即所述测量系统的限制。在特定测定、结果或实施方案的上下文中,除非实施例或说明书其它地方内另有明确说明,否则“约”意指给定数值±5%以内的范围。
“缓冲剂”指通过其酸-碱共轭组分的作用而耐受pH变化的缓冲剂。将pH控制在适当范围中的缓冲剂的例子包括醋酸盐、琥珀酸盐、葡萄糖酸盐、组氨酸盐、草酸盐、乳酸盐、磷酸盐、枸橼酸盐、酒石酸盐、延胡索酸盐、甘氨酰甘氨酸和其它有机酸缓冲剂。
“组氨酸盐缓冲剂”是包含组氨酸根离子的缓冲剂。组氨酸盐缓冲剂的实例包括组氨酸-盐酸盐,组氨酸-醋酸盐,组氨酸-磷酸盐,组氨酸-硫酸盐等缓冲剂, 优选组氨酸-盐酸盐缓冲剂或组氨酸-醋酸盐缓冲剂,组氨酸-醋酸盐缓冲剂是组氨酸与醋酸配制而成,组氨酸-盐酸盐缓冲剂是组氨酸与组氨酸盐酸盐配制而成,或组氨酸与盐酸配制而成。
“枸橼酸盐缓冲剂”是包括枸橼酸根离子的缓冲剂。枸橼酸盐缓冲剂的实例包括枸橼酸-枸橼酸钠、枸橼酸-枸橼酸钾、枸橼酸-枸橼酸钙、枸橼酸-枸橼酸镁等。优选的枸橼酸盐缓冲剂是枸橼酸-枸橼酸钠。
“琥珀酸盐缓冲剂”是包括琥珀酸根离子的缓冲剂。琥珀酸盐缓冲剂的实例包括琥珀酸-琥珀酸钠、琥珀酸-琥珀酸钾、琥珀酸-琥珀酸钙盐等。优选的琥珀酸盐缓冲剂是琥珀酸-琥珀酸钠。示例性的,所述的琥珀酸-琥珀酸钠可由琥铂酸与氢氧化钠配制而成,或由琥铂酸与琥珀酸钠配制而成。
“磷酸盐缓冲剂”是包括磷酸根离子的缓冲剂。磷酸盐缓冲剂的实例包括磷酸氢二钠-磷酸二氢钠、磷酸氢二钠-磷酸二氢钾、磷酸氢二钠-枸橼酸等。优选的磷酸盐缓冲剂是磷酸氢二钠-磷酸二氢钠。
“醋酸盐缓冲剂”是包括醋酸根离子的缓冲剂。醋酸盐缓冲剂的实例包括醋酸-醋酸钠、醋酸组氨酸盐、醋酸-醋酸钾、醋酸醋酸钙、醋酸-醋酸镁等。优选的醋酸盐缓冲剂是醋酸-醋酸钠。
“稳定剂”是指有助于维持生物制药药物的结构完整性的组分,特别是在冷冻和/或冻干和/或储存期间(特别是当暴露于应激(stress)时)。这种稳定作用可以由于多种原因而产生,通常这种稳定剂可起到减轻蛋白质变性的渗透剂的作用。本文中额外的稳定剂是指除了缓冲体系、表面活性剂和糖醇以外的稳定剂,例如选自PEG、精氨酸和EDTA的稳定剂。
“药物组合物”表示含有一种或多种本文所述抗体与其他化学组分的混合物,所述其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是保持活性成分的稳定性,促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
本披露中,“药物组合物”和“制剂”并不互相排斥。
本披露中所述药物组合物的溶液形式,若无特殊说明,其中的溶剂均为水。
“冻干制剂”表示液体或溶液形式的药物组合物或液体或溶液制剂经真空冷冻干燥步骤之后获得的制剂或药物组合物。
尽管本披露提供了含量范围或含量值,但本领域一般技术人员理解,所述含量范围或含量值涵盖了所测定具体值的可接受误差范围。
本披露所述的药物组合物能够达到一种稳定的效果:其中的抗体在贮藏后基本上保留其物理稳定性和/或化学稳定性和/或生物学活性的药物组合物,优选地,药物组合物在贮藏后基本上保留其物理和化学稳定性以及其生物学活性。贮藏期一般基于药物组合物的预定保存期来选择。目前有多种测量蛋白质稳定性的分析技术,可测量在选定温度贮藏选定时间段后的稳定性。
稳定的制剂是在下述情况下没有观察到显著变化的制剂:在冷藏温度(2-8℃) 保存至少3个月、优选6个月、更优选1年,且甚至更优选地多达2年。另外,稳定的液体制剂包括这样的液体制剂:其在包括25℃的温度保存包括1个月、3个月、6个月在内的时段后表现出期望的特征。稳定性的典型的例子:通过SEC-HPLC测得,通常不超过约10%、优选不超过约5%的抗体单体发生聚集或降解。通过视觉分析,制剂是淡黄色近无色澄明液体或者无色澄明液体,或澄清至稍微乳白色。所述制剂的浓度、pH和重量克分子渗透压浓度具有不超过±10%变化。通常观察到不超过约10%、优选不超过约5%的减少。通常形成不超过约10%、优选不超过约5%的聚集。
如果在目检颜色和/或澄清度后,或者通过UV光散射、尺寸排阻色谱法(SEC)和动态光散射(DLS)测得,抗体没有显示出显著的聚集增加、沉淀和/或变性,那么所述抗体在药物制剂中“保留它的物理稳定性”。蛋白构象的变化可以通过荧光光谱法(其确定蛋白三级结构)和通过FTIR光谱法(其确定蛋白二级结构)来评价。
如果抗体没有显示出显著的化学改变,那么所述抗体在药物制剂中“保留它的化学稳定性”。通过检测和定量化学上改变的形式的蛋白,可以评估化学稳定性。经常改变蛋白化学结构的降解过程包括水解或截短(通过诸如尺寸排阻色谱法和CE-SDS等方法来评价)、氧化(通过诸如与质谱法或MALDI/TOF/MS结合的肽谱法等方法来评价)、脱酰胺作用(通过诸如离子交换色谱法、毛细管等电聚焦、肽谱法、异天冬氨酸测量等方法来评价)和异构化(通过测量异天冬氨酸含量、肽谱法等来评价)。
如果抗体在给定时间的生物活性是在制备药物制剂时表现出的生物活性的预定范围内,那么所述抗体在药物制剂中“保留它的生物活性”。
“施用”、“给予”和“处理”,当其应用于动物、人、实验受试者、细胞、组织、器官或生物流体时,是指外源性药物、治疗剂、诊断剂或组合物与动物、人、受试者、细胞、组织、器官或生物流体的接触。“施用”、“给予”和“处理”可以指例如治疗、药物代谢动力学、诊断、研究和实验方法。细胞的处理包括试剂与细胞的接触,以及试剂与流体的接触,其中所述流体与细胞接触。“施用”、“给予”和“处理”还意指通过试剂、诊断、结合组合物或通过另一种细胞体外和离体处理例如细胞。“处理”当其应用于人、兽医学或研究受试者时,是指治疗处理、预防或预防性措施,研究和诊断应用。
“治疗”意指给予患者内用或外用治疗剂,例如包含本披露的任一种的药物组合物,所述患者具有一种或多种疾病症状,而已知所述治疗剂对这些症状具有治疗作用。通常,在受治疗患者或群体中以有效缓解一种或多种疾病症状的量给予治疗剂,以诱导这类症状退化或抑制这类症状发展到任何临床右测量的程度。有效缓解任何具体疾病症状的治疗剂的量(也称作“治疗有效量”)可根据多种因素变化,例如患者的疾病状态、年龄和体重,以及药物在患者产生需要疗效的 能力。通过医生或其它专业卫生保健人士通常用于评价该症状的严重性或进展状况的任何临床检测方法,可评价疾病症状是否已被减轻。尽管本披露的实施方案(例如治疗方法或制品)在缓解每个目标疾病症状方面可能无效,但是根据本领域已知的任何统计学检验方法如Student t检验、卡方检验、依据Mann和Whitney的U检验、Kruskal-Wallis检验(H检验)、Jonckheere-Terpstra检验和Wilcoxon检验确定,其在统计学显著数目的患者中应当减轻目标疾病症状。
本披露中与CTGF相关的疾病没有限制,只要它是与CTGF相关的疾病即可,例如利用本披露的分子诱导的治疗反应可通过结合人类CTGF,然后阻遏CTGF与其受体/配体的结合,或杀伤过表达CTGF的肿瘤细胞。因此,当处于适于治疗应用的制备物和制剂中时,本披露的分子对这样一些人是非常有用的,他们患有肿瘤或癌症,可选地包括肺纤维化、肾纤维化、肿瘤形成和生长、青光眼、细胞增殖性疾病、白内障、脉络膜新血管形成、视网膜剥脱、增生性玻璃体视网膜病变、黄斑变性、糖尿病性视网膜病、角膜瘢痕形成和角膜浑浊、囊肿、减少血管钙化、胰腺导管腺癌、胰腺癌、黑色素瘤、放射性纤维化(radiation-induced fibrosis(RIF))、特发性肺纤维化、肺重塑疾病选自集团构成的哮喘、慢性支气管炎、慢性阻塞性肺疾病(COPD)、囊性纤维化、肺气肿等,优选胰腺癌、肺纤维化、肾纤维化。
在以上说明书中提出了本披露一种或多种实施方式的细节。虽然可使用与本文所述类似或相同的任何方法和材料来实施或测试本披露,但是以下描述优选的方法和材料。通过说明书和权利要求书,本披露的其他特点、目的和优点将是显而易见的。在说明书和权利要求书中,除非上下文中有清楚的另外指明,单数形式包括复数指代物的情况。除非另有定义,本文使用的所有技术和科学术语都具有本披露所属领域普通技术人员所理解的一般含义。说明书中引用的所有专利和出版物都通过引用纳入。提出以下实施例是为了更全面地说明本披露的优选实施方式。这些实施例不应以任何方式理解为限制本披露的范围,本披露的范围由权利要求书限定。
实施例
以下结合实施例进一步描述本披露,但这些实施例并非是对本披露范围的限制。本披露实施例中未注明具体条件的实验方法,通常按照常规条件,如参照冷泉港实验室出版的《抗体技术实验手册》,《分子克隆手册》;或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
一、抗体
实施例1-1.CTGF抗原、抗体的制备
一、抗原的设计及表达
以人CTGF蛋白(Genbank编号:NM_001901.2)作为模板,设计抗原及检测用蛋白的氨基酸序列,可选的在CTGF蛋白或者片段上融合不同的标签,分别克隆到pTT5载体上或pXC载体上,在293细胞瞬转表达或LONZA CHO细胞稳定表达,获得编码本披露抗原及检测用蛋白。以下CTGF抗原未特殊说明的均指人CTGF。
人CTGF全长蛋白(用于免疫),SEQ ID NO:1)
CTGF-his(人CTGF成熟蛋白与his标签的融合蛋白),可用于检测,SEQ ID NO:2
(备注:单下划线为信号肽,斜体为人CTGF编码区,双下划线为his标签。)
mCTGF-mFc(小鼠CTGF编码区与小鼠Fc标签的融合蛋白),可用于检测,SEQ ID NO:3
(备注:单下划线为信号肽,斜体为小鼠CTGF编码区,双下划线为mFc标签。)
小鼠CTGF蛋白-His标签,SEQ ID NO:4
(备注:单下划线为信号肽,斜体为小鼠CTGF编码区,双下划线为his标签。)
食蟹猴CTGF-Fc(食蟹猴CTGF编码区与Fc的融合蛋白),可用于检测,SEQ ID NO:5
(备注:单下划线为信号肽,斜体食蟹猴CTGF编码区,双下划线为Fc标签。)
二、CTGF相关重组蛋白的纯化,以及抗人CTGF杂交瘤抗体、重组抗体的纯化
1.ProteinG亲和层析分离纯化杂交瘤上清
对于小鼠杂交瘤上清纯化,首选ProteinG进行亲和层析,将培养所得杂交瘤离心取上清,根据上清体积加入10-15%体积的1M Tris-HCl(pH8.0-8.5)调节上清pH至中性。利用6M盐酸胍,将ProteinG柱洗3-5倍柱体积,然后利用纯水清洗3-5倍柱体积;利用如1×PBS(pH7.4)对层析柱平衡3-5倍柱体积;细胞上清利用低流速上样结合,控制流速使保留时间约1min或更长时间;利用1×PBS(pH7.4)洗涤层析柱3-5倍柱体积至紫外吸收回落至基线;利用0.1M醋酸/醋酸钠(pH3.0)缓冲液进行样品洗脱,根据紫外检测收集洗脱峰,洗脱产物利用1M Tris-HCl(pH8.0)快速调节洗脱产物的pH至5-6。可以利用本领域技术人员熟知的方法,对洗脱产物进行溶液置换,如利用超滤管进行超滤浓缩及溶液置换至所需的缓冲体系,或者利用分子排阻如G-25脱盐替换成所需的缓冲体系,或者利用如Superdex200等高分辨率分子排阻柱去除洗脱产物中的聚体成分以提高样品纯度。
2.Protein A亲和层析纯化抗体
首先将表达抗体的细胞培养上清进行高速离心收取上清。利用6M盐酸胍将 ProteinA亲和柱洗3-5倍柱体积,然后利用纯水清洗3-5倍柱体积。利用如1×PBS(pH 7.4)对层析柱平衡3-5倍柱体积。细胞上清利用低流速上样结合,控制流速使保留时间约1min或更长时间,结合完毕后利用1×PBS(pH 7.4)洗涤层析柱3-5倍柱体积至紫外吸收回落至基线。利用0.1M醋酸/醋酸钠(pH3.0-3.5)缓冲液进行样品洗脱,根据紫外检测收集洗脱峰,洗脱产物利用1M Tris-HCl(pH 8.0)快速调节洗脱产物的pH至5-6。可以利用本领域技术人员熟知的方法,对洗脱产物进行溶液置换,如利用超滤管进行超滤浓缩及溶液置换至所需的缓冲体系,或者利用分子排阻如G-25脱盐替换成所需的缓冲体系,或者利用如Superdex 200等高分辨率分子排阻柱去除洗脱产物中的聚体成分以提高样品纯度。
3.镍柱纯化人CTGF-his等CTGF相关重组蛋白
将细胞表达上清样品高速离心去除杂质,并将缓冲液置换为PBS,加入咪唑至终浓度为5mM。用含有5mM咪唑的PBS溶液平衡镍柱,冲洗2-5倍柱体积。将置换后的上清样品上柱结合,介质可以选择不同公司的镍柱。用含有5mM咪唑的PBS溶液冲洗柱子,至A280读数降至基线。后用PBS+10mM咪唑冲洗层析柱,除去非特异结合的杂蛋白,并收集流出液。再用含有300mM咪唑的PBS溶液洗脱目的蛋白,并收集洗脱峰。
收集的洗脱产物浓缩后可用凝胶层析Superdex200(GE)进一步纯化,流动相为PBS,去除聚体及杂蛋白峰,收集目的产物洗脱峰。所得到的蛋白经电泳,肽图,LC-MS鉴定为正确后分装备用。
4.Protein A亲和层析纯化人CTGF-Fc,食蟹猴CTGF-Fc等CTGF相关重组蛋白
首先将培养上清进行高速离心收取上清。利用6M盐酸胍将ProteinA亲和柱洗3-5倍柱体积,然后利用纯水清洗3-5倍柱体积。利用如1×PBS(pH 7.4)对层析柱平衡3-5倍柱体积。细胞上清利用低流速上样结合,控制流速使保留时间约1min或更长时间,结合完毕后利用1×PBS(pH 7.4)洗涤层析柱3-5倍柱体积至紫外吸收回落至基线。利用0.1M醋酸/醋酸钠(pH3.0-3.5)缓冲液进行样品洗脱,根据紫外检测收集洗脱峰。
收集的洗脱产物浓缩后可用凝胶层析Superdex200(GE)进一步纯化,流动相为PBS,去除聚体及杂蛋白峰,收集目的产物洗脱峰。所得到的蛋白经电泳,肽图,LC-MS鉴定为正确后分装备用。
实施例1-2.抗人CTGF单克隆抗体的制备
一、免疫
抗人CTGF单克隆抗体通过免疫小鼠产生。实验用SJL白小鼠,雌性,6-8周龄(北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2012-0001)。饲养环境:SPF级。小鼠购进后,实验室环境饲养1周,12/12小时 光/暗周期调节,温度20-25℃;湿度40-60%。将已适应环境的小鼠按以下方案免疫。免疫抗原为CTGF(R&D)和mCTGF-mFc。
免疫方案:用CTGF蛋白进行小鼠免疫,25微克/只/次,腹腔内注射。第0天腹膜内(IP)注射100μL/只,之后每14天进行一次加强免疫。于第21、35、49、63天取血,用ELISA方法确定小鼠血清中的抗体滴度。在7-9次免疫以后,选择血清中抗体滴度高并且滴度趋于平台的小鼠进行脾细胞融合。在进行脾细胞融合前3天加强免疫,腹膜内(IP)注射25μg/只的生理盐水配制的CTGF蛋白抗原溶液。
二、脾细胞融合
采用PEG介导的融合步骤将脾淋巴细胞与骨髓瘤细胞Sp2/0(
CRL-8287
TM)进行融合得到杂交瘤细胞。融合好的杂交瘤细胞以0.5-1×10
6/mL的密度用完全培养基(含20%FBS、1×HAT、1×OPI的IMDM培养基)重悬,100μL/孔接种于96孔板中,37℃,5%CO
2孵育3-4天后,补充HAT完全培养基100μL/孔,继续培养3-4天至形成针尖般克隆。去除上清,加入200μL/孔的HT完全培养基(含20%FBS、1×HT和1×OPI的IMDM培养基),37℃,5%CO
2培养3天后进行ELISA检测。
三、杂交瘤细胞的筛选
根据杂交瘤细胞生长密度,用结合ELISA方法进行杂交瘤培养上清检测。并将结合ELISA检测的阳性孔细胞上清与猴CTGF/小鼠CTGF/人CTGF蛋白结合实验(具体方法实施例3相同)。对蛋白ELISA结合实验为阳性的孔细胞及时进行扩增冻存保种及2到3次亚克隆直至获得单细胞克隆。
每次亚克隆细胞也均需进行CTGF结合ELISA。通过以上实验筛选得到杂交瘤克隆,用无血清细胞培养法进一步制备抗体,按纯化实例纯化抗体,供在检测例中使用。
四、杂交瘤阳性克隆序列测定
从阳性杂交瘤中克隆序列的过程如下。收集对数生长期的杂交瘤细胞,用Trizol(Invitrogen,Cat No.15596-018)按照试剂盒说明书步骤提取RNA,用PrimeScript
TM Reverse Transcriptase试剂盒反转录(Takara,Cat No.2680A)。将反转录得到的cDNA采用mouse Ig-Primer Set(Novagen,TB326 Rev.B 0503)进行PCR扩增后,将扩增产物送测序公司测序。经测序得到鼠源抗CTGF抗体:mab147、mab164、mab95的可变区氨基酸序列如下:
mab147 VH氨基酸序列如SEQ ID NO:6所示,
mab147 VL氨基酸序列如SEQ ID NO:7所示,
mab164 VH氨基酸序列如SEQ ID NO:8所示,
mab164 VL氨基酸序列如SEQ ID NO:9所示,
mab95 VH氨基酸序列如SEQ ID NO:69所示,
mab95 VL氨基酸序列如SEQ ID NO:70所示,
上述mab147、mab164、mab95抗体可变区序列中,斜体为FR序列,下划线斜体为CDR序列,序列顺序依次为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
表5.抗CTGF抗体重链及轻链CDR区氨基酸序列表*
*表格中CDR由Kabat编号规则确定。
五、人IgG1嵌合抗体制备
mab147、mab164、mab95候选分子经过扩增测序可得到可变区编码基因序列,以测序所得序列设计首尾引物,以测序基因为模板,经过PCR搭建各抗体VH/VK 基因片段,再与表达载体pHr(带信号肽及hIgG1/hkappa/hlambda恒定区基因(CH1-Fc/CL)片段)进行同源重组,构建重组嵌合抗体的全长表达质粒VH-CH1-Fc-pHr/VL-CL-pHr,形成Ch147,Ch164,Ch95三个嵌合抗体。
六、鼠源抗人CTGF抗体的人源化
通过比对IMGT(https://imgt.cines.fr)人类抗体重轻链可变区种系基因数据库和MOE(Molecular Operating Environment,分子操作环境)软件,分别挑选与鼠源抗体同源性高的重链和轻链可变区种系基因作为模板,将鼠源抗体的CDR分别移植到相应的人源模板中,形成次序为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4的可变区序列。
1.mab147的人源化改造
鼠源抗体mab147的人源化轻链模板为IGKV3-11*01和IGKJ2*01或IGKV1-39*01和IGKJ2*01,人源化重链模板为IGHV3-72*01和IGHJ1*01,将鼠源抗体mab147的CDR分别移植到其人源模板中,进而,对人源化抗体的FR部分氨基酸进行回复突变改造,其中轻链可变区回复突变包括4L、36F、43S、45K、47W、58V或71Y中的一个或更多个,重链可变区回复突变包括28S、30N、49A、75E、76S、93V、94E或104D中的一个或更多个(轻链可变区和重链可变区中的回复突变位点的位置根据Kabat编号规则确定),得到具有不同序列的轻链可变区和重链可变区。即获得含有mab147的CDR的人源化抗体,其可变区序列如下:
mAb147人源化抗体可变区具体序列如下:
Hu147-VL1氨基酸序列如SEQ ID NO:22所示:
Hu147-VL2氨基酸序列如SEQ ID NO:23所示:
Hu147-VL3氨基酸序列如SEQ ID NO:24所示:
Hu147-VL4氨基酸序列如SEQ ID NO:25所示:
Hu147-VL5氨基酸序列如SEQ ID NO:26所示:
Hu147-VH1氨基酸序列如SEQ ID NO:27所示:
Hu147-VH2氨基酸序列如SEQ ID NO:28所示:
Hu147-VH3氨基酸序列如SEQ ID NO:29所示:
注:下划线为以Kabat规则定义的CDR序列,顺序依次为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
2.mab164的人源化改造
鼠源抗体mab164的人源化轻链模板分别由IGLV7-43*01和IGLJ2*01、IGLV8-61*01和IGLJ2*01,或IGLV1-40*02和IGLJ2*01构成,人源化重链模板分别由IGHV2-26*01和IGHJ6*01,或IGHV4-31*02和IGHJ6*01构成,将鼠源抗体mab164的CDR分别移植到其人源模板中,进而,对人源化抗体的FR部分氨基酸进行回复突变改造,其中轻链可变区回复突变包括36V、44F、46G或49G中的一个或更多个,重链可变区回复突变包括44G、49G、27F、48L、67L、71K、78V或80F中的一个或更多个(其中的回复突变位点的位置根据Kabat编号规则确定),即获得mab164的人源化抗体重链,人源化抗体轻链,其可变区序列如下:
mAb164人源化抗体可变区具体序列如下:
Hu164-VL7氨基酸序列如SEQ ID NO:30所示:
Hu164-VL8氨基酸序列如SEQ ID NO:31所示:
Hu164-VL9氨基酸序列如SEQ ID NO:32所示:
Hu164-VH5氨基酸序列如SEQ ID NO:33所示:
Hu164-VH6氨基酸序列如SEQ ID NO:34所示:
Hu164-VH7氨基酸序列如SEQ ID NO:35所示:
Hu164-VH8氨基酸序列如SEQ ID NO:36所示:
注:上述Hu164抗体序列中,下划线为CDR序列,顺序依次为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,其中的CDR序列根据Kabat规则进行定义。
3.mab95的人源化改造
鼠源抗体mab95的人源化轻链模板为IGKV3-20*02和IGKV1-40*01,人源化重链模板为IGHV1-3*01,将鼠源抗体mab95的CDR分别移植到其人源模板中,进而,对人源化抗体的FR部分氨基酸进行回复突变改造,其中轻链可变区回复突变包括45P、46W、48Y、69S或70Y中的一个或更多个,重链可变区回复突变包括27F、38K、48I、67K、68A、70L或72F中的一个或更多个(轻链可变区和重链可变区中的回复突变位点的位置根据Kabat编号规则确定),得到具有不同序列的轻链可变区和重链可变区。即获得含有mab95的CDR的人源化抗体,其可变区序列如下:
mAb95人源化抗体可变区具体序列如下:
Hu95-VL1氨基酸序列如SEQ ID NO:77所示:
Hu95-VL2氨基酸序列如SEQ ID NO:78所示:
Hu95-VL3氨基酸序列如SEQ ID NO:79所示:
Hu95-VL4氨基酸序列如SEQ ID NO:80所示:
Hu95-VH1氨基酸序列如SEQ ID NO:81所示:
Hu95-VH2氨基酸序列如SEQ ID NO:82所示:
Hu95-VH3氨基酸序列如SEQ ID NO:83所示:
Hu95-VH4氨基酸序列如SEQ ID NO:84所示:
Hu95-VH5氨基酸序列如SEQ ID NO:85所示:
注:下划线为以Kabat规则定义的CDR序列,顺序依次为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
其中,Hu95-VH5的CDR区进行了进一步的修饰,其HCDR1如SEQ ID NO:102(NYAIH)所示,HCDR2如SEQ ID NO:103(LVYPYTGGTAYNQKFKD)所示,HCDR3如SEQ ID NO:104(WGMIPGTNSYFDV)所示。
4.抗CTGF人源化全长抗体的构建和表达
设计引物PCR搭建各人源化抗体VH/VL基因片段,再与表达载体pHr(带信号肽及恒定区基因(CH/CL)片段)进行同源重组,构建抗体全长表达载体VH-CH-pHr/VL-CL-pHr。所述人源化抗体的恒定区可选自人κ、λ链轻链恒定区,以及选自IgG1、IgG2、IgG3或IgG4或其变体的重链恒定区,非限制性实施包括对人IgG1、IgG2、IgG4的恒定区进行优化设计,改善抗体功能,如恒定区的M252Y/S254T/T256E(”YTE”)位点突变可以延长抗体的半衰期,S228P、F234A和L235A等其他恒定区位点突变等。
示例性的抗CTGF人源化抗体恒定区序列如下:
重链恒定区氨基酸序列如SEQ ID NO:37所示(所形成的全长抗体重链的名称后缀为w):
YTE改造抗体的重链恒定区氨基酸序列如SEQ ID NO:38所示(所形成全长 抗体重链的名称后缀为y):
抗CTGF人源化抗体的轻链kappa恒定区氨基酸序列如SEQ ID NO:39所示(所形成全长抗体重链的名称后缀为k):
抗CTGF人源化抗体轻链lambda恒定区氨基酸序列如SEQ ID NO:40所示(所形成全长抗体重链的名称后缀为l):
人源化抗体的重链可变区与SEQ ID NO:37所示的重链恒定区连接,以及人源化抗体的轻链可变区与SEQ ID NO:39所示的轻链kappa恒定区连接形成的来源自mab147的全长人源化抗体包括:
表6
| Hu147-VL1 | Hu147-VL2 | Hu147-VL3 | Hu147-VL4 | Hu147-VL5 | |
| Hu147-VH1 | Hu147-11wk | Hu147-12wk | Hu147-13wk | Hu147-14wk | Hu147-15wk |
| Hu147-VH2 | Hu147-21wk | Hu147-22wk | Hu147-23wk | Hu147-24wk | Hu147-25wk |
| Hu147-VH3 | Hu147-31wk | Hu147-32wk | Hu147-33wk | Hu147-34wk | Hu147-35wk |
人源化抗体重链的可变区与SEQ ID NO:38所示的重链恒定区YTE变体连接,以及人源化抗体的轻链可变区与SEQ ID NO:39所示的轻链kappa恒定区连接形成的来源自mab147的全长人源化抗体包括:
表7
| Hu147-VL1 | Hu147-VL2 | Hu147-VL3 | Hu147-VL4 | Hu147-VL5 | |
| Hu147-VH1 | Hu147-11yk | Hu147-12yk | Hu147-13yk | Hu147-14yk | Hu147-15yk |
| Hu147-VH2 | Hu147-21yk | Hu147-22yk | Hu147-23yk | Hu147-24yk | Hu147-25yk |
| Hu147-VH3 | Hu147-31yk | Hu147-32yk | Hu147-33yk | Hu147-34yk | Hu147-35yk |
人源化抗体重链可变区与SEQ ID NO:37所示的重链恒定区连接,以及人源化 抗体轻链可变区与SEQ ID NO:40所示的轻链lambda恒定区连接形成的来源自mab164的全长人源化抗体包括:
表8
| Hu164-VH5 | Hu164-VH6 | Hu164-VH7 | Hu164-VH8 | |
| Hu164-VL7 | Hu164-57wl | Hu164-67wl | Hu164-77wl | Hu164-87wl |
| Hu164-VL8 | Hu164-58wl | Hu164-68wl | Hu164-78wl | Hu164-88wl |
| Hu164-VL9 | Hu164-59wl | Hu164-69wl | Hu164-79wl | Hu164-89wl |
人源化抗体重链可变区与SEQ ID NO:38所示的重链恒定区YTE变体连接,以及人源化抗体轻链可变区与SEQ ID NO:40所示的轻链lambda恒定区连接形成的来源自mab164的全长人源化抗体包括:
表9
| Hu164-VH5 | Hu164-VH6 | Hu164-VH7 | Hu164-VH8 | |
| Hu164-VL7 | Hu164-57yl | Hu164-67yl | Hu164-77yl | Hu164-87yl |
| Hu164-VL8 | Hu164-58yl | Hu164-68yl | Hu164-78yl | Hu164-88yl |
| Hu164-VL9 | Hu164-59yl | Hu164-69yl | Hu164-79yl | Hu164-89yl |
人源化抗体重链可变区与SEQ ID NO:37所示的重链恒定区连接,以及人源化抗体轻链可变区与SEQ ID NO:39所示的轻链kappa恒定区连接形成的来源自mab95的全长人源化抗体包括:
表10
| Hu95-VH1 | Hu95-VH2 | Hu95-VH3 | Hu95-VH4 | Hu95-VH5 | |
| Hu95-VL1 | Hu95-11wk | Hu95-21wk | Hu95-31wk | Hu95-41wk | Hu95-51wk |
| Hu95-VL2 | Hu95-12wk | Hu95-22wk | Hu95-32wk | Hu95-42wk | Hu95-52wk |
| Hu95-VL3 | Hu95-13wk | Hu95-23wk | Hu95-33wk | Hu95-43wk | Hu95-53wk |
| Hu95-VL4 | Hu95-14wk | Hu95-24wk | Hu95-34wk | Hu95-44wk | Hu95-54wk |
人源化抗体重链可变区与SEQ ID NO:38所示的重链恒定区YTE变体连接,以及人源化抗体轻链可变区与SEQ ID NO:39所示的轻链kappa恒定区连接形成的来源自mab95的全长人源化抗体包括:
表11
| Hu95-VH1 | Hu95-VH2 | Hu95-VH3 | Hu95-VH4 | Hu95-VH5 | |
| Hu95-VL1 | Hu95-11yk | Hu95-21yk | Hu95-31yk | Hu95-41yk | Hu95-51yk |
| Hu95-VL2 | Hu95-12yk | Hu95-22yk | Hu95-32yk | Hu95-42yk | Hu95-52yk |
| Hu95-VL3 | Hu95-13yk | Hu95-23yk | Hu95-33yk | Hu95-43yk | Hu95-53yk |
| Hu95-VL4 | Hu95-14yk | Hu95-24yk | Hu95-34yk | Hu95-44yk | Hu95-54yk |
示例性的抗CTGF抗体全长氨基酸序列如下:
表12全长抗体的轻链或重链
作为阳性对照的CTGF抗体mAb1(来源自CN1829740B,抗体名称为pamrevlumab,又名为FG-3019)的序列如下:
重链:(SEQ ID NO:67)
轻链:(SEQIDNO:68)
实施例1-3.CTGF抗体的结合活性检测
一、CTGF抗体结合人CTGF蛋白的ELISA实验
抗人CTGF抗体的结合力通过抗体与人CTGF蛋白的ELISA实验和Biacore来检测。用CTGF重组蛋白直接包被在96孔酶标板中,抗体加入后信号的强弱被用于判断抗体和CTGF的结合活性。具体实验方法如下:
用pH 7.4的PBS(上海源培,Cat No.B320)缓冲液将CTGF蛋白(R&D,Cat No.9190-CC)稀释至0.2μg/mL浓度,以50μL/孔的体积加入96孔酶标板(Corning,Cat No.CLS3590-100EA)中,于37℃孵育箱中放置2小时或4℃放置过夜(16-18小时)。弃去液体后,加入用PBS稀释的5%脱脂牛奶(BD skim milk,Cat No.232100)封闭液250μL/孔,37℃孵育箱孵育3小时或4℃放置过夜(16-18小时)进行封闭。封闭结束后,弃去封闭液,并用PBST缓冲液(含0.1%Tween-20的PBS,pH7.4)洗板5次后,加入50μL/孔用样品稀释液稀释的不同浓度待测抗体(杂交瘤纯化抗体或人源化抗体),放于37℃孵育箱孵育1小时。孵育结束后用PBST洗板3次,加入50μL/孔用样品稀释液稀释的HRP标记的羊抗鼠二抗(Jackson Immuno Research,Cat No.115-035-003)或羊抗人二抗(Jackson Immuno Research,Cat No.109-035-003),37℃孵育1小时。用PBST洗板3次后,加入50μL/孔TMB显色底物(KPL,Cat No.52-00-03),于室温孵育5-10min,加入50μL/孔1M H
2SO
4终止反应,用酶标仪(Molecular Devices,VERSA max)在波长450nm处读取吸收值,用GraphPad Prism 5分析数据,计算CTGF抗体对人CTGF蛋白的结合EC50值。实验结果见图1及表13所示。
表13.CTGF抗体结合人CTGF蛋白ELISA实验结果
实验结果显示,本披露的人源化全长抗CTGF抗体均与人CTGF蛋白有很好的结合作用。
二、CTGF抗体结合食蟹猴CTGF蛋白的ELISA实验
抗猴CTGF抗体的结合力通过抗体与猴CTGF蛋白的ELISA实验来检测。用抗-mFc蛋白直接包被在96孔酶标板中,后续用带有Fc标签的cyno-CTGF蛋白与板子结合,然后加入抗体加入后信号的强弱被用于判断抗体和cyno-CTGF的结合活性。具体实验方法如下:
用pH7.4的PBS(上海源培,Cat No.B320)缓冲液将抗-mFc蛋白(Sigma,Cat No.M4280)稀释至2μg/mL浓度,以50μl/孔的体积加入96孔酶标板(Corning,Cat No.CLS3590-100EA)中,于37℃孵育箱中放置2小时。弃去液体后,加入用PBS稀释的5%脱脂牛奶(BD skim milk,Cat No.232100)封闭液250μL/孔,37℃孵育箱孵育3小时或4℃放置过夜(16-18小时)进行封闭。封闭结束后,弃去封闭液,并用PBST缓冲液(含0.1%Tween-20的PBS,pH7.4)洗板3次后,每孔加入50μl的1μg/mL的cyno-CTGF-mFc蛋白,37℃孵育箱孵育1小时后,用PBST缓冲液(含0.1%Tween-20的PBS,pH7.4)洗板3次后,加入50μL/孔用样品稀释液稀释的不同浓度待测抗体(杂交瘤纯化抗体或人源化抗体),放于37℃孵育箱孵育1小时。孵育结束后用PBST洗板3次,加入50μl/孔用样品稀释液稀释的HRP标记的羊抗鼠二抗(Jackson Immuno Research,Cat No.115-035-003)或羊抗人二抗(Jackson Immuno Research,Cat No.109-035-003),37℃孵育1小时。用PBST洗板5次后,加入50μL/孔TMB显色底物(KPL,Cat No.52-00-03),于室温孵育5-10min,加入50μL/孔1M H
2SO
4终止反应,用酶标仪(Molecular Devices,VERSA max)在波长450nm处读取吸收值,用GraphPad Prism 5分析数据,计算CTGF抗体对食蟹猴CTGF蛋白的结合EC50值。实验结果见表14所示。
表14.CTGF抗体结合食蟹猴CTGF蛋白ELISA实验结果
实验结果表明,本披露的人源化抗CTGF抗体均与猴CTGF蛋白有很好的结合作用。
三、CTGF抗体与小鼠CTGF蛋白的ELISA实验
抗小鼠CTGF抗体的结合力通过抗体与小鼠CTGF蛋白的ELISA实验来检测。用小鼠-CTGF融合蛋白直接包被在96孔酶标板中,抗体加入后信号的强弱被用于判断抗体和小鼠-CTGF的结合活性。具体实验方法如下:
用pH7.4的PBS(上海源培,Cat No.B320)缓冲液将小鼠CTGF-his蛋白稀释至0.5μg/mL浓度,以50μL/孔的体积加入96孔酶标板(Corning,Cat No.CLS3590-100EA)中,于37℃孵育箱中放置2小时。弃去液体后,加入用PBS稀释的5%脱脂牛奶(BD skim milk,Cat No.232100)封闭液250μL/孔,37℃孵育箱孵育3小时或4℃放置过夜(16-18小时)进行封闭。封闭结束后,弃去封闭液,并用PBST缓冲液(pH7.4PBS含0.1%tween-20)洗板3次后,加入50μL/孔用样品稀释液稀释的不同浓度待测抗体(杂交瘤纯化抗体或人源化抗体),放于37℃孵育箱孵育1小时。孵育结束后用PBST洗板3次,加入50μl/孔用样品稀释液稀释的HRP标记的羊抗鼠二抗(Jackson Immuno Research,Cat No.115-035-003)或羊抗人二抗(Jackson Immuno Research,Cat No.109-035-003),37℃孵育1小时。用PBST洗板5次后,加入50μL/孔TMB显色底物(KPL,Cat No.52-00-03),于室温孵育5-10min,加入50μL/孔1M H
2SO
4终止反应,用酶标仪(Molecular Devices,VERSA max)在波长450nm处读取吸收值,用GraphPad Prism 5分析数据,计算CTGF抗体对小鼠CTGF蛋白的结合EC50值。实验结果见表15所示。
表15.CTGF抗体结合小鼠CTGF蛋白ELISA实验结果
实验结果表明,本披露的人源化全长抗CTGF抗体均与小鼠CTGF蛋白有很好的结合作用。
实施例1-4.CTGF抗体的功能阻断实验
该试验用Biacore仪器检测待测人源化抗CTGF抗体对人TGF-β1功能的阻断活性。
首先将抗原人CTGF以氨基偶联的方式固定到CM5生物传感芯片(Cat.#BR-1005-30,GE)上,固化水平1500RU,然后于芯片表面流经高浓度的CTGF抗 体(150μg/ml)150s,再进样50nM TGF-β1蛋白120s,用Biacore T200仪器实时检测反应信号获得结合和解离曲线。在每个试验循环解离完成后,用再生缓冲液将生物传感芯片洗净再生。
试验得到的数据用GE Biacore T200 Evaluation version 3.0软件进行统计分析。
阻断效率(Blocking efficiency)=[1-(样品响应值/空白对照响应值)]×100%。具体结果见表16所示。
表16.CTGF抗体的功能阻断实验结果
试验结果表明,本披露的人源化抗CTGF抗体均具有高功能阻断活性。
抗CTGF抗体亲和力的Biacore测定
该试验用Biacore仪器测定待测人源化抗CTGF抗体与人CTGF、小鼠CTGF的亲和力。
分别用Protein A生物传感芯片(Cat.#29127556,GE)亲和捕获一定量的待测抗体,然后于芯片表面流经一定浓度的人、鼠CTGF抗原,利用Biacore仪器实时检测反应信号从而获得结合和解离曲线。在每个循环解离完成后,pH1.5的甘氨酸-盐酸再生溶液(Cat.#BR-1003-54,GE)将生物芯片洗净再生。试验运行缓冲液为1×HBS-EP缓冲溶液(Cat.#BR-1001-88,GE)。
试验得到的数据用GE Biacore T200 Evaluation version 3.0软件以(1:1)Langmuir模型进行拟合,得出亲和力数值,具体见表17、18所示。
表17.CTGF抗体与人CTGF蛋白的反应亲和力
表18.CTGF抗体与小鼠CTGF蛋白的反应亲和力
| 抗体 | ka(1/Ms) | kd(1/s) | KD(M) |
| Ch147 | 3.12E+07 | 3.84E-02 | 1.23E-09 |
| Ch164 | 1.23E+08 | 1.01E-02 | 8.22E-11 |
| Ch95 | 1.38E+07 | 2.35E-02 | 1.71E-09 |
| Hu147-11wk | 1.20E+08 | 3.74E-01 | 3.11E-09 |
| Hu147-12wk | 3.75E+07 | 1.16E-01 | 3.09E-09 |
| Hu147-13wk | 5.73E+07 | 1.46E-01 | 2.55E-09 |
| Hu147-23wk | 8.18E+07 | 1.73E-01 | 2.12E-09 |
| Hu147-31wk | 3.83E+07 | 1.07E-02 | 2.79E-09 |
| Hu147-32wk | 1.37E+08 | 3.43E-01 | 2.49E-09 |
| Hu147-33wk | 9.01E+07 | 1.74E-01 | 1.93E-09 |
| Hu164-57wl | 7.35E+07 | 2.37E-03 | 3.22E-11 |
| Hu164-67wl | 6.36E+07 | 1.17E-03 | 1.84E-11 |
| Hu164-67yl | 5.34E+07 | 1.94E-03 | 3.63E-11 |
| Hu164-77wl | 5.98E+07 | 8.83E-03 | 1.48E-10 |
| Hu164-87wl | 5.24E+07 | 4.40E-03 | 8.40E-11 |
| Hu164-68wl | 5.70E+07 | 7.60E-03 | 1.33E-10 |
| Hu164-69wl | 6.17E+07 | 7.74E-03 | 1.26E-10 |
| Hu95-21wk | 5.29E+06 | 2.11E-02 | 3.99E-09 |
| Hu95-31wk | 7.84E+06 | 2.25E-02 | 2.87E-09 |
| Hu95-41wk | 1.39E+07 | 3.39E-02 | 2.44E-09 |
| Hu95-42wk | 5.66E+06 | 1.37E-02 | 2.42E-09 |
| Hu95-51yk | 2.56E+07 | 5.16E-04 | 2.02E-11 |
试验结果表明,来源自鼠源抗体mAb147和mAb164的嵌合抗体Ch147和Ch164及人源化抗CTGF抗体均能与人CTGF和小鼠CTGF以高亲和力结合,多种人来源抗体种系FR区的替换和回复突变改造均不影响人源化抗体的亲和力,部分改造甚至会增强抗体与抗原的亲和力。
实施例1-5.CTGF抗体对TGFβ诱导的C2C12细胞体外迁移抑制实验
C2C12细胞(小鼠成肌细胞,中科院细胞库,#GNM26)用0.25%胰酶(Gibco,#25200-072)消化,离心后用无血清的DMEM培养基(Gibco,#10564-029)重悬。用无血清的DMEM培养基配制细胞-抗体混合物及TGFβ1-抗体混合物,细胞密度为2×10
5/mL,重组人TGFβ1(Cell signaling Technology,#8915LC)浓度为10ng/mL,待测抗体浓度均为30μg/mL。
打开
Disposable Chemotaxis System(Neuro Probe,#106-8)的上盖及过滤膜,将TGFβ-抗体混合物加入下室中,每孔30μL,每组4副孔。盖上过滤膜,在膜上加细胞-抗体混合物,每孔加入50μL,每组4副孔。盖上上盖,置于培养箱(37℃,5%CO
2)中。
孵育48小时后,用干净纸巾吸去过滤膜上液体,打开过滤膜,向下室中每孔加入10μL预冷的0.25%胰酶,盖上过滤膜。消化5分钟后,1000rpm离心1分钟。打开过滤膜,向下室中每孔加入20μL Cell Titer-Glo溶液(Promega,#G7573),室温孵育10分钟。将液体转移至384孔白底板(Thermo Scientific,#267462)中,用酶标仪(BMG,#PheraStar)采用化学发光法读板。用Graphpad Prism 6对数据进行分析处理。
抑制率=[(TGFβ平均值-样品组平均值)/(TGFβ组平均值-未处理组平均值)]×100%
表19.CTGF抗体对C2C12细胞体外迁移实验的抑制结果
| 受试样品 | 对C2C12细胞体外迁移的抑制百分比(%) |
| Hu147-11wk | 72.2% |
| Hu147-33wk | 63.8% |
| Hu164-57wl | 75.4% |
| Hu164-67wl | 78.8% |
| Hu164-67yl | 76.5% |
| Hu164-77wl | 72.8% |
| Hu164-87wl | 76.4% |
| Hu164-68wl | 76.3% |
| Hu164-69wl | 74.2% |
| Hu95-51yk | 80.0% |
| mAb1 | 63.0% |
结果表明,本披露的人源化抗CTGF抗体可抑制TGFβ1诱导后C2C12细胞在体外的迁移能力,对C2C12细胞迁移能力的抑制均比阳性对照抗体mAb1强。
实施例1-6.CTGF抗体对TGFβ诱导PANC1细胞体外迁移抑制实验
PANC-1细胞(人胰腺癌细胞,ATCC,#CRL-1469)用0.25%胰酶(Gibco,#25200-072)消化,离心后用含0.1%胎牛血清(Gibco,#10099-141)的DMEM培养基(Gibco,#10564-029)重悬。用含0.1%胎牛血清的DMEM培养基配制细胞-抗体混合物及TGFβ-抗体混合物,细胞密度为4×10
5/mL,重组人TGFβ(Cell signaling Technology,#8915LC)浓度为10ng/mL,待测抗体浓度均为30μg/mL。
打开
Disposable Chemotaxis System(Neuro Probe,#106-8)的上盖及过滤膜,将TGFβ-抗体混合物加入下室中,每孔30μL,每组4副孔。盖上过滤膜,在膜上加细胞-抗体混合物,每孔加入50μL,每组4副孔。盖上上盖,置于培养箱(37℃,5%CO
2)中。
孵育48小时后,用干净纸巾吸去过滤膜上液体,打开过滤膜,向下室中每孔加入10μl预冷的0.25%胰酶,盖上过滤膜。消化5分钟后,1000rpm离心1分钟。在倒置显微镜(Leica,#DMIL LED)下计数沉于板底的细胞。用Graphpad Prism 6对数据进行分析处理。抑制率=[(TGFβ平均值-样品组平均值)/(TGFβ组平均值-未处理组平均值)]×100%
表20.CTGF抗体对PANC1细胞体外迁移实验的抑制结果
结果表明,本披露的人源化抗CTGF抗体均可抑制TGFβ1诱导后PANC1细胞在体外的迁移能力。
实施例1-7.CTGF抗体抑制PANC1软琼脂体外增殖实验
在琼脂(BD,#214220)中加入去离子水,加热配制成1.4%的凝胶溶液。将2×DMEM培养基(Thermo,#12100046)与凝胶溶液按照1:1的体积比混合,在24孔板(Costar,#3524)中每孔加入500μL,4度放置使其凝固。
PANC-1细胞(人胰腺癌细胞,ATCC,#CRL-1469)用0.25%胰酶(Gibco,#25200-072)消化,离心后用含4%胎牛血清(Gibco,#10099-141)的DMEM培养基(GE,#SH30243.01)调整细胞密度至5×10
4个/mL。用2×DMEM培养基配制抗体至2mg/mL。将细胞、抗体及1.4%的凝胶溶液按照2:1:1的体积比混合,在铺了下层胶的24孔板中每孔加入200μL。待上层胶凝固后,在24孔板中再加入 200μL含2%胎牛血清的DMEM培养基。在培养箱中(37℃,5%CO2)培养28天后,用高内涵分析系统(Molecular Devices,ImageXpress)拍照,并分析形成的细胞克隆面积。抑制率=(1-样品组平均值/未处理组平均值)×100%。实验结果见表21。
表21.CTGF抗体对PANC1细胞软琼脂体外增殖实验的抑制结果
| 受试样品 | 对PANC1细胞体外增殖的抑制百分比(%) |
| Hu147-11wk | 23.76% |
| Hu147-33wk | 22.30% |
| Hu164-67wl | 24.2% |
| Hu164-67yl | 21.7% |
| Hu95-51yk | 20.24% |
结果表明,来自mAb147和mAb164克隆的人源化抗体对人胰腺癌细胞(PANC-1细胞)的体外增殖具有显著的抑制作用。
实施例1-8.CTGF抗体的动物体内生物学活性
一、CTGF抗体对博莱霉素诱导的小鼠肺纤维化抑制试验
实验方法:将40只小鼠按照体重随机分成以下4组:正常对照组(PBS,ip,qod)、mAb1组(10mg/kg,ip,qod)、Hu164-67wl(10mg/kg,ip,qod)组、Hu164-67yl(10mg/kg,ip,qod)组。每组10只,具体分组见下表21。实验第1天按照体重腹腔注射相应溶剂和抗体(10mL/kg,正常对照和模型组给予PBS),2小时后进行博莱霉素雾化(50mg/8mL雾化30min并停留5min)造模。然后按照上述组别每隔日一次腹腔注射溶剂或抗体,实验周期21天,累计腹腔给药共11次。实验第22天,小鼠腹腔内注射1%戊巴比妥钠(10ml/kg)麻醉后,将小鼠仰卧固定在操作台上,沿颈部正中线切开1cm皮肤,切口下缘至胸腔入口处,用止血钳钝性分离皮下结缔组织和肌肉,暴露气管,分离气管两侧及气管与食管间结缔组织,游离气管,插入静脉留置针,使用手术缝线在套管进入气管处结扎固定。以1mL注射器抽吸0.8ml PBS,接在静脉套管针进液端,将PBS缓缓注入气管,停留30s后将PBS缓缓回抽,可见回抽出带乳白色泡沫状液体,重复灌洗三次,将灌洗液转移至EP管中,再吸取0.5ml PBS,重复以上步骤。将两次灌洗液混合后1500rpm离心5min,保存上清液-20℃待测,BALF上清再次10000rpm离心10min后取上清检测可溶性胶原(试剂盒:Biocolor,批号AA883)。
表22.试验分组及给药情况
| 组别 | 动物数量 | 药物 | 药物剂量(mg/mL) | 给药途径 | 给药时间 |
| 1 | 10 | PBS | - | i.p. | 隔日1次 |
| 2 | 10 | mAb1 | 10 | i.p. | 隔日1次 |
| 3 | 10 | Hu164-67wl | 10 | i.p. | 隔日1次 |
| 4 | 10 | Hu164-67yl | 10 | i.p. | 隔日1次 |
使用Excel统计软件:平均值以avg(Average,平均值)计算;SD(Standard diviation,标准偏差)值以STDEV(Standard diviation,标准差)计算;SEM(Standard Error of Mean,样本均数的标准差)值以STDEV/SQRT(Square root,开平方根)(每组动物数)计算;GraphPad Prism软件作图,采用Two-way ANOVA(双因素方差分析)或One-way ANOVA(单因素方差分析)对数据进行统计学分析。实验结果见表23。
表23.CTGF抗体对博莱霉素诱导的小鼠肺纤维化抑制试验结果
结果显示,Hu164-67wl或Hu164-67yl显示出很强的小鼠肺纤维化抑制作用。
二、CTGF抗体对Su86.86人胰腺癌细胞皮下移植瘤的抑制实验
实验方法:将SU86.86细胞(ATCC,CRL-1837、3.0×10
6个)200μL接种于Nu/Nu裸鼠右肋部皮下,接种11天后,待肿瘤体积在~140mm
3后去除体重、肿瘤过大和过小的,按肿瘤体积将小鼠随机分为5组,每组10只,当天开始给药。通过腹腔注射抗体,每周注射2次,共18天。每周测1-2次瘤体积,称体重,记录数据。分组及给药情况见表24。
表24.试验分组及给药情况
使用Excel统计软件记录数据:平均值以avg计算;SD值以STDEV计算;SEM值以STDEV/SQRT(每组动物数)计算;采用GraphPad Prism软件作图,采用Two-way ANOVA或One-way ANOVA对数据进行统计学分析。
肿瘤体积(V)计算公式为:V=1/2×L
长×L
短 2
相对肿瘤增殖率T/C(%)=(T
t-T
0)/(C
t-C
0)×100,其中T
t、C
t为实验结束时治疗组和对照组的肿瘤体积;T
0、C
0为实验开始时的肿瘤体积。
抑瘤率TGI(%)=1-T/C(%)。
实验结果:
实验第1-18天中(D0代表实验开始时,D18代表第18天),每周皮下注射给药2次,检测CTGF抗体对SU86.86肿瘤的生长抑制作用。试验结果见表24和图2所示。与同型人IgG的空白对照组相比,mAb1-40mg/kg、Hu164-67yl-40mg/kg、Hu164-67yl-20mg/kg、Hu147-33wk(40mg/kg)组抑瘤率分别为45%、53%、47%和54%,mAb1-40mg/kg、Hu164-67yl-40mg/kg、Hu164-67yl-20mg/kg、Hu147-33wk(40mg/kg)组能够显著抑制Su86.86肿瘤的生长(p<0.001),且对SU86.86肿瘤 的抑制作用具有一定剂量依赖性。另外,各组小鼠体重没有明显变化。
表25.CTGF抗体对SU86.86小鼠移植瘤的抑制实验结果
二、制剂
制剂制备与检测过程中使用的设备、抗体及方法如下:
SEC分子排阻色谱法:
根据凝胶孔隙的孔径大小与高分子样品分子的线团尺寸间的相对关系而对溶质进行分离的分析的方法。
SEC%(SEC单体含量百分比)=A单体/A总*100%(A单体为样品中主峰单体的峰面积,A总为所有峰面积之和。)
NR-CE毛细管凝胶电泳:
将凝胶移到毛细管中作为支持介质进行的一种电泳,并在一定的电压下根据样品分子量的大小进行分离的方法。
非还原CE纯度百分比=A主峰/A总*100%(A主峰为样品中轻链主峰+重链主峰的峰面积,A总为所有峰面积之和。
CE测定用仪器:Beckman型号plus800。
iCIEF成像毛细管等点聚焦电泳:
根据蛋白质等电点pI不同进行分离的技术。
iCIEF中性峰含量百分比=中性峰面积/总面积*100%(总面积为酸性峰、中性峰和碱性峰面积之和)。
iCIEF测定所用仪器厂家simple protein,型号muarice。
渗透压测定:
冰点法测定渗透压,以冰点下降值与溶液的摩尔浓度成正比例关系为基础,采用高灵敏度感温元件,测定溶液结冰点,通过电量转化为渗透压。仪器厂家罗泽Loser,型号OM815。
蛋白浓度测定:
蛋白浓度测定仪器:紫外可见分光光度计,型号:Nano Drop oneC,光程为1mm。以下抗体的浓度采用蛋白浓度计。
CTGF抗体
以下实施例所采用的抗CTGF抗体为Hu164-67yl,其中实施例2-1、实施例2-2、实施例2-3、实施例2-4的第1-6号样品以及实施例2-5的第1、2号样品中采用的抗体由蛋白表达后亲和层析得到;实施例2-4的第7、8号样品和实施例2-5的第3-9号样品中采用的抗体由前述抗体经进一步离子交换层析和过滤后得到。
实施例2-1.制剂缓冲体系与pH值的筛选
配制含有200mg/mL Hu164-67yl的液体制剂,该制剂中还含有0.4mg/mL聚山梨酯80(PS80),70mg/mL蔗糖和不同的缓冲体系。缓冲体系分别为50mM醋酸-醋酸钠盐(AA)pH 5.0、5.5;50mM组氨酸-醋酸盐(His-AA)pH 5.5;50mM琥珀酸钠盐(SA)pH 5.5;50mM枸橼酸钠盐(CA)pH 5.5;50mM组氨酸-盐酸盐缓冲剂(His-HCl)pH 5.5、6.0、6.5;50mM磷酸二氢钠-磷酸氢二钠盐(PB)pH 6.5、7.0。将每种制剂过滤,灌装,加塞,轧盖,然后将制剂在40℃恒温条件下放置1个月,评价SEC、非还原CE等指标。
结果见表26。SEC数据显示,40℃放置1个月条件下采用AA(pH5.5)、His-AA(pH5.5)、CA(pH5.5)、His-HCl(pH5.5)的样品的主峰下降小于其他样品;NR-CE数据显示,40℃放置1个月条件下,采用His-HCl(pH5.5)的样品的主峰下降最小(5.1%)。
表26.pH和缓冲体系筛选结果
注:表中“D”表示天,例如D7表示7天,以此类推;D0表示实验开始时;“M”表示月,例如M1表示1个月,以此类推。
实施例2-2长期稳定性试验
制备含有200mg/mL Hu164-67yl、50mM His-HCl(pH 5.5)、70mg/mL蔗糖和0.4mg/mL PS80。将样品置于25℃及4℃条件考察稳定性,结果见表27。
表27.长期稳定性试验
| 条件 | SEC% | NR-CE% | iCIEF% |
| D0 | 97.9 | 93.4 | 57.1 |
| 4℃M3 | 96.7 | 93.7 | 57.6 |
| 4℃M5 | 97.4 | 93.4 | 57.5 |
| 25℃M3 | 94.0 | 92.0 | 51.4 |
| 25℃M5 | 94.3 | 90.3 | 46.0 |
注:表中“M”表示月,例如M3表示3个月,以此类推。下同。
结果显示:样品在25℃条件下放置5个月后,纯度项略有下降,但下降幅度均在可接受范围;4℃条件下放置5个月,各检测项均无显著变化,该处方稳定性较好。
实施例2-3蛋白浓度的筛选
制备如下配比的液体制剂:
1)200mg/mL Hu164-67yl,50mM His-HCl(pH6.0),0.4mg/mL PS80,70mg/mL蔗糖
2)150mg/mL Hu164-67yl,50mM His-HCl(pH6.0),0.4mg/mL PS80,70mg/mL蔗糖
将两种制剂过滤,灌装,加塞,轧盖。将样品进行40℃稳定性及长期稳定性考察,以SEC、iCIEF、非还原CE作为评价指标。
表28.蛋白浓度筛选结果
结果显示,1)号和2)号样品在40℃M1、25℃M3和4℃M5的条件放置后,纯度项无明显差异。1)号样品在25℃M5的条件放置后,SEC和iCIEF的主峰下降略多于2)号样品。
实施例2-4表面活性剂的筛选
制备含150mg/mL Hu164-67yl、50mM His-HCl pH 5.5、70mg/mL蔗糖和不同的表面活性剂的制剂。将每种制剂过滤,灌装,加塞,轧盖。取样品进行振摇(25℃,300rpm)、冻融5次循环(FT5C,条件为-35℃-2~8℃)、40℃高温放置及长期稳定性(4℃M3)研究,考察SEC、非还原CE和iCIEF,具体处方设计见表29。
表29.表面活性剂种类及浓度筛选结果
实验结果显示,含有不同种类和浓度的聚山梨酯的样品的纯度检测结果无明显差异。含有相同浓度的PS80和泊洛沙姆188,40℃放置1个月后两组样品纯度无明显差异。
实施例2-5制剂处方优化
制备如下配比的液体制剂:
1)200mg/mL Hu164-67yl,50mM His-HCl(pH 6.0),70mg/mL蔗糖,0.4mg/mL PS80
2)200mg/mL Hu164-67yl,50mM His-HCl(pH 6.0),70mg/mL海藻糖,0.4mg/mL PS80
3)150mg/mL Hu164-67yl、50mM His-HCl(pH 5.5)、70mg/mL蔗糖和0.4mg/mL PS80
4)150mg/mL Hu164-67yl、50mM His-HCl(pH 5.5)、70mg/mL蔗糖、0.4mg/mL PS80和2%PEG 3350
5)150mg/mL Hu164-67yl,50mM His-HCl(pH 5.5),70mg/mL蔗糖,0.4mg/mL PS80和50mM精氨酸
6)150mg/mL Hu164-67yl,50mM His-HCl(pH 5.5),70mg/mL蔗糖,0.4mg/mL PS80和1%甘露醇
7)150mg/mL Hu164-67yl,50mM His-HCl(pH 5.5),70mg/mL蔗糖,0.4mg/mL PS80和0.5mM EDTA
8)150mg/mL Hu164-67yl,50mM His-HCl(pH 5.5),70mg/mL蔗糖,0.4mg/mL PS80和5mM EDTA
9)150mg/mL Hu164-67yl,50mM His-HCl(pH 5.5),70mg/mL蔗糖,0.4mg/mL PS80和10mM EDTA
将每种制剂过滤,灌装,加塞,轧盖。将样品进行40℃稳定性考察,以SEC、iCIEF、非还原CE作为评价指标。
表30.处方优化
结果显示:样品在40℃放置1个月后,只加蔗糖的样品和加入其他稳定剂的样品的纯度无显著差异,各条件下处方稳定性良好。该结果提示蔗糖以外其他稳定剂的加入不会影响处方稳定性,并且不含其他稳定剂的处方已达到含其他稳定剂处方的稳定效果。
Claims (18)
- 一种药物组合物,包含抗CTGF抗体和缓冲剂,其中所述抗CTGF抗体包含重链可变区和轻链可变区,其中:i)所述重链可变区包含与如SEQ ID NO:8所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:9所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3;ii)所述重链可变区包含与如SEQ ID NO:6所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:7所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3;ii-i)所述重链可变区包含与如SEQ ID NO:69所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:70所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3;或ii-ii)所述重链可变区包含与如SEQ ID NO:85所示的重链可变区相同序列的HCDR1、HCDR2和HCDR3,所述轻链可变区包含与如SEQ ID NO:70所示的轻链可变区相同序列的LCDR1、LCDR2和LCDR3;所述缓冲剂是组氨酸盐缓冲剂,优选为组氨酸-盐酸盐缓冲剂或组氨酸-醋酸盐缓冲剂,更优选为组氨酸-盐酸盐缓冲剂。
- 根据权利要求1所述的药物组合物,其中所述抗CTGF抗体包含重链可变区和轻链可变区,其中:所述重链可变区包含分别如SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18所示的HCDR1、HCDR2和HCDR3,所述轻链可变区包含分别如SEQ ID NO:19、SEQ ID NO:20和SEQ ID NO:21所示的LCDR1、LCDR2和LCDR3;优选的,所述重链可变区,其氨基酸序列如SEQ ID NO:34所示;和所述轻链可变区,其氨基酸序列如SEQ ID NO:30所示;更优选的,所述抗CTGF抗体包含如SEQ ID NO:61所示的重链和如SEQ ID NO:64所示的轻链。
- 根据权利要求1或2所述的药物组合物,其中所述药物组合物的pH为约5.0至约6.5,优选为约5.0至约6.0,更优选为约5.5。
- 根据权利要求1至3任一项所述的药物组合物,其中所述抗CTGF抗体的浓度为约100mg/mL至约200mg/mL,优选为约150mg/mL至约200mg/mL,更优选为约150mg/mL。
- 根据权利要求1至4任一项所述的药物组合物,其中所述药物组合物还包含表面活性剂,所述表面活性剂优选为聚山梨酯或泊洛沙姆,更优选为聚山梨酯 80、聚山梨酯20或泊洛沙姆188,最优选为聚山梨酯80。
- 根据权利要求5所述的药物组合物,其中所述表面活性剂的浓度为约0.05mg/mL至约1.0mg/mL,优选为约0.2mg/mL至约0.6mg/mL,更优选为约0.4mg/mL。
- 根据权利要求1至6任一项所述的药物组合物,其中所述药物组合物还包含糖,所述糖优选选自蔗糖、甘露醇和海藻糖中的一种或多种,更优选为蔗糖。
- 根据权利要求7所述的药物组合物,其中所述糖的浓度为约20mg/mL至约100mg/mL,优选为约40mg/mL至约80mg/mL,更优选为约70mg/mL。
- 根据权利要求1至8任一项所述的药物组合物,其中所述缓冲剂的浓度为约5mM至约100mM,优选为约30mM至约70mM,更优选为约50mM。
- 根据权利要求1至9任一项所述的药物组合物,其中所述药物组合物还包含稳定剂,所述稳定剂选自PEG、精氨酸和EDTA。
- 根据权利要求1至10任一项所述的药物组合物,其包含如下组分:(a)约150mg/mL至约200mg/mL的所述抗CTGF抗体,(b)约0.2mg/mL至约0.6mg/mL的聚山梨酯,(c)约40mg/mL至约80mg/mL的糖,和(d)约30mM至约70mM的组氨酸盐缓冲剂;所述药物组合物的pH为约5.0至约6.0;优选地,所述药物组合物包含如下组分:(a)约150mg/mL的所述抗CTGF抗体,(b)约0.4mg/mL的聚山梨酯80,(c)约70mg/mL的蔗糖,和(d)约50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为约5.5至约5.7;所述抗CTGF抗体包含如SEQ ID NO:61所示的重链和如SEQ ID NO:64所示的轻链。
- 一种冻干制剂,所述冻干制剂复溶后可形成权利要求1至11任一项所述的药物组合物。
- 一种制备冻干制剂的方法,其包括将权利要求1至11中任一项所述的药物组合物进行冷冻干燥的步骤。
- 一种冻干制剂,所述制剂通过将权利要求1至11中任一项所述的药物组合物经冷冻干燥获得。
- 一种复溶溶液,所述复溶溶液是通过将权利要求12或14所述的冻干制剂经复溶制备;优选地,所述复溶溶液包含:(a)约150mg/mL至约200mg/mL的所述抗CTGF抗体,(b)约0.2mg/mL至约0.6mg/mL的聚山梨酯,(c)约40mg/mL至约80mg/mL的糖,和(d)约30mM至约70mM的组氨酸盐缓冲剂;所述药物组合物的pH为约5.0至约6.0;更优选地,所述复溶溶液包含:(a)约150mg/mL的所述抗CTGF抗体,(b)约0.4mg/mL的聚山梨酯80,(c)约70mg/mL的蔗糖,和(d)约50mM的组氨酸-盐酸盐缓冲剂;所述药物组合物的pH为约5.5至约5.7;所述抗CTGF抗体包含如SEQ ID NO:61所示的重链和如SEQ ID NO:64所示的轻链。
- 根据权利要求1至11任一项所述的药物组合物或权利要求15所述的复溶溶液,其为静脉注射制剂、皮下注射制剂、腹腔注射制剂或肌肉注射制剂;优选为静脉注射制剂。
- 一种制品,其包括容器,该容器中装有如权利要求1至11任一项所述的药物组合物、权利要求12或14所述的冻干制剂或权利要求15所述的复溶溶液。
- 一种治疗或预防与CTGF相关的疾病的方法,所述方法包括给予受试者有效量的权利要求1至11任一项所述的药物组合物、权利要求12或14所述的冻干制剂、权利要求15所述的复溶溶液或权利要求17所述制品;其中所述与CTGF相关的疾病优选为纤维性疾病、高血压、糖尿病、心肌梗死、关节炎、CTGF相关细胞增殖性疾病、动脉粥样硬化、青光眼或癌症;优选地,所述纤维性疾病选自:自发性肺纤维化、糖尿病性肾病、糖尿病性视网膜病、骨关节炎、硬皮病、慢性心力衰竭、肝硬化或肾纤维化;优选地,所述癌症选自:急性淋巴母细胞性白血病、皮肤纤维瘤、乳腺癌、血管脂肪瘤、血管平滑肌瘤、结缔组织生成性癌症、前列腺癌、卵巢癌、结肠直肠癌、胰腺癌、胃肠道癌症或肝癌。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2020114054905 | 2020-12-03 | ||
| CN202011405490 | 2020-12-03 | ||
| CN202111366667X | 2021-11-18 | ||
| CN202111366667 | 2021-11-18 | ||
| PCT/CN2021/135203 WO2022117060A1 (zh) | 2020-12-03 | 2021-12-03 | 一种含抗结缔组织生长因子抗体的药物组合物 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN116391041A true CN116391041A (zh) | 2023-07-04 |
Family
ID=81853824
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202180069825.7A Pending CN116391041A (zh) | 2020-12-03 | 2021-12-03 | 一种含抗结缔组织生长因子抗体的药物组合物 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20230416352A1 (zh) |
| EP (1) | EP4257603A4 (zh) |
| JP (1) | JP2024500311A (zh) |
| KR (1) | KR20230117161A (zh) |
| CN (1) | CN116391041A (zh) |
| AU (1) | AU2021390125A1 (zh) |
| BR (1) | BR112023009093A2 (zh) |
| CA (1) | CA3200705A1 (zh) |
| MX (1) | MX2023006383A (zh) |
| TW (1) | TW202227485A (zh) |
| WO (1) | WO2022117060A1 (zh) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115645525B (zh) * | 2022-12-14 | 2023-04-14 | 北京大学第三医院(北京大学第三临床医学院) | Ctgf中和抗体在制备防治绝经后骨关节炎的药物中的应用 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7405274B2 (en) * | 2003-06-04 | 2008-07-29 | Fibrogen, Inc. | Connective tissue growth factor antibodies |
| WO2010042201A1 (en) * | 2008-10-07 | 2010-04-15 | Fibrogen, Inc. | Methods for treatment of focal segmental glomerulosclerosis |
| WO2011002525A1 (en) * | 2009-07-02 | 2011-01-06 | Fibrogen, Inc. | Methods for treatment of muscular dystrophy |
| US9102721B2 (en) * | 2011-01-21 | 2015-08-11 | Fibrogen, Inc. | Therapeutic method |
| CA3042808A1 (en) * | 2011-04-12 | 2012-10-18 | Moerae Matrix, Inc. | Compositions and methods for preventing or treating diseases, conditions, or processes characterized by aberrant fibroblast proliferation and extracellular matrix deposition |
| ES2665851T3 (es) * | 2011-12-22 | 2018-04-27 | Astellas Pharma Inc. | Nuevo anticuerpo anti-CTGF humano |
| SG11202111414RA (en) * | 2019-04-24 | 2021-11-29 | Regenxbio Inc | Fully-human post-translationally modified antibody therapeutics |
| WO2020244540A1 (zh) * | 2019-06-04 | 2020-12-10 | 江苏恒瑞医药股份有限公司 | 抗结缔组织生长因子抗体及其应用 |
-
2021
- 2021-12-03 AU AU2021390125A patent/AU2021390125A1/en active Pending
- 2021-12-03 JP JP2023534092A patent/JP2024500311A/ja active Pending
- 2021-12-03 TW TW110145274A patent/TW202227485A/zh unknown
- 2021-12-03 BR BR112023009093A patent/BR112023009093A2/pt unknown
- 2021-12-03 WO PCT/CN2021/135203 patent/WO2022117060A1/zh active Application Filing
- 2021-12-03 US US18/039,683 patent/US20230416352A1/en active Pending
- 2021-12-03 EP EP21900086.6A patent/EP4257603A4/en active Pending
- 2021-12-03 CA CA3200705A patent/CA3200705A1/en active Pending
- 2021-12-03 MX MX2023006383A patent/MX2023006383A/es unknown
- 2021-12-03 CN CN202180069825.7A patent/CN116391041A/zh active Pending
- 2021-12-03 KR KR1020237021361A patent/KR20230117161A/ko unknown
Also Published As
| Publication number | Publication date |
|---|---|
| WO2022117060A1 (zh) | 2022-06-09 |
| EP4257603A4 (en) | 2024-07-31 |
| TW202227485A (zh) | 2022-07-16 |
| MX2023006383A (es) | 2023-06-14 |
| AU2021390125A1 (en) | 2023-06-22 |
| JP2024500311A (ja) | 2024-01-09 |
| EP4257603A1 (en) | 2023-10-11 |
| US20230416352A1 (en) | 2023-12-28 |
| AU2021390125A9 (en) | 2024-10-03 |
| BR112023009093A2 (pt) | 2024-02-06 |
| KR20230117161A (ko) | 2023-08-07 |
| CA3200705A1 (en) | 2022-06-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN112512550B (zh) | 一种TGF-β受体融合蛋白药物组合物及其用途 | |
| CN111744007B (zh) | 一种抗tigit抗体药物组合物及其用途 | |
| CN110538321B (zh) | 一种cd47抗体药物组合物及其用途 | |
| CN110732023B (zh) | 一种her2抗体药物组合物及其用途 | |
| RU2771384C2 (ru) | Фармацевтическая композиция, содержащая антитело к lag-3, и ее применение | |
| WO2022068914A1 (zh) | 一种含抗体药物偶联物的药物组合物及其用途 | |
| CN110960490A (zh) | 一种抗egfr抗体偶联药物组合物及其用途 | |
| CN113840836B (zh) | 抗结缔组织生长因子抗体及其应用 | |
| CN111375059B (zh) | 一种抗gitr抗体药物组合物及其用途 | |
| US20230295329A1 (en) | Anti-pd-1 antibody pharmaceutical composition and use thereof | |
| WO2022117060A1 (zh) | 一种含抗结缔组织生长因子抗体的药物组合物 | |
| JP2022513671A (ja) | Cd40抗体医薬品組成物およびその使用 | |
| TW202320847A (zh) | 一種抗angptl3抗體或其抗原結合片段的醫藥組成物及其用途 | |
| WO2020200099A1 (zh) | 包含抗il-5抗体的药物组合物及其用途 | |
| TWI853912B (zh) | 包含抗il-5抗體的醫藥組成物及其用途 | |
| WO2024088342A1 (en) | Antibodies against cd24 and uses thereof | |
| CN114591428A (zh) | 抗Dsg1抗体及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 40096044 Country of ref document: HK |