CN116003628A - 靶向人dll3抗原的全人源特异性嵌合抗原受体及其应用 - Google Patents
靶向人dll3抗原的全人源特异性嵌合抗原受体及其应用 Download PDFInfo
- Publication number
- CN116003628A CN116003628A CN202211314320.5A CN202211314320A CN116003628A CN 116003628 A CN116003628 A CN 116003628A CN 202211314320 A CN202211314320 A CN 202211314320A CN 116003628 A CN116003628 A CN 116003628A
- Authority
- CN
- China
- Prior art keywords
- seq
- amino acid
- car
- acid sequence
- dll3
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 101000928513 Homo sapiens Delta-like protein 3 Proteins 0.000 title claims abstract description 201
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 title claims abstract description 177
- 239000000427 antigen Substances 0.000 title claims abstract description 49
- 102000036639 antigens Human genes 0.000 title claims abstract description 49
- 108091007433 antigens Proteins 0.000 title claims abstract description 49
- 230000008685 targeting Effects 0.000 title claims description 15
- 102000053255 human DLL3 Human genes 0.000 title abstract description 46
- 210000004027 cell Anatomy 0.000 claims abstract description 186
- 102100036466 Delta-like protein 3 Human genes 0.000 claims abstract description 154
- 229940127276 delta-like ligand 3 Drugs 0.000 claims abstract description 153
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 45
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 claims abstract description 29
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 claims abstract description 29
- 208000000587 small cell lung carcinoma Diseases 0.000 claims abstract description 29
- 206010041067 Small cell lung cancer Diseases 0.000 claims abstract description 28
- 108010076504 Protein Sorting Signals Proteins 0.000 claims abstract description 19
- 210000002865 immune cell Anatomy 0.000 claims abstract description 16
- 230000004068 intracellular signaling Effects 0.000 claims abstract description 9
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 88
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 85
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 56
- 230000014509 gene expression Effects 0.000 claims description 50
- 239000013598 vector Substances 0.000 claims description 29
- 108020004707 nucleic acids Proteins 0.000 claims description 27
- 102000039446 nucleic acids Human genes 0.000 claims description 27
- 150000007523 nucleic acids Chemical class 0.000 claims description 27
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 20
- 208000020816 lung neoplasm Diseases 0.000 claims description 20
- 201000005202 lung cancer Diseases 0.000 claims description 19
- 201000010099 disease Diseases 0.000 claims description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 18
- 239000008194 pharmaceutical composition Substances 0.000 claims description 13
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 11
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 11
- 238000000034 method Methods 0.000 claims description 11
- 201000011510 cancer Diseases 0.000 claims description 10
- 230000000139 costimulatory effect Effects 0.000 claims description 9
- 210000004475 gamma-delta t lymphocyte Anatomy 0.000 claims description 4
- 210000004986 primary T-cell Anatomy 0.000 claims description 4
- 208000009018 Medullary thyroid cancer Diseases 0.000 claims description 3
- 206010060862 Prostate cancer Diseases 0.000 claims description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 3
- 208000005017 glioblastoma Diseases 0.000 claims description 3
- 230000003834 intracellular effect Effects 0.000 claims description 3
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 claims description 3
- 201000001441 melanoma Diseases 0.000 claims description 3
- 201000002120 neuroendocrine carcinoma Diseases 0.000 claims description 3
- 230000011664 signaling Effects 0.000 claims description 3
- 230000002147 killing effect Effects 0.000 abstract description 44
- 238000000338 in vitro Methods 0.000 abstract description 28
- 239000003814 drug Substances 0.000 abstract description 12
- 230000000694 effects Effects 0.000 abstract description 11
- 230000005764 inhibitory process Effects 0.000 abstract description 8
- 238000002474 experimental method Methods 0.000 abstract description 5
- 238000010171 animal model Methods 0.000 abstract description 4
- 238000012216 screening Methods 0.000 abstract description 3
- 238000001514 detection method Methods 0.000 description 26
- 210000004881 tumor cell Anatomy 0.000 description 21
- 108090000623 proteins and genes Proteins 0.000 description 18
- 239000013612 plasmid Substances 0.000 description 15
- 241000699670 Mus sp. Species 0.000 description 13
- 238000012360 testing method Methods 0.000 description 13
- 230000008859 change Effects 0.000 description 12
- 238000012258 culturing Methods 0.000 description 9
- 238000003501 co-culture Methods 0.000 description 8
- 102000004169 proteins and genes Human genes 0.000 description 8
- 238000011282 treatment Methods 0.000 description 8
- 108090000790 Enzymes Proteins 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 7
- 239000012636 effector Substances 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- 108090000695 Cytokines Proteins 0.000 description 6
- 102000004127 Cytokines Human genes 0.000 description 6
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 6
- 241001529936 Murinae Species 0.000 description 6
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 6
- 230000000259 anti-tumor effect Effects 0.000 description 6
- 230000007774 longterm Effects 0.000 description 6
- 239000008188 pellet Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000006228 supernatant Substances 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 108010074328 Interferon-gamma Proteins 0.000 description 5
- 239000006285 cell suspension Substances 0.000 description 5
- 239000013604 expression vector Substances 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 238000010361 transduction Methods 0.000 description 5
- 230000026683 transduction Effects 0.000 description 5
- OZFAFGSSMRRTDW-UHFFFAOYSA-N (2,4-dichlorophenyl) benzenesulfonate Chemical compound ClC1=CC(Cl)=CC=C1OS(=O)(=O)C1=CC=CC=C1 OZFAFGSSMRRTDW-UHFFFAOYSA-N 0.000 description 4
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 4
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 4
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 230000009260 cross reactivity Effects 0.000 description 4
- 230000000857 drug effect Effects 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 4
- 230000003285 pharmacodynamic effect Effects 0.000 description 4
- 238000002331 protein detection Methods 0.000 description 4
- 239000013603 viral vector Substances 0.000 description 4
- 108090001008 Avidin Proteins 0.000 description 3
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 3
- 102100037850 Interferon gamma Human genes 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 101100499378 Mus musculus Dll3 gene Proteins 0.000 description 3
- 101100439689 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) chs-4 gene Proteins 0.000 description 3
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 102000023732 binding proteins Human genes 0.000 description 3
- 108091008324 binding proteins Proteins 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 230000002538 fungal effect Effects 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000009466 transformation Effects 0.000 description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 3
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 2
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 2
- 238000012404 In vitro experiment Methods 0.000 description 2
- 102100021244 Integral membrane protein GPR180 Human genes 0.000 description 2
- 102000008579 Transposases Human genes 0.000 description 2
- 108010020764 Transposases Proteins 0.000 description 2
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 101150058049 car gene Proteins 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000005206 flow analysis Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 239000012212 insulator Substances 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 238000004445 quantitative analysis Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 231100000820 toxicity test Toxicity 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 210000005253 yeast cell Anatomy 0.000 description 2
- 244000247812 Amorphophallus rivieri Species 0.000 description 1
- 235000001206 Amorphophallus rivieri Nutrition 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- -1 CD86 Proteins 0.000 description 1
- 102100037904 CD9 antigen Human genes 0.000 description 1
- 102100025466 Carcinoembryonic antigen-related cell adhesion molecule 3 Human genes 0.000 description 1
- 101100118093 Drosophila melanogaster eEF1alpha2 gene Proteins 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000738354 Homo sapiens CD9 antigen Proteins 0.000 description 1
- 101000914337 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 3 Proteins 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 101000599940 Homo sapiens Interferon gamma Proteins 0.000 description 1
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 description 1
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 102100025390 Integrin beta-2 Human genes 0.000 description 1
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 1
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 1
- 229920002752 Konjac Polymers 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 1
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 1
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 206010041047 Slow virus infection Diseases 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 1
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 210000002390 cell membrane structure Anatomy 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 235000010485 konjac Nutrition 0.000 description 1
- 239000000252 konjac Substances 0.000 description 1
- 238000002843 lactate dehydrogenase assay Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 201000005296 lung carcinoma Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- JMANVNJQNLATNU-UHFFFAOYSA-N oxalonitrile Chemical compound N#CC#N JMANVNJQNLATNU-UHFFFAOYSA-N 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 238000010837 poor prognosis Methods 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000004451 qualitative analysis Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 101150003509 tag gene Proteins 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 230000005909 tumor killing Effects 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Cell Biology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Urology & Nephrology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
Abstract
本发明涉及一种基于全人源抗DLL3单链抗体的特异性嵌合抗原受体(CAR)及其应用。所述CAR包含CD8信号肽,人DLL3抗原特异性的全人源单链抗体和CD8跨膜区以及41BB,CD3ζ胞内信号传导结构域依次串联。本发明通过构建并筛选不同DLL3抗原特异的人源化单链抗体,提供了人DLL3嵌合抗原受体修饰的免疫细胞,其能够特异性地与人DLL3抗原结合。在对人DLL3抗原阳性肿瘤模型体内外杀伤试验中,本发明靶向人DLL3抗原的CAR‑T细胞能够对人DLL3阳性的小细胞肺癌(SCLC)细胞株产生显著的特异性杀伤。动物模型实验表明,本发明优选的DLL3CAR‑T给药后,各个药物组疗效显著,抑瘤率在25‑97%。
Description
技术领域
本发明涉及生物医学或生物制药技术领域,尤其涉及一种靶向人DLL3的嵌合抗原受体,及其制备方法和用于制备药物、治疗、预防疾病的用途。
背景技术
小细胞肺癌(SCLC)是肺癌中的一种,根据NCCN指南,约占所有肺癌的15%,具有进展快、高复发率、早期转移、预后差的特点,5年生存率低于5%,且治疗手段有限。传统放化疗只能短期获益,暂无明显延长患者生存时间的有效手段。
人DLL3蛋白(δ样配体,Delta-Like Ligand 3,DLL3)是由619个氨基酸组成的单次跨膜蛋白,属于Notch配体家族。它是一种高度肿瘤选择性的细胞表面靶点,在大多数小细胞肺癌(SCLC)和类癌亚组中高表达(Lung Cancer;135:73-79;2019),但在正常肺癌组织及癌旁组织中不表达。在一项研究中,对1073例SLCL患者的独立肿瘤标本研究显示,DLL3阳性表达(≥25%)达到85%,DLL3高表达(≥75%)达到68%(Lung Cancer;147:237-243;2020)。靶向人DLL3的嵌合抗原受体T细胞可以通过识别肿瘤表面DLL3抗原从而刺激T细胞对肿瘤细胞进行特异性杀伤。
美国安进公司(Amgen)开发的AMG 757项目在临床中对DLL3靶点进行验证。AMG757是一种可结合DLL3和CD3的双特异性抗体。在治疗SCLC的中期1期剂量探索研究中,其疾病控制率(疾病稳定/CR/PR)为51%,中位PFS为3.5个月,中位OS为12.3个月,显示出AMG 757初步的疗效和可接受的安全性证据(NCT03319940)。同时,其开发的DLL3 CAR-T项目AMG119也在评估用于SCLC治疗的安全性、耐受性和有效性的临床I期研究中(NCT03392064)。Harpoon Therapeutics公司的HPN-328以及勃林格殷格翰的OBT-620也处于临床I/II期中。DLL3作为一个重要的Notch配体与多种肿瘤的发生发展密切相关,以DLL3为靶点的多种治疗方法开发有望为临床肿瘤治疗带来更多治疗选择。
针对以上,以DLL3为靶点的CAR-T细胞作为抗癌的细胞疗法,尤其是在高表达DLL3的癌症中,具有重大意义。本发明提供了具有良好的抗人DLL3阳性肿瘤效果的靶向人DLL3的嵌合抗原受体T细胞,为晚期DLL3阳性肿瘤患者带来新的希望。
发明内容
为解决提供更多抗癌药物,特别是提供针对高表达DLL3的癌症,例如肺癌,特别是小细胞肺癌的药物的技术问题,本发明提供一种以DLL3为靶点的嵌合抗原受体(CAR),包含所述CAR的免疫细胞,例如T细胞。本发明还提供了编码所述CAR的核酸;含有所述核酸的表达盒、载体、细胞;含有所述CAR、所述核酸、所述表达盒、所述载体、所述细胞的药物组合物;含有所述CAR、所述核酸、所述表达盒、所述载体、所述细胞、所述药物组合物的试剂盒;所述CAR、包含所述CAR的免疫细胞、所述核酸、所述表达盒、所述载体、所述细胞、所述药物组合物在预防、治疗、检测或诊断与DLL3相关的疾病的应用,或在制备预防和/或治疗癌症或肿瘤的药物或制剂的用途,所述与DLL3相关的疾病是DLL3高表达疾病,进一步所述疾病是DLL3高表达癌症或肿瘤,再进一步,所述癌症或肿瘤选自肺癌、黑色素瘤、甲状腺髓样癌、胶质母细胞瘤、前列腺癌、神经内分泌癌中的一种或多种;再进一步所述癌症或肿瘤是肺癌,特别是小细胞肺癌。本发明还提供一种制备工程化免疫细胞的方法。
本发明的第一个方面提供一种靶向DLL3抗原的嵌合抗原受体(CAR),其特征在于,所述CAR包含抗DLL3抗体的scFv,所述scFv包含3个轻链互补决定区和/或3个重链互补决定区,其中:
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:93所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:58所示的HCDR1、SEQ ID NO:59所示的HCDR2和SEQ ID NO:60所示的HCDR3;优选地,所述CAR编号为654;
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:62所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:38所示的HCDR1、SEQ ID NO:64所示的HCDR2和SEQ ID NO:65所示的HCDR3;优选地,所述CAR编号为108;
所述3个轻链互补决定区包含SEQ ID NO:73所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:74所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:76所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:77所示的HCDR3;优选地,所述CAR编号为131;
所述3个轻链互补决定区包含SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2和SEQ ID NO:21所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:23所示的HCDR1、SEQ ID NO:24所示的HCDR2和SEQ ID NO:25所示的HCDR3;优选地,所述CAR编号为332;
所述3个轻链互补决定区包含SEQ ID NO:27所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:29所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:31所示的HCDR1、SEQ ID NO:32所示的HCDR2和SEQ ID NO:33所示的HCDR3;优选地,所述CAR编号为244;
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:36所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:38所示的HCDR1、SEQ ID NO:39所示的HCDR2和SEQ ID NO:40所示的HCDR3;优选地,所述CAR编号为306;
所述3个轻链互补决定区包含SEQ ID NO:42所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:29所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:44所示的HCDR1、SEQ ID NO:45所示的HCDR2和SEQ ID NO:46所示的HCDR3;优选地,所述CAR编号为304;
所述3个轻链互补决定区包含SEQ ID NO:48所示的LCDR1、SEQ ID NO:49所示的LCDR2和SEQ ID NO:50所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:52所示的HCDR1、SEQ ID NO:53所示的HCDR2和SEQ ID NO:54所示的HCDR3;优选地,所述CAR编号为229;
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:56所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:58所示的HCDR1、SEQ ID NO:59所示的HCDR2和SEQ ID NO:60所示的HCDR3;优选地,所述CAR编号为564;
所述3个轻链互补决定区包含SEQ ID NO:67所示的LCDR1、SEQ ID NO:68所示的LCDR2和SEQ ID NO:69所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:44所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:46所示的HCDR3;优选地,所述CAR编号为83;
所述3个轻链互补决定区包含SEQ ID NO:48所示的LCDR1、SEQ ID NO:49所示的LCDR2和SEQ ID NO:79所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:81所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:82所示的HCDR3;优选地,所述CAR编号为136;
所述3个轻链互补决定区包含SEQ ID NO:84所示的LCDR1、SEQ ID NO:49所示的LCDR2和SEQ ID NO:79所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:86所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:82所示的HCDR3;优选地,所述CAR编号为412;或者,
所述3个轻链互补决定区包含SEQ ID NO:67所示的LCDR1、SEQ ID NO:68所示的LCDR2和SEQ ID NO:88所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:90所示的HCDR1、SEQ ID NO:91所示的HCDR2和SEQ ID NO:92所示的HCDR3;优选地,所述CAR编号为303。
本发明进一步提供所述靶向DLL3抗原的嵌合抗原受体,其特征在于,
所述抗DLL3抗体的scFv包含与SEQ ID NO:61所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:94所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为654;
所述抗DLL3抗体的scFv包含与SEQ ID NO:95所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:63所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为108;
所述抗DLL3抗体的scFv包含与SEQ ID NO:72所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:75所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为131;
所述抗DLL3抗体的scFv包含与SEQ ID NO:18所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:22所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为332;
所述抗DLL3抗体的scFv包含与SEQ ID NO:26所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:30所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为244;
所述抗DLL3抗体的scFv包含与SEQ ID NO:34所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:37所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为306;
所述抗DLL3抗体的scFv包含与SEQ ID NO:41所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:43所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为304;
所述抗DLL3抗体的scFv包含与SEQ ID NO:47所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:51所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为229;
所述抗DLL3抗体的scFv包含与SEQ ID NO:55所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:57所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为564;
所述抗DLL3抗体的scFv包含与SEQ ID NO:66所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:70所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为83;
所述抗DLL3抗体的scFv包含与SEQ ID NO:78所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:80所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为136;
所述抗DLL3抗体的scFv包含与SEQ ID NO:83所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:85所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为412;或者,
所述抗DLL3抗体的scFv包含与SEQ ID NO:87所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:89所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;优选地,所述CAR编号为303。
进一步,所述CAR还包含跨膜结构域,优选地,所述跨膜结构域为CD8跨膜区,所述跨膜结构域还可以选自下列蛋白质的跨膜区:T细胞受体的α、β或ζ链,CD28,CD3ε,CD45,CD4,CD5,CD8,CD9,CD16,CD22,CD33,CD37,CD64,CD80,CD86,CD123,CD134,CD137,CD154,PD1,或其组合。
进一步,所述CAR还包含细胞内信号传导结构域,优选地,所述细胞内信号传导结构域为CD3ζ胞内信号域,所述细胞内信号传导结构域还可以选自下列蛋白质的信号传导结构域:FcRγ、FcRβ、CD3γ、CD3δ、CD3ε、CDS、CD22、CD79a、CD79b、CD66d,或其组合。
进一步,所述CAR还包含铰链区,优选地,所述铰链区为CD8铰链区,所述铰链区还可以选自下列蛋白质的铰链区:CD28、GM-CSF、CD4、CD137、或其组合。
进一步,所述CAR还包含共刺激信号域,优选地,所述共刺激信号域为4-1BB共刺激信号,所述共刺激信号还可以选自下列蛋白质的共刺激信号:OX40、CD2、CD27、CD28、CDS、ICAM-1、LFA-1(CD11a/CD18)、ICOS(CD278)、HVEM,或其组合。
进一步,所述CAR还包含信号肽,优选地,所述信号肽为CD8α信号肽,所述信号肽还可以选自下列蛋白质的信号肽:CD8、CD28、GM-CSF、CD4、CD137、或其组合。
进一步,所述CD8α信号肽包含与SEQ ID NO:1所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;CD8铰链区及跨膜区包含与SEQ IDNO:2所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;所述4-1BB共刺激信号域包含与SEQ ID NO:3所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;或者,所述CD3ζ胞内信号域包含与SEQ ID NO:4所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
进一步,所述CAR从N端到C端依次包含CD8α信号肽、DLL3抗体scFv VH-linker-DLL3抗体scFv VL、CD8铰链区、CD8跨膜区、4-1BB共刺激信号和CD3ζ胞内信号域;可选地,所述CAR不包含CD8α信号肽的氨基酸序列。
进一步,所述CAR的氨基酸序列如SEQ ID NO:5-17任一所示;更优选地,所述CAR在氨基酸序列如SEQ ID NO:5-17任一所示的基础上,去除CD8α信号肽的氨基酸序列。
本发明的第二方面提供了一种核酸,其编码所述CAR。
本发明的第三方面提供了一种表达盒,其包含所述核酸。
本发明的第四方面提供了一种载体,其包含编码所述CAR的核酸或所述表达盒。所述载体可用于表达所述CAR。优选地,所述载体可以是病毒载体;优选地,所述病毒载体包含但不限于慢病毒载体、腺病毒载体、腺相关病毒载体或逆转录病毒载体等;优选地,所述载体可以是非病毒载体;优选地,所述载体可以是哺乳细胞表达载体;优选地,所述表达载体可以是细菌表达载体;优选地,所述表达载体可以是真菌表达载体。
本发明的第五方面提供了一种细胞,所述细胞包括所述核酸、或所述表达盒、或所述载体,所述细胞可表达所述CAR。优选地,所述细胞为细菌细胞;优选地,所述细菌细胞为大肠杆菌细胞等;优选地,所述细胞为真菌细胞;优选地,所述真菌细胞为酵母细胞;优选地,所述酵母细胞为毕赤酵母细胞等;优选地,所述细胞为哺乳动物细胞;优选地,所述哺乳动物细胞为中国仓鼠卵巢细胞(CHO)、人胚胎肾细胞(293)、B细胞、T细胞、DC细胞或NK细胞等。优选地,所述细胞为工程化的免疫细胞;更优选地,所述工程化的免疫细胞为T细胞;最优选地,所述T细胞为原代T细胞、γ-δT细胞或NK T细胞。本发明的第六方面提供了一种药物组合物,其包含所述CAR、核酸、表达盒、载体或细胞,优选地,所述药物组合物还包含药学上可接受的载体,优选地,所述药学上可接受的载体包括以下中的一种或多种:药学上可接受的溶剂、分散剂、附加剂、塑形剂、药物辅料。
本发明的第七方面提供了一种试剂盒,其包含本发明所述CAR,或包含编码CAR的核酸、或所述表达盒。
本发明的第八方面提供了所述CAR、核酸、表达盒、载体或细胞在制备治疗或预防疾病的药物组合物中的应用。
本发明的第九方面提供了所述CAR或核酸或表达盒在制备诊断、检测试剂盒中的应用。
本发明的第十方面提供了一种治疗或预防疾病的方法,包括将本发明的所述CAR、核酸、表达盒、载体、细胞或药物组合物给予有需要的受试者。
本发明的第十一方面提供了一种诊断、检测的方法,包括将本发明的所述CAR、核酸、表达盒、试剂盒或药物组合物给予有需要的受试者或样本。
本发明的第十二方面提供了所述CAR、核酸、表达盒、载体、细胞或药物组合物用于治疗、预防疾病的用途。
本发明的第十三方面提供了所述CAR、核酸、表达盒、试剂盒、或药物组合物用于检测、诊断的用途。
本发明的第十四方面提供了所述CAR,所述核酸、或所述表达盒,或所述载体、或所述药物组合物用于预防、治疗、检测或诊断与DLL3相关的疾病的应用。
在本发明的方案中,所述与DLL3相关的疾病是DLL3高表达疾病;优选地,所述疾病是DLL3高表达癌症或肿瘤;更优选地,所述癌症或肿瘤选自肺癌、黑色素瘤、甲状腺髓样癌、胶质母细胞瘤、前列腺癌、神经内分泌癌中的一种或多种;最优选地,所述癌症是肺癌,特别是小细胞肺癌。
本发明的第十五方面提供了一种制备工程化免疫细胞的方法,其特征在于,包括以下步骤:
(1)提供一待改造的免疫细胞;和
(2)将所述核酸、或所述表达盒、或所述载体导入到所述免疫细胞。
优选地,所述免疫细胞为T细胞;更优选地,所述T细胞为原代T细胞、γ-δT细胞或NK T细胞。
本发明提供的靶向人DLL3抗原的全人源特异性嵌合抗原受体具有以下的一种或多种优势:
1.本发明的人DLL3嵌合抗原受体修饰的T细胞(DLL3 CAR-T),能够特异性地与人DLL3抗原结合。
2.本发明的人DLL3嵌合抗原受体修饰的T细胞(DLL3 CAR-T)采用的是全人源抗DLL3抗体scfv结构,理论上具有低免疫原性的优势。
3.本发明的13种DLL3 CAR-T在培养不同天数下,CAR表达情况基本稳定,未出现下降等异常现象。
4.本发明的13种DLL3 CAR-T体外毒性测试表明,在肿瘤细胞数目固定的情况下,除564scfv CAR-T外,其余12种DLL3 CAR-T与肿瘤细胞以效靶比5:1共孵育时,对于人DLL3抗原中表达的SHP-77细胞株,24h后的杀伤效率在18%-48%;对于人DLL3抗原高表达的SHP-77-hDLL3细胞株,24h后的杀伤效率在21%-56%;而对人DLL表达阴性的细胞株NCI-H460无显著杀伤效果
5.评估不同scfv DLL3 CAR-T细胞在体外长期抗肿瘤作用,在效应细胞:靶细胞在1:10的情况下,本发明108、131和654scfv DLL3 CAR-T能够完全清除肿瘤细胞。
6.动物模型实验表明,本发明优选的6种DLL3 CAR-T(332、304、229、654、108、131scfv DLL3 CAR-T)给药17天后,各个药物组疗效显著,抑瘤率在25-97%。
附图说明
图1示出了重组质粒pRRLSIN-DLL3 CAR-EGFP(PB DLL3 CAR)的结构示意图。
图2A-图2N,示出了通过抗人IgG(Fab)2抗体检测表达不同靶向DLL3嵌合抗原受体的T淋巴细胞的CAR阳性流式示意图,其中图2A示出了未转导CAR的T细胞结果,图2B示出了332DLL3 CAR-T的结果,图2C示出了244DLL3 CAR-T结果,图2D示出了306DLL3 CAR-T结果,图2E示出了304DLL3 CAR-T结果,图2F示出了229DLL3 CAR-T结果,图2G示出了564DLL3CAR-T结果,图2H示出了654DLL3 CAR-T结果,图2I示出了108DLL3 CAR-T结果,图2J示出了83DLL3 CAR-T结果,图2K示出了131DLL3 CAR-T结果,图2L示出了136DLL3 CAR-T结果,图2M示出了412DLL3 CAR-T结果,图2N示出了303DLL3 CAR-T结果。
图3A-图3N,示出了通过DLL抗原检测表达不同靶向DLL3嵌合抗原受体的T细胞的CAR阳性流式示意图,其中图3A示出了未转导CAR的T细胞结果,图3B示出了332DLL3 CAR-T的结果,图3C示出了244DLL3 CAR-T结果,图3D示出了306DLL3 CAR-T结果,图3E示出了304DLL3 CAR-T结果,图3F示出了229DLL3 CAR-T结果,图3G示出了564DLL3 CAR-T结果,图3H示出了654DLL3 CAR-T结果,图3I示出了108DLL3 CAR-T结果,图3J示出了83DLL3 CAR-T结果,图3K示出了131DLL3 CAR-T结果,图3L示出了136DLL3 CAR-T结果,图3M示出了412DLL3 CAR-T结果,图3N示出了303DLL3 CAR-T结果。
图4A-图4B,其中图4A示出了抗人IgG(Fab)2抗体检测方法检测的13种靶向DLL3嵌合抗原受体的T细胞的CAR阳性率结果;图4B示出了人DLL3抗原蛋白检测方法检测的13种靶向DLL3嵌合抗原受体的T细胞的CAR阳性率结果。
图5A-图5B,图5A示出了抗人IgG(Fab)2抗体检测方法的13种靶向DLL3嵌合抗原受体的T细胞在培养不同天数下CAR阳性率的变化结果;图5B示出了人DLL3抗原蛋白检测方法的13种靶向DLL3嵌合抗原受体的T细胞在培养不同天数下CAR阳性率的变化结果。
图6示出了示出了人NCI-H460、SHP-77、SHP-77-hDLL3肺癌细胞株DLL3抗原表达流式检测结果。
图7A-图7C,图7A示出了13种DLL3 CAR-T细胞对NCI-H460(非小细胞肺癌)细胞株的体外特异性杀伤结果,图7B示出了13种DLL3 CAR-T细胞对SHP-77(小细胞肺癌)细胞株的体外特异性杀伤结果,图7C示出了13种DLL3 CAR-T细胞对人DLL3阳性SHP-77-hDLL3(小细胞肺癌)的体外特异性杀伤结果。
图8A-图8C,图8A示出了13种DLL3 CAR-T与NCI-H460细胞株共培养后的IFN-γ释放,图8B示出了13种DLL3 CAR-T与SHP-77细胞株共培养后的IFN-γ释放,图8C示出了13种DLL3 CAR-T与SHP-77-hDLL3细胞株共培养后的IFN-γ释放。
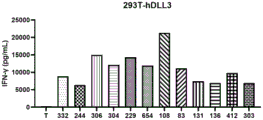
图9A-图9C,图9A示出了13种DLL3 CAR-T细胞对293T细胞株的体外杀伤结果,图9B示出了13种DLL3 CAR-T细胞对人DLL3蛋白过表达293T细胞株(293T-hDLL3)的体外杀伤结果,图9C示出了13种DLL3 CAR-T细胞对鼠DLL3蛋白过表达293T细胞株(293T-mDLL3)的体外杀伤结果。
图10A-图10C,图10A示出了13种DLL3 CAR-T细胞对293T细胞株的体外杀伤后IFN-γ释放结果,图10B示出了13种DLL3 CAR-T细胞对人DLL3蛋白过表达293T细胞株(293T-hDLL3)的体外杀伤后IFN-γ释放结果,图10C示出了13种DLL3 CAR-T细胞对鼠DLL3蛋白过表达293T细胞株(293T-mDLL3)的体外杀伤后IFN-γ释放结果。
图11A-图11B,示出了13种DLL3 CAR-T细胞对DLL3表达阳性细胞长期抗肿瘤作用结果,其中图11A示出了13种DLL3 CAR-T细胞对DLL3表达阳性细胞长期抗肿瘤作用的肿瘤细胞数量变化结果,图11B示出了13种DLL3 CAR-T细胞对DLL3表达阳性细胞长期抗肿瘤作用的CAR阳性T细胞数量变化结果。
图12A-图12G,示出了用于体内药效研究的不同DLL3 CAR-T细胞阳性率检测结果,其中图12A示出了未转导CAR的T细胞结果,图12B示出了332DLL3 CAR-T结果,图12C示出了304DLL3 CAR-T结果,图12D示出了229DLL3 CAR-T结果,图12E示出了654DLL3 CAR-T结果,图12F示出了108DLL3 CAR-T结果,图12G示出了131DLL3 CAR-T结果。
图13示出了6种DLL3 CAR-T细胞在小细胞肺癌SHP-77肿瘤荷瘤NCG小鼠的小鼠体重变化的药效研究。
图14示出了6种DLL3 CAR-T细胞在小细胞肺癌SHP-77肿瘤荷瘤NCG小鼠的小鼠肿瘤大小变化的药效研究。
图15示出了6种DLL3 CAR-T细胞在小细胞肺癌SHP-77肿瘤荷瘤NCG小鼠的小鼠存活率的药效研究。
具体实施方式
下面结合具体实施例,进一步阐述本发明。所描述的实施例是本发明一部分实施例,而不是全部的实施例。应理解,举出以下实施例是为了向本发明所属技术领域的一般专业人员就如何利用本发明之方法和组合物提供一个完整的公开和说明,并非用于限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1.靶向DLL3嵌合抗原受体(CAR)基因片段制备
本发明按以下编码基因的顺序设计融合基因片段:CD8α信号肽、DLL3 antibodyscFv VH-linker-DLL3 antibody scFv VL、CD8铰链区、CD8跨膜区以及4-1BB共刺激信号和CD3ζ胞内信号域,通过基因合成技术直接合成融合基因,使表达的嵌合抗原受体具有scFvVH-linker-scFv VL-CD8 hinge-CD8TM-4-IBB-CD3ζ的氨基酸结构。其中接头(linker)氨基酸序列为(G4S)3,即GGGGSGGGGSGGGGS,CD8α信号肽氨基酸序列为SEQ ID NO:1,CD8铰链区(CD8 hinge)及跨膜区(CD8 TM)氨基酸序列为SEQ ID NO:2,4-1BB氨基酸序列为SEQ IDNO:3,CD3ζ氨基酸序列为SEQ ID NO:4,SEQ ID NO:1-4具体序列见表1-1。通过基因合成技术制备靶向DLL3嵌合抗原受体基因片段,其氨基酸序列分别如SEQ ID NO:5-17所示,具体序列见表1-2。其中CAR中使用的不同活性克隆抗DLL3抗体scFv VH及VL、以及LCDR1-3、HCDR1-3的氨基酸序列见表1-3,分析系统为IMGT系统。
表1-1.CAR部分元件氨基酸序列
表1-2.DLL3 CAR氨基酸序列
表1-3.抗DLL3抗体活性克隆可变区、CDR的氨基酸序列
注:VL、VH中下划线部分为CDR。
实施例2.DLL3特异性嵌合抗原受体修饰的T细胞的制备
2.1非病毒piggybac(PB)转座子载体构建
以pBluescirpt载体(通用生物合成)为起始骨架,寻找到基因绝缘子序列cHS4,安置在多克隆位点两端,寻找到PB transposon的5'ITR和3'ITR序列,构建进入载体的cHS4序列的内侧,在ITR内侧,5端插入EF1a启动子,在3端插入polyA信号,中间保留多克隆序列,在多克隆序列内部接入CD8α-DLL3 antibody ScFv HV-linker-ScFv VL-CD8 hinge-CD8TM-4-1BB-CD3ζ(DLL3 CAR)序列的基因,同时在DLL3 CAR序列后面接入EGFP标签基因序列,以P2A连接。以上序列形成pRRLSIN-DLL3 CAR-EGFP质粒结构(质粒简称PB DLL3 CAR),示意图如图1所示。
对由13个不同DLL3抗体(活性克隆编号332、244、306、304、229、564、654、108、83、131、136、412、303)scfv构建的PB DLL3 CAR载体进行抽提(南京金斯瑞完成),得到PB DLL3CAR转染级质粒。
2.2 T淋巴细胞的制备
通过CD3 MicroBeads human-lyophilized Kit(Miltenyi Biotech)对外周血单核细胞(PBMC)(上海澳能生物)进行磁珠标记,阳性分选出高纯度的CD3阳性T淋巴细胞,分选后的CD3阳性T细胞比例在95%以上。纯化后的T细胞,再利用Dynabeads Human T-Activator CD3/CD28(Thermo Fisher,11132D)进行T淋巴细胞激活及增殖。
2.3 CAR基因转导T细胞
在T细胞刺激活化后72-96小时,分别采用实施例2.1中得到的13个DLL3抗体(332、244、306、304、229、564、654、108、83、131、136、412、303)scfv构建的PB DLL3 CAR质粒进行电转。首先将用于电转的T细胞进行重悬,使用吸头或移液管吹散T细胞团块,对T细胞重悬液进行计数,使用5x106T细胞用于单次电转实验。使用DPBS(GIBCO,14190-144)将5x106细胞稀释至5mL,室温条件下300x g离心10分钟,尽可能吸弃上清,避免接触到T细胞沉淀,加入5mL DPBS重悬清洗T细胞,室温条件下300x g离心10分钟,尽可能吸弃上清,避免接触到T细胞沉淀,加入100μL电转缓冲液Entranster-E(Engreen,98668-20)重悬细胞,将细胞悬液转移到1.5mL离心管中。将表2中的组分加入到离心管中,混匀。
表2.每组电转体系
| 组分 | 体积(μL) |
| PB DLL3 CAR质粒(1ug/uL) | 5 |
| Transposase mRNA(1ug/uL) | 5 |
| T细胞悬液 | 100 |
| 总体积 | 110 |
采用4D-Nucleofector细胞核转仪(Lonza公司)进行电转,将细胞/质粒悬液迅速转移至电击杯中,并轻轻磕击电击杯使细胞悬液充分在电击杯中形成平衡液面,使用程序EO115进行电转。电转后,将电击杯小心取出。加入500uL预热T细胞培养基X-VIVO 15(Lonza,04-418Q)并在37℃培养箱中平衡5分钟,使用微孔上样吸头重悬细胞,轻轻吹打2-3次。将细胞转移至加有2mL预热培养基的12孔板中,37℃培养。电转后4-6小时对细胞进行换液有利于增加细胞存活率。小心吸弃上清,加入预热的新鲜培养基。在37℃,5% CO2培养箱中培养48-72h小时直至检测。
2.4 DLL3 CAR-T细胞电转效率检测
在电转48-72h后,获取13组PB DLL3 CAR质粒电转后的T细胞以及未进行CAR质粒电转的T细胞对照进行CAR阳性率流式分析。采用生物素标记的抗人IgG(Fab)2抗体(jackson immuno,109-065-006)或者人DLL3抗原蛋白(ACRO,DL3-H82E4)作为CAR结合蛋白,再用亲和素偶联PE荧光染料通过流式细胞技术检测嵌合抗原受体(CAR)表达,以未转导的T淋巴细胞作为阴性对照,表达不同嵌合抗原受体的T淋巴细胞其CAR阳性率如表3所示,其CAR阳性率范围在10-50%。实验结果表明:本发明不同scfv构建的CAR结构均可用于制备CAR-T细胞,且同一条件下,转导效率越高的DLL3 CAR-T,越有利于后续应用。图2A-图2N示出了通过抗人IgG(Fab)2抗体检测表达不同靶向DLL3嵌合抗原受体的T淋巴细胞的CAR阳性流式示意图,其中图2A示出了未转导CAR的T细胞结果,图2B示出了332DLL3 CAR-T的结果,图2C示出了244DLL3 CAR-T结果,图2D示出了306DLL3 CAR-T结果,图2E示出了304DLL3CAR-T结果,图2F示出了229DLL3 CAR-T结果,图2G示出了564DLL3 CAR-T结果,图2H示出了654DLL3 CAR-T结果,图2I示出了108DLL3 CAR-T结果,图2J示出了83DLL3 CAR-T结果,图2K示出了131DLL3 CAR-T结果,图2L示出了136DLL3 CAR-T结果,图2M示出了412DLL3 CAR-T结果,图2N示出了303DLL3 CAR-T结果。图3A-图3N示出了通过DLL抗原检测表达不同靶向DLL3嵌合抗原受体的T细胞的CAR阳性流式示意图,其中图3A示出了未转导CAR的T细胞结果,图3B示出了332DLL3 CAR-T的结果,图3C示出了244DLL3 CAR-T结果,图3D示出了306DLL3CAR-T结果,图3E示出了304DLL3 CAR-T结果,图3F示出了229DLL3 CAR-T结果,图3G示出了564DLL3 CAR-T结果,图3H示出了654DLL3 CAR-T结果,图3I示出了108DLL3 CAR-T结果,图3J示出了83DLL3 CAR-T结果,图3K示出了131DLL3 CAR-T结果,图3L示出了136DLL3 CAR-T结果,图3M示出了412DLL3 CAR-T结果,图3N示出了303DLL3 CAR-T结果。图4A示出了抗人IgG(Fab)2抗体检测方法检测的13种靶向DLL3嵌合抗原受体的T细胞的CAR阳性率结果。图4B示出了人DLL3抗原蛋白检测方法检测的13种靶向DLL3嵌合抗原受体的T细胞的CAR阳性率结果。
表3.表达不同嵌合抗原受体的T淋巴细胞的阳性率
2.5 DLL3 CAR-T细胞CAR表达稳定性检测
对13组PB DLL3 CAR质粒电转后的T细胞以及未进行CAR质粒电转的T细胞进行持续培养,同时在电转后第4、6、8、11天进行CAR阳性率检测,分别采用生物素标记的抗人IgG(Fab)2抗体及人DLL3抗原蛋白作为CAR结合蛋白,再用亲和素偶联PE荧光染料通过流式细胞技术检测嵌合抗原受体(CAR)表达,以未转导的T淋巴细胞作为阴性对照,记录13种DLL3CAR-T在培养不同天数下CAR阳性率的变化。图5A示出了抗人IgG(Fab)2抗体检测方法的13种靶向DLL3嵌合抗原受体的T细胞在培养不同天数下CAR阳性率的变化结果;图5B示出了人DLL3抗原蛋白检测方法的13种靶向DLL3嵌合抗原受体的T细胞在培养不同天数下CAR阳性率的变化结果。结果显示在一定时间范围内对不同DLL3 CAR-T阳性率检测,其CAR表达情况基本稳定,未出现下降等异常现象。
实施例3.DLL3特异性嵌合抗原受体修饰的T细胞体外毒性测试
通过模拟产品的作用机制(MOA)建立体外药效试验。以DLL3靶点相关的肺癌细胞株NCI-H460(非小细胞肺癌)、SHP-77(小细胞肺癌)以及SHP-77-hDLL3(小细胞肺癌)作为DLL3CAR-T细胞功能验证的靶细胞,其中SHP-77-hDLL3细胞株是通过人DLL3蛋白过表达慢病毒感染、筛选获得的高表达人DLL3蛋白的SHP-77细胞,通过流式细胞技术对这三株肺癌细胞株进行人DLL3抗原检测,NCI-H460细胞株人DLL3抗原低表达,SHP-77细胞株人DLL3抗原中表达,SHP-77-hDLL3细胞株人DLL3抗原高表达,图6示出了人NCI-H460、SHP-77、SHP-77-hDLL3肺癌细胞株DLL3抗原表达流式检测结果。
按照设置不同的E:T(效应细胞:靶细胞)比,建立CAR-T细胞与靶向肿瘤细胞的共培养体系,通过检测肿瘤细胞杀伤率来评估CAR-T生物学效力,同时设立未经转导的T细胞与肿瘤细胞共培养对照体系。图7A-C示出了不同DLL3 CAR-T细胞对肺癌细胞株的体外特异性杀伤结果,图7A示出了13种DLL3 CAR-T细胞对NCI-H460(非小细胞肺癌)细胞株的体外特异性杀伤结果,图7B示出了13种DLL3 CAR-T细胞对SHP-77(小细胞肺癌)细胞株的体外特异性杀伤结果,图7C示出了13种DLL3 CAR-T细胞对人DLL3阳性SHP-77-hDLL3(小细胞肺癌)的体外特异性杀伤结果。图7A-C中T代表未转导CAR的T细胞实验结果。体外实验结果所示,在肿瘤细胞数目固定的情况下,除564scfv CAR-T外,其余12种DLL3 CAR-T与肿瘤细胞以效靶比5:1共孵育时,对于人DLL3抗原中表达的SHP-77细胞株,24h后的杀伤效率在18%-48%;对于人DLL3抗原高表达的SHP-77-hDLL3细胞株,24h后的杀伤效率在21%-56%;而对人DLL抗原低表达的细胞株NCI-H460无显著杀伤效果。该结果说明12种DLL3 CAR-T能够特异性的杀伤人DLL3抗原表达的肿瘤细胞,且杀伤效率与人DLL3抗原的表达量呈正相关。表5给出了13种DLL3 CAR-T对上述三种肺癌细胞株的杀伤效果。
表5 13种DLL3 CAR-T对上述三种肺癌细胞株的杀伤效果
同时通过检测分泌至培养基上清中细胞因子(INF-γ)含量来评估CAR-T生物学效力,DLL3 CAR-T与人DLL3高表达肿瘤细胞(SHP-77-hDLL3)共培养后,除564scfv CAR-T外,其余12种DLL3 CAR-T细胞组杀伤肿瘤细胞后细胞因子IFN-γ释放水平高于阴性对照(未转导CAR的T细胞)至少2倍以上(参见图8C、表6)。表6给出了未转导CAR的T细胞,本发明的13种DLL3 CAR-T与NCI-H460、SHP-77、SHP-77-hDLL3三种细胞株共培养后的IFN-γ释放。图8A-C给出了不同DLL3 CAR-T细胞对3种肺癌细胞杀伤后IFN-γ释放结果,其中图8A示出了13种DLL3 CAR-T与NCI-H460细胞株共培养后的IFN-γ释放,图8B示出了13种DLL3 CAR-T与SHP-77细胞株共培养后的IFN-γ释放,图8C示出了13种DLL3 CAR-T与SHP-77-hDLL3细胞株共培养后的IFN-γ释放,图8A-C中T代表未转导CAR的T细胞的IFN-γ释放。
表6.共培养上清细胞因子IFN-γ释放
基于上述体外细胞毒性试验,表明除564scfv CAR-T外,表达不同DLL3嵌合抗原受体的本发明12种T淋巴细胞能对DLL3阳性肺癌细胞均有良好的杀伤作用,这为动物体内药效研究提供了依据。
其中,特异性杀伤检测方法:采用乳酸脱氢酶释放检测试剂盒(LDH ReleaseAssay Kit)(日本同仁化学,CK12)进行,是一种基于diaphorase催化的INT显色反应,通过比色法检测细胞毒性时释放的乳酸脱氢酶活性。它的原理是采用细胞凋亡或坏死而造成的细胞膜结构的破坏会导致细胞浆内的酶释放到培养液里,其中包括酶活性较为稳定的乳酸脱氢酶(lactate dehydrogenase,LDH)。通过检测从质膜破裂的细胞中释放到培养液中的LDH的活性,就可以实现对细胞毒性的定量分析。LDH释放被看做细胞膜完整性的重要指标,并被广泛用于细胞毒性检测。
其中,细胞因子检测方法:采用人IFN-gamma酶联免疫检测试剂盒(R&D Systems,SIF50)进行,是基于抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。进行检测时,样品中的受检物质(抗原或抗体)与固定的抗体或抗原结合。通过洗板除去非结合物,再加入酶标记的抗原或抗体,此时,能固定下来的酶量与样品中被检物质的量相关。通过加入与酶反应的底物后显色,根据颜色的深浅可以判断样品中物质的含量,进行定性或定量的分析。
实施例4:DLL3特异性嵌合抗原受体修饰的T细胞对不同种属DLL3表达阳性细胞的交叉反应性测试
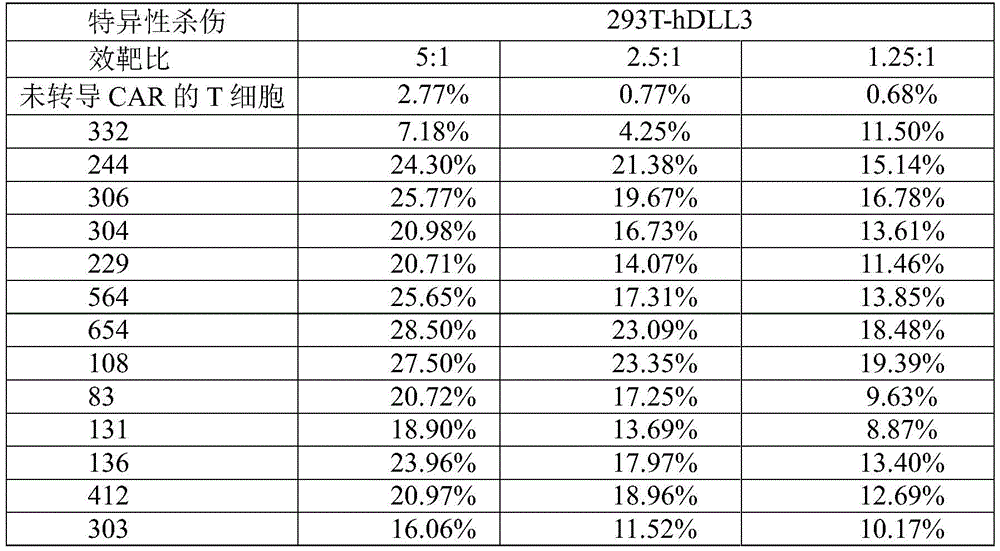
通过免疫缺陷小鼠来评估CAR-T产品安全性,其最关键一点是其抗体scfv对小鼠自身的靶蛋白存在交叉反应,因此本发明进行了DLL3特异性嵌合抗原受体修饰的T细胞对不同种属DLL3表达阳性细胞的交叉反应性测试。
在293T细胞上通过人DLL3蛋白或者鼠DLL3蛋白慢病毒(采购于吉满生物)感染、筛选获得的高表达人DLL3蛋白或者鼠DLL3蛋白的293T细胞,分别命名为293T-hDLL3和293T-mDLL3。通过上述制备的不同scfv的DLL3 CAR-T作为效应细胞,以293T细胞、过表达人DLL3蛋白的293T细胞及过表达鼠DLL3蛋白的293T细胞为靶细胞,按照不同的E:T(效应细胞:靶细胞=5:1,2.5:1,1.25:1)比,建立CAR-T细胞与靶细胞的共培养体系,通过检测肿瘤细胞杀伤率来评估CAR-T对两个蛋白的特异性反应。体外实验结果,在图9A-9C示出,图9A示出了13种DLL3 CAR-T细胞对293T细胞株的体外杀伤结果,图9B示出了13种DLL3 CAR-T细胞对人DLL3蛋白过表达293T细胞株(293T-hDLL3)的体外杀伤结果,图9C示出了13种DLL3 CAR-T细胞对鼠DLL3蛋白过表达293T细胞株(293T-mDLL3)的体外杀伤结果。表7-1~表7-3给出了13种DLL3 CAR-T,以及未转导CAR的T细胞对293T、293T-hDLL3、293T-mDLL3细胞株的杀伤检测实验结果。体外实验结果表明,在肿瘤细胞数目固定的情况下,制备的不同scfv的DLL3CAR-T与293T-hDLL3肿瘤细胞以效靶比5:1共孵育时,杀伤肿瘤细胞的效率24h可达15%-20%,与293T-mDLL3肿瘤细胞以效靶比1.25:1、2.5:1、5:1共孵育时,不同scfv制备的DLL3CAR-T均对其特异性杀伤有显著性差异,表明DLL3 CAR-T可能在小鼠体内对鼠DLL3靶点分布的组织产生攻击,由此可用于评估DLL3CAR-T细胞的体内安全性。
表7-1.DLL3 CAR-T对293T细胞株的杀伤检测实验结果
表7-2 DLL3 CAR-T对293T-hDLL3细胞株的杀伤检测实验结果
表7-3 DLL3 CAR-T对293T-mDLL3细胞株的杀伤检测实验结果
同时通过检测分泌至培养基上清中细胞因子(INF-γ)含量来评估CAR-T特异性反应,不同scfv的DLL3 CAR-T与DLL3特异性嵌合抗原受体修饰的T细胞共培养上清释放的IFN-γ细胞因子释放表达差异(参见图10A-C、表8)和杀伤试验结果一致(参见图9A-C、表7-1~表7-3)。图10A示出了13种DLL3 CAR-T细胞对293T细胞株的体外杀伤后IFN-γ释放结果,图10B示出了13种DLL3 CAR-T细胞对人DLL3蛋白过表达293T细胞株(293T-hDLL3)的体外杀伤后IFN-γ释放结果,图10C示出了13种DLL3 CAR-T细胞对鼠DLL3蛋白过表达293T细胞株(293T-mDLL3)的体外杀伤后IFN-γ释放结果。表8给出了13种DLL3 CAR-T对293T、293T-hDLL3、293T-mDLL3细胞株的杀伤后IFN-γ释放检测具体试验结果。
研究结果显示,本发明涉及的不同scfv DLL3 CAR-T细胞均对人DLL3蛋白过表达的293T细胞产生杀伤和释放细胞因子,同时也能对鼠DLL3蛋白过表达的293T细胞产生杀伤和释放细胞因子IFN-γ,证明其对小鼠自身靶蛋白有交叉反应性,为后期采用小鼠动物模型评估安全性提供了理论依据。
表8.DLL3 CAR-T对293T、293T-hDLL3、293T-mDLL3细胞株的杀伤后IFN-γ释放检测试验结果
实施例5:DLL3特异性嵌合抗原受体修饰的T细胞对人小细胞肺癌SHP-77细胞株持续抑制作用测试
为了评估不同scfv DLL3 CAR-T细胞在体外长期抗肿瘤作用,本发明设计了本实施例5。通过上述不同scfv的DLL3 CAR-T作为效应细胞,以人小细胞肺癌SHP-77细胞株为靶细胞,按照1:10的E:T(效应细胞:靶细胞)比,采用无细胞因子共培养体系,通过检测CAR-T细胞和肿瘤细胞在共培养体系中的数量变化来评估DLL3 CAR-T细胞持续杀瘤能力。
图11A-B示出了13种DLL3 CAR-T细胞对DLL3表达阳性细胞SHP-77长期抗肿瘤作用结果,其中图11A示出了13种DLL3 CAR-T细胞对DLL3表达阳性细胞SHP-77长期抗肿瘤作用的肿瘤细胞数量变化结果,图11B示出了13种DLL3 CAR-T细胞对DLL3表达阳性细胞SHP-77长期抗肿瘤作用的CAR阳性T细胞数量变化结果。研究结果显示,在效应细胞:靶细胞在1:10的情况下,不同scfv的DLL3 CAR-T在对人小细胞肺癌SHP-77细胞株持续抑制能力上存在差异,其中108、131和654scfv DLL3 CAR-T能够完全清除肿瘤细胞。
实施例6DLL3 CAR-T动物体内药效试验
在本实施例6中,建立人小细胞肺癌肿瘤细胞负荷的免疫缺陷型小鼠药效模型,用于评估不同scfv DLL3 CAR-T细胞在小鼠体内的药效及安全性。
6.1 DLL3 CAR-T细胞制备
6.1.1 T细胞的分选及激活
提供外周血单核细胞(PBMC)(由上海澳能公司提供分离服务),通过CD3MicroBeads human-lyophilized Kit(购自Miltenyi Biotech)对细胞进行磁珠标记,阳性分选出高纯度的CD3+T淋巴细胞,分选后的CD3阳性T细胞比例在95%以上。纯化后的T细胞,再利用Dynabeads Human T-Activator CD3/CD28(Thermo Fisher,11132D)进行T淋巴细胞激活及增殖。
6.1.2 CAR基因转导T细胞
对优选的6个DLL3抗体(332、304、229、654、108、131)scfv构建的PB DLL3 CAR质粒进行电转。首先将用于电转的细胞进行重悬,使用吸头或移液管吹散细胞团块,对细胞重悬液进行计数,使用5x106细胞用于单次电转实验。使用DPBS(GIBCO,14190-144)将5x106细胞稀释至5mL,室温条件下300x g离心10分钟,尽可能吸弃上清,避免接触到细胞沉淀,加入5ml DPBS重悬清洗细胞,室温条件下300x g离心10分钟,尽可能吸弃上清,避免接触到细胞沉淀,加入100μL电转缓冲液Entranster-E(Engreen,98668-20)重悬细胞,将细胞悬液转移到1.5mL离心管中。将表9(每组电转体系)中的组分加入到离心管中,混匀。
表9.每组电转体系
| 组分 | 体积(μL) |
| PB DLL3 CAR质粒(1ug/uL) | 5 |
| Transposase mRNA(1ug/uL) | 5 |
| 细胞悬液 | 100 |
| 总体积 | 110 |
6.1.3 DLL3 CAR-T细胞电转效率检测
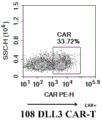
在电转48-72h后,获取6组PB DLL3 CAR质粒电转后的T细胞以及未进行CAR质粒电转的T细胞对照进行CAR阳性率流式分析。采用生物素标记的人DLL3抗原蛋白(ACRO,DL3-H82E4)作为CAR结合蛋白,再用亲和素偶联PE荧光染料通过流式细胞技术检测嵌合抗原受体(CAR)表达,以未转导的T淋巴细胞作为阴性对照,表达6种不同嵌合抗原受体的T淋巴细胞其阳性率如表10所示,图12A-图12G示出了用于体内药效研究的6种不同DLL3CAR-T细胞阳性率检测结果,其阳性率范围在10-40%之间,其中图12A示出了未转导CAR的T细胞结果,图12B示出了332DLL3 CAR-T结果,图12C示出了304DLL3 CAR-T结果,图12D示出了229DLL3CAR-T结果,图12E示出了654DLL3 CAR-T结果,图12F示出了108DLL3 CAR-T结果,图12G示出了131DLL3 CAR-T结果。
表10.表达不同嵌合抗原受体的T淋巴细胞的阳性率
| 分组 | CAR阳性率 |
| 未转导CAR的T细胞(Mock T) | 0.12% |
| 332DLL3 CAR-T | 24.18% |
| 304DLL3 CAR-T | 26.50% |
| 229DLL3 CAR-T | 26.92% |
| 654DLL3 CAR-T | 12.77% |
| 108DLL3 CAR-T | 33.72% |
| 131DLL3 CAR-T | 24.63% |
6.1.4 DLL3 CAR-T动物模型试验
基于体外研究以雌性NCG小鼠(购自集萃药康)经背皮注射5×106个人小细胞肺癌细胞SHP-77,接种SHP-77细胞第11天(肿瘤体积在60mm3大小左右)给药,Mock-T(未转导CAR的T细胞组)组为5×106数量T细胞,各不同scfv DLL3 CAR-T细胞组(332、304、229、654、108、131scfv DLL3 CAR-T)分别给药5×106数量CAR阳性T细胞,给药体积均为200uL。所有条件组动物数量均为5只。给药后每周2次量瘤;绘制肿瘤生长曲线,计算TGI、T/C,试验终点对所有肿瘤进行拍照。CAR-T给药后第2、14和28天及终点取血,通过qPCR的方法检测小鼠外周血中CAR的拷贝数(VCN),从而确认CAR-T细胞的扩增情况。结果表明CAR-T给药17天,各个药物组疗效显著,抑瘤率在25-97%,具体包含如下指标:
(1)体重:与Mock T组(未转导CAR的T细胞组)比较,不同scfv DLL3 CAR-T给药组体重无显著性差异,图13示出了6种DLL3 CAR-T细胞在小细胞肺癌SHP-77肿瘤荷瘤NCG小鼠的小鼠体重变化的药效研究。
(2)肿瘤抑制率(TGI)统计:至药后17天,各个药物组疗效显著,抑瘤率在25-97%,其中108药效最佳,抑瘤率为96.53%,图14示出了6种DLL3 CAR-T细胞在小细胞肺癌SHP-77肿瘤荷瘤NCG小鼠的小鼠肿瘤大小变化的药效研究。
(3)死亡率:至药后17天,Mock-T细胞组、不同scfv DLL3 CAR-T给药组小鼠生存状态良好,未出现小鼠死亡现象,图15示出了6种DLL3 CAR-T细胞在小细胞肺癌SHP-77肿瘤荷瘤NCG小鼠的小鼠存活率的药效研究。
Claims (13)
1.一种靶向DLL3抗原的嵌合抗原受体(CAR),其特征在于,所述CAR包含抗DLL3抗体的scFv,所述scFv包含3个轻链互补决定区和/或3个重链互补决定区,其中
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:93所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:58所示的HCDR1、SEQ ID NO:59所示的HCDR2和SEQ ID NO:60所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:62所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:38所示的HCDR1、SEQ ID NO:64所示的HCDR2和SEQ ID NO:65所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:73所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:74所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:76所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:77所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2和SEQ ID NO:21所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:23所示的HCDR1、SEQ ID NO:24所示的HCDR2和SEQ ID NO:25所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:27所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:29所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:31所示的HCDR1、SEQ ID NO:32所示的HCDR2和SEQ ID NO:33所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:36所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:38所示的HCDR1、SEQ ID NO:39所示的HCDR2和SEQ ID NO:40所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:42所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:29所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:44所示的HCDR1、SEQ ID NO:45所示的HCDR2和SEQ ID NO:46所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:48所示的LCDR1、SEQ ID NO:49所示的LCDR2和SEQ ID NO:50所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:52所示的HCDR1、SEQ ID NO:53所示的HCDR2和SEQ ID NO:54所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:35所示的LCDR1、SEQ ID NO:28所示的LCDR2和SEQ ID NO:56所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:58所示的HCDR1、SEQ ID NO:59所示的HCDR2和SEQ ID NO:60所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:67所示的LCDR1、SEQ ID NO:68所示的LCDR2和SEQ ID NO:69所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:44所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:46所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:48所示的LCDR1、SEQ ID NO:49所示的LCDR2和SEQ ID NO:79所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:81所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:82所示的HCDR3;
所述3个轻链互补决定区包含SEQ ID NO:84所示的LCDR1、SEQ ID NO:49所示的LCDR2和SEQ ID NO:79所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:86所示的HCDR1、SEQ ID NO:71所示的HCDR2和SEQ ID NO:82所示的HCDR3;或者
所述3个轻链互补决定区包含SEQ ID NO:67所示的LCDR1、SEQ ID NO:68所示的LCDR2和SEQ ID NO:88所示的LCDR3,和/或所述3个重链互补决定区包含SEQ ID NO:90所示的HCDR1、SEQ ID NO:91所示的HCDR2和SEQ ID NO:92所示的HCDR3。
2.根据权利要求1所述的靶向DLL3抗原的嵌合抗原受体,其特征在于,
所述抗DLL3抗体的scFv包含与SEQ ID NO:61所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:94所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:95所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:63所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:72所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:75所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:18所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:22所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:26所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:30所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:34所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:37所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:41所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:43所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:47所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:51所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:55所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:57所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:66所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:70所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:78所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:80所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;
所述抗DLL3抗体的scFv包含与SEQ ID NO:83所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:85所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区;或者
所述抗DLL3抗体的scFv包含与SEQ ID NO:87所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的轻链可变区,和/或与SEQ ID NO:89所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的重链可变区。
3.根据权利要求1所述的靶向DLL3抗原的嵌合抗原受体,其特征在于,所述CAR还包含跨膜结构域和细胞内信号传导结构域;
优选地,所述CAR还包含铰链区、信号肽和共刺激信号域中的一种或多种;
更优选地,所述跨膜结构域为CD8跨膜区,所述铰链区为CD8铰链区,所述细胞内信号传导结构域为CD3ζ胞内信号域,所述信号肽为CD8α信号肽,或所述共刺激信号域为4-1BB共刺激信号域。
4.根据权利要求3所述的靶向DLL3抗原的嵌合抗原受体,其特征在于,所述CAR从N端到C端依次包含CD8α信号肽、DLL3抗体scFv VH-linker-DLL3抗体scFv VL、CD8铰链区、CD8跨膜区、4-1BB共刺激信号和CD3ζ胞内信号域;可选地,所述CAR不包含CD8α信号肽的氨基酸序列。
5.根据权利要求3或4所述的靶向DLL3抗原的嵌合抗原受体,其特征在于,
所述CD8α信号肽包含与SEQ ID NO:1所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;
CD8铰链区及跨膜区包含与SEQ ID NO:2所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;
所述4-1BB共刺激信号域包含与SEQ ID NO:3所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;或者
所述CD3ζ胞内信号域包含与SEQ ID NO:4所示氨基酸序列具有至少95%、96%、97%、98%、99%或100%同一性的氨基酸序列;
优选地,所述CAR的氨基酸序列如SEQ ID NO:5-17任一所示;更优选地,所述CAR在氨基酸序列如SEQ ID NO:5-17任一所示的基础上,去除CD8α信号肽的氨基酸序列。
6.一种核酸,其编码权利要求1-5任一项所述的靶向DLL3抗原的嵌合抗原受体。
7.一种表达盒,其包含权利要求6所述的核酸。
8.一种载体,其含有权利要求6所述核酸或权利要求7所述表达盒。
9.一种细胞,其包含权利要求6所述核酸或权利要求7所述表达盒或权利要求8所述载体;优选地,所述细胞为工程化的免疫细胞;更优选地,所述工程化的免疫细胞为T细胞;最优选地,所述T细胞为原代T细胞、γ-δT细胞或NK T细胞。
10.一种药物组合物,其含有权利要求1-5任一项所述的靶向DLL3抗原的嵌合抗原受体、或权利要求6所述核酸、或权利要求7所述表达盒、或权利要求8所述载体、或权利要求9所述细胞。
11.一种试剂盒,其含有权利要求1-5任一项所述的靶向DLL3抗原的嵌合抗原受体、或权利要求6所述核酸、或权利要求7所述表达盒、或权利要求8所述载体、或权利要求9所述细胞。
12.权利要求1-5任一项所述的靶向DLL3抗原的嵌合抗原受体、或权利要求6所述核酸、或权利要求7所述表达盒、或权利要求8所述载体、或权利要求9所述细胞、或权利要求10所述药物组合物、或权利要求11所述试剂盒用于预防、治疗、检测或诊断与DLL3相关的疾病的应用;优选地,所述与DLL3相关的疾病是DLL3高表达疾病;更优选地,所述疾病是DLL3高表达癌症或肿瘤;更优选地,所述癌症或肿瘤选自肺癌、黑色素瘤、甲状腺髓样癌、胶质母细胞瘤、前列腺癌、神经内分泌癌中的一种或多种;最优选地,所述癌症是肺癌,特别是小细胞肺癌。
13.一种制备工程化免疫细胞的方法,其特征在于,包括以下步骤:
(1)提供一待改造的免疫细胞;和
(2)将权利要求6所述核酸、或权利要求7所述表达盒、或权利要求8所述载体导入到所述免疫细胞;
优选地,所述免疫细胞为T细胞;更优选地,所述T细胞为原代T细胞、γ-δT细胞或NK T细胞。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202210973673X | 2022-08-15 | ||
| CN202210973673 | 2022-08-15 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN116003628A true CN116003628A (zh) | 2023-04-25 |
Family
ID=86023673
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202211314320.5A Pending CN116003628A (zh) | 2022-08-15 | 2022-10-25 | 靶向人dll3抗原的全人源特异性嵌合抗原受体及其应用 |
| CN202310907882.9A Pending CN116731182A (zh) | 2022-08-15 | 2023-07-24 | 靶向dll3的抗体、抗原结合片段及其用途 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202310907882.9A Pending CN116731182A (zh) | 2022-08-15 | 2023-07-24 | 靶向dll3的抗体、抗原结合片段及其用途 |
Country Status (2)
| Country | Link |
|---|---|
| CN (2) | CN116003628A (zh) |
| WO (1) | WO2024037288A1 (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116813784A (zh) * | 2023-05-17 | 2023-09-29 | 星奕昂(上海)生物科技有限公司 | 靶向dll3的抗体及其应用 |
| CN116874599A (zh) * | 2023-07-11 | 2023-10-13 | 四川大学 | 靶向人dll3的嵌合抗原受体t细胞及其应用 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116789836B (zh) * | 2023-08-14 | 2024-01-05 | 浙江时迈药业有限公司 | 针对dll3的抗体及其用途 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112334193A (zh) * | 2018-04-10 | 2021-02-05 | 美国安进公司 | Dll3的嵌合受体及其使用方法 |
| CN113543799B (zh) * | 2019-03-01 | 2024-08-02 | 艾洛基治疗公司 | 靶向dll3的嵌合抗原受体和结合剂 |
| US20220348648A1 (en) * | 2019-07-11 | 2022-11-03 | Memorial Sloan Kettering Cancer Center | Dll3-targeting antibodies and uses thereof |
| CN114181311B (zh) * | 2021-12-20 | 2023-06-20 | 华东师范大学 | 一种全人源抗DLL3 scFv及其在CART细胞治疗中的应用 |
-
2022
- 2022-10-25 CN CN202211314320.5A patent/CN116003628A/zh active Pending
-
2023
- 2023-07-24 WO PCT/CN2023/108807 patent/WO2024037288A1/zh unknown
- 2023-07-24 CN CN202310907882.9A patent/CN116731182A/zh active Pending
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116813784A (zh) * | 2023-05-17 | 2023-09-29 | 星奕昂(上海)生物科技有限公司 | 靶向dll3的抗体及其应用 |
| CN116813784B (zh) * | 2023-05-17 | 2024-03-01 | 星奕昂(上海)生物科技有限公司 | 靶向dll3的抗体及其应用 |
| CN116874599A (zh) * | 2023-07-11 | 2023-10-13 | 四川大学 | 靶向人dll3的嵌合抗原受体t细胞及其应用 |
| CN116874599B (zh) * | 2023-07-11 | 2024-07-26 | 四川大学 | 靶向人dll3的嵌合抗原受体t细胞及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN116731182A (zh) | 2023-09-12 |
| WO2024037288A1 (zh) | 2024-02-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7402933B2 (ja) | 導入遺伝子の遺伝子タグおよびその使用方法 | |
| AU2020200751B2 (en) | Universal chimeric antigen receptor expressing immune cells for targeting of diverse multiple antigens and method of manufacturing the same and use of the same for treatment of cancer, infections and autoimmune disorders | |
| US11639387B2 (en) | Bispecific chimeric antigen receptors, encoding polynucleotides thereof and methods of use thereof to treat disease | |
| US20230256018A1 (en) | T cell receptors and engineered cells expressing same | |
| US11026975B2 (en) | Chimeric antigen receptor (CAR) binding to BCMA, and uses thereof | |
| US12042515B2 (en) | Killer cell capable of efficiently and stably expressing antibody, and uses thereof | |
| JP2023145589A (ja) | 共刺激のための新規のプラットフォーム、新規のcar設計、および養子細胞療法のための他の増強 | |
| US11090335B2 (en) | Chimeric antigen receptor targeting human NKG2DL and methods of preparing said receptor and pharmaceutical composition | |
| CN107903324B (zh) | 一种结合人cd19和cd3的双特异性抗体 | |
| EP2884999B1 (en) | Method and compositions for cellular immunotherapy | |
| CN108384760B (zh) | 携带cd20/cd19双特异性嵌合抗原受体的人t淋巴细胞及制备方法和应用 | |
| CN116003628A (zh) | 靶向人dll3抗原的全人源特异性嵌合抗原受体及其应用 | |
| CN110964121B (zh) | 一种分泌il-7、il-15因子的cd19-car-t细胞及其应用 | |
| AU2016341527A1 (en) | Methods, kits, agents and apparatuses for transduction | |
| WO2017219933A1 (zh) | 一种高效稳定表达抗体的t细胞及其用途 | |
| WO2023109257A1 (zh) | 人源化的bcma抗体和bcma-car-t/bcma-car-dnt细胞 | |
| CN111378046B (zh) | 一种免疫效应细胞转换受体 | |
| WO2022116952A1 (zh) | 靶向cd70的抗原结合蛋白及其应用 | |
| WO2021139755A1 (zh) | 工程改造的t细胞、其制备及应用 | |
| TW202144569A (zh) | 用於調節免疫細胞中精胺酸含量之方法及組合物 | |
| US20240366672A1 (en) | Chimeric antigen receptor and use thereof | |
| CN116284389A (zh) | 抗afp/hla02 tcr样抗体及其用途 | |
| CN114853893A (zh) | 一种靶向gpc3嵌合抗原受体t细胞及其应用 | |
| CN115397439A (zh) | 表达通用免疫受体的工程化细胞活性的定量控制 | |
| WO2023273762A1 (zh) | 介导细胞内有效滞留cd3的空间构象表位及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |