CN115698064A - 用于皮下施用的抗cd38抗体的配制品 - Google Patents
用于皮下施用的抗cd38抗体的配制品 Download PDFInfo
- Publication number
- CN115698064A CN115698064A CN202080094829.6A CN202080094829A CN115698064A CN 115698064 A CN115698064 A CN 115698064A CN 202080094829 A CN202080094829 A CN 202080094829A CN 115698064 A CN115698064 A CN 115698064A
- Authority
- CN
- China
- Prior art keywords
- formulation
- cdr
- antibody
- certain embodiments
- viscosity
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Rheumatology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Pain & Pain Management (AREA)
- Transplantation (AREA)
- Dermatology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
提供了适合于皮下施用给有需要的受试者的抗CD38抗体的配制品。所述配制品包括高浓度的抗体、降粘剂、稳定剂、缓冲剂和表面活性剂。在某些实施方案中,溶液的粘度最多为25mPa·s,且所述溶液的pH为5.9至7.0。在某些实施方案中,所述抗CD38抗体是伊沙妥昔单抗。所述配制品可用于治疗人类的包括多发性骨髓瘤在内的CD38+血液恶性肿瘤以及自身免疫疾病和炎性疾病。
Description
相关申请的交叉引用
本申请要求2019年12月5日提交的美国临时专利申请号62/944,082的权益,将其公开内容通过引用以其整体特此并入。
序列表
本申请含有序列表,所述序列表已经以电子方式以ASCII格式的提交并且通过引用以其整体特此并入。所述ASCII副本创建于2020年12月4日,名为“712533_SA9-295PC_ST25.txt”,并且大小为9,675字节。
技术领域
本公开文本涉及可用于治疗疾病的抗体的配制品。更具体地,它涉及抗CD38抗体的配制品,其适合于皮下施用以治疗癌症,包括多发性骨髓瘤,以及其中CD38+细胞起作用的其他疾病和病症。
背景技术
CD38是45kDa II型跨膜糖蛋白,具有长C末端胞外结构域和短N末端胞质结构域。所述CD38蛋白是双功能胞外酶,其可以催化NAD+转化为环状ADP-核糖(cADPR),也可以将cADPR水解为ADP-核糖。
CD38在许多血液恶性肿瘤和源自各种血液恶性肿瘤的细胞系中上调。此外,血液系统的大多数原始多能干细胞是CD38-。CD38在血液恶性肿瘤中的表达及其与慢性淋巴细胞白血病(CLL)疾病进展的相关性使CD38成为抗体疗法的诱人靶标。
还报道了CD38+细胞与多种其他疾病和病症(包括许多自身免疫疾病,诸如类风湿性关节炎和红斑狼疮以及脂多糖(LPS)或脓毒症诱导的急性肾损伤)相关(Shu B等人,CellSignal(2018)42:249-58)。
先前已经在例如国际专利申请WO 2006/099875中描述了特异性识别CD38的抗CD38抗体。但是,这些抗体在用作单一药剂并与表达CD38+的细胞一起孵育时无法诱导凋亡。
单克隆抗CD38抗体已在国际专利申请WO 2008/047242中描述。
这些特异性抗CD38抗体与细胞毒性剂(诸如阿糖胞苷、长春新碱、环磷酰胺和美法仑)的组合使用已在国际专利申请WO 2010/061357、WO2010/061358、WO 2010/061359和WO2010/061360中报道。
国际专利申请WO 2015/066450、WO 2012/076663和WO 2014/089416、WO 2014/159911也描述了人源化形式的38SB19(也称为SAR650984或伊沙妥昔单抗)的使用。伊沙妥昔单抗与泊马度胺和地塞米松的组合用于治疗复发/难治性多发性骨髓瘤患者的3期临床试验(NCT02990338)最近达到了其主要终点,延长了无进展生存期。
发明内容
本公开文本的一个方面涉及适合于皮下施用给受试者的抗CD38抗体的配制品。有利地,本文公开的配制品适合于通过注射或输注(包括大体积皮下输注)进行皮下施用。所述配制品可用于治疗以表达CD38的细胞为特征的疾病或病症。此类疾病和病症包括但不限于表达CD38的实体瘤(诸如前列腺癌)、各种血液恶性肿瘤(诸如非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM)、急性髓性白血病(AML)、急性成淋巴细胞性白血病(B细胞ALL)和/或慢性淋巴细胞白血病(CLL))。此类疾病和病症进一步包括但不限于自身免疫疾病(包括类风湿性关节炎和系统性红斑狼疮)以及脂多糖(LPS)或脓毒症诱导的急性肾损伤。
在某些实施方案中,本公开文本涉及抗CD38抗体的配制品,其包含高浓度的抗体,pH为5.9-7.0,且在20℃下的粘度最多为25mPa·s。
在某些实施方案中,本公开文本涉及包含至少100mg/mL的抗CD38抗体、降粘剂、稳定剂、缓冲剂和表面活性剂的配制品,其中所述配制品的pH为5.9-7.0,且在20℃下的粘度最多为25mPa·s。
本公开文本的一个方面涉及包含至少100mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR2-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含降粘剂、稳定剂、缓冲剂和表面活性剂,且
所述配制品的pH为5.9-7.0,且在20℃下的粘度最多为25mPa·s。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl。
在某些实施方案中,所述降粘剂是110mM Arg-Cl。
在某些实施方案中,所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述缓冲剂是组氨酸。
在某些实施方案中,所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac。
在某些实施方案中,所述降粘剂是125mM Lys-Ac。
在某些实施方案中,所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体。
在某些实施方案中,所述稳定剂是蔗糖。
在某些实施方案中,所述稳定剂是2%(w/v)的蔗糖。
在某些实施方案中,pH为5.9-7.0。
在某些实施方案中,pH为5.9-6.5。
本公开文本的一个方面涉及包含140mg/mL的抗CD38抗体的配制品,其中所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且其中
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s。
本公开文本的一个方面涉及包含140mg/mL的抗CD38抗体的配制品,其中所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含125mM Lys-Ac、2%(w/v)的蔗糖以及0.04%(w/v)的聚山梨醇酯80,且
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s。
在某些实施方案中,所述配制品适合于通过注射或输注(包括大体积皮下输注)进行皮下施用。
在某些实施方案中,所述抗CD38抗体的VH包含SEQ ID NO:7中列出的氨基酸序列,且所述抗CD38抗体的VL包含SEQ ID NO:8中列出的氨基酸序列。
在某些实施方案中,所述抗CD38抗体是伊沙妥昔单抗。
本公开文本的一个方面涉及一种经包装的药物产品,其包含无菌容器,所述无菌容器包含治疗有效量的本公开文本的配制品。
本公开文本的一个方面涉及一种装置,所述装置包含治疗有效量的本公开文本的配制品。
在某些实施方案中,所述装置可以是例如注射器、注射器驱动器和包含所述配制品的输液泵。
在某些实施方案中,所述注射器是预填充式注射器。
本公开本文的一个方面是一种治疗以CD38+细胞的存在或活性为特征的疾病或病症的方法,其包括向有需要的受试者施用有效量的本公开文本的配制品,其中所述配制品是皮下施用的。
在某些实施方案中,所述以CD38+细胞的存在或活性为特征的疾病或病症是CD38+血液恶性肿瘤。
在某些实施方案中,所述以CD38+细胞的存在或活性为特征的疾病或病症是自身免疫或炎性疾病或病症。
本公开本文的一个方面是一种治疗CD38+血液恶性肿瘤的方法,其包括向有需要的受试者施用有效量的本公开文本的配制品,其中所述配制品是皮下施用的。
本公开文本的一个方面是一种治疗CD38+血液恶性肿瘤的方法,其包括向有需要的受试者施用有效量的包含至少100mg/mL的抗CD38抗体的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含降粘剂、稳定剂、缓冲剂和表面活性剂,且
所述配制品的pH为5.5-7.0,且在20℃下的粘度最多为25mPa·s,其中所述配制品是皮下施用的。
本公开文本的一个方面是一种治疗CD38+血液恶性肿瘤的方法,其包括向有需要的受试者施用有效量的包含140mg/mL的抗CD38抗体的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且其中
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s,其中所述配制品是皮下施用的。
在某些实施方案中,所述方法包括向所述有需要的受试者施用有效量的包含140mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且其中
所述配制品的pH为6.3,且在20℃下的粘度最多为14mPa·s,其中所述配制品是皮下施用的。
在某些实施方案中,通过皮下输注施用所述配制品。
在某些实施方案中,通过皮下输注施用所述配制品。
在某些实施方案中,所述皮下输注是大体积皮下输注,例如,>2mL至30mL。
在某些实施方案中,所述治疗CD38+血液恶性肿瘤的方法进一步包括向所述受试者施用一种或多种适合于治疗C38+血液癌症的其他药剂。在一些实施方案中,所述其他试剂是例如皮质类固醇(例如,地塞米松)、化疗药物、蛋白酶体抑制剂、免疫调节药物或其组合。
在某些实施方案中,所述化疗药物是例如阿糖胞苷、柔红霉素、道诺霉素、多柔比星、脂质体多柔比星、伊达比星、米托蒽醌、吉妥珠单抗、氯法拉滨、克拉屈滨、羟基脲、依托泊苷、安吖啶、FLT5抑制剂(诸如吉列替尼)、5-氮杂胞苷、地西他滨、美法仑、环磷酰胺或长春新碱或其组合。
在某些实施方案中,所述免疫调节药物是例如沙利度胺、来那度胺或泊马度胺或其组合。
在某些实施方案中,所述蛋白酶体抑制剂是例如艾沙佐米、卡非佐米或硼替佐米或其组合。
在某些实施方案中,所述治疗CD38+血液恶性肿瘤的方法包括向所述受试者施用如本文所定义用于皮下施用的配制的伊沙妥昔单抗,以及来自不同类别化合物的两种或更多种其他药剂(诸如例如免疫调节药物或蛋白酶体抑制剂)。
在某些实施方案中,所述CD38+血液恶性肿瘤是多发性骨髓瘤。
在某些实施方案中,所述多发性骨髓瘤是复发/难治性多发性骨髓瘤。在一些实施方案中,所述患者已经接受了包括来那度胺和蛋白酶体抑制剂的用于多发性骨髓瘤的至少两种先前的疗法,并且在进行最后的疗法时或在最后的疗法完成后已经展现出疾病进展。
附图说明
图1是一系列图,其描绘了在所示缓冲系统中,伊沙妥昔单抗的热应力(上图)和振动应力(下图)后,≥10μm和≥25μm的亚可见颗粒的数量。2w 40℃,在40℃下两周;4w 40℃,在40℃下4周;Cit,柠檬酸盐缓冲液;His,组氨酸缓冲液;Pho,磷酸盐缓冲液;Ace,乙酸盐缓冲液。
图2是描绘在40℃热应力下可溶性聚集体(使用尺寸排阻色谱(SE-HPLC)测量的高分子量聚集体(HMW))的百分比的图。2w 40℃,在40℃下两周;4w 40℃,在40℃下4周;Cit,柠檬酸盐缓冲液;His,组氨酸缓冲液;Pho,磷酸盐缓冲液;Ace,乙酸盐缓冲液。
图3是描绘在具有所示pH和浓度值的组氨酸缓冲液中在40℃热应力下使用尺寸排阻色谱(SE-HPLC)测量的可溶性聚集体(高分子量聚集体(HMW))的百分比的图。1M 40℃,在40℃下一个月。
图4是描绘在具有所示pH和浓度值的组氨酸缓冲液中在40℃振动应力下使用弱阳离子交换分析测量的伊沙妥昔单抗的酸性形式的百分比的图。1M40℃,在40℃下一个月。
图5是描绘在所示浓度的精氨酸-Cl pH 6.0中200mg/mL的伊沙妥昔单抗的粘度的图。
图6A是描绘在一定浓度范围的精氨酸-HCl缓冲液(pH 6.3)下150mg/mL的伊沙妥昔单抗的粘度的图。插图显示了在更高浓度的精氨酸-HCl下的细节。
图6B是描绘在一定浓度范围的精氨酸-HCl缓冲液(pH 6.3)下180mg/mL的伊沙妥昔单抗的粘度的图。插图显示了在更高浓度的精氨酸-HCl下的细节。
图7A是描绘在150mM精氨酸-HCl缓冲液中一定pH范围下150mg/mL的伊沙妥昔单抗的粘度的图。
图7B是描绘在200mM精氨酸-HCl缓冲液中一定pH范围下150mg/mL的伊沙妥昔单抗的粘度的图。
图8是描绘在pH 5.5、5.9、6.2和7.0(T=20℃)下随mAb浓度变化绘制的粘度的图。拟合:基于Mooney的方程式。
图9是描绘在126、140、147和154g/L的mAb浓度下(T=20℃)随pH变化绘制的粘度的图。
图10是描绘在126、143和154g/L的mAb浓度下(pH=6.2)随温度变化绘制的粘度的图。
图11是描绘在142和152g/L的mAb浓度下(pH=5.9)随温度变化绘制的粘度的图。
图12是描绘在140g/L的mAb浓度下(pH=6.2,T=20℃)随精氨酸浓度变化绘制的粘度的图。
图13是描绘在配制品F4-1至F4-16中使用伊沙妥昔单抗的HP-SEC分析检测的相对单体含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-mech:机械应力,T-5xFT:5个冻/融循环,T-1m_40℃:在40℃下1个月。
图14是描绘在配制品F10-1至F10-16中使用伊沙妥昔单抗的HP-SEC分析检测的相对单体含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-mech:机械应力,T-5xFT:5个冻/融循环,T-1m_40℃:在40℃下1个月。
图15是描绘在配制品F4-1至F4-16中使用伊沙妥昔单抗的HP-SEC分析检测的所有聚集体(HMWS)的相对含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-mech:机械应力,T-5xFT:5个冻/融循环,T-1m_40℃:在40℃下1个月。
图16是描绘在配制品F10-1至F10-16中使用伊沙妥昔单抗的HP-SEC分析检测的所有聚集体(HMWS)的相对含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-mech:机械应力,T-5xFT:5个冻/融循环,T-1m_40℃:在40℃下1个月。
图17是描绘在配制品F4-1至F4-16中使用伊沙妥昔单抗的HP-SEC分析检测的所有片段(LMWS)的相对含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-mech:机械应力,T-5xFT:5个冻/融循环,T-1m_40℃:在40℃下1个月。
图18是描绘在配制品F10-1至F10-16中使用伊沙妥昔单抗的HP-SEC分析检测的所有片段(LMWS)的相对含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-mech:机械应力,T-5xFT:5个冻/融循环,T-1m_40℃:在40℃下1个月。
图19是描绘对伊沙妥昔单抗配制品F4-1至F4-16进行的毛细管等电聚焦(cIEF)分析获得的酸性峰含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-1m_40℃:在40℃下1个月。
图20是描绘对在配制品F10-1至F10-16中的伊沙妥昔单抗进行的cIEF分析获得的酸性峰含量的图(分别为运行1至运行16,n=2,均值);T0:无处理,T-1m_40℃:在40℃下1个月。
图21是描绘在40℃/75%r.h.下储存一个月之后,对在配制品F4-1至F4-16和F10-1至F10-16中的伊妥昔单抗进行的cIEF分析获得的单体峰含量的相对面积[%]的损失的图(分别为运行1至运行16,n=2,均值)。
图22是描绘如实施例5中所述的皮下输注伊妥昔单抗或NaCl对照的所示配制品的小型猪的血浆皮质醇的图。
图23是描绘如实施例5中所述的皮下输注伊妥昔单抗或NaCl对照的所示配制品的小型猪的血浆物质P的图。
图24是描绘如实施例6中所述的组I中的个体小型猪1至5中伊妥昔单抗的血清浓度随时间变化的图。
图25是描绘如实施例6中所述的组II中的个体小型猪6至10中伊妥昔单抗的血清浓度随时间变化的图。
图26是描绘如实施例6中所述的组III中的个体小型猪11至15中伊妥昔单抗的血清浓度随时间变化的图。
图27是描绘如实施例6中所述的组IV中的个体小型猪16至20中伊妥昔单抗的血清浓度随时间变化的图。
具体实施方式
本文提供了适合于皮下施用给受试者的抗CD38抗体的配制品。有利地,本文公开的配制品适合于通过注射或通过输注(包括大体积皮下输注)进行皮下施用。所述配制品可用于治疗以表达CD38的细胞为特征的疾病或病症。此类疾病和病症包括但不限于各种血液恶性肿瘤,诸如非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM)、急性髓性白血病(AML)、急性成淋巴细胞性白血病(B细胞ALL)和/或慢性淋巴细胞白血病(CLL)。此类疾病和病症进一步包括但不限于自身免疫疾病(包括类风湿性关节炎和系统性红斑狼疮)以及脂多糖(LPS)或脓毒症诱导的急性肾损伤。在某些实施方案中,本文提供的配制品包含高浓度的抗体,pH为5.5-7.0,且在20℃下的粘度最多为25mPa·s。在本文提供的一些实施方案中,所述配制品是水性配制品。
“血液恶性肿瘤”是影响血液、骨髓和淋巴结的癌症类型。由于三者通过免疫系统紧密相连,因此影响三者之一的疾病也可能影响其他者。血液恶性肿瘤包括非霍奇金淋巴瘤(NHL)(包括例如伯基特淋巴瘤(BL)和T细胞淋巴瘤(TCL))、多发性骨髓瘤(MM)、慢性淋巴细胞白血病(CLL)(诸如例如B细胞慢性淋巴细胞白血病(B-CLL)和毛细胞白血病(HCL))、B和T细胞急性淋巴细胞白血病(ALL)、急性髓性白血病(AML)、霍奇金淋巴瘤(HL)和慢性髓性白血病(CML)。在一些实施方案中,所述血液恶性肿瘤是CD38+血液恶性肿瘤。
因此,“CD38+血液恶性肿瘤”是如上所述的血液恶性肿瘤,其中癌细胞表达CD38。据报道,CD38+细胞也参与许多自身免疫疾病和障碍以及炎性疾病和障碍(包括类风湿性关节炎和系统性红斑狼疮)以及其他病症(包括LPS或脓毒症诱导的急性肾损伤)。
CD38+血液恶性肿瘤包括B细胞非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM)、急性髓性白血病(AML)、急性成淋巴细胞性白血病(B细胞ALL)和/或慢性淋巴细胞白血病(CLL)。在一些实施方案中,所述CD38+血液恶性肿瘤是MM。在一些实施方案中,所述CD38+血液恶性肿瘤是复发和/或难治性多发性骨髓瘤。
“抗体”可以是天然的或常规的抗体,其中两个重链通过二硫键彼此连接并且每个重链通过二硫键与轻链连接。有两种类型的轻链,λ(λ)和κ(κ)。有五种主要的重链类别(或同种型):IgM、IgG、IgA、IgD和IgE,它们决定了抗体分子的功能活性。另外,免疫球蛋白亚类(或亚同种型)(例如IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)充分表征并且已知它们赋予功能特化。每条链含有不同的序列结构域。所述轻链包括两个结构域或区域,可变结构域(VL)和恒定结构域(CL)。所述重链包括四个结构域,一个可变结构域(VH)和三个恒定结构域(CH1、CH2和CH3,统称为CH)。轻链(VL)和重链(VH)的可变区决定了对抗原的结合识别和特异性。所述轻链(CL)和重链(CH)的恒定区结构域具有重要的生物学特性,诸如抗体链缔合、分泌、经胎盘移动性、补体结合以及与Fc受体(FcR)的结合。Fv片段是免疫球蛋白的Fab片段的N末端部分,其包括一条轻链和一条重链的可变部分。抗体的特异性在于抗体结合位点和抗原决定簇之间的结构互补性。抗体结合位点由主要来自高变或互补决定区(CDR)的残基组成。有时,来自非高变区或框架区(FR)的残基会影响整体结构域结构,进而影响结合位点。
“互补决定区”或“CDR”是指一起限定天然免疫球蛋白结合位点的天然Fv区的结合特异性和亲和力的氨基酸序列。免疫球蛋白的轻链和重链分别具有三个CDR,分别称为CDR-L1、CDR-L2、CDR-L3和CDR-H1、CDR-H2、CDR-H3。因此,常规的抗体抗原结合位点包括六个CDR,其包含来自重链和轻链V区中的每一个的CDR组。
基于Kabat定义(worlwideweb.bioinf.org.uk/abs/),给出了有关免疫球蛋白轻链或重链的CDR/FR定义。
抗体也可以是非天然存在的抗体,例如单克隆抗体、嵌合抗体或人源化抗体。如本文所用,术语“单克隆抗体”或“mAb”是指针对特定抗原的单一氨基酸组合物的抗体分子,并且不应解释为要求通过任何特定方法来产生抗体。单克隆抗体可以由B细胞的单个克隆或杂交瘤产生,但是也可以是重组的,即通过蛋白工程产生。
术语“人源化抗体”是指最初完全或部分非人类来源的抗体,且已被修饰以替代某些氨基酸,例如在重链和轻链的框架区中,以避免或最小化人类的免疫反应。人源化抗体的恒定结构域可以是例如人类CH和CL结构域。在一个实施方案中,人源化抗体具有人源恒定结构域。
在一些实施方案中,根据本公开文本的抗CD38抗体包含重链,所述重链包含含有如SEQ ID NO:1列出的氨基酸序列的CDR-H1、含有氨基酸序列SEQ ID NO:2的CDR-H2以及含有氨基酸序列SEQ ID NO:3的CDR-H3;以及轻链,所述轻链包含含有如SEQ ID NO:4列出的氨基酸序列的CDR-L1、含有如SEQ ID NO:5列出的氨基酸序列的CDR-L2以及含有如SEQ IDNO:6列出的氨基酸序列的CDR-L3。
CDR-H1 DYWMQ (SEQ ID NO:1)
CDR-H2 TIYPGDGDTGYAQKFQG (SEQ ID NO:2)
CDR-H3 GDYYGSNSLDY (SEQ ID NO:3)
CDR-L1 KASQDVSTVVA (SEQ ID NO:4)
CDR-L2 SASYRYI (SEQ ID NO:5)
CDR-L3 QQHYSPPYT (SEQ ID NO:6)
在一些实施方案中,所述抗体包含重链可变结构域(VH),其包含如SEQ ID NO:7列出的氨基酸序列。
在一些实施方案中,所述抗体包含轻链可变结构域(VL),其包含如SEQ ID NO:8列出的氨基酸序列。
在一些实施方案中,所述抗体包含重链可变结构域(VH),其含有如SEQ ID NO:7列出的氨基酸序列;和轻链可变结构域(VL),其含有如SEQ ID NO:8列出的氨基酸序列。
QVQLVQSGAEVAKPGTSVKLSCKASGYTFTDYWMQWVKQRPGQGLEWIGTIYPGDGDTGYAQKFQGKATLTADKSSKTVYMHLSSLASEDSAVYYCARGDYYGSNSLDYWGQGTSVTVSS
(SEQ ID NO:7)
DIVMTQSHLSMSTSLGDPVSITCKASQDVSTVVAWYQQKPGQSPRRLIYSASYRYIGVPDRFTGSGAGTDFTFTISSVQAEDLAVYYCQQHYSPPYTFGGGTKLEIKR
(SEQ ID NO:8)
在一些实施方案中,根据本公开文本的抗CD38抗体是伊沙妥昔单抗。伊沙妥昔单抗的重链(HC)包含如SEQ ID NO:9列出的氨基酸序列,且依沙妥昔单抗的轻链(LC)包含如SEQ ID NO:10列出的氨基酸序列。
QVQLVQSGAEVAKPGTSVKLSCKASGYTFTDYWMQWVKQRPGQGLEWIGTIYPGDGDTGYAQKFQGKATLTADKSSKTVYMHLSSLASEDSAVYYCARGDYYGSNSLDYWGQGTSVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
(SEQ ID NO:9)
DIVMTQSHLSMSTSLGDPVSITCKASQDVSTVVAWYQQKPGQSPRRLIYSASYRYIGVPDRFTGSGAGTDFTFTISSVQAEDLAVYYCQQHYSPPYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
(SEQ ID NO:10)
在一些实施方案中,所述抗体用于治疗CD38+血液恶性肿瘤,诸如多发性骨髓瘤(MM)(包括复发和/或难治性MM),或已接受一种或多种MM先前疗法的患有MM的患者。
在本公开文本的上下文中,本文所用的术语“治疗(treating或treatment)”意指逆转、减轻、抑制所述术语所适用的障碍或病症或者所述障碍或病症的一种或多种症状的进展,或预防所述术语所适用的障碍或病症或者所述障碍或病症的一种或多种症状。在某些实施方案中,本文所用的术语“治疗(treating或treatment)”意指逆转、减轻、抑制所述术语所适用的障碍或病症或者所述障碍或病症的一种或多种症状的进展。
如本文所用的术语“治疗CD38+血液恶性肿瘤”意指抑制肿瘤的CD38+恶性细胞的生长和/或从所述CD38+肿瘤转移的进展。这样的治疗还可以导致肿瘤生长的消退,即,可测量肿瘤的尺寸减小。
在本公开文本的上下文中,抗体的“治疗有效量”意指足以治疗本文所述的CD38+血液恶性肿瘤的足量抗体。
在某些实施方案中,皮下施用至受试者的抗体的所述治疗有效量为每剂500mg至2000mg的抗体的剂量。
在某些实施方案中,所述施用至受试者的抗体的治疗有效量为每剂1000mg的抗体。在某些实施方案中,所述施用至受试者的抗体的治疗有效量为每剂1400mg的抗体。在某些实施方案中,所述施用至受试者的抗体的治疗有效量为每剂1600mg的抗体。
如本文所用,术语“受试者”是指哺乳动物。在某些实施方案中,术语“受试者”是指人类。
本公开文本的抗体可以每周一次(QW)、每两周一次(Q2W)施用或每周一次和两周一次组合施用。在一些实施方案中,将所述抗体每四周施用一次。
例如,可以将所述抗体以每周一次从500mg至1400mg的剂量施用给受试者,持续四周(周期1),随后每两周一次(例如,在每个后续周周期的第1天和第15天)。
在一些实施方案中,每周一次向受试者施用1000mg抗体,持续四周(周期1),然后在每个后续四周周期的第1天和第15天向受试者施用1000mg抗体。
在一些实施方案中,每两周一次将1000mg的抗体施用给所述受试者。
在一些实施方案中,每周一次向受试者施用1400mg抗体,持续四周(周期1),然后在每个后续四周周期的第1天和第15天施用1400mg抗体。
在一些实施方案中,每两周一次将1400mg的抗体施用给所述受试者。在一些实施方案中,可以根据间断程序来施用抗体,每次施用之间的间隔为1周或2周,取决于对先前施用的耐受性,所述间隔可以延长1至2周。
如本文所用的“周期”是指4个日历周,即28天。施用“每周一次”意指每7天一次。施用“两周一次”意指每14天一次。施用每周期一次或每四周一次意指每28天一次。
在一些实施方案中,抗体施用的周期数可以是2至50,诸如2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、45、50个周期。
本发明的配制品
本公开文本提供了抗CD38抗体的某些配制品。在一些实施方案中,所述配制品是液体配制品。在某些实施方案中,此类配制品(抗体配制品)适合于施用至需要用所述抗CD38抗体治疗的受试者。
有利地,本公开文本的抗体配制品可以通过注射或通过输注(包括大体积皮下输注)皮下施用给受试者。
在某些实施方案中,本公开文本涉及抗CD38抗体的配制品,其包含高浓度的抗体,pH为5.5-7.0,且在20℃下的粘度最多为25mPa·s。
在某些实施方案中,本公开文本涉及包含至少100mg/mL的抗CD38抗体、降粘剂、稳定剂、缓冲剂和表面活性剂的配制品,其中所述配制品的pH为5.5-7.0,且在20℃下的粘度最多为25mPa·s。
在一些实施方案中,提供了包含至少100mg/mL的抗CD38抗体的抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含降粘剂、稳定剂、缓冲剂和表面活性剂,且
所述配制品的pH为5.5-7.0,且在20℃下的粘度最多为25mPa·s。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl。
在某些实施方案中,所述降粘剂是90-130mM Arg-Cl。
在某些实施方案中,所述降粘剂是110mM Arg-Cl。
在某些实施方案中,所述稳定剂是蔗糖。
在某些实施方案中,所述水性配制品包含125-155mg/mL的抗CD38抗体、90-150mMArg-Cl、和蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Arg-Cl、和蔗糖。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-130mM Arg-Cl、和蔗糖。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体,110mM Arg-Cl、和蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-130mM Arg-Cl、和蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、110mM Arg-Cl、和蔗糖。
在某些实施方案中,所述配制品包含2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Arg-Cl和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-130mM Arg-Cl、和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、110mM Arg-Cl、和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含表面活性剂。
在某些实施方案中,所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是蔗糖,且所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、和泊洛沙姆188。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、和泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-130mM Arg-Cl,所述稳定剂是蔗糖,且所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是蔗糖,且所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、和泊洛沙姆188。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、和泊洛沙姆188。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、和泊洛沙姆188。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、和泊洛沙姆188。
在某些实施方案中,所述配制品包含0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是蔗糖,且所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、和0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、和0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是蔗糖,且所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是蔗糖,且所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、和0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、和0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、和0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、和0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述配制品包含缓冲剂。
在某些实施方案中,所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是0.4%(w/v)的泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和组氨酸。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和组氨酸。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是0.4%(w/v)的泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是0.4%(w/v)的泊洛沙姆188,且所述缓冲剂是组氨酸。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和组氨酸。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和组氨酸。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和组氨酸。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和组氨酸。
在某些实施方案中,所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是0.4%(w/v)的泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和9mM组氨酸。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-150mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和9mM组氨酸。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-125mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是0.4%(w/v)的泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是110mM Arg-Cl,所述稳定剂是2%(w/v)的蔗糖,所述表面活性剂是0.4%(w/v)的泊洛沙姆188,且所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和9mM组氨酸。
在某些实施方案中,所述溶液包含125-155mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和9mM组氨酸。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、90-125mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和9mM组氨酸。
在某些实施方案中,所述溶液包含140mg/mL的抗CD38抗体、110mM Arg-Cl、2%(w/v)的蔗糖、0.4%(w/v)的泊洛沙姆188、和9mM组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac。
在某些实施方案中,所述降粘剂是125mM Lys-Ac。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Lys-Ac、和蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Lys-Ac、和蔗糖。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、125mM Lys-Ac、和蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、125mM Lys-Ac、和蔗糖。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Lys-Ac和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Lys-Ac和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、125mM Lys-Ac和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、125mM Lys-Ac和2%(w/v)的蔗糖。
在某些实施方案中,所述配制品包含表面活性剂。
在某些实施方案中,所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac,所述稳定剂是蔗糖,且所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Lys-Ac、蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Lys-Ac、蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Lys-Ac、2%(w/v)的蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Lys-Ac、2%(w/v)的蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述降粘剂是125mM Lys-Ac,所述稳定剂是蔗糖,且所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、125mM Lys-Ac、蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、125mM Lys-Ac、蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述降粘剂是125mM Lys-Ac,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、125mM Lys-Ac、2%(w/v)的蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、125mM Lys-Ac、2%(w/v)的蔗糖、和聚山梨醇酯80。
在某些实施方案中,所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac,所述稳定剂是蔗糖,且所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Lys-Ac、蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Lys-Ac、蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、90-150mM Lys-Ac、2%(w/v)的蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、90-150mM Lys-Ac、2%(w/v)的蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述降粘剂是125mM Lys-Ac,所述稳定剂是蔗糖,且所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、125mM Lys-Ac、蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、125mM Lys-Ac、蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述降粘剂是125mM Lys-Ac,所述稳定剂是2%(w/v)的蔗糖,且所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体、125mM Lys-Ac、2%(w/v)的蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体、125mM Lys-Ac、2%(w/v)的蔗糖和0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品的pH为5.9-7.0。
在某些实施方案中,所述配制品的pH为5.9-6.5。
在某些实施方案中,所述配制品的pH为6.2。
在一些实施方案中,所述配制品包含140mg/mL的抗CD38抗体,其中所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且其中
所述配制品的pH为6.2-6.3,且在20℃下的粘度最多为14mPa·s。
本公开文本的一个方面涉及包含140mg/mL的抗CD38抗体的配制品,其中所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含125mM Lys-Ac、2%(w/v)的蔗糖以及0.04(w/v)的聚山梨醇酯80,且
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s。
根据每个前述方面和实施方案,在某些实施方案中,抗CD38抗体的VH包含SEQ IDNO:7中列出的氨基酸序列。
根据每个前述方面和实施方案,在某些实施方案中,抗CD38抗体的VL包含SEQ IDNO:8中列出的氨基酸序列。
根据每个前述方面和实施方案,在某些实施方案中,所述抗CD38抗体的VH包含SEQID NO:7中列出的氨基酸序列,且所述抗CD38抗体的VL包含SEQ ID NO:8中列出的氨基酸序列。
根据每个前述方面和实施方案,在某些实施方案中,所述抗CD38抗体是伊沙妥昔单抗。
根据每个前述方面和实施方案,所述配制品进一步包含水,例如注射用水(WFI),其量足以实现其他成分的指定浓度。
根据每个前述方面和实施方案,在某些实施方案中,所述配制品适合于皮下施用。例如,所述配制品可以是无菌的。在某些实施方案中,可以将配制品的组分合并以形成溶液,然后可以将溶液无菌过滤以提供无菌配制品。
在某些实施方案中,完成的配制品基本上不含溶解氧。例如,可以用氮气平衡配制品,然后在氮气气氛下密封。
仍进一步根据每个前述方面和实施方案,在某些实施方案中,所述配制品可以进一步包含至少一种用于改善稳定性的另外的赋形剂或组分,例如防腐剂。
经包装的药物产品
本公开文本的一个方面涉及一种经包装的药物产品,其包含无菌容器,所述无菌容器包含单一剂量的本公开文本的配制品。合适的无菌容器包括但不限于小瓶、安瓿瓶、瓶子、袋子、小袋、预填充式注射器、注射器驱动器、输液泵、以及适合与注射器驱动器和/或输液泵一起使用的容器。合适的容器包括一次性容器和多次使用容器。在某些实施方案中,容器是一次性容器,例如含有对应于单剂量的量的抗体的小瓶。
如本文所使用的注射器驱动器是指构造或布置成接合注射器的柱塞并轴向向前和/或向后驱动它以使注射器的内容物以期望的速率递送的机械或气动装置。注射器驱动器在本领域中是已知的,并且包括,例如但不限于,美国专利号5,064,413;5,449,345;5,954,695;6,428,509;6,645,177;7,195,610;8,231,576和8,814,830中公开的装置,其全部内容通过引用并入本文。
输液泵在本领域中是众所周知的,并且包括,例如,Baxter Colleague CXE定量输液泵和Cané Crono泵。
本公开文本的一个方面涉及一种装置,所述装置包含治疗有效量的本公开文本的配制品。在某些实施方案中,所述装置可以是例如注射器、注射器驱动器和包含所述配制品的输液泵。在某些实施方案中,所述注射器是预填充式注射器。
在一些实施方案中,本公开文本的抗体配制品以固定体积形式提供。这样的配制品可以存在于例如小瓶或安瓿瓶中或作为小瓶或安瓿瓶存在。例如,在一些实施方案中,以约10mL至约20mL的体积提供本公开文本的抗体配制品。在一些实施方案中,以约10mL至约15mL的体积提供本公开文本的抗体配制品。在一些实施方案中,以约10mL至约12.5mL的体积提供本公开文本的抗体配制品。例如,在包含140mg/mL的抗体的配制品的一个实施方案中,含有10mL这样的配制品的小瓶含有1400mg抗体。
治疗方法
本公开文本的配制品可以用在治疗以CD38+细胞的存在或活性为特征的疾病或病症的方法中。这样的疾病或病症可以包括但不限于CD38+血液恶性肿瘤、自身免疫疾病或病症、炎性疾病或病症以及LPS或脓毒症诱导的肾损伤或功能不全。所述方法通常需要向有需要的受试者施用有效量的本文提供的配制抗体,其中所述施用是通过皮下注射或输注,任选地通过大体积(例如,10mL或更多)皮下输注。在某些实施方案中,所述受试者是人。
本公开文本的一个方面是在有需要的人类受试者中治疗CD38+血液恶性肿瘤的方法,所述方法包括向所述人类受试者施用有效量的包含至少100mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含降粘剂、稳定剂、缓冲剂和表面活性剂,且
所述配制品的pH为5.7-7.0,且在20℃下的粘度最多为25mPa·s,且其中施用是皮下施用。
在某些实施方案中,所述降粘剂是90-150mM Arg-Cl。
在某些实施方案中,所述降粘剂是90-130mM Arg-Cl。
在某些实施方案中,所述降粘剂是110mM Arg-Cl。
在某些实施方案中,所述表面活性剂是泊洛沙姆188。
在某些实施方案中,所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
在某些实施方案中,所述缓冲剂是组氨酸。
在某些实施方案中,所述缓冲剂是9mM组氨酸。
在某些实施方案中,所述降粘剂是90-150mM Lys-Ac。
在某些实施方案中,所述降粘剂是125mM Lys-Ac。
在某些实施方案中,所述表面活性剂是聚山梨醇酯80。
在某些实施方案中,所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
在某些实施方案中,所述配制品包含125-155mg/mL的抗CD38抗体。
在某些实施方案中,所述配制品包含140mg/mL的抗CD38抗体。
在某些实施方案中,所述稳定剂是蔗糖。
在某些实施方案中,所述稳定剂是2%(w/v)的蔗糖。
在某些实施方案中,所述配制品的pH为5.9-7.0。
在某些实施方案中,所述配制品的pH为5.9-6.5
在某些实施方案中,所述配制品的pH为6.2。
在某些实施方案中,所述配制品的pH为6.3。
本公开文本的一个方面是在有需要的人类受试者中治疗CD38+血液恶性肿瘤的方法,所述方法包括向所述人类受试者施用有效量的包含140mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s,且
其中所述施用是皮下施用。
本公开文本的一个方面是在有需要的人类受试者中治疗CD38+血液恶性肿瘤的方法,所述方法包括向所述人类受试者施用有效量的包含140mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含125mM Lys-Ac、2%(w/v)的蔗糖以及0.04%(w/v)的聚山梨醇酯80,且
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s,且
其中所述施用是皮下施用。
在根据上述每种方法的某些实施方案中,所述皮下施用包括一次或多次皮下注射。
在根据上述每种方法的某些实施方案中,所述皮下施用包括一次或多次皮下输注。
在根据上述每种方法的某些实施方案中,所述皮下施用包括一次或多次大体积皮下输注。如本文所用,“大体积输注”是指大于或等于5mL的输注体积。在某些实施方案中,“大体积输注”是指约5-10mL、约10-15mL、约15-20mL、约20-25mL或约25-30mL的输注体积。在一个实施方案中,“大体积输注”是指约5-10mL的输注体积。在一个实施方案中,“大体积输注”是指约10-15mL的输注体积。在一个实施方案中,“大体积输注”是指约15-20mL的输注体积。在一个实施方案中,“大体积输注”是指约20-25mL的输注体积。在一个实施方案中,“大体积输注”是指约25-30mL的输注体积。
令人惊讶地,发现大体积输注本文提供的组合物可有效实现全身递送治疗有效量的抗CD38抗体(诸如伊沙妥昔单抗),以治疗以CD38+细胞的存在和/或活性为特征的疾病或病症,包括人类CD38+血液恶性肿瘤。令人惊讶地,当在不存在诸如透明质酸酶等的分散剂的情况下对小型猪皮下施用时,本文提供的抗体配制品展现至少89%的生物利用度。因此,本文提供了不包含生物分散剂的配制品。
如实施例6中所公开,在30分钟的时间内以1800mg/动物将伊沙妥昔单抗单次静脉内(IV)输注给小型猪之后,在整个672小时的剂量后采样期间(AUC最后)的平均AUC为364,000hr*μg/mL。在以0.5、1或2mL/min的流速以1806mg/动物将伊沙妥昔单抗单次皮下(SC)输注给小型猪之后,在整个672小时的剂量后采样期间(AUC最后)的平均AUC分别为326,000、565,000和369,000hr*μg/mL。此外,当以0.5至2mL/min的流速通过SC输注以1806mg/动物(140mg/mL的溶液)的剂量给予时,小型猪中伊沙妥昔单抗的绝对SC生物利用度至少为89%。
如本文所用,“受试者”和/或“有需要的受试者”是患有CD38+血液恶性肿瘤或被怀疑患有CD38+血液恶性肿瘤的个体。如本文所用,“受试者”也可以指患者。
根据本公开文本的受试者可以是男性或女性。
在一些实施方案中,所述受试者先前已经用一种或多种适合于治疗表达CD38的血液恶性肿瘤的药剂或疗法进行了治疗。先前的抗癌疗法可以是例如皮质类固醇(例如,地塞米松)、化疗药物、蛋白酶体抑制剂、免疫调节药物、放射疗法、骨髓和/或干细胞移植以及免疫疗法。
“化疗药物”是例如用于治疗血液恶性肿瘤的细胞毒性剂,包括但不限于阿糖胞苷(胞嘧啶阿拉伯糖苷或ara-C)和蒽环类药物(诸如柔红霉素和/或道诺霉素、多柔比星和脂质体多柔比星、伊达比星和米托蒽醌)、吉妥珠单抗、氯法拉滨、克拉屈滨、羟基脲、依托泊苷、安吖啶、FLT3抑制剂和脱甲基剂(5-氮杂胞苷和地西他滨)、美法仑、环磷酰胺和长春新碱。
蛋白酶体抑制剂包括例如硼替佐米、卡非佐米和伊沙佐米。免疫调节药物包括例如沙利度胺、来那度胺和泊马度胺。
“放射疗法”或“放射”是指用于除去癌细胞的高能放射。在骨髓或外周血干细胞移植之前可能要使用放射疗法。
“骨髓和/或干细胞移植”是指旨在恢复被一种或多种高剂量化疗药物和/或放射疗法破坏的干细胞的细胞移植。干细胞的来源包括骨髓、外周血或脐带血。根据所移植的干细胞的来源,所述程序可以分为骨髓移植(BMT)或外周血干细胞移植(PBSCT)或脐带血移植(UCBT)。此外,骨髓和/或干细胞移植可以指自体干细胞移植和/或同种异体移植。
在“自体移植”中,受试者自身的干细胞从他或她的骨髓或外周血中取出、冷冻并在患者接受治疗(一种或多种高剂量化疗药物和/或放射)时储存。可以使用称为“清除(purging)”的过程来尝试除去样品中的任何癌细胞。治疗后,干细胞然后被重新注入受试者的血液中。
“同种异体移植”是来自匹配供体的移植。同种异体骨髓移植的优势在于,来自供体的移植细胞可以建立新的免疫系统,从而可以检测出白血病细胞是外来的,并将其除去。同种异体移植的缺点是匹配供体的限制和副作用。
“免疫疗法”是指刺激受试者的免疫系统,以攻击对所述疾病负责的恶性肿瘤细胞。这可以通过对受试者进行免疫,例如通过施用癌症疫苗来进行(在这种情况下,对受试者自身的免疫系统进行训练以识别肿瘤细胞为要被破坏的靶标),或者通过将治疗性抗体作为药物进施用(在这种情况下,受试者的免疫系统会被治疗性抗体募集来破坏肿瘤细胞)。
在本公开文本的上下文中,受试者可能先前已经接受过血液恶性肿瘤的治疗,但是复发和/或是难治性的。
在一些实施方案中,所述受试者患有多发性骨髓瘤。在一些实施方案中,所述受试者患有复发和/或难治性多发性骨髓瘤。
“复发”是指疾病或病症(诸如血液恶性肿瘤),其先前已经被治疗且正在进展且需要开始其他治疗,但是不符合原发性难治性或复发和难治性疾病的标准。
“难治性”是指在初次或挽救疗法中无反应(在疗法中未能实现最小反应或发展为进展性疾病)或在最后一次疗法的60天内进展的疾病或病症。
复发和难治性疾病在进行挽救疗法(例如,在一线疗法治疗失败后施用的疗法)时无反应,或是在当前病程进展之前的某个时间点实现最低反应或更好的患者中在最后一次疗法后60天内进展的疾病。
原发性难治性疾病是在用任何疗法从来没有实现最低反应或更好的患者中的无反应疾病。
在一些实施方案中,所述受试者先前已经用硼替佐米和/或来那度胺进行治疗。
在一些实施方案中,所述受试者先前已经接受了自体干细胞移植(ASCT)。
在一些实施方案中,所述受试者在自体移植后6个月内复发。
剂量和施用
在一些实施方案中,将本文提供的配制的抗体以“固定剂量”施用,使得不基于身体大小或体重调整施用给患者的抗体的量。在一些实施方案中,施用给患者的固定剂量包含1000-1800mg的抗体。在一些实施方案中,所述固定剂量是1000mg。在一些实施方案中,所述固定剂量是1400mg。
在一些实施方案中,将配制的抗体,诸如固定剂量的抗体以固定体积施用给患者。例如,在一些实施方案中,以约10至约20mL的体积施用本公开文本的抗体配制品。在一些实施方案中,以约10至约15mL的体积施用本公开文本的抗体配制品。在一些实施方案中,以约10mL至约12.5mL的体积施用本公开文本的抗体配制品。在一些实施方案中,以约10mL至约11mL的体积施用本公开文本的抗体配制品。在一些实施方案中,以约10mL至约10.5mL的体积施用本公开文本的抗体配制品。
在一些实施方案中,在约10至约60分钟内皮下施用本文提供的配制的抗体的剂量。在一些实施方案中,在约20至约40分钟内皮下施用配制的抗体的剂量。在一些实施方案中,在约10分钟内皮下施用配制的抗体的剂量。在一些实施方案中,在约20分钟内皮下施用配制的抗体的剂量。在一些实施方案中,在约30分钟内皮下施用配制的抗体的剂量。在一些实施方案中,在约40分钟内皮下施用配制的抗体的剂量。在一些实施方案中,在约50分钟内皮下施用配制的抗体的剂量。在一些实施方案中,在约60分钟内皮下施用配制的抗体的剂量。
在一些实施方案中,所述皮下施用以所述抗体的一定输注速率进行。例如,可以在最短的时间内以合适的速率皮下施用所述配制品,以实现所需剂量的完全递送,而没有显著的渗漏或显著的不适感。这样的该速率可以在例如约0.1mL/min至约1.5mL/min的范围内。在一些实施方案中,大约的输注速率为0.8mL/min。在一些实施方案中,所述速率是1mL/min。在一些实施方案中,所述速率是1.2mL/min。在一些实施方案中,所述速率是1.5mL/min。
在一些实施方案中,可以在整个输注期间维持初始输注速率。在其他实施方案中,可以在输注期间上调或下调输注速率,或者上调和下调输注速率。
在一些实施方案中,将抗CD38抗体单独施用。在其他实施方案中,将抗CD38抗体与适合于治疗CD38+血液癌症的另一种药剂一起施用。在一些实施方案中,所述其他试剂是皮质类固醇(例如,地塞米松)、化疗药物、蛋白酶体抑制剂、免疫调节药物或其组合。
当与适合于治疗CD38+血液癌症的另一种药剂一起使用时,抗CD38抗体和一种或多种其他药剂可以同时或分别(例如在一段时间内顺序)施用。可以通过相同或不同的施用途径来施用抗CD38抗体和一种或多种其他药剂。当抗CD38抗体和一种或多种其他药剂通过相同的施用途径施用时,它们可以通过相同或不同的施用部位施用。
皮质类固醇(诸如地塞米松)用于治疗各种炎性病症、自身免疫病症和过敏性病症。它也可以作为直接药剂(例如,在多发性骨髓瘤中)或与其他药剂(例如,免疫调节药物、化疗药物和蛋白酶体抑制剂)组合用于癌症的治疗。皮质类固醇(诸如地塞米松)也可用于抵消一种或多种化疗药物的副作用(例如,恶心和炎症)。皮质类固醇(诸如地塞米松)也可用作预防药物,以减少由于抗体输注而引起的输注反应(IR)的潜在风险和/或严重程度。通常口服施用地塞米松。
泊马度胺是一种沙利度胺类似物和免疫调节药物,具有多种细胞作用,可抑制多发性骨髓瘤细胞的生长和存活,阻断促进骨髓瘤细胞的生长的骨髓微环境的基质支持;此外,泊马度胺具有有效的免疫调节作用,可通过刺激自然杀伤(NK)细胞和抑制调节性T细胞来增强对骨髓瘤细胞的免疫反应。通常口服施用泊马度胺。
在本公开文本的上下文中,医师可以评价疾病反应并因此适配施用方案。
在施用抗体之前,受试者接受预防药物以降低通常在施用单克隆抗体时观察到的输注反应(IR)的风险和/或严重程度。预防药物可包括例如孟鲁司特、对乙酰氨基酚、雷尼替丁、二苯基茶苯海明、地塞米松或其组合。在一些实施方案中,在如本文所述连续四次施用抗体后受试者未经历IR的情况下,可以终止预防药物。
可以根据血液恶性肿瘤的规范标准和分期确定“疾病反应”。评价血液恶性肿瘤,特别是CD38+血液恶性肿瘤的疾病反应的方法是本领域技术人员已知的。例如,评价疾病反应的方法包括表现状态评价,诸如东部肿瘤协作组(ECOG)表现状态和国际骨髓瘤工作组反应标准(分别参见Oken等人,Am.J.Clin.Oncol.1982;5(6):649-655和Kumar等人,LancetOncol.2016;17(8):328-346,respectively)。评价疾病反应的方法还包括疾病标记物的定量、骨髓活检和/或抽吸、浆细胞瘤的放射学成像、骨骼检查、M蛋白定量(血清和/或24小时尿液)和血清游离轻链或尿轻链水平、血清β2-微球蛋白、淋巴结活检、放射肿瘤评估(通过X射线、计算机断层摄影(CT)扫描、PET扫描或磁共振成像(MRI))以及包括母细胞计数的血液计数。该评价方法清单应被理解为非限制性的。
基于从疾病反应评价中获得的结果,然后可以根据潜在疾病的规范标准对疾病反应进行分层,并将其分为完全反应或完全缓解(CR)、部分反应(PR)、稳定疾病(SD)或进展性疾病(PD)。
在反应评价中使用的“标记物”可包括血清和/或血浆标记物,诸如C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)、IL-6、IL-1β或IFN。标记物还可以包括细胞表面标记物,诸如CD38。
在患有多发性骨髓瘤的受试者中评价疾病反应的技术包括,例如,骨髓活检和/或抽吸、浆细胞瘤的放射成像、骨骼检查、M蛋白定量以及血清β2-微球蛋白量度。
疾病反应评价可以进一步包括循环肿瘤细胞(外周血)上的受体密度和受体占有率,骨髓母细胞和浆细胞上的受体密度和受体占有率,以及人类抗药物抗体(ADA)的水平。
在本公开文本中引用的所有专利和公开的专利申请的全部内容通过引用并入本文。
通过参考以下非限制性实施例将进一步理解本公开内容。为了说明和描述本公开文本的某些实施方案,下面已经列出了实施例。权利要求的范围不以任何方式受到本文列出的实施例的限制。
实施例
提出以下实施例以向本领域普通技术人员提供关于如何制备和使用本公开文本的方法和组合物的完整公开内容和描述,并且不旨在限制本发明人视为其发明的范围。已经努力确保关于所使用的数字(例如量、温度等)的准确性。
实施例1-初始筛选
最初的配制品开发活动包括筛选缓冲液-pH体系、热稳定剂、表面活性剂和降粘剂,以鉴定与伊沙妥昔单抗相容并增强其稳定性,同时保持适合于皮下注射的重量摩尔渗透压浓度和粘度的赋形剂及其组合。
缓冲液和pH系统的选择
为了鉴定缓冲液和pH系统,在16种不同的缓冲液-pH系统中评价了伊沙妥昔单抗的稳定性。缓冲剂-pH系统(表1)是基于其在目标pH范围内的缓冲能力来测试。
表1-测试的缓冲液-pH系统
在浓度为5mg/mL的伊沙妥昔单抗的液体配制品中,在振摇和热应力之后在可见和亚可见颗粒和可溶性聚集体(高分子量种类HMW)的形成方面,评价了缓冲液-pH系统对依沙妥昔单抗聚集的影响。
如表2所示,发现伊沙昔单抗聚集成可见颗粒取决于pH和缓冲液系统。pH在5.5至6.5范围内的组氨酸缓冲液系统在振动应力下显示最高的稳定性(应力后呈现出较少的可见颗粒),且pH 5.0至7.0的柠檬酸盐缓冲系统以及pH 5.5、6.5和7.0的柠檬酸盐缓冲系统在热应力下显示最高的稳定性(应力两周后呈现出较少的可见颗粒)。有趣的是,pH在6.5-7.4范围内的磷酸盐缓冲液系统在热应力一周后显示出最高的热稳定性,但是在热应力两周后具有几个可见的颗粒,并且在所有测试的缓冲液系统的振动应力下,显示伊沙妥昔单抗的稳定性最低。
表2-外观检查
0:没有可见颗粒
+:可见颗粒很少
++:几个可见颗粒
+++:大量可见颗粒
通过光透法(LO)测量振动应力和热应力后≥10μm和≥25μm的亚可见颗粒的数量。如图1所示,在振动和热应力作用下,磷酸盐缓冲液呈现出最高水平的亚可见颗粒。组氨酸和乙酸盐缓冲液系统提供了最低水平的亚可见颗粒,表明伊沙妥昔单抗的稳定性更高。
在各种pH下在柠檬酸盐、组氨酸、磷酸盐、琥珀酸盐和乙酸盐缓冲液中热应力之后,通过尺寸排阻色谱(SE-HPLC)观察到可溶性聚集体(HMW)。如图2所示,柠檬酸盐、磷酸盐和琥珀酸盐缓冲液系统显示可溶性聚集体的增加更高,并且观察到的总体趋势表明,pH越高,可溶性聚集体(HMW)含量越高。在pH高于7.0时,这一点尤为显著。振动应力似乎对可溶性聚集体没有任何影响。
在蔗糖和聚山梨醇酯80存在下,在组氨酸缓冲液中进一步研究了pH对伊沙妥昔单抗稳定性的影响。将表3所示配制品中浓度为5mg/mL的伊沙妥昔单抗在40℃下孵育1个月,并通过SE-HPLC测定HMW。
表3-测试的缓冲液-pH系统
通过SE-HPLC观察HMW。如图3所示,与pH 6.5相比,在pH 6.0的组氨酸缓冲液中于40℃热应力1个月后,可溶性聚集体(HMW)几乎没有。
在表3所示的配制品中将5mg/mL的伊沙妥昔单抗在40℃下孵育1个月后,通过WCX(每周阳离子交换)测量伊沙妥昔单抗的酸性同工型的水平。如图4所示,与在pH 6.5、40℃下放置1个月相比,在pH 6.0下的组氨酸配制品显示伊沙妥昔单抗的酸性形式的水平的增加较小。
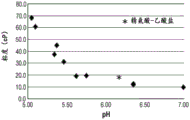
这些结果显示,pH和缓冲液系统影响了伊沙妥昔单抗的稳定性,pH 6.0左右的pH比pH 6.5稳定。
降低粘度的赋形剂的选择
为了能够皮下递送伊沙妥昔单抗,测试了多种具有降粘赋形剂的配制条件,以确定是否可以开发出在20℃时粘度低于25cP的高浓度。
将抗体浓缩并配制在测试配制品中。用SoloVPE仪器以光谱学方式确认所得配制品的蛋白浓度,并测量最终溶液的pH。
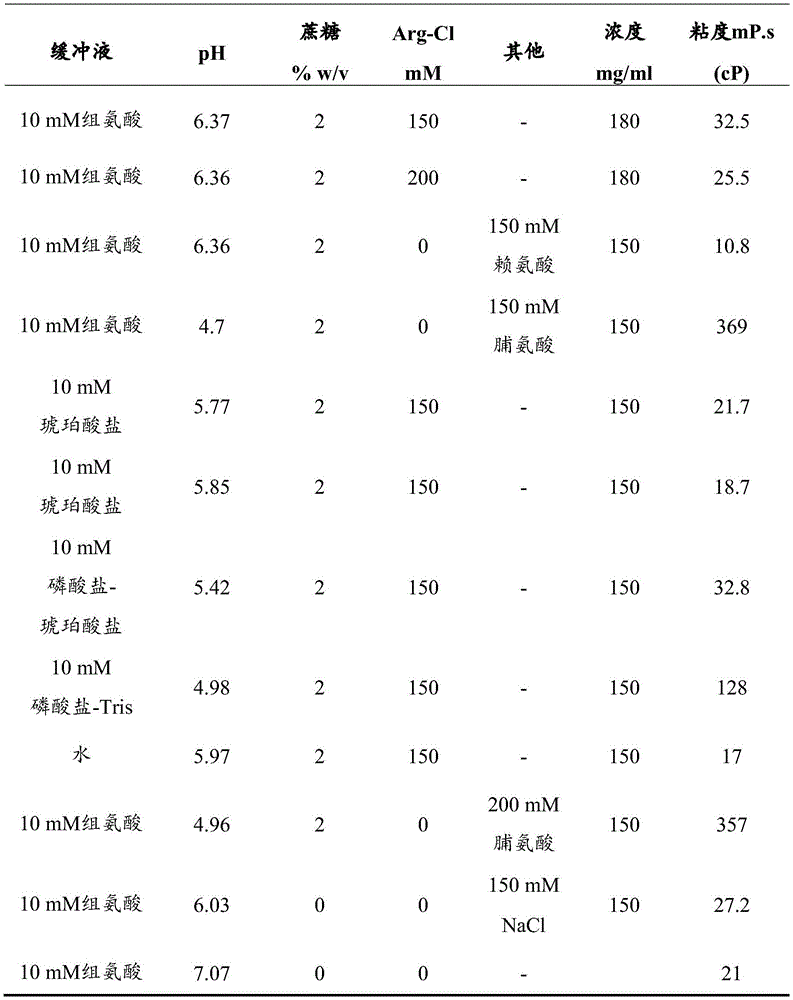
表4-在粘度研究中测试的配制品
*:配制品中使用的是精氨酸-乙酸盐,而不是精氨酸-Cl
使用RheoSense Initium仪器,使用自动方法在20℃下测量所有样品的粘度。这会自动确定合适的剪切速率,以使仪器在传感器所需的压力范围内运行。由于剪切速率不超过10,000s-1,因此非牛顿效应(诸如剪切稀化)被忽略不计。
图5显示在0、50、100和200mM L-精氨酸-Cl的存在下,pH 6.0时200mg/mL的伊沙妥昔单抗溶液的粘度(cP)。初步测量表明,精氨酸-Cl是以浓度依赖的方式有效的降粘赋形剂;精氨酸-Cl浓度的增加与粘度的降低有关。
测试了40多种具有不同pH的不同配制品,测试了用于各种浓度的伊沙妥昔单抗的降粘剂。结果示于表4中。
在存在10mM组氨酸和2%蔗糖的情况下,精氨酸-Cl的浓度对两种浓度的伊沙妥昔单抗150mg/mL(图6A)和180mg/mL(图6B)的粘度的影响示于图6A和6B中。
除了精氨酸-Cl的浓度外,还观察到pH对伊沙妥昔单抗的粘度的显著影响。图7A和7B显示对于150mM精氨酸-Cl(图7A)和200mM精氨酸-Cl(图7B),随pH变化的粘度。
令人惊讶地,示于图7A和7B中的结果显示了粘度和pH之间的反向相关,即,粘度增加与pH降低有关。在pH≤5.7时,粘度急剧增加。这种反向相关与蛋白溶液通常预期和观察到的相反。另外,这种意想不到的影响随着抗体浓度的增加而进一步放大(图8)。
已显示至少100mM的精氨酸-Cl浓度可将150mg/mL的伊沙妥昔单抗的粘度降低至小于20cP,且将180mg/mL的伊沙妥昔单抗的粘度降低至小于40cP。另外,如pH低于5.7的粘度急剧增加所证明,显示pH对粘度具有显著影响。同时,必须考虑pH对伊沙妥昔单抗的稳定性的影响。如图3和图4所展现的,与在pH 6.5下的缓冲液系统相比,在pH值接近6.0的组氨酸缓冲液系统在1个月的热应力后产生较少的HMW。
实施例2-粘度研究
在掌握了实施例1中所述的研究结果,并且目的是获得含有可能适合皮下施用的高浓度(例如,至少100mg/mL)伊沙妥昔单抗的配制品的情况下,制备了许多配制品并对其进行了更详细的研究。不同的参数可能会影响溶液中蛋白的粘度,诸如蛋白浓度、pH、降粘剂的浓度和温度。进行了几次实验以评价蛋白浓度、pH、精氨酸浓度对配制品粘度的影响。表5显示测试的参数和值范围。考虑到药品将在冷藏条件下(5℃±3℃)存储,还检查了温度的影响。
表5-粘度研究
*在固定的pH 6.2和mAb浓度140mg/mL下进行探测
将目标浓度设置为140mg/mL,以在20℃下实现低于25cPs的粘度,包括当mAb溶液在制造过程中固有的抗体浓度或降粘剂浓度或pH出现波动时。实际上,由于道南效应(Donnan effect)或在混合步骤中,由于赋形剂称量的准确性或可能影响最终的药品中的赋形剂水平的其他制造步骤(例如过滤)的准确性,通常用UF/DF观察到每种赋形剂实际成分和目标组成之间的这种差异。
高浓度mAb的溶液倾向于表现出高粘度。选择精氨酸作为降粘剂,以确定是否可以开发出在20℃时粘度低于25mPa·s的伊沙妥昔单抗的高浓度液体配制品。
该研究分三组进行。第一组检查粗pH和浓度。第二组检查细pH和浓度。第三组检查精氨酸浓度。
在研究的第一组中,研究了伊沙妥昔单抗浓度、pH和温度对粘度的影响。为此研究组制备了七种配制品。表6列出了详细组成以及测量值。
表6-配制品中具有伊沙妥昔单抗浓度(Cmab)和pH的测量值的配制品
与不含表面活性剂的配制品相比,P188的0.4%w/v的浓度显示积极的稳定作用。浓度为2%的蔗糖在保持重量摩尔渗透压浓度接近等渗性的同时,具有足够的稳定性。
在研究的第二组中,研究了伊沙妥昔单抗浓度和pH对20℃时粘度的影响。制备总计32种配制品。以4个目标浓度的抗体(126、140、147和154g/L)和8个目标pH值(5.5、5.7、5.9、6.2、6.5、6.7、6.9、7.0)制备溶液。表7列出了详细组成以及测量值。
表7-配制品中具有伊沙妥昔单抗浓度(Cmab)和pH的测量值的配制品
在研究的第三组中,精氨酸浓度在90和150mM之间变化。表8列出了5种配制品的详细组成以及测量值(如果有)。
表8-参考溶液(加标前)的配制,研究组3-精氨酸浓度对稳定性和粘度的影响的研究
对于研究的第1组,所有样品的粘度均在Rheosense m-VROC粘度计上于5℃、10℃、15℃、20℃、25℃和30℃下测定。对于每个样品和每个温度,选择的流速为最大流速的50%,导致剪切速率介于250和2500s-1之间。假定所有样品都具有牛顿行为。
对于研究的第2组,所有样品的粘度均在Rheosense m-VROC粘度计上于20℃下测定。对于每个样品,选择的流速为在灌注阶段仪器测定的最大流速的50%。这导致了介于250和2500s-1之间的剪切速率。假定所有样品都具有牛顿行为。
对于研究的第3组,所有样品的粘度均在Rheosense m-VROC粘度计上于20℃下测定。对于每个样品,选择的流速为在灌注阶段仪器测定的最大流速的50%。这导致了介于1200和1600s-1之间的剪切速率。假定所有样品都具有牛顿行为。
随浓度变化的粘度
在pH 5.5下,粘度从浓度为126mg/mL的16mPa·s增加至浓度为154mg/mL的54mPa·s。在pH 7.0下,在相同的浓度范围内,粘度从5.8mPa·s增加至11mPa·s。对于所有条件,使用Mooney方程拟合数据:
其中ηsolv是溶剂的粘度,[η]是蛋白的特性粘度,K是“群集因子”,且S是“形状系数”。拟合参数为[η]和K/S。对应于配制品缓冲液在20℃时的粘度,对ηsolv=1.26mPa·s使用固定值。
如图8所示,伊沙妥昔单抗溶液的粘度随mAb浓度的增加而增加。
随pH变化的粘度
图9显示了在第2组中使用m-VROC所获得的数据,绘制了5种浓度的伊沙妥昔单抗(126、140、147和154mg/mL)随pH变化的粘度。如图9所示,伊沙妥昔单抗溶液的粘度随着pH的增加而降低。
在pH 6.2时,在测试抗体的整个浓度范围内,粘度均小于25mPa·s。对于所有高于或等于5.9的pH值,粘度均小于25mPa·s。然而,在较低的探测pH值(5.5和5.7)下,当mAb浓度高于或等于147g/L时,粘度高于25mPa·s。
随温度变化的粘度
在第1组中,测量了随介于5和30℃之间的温度变化的所探测配制品的粘度。如图10和图11所示,粘度随温度的增加而降低。使用Arrhenius拟合,确定了配制品的活化能(表9)。用Mooney方程将这些值与20℃下的拟合数据组合使用,可计算出理论值。如图10所示,模型与实验数据一致。
表9-第1组的不同配制品的活化能
活化能随着伊沙妥昔单抗的浓度的增加而增加。活化能在介于pH 5.9和6.2之间降低。在较小的程度上,活化能在介于pH 6.2和6.8之间增加。为了在溶液中移动,mAb必须从其邻域中逃逸,因此需要在此定义为Ea的最小能量。根据玻尔兹曼定律,mAb可以获取此能量的概率与exp(-Ea/RT)成正比,因此与mAb的迁移率成反比的粘度遵循方程:粘度=exp(+Ea/RT)。
对于pH 6.2的配制品,mAb浓度为143和126mg/mL,在5℃-30℃的温度范围内,粘度保持在25mPa·s以下。在154mg/mL的情况下,在5℃时记录的值略微高于25mPa·s。
对于pH 5.9的配制品,伊沙妥昔单抗在142mg/mL的粘度在5℃下约为25mPa·s。
随精氨酸浓度变化的粘度
初步研究显示,对于150mg/mL的伊沙妥昔单抗配制品(无表面活性剂),在介于0和100mM之间的精氨酸的情况下,粘度从60mPa·s降低至16mPa·s,而在介于100mM和200mM之间的精氨酸的情况下仅降低至12mPa·s。
在本研究中,测试了90至150mM的精氨酸浓度,点分别为90、100、115、125和150mM。粘度随着精氨酸浓度的增加而降低(图12)。值从11mPa·s降低到9mPa·s,证实了在初步研究中获得的趋势。
在所研究的精氨酸浓度范围内(90-150mM),粘度变化小于2mPa·s。
实施例3–稳定性
该实施例描述了一系列稳定性研究,其中在5℃下对2组配制品进行了稳定性研究,并在40℃/75%r.h.下进行了加速稳定性研究以及冻融和振动应力测试研究。
表10和表11汇总了所测试的配制品。
表10-F4-1至F4-16
*1已作为加速研究的一部分进行了测试。
表11-F10-1至F10-16
*1已作为加速研究的一部分进行了测试。
冻融应力是通过使用Epsilon1-6CC冻融装置(Martin Christ GmbH,奥斯特罗德,德国)进行的。样品经受冻融应力。
将来自每种配制品(F4和F10)的一个小瓶放入冷冻干燥器中,并根据以下参数运行循环:速度,0.1℃/min;冷冻温度,-30℃;解冻温度25℃;周期数,5;保持温度时间,60min。五个循环后,检查样品中的可见颗粒并进行均质化。
将每种配制品的一个小瓶安装在水平振动平台(IKA,KS4000 IC)上,并在25℃和300rpm下加应力21天。分析了T-mech样品以及T-1个月的时间点。
使用Gonotec Osmomat 3000(Gonotec,柏林,德国),通过凝固点降低法测量样品的重量摩尔渗透压浓度。在仪器运行之前进行了3点校准,其中包括Milli-Q水和分别为300和400mOsmol/kg的两种重量摩尔渗透压浓度标准。
蛋白浓度是通过在Tecan Safire2平板读数器(Tecan Austria GmbH,格罗迪格,奥地利)上的96孔板(Corning Incorporation,纽约,USA)中进行UV光谱测定的。用重量分析法将样品从150mg/mL溶液稀释至1mg/mL的蛋白浓度。从天平打印输出中计算出稀释因子。对于每个数据点,测量了三个装有200μL溶液的孔(n=3),以最大程度地减少测量误差。测量池的温度设置为25℃。测量稀释缓冲液作为空白光谱。测量之后,针对路径长度校正在280nm处获得的吸光度值,并用相应的空白值减去。使用在280nm处计算出的摩尔消光系数(εmolar)224,320M-1cm-1来计算消光系数(ε)。计算出的1.548mL mg-1cm-1的消光系数(ε)用于基于280nm处的吸光度值确定蛋白浓度。
根据欧洲药典(第8版;专著2.9.20),在约3750lux下,在白色背景前轻柔、手动、径向搅动5秒钟且在黑色背景前5秒钟,检查小瓶中是否存在可见颗粒。所述检查是由两名训练有素的检查员独立进行的。
为了对观察到的可见颗粒进行分类,使用了基于“Deutscher Arzneimittel-Codex”(DAC 2006)的数字评分(0,在5秒钟内看不到任何颗粒;1,在5秒钟内可见很少颗粒;2,在5秒钟内可见中等数量颗粒;10,直接可见大量颗粒)。可能不属于产品的纤维状结构和颗粒不是由数字评分来解释的。
高效体积排阻色谱(HP-SEC)
在进行样品分析之前,使用BioRad凝胶过滤标准(包含甲状腺球蛋白、γ球蛋白、卵清蛋白、肌红蛋白和维生素B12)测试HP-SEC柱的性能。通过将冻干的物质溶解在500μLMilli-Q水中,随后在流动相中稀释10倍(最终蛋白浓度为3.6mg/mL)来制备标准。通过注入凝胶过滤标准品(BioRad),在每个序列的开始进行系统适用性测试,并通过计算γ球蛋白和卵清蛋白峰之间的USP解析进行评估。通过将40μL母液与160μL溶液A(不含乙腈的流动相)混合,将50mg/mL储备样品在1.5mL聚丙烯管(Eppendorf)中稀释5倍,得到10.0mg/mL的蛋白浓度。
为避免在加速的稳定性/压力测试过程中可能形成的较大的不溶性颗粒堵塞HP-SEC柱,将样品在18,000rcf稀释后离心5分钟,然后将上清液转移至HPLC小瓶中。将样品涡旋并在自动进样器中于5℃下储存直至分析。
以下参数用于HP-SEC分析:
仪器:Ultimate 3000(Dionex)
柱:非晶硅柱ProSEC 300S;300mm
安全保护:保护柱50mm x 7.5mm
流速:0.3mL/min
流动相:90%的100mM磷酸盐,pH 7.2,300mM NaClO4+10%ACN
检测:280nm和214nm处的UV
柱温箱:25℃
样品冷却:5℃–8℃
进样量:对于5.0mg/mL样品为10μL,对于空白和SEC标准为10μL
分析时间:90min
毛细管等电聚焦(cIEF)
成像毛细管等电聚焦(cIEF)在与PrinCE Microinjector(ConvergentBioscience,多伦多,加拿大)连接的iCE280仪器上进行。不像常规cIEF中实践的通过固定的检测点洗脱聚焦的分子种类,在成像的cIEF中,在整个IEF毛细管中检测分子。为此,将波长为280nm的UV光聚焦在UV透明毛细管上,并借助电荷耦合器件(CCD)相机以规则的间隔捕获图像。
在分析之前,请按照仪器说明安装熔融的石英涂层(FC)滤芯。阳极储槽中填充了0.08M磷酸(在0.1%甲基纤维素中,电解质试剂盒,ProteinSimple),阴极储槽中填充了0.1M氢氧化钠(在0.1%甲基纤维素中,电解质试剂盒,ProteinSimple)。通过测量血红蛋白标准(iCE280系统适用性套件,ProteinSimple)来检查系统的性能。根据制造商进行血红蛋白标准溶液的等电聚焦(预聚焦:在1500V时1min;聚焦:在3000V时4.5min)。
通过混合2360μL的Milli-Q水、1400μL的1%甲基纤维素、160μL两性电解质pH 3-10、20μL的pI标记7.05和20μL的pI标记物9.50制备用于20个样品的主混合物。通过涡旋将主混合物匀浆,并在5,000rcf下短暂离心。用0.45μm注射器PVDF过滤器单元(Millex-GV,Millipore)过滤混合物。
通过将20μL母溶液(C=50mg/mL)与30μL相应的配制品缓冲液混合,将样品预稀释至20.0mg/mL的蛋白浓度。通过将2μL的20.0mg/mL的预稀释样品与198μL的主混合物混合,以获得200μL的总体积和0.2mg/mL的蛋白浓度,来制备用于cIEF分析的最终样品。
DP的等电聚焦是通过在1500V下预聚焦1min,随后在3000V下聚焦8min来进行的。通过使用ChromPerfect软件(版本5.5.6)分析UV吸收图像。
外观检查结果
由两名独立的操作员进行外观检查,将冻融后的样品溶液标记为不均匀(S-Schlieren*,相分离)。在稳定性研究过程中,所有测试配制品的可见颗粒含量和浊度均未观察到重大变化。
重量摩尔渗透压浓度的测量结果示于表12中。在T0时,重量摩尔渗透压浓度的范围介于275-418mOsmol/kg之间。显示F10配制品的重量摩尔渗透压浓度值比F4配制品高。储存在40℃/75%r.h.对测试样品的重量摩尔渗透压浓度没有影响。
表12-在T0时的重量摩尔渗透压浓度测量结果(n=1)
表13-在T-1w_40℃、T-2w_40℃和T-1m_40℃时的重量摩尔渗透压浓度测量结果
在T0时的粘度测量结果表明,F10配制品显示出比F4配制品略微高的粘度。对于配制品F4-8(20℃在1000s-1时为30.03cP)和F10-8(20℃在1000s-1时为34.13cP)测量了最高粘度。对于两组配制品(F4和F10),运行8均包含最高的蛋白质浓度(154mg/mL)、最低的pH(5.9)和最高的蔗糖浓度(24mg/mL)。
表14和表15提供了通过UV光谱测定蛋白浓度的结果。在T0时,蛋白浓度介于124和156mg/mL之间。测试配制品中的蛋白浓度在40℃/75%r.h储存期间保持稳定。
表14–蛋白浓度
表15–蛋白浓度
将十二烷基硫酸钠凝胶电泳(SDS-PAGE)用于表征蛋白种类的分子量和相对数量。通过测量检测到的蛋白条带的光密度,从SDS-PAGE凝胶中计算出分离的种类的相对量。表16和表17分别显示了在非还原和还原条件下所有检测到的蛋白种类的相对数量和分子量。
表16-通过非还原SDS-PAGE检测的种类的相对数量和计算的分子量
表17-通过非还原SDS-PAGE检测的种类的相对数量和计算的分子量
进行高效体积排阻色谱(HP-SEC)来评估单体、聚集体和片段。分配了四个聚集体种类(HMW1、HMW2、HMW3和HMW4)和两个片段种类(LMW1和LMW2)。
在T0时,配制品F4和F10中的相对单体含量为98.5%-99.0%之间。储存在40℃/75%r.h.导致所有测试样品中的单体含量降低。在40℃/75%r.h.下储存一个月后,测试配制品中的单体含量介于96.2%-97.2%之间;在配制品F4-2中发现此时间点最低的单体含量。重复的冻融循环几乎对相对单体含量没有影响,而机械应力导致少量下降(97.7%-98.2%)。参见图13和图14。
对于几乎所有样品和时间点,HMW1的相对含量均低于0.15%的定量限,同样,对于几乎所有样品和时间点,HMW2的相对含量均低于0.15%的定量限。
在T0时HMW3的相对含量在0.7%-0.9%的范围内。在40℃/75%r.h.下保存一个月后,HMW3含量增加到1.1%-1.5%。在F4-14、F10-5、F10-12和F10-14样品中观察到HMW3含量增加最多,而在配制品F4-1和F4-7样品中观察到增加最少。重复的冻融循环不会导致HMW3相对含量的增加,而机械应力导致HMW3轻微增加至0.9%-1.2%。
对于几乎所有样品和时间点,HMW4的相对含量均低于0.15%的定量限。
计算所有聚集体(HMWS)的总和,且峰≥0.15%相对面积。在T0时,聚集体的总含量(HMWS)在0.6%-1.2%的范围内。储存在40℃/75%r.h.导致所有测试配制品中HMWS含量显著增加。在40℃/75%r.h.下储存一个月后的相对HMWS含量介于1.1%-1.9%之间。对于配制品F4-7,观察到HWM种类的增加最少,而对于配制品F4-2和F10-14,观察到增加最多。冻融后未观察到HMWS含量的实质性变化,且在暴露于机械应力后仅检测到少量增加,导致HWMS含量介于0.9%-1.3%之间。参见图15和图16)。
在T0,片段LMW1的含量为约0.3。储存在40℃/75%r.h.导致所有测试样品中LMW1含量的增加。在40℃/75%r.h.下储存一个月后的相对LMW1含量最高,且介于1.1%-1.5%之间。冻融对LMW1含量没有影响。机械应力导致LMW1含量少量增加。
在T0时,所有测试配制品的LMW2片段的相对含量均低于定量限(≥0.15%)。在40℃/75%r.h.下储存两周零一个月导致LMW2含量少量增加,在T-1m_40℃时观察到最高值(0.3%-0.5%)。
计算所有LMWS含量的总和,且峰≥0.15%。在T0时,所有测试配制品的总LMWS含量约为0.3%。冻融对LMWS含量没有影响,而机械应力导致LMWS含量少量增加(0.7%-0.9%)。储存在40℃/75%r.h.导致较显著增加,尤其是在稍后的时间点(图17和图18)。在T-1m_40℃时观察到增加最多,而LMWS的总含量介于1.4%-1.8%之间。
在T0时,通过毛细管等电聚焦(cIEF)测量的主峰的相对含量介于70.3%-74.0%之间。在40℃/75%r.h.储存一周、两周和一个月后,检测到主峰的相对含量逐渐降低。对于配制品F10-8观察到降低最多(在T-1m_40℃下为55.4%)。对于在所有稳定时间点的所有配制品,主峰的pI保持稳定在约8.2。
在T0时,酸性种类的相对含量介于约17.9%-20.9%之间。储存在40℃/75%r.h.导致酸性种类含量显著增加。在时间点T-1m_40℃观察到增加最多,值介于30.4%-36.9%之间。对于配制品F10-8观察到的增加最多,而配制品F4-7显示的增加最少。数据的图形表示在图19和图20中示出。
在T0时,观察到的基本峰含量介于8.1%-9.5%之间。在稳定性研究期间,在大多数时间点,所有配制品的基本峰含量均保持相对稳定。对于T-1m_40℃,基本峰含量为7.1%-9.1%。
在40℃/75%r.h下储存后,毛细管等电聚焦(cIEF)数据显示酸性种类含量增加,而所有配制品的主峰含量却有所降低。如图21所示,F4配制品显示出比F10配制品更好的化学稳定性,并且在40℃/75%r.h.下储存一个月后的主峰相对含量的降低较少。在40℃/75%r.h.下储存一个月后,F4配制品的单体峰损失在9.5%-13.9%的范围内,而F10配制品的单体峰损失显示在14.7%-17.3%的范围内。
实施例4–稳定性
提供了对在110mM精氨酸-HCl、9mM组氨酸,2%蔗糖、0.4%泊洛沙姆188(pH 6.2)中配制的140mg/mL伊沙妥昔单抗进行稳定性研究的结果。
结果
在-20℃±5℃下的稳定性
如表18所示,在-20℃±5℃下储存1个月后,所有测试的质量属性(可见颗粒、颜色、乳光度、SEC和cGE纯度、UV蛋白浓度、ADCC和CDC生物测定效能、光透法颗粒物质和pH)保持稳定。
与起始材料相比,icIEF的电荷异质性未显示任何显著变化。
在+5℃±3℃下的稳定性(长期储存条件)
如表19和表20所示,在+5℃±3℃下储存1、3、6、9和12个月后,所有测试的质量属性(可见颗粒、SEC和cGE纯度、UV蛋白浓度、CDC生物测定效能、光透法颗粒物质和pH)至少保持稳定12个月。
与起始材料相比,颜色、乳光度和icIEF和电荷异质性与起始材料相比至少12个月未显示任何显著变化。
在+25℃±2℃/60%±5%RH下的稳定性(加速储存条件)
如表21所示,在+25℃±2℃下储存6个月后,所有测试的质量属性(可见颗粒、SEC纯度、UV蛋白浓度、ADCC和CDC生物测定效能、光透法颗粒物质和pH)至少保持稳定6个月。
在+25℃±2℃下6个月后,颜色和乳光度均未观察到变化。
在+25℃±2℃下6个月后,观察到icIEF的电荷异质性分布的变化如下:观察到主要同工型含量降低了9%,而酸性同工型含量增加了9%。
观察到cGE纯度的主峰轻微下降(-2%)与低分子种类总和的增加(+2%)相关。
观察到SEC单体纯度轻微下降(-1.7%)。
与起始材料相比,所有其他参数均未显示任何显著变化。
在+40℃±2℃/75%±5%RH下的稳定性(应力条件)
如表22所示,在应力条件下,1个月后观察到以下变化:
观察到的icIEF电荷异质性分布的变化如下:主要同工型含量降低14%,主要与酸性形式增加15%有关。
观察到cGE纯度的主峰轻微下降(-2%)与低分子种类总和的增加(+2%)相关。
SEC聚集体的百分比保持不变。
结论
该稳定性研究的结果表明,在110mM精氨酸-HCl、9mM组氨酸、蔗糖2%、泊洛沙姆188 0.4%(pH 6.2)中配制的伊沙妥昔单抗-140mg/mL在-20℃下保持稳定至少1个月,并在+5℃±3℃下保持稳定至少12个月。
表18–伊沙妥昔单抗140mg/mL-在-20℃±5℃下的稳定性结果
表19–注射用伊沙妥昔单抗溶液140mg/mL–
在+5℃±3℃下的稳定性结果(T1M至T6M)
表20–注射用伊沙妥昔单抗溶液140mg/mL-在+5℃±3℃下的稳定性结果(T9M至T12M)
表21-注射用伊沙妥昔单抗溶液,140mg/mL-在+25℃±2℃/60%±5%RH下的稳定性结果
表22-注射用伊沙妥昔单抗溶液,140mg/mL-在+40℃±2℃/75%±5%RH下的稳定性结果
实施例5-小型猪的体内研究
该实施例描述了一项研究,其中通过皮下注射施用伊沙妥昔单抗的配制品治疗小型猪。选择小型猪作为该皮下局部耐受性研究的测试模型,是因为其良好的可接受性,并且因为它通常用于对预期的人类施用途径进行非临床评估。
在8只小型猪(1岁雌性,体重20-25kg)上将四种配制品(F1、F2、F4和F10)和盐溶液(0.9%氯化钠)作为阴性对照进行了测试,每个测试组有4只动物。每只动物接受2种配制品和阴性对照的注射,每次注射之间有3周的恢复。通过使用配备有背压捕获器(RSB5Subminiature Load Cell 50LB/200N)的注射泵(Harvard Apparatus Model‘22’),通过装有27G蝶形针的导管在侧面区域进行施用,以监测组织背压。
在输注过程中,观察动物时着重于一般行为、发声和用于评估疼痛的视觉参数。输注注射器压力和泄漏的证据也受到监测。观察注射部位的皮肤变化,并进行物质P和皮质醇的血浆分析。第5天在10%NBF中收集皮肤活检。
在注射期间和之后5天记录疼痛症状。在注射过程中以及随后的90分钟内,将疼痛标记物给予到采样的血液中。然后对在注射点采集的皮肤样品进行了组织病理学研究。就组织病理学而言,所有配制品均具有良好的耐受性。
伊沙妥昔单抗的所有溶液均从同一批次的伊沙妥昔单抗溶液中配制制备。该批次已被配制为在20mM组氨酸和5%蔗糖中的30mg/mL(pH为6)。
表23中描述了用于研究小型猪研究的所有测试配制品。
表23-小型猪配制品
*渗滤缓冲液和CES的标称值,未考虑超滤过程中道南效应引起的偏移
**渗滤缓冲液和CES的标称值,未考虑超滤过程中道南效应引起的偏移,但后来在F4和F10中进行了量化
为了制备每种配制品,通过渗滤交换缓冲液(没有蔗糖和表面活性剂),并且将抗体浓缩至比目标配制品更高的值。在首次调整浓度后,添加浓缩的赋形剂溶液(溶解在渗滤缓冲液中的浓缩的蔗糖和表面活性剂)以获得最终配制品。
表24列出了研究的渗滤缓冲液。
表24-渗滤缓冲液的组成
最终配制品的记录值示于表25中。
表25-分析结果
*过滤前配制品的密度
**过滤后用微电极测量的pH
n.a.=不可用(未测量)
研究总共使用了八只1岁雌性小型猪。在4只动物上测试每种配制品,每只动物在30分钟内接受18mL的体积(0.6mL/min)。研究持续了5天,在此期间记录了疼痛标记物和症状。在5天结束时,取样8mm皮肤圆盘(活检)以进行组织病理学检查。
首先在小型猪上测试配制品F2和F4。在21天的滞后时间之后,然后在相同的8只小型猪上测试配制品F1和F10。最后,在第二次滞后时间之后,在相同的8只小型猪上测试了盐溶液。
对于每种配制品/盐溶液,进行如下研究:
·注射溶液至4只小型猪(盐溶液8只)
·输注期间:实时记录以下参数:
o遥感测量(ECG)
o注射器背压(用于计算组织背压)
o疼痛标记物(皮质醇、物质P,在血液中给予-需要定期抽血)
o疼痛症状(抓挠、擦洗、噪音、发红)和输注引起的水肿的大小。
·输注后:
o输注结束后90分钟内出现疼痛标记物
o连续5天出现疼痛症状(抓挠、擦洗、发红)(外观检查,任意单位)
o样品组织的组织病理学(5天后的皮肤活检)
表26总结了疼痛的主要结果。
表26-疼痛标记物和疼痛症状
*对于相同配制品,动物之间差异很大
**n.r.=未报告
在表26中,仅血浆皮质醇被报告为疼痛标记物。对所有配制品测得的物质P的水平均未随时间变化。注射后血浆皮质醇增加。表26报道了每种配制品在4只小型猪上计算出的平均值的最大值。对于F10,获得了所述平均值的最大值。对于所有配制品,在4只测试动物之间血浆皮质醇水平存在差异。
F10的疼痛症状的数量也是4种配制品中最高的,并且血浆皮质醇水平最高(图22)。F2的疼痛症状数量第二高,且物质P水平最高(图23)。表26中未显示F1和F2均具有较差的抗体稳定性的发现。
在使用4种配制品的注射过程中,未观察到泄漏和几乎恒定的注射器背压。
表27总结了组织病理学的主要结果。
表27-组织病理学结果
真皮和皮下组织在配制品之间没有显示出有意义的差异。与配制品F1(25%)、F4(25%)、F10(0%)或盐水(25%)相比,配制品F2显示出更高的骨骼肌变化发生率(100%)。
实施例6-小型猪的第二次体内研究
在实施例中描述的研究的目的是通过使用三种不同的流速皮下输注给小型猪,对伊沙妥昔单抗单次施用后的局部耐受性和血浆药代动力学进行评估。此外,一组动物静脉内给药一次,以评价不同皮下输注后伊沙妥昔单抗的生物利用度。
使用测试样品,用于SC输注的伊沙妥昔单抗500mg/25mL(20mg/mL)以及用于SC输注的伊沙妥昔单抗140mg/mL(实施例5中的配制品F4)。对于第2、3和4组,注射用盐水(0.9%NaCl)用作阴性对照项目。
研究是在20头来自丹麦代尔莫瑟DK-4261的EllegaardMinipigs A/S的雌性SPF(无特定病原体)小型猪中进行的。到来时订购的动物的体重为20-25kg。允许15天的预处理期(包括5天的适应期),在此期间每天观察动物以排除任何状况较差的动物。记录所有观察结果。
如表28所示,将动物随机分为四个治疗组:
表28-治疗组
对于静脉内输注,在治疗开始前9天,将耳静脉导管植入6只动物中(5+1只备用)。将这些动物中的五只分配到第1组(IV输注组);最后一只动物被纳入一个皮下组中。
所有施用均使用Baxter Colleague CXE定量输液泵进行。Baxter Colleague CXE泵能够从半刚性容器、刚性容器、柔性IV袋和排气注射器中输注。在施用过程中,将测试和阴性对照项目放置在无菌玻璃输注瓶中。
-治疗的第一天被指定为第一天。
-在第1组的第1天,通过植入的耳静脉导管以3mL/min的流速输注30分钟给予单剂量的伊沙妥昔单抗(1800mg/动物)。
-在第2、3和4组的第1天,分别在0.5、1和2mL/min的流速下通过带蝶形针的皮下导管给予单剂量的伊沙妥昔单抗(1806mg/动物)。将蝶形针放置在膝盖区域正前方的左下侧面区域中。
-在第2、3和4组的第8天,分别在0.5、1和2mL/min的流速下通过带蝶形针的皮下导管给予单剂量的盐水(阴性对照)。将蝶形针放置在膝盖区域正前方的右下侧面区域中。
-第1组的剂量体积为90mL,第2-4组的为12.9mL。
-观察第2-4组中皮下注射部位在输注期间的渗漏。
-沿着输注程序中发生的局部肿胀的边缘标记皮下注射部位,并在必要时重新标记。
-SC输注的针头大小为23G。
每天记录所有不良健康迹象和任何行为改变。记录任何偏离正常的情况。在给药期间,观察动物的一般行为和任何发声,重点是应力、不适或疼痛的任何迹象。
对于第2-4组,从给药当天起每天观察皮下注射部位是否有出血、红斑、肿胀(水泡形成,指示大小)和牢固性,但不排除其他迹象。在给药的几天,在输注之前和输注结束时,然后在给药结束后15min(±2min)、30min(±2min)、1(±3min)、2(±6min)和4小时(±12min)时观察注射部位。此后,每天观察注射部位直至第17天,尽管从第10天起未观察到局部反应。根据以下评分系统对参数评分:0-不存在;1-最小;2-轻微;3中度;和4-显著。
血液样品的药代动力学
从第1天开始,采集所有动物的血液样品。在以下时间点进行血液采样:预处理、输注结束后2分钟内、以及输注结束后1(±3min)、4(±12min)、24(±1小时12min)、48(±2小时24min)、72、96、168、192、264、336、504和672小时(容差从72小时开始为±3小时)。
使用美国加利福尼亚州山景城的Pharsight Corporation的Phoenix WinNonlin版本6.3软件执行药代动力学(PK)分析。适当地进行使用WinNonlin血浆模型(静脉输注和血管外剂量模型)的非隔室分析。
来自每只动物的血浆浓度-时间数据用于药代动力学计算。除个别动物的参数估计值外,还报告了适当的描述性统计数据(例如,均值、标准差和变异系数)。每只动物的所有参数均来自第1天治疗后血浆中的各个测试品浓度。为了确定各个药代动力学参数,将低于定量限的浓度视为零。为了确定平均浓度,将低于定量限的样品视为零。
使用标称剂量水平估算参数。由于没有记录到与标称值的时间偏差超过15%的情况,因此使用标称采样时间对参数进行了估算。将第1天的给药前浓度设定为零。
描述性统计(均值、标准差,如适用)和药代动力学参数据报道为三个有效数字。报告的变异系数不带小数位。
估算了伊沙妥昔单抗的以下PK参数:
·Cmax-观察到的最大浓度,
·tmax-最大浓度的时间,
·C最后-最后可测量的浓度,
·t最后-最后可测量浓度的时间,
·AUC0-24h-使用线性梯形法则通过非隔室分析计算从0至24小时的血浆浓度-时间曲线下的面积,
·AUC0-72h-使用线性梯形法则通过非隔室分析计算从0至72小时的血浆浓度-时间曲线下的面积,
·AUC0-168h-使用线性梯形法则通过非隔室分析计算从0至168小时的血浆浓度-时间曲线下的面积,
·AUC0-t-由0-t计算得出的血浆浓度-时间曲线下的面积,其中t是最后可测量浓度的时间,是使用线性梯形法则通过非隔室分析计算的,
·使用AUC0-24h、AUC0-72h、AUC0-168h和AUC0-t评价了SC输注相对IV输注的生物利用度。
针对IV途径计算了其他参数(即t1/2z,Vz.,CL)。
从SC注射部位收集皮肤活检(第2至4组)
在第8天和第29天,使用6mm活检打孔器从第2组至第4组所有动物的左皮下输注部位(测试项目部位)进行了3次深度约7-10mm的皮肤活检,以进行组织病理学检查。在给药用盐水(阴性对照)后第8天进行收集,以便能够在输注期间监测动物。
在第8天收集的活检(1-3号活检)取自输注区的前半部分。从背部区域收集1号活检,从中部区域收集2号活检,并从腹侧部分收集3号活检。在第29天收集的活检以类似的方式从输注区域的后半部分收集。此外,在两天中,从所有动物的相同区域收集了来自剂量区域之外的未经处理的对照(4号活检)。
在第15天和第36天,以相似的方式从第2至4组中所有动物的右皮下输注部位(盐水部位)收集皮肤活检。
在第15天收集的活检(5-7号活检)取自输注区的前半部分。从背部区域收集5号活检,从中部区域收集6号活检,并从腹侧部分收集7号活检。在第36天收集的活检以类似的方式从输注区域的后半部分收集。此外,在两天中,从所有动物的相同区域收集了来自剂量区域之外的未经处理的对照(8号活检)。
将来自每只动物的每次活检置于单独的容器中,并固定在磷酸盐缓冲的中性4%甲醛中。
结果
在任何动物中均未观察到与测试样品相关的临床体征。
在第1天和第2天,对三只动物(第1组第4号和第2组第6和7号)的皮肤触摸是温暖的。但是,由于受影响的动物数量很少,因此被认为是偶然发现。
在所有组中,在输注当天对输注部位的局部反应进行评分。前几天没有评分。
在第1天(伊沙妥昔单抗)的第2组(0.5mL/min)中,在输注结束后的前两个小时内,在所有动物中在输注部位主要注释了轻微红斑,在三只动物中观察到最小至中度肿胀(水泡形成)。此外,三只动物在输注结束后的前15分钟内出血最少。
对于第8天(0.5mL/min的盐水)的第2组,在输注结束后的前两个小时内,所有动物中在输注部位主要注释了最小红斑,在两只动物中观察到最小至中度肿胀(水泡形成)。此外,输注结束后在三只动物中观察到最少出血。
在第1天(伊沙妥昔单抗)的第3组(1mL/min)中,在输注结束后的前4小时内在输注部位的四只动物中观察到最小至轻微红斑,在输注结束后4小时三只动物出现最小至显著肿胀(水泡形成),尺寸减小。输注结束后的前30分钟内,在三只动物中观察到一只动物的最少出血和轻微出血。
对于第8天(1mL/min的盐水)的第3组,在输注结束后的前4小时内所有动物中在输注部位观察到最小至轻微红斑,在输注结束后2小时一只动物在给药后具有最小至中度肿胀(水泡形成),尺寸减小。在输注结束后的前15分钟内,在所有动物中观察到一只动物的最少出血和轻微出血。
在第1天(伊沙妥昔单抗),在第4组(2mL/min)中,在输注结束后的前2小时内在四只动物中在输注部位观察到最小至轻微红斑(一只动物中度),在输注结束后4小时动物给药后出现显著肿胀(水泡形成),尺寸减小。两只动物在输注结束时显示最少出血。
对于第8天(2mL/min的盐水)的第4组,在输注结束后的前30分钟内所有动物中在输注部位主要观察到最小红斑(两例轻微),在输注结束后1小时两只动物在给药后出现中度肿胀(水泡形成),尺寸减小。在输注结束时,在两只动物中观察到最少出血。
输注过程中未观察到渗漏迹象。
表29-SC输注部位的局部反应发现的概述
药代动力学
依沙妥昔单抗随时间的各个血浆浓度显示在图24-27中。
使用Phoenix WinNonlin版本6.3药代动力学软件进行血浆水平数据的非隔室药代动力学分析。
表30-单次静脉内(IV)或皮下(SC)输注后小型猪血浆中伊沙妥昔单抗的平均(CV%,n=5)药代动力学参数
结束=输注结束
1使用AUC最后计算
2中值[min-max]
3中值、min和max的值相同
4高F值与对该组注释的较高变异性有关;2/5动物的贡献显示暴露量明显更高
在研究中,从输注结束开始收集的所有血浆样品中的伊沙妥昔单抗均可量化,但除了对第4组女性在SC输注结束时和对第3组在SC输注后1小时采集的单个样品低于定量下限(LLOQ)的情况。所有给药前样品中的浓度均低于LLOQ。对于SC和IV途径,曲线分别与血管外和静脉内给药一致。总体而言,IV输注在PK参数中观察到的变异性较低,而SC输注在低至中度。
在30分钟的时间内以1800mg/动物将伊沙妥昔单抗单次IV输注给小型猪之后,在所有动物的输注期结束时均观察到最大血浆水平。在0.5、1或2mL/min的流速下以1806mg/动物将伊沙妥昔单抗单次SC输注给小型猪之后,分别在输注结束后96、192和168小时观察到最大血浆水平中值。但是,单个的Tmax值在48至264小时的范围内,并且显示与SC输注速率无关。
在30分钟的时间内以1800mg/动物将伊沙妥昔单抗单次IV输注给小型猪之后,在整个672小时的剂量后采样期间(AUC最后)的平均AUC为364,000hr*μg/mL。在以0.5、1或2mL/min的流速以1806mg/动物将伊沙妥昔单抗单次SC输注给小型猪之后,在整个672小时的剂量后采样期间(AUC最后)的平均AUC分别为326,000、565,000和369,000hr*μg/mL。每个SC组的AUC最后值大体相似,表明输注速率对暴露没有影响。
在该研究的条件下,当以0.5、1或2mL/min的流速向小型猪SC输注时,伊沙妥昔单抗的绝对SC生物利用度与在每个AUC间隔所测试的3个流速大致相似。当使用整个672小时的剂量后采样期间(AUC最后)的AUC计算时,生物利用度随着AUC间隔的增加而增加,在0.5、1和2mL/min的流速下分别达到0.89、1.55和1.01的F值。对于以1mL/min输注的组,估计的高F值与对该组注释的较高变异性有关;2/5动物的贡献显示暴露量明显更高。
总的来说,得出的结论是当以0.5至2mL/min的流速通过SC输注以1806mg/动物(140mg/mL的溶液)的剂量给予时,小型猪中伊沙妥昔单抗的绝对SC生物利用度至少为89%。
皮肤活检的显微镜检查
在注射部位皮肤活检的显微镜检查中,任何皮下组均未观察到与治疗相关的变化。显微镜下的发现主要是单核细胞的局灶性浸润最少,而表皮的局灶性痂最少,皮下剂量组之间的发生率和形态无差异。同样地,当比较剂量组(相同的输注速度)中盐水(阴性对照)治疗的注射部位与测试样品治疗的注射部位时,发现被认为是相似的。所有显微镜检查发现均被认为是小型猪皮肤中众所周知的偶然背景变化。
讨论
依沙妥昔单抗,当以3mL/min的流速并以1800mg/动物的剂量通过静脉内输注(20mg/mL溶液)或当以0.5、1或2mL/min的流速以1806mg/动物的剂量皮下输注(作为实施例5的配制品F4中的140mg/mL溶液)给予雌性小型猪时,在临床和组织病理学上都很好地耐受了。
仅在输注当天在部位观察到所有组的皮下注射部位处的局部反应。
对于三种测试的皮下流速(0.5、1和2mL/min),红斑和出血的发生率和严重程度评分是相当的,而伊沙妥昔单抗和盐水阴性对照的红斑和出血的发生率和严重程度评分相似。但是,与以0.5mL/min输注相比,以1mL/min和2mL/min输注的伊沙妥昔单抗在输注部位的肿胀(水泡形成)更为明显。这很可能是一种物理现象,与在单个部位注射的大体积有关,其严重程度与输注时间成反向相关,并且从输注部位排出的流体速率恒定。此外,输注伊沙妥昔单抗后的肿胀比输注盐水后更显著。输注盐水后的肿胀在所有3种流速下均相当。
在注射部位皮肤活检的显微镜检查中,任何皮下组均未观察到与治疗相关的变化。
在30分钟的时间内以1800mg/动物将伊沙妥昔单抗单次IV输注给小型猪之后,在所有动物的输注期结束时均观察到最大血浆水平。在0.5、1或2mL/min的流速下以1806mg/动物将伊沙妥昔单抗单次SC输注给小型猪之后,分别在输注结束后96、192和168小时观察到最大血浆水平中值。但是,单个的Tmax值在48至264小时的范围内,并且显示与SC输注速率无关。
在30分钟的时间内以1800mg/动物将伊沙妥昔单抗单次IV输注给小型猪之后,在整个672小时的剂量后采样期间(AUC最后)的平均AUC为364,000hr*μg/mL。在以0.5、1或2mL/min的流速以1806mg/动物将伊沙妥昔单抗单次SC输注给小型猪之后,在整个672小时的剂量后采样期间(AUC最后)的平均AUC分别为326,000、565,000和369,000hr*μg/mL。每个SC组的AUC最后值大体相似,表明输注速率对暴露没有影响。
在该研究的条件下,当以0.5、1或2mL/min的流速向小型猪SC输注时,实施例4的F4中配制的伊沙妥昔单抗的绝对SC生物利用度与在所考虑的每个AUC间隔所测试的3个流速大致相似。当使用整个672小时的剂量后采样期间(AUC最后)的AUC计算时,生物利用度随着AUC间隔的增加而增加,在0.5、1和2mL/min的流速下分别达到0.89、1.55和1.01的F值。对于以1mL/min输注的组,估计的高F值与对该组注释的较高变异性有关;2/5动物的贡献显示暴露量明显更高。
实施例7-人类皮下伊沙妥昔单抗的1b期研究
该实施例描述了多中心、开放标签、1b期研究,旨在评估皮下和静脉内注射伊沙妥昔单抗与泊马度胺和地塞米松组合在复发/难治性多发性骨髓瘤(RRMM)患者中的药代动力学、安全性和疗效。
本研究旨在首次评估伊沙妥昔单抗的SC施用。此外,SC配制品与用于IV给药的配制品不同。与上述以前的研究相似,将伊沙妥昔单抗SC与泊马度胺和地塞米松组合施用于类似的患者群体中。该研究还包括使用伊沙妥昔单抗IV施用的群组,用以评估相对于伊沙妥昔单抗SC的安全性和PK。
研究的主要终点是:(i)评价使用输液泵皮下施用(SC)伊沙妥昔单抗与静脉内施用(IV)伊沙妥昔单抗的安全性和耐受性(包括局部注射部位耐受性);以及(ii)评价当与泊马度胺和地塞米松组合SC和IV给予时,伊沙妥昔单抗的药代动力学。所述研究的次要终点包括:(i)估计伊沙妥昔单抗SC和IV的绝对生物利用度;(ii)测量SC施用与IV施用后骨髓抽吸物的浆细胞中伊沙妥昔单抗的CD38受体占有率(RO);以及(iii)评价伊沙妥昔单抗SC/IV施用的疗效。
所述研究包括5个参与者群组。将患者随机分配到群组1a(SC 1000mg剂量)或群组1b(IV)中(2:1的随机化比率)。在评价了1a群组中的伊沙妥昔单抗SC安全性、PK和RO数据后,将其他参与者随机分配到2a或2b群组中(随机比率为2:1),在2a群组中使用更高剂量的伊沙妥昔单抗SC(1400mg剂量),且在2b群组中使用相同的IV剂量。一旦2a和2b群组中的所有患者均完成了治疗的第1周期,就应在施用伊妥昔单抗SC和IV后对安全性、PK和RO数据进行最终审查。在确认推荐的2期剂量(RP2D)水平后,在群组2c中招募了其他22名患者,并以该剂量水平施用伊沙妥昔单抗SC。表31更详细地描述了群组治疗。
表31–群组治疗详细信息
每周一次施用依沙妥昔单抗,持续4周(周期1),并在每个后续周期的第1天和第15天与泊马度胺和地塞米松组合施用。每个周期持续28天。研究中的所有参与者都继续治疗,直到疾病进展、不可接受的不良反应或其他终止原因为止。
群组1a、2a和2c通过皮下(SC)输注接受伊沙妥昔单抗配制品,其包含140mg/mL伊沙妥昔单抗、9mM组氨酸、110mM精氨酸一盐酸盐、2%(w/v)蔗糖和0.4%(w/v)泊洛沙姆188(pH 6.2)。1a、2a和2c群组在每28天周期的第1到21天也口服(p.o.)接受4mg泊马度胺;且在每28天周期的第1、8、15和22天口服地塞米松4mg。
1b和2b群组通过静脉内(IV)输注接受不同的伊沙妥昔单抗配制品,其包含20mg/mL伊沙妥昔单抗、20mM组氨酸、10%(w/v)蔗糖和0.02%(w/v)泊洛沙姆80(pH 6.0)。1b和2b群组在每28天周期的第1到21天也口服(p.o.)接受4mg泊马度胺;且在每28天周期的第1、8、15和22天口服地塞米松4mg。
在进行2a或2c群组之前,先分别审查了群组1a和群组2a的第1周期(前4周)的安全性、PK和RO数据。
对1群组(a/b)和2群组(a/b)中收集的安全性、PK和RO数据进行了审查,以支持选择最合适的SC伊沙妥昔单抗剂量RP2D。
根据PK模型和模拟,选择了1000mg的伊沙妥昔单抗剂量作为起始剂量,这证明即使假设80%的SC生物利用度,伊沙妥昔单抗浓度(第28天的谷血浆浓度[C谷])也将与IV施用10mg/kg和远低于20mg/kg IV后观察到的第28天浓度在相似范围内,这在临床上已显示是安全的。低于1000mg的剂量不被视为起始剂量,因为伊沙妥昔单抗的PK非线性。
SC伊沙妥昔单抗的1400mg剂量的选择基于使用IV数据建立的群体PK模型(n=l27)。该模型表明,以QWx4/Q2W施用的1400mg SC伊沙妥昔单抗可以将C谷维持在10mg/kgIV QWx4/Q2W后所达到的水平之上,假设绝对生物利用度为2:50%。PK/PD分析证明,第4周的C谷是反应的显著预测指标(客观反应率,IV施用)。
纳入标准包括以下:
根据国际骨髓瘤工作组(IMWG)标准,先前已根据规范标准被诊断出患有多发性骨髓瘤(MM)且目前因为MM在反应后已复发而需要治疗的患者。
已经接受了包括来那度胺和蛋白酶体抑制剂的至少2种先前的疗法并且在进行最后的疗法时或在最后的疗法完成后已经展现出疾病进展的患者;以及
定义为以下至少一项的具有可测量疾病的患者:
·血清M蛋白≥0.5g/dL(≥5g/L);
·尿液M蛋白≥200mg/24小时;以及
·血清游离轻链(FLC)测定:涉及的FLC测定≥10mg/dL(≥100mg/L)和异常的血清FLC比率(<0.26或>1.65)。
收集骨髓和血液样品用于以下生物标记物分析:
·在骨髓抽吸物的浆细胞中测量伊沙妥昔单抗的CD38受体占有率,并与PK参数和临床反应相关联。在筛选时和第2周期的第1天(给药前)收集骨髓样品。选择RP2D伊沙妥昔单抗SC剂量后,将停止该样品收集(仅1a/b群组和2a/b群组)。
·通过下一代测序在骨髓抽吸物中评估最小残留病(MRD),并与临床反应的参数相关联。在筛选所有参与者时以及在完全反应(CR)或非常好的部分反应(VGPR)的最大确认反应时收集骨髓样品。仅针对达到VGPR或更好的参与者分析筛选时的样品。
·在免疫电泳和免疫固定测定中,对M蛋白评估中潜在的伊沙妥昔单抗干扰是使用消除伊沙妥昔单抗干扰的测定对血清样品进行评估的。
序列表
<110> 赛诺菲-安万特美国有限责任公司
<120> 用于皮下施用的抗CD38抗体的配制品
<130> 712537: SA9-295TW
<160> 10
<170> PatentIn 3.5版
<210> 1
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 1
Asp Tyr Trp Met Gln
1 5
<210> 2
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 2
Thr Ile Tyr Pro Gly Asp Gly Asp Thr Gly Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 3
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 3
Gly Asp Tyr Tyr Gly Ser Asn Ser Leu Asp Tyr
1 5 10
<210> 4
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 4
Lys Ala Ser Gln Asp Val Ser Thr Val Val Ala
1 5 10
<210> 5
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 5
Ser Ala Ser Tyr Arg Tyr Ile
1 5
<210> 6
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 6
Gln Gln His Tyr Ser Pro Pro Tyr Thr
1 5
<210> 7
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 7
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Ala Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Lys Thr Val Tyr
65 70 75 80
Met His Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Tyr Gly Ser Asn Ser Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 8
Asp Ile Val Met Thr Gln Ser His Leu Ser Met Ser Thr Ser Leu Gly
1 5 10 15
Asp Pro Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Val
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Arg Arg Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ile Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ala Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Pro Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 9
<211> 450
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 9
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Ala Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Lys Thr Val Tyr
65 70 75 80
Met His Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Tyr Gly Ser Asn Ser Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 10
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 10
Asp Ile Val Met Thr Gln Ser His Leu Ser Met Ser Thr Ser Leu Gly
1 5 10 15
Asp Pro Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Val
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Arg Arg Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ile Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ala Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Pro Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
Claims (43)
1.一种包含至少100mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,
所述配制品包含降粘剂、稳定剂、缓冲剂和表面活性剂,且
所述配制品的pH为5.9-7.0,且在20℃下的粘度最多为25mPa·s。
2.根据权利要求1所述的配制品,其中所述降粘剂是90-150mM Arg-Cl。
3.根据权利要求2所述的配制品,其中所述降粘剂是90-125mM Arg-Cl。
4.根据权利要求2所述的配制品,其中所述降粘剂是110mM Arg-Cl。
5.根据前述权利要求中任一项所述的配制品,其中所述表面活性剂是泊洛沙姆188。
6.根据前述权利要求中任一项所述的配制品,其中所述表面活性剂是0.4%(w/v)的泊洛沙姆188。
7.根据前述权利要求中任一项所述的配制品,其中所述缓冲剂是组氨酸。
8.根据前述权利要求中任一项所述的配制品,其中所述缓冲剂是9mM组氨酸。
9.根据权利要求1所述的配制品,其中所述降粘剂是90-150mM Lys-Ac。
10.根据权利要求9所述的配制品,其中所述降粘剂是125mM Lys-Ac。
11.根据权利要求9或10所述的配制品,其中所述表面活性剂是聚山梨醇酯80。
12.根据权利要求11所述的配制品,其中所述表面活性剂是0.04%(w/v)的聚山梨醇酯80。
13.根据前述权利要求中任一项所述的配制品,其包含125-155mg/mL的所述抗CD38抗体。
14.根据前述权利要求中任一项所述的配制品,其包含140mg/mL的所述抗CD38抗体。
15.根据前述权利要求中任一项所述的配制品,其中所述稳定剂是蔗糖。
16.根据前述权利要求中任一项所述的配制品,其中所述稳定剂是2%(w/v)的蔗糖。
17.根据前述权利要求中任一项所述的配制品,其中所述pH为5.9-7.0。
18.根据权利要求17所述的配制品,其中所述pH为6.2-6.3。
19.一种包含140mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且其中
所述配制品的pH为6.2-6.3,且在20℃下的粘度最多为14mPa·s。
20.一种包含140mg/mL的抗CD38抗体的配制品,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,所述配制品包含125mM Lys-Ac、2%(w/v)的蔗糖以及0.04%(w/v)的聚山梨醇酯80,且
所述配制品的pH为6.2,且在20℃下的粘度最多为14mPa·s。
21.根据前述权利要求中任一项所述的配制品,其中所述配制品适合于皮下施用。
22.根据权利要求21所述的配制品,其中所述皮下施用是大体积皮下施用。
23.根据前述权利要求中任一项所述的配制品,其中所述抗CD38抗体的VH包含SEQ IDNO:7中列出的氨基酸序列,且所述抗CD38抗体的VL包含SEQ ID NO:8中列出的氨基酸序列。
24.根据前述权利要求中任一项所述的配制品,其中所述抗CD38抗体是伊沙妥昔单抗。
25.一种经包装的药物产品,其包含无菌容器,所述无菌容器包含治疗有效量的根据权利要求1至24中任一项所述的配制品。
26.一种装置,其包含治疗有效量的根据权利要求1至24中任一项所述的配制品。
27.根据权利要求26所述的装置,其中所述装置选自注射器、注射器驱动器和包含所述配制品的输液泵。
28.根据权利要求27所述的装置,其中所述注射器是预填充式注射器。
29.一种治疗以CD38+细胞的存在或活性为特征的疾病或病症的方法,其包括向有需要的受试者施用有效量的根据权利要求1至8或13至19中任一项所述的配制品,其中所述配制品是皮下施用的。
30.根据权利要求29所述的方法,其中所述以CD38+细胞的存在或活性为特征的疾病或病症是CD38+血液恶性肿瘤。
31.根据权利要求29所述的方法,其中所述以CD38+细胞的存在或活性为特征的疾病或病症是自身免疫疾病或病症或者炎性疾病或病症。
32.一种治疗CD38+血液恶性肿瘤的方法,其包括向有需要的受试者施用有效量的根据权利要求1至8或13至19中任一项所述的配制品,其中所述配制品是皮下施用的。
33.根据权利要求32所述的方法,其中所述配制品包含140mg/mL的抗CD38抗体,其中
所述抗CD38抗体包含可变重链区(VH),其包含分别含有SEQ ID NO:1-3中列出的氨基酸序列的三个互补决定区(CDR)CDR-H1、CDR-H2和CDR-H3;以及可变轻链区(VL),其包含分别含有SEQ ID NO:4-6中列出的氨基酸序列的三个CDR CDR-L1、CDR-L2和CDR-L3,所述配制品包含9mM组氨酸、110mM Arg-Cl、2%(w/v)的蔗糖和0.4%(w/v)的泊洛沙姆188,且其中
所述配制品的pH为6.2或6.3,且在20℃下的粘度最多为14mPa·s。
34.根据权利要求32或33所述的方法,其中通过皮下输注施用所述配制品。
35.根据权利要求34所述的方法,其中所述皮下输注是大体积皮下输注。
36.根据权利要求34所述的方法,其中所述受试者是人类,且所述大体积皮下输注为5至10mL。
37.根据权利要求32至34中任一项所述的方法,其中所述CD38+血液恶性肿瘤是多发性骨髓瘤。
38.根据权利要求37所述的方法,其中多发性骨髓瘤是复发/难治性多发性骨髓瘤。
39.根据权利要求37或38所述的方法,其进一步包括向所述受试者施用一种或多种选自皮质类固醇、蛋白酶体抑制剂、免疫调节药物、化疗药物及其组合的药剂。
40.根据权利要求39所述的方法,其中所述化疗药物选自阿糖胞苷、柔红霉素、道诺霉素、多柔比星、脂质体多柔比星、伊达比星、米托蒽醌、吉妥珠单抗、氯法拉滨、克拉屈滨、羟基脲、依托泊苷、美法仑、环磷酰胺、长春新碱及其组合。
41.根据权利要求39所述的方法,其中所述蛋白酶体抑制剂选自卡非佐米、硼替佐米及其组合。
42.根据权利要求39所述的方法,其中所述免疫调节药物选自沙利度胺、来那度胺、泊马度胺及其组合。
43.根据权利要求39所述的方法,其中所述皮质类固醇是地塞米松。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962944082P | 2019-12-05 | 2019-12-05 | |
| US62/944,082 | 2019-12-05 | ||
| PCT/US2020/063452 WO2021113739A1 (en) | 2019-12-05 | 2020-12-04 | Formulations of anti-cd38 antibodies for subcutaneous administration |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN115698064A true CN115698064A (zh) | 2023-02-03 |
Family
ID=74130308
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202080094829.6A Pending CN115698064A (zh) | 2019-12-05 | 2020-12-04 | 用于皮下施用的抗cd38抗体的配制品 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20210188996A1 (zh) |
| EP (1) | EP4069743A1 (zh) |
| JP (1) | JP2023505217A (zh) |
| KR (1) | KR20220159947A (zh) |
| CN (1) | CN115698064A (zh) |
| AU (1) | AU2020397170A1 (zh) |
| BR (1) | BR112022010905A2 (zh) |
| CA (1) | CA3160502A1 (zh) |
| CO (1) | CO2022009089A2 (zh) |
| IL (1) | IL293563A (zh) |
| MX (1) | MX2022006882A (zh) |
| TW (1) | TW202133879A (zh) |
| WO (1) | WO2021113739A1 (zh) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11655302B2 (en) | 2019-06-10 | 2023-05-23 | Sanofi | Anti-CD38 antibodies and formulations |
| WO2023212526A1 (en) * | 2022-04-26 | 2023-11-02 | Keystone Bio, Inc. | Formulation for antigen-binding molecules that bind to porphyromonas gingivalis |
| WO2024023843A1 (en) * | 2022-07-26 | 2024-02-01 | Dr. Reddy’S Laboratories Limited | A pharmaceutical formulation of a therapeuticantibody and preparations thereof |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5449345A (en) | 1989-03-17 | 1995-09-12 | Merit Medical Systems, Inc. | Detachable and reusable digital control unit for monitoring balloon catheter data in a syringe inflation system |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US5722956A (en) | 1995-08-24 | 1998-03-03 | The General Hospital Corporation | Multi-dose syringe driver |
| US6645177B1 (en) | 1999-02-09 | 2003-11-11 | Alaris Medical Systems, Inc. | Directly engaged syringe driver system |
| US6428509B1 (en) | 1999-07-29 | 2002-08-06 | Alaris Medical Systems, Inc. | Syringe plunger driver system and method |
| US7195610B1 (en) | 2001-09-17 | 2007-03-27 | Cardinal Health 303, Inc. | Pneumatic syringe driver |
| US7150724B2 (en) | 2002-06-05 | 2006-12-19 | Cardinal Health 303, Inc. | Syringe plunger driver system |
| SI2567976T1 (sl) | 2005-03-23 | 2017-11-30 | Genmab A/S | Protitelesa usmerjena proti cd38 za zdravljenje multiplega mieloma |
| US7867197B2 (en) | 2006-03-29 | 2011-01-11 | The General Hospital Corporation | Single-dose syringe driver |
| EP1914242A1 (en) | 2006-10-19 | 2008-04-23 | Sanofi-Aventis | Novel anti-CD38 antibodies for the treatment of cancer |
| EP2191842A1 (en) | 2008-11-28 | 2010-06-02 | Sanofi-Aventis | Antitumor combinations containing antibodies recognizing specifically CD38 and cytarabine |
| EP2191840A1 (en) | 2008-11-28 | 2010-06-02 | Sanofi-Aventis | Antitumor combinations containing antibodies recognizing specifically CD38 and melphalan |
| EP2191841A1 (en) | 2008-11-28 | 2010-06-02 | Sanofi-Aventis | Antitumor combinations containing antibodies recognizing specifically CD38 and vincristine |
| EP2191843A1 (en) | 2008-11-28 | 2010-06-02 | Sanofi-Aventis | Antitumor combinations containing antibodies recognizing specifically CD38 and cyclophosphamide |
| UA112170C2 (uk) | 2010-12-10 | 2016-08-10 | Санофі | Протипухлинна комбінація, що містить антитіло, яке специфічно розпізнає cd38, і бортезоміб |
| UA118255C2 (uk) | 2012-12-07 | 2018-12-26 | Санофі | Композиція, яка містить антитіло до cd38 і леналідомід |
| RU2723937C2 (ru) | 2013-03-13 | 2020-06-18 | Санофи | Композиции, включающие антитела к cd38 и карфилзомиб |
| PL3063173T3 (pl) | 2013-10-31 | 2021-01-11 | Sanofi | Swoiste przeciwciała anty-cd38 do leczenia nowotworów u ludzi |
| EP3240571A4 (en) * | 2014-12-31 | 2018-06-13 | NovelMed Therapeutics, Inc. | Formulation of aglycosylated therapeutic antibodies |
| CN108472369A (zh) * | 2015-11-03 | 2018-08-31 | 詹森生物科技公司 | 抗cd38抗体的皮下制剂及其用途 |
| SG11202003754YA (en) * | 2017-05-16 | 2020-05-28 | Bhamis Research Laboratory Pvt Ltd | High concentration protein formulations with reduced viscosity |
| MA54860A (fr) * | 2019-01-28 | 2022-05-04 | Sanofi Sa | Méthodes de traitement du myélome multiple |
| MX2021012968A (es) * | 2019-04-23 | 2022-01-18 | Sanofi Sa | Formulaciones de anticuerpo de baja viscosidad, estables y usos de las mismas. |
-
2020
- 2020-12-04 TW TW109142916A patent/TW202133879A/zh unknown
- 2020-12-04 CA CA3160502A patent/CA3160502A1/en active Pending
- 2020-12-04 US US17/112,768 patent/US20210188996A1/en active Pending
- 2020-12-04 BR BR112022010905A patent/BR112022010905A2/pt unknown
- 2020-12-04 MX MX2022006882A patent/MX2022006882A/es unknown
- 2020-12-04 CN CN202080094829.6A patent/CN115698064A/zh active Pending
- 2020-12-04 IL IL293563A patent/IL293563A/en unknown
- 2020-12-04 KR KR1020227022845A patent/KR20220159947A/ko unknown
- 2020-12-04 AU AU2020397170A patent/AU2020397170A1/en active Pending
- 2020-12-04 EP EP20838318.2A patent/EP4069743A1/en active Pending
- 2020-12-04 JP JP2022533413A patent/JP2023505217A/ja active Pending
- 2020-12-04 WO PCT/US2020/063452 patent/WO2021113739A1/en active Application Filing
-
2022
- 2022-06-29 CO CONC2022/0009089A patent/CO2022009089A2/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CA3160502A1 (en) | 2021-06-10 |
| JP2023505217A (ja) | 2023-02-08 |
| CO2022009089A2 (es) | 2022-07-08 |
| IL293563A (en) | 2022-08-01 |
| EP4069743A1 (en) | 2022-10-12 |
| AU2020397170A1 (en) | 2022-07-21 |
| BR112022010905A2 (pt) | 2022-09-06 |
| TW202133879A (zh) | 2021-09-16 |
| WO2021113739A1 (en) | 2021-06-10 |
| MX2022006882A (es) | 2022-11-08 |
| US20210188996A1 (en) | 2021-06-24 |
| KR20220159947A (ko) | 2022-12-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI733664B (zh) | 包含抗pd1抗體及另一種抗體之組合的組合物 | |
| KR102594028B1 (ko) | 항-pd-1 항체 조성물 | |
| KR20180067693A (ko) | 항-cd38 항체의 피하 제제 및 이의 용도 | |
| TR201808801T4 (tr) | İmmünoglobulin formülasyonu ve bunun hazırlanış yöntemi. | |
| CN115698064A (zh) | 用于皮下施用的抗cd38抗体的配制品 | |
| US20240252629A1 (en) | Methods of treating tumors | |
| TW202011954A (zh) | 第三期nsclc之治療及與該治療相關之病理症狀之減緩 | |
| TWI782397B (zh) | 重組全人源抗tigit單株抗體製劑及其製備方法和用途 | |
| EP4326242A1 (en) | High concentration bispecific antibody formulations | |
| TW202003577A (zh) | 用於在未曾接受過治療之個體治療癌症的標靶性TGF-β抑制之給藥方案 | |
| TW202019405A (zh) | 用於治療晚期非小細胞肺癌之標靶性TGF-β抑制之組合療法 | |
| CN116745322A (zh) | 使用抗岩藻糖基-gm1抗体的组合疗法 | |
| KR20220146488A (ko) | 항-cd30 항체-약물 컨쥬게이트 및 비-호지킨 림프종의 치료를 위한 그의 용도 | |
| CN113365659A (zh) | 抗pd-l1抗体治疗头颈癌的用途 | |
| CN111683681A (zh) | 包含抗ox40抗体的制剂、其制备方法及其用途 | |
| WO2023235847A1 (en) | Antibody compositions and methods of use thereof | |
| KR20240100493A (ko) | 항-cd22 항체의 수성 제제 및 이의 용도 | |
| KR20240027701A (ko) | 동결건조 제형의 재구성 방법 | |
| CN116710071A (zh) | Pd1/pd-l1抗体的皮下施用 | |
| CN118924895A (zh) | 用于癌症治疗的结合her2、nkg2d和cd16的多特异性结合蛋白的药物制剂和剂量方案 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |