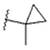
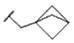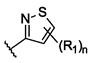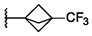CN115667253A - 可用于抑制ret激酶的化合物 - Google Patents
可用于抑制ret激酶的化合物 Download PDFInfo
- Publication number
- CN115667253A CN115667253A CN202180044981.8A CN202180044981A CN115667253A CN 115667253 A CN115667253 A CN 115667253A CN 202180044981 A CN202180044981 A CN 202180044981A CN 115667253 A CN115667253 A CN 115667253A
- Authority
- CN
- China
- Prior art keywords
- cancer
- mmol
- pharmaceutically acceptable
- amino
- ret
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000001875 compounds Chemical class 0.000 title claims description 311
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 title abstract description 9
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 title abstract description 7
- 230000005764 inhibitory process Effects 0.000 title description 6
- 150000003839 salts Chemical class 0.000 claims abstract description 51
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 21
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 10
- 201000010099 disease Diseases 0.000 claims abstract description 9
- -1 cyano, hydroxy, oxo, methyl Chemical group 0.000 claims description 114
- 206010028980 Neoplasm Diseases 0.000 claims description 70
- 229910052736 halogen Inorganic materials 0.000 claims description 54
- 150000002367 halogens Chemical class 0.000 claims description 48
- 201000011510 cancer Diseases 0.000 claims description 43
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 42
- 125000004201 2,4-dichlorophenyl group Chemical group [H]C1=C([H])C(*)=C(Cl)C([H])=C1Cl 0.000 claims description 39
- 238000000034 method Methods 0.000 claims description 31
- 206010033701 Papillary thyroid cancer Diseases 0.000 claims description 28
- 208000030045 thyroid gland papillary carcinoma Diseases 0.000 claims description 28
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 22
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 18
- 208000020816 lung neoplasm Diseases 0.000 claims description 17
- 206010006187 Breast cancer Diseases 0.000 claims description 15
- 208000026310 Breast neoplasm Diseases 0.000 claims description 15
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 claims description 15
- 201000002510 thyroid cancer Diseases 0.000 claims description 15
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 14
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 14
- 201000005202 lung cancer Diseases 0.000 claims description 14
- 125000006432 1-methyl cyclopropyl group Chemical group [H]C([H])([H])C1(*)C([H])([H])C1([H])[H] 0.000 claims description 13
- 125000003118 aryl group Chemical group 0.000 claims description 12
- 206010009944 Colon cancer Diseases 0.000 claims description 10
- 239000003814 drug Substances 0.000 claims description 9
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 9
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 claims description 8
- 208000009018 Medullary thyroid cancer Diseases 0.000 claims description 8
- 125000002619 bicyclic group Chemical group 0.000 claims description 8
- 208000015799 differentiated thyroid carcinoma Diseases 0.000 claims description 8
- 201000005249 lung adenocarcinoma Diseases 0.000 claims description 8
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 8
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 7
- 208000037196 Medullary thyroid carcinoma Diseases 0.000 claims description 7
- 208000033781 Thyroid carcinoma Diseases 0.000 claims description 7
- 208000013077 thyroid gland carcinoma Diseases 0.000 claims description 7
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 claims description 6
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 6
- 206010041067 Small cell lung cancer Diseases 0.000 claims description 6
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 claims description 6
- 208000000587 small cell lung carcinoma Diseases 0.000 claims description 6
- 125000004953 trihalomethyl group Chemical group 0.000 claims description 6
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 6
- 208000003200 Adenoma Diseases 0.000 claims description 5
- 201000009030 Carcinoma Diseases 0.000 claims description 5
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 5
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 claims description 5
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 5
- 201000010881 cervical cancer Diseases 0.000 claims description 5
- 229910052805 deuterium Inorganic materials 0.000 claims description 5
- 230000002124 endocrine Effects 0.000 claims description 5
- 230000002496 gastric effect Effects 0.000 claims description 5
- 229910052739 hydrogen Inorganic materials 0.000 claims description 5
- 239000001257 hydrogen Substances 0.000 claims description 5
- 201000010279 papillary renal cell carcinoma Diseases 0.000 claims description 5
- 208000025061 parathyroid hyperplasia Diseases 0.000 claims description 5
- 208000028591 pheochromocytoma Diseases 0.000 claims description 5
- 230000000306 recurrent effect Effects 0.000 claims description 5
- PHTOWWPGFXEOCZ-UHFFFAOYSA-N FS(F)(F)(F)F Chemical compound FS(F)(F)(F)F PHTOWWPGFXEOCZ-UHFFFAOYSA-N 0.000 claims description 4
- 125000002618 bicyclic heterocycle group Chemical group 0.000 claims description 4
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 4
- 125000001072 heteroaryl group Chemical group 0.000 claims description 4
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 4
- 210000005265 lung cell Anatomy 0.000 claims description 4
- 208000013818 thyroid gland medullary carcinoma Diseases 0.000 claims description 4
- 125000006716 (C1-C6) heteroalkyl group Chemical group 0.000 claims description 3
- 206010001233 Adenoma benign Diseases 0.000 claims description 3
- KLJYQOSMCTZTGU-UHFFFAOYSA-N difluoromethanethiol Chemical compound FC(F)S KLJYQOSMCTZTGU-UHFFFAOYSA-N 0.000 claims description 3
- 239000003085 diluting agent Substances 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 3
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 3
- 238000002560 therapeutic procedure Methods 0.000 claims description 3
- 150000002431 hydrogen Chemical class 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 229940043355 kinase inhibitor Drugs 0.000 abstract description 5
- 239000003757 phosphotransferase inhibitor Substances 0.000 abstract description 5
- 230000002757 inflammatory effect Effects 0.000 abstract description 4
- 208000037765 diseases and disorders Diseases 0.000 abstract 1
- 239000000203 mixture Substances 0.000 description 159
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 141
- 230000008707 rearrangement Effects 0.000 description 133
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 122
- 238000002360 preparation method Methods 0.000 description 100
- 239000007787 solid Substances 0.000 description 93
- 230000002829 reductive effect Effects 0.000 description 82
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 75
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 74
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 71
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 70
- 235000019439 ethyl acetate Nutrition 0.000 description 70
- 239000000243 solution Substances 0.000 description 66
- 238000006243 chemical reaction Methods 0.000 description 59
- 239000012071 phase Substances 0.000 description 58
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 57
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 56
- 239000011734 sodium Substances 0.000 description 48
- 108091000080 Phosphotransferase Proteins 0.000 description 44
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 44
- 102000020233 phosphotransferase Human genes 0.000 description 44
- 125000004398 2-methyl-2-butyl group Chemical group CC(C)(CC)* 0.000 description 37
- 238000000746 purification Methods 0.000 description 37
- 230000035772 mutation Effects 0.000 description 33
- 229920006395 saturated elastomer Polymers 0.000 description 32
- 229910052799 carbon Inorganic materials 0.000 description 31
- 239000000284 extract Substances 0.000 description 31
- 125000004289 pyrazol-3-yl group Chemical group [H]N1N=C(*)C([H])=C1[H] 0.000 description 31
- 238000003818 flash chromatography Methods 0.000 description 29
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 28
- 101150077555 Ret gene Proteins 0.000 description 27
- 230000000694 effects Effects 0.000 description 27
- 230000014509 gene expression Effects 0.000 description 27
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 25
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 25
- 230000002441 reversible effect Effects 0.000 description 25
- 239000003153 chemical reaction reagent Substances 0.000 description 22
- 239000000460 chlorine Substances 0.000 description 22
- 108090000623 proteins and genes Proteins 0.000 description 22
- 230000035484 reaction time Effects 0.000 description 22
- 239000012141 concentrate Substances 0.000 description 20
- 238000010898 silica gel chromatography Methods 0.000 description 20
- 239000012267 brine Substances 0.000 description 19
- 102000004169 proteins and genes Human genes 0.000 description 19
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 19
- 230000008482 dysregulation Effects 0.000 description 18
- 239000011541 reaction mixture Substances 0.000 description 18
- 210000004027 cell Anatomy 0.000 description 17
- 239000003112 inhibitor Substances 0.000 description 17
- 235000018102 proteins Nutrition 0.000 description 17
- 102200006099 rs79658334 Human genes 0.000 description 16
- 238000005481 NMR spectroscopy Methods 0.000 description 15
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 15
- 238000003756 stirring Methods 0.000 description 15
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 14
- 239000000706 filtrate Substances 0.000 description 14
- 239000011780 sodium chloride Substances 0.000 description 14
- ZVXKYWHJBYIYNI-UHFFFAOYSA-N 1h-pyrazole-4-carboxamide Chemical compound NC(=O)C=1C=NNC=1 ZVXKYWHJBYIYNI-UHFFFAOYSA-N 0.000 description 13
- RJUFJBKOKNCXHH-UHFFFAOYSA-N Methyl propionate Chemical compound CCC(=O)OC RJUFJBKOKNCXHH-UHFFFAOYSA-N 0.000 description 13
- 230000037430 deletion Effects 0.000 description 13
- 238000012217 deletion Methods 0.000 description 13
- 235000019260 propionic acid Nutrition 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 12
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 12
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 11
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 11
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 11
- WARCRYXKINZHGQ-UHFFFAOYSA-N benzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1 WARCRYXKINZHGQ-UHFFFAOYSA-N 0.000 description 11
- 239000012043 crude product Substances 0.000 description 11
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 11
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 11
- 239000012258 stirred mixture Substances 0.000 description 11
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 10
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 10
- 229940125905 RET kinase inhibitor Drugs 0.000 description 10
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 10
- 238000003556 assay Methods 0.000 description 10
- 238000003821 enantio-separation Methods 0.000 description 10
- OAKJQQAXSVQMHS-UHFFFAOYSA-N hydrazine Substances NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 10
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- CIUQDSCDWFSTQR-UHFFFAOYSA-N [C]1=CC=CC=C1 Chemical compound [C]1=CC=CC=C1 CIUQDSCDWFSTQR-UHFFFAOYSA-N 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- 238000001914 filtration Methods 0.000 description 9
- 230000037431 insertion Effects 0.000 description 9
- 238000003780 insertion Methods 0.000 description 9
- 208000002551 irritable bowel syndrome Diseases 0.000 description 9
- 229940017219 methyl propionate Drugs 0.000 description 9
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 9
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 9
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 8
- BHKKSKOHRFHHIN-MRVPVSSYSA-N 1-[[2-[(1R)-1-aminoethyl]-4-chlorophenyl]methyl]-2-sulfanylidene-5H-pyrrolo[3,2-d]pyrimidin-4-one Chemical compound N[C@H](C)C1=C(CN2C(NC(C3=C2C=CN3)=O)=S)C=CC(=C1)Cl BHKKSKOHRFHHIN-MRVPVSSYSA-N 0.000 description 8
- JVVRJMXHNUAPHW-UHFFFAOYSA-N 1h-pyrazol-5-amine Chemical compound NC=1C=CNN=1 JVVRJMXHNUAPHW-UHFFFAOYSA-N 0.000 description 8
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 8
- 102000001253 Protein Kinase Human genes 0.000 description 8
- 230000001594 aberrant effect Effects 0.000 description 8
- 235000001014 amino acid Nutrition 0.000 description 8
- 150000001413 amino acids Chemical class 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- 239000003054 catalyst Substances 0.000 description 8
- 238000004296 chiral HPLC Methods 0.000 description 8
- 238000010790 dilution Methods 0.000 description 8
- 239000012895 dilution Substances 0.000 description 8
- 239000012065 filter cake Substances 0.000 description 8
- 150000007857 hydrazones Chemical class 0.000 description 8
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical compound CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 8
- 229940080818 propionamide Drugs 0.000 description 8
- 108060006633 protein kinase Proteins 0.000 description 8
- 238000010791 quenching Methods 0.000 description 8
- 239000000741 silica gel Substances 0.000 description 8
- 229910002027 silica gel Inorganic materials 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- ZOYUTXAEVFZRGX-UHFFFAOYSA-N 2-[4-(5-amino-4-cyano-1-propan-2-ylpyrazol-3-yl)phenyl]propanoic acid Chemical compound CC(C)N(C(N)=C1C#N)N=C1C1=CC=C(C(C)C(O)=O)C=C1 ZOYUTXAEVFZRGX-UHFFFAOYSA-N 0.000 description 7
- 241000282414 Homo sapiens Species 0.000 description 7
- 239000007864 aqueous solution Substances 0.000 description 7
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 7
- 238000010828 elution Methods 0.000 description 7
- 239000010410 layer Substances 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 102220122598 rs76625876 Human genes 0.000 description 7
- 125000001424 substituent group Chemical group 0.000 description 7
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 7
- KKFDJZZADQONDE-UHFFFAOYSA-N (hydridonitrato)hydroxidocarbon(.) Chemical compound O[C]=N KKFDJZZADQONDE-UHFFFAOYSA-N 0.000 description 6
- NUGZBVBZIDWZAD-UHFFFAOYSA-N 1h-pyrazole-4-carbonitrile Chemical compound N#CC=1C=NNC=1 NUGZBVBZIDWZAD-UHFFFAOYSA-N 0.000 description 6
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 6
- CWYJLHGNNDTCDC-UHFFFAOYSA-N 5-amino-3-[4-[1-[[3-(2,2-dimethylpropyl)-1,2-oxazol-5-yl]amino]-1-oxopropan-2-yl]phenyl]-1-propan-2-ylpyrazole-4-carboxamide Chemical compound CC(C)N(C(N)=C1C(N)=O)N=C1C1=CC=C(C(C)C(NC2=CC(CC(C)(C)C)=NO2)=O)C=C1 CWYJLHGNNDTCDC-UHFFFAOYSA-N 0.000 description 6
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 6
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 6
- 101000974343 Homo sapiens Nuclear receptor coactivator 4 Proteins 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 6
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 6
- 102100022927 Nuclear receptor coactivator 4 Human genes 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- 125000005842 heteroatom Chemical group 0.000 description 6
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 6
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N n-Butyllithium Substances [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- 230000000171 quenching effect Effects 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 5
- 125000004429 atom Chemical group 0.000 description 5
- 125000004432 carbon atom Chemical group C* 0.000 description 5
- 239000013058 crude material Substances 0.000 description 5
- QUPDWYMUPZLYJZ-UHFFFAOYSA-N ethyl Chemical compound C[CH2] QUPDWYMUPZLYJZ-UHFFFAOYSA-N 0.000 description 5
- 102000037865 fusion proteins Human genes 0.000 description 5
- 108020001507 fusion proteins Proteins 0.000 description 5
- 239000012044 organic layer Substances 0.000 description 5
- 239000012074 organic phase Substances 0.000 description 5
- 102200006097 rs79658334 Human genes 0.000 description 5
- 230000011664 signaling Effects 0.000 description 5
- WKEGBBMVTGIFIR-UHFFFAOYSA-N 2-[4-(5-amino-4-carbamoyl-1-propan-2-ylpyrazol-3-yl)phenyl]propanoic acid Chemical compound CC(C)N(C(N)=C1C(N)=O)N=C1C1=CC=C(C(C)C(O)=O)C=C1 WKEGBBMVTGIFIR-UHFFFAOYSA-N 0.000 description 4
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 4
- YHCHATDVXPJZKU-UHFFFAOYSA-N 3-(2,2-dimethylpropyl)-1,2-oxazol-5-amine Chemical compound CC(C)(C)CC=1C=C(N)ON=1 YHCHATDVXPJZKU-UHFFFAOYSA-N 0.000 description 4
- USPMHEZGVPMUAW-UHFFFAOYSA-N 5-amino-3-[5-[1-[[3-(2,2-dimethylpropyl)-1,2-oxazol-5-yl]amino]-1-oxopropan-2-yl]pyridin-2-yl]-1-propan-2-ylpyrazole-4-carboxamide Chemical compound CC(C)N(C(N)=C1C(N)=O)N=C1C1=NC=C(C(C)C(NC2=CC(CC(C)(C)C)=NO2)=O)C=C1 USPMHEZGVPMUAW-UHFFFAOYSA-N 0.000 description 4
- CJLHTKGWEUGORV-UHFFFAOYSA-N Artemin Chemical compound C1CC2(C)C(O)CCC(=C)C2(O)C2C1C(C)C(=O)O2 CJLHTKGWEUGORV-UHFFFAOYSA-N 0.000 description 4
- 206010052358 Colorectal cancer metastatic Diseases 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- 208000014767 Myeloproliferative disease Diseases 0.000 description 4
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 4
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 150000001499 aryl bromides Chemical class 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 201000010902 chronic myelomonocytic leukemia Diseases 0.000 description 4
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 4
- 238000002868 homogeneous time resolved fluorescence Methods 0.000 description 4
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 4
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- 201000002528 pancreatic cancer Diseases 0.000 description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 description 4
- 102220322542 rs764784013 Human genes 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 230000005945 translocation Effects 0.000 description 4
- LBEGUUNLNFJDSY-UHFFFAOYSA-N (1-methylcyclopropyl)hydrazine hydrochloride Chemical compound CC1(CC1)NN.Cl LBEGUUNLNFJDSY-UHFFFAOYSA-N 0.000 description 3
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 3
- CRBHJTAZXKMAGU-UHFFFAOYSA-N 2-[6-(5-amino-4-cyano-1-propan-2-ylpyrazol-3-yl)pyridin-3-yl]propanoic acid Chemical compound CC(C)N(C(N)=C1C#N)N=C1C1=CC=C(C(C)C(O)=O)C=N1 CRBHJTAZXKMAGU-UHFFFAOYSA-N 0.000 description 3
- CBTACQKUWICLPE-UHFFFAOYSA-N 3-(2-chloro-4-fluorophenyl)-1,2-oxazol-5-amine Chemical compound O1C(N)=CC(C=2C(=CC(F)=CC=2)Cl)=N1 CBTACQKUWICLPE-UHFFFAOYSA-N 0.000 description 3
- GLQVGWKUATWUMD-UHFFFAOYSA-N 3-oxo-3-[3-(trifluoromethyl)-1-bicyclo[1.1.1]pentanyl]propanenitrile Chemical compound N#CCC(C(C1)(C2)CC12C(F)(F)F)=O GLQVGWKUATWUMD-UHFFFAOYSA-N 0.000 description 3
- DGVCZUFPVQUFNY-UHFFFAOYSA-N 5-amino-3-(4-bromo-2-fluorophenyl)-1-(1-methylcyclopropyl)pyrazole-4-carbonitrile Chemical compound CC1(CC1)N(C(N)=C1C#N)N=C1C(C=CC(Br)=C1)=C1F DGVCZUFPVQUFNY-UHFFFAOYSA-N 0.000 description 3
- PESKMFPBZOGZBA-UHFFFAOYSA-N 5-amino-3-(4-bromophenyl)-1-(1-methylcyclopropyl)pyrazole-4-carbonitrile Chemical compound CC1(CC1)N(C(N)=C1C#N)N=C1C(C=C1)=CC=C1Br PESKMFPBZOGZBA-UHFFFAOYSA-N 0.000 description 3
- YGTKFNGMWSEHNO-UHFFFAOYSA-N 5-amino-3-(4-bromophenyl)-1-propan-2-ylpyrazole-4-carbonitrile Chemical compound N#CC1=C(N)N(C(C)C)N=C1C1=CC=C(Br)C=C1 YGTKFNGMWSEHNO-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 3
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 3
- OVVUNXXROOFSIM-SDDRHHMPSA-N Arg-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O OVVUNXXROOFSIM-SDDRHHMPSA-N 0.000 description 3
- 102220618619 Arginine-glutamic acid dipeptide repeats protein_V804E_mutation Human genes 0.000 description 3
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 3
- 102100031048 Coiled-coil domain-containing protein 6 Human genes 0.000 description 3
- 206010010774 Constipation Diseases 0.000 description 3
- 102100029505 E3 ubiquitin-protein ligase TRIM33 Human genes 0.000 description 3
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 description 3
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 description 3
- 101000777370 Homo sapiens Coiled-coil domain-containing protein 6 Proteins 0.000 description 3
- 101000634991 Homo sapiens E3 ubiquitin-protein ligase TRIM33 Proteins 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 3
- 208000007727 Muscle Tissue Neoplasms Diseases 0.000 description 3
- 208000033833 Myelomonocytic Chronic Leukemia Diseases 0.000 description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 150000001336 alkenes Chemical class 0.000 description 3
- 125000000217 alkyl group Chemical group 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- 108010013835 arginine glutamate Proteins 0.000 description 3
- 230000035578 autophosphorylation Effects 0.000 description 3
- 201000008275 breast carcinoma Diseases 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 208000029742 colonic neoplasm Diseases 0.000 description 3
- 239000012045 crude solution Substances 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 108010050848 glycylleucine Proteins 0.000 description 3
- 230000002489 hematologic effect Effects 0.000 description 3
- 150000002429 hydrazines Chemical class 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 239000000543 intermediate Substances 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 125000004284 isoxazol-3-yl group Chemical group [H]C1=C([H])C(*)=NO1 0.000 description 3
- 125000004499 isoxazol-5-yl group Chemical group O1N=CC=C1* 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 239000002480 mineral oil Substances 0.000 description 3
- 235000010446 mineral oil Nutrition 0.000 description 3
- 208000024305 myofibroblastoma Diseases 0.000 description 3
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 102220007199 rs377767418 Human genes 0.000 description 3
- 102220007211 rs377767426 Human genes 0.000 description 3
- 102200006308 rs74799832 Human genes 0.000 description 3
- 125000003003 spiro group Chemical group 0.000 description 3
- 206010043688 thyroid adenoma Diseases 0.000 description 3
- 238000001665 trituration Methods 0.000 description 3
- 108010009962 valyltyrosine Proteins 0.000 description 3
- 238000010626 work up procedure Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- IAXWZYXUKABJAN-UHFFFAOYSA-N 1,2-oxazol-5-amine Chemical compound NC1=CC=NO1 IAXWZYXUKABJAN-UHFFFAOYSA-N 0.000 description 2
- OJVAMHKKJGICOG-UHFFFAOYSA-N 2,5-hexanedione Chemical compound CC(=O)CCC(C)=O OJVAMHKKJGICOG-UHFFFAOYSA-N 0.000 description 2
- ZHAOZSGXPJYHCR-UHFFFAOYSA-N 3-(2,2-dimethylpropyl)-4-fluoro-1,2-oxazol-5-amine Chemical compound CC(C)(C)CC1=NOC(N)=C1F ZHAOZSGXPJYHCR-UHFFFAOYSA-N 0.000 description 2
- FPVJIZIHNFOULB-UHFFFAOYSA-N 3-(3,3-dimethylcyclobutyl)-1,2-oxazol-5-amine Chemical compound CC(C)(C1)CC1C1=NOC(N)=C1 FPVJIZIHNFOULB-UHFFFAOYSA-N 0.000 description 2
- OZOXAMVWRYJQAE-UHFFFAOYSA-N 3-(3-methyl-1-bicyclo[1.1.1]pentanyl)-1,2-oxazol-5-amine Chemical compound CC(C1)(C2)CC12C1=NOC(N)=C1 OZOXAMVWRYJQAE-UHFFFAOYSA-N 0.000 description 2
- XVOSAYBYHGHPGM-UHFFFAOYSA-N 3-(3-methyl-1-bicyclo[1.1.1]pentanyl)-3-oxopropanenitrile Chemical compound CC(C1)(C2)CC12C(CC#N)=O XVOSAYBYHGHPGM-UHFFFAOYSA-N 0.000 description 2
- ITXAYBQSMMRRPJ-UHFFFAOYSA-N 3-[3-(trifluoromethyl)-1-bicyclo[1.1.1]pentanyl]-1,2-oxazol-5-amine Chemical compound NC1=CC(C(C2)(C3)CC23C(F)(F)F)=NO1 ITXAYBQSMMRRPJ-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 2
- AJZPKCNMAULNPR-UHFFFAOYSA-N 5-(2-methylbutan-2-yl)-1,2-oxazol-3-amine Chemical compound CCC(C)(C)C1=CC(N)=NO1 AJZPKCNMAULNPR-UHFFFAOYSA-N 0.000 description 2
- FVDQZHAZQKYCSB-UHFFFAOYSA-N 5-amino-3-[4-[1-[(5-tert-butyl-1,2-thiazol-3-yl)amino]-1-oxopropan-2-yl]phenyl]-1-propan-2-ylpyrazole-4-carboxamide Chemical compound CC(C)N(C(N)=C1C(N)=O)N=C1C1=CC=C(C(C)C(NC2=NSC(C(C)(C)C)=C2)=O)C=C1 FVDQZHAZQKYCSB-UHFFFAOYSA-N 0.000 description 2
- CJTVSANTDRFRAK-UHFFFAOYSA-N 5-amino-3-[4-[1-[[3-(1-bicyclo[1.1.1]pentanylmethyl)-1,2-oxazol-5-yl]amino]-1-oxopropan-2-yl]phenyl]-1-propan-2-ylpyrazole-4-carboxamide Chemical compound CC(C)N(C(N)=C1C(N)=O)N=C1C1=CC=C(C(C)C(NC2=CC(CC3(C4)CC4C3)=NO2)=O)C=C1 CJTVSANTDRFRAK-UHFFFAOYSA-N 0.000 description 2
- NBHZYSKHVQXYPS-UHFFFAOYSA-N 5-amino-3-[6-[1-[[3-(2-methylbutan-2-yl)-1,2-oxazol-5-yl]amino]-1-oxopropan-2-yl]pyridin-3-yl]-1-propan-2-ylpyrazole-4-carboxamide Chemical compound CCC(C)(C)C1=NOC(NC(C(C)C(N=C2)=CC=C2C2=NN(C(C)C)C(N)=C2C(N)=O)=O)=C1 NBHZYSKHVQXYPS-UHFFFAOYSA-N 0.000 description 2
- XHZWFUVEKDDQPF-UHFFFAOYSA-N 5-bromo-1h-pyrazole Chemical compound BrC1=CC=NN1 XHZWFUVEKDDQPF-UHFFFAOYSA-N 0.000 description 2
- 102100024049 A-kinase anchor protein 13 Human genes 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 2
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 2
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 2
- 102100026376 Artemin Human genes 0.000 description 2
- 101710205806 Artemin Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- GBYNUKLBMUWOFG-UHFFFAOYSA-N CC(C)N1N=CC(C#N)=C1N(C(OC(C)(C)C)=O)C(OC(C)(C)C)=O Chemical compound CC(C)N1N=CC(C#N)=C1N(C(OC(C)(C)C)=O)C(OC(C)(C)C)=O GBYNUKLBMUWOFG-UHFFFAOYSA-N 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 102100038415 ELKS/Rab6-interacting/CAST family member 1 Human genes 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 208000018522 Gastrointestinal disease Diseases 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- XTQFHTHIAKKCTM-YFKPBYRVSA-N Gly-Glu-Gly Chemical compound NCC(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O XTQFHTHIAKKCTM-YFKPBYRVSA-N 0.000 description 2
- JBCLFWXMTIKCCB-UHFFFAOYSA-N H-Gly-Phe-OH Natural products NCC(=O)NC(C(O)=O)CC1=CC=CC=C1 JBCLFWXMTIKCCB-UHFFFAOYSA-N 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 101000833679 Homo sapiens A-kinase anchor protein 13 Proteins 0.000 description 2
- 101001100208 Homo sapiens ELKS/Rab6-interacting/CAST family member 1 Proteins 0.000 description 2
- 101000581507 Homo sapiens Methyl-CpG-binding domain protein 1 Proteins 0.000 description 2
- 101001134861 Homo sapiens Pericentriolar material 1 protein Proteins 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 2
- XVZCXCTYGHPNEM-UHFFFAOYSA-N Leu-Leu-Pro Natural products CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O XVZCXCTYGHPNEM-UHFFFAOYSA-N 0.000 description 2
- JIHDFWWRYHSAQB-GUBZILKMSA-N Leu-Ser-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCC(O)=O JIHDFWWRYHSAQB-GUBZILKMSA-N 0.000 description 2
- SVBJIZVVYJYGLA-DCAQKATOSA-N Leu-Ser-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O SVBJIZVVYJYGLA-DCAQKATOSA-N 0.000 description 2
- VUTWYNQUSJWBHO-BZSNNMDCSA-N Lys-Leu-Tyr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O VUTWYNQUSJWBHO-BZSNNMDCSA-N 0.000 description 2
- 102100027383 Methyl-CpG-binding domain protein 1 Human genes 0.000 description 2
- 102000005431 Molecular Chaperones Human genes 0.000 description 2
- 108010006519 Molecular Chaperones Proteins 0.000 description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 2
- 208000037538 Myelomonocytic Juvenile Leukemia Diseases 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- XZFYRXDAULDNFX-UHFFFAOYSA-N N-L-cysteinyl-L-phenylalanine Natural products SCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XZFYRXDAULDNFX-UHFFFAOYSA-N 0.000 description 2
- SDASXEJIBXWWMG-KPKJPENVSA-N N-[(E)-(4-bromophenyl)methylideneamino]propan-2-amine Chemical compound CC(C)N/N=C/C(C=C1)=CC=C1Br SDASXEJIBXWWMG-KPKJPENVSA-N 0.000 description 2
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 2
- 108010002311 N-glycylglutamic acid Proteins 0.000 description 2
- 208000006066 Neoplasms by Site Diseases 0.000 description 2
- 102100021584 Neurturin Human genes 0.000 description 2
- 108010015406 Neurturin Proteins 0.000 description 2
- 208000033755 Neutrophilic Chronic Leukemia Diseases 0.000 description 2
- 102100036660 Persephin Human genes 0.000 description 2
- JIYJYFIXQTYDNF-YDHLFZDLSA-N Phe-Asn-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC1=CC=CC=C1)N JIYJYFIXQTYDNF-YDHLFZDLSA-N 0.000 description 2
- QARPMYDMYVLFMW-KKUMJFAQSA-N Phe-Pro-Glu Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(O)=O)C1=CC=CC=C1 QARPMYDMYVLFMW-KKUMJFAQSA-N 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 208000033766 Prolymphocytic Leukemia Diseases 0.000 description 2
- 208000033826 Promyelocytic Acute Leukemia Diseases 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- NLOAIFSWUUFQFR-CIUDSAMLSA-N Ser-Leu-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O NLOAIFSWUUFQFR-CIUDSAMLSA-N 0.000 description 2
- AZWNCEBQZXELEZ-FXQIFTODSA-N Ser-Pro-Ser Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O AZWNCEBQZXELEZ-FXQIFTODSA-N 0.000 description 2
- 102100021400 Sickle tail protein homolog Human genes 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 208000017733 acquired polycythemia vera Diseases 0.000 description 2
- 208000036676 acute undifferentiated leukemia Diseases 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 2
- 108010060035 arginylproline Proteins 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- QUKGYYKBILRGFE-UHFFFAOYSA-N benzyl acetate Chemical compound CC(=O)OCC1=CC=CC=C1 QUKGYYKBILRGFE-UHFFFAOYSA-N 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 201000010903 chronic neutrophilic leukemia Diseases 0.000 description 2
- 238000010549 co-Evaporation Methods 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- OBDWNWOYULJOBW-UHFFFAOYSA-N dimethylphosphinite dimethylphosphinous acid platinum(2+) Chemical compound [Pt++].CP(C)O.CP(C)[O-].CP(C)[O-] OBDWNWOYULJOBW-UHFFFAOYSA-N 0.000 description 2
- 229960003722 doxycycline Drugs 0.000 description 2
- XQTWDDCIUJNLTR-CVHRZJFOSA-N doxycycline monohydrate Chemical compound O.O=C1C2=C(O)C=CC=C2[C@H](C)[C@@H]2C1=C(O)[C@]1(O)C(=O)C(C(N)=O)=C(O)[C@@H](N(C)C)[C@@H]1[C@H]2O XQTWDDCIUJNLTR-CVHRZJFOSA-N 0.000 description 2
- 235000019441 ethanol Nutrition 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000012458 free base Substances 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 230000004077 genetic alteration Effects 0.000 description 2
- 231100000118 genetic alteration Toxicity 0.000 description 2
- XBGGUPMXALFZOT-UHFFFAOYSA-N glycyl-L-tyrosine hemihydrate Natural products NCC(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 XBGGUPMXALFZOT-UHFFFAOYSA-N 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 108010092114 histidylphenylalanine Proteins 0.000 description 2
- 102000050427 human RET Human genes 0.000 description 2
- LIAWOTKNAVAKCX-UHFFFAOYSA-N hydrazine;dihydrochloride Chemical compound Cl.Cl.NN LIAWOTKNAVAKCX-UHFFFAOYSA-N 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 2
- 201000005992 juvenile myelomonocytic leukemia Diseases 0.000 description 2
- 238000000021 kinase assay Methods 0.000 description 2
- 229960003784 lenvatinib Drugs 0.000 description 2
- WOSKHXYHFSIKNG-UHFFFAOYSA-N lenvatinib Chemical compound C=12C=C(C(N)=O)C(OC)=CC2=NC=CC=1OC(C=C1Cl)=CC=C1NC(=O)NC1CC1 WOSKHXYHFSIKNG-UHFFFAOYSA-N 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 239000011572 manganese Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- OOFILLATSXDCOM-UHFFFAOYSA-N methyl 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]phenyl]propanoate Chemical compound CC(C(OC)=O)C(C=C1)=CC=C1C1=NN(C2(C)CC2)C(N)=C1C#N OOFILLATSXDCOM-UHFFFAOYSA-N 0.000 description 2
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 2
- 208000025113 myeloid leukemia Diseases 0.000 description 2
- XBXCNNQPRYLIDE-UHFFFAOYSA-M n-tert-butylcarbamate Chemical compound CC(C)(C)NC([O-])=O XBXCNNQPRYLIDE-UHFFFAOYSA-M 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000010451 perlite Substances 0.000 description 2
- 235000019362 perlite Nutrition 0.000 description 2
- 108010070453 persephin Proteins 0.000 description 2
- 108010018625 phenylalanylarginine Proteins 0.000 description 2
- 208000037244 polycythemia vera Diseases 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 150000003141 primary amines Chemical class 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 102220007216 rs267607011 Human genes 0.000 description 2
- 102220007200 rs377767419 Human genes 0.000 description 2
- 102200006306 rs377767430 Human genes 0.000 description 2
- 102220010313 rs377767442 Human genes 0.000 description 2
- 102200006162 rs75076352 Human genes 0.000 description 2
- 102200006166 rs77709286 Human genes 0.000 description 2
- 102200006095 rs77724903 Human genes 0.000 description 2
- 102220007221 rs78347871 Human genes 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000013207 serial dilution Methods 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 230000000707 stereoselective effect Effects 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 125000006633 tert-butoxycarbonylamino group Chemical group 0.000 description 2
- NCQGPMUZGGNYBW-UHFFFAOYSA-N tert-butyl N-[4-cyano-5-[6-[1-[[5-(2-methylbutan-2-yl)-1,2-oxazol-3-yl]amino]-1-oxopropan-2-yl]pyridin-3-yl]-2-propan-2-ylpyrazol-3-yl]carbamate Chemical compound CCC(C)(C)C1=CC(NC(C(C)C(N=C2)=CC=C2C2=NN(C(C)C)C(NC(OC(C)(C)C)=O)=C2C#N)=O)=NO1 NCQGPMUZGGNYBW-UHFFFAOYSA-N 0.000 description 2
- LFKDJXLFVYVEFG-UHFFFAOYSA-N tert-butyl carbamate Chemical compound CC(C)(C)OC(N)=O LFKDJXLFVYVEFG-UHFFFAOYSA-N 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 108010061238 threonyl-glycine Proteins 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- CYEKPWVHQSJODM-UHFFFAOYSA-N (1-methylcyclopropyl)hydrazine Chemical compound C1(NN)(CC1)C CYEKPWVHQSJODM-UHFFFAOYSA-N 0.000 description 1
- XVZCXCTYGHPNEM-IHRRRGAJSA-N (2s)-1-[(2s)-2-[[(2s)-2-amino-4-methylpentanoyl]amino]-4-methylpentanoyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(O)=O XVZCXCTYGHPNEM-IHRRRGAJSA-N 0.000 description 1
- NTUPOKHATNSWCY-PMPSAXMXSA-N (2s)-2-[[(2s)-1-[(2r)-2-amino-3-phenylpropanoyl]pyrrolidine-2-carbonyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound C([C@@H](N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)C1=CC=CC=C1 NTUPOKHATNSWCY-PMPSAXMXSA-N 0.000 description 1
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 1
- VYXHVRARDIDEHS-UHFFFAOYSA-N 1,5-cyclooctadiene Chemical compound C1CC=CCCC=C1 VYXHVRARDIDEHS-UHFFFAOYSA-N 0.000 description 1
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 1
- ABDDQTDRAHXHOC-QMMMGPOBSA-N 1-[(7s)-5,7-dihydro-4h-thieno[2,3-c]pyran-7-yl]-n-methylmethanamine Chemical compound CNC[C@@H]1OCCC2=C1SC=C2 ABDDQTDRAHXHOC-QMMMGPOBSA-N 0.000 description 1
- QEOBPMIXVYRLKE-UHFFFAOYSA-N 1-bromo-1,1-difluoropropan-2-one Chemical compound CC(=O)C(F)(F)Br QEOBPMIXVYRLKE-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- 125000004215 2,4-difluorophenyl group Chemical group [H]C1=C([H])C(*)=C(F)C([H])=C1F 0.000 description 1
- OVFRUXBYUUKVJK-UHFFFAOYSA-N 2-(4-bromo-2-fluorobenzoyl)propanedinitrile Chemical compound FC1=CC(Br)=CC=C1C(=O)C(C#N)C#N OVFRUXBYUUKVJK-UHFFFAOYSA-N 0.000 description 1
- PTFWMBRJNNGKJW-UHFFFAOYSA-N 2-[(4-bromo-2,3-difluorophenyl)-hydroxymethylidene]propanedinitrile Chemical compound N#CC(C#N)=C(C(C=CC(Br)=C1F)=C1F)O PTFWMBRJNNGKJW-UHFFFAOYSA-N 0.000 description 1
- ONOCOPYLLUDCAF-UHFFFAOYSA-N 2-[(4-bromo-2,3-difluorophenyl)-methoxymethylidene]propanedinitrile Chemical compound BrC1=C(C(=C(C=C1)C(=C(C#N)C#N)OC)F)F ONOCOPYLLUDCAF-UHFFFAOYSA-N 0.000 description 1
- WFSMCEKNUBDCGD-UHFFFAOYSA-N 2-[(4-bromo-2-fluorophenyl)-methoxymethylidene]propanedinitrile Chemical compound N#CC(C#N)=C(OC)C1=CC=C(Br)C=C1F WFSMCEKNUBDCGD-UHFFFAOYSA-N 0.000 description 1
- PYXJIIXBTXFWKU-UHFFFAOYSA-N 2-[(4-bromophenyl)-methoxymethylidene]propanedinitrile Chemical compound N#CC(C#N)=C(OC)C1=CC=C(Br)C=C1 PYXJIIXBTXFWKU-UHFFFAOYSA-N 0.000 description 1
- YRUDEDJYKDRPFR-UHFFFAOYSA-N 2-[4-(5-amino-4-cyano-1-propan-2-ylpyrazol-3-yl)phenyl]-N-[3-(2,2-dimethylpropyl)-1,2-oxazol-5-yl]propanamide Chemical compound CC(C)N(C(N)=C1C#N)N=C1C1=CC=C(C(C)C(NC2=CC(CC(C)(C)C)=NO2)=O)C=C1 YRUDEDJYKDRPFR-UHFFFAOYSA-N 0.000 description 1
- PJNLWJMAPDDGLZ-UHFFFAOYSA-N 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]-3-fluorophenyl]propanoic acid Chemical compound CC(C(O)=O)C(C=C1)=CC(F)=C1C1=NN(C2(C)CC2)C(N)=C1C#N PJNLWJMAPDDGLZ-UHFFFAOYSA-N 0.000 description 1
- SOAXVAKYOXXSHG-UHFFFAOYSA-N 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]phenyl]-N-[3-(2,2-dimethylpropyl)-1,2-oxazol-5-yl]propanamide Chemical compound CC(C(NC1=CC(CC(C)(C)C)=NO1)=O)C(C=C1)=CC=C1C1=NN(C2(C)CC2)C(N)=C1C#N SOAXVAKYOXXSHG-UHFFFAOYSA-N 0.000 description 1
- FHGSQKOZCXTQQF-UHFFFAOYSA-N 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]phenyl]propanoic acid Chemical compound CC(C(O)=O)C(C=C1)=CC=C1C1=NN(C2(C)CC2)C(N)=C1C#N FHGSQKOZCXTQQF-UHFFFAOYSA-N 0.000 description 1
- PFQYCLGNFRGOJA-UHFFFAOYSA-N 2-[5-[4-cyano-5-[(2-methylpropan-2-yl)oxycarbonylamino]-1-propan-2-ylpyrazol-3-yl]pyridin-2-yl]propanoic acid Chemical group CC(C)N(C(NC(OC(C)(C)C)=O)=C1C#N)N=C1C1=CN=C(C(C)C(O)=O)C=C1 PFQYCLGNFRGOJA-UHFFFAOYSA-N 0.000 description 1
- NYHOAEGAUVDZSX-UHFFFAOYSA-N 2-[6-(5-amino-4-cyano-1-propan-2-ylpyrazol-3-yl)pyridin-3-yl]-N-[3-(2,2-dimethylpropyl)-1,2-oxazol-5-yl]propanamide Chemical compound CC(C)N(C(N)=C1C#N)N=C1C1=CC=C(C(C)C(NC2=CC(CC(C)(C)C)=NO2)=O)C=N1 NYHOAEGAUVDZSX-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- AMDYYTRPAZZNES-UHFFFAOYSA-N 3-(2,4-dichlorophenyl)-1,2-oxazol-5-amine Chemical compound O1C(N)=CC(C=2C(=CC(Cl)=CC=2)Cl)=N1 AMDYYTRPAZZNES-UHFFFAOYSA-N 0.000 description 1
- AKSMJAXTUMPWCX-UHFFFAOYSA-N 3-(2,4-dichlorophenyl)-3-oxopropanenitrile Chemical compound ClC1=CC=C(C(=O)CC#N)C(Cl)=C1 AKSMJAXTUMPWCX-UHFFFAOYSA-N 0.000 description 1
- FRWOOSGBWOVTPP-UHFFFAOYSA-N 3-(3,3-dimethylcyclobutyl)-3-oxopropanenitrile Chemical compound CC1(CC(C1)C(CC#N)=O)C FRWOOSGBWOVTPP-UHFFFAOYSA-N 0.000 description 1
- WNEODWDFDXWOLU-QHCPKHFHSA-N 3-[3-(hydroxymethyl)-4-[1-methyl-5-[[5-[(2s)-2-methyl-4-(oxetan-3-yl)piperazin-1-yl]pyridin-2-yl]amino]-6-oxopyridin-3-yl]pyridin-2-yl]-7,7-dimethyl-1,2,6,8-tetrahydrocyclopenta[3,4]pyrrolo[3,5-b]pyrazin-4-one Chemical compound C([C@@H](N(CC1)C=2C=NC(NC=3C(N(C)C=C(C=3)C=3C(=C(N4C(C5=CC=6CC(C)(C)CC=6N5CC4)=O)N=CC=3)CO)=O)=CC=2)C)N1C1COC1 WNEODWDFDXWOLU-QHCPKHFHSA-N 0.000 description 1
- IFUHHVOEHBXDPB-UHFFFAOYSA-N 3-methoxy-2-methylprop-1-ene Chemical compound COCC(C)=C IFUHHVOEHBXDPB-UHFFFAOYSA-N 0.000 description 1
- FCKUFAMJTSMJSW-UHFFFAOYSA-N 4,4-dimethyl-3-oxohexanenitrile Chemical compound CCC(C)(C)C(=O)CC#N FCKUFAMJTSMJSW-UHFFFAOYSA-N 0.000 description 1
- BTNDDYKGSVIOIN-UHFFFAOYSA-N 4-(1-bicyclo[1.1.1]pentanyl)-3-oxobutanenitrile Chemical compound N#CCC(CC1(C2)CC2C1)=O BTNDDYKGSVIOIN-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- ZNBNBTIDJSKEAM-UHFFFAOYSA-N 4-[7-hydroxy-2-[5-[5-[6-hydroxy-6-(hydroxymethyl)-3,5-dimethyloxan-2-yl]-3-methyloxolan-2-yl]-5-methyloxolan-2-yl]-2,8-dimethyl-1,10-dioxaspiro[4.5]decan-9-yl]-2-methyl-3-propanoyloxypentanoic acid Chemical compound C1C(O)C(C)C(C(C)C(OC(=O)CC)C(C)C(O)=O)OC11OC(C)(C2OC(C)(CC2)C2C(CC(O2)C2C(CC(C)C(O)(CO)O2)C)C)CC1 ZNBNBTIDJSKEAM-UHFFFAOYSA-N 0.000 description 1
- WYZKTBOHUFVRGT-UHFFFAOYSA-N 4-bromo-2,3-difluorobenzoyl chloride Chemical compound FC1=C(F)C(C(Cl)=O)=CC=C1Br WYZKTBOHUFVRGT-UHFFFAOYSA-N 0.000 description 1
- ZRYZBQLXDKPBDU-UHFFFAOYSA-N 4-bromobenzaldehyde Chemical compound BrC1=CC=C(C=O)C=C1 ZRYZBQLXDKPBDU-UHFFFAOYSA-N 0.000 description 1
- RKNBCPYZUCVBRW-UHFFFAOYSA-N 5,5-difluoro-4,4-dimethyl-3-oxohexanenitrile Chemical compound CC(C)(C(C)(F)F)C(CC#N)=O RKNBCPYZUCVBRW-UHFFFAOYSA-N 0.000 description 1
- UBCSKYKURBXCGZ-UHFFFAOYSA-N 5-(3,3-difluoro-2-methylbutan-2-yl)-1,2-oxazol-3-amine Chemical compound CC(C)(C(C)(F)F)C1=CC(N)=NO1 UBCSKYKURBXCGZ-UHFFFAOYSA-N 0.000 description 1
- QSESIAWGOVMSSH-UHFFFAOYSA-N 5-amino-1-(1-bromo-1,1-difluoropropan-2-yl)-3-(4-bromophenyl)pyrazole-4-carbonitrile Chemical compound CC(C(F)(F)Br)N(C(N)=C1C#N)N=C1C(C=C1)=CC=C1Br QSESIAWGOVMSSH-UHFFFAOYSA-N 0.000 description 1
- HWLUYAARRNLXJL-UHFFFAOYSA-N 5-amino-1-propan-2-ylpyrazole-4-carbonitrile Chemical compound CC(C)N1N=CC(C#N)=C1N HWLUYAARRNLXJL-UHFFFAOYSA-N 0.000 description 1
- JJTBCNVVRNFOII-UHFFFAOYSA-N 5-amino-3-[4-[1-[[3-(3-methyl-1-bicyclo[1.1.1]pentanyl)-1,2-oxazol-5-yl]amino]-1-oxopropan-2-yl]phenyl]-1-propan-2-ylpyrazole-4-carboxamide Chemical compound CC(C)N(C(N)=C1C(N)=O)N=C1C1=CC=C(C(C)C(NC2=CC(C3(C4)CC4(C)C3)=NO2)=O)C=C1 JJTBCNVVRNFOII-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 206010000060 Abdominal distension Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 102100036780 Actin filament-associated protein 1 Human genes 0.000 description 1
- 102100040634 Actin filament-associated protein 1-like 2 Human genes 0.000 description 1
- 102100035919 Acyl-CoA-binding domain-containing protein 5 Human genes 0.000 description 1
- RLMISHABBKUNFO-WHFBIAKZSA-N Ala-Ala-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O RLMISHABBKUNFO-WHFBIAKZSA-N 0.000 description 1
- FJVAQLJNTSUQPY-CIUDSAMLSA-N Ala-Ala-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN FJVAQLJNTSUQPY-CIUDSAMLSA-N 0.000 description 1
- DVWVZSJAYIJZFI-FXQIFTODSA-N Ala-Arg-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(O)=O DVWVZSJAYIJZFI-FXQIFTODSA-N 0.000 description 1
- GWFSQQNGMPGBEF-GHCJXIJMSA-N Ala-Asp-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](C)N GWFSQQNGMPGBEF-GHCJXIJMSA-N 0.000 description 1
- LGFCAXJBAZESCF-ACZMJKKPSA-N Ala-Gln-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O LGFCAXJBAZESCF-ACZMJKKPSA-N 0.000 description 1
- FVSOUJZKYWEFOB-KBIXCLLPSA-N Ala-Gln-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)N FVSOUJZKYWEFOB-KBIXCLLPSA-N 0.000 description 1
- KXEVYGKATAMXJJ-ACZMJKKPSA-N Ala-Glu-Asp Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O KXEVYGKATAMXJJ-ACZMJKKPSA-N 0.000 description 1
- WKOBSJOZRJJVRZ-FXQIFTODSA-N Ala-Glu-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O WKOBSJOZRJJVRZ-FXQIFTODSA-N 0.000 description 1
- LJFNNUBZSZCZFN-WHFBIAKZSA-N Ala-Gly-Cys Chemical compound N[C@@H](C)C(=O)NCC(=O)N[C@@H](CS)C(=O)O LJFNNUBZSZCZFN-WHFBIAKZSA-N 0.000 description 1
- CKLDHDOIYBVUNP-KBIXCLLPSA-N Ala-Ile-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(O)=O CKLDHDOIYBVUNP-KBIXCLLPSA-N 0.000 description 1
- YHKANGMVQWRMAP-DCAQKATOSA-N Ala-Leu-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YHKANGMVQWRMAP-DCAQKATOSA-N 0.000 description 1
- OYJCVIGKMXUVKB-GARJFASQSA-N Ala-Leu-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N OYJCVIGKMXUVKB-GARJFASQSA-N 0.000 description 1
- MEFILNJXAVSUTO-JXUBOQSCSA-N Ala-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MEFILNJXAVSUTO-JXUBOQSCSA-N 0.000 description 1
- HYIDEIQUCBKIPL-CQDKDKBSSA-N Ala-Phe-His Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)N HYIDEIQUCBKIPL-CQDKDKBSSA-N 0.000 description 1
- WEZNQZHACPSMEF-QEJZJMRPSA-N Ala-Phe-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=CC=C1 WEZNQZHACPSMEF-QEJZJMRPSA-N 0.000 description 1
- FFZJHQODAYHGPO-KZVJFYERSA-N Ala-Pro-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](C)N FFZJHQODAYHGPO-KZVJFYERSA-N 0.000 description 1
- DCVYRWFAMZFSDA-ZLUOBGJFSA-N Ala-Ser-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O DCVYRWFAMZFSDA-ZLUOBGJFSA-N 0.000 description 1
- YNOCMHZSWJMGBB-GCJQMDKQSA-N Ala-Thr-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O YNOCMHZSWJMGBB-GCJQMDKQSA-N 0.000 description 1
- IETUUAHKCHOQHP-KZVJFYERSA-N Ala-Thr-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@H](C)N)[C@@H](C)O)C(O)=O IETUUAHKCHOQHP-KZVJFYERSA-N 0.000 description 1
- IEAUDUOCWNPZBR-LKTVYLICSA-N Ala-Trp-Gln Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N IEAUDUOCWNPZBR-LKTVYLICSA-N 0.000 description 1
- XCIGOVDXZULBBV-DCAQKATOSA-N Ala-Val-Lys Chemical compound CC(C)[C@H](NC(=O)[C@H](C)N)C(=O)N[C@@H](CCCCN)C(O)=O XCIGOVDXZULBBV-DCAQKATOSA-N 0.000 description 1
- 208000001446 Anaplastic Thyroid Carcinoma Diseases 0.000 description 1
- KWKQGHSSNHPGOW-BQBZGAKWSA-N Arg-Ala-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)NCC(O)=O KWKQGHSSNHPGOW-BQBZGAKWSA-N 0.000 description 1
- PVSNBTCXCQIXSE-JYJNAYRXSA-N Arg-Arg-Phe Chemical compound NC(=N)NCCC[C@H](N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 PVSNBTCXCQIXSE-JYJNAYRXSA-N 0.000 description 1
- BVBKBQRPOJFCQM-DCAQKATOSA-N Arg-Asn-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O BVBKBQRPOJFCQM-DCAQKATOSA-N 0.000 description 1
- IIABBYGHLYWVOS-FXQIFTODSA-N Arg-Asn-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O IIABBYGHLYWVOS-FXQIFTODSA-N 0.000 description 1
- RWCLSUOSKWTXLA-FXQIFTODSA-N Arg-Asp-Ala Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(O)=O RWCLSUOSKWTXLA-FXQIFTODSA-N 0.000 description 1
- VXXHDZKEQNGXNU-QXEWZRGKSA-N Arg-Asp-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCCN=C(N)N VXXHDZKEQNGXNU-QXEWZRGKSA-N 0.000 description 1
- DQNLFLGFZAUIOW-FXQIFTODSA-N Arg-Cys-Ala Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](C)C(O)=O DQNLFLGFZAUIOW-FXQIFTODSA-N 0.000 description 1
- RKRSYHCNPFGMTA-CIUDSAMLSA-N Arg-Glu-Asn Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O RKRSYHCNPFGMTA-CIUDSAMLSA-N 0.000 description 1
- UFBURHXMKFQVLM-CIUDSAMLSA-N Arg-Glu-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O UFBURHXMKFQVLM-CIUDSAMLSA-N 0.000 description 1
- OTZMRMHZCMZOJZ-SRVKXCTJSA-N Arg-Leu-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O OTZMRMHZCMZOJZ-SRVKXCTJSA-N 0.000 description 1
- SSZGOKWBHLOCHK-DCAQKATOSA-N Arg-Lys-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCCN=C(N)N SSZGOKWBHLOCHK-DCAQKATOSA-N 0.000 description 1
- PAPSMOYMQDWIOR-AVGNSLFASA-N Arg-Lys-Val Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O PAPSMOYMQDWIOR-AVGNSLFASA-N 0.000 description 1
- YCYXHLZRUSJITQ-SRVKXCTJSA-N Arg-Pro-Pro Chemical compound NC(=N)NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 YCYXHLZRUSJITQ-SRVKXCTJSA-N 0.000 description 1
- UVTGNSWSRSCPLP-UHFFFAOYSA-N Arg-Tyr Natural products NC(CCNC(=N)N)C(=O)NC(Cc1ccc(O)cc1)C(=O)O UVTGNSWSRSCPLP-UHFFFAOYSA-N 0.000 description 1
- ULBHWNVWSCJLCO-NHCYSSNCSA-N Arg-Val-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CCCN=C(N)N ULBHWNVWSCJLCO-NHCYSSNCSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- NUHQMYUWLUSRJX-BIIVOSGPSA-N Asn-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)N)N NUHQMYUWLUSRJX-BIIVOSGPSA-N 0.000 description 1
- GXMSVVBIAMWMKO-BQBZGAKWSA-N Asn-Arg-Gly Chemical compound NC(=O)C[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CCCN=C(N)N GXMSVVBIAMWMKO-BQBZGAKWSA-N 0.000 description 1
- XQQVCUIBGYFKDC-OLHMAJIHSA-N Asn-Asp-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XQQVCUIBGYFKDC-OLHMAJIHSA-N 0.000 description 1
- TWVTVZUGEDBAJF-ACZMJKKPSA-N Asn-Cys-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CC(=O)N)N TWVTVZUGEDBAJF-ACZMJKKPSA-N 0.000 description 1
- SRUUBQBAVNQZGJ-LAEOZQHASA-N Asn-Gln-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC(=O)N)N SRUUBQBAVNQZGJ-LAEOZQHASA-N 0.000 description 1
- FTCGGKNCJZOPNB-WHFBIAKZSA-N Asn-Gly-Ser Chemical compound NC(=O)C[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O FTCGGKNCJZOPNB-WHFBIAKZSA-N 0.000 description 1
- YXVAESUIQFDBHN-SRVKXCTJSA-N Asn-Phe-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(O)=O YXVAESUIQFDBHN-SRVKXCTJSA-N 0.000 description 1
- FMNBYVSGRCXWEK-FOHZUACHSA-N Asn-Thr-Gly Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O FMNBYVSGRCXWEK-FOHZUACHSA-N 0.000 description 1
- AMGQTNHANMRPOE-LKXGYXEUSA-N Asn-Thr-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O AMGQTNHANMRPOE-LKXGYXEUSA-N 0.000 description 1
- UPAGTDJAORYMEC-VHWLVUOQSA-N Asn-Trp-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CC(=O)N)N UPAGTDJAORYMEC-VHWLVUOQSA-N 0.000 description 1
- XPGVTUBABLRGHY-BIIVOSGPSA-N Asp-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)O)N XPGVTUBABLRGHY-BIIVOSGPSA-N 0.000 description 1
- FANQWNCPNFEPGZ-WHFBIAKZSA-N Asp-Asp-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O FANQWNCPNFEPGZ-WHFBIAKZSA-N 0.000 description 1
- QXHVOUSPVAWEMX-ZLUOBGJFSA-N Asp-Asp-Ser Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O QXHVOUSPVAWEMX-ZLUOBGJFSA-N 0.000 description 1
- ZRAOLTNMSCSCLN-ZLUOBGJFSA-N Asp-Cys-Asn Chemical compound C([C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(=O)N)C(=O)O)N)C(=O)O ZRAOLTNMSCSCLN-ZLUOBGJFSA-N 0.000 description 1
- IJHUZMGJRGNXIW-CIUDSAMLSA-N Asp-Glu-Arg Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IJHUZMGJRGNXIW-CIUDSAMLSA-N 0.000 description 1
- PDECQIHABNQRHN-GUBZILKMSA-N Asp-Glu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(O)=O PDECQIHABNQRHN-GUBZILKMSA-N 0.000 description 1
- ZSVJVIOVABDTTL-YUMQZZPRSA-N Asp-Gly-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)O)N ZSVJVIOVABDTTL-YUMQZZPRSA-N 0.000 description 1
- POTCZYQVVNXUIG-BQBZGAKWSA-N Asp-Gly-Pro Chemical compound OC(=O)C[C@H](N)C(=O)NCC(=O)N1CCC[C@H]1C(O)=O POTCZYQVVNXUIG-BQBZGAKWSA-N 0.000 description 1
- SVABRQFIHCSNCI-FOHZUACHSA-N Asp-Gly-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O SVABRQFIHCSNCI-FOHZUACHSA-N 0.000 description 1
- TVIZQBFURPLQDV-DJFWLOJKSA-N Asp-His-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC(=O)O)N TVIZQBFURPLQDV-DJFWLOJKSA-N 0.000 description 1
- UBPMOJLRVMGTOQ-GARJFASQSA-N Asp-His-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CN=CN2)NC(=O)[C@H](CC(=O)O)N)C(=O)O UBPMOJLRVMGTOQ-GARJFASQSA-N 0.000 description 1
- CYCKJEFVFNRWEZ-UGYAYLCHSA-N Asp-Ile-Asn Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(O)=O CYCKJEFVFNRWEZ-UGYAYLCHSA-N 0.000 description 1
- JNNVNVRBYUJYGS-CIUDSAMLSA-N Asp-Leu-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O JNNVNVRBYUJYGS-CIUDSAMLSA-N 0.000 description 1
- UZFHNLYQWMGUHU-DCAQKATOSA-N Asp-Lys-Arg Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O UZFHNLYQWMGUHU-DCAQKATOSA-N 0.000 description 1
- BWJZSLQJNBSUPM-FXQIFTODSA-N Asp-Pro-Asn Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(O)=O BWJZSLQJNBSUPM-FXQIFTODSA-N 0.000 description 1
- UAXIKORUDGGIGA-DCAQKATOSA-N Asp-Pro-Lys Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CC(=O)O)N)C(=O)N[C@@H](CCCCN)C(=O)O UAXIKORUDGGIGA-DCAQKATOSA-N 0.000 description 1
- CUQDCPXNZPDYFQ-ZLUOBGJFSA-N Asp-Ser-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O CUQDCPXNZPDYFQ-ZLUOBGJFSA-N 0.000 description 1
- XYPJXLLXNSAWHZ-SRVKXCTJSA-N Asp-Ser-Tyr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O XYPJXLLXNSAWHZ-SRVKXCTJSA-N 0.000 description 1
- JSHWXQIZOCVWIA-ZKWXMUAHSA-N Asp-Ser-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O JSHWXQIZOCVWIA-ZKWXMUAHSA-N 0.000 description 1
- HCOQNGIHSXICCB-IHRRRGAJSA-N Asp-Tyr-Arg Chemical compound N[C@@H](CC(=O)O)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)O HCOQNGIHSXICCB-IHRRRGAJSA-N 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 102100028737 CAP-Gly domain-containing linker protein 1 Human genes 0.000 description 1
- 108091007381 CBL proteins Proteins 0.000 description 1
- SBHGMZRERLSEOI-UHFFFAOYSA-N CC(C(F)(F)Br)NNC(C1=CC=CC=C1)=O Chemical class CC(C(F)(F)Br)NNC(C1=CC=CC=C1)=O SBHGMZRERLSEOI-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102100031203 Centrosomal protein 43 Human genes 0.000 description 1
- 102100031219 Centrosomal protein of 55 kDa Human genes 0.000 description 1
- 101710092479 Centrosomal protein of 55 kDa Proteins 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000016718 Chromosome Inversion Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 102100035396 Cingulin-like protein 1 Human genes 0.000 description 1
- 102220622177 Collagen alpha-2(VI) chain_V804G_mutation Human genes 0.000 description 1
- 102220593375 Complement factor H_C630W_mutation Human genes 0.000 description 1
- RRIJEABIXPKSGP-FXQIFTODSA-N Cys-Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CS RRIJEABIXPKSGP-FXQIFTODSA-N 0.000 description 1
- BYALSSDCQYHKMY-XGEHTFHBSA-N Cys-Arg-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CS)N)O BYALSSDCQYHKMY-XGEHTFHBSA-N 0.000 description 1
- JIVJXVJMOBVCJF-ZLUOBGJFSA-N Cys-Asn-Cys Chemical compound C([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CS)N)C(=O)N JIVJXVJMOBVCJF-ZLUOBGJFSA-N 0.000 description 1
- WXKWQSDHEXKKNC-ZKWXMUAHSA-N Cys-Asp-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CS)N WXKWQSDHEXKKNC-ZKWXMUAHSA-N 0.000 description 1
- GOKFTBDYUJCCSN-QEJZJMRPSA-N Cys-Glu-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CS)N GOKFTBDYUJCCSN-QEJZJMRPSA-N 0.000 description 1
- ZLHPWFSAUJEEAN-KBIXCLLPSA-N Cys-Ile-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CS)N ZLHPWFSAUJEEAN-KBIXCLLPSA-N 0.000 description 1
- ZHCCYSDALWJITB-SRVKXCTJSA-N Cys-Phe-Cys Chemical compound N[C@@H](CS)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CS)C(O)=O ZHCCYSDALWJITB-SRVKXCTJSA-N 0.000 description 1
- ZGERHCJBLPQPGV-ACZMJKKPSA-N Cys-Ser-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CS)N ZGERHCJBLPQPGV-ACZMJKKPSA-N 0.000 description 1
- YNJBLTDKTMKEET-ZLUOBGJFSA-N Cys-Ser-Ser Chemical compound SC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O YNJBLTDKTMKEET-ZLUOBGJFSA-N 0.000 description 1
- DQGIAOGALAQBGK-BWBBJGPYSA-N Cys-Ser-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CS)N)O DQGIAOGALAQBGK-BWBBJGPYSA-N 0.000 description 1
- VIOQRFNAZDMVLO-NRPADANISA-N Cys-Val-Glu Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O VIOQRFNAZDMVLO-NRPADANISA-N 0.000 description 1
- 102100038281 Cytospin-A Human genes 0.000 description 1
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 1
- 108010090461 DFG peptide Proteins 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 102100031598 Dedicator of cytokinesis protein 1 Human genes 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 102100022258 Disks large homolog 5 Human genes 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 102100027100 Echinoderm microtubule-associated protein-like 4 Human genes 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 102100026353 F-box-like/WD repeat-containing protein TBL1XR1 Human genes 0.000 description 1
- 102100029327 FERM domain-containing protein 4A Human genes 0.000 description 1
- 102100040351 FK506-binding protein 15 Human genes 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 102100027579 Forkhead box protein P4 Human genes 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- RNPABQVCNAUEIY-GUQYYFCISA-N Germine Chemical compound O1[C@@]([C@H](CC[C@]23C)O)(O)[C@H]3C[C@@H](O)[C@@H]([C@]3(O)[C@@H](O)[C@H](O)[C@@H]4[C@]5(C)O)[C@@]12C[C@H]3[C@@H]4CN1[C@H]5CC[C@H](C)C1 RNPABQVCNAUEIY-GUQYYFCISA-N 0.000 description 1
- NNQHEEQNPQYPGL-FXQIFTODSA-N Gln-Ala-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(O)=O NNQHEEQNPQYPGL-FXQIFTODSA-N 0.000 description 1
- KYFSMWLWHYZRNW-ACZMJKKPSA-N Gln-Asp-Cys Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CS)C(=O)O)N KYFSMWLWHYZRNW-ACZMJKKPSA-N 0.000 description 1
- XEZWLWNGUMXAJI-QEJZJMRPSA-N Gln-Cys-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CS)NC(=O)[C@H](CCC(N)=O)N)C(O)=O)=CNC2=C1 XEZWLWNGUMXAJI-QEJZJMRPSA-N 0.000 description 1
- NPTGGVQJYRSMCM-GLLZPBPUSA-N Gln-Gln-Thr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O NPTGGVQJYRSMCM-GLLZPBPUSA-N 0.000 description 1
- NSNUZSPSADIMJQ-WDSKDSINSA-N Gln-Gly-Asp Chemical compound NC(=O)CC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O NSNUZSPSADIMJQ-WDSKDSINSA-N 0.000 description 1
- RONJIBWTGKVKFY-HTUGSXCWSA-N Gln-Thr-Phe Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O RONJIBWTGKVKFY-HTUGSXCWSA-N 0.000 description 1
- YJCZUTXLPXBNIO-BHYGNILZSA-N Gln-Trp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CNC3=CC=CC=C32)NC(=O)[C@H](CCC(=O)N)N)C(=O)O YJCZUTXLPXBNIO-BHYGNILZSA-N 0.000 description 1
- VCUNGPMMPNJSGS-JYJNAYRXSA-N Gln-Tyr-Lys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O VCUNGPMMPNJSGS-JYJNAYRXSA-N 0.000 description 1
- AKJRHDMTEJXTPV-ACZMJKKPSA-N Glu-Asn-Ala Chemical compound C[C@H](NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CCC(O)=O)C(O)=O AKJRHDMTEJXTPV-ACZMJKKPSA-N 0.000 description 1
- FLLRAEJOLZPSMN-CIUDSAMLSA-N Glu-Asn-Arg Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N FLLRAEJOLZPSMN-CIUDSAMLSA-N 0.000 description 1
- SBCYJMOOHUDWDA-NUMRIWBASA-N Glu-Asp-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SBCYJMOOHUDWDA-NUMRIWBASA-N 0.000 description 1
- GFLQTABMFBXRIY-GUBZILKMSA-N Glu-Gln-Arg Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O GFLQTABMFBXRIY-GUBZILKMSA-N 0.000 description 1
- NUSWUSKZRCGFEX-FXQIFTODSA-N Glu-Glu-Cys Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CS)C(O)=O NUSWUSKZRCGFEX-FXQIFTODSA-N 0.000 description 1
- LGYZYFFDELZWRS-DCAQKATOSA-N Glu-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O LGYZYFFDELZWRS-DCAQKATOSA-N 0.000 description 1
- PHONAZGUEGIOEM-GLLZPBPUSA-N Glu-Glu-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PHONAZGUEGIOEM-GLLZPBPUSA-N 0.000 description 1
- QJCKNLPMTPXXEM-AUTRQRHGSA-N Glu-Glu-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O QJCKNLPMTPXXEM-AUTRQRHGSA-N 0.000 description 1
- LZMQSTPFYJLVJB-GUBZILKMSA-N Glu-Leu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCC(=O)O)N LZMQSTPFYJLVJB-GUBZILKMSA-N 0.000 description 1
- GJBUAAAIZSRCDC-GVXVVHGQSA-N Glu-Leu-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O GJBUAAAIZSRCDC-GVXVVHGQSA-N 0.000 description 1
- AQNYKMCFCCZEEL-JYJNAYRXSA-N Glu-Lys-Tyr Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 AQNYKMCFCCZEEL-JYJNAYRXSA-N 0.000 description 1
- YHOJJFFTSMWVGR-HJGDQZAQSA-N Glu-Met-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O YHOJJFFTSMWVGR-HJGDQZAQSA-N 0.000 description 1
- YRMZCZIRHYCNHX-RYUDHWBXSA-N Glu-Phe-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(O)=O YRMZCZIRHYCNHX-RYUDHWBXSA-N 0.000 description 1
- DXVOKNVIKORTHQ-GUBZILKMSA-N Glu-Pro-Glu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O DXVOKNVIKORTHQ-GUBZILKMSA-N 0.000 description 1
- HMJULNMJWOZNFI-XHNCKOQMSA-N Glu-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)O)N)C(=O)O HMJULNMJWOZNFI-XHNCKOQMSA-N 0.000 description 1
- MXJYXYDREQWUMS-XKBZYTNZSA-N Glu-Thr-Ser Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O MXJYXYDREQWUMS-XKBZYTNZSA-N 0.000 description 1
- 108010070675 Glutathione transferase Proteins 0.000 description 1
- UGVQELHRNUDMAA-BYPYZUCNSA-N Gly-Ala-Gly Chemical compound [NH3+]CC(=O)N[C@@H](C)C(=O)NCC([O-])=O UGVQELHRNUDMAA-BYPYZUCNSA-N 0.000 description 1
- KFMBRBPXHVMDFN-UWVGGRQHSA-N Gly-Arg-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CCCNC(N)=N KFMBRBPXHVMDFN-UWVGGRQHSA-N 0.000 description 1
- FZQLXNIMCPJVJE-YUMQZZPRSA-N Gly-Asp-Leu Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O FZQLXNIMCPJVJE-YUMQZZPRSA-N 0.000 description 1
- PMNHJLASAAWELO-FOHZUACHSA-N Gly-Asp-Thr Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PMNHJLASAAWELO-FOHZUACHSA-N 0.000 description 1
- GVVKYKCOFMMTKZ-WHFBIAKZSA-N Gly-Cys-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CS)NC(=O)CN GVVKYKCOFMMTKZ-WHFBIAKZSA-N 0.000 description 1
- BIRKKBCSAIHDDF-WDSKDSINSA-N Gly-Glu-Cys Chemical compound NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CS)C(O)=O BIRKKBCSAIHDDF-WDSKDSINSA-N 0.000 description 1
- YYPFZVIXAVDHIK-IUCAKERBSA-N Gly-Glu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CN YYPFZVIXAVDHIK-IUCAKERBSA-N 0.000 description 1
- KMSGYZQRXPUKGI-BYPYZUCNSA-N Gly-Gly-Asn Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CC(N)=O KMSGYZQRXPUKGI-BYPYZUCNSA-N 0.000 description 1
- XPJBQTCXPJNIFE-ZETCQYMHSA-N Gly-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)CN XPJBQTCXPJNIFE-ZETCQYMHSA-N 0.000 description 1
- TVDHVLGFJSHPAX-UWVGGRQHSA-N Gly-His-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CN=CN1 TVDHVLGFJSHPAX-UWVGGRQHSA-N 0.000 description 1
- ORXZVPZCPMKHNR-IUCAKERBSA-N Gly-His-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CNC=N1 ORXZVPZCPMKHNR-IUCAKERBSA-N 0.000 description 1
- BHPQOIPBLYJNAW-NGZCFLSTSA-N Gly-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN BHPQOIPBLYJNAW-NGZCFLSTSA-N 0.000 description 1
- UHPAZODVFFYEEL-QWRGUYRKSA-N Gly-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)CN UHPAZODVFFYEEL-QWRGUYRKSA-N 0.000 description 1
- NNCSJUBVFBDDLC-YUMQZZPRSA-N Gly-Leu-Ser Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O NNCSJUBVFBDDLC-YUMQZZPRSA-N 0.000 description 1
- PDUHNKAFQXQNLH-ZETCQYMHSA-N Gly-Lys-Gly Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)NCC(O)=O PDUHNKAFQXQNLH-ZETCQYMHSA-N 0.000 description 1
- OQQKUTVULYLCDG-ONGXEEELSA-N Gly-Lys-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CCCCN)NC(=O)CN)C(O)=O OQQKUTVULYLCDG-ONGXEEELSA-N 0.000 description 1
- IFHJOBKVXBESRE-YUMQZZPRSA-N Gly-Met-Gln Chemical compound CSCC[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)CN IFHJOBKVXBESRE-YUMQZZPRSA-N 0.000 description 1
- OMOZPGCHVWOXHN-BQBZGAKWSA-N Gly-Met-Ser Chemical compound CSCC[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)CN OMOZPGCHVWOXHN-BQBZGAKWSA-N 0.000 description 1
- NSVOVKWEKGEOQB-LURJTMIESA-N Gly-Pro-Gly Chemical compound NCC(=O)N1CCC[C@H]1C(=O)NCC(O)=O NSVOVKWEKGEOQB-LURJTMIESA-N 0.000 description 1
- ABPRMMYHROQBLY-NKWVEPMBSA-N Gly-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)CN)C(=O)O ABPRMMYHROQBLY-NKWVEPMBSA-N 0.000 description 1
- LLWQVJNHMYBLLK-CDMKHQONSA-N Gly-Thr-Phe Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O LLWQVJNHMYBLLK-CDMKHQONSA-N 0.000 description 1
- HQSKKSLNLSTONK-JTQLQIEISA-N Gly-Tyr-Gly Chemical compound OC(=O)CNC(=O)[C@@H](NC(=O)CN)CC1=CC=C(O)C=C1 HQSKKSLNLSTONK-JTQLQIEISA-N 0.000 description 1
- BAYQNCWLXIDLHX-ONGXEEELSA-N Gly-Val-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)CN BAYQNCWLXIDLHX-ONGXEEELSA-N 0.000 description 1
- 102100041032 Golgin subfamily A member 5 Human genes 0.000 description 1
- RVKIPWVMZANZLI-UHFFFAOYSA-N H-Lys-Trp-OH Natural products C1=CC=C2C(CC(NC(=O)C(N)CCCCN)C(O)=O)=CNC2=C1 RVKIPWVMZANZLI-UHFFFAOYSA-N 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 238000003043 HTRF KinEASE-TK Methods 0.000 description 1
- 102100029100 Hematopoietic prostaglandin D synthase Human genes 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- FLYSHWAAHYNKRT-JYJNAYRXSA-N His-Gln-Phe Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O FLYSHWAAHYNKRT-JYJNAYRXSA-N 0.000 description 1
- TVRMJKNELJKNRS-GUBZILKMSA-N His-Glu-Asn Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CC(=O)N)C(=O)O)N TVRMJKNELJKNRS-GUBZILKMSA-N 0.000 description 1
- VIJMRAIWYWRXSR-CIUDSAMLSA-N His-Ser-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CN=CN1 VIJMRAIWYWRXSR-CIUDSAMLSA-N 0.000 description 1
- PBJOQLUVSGXRSW-YTQUADARSA-N His-Trp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CNC3=CC=CC=C32)NC(=O)[C@H](CC4=CN=CN4)N)C(=O)O PBJOQLUVSGXRSW-YTQUADARSA-N 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 101000928226 Homo sapiens Actin filament-associated protein 1 Proteins 0.000 description 1
- 101000892366 Homo sapiens Actin filament-associated protein 1-like 2 Proteins 0.000 description 1
- 101000782705 Homo sapiens Acyl-CoA-binding domain-containing protein 5 Proteins 0.000 description 1
- 101000767052 Homo sapiens CAP-Gly domain-containing linker protein 1 Proteins 0.000 description 1
- 101000776477 Homo sapiens Centrosomal protein 43 Proteins 0.000 description 1
- 101000737619 Homo sapiens Cingulin-like protein 1 Proteins 0.000 description 1
- 101000884816 Homo sapiens Cytospin-A Proteins 0.000 description 1
- 101000866235 Homo sapiens Dedicator of cytokinesis protein 1 Proteins 0.000 description 1
- 101000902114 Homo sapiens Disks large homolog 5 Proteins 0.000 description 1
- 101000619542 Homo sapiens E3 ubiquitin-protein ligase parkin Proteins 0.000 description 1
- 101001057929 Homo sapiens Echinoderm microtubule-associated protein-like 4 Proteins 0.000 description 1
- 101000835675 Homo sapiens F-box-like/WD repeat-containing protein TBL1XR1 Proteins 0.000 description 1
- 101001062454 Homo sapiens FERM domain-containing protein 4A Proteins 0.000 description 1
- 101000891018 Homo sapiens FK506-binding protein 15 Proteins 0.000 description 1
- 101000861403 Homo sapiens Forkhead box protein P4 Proteins 0.000 description 1
- 101001066129 Homo sapiens Glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 101001039330 Homo sapiens Golgin subfamily A member 5 Proteins 0.000 description 1
- 101000726740 Homo sapiens Homeobox protein cut-like 1 Proteins 0.000 description 1
- 101001090172 Homo sapiens Kinectin Proteins 0.000 description 1
- 101001050559 Homo sapiens Kinesin-1 heavy chain Proteins 0.000 description 1
- 101001091266 Homo sapiens Kinesin-like protein KIF13A Proteins 0.000 description 1
- 101001064427 Homo sapiens Liprin-beta-2 Proteins 0.000 description 1
- 101001028827 Homo sapiens Myosin phosphatase Rho-interacting protein Proteins 0.000 description 1
- 101001000109 Homo sapiens Myosin-10 Proteins 0.000 description 1
- 101000588961 Homo sapiens Myosin-13 Proteins 0.000 description 1
- 101001120760 Homo sapiens Olfactomedin-4 Proteins 0.000 description 1
- 101001135199 Homo sapiens Partitioning defective 3 homolog Proteins 0.000 description 1
- 101000583474 Homo sapiens Phosphatidylinositol-binding clathrin assembly protein Proteins 0.000 description 1
- 101000583459 Homo sapiens Progesterone-induced-blocking factor 1 Proteins 0.000 description 1
- 101000761460 Homo sapiens Protein CASP Proteins 0.000 description 1
- 101000956094 Homo sapiens Protein Daple Proteins 0.000 description 1
- 101000866633 Homo sapiens Protein Hook homolog 3 Proteins 0.000 description 1
- 101000713957 Homo sapiens Protein RUFY3 Proteins 0.000 description 1
- 101000708591 Homo sapiens RAB11-binding protein RELCH Proteins 0.000 description 1
- 101000712899 Homo sapiens RNA-binding protein with multiple splicing Proteins 0.000 description 1
- 101000714026 Homo sapiens RUN and FYVE domain-containing protein 1 Proteins 0.000 description 1
- 101000713960 Homo sapiens RUN and FYVE domain-containing protein 2 Proteins 0.000 description 1
- 101001023826 Homo sapiens Ras GTPase-activating protein nGAP Proteins 0.000 description 1
- 101001092172 Homo sapiens Ras-GEF domain-containing family member 1A Proteins 0.000 description 1
- 101000683584 Homo sapiens Ribosome-binding protein 1 Proteins 0.000 description 1
- 101000644537 Homo sapiens Sequestosome-1 Proteins 0.000 description 1
- 101000629638 Homo sapiens Sorbin and SH3 domain-containing protein 2 Proteins 0.000 description 1
- 101000813738 Homo sapiens Transcription factor ETV6 Proteins 0.000 description 1
- 101000625376 Homo sapiens Transcription initiation factor TFIID subunit 3 Proteins 0.000 description 1
- 101000607560 Homo sapiens Ubiquitin-conjugating enzyme E2 variant 3 Proteins 0.000 description 1
- 101000634977 Homo sapiens Zinc finger protein RFP Proteins 0.000 description 1
- 101001026573 Homo sapiens cAMP-dependent protein kinase type I-alpha regulatory subunit Proteins 0.000 description 1
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 1
- QIHJTGSVGIPHIW-QSFUFRPTSA-N Ile-Asn-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](C(C)C)C(=O)O)N QIHJTGSVGIPHIW-QSFUFRPTSA-N 0.000 description 1
- WEWCEPOYKANMGZ-MMWGEVLESA-N Ile-Cys-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CS)C(=O)N1CCC[C@@H]1C(=O)O)N WEWCEPOYKANMGZ-MMWGEVLESA-N 0.000 description 1
- GECLQMBTZCPAFY-PEFMBERDSA-N Ile-Gln-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N GECLQMBTZCPAFY-PEFMBERDSA-N 0.000 description 1
- BEWFWZRGBDVXRP-PEFMBERDSA-N Ile-Glu-Asn Chemical compound [H]N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O BEWFWZRGBDVXRP-PEFMBERDSA-N 0.000 description 1
- JNDYZNJRRNFYIR-VGDYDELISA-N Ile-His-Cys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CS)C(=O)O)N JNDYZNJRRNFYIR-VGDYDELISA-N 0.000 description 1
- HUORUFRRJHELPD-MNXVOIDGSA-N Ile-Leu-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N HUORUFRRJHELPD-MNXVOIDGSA-N 0.000 description 1
- UIEZQYNXCYHMQS-BJDJZHNGSA-N Ile-Lys-Ala Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)O)N UIEZQYNXCYHMQS-BJDJZHNGSA-N 0.000 description 1
- YSGBJIQXTIVBHZ-AJNGGQMLSA-N Ile-Lys-Leu Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O YSGBJIQXTIVBHZ-AJNGGQMLSA-N 0.000 description 1
- MLSUZXHSNRBDCI-CYDGBPFRSA-N Ile-Pro-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)O)N MLSUZXHSNRBDCI-CYDGBPFRSA-N 0.000 description 1
- XMYURPUVJSKTMC-KBIXCLLPSA-N Ile-Ser-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N XMYURPUVJSKTMC-KBIXCLLPSA-N 0.000 description 1
- ZDNNDIJTUHQCAM-MXAVVETBSA-N Ile-Ser-Phe Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N ZDNNDIJTUHQCAM-MXAVVETBSA-N 0.000 description 1
- PXKACEXYLPBMAD-JBDRJPRFSA-N Ile-Ser-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)O)N PXKACEXYLPBMAD-JBDRJPRFSA-N 0.000 description 1
- PZWBBXHHUSIGKH-OSUNSFLBSA-N Ile-Thr-Arg Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N PZWBBXHHUSIGKH-OSUNSFLBSA-N 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 101710059804 KIAA1217 Proteins 0.000 description 1
- 102100034751 Kinectin Human genes 0.000 description 1
- 102100023422 Kinesin-1 heavy chain Human genes 0.000 description 1
- 102100034865 Kinesin-like protein KIF13A Human genes 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- LHSGPCFBGJHPCY-UHFFFAOYSA-N L-leucine-L-tyrosine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 LHSGPCFBGJHPCY-UHFFFAOYSA-N 0.000 description 1
- SENJXOPIZNYLHU-UHFFFAOYSA-N L-leucyl-L-arginine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CCCN=C(N)N SENJXOPIZNYLHU-UHFFFAOYSA-N 0.000 description 1
- LZDNBBYBDGBADK-UHFFFAOYSA-N L-valyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)C(C)C)C(O)=O)=CNC2=C1 LZDNBBYBDGBADK-UHFFFAOYSA-N 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002176 L01XE26 - Cabozantinib Substances 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- 241000880493 Leptailurus serval Species 0.000 description 1
- CQQGCWPXDHTTNF-GUBZILKMSA-N Leu-Ala-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O CQQGCWPXDHTTNF-GUBZILKMSA-N 0.000 description 1
- REPPKAMYTOJTFC-DCAQKATOSA-N Leu-Arg-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O REPPKAMYTOJTFC-DCAQKATOSA-N 0.000 description 1
- HASRFYOMVPJRPU-SRVKXCTJSA-N Leu-Arg-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(O)=O)C(O)=O HASRFYOMVPJRPU-SRVKXCTJSA-N 0.000 description 1
- KSZCCRIGNVSHFH-UWVGGRQHSA-N Leu-Arg-Gly Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(O)=O KSZCCRIGNVSHFH-UWVGGRQHSA-N 0.000 description 1
- IGUOAYLTQJLPPD-DCAQKATOSA-N Leu-Asn-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N IGUOAYLTQJLPPD-DCAQKATOSA-N 0.000 description 1
- YKNBJXOJTURHCU-DCAQKATOSA-N Leu-Asp-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YKNBJXOJTURHCU-DCAQKATOSA-N 0.000 description 1
- HQUXQAMSWFIRET-AVGNSLFASA-N Leu-Glu-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN HQUXQAMSWFIRET-AVGNSLFASA-N 0.000 description 1
- HVJVUYQWFYMGJS-GVXVVHGQSA-N Leu-Glu-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O HVJVUYQWFYMGJS-GVXVVHGQSA-N 0.000 description 1
- POZULHZYLPGXMR-ONGXEEELSA-N Leu-Gly-Val Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O POZULHZYLPGXMR-ONGXEEELSA-N 0.000 description 1
- OYQUOLRTJHWVSQ-SRVKXCTJSA-N Leu-His-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(O)=O OYQUOLRTJHWVSQ-SRVKXCTJSA-N 0.000 description 1
- HMDDEJADNKQTBR-BZSNNMDCSA-N Leu-His-Tyr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O HMDDEJADNKQTBR-BZSNNMDCSA-N 0.000 description 1
- NRFGTHFONZYFNY-MGHWNKPDSA-N Leu-Ile-Tyr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 NRFGTHFONZYFNY-MGHWNKPDSA-N 0.000 description 1
- KYIIALJHAOIAHF-KKUMJFAQSA-N Leu-Leu-His Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 KYIIALJHAOIAHF-KKUMJFAQSA-N 0.000 description 1
- ZGUMORRUBUCXEH-AVGNSLFASA-N Leu-Lys-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZGUMORRUBUCXEH-AVGNSLFASA-N 0.000 description 1
- LVTJJOJKDCVZGP-QWRGUYRKSA-N Leu-Lys-Gly Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(O)=O LVTJJOJKDCVZGP-QWRGUYRKSA-N 0.000 description 1
- OVZLLFONXILPDZ-VOAKCMCISA-N Leu-Lys-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OVZLLFONXILPDZ-VOAKCMCISA-N 0.000 description 1
- WXZOHBVPVKABQN-DCAQKATOSA-N Leu-Met-Asp Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(=O)O)C(=O)O)N WXZOHBVPVKABQN-DCAQKATOSA-N 0.000 description 1
- DDVHDMSBLRAKNV-IHRRRGAJSA-N Leu-Met-Leu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(O)=O DDVHDMSBLRAKNV-IHRRRGAJSA-N 0.000 description 1
- FYPWFNKQVVEELI-ULQDDVLXSA-N Leu-Phe-Val Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CC1=CC=CC=C1 FYPWFNKQVVEELI-ULQDDVLXSA-N 0.000 description 1
- QMKFDEUJGYNFMC-AVGNSLFASA-N Leu-Pro-Arg Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O QMKFDEUJGYNFMC-AVGNSLFASA-N 0.000 description 1
- XXXXOVFBXRERQL-ULQDDVLXSA-N Leu-Pro-Phe Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 XXXXOVFBXRERQL-ULQDDVLXSA-N 0.000 description 1
- CHJKEDSZNSONPS-DCAQKATOSA-N Leu-Pro-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O CHJKEDSZNSONPS-DCAQKATOSA-N 0.000 description 1
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 1
- AIQWYVFNBNNOLU-RHYQMDGZSA-N Leu-Thr-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O AIQWYVFNBNNOLU-RHYQMDGZSA-N 0.000 description 1
- WGAZVKFCPHXZLO-SZMVWBNQSA-N Leu-Trp-Glu Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N WGAZVKFCPHXZLO-SZMVWBNQSA-N 0.000 description 1
- XZNJZXJZBMBGGS-NHCYSSNCSA-N Leu-Val-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O XZNJZXJZBMBGGS-NHCYSSNCSA-N 0.000 description 1
- QESXLSQLQHHTIX-RHYQMDGZSA-N Leu-Val-Thr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QESXLSQLQHHTIX-RHYQMDGZSA-N 0.000 description 1
- 102100031981 Liprin-beta-2 Human genes 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- KCXUCYYZNZFGLL-SRVKXCTJSA-N Lys-Ala-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O KCXUCYYZNZFGLL-SRVKXCTJSA-N 0.000 description 1
- KNKHAVVBVXKOGX-JXUBOQSCSA-N Lys-Ala-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KNKHAVVBVXKOGX-JXUBOQSCSA-N 0.000 description 1
- ZAWOJFFMBANLGE-CIUDSAMLSA-N Lys-Cys-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CCCCN)N ZAWOJFFMBANLGE-CIUDSAMLSA-N 0.000 description 1
- HWMZUBUEOYAQSC-DCAQKATOSA-N Lys-Gln-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O HWMZUBUEOYAQSC-DCAQKATOSA-N 0.000 description 1
- AFLBTVGQCQLOFJ-AVGNSLFASA-N Lys-Pro-Arg Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O AFLBTVGQCQLOFJ-AVGNSLFASA-N 0.000 description 1
- UQJOKDAYFULYIX-AVGNSLFASA-N Lys-Pro-Pro Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 UQJOKDAYFULYIX-AVGNSLFASA-N 0.000 description 1
- RPWTZTBIFGENIA-VOAKCMCISA-N Lys-Thr-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O RPWTZTBIFGENIA-VOAKCMCISA-N 0.000 description 1
- KQAREVUPVXMNNP-WDSOQIARSA-N Lys-Trp-Met Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CCSC)C(O)=O KQAREVUPVXMNNP-WDSOQIARSA-N 0.000 description 1
- IKXQOBUBZSOWDY-AVGNSLFASA-N Lys-Val-Val Chemical compound CC(C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)O)NC(=O)[C@H](CCCCN)N IKXQOBUBZSOWDY-AVGNSLFASA-N 0.000 description 1
- 206010073059 Malignant neoplasm of unknown primary site Diseases 0.000 description 1
- 102000047724 Member 2 Solute Carrier Family 12 Human genes 0.000 description 1
- KQBJYJXPZBNEIK-DCAQKATOSA-N Met-Glu-Arg Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CCCNC(N)=N KQBJYJXPZBNEIK-DCAQKATOSA-N 0.000 description 1
- KMSMNUFBNCHMII-IHRRRGAJSA-N Met-Leu-Lys Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCCN KMSMNUFBNCHMII-IHRRRGAJSA-N 0.000 description 1
- HOZNVKDCKZPRER-XUXIUFHCSA-N Met-Lys-Ile Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HOZNVKDCKZPRER-XUXIUFHCSA-N 0.000 description 1
- HSJIGJRZYUADSS-IHRRRGAJSA-N Met-Lys-Leu Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O HSJIGJRZYUADSS-IHRRRGAJSA-N 0.000 description 1
- VOAKKHOIAFKOQZ-JYJNAYRXSA-N Met-Tyr-Arg Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CCSC)CC1=CC=C(O)C=C1 VOAKKHOIAFKOQZ-JYJNAYRXSA-N 0.000 description 1
- IQJMEDDVOGMTKT-SRVKXCTJSA-N Met-Val-Val Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(O)=O IQJMEDDVOGMTKT-SRVKXCTJSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 238000007006 Miyaura reaction Methods 0.000 description 1
- 208000003445 Mouth Neoplasms Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 102100037183 Myosin phosphatase Rho-interacting protein Human genes 0.000 description 1
- 102100036640 Myosin-10 Human genes 0.000 description 1
- 102100033013 Myosin-13 Human genes 0.000 description 1
- RKOTXQYWCBGZLP-UHFFFAOYSA-N N-[(2,4-difluorophenyl)methyl]-2-ethyl-9-hydroxy-3-methoxy-1,8-dioxospiro[3H-pyrido[1,2-a]pyrazine-4,3'-oxolane]-7-carboxamide Chemical compound CCN1C(OC)C2(CCOC2)N2C=C(C(=O)NCC3=C(F)C=C(F)C=C3)C(=O)C(O)=C2C1=O RKOTXQYWCBGZLP-UHFFFAOYSA-N 0.000 description 1
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 1
- 108010079364 N-glycylalanine Proteins 0.000 description 1
- 108010066427 N-valyltryptophan Proteins 0.000 description 1
- CXQHYVUVSFXTMY-UHFFFAOYSA-N N1'-[3-fluoro-4-[[6-methoxy-7-[3-(4-morpholinyl)propoxy]-4-quinolinyl]oxy]phenyl]-N1-(4-fluorophenyl)cyclopropane-1,1-dicarboxamide Chemical compound C1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1OC(C(=C1)F)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 CXQHYVUVSFXTMY-UHFFFAOYSA-N 0.000 description 1
- 108010087066 N2-tryptophyllysine Proteins 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 208000014174 Oesophageal disease Diseases 0.000 description 1
- 102100026071 Olfactomedin-4 Human genes 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 101150090128 PCM1 gene Proteins 0.000 description 1
- 102100033496 Partitioning defective 3 homolog Human genes 0.000 description 1
- 102100033422 Pericentriolar material 1 protein Human genes 0.000 description 1
- YRKFKTQRVBJYLT-CQDKDKBSSA-N Phe-Ala-His Chemical compound C([C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1NC=NC=1)C(O)=O)C1=CC=CC=C1 YRKFKTQRVBJYLT-CQDKDKBSSA-N 0.000 description 1
- MECSIDWUTYRHRJ-KKUMJFAQSA-N Phe-Asn-Leu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O MECSIDWUTYRHRJ-KKUMJFAQSA-N 0.000 description 1
- LLGTYVHITPVGKR-RYUDHWBXSA-N Phe-Gln-Gly Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O LLGTYVHITPVGKR-RYUDHWBXSA-N 0.000 description 1
- DMEYUTSDVRCWRS-ULQDDVLXSA-N Phe-Lys-Arg Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC1=CC=CC=C1 DMEYUTSDVRCWRS-ULQDDVLXSA-N 0.000 description 1
- JLLJTMHNXQTMCK-UBHSHLNASA-N Phe-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CC1=CC=CC=C1 JLLJTMHNXQTMCK-UBHSHLNASA-N 0.000 description 1
- WWPAHTZOWURIMR-ULQDDVLXSA-N Phe-Pro-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CC1=CC=CC=C1 WWPAHTZOWURIMR-ULQDDVLXSA-N 0.000 description 1
- ZLAKUZDMKVKFAI-JYJNAYRXSA-N Phe-Pro-Val Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O ZLAKUZDMKVKFAI-JYJNAYRXSA-N 0.000 description 1
- BPCLGWHVPVTTFM-QWRGUYRKSA-N Phe-Ser-Gly Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)NCC(O)=O BPCLGWHVPVTTFM-QWRGUYRKSA-N 0.000 description 1
- GLUYKHMBGKQBHE-JYJNAYRXSA-N Phe-Val-Arg Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CC1=CC=CC=C1 GLUYKHMBGKQBHE-JYJNAYRXSA-N 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 102100031014 Phosphatidylinositol-binding clathrin assembly protein Human genes 0.000 description 1
- KIZQGKLMXKGDIV-BQBZGAKWSA-N Pro-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1 KIZQGKLMXKGDIV-BQBZGAKWSA-N 0.000 description 1
- XQLBWXHVZVBNJM-FXQIFTODSA-N Pro-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1 XQLBWXHVZVBNJM-FXQIFTODSA-N 0.000 description 1
- BNBBNGZZKQUWCD-IUCAKERBSA-N Pro-Arg-Gly Chemical compound NC(N)=NCCC[C@@H](C(=O)NCC(O)=O)NC(=O)[C@@H]1CCCN1 BNBBNGZZKQUWCD-IUCAKERBSA-N 0.000 description 1
- CJZTUKSFZUSNCC-FXQIFTODSA-N Pro-Asp-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H]1CCCN1 CJZTUKSFZUSNCC-FXQIFTODSA-N 0.000 description 1
- ZCXQTRXYZOSGJR-FXQIFTODSA-N Pro-Asp-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O ZCXQTRXYZOSGJR-FXQIFTODSA-N 0.000 description 1
- PULPZRAHVFBVTO-DCAQKATOSA-N Pro-Glu-Arg Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O PULPZRAHVFBVTO-DCAQKATOSA-N 0.000 description 1
- VYWNORHENYEQDW-YUMQZZPRSA-N Pro-Gly-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H]1CCCN1 VYWNORHENYEQDW-YUMQZZPRSA-N 0.000 description 1
- LPGSNRSLPHRNBW-AVGNSLFASA-N Pro-His-Val Chemical compound C([C@@H](C(=O)N[C@@H](C(C)C)C([O-])=O)NC(=O)[C@H]1[NH2+]CCC1)C1=CN=CN1 LPGSNRSLPHRNBW-AVGNSLFASA-N 0.000 description 1
- NFLNBHLMLYALOO-DCAQKATOSA-N Pro-Leu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@@H]1CCCN1 NFLNBHLMLYALOO-DCAQKATOSA-N 0.000 description 1
- XYSXOCIWCPFOCG-IHRRRGAJSA-N Pro-Leu-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O XYSXOCIWCPFOCG-IHRRRGAJSA-N 0.000 description 1
- FKYKZHOKDOPHSA-DCAQKATOSA-N Pro-Leu-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O FKYKZHOKDOPHSA-DCAQKATOSA-N 0.000 description 1
- SUENWIFTSTWUKD-AVGNSLFASA-N Pro-Leu-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O SUENWIFTSTWUKD-AVGNSLFASA-N 0.000 description 1
- ZVEQWRWMRFIVSD-HRCADAONSA-N Pro-Phe-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CC2=CC=CC=C2)C(=O)N3CCC[C@@H]3C(=O)O ZVEQWRWMRFIVSD-HRCADAONSA-N 0.000 description 1
- RMJZWERKFFNNNS-XGEHTFHBSA-N Pro-Thr-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O RMJZWERKFFNNNS-XGEHTFHBSA-N 0.000 description 1
- IALSFJSONJZBKB-HRCADAONSA-N Pro-Tyr-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)N3CCC[C@@H]3C(=O)O IALSFJSONJZBKB-HRCADAONSA-N 0.000 description 1
- VDHGTOHMHHQSKG-JYJNAYRXSA-N Pro-Val-Phe Chemical compound CC(C)[C@H](NC(=O)[C@@H]1CCCN1)C(=O)N[C@@H](Cc1ccccc1)C(O)=O VDHGTOHMHHQSKG-JYJNAYRXSA-N 0.000 description 1
- 206010036772 Proctalgia Diseases 0.000 description 1
- 102100031015 Progesterone-induced-blocking factor 1 Human genes 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 102100024933 Protein CASP Human genes 0.000 description 1
- 102100038589 Protein Daple Human genes 0.000 description 1
- 102100031717 Protein Hook homolog 3 Human genes 0.000 description 1
- 102100036452 Protein RUFY3 Human genes 0.000 description 1
- 102100028680 Protein patched homolog 1 Human genes 0.000 description 1
- 101710161390 Protein patched homolog 1 Proteins 0.000 description 1
- 102220533302 Proto-oncogene tyrosine-protein kinase receptor Ret_E921K_mutation Human genes 0.000 description 1
- 102220533283 Proto-oncogene tyrosine-protein kinase receptor Ret_F961L_mutation Human genes 0.000 description 1
- 102220570924 Proto-oncogene tyrosine-protein kinase receptor Ret_G593E_mutation Human genes 0.000 description 1
- 102220570865 Proto-oncogene tyrosine-protein kinase receptor Ret_L40P_mutation Human genes 0.000 description 1
- 102220570931 Proto-oncogene tyrosine-protein kinase receptor Ret_R360W_mutation Human genes 0.000 description 1
- 102220570913 Proto-oncogene tyrosine-protein kinase receptor Ret_V145G_mutation Human genes 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102100032798 RAB11-binding protein RELCH Human genes 0.000 description 1
- 108010079005 RDV peptide Proteins 0.000 description 1
- 102100033135 RNA-binding protein with multiple splicing Human genes 0.000 description 1
- 102100036446 RUN and FYVE domain-containing protein 1 Human genes 0.000 description 1
- 102100036453 RUN and FYVE domain-containing protein 2 Human genes 0.000 description 1
- 102100035410 Ras GTPase-activating protein nGAP Human genes 0.000 description 1
- 102100035771 Ras-GEF domain-containing family member 1A Human genes 0.000 description 1
- 102100023542 Ribosome-binding protein 1 Human genes 0.000 description 1
- 108091006620 SLC12A2 Proteins 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 102100020814 Sequestosome-1 Human genes 0.000 description 1
- NLQUOHDCLSFABG-GUBZILKMSA-N Ser-Arg-Arg Chemical compound NC(N)=NCCC[C@H](NC(=O)[C@H](CO)N)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O NLQUOHDCLSFABG-GUBZILKMSA-N 0.000 description 1
- QWZIOCFPXMAXET-CIUDSAMLSA-N Ser-Arg-Gln Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(O)=O QWZIOCFPXMAXET-CIUDSAMLSA-N 0.000 description 1
- OLIJLNWFEQEFDM-SRVKXCTJSA-N Ser-Asp-Phe Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 OLIJLNWFEQEFDM-SRVKXCTJSA-N 0.000 description 1
- MMAPOBOTRUVNKJ-ZLUOBGJFSA-N Ser-Asp-Ser Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CO)N)C(=O)O MMAPOBOTRUVNKJ-ZLUOBGJFSA-N 0.000 description 1
- SWSRFJZZMNLMLY-ZKWXMUAHSA-N Ser-Asp-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O SWSRFJZZMNLMLY-ZKWXMUAHSA-N 0.000 description 1
- XWCYBVBLJRWOFR-WDSKDSINSA-N Ser-Gln-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O XWCYBVBLJRWOFR-WDSKDSINSA-N 0.000 description 1
- UOLGINIHBRIECN-FXQIFTODSA-N Ser-Glu-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O UOLGINIHBRIECN-FXQIFTODSA-N 0.000 description 1
- UQFYNFTYDHUIMI-WHFBIAKZSA-N Ser-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CO UQFYNFTYDHUIMI-WHFBIAKZSA-N 0.000 description 1
- YMTLKLXDFCSCNX-BYPYZUCNSA-N Ser-Gly-Gly Chemical compound OC[C@H](N)C(=O)NCC(=O)NCC(O)=O YMTLKLXDFCSCNX-BYPYZUCNSA-N 0.000 description 1
- UIPXCLNLUUAMJU-JBDRJPRFSA-N Ser-Ile-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O UIPXCLNLUUAMJU-JBDRJPRFSA-N 0.000 description 1
- DOSZISJPMCYEHT-NAKRPEOUSA-N Ser-Ile-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(O)=O DOSZISJPMCYEHT-NAKRPEOUSA-N 0.000 description 1
- IUXGJEIKJBYKOO-SRVKXCTJSA-N Ser-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CO)N IUXGJEIKJBYKOO-SRVKXCTJSA-N 0.000 description 1
- VZQRNAYURWAEFE-KKUMJFAQSA-N Ser-Leu-Phe Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 VZQRNAYURWAEFE-KKUMJFAQSA-N 0.000 description 1
- NNFMANHDYSVNIO-DCAQKATOSA-N Ser-Lys-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NNFMANHDYSVNIO-DCAQKATOSA-N 0.000 description 1
- PPNPDKGQRFSCAC-CIUDSAMLSA-N Ser-Lys-Asp Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPNPDKGQRFSCAC-CIUDSAMLSA-N 0.000 description 1
- NIOYDASGXWLHEZ-CIUDSAMLSA-N Ser-Met-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(O)=O NIOYDASGXWLHEZ-CIUDSAMLSA-N 0.000 description 1
- JAWGSPUJAXYXJA-IHRRRGAJSA-N Ser-Phe-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CO)N)CC1=CC=CC=C1 JAWGSPUJAXYXJA-IHRRRGAJSA-N 0.000 description 1
- RRVFEDGUXSYWOW-BZSNNMDCSA-N Ser-Phe-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O RRVFEDGUXSYWOW-BZSNNMDCSA-N 0.000 description 1
- SRSPTFBENMJHMR-WHFBIAKZSA-N Ser-Ser-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O SRSPTFBENMJHMR-WHFBIAKZSA-N 0.000 description 1
- BMKNXTJLHFIAAH-CIUDSAMLSA-N Ser-Ser-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O BMKNXTJLHFIAAH-CIUDSAMLSA-N 0.000 description 1
- PCJLFYBAQZQOFE-KATARQTJSA-N Ser-Thr-Lys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CO)N)O PCJLFYBAQZQOFE-KATARQTJSA-N 0.000 description 1
- OJFFAQFRCVPHNN-JYBASQMISA-N Ser-Thr-Trp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O OJFFAQFRCVPHNN-JYBASQMISA-N 0.000 description 1
- VVKVHAOOUGNDPJ-SRVKXCTJSA-N Ser-Tyr-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(O)=O VVKVHAOOUGNDPJ-SRVKXCTJSA-N 0.000 description 1
- HAYADTTXNZFUDM-IHRRRGAJSA-N Ser-Tyr-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C(C)C)C(O)=O HAYADTTXNZFUDM-IHRRRGAJSA-N 0.000 description 1
- UKKROEYWYIHWBD-ZKWXMUAHSA-N Ser-Val-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O UKKROEYWYIHWBD-ZKWXMUAHSA-N 0.000 description 1
- YEDSOSIKVUMIJE-DCAQKATOSA-N Ser-Val-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O YEDSOSIKVUMIJE-DCAQKATOSA-N 0.000 description 1
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 1
- 102100026901 Sorbin and SH3 domain-containing protein 2 Human genes 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- 206010042971 T-cell lymphoma Diseases 0.000 description 1
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 108091007283 TRIM24 Proteins 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- CAGTXGDOIFXLPC-KZVJFYERSA-N Thr-Arg-Ala Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C)C(O)=O)CCCN=C(N)N CAGTXGDOIFXLPC-KZVJFYERSA-N 0.000 description 1
- GZYNMZQXFRWDFH-YTWAJWBKSA-N Thr-Arg-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1CCC[C@@H]1C(=O)O)N)O GZYNMZQXFRWDFH-YTWAJWBKSA-N 0.000 description 1
- VOGXLRKCWFLJBY-HSHDSVGOSA-N Thr-Arg-Trp Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)N)O VOGXLRKCWFLJBY-HSHDSVGOSA-N 0.000 description 1
- KWQBJOUOSNJDRR-XAVMHZPKSA-N Thr-Cys-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)N1CCC[C@@H]1C(=O)O)N)O KWQBJOUOSNJDRR-XAVMHZPKSA-N 0.000 description 1
- MMTOHPRBJKEZHT-BWBBJGPYSA-N Thr-Cys-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](CO)C(O)=O MMTOHPRBJKEZHT-BWBBJGPYSA-N 0.000 description 1
- KCRQEJSKXAIULJ-FJXKBIBVSA-N Thr-Gly-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O KCRQEJSKXAIULJ-FJXKBIBVSA-N 0.000 description 1
- MEJHFIOYJHTWMK-VOAKCMCISA-N Thr-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)[C@@H](C)O MEJHFIOYJHTWMK-VOAKCMCISA-N 0.000 description 1
- PUEWAXRPXOEQOW-HJGDQZAQSA-N Thr-Met-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(N)=O)C(O)=O PUEWAXRPXOEQOW-HJGDQZAQSA-N 0.000 description 1
- WYLAVUAWOUVUCA-XVSYOHENSA-N Thr-Phe-Asp Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O WYLAVUAWOUVUCA-XVSYOHENSA-N 0.000 description 1
- SGAOHNPSEPVAFP-ZDLURKLDSA-N Thr-Ser-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)NCC(O)=O SGAOHNPSEPVAFP-ZDLURKLDSA-N 0.000 description 1
- MFMGPEKYBXFIRF-SUSMZKCASA-N Thr-Thr-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O MFMGPEKYBXFIRF-SUSMZKCASA-N 0.000 description 1
- LECUEEHKUFYOOV-ZJDVBMNYSA-N Thr-Thr-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](N)[C@@H](C)O LECUEEHKUFYOOV-ZJDVBMNYSA-N 0.000 description 1
- CYCGARJWIQWPQM-YJRXYDGGSA-N Thr-Tyr-Ser Chemical compound C[C@@H](O)[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CO)C([O-])=O)CC1=CC=C(O)C=C1 CYCGARJWIQWPQM-YJRXYDGGSA-N 0.000 description 1
- 208000000728 Thymus Neoplasms Diseases 0.000 description 1
- 102100039580 Transcription factor ETV6 Human genes 0.000 description 1
- 102100025042 Transcription initiation factor TFIID subunit 3 Human genes 0.000 description 1
- 102100022011 Transcription intermediary factor 1-alpha Human genes 0.000 description 1
- WFZYXGSAPWKTHR-XEGUGMAKSA-N Trp-Ala-Gln Chemical compound C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N WFZYXGSAPWKTHR-XEGUGMAKSA-N 0.000 description 1
- OBAMASZCXDIXSS-SZMVWBNQSA-N Trp-Glu-Lys Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N OBAMASZCXDIXSS-SZMVWBNQSA-N 0.000 description 1
- OKAMOYTUQMIFJO-JBACZVJFSA-N Trp-Glu-Phe Chemical compound C([C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)N)C(O)=O)C1=CC=CC=C1 OKAMOYTUQMIFJO-JBACZVJFSA-N 0.000 description 1
- RQLNEFOBQAVGSY-WDSOQIARSA-N Trp-Met-Leu Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(O)=O RQLNEFOBQAVGSY-WDSOQIARSA-N 0.000 description 1
- WMIUTJPFHMMUGY-ZFWWWQNUSA-N Trp-Pro-Gly Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CC2=CNC3=CC=CC=C32)N)C(=O)NCC(=O)O WMIUTJPFHMMUGY-ZFWWWQNUSA-N 0.000 description 1
- GBEAUNVBIMLWIB-IHPCNDPISA-N Trp-Ser-Phe Chemical compound C([C@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)N)C(O)=O)C1=CC=CC=C1 GBEAUNVBIMLWIB-IHPCNDPISA-N 0.000 description 1
- JONPRIHUYSPIMA-UWJYBYFXSA-N Tyr-Ala-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 JONPRIHUYSPIMA-UWJYBYFXSA-N 0.000 description 1
- YGKVNUAKYPGORG-AVGNSLFASA-N Tyr-Asp-Glu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O YGKVNUAKYPGORG-AVGNSLFASA-N 0.000 description 1
- WVRUKYLYMFGKAN-IHRRRGAJSA-N Tyr-Glu-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 WVRUKYLYMFGKAN-IHRRRGAJSA-N 0.000 description 1
- CNLKDWSAORJEMW-KWQFWETISA-N Tyr-Gly-Ala Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H](C)C(O)=O CNLKDWSAORJEMW-KWQFWETISA-N 0.000 description 1
- WVGKPKDWYQXWLU-BZSNNMDCSA-N Tyr-His-Lys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)N[C@@H](CCCCN)C(=O)O)N)O WVGKPKDWYQXWLU-BZSNNMDCSA-N 0.000 description 1
- DWAMXBFJNZIHMC-KBPBESRZSA-N Tyr-Leu-Gly Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O DWAMXBFJNZIHMC-KBPBESRZSA-N 0.000 description 1
- PRONOHBTMLNXCZ-BZSNNMDCSA-N Tyr-Leu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 PRONOHBTMLNXCZ-BZSNNMDCSA-N 0.000 description 1
- PYJKETPLFITNKS-IHRRRGAJSA-N Tyr-Pro-Asn Chemical compound N[C@@H](Cc1ccc(O)cc1)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(O)=O PYJKETPLFITNKS-IHRRRGAJSA-N 0.000 description 1
- WQOHKVRQDLNDIL-YJRXYDGGSA-N Tyr-Thr-Ser Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O WQOHKVRQDLNDIL-YJRXYDGGSA-N 0.000 description 1
- XTOCLOATLKOZAU-JBACZVJFSA-N Tyr-Trp-Glu Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](CC3=CC=C(C=C3)O)N XTOCLOATLKOZAU-JBACZVJFSA-N 0.000 description 1
- NXPDPYYCIRDUHO-ULQDDVLXSA-N Tyr-Val-His Chemical compound C([C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(O)=O)C1=CC=C(O)C=C1 NXPDPYYCIRDUHO-ULQDDVLXSA-N 0.000 description 1
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 1
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 1
- 102100039936 Ubiquitin-conjugating enzyme E2 variant 3 Human genes 0.000 description 1
- 208000006593 Urologic Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- YFOCMOVJBQDBCE-NRPADANISA-N Val-Ala-Glu Chemical compound C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](C(C)C)N YFOCMOVJBQDBCE-NRPADANISA-N 0.000 description 1
- WGHVMKFREWGCGR-SRVKXCTJSA-N Val-Arg-Arg Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N WGHVMKFREWGCGR-SRVKXCTJSA-N 0.000 description 1
- GNWUWQAVVJQREM-NHCYSSNCSA-N Val-Asn-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N GNWUWQAVVJQREM-NHCYSSNCSA-N 0.000 description 1
- VUTHNLMCXKLLFI-LAEOZQHASA-N Val-Asp-Gln Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N VUTHNLMCXKLLFI-LAEOZQHASA-N 0.000 description 1
- OVLIFGQSBSNGHY-KKHAAJSZSA-N Val-Asp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](C(C)C)N)O OVLIFGQSBSNGHY-KKHAAJSZSA-N 0.000 description 1
- CFSSLXZJEMERJY-NRPADANISA-N Val-Gln-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O CFSSLXZJEMERJY-NRPADANISA-N 0.000 description 1
- VVZDBPBZHLQPPB-XVKPBYJWSA-N Val-Glu-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O VVZDBPBZHLQPPB-XVKPBYJWSA-N 0.000 description 1
- XWYUBUYQMOUFRQ-IFFSRLJSSA-N Val-Glu-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C(C)C)N)O XWYUBUYQMOUFRQ-IFFSRLJSSA-N 0.000 description 1
- OPGWZDIYEYJVRX-AVGNSLFASA-N Val-His-Arg Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N OPGWZDIYEYJVRX-AVGNSLFASA-N 0.000 description 1
- CPGJELLYDQEDRK-NAKRPEOUSA-N Val-Ile-Ala Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H](N)C(C)C)C(=O)N[C@@H](C)C(O)=O CPGJELLYDQEDRK-NAKRPEOUSA-N 0.000 description 1
- FEXILLGKGGTLRI-NHCYSSNCSA-N Val-Leu-Asn Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](C(C)C)N FEXILLGKGGTLRI-NHCYSSNCSA-N 0.000 description 1
- UMPVMAYCLYMYGA-ONGXEEELSA-N Val-Leu-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O UMPVMAYCLYMYGA-ONGXEEELSA-N 0.000 description 1
- GVJUTBOZZBTBIG-AVGNSLFASA-N Val-Lys-Arg Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N GVJUTBOZZBTBIG-AVGNSLFASA-N 0.000 description 1
- HJSLDXZAZGFPDK-ULQDDVLXSA-N Val-Phe-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)[C@H](C(C)C)N HJSLDXZAZGFPDK-ULQDDVLXSA-N 0.000 description 1
- NHXZRXLFOBFMDM-AVGNSLFASA-N Val-Pro-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)C(C)C NHXZRXLFOBFMDM-AVGNSLFASA-N 0.000 description 1
- LCHZBEUVGAVMKS-RHYQMDGZSA-N Val-Thr-Leu Chemical compound CC(C)C[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)[C@@H](C)O)C(O)=O LCHZBEUVGAVMKS-RHYQMDGZSA-N 0.000 description 1
- OFTXTCGQJXTNQS-XGEHTFHBSA-N Val-Thr-Ser Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](C(C)C)N)O OFTXTCGQJXTNQS-XGEHTFHBSA-N 0.000 description 1
- HTONZBWRYUKUKC-RCWTZXSCSA-N Val-Thr-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O HTONZBWRYUKUKC-RCWTZXSCSA-N 0.000 description 1
- PGBMPFKFKXYROZ-UFYCRDLUSA-N Val-Tyr-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=CC=C2)C(=O)O)N PGBMPFKFKXYROZ-UFYCRDLUSA-N 0.000 description 1
- NLNCNKIVJPEFBC-DLOVCJGASA-N Val-Val-Glu Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCC(O)=O NLNCNKIVJPEFBC-DLOVCJGASA-N 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 102100029504 Zinc finger protein RFP Human genes 0.000 description 1
- 102220585903 Zinc finger transcription factor Trps1_R908P_mutation Human genes 0.000 description 1
- 108010081404 acein-2 Proteins 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- QLDHWVVRQCGZLE-UHFFFAOYSA-N acetyl cyanide Chemical compound CC(=O)C#N QLDHWVVRQCGZLE-UHFFFAOYSA-N 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 102000035181 adaptor proteins Human genes 0.000 description 1
- 108091005764 adaptor proteins Proteins 0.000 description 1
- 201000008395 adenosquamous carcinoma Diseases 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 108010008685 alanyl-glutamyl-aspartic acid Proteins 0.000 description 1
- 108010086434 alanyl-seryl-glycine Proteins 0.000 description 1
- 108010005233 alanylglutamic acid Proteins 0.000 description 1
- 108010047495 alanylglycine Proteins 0.000 description 1
- 108010087924 alanylproline Proteins 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 238000010976 amide bond formation reaction Methods 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 239000006286 aqueous extract Substances 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 108010069926 arginyl-glycyl-serine Proteins 0.000 description 1
- 108010029539 arginyl-prolyl-proline Proteins 0.000 description 1
- 108010062796 arginyllysine Proteins 0.000 description 1
- 108010077245 asparaginyl-proline Proteins 0.000 description 1
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 1
- 108010093581 aspartyl-proline Proteins 0.000 description 1
- 108010047857 aspartylglycine Proteins 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 229940007550 benzyl acetate Drugs 0.000 description 1
- 150000001602 bicycloalkyls Chemical group 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 102100037490 cAMP-dependent protein kinase type I-alpha regulatory subunit Human genes 0.000 description 1
- 229960001292 cabozantinib Drugs 0.000 description 1
- ONIQOQHATWINJY-UHFFFAOYSA-N cabozantinib Chemical compound C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 ONIQOQHATWINJY-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 201000003719 cervical neuroblastoma Diseases 0.000 description 1
- 239000012069 chiral reagent Substances 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 230000006552 constitutive activation Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 108010016616 cysteinylglycine Proteins 0.000 description 1
- 108010060199 cysteinylproline Proteins 0.000 description 1
- 108010069495 cysteinyltyrosine Proteins 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000000741 diarrhetic effect Effects 0.000 description 1
- 208000024334 diffuse gastric cancer Diseases 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 108010054813 diprotin B Proteins 0.000 description 1
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000005837 enolization reaction Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000001952 enzyme assay Methods 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 208000028299 esophageal disease Diseases 0.000 description 1
- XDDCZSZXSOBENS-UHFFFAOYSA-N ethyl 3,3-difluoro-2,2-dimethylbutanoate Chemical compound CCOC(=O)C(C)(C)C(C)(F)F XDDCZSZXSOBENS-UHFFFAOYSA-N 0.000 description 1
- 239000002024 ethyl acetate extract Substances 0.000 description 1
- 125000000219 ethylidene group Chemical group [H]C(=[*])C([H])([H])[H] 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229950008692 foretinib Drugs 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 230000037433 frameshift Effects 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 201000000117 functional diarrhea Diseases 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- RNPABQVCNAUEIY-UHFFFAOYSA-N germine Natural products O1C(C(CCC23C)O)(O)C3CC(O)C(C3(O)C(O)C(O)C4C5(C)O)C12CC3C4CN1C5CCC(C)C1 RNPABQVCNAUEIY-UHFFFAOYSA-N 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 108010078144 glutaminyl-glycine Proteins 0.000 description 1
- 108010013768 glutamyl-aspartyl-proline Proteins 0.000 description 1
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 1
- 229930004094 glycosylphosphatidylinositol Natural products 0.000 description 1
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 1
- 108010074027 glycyl-seryl-phenylalanine Proteins 0.000 description 1
- 108010089804 glycyl-threonine Proteins 0.000 description 1
- 108010081551 glycylphenylalanine Proteins 0.000 description 1
- 108010087823 glycyltyrosine Proteins 0.000 description 1
- 108010037850 glycylvaline Proteins 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 208000019691 hematopoietic and lymphoid cell neoplasm Diseases 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004404 heteroalkyl group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 108010040030 histidinoalanine Proteins 0.000 description 1
- 108010025306 histidylleucine Proteins 0.000 description 1
- 102000047486 human GAPDH Human genes 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 125000001145 hydrido group Chemical group *[H] 0.000 description 1
- ILULYDJFTJKQAP-UHFFFAOYSA-N hydron;propan-2-ylhydrazine;chloride Chemical compound [Cl-].CC(C)N[NH3+] ILULYDJFTJKQAP-UHFFFAOYSA-N 0.000 description 1
- VGYYSIDKAKXZEE-UHFFFAOYSA-L hydroxylammonium sulfate Chemical compound O[NH3+].O[NH3+].[O-]S([O-])(=O)=O VGYYSIDKAKXZEE-UHFFFAOYSA-L 0.000 description 1
- 229910000378 hydroxylammonium sulfate Inorganic materials 0.000 description 1
- 229940027941 immunoglobulin g Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000003121 in-cell western assay Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 108010031424 isoleucyl-prolyl-proline Proteins 0.000 description 1
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 1
- 108010027338 isoleucylcysteine Proteins 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 208000022013 kidney Wilms tumor Diseases 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 108010044311 leucyl-glycyl-glycine Proteins 0.000 description 1
- 108010030617 leucyl-phenylalanyl-valine Proteins 0.000 description 1
- 108010000761 leucylarginine Proteins 0.000 description 1
- 108010057821 leucylproline Proteins 0.000 description 1
- 108010012058 leucyltyrosine Proteins 0.000 description 1
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- 108010038320 lysylphenylalanine Proteins 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- MMIPFLVOWGHZQD-UHFFFAOYSA-N manganese(3+) Chemical compound [Mn+3] MMIPFLVOWGHZQD-UHFFFAOYSA-N 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- NIAATLPQSKGUBG-UHFFFAOYSA-N methyl 2-(5-bromopyridin-2-yl)acetate Chemical compound COC(=O)CC1=CC=C(Br)C=N1 NIAATLPQSKGUBG-UHFFFAOYSA-N 0.000 description 1
- KHADGDFAJAGKRC-UHFFFAOYSA-N methyl 2-(5-bromopyridin-2-yl)propanoate Chemical compound CC(C(OC)=O)C(C=C1)=NC=C1Br KHADGDFAJAGKRC-UHFFFAOYSA-N 0.000 description 1
- SUWLKZHNJDJXQB-UHFFFAOYSA-N methyl 2-[4-(2,2-dicyano-1-hydroxyethenyl)phenyl]propanoate Chemical compound CC(C(OC)=O)C(C=C1)=CC=C1C(O)=C(C#N)C#N SUWLKZHNJDJXQB-UHFFFAOYSA-N 0.000 description 1
- YFDYDJVDFIIZTR-UHFFFAOYSA-N methyl 2-[4-(5-amino-4-cyano-1-propan-2-ylpyrazol-3-yl)phenyl]prop-2-enoate Chemical compound CC(C)N(C(N)=C1C#N)N=C1C(C=C1)=CC=C1C(C(OC)=O)=C YFDYDJVDFIIZTR-UHFFFAOYSA-N 0.000 description 1
- IORSMEUTDQJWCP-UHFFFAOYSA-N methyl 2-[4-(5-amino-4-cyano-1-propan-2-ylpyrazol-3-yl)phenyl]propanoate Chemical compound CC(C)N(C(N)=C1C#N)N=C1C1=CC=C(C(C)C(OC)=O)C=C1 IORSMEUTDQJWCP-UHFFFAOYSA-N 0.000 description 1
- UYTWVJKHHBTNOC-UHFFFAOYSA-N methyl 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]-3-fluorophenyl]prop-2-enoate Chemical compound CC1(CC1)N(C(N)=C1C#N)N=C1C(C=CC(C(C(OC)=O)=C)=C1)=C1F UYTWVJKHHBTNOC-UHFFFAOYSA-N 0.000 description 1
- HEMUGOXWNRGPNV-UHFFFAOYSA-N methyl 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]-3-fluorophenyl]propanoate Chemical compound CC(C(OC)=O)C(C=C1)=CC(F)=C1C1=NN(C2(C)CC2)C(N)=C1C#N HEMUGOXWNRGPNV-UHFFFAOYSA-N 0.000 description 1
- OBFUQJUDAHKFBS-UHFFFAOYSA-N methyl 2-[4-[5-amino-4-cyano-1-(1-methylcyclopropyl)pyrazol-3-yl]phenyl]prop-2-enoate Chemical compound CC1(CC1)N(C(N)=C1C#N)N=C1C(C=C1)=CC=C1C(C(OC)=O)=C OBFUQJUDAHKFBS-UHFFFAOYSA-N 0.000 description 1
- FSRRJDNGSUADDM-UHFFFAOYSA-N methyl 2-[5-[4-cyano-5-[(2-methylpropan-2-yl)oxycarbonylamino]-1-propan-2-ylpyrazol-3-yl]pyridin-2-yl]propanoate Chemical compound CC(C)N(C(NC(OC(C)(C)C)=O)=C1C#N)N=C1C1=CN=C(C(C)C(OC)=O)C=C1 FSRRJDNGSUADDM-UHFFFAOYSA-N 0.000 description 1
- ZLONNSYMBCDWMH-UHFFFAOYSA-N methyl 2-[5-[5-[bis[(2-methylpropan-2-yl)oxycarbonyl]amino]-4-cyano-1-propan-2-ylpyrazol-3-yl]pyridin-2-yl]propanoate Chemical compound CC(C)N(C(N(C(OC(C)(C)C)=O)C(OC(C)(C)C)=O)=C1C#N)N=C1C1=CN=C(C(C)C(OC)=O)C=C1 ZLONNSYMBCDWMH-UHFFFAOYSA-N 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 238000003032 molecular docking Methods 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 206010028537 myelofibrosis Diseases 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- 150000002825 nitriles Chemical group 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 230000000683 nonmetastatic effect Effects 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 201000005443 oral cavity cancer Diseases 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000020477 pH reduction Effects 0.000 description 1
- 102000045222 parkin Human genes 0.000 description 1
- 230000007918 pathogenicity Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 108010024654 phenylalanyl-prolyl-alanine Proteins 0.000 description 1
- 108010089198 phenylalanyl-prolyl-arginine Proteins 0.000 description 1
- 108010051242 phenylalanylserine Proteins 0.000 description 1
- PARWUHTVGZSQPD-UHFFFAOYSA-N phenylsilane Chemical compound [SiH3]C1=CC=CC=C1 PARWUHTVGZSQPD-UHFFFAOYSA-N 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- CHKVPAROMQMJNQ-UHFFFAOYSA-M potassium bisulfate Chemical compound [K+].OS([O-])(=O)=O CHKVPAROMQMJNQ-UHFFFAOYSA-M 0.000 description 1
- 229910000343 potassium bisulfate Inorganic materials 0.000 description 1
- 229940121597 pralsetinib Drugs 0.000 description 1
- GBLBJPZSROAGMF-BATDWUPUSA-N pralsetinib Chemical compound CO[C@]1(CC[C@@H](CC1)C1=NC(NC2=NNC(C)=C2)=CC(C)=N1)C(=O)N[C@@H](C)C1=CC=C(N=C1)N1C=C(F)C=N1 GBLBJPZSROAGMF-BATDWUPUSA-N 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 208000003476 primary myelofibrosis Diseases 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 108010015796 prolylisoleucine Proteins 0.000 description 1
- 108010090894 prolylleucine Proteins 0.000 description 1
- 108010053725 prolylvaline Proteins 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 208000010639 renal pelvis urothelial carcinoma Diseases 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 102220218564 rs1035958105 Human genes 0.000 description 1
- 102220226553 rs1064793638 Human genes 0.000 description 1
- 102220041201 rs115423919 Human genes 0.000 description 1
- 102220001105 rs121908076 Human genes 0.000 description 1
- 102200006199 rs121913308 Human genes 0.000 description 1
- 102220007180 rs121913308 Human genes 0.000 description 1
- 102220335411 rs1280250127 Human genes 0.000 description 1
- 102220194859 rs137855422 Human genes 0.000 description 1
- 102220335403 rs1393753095 Human genes 0.000 description 1
- 102200006129 rs141185224 Human genes 0.000 description 1
- 102220007191 rs143795581 Human genes 0.000 description 1
- 102220009196 rs145633958 Human genes 0.000 description 1
- 102220007192 rs146646971 Human genes 0.000 description 1
- 102220007214 rs146838520 Human genes 0.000 description 1
- 102220007188 rs148935214 Human genes 0.000 description 1
- 102200006247 rs149513065 Human genes 0.000 description 1
- 102220007206 rs149891333 Human genes 0.000 description 1
- 102220091832 rs150214547 Human genes 0.000 description 1
- 102220335400 rs1554818626 Human genes 0.000 description 1
- 102220335404 rs1554818786 Human genes 0.000 description 1
- 102220335415 rs1554819392 Human genes 0.000 description 1
- 102220335418 rs1554820079 Human genes 0.000 description 1
- 102220335419 rs1554820153 Human genes 0.000 description 1
- 102220335420 rs1554820165 Human genes 0.000 description 1
- 102200006288 rs17158558 Human genes 0.000 description 1
- 102200006127 rs1799939 Human genes 0.000 description 1
- 102220029564 rs185760342 Human genes 0.000 description 1
- 102200004935 rs192489011 Human genes 0.000 description 1
- 102220007162 rs201101792 Human genes 0.000 description 1
- 102220007165 rs201553718 Human genes 0.000 description 1
- 102220007164 rs201745826 Human genes 0.000 description 1
- 102200119611 rs267606715 Human genes 0.000 description 1
- 102220007217 rs267607011 Human genes 0.000 description 1
- 102200034108 rs28933683 Human genes 0.000 description 1
- 102200006103 rs34617196 Human genes 0.000 description 1
- 102200004867 rs34682185 Human genes 0.000 description 1
- 102220197863 rs374250186 Human genes 0.000 description 1
- 102220007163 rs377767388 Human genes 0.000 description 1
- 102220010314 rs377767389 Human genes 0.000 description 1
- 102220007166 rs377767390 Human genes 0.000 description 1
- 102200004573 rs377767391 Human genes 0.000 description 1
- 102200004574 rs377767391 Human genes 0.000 description 1
- 102200004575 rs377767391 Human genes 0.000 description 1
- 102200004634 rs377767393 Human genes 0.000 description 1
- 102220007168 rs377767394 Human genes 0.000 description 1
- 102220007169 rs377767395 Human genes 0.000 description 1
- 102200004571 rs377767396 Human genes 0.000 description 1
- 102200004579 rs377767397 Human genes 0.000 description 1
- 102220007170 rs377767397 Human genes 0.000 description 1
- 102220007174 rs377767400 Human genes 0.000 description 1
- 102220007175 rs377767402 Human genes 0.000 description 1
- 102220007176 rs377767404 Human genes 0.000 description 1
- 102200006195 rs377767405 Human genes 0.000 description 1
- 102200006197 rs377767405 Human genes 0.000 description 1
- 102200006198 rs377767405 Human genes 0.000 description 1
- 102220007177 rs377767406 Human genes 0.000 description 1
- 102220007178 rs377767406 Human genes 0.000 description 1
- 102220007183 rs377767407 Human genes 0.000 description 1
- 102220010316 rs377767409 Human genes 0.000 description 1
- 102220007184 rs377767410 Human genes 0.000 description 1
- 102220101322 rs377767411 Human genes 0.000 description 1
- 102220007190 rs377767413 Human genes 0.000 description 1
- 102220007195 rs377767414 Human genes 0.000 description 1
- 102220007196 rs377767415 Human genes 0.000 description 1
- 102220007197 rs377767416 Human genes 0.000 description 1
- 102220007198 rs377767417 Human genes 0.000 description 1
- 102220007201 rs377767420 Human genes 0.000 description 1
- 102220007203 rs377767421 Human genes 0.000 description 1
- 102220007204 rs377767422 Human genes 0.000 description 1
- 102220007208 rs377767423 Human genes 0.000 description 1
- 102220007209 rs377767424 Human genes 0.000 description 1
- 102220007212 rs377767427 Human genes 0.000 description 1
- 102220007213 rs377767428 Human genes 0.000 description 1
- 102200006109 rs377767429 Human genes 0.000 description 1
- 102220007219 rs377767431 Human genes 0.000 description 1
- 102200006311 rs377767432 Human genes 0.000 description 1
- 102220010311 rs377767433 Human genes 0.000 description 1
- 102220009701 rs377767439 Human genes 0.000 description 1
- 102220010312 rs377767441 Human genes 0.000 description 1
- 102220015060 rs397517348 Human genes 0.000 description 1
- 102220041202 rs545625150 Human genes 0.000 description 1
- 102220007181 rs55846256 Human genes 0.000 description 1
- 102200006107 rs55947360 Human genes 0.000 description 1
- 102220007210 rs55947360 Human genes 0.000 description 1
- 102220041909 rs587780810 Human genes 0.000 description 1
- 102200164125 rs63750240 Human genes 0.000 description 1
- 102220265970 rs747844360 Human genes 0.000 description 1
- 102200006093 rs75030001 Human genes 0.000 description 1
- 102200006135 rs75075748 Human genes 0.000 description 1
- 102200006161 rs75076352 Human genes 0.000 description 1
- 102200006302 rs75234356 Human genes 0.000 description 1
- 102220265321 rs753156691 Human genes 0.000 description 1
- 102200006140 rs75686697 Human genes 0.000 description 1
- 102220007167 rs75873440 Human genes 0.000 description 1
- 102200006164 rs75996173 Human genes 0.000 description 1
- 102200006167 rs75996173 Human genes 0.000 description 1
- 102200006205 rs75996173 Human genes 0.000 description 1
- 102200006305 rs76087194 Human genes 0.000 description 1
- 102220265166 rs761720362 Human genes 0.000 description 1
- 102200006358 rs76262710 Human genes 0.000 description 1
- 102200006359 rs76262710 Human genes 0.000 description 1
- 102200004939 rs76397662 Human genes 0.000 description 1
- 102200006285 rs76534745 Human genes 0.000 description 1
- 102200004609 rs767601598 Human genes 0.000 description 1
- 102200004932 rs76764689 Human genes 0.000 description 1
- 102200006363 rs77316810 Human genes 0.000 description 1
- 102200006364 rs77316810 Human genes 0.000 description 1
- 102200006191 rs77503355 Human genes 0.000 description 1
- 102200006362 rs77503355 Human genes 0.000 description 1
- 102200006365 rs77503355 Human genes 0.000 description 1
- 102200004570 rs77558292 Human genes 0.000 description 1
- 102200004635 rs77558292 Human genes 0.000 description 1
- 102220007154 rs77558292 Human genes 0.000 description 1
- 102200004934 rs77596424 Human genes 0.000 description 1
- 102220279293 rs776013456 Human genes 0.000 description 1
- 102220004874 rs77711105 Human genes 0.000 description 1
- 102200004572 rs77939446 Human genes 0.000 description 1
- 102220010204 rs77939446 Human genes 0.000 description 1
- 102200006139 rs78014899 Human genes 0.000 description 1
- 102200004641 rs78098482 Human genes 0.000 description 1
- 102220007220 rs78347871 Human genes 0.000 description 1
- 102200006170 rs78935588 Human genes 0.000 description 1
- 102200006357 rs79781594 Human genes 0.000 description 1
- 102200006360 rs79781594 Human genes 0.000 description 1
- 102200006361 rs79781594 Human genes 0.000 description 1
- 102200006366 rs79890926 Human genes 0.000 description 1
- 102200004577 rs80069458 Human genes 0.000 description 1
- 102200004872 rs80236571 Human genes 0.000 description 1
- 102220095273 rs876658138 Human genes 0.000 description 1
- 102220101325 rs878855060 Human genes 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 238000009738 saturating Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 239000012363 selectfluor Substances 0.000 description 1
- 238000010956 selective crystallization Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 108010069117 seryl-lysyl-aspartic acid Proteins 0.000 description 1
- 108010026333 seryl-proline Proteins 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 108091006024 signal transducing proteins Proteins 0.000 description 1
- 102000034285 signal transducing proteins Human genes 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- PNGLEYLFMHGIQO-UHFFFAOYSA-M sodium;3-(n-ethyl-3-methoxyanilino)-2-hydroxypropane-1-sulfonate;dihydrate Chemical compound O.O.[Na+].[O-]S(=O)(=O)CC(O)CN(CC)C1=CC=CC(OC)=C1 PNGLEYLFMHGIQO-UHFFFAOYSA-M 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 208000037969 squamous neck cancer Diseases 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 1
- RGCJAKZXSHCOCS-UHFFFAOYSA-N tert-butyl N-(1-methoxy-2-methylpropan-2-yl)-N-[(2-methylpropan-2-yl)oxycarbonylamino]carbamate Chemical compound CC(C)(C)OC(NN(C(C)(C)COC)C(OC(C)(C)C)=O)=O RGCJAKZXSHCOCS-UHFFFAOYSA-N 0.000 description 1
- NFNZLGQQOGDBQY-UHFFFAOYSA-N tert-butyl N-(1-methylcyclopropyl)-N-nitrosocarbamate Chemical compound CC(C)(C)OC(N(C1(C)CC1)N=O)=O NFNZLGQQOGDBQY-UHFFFAOYSA-N 0.000 description 1
- PJNBAQDPGDFJRG-UHFFFAOYSA-N tert-butyl n-(1-methylcyclopropyl)carbamate Chemical compound CC(C)(C)OC(=O)NC1(C)CC1 PJNBAQDPGDFJRG-UHFFFAOYSA-N 0.000 description 1
- IOGXOCVLYRDXLW-UHFFFAOYSA-N tert-butyl nitrite Chemical compound CC(C)(C)ON=O IOGXOCVLYRDXLW-UHFFFAOYSA-N 0.000 description 1
- 239000012414 tert-butyl nitrite Substances 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 208000008732 thymoma Diseases 0.000 description 1
- 201000009377 thymus cancer Diseases 0.000 description 1
- 201000008440 thyroid gland anaplastic carcinoma Diseases 0.000 description 1
- 208000019179 thyroid gland undifferentiated (anaplastic) carcinoma Diseases 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 201000000334 ureter transitional cell carcinoma Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 208000037965 uterine sarcoma Diseases 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 108010073969 valyllysine Proteins 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/422—Oxazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/427—Thiazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
- C07D231/40—Acylated on said nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/05—Isotopically modified compounds, e.g. labelled
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Enzymes And Modification Thereof (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
背景
转染重排(Rearranged during transfection)(RET)激酶是属于酪氨酸激酶超家族的单次跨膜受体,其是几种组织和细胞类型的正常发育、成熟和维持所必需的。RET激酶的细胞外部分含有四个参与配体结合的钙依赖性钙粘蛋白样重复以及RET胞外域的正确折叠所必需的近膜半胱氨酸富集区,而受体的细胞质部分包括两个酪氨酸激酶亚结构域。
RET信号转导由胶质细胞系源性神经营养因子(GDNF)家族配体(GFL)的一组35种可溶性蛋白的结合介导,其还包括neurturin(NTRN)、artemin(ARTN)和persephin(PSPN)。不同于其它受体酪氨酸激酶,RET没有直接结合到GFL,并且需要附加的辅助受体,其可以是通过糖基磷脂酰肌醇键连接到细胞表面的四种GDNF家族受体-α(GFRα)家族成员之一。GFL和GFRα家族成员形成二元复合物,其再结合到RET并将其募集到发生RET信号转导的富含胆固醇的膜亚结构域中。
在配体-辅助受体复合物结合后,细胞内酪氨酸残基上的RET二聚和自磷酸化募集衔接子和信号蛋白以刺激多种下游通路。衔接蛋白结合到这些停泊位点导致Ras-MAPK和PI3K-Akt/mTOR信号通路的活化,或导致CBL家族的泛素连接酶的募集,这在RET介导的功能的RET下调中发挥作用。
由归因于RET激酶的遗传改变(包括蛋白质-基因融合和激活点突变)的异常RET表达引起的正常RET活性的扰乱导致过度活跃的RET信号转导和不受控制的细胞生长,例如各种癌症类型和某些胃肠失调,如肠易激综合征(IBS)。抑制癌症患者或与过度活跃的RET信号转导相关的其它障碍的患者的异常RET活性的能力对这些患者非常有益。另外,一些RET激酶遗传改变使得RET激酶的构象结构改变以致给定的RET激酶抑制剂可能不太有效(或无效)。在这些情况下,对修饰后的RET激酶有效的新型RET激酶抑制剂将使患者受益匪浅。
概述
本文提供下式的化合物:
其可药用盐及其药物组合物。在式(I)中,A可以是五元或六元芳基或杂芳基;R1可以是氢、卤素、C1-C6烷基、C1-C6杂烷基、-(C0-C4烷基)(C5-C6杂烷基)、-(C0-C4烷基)(C3-C7环烷基)、-(C0-C4杂烷基)(C3-C7环烷基)、-(C0-C4烷基)(C4-C7环杂烷基)、-(C0-C4杂烷基)(C3-C7环杂烷基)、-(C0-C4烷基)(C4-C10双环)、-(C0-C4烷基)(C5-C6芳基)、-(C0-C4烷基)(C5-C6杂芳基)、-(C0-C4烷基)(C4-C10杂双环)、C5-C12螺烷、C5-C12杂螺烷、金刚烷、二氟甲基硫烷或五氟硫烷,其中各R1任选被一个或多个基团取代,所述基团独立地为卤素、氰基、羟基、氧代、甲基、甲氧基、羟甲基、乙基、乙氧基、羟乙基、甲基胺、N,N-二甲基甲基胺或单-、二-或三-卤代甲基,并且其中两个R1基团能够稠合形成包括A的一部分并任选为芳族的环结构,并且n为1、2、3、4或5;X1、X2、X3和X4各自能够独立地为N、CH、C-CH3、C-CH2-OH、C-OCH3、C-CH2-OCH3或C-卤素;且R2可以是C1-C4烷基、-(C0-C4烷基)(C3-C7环烷基)、-(C0-C4烷基)(C4-C7杂环烷基)、-(C0-C4烷基)(C4-C10双环),各自任选被一个或多个基团取代,所述基团独立地为氘、卤素、氰基、羟基、氧代、甲基、甲氧基、羟甲基、乙基、乙氧基、羟乙基、环丙基或单-、二-或三-卤代甲基。式(I)的化合物含有手性中心以提供如此处所示的R-对映异构体形式和S-对映异构体形式:
(R-对映异构体)
(S-对映异构体)
还提供了R-对映异构体和S-对映异构体、其可药用盐及其药物组合物,其中A、R1、n、X1、X2、X3、X4和R2如本文中定义。要理解的是,式II和III是式I的亚类,因此在本申请通篇提到式I也适用于式II和III。
还提供了使用式I、II或III的化合物、其可药用盐及其药物组合物治疗癌症,特别是治疗具有异常RET表达的癌症(例如RET相关癌症,如甲状腺髓样癌或RET融合肺癌)的方法。该方法包括给予有需要的患者治疗有效量的式I、II或III的化合物或其可药用盐。
本文还提供了用于疗法的式I、II和III的化合物及其可药用盐。本文进一步提供了用于治疗癌症,特别是用于治疗具有异常RET表达的癌症(例如RET相关癌症,如甲状腺髓样癌或RET融合肺癌)的式I、II和III的化合物及其可药用盐。还提供了式I、II和III的化合物或其可药用盐在用于制备用于治疗癌症,特别是用于治疗具有异常RET表达的癌症(例如RET相关癌症,如甲状腺髓样癌或RET融合肺癌)的药物的用途。
描述
本文描述了新型RET激酶抑制剂化合物。这些新型化合物可解决强力有效治疗与异常RET活性相关的障碍,例如IBS或癌症,尤其是由过度活跃的RET信号转导引起的癌症(即RET相关癌症)的需要。更具体地,这些新型化合物可解决强力有效治疗RET相关癌症,如肺癌(例如小细胞肺癌或非小细胞肺癌)、甲状腺癌(例如乳头状甲状腺癌、甲状腺髓样癌、分化型甲状腺癌、复发性甲状腺癌或难治性分化型甲状腺癌)、甲状腺腺瘤、内分泌腺肿瘤、肺腺癌、细支气管肺细胞癌、多发性内分泌腺瘤2A型或2B型(分别为MEN2A或MEN2B)、嗜铬细胞瘤、甲状旁腺增生、乳腺癌、乳癌(mammary cancer)、乳癌(mammary carcinoma)、乳腺肿瘤、结直肠癌(例如转移性结直肠癌)、乳头状肾细胞癌、胃肠粘膜神经节细胞瘤病、炎性肌纤维母细胞瘤或宫颈癌的需要。
本文描述的化合物是式(I)的化合物:
或其可药用盐。在式(I)中,
A是五元或六元芳基或杂芳基;
各R1可在各种化学上适当的位置连接到A并且独立地为氢、卤素、C1-C6烷基、C1-C6杂烷基、-(C0-C4烷基)(C5-C6杂烷基)、-(C0-C4烷基)(C3-C7环烷基)、-(C0-C4杂烷基)(C3-C7环烷基)、-(C0-C4烷基)(C4-C7环杂烷基)、-(C0-C4杂烷基)(C3-C7环杂烷基)、-(C0-C4烷基)(C4-C10双环)、-(C0-C4烷基)(C5-C6芳基)、-(C0-C4烷基)(C5-C6杂芳基)、-(C0-C4烷基)(C4-C10杂双环)、C5-C12螺烷、C5-C12杂螺烷、金刚烷、二氟甲基硫烷或五氟硫烷,其中各R1任选被一个或多个基团取代,所述基团独立地为卤素、氰基、羟基、氧代、甲基、甲氧基、羟甲基、乙基、乙氧基、羟乙基、甲基胺、N,N-二甲基甲基胺或单-、二-或三-卤代甲基,并且其中两个R1基团能够稠合形成包括A的一部分并任选为芳族的环结构,并且n为1、2、3、4或5;
X1、X2、X3和X4各自独立地为N、CH、C-CH3、C-CH2-OH、C-OCH3、C-CH2-OCH3或C-卤素;和
R2是C1-C4烷基、-(C0-C4烷基)(C3-C7环烷基)、-(C0-C4烷基)(C4-C7杂环烷基)、-(C0-C4烷基)(C4-C10双环),各自任选被一个或多个基团取代,所述基团独立地为氘、卤素、氰基、羟基、氧代、甲基、甲氧基、羟甲基、乙基、乙氧基、羟乙基、环丙基或单-、二-或三-卤代甲基。
尽管n被定义为1、2、3、4或5,但一些A环具有5个可容纳R1基团的位置,而另一些没有。例如,苯基具有5个可取代位置,吡唑具有三个可取代位置,而异噁唑只有两个。因此,变量n的最大值可取决于A环是什么。
本文所用的具体化学命名惯例是化学领域的技术人员熟悉的。为了更加清楚起见,具体定义一些术语。
本文所用的术语烷基是指1至4个原子的饱和的直链或支链的一价烃基,例如“C1-C4烷基”。在指示0的情况,例如C0-C4烷基,取代基的这种组分可以不存在,因此,如果C5杂环烷基取代基在式(I)中的R2位置,C5杂环烷基取代基将通过如对R2所述的-(C0-C4烷基)(C4-C7杂环烷基)取代基描述,即该取代基是-(C0)(C5杂环烷基)。实例包括但不限于,甲基、乙基、丙基、1-丙基、异丙基和丁基。类似地,本文所用的术语杂烷基是指含有一个或多个杂原子替代烷基链中的碳的如本文定义的饱和的直链或支链的一价烷基分子。
本文所用的术语C5-C6芳基是指衍生自含有5至7个碳原子并且不含杂原子的芳环的官能团或取代基。本文所用的术语C5-C6杂芳基是指衍生自含有碳原子和一个或多个杂原子(例如氮、氧或硫)作为芳环的一部分以使该环含有5至7个原子的芳环的官能团或取代基。芳基和杂芳基的实例包括但不限于,苯、吡啶、吡嗪、嘧啶、哒嗪、呋喃、吡咯、噻吩、咪唑、吡唑、噁唑、异噁唑和噻唑。
本文所用的术语C3-C7环烷基是指含有3至7个碳原子的环烷基分子。C3-C7环烷基的实例包括但不限于,环丙基、环丁基和环戊基。类似地,本文所用的术语C4-C7环杂烷基是指含有4至7个总原子并包括一个或多个杂原子替代环烷基链中的碳的如本文定义的环烷基分子。
本文所用的术语C4-C10双环是指具有两个或更多个稠合或桥连的由4至10个碳原子组成的环的基团。当C4-C10双环基团稠合时,这两个环共享两个相邻原子。当C4-C10双环基团桥连时,这两个环共享三个或更多个原子。双环分子可以是全脂族、全芳族或混合芳族-脂族的。术语C4-C10杂双环是指也包括一个或多个杂原子的如定义的C4-C10双环基团。可用于式(I)的化合物的桥连C4-C8双环烷基分子的实例包括,但不限于:
本文所用的术语C5-C12螺烷是指具有经由单个共用碳原子连接的两个或更多个由7至12个碳原子组成的环的基团。类似地,术语C5-C12杂螺烷是指具有通过螺环键(spirocyclic linkage)经由碳原子连接的两个或更多个由包括碳和至少一个杂原子的7至12个原子组成的环的基团,其中各个环具有3至6个环原子(其中一个碳原子是两个环共用的),并且其中两个环原子是氮原子。可用于式(I)的化合物的C5-C12螺烷和杂螺烷的实例包括,但不限于:
本文所用的术语卤素是指氟(F)、氯(Cl)、溴(Br)或碘(I)。
本文所用的术语氧代是指双键键合到碳原子的氧。
在式(I)的化合物中,A-(R1)n可以是
其中波浪线指示A与如式(I)中所示的主链的连接点。
在另一实施方案中,在式(I)的化合物中,A-(R1)n可以是
在一个实施方案中,在式(I)的化合物中,A-(R1)n是
在一个实施方案中,A-(R1)n是被(R1)n取代的苯基。在进一步实施方案中,n是1-4、或1-3、或1-2、或1、或2、或2-4、或2-5。在一些实施方案中,当A-(R1)n是被(R1)n取代的苯基时,两个R1基团稠合形成包括A的一部分并任选为芳族的环结构,所得A环任选如本文所述被取代。
在进一步实施方案中,在式(I)的化合物中,至少一个R1基团是H或CH3。
在另一实施方案中,在式(I)的化合物中,至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再一实施方案中,至少一个R1是CH3、-CH2C(CH3)3、-C(CH3)2CF3、C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3或CF3。
在另一实施方案中,至少一个R1是任选取代的C5-C12螺烷。
在再一实施方案中,至少一个R1是二氟甲基硫烷或五氟硫烷。
在再一实施方案中,至少一个R1是2-氟-4-氯苯基;2-氯-4-氟苯基;2,4-二氯苯基;或2,4-二氟苯基。
在式(I)的化合物中,R2可以是
在一些实施方案中,在式(I)的化合物中,R2是氘化的,即其含有至少一个氘。在一些进一步的实施方案中,氘化的R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3。
在一些实施方案中,R2是-CH(CD3)2。
在各种实施方案中,X1、X2、X3和X4是CH。
在另一些实施方案中,X1、X2、X3和X4各自独立地为CH、C-CH3、C-CH2-OH、C-OCH3、C-CH2-OCH3或C-卤素,其中X1、X2、X3和X4的至少一个不是CH。
在一些实施方案中,X1、X2、X3和X4的两个是CH,而另外两个是C-卤素。在进一步实施方案中,X1和X2是CF,且X3和X4是CH。
在各种实施方案中,X1、X2、X3和X4的三个是CH,而一个是C-卤素。在进一步实施方案中,X2是CF,而X1、X3和X4是CH。
在再一些实施方案中,X1、X2、X3和X4之一是N。
在进一步实施方案中,X2是N且X1、X3和X4的至少两个是CH。
在再进一步实施方案中,X1是N且X2、X3和X4的至少两个是CH。
在所有上述实施方案中,要理解的是,变量的定义适用于非盐形式“或其可药用盐”。
本领域技术人员会认识到,如式(I)描述的化合物或其可药用盐含有至少一个手性中心,其位置在式(I)ϕ中由ϕ标示:
(也可能由R1和R2的各种任选取代型式创建其它手性中心,并且可以创建进一步的非对映异构体集)。本领域技术人员也会认识到,手性中心的Cahn-Ingold-Prelog (R)或(S)名称将随围绕手性中心的取代型式而变。在式(I)的化合物中标出的手性中心提供式(II)所示的R-对映异构体形式和式(III)所示的S-对映异构体形式:
本文还提供了式(II)和式(III)的化合物或其可药用盐,其中A、R1、n、X1、X2、X3、X4和R2如对式(I)所定义。如果存在多个手性中心,也可能存在非对映异构体。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是或,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是或,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是或,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是或,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是或,其中R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、 、和。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1选自H、-CH3、-CH2C(CH3)3、-C(CH3)2CF3、、和。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4是CH;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4是CH;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4是CH;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4是CH;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中至少一个R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是或,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是或,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4是CH;A-(R1)n是或,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是或,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是或,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是或,其中R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在另一个方面,在式(I)、(II)和/或(III)的化合物中,R2是异丙基;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在一个方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4是CH;A-(R1)n是,其中各R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
在再进一步方面,在式(I)、(II)和/或(III)的化合物中,R2是-CH(CH3)CF2D、-CH(CD3)2、-CH(CF3)CD3、-CH(CH3)CDF2、-CD(CD3)2或-CD(CH3)CD3;X1、X2、X3和X4的三个是CH,而X1、X2、X3和X4的一个是N;A-(R1)n是,其中各R1是卤素、、-CH2C(CH3)3、2-氯-4-氟苯基、2,4-二氯苯基、-CH2C(CH3)3、-C(CH3)2CF3、、、、-C(CH3)2CH2CH3、-C(CH3)2CF2CH3、-C(CH3)2CH2CF3、-C(CH3)3、或CF3。
每当变量被定义为“各”,例如,“各R1是…”,要理解的是,该变量在每次出现时的定义独立地选自该定义中所含的基团。因此,例如,如果苯基被四个R1基团取代,各R1基团的身份(identity)独立地选自在R1的定义中列举的基团。相应地,所有四个R1基团可以相同或它们可以都不同,或一些基团可以相同而另一些不同。
特定的对映异构体可以用手性试剂开始制备或通过立体选择性或立体定向合成技术制备。或者,可以在式(I)、式(II)和式(III)的化合物合成中的任何方便的点通过标准手性色谱或结晶技术从不同手性形式的混合物中分离单一对映异构体。本文旨在包括所有独立的对映异构体,以及式(II)和式(III)的化合物的对映异构体的混合物,包括外消旋体。
式(I)的化合物的具体实例,包括式(II)和式(III)的形式,显示在下面的实施例中。实施例中可用的分子的子集显示在表A中。
表A中所绘的结构并非指示在主链手性位置(如式(I)ϕ中的ϕ所示)的绝对立体化学。但是,异构体可通过如下面的实施例中描述的手性色谱法分离并且经常在异构体之间注意到不同的活性。因此,在表A中的各实施例中,标注的异构体(即异构体1或异构体2)可以是该分子的如有别于S-对映异构体形式(或反之亦然)的R-对映异构体形式。R-对映异构体形式和S-对映异构体形式都在下面的实施例中指出并且这两种形式都旨在包括在本公开内。
式(I)的化合物,包括式(II)和式(III)的形式也可以在特定位置氘化,并且这样的氘化形式被理解为公开在本文中,其中在所公开的分子中氢可被氘替代。
本文所述的式(I)、(II)和(III)的化合物可能形成可药用盐。意在包括式(I)、(II)和(III)的化合物的此类可药用盐。可药用盐和它们的常用制备方法是本领域中公知的(参见例如P. Stahl等人Handbook of Pharmaceutical Salts: Properties, Selection and Use, 第二修订版(Wiley-VCH, 2011);S.M. Berge等人,“Pharmaceutical Salts,” Journal of Pharmaceutical Sciences, Vol. 66, No. 1,1977年1月)。
如本文所述的式(I)、(II)和(III)的化合物通常在宽剂量范围内有效。例如,每日剂量在大约1 mg/kg至大约200 mg/kg的范围内。此外,如本文所述的式(I)、(II)和(III)的化合物可以例如以大约1 mg/kg至大约150 mg/kg、大约1 mg/kg至大约100 mg/kg、大约5mg/kg至大约150 mg/kg、大约5 mg/kg至大约100 mg/kg、大约20 mg/kg至大约40 mg/kg、大约25 mg/kg至大约35 mg/kg、大约50 mg/kg至大约70 mg/kg、大约55 mg/kg至大约65 mg/kg、大约90 mg/kg至大约110 mg/kg、大约95 mg/kg至大约105 mg/kg、或大约50 mg/kg至大约150 mg/kg的量给药。另外,如本文所述的式(I)、(II)和(III)的化合物可以例如以大约5mg/kg、大约10 mg/kg、大约15 mg/kg、大约20 mg/kg、大约25 mg/kg、大约30 mg/kg、大约35mg/kg、大约40 mg/kg、大约45 mg/kg、大约50 mg/kg、大约55 mg/kg、大约60 mg/kg、大约65mg/kg、大约70 mg/kg、大约75 mg/kg、大约80 mg/kg、大约85 mg/kg、大约90 mg/kg、大约95mg/kg、大约100 mg/kg、大约105 mg/kg、大约110 mg/kg、大约115 mg/kg、大约120 mg/kg、大约125 mg/kg、大约130 mg/kg、大约135 mg/kg、大约140 mg/kg、大约145 mg/kg、大约150mg/kg、大约155 mg/kg、大约160 mg/kg、大约165 mg/kg、大约170 mg/kg、大约175 mg/kg、大约180 mg/kg、大约185 mg/kg、大约190 mg/kg、大约195 mg/kg、或大约200 mg/kg的量给药。每日给药可以是每日一次或在多剂量中,例如每日两次(BID)给药。要理解的是,由医师根据相关情况,包括要治疗的状况、所选给药途径、施用的实际化合物、个体患者的年龄、体重和响应以及患者症状的严重程度确定实际施用的化合物的量。
如本文所述的式(I)、(II)和(III)的化合物可配制为可通过各种途径给药的药物组合物。这样的药物组合物及其制备方法是本领域中公知的(参见例如Remington:The Science and Practice of Pharmacy (A. Gennaro等人著, 第21版, Mack PublishingCo.、2005))。具体地,如本文所述的式(I)、(II)和(III)的化合物或其可药用盐可与一种或多种可药用载体、稀释剂或赋形剂组合。更特别地,本文所述的式(I)、(II)和(III)的化合物可配制为药物组合物。此外,如本文所述的式(I)、(II)和(III)的化合物或其可药用盐可与一种或多种其它治疗剂组合。例如,如本文所述的式(I)、(II)和(III)的化合物或其可药用盐可以是用于治疗癌症的药物组合物中的组分,与一种或多种可药用载体、稀释剂或赋形剂以及任选与一种或多种附加治疗剂组合。含有如本文所述的式(I)、(II)和(III)的化合物或其可药用盐的药物组合物可用于本文所述的方法。
本文所用的术语“治疗”是指抑制、减慢、停止或逆转已有症状、状况或障碍的进展或严重程度。
本文所用的术语“肠易激综合征”或“IBS”是指肠胃失调,包括但不限于,腹泻型、便秘型或交替排便模式(alternating stool pattern)、功能性腹胀、功能性便秘、功能性腹泻、非特异性功能性肠病(unspecified functional bowel disorder)、功能性腹痛综合征、慢性特发性便秘、功能性食管障碍、功能性胃十二指肠障碍、功能性肛门直肠疼痛和炎性肠病。
本文所用的术语“癌症”和“癌性”是指或描述通常以不受调节的细胞增殖为特征的患者生理状况。在这一定义中包括良性和恶性癌症。“早期癌症”或“早期肿瘤”是指非晚期或非转移性的或被归类为0期、I期或II期癌症的癌症。癌症的实例包括但不限于,肺癌(例如小细胞肺癌或非小细胞肺癌)、甲状腺癌(例如乳头状甲状腺癌、甲状腺髓样癌、分化型甲状腺癌、复发性甲状腺癌、或难治性分化型甲状腺癌)、甲状腺腺瘤、内分泌腺肿瘤、肺腺癌、细支气管肺细胞癌、多发性内分泌腺瘤2A型或2B型(分别为MEN2A或MEN2B)、嗜铬细胞瘤、甲状旁腺增生、乳腺癌、乳癌(mammary cancer)、乳癌(mammary carcinoma)、乳腺肿瘤、结直肠癌(例如转移性结直肠癌)、乳头状肾细胞癌、胃肠粘膜神经节细胞瘤病、炎性肌纤维母细胞瘤和宫颈癌。
本文所用的术语“RET相关疾病或障碍”是指与以下调节异常相关或具有以下调节异常的疾病或障碍:RET基因、RET激酶(在本文中也称为RET激酶蛋白)或其任一种(例如一种或多种)的表达或活性或含量的调节异常(例如RET基因、RET激酶、RET激酶结构域或本文所述的其任一种的表达或活性或含量的任何类型的调节异常)。
本文所用的术语“RET相关癌症”是指与以下调节异常相关或具有以下调节异常的癌症:RET基因、RET激酶(在本文中也称为RET激酶蛋白)或其任一种的表达或活性或含量的调节异常。在本文中描述了RET相关癌症的非限制性实例。
短语“RET基因、RET激酶或其任一种的表达或活性或含量的调节异常”是指基因突变。引起RET基因、RET激酶或其任一种的表达或活性或含量的调节异常的这样的基因突变的实例包括但不限于,导致表达融合蛋白的RET基因易位、导致表达与野生型RET蛋白相比包括删除至少一个氨基酸的RET蛋白的RET基因删除、导致表达具有一种或多种点突变的RET蛋白的RET基因突变或导致产生与野生型RET蛋白相比删除RET蛋白中的至少一个氨基酸的RET蛋白的RET mRNA的替代性拼接版本、或导致过表达RET蛋白或由细胞中的RET基因的过表达引起的自分泌活性以造成细胞中的RET蛋白的激酶结构域的活性的致病性增加(例如RET蛋白的组成性激活激酶结构域)的RET基因扩增。RET基因、RET蛋白或其任一种的表达或活性或含量的调节异常可以是编码RET蛋白的RET基因中的突变,其是组成性激活的或与由不包括该突变的RET基因编码的蛋白质相比具有提高的活性。例如,RET基因、RET蛋白或其任一种的表达或活性或含量的调节异常可以是基因或染色体易位以致表达含有包括功能激酶结构域的RET的第一部分和伴侣蛋白(即非RET)的第二部分的融合蛋白的结果。在一些实例中,RET基因、RET蛋白或其任一种的表达或活性或含量的调节异常可以是一种RET基因与另一种非RET基因的基因易位的结果。
提供了使用如本文所述的式(I)、(II)和(III)的化合物治疗RET相关疾病或障碍,特别是治疗IBS或具有异常RET表达的癌症的方法。具有异常RET表达的癌症的实例包括由RET基因、RET激酶或其任一种的表达或活性或含量的调节异常引起的癌症。一种这样的治疗RET相关疾病或障碍,如IBS或癌症的方法包括给予需要其的患者治疗有效量的。另一种治疗RET相关疾病或障碍,如IBS或癌症的方法包括a) 检测来自患者的样本中的RET基因、RET激酶或其任一种的表达或活性或含量的调节异常;和b) 给予治疗有效量的式I的化合物或可药用盐。
RET基因、RET激酶或其任一种的表达或活性或含量的调节异常可以是一种或多种导致RET基因融合的染色体易位或倒位的结果(即基因易位导致表达的蛋白质是含有来自非RET伴侣蛋白的残基并包括最少量的功能RET激酶结构域的融合蛋白)。RET融合伴侣和它们的相关癌症的非限制性实例包括ACBD5(乳头状甲状腺癌);AFAP1(NSCLC);AFAP1L2(乳头状甲状腺癌);AKAP13(乳头状甲状腺癌);BCR(慢性粒单核细胞白血病);C10orf118(乳头状甲状腺癌);CCDC6(也称为PTC1、D10S170或H4)(NSCLC、结肠癌、乳头状甲状腺癌、腺癌、肺腺癌、转移性结直肠癌、腺鳞癌、乳腺癌);CCDC88C(NSCLC);CEP55(弥漫性胃癌);CGNL1(胰腺癌);CLIP1(腺癌);CUX1(肺腺癌);DLG5(非间变性甲状腺癌);DOCK1(NSCLC、;EML4(乳头状甲状腺癌);ERC1(也称为ELKS)(乳头状甲状腺癌、乳腺癌);ETV6(唾液癌);FGFR1OP(CMML,原发性骨髓纤维化伴有继发性急性髓系白血病);FKBP15(乳头状甲状腺癌);FOXP4(肺腺癌);FRMD4A(NSCLC);GOLGA5(也称为PTC5)(乳头状甲状腺癌、Spitzoid瘤);H4L(各种);HOOK3(乳头状甲状腺癌);HRH4-RET(甲状腺癌和/或乳头状甲状腺癌);HTIF1(各种);KIAA1217(也称为SKT)(乳头状甲状腺癌、肺腺癌、NSCLC);KIAA1468(也称为PTC9和RFG9)(乳头状甲状腺癌、肺腺癌);KIF13A(NSCLC);KIF5B(NSCLC、卵巢癌、Spitzoid瘤、肺腺癌、腺鳞癌);KTN1(也称为PTC8)(乳头状甲状腺癌);MBD1(也称为PCM1)(乳头状甲状腺癌);MPRIP(NSCLC);MYH10(婴幼儿肌纤维瘤病);MYH13(甲状腺髓样癌);NCOA4(也称为PTC3、ELE1和RFG)(乳头状甲状腺癌、NSCLC、结肠癌、唾液腺癌、转移性结直肠癌、肺腺癌、乳头状甲状腺癌的腺鳞癌弥漫性硬化性变体、乳腺癌、腺泡细胞癌、乳腺样分泌性癌);OLFM4(小肠癌);PARD3(NSCLC);PCM1(乳头状甲状腺癌);PIBF1(细支气管肺细胞癌);PICALM(NSCLC);PPFIBP2(乳头状甲状腺癌);PRKAR1A(也称为PTC2)(乳头状甲状腺癌);PTC1ex9(新型CCDC6重排)(转移性乳头状甲状腺癌);PTC4(新型NCO4/ELE1重排)(乳头状甲状腺癌);RAB61P2(乳头状甲状腺癌);RASAL2(肉瘤);RASGEF1A(乳腺癌);RBPMS(NSCLC);RFG8(乳头状甲状腺癌);RRBP1(结肠癌);RUFY1(结直肠癌);RUFY2(NSCLC;乳头状甲状腺癌);RUFY3(乳头状甲状腺癌);SLC12A2(NSCLC);SORBS2(乳头状甲状腺癌);SPECC1L(乳头状甲状腺癌;甲状腺癌);SQSTM1(乳头状甲状腺癌);TAF3(胰腺癌);TBL1XR1(乳头状甲状腺癌、甲状腺癌);TFG(胰腺癌);TIF1G(各种);TRIM24(也称为PTC6)(乳头状甲状腺癌);TRIM27(也称为RFP)(乳头状甲状腺癌);AKAP13(乳头状甲状腺癌);TRIM33(也称为PTC7和RFG7)(NSCLC、乳头状甲状腺癌);和UEVLD(乳头状甲状腺癌)。融合蛋白可以是例如,KIF5B-RET。另一些RET融合蛋白可能未包括在此名单中或尚且未知;但是,如本文所述的式(I)、(II)和(III)的化合物和它们的使用方法预计是有效的抑制剂。
RET基因、RET激酶或其任一种的表达或活性或含量的调节异常可由(与野生型RET相比)在RET基因中的一个或多个点突变、插入或删除引起。作为参考,在此提供成熟的人RET蛋白的序列(SEQ ID NO: 1:
与野生型RET激酶相比的激活RET激酶蛋白点突变、插入或缺失的非限制性实例可发生在以下氨基酸位置:2、3、4、5、6、7、8、11、12、13、20、32(例如S32L)、34(例如D34S)、40(例如L40P)、56(例如L56M)、64(例如P64L)、67(例如R67H)、114(例如R114H)、136(例如谷氨酸至终止密码子)、145(例如V145G)、氨基酸位置180(例如精氨酸至终止密码子)、200、292(例如V292M)、294、321(例如G321R)、330(例如R330Q)、338(例如T338I)、360(例如R360W)、373(例如丙氨酸至移码)、393(例如F393L)、423(例如G423R)、432、446(例如G446R)、505-506(外显子7中的6-碱基对框内Germline Deletion)、510(例如A510V)、511(例如E511K)、513(例如G513D)、515(例如C515R、C515S、C515W)、525(例如R525W)、531(例如C531R或9碱基对复制)、532(例如复制)、533(例如G533C、G533S)、550(例如G550E)、591(例如V591I)、593(例如G593E)、595(例如E595D和E595A)、600(例如R600Q)、602(例如I602V)、603(例如K603Q、K603E)、606(例如Y606C)、609(例如C609Y、C609S、C609G、C609R、C609F、C609W、C609C)、611(例如C611R、C611S、C611G、C611Y、C611F、C611W)、616(例如E616Q)、618(例如C618S、C618Y、C618R、C618T、C618G、C618F、C618W)、620(例如C620S、C620W、C620R、C620G、C620L、C620Y、C620F)、623(例如E623K)、624(例如D624N)、630(例如C630A、C630R、C630S、C630Y、C630F、C630W、C630G)、631(例如D631N、D631Y、D631A、D631G、D631V、D631E)、632(例如E632K、E632G)、632-633(外显子11中的6-碱基对框内Germline Deletion)、633(例如9碱基对复制)、634(例如C634W、C634Y、C634S、C634R、C634F、C634G、C634L、C634A或C634T,或插入ELCR,或12碱基对复制,或与A640G、A641A或A641T组合)(例如引起MTC)、634/852(例如C634R/I852M)、635(例如R635G)、636(例如T636P、T636M)、648(例如V648I)、649(例如S649L)、664(例如A664D)、665(例如H665Q)、666(例如K666E、K666M、K666N、K666R)、675(T675T、沉默核苷酸变化)、686(例如S686N)、689(例如S689T)、691(例如G691S)、694(例如R694Q)、700(例如M700L)、706(例如V706M、V706A)、713剪接变体(例如E713K)、732(例如E732K)、736(例如G736R)、748(例如G748C)、765(例如S765P)、766(例如P766S、P766M6)、768(例如E768Q、E768D)、769(例如L769L)、770(例如R770Q)、771(例如D771N)、777(例如N777S)、778(例如V778I)、781(例如Q781R)、788(例如I788I)、790(例如L790F、L790T)、791(例如Y791F、Y791N)、791/852(例如Y791F /I852M)、802、804(例如V804L、V804M、V804E、V804G、V804S)(例如引起MTC)、804/918(例如V804M/M918T、V804L/M918T)、805(例如E805K)、804/805(例如V804M/E805K)、806(例如Y806F、Y806C、Y806H、Y806Y)、810(例如G810R、G810S、G810A、G810C、G810V)、818(例如E818K)、819(例如S819I)、823(例如G823E)、826(例如Y826M、Y826S)、833(例如R833C)、841(例如P841L、P841P)、843(例如E843D)、844(例如R844W、R844Q、R844L)、848(例如M848T)、852(例如I852M)、865(例如L865V)、870(例如L870F)、873(例如R873W)、876(例如A876V)、881(例如L881V)、882、883(例如A883F、A883P、A883S、A883T、A883Y)、884(例如E884K)、886(例如R886W)、891(例如S891A)、897(例如R897Q)、898(例如D898V)、900(例如Y900F)、901(例如E901K)、904(例如S904F、S904C)、905(例如Y905F)、907(例如K907E、K907M)、908(例如R908K)、911(例如G911D)、912(例如R912P、R912Q)、918(例如M918T、M918V、M918L、M918R)(例如引起MTC)、919(例如A919V)、921(例如E921K)、922(例如S922P、S922Y)、930(例如T930M)、961(例如F961L)、972(例如R972G)、981(例如Y981F)、982(例如R982C)、1009(例如M1009V)、1015(例如Y1015F)、1017(例如D1017N)、1041(例如V1041G)、1064(例如M1064T)、1096(例如Y1096F)、RET+3、外显子6和11中的框内缺失、外显子15中的3bp框内缺失、核苷酸位置2136+2(例如2136+2T>G)、del632-636 ins6。RET激酶蛋白点突变/插入/缺失可以是例如M918T、M918V、C634W、V804L或V804M。另一些RET激酶蛋白点突变/插入/缺失可能未包括在此名单中或尚且未知;但是,如本文所述的式(I)、(II)和(III)的化合物和它们的使用方法预计是有效的抑制剂。
RET基因、RET激酶或其任一种的表达或活性或含量的调节异常还可包括RET mRNA中的拼接变化,其导致表达的蛋白质是(与野生型RET激酶相比)已经删除至少一个残基以造成RET激酶结构域的组成性激活的RET的替代性拼接变体。
如本文定义的“RET激酶抑制剂”是指使用测量法,如下面在实施例中描述的生物测定法抑制RET活性的化合物。
在一些情况下,含有突变、插入或缺失的RET激酶与野生型RET激酶或不包括相同突变的RET激酶相比更耐受一种或多种第一RET激酶抑制剂对其磷酸转移酶活性的抑制。这样的突变可能并不降低具有RET激酶的癌细胞或肿瘤对如本文所述的式(I)、(II)和(III)的化合物的治疗的敏感性(例如与不包括特定RET抑制剂耐药突变的癌细胞或肿瘤相比)。在这些情况下,与野生型RET激酶或不具有相同突变的RET激酶在相同的第一RET激酶抑制剂存在下相比,RET抑制剂耐药突变可导致RET激酶在第一RET激酶抑制剂存在下具有提高的Vmax、降低的对ATP的Km和提高的对第一RET激酶抑制剂的KD的一种或多种。
在另一些情况下,含有突变、插入或缺失的RET激酶与野生型RET激酶或不包括相同突变的RET激酶相比具有提高的对如本文所述的式(I)、(II)和(III)的化合物的耐药性。在这样的情况下,与野生型RET激酶或不具有相同突变的RET激酶在相同的如本文所述的式(I)、(II)和(III)的化合物存在下相比,RET抑制剂耐药突变可导致RET激酶在如本文所述的式(I)、(II)和(III)的化合物存在下具有提高的Vmax、降低的Km和提高的KD的一种或多种。
RET抑制剂耐药突变的实例可包括在RET激酶的三级结构中的ATP结合位点(包括但不限于卡口残基(gatekeeper residue)、P-环残基、DFG基序中或附近的残基,和ATP裂缝溶剂前沿氨基酸残基)中和附近的点突变、插入或缺失。这些类型的突变的另外的实例包括可能影响酶活性和/或药物结合的残基的变化,包括但不限于活化环中的残基、活化环附近或与活化环相互作用的残基、有助于活性或无活性酶构象的残基、包括在接续C螺旋的环(loop proceeding the C-helix)中和在C螺旋中的突变、缺失和插入的变化。在此处的突变已知形成RET抑制剂耐药性的特定残基或残基区包括但不限于以下氨基酸(基于人野生型RET蛋白序列(SEQ ID NO: 1)):732(例如E732K);788(例如I788N);804(例如V804M、V804L、V804E);804/805(例如V804M/E805K);806(例如Y806C、Y806E、Y806S、Y806H、Y806N);810(例如G810A、G810C、G810R、G810S、G810V);和865(例如L865V)。RET抑制剂耐药突变位置的进一步实例包括但不限于以下氨基酸(基于人野生型RET蛋白序列(SEQ ID NO: 1)):L730P、G731V、E732K、G733V、E734K、L760M、K761E、E762K、N763D、A764V、S765N、P766A、S767C、E768K、L779M、I788M、M868R、K869E、L870Q、V871M、H872R、R873P、D874Y、L881R、L895M、S896N、R897C、D898Y、V899G、Y900D、E901K、E902K、D903Y、S904C、Y905D、V906M、K907E、R908P、S909C、Q910R、G911C和R912P。这些突变(其也可能包括单个或多个氨基酸变化,在序列内或在序列侧面的插入,以及在序列内或在序列侧面的缺失)被认为诱发位阻和/或活性构象效应(active conformational effect),其改变抑制剂结合特征。
如本文所述的式(I)、(II)和(III)的化合物可用于治疗患上具有某些RET抑制剂耐药突变的癌症的患者。例如,导致对RET抑制剂的耐药性提高的耐药突变,如在氨基酸位置804的取代(例如V804M、V804L或V804E),和/或一种或多种其它RET抑制剂耐药突变,如上文论述的那些,可通过联合给药或作为对现有药物治疗的后续治疗进行治疗。例如,如果患者用第一RET激酶抑制剂治疗且该患者产生RET抑制剂耐药突变,该患者可随后用如本文所述的式(I)、(II)和(III)的化合物或其可药用盐治疗(假设如本文所述的式(I)、(II)和(III)的化合物是存在的特定RET激酶抑制剂突变的合适抑制剂)。作为另一实例,如果患者已知具有特定的RET激酶抑制剂突变(或多种突变),该患者可同时用多种RET激酶抑制剂治疗,包括如本文所述的式(I)、(II)和(III)的化合物或其可药用盐,它们有效对抗存在的RET激酶抑制剂突变。目前已知的RET激酶抑制剂的实例包括阿来替尼、BLU6864、卡博替尼、多韦替尼、foretinib、乐伐替尼(lenvatinib)、帕纳替尼、普拉替尼(pralsetinib)、塞尔帕替尼、索拉非尼、舒尼替尼和凡德他尼。
可使用本文所述的方法治疗的癌症的类型包括血液癌或实体瘤癌。可使用如本文所述的式(I)、(II)和(III)的化合物治疗的癌症的类型的实例包括肺癌(例如小细胞肺癌或非小细胞肺癌)、甲状腺癌(例如乳头状甲状腺癌、甲状腺髓样癌、分化型甲状腺癌、复发性甲状腺癌、或难治性分化型甲状腺癌)、甲状腺腺瘤、内分泌腺肿瘤、肺腺癌、细支气管肺细胞癌、多发性内分泌腺瘤2A型或2B型(分别为MEN2A或MEN2B)、嗜铬细胞瘤、甲状旁腺增生、乳癌、乳腺癌、mammary carcinoma、乳腺肿瘤、结直肠癌(例如转移性结直肠癌)、乳头状肾细胞癌、胃肠粘膜神经节细胞瘤病、炎性肌纤维母细胞瘤和宫颈癌。具体地,癌症类型可以是肺癌或甲状腺癌。更具体地,该癌症可以是非小细胞肺癌或甲状腺髓样癌。可使用如本文所述的式(I)、(II)和(III)的化合物和方法治疗的癌症类型的进一步实例包括急性成淋巴细胞性白血病(ALL)、急性髓细胞性白血病(AML)、青少年癌症、肾上腺皮质癌、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎样/横纹肌样肿瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑干胶质瘤、脑肿瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤、原发灶不明癌、心脏肿瘤、宫颈癌、儿童癌症、脊索瘤、慢性淋巴细胞性白血病(CLL)、慢性髓细胞性白血病(CML)、慢性骨髓增殖性肿瘤、neoplasms by site、肿瘤(neoplasms)、结肠癌、结直肠癌、颅咽管瘤、皮肤T细胞淋巴瘤、胆管癌、导管原位癌、胚胎瘤、子宫内膜癌、室管膜瘤、食管癌、嗅神经母细胞瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞肿瘤、肝外胆管癌、眼癌、输卵管癌、骨纤维组织细胞瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(GIST)、生殖细胞瘤、妊娠滋养细胞疾病、胶质瘤、毛细胞肿瘤、毛细胞白血病、头颈癌、胸部肿瘤、头颈部肿瘤、CNS肿瘤、原发性中枢神经系统肿瘤、心脏癌、肝细胞癌、组织细胞增多症、霍奇金氏淋巴瘤、下咽癌、眼内黑色素瘤、胰岛细胞瘤、胰腺神经内分泌肿瘤、卡波西肉瘤、肾癌、朗格汉斯细胞组织细胞增生症、喉癌、白血病、唇口腔癌、肝癌、肺癌、淋巴瘤、巨球蛋白血症、骨恶性纤维组织细胞瘤、骨癌、黑色素瘤、梅克尔细胞癌、间皮瘤、转移性鳞状颈癌、中线束癌、口腔癌、多发性内分泌腺瘤综合征、多发性骨髓瘤、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增殖性肿瘤、neoplasms by site、肿瘤(neoplasms)、髓细胞性白血病(myelogenousleukemia)、骨髓性白血病(myeloid leukemia)、多发性骨髓瘤、骨髓增殖性肿瘤、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、肺肿瘤(lung neoplasm)、肺癌(pulmonary cancer)、肺肿瘤(pulmonary neoplasms)、呼吸道肿瘤、支气管癌、支气管肿瘤、口腔癌(oral cancer)、口腔癌(oral cavity cancer)、唇癌、口咽癌、骨肉瘤、卵巢癌、胰腺癌、乳头状瘤病、副神经节瘤、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬瘤(pheochromosytoma)、垂体癌、浆细胞肿瘤、胸膜肺母细胞瘤、妊娠和乳腺癌、原发性中枢神经系统淋巴瘤、原发性腹膜癌、前列腺癌、肾癌、结肠癌、结肠肿瘤、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、Sezary综合征、皮肤癌、小细胞肺癌、小肠癌、软组织肉瘤、鳞状细胞癌、鳞状颈癌、胃癌、T细胞淋巴瘤、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管移行细胞癌、原发灶不明癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌和肾母细胞瘤。
可使用如本文所述的式(I)、(II)和(III)的化合物和方法治疗的血液癌类型的实例包括白血病、淋巴瘤(非霍奇金淋巴瘤)、霍奇金病(也称为霍奇金氏淋巴瘤)和骨髓瘤,例如急性淋巴细胞白血病(ALL)、急性髓细胞性白血病(AML)、急性早幼粒细胞白血病(APL)、慢性淋巴细胞性白血病(CLL)、慢性粒细胞白血病(CML)、慢性粒单核细胞白血病(CMML)、慢性中性粒细胞白血病(CNL)、急性未分化性白血病(AUL)、间变性大细胞淋巴瘤(ALCL)、幼淋巴细胞白血病(PML)、幼年型粒单核细胞白血病(JMML)、成人T细胞ALL、AML伴骨髓三系病态造血(AML/TMDS)、混合系白血病(MLL)、骨髓增生异常综合征(MDS)、骨髓增生性疾病(MPD)和多发性骨髓瘤(MM)。血液癌的另外的实例包括骨髓增生性疾病(MPD),如真性红细胞增多症(PV)、特发性血小板减少症(ET)和特发性原发性骨髓纤维化(IMF/IPF/PMF)。在一个实施方案中,血液癌(例如作为RET相关癌症的血液癌)是AML或CMML。
可使用如本文所述的式(I)、(II)和(III)的化合物和方法治疗的实体瘤癌类型的实例包括甲状腺癌(例如乳头状甲状腺癌、甲状腺髓样癌)、肺癌(例如肺腺癌、小细胞肺癌)、胰腺癌、胰腺导管癌、乳腺癌、结肠癌、结直肠癌、前列腺癌、肾细胞癌、头颈部肿瘤、成神经细胞瘤和黑色素瘤。
如本文所述的式(I)、(II)和(III)的化合物或其可药用盐可用于制备用于治疗RET相关疾病或障碍,如IBS或癌症的药物。上文描述了可使用这样的药物治疗的癌症。如本文所述的式(I)、(II)或(III)的化合物或其可药用盐在药物制备中的使用还可包括步骤:使用来自患者的生物样本进行体外检测,测定存在RET基因、RET激酶或其任一种的表达或活性或含量的调节异常,和如果存在RET基因、RET激酶或其任一种的表达或活性或含量的调节异常,给予患者治疗有效量的 如本文所述的式(I)、(II)和(III)的化合物。在这些用途中,生物样本可以是肿瘤样本,并可使用本领域技术人员已知的方法,如基因组/DNA测序分析肿瘤样本。另外,在这些用途中,样本可在如本文所述的式(I)、(II)和(III)的化合物的首次给药之前获自患者。如本文所述的式(I)、(II)和(III)的化合物在治疗中的这些用途可基于通过具有RET基因、RET激酶或其任一种的表达或活性或含量的至少一种调节异常而选择患者进行治疗。此外,在这些用途中,如本文所述的式(I)、(II)和(III)的化合物或其可药用盐可以以大约1 mg/kg至200 mg/kg的剂量给药于患者(有效剂量的子范围如上所述)。
如本文所述的式(I)、(II)和(III)的化合物或其可药用盐可通过本领域中已知的各种程序以及下面的“制备例和实施例”制备。所述各路线的具体合成步骤可以不同方式组合或与来自不同方案的步骤组合,以制备式(I)、(II)和(III)的化合物或其可药用盐。以下方案中的各步骤的产物可通过本领域众所周知的常规方法回收,包括萃取、蒸发、沉淀、色谱法、过滤、研制和结晶。试剂和原材料是本领域普通技术人员易得的。
为清楚起见,在以下方案中某些立体化学中心并未指定并且已经消除某些取代基,并且无意以任何方式限制方案的教导。此外,本领域普通技术人员可在本发明的化合物的合成中的任何方便的点通过如选择性结晶技术或手性色谱法之类的方法分离或拆分独立的异构体、对映异构体和非对映异构体(参见例如J. Jacques等人, "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, Inc., 1981和E.L. Eliel和S.H. Wilen, “Stereochemistry of Organic Compounds”, Wiley-Interscience,1994)。例如,以下分子具有两个手性中心,由ϕ(如上文在式(I)ϕ中)和星号(*)(以显示第二手性中心)标示。这种分子有四种可能的异构体,它们可以在没有测定绝对立体化学的情况下分离,即这些非对映异构体对可以是RR、RS、SR和SS。在没有测定立体化学的情况下,可通过它们在手性柱上的保留时间区分分子。
例如,名称“异构体1”和“异构体2”是指在本文所述的条件下分别第一个和第二个从手性色谱法中洗脱的化合物并且如果在合成早期就开始手性色谱法,相同名称适用于后续中间体和实施例。类似地,当也存在非对映异构体时,除名称异构体1和异构体2外还使用名称“非对映异构体A”和“非对映异构体B”。另外,以下方案中描述的中间体可能含有许多氮保护基。变量保护基在每次出现时可以相同或不同,取决于特定反应条件和要进行的特定转化。保护和脱保护条件是技术人员公知的并描述在文献中(参见例如“Greene’s Protective Groups in Organic Synthesis”, 第四版, Peter G.M. Wuts和Theodora W.Greene, John Wiley and Sons, Inc. 2007)。
某些缩写如下定义:“ACN”是指乙腈;“ATP”是指三磷酸腺苷;“BSA”是指牛血清白蛋白;“n-BuLi”是指正丁基锂;“DCM”是指二氯甲烷或亚甲基氯;“DEA”是指二乙胺;“DIPEA”是指N,N-二异丙基乙基胺或N-乙基-N-异丙基-丙-2-胺;“DMA”是指二甲胺;“DMF”是指N,N-二甲基甲酰胺;“DMSO”是指二甲亚砜;“DTT”是指二硫苏糖醇;“Et3N”是指三乙胺;“EtOAc”是指乙酸乙酯;“ee”是指对映异构体过量;“Et2O”是指二乙基醚;“EtOH”是指乙醇或乙基醇;“FA”是指甲酸;“GST”是指谷胱甘肽S-转移酶;“HEK”是指人胚胎肾;“hr”或“hrs”是指小时;“HTRF”是指均相时间分辨荧光;“IgG”是指免疫球蛋白G;“IPA”是指异丙基醇或异丙醇;“KOAc”是指乙酸钾;“LDA”是指二异丙基氨基锂;“MeOH”是指甲醇或甲基醇;“MeTHF”是指2-甲基四氢呋喃;“min”是指分钟;“Mn(dpm)3”是指三[(3Z)-2,2,6,6-四甲基-5-氧代-3-庚烯-3-酸]锰(3+);“MtBE”是指甲基叔丁基醚;“NaOAc”是指乙酸钠;“NBS”是指N-溴代琥珀酰亚胺;“NMI”是指1-甲基咪唑或N-甲基咪唑;“PBS-T”是指磷酸盐缓冲盐水 + Tween®20;“Pd(dppf)Cl2)”是指[1,1’双(二苯基膦基) 二茂铁]二氯化钯(II);“PE”是指石油醚;“PhSiH3”是指苯基硅烷;“RT”是指室温;“TCHF”是指六氟磷酸四甲基氯甲脒;“tert-BuOH”是指叔丁基醇;“TCFH”是指六氟磷酸N,N,N',N'-四甲基氯甲脒;“TFA”是指三氟乙酸;“THF”是指四氢呋喃;和“T3P®”是指丙膦酸酐、2,4,6-三丙基-1,3,5,2,4,6-三氧杂三磷杂环己烷-2,4,6-三氧化物或PPACA;“t(R)”是指保留时间和“WT”是指野生型。
在以下方案中,除非另行指明,所有取代基如上文定义。试剂和原材料通常是本领域普通技术人员易得的。另一些可通过与已知的结构相似化合物的合成类似的有机和杂环化学的标准技术以及下面的“制备例和实施例”中描述的程序,包括任何新型程序制造。在本说明书中旨在包括可用于合成式(I)所述的化合物的中间体和方法。
方案1
方案1描绘(13)的化合物的制备,其可用于制备式(I)、(II)和(III)的化合物。本领域普通技术人员会认识到,芳基醛(1)可与烷基肼(4)发生缩合以提供腙(2)。腙(2)可以使用本领域中公知的试剂卤化以提供肼酰溴(3)。氨基吡唑(6)可通过肼酰溴(3)与丙二腈的缩合和随后成环形成。氨基吡唑(6)也可通过使适当取代的肼(4)与适当的二腈迈克尔受体(5)反应合成。芳基溴(6)在典型Miyaura反应条件下的硼化可提供硼酸酯(boronicester)(7)。硼酸酯(7)用适当的金属催化剂和卤化物处理可提供α,ß不饱和酯(8)。烯烃(8)的还原可在还原条件,如氢气气氛和合适的金属催化剂,优选Pd/C下实现,以提供α-甲基酯(13)。
方案2
方案2描绘如本文所述的式(I)、(II)和(III)的化合物的制备。技术人员会认识到,α-甲基酯(13)的替代性合成可通过乙酸甲酯(9)在典型烯醇烷基化(archetypalenolate alkylation)条件下的α-甲基化实现以提供α甲基酯(10)。芳基溴(10)通过Miyaura条件的硼化可以以与方案1中对硼酸酯(7)所述基本相同的方式提供硼酸酯(11)。硼酸酯(11)在Suzuki偶联条件下用适当的溴吡唑(12)和金属催化剂处理可提供α-甲基酯(13)。羧酸(14)可通过酯(13)与适当的亲核碱的皂化获得。羧酸(14)的对映异构体可使用本领域中公知的手性分离技术分离或在合成中的稍后步骤中分离。羧酸(14)和伯胺(15)可使用适当的酰胺偶联剂在适用于酰胺键形成的条件下连接以提供(16)。氨基吡唑(16)的腈部分可在各种条件,如金属催化水合、酸性水解和氧化下转化成如本文所述的式(I)、(II)和(III)的化合物。对映异构体可使用本领域中公知的手性分离技术分离以得到如本文所述的式(I)、(II)和(III)的化合物。
制备例和实施例
制备例1
2-(5-溴-2-吡啶基)丙酸甲酯
在N2下和在-20℃下向在THF(84 mL)中的2-(5-溴吡啶-2-基)乙酸甲酯(4.20 g,17.5 mmol)中加入在矿物油中的60% NaH(w/w)(771 mg, 19.3 mmol)。该混合物在-20℃下搅拌直至气体析出平息。然后向反应混合物中加入碘甲烷(4.4 mL, 70.1 mmol)。将混合物在-20℃下搅拌5分钟,此后使其升温至室温。在1小时后,反应混合物在减压下浓缩并在真空下干燥。向残留物中加入DCM(15 mL)、H2O(10 mL)和饱和NaHCO3水溶液(10 mL)。分离有机层,经Na2SO4干燥,过滤并在减压下浓缩。粗制材料通过用EtOAc/DCM从0%至20%梯度洗脱的硅胶快速色谱法提纯,以产生作为无色油的标题化合物(3.16 g, 68.59%)。
制备例2
2-[4-(2,2-二氰基-1-羟基-乙烯基)苯基]丙酸甲酯
在室温下和在N2下将矿物油中的60% NaH(w/w)(3.85 g, 96.091 mmol)分份加入THF(180 mL),在0-10℃下向混合物中逐滴加入在THF(20 mL)中的丙二腈(3.17 g, 48.046mmol),将混合物在室温下搅拌30分钟。在0℃下向该混合物中逐滴加入在THF(30 mL)中的2-(4-氯羰基苯基)丙酸甲酯(13 g, 粗),在室温下将混合物搅拌2小时。所得混合物直接使用,不经进一步提纯。
制备例2a
2-[(4-溴-2,3-二氟-苯基)-羟基-亚甲基]丙二腈
在0℃下和在N2下向NaH(1.68 g, 42.13 mmol, 60%)在THF(100 mL)中的搅拌混合物中逐滴加入在THF(100 mL)中的丙二腈(1.53 g, 23.160 mmol)。将混合物在室温下和在N2下搅拌30分钟。在0℃下向上述混合物中逐滴加入在THF(10 mL)中的4-溴-2,3-二氟苯甲酰氯。将混合物在室温下搅拌附加的2小时。使用该混合物,不经进一步提纯。
制备例3
2-[4-(2,2-二氰基-1-甲氧基乙-1-烯-1-基)苯基]丙酸甲酯
在室温下和在N2下向在THF溶液中的粗2-[4-(2,2-二氰基-1-羟基-乙烯基)苯基]丙酸甲酯中逐滴加入硫酸二甲酯(7.67 g, 60.810 mmol),并将混合物在80℃下和在N2下搅拌整夜。令混合物冷却至室温并用H2O(300 mL)猝灭。该混合物用EtOAc(3×300 mL)萃取,并且合并的有机萃取物用饱和NaCl水溶液(3×500 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过用己烷/EtOAc(6:1-1:1)洗脱的硅胶柱色谱法提纯以产生作为黄色油的标题化合物(5 g, 36.49%经3个步骤)。1H NMR (d6-DMSO) δ 7.71 –7.62 (m,2H), 7.59 –7.50 (m, 2H), 4.00 –3.93 (m, 1H), 3.90 (s, 3H), 3.63 (s, 3H), 1.44(d, 3H)。
制备例3a
2-[(4-溴-2,3-二氟-苯基)-甲氧基-亚甲基]丙二腈
在室温下向粗2-[(4-溴-2,3-二氟-苯基)-羟基-亚甲基]丙二腈中逐滴加入硫酸二甲酯(3.35 g, 26.56 mmol)。将混合物在80℃下和在N2下搅拌整夜。将混合物冷却至室温。该反应在室温下用H2O猝灭。该混合物用EtOAc(3×100 mL)萃取。合并的有机萃取物用盐水(3×100 mL)洗涤,在无水Na2SO4上干燥,过滤并将滤液在减压下浓缩。残余物通过用PE/EtOAc(3:1-2:1)洗脱的硅胶柱色谱法提纯以产生作为浅灰色固体的标题化合物(5.0g, 75.5%经3个步骤)。1H NMR (300 MHz, CDCl3) δ 7.64-7.54 (m, 1H), 7.18-7.11 (m,1H), 3.99 (d, 3H)。
制备例3b
2-[(4-溴-2-氟苯基)(甲氧基)甲叉基]丙二腈
向2-(4-溴-2-氟苯甲酰基)丙二腈(23.40 g, 87.62 mmol)在THF(300 mL)中的溶液中加入硫酸二甲酯(13.26 g, 105.13 mmol),混合物在80℃下和在N2下搅拌整夜。将溶液冷却至室温并在减压下浓缩。粗产物溶解在EtOAc(200 mL)中并用H2O(200 mL)稀释。该混合物用EtOAc(3×200 mL)萃取,有机萃取物用盐水(2×100 mL)洗涤,在无水Na2SO4上干燥并在减压下浓缩。粗产物通过用5:1至3:1 PE至EtOAc的梯度洗脱的硅胶色谱法提纯以获得作为棕色半固体的标题产物(23.5 g, 95.4%)。ES/MS m/z(79Br/81Br) 265.0/267.0 [M+H]+。
制备例4
5,5-二氟-4,4-二甲基-3-氧代己腈
在-70℃下向LDA(20.81 mL, 41.62 mmol)在THF(100 mL)中的搅拌混合物中逐滴加入在THF中的ACN(1.82 g, 44.33 mmol)。该混合物在-70℃下搅拌30分钟。在-70℃下向上述混合物中逐滴加入在THF中的3,3-二氟-2,2-二甲基丁酸乙酯(5 g, 27.75 mmol),混合物缓慢升温至室温。反应通过在0℃下加入饱和NH4Cl(水溶液)(30 mL)来猝灭,并用PE(200 mL)萃取。用HCl(水溶液)(1 N)将水相酸化至pH= 3并用EtOAc(3×100 mL)萃取。EtOAc萃取物用饱和NaCl水溶液(3×50 mL)洗涤,在无水Na2SO4上干燥,过滤, 滤液在减压下浓缩以产生作为棕色油的标题化合物(1.9 g, 39.09%),其不经进一步提纯使用。1H NMR(CDCl3) δ 3.79 (s, 2H), 1.63 (t, 3H), 1.34 (s, 6H)。
制备例5
4-(3-双环[1.1.1]戊基)-3-氧代-丁腈
室温下将在THF(1 mL)中的矿物油中的60% NaH (w/w)(140 mg, 3.5 mmol)逐滴添加到2-(3-双环[1.1.1]戊基)乙酸苄酯(504 mg, 2.33 mmol)和ACN(134 μL, 2.56mmol)在THF(8 mL, 0.3 M)中的搅拌溶液中。在60℃下将反应混合物加热并搅拌25分钟。反应混合物用冰H2O(10 mL)猝灭,用HCl(c)酸化至pH 5并用EtOAc(3×10 mL)萃取。合并的有机萃取物用饱和NaCl水溶液(10 mL)洗涤,在无水Na2SO4上干燥,并在减压下浓缩以产生标题化合物(350 mg)。
制备例5a
3-[3-甲基双环[1.1.1]戊-1-基]-3-氧代丙腈
在0℃下和在N2下向THF(5.00 mL)中加入n-BuLi(1.71 mL, 4.28 mmol, 2.5 M在THF中)。在-78℃下和在N2下向该混合物中经5分钟逐滴加入在THF(5 mL)中的ACN(187.42mg, 4.56 mmol)。该混合物在-78℃下搅拌1小时。在-78℃下和在N2下向该混合物中逐滴加入在THF(5 mL)中的3-甲基双环[1.1.1]戊烷-1-甲酸甲酯(400.00 mg, 2.85 mmol)。该混合物在室温下搅拌1小时。该反应通过在0℃下加入饱和NH4Cl水溶液(20 mL)来猝灭。混合物用HCl(1 N)水溶液酸化至pH 4,并用DCM(3×50 mL)萃取。合并的有机萃取物用盐水(2×100 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩以获得作为棕色液体的标题化合物(360 mg, 84.5%)。
制备例5b
3-氧代-3-[3-(三氟甲基)双环[1.1.1]戊-1-基]丙腈
在0℃下和在N2下将n-BuLi(0.83 mL, 2.087 mmol, 2.5 M在己烷中)加入到THF(10 mL)中。在-78℃下和在N2下经2分钟逐滴加入在THF(2 mL)中的ACN(91.34 mg, 2.23mmol),将反应在-78℃下搅拌1小时。在-78℃下将在THF(2 mL)中的3-(三氟甲基)双环[1.1.1]戊烷-1-甲酸甲酯(270.00 mg, 1.39 mmol)逐滴添加到该反应混合物中,该反应在室温下搅拌12小时。该反应通过加入饱和NH4Cl水溶液(20 mL)来猝灭,用浓HCl酸化至pH =4,并用DCM(3×50 mL)萃取。合并的有机萃取物用盐水洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。在未经进一步提纯的情况下使用粗产物(290 mg)。1H NMR (300 MHz, CDCl3)δ 3.54 (s, 2H), 2.39 (s, 6H)。
表1中的下列化合物基本如对3-氧代-3-[3-(三氟甲基)双环[1.1.1]戊-1-基]丙腈所述来制备,调节反应时间以确定反应完成和适当的提纯条件。在加入羧酸酯后,令该反应升温至室温。可以加入在己烷或THF中的n-BuLi。
制备例6
N-(叔丁氧基羰基氨基)-N-(2-甲氧基-1,1-二甲基-乙基)氨基甲酸叔丁酯
在0℃下和在N2下向Mn(dpm)3(60.31 mg, 0.100 mmol)在IPA (20.00 mL)中的搅拌溶液中分份加入3-甲氧基-2-甲基-丙-1-烯(860.00 mg, 9.984 mmol)、PhSiH3(1.08 g,9.984 mmol)和(E)-N-[(叔丁氧基羰基)亚氨基](叔丁氧基)甲酰胺(3.45 g, 14.98mmol)。所得混合物在室温下和在N2下搅拌2小时并在真空下浓缩。加入H2O(15 mL),所得混合物用EtOAc(3×30mL)萃取。合并的有机萃取物用饱和NaCl水溶液(2×20 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过用PE/EtOAc(10:1至7:3)的梯度洗脱的硅胶柱色谱法提纯以产生作为无色油的标题化合物(1.8 g, 56.62%)。1H NMR (CDCl3) δ3.38-3.32 (m, 5H), 1.49-1.46 (m, 24H)。
制备例7
N-(1-甲基环丙基)-N-亚硝基-氨基甲酸叔丁酯
在室温下和在N2下向N-(1-甲基环丙基)氨基甲酸叔丁酯(2.00 g, 11.68 mmol)在DCM(20.00 mL)中的搅拌溶液中分份加入亚硝酸叔丁酯(2.40 g, 23.36 mmol),混合物在室温下和在N2下搅拌2小时。混合物在减压下浓缩,残余物通过用PE/EtOAc(25/1至20/1)洗脱的硅胶柱色谱法提纯以产生作为棕色液体的标题化合物(1.3 g, 55.59%)。1H NMR(d6-DMSO) δ 1.59 (s, 9H), 1.10 (s, 3H), 0.86-0.84 (m, 2H), 0.70-0.65 (m, 2H)。
制备例8
(1-甲基环丙基)肼盐酸盐
在0℃下和在N2下向N-(1-甲基环丙基)-N-亚硝基-氨基甲酸叔丁酯(1.20 g,5.99 mmol)在4 N HCl(8.00 mL)中的搅拌溶液中分份加入Zn(783.98 mg, 11.99 mmol),混合物在室温下和在N2下搅拌12小时。将混合物过滤,滤饼用H2O(3×10 mL)洗涤,滤液在减压下浓缩以产生作为灰白色固体的标题化合物(2 g, 粗),其直接使用,不经进一步提纯。1H NMR (d6-DMSO) δ 1.30 (s, 3H), 0.77-0.73 (m, 2H), 0.54-0.50 (m, 2H)。
制备例9
(1-甲氧基-2-甲基丙-2-基)肼盐酸盐
将N-(叔丁氧基羰基氨基)-N-(2-甲氧基-1,1-二甲基-乙基)氨基甲酸叔丁酯(1.6g, 5.00 mmol)在HCl(气体)中在1,4-二氧杂环己烷(15.00 mL)中的溶液在室温下和在N2下搅拌6小时。该混合物在真空下浓缩并用Et2O(3×10 mL)研磨以产生作为半固体的标题化合物(400 mg, 52%)。1H NMR (d6-DMSO) δ 3.36 (s, 2H), 3.32 (s, 3H), 1.17 (s,6H)。
制备例10
(1,1,1-三氟-2-甲基丙-2-基)肼二盐酸盐
在室温下和在N2下向N'-(1,1,1-三氟-2-甲基丙-2-基)苯甲酰肼(7.50 g)在H2O(40.00 mL)中的搅拌混合物中分份加入HCl(c)(40.00 mL)。所得混合物在80℃下和在N2下搅拌12小时。令混合物冷却至室温并在减压下浓缩。所得固体用Et2O(30 mL)研磨,通过过滤收集沉淀的固体,用Et2O(3×30 mL)洗涤以产生作为灰白色固体的标题化合物(4.0 g,61%)。1H NMR (d6-DMSO) δ 9.55 (br, s, 2H), 5.60 (br, s, 3H), 1.34 (s, 6H)。
制备例11
N-[(E)-(4-溴苯基)亚甲基氨基]丙-2-胺
在80℃下和在N2下将4-溴-苯甲醛(100.00 g, 540.48 mmol)、异丙基肼盐酸盐(65.75 g, 594.53 mmol)和DIPEA(76.84 g, 594.53 mmol)在DMF(500 mL)中的溶液搅拌3小时。将该反应冷却至室温。所得混合物直接使用,无需后处理或进一步提纯。ES/MS m/z(79Br/81Br) 241.1/243.1 [M+H]+。
表1a中的下列化合物基本如对N-[(E)-(4-溴苯基)亚甲基氨基]丙-2-胺所述制备,使用适当的试剂并调节反应时间以确定反应完成。
制备例13a
N'-[(2Z/E)-1-溴-1,1-二氟丙-2-叉基]苯甲酰肼
在室温下和在N2下向1-溴-1,1-二氟-丙-2-酮(200 mL的3/1 Et2O/甲苯)的粗溶液中加入在密封管中的苯甲酰肼(23.62 g)。该混合物在50℃下和在N2下搅拌2小时。令混合物冷却至室温。通过过滤收集沉淀的固体并用甲苯(3×100 mL)洗涤以产生作为白色固体的标题化合物(28 g, 34%, 经2个步骤, 在1H-NMR上纯度62%)。
制备例13b
(Z/E)- N-[(2,2,2-三氘代-1-甲基-乙叉基)氨基]苯甲酰胺
在-78℃下和在N2下向1,1,1-三氘代丙-2-酮(0.24 g, 3.93 mmol)在THF(50 mL)中的搅拌混合物中逐滴加入苯甲酰肼(2.14 g, 15.71 mmol, 溶解在THF(10 mL)中)。该混合物在-78℃下搅拌2小时。该混合物用EtOAc(200 mL)稀释。有机相用H2O(2×50 mL)和盐水(50 mL)洗涤,在无水Na2SO4上干燥,过滤,滤液在减压下浓缩以产生标题化合物,其直接使用不经进一步提纯。ES/MS (m/z) 180.1 (M+H)。
制备例13c
N-[[2,2,2-三氘代-1-(三氘代甲基)乙叉基]氨基]苯甲酰胺
在室温下向苯甲酰肼(5.00 g, 36.723 mmol)在MeOH (100.00 mL)中的搅拌溶液中逐滴加入1,1,1,3,3,3-六氘代丙-2-酮(2.35 g, 36.723 mmol)。混合物在室温下搅拌整夜,随后在减压下浓缩以产生作为白色固体的标题化合物(5 g, 74.70%)。ES/MS (m/z)183.3 (M+H)。
制备例13d
N’-(2,2,2-三氘代-1-甲基-乙基)苯甲酰肼
在0℃下向(Z/E)-N-[(2,2,2-三氘代-1-甲基-乙叉基)氨基]苯甲酰胺(695 mg,3.88 mmol)在MeOH(5 mL)中的搅拌混合物中分份加入NaBH4(293.40 mg, 7.76 mmol)。混合物在室温下搅拌1小时。该混合物用EtOAc(100 mL)稀释,用H2O(30 mL)、盐水(30mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过用PE:EtOAc(3:1~1:3)洗脱的硅胶柱色谱法提纯以产生作为白色固体的标题化合物(280 mg, 39.8%)。ES/MS (m/z) 182.2(M+H)。
制备例13e
N’-[2,2,2-三氘代-1-(三氘代甲基)乙基]苯甲酰肼
在室温下向N-[[2,2,2-三氘代-1-(三氘代甲基)乙叉基]氨基]苯甲酰胺(2.00 g,10.97 mmol)在MeOH(30.00 mL)中的搅拌溶液中分份加入NaBH4(0.81 g, 21.95 mmol)。混合物搅拌2小时。该反应用H2O(50 mL)猝灭,并用DCM(3×50 mL)萃取。合并的有机萃取物用H2O(3×50 mL)洗涤,在无水Na2SO4上干燥,并在减压下浓缩以产生作为白色固体的标题化合物(1.9 g, 93.96%)。ES/MS (m/z) 185.3 (M+H)。
制备例13f
N’-(1,2,2,2-四氘代-1-甲基-乙基)苯甲酰肼
在0℃下向(Z/E)- N-[(2,2,2-三氘代-1-甲基-乙叉基)氨基]苯甲酰胺(695.00mg, 3.88 mmol)在CD3OD(5 mL)中的搅拌混合物中分份加入NaBD4(326.15 mg, 7.77mmol)。混合物在室温下搅拌1小时。该混合物用EtOAc(100 mL)稀释,并用H2O(30 mL)和盐水(30 mL)洗涤,在无水Na2SO4上干燥,过滤,滤液在减压下浓缩。残余物通过用PE:EtOAc(3:1~1:3)洗脱的硅胶色谱法提纯以产生作为白色固体的标题化合物(260 mg, 36.6%)。ES/MS(m/z) 183.2 (M+H)。
表1b中的下列化合物基本如对N’-(1,2,2,2-四氘代-1-甲基-乙基)苯甲酰肼所述制备,使用适当的试剂并调节反应时间以确定反应完成。NaBD4可以在室温下添加,并可以在未经进一步提纯的情况下使用。
制备例13h
N'-(2-溴-2,2-二氟-1-甲基-乙基)苯甲酰肼
在0℃下和在N2下向N'-[(2E)-1-溴-1,1-二氟丙-2-叉基]苯甲酰肼(12 g, 41.22mmol)在THF(100 mL)中的搅拌溶液中逐滴加入BH3-THF(82.45 mL, 82.45 mmol, 1 M在THF中)。混合物在室温下和在N2下搅拌12小时。该反应通过在0℃下加入MeOH(5 mL)来猝灭。该混合物用H2O(50 mL)稀释并用DCM(3×50 mL)萃取。合并的有机萃取物用盐水(2×100 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过硅胶柱色谱法提纯,用PE/EtOAc(8/1至6/1)洗脱以产生作为白色固体的标题化合物(7 g, 57%)。1H NMR (400MHz, CDCl3) δ 7.78-7.73 (m, 2H), 7.60-7.53 (m, 1H), 7.52-7.45 (m, 2H), 3.57-3.49(m, 1H), 1.45 (d, 3H)。
制备例13i
[2,2,2-三氘代-1-(三氘代甲基)乙基]肼.HCl
将N'-[2,2,2-三氘代-1-(三氘代甲基)乙基]苯甲酰肼(500 mg, 2.71 mmol)在HCl(5.00 mL, 浓缩)中的混合物在80℃下搅拌整夜。令混合物冷却至室温并在减压下浓缩。粗产物用Et2O(3 mL)研磨。将所得沉淀物过滤,滤饼用Et2O(3×2 mL)洗涤以产生作为白色固体的标题化合物(180 mg, 56.88%)。
表1c中的下列化合物基本如对[2,2,2-三氘代-1-(三氘代甲基)乙基]肼.HCl所述制备,使用适当的试剂并调节反应时间以确定反应完成。
制备例14
(1Z)-4-溴-N-异丙基-苯甲肼酰溴
向N-[(E)-(4-溴苯基)亚甲基氨基]丙-2-胺中逐滴加入在DMF中的NBS(106.04 g,595.77 mmol),混合物在0℃下和在N2下搅拌3小时。所得混合物直接使用,无需后处理或进一步提纯。
表2中的下列化合物基本如对(1Z)-4-溴-N-异丙基-苯甲肼酰溴所述制备,使用适当的试剂并调节反应时间以确定反应完成。
制备例17
5-氨基-3-(4-溴苯基)-1-异丙基吡唑-4-甲腈
在0℃下和在N2下将乙醇钠(91.88 g, 1.351 mol)和丙二腈(39.24 g, 594.53mmol)在EtOH(400 mL)中的溶液搅拌1小时。将(1Z)-4-溴-N-异丙基-苯甲肼酰溴的粗溶液加入到该混合物中。该混合物在室温下搅拌2小时。该混合物在减压下浓缩,用H2O(3 L)稀释,通过过滤收集所得沉淀固体,用H2O(3×200 mL)洗涤,固体在烘箱中在50℃下干燥以产生标题化合物(127 g, 73.7%经3个步骤)。ES/MS (m/z) (79Br/81Br 305/307 (M+H)。
表3中的下列化合物基本如对5-氨基-3-(4-溴苯基)-1-异丙基吡唑-4-甲腈所述制备,使用适当的试剂并调节反应时间以确定反应完成和在适当情况下的提纯条件。粗反应可以用H2O稀释,用EtOAc萃取,并采用适当条件用色谱法提纯。
制备例20
5-氨基-3-(4-溴苯基)-1-(1-甲基环丙基)吡唑-4-甲腈
一起加入(1-甲基环丙基)肼盐酸盐(1.63 g, 13.30 mmol)、THF(20 mL)、Et3N(3.08 g, 30.41 mmol)和2-[(4-溴苯基)(甲氧基)甲叉基]丙二腈(1.00 g, 3.80 mmol),并在50℃下搅拌6小时。所得混合物用EtOAc(100 mL)稀释,用H2O(2×30 mL)和饱和NaCl水溶液(20 mL)洗涤。有机相在减压下浓缩。残余物通过反相组合快速色谱法用下列条件来提纯:C18;ACN在H2O中(0.1% NH4HCO3), UV 254 nm,用70%至100%梯度在15分钟内洗脱,以产生作为灰白色固体的标题化合物(375 mg, 31%)。ES/MS m/z(79Br/81Br) 317.0/319.0 [M+H]+。
表3a中的下列化合物基本如对5-氨基-3-(4-溴苯基)-1-(1-甲基环丙基)吡唑-4-甲腈所述制备,使用适当的试剂,调节反应时间以确定反应完成。Et3N可以逐滴加入。粗反应可浓缩至干燥并在适当的情况下提纯。
制备例20c
5-氨基-3-(4-溴-2-氟苯基)-1-(1-甲基环丙基)吡唑-4-甲腈
在室温下和在N2下将2-[(4-溴-2-氟苯基)(甲氧基)甲叉基]丙二腈(1.50 g,5.34 mmol)、(1-甲基环丙基)肼 HCl(1.96 g, 15.99 mmol)和Et3N(2.70 g, 26.682mmol)在EtOH(20.00 mL)中的溶液搅拌1小时。混合物在减压下浓缩,残余物通过用3:1至2:1 PE:EtOAc的梯度洗脱的硅胶色谱法提纯以产生作为浅黄色固体的标题化合物(1.2 g,67.09%)。ES/MS m/z(79Br/81Br) 335.1/337.1 [M+H]+。
表3b中的下列化合物基本如对5-氨基-3-(4-溴-2-氟苯基)-1-(1-甲基环丙基)吡唑-4-甲腈所述制备,使用适当的试剂并调节反应时间以确定反应完成和在适当情况下的提纯条件。该反应可以在50℃下搅拌,如果可用的话,该肼可以是游离胺。
制备例20h
5-氨基-3-(4-溴苯基)-1-(2-氘代-2,2-二氟-1-甲基-乙基)吡唑-4-甲腈
在室温下和在N2下向5-氨基-1-(1-溴-1,1-二氟丙-2-基)-3-(4-溴苯基)吡唑-4-甲腈(300.00 mg, 0.71 mmol, 与2×CD3OD共蒸发)在CD3COOD (3.00 mL)中的搅拌溶液中分份加入Zn(467.14 mg, 7.14 mmol, 与2×CD3OD共蒸发)。混合物在80℃下和在N2下搅拌1小时。令混合物冷却至室温并用EtOAc猝灭。将混合物过滤,滤饼用EtOAc(3×10 mL)洗涤并在减压下浓缩。残余物通过用PE/EtOAc(2:1-1:1)洗脱的硅胶柱色谱法提纯以产生作为黄色固体的标题化合物(100 mg, 40.92%)。1H NMR (300 MHz, d6-DMSO) δ 7.79-7.65 (m,4H), 7.00 (s, 2H), 4.93-4.68 (m, 1H), 1.48 (d, 3H)。
制备例20i
2-[4-[5-氨基-4-氰基-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-3-基]苯基]丙酸甲酯
在室温下将2-[4-(2,2-二氰基-1-甲氧基乙-1-烯-1-基)苯基]丙酸甲酯(500 mg,1.85 mmol)、[2,2,2-三氘代-1-(三氘代甲基)乙基]肼.HCl(648 mg, 5.56 mmol)和Et3N(936 mg, 9.25 mmol)在EtOH(20 mL)中的溶液搅拌1小时。该溶液用H2O(30 mL)稀释并用EtOAc(3×50 mL)萃取。有机层在无水Na2SO4上干燥并在减压下浓缩以产生作为浅黄色固体的标题化合物(650 mg, 粗)。在没有进一步提纯的情况下使用粗产物。ES/MS (m/z)319.40 (M+H)。
制备例21
N-叔丁氧基羰基-N-(4-氰基-2-异丙基-吡唑-3-基)氨基甲酸叔丁酯
向5-氨基-1-异丙基-吡唑-4-甲腈(13.58 g, 85.0 mmol)在THF(170 mL)中的搅拌溶液中连续加入N,N-二甲基吡啶-4-胺(1.05 g, 8.50 mmol)、Et3N(36 mL, 0.255 mol)和叔丁氧基羰基叔丁基碳酸酯(40.81 g, 0.187 mol)。反应混合物在室温下搅拌整夜。反应混合物用NH4Cl的饱和水溶液(15 mL)猝灭。水层用EtOAc(3×20 mL)萃取,并且合并的有机萃取物用饱和NaCl水溶液洗涤,在Na2SO4上干燥,过滤并在减压下浓缩。粗产物通过用环己烷中的EtOAc从2%至30%的梯度洗脱的硅胶快速色谱法提纯以产生作为浅黄色固体的标题化合物(9.29 g, 31%)和作为浅黄色固体的第二批次(4.86 g, 16%),其合并提供14.15克,收率47%。
制备例22
2-[5-[5-(叔丁氧基羰基氨基)-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸甲酯
和
制备例23
2-[5-[5-[双(叔丁氧基羰基)氨基]-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸甲酯
在真空下一起加入N-叔丁氧基羰基-N-(4-氰基-2-异丙基-吡唑-3-基)氨基甲酸叔丁酯(4.02 g, 11.5 mmol)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1,3,2-二氧杂硼杂环戊烷(2.39 g, 9.42 mmol)、二-µ-甲基氧代双(1,5-环辛二烯) 二铱(CAS# 12148-71-9)(1:2)(136 mg, 0.21 mmol)和4-叔丁基-2-(4-叔丁基-2-吡啶基)吡啶(112 mg, 0.41 mmol),加入THF(11.60 mL),反应保持在N2下。混合物在80℃下搅拌并加热6小时。将反应混合物冷却至室温并搅拌整夜。反应混合物在减压下浓缩,残余物溶解在DCM/EtOAc 3:1的混合物(10 mL)中,该溶液穿过硅胶垫,并用DCM/EtOAc 3:1(2×10 mL)洗涤。将滤液合并,在减压下浓缩,并在真空下干燥以获得粗残余物。向粗制材料中加入Cs2CO3(8049 mg, 24.6 mmol)、2-(5-溴-2-吡啶基)丙酸甲酯(2.00 g, 8.19 mmol)、Pd(dppf)Cl2) DCM(342 mg, 0.410 mmol)和4Å分子筛(5 g)。该反应混合物随后通过真空/N2(3×)脱气并加热至100℃下持续2小时。将该反应冷却至室温,通过珍珠岩床过滤,珍珠岩床用THF(3×60 mL)洗涤。将有机溶液合并,在减压下浓缩,并在真空下干燥。向残留物中加入DCM(60 mL)、H2O(80 mL)和饱和NaHCO3水溶液(60 mL)。分离有机层,在无水Na2SO4上干燥,在减压下浓缩并在真空下干燥。粗制材料通过用在DCM中的EtOAc从0%至20%的梯度洗脱的硅胶快速色谱法提纯以获得制备例22标题化合物(2.47g, 68.53%)和制备例23标题化合物。制备例23的材料通过用环己烷中10%至80% EtOAc的梯度洗脱的硅胶色谱法进一步提纯以产生制备例23的标题化合物。
制备例24
5-氨基-1-异丙基-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]吡唑-4-甲腈
在80℃下和在N2下将5-氨基-3-(4-溴苯基)-1-异丙基吡唑-4-甲腈(100 g,327.68 mmol)、双(频哪醇合)二硼(91.53 g, 360.444 mmol)、KOAc(48.24 g, 491.52mmol)和Pd(dppf)Cl2(11.99 g, 16.38 mmol)在1,4-二氧杂环己烷(1 L)中的混合物搅拌6小时。令混合物冷却至室温。将所得混合物过滤,用EtOAc(3×100 mL)洗涤,并在减压下浓缩。残余物通过用PE/EtOAc(10:1-5:1)洗脱的硅胶柱色谱法提纯以产生作为棕色固体的标题化合物(100 g, 86.6%)。ES/MS (m/z) 353.2 (M+H)。
表4中的下列化合物基本如对5-氨基-1-异丙基-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]吡唑-4-甲腈所述制备,使用适当的试剂,调节反应时间以确定反应完成,并在适当条件下调节提纯条件。还将该材料过滤而不经后处理,并在没有进一步提纯的情况下使用。
替代制备例26
5-氨基-1-(1-甲基环丙基)-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]吡唑-4-甲腈
在二氧杂环己烷(5.00 mL)中一起加入5-氨基-3-(4-溴苯基)-1-(1-甲基环丙基)吡唑-4-甲腈(350 mg, 1.10 mmol)、双(频哪醇合)二硼(560.41 mg, 2.21mmol)、KOAc(325mg, 3.31 mmol)和Pd(dppf)Cl2(121 mg, 0.17 mmol.)。该溶液在80℃下和在N2下搅拌2小时。将混合物过滤并在不提纯的情况下直接使用。ES/MS (m/z) 365.2 (M+H)。
制备例29f
5-氨基-3-[2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-1-(1-甲基环丙基)吡唑-4-甲腈
在80℃下和在N2下将5-氨基-3-(4-溴-2-氟苯基)-1-(1-甲基环丙基)吡唑-4-甲腈(700 mg, 2.09 mmol)、4,4,5,5-四甲基-2-(四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1,3,2-二氧杂硼杂环戊烷(636.40 mg, 2.51 mmol)、Pd(dppf)Cl2·CH2Cl2(341.10 mg,0.42 mmol)和KOAc(614.89 mg, 6.26 mmol)在二氧杂环己烷 (10.00 mL)中的溶液搅拌1小时。将该溶液冷却至室温,过滤,滤饼用1,4-二氧杂环己烷(2×3 mL)洗涤。混合物直接使用,不经进一步提纯。ES/MS (m/z) 383.3 (M+H)。
制备例29g
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]丙-2-烯酸甲酯
在80℃下和在N2下将5-氨基-3-[2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-1-(1-甲基环丙基)吡唑-4-甲腈(980 mg, 2.56 mmol)、2-(三氟甲烷磺酰氧基)丙-2-烯酸甲酯(1200.61 mg, 5.13 mmol)、Pd(dppf)Cl2·CH2Cl2(418.73 mg,0.51 mmol)和K2CO3(708.65 mg, 5.128 mmol)在二氧杂环己烷/H2O(4:1, 10 mL)中的溶液搅拌1小时。将该溶液冷却至室温并在减压下浓缩至干燥。残余物通过用3:1至2:1 PE:EtOAc的梯度洗脱的硅胶色谱法提纯以产生作为黄色固体的标题化合物(430 mg,49.28%)。ES/MS (m/z) 341.2 (M+H)。
制备例30
2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]丙-2-烯酸甲酯
在90℃下和在N2下将5-氨基-1-异丙基-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]吡唑-4-甲腈(100.00 g, 283.89 mmol)、2-(三氟甲烷磺酰氧基)丙-2-烯酸甲酯(99.71 g, 425.83 mmol)、K2CO3(117.71 g, 851.67 mmol)和Pd(dppf)Cl2(10.39 g, 14.19 mmol)在1,4-二氧杂环己烷(1 L)和H2O(250 mL)中的混合物搅拌整夜。令混合物冷却至室温。将所得混合物过滤,滤饼用EtOAc(3×100 mL)洗涤。滤液在减压下浓缩,用H2O(500 mL)稀释,并用EtOAc(3×500 mL)萃取。合并的有机萃取物用饱和NaCl水溶液(3×200 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过用PE/EtOAc(10:1-3:1)洗脱的硅胶柱色谱法提纯以产生作为黄色固体的标题化合物(43 g, 48.8%)。ES/MS (m/z): 311.2 (M+H)。
表5中的下列化合物基本如对2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]丙-2-烯酸甲酯所述制备,使用适当的试剂并调节反应时间以确定反应完成。温度为80-90℃,二氧杂环己烷和H2O可用作溶剂。
表5
*标题化合物通过反相组合色谱法用以下条件来提纯:C18;用H2O中的ACN(0.1%NH4HCO3)从70%至100%的梯度在15分钟内洗脱;UV 254 nm。
替代制备例32
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙-2-烯酸甲酯
在二氧杂环己烷 (6.00 mL)和H2O(1.50 mL)中一起加入5-氨基-1-(1-甲基环丙基)-3-[4-(4,4,5,5–四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]吡唑-4-甲腈(400 mg,1.10 mmol)、2-(三氟甲烷磺酰氧基)丙-2-烯酸甲酯(642.95 mg, 2.7 5mmol)、K2CO3(455mg, 3.30 mmol)和Pd(dppf)Cl2(85 mg, 0.09 mmol)。该溶液在80℃下搅拌2小时。该混合物用EtOAc(100 mL)稀释,用H2O(2×30mL)和盐水(20 mL)洗涤。将有机相分离并在减压下浓缩。残余物通过反相组合色谱法用以下条件提纯:C18;用在H2O中的ACN(0.1% NH4HCO3)的梯度洗脱以产生作为棕色固体的标题化合物(280 mg, 78.5)。ES/MS (m/z) 323.1 (M+H)。
制备例36
2-[4-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]苯基]丙-2-烯酸甲酯,异构体1
和
制备例37
2-[4-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]苯基]丙-2-烯酸甲酯,异构体2
2-[4-[5-氨基-4-氰基-1-(1,1,1-三氟丙-2-基)吡唑-3-基]苯基]丙-2-烯酸甲酯(2.00 g)通过Prep-HPLC用以下条件提纯:柱: N—(R,R)-Whelk-O1 4.6*50 mm, 3.5 µm;流动相A: 流动相B: MeOH(0.1% DEA), 流速为2 mL/min;用10% B洗脱, UV 254 nm;t(R)异构体1为6.7 min;t(R) 异构体2为7.2;作为黄色固体(700 mg, 35.0%, 100% ee)和作为黄色固体(700 mg, 35.0%, 100% ee)。
表6中的下列化合物基本如对2-[4-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]苯基]丙-2-烯酸甲酯, 异构体1和2-[4-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]苯基]丙-2-烯酸甲酯, 异构体2所述制备,使用合适的提纯条件。
表6
1CHIRALPAK IG, 2*25 cm,5 µm;用己烷中30% EtOH(10 mM NH3-MeOH)洗脱,流速:20 mL/min, UV 234/274 nm。
2CHIRAL ART Amylose-SA, 2*25 cm, 5 µm;用己烷中10% EtOH(0.5% 2 M NH3-MeOH)洗脱,流速:20 mL/min, 210/220 nm。
3 CHIRALPAK IH, 2.0*2.5 cm, 5 µm 用己烷中40% EtOH(10 mM NH3-MeOH)洗脱,流速:20 mL/min, UV 235.275。
制备例40
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸甲酯
在室温下和在N2下将2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]丙-2-烯酸甲酯(43.00 g, 138.55 mmol)和50% Pd/C(43.00 g)在MeOH(1 L)中的混合物搅拌4小时。将所得混合物过滤(如果需要的话通过硅藻土),滤饼用MeOH(300 mL)洗涤。滤液在减压下浓缩以产生作为黄色固体的标题化合物(40 g, 92.4%)。ES/MS (m/z) 313.2 (M+H)。
表7中的下列化合物基本如对2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸甲酯所述制备,使用适当的试剂,在适当情况下使用氢气球,使用10-50% Pd/C,并调节反应时间以确定反应完成。产物也通过用溶剂体系如2:1至1:1的PE:EtOAc洗脱的硅胶色谱法提纯。
表7
1PD(OH)2/C是催化剂,DCM是所用溶剂。
替代制备例42
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸甲酯
一起加入2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙-2-烯酸甲酯(260 mg, 0.81 mmol)、MeOH(15.00 mL)和50% Pd/C(275 mg)。该溶液在室温下和在H2下搅拌2小时。将混合物过滤,该溶液在真空下浓缩以产生作为浅黄色固体的标题化合物(240 mg, 91%)。粗产物直接使用,不经进一步提纯。ES/MS (m/z) 325.1 (M+H)。
替代制备例42
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸甲酯
在室温下和在N2下向2-[4-(2,2-二氰基-1-甲氧基乙-1-烯-1-基)苯基]丙酸甲酯(4.00 g, 14.80 mmol)和(1-甲基环丙基)肼盐酸盐(1.81 g, 14.80 mmol)在THF(50.00mL)中的搅拌溶液中逐滴加入Et3N(7.49 g, 73.99 mmol)。混合物在50℃下和在N2下搅拌1小时。该混合物用H2O(50 mL)稀释,并用EtOAc(3×100 mL)萃取。合并的有机萃取物用盐水(3×200 mL)洗涤,在无水Na2SO4上干燥,过滤,滤液在减压下浓缩。残余物通过用己烷/EtOAc(5:1-1:1)洗脱的硅胶柱色谱法提纯以产生作为灰白色固体的标题化合物(3.8 g,79.16%)。ES/MS (m/z) 325.2 (M+H)。
制备例47h
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]丙酸甲酯
向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]丙-2-烯酸甲酯(410 mg, 1.21 mmol)在MeOH(10 mL)中的溶液中加入Pd/C(10%, 0.64 g)。该混合物使用H2气球在室温下氢化1小时。将混合物过滤,滤饼用MeOH(3×50 mL)洗涤,滤液在减压下浓缩以产生作为深黄色固体的标题化合物(340 mg, 82.44%)。ES/MS (m/z) 343.2 (M+H)。
制备例48
2-[4-[5-氨基-4-氰基-1-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]苯基]丙酸甲酯
在室温下和在N2下向2-[4-(2,2-二氰基-1-甲氧基乙-1-烯-1-基)苯基]丙酸甲酯(400.00 mg, 1.48 mmol)和(1,1,1-三氟-2-甲基丙-2-基)肼二盐酸盐(210.33 mg, 1.48mmol)在EtOH(5.00 mL)中的搅拌混合物中分份加入Et3N(449.25 mg, 4.44 mmol)。所得混合物在50℃下和在N2下搅拌2小时。令混合物冷却至室温并在减压下浓缩。残余物通过用PE/EtOAc(2/1至1/1)的梯度洗脱的硅胶柱色谱法提纯以产生作为灰白色固体的标题化合物(270 mg, 47%)。ES/MS (m/z) 381.2 (M+H)。
表8中的下列化合物基本如对2-[4-[5-氨基-4-氰基-1-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]苯基]丙酸甲酯所述制备,使用适当的试剂,调节反应时间以确定反应完成,并在需要的情况下调节提纯条件。该反应可以在RT-50℃下搅拌,并且无需提纯即可使用。
制备例50
2-[5-[5-(叔丁氧基羰基氨基)-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸锂
在MeOH(8.20 mL)中一起加入2-[5-[5-(叔丁氧基羰基氨基)-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸甲酯(100 mg, 0.227 mmol)、2-[5-[5-[双(叔丁氧基羰基)氨基]-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸甲酯(958 mg, 1.87 mmol)。LiOH(142mg, 5.69 mmol)溶解在H2O(2.46 mL)中并添加到该混合物中。反应混合物在室温下搅拌18小时并在减压下浓缩以产生标题化合物(926 mg, 111.39%)。
制备例51
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸
在50℃下将2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸甲酯(40.00g, 128.05 mmol)和NaOH(25.61 g, 640.26 mmol)在MeOH(500 mL)和H2O(500 mL)中的混合物搅拌5小时。令混合物冷却至室温。所得混合物在减压下浓缩,用H2O(500 mL)稀释,水层用EtOAc(2×300 mL)萃取。用6 N HCl将水层酸化至pH 3-4,通过过滤收集所得沉淀固体,用H2O(3×50 mL)洗涤,并在真空下干燥以产生作为浅黄色固体的标题化合物(34 g,89.0%)。ES/MS (m/z) 299.2 (M+H)。
表9中的下列化合物基本如对2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸所述制备,在室温下搅拌直到完成。
表9
1使用2 M NaOH,没有额外的H2O,在用硫酸氢钾酸化后,混合物在0℃下冷却1小时,将标题化合物过滤、收集、干燥并直接使用,不进行进一步提纯。
制备例54
2-(6-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]吡啶-3-基)丙酸, 异构体1
在室温下和在N2下向2-(6-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]吡啶-3-基)丙酸甲酯, 异构体2(1.30 g, 3.53 mmol)在THF(16.00 mL)和H2O(4.00 mL)中的搅拌溶液中分份加入LiOH(253.56 mg, 10.59 mmol)。所得混合物在室温下和在N2下搅拌2小时。混合物在减压下浓缩,用H2O(20 mL)稀释,并用HCl(c)酸化至pH 3。所得混合物用EtOAc(3×50 mL)萃取。合并的有机萃取物用饱和NaCl水溶液(2×100 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩以产生作为浅黄色固体的标题化合物(1.2 g, 96%)。ES/MS (m/z) 353.9 (M+H)。
表10中的下列化合物基本如对2-(6-[5-氨基-4-氰基-1-[-1,1,1-三氟丙-2-基]吡唑-3-基]吡啶-3-基)丙酸, 异构体1所述制备,使用适当的试剂,在室温至50℃下并调节反应时间以确定反应完成。LiOH可以逐份或以单一量加入,取决于反应的规模。
制备例60k
2-[4-[5-氨基-4-氰基-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-3-基]苯基]丙酸
在室温下将2-[4-[5-氨基-4-氰基-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-3-基]苯基]丙酸甲酯(630 mg, 1.98 mmol)和LiOH (143 mg, 5.94 mmol)在MeOH/H2O(25 mL, 4:1)中的溶液搅拌1小时。该溶液用EtOAc(2×5mL)萃取。水层用HCl(2 M)酸化并用EtOAc(3×50 mL)萃取。有机萃取物在无水Na2SO4上干燥并在减压下浓缩以产生作为浅黄色固体的标题化合物(460 mg, 粗)。该产物用Et2O(10mL)洗涤,不经进一步提纯直接使用。ES/MS (m/z) 305.20 (M+H)。
制备例60l
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸
一起加入2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸甲酯(220.00 mg, 0.68 mmol)、MeOH(2.00 mL)、H2O(2.00 mL)和NaOH(109 mg, 2.71 mmol)。该溶液在50℃下搅拌2小时,随后在减压下除去MeOH。用4 N HCl将混合物的pH调节至4,该混合物用EtOAc(2×50 mL)萃取。合并的有机萃取物用H2O(2×15 mL)洗涤,用盐水(10 mL)洗涤并浓缩以产生作为灰白色固体的标题化合物(240 mg, 100% 粗)。粗产物直接使用,不经进一步提纯。ES/MS (m/z) 311.2 (M+H)。
制备例60m
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]丙酸
在50℃下和在N2下将2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]丙酸甲酯(340 mg, 0.99 mmol)和LiOH(118.91 mg, 4.96 mmol)在THF/H2O(4:1,5.00 mL)中的溶液搅拌1小时。将该溶液冷却至室温,用HCl(水溶液,1 N)将混合物酸化至pH=3。该混合物用EtOAc(3×100 mL)萃取。合并的有机萃取物用盐水(2×20 mL)洗涤,在无水Na2SO4上干燥,过滤,滤液在减压下浓缩以产生作为浅黄色固体的标题化合物(280mg,85.87%)。ES/MS (m/z) 329.2 (M+H)。
制备例61
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸, 异构体1
和
制备例62
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸, 异构体2
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸(500 mg)通过制备型手性HPLC在下列条件下分离:柱: (R,R)Whelk-O 1, 21.1*250 mm, 5 µm;流动相A: 己烷(0.1%FA), 流动相B: IPA;用0-30% B的梯度在17分钟内以20 mL/min洗脱;UV 254 nm;t(R) 异构体1 9.2分钟(209.6 mg, 41.2%, 100% ee),作为白色固体,ES/MS (m/z) 299.1 (M+H),t(R) 异构体2 12分钟(206.8 mg, 41.03%, 100% ee) 作为白色固体,ES/MS (m/z) 299.1(M+H)。
制备例63
2-[6-(5-氨基-4-氰基-1-异丙基吡唑-3-基)吡啶-3-基]丙酸, 异构体1
和
制备例64
2-[6-(5-氨基-4-氰基-1-异丙基吡唑-3-基)吡啶-3-基]丙酸, 异构体2
2-[6-(5-氨基-4-氰基-1-异丙基吡唑-3-基)吡啶-3-基]丙酸(290.00 mg)通过制备型手性HPLC在下列条件下分离:柱: CHIRALPAK AD-H, 2.0*25 cm L;流动相A: 己烷(0.1% TFA), 流动相B: IPA;用30-0% B的梯度在9.5分钟内洗脱;流速20 mL/min;UV 230/254 nm, t(R) 异构体1 6.2分钟(102.5 mg, 35.3%),作为白色固体,100% ee;ES/MS (m/z)300.1 (M+H), t(R) 异构体2 7.8分钟(104.8 mg, 36.1%),作为白色固体,100% ee, ES/MS(m/z) 300.1 (M+H)。
制备例64a
2-[4-(5-氨基-4-氨基甲酰基-1-异丙基吡唑-3-基)苯基]丙酸
在50℃下将2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸(1.00 g,3.352 mmol)、NaOH(671 mg, 16.759 mmol)和H2O2(7.81 mL, 68.873 mmol, 30%)在EtOH(20.00 mL)/DMSO(2.00 mL)中的混合物搅拌整夜。该反应在0℃下用饱和Na2SO3水溶液(20mL)猝灭。所得混合物用H2O(200 mL)稀释并用6 N HCl酸化至pH 3-4。通过过滤收集沉淀的固体并用H2O(2×10 mL)洗涤。该固体通过反相组合快速色谱法用以下条件提纯:柱, C18;流动相, 在H2O中的ACN,在25分钟内用30%至60%的梯度洗脱;检测器, UV 220 nm,随后冷冻干燥以产生作为灰白色固体的标题化合物(670 mg, 62.5%)。ES/MS (m/z) 317.2 (M+H)。
制备例64b
2-[4-(5-氨基-4-氨基甲酰基-1-异丙基吡唑-3-基)苯基]丙酸, 异构体1
和
制备例64c
2-[4-(5-氨基-4-氨基甲酰基-1-异丙基吡唑-3-基)苯基]丙酸, 异构体2
2-[4-(5-氨基-4-氨基甲酰基-1-异丙基吡唑-3-基)苯基]丙酸(280 mg)通过制备型手性HPLC在下列条件下分离:柱: CHIRALPAK AD-H, 2.0*25 cm;流动相A: 己烷(0.1%FA), 流动相B: IPA;流速:20 mL/min,用15% B在21分钟内洗脱;UV 210\254 nm;t(R) 异构体1 16 min, (106.2 mg, 37.6%, 100% ee) 作为白色固体, ES/MS (m/z) 317.1 (M+H);t(R) 异构体2 19 min, (94.96 mg,33.3%, 98.3% ee) 作为白色固体, ES/MS (m/z)317.1 (M+H)。
制备例65
(Z/E)-5,5-二氟-N'-羟基-4,4-二甲基-3-氧代己脒
在65℃下和在N2下将5,5-二氟-4,4-二甲基-3-氧代己腈(1.50 g, 8.56 mmol)、NaHCO3(1.80 g, 21.427 mmol)和硫酸双(羟基铵)(1.69 g, 10.30 mmol)在H2O(27.00 mL)和MeOH(3.00 mL)中的溶液搅拌整夜。混合物直接使用,不经进一步提纯。ES/MS m/z 209.2(M+H)。
制备例66
3-(3,3-二甲基环丁基)-1,2-噁唑-5-胺
在100℃下和在N2下将3-(3,3-二甲基环丁基)-3-氧代丙腈(1.50 g, 9.92mmol)、NH2OH.HCl(0.76 g, 10.94 mmol)和NaOH(0.79 g, 19.84 mmol)在H2O(15.00 mL)中的溶液搅拌2小时。令混合物冷却至室温。通过过滤收集沉淀的固体并用H2O(3×30 mL)洗涤。所得混合物在减压下浓缩以产生作为灰白色固体的标题化合物(1.5 g, 90.97%)。ES/MS (m/z) 167.3 (M+H)。
表11中的下列化合物基本如对3-(3,3-二甲基环丁基)-1,2-噁唑-5-胺所述制备,使用适当的试剂并调节反应时间以确定反应完成。碱可以分份加入,反应混合物可以用DCM萃取或在适当情况下过滤。
制备例67b
3-(3-甲基-1-双环[1.1.1]戊基)异噁唑-5-胺
在室温下和在N2下向3-[3-甲基双环[1.1.1]戊-1-基]-3-氧代丙腈(350.00 mg,2.41 mmol)和羟胺 HCl(183.83 mg, 2.65 mmol)在H2O(8.00 mL)中的搅拌混合物中分份加入NaOH(192.38 mg, 4.81 mmol)。混合物在100℃下和在N2下搅拌1小时。令混合物冷却至室温。通过过滤收集沉淀的固体并用H2O(3×20 mL)洗涤以获得作为浅黄色固体的标题化合物(300 mg, 77.9%)。ES/MS m/z (M+H) 165.1。
制备例67c
3-(2,2-二甲基丙基)-4-氟-1,2-噁唑-5-胺
在50℃下和在N2下将3-(2,2-二甲基丙基)-1,2-噁唑-5-胺(5.00 g, 32.42mmol)和Selectfluor™(13.78 g, 38.90 mmol)在MeOH(100 mL, 780.04 mmol)中的溶液搅拌30分钟。将该反应冷却至室温,用H2O(100 mL)稀释,并用EtOAc(3×100mL)萃取。有机萃取物在无水Na2SO4上干燥并在减压下浓缩。粗产物通过硅胶色谱法 (PE:EtOAc =10:1至5:1)提纯以产生作为浅黄色固体的标题化合物(1.55 g, 27.7%)。LC-MS: (ES+H, m/z):[M+H]+=173.10
制备例67d
3-(3-(三氟甲基)双环[1.1.1]戊-1-基)异噁唑-5-胺
在室温下和在N2下向3-氧代-3-[3-(三氟甲基)双环[1.1.1]戊-1-基]丙腈(280.00 mg, 1.38 mmol)、羟胺HCl(105.35 mg, 1.52 mmol)和H2O(10 mL)的混合物中分份加入NaOH(110.25 mg, 2.76 mmol)。所得混合物加热至100℃下1小时。令混合物冷却至室温并用DCM(3×50 mL)萃取。合并的有机萃取物用盐水洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。所得固体用Et2O(10 mL)研磨。通过过滤收集所得固体,并用Et2O洗涤以产生标题化合物(220 mg,73%)。ES/MS m/z (M+H) 219.2。
制备例68
5-(3,3-二氟-2-甲基丁-2-基)-1,2-噁唑-3-胺
用HCl(c)将(Z)-5,5-二氟-N'-羟基-4,4-二甲基-3-氧代己脒的粗溶液酸化至pH= 1,所得混合物在100℃下和在N2下搅拌1小时。将混合物缓慢冷却至室温并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;流动相, H2O 中的ACN,用30%至50%的梯度在20分钟内洗脱;UV 220 nm以产生作为黄色固体的标题化合物(230 mg,14%)。ES/MS (m/z) 191.2 (M+H)。
制备例69
3-(2-氯-4-氟苯基)-1,2-噁唑-5-胺
向3-(2-氯-4-氟苯基)-3,2-氧代丙腈(2.8 g, 14. mmol)的粗混合物中加入NH2OH.HCl(0.98 g, 14.17 mmol)、KOAc(2.09 g, 21.30 mmol)和1,4-二氧杂环己烷(30.00 mL)。所得混合物在100℃下搅拌整夜。令混合物冷却至室温并用H2O(30 mL)和EtOAc(30 mL)稀释。该混合物用EtOAc(3×30 mL)萃取。合并的有机萃取物在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过用PE/EtOAc的梯度(9:1-2:1)洗脱的硅胶柱色谱法提纯以产生作为黄色固体的标题化合物(1.2 g, 39.83%)。ES/MS (m/z) (35Cl/37Cl)213.0/215.0 (M+H)。
表12中的下列化合物基本如对3-(2-氯-4-氟苯基)-1,2-噁唑-5-胺所述制备,使用适当的试剂并调节反应时间以确定反应完成,以及在适当的情况下确定提纯条件。反应温度可以为大约70℃至100℃。NaOAc可替代KOAc,EtOH可替代1,4-二氧杂环己烷。
制备例71
5-(2-甲基丁-2-基)-1,2-噁唑-3-胺
在室温下和在N2下向4,4-二甲基-3-氧代己腈(3.00 g, 21.55 mmol)和硫酸羟胺(3.89 g, 23.71 mmol)在MeOH(5.00 mL)和H2O(45 mL)中的搅拌混合物中分份加入NaHCO3(4.53 g, 53.88 mmol)。所得混合物在65℃下和在N2下搅拌5小时。令混合物冷却至室温。用HCl(c)将混合物酸化至pH 1,并在130℃下和在N2下搅拌20分钟。令混合物冷却至室温,并用NaOH将pH调节至8。所得混合物用DCM(3×200 mL)萃取。合并的有机萃取物用饱和NaCl水溶液(2×200 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过反相组合快速色谱法在以下条件下提纯:柱, C18;流动相, 在H2O中的ACN(0.1% NH4HCO3),用30%至40%梯度在10分钟内洗脱;UV 220 nm, 以获得作为浅黄色固体的标题化合物(1.2 g,36%)。1H NMR (CDCl3) δ 5.53 (s, 1H), 1.66 (q, 2H), 1.27 (s, 6H), 0.82 (t, 3H)。
制备例72
3-(2,4-二氯苯基)-1,2-噁唑-5-胺
在室温下和在N2下将NH2OH.HCl(535.66 mg, 7.71 mmol)和KOAc(756.53 mg,7.71 mmol)在MeOH(10.00 mL)中的溶液搅拌1小时。向该混合物中加入3-(2,4-二氯苯基)-3-氧代丙腈(550.00 mg, 2.57 mmol),反应在室温下搅拌附加的1小时。将所得混合物过滤,滤饼用MeOH(3×20 mL)洗涤,滤液在减压下浓缩。残余物用H2O(30 mL)稀释并通过过滤收集沉淀的固体,用H2O(3×20 mL)洗涤,并在减压下干燥以产生作为黄色固体的标题化合物(200 mg, 35.0%)。ES/MS m/z (35Cl/37Cl) 229.0/231.0 (M+H)。
制备例72a
5-(2,5-二甲基-1H-吡咯-1-基)-3-(1,1,1-三氟-2-甲基丙-2-基)-1H-吡唑
在100℃下和在N2下将3-(1,1,1-三氟-2-甲基丙-2-基)-1H-吡唑-5-胺(500.0mg, 2.59 mmol)、己-2,5-二酮(886.3 mg, 7.77 mmol)和HOAc(15.5 mg, 0.26 mmol)在甲苯 (10.00 mL)中的溶液搅拌2小时。混合物在减压下浓缩。残余物通过用以下条件洗脱的反相组合快速色谱法提纯:柱, C18凝胶,在H2O 中的ACN(0.1% FA),用30%至50%的梯度经10分钟洗脱;UV 254 nm以产生作为黄色固体的标题化合物(610 mg, 87%)。ES/MS m/z (M+H) 272.1。
制备例72b
3-(2,5-二甲基-1H-吡咯-1-基)-1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)-1H-吡唑
在80℃下和在N2下将5-(2,5-二甲基-1H-吡咯-1-基)-3-(1,1,1-三氟-2-甲基丙-2-基)-1H-吡唑(500.0 mg, 1.84 mmol)、MeI(1046.4 mg, 7.37 mmol)和K2CO3(509.4 mg,3.69 mmol)在ACN(10.00 mL)中的溶液搅拌4小时。混合物在减压下浓缩。残余物通过用5:1PE/EtOAc洗脱的Prep-TLC, 254 nm提纯以产生作为白色固体的标题化合物(95 mg, 18%)。ES/MS m/z (M+H) 286.2。
制备例72c
1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)-1H-吡唑-3-胺
将KOH(53.1 mg, 0.95 mmol)在EtOH(1.00 mL)和H2O(1.00 mL)中的溶液添加到羟胺HCl(131.5 mg, 1.89 mmol)在EtOH(2.00 mL)中的溶液中。加入3-(2,5-二甲基-1H-吡咯-1-基)-1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)-1H-吡唑(90.0 mg, 0.32 mmol),混合物在100℃下和在N2下搅拌4小时。该混合物在减压下浓缩。残余物通过反相组合快速色谱法用以下条件提纯:柱, C18 gel,在H2O 中的ACN(0.1% FA),用10%至30%的梯度经10分钟洗脱;UV 254 nm以产生作为白色固体的标题化合物(45 mg, 68%)。ES/MS m/z (M+H)208.1。
制备例73
N-[4-氰基-5-[6-[2-[[5-(1,1-二甲基丙基)异噁唑-3-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]-2-异丙基-吡唑-3-基]氨基甲酸叔丁酯
在N2下向2-[5-[5-(叔丁氧基羰基氨基)-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸锂(300 mg, 0.740 mmol)在吡啶(1.85 mL)中的悬浮液中加入MeTHF(1.85 mL)、5-(1,1-二甲基丙基)异噁唑-3-胺(171 mg, 1.11 mmol),随后加入在MeTHF中的T3P®溶液(50%, 1413 mg, 2.22 mmol)。反应混合物在室温下搅拌整夜,随后倾入NH4Cl的饱和水溶液中。水层用EtOAc(2×)萃取。合并的有机萃取物用饱和NaCl水溶液洗涤,在Na2SO4上干燥,过滤并在减压下浓缩。粗制材料通过用DCM中的丙酮从1至10%的梯度洗脱的硅胶快速色谱法提纯以产生标题化合物(181.3 mg, 43%)。1H NMR (d6-DMSO) δ 11.17 (s, 1H), 9.91(s, 1H), 8.92 (d, J = 2.3 Hz, 1H), 8.16 (dd, J = 8.2, 2.4 Hz, 1H), 7.60 (d, J= 8.2 Hz, 1H), 6.61 (s, 1H), 4.58 (p, J = 6.5 Hz, 1H), 4.16 (q, J = 6.9 Hz,1H), 1.61 (q, J = 7.5 Hz, 2H), 1.50 (d, J = 8.4 Hz, 13H), 1.41 (d, J = 6.6Hz, 7H), 1.24 (s, 7H), 1.08 (s, 1H), 0.73 (t, J = 7.5 Hz, 3H)。
表13中的下列化合物基本如对N-[4-氰基-5-[6-[2-[[5-(1,1-二甲基丙基)异噁唑-3-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]-2-异丙基-吡唑-3-基]氨基甲酸叔丁酯所述制备,调节反应时间以确定反应完成,并使用适当的色谱法条件以便提纯。
表13
a1H NMR (400 MHz, d6-DMSO) δ 8.95 –8.90 (m, 1H), 8.58 (dd, J =5.8, 1.6Hz, 1H), 8.17 (dd, J = 8.2, 2.4 Hz, 1H), 7.60 (d, J = 8.2 Hz, 1H), 7.39 (ddd,J = 7.6, 4.3, 1.5 Hz, 1H), 6.38 (s, 1H), 4.58 (p, J = 6.5 Hz, 1H), 4.17 (q, J= 7.0 Hz, 1H), 1.55 –1.46 (m, 20H), 1.41 (d, J = 6.6 Hz, 8H)。
b1H NMR (400 MHz, d6-DMSO) δ 11.76 (s, 1H), 9.91 (s, 1H), 8.93 (d, J =2.4 Hz, 1H), 8.17 (dd, J = 8.2, 2.4 Hz, 1H), 7.60 (d, J = 8.2 Hz, 1H), 6.12(s, 1H), 4.58 (p, J = 6.6 Hz, 1H), 4.15 (q, J = 7.0 Hz, 1H), 2.45 (s, 2H),1.52-1.49 (m, 12H), 1.41 (d, J = 6.6 Hz, 6H), 0.93 (s, 9H)。
c使用2-[5-[5-(叔丁氧基羰基氨基)-4-氰基-1-异丙基-吡唑-3-基]-2-吡啶基]丙酸取代锂盐。
制备例80
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]-N-[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]丙酰胺
向3-(2,2-二甲基丙基)-1,2-噁唑-5-胺(62 mg, 0.402 mmol)、2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸(120 mg, 0.402 mmol)和NMI(99 mg, 1.206 mmol)在ACN(5.00 mL)中的混合物中加入TCFH(338 mg, 1.206 mmol)。所得混合物在50℃下和在N2下搅拌2小时,并随后在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;流动相, 在H2O中的ACN(0.1% NH4CO3),用0%至50%的梯度在25分钟内洗脱;UV 254nm以产生作为白色固体的标题化合物(130 mg, 74.41%)。ES/MS (m/z) 435.2 (M+H)。
表14中的下列化合物基本如对2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]-N-[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]丙酰胺所述制备,使用适当的试剂,调节反应时间以确定反应完成,和在适当情况下确定提纯条件。反应温度可以为大约50℃至80℃。
表14
*将4Å分子筛添加到反应中。
替代制备例82
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]-N-[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]丙酰胺
向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸(220 mg,0.71 mmol)和3-(2,2-二甲基丙基)-1,2-噁唑-5-胺(131 mg, 0.85 mmol)在ACN(3.00 mL)中的搅拌混合物中加入NMI(291 mg, 3.54 mmol)和TCFH(995 mg, 3.54 mmol)。该混合物在50℃下搅拌3小时。该混合物通过反相组合快速色谱法以下列条件提纯:C18;在H2O中的ACN(0.1% FA),用50%至80%的梯度洗脱以产生作为灰白色固体的标题化合物(200 mg,63.1%)。ES/MS (m/z) 447.3 (M+H)。
制备例96l
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]-N-(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)丙酰胺
在室温下和在N2下向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸(150 mg, 0.48 mmol)和3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-胺(79.36 mg,0.48 mmol)在ACN(5.00 mL)中的搅拌混合物中分份加入NMI(119.05 mg, 1.45 mmol)和TCFH(271.22 mg, 0.97 mmol)。该混合物在50℃下和在N2下搅拌2小时。令混合物冷却至室温并在减压下浓缩。残余物通过用PE/EtOAc(3/1至2/1)洗脱的硅胶柱色谱法提纯以产生作为灰白色固体的标题化合物(130 mg, 58.9%)。ES/MS (m/z) 457.2 (M+H)。
制备例96m
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]-N-(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)丙酰胺
向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]丙酸(150mg, 0.46 mmol)、3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-胺(90.02 mg, 0.55mmol)和NMI(112.52 mg, 1.37 mmol)在ACN(5.00 mL)中的溶液中加入TCFH(192.27 mg,0.68 mmol)。该反应在50℃下搅拌1小时。令混合物冷却至室温并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;在H2O中的ACN(0.1% NH4HCO3),用20%至40%的梯度洗脱以产生作为白色固体的标题化合物(110 mg, 50.74%)。ES/MS (m/z) 475.1(M+H)。
制备例96n
2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]-N-[3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]丙酰胺
向2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸(300 mg, 1.01 mmol)、3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-胺(264 mg, 1.21 mmol)和NMI(248mg, 3.02 mmol)在ACN(20 mL)中的溶液中加入TCFH(1.41 g, 5.03 mmol),该混合物在密封管中在50℃下和在N2下搅拌1小时。将混合物混合物冷却至室温并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18,在H2O中的ACN(0.1% NH4HCO3),用10%至50%的梯度洗脱以产生作为浅棕色固体的标题化合物(250 mg, 49.9%)。ES/MS (m/z)499.10 (M+H)。
制备例96o
2-[4-[5-氨基-4-氰基-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-3-基]苯基]-N-[3-(2,2-二甲基丙基)-4-氟-异噁唑-5-基]丙酰胺
在室温下和在N2下向2-[4-[5-氨基-4-氰基-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-3-基]苯基]丙酸(700 mg, 2.30 mmol)和3-(2,2-二甲基丙基)-4-氟-1,2-噁唑-5-胺(435.62 mg, 2.53 mmol)在ACN(5.00 mL)中的搅拌溶液中逐滴加入NMI(1.89 g,22.99 mmol)和TCFH(6.45 g, 22.99 mmol)。该混合物在50℃下和在N2下搅拌3小时。该混合物在减压下浓缩。残余物通过用PE:EtOAc(3:2-1:1)洗脱的硅胶柱色谱法提纯以产生作为灰白色固体的标题化合物(400 mg, 39.93%)。ES/MS (m/z) 459.2 (M+H)。
制备例97
2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]-N-[3-(3-双环[1.1.1]戊基甲基)异噁唑-5-基]丙酰胺, 异构体1
将T3P®(250 μL, 0.427 mmol, 在EtOAc中的50%溶液)逐滴添加到2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸, 异构体1(51 mg, 0.171 mmol)、3-(3-双环[1.1.1]戊基甲基)异噁唑-5-胺(28.1 mg, 0.171 mmol)和吡啶(27.7 μL, 0.342 mmol)在EtOAc(2 mL, 0.1 M)中的搅拌溶液中。该反应在室温下搅拌18小时。反应混合物在EtOAc(5mL)和饱和NaCl水溶液(5 mL)之间分配。将有机层分离并浓缩至干燥。粗产物通过用含有0.1% TFA的H2O:ACN(5-95%)洗脱的C18 HPLC提纯以产生作为盐的标题化合物。所需产物的游离碱通过经碳酸盐树脂的药筒洗脱所需产物以产生标题化合物(10 mg, 0.0225 mmol,13%)来形成。ES/MS (m/z) 445.2 (M+H)。
制备例98
2-(6-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]吡啶-3-基)-N-[3-(2-氯-4-氟苯基)-1,2-噁唑-5-基]丙酰胺, 异构体2
向2-(6-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]吡啶-3-基)丙酸,异构体2(200 mg, 0.57 mmol)、3-(2-氯-4-氟苯基)-1,2-噁唑-5-胺(180 mg, 0.84 mmol)和DIPEA(273 mg, 2.11 mmol)在DCM(15 mL)中的溶液中加入T3P®(2.24 g, 3.52 mmol,在EtOAc中50%),该混合物在50℃下搅拌整夜。将该反应冷却至室温并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;流动相, 在H2O中的ACN(0.1%NH4HCO3),用10%至50%的梯度在10分钟内洗脱;UV 254 nm以产生作为灰白色固体的标题化合物(100 mg, 32.2%)。ES/MS (m/z) 548.10 (M+H)。
表15中的下列化合物基本如对2-(6-[5-氨基-4-氰基-1-[1,1,1-三氟丙-2-基]吡唑-3-基]吡啶-3-基)-N-[3-(2-氯-4-氟苯基)-1,2-噁唑-5-基]丙酰胺, 异构体2所述制备,使用适当的试剂,调节反应时间以确定反应完成,和使用适当的色谱法条件以便提纯。温度可以为室温至80℃,并且在适当的情况下可以在密封管中完成。二甲基乙酰胺(DMA)可以代替DCM。
制备例119g
2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]-N-[3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]丙酰胺
在密封管中在室温下和在N2下向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]丙酸(400 mg, 1.29 mmol)和3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-胺(281.20 mg, 1.29 mmol)在DCM(5.00 mL)中的搅拌混合物中逐滴加入DIPEA(499.72 mg, 3.87 mmol)和T3P®(4.10 g, 6.44 mmol, 在EtOAc中50重量%)。混合物在80℃下和在N2下搅拌1小时。混合物在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:C18;在H2O中的ACN,用30%至50%的梯度洗脱以产生作为浅黄色固体的标题化合物(230 mg, 34%)。ES/MS (m/z) 511.2 (M+H)。
制备例119h
2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]-N-[3-(3-甲基-1-双环[1.1.1]戊基)异噁唑-5-基]丙酰胺, 异构体1
在EtOAc(3 mL)中合并2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]丙酸,异构体1(78 mg, 0.25 mmol), 3-(3-甲基双环[1.1.1]戊-1-基)异噁唑-5-胺(34 mg,0.21 mmol)和1-甲基咪唑(39 mg, 0.038mL, 0.48 mmol)。该橙色溶液在室温下搅拌2分钟,随后加入T3P®(0.31 g, 0.29 mL, 在EtOAc中50重量%, 0.49 mmol)。该反应搅拌16小时。该反应随后用5 mL H2O稀释并用EtOAc(3×25 mL)萃取。合并的有机萃取物在Na2SO4上干燥,在减压下除去溶剂。残余物在没有进一步提纯的情况下使用。ES/MS (m/z) 511.2 (M+H). ES/MS (m/z) 445.2 (M+H)。
制备例120
N-[4-氨基甲酰基-2-异丙基-5-[6-[1-甲基-2-氧代-2-[[5-(2,2,2-三氟-1,1-二甲基-乙基)异噁唑-3-基]氨基]乙基]-3-吡啶基]吡唑-3-基]氨基甲酸叔丁酯
在tert-BuOH(2.6 mL)和H2O(1.3 mL)的混合物中一起加入N-[4-氰基-2-异丙基-5-[6-[1-甲基-2-氧代-2-[[5-(2,2,2-三氟-1,1-二甲基-乙基)异噁唑-3-基]氨基]乙基]-3-吡啶基]吡唑-3-基]氨基甲酸叔丁酯(130 mg, 0.226 mmol)和铂酸(2-), 三(二甲基膦酸-P)氢-, 二氢(platinate(2-), tris(dimethylphosphinito-P)hydro-, dihydrogen)(Parkins 催化剂, CAS# 173416-05-2)(116 mg, 0.271 mmol)。该反应混合物在60℃下搅拌整夜,经滑石粉垫过滤,并用EtOAc洗涤。有机相用H2O洗涤,水相用EtOAc萃取。合并有机萃取物,在Na2SO4上干燥,过滤,并在真空下浓缩以产生作为白色固体的标题化合物(147.8mg, 104.73%)。该材料不经提纯直接使用。
表16中的下列化合物基本如对N-[4-氨基甲酰基-2-异丙基-5-[6-[1-甲基-2-氧代-2-[[5-(2,2,2-三氟-1,1-二甲基-乙基)异噁唑-3-基]氨基]乙基]-3-吡啶基]吡唑-3-基]氨基甲酸叔丁酯所述制备,使用适当的试剂,调节反应时间以确定反应完成,和在需要的情况下使用适当的色谱法条件以便提纯。温度可以为大约60至70℃。
表16
1 EtOH可替代tert-BuOH。
制备例129a
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺
向2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]-N-[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]丙酰胺(120 mg, 0.276 mmol)、NaOH(55 mg, 1.38 mmol)、H2O(2.00 mL)和DMSO(1.00 mL)在EtOH(5.00 mL)中的混合物中加入H2O2(187.86 mg, 5.523 mmol, 30%水溶液)。所得混合物在40℃下搅拌4小时。令混合物冷却至室温并通过加入饱和Na2SO3水溶液(10 mL)来猝灭。该混合物用EtOAc(3×50 mL)萃取。合并的有机萃取物用饱和NaCl水溶液(50 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;流动相,在H2O中的ACN(0.1% NH4CO3),用0%至50%的梯度在25分钟内洗脱;UV 254 nm以产生作为白色固体的标题化合物(100 mg, 80.02%)。ES/MS (m/z) 453.4 (M+H)。
表17中的下列化合物基本如对5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺所述制备,使用适当的试剂,调节反应时间以确定反应完成,并使用适当的色谱条件以便提纯。NaOH和H2O2可以分份加入,溶剂H2O、EtOH和DMSO的相对量可以改变。温度可以为室温至50℃。
表17
*猝灭后,混合物用HCl(水溶液)酸化至pH=3-6。
替代制备例129
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺
在室温下和在N2下将2-[4-(5-氨基-4-氨基甲酰基-1-异丙基吡唑-3-基)苯基]丙酸(1.30 g, 4.109 mmol), 3-(2,2-二甲基丙基)-1,2-噁唑-5-胺(0.70 g, 4.520 mmol)、NMI(2.12 g, 16.437 mmol)和TCFH(2.31 g, 8.218 mmol)在DMF(50 mL)中的混合物搅拌4小时。该混合物用H2O(200 mL)稀释,并用EtOAc(3×200 mL)萃取。合并的有机萃取物用饱和NaCl水溶液(3×100 mL)洗涤,并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;流动相, 在H2O中的ACN(0.1% FA),用55%至65%的梯度在10分钟内洗脱;UV 220 nm以产生作为浅黄色固体的标题化合物(500 mg, 26.9%)。ES/MS (m/z) 453.4(M+H)。
替代制备例130
5-氨基-3-[5-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)吡啶-2-基]-1-异丙基吡唑-4-甲酰胺
向2-[6-(5-氨基-4-氰基-1-异丙基吡唑-3-基)吡啶-3-基]-N-[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]丙酰胺(120 mg, 0.28 mmol)、NaOH(55 mg, 1.38 mmol)、DMSO(0.40mL)、H2O(0.80 mL)在EtOH(2.00 mL)中的混合物中加入H2O2(937 mg, 8.27 mmol, 30%)。该混合物在40℃下搅拌4小时。令混合物冷却至室温,通过加入饱和Na2SO3水溶液(30 mL)来猝灭,并用EtOAc(3×50 mL)萃取。合并的有机萃取物用盐水(50 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18, 用H2O中0至50% ACN(0.1% NH4CO3)的梯度洗脱以产生作为白色固体的标题化合物(100 mg,80%)。ES/MS (m/z) 454.2 (M+H)。
替代制备例138
5-氨基-3-[4-[1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基]苯基]-1-(1-甲基环丙基)吡唑-4-甲酰胺
一起加入2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]-N-[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]丙酰胺(190 mg, 0.43 mmol)、EtOH(5.00 mL)、H2O(2.00mL)、DMSO(1.00 mL)、NaOH(170.00 mg, 4.26 mmol)和H2O2(2.43 g, 21.30 mmol, 30%)。该溶液在40℃下搅拌5小时。该反应通过饱和Na2SO3(10 mL)来猝灭。该溶液用EtOAc(100 mL)稀释,用H2O(2×30mL)和盐水(20 mL)洗涤。有机相在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:C18;用H2O中50至80% ACN(0.1% NH4HCO3)的梯度洗脱以产生作为白色固体的标题化合物(190 mg, 95.9%)。ES/MS (m/z) 465.3 (M+H)。
制备例167p
5-氨基-1-(1-甲基环丙基)-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺
在室温下和在N2下向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]-N-[3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]丙酰胺(225.00 mg,0.44 mmol)在EtOH(5.00 mL)和DMSO(1.00 mL)中的搅拌溶液中分份加入NaOH(176.28 mg,4.41 mmol)和H2O2(30%, 999.40 mg, 8.82 mmol, 30重量%)。该混合物在50℃下在密封管中在N2下搅拌2小时。将混合物冷却至室温。该反应通过在室温下加入饱和Na2SO3(20 mL)来猝灭。该混合物用EtOAc(3×50 mL)萃取。合并的有机萃取物用盐水(2×100 mL)洗涤,在无水Na2SO4上干燥并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱,C18;用H2O中40至50% ACN(0.1% NH4HCO3)的梯度洗脱以产生作为白色固体的标题化合物(70 mg, 30%)。ES/MS (m/z) 529.2 (M+H)
制备例167q
5-氨基-3-(4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基)-1-(1-甲基环丙基)吡唑-4-甲酰胺
在室温下和在N2下向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]苯基]-N-(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)丙酰胺(130 mg, 0.29 mmol)在EtOH(5.00 mL)和DMSO(1.00 mL)中的搅拌溶液中分份加入NaOH(113.89 mg, 2.85 mmol)和H2O2(30%, 645.70 mg, 5.70 mmol, 30重量%)。该混合物在50℃下和在N2下搅拌4小时。令混合物冷却至室温并通过在室温下加入饱和Na2SO3(30 mL)来猝灭。该混合物用DCM(3×50mL)萃取,并且合并的有机萃取物用盐水(2×100 mL)洗涤,在无水Na2SO4上干燥,过滤,滤液在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;用H2O中40至50% ACN(0.1% NH4HCO3)的梯度洗脱以产生作为粉色固体的标题化合物(95 mg, 70%)。ES/MS (m/z) 497.2 (M+Na)。
制备例167r
5-氨基-1-异丙基-3-[4-(1-[[1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]氨基甲酰基]乙基)苯基]吡唑-4-甲酰胺
在2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]-N-[1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]丙酰胺(130 mg, 0.27 mmol)、NaOH(53.33 mg, 1.33mmol)在EtOH/DMSO(6 mL, 5:1)中的溶液中一起加入H2O2(907 mg, 7.99 mmol, 30%),并在50℃下搅拌2小时。将该溶液冷却至室温,用饱和Na2SO3溶液(10 mL)猝灭,并用EtOAc(3×20mL)萃取,有机萃取物在无水Na2SO4上干燥并在减压下浓缩。粗产物通过反相组合快速色谱法以下列条件提纯:柱, C18;用H2O中40至60% ACN(0.1% NH4HCO3)的梯度洗脱以获得标题化合物(100 mg, 74.18%)。ES/MS (m/z) 506.4 (M+H)。
制备例167s
5-氨基-3-(2-氟-4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基)-1-(1-甲基环丙基)吡唑-4-甲酰胺
向2-[4-[5-氨基-4-氰基-1-(1-甲基环丙基)吡唑-3-基]-3-氟苯基]-N-(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)丙酰胺(100 mg, 0.21 mmol)和NaOH(42.14 mg,1.05 mmol)在EtOH(5.00 mL)和DMSO(1.00 mL)中的溶液中加入H2O2(358.39 mg, 3.161mmol, 30%)。该反应在50℃下搅拌2小时。该反应在0℃下用饱和Na2SO3水溶液(10 mL)猝灭。水层用EtOAc(3×30 mL)萃取。合并的有机层用盐水(2×20 mL)洗涤,在无水Na2SO4上干燥,过滤,滤液在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;用H2O中20至40% ACN(0.1% NH4HCO3)的梯度洗脱以产生作为白色固体的标题化合物(70 mg,67.44%)。ES/MS (m/z) 493.2 (M+H)。
制备例167t
5-氨基-1-异丙基-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺
在40℃下将2-[4-(5-氨基-4-氰基-1-异丙基吡唑-3-基)苯基]-N-[3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]丙酰胺(230 mg, 0.46 mmol)、H2O2(1.05 g,9.23 mmol, 30%)和NaOH(93 mg, 2.31 mmol)在EtOH/DMSO(20 mL, 4:1)中的溶液搅拌2小时。将该溶液冷却至室温,加入饱和Na2SO3溶液(10 mL),混合物在室温下搅拌10分钟。该混合物在减压下浓缩并通过反相组合快速色谱法以下列条件提纯:柱, C18;用H2O中20至50%MeOH(0.1% NH4HCO3)的梯度洗脱以产生作为白色固体的标题化合物(166 mg, 69.7%)。ES/MS (m/z) 517.10 (M+H)。
制备例167u
5-氨基-3-[4-[2-[[3-(2,2-二甲基丙基)-4-氟-异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]苯基]-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-4-甲酰胺
在室温下和在N2下向2-[4-[5-氨基-4-氰基-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-3-基]苯基]-N-[3-(2,2-二甲基丙基)-4-氟-异噁唑-5-基]丙酰胺(400 mg,0.87 mmol)在EtOH(5.00 mL)和DMSO(1.00 mL)中的搅拌溶液中逐滴加入NaOH(174.44 mg,4.36 mmol)和H2O2(1.98 g, 17.45 mmol, 30重量%)。将该混合物在50℃下和在N2下搅拌1小时并随后用饱和Na2SO3猝灭。该混合物用EtOAc(3×100 mL)萃取。合并的有机萃取物用盐水(3×100 mL)洗涤,在无水Na2SO4上干燥,过滤并在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱C18;用H2O中30至50% ACN洗脱以产生作为黄色固体的标题化合物(120.00 mg, 28.87%)。ES/MS (m/z) 477.3 (M+H)。
制备例168
5-氨基-3-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]-1-异丙基-吡唑-4-甲酰胺
向在DCM(1.45 mL)中的N-[4-氨基甲酰基-5-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]-2-异丙基-吡唑-3-基]氨基甲酸叔丁酯(134 mg, 0.242 mmol)中加入TFA(0.72 mL, 9.68 mmol)。该反应混合物在室温下搅拌3小时。该反应混合物用NaHCO3的冷饱和水溶液猝灭,水层用EtOAc萃取。合并的有机萃取物用饱和NaCl水溶液洗涤,在Na2SO4上干燥,过滤并在减压下浓缩。粗制材料通过用DCM中的MeOH从0%至5%的梯度洗脱的硅胶快速色谱法提纯以产生标题化合物(68 mg, 61.95%)。
表18中的下列化合物基本如对5-氨基-3-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]-1-异丙基-吡唑-4-甲酰胺所述制备,调节反应时间以确定反应完成和使用适当的色谱条件以便提纯。产物也可以在异丙醚中研磨,过滤,并在真空下干燥。
实施例1
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺, 异构体1
和
实施例2
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺, 异构体2
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺(100.00 mg, 0.22 mmol)通过制备型手性色谱法以下列条件分离:柱: CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm;流动相A: 己烷(10 mM NH3), 流动相B: IPA;流速20 mL/min; 30% B在15分钟内洗脱;254 nm;t(R) 异构体1为8.2分钟(33.3 mg, 33.3%), [α]D 20 = 0.22696º (C=0.1, MeOH)作为白色固体,具有100% ee。t(R)异构体2为11.0分钟(33.1 mg, 33.1%), [α]D 20 = -0.2113º (C=0.1, MeOH) 作为白色固体,具有100% ee。ES/MS (m/z) 453.4 (M+H)。
表19中的下列化合物基本如对5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺, 异构体1和异构体2所述制备,在适当的情况下调节提纯系统。
表19
1 柱: Chiralpak AD-H, 2*25 cm, 5 µm.
2柱: (R,R)Whelk-O 1, 21.1*250 mm, 5 µm.
3柱: (R,R)Whelk-O 1, Kromasil(02), 5*25 cm, 5 µm.
4CHIRALPAK IF, 2*25 cm, 5 µm.
5CHIRALPAK IA, 2*25 cm, 5 µm.
6CHIRALPAK IA, 2*25 cm, 5 µm.
7流动相B, EtOH.
8(R,R)-Whelk-01, 2.12*25, 5 µm, 流动相B, EtOH.
9用25% IPA洗脱, 246/210 nm。
替代实施例1
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺, 异构体1
5-氨基-3-[4-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)苯基]-1-异丙基吡唑-4-甲酰胺(17 g)通过制备型手性色谱法以下列条件来分离:柱:CHIRAL ART Cellulose-SB, 2*25 cm,5 µm;流动相A 己烷(10 mM NH3-MeOH), 流动相BIPA;流速20 mL/min;用30% B在12分钟内洗脱;UV 254/220 nm;t(R) 异构体1为7.0。所得溶液在减压下浓缩。残余物通过反相组合快速色谱法以下列条件提纯:柱, C18;流动相, 在H2O中的ACN(0.1% FA),用55%至65%的梯度在10分钟内洗脱;UV 220 nm, (6.1315 g,35.7%) 作为白色固体,具有99.8% ee, MP 128℃, ES/MS (m/z) 453.2 (M+H)。
实施例36c
5-氨基-3-[4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基]-1-(1-甲基环丙基)吡唑-4-甲酰胺, 异构体1
和
实施例36d
5-氨基-3-[4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基]-1-(1-甲基环丙基)吡唑-4-甲酰胺, 异构体2
5-氨基-3-(4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基)-1-(1-甲基环丙基)吡唑-4-甲酰胺(93 mg)通过制备型HPLC以下列条件提纯:柱CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm;用在己烷中20% IPA(10 mM NH3-MeOH)洗脱,流速20 mL/min;254/210 nm以获得作为白色固体的异构体1, t(R) 12.22, (30.8mg, 33%收率, 100% ee), ES/MS (m/z) 475.3 (M+H)和作为白色固体的异构体2, t(R)16.56, (30.5 mg, 33%收率 100% ee), ES/MS (m/z) 475.3 (M+H)。
实施例36e
5-氨基-1-异丙基-3-[4-[1-[[1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]氨基甲酰基]乙基]苯基]吡唑-4-甲酰胺, 异构体1
和
实施例36f
5-氨基-1-异丙基-3-[4-[1-[[1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]氨基甲酰基]乙基]苯基]吡唑-4-甲酰胺, 异构体2
5-氨基-1-异丙基-3-[4-(1-[[1-甲基-5-(1,1,1-三氟-2-甲基丙-2-基)吡唑-3-基]氨基甲酰基]乙基)苯基]吡唑-4-甲酰胺(90 mg)通过制备型手性HPLC以下列条件提纯:柱CHIRALPAK IC, 2*25 cm,5 µm;用在己烷中的30% IPA(10 mM NH3-MeOH)洗脱, 流速20mL/min;240/210 nm以产生作为白色固体的异构体1的标题化合物, t(R) 15.48, (35.2mg, 39.22%收率, 100% ee), ES/MS (m/z) 506.3 (M+H)和作为白色固体的异构体2的标题化合物, t(R) 20.74, (32.3 mg, 35.89%收率, 97.7% ee), ES/MS (m/z) 506.3 (M+H)。
实施例36g
5-氨基-1-异丙基-3-(4-(1-((3-(3-甲基双环[1.1.1]戊-1-基)异噁唑-5-基)氨基)-1-氧代丙-2-基)苯基)-1H-吡唑-4-甲酰胺, 异构体1
将2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]-N-[3-(3-甲基-1-双环[1.1.1]戊基)异噁唑-5-基]丙酰胺, 异构体1(110 mg, 247 μmol)和Parkins催化剂(106mg, 247 μmol)在EtOH(4 mL)和H2O(1 mL)中混合。将该混合物加热到60℃下持续24小时。该混合物穿过0.45 µM过滤器,在减压下除去溶剂。残余物经由用0-100% 庚烷:EtOAc的梯度洗脱的硅胶快速色谱法提纯以产生作为黄色固体的标题化合物(26 mg, 23%)。ES/MS(m/z) 463.2(M+H)。
实施例36h
5-氨基-1-(1-甲基环丙基)-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺, 异构体1
和
实施例36i
5-氨基-1-(1-甲基环丙基)-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺, 异构体2
5-氨基-1-(1-甲基环丙基)-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺(68 mg)通过制备型手性HPLC以下列条件来提纯:柱: CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm;用在己烷中的15% EtOH(10 mM NH3-MeOH)洗脱, 流速20 mL/min,在18分钟内, 254/210 nm以产生作为白色固体的异构体1的标题化合物, t(R) 11.72, (15.3 mg, 22%收率, 100% ee), ES/MS (m/z)529.2 (M+H)和作为白色固体的异构体2的标题化合物, t(R) 14.41, (16.8 mg, 24%收率,100% ee)。ES/MS (m/z) 529.2 (M+H)。
表19a中的下列化合物基本如对5-氨基-1-(1-甲基环丙基)-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺,异构体1和异构体2所述制备,并在适当的情况下调节色谱条件。
表19a
1用1:1 己烷:MTBE中10% EtOH(0.5% 2 M NH3-MeOH)洗脱。
2用己烷中10% EtOH(10 mM NH3-MeOH)洗脱, 245/210 nm。
3柱:CHIRALPAK ID 2*25 cm, 5 µm;用1:1己烷:MTBE中的8% IPA(0.5% 2 M NH3-MeOH)洗脱, 245/210 nm。
4UV 245/210 nm。
实施例36t
5-氨基-3-(2-氟-4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基)-1-(1-甲基环丙基)吡唑-4-甲酰胺, 异构体1
和
实施例36u
5-氨基-3-(2-氟-4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基)-1-(1-甲基环丙基)吡唑-4-甲酰胺, 异构体2
5-氨基-3-(2-氟-4-[1-[(3-[3-甲基双环[1.1.1]戊-1-基]-1,2-噁唑-5-基)氨基甲酰基]乙基]苯基)-1-(1-甲基环丙基)吡唑-4-甲酰胺(70 mg)通过制备型手性HPLC通过以下条件来提纯:柱CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm 用己烷中30% IPA(10 mMNH3-MeOH)洗脱, 250/210 nm以产生作为白色固体的异构体1的标题化合物t(R) 7.04,(20.3 mg, 29.0%, 99.76% ee), ES/MS (m/z) 454.2 (M+H)和作为白色固体的异构体2的标题化合物t(R) 9.48, (18.9 mg, 27.0%, 99.26% ee), ES/MS (m/z) 454.2 (M+H)。
实施例36v
5-氨基-1-异丙基-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺, 异构体1
和
实施例36w
5-氨基-1-异丙基-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺, 异构体2
5-氨基-1-异丙基-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺(162 mg)通过制备型手性HPLC通过以下条件来提纯:柱CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm 用己烷中20% EtOH(10 mMNH3-MeOH)洗脱, 254/210 nm以产生作为白色固体的异构体1的标题化合物t(R) 10.66,(48.1 mg, 29.6%, 100% ee), ES/MS (m/z) 517.05 (M+H)和作为白色固体的异构体2的标题化合物t(R) 13.23, (50.4 mg, 30.6%, 99.74% ee), ES/MS (m/z) 517.05 (M+H)。
表19b中的下列化合物基本如对5-氨基-1-异丙基-3-[4-[1-([3-[3-(三氟甲基)双环[1.1.1]戊-1-基]-1,2-噁唑-5-基]氨基甲酰基)乙基]苯基]吡唑-4-甲酰胺, 异构体1和异构体2所述制备,并在适当情况下调节色谱条件。
表19b
1UV为210/237 nm。
实施例36zf
5-氨基-3-[4-[2-[[3-(2,2-二甲基丙基)-4-氟-异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]苯基]-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-4-甲酰胺, 异构体1
和
实施例36zg
5-氨基-3-[4-[2-[[3-(2,2-二甲基丙基)-4-氟-异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]苯基]-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-4-甲酰胺, 异构体2
5-氨基-3-[4-[2-[[3-(2,2-二甲基丙基)-4-氟-异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]苯基]-1-[2,2,2-三氘代-1-(三氘代甲基)乙基]吡唑-4-甲酰胺(120 mg)通过制备型手性HPLC通过以下条件提纯:柱CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm 用己烷中20% EtOH(10 mM NH3-MeOH)洗脱, 213/237 nm以产生作为米色固体的异构体1的标题化合物t(R) 7.78, (22.2 mg, 18.5%, 100% ee), ES/MS (m/z) 477.25 (M+H)和作为米色固体的异构体2的标题化合物t(R)9.43, (27.1 mg, 22.6%, 98.14% ee), ES/MS (m/z)477.25 (M+H)。
实施例37
5-氨基-3-[5-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)吡啶-2-基]-1-异丙基吡唑-4-甲酰胺, 异构体1
和
实施例38
5-氨基-3-[5-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)吡啶-2-基]-1-异丙基吡唑-4-甲酰胺, 异构体2
5-氨基-3-[5-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)吡啶-2-基]-1-异丙基吡唑-4-甲酰胺(97.00 mg, 0.21 mmol)通过制备型手性色谱法以下列条件来分离:柱: CHIRAL ART Cellulose-SB, 2*25 cm, 5 µm;流动相A: 己烷(10 mMNH3), 流动相B: EtOH;流速20 mL/min;用40% B在11分钟内洗脱;254/220 nm;t(R) 异构体1为5.2分钟(35.8 mg, 36.9%),作为白色固体,100% ee. ES/MS (m/z) 454.2 (M+H). t(R)异构体2为7.5分钟(42.1 mg, 43.4%),作为白色固体,100% ee。ES/MS (m/z) 454.2 (M+H)。
表20中的下列化合物基本如对5-氨基-3-[5-(1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基)吡啶-2-基]-1-异丙基吡唑-4-甲酰胺, 异构体1和异构体2所述制备,并在适当情况下调节提纯系统。
表20
1柱 CHIRAL ART Cellulose-SB, S-5 µm, 50*250 mm, 5 µm.
2柱 CHIRAL ART Cellulose-SB S-5 µm, 2*25 cm.
3柱 CHIRALCEL OD-H, 2*25 mm.
4柱 CHIRALCEL OD-H, 4.6X150 mm, 5 µm, 25% EtOH/CO2, 5 mL/min, 225 nm.
5柱 CHIRAL ART Cellulose-SC.
6柱: (R,R)Whelk-O 1, 21.1*250 mm, 5 µm.
7柱: (R,R)Whelk-O1, 2.12*25 cm, 5 µm.
8EtOH用于流动相A和B, 50%等度.
9柱: CHIRALPAK IH, 25*2 cm, 5 µm, 流动相A CO2, 流动相B IPA, 等度45% B.
10(R,R)-Whelk-01, 2*25 mm, 5 µm.
11柱: Chiralpak AD-H, 2*25 cm, 5 µm.
12柱: Chiralpak AD-H, 2*25 cm, 5 µm, 用50% B至0 B的梯度洗脱.
13柱: Chiralpak ADH, 2*25 cm, 5 µm, 用己烷(10 mM NH3MeOH)和30% IPA洗脱.
14溶剂体系是己烷中的30% EtOH(10 mM NH3-MeOH).
15柱: CHIRALPAK IG, 2*25 cm,5 µm;用己烷中的30% EtOH (10 mM NH3-MeOH)洗脱, 流速20 mL/min, 234/274 nm.
16 柱: CHIRAL ART Amylose-C NEO, 2.0*2 cm, 5 µm;用己烷中40% EtOH(10 mMNH3-MeOH)洗脱, 流速20 mL/min, 245/254 nm。
替代实施例61
-氨基-3-[4-[1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基]苯基]-1-(1-甲基环丙基)吡唑-4-甲酰胺, 异构体1
和
替代实施例62
5-氨基-3-[4-[1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基]苯基]-1-(1-甲基环丙基)吡唑-4-甲酰胺, 异构体2
5-氨基-3-[4-[1-[[3-(2,2-二甲基丙基)-1,2-噁唑-5-基]氨基甲酰基]乙基]苯基]-1-(1-甲基环丙基)吡唑-4-甲酰胺(95 mg)用以下条件分离:柱: (R,R)-Whelk-01,2.12*25 cm, 5 µm;用己烷中的30% EtOH(10 mM-MeOH)洗脱, 流速20 mL/min, UV 254 nm以产生作为白色固体的异构体1的标题化合物t(R) 11.5 min, (38.6 mg, 40.6%, 100%ee), ES/MS (m/z) 465.3 (M+H)和作为白色固体的异构体2的标题化合物 t(R) 20分钟(30.7 mg, 32.3%, 99.6%ee), ES/MS (m/z) 465.3 (M+H)。
实施例79
5-氨基-3-(4-[1-[(5-叔丁基-1,2-噻唑-3-基)氨基甲酰基]乙基]苯基)-1-异丙基吡唑-4-甲酰胺, 异构体1
和
实施例80
5-氨基-3-(4-[1-[(5-叔丁基-1,2-噻唑-3-基)氨基甲酰基]乙基]苯基)-1-异丙基吡唑-4-甲酰胺, 异构体2
5-氨基-3-(4-[1-[(5-叔丁基-1,2-噻唑-3-基)氨基甲酰基]乙基]苯基)-1-异丙基吡唑-4-甲酰胺(90 mg, 0.20 mmol)通过制备型手性色谱法用以下条件来分离:柱:CHIRALPAK IG-3, 4.6*50 mm, 3.0 µm, 流动相A: 己烷(0.1% DEA);流动相B: EtOH 用70%至30% B的梯度洗脱;流速1 mL/min, UV 254 nm, t(R) 异构体1为2.1分钟(25 mg,21.8%),作为白色固体, t(R) 异构体2为3.3分钟(25 mg, 21.8%),作为白色固体。ES/MS(m/z) 455.25 (M+H)。
实施例81
5-氨基-1-异丙基-3-[4-(1-[[5-(1,1,1-三氟-2-甲基丙-2-基)-1,2-噁唑-3-基]氨基甲酰基]乙基)苯基]吡唑-4-甲酰胺, 异构体1
和
实施例82
5-氨基-1-异丙基-3-[4-(1-[[5-(1,1,1-三氟-2-甲基丙-2-基)-1,2-噁唑-3-基]氨基甲酰基]乙基)苯基]吡唑-4-甲酰胺, 异构体2
5-氨基-1-异丙基-3-[4-(1-[[5-(1,1,1-三氟-2-甲基丙-2-基)-1,2-噁唑-3-基]氨基甲酰基]乙基)苯基]吡唑-4-甲酰胺(90 mg, 0.18 mmol)通过制备型手性色谱法用以下条件来分离:柱: CHIRALPAK IE, 2*25 cm, 5 µm;流动相A: ACN;流动相B: MtBE 用25%B洗脱;210 nm, 254 nm;t(R)异构体1为5分钟(39.3 mg, 43.6%, 100% ee),作为白色固体。t(R) 异构体2为6分钟(36.1 mg, 40.1%, 100% ee),作为白色固体。ES/MS (m/z) 493.3 (M+H)。
实施例83
5-氨基-1-异丙基-3-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]吡唑-4-甲酰胺, 异构体1
和
实施例84
5-氨基-1-异丙基-3-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]吡唑-4-甲酰胺, 异构体2
5-氨基-3-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]-1-异丙基-吡唑-4-甲酰胺(68 mg, 0.18 mmol)用以下条件手性分离:柱:Acquity UPLC CSH C18 (2.1×50 mm) 1.7µm;流动相A: H2O + 0.02% FA;流动相B: ACN+ 0.02% FA 用2% B至98% B的梯度经4分钟洗脱;流速为1 ml/min, 温度为55℃. t(R) 异构体1为3.3分钟(22 mg, 20%)。t(R)异构体2为4.7分钟(23 mg, 21%)。ES/MS (m/z) 454 (M+H)。
表21中的下列化合物基本如对5-氨基-1-异丙基-3-[6-[2-[[3-(1,1-二甲基丙基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]-3-吡啶基]吡唑-4-甲酰胺, 异构体1和异构体2所述手性分离,在适当条件下调节条件。标题化合物可用异丙基醚研磨并在真空下在大约45℃下干燥14小时以获得白色固体。
实施例97
5-氨基-3-[4-[2-[[3-(3-双环[1.1.1]戊基甲基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]苯基]-1-异丙基-吡唑-4-甲酰胺, 异构体1
将2-[4-(5-氨基-4-氰基-1-异丙基-吡唑-3-基)苯基]-N-[3-(3-双环[1.1.1]戊基甲基)异噁唑-5-基]丙酰胺, 异构体1(10 mg, 0.023 mmol)和铂酸(2-), 三(二甲基膦酸-P)氢-, 二氢(Parkins 催化剂, CAS# 173416-05-2)(10 mg, 0.023 mmol)在EtOH(0.2mL)和H2O(0.2 mL)中在70℃下搅拌90分钟。该反应混合物通过硅藻土过滤并浓缩。残余物通过用含有0.1% TFA的H2O:ACN(5-95%)洗脱的C18 HPLC提纯。所需产物的游离碱通过经碳酸盐树脂的药筒洗脱该材料以产生标题化合物(4.3 mg, 39%)而形成。ES/MS (m/z) 463.2(M+H) 99% ee, 手性纯度测定:YMA Chiral Cellulose-SB 柱, 4.6 x 100 mm, 3 µm 用70/30己烷(0.1% 乙二胺)/IPA洗脱,1毫升/分钟, t(R) 3.78。
表22中的下列化合物基本如对5-氨基-3-[4-[2-[[3-(3-双环[1.1.1]戊基甲基)异噁唑-5-基]氨基]-1-甲基-2-氧代-乙基]苯基]-1-异丙基-吡唑-4-甲酰胺, 异构体1所述制备,使用适当的试剂,调节反应时间以确定反应完成,并在需要的情况下使用适当的色谱条件以便提纯。温度可以为大约60至80℃。此外,如果需要的话,Parkin’s催化剂可用于推动反应至完成。
尽管仅明确描述了本文中公开的某些代表性化合物、材料和方法步骤,但化合物、材料和方法步骤的其它组合也意图落在所附权利要求书的范围内,即使没有明确列举。因此,在本文中可能明确提到步骤、要素、组分或成分的组合;但是,即使没有明确指定,也包括步骤、要素、组分和成分的其它组合。本文所用的术语“包含”及其变体与术语“包括”及其变体同义使用并且是开放的非限制性术语。尽管术语“包含”和“包括”在本文中已用于描述各种实施方案,但可以使用术语“基本由...组成”和“由...组成”代替“包含”和“包括”以提供本发明的更具体的实施方案并且也作出公开。
生物测定法
以下测定法证实本文所述的化合物是RET激酶抑制剂。
测定法A: RET酶测定法
使用CisBio’s HTRF® KinEASE™-TK测定技术筛选式I、II或III的化合物的抑制野生型、V804M和G810S突变型RET激酶的能力。来自Eurofins的N-端GST标记重组人RET胞浆域(aa 658-end)(1.25 nM RET;Catalog No. 14-570M)或来自Millipore的N-端GST标记重组人V804M突变RET胞浆域(aa 658-end)(1.25 nM酶;Catalog No. 14-760)或N-端GST标记重组人G810S(aa-658-end)(1.25nM酶;在昆虫细胞中产生)用62.5 nM TK底物生物素(CisBio,Catalog No. 62TK0PEC的一部分)和1mM ATP与受试化合物(在该测定中0.4%最终DMSO)一起在由1 nM DTT、5 mM MgCl2、0.04% BSA和0.05% Tween20组成的1X Cisbio酶缓冲液中孵育,体积为10 µL。化合物通常在DMSO中以三倍连续稀释制备,并添加到该测定中以得到适当的最终浓度。在22℃下40-60分钟(对于V804M为40分钟,对于WT和G810S为60分钟)孵育后,通过在HTRF检测缓冲液中加入含有7.8 nM链霉亲和素-XL665和0.5X TK-ab-Cryptate的猝灭溶液(10 µL)(都来自CisBio,Cat. No. 62TK0PEC的一部分)而猝灭反应。在22℃下60-80分钟(对于WT为60分钟,对于V804M和G810S为80分钟)孵育后,使用PHERastar读板机通过在激发/发射337/665 nm下的HTRF检测来测定反应程度。计算抑制百分比,其中0%抑制是指不含化合物的对照条件(仅0.4% DMSO),100%抑制表示不含酶的条件。将%抑制值拟合到4参数逻辑曲线,且测定的IC50值被定义为在拟合曲线的拐点处的抑制剂的估计浓度。实施例1、15、17、35、45、52、64、66、68、70、76、80、81、84、90、94和98的化合物在这些测定中都表现出对于野生型、V804M和G810S突变型RET激酶各自小于100 nM的IC50值。表A中的所有化合物在野生型、V804M和G810S突变型RET激酶测定中具有小于700 nm的IC50值。
测定法B: RET细胞测定法
如通过In-Cell Western检测,筛选式(I)、(II)和(III)的化合物的抑制酪氨酸1062处的RET的细胞内自身磷酸化的能力。将含有用于KIF5B-RET WT和RET突变形式V804M和G810S的诱导性表达的强力霉素诱导型质粒的HEK293细胞以25,000个细胞/孔接种到黑色聚-D-赖氨酸预包被的384孔板中(Corning,Catalog No. 356697)。用1 µg/mL的强力霉素诱导KIF5B-RET的表达并将细胞在37℃下培养整夜。化合物在DMSO中以三倍连续稀释制备,然后在培养基中进一步稀释1:100,然后添加到细胞中(0.1%最终DMSO浓度)。化合物处理在37℃下进行1小时,然后用4%甲醛在室温下固定细胞20分钟,细胞用冰冷MeOH在室温下透化10分钟。细胞用Intercept®封闭缓冲液(Li-COR,Catalogue No. 927-70010)在室温下孵育1小时。用抗人phospho-RET的一抗(Y1062)(R&D,Catalogue No. AF5009,1/250稀释)和人甘油醛-3-磷酸脱氢酶(克隆6C5,Merck,Catalog No. MAB374,1/1000稀释)的孵育在4℃下进行整夜。用二抗IRDye® 800CW山羊抗兔IgG(Li-COR,Catalogue No. 926-32211,1/1000稀释)和IRDye® 680CW山羊抗小鼠IgG(Li-COR,Catalogue No. 926-68070,1/1000稀释)的孵育在室温下进行1小时。所有抗体稀释在含有0.05% Tween20的Intercept®封闭缓冲液中进行。在用PBS-T(Cell Signaling technology,Catalogue No. 9809)洗涤细胞后,在Li-COR Odyssey LCx上在700和800 nm下获取图像。计算DMSO对照的百分比,其中100%信号是指不含化合物的对照条件(仅0.4% DMSO),0%信号表示含对照化合物的条件。将DMSO对照的%值拟合到4参数逻辑曲线,且测定的EC50值被定义为在拟合曲线的拐点处的抑制剂的估计浓度。实施例1、15、17、31、33、35、45、52、64、66、68、70、76、80、81、84、90、94和98的化合物在这些测定中都在野生型、V804M和G810S RET突变细胞各自中以小于100 nM的EC50值抑制酪氨酸1062处的RET的细胞内自身磷酸化。表B中的所有化合物在野生型、V804M和G810S突变型RET激酶测定中具有小于700 nm的IC50值。
序列表
<110> Eli Lilly and Company
<120> 可用于抑制RET激酶的化合物
<130> X22660
<150> 63/015,933
<151> 2020-04-27
<160> 1
<170> PatentIn版本3.5
<210> 1
<211> 1114
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Lys Ala Thr Ser Gly Ala Ala Gly Leu Arg Leu Leu Leu Leu
1 5 10 15
Leu Leu Leu Pro Leu Leu Gly Lys Val Ala Leu Gly Leu Tyr Phe Ser
20 25 30
Arg Asp Ala Tyr Trp Glu Lys Leu Tyr Val Asp Gln Ala Ala Gly Thr
35 40 45
Pro Leu Leu Tyr Val His Ala Leu Arg Asp Ala Pro Glu Glu Val Pro
50 55 60
Ser Phe Arg Leu Gly Gln His Leu Tyr Gly Thr Tyr Arg Thr Arg Leu
65 70 75 80
His Glu Asn Asn Trp Ile Cys Ile Gln Glu Asp Thr Gly Leu Leu Tyr
85 90 95
Leu Asn Arg Ser Leu Asp His Ser Ser Trp Glu Lys Leu Ser Val Arg
100 105 110
Asn Arg Gly Phe Pro Leu Leu Thr Val Tyr Leu Lys Val Phe Leu Ser
115 120 125
Pro Thr Ser Leu Arg Glu Gly Glu Cys Gln Trp Pro Gly Cys Ala Arg
130 135 140
Val Tyr Phe Ser Phe Phe Asn Thr Ser Phe Pro Ala Cys Ser Ser Leu
145 150 155 160
Lys Pro Arg Glu Leu Cys Phe Pro Glu Thr Arg Pro Ser Phe Arg Ile
165 170 175
Arg Glu Asn Arg Pro Pro Gly Thr Phe His Gln Phe Arg Leu Leu Pro
180 185 190
Val Gln Phe Leu Cys Pro Asn Ile Ser Val Ala Tyr Arg Leu Leu Glu
195 200 205
Gly Glu Gly Leu Pro Phe Arg Cys Ala Pro Asp Ser Leu Glu Val Ser
210 215 220
Thr Arg Trp Ala Leu Asp Arg Glu Gln Arg Glu Lys Tyr Glu Leu Val
225 230 235 240
Ala Val Cys Thr Val His Ala Gly Ala Arg Glu Glu Val Val Met Val
245 250 255
Pro Phe Pro Val Thr Val Tyr Asp Glu Asp Asp Ser Ala Pro Thr Phe
260 265 270
Pro Ala Gly Val Asp Thr Ala Ser Ala Val Val Glu Phe Lys Arg Lys
275 280 285
Glu Asp Thr Val Val Ala Thr Leu Arg Val Phe Asp Ala Asp Val Val
290 295 300
Pro Ala Ser Gly Glu Leu Val Arg Arg Tyr Thr Ser Thr Leu Leu Pro
305 310 315 320
Gly Asp Thr Trp Ala Gln Gln Thr Phe Arg Val Glu His Trp Pro Asn
325 330 335
Glu Thr Ser Val Gln Ala Asn Gly Ser Phe Val Arg Ala Thr Val His
340 345 350
Asp Tyr Arg Leu Val Leu Asn Arg Asn Leu Ser Ile Ser Glu Asn Arg
355 360 365
Thr Met Gln Leu Ala Val Leu Val Asn Asp Ser Asp Phe Gln Gly Pro
370 375 380
Gly Ala Gly Val Leu Leu Leu His Phe Asn Val Ser Val Leu Pro Val
385 390 395 400
Ser Leu His Leu Pro Ser Thr Tyr Ser Leu Ser Val Ser Arg Arg Ala
405 410 415
Arg Arg Phe Ala Gln Ile Gly Lys Val Cys Val Glu Asn Cys Gln Ala
420 425 430
Phe Ser Gly Ile Asn Val Gln Tyr Lys Leu His Ser Ser Gly Ala Asn
435 440 445
Cys Ser Thr Leu Gly Val Val Thr Ser Ala Glu Asp Thr Ser Gly Ile
450 455 460
Leu Phe Val Asn Asp Thr Lys Ala Leu Arg Arg Pro Lys Cys Ala Glu
465 470 475 480
Leu His Tyr Met Val Val Ala Thr Asp Gln Gln Thr Ser Arg Gln Ala
485 490 495
Gln Ala Gln Leu Leu Val Thr Val Glu Gly Ser Tyr Val Ala Glu Glu
500 505 510
Ala Gly Cys Pro Leu Ser Cys Ala Val Ser Lys Arg Arg Leu Glu Cys
515 520 525
Glu Glu Cys Gly Gly Leu Gly Ser Pro Thr Gly Arg Cys Glu Trp Arg
530 535 540
Gln Gly Asp Gly Lys Gly Ile Thr Arg Asn Phe Ser Thr Cys Ser Pro
545 550 555 560
Ser Thr Lys Thr Cys Pro Asp Gly His Cys Asp Val Val Glu Thr Gln
565 570 575
Asp Ile Asn Ile Cys Pro Gln Asp Cys Leu Arg Gly Ser Ile Val Gly
580 585 590
Gly His Glu Pro Gly Glu Pro Arg Gly Ile Lys Ala Gly Tyr Gly Thr
595 600 605
Cys Asn Cys Phe Pro Glu Glu Glu Lys Cys Phe Cys Glu Pro Glu Asp
610 615 620
Ile Gln Asp Pro Leu Cys Asp Glu Leu Cys Arg Thr Val Ile Ala Ala
625 630 635 640
Ala Val Leu Phe Ser Phe Ile Val Ser Val Leu Leu Ser Ala Phe Cys
645 650 655
Ile His Cys Tyr His Lys Phe Ala His Lys Pro Pro Ile Ser Ser Ala
660 665 670
Glu Met Thr Phe Arg Arg Pro Ala Gln Ala Phe Pro Val Ser Tyr Ser
675 680 685
Ser Ser Gly Ala Arg Arg Pro Ser Leu Asp Ser Met Glu Asn Gln Val
690 695 700
Ser Val Asp Ala Phe Lys Ile Leu Glu Asp Pro Lys Trp Glu Phe Pro
705 710 715 720
Arg Lys Asn Leu Val Leu Gly Lys Thr Leu Gly Glu Gly Glu Phe Gly
725 730 735
Lys Val Val Lys Ala Thr Ala Phe His Leu Lys Gly Arg Ala Gly Tyr
740 745 750
Thr Thr Val Ala Val Lys Met Leu Lys Glu Asn Ala Ser Pro Ser Glu
755 760 765
Leu Arg Asp Leu Leu Ser Glu Phe Asn Val Leu Lys Gln Val Asn His
770 775 780
Pro His Val Ile Lys Leu Tyr Gly Ala Cys Ser Gln Asp Gly Pro Leu
785 790 795 800
Leu Leu Ile Val Glu Tyr Ala Lys Tyr Gly Ser Leu Arg Gly Phe Leu
805 810 815
Arg Glu Ser Arg Lys Val Gly Pro Gly Tyr Leu Gly Ser Gly Gly Ser
820 825 830
Arg Asn Ser Ser Ser Leu Asp His Pro Asp Glu Arg Ala Leu Thr Met
835 840 845
Gly Asp Leu Ile Ser Phe Ala Trp Gln Ile Ser Gln Gly Met Gln Tyr
850 855 860
Leu Ala Glu Met Lys Leu Val His Arg Asp Leu Ala Ala Arg Asn Ile
865 870 875 880
Leu Val Ala Glu Gly Arg Lys Met Lys Ile Ser Asp Phe Gly Leu Ser
885 890 895
Arg Asp Val Tyr Glu Glu Asp Ser Tyr Val Lys Arg Ser Gln Gly Arg
900 905 910
Ile Pro Val Lys Trp Met Ala Ile Glu Ser Leu Phe Asp His Ile Tyr
915 920 925
Thr Thr Gln Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Ile
930 935 940
Val Thr Leu Gly Gly Asn Pro Tyr Pro Gly Ile Pro Pro Glu Arg Leu
945 950 955 960
Phe Asn Leu Leu Lys Thr Gly His Arg Met Glu Arg Pro Asp Asn Cys
965 970 975
Ser Glu Glu Met Tyr Arg Leu Met Leu Gln Cys Trp Lys Gln Glu Pro
980 985 990
Asp Lys Arg Pro Val Phe Ala Asp Ile Ser Lys Asp Leu Glu Lys Met
995 1000 1005
Met Val Lys Arg Arg Asp Tyr Leu Asp Leu Ala Ala Ser Thr Pro
1010 1015 1020
Ser Asp Ser Leu Ile Tyr Asp Asp Gly Leu Ser Glu Glu Glu Thr
1025 1030 1035
Pro Leu Val Asp Cys Asn Asn Ala Pro Leu Pro Arg Ala Leu Pro
1040 1045 1050
Ser Thr Trp Ile Glu Asn Lys Leu Tyr Gly Met Ser Asp Pro Asn
1055 1060 1065
Trp Pro Gly Glu Ser Pro Val Pro Leu Thr Arg Ala Asp Gly Thr
1070 1075 1080
Asn Thr Gly Phe Pro Arg Tyr Pro Asn Asp Ser Val Tyr Ala Asn
1085 1090 1095
Trp Met Leu Ser Pro Ser Ala Ala Lys Leu Met Asp Thr Phe Asp
1100 1105 1110
Ser
Claims (30)
1.下式的化合物或其可药用盐:
其中
A是五元或六元芳基或杂芳基;
各R1独立地为氢、卤素、C1-C6烷基、C1-C6杂烷基、-(C0-C4烷基)(C5-C6杂烷基)、-(C0-C4烷基)(C3-C7环烷基)、-(C0-C4杂烷基)(C3-C7环烷基)、-(C0-C4烷基)(C4-C7环杂烷基)、-(C0-C4杂烷基)(C3-C7环杂烷基)、-(C0-C4烷基)(C4-C10双环)、-(C0-C4烷基)(C5-C6芳基)、-(C0-C4烷基)(C5-C6杂芳基)、-(C0-C4烷基)(C4-C10杂双环)、C5-C12螺烷、C5-C12杂螺烷、金刚烷、二氟甲基硫烷或五氟硫烷,其中各R1任选被一个或多个基团取代,所述基团独立地为卤素、氰基、羟基、氧代、甲基、甲氧基、羟甲基、乙基、乙氧基、羟乙基、甲基胺、N,N-二甲基甲基胺或单-、二-或三-卤代甲基,并且其中两个R1基团能够稠合形成包括A的一部分并任选为芳族的环结构,并且n为1、2或3;
X1、X2、X3和X4各自独立地为N、CH、C-CH3、C-CH2-OH、C-OCH3、C-CH2-OCH3或C-卤素;和
R2是C1-C4烷基、-(C0-C4烷基)(C3-C7环烷基)、-(C0-C4烷基)(C4-C7杂环烷基)、-(C0-C4烷基)(C4-C10双环),各自任选被一个或多个基团取代,所述基团独立地为氘、卤素、氰基、羟基、氧代、甲基、甲氧基、羟甲基、乙基、乙氧基、羟乙基、环丙基或单-、二-或三-卤代甲基。
2.根据权利要求1的化合物或其可药用盐,其中X1、X2、X3和X4各自是CH。
3.根据权利要求1的化合物或其可药用盐,其中X1是N,并且X2、X3和X4各自是CH。
4.根据权利要求1的化合物或其可药用盐,其中X2是N,并且X1、X3和X4各自是CH。
7.根据权利要求5或6的化合物或其可药用盐,其中R1是2,2-二甲基丙基;2-氯-4-氟-苯基;2,4-二氯苯基;1,1-二甲基-2,2,2-三氟乙基;1,1-二甲基乙基;1,1-二甲基丙基;三氟甲基;1,1-二甲基-2,2-二氟丙基;1,1-二甲基-3,3,3-三氟丙基;1-甲基环丙基;(1-甲基环丙基)甲基;3-甲基双环[1.1.1]戊-1-基;3-(三氟甲基)双环[1.1.1]戊-1-基;(3,3-二甲基环丁基)甲基。
8.根据权利要求5、6或7的化合物或其可药用盐,其中R1是2,2-二甲基丙基。
16.根据权利要求15的化合物,其中所述式在ϕ位置具有R-对映异构体手性。
17.根据权利要求15的化合物,其中所述式在ϕ位置具有S-对映异构体手性。
18.一种治疗患者的癌症的方法,其包括给予需要这种治疗的患者有效量的根据权利要求1至17任一项的化合物或其可药用盐。
19.权利要求18的方法,其中所述癌症是RET相关癌症。
20.根据权利要求18或19的方法,其中所述癌症选自:肺癌、乳头状甲状腺癌、甲状腺髓样癌、分化型甲状腺癌、复发性甲状腺癌、难治性分化型甲状腺癌、多发性内分泌腺瘤2A型或2B型(分别为MEN2A或MEN2B)、嗜铬细胞瘤、甲状旁腺增生、乳腺癌、结直肠癌、乳头状肾细胞癌、胃肠粘膜神经节细胞瘤病和宫颈癌。
21.权利要求20的方法,其中所述癌症是甲状腺髓样癌。
22.权利要求20的方法,其中所述肺癌是小细胞肺癌、非小细胞肺癌、细支气管肺细胞癌、RET融合肺癌或肺腺癌。
23.根据权利要求1至17任一项的化合物或其可药用盐,其用于疗法。
24.根据权利要求1至17任一项的化合物或其可药用盐,其用于治疗癌症。
25.权利要求24的用于治疗癌症的化合物或其可药用盐,其中所述癌症是RET相关癌症。
26.权利要求24或25的用于治疗癌症的化合物或其可药用盐,其中所述癌症选自:肺癌、乳头状甲状腺癌、甲状腺髓样癌、分化型甲状腺癌、复发性甲状腺癌、难治性分化型甲状腺癌、多发性内分泌腺瘤2A型或2B型(分别为MEN2A或MEN2B)、嗜铬细胞瘤、甲状旁腺增生、乳腺癌、结直肠癌、乳头状肾细胞癌、胃肠粘膜神经节细胞瘤病和宫颈癌。
27.权利要求26的用于治疗癌症的化合物或其可药用盐,其中所述癌症是甲状腺髓样癌。
28.权利要求26的用于治疗癌症的化合物或其可药用盐,其中所述肺癌是小细胞肺癌、非小细胞肺癌、细支气管肺细胞癌、RET融合肺癌或肺腺癌。
29.根据权利要求1至17任一项的化合物或其可药用盐用于制备用于治疗癌症的药物的用途。
30.一种药物组合物,其包含根据权利要求1至17任一项的化合物或其可药用盐以及一种或多种可药用载体、稀释剂或赋形剂。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063015933P | 2020-04-27 | 2020-04-27 | |
| US63/015933 | 2020-04-27 | ||
| PCT/US2021/028836 WO2021222017A1 (en) | 2020-04-27 | 2021-04-23 | Compounds useful for inhibiting ret kinase |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN115667253A true CN115667253A (zh) | 2023-01-31 |
Family
ID=75914595
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202180044981.8A Pending CN115667253A (zh) | 2020-04-27 | 2021-04-23 | 可用于抑制ret激酶的化合物 |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US11613533B2 (zh) |
| EP (1) | EP4143184A1 (zh) |
| JP (1) | JP7441972B2 (zh) |
| KR (1) | KR20230005301A (zh) |
| CN (1) | CN115667253A (zh) |
| AR (1) | AR121914A1 (zh) |
| AU (1) | AU2021263541B2 (zh) |
| BR (1) | BR112022021735A2 (zh) |
| CA (1) | CA3177080A1 (zh) |
| CL (1) | CL2022003000A1 (zh) |
| CO (1) | CO2022016013A2 (zh) |
| DO (1) | DOP2022000234A (zh) |
| EC (1) | ECSP22083926A (zh) |
| IL (1) | IL297551B2 (zh) |
| MX (1) | MX2022013482A (zh) |
| PE (1) | PE20230780A1 (zh) |
| TW (1) | TWI777509B (zh) |
| WO (1) | WO2021222017A1 (zh) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PE20231984A1 (es) * | 2020-11-06 | 2023-12-12 | Lilly Co Eli | Derivados de pirazol como inhibidores de la ret-cinasa |
| WO2024206858A1 (en) | 2023-03-30 | 2024-10-03 | Revolution Medicines, Inc. | Compositions for inducing ras gtp hydrolysis and uses thereof |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012019015A2 (en) * | 2010-08-04 | 2012-02-09 | Deciphera Pharmaceuticals, Llc | Methods and compositions for the treatment of myeloproliferative diseases and other proliferative diseases |
| CN105051027A (zh) * | 2013-03-15 | 2015-11-11 | 葛兰素史密斯克莱知识产权发展有限公司 | 作为转染期间重排(ret)激酶抑制剂的吡啶衍生物 |
| WO2017145050A1 (en) * | 2016-02-23 | 2017-08-31 | Glaxosmithkline Intellectual Property Development Limited | Pyridylpyridone derivative useful as a ret kinase inhibitor in the treatment of ibs and cancer |
| US20170267661A1 (en) * | 2016-03-17 | 2017-09-21 | Blueprint Medicines Corporation | Inhibitors of ret |
| CN110267960A (zh) * | 2017-01-18 | 2019-09-20 | 阿雷生物药品公司 | 作为RET激酶抑制剂的取代的吡唑并[1,5-a]吡嗪化合物 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112566907A (zh) * | 2018-08-17 | 2021-03-26 | 南京明德新药研发有限公司 | 作为ret抑制剂的吡唑衍生物 |
-
2021
- 2021-04-22 TW TW110114546A patent/TWI777509B/zh active
- 2021-04-22 AR ARP210101083A patent/AR121914A1/es unknown
- 2021-04-23 CA CA3177080A patent/CA3177080A1/en active Pending
- 2021-04-23 PE PE2022002489A patent/PE20230780A1/es unknown
- 2021-04-23 EP EP21725633.8A patent/EP4143184A1/en active Pending
- 2021-04-23 BR BR112022021735A patent/BR112022021735A2/pt unknown
- 2021-04-23 CN CN202180044981.8A patent/CN115667253A/zh active Pending
- 2021-04-23 WO PCT/US2021/028836 patent/WO2021222017A1/en active Application Filing
- 2021-04-23 IL IL297551A patent/IL297551B2/en unknown
- 2021-04-23 MX MX2022013482A patent/MX2022013482A/es unknown
- 2021-04-23 AU AU2021263541A patent/AU2021263541B2/en active Active
- 2021-04-23 JP JP2022565547A patent/JP7441972B2/ja active Active
- 2021-04-23 KR KR1020227041444A patent/KR20230005301A/ko active Search and Examination
- 2021-04-23 US US17/238,370 patent/US11613533B2/en active Active
-
2022
- 2022-10-27 EC ECSENADI202283926A patent/ECSP22083926A/es unknown
- 2022-10-27 DO DO2022000234A patent/DOP2022000234A/es unknown
- 2022-10-27 CL CL2022003000A patent/CL2022003000A1/es unknown
- 2022-11-09 CO CONC2022/0016013A patent/CO2022016013A2/es unknown
-
2023
- 2023-02-06 US US18/165,037 patent/US11964968B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012019015A2 (en) * | 2010-08-04 | 2012-02-09 | Deciphera Pharmaceuticals, Llc | Methods and compositions for the treatment of myeloproliferative diseases and other proliferative diseases |
| CN105051027A (zh) * | 2013-03-15 | 2015-11-11 | 葛兰素史密斯克莱知识产权发展有限公司 | 作为转染期间重排(ret)激酶抑制剂的吡啶衍生物 |
| WO2017145050A1 (en) * | 2016-02-23 | 2017-08-31 | Glaxosmithkline Intellectual Property Development Limited | Pyridylpyridone derivative useful as a ret kinase inhibitor in the treatment of ibs and cancer |
| US20170267661A1 (en) * | 2016-03-17 | 2017-09-21 | Blueprint Medicines Corporation | Inhibitors of ret |
| CN110267960A (zh) * | 2017-01-18 | 2019-09-20 | 阿雷生物药品公司 | 作为RET激酶抑制剂的取代的吡唑并[1,5-a]吡嗪化合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3177080A1 (en) | 2021-11-04 |
| EP4143184A1 (en) | 2023-03-08 |
| CO2022016013A2 (es) | 2022-11-18 |
| AU2021263541A1 (en) | 2022-11-24 |
| ECSP22083926A (es) | 2022-11-30 |
| AU2021263541B2 (en) | 2024-03-07 |
| WO2021222017A1 (en) | 2021-11-04 |
| DOP2022000234A (es) | 2022-11-30 |
| US11613533B2 (en) | 2023-03-28 |
| JP2023523315A (ja) | 2023-06-02 |
| CL2022003000A1 (es) | 2023-06-23 |
| IL297551B2 (en) | 2024-06-01 |
| KR20230005301A (ko) | 2023-01-09 |
| IL297551A (en) | 2022-12-01 |
| JP7441972B2 (ja) | 2024-03-01 |
| AR121914A1 (es) | 2022-07-20 |
| US11964968B2 (en) | 2024-04-23 |
| US20210363140A1 (en) | 2021-11-25 |
| TWI777509B (zh) | 2022-09-11 |
| US20230312544A1 (en) | 2023-10-05 |
| PE20230780A1 (es) | 2023-05-09 |
| BR112022021735A2 (pt) | 2022-12-06 |
| MX2022013482A (es) | 2022-11-16 |
| TW202206428A (zh) | 2022-02-16 |
| IL297551B1 (en) | 2024-02-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10035789B2 (en) | Compounds useful for treating disorders related to RET | |
| JP7426398B2 (ja) | Ras阻害剤としての新規イソインドリノン置換インドールおよび誘導体 | |
| WO2018017983A1 (en) | Compounds useful for treating disorders related to ret | |
| TW201738228A (zh) | Ret之抑制劑 | |
| KR20140093665A (ko) | Fgfr 키나제 조절제로서의 퀴놀린 | |
| WO2018028438A1 (zh) | 作为fgfr抑制剂的杂环化合物 | |
| KR20140096033A (ko) | 신규 화합물 | |
| KR20150027121A (ko) | 신규 화합물 | |
| US11964968B2 (en) | Compounds useful for inhibiting RET kinase | |
| TWI833819B (zh) | 用於治療與apj受體活性相關的病狀的化合物及組成物 | |
| JP2021532103A (ja) | 置換トリアゾロキノキサリン誘導体 | |
| AU2020218838B2 (en) | New N-benzyl-2-phenoxybenzamide derivatives as prostaglandin E2 (PGE2) receptors modulators | |
| JP7338072B2 (ja) | Retキナーゼ阻害剤としてのピラゾール誘導体 | |
| JP6920553B2 (ja) | Btk阻害剤化合物 | |
| TW202400148A (zh) | 作為trpa1抑制劑之吡啶酮化合物 | |
| WO2019218928A1 (zh) | 吲哚啉-1-甲酰胺类化合物、其制备方法及其在医药学上的应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |