CN114617974A - 一种多肽白蛋白纳米粒及其制备方法和应用 - Google Patents
一种多肽白蛋白纳米粒及其制备方法和应用 Download PDFInfo
- Publication number
- CN114617974A CN114617974A CN202111151600.4A CN202111151600A CN114617974A CN 114617974 A CN114617974 A CN 114617974A CN 202111151600 A CN202111151600 A CN 202111151600A CN 114617974 A CN114617974 A CN 114617974A
- Authority
- CN
- China
- Prior art keywords
- albumin
- polypeptide
- solution
- nanoparticles
- cationic amphiphilic
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 239000002105 nanoparticle Substances 0.000 title claims abstract description 169
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 152
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 147
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 147
- 102000009027 Albumins Human genes 0.000 title claims abstract description 114
- 108010088751 Albumins Proteins 0.000 title claims abstract description 114
- 238000002360 preparation method Methods 0.000 title claims abstract description 18
- 125000002091 cationic group Chemical group 0.000 claims abstract description 62
- 230000002209 hydrophobic effect Effects 0.000 claims abstract description 19
- 150000001768 cations Chemical class 0.000 claims abstract description 6
- 239000000243 solution Substances 0.000 claims description 66
- 108091006905 Human Serum Albumin Proteins 0.000 claims description 59
- 102000008100 Human Serum Albumin Human genes 0.000 claims description 59
- 238000002156 mixing Methods 0.000 claims description 30
- 229910001868 water Inorganic materials 0.000 claims description 28
- 238000000034 method Methods 0.000 claims description 18
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 18
- 239000003814 drug Substances 0.000 claims description 14
- 229940024606 amino acid Drugs 0.000 claims description 10
- 235000001014 amino acid Nutrition 0.000 claims description 10
- 150000001413 amino acids Chemical class 0.000 claims description 10
- 239000004475 Arginine Substances 0.000 claims description 8
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 claims description 8
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 8
- 239000007853 buffer solution Substances 0.000 claims description 8
- 150000002632 lipids Chemical class 0.000 claims description 7
- 239000008055 phosphate buffer solution Substances 0.000 claims description 7
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 6
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 claims description 6
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 claims description 6
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 claims description 6
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 claims description 6
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 claims description 5
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 5
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 5
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 claims description 5
- 229960000310 isoleucine Drugs 0.000 claims description 5
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 claims description 5
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 claims description 4
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 claims description 4
- 239000004472 Lysine Substances 0.000 claims description 4
- 230000000259 anti-tumor effect Effects 0.000 claims description 4
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 4
- 239000004474 valine Substances 0.000 claims description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 claims description 3
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 claims description 3
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 claims description 3
- 235000004279 alanine Nutrition 0.000 claims description 3
- 235000012000 cholesterol Nutrition 0.000 claims description 3
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 3
- 229930195729 fatty acid Natural products 0.000 claims description 3
- 239000000194 fatty acid Substances 0.000 claims description 3
- 150000004665 fatty acids Chemical class 0.000 claims description 3
- 229930182817 methionine Natural products 0.000 claims description 3
- MCHZKGNHFPNZDP-UHFFFAOYSA-N 2-aminoethane-1,1,1-triol;hydrochloride Chemical compound Cl.NCC(O)(O)O MCHZKGNHFPNZDP-UHFFFAOYSA-N 0.000 claims description 2
- 229940098773 bovine serum albumin Drugs 0.000 claims description 2
- 239000003085 diluting agent Substances 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 230000000694 effects Effects 0.000 abstract description 24
- 210000004881 tumor cell Anatomy 0.000 abstract description 21
- 230000008685 targeting Effects 0.000 abstract description 15
- 230000008961 swelling Effects 0.000 abstract description 11
- 230000005975 antitumor immune response Effects 0.000 abstract description 7
- 230000002949 hemolytic effect Effects 0.000 abstract description 7
- 230000001976 improved effect Effects 0.000 abstract description 7
- 231100000419 toxicity Toxicity 0.000 abstract description 7
- 230000001988 toxicity Effects 0.000 abstract description 7
- 230000022534 cell killing Effects 0.000 abstract description 2
- 230000002829 reductive effect Effects 0.000 abstract description 2
- 210000004027 cell Anatomy 0.000 description 48
- 206010028980 Neoplasm Diseases 0.000 description 37
- 239000002245 particle Substances 0.000 description 24
- 108010011110 polyarginine Proteins 0.000 description 22
- 229910021642 ultra pure water Inorganic materials 0.000 description 20
- 239000012498 ultrapure water Substances 0.000 description 20
- 229910052741 iridium Inorganic materials 0.000 description 17
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 17
- 241000699670 Mus sp. Species 0.000 description 16
- 239000000872 buffer Substances 0.000 description 12
- 238000009826 distribution Methods 0.000 description 11
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 150000001875 compounds Chemical class 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 210000003462 vein Anatomy 0.000 description 10
- 238000010586 diagram Methods 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 230000002147 killing effect Effects 0.000 description 9
- 230000002860 competitive effect Effects 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 7
- 238000007920 subcutaneous administration Methods 0.000 description 7
- 210000004443 dendritic cell Anatomy 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 238000010186 staining Methods 0.000 description 6
- 230000005909 tumor killing Effects 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- 206010018910 Haemolysis Diseases 0.000 description 5
- 210000001165 lymph node Anatomy 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 238000003917 TEM image Methods 0.000 description 4
- 239000002246 antineoplastic agent Substances 0.000 description 4
- 229940041181 antineoplastic drug Drugs 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 238000007385 chemical modification Methods 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- 238000002296 dynamic light scattering Methods 0.000 description 4
- 230000008030 elimination Effects 0.000 description 4
- 238000003379 elimination reaction Methods 0.000 description 4
- 230000008588 hemolysis Effects 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 239000011259 mixed solution Substances 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 230000004614 tumor growth Effects 0.000 description 4
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 3
- 108010036176 Melitten Proteins 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 3
- 230000005540 biological transmission Effects 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 210000004013 groin Anatomy 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 150000003904 phospholipids Chemical class 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000010254 subcutaneous injection Methods 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 241000024188 Andala Species 0.000 description 2
- 101800000245 Antibacterial peptide LL-37 Proteins 0.000 description 2
- 102400000669 Antibacterial peptide LL-37 Human genes 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 2
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 2
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 208000019065 cervical carcinoma Diseases 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000000502 dialysis Methods 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 229960001680 ibuprofen Drugs 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 229960004194 lidocaine Drugs 0.000 description 2
- 230000029226 lipidation Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- VDXZNPDIRNWWCW-JFTDCZMZSA-N melittin Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(N)=O)CC1=CNC2=CC=CC=C12 VDXZNPDIRNWWCW-JFTDCZMZSA-N 0.000 description 2
- 230000003606 oligomerizing effect Effects 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 108700042778 Antimicrobial Peptides Proteins 0.000 description 1
- 102000044503 Antimicrobial Peptides Human genes 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000000980 acid dye Substances 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000005809 anti-tumor immunity Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 230000008106 antitumoral immune reaction Effects 0.000 description 1
- QZPSXPBJTPJTSZ-UHFFFAOYSA-N aqua regia Chemical compound Cl.O[N+]([O-])=O QZPSXPBJTPJTSZ-UHFFFAOYSA-N 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000007664 blowing Methods 0.000 description 1
- 210000005252 bulbus oculi Anatomy 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 210000003617 erythrocyte membrane Anatomy 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000000695 excitation spectrum Methods 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 229920001427 mPEG Polymers 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 239000002091 nanocage Substances 0.000 description 1
- 239000002086 nanomaterial Substances 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 210000004882 non-tumor cell Anatomy 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 229960002895 phenylbutazone Drugs 0.000 description 1
- VYMDGNCVAMGZFE-UHFFFAOYSA-N phenylbutazonum Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=CC=C1 VYMDGNCVAMGZFE-UHFFFAOYSA-N 0.000 description 1
- IYDGMDWEHDFVQI-UHFFFAOYSA-N phosphoric acid;trioxotungsten Chemical compound O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.OP(O)(O)=O IYDGMDWEHDFVQI-UHFFFAOYSA-N 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 108010005636 polypeptide C Proteins 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/643—Albumins, e.g. HSA, BSA, ovalbumin or a Keyhole Limpet Hemocyanin [KHL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/645—Polycationic or polyanionic oligopeptides, polypeptides or polyamino acids, e.g. polylysine, polyarginine, polyglutamic acid or peptide TAT
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6927—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores
- A61K47/6929—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5169—Proteins, e.g. albumin, gelatin
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y40/00—Manufacture or treatment of nanostructures
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nanotechnology (AREA)
- Physics & Mathematics (AREA)
- Immunology (AREA)
- Optics & Photonics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- Inorganic Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Manufacturing & Machinery (AREA)
- Crystallography & Structural Chemistry (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明涉及一种多肽白蛋白纳米粒及其制备方法和应用。所述多肽白蛋白纳米粒由阳离子双亲性多肽和白蛋白组装形成。所述阳离子双亲性多肽的疏水部分与白蛋白结合,阳离子双亲性多肽所携带的正电荷能够和白蛋白表面的负电荷相互作用,从而使得阳离子双亲性多肽和白蛋白进行组装形成多肽白蛋白纳米粒,所述多肽白蛋白纳米粒中,阳离子双亲性多肽和白蛋白相互配合,提高了稳定性并降低了溶血毒性,具备高靶向性,同时能够诱导肿瘤细胞胀亡,诱发机体自身抗肿瘤免疫反应,从而实现了高靶向性、高效杀伤肿瘤细胞的效果。
Description
本申请要求申请号为202011455391.8专利申请的优先权(在先申请的申请日为2020年12月10日,发明名称为一种多肽白蛋白纳米粒及其制备方法和应用)。
技术领域
本发明属于生物医药技术领域,涉及一种多肽白蛋白纳米粒及其制备方法和应用。
背景技术
由碱性氨基酸和疏水性氨基酸组成的阳离子双亲性多肽,可以通过其阳离子(正电荷)和双亲性(亲水性和疏水性)特征与生物膜上的磷脂及糖类分子产生静电作用和疏水作用,发挥裂膜或穿膜杀伤的作用。
生物膜功能重要、结构均一且与遗传突变无关,许多研究认为基于裂膜或穿膜杀伤机制的药物并不会引起肿瘤的耐药性,并且肿瘤细胞表面相比正常细胞具有更多的负电荷,含有较多阳离子的双亲性多肽能对肿瘤细胞产生更高的选择性杀伤的效果,因此,阳离子双亲性多肽被认为在抗肿瘤药物领域具有广阔发展前景。然而,阳离子双亲性多肽容易引起溶血反应,并且存在体内动力学、靶向性以及毒副作用等方面的问题,限制了其应用于制备抗肿瘤药物。
目前阳离子双亲性多肽的成药优化方法主要包括化学修饰和采用载体系统。化学修饰如使用非天然的D型氨基酸替换L型氨基酸、多肽环化和保存侧链修改主肽链制备模拟肽等能够一定程度上抵抗酶的降解,然而不能解决安全性及肿瘤靶向性的问题,并且D型多肽的经济成本较高;聚乙二醇修饰(PEGylated)具有减少组织中的非特异性摄取、降低细胞毒性、增加血液半衰期和减少蛋白降解的优点,但降低了多肽的活性;脂类修饰被认为是阳离子双亲性多肽成药化最具优势的一种方法,脂化策略的细微变化,包括脂肪酸类型、脂锚位置或间隔插入等,均会对脂化肽的理化性质、生物活性和药代动力学产生深远的影响,然而设计脂化策略过程复杂,难度高。
采用载体系统改善阳离子双亲性多肽的稳定性、毒性、半衰期以及靶向性是另一种成药化策略。然而由于结构的相似性,一些同样由含疏水端和亲水端的单体组成的聚合物胶束或者脂质体可能会受到阳离子双亲性多肽的破坏,一定程度上增加了递送的难度。目前这类载体系统还停留在基础研究阶段,有研究者报道了二氧化硅纳米粒子作为载药体系负载抗菌肽LL-37,虽然通过将抗菌肽LL-37负载于二氧化硅纳米粒子提高了多肽对酶解的抵抗能力,但仍存在载药量低和溶血毒性等问题(Braun K,Pochert A,Lindén Mika,etal.Membrane interactions of mesoporous silica nanoparticles as carriers ofantimicrobial peptides[J].Journal of Colloid&Interface ence,2016,475:161-170.)。Huang等报道在阳离子双亲性多肽melittin的N端连接一条能够调控纳米结构的α-螺旋肽从而将melittin的阳离子深埋于脂质体的磷脂中,能在一定程度上屏蔽掉melittin的溶血效应,然而这种连接另一条多肽的方法会改变多肽的理化性质,适应范围也有待进一步验证(Huang C,Jin H,QianY,et al.Hybrid melittin cytolytic Peptide-drivenultrasmall lipid nanoparticles block melanoma growth in vivo.[J].Acs Nano,2013,7(7):5791-800.)。也有研究报道通过Au-S键将裂膜肽cTL连接到金纳米笼上,外层再修饰SH-mPEG,该纳米粒子被近红外光照射后溶血毒性明显提升,可使照射过和未照射过的肿瘤细胞均发生损伤,但这类金属载多肽系统存在着当光/近红外触发时对非肿瘤细胞具有细胞毒性的潜在风险,安全性需要进一步评估(Ji-Gang Piao,Dong Liu,Kan Hu,etal.Cooperative Nanoparticle System for Photothermal Tumor Treatment withoutSkin Damage[J].ACS Applied Materials&Interfaces,2016,8(4):acsami.5b11664.)。
综合上述,现有技术均存在载药体系不稳定、制备难度高、药物载体生物安全性存疑等问题,提供一种具有良好的生物安全性、稳定性、肿瘤靶向性以及肿瘤杀伤作用的阳离子双亲性多肽,用于阳离子膜活性抗肿瘤药物的制剂制备,助其实现药物体内递送和治疗应用,对于制备抗肿瘤药物领域具有重要意义。
发明内容
本发明提供一种多肽白蛋白纳米粒及其制备方法和应用,所述多肽白蛋白纳米粒具备较高的稳定性和靶向性,溶血毒副作用低,通过胀亡机制杀伤肿瘤细胞,同时诱发机体自身的抗肿瘤免疫反应,在制备抗肿瘤药物中具有广阔的发展前景。
为实现上述目的,本发明采用以下技术方案:
第一方面,本发明提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由阳离子双亲性多肽和白蛋白组装形成。
本发明中,所述阳离子双亲性多肽的疏水部分与白蛋白结合,阳离子双亲性多肽所携带的正电荷能够和白蛋白表面的负电荷相互作用,从而使得阳离子双亲性多肽和白蛋白进行组装形成多肽白蛋白纳米粒(组装示意图如图1所示)。通过组装形成多肽白蛋白纳米粒,将阳离子双亲性多肽包埋于白蛋白中,避免了阳离子双亲性多肽与降解酶和红细胞膜接触,从而提高了阳离子双亲性多肽的稳定性及安全性。
本发明中,多肽白蛋白纳米粒为纳米尺度,具有高渗透长滞留效应,其中的白蛋白会被肿瘤细胞主动吸收富集,因此具备高靶向性,同时其能够诱导肿瘤细胞胀亡,并诱发机体自身抗肿瘤免疫反应,从而实现了高靶向性、高效杀伤肿瘤细胞的效果。
优选地,所述阳离子双亲性多肽包括疏水部分和亲水部分。
优选地,所述亲水部分包括精氨酸(Arg,R)、赖氨酸(Lys,K)或组氨酸(His,H)中的任意一种或至少两种的组合,其中典型但非限制性的组合包括精氨酸和赖氨酸的组合、精氨酸和组氨酸的组合或精氨酸、赖氨酸和组氨酸的组合,优选为精氨酸。
优选地,所述疏水部分包括[Ir(ppy)2(H2O)2]OTf、疏水性氨基酸或脂类中的任意一种或至少两种的组合,其中典型但非限制性的组合包括[Ir(ppy)2(H2O)2]OTf和疏水性氨基酸的组合或疏水性氨基酸和脂类的组合。
优选地,所述疏水性氨基酸包括苯丙氨酸(Phe,F)、亮氨酸(Leu,F)、异亮氨酸(Ile,I)、色氨酸(Trp,W)、缬氨酸(Val,V)、甲硫氨酸(Met,M)或丙氨酸(Ala,A)中的任意一种或至少两种的组合,其中典型但非限制性的组合包括苯丙氨酸、亮氨酸、异亮氨酸和色氨酸的组合、苯丙氨酸、亮氨酸和色氨酸的组合或亮氨酸、异亮氨酸、色氨酸和缬氨酸的组合。
优选地,所述脂类包括胆固醇及其衍生物或脂肪酸及其衍生物中的任意一种或至少两种的组合。
优选地,所述阳离子双亲性多肽的结构式如式I或式II所示,其中,n为精氨酸残基的数目,为1~9的整数,包括但不限于2、3、5、6、7或8,优选为5~9,进一步优选为8。
本发明中,疏水性铱配体[Ir(ppy)2(H2O)2]OTf和亲水性寡聚精氨酸结合获得双亲性铱配位寡聚精氨酸多肽,所述双亲性铱配位寡聚精氨酸多肽能以静电作用和疏水作用与生物膜上的磷脂及糖类分子发生吸附,发挥裂膜或者穿膜杀伤的作用,提高了抑制肿瘤细胞活性的能力。
优选地,所述阳离子双亲性多肽的一级结构为CH3CO-XRn-CONH2或脂类-Rn-CONH2,其中,X包括Phe、Leu、Ile、Trp、Val、Met或Ala中的任意一种或至少两种的组合,n为精氨酸残基的数目,为1~12的整数,包括但不限于2、3、5、6、8、9或11,优选为3~9,进一步优选为5~9,更进一步优选为8。
优选地,X包括Phe、Leu、Ile、Trp、Val、Met和Ala各1~5个,包括但不限于2、3或4个,优选为Phe、Leu、Ile和Trp各1~5个。
优选地,所述阳离子双亲性多肽的一级结构为CH3CO-FWLFLRRRRRRRR-CONH2或chol-RRRRRRRR-CONH2,chol为胆固醇。
优选地,所述白蛋白包括哺乳动物白蛋白。
优选地,所述哺乳动物白蛋白包括人血清白蛋白(Human Serum Albumin,HSA)和/或牛血清白蛋白。
第二方面,本发明提供一种第一方面所述的多肽白蛋白纳米粒的制备方法,所述制备方法包括:
分别配制阳离子双亲性多肽溶液和白蛋白溶液,按摩尔比将所述阳离子双亲性多肽溶液和白蛋白溶液混合,得到所述多肽白蛋白纳米粒。
优选地,所述阳离子双亲性多肽溶液的浓度为20~5000μM,包括但不限于30μM、40μM、50μM、60μM、100μM、200μM、500μM、1000μM、2000μM、3000μM、3500μM、4000μM、4200μM、4400μM、4800μM或4900μM。
优选地,所述白蛋白溶液的浓度为20~5000μM,包括但不限于30μM、40μM、50μM、60μM、100μM、200μM、500μM、1000μM、2000μM、3000μM、3500μM、4000μM、4200μM、4400μM、4800μM或4900μM。
优选地,所述阳离子双亲性多肽溶液中阳离子双亲性多肽和所述白蛋白溶液中白蛋白的摩尔比为(0.1~10):1,包括但不限于0.2:1、0.8:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1或9:1。
优选地,所述混合的温度为5~100℃,包括但不限于6℃、7℃、9℃、10℃、15℃、30℃、40℃、50℃、70℃、80℃、85℃、90℃、92℃、94℃、或98℃。
优选地,所述混合的时间为0.5~120min,包括但不限于0.6min、0.7min、0.9min、1.5min、2min、5min、10min、20min、30min、50min、60min、80min、90min、100min、110min或115min。
作为优选的技术方案,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)将阳离子双亲性多肽加入到水、40~60mM三羟甲基氨基甲烷盐酸盐缓冲液或10~20mM磷酸盐缓冲液中,获得20~5000μM阳离子双亲性多肽溶液;将白蛋白加入到水或10~20mM磷酸盐缓冲液中,获得20~5000μM白蛋白溶液;
(2)按阳离子双亲性多肽和白蛋白的摩尔比为(0.1~10):1将阳离子双亲性多肽溶液和白蛋白溶液混合,加入水或磷酸盐缓冲液,于5~100℃混合0.5~120min,得到所述多肽白蛋白纳米粒。
本发明中,在常压条件下简单混合阳离子双亲性多肽溶液和白蛋白溶液即可得到所述多肽白蛋白纳米粒,不需要额外的化学修饰,成本低,且具备良好的可重复性。
第三方面,本发明提供一种药物组合物,所述药物组合物包括第一方面所述的多肽白蛋白纳米粒。
优选地,所述药物组合物还包括药学上可接受的载体、赋形剂或稀释剂中的任意一种或至少两种的组合。
第四方面,本发明提供第一方面所述的多肽白蛋白纳米粒或第三方面所述的药物组合物在制备抗肿瘤药物中的应用。
与现有技术相比,本发明具有以下有益效果:
(1)本发明中,所述阳离子双亲性多肽的疏水部分与白蛋白结合,阳离子双亲性多肽所携带的正电荷能够和白蛋白表面的负电荷相互作用,从而使得阳离子双亲性多肽和白蛋白进行组装形成多肽白蛋白纳米粒,所述多肽白蛋白纳米粒中,阳离子双亲性多肽和白蛋白相互配合,提高了稳定性并降低了溶血毒性,具备高靶向性,同时能够诱导肿瘤细胞胀亡,诱发机体自身抗肿瘤免疫反应,从而实现了高靶向性、高效杀伤肿瘤细胞的效果;
(2)本发明的多肽白蛋白纳米粒能够有效抑制酶降解,在血液中的消除半衰期长,具备较高的稳定性;溶血作用低,安全性高;能够使肿瘤细胞肿胀并吐出胞内容物,具有诱发胀亡的杀伤肿瘤机制;能够有效在肿瘤部位蓄积,具备高靶向性;能够促进淋巴结的树突状细胞成熟,增加T细胞(CD8+),诱导机体自身抗肿瘤免疫反应;
(3)本发明中,在常压条件下简单混合阳离子双亲性多肽溶液和白蛋白溶液即可得到所述多肽白蛋白纳米粒,不需要额外的化学修饰,成本低,且具备良好的可重复性。
附图说明
图1为本发明多肽白蛋白纳米粒的组装示意图,其中i)为多肽结合白蛋白模型,ii)为多肽白蛋白复合物表面静电展示模型,iii)、iv)为多肽白蛋白复合物组装成纳米粒;
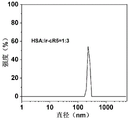
图2为Ir-cR8-HSA纳米粒的水合粒径分布图;
图3为Ir-cR5-HSA纳米粒的水合粒径分布图;
图4为Ir-aR8-HSA纳米粒的水合粒径分布图;
图5为FR-HSA纳米粒的水合粒径分布图;
图6为CR-HSA纳米粒的水合粒径分布图;
图7为Ir-cr8-HSA纳米粒的水合粒径分布图;
图8为Ir-mK8-HSA纳米粒的水合粒径分布图;
图9为Ir-cK8-HSA纳米粒的水合粒径分布图;
图10为Ir-cR8-HSA纳米粒的透射电镜图;
图11为Ir-cR5-HSA纳米粒的透射电镜图;
图12为Ir-aR8-HSA纳米粒的透射电镜图;
图13为FR-HSA纳米粒的透射电镜图;
图14为CR-HSA纳米粒的透射电镜图;
图15为阳离子双亲性多肽的电荷数及阳离子双亲性多肽和白蛋白的比例对多肽白蛋白纳米粒组装的影响图;
图16为有无竞争化合物下Ir-cR8与白蛋白组装的水合粒径分布图;
图17为Ir-cR8及Ir-cR8-HSA纳米粒对4T1细胞的活性抑制作用图;
图18为Ir-cR5及Ir-cR5-HSA纳米粒对4T1细胞的活性抑制作用图;
图19为Ir-aR8及Ir-aR8-HSA纳米粒对4T1细胞的活性抑制作用图;
图20为Ir-cR8及Ir-cR8-HSA纳米粒孵育的4T1细胞胀亡图;
图21为Ir-cR5-HSA纳米粒孵育的4T1细胞胀亡图;
图22为Ir-aR8-HSA纳米粒孵育的4T1细胞胀亡图;
图23为Ir-cR8及Ir-cR8-HSA纳米粒在不同pH下的释放曲线图;
图24为Ir-cR8及Ir-cR8-HSA纳米粒的血清稳定性图;
图25为不同时间点Ir-cR8及Ir-cR8-HSA纳米粒在血液中的浓度图;
图26为Ir-cR8及Ir-cR8-HSA纳米粒的溶血毒性图;
图27为尾静脉注射Ir-cR8及Ir-cR8-HSA纳米粒24小时后在小鼠体内的组织分布图;
图28为尾静脉注射PBS、HSA、Ir-cR8及Ir-cR8-HSA纳米粒对小鼠树突状细胞的促成熟率图;
图29为肿瘤组织中T细胞的比例图;
图30为各实验组肿瘤生长曲线图;
图31为第22天各实验组的肿瘤大小及Ir-cR8-HSA纳米粒组的小鼠照片图,圆圈代表小鼠之前已死亡,方框代表无肿瘤;
图32为再次接种肿瘤细胞后小鼠肿瘤的生长曲线图;
图33为再次接种肿瘤细胞后第30天小鼠照片图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由铱配位寡聚精氨酸多肽和人血清白蛋白(HSA)组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)于37℃,按摩尔比为1:1将寡聚精氨酸多肽与[Ir(ppy)2(H2O)2]OTf在50mM的三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl)中混合12h,获得铱配位寡聚精氨酸多肽(Ir-cR8),如式Ⅲ所示;
(2)将Ir-cR8加入到超纯水中,得到500μM的Ir-cR8溶液,取人血清白蛋白,将其用水溶解并制备成同浓度的人血清白蛋白溶液;
(3)按照摩尔比为1:1为将Ir-cR8溶液和人血清白蛋白溶液混合,加入等体积的磷酸盐缓冲液(1×PBS),室温下混合2h,再加入1倍当前体积的1×PBS,获得Ir-cR8-HSA纳米粒。
实施例2
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由铱配位寡聚精氨酸多肽和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
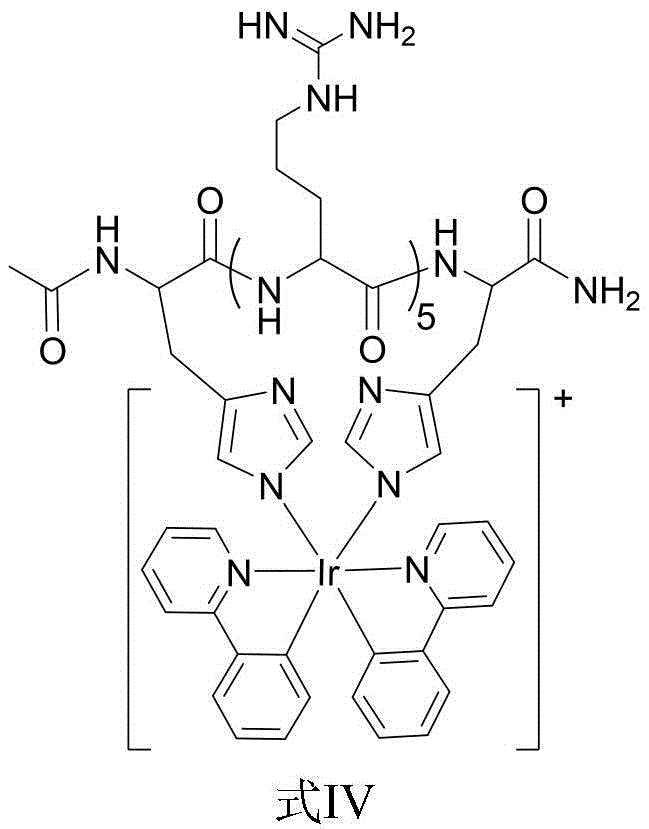
(1)于37℃,按摩尔比为1:1将寡聚精氨酸多肽与[Ir(ppy)2(H2O)2]OTf在50mM的三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl)中混合12h,获得铱配位寡聚精氨酸多肽(Ir-cR5),如式Ⅳ所示;
(2)将Ir-cR5加入到超纯水中,得到500μM的Ir-cR5溶液,取人血清白蛋白,将其用水溶解并制备成同浓度的人血清白蛋白溶液;
(3)按照摩尔比为3:1为将Ir-cR5溶液和人血清白蛋白溶液混合,加入等体积的超纯水,室温下混合2h,再加入1倍当前体积的1×PBS,获得Ir-cR5-HSA纳米粒。
实施例3
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由铱配位寡聚精氨酸多肽和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)于37℃,按摩尔比为1:1将寡聚精氨酸多肽与[Ir(ppy)2(H2O)2]OTf在50mM的三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl)中混合12h,获得铱配位寡聚精氨酸多肽(Ir-aR8),如式V所示;
(2)将Ir-aR8加入到超纯水中,得到500μM的Ir-aR8溶液,取人血清白蛋白,将其用超纯水溶解并制备成同浓度的人血清白蛋白溶液;
(3)按照摩尔比为2:1为将Ir-aR8溶液和人血清白蛋白溶液混合,加入等体积的超纯水,室温下混合2h,再加入1倍当前体积的1×PBS,获得Ir-aR8-HSA纳米粒。
实施例4
本实施提例供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由CH3CO-FWLFLRRRRRRRR-CONH2(FR)和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)将FR加入到超纯水中,得到500μM的FR溶液,取人血清白蛋白,将其用超纯水溶解并制备成同浓度的人血清白蛋白溶液;
(2)按照摩尔比为1:1为将FR溶液和人血清白蛋白溶液混合,加入等体积的超纯水,50℃水浴1min,逐滴加入1×PBS至澄清,再加入1倍当前体积的超纯水,获得FR-HSA纳米粒。
实施例5
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由chol-RRRRRRRR-CONH2(CR)和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)将CR加入到超纯水中,得到500μM的CR溶液,取人血清白蛋白,将其用超纯水溶解并制备成同浓度的人血清白蛋白溶液;
(2)按照摩尔比为2:1为将CR溶液和人血清白蛋白溶液混合,加入等体积的超纯水,50℃水浴1min,逐滴加入1×PBS至澄清,再加入1倍当前体积的超纯水,获得CR-HSA纳米粒。
实施例6
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由铱配位寡聚精氨酸多肽和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)于37℃,按摩尔比为1:1将寡聚精氨酸(D型)多肽CH3CO-hrrrrrrrrh-CONH2与[Ir(ppy)2(H2O)2]OTf在50mM的三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl)中混合2h,获得铱配位寡聚精氨酸多肽(Ir-cr8),如式VI所示;
(2)将Ir-cr8加入到超纯水中,得到500μM的Ir-cr8溶液,取人血清白蛋白,将其用水溶解并制备成同浓度的人血清白蛋白溶液;
(3)按照摩尔比为1:1为将Ir-cr8溶液和人血清白蛋白溶液混合,加入等体积的超纯水,室温下混合2h,再加入1倍当前体积的1×PBS,获得Ir-cr8-HSA纳米粒。
实施例7
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由铱配位寡聚多肽和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)于37℃,按摩尔比为1:1将寡聚多肽CH3CO-KKKKHHKKKK-CONH2与[Ir(ppy)2(H2O)2]OTf在50mM的三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl)中混合2h,获得铱配位寡聚精氨酸多肽(Ir-mK8),如式Ⅶ所示;
(2)将Ir-mK8加入到超纯水中,得到500μM的Ir-mK8溶液,取人血清白蛋白,将其用水溶解并制备成同浓度的人血清白蛋白溶液;
(3)按照摩尔比为1:1为将Ir-mK8溶液和人血清白蛋白溶液混合,加入等体积的超纯水,室温下混合60min,再加入1倍当前体积的1×PBS,获得Ir-mK8-HSA纳米粒。
实施例8
本实施例提供一种多肽白蛋白纳米粒,所述多肽白蛋白纳米粒由铱配位寡聚多肽和人血清白蛋白组装形成,所述多肽白蛋白纳米粒的制备方法包括以下步骤:
(1)于37℃,按摩尔比为1:1将寡聚多肽CH3CO-HKKKKKKKKH-CONH2与[Ir(ppy)2(H2O)2]OTf在50mM的三羟甲基氨基甲烷盐酸盐缓冲液(Tris-HCl)中混合2h,获得铱配位寡聚精氨酸多肽(Ir-cK8),如式Ⅷ所示;
(2)将Ir-cK8加入到超纯水中,得到500μM的Ir-cK8溶液,取人血清白蛋白,将其用水溶解并制备成同浓度的人血清白蛋白溶液;
(3)按照摩尔比为1:1为将Ir-cK8溶液和人血清白蛋白溶液混合,加入等体积的超纯水,室温下混合60min,再加入1倍当前体积的1×PBS,获得Ir-cK8-HSA纳米粒。
试验例1
本试验例使用动态光散射仪和透射电镜检测实施例1-8制备的多肽白蛋白纳米粒的粒径。
使用1×PBS分别将Ir-cR8-HSA纳米粒、Ir-cR5-HSA纳米粒、Ir-aR8-HSA纳米粒、Ir-cr8-HSA纳米粒、Ir-mK8-HSA纳米粒和Ir-cK8-HSA纳米粒稀释至10μM,将FR-HSA纳米粒和CR-HSA纳米粒稀释至20μM,于25℃使用动态光散射仪进行检测,只计算所形成多肽白蛋白纳米粒的峰,结果如图2-图9所示。
由图2-图9可知,Ir-cR8-HSA纳米粒的平均水合粒径为155.6nm,Ir-cR5-HSA纳米粒的平均水合粒径为240.6nm,Ir-aR8-HSA纳米粒的平均水合粒径为258.7nm,Ir-cr8-HSA纳米粒的平均水合粒径为144.9nm,Ir-mK8-HSA纳米粒的平均水合粒径为266.5nm,Ir-cK8-HSA纳米粒的平均水合粒径为322.4nm,FR-HSA纳米粒的平均水合粒径为396.1nm,CR-HSA纳米粒的平均水合粒径为295.3nm。
使用1×PBS分别将Ir-cR8-HSA纳米粒、Ir-cR5-HSA纳米粒、Ir-aR8-HSA纳米粒、FR-HSA纳米粒和CR-HSA纳米粒稀释至500μM,分别滴于300目的碳支持膜上,待液滴将干未干时再滴加一滴3%的磷钨酸染液负染1~2min,吸去染液,用水清洗3遍,晾干,使用透射电镜分析,结果如图10-图14所示。
由图10-图14可知Ir-cR8-HSA纳米粒的粒径分布于40~100nm之间,Ir-cR5-HSA纳米粒的粒径分布于50~200nm之间,Ir-aR8-HSA纳米粒的粒径分布于40~200nm之间,FR-HSA纳米粒的粒径分布于40~400nm之间,CR-HSA纳米粒的粒径分布于40~400nm之间。
试验例2
本试验例考察阳离子双亲性多肽的电荷数以及阳离子双亲性多肽和人血清白蛋白的比例对多肽白蛋白纳米粒组装的影响。
分别取Ir-cR3(如式Ⅸ所示)、Ir-cR5和Ir-cR8与人血清白蛋白按照摩尔比为2:1、1:1、1:2和1:3混合,人血清白蛋白的终浓度为10μM,使用动态光散射仪检测多肽白蛋白混合溶液的水和粒径分布情况,结果如图15所示,可知阳离子双亲性多肽亲水部分正电荷数量越多(精氨酸个数越多),白蛋白比例越小,阳离子双亲性多肽与白蛋白越容易组装成多肽白蛋白纳米粒。
试验例3
本试验例检测铱配位寡聚精氨酸多肽对肿瘤细胞活性的抑制能力。
取人宫颈癌细胞Hela细胞,将其用含10%胎牛血清的DMEM培养基分散后铺至96孔板,每孔8000个细胞,待细胞贴壁后加入2、4、8、16、32、64和128μM的Ir-cR5、Ir-cR8和Ir-aR8以及相应的寡聚精氨酸多肽cR5、cR8和aR8,孵育24h,采用噻唑蓝法检测细胞活性,并计算半数抑制浓度(IC50),结果如表1所示,铱配位寡聚精氨酸多肽的半数抑制浓度(IC50)相比于配位前的寡聚精氨酸多肽显著减小,对Hela细胞的杀伤毒性明显提升。
表1
| 实验组 | IC<sub>50</sub>(μM) |
| Ir-cR5 | 23.5 |
| Ir-cR8 | 7.3 |
| Ir-aR8 | 7.3 |
| cR5 | >100 |
| cR8 | >100 |
| aR8 | >100 |
试验例4
人血清白蛋白是一条单链多肽,可分为AB两个亚结构域,每个亚结构域进一步还可分为Ⅰ、Ⅱ、Ⅲ三个区域。它具有3种主要的药物结合位点,分别为位于ⅡA的药物结合位点1(也称为Sudlow位点1)、位于ⅢA的药物结合位点2(也称Sudlow位点2)以及位于ⅠB的药物结合位点3。本试验例检测Ir-cR8在人血清白蛋白上的结合位置。制备10μM人血清白蛋白的水溶液以及10μM人血清白蛋白与人血清白蛋白的药物结合位点1、2、3的竞争化合物保泰松、布洛芬和利多卡因的混合溶液,混合5分钟后分别加入0、2、4、6、8、和10μM的Ir-cR8,用280nm的光激发,扫描其在300~450nm的激发光谱,根据公式(1)计算Ir-cR8在有无竞争化合物存在下与白蛋白的结合常数及结合位点数:
lg(FO-F)/F==lgKa+nlgc (1)
其中F0表示未添加竞争化合物时体系的荧光强度,F表示添加竞争化合物时体系的荧光强度,Ka为结合常数,c为淬灭剂浓度,n为结合位点数。
结果如表2所示,可知Ir-cR8在人血清白蛋白上的结合位点数为1,主要结合在位点1。
表2
| 竞争化合物 | 结合常数Kb(L/mol) | 结合位点(n) |
| \ | 1.33×10<sup>6</sup> | 1.19 |
| 保泰松 | 1.09×10<sup>6</sup> | 1.18 |
| 布洛芬 | 1.69×10<sup>6</sup> | 1.22 |
| 利多卡因 | 1.35×10<sup>6</sup> | 1.20 |
为了进一步验证上述结论,将10μM人血清白蛋白与各位点竞争化合物以1:4的摩尔比混合,然后加入10μM的Ir-cR8,以等浓度未加竞争化合物时的人血清白蛋白与Ir-cR8的混合溶液作为对照,采用动态光散射仪检测各竞争化合物存在条件下及无竞争化合物时的多肽白蛋白纳米粒组装情况,结果如图16所示,进一步验证了Ir-cR8在人血清白蛋白上的主要结合位点为位点1。
试验例5
本试验例对Ir-cR8-HSA纳米粒、Ir-cR5-HSA纳米粒和Ir-aR8-HSA纳米粒的肿瘤杀伤能力和杀伤机制进行研究。
取小鼠乳腺癌细胞4T1,用含10%胎牛血清的DMEM培养基分散后铺至96孔板,每孔8000个细胞,待细胞贴壁后分别加入2、4、8、16、32、64、128μM的Ir-cR8-HSA纳米粒、Ir-cR5-HSA纳米粒和Ir-aR8-HSA纳米粒和Ir-cR8、Ir-cR5和Ir-aR8,孵育24h,采用噻唑蓝法检测细胞活性,结果如图17-图19所示,可知,Ir-cR8及Ir-cR8-HSA纳米粒的半数抑制浓度分别为10.1μM和13.9μM,Ir-cR5及Ir-cR5-HSA纳米粒的半数抑制浓度分别为25.45μM和29.64μM,Ir-aR8及Ir-aR8-HSA纳米粒的半数抑制浓度分别为13.16μM和16.20μM,表明将阳离子双亲性多肽制备成多肽白蛋白纳米粒后对肿瘤细胞的杀伤活性并没有受到显著的影响。
取玻片直径15mm的玻底皿,加入3×105个4T1细胞,待其贴壁后,分别加入1mL半数抑制浓度Ir-cR8-HSA纳米粒、Ir-cR5-HSA纳米粒、Ir-aR8-HSA纳米粒和Ir-cR8(均含5μg/mL的碘化丙啶),于405nm及561nm激发激光共聚焦,观察细胞的死亡过程,结果如图20-图22所示,肿瘤细胞表现为细胞肿胀并吐出胞内容物,表明多肽白蛋白纳米粒具有诱发胀亡的杀伤肿瘤机制。
试验例6
本试验例对Ir-cR8-HSA纳米粒的稳定性和安全性进行分析。
取500μL的Ir-cR8及Ir-cR8-HSA纳米粒(200μM),分别置于8000~14000D分子量的透析袋中,将透析袋置于15mL的离心管中,每个离心管中分别加入5mLpH为5.0、6.5和7.4的PBS缓冲液,将离心管放置于37℃、200rpm的恒温振荡器中,分别在1h、2h、4h、6h、16h和24h取出500μL缓冲液并补充500μL新鲜的缓冲液于离心管中,于328nm波长激发检测所取的缓冲液在350~550nm的发射光谱,根据Ir-cR8在缓冲液中的荧光标曲定量缓冲液中的Ir-cR8浓度,结果如图23所示,可知Ir-cR8-HSA纳米粒中的Ir-cR8相比于游离Ir-cR8更不易释放出来。
将100μL Ir-cR8和Ir-cR8-HSA纳米粒(160μM)分别与900μL含10%胎牛血清的PBS溶液混合孵育2、4、16和24h,将孵育后的混合溶液加入铺好4T1细胞的96孔板中,孵育24h,加入噻唑蓝检测细胞抑制活性,与未经血清处理过的Ir-cR8和Ir-cR8-HSA纳米粒的细胞抑制活性比较,结果如图24所示,Ir-cR8-HSA纳米粒保留了87.05%的细胞抑制活性,而Ir-cR8仅剩余42.74%的细胞抑制活性,表明通过制备多肽白蛋白纳米粒,能够抑制血清中各种酶对阳离子双亲性多肽的降解,有利于阳离子双亲性多肽在体内的循环。
取36只Bal b/c小鼠,均分为2组,尾静脉分别注射500μM的Ir-cR8及其Ir-cR8-HSA纳米粒各100μL,分别于0.5h、2h、4h、8h、24h和48h摘眼球取血,10000rpm离心10min,取100μL离心后的血清,加入1mL高氯酸和3mL王水,260℃消解2h,加水至10mL,使用ICP-MASS检测各时间点血液中金属铱的含量,结果如图25所示,结果表明Ir-cR8在血液中的消除半衰期小于0.5h,而Ir-cR8-HSA纳米粒在血液中的消除半衰期为12.75h,Ir-cR8-HSA纳米粒在血液中的循环时间明显提升。
取1mL小鼠血液,加入1mLPBS,吹打均匀后于1000rpm离心5min,重复上述步骤,弃掉PBS,加入52.5mL新鲜的PBS,设置空白对照组(140μLPBS/孔),阴性对照组(70μL红细胞悬液+70μL PBS/孔),阳性对照组(70μL红细胞的纯水裂解液+70μL纯水/孔),实验组(70μLIr-cR8或Ir-cR8-HSA纳米粒+70μL红细胞悬液),于37℃、87rpm振荡2h,3000rpm离心5min,取90μL上清检测其在405nm处的吸收值,结果如图26所示,Ir-cR8在浓度为78.125μM时造成52.87%的溶血,而Ir-cR8-HSA纳米粒在浓度为625μM时只造成15.70%的溶血,表明将阳离子双亲性多肽制备成多肽白蛋白纳米粒能够明显降低多肽本身的溶血作用,提高了生物安全性。
试验例7
本试验例对Ir-cR8-HSA纳米粒的肿瘤靶向性和激发机体自身抗肿瘤免疫反应的效果进行研究。
在Bal b/c小鼠腹股沟处皮下注射106个4T1细胞,构建Bal b/c小鼠皮下瘤模型,待肿瘤体积(体积=L×D2/2,L为肿瘤长度,D为肿瘤宽度)达到100mm3,尾静脉各注射100μL500μM的Ir-cR8和Ir-cR8-HSA纳米粒,24h后处死小鼠,分别取心、肝、脾、肺、肾和肿瘤,称重后剪碎加入1mLPBS匀浆破碎,10000rpm离心10分钟,取上清用328nm波长激发,测各样品在502nm处的荧光发射强度,根据Ir-cR8和Ir-cR8-HSA纳米粒的PBS溶液在同样激发条件下的502nm处的荧光发射强度计算各组织上清液中Ir-cR8和Ir-cR8-HSA纳米粒的浓度。结果如图27所示,Ir-cR8-HSA纳米粒在肿瘤部位的浓度为12.19μg/g,Ir-cR8在肿瘤部位的浓度为4.14μg/g,尾静脉注射24h后Ir-cR8-HSA纳米粒在肿瘤部位的蓄积量约为Ir-cR8的3倍,表明Ir-cR8-HSA纳米粒相比Ir-cR8在肿瘤部位具有更好的蓄积作用,具备高靶向性。
在Bal b/c小鼠腹股沟处皮下注射106个4T1细胞,构建Bal b/c小鼠皮下瘤模型,待肿瘤体积(体积=长*宽^2/2)达到100mm3,连续4天各尾静脉注射100μL 500μM的HSA、Ir-cR8、Ir-cR8-HSA纳米粒,尾静脉注射同样体积的PBS作为对照。在给药后的第5天,取肿瘤侧的腹股沟淋巴结,分散成单个细胞,过70μm滤器,于4℃用抗小鼠CD11c-FITC、CD80-PE和CD86-APC的抗体在细胞染色缓冲液中染色15min,再用细胞染色缓冲液洗3遍,用500μL细胞染色缓冲液重悬,使用流式细胞仪检测,结果如图28所示,Ir-cR8-HSA纳米粒能够在肿瘤处蓄积,其通过胀亡杀伤肿瘤细胞使得附近腹股沟淋巴结的树突状细胞(Dendritic Cells,DC)摄取肿瘤相关抗原并成熟得更多。
在Bal b/c小鼠腹股沟处皮下注射106个4T1细胞,构建Bal b/c小鼠皮下瘤模型,待肿瘤体积(体积=长*宽^2/2)达到100mm3,连续4天分别尾静脉注射100μL 500μM的HSA、Ir-cR8和Ir-cR8-HSA纳米粒,尾静脉注射同样体积的PBS作为对照。在给药后的第7天,取肿瘤,分散成单个细胞,过70μm滤器,于4℃用抗小鼠CD3-FITC、CD4-Percp-Cy5.5和CD8a-APC的抗体在细胞染色缓冲液中染色15min,并用细胞染色缓冲液洗3遍,用500μL的细胞染色缓冲液重悬,采用流式细胞仪检测。结果如图29所示,由于Ir-cR8-HSA纳米粒促进了腹股沟淋巴结中树突状细胞的成熟及肿瘤部位死亡的肿瘤细胞碎片,使得肿瘤部位细胞毒T细胞(CD8+)显著增加,抗肿瘤免疫进一步增强。
取6周的成年雌性Bal b/c小白鼠,在其背部皮下种植106个4T1细胞构建皮下瘤小鼠模型,待肿瘤体积达到50~60mm3时将小鼠分为4组,每组5只,分别连续4天尾静脉注射PBS以及500μM的HSA、Ir-cR8和Ir-cR8-HSA纳米粒各100μL,观察各小鼠肿瘤的生长情况,结果如图30和图31所示,Ir-cR8-HSA纳米粒组具有良好的肿瘤抑制效果,能够使小鼠的肿瘤完全消退,而其他组则无法有效地抑制肿瘤的生长。
取第一次皮下瘤已消除的Ir-cR8-HSA纳米粒组小鼠5只,再次在另一边皮下接种8×105个4T1细胞,取年龄相同的未受任何处理的小鼠5只作为对照组(未治疗),同样在皮下接种8×105个4T1细胞,观察两组的肿瘤生长情况,结果如图32和图33所示,已接受过Ir-cR8-HSA纳米粒治疗的小鼠对肿瘤形成了抗肿瘤免疫记忆,不易再受到肿瘤的二次侵害,表明本发明的多肽白蛋白纳米粒能够能诱导机体自身抗肿瘤免疫反应。
综上所述,本发明的多肽白蛋白纳米粒能够有效抑制酶降解,在血液中的消除半衰期长,具备较高的稳定性;溶血作用低,安全性高;能够使肿瘤细胞肿胀并吐出胞内容物,具有诱发胀亡的杀伤肿瘤机制;能够有效在肿瘤部位蓄积,具备高靶向性;能够促进淋巴结的树突状细胞成熟,增加T细胞(CD8+),诱导机体自身抗肿瘤免疫反应。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
Claims (10)
1.一种多肽白蛋白纳米粒,其特征在于,所述多肽白蛋白纳米粒由阳离子双亲性多肽和白蛋白组装形成。
2.根据权利要求1所述的多肽白蛋白纳米粒,其特征在于,所述阳离子双亲性多肽包括疏水部分和亲水部分;
优选地,所述亲水部分包括精氨酸、赖氨酸或组氨酸中的任意一种或至少两种的组合,优选为精氨酸;
优选地,所述疏水部分包括[Ir(ppy)2(H2O)2]OTf、疏水性氨基酸或脂类中的任意一种或至少两种的组合;
优选地,所述疏水性氨基酸包括苯丙氨酸、亮氨酸、异亮氨酸、色氨酸、缬氨酸、甲硫氨酸或丙氨酸中的任意一种或至少两种的组合;
优选地,所述脂类包括胆固醇及其衍生物或脂肪酸及其衍生物中的任意一种或至少两种的组合;
优选地,所述阳离子双亲性多肽的结构式如式I或式II所示;
其中,n为精氨酸残基的数目,为1~9的整数;
优选地,所述阳离子双亲性多肽的一级结构为CH3CO-XRn-CONH2或脂类-Rn-CONH2;
其中,X包括苯丙氨酸、亮氨酸、异亮氨酸、色氨酸、缬氨酸、甲硫氨酸或丙氨酸中的任意一种或至少两种的组合,n为精氨酸残基的数目,为1~12的整数。
3.根据权利要求1或2所述的多肽白蛋白纳米粒,其特征在于,所述白蛋白包括哺乳动物白蛋白;
优选地,所述哺乳动物白蛋白包括人血清白蛋白和/或牛血清白蛋白。
4.一种权利要求1-3任一项所述的多肽白蛋白纳米粒的制备方法,其特征在于,所述制备方法包括:
分别配制阳离子双亲性多肽溶液和白蛋白溶液,将所述阳离子双亲性多肽溶液和白蛋白溶液混合,得到所述多肽白蛋白纳米粒。
5.根据权利要求4所述的制备方法,其特征在于,所述阳离子双亲性多肽溶液的浓度为20~5000μM;
优选地,所述白蛋白溶液的浓度为20~5000μM。
6.根据权利要求4或5所述的制备方法,其特征在于,所述阳离子双亲性多肽和所述白蛋白的摩尔比为(0.1~10):1。
7.根据权利要求4-6任一项所述的制备方法,其特征在于,所述混合的温度为5~100℃;
优选地,所述混合的时间为0.5~120min。
8.根据权利要求4-7任一项所述的制备方法,其特征在于,所述制备方法包括以下步骤:
(1)将阳离子双亲性多肽加入到水、40~60mM三羟甲基氨基甲烷盐酸盐缓冲液或10~20mM磷酸盐缓冲液中,获得20~5000μM阳离子双亲性多肽溶液;将白蛋白加入到水或10~20mM磷酸盐缓冲液中,获得20~5000μM白蛋白溶液;
(2)按阳离子双亲性多肽和白蛋白的摩尔比为(0.1~10):1将阳离子双亲性多肽溶液和白蛋白溶液混合,加入水或磷酸盐缓冲液,于5~100℃混合0.5~120min,得到所述多肽白蛋白纳米粒。
9.一种药物组合物,其特征在于,所述药物组合物包括权利要求1-3任一项所述的多肽白蛋白纳米粒;
优选地,所述药物组合物还包括药学上可接受的载体、赋形剂或稀释剂中的任意一种或至少两种的组合。
10.权利要求1-3任一项所述的多肽白蛋白纳米粒或权利要求9所述的药物组合物在制备抗肿瘤药物中的应用。
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2021394243A AU2021394243A1 (en) | 2020-12-10 | 2021-11-03 | Polypeptide albumin nanoparticle, preparation method therefor, and application thereof |
| US17/998,404 US20240261365A1 (en) | 2020-12-10 | 2021-11-03 | Polypeptide albumin nanoparticle, preparation method therefor, and application thereof |
| EP21902268.8A EP4122496A4 (en) | 2020-12-10 | 2021-11-03 | POLYPEPTIDE ALBUMIN NANOPARTICLE, ITS PREPARATION METHOD, AND ITS APPLICATION |
| PCT/CN2021/128313 WO2022121561A1 (zh) | 2020-12-10 | 2021-11-03 | 一种多肽白蛋白纳米粒及其制备方法和应用 |
| JP2022563369A JP7523159B2 (ja) | 2020-12-10 | 2021-11-03 | ポリペプチドアルブミンナノ粒子、およびその調製方法と使用 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2020114553918 | 2020-12-10 | ||
| CN202011455391 | 2020-12-10 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN114617974A true CN114617974A (zh) | 2022-06-14 |
| CN114617974B CN114617974B (zh) | 2023-10-03 |
Family
ID=81897400
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111151600.4A Active CN114617974B (zh) | 2020-12-10 | 2021-09-29 | 一种多肽白蛋白纳米粒及其制备方法和应用 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20240261365A1 (zh) |
| EP (1) | EP4122496A4 (zh) |
| JP (1) | JP7523159B2 (zh) |
| CN (1) | CN114617974B (zh) |
| AU (1) | AU2021394243A1 (zh) |
| WO (1) | WO2022121561A1 (zh) |
Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013084198A1 (en) * | 2011-12-07 | 2013-06-13 | Universidade De Lisboa | Chemical modification and bioconjugation of proteins or peptides using boron compounds |
| CN103204899A (zh) * | 2013-03-12 | 2013-07-17 | 中国科学院苏州纳米技术与纳米仿生研究所 | 一种基于组氨酸与金属铱配合物结合的多肽环化方法 |
| CN104684546A (zh) * | 2012-06-07 | 2015-06-03 | 哈佛大学校长及研究员协会 | 用于药物靶向的纳米疗法 |
| US20160022976A1 (en) * | 2002-02-14 | 2016-01-28 | Gholam A. Peyman | Method and composition for hyperthermally treating cells |
| CN106729755A (zh) * | 2016-12-31 | 2017-05-31 | 中山大学肿瘤防治中心 | 一种miR‑214纳米基因复合物及其制备方法、应用 |
| CN106831997A (zh) * | 2015-12-03 | 2017-06-13 | 中国科学院苏州纳米技术与纳米仿生研究所 | 多肽、脂蛋白样纳米粒子及其应用 |
| US20180078510A1 (en) * | 2016-09-19 | 2018-03-22 | Universidade De Santiago De Compostela | Nanoparticles with protected interiors, and methods of use thereof |
| CN108078958A (zh) * | 2017-12-28 | 2018-05-29 | 国家纳米科学中心 | 一种抗肿瘤多肽纳米药物及其制备方法和应用 |
| CN108578369A (zh) * | 2018-05-21 | 2018-09-28 | 天津科技大学 | 表面双修饰的靶向人血清白蛋白纳米药物载体的制备与应用 |
| CN109152702A (zh) * | 2016-04-12 | 2019-01-04 | 伊拉斯吹斯制药有限公司 | 用于化合物的局部应用的组合物 |
| CN110496229A (zh) * | 2019-09-16 | 2019-11-26 | 上海市肺科医院 | 一种具有缓释性的纳米颗粒包被的抗菌肽及其制备方法 |
| CN111888484A (zh) * | 2020-08-18 | 2020-11-06 | 上海市第一人民医院 | 一种可穿透角膜并靶向视网膜的眼用脂质体及其制备方法和应用 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012017281A (ja) | 2010-07-07 | 2012-01-26 | Canon Inc | 化合物及び前記化合物を有する造影剤 |
| US20200282075A1 (en) | 2017-09-07 | 2020-09-10 | AbbVie Deutschland GmbH & Co. KG | Albumin-modified nanoparticles carrying a targeting ligand |
| CN110548142A (zh) * | 2019-09-19 | 2019-12-10 | 湖北大学 | 一种提高光动力和免疫治疗的纳米粒子及其制备方法 |
-
2021
- 2021-09-29 CN CN202111151600.4A patent/CN114617974B/zh active Active
- 2021-11-03 US US17/998,404 patent/US20240261365A1/en active Pending
- 2021-11-03 JP JP2022563369A patent/JP7523159B2/ja active Active
- 2021-11-03 EP EP21902268.8A patent/EP4122496A4/en active Pending
- 2021-11-03 WO PCT/CN2021/128313 patent/WO2022121561A1/zh active Application Filing
- 2021-11-03 AU AU2021394243A patent/AU2021394243A1/en active Pending
Patent Citations (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20160022976A1 (en) * | 2002-02-14 | 2016-01-28 | Gholam A. Peyman | Method and composition for hyperthermally treating cells |
| WO2013084198A1 (en) * | 2011-12-07 | 2013-06-13 | Universidade De Lisboa | Chemical modification and bioconjugation of proteins or peptides using boron compounds |
| CN104684546A (zh) * | 2012-06-07 | 2015-06-03 | 哈佛大学校长及研究员协会 | 用于药物靶向的纳米疗法 |
| CN107129519A (zh) * | 2013-03-12 | 2017-09-05 | 中国科学院苏州纳米技术与纳米仿生研究所 | 基于金属铱配合物的多肽荧光环化方法及环化多肽 |
| CN103204899A (zh) * | 2013-03-12 | 2013-07-17 | 中国科学院苏州纳米技术与纳米仿生研究所 | 一种基于组氨酸与金属铱配合物结合的多肽环化方法 |
| CN106831997A (zh) * | 2015-12-03 | 2017-06-13 | 中国科学院苏州纳米技术与纳米仿生研究所 | 多肽、脂蛋白样纳米粒子及其应用 |
| CN109152702A (zh) * | 2016-04-12 | 2019-01-04 | 伊拉斯吹斯制药有限公司 | 用于化合物的局部应用的组合物 |
| US20180078510A1 (en) * | 2016-09-19 | 2018-03-22 | Universidade De Santiago De Compostela | Nanoparticles with protected interiors, and methods of use thereof |
| CN106729755A (zh) * | 2016-12-31 | 2017-05-31 | 中山大学肿瘤防治中心 | 一种miR‑214纳米基因复合物及其制备方法、应用 |
| CN108078958A (zh) * | 2017-12-28 | 2018-05-29 | 国家纳米科学中心 | 一种抗肿瘤多肽纳米药物及其制备方法和应用 |
| CN108578369A (zh) * | 2018-05-21 | 2018-09-28 | 天津科技大学 | 表面双修饰的靶向人血清白蛋白纳米药物载体的制备与应用 |
| CN110496229A (zh) * | 2019-09-16 | 2019-11-26 | 上海市肺科医院 | 一种具有缓释性的纳米颗粒包被的抗菌肽及其制备方法 |
| CN111888484A (zh) * | 2020-08-18 | 2020-11-06 | 上海市第一人民医院 | 一种可穿透角膜并靶向视网膜的眼用脂质体及其制备方法和应用 |
Non-Patent Citations (7)
Also Published As
| Publication number | Publication date |
|---|---|
| US20240261365A1 (en) | 2024-08-08 |
| JP7523159B2 (ja) | 2024-07-26 |
| CN114617974B (zh) | 2023-10-03 |
| JP2023529545A (ja) | 2023-07-11 |
| WO2022121561A1 (zh) | 2022-06-16 |
| AU2021394243A1 (en) | 2022-11-17 |
| EP4122496A1 (en) | 2023-01-25 |
| EP4122496A4 (en) | 2024-10-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US5389377A (en) | Solid care therapeutic compositions and methods for making same | |
| CN110522918B (zh) | 靶向元件及其制备方法和运用 | |
| JPH09508530A (ja) | 核酸を含む組成物、その調製および使用 | |
| CN108143718B (zh) | 一种抗肿瘤纳米基因药物及其制备方法和应用 | |
| Yang et al. | A new concept of enhancing immuno-chemotherapeutic effects against B16F10 tumor via systemic administration by taking advantages of the limitation of EPR effect | |
| CN113750232A (zh) | 一种巨噬细胞膜包覆精氨酸脱亚胺酶/过氧化氢酶/ir780纳米粒、制备方法和应用 | |
| CN101864078A (zh) | 聚乙烯亚胺-壳聚糖-硬脂酸嫁接物及制备与应用 | |
| CA2153147A1 (en) | Red blood cell surrogate | |
| Bergers et al. | Interleukin-2-containing liposomes: interaction of interleukin-2 with liposomal bilayers and preliminary studies on application in cancer vaccines | |
| JP6238366B2 (ja) | 非極性溶媒に分散性を有する細菌菌体成分を内封する脂質膜構造体およびその製造方法 | |
| CN114848831A (zh) | 包裹型纳米制剂及其载体的制备方法和应用 | |
| CN114617974B (zh) | 一种多肽白蛋白纳米粒及其制备方法和应用 | |
| CN117180200B (zh) | 一种ros响应性脂质纳米递送系统及其制备方法和在靶向制剂中的应用 | |
| CN113616602B (zh) | 一种重组高密度脂蛋白-聚酰胺-胺纳米复合物、制法及应用 | |
| CN115054699A (zh) | 一种肝靶向递送miR-26a类似物的纳米药物载体及其制备方法 | |
| CN113546179A (zh) | 一种阿霉素长循环脂质体靶向药物及其制备方法 | |
| Chandraprakash et al. | Effect of niosome encapsulation of methotrexate, macrophage activation on tissue distribution of methotrexate and tumor size | |
| CN112159527A (zh) | 一种含有透明质酸基团的聚甘油脂肪酸酯衍生物及其合成方法和其在药物制剂中的应用 | |
| CN114306316B (zh) | 一种肿瘤靶向性的复合纳米药物及其制备方法和用途 | |
| CN116019770B (zh) | 白蛋白/乳铁蛋白嵌合纳米粒、其制备方法和用途 | |
| CN113116854B (zh) | 一种壳聚糖脂蛋白鼻腔给药纳米复合物及其制备方法和应用 | |
| CN114748446B (zh) | 一种mRNA的铝基自组装递送系统及其制备方法和应用 | |
| CN117442749A (zh) | 一种rvg15肽修饰的脑靶向性金属有机框架药物载体及其制备方法和应用 | |
| WO2006126267A1 (ja) | 遺伝子類導入方法 | |
| CN118105361A (zh) | 一种融合膜包裹的精氨酸脱亚胺酶/ir780-普鲁士蓝/淫羊藿素纳米粒及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |