CN114191420A - 稳定的大麻素类化合物制剂 - Google Patents
稳定的大麻素类化合物制剂 Download PDFInfo
- Publication number
- CN114191420A CN114191420A CN202110901202.3A CN202110901202A CN114191420A CN 114191420 A CN114191420 A CN 114191420A CN 202110901202 A CN202110901202 A CN 202110901202A CN 114191420 A CN114191420 A CN 114191420A
- Authority
- CN
- China
- Prior art keywords
- formulation
- cannabidiol
- patient
- oil
- disorder
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 297
- 238000009472 formulation Methods 0.000 title claims abstract description 292
- 229930003827 cannabinoid Natural products 0.000 title claims abstract description 52
- 239000003557 cannabinoid Substances 0.000 title claims abstract description 52
- 229950011318 cannabidiol Drugs 0.000 claims abstract description 197
- ZTGXAWYVTLUPDT-UHFFFAOYSA-N cannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1C1C(C(C)=C)CC=C(C)C1 ZTGXAWYVTLUPDT-UHFFFAOYSA-N 0.000 claims abstract description 196
- QHMBSVQNZZTUGM-ZWKOTPCHSA-N cannabidiol Chemical compound OC1=CC(CCCCC)=CC(O)=C1[C@H]1[C@H](C(C)=C)CCC(C)=C1 QHMBSVQNZZTUGM-ZWKOTPCHSA-N 0.000 claims abstract description 188
- QHMBSVQNZZTUGM-UHFFFAOYSA-N Trans-Cannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1C1C(C(C)=C)CCC(C)=C1 QHMBSVQNZZTUGM-UHFFFAOYSA-N 0.000 claims abstract description 187
- PCXRACLQFPRCBB-ZWKOTPCHSA-N dihydrocannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1[C@H]1[C@H](C(C)C)CCC(C)=C1 PCXRACLQFPRCBB-ZWKOTPCHSA-N 0.000 claims abstract description 186
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims abstract description 150
- 238000000034 method Methods 0.000 claims abstract description 86
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims abstract description 51
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 22
- 229920001223 polyethylene glycol Polymers 0.000 claims abstract description 19
- 239000002202 Polyethylene glycol Substances 0.000 claims abstract description 15
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 14
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 48
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 claims description 43
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 claims description 43
- XXGMIHXASFDFSM-UHFFFAOYSA-N Delta9-tetrahydrocannabinol Natural products CCCCCc1cc2OC(C)(C)C3CCC(=CC3c2c(O)c1O)C XXGMIHXASFDFSM-UHFFFAOYSA-N 0.000 claims description 36
- 206010010904 Convulsion Diseases 0.000 claims description 30
- 208000035475 disorder Diseases 0.000 claims description 29
- 239000003963 antioxidant agent Substances 0.000 claims description 27
- 235000006708 antioxidants Nutrition 0.000 claims description 27
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 claims description 26
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 claims description 24
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 claims description 24
- 208000024891 symptom Diseases 0.000 claims description 22
- 206010021750 Infantile Spasms Diseases 0.000 claims description 21
- 201000006791 West syndrome Diseases 0.000 claims description 21
- 230000003078 antioxidant effect Effects 0.000 claims description 20
- 208000004296 neuralgia Diseases 0.000 claims description 20
- 208000021722 neuropathic pain Diseases 0.000 claims description 20
- 201000010099 disease Diseases 0.000 claims description 19
- -1 levonantrobuo Chemical compound 0.000 claims description 19
- 150000002632 lipids Chemical class 0.000 claims description 17
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 claims description 16
- 241000218236 Cannabis Species 0.000 claims description 13
- 208000005392 Spasm Diseases 0.000 claims description 13
- 229930003427 Vitamin E Natural products 0.000 claims description 13
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 claims description 13
- 239000011709 vitamin E Substances 0.000 claims description 13
- 229940046009 vitamin E Drugs 0.000 claims description 13
- 235000019165 vitamin E Nutrition 0.000 claims description 13
- ZROLHBHDLIHEMS-UHFFFAOYSA-N Delta9 tetrahydrocannabivarin Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCC)=CC(O)=C3C21 ZROLHBHDLIHEMS-UHFFFAOYSA-N 0.000 claims description 12
- 235000010323 ascorbic acid Nutrition 0.000 claims description 12
- 229960005070 ascorbic acid Drugs 0.000 claims description 12
- 239000011668 ascorbic acid Substances 0.000 claims description 12
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 claims description 12
- ZROLHBHDLIHEMS-HUUCEWRRSA-N (6ar,10ar)-6,6,9-trimethyl-3-propyl-6a,7,8,10a-tetrahydrobenzo[c]chromen-1-ol Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCC)=CC(O)=C3[C@@H]21 ZROLHBHDLIHEMS-HUUCEWRRSA-N 0.000 claims description 11
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 claims description 10
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 claims description 10
- 208000007101 Muscle Cramp Diseases 0.000 claims description 10
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 claims description 10
- 235000010385 ascorbyl palmitate Nutrition 0.000 claims description 10
- 208000011580 syndromic disease Diseases 0.000 claims description 10
- VBGLYOIFKLUMQG-UHFFFAOYSA-N Cannabinol Chemical compound C1=C(C)C=C2C3=C(O)C=C(CCCCC)C=C3OC(C)(C)C2=C1 VBGLYOIFKLUMQG-UHFFFAOYSA-N 0.000 claims description 9
- 208000034189 Sclerosis Diseases 0.000 claims description 9
- 229960003453 cannabinol Drugs 0.000 claims description 9
- 230000000366 juvenile effect Effects 0.000 claims description 9
- 208000028173 post-traumatic stress disease Diseases 0.000 claims description 9
- 208000024827 Alzheimer disease Diseases 0.000 claims description 8
- 208000019901 Anxiety disease Diseases 0.000 claims description 8
- 206010003805 Autism Diseases 0.000 claims description 8
- 208000020706 Autistic disease Diseases 0.000 claims description 8
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 8
- 201000007547 Dravet syndrome Diseases 0.000 claims description 8
- 208000001654 Drug Resistant Epilepsy Diseases 0.000 claims description 8
- 206010071082 Juvenile myoclonic epilepsy Diseases 0.000 claims description 8
- 201000006792 Lennox-Gastaut syndrome Diseases 0.000 claims description 8
- 208000036572 Myoclonic epilepsy Diseases 0.000 claims description 8
- 206010073677 Severe myoclonic epilepsy of infancy Diseases 0.000 claims description 8
- 239000002253 acid Substances 0.000 claims description 8
- 229940087168 alpha tocopherol Drugs 0.000 claims description 8
- 230000036506 anxiety Effects 0.000 claims description 8
- 208000034287 idiopathic generalized susceptibility to 7 epilepsy Diseases 0.000 claims description 8
- 201000000980 schizophrenia Diseases 0.000 claims description 8
- 235000010378 sodium ascorbate Nutrition 0.000 claims description 8
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 claims description 8
- 229960005055 sodium ascorbate Drugs 0.000 claims description 8
- 239000001509 sodium citrate Substances 0.000 claims description 8
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 claims description 8
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 claims description 8
- 229960000984 tocofersolan Drugs 0.000 claims description 8
- 239000002076 α-tocopherol Substances 0.000 claims description 8
- 235000004835 α-tocopherol Nutrition 0.000 claims description 8
- AOYYFUGUUIRBML-IAGOWNOFSA-N (6ar,10ar)-6,6-dimethyl-9-methylidene-3-pentyl-7,8,10,10a-tetrahydro-6ah-benzo[c]chromen-1-ol Chemical compound C1C(=C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 AOYYFUGUUIRBML-IAGOWNOFSA-N 0.000 claims description 7
- YCBKSSAWEUDACY-IAGOWNOFSA-N 11-hydroxy-Delta(9)-tetrahydrocannabinol Chemical compound C1=C(CO)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 YCBKSSAWEUDACY-IAGOWNOFSA-N 0.000 claims description 7
- YCBKSSAWEUDACY-UHFFFAOYSA-N 7-Hydroxy-Delta1-THC Natural products C1=C(CO)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 YCBKSSAWEUDACY-UHFFFAOYSA-N 0.000 claims description 7
- CYQFCXCEBYINGO-DLBZAZTESA-N Dronabinol Natural products C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@H]21 CYQFCXCEBYINGO-DLBZAZTESA-N 0.000 claims description 7
- HCAWPGARWVBULJ-IAGOWNOFSA-N delta8-THC Chemical compound C1C(C)=CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 HCAWPGARWVBULJ-IAGOWNOFSA-N 0.000 claims description 7
- 229960004242 dronabinol Drugs 0.000 claims description 7
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 claims description 6
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 claims description 6
- 208000035899 Infantile spasms syndrome Diseases 0.000 claims description 6
- 229960003920 cocaine Drugs 0.000 claims description 6
- 229960002069 diamorphine Drugs 0.000 claims description 6
- 125000005456 glyceride group Chemical group 0.000 claims description 6
- 229960002715 nicotine Drugs 0.000 claims description 6
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 claims description 6
- 229940005483 opioid analgesics Drugs 0.000 claims description 6
- QIJRTFXNRTXDIP-UHFFFAOYSA-N (1-carboxy-2-sulfanylethyl)azanium;chloride;hydrate Chemical compound O.Cl.SCC(N)C(O)=O QIJRTFXNRTXDIP-UHFFFAOYSA-N 0.000 claims description 5
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 claims description 5
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 claims description 5
- 208000028017 Psychotic disease Diseases 0.000 claims description 5
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 claims description 5
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 claims description 5
- 235000010354 butylated hydroxytoluene Nutrition 0.000 claims description 5
- 229960004106 citric acid Drugs 0.000 claims description 5
- 229960001305 cysteine hydrochloride Drugs 0.000 claims description 5
- 239000000787 lecithin Substances 0.000 claims description 5
- 235000010445 lecithin Nutrition 0.000 claims description 5
- 229940067606 lecithin Drugs 0.000 claims description 5
- 239000000473 propyl gallate Substances 0.000 claims description 5
- 235000010388 propyl gallate Nutrition 0.000 claims description 5
- 229940075579 propyl gallate Drugs 0.000 claims description 5
- GHBFNMLVSPCDGN-UHFFFAOYSA-N rac-1-monooctanoylglycerol Chemical compound CCCCCCCC(=O)OCC(O)CO GHBFNMLVSPCDGN-UHFFFAOYSA-N 0.000 claims description 5
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 claims description 5
- 229910000342 sodium bisulfate Inorganic materials 0.000 claims description 5
- 229940100996 sodium bisulfate Drugs 0.000 claims description 5
- 229960001790 sodium citrate Drugs 0.000 claims description 5
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 claims description 5
- 229940001584 sodium metabisulfite Drugs 0.000 claims description 5
- 235000010262 sodium metabisulphite Nutrition 0.000 claims description 5
- 229910052938 sodium sulfate Inorganic materials 0.000 claims description 5
- 229960003010 sodium sulfate Drugs 0.000 claims description 5
- 235000011152 sodium sulphate Nutrition 0.000 claims description 5
- 229960001484 edetic acid Drugs 0.000 claims description 4
- 235000011803 sesame oil Nutrition 0.000 claims description 4
- 239000008159 sesame oil Substances 0.000 claims description 4
- 235000019486 Sunflower oil Nutrition 0.000 claims description 3
- 239000003240 coconut oil Substances 0.000 claims description 3
- 235000005687 corn oil Nutrition 0.000 claims description 3
- 239000002285 corn oil Substances 0.000 claims description 3
- PJUIMOJAAPLTRJ-UHFFFAOYSA-N monothioglycerol Chemical compound OCC(O)CS PJUIMOJAAPLTRJ-UHFFFAOYSA-N 0.000 claims description 3
- 235000012424 soybean oil Nutrition 0.000 claims description 3
- 239000003549 soybean oil Substances 0.000 claims description 3
- 239000002600 sunflower oil Substances 0.000 claims description 3
- 229940035024 thioglycerol Drugs 0.000 claims description 3
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 claims description 2
- WECGLUPZRHILCT-GSNKCQISSA-N 1-linoleoyl-sn-glycerol Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(=O)OC[C@@H](O)CO WECGLUPZRHILCT-GSNKCQISSA-N 0.000 claims description 2
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 claims description 2
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 claims description 2
- 235000019489 Almond oil Nutrition 0.000 claims description 2
- 235000019492 Cashew oil Nutrition 0.000 claims description 2
- 239000005642 Oleic acid Substances 0.000 claims description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 claims description 2
- 235000019482 Palm oil Nutrition 0.000 claims description 2
- 235000019483 Peanut oil Nutrition 0.000 claims description 2
- 235000019484 Rapeseed oil Nutrition 0.000 claims description 2
- 235000019774 Rice Bran oil Nutrition 0.000 claims description 2
- 235000019485 Safflower oil Nutrition 0.000 claims description 2
- 235000019498 Walnut oil Nutrition 0.000 claims description 2
- 239000008168 almond oil Substances 0.000 claims description 2
- 239000010467 cashew oil Substances 0.000 claims description 2
- 229940059459 cashew oil Drugs 0.000 claims description 2
- 239000004359 castor oil Substances 0.000 claims description 2
- 235000019438 castor oil Nutrition 0.000 claims description 2
- 235000019864 coconut oil Nutrition 0.000 claims description 2
- RZRNAYUHWVFMIP-HXUWFJFHSA-N glycerol monolinoleate Natural products CCCCCCCCC=CCCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-HXUWFJFHSA-N 0.000 claims description 2
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 claims description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 claims description 2
- 125000002669 linoleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 2
- 235000021388 linseed oil Nutrition 0.000 claims description 2
- 239000000944 linseed oil Substances 0.000 claims description 2
- 239000002609 medium Substances 0.000 claims description 2
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 claims description 2
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 claims description 2
- 125000002811 oleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 2
- 239000004006 olive oil Substances 0.000 claims description 2
- 235000008390 olive oil Nutrition 0.000 claims description 2
- 239000002540 palm oil Substances 0.000 claims description 2
- 239000000312 peanut oil Substances 0.000 claims description 2
- 239000008165 rice bran oil Substances 0.000 claims description 2
- 235000005713 safflower oil Nutrition 0.000 claims description 2
- 239000003813 safflower oil Substances 0.000 claims description 2
- 150000003626 triacylglycerols Chemical class 0.000 claims description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 claims description 2
- 239000008158 vegetable oil Substances 0.000 claims description 2
- 239000008170 walnut oil Substances 0.000 claims description 2
- 239000004255 Butylated hydroxyanisole Substances 0.000 claims 2
- 239000004322 Butylated hydroxytoluene Substances 0.000 claims 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 claims 2
- 235000019282 butylated hydroxyanisole Nutrition 0.000 claims 2
- 229940043253 butylated hydroxyanisole Drugs 0.000 claims 2
- 229940095259 butylated hydroxytoluene Drugs 0.000 claims 2
- 229940065144 cannabinoids Drugs 0.000 abstract description 18
- 239000003795 chemical substances by application Substances 0.000 abstract description 3
- 238000011282 treatment Methods 0.000 description 45
- 239000012535 impurity Substances 0.000 description 42
- 239000000796 flavoring agent Substances 0.000 description 34
- 241000699670 Mus sp. Species 0.000 description 30
- 241001465754 Metazoa Species 0.000 description 26
- 235000003599 food sweetener Nutrition 0.000 description 22
- 239000003765 sweetening agent Substances 0.000 description 22
- 238000012360 testing method Methods 0.000 description 22
- 229940100688 oral solution Drugs 0.000 description 21
- 229920002961 polybutylene succinate Polymers 0.000 description 21
- 239000004631 polybutylene succinate Substances 0.000 description 21
- 235000013355 food flavoring agent Nutrition 0.000 description 18
- 230000000694 effects Effects 0.000 description 17
- 235000019634 flavors Nutrition 0.000 description 16
- 239000008389 polyethoxylated castor oil Substances 0.000 description 15
- 229920000609 methyl cellulose Polymers 0.000 description 14
- 239000001923 methylcellulose Substances 0.000 description 14
- 239000002904 solvent Substances 0.000 description 14
- 229930012538 Paclitaxel Natural products 0.000 description 13
- 229960001592 paclitaxel Drugs 0.000 description 13
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 13
- 206010028980 Neoplasm Diseases 0.000 description 12
- 229940068918 polyethylene glycol 400 Drugs 0.000 description 11
- 230000000638 stimulation Effects 0.000 description 11
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 10
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 9
- VTAJIXDZFCRWBR-UHFFFAOYSA-N Licoricesaponin B2 Natural products C1C(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2)C(O)=O)C)(C)CC2)(C)C2C(C)(C)CC1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O VTAJIXDZFCRWBR-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000003814 drug Substances 0.000 description 9
- 208000005017 glioblastoma Diseases 0.000 description 9
- LPLVUJXQOOQHMX-UHFFFAOYSA-N glycyrrhetinic acid glycoside Natural products C1CC(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2=O)C(O)=O)C)(C)CC2)(C)C2C(C)(C)C1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O LPLVUJXQOOQHMX-UHFFFAOYSA-N 0.000 description 9
- 239000001685 glycyrrhizic acid Substances 0.000 description 9
- 229960004949 glycyrrhizic acid Drugs 0.000 description 9
- UYRUBYNTXSDKQT-UHFFFAOYSA-N glycyrrhizic acid Natural products CC1(C)C(CCC2(C)C1CCC3(C)C2C(=O)C=C4C5CC(C)(CCC5(C)CCC34C)C(=O)O)OC6OC(C(O)C(O)C6OC7OC(O)C(O)C(O)C7C(=O)O)C(=O)O UYRUBYNTXSDKQT-UHFFFAOYSA-N 0.000 description 9
- 235000019410 glycyrrhizin Nutrition 0.000 description 9
- LPLVUJXQOOQHMX-QWBHMCJMSA-N glycyrrhizinic acid Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@@H]1C([C@H]2[C@]([C@@H]3[C@@]([C@@]4(CC[C@@]5(C)CC[C@@](C)(C[C@H]5C4=CC3=O)C(O)=O)C)(C)CC2)(C)CC1)(C)C)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O LPLVUJXQOOQHMX-QWBHMCJMSA-N 0.000 description 9
- 239000003002 pH adjusting agent Substances 0.000 description 9
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 9
- 150000001875 compounds Chemical class 0.000 description 8
- 235000016623 Fragaria vesca Nutrition 0.000 description 7
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 7
- 240000007651 Rubus glaucus Species 0.000 description 7
- 235000011034 Rubus glaucus Nutrition 0.000 description 7
- 235000009122 Rubus idaeus Nutrition 0.000 description 7
- 210000000481 breast Anatomy 0.000 description 7
- 239000000812 cholinergic antagonist Substances 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- 206010033128 Ovarian cancer Diseases 0.000 description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- 150000003863 ammonium salts Chemical class 0.000 description 6
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 6
- 230000002357 endometrial effect Effects 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 6
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 6
- 241000700159 Rattus Species 0.000 description 5
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 5
- 239000002246 antineoplastic agent Substances 0.000 description 5
- 230000002566 clonic effect Effects 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 5
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 5
- 229960002216 methylparaben Drugs 0.000 description 5
- 230000002151 myoclonic effect Effects 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- 229960004964 temozolomide Drugs 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 206010006187 Breast cancer Diseases 0.000 description 4
- 208000026310 Breast neoplasm Diseases 0.000 description 4
- 206010008342 Cervix carcinoma Diseases 0.000 description 4
- 206010014733 Endometrial cancer Diseases 0.000 description 4
- 206010014759 Endometrial neoplasm Diseases 0.000 description 4
- 240000009088 Fragaria x ananassa Species 0.000 description 4
- 235000014766 Mentha X piperi var citrata Nutrition 0.000 description 4
- 244000007703 Mentha citrata Species 0.000 description 4
- 235000007421 Mentha citrata Nutrition 0.000 description 4
- 235000008660 Mentha x piperita subsp citrata Nutrition 0.000 description 4
- 235000002431 Monarda citriodora Nutrition 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 208000008238 Muscle Spasticity Diseases 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 231100000288 TD50 Toxicity 0.000 description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 4
- 235000009754 Vitis X bourquina Nutrition 0.000 description 4
- 235000012333 Vitis X labruscana Nutrition 0.000 description 4
- 240000006365 Vitis vinifera Species 0.000 description 4
- 235000014787 Vitis vinifera Nutrition 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000002921 anti-spasmodic effect Effects 0.000 description 4
- 230000006399 behavior Effects 0.000 description 4
- 210000004027 cell Anatomy 0.000 description 4
- 201000010881 cervical cancer Diseases 0.000 description 4
- 206010013663 drug dependence Diseases 0.000 description 4
- 235000013399 edible fruits Nutrition 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 210000003141 lower extremity Anatomy 0.000 description 4
- 239000008368 mint flavor Substances 0.000 description 4
- 231100000189 neurotoxic Toxicity 0.000 description 4
- 230000002887 neurotoxic effect Effects 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical group [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 208000018198 spasticity Diseases 0.000 description 4
- 230000001256 tonic effect Effects 0.000 description 4
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 3
- SPSPIUSUWPLVKD-UHFFFAOYSA-N 2,3-dibutyl-6-methylphenol Chemical compound CCCCC1=CC=C(C)C(O)=C1CCCC SPSPIUSUWPLVKD-UHFFFAOYSA-N 0.000 description 3
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 3
- 108010011485 Aspartame Proteins 0.000 description 3
- 239000005711 Benzoic acid Substances 0.000 description 3
- 235000019499 Citrus oil Nutrition 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 244000307700 Fragaria vesca Species 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- 229930195725 Mannitol Natural products 0.000 description 3
- ILRKKHJEINIICQ-OOFFSTKBSA-N Monoammonium glycyrrhizinate Chemical compound N.O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@H]1CC[C@]2(C)[C@H]3C(=O)C=C4[C@@H]5C[C@](C)(CC[C@@]5(CC[C@@]4(C)[C@]3(C)CC[C@H]2C1(C)C)C)C(O)=O)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O ILRKKHJEINIICQ-OOFFSTKBSA-N 0.000 description 3
- 235000019502 Orange oil Nutrition 0.000 description 3
- 208000002193 Pain Diseases 0.000 description 3
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 3
- 239000004376 Sucralose Substances 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- PPWHTZKZQNXVAE-UHFFFAOYSA-N Tetracaine hydrochloride Chemical compound Cl.CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 PPWHTZKZQNXVAE-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 239000001099 ammonium carbonate Substances 0.000 description 3
- 235000012501 ammonium carbonate Nutrition 0.000 description 3
- 230000000202 analgesic effect Effects 0.000 description 3
- 239000001961 anticonvulsive agent Substances 0.000 description 3
- 239000000605 aspartame Substances 0.000 description 3
- 235000010357 aspartame Nutrition 0.000 description 3
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 3
- 229960003438 aspartame Drugs 0.000 description 3
- 235000010233 benzoic acid Nutrition 0.000 description 3
- 229960004365 benzoic acid Drugs 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 239000007958 cherry flavor Substances 0.000 description 3
- 239000010630 cinnamon oil Substances 0.000 description 3
- 229960004316 cisplatin Drugs 0.000 description 3
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 3
- 239000010500 citrus oil Substances 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 239000008121 dextrose Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 230000002996 emotional effect Effects 0.000 description 3
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 3
- 239000001530 fumaric acid Substances 0.000 description 3
- 229960001031 glucose Drugs 0.000 description 3
- 238000007917 intracranial administration Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 239000007928 intraperitoneal injection Substances 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 239000000594 mannitol Substances 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 229960001855 mannitol Drugs 0.000 description 3
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 3
- 239000001683 mentha spicata herb oil Substances 0.000 description 3
- 229940041616 menthol Drugs 0.000 description 3
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 239000010502 orange oil Substances 0.000 description 3
- 235000019477 peppermint oil Nutrition 0.000 description 3
- 208000033808 peripheral neuropathy Diseases 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 3
- 159000000001 potassium salts Chemical class 0.000 description 3
- 229960003415 propylparaben Drugs 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 3
- 235000019204 saccharin Nutrition 0.000 description 3
- 229940081974 saccharin Drugs 0.000 description 3
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 235000010234 sodium benzoate Nutrition 0.000 description 3
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 3
- 239000004299 sodium benzoate Substances 0.000 description 3
- 229960003885 sodium benzoate Drugs 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 239000004334 sorbic acid Substances 0.000 description 3
- 235000010199 sorbic acid Nutrition 0.000 description 3
- 229940075582 sorbic acid Drugs 0.000 description 3
- 235000019721 spearmint oil Nutrition 0.000 description 3
- 239000007929 subcutaneous injection Substances 0.000 description 3
- 238000010254 subcutaneous injection Methods 0.000 description 3
- 235000019408 sucralose Nutrition 0.000 description 3
- BAQAVOSOZGMPRM-QBMZZYIRSA-N sucralose Chemical compound O[C@@H]1[C@@H](O)[C@@H](Cl)[C@@H](CO)O[C@@H]1O[C@@]1(CCl)[C@@H](O)[C@H](O)[C@@H](CCl)O1 BAQAVOSOZGMPRM-QBMZZYIRSA-N 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 229960004793 sucrose Drugs 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- 239000000811 xylitol Substances 0.000 description 3
- 235000010447 xylitol Nutrition 0.000 description 3
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 3
- 229960002675 xylitol Drugs 0.000 description 3
- 208000002874 Acne Vulgaris Diseases 0.000 description 2
- 102100026423 Adhesion G protein-coupled receptor E5 Human genes 0.000 description 2
- 208000029197 Amphetamine-Related disease Diseases 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 208000022497 Cocaine-Related disease Diseases 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- 208000032612 Glial tumor Diseases 0.000 description 2
- 206010018338 Glioma Diseases 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 208000003698 Heroin Dependence Diseases 0.000 description 2
- 101000718243 Homo sapiens Adhesion G protein-coupled receptor E5 Proteins 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 2
- 206010028347 Muscle twitching Diseases 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 206010028813 Nausea Diseases 0.000 description 2
- 206010057852 Nicotine dependence Diseases 0.000 description 2
- 208000026251 Opioid-Related disease Diseases 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- 208000037012 Psychomotor seizures Diseases 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 206010041250 Social phobia Diseases 0.000 description 2
- 208000025569 Tobacco Use disease Diseases 0.000 description 2
- 206010000496 acne Diseases 0.000 description 2
- 230000003444 anaesthetic effect Effects 0.000 description 2
- 229940034982 antineoplastic agent Drugs 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 230000003542 behavioural effect Effects 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 208000028502 clonic seizure Diseases 0.000 description 2
- 201000006145 cocaine dependence Diseases 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 125000003074 decanoyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 208000037765 diseases and disorders Diseases 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 238000007877 drug screening Methods 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 229960005420 etoposide Drugs 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- 231100001231 less toxic Toxicity 0.000 description 2
- 229960002247 lomustine Drugs 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- 231100000324 minimal toxicity Toxicity 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000008693 nausea Effects 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 201000001119 neuropathy Diseases 0.000 description 2
- 230000007823 neuropathy Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- IRMPFYJSHJGOPE-UHFFFAOYSA-N olivetol Chemical compound CCCCCC1=CC(O)=CC(O)=C1 IRMPFYJSHJGOPE-UHFFFAOYSA-N 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 2
- 229960000624 procarbazine Drugs 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 229960002494 tetracaine hydrochloride Drugs 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 229920002725 thermoplastic elastomer Polymers 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 231100000048 toxicity data Toxicity 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- SSNHGLKFJISNTR-FWUPRJFYSA-N (6ar,10ar)-6,6,9-trimethyl-3-pentyl-6a,7,8,10a-tetrahydrobenzo[c]chromen-1-ol;2-[(6r)-3-methyl-6-prop-1-en-2-ylcyclohex-2-en-1-yl]-5-pentylbenzene-1,3-diol Chemical compound OC1=CC(CCCCC)=CC(O)=C1C1[C@H](C(C)=C)CCC(C)=C1.C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 SSNHGLKFJISNTR-FWUPRJFYSA-N 0.000 description 1
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 1
- ZYVAQZSGKALVEU-UHFFFAOYSA-N 2-[2-[bis(2-hydroxy-2-oxoethyl)amino]ethyl-(2-hydroxy-2-oxoethyl)amino]ethanoic acid Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O ZYVAQZSGKALVEU-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- 208000009132 Catalepsy Diseases 0.000 description 1
- 206010053398 Clonic convulsion Diseases 0.000 description 1
- 206010009346 Clonus Diseases 0.000 description 1
- 206010010071 Coma Diseases 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 206010024264 Lethargy Diseases 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 238000000585 Mann–Whitney U test Methods 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 208000016285 Movement disease Diseases 0.000 description 1
- 208000029549 Muscle injury Diseases 0.000 description 1
- 208000028389 Nerve injury Diseases 0.000 description 1
- 206010061334 Partial seizures Diseases 0.000 description 1
- 206010034620 Peripheral sensory neuropathy Diseases 0.000 description 1
- 229920002565 Polyethylene Glycol 400 Polymers 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 206010047853 Waxy flexibility Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229940025084 amphetamine Drugs 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 230000001773 anti-convulsant effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 235000009120 camo Nutrition 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 235000005607 chanvre indien Nutrition 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 230000002920 convulsive effect Effects 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 201000010251 cutis laxa Diseases 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 235000021186 dishes Nutrition 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 239000008151 electrolyte solution Substances 0.000 description 1
- 229940021013 electrolyte solution Drugs 0.000 description 1
- 238000002001 electrophysiology Methods 0.000 description 1
- 230000007831 electrophysiology Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 230000021824 exploration behavior Effects 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000009969 flowable effect Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 239000000380 hallucinogen Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000011487 hemp Substances 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- 208000013403 hyperactivity Diseases 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011503 in vivo imaging Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 230000004220 muscle function Effects 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000008764 nerve damage Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- JLFNLZLINWHATN-UHFFFAOYSA-N pentaethylene glycol Chemical compound OCCOCCOCCOCCOCCO JLFNLZLINWHATN-UHFFFAOYSA-N 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 238000013105 post hoc analysis Methods 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 210000004129 prosencephalon Anatomy 0.000 description 1
- LKUNXBRZDFMZOK-UHFFFAOYSA-N rac-1-monodecanoylglycerol Chemical compound CCCCCCCCCC(=O)OCC(O)CO LKUNXBRZDFMZOK-UHFFFAOYSA-N 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 201000005572 sensory peripheral neuropathy Diseases 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000012430 stability testing Methods 0.000 description 1
- 230000005477 standard model Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229960002372 tetracaine Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 210000001364 upper extremity Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/658—Medicinal preparations containing organic active ingredients o-phenolic cannabinoids, e.g. cannabidiol, cannabigerolic acid, cannabichromene or tetrahydrocannabinol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/44—Oils, fats or waxes according to two or more groups of A61K47/02-A61K47/42; Natural or modified natural oils, fats or waxes, e.g. castor oil, polyethoxylated castor oil, montan wax, lignite, shellac, rosin, beeswax or lanolin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Addiction (AREA)
- Psychiatry (AREA)
- Pain & Pain Management (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
本发明一般涉及基本上纯的大麻二酚,稳定的大麻素类化合物药物制剂,和其使用方法。一方面,本发明涉及用于口服施用的稳定的药物制剂,所述试剂包括约0.1至约50%的大麻素类化合物,约0.1至约40%的聚乙二醇,约0.1至约50%的丙二醇,和约0.1至约20%的水,其中所述制剂不包括乙醇并且制剂的pH值为约5至约8。
Description
优先权
本申请要求享有在2014年5月29日提交的美国临时专利申请号62/004,495和在2015年4月29日提交的美国临时专利申请号62/154,660的优先权。每个申请的全部内容以引用的方式并入本文。
技术领域
本发明通常涉及基本上是纯的大麻二酚,稳定的大麻素类化合物药物制剂,和其使用方法。
背景技术
大麻素类化合物是由大麻花生产的化学物质。大麻素类化合物模仿人体的内源性物质。
大麻素类化合物包括大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、四氢次大麻酚(tetrahydrocannabivarin)、amandamide、大麻隆、和酸和其类似物。现在可以在实验室中合成许多大麻素类化合物,从而消除了为了提取化合物而种植大麻的需要。
其中一种大麻素类化合物,大麻二酚,即左旋-反-大麻二酚((-)-trans-2-p-mentha-1,8-dien-3-yl-5-pentylresorcinol)是非精神活性的,并在治疗许多疾病和病症中显示出前景。人造的大麻二酚与天然存在的大麻二酚具有相同的结构。
市售的大麻二酚通常被δ9-四氢大麻酚污染。δ-9-四氢大麻酚的存在是一个问题,因为δ-9-四氢大麻酚被美国毒品管制局作为表I类药物来管制。更高表类编号的结果是药物更容易获得,使患者倾向于用大麻二酚治疗。此外,δ-9-四氢大麻酚是一种致幻剂,并且接受大麻二酚治疗的患者希望避免δ-9-四氢大麻酚污染这种不期望的副作用。因此,需要不含δ-9-四氢大麻酚的基本上是纯的人造的合成大麻二酚。
大麻素类化合物,包括大麻二酚,可适用于治疗疾病或病症,或疾病或病症的症状,例如Dravet综合征、Lennox Gastaut综合征、肌阵挛性痉挛(mycolonic seizures)、青少年肌阵挛性癫痫(juvenile mycolonic epilepsy)、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、顽固性婴儿痉挛症、婴儿痉挛症、管状硬化综合征(tubularsclerosis complex)、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病自闭症,和从阿片类药物、可卡因、海洛因、安非他命和尼古丁的戒断。
因此,需要新的稳定的大麻素类化合物制剂。也需要基本上纯的大麻二酚。
发明内容
一方面,本发明涉及用于口服施用的稳定的药物制剂,所述试剂包括约0.1至约50%的大麻素类化合物,约0.1至约40%的聚乙二醇,约0.1至约50%的丙二醇,和约0.1至约20%的水,其中所述制剂不包括乙醇并且制剂的pH值为约5至约8。
另一方面,本发明涉及用于口服施用的稳定的药物制剂,所述制剂包括约0.1至约40%的大麻素类化合物,约0.1至约25%的聚乙二醇,约0.1至约40%的丙二醇;任选地约0.1至约50%的水,和约0.1至约70%的乙醇,其中所述制剂的pH值为约5至约8。
再另一方面,本发明涉及用于口服施用的稳定的药物制剂,包括约0.1至约40%的大麻素类化合物和约10至约95%的脂质。
另一方面,本发明涉及使用大麻素类化合物或基本上纯的,人造合成的大麻二酚的方法:用于治疗疾病或病症,或疾病或病症的症状,例如Dravet综合征、Lennox Gastaut综合征、肌阵挛性痉挛、青少年肌阵挛性癫痫、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、婴儿痉挛症、顽固性婴儿痉挛症、管状硬化综合征、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病、和自闭症;用于帮助从阿片类药物、可卡因、海洛因、安非他命和尼古丁的戒断;和作为止痛剂或帮助处理不良情绪刺激。
附图说明
图1显示了实施例7详细的研究结果,并且说明了施用基本上纯的,人造合成的大麻二酚制剂用于治疗神经性疼痛的优点。
图2显示了实施例9详细的研究结果,并且说明了施用基本上纯的,人造合成的大麻二酚制剂用于治疗多形性成胶质细胞瘤的优点。
具体实施方式
申请人意外地创造了包括大麻素类化合物的新的储存稳定的制剂。申请人确定约5至约8,优选约6至约7的pH值对于制剂保持稳定是关键的。例如,如下实施例2中所示,不包括乙醇制剂的#AF3和#AF4在不管怎样的温度和湿度的条件下都表现出4周的优秀的稳定性。另外,在实施例4中,申请人意外地发现包括乙醇的制剂#A7和#A8在不管怎样的温度和湿度的条件下都表现出至少12个月的优秀的稳定性。申请人还确定一种抗氧化剂对保持长期储存的稳定性是重要的。这些结果是难以预测的因为制剂科学很难预测并且许多其他原本合适的药物制剂在使用期时是储存不稳定的。
如上所述,申请人创造的稳定的制剂包括或不包括乙醇(参见实施例1和3)。不含乙醇的制剂特别适合施用于儿童。而且,不含乙醇的制剂的特别适合处于毒品和乙醇成瘾恢复的病人。
此外,申请人创造了稳定的制剂的脂质制剂(参见实施例5)。这些制剂在储存时也意外地稳定的(参见实施例6)。
此外,申请人意外地发现基本上纯的大麻二酚的制剂特别适合治疗癫痫(参见实施例6、8、10和11),神经性疼痛(参见实施例7和图1),和多形性成胶质细胞瘤(参见实施例9和图2)。
不含乙醇的制剂
在一个实施方式中,本发明涉及口服施用的稳定的药物制剂,所述制剂包括约0.1至约50%的大麻素类化合物,约0.1至约40%的聚乙二醇,约0.1至约50%的丙二醇,和约0.1至约20%的水,其中所述制剂不包括乙醇并且制剂的pH值为约5至约8。
在一个优选的实施方式中,制剂含有约1至约40%的大麻素类化合物。在一个更优选的实施例中,制剂含有约5至约35%,约20至约35%或约30至约35%的大麻素类化合物。
在另一个实施方式中,制剂包括的大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、氢化次大麻酚(tetrahydrocannabivarin)、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。在一个优选的实施方式中,大麻素类化合物是大麻二酚。
在一个优选的实施方式中,制剂含有约1至约40%的大麻二酚。在一个更优选的实施方式中,制剂含有约5至约35%,约20至约35%或约30至约35%的大麻二酚。
在另一个实施方式中,制剂包括的基本上纯的和人造合成的大麻二酚,其中大麻二酚的纯度大于98%。在一个更优选的实施方式中,大麻二酚的纯度大于99%。在一个更优选的实施方式中,大麻二酚的纯度大于99.5%。在一个最优选的实施方式中,大麻二酚中含有不到0.3%的δ-9-四氢大麻酚。
在另一个实施方式中,制剂含有约0.001至约1%的抗氧化剂。在一个优选的实施方式中,制剂含有约0.01至约1%的抗氧化剂。在一个更优选的实施方式中,制剂含有约0.02至约0.5%的抗氧化剂。
合适的抗氧化剂包括二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素E)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸(ethylenediamino tetraaceticacid)、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠、硫代甘油和其组合物。
在另一个实施方式中,制剂含有约1至约40%的聚乙二醇。在一个优选的实施方式中,制剂含有约1至约35%,约5至约35%,约20至约30%,或约25至约30%的聚乙二醇。
合适的聚乙二醇包括平均分子量在200和10000之间的低分子量聚乙二醇。一个优选的可以使用的聚乙二醇是聚乙二醇400。
在另一个实施方式中,制剂含有约1至约40%的聚乙二醇400。在一个优选的实施方式中,制剂含有约1至约35%,约5至约35%,约20至约30%,或约25至约30%的聚乙二醇400。
在另一个实施方式中,制剂含有约1至约50%的丙二醇。在一个优选的实施方式中,制剂含有约1至约40%,约5至约35%,约20至约35%,或约30至约35%的丙二醇。
在一个另外的实施方式中,制剂包括水。制剂可以包括0%的水。如果制剂包括水,它们可以含有约1至约15%的水,约1至约10%的水,或约4至约8%的水。
制剂的pH值可以通过使用任何药物学上可接受的方法来调整。制剂优选的pH值为约5至约8。在一个优选的实施方式中,制剂的pH值为约6至约7。在一个最优选的实施方式中,制剂的pH值为约6.2至约6.7。
本发明的制剂也可以包括甜味剂、增甜剂、防腐剂、pH值调节剂、和调味剂。
合适的甜味剂包括但不限于蔗糖、阿斯巴甜、糖精、葡萄糖、甘露醇、木糖醇、和其组合物。
如果制剂包括甜味剂,制剂优选包括约0.001至约1%的甜味剂。
如果制剂包括增甜剂,制剂优选包括约0.001至约1%的增甜剂。
合适的增甜剂包括,但不限于,铵盐形式的粗制和精制的甘草酸。产品(可以从Mafco全球公司获取,Magnasweet是Mafco全球公司的注册商标)使用铵盐形式的粗制和精炼的甘草酸。甘草酸在钠和钾盐中也能以纯粹的衍生物的形式存在。
合适的pH值调节剂包括,但不限于,盐酸、抗坏血酸、柠檬酸、柠檬酸钠、富马酸、氢氧化钠、碳酸氢钠、碳酸钠、碳酸铵和其组合物。
合适的防腐剂包括,但不限于,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲醇、苯甲酸、苯甲酸钠、山梨酸和其组合物。
合适的调味剂包括但不限于覆盆子、薄荷油、葡萄香精、薄荷醇、留兰香油、柑橘油、肉桂油、草莓香精、樱桃香精、覆盆子香精、橙油、柠檬油、柠檬薄荷香精、水果宾治香精和其组合物。在一个优选的实施方式中,制剂包括草莓香精。
如果制剂含调味剂,制剂优选含有约0.001至约1%的调味剂。在一个更优选的实施方式中,制剂含有约0.005至约0.5%的调味剂。
制剂适用于口服、含服、舌下、吸入或静脉/肌内施用。优选的,制剂是液体口服施用。
含乙醇的制剂
在另一个实施方式中,发明涉及口服施用的稳定的药物制剂,含有约0.1至约40%的大麻素类化合物,约0.1至约25%的聚乙二醇,约0.1至约40%的丙二醇,任选地约0.1至约50%的水,和约0.1至约70%的乙醇,其中制剂的pH值为约5至约8。
在一个优选的实施方式中,制剂含有约1至35%的大麻素类化合物。在一个更优选的实施方式中,制剂含有约1至约15%,约5至约12%或约7至约11%的大麻素类化合物。可替代地,制剂可能含有来自约20至约35%或约30至约35%的大麻素类化合物。
在另一个实施方式中,制剂含有的大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。在一个优选的实施方式中,大麻素类化合物是大麻二酚。
在一个优选的实施方式中,制剂含有约1至约35%的大麻二酚。在一个更优选的实施方式中,制剂含有约1至约15%,约5至约12%或约7至约11%的大麻二酚。可替代地,制剂可含有约20至约35%或约30至约35%的大麻二酚。
在另一个实施方式中,制剂含有基本上纯的和人造合成的大麻二酚,其中大麻二酚的纯度大于98%。在一个更优选的实施方式中,大麻二酚的纯度大于99%。在一个更优选的实施方式中,大麻二酚的纯度是大于99.5%。在一个最优选的实施方式中,大麻二酚制剂含有的δ-9-四氢大麻酚小于0.3%。
在另一个实施方式中,制剂含有约0.001至约1%的抗氧化剂。在一个优选的实施方式中,制剂含有从约0.01至约1%的抗氧化剂。在一个更优选的实施方式中,制剂含有约0.02至0.5%的抗氧化剂。
合适的抗氧化剂包括二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素E)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠和其组合物。在一个优选的实施方式中,制剂含有α-生育酚(维生素E),抗坏血酸,抗坏血酸钠,抗坏血酸棕榈酸酯或其组合物。
在另一个实施方式中,制剂含有约1至约20%的丙二醇。在一个优选的实施方式中,制剂含有约1至约15%或约5至约10%的丙二醇。
在一个可替代的实施方式中,制剂含有约20至约50%的丙二醇。在一个优选的实施方式中,制剂含有约30至约40%或约30至约35%的丙二醇。
在另一个实施方式中,制剂含有约1至约20%的聚乙二醇。在一个优选的实施方式中,制剂含有约1至约10%或约1至约5%的聚乙二醇。
在一个可替代的实施方式中,制剂含有约10至约20%的聚乙二醇。在一个优选的可替代的实施方式中,制剂含有约15至约20%的聚乙二醇。
合适的聚乙二醇包括平均分子量在200和10000之间的低分子量聚乙二醇。一个可以使用的优选的聚乙二醇是聚乙二醇400。
在另一个实施方式中,制剂含有约1至约20%的聚乙二醇400。在一个优选的实施方式中,制剂含有约1至约10%或约1至约5%的聚乙二醇400。
在一个可替代的实施方式中,制剂含有约10至约20%的聚乙二醇400。在一个优选的可替代的实施方式中,制剂含有约15至约20%的聚乙二醇400。
在一个另外的实施方式中,制剂含有水。制剂可以含有0%的水。如果制剂含有水,他们可以含有约1至约40%的水,约5至约40%的水,约10至约35%的水或约25至约35%的水。
在另一个实施方式中,制剂含有约1至约65%的乙醇。在一个优选的实施方式中,制剂含有约10至约65%,约15至约60%,或约30至约55%的乙醇。
在一个可替代的实施方式中,制剂含有约1至约20%的乙醇。在一个优选的可替代的实施方式中,制剂含有约1至约10%或约3至约7%的乙醇。
制剂的pH值可以通过使用任何药物学上可接受的方法来调整。制剂优选的pH值是约6至约7。在一个优选的实施方式中,制剂的pH值是约6.2至约6.7。
本发明的制剂也可以含有甜味剂、增甜剂、防腐剂、pH值调节剂、和调味剂。
合适的甜味剂包括但不限于蔗糖,阿斯巴甜,糖精,葡萄糖,甘露醇,木糖醇和其组合物。
如果制剂含有甜味剂,制剂优选含有约0.001至约1%的甜味剂。
合适的增甜剂包括,但不限于,铵盐形式的粗制和精制的甘草酸。产品(可以从Mafco全球公司获取,Magnasweet是Mafco全球公司的注册商标)使用铵盐形式的粗制和精炼的甘草酸。甘草酸在钠和钾盐中也能以纯粹的衍生物的形式存在。
如果制剂含有增甜剂,制剂优选含有约0.001至约1%的增甜剂。
合适的pH值调节剂包括,但不限于,盐酸、抗坏血酸、柠檬酸、柠檬酸钠、富马酸、氢氧化钠、碳酸氢钠、碳酸钠、碳酸铵和其组合物。
合适的防腐剂包括,但不限于,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲醇、苯甲酸、苯甲酸钠、山梨酸及其组合物。
合适的调味剂包括但不限于覆盆子、薄荷油、葡萄香精、薄荷醇、留兰香油、柑橘油、肉桂油、草莓香精、樱桃香精、覆盆子香精、橙油、柠檬油、柠檬薄荷香精、水果宾治香精和其组合物。在一个优选的实施方式中,制剂含有水果宾治香精、覆盆子香精、葡萄香精或柠檬薄荷香精。
如果制剂含有调味剂,制剂优选含有约0.001至约1%的调味剂。在一个更优选的实施例中,制剂含有约0.005至约0.5%的调味剂。
制剂适用于口服、含服、舌下、吸入或静脉/肌内施用。优选的,制剂是液体施用的口服药物。
含有脂质的制剂
在另一个实施方式中,本发明涉及口服施用的稳定的药物制剂,含有约0.1至约40%的大麻素类化合物和约10至约40%的脂类。
在一个优选的实施方式中,脂质选自由芝麻油、橄榄油、玉米油、向日葵油、红花油、亚麻油、杏仁油、花生油、核桃油、腰果油、蓖麻油、椰子油、棕榈油、大豆油、菜籽油、植物油、米糠油、中链甘油酯、癸酰酸甘油酯(decanoyl glycerides)、辛酰酸甘油酯(octanoylglycerides)、辛酸/癸酸甘油三酯、油酰酸聚乙二醇-6甘油酯(oleoyl polyoxyl-6glycerides)、亚油酰酸聚乙二醇-6甘油酯(linoleoyl polyoxyl-6glycerides)、聚甘油-3二油酸酯、甘油单亚油酸酯、甘油单辛酸酯、油酸及其组合组成的组。在一个优选的实施方式中,脂质选自由芝麻油、向日葵油、大豆油、玉米油、癸酰酸甘油酯和辛酰酸甘油酯的混合物、和其组合物构成的组。
脂类的合适的商业来源包括癸酰酸和辛酰酸甘油酯(脂肪酸酯)专有混合物的812N和也包括取自椰子油的癸酰酸和辛酰酸脂肪酸专有混合物的810N(Miglyol购自Cremer Oleo GmbH&Co.并且是其注册商标)。
在另一个实施方式中,制剂所含的大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。在一个优选的实施方式中,大麻素类化合物是大麻二酚。
在另一个实施方式中,制剂含有基本上纯的人造合成大麻酚,其中大麻酚的纯度大于98%。在一个更优选的实施方式中,大麻二酚的纯度大于99%。在一个更优选的实施方式中,大麻二酚的纯度大于99.5%。在一个最优选的实施方式中,大麻二酚制剂包括的δ-9-四氢大麻酚小于0.3%。
在一个优选的实施方式中,制剂含有约1至约35%的大麻二酚。在一个更优选的实施方式中,制剂含有约10至约32%的大麻二酚。在一个最优选的实施方式中,制剂含有约17至约29%的大麻二酚。
在一个优选的实施方式中,制剂含有约20至约90%的脂质。在一个更优选的实施方式中,制剂含有约50至约90%的脂质。在一个最优选的实施方式中,制剂含有约60至约85%的脂质。
在另一个实施方式中,制剂含有乙醇。制剂可以含有0%的乙醇。如果制剂包括乙醇,它们可以含有约0.1至约20%的乙醇。在一个优选的实施方式中,制剂含有约3至约17%的乙醇。在一个更优选的实施方式中,制剂含有约5至约15%的乙醇。
在另一个实施方式中,制剂含有抗氧化剂。制剂可以含有0%抗氧化剂。如果制剂含有抗氧化剂,它们可以含有约0.01至约1%的抗氧化剂。在一个优选的实施方式中,制剂含有约0.02至约0.5%的抗氧化剂。在一个更优选的实施方式中,制剂含有约0.03至约0.1%的抗氧化剂。
合适的抗氧化剂包括二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素E)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠、和其组合物。在一个优选的实施方式中,抗氧化剂包括α-生育酚(维生素E)、抗坏血酸、抗坏血酸钠、抗坏血酸棕榈酸酯或其组合物。
合适的甜味剂包括但不限于蔗糖、阿斯巴甜、糖精、葡萄糖、甘露醇、木糖醇和其组合物。
如果制剂含有甜味剂,制剂优选含有约0.1至约2%的甜味剂。在一个优选的实施方式中,制剂优选含有约0.1至约0.8%的甜味剂。在一个最优选的实施方式中,制剂优选含有约0.2至约0.5%的甜味剂。
合适的增甜剂包括,但不限于,铵盐形式的粗制和精制的甘草酸。产品(可以从Mafco全球公司获取,Magnasweet是Mafco全球公司的注册商标)使用铵盐形式的粗制和精炼的甘草酸。甘草酸在钠和钾盐中也能以纯粹的衍生物的形式存在。
如果制剂含有增甜剂,则制剂优选含有约0.001至约1%的增甜剂。
合适的pH值调节剂包括,但不限于,盐酸、抗坏血酸、柠檬酸、柠檬酸钠、富马酸、氢氧化钠、碳酸氢钠、碳酸钠、碳酸铵和其组合物。
合适的防腐剂包括,但不限于,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲醇、苯甲酸、苯甲酸钠、山梨酸和其组合物。
合适的调味剂包括但不限于覆盆子、薄荷油、葡萄香精、薄荷醇、留兰香油、柑橘油、肉桂油、草莓香精、樱桃香精、覆盆子香精、橙油、柠檬油、柠檬薄荷香精、水果宾治香精、和其组合物。
如果制剂含有调味剂,制剂优选含有约0.001至约1%的调味剂。在一个更优选的实施方式中,制剂含有约0.005至约0.5%的调味剂。
制剂适用于口服、含服、舌下、吸入或静脉/肌内施用。优选的,制剂是液体施用的口服药物。
使用本发明的制剂(包括乙醇的,不包括乙醇的和脂质)和人造合成的、基本上纯
的,大麻二酚的示例
本发明的制剂特别适用于治疗许多疾病或病症或疾病和病症的症状。此外,人造合成的和基本上纯的大麻二酚更有效并且适合用于治疗这些疾病或疾病的症状。
如在美国专利申请号62/004,495中首先描述的,申请人意外地创造了用于制备大麻二酚的新的人造的途径。这新的方法消除了为了提取化合物而种植大麻的需要。申请人的大麻二酚具有高纯度水平,并且基本上不包括表I药物,包括δ-9-四氢大麻酚。
申请人化学合成大麻二酚是通过将对-薄荷二烯醇(p-Menthadienol)和橄榄醇在甲苯或二氯甲烷或己烷中与对甲苯磺酸催化剂组合来制备大麻二酚(参见下图)。
在一个实施方式中,本发明涉及治疗脑肿瘤的方法,所述方法包括施用本发明的制剂于有需要的患者。
在另一个实施方式中,本发明涉及治疗脑肿瘤的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及治疗神经胶质瘤的方法,所述方法包括施用本发明的制剂于有需要的患者。
在另一个实施方式中,本发明涉及治疗神经胶质瘤的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗多形性成胶质细胞瘤的方法,所述方法包括施用本发明的制剂于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗多形性成胶质细胞瘤的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗Dravet综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗Dravet综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在另一个实施方式中,本发明涉及治疗Lennox Gastaut综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。
在另一个实施方式中,本发明涉及治疗Lennox Gastaut综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外的实施方式中,本发明涉及治疗肌阵挛性痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个更优选的实施方式中,不包括乙醇的制剂包括基本上纯的大麻二酚。
在另一个实施方式中,本发明涉及治疗肌阵挛性痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外的实施方式中,本发明涉及用于治疗青少年肌阵挛性癫痫的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及用于治疗青少年肌阵挛性癫痫的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及治疗顽固性癫痫的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及治疗顽固性癫痫的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗青少年痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及用于治疗青少年痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及治疗韦斯特综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及治疗韦斯特综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及治疗婴儿痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及治疗婴儿痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及治疗顽固性婴儿痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及治疗顽固性婴儿痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及治疗管状硬化综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含乙醇的制剂施用于有治疗需要的年轻患者。
在另一个实施方式中,本发明涉及治疗管状硬化综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外的实施方式中,本发明涉及治疗神经性疼痛的方法,所述方法包括施用本发明的制剂于需要的患者。在另一个实施方式中,神经性疼痛由神经毒性化疗剂如紫杉醇,多烯紫杉醇,顺铂,奥沙利铂,卡铂,长春新碱,氨甲蝶呤,阿糖胞苷,氟尿嘧啶,异环磷酰胺,环磷酰胺,甲基苄肼,依托泊苷,卡莫司汀和洛莫司汀引起的。在另一个实施方式中,神经性疼痛由紫杉醇引起,并且患者由于乳腺,子宫颈,子宫内膜和/或卵巢癌的诊断而接受紫杉醇。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是耐铂性的。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是复发性的。
在另一个实施方式中,本发明涉及治疗神经性疼痛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,神经性疼痛由神经毒性化疗剂如紫杉醇,多烯紫杉醇,顺铂,奥沙利铂,卡铂,长春新碱,氨甲蝶呤,阿糖胞苷,氟尿嘧啶,异环磷酰胺,环磷酰胺,甲基苄肼,依托泊苷,卡莫司汀和洛莫司汀引起的。在另一个实施方式中,神经性疼痛由紫杉醇引起,并且患者由于乳腺,子宫颈,子宫内膜和/或卵巢癌的诊断而接受紫杉醇。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是耐铂性的。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是复发性的。
在另一个实施方式中,本发明涉及使用大麻二酚作为止痛剂的方法,所述方法包括施用本发明的制剂于有需要的患者。
在另一个实施方式中,本发明涉及使用大麻二酚作为止痛剂的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗阿片类药物成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗阿片类药物成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗可卡因成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗可卡因成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外实施方式中,本发明涉及用于治疗海洛因成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗海洛因成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外实施方式中,本发明涉及用于治疗尼古丁成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗尼古丁成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外实施方式中,本发明涉及用于治疗安非他命成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗安非他命成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗痤疮的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗痤疮的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗帕金森病的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗帕金森病的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗精神分裂症的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗精神分裂症的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗社交焦虑症的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗社交焦虑症的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外的实施方式中,本发明涉及用于治疗抑郁症的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗抑郁症的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个另外的实施方式中,本发明涉及用于治疗遭遇不良情绪刺激的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗遭遇不良情绪刺激的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗恶心的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗恶心的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗多发性硬化的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗多发性硬化的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗大麻使用障碍症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗大麻使用障碍症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗早期精神病症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗早期精神病症状症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗阿尔茨海默病症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗阿尔茨海默病症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在另一个实施方式中,本发明涉及用于治疗创伤后应激障碍(“PTSD”)症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗创伤后应激障碍症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗焦虑症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗焦虑症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
在一个实施方式中,本发明涉及用于治疗自闭症症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。
在另一个实施方式中,本发明涉及用于治疗自闭症症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。
定义
如本文所述,“患者”指的是单个患者而不是患者群体。
如本文所述,“人造”指的是化学合成的大麻二酚不是从大麻植物材料中提取的大麻二酚。
如本文所述用语,“基本上纯的”指的是从大麻植物材料提取的具有色谱纯度大于98%,优选大于98.5%,更优选大于99.0%,最优选大于99.5%的大麻二酚。
如本文所述,“基本上不包括δ-9-四氢大麻酚”指的是通过HPLC测定的具有小于0.3%的δ-9-四氢大麻酚的大麻二酚制剂。优选地,制剂包括小于0.25%的δ-9-四氢大麻酚,更优选0.2%,并且最优选小于0.1%的δ-9-四氢大麻酚。
如本文所述,与量,重量等相关的数值,被定义的“约”是每个特定值的所有数值加或减10%。例如,用语“约10%w/w”应理解为“9%w/w至11%w/w”。因此,权利要求值中的数量10%包括在权利要求的范围内。
如本文所述,“液体”指的是可流动的流体药物制剂。这种类型的制剂不是粉末固体。
本文中所述的重量指的是总制剂的%w/w或重量百分比。
如本文所述,用语“有效量”指的是治疗有需要的患者所需的量。
如本文所述,用语“药物学上可接受的”指的不是在口服制剂中的生物学或另外其它方面不期望的成分。
如本文所述,“qs”表示能达到所需的体积或浓度的足够量的组分。
公开的实施方式仅仅是本文公开的发明构思的示例性实施例,并且不应被认为是限制性的,除非权利要求另有明确说明。
以下实施方式旨在说明本发明并教导本领域普通技术人员如何使用本发明的制剂。它们不旨在以任何方式进行限制。
本发明的所有权利要求,所有方面和实施方式和其具体示例旨在涵盖其等同物。
实施例
实施例1.不含乙醇的制剂
表1中的制剂如下制备。所有溶剂在用于生产之前用氮气净化。将维生素E,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯溶解在丙二醇中。将聚乙二醇400(PEG400)和调味剂加入到丙二醇溶液中并充分混合。通过将三氯蔗糖和抗坏血酸钠溶解在水中来制备水相。接下来,将溶液合并,并使用pH值调节剂调节pH值。将大麻素类化合物加入到赋形剂溶液中并混合直至溶解。
使用人造合成的,基本上纯的大麻二酚作为大麻素类化合物。
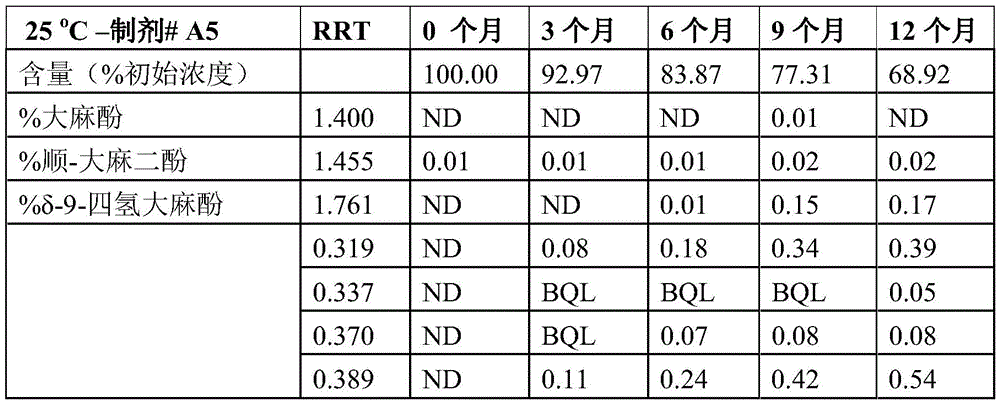
使用草莓香精作为调味剂。
表1.不含乙醇的制剂
实施例2.不含乙醇制剂的稳定性
表1中所列的制剂在55℃±2℃,40℃±2℃,75%±5%相对湿度和25℃±2℃,60%±5%相对湿度的条件下的稳定性。通过在特定的时间点评价其效力(测定值)和杂质水平来分析制剂的稳定性。使用具有紫外检测器的高效液相色谱法检测含量和杂质。该含量在228nm下进行并表示为%初始浓度。对于所有杂质,在228nm进行分析并表示为%面积。以每种制剂的面积的百分比的表示的特定杂质的量总杂质的量列于表2至13中。每种杂质的相对保留时间(RRT)被给出。
表2.在55℃±2℃储存的大麻二酚口服溶液制剂#AF1的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表3.在55℃±2℃储存的大麻二酚口服溶液制剂#AF2的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表4.在55℃±2℃储存的大麻二酚口服溶液制剂#AF3的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表5.储存在55℃±2℃的大麻二酚口服溶液制剂#AF4的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表6.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF1的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表7.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF2的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表8.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF3的稳定性数据
ND-未检测到
表9.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF4的稳定性数据
| 40℃-制剂#AF4 | RRT | 0周 | 2周 | 4周 |
| 含量(%初始浓度) | 100.00 | 99.63 | 99.50 | |
| %顺-大麻二酚 | 1.437 | 0.01% | 0.01% | 0.01% |
| %反-(1R,6R)-3'-甲基-大麻二酚 | 1.840 | 0.05% | 0.05% | 0.06% |
| %未知杂质 | 0.776 | 0.07% | 0.07% | 0.08% |
| 总杂质(%面积) | 0.13% | 0.13% | 0.15% |
表10.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF1的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表11.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF2的稳定性数据
| 25℃-制剂#AF2 | RRT | 0周 | 4周 |
| 含量(%初始浓度) | 100.00 | 100.22 | |
| %顺-大麻二酚 | 1.442 | 0.01% | 0.01% |
| %反-(1R,6R)-3'-甲基-大麻二酚 | 1.848 | 0.05% | 0.05% |
| %未知杂质 | 0.776 | 0.07% | 0.07% |
| 总杂质(%面积) | 0.13% | 0.13% |
表12.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF3的稳定性数据
| 25℃-制剂#AF3 | RRT | 0周 | 4周 |
| 含量(%初始浓度) | 100.00 | 97.52 | |
| %顺-大麻二酚 | 1.442 | 0.01% | 0.01% |
| %反-(1R,6R)-3'-甲基-大麻二酚 | 1.846 | 0.05% | 0.05% |
| %未知杂质 | 0.775 | 0.06% | 0.08% |
| 总杂质(%面积) | 0.12% | 0.14% |
表13.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#AF4的稳定性数据
对照制剂(#AF1)显示出总杂质水平的显着增加和含量值的降低。与对照制剂相比,将制剂(#AF2)的pH值调节在约6至约7的范围内提高了制剂的稳定性。这说明pH值在大麻素类化合物制剂的稳定性中起关键作用。申请人确定约6至约7的pH值可获得最佳稳定性。加入抗氧化剂以及pH值调节剂进一步提高了大麻素类化合物制剂的稳定性。例如,包括抗氧化剂和pH值调节剂的制剂#AF3和#AF4在温度和湿度条件下显示出持续4周的优异的稳定性。
实施例3.含乙醇制剂
表14和15中的制剂如下制备。所有溶剂在用于生产之前用氮气净化。将维生素E,抗坏血酸棕榈酸酯,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯,三氯蔗糖溶于乙醇。丙二醇,聚乙二醇400,甘油,调味剂和水加入到溶液中并充分混合。然后,如果适用,使用pH值调节剂调节溶液的pH值。将大麻素类化合物加入赋形剂溶液中并混合直至完全溶解。
使用人造合成的,基本上纯的大麻二酚作为大麻素类化合物。使用草莓香精作为调味剂。
表14.含乙醇的制剂
表15.额外含乙醇的制剂
| 制剂 | #A9 | #A10 |
| 大麻素类化合物 | 32 | 32 |
| 聚乙二醇400 | 18.8 | 23.8 |
| 丙二醇 | 39 | 39 |
| 乙醇 | 5 | |
| 大麻素类化合物 | 5 | 5 |
| 维生素E(α-生育酚) | 0.05 | 0.05 |
| 棕榈酸抗坏血酸酯 | 0.1 | 0.1 |
| 三氯蔗糖 | 0.05 | 0.05 |
| 对羟基苯甲酸甲酯 | 0.02 | 0.02 |
| 对羟基苯甲酸丙酯 | 0.02 | 0.02 |
实施例4.含乙醇制剂的稳定性
表14和表15中所列的制剂在25℃±2℃,60%±5%相对湿度和40℃±2℃,75%±5%相对湿度的条件下的稳定性。通过在特定的时间点评价其效力(测定值)和杂质水平来分析制剂的稳定性。使用具有紫外检测器的高效液相色谱法检测含量和杂质。该测定在228nm下进行并表示为%初始浓度。对于所有杂质,在228nm进行分析并表示为%面积。以每种制剂的面积的百分比的表示的特定杂质的量总杂质的量列于表16至22中。每种杂质的相对保留时间(RRT)被给出。
表16.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#A5的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表17.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#A6的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表18.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#A7的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表19.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#A8的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表20.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#A7的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表21.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#A8的稳定性数据
ND-未检测到
BQL-低于定量限,仅限未知杂质
表22.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#A9的稳定性数据
| 40℃–制剂#A9 | RRT | 0周 | 2周 | 4周 |
| 含量(%初始浓度) | 100.00 | 99.77 | 100.65 | |
| %顺-大麻二酚 | 1.440 | 0.01 | 0.01 | 0.01 |
| %反-(1R,6R)-3'-甲基-大麻二酚 | 1.841 | 0.05 | 0.06 | 0.05 |
| %未知杂质 | 0.770 | 0.06 | 0.07 | 0.08 |
| 总杂质(%面积) | 0.12 | 0.14 | 0.14 |
表23.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#A10的稳定性数据
ND-未检测到
对照制剂(#A5)显示出总杂质水平的显着增加和测定值的降低。添加抗氧化剂,维生素E和抗坏血酸棕榈酸酯(参见#A6)显着提高了制剂的稳定性。这些结果说明抗氧化剂在稳定的大麻素类化合物制剂中的关键作用。抗氧化剂维生素E和抗坏血酸(或其盐)显示出优异的协同作用,因为抗坏血酸(或其盐)通过再生而强烈抑制维生素E的消耗。与抗氧化剂一起,加入pH值调节剂以将pH值调节至6至7的范围导致异常稳定的制剂(#A7和#A8)。稳定性测试数据说明约6至约7的pH值范围是关键的。制剂#A9和#A10在四周后也显示出良好的稳定性。
实施例5.含脂质制剂
表24中的制剂通过将所有固体和液体赋形剂混合在脂质中来制备。然后溶解大麻二酚。人造合成的,基本上纯的,大麻二酚用作大麻素类化合物的来源。草莓被用作调味剂的来源。
表24.含脂质的制剂
实施例6.含脂质的制剂的稳定性
制剂#LF1在25℃±2℃,60%±5%相对湿度和40℃±2℃,75%±5%相对湿度条件下的稳定性。通过在特定的时间点评价其效力(测定值)和杂质水平来分析制剂的稳定性。使用具有紫外检测器的高效液相色谱法检测含量和杂质。该含量在228nm下进行并表示为%初始浓度。对于所有杂质,在228nm进行分析并表示为%面积。以每种制剂的面积的百分比的表示的特定杂质的量以及总杂质的量列于表25中。每种杂质的相对保留时间(RRT)被给出。
表25.在40℃±2℃下75%±5%相对湿度下储存和在25℃±2℃下在60%±5%相对湿度下储存的大麻二酚口服溶液制剂#LF1的三个月稳定性数据
| 制剂#LF1 | RRT | 0个月 | 3个月-40℃ | 3个月25℃ |
| 含量(%初始浓度) | 100.00 | 100.87 | 100.72 | |
| %顺-大麻二酚 | 1.437 | 0.03 | 0.04 | 0.04 |
| %δ-9-四氢大麻酚 | 1.736 | 0.06 | 0.06 | 0.08 |
| %反-(1R,6R)-3'-甲基-大麻二酚 | 1.840 | 0.02 | 0.06 | 0.02 |
| 总杂质(%面积) | 0.11 | 0.16 | 0.14 |
如上表25中所述,含芝麻油的制剂#LF1在25℃±2℃/60%±5%相对湿度和40℃±2℃/75%±5%相对湿度的两个储存条件下3个月后显示出良好的稳定性。
实施例7.紫杉醇诱导的神经性疼痛的研究
紫杉醇是对几种类型的癌症包括卵巢,乳腺,肺和头部和颈部具有活性的抗肿瘤剂。紫杉醇的作用是通过促进微管组装,可以导致神经病变的毒副作用。外周感觉神经病变是紫杉醇最常报道的神经毒性副作用,并且当单独施用或与其它神经毒性抗肿瘤剂例如顺铂一同施用时,限制了高剂量和累积剂量的紫杉醇的治疗。目前对于这种类型的疼痛没有高度有效的治疗。因此,需要高度有效的治疗以缓解紫杉醇诱发的神经病的症状。
进行小鼠研究以确定大麻二醇,δ-9-四氢大麻酚和大麻二酚加上δ-9-四氢大麻酚组合物对减轻由化疗诱导的周围神经病变引起的神经性疼痛的作用。给小鼠施用的大麻二酚是基本上纯的,人造合成的大麻二酚,其纯度大于98%。
图1的详细说明如下。Y轴表示对机械刺激的阈值灵敏度,表示为基线灵敏度的百分比。X轴代表腹膜内施用的药物mg/kg的剂量。而点状线表示对盐水对照的机械刺激的戒断阈值水平,短划线代表紫杉醇治疗的动物。沿短划线的点表示神经性疼痛,而沿点状线的点表示对神经性疼痛的保护。所显示的数据是在治疗后第21天测量的平均值+SEM敏感性。通过单因素ANOVA测定的盐水对照的*p<0.05。
当一起加入时会产生的加和效应水平,特定剂量的试剂产生了类似的明显行为效应。
例子:
1)如果1.25mg/kg大麻二酚产生100%的疼痛作用减轻,1.25mg/kgδ-9-四氢大麻酚产生0%作用,那么一起加入的那些剂量应该是完全有效的(2.5mg/kg大麻二酚+2.5mg/kgδ-9-四氢大麻酚)。
2)如果0.625mg/kg大麻二酚和0.625δ-9-四氢大麻酚产生0%效果,那么它们剂量的组合应该是无效的。
申请人发现(如图1所示),与δ-9-四氢大麻酚相比,单独施用的大麻二酚提供了减轻化疗诱发的神经性疼痛的最有效水平。存在的δ-9-四氢大麻酚取决于其浓度可以抑制大麻二酚减轻神经性疼痛的能力。δ-9-四氢大麻酚阻断大麻二酚的疼痛缓解活性的能力也取决于大麻二酚的浓度。该试验说明非常需要基本上纯的大麻二酚制剂。
实施例8.抗痉挛研究
本研究如下进行,根据抗痉挛药筛选的标准模型,其包括最大电休克试验(“MES”),最小阵挛性发作发作(“6Hz”)试验和毒性评价(“TOX”)。将数据记录为所测试的动物数目(F)中受保护的动物数目(N),参见下表26至29。该试验重复一次。施用于小鼠和大鼠的大麻二酚是基本上纯的,人造合成的大麻二酚,其纯度大于98%。将大麻二酚溶解于0.5%甲基纤维素或1:1:18比例的乙醇:聚乙氧基化蓖麻油:磷酸盐缓冲盐水(“PBS”)中。
最大电休克试验是一般性强直阵挛性发作的模型,并且提供了当脑中所有神经元回路最大活性时化合物预防痉挛发作扩散的能力的指示。这些发作是高度可再现的,并且在电生理学上与人的痉挛发作一致。对于基于最大电休克痉挛的所有测试,通过用包括麻醉剂(0.5%盐酸丁卡因)的电解质溶液引发的角膜电极递送60Hz的交流电流(小鼠中50mA,大鼠中150小时)0.2s。通过在腹膜内以0.01mL/g体积计注射的10,30和100mg/kg剂量的大麻二酚后,在不同的时间间隔测试小鼠。在消除痉挛发作的后肢强直伸肌部分时,动物被认为“受保护”免受最大电休克诱导的痉挛发作。
使用最小运动损伤测试来测定化合物的不期望的副作用或毒性。在该测试期间,监测动物的神经功能或肌肉功能受损的明显迹象。旋转程序用于公开最小的肌肉或神经损伤。当将对照小鼠放置在以6rpm的速度旋转的杆上时,动物可以长时间保持其平衡。如果动物在60秒期间从该旋转棒上脱落三次,则认为该动物是中毒的。除了最小的运动障碍之外,动物可能展示出圆形或之字形步态,身体姿势异常和腿部伸展,震颤,多动,缺乏探索行为,嗜睡,昏迷,僵住症,放置反应丧失和肌肉张力变化。
第三个测试是最小阵挛性发作(6Hz)测试。类似于最大电休克试验,最小阵挛性发作(6Hz)试验用于评价化合物对电诱发性发作的功效,使用较低频率(6Hz)和较长的刺激持续时间(3s)。通过腹膜内注射向小鼠预施用大麻二酚。在不同时间,通过用角膜电极递送的足够电流处理个体小鼠(每个时间点4只),为了在97%的动物中引起精神运动性发作(32mA,持续3s)。未治疗的小鼠将显示以最小克隆阶段为特征的痉挛发作,随后是定型的自动行为,最初描述为类似于具有部分发作的人类患者的预兆。表现出这种行为的动物不被认为是受保护的。
表26.抗痉挛药物筛选,小鼠,甲基纤维素
表27.抗痉挛药物筛选,小鼠,乙醇:聚乙氧基化蓖麻油:PBS
表28.抗痉挛筛查,大鼠,甲基纤维素
表29.抗痉挛筛查,大鼠,乙醇:聚乙氧基化蓖麻油:PBS
实施例9.多形性成胶质细胞瘤研究
在使用U87细胞的多形性成胶质细胞瘤的原位小鼠模型中,进行研究以确定大麻二酚或大麻二酚加上δ-9-四氢大麻酚(大麻二酚/δ9-四氢大麻酚1:1)可抑制多形性成胶质细胞瘤发展并增强替莫唑胺活性的全身施用的程度,替莫唑胺是一种化疗药物。上述建议的大麻二酚加δ-9-四氢大麻酚的组合是指向源自U87血清源性多形性成胶质细胞瘤细胞的肿瘤最有效的疗法。
研究如下进行。将人U87萤光素酶标记的细胞在具有10%胎牛血清的RoswellPark Memorial Institute培养基中生长,然后从培养皿中收获,之后在具有0.1%胰蛋白酶/乙二胺四乙酸的培养物中培养指数生长期,并用无血清的Roswell Park MemorialInstitute培养基洗涤两次。对于颅内模型,在4μl的Roswell Park Memorial Institute培养基中,通过颅内注射0.3×106个U87细胞以雌性无胸腺nu/nu小鼠中产生肿瘤。使用此模型,您可以评估药物功效(体内成像)以及同一组动物的生存。根据国家卫生研究院的指南进行存活研究,包括实验性瘤形成和我们批准的机构动物护理和使用委员会协议。当组中的动物显示出任何单一征兆象征着显着的肿瘤负荷发育,包括聚集,持续降低的一般活性或重量显着降低,从研究中移除所有组中的动物。在限制肿瘤能够逃离颅内空间的条件下,当通过卡尺评估外部肿瘤测量大于5mm时,对小鼠实施安乐死。此外,将肿瘤测量>500×106辐射的小鼠从研究中移除,即使没有观察到症状以确保发生与痉挛发作相关的自发性死亡,没有存在大颅内肿瘤。
将大麻素类化合物溶解在3%乙醇,3%表面活性剂和94%盐水的混合物中,并将替莫唑胺溶解在30%二甲基亚砜和70%盐水中。在本研究中使用人造合成的和基本上纯的大麻二酚。在注射肿瘤细胞9天后开始治疗。在第一次注射前的早晨对小鼠成像以确定初始肿瘤大小,然后将组安排在第一次注射开始之前具有相等的肿瘤大小分布。用替莫唑胺对小鼠每天一次治疗5天。除了研究的第一周(小鼠在周末接受注射)外,以每天一次,每周5天(周一至周五)用大麻素类化合物治疗小鼠,直到研究完成。所有小鼠通过腹膜内注射施用治疗。每组12只小鼠,总共72只小鼠。治疗量如下:大麻二酚(15mg/kg);大麻二酚/δ-9-四氢大麻酚(1:1,共15mg/kg);和替莫唑胺(2mg/kg腹膜内注射。
使用单因素方差分析(one-way ANOVA)确定显着性差异。适当时进行Bonferroni-Dunn事后分析。使用长排Mantel-Cox试验比较组间的存活率。P值<0.05定义的统计学意义。
图2的详细解释如下。X轴表示治疗后的天数,Y轴表示存活率。
如图2所示。单独的15mg/kg大麻二酚或大麻二酚/δ-9-四氢大麻酚(1:1)不抑制多形性成胶质细胞瘤发育,其能增强次优剂量的替莫唑胺的抗肿瘤活性,导致存活率的显着增加。此外,基本上纯的,人造合成的大麻二酚呈现20%肿瘤的完全消退。在1:1大麻二酚:δ-9-四氢大麻酚治疗后没有观察到这种效果。意想不到的是基本上纯的,人造合成的大麻二酚具有这些效果,因为以前认为1:1比例的大麻二酚(从大麻中提取并且不是基本上纯的):δ-9-四氢大麻酚将产生比单独的大麻二酚更好的效果。然而,该研究再次说明了申请人的基本上纯的,人造合成的大麻二酚的优越性。
实施例10.6Hz精神运动性发作试验
进行该研究以确定人造合成的,基本上纯的大麻二酚阻断由长持续时间频率(6Hz)刺激诱导的精神运动性发作的能力。这是对于治疗抗性部分发作的研究模型。
用100mg/kg剂量的大麻二酚腹膜内预处理成年雄性CF1小鼠(体重18至25g)。给小鼠施用的大麻二酚基本上是纯的,人造合成的大麻二酚,其纯度大于98%。将大麻二酚溶解在0.5%甲基纤维素或1:1:18比例的乙醇:聚乙氧基化蓖麻油:PBS中。
在用大麻二酚处理后的五个时间点(1/4,1/2,1,2和4小时)之一检查每个治疗组(n=4只小鼠/组)的抗痉挛作用。在预处理后,每只小鼠接受一滴0.5%盐酸丁卡因,施用于每只眼。然后用通过角膜电极递送的低频(6Hz)刺激3秒来处理小鼠。低频,长持续时间刺激最初以32mA强度递送。手动限制动物,并在刺激后立即释放,并观察痉挛活动。如果测试化合物在32mA筛选中有效,那么使用与上述相同的方案使用其中刺激电流增加至44mA的另外的测定。此外,可以在特定刺激强度的峰值效应(TPE)时生成剂量反应曲线。
通常,6Hz刺激导致痉挛发作,其特征在于最小的阵挛期,随后是定型的,自动行为,包括触须的颤搐和Straub-tail(斯特劳布举尾)。不显示这些行为的动物被认为是被保护的。通过Mann-Whitney U检验分析数据,p<0.05确定为具有统计学显着性。
对于每个时间组,结果表示为随着时间的推移,从受试的动物数量中被保护的动物总数(即2/4表示受试的4只小鼠中的2只被保护)。
表30.ED50生物反应,甲基纤维素
表31.到峰值效应的时间,甲基纤维素
表32.ED50生物反应,乙醇:聚乙氧基化蓖麻油:PBS
| 测试 | 剂量 | 时间 | N/F |
| 6Hz | 50 | 0.5 | 1/8 |
| 6Hz | 100 | 0.5 | 1/8 |
| 6Hz | 130 | 0.5 | 4/8 |
| 6Hz | 170 | 0.5 | 6/8 |
| 6Hz | 200 | 0.5 | 8/8 |
| TOX | 200 | 2 | 0/8 |
| TOX | 250 | 2 | 4/8 |
| TOX | 300 | 2 | 6/8 |
| TOX | 500 | 2 | 8/8 |
表33.达到峰值效应的时间,乙醇:聚乙氧基化蓖麻油:PBS
如表30至33所示,两种溶剂中的大麻二酚在100mg/kg范围内在50%动物中抑制痉挛发作(ED50s)显示出的可比的半数有效剂量。虽然溶解在甲基纤维素溶剂中的大麻二酚的ED 50为103.75mg/kg(95%置信区间为53.89mg/kg至163.84mg/kg),但当溶解于1:1:18的乙醇:聚乙氧基化蓖麻油:PBS溶剂(95%置信区间为87.83mg/kg至152.96mg/kg)时显示出121.52mg/kg的ED 50。基于甲基纤维素溶剂中大麻二酚的毒性数据,50%动物(“TD50”)中观察到毒性的中间毒性剂量在施用后0.5小时被确定超过500mg/kg。测试的最高剂量,在24小时500mg/kg下报告于24小时腹泻和1死亡。
TD50被确定为具有溶解在1:1:18的乙醇:聚乙氧基化蓖麻油:PBS溶剂中的大麻二酚的262.37mg/kg(95%置信区间为232.64至301.78)。在24小时以300mg/kg报告死亡,在6和24小时以500mg/kg报告死亡,其中使用1:1:18的乙醇:聚乙氧基化蓖麻油:PBS溶剂。
这些结果进一步说明大麻二酚可能在人体中有效用于治疗痉挛和其他病症。此外,人造合成的大麻二酚可能比源自植物且不是基本上纯的大麻二酚毒性更小。
实施例11.最大电休克痉挛发作和皮下注射卡地阿唑
最大电休克痉挛发作(“MES”)和皮下注射卡地阿唑(“sc Met”)试验是用于研究抗痉挛药物的早期鉴定和高通量筛选的两种最广泛使用的临床痉挛模型。这些测试在鉴定可用于治疗人类全身性强直阵挛性痉挛和广泛性肌阵挛性痉挛发作的新的抗痉挛药物中极为有效。MES试验提供了当脑中所有神经元回路最大活性时防止痉挛发作扩散的能力的指示。sc Met测试检测CBD提高动物的化学痉挛诱发的发作阈值的能力,并因此保护其不表现出阵挛性前脑发作。
对于MES测试,60Hz的交流电通过角膜电极递送0.2秒。用诱发阈值强直性延伸痉挛发作所必需的5倍的电流强度引发最大痉挛发作,即小鼠中50mA,大鼠中150mA。在将角膜电极施加到眼睛之前,将一滴麻醉剂溶液(0.5%盐酸丁卡因)放置在每只动物的眼睛上,以引起电刺激。用手限制动物,并在刺激后立即释放,以允许观察整个发作。抑制后腿紧张伸肌部分作为MES试验的终点。
一定剂量的卡地阿唑(在小鼠中为85mg/kg)将在97%的小鼠(CD97)中诱发痉挛。将CD97剂量的卡地阿唑注射到颈部中线的松弛的皮肤皱褶中。每年确认小鼠中卡地阿唑的CD97剂量。它以体重的0.01ml/g体积施用于小鼠。然后将动物置于隔离笼中以使应激最小化,并连续监测下一个30分钟是否存在发作。将前肢和/或后肢,颌或触须的阵挛痉挛发作约3至5秒作为终点。不显示前肢和/或后肢阵挛,下巴咬响或触须颤搐的动物认为是被保护的。
所有定量体内抗痉挛/行为障碍研究通常在先前测定的TPE下进行。使用各种剂量的大麻二酚测试至少8只小鼠的组,直到在100%保护或最小毒性和0%保护或最小毒性的限度之间建立至少两个点。在每个试验中在50%动物中产生所需终点(ED 50或TD 50)所需的药物剂量,95%置信区间,回归线的斜率,然后通过概率分析计算斜率的平均值的标准误差(S.E.M.)。
给小鼠施用的大麻二酚是基本上纯的,人造合成的大麻二酚,其纯度大于98%。将大麻二酚溶解在0.5%甲基纤维素或1:1:18比例的乙醇:聚乙氧基化蓖麻油:PBS中。最大电休克痉挛发作(MES)和皮下注射卡地阿唑(“sc MET”)是用于早期识别和筛选新抗痉挛药物的最广泛使用的临床痉挛发作模型。
表34.ED50生物反应,甲基纤维素
| 测试 | 剂量 | 时间 | N/F |
| MES | 200 | 2 | 5/8 |
| MES | 250 | 2 | 4/8 |
| MES | 300 | 2 | 4/8 |
| MES | 350 | 2 | 3/8 |
| MES | 400 | 2 | 3/8 |
| MES | 450 | 2 | 6/8 |
| MES | 500 | 2 | 8/8 |
| Sc MET | 150 | 2 | 1/8 |
| Sc MET | 200 | 2 | 3/8 |
| Sc MET | 300 | 2 | 5/8 |
| Sc MET | 360 | 2 | 7/8 |
| TOX | 500 | 2 | 0/8 |
表35.到峰值效应的时间,甲基纤维素
表36.ED50生物反应,乙醇:聚乙氧基化蓖麻油:PBS
| 测试 | 剂量 | 时间 | N/F |
| MES | 75 | 2 | 1/8 |
| MES | 95 | 2 | 5/8 |
| MES | 120 | 2 | 7/8 |
| MES | 150 | 2 | 8/8 |
| Sc MET | 120 | 2 | 0/8 |
| Sc MET | 160 | 2 | 2/8 |
| Sc MET | 220 | 2 | 5/8 |
| Sc MET | 260 | 2 | 7/8 |
| TOX | 175 | 2 | 0/8 |
| TOX | 250 | 2 | 4/8 |
| TOX | 325 | 2 | 6/8 |
| TOX | 500 | 2 | 8/8 |
表37.达到峰值效应的时间,乙醇:聚乙氧基化蓖麻油:PBS
由于U形剂量响应(1/4保护在0.5小时,1/4在1小时,4/8在2小时和2/4小时在4小时),因此不能计算溶解在甲基纤维素溶剂中的大麻二醇的MES模型中的ED50。然而,溶解在1:1:18乙醇:聚乙氧基化蓖麻油:PBS溶剂中的大麻二酚的ED 50为92.21mg/kg(95%置信区间为78.4mg/kg至104.63mg/kg)。
对于MET模型,对于溶解在甲基纤维素溶剂中的大麻二酚的ED50为241.03mg/kg(95%置信区间为182.23至311.87),并且用于溶解在1:1:18乙醇:聚乙氧基化蓖麻油:PBS溶剂中的大麻二酚的ED50为198.51mg/kg(95%置信区间为167.76mg/kg至232.58mg/kg)。基于溶解在甲基纤维素溶剂中的大麻二酚的毒性数据,测定TD 50超过500mg/kg是所测试的最高剂量。
在1小时内以200mg/kg剂量和在2小时时以360mg/kg剂量报告肌阵挛性抽搐。溶解在1:1:18乙醇:聚乙氧基化蓖麻油:PBS溶剂中的大麻二酚的TD50被确定为266.76mg/kg(95%置信区间为222.28mg/kg至317.42mg/kg)。
这些结果进一步说明大麻二酚可能在人体中有效用于治疗痉挛和其他病症。此外,人造合成的大麻二酚可能比源自植物且不是基本上纯的大麻二酚毒性更小。
Claims (27)
1.一种用于口服施用的稳定的药物制剂,所述制剂包含
约0.1至约50%的大麻素类化合物;
约0.1至约40%的聚乙二醇;
约0.1至约50%的丙二醇;和
任选地约0.1至约20%的水,
其中所述制剂不包括乙醇和
其中制剂的pH值为约5至约8。
2.根据权利要求1所述的制剂,其中所述大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin(四氢次大麻酚)、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。
3.根据权利要求2所述的制剂,其中所述大麻素类化合物是大麻二酚。
4.根据权利要求3所述的制剂,其中所述大麻二酚是基本上纯的,人造合成的,其中大麻二酚的纯度大于98%。
5.根据权利要求1所述的制剂,其中所述pH值为约6至约7。
6.根据权利要求1所述的制剂还包含约0.001至约1%的抗氧化剂。
7.根据权利要求6所述的制剂,其中所述抗氧化剂选自由二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素E)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠、硫代甘油和其组合物构成的组。
8.一种用于口服施用的稳定的药物制剂,其含有
约0.1至约40%的大麻素类化合物;
约0.1至约25%的聚乙二醇;
约0.1至约40%的丙二醇;和
任选地约0.1至约50%的水;和
约0.1至约70%的乙醇,
其中所述制剂的pH值为约5至约8。
9.根据权利要求8所述的制剂,其中所述大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin(四氢次大麻酚)、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。
10.根据权利要求9所述的制剂,其中所述大麻素类化合物是大麻二酚。
11.根据权利要求10所述的制剂,其中所述大麻二酚是基本上纯的,人造合成的,其中大麻二酚的纯度大于98%。
12.根据权利要求8所述的制剂,其中所述的pH值为约6至约7。
13.根据权利要求8所述的制剂,其中所述制剂另外含有约0.001至约1%的抗氧化剂。
14.根据权利要求13所述的制剂,其中所述抗氧化剂选自由二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素E)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠、硫代甘油和其组合物构成的组。
15.一种用于口服施用的稳定的药物制剂,所述制剂含有
约0.1至约40%的大麻素类化合物和
约10至约95%的脂质。
16.根据权利要求15所述的制剂,其中所述脂质选自由芝麻油、橄榄油、玉米油、向日葵油、红花油、亚麻油、杏仁油、花生油、核桃油、腰果油、蓖麻油、椰子油、棕榈油、大豆油、菜籽油、植物油、米糠油、中链甘油酯、癸酰酸甘油酯、辛酰酸甘油酯、辛酸/癸酸甘油三酯、油酰酸聚乙二醇-6甘油酯、亚油酰酸聚乙二醇-6甘油酯、聚甘油-3二油酸酯、甘油单亚油酸酯、甘油单辛酸酯、油酸、和其组合物构成的组。
17.根据权利要求15所述的制剂,其中所述大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin(四氢次大麻酚)、amandamide、大麻隆、酸、类似物、和其合成的衍生物构成的组。
18.根据权利要求17所述的制剂,其中所述大麻素类化合物是大麻二酚。
19.根据权利要求18所述的制剂,其中所述大麻二酚是基本上纯的,人造合成的,其中大麻二酚的纯度大于98%。
20.一种用于治疗疾病或病症,或疾病或病症的症状的方法,包括施用权利要求1的制剂于有需要的患者,其中所述疾病或病症选自由Dravet综合征、LennoxGastaut综合征、肌阵挛性痉挛、青少年肌阵挛性癫痫、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、婴儿痉挛症、顽固性婴儿痉挛症、管状硬化综合征、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病、和自闭症构成的组。
21.一种用于帮助从阿片类药物、可卡因、海洛因、安非他命或尼古丁戒断的方法,包括施用权利要求1的制剂于有需要的患者。
22.一种用于治疗疾病或病症,或疾病或病症的症状的方法,包括施用权利要求8的制剂于有需要的患者,其中所述疾病或病症选自由Dravet综合征、LennoxGastaut综合征、肌阵挛性痉挛、青少年肌阵挛性癫痫、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、婴儿痉挛症、顽固性婴儿痉挛症、管状硬化综合征、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病、和自闭症构成的组。
23.一种用于帮助从阿片类药物、可卡因、海洛因、安非他命或尼古丁戒断的方法,包括施用权利要求8的制剂于有需要的患者。
24.一种用于治疗疾病或病症,或疾病或病症的症状的方法,包括施用权利要求15的制剂于有需要的患者,其中所述疾病或病症选自由Dravet综合征、Lennox Gastaut综合征、肌阵挛性痉挛、青少年肌阵挛性癫痫、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、婴儿痉挛症、顽固性婴儿痉挛症、管状硬化综合征、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病、和自闭症构成的组。
25.一种用于帮助从阿片类药物、可卡因、海洛因、安非他命或尼古丁戒断的方法,包括施用权利要求15的制剂于有需要的患者。
26.一种用于治疗疾病或病症,或疾病或病症的症状的方法,包括施用基本上纯的,人造合成的大麻二酚于有需要的患者,其中所述疾病或病症选自由Dravet综合征、LennoxGastaut综合征、肌阵挛性痉挛、青少年肌阵挛性癫痫、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、婴儿痉挛症、顽固性婴儿痉挛症、管状硬化综合征、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病、和自闭症构成的组。
27.一种用于帮助从阿片类药物、可卡因、海洛因、安非他命或尼古丁戒断的方法,包括施用基本上纯的,人造合成的大麻二酚于有需要的患者。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462004495P | 2014-05-29 | 2014-05-29 | |
| US62/004,495 | 2014-05-29 | ||
| US201562154660P | 2015-04-29 | 2015-04-29 | |
| US62/154,660 | 2015-04-29 | ||
| CN201580041466.9A CN106999598B (zh) | 2014-05-29 | 2015-05-28 | 稳定的大麻素类化合物制剂 |
| PCT/US2015/032955 WO2015184127A2 (en) | 2014-05-29 | 2015-05-28 | Stable cannabinoid formulations |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580041466.9A Division CN106999598B (zh) | 2014-05-29 | 2015-05-28 | 稳定的大麻素类化合物制剂 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN114191420A true CN114191420A (zh) | 2022-03-18 |
Family
ID=54700061
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110901202.3A Pending CN114191420A (zh) | 2014-05-29 | 2015-05-28 | 稳定的大麻素类化合物制剂 |
| CN201580041466.9A Active CN106999598B (zh) | 2014-05-29 | 2015-05-28 | 稳定的大麻素类化合物制剂 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580041466.9A Active CN106999598B (zh) | 2014-05-29 | 2015-05-28 | 稳定的大麻素类化合物制剂 |
Country Status (12)
| Country | Link |
|---|---|
| US (4) | US11224660B2 (zh) |
| EP (2) | EP3148589B1 (zh) |
| JP (1) | JP6659933B2 (zh) |
| KR (1) | KR20170008311A (zh) |
| CN (2) | CN114191420A (zh) |
| AU (1) | AU2015266897B2 (zh) |
| CA (1) | CA2950424C (zh) |
| IL (2) | IL249197B2 (zh) |
| MX (2) | MX2016015636A (zh) |
| NZ (1) | NZ726746A (zh) |
| WO (1) | WO2015184127A2 (zh) |
| ZA (1) | ZA201608209B (zh) |
Families Citing this family (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2471523A (en) | 2009-07-03 | 2011-01-05 | Gw Pharma Ltd | Use of tetrahydrocannibivarin (THCV) and optionally cannabidiol (CBD) in the treatment of epilepsy |
| TWI583374B (zh) | 2010-03-30 | 2017-05-21 | Gw伐瑪有限公司 | 使用植物大麻素次大麻二酚(cbdv)來治療癲癇之用途 |
| GB2514054A (en) | 2011-09-29 | 2014-11-12 | Gw Pharma Ltd | A pharmaceutical composition comprising the phytocannabinoids cannabidivarin (CBDV) and cannabidiol (CBD) |
| US11331279B2 (en) | 2014-05-29 | 2022-05-17 | Radius Pharmaceuticals, Inc. | Stable cannabinoid formulations |
| US11911361B2 (en) | 2014-05-29 | 2024-02-27 | Radius Pharmaceuticals, Inc. | Stable cannabinoid formulations |
| GB2530001B (en) * | 2014-06-17 | 2019-01-16 | Gw Pharma Ltd | Use of cannabidiol in the reduction of convulsive seizure frequency in treatment-resistant epilepsy |
| GB2527599A (en) | 2014-06-27 | 2015-12-30 | Gw Pharma Ltd | Use of 7-OH-Cannabidiol (7-OH-CBD) and/or 7-OH-Cannabidivarin (7-OH-CBDV) in the treatment of epilepsy |
| GB2531278A (en) | 2014-10-14 | 2016-04-20 | Gw Pharma Ltd | Use of cannabidiol in the treatment of intractable epilepsy |
| GB2531281A (en) | 2014-10-14 | 2016-04-20 | Gw Pharma Ltd | Use of cannabidiol in the treatment of intractable epilepsy |
| GB2531282A (en) | 2014-10-14 | 2016-04-20 | Gw Pharma Ltd | Use of cannabinoids in the treatment of epilepsy |
| US20170021029A1 (en) * | 2015-04-15 | 2017-01-26 | Jeffrey Charles Raber | Topical formulations and uses |
| WO2016176279A1 (en) * | 2015-04-28 | 2016-11-03 | The Regents Of The University Of California | Uses of cannabidiol for treatment of infantile spasms |
| GB201508656D0 (en) | 2015-05-20 | 2015-07-01 | Sunstone Ip Systems Ltd | Portable power generating apparatus |
| WO2016191651A1 (en) * | 2015-05-28 | 2016-12-01 | Insys Development Company, Inc. | Stable cannabinoid formulations |
| GB2539472A (en) | 2015-06-17 | 2016-12-21 | Gw Res Ltd | Use of cannabinoids in the treatment of epilepsy |
| GB2541191A (en) | 2015-08-10 | 2017-02-15 | Gw Pharma Ltd | Use of cannabinoids in the treatment of epilepsy |
| BR102015024165A2 (pt) * | 2015-09-18 | 2017-03-28 | Prati Donaduzzi & Cia Ltda | composição farmacêutica oral compreendendo canabinóide, processo para sua preparação e seu uso |
| GB2544468A (en) * | 2015-11-12 | 2017-05-24 | Jaytee Biosciences Ltd | Liquid formulation |
| GB2548873B (en) | 2016-03-31 | 2020-12-02 | Gw Res Ltd | Use of Cannabidiol in the Treatment of SturgeWeber Syndrome |
| GB2549277B (en) * | 2016-04-11 | 2021-02-17 | Gw Res Ltd | Cannabidiolic Acid for use in the Treatment of Autism Spectrum Disorder |
| GB2549278B (en) * | 2016-04-11 | 2021-02-17 | Gw Res Ltd | Use of cannabidivarin in the treatment of autism spectrum disorder |
| EP3462885A4 (en) * | 2016-05-27 | 2020-01-22 | Insys Development Company, Inc. | STABLE CANNABINOID FORMULATIONS |
| WO2017218629A1 (en) * | 2016-06-15 | 2017-12-21 | India Globalization Capital, Inc. | Method and composition for treating seizure disorders |
| GB2551987A (en) * | 2016-07-01 | 2018-01-10 | Gw Res Ltd | Oral cannabinoid formulations |
| GB2551986A (en) | 2016-07-01 | 2018-01-10 | Gw Res Ltd | Parenteral formulations |
| GB2553139A (en) | 2016-08-25 | 2018-02-28 | Gw Res Ltd | Use of cannabinoids in the treatment of multiple myeloma |
| US10653640B2 (en) | 2016-10-11 | 2020-05-19 | Gbs Global Biopharma, Inc. | Cannabinoid-containing complex mixtures for the treatment of neurodegenerative diseases |
| WO2018096504A1 (en) * | 2016-11-28 | 2018-05-31 | Kalytera Therapeutics, Inc | Cbd prodrugs, compositions, and methods of administering cbd and cbd prodrugs |
| GB2557921A (en) | 2016-12-16 | 2018-07-04 | Gw Res Ltd | Use of cannabinoids in the treatment of angelman syndrome |
| CN107753560A (zh) * | 2016-12-28 | 2018-03-06 | 汉义生物科技(北京)有限公司 | 一种含大麻提取物的组合物及应用 |
| CA3052146A1 (en) | 2017-02-01 | 2018-08-09 | Gbs Global Biopharma, Inc. | Cannabinoid-containing complex mixtures for the treatment of mast cell-associated or basophil-mediated inflammatory disorders |
| GB2559774B (en) | 2017-02-17 | 2021-09-29 | Gw Res Ltd | Oral cannabinoid formulations |
| NL2018504B1 (en) * | 2017-03-13 | 2018-09-21 | Pharma Unlimited B V | Tobacco- and smoke-less products consumable by humans as epicurean or medical products and method of treating smoking addiction |
| WO2018200024A1 (en) | 2017-04-27 | 2018-11-01 | Insys Development Company, Inc. | Stable cannabinoid formulations |
| GB2564383B (en) * | 2017-06-23 | 2021-04-21 | Gw Res Ltd | Use of cannabidiol in the treatment of tumours assoicated with Tuberous Sclerosis Complex |
| US20190022028A1 (en) * | 2017-07-21 | 2019-01-24 | Annabelle Manalo | Cannabidiol-enriched caprylic acid |
| US10220061B1 (en) | 2017-09-26 | 2019-03-05 | Cynthia Denapoli | Method of reducing stress and anxiety in equines |
| AU2018343256B2 (en) | 2017-09-28 | 2024-09-19 | Harmony Biosciences Management, Inc. | Treatment of Fragile X Syndrome with cannabidiol |
| GB2568471B (en) * | 2017-11-15 | 2022-04-13 | Gw Res Ltd | Use of cannabinoids in the treatment of epilepsy |
| GB2572126B (en) * | 2018-01-03 | 2021-01-13 | Gw Res Ltd | Pharmaceutical |
| GB2572125B (en) * | 2018-01-03 | 2021-01-13 | Gw Res Ltd | Pharmaceutical |
| GB2569961B (en) | 2018-01-03 | 2021-12-22 | Gw Res Ltd | Pharmaceutical |
| WO2019153073A1 (en) | 2018-02-07 | 2019-08-15 | Scf Pharma Inc. | Polyunsaturated fatty acid monoglycerides, compositions, methods and uses thereof |
| BR102018002843A2 (pt) * | 2018-02-09 | 2019-08-27 | Prati Donaduzzi & Cia Ltda | composição farmacêutica e uso da mesma |
| GB201806953D0 (en) | 2018-04-27 | 2018-06-13 | Gw Res Ltd | Cannabidiol Preparations |
| MX2020011536A (es) * | 2018-05-01 | 2020-11-24 | Chibi Inc | Deposito de liquido para liberacion sostenida no invasiva de agentes al ojo. |
| BR112020022083A2 (pt) | 2018-05-01 | 2021-02-02 | Chibi, Inc. | depot líquido, estojo e método para tratar a retina. |
| US11166933B2 (en) | 2018-05-03 | 2021-11-09 | Scf Pharma Inc. | Polyunsaturated fatty acid monoglycerides, compositions, methods and uses thereof |
| CN110575448A (zh) * | 2018-06-08 | 2019-12-17 | 云南汉素生物科技有限公司 | 大麻二酚组合物及其用途 |
| CN109627148B (zh) * | 2018-11-28 | 2021-09-03 | 中国农业科学院麻类研究所 | 一种大麻二酚的制备方法、制得的大麻二酚及其用途 |
| CA3119037A1 (en) | 2018-12-11 | 2020-06-18 | Disruption Labs Inc. | Compositions for the delivery of therapeutic agents and methods of use and making thereof |
| JOP20210140A1 (ar) | 2018-12-14 | 2023-01-30 | Zynerba Pharmaceuticals Inc | معالجة متلازمة الحذف 22q11.2 بكانابيديول |
| DE102019100483A1 (de) * | 2019-01-10 | 2020-07-16 | Lts Lohmann Therapie-Systeme Ag | Oraler Dünnfilm |
| GB2584341B (en) | 2019-05-31 | 2023-03-01 | Gw Res Ltd | Cannabinoid formulations |
| EP4010024A4 (en) * | 2019-08-08 | 2023-05-03 | Neptune Wellness Solutions Inc. | ORAL FORMULATIONS OF CANNABIS EXTRACTS AND THEIR PRODUCTION PROCESSES |
| CN111202767A (zh) * | 2019-09-04 | 2020-05-29 | 汉义生物科技(北京)有限公司 | 大麻全草提取物在改善tau蛋白和β-淀粉样蛋白病理损伤中应用 |
| MX2022002548A (es) * | 2019-09-09 | 2022-03-22 | Cardiol Therapeutics Inc | Composiciones medicinales estables de cannabidiol. |
| US12016829B2 (en) | 2019-10-11 | 2024-06-25 | Pike Therapeutics Inc. | Pharmaceutical composition and method for treating seizure disorders |
| US12121617B2 (en) | 2019-10-14 | 2024-10-22 | Pike Therapeutics Inc. | Transdermal delivery of cannabidiol |
| US12097293B2 (en) | 2019-10-14 | 2024-09-24 | Pike Therapeutics Inc. | Transdermal delivery of cannabidiol |
| US20210169795A1 (en) * | 2019-12-06 | 2021-06-10 | Joshua Steindler | Colloidal Suspensions of Plant Extracts in Aqueous Solutions |
| GB201918846D0 (en) | 2019-12-19 | 2020-02-05 | Gw Res Ltd | Oral cannabinoid formulations |
| CN113087741B (zh) * | 2020-01-08 | 2023-04-28 | 成都百裕制药股份有限公司 | 大麻二酚衍生物及其制备方法和在医药上的应用 |
| GB202002754D0 (en) | 2020-02-27 | 2020-04-15 | Gw Res Ltd | Methods of treating tuberous sclerosis complex with cannabidiol and everolimus |
| KR102213253B1 (ko) * | 2020-04-29 | 2021-02-08 | 한국과학기술원 | 산화적 스트레스에 대한 칸나비디올의 신경세포 보호 효과 평가 방법 및 칸나비디올을 유효성분으로 포함하는 신경퇴행성 질환의 예방 또는 치료용 약학적 조성물 |
| AU2021347760B2 (en) * | 2020-09-24 | 2024-07-25 | Nicoventures Trading Limited | Formulation |
| US11160757B1 (en) | 2020-10-12 | 2021-11-02 | GW Research Limited | pH dependent release coated microparticle cannabinoid formulations |
| WO2022140245A1 (en) * | 2020-12-21 | 2022-06-30 | Isosceles Pharmaceuticals, Inc. | Parenteral cannabinoid formulations and uses thereof |
| US11242328B1 (en) | 2021-02-25 | 2022-02-08 | Acid Neutral Alkaline Laboratory | Heterogeneous catalyst and method for preparation of aromatic tricyclic pyrans |
| US11242330B1 (en) | 2021-02-25 | 2022-02-08 | Acid Neutral Alkaline Laboratory | Organic catalyst and method for preparation of aromatic tricyclic pyrans |
| CN113398104B (zh) * | 2021-07-14 | 2022-04-08 | 北京森宏健康科技有限公司 | 大麻二酚在治疗胆红素脑病中的用途 |
| CA3239914A1 (en) * | 2021-12-03 | 2023-06-08 | Avicanna Inc. | Oral cannabinoid compositions and methods for treating neurological diseases and disorders |
| AU2023251986A1 (en) | 2022-04-12 | 2024-10-31 | Shackelford Pharma Inc. | Treatment of seizure disorders |
| WO2024079542A1 (en) * | 2022-10-12 | 2024-04-18 | Leiutis Pharmaceuticals Llp | Novel liquid oral formulations of cannabidiol |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1652766A (zh) * | 2002-03-18 | 2005-08-10 | 免疫力药品有限公司 | 间苯二酚和大麻素的局部制剂及其施用方法 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1212039B1 (en) * | 1999-08-20 | 2005-11-02 | Unimed Pharmaceuticals Inc. | Composition for inhalation comprising delta-9-tetrahydrocannabinol in a semiaqueous solvent |
| AU2002231970B2 (en) | 2001-02-14 | 2007-08-16 | GW Research Limited | Mucoadhesive pharmaceutical formulations |
| GB0103638D0 (en) * | 2001-02-14 | 2001-03-28 | Gw Pharmaceuticals Ltd | Pharmaceutical formulations |
| MXPA04011808A (es) * | 2002-05-31 | 2005-09-12 | Univ Mississippi | Liberacion transmucosica de canabinoides. |
| GB2393182B (en) | 2002-09-23 | 2007-03-14 | Gw Pharma Ltd | Method of preparing cannabidiol from plant material |
| GB0222077D0 (en) * | 2002-09-23 | 2002-10-30 | Gw Pharma Ltd | Methods of preparing cannabinoids from plant material |
| MX2007007038A (es) * | 2004-12-09 | 2008-03-07 | Insys Therapeutics Inc | Formulacion de dronabinol en temperatura ambiente. |
| NZ601567A (en) * | 2005-09-29 | 2013-03-28 | Albany Molecular Res Inc | Process for production of delta-9-tetrahydrocannabinol |
| WO2008086804A2 (en) * | 2007-01-16 | 2008-07-24 | Egalet A/S | Use of i) a polyglycol and n) an active drug substance for the preparation of a pharmaceutical composition for i) mitigating the risk of alcohol induced dose dumping and/or ii) reducing the risk of drug abuse |
| US8222292B2 (en) * | 2007-08-06 | 2012-07-17 | Insys Therapeutics, Inc. | Liquid cannabinoid formulations |
| EP2184983A1 (en) * | 2007-08-06 | 2010-05-19 | Insys Therapeutics Inc. | Oral cannabinoid liquid formulations and methods of treatment |
| GB2471987B (en) * | 2008-06-04 | 2012-02-22 | Gw Pharma Ltd | Anti-tumoural effects of cannabinoid combinations |
| AT509000B1 (de) * | 2009-10-23 | 2012-12-15 | Rausch Peter | Wasserlösliche zubereitungen von cannabinoiden und cannabispräparaten und deren anwendungen |
| WO2012071389A2 (en) * | 2010-11-22 | 2012-05-31 | Johnson Matthey Public Limited Company | Stable cannabinoid compositions and methods for making and storing them |
| US20130289019A1 (en) * | 2012-04-26 | 2013-10-31 | Amazing Grace, Inc. | Methods of treating behaviorial and/or mental disorders |
| US9345771B2 (en) | 2012-10-04 | 2016-05-24 | Insys Development Company, Inc. | Oral cannabinoid formulations |
-
2015
- 2015-05-28 AU AU2015266897A patent/AU2015266897B2/en active Active
- 2015-05-28 US US14/724,351 patent/US11224660B2/en active Active
- 2015-05-28 MX MX2016015636A patent/MX2016015636A/es unknown
- 2015-05-28 CN CN202110901202.3A patent/CN114191420A/zh active Pending
- 2015-05-28 IL IL249197A patent/IL249197B2/en unknown
- 2015-05-28 CN CN201580041466.9A patent/CN106999598B/zh active Active
- 2015-05-28 WO PCT/US2015/032955 patent/WO2015184127A2/en active Application Filing
- 2015-05-28 KR KR1020167036656A patent/KR20170008311A/ko unknown
- 2015-05-28 IL IL302782A patent/IL302782A/en unknown
- 2015-05-28 EP EP15800669.2A patent/EP3148589B1/en active Active
- 2015-05-28 EP EP22197632.7A patent/EP4151234A1/en active Pending
- 2015-05-28 CA CA2950424A patent/CA2950424C/en active Active
- 2015-05-28 NZ NZ726746A patent/NZ726746A/en unknown
- 2015-05-28 JP JP2016569911A patent/JP6659933B2/ja active Active
-
2016
- 2016-11-28 ZA ZA2016/08209A patent/ZA201608209B/en unknown
- 2016-11-28 MX MX2021006035A patent/MX2021006035A/es unknown
-
2021
- 2021-07-06 US US17/367,876 patent/US20210330797A1/en active Pending
- 2021-11-05 US US17/519,844 patent/US20220125932A1/en active Pending
- 2021-12-22 US US17/559,155 patent/US20220184215A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1652766A (zh) * | 2002-03-18 | 2005-08-10 | 免疫力药品有限公司 | 间苯二酚和大麻素的局部制剂及其施用方法 |
Non-Patent Citations (2)
| Title |
|---|
| BARBARA COSTA等: "The non-psychoactive cannabis constituent cannabidiol is an orally effective therapeutic agent in rat chronic inflammatory and neuropathic pain", 《EUROPEAN JOURNAL OF PHARMACOLOGY》, vol. 556, pages 75 - 83, XP005829802, DOI: 10.1016/j.ejphar.2006.11.006 * |
| BRENDA E. PORTER等: "Report of a parent survey of cannabidiol-enriched cannabis use in pediatric treatment-resistant epilepsy", 《EPILEPSY & BEHAVIOR》, vol. 29, pages 574 - 577, XP028775189, DOI: 10.1016/j.yebeh.2013.08.037 * |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2021006035A (es) | 2021-07-06 |
| US20210330797A1 (en) | 2021-10-28 |
| CA2950424C (en) | 2023-03-14 |
| EP3148589A4 (en) | 2018-01-17 |
| KR20170008311A (ko) | 2017-01-23 |
| US20220125932A1 (en) | 2022-04-28 |
| CN106999598A (zh) | 2017-08-01 |
| EP3148589B1 (en) | 2024-10-30 |
| US20220184215A1 (en) | 2022-06-16 |
| IL249197A0 (en) | 2017-01-31 |
| MX2016015636A (es) | 2017-08-02 |
| CN106999598B (zh) | 2022-02-08 |
| WO2015184127A9 (en) | 2016-05-19 |
| IL249197B2 (en) | 2024-09-01 |
| WO2015184127A2 (en) | 2015-12-03 |
| AU2015266897A1 (en) | 2016-12-15 |
| WO2015184127A3 (en) | 2016-03-17 |
| AU2015266897B2 (en) | 2020-07-30 |
| US11224660B2 (en) | 2022-01-18 |
| JP2017519742A (ja) | 2017-07-20 |
| US20150343071A1 (en) | 2015-12-03 |
| NZ726746A (en) | 2020-08-28 |
| EP3148589A2 (en) | 2017-04-05 |
| NZ763449A (en) | 2024-02-23 |
| ZA201608209B (en) | 2023-06-28 |
| IL302782A (en) | 2023-07-01 |
| IL249197B1 (en) | 2024-05-01 |
| EP4151234A1 (en) | 2023-03-22 |
| JP6659933B2 (ja) | 2020-03-04 |
| CA2950424A1 (en) | 2015-12-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN106999598B (zh) | 稳定的大麻素类化合物制剂 | |
| US20220280446A1 (en) | Stable cannabinoid formulations | |
| AU2022201441B2 (en) | Stable cannabinoid formulations | |
| US20160271252A1 (en) | Stable cannabinoid formulations | |
| CA3025702C (en) | Stable cannabinoid formulations | |
| US20170224634A1 (en) | Stable cannabinoid formulations | |
| US20160367496A1 (en) | Stable cannabinoid formulations | |
| CA3062814C (en) | Stable cannabinoid formulations | |
| US20220054450A1 (en) | Stable cannabinoid formulations | |
| JP2024161363A (ja) | 安定なカンナビノイド製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 40067563 Country of ref document: HK |