CN1137119C - 取代的噻吩基(氨基)磺酰脲类化合物 - Google Patents
取代的噻吩基(氨基)磺酰脲类化合物 Download PDFInfo
- Publication number
- CN1137119C CN1137119C CNB00811417XA CN00811417A CN1137119C CN 1137119 C CN1137119 C CN 1137119C CN B00811417X A CNB00811417X A CN B00811417XA CN 00811417 A CN00811417 A CN 00811417A CN 1137119 C CN1137119 C CN 1137119C
- Authority
- CN
- China
- Prior art keywords
- group
- randomly
- compound
- alkyl
- ethyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 229940100389 Sulfonylurea Drugs 0.000 title abstract 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims abstract description 54
- 238000000034 method Methods 0.000 claims abstract description 32
- 238000002360 preparation method Methods 0.000 claims abstract description 30
- -1 methylidene, ethyl Chemical group 0.000 claims description 77
- 241000196324 Embryophyta Species 0.000 claims description 28
- 238000006243 chemical reaction Methods 0.000 claims description 26
- 239000001257 hydrogen Substances 0.000 claims description 19
- 229910052739 hydrogen Inorganic materials 0.000 claims description 19
- 229910052736 halogen Inorganic materials 0.000 claims description 18
- 150000002367 halogens Chemical class 0.000 claims description 18
- 125000000217 alkyl group Chemical group 0.000 claims description 16
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 15
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- 239000000203 mixture Substances 0.000 claims description 12
- LFCMKGYNGXSZHI-UHFFFAOYSA-N 2-aminoguanidine;dihydrochloride Chemical compound Cl.Cl.NNC(N)=N LFCMKGYNGXSZHI-UHFFFAOYSA-N 0.000 claims description 11
- 125000003545 alkoxy group Chemical group 0.000 claims description 11
- 239000003795 chemical substances by application Substances 0.000 claims description 10
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 9
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 8
- 229930192474 thiophene Natural products 0.000 claims description 8
- 241001597008 Nomeidae Species 0.000 claims description 7
- 239000013543 active substance Substances 0.000 claims description 6
- 125000004104 aryloxy group Chemical group 0.000 claims description 6
- 150000003839 salts Chemical class 0.000 claims description 6
- 230000002363 herbicidal effect Effects 0.000 claims description 5
- 150000003863 ammonium salts Chemical class 0.000 claims description 4
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- WRJWRGBVPUUDLA-UHFFFAOYSA-N chlorosulfonyl isocyanate Chemical compound ClS(=O)(=O)N=C=O WRJWRGBVPUUDLA-UHFFFAOYSA-N 0.000 claims description 4
- 159000000000 sodium salts Chemical class 0.000 claims description 4
- GLQWRXYOTXRDNH-UHFFFAOYSA-N thiophen-2-amine Chemical compound NC1=CC=CS1 GLQWRXYOTXRDNH-UHFFFAOYSA-N 0.000 claims description 3
- YEOQVMVZUKOEKI-UHFFFAOYSA-N NC(C(CNCC1)(N1N)S(Cl)(=O)=O)=O Chemical compound NC(C(CNCC1)(N1N)S(Cl)(=O)=O)=O YEOQVMVZUKOEKI-UHFFFAOYSA-N 0.000 claims description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 claims description 2
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical class NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 claims description 2
- 159000000007 calcium salts Chemical class 0.000 claims description 2
- 238000007796 conventional method Methods 0.000 claims description 2
- 159000000003 magnesium salts Chemical class 0.000 claims description 2
- 239000001103 potassium chloride Substances 0.000 claims description 2
- 235000011164 potassium chloride Nutrition 0.000 claims description 2
- 150000001721 carbon Chemical group 0.000 claims 4
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 claims 2
- 241000405414 Rehmannia Species 0.000 claims 1
- 230000002508 compound effect Effects 0.000 claims 1
- 239000004009 herbicide Substances 0.000 abstract description 4
- 125000001544 thienyl group Chemical group 0.000 abstract description 2
- 239000000460 chlorine Substances 0.000 description 21
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 20
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 20
- 229910052801 chlorine Inorganic materials 0.000 description 20
- 239000011737 fluorine Substances 0.000 description 20
- 229910052731 fluorine Inorganic materials 0.000 description 20
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 19
- 239000002994 raw material Substances 0.000 description 18
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 15
- 239000002585 base Substances 0.000 description 14
- 125000004093 cyano group Chemical group *C#N 0.000 description 13
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 12
- 150000004702 methyl esters Chemical class 0.000 description 12
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 11
- 244000025254 Cannabis sativa Species 0.000 description 11
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 10
- 230000000694 effects Effects 0.000 description 10
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 9
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 8
- 229910052794 bromium Inorganic materials 0.000 description 8
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 150000002431 hydrogen Chemical class 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 239000003995 emulsifying agent Substances 0.000 description 6
- 125000004494 ethyl ester group Chemical group 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 239000001301 oxygen Substances 0.000 description 6
- 229910052760 oxygen Inorganic materials 0.000 description 6
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 5
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 5
- 241000209140 Triticum Species 0.000 description 5
- 235000021307 Triticum Nutrition 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 239000000975 dye Substances 0.000 description 5
- 229910052500 inorganic mineral Inorganic materials 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000011707 mineral Substances 0.000 description 5
- 235000010755 mineral Nutrition 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 239000002689 soil Substances 0.000 description 5
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 5
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 4
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 4
- 125000003282 alkyl amino group Chemical group 0.000 description 4
- 125000004414 alkyl thio group Chemical group 0.000 description 4
- 125000003368 amide group Chemical group 0.000 description 4
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 229940043265 methyl isobutyl ketone Drugs 0.000 description 4
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- DCTOHCCUXLBQMS-UHFFFAOYSA-N 1-undecene Chemical compound CCCCCCCCCC=C DCTOHCCUXLBQMS-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 235000021506 Ipomoea Nutrition 0.000 description 3
- 241000207783 Ipomoea Species 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 241000209117 Panicum Species 0.000 description 3
- 235000006443 Panicum miliaceum subsp. miliaceum Nutrition 0.000 description 3
- 235000009037 Panicum miliaceum subsp. ruderale Nutrition 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 3
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 241000209149 Zea Species 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 125000002877 alkyl aryl group Chemical group 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- 125000000753 cycloalkyl group Chemical group 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000008029 eradication Effects 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 229920000151 polyglycol Polymers 0.000 description 3
- 239000010695 polyglycol Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000005507 spraying Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 239000010902 straw Substances 0.000 description 3
- 238000009333 weeding Methods 0.000 description 3
- JSLZUBLGGPEVQN-DIPNUNPCSA-N (2r)-4-methyl-2-propan-2-yl-2-[2-[4-[4-[2-(3,4,5-trimethoxyphenyl)ethyl]piperazin-1-yl]butoxy]phenyl]-1,4-benzothiazin-3-one Chemical compound COC1=C(OC)C(OC)=CC(CCN2CCN(CCCCOC=3C(=CC=CC=3)[C@@]3(C(N(C)C4=CC=CC=C4S3)=O)C(C)C)CC2)=C1 JSLZUBLGGPEVQN-DIPNUNPCSA-N 0.000 description 2
- NFDXQGNDWIPXQL-UHFFFAOYSA-N 1-cyclooctyldiazocane Chemical compound C1CCCCCCC1N1NCCCCCC1 NFDXQGNDWIPXQL-UHFFFAOYSA-N 0.000 description 2
- IBXNCJKFFQIKKY-UHFFFAOYSA-N 1-pentyne Chemical compound CCCC#C IBXNCJKFFQIKKY-UHFFFAOYSA-N 0.000 description 2
- ABOOPXYCKNFDNJ-UHFFFAOYSA-N 2-{4-[(6-chloroquinoxalin-2-yl)oxy]phenoxy}propanoic acid Chemical compound C1=CC(OC(C)C(O)=O)=CC=C1OC1=CN=C(C=C(Cl)C=C2)C2=N1 ABOOPXYCKNFDNJ-UHFFFAOYSA-N 0.000 description 2
- QDFXRVAOBHEBGJ-UHFFFAOYSA-N 3-(cyclononen-1-yl)-4,5,6,7,8,9-hexahydro-1h-diazonine Chemical compound C1CCCCCCC=C1C1=NNCCCCCC1 QDFXRVAOBHEBGJ-UHFFFAOYSA-N 0.000 description 2
- PVSGXWMWNRGTKE-UHFFFAOYSA-N 5-methyl-2-[4-methyl-5-oxo-4-(propan-2-yl)-4,5-dihydro-1H-imidazol-2-yl]pyridine-3-carboxylic acid Chemical compound N1C(=O)C(C(C)C)(C)N=C1C1=NC=C(C)C=C1C(O)=O PVSGXWMWNRGTKE-UHFFFAOYSA-N 0.000 description 2
- 235000005781 Avena Nutrition 0.000 description 2
- 244000075850 Avena orientalis Species 0.000 description 2
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 235000007516 Chrysanthemum Nutrition 0.000 description 2
- 244000189548 Chrysanthemum x morifolium Species 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 239000005531 Flufenacet Substances 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000219146 Gossypium Species 0.000 description 2
- RMFGNMMNUZWCRZ-UHFFFAOYSA-N Humulone Natural products CC(C)CC(=O)C1=C(O)C(O)(CC=C(C)C)C(O)=C(CC=C(C)C)C1=O RMFGNMMNUZWCRZ-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 241000801118 Lepidium Species 0.000 description 2
- 241000209510 Liliopsida Species 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 241000219053 Rumex Species 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical class [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 235000002634 Solanum Nutrition 0.000 description 2
- 241000207763 Solanum Species 0.000 description 2
- 240000003829 Sorghum propinquum Species 0.000 description 2
- 235000011684 Sorghum saccharatum Nutrition 0.000 description 2
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 150000003851 azoles Chemical class 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 2
- 235000005822 corn Nutrition 0.000 description 2
- MZZBPDKVEFVLFF-UHFFFAOYSA-N cyanazine Chemical compound CCNC1=NC(Cl)=NC(NC(C)(C)C#N)=N1 MZZBPDKVEFVLFF-UHFFFAOYSA-N 0.000 description 2
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 2
- 239000012973 diazabicyclooctane Substances 0.000 description 2
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 2
- IANUJLZYFUDJIH-UHFFFAOYSA-N flufenacet Chemical compound C=1C=C(F)C=CC=1N(C(C)C)C(=O)COC1=NN=C(C(F)(F)F)S1 IANUJLZYFUDJIH-UHFFFAOYSA-N 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- VMSLCPKYRPDHLN-NRFANRHFSA-N humulone Chemical compound CC(C)CC(=O)C1=C(O)C(CC=C(C)C)=C(O)[C@@](O)(CC=C(C)C)C1=O VMSLCPKYRPDHLN-NRFANRHFSA-N 0.000 description 2
- 229950001891 iprotiazem Drugs 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 2
- QYPPRTNMGCREIM-UHFFFAOYSA-N methylarsonic acid Chemical compound C[As](O)(O)=O QYPPRTNMGCREIM-UHFFFAOYSA-N 0.000 description 2
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 2
- FBUKVWPVBMHYJY-UHFFFAOYSA-N nonanoic acid Chemical compound CCCCCCCCC(O)=O FBUKVWPVBMHYJY-UHFFFAOYSA-N 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- QQVIHTHCMHWDBS-UHFFFAOYSA-N perisophthalic acid Natural products OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- BACHBFVBHLGWSL-JTQLQIEISA-N rac-diclofop methyl Natural products C1=CC(O[C@@H](C)C(=O)OC)=CC=C1OC1=CC=C(Cl)C=C1Cl BACHBFVBHLGWSL-JTQLQIEISA-N 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 125000000547 substituted alkyl group Chemical group 0.000 description 2
- BUXTXUBQAKIQKS-UHFFFAOYSA-N sulfuryl diisocyanate Chemical class O=C=NS(=O)(=O)N=C=O BUXTXUBQAKIQKS-UHFFFAOYSA-N 0.000 description 2
- XLNZEKHULJKQBA-UHFFFAOYSA-N terbufos Chemical compound CCOP(=S)(OCC)SCSC(C)(C)C XLNZEKHULJKQBA-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 235000013311 vegetables Nutrition 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- VIXCLRUCUMWJFF-KGLIPLIRSA-N (1R,5S)-benzobicyclon Chemical compound CS(=O)(=O)c1ccc(C(=O)C2=C(Sc3ccccc3)[C@H]3CC[C@H](C3)C2=O)c(Cl)c1 VIXCLRUCUMWJFF-KGLIPLIRSA-N 0.000 description 1
- IPPAUTOBDWNELX-UHFFFAOYSA-N (2-ethoxy-2-oxoethyl) 5-[2-chloro-4-(trifluoromethyl)phenoxy]-2-nitrobenzoate Chemical group C1=C([N+]([O-])=O)C(C(=O)OCC(=O)OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 IPPAUTOBDWNELX-UHFFFAOYSA-N 0.000 description 1
- NYHLMHAKWBUZDY-QMMMGPOBSA-N (2s)-2-[2-chloro-5-[2-chloro-4-(trifluoromethyl)phenoxy]benzoyl]oxypropanoic acid Chemical compound C1=C(Cl)C(C(=O)O[C@@H](C)C(O)=O)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 NYHLMHAKWBUZDY-QMMMGPOBSA-N 0.000 description 1
- XJPOOEMIUDHWSO-PHIMTYICSA-N (2s,5r)-2,5-dimethyl-n-phenylpyrrolidine-1-carboxamide Chemical compound C[C@H]1CC[C@@H](C)N1C(=O)NC1=CC=CC=C1 XJPOOEMIUDHWSO-PHIMTYICSA-N 0.000 description 1
- LNGRZPZKVUBWQV-UHFFFAOYSA-N (4-chloro-2-methylsulfonylphenyl)-(5-cyclopropyl-1,2-oxazol-4-yl)methanone Chemical compound CS(=O)(=O)C1=CC(Cl)=CC=C1C(=O)C1=C(C2CC2)ON=C1 LNGRZPZKVUBWQV-UHFFFAOYSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- OVXMBIVWNJDDSM-UHFFFAOYSA-N (benzhydrylideneamino) 2,6-bis[(4,6-dimethoxypyrimidin-2-yl)oxy]benzoate Chemical compound COC1=CC(OC)=NC(OC=2C(=C(OC=3N=C(OC)C=C(OC)N=3)C=CC=2)C(=O)ON=C(C=2C=CC=CC=2)C=2C=CC=CC=2)=N1 OVXMBIVWNJDDSM-UHFFFAOYSA-N 0.000 description 1
- YKYIFUROKBDHCY-ONEGZZNKSA-N (e)-4-ethoxy-1,1,1-trifluorobut-3-en-2-one Chemical group CCO\C=C\C(=O)C(F)(F)F YKYIFUROKBDHCY-ONEGZZNKSA-N 0.000 description 1
- FIDRAVVQGKNYQK-UHFFFAOYSA-N 1,2,3,4-tetrahydrotriazine Chemical compound C1NNNC=C1 FIDRAVVQGKNYQK-UHFFFAOYSA-N 0.000 description 1
- QVCUKHQDEZNNOC-UHFFFAOYSA-N 1,2-diazabicyclo[2.2.2]octane Chemical compound C1CC2CCN1NC2 QVCUKHQDEZNNOC-UHFFFAOYSA-N 0.000 description 1
- LZDKZFUFMNSQCJ-UHFFFAOYSA-N 1,2-diethoxyethane Chemical compound CCOCCOCC LZDKZFUFMNSQCJ-UHFFFAOYSA-N 0.000 description 1
- OCJBOOLMMGQPQU-UHFFFAOYSA-N 1,4-dichlorobenzene Chemical compound ClC1=CC=C(Cl)C=C1 OCJBOOLMMGQPQU-UHFFFAOYSA-N 0.000 description 1
- BXKKQFGRMSOANI-UHFFFAOYSA-N 1-methoxy-3-[4-[(2-methoxy-2,4,4-trimethyl-3h-chromen-7-yl)oxy]phenyl]-1-methylurea Chemical compound C1=CC(NC(=O)N(C)OC)=CC=C1OC1=CC=C2C(C)(C)CC(C)(OC)OC2=C1 BXKKQFGRMSOANI-UHFFFAOYSA-N 0.000 description 1
- PAMIQIKDUOTOBW-UHFFFAOYSA-N 1-methylpiperidine Chemical class CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 description 1
- BDQWWOHKFDSADC-UHFFFAOYSA-N 2-(2,4-dichloro-3-methylphenoxy)-n-phenylpropanamide Chemical compound C=1C=CC=CC=1NC(=O)C(C)OC1=CC=C(Cl)C(C)=C1Cl BDQWWOHKFDSADC-UHFFFAOYSA-N 0.000 description 1
- WNTGYJSOUMFZEP-UHFFFAOYSA-N 2-(4-chloro-2-methylphenoxy)propanoic acid Chemical compound OC(=O)C(C)OC1=CC=C(Cl)C=C1C WNTGYJSOUMFZEP-UHFFFAOYSA-N 0.000 description 1
- NUPJIGQFXCQJBK-UHFFFAOYSA-N 2-(4-isopropyl-4-methyl-5-oxo-4,5-dihydro-1H-imidazol-2-yl)-5-(methoxymethyl)nicotinic acid Chemical compound OC(=O)C1=CC(COC)=CN=C1C1=NC(C)(C(C)C)C(=O)N1 NUPJIGQFXCQJBK-UHFFFAOYSA-N 0.000 description 1
- YUVKUEAFAVKILW-UHFFFAOYSA-N 2-(4-{[5-(trifluoromethyl)pyridin-2-yl]oxy}phenoxy)propanoic acid Chemical compound C1=CC(OC(C)C(O)=O)=CC=C1OC1=CC=C(C(F)(F)F)C=N1 YUVKUEAFAVKILW-UHFFFAOYSA-N 0.000 description 1
- KRQUFUKTQHISJB-YYADALCUSA-N 2-[(E)-N-[2-(4-chlorophenoxy)propoxy]-C-propylcarbonimidoyl]-3-hydroxy-5-(thian-3-yl)cyclohex-2-en-1-one Chemical compound CCC\C(=N/OCC(C)OC1=CC=C(Cl)C=C1)C1=C(O)CC(CC1=O)C1CCCSC1 KRQUFUKTQHISJB-YYADALCUSA-N 0.000 description 1
- IRJQWZWMQCVOLA-ZBKNUEDVSA-N 2-[(z)-n-[(3,5-difluorophenyl)carbamoylamino]-c-methylcarbonimidoyl]pyridine-3-carboxylic acid Chemical compound N=1C=CC=C(C(O)=O)C=1C(/C)=N\NC(=O)NC1=CC(F)=CC(F)=C1 IRJQWZWMQCVOLA-ZBKNUEDVSA-N 0.000 description 1
- ONNQFZOZHDEENE-UHFFFAOYSA-N 2-[5-(but-3-yn-2-yloxy)-4-chloro-2-fluorophenyl]-4,5,6,7-tetrahydro-1H-isoindole-1,3(2H)-dione Chemical compound C1=C(Cl)C(OC(C)C#C)=CC(N2C(C3=C(CCCC3)C2=O)=O)=C1F ONNQFZOZHDEENE-UHFFFAOYSA-N 0.000 description 1
- IOYNQIMAUDJVEI-ZFNPBRLTSA-N 2-[N-[(E)-3-chloroprop-2-enoxy]-C-ethylcarbonimidoyl]-3-hydroxy-5-(oxan-4-yl)cyclohex-2-en-1-one Chemical compound C1C(=O)C(C(=NOC\C=C\Cl)CC)=C(O)CC1C1CCOCC1 IOYNQIMAUDJVEI-ZFNPBRLTSA-N 0.000 description 1
- IAJOBQBIJHVGMQ-UHFFFAOYSA-N 2-amino-4-[hydroxy(methyl)phosphoryl]butanoic acid Chemical compound CP(O)(=O)CCC(N)C(O)=O IAJOBQBIJHVGMQ-UHFFFAOYSA-N 0.000 description 1
- YHKBGVDUSSWOAB-UHFFFAOYSA-N 2-chloro-3-{2-chloro-5-[4-(difluoromethyl)-3-methyl-5-oxo-4,5-dihydro-1H-1,2,4-triazol-1-yl]-4-fluorophenyl}propanoic acid Chemical compound O=C1N(C(F)F)C(C)=NN1C1=CC(CC(Cl)C(O)=O)=C(Cl)C=C1F YHKBGVDUSSWOAB-UHFFFAOYSA-N 0.000 description 1
- JLYFCTQDENRSOL-UHFFFAOYSA-N 2-chloro-N-(2,4-dimethylthiophen-3-yl)-N-(1-methoxypropan-2-yl)acetamide Chemical compound COCC(C)N(C(=O)CCl)C=1C(C)=CSC=1C JLYFCTQDENRSOL-UHFFFAOYSA-N 0.000 description 1
- WVQBLGZPHOPPFO-UHFFFAOYSA-N 2-chloro-N-(2-ethyl-6-methylphenyl)-N-(1-methoxypropan-2-yl)acetamide Chemical compound CCC1=CC=CC(C)=C1N(C(C)COC)C(=O)CCl WVQBLGZPHOPPFO-UHFFFAOYSA-N 0.000 description 1
- KZNDFYDURHAESM-UHFFFAOYSA-N 2-chloro-n-(2-ethyl-6-methylphenyl)-n-(propan-2-yloxymethyl)acetamide Chemical compound CCC1=CC=CC(C)=C1N(COC(C)C)C(=O)CCl KZNDFYDURHAESM-UHFFFAOYSA-N 0.000 description 1
- IRCMYGHHKLLGHV-UHFFFAOYSA-N 2-ethoxy-3,3-dimethyl-2,3-dihydro-1-benzofuran-5-yl methanesulfonate Chemical compound C1=C(OS(C)(=O)=O)C=C2C(C)(C)C(OCC)OC2=C1 IRCMYGHHKLLGHV-UHFFFAOYSA-N 0.000 description 1
- UPMXNNIRAGDFEH-UHFFFAOYSA-N 3,5-dibromo-4-hydroxybenzonitrile Chemical compound OC1=C(Br)C=C(C#N)C=C1Br UPMXNNIRAGDFEH-UHFFFAOYSA-N 0.000 description 1
- XMTQQYYKAHVGBJ-UHFFFAOYSA-N 3-(3,4-DICHLOROPHENYL)-1,1-DIMETHYLUREA Chemical compound CN(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XMTQQYYKAHVGBJ-UHFFFAOYSA-N 0.000 description 1
- DXBQEHHOGRVYFF-UHFFFAOYSA-N 3-pyridin-4-ylpentane-2,4-dione Chemical group CC(=O)C(C(C)=O)C1=CC=NC=C1 DXBQEHHOGRVYFF-UHFFFAOYSA-N 0.000 description 1
- VFEYBTFCBZMBAU-UHFFFAOYSA-N 4-chloro-6-methoxypyrimidin-2-amine Chemical compound COC1=CC(Cl)=NC(N)=N1 VFEYBTFCBZMBAU-UHFFFAOYSA-N 0.000 description 1
- NYRMIJKDBAQCHC-UHFFFAOYSA-N 5-(methylamino)-2-phenyl-4-[3-(trifluoromethyl)phenyl]furan-3(2H)-one Chemical compound O1C(NC)=C(C=2C=C(C=CC=2)C(F)(F)F)C(=O)C1C1=CC=CC=C1 NYRMIJKDBAQCHC-UHFFFAOYSA-N 0.000 description 1
- QQOGZMUZAZWLJH-UHFFFAOYSA-N 5-[2-chloro-6-fluoro-4-(trifluoromethyl)phenoxy]-n-ethylsulfonyl-2-nitrobenzamide Chemical compound C1=C([N+]([O-])=O)C(C(=O)NS(=O)(=O)CC)=CC(OC=2C(=CC(=CC=2F)C(F)(F)F)Cl)=C1 QQOGZMUZAZWLJH-UHFFFAOYSA-N 0.000 description 1
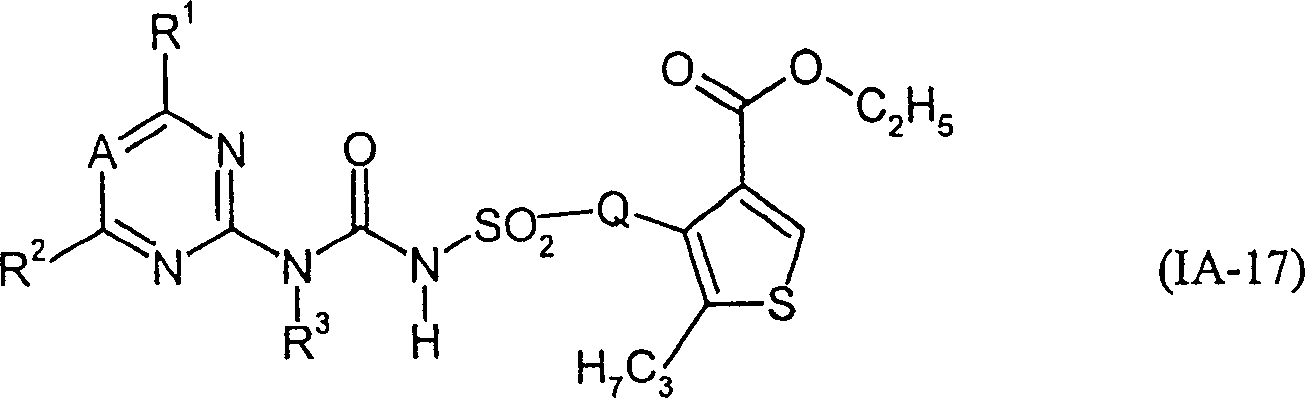
- VPXWITYNJWPYDU-UHFFFAOYSA-N 5-methyl-4-sulfamoylthiophene-3-carboxylic acid Chemical compound Cc1scc(C(O)=O)c1S(N)(=O)=O VPXWITYNJWPYDU-UHFFFAOYSA-N 0.000 description 1
- DVOODWOZJVJKQR-UHFFFAOYSA-N 5-tert-butyl-3-(2,4-dichloro-5-prop-2-ynoxyphenyl)-1,3,4-oxadiazol-2-one Chemical group O=C1OC(C(C)(C)C)=NN1C1=CC(OCC#C)=C(Cl)C=C1Cl DVOODWOZJVJKQR-UHFFFAOYSA-N 0.000 description 1
- HZKBYBNLTLVSPX-UHFFFAOYSA-N 6-[(6,6-dimethyl-5,7-dihydropyrrolo[2,1-c][1,2,4]thiadiazol-3-ylidene)amino]-7-fluoro-4-prop-2-ynyl-1,4-benzoxazin-3-one Chemical compound C#CCN1C(=O)COC(C=C2F)=C1C=C2N=C1SN=C2CC(C)(C)CN21 HZKBYBNLTLVSPX-UHFFFAOYSA-N 0.000 description 1
- 241000219144 Abutilon Species 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- VTNQPKFIQCLBDU-UHFFFAOYSA-N Acetochlor Chemical compound CCOCN(C(=O)CCl)C1=C(C)C=CC=C1CC VTNQPKFIQCLBDU-UHFFFAOYSA-N 0.000 description 1
- 241000427159 Achyranthes Species 0.000 description 1
- 239000002890 Aclonifen Substances 0.000 description 1
- 241000209758 Aegilops Species 0.000 description 1
- 241000209136 Agropyron Species 0.000 description 1
- 240000007241 Agrostis stolonifera Species 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- XKJMBINCVNINCA-UHFFFAOYSA-N Alfalone Chemical compound CON(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XKJMBINCVNINCA-UHFFFAOYSA-N 0.000 description 1
- 241000234282 Allium Species 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 241000219318 Amaranthus Species 0.000 description 1
- 240000001592 Amaranthus caudatus Species 0.000 description 1
- 235000009328 Amaranthus caudatus Nutrition 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 244000099147 Ananas comosus Species 0.000 description 1
- NXQDBZGWYSEGFL-UHFFFAOYSA-N Anilofos Chemical compound COP(=S)(OC)SCC(=O)N(C(C)C)C1=CC=C(Cl)C=C1 NXQDBZGWYSEGFL-UHFFFAOYSA-N 0.000 description 1
- 241001547866 Anoda Species 0.000 description 1
- 241000404028 Anthemis Species 0.000 description 1
- 241001666377 Apera Species 0.000 description 1
- 241000581616 Aphanes Species 0.000 description 1
- 235000003911 Arachis Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000005340 Asparagus officinalis Nutrition 0.000 description 1
- 241000219305 Atriplex Species 0.000 description 1
- QGQSRQPXXMTJCM-UHFFFAOYSA-N Benfuresate Chemical compound CCS(=O)(=O)OC1=CC=C2OCC(C)(C)C2=C1 QGQSRQPXXMTJCM-UHFFFAOYSA-N 0.000 description 1
- 239000005476 Bentazone Substances 0.000 description 1
- JDWQITFHZOBBFE-UHFFFAOYSA-N Benzofenap Chemical compound C=1C=C(Cl)C(C)=C(Cl)C=1C(=O)C=1C(C)=NN(C)C=1OCC(=O)C1=CC=C(C)C=C1 JDWQITFHZOBBFE-UHFFFAOYSA-N 0.000 description 1
- DTCJYIIKPVRVDD-UHFFFAOYSA-N Benzthiazuron Chemical compound C1=CC=C2SC(NC(=O)NC)=NC2=C1 DTCJYIIKPVRVDD-UHFFFAOYSA-N 0.000 description 1
- 241000143476 Bidens Species 0.000 description 1
- 239000005484 Bifenox Substances 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 241000611157 Brachiaria Species 0.000 description 1
- 241000339490 Brachyachne Species 0.000 description 1
- 244000056139 Brassica cretica Species 0.000 description 1
- 235000003351 Brassica cretica Nutrition 0.000 description 1
- 235000003343 Brassica rupestris Nutrition 0.000 description 1
- XTFNPKDYCLFGPV-OMCISZLKSA-N Bromofenoxim Chemical compound C1=C(Br)C(O)=C(Br)C=C1\C=N\OC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O XTFNPKDYCLFGPV-OMCISZLKSA-N 0.000 description 1
- 239000005489 Bromoxynil Substances 0.000 description 1
- ZOGDSYNXUXQGHF-XIEYBQDHSA-N Butroxydim Chemical compound CCCC(=O)C1=C(C)C=C(C)C(C2CC(=O)C(\C(CC)=N\OCC)=C(O)C2)=C1C ZOGDSYNXUXQGHF-XIEYBQDHSA-N 0.000 description 1
- BMTAFVWTTFSTOG-UHFFFAOYSA-N Butylate Chemical compound CCSC(=O)N(CC(C)C)CC(C)C BMTAFVWTTFSTOG-UHFFFAOYSA-N 0.000 description 1
- HSWIRUMELWLWDM-UHFFFAOYSA-N CCC1(C(C=CS1)N)C(=O)O Chemical compound CCC1(C(C=CS1)N)C(=O)O HSWIRUMELWLWDM-UHFFFAOYSA-N 0.000 description 1
- 229910021532 Calcite Inorganic materials 0.000 description 1
- 241000217446 Calystegia sepium Species 0.000 description 1
- 235000011305 Capsella bursa pastoris Nutrition 0.000 description 1
- 240000008867 Capsella bursa-pastoris Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- 239000005490 Carbetamide Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 244000036828 Carduus nutans Species 0.000 description 1
- 241001070941 Castanea Species 0.000 description 1
- 235000014036 Castanea Nutrition 0.000 description 1
- 240000004385 Centaurea cyanus Species 0.000 description 1
- 235000005940 Centaurea cyanus Nutrition 0.000 description 1
- 241000219312 Chenopodium Species 0.000 description 1
- 235000000509 Chenopodium ambrosioides Nutrition 0.000 description 1
- 244000098897 Chenopodium botrys Species 0.000 description 1
- 235000005490 Chenopodium botrys Nutrition 0.000 description 1
- DXXVCXKMSWHGTF-UHFFFAOYSA-N Chlomethoxyfen Chemical compound C1=C([N+]([O-])=O)C(OC)=CC(OC=2C(=CC(Cl)=CC=2)Cl)=C1 DXXVCXKMSWHGTF-UHFFFAOYSA-N 0.000 description 1
- HSSBORCLYSCBJR-UHFFFAOYSA-N Chloramben Chemical compound NC1=CC(Cl)=CC(C(O)=O)=C1Cl HSSBORCLYSCBJR-UHFFFAOYSA-N 0.000 description 1
- 239000005494 Chlorotoluron Substances 0.000 description 1
- 239000005496 Chlorsulfuron Substances 0.000 description 1
- 241000723353 Chrysanthemum Species 0.000 description 1
- 235000005633 Chrysanthemum balsamita Nutrition 0.000 description 1
- 244000192528 Chrysanthemum parthenium Species 0.000 description 1
- 244000037364 Cinnamomum aromaticum Species 0.000 description 1
- 235000014489 Cinnamomum aromaticum Nutrition 0.000 description 1
- 241000132536 Cirsium Species 0.000 description 1
- 241000207199 Citrus Species 0.000 description 1
- 239000005497 Clethodim Substances 0.000 description 1
- 239000005499 Clomazone Substances 0.000 description 1
- 239000005500 Clopyralid Substances 0.000 description 1
- 235000013162 Cocos nucifera Nutrition 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 235000010071 Cucumis prophetarum Nutrition 0.000 description 1
- 244000024469 Cucumis prophetarum Species 0.000 description 1
- 241000219122 Cucurbita Species 0.000 description 1
- VYNOULHXXDFBLU-UHFFFAOYSA-N Cumyluron Chemical compound C=1C=CC=CC=1C(C)(C)NC(=O)NCC1=CC=CC=C1Cl VYNOULHXXDFBLU-UHFFFAOYSA-N 0.000 description 1
- 239000005501 Cycloxydim Substances 0.000 description 1
- 239000005502 Cyhalofop-butyl Substances 0.000 description 1
- TYIYMOAHACZAMQ-CQSZACIVSA-N Cyhalofop-butyl Chemical group C1=CC(O[C@H](C)C(=O)OCCCC)=CC=C1OC1=CC=C(C#N)C=C1F TYIYMOAHACZAMQ-CQSZACIVSA-N 0.000 description 1
- 241000234653 Cyperus Species 0.000 description 1
- NNYRZQHKCHEXSD-UHFFFAOYSA-N Daimuron Chemical compound C1=CC(C)=CC=C1NC(=O)NC(C)(C)C1=CC=CC=C1 NNYRZQHKCHEXSD-UHFFFAOYSA-N 0.000 description 1
- 241000208296 Datura Species 0.000 description 1
- 241000721045 Daubentonia Species 0.000 description 1
- 241000208175 Daucus Species 0.000 description 1
- 239000005503 Desmedipham Substances 0.000 description 1
- SPANOECCGNXGNR-UITAMQMPSA-N Diallat Chemical compound CC(C)N(C(C)C)C(=O)SC\C(Cl)=C\Cl SPANOECCGNXGNR-UITAMQMPSA-N 0.000 description 1
- 239000005504 Dicamba Substances 0.000 description 1
- QNXAVFXEJCPCJO-UHFFFAOYSA-N Diclosulam Chemical compound N=1N2C(OCC)=NC(F)=CC2=NC=1S(=O)(=O)NC1=C(Cl)C=CC=C1Cl QNXAVFXEJCPCJO-UHFFFAOYSA-N 0.000 description 1
- LBGPXIPGGRQBJW-UHFFFAOYSA-N Difenzoquat Chemical compound C[N+]=1N(C)C(C=2C=CC=CC=2)=CC=1C1=CC=CC=C1 LBGPXIPGGRQBJW-UHFFFAOYSA-N 0.000 description 1
- 239000005507 Diflufenican Substances 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical group CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 239000005508 Dimethachlor Substances 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- OFDYMSKSGFSLLM-UHFFFAOYSA-N Dinitramine Chemical compound CCN(CC)C1=C([N+]([O-])=O)C=C(C(F)(F)F)C(N)=C1[N+]([O-])=O OFDYMSKSGFSLLM-UHFFFAOYSA-N 0.000 description 1
- QAHFOPIILNICLA-UHFFFAOYSA-N Diphenamid Chemical compound C=1C=CC=CC=1C(C(=O)N(C)C)C1=CC=CC=C1 QAHFOPIILNICLA-UHFFFAOYSA-N 0.000 description 1
- 239000005630 Diquat Substances 0.000 description 1
- YUBJPYNSGLJZPQ-UHFFFAOYSA-N Dithiopyr Chemical compound CSC(=O)C1=C(C(F)F)N=C(C(F)(F)F)C(C(=O)SC)=C1CC(C)C YUBJPYNSGLJZPQ-UHFFFAOYSA-N 0.000 description 1
- 239000005510 Diuron Substances 0.000 description 1
- GUVLYNGULCJVDO-UHFFFAOYSA-N EPTC Chemical compound CCCN(CCC)C(=O)SCC GUVLYNGULCJVDO-UHFFFAOYSA-N 0.000 description 1
- 241000192043 Echinochloa Species 0.000 description 1
- 235000001950 Elaeis guineensis Nutrition 0.000 description 1
- 244000127993 Elaeis melanococca Species 0.000 description 1
- 241000202829 Eleocharis Species 0.000 description 1
- 235000014716 Eleusine indica Nutrition 0.000 description 1
- 244000025670 Eleusine indica Species 0.000 description 1
- 241001517310 Eria Species 0.000 description 1
- 241000919496 Erysimum Species 0.000 description 1
- BXEHUCNTIZGSOJ-UHFFFAOYSA-N Esprocarb Chemical compound CC(C)C(C)N(CC)C(=O)SCC1=CC=CC=C1 BXEHUCNTIZGSOJ-UHFFFAOYSA-N 0.000 description 1
- PTFJIKYUEPWBMS-UHFFFAOYSA-N Ethalfluralin Chemical compound CC(=C)CN(CC)C1=C([N+]([O-])=O)C=C(C(F)(F)F)C=C1[N+]([O-])=O PTFJIKYUEPWBMS-UHFFFAOYSA-N 0.000 description 1
- 239000005512 Ethofumesate Substances 0.000 description 1
- UWVKRNOCDUPIDM-UHFFFAOYSA-N Ethoxysulfuron Chemical compound CCOC1=CC=CC=C1OS(=O)(=O)NC(=O)NC1=NC(OC)=CC(OC)=N1 UWVKRNOCDUPIDM-UHFFFAOYSA-N 0.000 description 1
- 241000221079 Euphorbia <genus> Species 0.000 description 1
- LLQPHQFNMLZJMP-UHFFFAOYSA-N Fentrazamide Chemical compound N1=NN(C=2C(=CC=CC=2)Cl)C(=O)N1C(=O)N(CC)C1CCCCC1 LLQPHQFNMLZJMP-UHFFFAOYSA-N 0.000 description 1
- 241000234642 Festuca Species 0.000 description 1
- 241001290564 Fimbristylis Species 0.000 description 1
- 239000005529 Florasulam Substances 0.000 description 1
- QZXATCCPQKOEIH-UHFFFAOYSA-N Florasulam Chemical compound N=1N2C(OC)=NC=C(F)C2=NC=1S(=O)(=O)NC1=C(F)C=CC=C1F QZXATCCPQKOEIH-UHFFFAOYSA-N 0.000 description 1
- RXCPQSJAVKGONC-UHFFFAOYSA-N Flumetsulam Chemical compound N1=C2N=C(C)C=CN2N=C1S(=O)(=O)NC1=C(F)C=CC=C1F RXCPQSJAVKGONC-UHFFFAOYSA-N 0.000 description 1
- 239000005533 Fluometuron Substances 0.000 description 1
- YWBVHLJPRPCRSD-UHFFFAOYSA-N Fluridone Chemical compound O=C1C(C=2C=C(C=CC=2)C(F)(F)F)=CN(C)C=C1C1=CC=CC=C1 YWBVHLJPRPCRSD-UHFFFAOYSA-N 0.000 description 1
- 239000005558 Fluroxypyr Substances 0.000 description 1
- 239000005559 Flurtamone Substances 0.000 description 1
- 235000014820 Galium aparine Nutrition 0.000 description 1
- 240000005702 Galium aparine Species 0.000 description 1
- 239000005561 Glufosinate Substances 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 239000005562 Glyphosate Substances 0.000 description 1
- 235000009438 Gossypium Nutrition 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 241000208818 Helianthus Species 0.000 description 1
- CAWXEEYDBZRFPE-UHFFFAOYSA-N Hexazinone Chemical compound O=C1N(C)C(N(C)C)=NC(=O)N1C1CCCCC1 CAWXEEYDBZRFPE-UHFFFAOYSA-N 0.000 description 1
- 235000005206 Hibiscus Nutrition 0.000 description 1
- 235000007185 Hibiscus lunariifolius Nutrition 0.000 description 1
- 244000284380 Hibiscus rosa sinensis Species 0.000 description 1
- 241000209219 Hordeum Species 0.000 description 1
- 240000005979 Hordeum vulgare Species 0.000 description 1
- 235000007340 Hordeum vulgare Nutrition 0.000 description 1
- 235000008694 Humulus lupulus Nutrition 0.000 description 1
- 241000169108 Hydrothrix Species 0.000 description 1
- 239000005566 Imazamox Substances 0.000 description 1
- XVOKUMIPKHGGTN-UHFFFAOYSA-N Imazethapyr Chemical compound OC(=O)C1=CC(CC)=CN=C1C1=NC(C)(C(C)C)C(=O)N1 XVOKUMIPKHGGTN-UHFFFAOYSA-N 0.000 description 1
- 240000007171 Imperata cylindrica Species 0.000 description 1
- 241001327265 Ischaemum Species 0.000 description 1
- NEKOXWSIMFDGMA-UHFFFAOYSA-N Isopropalin Chemical compound CCCN(CCC)C1=C([N+]([O-])=O)C=C(C(C)C)C=C1[N+]([O-])=O NEKOXWSIMFDGMA-UHFFFAOYSA-N 0.000 description 1
- 239000005571 Isoxaflutole Substances 0.000 description 1
- 241000110847 Kochia Species 0.000 description 1
- 241000208822 Lactuca Species 0.000 description 1
- 241000520028 Lamium Species 0.000 description 1
- 239000005572 Lenacil Substances 0.000 description 1
- 241000320639 Leptochloa Species 0.000 description 1
- 241000208204 Linum Species 0.000 description 1
- 241000209082 Lolium Species 0.000 description 1
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 1
- SUSRORUBZHMPCO-UHFFFAOYSA-N MC-4379 Chemical compound C1=C([N+]([O-])=O)C(C(=O)OC)=CC(OC=2C(=CC(Cl)=CC=2)Cl)=C1 SUSRORUBZHMPCO-UHFFFAOYSA-N 0.000 description 1
- 235000017945 Matricaria Nutrition 0.000 description 1
- 235000007232 Matricaria chamomilla Nutrition 0.000 description 1
- 235000014435 Mentha Nutrition 0.000 description 1
- 241001072983 Mentha Species 0.000 description 1
- 239000005578 Mesotrione Substances 0.000 description 1
- 239000005579 Metamitron Substances 0.000 description 1
- 239000005580 Metazachlor Substances 0.000 description 1
- RRVIAQKBTUQODI-UHFFFAOYSA-N Methabenzthiazuron Chemical compound C1=CC=C2SC(N(C)C(=O)NC)=NC2=C1 RRVIAQKBTUQODI-UHFFFAOYSA-N 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- 239000005581 Metobromuron Substances 0.000 description 1
- WLFDQEVORAMCIM-UHFFFAOYSA-N Metobromuron Chemical compound CON(C)C(=O)NC1=CC=C(Br)C=C1 WLFDQEVORAMCIM-UHFFFAOYSA-N 0.000 description 1
- 239000005582 Metosulam Substances 0.000 description 1
- VGHPMIFEKOFHHQ-UHFFFAOYSA-N Metosulam Chemical compound N1=C2N=C(OC)C=C(OC)N2N=C1S(=O)(=O)NC1=C(Cl)C=CC(C)=C1Cl VGHPMIFEKOFHHQ-UHFFFAOYSA-N 0.000 description 1
- 239000005584 Metsulfuron-methyl Substances 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- 235000003990 Monochoria hastata Nutrition 0.000 description 1
- 240000000178 Monochoria vaginalis Species 0.000 description 1
- LKJPSUCKSLORMF-UHFFFAOYSA-N Monolinuron Chemical compound CON(C)C(=O)NC1=CC=C(Cl)C=C1 LKJPSUCKSLORMF-UHFFFAOYSA-N 0.000 description 1
- 241001504654 Mustela nivalis Species 0.000 description 1
- 241001442158 Myosotis sylvatica Species 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- WXZVAROIGSFCFJ-UHFFFAOYSA-N N,N-diethyl-2-(naphthalen-1-yloxy)propanamide Chemical compound C1=CC=C2C(OC(C)C(=O)N(CC)CC)=CC=CC2=C1 WXZVAROIGSFCFJ-UHFFFAOYSA-N 0.000 description 1
- CMEWLCATCRTSGF-UHFFFAOYSA-N N,N-dimethyl-4-nitrosoaniline Chemical compound CN(C)C1=CC=C(N=O)C=C1 CMEWLCATCRTSGF-UHFFFAOYSA-N 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical class CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- WDWPBRRWZJBRPQ-REOHCLBHSA-N N[C@@H](C)C(=O)[P] Chemical compound N[C@@H](C)C(=O)[P] WDWPBRRWZJBRPQ-REOHCLBHSA-N 0.000 description 1
- LVKTWOXHRYGDMM-UHFFFAOYSA-N Naproanilide Chemical compound C=1C=C2C=CC=CC2=CC=1OC(C)C(=O)NC1=CC=CC=C1 LVKTWOXHRYGDMM-UHFFFAOYSA-N 0.000 description 1
- 239000005585 Napropamide Substances 0.000 description 1
- CCGPUGMWYLICGL-UHFFFAOYSA-N Neburon Chemical compound CCCCN(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 CCGPUGMWYLICGL-UHFFFAOYSA-N 0.000 description 1
- 241000208125 Nicotiana Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- UMKANAFDOQQUKE-UHFFFAOYSA-N Nitralin Chemical compound CCCN(CCC)C1=C([N+]([O-])=O)C=C(S(C)(=O)=O)C=C1[N+]([O-])=O UMKANAFDOQQUKE-UHFFFAOYSA-N 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 1
- BPQQTUXANYXVAA-UHFFFAOYSA-N Orthosilicate Chemical compound [O-][Si]([O-])([O-])[O-] BPQQTUXANYXVAA-UHFFFAOYSA-N 0.000 description 1
- 241000209094 Oryza Species 0.000 description 1
- 239000005589 Oxasulfuron Substances 0.000 description 1
- FCOHEOSCARXMMS-UHFFFAOYSA-N Oxaziclomefone Chemical compound C1OC(C)=C(C=2C=CC=CC=2)C(=O)N1C(C)(C)C1=CC(Cl)=CC(Cl)=C1 FCOHEOSCARXMMS-UHFFFAOYSA-N 0.000 description 1
- 239000005590 Oxyfluorfen Substances 0.000 description 1
- OQMBBFQZGJFLBU-UHFFFAOYSA-N Oxyfluorfen Chemical compound C1=C([N+]([O-])=O)C(OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 OQMBBFQZGJFLBU-UHFFFAOYSA-N 0.000 description 1
- 235000011096 Papaver Nutrition 0.000 description 1
- 240000001090 Papaver somniferum Species 0.000 description 1
- 241001330453 Paspalum Species 0.000 description 1
- 239000005591 Pendimethalin Substances 0.000 description 1
- 241000219833 Phaseolus Species 0.000 description 1
- 239000005594 Phenmedipham Substances 0.000 description 1
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 1
- UNLYSVIDNRIVFJ-UHFFFAOYSA-N Piperophos Chemical compound CCCOP(=S)(OCCC)SCC(=O)N1CCCCC1C UNLYSVIDNRIVFJ-UHFFFAOYSA-N 0.000 description 1
- 241000219843 Pisum Species 0.000 description 1
- 241001092090 Pittosporum Species 0.000 description 1
- 241001127637 Plantago Species 0.000 description 1
- 244000292693 Poa annua Species 0.000 description 1
- 241000205407 Polygonum Species 0.000 description 1
- 235000006386 Polygonum aviculare Nutrition 0.000 description 1
- 244000292697 Polygonum aviculare Species 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 241000219295 Portulaca Species 0.000 description 1
- 239000005600 Propaquizafop Substances 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 239000005603 Prosulfocarb Substances 0.000 description 1
- 239000005604 Prosulfuron Substances 0.000 description 1
- LTUNNEGNEKBSEH-UHFFFAOYSA-N Prosulfuron Chemical compound COC1=NC(C)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)CCC(F)(F)F)=N1 LTUNNEGNEKBSEH-UHFFFAOYSA-N 0.000 description 1
- VXMNDQDDWDDKOQ-UHFFFAOYSA-N Pyrazosulfuron Chemical compound COC1=CC(OC)=NC(NC(=O)NS(=O)(=O)C=2N(N=CC=2C(O)=O)C)=N1 VXMNDQDDWDDKOQ-UHFFFAOYSA-N 0.000 description 1
- 239000005606 Pyridate Substances 0.000 description 1
- JTZCTMAVMHRNTR-UHFFFAOYSA-N Pyridate Chemical compound CCCCCCCCSC(=O)OC1=CC(Cl)=NN=C1C1=CC=CC=C1 JTZCTMAVMHRNTR-UHFFFAOYSA-N 0.000 description 1
- CNILNQMBAHKMFS-UHFFFAOYSA-M Pyrithiobac-sodium Chemical compound [Na+].COC1=CC(OC)=NC(SC=2C(=C(Cl)C=CC=2)C([O-])=O)=N1 CNILNQMBAHKMFS-UHFFFAOYSA-M 0.000 description 1
- 239000005608 Quinmerac Substances 0.000 description 1
- OBLNWSCLAYSJJR-UHFFFAOYSA-N Quinoclamin Chemical compound C1=CC=C2C(=O)C(N)=C(Cl)C(=O)C2=C1 OBLNWSCLAYSJJR-UHFFFAOYSA-N 0.000 description 1
- 239000002167 Quinoclamine Substances 0.000 description 1
- 241000218206 Ranunculus Species 0.000 description 1
- 240000001451 Rottboellia cochinchinensis Species 0.000 description 1
- 240000000111 Saccharum officinarum Species 0.000 description 1
- 235000007201 Saccharum officinarum Nutrition 0.000 description 1
- 241001632050 Salsola Species 0.000 description 1
- 241000202758 Scirpus Species 0.000 description 1
- 241000209056 Secale Species 0.000 description 1
- 241000780602 Senecio Species 0.000 description 1
- 239000004113 Sepiolite Substances 0.000 description 1
- 235000005775 Setaria Nutrition 0.000 description 1
- 241000232088 Setaria <nematode> Species 0.000 description 1
- CSPPKDPQLUUTND-NBVRZTHBSA-N Sethoxydim Chemical compound CCO\N=C(/CCC)C1=C(O)CC(CC(C)SCC)CC1=O CSPPKDPQLUUTND-NBVRZTHBSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 240000003768 Solanum lycopersicum Species 0.000 description 1
- 241000488874 Sonchus Species 0.000 description 1
- 240000006694 Stellaria media Species 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- 239000005864 Sulphur Substances 0.000 description 1
- 240000001949 Taraxacum officinale Species 0.000 description 1
- 235000005187 Taraxacum officinale ssp. officinale Nutrition 0.000 description 1
- 239000005621 Terbuthylazine Substances 0.000 description 1
- 244000269722 Thea sinensis Species 0.000 description 1
- 244000299461 Theobroma cacao Species 0.000 description 1
- 235000009470 Theobroma cacao Nutrition 0.000 description 1
- QHTQREMOGMZHJV-UHFFFAOYSA-N Thiobencarb Chemical compound CCN(CC)C(=O)SCC1=CC=C(Cl)C=C1 QHTQREMOGMZHJV-UHFFFAOYSA-N 0.000 description 1
- 240000008488 Thlaspi arvense Species 0.000 description 1
- 235000008214 Thlaspi arvense Nutrition 0.000 description 1
- PHSUVQBHRAWOQD-UHFFFAOYSA-N Tiocarbazil Chemical compound CCC(C)N(C(C)CC)C(=O)SCC1=CC=CC=C1 PHSUVQBHRAWOQD-UHFFFAOYSA-N 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- 239000005624 Tralkoxydim Substances 0.000 description 1
- 239000005625 Tri-allate Substances 0.000 description 1
- MWBPRDONLNQCFV-UHFFFAOYSA-N Tri-allate Chemical compound CC(C)N(C(C)C)C(=O)SCC(Cl)=C(Cl)Cl MWBPRDONLNQCFV-UHFFFAOYSA-N 0.000 description 1
- 239000005627 Triclopyr Substances 0.000 description 1
- IBZHOAONZVJLOB-UHFFFAOYSA-N Tridiphane Chemical compound ClC1=CC(Cl)=CC(C2(CC(Cl)(Cl)Cl)OC2)=C1 IBZHOAONZVJLOB-UHFFFAOYSA-N 0.000 description 1
- 241000219793 Trifolium Species 0.000 description 1
- 235000019714 Triticale Nutrition 0.000 description 1
- 241000219422 Urtica Species 0.000 description 1
- 241000159750 Urtica cannabina Species 0.000 description 1
- 241001573053 Vandellia Species 0.000 description 1
- 241000219873 Vicia Species 0.000 description 1
- 241001506766 Xanthium Species 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- AMRQXHFXNZFDCH-SECBINFHSA-N [(2r)-1-(ethylamino)-1-oxopropan-2-yl] n-phenylcarbamate Chemical compound CCNC(=O)[C@@H](C)OC(=O)NC1=CC=CC=C1 AMRQXHFXNZFDCH-SECBINFHSA-N 0.000 description 1
- FDTAOSBGUZWNSN-UHFFFAOYSA-N [Cl].[F].N1C=CC=C1 Chemical compound [Cl].[F].N1C=CC=C1 FDTAOSBGUZWNSN-UHFFFAOYSA-N 0.000 description 1
- GOIGHUHRYZUEOM-UHFFFAOYSA-N [S].[I] Chemical compound [S].[I] GOIGHUHRYZUEOM-UHFFFAOYSA-N 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000642 acaricide Substances 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- NUFNQYOELLVIPL-UHFFFAOYSA-N acifluorfen Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 NUFNQYOELLVIPL-UHFFFAOYSA-N 0.000 description 1
- DDBMQDADIHOWIC-UHFFFAOYSA-N aclonifen Chemical compound C1=C([N+]([O-])=O)C(N)=C(Cl)C(OC=2C=CC=CC=2)=C1 DDBMQDADIHOWIC-UHFFFAOYSA-N 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 244000193174 agave Species 0.000 description 1
- XCSGPAVHZFQHGE-UHFFFAOYSA-N alachlor Chemical compound CCC1=CC=CC(CC)=C1N(COC)C(=O)CCl XCSGPAVHZFQHGE-UHFFFAOYSA-N 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- ORFLOUYIJLPLPL-WOJGMQOQSA-N alloxydim Chemical compound CCC\C(=N/OCC=C)C1=C(O)CC(C)(C)C(C(=O)OC)C1=O ORFLOUYIJLPLPL-WOJGMQOQSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- RQVYBGPQFYCBGX-UHFFFAOYSA-N ametryn Chemical compound CCNC1=NC(NC(C)C)=NC(SC)=N1 RQVYBGPQFYCBGX-UHFFFAOYSA-N 0.000 description 1
- 238000004176 ammonification Methods 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 239000012874 anionic emulsifier Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- MXWJVTOOROXGIU-UHFFFAOYSA-N atrazine Chemical compound CCNC1=NC(Cl)=NC(NC(C)C)=N1 MXWJVTOOROXGIU-UHFFFAOYSA-N 0.000 description 1
- 229960000892 attapulgite Drugs 0.000 description 1
- XOEMATDHVZOBSG-UHFFFAOYSA-N azafenidin Chemical compound C1=C(OCC#C)C(Cl)=CC(Cl)=C1N1C(=O)N2CCCCC2=N1 XOEMATDHVZOBSG-UHFFFAOYSA-N 0.000 description 1
- 229910052728 basic metal Inorganic materials 0.000 description 1
- 150000003818 basic metals Chemical class 0.000 description 1
- ZOMSMJKLGFBRBS-UHFFFAOYSA-N bentazone Chemical compound C1=CC=C2NS(=O)(=O)N(C(C)C)C(=O)C2=C1 ZOMSMJKLGFBRBS-UHFFFAOYSA-N 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- CNBGNNVCVSKAQZ-UHFFFAOYSA-N benzidamine Natural products C12=CC=CC=C2C(OCCCN(C)C)=NN1CC1=CC=CC=C1 CNBGNNVCVSKAQZ-UHFFFAOYSA-N 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- QKSKPIVNLNLAAV-UHFFFAOYSA-N bis(2-chloroethyl) sulfide Chemical compound ClCCSCCCl QKSKPIVNLNLAAV-UHFFFAOYSA-N 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- WZDDLAZXUYIVMU-UHFFFAOYSA-N bromobutide Chemical compound CC(C)(C)C(Br)C(=O)NC(C)(C)C1=CC=CC=C1 WZDDLAZXUYIVMU-UHFFFAOYSA-N 0.000 description 1
- HKPHPIREJKHECO-UHFFFAOYSA-N butachlor Chemical compound CCCCOCN(C(=O)CCl)C1=C(CC)C=CC=C1CC HKPHPIREJKHECO-UHFFFAOYSA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- KVNRLNFWIYMESJ-UHFFFAOYSA-N butyronitrile Chemical compound CCCC#N KVNRLNFWIYMESJ-UHFFFAOYSA-N 0.000 description 1
- HFEJHAAIJZXXRE-UHFFFAOYSA-N cafenstrole Chemical compound CCN(CC)C(=O)N1C=NC(S(=O)(=O)C=2C(=CC(C)=CC=2C)C)=N1 HFEJHAAIJZXXRE-UHFFFAOYSA-N 0.000 description 1
- VSGNNIFQASZAOI-UHFFFAOYSA-L calcium acetate Chemical compound [Ca+2].CC([O-])=O.CC([O-])=O VSGNNIFQASZAOI-UHFFFAOYSA-L 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- GGWHBJGBERXSLL-NBVRZTHBSA-N chembl113137 Chemical compound C1C(=O)C(C(=N/OCC)/CCC)=C(O)CC1C1CSCCC1 GGWHBJGBERXSLL-NBVRZTHBSA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- WYKYKTKDBLFHCY-UHFFFAOYSA-N chloridazon Chemical compound O=C1C(Cl)=C(N)C=NN1C1=CC=CC=C1 WYKYKTKDBLFHCY-UHFFFAOYSA-N 0.000 description 1
- RIUXZHMCCFLRBI-UHFFFAOYSA-N chlorimuron Chemical compound COC1=CC(Cl)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)C(O)=O)=N1 RIUXZHMCCFLRBI-UHFFFAOYSA-N 0.000 description 1
- XQNAUQUKWRBODG-UHFFFAOYSA-N chlornitrofen Chemical compound C1=CC([N+](=O)[O-])=CC=C1OC1=C(Cl)C=C(Cl)C=C1Cl XQNAUQUKWRBODG-UHFFFAOYSA-N 0.000 description 1
- JXCGFZXSOMJFOA-UHFFFAOYSA-N chlorotoluron Chemical compound CN(C)C(=O)NC1=CC=C(C)C(Cl)=C1 JXCGFZXSOMJFOA-UHFFFAOYSA-N 0.000 description 1
- VJYIFXVZLXQVHO-UHFFFAOYSA-N chlorsulfuron Chemical compound COC1=NC(C)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)Cl)=N1 VJYIFXVZLXQVHO-UHFFFAOYSA-N 0.000 description 1
- 235000019504 cigarettes Nutrition 0.000 description 1
- 235000020971 citrus fruits Nutrition 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- SILSDTWXNBZOGF-JWGBMQLESA-N clethodim Chemical compound CCSC(C)CC1CC(O)=C(C(CC)=NOC\C=C\Cl)C(=O)C1 SILSDTWXNBZOGF-JWGBMQLESA-N 0.000 description 1
- KIEDNEWSYUYDSN-UHFFFAOYSA-N clomazone Chemical compound O=C1C(C)(C)CON1CC1=CC=CC=C1Cl KIEDNEWSYUYDSN-UHFFFAOYSA-N 0.000 description 1
- HUBANNPOLNYSAD-UHFFFAOYSA-N clopyralid Chemical compound OC(=O)C1=NC(Cl)=CC=C1Cl HUBANNPOLNYSAD-UHFFFAOYSA-N 0.000 description 1
- YIANBKOBVRMNPR-UHFFFAOYSA-N cloransulam Chemical compound N=1N2C(OCC)=NC(F)=CC2=NC=1S(=O)(=O)NC1=C(Cl)C=CC=C1C(O)=O YIANBKOBVRMNPR-UHFFFAOYSA-N 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 229960003280 cupric chloride Drugs 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 description 1
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000006837 decompression Effects 0.000 description 1
- WZJZMXBKUWKXTQ-UHFFFAOYSA-N desmedipham Chemical compound CCOC(=O)NC1=CC=CC(OC(=O)NC=2C=CC=CC=2)=C1 WZJZMXBKUWKXTQ-UHFFFAOYSA-N 0.000 description 1
- GUJOJGAPFQRJSV-UHFFFAOYSA-N dialuminum;dioxosilane;oxygen(2-);hydrate Chemical compound O.[O-2].[O-2].[O-2].[Al+3].[Al+3].O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O GUJOJGAPFQRJSV-UHFFFAOYSA-N 0.000 description 1
- IWEDIXLBFLAXBO-UHFFFAOYSA-N dicamba Chemical compound COC1=C(Cl)C=CC(Cl)=C1C(O)=O IWEDIXLBFLAXBO-UHFFFAOYSA-N 0.000 description 1
- 229940117389 dichlorobenzene Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- WYEHFWKAOXOVJD-UHFFFAOYSA-N diflufenican Chemical compound FC1=CC(F)=CC=C1NC(=O)C1=CC=CN=C1OC1=CC=CC(C(F)(F)F)=C1 WYEHFWKAOXOVJD-UHFFFAOYSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- BWUPSGJXXPATLU-UHFFFAOYSA-N dimepiperate Chemical compound C=1C=CC=CC=1C(C)(C)SC(=O)N1CCCCC1 BWUPSGJXXPATLU-UHFFFAOYSA-N 0.000 description 1
- SCCDDNKJYDZXMM-UHFFFAOYSA-N dimethachlor Chemical compound COCCN(C(=O)CCl)C1=C(C)C=CC=C1C SCCDDNKJYDZXMM-UHFFFAOYSA-N 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- SYJFEGQWDCRVNX-UHFFFAOYSA-N diquat Chemical compound C1=CC=[N+]2CC[N+]3=CC=CC=C3C2=C1 SYJFEGQWDCRVNX-UHFFFAOYSA-N 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- XJWSAJYUBXQQDR-UHFFFAOYSA-M dodecyltrimethylammonium bromide Chemical compound [Br-].CCCCCCCCCCCC[N+](C)(C)C XJWSAJYUBXQQDR-UHFFFAOYSA-M 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 1
- QMTNOLKHSWIQBE-FGTMMUONSA-N exo-(+)-cinmethylin Chemical compound O([C@H]1[C@]2(C)CC[C@@](O2)(C1)C(C)C)CC1=CC=CC=C1C QMTNOLKHSWIQBE-FGTMMUONSA-N 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000003337 fertilizer Substances 0.000 description 1
- GINFBXXYGUODAT-UHFFFAOYSA-N flucarbazone Chemical compound O=C1N(C)C(OC)=NN1C(=O)NS(=O)(=O)C1=CC=CC=C1OC(F)(F)F GINFBXXYGUODAT-UHFFFAOYSA-N 0.000 description 1
- FOUWCSDKDDHKQP-UHFFFAOYSA-N flumioxazin Chemical compound FC1=CC=2OCC(=O)N(CC#C)C=2C=C1N(C1=O)C(=O)C2=C1CCCC2 FOUWCSDKDDHKQP-UHFFFAOYSA-N 0.000 description 1
- RZILCCPWPBTYDO-UHFFFAOYSA-N fluometuron Chemical compound CN(C)C(=O)NC1=CC=CC(C(F)(F)F)=C1 RZILCCPWPBTYDO-UHFFFAOYSA-N 0.000 description 1
- 125000003983 fluorenyl group Chemical class C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- MEFQWPUMEMWTJP-UHFFFAOYSA-N fluroxypyr Chemical compound NC1=C(Cl)C(F)=NC(OCC(O)=O)=C1Cl MEFQWPUMEMWTJP-UHFFFAOYSA-N 0.000 description 1
- XWROTTLWMHCFEC-LGMDPLHJSA-N fluthiacet Chemical compound C1=C(Cl)C(SCC(=O)O)=CC(\N=C/2N3CCCCN3C(=O)S\2)=C1F XWROTTLWMHCFEC-LGMDPLHJSA-N 0.000 description 1
- BGZZWXTVIYUUEY-UHFFFAOYSA-N fomesafen Chemical compound C1=C([N+]([O-])=O)C(C(=O)NS(=O)(=O)C)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 BGZZWXTVIYUUEY-UHFFFAOYSA-N 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000004459 forage Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000003502 gasoline Substances 0.000 description 1
- 230000035784 germination Effects 0.000 description 1
- XDDAORKBJWWYJS-UHFFFAOYSA-N glyphosate Chemical compound OC(=O)CNCP(O)(O)=O XDDAORKBJWWYJS-UHFFFAOYSA-N 0.000 description 1
- 229940097068 glyphosate Drugs 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- MFSWTRQUCLNFOM-SECBINFHSA-N haloxyfop-P-methyl Chemical group C1=CC(O[C@H](C)C(=O)OC)=CC=C1OC1=NC=C(C(F)(F)F)C=C1Cl MFSWTRQUCLNFOM-SECBINFHSA-N 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- 239000010903 husk Substances 0.000 description 1
- 150000004678 hydrides Chemical class 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 239000000413 hydrolysate Substances 0.000 description 1
- KQSBZNJFKWOQQK-UHFFFAOYSA-N hystazarin Natural products O=C1C2=CC=CC=C2C(=O)C2=C1C=C(O)C(O)=C2 KQSBZNJFKWOQQK-UHFFFAOYSA-N 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- NRXQIUSYPAHGNM-UHFFFAOYSA-N ioxynil Chemical compound OC1=C(I)C=C(C#N)C=C1I NRXQIUSYPAHGNM-UHFFFAOYSA-N 0.000 description 1
- HDHLIWCXDDZUFH-UHFFFAOYSA-N irgarol 1051 Chemical compound CC(C)(C)NC1=NC(SC)=NC(NC2CC2)=N1 HDHLIWCXDDZUFH-UHFFFAOYSA-N 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N iron oxide Inorganic materials [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 1
- DCYOBGZUOMKFPA-UHFFFAOYSA-N iron(2+);iron(3+);octadecacyanide Chemical compound [Fe+2].[Fe+2].[Fe+2].[Fe+3].[Fe+3].[Fe+3].[Fe+3].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-] DCYOBGZUOMKFPA-UHFFFAOYSA-N 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-O isopropylaminium Chemical class CC(C)[NH3+] JJWLVOIRVHMVIS-UHFFFAOYSA-O 0.000 description 1
- PUIYMUZLKQOUOZ-UHFFFAOYSA-N isoproturon Chemical compound CC(C)C1=CC=C(NC(=O)N(C)C)C=C1 PUIYMUZLKQOUOZ-UHFFFAOYSA-N 0.000 description 1
- OYIKARCXOQLFHF-UHFFFAOYSA-N isoxaflutole Chemical compound CS(=O)(=O)C1=CC(C(F)(F)F)=CC=C1C(=O)C1=C(C2CC2)ON=C1 OYIKARCXOQLFHF-UHFFFAOYSA-N 0.000 description 1
- 229940088649 isoxaflutole Drugs 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- CONWAEURSVPLRM-UHFFFAOYSA-N lactofen Chemical compound C1=C([N+]([O-])=O)C(C(=O)OC(C)C(=O)OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 CONWAEURSVPLRM-UHFFFAOYSA-N 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- ZTMKADLOSYKWCA-UHFFFAOYSA-N lenacil Chemical compound O=C1NC=2CCCC=2C(=O)N1C1CCCCC1 ZTMKADLOSYKWCA-UHFFFAOYSA-N 0.000 description 1
- 229920005610 lignin Polymers 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 239000004579 marble Substances 0.000 description 1
- XIGAUIHYSDTJHW-UHFFFAOYSA-N mefenacet Chemical compound N=1C2=CC=CC=C2SC=1OCC(=O)N(C)C1=CC=CC=C1 XIGAUIHYSDTJHW-UHFFFAOYSA-N 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- KPUREKXXPHOJQT-UHFFFAOYSA-N mesotrione Chemical compound [O-][N+](=O)C1=CC(S(=O)(=O)C)=CC=C1C(=O)C1C(=O)CCCC1=O KPUREKXXPHOJQT-UHFFFAOYSA-N 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- VHCNQEUWZYOAEV-UHFFFAOYSA-N metamitron Chemical compound O=C1N(N)C(C)=NN=C1C1=CC=CC=C1 VHCNQEUWZYOAEV-UHFFFAOYSA-N 0.000 description 1
- STEPQTYSZVCJPV-UHFFFAOYSA-N metazachlor Chemical compound CC1=CC=CC(C)=C1N(C(=O)CCl)CN1N=CC=C1 STEPQTYSZVCJPV-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- BACHBFVBHLGWSL-UHFFFAOYSA-N methyl 2-[4-(2,4-dichlorophenoxy)phenoxy]propanoate Chemical group C1=CC(OC(C)C(=O)OC)=CC=C1OC1=CC=C(Cl)C=C1Cl BACHBFVBHLGWSL-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- NDNKHWUXXOFHTD-UHFFFAOYSA-N metizoline Chemical compound CC=1SC2=CC=CC=C2C=1CC1=NCCN1 NDNKHWUXXOFHTD-UHFFFAOYSA-N 0.000 description 1
- 229960002939 metizoline Drugs 0.000 description 1
- DSRNRYQBBJQVCW-UHFFFAOYSA-N metoxuron Chemical compound COC1=CC=C(NC(=O)N(C)C)C=C1Cl DSRNRYQBBJQVCW-UHFFFAOYSA-N 0.000 description 1
- RSMUVYRMZCOLBH-UHFFFAOYSA-N metsulfuron methyl Chemical group COC(=O)C1=CC=CC=C1S(=O)(=O)NC(=O)NC1=NC(C)=NC(OC)=N1 RSMUVYRMZCOLBH-UHFFFAOYSA-N 0.000 description 1
- 239000011785 micronutrient Substances 0.000 description 1
- 235000013369 micronutrients Nutrition 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- DEDOPGXGGQYYMW-UHFFFAOYSA-N molinate Chemical compound CCSC(=O)N1CCCCCC1 DEDOPGXGGQYYMW-UHFFFAOYSA-N 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 229910052901 montmorillonite Inorganic materials 0.000 description 1
- 235000010460 mustard Nutrition 0.000 description 1
- 229940031815 mycocide Drugs 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- QTGVGIVRLSGTJJ-UHFFFAOYSA-N n-(acetamidomethyl)-2-chloro-n-(2,6-diethylphenyl)acetamide Chemical compound CCC1=CC=CC(CC)=C1N(CNC(C)=O)C(=O)CCl QTGVGIVRLSGTJJ-UHFFFAOYSA-N 0.000 description 1
- HNHVTXYLRVGMHD-UHFFFAOYSA-N n-butyl isocyanate Chemical compound CCCCN=C=O HNHVTXYLRVGMHD-UHFFFAOYSA-N 0.000 description 1
- JIKUXBYRTXDNIY-UHFFFAOYSA-N n-methyl-n-phenylformamide Chemical compound O=CN(C)C1=CC=CC=C1 JIKUXBYRTXDNIY-UHFFFAOYSA-N 0.000 description 1
- 229940042880 natural phospholipid Drugs 0.000 description 1
- 229920005615 natural polymer Polymers 0.000 description 1
- 230000001069 nematicidal effect Effects 0.000 description 1
- 239000005645 nematicide Substances 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 239000012875 nonionic emulsifier Substances 0.000 description 1
- NVGOPFQZYCNLDU-UHFFFAOYSA-N norflurazon Chemical compound O=C1C(Cl)=C(NC)C=NN1C1=CC=CC(C(F)(F)F)=C1 NVGOPFQZYCNLDU-UHFFFAOYSA-N 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- LLLFASISUZUJEQ-UHFFFAOYSA-N orbencarb Chemical compound CCN(CC)C(=O)SCC1=CC=CC=C1Cl LLLFASISUZUJEQ-UHFFFAOYSA-N 0.000 description 1
- 239000002420 orchard Substances 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000011146 organic particle Substances 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- IOXAXYHXMLCCJJ-UHFFFAOYSA-N oxetan-3-yl 2-[(4,6-dimethylpyrimidin-2-yl)carbamoylsulfamoyl]benzoate Chemical compound CC1=CC(C)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)C(=O)OC2COC2)=N1 IOXAXYHXMLCCJJ-UHFFFAOYSA-N 0.000 description 1
- NDLPOXTZKUMGOV-UHFFFAOYSA-N oxo(oxoferriooxy)iron hydrate Chemical compound O.O=[Fe]O[Fe]=O NDLPOXTZKUMGOV-UHFFFAOYSA-N 0.000 description 1
- 229910052625 palygorskite Inorganic materials 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- FIKAKWIAUPDISJ-UHFFFAOYSA-L paraquat dichloride Chemical compound [Cl-].[Cl-].C1=C[N+](C)=CC=C1C1=CC=[N+](C)C=C1 FIKAKWIAUPDISJ-UHFFFAOYSA-L 0.000 description 1
- CHIFOSRWCNZCFN-UHFFFAOYSA-N pendimethalin Chemical compound CCC(CC)NC1=C([N+]([O-])=O)C=C(C)C(C)=C1[N+]([O-])=O CHIFOSRWCNZCFN-UHFFFAOYSA-N 0.000 description 1
- JZPKLLLUDLHCEL-UHFFFAOYSA-N pentoxazone Chemical compound O=C1C(=C(C)C)OC(=O)N1C1=CC(OC2CCCC2)=C(Cl)C=C1F JZPKLLLUDLHCEL-UHFFFAOYSA-N 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- IDOWTHOLJBTAFI-UHFFFAOYSA-N phenmedipham Chemical compound COC(=O)NC1=CC=CC(OC(=O)NC=2C=C(C)C=CC=2)=C1 IDOWTHOLJBTAFI-UHFFFAOYSA-N 0.000 description 1
- OTYNBGDFCPCPOU-UHFFFAOYSA-N phosphane sulfane Chemical compound S.P[H] OTYNBGDFCPCPOU-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 1
- 235000015320 potassium carbonate Nutrition 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- AAEVYOVXGOFMJO-UHFFFAOYSA-N prometryn Chemical compound CSC1=NC(NC(C)C)=NC(NC(C)C)=N1 AAEVYOVXGOFMJO-UHFFFAOYSA-N 0.000 description 1
- MFOUDYKPLGXPGO-UHFFFAOYSA-N propachlor Chemical compound ClCC(=O)N(C(C)C)C1=CC=CC=C1 MFOUDYKPLGXPGO-UHFFFAOYSA-N 0.000 description 1
- OYJMHAFVOZPIOY-UHFFFAOYSA-N propan-2-yl 2-chloro-5-[3-methyl-2,6-dioxo-4-(trifluoromethyl)pyrimidin-1-yl]benzoate Chemical compound C1=C(Cl)C(C(=O)OC(C)C)=CC(N2C(N(C)C(=CC2=O)C(F)(F)F)=O)=C1 OYJMHAFVOZPIOY-UHFFFAOYSA-N 0.000 description 1
- FKLQIONHGSFYJY-UHFFFAOYSA-N propan-2-yl 5-[4-bromo-1-methyl-5-(trifluoromethyl)pyrazol-3-yl]-2-chloro-4-fluorobenzoate Chemical compound C1=C(Cl)C(C(=O)OC(C)C)=CC(C=2C(=C(N(C)N=2)C(F)(F)F)Br)=C1F FKLQIONHGSFYJY-UHFFFAOYSA-N 0.000 description 1
- FROBCXTULYFHEJ-OAHLLOKOSA-N propaquizafop Chemical compound C1=CC(O[C@H](C)C(=O)OCCON=C(C)C)=CC=C1OC1=CN=C(C=C(Cl)C=C2)C2=N1 FROBCXTULYFHEJ-OAHLLOKOSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- NQLVQOSNDJXLKG-UHFFFAOYSA-N prosulfocarb Chemical compound CCCN(CCC)C(=O)SCC1=CC=CC=C1 NQLVQOSNDJXLKG-UHFFFAOYSA-N 0.000 description 1
- 229960003351 prussian blue Drugs 0.000 description 1
- 239000013225 prussian blue Substances 0.000 description 1
- YXIIPOGUBVYZIW-UHFFFAOYSA-N pyraflufen Chemical compound ClC1=C(OC(F)F)N(C)N=C1C1=CC(OCC(O)=O)=C(Cl)C=C1F YXIIPOGUBVYZIW-UHFFFAOYSA-N 0.000 description 1
- 150000003217 pyrazoles Chemical class 0.000 description 1
- ASRAWSBMDXVNLX-UHFFFAOYSA-N pyrazolynate Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(=O)C=1C(C)=NN(C)C=1OS(=O)(=O)C1=CC=C(C)C=C1 ASRAWSBMDXVNLX-UHFFFAOYSA-N 0.000 description 1
- FKERUJTUOYLBKB-UHFFFAOYSA-N pyrazoxyfen Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(=O)C=1C(C)=NN(C)C=1OCC(=O)C1=CC=CC=C1 FKERUJTUOYLBKB-UHFFFAOYSA-N 0.000 description 1
- VTRWMTJQBQJKQH-UHFFFAOYSA-N pyributicarb Chemical compound COC1=CC=CC(N(C)C(=S)OC=2C=C(C=CC=2)C(C)(C)C)=N1 VTRWMTJQBQJKQH-UHFFFAOYSA-N 0.000 description 1
- DEIKMOQTJBGGAX-DJKKODMXSA-N pyriminobac Chemical compound CO\N=C(/C)C1=CC=CC(OC=2N=C(OC)C=C(OC)N=2)=C1C(O)=O DEIKMOQTJBGGAX-DJKKODMXSA-N 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- FFSSWMQPCJRCRV-UHFFFAOYSA-N quinclorac Chemical compound ClC1=CN=C2C(C(=O)O)=C(Cl)C=CC2=C1 FFSSWMQPCJRCRV-UHFFFAOYSA-N 0.000 description 1
- ALZOLUNSQWINIR-UHFFFAOYSA-N quinmerac Chemical compound OC(=O)C1=C(Cl)C=CC2=CC(C)=CN=C21 ALZOLUNSQWINIR-UHFFFAOYSA-N 0.000 description 1
- 239000005871 repellent Substances 0.000 description 1
- 230000002940 repellent Effects 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 1
- 229910052624 sepiolite Inorganic materials 0.000 description 1
- 235000019355 sepiolite Nutrition 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229960001866 silicon dioxide Drugs 0.000 description 1
- ODCWYMIRDDJXKW-UHFFFAOYSA-N simazine Chemical compound CCNC1=NC(Cl)=NC(NCC)=N1 ODCWYMIRDDJXKW-UHFFFAOYSA-N 0.000 description 1
- MGLWZSOBALDPEK-UHFFFAOYSA-N simetryn Chemical compound CCNC1=NC(NCC)=NC(SC)=N1 MGLWZSOBALDPEK-UHFFFAOYSA-N 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000011121 sodium hydroxide Nutrition 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 239000003516 soil conditioner Substances 0.000 description 1
- 238000010025 steaming Methods 0.000 description 1
- 239000004575 stone Substances 0.000 description 1
- OORLZFUTLGXMEF-UHFFFAOYSA-N sulfentrazone Chemical compound O=C1N(C(F)F)C(C)=NN1C1=CC(NS(C)(=O)=O)=C(Cl)C=C1Cl OORLZFUTLGXMEF-UHFFFAOYSA-N 0.000 description 1
- ZDXMLEQEMNLCQG-UHFFFAOYSA-N sulfometuron methyl Chemical group COC(=O)C1=CC=CC=C1S(=O)(=O)NC(=O)NC1=NC(C)=CC(C)=N1 ZDXMLEQEMNLCQG-UHFFFAOYSA-N 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 229910021653 sulphate ion Inorganic materials 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- RJKCKKDSSSRYCB-UHFFFAOYSA-N tebutam Chemical compound CC(C)(C)C(=O)N(C(C)C)CC1=CC=CC=C1 RJKCKKDSSSRYCB-UHFFFAOYSA-N 0.000 description 1
- IROINLKCQGIITA-UHFFFAOYSA-N terbutryn Chemical compound CCNC1=NC(NC(C)(C)C)=NC(SC)=N1 IROINLKCQGIITA-UHFFFAOYSA-N 0.000 description 1
- FZXISNSWEXTPMF-UHFFFAOYSA-N terbutylazine Chemical compound CCNC1=NC(Cl)=NC(NC(C)(C)C)=N1 FZXISNSWEXTPMF-UHFFFAOYSA-N 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 description 1
- 229960000278 theophylline Drugs 0.000 description 1
- WOSNCVAPUOFXEH-UHFFFAOYSA-N thifluzamide Chemical compound S1C(C)=NC(C(F)(F)F)=C1C(=O)NC1=C(Br)C=C(OC(F)(F)F)C=C1Br WOSNCVAPUOFXEH-UHFFFAOYSA-N 0.000 description 1
- ZWZVWGITAAIFPS-UHFFFAOYSA-N thiophosgene Chemical compound ClC(Cl)=S ZWZVWGITAAIFPS-UHFFFAOYSA-N 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- DQFPEYARZIQXRM-LTGZKZEYSA-N tralkoxydim Chemical compound C1C(=O)C(C(/CC)=N/OCC)=C(O)CC1C1=C(C)C=C(C)C=C1C DQFPEYARZIQXRM-LTGZKZEYSA-N 0.000 description 1
- XOPFESVZMSQIKC-UHFFFAOYSA-N triasulfuron Chemical compound COC1=NC(C)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)OCCCl)=N1 XOPFESVZMSQIKC-UHFFFAOYSA-N 0.000 description 1
- YMXOXAPKZDWXLY-QWRGUYRKSA-N tribenuron methyl Chemical group COC(=O)[C@H]1CCCC[C@@H]1S(=O)(=O)NC(=O)N(C)C1=NC(C)=NC(OC)=N1 YMXOXAPKZDWXLY-QWRGUYRKSA-N 0.000 description 1
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 1
- REEQLXCGVXDJSQ-UHFFFAOYSA-N trichlopyr Chemical compound OC(=O)COC1=NC(Cl)=C(Cl)C=C1Cl REEQLXCGVXDJSQ-UHFFFAOYSA-N 0.000 description 1
- ZSDSQXJSNMTJDA-UHFFFAOYSA-N trifluralin Chemical compound CCCN(CCC)C1=C([N+]([O-])=O)C=C(C(F)(F)F)C=C1[N+]([O-])=O ZSDSQXJSNMTJDA-UHFFFAOYSA-N 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 239000004563 wettable powder Substances 0.000 description 1
- 239000002023 wood Substances 0.000 description 1
- 241000228158 x Triticosecale Species 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/08—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having one or more single bonds to nitrogen atoms
- A01N47/28—Ureas or thioureas containing the groups >N—CO—N< or >N—CS—N<
- A01N47/36—Ureas or thioureas containing the groups >N—CO—N< or >N—CS—N< containing the group >N—CO—N< directly attached to at least one heterocyclic ring; Thio analogues thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/08—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having one or more single bonds to nitrogen atoms
- A01N47/28—Ureas or thioureas containing the groups >N—CO—N< or >N—CS—N<
- A01N47/34—Ureas or thioureas containing the groups >N—CO—N< or >N—CS—N< containing the groups, e.g. biuret; Thio analogues thereof; Urea-aldehyde condensation products
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D521/00—Heterocyclic compounds containing unspecified hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明涉及通式(I)的噻吩基(氨基)磺酰脲类化合物,其中,A、Q、R1、R2、R3、R4和R5各具有说明书中给出的意义。本发明还涉及所述化合物的制备方法以及它们作为除草剂的应用。
Description
技术领域
本发明涉及新的取代的噻吩基(氨基)磺酰脲类化合物、它们的制备方法以及它们作为除草剂的应用。
背景技术
业已知道某些取代的噻吩基磺酰脲具有除草性能(参见,EP-A-30142/US-A-4481029/US-A-4599103/US-A-4701535,BP-A-97122/US-A-4549898,EP-A-207609/US-A-4668281)。然而,这些已知化合物的除草活性并不是完全令人满意的。
发明内容
因此,本发明提供了新颖的通式(I)的取代的噻吩基(氨基)磺酰脲类化合物及其盐,其中,A代表N或CH基团;Q代表单键或NH;R1代表氢、卤素或各自任选地被取代的烷基、烷氧基、烷硫基、烷基氨基、二烷基氨基、芳氧基或杂环氧基;R2代表氢、卤素或各自任选地被取代的烷基、烷氧基、烷硫基、烷基氨基、二烷基氨基、芳氧基或杂环氧基;R3代表氢或任选地被取代的烷基;R4代表卤素或任选地被取代的烷基以及-如果Q代表NH-也代表氢;和R5代表氢或各自任选地被取代的烷基、链烯基、炔基、环烷基、环烷基烷基或杂环基。
饱和或不饱和的烃链如烷基、链烯基或炔基,包括与杂原子结合的情况如在烷氧基中时,只要有可能,各自就可以是直链或支链的。
任选地被取代的基团可以是单或多取代的,其中在多取代的情况下,取代基可以相同或不同。
存在于上述和下述各式中的各基团的优选的取代基或范围定义如下:A优选代表N或CH基团。Q优选代表单键或NH。R1优选代表氢,优选代表卤素,优选代表各自任选地被氰基、卤素或C1-C4-烷氧基取代的在烷基中各具有1-4个碳原子的烷基、烷氧基、烷硫基、烷基氨基或二烷基氨基,或优选代表各自任选地被氰基、卤素、C1-C4-烷基或C1-C4-烷氧基取代的苯氧基、氧杂环丁烷基氧基、呋喃基氧基或四氢呋喃基氧基。R2优选代表氢,优选代表卤素,优选代表各自任选地被氰基、卤素或C1-C4-烷氧基取代的在烷基中各具有1-4个碳原子的烷基、烷氧基、烷硫基、烷基氨基或二烷基氨基,或优选代表各自任选地被氰基、卤素、C1-C4-烷基或C1-C4-烷氧基取代的苯氧基、氧杂环丁烷基氧基、呋喃基氧基或四氢呋喃基氧基。R3优选代表氢或任选地被C1-C4-烷氧基、C1-C4-烷基羰基或C1-C4-烷氧基羰基取代的具有1-4个碳原子的烷基。R4优选代表任选地被氰基、卤素或C1-C4-烷氧基取代的具有1-6个碳原子的烷基以及-如果Q代表NH-也优选代表氢。R5优选代表氢,优选代表任选地被氰基、卤素或C1-C4-烷氧基取代的具有1-6个碳原子的烷基,优选代表各自任选地被卤素取代的各具有2-6个碳原子的链烯基或炔基,优选代表各自任选地被氰基、卤素或C1-C4-烷基取代的各在环烷基中具有3-6个碳原子和任选地在烷基中具有1-4个碳原子的环烷基或环烷基烷基,或优选代表各自任选地被氰基、卤素、C1-C4-烷基或C1-C4-烷氧基取代的氧杂环丁烷基、呋喃基或四氢呋喃基。A特别优选代表N或CH基团。Q特别优选代表单键或NH。R1特别优选代表氢、氟、氯、溴、碘,特别优选代表各自任选地被氰基、氟、氯、甲氧基或乙氧基取代的甲基、乙基、正或异丙基、甲 氧基、乙氧基、正或异丙氧基、甲硫基、乙硫基、正或异丙硫基、甲基氨基、乙基氨基、正或异丙基氨基、二甲基氨基或二乙基氨基。R2特别优选代表氟、氯、溴,特别优选代表各自任选地被氰基、氟、氯、甲氧基或乙氧基取代的甲基、乙基、正或异丙基、甲氧基、乙氧基、正或异丙氧基、甲硫基、乙硫基、正或异丙硫基、甲基氨基、乙基氨基、正或异丙基氨基、二甲基氨基或二乙基氨基。R3特别优选代表氢或特别优选代表各自任选地被甲氧基、乙氧基、正或异丙氧基、乙酰基、丙酰基、正或异丁酰基、甲氧基羰基、乙氧基羰基、正或异丙氧基羰基取代的甲基或乙基。R4特别优选代表各自任选地被氰基、氟、氯、甲氧基或乙氧基取代的甲基、乙基、正或异丙基、正-、异-、仲-或叔丁基。R5特别优选代表氢,特别优选代表各自任选地被氰基、氟、氯、甲氧基、乙氧基、正或异丙氧基取代的甲基、乙基、正或异丙基、正-、异-、仲-或叔丁基,特别优选代表各自任选地被氟、氯或溴取代的丙烯基、丁烯基、丙炔基或丁炔基,或特别优选代表各自任选地被氰基、氟、氯、溴、甲基、乙基、正或异丙基取代的环丙基、环丁基、环戊基、环己基、环丙基甲基、环丁基甲基、环戊基甲基或环己基甲基。A非常特别优选代表N或CH基团。Q非常特别优选代表单键或NH。R1非常特别优选代表氢、氟、氯、溴,非常特别优选代表各自任选地被氟、氯、甲氧基或乙氧基取代的甲基、乙基、甲氧基、乙氧基、甲硫基、乙硫基、甲基氨基、乙基氨基,或非常特别优选代表二甲基氨基。R2非常特别优选代表氟、氯、溴,非常特别优选代表各自任选地被氟、氯、甲氧基或乙氧基取代的甲基、乙基、甲氧基、乙氧基、甲硫基、乙硫基、甲基氨基或乙基氨基,或非常特别优选代表二甲基氨基。R3非常特别优选代表氢或甲基。R4非常特别优选代表各自任选地被氟或氯取代的甲基、乙基、正或异丙基。R5非常特别优选代表各自任选地被氟、氯、甲氧基或乙氧基取代的甲 基、乙基、正或异丙基,或非常特别优选代表各自任选地被氟或氯取代的丙烯基或丙炔基。A最优选代表CH基团。R1和R2最优选代表甲氧基。R3最优选代表氢。
本发明也优选提供其中A、Q、R1、R2、R3、R4和R5各具有上面作为优选给出的意义的式(I)化合物的钠盐、钾盐、镁盐、钙盐、铵盐、C1-C4-烷基铵盐、二-(C1-C4-烷基)-铵盐、三-(C1-C4-烷基)-铵盐、四-(C1-C4-烷基)-铵盐、三-(C1-C4-烷基)-锍盐、C5-或C6-环烷基-铵盐和二-(C1-C2-烷基)-苄基铵盐。
列于上文中的一般或优选的基团定义适合于式(I)的终产物,且相应地,适合于在每一种情况下制备所需的起始原料和中间体。这些基团定义可以相互间按需要组合,即,包括给定的优选范围间的组合。
本发明优选的是含有上面所列优选含义组合的式(I)化合物。
本发明特别优选的是含有上面所列特别优选含义组合的式(I)化合物。
本发明非常特别优选的是含有上面所列非常特别优选含义组合的式(I)化合物。
本发明最优选的是其中R1、R2、R3或A具有作为最优选给出的意义之一的化合物。
本发明的式(I)化合物的实例列在下列各组中。组1
在此,A、Q、R1、R2和R3具有例如下面所列的意义:
组2 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组3 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组4 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组5 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组6 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组7 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组8 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组9 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组10 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组11 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组12 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组13 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组14 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组15 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组16 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组17 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组18 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组19 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组20 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组21 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组22 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组23 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组24 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。组25 在此,A、Q、R1、R2和R3具有例如在组1中给出的意义。
| A | Q | R1 | R2 | R3 |
| CH | - | OCH3 | OCH3 | H |
| CH | NH | OCH3 | OCH3 | H |
| CH | - | CH3 | OCH3 | H |
| CH | NH | CH3 | OCH3 | H |
| CH | - | CH3 | CH3 | H |
| CH | NH | CH3 | CH3 | H |
| CH | - | Cl | OCH3 | H |
| CH | - | H | CH3 | H |
| N | - | CH3 | OCH3 | CH3 |
| N | - | OCH3 | OCH3 | CH3 |
| N | - | CH3 | OCH3 | H |
| N | NH | CH3 | OCH3 | H |
| N | - | OCH3 | OCH3 | H |
| N | NH | OCH3 | OCH3 | H |
| N | - | CH3 | CH3 | H |
| N | - | OCHF2 | N(CH3)2 | H |
| N | - | CH3 | SCH3 | H |
| N | - | C2H5 | OCH3 | H |
| N | - | CH3 | OC2H5 | H |
| N | - | H | OCH3 | H |
新颖的通式(I)的取代的噻吩基(氨基)磺酰脲类化合物具有强的除草活性。
新颖的通式(I)的取代的噻吩基(氨基)磺酰脲类化合物如下获得:(a)任选地在反应辅助剂存在下和任选地在稀释剂存在下,使通式(II)的氨基嗪与通式(III)的噻吩基(氨基)磺酰基异氰酸酯反应,其中A、R1和R2各如上文所定义,其中Q、R4和R5各如上所定义;或(b)任选地在反应辅助剂存在下和任选地在稀释剂存在下,使通式(IV)的取代的氨基嗪与通式(V)的噻吩衍生物反应,其中A、R1和R2各如上文所定义,Z代表卤素、烷氧基或芳氧基,和R具有对R3给出的意义或代表基团-C(O)-Z,其中Q、R4和R5各如上所定义;或(c)任选地在反应辅助剂存在下和任选地在稀释剂存在下,使通式(II)的氨基嗪与通式(VI)的噻吩衍生物反应,其中A、R1和R2各如上文所定义,其中Q、R4和R5各如上所定义,和Z代表卤素、烷氧基或芳氧基;或(d)任选地在稀释剂存在下,使通式(II)的氨基嗪与氯磺酰基异氰酸酯反应,其中A、R1和R2各如上文所定义,以及,任选地在反应辅助剂存在下和任选地在稀释剂存在下,使所得的通式(VII)的氯磺酰基氨基羰基氨基嗪在中间分离后或“就地地”与通式(VIII)的取代的氨基噻吩反应,其中A、R1和R2各如上所定义,其中R4和R5各如上所定义;并且,任选地将通过方法(a)、(b)、(c)和(d)得到的式(I)化合物通过常规的方法转化成盐。
使用例如2-甲氧基羰基氨基-4-甲氧基-6-三氟甲基-1,3,5-三嗪和2-乙基-4-异丙氧基羰基-噻吩-3-磺酰胺作为起始原料,本发明方法(b)的反应过程可以用下列反应式来说明:
使用例如2-氨基-4-甲氧基-6-三氟甲基嘧啶、氯磺酰基异氰酸酯和3-氨基-2-乙基-噻吩-羧酸乙酯作为起始原料,本发明方法(d)的反应过程可以用下列反应式来说明:
式(II)提供在制备通式(I)化合物的本发明方法(a)、(c)和(d)中用作起始原料的氨基嗪的一般定义。在式(II)中,A、R1和R2各优选或特别具有在上文有关本发明式(I)化合物的描述中业已提到的A、R1和R2的优选或特别优选的含义。
通式(II)的氨基嗪是已知的合成化学品,它们中的一些是市售的。
式(III)提供在制备式(I)化合物的本发明方法(a)中另一用作起始原料的噻吩基(氨基)磺酰基异氰酸酯的一般定义。在式(III)中,Q、R4和R5各优选或特别具有在上文有关本发明式(I)化合物的描述中业已提到的Q、R4和R5的优选或特别优选的含义。
通式(III)的起始原料是已知的和/或可以通过本身已知的方法制备(参见EP30 142/US-A-4 481 029/US-A-4 599 103/US-A-4 701535)。
式(III)的噻吩基(氨基)磺酰基异氰酸酯如下获得:使式(V)的噻吩衍生物-见上-与光气或硫光气任选地在烷基异氰酸酯如异氰酸丁酯存在下任选地在反应辅助剂如二氮杂双环[2.2.2]辛烷存在下以及在稀释剂如甲苯、二甲苯或氯苯存在下在80℃-150℃的温度下反应,并且在反应结束后在减压下蒸掉挥发性组分。
式(IV)提供在制备通式(I)化合物的本发明方法(b)中用作起始原料的取代的氨基嗪的一般定义。在式(IV)中,A、R1和R2各优选或特别具有在上文有关本发明式(I)化合物的描述中业已提到的A、R1和R2的优选或特别优选的含义;Z优选代表氟、氯、溴、C1-C4-烷氧基或苯氧基,特别是氯、甲氧基、乙氧基或苯氧基。
通式(IV)的起始原料是已知的和/或可以通过本身已知的方法制备(参见US4 690 707、DE19 501 174)。
式(V)提供在制备式(I)化合物的本发明方法(b)中另一用作起始原料的噻吩衍生物的一般定义。在式(V)中,Q、R4和R5各优选或特别具有在上文有关本发明式(I)化合物的描述中业已提到的Q、R4和R5的优选或特别优选的含义。
通式(V)的起始原料是已知的和/或可以通过本身已知的方法制备(参见EP30 142/US-A-4 481 029/US-A-4 599 103/US-A-4 701535,制备实施例)。
式(VI)提供在制备式(I)化合物的本发明方法(c)中用作起始原料的取代的噻吩衍生物的一般定义。在式(VI)中,Q、R4和R5各优选或特别具有在上文有关本发明式(I)化合物的描述中业已提到的Q、R4和R5的优选或特别优选的含义;Z优选代表氟、氯、溴、C1-C4-烷氧基或苯氧基,特别是氯、甲氧基、乙氧基或苯氧基。
通式(VI)的起始原料是已知的和/或可以通过本身已知的方法制备。
式(VIII)提供在制备式(I)化合物的本发明方法(d)中用作起始原料的取代的氨基噻吩的一般定义。在式(VIII)中,R4和R5各优选或特别具有在上文有关本发明式(I)化合物的描述中业已提到的R4和R5的优选或特别优选的含义。
通式(VIII)的起始原料是已知的和/或可以通过本身已知的方法制备(参见Aust.J.Chem.48(1995),1907-1916)。
适合的进行本发明方法(a)、(b)、(c)和(d)的稀释剂特别是惰性有机溶剂。这些溶剂特别包括脂肪族、脂环族或芳族的任选卤代的烃,诸如,例如汽油、苯、甲苯、二甲苯、氯苯、二氯苯、石油醚、己烷、环己烷、二氯甲烷、氯仿、四氯化碳;醚类,如乙醚、异丙醚、二噁烷、四氢呋喃或乙二醇二甲醚或乙二醇二乙醚;酮类,如丙酮、丁酮或甲基异丁基酮;腈类,如乙腈、丙腈或丁腈;酰胺类,如N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基-甲酰苯胺、N-甲基-吡咯烷酮或六甲基磷酰三胺;酯类,如乙酸甲酯或乙酸乙酯;以及亚砜类,如二甲基亚砜。
本发明方法(a)、(b)、(c)和(d)优选在合适的反应辅助剂存在下进行。合适的反应辅助剂是所有常规的无机或有机碱。这些物质优选包括碱金属或碱土金属的氢化物、氢氧化物、氨化物、醇盐、乙酸盐、碳酸盐或碳酸氢盐,如氢化钠、氨化钠、甲醇钠、乙醇钠、叔丁醇钾、氢氧化钠、氢氧化钾、氢氧化铵、乙酸钠、乙酸钾、乙酸钙、乙酸铵、碳酸钠、碳酸钾、碳酸氢钾、碳酸氢钠或碳酸铵;另外还有叔胺如三甲胺、三乙胺、三丁胺、N,N-二甲基苯胺、吡啶、N-甲基-哌啶、N,N-二甲基氨基吡啶、二氮杂二环辛烷(DABCO)、二氮杂二环壬烯(DBN)或二氮杂二环十一烯(DBU)。
进行本发明方法(a)、(b)、(c)和(d)时,反应温度可以在较宽的范围内变化。通常,反应是在-20℃至+150℃,优选在-10℃至+120℃间的温度下进行。
本发明的方法(a)、(b)、(c)和(d)通常是在常压下进行的。然而,本发明方法也可以在加压或减压下——通常是在0.1巴至10巴间的压力下进行。
进行本发明方法(a)、(b)、(c)和(d)时,通常采用大致等摩尔量的起始原料。然而,也可以相对大地过量采用反应组分之一。反应通常是在适合的稀释剂中在反应辅助剂存在下进行的,且反应混合物通常在所需的温度下搅拌数小时。后处理是用常规方法进行(参见,制备
实施例)。
任选地,可以根据本发明从式(I)化合物制备盐。这样的盐以简单的方式通过常规的成盐方法获得,例如,将式(I)化合物溶解或分散在合适的溶剂如二氯甲烷、丙酮、叔丁基甲基醚或甲苯中,加入适当的碱。然后,盐-任选地在长时间的搅拌之后-通过浓缩或吸滤分离。
本发明活性化合物可以用作脱叶剂、干燥剂、杀茎杆剂,和特别是用作除草剂。所谓的杂草,就其最广义而言,应理解为生长在不该生长的地方的所有植物。本发明的物质是作为灭生性除草剂或是选择性除草剂基本上取决于所用的量。
本发明化合物可以与例如下列植物相关使用:
下列属的双子叶杂草:苘麻属、苋属、豚草属、Anoda、春黄菊属、Aphanes、滨藜属、雏菊属、鬼针草属、荠属、飞廉属、决明属、矢车菊属、藜属、蓟属、旋花属、曼陀罗属、山马蝗属、刺酸模属、糖芥属、大戟属、鼬瓣花属、牛膝菊属、猪殃殃属、木槿属、番薯属、地肤属、野芝麻属、独行草属、母草属、母菊属、薄荷属、山靛属、Mullugo、勿忘我属、罂粟属、牵牛属、车前属、蓼属、马齿苋属、毛莨属、萝卜属、薄菜属、节节菜属、酸模属、猪毛菜属、千里光属、田菁属、黄花稔属、芥属、茄属、苦苣菜属、尖瓣花属、繁缕属、蒲公英属、遏蓝菜属、三叶草属、荨麻属、婆婆纳属、堇菜属、苍耳属。
下列属的双子叶作物:花生属、甜菜属、芸苔属、黄瓜属、南瓜属、向日葵属、胡萝卜属、大豆属、棉属、番薯属、莴苣属、亚麻属、番茄属、烟草属、菜豆属、豌豆属、茄属、巢菜属。
下列属的单子叶杂草:山羊草属、冰草属、翦股颖属、看麦娘属、Apera、燕麦属、臂形草属、雀麦属、栗草属、鸭跖草属、狗牙根属、莎草属、龙爪茅属、马唐属、稗属、荸荠属、蟋蟀草属、画眉草属、野黍属、羊茅属、飘拂草属、异蕊花属、白茅属、鸭嘴草属、千金子属、黑麦草属、雨久花属、黍属、雀稗属、茵草属、梯牧草属、早熟禾属、筒轴茅属、慈姑属、莞草属、狗尾草属、高粱属。
下列属的单子叶作物:葱属、凤梨属、天门冬属、燕麦属、大麦属、稻属、黍属、蔗属、黑麦属、高粱属、黑小麦、小麦属、玉蜀黍属。
然而,本发明活性化合物的应用决不限于这些属,且也可以相同的方式延伸至其它植物。
取决于其浓度,本发明的活性化合物适合于灭生性防治杂草,例如工业地域和铁道线,以及有或无种植树林的道路和广场。同样,活性化合物可以用于防治多年生作物中的杂草,例如森林、装饰树林、果园、葡萄园、柑桔林、坚果园、蕉种植园、咖啡种植园、茶园、橡胶种植园、油棕榈种植园、可可种植园、软果林和啤酒花田、草场、体育场和牧场中的杂草且用于选择性地防治一年生作物中的杂草。
本发明式(I)化合物当施于土壤或用于植物地上部分时,具有强的除草活性和宽阔的活性谱;在某种程度上,它们还适合于以芽前和芽后二种方式选择性地防治单子叶和双子叶作物中的单子叶和双子叶杂草。
活性化合物可以转化成常规的制剂,如溶液、乳剂、可湿性粉剂、悬浮剂、粉剂、粉尘剂、膏剂、可溶性粉剂、颗粒剂、悬乳剂、用活性化合物浸渍的天然或合成材料,以及包在聚合物中的微细胶囊。
这些制剂可以用已知的方式生产,例如,将活性化合物与扩充剂,即液体溶剂和/或与固体载体混合,并任选使用表面活性剂,即乳化剂和/或分散剂和/或起泡剂。
如果用水作扩充剂,也可以用有机溶剂作助溶剂。适合的液体溶剂主要有:芳族化合物,如二甲苯,甲苯或烷基萘,氯代芳族化合物或氯代脂肪烃,如氯代苯类、氯乙烯类或二氯甲烷,脂族烃,如环己烷或石蜡,例如石油馏份、矿物和植物油,醇类,如丁醇或乙二醇以及其醚和酯,酮类,如丙酮、甲乙酮、甲基异丁基酮或环己酮,强极性溶剂,如二甲基甲酰胺或二甲基亚砜,以及水。
适合的固体载体是:例如铵盐和磨碎的天然矿物质,如高岭土、粘土、滑石、白垩、石英、硅镁土、蒙脱石或硅藻土,和磨碎的合成矿物质,如高分散二氧化硅、矾土和硅酸盐,适合用于颗粒剂的固体载体有:例如压碎并分级的天然矿物质如方解石、大理石、浮石、海泡石和白云石,以及有机和无机粉的合成颗粒,和如下有机物的颗粒:锯木屑、椰壳、玉米稳轴和烟茎;适合的乳化剂和/或起泡剂是:例如非离子和阴离子乳化剂,如聚氧乙烯脂肪酸酯、聚氧乙烯脂肪醇醚,例如,烷芳基聚乙二醇醚,烷基磺酸盐,烷基硫酸盐,芳基磺酸盐以及白蛋白水解产物;适合的分散剂是:例如,木素亚硫酸废液和甲基纤维素。
制剂中可以使用粘合剂如羧甲基纤维素和粉状、颗粒或乳胶形式的天然和合成聚合物,如阿拉伯胶、聚乙烯醇和聚乙酸乙烯酯,以及天然磷脂,如脑磷脂和卵磷脂,和合成磷脂。其它可能的添加剂是矿物油和植物油。
也可以使用着色剂,如无机颜料,例如氧化铁、氧化钛和普鲁士蓝,和有机染料,如茜素染料、偶氮染料和金属酞菁染料,和微量营养元素如铁、锰、硼、铜、钴、钼和锌的盐。
制剂中通常含有按重量计0.1至95%的活性化合物,优选0.5至90%。
为防治杂草,本发明活性化合物,其原样或以其制剂形式,也可以作为与已知除草剂一起的混合物使用,可以是终制剂或桶混物。
混合物的可能的共组分是已知除草剂,例如,乙草胺、三氟羧草醚(钠盐)、苯草醚、甲草胺、禾草灭(钠盐)、莠灭净、amidochlor、酰嘧黄隆、莎稗磷、磺草灵、莠去津、azafenidin、四唑嘧黄隆、草除灵、呋草黄、苄嘧黄隆(甲酯)、灭草松、benzobicyclon、吡草酮、新燕灵(乙酯)、双丙氨酰磷、甲羧除草醚、双草醚、溴丁酰草胺、溴酚肟、溴苯腈、丁草胺、butroxydim、丁草敌、cafenstrole、caloxydim、双酰草胺、carfentrazone(-ethyl)、甲氧除草醚、草灭畏、杀草敏、氯嘧黄隆(乙酯)、草枯醚、绿黄隆、绿麦隆、cinidon(-ethyl)、环庚草醚、醚黄隆、clefoxydim、烯草酮、炔草酸、异噁草酮、氯甲酰草胺、二氯吡啶酸、clopyrasulfuron(-methyl)、cloransulam(-methyl)、cumyluron、氰草津、cybutryne、灭草特、环丙嘧磺隆、噻草酮、氰氟草酯、2,4-滴、2,4-滴丁酸、2,4-滴丙酸、甜菜安、燕麦敌、麦草畏、禾草灵(甲酯)、diclosulam、乙酰甲草胺、野燕枯、吡氟草胺、diflufenzopyr、唑隆、哌草丹、二甲草胺、二甲丙乙净、二甲吩草胺、dimexyflam、氨氟灵、双苯酰草胺、敌草快、氟硫草定、敌草隆、杀草隆、epoprodan、茵达灭、戊草丹、乙丁烯氟灵、胺苯黄隆(甲酯)、乙呋草黄、ethoxyfen、ethoxysulfuron、etobenzanid、噁唑禾草灵乙酯、fentrazamide、麦草伏(异丙酯)、麦草伏(异丙酯-L)、麦草伏(甲酯)、啶嘧黄隆、florasulam、吡氟禾草灵(丁酯)、fluazolate、flucarbazone、flufenacet、唑嘧磺草胺、氟烯草酸、丙炔氟草胺、flumipropyn、吡唑磺草胺、氟草隆、氟咯草隆、乙羧氟草醚(乙酯)、胺草唑、flupropacil、flurpyrsulfuron(-methyl、sodium)、芴丁酸、氟啶草酮、氯氟吡氧乙酸、氟嘧醇、flurtamone、fluthiacet(-methyl)、fluthiamide、氟黄胺草醚、草铵磷(铵盐)、草甘磷(异丙铵盐)、halosafen、吡氟氯禾灵(乙氧基乙酯)、精吡氟氯禾灵(甲酯)、环嗪酮、咪草酯(甲酯)、imazamethapyr、imazamox、imazapic、灭草烟、灭草喹、咪草烟、咪唑黄隆、碘磺隆(甲酯,钠盐)、碘苯腈、异丙乐灵、异丙隆、异噁隆、异噁酰草胺、isoxachlortole、isoxaflutole、噁草醚、乳氟禾草灵、环草定、利谷隆、2甲4氯、2甲4氯丙酸、苯噻酰草胺、mesotrione、苯嗪草酮、吡唑草胺、甲基苯噻隆、吡喃隆、秀谷隆、(α-)异丙甲草胺、磺草唑胺、甲氧隆、嗪草酮、甲黄隆(甲酯)、草达灭、绿谷隆、萘丙胺、萘氧丙草胺、草不隆、烟嘧黄隆、哒草伏、坪草丹、安磺乐灵、oxadiargyl、噁草酮、oxasulfuron、oxaziclomefone、乙氧氟草醚、百草枯、壬酸、二甲戊灵、pendralin、pentoxazone、甜菜宁、哌草磷、丙草胺、氟嘧黄隆(甲酯)、扑草净、毒草胺、敌稗、喔草酯、异丙草胺、戊炔草胺、苄草丹、氟磺隆、pyraflufen(-ethyl)、吡唑特、吡嘧黄隆(乙酯)、苄草唑、pyribenzoxim、稗草丹、哒草特、pyriminobac(-methyl)、嘧草硫醚、二氯喹啉酸、喹草酸、灭藻醌、喹禾灵(乙酯)、喹禾灵(四氢糠酯)、砜嘧黄隆、稀禾定、西玛津、西草净、sulcitrione、甲磺草胺、嘧黄隆(甲酯)、草锍磷、甲嘧磺隆、牧草胺、特丁噻草隆、tepraloxydim、特丁津、特丁净、噻吩草胺、噻呋酰胺、噻唑烟酸、thidiazimin、噻黄隆(甲酯)、杀草丹、仲草丹、肟草酮、野燕畏、醚苯黄隆、苯黄隆(甲酯)、绿草定、灭草环、氟乐灵和氟胺黄隆。
也可以是与其它已知活性化合物如杀真菌剂、杀虫剂、杀螨剂、杀线虫剂、驱鸟剂、植物养料和土壤结构改良剂一起的混合物。
活性化合物可以以其本身、以其制剂或由之经进一步稀释而制备的使用形式使用,如直接可用溶液、悬浮液、乳液、粉剂、膏剂和颗粒剂。它们以常规方法使用,例如浇泼、喷雾、弥雾或撒施等等。
本发明活性化合物可以在植物萌发前或后施用。它们也可以在播种前掺入土壤中。
所用的活性化合物的量可以在相当宽的范围内变化。用量基本上取决于所需的效果。通常,使用量在每公顷土表面积用1克至10千克之间,优选每公顷5克至5千克。
本发明活性化合物的制备和使用可以参见下列实施例。
具体实施方式制备实施例:实施例1 (方法(b))
将0.75g(2.9mmol)2-苯氧基羰基氨基-4-甲氧基-6-甲基-1,3,5-三嗪溶解在40ml乙腈中,依次与0.75g(3.2mmol)2-甲基-3-氨磺酰基噻吩-4-羧酸乙酯和0.49g(3.2mmol)二氮杂双环十一烯(DBU)混合。将反应混合物在室温(大约20℃)下搅拌12小时,然后在水泵真空下浓缩。将残留物吸收在二氯甲烷中,混合物用2N盐酸和水洗涤,用硫酸镁干燥,过滤。在水泵真空下浓缩滤液,残留物用乙醚消化,吸滤出产生的结晶产物。
由此给出0.60g(理论值的52%)N-(4-甲氧基-6-甲基-1,3,5-三嗪-2-基)-N’-(4-甲氧基羰基-2-甲基-噻吩-3-基磺酰基)-脲,熔点195℃。实施例2 (方法(d))
将1.05g(7.5mmol)氯磺酰基异氰酸酯先加入到75ml二氯甲烷中。冷却至-10℃后,搅拌下向该混合物中滴加1.16g(7.5mmol)2-氨基-4,6-二甲氧基-嘧啶在30ml二氯甲烷中的溶液,将该混合物在-10℃下搅拌30分钟。在0℃下,然后滴加1.28g(7.5mmol)3-氨基-2-甲基噻吩-4-羧酸甲酯和0.75g(7.5mmol)三乙胺在50ml二氯甲烷中的溶液。将反应混合物在室温(大约20℃)下搅拌12小时。然后加入100ml水和100ml 2N盐酸,分离有机相,用50ml水洗涤,用硫酸镁干燥,过滤。在水泵真空下浓缩滤液,残留物用乙醇结晶。
由此给出2.1g(理论值的66%)N-(4,6-二甲氧基-嘧啶-2-基)-N’-(4-甲氧基羰基-2-甲基-噻吩-3-基氨基磺酰基)-脲,熔点174℃。
类似于实施例1和2,并根据本发明制备方法的一般描述,也可以制备出例如列于下文表1中的通式(I)化合物。 表1:通式(I)化合物的实例
式(V)起始原料 实施例(V-1) 步骤1
| 实施例号 | A | Q | R1 | R2 | R3 | R4 | R5 | 熔点(℃) |
| 3 | CH | NH | OCH3 | OCH3 | H | n-C3H7 | C2H5 | 140 |
| 4 | CH | NH | OCH3 | OCH3 | H | i-C3H7 | C2H5 | 154 |
| 5 | CH | NH | OCH3 | OCH3 | H | C2H5 | CH3 | 195 |
| 6 | CH | - | OCH3 | OCH3 | H | CH3 | CH3 | 194 |
在0-5℃,将19.9g(0.29mol)亚硝酸钠在60ml水中的溶液在搅拌下滴加到42.7g(0.25mol)3-氨基-2-甲基噻吩-4-羧酸甲酯在75ml 10%的盐酸水溶液中的溶液中。将反应混合物在0-5℃下搅拌60分钟。随后用氨基磺酸破坏掉过量的亚硝酸盐。在0-5℃,然后将混合物在搅拌下滴加到35g(0.55mol)二氧化硫在300ml二氯甲烷中的溶液中。加入1.5g氯化铜(I)和1.5g十二烷基三甲基溴化铵后,将反应混合物在40℃搅拌60分钟,然后在20℃搅拌12小时。然后加入18ml 35%的盐酸水溶液,将混合物在20℃搅拌4小时,分相。水相用二氯甲烷再萃取,合并的有机相用水洗涤,用硫酸镁干燥,过滤。在水泵真空下浓缩滤液,残留物用己烷结晶。
由此给出51.7g(理论值的81%)的4-甲氧基羰基-2-甲基噻吩-3-磺酰氯。步骤2
将45g(177mmol)4-甲氧基羰基-2-甲基噻吩-3-磺酰氯、34g(354mmol)碳酸铵和400ml二氯甲烷的混合物在室温(大约20℃)搅拌12小时。将混合物过滤,在水泵真空下从滤液中蒸掉溶剂。残留物用乙醚消化,吸滤出结晶产物。
由此给出21.5g(理论值的52%)的4-甲氧基羰基-2-甲基噻吩-3-磺酰胺。应用实施例 实施例A芽前试验
溶剂: 5份重量丙酮
乳化剂: 1份重量的烷芳基聚乙二醇醚
制备适合的活性化合物制剂时,将1份重量的活性化合物与所述量的溶剂混合,将所述量的乳化剂加入,并用水将此乳油稀释至所需浓度。
将试验植物的种子播入通常的土壤中,约24小时后,土壤用活性化合物制剂浇水,在每单位面积上施用特定量的活性成分。选择喷雾液的浓度,使所需的活性化合物的特定量以1000升水/公顷的喷雾量施用。
三周后,将植物的损害程度与未处理对照的发育相比较,目测定出损害%。
数值的含义如下:
0%=无作用(与未处理相同)
100%=完全破坏
在此试验中,例如,制备实施例1、2、3、4、5和6化合物对杂草显示出非常强的活性,并且它们中的一些被作物如棉花、玉米和大豆很好地耐受。表A1:芽前试验/温室 表A2:芽前试验/温室 表A3:芽前试验/温室 表A4:芽前试验/温室 表A5:芽前试验/温室 表A6:芽前试验/温室 实施例B芽后试验
溶剂: 5份重量丙酮
乳化剂:1份重量的烷芳基聚乙二醇醚
制备适合的活性化合物制剂时,将1份重量的活性化合物与所述量的溶剂混合,将所述量的乳化剂加入,并用水将此乳油稀释至所需浓度。
向株高5-15厘米的试验植物按单位面积喷雾施用一定量的所需活性化合物制剂。选择喷雾液的浓度,使所需化合物的特定量以1,000升水/公顷的量施用。
三周后,将植物的损害程度与未处理对照相比较,定出损害%。
数值的含义如下:
0%=无作用(与未处理相同)
100%=完全破坏
Claims (8)
2.根据权利要求1的化合物,其特征在于R1代表甲基、乙基、正或异丙基、甲氧基、乙氧基、正或异丙氧基;R2代表甲基、乙基、正或异丙基、甲氧基、乙氧基、正或异丙氧基;R3代表氢;R4代表甲基、乙基、正或异丙基、正-、异-、仲-或叔丁基;和R5代表甲基、乙基、正或异丙基、正-、异-、仲-或叔丁基。
3.根据权利要求1的化合物,其特征在于R1代表甲基、乙基、甲氧基或乙氧基;R2代表甲基、乙基、甲氧基或乙氧基;R3代表氢;R4代表甲基、乙基、正或异丙基;R5代表甲基、乙基、正或异丙基。
4.权利要求1-3任一项的化合物的钠盐、钾盐、镁盐、钙盐、铵盐、C1-C4-烷基铵盐、二-(C1-C4-烷基)-铵盐、三-(C1-C4-烷基)-铵盐、四-(C1-C4-烷基)-铵盐、三-(C1-C4-烷基)-铳盐、C5-或C6-环烷基-铵盐和二-(C1-C2-烷基)-苄基铵盐。
5.制备权利要求1的化合物的方法,其特征在于,(a)任选地在反应辅助剂存在下和任选地在稀释剂存在下,使通式(II)的氨基嗪与通式(III)的噻吩基(氨基)磺酰基异氰酸酯反应,其中A、R1和R2各如权利要求1中所定义,其中Q、R4和R5各如权利要求1中所定义;或(b)任选地在反应辅助剂存在下和任选地在稀释剂存在下,使通式(IV)的取代的氨基嗪与通式(V)的噻吩衍生物反应,其中A、R1和R2各如权利要求1中所定义,Z代表卤素、烷氧基或芳氧基,和R具有在权利要求1中对R3给出的意义或代表基团-C(O)-Z,其中Q、R4和R5各如权利要求1中所定义;或(c)任选地在反应辅助剂存在下和任选地在稀释剂存在下,使通式(II)的氨基嗪与通式(VI)的噻吩衍生物反应,其中A、R1和R2各如权利要求1中所定义,其中Q、R4和R5各如权利要求1中所定义,和Z代表卤素、烷氧基或芳氧基;或(d)任选地在稀释剂存在下,使通式(II)的氨基嗪与氯磺酰基异氰酸酯反应,其中A、R1和R2各如权利要求1中所定义,以及,任选地在反应辅助剂存在下和任选地在稀释剂存在下,使所得的通式(VII)的氯磺酰基氨基羰基氨基嗪在中间分离后或“就地地”与通式(VIII)的取代的氨基噻吩反应,其中A、R1和R2各如权利要求1中所定义,其中R4和R5各如权利要求1中所定义;并且,任选地将通过方法(a)、(b)、(c)或(d)得到的式(I)化合物通过常规的方法转化成盐。
6.防治不希望的植物的方法,其特征在于,将权利要求1的至少一种化合物作用于不希望的植物和/或其栖生地。
7.权利要求1的至少一种化合物防治不希望的植物的应用。
8.除草组合物,其特征在于,它包含权利要求1的化合物和常规的扩充剂和/或表面活性剂。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19937118.0 | 1999-08-06 | ||
| DE19937118A DE19937118A1 (de) | 1999-08-06 | 1999-08-06 | Substituierte Thienyl(amino)sulfonylharnstoffe |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1368971A CN1368971A (zh) | 2002-09-11 |
| CN1137119C true CN1137119C (zh) | 2004-02-04 |
Family
ID=7917419
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB00811417XA Expired - Fee Related CN1137119C (zh) | 1999-08-06 | 2000-07-25 | 取代的噻吩基(氨基)磺酰脲类化合物 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US6887831B1 (zh) |
| EP (2) | EP1598351A1 (zh) |
| JP (1) | JP4825384B2 (zh) |
| KR (2) | KR100839819B1 (zh) |
| CN (1) | CN1137119C (zh) |
| AR (2) | AR025002A1 (zh) |
| AT (1) | ATE297919T1 (zh) |
| AU (1) | AU770451C (zh) |
| BR (1) | BR0012980A (zh) |
| CA (1) | CA2381009C (zh) |
| CO (1) | CO5210912A1 (zh) |
| DE (2) | DE19937118A1 (zh) |
| ES (1) | ES2243296T3 (zh) |
| HK (1) | HK1049484A1 (zh) |
| MX (1) | MXPA02001245A (zh) |
| PL (1) | PL206262B1 (zh) |
| RU (1) | RU2252223C2 (zh) |
| UA (1) | UA73950C2 (zh) |
| WO (1) | WO2001010863A2 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108752312A (zh) * | 2018-08-29 | 2018-11-06 | 常州沃腾化工科技有限公司 | 一种新的制备2-甲基-3-噻吩-5-甲氧羰基磺酰氯的方法 |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102004063192A1 (de) | 2004-12-29 | 2006-07-13 | Bayer Cropscience Ag | Verfahren zur Herstellung von substituierten Thiophensulfonylisocyanaten |
| US7663592B2 (en) | 2005-10-19 | 2010-02-16 | Tpo Displays Corp. | Systems involving signal driving circuits for driving displays |
| CN102020613B (zh) * | 2009-09-21 | 2012-11-07 | 中国中化股份有限公司 | 具有除草活性的氨基磺酰脲类化合物及其应用 |
| CN103288749A (zh) * | 2013-03-04 | 2013-09-11 | 盐城工学院 | 可作除草剂的氨基磺酰脲类化合物 |
| GB201721185D0 (en) | 2017-12-18 | 2018-01-31 | Nodthera Ltd | Sulphonyl urea derivatives |
| PT3983387T (pt) | 2019-06-12 | 2024-07-10 | Nodthera Ltd | Derivados de sulfonilurea e seus usos |
| CN113402427A (zh) * | 2021-05-11 | 2021-09-17 | 台州学院 | 一种磺酰脲类化合物的合成方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4701535A (en) | 1979-11-30 | 1987-10-20 | E. I. Du Pont De Nemours And Company | Agricultural ureas and isoureas |
| JPS56103179A (en) * | 1979-11-30 | 1981-08-18 | Du Pont | Agricultural urea and isourea and their application |
| DK172396B1 (da) | 1979-11-30 | 1998-05-18 | Du Pont | Thiophencarboxylsyrederivater, middel til bekæmpelse af væksten af uønsket vegetation, fremgangsmåde til bekæmpelse af uønsket vegetation samt mellemprodukter til fremstilling af de nævnte derivater |
| US4481029A (en) * | 1979-11-30 | 1984-11-06 | E. I. Du Pont De Nemours And Company | Triazinyl-sulfonyl-ureas and isoureas |
| MA19797A1 (fr) | 1982-06-14 | 1983-12-31 | Ciba Geigy Ag | N-heterocyclosulfonyl -n- pyrimidinyl et triazinylurees . |
| US4579583A (en) | 1982-09-08 | 1986-04-01 | Ciba-Geigy Corporation | Novel sulfonylureas |
| US4659361A (en) | 1984-06-11 | 1987-04-21 | E. I. Du Pont De Nemours And Company | Herbicidal iodopyrimidines |
| US4668281A (en) | 1985-05-20 | 1987-05-26 | E. I. Du Pont De Nemours And Company | Thiophenesulfonamides |
| US4877440A (en) | 1985-05-29 | 1989-10-31 | E. I. Du Pont De Nemours And Company | Thiophenesulfonamide herbicides |
| US4743290A (en) | 1986-04-21 | 1988-05-10 | E. I. Du Pont De Nemours And Company | Thiophenesulfonamide herbicides |
| JPS62242678A (ja) | 1986-04-10 | 1987-10-23 | イ−・アイ・デユポン・デ・ニモアス・アンド・カンパニ− | 除草剤性チオフエンスルホンアミド類 |
| DE4105518A1 (de) | 1991-02-22 | 1992-08-27 | Basf Ag | Sulfonylharnstoffderivate, verfahren zu ihrer herstellung und ihre verwendung |
| KR100298470B1 (ko) | 1993-11-10 | 2001-11-05 | 김충섭 | 신규한티오펜설포닐우레아유도체,그의제조방법및제초제로서의용도 |
| DE19501174A1 (de) | 1995-01-17 | 1996-07-18 | Bayer Ag | Verfahren zur Herstellung von Sulfonylharnstoffen |
| DE19608831A1 (de) | 1996-03-07 | 1997-09-18 | Bayer Ag | Substituierte Thienylsulfonyl(thio)harnstoffe |
-
1999
- 1999-08-06 DE DE19937118A patent/DE19937118A1/de not_active Withdrawn
-
2000
- 2000-07-25 EP EP05003841A patent/EP1598351A1/de not_active Withdrawn
- 2000-07-25 PL PL353450A patent/PL206262B1/pl not_active IP Right Cessation
- 2000-07-25 UA UA2002031830A patent/UA73950C2/uk unknown
- 2000-07-25 CA CA2381009A patent/CA2381009C/en not_active Expired - Fee Related
- 2000-07-25 RU RU2002106400/04A patent/RU2252223C2/ru not_active IP Right Cessation
- 2000-07-25 BR BR0012980-1A patent/BR0012980A/pt not_active Application Discontinuation
- 2000-07-25 EP EP00958292A patent/EP1206468B1/de not_active Expired - Lifetime
- 2000-07-25 MX MXPA02001245A patent/MXPA02001245A/es active IP Right Grant
- 2000-07-25 WO PCT/EP2000/007096 patent/WO2001010863A2/de active IP Right Grant
- 2000-07-25 KR KR1020027000561A patent/KR100839819B1/ko not_active IP Right Cessation
- 2000-07-25 US US10/049,747 patent/US6887831B1/en not_active Expired - Fee Related
- 2000-07-25 ES ES00958292T patent/ES2243296T3/es not_active Expired - Lifetime
- 2000-07-25 CN CNB00811417XA patent/CN1137119C/zh not_active Expired - Fee Related
- 2000-07-25 AU AU69863/00A patent/AU770451C/en not_active Ceased
- 2000-07-25 DE DE50010572T patent/DE50010572D1/de not_active Expired - Lifetime
- 2000-07-25 AT AT00958292T patent/ATE297919T1/de active
- 2000-07-25 JP JP2001515672A patent/JP4825384B2/ja not_active Expired - Fee Related
- 2000-07-25 KR KR1020067026763A patent/KR100916294B1/ko not_active IP Right Cessation
- 2000-07-31 AR ARP000103959A patent/AR025002A1/es active IP Right Grant
- 2000-08-02 CO CO00058177A patent/CO5210912A1/es not_active Application Discontinuation
-
2003
- 2003-03-05 HK HK03101633.8A patent/HK1049484A1/zh unknown
-
2005
- 2005-01-10 US US11/032,489 patent/US7091158B2/en not_active Expired - Fee Related
-
2007
- 2007-01-23 AR ARP070100297A patent/AR059171A2/es not_active Application Discontinuation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108752312A (zh) * | 2018-08-29 | 2018-11-06 | 常州沃腾化工科技有限公司 | 一种新的制备2-甲基-3-噻吩-5-甲氧羰基磺酰氯的方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1361778A (zh) | 取代的噻吩-3-基磺酰基氨基(硫代)羰基三唑啉(硫)酮类化合物 | |
| EP1444208A1 (de) | Substituierte pyrimidine | |
| CN1119337C (zh) | 作为除草剂的取代的2,4-二氨基-1,3,5-三嗪 | |
| EP1373228A1 (de) | Substituierte fluoralkoxyphenylsulfonylharnstoffe | |
| CN1137119C (zh) | 取代的噻吩基(氨基)磺酰脲类化合物 | |
| CN1088705C (zh) | 噻吩磺酰氨基(硫代)羰基化合物 | |
| CN1113063C (zh) | 杂环基尿嘧啶 | |
| CN1130360C (zh) | 取代的噻吩并环烷(烯)基氨基-1,3,5-三嗪类化合物 | |
| CN1370160A (zh) | 取代的杂环基-2h-苯并吡喃类化合物 | |
| CN1140514C (zh) | 取代的亚氨基烷氧基苯基尿嘧啶及其制法和作为除草剂的应用 | |
| CN1103764C (zh) | 取代的苯基尿嘧啶 | |
| CN1101390C (zh) | 杂环基尿嘧啶 | |
| CN1324964C (zh) | 被取代的噻吩-3-基-磺酰基氨基(硫代)羰基-三唑啉(硫)酮 | |
| CN1361777A (zh) | 取代的苯基尿嘧啶类化合物 | |
| CN1361772A (zh) | 取代的杂芳基氧基乙酰苯胺类化合物及其作为除草剂的应用 | |
| CN1377343A (zh) | 取代的芳基酮类 | |
| CN100475040C (zh) | 经氨基羰基取代的噻吩基磺酰基氨基(硫代)羰基三唑啉(硫)酮,其制备方法和用途 | |
| CN1350517A (zh) | 取代的n-氰基脒类化合物 | |
| CN1121396C (zh) | 取代的苯基三唑啉酮及其作为除草剂的应用 | |
| CN1356989A (zh) | 取代的除草苯基尿嘧啶类化合物 | |
| CN1284069A (zh) | 取代的2,4-二氨基-1,3,5-三嗪类 | |
| CN1980921A (zh) | 经二噁嗪基取代的噻吩基磺酰基氨基羰基化合物 | |
| WO2006012981A1 (de) | Aminocarbonyl-substituierte thienylsulfonylharnstoffe | |
| CN1384828A (zh) | 5-氯二氟甲基-1,3,4-噻二唑-2-基-氧乙酰苯胺 | |
| CN1253550A (zh) | 具有除草作用的苯基-尿嘧啶衍生物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20040204 Termination date: 20120725 |