CN110049977B - 作为强效和选择性rock抑制剂的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物 - Google Patents
作为强效和选择性rock抑制剂的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物 Download PDFInfo
- Publication number
- CN110049977B CN110049977B CN201780054580.4A CN201780054580A CN110049977B CN 110049977 B CN110049977 B CN 110049977B CN 201780054580 A CN201780054580 A CN 201780054580A CN 110049977 B CN110049977 B CN 110049977B
- Authority
- CN
- China
- Prior art keywords
- phenyl
- dihydrophthalazin
- independently selected
- oxo
- independently
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
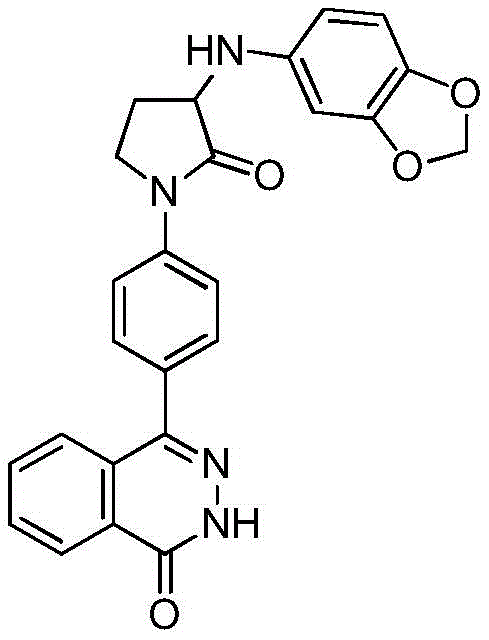
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/5025—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
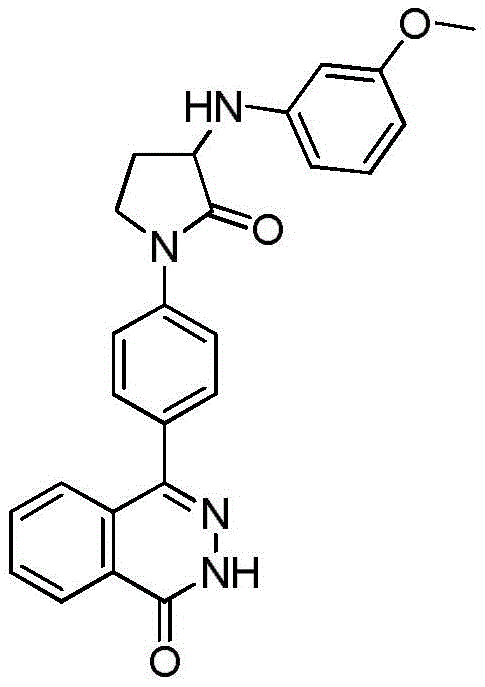
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Immunology (AREA)
- Neurology (AREA)
- Epidemiology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Pulmonology (AREA)
- Biomedical Technology (AREA)
- Vascular Medicine (AREA)
- Transplantation (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Pyridine Compounds (AREA)
Abstract
本申请提供式(I)化合物或其立体异构体、互变异构体或药用盐,其中所有变量如本文所定义。这些化合物为选择性ROCK抑制剂。本申请还涉及包含这些化合物的药物组合物和使用其治疗心血管、平滑肌、肿瘤学、神经病理学、自身免疫、纤维变性和/或炎性病症的方法。
Description
对相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求在2017年7月7日提交的美国临时专利申请62/359,341的优先权,将其全部内容引入到本申请中。
技术领域
本申请涉及新颖的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物,含有它们的组合物以及使用它们例如治疗或预防与异常Rho激酶活性相关的病症的方法。
背景技术
Rho-激酶(ROCK)是丝氨酸-苏氨酸蛋白激酶家族的成员。ROCK以两种亚型ROCK1和ROCK2存在(Ishizaki,T.et al.,EMBO J.,15:1885-1893(1996))。ROCK已被鉴定为RhoA的效应器分子,其是在多种细胞信号传导途径中起关键作用的小GTP结合蛋白(G蛋白)。ROCK和RhoA广泛表达于组织中。RhoA/ROCK信号传导途径参与多种细胞功能,诸如肌动蛋白组织(actin organization)、细胞粘附、细胞迁移和胞质分裂(Riento,K.et al.,Nat.Rev.Mol.Cell Biol.,4:446-456(2003))。它还直接参与调控平滑肌收缩(Somlyo,A.P.,Nature,389:908-911(1997))。在活化RhoA的受体后,RhoA被活化,且继而其活化ROCK。活化的ROCK磷酸化肌球蛋白轻链磷酸酯酶的肌球蛋白结合亚单位,从而抑制磷酸酯酶的活性并导致收缩。脉管系统中的平滑肌收缩使血压升高,从而导致高血压。
文献中有大量证据证明Rho A/ROCK信号传导途径在由例如以下的若干血管活性因子起始的信号转导中起重要作用:血管紧张素II(Yamakawa,T.et al.,Hypertension,35:313-318(2000))、尾加压素II(Sauzeau,V.et al.,Circ.Res.,88:1102-1104(2001))、内皮素-1(Tangkijvanich,P.et al.,Hepatology,33:74-80(2001))、血清素(Shimokawa,H.,Jpn.Circ.J.,64:1-12(2000))、去甲肾上腺素(Martinez,M.C.et al.,Am.J.Physiol.,279:H1228-H1238(2000))和血小板衍生生长因子(PDGF)(Kishi,H.et al.,J.Biochem.,128:719-722(2000))。这些因子中许多与心血管疾病的发病机制相关。
文献中的其它研究(一些使用已知的ROCK抑制剂法舒地尔(fasudil)(Asano,T.etal.,J.Pharmacol.Exp.Ther.,241:1033-1040(1987))或Y-27632(Uehata,M.et al.,Nature,389:990-994(1997)))进一步阐释了ROCK与心血管疾病之间的关联。例如,已显示ROCK表达和活性在自发性高血压大鼠中有所升高,从而表明其与这些动物中高血压的发生的关联(Mukai,Y.et al.、FASEB J.,15:1062-1064(2001))。显示ROCK抑制剂Y-27632(Uehata,M.et al.,Nature,ibid.)可使三种大鼠高血压模型(包括自发性高血压大鼠模型、肾性高血压大鼠模型和乙酸脱氧皮质酮盐型高血压大鼠模型)中的血压显著降低,而对对照大鼠中的血压仅具有较小效应。这增强了ROCK与高血压之间的关联。
其它研究表明ROCK与动脉粥样硬化之间的关联。例如,ROCK的显性负性形式的基因转移抑制猪股动脉中的球囊损伤后新生内膜的形成(Eto,Y.et al.,Am.J.Physiol.Heart Circ.Physiol.,278:H1744-H1750(2000))。在类似模型中,ROCK抑制剂Y-27632还抑制大鼠中的新生内膜形成(Sawada,N.et al.,Circulation,101:2030-2033(2000))。在猪的IL-1β诱导的冠状动脉狭窄模型中,显示用ROCK抑制剂法舒地尔长期治疗渐进地减少冠状动脉狭窄,以及促进冠状动脉收缩重塑的消退(Shimokawa,H.et al.,Cardiovasc.Res.,51:169-177(2001))。
其它调查表明ROCK抑制剂可用于治疗其它心血管疾病。例如,在大鼠中风模型中,显示法舒地尔既减小梗塞面积又减少神经缺陷(Toshima,Y.,Stroke,31:2245-2250(2000))。显示ROCK抑制剂Y-27632改善Dahl盐敏感型大鼠的充血性心力衰竭模型中的心室肥大、纤维变性和功能(Kobayashi,N.et al.,Cardiovasc.Res.,55:757-767(2002))。
其它动物或临床研究已暗示包括以下的其它疾病中的ROCK:冠状动脉痉挛(Shimokawa,H.et al.,Cardiovasc.Res.,43:1029-1039(1999))、脑血管痉挛(Sato,M.etal.,Circ.Res.,87:195-200(2000))、缺血/再灌注损伤(Yada,T.et al.,J.Am.Coll.Cardiol.,45:599-607(2005))、肺高血压(Fukumoto,Y.et al.,Heart,91:391-392(2005))、心绞痛(Shimokawa,H.et al.,J.Cardiovasc.Pharmacol.,39:319-327(2002))、肾病(Satoh,S.et al.,Eur.J.Pharmacol.,455:169-174(2002))和勃起功能障碍(Gonzalez-Cadavid,N.F.et al.,Endocrine,23:167-176(2004))。
在另一研究中,已证实RhoA/ROCK信号传导途径的抑制允许形成扰乱单核细胞的产生性迁移的多个竞争性板状伪足(Worthylake,R.A.et al.,J.Biol.Chem.,278:13578-13584(2003))。还已报道,Rho激酶的小分子抑制剂能够抑制体外MCP-1介导的趋化性(Iijima,H.,Bioorg.Med.Chem.,15:1022-1033(2007))。由于免疫细胞迁移依赖RhoA/ROCK信号传导途径,因此可预料抑制Rho激酶也应对诸如类风湿性关节炎、牛皮癣和炎性肠病的疾病提供益处。
上述研究提供ROCK与心血管疾病(包括高血压、动脉粥样硬化、再狭窄、中风、心力衰竭、冠状动脉痉挛、脑血管痉挛、缺血/再灌注损伤、肺高血压和心绞痛)以及肾病和勃起功能障碍之间的关联的证据。鉴于已证实ROCK对平滑肌的效应,ROCK抑制剂还可用于涉及平滑肌高反应性的其它疾病(包括哮喘和青光眼)(Shimokawa,H.et al.,Arterioscler.Thromb.Vase.Biol.,25:1767-1775(2005))。此外,已指示Rho-激酶作为用于治疗各种其它疾病的药物靶标,包括气道发炎和高反应性(Henry,P.J.et al.,Pulm.Pharmacol.Ther.,18:67-74(2005))、癌症(Rattan,R.et al.,J.Neurosci.Res.,83:243-255(2006);Lepley,D.et al.,Cancer Res.,65:3788-3795(2005))、纤维变性疾病(Jiang,C.et al.,Int.J.Mol.Sci.,13:8293-8307(2012);Zhou,L.et al.、Am.J.Nephrol.,34:468-475(2011)),以及神经疾病,诸如脊髓损伤、阿尔茨海默病、多发性硬化、中风和神经性疼痛(Mueller,B.K.et al.,Nat.Rev.Drug Disc.,4:387-398(2005);Sun,X.et al.,J.Neuroimmunol.,180:126-134(2006))。
对治疗心血管疾病的新药仍存在未满足的医学需求。在美国心脏病协会的心脏病和中风统计(Heart Disease and Stroke Statistics)的2012更新(Circulation,125:e2-e220(2012))中,已报道心血管疾病占美国所有死亡的32.8%,其中冠心病占美国总体死亡的约1/6。对这些数字有贡献的,已发现约33.5%的成年美国人口患有高血压,且据估计在2010年约660万美国成人将患有心力衰竭。因此,尽管存在大量可用于治疗心血管疾病(CVD)的药物(包括利尿剂、β阻断剂、血管紧张素转化酶抑制剂、血管紧张素阻断剂和钙通道阻断剂),但对于许多患者而言,CVD仍然控制不良或对当前药物有抗性。
尽管调查中有ROCK抑制剂的许多报道(参见,例如,US 2008/0275062 A1),但法舒地尔是当时唯一销售的ROCK抑制剂。静脉注射剂在日本已被批准用于治疗脑血管痉挛。仍需要用于治疗心血管疾病、癌症、神经病、肾病、纤维变性疾病、支气管哮喘、勃起功能障碍和青光眼的新型治疗剂(包括ROCK抑制剂)。
发明内容
本申请提供新颖的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物,包括其立体异构体、互变异构体、药用盐或溶剂化物,其可用作Rho激酶的选择性抑制剂。
本申请还提供制备本申请化合物的方法和中间体。
本申请还提供药物组合物,其包含药用载体和至少一种本申请化合物或其立体异构体、互变异构体、药用盐或溶剂化物。
本申请化合物可用于治疗和/或预防与异常ROCK活性相关的病症。
本申请化合物可用于治疗。
本申请化合物可用于制备用于治疗和/或预防与异常ROCK活性相关的病症的药物。
在另一方面,本申请针对治疗心血管或相关疾病的方法,所述方法包括向需要此类治疗的患者给予如上文所述的本申请化合物。可治疗的此类疾病的实例包括,例如,高血压、动脉粥样硬化、再狭窄、中风、心力衰竭、肾衰竭、冠状动脉疾病、外周动脉疾病、冠状动脉痉挛、脑血管痉挛、缺血/再灌注损伤、肺高血压、心绞痛、勃起功能障碍和肾病。
在另一方面,本申请针对治疗涉及平滑肌高反应性的疾病(包括哮喘、勃起功能障碍和青光眼)的方法,所述方法包括向需要此类治疗的患者给予如上文所述的本申请化合物。
在另一方面,本申请针对治疗至少部分由Rho激酶介导的疾病(包括纤维变性疾病、肿瘤、脊髓损伤、阿尔茨海默病、多发性硬化、中风、神经性疼痛、类风湿性关节炎、牛皮癣和炎性肠病)的方法,所述方法包括向需要此类治疗的患者给予如上文所述的本申请化合物。
在其它方面,本申请针对包含上述化合物的药物组合物、制备上述化合物的方法和这些方法中所使用的中间体。
本申请化合物可单独、与本申请的其它化合物组合、或与一种或多种(优选一种至两种)其它药物组合使用。
本申请的这些和其它特征将随本公开内容的继续以展开形式阐述。
具体实施方式
I.本申请化合物
在一个方面,本申请尤其提供式(I)化合物:
或其立体异构体、对映异构体、非对映异构体、互变异构体、药用盐、溶剂化物或前药,其中
环B独立选自
G独立选自N和CR7;
M独立选自N和CR9;
X独立选自CR1、NR2和O;
Y独立选自CR3和N;
L不存在或独立选自-NR4-、-C(O)NR4(CR4R4)n-和-O-;
R1是L-R5;
R2是-(CR4R4)n-R5;
R3独立选自H、取代有0-4个Re的C1-4烷基、-(CH2)rORb、(CH2)rS(O)pRc、-(CH2)rC(=O)Rb、-(CH2)rNRaRa、-(CH2)rCN、-(CH2)rC(=O)NRaRa、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)NRaRa、-(CH2)rNRaC(=O)ORb、-(CH2)rOC(=O)NRaRa、-(CH2)rC(=O)ORb、-(CH2)rS(O)pNRaRa、-(CH2)rNRaS(O)pNRaRa、-(CH2)rNRaS(O)pRc、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、芳基和杂芳基,其各自取代有1-5个R6;
可代替地,当L是-NR4-、-C(O)NR4-时,R4和R5与和它们均连接的氮原子一起形成取代有1-5个R6的杂环;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CRdRd)rS(O)pRc、-(CRdRd)rS(O)pNRaRa、-(CRdRd)rNRaS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)rNRaRa、-(CRdRd)rNRaC(=O)Rb、-(CRdRd)rNRaC(=O)NRaRa、-(CRdRd)rNRaC(=O)ORb、-(CRdRd)rC(=O)ORb、-(CRdRd)rC(=O)NRaRa、-(CRdRd)rC(=O)Rb、-(CRdRd)rOC(=O)Rb、-(CRdRd)rOC(=O)NRaRa、-(CRdRd)r-环烷基、-(CRdRd)r-杂环基、-(CRdRd)r-芳基和-(CRdRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
R7独立选自H、F、Cl、Br、CN、取代有0-3个Re的C1-4烷基、-(CH2)rORb、(CH2)rS(O)pRc、-(CH2)rC(=O)Rb、-(CH2)rNRaRa、-(CH2)rC(=O)NRaRa、-(CH2)rC(=O)(CH2)rNRaRa、-(CH2)rCN、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)ORb、-(CH2)rOC(=O)NRaRa、-(CH2)rNRaC(=O)NRaRa、-(CH2)rC(=O)ORb、-(CH2)rS(O)pNRaRa、-(CH2)rNRaS(O)pNRaRa、-(CH2)rNRaS(O)pRc、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
R8独立选自H、F、Cl、Br、-(CH2)rORb、(CH2)rS(O)pRc、-(CH2)rC(=O)Rb、-(CH2)rNRaRa、-(CH2)rCN、-(CH2)rC(=O)NRaRa、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)NRaRa、-(CH2)rNRaC(=O)ORb、-(CH2)rOC(=O)NRaRa、-(CH2)rC(=O)ORb、-(CH2)rS(O)pNRaRa、-(CH2)rNRaS(O)pNRaRa、-(CH2)rNRaS(O)pRc、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
R9独立选自H和取代有0-4个Re的C1-4烷基;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Rd独立选自H和取代有0-5个Re的C1-4烷基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
n在每次出现时独立选自0、1、2和3;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
在另一个方面,本申请提供式(II)化合物:
或其立体异构体、对映异构体、非对映异构体、互变异构体、药用盐、溶剂化物或前药,其中
环B选自
G选自N和CR7;
M独立选自N和CR9;
X独立选自CR1、NR2和O;
L不存在或独立选自-NR4-、-C(O)NR4(CR4R4)n-和-O-;
R1是L-R5;
R2是-(CR4R4)n-R5;
R3独立选自H、取代有0-4个Re的C1-4烷基、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、芳基和杂芳基,其各自取代有1-5个R6;
可代替地,当L是-NR4-、-C(O)NR4-时,R4和R5与和它们均连接的氮原子一起形成取代有1-5个R6的杂环;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CRdRd)rS(O)pRc、-(CRdRd)rS(O)pNRaRa、-(CRdRd)rNRaS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)rNRaRa、-(CRdRd)rNRaC(=O)Rb、-(CRdRd)rNRaC(=O)NRaRa、-(CRdRd)rNRaC(=O)ORb、-(CRdRd)rC(=O)ORb、-(CRdRd)rC(=O)NRaRa、-(CRdRd)rC(=O)Rb、-(CRdRd)rOC(=O)Rb、-(CRdRd)rOC(=O)NRaRa、-(CRdRd)r-环烷基、-(CRdRd)r-杂环基、-(CRdRd)r-芳基和-(CRdRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
R7独立选自H、F、Cl、Br、CN、取代有0-3个Re的C1-4烷基、-(CH2)rORb;
R8独立选自H、F、Cl、Br和-(CH2)rORb;
R9独立选自H和取代有0-4个Re的C1-4烷基;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Rd在每次出现时独立选自H和取代有0-5个Re的C1-4烷基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
n在每次出现时独立选自0、1和2;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
在另一个方面,本申请提供式(III)化合物:
或其立体异构体、互变异构体、药用盐、溶剂化物或前药,其中
L不存在或独立选自-NR4-、-C(O)NR4(CR4R4)n-和-O-;
M独立选自N和CH;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、芳基和杂芳基,其各自取代有1-5个R6;
可代替地,当L是-NR4-、-C(O)NR4-时,R4和R5与和它们均连接的氮原子一起形成取代有1-5个R6的杂环;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CRdRd)rS(O)pRc、-(CRdRd)rS(O)pNRaRa、-(CRdRd)rNRaS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)rNRaRa、-(CRdRd)rNRaC(=O)Rb、-(CRdRd)rNRaC(=O)NRaRa、-(CRdRd)rNRaC(=O)ORb、-(CRdRd)rC(=O)ORb、-(CRdRd)rC(=O)NRaRa、-(CRdRd)rC(=O)Rb、-(CRdRd)rOC(=O)Rb、-(CRdRd)rOC(=O)NRaRa、-(CRdRd)r-环烷基、-(CRdRd)r-杂环基、-(CRdRd)r-芳基和-(CRdRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Rd在每次出现时独立选自H和取代有0-5个Re的C1-4烷基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
在另一个方面,本申请提供式(III)化合物或其立体异构体、对映异构体、非对映异构体、互变异构体、药用盐、溶剂化物或前药,其中
L独立选自-NR4-、-C(O)NR4(CH2)0-1-和-O-;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CHRd)rS(O)pRc、-(CHRd)rS(O)pNRaRa、-(CHRd)rNRaS(O)pRc、-(CHRd)rORb、-(CHRd)rCN、-(CHRd)rNRaRa、-(CHRd)rNRaC(=O)Rb、-(CHRd)rNRaC(=O)NRaRa、-(CHRd)rNRaC(=O)ORb、-(CHRd)rC(=O)ORb、-(CHRd)rC(=O)NRaRa、-(CHRd)rOC(=O)NRaRa、-(CHRd)rC(=O)Rb、-(CHRd)rOC(=O)Rb、-(CHRd)r-环烷基、-(CHRd)r-杂环基、-(CHRd)r-芳基和-(CHRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
R6a独立选自H、C1-4烷基、-S(O)pRc、-S(O)pNRaRa、-C(=O)ORb、-(CH2)rC(=O)Rb、-(CH2)r-环烷基、-(CH2)r-杂环基、-(CH2)r-芳基和-(CH2)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
Ra在每次出现时独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb在每次出现时独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc在每次出现时独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Rd在每次出现时独立选自H和取代有0-5个Re的C1-4烷基;
Re在每次出现时独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、S(O)pNRfRf和-(CH2)rNRfRf;
Rf在每次出现时独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
p在每次出现时独立选自0、1和2;且
r在每次出现时独立选自0、1、2、3和4;且
其它变量如上述式(III)中所定义。
在另一个方面,本申请提供式(III)化合物或其立体异构体、对映异构体、非对映异构体、互变异构体、药用盐、溶剂化物或前药,其中
L独立选自-NR4-和-C(O)NR4-;
R4和R5与和它们连接的氮原子一起形成选自以下的杂环:
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CHRd)rS(O)pRc、-(CHRd)rS(O)pNRaRa、-(CHRd)rNRaS(O)pRc、-(CHRd)rORb、-(CHRd)rCN、-(CHRd)rNRaRa、-(CHRd)rNRaC(=O)Rb、-(CHRd)rNRaC(=O)NRaRa、-(CHRd)rNRaC(=O)ORb、-(CHRd)rC(=O)ORb、-(CHRd)rC(=O)NRaRa、-(CHRd)rOC(=O)NRaRa、-(CHRd)rC(=O)Rb、-(CHRd)rOC(=O)Rb、-(CHRd)r-环烷基、-(CHRd)r-杂环基、-(CHRd)r-芳基和-(CHRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
R6a独立选自H、C1-4烷基、-S(O)pRc、-S(O)pNRaRa、-C(=O)ORb、-(CH2)rC(=O)Rb、-(CH2)r-环烷基、-(CH2)r-杂环基、-(CH2)r-芳基和-(CH2)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
Ra在每次出现时独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb在每次出现时独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc在每次出现时独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Rd在每次出现时独立选自H和取代有0-5个Re的C1-4烷基;
Re在每次出现时独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、S(O)pNRfRf和-(CH2)rNRfRf;
Rf在每次出现时独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
p在每次出现时独立选自0、1和2;且
r在每次出现时独立选自0、1、2、3和4;且
其它变量如上述式(III)中所定义。
在另一个方面,本申请提供式(III)化合物或其立体异构体、对映异构体、非对映异构体、互变异构体、药用盐、溶剂化物或前药,其中
L是-O-;
R5独立选自
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CHRd)rS(O)pRc、-(CHRd)rS(O)pNRaRa、-(CHRd)rNRaS(O)pRc、-(CHRd)rORb、-(CHRd)rCN、-(CHRd)rNRaRa、-(CHRd)rNRaC(=O)Rb、-(CHRd)rNRaC(=O)NRaRa、-(CHRd)rNRaC(=O)ORb、-(CHRd)rC(=O)ORb、-(CHRd)rC(=O)NRaRa、-(CHRd)rOC(=O)NRaRa、-(CHRd)rC(=O)Rb、-(CHRd)rOC(=O)Rb、-(CHRd)r-环烷基、-(CHRd)r-杂环基、-(CHRd)r-芳基和-(CHRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
Ra在每次出现时独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb在每次出现时独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc在每次出现时独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Rd在每次出现时独立选自H和取代有0-5个Re的C1-4烷基;
Re在每次出现时独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、S(O)pNRfRf和-(CH2)rNRfRf;
Rf在每次出现时独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
p在每次出现时独立选自0、1和2;且
r在每次出现时独立选自0、1、2、3和4;且
其它变量如上述式(III)中所定义。
在另一个方面,本申请提供式(IV)化合物:
或其立体异构体、互变异构体、药用盐、溶剂化物或前药,其中
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、芳基和杂芳基,其各自取代有1-5个R6;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CRdRd)rS(O)pRc、-(CRdRd)rS(O)pNRaRa、-(CRdRd)rNRaS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)rNRaRa、-(CRdRd)rNRaC(=O)Rb、-(CRdRd)rNRaC(=O)NRaRa、-(CRdRd)rNRaC(=O)ORb、-(CRdRd)rC(=O)ORb、-(CRdRd)rC(=O)NRaRa、-(CRdRd)rC(=O)Rb、-(CRdRd)rOC(=O)Rb、-(CRdRd)rOC(=O)NRaRa、-(CRdRd)r-环烷基、-(CRdRd)r-杂环基、-(CRdRd)r-芳基和-(CRdRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
n在每次出现时独立选自0和1;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
在另一个方面,本申请提供式(V)化合物:
或其立体异构体、互变异构体、药用盐、溶剂化物或前药,其中
R3独立选自H、取代有0-4个Re的C1-4烷基、-(CH2)rORb、(CH2)rS(O)pRc、-(CH2)rC(=O)Rb、-(CH2)rNRaRa、-(CH2)rCN、-(CH2)rC(=O)NRaRa、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)NRaRa、-(CH2)rNRaC(=O)ORb、-(CH2)rOC(=O)NRaRa、-(CH2)rC(=O)ORb、-(CH2)rS(O)pNRaRa、-(CH2)rNRaS(O)pNRaRa、-(CH2)rNRaS(O)pRc、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
在另一个方面,本申请提供式(VI)化合物:
或其立体异构体、互变异构体、药用盐、溶剂化物或前药,其中
环B选自
G选自N和CR7;
M独立选自N和CR9;
R3独立选自H、取代有0-4个Re的C1-4烷基、-(CH2)rORb、(CH2)rS(O)pRc、-(CH2)rC(=O)Rb、-(CH2)rNRaRa、-(CH2)rCN、-(CH2)rC(=O)NRaRa、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)NRaRa、-(CH2)rNRaC(=O)ORb、-(CH2)rOC(=O)NRaRa、-(CH2)rC(=O)ORb、-(CH2)rS(O)pNRaRa、-(CH2)rNRaS(O)pNRaRa、-(CH2)rNRaS(O)pRc、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、芳基和杂芳基,其各自取代有1-5个R6;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CRdRd)rS(O)pRc、-(CRdRd)rS(O)pNRaRa、-(CRdRd)rNRaS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)rNRaRa、-(CRdRd)rNRaC(=O)Rb、-(CRdRd)rNRaC(=O)NRaRa、-(CRdRd)rNRaC(=O)ORb、-(CRdRd)rC(=O)ORb、-(CRdRd)rC(=O)NRaRa、-(CRdRd)rC(=O)Rb、-(CRdRd)rOC(=O)Rb、-(CRdRd)rOC(=O)NRaRa、-(CRdRd)r-环烷基、-(CRdRd)r-杂环基、-(CRdRd)r-芳基和-(CRdRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
R7独立选自H、F、Cl、Br、CN、取代有0-3个Re的C1-4烷基、-(CH2)rORb;
R8独立选自H、F、Cl、Br和-(CH2)rORb;
R9独立选自H和取代有0-4个Re的C1-4烷基;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
n在每次出现时独立选自0和1;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
在另一个方面,本申请提供式(VII)化合物:
或其立体异构体、对映异构体、非对映异构体、互变异构体、药用盐、溶剂化物或前药,其中
环B选自
G选自N和CR7;
M独立选自N和CR9;
R3独立选自H、取代有0-4个Re的C1-4烷基、-(CH2)rORb、(CH2)rS(O)pRc、-(CH2)rC(=O)Rb、-(CH2)rNRaRa、-(CH2)rCN、-(CH2)rC(=O)NRaRa、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)NRaRa、-(CH2)rNRaC(=O)ORb、-(CH2)rOC(=O)NRaRa、-(CH2)rC(=O)ORb、-(CH2)rS(O)pNRaRa、-(CH2)rNRaS(O)pNRaRa、-(CH2)rNRaS(O)pRc、取代有0-3个Re的(CH2)r-C3-6碳环基和取代有0-3个Re的-(CH2)r-杂环基;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、芳基和杂芳基,其各自取代有1-5个R6;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、C2-4烯基、C2-4炔基、硝基、-(CRdRd)rS(O)pRc、-(CRdRd)rS(O)pNRaRa、-(CRdRd)rNRaS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)rNRaRa、-(CRdRd)rNRaC(=O)Rb、-(CRdRd)rNRaC(=O)NRaRa、-(CRdRd)rNRaC(=O)ORb、-(CRdRd)rC(=O)ORb、-(CRdRd)rC(=O)NRaRa、-(CRdRd)rC(=O)Rb、-(CRdRd)rOC(=O)Rb、-(CRdRd)rOC(=O)NRaRa、-(CRdRd)r-环烷基、-(CRdRd)r-杂环基、-(CRdRd)r-芳基和-(CRdRd)r-杂芳基,其中所述烷基、环烷基、杂环基、芳基或杂芳基取代有0-4个Re;
R7独立选自H、F、Cl、Br、CN、取代有0-3个Re的C1-4烷基、-(CH2)rORb;
R8独立选自H、F、Cl、Br和-(CH2)rORb;
R9独立选自H和取代有0-4个Re的C1-4烷基;
Ra独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;或Ra和Ra与和它们均连接的氮原子一起形成取代有0-5个Re的杂环;
Rb独立选自H、取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、取代有0-5个Re的-(CH2)r-C3-10碳环基和取代有0-5个Re的-(CH2)r-杂环基;
Rc独立选自取代有0-5个Re的C1-6烷基、取代有0-5个Re的C2-6烯基、取代有0-5个Re的C2-6炔基、C3-6碳环基和杂环基;
Re独立选自取代有0-5个Rf的C1-6烷基、C2-6烯基、C2-6炔基、-(CH2)r-C3-6环烷基、-(CH2)r-C4-6杂环基、-(CH2)r-芳基、-(CH2)r-杂芳基、F、Cl、Br、CN、NO2、=O、CO2H、-(CH2)rORf、S(O)pRf、C(=O)NRfRf、NRfC(=O)Rd、S(O)pNRfRf、NRfS(O)pRd、NRfC(=O)ORd、OC(=O)NRfRf和-(CH2)rNRfRf;
Rf独立选自H、F、Cl、Br、CN、OH、C1-5烷基、C3-6环烷基和苯基;或Rf和Rf与和它们均连接的氮原子一起形成任选取代有C1-4烷基的杂环;
n在每次出现时独立选自0和1;
p在每次出现时独立选自0、1和2;且
r独立选自0、1、2、3和4。
本申请可在不偏离其精神或基本属性下以其它特定形式实施。本申请还涵盖本文提及的本申请的优选方面的所有组合。应当理解的是,本申请的任何和所有实施方案可与用于描述本申请的其它实施方案的任何其它实施方案结合。此外,实施方案的任何要素(包括单个变量定义)意欲与任何实施方案的任何和所有其它要素组合来描述其它实施方案。
例如,在一个非限制性实施方案中,环A是环B是G是CH;L是-O-;R5是R6独立选自H、F、Cl、取代有0-3个Re的C1-4烷基和取代有0-3个Re的-OC1-4烷基;且Re独立选自C1-6烷基、F、Cl、Br和CN。
在另一个非限制性实施方案中,环A是环B是G是CH;L是-NH-;R5独立选自R6独立选自H、F、Cl、取代有0-3个Re的C1-4烷基和取代有0-3个Re的-OC1-4烷基;且Re独立选自C1-6烷基、F、Cl、Br和CN。
在另一个非限制性实施方案中,环A是环B是G是CH;L是-C(O)NR4-;R4和R5与它们所连接的氮原子一起形成 R6独立选自H、F、Cl、取代有0-3个Re的C1-4烷基和取代有0-3个Re的-OC1-4烷基;且Re独立选自C1-6烷基、F、Cl、Br和CN。
在另一方面,本申请提供选自本申请中举例说明的化合物的任何子集列表的化合物。
在另一个实施方案中,本申请化合物具有≤10μM的ROCK IC50值。
在另一个实施方案中,本申请化合物具有≤1μM的ROCK IC50值。
在另一个实施方案中,本申请化合物具有≤0.5μM的ROCK IC50值。
在另一个实施方案中,本申请化合物具有≤0.1μM的ROCK IC50值。
在另一个实施方案中,本申请化合物具有≤0.05μM的ROCK IC50值。
在另一个实施方案中,本申请化合物具有≤0.01μM的ROCK IC50值。
II.本申请的其它实施方案
在另一个实施方案中,本申请提供组合物,其包含至少一种本申请化合物或其立体异构体、互变异构体、药用盐或溶剂化物。
在另一个实施方案中,本申请提供药物组合物,其包含药用载体和治疗有效量的至少一种本申请化合物或其立体异构体、互变异构体、药用盐或溶剂化物。
在另一个实施方案中,本申请提供用于制备本申请化合物的方法。
在另一个实施方案中,本申请提供用于制备本申请化合物的中间体。
在另一个实施方案中,本申请提供药物组合物,其还包含一种或多种其它治疗剂。
在另一个实施方案中,本申请提供治疗和/或预防与异常ROCK活性相关的病症的方法,其包括向需要此类治疗和/或预防的患者给予治疗有效量的至少一种本申请化合物或其立体异构体、互变异构体、药用盐或溶剂化物。本文使用的术语“患者”涵盖所有哺乳动物物种。
如本文所用,“治疗(treating或treatment)”涵盖治疗哺乳动物(尤其人类)的疾病状态且包括:(a)抑制所述疾病状态,即阻止其进展;和/或(b)减轻所述疾病状态,即引起所述疾病状态消退。
如本文所用,“预防(prophylaxis)”是疾病状态的保护性治疗,以通过向患者给予治疗有效量的至少一种本申请化合物或其立体异构体,互变异构体,药用盐或溶剂化物来降低和/或最小化疾病状态的风险和/或降低疾病状态的复发风险。可基于与一般人群相比已知会增加患有临床疾病状态的风险的因素来选择患者进行预防性治疗。对于预防性治疗,可能会或可能不会呈现临床疾病状态。“预防”治疗可分为(a)初级预防和(b)二级预防。初级预防定义为降低或最小化尚未呈现临床疾病状态的患者的疾病状态风险的治疗,而二级预防定义为最小化或降低相同或类似临床疾病状态的复发或二次发生的风险。
如本文所用,“预防(prevention)”涵盖预防性治疗哺乳动物(尤其人类)的亚临床疾病状态,其旨在减小发生临床疾病状态的可能性。基于已知与一般群体相比患有临床疾病状态的风险增加的因素来选择用于预防性疗法的患者。
本申请可在不偏离其精神或基本属性下以其它特定形式实施。本申请涵盖本文提及的本申请的优选方面的所有组合。应当理解的是,本申请的任何和所有实施方案可与用于描述其它实施方案的任何其它一个或多个实施方案结合。还应当理解的是,实施方案的每一个别要素是其自身独立的实施方案。此外,实施方案的任何要素意欲与任何实施方案的任何和所有其它要素组合来描述其它实施方案。
III.化学
在说明书和随附权利要求书中,给定化学式或名称在存在这种异构体的情况下应涵盖所有立体和光学异构体及其外消旋体。除非另外指出,否则所有手性(对映异构体和非对映异构体)和外消旋形式都在本申请的范围内。所述化合物中也可存在C=C双键、C=N双键、环系统等的许多几何异构体,且所有所述稳定异构体都涵盖于本申请中。描述本申请化合物的顺式和反式(或E-和Z-)几何异构体且可分离成异构体混合物或分开的异构体形式。本申请化合物可以光学活性或外消旋形式加以分离。可通过拆分外消旋形式或通过自光学活性起始材料合成来制备光学活性形式。用于制备本申请化合物和其中制得的中间体的所有方法都视为本申请的一部分。当制备对映异构体或非对映异构体产物时,其可通过常用方法(例如通过色谱或分级结晶)进行分离。取决于方法条件,以游离(中性)或盐形式得到本申请的最终产物。这些最终产物的游离形式和盐都在本申请的范围内。若需要,则可将化合物的一种形式转化成另一形式。可将游离碱或酸转化成盐;可将盐转化成游离化合物或另一盐;可将本申请异构体化合物的混合物分离成个别异构体。本申请化合物、其游离形式和盐可以多种互变异构体形式存在,其中氢原子换位至分子的其它部分上并由此重排分子原子间的化学键。应理解,可存在的所有互变异构体形式都包括在本申请内。
术语“立体异构体”是指构成相同但在其原子空间排列上不同的异构体。对映异构体和非对映异构体是立体异构体的实例。术语“对映异构体”是指互为镜像但不可重叠的一对分子物质之一。术语“非对映异构体”是指不为镜像的立体异构体。术语“外消旋体”或“外消旋混合物”是指由等摩尔量的两种对映异构体物质组成的组合物,其中所述组合物没有光学活性。
符号“R”和“S”代表手性碳原子周围的取代基的构型。异构体描述语“R”和“S”如本文所述用于指示相对于核心分子的原子构型且意欲如文献中所定义来使用(IUPACRecommendations 1996,Pure and Applied Chemistry,68:2193-2222(1996))。
术语“手性”是指分子的使其不可能与其镜像重叠的结构特征。术语“纯手性”是指对映异构体纯度的状态。术语“光学活性”是指纯手性分子或手性分子的非外消旋混合物在偏振光平面上旋转的程度。
本文所用的术语“烷基”或“亚烷基”意欲包括具有指定碳原子数的支链和直链饱和脂族烃基团。例如,“C1-C10烷基”或“C1-10烷基”(或亚烷基)意欲包括C1、C2、C3、C4、C5、C6、C7、C8、C9和C10烷基。此外,例如,“C1-C6烷基”或“C1-6烷基”表示具有1个至6个碳原子的烷基。烷基可为未取代的或取代的(其中至少一个氢被另一个化学基团替代)。烷基的实例包括但不限于甲基(Me)、乙基(Et)、丙基(例如,正丙基和异丙基)、丁基(例如,正丁基、异丁基、叔丁基)和戊基(例如,正戊基、异戊基、新戊基)。
“烯基”或“亚烯基”意欲包括具有指定碳原子数和一个或多个、优选地一个至两个碳-碳双键(其可存在于沿链的任何稳定点处)的直链或支链构型的烃链。例如,“C2-C6烯基”或“C2-6烯基”(或亚烯基)意欲包括C2、C3、C4、C5和C6烯基。烯基的实例包括但不限于乙烯基、1-丙烯基、2-丙烯基、2-丁烯基、3-丁烯基、2-戊烯基、3-戊烯基、4-戊烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、2-甲基-2-丙烯基和4-甲基-3-戊烯基。
“炔基”或“亚炔基”意欲包括具有一个或多个、优选地一个至三个碳-碳三键(其可存在于沿链的任何稳定点处)的直链或支链构型的烃链。例如,“C2-C6炔基”或“C2-6炔基”(或亚炔基)意欲包括C2、C3、C4、C5和C6炔基;诸如乙炔基、丙炔基、丁炔基、戊炔基和己炔基。
术语“烷氧基”或“烷基氧基”是指-O-烷基。“C1-C6烷氧基”或“C1-6烷氧基”(或烷基氧基)意欲包括C1、C2、C3、C4、C5和C6烷氧基。烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基(例如,正丙氧基和异丙氧基)和叔丁氧基。类似地,“烷基硫基”或“硫代烷氧基”表示具有指定数量碳原子的经硫桥进行连接的如上文所定义的烷基;例如甲基-S-和乙基-S-。
“卤代”或“卤素”包括氟(F)、氯(Cl)、溴(Br)和碘(I)。“卤代烷基”意欲包括具有指定碳原子数且取代有一个或多个卤素的支链和直链饱和脂族烃基团。卤代烷基的实例包括但不限于氟甲基、二氟甲基、三氟甲基、三氯甲基、五氟乙基、五氯乙基、2,2,2-三氟乙基、七氟丙基和七氯丙基。卤代烷基的实例还包括意欲包括具有指定碳原子数且取代有一个或多个氟原子的支链和直链饱和脂族烃基团的“氟烷基”。
“卤代烷氧基”或“卤代烷基氧基”表示具有指定数量碳原子的经氧桥进行连接的如上文所定义的卤代烷基。例如,“C1-C6卤代烷氧基”或“C1-6卤代烷氧基”意欲包括C1、C2、C3、C4、C5和C6卤代烷氧基。卤代烷氧基的实例包括但不限于三氟甲氧基、2,2,2-三氟乙氧基和五氟乙氧基。类似地,“卤代烷基硫基”或“硫代卤代烷氧基”表示具有指定数量碳原子的经硫桥进行连接的如上文所定义的卤代烷基;例如三氟甲基-S-和五氟乙基-S-。
术语“环烷基”是指环状烷基,其包括单环、二环或多环环系。例如,“C3-C7环烷基”或“C3-7环烷基”意欲包括C3、C4、C5、C6和C7环烷基。环烷基实例包括但不限于环丙基、环丁基、环戊基、环己基和降冰片烷基。支链环烷基(诸如1-甲基环丙基和2-甲基环丙基)包括在“环烷基”的定义中。
如本文所用,“碳环”、“碳环基”或“碳环残基”意指任何稳定的3-、4-、5-、6-、7-或8元单环或二环或7-、8-、9-、10-、11-、12-或13元二环或三环烃环,任何所述环可以是饱和的、部分不饱和的、不饱和的或芳族的。所述碳环的实例包括但不限于环丙基、环丁基、环丁烯基、环戊基、环戊烯基、环己基、环庚烯基、环庚基、环庚烯基、金刚烷基、环辛基、环辛烯基、环辛二烯基、[3.3.0]二环辛烷、[4.3.0]二环壬烷、[4.4.0]二环癸烷(十氢萘)、[2.2.2]二环辛烷、芴基、苯基、萘基、茚满基、金刚烷基、蒽基和四氢萘基(四氢萘)。如上文所示,桥环也包括在碳环的定义内(例如,[2.2.2]二环辛烷)。除非另有说明,否则优选的碳环为环丙基、环丁基、环戊基、环己基、苯基和茚满基。当使用术语“碳环基”时,其意欲包括“芳基”。当一个或多个碳原子连接两个非毗邻碳原子时,出现桥环。优选的桥为一个或两个碳原子。应注意,桥总是将单环转化成三环。当环是桥接的时,对于该环所列举的取代基也可存在于桥上。
如本文所用,术语“二环碳环基”或“二环碳环基团”意指含有两个稠环且由碳原子组成的稳定的9-或10元碳环环系。两个稠环中,一个环是稠合至第二个环的苯并环;且第二个环是饱和的、部分不饱和的或不饱和的5-或6元碳环。二环碳环基团可在任何碳原子处连接至其侧基,从而得到稳定结构。如果所得化合物是稳定的,则本文所述的二环碳环基团可在任何碳上被取代。二环碳环基团的实例是但不限于萘基、1,2-二氢萘基、1,2,3,4-四氢萘基和茚满基。
“芳基”是指单环或多环芳族烃,其包括例如苯基、萘基和菲基。芳基部分是公知的且述于例如Lewis,R.J.,ed.,Hawley’s Condensed Chemical Dictionary,13th Edition,John Wiley&Sons,Inc.,New York(1997)中。“C6或C10芳基”、“C6-10芳基”是指苯基和萘基。除非另有说明,否则“芳基”、“C6或C10芳基”或“C6-10芳基”或“芳族残基”可以是未取代的或取代有1至5个、优选1至3个下述基团:OH、OCH3、Cl、F、Br、I、CN、NO2、NH2、N(CH3)H、N(CH3)2、CF3、OCF3、C(=O)CH3、SCH3、S(=O)CH3、S(=O)2CH3、CH3、CH2CH3、CO2H和CO2CH3。
如本文所用,术语“苄基”是指其中一个氢原子被苯基代替的甲基,其中所述苯基可任选被1至5个、优选1至3个下述基团取代:OH、OCH3、Cl、F、Br、I、CN、NO2、NH2、N(CH3)H、N(CH3)2、CF3、OCF3、C(=O)CH3、SCH3、S(=O)CH3、S(=O)2CH3、CH3、CH2CH3、CO2H和CO2CH3。
如本文所用,术语“杂环(heterocycle)”、“杂环基”或“杂环(heterocyclicring)”意指稳定的3-、4-、5-、6-或7元单环或二环或7-、8-、9-、10-、11-、12-、13-或14元多环杂环,其为饱和的、部分不饱和的或完全不饱和的,且其含有碳原子和1、2、3或4个独立地选自N、O和S的杂原子;且包括其中任何上文所定义的杂环稠合至苯环的任何多环基团。氮和硫杂原子可任选为氧化的(即N→O和S(O)p,其中p为0、1或2)。氮原子可以是取代的或未取代的(即如果定义的话,则为N或NR,其中R为H或另一取代基)。杂环可在任何杂原子或碳原子处连接至其侧基,从而得到稳定结构。如果所得化合物是稳定的,则本文所述的杂环可在碳或氮原子上被取代。杂环中的氮可任选为季铵化的。优选的是当杂环中的S和O原子总数超过1时,则这些杂原子不彼此毗邻。优选的是杂环中的S和O原子总数不大于1。当使用术语“杂环”时,其意欲包括杂芳基。
桥环也包括在杂环的定义中。当一个或多个原子(即C、O、N或S)连接两个非毗邻碳或氮原子时,出现桥环。桥环的实例包括但不限于一个碳原子、两个碳原子、一个氮原子、两个氮原子和碳-氮基团。应注意,桥总是将单环转化成三环。当环为桥接的时,对于该环所列举的取代基也可存在于桥上。
杂环的实例包括但不限于吖啶基、氮杂环丁烷基、氮杂环辛四烯基(azocinyl)、苯并咪唑基、苯并呋喃基、苯并硫代呋喃基、苯并噻吩基、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、4aH-咔唑基、咔啉基、色满基、色烯基、噌啉基、十氢喹啉基、2H,6H-1,5,2-二噻嗪基、二氢呋喃并[2,3-b]四氢呋喃基、呋喃基、呋咱基、咪唑烷基、咪唑啉基、咪唑基、1H-吲唑基、咪唑并吡啶基、假吲哚基(indolenyl)、吲哚啉基、吲嗪基、吲哚基、3H-吲哚基、靛红酰基(isatinoyl)、异苯并呋喃基、异色满基、异吲唑基、异吲哚啉基、异吲哚基、异喹啉基、异噻唑基、异噻唑并吡啶基、异噁唑基、异噁唑并吡啶基、亚甲二氧基苯基、吗啉基、萘啶基、八氢异喹啉基、噁二唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、噁唑烷基、噁唑基、噁唑并吡啶基、噁唑烷基萘嵌间二氮杂苯基(perimidinyl)、羟吲哚基(oxindolyl)、嘧啶基、菲啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噁噻基、吩噁嗪基、酞嗪基、哌嗪基、哌啶基、哌啶酮基、4-哌啶酮基、胡椒基(piperonyl)、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑并吡啶基、吡唑基、哒嗪基、吡啶并噁唑基、吡啶并咪唑基、吡啶并噻唑基、吡啶基、嘧啶基、吡咯烷基、吡咯啉基、2-吡咯烷酮基、2H-吡咯基、吡咯基、喹唑啉基、喹啉基、4H-喹嗪基、喹喔啉基、奎宁环基、四唑基、四氢呋喃基、四氢异喹啉基、四氢喹啉基、6H-1,2,5-噻二嗪基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻唑并吡啶基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基、三嗪基、1,2,3-三唑基、1,2,4-三唑基、1,2,5-三唑基、1,3,4-三唑基和呫吨基。含有例如上述杂环的稠环和螺环化合物也包括在内。
5-至10元杂环的实例包括但不限于吡啶基、呋喃基、噻吩基、吡咯基、吡唑基、吡嗪基、哌嗪基、哌啶基、咪唑基、咪唑烷基、吲哚基、四唑基、异噁唑基、吗啉基、噁唑基、噁二唑基、噁唑烷基、四氢呋喃基、噻二嗪基、噻二唑基、噻唑基、三嗪基、三唑基、苯并咪唑基、1H-吲唑基、苯并呋喃基、苯并硫代呋喃基、苯并四唑基、苯并三唑基、苯并异噁唑基、苯并噁唑基、羟吲哚基、苯并噁唑啉基、苯并噻唑基、苯并异噻唑基、靛红酰基、异喹啉基、八氢异喹啉基、四氢异喹啉基、四氢喹啉基、异噁唑并吡啶基、喹唑啉基、喹啉基、异噻唑并吡啶基、噻唑并吡啶基、噁唑并吡啶基、咪唑并吡啶基和吡唑并吡啶基。
5-至6元杂环的实例包括但不限于吡啶基、呋喃基、噻吩基、吡咯基、吡唑基、吡嗪基、哌嗪基、哌啶基、咪唑基、咪唑烷基、吲哚基、四唑基、异噁唑基、吗啉基、噁唑基、噁二唑基、噁唑烷基、四氢呋喃基、噻二嗪基、噻二唑基、噻唑基、三嗪基和三唑基。含有例如上述杂环的稠环和螺环化合物也包括在内。
如本文所用,术语“二环杂环”或“二环杂环基团”意指稳定的9-或10元杂环系统,其含有两个稠环且由碳原子和1、2、3或4个独立地选自N、O和S的杂原子组成。两个稠环中,一个环是5-或6元单环芳族环,其包含5元杂芳基环、6元杂芳基环或苯并环,各自稠合至第二个环。第二个环是饱和的、部分不饱和的或不饱和的5-或6元单环,且包含5元杂环、6元杂环或碳环(前提是当第二个环是碳环时,第一个环不为苯并环)。
二环杂环基团可在任何杂原子或碳原子处连接至其侧基,从而得到稳定结构。如果所得化合物是稳定的,则本文所述的二环杂环基团可在碳或氮原子上被取代。优选的是当杂环中的S和O原子总数超过1时,则这些杂原子不彼此毗邻。优选的是杂环中的S和O原子总数不大于1。
二环杂环基团的实例是但不限于喹啉基、异喹啉基、酞嗪基、喹唑啉基、吲哚基、异吲哚基、吲哚啉基、1H-吲唑基、苯并咪唑基、1,2,3,4-四氢喹啉基、1,2,3,4-四氢异喹啉基、5,6,7,8-四氢-喹啉基、2,3-二氢-苯并呋喃基、色满基、1,2,3,4-四氢-喹喔啉基和1,2,3,4-四氢-喹唑啉基。
如本文所用,术语“芳族杂环基团”或“杂芳基”是指取代和未取代的芳族5-或6元单环基团、9-或10元双环基团和11-至14元三环基团,其在至少一个环中具有至少有一个杂原子(O、S或N),所述含杂原子的环优选具有1、2或3个选自O、S和N的杂原子。每个含有杂原子的杂芳基的环可含有一个或两个氧或硫原子和/或1至4个氮原子,条件是每个环中杂原子的总数为4或更少且每个环具有至少一个碳原子。杂芳基可以是取代的或未取代的。氮原子可以是取代的或未取代的(即N或NR,其中R为H或另一个取代基,如果定义的话)。氮和硫杂原子可任选被氧化(即N→O和S(O)p)且氮原子可任选被季铵化。
二环或三环的杂芳基必须包括至少一个完全的芳族环,但另一个或多个稠环可以是芳族或非芳族的。杂芳基可以连接在任何环的任何可用的氮或碳原子上。杂芳基环系统可含有0、1、2或3个取代基。杂芳基包括但不限于吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、呋喃基、喹啉基、异喹啉基、噻吩基、咪唑基、噻唑基、吲哚基、吡咯基、噁唑基、苯并呋喃基、苯并噻吩基、苯并噻唑基、异噁唑基、吡唑基、三唑基、四唑基、吲唑基、1,2,4-噻二唑基、异噻唑基、嘌呤基、咔唑基、苯并咪唑基、吲哚啉基、苯并二氧杂环戊烯基和苯并二噁烷。
术语“抗衡离子”用于表示带负电荷的物质,例如氯离子、溴离子、氢氧根、乙酸根和硫酸根。
当环结构内使用虚线环时,这指示所述环结构可以是饱和的、部分饱和的或不饱和的。
如本文中所提及,术语“取代的”意指至少一个氢原子被非氢基团代替,前提是维持正常的化合价且所述取代得到稳定化合物。当取代基是酮基(即=O)时,则原子上的2个氢被代替。酮基取代基不存在于芳族部分上。当提及环系统(例如,碳环或杂环)被羰基或双键取代时,意指所述羰基或双键是环的一部分(即在环内)。如本文所用,环双键为在两个毗邻环原子之间形成的双键(例如,C=C、C=N或N=N)。
在本申请化合物上存在氮原子(例如,胺)的情形下,可通过用氧化剂(例如,mCPBA和/或过氧化氢)处理而将其转化成N-氧化物,得到本申请的其它化合物。因此,所显示和要求保护的氮原子视为涵盖所显示氮及其N-氧化物(N→O)衍生物二者。
当任何变量在化合物的任何构成或式中出现多于一次时,其在每次出现时的定义独立于其在每次其它出现时的定义。因此,例如,如果显示基团被0-3个R基团取代,则所述基团可任选被至多三个R基团取代,且在每次出现时R独立地选自R的定义。此外,取代基和/或变量的组合仅当所述组合得到稳定化合物时才是允许的。
当显示键合至取代基的键与连接环中两个原子的键交叉时,则所述取代基可键合至所述环的任何原子上。当列举取代基但未指明所述取代基键合至给定式的化合物的其余部分上的原子时,则所述取代基可通过所述取代基中的任何原子来键合。取代基和/或变量的组合仅当所述组合得到稳定化合物时才是允许的。
短语“药用”在本文中用于指以下那些化合物、材料、组合物和/或剂型:其在合理医学判断的范围内,适用于与人类和动物的组织接触而无过度的毒性、刺激性、过敏反应和/或其它问题或并发症并与合理的益处/风险比率相称。
如本文中所用,“药用盐”是指所公开化合物的衍生物,其中通过制备其酸或碱盐来修饰母体化合物。药用盐的实例包括但不限于碱性基团诸如胺的无机或有机酸盐;和酸性基团诸如羧酸的碱性或有机盐。药用盐包括例如自无毒无机或有机酸形成的母体化合物的常规无毒盐或季铵盐。例如,所述常规无毒盐包括衍生自无机酸的那些,所述无机酸诸如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸和硝酸;和制备自有机酸的盐,所述有机酸诸如乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、扑酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、磺胺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲烷磺酸、乙烷二磺酸、草酸和羟乙磺酸。
本申请的药用盐可通过常用化学方法自含有碱性或酸性部分的母体化合物合成。通常,可通过使这些化合物的游离酸或碱形式与化学计量量的适当碱或酸在水中或在有机溶剂中或在二者的混合物中反应来制备所述盐;通常,优选非水性介质,如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈。适宜盐的列表见于Remington’s Pharmaceutical Sciences,18thEdition,Mack PublishingCompany,Easton,PA(1990),通过引用的方式将其公开内容并入本文中。
此外,式I化合物可具有前药形式。本申请的范围和精神内的前药是在体内转化以提供生物活性剂(即式I化合物)的任何化合物。前药的各种形式是本领域熟知的。所述前药衍生物的实例,参见:
a)Bundgaard,H.,ed.,Design of Prodrugs,Elsevier(1985),and Widder,K.etal.,eds.,Methods in Enzymology,112:309-396、Academic Press(1985);
b)Bundgaard,H.,Chapter 5,"Design和Application of Prodrugs"、A Textbookof Drug Design and Development,pp.113-191,Krosgaard-Larsen,P.et al.,eds.,Harwood Academic Publishers(1991);
c)Bundgaard,H.、Adv.Drug Deliv.Rev.,8:1-38(1992);
d)Bundgaard,H.et al.,J.Pharm.Sci.,77:285(1988);和
e)Kakeya,N.et al.,Chem.Pharm.Bull.,32:692(1984)。
含有羧基的化合物可形成生理上可水解的酯,所述酯通过在体内水解以得到式I化合物本身来用作前药。由于在许多情形下水解主要在消化酶的影响下发生,因此优选口服给予所述前药。肠胃外给予可用于酯自身具有活性的情形或在血液中发生水解的那些情形。式I化合物的生理上可水解酯的实例包括C1-6烷基、C1-6烷基苄基、4-甲氧基苄基、茚满基、邻苯二甲酰基、甲氧基甲基、C1-6烷酰氧基-C1-6烷基(例如,乙酰氧基甲基、新戊酰基氧基甲基或丙酰基氧基甲基)、C1-6烷氧基羰基氧基-C1-6烷基(例如,甲氧基羰基-氧基甲基或乙氧基羰基氧基甲基、甘胺酰基氧基甲基、苯基甘胺酰基氧基甲基、(5-甲基-2-氧代-1,3-二氧杂环戊烯-4-基)-甲基)酯及用于例如青霉素和头孢菌素领域中的其它熟知的生理上可水解的酯。可通过本领域已知的常用技术来制备所述酯。
前药的制备是本领域中公知的且述于例如King、F.D.,ed.,MedicinalChemistry:Principles and Practice,The Royal Society of Chemistry,Cambridge,UK(1994);Testa,B.et al.,Hydrolysis in Drug and Prodrug Metabolism.Chemistry,Biochemistry and Enzymology,VCHA and Wiley-VCH,Zurich,Switzerland(2003);Wermuth,C.G.,ed.,The Practice of Medicinal Chemistry、Academic Press,SanDiego,CA(1999)中。
本申请意欲包括在本申请化合物中出现的原子的所有同位素。同位素包括具有相同原子序数但不同质量数的那些原子。藉助一般实例但不加以限制,氢的同位素包括氘和氚。氘在其核中具有一个质子和一个中子且其具有普通氢的两倍的质量。氘可通过诸如“2H”或“D”的符号来表示。在本文中术语“氘化”,其本身或用于修饰化合物或基团,是指用氘原子代替连接至碳的一个或多个氢原子。碳的同位素包括13C和14C。
同位素标记的本申请化合物通常可通过本领域技术人员已知的常用技术,或可通过与本文所述的那些类似的方法,使用适当同位素标记试剂代替原本采用的未标记试剂来制备。所述化合物具有多种潜在用途,例如,作为测定潜在医药化合物结合至靶蛋白或受体的能力的标准品和试剂,或用于使体内或体外结合至生物受体的本申请化合物成像。
“稳定的化合物”和“稳定的结构”意欲指示足够稳健以经受自反应混合物以有用纯度分离并配制成有效治疗剂的化合物。优选地,本申请化合物不含N-卤素、S(O)2H或S(O)H基团。
术语“溶剂化物”意指本申请化合物与一种或多种溶剂分子(有机或无机)的物理缔合。此物理缔合包括氢键合。在某些情形下,例如,当一种或多种溶剂分子掺入结晶固体的晶格中时,溶剂化物将能够分离。溶剂化物中的溶剂分子可以规则排列和/或无序排列存在。溶剂化物可包含化学计量或非化学计量量的溶剂分子。“溶剂化物”涵盖溶液相和可分离溶剂化物二者。示例性溶剂化物包括但不限于水合物、乙醇合物、甲醇合物和异丙醇合物。溶剂化方法是本领域普遍已知的。
本文所用的缩写定义如下:“1×”表示一次,“2×”表示两次,“3×”表示三次,“℃”表示摄氏度,“eq”表示当量,“g”表示克,“mg”表示毫克,“L”表示升,“mL”表示毫升,“μL”表示微升,“N”表示当量浓度(normal),“M”表示摩尔浓度(molar),“mmol”表示毫摩尔,“min”表示分钟,“h”表示小时,“rt”表示室温,“RT”表示保留时间,“atm”表示大气压,“psi”表示磅/立方英寸,“conc.”表示浓的,“sat”或“saturated”表示饱和,“MW”表示分子量,“mp”表示熔点,"ee"表示对映体过量,“MS”或“Mass Spec”表示质谱,“ESI”表示电喷雾电离质谱,“HR”表示高分辨率,“HRMS”表示高分辨率质谱,“LCMS”表示液相色谱质谱,“HPLC”表示高效液相色谱,“RP HPLC”表示反相HPLC,“TLC”或“tlc”表示薄层色谱,“NMR”表示核磁共振光谱,“nOe”表示核欧沃豪斯效应光谱(nuclear Overhauser effect spectroscopy),“1H”表示质子,“δ”表示德尔塔(delta),“s”表示单峰,“d”表示二重峰,“t”表示三重峰,“q”表示四重峰,“m”表示多重峰,“br”表示宽峰,“Hz”表示赫兹,且“α”、“β”、“R”、“S”、“E”和“Z”是本领域技术人员所熟知的立体化学命名。
Me 甲基
Et 乙基
Pr 丙基
i-Pr 异丙基
Bu 丁基
i-Bu 异丁基
t-Bu 叔丁基
Ph 苯基
Bn 苄基
Boc 叔丁基氧基羰基
AcOH或HOAc 乙酸
AlCl3 氯化铝
AIBN 偶氮二异丁腈
BBr3 三溴化硼
BCl3 三氯化硼
BEMP 2-叔丁基亚氨基-2-二乙基氨基-1,3-二甲基全氢-1,3,2-二氮杂磷杂苯
BOP试剂 苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸盐
Burgess试剂 1-甲氧基-N-三乙基铵磺酰基-甲亚胺酯
CBz 苄氧羰基
CH2Cl2 二氯甲烷
CH3CN或ACN 乙腈
CDCl3 氘代-氯仿
CHCl3 氯仿
mCPBA或m-CPBA 间-氯过氧苯甲酸
Cs2CO3 碳酸铯
Cu(OAc)2 乙酸铜(II)
Cy2NMe N-环己基-N-甲基环己胺
DBU 1,8-二氮杂二环[5.4.0]十一-7-烯
DCE 1,2二氯乙烷
DCM 二氯甲烷
DEA 二乙胺
Dess-Martin 1,1,1-三(乙酰基氧基)-1,1-二氢-1,2-苯碘酰-3-(1H)-酮
DIC或DIPCDI 二异丙基碳二亚胺
DIEA、DIPEA或Hunig碱 二异丙基乙基胺
DMAP 4-二甲基氨基吡啶
DME 1,2-二甲氧基乙烷
DMF 二甲基甲酰胺
DMSO 二甲基亚砜
cDNA 互补DNA
Dppp (R)-(+)-1,2-二(二苯基膦基)丙烷
DuPhos (+)-1,2-二((2S,5S)-2,5-二乙基磷杂环戊基)苯
EDC N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺
EDCI N-(3-二甲基氨基丙基)-N’-乙基碳二亚胺盐酸盐
EDTA 乙二胺四乙酸
(S,S)-EtDuPhosRh(I) (+)-1,2-二((2S,5S)-2,5-二乙基磷杂环戊基)苯(1,5-环辛二烯)三氟甲磺酸铑(I)
Et3N或TEA 三乙胺
EtOAc 乙酸乙酯
Et2O 乙醚
EtOH 乙醇
GMF 玻璃微纤维过滤器
Grubbs(II) (1,3-二(2,4,6-三甲基苯基)-2-咪唑烷亚基)二氯(苯基亚甲基)(三环己基膦)钌
HCl 盐酸
HATU O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲鎓六氟磷酸盐
HEPES 4-(2-羟基乙基)哌嗪-1-乙烷磺酸
Hex 己烷
HOBt或HOBT 1-羟基苯并三唑
H2SO4 硫酸
K2CO3 碳酸钾
KOAc 乙酸钾
K3PO4 磷酸钾
LAH 氢化铝锂
LG 离去基团
LiOH 氢氧化锂
MeOH 甲醇
MgSO4 硫酸镁
MsOH或MSA 甲基磺酸
NaCl 氯化钠
NaH 氢化钠
NaHCO3 硼氢化钠
Na2CO3 碳酸钠
NaOH 氢氧化钠
Na2SO3 亚硫酸钠
Na2SO4 硫酸钠
NBS N-溴代琥珀酰亚胺
NCS N-氯代琥珀酰亚胺
NH3 氨
NH4Cl 氯化铵
NH4OH 氢氧化铵
OTf 三氟甲磺酸酯或三氟甲烷磺酸酯
Pd2(dba)3 三(二亚苄基丙酮)二钯(0)
Pd(OAc)2 乙酸钯(II)
Pd/C 钯/炭
Pd(dppf)Cl2 [1,1’-二(二苯基膦基)-二茂铁]二氯化钯(II)
Ph3PCl2 三苯基二氯化膦
PG 保护基团
POCl3 磷酰氯
i-PrOH或IPA 异丙醇
PS 聚苯乙烯
PyBOP 苯并三唑-1-基-氧基三吡咯烷基鏻六氟磷酸盐
SEM-Cl 2-(三甲基甲硅烷基)乙氧基甲基氯
第2代XPhos预催化剂 氯(2-二环己基膦基-2’,4’,6’-三异丙基-1,1’-联苯)[2-(2’-氨基-1,1’-联苯)]钯(II)THF加合物
SiO2 二氧化硅
SnCl2 氯化锡(II)
TBAI 四正丁基碘化铵
TEA 三乙胺
TFA 三氟乙酸
THF 四氢呋喃
TMSCHN2 三甲基甲硅烷基重氮甲烷
TRIS 三(羟基甲基)氨基甲烷
本申请化合物可以有机合成领域技术人员已知的多种方式来制备。
IV.生物学
体外测定
可在30μL测定(含有20mM HEPES,pH 7.5、20mM MgCl2、0.015%Brij-35、4mM DTT、5μM ATP和1.5μM肽底物(FITC-AHA-AKRRRLSSLRA-OH)(SEQ ID NO.1))中测定本申请化合物作为ROCK抑制剂的有效性。将化合物溶于DMSO中,从而使得DMSO的最终浓度为<2%并用Rho激酶变体起始反应。孵育后,通过加入EDTA终止反应并使用3000读取器(Caliper Life Sciences)分离磷酸化肽和非磷酸化肽。对照由不含有化合物的测定组成且背景由含有酶和底物但从反应开始具有EDTA以抑制激酶活性的测定组成。以剂量反应形式测试化合物并计算每一化合物浓度的激酶活性抑制。使用曲线拟合程序拟合抑制数据以测定IC50;即抑制50%的激酶活性所需的化合物浓度。
在上文所述的ROCK2测定中测试代表性实施例并发现具有ROCK2抑制活性。观察到它们的ROCK2抑制活性(IC50值)为≤2μM(2000nM)并示于下表A中。ROCK2IC50值的范围如下:ROCK2IC50:++++(<10nM),+++(10-100nM),++(100-500nM),+(500-2000nM)
表A
V.药物组合物、制剂和组合
本申请化合物可以这样的口服剂型给予,如片剂、胶囊剂(其各自包括持续释放或定时释放制剂)、丸剂、粉剂、颗粒剂、酏剂、酊剂、悬浮剂、糖浆剂和乳剂。其也可以静脉内(推注或输注)、腹膜内、皮下或肌内形式给予,所有均使用药学领域的普通技术人员所熟知的剂型。其可单独给予,但通常将与基于所选给予途径和标准药学实践选择的药物载体一起给予。
术语“药物组合物”意指包含本申请化合物与至少一种其它药用载体的组合的组合物。“药用载体”是指本领域通常接受用于将生物活性剂递送至动物(尤其哺乳动物)的介质,包括,即辅料、赋形剂或媒介物,诸如稀释剂、防腐剂、填充剂、流动调节剂、崩解剂、湿润剂、乳化剂、助悬剂、甜味剂、矫味剂、芳香剂、抗细菌剂、抗真菌剂、润滑剂和分散剂,其取决于给予模式和剂型的性质。根据本领域普通技术人员所知范围内的许多因素来配制药用载体。这些因素包括但不限于:所配制活性剂的类型和性质;含有所述药物的组合物欲给予的患者;组合物的预期给予途径;和所靶向的治疗适应症。药用载体包括水性和非水性液体介质,以及多种固体和半固体剂型。所述载体可包括除活性剂外的许多不同成份和添加剂,所述其它成份出于本领域普通技术人员所熟知的多种原因(例如,活性剂的稳定、粘合剂等)而包括在制剂中。合适的药用载体及其选择中所涉及的因素的描述见于多个容易得到的来源,例如,Remington’s Pharmaceutical Sciences,18th Edition(1990)。
当然,本申请化合物的剂量方案将根据已知因素而变化,诸如具体药物的药效学特征及其给予模式和途径;接受者的物种、年龄、性别、健康状况、医学状态和体重;症状的性质和程度;同时治疗的种类;治疗频率;给予途径;患者的肾和肝功能;和期望效应。医师或兽医可确定和开出预防、抵抗或阻止病症进展所需的药物的有效量。
根据通用指南,当用于所示效应时,各活性成分的每日口服剂量的范围将为约0.001-约1000mg/kg体重,优选约0.01-约100mg/kg体重/天,且最优选约0.1-约20mg/kg/天。在恒速输注期间,静脉内最优选剂量的范围将为约0.001-约10mg/kg/分钟。本申请化合物可以每日单次剂量给予,或每日总剂量可以每日两次、三次或四次的分开剂量给予。
本申请化合物也可通过肠胃外给予(例如,静脉内、动脉内、肌内或皮下)来给予。当静脉内或动脉内给予时,所述剂量可连续或间歇给予。此外,可开发用于肌内和皮下递送以确保逐步释放活性药物成分的制剂。
本申请化合物可经由局部使用合适的鼻内媒介物以鼻内形式给予,或使用透皮皮肤贴剂经由透皮途径给予。当以透皮递送系统的形式进行给予时,整个剂量方案中剂量给予当然将为连续的而非间歇的。
所述化合物通常以与针对预期给予形式(例如,口服片剂、胶囊剂、酏剂和糖浆剂)适当选择并与常规药物实践相符的合适的药物稀释剂、赋形剂或载体(在本文中统称为药物载体)的混合物形式进行给予。
例如,对于以片剂或胶囊剂形式的口服给予,所述活性药物组分可与口服无毒的药用惰性载体组合,所述惰性载体诸如乳糖、淀粉、蔗糖、葡萄糖、甲基纤维素、硬脂酸镁、磷酸二钙、硫酸钙、甘露醇、山梨醇等;对于以液体形式的口服给予,所述口服药物组分可与任何口服无毒的药用惰性载体组合,所述惰性载体诸如乙醇、甘油、水等。此外,当期望或必要时,也可将合适的粘合剂、润滑剂、崩解剂和着色剂掺入混合物中。合适的粘合剂包括淀粉、明胶、天然糖类(诸如葡萄糖或β-乳糖)、玉米甜味剂、天然和合成树胶(诸如阿拉伯胶、西黄蓍胶或海藻酸钠)、羧甲基纤维素、聚乙二醇、蜡等。这些剂型中所使用的润滑剂包括油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠、氯化钠等。崩解剂包括但不限于淀粉、甲基纤维素、琼脂、膨润土、黄原胶等。
本申请化合物也可以脂质体递送系统的形式给予,诸如小单层囊泡、大单层囊泡和多层囊泡。脂质体可形成自多种磷脂,诸如胆固醇、硬脂酰胺或磷脂酰胆碱。
本申请化合物也可与作为可靶向药物载体的可溶性聚合物偶联。所述聚合物可包括聚乙烯吡咯烷酮、吡喃共聚物、聚羟丙基甲基丙烯酰胺-苯酚、聚羟乙基天门冬酰胺苯酚或被棕榈酰残基取代的聚环氧乙烷-聚赖氨酸。此外,本申请化合物可与可用于实现药物受控释放的一类生物可降解聚合物偶联,所述聚合物例如聚乳酸、聚乙醇酸、聚乳酸与聚乙醇酸的共聚物、聚ε己内酯、聚羟基丁酸、聚原酸酯、聚缩醛、聚二氢吡喃、聚氰基丙烯酸酯和水凝胶的交联或两亲性嵌段共聚物。
适于给予的剂型(药物组合物)可含有约1毫克至约1000毫克活性成分/剂量单位。在这些药物组合物中,所述活性成分通常将以基于组合物总重量的约0.1-95重量%的量存在。
明胶胶囊剂可含有活性成分和粉末状载体,诸如乳糖、淀粉、纤维素衍生物、硬脂酸镁、硬脂酸等。类似的稀释剂可用于制备压制片剂。片剂和胶囊剂二者均可制成持续释放产品,以提供药物在数小时时段内的连续释放。压制片剂可以是包糖衣的或包薄膜衣的,以掩蔽任何不愉快的味道并保护片剂远离大气,或是包肠溶衣的,用于在胃肠道中选择性崩解。
用于口服给予的液体剂型可含有着色剂和矫味剂以提高患者接受度。
一般而言,水、合适的油、盐水、水性右旋糖(葡萄糖)以及相关的糖溶液和二醇类诸如丙二醇或聚乙二醇为用于肠胃外溶液剂的合适载体。用于肠胃外给予的溶液剂优选含有活性成分的水溶性盐、合适的稳定剂和缓冲物质(如有必要)。抗氧化剂诸如亚硫酸氢钠、亚硫酸钠或抗坏血酸(单独或组合)为合适的稳定剂。也使用柠檬酸及其盐和EDTA钠。此外,肠胃外溶液剂可含有防腐剂,诸如苯扎氯铵、对羟基苯甲酸甲酯或对羟基苯甲酸丙酯和氯丁醇。
本申请化合物可单独给予或与一种或多种其它治疗剂组合给予。“组合给予”或“组合疗法”意指向所治疗的哺乳动物同时给予本申请化合物和一种或多种其它治疗剂。当组合给予时,每一组分可同时给予或在不同时间点以任何顺序连续给予。因此,可单独给予每一组分但时间足够接近以提供期望的治疗效应。
本申请化合物也可用作涉及抑制ROCK的测试或测定中的标准或参考化合物,例如用作质量标准或对照。所述化合物可提供于商业试剂盒中,例如,用于涉及ROCK的药物研究中。例如,本申请化合物可用作测定中的参考以与具有未知活性的化合物比较其已知活性。这将确保实验者合理实施测定且提供比较依据,尤其在测试化合物是参考化合物的衍生物的情形下。当开发新测定或方案时,可使用本申请化合物测试其有效性。
本申请也涵盖制品。如本文所用,制品意欲包括但不限于试剂盒和包装。本申请制品包含:(a)第一容器;(b)位于第一容器内的药物组合物,其中所述组合物包含:第一治疗剂,其包含:本申请化合物或其药用盐形式;和(c)包装说明书,其说明所述药物组合物可用于治疗心血管和/或炎性病症(如前文所定义)。在另一实施方案中,所述包装说明书说明所述药物组合物可与第二治疗剂组合使用(如前文所定义)以治疗心血管和/或炎性病症。所述制品可进一步包含:(d)第二容器,其中组分(a)和(b)位于第二容器内且组分(c)位于第二容器内部或外部。位于第一和第二容器内意指各容器将物品保留在其边界内。
第一容器为用于容纳药物组合物的贮器。该容器可用于制造、储存、运送和/或个别/批量销售。第一容器意欲涵盖瓶、罐、小瓶、烧瓶、注射器、管(例如,用于乳膏制剂),或用于制造、容纳、储存或分配药物产品的任何其它容器。
第二容器为用于容纳第一容器和任选包装说明书的容器。第二容器的实例包括但不限于盒(例如,纸盒或塑料盒)、篓、纸箱、袋(例如,纸袋或塑料袋)、小袋和大袋。包装说明书可经由胶带、胶水、U形钉或另一连接方法物理连接至第一容器外部,或其可放在第二容器内部,而无需连接至第一容器的任何物理方式。可选择地,包装说明书位于第二容器外部。当位于第二容器外部时,优选的是包装说明书经由胶带、胶水、U形钉或另一连接方法物理连接。替代地,其可毗邻或接触第二容器外部而无物理连接。
包装说明书为标记、标签、标记物等,其记载与位于第一容器内的药物组合物相关的信息。所记载的信息通常将由管理销售制品的区域的管理机构(例如,美国食品与药品管理局)确定。优选地,包装说明书具体记载药物组合物获批用于的适应症。包装说明书可由任何材料制成,人们可在所述材料上读取包含于其中或其上的信息。优选地,包装说明书为可印刷材料(例如,纸、塑料、卡纸板、箔、胶粘纸或塑料等),其上已形成(例如,印刷或施加)期望的信息。
在下文描述示例性实施方案的过程中,本申请的其它特征将变得显而易见,给出所述实施方案用于说明本申请而不意欲成为其限制。以下实施例使用本文所公开的方法制备、分离和表征。
VI.包括方案的一般合成
可通过有机化学领域技术人员可使用的许多方法来合成本申请化合物(Maffrand,J.P.et al.,Heterocycles,16(1):35-37(1981))。下文描述用于制备本申请化合物的一般合成方案。这些方案是说明性的且并非意欲限制本领域技术人员可用于制备本文所公开化合物的可能技术。本领域技术人员将明了制备本申请化合物的不同方法。此外,可以交替(alternate)顺序实施合成中的各个步骤以得到一种或多种期望化合物。
通过一般方案中所述的方法制备的本申请化合物的实例在下文所述的中间体和实施例部分中给出。可通过本领域技术人员已知的技术来实施制备纯手性实例。例如,可通过手性相制备型HPLC分离外消旋产物来制备纯手性化合物。可选择地,可通过已知得到富含对映异构体的产物的方法来制备实施例化合物。这些包括但不限于在外消旋中间体中掺入手性辅助官能团以用于控制转换的非对映异构选择性,从而在裂解手性辅助官能团后提供富含对映异构体的产物。
可使用下述方法以及合成有机化学领域中已知的合成方法或通过本领域技术人员所了解的其变化形式来合成本申请化合物。优选方法包括但不限于下文所述的那些。在适用于所使用试剂和材料和适用于所实现转变的溶剂或溶剂混合物中实施反应。有机合成领域的技术人员将理解,分子上存在的官能性应与所提出的转变一致。这有时需要加以判断以改变合成步骤的顺序或选择一种特定方法方案(与另一方案相比)以得到期望的本申请化合物。
还将意识到,在计划该领域中的任何合成途径时的另一主要考虑为,谨慎选择用于保护本申请所述化合物中存在的反应性官能基的保护基团。描述用于经培训从业人员的许多替代方式的权威性报告为Greene等人(Protective Groups in Organic Synthesis,4th Edition,Wiley-Interscience(2006))。
方案1
方案1显示了通用化合物1f的合成。芳基卤化物1a和内酰胺或脲或环状氨基甲酸酯1b之间的Ullmann型偶联,得到中间体1c。将中间体1c转化为硼酸或硼酸酯1d,其在碱诸如K3PO4和催化剂诸如Pd(PPh3)4存在下与1e进行Suzuki-Miyaura偶联,得到1f。
方案2
方案2中的噁唑烷酮衍生物2d自羟胺中间体2c利用CDI经由环化反应形成,其通过使苯胺衍生物2a与环氧化物2b在使用TEA、K2CO3或Cs2CO3的碱性反应条件下反应得到。
方案3
在方案3中概述了通用的碳连接的内酰胺目标化合物3f的合成。在碱(诸如KHMDS)存在下,将4-溴苯基乙酸酯3a与适当官能化的烷基溴3b进行烷基化,在酸后处理后得到中间体3c。中间体3c经受与伯胺的还原胺化,接着原位闭环,得到内酰胺3d。中间体3d转化为硼酸或硼酸盐3e,其在Suzuki-Miyaura偶联条件下在碱诸如K3PO4和催化剂诸如Pd(PPh3)4存在下与1e反应,得到3f。
方案4
方案4显示咪唑酮或三唑酮目标化合物4e的合成。4a烷基化得到4b。4b与芳基碘4c的Ullmann型反应得到硼酸酯4d,其在碱诸如K3PO4和催化剂诸如Pd(PPh3)4存在下与1e进行Suzuki-Miyaura偶联,得到目标化合物4e。
方案5
方案5显示自2a合成内酰胺目标化合物5c。苯胺2a在碱诸如K3PO4、NaOH存在下与2,4-二溴丁酰氯反应,得到溴内酰胺5b。中间体5b与胺反应,得到5c。
方案6
方案6显示自苯胺6a的目标化合物6e的合成和目标化合物5c的替代合成。在碱性条件下,6a与2,4-二溴丁酰氯反应,得到二溴化物6b。中间体6b在碱诸如K2CO3存在下与胺或醇反应,得到内酰胺衍生物6c。通过在碱诸如乙酸钾和催化剂诸如PdCl2(dppf)存在下与二(频哪醇合)二硼偶联,将芳基溴6c转化为芳基硼酸或硼酸酯6d。在碱诸如K3PO4和催化剂诸如Pd(PPh3)4存在下,6dy芳基卤1e之间的Suzuki-Miyaura偶联得到目标化合物6e。
通过正相或反相色谱实施中间体和最终产物的纯化。除非另外指出,否则使用预先填充的SiO2筒(用己烷和EtOAc或DCM和MeOH的梯度进行洗脱)实施正相色谱。使用以下实施反相制备型HPLC:用溶剂A(90%H2O,10%MeOH,0.1%TFA)和溶剂B(10%H2O,90%MeOH,0.1%TFA,UV 220nm)的梯度,或用溶剂A(90%H2O,10%ACN,0.1%TFA)和溶剂B(10%H2O,90%ACN,0.1%TFA,UV 220nm)的梯度,或用溶剂A(98%H2O,2%ACN,0.05%TFA)和溶剂B(98%ACN,2%H2O,0.05%TFA,UV 220nm)的梯度进行洗脱的C18柱;(或)Sunfire PrepC18OBD 5μ30x100mm,25min,梯度为0-100%B,A=H2O/ACN/TFA 90:10:0.1,B=ACN/H2O/TFA90:10:0.1;(或)Waters XBridge C18,19×200mm,5μm颗粒;保护柱:Waters XBridge C18,19×10mm,5μm颗粒;溶剂A:含20-mM乙酸铵的水;溶剂B:95:5含20-mM乙酸铵的乙腈:水;梯度:25-65%B历时20分钟,然后在100%B保持5分钟;流速:20mL/min。
除非另外说明,否则通过反相分析型HPLC来实施最终产物的分析。
方法A:Sunfire C18柱(3.5μm C18,3.0×150mm)。使用以下梯度洗脱(1.0mL/min):自10-100%溶剂B历时10min,然后100%溶剂B持续5min。溶剂A为(95%水,5%乙腈,0.05%TFA)且溶剂B为(5%水,95%乙腈,0.05%TFA,UV 254nm)。
方法B:XBridge Phenyl柱(3.5μm C18,3.0×150mm)。使用以下梯度洗脱(1.0mL/min):自10-100%溶剂B历时10min,然后100%溶剂B持续5min。溶剂A为(95%水,5%乙腈,0.05%TFA)且溶剂B为(5%水,95%乙腈,0.05%TFA,UV 254nm)。
方法C:Waters BEH C18,2.1×50mm,1.7μm颗粒;流动相A:5:95含0.05%TFA的乙腈:水;流动相B:95:5含0.05%TFA的乙腈:水;温度:50℃;梯度:0-100%B历时3分钟;流速:1.11mL/min。
方法D:Waters BEH C18,2.1×50mm,1.7μm颗粒;流动相A:5:95含10mM乙酸铵的乙腈:水;流动相B:95:5含10mM乙酸铵的乙腈:水;温度:50℃;梯度:0-100%B历时3分钟;流速:1.11mL/min。
中间体1:4-(4-氨基苯基)酞嗪-1(2H)-酮三氟乙酸盐
中间体1A:(4-(4-氧代-3,4-二氢酞嗪-1-基)苯基)氨基甲酸叔丁酯
向4-氯酞嗪-1(2H)-酮(118mg,0.653mmol)、(4-((叔丁氧基羰基)氨基)苯基)硼酸(170mg,0.72mmol)和K3PO4(347mg,1.63mmol)中添加二噁烷(9mL)和水(1mL)。将混合物脱气(抽真空并用氩气冲洗(5×))。添加Pd(PPh3)4(37.8mg,0.033mmol),然后将混合物脱气(2×)。将反应小瓶密封并在微波反应器中在150℃加热35分钟。浓缩反应混合物并通过快速色谱纯化,得到150mg(68%)的中间体1A。MS(ESI)m/z 338.1(M+H)+。
中间体1B:
将中间体1A(150mg,0.45mmol)与CH2Cl2(3mL)混合,添加TFA(2mL),在室温搅拌2小时。浓缩混合物并先后通过快速色谱和制备型HPLC纯化,得到62mg(59%)的中间体3。MS(ESI)m/z 238.1(M+H)+。1H NMR(500MHz,CD3OD)δ8.44(dt,J=4.7,2.3Hz,1H),7.97-7.87(m,2H),7.81-7.75(m,1H),
7.71-7.61(m,2H),7.41-7.30(m,2H)。
中间体2:3-溴-1-(4-溴苯基)吡咯烷-2-酮
在0℃向4-溴苯胺(4.85g,28.2mmol)于乙腈(30mL)中的溶液中添加K3PO4(5.98g,28.2mmol)和2,4-二溴丁酰氯(3.73mL,28.2mmol)。将反应混合物在N2下在室温搅拌1小时。然后向反应混合物中添加50%NaOH溶液(7.44mL,141mmol)且将反应混合物在室温再搅拌1小时。滤出固体并用乙腈洗涤。滤液经Na2SO4干燥,过滤并除去溶剂。通过正相色谱纯化粗产物,得到中间体2(7.66g,85%),其为白色固体。MS(ESI)m/z317.9/319.9/321.9(M+H)+。1HNMR(400MHz,CDCl3)δ7.60-7.54(m,2H),7.53-7.47(m,2H),4.59(dd,J=7.0,2.9Hz,1H),4.03(ddd,J=9.8,7.8,6.6Hz,1H),3.81(ddd,J=10.0,7.6,2.6Hz,1H),2.75(dq,J=14.6,7.5Hz,1H),2.47(ddt,J=14.4,6.7,2.9Hz,1H)。
中间体3:4-(4-(3-溴-2-氧代吡咯烷-1-基)苯基)酞嗪-1(2H)-酮
在0℃向中间体1(300mg,1.26mmol)于乙腈(10mL)中的混悬液中添加K3PO4(268mg,1.26mmol)和2,4-二溴丁酰氯(0.17mL,1.26mmol)。将反应混合物在N2下在室温搅拌1小时。然后向反应混合物中添加NaOH(50%水溶液,0.33mL,6.32mmol)且将反应混合物在室温再搅拌1小时。滤出固体并用乙腈洗涤。滤液经Na2SO4干燥,过滤并除去溶剂,得到中间体3,其为固体。MS(ESI)m/z 384.0/386.0(M+H)+。
中间体4:3-氨基-1-(4-溴苯基)吡咯烷-2-酮三氟乙酸盐
中间体4A:3-叠氮基-1-(4-溴苯基)吡咯烷-2-酮
在室温向中间体2(1.1g,3.45mmol)于DMF(10mL)中的溶液中添加NaN3(0.673g,10.4mmol)。将反应混合物在N2下在60℃搅拌16小时。反应混合物用EtOAc稀释,用H2O和盐水洗涤。有机相经Na2SO4干燥,过滤并浓缩。通过正相色谱纯化粗产物,得到中间体4A(0.92g,95%),其为白色固体。MS(ESI)m/z 281/283(M+H)+。1H NMR(400MHz,CDCl3,ppm)δ7.58-7.43(m,4H),4.31(t,J=8.4Hz,1H),3.91-3.66(m,2H),2.49(dddd,J=13.1,8.5,7.0,3.5Hz,1H),2.00(dq,J=13.0,8.4Hz,1H)。
中间体4B
在室温向中间体4A(0.92g,3.27mmol)于THF(20mL)中的溶液中添加H2O(5ml,278mmol)和Ph3P(1.29g,4.91mmol)。将反应混合物在N2下在70℃搅拌5小时,然后将其冷却至室温。反应混合物用EtOAc稀释,用H2O和盐水洗涤。有机相经Na2SO4干燥,过滤并浓缩。通过反相色谱纯化粗产物,得到中间体4(三氟乙酸盐,0.85g,71%),其为白色固体。MS(ESI)m/z 255/257(M+H)+。1H NMR(400MHz,CD3OD)δ7.73-7.62(m,2H),7.59-7.50(m,2H),4.26(dd,J=10.9,8.7Hz,1H),4.02-3.84(m,2H),2.77-2.62(m,1H),2.25-2.08(m,1H)。
实施例1:4-[4-(2-氧代-3-苯基吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
实施例1A:3-苯基吡咯烷-2-酮
4-氨基-2-苯基丁酸(250mg,1.40mmol)和TEA(0.58mL,4.18mmol)于MeOH(2mL)中的溶液用微波在140℃加热3小时。通过反相色谱纯化,得到实施例1A,其为白色固体(143mg,64%)。MS(ESI)m/z 162(M+H)+。1H NMR(500MHz,CDCl3)δ7.54(br.s.,1H),7.39-7.32(m,2H),7.30-7.24(m,3H),7.21(br.s.,1H),3.68(t,J=8.9Hz,1H),3.52-3.35(m,2H),2.59(dddd,J=13.0,9.3,7.5,3.9Hz,1H),2.35-2.14(m,1H)。
实施例1B:1-(4-溴苯基)-3-苯基吡咯烷-2-酮
1-溴-4-碘苯(235mg,0.83mmol)、实施例1A(147mg,0.91mmol)、碘化亚铜(I)(7.91mg,0.042mmol)、N1,N2-二甲基乙烷-1,2-二胺(7.32mg,0.083mmol)、氟化铯(315mg,2.08mmol)的混合物在密封管中用氩气填充,然后添加EtOAc(2mL)。将反应混合物在60℃搅拌16小时。反应混合物用EtOAc稀释并过滤。从滤液中除去溶剂。通过正相色谱纯化,得到实施例1B(180mg,69%),其为白色固体。MS(ESI)m/z 316(M+H)+。1H NMR(400MHz,CDCl3)δ7.65-7.59(m,2H),7.54-7.47(m,2H),7.43-7.36(m,2H),7.35-7.30(m,3H),4.01-3.77(m,3H),2.81-2.56(m,1H),2.41-2.17(m,1H)。
实施例1C:3-苯基-1-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯基)吡咯烷-2-酮
在密封小瓶中将实施例1B(105mg,0.33mmol)、4,4,4’,4’,5,5,5’,5’-八甲基-2,2’-联1,3,2-二氧杂硼杂环戊烷)(93mg,0.37mmol)、KOAc(98mg,1.00mmol)和PdCl2(dppf)-CH2Cl2加合物(7.29mg,9.96μmol)于二噁烷(2mL)中的混合物脱气并用氩气填充。然后将混合物在110℃加热6小时。添加H2O并用EtOAc萃取反应混合物。从有机相中除去溶剂。通过正相色谱纯化,得到实施例1C(65mg,54%),其为白色固体。MS(ESI)m/z 364(M+H)+。1H NMR(400MHz,CDCl3)δ7.88-7.82(m,2H),7.75-7.69(m,2H),7.43-7.28(m,5H),3.95(dd,J=8.4,5.5Hz,2H),3.89(t,J=9.0Hz,1H),2.72-2.59(m,1H),2.40-2.25(m,1H),1.36(s,12H)。
实施例1:4-[4-(2-氧代-3-苯基吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
在室温向含有4-氯酞嗪-1(2H)-酮(20mg,0.11mmol)、实施例1C(42mg,0.12mmol)于二噁烷(2mL)中的溶液的微波小瓶中添加K3PO4(59mg,0.28mmol)、H2O(0.2mL)和PdCl2(dppf)-CH2Cl2(9.04mg,0.011mmol)。反应混合物用N2吹扫,然后用微波在130℃加热15分钟。除去溶剂。通过反相色谱纯化,得到实施例1(8.6mg,21%)。MS(ESI)m/z 382.1(M+H)+。1HNMR(500MHz,DMSO-d6,ppm)δ8.44-8.27(m,1H),7.98-7.83(m,4H),7.72(d,J=7.1Hz,1H),7.63(d,J=8.4Hz,2H),7.43-7.22(m,5H),4.12-3.97(m,3H),2.71-2.58(m,1H),2.23(dd,J=12.5,9.4Hz,1H)。分析型HPLC:RT=1.56min(方法D)。
实施例2:4-[4-(2-氧代-3-苯基咪唑烷-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例1B中用苯基咪唑烷-2-酮代替实施例1A按照与实施例1所述类似的操作制备实施例2。MS(ESI)m/z 383.2(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.81(s,1H),8.41-8.30(m,1H),7.99-7.87(m,2H),7.83(d,J=8.8Hz,2H),7.75(d,J=7.2Hz,1H),7.67(d,J=8.0Hz,2H),7.61(d,J=8.8Hz,2H),7.39(t,J=8.0Hz,2H),7.09(t,J=7.3Hz,1H),4.11-3.97(m,4H)。分析型HPLC:RT=1.73min(方法C)。
实施例3:4-{4-[3-(2,3-二氢-1H-吲哚-1-羰基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮
实施例3A:2-氧代-1-(4-(4-氧代-3,4-二氢酞嗪-1-基)苯基)吡咯烷-3-甲酸
向2-氧代-1-(4-(4-氧代-3,4-二氢酞嗪-1-基)苯基)吡咯烷-3-甲酸乙酯(33mg,0.087mmol)(通过用2-氧代吡咯烷-3-甲酸乙酯代替实施例1A按照与实施例1所述类似的操作制备)于THF(2mL)中的溶液中添加1.0N LiOH(0.5ml,0.50mmol)。在室温搅拌2小时后,除去溶剂。通过反相色谱纯化,得到实施例3A(12mg,39%),其为白色固体。MS(ESI)m/z 350(M+H)+。1H NMR(500MHz,CD3OD,ppm)δ8.46-8.41(m,1H),7.89-7.84(m,2H),7.83-7.78(m,3H),7.67-7.59(m,2H),4.07(dq,J=8.5,4.8Hz,1H),4.02-3.92(m,1H),3.70-3.62(m,1H),2.59-2.44(m,2H)。
实施例3B:
向实施例3A(5mg,0.014mmol)、吲哚啉(3.4mg,0.029mmol)、HATU(6.5mg,0.017mmol)于DMF(1.5mL)中的溶液中添加DIEA(0.012mL,0.072mmol)。将反应混合物在室温搅拌16小时。通过反相色谱纯化,得到实施例3(4.1mg,62%)。MS(ESI)m/z 451.2(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.38-8.32(m,1H),8.11(d,J=8.1Hz,1H),7.94(s,1H),7.92-7.83(m,4H),7.71(d,J=7.1Hz,1H),7.63(d,J=8.8Hz,2H),7.28(d,J=7.1Hz,1H),7.18(t,J=7.6Hz,1H),7.09-7.00(m,1H),4.49(q,J=9.0Hz,1H),4.33-4.24(m,2H),4.09-3.94(m,2H),3.39(d,J=7.4Hz,1H),3.20(t,J=8.6Hz,2H),2.64-2.55(m,1H),2.42-2.32(m,1H)。分析型HPLC:RT=1.5min(方法D)。
实施例4:4-[4-(2-氧代-4-苯基吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过用4-苯基吡咯烷-2-酮代替实施例1A按照与实施例1所述类似的操作制备实施例4。MS(ESI)m/z 382.1(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.39-8.31(m,1H),7.94-7.86(m,4H),7.75-7.69(m,1H),7.61(d,J=8.4Hz,2H),7.47-7.41(m,2H),7.38(t,J=7.6Hz,2H),7.31-7.24(m,1H),4.30(t,J=8.8Hz,1H),3.94(t,J=8.8Hz,1H),3.77(t,J=8.6Hz,1H),2.96(dd,J=16.5,8.4Hz,1H),2.84-2.76(m,1H)。分析型HPLC:RT=1.52min(方法D)
实施例5:4-{4-[3-(2,3-二氢-1H-异吲哚-2-羰基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐
按照与实施例3所述类似的操作制备实施例5。MS(ESI)m/z 451.2(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.39-8.24(m,1H),7.97-7.82(m,4H),7.71(d,J=8.4Hz,1H),7.62(d,J=8.8Hz,2H),7.42-7.35(m,2H),7.35-7.29(m,2H),5.22(d,J=14.1Hz,1H),5.04(d,J=14.5Hz,1H),4.79-4.65(m,2H),4.20(t,J=8.2Hz,1H),4.10-3.93(m,2H),3.47-3.33(m,1H),2.60-2.52(m,1H),2.36(dd,J=8.8,4.4Hz,1H)。分析型HPLC:RT=1.44min(方法C)。
实施例6:2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]-N-苯基吡咯烷-3-甲酰胺
按照与实施例3所述类似的操作制备实施例6。MS(ESI)m/z 425.1(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ10.34(s,1H),8.42-8.23(m,1H),7.93-7.85(m,2H),7.82(d,J=8.8Hz,2H),7.70(d,J=8.4Hz,1H),7.59(t,J=7.6Hz,4H),7.32(t,J=7.7Hz,2H),7.09(t,J=7.2Hz,1H),3.79(t,J=8.6Hz,1H),2.42(d,J=7.7Hz,2H)。分析型HPLC:RT=1.39min(方法D)。
实施例7:N-苄基-2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-甲酰胺
按照与实施例3所述类似的操作制备实施例7。MS(ESI)m/z 439.2(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.79-8.72(m,1H),8.33(d,J=6.7Hz,1H),7.90(br.s.,2H),7.83(d,J=8.8Hz,2H),7.70(d,J=6.7Hz,1H),7.60(d,J=8.8Hz,2H),7.35-7.27(m,5H),7.23(br.s.,2H),4.40(dd,J=15.3,6.2Hz,1H),4.28(dd,J=15.3,5.2Hz,1H),4.20(d,J=6.1Hz,1H),4.11(br.s.,1H),3.97(br.s.,1H),3.91(d,J=8.4Hz,1H),2.35(d,J=7.7Hz,2H)。分析型HPLC:RT=1.33min(方法D)。
实施例8:4-[4-(1-苄基-2-氧代吡咯烷-3-基)苯基]-1,2-二氢酞嗪-1-酮
实施例8A:2-(4-溴苯基)-4-氧代丁酸乙酯
将2-(4-溴苯基)乙酸乙酯(0.50g,2.1mmol)于DMF(2mL)中的溶液添加至KHMDS的溶液(2.3mL,2.3mmol)中。将反应混合物在室温搅拌10分钟,然后滴加2-溴-1,1-二乙氧基乙烷(0.35mL,2.3mmol)。然后将反应混合物在45℃加热2小时。将反应混合物冷却至0℃并添加饱和NH4Cl(5mL)。用己烷萃取混合物。用H2O洗涤有机相且除去溶剂。将所得油状物混悬于H2O(7mL)中,冷却至0℃并用CHCl3:TFA(1:1.5mL)处理2小时。将反应混合物倒入1MK2CO3水溶液(5mL)和CH2Cl2(50mL)的混悬液中。添加固体K2CO3至pH约7.5。分离有机相且水层进一步用CH2Cl2(120mL)萃取。合并的有机相用H2O和盐水洗涤,然后经Na2SO4干燥,过滤并蒸发,得到油状物。进行正相色谱,得到实施例8A(220mg,38%),其为无色油状物。MS(ESI)m/z285/287(M+H)+。1H NMR(400MHz,CDCl3)δ9.74(s,1H),7.50-7.38(m,2H),7.21-7.05(m,2H),4.26-4.01(m,3H),3.40-3.26(m,1H),2.90-2.67(m,1H),1.18(t,J=7.2Hz,3H)。
实施例8B:1-苄基-3-(4-溴苯基)吡咯烷-2-酮
向实施例8A(115mg,0.40mmol)于DCE中的溶液中添加苄胺(0.053mL,0.48mmol)、NaBH(OAc)3(128mg,0.61mmol)和5滴AcOH。将反应混合物在室温搅拌16小时。向反应混合物中添加H2O,用EtOAc萃取并除去溶剂。进行正相色谱,得到实施例8B(46mg,35%)。MS(ESI)m/z 330/332(M+H)+。1H NMR(500MHz,CDCl3)δ7.50-7.43(m,2H),7.39-7.23(m,5H),7.19-7.11(m,2H),4.58(d,J=14.6Hz,1H),4.46(d,J=14.6Hz,1H),3.68(t,J=8.8Hz,1H),3.36-3.22(m,2H),2.56-2.40(m,1H),2.09-2.00(m,1H)。
实施例8C:通过用实施例8B代替实施例1B按照与实施例1所述类似的操作制备实施例8。MS(ESI)m/z 396.3(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.86(s,1H),8.40-8.26(m,1H),7.96-7.86(m,2H),7.78-7.67(m,1H),7.61-7.51(m,J=8.1Hz,2H),7.49-7.41(m,J=8.1Hz,2H),7.41-7.35(m,2H),7.33-7.23(m,3H),4.55-4.41(m,2H),3.87(t,J=9.1Hz,1H),3.41-3.29(m,2H),2.56-2.52(m,1H),2.10(dq,J=12.6,8.6Hz,1H)。分析型HPLC:RT=1.58min(方法D)。
实施例9:4-[4-(2-氧代-1-苯基吡咯烷-3-基)苯基]-1,2-二氢酞嗪-1-酮
通过在步骤8B中用苯胺代替苄胺按照与实施例8所述类似的操作制备实施例9。MS(ESI)m/z 382.3(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.87(s,1H),8.39-8.31(m,1H),7.97-7.87(m,2H),7.71(d,J=8.1Hz,3H),7.64-7.55(m,J=8.1Hz,2H),7.54-7.47(m,J=8.1Hz,2H),7.40(t,J=7.9Hz,2H),7.17(t,J=7.4Hz,1H),4.06(t,J=9.3Hz,1H),3.96(dd,J=8.4,5.4Hz,2H),2.68-2.58(m,1H),2.36-2.17(m,1H)。分析型HPLC:RT=1.61min(方法D)。
实施例10:4-[4-(3-苄基-2-氧代咪唑烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在步骤1B中用1-苄基咪唑烷-2-酮代替1A按照与实施例1所述类似的操作制备实施例10。MS(ESI)m/z 397(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.81(s,1H),8.34(d,J=7.1Hz,1H),7.97-7.87(m,2H),7.82-7.70(m,3H),7.56(d,J=8.8Hz,2H),7.43-7.36(m,2H),7.35-7.27(m,3H),4.43(s,2H),3.90(t,J=8.1Hz,2H),3.40(d,J=9.8Hz,2H)。分析型HPLC:RT=1.66min(方法C)。
实施例11:4-{4-[2-氧代-3-(吡啶-3-基)咪唑烷-1-基]苯基}-1,2-二氢酞嗪-1-酮
通过在步骤1B中用1-(吡啶-3-基)咪唑烷-2-酮代替1A按照与实施例1所述类似的操作制备实施例11。MS(ESI)m/z 384(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.88(d,J=2.0Hz,1H),8.35(d,J=7.4Hz,1H),8.30(d,J=3.7Hz,1H),8.09(d,J=8.4Hz,1H),7.97-7.87(m,2H),7.87-7.79(m,J=8.8Hz,2H),7.75(d,J=7.4Hz,1H),7.66-7.58(m,J=8.4Hz,2H),7.43(dd,J=8.2,4.5Hz,1H),4.19-4.02(m,4H)。分析型HPLC:RT=1.16min(方法D)。
实施例12:4-{4-[2-氧代-3-(吡啶-2-基)咪唑烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在步骤1B中用1-(吡啶-2-基)咪唑烷-2-酮代替1A按照与实施例1所述类似的操作制备实施例12。MS(ESI)m/z 384(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.34(s,1H),8.37(s,1H),8.26(d,J=8.8Hz,1H),7.95-7.88(m,2H),7.84(d,J=8.8Hz,2H),7.75(d,J=8.1Hz,1H),7.63(d,J=8.4Hz,2H),7.09(s,2H),4.14(d,J=8.4Hz,2H),4.07(d,J=8.8Hz,2H)。分析型HPLC:RT=1.43min(方法D)。
实施例13:4-[4-(5-苄基-2-氧代-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐
实施例13A:4-(4-((2-羟基-3-苯基丙基)氨基)苯基)酞嗪-1(2H)-酮
将中间体1(200mg,0.84mmol)、2-苄基环氧乙烷(136mg,1.01mmol)、DIEA(0.29mL,1.69mmol)于EtOH(3.5mL)和H2O(3.5mL)中的混合物在氩气下回流16小时。在反应过程中再添加另外两份2-苄基环氧乙烷(136mg,1.01mmol)。冷却至室温后,反应混合物用EtOAc和H2O稀释。分离有机相且用H2O和盐水洗涤,经Na2SO4干燥,过滤并浓缩。进行正相色谱,得到实施例13A(190mg,43%)。MS(ESI)m/z 372(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.65(s,1H),8.40-8.28(m,1H),7.87(quin,J=7.5,1.5Hz,2H),7.80-7.71(m,1H),7.38-7.23(m,6H),7.22-7.11(m,1H),6.73(d,J=8.6Hz,2H),4.01-3.84(m,1H),3.22-3.09(m,1H),3.07-2.97(m,1H),2.90-2.80(m,1H),2.77-2.65(m,1H)。
实施例13B:5-苄基-3-(4-(4-氧代-3,4-二氢酞嗪-1-基)苯基)噁唑烷-2-酮
在室温向实施例13A(140mg,0.26mmol)于THF(4mL)中的溶液中添加CDI(64mg,0.40mmol)。将混合物在室温搅拌3.5小时。然后除去溶剂。通过反相色谱纯化,得到实施例13(38mg,25%)。MS(ESI)m/z 398(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.82(s,1H),8.47-8.22(m,1H),7.99-7.81(m,2H),7.69(d,J=8.5Hz,3H),7.59(d,J=8.5Hz,2H),7.42-7.30(m,4H),7.26(dt,J=5.6,2.9Hz,1H),5.13-4.89(m,1H),4.21(t,J=8.9Hz,1H),3.87(dd,J=8.9,6.7Hz,1H),3.11(d,J=6.1Hz,2H)。分析型HPLC:RT=1.68min(方法C)。
实施例14:4-[4-(2-氧代-4-苯基-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮;和
实施例15:4-[4-(2-氧代-5-苯基-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮
实施例14A:4-(4-((2-羟基-2-苯基乙基)氨基)苯基)酞嗪-1(2H)-酮;和
实施例15A:4-(4-((2-羟基-2-苯基乙基)氨基)苯基)酞嗪-1(2H)-酮
将中间体1(200mg,0.84mmol)、2-苯基环氧乙烷(0.12mL,1.01mmol)、DIEA(0.29mL,1.69mmol)于EtOH(7mL)和H2O(1mL)中的混合物在氩气下回流2小时。冷却至室温后,反应混合物用EtOAc和H2O稀释。分离有机相且用H2O和盐水洗涤,经Na2SO4干燥,过滤并浓缩。进行正相色谱,得到实施例14A和15A的混合物(210mg,49%)。MS(ESI)m/z 358(M+H)+。
实施例14B和15B:
在室温向实施例14A和15A的混合物(180mg,0.35mmol)于THF(4mL)中的溶液中添加CDI(131mg,0.81mmol)和DMAP(8.6mg,0.071mmol)。将反应混合物在室温搅拌2小时,然后在50℃在氩气下加热1小时。除去溶剂。通过反相色谱纯化,得到实施例14(15.5mg,11%)和实施例15(8.5mg,6%)。
实施例14:MS(ESI)m/z 384(M+H)+。1H NMR(500MHz,DMSO-d6)δ12.80(s,1H),8.37-8.28(m,1H),7.91-7.83(m,2H),7.62(d,J=8.2Hz,3H),7.52(d,J=8.5Hz,2H),7.45-7.35(m,4H),7.34-7.27(m,1H),5.79(dd,J=8.5,5.5Hz,1H),4.88(t,J=8.5Hz,1H),4.18(dd,J=8.5,5.5Hz,1H)。分析型HPLC:RT=1.52min(方法D)。
实施例15:MS(ESI)m/z 384(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.40-8.29(m,1H),7.97-7.86(m,2H),7.78(d,J=8.5Hz,2H),7.71(d,J=7.0Hz,1H),7.63(d,J=8.5Hz,2H),7.57-7.52(m,2H),7.50-7.38(m,3H),5.81(t,J=8.1Hz,1H),4.57(t,J=9.0Hz,1H),4.09(t,J=8.4Hz,1H)。分析型HPLC:RT=1.63min(方法D)。
实施例16:N-({2-氧代-3-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]-1,3-噁唑烷-5-基}甲基)氨基甲酸叔丁酯
通过在13A中用(环氧乙烷-2-基甲基)氨基甲酸叔丁酯代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例16。MS(ESI)m/z 437(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.82(s,1H),8.42-8.28(m,1H),7.98-7.86(m,2H),7.77-7.68(m,3H),7.66-7.58(m,2H),7.33-7.17(m,1H),4.82-4.68(m,1H),4.21(t,J=8.9Hz,1H),3.90(dd,J=9.0,5.9Hz,1H),3.33(t,J=5.2Hz,2H),1.37(s,9H)。分析型HPLC:RT=6.94min(方法B)
实施例17:4-[4-(2-氧代-5-丙基-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮
通过在13A中用2-丙基环氧乙烷代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例17。MS(ESI)m/z 350(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.43-8.25(m,1H),7.95-7.81(m,2H),7.76-7.67(m,3H),7.60(d,J=8.5Hz,2H),4.73(quin,J=6.9Hz,1H),4.21(t,J=8.7Hz,1H),3.77(t,J=8.1Hz,1H),1.83-1.61(m,2H),1.43(td,J=14.6,7.3Hz,2H),0.94(t,J=7.3Hz,3H)。分析型HPLC:RT=1.59min(方法C)。
实施例18:N-({2-氧代-3-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]-1,3-噁唑烷-5-基}甲基)苯甲酰胺
实施例18A:5-(氨基甲基)-3-(4-(4-氧代-3,4-二氢酞嗪-1-基)苯基)噁唑烷-2-酮三氟乙酸盐
向实施例16(10mg,0.023mmol)于DCM(1.6mL)中的溶液中添加TFA(0.40mL)。将反应混合物在室温在氩气下搅拌25分钟并除去溶剂,得到实施例18A(7.0mg,68%产率),其为灰白色固体。MS(ESI)m/z 337(M+H)+。
实施例18B:
向实施例18A(7.0mg,0.016mmol)于DMF(1mL)中的溶液中添加苯甲酸(3.80mg,0.031mmol)、HATU(8.86mg,0.023mmol)和DIPEA(0.014mL,0.078mmol)。将反应混合物在氩气下在室温搅拌70分钟。通过反相色谱纯化,得到实施例18(4.4mg,64%)。MS(ESI)m/z 441(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.86(t,J=5.6Hz,1H),8.51-8.25(m,1H),7.96-7.86(m,2H),7.83(d,J=7.3Hz,2H),7.72(d,J=8.5Hz,2H),7.68(d,J=7.0Hz,1H),7.61(d,J=8.5Hz,2H),7.56-7.50(m,1H),7.49-7.41(m,2H),4.92(dd,J=8.5,5.2Hz,1H),4.26(t,J=8.9Hz,1H),3.97(dd,J=9.0,6.0Hz,1H),3.76-3.61(m,2H)。分析型HPLC:RT=1.32min(方法D)。
实施例19:4-{4-[5-(4-氟苯基)-2-氧代-1,3-噁唑烷-3-基]苯基}-1,2-二氢酞嗪-1-酮
通过在13A中用2-(4-氟苯基)环氧乙烷代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例19。MS(ESI)m/z 402.1(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.40-8.30(m,1H),7.97-7.85(m,2H),7.75(d,J=8.5Hz,2H),7.69(d,J=7.0Hz,1H),7.64-7.52(m,4H),7.28(t,J=8.7Hz,2H),5.80(t,J=8.1Hz,1H),4.53(t,J=9.0Hz,1H),4.06(t,J=8.4Hz,1H)。分析型HPLC:RT=1.51min(方法D)。
实施例20:4-(4-{5-[(4-甲烷磺酰基苯基)甲基]-2-氧代-1,3-噁唑烷-3-基}苯基)-1,2-二氢酞嗪-1-酮
通过在13A中用2-(4-(甲基磺酰基)苄基)环氧乙烷代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例20。MS(ESI)m/z 476(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.40-8.28(m,1H),7.98-7.79(m,4H),7.73-7.53(m,7H),5.11-4.99(m,1H),4.26(t,J=8.7Hz,1H),3.94-3.86(m,1H),3.29-3.18(m,2H),3.17(s,3H)。分析型HPLC:RT=1.32min(方法C)。
实施例21:4-[4-(2-氧代-八氢-1,3-苯并噁唑-3-基)苯基]-1,2-二氢酞嗪-1-酮
通过在13A中用7-氧杂二环[4.1.0]庚烷代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例21。MS(ESI)m/z 362(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.87(s,1H),8.46-8.29(m,1H),7.99-7.85(m,2H),7.80-7.70(m,1H),7.64(d,J=8.6Hz,2H),7.47(d,J=8.6Hz,2H),4.13(td,J=11.3,3.5Hz,1H),3.95(td,J=10.9,3.0Hz,1H),2.19(t,J=12.2Hz,2H),1.89(d,J=7.3Hz,1H),1.83-1.64(m,2H),1.57-1.32(m,3H)。分析型HPLC:RT=10.5min(方法A)。
实施例22:4-{4-[2-氧代-5-(2,2,2-三氟-1-羟基-1-苯基乙基)-1,3-噁唑烷-3-基]苯基}-1,2-二氢酞嗪-1-酮
通过在13A中用2,2,2-三氟-1-(环氧乙烷-2-基)-1-苯基乙醇代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例20。MS(ESI)m/z 482(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.80(s,1H),8.34-8.24(m,1H),7.89-7.79(m,2H),7.63(d,J=8.4Hz,5H),7.57-7.38(m,6H),5.69(dd,J=8.9,7.4Hz,1H),3.85(t,J=9.1Hz,1H),3.51(t,J=8.0Hz,1H)。分析型HPLC:RT=1.74min(方法C)。
实施例23:4-{4-[(4R,5S)-5-甲基-2-氧代-4-苯基-1,3-噁唑烷-3-基]苯基}-1,2-二氢酞嗪-1-酮
通过在13A中用(2S,3S)-2-甲基-3-苯基环氧乙烷代替2-苄基环氧乙烷按照与实施例13所述类似的操作制备实施例20。MS(ESI)m/z 398(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.79(s,1H),8.34-8.16(m,1H),7.91-7.73(m,2H),7.63(d,J=8.5Hz,2H),7.60-7.54(m,1H),7.47(d,J=8.5Hz,2H),7.41-7.34(m,2H),7.33-7.27(m,1H),7.23(d,J=7.0Hz,2H),5.71(d,J=7.6Hz,1H),5.16-5.06(m,1H),0.85(d,J=6.4Hz,3H)。分析型HPLC:RT=1.63min(方法C)。
实施例24:4-{4-[3-(吗啉-4-基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮
在室温向中间体3(20mg,0.052mmol)于DMF(1mL)中的溶液中添加K2CO3(36mg,0.26mmol)和吗啉(4.5mg,0.052mmol)。将反应混合物在N2下在95℃搅拌1小时。冷却至室温后,将反应混合物过滤。通过反相色谱纯化,得到实施例24(2.9mg,13%)。MS(ESI)m/z 391(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.42-8.24(m,1H),7.95-7.81(m,4H),7.70(d,J=8.5Hz,1H),7.61(d,J=8.5Hz,2H),3.88-3.75(m,2H),3.65-3.54(m,4H),3.47(br.s.,1H),2.94-2.80(m,2H),2.57-2.51(m,2H),2.31-2.18(m,1H),2.14-2.00(m,1H)。分析型HPLC:RT=1.15min(方法D)。
实施例25:4-{4-[3-(苄基氨基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过用苄胺代替吗啉按照与实施例24所述类似的操作制备实施例25。MS(ESI)m/z411(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.86(s,1H),8.37-8.26(m,1H),7.93-7.86(m,2H),7.80(d,J=8.5Hz,2H),7.69(d,J=9.2Hz,1H),7.62(d,J=8.5Hz,2H),7.47(br.s.,2H),7.43(d,J=5.2Hz,3H),4.58-3.76(m,5H),2.60(br.s.,1H),2.25-2.09(m,1H)。分析型HPLC:RT=1.53min(方法D)。
实施例26:4-(4-{3-[(3-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过用3-甲氧基苯胺代替吗啉按照与实施例24所述类似的操作制备实施例26。MS(ESI)m/z 427(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.86(s,1H),8.32(d,J=6.7Hz,1H),7.95-7.85(m,2H),7.82(d,J=8.9Hz,2H),7.71(d,J=8.8Hz,1H),7.59(d,J=8.5Hz,2H),6.99(t,J=7.9Hz,1H),6.29(d,J=7.6Hz,1H),6.24(s,1H),6.18(d,J=8.2Hz,1H),5.75(d,J=6.4Hz,1H),4.50-3.82(m,2H),3.64(s,3H),2.59(br.s.,1H),1.99-1.84(m,1H)。分析型HPLC:RT=1.61min(方法D)。
实施例27:4-{4-[2-氧代-3-(苯基氨基)吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过用苯胺代替吗啉按照与实施例24所述类似的操作制备实施例27。MS(ESI)m/z397(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.32(d,J=7.1Hz,1H),7.95-7.86(m,2H),7.84(d,J=8.4Hz,2H),7.71(d,J=8.1Hz,1H),7.59(d,J=8.4Hz,2H),7.09(t,J=7.7Hz,2H),6.69(d,J=7.7Hz,2H),6.59(t,J=7.2Hz,1H),4.44-4.33(m,1H),4.13-4.08(m,1H),3.87(d,J=8.4Hz,1H),2.61(br.s.,1H),2.02-1.83(m,1H)。分析型HPLC:RT=1.60min(方法C)。
实施例28:4-{4-[3-(环戊基氨基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过用环戊基胺代替吗啉按照与实施例24所述类似的操作制备实施例28。MS(ESI)m/z 389(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.89(s,1H),8.40-8.28(m,1H),7.99-7.82(m,4H),7.75-7.59(m,3H),4.38(t,J=9.6Hz,1H),4.08-3.89(m,2H),2.65(d,J=7.4Hz,1H),2.15(t,J=10.4Hz,1H),2.04(br.s.,2H),1.84-1.35(m,7H)。分析型HPLC:RT=1.06min(方法C)。
实施例29:4-(4-{3-[(2,3-二氢-1H-茚-2-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过用2-氨基茚满代替吗啉按照与实施例24所述类似的操作制备实施例29。MS(ESI)m/z 437(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.88(s,1H),8.34(dd,J=6.4,2.7Hz,1H),7.90(t,J=2.9Hz,2H),7.87(d,J=8.9Hz,2H),7.72-7.68(m,1H),7.64(d,J=8.5Hz,2H),7.27-7.21(m,2H),7.19-7.14(m,2H),3.91(br.s.,4H),3.31-3.21(m,2H),3.03-2.88(m,2H),2.63(br.s.,1H),2.13-1.98(m,1H)。分析型HPLC:RT=1.29min(方法C)。
实施例30:4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
实施例30A:1-(4-溴苯基)-3-((3-(二氟甲氧基)苯基)氨基)吡咯烷-2-酮
在室温向中间体2(100mg,0.31mmol)于THF(2mL)和H2O(0.3mL)中的溶液中添加3-(二氟甲氧基)苯胺(50mg,0.31mmol)和Cs2CO3(102mg,0.31mmol)。将反应混合物在密封管中在N2下在100℃搅拌24小时。除去溶剂。通过正相色谱纯化,得到实施例30A(65mg,52%),其为白色固体。MS(ESI)m/z 397/399(M+H)+。1H NMR(400MHz,CDCl3)δ7.60-7.46(m,4H),7.18(t,J=8.1Hz,1H),6.55(ddd,J=10.3,8.3,1.9Hz,2H),6.45(t,J=2.1Hz,1H),6.50(t,J=73.9Hz,1H),4.20(dd,J=10.6,7.9Hz,1H),3.96-3.78(m,2H),2.86(dddd,J=12.5,7.9,6.2,1.5Hz,1H),2.12-2.00(m,1H)。
实施例30B:3-((3-(二氟甲氧基)苯基)氨基)-1-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯基)吡咯烷-2-酮
在室温向实施例30A(65mg,0.16mmol)于乙腈(4mL)中的溶液中添加4,4,4’,4’,5,5,5’,5’-八甲基-2,2’-联1,3,2-二氧杂硼杂环戊烷)(46mg,0.18mmol)、KOAc(32mg,0.33mmol)和PdCl2(dppf)(12mg,0.016mmol)。将反应混合物在N2下在90℃搅拌1小时。将反应混合物冷却至室温并除去溶剂,得到实施例30B的粗产物。MS(ESI)m/z 445(M+H)+。
实施例30C:
在室温向实施例30B(44mg,0.10mmol)于二噁烷(2mL)和H2O(0.5mL)中的溶液中添加4-氯酞嗪-1(2H)-酮(18mg,0.10mmol)、K3PO4(43mg,0.20mmol)和第2代Xphos预催化剂(8mg,0.01mmol)。反应混合物用油浴在90℃加热1小时。除去溶剂。通过反相色谱纯化,得到实施例30(38mg,82%)。MS(ESI)m/z 463(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.42-8.27(m,1H),7.98-7.85(m,4H),7.77-7.68(m,1H),7.64(d,J=8.5Hz,2H),7.12(d,J=7.9Hz,1H),7.12(t,J=74.2Hz,1H),6.60(d,J=7.9Hz,1H),6.52(s,1H),6.36(d,J=7.9Hz,1H),6.31(d,J=7.3Hz,1H),4.56-4.42(m,1H),4.00-3.82(m,2H),2.70-2.59(m,1H),2.01-1.89(m,1H)。分析型HPLC:RT=1.76min(方法D)。
实施例31:4-(4-{3-[(2-乙基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用2-乙基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例31。MS(ESI)m/z 425(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.42-8.28(m,1H),8.01-7.86(m,4H),7.73(d,J=7.6Hz,1H),7.65(d,J=8.5Hz,2H),7.09-6.98(m,2H),6.75(d,J=7.9Hz,1H),6.63(t,J=7.3Hz,1H),5.07(d,J=6.4Hz,1H),4.54-4.36(m,1H),4.04-3.85(m,2H),3.47-3.28(m,2H),2.70(dt,J=11.7,6.0Hz,1H),2.11-1.97(m,1H),1.19(t,J=7.5Hz,3H)。分析型HPLC:RT=1.94min(方法C)。
实施例32:4-(4-{3-[(3-氟-5-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-氟-5-甲氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例32。MS(ESI)m/z 445(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.35(d,J=7.0Hz,1H),7.90(d,J=8.2Hz,4H),7.72(d,J=7.3Hz,1H),7.64(d,J=8.5Hz,2H),6.33(d,J=7.3Hz,1H),6.20-6.09(m,2H),6.00(d,J=11.0Hz,1H),4.46(q,J=8.3Hz,1H),3.90(dd,J=17.5,8.1Hz,2H),3.69(s,3H),2.64(br.s.,1H),1.99-1.84(m,1H)。分析型HPLC:RT=1.73min(方法C)。
实施例33:4-(4-{3-[(2H-1,3-苯并二氧杂环戊烯-5-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用苯并[d][1,3]二氧杂环戊烯-5-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例33。MS(ESI)m/z441(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.34(d,J=6.7Hz,1H),7.98-7.84(m,4H),7.71(d,J=7.3Hz,1H),7.63(d,J=8.2Hz,2H),6.68(d,J=8.2Hz,1H),6.46(s,1H),6.17(d,J=7.0Hz,1H),5.85(s,2H),5.67(d,J=6.4Hz,1H),4.32(q,J=8.0Hz,1H),3.99-3.76(m,2H),2.70-2.59(m,1H),1.98-1.84(m,1H)。分析型HPLC:RT=1.40min(方法C)。
通过在实施例30A中用3,4-二氢-2H-苯并[b][1,4]二氧杂-7-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例34。MS(ESI)m/z 469(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.41-8.27(m,1H),7.98-7.83(m,4H),7.76-7.68(m,1H),7.63(d,J=8.5Hz,2H),6.74(d,J=8.5Hz,1H),6.38(d,J=2.7Hz,1H),6.32(dd,J=8.5,2.7Hz,1H),5.72(d,J=7.0Hz,1H),4.38-4.27(m,1H),4.03(d,J=3.7Hz,2H),3.95(t,J=5.2Hz,2H),3.92-3.82(m,2H),2.67-2.56(m,1H),2.07-1.97(m,2H),1.95-1.83(m,1H)。分析型HPLC:RT=1.49min(方法C)。
实施例35:4-(4-{3-[(3-环丙基-1-甲基-1H-吡唑-5-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-环丙基-1-甲基-1H-吡唑-5-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例35。MS(ESI)m/z 441.2(M+H)+。1H NMR(500MHz,DMSO-d6)δ12.84(s,1H),8.41-8.27(m,1H),7.96-7.87(m,4H),7.76-7.69(m,1H),7.65(d,J=8.5Hz,2H),5.22(s,1H),4.29-4.13(m,1H),3.98-3.79(m,2H),3.48(s,3H),2.63-2.53(m,1H),2.07-1.94(m,1H),1.76-1.62(m,1H),0.84-0.69(m,2H),0.63-0.46(m,2H)。分析型HPLC:RT=1.18min(方法C)。
实施例36:4-(4-{3-[(3-环丙基-5-甲基-1H-吡唑-4-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-环丙基-5-甲基-1H-吡唑-4-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例36。MS(ESI)m/z 441(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ1H NMR(500MHz,DMSO-d6)δ12.84(s,1H),8.42-8.30(m,1H),7.98-7.84(m,4H),7.78-7.69(m,1H),7.64(d,J=8.5Hz,2H),4.05-3.88(m,3H),3.51(s,3H),2.45(dt,J=8.5,4.2Hz,1H),2.27-2.14(m,1H),1.71-1.55(m,1H),0.87-0.70(m,3H),0.70-0.56(m,1H)。分析型HPLC:RT=1.13min(方法C)。
实施例37:4-(4-{3-[(2-氟-5-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用2-氟-5-甲氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例37。MS(ESI)m/z 445(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.41-8.27(m,1H),7.99-7.86(m,4H),7.73(d,J=7.3Hz,1H),7.65(d,J=8.5Hz,2H),6.97(dd,J=11.4,9.0Hz,1H),6.48(dd,J=7.3,2.7Hz,1H),6.20-6.09(m,1H),5.73(d,J=7.9Hz,1H),4.67-4.48(m,1H),4.04-3.84(m,2H),3.70(s,3H),2.67-2.57(m,1H),2.16-2.05(m,1H)。分析型HPLC:RT=1.73min(方法C)。
实施例38:4-(4-{3-[(3-甲氧基-5-甲基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例30A中用3-甲氧基-5-甲基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例38。MS(ESI)m/z 441(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.35(d,J=7.3Hz,1H),7.98-7.83(m,4H),7.72(d,J=7.3Hz,1H),7.64(d,J=8.2Hz,2H),6.15(s,1H),6.12(s,1H),6.02(s,1H),5.85(d,J=7.3Hz,1H),4.47-4.34(m,1H),3.97-3.83(m,2H),3.67(s,3H),2.69-2.59(m,1H),2.17(s,3H),1.99-1.86(m,1H)。分析型HPLC:RT=1.69min(方法C)。
实施例39:4-(4-{2-氧代-3-[(1-苯基-1H-吡唑-4-基)氨基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用1-苯基-1H-吡唑-4-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例39。MS(ESI)m/z 463(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.35(d,J=7.3Hz,1H),7.98-7.85(m,5H),7.77-7.68(m,3H),7.64(d,J=8.5Hz,2H),7.49-7.40(m,3H),7.21(t,J=7.3Hz,1H),5.23(d,J=5.8Hz,1H),4.19-4.08(m,1H),3.99-3.92(m,1H),3.91-3.83(m,1H),2.80-2.67(m,1H),2.03-1.88(m,1H)。分析型HPLC:RT=1.51min(方法C)。
实施例40:4-(4-{3-[(2,4-二氟-3-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用2,4-二氟-3-甲氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例40。MS(ESI)m/z 463(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.34(d,J=7.0Hz,1H),7.90(d,J=7.3Hz,4H),7.71(d,J=7.0Hz,1H),7.64(d,J=7.9Hz,2H),6.46(d,J=10.7Hz,2H),6.37(d,J=6.7Hz,1H),4.43(d,J=8.5Hz,1H),3.99-3.82(m,2H),3.75(s,3H),2.64(br.s.,1H),1.91(quin,J=9.9Hz,1H)。分析型HPLC:RT=1.71min(方法D)。
实施例41:4-[4-(4-苄基-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐
实施例41A:4-苄基-1H-1,2,4-三唑-5(4H)-酮
向1H-1,2,4-三唑-5(4H)-酮(70mg,0.82mmol)于DMF(7mL)中的溶液中添加K2CO3(227mg,1.65mmol),然后在室温历时10分钟滴加苄基溴(0.10mL,0.82mmol)。将反应混合物在室温搅拌24小时。反应混合物用MeOH稀释并过滤。从滤液中除去溶剂。通过反相色谱纯化,得到实施例41A(130mg,90%)。MS(ESI)m/z 176(M+H)+。1H NMR(400MHz,DMSO-d6)δ11.72(br.s.,1H),7.96(d,J=1.3Hz,1H),7.40-7.33(m,2H),7.33-7.23(m,3H),4.75(s,2H)。
实施例41B:4-苄基-1-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯基)-1H-1,2,4-三唑-5(4H)-酮
向小瓶中装入二噁烷(2mL)、CuI(5.4mg,0.029mmol)、(1R,2R)-N1,N2-二甲基环己烷-1,2-二胺(16mg,0.11mmol)、K3PO4(133mg,0.63mmol)、2-(4-碘苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(141mg,0.43mmol)和实施例41A(50mg,0.29mmol)。反应混合物用微波在150℃加热70分钟。反应混合物通过硅藻土垫过滤,所述硅藻土垫进一步用MeOH淋洗。将合并的溶液浓缩并通过正相色谱纯化,得到实施例41B(81mg,73%),其为白色固体。MS(ESI)m/z 378(M+H)+。
实施例41C:
通过用实施例41B代替实施例30C按照与实施例30所述类似的操作制备实施例41。MS(ESI)m/z 396(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.86(s,1H),8.39(s,1H),8.34(d,J=7.3Hz,1H),8.08(d,J=8.2Hz,2H),7.96-7.83(m,2H),7.78-7.62(m,3H),7.46-7.26(m,5H),4.91(s,2H)。分析型HPLC:RT=1.59min(方法D)。
实施例42:4-(4-{3-[(4-氟-3-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用4-氟-3-甲氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例42。MS(ESI)m/z 445(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.35(d,J=6.7Hz,1H),7.89(d,J=8.2Hz,4H),7.71(d,J=7.0Hz,1H),7.63(d,J=7.9Hz,2H),6.92(t,J=9.9Hz,1H),6.54(d,J=7.3Hz,1H),6.23(d,J=7.3Hz,1H),4.40(t,J=9.0Hz,1H),3.96-3.85(m,2H),3.77(s,3H),2.65(br.s.,1H),1.93(quin,J=10.0Hz,1H)。分析型HPLC:RT=1.64min(方法D)。
实施例43:4-(4-{3-[(3-乙氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-乙氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例43。MS(ESI)m/z 441(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(br.s.,1H),8.35(d,J=6.7Hz,1H),7.90(d,J=7.9Hz,4H),7.71(d,J=7.0Hz,1H),7.63(d,J=7.6Hz,2H),6.98(t,J=7.8Hz,1H),6.36-6.23(m,2H),6.17(d,J=7.6Hz,1H),4.41(d,J=7.0Hz,1H),4.01-3.92(m,2H),3.90(d,J=7.6Hz,2H),2.63(br.s.,1H),1.94(quin,J=9.8Hz,1H),1.29(t,J=6.4Hz,3H)。分析型HPLC:RT=1.75min(方法D)。
实施例44:4-[4-(3-{[(1R)-1-(3-甲氧基苯基)乙基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用(R)-1-(3-甲氧基苯基)乙胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例44。MS(ESI)m/z 455(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.34(d,J=6.7Hz,1H),7.91(br.s.,2H),7.83(d,J=8.2Hz,2H),7.70(d,J=6.7Hz,1H),7.60(d,J=7.9Hz,2H),7.27(q,J=8.6Hz,1H),7.07-6.92(m,2H),6.83(br.s.,1H),4.26(br.s.,1H),3.94-3.82(m,1H),3.76(s,3H),3.60-3.53(m,2H),2.42-2.01(m,1H),1.96-1.64(m,1H),1.35(dd,J=16.0,4.7Hz,3H)。分析型HPLC:RT=1.68min(方法D)。
实施例45:4-(4-{2-氧代-3-[(2-苯基乙基)氨基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用苯乙胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例45。MS(ESI)m/z 425(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.87(s,1H),8.35(d,J=6.7Hz,1H),8.00-7.79(m,4H),7.75-7.58(m,3H),7.42-7.17(m,5H),4.18(t,J=9.2Hz,1H),4.02-3.83(m,2H),3.33-3.21(m,1H),3.21-3.09(m,1H),3.02-2.84(m,2H),2.58(br.s.,1H),2.17-1.99(m,1H)。分析型HPLC:RT=1.26min(方法C)。
实施例46:4-(4-{4-[(3-甲氧基苯基)甲基]-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例41A中用3-甲氧基苄基溴代替苄基溴按照与实施例41所述类似的操作制备实施例46。MS(ESI)m/z 426(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.42(s,1H),8.35(d,J=7.0Hz,1H),8.10(d,J=7.9Hz,2H),7.98-7.83(m,2H),7.78-7.60(m,3H),7.32(t,J=7.9Hz,1H),7.03-6.85(m,3H),4.89(s,2H),3.76(s,3H)。分析型HPLC:RT=1.61min(方法D)。
实施例47:4-苄基-1-(4-{4-氧代-3H,4H-吡咯并[1,2-d][1,2,4]三嗪-1-基}苯基)-4,5-二氢-1H-1,2,4-三唑-5-酮
实施例47A:1H-吡咯-2-甲酰肼
将1H-吡咯-2-甲酸甲酯(1.00g,8.0mmol)置于压力小瓶中且添加水合肼(7.8ml,160mmol)。在室温保持约1小时后,反应混合物变为非均质且形成白色析出物。将反应混合物在100℃搅拌6小时。将反应混合物冷却至室温。反应混合物用H2O(20mL)稀释,过滤且滤饼用水(2×5mL)洗涤。将所得残余物在真空烘箱中干燥24小时,得到实施例47A(0.87g,87%),其为白色固体。MS(ESI)m/z 148(M+Na)+。1H NMR(400MHz,DMSO-d6,ppm)δ11.41(br.s.,1H),9.21(br.s.,1H),6.83(td,J=2.7,1.4Hz,1H),6.76-6.66(m,1H),6.05(dt,J=3.7,2.4Hz,1H),4.28(s,2H)。
实施例47B:2,3-二氢吡咯并[1,2-d][1,2,4]三嗪-1,4-二酮
在室温向实施例47A(0.55g,4.4mmol)于DCM(29ml)中的混悬液中先后添加DIEA(2.30ml,13.2mmol)和氯甲酸甲酯(0.51ml,6.6mmol),然后将反应混合物在室温搅拌14小时。减压除去溶剂。将残余物溶于无水EtOH(80mL)中并添加KOH(0.86g,15.4mmol)。将反应混合物在回流下搅拌2小时且将其冷却至室温。滤出形成的析出物且将其吸收于H2O(20mL)中。所得溶液用1.0N HCl(水溶液)酸化至pH约4并在室温搅拌30分钟。收集所得析出物并在真空烘箱(约50℃,4小时)中减压干燥,得到实施例47B(0.50g,76%),其为白色固体。MS(ESI)m/z 152(M+H)+。1H NMR(400MHz,DMSO-d6,ppm)δ11.43(br s,2H),7.66(dd,J=2.9,1.5Hz,1H),6.80(dd,J=3.5,1.3Hz,1H),6.71(t,J=3.3Hz,1H)。
实施例47C:1-氯吡咯并[1,2-d][1,2,4]三嗪-4(3H)-酮
在具有DIEA(2.1ml,11.9mmol)和H2O(0.14ml,7.74mmol)于甲苯(20.0ml)中的溶液的压力烧瓶中在5分钟内向实施例47B(0.900g,5.96mmol)中滴加POCl3(2.78ml,29.8mmol)。封盖烧瓶且将反应混合物在135℃搅拌18小时。将反应混合物在室温在10分钟内滴加至EtOH(50mL)中,然后将其在室温搅拌15分钟。减压除去大部分EtOH。通过正相色谱纯化,得到实施例47C(0.554g,3.27mmol,55%),其为白色固体。MS(ESI)m/z 170(M+H)+。1HNMR(400MHz,DMSO-d6,ppm)δ12.52(br s,1H),7.86(dd,J=2.8,1.4Hz,1H),6.91(dd,J=3.9,1.9Hz,1H),6.90-6.86(m,1H)。
实施例47D:
通过用实施例47C代替4-氯酞嗪-1(2H)-酮按照与实施例41所述类似的操作制备实施例47。MS(ESI)m/z 385(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.52(s,1H),8.42(s,1H),8.09(d,J=7.9Hz,2H),7.96-7.80(m,3H),7.43-7.30(m,5H),6.98(br.s.,1H),6.90(br.s.,1H),4.92(s,2H)。分析型HPLC:RT=1.63min(方法D)。
实施例48:4-[4-(3-{[3-甲氧基-4-(4-甲基哌嗪-1-基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-甲氧基-4-(4-甲基哌嗪-1-基)苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例48。MS(ESI)m/z525(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.36(d,J=6.7Hz,1H),7.91(d,J=6.7Hz,4H),7.72(d,J=6.4Hz,1H),7.65(d,J=7.9Hz,2H),6.76(d,J=7.9Hz,1H),6.46(br.s.,1H),6.26(d,J=8.5Hz,1H),4.40(t,J=8.5Hz,1H),3.99-3.86(m,2H),3.80-3.10(m,8H),2.85(br.s.,4H),2.64(br.s.,1H),2.01-1.85(m,1H)。分析型HPLC:RT=1.13min(方法C)。
实施例49:4-[4-(3-{[3-甲氧基-4-(吗啉-4-基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-甲氧基-4-吗啉代苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例49。MS(ESI)m/z 512(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.36(d,J=7.0Hz,1H),7.92(d,J=7.0Hz,4H),7.72(d,J=7.0Hz,1H),7.65(d,J=7.9Hz,2H),6.85(br.s.,1H),6.48(br.s.,1H),6.29(d,J=7.6Hz,1H),4.42(br.s.,1H),4.00-3.85(m,2H),3.78(br.s.,3H),3.76-3.64(m,2H),3.59-2.78(m,6H),2.65(br.s.,1H),1.95(quin,J=9.7Hz,1H)。分析型HPLC:RT=1.18min(方法C)。
实施例50:4-(4-{3-[(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用2,3-二氢苯并[b][1,4]二氧杂环己烯-6-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例50。MS(ESI)m/z 455(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.35(d,J=7.3Hz,1H),7.91(d,J=6.7Hz,4H),7.73(d,J=7.0Hz,1H),7.64(d,J=7.9Hz,2H),6.62(d,J=7.9Hz,1H),6.27(br.s.,1H),5.55(d,J=6.4Hz,1H),4.35-4.25(m,1H),4.18(br.s.,2H),4.13(br.s.,2H),3.97-3.83(m,2H),2.64(br.s.,1H),1.97-1.84(m,1H)。分析型HPLC:RT=1.40min(方法C)。
实施例51:4-(4-{3-[(2,2-二氟-2H-1,3-苯并二氧杂环戊烯-5-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用2,2-二氟苯并[d][1,3]二氧杂环戊烯-5-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例51。MS(ESI)m/z 477(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.34(d,J=7.3Hz,1H),7.90(d,J=7.3Hz,4H),7.71(d,J=7.0Hz,1H),7.64(d,J=7.9Hz,2H),7.11(d,J=8.5Hz,1H),6.80(s,1H),6.49(d,J=8.9Hz,1H),6.23(d,J=6.7Hz,1H),4.43(q,J=8.2Hz,1H),3.96-3.84(m,2H),2.72-2.62(m,1H),1.93(quin,J=10.0Hz,1H)。分析型HPLC:RT=1.90min(方法C)。
实施例52:4-[4-(2-氧代-3-{[3-(三氟甲氧基)苯基]氨基}吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-(三氟甲氧基)苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例52。MS(ESI)m/z 481(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.35(d,J=7.0Hz,1H),7.90(d,J=7.0Hz,4H),7.72(d,J=7.0Hz,1H),7.64(d,J=7.9Hz,2H),7.19(t,J=7.9Hz,1H),6.74(d,J=8.2Hz,1H),6.68(br.s.,1H),6.49(dd,J=13.4,7.6Hz,2H),4.51(q,J=8.3Hz,1H),4.01-3.83(m,2H),2.70-2.60(m,1H),1.96(quin,J=10.0Hz,1H)。分析型HPLC:RT=1.95min(方法D)。
实施例53:4-(4-{4-[(3-氟苯基)甲基]-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例41A中用3-氟苄基溴代替苄基溴按照与实施例41所述类似的操作制备实施例53。MS(ESI)m/z 414(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.44(s,1H),8.35(d,J=6.4Hz,1H),8.10(d,J=7.9Hz,2H),7.91(br.s.,2H),7.78-7.61(m,3H),7.52-7.39(m,1H),7.34-7.11(m,3H),4.95(br.s.,2H)。分析型HPLC:RT=1.63min(方法C)。
实施例54:4-{4-[5-氧代-4-(1-苯基乙基)-4,5-二氢-1H-1,2,4-三唑-1-基]苯基}-1,2-二氢酞嗪-1-酮
通过在实施例41A中用(1-溴乙基)苯代替苄基溴按照与实施例41所述类似的操作制备实施例54。MS(ESI)m/z 410(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s.,1H),8.60(br.s.,1H),8.34(d,J=6.4Hz,1H),8.08(d,J=7.6Hz,2H),7.90(br.s.,2H),7.79-7.64(m,3H),7.45-7.27(m,5H),5.32(d,J=6.7Hz,1H),1.80(d,J=6.4Hz,3H)。分析型HPLC:RT=1.68min(方法D)。
实施例55:4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮对映异构体1;和
实施例56:4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮对映异构体2
实施例30(外消旋)经受SFC手性分离(柱:(R,R)Whelk-O1,21×250mm,5微米;流动相:50%MeOH/50%CO2;流动条件:45mL/min;压力:150巴;温度:40℃;检测器波长:220nm)。得到两种对映异构体,其为白色固体。
实施例55,峰1,对映异构体1,ee>99%。MS(ESI)m/z 463(M+H)+。1H NMR(400MHz,CDCl3)δ10.34(br.s.,1H),8.63-8.47(m,1H),7.87(d,J=8.6Hz,2H),7.84-7.74(m,3H),7.65(d,J=8.6Hz,2H),7.19(t,J=8.0Hz,1H),6.59(dd,J=8.1,1.5Hz,1H),6.53(d,J=8.1Hz,1H),6.47(s,1H),6.51(t,J=74.4Hz,1H),4.74(br.s.,1H),4.20(t,J=8.0Hz,1H),4.07-3.85(m,2H),2.93(dt,J=12.3,6.2Hz,1H),2.19-2.03(m,1H)。分析型HPLC:RT=12.10min(方法A)。
实施例56,峰2,对映异构体2,ee 98.4%。MS(ESI)m/z 463(M+H)+。1H NMR(400MHz,CDCl3)δ10.21(br.s.,1H),8.61-8.48(m,1H),7.87(d,J=8.6Hz,2H),7.84-7.76(m,3H),7.65(d,J=8.6Hz,2H),7.20(t,J=8.1Hz,1H),6.59(dd,J=8.1,2.0Hz,1H),6.56-6.52(m,1H),6.50-6.45(m,1H),6.51(t,J=74.6Hz,1H),4.74(d,J=2.6Hz,1H),4.20(ddd,J=10.6,7.8,3.0Hz,1H),4.05-3.89(m,2H),3.01-2.87(m,1H),2.18-2.01(m,1H)。分析型HPLC:RT=12.04min(方法A)。
实施例57:4-[4-(2-氧代-3-{[3-(丙-2-基氧基)苯基]氨基}吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-异丙氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例57。MS(ESI)m/z 455(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(br.s.,1H),8.36(d,J=6.1Hz,1H),7.92(d,J=5.5Hz,4H),7.73(d,J=6.4Hz,1H),7.65(d,J=7.6Hz,2H),6.98(t,J=6.9Hz,1H),6.30(br.s.,2H),6.17(d,J=7.6Hz,1H),5.92(d,J=5.2Hz,1H),4.52(br.s.,1H),4.42(d,J=7.9Hz,1H),3.92(d,J=8.5Hz,2H),2.64(br.s.,1H),1.95(t,J=9.9Hz,1H),1.25(br.s.,6H)。分析型HPLC:RT=1.84min(方法D)。
实施例58:4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢异喹啉-1-酮
通过在实施例30C中用4-溴异喹啉-1(2H)-酮代替4-氯酞嗪-1(2H)-酮按照与实施例30所述类似的操作制备实施例58。MS(ESI)m/z 462(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ11.45(br.s.,1H),8.30(d,J=7.3Hz,1H),7.83(d,J=7.6Hz,2H),7.75-7.64(m,1H),7.59-7.50(m,2H),7.47(d,J=7.3Hz,2H),7.33-6.93(m,3H),6.60(d,J=7.6Hz,1H),6.52(br.s.,1H),6.36(d,J=7.6Hz,1H),6.31(d,J=5.5Hz,1H),4.45(d,J=7.9Hz,1H),3.89(d,J=7.9Hz,2H),2.63(br.s.,1H),1.94(t,J=9.9Hz,1H)。分析型HPLC:RT=1.83min(方法C)。
实施例59:2-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-1,3-噻唑-5-甲腈
通过在实施例30A中用2-氨基噻唑-5-甲腈代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例59。MS(ESI)m/z 429(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(br.s.,1H),8.35(br.s.,1H),7.99-7.85(m,5H),7.73(br.s.,1H),7.65(d,J=7.3Hz,2H),4.82(br.s.,1H),3.94(d,J=8.5Hz,2H),2.64(br.s.,1H),2.15(t,J=10.2Hz,1H)。分析型HPLC:RT=1.34min(方法D)。
实施例60:4-[4-(3-{[4-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例30A中用4-(二氟甲氧基)苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例60。MS(ESI)m/z 463(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.41-8.30(m,1H),7.96-7.85(m,4H),7.75-7.69(m,1H),7.63(d,J=8.5Hz,2H),7.11-6.78(m,3H),6.75(d,J=8.9Hz,2H),4.41(t,J=9.0Hz,1H),4.00-3.81(m,2H),2.70-2.60(m,1H),2.01-1.86(m,1H)。分析型HPLC:RT=1.73min(方法D)。
实施例61:4-(4-{3-[(2-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例30A中用2-甲氧基苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例61。MS(ESI)m/z 427(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.42-8.30(m,1H),7.97-7.85(m,4H),7.77-7.70(m,1H),7.64(d,J=8.5Hz,2H),6.87(d,J=7.9Hz,1H),6.84-6.78(m,1H),6.73(d,J=7.0Hz,1H),6.68-6.61(m,1H),5.15(d,J=5.5Hz,1H),4.36(ddd,J=10.4,8.1,5.6Hz,1H),3.93(dd,J=9.6,3.8Hz,2H),3.82(s,3H),2.75(ddt,J=11.8,7.9,3.9Hz,1H),2.05-1.94(m,1H)。分析型HPLC:RT=1.65min(方法C)。
实施例62:7-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-3,4-二氢-2H-1,4-苯并噁嗪-3-酮
通过在实施例30A中用7-氨基-2H-苯并[b][1,4]噁嗪-3(4H)-酮代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例62。MS(ESI)m/z468(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(d,J=7.9Hz,1H),10.34(d,J=7.6Hz,1H),8.36(d,J=6.4Hz,1H),7.92(br.s.,4H),7.79-7.69(m,1H),7.69-7.57(m,2H),6.76-6.62(m,1H),6.46-6.30(m,2H),5.84(d,J=6.4Hz,1H),4.51-4.42(m,2H),4.39-4.28(m,1H),3.90(dd,J=14.5,7.8Hz,2H),2.63(br.s.,1H),1.93(d,J=8.9Hz,1H)。分析型HPLC:RT=1.29min(方法D)。
实施例63:4-[4-(4-{[3-(二氟甲氧基)苯基]甲基}-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例41A中用1-(溴甲基)-3-(二氟甲氧基)苯代替苄基溴按照与实施例41所述类似的操作制备实施例63。MS(ESI)m/z 462(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.86(s,1H),8.43(s,1H),8.34(dd,J=6.6,2.6Hz,1H),8.09(d,J=8.5Hz,2H),7.98-7.86(m,2H),7.77-7.63(m,3H),7.46(t,J=7.9Hz,1H),7.29-7.21(m,2H),7.16(dd,J=8.2,1.8Hz,1H),4.95(s,2H)。分析型HPLC:RT=1.7min(方法D)。
实施例64:4-[4-(2-氧代-3-{[1-(丙-2-基)-1H-吡唑-3-基]氨基}吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用1-异丙基-1H-吡唑-3-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例64。MS(ESI)m/z 429(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.76(s,1H),8.34-8.20(m,1H),7.90-7.78(m,4H),7.65(d,J=7.0Hz,1H),7.56(d,J=8.5Hz,2H),7.32(d,J=2.1Hz,1H),5.51-5.39(m,2H),4.28-4.10(m,2H),3.90-3.74(m,2H),2.55-2.50(m,1H),2.00-1.88(m,1H),1.26(d,J=6.4Hz,6H)。分析型HPLC:RT=1.45min(方法D)。
实施例65:4-(4-{3-[(1-甲基-1H-吡唑-3-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用1-甲基-1H-吡唑-3-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例65。MS(ESI)m/z 401(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.82(s,1H),8.41-8.27(m,1H),7.98-7.84(m,4H),7.77-7.69(m,1H),7.63(d,J=8.5Hz,2H),7.33(d,J=1.8Hz,1H),5.57-5.44(m,2H),4.38-4.25(m,1H),3.96-3.79(m,2H),3.61(s,3H),2.66-2.57(m,1H),2.06-1.91(m,1H)。分析型HPLC:RT=1.11min(方法C)。
实施例66:4-(4-{3-[(2-甲基-1,3-苯并噻唑-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用2-甲基苯并[d]噻唑-6-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例66。MS(ESI)m/z 468.1(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.40-8.28(m,1H),8.01-7.85(m,4H),7.75-7.70(m,1H),7.63(dd,J=12.1,8.7Hz,3H),7.24(d,J=2.1Hz,1H),6.93(dd,J=8.9,2.1Hz,1H),6.23(d,J=7.0Hz,1H),4.56-4.45(m,1H),4.01-3.85(m,2H),2.70-2.67(m,3H),2.78-2.65(m,1H),2.03-1.90(m,1H)。分析型HPLC:RT=140min(方法C)。
实施例67:4-(4-{3-[(3-甲烷磺酰基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例30A中用3-(甲基磺酰基)苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例67。MS(ESI)m/z 475(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(s,1H),8.40-8.26(m,1H),7.97-7.84(m,4H),7.75-7.69(m,1H),7.64(d,J=8.5Hz,2H),7.36(t,J=7.9Hz,1H),7.24(s,1H),7.14-7.00(m,2H),6.65(d,J=7.3Hz,1H),4.67-4.52(m,1H),4.01-3.84(m,2H),3.14(s,3H),2.65(dt,J=12.1,6.2Hz,1H),2.06-1.90(m,1H)。分析型HPLC:RT=1.38min(方法D)。
实施例68:4-[4-(3-{[3-(甲基硫基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮
通过在实施例30A中用3-(甲基硫基)苯胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例68。MS(ESI)m/z 443(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.83(br.s.,1H),8.43-8.29(m,1H),7.91(d,J=8.2Hz,4H),7.76-7.69(m,1H),7.64(d,J=8.5Hz,2H),7.04(t,J=7.8Hz,1H),6.64(s,1H),6.52(d,J=7.9Hz,1H),6.48(d,J=7.6Hz,1H),6.05(d,J=7.3Hz,1H),4.56-4.40(m,1H),3.99-3.82(m,2H),2.69-2.58(m,1H),2.42(s,3H),2.02-1.88(m,1H)。分析型HPLC:RT=1.8min(方法D)。
实施例69:4-(4-{3-[(6-氟吡啶-2-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
实施例69A:1-(4-溴苯基)-3-((6-氟吡啶-2-基)氨基)吡咯烷-2-酮
在室温向中间体4(30mg,0.081mmol)于NMP(2mL)中的溶液中添加2,6-二氟吡啶(18.7mg,0.16mmol)和DIEA(0.07mL,0.41mmol)。反应混合物用微波在200℃加热1.5小时。通过反相色谱纯化粗产物,得到实施例69A(17mg,60%),其为白色固体。MS(ESI)m/z350.0/352.0(M+H)+。1H NMR(400MHz,CD3OD)δ7.76(s,1H),7.63-7.57(m,2H),7.55-7.45(m,3H),6.44(dd,J=8.0,1.9Hz,1H),6.13(dd,J=7.7,1.8Hz,1H),4.75(dd,J=10.3,8.6Hz,1H),3.96-3.81(m,2H),2.71(dddd,J=12.3,8.7,5.9,2.8Hz,1H),2.19-2.02(m,1H)。
实施例69B:
通过用实施例69A代替实施例30A按照与实施例30所述类似的操作制备实施例69。MS(ESI)m/z 416(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ8.46-8.22(m,1H),7.99-7.84(m,4H),7.77-7.69(m,1H),7.64(d,J=8.5Hz,2H),7.55(q,J=8.0Hz,1H),7.42(d,J=7.9Hz,1H),6.49(dd,J=8.1,1.7Hz,1H),6.17(dd,J=7.6,1.5Hz,1H),4.90-4.72(m,1H),4.02-3.83(m,2H),2.57(dt,J=7.9,4.0Hz,1H),2.13-1.96(m,1H)。分析型HPLC:RT=1.53min(方法D)。
实施例70:4-(4-{2-氧代-3-[(1,2,3,4-四氢异喹啉-6-基)氨基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
通过在实施例30A中用6-氨基-3,4-二氢异喹啉-2(1H)-甲酸叔丁酯代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备6-((2-氧代-1-(4-(4-氧代-3,4-二氢酞嗪-1-基)苯基)吡咯烷-3-基)氨基)-3,4-二氢异喹啉-2(1H)-甲酸叔丁酯(70A)。
向70A中添加DCM(2mL)和TFA(0.5mL)。在室温搅拌30分钟后,除去溶剂。进行反相色谱,得到实施例70(21mg,39%),其为白色固体。MS(ESI)m/z(M+H)+。1H NMR(500MHz,CD3OD,ppm)δ8.49-8.41(m,1H),7.95-7.87(m,4H),7.85-7.79(m,1H),7.66(d,J=8.6Hz,2H),7.00(d,J=8.4Hz,1H),6.74(dd,J=8.4,2.4Hz,1H),6.66(d,J=2.0Hz,1H),4.47(dd,J=10.1,8.1Hz,1H),4.23(s,2H),4.05-3.94(m,2H),3.46(t,J=6.4Hz,2H),3.05(t,J=6.4Hz,2H),2.84-2.72(m,1H),2.06(dq,J=12.3,9.6Hz,1H)。分析型HPLC:RT=5.55min(方法B)
实施例71:4-[4-(3-{[1-甲基-3-(丙-2-基)-1H-吡唑-5-基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例30A中用3-异丙基-1-甲基-1H-吡唑-5-胺代替3-(二氟甲氧基)苯胺按照与实施例30所述类似的操作制备实施例71。MS(ESI)m/z 443(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.42-8.29(m,1H),7.97-7.83(m,4H),7.75-7.67(m,1H),7.64(d,J=8.5Hz,2H),5.75(s,1H),4.46(t,J=9.5Hz,1H),4.01-3.81(m,2H),3.63(s,3H),2.85(quin,J=6.9Hz,1H),2.65-2.56(m,1H),2.07(quin,J=10.4Hz,1H),1.19(d,J=6.7Hz,6H)。分析型HPLC:RT=1.46min(方法D)。
实施例72:4-[(3-甲氧基苯基)甲基]-3-甲基-1-(4-{4-氧代-3aH,4H,5H,7aH-噻吩并[3,2-c]吡啶-7-基}苯基)-4,5-二氢-1H-1,2,4-三唑-5-酮三氟乙酸盐
实施例72A:7-溴噻吩并[3,2-c]吡啶-4(5H)-酮
在0℃历时10分钟向噻吩并[3,2-c]吡啶-4(5H)-酮(650mg,4.30mmol)于DMF(5mL)中的溶液中逐份添加NBS(765mg,4.30mmol)。将反应混合物在室温搅拌16小时。反应混合物用冷水(100mL)稀释以形成固体,其通过过滤收集并真空干燥,得到实施例72A(600mg,58%)。MS(ESI)m/z 230/232(M+H)+。
实施例72B:
按照与实施例30所述类似的操作制备实施例72。MS(ESI)m/z 445(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ11.73(s,1H)8.02(d,J=8.8Hz,2H),7.67-7.73(m,3H),7.57(d,J=5.2Hz,1H),7.29-7.36(m,2H)6.85-6.91(m,3H),4.91(s,2H),3.75(s,3H),2.25(s,3H)。分析型HPLC:RT=1.60min(方法C)。
实施例73:4-(4-{2-氧代-3-[3-(三氟甲氧基)苯氧基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
实施例73A:1-(4-溴苯基)-3-(3-(三氟甲氧基)苯氧基)吡咯烷-2-酮
在室温向中间体2(50mg,0.16mmol)于THF(4mL)和H2O(0.3mL)中的溶液中添加3-(三氟甲氧基)苯酚(42mg,0.24mmol)和K2CO3(65mg,0.470mmol)。将反应混合物在密封小瓶中在80℃加热16小时。除去溶剂。通过正相色谱纯化粗产物,得到实施例73A(56mg,86%),其为白色固体。MS(ESI)m/z 416/418(M+H)+。1H NMR(400MHz,CDCl3)δ7.64-7.56(m,2H),7.54-7.47(m,2H),7.31(t,J=8.3Hz,1H),7.03(dd,J=8.4,1.8Hz,1H),6.95(s,1H),6.88(dt,J=8.2,1.1Hz,1H),5.03(t,J=7.6Hz,1H),3.99-3.80(m,2H),2.71(dtd,J=13.4,7.5,3.7Hz,1H),2.33(ddt,J=13.3,8.6,7.3Hz,1H)。
实施例73B:
通过用实施例73A代替实施例30A按照与实施例30所述类似的操作制备实施例73。MS(ESI)m/z 482.3(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.87(s,1H),8.34(d,J=7.8Hz,1H),7.97-7.83(m,4H),7.71(d,J=7.5Hz,1H),7.65(d,J=8.3Hz,2H),7.45(t,J=8.2Hz,1H),7.14(d,J=8.5Hz,1H),7.12(br.s.,1H),6.99(d,J=8.0Hz,1H),5.40(t,J=8.2Hz,1H),4.07-3.82(m,2H),2.76(d,J=6.1Hz,1H),2.25-2.03(m,1H)。分析型HPLC:RT=1.88min(方法D)。
实施例74:2-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)吡啶-4-甲腈三氟乙酸盐
通过在实施例69A中用2-氟吡啶-4-甲腈代替2,6-二氟吡啶按照与实施例69所述类似的操作制备实施例74。MS(ESI)m/z 423(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.84(s,1H),8.41-8.29(m,1H),8.17(d,J=5.2Hz,1H),7.95-7.82(m,4H),7.75-7.68(m,1H),7.62(d,J=8.9Hz,2H),7.57(d,J=7.9Hz,1H),6.97(s,1H),6.86(d,J=4.9Hz,1H),4.97-4.81(m,1H),4.07-3.77(m,2H),2.56(d,J=2.7Hz,1H),2.14-1.99(m,1H)。分析型HPLC:RT=1.48min(方法D)。
实施例75:4-(4-{3-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
在室温向实施例70(18mg,0.040mmol)于DCE(2mL)中的溶液中添加多聚甲醛(3.6mg,0.12mmol)、NaBH(OAc)3(25mg,0.12mmol)和两滴乙酸。将反应混合物在N2下在室温搅拌16小时。通过反相色谱纯化,得到实施例75(6.5mg,35%)。MS(ESI)m/z 466(M+H)+。1HNMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.41-8.29(m,1H),7.97-7.84(m,4H),7.70(d,J=7.0Hz,1H),7.62(d,J=8.5Hz,2H),6.85(d,J=8.5Hz,1H),6.59(d,J=8.5Hz,1H),6.52(s,1H),5.88(br.s.,1H),4.47-4.35(m,1H),3.89(d,J=8.9Hz,2H),3.06(br.s.,2H),2.86(br.s.,2H),2.64(br.s.,4H),1.97-1.85(m,1H)。分析型HPLC:RT=1.13min(方法C)。
实施例34经受SFC手性分离(柱:(R,R)Whelk-O1,21×250mm,5微米;流动相:55%MeOH/45%CO2;流动条件:45mL/min;压力:140巴;温度:40℃;检测器波长:220nm)。得到两种对映异构体,其为白色固体。
实施例76,峰1,对映异构体1,ee>99%。MS(ESI)m/z 469(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.86(s,1H),8.41-8.29(m,1H),7.97-7.86(m,4H),7.74-7.69(m,1H),7.67-7.59(m,2H),6.75(d,J=8.6Hz,1H),6.38(d,J=2.6Hz,1H),6.32(dd,J=8.7,2.8Hz,1H),5.79(br.s.,1H),4.34(t,J=9.0Hz,1H),4.07-4.01(m,2H),3.95(t,J=5.4Hz,2H),3.92-3.82(m,2H),2.65-2.56(m,1H),2.06-1.98(m,2H),1.96-1.83(m,1H)。分析型HPLC:RT=10.51min(方法A)。
实施例77,峰2,对映异构体2,ee>99%。MS(ESI)m/z 469(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.86(s,1H),8.41-8.29(m,1H),7.97-7.86(m,4H),7.74-7.69(m,1H),7.67-7.59(m,2H),6.75(d,J=8.6Hz,1H),6.38(d,J=2.6Hz,1H),6.32(dd,J=8.7,2.8Hz,1H),5.79(br.s.,1H),4.34(t,J=9.0Hz,1H),4.07-4.01(m,2H),3.95(t,J=5.4Hz,2H),3.92-3.82(m,2H),2.65-2.56(m,1H),2.06-1.98(m,2H),1.96-1.83(m,1H)。分析型HPLC:RT=10.42min(方法A)。
实施例78:4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢异喹啉-1-酮对映异构体1;和
实施例79:4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢异喹啉-1-酮对映异构体2
实施例58(外消旋)经受SFC手性分离(柱:(R,R)Whelk-O1,21×250mm,5微米;流动相:50%MeOH/50%CO2;流动条件:45mL/min;压力:150巴;温度:40℃;检测器波长:220nm)。得到两种对映异构体,其为白色固体。
实施例78,峰1,对映异构体1,ee>99%。MS(ESI)m/z 462(M+H)+。1H NMR(500MHz,DMSO-d6)δ11.45(d,J=5.5Hz,1H),8.30(d,J=8.0Hz,1H),7.83(d,J=8.8Hz,2H),7.75-7.67(m,1H),7.58-7.50(m,2H),7.47(d,J=8.8Hz,2H),7.32-6.96(m,3H),6.60(dd,J=8.3,1.7Hz,1H),6.54-6.48(m,1H),6.36(dd,J=8.0,1.9Hz,1H),6.31(d,J=7.2Hz,1H),4.50-4.40(m,1H),3.96-3.82(m,2H),2.67-2.61(m,1H),1.98-1.87(m,1H)。分析型HPLC:RT=11.23min(方法A)。
实施例79,峰2,对映异构体2,ee>99%。MS(ESI)m/z 462(M+H)+。1H NMR(500MHz,DMSO-d6)δ11.46(d,J=4.7Hz,1H),8.39-8.25(m,1H),7.83(d,J=8.8Hz,2H),7.76-7.67(m,1H),7.59-7.50(m,2H),7.47(d,J=8.5Hz,2H),7.31-6.96(m,3H),6.60(dd,J=8.1,1.8Hz,1H),6.52(t,J=2.1Hz,1H),6.36(dd,J=7.8,2.1Hz,1H),6.31(d,J=7.4Hz,1H),4.51-4.40(m,1H),3.97-3.83(m,2H),2.70-2.59(m,1H),1.99-1.86(m,1H)。分析型HPLC:RT=11.22min(方法A)。
实施例80:4-(4-{3-[(2-甲基-1,3-苯并噻唑-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮
实施例66(外消旋)经受SFC手性分离(柱:Chiralcel OJ,21×250mm,5微米;流动相:45%MeOH/55%CO2;流动条件:45mL/min;压力:150巴;温度:40℃;检测器波长:220nm)。得到两种对映异构体,其为白色固体。
实施例80,峰1,对映异构体1,ee>97%。MS(ESI)m/z 468(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.83(s,1H),8.38-8.31(m,1H),7.97-7.85(m,4H),7.75-7.69(m,1H),7.63(dd,J=11.2,8.8Hz,3H),7.24(d,J=2.0Hz,1H),6.92(dd,J=8.9,2.3Hz,1H),6.24(d,J=7.0Hz,1H),4.58-4.44(m,1H),4.02-3.84(m,2H),2.77-2.70(m,1H),2.68(s,3H),2.06-1.91(m,1H)。分析型HPLC:RT=6.03min(方法A)。
实施例81,峰2,对映异构体2,ee>96%。MS(ESI)m/z 468(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.83(s,1H),8.35(dd,J=6.4,2.6Hz,1H),7.97-7.86(m,4H),7.77-7.69(m,1H),7.68-7.58(m,3H),7.24(d,J=2.2Hz,1H),6.92(dd,J=8.8,2.2Hz,1H),6.24(d,J=7.0Hz,1H),4.56-4.44(m,1H),4.02-3.83(m,2H),2.77-2.70(m,1H),2.69(s,3H),2.05-1.87(m,1H)。分析型HPLC:RT=6.04min(方法A)。
实施例82:7-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-3,4-二氢-2H-1,4-苯并噁嗪-3-酮对映异构体1;和
实施例83:7-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-3,4-二氢-2H-1,4-苯并噁嗪-3-酮对映异构体2
实施例62(外消旋)经受SFC手性分离(柱:(R,R)Whelk-O1,21×250mm,5微米;流动相:60%MeOH/40%CO2;流动条件:45mL/min;压力:125巴;温度:40℃;检测器波长:220nm)。得到两种对映异构体,其为白色固体。
实施例82,峰1,对映异构体1,ee>97%。MS(ESI)m/z 468(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.83(br.s.,1H),10.32(s,1H),8.35(d,J=7.0Hz,1H),7.92-7.89(m,4H),7.72(d,J=9.2Hz,1H),7.64(d,J=8.6Hz,2H),6.66(d,J=8.4Hz,1H),6.39(s,1H),6.35(d,J=8.4Hz,1H),5.83(d,J=7.3Hz,1H),4.46(s,2H),4.35(q,J=8.6Hz,1H),3.89(br.s.,2H),2.61(br.s.,1H),1.97-1.87(m,1H)。分析型HPLC:RT=6.56min(方法B)
实施例83,峰2,对映异构体2,ee>96%。MS(ESI)m/z 468(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.87(s,1H),10.37(s,1H),8.42-8.29(m,1H),7.99-7.86(m,4H),7.78-7.70(m,1H),7.68-7.59(m,2H),6.67(d,J=8.4Hz,1H),6.40(d,J=2.4Hz,1H),6.36(dd,J=8.6,2.4Hz,1H),4.47(s,2H),4.38(dd,J=9.9,8.4Hz,1H),3.98-3.84(m,2H),2.61(dd,J=12.0,6.1Hz,1H),1.99-1.85(m,1H)。分析型HPLC:RT=6.56min(方法B)
实施例84:4-(4-{2-氧代-3-[3-(三氟甲氧基)苯氧基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮对映异构体1;和
实施例85:4-(4-{2-氧代-3-[3-(三氟甲氧基)苯氧基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮对映异构体2
实施例73(外消旋)经受SFC手性分离(柱:Chiralcel OJ,21×250mm,5微米;流动相:45%MeOH/55%CO2;流动条件:45mL/min;压力:125巴;温度:40℃;检测器波长:220nm)。得到两种对映异构体,其为白色固体。
实施例84,峰1,对映异构体1,ee>99%。MS(ESI)m/z 482(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.84(s,1H),8.39-8.31(m,1H),7.97-7.87(m,4H),7.75-7.69(m,1H),7.66(d,J=8.8Hz,2H),7.50-7.41(m,1H),7.18-7.10(m,2H),7.00(d,J=8.1Hz,1H),5.41(t,J=8.3Hz,1H),4.05-3.85(m,2H),2.84-2.71(m,1H),2.24-2.11(m,1H)。分析型HPLC:RT=9.48min(方法A)。
实施例85,峰2,对映异构体2,ee>99%。MS(ESI)m/z 482(M+H)+。1H NMR(400MHz,DMSO-d6)δ12.84(s,1H),8.38-8.32(m,1H),7.98-7.86(m,4H),7.76-7.69(m,1H),7.66(d,J=8.6Hz,2H),7.51-7.41(m,1H),7.19-7.10(m,2H),7.00(d,J=8.1Hz,1H),5.41(t,J=8.3Hz,1H),4.04-3.88(m,2H),2.84-2.72(m,1H),2.21-2.14(m,1H)。分析型HPLC:RT=9.37min(方法A)。
实施例86:4-{4-[3-(3-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐
通过在实施例73A中用3-甲氧基苯酚代替3-三氟甲氧基苯酚按照与实施例73所述类似的操作制备实施例86。MS(ESI)m/z 428.1(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.85(s,1H),8.39-8.27(m,1H),7.98-7.83(m,4H),7.71(d,J=7.0Hz,1H),7.65(d,J=8.5Hz,2H),7.22(t,J=8.1Hz,1H),6.70-6.61(m,2H),6.60-6.54(m,1H),5.28(t,J=8.1Hz,1H),4.04-3.85(m,2H),3.75(s,3H),2.82-2.67(m,1H),2.19-2.05(m,1H)。分析型HPLC:RT=1.68min(方法C)。
实施例87:4-{4-[3-(2-氟-5-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮
通过在实施例73A中用2-氟-5-甲氧基苯酚代替3-三氟甲氧基苯酚按照与实施例73所述类似的操作制备实施例87。MS(ESI)m/z 446.2(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.87(s,1H),8.34(d,J=6.6Hz,1H),7.90(d,J=7.6Hz,4H),7.71(d,J=7.0Hz,1H),7.65(d,J=8.2Hz,2H),7.16(t,J=9.8Hz,1H),6.95(d,J=4.8Hz,1H),6.54(d,J=8.8Hz,1H),5.36(t,J=7.9Hz,1H),4.03-3.94(m,1H),3.94-3.85(m,1H),3.74(s,3H),2.75(br.s.,1H),2.24-2.07(m,1H)。分析型HPLC:RT=1.61min(方法C)。
实施例88:4-{4-[3-(4-氟-3-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮
通过在实施例73A中用4-氟-5-甲氧基苯酚代替3-三氟甲氧基苯酚按照与实施例73所述类似的操作制备实施例88。MS(ESI)m/z 446(M+H)+。1H NMR(500MHz,DMSO-d6,ppm)δ12.87(s,1H),8.35(d,J=7.2Hz,1H),7.92(d,J=7.2Hz,4H),7.71(d,J=6.8Hz,1H),7.66(d,J=7.9Hz,2H),7.15(t,J=10.0Hz,1H),6.89(d,J=6.6Hz,1H),6.64(d,J=7.7Hz,1H),5.28(t,J=8.1Hz,1H),4.03-3.94(m,1H),3.91(d,J=7.8Hz,1H),3.83(s,3H),2.75(br.s.,1H),2.18-2.06(m,1H)。分析型HPLC:RT=1.59min(方法C)。
实施例89:4-{4-[3-(3-氟-5-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮
通过在实施例73A中用3-氟-5-甲氧基苯酚代替3-三氟甲氧基苯酚按照与实施例73所述类似的操作制备实施例89。MS(ESI)m/z 446(M+H)+。1H NMR(500MHz,DMSO-d6)δ12.84(s,1H),8.34(d,J=7.9Hz,1H),7.98-7.84(m,4H),7.71(d,J=7.0Hz,1H),7.65(d,J=8.5Hz,2H),6.58(d,J=11.0Hz,1H),6.51(s,1H),6.47(d,J=11.0Hz,1H),5.34(t,J=8.1Hz,1H),4.03-3.94(m,1H),3.93-3.85(m,1H),3.76(s,3H),2.82-2.68(m,1H),2.18-2.07(m,1H)。分析型HPLC:RT=1.78min(方法C)。
序列表
<110> 百时美施贵宝公司(Bristol-Myers Squibb Company)
<120> 作为强效和选择性ROCK抑制剂的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物
<130> 12401 WO
<150> US62/359341
<151> 2016-07-07
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 肽
<220>
<221> MISC_FEATURE
<223> FITC-AHA附接在A1 - A11的N末端
<220>
<221> MISC_FEATURE
<223> OH附接在A1 - A11的C末端
<400> 1
Ala Lys Arg Arg Arg Leu Ser Ser Leu Arg Ala
1 5 10
Claims (17)
1.式(I)化合物或其立体异构体或药用盐:
其中
环A独立选自
环B独立选自
G独立为CR7;
M独立选自N和CR9;
X独立选自CHR1、NR2和O;
Y独立选自N;
R1是L-R5;
L不存在或独立选自-NR4-、-C(O)NR4(CR4R4)n-和-O-;
R2是-(CR4R4)n-R5;
R3独立选自H、取代有0-4个Re的C1-4烷基、-(CH2)rNRaC(=O)Rb、-(CH2)rNRaC(=O)ORb和取代有0-3个Re的(CH2)r-C3-6碳环基;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、苯基和杂芳基,其各自取代有1-5个R6;
可代替地,当L是-NR4-、-C(O)NR4-时,R4和R5与和它们均连接的氮原子一起形成取代有1-5个R6的杂环;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、-(CRdRd)rS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)r-C3-6环烷基、-(CRdRd)r-杂环基和-(CRdRd)r-苯基,其中所述杂环基取代有0-4个Re;
R7独立为H;
R8独立为H;
R9独立为H;
Ra独立为H;
Rb独立选自取代有0-5个Re的C1-6烷基和-(CH2)r-C3-10碳环基;
Rc独立为C1-6烷基;
Rd独立为H;
Re独立选自取代有0-5个Rf的C1-6烷基、-(CH2)r-苯基、F、Cl、Br、-(CH2)rORf和S(O)pRf;
Rf独立选自H、F、Cl、Br和C1-5烷基;
n在每次出现时独立选自0、1和2;
p在每次出现时独立选自0和2;且
r独立选自0和1,
其中:
术语“C3-6碳环基”和“C3-10碳环基”指的是苯基,
术语“杂环基”和“杂环”指的是饱和的5、6或7元单环,其包含碳原子和1或2个独立地选自N、O和S的杂原子,或指的是其中任何上文定义的杂环稠合至苯环的基团;和
术语“杂芳基”指的是芳族5或6元单环基团或9元双环基团,其包含1或2个选自N、O和S的杂原子。
2.权利要求1的化合物或其立体异构体或药用盐,所述化合物具有式(II):
其中
G为CR7;
M独立选自N和CR9;
X独立选自CHR1、NR2和O;
R1是L-R5;
L不存在或独立选自-NR4-、-C(O)NR4(CR4R4)n-和-O-;
R2是-(CR4R4)n-R5;
R3独立选自H、取代有0-4个Re的C1-4烷基和取代有0-3个Re的(CH2)r-C3-6碳环基;
R4独立选自H和取代有0-4个Re的C1-4烷基;
R5独立选自C3-6环烷基、杂环基、苯基和杂芳基,其各自取代有1-5个R6;
可代替地,当L是-NR4-、-C(O)NR4-时,R4和R5与和它们均连接的氮原子一起形成取代有1-5个R6的杂环;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、-(CRdRd)rS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)r-C3-6环烷基、-(CRdRd)r-杂环基和-(CRdRd)r-苯基,其中所述杂环基取代有0-4个Re;
R7独立为H;
R8独立为H;
R9独立为H;
Ra独立为H;
Rb独立为取代有0-5个Re的C1-6烷基;
Rc独立为C1-6烷基;
Re独立选自C1-6烷基、-(CH2)r-苯基、F、Cl、Br、-(CH2)rORf和S(O)pRf;
Rf独立选自H、F、Cl、Br和C1-5烷基;
n在每次出现时独立选自0、1和2;
p在每次出现时独立选自0和2;且
r独立选自0和1。
3.权利要求1的化合物或其立体异构体或药用盐,所述化合物具有式(III):
其中
L不存在或独立选自-NR4-、-C(O)NR4(CR4R4)n-和-O-;
M独立选自N和CH;
R4独立选自H和C1-4烷基;
R5独立选自C3-6环烷基、杂环基、苯基和杂芳基,其各自取代有1-5个R6;
可代替地,当L是-NR4-、-C(O)NR4-时,R4和R5与和它们均连接的氮原子一起形成取代有1个R6的杂环;
R6独立选自H、=O、F、Cl、Br、C1-4烷基、-(CRdRd)rS(O)pRc、-(CRdRd)rORb、-(CRdRd)rCN、-(CRdRd)r-C3-6环烷基、-(CRdRd)r-杂环基和-(CRdRd)r-苯基,其中所述杂环基取代有0-4个Re;
Rb独立为取代有0-5个Re的C1-6烷基;
Rc独立为C1-6烷基;
Re独立选自C1-6烷基、F、Cl和Br;
p在每次出现时独立选自0和2;且
r独立为0。
4.权利要求3的化合物或其立体异构体或药用盐,其中
L独立选自-NR4-、-C(O)NR4(CH2)0-1-和-O-;
R4独立选自H和C1-4烷基;
R5独立选自
R6独立选自H、=O、F、Cl、Br、C1-4烷基、-(CHRd)rS(O)pRc、-(CHRd)rORb、-(CHRd)rCN、-(CHRd)r-C3-6环烷基、-(CHRd)r-杂环基和-(CHRd)r-苯基;
R6a独立选自H、C1-4烷基和-(CH2)r-苯基;
Rb在每次出现时独立为C1-6烷基;
Rc在每次出现时独立为C1-6烷基;
Re在每次出现时独立选自C1-6烷基、F、Cl和Br;
p在每次出现时独立选自0和2;且
r在每次出现时独立为0。
11.一种化合物或其立体异构体或药用盐,所述化合物选自:
4-[4-(2-氧代-3-苯基吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-3-苯基咪唑烷-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-{4-[3-(2,3-二氢-1H-吲哚-1-羰基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-4-苯基吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-{4-[3-(2,3-二氢-1H-异吲哚-2-羰基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐;
2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]-N-苯基吡咯烷-3-甲酰胺;
N-苄基-2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-甲酰胺;
4-[4-(1-苄基-2-氧代吡咯烷-3-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-1-苯基吡咯烷-3-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(3-苄基-2-氧代咪唑烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-{4-[2-氧代-3-(吡啶-3-基)咪唑烷-1-基]苯基}-1,2-二氢酞嗪-1-酮;
4-{4-[2-氧代-3-(吡啶-2-基)咪唑烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-[4-(5-苄基-2-氧代-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-[4-(2-氧代-4-苯基-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-5-苯基-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮;
N-({2-氧代-3-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]-1,3-噁唑烷-5-基}甲基)氨基甲酸叔丁酯;
4-[4-(2-氧代-5-丙基-1,3-噁唑烷-3-基)苯基]-1,2-二氢酞嗪-1-酮;
N-({2-氧代-3-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]-1,3-噁唑烷-5-基}甲基)苯甲酰胺;
4-{4-[5-(4-氟苯基)-2-氧代-1,3-噁唑烷-3-基]苯基}-1,2-二氢酞嗪-1-酮;
4-(4-{5-[(4-甲烷磺酰基苯基)甲基]-2-氧代-1,3-噁唑烷-3-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-八氢-1,3-苯并噁唑-3-基)苯基]-1,2-二氢酞嗪-1-酮;
4-{4-[2-氧代-5-(2,2,2-三氟-1-羟基-1-苯基乙基)-1,3-噁唑烷-3-基]苯基}-1,2-二氢酞嗪-1-酮;
4-{4-[(4R,5S)-5-甲基-2-氧代-4-苯基-1,3-噁唑烷-3-基]苯基}-1,2-二氢酞嗪-1-酮;
4-{4-[3-(吗啉-4-基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮;
4-{4-[3-(苄基氨基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-(4-{3-[(3-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-{4-[2-氧代-3-(苯基氨基)吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-{4-[3-(环戊基氨基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-(4-{3-[(2,3-二氢-1H-茚-2-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2-乙基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(3-氟-5-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2H-1,3-苯并二氧杂环戊烯-5-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(3-环丙基-1-甲基-1H-吡唑-5-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(3-环丙基-5-甲基-1H-吡唑-4-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2-氟-5-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(3-甲氧基-5-甲基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-(4-{2-氧代-3-[(1-苯基-1H-吡唑-4-基)氨基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2,4-二氟-3-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(4-苄基-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-(4-{3-[(4-氟-3-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(3-乙氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[(1R)-1-(3-甲氧基苯基)乙基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-(4-{2-氧代-3-[(2-苯基乙基)氨基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{4-[(3-甲氧基苯基)甲基]-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-苄基-1-(4-{4-氧代-3H,4H-吡咯并[1,2-d][1,2,4]三嗪-1-基}苯基)-4,5-二氢-1H-1,2,4-三唑-5-酮;
4-[4-(3-{[3-甲氧基-4-(4-甲基哌嗪-1-基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[3-甲氧基-4-(吗啉-4-基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2,2-二氟-2H-1,3-苯并二氧杂环戊烯-5-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-3-{[3-(三氟甲氧基)苯基]氨基}吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-(4-{4-[(3-氟苯基)甲基]-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-{4-[5-氧代-4-(1-苯基乙基)-4,5-二氢-1H-1,2,4-三唑-1-基]苯基}-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-3-{[3-(丙-2-基氧基)苯基]氨基}吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢异喹啉-1-酮;
2-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-1,3-噻唑-5-甲腈;
4-[4-(3-{[4-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-(4-{3-[(2-甲氧基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮三氟乙酸盐;
7-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-3,4-二氢-2H-1,4-苯并噁嗪-3-酮;
4-[4-(4-{[3-(二氟甲氧基)苯基]甲基}-5-氧代-4,5-二氢-1H-1,2,4-三唑-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-[4-(2-氧代-3-{[1-(丙-2-基)-1H-吡唑-3-基]氨基}吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(1-甲基-1H-吡唑-3-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(2-甲基-1,3-苯并噻唑-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(3-甲烷磺酰基苯基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-[4-(3-{[3-(甲基硫基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮;
4-(4-{3-[(6-氟吡啶-2-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-(4-{2-氧代-3-[(1,2,3,4-四氢异喹啉-6-基)氨基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[1-甲基-3-(丙-2-基)-1H-吡唑-5-基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-[(3-甲氧基苯基)甲基]-3-甲基-1-(4-{4-氧代-3aH,4H,5H,7aH-噻吩并[3,2-c]吡啶-7-基}苯基)-4,5-二氢-1H-1,2,4-三唑-5-酮三氟乙酸盐;
4-(4-{2-氧代-3-[3-(三氟甲氧基)苯氧基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
2-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)吡啶-4-甲腈三氟乙酸盐;
4-(4-{3-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-[4-(3-{[3-(二氟甲氧基)苯基]氨基}-2-氧代吡咯烷-1-基)苯基]-1,2-二氢异喹啉-1-酮;
4-(4-{3-[(2-甲基-1,3-苯并噻唑-6-基)氨基]-2-氧代吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
7-({2-氧代-1-[4-(4-氧代-3,4-二氢酞嗪-1-基)苯基]吡咯烷-3-基}氨基)-3,4-二氢-2H-1,4-苯并噁嗪-3-酮;
4-(4-{2-氧代-3-[3-(三氟甲氧基)苯氧基]吡咯烷-1-基}苯基)-1,2-二氢酞嗪-1-酮;
4-{4-[3-(3-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮三氟乙酸盐;
4-{4-[3-(2-氟-5-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮;
4-{4-[3-(4-氟-3-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮;和
4-{4-[3-(3-氟-5-甲氧基苯氧基)-2-氧代吡咯烷-1-基]苯基}-1,2-二氢酞嗪-1-酮。
12.一种药物组合物,其包含一种或多种权利要求1-11中任一项的化合物或其立体异构体或药用盐和药用载体或稀释剂。
13.权利要求1-11中任一项的化合物或其立体异构体或药用盐在制备用于预防和/或治疗与异常Rho激酶活性相关的病症的药物中的用途。
14.权利要求13的用途,其中所述病症选自心血管病症、平滑肌相关病症、纤维化疾病、炎性疾病、神经病症、肿瘤病症和自身免疫病症。
15.权利要求14的用途,其中所述心血管病症选自心绞痛、动脉粥样硬化、心力衰竭、冠状动脉疾病、心肌梗塞、外周血管疾病、狭窄、血管痉挛、高血压和肺动脉高压。
16.权利要求13的用途,其中所述疾病为中风。
17.权利要求13的用途,其中所述疾病为脑血管疾病。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662359341P | 2016-07-07 | 2016-07-07 | |
| US62/359,341 | 2016-07-07 | ||
| PCT/US2017/040846 WO2018009622A1 (en) | 2016-07-07 | 2017-07-06 | Lactam, cyclic urea and carbamate, and triazolone derivatives as potent and selective rock inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN110049977A CN110049977A (zh) | 2019-07-23 |
| CN110049977B true CN110049977B (zh) | 2022-01-18 |
Family
ID=59351142
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780054580.4A Active CN110049977B (zh) | 2016-07-07 | 2017-07-06 | 作为强效和选择性rock抑制剂的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US10730858B2 (zh) |
| EP (1) | EP3481816B1 (zh) |
| JP (2) | JP6903731B2 (zh) |
| KR (1) | KR102473481B1 (zh) |
| CN (1) | CN110049977B (zh) |
| ES (1) | ES2814325T3 (zh) |
| WO (1) | WO2018009622A1 (zh) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UY37073A (es) | 2016-01-13 | 2017-07-31 | Bristol-Myers Squibb Company Una Corporación Del Estado De Delaware | Salicilamidas espiroheptanos y compuestos relacionados como inhibidores de rock, y las composiciones que los contienen |
| WO2017205709A1 (en) | 2016-05-27 | 2017-11-30 | Bristol-Myers Squibb Company | Triazolones and tetrazolones as inhibitors of rock |
| JP7155102B2 (ja) | 2016-07-07 | 2022-10-18 | ブリストル-マイヤーズ スクイブ カンパニー | Rock阻害剤としてのスピロ縮合環尿素 |
| US10696674B2 (en) | 2016-07-07 | 2020-06-30 | Bristol-Myers Squibb Company | Spirolactams as inhibitors of ROCK |
| JP7191826B2 (ja) | 2016-11-30 | 2022-12-19 | ブリストル-マイヤーズ スクイブ カンパニー | 三環式rhoキナーゼ阻害剤 |
| KR102644889B1 (ko) | 2017-07-12 | 2024-03-06 | 브리스톨-마이어스 스큅 컴퍼니 | Rock 억제제로서의 스피로헵타닐 히단토인 |
| JP7234201B2 (ja) | 2017-07-12 | 2023-03-07 | ブリストル-マイヤーズ スクイブ カンパニー | 心不全の治療のためのrockの5員アミノヘテロ環および5,6-または6,6員二環式アミノヘテロ環の阻害剤 |
| US12060341B2 (en) | 2017-07-12 | 2024-08-13 | Bristol-Myers Squibb Company | Spiroheptanyl hydantoins as ROCK inhibitors |
| TW201908293A (zh) | 2017-07-12 | 2019-03-01 | 美商必治妥美雅史谷比公司 | 作為rock抑制劑之5員及雙環雜環醯胺 |
| ES2951212T3 (es) | 2017-07-12 | 2023-10-18 | Bristol Myers Squibb Co | Fenilacetamidas como inhibidores de ROCK |
| EP3704121B1 (en) | 2017-11-03 | 2022-12-21 | Bristol-Myers Squibb Company | Diazaspiro rock inhibitors |
| US11248004B2 (en) | 2018-11-06 | 2022-02-15 | Cervello Therapeutics, Llc. | Substituted isoquinolines as rock kinase inhibitors |
| JP2022506572A (ja) | 2018-11-06 | 2022-01-17 | サーベロ・セラピューティクス・エル・エル・シー | Rockキナーゼ阻害剤 |
| EP4025570A4 (en) * | 2019-09-06 | 2022-11-02 | ONO Pharmaceutical Co., Ltd. | HYDANTOINDIVATIVES |
| US11691971B2 (en) | 2020-06-19 | 2023-07-04 | Incyte Corporation | Naphthyridinone compounds as JAK2 V617F inhibitors |
| WO2021257863A1 (en) | 2020-06-19 | 2021-12-23 | Incyte Corporation | Pyrrolotriazine compounds as jak2 v617f inhibitors |
| WO2022006456A1 (en) | 2020-07-02 | 2022-01-06 | Incyte Corporation | Tricyclic pyridone compounds as jak2 v617f inhibitors |
| IL299612A (en) | 2020-07-02 | 2023-03-01 | Incyte Corp | Tricyclic urea compounds as JAK2 V617F inhibitors |
| US11661422B2 (en) | 2020-08-27 | 2023-05-30 | Incyte Corporation | Tricyclic urea compounds as JAK2 V617F inhibitors |
| US11919908B2 (en) | 2020-12-21 | 2024-03-05 | Incyte Corporation | Substituted pyrrolo[2,3-d]pyrimidine compounds as JAK2 V617F inhibitors |
| EP4298099A1 (en) | 2021-02-25 | 2024-01-03 | Incyte Corporation | Spirocyclic lactams as jak2 v617f inhibitors |
| CA3237199A1 (en) | 2021-11-02 | 2023-05-11 | Flare Therapeutics Inc. | Pparg inverse agonists and uses thereof |
| JPWO2023085369A1 (zh) | 2021-11-11 | 2023-05-19 | ||
| AU2023235313A1 (en) | 2022-03-17 | 2024-10-03 | Incyte Corporation | Tricyclic urea compounds as jak2 v617f inhibitors |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105073741A (zh) * | 2013-01-18 | 2015-11-18 | 百时美施贵宝公司 | 作为rock抑制剂的酞嗪酮及异喹啉酮 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1713775A4 (en) | 2004-01-30 | 2009-08-12 | Smithkline Beecham Corp | CHEMICAL COMPOUNDS |
| JP2008514636A (ja) | 2004-09-28 | 2008-05-08 | アンジオン バイオメディカ コーポレイション | サイトカイン活性の低分子モジュレーター |
| NZ598352A (en) * | 2006-12-28 | 2013-08-30 | Abbott Lab | Inhibitors of poly(adp-ribose)polymerase |
| JP6423372B2 (ja) | 2013-02-28 | 2018-11-14 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 強力なrock1およびrock2阻害剤としてのフェニルピラゾール誘導体 |
| DK2986611T3 (da) | 2013-04-18 | 2019-05-06 | Shanghai Fochon Pharmaceutical Co Ltd | Bestemte proteinkinaseinhibitorer |
| JP6522602B2 (ja) | 2013-07-02 | 2019-05-29 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | Rock阻害剤としての三環式ピリド−カルボキサミド誘導体 |
| ES2633987T3 (es) | 2013-07-02 | 2017-09-26 | Bristol-Myers Squibb Company | Derivados de pirido-carboxamidas tricíclicas como inhibidores de ROCK |
| US9902702B2 (en) * | 2014-07-15 | 2018-02-27 | Bristol-Myers Squibb Company | Spirocycloheptanes as inhibitors of rock |
| ES2838573T3 (es) | 2014-08-21 | 2021-07-02 | Bristol Myers Squibb Co | Derivados de benzamida ligados como inhibidores potentes de ROCK |
| ES2815681T3 (es) * | 2015-01-09 | 2021-03-30 | Bristol Myers Squibb Co | Ureas cíclicas como inhibidores de ROCK |
| EP3268360B1 (en) | 2015-03-09 | 2019-04-24 | Bristol-Myers Squibb Company | Lactams as inhibitors of rock |
| UY37073A (es) | 2016-01-13 | 2017-07-31 | Bristol-Myers Squibb Company Una Corporación Del Estado De Delaware | Salicilamidas espiroheptanos y compuestos relacionados como inhibidores de rock, y las composiciones que los contienen |
| WO2017205709A1 (en) | 2016-05-27 | 2017-11-30 | Bristol-Myers Squibb Company | Triazolones and tetrazolones as inhibitors of rock |
| US10696674B2 (en) | 2016-07-07 | 2020-06-30 | Bristol-Myers Squibb Company | Spirolactams as inhibitors of ROCK |
| JP7155102B2 (ja) | 2016-07-07 | 2022-10-18 | ブリストル-マイヤーズ スクイブ カンパニー | Rock阻害剤としてのスピロ縮合環尿素 |
| JP7191826B2 (ja) | 2016-11-30 | 2022-12-19 | ブリストル-マイヤーズ スクイブ カンパニー | 三環式rhoキナーゼ阻害剤 |
-
2017
- 2017-07-06 KR KR1020197003126A patent/KR102473481B1/ko active IP Right Grant
- 2017-07-06 CN CN201780054580.4A patent/CN110049977B/zh active Active
- 2017-07-06 US US16/315,674 patent/US10730858B2/en active Active
- 2017-07-06 JP JP2019500450A patent/JP6903731B2/ja active Active
- 2017-07-06 EP EP17740240.1A patent/EP3481816B1/en active Active
- 2017-07-06 WO PCT/US2017/040846 patent/WO2018009622A1/en unknown
- 2017-07-06 ES ES17740240T patent/ES2814325T3/es active Active
-
2021
- 2021-06-23 JP JP2021103777A patent/JP7225317B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105073741A (zh) * | 2013-01-18 | 2015-11-18 | 百时美施贵宝公司 | 作为rock抑制剂的酞嗪酮及异喹啉酮 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019520402A (ja) | 2019-07-18 |
| US20190300510A1 (en) | 2019-10-03 |
| KR20190025960A (ko) | 2019-03-12 |
| EP3481816B1 (en) | 2020-06-24 |
| JP7225317B2 (ja) | 2023-02-20 |
| KR102473481B1 (ko) | 2022-12-01 |
| EP3481816A1 (en) | 2019-05-15 |
| CN110049977A (zh) | 2019-07-23 |
| US10730858B2 (en) | 2020-08-04 |
| JP2021152061A (ja) | 2021-09-30 |
| JP6903731B2 (ja) | 2021-07-14 |
| WO2018009622A1 (en) | 2018-01-11 |
| ES2814325T3 (es) | 2021-03-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN110049977B (zh) | 作为强效和选择性rock抑制剂的内酰胺、环状脲和氨基甲酸酯及三唑酮衍生物 | |
| JP6770053B2 (ja) | Rock阻害剤としてのフタラジノンおよびイソキノリノン | |
| CN109153663B (zh) | 作为rock抑制剂的三唑酮类化合物和四唑酮类化合物 | |
| CN109661396B (zh) | 作为rock抑制剂的螺稠合环状脲 | |
| CN109689639B (zh) | 作为rock抑制剂的螺内酰胺 | |
| EP3268360B1 (en) | Lactams as inhibitors of rock | |
| CN107108581B (zh) | 作为强效rock抑制剂的回接苯甲酰胺衍生物 | |
| CN107406426B (zh) | 作为rock抑制剂的环状脲类 | |
| EP3704121B1 (en) | Diazaspiro rock inhibitors | |
| CN110869361B (zh) | 用于治疗心力衰竭的rock的五元氨基杂环和5,6元或6,6元双环氨基杂环抑制剂 | |
| WO2014134388A1 (en) | Phenylpyrazole derivatives as potent rock1 and rock2 inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |