CN108912077B - 一种手性苯酞衍生物的制备方法 - Google Patents
一种手性苯酞衍生物的制备方法 Download PDFInfo
- Publication number
- CN108912077B CN108912077B CN201810942158.9A CN201810942158A CN108912077B CN 108912077 B CN108912077 B CN 108912077B CN 201810942158 A CN201810942158 A CN 201810942158A CN 108912077 B CN108912077 B CN 108912077B
- Authority
- CN
- China
- Prior art keywords
- branched
- group
- straight
- linear
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000002360 preparation method Methods 0.000 title claims abstract description 12
- 125000005506 phthalide group Chemical class 0.000 title claims abstract 4
- 239000001257 hydrogen Substances 0.000 claims abstract description 56
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 56
- 238000005984 hydrogenation reaction Methods 0.000 claims abstract description 43
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 36
- 238000006722 reduction reaction Methods 0.000 claims abstract description 23
- 229910052741 iridium Inorganic materials 0.000 claims abstract description 22
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 claims abstract description 21
- 150000001875 compounds Chemical class 0.000 claims abstract description 12
- 239000003960 organic solvent Substances 0.000 claims abstract description 8
- 125000000217 alkyl group Chemical group 0.000 claims description 80
- 238000000034 method Methods 0.000 claims description 54
- 229910052736 halogen Inorganic materials 0.000 claims description 40
- 150000002367 halogens Chemical class 0.000 claims description 40
- 125000003545 alkoxy group Chemical group 0.000 claims description 33
- 125000001424 substituent group Chemical group 0.000 claims description 26
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical group ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 24
- 125000001188 haloalkyl group Chemical group 0.000 claims description 21
- 125000004104 aryloxy group Chemical group 0.000 claims description 20
- 239000000460 chlorine Substances 0.000 claims description 20
- 150000002431 hydrogen Chemical class 0.000 claims description 20
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 18
- 229910052801 chlorine Inorganic materials 0.000 claims description 18
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 17
- 229910052799 carbon Inorganic materials 0.000 claims description 17
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 14
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 12
- 125000003118 aryl group Chemical group 0.000 claims description 12
- 229910052731 fluorine Inorganic materials 0.000 claims description 12
- 239000011737 fluorine Substances 0.000 claims description 12
- 229910052794 bromium Inorganic materials 0.000 claims description 11
- 125000001072 heteroaryl group Chemical group 0.000 claims description 11
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 10
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 10
- 125000005842 heteroatom Chemical group 0.000 claims description 9
- 125000004432 carbon atom Chemical group C* 0.000 claims description 8
- 229910052757 nitrogen Inorganic materials 0.000 claims description 8
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 6
- 229910052717 sulfur Inorganic materials 0.000 claims description 6
- 229910052760 oxygen Inorganic materials 0.000 claims description 5
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 5
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 3
- 239000011541 reaction mixture Substances 0.000 claims description 3
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 claims description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 2
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 2
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 claims description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 2
- 125000001624 naphthyl group Chemical group 0.000 claims description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 2
- 125000001544 thienyl group Chemical group 0.000 claims description 2
- 230000015572 biosynthetic process Effects 0.000 abstract description 50
- 238000003786 synthesis reaction Methods 0.000 abstract description 49
- 238000006243 chemical reaction Methods 0.000 abstract description 35
- 239000000758 substrate Substances 0.000 abstract description 13
- 239000000654 additive Substances 0.000 abstract description 5
- 239000006227 byproduct Substances 0.000 abstract description 4
- 239000003513 alkali Substances 0.000 abstract description 3
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 128
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 81
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 75
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 74
- 239000000047 product Substances 0.000 description 42
- 238000004296 chiral HPLC Methods 0.000 description 39
- 238000005160 1H NMR spectroscopy Methods 0.000 description 38
- 238000000825 ultraviolet detection Methods 0.000 description 35
- WNZQDUSMALZDQF-UHFFFAOYSA-N 2-benzofuran-1(3H)-one Chemical class C1=CC=C2C(=O)OCC2=C1 WNZQDUSMALZDQF-UHFFFAOYSA-N 0.000 description 32
- 238000002844 melting Methods 0.000 description 29
- 230000008018 melting Effects 0.000 description 29
- 239000007787 solid Substances 0.000 description 29
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 20
- 239000002904 solvent Substances 0.000 description 13
- -1 (S) -3-n-Butylphthalide ((S) -3-Butylphthalide) Chemical compound 0.000 description 9
- 239000003446 ligand Substances 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 7
- 238000005481 NMR spectroscopy Methods 0.000 description 7
- 150000002503 iridium Chemical class 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 238000004293 19F NMR spectroscopy Methods 0.000 description 5
- 239000012300 argon atmosphere Substances 0.000 description 5
- 238000011160 research Methods 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 239000011261 inert gas Substances 0.000 description 4
- 238000010926 purge Methods 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 239000000741 silica gel Substances 0.000 description 4
- 229910002027 silica gel Inorganic materials 0.000 description 4
- NHFAABIHBNXKDT-UHFFFAOYSA-N 4,5-dihydro-1,3-oxazole;phosphane Chemical compound P.C1CN=CO1 NHFAABIHBNXKDT-UHFFFAOYSA-N 0.000 description 3
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- HJXMNVQARNZTEE-UHFFFAOYSA-N Butylphthalide Chemical compound C1=CC=C2C(CCCC)OC(=O)C2=C1 HJXMNVQARNZTEE-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 230000000996 additive effect Effects 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 150000008282 halocarbons Chemical class 0.000 description 3
- 239000007791 liquid phase Substances 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- KSJWJETYRIELOC-UHFFFAOYSA-N 3-heptyl-4,5,6-trihydroxy-3h-2-benzofuran-1-one Chemical compound OC1=C(O)C(O)=C2C(CCCCCCC)OC(=O)C2=C1 KSJWJETYRIELOC-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 239000003849 aromatic solvent Substances 0.000 description 2
- 238000011914 asymmetric synthesis Methods 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- SISAYUDTHCIGLM-UHFFFAOYSA-N bromine dioxide Inorganic materials O=Br=O SISAYUDTHCIGLM-UHFFFAOYSA-N 0.000 description 2
- 244000309464 bull Species 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 230000007547 defect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 238000003912 environmental pollution Methods 0.000 description 2
- 238000003818 flash chromatography Methods 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 229930014626 natural product Natural products 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- FANCTJAFZSYTIS-IQUVVAJASA-N (1r,3s,5z)-5-[(2e)-2-[(1r,3as,7ar)-7a-methyl-1-[(2r)-4-(phenylsulfonimidoyl)butan-2-yl]-2,3,3a,5,6,7-hexahydro-1h-inden-4-ylidene]ethylidene]-4-methylidenecyclohexane-1,3-diol Chemical compound C([C@@H](C)[C@@H]1[C@]2(CCCC(/[C@@H]2CC1)=C\C=C\1C([C@@H](O)C[C@H](O)C/1)=C)C)CS(=N)(=O)C1=CC=CC=C1 FANCTJAFZSYTIS-IQUVVAJASA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- VYXHVRARDIDEHS-UHFFFAOYSA-N 1,5-cyclooctadiene Chemical compound C1CC=CCCC=C1 VYXHVRARDIDEHS-UHFFFAOYSA-N 0.000 description 1
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 1
- QGHNDAKWOGAJHS-UHFFFAOYSA-N 2-Phenylbutyrolactone Chemical compound O=C1OCCC1C1=CC=CC=C1 QGHNDAKWOGAJHS-UHFFFAOYSA-N 0.000 description 1
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 1
- VXRIEWIAVSRHJN-UHFFFAOYSA-N 4,5-dihydroxy-3,7,7-trimethyl-8,9-dihydro-3h-furo[3,4-f]chromen-1-one Chemical compound O1C(C)(C)CCC2=C1C(O)=C(O)C1=C2C(=O)OC1C VXRIEWIAVSRHJN-UHFFFAOYSA-N 0.000 description 1
- WDYVUKGVKRZQNM-UHFFFAOYSA-N 6-phosphonohexylphosphonic acid Chemical compound OP(O)(=O)CCCCCCP(O)(O)=O WDYVUKGVKRZQNM-UHFFFAOYSA-N 0.000 description 1
- 201000006474 Brain Ischemia Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 206010008120 Cerebral ischaemia Diseases 0.000 description 1
- JZUTXVTYJDCMDU-MOPGFXCFSA-N Hydrastine Chemical compound CN1CCC2=CC=3OCOC=3C=C2[C@@H]1[C@@H]1C2=CC=C(OC)C(OC)=C2C(=O)O1 JZUTXVTYJDCMDU-MOPGFXCFSA-N 0.000 description 1
- 238000003820 Medium-pressure liquid chromatography Methods 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- KUXDQQMEFBFTGX-UHFFFAOYSA-N [N].P Chemical compound [N].P KUXDQQMEFBFTGX-UHFFFAOYSA-N 0.000 description 1
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000009876 asymmetric hydrogenation reaction Methods 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 230000002210 biocatalytic effect Effects 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 239000002327 cardiovascular agent Substances 0.000 description 1
- 229940125692 cardiovascular agent Drugs 0.000 description 1
- 238000010523 cascade reaction Methods 0.000 description 1
- 239000012018 catalyst precursor Substances 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- OSVXSBDYLRYLIG-UHFFFAOYSA-N chlorine dioxide Inorganic materials O=Cl=O OSVXSBDYLRYLIG-UHFFFAOYSA-N 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 238000007273 lactonization reaction Methods 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000004983 proton decoupled 13C NMR spectroscopy Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- AKPACZKSSWMEGD-UHFFFAOYSA-N vermistatin Natural products COc1cc(OC)c2c(c1)C(=O)OC2(C)C3=COC(=CC3=O)C=CC AKPACZKSSWMEGD-UHFFFAOYSA-N 0.000 description 1
- YORFGPDHNOBVBM-BDUNBXCCSA-N vermistatin Chemical compound C1([C@@H]2OC(=O)C=3C=C(C=C(OC)C=32)OC)=COC(\C=C\C)=CC1=O YORFGPDHNOBVBM-BDUNBXCCSA-N 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/87—Benzo [c] furans; Hydrogenated benzo [c] furans
- C07D307/88—Benzo [c] furans; Hydrogenated benzo [c] furans with one oxygen atom directly attached in position 1 or 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/92—Naphthofurans; Hydrogenated naphthofurans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本发明公开了一种如式II所示的手性苯酞衍生物的制备方法。本发明的制备方法包括以下步骤:有机溶剂中,在铱络合物的作用下,如式I所示化合物与氢气进行如下所示的氢化还原反应,即可;本发明的制备方法无需碱及添加剂的参与,反应条件温和,操作简便,底物适用范围广,无副产物形成,立体选择性好,产率高,合成效率高,经济环保,具有良好的应用前景。
Description
技术领域
本发明涉及一种手性苯酞衍生物的制备方法。
背景技术
苯酞衍生物是指分子结构中含有苯并丁内酯这一结构单元的一类化合物,该结构单元经常出现在具有生物活性及药用价值的天然产物中,并作为关键中间体用于碳环及杂环的合成。研究表明,很多3-位取代的手性苯酞衍生物具有抗菌、抗肿瘤等多种生物活性,因此具有较好的药用价值,如下所示。例如,Fuscinarin可干扰HIV进入人类主体细胞[J.Nat.Prod.2003,66,1116]。(-)-Hydrastine具有抗癌活性并处于临床一期的试验中[J.Biol.Chem.2002,277,39777]。Vermistatin和alcyopterosin E表现出良好的细胞毒性[J.Org.Chem.2000,65,4482]。Cytosporone E[Org.Lett.2000,2,4043]和CJ-12954[Antibiot.1997,50,833]具有良好的抗菌抗肿瘤活性。(S)-3-正丁基苯酞((S)-3-Butylphthalide),作为中药中的一种有效成分,已经作为药物上市,它能够有效的预防和治疗脑缺血所引发的疾病[a)Pharm.Bull.1963,11,1317;b)Drug Metab.Dispos.2013,41,430]。
研究表明,手性分子的生物活性常常取决于其立体化学构型,因此近些年来,光学活性的手性苯酞衍生物相关研究备受关注,相应的不对称合成方法研究也引起广泛兴趣。到目前为止,光学活性的手性苯酞化合物主要通过以下几种途径获得:
一、外消旋苯酞化合物通过手性HPLC拆分[邹杨靖华;张迎新;冯亦璞.CN99109673.8],得到相应的光学纯手性苯酞化合物。该方法的缺陷是原子经济性较低,仪器设备操作复杂。
二、利用手性硼氢试剂进行还原[Tetrahedron Lett.1996,37,2205]。该过程需要消耗化学计量甚至过量的手性硼氢还原试剂,价格昂贵,且对操作要求较高,难以放大合成,且产生较多副产物造成环境负担。
三、利用生物催化不对称还原的方法[Tetrahedron Lett.1997,38,3765],但该方法底物适用性较窄,对于某种微生物催化只适用于少数特定底物的转化。
四、通过对2-酰基取代的苯甲酸酯进行羰基的还原和内酯化串联反应合成相应的手性苯酞化合物[Tetrahedron Lett.1990,31,5509;Org.Lett.2009,20,4712;Angew.Chem.2011,123,7467;Angew.Chem.,Int.Ed.2011,50,7329]。
五、利用在底物结构中引入手性辅基,在苯酞化合物合成的反应中进行不对称诱导,从而制备相应的手性苯酞化合物[Chem.Pharm.Bull.1991,39,3136;Synthesis 1992,681;Tetrahedron 2006,62,10400]。该类过程须经历手性辅基的引入和脱除的步骤,使得合成路线较为繁琐,且增大了工艺成本和环境污染。
因此,发展更加高效高选择性的手性苯酞化合物的创新不对称合成方法,具有重要的实用价值。
发明内容
本发明所要解决的技术问题是克服现有的手性苯酞衍生物的不对称合成方法中原子经济性低,有副产物生成,反应条件严苛,操作复杂,底物适应性低,成本高,环境污染等缺陷,而提供了一种手性苯酞衍生物的制备方法。该方法无需碱及添加剂的参与,反应条件温和,操作简便,底物适用范围广,无副产物形成,立体选择性好,产率高,合成效率高,经济环保,具有良好的应用前景。
本发明主要是通过以下技术方案解决上述技术问题的。
本发明提供了一种如式II所示的苯酞衍生物的制备方法,其包括下述步骤:有机溶剂中,在铱络合物作用下,如式I所示化合物与氢气进行如下所示氢化还原反应,即可;
其中,
以“*1”标记的碳原子为(R)或(S)构型的碳原子;
以“*2”标记的碳原子为(R)、(S)构型或非手性的碳原子;
R1和R2独立地选自氢、C1~C20直链或支链的烷基、C4~C24的杂芳基、取代或未取代的C6~C24的芳基、取代或未取代的C6~C24的芳氧基或-(CH2)n-OR7;其中,所述的杂芳基中的杂原子选自O、N和S,杂原子个数为1、2、3或4;n为1~8的整数;所述R7为C1~C10直链或支链的烷基;所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基选自下列基团中的一个或多个(例如1-6,优选2-4):C1~C10直链或支链的烷基、C1~C10直链或支链的烷氧基、C1-C6的直链或支链的卤代烷基或卤素;当取代基为多个时,所述的取代基相同或不同;
R3、R4、R5和R6独立地选自氢、卤素、羟基、C1-C6的直链或支链的卤代烷基、C1~C20直链或支链的烷基、C1~C20直链或支链的烷氧基或C6~C24的芳基;
或R3与R4和与其相连的碳一起形成C6~C24的芳环;
或R4与R5和与其相连的碳一起形成C6~C24的芳环。
在本发明一优选实施方案中,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1~C10直链或支链的烷基时,所述C1~C10直链或支链的烷基优选C1~C4直链或支链的烷基,更优选甲基。
在本发明一优选实施方案中,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1~C10直链或支链的烷氧基时,所述C1~C10直链或支链的烷氧基优选C1~C4直链或支链的烷氧基,更优选甲氧基。
在本发明一优选实施方案中,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1-C6的直链或支链的卤代烷基时,所述的C1-C6直链或支链的卤代烷基优选C1-C3直链或支链的卤代烷基,更优选三氟甲基。
在本发明一优选实施方案中,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为卤素时,所述卤素优选氟、氯或溴,更优选氟或氯。
在本发明一优选实施方案中,当R1为C1~C20直链或支链的烷基时,所述C1~C20直链或支链的烷基优选C1~C10直链或支链的烷基,更优选C1~C8直链或支链的烷基,进一步优选甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、正己基或正庚基。
在本发明一优选实施方案中,当R1为C4~C24的杂芳基时,所述的杂芳基中的杂原子选自O、N和S,杂原子个数为1或2,优选C4~C6的杂芳基,更优选噻吩基。
在本发明一优选实施方案中,当R1为取代或未取代的C6~C24的芳基时,所述C6~C24的芳基优选C6~C10的芳基,更优选苯基或萘基。
在本发明一优选实施方案中,当R1为取代或未取代的C6~C24的芳氧基时,所述C6~C24的芳氧基优选C6~C10的芳氧基,更优选苯氧基。
在本发明一优选实施方案中,当R1为-(CH2)n-OR7时,n优选1~4的整数,更优选1。其中,所述R7优选C1~C10直链或支链的烷基,进一步优选C1~C4直链或支链的烷基,更优选甲基。
在本发明一优选实施方案中,当R2为C1~C20直链或支链的烷基时,所述C1~C20直链或支链的烷基优选C1~C4直链或支链的烷基,更优选甲基。
在本发明一优选实施方案中,当R3为卤素时,所述卤素优选氟、氯或溴,更优选氯。
在本发明一优选实施方案中,当R3为C1-C6的直链或支链的卤代烷基时,所述C1-C6的直链或支链的卤代烷基优选C1-C3的直链或支链的卤代烷基,更优选三氟甲基。
在本发明一优选实施方案中,当R3为C1~C20直链或支链的烷基时,所述C1~C20直链或支链的烷基优选C1~C4直链或支链的烷基,更优选甲基。
在本发明一优选实施方案中,当R3为C1~C20直链或支链的烷氧基时,所述C1~C20直链或支链的烷氧基优选C1~C4直链或支链的烷氧基,更优选甲氧基。
在本发明一优选实施方案中,当R3为C6~C24的芳基时,所述C6~C24的芳基优选C6~C10的芳基,更优选苯基。
在本发明一优选实施方案中,当R4为卤素时,所述卤素优选氟、氯或溴。
在本发明一优选实施方案中,当R5为卤素时,所述卤素优选氟、氯或溴,更优选氯。
在本发明一优选实施方案中,当R5为C1~C20直链或支链的烷氧基时,所述C1~C20直链或支链的烷氧基优选C1~C4直链或支链的烷氧基,更优选甲氧基。
在本发明一优选实施方案中,当R6为卤素时,所述卤素优选氟、氯、溴或碘,更优选氯。
在本发明一优选实施方案中,R3与R4和与其相连的碳一起形成C1~C10的芳环,优选苯环。
在本发明一优选实施方案中,R4与R5和与其相连的碳一起形成C1~C10的芳环,优选苯环。
在本发明一优选实施方案中,其中,
R1选自氢、C1~C20直链或支链的烷基、C4~C24的杂芳基、取代或未取代的C6~C24的芳基、取代或未取代的C6~C24的芳氧基或-(CH2)n-OR7;其中,所述的杂芳基中的杂原子选自O、N和S,杂原子个数为1、2、3或4;n为1~8的整数;所述R7为C1~C10直链或支链的烷基;所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基选自下列基团中的一个或多个(例如1-6,优选2-4):C1~C10直链或支链的烷基、C1~C10直链或支链的烷氧基、C1-C6的直链或支链的卤代烷基或卤素;当取代基为多个时,所述的取代基相同或不同;
R2选自氢或C1~C20直链或支链的烷基;
R3选自氢、卤素、羟基、C1-C6的直链或支链的卤代烷基、C1~C20直链或支链的烷基、C1~C20直链或支链的烷氧基或C6~C24的芳基;
R4选自氢或卤素;
R5选自氢、卤素或C1~C20直链或支链的烷氧基;
R6选自氢、卤素或羟基。
或R3与R4和与其相连的碳一起形成C6~C24的芳环;
或R4与R5和与其相连的碳一起形成C6~C24的芳环。
在本发明一优选实施方案中,其中,
R2选自-H或-CH3;
R4选自-H、-F、-Cl或Br;
R5选自-H、-Cl或-OCH3;
R6选自-H、-OH或-Cl;
或R3与R4和与其相连的碳一起形成苯环;
或R4与R5和与其相连的碳一起形成苯环。
在本发明一优选实施方案中,R1为C1~C20直链或支链的烷基,R2、R3、R4、R5和R6为氢。
在本发明一优选实施方案中,R1为C4~C24的杂芳基,R2、R3、R4、R5和R6为氢。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳基,R2、R3、R4、R5和R6为氢。
在本发明一优选实施方案中,R1为-(CH2)n-OR7,R2、R3、R4、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R4为卤素,R2、R3、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R3为C1-C6的直链或支链的卤代烷基,R2、R4、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R3为取代或未取代的C6~C24的芳基,R2、R4、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R3为C1~C20直链或支链的烷基,R2、R4、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R3为C1~C20直链或支链的烷氧基,R2、R4、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R2和R3各自独立地为C1~C20直链或支链的烷基,R4、R5和R6为氢。
在本发明的一选实施方案中,R1为C1~C20直链或支链的烷基,R3和R5各自独立地为C1~C20直链或支链的烷氧基,R2、R4和R6为氢。
在本发明一优选实施方案中,R1为C1~C20直链或支链的烷基,R2、R3、R4和R5为氢,R6为羟基。
在本发明一优选实施方案中,R1为C1~C20直链或支链的烷基,R3与R4和与其相连的碳一起形成苯环,R2、R5和R6为氢。
在本发明一优选实施方案中,R1为C1~C20直链或支链的烷基,R4与R5和与其相连的碳一起形成苯环,R2、R3和R6为氢。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳基,R2、R3为氢,R4、R5和R6独立地为卤素。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳氧基,R2为氢,R3、R4、R5和R6独立地为卤素。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳基,R4与R5和与其相连的碳一起形成苯环,R2、R3和R6为氢。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳基,R3为C1~C20直链或支链的烷基,R2、R4、R5和R6为氢。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳基,R3为C1~C20直链或支链的烷氧基,R2、R4、R5和R6为氢。
在本发明一优选实施方案中,R1为取代或未取代的C6~C24的芳基,R3为羟基,R2、R4、R5和R6为氢。
本发明中,所述铱络合物作为催化剂,优选含有手性膦-氮双齿配体的铱络合物,进一步优选含有手性膦-噁唑啉配体的铱络合物,更优选如下所示的含有手性膦-噁唑啉配体的铱络合物中的一种或多种:
其中,R1a’、R1b’、R1c’和R1d’独立地选自C1~C10直链或支链的烷基、C3~C10的环烷基、取代或未取代的C6~C24的芳基或金刚烷基;所述取代的C6~C24的芳基的取代基为C1~C10直链或支链的烷基;所述的取代基的个数为一个或多个(例如1-6,优选2-4);当取代基为多个时,所述的取代基相同或不同;
R2a’、R2b’、R2c’、R2d’和R3’独立地选自氢、C1~C10直链或支链的烷基、C3~C10的环烷基、C1~C10直链或支链的烷氧基、C6~C36的芳基或C6~C36的芳基烷基;
X-选自BArF -、B(C6F5)4 -、PF6 -、BF4 -、CF3SO3 -或Cl-。
本发明一优选实施方案中,R1a’、R1b’、R1c’和R1d’独立地选自C3~C10的环烷基或取代或未取代的C6~C24的芳基。
在本发明一优选实施方案中,R2a’、R2b’、R2c’和R2d’独立地选自氢、C1~C10直链或支链的烷基、C6~C36的芳基或C6~C36的芳基烷基。
在本发明一优选实施方案中,当所述的取代的C6~C24的芳基的取代基为C1~C10直链或支链的烷基时,所述的C1~C10直链或支链的烷基优选C1~C4直链或支链的烷基,更优选甲基、叔丁基。
在本发明一优选实施方案中,当R1a’、R1b’、R1c’或R1d’独自地为C3~C10的环烷基时,所述C3~C10的环烷基优选C3~C6的环烷基,更优选环己基。
在本发明一优选实施方案中,当R1a’、R1b’、R1c’或R1d’独自地为取代或未取代的C6~C24的芳基时,所述C6~C24的芳基优选C6~C10的芳基,更优选苯基。
在本发明一优选实施方案中,当R2a’、R2b’、R2c’或R2d’独自地为C1~C10直链或支链的烷基时,所述C1~C10直链或支链的烷基优选C1~C4直链或支链的烷基,更优选异丙基、异丁基、仲丁基或叔丁基。
在本发明一优选实施方案中,当R2a’、R2b’、R2c’或R2d’独自地为C6~C36的芳基时,所述C6~C36的芳基优选C6~C10的芳基,更优选苯基。
在本发明一优选实施方案中,当R2a’、R2b’、R2c’或R2d’独自地为C6~C36的芳基烷基时,所述C6~C36的芳基烷基优选C6~C10的芳基烷基,更优选苄基。
在本发明一优选实施方案中,R3’为氢。
本发明一优选实施方案中,所述X-优选BArF-{Tetrakis[3,5-bis(trifluoromethyl)phenyl]borate},其结构如下所示:
本发明的一优选实施方案中,其中,
R1a’、R1b’、R1c’和R1d’独立地选自C3~C10的环烷基或取代或未取代的C6~C24的芳基;
R2a’、R2b’、R2c’和R2d’独立地选自氢、C1~C10直链或支链的烷基、C6~C36的芳基或C6~C36的芳基烷基;
R3’为氢。
本发明的一优选实施方案中,其中,
R3’为-H。
在本发明的一优选实施方案中,R1a’为取代或未取代的C6~C10的芳基,R2a’为C1~C4直链或支链的烷基。
本发明中,所述铱络合物可为以下任一铱络合物:
在本发明一优选实施方案中,所述铱络合物为铱络合物1a。
本发明中,所述如式I所示化合物与所述铱络合物的摩尔比可为本领域上述氢化还原反应常规的摩尔比,优选50~10000:1,进一步优选50~200:1。
本发明中,所述有机溶剂为醇类溶剂、醚类溶剂、卤代烃类溶剂和芳香类溶剂中的一种或多种。所述醇类溶剂优选乙醇、异丙醇和叔丁醇中的一种或多种。所述醚类溶剂优选乙醚、2-甲基四氢呋喃、二氧六环、乙二醇二甲醚和叔丁基甲基醚中的一种或多种。所述卤代烃类溶剂优选二氯甲烷、1,2-二氯乙烷和氯仿中的一种或多种。所述芳香类溶剂优选甲苯、氯苯、苯和二甲苯中的一种或多种。
在本发明一优选实施方案中,所述有机溶剂优选卤代烃类溶剂,例如二氯甲烷。
本发明中,所述如式I所示化合物在所述溶剂的摩尔浓度可为本领域上述反应常规的摩尔浓度,优选0.0025M~2M,更优选0.025M~0.2M。
本发明中,所述氢化还原反应的温度可为本领域上述氢化还原反应常规的温度,优选0~120℃,更优选25~60℃,进一步优选25℃。
本发明中,所述氢化还原反应的氢气压力可为本领域上述氢化还原反应常规的氢气压力,优选1~100大气压,更优选2~80大气压,例如2、5、10、30、50、60或80大气压。
本发明中,所述氢化还原反应的时间可为本领域上述氢化还原反应常规的反应时间,优选0.1~48小时,更优选4~24小时。
本发明中,所述氢化还原反应在加料阶段优选在惰性气体氛围中进行,所述惰性气体优选氩气或氮气。
本发明中,所述氢化还原反应包括下列步骤:惰性气体氛围中,向氢化瓶中加入铱络合物和如式I所示化合物,抽换气后加入溶剂。将体系置于高压装置中,置换氢气,充至相应的反应压力,反应即可。
本发明中,所述氢化还原反应的后处理包括下列步骤:反应结束后,放出氢气,浓缩,柱层析纯化。
本发明中,转化率根据1H NMR判断。
本发明所获得的如式II所示的手性苯酞衍生物如表1所示:
表1
本发明中,所述铱络合物及其配体市售可得或依照文献的报道完成[Angew.Chem.Int.Ed.2009,48,5345-5349;Angew.Chem.1998,110,3047;Angew.Chem.Int.Ed.1998,37,2897;J.Am.Chem.Soc.2006,128,12886]。
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
若无特殊说明,本发明所用试剂和原料均市售可得。
本发明中所用的术语“转化效率”(或简称效率)是指在化学反应中已消耗掉的反应物的量与初始加入的该反应物总量的百分比率。对于本发明中的反应,转化率是在特定条件下在某一反应时间内,所消耗的苯酞衍生物的摩尔数与初始加入的苯酞衍生物总量的摩尔数比值,用百分数表示。
本发明的积极进步效果在于:
(1)苯酞衍生物是一种非常重要的天然产物和有机合成中间体。他们中的大部分都具有显著的生物活性,其中3-丁基苯酞(2a)已经作为治疗心脑血管疾病的药物上市,溴代-3-丁基苯酞(2s)是在研二期临床心血管药物BZP的合成前体。因此,高效构建光学纯的3-取代苯酞衍生物具有重要意义;
(2)本发明首次通过对亚烷基苯酞衍生物的环外双键直接不对称氢化,实现了手性苯酞的高效合成,不仅大大缩减了路线降低了反应成本,提高了合成效率;而且反应过程不使用添加剂,绿色环保;
(3)本发明中,不对称氢化反应的起始原料合成简便,均只需一步反应,简单高效;
(4)本发明的氢化过程中,不需要外加任何碱或添加剂,条件温和,底物官能团兼容性好;
(5)本发明方法操作简便,能够高选择性高产率的制备得到高光学纯度的3-取代手性苯酞衍生物,底物适用性较好,通常没有副反应发生;
(6)本发明方法不产生废料,经济环保。
附图说明
图1为铱络合物1a的X-射线单晶衍射结构图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。以下实施例中未注明的具体实验条件通常按照本领域技术人员熟知的常规操作条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
实施例1:铱络合物及其配体的制备
铱络合物1a~1g及其配体的合成依据文献的报道完成[Angew.Chem.Int.Ed.2009,48,5345-5349],其制备方法如下所示:
在惰性气体,如氮气或氩气气氛下,将1当量的[Ir(cod)Cl2](其中所述的cod代表1,5-环辛二烯)与1~1.2当量的双齿膦-噁唑啉配体在二氯甲烷中回流两小时,冷至室温,加入1.3当量的NaBArF,室温下剧烈搅拌1h,加入水,室温搅拌1h。分出二氯甲烷层,水相用二氯甲烷萃取三次。蒸去溶剂,残余物经柱层析可得相应的铱络合物1a-1g。
铱络合物1h~1i’及其配体的合成依据文献的报道完成[a)Angew.Chem.1998,110,3047;Angew.Chem.Int.Ed.1998,37,2897;b)J.Am.Chem.Soc.2006,128,12886]。
铱络合物1j~1k由TCI处购买得到。
实施例2:2a的合成
在氩气氛围下,向一10mL氢化瓶中加入铱络合物0.002mmol,苯酞衍生物底物0.2mmol,抽换气后加入二氯甲烷2.0mL。在手套箱中,将体系置于高压釜中。高压釜置换氢气三次后,充至相应的反应压力,在25℃下反应24h。反应结束后,小心放出氢气,取少量样品经1H NMR判断转化率。反应体系经硅胶短柱过滤除去金属,用高效液相测定产物的对映选择性。产率和ee值见表2(负值表示产物构型相反)。
表2
实施例3:2a的合成
在氩气氛围下,向一10mL氢化瓶中加入铱络合物1a 0.002mmol,苯酞衍生物底物0.4mmol,抽换气后加入溶剂2.0mL。在手套箱中,将体系置于高压釜中。高压釜置换氢气三次后,充至相应的反应压力,在相应的反应温度下反应指定的时间。反应结束后,小心放出氢气,取少量样品经1H NMR判断转化率。反应体系经硅胶短柱过滤除去金属,用高效液相测定产物的对映选择性。产率和ee值见表3。
表3
实施例4:2a的合成
在氩气氛围下,向一10mL氢化瓶中加入铱络合物1a 0.002mmol,苯酞衍生物底物0.4mmol,抽换气后加入二氯甲烷2.0mL。在手套箱中,将体系置于高压釜中。高压釜置换氢气三次后,充至10atm,在25℃下反应24h。反应结束后,小心放出氢气,取少量样品经1H NMR判断转化率。反应体系经浓缩,快速柱层析纯化,得到相应的苯酞化合物2a,产率98%,ee95%。
无色液体,[α]D 20=+48.17(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.88(d,J=7.6Hz,1H),7.66(t,J=7.5Hz,1H),7.51(t,J=7.5Hz,1H),7.43(d,J=7.6Hz,1H),5.46(dd,J=7.9,4.1Hz,1H),2.10-1.98(m,2H),1.81-1.69(m,2H),1.53-1.32(m,4H),0.89(t,J=7.0Hz,3H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel AD-H column,正己烷:异丙醇=98:2,流速=1.0mL/min,紫外检测波长λ=210nm,tR=12.3min(major),tR=15.6min(minor).
实施例5:2b的合成
操作同实施例4,产率86%,ee 86%。
白色固体,熔点51-52℃,[α]D 20=+6.13(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.88(d,J=7.6Hz,1H),7.67(t,J=7.5Hz,1H),7.52(t,J=7.5Hz,1H),7.44(d,J=7.6Hz,1H),5.56(q,J=6.7Hz,1H),1.63(d,J=6.7Hz,3H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OJ-H column,正己烷:异丙醇=90:10,流速=0.7mL/min,紫外检测波长λ=254nm,tR=14.7min(minor),tR=16.8min(major).
实施例6:2c的合成
操作同实施例4,产率93%,ee 96%。
无色液体,[α]D 20=42.40.1H NMR(400MHz,CDCl3)δ7.88(d,J=7.7Hz,1H),7.66(t,J=7.5Hz,1H),7.51(t,J=7.5Hz,1H),7.43(d,J=7.6Hz,1H),5.44(dd,J=7.1,4.4Hz,1H),2.18-2.06(m,1H),1.88-1.74(m,1H),0.98(t,J=7.4Hz,3H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IA column,正己烷:异丙醇=95:5,流速=0.5mL/min,紫外检测波长λ=210nm,tR=19.7min(major),tR=21.5min(minor).
实施例7:2d的合成
操作同实施例4,产率94%,ee 91%。
无色液体,[α]D 20=+47.60(c 0.5,CHCl3).1H NMR(400MHz,CDCl3)δ7.84(d,J=7.7Hz,1H),7.64(t,J=7.5Hz,1H),7.48(t,J=7.6Hz,1H),7.42(d,J=7.6Hz,1H),5.44(dd,J=8.3,4.0Hz,1H),2.05-1.89(m,1H),1.76-1.64(m,1H),1.57-1.39(m,2H),0.94(t,J=7.5,3H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel AD-Hcolumn,正己烷:异丙醇=98:2,流速=1.0mL/min,紫外检测波长λ=254nm,tR=13.2min(major),tR=15.0min(minor).
实施例8:2e的合成
操作同实施例4,产率95%,ee 94%。
无色液体,[α]D 20=+42.70(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.91-7.84(d,J=7.7Hz,1H),7.71-7.61(t,J=7.5Hz,1H),7.55-7.48(t,J=7.5Hz,1H),7.46-7.39(d,J=7.6Hz,1H),5.50-5.42(dd,J=8.0,4.1Hz,1H),2.09-1.95(m,1H),1.81-1.68(m,1H),1.57-1.22(m,6H),0.94-0.82(m,3H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OD-3column,正己烷:异丙醇=95:5,流速=1.0mL/min,紫外检测波长λ=220nm,tR=7.4min(minor),tR=8.5min(major).
实施例9:2f的合成
操作同实施例4,产率95%,ee 89%。
无色液体,[α]D 20=+62.07(c 0.5,CHCl3).1H NMR(400MHz,CDCl3)δ7.87(dt,J=7.6,1.0Hz,1H),7.66(td,J=7.5,1.1Hz,1H),7.53-7.43(m,1H),7.46-7.43(m,1H),5.63(dd,J=9.4,3.6Hz,1H),3.70-3.64(m,1H),3.59-3.54(m,1H),3.37(s,3H),2.34-2.22(m,1H),1.93-1.84(m,1H).13C NMR(100MHz,CDCl3)δ170.41,149.95,133.96,129.05,125.78,125.63,121.81,78.35,68.20,58.82,35.35.IR(film)ν2924,2877,2815,1756,1613,1466,1388,1286,1115,1051,859,758,740cm-1.HRMS-ESI(m/z)calcd for C11H13O3 +,193.0859;found,193.0860[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IA column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=220nm,tR=8.6min(major),tR=12.3min(minor).
实施例10:2g的合成
操作同实施例4,产率100%,ee 95%。
白色固体,熔点104-105℃,[α]D 20=+85.47(c 1.0,CHCl3).1HNMR(400MHz,CDCl3)δ8.46(s,1H),8.03(d,J=8.2Hz,1H),7.94(d,J=8.3Hz,1H),7.84(s,1H),7.67-7.62(m,1H),7.61-7.53(m,1H),5.61(dd,J=6.9,4.4Hz,1H),2.26-2.14(m,1H),1.96-1.86(m,1H),1.04(t,J=7.4,3H).13C NMR(100MHz,CDCl3)δ170.54,143.39,136.13,133.08,129.83,128.86,128.14,126.83,124.10,120.51,82.34,28.23,8.79.IR(film)ν2967,2917,2871,2849,1746,1612,1454,1228,1172,1087,1053,829,783,536cm-1.HRMS-ESI(m/z)calcd for C14H13O2 +,219.0910;found,219.0911[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IA column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=214nm,tR=10.3min(major),tR=11.8min(minor).
实施例11:2h的合成
操作同实施例4,产率100%,ee 95%。
白色固体,熔点64-65℃,[α]D 20=+32.27(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ9.06-8.93(m,1H),8.11(d,J=8.4Hz,1H),7.95(d,J=8.2Hz,1H),7.73-7.67(m,1H),7.65-7.57(m,1H),7.46(d,J=8.4Hz,1H),5.50(dd,J=7.2,4.1Hz,1H),2.26-2.14(m,1H),1.90-1.78(m,1H),1.00(t,J=7.4Hz,3H).13C NMR(100MHz,CDCl3)δ170.93,151.31,135.33,133.23,129.13,128.89,128.35,127.13,123.42,120.31,118.37,81.42,27.24,8.81.IR(film)ν2971,2916,2870,2850,1739,1576,1454,1225,1108,963,795,766,528cm-1.HRMS-ESI(m/z)calcd for C14H13O2 +,219.0910;found,219.0911[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IC-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=214nm,tR=24.9min(minor),tR=27.5min(major).
实施例12:2i的合成
操作同实施例4,产率95%,ee 95%。
白色固体,熔点64-65℃,[α]D 20=+42.73(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ8.00(d,J=1.7Hz,1H),7.77(dd,J=8.1,1.8Hz,1H),7.32(d,J=8.1Hz,1H),5.41(dd,J=7.1,4.3Hz,1H),2.15-2.05(m,1H),1.85-1.75(m,1H),0.98(t,J=7.4Hz,3H).13C NMR(100MHz,CDCl3)δ168.98,148.27,136.95,128.57,128.32,123.32,122.94,82.16,27.44,8.71.IR(film)ν2971,2920,2877,2850,1749,1462,1413,1341,1287,1120,867,754,528cm-1.HRMS-ESI(m/z)calcd for C10H10BrO2 +,240.9859;found,240.9860[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IC-3column,正己烷:异丙醇=85:15,流速=1.0mL/min,紫外检测波长λ=220nm,tR=21.6min(major),tR=23.4min(minor).
实施例13:2j的合成
操作同实施例4,产率95%,ee 95%。
白色固体,熔点68-69℃,[α]D 20=+50.97(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.53(dd,J=7.2,2.1Hz,1H),7.45-7.32(m,2H),5.43(dd,J=6.7,4.7Hz,1H),2.15-2.05(m,1H),1.86-1.76(m,1H),0.99(t,J=7.4Hz,3H).13C NMR(100MHz,CDCl3)δ169.45(d,4JF-C=3.8Hz),163.07(d,1JF-C=248.2Hz),145.21(d,4JF-C=2.3Hz),128.35(d,3JF-C=9.1Hz),123.44(d,3JF-C=8.3Hz)121.90(d,2JF-C=24.3Hz),111.94(d,2JF-C=23.5Hz),82.19,27.68,8.77.19F NMR(376MHz,CDCl3)δ-111.66-111.72(m).IR(film)ν2920,2850,1752,1482,1311,1286,1260,1225,1187,1109,956,875,785,553cm-1.HRMS-ESI(m/z)calcd for C10H10FO2 +,181.0659;found,181.0659[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IA column,正己烷:异丙醇=97:3,流速=1.0mL/min,紫外检测波长λ=220nm,tR=10.5min(major),tR=13.8min(minor).
实施例14:2k的合成
操作同实施例4,产率96%,ee 88%。
白色固体,熔点91-92℃,[α]D 20=+34.93(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.92-7.73(m,2H),7.68-7.64(m,1H),5.46(dd,J=7.3,4.1Hz,1H),2.21-2.11(m,1H),1.89-1.78(m,1H),1.01(t,J=7.4,3H).13C NMR(100MHz,CDCl3)δ166.53,152.10,133.91,128.53(q,J=35.1Hz),126.64(q,J=5.6Hz),126.52,123.44,122.17(q,J=273.6Hz),81.47,27.58,8.84.19F NMR(376MHz,CDCl3)δ-61.0.IR(film)ν2987,2921,2852,1761,1490,1333,1286,1206,1171,1068,880,823,800,723,552,520cm-1.HRMS-ESI(m/z)calcd for C11H13F3NO2 +,248.0894;found,248.0893[M+NH4]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IC-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=220nm,tR=20.8min(major),tR=25.2min(minor).
实施例15:2l的合成
操作同实施例4,产率100%,ee 90%。
无色液体,[α]D 20=+44.93(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.59(t,J=7.9Hz,1H),6.92(dd,J=12.6,7.9Hz,2H),5.33(dd,J=7.2,4.2Hz,1H),3.97(s,3H),2.13-2.03(m,1H),1.82-1.70(m,1H),0.96(t,J=7.4Hz,3H).13C NMR(100MHz,CDCl3)δ168.79,158.49,152.59,136.17,113.70,113.37,110.54,81.13,55.96,27.65,8.76.IR(film)ν2969,2935,2845,1748,1602,1485,1355,1317,1241,1199,1090,1069,963,776,688,593,490cm-1.HRMS-ESI(m/z)calcd for C11H13O3 +,193.0859;found,193.0860[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel ID-3column,正己烷:异丙醇=85:15,流速=1.0mL/min,紫外检测波长λ=220nm,tR=26.9min(minor),tR=29.4min(major).
实施例16:2m的合成
操作同实施例4,产率100%,ee 91%。
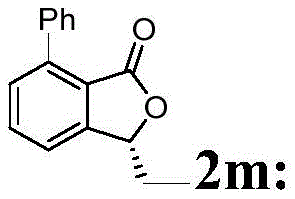
白色固体,熔点82-83℃,[α]D 20=+21.67(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.69(t,J=7.6Hz,1H),7.58-7.52(m,2H),7.49-7.37(m,5H),5.43(dd,J=7.2,4.2Hz,1H),2.12-2.10(m,1H),1.92-1.78(m,1H),1.03(t,J=7.4Hz,3H).13C NMR(100MHz,CDCl3)δ169.44,151.13,142.67,136.48,133.75,130.83,129.56,128.32,127.97,122.27,120.51,80.75,27.83,8.91.IR(film)ν2921,2876,2851,1745,1593,1467,1236,1200,1097,1067,963,756,694,579cm-1.HRMS-ESI(m/z)calcd for C16H15O2 +,239.1067;found,239.1067[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OD-H column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=220nm,tR=9.2min(minor),tR=13.0min(major).
实施例17:2n的合成
操作同实施例4,产率100%,ee 88%。
无色液体,[α]D 20=+41.93(c 0.5,CHCl3).1H NMR(400MHz,CDCl3)δ7.50(t,J=7.6Hz,1H),7.25-7.19(m,2H),5.38(dd,J=7.9,4.0Hz,1H),2.67(s,3H),2.05-1.95(m,1H),1.76-1.65(m,1H),1.52-1.27(m,4H),0.89(t,J=7.1Hz,3H).13C NMR(1100MHz,CDCl3)δ170.86,150.65,139.61,133.62,130.55,123.57,119.00,80.39,34.57,26.86,22.44,17.37,13.86.IR(film)ν2956,2929,2865,1748,1602,1479,1346,1302,1237,1201,1082,907,782,685cm-1.HRMS-ESI(m/z)calcd for C13H17O2 +,205.1223;found,205.1225[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IC-3column,正己烷:异丙醇=95:5,流速=1.0mL/min,紫外检测波长λ=214nm,tR=19.9min(minor),tR=21.4min(major).
实施例18:2o的合成
操作同实施例4,产率98%,ee 92%。
白色固体,熔点81-82℃,[α]D 20=+60.67(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ6.87(s,1H),6.64(s,1H),5.41(dd,J=8.1,2.9Hz,1H),3.84(s,3H),3.82(s,3H),2.28-2.11(m,1H),1.68-1.59(m,1H),1.47-1.14(m,10H),0.84(t,J=6.6Hz,3H).13C NMR(100MHz,CDCl3)δ170.82,162.24,154.83,131.18,128.44,104.65,98.28,80.70,55.80,55.56,32.87,31.64,29.18,29.01,24.66,22.54,14.01.IR(film)ν2919,2850,1752,1625,1501,1462,1332,1291,1154,1109,951,840,768,684,549cm-1.HRMS-ESI(m/z)calcd for C17H25O4 +,293.1747;found,293.1747[M+H]+.HRMS-ESI(m/z)calcd for C17H25O4 +,293.1747;found,293.1747[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OD-H column,正己烷:异丙醇=97:3,流速=0.7mL/min,紫外检测波长λ=214nm,tR=13.4min(minor),tR=16.4min(major).
实施例19:2p的合成
操作同实施例4,产率95%,ee 68%。
白色固体,熔点45-46℃,[α]D 20=+36.67(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.51(t,J=7.6Hz,1H),7.27-7.19(m,2H),5.43(dd,J=10.0,3.5Hz,1H),2.69(s,3H),2.15-2.00(m,1H),1.77-1.72(m,1H),1.65-1.56(m,1H),1.07(d,J=6.6Hz,3H),1.00(d,J=6.7Hz,3H).13C NMR(100MHz,CDCl3)δ170.87,151.20,139.67,133.58,130.51,123.34,118.95,78.96,44.44,25.14,23.36,21.82,17.37.IR(film)ν2957,2923,2871,1735,1601,1469,1348,1309,1204,1166,1050,781,578,493cm-1.HRMS-ESI(m/z)calcd for C13H17O2 +,205.1223;found,205.1223[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IC-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=220nm,tR=12.3min(minor),tR=14.1min(major).
实施例20:2q的合成
操作同实施例4,产率94%,ee 92%。
白色固体,熔点54-55℃,[α]D 20=+49.97(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.52(t,J=7.6Hz,1H),7.29-7.20(m,2H),5.30(d,J=3.5Hz,1H),2.70(s,3H),2.31-2.21(m,1H),1.14(d,J=6.9Hz,3H),0.78(d,J=6.9Hz,3H).13C NMR(100MHz,CDCl3)δ171.05,149.43,139.60,133.53,130.62,124.13,119.34,84.62,32.37,18.84,17.42,15.46.IR(film)ν2965,2920,2851,1739,1600,1475,1355,1293,1258,1205,1053,917,826,749,640,585cm-1.HRMS-ESI(m/z)calcd for C12H15O2 +,191.1067;found,191.1067[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OJ-3column,正己烷:异丙醇=97:3,流速=0.5mL/min,紫外检测波长λ=220nm,tR=16.7min(minor),tR=18.2min(major).
实施例21:2r的合成
操作同实施例4,产率96%,ee 92%。
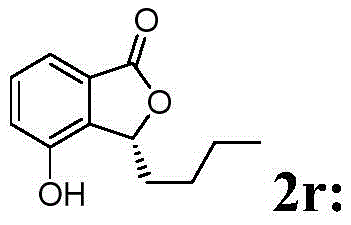
白色固体,熔点192-193℃,[α]D 20=+111.93(c 0.5,actone).1HNMR(400MHz,CDCl3)δ7.80-7.63(br,1H),7.47(t,J=7.9Hz,1H),7.36-7.17(m,5H),6.89(d,J=8.2Hz,1H),6.65(d,J=7.5Hz,1H),5.70(t,J=6.5Hz,1H),3.27(dd,J=14.2,6.7Hz,1H),3.16(dd,J=14.2,6.2Hz,1H).13C NMR(100MHz,CDCl3)δ171.74,156.45,149.35,136.62,134.73,129.64,128.54,127.23,115.47,113.66,111.26,82.57,40.66..IR(film)ν3527,3415,3032,2921,2824,2698,1721,1604,1472,1271,1072,912,942,755,692,502cm-1.HRMS-EI(m/z)calcd for C15H12O3 +,240.0793;found,240.0786[M]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel ID-3column,正己烷:异丙醇=95:5,流速=0.6mL/min,紫外检测波长λ=220nm,tR=22.5min(minor),tR=27.5min(major).
实施例22:2s的合成
操作同实施例4,产率97%,ee 95%。
白色固体,熔点63-64℃,[α]D 20=+43.33(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.98(d,J=1.7Hz,1H),7.76(dd,J=8.1,1.7Hz,1H),7.32(d,J=8.1Hz,1H),5.43(dd,J=7.9,4.1Hz,1H),2.08-1.95(m,1H),1.81-1.66(m,1H),1.51-1.28(m,4H),0.88(t,J=6.9Hz,3H).13C NMR(100MHz,CDCl3)δ169.01,148.70,136.98,128.61,128.22,123.37,122.93,81.35,34.22,26.76,22.37,13.84.IR(film)ν2958,2925,2861,1739,1464,1415,1343,1257,1200,1126,1052,961,638cm-1.HRMS-ESI(m/z)calcd forC12H14BrO2 +,269.0172;found,269.0172[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IA-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=254nm,tR=7.9min(major),tR=8.4min(minor).
实施例23:3a的合成
在氩气氛围下,向一10mL氢化瓶中加入铱络合物1a 0.002mmol,相应量的苯酞衍生物底物及添加剂,抽换气后加入溶剂。在手套箱中,将体系置于高压釜中。高压釜置换氢气三次后,充至相应的反应压力,在25℃下反应24h。反应结束后,小心放出氢气,取少量样品经1H NMR判断转化率。反应体系经硅胶短柱过滤除去金属,用高效液相测定产物的对映选择性。产率和ee值见表4。
表4
注:括号中的数据为分离收率
实施例24:3a的合成
在氩气氛围下,向一10mL氢化瓶中加入铱络合物1a 0.002mmol,苯酞衍生物底物0.1mmol,抽换气后加入溶剂4.0mL。在手套箱中,将体系置于高压釜中。高压釜置换氢气三次后,充至80atm,在25℃下反应24h。反应结束后,小心放出氢气,取少量样品经1H NMR判断转化率。反应体系经浓缩,快速柱层析纯化,得到相应的苯酞化合物3a,产率100%,ee97%。
白色固体,熔点60-61℃,[α]D 20=+51.27(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.84(d,J=7.6Hz,1H),7.60(dd,J=8.2,6.8Hz,1H),7.49(t,J=7.5Hz,1H),7.33-7.14(m,6H),5.69(t,J=6.4Hz,1H),3.28(dd,J=14.1,6.6Hz,1H),3.16(dd,J=14.0,6.2Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IA-3column,正己烷:异丙醇=95:5,流速=0.5mL/min,紫外检测波长λ=210nm,tR=24.5min(major),tR=27.3min(minor).
实施例25:3b的合成
操作同实施例24,产率100%,ee 98%。
白色固体,熔点93-94℃,[α]D 20=+33.60(c 1.0,CHCl3).1HNMR(400MHz,CDCl3)δ7.84(d,J=7.6Hz,1H),7.60(t,J=7.5Hz,1H),7.49(t,J=7.5Hz,1H),7.17(d,J=7.6Hz,1H),7.10(s,4H),5.67(t,J=6.4Hz,1H),3.25(dd,J=14.1,6.5Hz,1H),3.11(dd,J=14.1,6.3Hz,1H),2.32(s,3H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OJ-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=214nm,tR=19.3min(major),tR=24.2min(minor).
实施例26:3c的合成
操作同实施例24,产率98%,ee 97%。
白色固体,熔点114-115℃,[α]D 20=+34.50(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.84(d,J=7.6Hz,1H),7.60(t,J=7.5Hz,1H),7.48(t,J=7.5Hz,1H),7.19-7.15(m,1H),7.14-7.08(m,2H),6.86-6.77(m,2H),5.65(t,J=6.3Hz,1H),3.78(s,3H),3.24(dd,J=14.2,6.4Hz,1H),3.10(dd,J=14.2,6.3Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OB-H column,正己烷:异丙醇=70:30,流速=1.0mL/min,紫外检测波长λ=214nm,tR=19.8min(minor),tR=24.6min(major).
实施例27:3d的合成
操作同实施例24,产率97%,ee 96%。
白色固体,熔点77-78℃,[α]D 20=+34.87(c 1.0,CHCl3).1HNMR(400MHz,CDCl3)δ7.83(d,J=7.6Hz,1H),7.60(t,J=7.5Hz,1H),7.48(t,J=7.5Hz,1H),7.19(d,J=7.7Hz,1H),6.79-6.71(m,2H),6.67(d,J=1.9Hz,1H),5.68(t,J=6.2Hz,1H),3.85(s,3H),3.81(s,3H),3.25(dd,J=14.2,6.1Hz,1H),3.12(dd,J=14.2,6.2Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OD-H column,正己烷:异丙醇=80:20,流速=1.0mL/min,紫外检测波长λ=214nm,tR=16.1min(minor),tR=18.6min(major).
实施例28:3e的合成
操作同实施例24,产率98%,ee 94%。
白色固体,熔点145-146℃,[α]D20=+19.8(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ8.10(d,J=8.3Hz,1H),7.96-7.88(m,2H),7.85(d,J=8.2Hz,1H),7.63-7.41(m,5H),7.38(d,J=7.0Hz,1H),6.98(d,J=7.3Hz,1H),5.86(t,J=7.0Hz,1H),3.81(dd,J=14.3,6.9Hz,1H),3.48(dd,J=14.3,7.1Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel AD-H column,正己烷:异丙醇=95:5,流速=1.0mL/min,紫外检测波长λ=214nm,tR=14.8min(major),tR=16.9min(minor).
实施例29:3f的合成
操作同实施例24,产率83%,ee 95%。
白色固体,熔点152-153℃,[α]D20=+72.00(c 0.3,CHCl3).1HNMR(400MHz,CDCl3)δ7.85(d,J=7.6Hz,1H),7.64(t,J=7.5Hz,1H),7.51(t,J=7.5Hz,1H),7.29-7.21(m,3H),7.16-7.10(m,2H),5.68(t,J=6.1Hz,1H),3.21(d,J=6.1Hz,2H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OD-3column,正己烷:异丙醇=95:5,流速=1.0mL/min,紫外检测波长λ=210nm,tR=23.3min(minor),tR=24.6min(major).
实施例30:3g的合成
操作同实施例24,产率79%,ee 95%。
白色固体,熔点99-100℃,[α]D 20=+54.67(c 0.5,CHCl3).1HNMR(400MHz,CDCl3)δ7.86-7.66(m,1H),7.65(td,J=7.5,1.2Hz,1H),7.52(t,J=7.5Hz,1H),7.30-7.19(m,4H),7.13-7.11(m,1H),5.68(t,J=6.3Hz,1H),3.19(d,J=6.3Hz,2H).13C NMR(100MHz,CDCl3)δ170.03,148.69,137.06,134.24,133.91,129.76,129.65,129.37,127.86,127.36,126.12,125.80,122.08,80.74,40.46.IR(film)ν2957,2850,1749,1466,1348,1260,1101,983,781,761,742,598,491cm-1.HRMS-ESI(m/z)calcd forC15H12ClO2 +,259.0520;found,259.0522[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OD-3column,正己烷:异丙醇=95:5,流速=1.0mL/min,紫外检测波长λ=220nm,tR=25.7min(minor),tR=27.4min(major).
实施例31:3h的合成
操作同实施例24,产率64%,ee 93%。
白色固体,熔点128-129℃,[α]D20=+62.47(c 0.5,CHCl3).1H NMR(400MHz,CDCl3)δ7.85(d,J=7.7Hz,1H),7.66(t,J=7.5Hz,1H),7.57-7.49(m,3H),7.38-7.27(m,3H),5.71(dd,J=6.8,5.4Hz,1H),3.34(dd,J=14.3,5.4Hz,1H),3.24(dd,J=14.3,6.9Hz,1H).19F NMR(376MHz,CDCl3)δ-62.54.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OJ-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=214nm,tR=19.3min(minor),tR=21.3min(major).
实施例32:3i的合成
操作同实施例24,产率49%,ee 92%。
白色固体,熔点117-118℃,[α]D 20=+57.06(c 0.17,CHCl3).1HNMR(400MHz,CDCl3)δ7.87(d,J=7.6Hz,1H),7.67(t,J=7.5Hz,1H),7.53(t,J=7.5Hz,1H),7.32(d,J=7.7Hz,1H),6.83-6.64(m,3H),5.67(dd,J=7.1,5.2Hz,1H),3.25(dd,J=14.4,5.2Hz,1H),3.15(dd,J=14.4,7.2Hz,1H).19F NMR(376MHz,CDCl3)δ-109.61.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OJ-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=214nm,tR=21.8min(minor),tR=23.8min(major).
实施例33:3j的合成
操作同实施例24,产率100%,ee 97%。
白色固体,熔点140-141℃,[α]D 20=+38.43(c 1.0,CHCl3).1HNMR(400MHz,CDCl3)δ7.86(dt,J=7.6,1.0Hz,1H),7.63(td,J=7.5,1.1Hz,1H),7.57-7.42(m,1H),7.33-7.17(m,3H),7.13-6.95(m,2H),5.73(t,J=6.4Hz,1H),3.33-3.19(m,2H).19FNMR(376MHz,CDCl3)δ-117.28-117.53(m).13C NMR(100MHz,CDCl3)δ170.15,161.03(d,1JF-C=245.6Hz),148.89,133.82,132.03(d,4JF-C=4.3Hz),129.27,129.09(d,3JF-C=8.2Hz),126.10,125.61,124.16(d,3JF-C=3.7Hz),122.46,122.43(d,2JF-C=15.2Hz),115.32(d,2JF-C=22.0Hz),80.03(d,4JF-C=1.8Hz),34.08(d,4JF-C=1.7Hz).IR(film)ν2958,2919,2850,1759,1643,1493,1462,1348,1228,1102,982,800,693,621cm-1.HRMS-ESI(m/z)calcdfor C15H12FO2 +,243.0816;found,243.0817[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel AD-H column,正己烷:异丙醇=95:5,流速=1.0mL/min,紫外检测波长λ=220nm,tR=11.5min(major),tR=14.1min(minor).
实施例34:3k的合成
操作同实施例24,产率98%,ee 80%。
白色固体,熔点104-105℃,[α]D 20=-6.73(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.95(d,J=7.6Hz,1H),7.71(t,J=7.5Hz,1H),7.65-7.54(m,2H),7.26-7.18(m,2H),6.86-6.76(m,2H),5.77(t,J=5.4Hz,1H),4.34(dd,J=9.9,5.5Hz,1H),4.26(dd,J=9.9,5.2Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel AD column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=214nm,tR=17.4min(major),tR=20.2min(minor).
实施例35:3l的合成
操作同实施例24,产率40%,ee 95%。
白色固体,熔点84-85℃,[α]D 20=+20.33(c 0.2,CHCl3).1H NMR(400MHz,CDCl3)δ7.86(d,J=7.6Hz,1H),7.63(td,J=7.5,1.1Hz,1H),7.56-7.46(m,1H),7.24(d,J=7.7Hz,1H),7.16(dd,J=5.1,1.2Hz,1H),6.93-6.90(m,1H),6.87-6.84(m,1H),5.70(t,J=6.0Hz,1H),3.47(d,J=6.1Hz,2H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel ID-3column,正己烷:异丙醇=70:30,流速=0.7mL/min,紫外检测波长λ=214nm,tR=7.15min(major),tR=9.65min(minor).
实施例36:3m的合成
操作同实施例24,产率93%,ee 97%。
Yellow solid,熔点160-161℃,[α]D 20=+52.40(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.90(s,1H),7.41-7.25(m,3H),7.25-7.16(m,3H),5.65(t,J=6.5Hz,1H),3.30(dd,J=14.1,6.4Hz,1H),3.12(dd,J=14.1,6.5Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel OJ-3column,正己烷:异丙醇=85:15,流速=1.0mL/min,紫外检测波长λ=214nm,tR=24.7min(major),tR=29.3min(minor).
实施例37:3n的合成
操作同实施例24,产率97%,ee 97%。
Yellow solid,熔点183-184℃,[α]D 20=+151.43(c1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.06-6.98(m,2H),6.77-6.69(m,2H),5.65(dd,J=5.5,3.4Hz,1H),3.74(s,3H),3.56(dd,J=14.8,3.4Hz,1H),3.25(dd,J=14.8,5.5Hz,1H).13CNMR(100MHz,CDCl3)δ164.66,158.78,146.31,138.94,135.27,131.30,130.54,126.57,125.40,123.88,113.96,55.13,36.33.IR(film)ν2960,2919,2848,1891,1644,1573,1465,1332,1084,1033,801,731,567cm-1.HRMS-ESI(m/z)calcd for C16H10Cl4NaO3 +,412.9276;found,412.9284[M+Na]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型ChiralcelIA column,正己烷:异丙醇=70:30,流速=0.7mL/min,紫外检测波长λ=230nm,tR=9.9min(minor),tR=10.8min(major).
实施例38:3o的合成
操作同实施例24,产率95%,ee 95%。
白色固体,熔点177-178℃,[α]D 20=+45.80(c 1.0,CHCl3).1HNMR(400MHz,CDCl3)δ8.41(s,1H),8.00(d,J=8.1Hz,1H),7.86(d,J=8.2Hz,1H),7.68-7.51(m,3H),7.37-7.17(m,5H),5.84(t,J=6.4Hz,1H),3.36(dd,J=14.1,6.7Hz,1H),3.23(dd,J=14.1,6.2Hz,1H).氢化产物的ee值由手性HPLC测定,条件:手性柱类型ChiralcelIA column,正己烷:异丙醇=90:10,流速=0.7mL/min,紫外检测波长λ=214nm,tR=18.6min(major),tR=21.1min(minor).
实施例38:3p的合成
操作同实施例24,产率100%,ee 97%。
白色固体,熔点97-98℃,[α]D 20=+18.17(c 1.0,CHCl3).1H NMR(400MHz,CDCl3)δ7.45(t,J=7.6Hz,1H),7.25-7.17(m,2H),7.10-7.02(m,3H),6.96(d,J=7.6Hz,1H),5.59(t,J=6.6Hz,1H),3.19(dd,J=14.1,7.2Hz,1H),3.07(dd,J=14.1,6.0Hz,1H),2.66(s,3H),2.33(s,3H).13C NMR(100MHz,CDCl3)δ170.49,149.80,139.68,138.15,135.38,133.39,130.74,130.38,128.40,127.81,126.62,123.65,119.59,80.48,41.16,21.39,17.38.IR(film)ν2970,2918,1743,1598,1470,1350,1313,1260,1202,1069,982,782,693,743,627cm-1.HRMS-ESI(m/z)calcd for C17H17O2 +,253.1223;found,253.1224[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel IC-3column,正己烷:异丙醇=90:10,流速=1.0mL/min,紫外检测波长λ=220nm,tR=21.0min(major),tR=25.6min(minor).
实施例39:3q的合成
操作同实施例24,产率80%,ee 96%。
无色液体,[α]D 20=+26.33(c 0.5,CHCl3).1H NMR(400MHz,CDCl3)δ7.55(t,J=7.9Hz,1H),7.34-7.15(m,5H),6.89(d,J=8.3Hz,1H),6.75(d,J=7.5Hz,1H),5.60(t,J=6.3Hz,1H),3.96(s,3H),3.28-3.09(m,2H).13C NMR(100MHz,CDCl3)δ168.26,158.45,151.88,135.91,135.05,129.64,128.42,127.02,113.86,113.63,110.65,80.11,55.92,40.81.IR(film)ν3028,2920,2846,1751,1602,1485,1314,1284,1240,1200,1075,1033,994,797,693,600,512cm-1.HRMS-ESI(m/z)calcd for C16H15O3 +,255.1016;found,255.1016[M+H]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel AD-3column,正己烷:异丙醇=97:3,流速=1.0mL/min,紫外检测波长λ=220nm,tR=44.4min(minor),tR=47.6min(major).
实施例40:3r的合成
操作同实施例24,产率96%,ee 94%。
白色固体,熔点192-193℃,[α]D 20=+111.93(c 0.5,actone).1HNMR(400MHz,CDCl3)δ7.80-7.63(br,1H),7.47(t,J=7.9Hz,1H),7.36-7.17(m,5H),6.89(d,J=8.2Hz,1H),6.65(d,J=7.5Hz,1H),5.70(t,J=6.5Hz,1H),3.27(dd,J=14.2,6.7Hz,1H),3.16(dd,J=14.2,6.2Hz,1H).13C NMR(100MHz,CDCl3)δ171.74,156.45,149.35,136.62,134.73,129.64,128.54,127.23,115.47,113.66,111.26,82.57,40.66.IR(film)ν3527,3415,3032,2921,2824,2698,1721,1604,1472,1271,1072,912,942,755,692,502cm-1.HRMS-EI(m/z)calcd for C15H12O3 +,240.0793;found,240.0786[M]+.氢化产物的ee值由手性HPLC测定,条件:手性柱类型Chiralcel ID-3column,正己烷:异丙醇=95:5,流速=0.6mL/min,紫外检测波长λ=220nm,tR=22.5min(minor),tR=27.5min(major).
对比例1:2a’的合成
在氮气氛围下,将催化剂前体(5.0μmol),(S,S)-(R,R)-PhTRAP(4.4mg,5.5μmol),碳酸铯(16.3mg,50μmol)加到干燥的2-丙醇(1.0ml)中,室温搅拌10min。通过套管将所得悬浮液转移至1a’(0.50mmol)中。将混合物移入充满氮气的50mL不锈钢高压釜中,将氢气引入高压釜中直至压力计指示超过50atm,然后小心地将压力释放至1atm。重复该过程四次,最后用氢气将高压釜内部加压至50atm,将反应混合物在60℃下搅拌2小时,减压蒸发所得混合物。经1H NMR分析残余物以确定2a’的产率,并使其通过短硅胶柱(乙酸乙酯/己烷=1/10)以除去催化剂。当残余物含有大量1a’时,用MPLC纯化,用高效液相测定产物的对映选择性。产率和ee值见表5。
表5
无色油状物,[α]25 D=–44.6(c 0.52,CHCl3),lit.[α]25 D=+39(c 0.0101,CHCl3)for 97%ee(S);1H NMR(400MHz,CDCl3,TMS)δ1.29(d,J=6.3Hz,3H),1.57(s,9H),2.60(dd,J=2.1,15.9Hz,1H),3.34(dd,J=9.6,15.9Hz,1H),4.50(br,1H),6.93(dt,J=0.9,7.4Hz,1H),7.11–7.19(m,2H),7.72(br,1H);13C{1H}NMR(100MHz,CDCl3)δ21.1,28.5,35.7,55.2,80.6,115.3,122.2,124.9,127.3,130.0,141.6,152.3.ee值由手性HPLC测定,条件:手性柱类型CHIRALCEL OC(4.6mm×250mm),正己烷:异丙醇=996:4,流速=0.5mL/min,紫外检测波长λ=254nm,(S)t1=14.3min,(R)t2=15.7min.
Claims (8)
1.一种如式II所示的手性苯酞衍生物的制备方法,其特征在于,其包括下述步骤:有机溶剂中,在铱络合物的作用下,如式I所示化合物与氢气进行如下所示的氢化还原反应,即可;
其中,
以“*1”标记的碳原子为(R)或(S)构型的碳原子;
以“*2”标记的碳原子为(R)、(S)构型或非手性的碳原子;
R1和R2独立地选自氢、C1~C20直链的烷基、C4~C24的杂芳基、取代或未取代的C6~C24的芳基、取代或未取代的C6~C24的芳氧基或-(CH2)n-OR7;其中,所述杂芳基中的杂原子选自O、N和S,杂原子个数为1、2、3或4;n为1~8的整数;所述R7为C1~C10直链或支链的烷基;所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基选自下列基团中的一个或多个:C1~C10直链或支链的烷基、C1~C10直链或支链的烷氧基、C1-C6的直链或支链的卤代烷基或卤素;当取代基为多个时,所述的取代基相同或不同;R3、R4、R5和R6独立地选自氢、卤素、羟基、C1-C6的直链或支链的卤代烷基、C1~C20直链或支链的烷基、C1~C20直链或支链的烷氧基或C6~C24的芳基;
或者,R3与R4和与其相连的碳一起形成C6~C24的芳环;
或者,R4与R5和与其相连的碳一起形成C6~C24的芳环;
所述有机溶剂为二氯甲烷或1,2-二氯乙烷。
2.如权利要求1所述的制备方法,其特征在于,其中,
当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1~C10直链或支链的烷基时,所述的C1~C10直链或支链的烷基为C1~C4直链或支链的烷基;
和/或,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1~C10直链或支链的烷氧基时,所述C1~C10直链或支链的烷氧基为C1~C4直链或支链的烷氧基;
和/或,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1-C6的直链或支链的卤代烷基时,所述的C1-C6直链或支链的卤代烷基为C1-C3直链或支链的卤代烷基;
和/或,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为卤素时,所述卤素为氟、氯或溴;
和/或,当R1为C1~C20直链的烷基时,所述C1~C20直链的烷基为C1~C10直链的烷基;
和/或,当R1为C4~C24的杂芳基时,所述杂芳基中的杂原子选自O、N和S,杂原子个数为1或2;
和/或,当R1为取代或未取代的C6~C24的芳基时,所述C6~C24的芳基为C6~C10的芳基;
和/或,当R1为取代或未取代的C6~C24的芳氧基时,所述C6~C24的芳氧基为C6~C10的芳氧基;
和/或,当R1为-(CH2)n-OR7时,n为1~4的整数;其中,所述R7为C1~C10直链或支链的烷基;
和/或,当R2为C1~C20直链的烷基时,所述C1~C20直链的烷基为C1~C4直链的烷基;
和/或,当R3为卤素时,所述卤素为氟、氯或溴;
和/或,当R3为C1-C6的直链或支链的卤代烷基时,所述C1-C6的直链或支链的卤代烷基为C1-C3的直链或支链的卤代烷基;
和/或,当R3为C1~C20直链或支链的烷基时,所述C1~C20直链或支链的烷基为C1~C4直链或支链的烷基;
和/或,当R3为C1~C20直链或支链的烷氧基时,所述C1~C20直链或支链的烷氧基为C1~C4直链或支链的烷氧基;
和/或,当R3为C6~C24的芳基时,所述C6~C24的芳基为C6~C10的芳基;
和/或,当R4为卤素时,所述卤素为氟、氯或溴;
和/或,当R5为卤素时,所述卤素为氟、氯或溴;
和/或,当R5为C1~C20直链或支链的烷氧基时,所述C1~C20直链或支链的烷氧基为C1~C4直链或支链的烷氧基;
和/或,当R6为卤素时,所述卤素为氟、氯或溴;
或者,R3与R4和与其相连的碳一起形成C6~C10的芳环;
或者,R4与R5和与其相连的碳一起形成C6~C10的芳环。
3.如权利要求2所述的制备方法,其特征在于,其中,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1~C10直链或支链的烷基时,所述的C1~C10直链或支链的烷基为甲基;
和/或,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1~C10直链或支链的烷氧基时,所述C1~C10直链或支链的烷氧基为甲氧基;
和/或,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为C1-C6的直链或支链的卤代烷基时,所述的C1-C6直链或支链的卤代烷基为三氟甲基;
和/或,当所述的取代的C6~C24的芳基和所述的取代的C6~C24的芳氧基中的取代基为卤素时,所述卤素为氟或氯;
和/或,当R1为C1~C20直链的烷基时,所述C1~C20直链的烷基为C1~C8直链的烷基;
和/或,当R1为C4~C24的杂芳基时,所述杂芳基为C4~C6的杂芳基;
和/或,当R1为取代或未取代的C6~C24的芳基时,所述C6~C24的芳基为苯基或萘基;
和/或,当R1为取代或未取代的C6~C24的芳氧基时,所述C6~C24的芳氧基为苯氧基;
和/或,当R1为-(CH2)n-OR7时,n为1;其中,所述R7为C1~C4直链或支链的烷基;
和/或,当R2为C1~C20直链的烷基时,所述C1~C20直链的烷基为甲基;
和/或,当R3为卤素时,所述卤素为氯;
和/或,当R3为C1-C6的直链或支链的卤代烷基时,所述C1-C6的直链或支链的卤代烷基为三氟甲基;
和/或,当R3为C1~C20直链或支链的烷基时,所述C1~C20直链或支链的烷基为甲基;
和/或,当R3为C1~C20直链或支链的烷氧基时,所述C1~C20直链或支链的烷氧基为甲氧基;
和/或,当R3为C6~C24的芳基时,所述C6~C24的芳基为苯基;
和/或,当R5为卤素时,所述卤素为氯;
和/或,当R5为C1~C20直链或支链的烷氧基时,所述C1~C20直链或支链的烷氧基为甲氧基;
和/或,当R6为卤素时,所述卤素为氯;
或者,R3与R4和与其相连的碳一起形成苯环;
或者,R4与R5和与其相连的碳一起形成苯环。
4.如权利要求2所述的制备方法,其特征在于,其中,当R1为C1~C20直链的烷基时,所述C1~C20直链的烷基为甲基、乙基、丙基、正丁基、正戊基、正己基或正庚基;
和/或,当R1为C4~C24的杂芳基时,所述杂芳基为噻吩基;
和/或,当R1为-(CH2)n-OR7时,所述R7为甲基。
6.如权利要求1所述的制备方法,其特征在于,
所述如式I所示化合物与所述铱络合物的摩尔比为50~10000:1;
和/或,所述如式I所示化合物在所述有机溶剂的摩尔浓度为0.0025M~2M;
和/或,所述氢化还原反应的温度为0~120℃;
和/或,所述氢化还原反应的氢气压力为1~100大气压;
和/或,所述氢化还原反应的时间为0.1~48小时。
7.如权利要求1所述的制备方法,其特征在于,
所述如式I所示化合物与所述铱络合物的摩尔比为50~200:1;
和/或,所述如式I所示化合物在所述有机溶剂的摩尔浓度为0.025M~0.2M;
和/或,所述氢化还原反应的温度为25~60℃;
和/或,所述氢化还原反应的氢气压力为2~80大气压;
和/或,所述氢化还原反应的时间为4~24小时。
8.如权利要求7所述的制备方法,其特征在于,所述氢化还原反应的温度为25℃。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201810942158.9A CN108912077B (zh) | 2018-08-17 | 2018-08-17 | 一种手性苯酞衍生物的制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201810942158.9A CN108912077B (zh) | 2018-08-17 | 2018-08-17 | 一种手性苯酞衍生物的制备方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108912077A CN108912077A (zh) | 2018-11-30 |
| CN108912077B true CN108912077B (zh) | 2022-06-21 |
Family
ID=64404902
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201810942158.9A Active CN108912077B (zh) | 2018-08-17 | 2018-08-17 | 一种手性苯酞衍生物的制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN108912077B (zh) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101555259A (zh) * | 2009-05-15 | 2009-10-14 | 中国科学院上海有机化学研究所 | 螺环骨架膦噁唑啉配体、合成方法及其在不对称氢化反应中的应用 |
-
2018
- 2018-08-17 CN CN201810942158.9A patent/CN108912077B/zh active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101555259A (zh) * | 2009-05-15 | 2009-10-14 | 中国科学院上海有机化学研究所 | 螺环骨架膦噁唑啉配体、合成方法及其在不对称氢化反应中的应用 |
Non-Patent Citations (3)
| Title |
|---|
| Enantioselective Iridium-Catalyzed Phthalide Formation through Internal Redox Allylation of Phthalaldehydes;James M. Cabrera,et al;《Angew. Chem.》;20181231;第130卷;第1404-1407页 * |
| SpinPhox/Iridium(I)-Catalyzed Asymmetric Hydrogenation of Cyclic a-Alkylidene Carbonyl Compounds;Xu Liu, et al;《Angew. Chem. Int. Ed.》;20140120;第53卷;第1978-1982页 * |
| Synthesis of (+)-Spirolaxine Methyl Ether;Raffaella Nannei, et al;《J. Org. Chem.》;20061107;第71卷;第6277-6280页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN108912077A (zh) | 2018-11-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0916637B1 (en) | Process for preparating optically active compounds | |
| An et al. | Simple amphiphilic isosteviol–proline conjugates as chiral catalysts for the direct asymmetric aldol reaction in the presence of water | |
| RU2335500C2 (ru) | Способ получения производных мевалоновой кислоты, ингибирующих гмг-соа редуктазу | |
| Quan et al. | The synthesis of chiral β-aryl-α, β-unsaturated amino alcohols via a Pd-catalyzed asymmetric allylic amination | |
| Rachwalski et al. | Aziridine ring-containing chiral ligands as highly efficient catalysts in asymmetric synthesis | |
| Schwab et al. | Organocatalytic asymmetric aldol reactions mediated by a cysteine-derived prolinamide | |
| Wang et al. | Rh (III)-catalyzed aldehyde C–H bond functionalization of salicylaldehydes with arylboronic acids | |
| Shao et al. | Enantioselective phospha-Michael reaction of diethyl phosphonate with exocyclic α, β-unsaturated benzocyclic ketones catalyzed by a dinuclear zinc− AzePhenol catalyst | |
| EP2914574B1 (en) | New process | |
| CN112479982B (zh) | 一种手性吲哚-2,3-并八元碳环化合物的制备方法 | |
| CN108912077B (zh) | 一种手性苯酞衍生物的制备方法 | |
| JP5622019B2 (ja) | アミノアルコール誘導体塩構造を有する不斉有機分子触媒及び該不斉有機分子触媒を用いた光学活性化合物の製造方法 | |
| EP2607353B1 (fr) | "Nouveau procédé de synthèse de l'ivabradine et de ses sels d'addition à un acide pharmaceutiquement acceptable" | |
| JP5665041B2 (ja) | ヨードニウム化合物、その製造方法、及び官能基化スピロ環状化合物とその製造方法 | |
| He et al. | RuPHOX-Ru catalyzed asymmetric Guerbet reaction of secondary alcohols with primary alcohols | |
| JP4415543B2 (ja) | 光学活性6,6’−ジメチル−1,1’−ビフェニル−2,2’−ジオール誘導体の製造方法 | |
| CN102115446B (zh) | 一种催化合成手性姜黄素类似物的方法 | |
| CN112979523B (zh) | 一种手性1,4-二苯基-2-羟基-1,4-二丁酮类化合物的制备方法 | |
| JP2010229097A (ja) | 新規オキサゾリジン誘導体及び新規オキサゾリジン誘導体塩、並びに該オキサゾリジン誘導体塩を不斉有機分子触媒とした光学活性化合物の製造方法 | |
| Suzuki et al. | Formal total synthesis of ottelione using iridium-catalyzed oxidative desymmetrization | |
| Venugopal et al. | Synthesis and resolution of new cyclohexyl fused spirobiindane 7, 7′-diol | |
| JP2015172024A (ja) | 水素結合形成アミド基を持つキラル二環式ジエン配位子 | |
| FR2908131A1 (fr) | Derives d'aminobenzocycloheptene,leurs procedes de preparation et leur utilisation en therapeutique | |
| JP2008007457A (ja) | β−ヒドロキシカルボニル化合物の後処理方法 | |
| EP2876108B1 (en) | Compounds of chiral aromatic spiroketal diphosphine ligands, preparation methods and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |