CN103857683A - 抗病毒化合物 - Google Patents
抗病毒化合物 Download PDFInfo
- Publication number
- CN103857683A CN103857683A CN201280047516.0A CN201280047516A CN103857683A CN 103857683 A CN103857683 A CN 103857683A CN 201280047516 A CN201280047516 A CN 201280047516A CN 103857683 A CN103857683 A CN 103857683A
- Authority
- CN
- China
- Prior art keywords
- virus
- compound
- cell
- certain embodiments
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 179
- 230000000840 anti-viral effect Effects 0.000 title description 39
- 239000000203 mixture Substances 0.000 claims abstract description 63
- 238000011282 treatment Methods 0.000 claims abstract description 31
- 230000009385 viral infection Effects 0.000 claims abstract description 24
- 241000251539 Vertebrata <Metazoa> Species 0.000 claims abstract description 12
- 241000700605 Viruses Species 0.000 claims description 111
- 229910052799 carbon Inorganic materials 0.000 claims description 61
- 229910004013 NO 2 Inorganic materials 0.000 claims description 54
- 238000000034 method Methods 0.000 claims description 54
- 229910052794 bromium Inorganic materials 0.000 claims description 53
- 229910052801 chlorine Inorganic materials 0.000 claims description 53
- 125000000217 alkyl group Chemical group 0.000 claims description 41
- 229910052731 fluorine Inorganic materials 0.000 claims description 33
- 229910052740 iodine Inorganic materials 0.000 claims description 29
- 125000001072 heteroaryl group Chemical group 0.000 claims description 28
- 241000712461 unidentified influenza virus Species 0.000 claims description 25
- 125000003118 aryl group Chemical group 0.000 claims description 24
- 241000710886 West Nile virus Species 0.000 claims description 23
- 241000711549 Hepacivirus C Species 0.000 claims description 22
- 229960005486 vaccine Drugs 0.000 claims description 20
- 229910052717 sulfur Inorganic materials 0.000 claims description 14
- 238000005267 amalgamation Methods 0.000 claims description 12
- 229910052736 halogen Inorganic materials 0.000 claims description 12
- 210000002345 respiratory system Anatomy 0.000 claims description 12
- 208000001490 Dengue Diseases 0.000 claims description 11
- 206010012310 Dengue fever Diseases 0.000 claims description 11
- 241000725303 Human immunodeficiency virus Species 0.000 claims description 11
- 208000025729 dengue disease Diseases 0.000 claims description 11
- 241001493065 dsRNA viruses Species 0.000 claims description 11
- 229910052760 oxygen Inorganic materials 0.000 claims description 11
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 11
- 239000002671 adjuvant Substances 0.000 claims description 10
- 206010014599 encephalitis Diseases 0.000 claims description 10
- 150000002367 halogens Chemical class 0.000 claims description 9
- 238000000338 in vitro Methods 0.000 claims description 9
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 9
- 125000001624 naphthyl group Chemical group 0.000 claims description 8
- 241000178320 Alfuy virus Species 0.000 claims description 7
- 241000710912 Kunjin virus Species 0.000 claims description 7
- 241000710769 Louping ill virus Species 0.000 claims description 7
- 241000907332 Rocio virus Species 0.000 claims description 7
- 241000710888 St. Louis encephalitis virus Species 0.000 claims description 7
- 201000010099 disease Diseases 0.000 claims description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 7
- 230000015788 innate immune response Effects 0.000 claims description 7
- 241000283690 Bos taurus Species 0.000 claims description 6
- 206010012735 Diarrhoea Diseases 0.000 claims description 6
- 241000315672 SARS coronavirus Species 0.000 claims description 6
- 241000712892 Arenaviridae Species 0.000 claims description 5
- 241001533362 Astroviridae Species 0.000 claims description 5
- 241000714198 Caliciviridae Species 0.000 claims description 5
- 241000973027 Closteroviridae Species 0.000 claims description 5
- 241000702221 Cystoviridae Species 0.000 claims description 5
- 241000991587 Enterovirus C Species 0.000 claims description 5
- 241000710781 Flaviviridae Species 0.000 claims description 5
- 241000710842 Japanese encephalitis virus Species 0.000 claims description 5
- 241000714210 Leviviridae Species 0.000 claims description 5
- 241000712079 Measles morbillivirus Species 0.000 claims description 5
- 241001631646 Papillomaviridae Species 0.000 claims description 5
- 241000711504 Paramyxoviridae Species 0.000 claims description 5
- 241000150350 Peribunyaviridae Species 0.000 claims description 5
- 241000709664 Picornaviridae Species 0.000 claims description 5
- 241000702247 Reoviridae Species 0.000 claims description 5
- 241000712907 Retroviridae Species 0.000 claims description 5
- 241001533336 Tombusviridae Species 0.000 claims description 5
- 241000710772 Yellow fever virus Species 0.000 claims description 5
- 208000006454 hepatitis Diseases 0.000 claims description 5
- 231100000283 hepatitis Toxicity 0.000 claims description 5
- 239000000976 ink Substances 0.000 claims description 5
- 229940051021 yellow-fever virus Drugs 0.000 claims description 5
- 241000700739 Hepadnaviridae Species 0.000 claims description 4
- 241000961587 Secoviridae Species 0.000 claims description 4
- 241000710076 Bean common mosaic virus Species 0.000 claims description 3
- 235000011293 Brassica napus Nutrition 0.000 claims description 3
- 235000000540 Brassica rapa subsp rapa Nutrition 0.000 claims description 3
- 241000209202 Bromus secalinus Species 0.000 claims description 3
- 235000010726 Vigna sinensis Nutrition 0.000 claims description 3
- 244000042314 Vigna unguiculata Species 0.000 claims description 3
- 238000005452 bending Methods 0.000 claims description 3
- 239000011248 coating agent Substances 0.000 claims description 3
- 238000000576 coating method Methods 0.000 claims description 3
- 125000000623 heterocyclic group Chemical group 0.000 claims description 3
- 241000961634 Alphaflexiviridae Species 0.000 claims description 2
- 241001536481 Banzi virus Species 0.000 claims description 2
- 241000702628 Birnaviridae Species 0.000 claims description 2
- 241001533462 Bromoviridae Species 0.000 claims description 2
- 241000725619 Dengue virus Species 0.000 claims description 2
- 241001112094 Hepevirus Species 0.000 claims description 2
- 241000700586 Herpesviridae Species 0.000 claims description 2
- 241000609530 Ilheus virus Species 0.000 claims description 2
- 241000178323 Kokobera virus Species 0.000 claims description 2
- 241001466978 Kyasanur forest disease virus Species 0.000 claims description 2
- 241000253097 Luteoviridae Species 0.000 claims description 2
- 241000711513 Mononegavirales Species 0.000 claims description 2
- 241001292005 Nidovirales Species 0.000 claims description 2
- 241000723741 Nodaviridae Species 0.000 claims description 2
- 241000712464 Orthomyxoviridae Species 0.000 claims description 2
- 241001492235 Picobirnavirus Species 0.000 claims description 2
- 241001533393 Potyviridae Species 0.000 claims description 2
- 241000710884 Powassan virus Species 0.000 claims description 2
- 241000724318 Tenuivirus Species 0.000 claims description 2
- 241000710924 Togaviridae Species 0.000 claims description 2
- 241000710915 Totiviridae Species 0.000 claims description 2
- 241001059845 Tymoviridae Species 0.000 claims description 2
- 238000001727 in vivo Methods 0.000 claims description 2
- 229940021747 therapeutic vaccine Drugs 0.000 claims description 2
- 240000008100 Brassica rapa Species 0.000 claims 1
- 102100037435 Antiviral innate immune response receptor RIG-I Human genes 0.000 abstract description 20
- 101710127675 Antiviral innate immune response receptor RIG-I Proteins 0.000 abstract description 20
- 208000036142 Viral infection Diseases 0.000 abstract description 4
- 230000037361 pathway Effects 0.000 abstract 2
- 210000004027 cell Anatomy 0.000 description 123
- 230000014509 gene expression Effects 0.000 description 53
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 49
- -1 sec.-propyl etc.) Chemical group 0.000 description 42
- 239000003814 drug Substances 0.000 description 41
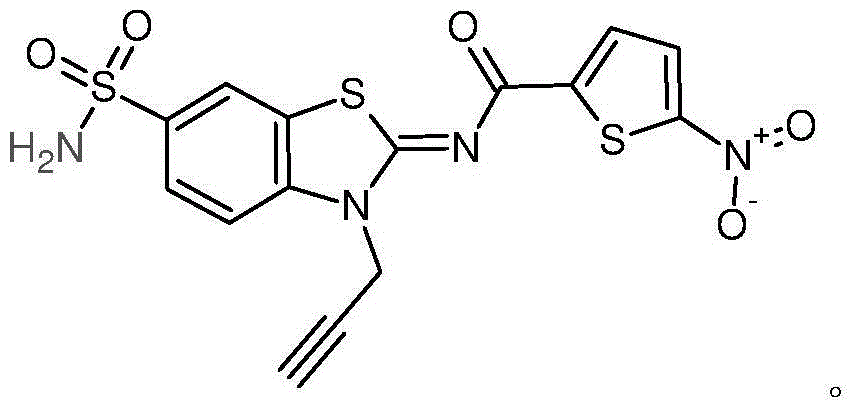
- YAISOECYKYATLL-UHFFFAOYSA-N n-([1,3]thiazolo[5,4-e][1,3]benzothiazol-2-yl)naphthalene-2-carboxamide Chemical compound C1=CC=CC2=CC(C(NC=3SC4=C5N=CSC5=CC=C4N=3)=O)=CC=C21 YAISOECYKYATLL-UHFFFAOYSA-N 0.000 description 38
- 230000000694 effects Effects 0.000 description 29
- 241001465754 Metazoa Species 0.000 description 27
- 208000015181 infectious disease Diseases 0.000 description 27
- 230000000670 limiting effect Effects 0.000 description 26
- 238000012545 processing Methods 0.000 description 26
- 150000003254 radicals Chemical class 0.000 description 24
- 241000699666 Mus <mouse, genus> Species 0.000 description 20
- 125000002757 morpholinyl group Chemical group 0.000 description 20
- 125000000304 alkynyl group Chemical group 0.000 description 19
- 230000003612 virological effect Effects 0.000 description 18
- 238000004458 analytical method Methods 0.000 description 17
- 239000003795 chemical substances by application Substances 0.000 description 17
- 125000000524 functional group Chemical group 0.000 description 17
- 230000002068 genetic effect Effects 0.000 description 17
- 206010022000 influenza Diseases 0.000 description 17
- 238000011160 research Methods 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
- 125000004429 atom Chemical group 0.000 description 16
- 239000002131 composite material Substances 0.000 description 15
- 238000005516 engineering process Methods 0.000 description 15
- 239000006228 supernatant Substances 0.000 description 14
- 125000002769 thiazolinyl group Chemical group 0.000 description 13
- 239000000427 antigen Substances 0.000 description 12
- 108091007433 antigens Proteins 0.000 description 12
- 102000036639 antigens Human genes 0.000 description 12
- 239000000872 buffer Substances 0.000 description 12
- 238000011081 inoculation Methods 0.000 description 12
- 239000003153 chemical reaction reagent Substances 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 125000001544 thienyl group Chemical group 0.000 description 11
- 102100027303 Interferon-induced protein with tetratricopeptide repeats 2 Human genes 0.000 description 10
- 239000003112 inhibitor Substances 0.000 description 10
- 239000007788 liquid Substances 0.000 description 10
- 210000002966 serum Anatomy 0.000 description 10
- 125000003545 alkoxy group Chemical group 0.000 description 9
- 108090000623 proteins and genes Proteins 0.000 description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- GXAFMKJFWWBYNW-OWHBQTKESA-N 2-[3-[(1r)-1-[(2s)-1-[(2s)-3-cyclopropyl-2-(3,4,5-trimethoxyphenyl)propanoyl]piperidine-2-carbonyl]oxy-3-(3,4-dimethoxyphenyl)propyl]phenoxy]acetic acid Chemical compound C1=C(OC)C(OC)=CC=C1CC[C@H](C=1C=C(OCC(O)=O)C=CC=1)OC(=O)[C@H]1N(C(=O)[C@@H](CC2CC2)C=2C=C(OC)C(OC)=C(OC)C=2)CCCC1 GXAFMKJFWWBYNW-OWHBQTKESA-N 0.000 description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 8
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 8
- 101001082058 Homo sapiens Interferon-induced protein with tetratricopeptide repeats 2 Proteins 0.000 description 8
- 125000000753 cycloalkyl group Chemical group 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 229910052757 nitrogen Inorganic materials 0.000 description 8
- 238000005556 structure-activity relationship Methods 0.000 description 8
- 206010010356 Congenital anomaly Diseases 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- 102100040019 Interferon alpha-1/13 Human genes 0.000 description 7
- 239000005089 Luciferase Substances 0.000 description 7
- 241000700159 Rattus Species 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 7
- 238000006073 displacement reaction Methods 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- 108010050904 Interferons Proteins 0.000 description 6
- 102000014150 Interferons Human genes 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 6
- 108010067390 Viral Proteins Proteins 0.000 description 6
- 230000009471 action Effects 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 150000001721 carbon Chemical group 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 238000010790 dilution Methods 0.000 description 6
- 239000012895 dilution Substances 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 239000001530 fumaric acid Substances 0.000 description 6
- 229910052739 hydrogen Inorganic materials 0.000 description 6
- 230000036039 immunity Effects 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 229940079322 interferon Drugs 0.000 description 6
- 239000013641 positive control Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 125000004076 pyridyl group Chemical group 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 238000007920 subcutaneous administration Methods 0.000 description 6
- 239000009871 tenuigenin Substances 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 238000004448 titration Methods 0.000 description 6
- 231100000419 toxicity Toxicity 0.000 description 6
- 230000001988 toxicity Effects 0.000 description 6
- 231100000027 toxicology Toxicity 0.000 description 6
- 229940123424 Neuraminidase inhibitor Drugs 0.000 description 5
- 108700008625 Reporter Genes Proteins 0.000 description 5
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 125000003282 alkyl amino group Chemical group 0.000 description 5
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 5
- 125000004414 alkyl thio group Chemical group 0.000 description 5
- 238000010171 animal model Methods 0.000 description 5
- 230000002155 anti-virotic effect Effects 0.000 description 5
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 5
- 125000000392 cycloalkenyl group Chemical group 0.000 description 5
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 5
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 5
- 230000003013 cytotoxicity Effects 0.000 description 5
- 231100000135 cytotoxicity Toxicity 0.000 description 5
- 238000013016 damping Methods 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 230000003203 everyday effect Effects 0.000 description 5
- 239000012530 fluid Substances 0.000 description 5
- 125000002541 furyl group Chemical group 0.000 description 5
- 239000005556 hormone Substances 0.000 description 5
- 229940088597 hormone Drugs 0.000 description 5
- 210000005260 human cell Anatomy 0.000 description 5
- 238000010185 immunofluorescence analysis Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000003094 microcapsule Substances 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 239000002911 sialidase inhibitor Substances 0.000 description 5
- 102100027769 2'-5'-oligoadenylate synthase 1 Human genes 0.000 description 4
- 240000006409 Acacia auriculiformis Species 0.000 description 4
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 4
- 239000004215 Carbon black (E152) Substances 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 101001008907 Homo sapiens 2'-5'-oligoadenylate synthase 1 Proteins 0.000 description 4
- 101000600434 Homo sapiens Putative uncharacterized protein encoded by MIR7-3HG Proteins 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- 102100037401 Putative uncharacterized protein encoded by MIR7-3HG Human genes 0.000 description 4
- 206010057293 West Nile viral infection Diseases 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 4
- 125000003368 amide group Chemical group 0.000 description 4
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 4
- 125000005110 aryl thio group Chemical group 0.000 description 4
- 239000012148 binding buffer Substances 0.000 description 4
- 229960000074 biopharmaceutical Drugs 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- 125000002837 carbocyclic group Chemical group 0.000 description 4
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 230000021615 conjugation Effects 0.000 description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- 238000004043 dyeing Methods 0.000 description 4
- 210000005069 ears Anatomy 0.000 description 4
- 229930195733 hydrocarbon Natural products 0.000 description 4
- 230000003308 immunostimulating effect Effects 0.000 description 4
- 210000000936 intestine Anatomy 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 4
- 230000004060 metabolic process Effects 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 210000002381 plasma Anatomy 0.000 description 4
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 150000003462 sulfoxides Chemical class 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 230000009466 transformation Effects 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- 210000003501 vero cell Anatomy 0.000 description 4
- 229940100050 virazole Drugs 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 241000700721 Hepatitis B virus Species 0.000 description 3
- 108090001007 Interleukin-8 Proteins 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 102100023727 Mitochondrial antiviral-signaling protein Human genes 0.000 description 3
- 101710142315 Mitochondrial antiviral-signaling protein Proteins 0.000 description 3
- 101710151805 Mitochondrial intermediate peptidase 1 Proteins 0.000 description 3
- 241000711408 Murine respirovirus Species 0.000 description 3
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 3
- 208000005155 Picornaviridae Infections Diseases 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 108091036414 Polyinosinic:polycytidylic acid Proteins 0.000 description 3
- 229940044606 RIG-I agonist Drugs 0.000 description 3
- CWHJIJJSDGEHNS-MYLFLSLOSA-N Senegenin Chemical compound C1[C@H](O)[C@H](O)[C@@](C)(C(O)=O)[C@@H]2CC[C@@]3(C)C(CC[C@]4(CCC(C[C@H]44)(C)C)C(O)=O)=C4[C@@H](CCl)C[C@@H]3[C@]21C CWHJIJJSDGEHNS-MYLFLSLOSA-N 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- 108091023040 Transcription factor Proteins 0.000 description 3
- 102000040945 Transcription factor Human genes 0.000 description 3
- 108020000999 Viral RNA Proteins 0.000 description 3
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 3
- 125000004104 aryloxy group Chemical group 0.000 description 3
- 229960001716 benzalkonium Drugs 0.000 description 3
- CYDRXTMLKJDRQH-UHFFFAOYSA-N benzododecinium Chemical compound CCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 CYDRXTMLKJDRQH-UHFFFAOYSA-N 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 230000036755 cellular response Effects 0.000 description 3
- 230000003399 chemotactic effect Effects 0.000 description 3
- 238000011284 combination treatment Methods 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 239000006184 cosolvent Substances 0.000 description 3
- ZICQBHNGXDOVJF-UHFFFAOYSA-N diamantane Chemical compound C1C2C3CC(C4)CC2C2C4C3CC1C2 ZICQBHNGXDOVJF-UHFFFAOYSA-N 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 238000010195 expression analysis Methods 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 210000001035 gastrointestinal tract Anatomy 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 125000004366 heterocycloalkenyl group Chemical group 0.000 description 3
- 125000004415 heterocyclylalkyl group Chemical group 0.000 description 3
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 3
- 125000002883 imidazolyl group Chemical group 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 229960001438 immunostimulant agent Drugs 0.000 description 3
- 239000003022 immunostimulating agent Substances 0.000 description 3
- 208000037797 influenza A Diseases 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 230000009545 invasion Effects 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 125000005956 isoquinolyl group Chemical group 0.000 description 3
- 125000001786 isothiazolyl group Chemical group 0.000 description 3
- 239000007937 lozenge Substances 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 210000001616 monocyte Anatomy 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 210000005259 peripheral blood Anatomy 0.000 description 3
- 239000011886 peripheral blood Substances 0.000 description 3
- 230000035699 permeability Effects 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 229920000728 polyester Polymers 0.000 description 3
- 229940115272 polyinosinic:polycytidylic acid Drugs 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 3
- 125000003226 pyrazolyl group Chemical group 0.000 description 3
- 125000000714 pyrimidinyl group Chemical group 0.000 description 3
- 238000003753 real-time PCR Methods 0.000 description 3
- 238000010839 reverse transcription Methods 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 150000004867 thiadiazoles Chemical class 0.000 description 3
- 231100000041 toxicology testing Toxicity 0.000 description 3
- 230000017105 transposition Effects 0.000 description 3
- 208000027930 type IV hypersensitivity disease Diseases 0.000 description 3
- 230000029812 viral genome replication Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- KTZQTRPPVKQPFO-UHFFFAOYSA-N 1,2-benzoxazole Chemical compound C1=CC=C2C=NOC2=C1 KTZQTRPPVKQPFO-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 2
- 102100022900 Actin, cytoplasmic 1 Human genes 0.000 description 2
- 108010085238 Actins Proteins 0.000 description 2
- 239000012103 Alexa Fluor 488 Substances 0.000 description 2
- 208000031295 Animal disease Diseases 0.000 description 2
- YFIJJNAKSZUOLT-UHFFFAOYSA-N Anthanthrene Chemical compound C1=C(C2=C34)C=CC=C2C=CC3=CC2=CC=CC3=CC=C1C4=C32 YFIJJNAKSZUOLT-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 108010062877 Bacteriocins Proteins 0.000 description 2
- GYFAGKUZYNFMBN-UHFFFAOYSA-N Benzo[ghi]perylene Chemical group C1=CC(C2=C34)=CC=C3C=CC=C4C3=CC=CC4=CC=C1C2=C43 GYFAGKUZYNFMBN-UHFFFAOYSA-N 0.000 description 2
- 108010017384 Blood Proteins Proteins 0.000 description 2
- 102000004506 Blood Proteins Human genes 0.000 description 2
- 240000002791 Brassica napus Species 0.000 description 2
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 2
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 2
- 238000011740 C57BL/6 mouse Methods 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 241000699802 Cricetulus griseus Species 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- 101150002750 IFIT1 gene Proteins 0.000 description 2
- 101150074358 IFIT2 gene Proteins 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 241000713297 Influenza C virus Species 0.000 description 2
- 102100027355 Interferon-induced protein with tetratricopeptide repeats 1 Human genes 0.000 description 2
- 108010065637 Interleukin-23 Proteins 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 108060004795 Methyltransferase Proteins 0.000 description 2
- 101800001014 Non-structural protein 5A Proteins 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 238000011529 RT qPCR Methods 0.000 description 2
- 206010061603 Respiratory syncytial virus infection Diseases 0.000 description 2
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 239000005864 Sulphur Substances 0.000 description 2
- 241000282898 Sus scrofa Species 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 2
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 2
- YQNQNVDNTFHQSW-UHFFFAOYSA-N acetic acid [2-[[(5-nitro-2-thiazolyl)amino]-oxomethyl]phenyl] ester Chemical compound CC(=O)OC1=CC=CC=C1C(=O)NC1=NC=C([N+]([O-])=O)S1 YQNQNVDNTFHQSW-UHFFFAOYSA-N 0.000 description 2
- LCJHLOJKAAQLQW-UHFFFAOYSA-N acetic acid;ethane Chemical compound CC.CC(O)=O LCJHLOJKAAQLQW-UHFFFAOYSA-N 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000000240 adjuvant effect Effects 0.000 description 2
- 125000004171 alkoxy aryl group Chemical group 0.000 description 2
- 125000001118 alkylidene group Chemical group 0.000 description 2
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 2
- 229910021502 aluminium hydroxide Inorganic materials 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 125000001769 aryl amino group Chemical group 0.000 description 2
- CUFNKYGDVFVPHO-UHFFFAOYSA-N azulene Chemical compound C1=CC=CC2=CC=CC2=C1 CUFNKYGDVFVPHO-UHFFFAOYSA-N 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 125000005605 benzo group Chemical group 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 125000000259 cinnolinyl group Chemical class N1=NC(=CC2=CC=CC=C12)* 0.000 description 2
- CJXAEXPPLWQRFR-UHFFFAOYSA-N clemizole Chemical compound C1=CC(Cl)=CC=C1CN1C2=CC=CC=C2N=C1CN1CCCC1 CJXAEXPPLWQRFR-UHFFFAOYSA-N 0.000 description 2
- 229950002020 clemizole Drugs 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- ZVTDLPBHTSMEJZ-JSZLBQEHSA-N danoprevir Chemical compound O=C([C@@]12C[C@H]1\C=C/CCCCC[C@@H](C(N1C[C@@H](C[C@H]1C(=O)N2)OC(=O)N1CC2=C(F)C=CC=C2C1)=O)NC(=O)OC(C)(C)C)NS(=O)(=O)C1CC1 ZVTDLPBHTSMEJZ-JSZLBQEHSA-N 0.000 description 2
- 230000005860 defense response to virus Effects 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 238000009509 drug development Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- MURGITYSBWUQTI-UHFFFAOYSA-N fluorescin Chemical compound OC(=O)C1=CC=CC=C1C1C2=CC=C(O)C=C2OC2=CC(O)=CC=C21 MURGITYSBWUQTI-UHFFFAOYSA-N 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 230000008348 humoral response Effects 0.000 description 2
- 239000000017 hydrogel Substances 0.000 description 2
- 150000002460 imidazoles Chemical class 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000012678 infectious agent Substances 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 2
- 229960000367 inositol Drugs 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 2
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 239000004005 microsphere Substances 0.000 description 2
- 125000004312 morpholin-2-yl group Chemical group [H]N1C([H])([H])C([H])([H])OC([H])(*)C1([H])[H] 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 229960002480 nitazoxanide Drugs 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 125000001715 oxadiazolyl group Chemical group 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- XRQDFNLINLXZLB-CKIKVBCHSA-N peramivir Chemical compound CCC(CC)[C@H](NC(C)=O)[C@@H]1[C@H](O)[C@@H](C(O)=O)C[C@H]1NC(N)=N XRQDFNLINLXZLB-CKIKVBCHSA-N 0.000 description 2
- 229960001084 peramivir Drugs 0.000 description 2
- 125000005561 phenanthryl group Chemical group 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 125000005936 piperidyl group Chemical group 0.000 description 2
- 229940068196 placebo Drugs 0.000 description 2
- 239000000902 placebo Substances 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 2
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 2
- 229960003415 propylparaben Drugs 0.000 description 2
- 230000005180 public health Effects 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- 125000005493 quinolyl group Chemical group 0.000 description 2
- 239000002516 radical scavenger Substances 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 2
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 210000000582 semen Anatomy 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- HEMHJVSKTPXQMS-UHFFFAOYSA-M sodium hydroxide Inorganic materials [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 150000005846 sugar alcohols Chemical class 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- NHKZSTHOYNWEEZ-AFCXAGJDSA-N taribavirin Chemical compound N1=C(C(=N)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NHKZSTHOYNWEEZ-AFCXAGJDSA-N 0.000 description 2
- 229950006081 taribavirin Drugs 0.000 description 2
- 229940095064 tartrate Drugs 0.000 description 2
- 125000001113 thiadiazolyl group Chemical group 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- XPFJYKARVSSRHE-UHFFFAOYSA-K trisodium;2-hydroxypropane-1,2,3-tricarboxylate;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [Na+].[Na+].[Na+].OC(=O)CC(O)(C(O)=O)CC(O)=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O XPFJYKARVSSRHE-UHFFFAOYSA-K 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000000811 xylitol Substances 0.000 description 2
- 235000010447 xylitol Nutrition 0.000 description 2
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 2
- 229960002675 xylitol Drugs 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- RNEACARJKXYVND-KQGZCTBQSA-N (2r)-2-[[(5z)-5-[(5-ethylfuran-2-yl)methylidene]-4-oxo-1,3-thiazol-2-yl]amino]-2-(4-fluorophenyl)acetic acid Chemical compound O1C(CC)=CC=C1\C=C/1C(=O)N=C(N[C@@H](C(O)=O)C=2C=CC(F)=CC=2)S\1 RNEACARJKXYVND-KQGZCTBQSA-N 0.000 description 1
- AQHMBDAHQGYLIU-XNFHFXFQSA-N (3s,6s,9s,12r,15s,18s,21s,24s,27r,30s,33s)-27-[2-(dimethylamino)ethylsulfanyl]-30-ethyl-33-[(e,1r,2r)-1-hydroxy-2-methylhex-4-enyl]-24-(2-hydroxy-2-methylpropyl)-1,4,7,10,12,15,19,25,28-nonamethyl-6,9,18-tris(2-methylpropyl)-3,21-di(propan-2-yl)-1,4,7,10, Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)(C)O)N(C)C(=O)[C@@H](SCCN(C)C)N(C)C1=O AQHMBDAHQGYLIU-XNFHFXFQSA-N 0.000 description 1
- HBZBAMXERPYTFS-SECBINFHSA-N (4S)-2-(6,7-dihydro-5H-pyrrolo[3,2-f][1,3]benzothiazol-2-yl)-4,5-dihydro-1,3-thiazole-4-carboxylic acid Chemical compound OC(=O)[C@H]1CSC(=N1)c1nc2cc3CCNc3cc2s1 HBZBAMXERPYTFS-SECBINFHSA-N 0.000 description 1
- PPDBOQMNKNNODG-NTEUORMPSA-N (5E)-5-(4-chlorobenzylidene)-2,2-dimethyl-1-(1,2,4-triazol-1-ylmethyl)cyclopentanol Chemical compound C1=NC=NN1CC1(O)C(C)(C)CC\C1=C/C1=CC=C(Cl)C=C1 PPDBOQMNKNNODG-NTEUORMPSA-N 0.000 description 1
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 description 1
- AGBQKNBQESQNJD-SSDOTTSWSA-N (R)-lipoic acid Chemical compound OC(=O)CCCC[C@@H]1CCSS1 AGBQKNBQESQNJD-SSDOTTSWSA-N 0.000 description 1
- RYDFXSRVZBYYJV-TYYBGVCCSA-N (e)-but-2-enedioic acid;sodium Chemical compound [Na].OC(=O)\C=C\C(O)=O RYDFXSRVZBYYJV-TYYBGVCCSA-N 0.000 description 1
- IOEPOEDBBPRAEI-UHFFFAOYSA-N 1,2-dihydroisoquinoline Chemical compound C1=CC=C2CNC=CC2=C1 IOEPOEDBBPRAEI-UHFFFAOYSA-N 0.000 description 1
- 125000005871 1,3-benzodioxolyl group Chemical group 0.000 description 1
- HPARLNRMYDSBNO-UHFFFAOYSA-N 1,4-benzodioxine Chemical compound C1=CC=C2OC=COC2=C1 HPARLNRMYDSBNO-UHFFFAOYSA-N 0.000 description 1
- OGNSDRMLWYNUED-UHFFFAOYSA-N 1-cyclohexyl-4-[4-[4-(4-cyclohexylcyclohexyl)cyclohexyl]cyclohexyl]cyclohexane Chemical group C1CCCCC1C1CCC(C2CCC(CC2)C2CCC(CC2)C2CCC(CC2)C2CCCCC2)CC1 OGNSDRMLWYNUED-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- YVSFLVNWJIEJRV-UHFFFAOYSA-N 1-undecyne Chemical compound CCCCCCCCCC#C YVSFLVNWJIEJRV-UHFFFAOYSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- HIYWOHBEPVGIQN-UHFFFAOYSA-N 1h-benzo[g]indole Chemical compound C1=CC=CC2=C(NC=C3)C3=CC=C21 HIYWOHBEPVGIQN-UHFFFAOYSA-N 0.000 description 1
- YFXGICNMLCGLHJ-RSKRLRQZSA-N 2,2-dimethylpropyl (2s)-2-[[[(2r,3r,4r,5r)-5-(2-amino-6-methoxypurin-9-yl)-3,4-dihydroxy-4-methyloxolan-2-yl]methoxy-naphthalen-1-yloxyphosphoryl]amino]propanoate Chemical compound C1=CC=C2C(OP(=O)(N[C@@H](C)C(=O)OCC(C)(C)C)OC[C@H]3O[C@H]([C@]([C@@H]3O)(C)O)N3C=4N=C(N)N=C(C=4N=C3)OC)=CC=CC2=C1 YFXGICNMLCGLHJ-RSKRLRQZSA-N 0.000 description 1
- HGUFODBRKLSHSI-UHFFFAOYSA-N 2,3,7,8-tetrachloro-dibenzo-p-dioxin Chemical compound O1C2=CC(Cl)=C(Cl)C=C2OC2=C1C=C(Cl)C(Cl)=C2 HGUFODBRKLSHSI-UHFFFAOYSA-N 0.000 description 1
- HTCSFFGLRQDZDE-UHFFFAOYSA-N 2-azaniumyl-2-phenylpropanoate Chemical compound OC(=O)C(N)(C)C1=CC=CC=C1 HTCSFFGLRQDZDE-UHFFFAOYSA-N 0.000 description 1
- SFNLLCUAISZNRV-UHFFFAOYSA-N 2-chloro-n-(9h-fluoren-9-ylcarbamoyl)-6-fluorobenzamide Chemical compound FC1=CC=CC(Cl)=C1C(=O)NC(=O)NC1C2=CC=CC=C2C2=CC=CC=C21 SFNLLCUAISZNRV-UHFFFAOYSA-N 0.000 description 1
- ZZUUMCMLIPRDPI-UHFFFAOYSA-N 2-hydroxypropanoic acid;sodium Chemical compound [Na].CC(O)C(O)=O ZZUUMCMLIPRDPI-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- ROSNVSQTEGHUKU-UHFFFAOYSA-N 4-[4-(4-chloro-phenoxy)-benzenesulfonylmethyl]-tetrahydro-pyran-4-carboxylic acid hydroxyamide Chemical compound C=1C=C(OC=2C=CC(Cl)=CC=2)C=CC=1S(=O)(=O)CC1(C(=O)NO)CCOCC1 ROSNVSQTEGHUKU-UHFFFAOYSA-N 0.000 description 1
- WPMJNLCLKAKMLA-UHFFFAOYSA-N 5-(3,3-dimethylbut-1-ynyl)-3-[(4-hydroxycyclohexyl)-[(4-methylcyclohexyl)-oxomethyl]amino]-2-thiophenecarboxylic acid Chemical compound C1CC(C)CCC1C(=O)N(C1=C(SC(=C1)C#CC(C)(C)C)C(O)=O)C1CCC(O)CC1 WPMJNLCLKAKMLA-UHFFFAOYSA-N 0.000 description 1
- SUBDBMMJDZJVOS-UHFFFAOYSA-N 5-methoxy-2-{[(4-methoxy-3,5-dimethylpyridin-2-yl)methyl]sulfinyl}-1H-benzimidazole Chemical compound N=1C2=CC(OC)=CC=C2NC=1S(=O)CC1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- PVRFQJIRERYGTQ-DSQUMVBZSA-N 9-[(2s,4ar,6r,7r,7ar)-7-fluoro-7-methyl-2-oxo-2-propan-2-yloxy-4,4a,6,7a-tetrahydrofuro[3,2-d][1,3,2]dioxaphosphinin-6-yl]-6-ethoxypurin-2-amine Chemical compound C([C@H]1O2)O[P@@](=O)(OC(C)C)O[C@H]1[C@](F)(C)[C@@H]2N1C(N=C(N)N=C2OCC)=C2N=C1 PVRFQJIRERYGTQ-DSQUMVBZSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 101100230376 Acetivibrio thermocellus (strain ATCC 27405 / DSM 1237 / JCM 9322 / NBRC 103400 / NCIMB 10682 / NRRL B-4536 / VPI 7372) celI gene Proteins 0.000 description 1
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 102100034613 Annexin A2 Human genes 0.000 description 1
- 108090000668 Annexin A2 Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000714197 Avian myeloblastosis-associated virus Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- TXVHTIQJNYSSKO-UHFFFAOYSA-N BeP Natural products C1=CC=C2C3=CC=CC=C3C3=CC=CC4=CC=C1C2=C34 TXVHTIQJNYSSKO-UHFFFAOYSA-N 0.000 description 1
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- 102100026735 Coagulation factor VIII Human genes 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 229940077097 Cyclophilin A inhibitor Drugs 0.000 description 1
- HEBKCHPVOIAQTA-QWWZWVQMSA-N D-arabinitol Chemical compound OC[C@@H](O)C(O)[C@H](O)CO HEBKCHPVOIAQTA-QWWZWVQMSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 238000011238 DNA vaccination Methods 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102100038132 Endogenous retrovirus group K member 6 Pro protein Human genes 0.000 description 1
- 101710091045 Envelope protein Proteins 0.000 description 1
- 239000004386 Erythritol Substances 0.000 description 1
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 241000272190 Falco peregrinus Species 0.000 description 1
- 241000272184 Falconiformes Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000710831 Flavivirus Species 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 241000531123 GB virus C Species 0.000 description 1
- 229940126656 GS-4224 Drugs 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- CATMPQFFVNKDEY-YPMHNXCESA-N Golotimod Chemical compound C1=CC=C2C(C[C@H](NC(=O)CC[C@@H](N)C(O)=O)C(O)=O)=CNC2=C1 CATMPQFFVNKDEY-YPMHNXCESA-N 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 229940121759 Helicase inhibitor Drugs 0.000 description 1
- 206010019663 Hepatic failure Diseases 0.000 description 1
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 101150103227 IFN gene Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 101710090028 Inositol-3-phosphate synthase 1 Proteins 0.000 description 1
- 102100034349 Integrase Human genes 0.000 description 1
- 238000012695 Interfacial polymerization Methods 0.000 description 1
- 102000007578 Interferon Regulatory Factor-3 Human genes 0.000 description 1
- 108010032038 Interferon Regulatory Factor-3 Proteins 0.000 description 1
- 102100040018 Interferon alpha-2 Human genes 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010079944 Interferon-alpha2b Proteins 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108090000174 Interleukin-10 Proteins 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108010066979 Interleukin-27 Proteins 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- QNRRHYPPQFELSF-CNYIRLTGSA-N Laninamivir Chemical compound OC[C@@H](O)[C@@H](OC)[C@@H]1OC(C(O)=O)=C[C@H](N=C(N)N)[C@H]1NC(C)=O QNRRHYPPQFELSF-CNYIRLTGSA-N 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 101150037717 Mavs gene Proteins 0.000 description 1
- 241000511739 Melampyrum Species 0.000 description 1
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical compound SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 description 1
- 229940122938 MicroRNA inhibitor Drugs 0.000 description 1
- 101100288142 Mus musculus Klkb1 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- XUYPXLNMDZIRQH-LURJTMIESA-N N-acetyl-L-methionine Chemical compound CSCC[C@@H](C(O)=O)NC(C)=O XUYPXLNMDZIRQH-LURJTMIESA-N 0.000 description 1
- MQUQNUAYKLCRME-INIZCTEOSA-N N-tosyl-L-phenylalanyl chloromethyl ketone Chemical compound C1=CC(C)=CC=C1S(=O)(=O)N[C@H](C(=O)CCl)CC1=CC=CC=C1 MQUQNUAYKLCRME-INIZCTEOSA-N 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102000002710 Neurophysins Human genes 0.000 description 1
- 108010018674 Neurophysins Proteins 0.000 description 1
- YEPBUHWNLNKZBW-UEMKMYPFSA-N O=C([C@]12NC(=O)[C@H]3N(C(N(C)CCCC\C=C/[C@@H]1C2)=O)CC[C@@H](C3)OC=1C2=CC=C(C(=C2N=C(C=1)C=1SC=C(N=1)C(F)(F)F)C)OC)NS(=O)(=O)C1(C)CC1 Chemical compound O=C([C@]12NC(=O)[C@H]3N(C(N(C)CCCC\C=C/[C@@H]1C2)=O)CC[C@@H](C3)OC=1C2=CC=C(C(=C2N=C(C=1)C=1SC=C(N=1)C(F)(F)F)C)OC)NS(=O)(=O)C1(C)CC1 YEPBUHWNLNKZBW-UEMKMYPFSA-N 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 229920002556 Polyethylene Glycol 300 Polymers 0.000 description 1
- 229920002565 Polyethylene Glycol 400 Polymers 0.000 description 1
- 229940123066 Polymerase inhibitor Drugs 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 101710188315 Protein X Proteins 0.000 description 1
- KDCGOANMDULRCW-UHFFFAOYSA-N Purine Natural products N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- JVWLUVNSQYXYBE-UHFFFAOYSA-N Ribitol Natural products OCC(C)C(O)C(O)CO JVWLUVNSQYXYBE-UHFFFAOYSA-N 0.000 description 1
- 125000005631 S-sulfonamido group Chemical group 0.000 description 1
- 108010090287 SCY-635 Proteins 0.000 description 1
- MHFMTUBUVQZIRE-WINRQGAFSA-N Sovaprevir Chemical compound C([C@H](C(=O)N1[C@@H](C[C@H](C1)OC=1C2=CC=C(C=C2N=C(C=1)C=1C=CC=CC=1)OC)C(=O)N[C@]1([C@@H](C1)C=C)C(=O)NS(=O)(=O)C1CC1)C(C)(C)C)C(=O)N1CCCCC1 MHFMTUBUVQZIRE-WINRQGAFSA-N 0.000 description 1
- UQZIYBXSHAGNOE-USOSMYMVSA-N Stachyose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](CO[C@@H]2[C@@H](O)[C@@H](O)[C@@H](O)[C@H](CO)O2)O1 UQZIYBXSHAGNOE-USOSMYMVSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 206010053613 Type IV hypersensitivity reaction Diseases 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 244000178320 Vaccaria pyramidata Species 0.000 description 1
- 235000010587 Vaccaria pyramidata Nutrition 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 235000009754 Vitis X bourquina Nutrition 0.000 description 1
- 235000012333 Vitis X labruscana Nutrition 0.000 description 1
- 240000006365 Vitis vinifera Species 0.000 description 1
- 235000014787 Vitis vinifera Nutrition 0.000 description 1
- MLESJYFEMSJZLZ-MAAOGQSESA-N [(2r,3r,4r,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-4-fluoro-4-methyl-3-(2-methylpropanoyloxy)oxolan-2-yl]methyl 2-methylpropanoate Chemical compound C[C@@]1(F)[C@H](OC(=O)C(C)C)[C@@H](COC(=O)C(C)C)O[C@H]1N1C(=O)N=C(N)C=C1 MLESJYFEMSJZLZ-MAAOGQSESA-N 0.000 description 1
- HOOMGTNENMZAFP-NYNCVSEMSA-N [(2r,3r,5s)-2-(5-amino-2-oxo-[1,3]thiazolo[4,5-d]pyrimidin-3-yl)-5-(hydroxymethyl)oxolan-3-yl] acetate Chemical compound CC(=O)O[C@@H]1C[C@@H](CO)O[C@H]1N1C(=O)SC2=CN=C(N)N=C21 HOOMGTNENMZAFP-NYNCVSEMSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- LPQOADBMXVRBNX-UHFFFAOYSA-N ac1ldcw0 Chemical compound Cl.C1CN(C)CCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN3CCSC1=C32 LPQOADBMXVRBNX-UHFFFAOYSA-N 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 125000004062 acenaphthenyl group Chemical group C1(CC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 230000004721 adaptive immunity Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000006323 alkenyl amino group Chemical group 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 125000002521 alkyl halide group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PQMKYFCFSA-N alpha-D-mannose Chemical compound OC[C@H]1O[C@H](O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-PQMKYFCFSA-N 0.000 description 1
- SRBFZHDQGSBBOR-LECHCGJUSA-N alpha-D-xylose Chemical compound O[C@@H]1CO[C@H](O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-LECHCGJUSA-N 0.000 description 1
- AGBQKNBQESQNJD-UHFFFAOYSA-N alpha-Lipoic acid Natural products OC(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 1
- 229960003805 amantadine Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000001387 anti-histamine Effects 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 229940031567 attenuated vaccine Drugs 0.000 description 1
- 229950007843 bavituximab Drugs 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 238000004638 bioanalytical method Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- OVYQSRKFHNKIBM-UHFFFAOYSA-N butanedioic acid Chemical compound OC(=O)CCC(O)=O.OC(=O)CCC(O)=O OVYQSRKFHNKIBM-UHFFFAOYSA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003262 carboxylic acid ester group Chemical group [H]C([H])([*:2])OC(=O)C([H])([H])[*:1] 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- OTAFHZMPRISVEM-UHFFFAOYSA-N chromone Chemical compound C1=CC=C2C(=O)C=COC2=C1 OTAFHZMPRISVEM-UHFFFAOYSA-N 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 150000003999 cyclitols Chemical class 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 230000000120 cytopathologic effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000002354 daily effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 125000005070 decynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical group C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 1
- 125000004611 dihydroisoindolyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- OSIAURSWRZARKZ-UHFFFAOYSA-N dihydroxyphosphinothioylformic acid Chemical compound OC(=O)P(O)(O)=S OSIAURSWRZARKZ-UHFFFAOYSA-N 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- OBISXEJSEGNNKL-UHFFFAOYSA-N dinitrogen-n-sulfide Chemical compound [N-]=[N+]=S OBISXEJSEGNNKL-UHFFFAOYSA-N 0.000 description 1
- OQOQSRMIBLJVHE-UHFFFAOYSA-L dipotassium 2-hydroxy-2-oxoacetate Chemical compound [K+].[K+].OC(=O)C(O)=O.[O-]C(=O)C([O-])=O OQOQSRMIBLJVHE-UHFFFAOYSA-L 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- WGFMTHGYKYEDHF-UHFFFAOYSA-L disodium 2-hydroxy-2-oxoacetate Chemical compound [Na+].[Na+].OC(=O)C(O)=O.[O-]C(=O)C([O-])=O WGFMTHGYKYEDHF-UHFFFAOYSA-L 0.000 description 1
- SILCDLWESNHZKB-UHFFFAOYSA-L disodium 4-hydroxy-4-oxobutanoate Chemical compound [Na+].[Na+].OC(=O)CCC([O-])=O.OC(=O)CCC([O-])=O SILCDLWESNHZKB-UHFFFAOYSA-L 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- ZVDBUOGYYYNMQI-UHFFFAOYSA-N dodec-1-yne Chemical compound CCCCCCCCCCC#C ZVDBUOGYYYNMQI-UHFFFAOYSA-N 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 1
- 210000003237 epithelioid cell Anatomy 0.000 description 1
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 description 1
- 229940009714 erythritol Drugs 0.000 description 1
- 235000019414 erythritol Nutrition 0.000 description 1
- JCEGKJFZOJBPOL-UHFFFAOYSA-N ethanol;2-hydroxypropanoic acid Chemical compound CCO.CC(O)C(O)=O JCEGKJFZOJBPOL-UHFFFAOYSA-N 0.000 description 1
- 125000004672 ethylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 238000009313 farming Methods 0.000 description 1
- ZCGNOVWYSGBHAU-UHFFFAOYSA-N favipiravir Chemical compound NC(=O)C1=NC(F)=CNC1=O ZCGNOVWYSGBHAU-UHFFFAOYSA-N 0.000 description 1
- 229950008454 favipiravir Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 229940125777 fusion inhibitor Drugs 0.000 description 1
- FBPFZTCFMRRESA-GUCUJZIJSA-N galactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-GUCUJZIJSA-N 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 231100000025 genetic toxicology Toxicity 0.000 description 1
- 230000001738 genotoxic effect Effects 0.000 description 1
- FVIZARNDLVOMSU-UHFFFAOYSA-N ginsenoside K Natural products C1CC(C2(CCC3C(C)(C)C(O)CCC3(C)C2CC2O)C)(C)C2C1C(C)(CCC=C(C)C)OC1OC(CO)C(O)C(O)C1O FVIZARNDLVOMSU-UHFFFAOYSA-N 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- UHUSDOQQWJGJQS-UHFFFAOYSA-N glycerol 1,2-dioctadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(CO)OC(=O)CCCCCCCCCCCCCCCCC UHUSDOQQWJGJQS-UHFFFAOYSA-N 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 108010049353 golotimod Proteins 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- YVXHZKKCZYLQOP-UHFFFAOYSA-N hept-1-yne Chemical compound CCCCCC#C YVXHZKKCZYLQOP-UHFFFAOYSA-N 0.000 description 1
- 125000003187 heptyl group Chemical class [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 244000144980 herd Species 0.000 description 1
- UCIDYSLOTJMRAM-UHFFFAOYSA-N hexadec-1-yne Chemical compound CCCCCCCCCCCCCCC#C UCIDYSLOTJMRAM-UHFFFAOYSA-N 0.000 description 1
- UOYPNWSDSPYOSN-UHFFFAOYSA-N hexahelicene Chemical compound C1=CC=CC2=C(C=3C(=CC=C4C=CC=5C(C=34)=CC=CC=5)C=C3)C3=CC=C21 UOYPNWSDSPYOSN-UHFFFAOYSA-N 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 238000013394 immunophenotyping Methods 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- ICIWUVCWSCSTAQ-UHFFFAOYSA-M iodate Chemical compound [O-]I(=O)=O ICIWUVCWSCSTAQ-UHFFFAOYSA-M 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- GWVMLCQWXVFZCN-UHFFFAOYSA-N isoindoline Chemical compound C1=CC=C2CNCC2=C1 GWVMLCQWXVFZCN-UHFFFAOYSA-N 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 238000009533 lab test Methods 0.000 description 1
- JJTUDXZGHPGLLC-UHFFFAOYSA-N lactide Chemical compound CC1OC(=O)C(C)OC1=O JJTUDXZGHPGLLC-UHFFFAOYSA-N 0.000 description 1
- 229950004244 laninamivir Drugs 0.000 description 1
- RGLRXNKKBLIBQS-XNHQSDQCSA-N leuprolide acetate Chemical compound CC(O)=O.CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 RGLRXNKKBLIBQS-XNHQSDQCSA-N 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 208000007903 liver failure Diseases 0.000 description 1
- 231100000835 liver failure Toxicity 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 229940087857 lupron Drugs 0.000 description 1
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 1
- 238000003754 machining Methods 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 239000000395 magnesium oxide Substances 0.000 description 1
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 1
- 235000012245 magnesium oxide Nutrition 0.000 description 1
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 1
- 231100000682 maximum tolerated dose Toxicity 0.000 description 1
- 239000008155 medical solution Substances 0.000 description 1
- 229940100630 metacresol Drugs 0.000 description 1
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 description 1
- 125000006431 methyl cyclopropyl group Chemical group 0.000 description 1
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- PJUIMOJAAPLTRJ-UHFFFAOYSA-N monothioglycerol Chemical compound OCC(O)CS PJUIMOJAAPLTRJ-UHFFFAOYSA-N 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- BSOQXXWZTUDTEL-ZUYCGGNHSA-N muramyl dipeptide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)O[C@@H](O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-ZUYCGGNHSA-N 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- UUROSJLZNDSXRF-UHFFFAOYSA-N n-[5-tert-butyl-3-(methanesulfonamido)-2-methoxyphenyl]-2-[4-(2-morpholin-4-ylethoxy)naphthalen-1-yl]-2-oxoacetamide Chemical compound C1=C(C(C)(C)C)C=C(NS(C)(=O)=O)C(OC)=C1NC(=O)C(=O)C(C1=CC=CC=C11)=CC=C1OCCN1CCOCC1 UUROSJLZNDSXRF-UHFFFAOYSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 239000002743 neurokinin 1 receptor agonist Substances 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 231100001083 no cytotoxicity Toxicity 0.000 description 1
- OSSQSXOTMIGBCF-UHFFFAOYSA-N non-1-yne Chemical group CCCCCCCC#C OSSQSXOTMIGBCF-UHFFFAOYSA-N 0.000 description 1
- 108091027963 non-coding RNA Proteins 0.000 description 1
- 102000042567 non-coding RNA Human genes 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 235000014571 nuts Nutrition 0.000 description 1
- IYDNQWWOZQLMRH-UHFFFAOYSA-N octadec-1-yne Chemical compound CCCCCCCCCCCCCCCCC#C IYDNQWWOZQLMRH-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229940039748 oxalate Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 108010092851 peginterferon alfa-2b Proteins 0.000 description 1
- 229940106366 pegintron Drugs 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- FWZLYKYJQSQEPN-SKLAJPBESA-N peregrine Chemical compound OC1[C@H]2[C@@H]3C4([C@@H]5C6OC(C)=O)C(OC)CC[C@@]5(C)CN(CC)[C@H]4C6[C@@]2(OC)C[C@H](OC)[C@H]1C3 FWZLYKYJQSQEPN-SKLAJPBESA-N 0.000 description 1
- FWZLYKYJQSQEPN-UHFFFAOYSA-N peregrine Natural products OC1C2C3C4(C5C6OC(C)=O)C(OC)CCC5(C)CN(CC)C4C6C2(OC)CC(OC)C1C3 FWZLYKYJQSQEPN-UHFFFAOYSA-N 0.000 description 1
- 229930192851 perforin Natural products 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 1
- 238000001050 pharmacotherapy Methods 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920000867 polyelectrolyte Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 239000004224 potassium gluconate Substances 0.000 description 1
- 229960003189 potassium gluconate Drugs 0.000 description 1
- LCPMNMXCIHBTEX-UHFFFAOYSA-M potassium;2-hydroxypropanoate;2-hydroxypropanoic acid Chemical compound [K+].CC(O)C(O)=O.CC(O)C([O-])=O LCPMNMXCIHBTEX-UHFFFAOYSA-M 0.000 description 1
- RYXIBQLRUHDYEE-UHFFFAOYSA-M potassium;5-(cyclohexen-1-yl)-3-[(4-methoxycyclohexyl)-(4-methylcyclohexanecarbonyl)amino]thiophene-2-carboxylate Chemical compound [K+].C1CC(OC)CCC1N(C1=C(SC(=C1)C=1CCCCC=1)C([O-])=O)C(=O)C1CCC(C)CC1 RYXIBQLRUHDYEE-UHFFFAOYSA-M 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 230000001915 proofreading effect Effects 0.000 description 1
- FWLKYEAOOIPJRL-UHFFFAOYSA-N prop-1-yn-1-ol Chemical compound CC#CO FWLKYEAOOIPJRL-UHFFFAOYSA-N 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 229940023143 protein vaccine Drugs 0.000 description 1
- 239000003379 purinergic P1 receptor agonist Substances 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 238000005173 quadrupole mass spectroscopy Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 239000012048 reactive intermediate Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000002787 reinforcement Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 229950010550 resiquimod Drugs 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- HEBKCHPVOIAQTA-ZXFHETKHSA-N ribitol Chemical compound OC[C@H](O)[C@H](O)[C@H](O)CO HEBKCHPVOIAQTA-ZXFHETKHSA-N 0.000 description 1
- 239000003419 rna directed dna polymerase inhibitor Substances 0.000 description 1
- 238000011808 rodent model Methods 0.000 description 1
- FGHMGRXAHIXTBM-TWFJNEQDSA-N s-[2-[[(2r,3r,4r,5r)-5-(2-amino-6-oxo-3h-purin-9-yl)-3,4-dihydroxy-4-methyloxolan-2-yl]methoxy-(benzylamino)phosphoryl]oxyethyl] 3-hydroxy-2,2-dimethylpropanethioate Chemical compound C([C@@H]1[C@H]([C@@](C)(O)[C@H](N2C3=C(C(NC(N)=N3)=O)N=C2)O1)O)OP(=O)(OCCSC(=O)C(C)(CO)C)NCC1=CC=CC=C1 FGHMGRXAHIXTBM-TWFJNEQDSA-N 0.000 description 1
- 239000011833 salt mixture Substances 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000001932 seasonal effect Effects 0.000 description 1
- 210000005212 secondary lymphoid organ Anatomy 0.000 description 1
- 239000003352 sequestering agent Substances 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- DEKOYVOWOVJMPM-RLHIPHHXSA-N setrobuvir Chemical compound N1([C@H]2[C@@H]3CC[C@@H](C3)[C@H]2C(O)=C(C1=O)C=1NC2=CC=C(C=C2S(=O)(=O)N=1)NS(=O)(=O)C)CC1=CC=C(F)C=C1 DEKOYVOWOVJMPM-RLHIPHHXSA-N 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 238000006884 silylation reaction Methods 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- BHZOKUMUHVTPBX-UHFFFAOYSA-M sodium acetic acid acetate Chemical compound [Na+].CC(O)=O.CC([O-])=O BHZOKUMUHVTPBX-UHFFFAOYSA-M 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- GNBVPFITFYNRCN-UHFFFAOYSA-M sodium thioglycolate Chemical compound [Na+].[O-]C(=O)CS GNBVPFITFYNRCN-UHFFFAOYSA-M 0.000 description 1
- 229940046307 sodium thioglycolate Drugs 0.000 description 1
- PODWXQQNRWNDGD-UHFFFAOYSA-L sodium thiosulfate pentahydrate Chemical compound O.O.O.O.O.[Na+].[Na+].[O-]S([S-])(=O)=O PODWXQQNRWNDGD-UHFFFAOYSA-L 0.000 description 1
- LLVQEXSQFBTIRD-UHFFFAOYSA-M sodium;2,3,4-trihydroxy-4-oxobutanoate;hydrate Chemical compound O.[Na+].OC(=O)C(O)C(O)C([O-])=O LLVQEXSQFBTIRD-UHFFFAOYSA-M 0.000 description 1
- ZEFCBWQRHWLUTC-UHFFFAOYSA-M sodium;2,3-dihydroxybutanedioic acid;2,3,4-trihydroxy-4-oxobutanoate Chemical compound [Na+].OC(=O)C(O)C(O)C(O)=O.OC(=O)C(O)C(O)C([O-])=O ZEFCBWQRHWLUTC-UHFFFAOYSA-M 0.000 description 1
- VDZDAHYKYRVHJR-UHFFFAOYSA-M sodium;2-hydroxypropanoate;hydrate Chemical compound [OH-].[Na+].CC(O)C(O)=O VDZDAHYKYRVHJR-UHFFFAOYSA-M 0.000 description 1
- SSERCMQZZYTNBY-UHFFFAOYSA-M sodium;3-[(4-hydroxycyclohexyl)-(4-methylcyclohexanecarbonyl)amino]-5-phenylthiophene-2-carboxylate Chemical compound [Na+].C1CC(C)CCC1C(=O)N(C1=C(SC(=C1)C=1C=CC=CC=1)C([O-])=O)C1CCC(O)CC1 SSERCMQZZYTNBY-UHFFFAOYSA-M 0.000 description 1
- OESFSXYRSCBAQJ-UHFFFAOYSA-M sodium;3-carboxy-3,5-dihydroxy-5-oxopentanoate;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [Na+].OC(=O)CC(O)(C(O)=O)CC(O)=O.OC(=O)CC(O)(C(O)=O)CC([O-])=O OESFSXYRSCBAQJ-UHFFFAOYSA-M 0.000 description 1
- DGPIGKCOQYBCJH-UHFFFAOYSA-M sodium;acetic acid;hydroxide Chemical compound O.[Na+].CC([O-])=O DGPIGKCOQYBCJH-UHFFFAOYSA-M 0.000 description 1
- JISIBLCXFLGVJX-UHFFFAOYSA-M sodium;butanedioic acid;hydroxide Chemical compound [OH-].[Na+].OC(=O)CCC(O)=O JISIBLCXFLGVJX-UHFFFAOYSA-M 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- KIJIBEBWNNLSKE-UHFFFAOYSA-M sodium;oxalic acid;hydroxide Chemical compound [OH-].[Na+].OC(=O)C(O)=O KIJIBEBWNNLSKE-UHFFFAOYSA-M 0.000 description 1
- 229960002063 sofosbuvir Drugs 0.000 description 1
- TTZHDVOVKQGIBA-IQWMDFIBSA-N sofosbuvir Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@]2(F)C)O)CO[P@@](=O)(N[C@@H](C)C(=O)OC(C)C)OC=2C=CC=CC=2)C=CC(=O)NC1=O TTZHDVOVKQGIBA-IQWMDFIBSA-N 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- UQZIYBXSHAGNOE-XNSRJBNMSA-N stachyose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO[C@@H]3[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O3)O)O2)O)O1 UQZIYBXSHAGNOE-XNSRJBNMSA-N 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000008227 sterile water for injection Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 239000004575 stone Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000008362 succinate buffer Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 125000004646 sulfenyl group Chemical group S(*)* 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 108010017101 telaprevir Proteins 0.000 description 1
- BBAWEDCPNXPBQM-GDEBMMAJSA-N telaprevir Chemical compound N([C@H](C(=O)N[C@H](C(=O)N1C[C@@H]2CCC[C@@H]2[C@H]1C(=O)N[C@@H](CCC)C(=O)C(=O)NC1CC1)C(C)(C)C)C1CCCCC1)C(=O)C1=CN=CC=N1 BBAWEDCPNXPBQM-GDEBMMAJSA-N 0.000 description 1
- 229960002935 telaprevir Drugs 0.000 description 1
- 125000001935 tetracenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C12)* 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- DBDCNCCRPKTRSD-UHFFFAOYSA-N thieno[3,2-b]pyridine Chemical compound C1=CC=C2SC=CC2=N1 DBDCNCCRPKTRSD-UHFFFAOYSA-N 0.000 description 1
- 229940125670 thienopyridine Drugs 0.000 description 1
- 239000002175 thienopyridine Substances 0.000 description 1
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- DTMHTVJOHYTUHE-UHFFFAOYSA-N thiocyanogen Chemical compound N#CSSC#N DTMHTVJOHYTUHE-UHFFFAOYSA-N 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- GZEDKDBFUBPZNG-UHFFFAOYSA-N tridec-1-yne Chemical compound CCCCCCCCCCCC#C GZEDKDBFUBPZNG-UHFFFAOYSA-N 0.000 description 1
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 150000004043 trisaccharides Chemical class 0.000 description 1
- 230000005951 type IV hypersensitivity Effects 0.000 description 1
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 1
- 229940045145 uridine Drugs 0.000 description 1
- 229940124856 vaccine component Drugs 0.000 description 1
- 239000012873 virucide Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 238000011816 wild-type C57Bl6 mouse Methods 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 229960003487 xylose Drugs 0.000 description 1
- 125000005023 xylyl group Chemical group 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/428—Thiazoles condensed with carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/429—Thiazoles condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/575—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 humoral response
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Virology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Mycology (AREA)
- Communicable Diseases (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本文揭示用于治疗病毒感染(包括RNA病毒感染)的化合物和相关组合物,和可以调节脊椎动物细胞中的RIG-I路径的化合物,包括可以活化所述RIG-I路径的化合物。
Description
技术领域
本文中所公开的化合物和方法适用于治疗脊椎动物的病毒感染,包括RNA病毒感染。
背景技术
总体来说,RNA病毒在美国和全世界代表一个巨大的公共卫生问题。熟知的RNA病毒包括流感病毒(包括禽类和猪类分离株)、C型肝炎病毒(HCV)、西尼罗河病毒(WestNile virus)、SARS冠状病毒、呼吸道融合性病毒(RSV)和人类免疫缺乏病毒(HIV)。
全世界超过17亿人感染HCV,并且其中13亿是处于患上慢性肝病(肝硬化、肝癌和肝衰竭)风险中的慢性携带者(chronic carrier)。因此,HCV是已开发世界中占所有肝脏移植三分之二的原因。最近研究显示HCV感染的死亡率因慢性感染患者的年龄增长而升高。同样,季节性流感感染5-20%的人口,导致每年200,000人住院和36,000人死亡。
与流感和HCV相比,西尼罗河病毒造成的感染数最低,2010年美国感染者是981。20%的感染患者患上重型疾病,导致4.5%的死亡率。与流感和HCV不同,不存在被核准用于治疗西尼罗河病毒感染的疗法,并且西尼罗河病毒因其可能作为生物战剂(bioterrorist agent)而是药物开发的高优先级病原体。
在所列举的RNA病毒中,仅流感病毒存在疫苗。因此,药物疗法对降低与这些病毒相关的显著发病率和死亡率必不可少。令人遗憾的是,抗病毒药物的数目有限,多数有效性较差,并且几乎全部受病毒抗性快速进化和有限作用范围困扰。此外,急性流感和HCV感染的治疗仅适度有效。HCV感染的照护标准(standard of care)聚乙二醇化干扰素和病毒唑(ribavirin)仅对50%的患者有效,并且存在许多与组合疗法有关的剂量限制性副作用。两类急性流感抗病毒剂(金刚烷和神经氨酸苷酶抑制剂)仅在感染后首先48小时内有效,因此限制治疗的机会窗口。金刚烷的高抗性已限制其使用,并且神经氨酸苷酶抑制剂的大量储备将最终导致滥用并且出现流感抗性株。
大部分针对这些病毒的药物开发上的努力靶向病毒蛋白。其较大部分原因在于当前药物作用范围较窄并且出现病毒抗性。大部分RNA病毒具有较小基因体并且多数编码不到一打蛋白质。病毒标靶因此有限。根据上文,对于针对病毒感染的有效治疗存在未满足的巨大需求。
发明内容
本文中所公开的化合物和方法将病毒药物开发的焦点从靶向病毒蛋白转变为开发靶向并且增强宿主先天抗病毒反应的药物。所述化合物和方法可能更有效,不太容易出现病毒抗性,引起较少副作用并且有效针对一系列不同病毒。
RIG-I路径密切涉及调控RNA病毒感染的先天免疫反应。预期RIG-I促效剂适用于治疗许多病毒,包括(但不限于)HCV、流感和西尼罗河病毒。因此,本发明涉及用于治疗病毒感染(包括RNA病毒感染)的化合物和方法,其中所述化合物可以调节RIG-I路径。
本发明的一个实施例包括由下式表示的化合物,
其中虚线表示存在或不存在一键;R1可以是Ra、OR2或NR2R3;每个Ra可以独立地是H、任选地经取代的烃基、任选地经取代的芳基、任选地经取代的杂芳基;R2和R3可以各自独立地是Ra、CORa或SO2Ra;Y1、Y2、Y3和Y4可以各自独立地是CR4或N;每个R4可以独立地是R2、ORa、NR2R3、SRa、SORa、SO2Ra、SO2NHRa、NCORa、卤素、三卤甲基、CN、S=O或硝基;R5可以是Ra、CORa、SO2Ra或不存在;V可以是CR2、CR2R3、C=O、COCR2R3或C=NR2;并且W和X可以各自独立地是N、NRa、O、S、CR2R4或CR4。
本发明的一些实施例包括由下式表示的化合物(“KIN1000”化合物):
附加实施例包括由下式表示的化合物,
其中R10、R13、R14、R16、R17、R18、R19、R20、R21和R22独立地是Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基;每个Rb独立地是H或C1-3烃基,并且每个Rc独立地是H或C1-3烷基。
本发明的其它实施例包括由下式表示的化合物(“KIN1148”化合物):
本发明的一些实施例包括一种医药组合物,所述医药组合物包含如本文所述的任一种化合物。
本发明的一些实施例包括治疗或预防脊椎动物病毒感染的方法,所述方法包含向所述脊椎动物投与如本文所述的医药组合物。在一些实施例中,病毒感染是由来自一个或一个以上以下病毒科的病毒引起:沙粒病毒科(Arenaviridae)、星状病毒科(Astroviridae)、双RNA病毒科(Birnaviridae)、雀麦镶嵌病毒科(Bromoviridae)、布尼亚病毒科(Bunyaviridae)、杯状病毒科(Caliciviridae)、长线形病毒科(Closteroviridae)、豇豆镶嵌病毒科(Comoviridae)、囊状噬菌体科(Cystoviridae)、黄病毒科(Flaviviridae)、弯曲病毒科(Flexiviridae)、肝炎病毒科(Hepevirus)、光滑病毒科(Leviviridae)、黄症病毒科(Luteoviridae)、单股负链病毒科(Mononegavirales)、花叶病毒科(Mosaic Viruses)、网巢病毒科(Nidovirales)、野田病毒科(Nodaviridae)、正粘液病毒科(Orthomyxoviridae)、小双节RNA病毒科(Picobirnavirus)、小RNA病毒科(Picornaviridae)、马铃薯Y病毒科(Potyviridae)、呼肠孤病毒科(Reoviridae)、逆转录病毒科(Retroviridae)、随伴病毒科(Sequiviridae)、纤细病毒科(Tenuivirus)、披衣病毒科(Togaviridae)、番茄丛矮病毒科(Tombusviridae)、整体病毒科(Totiviridae)、芜菁变黄镶嵌病毒科(Tymoviridae)、肝DNA病毒科(Hepadnaviridae)、疱疹病毒科(Herpesviridae)、副粘液病毒科(Paramyxoviridae)或乳头瘤病毒科(Papillomaviridae)。在一些实施例中,病毒感染是流感病毒、C型肝炎病毒、西尼罗河病毒、SARS冠状病毒、脊髓灰质炎病毒、麻疹病毒、登革热病毒(Dengue virus)、黄热病毒、蜱传脑炎病毒、日本脑炎病毒、圣路易脑炎病毒(St.Louis encephalitis virus)、墨瑞谷脑炎病毒(Murray Valley virus)、波瓦森病毒(Powassan virus)、罗西奥病毒(Rocio virus)、跳跃病病毒(louping-ill virus)、斑齐病毒(Banzi virus)、伊利乌斯病毒(Ilheus virus)、科科贝拉病毒(Kokobera virus)、库宁病毒(Kunjin virus)、阿尔弗病毒(Alfuy virus)、牛腹泻病毒、卡萨努森林病病毒(Kyasanurforest disease virus)、呼吸道融合性病毒或HIV。
本发明方法的一些实施例包括投与本文所述的任一种医药组合物作为预防性或治疗性疫苗的佐剂。在一些实施例中,所述方法包括通过另外投与针对以下病毒的疫苗对脊椎动物进行接种:流感病毒、C型肝炎病毒、西尼罗河病毒、SARS冠状病毒、脊髓灰质炎病毒、麻疹病毒、登革热病毒、黄热病毒、蜱传脑炎病毒、日本脑炎病毒、圣路易脑炎病毒、墨瑞谷脑炎病毒、波瓦森病毒、罗西奥病毒、跳跃病病毒、斑齐病毒、伊利乌斯病毒、科科贝拉病毒、库宁病毒、阿尔弗病毒、牛腹泻病毒、卡萨努森林病病毒或HIV。
本发明的一些实施例包括调节真核细胞的先天免疫反应的方法,所述方法包含向所述细胞投与如本文所述的任一种化合物。在一些实施例中,所述细胞是体内细胞。在其它实施例中,所述细胞是体外细胞。
附图说明
图1显示化合物KIN1000的验证和表征(“RLU”=相对荧光素酶单位)。在图1A中,通过证明IFNβ-荧光素酶(IFNβ-LUC,左)报道基因、ISG56-荧光素酶(ISG56-LUC,中)报道基因和ISG54-荧光素酶(ISG54-LUC,右)报道基因的剂量依赖性诱发来验证初始“攻击”化合物。图1B证实KIN1000的特异性,KIN1000不诱发非特异性β-肌动蛋白启动子(“0.5%DMSO”=媒剂对照;“10μM KIN1000”=在KIN1000存在下的β-肌动蛋白-荧光素酶报道体;“10μM化合物X”=阳性对照β-肌动蛋白诱发)。在图1C中,MTS分析证明KIN1000未显示对使用所述化合物处理48小时的人类细胞的明显细胞毒性。表示50%细胞死亡率的O.D.值由水平线显示,还证明KIN1000的CC50大于20μM。
图2显示KIN1000活化转录因子。在图2A中,用增加量KIN1000处理的海拉细胞显示通过细胞核强度减去细胞质强度(“校正细胞核强度”)定量的易位到细胞核的IRF-3随剂量变化而增加。在图2B中,用增加量KIN1000处理的海拉细胞显示通过细胞核强度减去细胞质强度定量的NFκB易位随剂量变化而增加。“SeV”是指仙台病毒感染(阳性对照)。
图3显示KIN1000的抗病毒活性。用增加量KIN1000处理的MRC5细胞显示流感病毒感染的剂量依赖性减少。
图4显示由KIN1000诱发的细胞激素表达的(德克萨斯州奥斯汀路明克斯公司(Luminex Corp.,Austin,TX))定量含量。用增加量KIN1000处理的人类树突状细胞显示包括IL-8、MCP-1(CCL2)和MIP-1α和β(分别是CCL3和CCL4)的细胞激素的剂量依赖性表达。
图5显示由KIN1000和其衍生化合物KIN1148诱发基因表达。图5A显示用10μM KIN1000(灰色)或KIN1148(黑色)处理后经4-24小时的时间,海拉细胞中IFIT2(左)和OAS1(右)的基因表达含量。图5B显示用KIN1000(实心灰色条形图)或KIN1148(实心黑色条形图)处理的PH5CH8细胞(左)中IFIT2的基因表达含量和用KIN1000(灰色条纹条形图)或KIN1148(黑色格纹条形图)处理的海拉细胞(右)中IFIT2的基因表达含量。在每一测试组中,三个垂直条形图分别表示5μM、10μM和20μM化合物(KIN1000或KIN1148)。图5C显示用1μM KIN1000(灰色)或1μM KIN1148(黑色)处理的初级HUVEC细胞中IFIT2(左)、OAS1(中)和MxA(右)的基因表达含量。
图6显示KIN1000和KIN1148针对呼吸道融合性病毒的抗病毒活性。图6A显示用增加量KIN1000和KIN1148处理的海拉细胞显示RSV感染随剂量变化而减少。图6B显示当在感染前至多24小时添加药物时,KIN1148显示针对RSV的抗病毒活性。
图7显示KIN1148针对A型流感病毒Udorn/72的抗病毒活性。用2μM(H292)或10μM(HEK293)KIN1148处理的H292细胞(左)和HEK293细胞(右)显示病毒感染减少。
图8显示KIN1148针对2型登革热病毒的抗病毒活性。用增加量KIN1148处理的Huh7细胞显示病毒感染随剂量变化而减少。
图9显示KIN1148针对B型肝炎病毒的抗病毒活性。用增加量KIN1148处理的HepAD38细胞显示上清液病毒含量随剂量变化而减少。表示上清液中无HBV的O.D.值由标记为“无HBV细胞”的水平线显示。
图10显示由KIN1000和KIN1148体内诱发的IgG抗体产生。动物(雌性路易斯大鼠,10-12周大)于足垫和尾根部皮下接种含OVA的PBS、OVA+polyI:C、OVA+KIN1000或OVA+KIN1148的悬浮液(每一部位注射0.025mL体积)。动物在初打后2和8周以同等方式追加接种。动物在指定时间点放血,制备血清并且通过ELISA检测抗体含量。将含KIN1000(大格纹条形图)和KIN1148(横条纹条形图)的疫苗制剂的OD450值校正到从仅接收含OVA的PBS作为疫苗的动物获得的值。Poly I:C(小格纹条形图)用作对照佐剂。
图11显示由KIN化合物接种引发的细胞反应。测量在第一次追加接种(初打后4周)后2周引发的延迟型过敏反应。通过在指定时间点注射0.02mL PBS(左耳廓)或0.02mL含OVA(1mg/mL)的PBS(右耳廓)攻击动物。24小时后使用测径规测量耳厚度。显示右耳与左耳间的计算差值。“OVA+K1148”(纵条纹条形图)=注射含KIN1148的疫苗的动物的耳厚度差值。Poly I:C(“OVA+pI:C”;横条纹条形图)用作对照佐剂。
具体实施方式
本发明提供将病毒治疗的焦点从靶向病毒蛋白转变为开发靶向并且增强宿主(患者)先天抗病毒反应的药物的化合物和方法。所述化合物和方法可能更有效,不太容易出现病毒抗性,引起较少副作用并且有效针对一系列不同病毒。
RIG-I路径密切涉及调控RNA病毒感染的先天免疫反应。RIG-1是触发各种RNA病毒免疫性所必需的胞溶质病原体识别受体。RIG-I是结合于RNA病毒基因体内由均聚尿苷延伸所表征的基序或聚合U/A基序的双股RNA解螺旋酶。结合于RNA诱发构形变化,减轻由自体阻遏域抑制RIG-I信号传导,因此允许RIG-I通过其串联卡斯蛋白酶活化和募集域(CARD)到信号下游。RIG-I信号传导取决于其NTP酶活性,但不需要解螺旋酶域。RIG-I信号传导于静止细胞中沉默,并且阻遏域充当对病毒感染作出反应支配信号传导的启闭开关。
RIG-I信号通过存在于线粒体外膜中的必需接附蛋白IPS-1(也称为Cardif、MAVs和VISA)转导。IPS-1募集刺激下游IRF-3活化的巨分子信号传导复合物,其中IRF-3是诱发控制感染的I型IFN基因和病毒反应性基因表达的转录因子。直接或通过调节RIG-I路径组分(包括IRF-3)触发RIG-I信号传导的化合物作为抗病毒剂或免疫调节剂提供有吸引力的治疗应用。
使用高通量筛选方法识别调节RIG-I路径的化合物,即RNA病毒感染细胞先天免疫反应的关键调控剂。在特定实施例中,已证明被验证的RIG-I促效剂主导化合物特异性活化干扰素调控因子-3(IRF-3)。在其它实施例中,所述化合物显示以下一者或一者以上:其诱发干扰素刺激基因(ISG)表达,在基于细胞的分析中具有低细胞毒性,适用于类似物开发和SAR研究,具有药物状生化性质,和具有针对A型流感病毒和/或HCV的抗病毒活性。
如下所述,这些化合物表示一类新型潜在抗病毒治疗剂。虽然本发明不受化合物体内特异性作用机制束缚,但选择用于调节RIG-I路径的化合物。在某些实施例中,所述调节是活化RIG-I路径。本文中所公开的化合物和方法用于以下一者或一者以上:减少HCV和/或流感病毒的细胞培养物模型中的病毒蛋白、病毒RNA和感染性病毒。
在一个实施例中,本发明涉及一类由下式表示的化合物:
其中虚线表示存在或不存在一键;R1可以是Ra、OR2或NR2R3;每个Ra可以独立地是H、任选地经取代的烃基、任选地经取代的芳基、任选地经取代的杂芳基;R2和R3可以各自独立地是Ra、CORa或SO2Ra;Y1、Y2、Y3和Y4可以各自独立地是CR4或N;每个R4可以独立地是R2、ORa、NR2R3、SRa、SORa、SO2Ra、SO2NHRa、NCORa、卤素、三卤甲基、CN、S=O或硝基;R5可以是Ra、CORa、SO2Ra或不存在;V可以是CR2、CR2R3、C=O、COCR2R3或C=NR2;并且W和X可以各自独立地是N、NRa、O、S、CR2R4或CR4。
关于式1,Y1可以是CR4或N。在一些实施例中,Y1是CR4。
关于式1,Y2可以是CR4或N。在一些实施例中,Y2是CR4。
在一些实施例中,Y1和Y2都是CR4,并且共同形成任选地被R18取代的另一杂环。在一些实施例中,V可以是:
关于式1,Y3可以是CR4或N。在一些实施例中,Y3是CR4。
关于式1,Y4可以是CR4或N。在一些实施例中,Y4是CR4。
一些实施例包括由式2-12中的任一者表示的化合物。
关于本文中的任何相关结构特征,每个Ra可以独立地是H;任选地经取代的烃基,如C1-12或C1-6烃基;任选地经取代的芳基,如任选地经取代的C6-12芳基,包括任选地经取代的苯基;任选地经取代的杂芳基,包括任选地经取代的C2-12杂芳基,如任选地经取代的吡啶基、任选地经取代的呋喃基、任选地经取代的噻吩基等。在一些实施例中,每个Ra可以独立地是H或C1-12烷基,包括:具有式CaHa+1的直链或支链烷基或具有式CaHa-1的环烷基,其中a是1、2、3、4、5、6、7、8、9、10、11或12,如下式的直链或支链烷基:CH3、C2H5、C3H7、C4H9、C5H11、C6H13、C7H15、C8H17、C9H19、C10H21等,或下式的环烷基:C3H5、C4H7、C5H9、C6H11、C7H13、C8H15、C9H17、C10H19等。
关于Ra,在一些实施例中,芳基被卤素、三卤甲基、烷氧基、烷基氨基、OH、CN、烷硫基、芳硫基、亚砜、芳基磺酰基、烷基磺酰基、羧酸、硝基或酰氨基取代。
关于Ra,在一些实施例中,杂芳基是单杂芳基或稠合杂芳基。在一些实施例中,单杂芳基是咪唑。在一些实施例中,稠合杂芳基是苯并咪唑。在一些实施例中,杂芳基被卤素、三卤甲基、烷氧基、烷基氨基、OH、CN、烷硫基、芳硫基、亚砜、芳基磺酰基、烷基磺酰基、羧酸、硝基或酰氨基取代。在一些实施例中,烷基是支链、环状或多环烷基。
关于Ra,烃基可以是烷基、烯基或炔基。在一些实施例中,烷基被卤素、三卤甲基、烷氧基、烷基氨基、OH、CN、杂芳基、烷硫基、芳硫基、亚砜、芳基磺酰基、烷基磺酰基、羧酸、硝基或酰氨基取代。在一些实施例中,杂芳基是单杂芳基或稠合杂芳基。在一些实施例中,单杂芳基是咪唑。在一些实施例中,稠合杂芳基是苯并咪唑。在一些实施例中,烯基是支链、环状或多环烯基。在一些实施例中,烯基被卤素、三卤甲基、烷氧基、烯基氨基、OH、CN、杂芳基、烷硫基、芳硫基、亚砜、芳基磺酰基、烷基磺酰基、羧酸、硝基或酰氨基取代。
关于本文中的任何相关结构特征,Rb可以是H或C1-3烃基,如CH3、C2H5、C3H7、环丙基、CH=CH2、CH2CH=CH2、C≡CH、CH2C≡CH等。
关于本文中的任何相关结构特征,Rc可以是H或C1-3烷基,如CH3、C2H5、C3H7、环丙基等。在一些实施例中,Rc是H。
关于本文中的任何相关式或结构叙述,如式1、式2、式3或式4,R1是Ra、OR2或NR2R3。在一些实施例中,R1是任选地经取代的苯基。在一些实施例中,R1是未经取代的苯基。在一些实施例中,R1是任选地经取代的萘基。在一些实施例中,R1是未经取代的萘基。
关于本文中的任何相关结构特征,R2可以是Ra、CORa或SO2Ra。在一些实施例中,R2可以是H、甲基、乙基、丙基(例如正丙基、异丙基等)、环丙基、丁基、环丁基或其异构体、戊基、环戊基或其异构体、己基、环己基或其异构体等。在一些实施例中,R2是H。
关于本文中的任何相关结构特征,R3可以是Ra、CORa或SO2Ra。在一些实施例中,R3可以是H、甲基、乙基、丙基(例如正丙基、异丙基等)、环丙基、丁基、环丁基或其异构体、戊基、环戊基或其异构体、己基、环己基或其异构体等。在一些实施例中,R3是H。
关于本文中的任何相关结构特征,每个R4可以独立地是R2、ORa、CORa、CO2Ra、OCORa、CONR2R3、NR2R3、NRbCORa、SRa、SORa、SO2Ra、SO2NRaRb、NCORa、卤素、三卤甲基、CN、S=O、硝基或C2-5杂芳基。在一些实施例中,R4是H。
通常,R5和R8-R32可以是H或任何取代基,如具有0到6个碳原子和0到5个杂原子和/或具有15g/mol到300g/mol的分子量的取代基,其中杂原子独立地选自:O、N、S、F、Cl、Br和I。R5和R8-R32中的任一者可以包含:a)一个或一个以上烷基部分,其任选地被b)一个或一个以上官能团取代或任选地由b)一个或一个以上官能团连接,所述一个或一个以上官能团是如C=C、C≡C、CO、CO2、CON、NCO2、OH、SH、O、S、N、N=C、F、Cl、Br、I、CN、NO2、CO2H、NH2等;或可以是不具有烷基部分的取代基,如F、Cl、Br、I、NO2、CN、NH2、OH、COH、CO2H等。
关于本文中的任何相关结构特征,在一些实施例中,R5可以是Ra、CORa、SO2Ra或可能不存在。R5的一些非限制性实例可以包括H或C1-3烷基,如CH3、C2H5、C7、环丙基等。在一些实施例中,R5可以是CH3。在一些实施例中,R5是H。
关于以上任何相关式或结构叙述,R8的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R8是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R8是H。
关于以上任何相关式或结构叙述,R9的一些非限制性实例可以包括Rb、CORb、CO2Rb、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN或C2-5杂环基。在一些实施例中,R9是H、CH3、CH2CH3、SO2NH2或CH2C≡CH。在一些实施例中,R9是H、CH3、CH2CH3、CH2CH2CH3、CH2CH=CH2或CH2C≡CH。在一些实施例中,R9是CH2C≡CH。在一些实施例中,R9是H。
关于以上任何相关式或结构叙述,R10的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R10是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R10是H。
关于以上任何相关式或结构叙述,R11的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R11是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R11是H、Cl或Br。在一些实施例中,R11是Cl。在一些实施例中,R11是Br。在一些实施例中,R11是H。
关于以上任何相关式或结构叙述,R12的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R12是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R12是H、Cl或SO2NH2。在一些实施例中,R12是H。在一些实施例中,R12是Cl。在一些实施例中,R12是SO2NH2。在一些实施例中,R12是H。
关于以上任何相关式或结构叙述,R13的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R13是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R13是H或Cl。在一些实施例中,R13是H。在一些实施例中,R13是Cl。在一些实施例中,R11和R13是Cl。
关于以上任何相关式或结构叙述,R14的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、CF3、CN、NO2、F、Cl、Br或I。在一些实施例中,R14是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、CH2C≡CH或NO2。在一些实施例中,R14是H。
在一些实施例中,R10和R14是H。在一些实施例中,R10、R12和R14是H。在一些实施例中,R10、R13和R14是H。在一些实施例中,R10、R11、R13和R14是H。在一些实施例中,R10、R11、R12和R14是H。在一些实施例中,R10、R11、R12、R13和R14是H。
关于以上任何相关式或结构叙述,R16的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br或C2-5杂环基。在一些实施例中,R16是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R16是H。
关于以上任何相关式或结构叙述,R17的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R17是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R17是H。
关于以上任何相关式或结构叙述,R18的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R18是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R18是H或CH3。在一些实施例中,R18是H。在一些实施例中,R18是CH3。在一些实施例中,R18是H。
关于以上任何相关式或结构叙述,R19的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br或C2-5杂环基。在一些实施例中,R19是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R19是H。
关于以上任何相关式或结构叙述,R20的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R20是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、CH2C≡CH或NO2。在一些实施例中,R20是H。
关于以上任何相关式或结构叙述,R21的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R21是H、CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R21是H。
关于以上任何相关式或结构叙述,R22的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R22是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基或NO2。在一些实施例中,R22是H。
在一些实施例中,R19、R20、R21和R22是H。
关于以上任何相关式或结构叙述,R23的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R23是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、CH2C≡CH或NO2。在一些实施例中,R23是H或SO2NH2。在一些实施例中,R23是H。在一些实施例中,R23是SO2NH2。
关于以上任何相关式或结构叙述,R24的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R24是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基或NO2。在一些实施例中,R24是H。
在一些实施例中,R23和R24是H。
关于以上任何相关式或结构叙述,R25的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F或C2-5杂环基。在一些实施例中,R25是H、CH3、CH2CH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R25是CH3或H。在一些实施例中,R25是H。
关于以上任何相关式或结构叙述,R26的一些非限制性实例可以包括Rb、CF3、CN或NO2。在一些实施例中,R26是H、CH3或CH2CH3。在一些实施例中,R26是H。
关于以上任何相关式或结构叙述,R27的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、CONRbRc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R27是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、SO2NH2、CH2C≡CH或NO2。在一些实施例中,R27是H、(CH2)3CH3、CH2CH2OCH3、CH2CH2N(CH3)2、CH2CH2-吗啉基或CH2CH2SCH3。在一些实施例中,R27是H。在一些实施例中,R27是(CH2)3CH3。在一些实施例中,R27是CH2CH2OCH3。在一些实施例中,R27是CH2CH2N(CH3)2。在一些实施例中,R27是CH2CH2-吗啉基。在一些实施例中,R27是CH2CH2SCH3。
关于以上任何相关式或结构叙述,R28的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R28是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R28是H、CH2CH3、OCH3、N(CH3)2、吗啉基或SCH3。在一些实施例中,R28是H。在一些实施例中,R28是CH2CH3。在一些实施例中,R28是OCH3。在一些实施例中,R28是CN(CH3)2。在一些实施例中,R28是吗啉基。在一些实施例中,R28是SCH3。
关于以上任何相关式或结构叙述,R29的一些非限制性实例可以包括Rb、ORb、SRb、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R29是H、CH3或CH2CH3。在一些实施例中,R29是H。
在一些实施例中,R8和R29是H。
关于以上任何相关式或结构叙述,R30的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br或I。在一些实施例中,R30是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、CH2C≡CH或NO2。在一些实施例中,R30是H。
关于以上任何相关式或结构叙述,R31的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R31是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R31是H。
关于以上任何相关式或结构叙述,R32的一些非限制性实例可以包括Rb、ORb、SRb、CORb、CO2Rb、OCORb、NRbRc、CONRbRc、NRbCORc、SO2NRbRc、CF3、CN、NO2、F、Cl、Br、I或C2-5杂环基。在一些实施例中,R32是H、CH3、CH2CH3、Cl、Br、OH、OCH3、SCH3、NH2、NHCH3、N(CH3)2、SO2NH2、吗啉基、CH2C≡CH或NO2。在一些实施例中,R32是H或NO2。在一些实施例中,R32是H。在一些实施例中,R32是NO2。
在一些实施例中,R30、R31和R32是H。在一些实施例中,R31和R32是H。
在本文中所公开的另一实施例中,化合物是(“KIN1000”化合物)
除非另外指明,否则通过结构、化学式、名称或任何其它手段对本文中化合物的任何提及包括医药学上可接受的盐,如钠盐、钾盐和铵盐;前药,如酯前药;替代固体形式,如多晶型物、溶剂合物、水合物等;互变异构体;或在如本文所述使用化合物的条件下可以迅速转化为本文所述的化合物的任何其它化学物质。
除非明确地描述立体化学,否则化合物的任何结构、化学式或名称可以指所述化合物的任何立体异构体或立体异构体的任何混合物。
如本文中所用,术语“官能团”是指不论何时存在于不同化合物中都具有相似化学性质的原子或原子团,并且因此官能团限定有机化合物家族的特征性物理和化学性质。
除非另外指明,否则当任何化合物或化学结构特征(在本文中统称为“化合物”)(如烷基、芳基等)称为“任选地经取代”时,所述化合物可能不具有取代基(在此情况下其“未经取代”),或其可能包括一个或一个以上取代基(在此情况下其“经取代”)。术语“取代基”具有所属领域的一般技术人员已知的普通含义。在一些实施例中,取代基可以是所属领域中已知的普通有机部分,其可以具有15g/mol到50g/mol、15g/mol到100g/mol、15g/mol到150g/mol、15g/mol到200g/mol、15g/mol到300g/mol或15g/mol到500g/mol的分子量(例如,取代基原子的原子质量的总和)。在一些实施例中,取代基包含:0-30、0-20、0-10或0-5个碳(C)原子;和/或0-30、0-20、0-10或0-5个杂原子,包括N、O、S、Si、F、Cl、Br或I;其限制条件是取代化合物中的取代基包含至少一个包括C、N、O、S、Si、F、Cl、Br或I的原子。取代基的实例包括(但不限于)烷基、烯基、炔基、杂烷基、杂烯基、杂炔基、芳基、杂芳基、羟基、烷氧基、芳氧基、酰基、酰氧基、烷基羧酸酯基、硫醇、烷硫基、氰基、卤基、硫羰基、O-氨甲酰基、N-氨甲酰基、O-硫氨甲酰基、N-硫氨甲酰基、C-酰氨基、N-酰氨基、S-磺酰氨基、N-磺酰氨基、异氰酰基、硫氰基、异硫氰基、硝基、硅烷基、次磺酰基、亚磺酰基、磺酰基、卤烷基、卤烷氧基、三卤甲磺酰基、三卤甲磺酰氨基、氨基等。为方便起见,对于分子的基团部分或一部分使用术语“分子量”以表示分子的所述基团部分或一部分中原子的原子质量总和,即使所述分子可能不是完整分子。
如本文中所用的术语“烃基”具有所属领域中通常理解的广泛含义并且可以包括由碳和氢构成的部分。一些实例可以包括烷基、烯基、炔基、芳基等和其组合,并且可以是直链、支链、环状或其组合。烃基可以键结于结构可以携带的任意其它数目的部分(例如,可以键结于一个其它基团,如-CH3、-CH=CH2等;两个其它基团,如-苯基-、-C≡C-等;或任意数目的其它基团),并且在一些实施例中,可以含有一到三十五个碳原子。烃基的实例包括(但不限于)C1烷基、C2烷基、C2烯基、C2炔基、C3烷基、C3烯基、C3炔基、C4烷基、C4烯基、C4炔基、C5烷基、C5烯基、C5炔基、C6烷基、C6烯基、C6炔基、苯基等。
如本文中所用的术语“烷基”具有所属领域中通常理解的广泛含义,并且可以包括由碳和氢构成、不含双键或三键并且不具有任何环状结构的部分。烷基可以是直链烷基、支链烷基、环烷基或其组合,并且在一些实施例中,可以含有一到三十五个碳原子。在一些实施例中,烷基可以包括C1-10直链烷基,如甲基(-CH3)、乙基(-CH2CH3)、正丙基(-CH2CH2CH3)、正丁基(-CH2CH2CH2CH3)、正戊基(-CH2CH2CH2CH2CH3)、正己基(-CH2CH2CH2CH2CH2CH3)等;C3-10支链烷基,如C3H7(例如异丙基)、C4H9(例如支链丁基异构体)、C5H11(例如支链戊基异构体)、C6H13(例如支链己基异构体)、C7H15(例如支链庚基异构体)等;C3-10环烷基,如C3H5(例如环丙基)、C4H7(例如环丁基异构体,如环丁基、甲基环丙基等)、C5H9(例如环戊基异构体,如环戊基、甲基环丁基、二甲基环丙基等)、C6H11(例如环己基异构体)、C7H13(例如环庚基异构体)等;和其类似物。
术语“烷基”、“烯基”和“炔基”分别是指经取代和未经取代的烷基、烯基和炔基。烷基可以如本文中所定义任选地经取代。
经取代的烷基、烯基和炔基是指被一到五个取代基取代的烷基、烯基和炔基,所述取代基包括H、低碳烷基、芳基、烯基、炔基、芳基烷基、烷氧基、芳氧基、芳基烷氧基、烷氧基烷基芳基、烷基氨基、芳基氨基、NH2、OH、CN、NO2、OCF3、CF3、F、1-脒、2-脒、烷基羰基、吗啉基、哌啶基、二噁烷基、吡喃基、杂芳基、呋喃基、噻吩基、四唑基、噻唑基、异噻唑基、咪唑基、噻二唑基、噻二唑S-氧化物、噻二唑S,S-二氧化物、吡唑基、噁唑基、异噁唑基、吡啶基、嘧啶基、喹啉基、异喹啉基、SR、SOR、SO2R、CO2R、COR、CONR′R″、CSNR′R″和SOnNR′R″。
如本文中单独或组合使用的术语“炔基”是指包含含2到20个碳原子并且具有一个或一个以上碳-碳三键并且不具有任何环状结构的直链或支链烃的官能团。炔基可以如本文中所定义任选地经取代。炔基的实例包括(但不限于)乙炔基、丙炔基、羟基丙炔基、丁炔基、丁炔-1-基、丁炔-2-基、3-甲基丁炔-1-基、戊炔基、戊炔-1-基、己炔基、己炔-2-基、庚炔基、辛炔基、壬炔基、癸炔基、十一炔基、十二炔基、十三炔基、十四炔基、十五炔基、十六炔基、十七炔基、十八炔基、十九炔基、二十炔基和其类似基团。
如本文中单独或组合使用的术语“亚烷基”是指衍生自直链或支链饱和烃并且在两个或两个以上位置处连接的饱和脂族基,如亚甲基(-CH2-)。除非另外指定,否则术语“烷基”可以包括“亚烷基”。
如本文中单独或组合使用的术语“烷基羰基”或“烷酰基”是指所包含的烷基通过羰基连接于亲本分子部分的官能团。烷基羰基的实例包括(但不限于)甲基羰基、乙基羰基和其类似基团。
如本文中单独或组合使用的术语“杂烷基”是指包含含仅由单键键联的1到20个原子的直链或支链烃的官能团,其中所述链中至少一个原子是碳并且所述链中至少一个原子是O、S、N或其任何组合。杂烷基可以完全饱和或含有1到3不饱和度。非碳原子可以在杂烷基的任意内部位置,并且至多两个非碳原子可以是连续的,如-CH2-NH-OCH3。此外,非碳原子可以任选地被氧化并且氮可以任选地季铵化。
如本文中单独或组合使用的术语“烷氧基”是指包含烷基醚基的官能团。烷氧基的实例包括(但不限于)甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基和其类似基团。
如本文中单独或组合使用的术语“羟基”是指官能团羟基(-OH)。
如本文中单独或组合使用的术语“羧基”是指官能团-C(=O)OH或相应“羧酸根”阴离子-C(=O)O-。实例包括(但不限于)甲酸、乙酸、草酸、苯甲酸。“O-羧基”是指具有通式RCOO的羧基,其中R是有机部分或基团。“C-羧基”是指具有通式COOR的羧基,其中R是有机部分或基团。
如本文中单独或组合使用的术语“氧代”是指官能团=O。
如本文中所用的术语“碳环”具有所属领域中通常理解的广泛含义,并且包括环原子全部是碳的环或环系统。实例包括(但不限于)苯基、萘基、蒽基、环烷基、环烯基、环炔基等,和其组合。
如本文中所用的术语“杂环”具有所属领域中通常理解的广泛含义,并且包括至少一个环原子不是碳(如N、O、S等)的环或环系统。实例包括(但不限于)杂芳基、环杂烷基、环杂烯基、环杂炔基等,和其组合。
如本文中单独或组合使用的术语“环烷基”和“碳环烷基”是指包含经取代或未经取代的具有3到12个碳原子的非共轭环状分子环结构的非芳族烃的官能团,其中所述碳环结构中仅使用碳-碳单键键联所述碳原子。环烷基可以是单环、双环或多环,并且可以任选地包括一到三个其它环状结构,如芳基、杂芳基、环烯基、杂环烷基或杂环烯基。
如本文中单独或组合使用的术语“低碳环烷基”是指包含经取代或未经取代的具有3到6个碳原子的非共轭环状分子环结构的单环非芳族烃的官能团,其中所述碳环结构中仅使用碳-碳单键键联所述碳原子。低碳环烷基的实例包括(但不限于)环丙基、环丁基、环戊基和环己基。
如本文中所用的术语“芳基”具有所属领域中通常理解的广泛含义,并且可以包括芳环或芳环系统。芳基可以是单环、双环或多环,并且可以任选地包括一到三个其它环状结构;如环烷基、环烯基、杂环烷基、杂环烯基或杂芳基。术语“芳基”包括(但不限于)苯基(次苄基)、噻吩基、吲哚基、萘基、甲苯基、二甲苯基、蒽基、菲基、薁基、联苯、萘基、1-甲基萘基、二氢苊基、苊基、蒽基、芴基、丙烯合萘基、菲基、苯并[a]蒽基、苯并[c]菲基、屈基、芴蒽基、芘基、并四苯基(稠四苯基)、三亚苯基、蒽嵌蒽基、苯并芘基、苯并[a]芘基、苯并[e]芴蒽基、苯并[ghi]苝基、苯并[j]芴蒽基、苯并[k]芴蒽基、碗烯基(corannulenyl)、蔻基、二蔻基、螺烯基(helicenyl)、稠七苯基、稠六苯基、莪基、稠五苯基、苉基、苝基、联四苯基等。
另外,如本文中单独或组合使用的术语“芳基”、“烃基芳基”或“芳基烃”可以指包含经取代或未经取代的具有3到12个碳原子的共轭环状分子环结构的芳族烃的官能团。经取代的芳基是指被一到五个取代基取代的芳基,所述取代基包括H、低碳烷基、芳基、烯基、炔基、芳基烷基、烷氧基、芳氧基、芳基烷氧基、烷氧基烷基芳基、烷基氨基、芳基氨基、NH2、OH、CN、NO2、OCF3、CF3、Br、Cl、F、1-甲脒基、2-甲脒基、烷基羰基、吗啉基、哌啶基、二噁烷基、吡喃基、杂芳基、呋喃基、噻吩基、四唑基、噻唑、异噻唑基、咪唑基、噻二唑、噻二唑S-氧化物、噻二唑S,S-二氧化物、吡唑基、噁唑、异噁唑、吡啶基、嘧啶基、喹啉、异喹啉、SR、SOR、SO2R、CO2R、COR、CONR′R″、CSNR′R″、SOnNR′R″。
如本文中单独或组合使用的术语“低碳芳基”是指包含经取代或未经取代的具有3到6个碳原子的共轭环状分子环结构的芳族烃的官能团。低碳芳基的实例包括(但不限于)苯基和萘基。
如本文中单独或组合使用的术语“杂芳基”是指包含经取代或未经取代的具有3到12个原子的共轭环状分子环结构的芳族烃的官能团,其中所述环结构中至少一个原子是碳并且所述环结构中至少一个原子是O、S、N或其任何组合。杂芳基可以是单环、双环或多环,并且可以任选地包括一到三个其它环状结构,如芳基、环烷基、环烯基、杂环烷基或杂环烯基。杂芳基的实例包括(但不限于)吖啶基、苯并吲哚基(benzidolyl)、苯并咪唑基、苯并异噁唑基、苯并二氧杂环己烯基、二氢苯并二氧杂环己烯基、苯并间二氧杂环戊烯基、1,3-苯并间二氧杂环戊烯基、苯并呋喃基、苯并异噁唑基、苯并吡喃基、苯并噻吩基、苯并[c]噻吩基、苯并三唑基、苯并噁二唑基、苯并噁唑基、苯并噻二唑基、苯并噻唑基、苯并噻吩基、咔唑基、色酮基、噌啉基、二氢噌啉基、香豆素基、二苯并呋喃基、呋喃并吡啶基、呋喃基、吲哚嗪基、吲哚基、二氢吲哚基、咪唑基、吲唑基、异苯并呋喃基、异吲哚基、异吲哚啉基、二氢异吲哚基、异喹啉基、二氢异喹啉基、异噁唑基、异噻唑基、噁唑基、噁二唑基、啡啉基、啡啶基、嘌呤基、吡喃基、吡嗪基、吡唑基、吡啶基、嘧啶基、哒嗪基、吡咯啉基、吡咯基、吡咯并吡啶基、喹啉基、喹喔啉基、喹唑啉基、四氢喹啉基、四唑并哒嗪基、四氢异喹啉基、噻吩基(thiophenyl)、噻唑基、噻二唑基、噻吩并吡啶基、噻吩基(thienyl)、噻吩基、三唑基、呫吨基和其类似基团。
如本文中单独或组合使用的术语“低碳杂芳基”是指包含经取代或未经取代的具有3到6个原子的共轭环状分子环结构的单环或双环芳族烃的官能团,其中所述环结构中至少一个原子是碳并且所述环结构中至少一个原子是O、S、N或其任何组合。
与本文所述的一些实施例有关的苯基结构描述如下。此结构可以如下所示未经取代,或可以经取代以使得取代基可以独立地处于所述结构未经取代时通常由氢原子占据的任何位置。除非连接点由-|表示,否则连接可以发生在通常由氢原子占据的任何位置处。
每个Ra可以独立地是H;任选地经取代的烃基;任选地经取代的芳基,如任选地经取代的苯基或任选地经取代的芳基;任选地经取代的杂芳基,如任选地经取代的吡啶基、任选地经取代的呋喃基、任选地经取代的噻吩基等。在一些实施例中,每个Ra可以独立地是H或C1-12烷基,包括:具有式CaHa+1的直链或支链烷基或具有式CaHa-1的环烷基,其中a是1、2、3、4、5、6、7、8、9、10、11或12,如下式的直链或支链烷基:CH3、C2H5、C3H7、C4H9、C5H11、C6H13、C7H15、C8H17、C9H19、C10H21等,或下式的环烷基:C3H5、C4H7、C5H9、C6H11、C7H13、C8H15、C9H17、C10H19等。
术语“治疗”包括人类或其它动物的疾病的诊断、治愈、缓解、接种、加强疗法或预防中的一者或一者以上。
如本文中所用,术语“脊椎动物”包括所有活的脊椎动物,如(但不限于)哺乳动物、人类、鸟类、犬、猫、家畜、农畜、放养区牧群等。
许多RNA病毒共用生物化学、调控和信号传导路径。这些病毒包括(但不限于)流感病毒(包括禽类和猪类分离株)、呼吸道融合性病毒、C型肝炎病毒、西尼罗河病毒、SARS冠状病毒、脊髓灰质炎病毒、麻疹病毒、登革热病毒、黄热病毒、蜱传脑炎病毒、日本脑炎病毒、圣路易脑炎病毒、墨瑞谷脑炎病毒、波瓦森病毒、罗西奥病毒、跳跃病病毒、斑齐病毒、伊利乌斯病毒、科科贝拉病毒、库宁病毒、阿尔弗病毒、牛腹泻病毒和卡萨努森林病病毒。本文中所公开的化合物和方法可以用于治疗这些病毒。
RNA病毒的相关分类病毒科包括(但不限于)沙粒病毒科、星状病毒科、双RNA病毒科、雀麦镶嵌病毒科、布尼亚病毒科、杯状病毒科、长线形病毒科、豇豆镶嵌病毒科、囊状噬菌体科、黄病毒科、弯曲病毒科、肝炎病毒科、光滑病毒科、黄症病毒科、单股负链病毒科、花叶病毒科、网巢病毒科、野田病毒科、正粘液病毒科、副粘液病毒科、小双节RNA病毒科、小RNA病毒科、马铃薯Y病毒科、呼肠孤病毒科、逆转录病毒科、随伴病毒科、纤细病毒科、披衣病毒科、番茄丛矮病毒科、整体病毒科和芜菁变黄镶嵌病毒科。本文中所公开的化合物和方法可以用于作为医药学上可接受的药物调配物的一部分治疗这些病毒科内的病毒。其它相关病毒科包括(但不限于)肝DNA病毒、疱疹病毒科和乳头瘤病毒科。
特定实施例提供包含单独或与抗原组合的化合物的医药组合物,用于治疗和/或预防动物(包括脊椎动物)的疾病。因此,在一些实施例中,医药组合物可以用作疫苗。
本发明提供所述化合物作为佐剂的用途。
本文中所公开的化合物和方法可以与目前开发或使用的其它疗法累加或协同。举例来说,病毒唑和干扰素-α在组合使用时提供对HCV感染的有效性治疗。其组合功效可以超过任一药品单独使用时的功效。本发明的组合物可以单独或与干扰素、病毒唑和/或针对病毒标靶(病毒蛋白酶、病毒聚合酶、病毒复制复合物的总成)和宿主标靶(病毒加工所需的宿主蛋白酶、病毒标靶(如NS5A)磷酸化所需的宿主激酶和有效使用病毒内部核糖体入口位点所需的宿主因子或IRES的抑制剂)两者所开发的多种小分子组合或结合投与。
本文中所公开的化合物和方法可以与以下组合或结合使用,但不限于金刚烷抑制剂、神经氨酸苷酶抑制剂、α干扰素、非核苷或核苷聚合酶抑制剂、NS5A抑制剂、抗组织胺剂、蛋白酶抑制剂、解螺旋酶抑制剂、P7抑制剂、进入抑制剂、IRES抑制剂、免疫刺激剂、HCV复制抑制剂、亲环蛋白A抑制剂、A3腺苷促效剂和微小RNA抑制剂。
可以与本文中所公开的化合物和方法组合或结合投与的细胞激素包括(但不限于)IL-2、IL-12、IL-23、IL-27或IFN-γ。可以用于或将用于可能与本文中所公开的化合物和方法组合或结合投与的新颖HCV药物包括(但不限于)ACH-1625(阿克琉斯公司(Achillion));糖基化干扰素(阿里奥斯生物制药公司(Alios Biopharma));ANA598、ANA773(阿那帝斯药厂(Anadys Pharm));ATI-0810(阿里森治疗公司(ArisynTherapeutics));AVL-181(阿维拉治疗公司(Avila Therapeutics));(比洛克西公司(Biolex));CTS-1027(珂尼蒂思公司(Conatus));SD-101(戴那瓦克斯技术公司(Dynavax Technologies));克立咪唑(Clemizole,艾格尔生物制药公司(EigerBiopharmaceuticals));GS-9190(吉利德科学公司(Gilead Sciences));GI-5005(哥洛巴尔伊穆生物制药公司(GlobalImmune BioPharma));雷西喹莫特(Resiquimod)/R-848(格雷斯威制药公司(Graceway Pharmaceuticals));人血清白蛋白融合干扰素α-2b(人类基因组科学公司(Human Genome Sciences));IDX-184、IDX-320、IDX-375(伊德尼克斯公司(Idenix));IMO-2125(伊德拉制药公司(Idera Pharmaceuticals));INX-189(因希比特克斯公司(Inhibitex));ITCA-638(银达尔西雅治疗公司(Intarcia Therapeutics));ITMN-191/RG7227(因特穆尼公司(Intermune));ITX-5061、ITX-4520(伊赛尔克斯制药公司(iTherx Pharmaceuticals));MB11362(美达贝斯治疗公司(Metabasis Therapeutics));巴维昔单抗(Bavituximab,游隼制药公司(Peregrine Pharmaceuticals));PSI-7977、RG7128、PSI-938(法玛赛特公司(Pharmasset));PHX1766(芬诺米克斯公司(Phenomix));硝唑尼特(Nitazoxanide)/(勒马克实验室(Romark Laboratories));SP-30(撒马利坦制药公司(Samaritan Pharmaceuticals));SCV-07(赛生公司(SciClone));SCY-635(西耐克西斯公司(Scynexis));TT-033(塔赛尔治疗公司(Tacere Therapeutics));伟拉咪定(Viramidine)/塔巴韦林(taribavirin)(威朗制药公司(Valeant Pharmaceuticals));特拉普维(Telaprevir)、VCH-759、VCH-916、VCH-222、VX-500、VX-813(威泰克斯制药公司(VertexPharmaceuticals));和PEG-INFλ(兹莫基因公司(Zymogenetics))。
可以用于或将用于可能与本文中所公开的化合物和方法组合或结合投与的新颖流感病毒药物和西尼罗河病毒药物包括(但不限于)神经氨酸苷酶抑制剂(帕拉米韦(Peramivir)、拉尼奈米韦(Laninamivir));三合一疗法-神经氨酸苷酶抑制剂病毒唑、金刚烷胺(ADS-8902);聚合酶抑制剂(法匹拉韦(Favipiravir));逆转录酶抑制剂(ANX-201);吸入型聚葡萄胺糖(ANX-211);进入/结合抑制剂(结合位点模拟剂,FLUCIDETM(康乃迪克州西汉文纳米杀病毒剂公司(NanoViricides,West Haven,Connecticut));进入抑制剂((加利福尼亚州圣地亚哥耐百公司(NexBio,SanDiego,California));融合抑制剂(MGAWN1用于西尼罗河病毒);宿主细胞抑制剂(羊毛硫抗生素(lantibiotics));RNA基因体裂解剂(RNAi、RNAse L);免疫刺激剂(干扰素,Alferon-LDO;神经激肽1促效剂、宏巴拉(Homspera)、干扰素Alferon N用于西尼罗河病毒);和TG21。
可以用于可能与本文中所公开的化合物和方法组合或结合投与的用于治疗流感和/或肝炎的其它药物包括(但不限于):
表1.肝炎和流感药物
这些药剂可以并入作为相同医药组合物的一部分或可以与本发明的化合物(并行或根据另一治疗进度)分开投与。
本文中所公开的化合物和方法可以与其它化合物和方法累加或协同以实现疫苗开发。所述化合物可以借助于其抗病毒性和免疫增强性用于实现预防性或治疗性接种。所述化合物不需要与其它疫苗组分同时或组合投与而具有有效性。所述化合物的疫苗应用因由所述化合物引发的免疫反应的一般性质,不限于预防或治疗病毒感染,而是可以涵盖所有治疗性和预防性疫苗应用。
如所属领域的一般技术人员所理解,疫苗可以抵抗病毒、细菌感染、癌症等并且可以包括(但不限于)以下一者或一者以上:活减毒疫苗(LAIV)、不活化疫苗(IIV;杀死的病毒疫苗)、次单位(裂解疫苗);亚病毒粒子疫苗;纯化蛋白疫苗;或DNA疫苗。合适佐剂包括(但不限于)以下一者或一者以上:水/油乳液;非离子型共聚物佐剂,例如CRL1005(OptivaxTM;乔治亚州诺克斯市瓦克赛尔公司(Vaxcel Inc.,Norcross,Ga.));磷酸铝;氢氧化铝;氢氧化铝和氢氧化镁的水性悬浮液;细菌内毒素;聚核苷酸;聚电解质;亲脂性佐剂和合成胞壁酰二肽(norMDP)类似物,如N-乙酰基-去甲基-胞壁酰-L-丙氨酰基-D-异谷氨酰胺、N-乙酰基-胞壁酰-(6-O-硬脂酰)-L-丙胺酰基-D-异谷氨酰胺或N-乙二醇-胞壁酰-L-α-Abu-D-异谷氨酰胺(汽巴-嘉基有限公司(Ciba-Geigy Ltd.))。
包含本发明化合物的医药组合物可以多种形式调配;例如以液体、凝胶、冻干或压缩固体形式。优选形式将取决于所治疗的具体适应症并且可以由所属领域的一般技术人员辨别。在一个实施例中,所公开的RIG-I促效剂包括用于经口递送的调配物,所述调配物可以是使用直接药物化学方法的小分子药物。
本发明调配物的投与可以多种方式进行,包括(但不限于)经口、皮下、静脉内、大脑内、经鼻内、经皮、腹膜内、肌内、肺内、鞘内、经阴道、经直肠、眼内或任何其它可接受的方式。所述调配物可以通过使用所属领域中已知的技术,如泵(例如皮下渗透泵)输注或植入而连续投与,但快速注射是可接受的。在一些情况下,所述调配物可以直接以溶液或喷雾形式应用。
医药组合物的实例是设计用于不经肠投药的溶液。虽然在许多情况下,医药溶液调配物以适于即刻使用的液体形式提供,但所述不经肠调配物还可以冷冻或冻干形式提供。在前一种情况下,所述组合物必须在使用之前融化。后一种形式常用以增强所述组合物中所含的活性化合物在较广泛多种储存条件下的稳定性,如所属领域的一般技术人员所公认的一样,冻干制剂通常比其液体对应物更稳定。所述冻干制剂在使用之前通过添加一种或一种以上合适的医药学上可接受的稀释剂(如(但不限于)无菌注射用水或无菌生理盐水溶液)复原。
不经肠药物可以通过使适当时具有所需纯度的化合物与通常用于所属领域的一种或一种以上医药学上可接受的载剂、赋形剂或稳定剂(其全部称为“赋形剂”),例如缓冲剂、稳定剂、防腐剂、等渗剂、非离子型洗涤剂、抗氧化剂和/或其它各种添加剂混合而制备为冻干调配物或水溶液以便储存。
缓冲剂有助于使pH值维持在近似生理学条件的范围内。其通常以介于2mM到50mM范围内的浓度存在。适合与本发明一起使用的缓冲剂包括有机酸与无机酸两者和其盐,如柠檬酸盐缓冲剂(例如柠檬酸一钠-柠檬酸二钠混合物、柠檬酸-柠檬酸三钠混合物、柠檬酸-柠檬酸一钠混合物等)、丁二酸盐缓冲剂(例如丁二酸-丁二酸一钠混合物、丁二酸-氢氧化钠混合物、丁二酸-丁二酸二钠混合物等)、酒石酸盐缓冲剂(例如酒石酸-酒石酸钠混合物、酒石酸-酒石酸钾混合物、酒石酸-氢氧化钠混合物等)、反丁烯二酸盐缓冲剂(例如反丁烯二酸-反丁烯二酸一钠混合物、反丁烯二酸-反丁烯二酸二钠混合物、反丁烯二酸一钠-反丁烯二酸二钠混合物等)、葡糖酸盐缓冲剂(例如葡糖酸-葡糖酸钠混合物、葡糖酸-氢氧化钠混合物、葡糖酸-葡糖酸钾混合物等)、草酸盐缓冲剂(例如草酸-草酸钠混合物、草酸-氢氧化钠混合物、草酸-草酸钾混合物等)、乳酸盐缓冲剂(例如乳酸-乳酸钠混合物、乳酸-氢氧化钠混合物、乳酸-乳酸钾混合物等)和乙酸盐缓冲剂(例如乙酸-乙酸钠混合物、乙酸-氢氧化钠混合物等)。其它可能缓冲剂是磷酸盐缓冲剂、组氨酸缓冲剂和三甲胺盐(如Tris)。
防腐剂可以被添加以延缓微生物生长,并且通常以0.2%-1%(w/v)的量添加。适合与本发明一起使用的防腐剂包括(但不限于)苯酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯化十八烷基二甲基苯甲基铵、卤化苯甲烃铵(例如氯化苯甲烃铵、溴化苯甲烃铵或碘化苯甲烃铵)、氯化六羟季铵、对羟基苯甲酸烷基酯(如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯)、儿茶酚、间苯二酚、环己醇和3-戊醇。
等渗剂可以被添加以确保液体组合物的等渗性并且包括(但不限于)多元糖醇,优选三元或三元以上糖醇,如甘油、赤藻糖醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇。以其它成分的相对量计,多元醇可以0.1重量%到25重量%、通常1重量%到5重量%的量存在。
稳定剂是指赋形剂的一大类,其功能范围可以从增积剂到溶解治疗剂或有助于防止变性或防止粘着于容器壁的添加剂。典型稳定剂可以是多元糖醇(上文所罗列);氨基酸,如精氨酸、赖氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、丙氨酸、鸟氨酸、L-亮氨酸、2-苯丙氨酸、谷氨酸、苏氨酸等;有机糖或糖醇,如乳糖、海藻糖、水苏糖、甘露糖醇、山梨糖醇、木糖醇、核糖醇、肌醇(myoinisitol)、半乳糖醇、甘油和其类似物,包括环多醇,如肌醇;聚乙二醇;氨基酸聚合物;含硫还原剂,如脲、麸胱甘肽、硫辛酸、硫代乙醇酸钠、硫代甘油、α-单硫代甘油和硫代硫酸钠;低分子量多肽(即<10个残基);蛋白质,如人血清白蛋白、牛血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;单糖,如木糖、甘露糖、果糖和葡萄糖;二糖,如乳糖、麦芽糖和蔗糖;三糖,如棉子糖;和多糖,如葡聚糖。以活性化合物重量计,稳定剂含量通常是0.1重量份到10,000重量份的范围内。
其它杂项赋形剂包括填充剂(例如淀粉)、螯合剂(例如EDTA)、抗氧化剂(例如抗坏血酸、甲硫氨酸、维生素E)和共溶剂。
还可以例如通过凝聚技术或通过界面聚合法,将活性成分囊封于所制备的微囊中,例如羟甲基纤维素微囊、明胶微囊或聚-(甲基丙烯酸甲酯)微囊;囊封于胶体药物递送系统(例如脂质体、白蛋白微球体、微乳液、纳米粒子和纳米胶囊)中或于巨乳液中。所述技术公开于雷明顿,药物科学与实践(Remington,The Science and Practice ofPharmacy),第21版,由利平科特威廉姆斯和威尔金斯出版社(Lippincott Williams&Wilkins),威科集团公司(A Wolters Kluwer Company)出版,2005中,所述文献的教示以引用的方式并入本文中。
欲用于体内投与的不经肠调配物通常是无菌。其很容易例如通过通过无菌过滤膜进行过滤来达成。
持续释放型制剂的适合实例包括含有化合物或组合物的固体疏水性聚合物的半渗透基质,所述基质具有适合形式,如膜或微囊。持续释放型基质的实例包括聚酯、水凝胶(例如聚(甲基丙烯酸2-羟乙酯)或聚(乙烯醇))、聚乳酸交酯、L-谷氨酸和L-谷氨酸乙酯的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物(如技术(马萨诸塞州坎布里奇市奥克美思公司(Alkermes,Cambridge,Massachusetts))或LUPRON(由乳酸-乙醇酸共聚物和亮丙立德乙酸盐构成的可注射微球体;伊利诺伊州雅培科技园雅培实验室(Abbott Laboratories,Abbott Park,Illinois)))和聚-D-(-)-3-羟基丁酸。虽然如乙烯-乙酸乙烯酯和乳酸-乙醇酸的聚合物能够释放分子维持较长时段(如多到100天或超过100天),但特定水凝胶释放化合物维持较短时段。
经口投与化合物和组合物是本发明的一个预定实践。对于经口投与,医药组合物可以呈固体或液体形式,例如呈胶囊、锭剂、散剂、颗粒、悬浮液、乳液或溶液形式。医药组合物优选以含有一定量活性成分的剂量单位形式制得。适用于人类或其它脊椎动物的日剂量可以取决于患者病状和其它因素而大范围变化,但可以由所属领域的一般技术人员使用常规方法确定。
在固体剂型中,活性化合物可以与至少一种惰性稀释剂(如蔗糖、乳糖或淀粉)混合。根据常规惯例,所述剂型还可以包含其它物质,例如润滑剂,如硬脂酸镁。在胶囊、锭剂和丸剂的情况下,剂型还可以包含缓冲剂。锭剂和丸剂可以另外使用肠溶衣制备。
化合物或组合物可以与佐剂,如乳糖、蔗糖、淀粉、烷酸纤维素酯、硬脂酸、滑石、硬脂酸镁、氧化镁、磷酸和硫酸的钠盐和钙盐、阿拉伯胶、明胶、褐藻酸钠、聚乙烯-吡咯烷和/或聚乙烯醇混合,并且制锭或囊封用于习知投与。或者,所述化合物或组合物可以溶解于盐水、水、聚乙二醇、丙二醇、乙醇、油类(如玉米油、花生油、棉籽油或芝麻油)、黄蓍胶和/或各种缓冲剂中。其它佐剂和投药模式在医药技术中所已知。载剂或稀释剂可以包括延时材料,如单独或与蜡组合的单硬脂酸甘油酯或二硬脂酸甘油酯,或所属领域中已知的其它材料。
本发明进一步包括本文中的化合物、组合物和方法在许多应用中的体外使用和应用,包括(但不限于)开发针对病毒感染的疗法和疫苗、调节真核细胞的先天免疫反应的研究等。本发明的化合物、组合物和方法还可以用于动物模型。本发明的化合物、组合物和方法的所述体外和动物体内使用的结果可以例如了解其在人类中的体内使用,或其可以具有与任何人类治疗性或预防性使用无关的价值。
实例
以下实例描述本发明化合物的抗病毒性和药理学性质。所包括的实例证明本发明的具体实施例。所属领域的一般技术人员应了解,实例中所公开的技术表示本发明的发明者所发现的技术和组合物在本发明实践中起良好作用,并且因此可以视为构成其优选实践模式。然而,所属领域的一般技术人员根据本发明应了解,在不悖离本发明的精神和范围的情况下,可以在所公开的特定实施例中进行许多变化并且仍获得相同或相似的结果。举例来说,以下实例提供用于测试本发明化合物的活体外方法。其它活体外病毒感染模型包括(但不限于)黄病毒属,如牛腹泻病毒、西尼罗河病毒和GBV-C病毒;其它RNA病毒,如呼吸道融合性病毒;和HCV复制子系统。此外,胜任于病毒复制的任何合适培养细胞可以用于抗病毒分析。
实例1.KIN1000的生物活性
识别活性化合物的荧光素酶分析。接种以与RIG-I信号传导路径反应启动子(IFNβ、ISG56或ISG54启动子)偶合的荧光素酶报道基因稳定转染的所培养的人类细胞并且使其生长过夜。接着添加化合物“KIN1000”并且使细胞在KIN1000存在下生长18-20小时。添加Steady-Glo荧光素酶底物(普洛麦格公司(Promega))并且在光度计(伯托公司(Berthold))上读取荧光。
图1A显示通过证明与IFNβ(“IFNβ-LUC”,左)、ISG56(“ISG56-LUC”,中)和ISG54(“ISG54-LUC”,右)的启动子偶合的荧光素酶报道基因的剂量依赖性诱发来验证如本文所述的KIN1000。另外,KIN1000未诱发非特异性启动子(β-肌动蛋白-LUC,图1B)。
测定细胞毒性的MTS分析。用稀释于培养基中的增加量的化合物或等量DMSO处理所培养的人类海拉细胞48小时以观察其对细胞生存率的影响。使用测量活细胞中四唑鎓化合物[3-(4,5-二甲基-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑鎓内盐;或MTS]转化为有色甲臜化合物的转化率的细胞生存率分析,计算活细胞比例。
在96孔微量滴定板读取器中检测MTS到甲臜的转化率,并且直接绘制所得光学密度以估计细胞生存率。Cell Titer One(普洛麦格公司)是如制造商方案建议所用的一步骤试剂,并且在试剂存在下培育细胞三小时,随后进行光密度(O.D.)读取。化合物在含有0.5%DMSO的培养基中稀释到0μM、1μM、5μM、10μM和20μM的最终浓度。使用10%DMSO检查不含有化合物的阴性对照孔和阳性对照的细胞毒性。每个KIN1000浓度和对照在三个重复孔中进行。KIN1000显示对多种细胞类型无细胞毒性(MTS分析,图1C)。
测定IRF-3活化和易位到细胞核的免疫荧光细胞化学分析。通过IRF-3转录因子的磷酸化、二聚化和细胞核易位而诱发由RIG-I介导的ISG表达。用稀释于培养基中的增加量化合物或等量DMSO处理所培养的人类海拉细胞20小时。用100HA/mL仙台病毒感染阳性对照孔一段相等时间。使用特异性针对IRF-3的多株兔血清和与(伊利诺伊州罗克福德皮尔斯生物技术公司(Pierce Biotechnology,Inc.,Rockford,IL))488结合的二级抗体检测IRF-3。KIN1000显示IRF-3的细胞核-细胞质差值随剂量变化而增加(图2A)。
测定NFκB活化的免疫荧光细胞化学分析。依赖RIG-I的先天免疫反应还活化NFκB转录因子并且因此增加细胞核含量。用稀释于培养基中的增加量化合物或等量DMSO处理所培养的人类海拉细胞20小时。用100HA/mL仙台病毒感染阳性对照孔一段相等时间。使用特异性针对NFκB的p65次单位的单株小鼠抗体和与DyLight488结合的二级抗体检测NFκB。
免疫荧光分析的定量。使用仪器和软件(赛洛美克斯(Cellomics))扫描并且定量含有用化合物处理并且染色的所培养的人类细胞的96孔板的IRF-3或NFκB。由经过细胞质强度校正后提高的细胞核强度或细胞核-细胞质差值证明转录因子活化。KIN1000显示NFκB的细胞核-细胞质差值随剂量变化而增加(图2B)。
如本文所述的其它化合物还可以通过此实例中所述的方法评估,并且还可以使用其它细胞类型。
实例2.KIN1000针对流感WSN病毒株的抗病毒活性
在被流感病毒感染之前,用增加量KIN1000处理MRC5细胞12-24小时。接着通过细胞中病毒蛋白的免疫荧光分析定量病毒引入后24小时感染细胞的数目。本文中所公开的KIN1000化合物证明针对流感病毒株WSN的有效活性。图3显示用增加量KIN1000处理的MRC5细胞显示流感病毒感染随剂量变化而减少。
实例3.KIN1000的离体免疫刺激活性
分析初级免疫细胞中KIN1000的活性以测定KIN1000是否刺激免疫反应。用0、1或10tM KIN1000处理所培养的人类初级树突状细胞24小时。分离所治疗孔的上清液并且测试细胞激素蛋白的含量。使用与磁珠粒结合的特异性抗体和与抗生蛋白链菌素/藻红蛋白反应产生荧光信号的二级抗体检测细胞激素。使用(路明克斯公司(Luminex Corp.))仪器检测并且定量结合的珠粒,但如所属领域中已知的相似技术可以用于测量荧光蛋白产量,如ELISA。
显示KIN1000诱发由树突状细胞表达趋化激素IL-8、MCP-1、MIP-1α和MIP-1β(图4)。
可以测量细胞激素分泌物的其它细胞包括例如(但不限于)人类外周血液单核细胞、人类巨噬细胞、小鼠巨噬细胞、小鼠脾细胞、大鼠胸腺细胞和大鼠脾细胞。
实例4.使用构效关系(SAR)研究的抗病毒活性和药理学性质
此实例描述化合物抗病毒作用的最佳化。首先使用较小类似衍生物集合来定义结构类型。接着使用在此第一阶段识别的活性类似物来定义所关注的结构类型的子集,用于进一步最佳化(阶段2)。
阶段2,衍生物扩展。阶段2集中于产生结构多样性和评估核心变化形式。测试结构衍生物在IRF-3易位分析中的生物活性、抗病毒活性和在一种或一种以上细胞株或外周血液单核细胞中的细胞毒性。显示改进的功效和低细胞毒性的最佳化分子再通过体外毒物学和吸收、分布、代谢和排出(ADME)的其它测量法进一步分析特征。还研究其作用机制和抗病毒活性广度。
SAR研究的化学设计。为设计类似物结构,分析主导化合物的类药物性质、代谢不稳定性和毒性潜能。如里宾斯基规则(Lipinski′s Rules)所测量的类药物性质和相关生理化学性质是生物可用性的主要指标。表现出代谢和毒物学倾向性的结构特征可以预示有限稳定性、半衰期缩短、反应性中间体或特异性毒性,并且因此应去除。构建5到10个化合物类似物集合,以去除或改变化学反应性或代谢敏感性结构特征,由此发展初步SAR。
测试化合物针对HCV2A、呼吸道融合性病毒、2型登革热病毒和A型流感病毒株的体外抗病毒活性。使用本文所述的分析,评估药物处理后的病毒蛋白和RNA含量。
在几轮反复SAR后,选择化合物用于分析其体外毒物学性质和ADME性质的特征,和用于进一步机转研究。设计SAR研究以提供具有皮摩尔到纳摩尔性能的主导化合物,其适于支持临床前开发。
体外药理学。进行体外药理学研究以测量在肠道渗透性、代谢稳定性和毒性的一个或一个以上分析中最有前途的类似物的性能。关键体外表征研究可以包括血浆蛋白结合;人类和模型生物体中血清、血浆和全血稳定性;肠道渗透性;内在清除率;人类Ether-à-go-go(hERG)通道抑制;和遗传毒性(genotoxicity)。
对于每种类似物,使用基于HPLC和/或基于HPLC-质谱分析的分析方法评估各种测试系统中的药物和代谢物浓度。虽然每种分子的特异性分析方法已最佳化,但逆相色谱可以单独或与四极质谱分析组合使用来表征若干主导分子的身分和纯度。最初,通过HPLC评估药物在哺乳动物物种(如小鼠、食蟹猕猴和人类)的增大浓度的血清、血浆和全血中随时间推移的稳定性并且测定半衰期。
通过质谱分析表征的显著代谢物。使用平衡透析通过分割分析(partition analysis)评估人类血浆蛋白结合。对于肠道渗透性建模,评估人类上皮细胞株TC7的顶端到基底侧通量。在人类肝微粒体培育期间,通过测量母体化合物消失的速率估算最有前途的类似物子集的肝脏清除率。特异性代谢物可以如上分离并且表征。
体外毒物学。进行体外毒物学研究以评估主导类似物的潜在心脏和遗传毒性。使用自动化膜片钳评估每种化合物对于转殖基因表达人类Kv11.1基因的重组中国仓鼠卵巢(CHO)细胞株中hERG通道电流的影响。评估每种化合物达小于30倍最大血清浓度的浓度或溶解度极限以便测定分子对于hERG通道的IC50值。在浓度范围内评估化合物子集的诱发鼠伤寒沙门杆菌(Salmonella typhimurium)病毒株TA98和TA100回复突变的能力或促进培养物的CHO细胞中形成小核的能力。
实例5.由KIN1000和衍生化合物活化基因表达
海拉细胞中的基因表达。用20μM、10μM、5μM化合物或DMSO对照处理培养的人类细胞并且培育达24小时。收集细胞并且使用QIAshredder柱和RNeasy小试剂盒(凯杰公司(Qiagen))根据制造商说明书分离RNA。进行逆转录并且cDNA模板用于定量实时PCR。使用市售经过验证的TaqMan基因表达分析(应用生物系统/生命技术公司(Applied Biosystems/Life Technologies)),根据制造商说明书进行PCR反应。使用相对表达分析(ΔΔCt)测量基因表达含量。
PH5CH8细胞中的基因表达。用10μM、5μM、1μM化合物或DMSO对照处理所培养的人类细胞并且培育达24小时。收集细胞并且使用QIAshredder柱和RNeasy小试剂盒(凯杰公司)根据制造商说明书分离RNA。进行逆转录并且cDNA模板用于定量实时PCR。使用市售经过验证的TaqMan基因表达分析(应用生物系统/生命技术公司),根据制造商说明书进行PCR反应。使用相对表达分析(ΔΔCt)测量基因表达含量。
HUVEC初级细胞中的基因表达。将细胞融化并且以每孔2.4×104个细胞接种于6孔板中并使其生长到80%汇合,一般在每48小时置换新鲜培养基的培养物中5天。添加10μM、1μM的化合物或DMSO对照并且培育达24小时。收集细胞并且使用QIAshredder柱和RNeasy小试剂盒(凯杰公司)根据制造商说明书分离RNA。进行逆转录并且cDNA模板用于定量实时PCR。使用市售经过验证的TaqMan基因表达分析(应用生物系统/生命技术公司),根据制造商说明书进行PCR反应。使用相对表达分析(ΔΔCt)测量基因表达含量。
图5显示由KIN1000和其衍生化合物KIN1148诱发基因表达。图5A显示用10μM KIN1000(灰色)或10μM KIN1148(黑色)处理后经4-24小时的时间,海拉细胞中IFIT2(左)和OAS1(右)随时间推移的基因表达含量。图5B显示用KIN1000(实心灰色条形图)或KIN1148(实心黑色条形图)处理的PH5CH8细胞(左)中IFIT2的基因表达含量和用KIN1000(灰色条纹条形图)或KIN1148(黑色格纹条形图)处理的海拉细胞(右)中中IFIT2的基因表达含量。在每一测试组中,三个垂直条形图分别表示5μM、10μM和20μM化合物(KIN1000或KIN1148)。图5C显示用1μM KIN1000(灰色)或1μMKIN1148(黑色)处理的初级HUVEC细胞中IFIT2(左)、OAS1(中)和MxA(右)的基因表达含量。轴标度的差值证明化合物在初级细胞类型中更具活性。这些资料证明化合物通过诱导反应性基因表达而在细胞中具有活性。
可以在包括(但不限于)以下的细胞类型中类似地分析基因表达:初级血液单核细胞、人类巨噬细胞、THP-1细胞、Huh7细胞、A549细胞、MRC5细胞、大鼠脾细胞、大鼠胸腺细胞、小鼠巨噬细胞、小鼠脾细胞和小鼠胸腺细胞。可以如本文所述分析其它所关注基因的表达。
实例6.KIN1000针对各种病毒的抗病毒活性
细胞培养感染模型中的抗病毒作用。为进一步表征最佳化分子的抗病毒活性广度,使用细胞培养感染模型分析不同病毒,包括(但不限于)流感病毒的不同病毒株、HCV、登革热病毒、RSV和西尼罗河病毒(WNV),一种新兴的公共卫生问题。研究包括在感染前用化合物处理细胞2-24小时或在感染后处理细胞达8小时。经一段时程评估病毒产生和细胞ISG表达以分析主导结构类型的代表性化合物的抗病毒作用。使用IFNβ处理作为阳性对照。
通过病灶形成或空斑分析测量病毒产生。在平行实验中,通过qPCR和免疫印迹分析测量病毒RNA和细胞ISG表达。设计这些实验以验证在病毒感染期间的化合物信号传导作用和评估化合物引导针对各种病毒株的先天免疫抗病毒程式的作用和在病毒对抗措施环境中的作用。在每一病毒感染系统中,对处理前和处理后感染模型两者进行每种化合物的详细剂量-反应分析以测定与对照细胞相比抑制病毒产生达50%(IC50)和90%(IC90)的有效剂量。
表2.主导化合物抗病毒分析的病毒系统和研究设计
实例7.KIN1000和衍生化合物针对呼吸道融合性病毒的活性。
在前一天将海拉细胞以每孔4×105个细胞接种于6孔板中。次日,培养基被含0.1MOI的RSV的无FBS培养基置换。在37℃下病毒结合2小时。2小时后细胞用温热的完全培养基洗涤并且被含有10μM、5μM、1μM变化浓度的药物或DMSO对照的培养基置换。将细胞放在37℃培育箱中48小时。
关于病毒检测和滴定,将海拉细胞以每孔8×103个细胞接种于96孔板中24小时,随后收集病毒上清液。在48小时培育期后,从被感染的板收集病毒上清液并且用于以1/10最终稀释度感染这些细胞。将细胞放在37℃培育箱中24小时。
在感染后24小时,细胞用PBS洗涤两次并且用甲醇/丙酮溶液固定。在固定后,细胞用PBS洗涤两次并且被阻断缓冲液(含10%马血清、1g/mL BSA和0.1%Triton-100X的PBS)置换1小时。在室温下,阻断缓冲液被含有1/2000稀释度的初级抗体的结合缓冲液置换2小时。初级抗体是针对RSV的小鼠单株抗体。在室温下,细胞用PBS洗涤两次并且被含有1/3000稀释度的Alexa Fluor-488山羊抗小鼠二级抗体和Hoechst核染剂的结合缓冲液置换1小时。细胞用PBS洗涤两次并且添加PBS到所有孔中。密封96孔板并且使用Array Scan仪器(赛黙飞世尔公司(Thermo-Fischer))通过免疫荧光分析测定与病毒感染性有关的荧光活性。
图6显示使用实例方案进行的实验,证明KIN1000和KIN1148针对呼吸道融合性病毒的抗病毒活性。图6A显示用增加量KIN1000和KIN1148处理的海拉细胞显示RSV感染随剂量变化而减少。图6B显示当在感染前达24小时添加药物时,KIN1148显示针对RSV的抗病毒活性。
在感染前用化合物处理。在此方法的变化形式中,在感染病毒前的不同时间点添加化合物。如描述般进行病毒检测和滴定。
类似物测试和SAR研究。使用针对RSV的抗病毒活性作为测量KIN1000结构衍生物活性的准则。表3显示显示针对RSV的抗病毒活性的KIN1000选择结构衍生物。与KIN1000母体化合物相比,这些类似物显示针对RSV的不同程度的抗病毒活性。+++=感染抑制大于70%,++=抑制大于50%,+=抑制大于30%,-=抑制小于30%。
表3
实例8.KIN1000和衍生化合物针对流感A/Udorn/72病毒的活性
H292细胞的流感A/Udorn/72感染。用含2μM KIN1148的0.5%最终浓度DMSO处理RPMI1640+10%FCS中的.2×106个H292细胞6小时。吸出含化合物的培养基并且被含0.1MOI的A/Udorn/72的1X MEM置换并放在37℃下CO2培育箱中。感染后两小时吸出含病毒培养基并且被含1μg/mL TPCK处理的胰蛋白酶、2μM KIN1148、0.5%DMSO的1X MEM置换。将细胞放在37℃的CO2培育箱中18小时。在感染后20小时后,收集病毒上清液并且对MDCK细胞进行滴定。
HEK293细胞的流感A/Udorn/72感染。用含0.2MOI的A/Udorn/72的1X MEM感染5×105个HEK293细胞。在感染后2小时后,吸出含病毒培养基并且被含1μg/mLTPCK处理的胰蛋白酶、10μM KIN1148、0.5%DMSO的1X MEM置换。将细胞放回到37℃、CO2培育箱中18小时。在感染后20小时后,收集病毒上清液并且对MDCK细胞进行滴定。
MDCK细胞的滴定。在2μg/mL TPCK-胰蛋白酶存在下,将10μL被感染的上清液添加到2×106个MDCK细胞中并且放置在37℃CO2培育箱中。在8小时后,去除上清液并且固定细胞并且用流感NP蛋白质的特异性FITC结合抗体染色。使用ArrayScan仪器和软件(赛洛美克斯)定量病灶数目。
图7显示KIN1148针对A型流感病毒Udorn/72的抗病毒活性。用2μM(H292)或10μM(HEK293)KIN1148处理的H292细胞(左)和HEK293细胞(右)显示病毒感染减少。
实例9.KIN1000和衍生化合物针对登革热病毒的活性
在前一天将Huh7细胞以每孔4×105个细胞接种于6孔板中。次日,培养基被含0.25MOI的2型登革热病毒的无FBS培养基置换。在4℃下病毒结合1小时。1小时后细胞用温热的完全培养基洗涤并且被含有10μM、5μM、1μM变化浓度的KIN1148或DMSO对照的培养基置换。将细胞放在37℃培育箱中48小时。
Vero细胞的滴定。将Vero细胞以每孔8×103个细胞接种于96孔板中24小时,随后收集病毒上清液。48小时后,收集病毒上清液并且用于以1/100最终稀释度感染Vero细胞。
在感染后24小时,Vero细胞用PBS洗涤两次并且用甲醇/丙酮固定15分钟。在固定后,细胞用PBS洗涤两次并且被阻断缓冲液置换30-45分钟。阻断缓冲液被含有1/2000稀释度的靶向包膜蛋白的初级单株抗体的结合缓冲液置换2小时。2小时后,细胞用PBS洗涤两次并且被含有1/3000稀释度的Alexa Fluor-488山羊抗小鼠二级抗体和Hoechst核染剂的结合缓冲液置换45分钟。45细胞后,细胞用PBS洗涤两次并且添加PBS到所有孔中。密封96孔板并且使用ArrayScan仪器和软件(赛洛美克斯)通过IF测定与病毒感染性有关的荧光活性。
图8显示使用此实例的方案所进行实验的结果,证明KIN1148针对2型登革热病毒的抗病毒活性。用增加量KIN1148处理的Huh7细胞显示病毒感染随剂量变化而减少。
实例10.KIN1000和衍生化合物针对B型肝炎病毒的活性
HepAD38细胞(表达受调控HBV基因体的Hep2细胞)在化合物(含1-10μM浓度的0.5%DMSO培养基)存在下生长72小时。使用不表达HBV的HepAD38细胞作为阴性对照。在72小时处理后,在ELISA中使用100μl培养基测量HBV表面抗原。通过来自新泽西州创新诊断公司(Creative Diagnostics,NJ)的ELISA市售HBV sAg ELISA测量上清液中由细胞产生的HBV表面抗原的量。
图9显示使用此实例方案所进行实验的结果,证明KIN1148针对B型肝炎病毒的抗病毒活性。用增加量KIN1148处理的HepAD38细胞显示上清液病毒含量随剂量变化而减少。
实例11.最佳化药物先导物在相关临床前动物模型中的体内药物动力学、毒物学和抗病毒性
临床前药物动力学和耐受性概况。评估KIN1000和相关化合物的体内药物动力学(PK)概况和耐受性/毒性,以便在流感病毒和WNV感染的动物模型中进行其抗病毒活性的进一步表征。小鼠是被选择用于这些研究的测试物种,因为其是最常用的WNV和流感的啮齿动物模型。
使用逆相HPLC-MS/MS检测方法测量小鼠血浆中每种化合物的浓度。在PK概况分析之前,使用主要集中于在少量储存条件下使水溶性和稳定性最大的有限调配物组分筛选开发每种化合物的初始经口和静脉内调配物。如所属领域中已知的任何分析方法可以用于测量调配物性能。根据三层策略开发每种化合物的调配物:
第1层:pH值(pH3到9)、缓冲液和重量摩尔渗透浓度调节
第2层:添加乙醇(<10%)、丙二醇(<40%)或聚乙二醇(PEG)300或400(<60%)共溶剂以增加溶解度
第3层:视需要添加N-N-二甲基乙酰胺(DMA,<30%)、N-甲基-2-吡咯烷酮(NMP,<20%)和/或二甲亚砜(DMSO,<20%)共溶剂或环糊精(<40%)以进一步改进溶解度。
对在体外抗病毒、机械学、ADME和毒物学研究中显示足够性能的化合物进行初步小鼠PK研究。参见表3。通过经口管饲(<10ml/kg)或静脉内快速注射(<5ml/kg)向空腹过夜后的动物投与单次剂量的每种化合物。每一给药组给多只动物服药,使得在每一时间点可以取样3只动物。在给药前和在给药后5、15和30分钟和1、2、4、8和24小时,由后眼眶窦收集血液样品。根据以前开发的生物分析方法测量药物浓度。使用WinNonlin软件评估药物动力学参数。
表4
基于探索性PK研究中的性能,进一步评估化合物在小鼠中的初步耐受性和毒性,随后评估其在抗病毒模型中的表征。分两阶段进行耐受性研究:首剂量增加阶段(多到5个剂量,每次隔开5天清除期)以测定最大耐受剂量(MTD,阶段1),随后七天每日投与MTD以评估急性毒性(阶段2)。参见表3。所有剂量通过经口管饲投与。在例示性实验中,将每种性别五只动物放在阶段1研究并且阶段2中每一给药组每种性别15只动物。研究端点包括测定MTD、身体检查、临床观察、血液学、血清化学和动物体重。对所有动物(无论已死亡的、在临终或在实验预定结束时安乐死的)进行大体病理学。毒物学研究实际上主要是探索性的并且意欲识别早期毒物学端点和驱使选择抗病毒动物模型的主导候选物。
表5.化合物针对WNV和流感病毒作用的体内研究
*数目反映每一实验至少两次反复的平均值
使用小鼠感染模型评估抗病毒性和免疫保护。基于化合物药物动力学、抗病毒作用和先天免疫作用选择最佳化化合物用于在临床前小鼠感染模型中进一步评估。参见表4。测量化合物的先天免疫作用,并且评估其保护小鼠免受WNV和流感病毒攻击的能力。关于WNV感染模型,用WNV的毒性谱系1病毒株(WNV-TX)皮下足垫感染野生型C57Bl/6小鼠。进行流感病毒株A/PR/8/34、A/WSN/33和A/Udorn/72的非手术气管滴入法。
用于特定实验的流感病毒株具有两种不同亚型(H1N1和H3N2)并且在C57Bl/6小鼠中显示不同致病性和临床表现。在单独或与感染前12小时或感染后24小时开始的化合物处理组合的攻击剂量(如10到1,000pfu的病毒)范围内监测小鼠发病率和死亡率并且每日持续进行以测定药物的血浆半衰期。进行化合物剂量-反应分析和感染时程研究,以评估化合物以下功效:1)限制血清病毒负荷、2)限制目标器官中的病毒复制和传播、和3)防止病毒发病。
关于WNV,除血清之外,评估淋巴结、脾脏和脑中的病毒负荷;关于流感病毒,评估心脏、肺脏、肾脏、肝脏和脑中的病毒负荷。这些实验设计中包括在100pfuWNV-TX或1,000pfu流感病毒的标准攻击后,测定每种化合物抑制50%和90%血清病毒负荷(ED50和ED90)时的有效剂量。在化合物处理后,在24小时时间间隔下通过病毒RNA的qPCR测定血清病毒负荷。使用WNV神经入侵感染模型,在ED50和ED90下测试化合物对于限制大脑神经系统中WNV发病的作用。
在单独或与感染后24小时开始的化合物处理组合的1pfu WNV-MAD标准颅内攻击后,监测小鼠发病率和死亡率。
实例12.KIN1000和衍生化合物的体内抗病毒活性
使用小鼠感染模型评估KIN1000和衍生化合物的抗病毒性。选择多达5种最有前途的化合物在感染流感和/或呼吸道融合性病毒的临床前小鼠模型中进一步评估。表6列出测量KIN1000和衍生化合物的抗病毒功效的非临床研究。
表6.测量药物浓度和体内抗病毒功效的非临床研究
小鼠流感模型。我们将进行流感病毒株A/WSN/33和A/Udorn/72的非手术气管滴入。这些流感病毒株是两种不同亚型(H1N1和H3N2)并且在C57Bl/6小鼠中显示不同致病性和临床表现。经整个感染过程(通常2周)通过经口管饲或腹膜内投药每日投与2个剂量的KIN1000族化合物的主导衍生物加安慰剂对照组。评估每组每种性别五只动物的端点,包括(但不限于)每日临床观察、死亡率、体重和体温。每种性别三只动物将用于测量血清、心脏、肺脏、肾脏、肝脏和脑中的病毒滴度。分析化合物处理的动物与对照动物在感染期间各个时间点的细胞激素表达。
小鼠RSV模型。我们将进行呼吸道融合性病毒A2长病毒株的非手术气管滴入。BALB-c小鼠将在不引起细胞病变效应的RSV A2病毒剂量下受到感染,随后每日经口或腹膜内投与2个剂量的化合物或安慰剂对照,持续直到21天。如上所述监测小鼠,包括检查发病率和死亡率、血清和血液中的病毒滴度、细胞激素分泌物、增加的免疫细胞群体和先天免疫基因表达。
实例13.KIN1000和衍生化合物的体内佐剂活性
为表征KIN1000和相关化合物的佐剂活性的广度,使用接种和接种加保护的体内动物模型。研究包括单独用化合物或用与抗原组合的化合物初打动物(包括(但不限于)大鼠和小鼠)并且随后评估佐剂作用。
通过分析由改变增强的免疫体液反应和细胞反应测量佐剂作用。随时间推移,在接种和/或追加接种后的离散时间,通过收集血液血清并且测定抗体类别(IgM IgG、IgA或IgE)和/或IgG抗体同型(包括IgG1、IgG2a、IgG2b、IgG2c、IgG3)的相对浓度来评估体液反应。此外,还测定所产生抗体的亲和力和亲合力。在疫苗制剂包括化合物和抗原组合的情形中,还测定所产生抗体的中和活性。
通过此领域中已确定的方法测量由化合物诱发的细胞介导型免疫反应,所述方法包括用抗原离体刺激外周血液单核细胞、淋巴结、脾细胞或其它二级淋巴器官并且此后测量上清液中的细胞激素或趋化激素产生若干次。所测量的细胞激素包括Th1型细胞激素,包括(但不限于)IFNγ和TNFα;Th2型细胞激素,包括(但不限于)IL-4、IL-10、IL-5和IL-13;和Th17细胞激素,包括(但不限于)IL-17、IL-21和IL-23。还测量由化合物引发的趋化激素,包括(但不限于)RANTES、IP-10、MIP1a、MIP1b和IL-8。还可以通过将胞内细胞激素用荧光标记的特异性抗体染色和通过流动式细胞测量术或通过ELISPOT测量细胞激素的T细胞抗原单位生产率。研究CD4+和CD8+T细胞群体两者。
还通过流动式细胞测量术由表面活化标记的免疫表型测定在细胞层次下的佐剂活性测量值。还通过穿孔素(perforin)的胞内细胞激素染色、细胞表面标记物表达或增殖分析(包括胸苷并入)评估CD8T细胞抗原特异性反应。
设计这些实验以验证初打-追加接种方案的不同组合中的化合物佐剂活性并且评估KIN1000或相关化合物对先天免疫抗病毒程式的作用如何形成对于疫苗制剂中的抗原所发动的适应性免疫反应。
使用每一所选抗原进行如上所述的每一化合物的详细免疫反应分析以测定具体抗原和化合物调配物的免疫相关物。这些结果指导随后用已知导致动物疾病或死亡的感染物剂量攻击用所选最佳化化合物和所选感染物的所需抗原调配物的组合接种和追加接种的动物的保护研究。通过接种提供的保护通常通过监测临床症状和存活率来测量。
进行概念实验证明。在第0天用抗原(卵白蛋白,0.2mg/kg)和KIN1000(1mg/kg)或KIN1148(1mg/mL)于磷酸盐盐水缓冲液(PBS)中的悬浮液初打10-12周大的路易斯雌性大鼠。对照动物接受含卵白蛋白(OVA,因维沃金公司(InvivoGen Inc.))的PBS或OVA和poly I:C(0.1mg/kg,因维沃金公司)。动物在第2周和第8周追加接种。初打是在足垫和尾根部皮下递送疫苗并且追加接种是在足垫和侧腹皮下递送疫苗(0.025毫升/部位)。在初打后第0、1、2、4、6和9周通过尾部放血收集血液样品并且加工成血清。使用抗IgM、抗IgG和抗IgG同型特异性抗体通过ELISA测定OVA特异性抗体的滴度。图10显示OVA+KIN1000和OVA+KIN1148接种动物中相对于仅接种OVA的对照的IgG抗体含量。
细胞介导型佐剂活性的测量还通过测定抗原的迟发型过敏症(DTH)来测定。在概念实验的相同证明中,通过测定在第一次追加接种后2周用OVA攻击的迟发型过敏性反应来评估细胞反应。用异氟烷使动物镇静并且分别在左耳廓和右耳廓注射PBS或OVA(OVA于PBS中的1mg/mL溶液,0.02mL)。24小时后计算耳厚度差值。图11显示右耳与左耳厚度之间的所测量的差值。
除非另有陈述,否则说明书和权利要求书中所使用的表示成分量、如分子量、反应条件等的性质的所有数字应被理解为在一切情况下由术语“约”修饰。因此,除非相反地指示,否则在说明书和随附权利要求书中阐明的数值参数是可以取决于设法通过本发明获得的所需性质而变化的近似值。最低限度地,并且并非作为限制均等论应用于权利要求书的范围的尝试,每一数值参数至少根据所报道的有效数位并且通过应用普通舍入技术来解释。
尽管阐述本发明的广泛范围的数值范围和参数是近似值,但已尽可能精确地报道特定实例中所述的数值。然而,任何数值都固有地含有某些必然误差,这是由其相应的测试测量中可见的标准差所产生。
除非本文中另作说明或与上下文明显抵触,否则描述本发明的上下文中(尤其在以下权利要求书的上下文中)所用的术语“一”、“所述”和类似指示物应解释为包括单数和复数。在本文中列举数值范围仅意欲充当个别参考处于所述范围内的每个独立值的简写方法。除非在本文中另外指明,否则每一个别值如其个别列举于本文中一般并入说明书。除非本文中另外指明或与上下文明显抵触,否则本文所述的所有方法可以任何适合顺序进行。除非另外要求,否则任何和所有实例或本文中所提供的例示性语言(例如,“如”)的使用仅意欲更好地阐明本发明并且不对本发明的范围予以限制。本说明书中所有语言都不应视为表明任何未要求要素为实施本发明所必要。
本文中所公开的本发明的替代性要素或实施例的分组不应理解为限制。每一组成员可以被个别提及和要求或与所述组的其它成员或本文中可见的其它要素任意组合。出于便利性和/或专利性的原因,预期一组的一个或一个以上成员可以包括于一组中或从一组中删去。当出现任何所述包括或删去时,本说明书视为含有被修改因此满足随附权利要求书中所用的所有马库什组(Markush groups)的书面说明的组。
本发明的某些实施例描述于本文中,包括本发明的发明者已知用于进行本发明的最佳方式。当然,关于这些所述实施例的变化将在所属领域的一般技术人员阅读以上描述后变得显而易知。本发明的发明者期望所属领域的技术人员任选地使用所述变化,并且除本文中特定描述之外,本发明的发明者意欲实践本发明。因此,本发明包括随附权利要求书中所述的标的物的所有修改形式和等效物,如适用的法律所容许。此外,除非本文中另外指明或与上下文明显抵触,否则本发明涵盖上述要素在所有可能变化形式中的任何组合。
本文中所公开的特定实施例可以在权利要求书中使用由组成或/和基本上由组成的措辞进一步限制。当用于权利要求书时,无论是否根据修正案申请或添加,过渡术语“由...组成”不包括权利要求书中未规定的任何要素、步骤或成分。过渡术语“基本上由...组成”限制权利要求书关于规定材料或步骤的范围并且其并未本质上影响基本特性和新颖特征。所要求的本发明实施例自然或明显地描述于本文中并且在本文中可行。
最后,应了解本文中所公开的本发明实施例说明本发明的原理。可以使用的其它修改形式属于本发明的范围。因此,举例来说(但不限于),可以根据本文中的教示使用本发明的替代性配置。因此,本发明不限于如精确所示和描述的内容。
Claims (27)
3.一种医药组合物,其包含根据权利要求1或2所述的化合物。
4.根据权利要求1所述的化合物,其中W是S并且X是N。
5.根据权利要求1或4所述的化合物,其中:
Y1和Y2都是CR4,并且共同形成任选地经R4取代的另一杂环;
Y3是CR4;并且
Y4是CR4。
6.根据权利要求1、4或5中任一项所述的化合物,其中R1是任选地经取代的萘基。
8.根据权利要求1或4所述的化合物,其中R1是任选地经取代的苯基。
9.根据权利要求1、2、3、4、5、6、7或8所述的化合物,其中R5是H或C1-3烷基。
10.根据权利要求1、8或9所述的化合物,其中W是S。
11.根据权利要求1、8、9或10所述的化合物,其中X是N。
12.根据权利要求1、4、5、6、9、10或11所述的化合物,其中Y3是CR4,其中R4是Rb、ORb、CORb、CO2Rb、OCORb、NRbRc、CF3、CN、NO2、F、Cl、Br或I,其中Rb和Rc独立地是H或C1-3烷基。
13.根据权利要求1、4、6、9、10、11或12所述的化合物,其中Y4是CR4,其中R4是Rb、ORb、CORb、CO2Rb、OCORb、NRbRc、CF3、CN、NO2、F、Cl、Br或I,其中Rb和Rc独立地是H或C1-3烷基。
14.根据权利要求1所述的化合物,其进一步由下式表示:
其中R10、R11、R12、R13、R14、R16、R17和R18独立地是Rb、ORb、CORb、CO2Rb、OCORb、NRbRc、CF3、CN、NO2、F、Cl、Br或I,其中Rb和Rc独立地是H或C1-3烷基,并且R5是H或C1-3烷基。
15.根据权利要求14所述的化合物,其中R18是CH3。
16.根据权利要求14或15所述的化合物,其中R13是Br。
19.一种医药组合物,其包含根据权利要求4、5、6、7、8、9、10、11、12、13、14、15、16、17或18所述的化合物。
20.一种治疗或预防脊椎动物的病毒感染的方法,其包含向所述脊椎动物投与根据权利要求3或19所述的医药组合物。
21.根据权利要求20所述的方法,其中所述病毒感染是由来自一个或一个以上以下病毒科的病毒引起:沙粒病毒科(Arenaviridae)、星状病毒科(Astroviridae)、双RNA病毒科(Birnaviridae)、雀麦镶嵌病毒科(Bromoviridae)、布尼亚病毒科(Bunyaviridae)、杯状病毒科(Caliciviridae)、长线形病毒科(Closteroviridae)、豇豆镶嵌病毒科(Comoviridae)、囊状噬菌体科(Cystoviridae)、黄病毒科(Flaviviridae)、弯曲病毒科(Flexiviridae)、肝炎病毒科(Hepevirus)、光滑病毒科(Leviviridae)、黄症病毒科(Luteoviridae)、单股负链病毒科(Mononegavirales)、花叶病毒科(MosaicViruses)、网巢病毒科(Nidovirales)、野田病毒科(Nodaviridae)、正粘液病毒科(Orthomyxoviridae)、小双节RNA病毒科(Picobirnavirus)、小RNA病毒科(Picornaviridae)、马铃薯Y病毒科(Potyviridae)、呼肠孤病毒科(Reoviridae)、逆转录病毒科(Retroviridae)、随伴病毒科(Sequiviridae)、纤细病毒科(Tenuivirus)、披衣病毒科(Togaviridae)、番茄丛矮病毒科(Tombusviridae)、整体病毒科(Totiviridae)、芜菁变黄镶嵌病毒科(Tymoviridae)、肝DNA病毒科(Hepadnaviridae)、疱疹病毒科(Herpesviridae)、副粘液病毒科(Paramyxoviridae)或乳头瘤病毒科(Papillomaviridae)。
22.根据权利要求20所述的方法,其中所述病毒感染是流感病毒、C型肝炎病毒、西尼罗河病毒(West Nile virus)、SARS冠状病毒、脊髓灰质炎病毒、麻疹病毒、登革热病毒(Dengue virus)、黄热病毒、蜱传脑炎病毒、日本脑炎病毒、圣路易脑炎病毒(St.Louis encephalitis virus)、墨瑞谷脑炎病毒(Murray Valley virus)、波瓦森病毒(Powassan virus)、罗西奥病毒(Rocio virus)、跳跃病病毒(louping-ill virus)、斑齐病毒(Banzi virus)、伊利乌斯病毒(Ilheus virus)、科科贝拉病毒(Kokobera virus)、库宁病毒(Kunjin virus)、阿尔弗病毒(Alfuy virus)、牛腹泻病毒、卡萨努森林病病毒(Kyasanur forest disease virus)、呼吸道融合性病毒或人类免疫缺乏病毒HIV。
23.根据权利要求20、21或22所述的方法,其中所述医药组合物是作为预防性或治疗性疫苗的佐剂而投与。
24.根据权利要求23所述的方法,其中所述方法包含通过另外投与针对以下病毒的疫苗对脊椎动物进行接种:流感病毒、C型肝炎病毒、西尼罗河病毒、SARS冠状病毒、脊髓灰质炎病毒、麻疹病毒、登革热病毒、黄热病毒、蜱传脑炎病毒、日本脑炎病毒、圣路易脑炎病毒、墨瑞谷脑炎病毒、波瓦森病毒、罗西奥病毒、跳跃病病毒、斑齐病毒、伊利乌斯病毒、科科贝拉病毒、库宁病毒、阿尔弗病毒、牛腹泻病毒、卡萨努森林病病毒、呼吸道融合性病毒或人类免疫缺乏病毒HIV。
25.一种调节真核细胞的先天免疫反应的方法,其包含向所述细胞投与根据权利要求1、2、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18中任一项所述的化合物。
26.根据权利要求25所述的方法,其中所述细胞是活体内细胞。
27.根据权利要求25所述的方法,其中所述细胞是活体外细胞。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161542049P | 2011-09-30 | 2011-09-30 | |
| US61/542,049 | 2011-09-30 | ||
| PCT/US2012/057646 WO2013049407A2 (en) | 2011-09-30 | 2012-09-27 | Anti-viral compounds |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN103857683A true CN103857683A (zh) | 2014-06-11 |
| CN103857683B CN103857683B (zh) | 2016-10-12 |
Family
ID=47996748
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201280047516.0A Expired - Fee Related CN103857683B (zh) | 2011-09-30 | 2012-09-27 | 抗病毒化合物 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US9555106B2 (zh) |
| EP (1) | EP2748172B1 (zh) |
| JP (2) | JP2014528412A (zh) |
| KR (1) | KR20140070631A (zh) |
| CN (1) | CN103857683B (zh) |
| AP (1) | AP2014007595A0 (zh) |
| AU (3) | AU2012315953A1 (zh) |
| BR (1) | BR112014007599A2 (zh) |
| CA (1) | CA2859946C (zh) |
| HK (1) | HK1199029A1 (zh) |
| IL (1) | IL231780A (zh) |
| MX (1) | MX351818B (zh) |
| SG (1) | SG11201401084TA (zh) |
| TW (1) | TW201326163A (zh) |
| WO (1) | WO2013049407A2 (zh) |
| ZA (1) | ZA201401825B (zh) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103857683B (zh) | 2011-09-30 | 2016-10-12 | 奇尼塔公司 | 抗病毒化合物 |
| US9073946B2 (en) * | 2013-01-15 | 2015-07-07 | Kineta, Inc. | Anti-viral compounds |
| TW201623265A (zh) * | 2014-05-09 | 2016-07-01 | 奇尼塔公司 | 抗病毒化合物、醫藥組合物及其使用方法 |
| MX2019012295A (es) | 2017-04-14 | 2020-02-07 | Tollnine Inc | Polinucleotidos inmunomoduladores, conjugados de anticuerpos de los mismos y metodos para su uso. |
| SG11202012625PA (en) | 2018-06-19 | 2021-01-28 | Novartis Ag | N-substituted tetrahydrothienopyridine derivatives and uses thereof |
| WO2020036574A1 (en) * | 2018-08-17 | 2020-02-20 | Kineta, Inc. | Activators of the retinoic acid inducible gene "rig-i' pathway and methods of use thereof |
| US11920136B2 (en) | 2020-02-28 | 2024-03-05 | Tallac Therapeutics, Inc. | Transglutaminase-mediated conjugation |
| CN116897155A (zh) * | 2021-02-24 | 2023-10-17 | 豪夫迈·罗氏有限公司 | 用于治疗和预防乙型肝炎病毒感染的苯并噻唑基双环[1.1.1]戊烷衍生物 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN87107330A (zh) * | 1986-12-10 | 1988-06-22 | 住友化学工业株式会社 | 种子消毒组合物 |
| JP2001206891A (ja) * | 2000-01-26 | 2001-07-31 | Otsuka Pharmaceut Factory Inc | ホスホン酸ジエステル誘導体 |
| WO2001070705A1 (en) * | 2000-03-17 | 2001-09-27 | Alcon, Inc. | 2-acylaminobenzimidazole derivatives for treating glaucoma |
| CN101031567A (zh) * | 2004-09-20 | 2007-09-05 | 4Sc股份有限公司 | 新型杂环NF-κB抑制剂 |
| WO2010008847A2 (en) * | 2008-06-24 | 2010-01-21 | Takeda Pharmaceutical Company Limited | Pi3k/m tor inhibitors |
| WO2010024903A1 (en) * | 2008-08-29 | 2010-03-04 | Yangbo Feng | BENZO[d]OXAZOLES AND BENZO[d]THIAZOLES AS KINASE INHIBITORS |
| WO2010071783A1 (en) * | 2008-12-16 | 2010-06-24 | Abbott Laboratories | Thiazoles as cannabinoid receptor ligands |
| US20100267717A1 (en) * | 2005-07-29 | 2010-10-21 | 4Sc Ag | Novel Heterocyclic NF-kB Inhibitors |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3489558A (en) * | 1967-09-18 | 1970-01-13 | Ibm | Photoconductive benzobisthiazoles and their use in electrophotographic processes |
| JPS60205454A (ja) * | 1984-03-29 | 1985-10-17 | Mitsubishi Paper Mills Ltd | 電子写真感光体 |
| JPS63190880A (ja) * | 1986-09-09 | 1988-08-08 | Nippon Tokushu Noyaku Seizo Kk | 新規n−ベンゾチアゾリル−アミド類及び殺虫剤 |
| JPS63270608A (ja) * | 1986-12-10 | 1988-11-08 | Sumitomo Chem Co Ltd | 種子消毒剤 |
| IL90337A0 (en) * | 1988-05-24 | 1989-12-15 | Pfizer | Aromatic and heterocyclic carboxamide derivatives as antineoplastic agents |
| ATE173466T1 (de) * | 1993-08-24 | 1998-12-15 | Medivir Ab | Verbindungen und methoden zur inhibition von hiv und verwandten viren |
| WO1998011073A1 (en) * | 1996-09-10 | 1998-03-19 | Pharmacia & Upjohn Company | 8-hydroxy-7-substituted quinolines as anti-viral agents |
| CN1623984A (zh) * | 1999-12-27 | 2005-06-08 | 日本烟草产业株式会社 | 稠环化合物及其药物用途 |
| CA2398754A1 (en) | 2000-02-07 | 2001-08-09 | Abbott Gmbh & Co. Kg | 2-benzothiazolyl urea derivatives and their use as protein kinase inhibitors |
| US7122544B2 (en) * | 2000-12-06 | 2006-10-17 | Signal Pharmaceuticals, Llc | Anilinopyrimidine derivatives as IKK inhibitors and compositions and methods related thereto |
| JP4038665B2 (ja) * | 2002-06-19 | 2008-01-30 | 株式会社大塚製薬工場 | ホスホン酸ジエステル誘導体 |
| WO2004078115A2 (en) | 2003-02-28 | 2004-09-16 | Viropharma, Incorporated | Benzothiazole compounds, compositions and methods for treatment and prophylaxis of rotavirus infections and associated diseases |
| EP1608369B1 (en) * | 2003-03-28 | 2013-06-26 | Novartis Vaccines and Diagnostics, Inc. | Use of organic compounds for immunopotentiation |
| US20050130974A1 (en) * | 2003-10-17 | 2005-06-16 | Rigel Pharmaceuticals, Inc. | Benzothiazole compositions and their use as ubiquitin ligase inhibitors |
| GB0421908D0 (en) * | 2004-10-01 | 2004-11-03 | Angeletti P Ist Richerche Bio | New uses |
| CN101247807A (zh) * | 2005-05-09 | 2008-08-20 | 艾其林医药公司 | 噻唑化合物及使用方法 |
| EP1945208A4 (en) * | 2005-10-06 | 2011-08-03 | Univ Massachusetts | COMPOSITION AND SYNTHESIS OF NEW REAGENTS TO INHIBIT HIV REPLICATION |
| CN101331116A (zh) * | 2005-12-12 | 2008-12-24 | 健亚生物科技公司 | N-(6-元芳香环)酰胺基抗病毒化合物 |
| MX2008011696A (es) * | 2006-03-15 | 2008-11-12 | 4Sc Ag | Inhibidores de nf-kb heterociclicos novedosos. |
| CN101528744A (zh) * | 2006-10-20 | 2009-09-09 | Irm责任有限公司 | 用于调节c-kit和pdgfr受体的组合物和方法 |
| WO2008141385A1 (en) * | 2007-05-21 | 2008-11-27 | Biota Scientific Management Pty Ltd | Viral polymerase inhibitors |
| WO2009019504A1 (en) * | 2007-08-03 | 2009-02-12 | Summit Corporation Plc | Drug combinations for the treatment of duchenne muscular dystrophy |
| UA100527C2 (en) * | 2007-10-10 | 2013-01-10 | Астразенека Аб | Benzothiazoles as ghrelin receptor modulators |
| GB0820856D0 (en) * | 2008-11-14 | 2008-12-24 | Univ Leuven Kath | Novel inhibitors of flavivirus replication |
| BRPI1005828A2 (pt) * | 2009-02-27 | 2017-07-18 | Siga Tech Inc | composição farmacêutica; método para o tratamento ou a profilaxia de uma infecção viral ou doença associada com a mesma; composto; método para a preparação de uma mistura de terc-butil(4e)-4-(hidroximetileno)-5-oxoazepano-1-carboxilato e terc-butil (3e)-3-(hidroximetileno)-4-oxoazepano-1-carboxilato; método para a preparação de uma mistura de terc-butil 3-ciano-2-tioxo-1,2,5,6,8,9-hexaidro-1h-pirido [2,3-d] azepina-7-carboxilato e terc-butil 3-ciano-2-tioxo-1,2,5,7,8,9-hexaidro-6h-pirido [3,2-c] azepina-6-carboxilato; método para a preparação de ácido 3-amino-7-terc-butiloxicarbonil-6,7,8,9-tetraidro-5h-1-tia-7,10-diaza-ciclohepta [f] indeno-2-carboxílico (5-fenil-[1,3,4]tiazol-2-il)-amida; método para a preparação de ácido 3-amino-6,7,8,9-tetraidro-5h-1-tia-7,10-diaza-ciclohepta [f] indeno-2-carboxílico (5-fenil-[1,3,4] tiadiazol-2-il)-amida; método para a preparação de ácido 3-amino-6-tercbutiloxicarbonil-6,7,8,9-tetraidro-5h-1-tia-6,10-diaza-ciclohepta [f] indeno-2-carboxílico (5-fenil-[1,3,4] tiadiazol-2-il)-amida e método para a preparação de ácido 3-amino-6,7,8,9-tetraidro-5h-1-tia-6,10-diaza-ciclohepta [f] indeno-2-carboxílico (5-fenil-[1,3,4] tiadiazol-2-il)-amida |
| WO2010100144A1 (en) * | 2009-03-04 | 2010-09-10 | Merck Serono S.A. | Fused bicyclic compounds as inhibitors for pi3 kinase |
| US8338441B2 (en) * | 2009-05-15 | 2012-12-25 | Gilead Sciences, Inc. | Inhibitors of human immunodeficiency virus replication |
| WO2010144909A1 (en) * | 2009-06-12 | 2010-12-16 | Novartis Ag | Fused heterocyclic compounds and their uses |
| CA2763194A1 (en) | 2009-06-30 | 2011-01-06 | Siga Technologies, Inc. | Treatment and prevention of dengue virus infections |
| US8785499B2 (en) * | 2009-07-10 | 2014-07-22 | University Of Maryland, Baltimore | Targeting NAD biosynthesis in bacterial pathogens |
| WO2011022721A1 (en) * | 2009-08-21 | 2011-02-24 | Microbiotix, Inc | Inhibitors of botulinum neurotoxins |
| CN103857683B (zh) | 2011-09-30 | 2016-10-12 | 奇尼塔公司 | 抗病毒化合物 |
-
2012
- 2012-09-27 CN CN201280047516.0A patent/CN103857683B/zh not_active Expired - Fee Related
- 2012-09-27 MX MX2014003887A patent/MX351818B/es active IP Right Grant
- 2012-09-27 SG SG11201401084TA patent/SG11201401084TA/en unknown
- 2012-09-27 AP AP2014007595A patent/AP2014007595A0/xx unknown
- 2012-09-27 US US14/348,516 patent/US9555106B2/en active Active
- 2012-09-27 KR KR1020147011230A patent/KR20140070631A/ko not_active Application Discontinuation
- 2012-09-27 EP EP12836843.8A patent/EP2748172B1/en not_active Not-in-force
- 2012-09-27 JP JP2014533336A patent/JP2014528412A/ja active Pending
- 2012-09-27 BR BR112014007599A patent/BR112014007599A2/pt active Search and Examination
- 2012-09-27 WO PCT/US2012/057646 patent/WO2013049407A2/en active Application Filing
- 2012-09-27 CA CA2859946A patent/CA2859946C/en not_active Expired - Fee Related
- 2012-09-27 AU AU2012315953A patent/AU2012315953A1/en not_active Abandoned
- 2012-09-28 TW TW101136064A patent/TW201326163A/zh unknown
-
2014
- 2014-03-13 ZA ZA2014/01825A patent/ZA201401825B/en unknown
- 2014-03-27 IL IL231780A patent/IL231780A/en active IP Right Grant
- 2014-12-12 HK HK14112536.0A patent/HK1199029A1/zh not_active IP Right Cessation
-
2017
- 2017-01-30 US US15/419,784 patent/US9956285B2/en not_active Expired - Fee Related
- 2017-06-13 JP JP2017116041A patent/JP2017222656A/ja active Pending
- 2017-07-31 AU AU2017210483A patent/AU2017210483A1/en not_active Abandoned
- 2017-10-30 AU AU2017254812A patent/AU2017254812B2/en not_active Ceased
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN87107330A (zh) * | 1986-12-10 | 1988-06-22 | 住友化学工业株式会社 | 种子消毒组合物 |
| JP2001206891A (ja) * | 2000-01-26 | 2001-07-31 | Otsuka Pharmaceut Factory Inc | ホスホン酸ジエステル誘導体 |
| WO2001070705A1 (en) * | 2000-03-17 | 2001-09-27 | Alcon, Inc. | 2-acylaminobenzimidazole derivatives for treating glaucoma |
| CN101031567A (zh) * | 2004-09-20 | 2007-09-05 | 4Sc股份有限公司 | 新型杂环NF-κB抑制剂 |
| US20100267717A1 (en) * | 2005-07-29 | 2010-10-21 | 4Sc Ag | Novel Heterocyclic NF-kB Inhibitors |
| WO2010008847A2 (en) * | 2008-06-24 | 2010-01-21 | Takeda Pharmaceutical Company Limited | Pi3k/m tor inhibitors |
| WO2010024903A1 (en) * | 2008-08-29 | 2010-03-04 | Yangbo Feng | BENZO[d]OXAZOLES AND BENZO[d]THIAZOLES AS KINASE INHIBITORS |
| WO2010071783A1 (en) * | 2008-12-16 | 2010-06-24 | Abbott Laboratories | Thiazoles as cannabinoid receptor ligands |
Non-Patent Citations (5)
| Title |
|---|
| CA: "CAS-RN: 361482-08-8", 《STN-REGISTRY数据库》, vol. 15192838, 11 October 2001 (2001-10-11) * |
| DHAIRYA BHAVSAR,等: "Synthesis and in vitro anti-HIV activity of N-1,3-benzo[d]thiazol-2-yl-2- (2-oxo-2H-chromen-4-yl)acetamide derivatives using MTT method", 《BIOORGANIC & MEDICINAL CHEMISTRY LETTERS》, vol. 21, no. 11, 5 April 2011 (2011-04-05) * |
| PUBCHEM: "CID: 3244649", 《PUBCHEMCOMPOUND》, 16 August 2005 (2005-08-16) * |
| PUBCHEM: "CID: 4137760", 《PUBCHEMCOMPOUND》, 13 September 2005 (2005-09-13) * |
| PUBCHEM: "CID: 4646016", 《PUBCHEMCOMPOUND》, 16 September 2008 (2008-09-16) * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013049407A2 (en) | 2013-04-04 |
| IL231780A (en) | 2017-08-31 |
| WO2013049407A3 (en) | 2013-05-30 |
| AP2014007595A0 (en) | 2014-04-30 |
| MX2014003887A (es) | 2014-11-21 |
| CA2859946A1 (en) | 2013-04-04 |
| US20170258897A1 (en) | 2017-09-14 |
| JP2017222656A (ja) | 2017-12-21 |
| TW201326163A (zh) | 2013-07-01 |
| BR112014007599A2 (pt) | 2017-04-11 |
| EP2748172A4 (en) | 2015-10-14 |
| EP2748172A2 (en) | 2014-07-02 |
| JP2014528412A (ja) | 2014-10-27 |
| NZ622636A (en) | 2016-07-29 |
| CA2859946C (en) | 2019-11-05 |
| AU2017254812A1 (en) | 2017-11-16 |
| AU2017254812B2 (en) | 2018-07-19 |
| EP2748172B1 (en) | 2017-12-06 |
| HK1199029A1 (zh) | 2015-06-19 |
| US20140227320A1 (en) | 2014-08-14 |
| MX351818B (es) | 2017-10-30 |
| SG11201401084TA (en) | 2014-04-28 |
| CN103857683B (zh) | 2016-10-12 |
| KR20140070631A (ko) | 2014-06-10 |
| IL231780A0 (en) | 2014-05-28 |
| AU2017210483A1 (en) | 2017-08-17 |
| ZA201401825B (en) | 2017-08-30 |
| US9555106B2 (en) | 2017-01-31 |
| US9956285B2 (en) | 2018-05-01 |
| AU2012315953A1 (en) | 2014-04-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103842364A (zh) | 抗病毒化合物 | |
| CN103857683A (zh) | 抗病毒化合物 | |
| US20200270274A1 (en) | Anti-viral compounds, pharmaceutical compositions, and methods of use thereof | |
| CN102939088A (zh) | 抗病毒化合物 | |
| CN105377253A (zh) | 抗病毒化合物、医药组合物和其使用方法 | |
| JP2013527159A (ja) | 抗ウイルス性化合物 | |
| TW201141853A (en) | Anti-viral compounds | |
| TW201625573A (zh) | 色烯酮(chromenone)抗病毒化合物、醫藥組合物及其使用方法 | |
| CN103491965A (zh) | 识别rig-i通路调节因子的方法和细胞 | |
| CN104918618A (zh) | 抗病毒化合物 | |
| TW201204351A (en) | Anti-viral compounds | |
| TW201202231A (en) | Anti-viral compounds | |
| TW201204344A (en) | Anti-viral compounds |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20161012 Termination date: 20210927 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |