CN101848935A - 选择蛋白酶抗性多肽的方法 - Google Patents
选择蛋白酶抗性多肽的方法 Download PDFInfo
- Publication number
- CN101848935A CN101848935A CN200880102138A CN200880102138A CN101848935A CN 101848935 A CN101848935 A CN 101848935A CN 200880102138 A CN200880102138 A CN 200880102138A CN 200880102138 A CN200880102138 A CN 200880102138A CN 101848935 A CN101848935 A CN 101848935A
- Authority
- CN
- China
- Prior art keywords
- polypeptide
- peptide
- proteolytic enzyme
- dom
- variable domains
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0078—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a nebulizer such as a jet nebulizer, ultrasonic nebulizer, e.g. in the form of aqueous drug solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
- A61K9/1623—Sugars or sugar alcohols, e.g. lactose; Derivatives thereof; Homeopathic globules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M11/00—Sprayers or atomisers specially adapted for therapeutic purposes
- A61M11/005—Sprayers or atomisers specially adapted for therapeutic purposes using ultrasonics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/08—Inhaling devices inserted into the nose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M16/00—Devices for influencing the respiratory system of patients by gas treatment, e.g. mouth-to-mouth respiration; Tracheal tubes
- A61M16/10—Preparation of respiratory gases or vapours
- A61M16/14—Preparation of respiratory gases or vapours by mixing different fluids, one of them being in a liquid phase
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/005—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies constructed by phage libraries
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/543—Mucosal route intranasal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/544—Mucosal route to the airways
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pulmonology (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Otolaryngology (AREA)
- Anesthesiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Virology (AREA)
- Dispersion Chemistry (AREA)
- Rheumatology (AREA)
- Microbiology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Mycology (AREA)
- Oncology (AREA)
- Transplantation (AREA)
- Neurosurgery (AREA)
- Ophthalmology & Optometry (AREA)
- Pain & Pain Management (AREA)
Abstract
本发明涉及从肽和多肽的文库或集(例如,展示系统)中选择、分离和/或回收对蛋白酶的降解有抗性的肽或多肽的方法,所述蛋白酶例如在人类的GI道或肺部组织中存在的蛋白酶。通常,该方法包括提供肽或多肽的文库或集,在适于蛋白酶活性的条件下将文库或集与蛋白酶组合,并选择、分离和/或回收对蛋白酶降解有抗性的并具有期望的生物活性的肽或多肽。所选择的肽和多肽具有作为治疗剂的实用性,例如,用于治疗人类GI道或肺部组织的疾病或状况。
Description
发明背景
多肽和肽在许多应用中成为越来越重要的试剂,包括工业应用和作为医学、治疗和诊断试剂的用途。然而,在某些生理状态例如炎症性状态(例如,COPD)和癌症中,组织、器官或动物(例如,在肺部、肿瘤内或邻近于肿瘤)中存在的蛋白酶的数量可能增加。这种蛋白酶的增加会导致内源蛋白质以及被施用来治疗疾病的治疗肽、多肽和蛋白质加速的降解和失活。因此,对体内使用(例如,用于在哺乳动物例如人类中治疗、诊断或预防疾病)具有潜力的某些药剂仅仅具有有限的功效,因为它们被蛋白酶快速降解和灭活。
蛋白酶抗性多肽提供了几种优点。例如,蛋白酶抗性多肽在体内能比蛋白酶敏感性试剂保持更长时间的活性,因此,能将功能保持足以产生生物效应的时间段。对于选择对蛋白酶降解有抗性并且还具有期望的生物活性的多肽的改进方法存在着需求。它对于提供对胃肠道(GI道)和/或肺系统的流体和组织中存在的蛋白酶有抗性的肽和多肽将是特别有用的,所述系统包括肺。GI道和肺系统是哺乳动物例如人类中疾病和不利状况的部位;在这种情境下蛋白酶抗性肽和多肽药物将是有益的。
发明概述
本发明涉及选择蛋白酶抗性肽或多肽的方法,以及选择以高亲和力结合目标配体的肽或多肽的方法。本发明进一步涉及产生蛋白酶抗性肽或多肽的集(repertoire)的方法。
在一个方面,本发明是选择蛋白酶抗性肽或多肽的方法。所述方法包括提供肽或多肽的集、在适合蛋白酶活性的条件下组合所述集和蛋白酶、以及回收具有期望的生物学活性的肽或多肽,从而选择蛋白酶抗性肽或多肽。在一个实施方式中,所述蛋白酶在溶液中与所述集组合(即,蛋白酶不固定在支持物上)。在一个实施方式中,所述期望的生物学活性是结合活性,例如,对配体,如目标配体或通用配体(generic ligand)的结合活性。
在一个方面,本发明提供了从肽或多肽的集中选择蛋白酶抗性肽或多肽的方法,包括
提供肽或多肽的集;
在适合蛋白酶活性的条件下组合所述集和蛋白酶;以及
回收具有期望的生物学活性的肽或多肽,从而选择蛋白酶抗性肽或多肽,
其中所述蛋白酶选自在痰、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管肺泡灌洗液、肺匀浆、肺提取物、胰提取物、胃液、唾液或泪液中存在的蛋白酶,以及
所述期望的生物学活性是结合活性。
因而,所述蛋白酶存在于痰、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管肺泡灌洗液、肺匀浆、肺提取物、胰提取物、胃液、唾液或泪液的一种或更多种中。在一个实施方式中,所述蛋白酶是在眼和/或泪液中存在的蛋白酶。如以上讨论的,选择的蛋白酶抗性肽或多肽在哺乳动物例如人类中疾病或状况的治疗、预防和诊断中是有用的。特别地,所述肽和多肽作为在施用给患者例如人类时可能遭遇蛋白酶的药物的基础是有用的。例如,当施用给GI道(例如,口服、舌下给药、直肠施用)时,在这种情况下,肽或多肽可能经受上部GI道、下部GI道、口腔、胃部、小肠和大肠的一种或更多种中的蛋白酶。因而,一个实施方式提供了将要口服、舌下或直肠地施用到患者的GI道来治疗和/或预防所述患者中的疾病或状况的蛋白酶抗性肽或多肽。例如,通过本发明的方法选择或可选择的TNFα拮抗剂肽或多肽的口服施用,用于治疗和/或预防TNF α介导的状况或疾病,例如关节炎(例如,类风湿性关节炎)、IBD、银屑病或Crohn’s病。在这个实施方式中,所述拮抗剂可以是抗-TNFR1免疫球蛋白单可变结构域(dAb)。在另一个实例中,当施用(例如,通过吸入或鼻内地)到肺部组织(例如,肺或气道)中时,所述肽或多肽可能遭遇蛋白酶。因而,一个实施方式提供了将要通过吸入或鼻内地施用到患者的肺部组织来治疗和/或预防所述患者中的疾病或状况的蛋白酶抗性肽或多肽。这样的状况可以是哮喘(例如,过敏性哮喘)、COPD、流感或在WO2006038027中公开的任何其他肺部疾病或状况,通过引用合并在此。根据本发明的肽和多肽可以显示改善的或相对高的解链温度(Tm),提供提高的稳定性。高亲和力目标结合也可以是所述肽和多肽的特征。这些特征,与蛋白酶抗性组合,使得所述肽和多肽能够用作哺乳动物例如人类中的药物,其中例如对于GI道或肺部组织施用可能遭遇到蛋白酶。
在另一个实例中,所述肽或多肽(例如,可变结构域或拮抗剂)当施用给患者的眼睛时(通过眼内注射或作为滴眼剂)可能遭遇蛋白酶。因而,一个实施方式提供了蛋白酶抗性肽、多肽、免疫球蛋白单可变结构域或拮抗剂向患者(例如,向人类)的眼施用,来治疗和/或预防所述患者中的疾病或状况(例如,眼的疾病或状况)。施用可以是以滴眼剂的形式,或通过注射到眼中,例如,注射到玻璃体液中向眼的局部施用。
在一个实施方式中,本发明提供了用于递送到肺部的肺部制剂,其中所述制剂包含本发明的拮抗剂、肽、多肽或可变结构域,其颗粒大小范围低于5微米,例如低于4.5、4、3.5或3微米(例如,当在Britton-Robinson缓冲液中时,例如在6.5到8.0的pH值下,例如在7到7.5的pH值下,例如在pH 7下或在pH 7.5下)。
在一个实施方式中,本发明的制剂和组合物以6.5到8.0,例如7到7.5,例如7,例如7.5的pH值来提供。
根据本发明的任何方面的肽或多肽(例如,可变结构域)可以具有至少50℃、或至少55℃、或至少60℃、或至少65℃、或至少70℃的Tm。本发明的拮抗剂、用途、方法、组合物、设备或制剂可以包含这样的肽或多肽。
在本发明的一个方面中,本发明的肽、多肽、可变结构域、拮抗剂、组合物或制剂在Britton-Robinson缓冲液中在37至50℃下孵育14天后(在1mg/ml的多肽或可变结构域浓度下)基本上是稳定的。在一个实施方式中,在37℃下这样的孵育后,至少65、70、75、80、85、86、87、88、90、91、92、93、94、95、96、97、98、99%的肽、多肽、拮抗剂或可变结构域保持未聚集。在一个实施方式中,在37℃下这样的孵育后,至少65、70、75、80、85、86、87、88、90、91、92、93、94、95、96、97、98、99%的肽、多肽或可变结构域保持单体。在一个实施方式中,在50℃下这样的孵育后,至少5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、86、87、88、90、91、92、93、94、95、96、97、98、99%的肽、多肽、拮抗剂或可变结构域保持未聚集。在一个实施方式中,在50℃下这样的孵育后,至少5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、86、87、88、90、91、92、93、94、95、96、97、98、99%的肽、多肽或可变结构域保持单体。在一个实施方式中,在任一个这样的孵育后,未看到肽、多肽、可变结构域、拮抗剂的聚集。在一个实施方式中,在37℃下在Britton-Robinson缓冲液中以1mg/ml的多肽或可变结构域浓度孵育后,所述肽、多肽或可变结构域的pI保持不变或基本上不变。
在本发明的一个方面中,本发明的肽、多肽、可变结构域、拮抗剂、组合物或制剂在Britton-Robinson缓冲液中在7至7.5的pH(例如,在pH7或pH7.5)在4℃下孵育7天后(在100mg/ml的多肽或可变结构域浓度下)基本上是稳定的。在一个实施方式中,在这样的孵育后,至少95、95.5、96、96.5、97、97.5、98、98.5、99或99.5%的肽、多肽、拮抗剂或可变结构域保持未聚集。在一个实施方式中,在这样的孵育后,至少95、95.5、96、96.5、97、97.5、98、98.5、99或99.5%的肽、多肽或可变结构域保持单体。在一个实施方式中,在任一个这样的孵育后,未看到肽、多肽、可变结构域、拮抗剂的聚集。
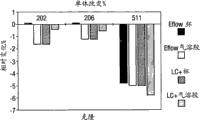
在本发明的一个方面中,本发明的肽、多肽、可变结构域、拮抗剂、组合物或制剂在例如喷射喷雾器,例如在Pari LC+杯中,例如,在室温、20℃或37℃下喷雾1小时后(在40mg/ml的多肽或可变结构域浓度下)基本上是稳定的。在一个实施方式中,在这样的喷雾后,至少65、70、75、80、85、86、87、88、90、91、92、93、94、95、95.5、96、96.5、97、97.5、98、98.5、99或99.5%的肽、多肽、拮抗剂或可变结构域保持未聚集。在一个实施方式中,在这样的喷雾后,至少65、70、75、80、85、86、87、88、90、91、92、93、94、95、95.5、96、96.5、97、97.5、98、98.5、99或99.5%的肽、多肽或可变结构域保持单体。在一个实施方式中,在任一个这样的喷雾后,未看到肽、多肽、可变结构域、拮抗剂的聚集。
所述肽或多肽可以是分离的和/或重组的。
在另一个方面,本发明提供了从肽或多肽的集中选择蛋白酶抗性肽或多肽的方法,包括
提供肽或多肽的集;
在适合蛋白酶活性的条件下组合所述集和蛋白酶;以及
回收具有期望的生物学活性的肽或多肽,从而选择蛋白酶抗性肽或多肽。
其中所述期望的生物学活性是结合活性,例如,对目标配体或通用配体的结合活性。
在一个实施方式中,在本发明的方法中,所述蛋白酶是非细菌的蛋白酶。在一个实施方式中,所述蛋白酶是动物,例如,哺乳动物,例如人类的蛋白酶。在一个实施方式中,所述蛋白酶是GI道蛋白酶,或肺部组织蛋白酶,例如,在人类中存在的GI道蛋白酶或肺部组织蛋白酶。
在一个方面,本发明提供了从肽或多肽的集中选择蛋白酶抗性肽或多肽的方法,包括
提供肽或多肽的集;
在适合蛋白酶活性的条件下组合所述集和蛋白酶;以及
回收具有期望的生物学活性的肽或多肽,从而选择蛋白酶抗性肽或多肽,
其中所述条件是(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃,和(iii)至少约30分钟。在一个实施方式中,这些严格的条件允许选择具有高亲和力和/或改善的Tm的肽或多肽。在这样的情况下,所述肽和多肽可以以单体形式显示高亲和力。
在一个实施方式中,在本发明的方法中,对于适合于蛋白酶活性的所述条件,使用约10到约100μg/ml蛋白酶。对于适合于蛋白酶活性的所述条件,可以使用约30到约37℃的温度(例如,在约37℃下,或在约室温下)。在一个实施方式中,所述集和蛋白酶可以组合至少约一小时(例如,约1小时,约两小时或过夜)。在本发明的方法中,在一个实施方式中,所述集和所述蛋白酶孵育至少约30分钟的时间。在一个实施方式中,所述蛋白酶在约100μg/ml下使用,所述组合的集和蛋白酶在约37℃下孵育至少约小时。
在一个实施方式中,蛋白酶例如胰蛋白酶与可变结构域的比例(在摩尔/摩尔的基础上)是8,000至80,000蛋白酶:可变结构域,例如当C是10微克/ml时,所述比例是800至80,000蛋白酶:可变结构域;或当C或C′是100微克/ml时,所述比例是8,000至80,000蛋白酶:可变结构域。在一个实施方式中,蛋白酶(例如,胰蛋白酶)与可变结构域的比例(在重量/重量,例如,微克/微克的基础上)是16,000至160,000蛋白酶:可变结构域,例如当C是10微克/ml时,所述比例是1,600至160,000蛋白酶:可变结构域;或当C或C′是100微克/ml时,所述比例是1,6000至160,000蛋白酶:可变结构域。在一个实施方式中,所述蛋白酶在至少100或1000微克/ml蛋白酶的浓度下使用。
在所述方法中可以使用任何期望的蛋白酶,如以下的一种或更多种,丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、巯基蛋白酶、基质金属蛋白酶、羧肽酶(例如,羧肽酶A、羧肽酶B)、胰蛋白酶、胰凝乳蛋白酶(chymotrypsin)、胃蛋白酶、木瓜蛋白酶、弹性蛋白酶、leucozyme、胰酶、凝血酶、纤维蛋白溶酶、组织蛋白酶(例如,组织蛋白酶G)、蛋白水解酶(proteinase)(例如,蛋白水解酶1、蛋白水解酶2、蛋白水解酶3)、嗜热菌蛋白酶、凝乳酶、肠肽酶、胱天蛋白酶(例如,胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶9、胱天蛋白酶12、胱天蛋白酶13)、钙激活中性蛋白酶、无花果蛋白酶(ficain)、梭菌蛋白酶、actinidain、菠萝蛋白酶和separase。在特定的实施方式中,所述蛋白酶是胰蛋白酶、弹性蛋白酶或leucozyme。还可以通过生物提取物、生物匀浆或生物制剂例如体外的完整细胞来提供蛋白酶。如果需要,所述方法进一步包括在完成孵育后将蛋白酶抑制剂加入所述集和蛋白酶的组合中。
在本发明的方法的一个实施方式中,当与所述集组合时,所述蛋白酶处在溶液中。
在一些实施方式中,基于结合活性回收具有期望的生物活性的肽或多肽。例如,可以基于结合通用配体(如蛋白A、蛋白G或蛋白L)来回收肽或多肽。结合活性还可以是对目标配体的特异性结合。示例性目标配体包括ApoE、Apo-SAA、BDNF、心肌营养蛋白-1、CEA、CD40、CD40配体、CD56、CD38、CD 138、EGF、EGF受体、ENA-78、嗜酸细胞活化趋化因子(Eotaxin)、嗜酸细胞活化趋化因子-2、Exodus-2、FAPα、FGF-酸性、FGF-碱性、成纤维细胞生长因子-10、FLT3配体、CXXXC趋化因子(Fractalkine)(CX3C)、GDNF、G-CSF、GM-CSF、GF-β1、人血清白蛋白、胰岛素、IFN-γ、IGF-I、IGF-II、IL-1α、IL-1β、IL-1受体、IL-1I型受体、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8(72a.a.)、IL-8(77a.a.)、IL-9、IL-10、IL-11、IL-12、IL-13、IL-15、IL-16、IL-17、IL-18(IGIF)、抑制素α、抑制素β、IP-10、角质形成细胞生长因子-2(KGF-2)、KGF、瘦蛋白、LIF、淋巴细胞趋化因子、缪勒管抑制物质、单核细胞集落抑制因子、单核细胞引诱蛋白、M-CSF、MDC(67a.a.)、MDC(69a.a.)、MCP-1(MCAF)、MCP-2、MCP-3、MCP-4、MDC(67a.a.)、MDC(69a.a.)、MIG、MIP-1α、MIP-1β、MIP-3α、MIP-3β、MIP-4、骨髓祖代抑制因子-1(MPIF-1)、NAP-2、Neurturin、神经生长因子、β-NGF、NT-3、NT-4、制瘤素M、PDGF-AA、PDGF-AB、PDGF-BB、PF-4、RANTES、SDF1α、SDF1β、SCF、SCGF、干细胞因子(SCF)、TARC、TGF-α、TGF-β、TGF-β2、TGF-β3、肿瘤坏死因子(TNF)、TNF-α、TNF-β、TNF受体I、TNF受体II、TNIL-1、TPO、VEGF、VEGF A、VEGF B、VEGF C、VEGF D、VEGF受体1、VEGF受体2、VEGF受体3、GCP-2、GRO/MGSA、GRO-β、GRO-γ、HCC1、1-309、HER 1、HER 2、HER 3、HER 4、血清白蛋白、vWF、淀粉样蛋白(例如,淀粉样蛋白α)、MMP12、PDK1、IgE、IL-13Rα1、IL-13Ra2、IL-15、IL-15R、IL-16、IL-17R、IL-17、IL-18、IL-18R、IL-23IL-23R、IL-25、CD2、CD4、CD11a、CD23、CD25、CD27、CD28、CD30、CD40、CD40L、CD56、CD138、ALK5、EGFR、FcER1、TGFb、CCL2、CCL18、CEA、CR8、CTGF、CXCL12(SDF-1)、糜蛋白酶(chymase)、FGF、弗林蛋白酶、内皮缩血管肽-1、嗜酸细胞活化趋化因子(例如,嗜酸细胞活化趋化因子、嗜酸细胞活化趋化因子-2、嗜酸细胞活化趋化因子-3)、GM-CSF、ICAM-1、ICOS、IgE、IFNa、I-309、整联蛋白、L-选择蛋白、MIF、MIP4、MDC、MCP-1、MMP、嗜中性白细胞弹性蛋白酶、骨桥蛋白、OX-40、PARC、PD-1、RANTES、SCF、SDF-1、siglec8、TARC、TGFb、凝血酶、Tim-1、TNF、TRANCE、类胰蛋白酶、VEGF、VLA-4、VCAM、α4β7、CCR2、CCR3、CCR4、CCR5、CCR7、CCR8、alphavbeta6、alphavbeta8、cMET、CD8、vWF、淀粉样蛋白(例如,淀粉样蛋白α)、MMP12、PDK1和IgE。
在特定的实施方式中,通过淘选来回收肽或多肽。
在本发明的方法的一个实施方式中,当在存在蛋白酶时所述集被暴露于配体(目标配体;通用配体),并根据对所述配体的结合来选择所述集的一个或更多个成员。
在一些实施方式中,所述集包括展示系统。例如,展示系统可以是细菌噬菌体(bacteriophage)展示、核糖体展示、乳液区室化(emulsioncompartmentalization)和展示、酵母展示、嘌呤霉素展示、细菌展示、在质粒上展示或共价展示。优选的展示系统与核酸的编码功能和由核酸编码的肽或多肽的功能性特征相关。在特定的实施方式中,展示系统含有可复制的遗传包(genetic package)。
在一些实施方式中,展示系统包括细菌噬菌体展示。例如,细菌噬菌体可以是fd、M13、λ、MS2或T7。在特定的实施方式中,细菌噬菌体展示系统是多价的。在一些实施方式中,作为pIII融合蛋白来展示肽或多肽。
在一个实施方式中,当与所述蛋白酶孵育时,所述肽或多肽(例如,可变结构域)的集在细菌噬菌体上展示,例如,以106到1013,例如108到1012复制单位(感染性病毒颗粒)的噬菌体(phage)库大小。
在其他实施方式中,所述方法进一步包括扩增编码具有期望的生物活性的肽或多肽的核酸。在特定的实施方式中,通过噬菌体扩增、细胞生长或聚合酶链式反应来扩增核酸。
在一些实施方式中,所述集是免疫球蛋白单可变结构域的集。在特定的实施方式中,免疫球蛋白单可变结构域是重链可变结构域。在更特定的实施方式中,重链可变结构域是人重链可变结构域。在其他实施方式中,免疫球蛋白单可变结构域是轻链可变结构域。在特定的实施方式中,轻链可变结构域是人轻链可变结构域。
在另一个方面中,本发明是从肽或多肽的集中选择以高亲和性结合目标配体的肽或多肽的方法。该方法包括提供肽或多肽的集,在适于蛋白酶活性的条件下组合所述集和蛋白酶并回收结合目标配体的肽或多肽。
通常将集和蛋白酶孵育至少约30分钟的时间段。在该方法中可以使用任何期望的蛋白酶,如以下的一种或更多种,丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、巯基蛋白酶、基质金属蛋白酶、羧肽酶(例如,羧肽酶A、羧肽酶B)、胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶、木瓜蛋白酶、弹性蛋白酶、leucozyme、胰酶、凝血酶、纤维蛋白溶酶、组织蛋白酶(例如,组织蛋白酶G)、蛋白水解酶(例如,蛋白水解酶1、蛋白水解酶2、蛋白水解酶3)、嗜热菌蛋白酶、凝乳酶、肠肽酶、胱天蛋白酶(例如,胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶9、胱天蛋白酶12、胱天蛋白酶13)、钙激活中性蛋白酶、无花果蛋白酶(ficain)、梭菌蛋白酶、actinidain、菠萝蛋白酶和separase。在特定的实施方式中,蛋白酶是胰蛋白酶、弹性蛋白酶或leucozyme。还可以通过生物提取物、生物匀浆或生物制剂来提供蛋白酶。如果需要,该方法进一步包括在完成孵育后将蛋白酶抑制剂加入集和蛋白酶的组合中。
可以基于结合任何期望的目标配体如在此公开的目标配体来回收肽或多肽。在特定的实施方式中,通过淘选来回收肽或多肽。
根据本发明的上述方法,当所述期望的生物学活性是结合活性时,所结合的配体(目标配体;通用配体)与所述蛋白酶不是相同的。
在一些实施方式中,所述集包括展示系统。例如,展示系统可以是细菌噬菌体展示、核糖体展示、乳液区室化(emulsioncompartmentalization)和展示、酵母展示、嘌呤霉素展示、细菌展示、在质粒上展示或共价展示。优选的展示系统与核酸的编码功能和由核酸编码的肽或多肽的功能性特征相关。在特定的实施方式中,展示系统含有可复制的遗传包。
在一些实施方式中,展示系统包括细菌噬菌体展示。例如,细菌噬菌体可以是fd、M13、λ、MS2或T7。在特定的实施方式中,细菌噬菌体展示系统是多价的。在一些实施方式中,作为pIII融合蛋白来展示肽或多肽。
在其他实施方式中,该方法进一步包括扩增编码具有期望的生物活性的肽或多肽的核酸。在特定的实施方式中,通过噬菌体扩增、细胞生长或聚合酶链式反应来扩增核酸。
在一些实施方式中,所述集是免疫球蛋白单可变结构域的集。在特定的实施方式中,免疫球蛋白单可变结构域是重链可变结构域。在更特定的实施方式中,重链可变结构域是人重链可变结构域。在其他实施方式中,免疫球蛋白单可变结构域是轻链可变结构域。在特定的实施方式中,轻链可变结构域是人轻链可变结构域。
在另一个方面中,本发明是生产蛋白酶抗性肽或多肽的集的方法。该方法包括提供肽或多肽的集,在适于蛋白酶活性的条件下组合肽或多肽的集和蛋白酶,并回收复数种具有期望的生物活性的肽或多肽,由此产生蛋白酶抗性肽或多肽的集。
在一些实施方式中,将所述集和蛋白酶孵育至少约30分钟的时间段。例如,在该方法中所用的蛋白酶可以是以下的一种或更多种,丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、巯基蛋白酶、基质金属蛋白酶、羧肽酶(例如,羧肽酶A、羧肽酶B)、胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶、木瓜蛋白酶、弹性蛋白酶、leucozyme、胰酶、凝血酶、纤维蛋白溶酶、组织蛋白酶(例如,组织蛋白酶G)、蛋白水解酶(例如,蛋白水解酶1、蛋白水解酶2、蛋白水解酶3)、嗜热菌蛋白酶、凝乳酶、肠肽酶、胱天蛋白酶(例如,胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶9、胱天蛋白酶12、胱天蛋白酶13)、钙激活中性蛋白酶、无花果蛋白酶(ficain)、梭菌蛋白酶、actinidain、菠萝蛋白酶和separase。在特定的实施方式中,蛋白酶是胰蛋白酶、弹性蛋白酶或leucozyme。还可以通过生物提取物、生物匀浆或生物制剂来提供蛋白酶。如果需要,该方法进一步包括在完成孵育后将蛋白酶抑制剂加入所述集和蛋白酶的组合中。
在一些实施方式中,基于结合活性回收复数种具有期望的生物活性的肽或多肽。例如,可以基于结合通用配体(如蛋白A、蛋白G或蛋白L)来回收复数种肽或多肽。结合活性还可以是对目标配体,如本文所述的目标配体的特异性结合。在特定的实施方式中,通过淘选回收复数种具有期望的生物活性的肽或多肽。
在一些实施方式中,集包括展示系统。例如,展示系统可以是细菌噬菌体展示、核糖体展示、乳液区室化(emulsion compartmentalization)和展示、酵母展示、嘌呤霉素展示、细菌展示、在质粒上展示或共价展示。在特定的实施方式中,展示系统与核酸的编码功能和由核酸编码的肽或多肽的功能性特征相关。在特定的实施方式中,展示系统含有可复制的遗传包。
在一些实施方式中,展示系统包括细菌噬菌体展示。例如,细菌噬菌体可以是fd、M13、λ、MS2或T7。在特定的实施方式中,细菌噬菌体展示系统是多价的。在一些实施方式中,作为pIII融合蛋白来展示肽或多肽。
在其他实施方式中,该方法进一步包括扩增编码复数种具有期望的生物活性的肽或多肽的核酸。在特定的实施方式中,通过噬菌体扩增、细胞生长或聚合酶链式反应来扩增核酸。
在一些实施方式中,所述集是免疫球蛋白单可变结构域的集。在特定的实施方式中,免疫球蛋白单可变结构域是重链可变结构域。在更特定的实施方式中,重链可变结构域是人重链可变结构域。在其他实施方式中,免疫球蛋白单可变结构域是轻链可变结构域。在特定的实施方式中,轻链可变结构域是人轻链可变结构域。
在另一个方面中,本发明是从集中选择蛋白酶抗性多肽的方法,该多肽包括结合目标配体的免疫球蛋白单可变结构域(dAb)。在一个实施方式中,该方法包括提供含有多肽集的噬菌体展示系统,该多肽含有免疫球蛋白单可变结构域,在适于蛋白酶活性的条件下,将噬菌体展示系统和选自弹性蛋白酶、leucozyme和胰蛋白酶的蛋白酶组合,并回收展示了含有结合目标配体的免疫球蛋白单可变结构域的多肽的噬菌体。
在一些实施方式中,以100μg/ml来使用蛋白酶,并将组合的噬菌体展示系统和蛋白酶在约37℃下孵育过夜。
在一些实施方式中,通过结合所述目标来回收展示了含有结合目标配体的免疫球蛋白单可变结构域的多肽的噬菌体。在其他实施方式中,通过淘选来回收展示了含有结合目标配体的免疫球蛋白单可变结构域的多肽的噬菌体。
本发明还涉及通过本文所述的方法可选择的或选择的分离的蛋白酶抗性肽或多肽。在特定的实施方式中,本发明涉及通过本文所述的方法可选择的或选择的分离的蛋白酶(例如,胰蛋白酶、弹性蛋白酶、leucozyme)抗性免疫球蛋白单可变结构域(例如,人抗体重链可变结构域,人抗体轻链可变结构域)。
本发明还涉及编码通过本文所述的方法可选择的或选择的蛋白酶抗性肽或多肽(例如,胰蛋白酶-、弹性蛋白酶-或leucozyme-抗性免疫球蛋白单可变结构域)的分离的或重组的核酸,以及含有该核酸的载体(例如,表达载体)和宿主细胞。
本发明还涉及制备通过本文所述的方法可选择的或选择的蛋白酶抗性肽或多肽(例如,胰蛋白酶-、弹性蛋白酶-或leucozyme-抗性免疫球蛋白单可变结构域)的方法,包括将含有编码蛋白酶抗性肽或多肽的重组核酸的宿主细胞维持在适于表达的条件下,由此产生蛋白酶抗性肽或多肽。
本发明还涉及用于药物中(例如,用于治疗或诊断)的通过本文所述的方法可选择的或选择的蛋白酶抗性肽或多肽(例如,胰蛋白酶-、弹性蛋白酶-或leucozyme-抗性免疫球蛋白单可变结构域)。本发明还涉及通过本文所述的方法可选择的或选择的蛋白酶抗性肽或多肽(例如,胰蛋白酶-、弹性蛋白酶-或leucozyme-抗性免疫球蛋白单可变结构域)用于制造治疗疾病的药物的用途。本发明还涉及治疗疾病的方法,包括将有效量的通过本文所述的方法可选择的或选择的蛋白酶抗性肽或多肽(例如,胰蛋白酶-、弹性蛋白酶-或leucozyme-抗性免疫球蛋白单可变结构域)给药于需要其的患者。
在本发明的方法的一个实施方式中,所述方法进一步包括在适合于第二蛋白酶的活性的条件下组合第二蛋白酶和蛋白酶抗性肽或多肽的集;以及
回收具有期望的生物学活性的至少一种肽或多肽,从而选择对所述第二蛋白酶有抗性的至少一种肽或多肽。所述第一和第二蛋白酶是不同的。所述第二蛋白酶可以是如上文对第一蛋白酶的特定实施方式所定义的。
本发明进一步提供了分离的肺部目标拮抗剂,其包含肽或多肽,例如免疫球蛋白单可变结构域,当在适合于本发明的方法的条件下,例如(1)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少约30分钟,(例如,在100μg/ml蛋白酶在37℃至少一小时的条件下),与蛋白酶孵育时,所述肽或多肽对上文提及的一种或更多种蛋白酶是有抗性的,所述蛋白酶例如选自胰蛋白酶、弹性蛋白酶和leucozyme的一种或更多种蛋白酶,所述分离的肺部目标拮抗剂用于向患者施用来治疗和/或预防肺部疾病或状况。所述拮抗剂可以用于通过吸入或鼻内地向患者施用。
本发明进一步提供了分离的GI道目标拮抗剂,其包含肽或多肽,例如免疫球蛋白单可变结构域,当在适合于本发明的方法的条件下,例如(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少30分钟,(例如,在100μg/ml蛋白酶在37℃至少一小时的条件下),与蛋白酶孵育时,所述肽或多肽对上文提及的一种或更多种蛋白酶是有抗性的,所述蛋白酶例如选自胰蛋白酶、弹性蛋白酶和leucozyme的一种或更多种蛋白酶,所述分离的GI道目标拮抗剂用于向患者施用来治疗和/或预防GI道疾病或状况。
所述拮抗剂可以用于口服,舌下地或直肠地向患者施用。
所述肺部目标或GI道目标拮抗剂可以拮抗TNFα。在一个实施方式中,所述肽、多肽或可变结构域包含TNFR1的结合位点。
在一个实施方式中,所述肺部目标或GI道目标拮抗剂拮抗TNFR1、VEGF或IL-1R1。所述肽、多肽或可变结构域可以分别包含TNFR1、VEGF或IL-1R1的结合位点。
在本发明的方法的一个实施方式中,所述选择的肽或多肽被进一步评估针对第二蛋白酶的抗性,或针对第一蛋白酶、但处在不同于选择方法中使用的一组条件下的抗性。所述第二蛋白酶不同于第一蛋白酶,但可以是如上所述的任何蛋白酶。在一个实施方式中,在本发明的方法中选择超过一种蛋白酶抗性肽或多肽,之后进一步的步骤测定这些肽或多肽的哪种显示了针对第二蛋白酶的抗性,或针对第一蛋白酶、但处在不同于选择方法中使用的一组条件下的抗性。所述第二蛋白酶不同于第一蛋白酶,但可以是如上所述的任何蛋白酶。这样,得到了对超过一种蛋白酶有抗性的一种或更多种肽或多肽。
在本发明的方法的一个实施方式中,选择蛋白酶抗性单体的肽或多肽(例如,免疫球蛋白单可变结构域单体)。
本发明的药物和拮抗剂可以包含与所述肽或多肽融合的抗体恒定区(例如,Fc)。
在一个实施方式中,本发明提供了蛋白酶抗性肽或多肽在制造用于向哺乳动物施用的药物、以提供具有改善的PK的药物中的用途。改善的PK可以是改善的AUG(曲线下面积)和/或改善的半衰期。在一个实施方式中,所述蛋白酶抗性肽或多肽是通过本发明的方法选择的或可选择的。在一个实施方式中,所述肽或多肽是免疫球蛋白单可变结构域。所述药物可以包含与所述肽或多肽融合的抗体恒定区,例如,抗体Fc。
本发明提供了包含蛋白酶抗性肽或多肽的药物,用于向哺乳动物(例如,人类)施用,用于提供在所述哺乳动物中具有改善的PK的药物。在一个实施方式中,所述蛋白酶抗性肽或多肽是通过本发明的方法选择的或可选择的。在一个实施方式中,所述肽或多肽是免疫球蛋白单可变结构域。本发明的药物可以包含与所述肽或多肽融合的抗体恒定区(例如,Fc)。
附图的简要描述
图1是pDOM 13(aka pDOM33)的多克隆位点的说明,其用来制备噬菌体展示集。
图2显示了用来自用40ug/ml胰蛋白酶在30℃下孵育不同时间点的dAb的样品进行的几个Novex 10-20%Tricene凝胶电泳。就在加入胰蛋白酶之前,然后在加入胰蛋白酶之后一小时、三小时和24小时时立即取样。用1xSureBlue将蛋白质染色。凝胶说明DOM 15-10和DOM 15-26-501在用胰蛋白酶孵育的头三个小时的过程中都得到了明显消化。DOM 15-26、DOM 4-130-54和DOM 1h-131-511的消化只在用胰蛋白酶孵育24小时后才变得明显。
图3是DOM 1h-131-511和24个选择的变体的氨基酸序列的说明。选定克隆中不同于亲本序列的氨基酸是高亮显示的(相同的那些用圆点标记)。用框显示对应于CDR1、CDR2和CDR3的环。
图4是DOM 4-130-54和27个选择的变体的氨基酸序列的说明。选定克隆中不同于亲本序列的氨基酸是高亮显示的(相同的那些用圆点标记)。用框显示对应于CDR1、CDR2和CDR3的环。
图5是DOM 15-26-555和21个选择的变体的氨基酸序列的说明。选定克隆中不同于亲本序列的氨基酸是高亮显示的(相同的那些用圆点标记)。用框显示对应于CDR1、CDR2和CDR3的环。
图6是DOM 15-10和16个选择的变体的氨基酸序列的说明。选定克隆中不同于亲本序列的氨基酸是高亮显示的(相同的那些用圆点标记)。用框显示对应于CDR1、CDR2和CDR3的环。
图7A-7D是显示了用不同浓度的胰蛋白酶(从0至100μg/ml)在37℃孵育过夜后亲本dAb,DOM 1h-131-511(图7A)和三个变体dAb,DOM1h-131-203(图7B)、DOM 1h-131-204(图7C)和DOM 1h-131-206(图7D)与固定的TNFR1结合的BIAcore痕迹。结果表明所有三个变体对高浓度胰蛋白酶(100ug/ml)的蛋白水解的抗性比亲本高。
图8A-8C是显示了用弹性蛋白酶和leucozyme孵育过夜后dAb DOM1h-131-511(图8A)、DOM 1h-131-202(图8B)和DOM 1h-131-206(图8C)与固定的TNFR1结合的BIAcore痕迹。与亲本相比,dAb显示出对抗弹性蛋白酶和leucozyme的蛋白水解提高的抗性。
图9显示了用胰蛋白酶孵育前dAb DOM 1h-131-511、DOM1h-131-203、DOM 1h-131-204、DOM 1h-131-206、DOM 1h-131-54、DOM1h-131-201和DOM 1h-131-202的样品和用100μg/ml胰蛋白酶孵育1小时、3小时和24小时后的样品进行的两个4-12%Novex Bis-Tris凝胶电泳。
图10A-10C是显示了用不同浓度的胰蛋白酶(从0至100μg/ml)在37℃孵育过夜后DOM 4-130-54(图10A)、DOM 4-130-201(图10B)和DOM 4-130-202(图10C)与固定的IL-1R1融合蛋白结合的BIAcore痕迹。结果显示两种变体对高浓度胰蛋白酶(100μg/ml)的蛋白水解的抗性都比它们的亲本高。
图11A-11C是显示了用弹性蛋白酶和leucozyme孵育过夜后DOM4-130-54(图11A)、DOM 4-130-201(图11B)和DOM 4-130-202(图11C)与固定的IL-1R1融合蛋白结合的BIAcore痕迹。与亲本相比,dAb显示出对抗所测试的两种蛋白酶的蛋白水解提高的抗性。
图12是DOM 15-26-555和6个变体的氨基酸序列的说明。选定克隆中不同于亲本序列的氨基酸是高亮显示的(相同的那些用圆点标记)。
图13A和13B是显示了亲本dAb,DOM 15-26-555(图13A)和蛋白酶抗性最大的变体,DOM 15-26-593(图13B)与固定的VEGF结合的BIAcore痕迹。在用浓度为200μg/ml的胰蛋白酶孵育后,在100nM的dAb浓度下,比较BIAcore上亲本和变体的hVEGF结合。将反应在37℃下进行三小时或24小时。结果表明在胰蛋白酶处理24小时后,变体对蛋白水解的抗性比亲本高。
图14是显示了胰蛋白酶处理对DOM 15-26-555变体的hVEGF结合的影响的图。结果清楚地显示出在胰蛋白酶处理24小时后,所有变体对蛋白水解的抗性比亲本(DOM 15-26-555)高。
图15显示了装载了15μg处理过的和未处理过的DOM 15-26-555或DOM 15-26-593样品的两个Novex 10-20%Tricine凝胶。就在加入胰蛋白酶之前,然后在加入胰蛋白酶之后一小时、三小时和24小时时立即取样。用1xSureBlue将蛋白质染色。凝胶说明DOM 15-26-593的胰蛋白酶抗性特征不同于BIAcore实验显示的特征。
图16是DOM 15-10和变体,DOM 15-10-11的氨基酸序列的说明。变体中不同于亲本序列的氨基酸是高亮显示的(相同的那些用圆点标记)。
图17A和17B是显示了亲本,DOM 15-10(图17A)和变体,DOM15-10-11(图17B)与固定的VEGF结合的BIAcore痕迹。在用浓度为200μg/ml的胰蛋白酶孵育后,在100nM的dAb浓度下,比较BIAcore上亲本和变体的hVEGF结合。将反应在37℃下进行一小时、三小时和24小时。结果表明在胰蛋白酶处理24小时后,变体对蛋白水解的抗性比亲本高。
图18显示了装载了15μg DOM 15-10和DOM 15-10-11样品的两个Novex 10-20%Tricine凝胶。在即将加入胰蛋白酶之前,然后在加入胰蛋白酶之后一小时、三小时和24小时时取样。用SureBlue(1x)将蛋白质染色。结果表明BIAcore研究中看到的结合活性直接反映出蛋白质的完整性。
图19A-19L说明了编码是DOM 1h-131-511或DOM 4-130-54变体的dAb的几个核酸的核苷酸序列。核苷酸序列各自编码图3和图4中所示的氨基酸序列。
图20A-20E说明了编码是DOM 15-26-555或DOM 15-10变体的dAb的几个核酸的核苷酸序列。核苷酸序列各自编码图5和图6中所示的氨基酸序列。
图21显示了pDOM 38的载体图谱。
图22:显示了Labchip上在30℃下在25∶1 dAb∶胰蛋白酶比例下用胰蛋白酶处理DOM 10-53-474和DOM 15-26-593蛋白质不同时间点的凝胶电泳。箭头显示全长蛋白。
图23:显示了通过MMC色谱接着阴离子交换的纯化后从每个样品获得的高水平纯度的大小排阻色谱痕迹。在225nm下监控UV,并将柱子在含有10%乙醇(v/v)的1xPBS中运行。通过整合使用基线校准的峰面积来计算单体百分比。
图24:显示了DOM 1h-131-511、DOM 1h-131-202和DOM 1h-131-206的蛋白酶稳定性数据。
图25:是SEC,其说明了DOM 1h-131-202、DOM 1h-131-206和DOM1h-131-511在37和50℃下在Britton-Robinson中的14天稳定性数据。对于所有dAb,蛋白质浓度为1mg/ml。SEC用来测定蛋白质在热应力过程中是否发生了任何变化和相对于时间=0(T0)样品溶液中残余的单体含量。
图26A至I:显示了SEC痕迹,其显示了热应力(37和50℃)对DOM1h-131-511(A至C),-202(D至F)和-206(G至I)的影响。还显示了在给定时间点时相对于T=0溶液中残余的单体含量。
图27:显示了DOM 1h-131-202、DOM 1h-131-206和DOM 1h-131-511在24hr、48hr以及7和14天热应力的IEF分析。样品已经在Britton-Robinson缓冲液中在37或50℃下进行了孵育。
图28:TNFR-1RBA,显示了DOM 1h-131-202、DOM 1h-131-206和DOM 1h-131-511在50℃下孵育14天的影响。假定蛋白质浓度为1mg/ml。还显示了没有结合抗原的阴性对照dAb(VH模型(dummy))。
图29:说明了将~100mg/ml的A:DOM 1h-131-202、B:DOM1h-131-206和C:DOM 1h-131-511在Britton-Robinson缓冲液中在+4℃下存储7天的影响。在280nm下监控UV。
图30:显示了来自DOM 1h-131-202、DOM 1h-131-206和DOM1h-131-511在Pari E-flow和LC+中的喷雾器测试的数据。在任一Britton-Robinson缓冲液中,蛋白质浓度为5mg/ml。
图31:说明了Britton-Robinson缓冲液中5mg/ml的DOM 1h-131-202、DOM 1h-131-206和DOM 1h-131-511在喷雾过程中单体浓度的相对百分比变化。
图32:显示了Britton-Robinson缓冲液中DOM 1h-131-206和DOM1h-131-511从Pari LC+喷雾后的SEC痕迹。
图33:显示了PBS中40mg/ml的DOM 1h-131-206在1小时的喷雾过程中的SEC痕迹。喷雾器杯和气雾剂中的蛋白质对于喷雾过程中dAb经受到的剪切力和热应力的影响都是高度抗性的。
图34:显示了三种前导蛋白质(DOM 1h-131-206和DOM 1h-131-511和DOM 1h-131-202)中每一种的沉淀速度曲线。对于DOM 1h-131-206较低浓度的样品观察到的双峰是由于该情况中样品从室中泄漏出来造成的假象。
图35:显示了缓冲液和装置对GSK 1995056A(DOM 1h-131-511)喷雾液滴大小的影响。
图36:显示了GSK 1995056A(DOM 1h-131-511)在各种装置中喷雾后的稳定性,通过二聚体形成来测定,如通过SEC来测量的。
图37:显示了GSK 1922567A(202)、GSK 1995057A(206)和GSK1995056A(511)在Pari E-flow和LC+中的喷雾器测试。A)在Britton-Robinson缓冲液中测试,B)在PEG1000/蔗糖缓冲液中测试。
图38:描绘了人TNFR1受体结合测试中的TNF-α剂量曲线。每个样品重复四次进行测试。
图39:显示了GSK 1922567A(DOM 1h-131-202)、GSK 1995057A(DOM 1h-131-206)和GSK 1995056A(DOM 1h-131-511)在人TNFR1受体结合测试中的抑制作用。每个样品重复四次进行测试。
图40:说明了DOM 15-26和DOM 15-26-593dAb在VEGF RBA中的功效。
图41:显示了将5mg/mg DMS1529(DOM 15-26-593)和DMS1545(DOM 15-26-501)以单次快速浓注(bolus)剂量i.v.给药于大鼠后的药物动力学。
图42a:显示了DMS 1529Fc融合体(DOM 15-26-593Fc融合体)的SEC-MALL(大小排阻色谱-多角度激光散射)分析,证实了单体的特征。显示了两个不同的批次,其对于折射率(即,浓度;虚线)和光散射(实线),显示了相似的特征。用箭头标记的线条表示分子量计算。
图42b:显示了DMS 1529Fc融合体(DOM 15-26-593Fc融合体)的AUC(分析超速离心)分析,证实了单体的特征。在三个不同的浓度下(PBS缓冲液中接近0.2、0.5&1.0mg/ml)测试一批材料。沉淀速率的分析证实了大约80kDa的分子量。
图43:显示了DMS 1529(DOM 15-26-593)和DOM 15-26-501的DSC痕迹。
图44:是对两个不同批次的材料进行10次冻-融循环之前和之后,DMS 1529(DOM 15-26-593)的VEGF结合ELISA。
图45:显示了10次冻-融循环之前和之后,DOM 15-26-593SEC特征的一致性。
图46:说明了DMS 1529融合体(DOM 15-26-593Fc融合体)的加速稳定性研究的结果;结合ELISA证明了在所示温度下孵育7天后的活性。
图47A:显示了在37℃孵育14&15天后,人短尾猴(cynomolgus)中的DMS 1529(DOM 15-26-593)的稳定性。
图47B:显示了在37℃孵育14&15天后,人血清中的DMS 1529(DOM15-26-593)的稳定性。
图48:显示了DOM 15-26&DOM 15-26-593dAb作为Fc融合体(各自为DOM 1564&DOM 1529)在VEGF RBA中的功效。
图49:说明了DMS 1529融合体(DOM 15-26-593FC融合体)对HUVEC细胞增殖的抑制作用。
图50:pDom33载体图谱。
图51:描绘了结合血清白蛋白的dAbs的序列(氨基酸和核苷酸)。
发明的详细说明
在本说明书中,已经参照实施方式,以使得说明书既清楚又简明的撰写方式来描述了本发明。但是打算并且应当理解,可以在不脱离本发明的条件下对这些实施方式进行各种组合和分开。
如在此使用的,“肽”指的是经由肽键连接在一起的约两个到约50个氨基酸。
如在此所用的,“多肽”指的是通过肽键连接在一起的至少约50个氨基酸。多肽通常包括三级结构并折叠成功能结构域。
如在此所用的,“对蛋白酶降解抗性的”肽或多肽(例如,结构域抗体(dAb))是在适于蛋白酶活性的条件下用蛋白酶孵育时,基本上不受蛋白酶的降解。在适于蛋白酶活性的温度下,例如37或50℃,用蛋白酶孵育约一小时,不超过约25%、不超过约20%、不超过约15%、不超过约14%、不超过约13%、不超过约12%、不超过约11%、不超过约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、不超过约1%或基本上没有蛋白质受蛋白酶降解时,多肽(例如,dAb)基本上是没有降解的。可以使用任何合适的方法来测定蛋白质降解,例如,如本文所述的。通过SDS-PAGE或通过功能测试(例如,配体结合)。
如在此所用的,“展示系统”指的是其中基于期望的特征(如,物理、化学或功能特征)易于选择的多肽或肽的集合的系统。展示系统可以是合适的多肽或肽的集(例如,在溶液中,固定在合适的支持物上)。展示系统还可以是使用细胞表达系统(例如,在例如转化的、感染的、转染的或转导的细胞中核酸文库的表达和细胞表面上所编码多肽的展示)或非细胞表达系统(例如,乳液区室化和展示)的生物化学系统。优选的展示系统与核酸的编码功能以及由核酸编码的多肽或肽的物理、化学和/或功能特征相关。使用这样的展示系统时,可以选择具有期望的物理、化学和/或功能特征的多肽或肽,并可以容易地分离或回收编码选定多肽或肽的核酸。与核酸的编码功能以及多肽或肽的物理、化学和/或功能特征相关的各种展示系统是本领域已知的,例如,细菌噬菌体(bacteriophage)展示(噬菌体(phage)展示)、核糖体展示、乳液区室化和展示、酵母展示、嘌呤霉素展示、细菌展示、在质粒上展示、共价展示等。(参见,例如,EP 0436597(Dyax)、U.S.专利No.6,172,197(McCafferty等)、U.S.专利No.6,489,103(Griffiths等))。
如在此所用的,“集(repertoire)”指的是特征在于氨基酸序列多样性的多肽或肽的集合。集的各个成员可以具有共同的特征,如共同的结构特征(例如,共同的核心结构)和/或共同的功能特征(例如,结合共同配体(例如,通用配体或目标配体)的能力)。
如在此所用的,“功能性”描述了具有生物活性的多肽或肽,如特定的结合活性。例如,术语“功能性多肽”包括通过其抗原-结合位点结合目标抗原的抗体或其抗原-结合片段,以及结合底物的酶。
如在此所用的,“通用配体”指的是结合给定集的相当大部分(例如,基本上全部)功能性成员的配体。通用配体(例如,共同的通用配体)可以结合给定集的许多成员,即使成员对于共同的目标配体不具有结合特异性。通常,多肽上功能性通用配体结合位点的存在(如通过结合通用配体的能力来表明)表明多肽是正确折叠的和功能性的。通用配体的合适实例包括超抗原、结合在集的相当大部分功能性成员上表达的表位的抗体等。
“超抗原”是指在与这些蛋白的目标配体结合位点不同的位点与免疫球蛋白超家族的成员相互作用的通用配体的术语。葡萄球菌(Staphylococcal)肠毒素是与T-细胞受体相互作用的超抗原的实例。结合抗体的超抗原包括蛋白G,其结合IgG恒定区(Bjorck和Kronvall,J.Immunol.,133:969(1984));蛋白A,其结合IgG恒定区和VH结构域(Forsgren和Sjoquist,J.Immunol.,97:822(1966));和蛋白L,其结合VL结构域(Bjorck,J.Immunol.,140:1194(1988))。
如在此所用的,“目标配体”指的是由多肽或肽特异性或选择性结合的配体。例如,当多肽是抗体或其抗原-结合片段时,目标配体可以是任何期望的抗原或表位,以及当多肽是酶时,目标配体可以是任何期望的底物。与目标抗原的结合取决于功能性的多肽或肽。
如在此所用的,“抗体形式”指的是其中可以引入抗体可变结构域使得给予结构上抗原结合特异性的任何合适的多肽结构。各种合适的抗体形式是本领域已知的,如,嵌合抗体、人源化抗体、人抗体、单链抗体、双特异性抗体、抗体重链、抗体轻链、抗体重链和/或轻链的同型二聚体和杂二聚体、之前任一项的抗原结合片段(例如,Fv片段(例如,单链Fv(scFv)、二硫化物键合的Fv)、Fab片段、Fab’片段、F(ab’)2片段)、单抗体可变结构域(例如,dAb、VH、VHH、VL)和之前任一项的修饰形式(例如,通过聚乙二醇或其他合适聚合物的共价连接修饰的)。
短语“免疫球蛋白单可变结构域”指的是与其他V区或结构域无关地特异性结合抗原或表位的抗体可变结构域(VH、VHH、VL)。免疫球蛋白单可变结构域可以以带有其他可变区或可变结构域的形式(例如,同型-或杂-多聚体)存在,其中其他区或结构域对于单免疫球蛋白可变结构域的抗原结合不是期望的(即,其中免疫球蛋白单可变结构域结合抗原与其他可变结构域无关)。“结构域抗体”或“dAb”与在此所用的术语“免疫球蛋白单可变结构域”相同。免疫球蛋白单可变结构域优选的是人抗体可变结构域,但还包括来自其他物种的单抗体可变结构域,如啮齿动物(例如,WO00/29004中公开的,在此将其内容作为整体通过援引并入)、铰口鲨(nurse shark)和Camelid VHH dAb。Camelid VHH是源自包括骆驼、美洲驼(llama)、羊驼(alpaca)、单峰骆驼(dromedary)和原驼(guanaco)的物种的免疫球蛋白单可变结构域多肽,其产生天然缺少轻链的重链抗体。
“结构域”是经过折叠的蛋白质结构,其具有与蛋白质其余部分无关的蛋白质三级结构。通常,结构域负责蛋白质的分离的功能特征,并且在许多情况下可以添加、去除或转移给其他蛋白质,而不丧失该蛋白质和/或该结构域的其余部分的功能。“单抗体可变结构域”是指经过折叠的多肽结构域,包含抗体可变结构域的序列特征。因此,其包括完整的抗体可变结构域和修饰的可变结构域,例如,其中一个或更多个环已经由不是抗体可变结构域特征性的序列替代,或已被截短或包含N-端或C-端延伸的抗体可变结构域,以及保留全长结构域的至少结合活性和特异性的可变结构域的折叠片段。
术语“文库”指的是异源多肽或核酸的混合物。文库由成员组成,每个成员具有单个多肽或核酸序列。就这点而言,“文库”和“集”同义。文库成员之间的序列差异造成文库中存在的多样性。文库可以采用多肽或核酸的简单混合物的形式,或者为核酸文库转化的生物体或细胞的形式,例如细菌、病毒、动物或植物细胞等。优选地,各个生物体或细胞仅含有一个或数目有限的文库成员。有益地,将核酸掺入到表达载体中,以表达该核酸所编码的多肽。因此,在优选的方面中,文库可以采用宿主生物体群的形式,每个生物体含有一个或更多个拷贝的表达载体,所述表达载体含有核酸形式的文库的单个成员,所述核酸可以表达而产生其相应的多肽成员。因此,宿主生物体群具有编码一大组不同多肽的潜力。
“通用框架”是单抗体框架序列,对应于序列保守的抗体区,如Kabat定义的(“Sequences of Proteins of Immunological Interest”,US Departmentof Health and Human Services1991),或对应于人种系免疫球蛋白集或结构,如Chothia和Lesk,(1987)J.Mol.Biol.196:910-917定义的。本发明提供了单个框架,或一组这样的框架的用途,已经发现其允许实质上任何结合特异性的产生,尽管变化仅在超变区内。
优选使用BLAST2 Sequences算法,使用缺省参数,来制备和测定如在此所限定的氨基酸和核苷酸序列比对和同源性、相似性或同一性(Tatusova,T.A.et al.,FEMS Microbiol Lett,174:187-188(1999))。
本发明涉及选择具有期望的生物学活性的蛋白酶抗性肽和多肽的方法。在所述方法中使用两种选择压力来产生用于选择多肽的有效的过程,所述多肽是高度稳定的并对蛋白酶降解有抗性,并且具有期望的生物学活性。如在此描述的,蛋白酶抗性肽和多肽通常保持生物学活性。相比之下,蛋白酶敏感的肽和多肽在此处描述的方法中被蛋白酶裂解或消化,因而失去它们的生物学活性。因此,蛋白酶抗性肽或多肽一般根据它们的生物学活性来选择,例如,结合活性。
在此描述的方法提供了几个优点。例如,如在此公开和例示的,选择了针对一种蛋白酶(例如,胰蛋白酶)的蛋白水解降解有抗性,对其他蛋白酶(例如,弹性蛋白酶、leucozyme)的降解也有抗性的肽或多肽。此外,蛋白酶抗性与肽或多肽的更高的解链温度(Tm)相关。更高的解链温度是更稳定的肽和多肽的表现。对蛋白酶降解的抗性还与对目标配体的高亲和力结合相关。因而,在此描述的方法提供了有效的途径来选择、分离和/或回收多肽,所述多肽具有期望的生物学活性,并且非常适合于体内治疗和/或诊断用途,因为它们是蛋白酶抗性的和稳定的。
选择方法
在一个方面中,提供了从肽和多肽的文库或集(例如,展示系统)中选择、分离和/或回收对蛋白酶(例如,一种或更多种蛋白酶)降解有抗性的肽或多肽的方法。优选的,该方法是从肽和多肽的文库或集(例如,展示系统)中选择、分离和/或回收对蛋白酶(例如,一种或更多种蛋白酶)降解有抗性的多肽的方法。通常,该方法包括提供肽或多肽的文库或集,在适于蛋白酶活性的条件下将文库或集与蛋白酶(例如,胰蛋白酶、弹性蛋白酶、leucozyme、胰酶、痰液)组合,并选择、分离和/或回收对蛋白酶降解有抗性的并具有期望的生物活性的肽或多肽。由于蛋白酶的活性,蛋白酶降解的肽或多肽通常具有降低的生物活性或失去其生物活性。因此,可以使用基于它们的生物活性的方法来选择、分离和/或回收对蛋白酶降解抗性的肽或多肽,生物活性如结合活性(例如,结合通用配体,结合特异性配体,结合底物)、催化活性或其他生物活性。
如在此描述和例示的,蛋白酶抗性dAbs一般地以高亲和力结合它们的目标配体。因而,在另一个方面,本发明是选择、分离和/或回收以高亲和力结合配体,优选的目标配体的肽或多肽的方法。优选的,所述方法是选择、分离和/或回收以高亲和力结合配体,优选的目标配体的多肽的方法。通常,该方法包括提供肽或多肽的文库或集,在适于蛋白酶活性的条件下将文库或集与蛋白酶(例如,胰蛋白酶、弹性蛋白酶、leucozyme、胰酶、痰液)组合,并选择、分离和/或回收结合配体(例如,目标配体)的肽或多肽。由于所述文库或集已经在蛋白酶敏感性肽或多肽将被消化的条件下暴露于蛋白酶,蛋白酶的活性可以消除具有低结合亲和力的较不稳定的多肽,从而产生高亲和力结合肽或多肽的集合。例如,选择的肽或多肽可以以1μM或更强的亲和力(KD;如通过表面等离子体共振测定的,KD=Koff(kd)/Kon(ka)),优选约500nM到约0.5pM,结合它的目标配体。例如,高亲和力肽或多肽可以以约500nM、约100nM、约10nM、约1nM、约500pM、约100pM、约10pM、约1pM或约0.5pM的亲和力结合目标配体。对蛋白酶有抗性的肽和多肽被认为具有更低的熵和/或更高的稳定能。因而,蛋白酶抗性与高亲和力结合之间的相关性可以与通过本发明的方法选择的肽和多肽的表面的致密性和稳定性相关。
在适于蛋白酶的蛋白水解活性的条件下,将肽或多肽的文库或集与蛋白酶(例如,一种或更多种蛋白酶)组合。适于蛋白酶的蛋白水解活性的条件以及含有蛋白水解活性的生物制剂或混合物是本领域公知的,并可以被本领域普通技术人员容易地测定。如果需要,例如,可以通过测定一定范围的pH条件、蛋白酶浓度、温度下的蛋白酶活性和/或通过改变文库或集与蛋白酶反应的时间量来鉴定或优化合适的条件。例如,在一些实施方式中,蛋白酶例如胰蛋白酶与肽或多肽(例如,可变结构域)的比例(以摩尔/摩尔为基础)为800至80,00(例如,8,000至80,000)蛋白酶∶肽或多肽,例如,使用10微克/ml蛋白酶时,比例为800至80,000蛋白酶∶肽或多肽;或使用100微克/ml蛋白酶时,比例为8,000至80,000蛋白酶∶肽或多肽。在一个实施方式中,蛋白酶(例如,胰蛋白酶)与肽或多肽(例如,可变结构域)的比例(以重量/重量为基础,例如微克/微克)为1,600至160,000(例如,16,000至160,000)蛋白酶∶肽或多肽,例如,使用10微克/ml蛋白酶时,比例为1,600至160,000蛋白酶∶肽或多肽;或使用100微克/ml蛋白酶时,比例为16,000至160,000蛋白酶∶肽或多肽。在一个实施方式中,使用至少100或1000微克/ml浓度的蛋白酶,并且蛋白酶例如胰蛋白酶与肽或多肽(例如,可变结构域)的蛋白酶∶肽比例(以摩尔/摩尔为基础)为8,000至80,000蛋白酶∶肽或多肽。在一个实施方式中,使用至少10微克/ml浓度的蛋白酶,并且蛋白酶例如胰蛋白酶与肽或多肽(例如,可变结构域)的蛋白酶∶肽比例(以摩尔/摩尔为基础)为800至80,000蛋白酶∶肽或多肽。在一个实施方式中,例如,C为10微克/ml时,蛋白酶(例如,胰蛋白酶)与肽或多肽(例如,可变结构域)的比例(以重量/重量为基础,例如微克/微克)为1600至160,000蛋白酶∶肽或多肽;或C或C’为100微克/ml时,比例为16,000至160,000蛋白酶∶肽或多肽。在一个实施方式中,浓度(c或c’)为至少100或1000微克/ml蛋白酶。对于测试单个或分离的肽或多肽(例如,免疫球蛋白可变结构域),例如,已经从集或文库中分离出来的,可以将蛋白酶加入合适缓冲液(例如,PBS)中的肽或多肽溶液中,以产生肽或多肽/蛋白酶溶液,如至少约0.01%(w/w)蛋白酶/肽或多肽的溶液,约0.01%至约5%(w/w)蛋白酶/肽或多肽,约0.05%至约5%(w/w)蛋白酶/肽或多肽,约0.1%至约5%(w/w)蛋白酶/肽或多肽,约0.5%至约5%(w/w)蛋白酶/肽或多肽,约1%至约5%(w/w)蛋白酶/肽或多肽,至少约0.01%(w/w)蛋白酶/肽或多肽,至少约0.02%(w/w)蛋白酶/肽或多肽,至少约0.03%(w/w)蛋白酶/肽或多肽,至少约0.04%(w/w)蛋白酶/肽或多肽,至少约0.05%(w/w)蛋白酶/肽或多肽,至少约0.06%(w/w)蛋白酶/肽或多肽,至少约0.07%(w/w)蛋白酶/肽或多肽,至少约0.08%(w/w)蛋白酶/肽或多肽,至少约0.09%(w/w)蛋白酶/肽或多肽,至少约0.1%(w/w)蛋白酶/肽或多肽,至少约0.2%(w/w)蛋白酶/肽或多肽,至少约0.3%(w/w)蛋白酶/肽或多肽,至少约0.4%(w/w)蛋白酶/肽或多肽,至少约0.5%(w/w)蛋白酶/肽或多肽,至少约0.6%(w/w)蛋白酶/肽或多肽,至少约0.7%(w/w)蛋白酶/肽或多肽,至少约0.8%(w/w)蛋白酶/肽或多肽,至少约0.9%(w/w)蛋白酶/肽或多肽,至少约1%(w/w)蛋白酶/肽或多肽,至少约2%(w/w)蛋白酶/肽或多肽,至少约3%(w/w)蛋白酶/肽或多肽,至少约4%(w/w)蛋白酶/肽或多肽,或约5%(w/w)蛋白酶/肽或多肽。可以在蛋白酶活性合适的温度下(例如,室温,约37℃)孵育混合物,并以(例如,1小时,2小时,3小时等)时间间隔取样。使用任何合适的方法,如SDS-PAGE分析或配体结合,分析样品的蛋白质降解,并且结果可以用来建立降解的时间过程。
在本文所述的方法中,可以使用任何期望的一种或复数种蛋白酶。例如,可以使用单种蛋白酶,不同蛋白酶的任何期望的组合或含有蛋白水解活性的任何生物制剂、生物提取物或生物匀浆。所用一种或复数种蛋白酶的身份不必要是已知的。可以单独或以任何期望的组合来使用的蛋白酶的合适实例包括丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、巯基蛋白酶、基质金属蛋白酶、羧肽酶(例如,羧肽酶A、羧肽酶B)、胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶、木瓜蛋白酶、弹性蛋白酶、leucozyme、胰酶、凝血酶、纤维蛋白溶酶、组织蛋白酶(例如,组织蛋白酶G)、蛋白水解酶(例如,蛋白水解酶1、蛋白水解酶2、蛋白水解酶3)、嗜热菌蛋白酶、凝乳酶、肠肽酶、胱天蛋白酶(例如,胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶9、胱天蛋白酶12、胱天蛋白酶13)、钙激活中性蛋白酶、无花果蛋白酶(ficain)、梭菌蛋白酶、actinidain、菠萝蛋白酶和separase等。合适的含有蛋白水解活性的生物提取物、匀浆和制剂包括痰液、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管肺泡灌洗液、肺匀浆、肺提取物、胰提取物、胃液、唾液、泪液等。在一个实施方式中,所述蛋白酶是在眼和/或泪液中存在的蛋白酶。以适于发生蛋白水解降解的含量使用蛋白酶。例如,如本文所述的,可以使用约0.01%至约5%(w/w,蛋白酶/肽或多肽)的蛋白酶。将蛋白酶与包括肽或多肽集的展示系统(例如,噬菌体展示系统)组合时,例如,可以使用的蛋白酶浓度为约10μg/ml至约3mg/ml,约10μg/ml,约20μg/ml,约30μg/ml,约40μg/ml,约50μg/ml,约60μg/ml,约70μg/ml,约80μg/ml,约90μg/ml,约100μg/ml,约200μg/ml,约300μg/ml,约400μg/ml,约500μg/ml,约600μg/ml,约700μg/ml,约800μg/ml,约900μg/ml,约1000μg/ml,约1.5mg/ml,约2mg/ml,约2.5mg/ml或约3mg/ml。适合的浓度是约10μg/ml到1mg/ml,10μg/ml到100、90、80、70、60、50或40μg/ml,或10、20、30、40或50μg/ml到100、90、80、70、60μg/ml。
在适于蛋白酶活性的温度下将蛋白酶与肽或多肽的集合(文库或集)一起孵育。例如,可以在约20℃至约40℃的温度下孵育蛋白酶和肽或多肽的集合(例如,在室温,约20℃,约21℃,约22℃,约23℃,约24℃,约25℃,约26℃,约27℃,约28℃,约29℃,约30℃,约31℃,约32℃,约33℃,约34℃,约35℃,约36℃,约37℃,约38℃,约39℃,约40。℃)。将蛋白酶和肽或多肽的集合一起孵育一段足以发生蛋白水解降解的时间。例如,可以将肽或多肽的集合与蛋白酶孵育约30分钟至约24或约48小时。在一些实施例中,将肽或多肽的集合与蛋白酶一起孵育过夜,或至少约30分钟,约1小时,约1.5小时,约2小时,约3小时,约4小时,约5小时,约6小时,约7小时,约8小时,约9小时,约10小时,约11小时,约12小时,约13小时,约14小时,约15小时,约16小时,约17小时,约18小时,约19小时,约20小时,约21小时,约22小时,约23小时,约24小时,约48小时,或更长时间。
通常理想的是,至少在较早的选择轮次中(例如,使用展示系统时),与没有包括蛋白酶孵育的选择相比,蛋白酶导致选择的具有期望的生物活性的克隆数量减少至少一个数量级。在特定的实施例中,方法中所用的蛋白酶含量和条件足以将回收的克隆数量减少至少一个对数(10倍),至少约2个对数(100倍),至少约3个对数(1000倍)或至少约4个对数(10,000倍)。使用常规方法和/或在此提供的指导,可以容易地测定导致期望的回收克隆减少的合适的蛋白酶含量和孵育条件。
可以使用任何合适的方法(例如,体外、体内或先体外后体内(exvivo))来组合并孵育蛋白酶和肽或多肽的集合。例如,可以在合适的容器中将蛋白酶和肽或多肽的集合组合并在适于蛋白酶活性的温度下保持静止、摇晃、振荡、涡旋(swirled)等。如果需要,可以在体内或先体外后体内(ex vivo)系统中组合蛋白酶和肽或多肽的集合,如通过将多肽的集合(例如,噬菌体展示文库或集)引入合适的动物中(例如,小鼠),经过对于蛋白酶活性而言足够的时间后,回收肽或多肽的集合。在另一个实施例中,用多肽的集合(例如,噬菌体展示文库或集)灌注器官或组织,经过对于蛋白酶活性而言足够的时间后,回收多肽的集合。
孵育后,可以基于期望的生物活性如结合活性来选择蛋白酶抗性肽或多肽。如果需要,可以在选择前加入蛋白酶抑制剂。可以使用基本上不干扰选择方法的任何合适的蛋白酶抑制剂(或两种或更多种蛋白酶抑制剂的组合)。合适的蛋白酶抑制剂的实例包括,α1-抗-胰蛋白酶、α2-巨球蛋白、氨肽酶抑制剂、抗蛋白酶、抗凝血酶III、抑酶肽、4-(2-氨乙基)苯磺酰基氟化物盐酸盐(AEBSF)、(4-脒基-苯基)-甲烷-磺酰氟化物(APMSF)、苯丁抑制素、苄脒、凝乳蛋白酶抑制剂、3,4-二氯异香豆素、二异丙基氟磷酸酯(DIFP)、E-64、乙二胺四乙酸(EDTA)、弹性蛋白酶抑制剂(elastatinal)、亮肽素、N-乙基马来酰亚胺、苯甲基磺酰氟化物(PMSF)、抑胃酶肽、1,10-二氮杂菲、膦酰二肽(phosphoramidon)、丝氨酸蛋白酶抑制剂、N-甲苯磺酰基-L-赖氨酸-氯甲基酮(TLCK)、Na-甲苯磺酰基-Phe-氯甲基酮(TPCK)等。此外,许多含有几类蛋白酶抑制剂的制剂是可购得的(例如,Roche CompleteProtease Inhibitor Cocktail TabletsTM(Roche Diagnostics Corporation;Indianapolis,IN,USA),其抑制胰凝乳蛋白酶、嗜热菌蛋白酶、木瓜蛋白酶、链霉蛋白酶、胰提取物和胰蛋白酶)。
可以使用期望的生物活性选择方法来选择蛋白酶抗性肽或多肽,这种选择方法可以使具有期望的生物活性的肽和多肽与不具有期望的生物活性的肽和多肽区分开来并进行选择。通常,已经受到蛋白酶消化或裂解的肽或多肽失去了它们的生物活性,而蛋白酶抗性肽或多肽仍然保留功能。因此,对于生物活性合适的测试可以用来选择蛋白酶抗性肽或多肽。例如,可以使用合适的结合测试(例如,ELISA、淘选)来测定共同的结合功能(例如,结合通用配体,结合特异性配体或结合底物)。例如,可以通过淘选或使用合适的亲和性基质来选择、分离和/或回收结合目标配体或通用配体(如蛋白A、蛋白L或抗体)的多肽。可以通过将配体(例如,通用配体、目标配体)溶液加入合适的容器(例如,试管、培养皿)中并使配体沉积或覆盖在容器壁上来完成淘选。将过量的配体洗掉并将多肽(例如,噬菌体展示文库)加入容器中,并将容器维持在适于多肽结合固定化配体的条件下。可将未结合的多肽洗掉,使用任何合适的方法(如刮下(scraping)或降低pH)来回收结合的多肽。
使用噬菌体展示系统时,可以在噬菌体ELISA中测试结合。可以根据任何合适的程序来进行噬菌体ELISA。在一个实施例中,通过ELISA筛选每一轮选择产生的噬菌体群与选定的目标配体或通用配体的结合,以鉴定呈现出蛋白酶抗性肽或多肽的噬菌体。如果需要,可以测试可溶性肽和多肽与目标配体或通用配体的结合,例如,通过ELISA,使用例如,对抗C-或N-端标记物的试剂(参见,例如Winter等(1994),Ann.Rev.Immunology 12,433-55以及其中引用的参考文献)。还可以通过PCR产物的凝胶电泳(Marks等,1991,上文;Nissim等,1994,上文)、探针检测(Tomlinson等,1992,J.Mol.Biol.227,776)或通过载体DNA的测序来测定选定噬菌体的多样性。
蛋白酶抗性肽和多肽也可以,例如,根据催化活性来选择,其可以使用催化活性分析来测量(例如,蛋白质水解活性分析、磷酸转移酶分析、磷酸水解酶分析、聚合酶活性分析)。
蛋白酶抗性肽或多肽(例如,单抗体可变结构域)可以具有对通用配体或任何期望的目标配体的结合特异性,例如,人类或动物蛋白,包括细胞因子、生长因子、细胞因子受体、生长因子受体、酶(例如,蛋白酶)、酶的辅助因子、DNA结合蛋白、脂质和碳水化物。包括细胞因子、生长因子、细胞因子受体、生长因子受体和其他蛋白质的适合的目标抗原,包括但不限于:ApoE、Apo-SAA、BDNF、心肌营养蛋白-1、CEA、CD40、CD40配体、CD56、CD38、CD138、EGF、EGF受体、ENA-78、嗜酸细胞活化趋化因子、嗜酸细胞活化趋化因子-2、Exodus-2、FAPα、FGF、-酸性、FGF-碱性、成纤维细胞生长因子-10、FLT3配体、CXXXC趋化因子(CX3C)、GDNF、G-CSF、GM-CSF、GF-β1、人血清白蛋白、胰岛素、IFN-γ、IGF-I、IGF-II、IL-1α、IL-1β、IL-1受体、IL-11型受体、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8(72a.a.)、IL-8(77a.a.)、IL-9、IL-10、IL-11、IL-12、IL-13、IL-15、IL-16、IL-17、IL-18(IGIF)、抑制素α、抑制素β、IP-10、角质形成细胞生长因子-2(KGF-2)、KGF、瘦蛋白、LIF、淋巴细胞趋化因子、缪勒管抑制物质、单核细胞集落抑制因子、单核细胞引诱蛋白质、M-CSF、c-fms、v-fmsMDC(67a.a.)、MDC(69a.a.)、MCP-1(MCAF)、MCP-2、MCP-3、MCP-4、MDC(67a.a.)、MDC(69a.a.)、MIG、MIP-1α、MIP-1β、MIP-3α、MIP-3β、MIP-4、骨髓祖代抑制因子-1(MPIF-1)、NAP-2、Neurturin、神经生长因子、β-NGF、NT-3、NT-4、制瘤素M、PDGF-AA、PDGF-AB、PDGF-BB、PF-4、RANTES、SDF1α、SDF1β、SCF、SCGF,干细胞因子(SCF)、TARC、TGF-α、TGF-β、TGF-β2、TGF-β3、肿瘤坏死因子(TNF)、TNF-α、TNF-β、TNF受体I、TNF受体II、TNIL-1、TPO、VEGF、VEGF A、VEGF B、VEGF C、VEGF D、VEGF受体1、VEGF受体2、VEGF受体3、GCP-2、GRO/MGSA、GRO-β、GRO-γ、HCC1、1-309、HER1、HER2、HER3、HER4、血清白蛋白、vWF,淀粉样蛋白(例如,淀粉样蛋白α)、MMP12、PDK1、IgE以及在此公开的其他目标。要理解的是,这个列表不是穷举的。
在某些实施方式中,所述蛋白酶抗性肽或多肽结合肺部组织中的目标,例如,选自以下构成的组的目标TNFR1、IL-1、IL-1R、IL-4、IL-4R、IL-5、IL-6、IL-6R、IL-8、IL-8R、IL-9、IL-9R、IL-10、IL-12IL-12R、IL-13、IL-13Rα1、IL-13Ra2、IL-15、IL-15R、IL-16、IL-17R、IL-17、IL-18、IL-18R、IL-23IL-23R、IL-25、CD2、CD4、CD11a、CD23、CD25、CD27、CD28、CD30、CD40、CD40L、CD56、CD138、ALK5、EGFR、FcER1、TGFb、CCL2、CCL18、CEA、CR8、CTGF、CXCL12(SDF-1)、糜蛋白酶、FGF、弗林蛋白酶、内皮素-1、嗜酸细胞活化趋化因子(例如、嗜酸细胞活化趋化因子、嗜酸细胞活化趋化因子-2、嗜酸细胞活化趋化因子-3)、GM-CSF、ICAM-1、ICOS、IgE、IFNa、I-309、整联蛋白、L-选择素、MIF、MIP4、MDC、MCP-1、MMPs、嗜中性白细胞弹性蛋白酶、骨桥蛋白、OX-40、PARC、PD-1、RANTES、SCF、SDF-1、siglec8、TARC、TGFb、凝血酶、Tim-1、TNF、TRANCE、类胰蛋白酶、VEGF、VLA-4、VCAM、α4β7、CCR2、CCR3、CCR4、CCR5、CCR7、CCR8、alphavbeta6、alphavbeta8、cMET、CD8、vWF、淀粉样蛋白(例如,淀粉样蛋白α)、MMP12、PDK1和IgE。
在本文所述的方法中使用展示系统时(例如,与核酸的编码功能和该核酸编码的肽或多肽的功能性特征相关的展示系统),常常能有利地扩增或提高编码选定肽或多肽的核酸的拷贝数。这提供了一条使用本文所述的方法或其他合适的方法获得足量核酸和/或肽或多肽的有效途径,以用于更多轮次的选择,或用于制备其他的集(例如,亲和成熟集)。因此,在一些实施方式中,本发明的方法包括使用展示系统(例如,与核酸的编码功能和该核酸编码的肽或多肽的功能性特征相关的展示系统,如噬菌体展示)并进一步包括扩增或提高编码选定肽或多肽的核酸的拷贝数。可以使用任何合适的方法来扩增核酸,如通过噬菌体扩增、细胞生长或聚合酶链式反应。
本文所述的方法可以用作程序的一部分来分离蛋白酶抗性肽或多肽,如果需要,其可以包括其他合适的选择方法。在这些情况中,可以在计划的任何期望的点使用本文所述的方法,如在使用其他选择方法之前或之后。本文所述的方法还可以用来提供两轮或更多轮的选择,如本文所述和举例说明的。
在一个实例中,本发明是选择对弹性蛋白酶的降解有抗性的肽或多肽的方法,包括提供肽或多肽的文库或集,在适合于弹性蛋白酶的蛋白水解消化的条件下组合所述文库或集与弹性蛋白酶(或包含弹性蛋白酶的生物制品、提取物或匀浆),并选择、分离和/或回收对弹性蛋白酶的降解有抗性、并具有期望的生物学活性(例如,结合活性)的肽或多肽。
在特定的实施方式中,本发明是选择对弹性蛋白酶的降解有抗性、并结合目标配体,例如肺部组织中的目标的免疫球蛋白单可变结构域(dAb)的方法。在这些实施方式中,提供包含dAbs的文库或集,在适用于弹性蛋白酶的蛋白水解消化的条件下与弹性蛋白酶(或包含弹性蛋白酶的生物制品、提取物或匀浆)组合。选择结合目标配体的弹性蛋白酶抗性dAbs。例如,所述弹性蛋白酶抗性dAb当在弹性蛋白酶的0.04%(w/w)溶液中在37℃孵育至少约2小时的时间时基本上不降解。优选的,所述弹性蛋白酶抗性dAb当在弹性蛋白酶的0.04%(w/w)溶液中在37℃孵育至少约12小时的时间时基本上不降解。更优选的,所述弹性蛋白酶抗性dAb当在弹性蛋白酶的0.04%(w/w)溶液中在37℃孵育至少约24小时、至少约36小时或至少约48小时的时间时基本上不降解。
在示范性的实施方式中,本发明是选择对弹性蛋白酶的降解有抗性并结合目标配体如肺部组织中的目标的免疫球蛋白单可变结构域(dAb)的方法。所述方法包括提供包含多肽的集的噬菌体展示系统,所述多肽的集包含免疫球蛋白单可变结构域,组合所述噬菌体展示系统与弹性蛋白酶(约100μg/ml)并在约37℃孵育所述混合物例如过夜(例如,约12-16小时),然后根据与目标抗原的结合来选择展示了结合期望的目标抗原的dAb的噬菌体。
在一个实例中,本发明是选择对leucozyme的降解有抗性的肽或多肽的方法,包括提供肽或多肽的文库或集,在适合于leucozyme的蛋白水解消化的条件下组合所述文库或集与leucozyme(或包含leucozyme的生物制品、提取物或匀浆),并选择、分离和/或回收对leucozyme的降解有抗性、并具有期望的生物学活性(例如,结合活性)的肽或多肽。
在特定的实施方式中,本发明是选择对leucozyme的降解有抗性、并结合目标配体,例如肺部组织中的目标的免疫球蛋白单可变结构域(dAb)的方法。在这些实施方式中,提供包含dAbs的文库或集,在适用于leucozyme的蛋白水解消化的条件下与leucozyme(或包含leucozyme的生物制品、提取物或匀浆)组合。选择结合目标配体的leucozyme抗性dAbs。例如,所述leucozyme抗性dAb当在leucozyme的0.04%(w/w)溶液中在37℃孵育至少约2小时的时间时基本上不降解。优选的,所述leucozyme抗性dAb当在leucozyme的0.04%(w/w)溶液中在37℃孵育至少约12小时的时间时基本上不降解。更优选的,所述leucozyme抗性dAb当在leucozyme的0.04%(w/w)溶液中在37℃孵育至少约24小时、至少约36小时或至少约48小时的时间时基本上不降解。
在示范性的实施方式中,本发明是选择对leucozyme的降解有抗性并结合目标配体如肺部组织中的目标的免疫球蛋白单可变结构域(dAb)的方法。所述方法包括提供包含多肽的集的噬菌体展示系统,所述多肽的集包含免疫球蛋白单可变结构域,组合所述噬菌体展示系统与leucozyme(约100μg/ml),并在约37℃孵育所述混合物例如过夜(例如,约12-16小时),然后根据与所述目标抗原的结合来选择展示了结合期望的目标抗原的dAb的噬菌体。
在另一个实例中,本发明是选择对胰蛋白酶的降解有抗性的肽或多肽的方法,包括提供肽或多肽的文库或集,在适合于胰蛋白酶的蛋白水解消化的条件下组合所述文库或集与胰蛋白酶,并选择、分离和/或回收对胰蛋白酶的降解有抗性、并具有期望的生物学活性的肽或多肽。
在特定的实施方式中,本发明是选择对胰蛋白酶的降解有抗性、并结合目标配体,例如肺部组织中的目标的免疫球蛋白单可变结构域(dAb)的方法。在这些实施方式中,提供包含dAbs的文库或集,在适用于胰蛋白酶的蛋白水解消化的条件下与胰蛋白酶(或包含胰蛋白酶的生物制品、提取物或匀浆)组合。选择结合目标配体的胰蛋白酶抗性dAbs。例如,所述胰蛋白酶抗性dAb当在胰蛋白酶的0.04%(w/w)溶液中在37℃孵育至少约2小时的时间时基本上不降解。优选的,所述胰蛋白酶抗性dAb当在胰蛋白酶的0.04%(w/w)溶液中在37℃孵育至少约3小时的时间时基本上不降解。更优选的,所述胰蛋白酶抗性dAb当在胰蛋白酶的0.04%(w/w)溶液中孵育至少约4小时、至少约5小时、至少约6小时、至少约7小时、至少约8小时、至少约9小时、至少约10小时、至少约11小时或至少约12小时的时间时基本上不降解。
在示范性的实施方式中,本发明是选择对胰蛋白酶的降解有抗性并结合目标配体如肺部组织中的目标的免疫球蛋白单可变结构域(dAb)的方法。所述方法包括提供包含多肽的集的噬菌体展示系统,所述多肽的集包含免疫球蛋白单可变结构域,组合所述噬菌体展示系统与胰蛋白酶(约100μg/ml),并在约37℃孵育所述混合物例如过夜(例如,约12-16小时),然后根据与所述目标抗原的结合来选择展示了结合期望的目标抗原的dAb的噬菌体。
在另一个方面,本发明是生产蛋白酶抗性肽或多肽的集的方法。所述方法包括提供肽或多肽的集;在适合蛋白酶活性的条件下组合所述肽或多肽的集与蛋白酶;以及回收具有期望的生物学活性的复数种肽或多肽;从而生产蛋白酶抗性肽或多肽的集。优选的,具有期望的生物学活性的复数种肽或多肽根据结合活性,例如对通用配体或目标配体的结合来回收。在此,对于本发明的其他方法,描述了在方法中适用的蛋白酶、展示系统、蛋白酶活性的条件以及选择肽或多肽的方法。
在某些实施方式中,使用包含肽或多肽的集的展示系统(例如,与核酸的编码功能和该核酸编码的肽或多肽的功能性特征相关的展示系统),以及所述方法进一步包括扩增编码所述复数种选定肽或多肽的核酸或提高所述核酸的拷贝数。可以使用任何合适的方法来扩增核酸,如通过噬菌体扩增、细胞生长或聚合酶链式反应。
在特定的实施方式中,本发明是生产包含dAbs的蛋白酶抗性多肽的集的方法。所述方法包括提供包含dAbs的多肽的集;在适合于蛋白酶活性的条件下组合所述肽或多肽的集与蛋白酶(例如,胰蛋白酶、弹性蛋白酶、leucozyme);以及回收包含具有对通用配体(例如,蛋白A、蛋白G、蛋白L)或目标配体的结合特异性的dAbs的复数种多肽。所述方法可以用于生产首次用于试验的()集,或偏向期望的结合特异性的集,例如基于具有对期望的目标配体的结合特异性的亲本dAb的亲和成熟集。
多肽展示系统
优选的,被提供用于本发明方法中的肽或多肽的集或文库包含合适的展示系统。所述展示系统优选可以抵抗蛋白酶的降解(例如,单种蛋白酶或蛋白酶的组合,以及含有蛋白水解活性的任何生物提取物、匀浆或制剂(例如,痰液、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管灌洗、肺匀浆、肺提取物、胰提取物、胃液、唾液、泪液等))。展示系统以及展示系统与所展示多肽之间的联系优选地至少与集中最稳定的肽或多肽那样抵抗蛋白酶。这容许容易地分离和/或扩增编码选定的展示多肽的核酸。
在一个实施例中,可以从溶液中或共价或非共价连接合适表面(如塑料或玻璃(例如,微滴定平板、多肽阵列,如微阵列))的肽或多肽的集中选择、分离和/或回收蛋白酶抗性肽或多肽。例如,可以使用在表面上的肽阵列,其排列方式使每个不同的文库成员(例如,独特的肽序列)处于阵列中分开的、预定的位置。可以通过阵列中的空间位置来测定该阵列中每个文库成员的身份。可以测定在目标配体例如与反应性文库成员之间发生结合作用的阵列中的位置,因此基于空间位置来鉴定反应性成员的序列。(参见,例如,U.S.专利No.5,143,854,WO90/15070和WO92/10092)。
优选,该方法使用与核酸的编码功能和该核酸编码的多肽的物理、化学和/或功能性特征相关的展示系统。这样的展示系统可以包括复数个可复制的遗传包,如细菌噬菌体或细胞(细菌)。优选,展示系统包括文库,如细菌噬菌体展示文库。细菌噬菌体展示是特别优选的展示系统。
已经描述了各种合适的细菌噬菌体展示系统(例如,单价展示和多价展示系统)。(参见,例如,Griffiths等,U.S.专利No.6,555,313B1(在此通过援引并入);Johnson等,U.S.专利No.5,733,743(在此通过援引并入);McCafferty等,U.S.专利No.5,969,108(在此通过援引并入);Mulligan-Kehoe,U.S.专利No.5,702,892(在此通过援引并入);Winter,G.等,Annu.Rev.Immunol.12:433-455(1994);Soumillion P.等,Appl.Biochem.Biotechnol.47(2-3):175-189(1994);Castagonoli,L.等,Comb.Chem.High Throughput Screen,4(2):121-133(2001))。细菌噬菌体展示系统中展示的肽或多肽可以在任何合适的细菌噬菌体上展示,如丝状噬菌体(例如,fd,M13,F1)、裂解性噬菌体(例如,T4、T7、λ)或RNA噬菌体(例如,MS2)。
通常,产生或提供展示肽或噬菌体多肽的集的噬菌体文库,作为与合适的噬菌体外壳蛋白(例如,fd pIII蛋白)的融合蛋白。融合蛋白可以展示在噬菌体外壳蛋白尖端的肽或多肽,或如果需要,在内部位置。例如,展示的肽或多肽可以存在于pIII结构域1的氨基-末端的位置。(pIII的结构域1也称为N1)。展示的多肽可以直接与pIII融合(例如,pIII结构域1的N-末端)或使用连接物与pIII融合。如果需要,融合体可以进一步包括标记物(例如,myc表位、His标记物)。可以使用任何合适的方法来产生包括作为与噬菌体外壳蛋白的融合蛋白展示的肽或多肽的集的文库,如通过将编码展示的肽或多肽的噬菌体载体或噬粒载体的文库引入合适的宿主细菌中,并培养所得到的细菌来产生噬菌体(例如,如果需要,使用合适的辅助噬菌体或互补质粒(complementary plasmid))。可以使用任何合适的方法从培养物中回收噬菌体文库,如沉淀和离心。
展示系统可以包含含有任何期望的量的多样性的肽或多肽的集。例如,集可以含有具有对应于由生物体、生物体组、期望的组织或期望的细胞类型表达的天然存在多肽的氨基酸序列的肽或多肽,或可以含有具有随机或随机化氨基酸序列的肽或多肽。如果需要,多肽可以共有共同的核心或支架。举例来说,所述集或文库中的所有多肽可以基于选自蛋白A、蛋白L、蛋白G、纤连蛋白结构域、anticalin、CTLA4、期望的酶(例如,聚合酶、纤维素酶)或来自免疫球蛋白超家族的多肽,如抗体或抗体片段(例如,抗体可变结构域)的支架。所述集或文库中的多肽可以包含随机或随机化氨基酸序列的限定区域和共同的氨基酸序列的区域。在某些实施方式中,集中所有或基本上所有的多肽是期望的类型,如期望的酶(例如,聚合酶)或期望的抗体的抗原结合片段(例如,人VH或人VL)。在优选的实施方式中,所述多肽展示系统包含多肽的集,其中每种多肽包含抗体可变结构域。举例来说,所述集中的每种多肽可以含有VH、VL或Fv(例如,单链Fv)。
可以使用任何合适的方法将氨基酸序列多样性引入任何期望的肽或多肽或支架的区域中。例如,可以通过使用任何合适的诱变方法(例如,低保真度PCR、寡核苷酸-介导的或定点突变、使用NNK密码子的多样化)或任何其他合适的方法制备编码多样化多肽的核酸的文库,将氨基酸序列多样性引入目标区域中,如抗体可变结构域的互补性决定区或疏水性结构域。如果需要,可以将待多样化的多肽区域随机化。
构成集的多肽的大小很大程度上是选择的问题,并且不需要统一的多肽大小。优选,集中的多肽至少具有三级结构(形成至少一个结构域)。
选择/分离/回收
可以使用任何合适的方法从集或文库(例如,在展示系统中)中选择、分离和/或回收蛋白酶抗性肽或多肽(例如,一群蛋白酶抗性多肽)。优选,基于可选择的特征(例如,物理特征、化学特征、功能性特征)来选择或分离蛋白酶抗性多肽。合适的可选择的功能性特征包括集中肽或多肽的生物活性,例如,结合通用配体(例如,超抗原)、结合目标配体(例如,抗原、表位、底物)、结合抗体(例如,通过肽或多肽上表达的表位)和催化活性。(参见,例如,Tomlinson等,WO99/20749;WO01/57065;WO99/58655)。
在一些实施方式中,从其中基本上所有蛋白酶抗性肽或多肽共有共同的可选择特征的肽或多肽的文库或集中选择和/或分离蛋白酶抗性肽或多肽。例如,可以从其中基本上所有蛋白酶抗性肽或多肽结合共同的通用配体、结合共同的目标配体、结合共同的抗体(或由其结合)或具有共同的催化活性的文库或集中选择蛋白酶抗性肽或多肽。这种类型的选择对于制备基于具有期望的生物活性的亲本肽或多肽的蛋白酶抗性肽或多肽的集特别有用,例如,进行免疫球蛋白单可变结构域的亲和性成熟时。
基于结合共同的通用配体的选择可以产生含有为原始库或集成分的全部或基本上全部蛋白酶抗性肽或多肽的肽或多肽的集合或群体。例如,可以通过淘选或使用合适的亲和性基质来选择、分离和/或回收结合目标配体或通用配体(如,蛋白A、蛋白L或抗体)的肽或多肽。可以通过将配体(例如,通用配体、目标配体)溶液加入合适的容器中(例如,试管、培养皿)并使配体沉积或覆盖在容器壁上来完成淘选。将过量的配体洗掉并将肽或多肽(例如,已经用蛋白酶孵育过的集)加入容器中,并将容器维持在适于肽或多肽结合固定化配体的条件下。将未结合的肽或多肽洗掉,使用任何合适的方法(如刮下(scraping)或降低pH)来回收结合的肽或多肽。
合适的配体亲和性基质通常含有固体支持物或珠子(例如,琼脂糖),配体与其共价或非共价连接。可以使用分批方法、柱方法或任何其他合适的方法,在适于肽或多肽与基质上的配体结合的条件下,将亲和性基质与肽或多肽(例如,已经用蛋白酶孵育过的集)组合。可以将没有结合亲和性基质的肽或多肽洗掉,并使用任何合适的方法将结合的肽或多肽洗脱并回收,例如用较低pH的缓冲液、用温和的变性剂(例如,脲)或竞争与配体结合的肽来洗脱。在一个实施例中,在适于集中的肽或多肽结合目标配体的条件下,将生物素化的目标配体与集组合。使用固定化的抗生物素蛋白或链霉抗生物素(例如,在珠子上)来回收结合的肽或多肽,
在一些实施方式中,通用或目标配体是抗体或其抗原结合片段。结合文库或集的肽或多肽中基本上保守的肽或多肽的结构特征的抗体或抗原结合片段作为通用配体是特别有用的。对于分离、选择和/或回收蛋白酶抗性肽或多肽而适宜用作配体的抗体和抗原结合片段可以是单克隆或多克隆的,并可以使用任何合适的方法来制备。
文库/集
在其他方面中,本发明涉及蛋白酶抗性肽和多肽的集、编码蛋白酶抗性肽和多肽的文库以及产生该文库和集的方法。
可以使用任何合适的方法制备或获得编码和/或含有蛋白酶抗性肽和多肽的文库。本发明的文库可被设计来编码基于感兴趣的肽或多肽(例如,选自文库的肽或多肽)的蛋白酶抗性肽或多肽,或可以使用本文所述的方法从另一个文库选择本发明的文库。例如,可以使用合适的多肽展示系统来制备富含蛋白酶抗性多肽的文库。
在一个实施例中,如本文所述的,在适于蛋白酶活性的条件下,将含有展示多肽的集的噬菌体展示文库与蛋白酶组合,该展示多肽含有免疫球蛋白单可变结构域(例如,VH、Vk、Vλ)。基于期望的生物活性,如结合活性(例如,结合通用配体,结合目标配体),来回收蛋白酶抗性多肽,由此产生富含蛋白酶抗性多肽的噬菌体展示文库。
在另一个实施例中,首先筛选包含展示的多肽的集的噬菌体文库来鉴定对期望的目标抗原具有结合特异性的集成员,该展示多肽含有免疫球蛋白单可变结构域(例如,VH、Vk、Vλ)。并如本文所述的,回收具有期望的结合特异性的多肽集合,在适于蛋白水解活性的条件下,将集合与蛋白酶组合。回收具有期望的目标结合特异性的蛋白酶抗性多肽的集合,产生富含蛋白酶抗性和高亲和性多肽的文库。如本文所述的,该选择方法中的蛋白酶抗性与高亲和性结合相关。
可以使用任何合适的方法容易地产生编码期望的类型多肽集的文库。例如,可以获得编码期望的类型多肽(例如,聚合酶、免疫球蛋白可变结构域)的核酸序列,并可以制备每个含有一个或更多个突变的核酸的集合,例如通过使用易错聚合酶链式反应(PCR)系统来扩增核酸,通过化学诱变(Deng等,J.Biol.Chem.269:9533(1994))或使用细菌突变体菌株(Low等,J.Mol.Biol.,260:359(1996))。
在其他实施方式中,为了多样化,可以靶向核酸的特定区域。突变选定位置的方法也是本领域公知的,并包括,例如,使用错配的寡核苷酸或简并的寡核苷酸,使用或不使用PCR。例如,已经通过将突变靶向抗原结合环形成了合成的抗体文库。已经将随机或半随机抗体H3和L3区域添加至种系免疫球蛋白V基因片段,以产生具有未突变框架区域的大文库(Hoogenboom和Winter(1992)上文;Nissim等(1994)上文;Griffiths等(1994)上文;DeKrui降(1995)上文)。将这样的多样化延伸来包括一些或全部其他抗原结合环(Crameri等(1996)Nature Med.2:100;Riechmann等(1995)Bio/Technology,13:475;Morphosys,WO97/08320,上文)。在其他实施方式中,对于多样化,可以靶向核酸的特定区域,例如,通过两步PCR策略,使用第一PCR的产物作为“mega-引物”。(参见,例如,Landt,O.等,Gene 96:125-128(1990))。例如,还可以通过SOE PCR来完成靶向多样化。(参见,例如,Horton,R.M.等,Gene 77:61-68(1989))。
可以通过改变编码序列来获得选定位置的序列多样性,编码序列限定了多肽的序列,使得可以在该位置引入各种可能的氨基酸(例如,全部的20个或其子集)。使用IUPAC命名,最通用的密码子是NNK,其编码所有氨基酸以及TAG终止密码子。优选使用NNK密码子,以引入期望的多样性。实现相同目的的其他密码子也是有用的,包括NNN密码子,其导致其他终止密码子TGA和TAA的产生。这样的靶向方法使得可以在目标区域中开发所有的序列空间。
优选的文库包含蛋白酶抗性多肽,其是免疫球蛋白超家族的成员(例如,抗体或其部分)。例如,文库可以包含具有已知主链构象的蛋白酶抗性抗体多肽。(参见,例如,Tomlinson等,WO99/20749)。可以在合适的质粒或载体中制备文库。如在此所用的,载体指的是用于将异源DNA引入用于其表达和/或复制的细胞中的离散元件。可以使用任何合适的载体,包括质粒(例如,细菌质粒)、病毒或细菌噬菌体载体、人造染色体和游离型载体。这样的载体可以用于简单克隆和诱变,或表达载体可以用于驱动文库的表达。载体和质粒通常含有一个或更多个克隆位点(例如,多连接物)、复制起点和至少一个可选择的标记基因。表达载体可以进一步含有用于驱动多肽转录和翻译的元件,如增强子元件、启动子、转录终止信号、信号序列等。可以以可操作地连接克隆的编码多肽的插入物的方式来安置这些元件,使得将该表达载体维持在适于表达的条件下(例如,在合适的宿主细胞中)时,表达和产生多肽。
克隆和表达载体通常含有能够使载体在一个或更多个选定的宿主细胞中复制的核酸序列。通常,在克隆载体中,该序列能够使载体独立于宿主染色体DNA而复制,并包括复制起点或自主复制序列。对于各种细菌、酵母和病毒,这样的序列是公知的。来自质粒pBR322的复制起点适用于大部分革兰氏阴性细菌,2微米质粒起点适用于酵母,而各种病毒起点(例如,SV40,腺病毒)适用于在哺乳动物细胞中克隆载体。通常,对于哺乳动物表达载体是不需要复制起点的,除非将这些用于能够复制高水平DNA的哺乳动物细胞中,如COS细胞。
克隆或表达载体可以含有也称为可选择标记的选择基因。这样的标记基因编码在选择性培养基中生长的转化宿主细胞的存活或生长需要的蛋白质。因此,没有用含有选择基因的载体转化的宿主细胞在培养基中将不会存活。通常的选择基因编码给予对抗生素和其他毒素(例如,氨苄青霉素、新霉素、氨甲喋呤或四环素)抗性、补充营养缺陷不足或提供生长培养基中不可获得的关键营养素的蛋白质。
合适的表达载体可以含有各种成分,例如,复制起点、可选择标记基因、一个或更多个表达控制元件,如转录控制元件(例如,启动子、增强子、终止子)和/或一个或更多个翻译信号、信号序列或前导序列等。表达控制元件和信号或前导序列如果存在,可以通过载体或其他来源来提供。例如,克隆的编码抗体链的核酸的转录和/或翻译控制序列可以用来指导表达。
可以提供启动子用于期望的宿主细胞中的表达。启动子可以是组成型或诱导型的。例如,启动子可以可操作地连接编码抗体、抗体链或其部分的核酸,使得其指导核酸的转录。用于原核宿主(例如,用于大肠杆菌的β-内酰胺酶和乳糖启动子系统、碱性磷酸酶、色氨酸(trp)启动子系统、lac、tac、T3、T7启动子)和真核宿主(例如,猿病毒40早期或晚期启动子、劳斯肉瘤病毒长末端重复启动子、巨细胞病毒启动子、腺病毒晚期启动子、EG-1a启动子)的各种合适的启动子是可获得的。
此外,表达载体通常含有用于选择携带载体的宿主细胞的可选择标记,并且在可复制表达载体的情况中,还含有复制起点。编码给予抗生素或药物抗性的产物的基因是常用的可选择标记,并可以用于原核细胞(例如,β-内酰胺酶基因(氨苄青霉素抗性)、用于四环素抗性的Tet基因)和真核细胞(例如,新霉素(G418或遗传霉素)、gpt(霉酚酸)、氨苄青霉素或潮霉素抗性基因)。二氢叶酸还原酶标记基因使得可以用氨甲喋呤在各种宿主中选择。编码宿主营养缺陷标记的基因产物的基因(例如,LEU2、URA3,HIS3)通常用作酵母中的可选择标记。还考虑了使用病毒(例如,杆状病毒)或噬菌体载体和能够整合至宿主细胞基因组的载体,如逆转录病毒载体。
用于在原核细胞(例如,细菌细胞,如大肠杆菌)或哺乳动物细胞中表达的合适表达载体包括,例如,pET载体(例如,pET-12a、pET-36、pET-37、pET-39、pET-40,Novagen等)、噬菌体载体(例如,pCANTAB5E,Pharmacia)、pRIT2T(蛋白A融合载体,Pharmacia)、pCDM8、pCDNA1.1/amp、pcDNA3.1、pRc/RSV、pEF-1(Invitrogen,Carlsbad,CA)、pCMV-SCRIPT、pFB、pSG5、pXT1(Stratagene,La Jolla,CA)、pCDEF3(Goldman,L A.等,Biotechniques,21:1013-1015(1996))、pSVSPORT(GibcoBRL,Rockville,MD)、pEF-Bos(Mizushima,S.等,Nucleic Acids Res.,18:5322(1990))等。适用于各种表达宿主如原核细胞(大肠杆菌)、昆虫细胞(果蝇Schnideer S2细胞,Sf9)、酵母(P.methanolica、巴斯德毕赤酵母、酿酒酵母(S.cerevisiae))和哺乳动物细胞(例如,COS细胞)中的表达载体是可获得的。
优选的载体是能够表达对应于多肽文库成员的核苷酸序列的表达载体。因此,可以通过分开的繁殖和表达表达多肽文库成员的单克隆的表达来进行使用通用配体和/或目标配体的选择。如以上所述的,优选的选择展示系统是细菌噬菌体展示。因此,可以使用噬菌体或噬粒载体。优选的载体是具有大肠杆菌复制起点(用于双链复制)以及噬菌体复制起点(用于生产单链DNA)的噬粒载体。这些载体的操纵和表达是本领域公知的(Hoogenboom和Winter(1992)上文;Nissim等(1994)上文)。简而言之,载体可以含有给予对噬粒的选择性的β-内酰胺酶基因和表达盒上游的lac启动子,该表达盒含有合适前导序列、多克隆位点、一个或更多个肽标记物、一个或更多个TAG终止密码子和噬菌体蛋白pIII。因此,使用大肠杆菌的各种抑制和非抑制菌株并添加葡萄糖、异丙基硫-β-D-半乳糖苷(IPTG)或辅助噬菌体如VCS M13,载体能够作为没有表达的质粒复制,只产生大量多肽文库成员或产物噬菌体,其中一些在其表面上含有多肽-pIII融合体的至少一个拷贝。
本发明的文库和集可以含有抗体形式。例如,文库和集内包含的多肽可以是完整的抗体或其片段,例如,Fab、F(ab’)2、Fv或scFv片段、独立的VH或VL结构域,其中任一个是修饰的或未修饰的。可以使用任何合适的方法,容易地产生scFv片段,以及其他抗体多肽。各种合适的抗体工程化方法是本领域公知的。例如,可以通过将编码两个可变结构域的核酸连接合适的编码合适的连接肽的寡核苷酸来形成scFv,连接肽如(Gly-Gly-Gly-Gly-Ser)3或其他合适的连接肽。连接物桥接第一V区的C-端和第二V区的N-端。可以使用相似的技术,用于构建其他抗体形式,如Fv、Fab和F(ab’)2片段。为了使Fab和F(ab’)2格式化,可以将VH和VL多肽与恒定区片段组合,恒定区片段分离自重排基因、种系C基因或从抗体序列数据合成的。根据本发明的文库或集可以是VH或VL文库或集。
包含蛋白酶抗性可变结构域的多肽优选的包含目标配体结合位点和/或通用配体结合位点。在某些实施方式中,通用配体结合位点是用于超抗原(如蛋白A、蛋白L或蛋白G)的结合位点。可变结构域可以基于任何期望的可变结构域,例如,人VH(例如,VH1a、VH1b、VH2、VH3、VH4、VH5、VH6)、人Vλ(例如,VλI、VλII、VλIII、VλIV、VλV、VλVI或Vκl)或人Vκ(例如,Vκ2,Vκ3,Vκ4,Vκ5,Vκ6,Vκ7,Vκ8,Vκ9或Vκ10)。
核酸、宿主细胞和生产蛋白酶抗性多肽的方法
本发明还涉及分离的和/或重组的编码蛋白酶抗性肽或多肽,例如,通过本文所述的方法可选择或选择的肽或多肽,的核酸。
在此称为“分离的”核酸是已经与原始环境(例如,在细胞或在核酸混合物如文库中)中的其他物质(例如,其他核酸,如基因组DNA、cDNA和/或RNA)分开的核酸。分离的核酸可以作为载体(例如,质粒)的一部分来分离。
在此称为“重组的”核酸是通过重组DNA方法产生的核酸,重组DNA方法包括依赖于人工重组的方法,如克隆至载体或染色体中,使用例如,限制性酶、同源重组、病毒等,以及使用聚合酶链式反应(PCR)制备的核酸。
本发明还涉及重组宿主细胞,其包括(一个或更多个)重组核酸或含有编码蛋白酶抗性肽或多肽的核酸的表达构建体,所述蛋白酶抗性肽或多肽例如,通过本文所述的方法可选择的或选择的肽或多肽。本发明还包括制备蛋白酶抗性肽或多肽的方法,其包括将本发明的重组宿主细胞维持在适于蛋白酶抗性肽或多肽表达的条件下。如果需要,该方法可以进一步包括分离或回收蛋白酶抗性肽或多肽的步骤。
例如,可以使用任何适于选定宿主细胞的方法(例如,转化、转染、电穿孔、感染),将编码蛋白酶抗性肽或多肽的核酸分子(即,一个或更多个核酸分子),或含有该核酸分子的表达构建体(即,一个或更多个构建体)引入合适的宿主细胞中,以形成重组宿主细胞,使得核酸分子可操作地连接一个或更多个表达控制元件(例如,在载体中、在通过细胞中的加工形成的构建体中、整合至宿主细胞基因组)。可将所得到的重组宿主细胞维持在适于表达的条件下(例如,在诱导剂的存在下、在合适的动物中、在补充了适当盐、生长因子、抗生素、营养补充剂等的合适培养基中等),由此产生编码的肽或多肽。如果需要,可以分离或回收编码的肽或多肽(例如,从动物、宿主细胞、培养基、乳)。该方法包括在转基因动物的宿主细胞中的表达(参见,例如,WO92/03918,GenPharm International)。
还可以在合适的体外表达系统中,通过化学合成或通过任何其他合适的方法,来产生通过本文所述的方法选择的蛋白酶抗性肽或多肽。
多肽、dAb&拮抗剂
如本文所述和举例说明的,本发明的蛋白酶抗性dAb通常以高亲和性结合它们的目标配体。因此,在另一个方面中,提供了选择、分离和/或回收本发明的以高亲和性结合目标抗原的多肽或dAb。通常,该方法包括提供肽或多肽(例如,dAb)的文库或集,在适于蛋白酶活性的条件下,将文库或集与蛋白酶(例如,胰蛋白酶、弹性蛋白酶、leucozyme、胰酶、痰液)组合,并选择、分离和/或回收结合配体(例如,目标配体)的肽或多肽。因为已经在蛋白酶敏感性肽或多肽将得到消化的条件下将文库或集暴露于蛋白酶,因此蛋白酶的活性可以消除具有低结合亲和性的不太稳定的多肽,并因此产生高亲和性结合肽或多肽的集合。例如,本发明的多肽或dAb可以以1μM或更强、或约500nM到约0.5pM的亲和性(KD,KD=Koff(kd)/Kon(ka),如通过表面等离子体共振所测定的)来结合目标抗原。例如,本发明的多肽或dAb可以以约500nM、约100nM、约10nM、约1nM、约500pM、约100pM、约10pM、约1pM或约0.5pM的亲和性结合目标抗原(例如,TNFR1)。尽管我们没有受到任何特定理论的束缚,认为能抵抗蛋白酶的肽或多肽具有较低的熵和/或较高的稳定能量。因此,蛋白酶抗性与高亲和性结合之间的关联可能与通过本文所述的方法选择的肽和多肽和dAb表面的紧密性和稳定性相关。
在一个实施方式中,本发明的多肽、dAb或拮抗剂以约500nM到50pM、或100nM到50pM、或10nM到100pM、或1nM到100pM;例如50nM或更低、或5nM或更低、或500pM或更低、或200pM或更低、或100pM或更低的抑制浓度50(IC50)抑制抗原配体(例如,TNFα)与它的相关受体(例如,TNF α受体I(p55受体))的结合。
在某些实施方式中,多肽、dAb或拮抗剂特异性地结合目标抗原,并与人目标抗原解离,具有300nM至1pM的解离常数(KD),或300nM至5pM,或50nM至1pM,或50nM至5pM,或50nM至20pM,或约10pM,或约15pM,或约20pM,如通过表面等离子体共振所测定的。在某些实施方式中,多肽、dAb或拮抗剂特异性地结合目标抗原(例如,TNFR1,人TNFRI),并与目标抗原解离,具有5×10-1s-1至1×10-7s-1、或1×10-3s-1至1×10-7s-1、或1×10-4s-1至1×10-7s-1、或1×10-5s-1至1×10-7s-1、或1×10-4s-1、或1×10-5s-1的Koff速度常数,如通过表面等离子体共振所测定的。在某些实施方式中,多肽、dAb或拮抗剂特异性地结合目标抗原(TNFR1,例如,人类TNFRI),具有1×10-3M-1s-1至1×10-7M-1s-1的Kon,或1×10-3M-1s-1至1×10-6M-1s-1,或约1×10-4M-1s-1或约1×10-5M-1s-1。在一个实施方式中,多肽、dAb或拮抗剂特异性地结合目标抗原(例如,TNFR1,例如,人类TNFRI),并与目标抗原解离,具有在本段落中限定的解离常数(KD)和Koff。在一个实施方式中,多肽、dAb或拮抗剂特异性地结合目标抗原(例如,TNFR1,例如,人类TNFRI),并与目标抗原解离,具有本段落中限定的解离常数(KD)和Kon。在一些实施方式中,多肽或dAb特异性地结合目标抗原(例如TNFR1,(例如,人类TNFR1)),具有该段落中引用的KD和/或Koff和/或Kon,并包括与附图中所示免疫球蛋白单可变结构域的氨基酸序列为至少或至少约80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
可以在大肠杆菌或毕赤酵母属种(例如,巴斯德毕赤酵母)中表达多肽、dAb或拮抗剂。在一个实施方式中,在大肠杆菌或毕赤酵母属种(例如,巴斯德毕赤酵母)中表达时,以至少约0.5mg/L的量来分泌配体或dAb单体。尽管,在大肠杆菌或毕赤酵母属种(例如,巴斯德毕赤酵母)中表达时,本文所述的配体和dAb单体是可分泌的,可以使用任何合适的方法来生产,如合成的化学方法或没有使用大肠杆菌或毕赤酵母属种的生物生产方法。
在一些实施方式中,多肽、dAb或拮抗剂不含有Camelid免疫球蛋白可变结构域,或一个或更多个框架氨基酸,这些氨基酸对于由Camelid种系抗体基因片段编码的免疫球蛋白可变结构域是独特的,例如,在位置108、37、44、45和/或47。
根据本发明的拮抗剂可以是单价的或多价的。在一些实施方式中,拮抗剂是单价的并含有一个与目标抗原相互作用的结合位点,该结合位点是由本发明的多肽或dAb提供的。单价拮抗剂结合一个目标抗原并可以不诱导导致受体和信号转导激活的细胞表面上的目标抗原(例如,受体抗原)的交联或聚集(clustering)。
在其他实施方式中,拮抗剂是多价的。多价拮抗剂可以含有两个或更多个用于目标抗原的特定结合位点的拷贝或含有两个或更多个结合目标抗原的不同结合位点,至少一个结合位点是由本发明的多肽或dAb提供的。例如,如本文所述的,拮抗剂可以是二聚体、三聚体或多聚体,其含有两个或更多个本发明的结合目标抗原的特定多肽或dAb的拷贝,或两个或更多个本发明的结合目标抗原的不同多肽或dAb。在一个实施方式中,多价拮抗剂结合细胞表面受体抗原,并且在标准的细胞分析中基本上不激动抗原(作为抗原的激动剂)。
在某些实施方式中,多价拮抗剂含有两个或更多个用于目标抗原的期望的表位或结构域的结合位点。
在其它实施方式中,多价拮抗剂含有结合目标抗原的不同表位或结构域的、由本发明的多肽或dAb提供的两个或更多个结合位点。
在某些实施方式中,给予有效量时,本发明的多肽、dAb或拮抗剂在慢性炎症疾病的模型中是有效的。通常,有效量为约1mg/kg至约10mg/kg(例如,约1mg/kg,约2mg/kg,约3mg/kg,约4mg/kg,约5mg/kg,约6mg/kg,约7mg/kg,约8mg/kg,约9mg/kg或约10mg/kg)。本领域技术人员认为慢性炎症的模型(参见WO2006038027中描述的那些)预示着在人体中的治疗功效。
通常,本发明的配体(例如,拮抗剂)将以纯化的形式与药物学上合适的载体一起使用。通常,这些载体包括水或醇/水溶液、乳液或悬浮液、任何包括盐和/或缓冲的基质。肠胃外载体包括氯化钠溶液、Ringer’s葡萄糖、葡萄糖和氯化钠和乳酸化Ringer’s。如果需要在悬浮液中保持多肽复合物,合适的生理学上可接受的佐剂可以选自增稠剂,如羧甲基纤维素、聚乙烯吡咯烷酮、明胶和藻酸盐。
静脉内载体包括流体和营养补充剂和电解质补充剂,如基于Ringer’s葡萄糖的那些。防腐剂和其他添加剂,如抗微生物剂、抗氧化剂、螯合剂和惰性气体,也可以存在(Mack(1982)Remington′sPharmaceutical Sciences,第16版)。可以使用各种合适的制剂,包括缓释制剂。
本发明的配体(例如,拮抗剂)可以用作分开给药的组合物或联合其他药剂。这些可包括各种免疫治疗药物,如环孢霉素、氨甲喋呤、阿霉素或顺铂和免疫毒素。药物组合物可以包括各种细胞毒性或其他药剂与本发明配体联合的“cocktails”,或甚至是根据本发明的具有不同特异性的配体的组合,如使用不同目标抗原或表位选择的配体,不管是否是在给药之前混合。
根据本发明的药物组合物的给药途径可以是任何本领域技术人员公知的那些。对于治疗,包括但不限于免疫治疗,根据标准技术将本发明选定的配体给药于任何患者。
给药可以是任何合适的模式,包括肠胃外、静脉内、肌内、腹膜内、经皮、通过肺的途径,或者其他,合适地,通过用导管直接灌输。给药的剂量和频率将取决于患者的年龄、性别和状况、其他药物的同时给药、禁忌和医师将要考虑的其他参数。如所示的,给药可以是局部(例如,通过肺部给药局部递送至肺,例如,鼻内给药)或全身的。
可以将本发明的配体冻干,用于存储以及在使用前在合适的载体中重建。已经表明该技术对常规的免疫球蛋白是有效的,并可以使用本领域已知的冻干和重建技术。本领域技术人员将认识到冻干和重建可能导致抗体活性不同程度的损耗(例如,使用常规的免疫球蛋白,IgM抗体的活性损耗易于比IgG抗体高),可以调高使用水平来补偿。
可以将含有本发明配体(例如,拮抗剂)或其cocktail的组合物给药来用于预防和/或治疗处理。在特定的治疗应用中,将实现选定细胞群的至少部分抑制(inhibition)、阻抑(suppression)、调节、杀灭或一些其他可测量参数的适当含量定义为“治疗有效量”。实现该剂量需要的含量将取决于疾病的严重程度和患者自身免疫系统的一般状况,但通常为0.005至5.0mg配体/kg体重,配体例如为dAb或拮抗剂,更常使用0.05至2.0mg/kg/剂的剂量。对于预防性应用,可以给药相似或略低剂量的含有本发明配体或其cocktail的组合物,以预防、抑制或延迟疾病的发作(例如,维持缓解或静止,或防止急性期)。本领域技术人员能够测定治疗、阻抑或预防疾病的合适给药间隔。将TNFR1的配体(例如,拮抗剂)给药来治疗、阻抑或预防慢性炎症疾病时,可以给药最高达四次/天,每周两次,每周一次,每两周一次,一月一次或每两月一次,例如,剂量为约10μg/kg至约80mg/kg,约100μg/kg至约80mg/kg,约1mg/kg至约80mg/kg,约1mg/kg至约70mg/kg,约1mg/kg至约60mg/kg,约1mg/kg至约50mg/kg,约1mg/kg至约40mg/kg,约1mg/kg至约30mg/kg,约1mg/kg至约20mg/kg,约1mg/kg至约10mg/kg,约10μg/kg至约10mg/kg,约10μg/kg至约5mg/kg,约10μg/kg至约2.5mg/kg,约1mg/kg,约2mg/kg,约3mg/kg,约4mg/kg,约5mg/kg,约6mg/kg,约7mg/kg,约8mg/kg,约9mg/kg或约10mg/kg。在特定的实施方式中,将TNFR1的配体(例如,拮抗剂)给药来治疗、阻抑或预防慢性炎症疾病,每两周一次或一月一次,剂量为约10μg/kg至约10mg/kg(例如,约10μg/kg,约100μg/kg,约1mg/kg,约2mg/kg,约3mg/kg,约4mg/kg,约5mg/kg,约6mg/kg,约7mg/kg,约8mg/kg,约9mg/kg或约10mg/kg)。
如果相对于治疗前存在的症状,或相对于没有用该组合物治疗的个体(人或模型动物)或其他合适对照中的症状,一种或更多种症状得到减轻(例如,至少10%或临床评价等级的至少一个点),认为使用本文所述的组合物进行的处理或治疗是″有效的″。症状将根据靶向的疾病或病症而明显不同,但可以通过普通医师或技术人员来测量。例如,可以通过监控疾病或病症的一个或更多个生化指示剂的水平(例如,与疾病相关的酶或代谢产物的水平、受影响细胞的数目等)、通过监控身体表现(例如,炎症、肿瘤大小等),或通过公认临床评价等级,例如,扩展的残疾状态等级(Expanded Disability Status Scale,用于多发性硬化)、Irvine炎症性肠病问卷(Irvine Inflammatory Bowel DiseaseQuestionnaire(32点评定评估关于肠功能、全身性症状、社会功能和情绪状态的生活质量,计分从32到224,更高的计分表明更好的生活质量)、类风湿性关节炎的生活质量等级(Quality of Life RheumatoidArthritis Scale),或本领域已知的其他公认的临床评估等级,来测量该症状。在疾病或病症症状方面维持降低(例如,一天或更多天,或更久)至少10%或给定临床等级的一个或更多个点值,是“有效的”治疗的指示。相似地,如果相对于未用组合物治疗的相似个体(人或动物模型)中的症状,一种或更多种症状的发作或严重程度得到了延迟、减轻或消除,使用本文所述的组合物进行的预防是″有效的″。
可以在预防或治疗情境中使用含有根据本发明的配体(例如,拮抗剂)或其cocktail的组合物,以帮助改变、灭活、杀灭或除去哺乳动物中选定的目标细胞群。此外,本文所述的选定的多肽集可以体外地(extracorporeally)或在体外(in vitro)选择性地从异源细胞集合中杀灭、耗尽或另外有效地除去目标细胞群。可以根据标准技术,将来自哺乳动物的血液在体外与配体组合,由此杀灭或另外从用于返回至哺乳动物的血液中除去不期望的细胞。
可以在预防或治疗情况中使用含有根据本发明的配体(例如,拮抗剂)的组合物,以帮助改变、灭活、杀灭或除去哺乳动物中选定的目标细胞群。
可以将配体(例如,抗-目标抗原拮抗剂、dAb单体)给药,和或与一种或更多种其他的治疗剂或活性剂一起配制。配体(例如,dAb)与其他的治疗剂一起给药时,可以在给药其他药剂之前、同时或之后,给药配体。通常,以提供重叠治疗效果的方式来给药配体和其他药剂。
在一个实施方式中,本发明是用于治疗、阻抑或预防慢性炎症疾病的方法,包括将治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂给药于需要其的哺乳动物。
在一个实施方式中,本发明是治疗、阻抑或预防关节炎(例如,类风湿性关节炎、青少年类风湿性关节炎、关节强硬性脊椎炎、银屑病性关节炎)的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
在另一个实施方式中,本发明是治疗、阻抑或预防银屑病的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
在另一个实施方式中,本发明是治疗、阻抑或预防炎症性肠病(例如,Crohn′s病、溃疡性结肠炎)的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
在另一个实施方式中,本发明是治疗、阻抑或预防慢性阻塞性肺病(例如,慢性支气管炎、慢性阻塞性支气管炎、肺气肿)的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
在另一个实施方式中,本发明是治疗、阻抑或预防肺炎(例如,细菌性肺炎,例如葡萄球菌肺炎)的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
本发明提供了治疗、阻抑或预防除了慢性阻塞性肺病和肺炎之外的其他肺部疾病的方法。根据本发明可以被治疗、阻抑或预防的其他肺部疾病包括,例如,囊性纤维化和哮喘(例如,类固醇抗性哮喘)。因而,在另一个实施方式中,本发明是治疗、阻抑或预防肺部疾病(例如,囊性纤维化,哮喘)的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
在特定的实施方式中,拮抗剂是经由肺部递送,例如,通过吸入(例如,支气管内的、鼻内的或口腔的吸入,鼻内的滴剂)或通过全身性递送(例如,肠胃外的、静脉内的、肌肉内的、腹膜内的、皮下的)来施用的。
在另一个实施方式中,本发明是治疗、阻抑或预防脓毒性休克的方法,包括向需要其的哺乳动物施用治疗有效剂量或数量的根据本发明的多肽、dAb或拮抗剂。
在本发明的进一步的方面中,提供了组合物,其包含根据本发明的多肽、dAb或拮抗剂,以及药学上可接受的载体、稀释剂或赋形剂。
此外,本发明提供了利用根据本发明的多肽、dAb或拮抗剂或组合物治疗疾病的方法。在一个实施方式中,所述疾病是癌症或炎性疾病,例如,类风湿性关节炎、哮喘或Crohn’s病。
形式
提高的半衰期在免疫球蛋白,特别是抗体,最特别是小尺寸的抗体片段的体内应用中是有用的。这样的片段(Fv、二硫化物键合的Fv、Fab、scFv、dAb)能从体内快速清除;因此,尽管它们能够快速地到达身体的大部分部位,并且能快速产生和更容易操作,但它们在体内的应用受到仅在体内短暂持续的限制。本发明的一个实施方式通过提供体内半衰期延长的配体并且随后配体的功能活性在体内持续更长时间来解决了该问题。
药物动力学分析和配体半衰期的测定的方法是本领域技术人员熟知的。可以在Kenneth,A等:Chemical Stability of Pharmaceuticals:AHandbook for Pharmacists(药物动力学的化学稳定性:药剂师手册)和Peters等,Pharmacokinetc analysis:A Phactical Approach(药物动力学分析:实践方法)(1996)中找到详细内容。还可以参考“Pharmacokinetics”(药物动力学),M Gibaldi & D Perron,Marcel Dekker出版,2nd Rev.exedition(1982),其描述了药物动力学参数,如tα和tβ半衰期和曲线下面积(AUC)。
可以从配体随时间的血清浓度曲线确定半衰期(t1/2α和t1/2β)和AUC。例如,可以使用WinNonlin分析包(从Pharsight Corp.,MountainView,CA94040,USA获得)来模拟曲线。在第一期中(α期),配体主要经历在患者中的分布,并有一些清除。第二期(β期)是配体已经得到分布的末期,血清浓度随着配体从患者体内清除出去而降低。tα半衰期是第一期的半衰期,而tβ半衰期是第二期的半衰期。因此,在一个实施方式中,本发明提供了具有15分钟或更长tα半衰期的根据本发明的配体或含有配体的组合物。在一个实施方式中,范围的下限是30分钟、45分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、10小时、11小时或12小时。此外,或可替换地,根据本发明的配体或组合物将具有最高达并包括12小时的tα半衰期。在一个实施方式中,范围的上限是11、10、9、8、7、6或5小时。合适范围的实例是1至6小时,2至5小时或3至4小时。
在一个实施方式中,本发明提供具有2.5小时或更长tβ半衰期的根据本发明的配体(多肽、dAb或拮抗剂)或含有配体的组合物。在一个实施方式中,范围的下限是3小时,4小时,5小时,6小时,7小时,10小时,11小时或12小时。此外,或可替换地,根据本发明的配体或组合物将具有最高达并包括21天的tβ半衰期。在一个实施方式中,范围的上限是12小时,24小时,2天,3天,5天,10天,15天或20天。在一个实施方式中,根据本发明的配体或组合物将具有12至60小时的tβ半衰期。在进一步的实施方式中,将是12至48小时。在仍然进一步的实施方式中,将是12至26小时。
对于以上标准,另外或可替换地,本发明提供了具有1mg.min/ml或更高AUC值(曲线下面积)的根据本发明的配体或含有配体的组合物。在一个实施方式中,范围的下限是5、10、15、20、30、100、200或300mg.min/ml。此外,或可替换地,根据本发明的配体或组合物具有最高达600mg.min/ml的AUC。在一个实施方式中,范围的上限是500、400、300、200、150、100、75或50mg.min/ml。在一个实施方式中,根据本发明的配体具有选自以下范围的AUC:15至150mg.min/ml,15至100mg.min/ml,15至75mg.min/ml和15至50mg.min/ml。
例如,通过连接PEG基团、血清白蛋白、转铁蛋白、转铁蛋白受体或至少其转铁蛋白结合部分、抗体Fc区,或通过缀合抗体结构域,将本发明的多肽和dAb以及含有这些的拮抗剂格式化,以具有较大的流体动力学大小。例如,将多肽dAb和拮抗剂格式化成较大的抗体的抗原结合片段或抗体(例如,格式化成Fab、Fab’、F(ab)2、F(ab’)2、IgG、scFv)。
可以使用本领域公知的方法来测定本发明配体(例如,dAb单体或多聚体)的流体动力学大小。例如,凝胶过滤色谱可以用来测定配体的流体动力学大小。用于测定配体的流体动力学大小的合适的凝胶过滤基质,如交联的琼脂糖基质,是公知的并容易获得。
配体形式的大小(例如,连接dAb单体的PEG部分的大小)可以根据期望的应用而改变。例如,在打算将配体离开循环并进入外周组织的情况中,希望保持低的配体流体动力学大小,以促进从血流中外渗。或者,在期望配体在全身循环中保持更长时间的情况中,可以提高配体的大小,例如,通过格式化成Ig样蛋白。
通过靶向提高体内半衰期的抗原或表位来延长半衰期
如本文所述的,还可以通过将本发明的目标抗原结合多肽、dAb或拮抗剂缀合或缔合结合提高体内半衰期的抗原或表位的结合结构域(例如,抗体或抗体片段)来提高配体的流体动力学大小及其血清半衰期。例如,可以将目标抗原结合剂(例如,多肽)缀合或连接抗-血清白蛋白或抗-新生儿Fc受体抗体或抗体片段,例如,抗-SA或抗新生儿Fc受体dAb、Fab、Fab’或scFv,或抗-SA affibody或抗-新生儿Fc受体affibody或抗-SA avimer,或抗-SA结合结构域,其包含选自但优选不限于CTLA-4、lipocallin、SpA、affibody、avimer、GroEl和纤连蛋白的支架(对于这些结合结构域的公开内容,参见,PCT/GB2008/000453,2008年2月8日申请,在此将该结构域及其序列通过援引并入,并形成本发明文本公开内容的部分)。缀合指的是含有结合(共价或非共价)于结合血清白蛋白的结合结构域的本发明的多肽、dAb或拮抗剂的组合物。
提高体内血清半衰期的合适多肽包括,例如,转铁蛋白受体特异性配体-神经药剂融合蛋白(参见,U.S.专利No.5,977,307,在此将其教导通过援引并入)、脑毛细管内皮细胞受体、转铁蛋白、转铁蛋白受体(例如,可溶性转铁蛋白受体)、胰岛素、胰岛素样生长因子1(IGF1)受体、胰岛素样生长因子2(IGF2)受体、胰岛素受体、凝血因子X、α1-抗胰蛋白酶和HNF1α。合适的提高血清半衰期的多肽还包括α1-糖蛋白(血清类粘蛋白;AAG)、α1-抗胰凝乳蛋白酶(ACT)、α1-微球蛋白(蛋白HC;AIM)、抗凝血酶III(AT III)、载脂蛋白A-1(Apo A-1)、载脂蛋白B(Apo B)、血浆铜蓝蛋白(Cp)、补体成分C3(C3)、补体成分C4(C4)、C1弹性蛋白酶抑制剂(C1 INH)、C-反应性蛋白(CRP)、铁蛋白(FER)、血红素结合蛋白(HPX)、脂蛋白(a)(Lp(a))、甘露糖-结合蛋白(MBP)、肌红蛋白(Myo)、前清蛋白(甲状腺素运载蛋白(transthyretin);PAL)、视黄醇-结合蛋白(RBP)和类风湿因子(RF)。
来自胞外基质的合适蛋白包括,例如,胶原蛋白、层粘连蛋白、整联蛋白和纤连蛋白。胶原蛋白是胞外基质主要的蛋白。目前已知约15种类型的胶原蛋白分子,在身体的不同部位发现,例如,在骨、皮肤、腱、韧带、角膜、内脏中发现的I型胶原蛋白(占身体胶原蛋白的90%),或在软骨、脊椎盘、脊索和眼的玻璃体液中发现的II型胶原蛋白。
来自血液的合适蛋白包括,例如,血浆蛋白(例如,纤维蛋白、α-2巨球蛋白、血清白蛋白、纤维蛋白原(例如,纤维蛋白原A、纤维蛋白原B)、血清淀粉状蛋白A、结合珠蛋白、抑制蛋白、泛素、子宫球蛋白和β-2-微球蛋白)、酶和酶抑制剂(例如,纤维蛋白溶酶原、溶菌酶、半胱氨酸蛋白酶抑制剂(cystatin)C、α-1-抗胰蛋白酶和胰腺胰蛋白酶抑制剂)、免疫系统的蛋白,如免疫球蛋白(例如,IgA、IgD、IgE、IgG、IgM、免疫球蛋白轻链(κ/λ))、转运蛋白(例如,视黄醇结合蛋白、α-1微球蛋白)、防卫素(例如,β-防卫素1、嗜中性白细胞防卫素1、嗜中性白细胞防卫素2和嗜中性白细胞防卫素3)等。
在血脑屏障或神经组织中发现的合适蛋白包括,例如,黑皮质素受体、髓磷脂、抗坏血酸转运蛋白等。
提高体内血清半衰期的合适多肽还包括位于肾脏中的蛋白(例如,多囊蛋白、IV型胶原蛋白、有机阴离子转运蛋白K1、Heymann’s抗原)、位于肝脏中的蛋白(例如,醇脱氢酶、G250)、位于肺中的蛋白(例如,分泌成分,其结合IgA)、位于心脏中的蛋白(例如,HSP27,其与扩张型心肌病相关)、位于皮肤中的蛋白(例如,角蛋白)、骨特异性蛋白,如骨形态发生蛋白(BMP),其是显示了骨形成活性的蛋白的转化生长因子β超家族的亚组(例如,BMP-2、BMP-4、BMP-5、BMP-6、BMP-7、BMP-8)、肿瘤特异性蛋白(例如,滋养层抗原、herceptin受体、雌激素受体、组织蛋白酶(例如,组织蛋白酶B,其可以在肝脏和脾脏中找到)。
合适的疾病特异性蛋白包括,例如,只在激活的T-细胞上表达的抗原,包括LAG-3(淋巴细胞激活基因)、骨保护素配体(OPGL;参见Nature 402,304-309(1999)),OX40(TNF受体家族的成员,在激活的T细胞上表达并在人I-型T细胞白血病病毒(HTLV-I)产生细胞中特异性地上调;参见Immunol.165(1):263-70(2000))。合适的疾病特异性蛋白还包括,例如,金属蛋白酶(与关节炎/癌症相关),包括CG6512果蝇、人截瘫蛋白(paraplegin)、人FtsH、人AFG3L2、鼠ftsH;和血管生成生长因子,包括酸性成纤维细胞生长因子(FGF-1)、碱性成纤维细胞生长因子(FGF-2)、血管内皮生长因子/血管通透因子(VEGF/VPF)、转化生长因子-α(TGFα)、肿瘤坏死因子-α(TNF-α)、血管生成素、白细胞介素-3(IL-3)、白细胞介素-8(IL-8)、血小板衍生内皮生长因子(PD-ECGF)、胎盘生长因子(PlGF)、中期因子(midkine)血小板-衍生生长因子-BB(PDGF)和CXXXC趋化因子。
提高体内血清半衰期的合适多肽还包括应激蛋白,如热休克蛋白(HSP)。HSP通常在细胞内发现。在胞外发现时,它是细胞已经死亡并溢出其内含物的指示剂。作为创伤、疾病或损伤的结果时,发生这种非程序化细胞死亡(坏死),胞外HSP引发了来自免疫系统的应答。结合胞外HSP可以导致将本发明的组合物定位于患病部位。
涉及Fc转运的合适蛋白包括,例如,Brambell受体(也称为FcRB)。这种Fc受体具有两个功能,对于递送都是潜在有用的。功能是(1)通过胎盘将IgG从母体转运至子女,(2)保护IgG免受降解,由此延长其血清半衰期。认为受体使来自核内体的IgG再循环。(参见,Holliger等,Nat Biotechnol 15(7):632-6(1997))。
结合血清白蛋白的dAb
在一个实施方式中,本发明提供了多肽或拮抗剂(例如,双特异性配体),其含有结合目标抗原的抗目标抗原dAb(第一dAb)和结合血清白蛋白(SA)的第二dAb,第二dAb结合SA,具有通过表面等离子体共振测定的1nM至1、2、3、4、5、10、20、30、40、50、60、70、100、200、300、400或500μM(即,×10-9至5×10-4)的KD,或100nM至10μM,或1至5μM,或3至70nM,或10nM至1、2、3、4或5μM。例如,30至70nM,如通过表面等离子体共振所测定的。在一个实施方式中,第一dAb(或dAb单体)结合SA(例如,HSA),具有通过表面等离子体共振测定的大约1、50、70、100、150、200、300nM或1、2或3μM的KD。在一个实施方式中,对于含有第一抗-SA dAb和第二对目标抗原的dAb的双特异性配体,第二dAb对其目标的亲和性(例如KD和/或Koff,如通过表面等离子体共振所测量的,例如使用BiaCore)为第一dAb对SA的亲和性的1至100000倍(例如,100至100000,或1000至100000,或10000至100000倍)。在一个实施方式中,血清白蛋白是人血清白蛋白(HSA)。例如,第一dAb以大约10μM的亲和性结合SA,而第二dAb以100pM的亲和性结合其目标。在一个实施方式中,血清白蛋白是人血清白蛋白(HSA)。在一个实施方式中,第一dAb以大约50,例如,70、100、150或200nM的KD结合SA(例如,HSA)。双特异性配体的详细内容可以在WO03002609、WO04003019和WO04058821中找到。
在一个实施方式中,本发明的配体包含结合血清白蛋白(SA)的dAb,具有通过表面等离子体共振测定的1nM至1、2、3、4、5、10、20、30、40、50、60、70、100、200、300、400或500μM(即,×10-9至5×10-4)的KD,或100nM至10μM,或1至5μM,或3至70nM,或10nM至1、2、3、4或5μM。例如,30至70nM,如通过表面等离子体共振所测定的。在一个实施方式中,第一dAb(或dAb单体)结合SA(例如,HSA),具有通过表面等离子体共振测定的大约1、50、70、100、150、200、300nM或1、2或3μM的KD。在一个实施方式中,第一和第二dAb通过连接物连接,例如,1至4个氨基酸的连接物,或1至3个氨基酸,或多于3个氨基酸,或多于4、5、6、7、8、9、10、15或20个氨基酸。在一个实施方式中,可以使用较长的连接物(多于3个氨基酸)来提高功效(拮抗剂中一个或两个dAb的KD)。
在配体和拮抗剂的特定实施方式中,dAb结合人血清白蛋白并与选自以下的dAb竞争与白蛋白的结合:
MSA-16、MSA-26(对于这些序列的公开内容,参见WO04003019,在此将该序列及其核酸对应物通过援引并入并形成本发明文本公开内容的部分),
DOM7m-16(SEQ ID NO:473),DOM7m-12(SEQ ID NO:474),DOM7m-26(SEQ ID NO:475),DOM7r-1(SEQ ID NO:476),DOM7r-3(SEQ ID NO:477),DOM7r-4(SEQ ID NO:478),DOM7r-5(SEQ ID NO:479),DOM7r-7(SEQ ID NO:480),DOM7r-8(SEQ ID NO:481),DOM7h-2(SEQ ID NO:482),DOM7h-3(SEQ IDNO:483),DOM7h-4(SEQ ID NO:484),DOM7h-6(SEQ ID NO:485),DOM7h-1(SEQ ID NO:486),DOM7h-7(SEQ ID NO:487),DOM7h-22(SEQ ID NO:489),DOM7h-23(SEQ ID NO:490),DOM7h-24(SEQ ID NO:491),DOM7h-25(SEQ IDNO:492),DOM7h-26(SEQ ID NO:493),DOM7h-21(SEQ ID NO:494),DOM7h-27(SEQ ID NO:495),DOM7h-8(SEQ ID NO:496),DOM7r-13(SEQ ID NO:497),DOM7r-14(SEQ ID NO:498),DOM7r-15(SEQ ID NO:499),DOM7r-16(SEQ IDNO:500),DOM7r-17(SEQ ID NO:501),DOM7r-18(SEQ ID NO:502),DOM7r-19(SEQ ID NO:503),DOM7r-20(SEQ ID NO:504),DOM7r-21(SEQ ID NO:505),DOM7r-22(SEQ ID NO:506),DOM7r-23(SEQ ID NO:507),DOM7r-24(SEQ IDNO:508),DOM7r-25(SEQ ID NO:509),DOM7r-26(SEQ ID NO:510),DOM7r-27(SEQ ID NO:511),DOM7r-28(SEQ IDNO:512),DOM7r-29(SEQ IDNO:513),DOM7r-30(SEQ ID NO:514),DOM7r-31(SEQ ID NO:515),DOM7r-32(SEQ IDNO:516),DOM7r-33(SEQ ID NO:517)
(对于这些序列的公开内容,参见WO2007080392,在此将其序列及其核酸对应物通过援引并入并形成本发明文本公开内容的部分;该段落中的SEQ ID NO是WO2007080392公开的那些),
dAb8(dAb10),dAb 10,dAb36,dAb7r20(DOM7r20),dAb7r21(DOM7r21),dAb7r22(DOM7r22),dAb7r23(DOM7r23),dAb7r24(DOM7r24),dAb7r25(DOM7r25),dAb7r26(DOM7r26),dAb7r27(DOM7r27),dAb7r28(DOM7r28),dAb7r29(DOM7r29),dAb7r29(DOM7r29),dAb7r31(DOM7r31),dAb7r32(DOM7r32),dAb7r33(DOM7r33),dAb7r33(DOM7r33),dAb7h22(DOM7h22),dAb7h23(DOM7h23),dAb7h24(DOM7h24),dAb7h25(DOM7h25),dAb7h26(DOM7h26),dAb7h27(DOM7h27),dAb7h30(DOM7h30),dAb7h31(DOM7h31),dAb2(dAbs 4,7,41),dAb4,dAb7,dAb11,dAb12(dAb7m12),dAb13(dAb15),dAb15,dAb16(dAb21,dAb7m16),dAb17,dAb18,dAb19,dAb21,dAb22,dAb23,dAb24,dAb25(dAb26,dAb7m26),dAb27,dAb30(dAb35),dAb31,dAb33,dAb34,dAb35,dAb38(dAb54),dAb41,dAb46(dAbs 47,52和56),dAb47,dAb52,dAb53,dAb54,dAb55,dAb56,dAb7m12,dAb7m16,dAb7m26,dAb7r1(DOM 7r1),dAb7r3(DOM7r3),dAb7r4(DOM7r4),dAb7r5(DOM7r5),dAb7r7(DOM7r7),dAb7r8(DOM7r8),dAb7r13(DOM7r13),dAb7r14(DOM7r14),dAb7r15(DOM7r15),dAb7r16(DOM7r16),dAb7r17(DOM7r17),dAb7r18(DOM7r18),dAb7r19(DOM7r19),dAb7h1(DOM7h1),dAb7h2(DOM7h2),dAb7h6(DOM7h6),dAb7h7(DOM7h7),dAb7h8(DOM7h8),dAb7h9(DOM7h9),dAb7h10(DOM7h10),dAb7h11(DOM7h11),dAb7h12(DOM7h12),dAb7h13(DOM7h13),dAb7h14(DOM7h14),dAb7p1(DOM7p1),和dAb7p2(DOM7p2)
(对于这些序列的公开内容,参见PCT/GB2008/000453,2008年2月8日申请,在此将其序列及其核酸对应物通过援引并入并形成本发明文本的公开内容的部分)。dAb后括号中显示了可替换的名称,例如dAb8具有可替换的名称dAb 10,即dAb8(dAb 10)。还在图51a和b中列出了这些序列。
在某些实施方式中,dAb结合人血清白蛋白,并包含与选自以下的dAb的氨基酸序列具有至少约80%,或至少约85%,或至少约90%,或至少约95%,或至少约96%,或至少约97%,或至少约98%,或至少约99%氨基酸序列同一性的氨基酸序列:
MSA-16,MSA-26,
DOM7m-16(SEQ ID NO:473),DOM7m-12(SEQ ID NO:474),DOM7m-26(SEQ ID NO:475),DOM7r-1(SEQ ID NO:476),DOM7r-3(SEQ ID NO:477),DOM7r-4(SEQ ID NO:478),DOM7r-5(SEQ ID NO:479),DOM7r-7(SEQ ID NO:480),DOM7r-8(SEQ ID NO:481),DOM7h-2(SEQ ID NO:482),DOM7h-3(SEQ IDNO:483),DOM7h-4(SEQ ID NO:484),DOM7h-6(SEQ ID NO:485),DOM7h-1(SEQ ID NO:486),DOM7h-7(SEQ ID NO:487),DOM7h-22(SEQ ID NO:489),DOM7h-23(SEQ ID NO:490),DOM7h-24(SEQ ID NO:491),DOM7h-25(SEQ IDNO:492),DOM7h-26(SEQ ID NO:493),DOM7h-21(SEQ ID NO:494),DOM7h-27(SEQ ID NO:495),DOM7h-8(SEQ ID NO:496),DOM7r-13(SEQ ID NO:497),DOM7r-14(SEQ ID NO:498),DOM7r-15(SEQ ID NO:499),DOM7r-16(SEQ IDNO:500),DOM7r-17(SEQ ID NO:501),DOM7r-18(SEQ ID NO:502),DOM7r-19(SEQ ID NO:503),DOM7r-20(SEQ ID NO:504),DOM7r-21(SEQ ID NO:505),DOM7r-22(SEQ ID NO:506),DOM7r-23(SEQ ID NO:507),DOM7r-24(SEQ IDNO:508),DOM7r-25(SEQ ID NO:509),DOM7r-26(SEQ ID NO:510),DOM7r-27(SEQ ID NO:511),DOM7r-28(SEQ ID NO:512),DOM7r-29(SEQ ID NO:513),DOM7r-30(SEQ ID NO:514),DOM7r-31(SEQ ID NO:515),DOM7r-32(SEQ IDNO:516),DOM7r-33(SEQ ID NO:517)
(该段落中的SEQ ID NO是WO2007080392中公开的那些),
dAb8,dAb10,dAb36,dAb7r20,dAb7r21,dAb7r22,dAb7r23,dAb7r24,dAb7r25,dAb7r26,dAb7r27,dAb7r28,dAb7r29,dAb7r30,dAb7r31,dAb7r32,dAb7r33,dAb7h21,dAb7h22,dAb7h23,Ab7h24,Ab7h25,Ab7h26,dAb7h27,dAb7h30,dAb7h31,dAb2,dAb4,dAb7,dAb11,dAb12,dAb13,dAb15,dAb16,dAb17,dAb18,dAb19,dAb21,dAb22,dAb23,dAb24,dAb25,dAb26,dAb27,dAb30,dAb31,dAb33,dAb34,dAb35,dAb38,dAb41,dAb46,dAb47,dAb52,dAb53,dAb54,dAb55,dAb56,dAb7m12,dAb7m16,dAb7m26,dAb7r1,dAb7r3,dAb7r4,dAb7r5,dAb7r7,dAb7r8,dAb7r13,dAb7r14,dAb7r15,dAb7r16,dAb7r17,dAb7r18,dAb7r19,dAb7h1,dAb7h2,dAb7h6,dAb7h7,dAb7h8,dAb7h9,dAb7h10,dAb7h11,dAb7h12,dAb7h13,dAb7h14,dAb7p1,和dAb7p2.
例如,结合人血清白蛋白的dAb可以含有与以下序列具有至少约90%,或至少约95%,或至少约96%,或至少约97%,或至少约98%,或至少约99%氨基酸序列同一性的氨基酸序列:
DOM7h-2(SEQID NO:482),DOM7h-3(SEQ ID NO:483),DOM7h-4(SEQ ID NO:484),DOM7h-6(SEQ ID NO:485),DOM7h-1(SEQ ID NO:486),DOM7h-7(SEQ ID NO:487),DOM7h-8(SEQ ID NO:496),DOM7r-13(SEQ IDNO:497),DOM7r-14(SEQ ID NO:498),DOM7h-22(SEQ ID NO:489),DOM7h-23(SEQ ID NO:490),DOM7h-24(SEQ ID NO:491),DOM7h-25(SEQ ID NO:492),DOM7h-26(SEQ ID NO:493),DOM7h-21(SEQ ID NO:494),DOM7h-27(SEQ IDNO:495)
(该段落中的SEQ ID NO是WO2007080392中公开的那些),
dAb8,dAb10,dAb36,dAb7h21,dAb7h22,dAb7h23,Ab7h24,Ab7h25,Ab7h26,dAb7h27,dAb7h30,dAb7h31,dAb2,dAb4,dAb7,dAb11,dAb12,dAb13,dAb15,dAb16,dAb17,dAb18,dAb19,dAb21,dAb22,dAb23,dAb24,dAb25,dAb26,dAb27,dAb30,dAb31,dAb33,dAb34,dAb35,dAb38,dAb41,dAb46,dAb47,dAb52,dAb53,dAb54,dAb55,dAb56,dAb7h1,dAb7h2,dAb7h6,dAb7h7,dAb7h8,dAb7h9,dAb7h10,dAb7h11,dAb7h12,dAb7h13和dAb7h14.
在某些实施方式中,dAb结合人血清白蛋白并含有与选自以下的dAb的氨基酸序列具有至少约80%,或至少约85%,或至少约90%,或至少约95%,或至少约96%,或至少约97%,或至少约98%,或至少约99%氨基酸序列同一性的氨基酸序列:
DOM7h-2(SEQ ID NO:482),DOM7h-6(SEQ ID NO:485),DOM7h-1(SEQID NO:486),DOM7h-7(SEQ ID NO:487),DOM7h-8(SEQ ID NO:496),DOM7h-22(SEQ ID NO:489),DOM7h-23(SEQ ID NO:490),DOM7h-24(SEQ ID NO:491),DOM7h-25(SEQ ID NO:492),DOM7h-26(SEQ ID NO:493),DOM7h-21(SEQ IDNO:494),DOM7h-27(SEQ ID NO:495)
(该段落中的SEQ ID NO是WO2007080392中公开的那些),
dAb7h21,dAb7h22,dAb7h23,Ab7h24,Ab7h25,Ab7h26,dAb7h27,dAb7h30,dAb7h31,dAb2,dAb4,dAb7,dAb38,dAb41,dAb7h1,dAb7h2,dAb7h6,dAb7h7,dAb7h8,dAb7h9,dAb7h10,dAb7h11,dAb7h12,dAb7h13和dAb7h14.
在更特别的实施方式中,dAb是结合人血清白蛋白的VκdAb,并具有选自以下的氨基酸序列:
DOM7h-2(SEQ ID NO:482),DOM7h-6(SEQ ID NO:485),DOM7h-1(SEQID NO:486),DOM7h-7(SEQ ID NO:487),DOM7h-8(SEQ ID NO:496)(该段落中的SEQ ID NO是WO2007080392中公开的那些),
dAb2,dAb4,dAb7,dAb38,dAb41,dAb54,dAb7h1,dAb7h2,dAb7h6,dAb7h7,dAb7h8,dAb7h9,dAb7h10,dAb7h11,dAb7h12,dAb7h13和dAb7h14.,
在更特别的实施方式中,dAb是结合人血清白蛋白的VH dAb,并具有选自dAb7h30和dAb7h31的氨基酸序列。
在更特别的实施方式中,dAb是dAb7h11或dAb7h14。
在其他实施方式中,dAb、配体或拮抗剂结合人血清白蛋白,并含有之前任一氨基酸序列的一个、两个或三个CDR,例如,dAb7h11或dAb7h14的一个、两个或三个CDR。
合适的结合血清白蛋白的Camelid VHH包括WO2004/041862(AblynxN.V.)和WO2007080392中公开的那些(在此将其VHH序列及其核酸对应物通过援引并入,并形成本发明文本公开内容的一部分),如序列A(SEQID NO:518)、序列B(SEQ ID NO:519)、序列C(SEQ ID NO:520)、序列D(SEQ ID NO:521)、序列E(SEQ ID NO:522)、序列F(SEQ IDNO:523)、序列G(SEQ ID NO:524)、序列H(SEQ ID NO:525)、序列I(SEQ ID NO:526)、序列J(SEQ ID NO:527)、序列K(SEQ ID NO:528)、序列L(SEQ ID NO:529)、序列M(SEQ ID NO:530)、序列N(SEQ IDNO:531)、序列O(SEQ ID NO:532)、序列P(SEQ ID NO:533)、序列Q(SEQ ID NO:534),这些序列编号对应于WO2007080392或WO2004/041862(Ablynx N.V.)中引用的那些。在某些实施方式中,Camelid VHH结合人血清白蛋白并含有与WO2007080392中公开的ALB1或SEQ ID NO:518-534中任一个具有至少约80%,或至少约85%,或至少约90%,或至少约95%,或至少约96%,或至少约97%,或至少约98%,或至少约99%氨基酸序列同一性的氨基酸序列,这些序列编号对应于WO2007080392或WO2004/041862中引用的那些。
在一些实施方式中,配体或拮抗剂含有与在此公开的任一抗-血清白蛋白dAb竞争与血清白蛋白(例如,人血清白蛋白)结合的抗-血清白蛋白dAb。
在可替换的实施方式中,拮抗剂或配体含有目标抗原(例如,人TNFR1)特异性的结合部分,其中该部分含有非免疫球蛋白序列,如2008年2月8日申请的共同未决申请PCT/GB2008/000453中所述的,这些结合部分、它们的生产和选择方法(例如,来自不同的文库)及其序列的公开内容在此通过援引并入,作为本发明文本的公开内容的部分。
与半衰期延长部分(例如,白蛋白)的缀合
在一个实施方式中,将(一个或更多个)半衰期延长部分(half-lifeextending moiety)(例如,白蛋白、转铁蛋白及其片段和类似物)缀合或缔合本发明的目标抗原-结合多肽、dAb或拮抗剂。对用于目标抗原-结合形式中的合适白蛋白、白蛋白片段或白蛋白变体的实例描述于WO2005077042中,在此将其公开内容通过援引并入,并形成本发明文本的公开内容的部分。特别地,以下的白蛋白、白蛋白片段或白蛋白变体可以用于本发明中:
·SEQ ID NO:1(如WO2005077042中公开的,在此明确地将该序列通过援引引入本发明公开内容中);
·含有WO2005077042中的SEQ ID NO:1的氨基酸1-387或由WO2005077042中的SEQ ID NO:1的氨基酸1-387组成的白蛋白片段或变体;
·白蛋白、或其片段或变体,含有选自以下的氨基酸序列:(a)WO2005077042中的SEQ ID NO:1的氨基酸54至61;(b)WO2005077042中的SEQ ID NO:1的氨基酸76至89;(c)WO2005077042中的SEQ IDNO:1的氨基酸92至100;(d)WO2005077042中的SEQ ID NO:1的氨基酸170至176;(e)WO2005077042中的SEQ ID NO:1的氨基酸247至252;(f)WO2005077042中的SEQ ID NO:1的氨基酸266至277;(g)WO2005077042中的SEQ ID NO:1的氨基酸280至288;(h)WO2005077042中的SEQ ID NO:1的氨基酸362至368;(i)WO2005077042中的SEQ ID NO:1的氨基酸439至447;(j)WO2005077042中的SEQ ID NO:1的氨基酸462至475;(k)WO2005077042中的SEQ ID NO:1的氨基酸478至486;和(l)WO2005077042中的SEQ ID NO:1的氨基酸560至566。
对用于目标抗原结合形式中的合适白蛋白、片段或类似物的更多实例描述于WO03076567中,在此将其公开内容通过援引并入,并形成本发明文本的公开内容的一部分。特别地,以下的白蛋白、片段或变体可以用于本发明中:
·如WO03076567中所述的人血清白蛋白,例如,图3中(在此明确地将该序列信息通过援引引入本发明公开内容中);
·由具有66,500通式分子量的585个氨基酸的单非糖基化多肽链组成的人血清白蛋白(HA)(参见,Meloun等,FEBS Letters 58:136(1975);Behrens等,Fed.Proc.34:591(1975);Lawn等,Nucleic Acids Research9:6102-6114(1981);Minghetti等,J.Biol.Chem.261:6747(1986));
·白蛋白的多态变体或类似物或片段,如Weitkamp等,Ann.Hum.Genet.37:219(1973)中所述的;
·如EP322094中所述的白蛋白片段或变体,例如,HA(1-373)、HA(1-388)、HA(1-389)、HA(1-369)和HA(1-419)以及1-369和1-419之间的片段;
·如EP399666中所述的白蛋白片段或变体,例如,HA(1-177)和HA(1-200)以及HA(1-X)之间的片段,其中X是178至199的任何数字。
在将(一个或更多个)半衰期延长部分(例如,白蛋白、转铁蛋白及其片段和类似物)用于格式化本发明的目标抗原-结合多肽、dAb和拮抗剂的情况中,可以使用任何合适的方法来缀合,如通过直接融合目标抗原-结合部分(例如,抗-TNFR1 dAb),例如,通过使用编码融合蛋白的单个核苷酸构建体,其中将融合蛋白编码为单多肽链,在位于目标抗原结合部分的N-或C-端具有半衰期延长部分。或者,可以通过在部分之间使用肽连接物来完成缀合,例如,WO03076567或WO2004003019中所述的肽连接物(在此将这些连接物的公开内容通过援引并入,以提供用于本发明中的实例)。通常,提高体内血清半衰期的多肽是在体内天然存在的多肽,并且能抵抗从生物体内(例如,人)除去不利物质的内源机制的降解或去除。例如,提高体内血清半衰期的多肽可以选自胞外基质的蛋白,血液中发现的蛋白,血脑屏障或神经组织中发现的蛋白,位于肾脏、肝脏、肺、心脏、皮肤或骨中的蛋白,应激蛋白,疾病特异性蛋白或涉及Fc转运的蛋白。
在整个公开内容中所述的本发明的实施方式中,替代本发明的拮抗剂或配体中的抗-目标抗原“dAb”的使用,考虑了本领域技术人员可以使用含有本发明的结合目标抗原的dAb的一个或更多个或全部3个CDR的多肽或结构域(例如,移植在合适蛋白支架或骨架上的CDR,支架或骨架例如为,affibody、SpA支架、LDL受体A类结构域或EGF结构域)。因此,认为该公开内容作为整体提供了使用这样的结构域替代dAb的拮抗剂的公开内容。在这点上,参见2008年2月8日申请的PCT/GB2008/000453,在此将其公开内容通过援引并入)。
因此,在一个实施方式中,本发明的拮抗剂包含具有目标抗原结合特异性的免疫球蛋白单可变结构域或结构域抗体(dAb)或该dAb合适形式的互补性决定区。拮抗剂可以是由该dAb组成的多肽,或基本上是由该dAb组成的多肽。拮抗剂可以是包含合适形式的dAb(或dAb的CDR)的多肽,如抗体形式(例如,IgG-样形式,scFv、Fab、Fab’、F(ab’)2),或含有结合目标抗原的dAb和结合另一个目标蛋白、抗原或表位(例如,血清白蛋白)的第二dAb的双特异性配体。
可以将根据本发明的多肽、dAb和拮抗剂格式化成本领域已知的各种合适的抗体形式,如IgG-样形式、嵌合抗体、人源化抗体、人抗体、单链抗体、双特异性抗体、抗体重链、抗体轻链、抗体重链和/或轻链的同型二聚体和杂二聚体、之前任一项的抗原结合片段(例如,Fv片段(例如,单链Fv(scFv)、二硫化物键合的Fv)、Fab片段、Fab’片段、F(ab’)2片段)、单可变结构域(例如,VH、VL)、dAb和之前任一项的修饰形式(通过共价连接聚亚烷基二醇(例如,聚乙二醇、聚丙二醇、聚丁二醇)或其他合适聚合物的修饰)。
在一些实施方式中,本发明提供了为IgG-样形式的配体(例如,抗-TNFR1拮抗剂)。这样的形式具有IgG分子常规的四条链结构(2条重链和两条轻链),其中一个或更多个可变区(VH和或VL)已经由本发明的dAb替代。在一个实施方式中,每个可变区(2个VH区和2个VL区)由dAb或单可变结构域替代,其中至少一个是根据本发明的抗-目标抗原dAb。IgG-样形式中包括的dAb或单可变结构域可以具有相同的特异性或不同的特异性。在一些实施方式中,IgG-样形式是三价的,并可以具有一种(只抗-目标抗原)、两种(例如,抗-目标抗原和抗-SA)、三种或四种特异性。例如,IgG样形式可以是单特异性的,并含有具有相同特异性的4个dAb;是双特异性的并含有3个具有相同特异性的dAb和另一个具有不同特异性的dAb;是双特异性的并含有两个具有相同特异性的dAb和两个具有共同的但不相同特异性的dAb;三特异性的并含有具有相同特异性的第一和第二dAb,具有不同特异性的第三dAb和具有不同于第一、第二和第三dAb的特异性的第四dAb;或四特异性的,并含有四个具有各不相同特异性的dAb。可以制备IgG样形式的抗原结合片段(例如,Fab、F(ab’)2、Fab’、Fv、scFv)。在一个实施方式中,IgG样形式或其抗原结合片段不与目标抗原交联,例如,该形式对于目标抗原可以是单价的。如果需要补体激活和/或抗体依赖性细胞毒性(ADCC)功能,配体可以是IgG1-样形式。如果需要,IgG-样形式可以包含突变的恒定区(变体IgG重链恒定区),以最小化与Fc受体的结合和/或固定补体的能力。(参见,例如,Winter等,GB2,209,757B;Morrison等,WO89/07142;Morgan等,WO94/29351,1994年12月22日)。
本发明的配体(多肽、dAb和拮抗剂)可以格式化成融合蛋白,其含有与第二免疫球蛋白单可变结构域直接融合的第一免疫球蛋白单可变结构域。如果需要,该形式可以进一步包含半衰期延长部分。例如,配体可以包含与第二免疫球蛋白单可变结构域直接融合的第一免疫球蛋白单可变结构域,而第二免疫球蛋白单可变结构域与结合血清白蛋白的免疫球蛋白可变结构域直接融合。
通常,具有对目标有结合特异性的结合位点的多肽结构域的方向,以及配体是否包含连接物,是设计选择的问题。然而,一些方向,使用或不使用连接物,可以提供比其他方向更好的结合特征。本发明包括的所有方向(例如,dAb1-连接物-dAb2;dAb2-连接物-dAb1)。含有提供期望的结合特征的方向的配体可以通过筛选容易地鉴定。
根据本发明的多肽和dAb,包括dAb单体、二聚体和三聚体,可以连接抗体Fc区,包含CH2和CH3结构域中的一个或两个,和任选铰链区。例如,作为单个核苷酸序列连接Fc区的编码配体载体可以用来制备这样的多肽。
此外,本发明提供了上述dAb单体的二聚体、三聚体和多聚体。
密码子优化序列
如上所述,本发明的实施方式提供了编码本发明的多肽和可变结构域的密码子优化核苷酸序列。如以下说明中所示的,可以产生编码相同可变结构域的约70%同一性的密码子优化序列(在该情况中,可变结构域氨基酸序列与DOM 1h-131-206相同)。在这种情况下,对于通过巴斯德毕赤酵母(密码子优化序列1-3)或大肠杆菌(密码子优化序列4和5)的表达,将序列优化。
我们在考虑了遗传密码的简并性之后进行了计算,并将通过附图19所示的DOM 1h-131-206的核苷酸序列和理论核苷酸序列编码的每个简并密码子内的核苷酸变化数量最大化,理论核苷酸序列仍然编码与DOM 1h-131-206相同的可变结构域。计算揭示了理论序列与附图19中所示的DOM 1h-131-206的核苷酸序列只具有57%的同一性。
密码子优化序列1
DNA序列
gaggttcaattgttggaatccggtggtggattggttcaacctggtggttctttgagattgtcctgtgctg
cttccggttttactttcgctcacgagactatggtttgggttagacaggctccaggtaaaggattggaatg
ggtttcccacattccaccagatggtcaagatccattctacgctgactccgttaagggaagattcactatc
tccagagacaactccaagaacactttgtacttgcagatgaactccttgagagctgaggatactgctgttt
accactgtgctttgttgccaaagagaggaccttggtttgattactggggacagggaactttggttactgt
ttcttcc
相应的AA序列
evqllesggglvqpggslrlscaasgftfahetmvwvrqapgkglewvshippdgqdpfyadsvkgrfti
srdnskntlylqmnslraedtavyhcallpkrgpwfdywgqgtlvtvss
·与WT序列74.1%的核苷酸序列同一性
密码子优化序列2
DNA序列
gagaaaagagaggttcaattgcttgaatctggaggaggtttggtccagccaggagggtcccttcgactaa
gttgtgctgccagtgggtttacgtttgctcatgaaactatggtatgggtccgacaggcacctggtaaagg
tcttgaatgggtttcacatatccctccagacggtcaagacccattttacgctgattccgtgaaaggcaga
tttacaatttcacgagataattctaaaaacaccttgtacttacaaatgaactcattgagagctgaggaca
ctgcagtttatcactgcgctttactaccaaaacgtggaccttggtttgattattggggccaaggtacgtt
agtgactgttagttct
相应的AA序列
ekrevqllesggglvqpggslrlscaasgftfahetmvwvrqapgkglewvshippdgqdpfyadsvkgr
ftisrdnskntlylqmnslraedtavyhcallpkrgpwfdywgqgtlvtvss
·与WT序列71.1%的核苷酸序列同一性
密码子优化序列3
DNA序列
gaagtgcagcttcttgaaagtggtggagggctagtgcagccagggggatctttaagattatcatgcgctg
ccagtggatttacttttgctcacgagacgatggtctgggtgagacaagctcctggaaaaggtttagagtg
ggtttctcacattccacctgatggtcaagatcctttctacgcagattccgtcaaaggaagatttactatc
tccagagataatagtaaaaacactttgtacctacagatgaactcacttagagccgaagataccgctgtgt
accactgcgccttgttgccaaagagaggtccttggttcgattactggggtcagggtactctggttacagt
ctcatct
相应的AA序列
evqllesggglvqpggslrlscaasgftfahetmvwvrqapgkglewvshippdgqdpfyadsvkgrfti
srdnskntlylqmnslraedtavyhcallpkrgpwfdywgqgtlvtvss
·与WT序列72.6%的核苷酸序列同一性
密码子优化序列4
DNA序列
gaagtacaactgctggagagcggtggcggcctggttcaaccgggtggttccctgcgcctgtcctgtgcgg
catctggtttcaccttcgcacacgaaaccatggtgtgggttcgccaagctccgggcaaaggcctggaatg
ggtaagccacattcctccagatggccaggacccattctatgcggattccgttaagggtcgctttaccatt
tctcgtgataactccaaaaacaccctgtacctgcagatgaactccctgcgcgccgaggatactgcggtgt
accattgtgcgctgctgcctaaacgtggcccgtggttcgattactggggtcagggtactctggtcaccgt
aagcagc
相应的AA序列
evqllesggglvqpggslrlscaasgftfahetmvwvrqapgkglewvshippdgqdpfyadsvkgrfti
srdnskntlylqmnslraedtavyhcallpkrgpwfdywgqgtlvtvss
·与WT序列76.5%的核苷酸序列同一性
密码子优化序列5
DNA序列
gaggttcaactgctggaatctggtggtggtctggtacaaccgggtggttccctgcgtctgagctgtgcag
cctctggtttcaccttcgctcatgagaccatggtttgggtacgccaggctccgggtaaaggcctggagtg
ggtaagccatatccctcctgatggtcaggacccgttctatgctgattccgtcaaaggccgttttaccatt
tctcgtgacaacagcaaaaacactctgtacctgcaaatgaactccctgcgtgcagaagacacggcggttt
atcactgtgcactgctgccaaaacgcggcccttggttcgactactggggccagggtactctggtcactgt
atcttct
相应的AA序列
evqllesggglvqpggslrlscaasgftfahetmvwvrqapgkglewvshippdgqdpfyadsvkgrfti
srdnskntlylqmnslraedtavyhcallpkrgpwfdywgqgtlvtvss
·与WT序列78.4%的核苷酸序列同一性
实施例
实施例A:人TNFR1的结构域抗体的前导选择(lead selection)&表征
结构域抗体从噬菌体文库产生。根据相关标准方法进行被动吸收人TNFR1的可溶性选择和淘选。从R&D systems(Cat No 636-R1-025/CF)或Peprotech(Cat no.310-07)购买人TNFR1作为可溶性重组蛋白,直接使用(在被动选择的情况中),或在使用通过伯胺偶联生物素化接着在生物测试中质量控制其活性以及通过质谱分析其MW和生物素化程度后使用。通常,利用每下一轮中降低水平的抗原来进行3轮选择。
对于抗-TNFR1结合克隆的存在,通过噬菌体ELISA来筛选来自选择的输出。从这些噬菌体选择中分离DNA并亚克隆至用于可溶性dAb片段表达的表达载体中。在96-孔平板中表达可溶性dAb片段,并将上清液用于筛选抗-TNFR1结合dAb的存在,使用直接结合ELISA,其使用抗-c-myc检测,或使用链霉抗生物素/生物素化TNFR1 BIAcoreTM芯片的BIAcoreTM,并根据解离速率(off-rate)来分级。
以下所述的前导分子(lead molecule)源自亲本dAb,命名为DOM1h-131(公开于WO2006038027中)。使用60nM生物素化抗原的3轮选择后,从噬菌体展示文库中选择了该分子。将链霉抗生物素或neutravidin覆盖的Dyna珠子替换为每轮选择中的捕获试剂,以防止对抗链霉抗生物素或neutravidin的粘合剂的选择。该阶段的前导DOM 1h-131功效是低微摩尔范围的,如通过MRC-5成纤维细胞/IL-8释放细胞测试所测定的。通过BIAcoreTM测定的结合动力学通常呈现出快结合/快解离速率(fast-on/fast-off rate)。该DOM 1h-131前导分子的大肠杆菌表达水平,作为C-端myc标记的单体,在8mg/l的范围中。
前导的亲和性成熟:
促使DOM 1h-131亲和性成熟,以产生具有较高功效和改进的生物物理特征的突变体(对于DOM 1h-131产生的前导的氨基酸序列,参考图3)。使用易错PCR聚合酶(Genemorph II,Stratagene)产生易错文库后(1个氨基酸变化/dAb序列的平均数,文库大小8×107),利用这些易错文库进行了七轮选择。该策略导致克隆DOM 1h-131-8的分离,这是其中有4个氨基酸变化的分子(一个在框架1中(FR1)、一个在CDR1中、一个在CDR3中和一个在FR4中),获得了大约100倍的功效提高,如通过MRC-5细胞测试所测量的(~4nM)。在该测试中,用测试样品将MRC-5细胞孵育一小时,然后加入TNF-α(200pg/ml)。在过夜孵育后,使用IL-8ABI 8200细胞检测测试(FMAT)测定IL-8释放。在每个实验中包括TNF-α剂量曲线。用于与dAb竞争与TNFR1结合的TNF-α浓度(200pg/ml)大约为该测试中最大TNF-α应答的70%。
为了进一步提高功效,通过在易错前导共有序列信息暗示的关键位置的寡-定向突变使单个氨基酸位置多样化。在该方法的过程中,通过BIAcoreTM筛选分离DOM 1h-131-8克隆的改进形式,DOM 1h-131-24(在校正之前最初命名为DOM 1h-131-8-2),其具有单个K94R氨基酸突变(根据Kabat氨基酸编号)和200-300pM的RBA功效。
产生进一步的基于该前导的易错文库和源自其的NNS文库,并接受三轮使用热处理的噬菌体选择(对于方法,参见Jespers L等,Aggregation-resistant domain antibodies selected on phage by heatdenaturation(通过热变性在噬菌体上选择的抗聚集结构域抗体),NatBiotechnol.2004年9月;22(9):1161-5)。在该选择过程中,将文库集合,并且源自第二轮选择的克隆产生了dAb,如DOM 1h-131-53,认为其热稳定性更高。推测这些克隆具有更好的生物物理特征。将克隆DOM1h-131-53中的一些框架突变种系化,以产生克隆DOM 1h-131-83。该克隆形成了进一步通过寡-定向单个CDR突变来多样化的基础,可以使用如上所述的噬菌体展示选择或使用体外区室化技术,该技术使用乳液。噬菌体展示策略产生了前导DOM 1h-131-117和DOM 1h-131-151。体外区室化技术产生了DOM 1h-131-151。
在该阶段,在生物物理和生物测试中比较了这三个前导,DOM1h-131-511是具有最佳特征的分子。此外,测试了这些分子在胰蛋白酶或leucozyme的存在下对蛋白水解裂解的抵抗性。Leucozyme由来自囊性纤维化患者的集合痰液组成,并含有高水平的弹性蛋白酶和其他蛋白酶,并用作肺病体内状况的替代品。该数据表明全部三种前导DOM1h-131-117、DOM 1h-131-151和DOM 1h-131-511在胰蛋白酶或leucozyme的存在下快速降解。这种发现引起了对DOM 1h-131-511在患者中时的体内持久性的关注,并且研发了一种策略来选择对胰蛋白酶提高的抵抗性。推测这种提高的胰蛋白酶抗性对分子的其他生物物理特征具有有益作用。基本上,改进了标准噬菌体选择方法,以允许在对抗原选择之前在蛋白酶的存在下进行选择。因此,工程化了一种新的噬菌体载体,其中检测c-myc标记物,以允许在胰蛋白酶存在下的选择而没有裂解噬菌体的展示的dAb。产生了基于易错文库的DOM 1h-131-511,并在pDOM33载体中克隆(对于pDOM33载体图谱,参见图50)。用1mg/ml或100μg/ml胰蛋白酶在37℃下将从该文库产生的噬菌体备料预处理24小时,随后将Roche Complete Protease Inhibitors(2x)的蛋白酶抑制剂加入,以在对相关抗原选择之前阻断胰蛋白酶活性。进行了四轮选择。在胰蛋白酶(100μg/ml或1000μg/ml终胰蛋白酶浓度)的存在或不存在下在37℃下孵育一小时或过夜的过程中,使用BIAcoreTM测定可溶性表达的TNFR1结合dAb在蛋白酶存在或不存在下结合TNFR1的能力。
这导致两种前导分子DOM 1h-131-202和DOM 1h-131-206的分离,其显示了提高的蛋白酶抗性,如通过BIAcoreTM抗原结合实验所显示的。感兴趣的是注意到与DOM 1h-131-511相比,DOM 1h-131-202只在CDR2中含有一个突变(V53D),所有氨基酸编号根据Kabat,而DOM1h-131-206只含有两个突变:第一突变与DOM 1h-131-202中的相同(CDR2中的V53D突变),第二突变是FR3中的Y91H突变(参见,图3)。该FR3中的Y91H突变在3-20种人种系基因中发生,表明该残基在人抗体中产生。三个克隆DOM 1h-131-511、DOM 1h-131-202和DOM 1h-131-206具有如图3中所示的氨基酸序列。
如下测定分子的活性:
DOM 1H-131-202、DOM 1H-131-511和DOM 1H-131-206与人TNFR1结合的BIAcoreTM结合亲和性测定。
通过BIAcoreTM分析测定DOM 1H-131-202、DOM 1H-131-511和DOM 1H-131-206对结合人重组大肠杆菌表达的人TNFR1的结合亲和性。使用生物素化的人TNFR1进行分析。将1400RU生物素化的TNFR1覆盖在链霉抗生物素(SA)芯片上。使用弱酸洗脱条件将表面再生回基线。使用50μl/min的流速,将限定浓度的DOM 1H-131-202、DOM1H-131-511和DOM 1H-131-206通过该表面。在BIAcoreTM 3000机器上进行工作,并分析数据和使其拟合于1∶1的结合模型。对于所有测试的分子,结合数据很好拟合于1∶1模型。从kon和koff速率计算所有KD值。在25℃下进行BIAcore TM运行。
从三个单独的实验产生以下的数据。在每个实验中,通过平均拟合的数量来计算结果,对于kd,使用最高的dAb浓度,对于ka,使用较低的浓度。数据作为结果的平均值和标准偏差(括号中)来呈现(表1)。表1:DOM 1H-131-202、DOM 1H-131-511和DOM 1H-131-206结合人TNFR1的BIAcoreTM数据
DOM 1H-131-202、DOM 1H-131-511和DOM 1H-131-206相似地,并以高亲和性结合人TNFR1。DOM 1H-131-202和DOM 1H-131-206各自以0.55nM和0.47nM的平均亲和性结合。与DOM 1H-131-511相比(其具有1.07nM的平均亲和性),DOM 1H-131-202和DOM 1H-13-206两者具有略高的亲和性。
受体结合测试:
在受体结合测试中测定dAb对抗人TNFR1的效力。该测试测量了TNF-α与TNFR1的结合和可溶性dAb阻断这种相互作用的能力。在预先覆盖山羊抗人IgG(H&L)的珠子上捕获TNFR1-FC融合体。在黑边透明底384孔平板中用TNF-α(10mg/ml)、dAb、生物素缀合的抗-TNF-α和链霉抗生物素alexa fluor 647孵育受体覆盖的珠子。6小时后,在ABI 8200Cellular Detection系统上阅读平板,并测定珠子相关的荧光。如果dAb阻断TNF-α结合TNFR1,荧光强度将降低。
使用ABI 8200分析软件分析数据。使用GraphPad Prism和具有可变斜率的S形剂量应答曲线测定浓度效应曲线和功效(EC50)值。对三种分开的情况重复测试。在每次实验中包括TNF-α剂量曲线(图38和39)。用于与dAb竞争结合TNFR1的TNF-α浓度(10ng/ml)大约为该测试中最大TNF-α应答的90%。
代表性的图显示于图39中,显示了dAb抑制TNF-α结合TNFR1的能力。在所有三个实验中,阴性对照样品(HEL4,抗-鸡蛋白色lysozyme dAb和VH模型(dummy))在高浓度下微弱地抑制TNF-α和TNFR1之间的相互作用。对于测试样品和阳性对照(获自R&D Systems的抗-TNFR1mAb,mAb 225)和Enbrel TM(etanercept;由连接IgG1的Fc部分的TNFR2组成的二聚融合体;得到许可用于治疗类风湿性关节炎)的平均功效(EC50)值显示于表2中。
表2:在三次重复实验的TNFR1受体结合测试中对DOM 1H-131-202、DOM 1H-131-206和DOM 1H-131-511的功效(EC50)值。
| 样品 | 平均EC50(nM) | SEM |
| DOM1H-131-202 | 0.11 | 0.008 |
| DOM1H-131-206 | 0.07 | 0.01 |
| DOM1H-131-511 | 0.19 | 0.01 |
| Enbrel TM(Etanercept) | 0.20 | 0.07 |
| 抗-TNFR1mAb#mAb225 | 0.08 | 0.003 |
在该测试中,DOM 1H-131-206显示出比其他两个测试的dAb功效高,并具有与可购得的抗-TNFR1mAb,MAB225(R&D Systems)相似的功效。
如下进行从巴斯德毕赤酵母的前导克隆的表达:
将三个前导分子的一级氨基酸序列用来产生用于在巴斯德毕赤酵母中分泌表达的密码子优化基因。在密码子优化和非密码子优化的DOM1H-131-206之间存在75%的序列同一性。将三个合成基因克隆至表达载体pPIC-Zα中(来自Invitrogen),然后转化至两个毕赤酵母菌株中,X33和KM71H。将转化的细胞涂布于递增浓度的Zeocin(100、300、600和900μg/ml)上,来选择具有多个成分的克隆。对于每个细胞系和构建体,选择大约15个克隆,用于表达筛选。因为高/低基因拷贝数和表达水平之间的相关性在巴斯德毕赤酵母中没有被完全理解,从Zeocin浓度范围中选择了几个克隆。使用没有对高生产率大范围筛选的克隆来进行5L发酵罐运行。这使得生产了大量的材料用于进一步研究。
用于蛋白质表征的材料生产:
基于蛋白A的色谱树脂已经广泛用于从微生物培养上清液中纯化VHdAb。尽管这使得可以用单步骤纯化方法用于生产高纯度材料,但通常在>90%的大部分情况中,对于一些分子,低pH洗脱条件会导致聚集物的形成。还存在亲和性树脂对dAb能力有限的问题;这意味着对于来自发酵罐的过程需要使用大量树脂。为了产生高质量的材料用于表征以及进一步的稳定性和喷雾器研究,使用混合模式电荷诱导树脂作为最初的捕获步骤接着阴离子交换来设计下游纯化方法。没有明显的优化,这使得回收了~70%的纯度为~95%的表达的dAb。
对于混合模式电荷诱导树脂上(来自GE Healthcare的Capto MMC)的捕获步骤,使用50mM磷酸钠pH6.0进行柱平衡,并且装载上清液,而不需要稀释或pH调节。柱子洗涤后,使用50mM Tris pH9.0的洗脱缓冲液通过pH梯度洗脱蛋白质。特定的洗涤和梯度条件将根据待洗脱蛋白质的pI而略有改变。
然后使用流过步骤进一步纯化洗脱物峰,使用阴离子交换色谱。这除去了残余的HMW污染,如醇氧化酶并减少了内毒素。用PBS或不含盐的磷酸盐缓冲液pH7.4将树脂平衡。将来自Capto MMC的洗脱物装载在阴离子交换树脂上时,dAb没有结合,并从流过物中回收。内毒素和其他污染物结合树脂。如果使用PBS缓冲液,盐的存在将该步骤中的蛋白质回收提高至91%,而无盐获得了86%回收。然而,盐的存在降低内毒素除去的有效性,使得与没有盐存在时获得的水平<1.0EU/ml相比较,使用盐的该步骤后的dAb的通常内毒素水平测量为58EU/ml。
蛋白质表征:
将产自5L发酵罐运行的材料进行表征,使用电喷雾质谱进行同一性分析,氨基端测序和等电子聚焦,以及使用SDS-PAGE,SEC和Gelcode糖蛋白染色试剂盒(Pierce)测定纯度。
同一性:
每个蛋白的头五个残基的氨基末端序列分析与预期的相同(EVQLL...)。对蛋白质样品进行了质谱分析,该样品已经使用C4Zip-tips(Millipore)缓冲交换至50∶50H2O∶含有0.1%冰醋酸的乙腈中。允许与内部二硫化物键的形成为-2的质量差异时,对于三个蛋白各自测量的质量在基于一级氨基酸序列的理论质量的0.5Da内(使用平均质量来计算)。IEF用来鉴定蛋白质,基于每种蛋白质各不相同的pI。
纯度:
将三种蛋白质以1μg和10μg的量装载于非还原SDS-PAGE凝胶上,一式两份。在所有情况中观察到单个条带。还进行了大小排阻色谱来证明了纯度的水平。对于大小排阻色谱(SEC),将100μg的各种蛋白装载于TOSOH G2000SWXL柱上,以0.5ml/min流动。移动相为PBS/10%乙醇。
对候选物选择的dAb稳定性的研究
对于COPD的指示,需要将dAb递送至肺,例如使用喷雾器装置。这将意味着蛋白质将可能经历各种剪切和热应激,这取决于所用的喷雾器类型,并将接受肺环境中蛋白酶的酶降解。测定了使用这种类型的装置来递送蛋白质,是否形成正确的颗粒大小分布并在喷雾器递送后保持功能性。因此,研究了各个分子对各种物理应力的内在稳定性,来测定基线稳定性和最敏感稳定性指示测试。因为每种蛋白质的稳定性将取决于其溶解的缓冲溶液,因此需要一些预配制的工作。该信息,如缓冲液、pH,对于理解下游纯化过程和随后的存储过程中的蛋白质稳定性也是有用的。为了表征分子在暴露于各种物理应力过程中的变化,使用了各种分析技术,如大小排阻色谱(SEC)、SDS-PAGE和等电聚焦(IEF)。
DOM 1H-131-202、DOM 1H-131-511和DOM 1H-131-206的蛋白酶稳定性测定:
通过在过量蛋白酶下预孵育限定的时间点后残余结合活性的BIAcoreTM分析来测定DOM 1H-131-202、DOM 1H-131-511和DOM1H-131-206的蛋白酶稳定性。将大约1400RU的生物素化TNFR1覆盖链霉抗生物素(SA)芯片。只用PBS或用100μg/ml胰蛋白酶、弹性蛋白酶或leucozyme来孵育250nM的DOM 1H-131-202、DOM 1H-131-511和DOM1H-131-206,在30℃下持续1、3和24小时。通过加入蛋白酶抑制剂的cocktail来停止反应。然后使用参考细胞减去将dAb/蛋白酶混合物在TNFR1覆盖的芯片上通过。在每个注射循环之间用10μl 0.1M甘氨酸PH2.2使芯片表面再生。相对于没有蛋白酶的dAb结合,测定用蛋白酶预孵育的结合人TNFR1(在10秒时)的DOM 1H-131-202、DOM 1H-131-511和DOM 1H-131-206的部分。在25℃下进行BIAcoreTM运行。从三个独立的实验产生数据。条形图表示平均值,而误差棒表示结果的标准偏差(对于结果,参见图24)。
发现与DOM 1H-131-511相比DOM 1H-131-202和DOM 1H-131-206显示出对胰蛋白酶、弹性蛋白酶或leucozyme的蛋白水解降解具有更高的抵抗力。用胰蛋白酶1hr后和用弹性蛋白酶或leucozyme 3hr后,与DOM1H-131-511相比DOM 1H-131-202和DOM 1H-131-206之间的差异最明显。
使用DSC测定的热稳定性:
为了测定分子具有最大稳定性的pH,使用差示扫描量热法(DSC)来测量Britton-Robinson缓冲液中各种dAb的解链温度(Tm)。因为Britton-Robinson是由三种成分的缓冲体系(醋酸盐、磷酸盐和硼酸盐)制成的,因此可能在相同的溶液中产生3-10的pH范围。从蛋白质一级氨基酸序列测定理论pI。从DSC,发现dAb具有最高内在热稳定性的pH,对于DOM 1H-131-202(202)为pH7,对于DOM 1H-131-206(206)为pH 7-7.5,和对于DOM 1H-131-511(511)为pH7.5。对于所有随后的应力和稳定性工作,对于各种dAb,使用以下的pH;在Britton-Robinson缓冲液中,对于DOM 1H-131-202(202)和DOM 1H-131-206(206)为pH7.0,而对于DOM 1H-131-511(511)为pH 7.5。结果概括于以下的表3中:
表3:在Britton-Robinson缓冲液中,以1mg/ml通过DSC测定的DOM1H-131-202(202)、DOM 1H-131-206(206)和DOM 1H-131-511(511)的pH和Tm的概括
| dAb | 获得最大内在热稳定性的pH | 给定pH下的dAb的Tm(℃) |
| DOM1H-131-202(202) | 7.0 | 68.6 |
| DOM1H-131-206(206) | 7.0-7.5 | 65.8 |
| DOM1H-131-511(511) | 7.5 | 58.0 |
内在稳定性测试:
在离心Vivaspin浓缩器(5K截留)中浓缩所有前导dAb,来测定最大的溶解性和浓缩时的回收水平。在Britton-Robinson缓冲液中在最稳定的pH下进行实验。在整个时间过程中测量样品体积和浓度,记录与预期浓度的偏差以及样品的回收百分比。
发现所有蛋白在Britton-Robinson缓冲液中可浓缩至超过100mg/ml。与DOM 1H-131-511(511)相比,DOM 1H-131-202(202)和DOM1H-131-206(206)显示出低于预期的回收,但仍然在可接受的水平内。
前导dAb的喷雾器递送:
通过测试不同的喷雾器和配制缓冲剂,证明了使用各种喷雾装置能有效地递送dAb。更重要地,第一次表明了配制缓冲液中的dAb的喷雾产生了有效肺递送期望的粒径分布(使用<5μm的液滴的百分比来比较),同时维持了蛋白的功能性。以下将对这进一步描述。
在不同装置中的性能比较:
在六个喷雾器装置中测试了DOM 1H-131-511(511),所述六个喷雾器装置包括来自液体制剂的三个主要喷雾器组,即超声波喷雾器、喷射喷雾器和振动筛喷雾器,的每组的两个装置。在每个装置中,使用各种PEG浓度,测试5mg/ml的dAb。对于每个样品,使用Malvern Spraytek装置(Malvern Instruments Limited,UK)测量液滴大小<5μm的百分比,并且在图35中显示了结果。使用SEC测定喷雾后每个样品的稳定性,以分析在杯子中剩余的材料中和在收集的气溶胶中已经二聚化的样品量。在图36中可看到结果。二聚物形成的程度越低,稳定性越高。
大部分装置可以递送40%或更多的正确大小范围中的液体制剂,但eFlow(振动筛喷雾器装置)和PARI LC(喷射喷雾器)装置进行地较好,缓冲液中包括PEG时,PARI LC*(星号)装置递送超过80%。使用eFlow也观察到了这种用PEG的递送提高,而使用PARI LC+,程度较低。
重要地,还发现在喷雾后,保持了dAb的活性(参见图8中的结果)。
缓冲添加剂的作用:
由于DOM 1H-131-511(511)较低的稳定性,50mM磷酸盐配制缓冲剂含有PEG 1000和蔗糖,并且具有限定为约等于含有1.2%(w/v蔗糖)的50mM磷酸盐缓冲液中约2%至约10%PEG 1000溶液粘度的范围内的粘度,以帮助保护dAb免受剪切和热应激。因为DOM 1H-131-202(202)和DOM 1H-131-206(206)都具有较高的Tm,并显示出显著提高的对热应力的稳定性,在最初的配制缓冲液和Britton-Robinson缓冲液中(其具有低于配制缓冲液的粘度)测试了所有的分子。在E-flow和Pari LC+装置中测试了dAb,在5mg/ml的蛋白质浓度下使用3.5分钟的运行时间,并使用Malvern Sparytek装置测定粒径分布。作为比较,在其自身的配制缓冲液中测试了使用喷雾器装置递送的用于囊性纤维化的市售药物(称为标准蛋白X)。结果显示于图37中。对于良好递送和分布至深肺中,理想的粒径为小于6微米,例如,<5μm。在Britton-Robinson缓冲液和配制缓冲液中(如之前所述的),所有dAb获得了低于5μm的类似的粒径水平。然而,配制缓冲液较高的粘度对产生正确大小范围内的颗粒特别有益,例如,颗粒<5μm。在喷雾之前和之后通过A280测量来测定装置杯中的dAb浓度。发现了蛋白质浓度没有显著变化,表明在递送过程中没有优先将蛋白质或载体喷雾。
结论:
如上所述,已经证明了可以在各种可购得的喷雾器装置中将多肽如dAb进行喷雾,重要的是在喷雾后保持稳定性和生物活性,并且在喷雾后不存在观察到的明显聚集。将提高粘度的赋形剂如PEG加入缓冲液制剂中时,可以改善粒径分布和液滴大小小于5μm的百分比,因此潜在地改善了将dAb递送至深肺。
还可以通过提高dAb的浓度和递送时间来改善dAb至肺部的递送,例如,最高达约40mg/ml的浓度,而dAb稳定性或活性没有任何降低。
实施例1
噬菌体载体pDOM13
使用了丝状噬菌体(fd)展示载体,pDOM13。该载体产生具有噬菌体外壳蛋白III的融合蛋白。图1中说明了pDOM13的多个克隆位点。作为SalI/NotI片段来克隆编码dAb的基因。
实施例2
对噬菌体展示的具有各种胰蛋白酶抗性的结构域抗体(dAb)测试
蛋白酶选择
在pDOM13中克隆编码dAb DOM 4-130-54(其结合IL-1R1)、DOM1h-131-511(其结合TNFR1)以及DOM 15-10、DOM15-26和DOM15-26-501(这些结合VEGFA)的基因,并根据标准技术产生展示这些dAb的噬菌体。通过PEG沉淀来纯化噬菌体,重悬浮于PBS中并滴定。
作为分离的蛋白测试时,以上的dAb展示了各种抵抗胰蛋白酶降解的能力。如下测定对降解的抵抗性:用40μg/ml的胰蛋白酶在30℃下孵育PBS中的dAb(1mg/ml),获得了25∶1dAb∶胰蛋白酶的分子比例。在即将加入胰蛋白酶之前,然后在T=1小时、3小时和24小时时,取样(30μl)。通过加入Roche Complete蛋白酶抑制剂(2x)来中和蛋白酶活性,接着浸入液氮中,并储存在干冰上。随后通过在Novex 10-20%Tricine凝胶上的电泳来分析15μg的各种dAb样品,并用SureBlue(1x)将蛋白质染色。
在头三个小时的过程中,DOM15-10和DOM 15-26-501得到了明显消化。DOM 15-26、DOM 4-130-54和DOM 1h-131-511更稳定,dAb的消化只在24小时后变得明显(图2)。
还在胰蛋白酶存在下孵育了噬菌体展示的dAb,以评价噬菌体展示的dAb的胰蛋白酶抗性是否与使用分离的可溶性dAb获得的结果相关联。测试了各种浓度的胰蛋白酶和孵育时间。在所有情况中,用RocheComplete蛋白酶抑制剂中和胰蛋白酶后,测试了噬菌体结合通用配体的能力,通用配体为蛋白A(其结合所有VH结构域抗体(例如,DOM 1h-131、DOM 15-26、DOM 15-26-501))或蛋白L(其结合所有Vk结构域抗体(例如,DOM 4-130-54、DOM15-10))。还测试了噬菌体结合目标抗原。在两种情况中,设想结合与dAb通过抵抗蛋白水解保持结构完整性相关。通过ELISA(使用对抗噬菌体的缀合抗体)或通过结合的噬菌体的洗脱和指数生长的大肠杆菌TG1细胞感染后的滴定度分析来测量结合活性。
用噬菌体上的DOM15-10、DOM15-26和DOM 15-26-501进行测试
在室温下用各种胰蛋白酶浓度(100μg/ml、10μg/ml和0μg/ml)处理每种dAb一小时。用Roche Complete蛋白酶抑制剂(1X)阻断胰蛋白酶活性,然后将噬菌体稀释于PBS中的2%Marvell中,在室温下用50nM生物素化的抗原(重组人VEGF(R&D systems))孵育一小时。加入在室温下用PBS中的2%Marvell预封闭一小时的链霉抗生物素覆盖的珠子(Dynabeads M-280(Invitrogen),然后将混合物在室温下孵育五分钟。使用Dynabeads的所有孵育步骤在转轮上进行。通过用1ml PBS中的0.1%吐温-20将珠子洗涤八次来洗掉未结合的噬菌体。用0.5ml的0.1M甘氨酸pH2.2洗脱结合的噬菌体,并用100μl1M Tris-HCl pH8.0中和。使用洗脱的噬菌体来感染指数生长的TG1细胞(在37℃下一小时),并涂布于四环素平板上。将平板在37℃下孵育过夜,并进行菌落计数(参见表4)。从用100μg/ml胰蛋白酶孵育的选择观察到最好的结果。与DOM 15-10和DOM 15-26-501相比较,DOM 15-26的产量提高约10倍。
在更严格的孵育条件下进行第二个实验来进一步证实这些结果。伴随搅拌(250rpm)将噬菌体展示的dAb在37℃下处理1小时或2小时。从用100μg/ml胰蛋白酶孵育2小时的选择观察到最好的结果。DOM15-26的产量是DOM 15-26-501的产量的200倍,是DOM 15-10的产量的1000倍。
在第三个实验中,开始时将展示DOM 15-26和DOM 15-26-501的噬菌体以1∶1混合。然后伴随搅拌(250rpm)用胰蛋白酶(1000μg/ml)或没用胰蛋白酶在37℃下孵育2小时,然后如上所述选择抗原结合。来自每个选择的十个克隆的测序揭示对于没用胰蛋白酶的预处理的克隆混合群(DOM 15-26:4/10;DOM 15-26-501:6/10),而来自用胰蛋白酶选择的所有克隆和预期一样编码DOM 15-26。
这些实验表明通过将蛋白酶加入展示dAb的噬菌体中可以获得选择压力,使得(在通用配体或抗原上淘选后)优先选择展示对蛋白水解最稳定dAb的噬菌体。
表4
用噬菌体上的DOM 4-130-54进行测试
用以上所述的相似实验方案测试了DOM 4-130-54。改变的参数如下:胰蛋白酶的浓度、孵育的温度和长度。对抗PBS中1nM浓度的IL-RI-Fc(IL-1RI和Fc的融合体)来进行生物淘选。只在37℃下用100μg/ml胰蛋白酶孵育噬菌体后观察到噬菌体滴定度的显著降低(参见表5)。
表5
| 孵育的长度 | 温度 | 胰蛋白酶浓度 | 滴度度 |
| 1hr | 室温 | 100μg/ml | 1.8×1010 |
| 1hr | 室温 | 10μg/ml | 7.2×109 |
| 1hr | 室温 | 0μg/ml | 6.6×109 |
| 过夜 | 室温 | 100μg/ml | 2.16×109 |
| 过夜 | 室温 | 10μg/ml | 7.2×109 |
| 过夜 | 室温 | 0μg/ml | 7.8×109 |
| 过夜 | 37℃ | 100μg/ml | 2.04×106 |
| 过夜 | 37℃ | 10μg/ml | 3.84×108 |
| 过夜 | 37℃ | 0μg/ml | 7.2×109 |
用DOM 1h-131噬菌体的测试
在室温下用0μg/ml、10μg/ml、100μg/ml和1000μg/ml胰蛋白酶处理DOM 1h-131噬菌体(对于氨基酸序列,与DOM 1h-131-511密切相关)一小时。通过加入25x Complete蛋白酶抑制剂(Roche)来抑制消化。沿着用1nM TNFRI覆盖的ELISA平板进行噬菌体的连续2-倍稀释,并用抗M13-HRP检测结合噬菌体。结果显示于以下的表6中。
表6
这些测试实验清楚地表明了100μg/ml胰蛋白酶和37℃的温度适于将选择压力施加于展示对胰蛋白酶的蛋白水解有不同程度抵抗性的dAb的噬菌体。如果需要,对于每种噬菌体展示的dAb,优化蛋白酶的孵育时间。
实施例3
噬菌体展示的结构域抗体集的蛋白酶选择
使用以下dAb作为母体分子形成了四个集:DOM 4-130-54、DOM1h-131-511、DOM 15-10和DOM 15-26-555。对于50μl反应,使用StratageneMutazyme II试剂盒、生物素化的引物和5-50pg的模板,通过PCR在基因中引入随机突变。用SalI和NotI消化后,用链霉抗生物素-覆盖的珠子从未消化的产品中纯化出插入片段,并在相应位点连接入pDOM13。用纯化的连接混合物转化大肠杆菌TB1细胞,形成四环素抗性克隆的大集:8.5×108(DOM 4-130-54)、1.5×109(DOM 1h-131-511)、6×108(DOM15-10)和3×109(DOM 15-26-555)。
通过用PEG双重沉淀来制备噬菌体文库,并重悬浮于PBS中。
对于DOM 1h-131-511和DOM 4-130-54集,氨基酸突变的比率各自为2.3和4.4。通过使用蛋白A或蛋白L(以1μg/ml)覆盖的孔在噬菌体ELISA中测试96个克隆来测定功能性。在DOM 1h-131-511和DOM 4-130-54集中,各自有62.5%和27%的克隆呈现出dAb的功能性展示。
对于DOM 15-10和DOM 15-26-555集,氨基酸突变的比率各自为2.5和4.6。通过使用蛋白A或蛋白L(以1μg/ml)覆盖的孔在噬菌体ELISA中测试96个克隆来测定功能性。在DOM 15-10和DOM 15-26-555集中,各自有31.3%和10.4%的克隆呈现出dAb的功能性展示。
DOM 4-130-54和DOM 1h-131-511集
用这些文库进行了四轮选择,来选择具有提高的蛋白酶抗性的dAb。
第一轮选择是通过抗原结合(1nM或10nM抗原),没有使用蛋白酶处理来清理文库,以除去任何不再以高亲和性结合抗原的克隆。第1轮的输出为108-1010范围(与1011噬菌体的输入相比),表明大部分文库以高亲和性结合抗原。
在第2轮中,引入了使用100μg/ml胰蛋白酶的蛋白酶处理,并且输出如以下表7中所示。
表7
| 胰蛋白酶孵育条件 | DOM1h-131-511文库 | DOM4-130-54文库 |
| 37℃过夜 | 1.86×106 | 2.1×106 |
| 37℃2hrs | 4.8×108 | 5.1×108 |
| 室温2hrs | 1.2×109 | 4.62×109 |
| 无胰蛋白酶 | ~1×109 | ~4×109 |
| 无抗原 | 1.8×104 | <6×103 |
用胰蛋白酶在37℃下处理dAb过夜时,存在显著的选择。将该输出带至第3轮,其中用1mg/ml或100μg/ml胰蛋白酶在37℃下将噬菌体处理24小时。第3轮的胰蛋白酶处理过的噬菌体的滴定度对于DOM1h-131-511集为105-106,对于DOM 4-130-154集为107-108。
来自第3轮的所有输出(用1mg/ml和100μg/ml的DOM 1h-131-511和DOM 4-130-154)经历了对抗1nM抗原的第四轮选择,使用100μg/ml胰蛋白酶。滴定度在106-108的范围内,与第3轮中看到的相似。对于DOM1h-131-511集,看到一些富集,但对于DOM 4-130-54集,没有看到富集。
DOM 15-10和DOM 15-26-555集
用2nM生物素化的hVEGF(人血管内皮生长因子)浓度进行第一轮选择,并且没有使用蛋白酶处理来清理文库以除去任何不再以高亲和性结合抗原的克隆。第1轮的输出为约108(与对于DOM 15-10的1010噬菌体的输入和对于DOM 15-26-555的1011噬菌体输入相比),表明大部分文库以高亲和性结合抗原。
用2nM生物素化的hVEGF进行第二轮和第三轮选择。在hVEGF淘选之前,在胰蛋白酶(100μg/ml)存在下,在摇床(250rpm)中37℃下孵育噬菌体。对于DOM15-10集,孵育时间为一小时,对于DOM 15-26-555集,为两小时。
输出如下:对于使用DOM 15-10集的第二轮和第三轮选择,为1.5×106和9×105;对于使用DOM 15-26-555的第二轮和第三轮选择,为2.2×108和3.9×109。
实施例4
选择输出的分析:DOM 4-130-54和DOM 1h-131-511的集
将来自第3轮和第4轮的所有输出亚克隆至pDOM5载体中,并转化至JM83细胞中。pDOM5载体是基于pUC119的载体。通过Plac启动子驱动蛋白质的表达。GAS1前导序列(参见WO2005/093074)确保了分离的可溶性dAb分泌至大肠杆菌JM83的周质和培养物上清液中。随机挑选来自第3轮和第4轮的96和72个单独的克隆,用于表达。
将各自来自第3轮和第4轮输出的12-24个克隆测序。在两个选择中都观察到了共有突变,并且选择大约25个带有共有基序的克隆用于进一步的表征。这些克隆的氨基酸序列显示于图3(DOM 1h-131-511选择的变体)和图4(DOM 4-130-54选择的变体)中,并作为DNA序列列于图19A-19L中。将不同于选定克隆中亲本序列的氨基酸高亮显示(相同的那些用圆点来标记)。用框显示对应于CDR1、CDR2和CDR3的环。
这些克隆以较大的量表达,并在蛋白L(对于DOM 4-130-54变体)和蛋白A(对于DOM 1h-131-511变体)上纯化,在胰蛋白酶(100μg/ml或1000μg/ml终浓度)存在或不存在下在37℃下孵育一小时或过夜后,在BIAcore上测试抗原结合。
通常,来自DOM 4-130-54选择的输出更稳定,对于一小时,大部分克隆保持对胰蛋白酶的抗性,对于过夜,最佳克隆保持抗性。相反,对于一小时,来自DOM 1h-131-511选择的少量克隆能抵抗胰蛋白酶,对于过夜,没有一个克隆有抵抗力。
实施例5
选择输出的分析:DOM15-10和DOM15-26-555的集
首先在使用或没有使用胰蛋白酶消化的单克隆噬菌体ELISA上测试了用胰蛋白酶预处理的选择的有效性。挑选了每个文库第二轮选择的十八个克隆和第三轮选择的24个克隆。将克隆DOM 15-10、DOM 15-26-501和DOM 15-26用作对照。另外的对照包括第二轮和第三轮胰蛋白酶选择后来自每个文库的扩增并纯化的噬菌体溶液。
将每个噬菌体样品分成两个部分,第一部分用100μg/ml胰蛋白酶处理,第二部分没有用胰蛋白酶处理。两个部分的孵育在37℃下进行一小时,伴随搅拌(250rpm),并通过加入Roche Complete蛋白酶抑制剂(1x)阻断。
使用胰蛋白酶消化的和未消化的样品进行噬菌体ELISA。用0.1M碳酸氢盐缓冲液中浓度为1μg/ml的neutravidin覆盖ELISA孔。用PBS的洗涤步骤和在室温下用PBS中的1%吐温-20封闭抗原覆盖的孔一小时之后,用稀释于PBS中1%吐温-20中的浓度为100ng/ml的生物素化hVEGF覆盖孔。接着,用PBS洗涤孔,并加入用1%吐温-20/PBS 1∶1稀释的处理过的或未处理过的噬菌体上清液。在37℃孵育30分钟后,用1%吐温-20/PBS洗涤孔,接着在37℃下用抗-M13噬菌体-HRP缀合物(在1%吐温-20/PBS中1/5000稀释)孵育30分钟。然后用PBS和过氧化物酶洗涤孔。通过加入SureBlue试剂启动反应。约十分钟后,用等体积的1M HCl停止反应,并在OD450nM阅读孔。
用胰蛋白酶处理的不稳定对照DOM 15-10和DOM 15-26-501的ELISA读数获得低于0.404的OD450,并且认为该值为不稳定克隆的边缘值。认为产生低于0.404OD的所有样品是不稳定的。认为所有超过该值的样品是稳定的。
表8
表8显示了每个文库第二轮和第三轮胰蛋白酶选择后稳定克隆的百分比。在第三轮选择后,可以看到两个文库中胰蛋白酶抗性克隆的富集。在胰蛋白酶消化后的每种情况中,含有扩增的纯化噬菌体混合物的对照ELISA孔的值在每次选择后都远高于0.404。此外,将来自第三轮选择的胰蛋白酶处理过的噬菌体与来自第二轮选择的胰蛋白酶处理过的噬菌体相比较时,观察到信号略有升高。DOM 15-10噬菌体文库显示出约14%起始值的升高。DOM 15-26-555噬菌体文库显示出表示约2%起始值的升高。
所有这些结果表明用胰蛋白酶预处理的选择能有效地从DOM15-10和DOM15-26-555的集中选择胰蛋白酶抗性噬菌体克隆。
将来自第二和第三轮选择(DOM 15-26-555)以及只来自第三轮选择(DOM 15-10)的所有输出亚克隆至pDOM5载体中,并转化至HB2151电感受态细胞中。pDOM5载体是基于pUC119的载体。通过Plac启动子来驱动蛋白质的表达。GAS1前导序列确保分离的可溶性dAb分泌至大肠杆菌HB2151的周质和培养物上清液中。从每轮选择(3和4)随机挑选184个单独的克隆,用于在1ml培养物体积中表达。
将细菌上清液稀释于HBS-EP BIAcore缓冲液中(1∶1体积比)并分成一式两份。将20μg/ml终浓度的胰蛋白酶只加入一个瓶中。伴随搅拌(250rpm)在37℃下进行孵育40分钟。用Roche Complete蛋白酶抑制剂(1X)阻断反应后,在BIAcore 3000上测试胰蛋白酶处理过的或未处理的噬菌体上清液的抗原结合(SA传感器芯片上2,000RU生物素化的hVEGF)。
挑选克隆的标准是:相对于未处理的dAb,<15%用胰蛋白酶处理过的dAb的抗原结合降低(基于选定时间点达到的最大RU),这通常将反映出dAb对蛋白酶处理的稳定性;dAb从抗原分离的过程中,两个时间点之间<40%的解离速率降低。基于这些值,将来自DOM 15-26-555文库的第二和第三轮选择的60个克隆以及来自DOM 15-10文库的第三轮选择的17个克隆测序。在两个文库的输出中观察到共有突变,从每个带有共有基序的文库中选择17个克隆,用于进一步的表征。这些克隆的氨基酸序列显示于图5(DOM 15-26-555选择的变体)和图6(DOM 15-10选择的变体)中,并且作为DNA序列列于图20A-20E中。将不同于选定克隆中亲本序列的氨基酸高亮显示(相同的那些用圆点来标记)。用框显示对应于CDR1、CDR2和CDR3的环。
在50ml表达培养物中表达这些克隆,在HBS-EP缓冲液中稀释至100nM浓度的蛋白A(对于DOM 15-26-555变体)或蛋白L(对于DOM15-10变体)上纯化,并在胰蛋白酶(20μg/ml终浓度)存在或不存在下伴随搅拌(250rpm)在37℃下孵育1.5小时后,在BIAcore上测试抗原结合。
还使用实施例2中所述的方法测试了这些克隆的胰蛋白酶抗性。将蛋白质缓冲交换至PBS中,并浓缩至1mg/ml。将25μg蛋白质与1μg胰蛋白酶(Promega)混合并在30℃下孵育0小时和24小时。该时间后,用RocheComplete蛋白酶抑制剂(1X)和DTT阻断反应,并加入装载剂。将样品在100℃下变性五分钟。然后,通过在Novex 10-20%Tricine凝胶上电泳来分析15μg每种样品,并且用SureBlue(1x)将蛋白质染色。
通常,来自DOM 15-26-555选择的输出更稳定,在BIAcore上测试时,大部分克隆保持对胰蛋白酶的抗性持续1.5小时,在SDS-PAGE上运行时,持续过夜。相反,在SDS-PAGE上运行时,只有少量来自DOM 15-10选择的克隆对胰蛋白酶的抗性持续过夜。
实施例6
DOM 1h-131-511变体的鉴定
更详细地分析DOM 1h-131-203、DOM 1h-131-204和DOM1h-131-206。用不同浓度的胰蛋白酶(0至100μg/ml)在37℃下孵育过夜后,在BIAcore上在500nM的dAb浓度下比较。BIAcore痕迹显示于图7中。结果清楚地显示了两种变体对高浓度胰蛋白酶(100μg/ml)的蛋白水解的抗性比它们的亲本更高。还在上述条件下,与它们的亲本一起,比较了两种dAb,DOM 1h-131-202和DOM 1h-131-206,对抗各种其他蛋白酶,包括leucozyme、弹性蛋白酶和胰酶,使用100μg/ml的蛋白酶浓度。与亲本相比较,dAb显示了提高的对抗所有测试的蛋白酶的蛋白水解的抗性。对于弹性蛋白酶和leucozyme的BIAcore痕迹显示于图8中。
用100μg/ml测序级别的胰蛋白酶处理5μM的每种dAb 0、1、3和24小时。用25X Roche Complete蛋白酶抑制剂抑制反应,并将反应在4-12%Novex Bis-Tris凝胶上运行。凝胶显示于图9中。
实施例7
DOM 4-130-54变体的鉴定
更详细地分析DOM 4-130-201和DOM 4-130-202。用不同浓度的胰蛋白酶(0至100μg/ml)在37℃下孵育过夜后,在BIAcore上在500nM的dAb浓度下比较。BIAcore痕迹显示于图10中。结果清楚地显示了所有三种变体对高浓度胰蛋白酶(100μg/ml)的蛋白水解的抗性比它们的亲本更高。还在上述条件下,比较了DOM 4-130-201和DOM 4-130-202与它们的亲本对抗各种其他蛋白酶,包括leucozyme、弹性蛋白酶和胰酶,使用100μg/ml的蛋白酶浓度。尽管结果没有使用胰蛋白酶那么明显,但与亲本相比较,前导dAb显示了提高的对抗所有测试的蛋白酶的蛋白水解的抗性。对于弹性蛋白酶和leucozyme的BIAcore痕迹显示于图11中。
用100μg/ml测序级别的胰蛋白酶处理5μM的每种dAb 0、1、3和24小时。用25X Roche Complete蛋白酶抑制剂抑制反应,并将反应在4-12%Novex Bis-Tris凝胶上运行。凝胶显示于图9中。
实施例8
DOM1h-131-511和DOM 4-130-54变体的进一步表征
首先使用差示扫描量热法(DSC)分析dAb,以确定胰蛋白酶抗性提高是否与解链温度(Tm)提高相关。胰蛋白酶稳定性的提高与Tm的提高相关(参见表9)。
表9
| 名称 | Tm.℃ |
| DOM1h-131-511 | 57.9 |
| DOM1h-131-202 | 67.5 |
| DOM1h-131-203 | 65.7 |
| DOM1h-131-204 | 62.3 |
| DOM1h-131-206 | 64.9 |
| DOM4-130-54 | 54.1 |
| DOM4-130-201 | 64.7 |
| DOM4-130-202 | 64.5 |
还在基于MRC-5细胞的测试中比较了DOM 1h-131-511来源的dAb(参见表10)。在该测试中,测量了dAb中和TNFα刺激的IL-8释放的能力,以确定胰蛋白酶稳定性的提高是否导致功效的降低。然而,该测试中胰蛋白酶抗性dAb的活性没有受到明显影响。
表10
| 样品 | ND50nM |
| DOM1h-131-511 | 1.98 |
| DOM1h-131-511 | 1.71 |
| DOM1h-131-511(230307CE) | 1.89 |
| DOM1h-131-203(230307CE) | 2.28 |
| DOM1h-131-204(230307CE) | 1.89 |
| DOM1h-131-511 | 1.46 |
| DOM1h-131-206(230307CE) | 0.71 |
在受体结合测试中测试DOM 4-130-54来源的dAb,以观察它们是否具有相同的抑制IL-1与IL-RI结合的能力(参见表11)。在该测试中,胰蛋白酶抗性dAb的活性没有受到影响。
表11
| dAb | IC50(nM) |
| DOM4-130-54 | 280pM |
| DOM4-130-201 | 257pM |
| DOM4-130-202 | 254pM |
实施例9
DOM 15-26-555变体的鉴定
与它们的亲本和两种另外的dAb,DOM 15-26-594和DOM 15-26-595一起,更详细地分析了DOM 15-26-588、DOM 15-26-589、DOM 15-26-591和DOM 15-26-593,这另外两种dAb是通过突变形成的,以组合对功效和稳定性具有最大影响的突变(E6V和F100S/I)。序列显示于图12中。在用200μg/ml浓度的胰蛋白酶孵育后,以100nM的dAb浓度,在BIAcore上比较克隆对hVEGF的结合。伴随搅拌(250rpm),将反应在37℃下进行三小时和24小时。最佳克隆DOM 15-26-593和亲本的BIAcore痕迹显示于图13中。其他结果作为图14中的图表来表示。结果清楚地表明了所有变体在24小时的胰蛋白酶处理后,对蛋白水解的抵抗性高于亲本。
还通过将处理过的和未处理过的样品在SDS-PAGE上跑胶检测了DOM 15-26-593和亲本的胰蛋白酶抗性。简而言之,将蛋白质缓冲交换至PBS中,并浓缩至1mg/ml。将25μg蛋白质与1μg测序级别的胰蛋白酶(Promega)混合,并在30℃下孵育0小时、1小时、3小时和24小时。该时间后,用Roche Complete蛋白酶抑制剂(1x)和DTT阻断反应,并加入装载剂。将样品在100℃下变性五分钟。在Novex 10-20%Tricine凝胶上装载15μg每种样品,并且用SureBlue(1x)将蛋白质染色。结果显示于图15中。该实验中,DOM 15-26-593的胰蛋白酶抗性特征不同于BIAcore实验显示的特征,表明反应条件的差异可能影响胰蛋白酶裂解的最终结果。尽管如此,DOM 15-26-593比其他选定的克隆具有更好的生物物理特性,以及亲和性,如下所示。还在以下的表12中显示了DOM15-26-555变体的特性概述。
表12
实施例10
DOM 15-10变体的鉴定
与其亲本DOM 15-10一起,更详细地分析了DOM 15-10-11。序列显示于图16中。在用200μg/ml浓度的胰蛋白酶孵育后,以100nM的dAb浓度,在BIAcore上比较dAb对hVEGF的结合。伴随搅拌(250rpm),将反应在37℃下进行1小时、3小时和24小时。这些dAb的BIAcore痕迹显示于图17中。结果清楚地表明了选定的变体在24小时的胰蛋白酶处理后,对蛋白水解的抵抗性高于亲本。
还通过将处理过的和未处理过的样品进行SDS-PAGE检查了前导和亲本的胰蛋白酶抗性。简而言之,将蛋白质缓冲交换至PBS中,并浓缩至1mg/ml。将25μg蛋白质与1μg测序级别的胰蛋白酶(Promega)混合,并在30℃下孵育0小时、1小时、3小时和24小时。该时间后,用RocheComplete蛋白酶抑制剂(1x)和DTT阻断反应,并加入装载剂。将样品在100℃下变性五分钟。在Novex 10-20%Tricine凝胶上装载15μg每种样品,并且用SureBlue(1x)将蛋白质染色。结果显示于图18中。在该情况中,胰蛋白酶抗性特征与BIAcore胰蛋白酶测试非常相关,显示了结合活性直接反映出蛋白质的完整性。
实施例11
DOM 15-26-555和DOM 15-10变体的进一步表征
使用差示扫描量热法(DSC)分析dAb,以确定胰蛋白酶抗性提高是否与Tm提高相关。结果显示于表13中。DOM 15-26-555变体的胰蛋白酶抗性和解链温度之间存在关联。前导DOM 15-26-588和DOM15-26-593显示出提高的Tm,但其他克隆没有。值得注意的是DOM15-26-555和DOM 15-10亲本分子在开始时(63.3-63.7℃)具有比DOM4-130-54和DOM 1h-131-511亲本分子(开始时的Tm:57.9-54.1℃)高得多的Tm,但整体上,蛋白酶抗性克隆达到了相似范围的Tm(对于DOM1h-131-511/DOM 4-130-54变体,平均Tm为65.1℃,而对于DOM15-26-55/DOM 15-10变体,平均Tm为64.9℃)。
表13
| 名称 | Tm℃ |
| DOM15-26-555 | 63.3 |
| DOM15-26-588 | 70.1 |
| DOM15-26-589 | 63 |
| DOM15-26-591 | 63 |
| DOM15-26-593 | 65 |
| DOM15-10 | 63.7 |
| DOM15-10-11 | 63.3 |
还在受体结合测试中比较了dAb,测量BIAcore动力学来测定胰蛋白酶稳定性提高是否导致功效降低。然而,测试中dAb的活性基本上没受影响,或甚至提高了。表14中呈现了该结果。
表14
| 克隆ID | EC50(nM) | KD(nM) |
| DOM15-26-555 | 11.7 | 26.1 |
| DOM15-26-588 | 27 | 59.1 |
| DOM15-26-589 | 1.94 | 9.6 |
| DOM15-26-591 | 16 | 38 |
| DOM15-26-593 | 0.323 | 3.2 |
| DOM15-26-594 | 4.09 | 15.1 |
| DOM15-26-595 | 0.828 | 5 |
| DOM15-10 | 10.23 | 23.6 |
| DOM15-10-11 | 3.58 | 14.6 |
提高的Tm的优势
大部分蛋白-包括结构域抗体-以两种状态存在:折叠状态(这导致生物活性分子)和去折叠状态(其不带有功能性活性)。在所有温度下,这两种状态共存,并且每种状态的相对比例通常由常数K来决定,常数K是折叠和去折叠的动力学常数的函数。通常将解链温度限定为K=1时的温度,即,在该温度下,折叠蛋白的部分等于去折叠蛋白的部分。通过使蛋白的分子内相互作用稳定和失去稳定来确定常数K,并且因此主要是通过蛋白质的氨基酸序列来决定。外部参数,如温度、pH、缓冲液组成、压力,影响着K,并因此影响解链温度。
对于降解机制,去折叠的蛋白是容易的目标:(i)二硫键的暴露提高了取决于环境的氧化或还原的风险,(ii)提高的主链灵活性有利于自体蛋白水解反应,(iii)肽片段的暴露将目标提供给体内的蛋白酶、生产过程中的蛋白酶以及下游加工和长期储存过程中的遗留(carry-over)蛋白酶,和(iv)易聚集片段的暴露导致分子间聚集和蛋白沉淀。在所有情况中,发生了蛋白完整性、蛋白含量和蛋白活性的丢失,因此妥协了努力来(i)确保批次可再现性,(ii)确保架存的长期稳定性和(iii)体内功效。
在自然界中,蛋白质通过进化得到了设计,以在体温下足以进行任务,并且通过体内平衡机制容易地替换。通过生物技术方法制造的治疗蛋白面对不同的环境:它们通常在外源宿主中通过重组DNA技术来生产,在大的容器中以较高的含量表达,在整个下游加工过程中经历非常重要的pH或缓冲液组成的变化,并且最终以高浓度存储在非生理学缓冲液中延长的时间段。新的递送技术(例如,吸入、sc贴剂、缓慢递送的纳米颗粒)还增加治疗蛋白经受的应力。最终,蛋白质工程化技术的出现将导致提高的或完全新的治疗蛋白的产生。因为大部分工程化技术是基于体外技术的,目的在于改变或形成新的氨基酸序列,没有产生逐渐改善生物蛋白的进化方法,因此导致对于应激抵抗力次佳性能的蛋白。
本发明的技术目的在于再现达尔文进化过程中蛋白质面对的条件之一。用在组织重塑和蛋白质体内平衡中起主要作用的蛋白酶浸渍(infuse)肽或多肽,例如免疫球蛋白单可变结构域。还测试了任何可以形成对其功能具有提高适合度的蛋白质的特定突变在其执行功能的环境中适合的能力。在本发明的一个实施方式中,再现了该方法:形成肽或多肽变体的集,并暴露于蛋白酶。在第二个步骤中,将该变体集接触特定的目标。只有那些通过蛋白酶持续降解的蛋白质变体能够啮合(engage)目标,并因此例如通过称为“生物淘选”的简单亲和性纯化方法来回收。与体内方法相比,该系统给予了各种优势:蛋白质集可以面对多种条件,例如,各种蛋白酶、浓度较高、持续较长时间、在不同的缓冲液和pH中以及在不同的温度下。因此,这种体外技术提供了一种设计蛋白质的方式,与产生它们的那些原始蛋白质相比,这些蛋白质可以在更多的环境中执行功能和保持稳定。显然,这对于生物技术工业,并且特别是治疗蛋白领域,提供了多个优势。
实施例12:对于蛋白酶抗性前导的PK相关性数据
在体内进一步评价了四个dAb谱系中每个的亲本dAb和蛋白酶抗性dAb(对于列表和详细内容,参见以下的表15)
表15
标注:DOM 15-26-501是本专利申请中以上举例的DOM 15-26-555的亲本形式。DOM 15-26-555在CDR1中具有一个种系氨基酸突变(134M)。DOM 15-26-501具有比DOM 15-26-555更低的解链温度(52℃v63.3℃),和提高的对胰蛋白酶消化的敏感性。对于PK研究,优于DOM 15-26-555,选择了DOM 15-26-501,因为其与DOM 15-26-593相比,对于差的稳定性,是更好的代表。
我们将抵抗性翻译如下:
1为低
2为中等
3为良好
4为高
5为非常高
然后这表示亲本分子的胰蛋白酶抗性为:
DOM 4-130-54良好
DOM 1h-131-511良好
DOM 15-10低
DOM 15-26-501低
对于选定的前导:
DOM 4-130-202非常高
DOM 1h-131-206非常高
DOM 15-10-11高
DOM 15-26-593高
因为结构域抗体的大小小(12-15kDa),iv或sc注射时,它们从循环中快速清除。实际上,肾小球过滤的截留为高于50kDa,并且因此小蛋白如dAb不能保持在循环中,因为它们能通过肾脏。因此,为了评价在体内对蛋白酶抗性的长期效果,我们用提高全身停留的部分标记了结构域抗体。文献中已经报道了几种目标为延长半衰期的方法(例如,PEG、Fc融合体、白蛋白融合体等)。在本申请中,已经用人IgG1抗体的Fc部分标记(或格式化)结构域抗体。这种形式提供了两个优点:(i)所得到dAb-Fc的分子大小为~75kDa,这已足够大来确保保持在循环中,(ii)抗体Fc部分结合FcRn受体(也称为“Brambell”受体)。该受体位于上皮细胞、内皮细胞和肝细胞中,并且涉及延长抗体和白蛋白的寿命:实际上,在抗体和其他血清蛋白胞饮作用时,将蛋白质定向于酸化内体,其中FcRn受体在运输到内体之前拦截抗体(通过结合Fc部分)并将它们返回循环中。因此,通过将Fc部分标记在dAb上,确保dAb将长期暴露于至少两个区室-血清和前-内体区室,其中每种含有特定组的蛋白水解酶。此外,FcRn受体介导转胞吞作用,由此将带有Fc的蛋白质转移至血管外空间或从血管外空间转移出来。
通过将编码VH和VK dAb的基因融合至编码人IgG1 Fc的基因来完成用Fc的格式化,通过短的插入肽连接物(粗体):
对于VH dAb(下划线的):
EVQ......GQGTLVTVSSASTHTCPPCPAPELLGGP...(hgG1Fc)...PGK*对于VK dAb(下划线的):
DIQ.........GQGTKVEIKRTVAAPSTHTCPPCPAPELLGGP...(hIgG1Fc)...PGK*
根据标准实验方案使用293-fectin(Invitrogen)通过HEK293/6E细胞的瞬时转染来产生材料。设计这些细胞用于联合pTT系列载体使用时的高水平瞬时表达(Durocher等,2002)。因此,将dAb基因克隆至改良的pTT5载体(pDOM38)中,以产生Fc融合体表达载体(参见图21)。在转染后5天收集来自转染细胞的上清液,通过离心澄清和通过0.2μm滤器过滤。通过在蛋白A流线型树脂(GE Healthcare)上捕获来纯化dAb-Fc融合蛋白。在10mM柠檬酸钠pH3中从柱洗脱蛋白质,接着加入1M柠檬酸钠pH6,来获得100mM柠檬酸钠pH6的终浓度。
在大鼠中测试dAb-Fc分子的体内半衰期,将5mg/kg的目标剂量给予雌性Sprague-Dawley大鼠中(n=3/组)。应当注意到目标剂量大大超过大鼠中的目标浓度,因此预期亲本dAb和胰蛋白酶抗性dAb之间的亲和性差异(参见实施例11)将不会影响分子在体内的命运。因此,预期在与抗原无关的消除过程中反映出dAb之间的pK特征差异。
在给药后0.03、1、4、8、24、48、72、96、120和168小时采取血样。血块形成后,取出血清,然后在hIL-1R1、TNFR1或VEGF抗原捕获测试中测试:
hIL-1R1抗原捕获测试:
用4ug/mL抗-hIL-1R1覆盖
封闭
加入500ng/mL shIL-1R1
加入样品
用抗人Fc HRP@1∶10,000检测
TNFR1抗原捕获测试:
用0.1ug/mL sTNFR1覆盖
封闭
加入样品
用抗人Fc HRP@1∶10,000检测
VEGF抗原捕获:
用0.25ug/mL VEGF覆盖
封闭
加入样品
用抗人Fc HRP@1∶10,000检测
将来自这些测试的原始数据转化成每种血清样品中的药物浓度。然后使用非区室分析(NCA)在WinNonLin中分析每个时间点的平均μg/mL。每种dAb-Fc对的PK特征显示于表16中,该表概括了测定的PK参数。
表16:
| ID | dAb | 半衰期(hr) | AUC/D(0-inf)(hr*μg/mL)/(mg/kg) | 推测的%AUC |
| DMS1541 | 4-130-54 | 93.2 | 691.5 | 22.7 |
| DMS1542 | 4-130-202 | 176.8 | 710.1 | 49 |
| DMS1543 | 1h-131-511 | 140.8 | 1807.5 | 40 |
| DMS1544 | 1h-131-206 | 158.6 | 2173.0 | 43.6 |
| DMS1546 | 15-10 | 43.2 | 324.6 | 3.8 |
| DMS1531 | 15-10-11 | 56.6 | 770.5 | n.d. |
| DMS1545 | 15-26-501 | 12.9 | 89 | 5.1 |
| DMS1529 | 15-26-593 | 86.2 | 804.7 | 21.0 |
结果清楚地表明-尽管dAb-Fc对4-130-54和1h-131-206的PK特征几乎是可重叠的(superimposable)-特征与其他对变化很大。考虑AUC/D时,作用大部分是可见的:15-10的AUC/D只是15-10-11的42%。15-26-501的AUC/D只是15-26-593的11%。这些重要的差异还影响了(程度较低)半衰期:对于15-10和15-10-11,各自为43.2h vs.56.6h。使用DOM 15-26谱系时,看到了更大的差异:对于15-26-501和15-26-593,各自为12.9hvs.86.2h。实际上,对于使用非区室分析的良好PK分析,应当存在至少4个用于拟合线性回归斜率的数据点,并且估算半衰期的时间段应当为计算的半衰期的至少3倍。
根据在此实施例中所述的生物物理特征,显示出任何给定的dAb抵抗胰蛋白酶降解的能力与dAb-Fc融合体在大鼠血清中循环较长的时间段的能力相关。实际上,如实施例中所示的,如实施例10,DOM 15-10和DOM 15-26-501是最可能降解的dAb:在1ug胰蛋白酶存在下将25ugdAb在30℃下孵育~3h导致完全降解。在该研究中,所有其他dAb(不管它们是否已经用胰蛋白酶选择(即,DOM 15-10-11、DOM 15-26-593、DOM 4-130-202和DOM 1h-131-206)或和亲本分子一样(DOM 4-130-54和DOM 1h-131-511)已经具有一定的胰蛋白酶抗性)再次格式化成dAb-Fc分子时,在大鼠中具有相当的PK特征。因此,本发明的PK研究表明那些dAb具有非常低的蛋白水解抵抗性时,对蛋白水解的敏感性对dAb的体内稳定性具有最大的影响。还表明了-超过一定的水平-对胰蛋白酶降解的抵抗性进一步增加(例如,DOM 4-130-206v DOM4-130-54)没有显著增加dAb-Fc分子进一步减缓体内消除的能力。
在三种情况中,在胰蛋白酶存在下的选择形成了具有提高的热稳定性的新分子(通过解链温度来限定):DOM 4-130-202、DOM 1h-131-206和DOM 15-26-593。PK研究表明-在本发明的数据集中-解链温度不是适当的参数来合理化观察到的PK特征:实际上,DOM 15-10具有高于DOM 15-10-11的Tm,并且也比DOM 15-10-11更快地从循环中清除。在别处,DOM 4-130谱系的两种dAb具有明显不同的Tm(差10℃),并且在格式化成dAb-Fc分子时显示出几乎相同的体内稳定性。应当注意到没有排除解链温度本身作为关键参数来预测体内稳定性。它只在使用本发明的数据集时发生,大的Tm差异(从54℃及以上)对dAb的体内命运不具有显著的影响。这没有排除在低于54℃的解链温度下,dAb的体内稳定性与热稳定性相关的可能,或甚至可能与热稳定性和对蛋白酶抗性都相关。
实施例13
对DOM 10-53-474的胰蛋白酶选择
纯化的DOM 10-53-474的胰蛋白酶稳定性:
DOM 10-53-474是结合IL-13的结构域抗体,具有高的功效。为了测定该dAb在胰蛋白酶存在下的稳定性,用胰蛋白酶消化纯化的dAb持续提高的时间点,并在凝胶上跑胶来检查任何可能的蛋白质降解。用1μl1mg/ml测序级别的胰蛋白酶在30℃下孵育25μl 1mg/ml纯化的DOM10-53-474,形成25∶1 dAb∶胰蛋白酶的分子比例。用胰蛋白酶孵育dAb 1h、4h和24h,并通过加入4μl Roche complete蛋白酶抑制剂接着在冰上孵育来中和蛋白酶活性。通过将蛋白酶抑制剂加入没有添加胰蛋白酶的dAb中来制备时间0样品。随后根据制造商的说明使用Labchip通过电泳分析2μl的样品。
图22显示了用胰蛋白酶孵育提高时间点的DOM 10-53-474的凝胶电泳。为了比较,还如上所述用胰蛋白酶处理了一种胰蛋白酶稳定的dAb,DOM 15-26-593,并且在旁侧跑胶。如图中所示的,甚至在用胰蛋白酶孵育24h后,DOM 15-26-593显示是稳定的。然而,在24h后,DOM10-53-474降解至一定的程度,但在1h和4h时间点时显示为稳定的。这些数据表明DOM 10-53-474能在一定程度上抵抗胰蛋白酶的降解,但是没有最胰蛋白酶稳定dAb之一的DOM 15-26-593那样稳定。
噬菌体展示的DOM 10-53-474的胰蛋白酶稳定性:
为了测定噬菌体展示的DOM 10-53-474的胰蛋白酶稳定性,将编码DOM 10-53-474的基因克隆至pDOM33的Sal/Not位点中(图50),并根据标准技术产生噬菌体。通过PEG沉淀纯化噬菌体,重悬浮于PBS中并滴定。
用胰蛋白酶孵育噬菌体展示的dAb不同的时间点,以评价胰蛋白酶抗性。用胰蛋白酶孵育后,感染指数生长的大肠杆菌TG1细胞后通过滴定分析来测量稳定性。
在振荡培养器中,在37℃下用100μg/ml胰蛋白酶孵育100μl噬菌体1h、2h、4h和过夜。用Roche complete蛋白酶抑制剂(x2)阻断胰蛋白酶活性,然后将噬菌体稀释于PBS中的2%marvel中,在室温下用10nM生物素化的IL-13孵育一小时。加入在室温下用PBS中的2%marvell预封闭一小时的链霉抗生物素覆盖的珠子(Dynabeads M-280(Invitrogen),然后将混合物在室温下孵育5分钟。使用Dynabeads的所有孵育步骤在转轮上进行。通过用1ml PBS中的0.1%吐温-20将珠子洗涤八次来洗掉未结合的噬菌体。用0.5ml的0.1M甘氨酸pH2.2洗脱结合的噬菌体,并用100μl 1M Tris-HCl pH8.0中和。使用洗脱的噬菌体来感染指数生长的TG1(在37℃下1h),并涂布于四环素平板上。将平板在37℃下孵育过夜,并进行菌落计数。用胰蛋白酶消化后的噬菌体输出滴定度概括于表17中。用胰蛋白酶孵育提高的时间点时,噬菌体滴定度降低。24h孵育后,所有噬菌体得到消化。
表17.对噬菌体展示的DOM 10-53-474亲本进行的胰蛋白酶选择的输出滴定度
| 胰蛋白酶孵育长度 | 胰蛋白酶浓度 | 滴定度 |
| 无胰蛋白酶对照 | - | 3×107 |
| 1h | 100μg/ml | 1×107 |
| 2h | 100μg/ml | 7×106 |
| 4h | 100μg/ml | 5×106 |
| 过夜 | 100μg/ml | 0 |
对胰蛋白酶抗性更大的dAb的选择:
为了选择对胰蛋白酶降解抗性更大的dAb,对于50μl反应,使用Stratergene Mutazyme 11试剂盒、生物素化的引物和5-50pg模板,通过PCR将随机突变引入编码DOM 10-53-474的基因中。用SalI和NotI消化后,用链霉抗生物素覆盖的珠子从未消化的产物中纯化插入片段,并在相应位点连接入pDOM33。用纯化的连接混合物转化大肠杆菌TB1细胞,形成DOM 10-53-474的易错文库。文库的大小为1.9×109,并且氨基酸的突变率为1.3。
使用该文库来进行三轮选择来选择具有提高的蛋白酶抗性的dAb。只使用抗原没有用胰蛋白酶处理进行第一轮选择,以清除文库,来除去任何不再以高亲和性结合抗原的克隆。以10nM IL-13进行选择。与6×1010的输入噬菌体相比,第一轮的输出为2×109,表明大部分文库以高亲和性结合抗原。
用1nM生物素化的IL-13进行第二轮和第三轮选择。在对IL-13淘选之前,用100μg/ml胰蛋白酶在摇床(250rpm)中在37℃下孵育噬菌体。对于第二轮选择,在室温下或在37℃下进行胰蛋白酶孵育1h。第2轮选择的输出显示于表18中。
表18.第二轮选择后的输出噬菌体滴定度
| 胰蛋白酶处理 | 滴定度 |
| 无处理 | 1×108 |
| 胰蛋白酶处理 | 滴定度 |
| 室温1h | 5×107 |
| 1h37℃ | 2×107 |
将来自37℃下1h胰蛋白酶处理的第2轮选择的噬菌体输出用作第3轮选择的输入。对于第3轮选择,用100μg/ml胰蛋白酶处理噬菌体,但持续了更长的时间点:37℃2h,37℃4h,室温下过夜或37℃下过夜。第3轮选择的输出滴定度概括于表19中。
表19:第三轮选择后的输出噬菌体滴定度
| 胰蛋白酶处理 | 滴定度 |
| 无胰蛋白酶 | 1.3×108 |
| 37℃2h | 1.9×107 |
| 37℃4h | 2×106 |
| 室温下过夜 | 4×107 |
| 37℃过夜 | 2.1×106 |
将第1、2和3轮的每个选择输出的几个克隆测序,以测定序列多样性。没有使用胰蛋白酶处理的第一轮后,50%的选择输出具有亲本DOM10-53-474序列。第2轮选择后,亲本的百分比提高至75%。第3轮选择后,亲本的百分比提高至80%。
该数据表明DOM 10-53-474已经能抵抗胰蛋白酶的降解,并且从这些胰蛋白酶选择中没有选择出很多新的克隆。图22显示了用胰蛋白酶消化纯化的蛋白时,即使在胰蛋白酶处理过夜后,DOM 10-53-474也没有完全消化。然而,为了观察选择输出中是否存在胰蛋白酶抗性比DOM10-53-474更高的任何新克隆,将其中用胰蛋白酶在37℃下处理噬菌体过夜的选择3输出亚克隆至pDOM5中。然后将一百个克隆测序,以寻找任何胰蛋白酶抗性克隆。在分析的一百个克隆中,只有26个克隆具有新的序列,然而,这些克隆中没有一个在胰蛋白酶裂解位点(赖氨酸或精氨酸)具有突变,表明这些克隆对胰蛋白酶的抗性没有比DOM 10-53-474更高。
实施例14
通过在胰蛋白酶存在下噬菌体选择将存储和生物物理改进引入前导DOM 0101(抗TNFR1)dAb中:
为了提高前导分子DOM 1h-131-511的蛋白酶抗性,如之前所述的,在胰蛋白酶存在下进行噬菌体选择。该方法产生了多个与亲本DOM1h-131-511分子相比具有提高的胰蛋白酶稳定性的克隆。选择了两个克隆,DOM 1h-131-202和DOM 1h-131-206用于进一步的表征,因为它们显示出对胰蛋白酶的作用最显著的提高。以下所述的更多工作表明伴随着对胰蛋白酶的作用提高的抵抗力,存在其他有益的作用,主要在于分子对剪切力和热应力的稳定性。这两个参数对提高生物药物产品的存储和架存期稳定性是关键的。
在巴斯德毕赤酵母中生产前导DOM 0101 dAb:
将编码三个前导分子的一级氨基酸序列的基因用于在巴斯德毕赤酵母中生产分泌的蛋白质。将三个合成基因(DOM 1h-131-511、DOM1h-131-202和DOM 1h-131-206)克隆至表达载体pPIC-Zα中,然后转化至两个毕赤酵母株中,X33和KM71H。将转化的细胞涂布于递增浓度的Zeocin上(100、300、600和900μg/ml),以选择具有多个组分的克隆。然后在2L烧瓶中筛选几个克隆,以鉴定高表达细胞系。然后将最佳表达的克隆用于在发酵罐中在5L规模下生产材料。
蛋白质纯化和材料表征:
为了生产用于表征和进一步稳定性研究的高质量材料,使用混合模式电荷诱导树脂(Capto MMC)作为最初的捕获步骤接着阴离子交换(QSepharose)来设计下游纯化过程。没有明显优化,这使得可以回收~70%纯度为~95%的表达的dAb。对于同一性,使用电喷雾质谱、氨基端测序和等电聚焦来表征材料,对于纯度,使用SDS-PAGE和SEC(大小排阻色谱)来表征材料。
蛋白质同一性:
每种蛋白质的头五个残基的氨基端序列分析与预期一样(EVQLL...)。对蛋白质样品进行了质谱分析,该样品已经使用C4Zip-tips(Millipore)缓冲交换至50∶50 H2O∶含有0.1%冰醋酸的乙腈中。允许与内部二硫化物键的形成为-2的质量差异时,对于三个蛋白各自测量的质量在基于一级氨基酸序列的理论质量的0.5Da内(使用平均质量来计算)。IEF用来鉴定蛋白质,基于每种蛋白质各不相同的pI。
蛋白质纯度:
将三种蛋白质以1μg和10μg的量装载于非还原SDS-PAGE凝胶上,一式两份。在所有情况中观察到单个条带。
还进行了大小排阻色谱来证明了纯度的水平。对于大小排阻色谱(SEC),将100μg的各种蛋白装载于TOSOH G2000 SWXL柱上,以0.5ml/min流动。移动相为PBS/10%乙醇。基于曲线下的面积来计算单体的百分比(参见图23)。
DOM 1h-131-511、-202和-206的稳定性比较
蛋白酶稳定性的测定:
通过在过量蛋白酶下预孵育限定的时间点后残余结合活性的BIAcoreTM分析来测定DOM 1h-131-511、DOM 1h-131-202和DOM1h-131-206的蛋白酶稳定性。将大约1400RU的生物素化TNFR1覆盖链霉抗生物素(SA)芯片。只用PBS或用100μg/ml胰蛋白酶、弹性蛋白酶或leucozyme来孵育250nM的DOM 1h-131-511、DOM 1h-131-202和DOM1h-131-206,在30℃下持续1、3和24小时。通过加入蛋白酶抑制剂的混合物来停止反应。然后使用参考细胞减去将dAb/蛋白酶混合物在TNFR1覆盖的芯片上通过。在每个注射循环之间用10μl 0.1M甘氨酸PH2.2使芯片表面再生。相对于没有蛋白酶的dAb结合,测定用蛋白酶预孵育的结合人TNFR1(在10秒时)的DOM 1h-131-511、DOM 1h-131-202和DOM1h-131-206的部分。在25℃下进行BIAcoreTM运行。从三个独立的实验产生以下的数据。条形图表示平均值,而误差棒表示结果的标准偏差(图24)。
发现与DOM 1h-131-511相比DOM 1h-131-202和DOM 1h-131-206显示出对胰蛋白酶、弹性蛋白酶或leucozyme的蛋白水解降解具有更高的抵抗力。用胰蛋白酶1hr后和用弹性蛋白酶或leucozyme 3hr后,与DOM1h-131-511相比DOM 1h-131-202和DOM 1hH-131-206之间的差异最明显。存在这样一种倾向:在大部分测试的条件中,DOM 1h-131-206比DOM 1h-131-202略微更稳定些。
使用DSC测定的dAb热稳定性:
为了测定前导分子具有最大稳定性的pH,使用差示扫描量热法(DSC)来测量Britton-Robinson缓冲液中各种dAb的解链温度(Tm)。因为Britton-Robinson是由三种成分的缓冲体系(各自40mM的醋酸、磷酸和硼酸)制成的,因此可能在相同的溶液中产生3-10的pH范围。从蛋白质一级氨基酸序列测定理论pI。从DSC,发现dAb具有最高内在热稳定性的pH,对于DOM 1h-131-202为pH7,对于DOM 1h-131-206为pH7-7.5,和对于DOM 1h-131-511,为pH7.5。对于所有随后的应力和稳定性工作,对于各种dAb,使用以下的pH;在Britton-Robinson缓冲液中,对于DOM 1h-131-202和GSK 1995057A DOM 1h-131-206为pH 7.0,而对于DOM 1h-131-511为pH 7.5。结果概括于以下的表20中:
表20:在Britton-Robinson缓冲液中,以1mg/ml通过DSC测定的DOM1h-131-202、DOM 1h-131-206和DOM 1h-131-511的pH和Tm的概括。温度变化为180℃/小时。
| dAb | 获得最大内在热稳定性的pH | 在给定pH下的dAb的Tm(℃) |
| DOM1h-131-202 | 7.0 | 68.6 |
| DOM1h-131-206 | 7.0-7.5 | 65.8 |
| DOM1h-131-511 | 7.5 | 58.0 |
两周热稳定性测试
蛋白质在升高的温度下能持续延长时间段的能力通常是稳定性的良好指示。在这些条件下,蛋白质可能经历几个物理过程,如聚集或化学修饰。将dAb(1mg/ml)在Britton-Robinson缓冲液中在37和50℃下孵育14天。使用SEC来测定14天的时间段中溶液中剩下多少单体(图25)。
从图25,可以看出DOM 1h-131-202和DOM 1h-131-206对热应力的稳定性显著高于DOM 1h-131-511。将蛋白质暴露于升高的温度下,如37和50℃,通常用于获得药物长期架存期的指示。将这些较高的温度用于加速与室温下长期存储相关的正常过程,如脱酰胺、氧化或聚集。还可以使用SEC监控溶液中聚集形成的水平(图26A至I)。在37℃下14天后,溶液中DOM 1h-131-511的丢失归因于更高级别的聚集物沉淀和形成,如通过SEC所测定的(图26B)。在37℃下14天后,还看到了DOM 1h-131-202和DOM 1h-131-206显著减少的蛋白质丢失,并且聚集物形成非常少或基本没有增加,尤其是在DOM 1h-131-206的情况中(图26H)。在50℃下,分子间的差异甚至更明显,DOM 1h-131-206在较高温度下14天后显示出高于DOM 1h-131-202的稳定性,表明较高分子量聚集物的形成明显减少(图26)。相对于t=0,DOM 1h-131-206在14天后只显示了聚集物形成的少量增加(图26I),而DOM 1h-131-511几乎全部从溶液中沉淀出来(图26C)。
这表明通过胰蛋白酶选择引入dAb中的变化,例如,提高的热稳定性,显著提高了在37和50℃下的蛋白质存储稳定性。DOM 1h-131-202和更明显地DOM 1h-131-206,清楚地在升高的温度下具有提高的溶液稳定性和较低的形成聚集物的趋势,这可以直接翻译成在更相关的温度下如+4℃和室温下提高的长期存储稳定性。
然后通过IEF分析从热应激实验的24hr、48hr、7天和14天时间点取样,以观察蛋白质是否经历了将影响蛋白质整体电荷的任何生物物理变化(图27)。
再次,与DOM 1h-131-511相比,DOM 1h-131-202和DOM 1h-131-206在37℃下显示出没有明显变化。使用DOM 1h-131-511,在37℃下24hr后出现了微弱的第二条条带。认为这条额外的条带是由于蛋白质的二聚化引起的,因此遮掩了电荷并产生了两个分子群。在50℃下,分子间的差异更明显,DOM 1h-131-206清楚地显示出在升高的温度下没有明显变化,而DOM 1h-131-202在24hr后显示出一些变化的征兆。Britton-Robinson中的大部分的DOM 1h-131-511在48hr后由于沉淀而丢失。
通过TNFR-1RBA分析50℃下T=0、7和14天时间点,以确定蛋白质在暴露于高温后的功能性(图28)。该测试在检测由于应力引起的分子细微变化中通常没有SEC或IEF那样灵敏,但可以使用来显示dAb仍然可结合抗原。
对于DOM 1h-131-511,曲线转移至左边,反映出大部分的dAb由于沉淀而丢失的事实。溶液中留下的材料仍然能够结合抗原。如图25中所示的,即使在14天后,DOM 1h-131-202和DOM 1h-131-206中的大部分能够维持在溶液中。RBA显示所有可溶性蛋白质仍然是功能性的并能够结合TNFR1。
在高蛋白浓度下的存储稳定性测试
进行实验来研究在非常高蛋白浓度下在+4℃下的存储稳定性,以观察每种分子在这些条件下怎样实施作用。将所有前导dAb在Britton-Robinson缓冲液中在其最稳定的pH下在离心Vivaspin浓缩器中(5K截留)浓缩至~100mg/ml。然后将~100mg/ml的样品在+4℃下保持7天,然后通过SEC分析来观察样品在高浓度存储过程中是否已经发生了任何其他物理变化(图29)。在1xPBS 10%乙醇(v/v)中的SEC柱上运行之前,将样品稀释至~1mg/ml。
从SEC痕迹,可以看出DOM 1h-131-202和DOM 1h-131-206在7天后都没有显示出聚集物形成的任何显著增加,其中对于DOM 1h-131-511,存在单体浓度~2%的降低。
前导dAb的喷雾器递送:
对于早期毒理学和临床工作,将dAb配制成液体,并通过喷雾装置来递送。根据装置(例如,超声波、喷射或振动筛),dAb将经历一定程度的剪切力和热应力,因为将其喷雾来形成限定粒径的气溶胶。因为与DOM 1h-131-511相比,DOM 1h-131-202和-206都具有较高的Tm,并显示出显著提高的对热应力的稳定性,在两个喷雾器装置中测试了所有dAb,以观察它们怎样应答喷雾过程中诱导的剪切力/热应力。然后通过SEC分析来自喷雾气溶胶的蛋白质和装置中(即,杯中)剩余的dAb,以确定该过程中产生的聚集量。
在其最稳定的pH下在Britton-Robinson缓冲液中测试所有分子。在E-flow Rapid(振动筛)和Pari LC+(喷射喷雾器)中测试了dAb,在5mg/ml的蛋白质浓度下使用3.5分钟的运行时间,并使用Malvern Sparytek测定粒径分布。结果显示于图30中。对于良好递送和分布至深肺中,理想的粒径为<5μm。在Britton-Robinson缓冲液中,所有dAb获得了低于5μm的类似的粒径水平。在喷雾之前和之后通过A280测量来测定装置杯中的dAb浓度(数据未显示)。发现了蛋白质浓度没有显著变化,表明在递送过程中没有优先将蛋白质或载体喷雾。
将Britton-Robinson缓冲液中喷雾的dAb样品在SEC上运行,以确定在递送的过程中蛋白质是否经历了任何物理变化。图31显示了通过SEC测定的杯中或气溶胶中的相对百分比变化。可以看到相对于DOM1h-131-511,DOM 1h-131-202和DOM 1h-131-206经历了相对小的单体浓度变化。这证明了具有提高Tm的DOM 1h-131-202和DOM 1h-131-206对喷雾过程中的聚集具有较低的倾向。
图32显示了Britton-Robinson缓冲液中的DOM 1h-131-206和DOM1h-131-511在喷雾后的实际SEC痕迹,并证明了单体的相对损耗(图31)是由于二聚体形成引起的。这再次给以下的理论提供了更多的支持证据:由DOM 1h-131-202和DOM 1h-131-206显示的更高热稳定性可以防止明显的聚集,即使是在未优化的配制缓冲液中。
对于毒理学和安全性测定工作,需要将明显高于给予患者的治疗剂量的水平的dAb递送至动物。这只能通过使用明显较高的蛋白质浓度和/或在延长的时间段内递送dAb来实现。因为已经表明DOM 1h-131-511以5mg/ml在3.5min喷雾过程中形成聚集物,在PBS中测试了40mg/ml的DOM 1h-131-206,并使用Pari LC+喷雾最高达1小时。在整个运行过程中的不同时间点从杯子和气溶胶中取样,以观察延长的喷雾是否导致dAb由于剪切力或热应力(通过SEC所测定)以及蛋白质浓度(A280nm测量)而聚集。表21显示了通过A280测定的杯子和气溶胶中的dAb蛋白质浓度。
表21:测量的使用Pari LC+的~40mg/ml的dAb喷雾过程中杯子和气溶胶中的DOM 1h-131-206的蛋白质浓度,通过A280吸光值读数测定的。考虑到稀释误差和仪器误差,在dAb喷雾1hr后,样品浓度没有变化。
| 时间(分钟) | 杯样品(mg/ml) | 气溶胶样品(mg/ml) |
| 1 | 43.8 | 43.4 |
| 29 | 44.5 | 43.5 |
| 59 | 44.6 | 44.1 |
从表21可以看出蛋白质浓度在运行过程中没有明显变化,证明不存在由于聚集引起的蛋白质明显损耗。图33显示了在喷雾的1小时时间段中,DOM 1h-131-206没有形成任何更高级别的聚集物,如二聚物,如通过SEC测定的。这清楚地证明了改善的生物物理特性,如通过胰蛋白酶选择引入分子中的,显著提高了dAb对剪切力和热应力的抗性,并且这与提高的存储架存期以及将蛋白质喷雾的能力直接相关,使得不形成较高级别的聚集物。
前导dAb的溶液状态
因为对于所有三种前导dAb的主要降解途径,看起来是自缔合最初导致二聚化,接着更多的聚集,并且最终沉淀,通过分析性超速离心(AUC)研究这三种前导分子,以测定自缔合的程度。通过两种方法,沉降平衡和沉降速度,来研究蛋白质。
对于沉降平衡方法,在0.5mg/ml至5mg/ml范围的三种不同浓度下运行三种样品,使用三种不同的转子速度而具有离心作用。通过该方法,测定了DOM 1h-131-511是稳定的二聚体(26.1-34.4kDa),DOM1h-131-202是单体/二聚体平衡(22.7-27.8kDa),在测量的浓度下具有相对稳定的二聚体状态,Kd=1.3μM,DOM 1h-131-206主要是单体的(15.4-17.9kDa),具有360μM从单体至二聚体缔合的Kd。
通过沉降速度方法,所有样品显示出稀释时一定程度的解离。从所获得的结果,显示于图34中,对于DOM 1h-131-511观察到的沉降系数表示了较高级别的聚集物,并且稀释时的峰值位移表示了这些聚集物的解离。蛋白质聚集和解离相互抵偿,这产生了形成稳定的二聚体的印象,如通过沉降平衡所观察到的。对于DOM 1h-131-202观察到的沉降系数,表示了快速动态平衡,因此单体和二聚体峰没有相互分开,产生了单峰,具有高于适于样品质量的沉降系数。该结果与通过沉降平衡方法获得的结果相一致,并且测量解离常数为1μM。测定DOM 1h-131-206比其他两种样品单体更多,具有1.9s的沉降系数,与其他两种样品的2.5s相比较。该数据与沉降平衡数据非常一致。在测量的浓度下,低于360μM的Kd~10倍,样品主要是单体。
实施例15
DOM 15-26-593dAb的功效增强:
图40中显示了DOM 15-26-593dAb超过DOM 15-26亲本的VEGFR2受体结合测试中功效增强的实例。在该测试中,在基于平板的测试中测量了潜在抑制剂防止VEGF结合VEGFR2的能力。在该测试中,将VEGFR2-Fc嵌合体覆盖在96-孔ELISA平板上,并且向其加入预定量的已经用连续稀释的测试dAb预孵育的VEGF。洗掉未结合的蛋白质后,用抗-VEGF抗体检测结合受体的VEGF的量,按比色法来测定其水平。按作为测试底物浓度函数的VEGF结合的抑制百分比将剂量应答效果作图。因此,有效的抑制剂是证明了在低浓度下基本上阻断了配体结合的那种。
FC融合体功效和半衰期:
VEGF阻断在肿瘤治疗中的治疗潜能已经被认识了超过30年。癌症的慢性性质决定了生物药物需要长的血清半衰期来介导它们的作用,但这与通过肾过滤从循环中快速清除游离的dAb不相一致。为了测定VEGFdAb作为抗血管生成药用于癌症治疗的实用性,通过杂交连接物将前导结构域抗体与野生型人IgG1Fc格式化成融合体,使得形成二价分子,其通过使用FcRn介导的抗体补救途径延长了血清半衰期。
在该Fc融合体形式中,使用之前所述的测试将前导胰蛋白酶选定dAb,DOM 15-26-593的功效与最初的亲本dAb(DOM 15-26)&胰蛋白酶不稳定dAb(DOM 15-26-501)相比较。结果显示于以下的表22中:
表22.Fc融合体形式的DOM 15-26前导的功效(RBA)&半衰期特征
| dAb | Fc | 功效(nM) | T1/2b(hrs) |
| DOM15-26 | hIgG1 | 0.506 | ND |
| dAb | Fc | 功效(nM) | T1/2b(hrs) |
| DOM15-26-501 | hIgG1 | 0.323 | 12.9 |
| DOM15-26-593 | hIgG1 | 0.033 | 84.6 |
从这些结果可以看出,二聚Fc融合体形式,由于抗体亲抗原性(avidity)的作用,相对于游离dAb,提高了亲和性&功效。清楚的是通过胰蛋白酶选择获得的DOM 15-26-593功效增强在该Fc形式中得到维持,甚至更明显。此外,热和蛋白酶稳定性的增强翻译成分子在体内的药物动力学行为的深刻变化。DOM 15-26-593与DOM 15-26-501相比较的消除半衰期的改善(参见图41)很可能是dAb提高稳定性的直接后果,使其对内体区室内发生的降解过程的抵抗性更大。因此,还预期了具有提高蛋白酶稳定性的dAb能够在其他生物区室中持续更长的时间,其他区室如血清、粘膜表面和各种组织区室,其中蛋白水解是涉及生物分子周转的活性过程。
药物动力学清除特征:
以5mg/kg的浓度将DOM 15-26-593和DOM 15-26-501 i.v.给药于3只大鼠后,测量DOM 15-26-593和DOM 15-26-501的药物动力学清除特征。然后使用直接VEGF结合标准ELISA测试和抗人Fc抗体测量了血清中DOM 15-26-593和DOM 15-26-501的水平,因此只检测了血清样品中的完整药物。以下的表23中显示了完整的药物动力学特征:
表23.大鼠中DOM 15-26&DOM 15-26-593Fc融合体的药物动力学参数概述
| dAb | 半衰期(hr) | Cmax(μg/ml) | AUC(0-inf)(hr*μg/ml) | 清除(ml/hr/kg) |
| DOM15-26-501 | 12.9 | 91.4 | 445.1 | 11.8 |
| DOM15-26-593 | 84.6 | 101.8 | 3810 | 1.3 |
从这些结果可以看出DOM 15-26-593具有显著提高的药物动力学特征,具有,例如,延长的半衰期和降低清除速率。
DOM 15-26-593显著提高的功效和药物动力学特征产生了化合物用于各种其他生物物理特性的分析。
溶液状态特征:通过SEC-MALLs&AUC的分析:
使用DOM15-26-593进行的实验如下:
DOM15-26-593在高达2.5mg/ml的浓度下在溶液中为单体,计算的分子量为78-81KDa,与大约76kDa的计算的完整分子量相符(附图42a&42b)。
热熔解性质:DSC的分析
使用DOM 15-26-593进行的实验如下:
胰蛋白酶选择的dAb的提高的热稳定性(65℃,附图43中间画面)被维持在Fc融合物中(64.5℃,附图43上部画面)。显示了DOM15-26-501dAb(52℃,附图43下部画面)的Tm曲线用于比较。
对冻融的稳定性、温度应力和血清成分
使用DOM15-26-593进行的实验如下:
DOM15-26-593dAb的稳定性质意味着,DOM15-26-593dAb可以经历物理的和生物的压力,而对它结合VEGF的能力仅有最小的影响(附图44-47(a和b))。举例来说,所述分子可以从液氮(-196℃)到体温(37℃)重复地冻融10个循环而不损失结合活性,如ELISA所测定的(附图44)。这种处理也不引起分子的聚集状态的明显改变,如通过常规的大小排阻色谱所评估的(附图45)。进一步测试展现了,该分子可以置于-80℃到55℃的大范围的不同温度下在仅在最高的孵育温度下168小时之后,仅有较小的抗原结合活性降低(附图46)。此外,与来自人类或短尾猴的血清在37℃孵育14天没有引起抗原结合能力的损失(附图47a和47b),如通过VEGF结合ELISA所测定的。
VEGFR2受体结合分析&HUVEC细胞分析中的功效:
如上所述的受体结合分析如下进行:
如上所述的受体结合分析被用于评定Fc融合体的功效(附图48)。发现的是,DOM15-26-593dAb在这项分析中具有提高的功效,其确立了dAb在体外阻断VEGF与VEGFR2的结合的能力。还在HUVEC(人类脐静脉内皮细胞)分析中展现了DMS 1529的功效,其中测量了VEGF拮抗剂阻断HUVE细胞的VEGF刺激的增殖的能力。在与预定数量的VEGF和改变数量的测试物质固定的孵育时间的结束时,测定了细胞数量。拮抗剂的功效更强,观察到更少的细胞增殖(附图49)。
实施例16
研究的目的
研究的目标是通过进行噬菌体的蛋白酶处理之后的噬菌体选择来获得GLP-1AlbudAbTM融合物的蛋白酶抗性变体。AlbudAbTM是特异性结合血清白蛋白的免疫球蛋白单可变结构域。
GLP-1受体
高血糖素样肽-1受体(GLP-1R)属于七种跨膜的G蛋白偶联受体的B1家族。受体和它的天然激动剂配体GLP-1之间的结合相互作用起始于配体与受体的细胞外N-末端结构域(ECD GLP-1R)的结合,随后是与跨膜分子的核心的相互作用(Al-Sabah等,2003)。已经显示的是,如果移除了跨膜核心,结合分离的N-末端结构域的GLP-1被保持,而亲和力被降低(Lopez de Maturana等,2003)。由于对于在溶液中的噬菌体选择使用完整的受体不是期望的,分离的细胞外结构域被用于噬菌体捕获。尽管肽与它的受体的亲和力不与它的活性直接相关,它容许我们简化实验并利用与ECD GLP-1R的亲和力来富集噬菌体展示分子。
测试噬菌体选择
进行测试来证实GLP-1受体的细胞外结构域可以用于噬菌体展示库选择。
噬菌体载体
使用丝状噬菌体(fd)展示载体(pDOM4),其基于具有myc标签的fd载体,其中蛋白质序列可以克隆到限制性位点之间来提供蛋白质-基因III融合物。编码文库集的基因作为NcoI/NotI片段来克隆。
载体在MachI细胞中增殖并使用Mega Preps,Qiagen来分离,超螺旋的级分在氯化铯梯度上分离。载体用NcoI和NotI酶随后PstI切割,来降低自身连接概率。在苯酚/氯仿萃取之后,DNA被乙醇沉淀,从Chromaspin TE-1000柱(Clontech)上的填充物中纯化。在纯化之后,载体DNA被用于测试与多种DAT-X DNA片段的连接。
DAT-X文库构建
基于包含GLP-1的DAT-X亲本分子构建十八个集。为了覆盖GLP-1的完整的序列(排除对受体结合重要的位点),17个集是基于利用50微升反应体积中的Phusion高保真聚合酶的组装PCR。每个文库通过引物在初次PCR中引入四个随机核苷酸,然后用生物素化的引物进行组装。对于50μl的反应,利用Stratagene Mutazyme II试剂盒、生物素化的引物和5-50pg模板的易错PCR,引入了GLP-1内的随机突变。使用螺旋接头序列。由于GLP-1核苷酸序列的短的长度,易错PCR进行两次,来提高突变率。
在用NcoI和NotI消化之后,利用链霉抗生物素蛋白覆盖的珠子从未消化的产物中纯化插入物,并在相应的位点连接到修饰的pDOM4中。
测试连接克隆的测序确认了所有文库中适当的多样性,因而遵循了文库的全尺度连接和转化。在500微升的总体积中进行连接,1000微克的消化的载体和插入物以1∶2(v∶i)的比例,使用T4DNA连接酶。在两次注射,每100微升的电感受态大肠杆菌TB1细胞10微升,转化每个文库,得到文库大小107-108。噬菌体库通过使用PEG的两次沉淀并悬浮在PBS中来制备。
来自未选择的文库的克隆被随机选择。
在噬菌体文库制备之后的第一轮选择
GLP-1受体的细胞外结构域被用于淘选。100微升的噬菌体文库与含有100nM受体的2%Marvell PBS孵育。孵育在RT进行1小时,然后噬菌体与预先阻断的(2%Marvell PBS,1h,RT)蛋白A dynabeads组合。在RT下在转轮上一小时孵育之后,珠子在King Fisher中用0.1%Tween PBS洗涤8次,通过在500微升0.1M甘氨酸pH 2.0中洗脱来回收特定噬菌体。在用100微升1M Tris-Cl pH 8.0中和之后,噬菌体用于对数期大肠杆菌TG1细胞的感染,37℃45分钟。在与胰蛋白酶的孵育(100μg/ml1小时4℃;1和2小时37℃250rpm)后进行DAT-X的测试选择。文库输入输出的滴定度和文库大小在下表中示出。
第一轮选择对于所有的文库产生了合理的输出,因而输出被扩增,噬菌体被用于第二轮选择。
使用蛋白酶的DAT-X噬菌体展示文库选择
接下来的选择对取出的噬菌体进行。通过含有来自第一轮选择的输出的大肠杆菌甘油的联合培养来获得噬菌体。
另外在用胰蛋白酶选择之前,噬菌体进行亚克隆,在AlbudAb序列中具有R108W突变,因为在过去的蛋白酶选择期间证实的是,当在噬菌体上展示时,这个突变使得Vkappa AlbudAb克隆对胰蛋白酶处理更有抗性。这得到了预备用于第二轮选择的两个批次的噬菌体,有或者没有AlbudAb中的R108W突变。
来自每次选择的噬菌体输出(0μg/ml-10μg/ml)被扩增,用于第三轮选择,使用相同的孵育条件。
在第二轮期间用10μg/ml胰凝乳蛋白酶浓度处理的噬菌体的滴定度仍然以比先前用较低浓度处理的噬菌体以较小的程度降低。在第二轮期间用10μg/ml胰蛋白酶浓度处理的噬菌体的滴定度是非常稳定的。
在使用α-胰凝乳蛋白酶的第三轮之后扩增的噬菌体也用大肠杆菌菌株HB2151的细胞溶胞产物(CL)和周质提取物(PE)处理,来得到对细菌蛋白酶的稳定性的了解。噬菌体与蛋白酶1∶1混合,在与受体孵育之前在摇动器中37℃孵育2小时。
| 出自第二轮和第三轮的Φ的浓度: | 输入 | 无蛋白酶 | CL | PE |
| Lib 1-180-0μg/ml α-chi | 1×1012 | 2×1010 | 3×109 | 5×109 |
| Lib 1-1810-1μg/ml α-chi | 7×1010 | 1×109 | 2×108 | 2×108 |
| Lib 1-1810-10μg/ml α-chi | 2×1011 | 3×108 | 2×108 | 4×108 |
| 对照DAT-X | 1×1012 | 3×107 | 2×106 | 7×106 |
对于所有的选择输出,包括对照的未修饰分子,滴定度方面的降低是非常小的(低于10倍),这可以表明,细胞溶胞产物和周质提取物中的蛋白酶与纯化的胰蛋白酶和胰凝乳蛋白酶相比严格度是较低的。因为克隆中的多样性在第三轮选择的输出亚克隆到表达载体中之后已经降低了。
DAT-X噬菌体展示文库选择输出
来自用胰蛋白酶和胰凝乳蛋白酶的第三轮选择、在选择过程期间用10μg/ml蛋白酶浓度处理两次的DAT-X文库输出被亚克隆到表达载体中。噬菌体载体DNA从选择输出中分离(Mini Prep,Qiagen),并用NcoI和NotI位点消化。并行地,表达载体通过两步裂解来制备。首先,它用KpnI限制性内切酶来消化,KpnI限制内切酶在AlbudAb序列的内侧切割。进行这个步骤来降低载体自身连接的概率。然后进行NcoI NotI位点的消化来诱导连接位点。在每个消化步骤之后,载体使用PCR纯化试剂盒,Qiagen来纯化。在第二次纯化后,载体DNA还加载在2%琼脂糖凝胶上,相应于4699bp的条带进行凝胶纯化(Gel纯化试剂盒,Qiagen)。
50ng的DNA与从使用胰蛋白酶/胰凝乳蛋白酶第三轮选择的输出上切下的插入物6ng/1.5ng,使用200u的T4DNA连接酶(NEB)在RT来连接1h。
5ul的连接混合物用于根据厂家方案的25ul MachI化学感受态细胞(Invitrogen)的转化,并平板接种。第二天,使用2XTY培养基中的15%甘油,菌落从平板上刮下,100微升的储备物用于DNA分离(MiniPrep,Qiagen)。约150ng的载体DNA用于40ul BL21(DE3)化学感受态的大肠杆菌细胞(Invitrogen)的转化。来自两种输出的87个菌落使用QPix2XT机器人挑出到具有carbenicilin和消泡剂20496的1ml的TBonex培养基中,在900rpm在潮湿空气中在96深孔平板中培养63h(首先20h 37℃,随后的小时30℃)。培养物4600rpm旋转40min,通过0.22滤板过滤,在蛋白L CIM圆盘HPLC上纯化。因而表达了几种蛋白酶抗性GLP-1变体肽。
DOM1h-131-511的核苷酸序列在这个段落中列出。
DOM1h-131-511的核苷酸序列:
GAGGTGCAGC TGTTGGAGTC TGGGGGAGGC TTGGTACAGC CTGGGGGGTC CCTGCGTCTC
TCCTGTGCAG CCTCCGGATT CACCTTTGCG CATGAGACGA TGGTGTGGGT CCGCCAGGCT
CCAGGGAAGG GTCTAGAGTG GGTCTCACAT ATTCCCCCGG TTGGTCAGGA TCCCTTCTAC
GCAGACTCCG TGAAGGGCCG GTTCACCATC TCCCGCGACA ATTCCAAGAA CACGCTATAT
CTGCAAATGA ACAGCCTGCG TGCCGAGGAC ACAGCGGTAT ATTACTGTGC GCTGCTTCCT
AAGAGGGGGC CTTGGTTTGA CTACTGGGGT CAGGGAACCC TGGTCACCGT CTCGAGC
Claims (67)
1.从肽或多肽的集中选择蛋白酶抗性肽或多肽的方法,包括
提供肽或多肽的集;
在适合蛋白酶活性的条件下组合所述集和蛋白酶;以及
回收具有期望的生物学活性的肽或多肽,
从而选择蛋白酶抗性肽或多肽,
其中所述蛋白酶选自在痰、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管肺泡灌洗液、肺匀浆、肺提取物、胰提取物、胃液、唾液或泪液中存在的蛋白酶。
2.从肽或多肽的集中选择蛋白酶抗性肽或多肽的方法,包括
提供肽或多肽的集;
在适合蛋白酶活性的条件下组合所述集和蛋白酶;以及
回收具有期望的生物学活性的肽或多肽,
从而选择蛋白酶抗性肽或多肽,
其中所述条件是(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少约30分钟。
3.权利要求2的方法,其中所述条件(i)是约10到约100μg/ml蛋白酶。
4.权利要求2或3的方法,其中所述条件(ii)是约30到约37℃。
5.权利要求2到4的任一项的方法,其中所述条件(iii)是至少约一小时。
6.权利要求2到5的任一项的方法,其中所述蛋白酶选自在痰、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管肺泡灌洗液、肺匀浆、肺提取物、胰提取物、胃液、唾液或泪液中存在的蛋白酶。
7.前述任一项权利要求的方法,其中所述蛋白酶包含以下的一种或更多种:丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、巯基蛋白酶、基质金属蛋白酶、羧肽酶(例如,羧肽酶A、羧肽酶B)、胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶、木瓜蛋白酶、弹性蛋白酶、leucozyme、胰酶、凝血酶、纤维蛋白溶酶、组织蛋白酶(例如,组织蛋白酶G)、蛋白水解酶(例如,蛋白水解酶1、蛋白水解酶2、蛋白水解酶3)、嗜热菌蛋白酶、凝乳酶、肠肽酶、胱天蛋白酶(例如,胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶9、胱天蛋白酶12、胱天蛋白酶13)、钙激活中性蛋白酶、无花果蛋白酶、梭菌蛋白酶、actinidain、菠萝蛋白酶和separase。
8.前述任一项权利要求的方法,其中所述蛋白酶是胰蛋白酶或弹性蛋白酶。
9.前述任一项权利要求的方法,其中所述蛋白酶是由生物学提取物、生物学匀浆或生物制品提供的。
10.权利要求9的方法,其中所述生物学提取物、生物学匀浆或生物制品选自由痰、粘液(例如,胃粘液、鼻粘液、支气管粘液)、支气管肺泡灌洗液、肺匀浆、肺提取物、胰提取物、胃液、唾液和泪液构成的组。
11.前述任一项权利要求的方法,其中所述期望的生物学活性是结合活性。
12.权利要求11的方法,其中所述结合活性是结合通用配体。
13.权利要求12的方法,其中所述通用配体是蛋白A、蛋白G或蛋白L。
14.权利要求11的方法,其中所述结合活性是特异性结合目标配体。
15.权利要求14的方法,其中所述目标配体选自由以下构成的组:ApoE、Apo-SAA、BDNF、心肌营养蛋白-1、CEA、CD40、CD40配体、CD56、CD38、CD138、EGF、EGF受体、ENA-78、嗜酸细胞活化趋化因子、嗜酸细胞活化趋化因子-2、Exodus-2、FAPα、FGF-酸性、FGF-碱性、成纤维细胞生长因子-10、FLT3配体、CXXXC趋化因子(CX3C)、
GDNF,G-CSF,GM-CSF,GF-β1,
人血清白蛋白、胰岛素、IFN-γ,IGF-I,IGF-II,IL-1α,IL-1β,IL-1受体、IL-1I型受体、IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8(72a.a.),IL-8(77a.a.),IL-9,IL-10,IL-11,IL-12,IL-13,IL-15,IL-16,IL-17,IL-18(IGIF),抑制素α、抑制素β、IP-10、角质形成细胞生长因子-2(KGF-2)、KGF、瘦蛋白、LIF、淋巴细胞趋化因子、缪勒管抑制物质、单核细胞集落抑制因子、单核细胞引诱蛋白、
M-CSF,MDC(67a.a.),
MDC(69a.a.),MCP-1(MCAF),MCP-2,MCP-3,MCP-4,MDC(67a.a.),MDC(69a.a.),MIG,MIP-1α,MIP-1β,MIP-3α,MIP-3β,MIP-4,骨髓祖代抑制因子-1(MPIF-1)、NAP-2、Neurturin、神经生长因子、β-NGF、NT-3、NT-4、制瘤素M、
PDGF-AA,PDGF-AB,PDGF-
BB,PF-4,RANTES,SDF1α,SDF1β,SCF,SCGF,干细胞因子(SCF)、TARC,TGF-α,TGF-β,TGF-β2,TGF-β3,肿瘤坏死因子(TNF)、TNF-α、TNF-β、TNF受体I、TNF受体II、TNIL-1,TPO,VEGF,VEGF A,VEGF B,VEGF C,VEGF D,VEGF受体1、VEGF受体2、VEGF受体3、
GCP-2,GRO/MGSA,GRO-β,GRO-γ,HCC1,1-309,HER1,HER 2,HER 3,HER 4,
血清白蛋白、vWF、淀粉样蛋白(例如,淀粉样蛋白α)、
MMP12,PDK1,IgE,IL-13Rα1,IL-13Ra2,IL-15,IL-15R,IL-16,IL-17R,IL-17,IL-18,IL-18R,IL-23IL-23R,IL-25,CD2,CD4,CD11a,CD23,CD25,CD27,CD28,CD30,CD40,CD40L,CD56,CD138,ALK5,EGFR,FcER1,TGFb,CCL2,CCL18,CEA,CR8,CTGF,CXCL12(SDF-1),
糜蛋白酶、FGF、弗林蛋白酶、内皮缩血管肽-1、嗜酸细胞活化趋化因子(例如,嗜酸细胞活化趋化因子、嗜酸细胞活化趋化因子-2、嗜酸细胞活化趋化因子-3)、
GM-CSF,ICAM-1,ICOS,IgE,IFNa,I-309,整联蛋白、L-选择蛋白、MIF,MIP4,MDC,MCP-1,MMPs,嗜中性白细胞弹性蛋白酶,骨桥蛋白、OX-40,PARC,PD-1,RANTES,SCF,SDF-1,siglec8,TARC,TGFb,凝血酶、Tim-1,TNF,TRANCE,类胰蛋白酶、VEGF,VLA-4,VCAM,α4β7,CCR2,CCR3,CCR4,CCR5,CCR7,CCR8,alphavbeta6,alphavbeta8,cMET,CD8,vWF,
淀粉样蛋白(例如,淀粉样蛋白α)、MMP12、PDK1和IgE。
16.前述任一项权利要求的方法,其中所述具有期望的生物学活性的肽或多肽通过淘选来回收。
17.前述权利要求的任一项的方法,其中所述集包含展示系统。
18.权利要求17的方法,其中所述展示系统选自由细菌噬菌体展示、核糖体展示、乳液区室化和展示、酵母展示、嘌呤霉素展示、细菌展示、在质粒上展示和共价展示构成的组。
19.权利要求17或18的方法,其中所述展示系统与核酸的编码功能和由核酸编码的肽或多肽的功能性特征相关。
20.权利要求17、18或19的方法,其中所述展示系统包含可复制的遗传包。
21.权利要求17到20的任一项的方法,其中所述展示系统包含细菌噬菌体展示。
22.权利要求21的方法,其中所述细菌噬菌体展示系统是多价的。
23.权利要求21的方法,其中所述细菌噬菌体选自由fd、M13、λ、MS2和T7构成的组。
24.权利要求23的方法,其中所述肽或多肽作为pIII融合蛋白来展示。
25.权利要求19的方法,其中所述肽或多肽位于pIII的结构域1的氨基-末端。
26.权利要求19的方法,进一步包括扩增编码具有期望的生物学活性的肽或多肽的核酸。
27.权利要求26的方法,其中所述核酸通过噬菌体扩增、细胞生长或聚合酶链式反应来扩增。
28.前述任一项权利要求的方法,其中所述集是免疫球蛋白单可变结构域的集。
29.权利要求28的方法,其中所述免疫球蛋白单可变结构域是重链可变结构域。
30.权利要求29的方法,其中所述重链可变结构域是人类或人源化的重链可变结构域。
31.权利要求28的方法,其中所述免疫球蛋白单可变结构域是轻链可变结构域。
32.权利要求31的方法,其中所述轻链可变结构域是人类或人源化的轻链可变结构域。
33.根据前述任一项权利要求的方法,用于从所述肽或多肽的集选择以高亲和力结合目标配体的肽或多肽。
34.前述任一项权利要求的方法,其中所述蛋白酶在约100μg/ml下使用,并且所述组合的集和蛋白酶在约37℃孵育至少约一小时。
35.任一前述权利要求的方法,其中每种所述多肽是结合目标的免疫球蛋白单可变结构域(dAb);所述集通过展示免疫球蛋白单可变结构域的集的噬菌体展示系统来提供,在所述组合步骤中
所述噬菌体展示系统与选自由弹性蛋白酶、leucozyme和胰蛋白酶构成的组的蛋白酶在适合于蛋白酶活性的条件下组合;以及在所述回收步骤中,展示了包含结合所述目标配体的免疫球蛋白单可变结构域的多肽的噬菌体被回收。
36.产生蛋白酶抗性肽或多肽的集的方法,包括进行前述任一项权利要求的方法,其中在所述回收步骤中,具有期望的生物学活性的复数种肽或多肽被回收,从而产生蛋白酶抗性肽或多肽的集。
37.权利要求36的方法,其中所述蛋白酶抗性肽或多肽的集是首次用于实验的集。
38.权利要求36或37的方法,进一步包括在适合于第二蛋白酶的活性的条件下组合第二蛋白酶与所述蛋白酶抗性肽或多肽的集;以及回收具有期望的生物学活性的至少一种肽或多肽,从而选择对所述第二蛋白酶有抗性的至少一种肽或多肽。
39.权利要求38的方法,其中所述第二蛋白酶是在权利要求6到10的任一项中所定义的。
40.前述任一项权利要求的方法,其中在所述集中蛋白酶与肽或多肽的比例(摩尔/摩尔)是8,000到80,000蛋白酶:肽或多肽。
41.前述任一项权利要求的方法,其中在所述集中蛋白酶与肽或多肽的比例(重量/重量)是1,600到160,000蛋白酶:肽或多肽。
42.通过前述权利要求的任一项的方法可选择的或选择的分离的蛋白酶抗性肽或多肽。
43.通过权利要求1到41的任一项的方法可选择的或选择的分离的蛋白酶抗性免疫球蛋白单可变结构域。
44.分离的肺部目标拮抗剂,包含免疫球蛋白单可变结构域,所述免疫球蛋白单可变结构域当在(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少约30分钟的条件下(例如,在100μg/ml的蛋白酶在37℃至少一小时的条件下),与所述蛋白酶孵育时对选自胰蛋白酶、弹性蛋白酶和leucozyme的一种或更多种蛋白酶有抗性,所述分离的肺部目标拮抗剂用于施用给患者来治疗和/或预防肺部疾病或状况。
45.权利要求44的拮抗剂,用于通过吸入或鼻内地向患者施用。
46.分离的GI道目标拮抗剂,包含免疫球蛋白单可变结构域,所述免疫球蛋白单可变结构域当在(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少约30分钟的条件下(例如,在100μg/ml的蛋白酶在37℃至少一小时的条件下),与所述蛋白酶孵育时对选自胰蛋白酶、弹性蛋白酶和leucozyme的一种或更多种蛋白酶有抗性,所述分离的GI道目标拮抗剂用于施用给患者来治疗和/或预防GI道疾病或状况。
47.权利要求46的拮抗剂,用于口服、舌下地或直肠地向患者施用。
48.权利要求44到47的任一项的拮抗剂,其中所述拮抗剂拮抗TNFα。
49.权利要求48的拮抗剂,其中所述可变结构域包含TNFR1的结合位点。
50.权利要求44到47的任一项的拮抗剂,其中所述拮抗剂拮抗TNFR1、VEGF或IL-1R1。
51.权利要求50的拮抗剂,其中所述可变结构域分别包含TNFR1、VEGF或IL-1R1的结合位点。
52.分离的肺部目标拮抗剂在制造药物中的用途,所述分离的肺部目标拮抗剂包含免疫球蛋白单可变结构域,所述免疫球蛋白单可变结构域当在(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少约30分钟的条件下(例如,在100μg/ml的蛋白酶在37℃至少一小时的条件下),与所述蛋白酶孵育时对选自胰蛋白酶、弹性蛋白酶和leucozyme的一种或更多种蛋白酶有抗性,所述药物用于施用给患者来治疗和/或预防肺部疾病或状况。
53.权利要求52的用途,其中所述施用是吸入或鼻内地施用给患者。
54.分离的GI道目标拮抗剂在制造药物中的用途,所述分离的GI道目标拮抗剂包含免疫球蛋白单可变结构域,所述免疫球蛋白单可变结构域当在(i)约10μg/ml到约3mg/ml蛋白酶,(ii)约20℃到约40℃和(iii)至少约30分钟的条件下(例如,在100μg/ml的蛋白酶在37℃至少一小时的条件下),与所述蛋白酶孵育时对选自胰蛋白酶、弹性蛋白酶和leucozyme的一种或更多种蛋白酶有抗性,所述药物用于施用给患者来治疗和/或预防GI道疾病或状况。
55.权利要求54的用途,其中所述施用是口服、舌下地或直肠地施用给患者。
56.权利要求52到54的任一项的用途,其中所述拮抗剂拮抗TNFα。
57.权利要求56的用途,其中所述可变结构域包含TNFR1的结合位点。
58.权利要求52到54的任一项的用途,其中所述拮抗剂拮抗TNFR1、VEGF或IL-1R1。
59.权利要求58的拮抗剂,其中所述可变结构域分别包含TNFR1、VEGF或IL-1R1的结合位点。
60.编码权利要求42或43的蛋白酶抗性肽、多肽或可变结构域或权利要求44到51的任一项的拮抗剂的分离的核酸。
61.编码权利要求42或43的蛋白酶抗性肽、多肽或可变结构域或权利要求44到51的任一项的拮抗剂的重组核酸。
62.包含权利要求60或61的核酸的载体。
63.包含权利要求62的核酸的宿主细胞。
64.生产通过权利要求1到41的任一项的方法可选择或选择的蛋白酶抗性肽或多肽、或权利要求44到51的任一项的拮抗剂的方法,包括将含有编码所述蛋白酶抗性肽或多肽或拮抗剂的重组核酸的宿主细胞维持在适合于表达的条件下,从而产生蛋白酶抗性肽或多肽或拮抗剂。
65.用于药物中的通过权利要求1到41的任一项的方法可选择或选择的蛋白酶抗性肽或多肽或权利要求43的可变结构域。
66.用于制造用于治疗和/或预防疾病的药物的通过权利要求1到41的任一项的方法可选择或选择的蛋白酶抗性肽或多肽或权利要求43的可变结构域。
67.治疗疾病的方法,包括向需要其的受试者施用有效量的、通过权利要求1到41的任一项的方法可选择或选择的蛋白酶抗性肽或多肽或可变结构域。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US93363207P | 2007-06-06 | 2007-06-06 | |
| US60/933632 | 2007-06-06 | ||
| GBGB0724331.4A GB0724331D0 (en) | 2007-12-13 | 2007-12-13 | Compositions for pulmonary delivery |
| GB0724331.4 | 2007-12-13 | ||
| PCT/GB2008/050399 WO2008149143A2 (en) | 2007-06-06 | 2008-06-03 | Methods for selecting protease resistant polypeptides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN101848935A true CN101848935A (zh) | 2010-09-29 |
Family
ID=39016531
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200880102138A Pending CN101848935A (zh) | 2007-06-06 | 2008-06-03 | 选择蛋白酶抗性多肽的方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (7) | US8357780B2 (zh) |
| EP (3) | EP2162466A2 (zh) |
| JP (3) | JP2010529840A (zh) |
| CN (1) | CN101848935A (zh) |
| BR (1) | BRPI0813898A2 (zh) |
| GB (1) | GB0724331D0 (zh) |
| WO (3) | WO2008149143A2 (zh) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102121043A (zh) * | 2010-12-16 | 2011-07-13 | 东华大学 | 一种亲和筛选菠萝蛋白酶的亲和配基的方法 |
| CN107376036A (zh) * | 2017-06-23 | 2017-11-24 | 淮阴工学院 | 一种酶响应型多功能纳米涂层的构建方法 |
| CN111763247A (zh) * | 2012-09-25 | 2020-10-13 | 阿菲博迪公司 | 白蛋白结合多肽 |
| CN114716513A (zh) * | 2015-01-20 | 2022-07-08 | 西托姆克斯治疗公司 | 基质金属蛋白酶可切割且丝氨酸蛋白酶可切割底物及其使用方法 |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005289809A (ja) | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| SG184709A1 (en) | 2005-05-18 | 2012-10-30 | Ablynx Nv | Improved nanobodies™ against tumor necrosis factor-alpha |
| DE102005023617A1 (de) | 2005-05-21 | 2006-11-23 | Aspre Ag | Verfahren zum Mischen von Farben in einem Display |
| US7838250B1 (en) | 2006-04-04 | 2010-11-23 | Singulex, Inc. | Highly sensitive system and methods for analysis of troponin |
| CA2648382C (en) | 2006-04-04 | 2016-10-11 | Singulex, Inc. | Methods and compositions for highly sensitive analysis of markers and detection of molecules |
| KR20100040840A (ko) * | 2007-06-06 | 2010-04-21 | 도만티스 리미티드 | 폴리펩티드,항체 가변 도메인 및 길항제 |
| CN102089325A (zh) | 2008-04-17 | 2011-06-08 | 埃博灵克斯股份有限公司 | 能够结合血清白蛋白的肽,以及包含其的化合物、构建体和多肽 |
| KR20110015604A (ko) | 2008-05-06 | 2011-02-16 | 글락소 그룹 리미티드 | 생물학적 활성제의 캡슐화 |
| CA2744055A1 (en) * | 2008-11-26 | 2010-06-03 | Glaxo Group Limited | Polypeptides, antibody variable domains & antagonists |
| KR101740066B1 (ko) * | 2008-12-05 | 2017-05-25 | 글락소 그룹 리미티드 | 프로테아제 저항성 폴리펩티드를 선택하는 방법 |
| WO2010081787A1 (en) | 2009-01-14 | 2010-07-22 | Domantis Limited | IMPROVED TNFα ANTAGONISM, PROPHYLAXIS & THERAPY WITH REDUCED ORGAN NECROSIS |
| WO2010094722A2 (en) * | 2009-02-19 | 2010-08-26 | Glaxo Group Limited | Improved anti-serum albumin binding variants |
| WO2010094723A2 (en) | 2009-02-19 | 2010-08-26 | Glaxo Group Limited | Improved anti-serum albumin binding variants |
| JP2012517818A (ja) * | 2009-02-19 | 2012-08-09 | グラクソ グループ リミテッド | 改善された抗tnfr1ポリペプチド、抗体可変ドメインおよびアンタゴニスト |
| WO2010097394A1 (en) | 2009-02-24 | 2010-09-02 | Glaxo Group Limited | Multivalent and/or multispecific rankl-binding constructs |
| US20110305692A1 (en) | 2009-02-24 | 2011-12-15 | Glaxo Group Limited | Antigen-binding contructs |
| MX2011010151A (es) | 2009-03-27 | 2011-12-14 | Glaxo Group Ltd | Fusiones y conjugados de farmaco. |
| AU2010259022B2 (en) | 2009-06-08 | 2016-05-12 | Singulex, Inc. | Highly sensitive biomarker panels |
| WO2011008814A2 (en) | 2009-07-14 | 2011-01-20 | Immune Tolerance Institute, Inc., A California Not-For-Profit Corporation | Multiplexed measurement of exogenous and endogenous dna |
| WO2011006914A2 (en) | 2009-07-16 | 2011-01-20 | Glaxo Group Limited | Antagonists, uses & methods for partially inhibiting tnfr1 |
| JP2013500030A (ja) | 2009-07-29 | 2013-01-07 | グラクソ グループ リミテッド | TGF−β受容体RIIを結合するリガンド |
| SG10201406063XA (en) * | 2009-09-30 | 2014-11-27 | Glaxo Group Ltd | Drug fusions and conjugates with extended half life |
| BR112012010114A2 (pt) * | 2009-10-27 | 2017-08-08 | Glaxo Group Ltd | domínio variável único de imunoglobulina, ligante multiespecífico, antagonista, uso do antagonista, método para tratamento e/ou profilaxia de uma condição inflamatória em um paciente, ácido nucleico, vetor, e, célula hospedeira. |
| JP2013518558A (ja) * | 2010-02-04 | 2013-05-23 | メディカル リサーチ カウンシル | 構造化されたペプチドプロセシング |
| JP2013518853A (ja) | 2010-02-05 | 2013-05-23 | アブリンクス エン.ヴェー. | 血清アルブミンと結合することが可能なペプチド並びにこれを含む化合物、構築物及びポリペプチド |
| SG185437A1 (en) | 2010-05-20 | 2012-12-28 | Glaxo Group Ltd | Improved anti-serum albumin binding variants |
| JP2013538566A (ja) | 2010-08-13 | 2013-10-17 | グラクソスミスクライン、インテレクチュアル、プロパティー、ディベロップメント、リミテッド | 改良された抗血清アルブミン結合変異体 |
| BR112013003899A2 (pt) | 2010-08-20 | 2016-06-07 | Glaxosmithkline Ip Dev Ltd | domínio variável único da imunoglobina anti-albumina sérica (sa), ligando multiespecífico, proteína de fusão, composição, ácido nucleico, vetor, célula hospedeira isolada, e, método de tratar ou previnir uma doença ou distúrbio em um paciente |
| HUE031371T2 (en) | 2010-08-23 | 2017-07-28 | Univ Texas | Anti-OX40 antibodies and their application procedures |
| WO2012064792A2 (en) | 2010-11-09 | 2012-05-18 | Altimab Therapeutics, Inc. | Protein complexes for antigen binding and methods of use |
| MX2013005847A (es) * | 2010-11-24 | 2013-12-12 | Glaxo Group Ltd | Proteinas de union a antigeno multiespecificas que eligen como blanco a hgf. |
| CN103443126B (zh) | 2011-01-06 | 2016-11-23 | 葛兰素集团有限公司 | 结合TGFβ受体II的配体 |
| EP2699601B1 (en) | 2011-04-21 | 2018-01-17 | Bristol-Myers Squibb Company | Antibody polypeptides that antagonize cd40 |
| PE20141659A1 (es) * | 2011-07-27 | 2014-11-21 | Glaxo Group Ltd | Dominios variables singulares anti-vgf fusionados con dominios de fc |
| EP2987806A3 (en) * | 2011-08-17 | 2016-07-13 | Glaxo Group Limited | Modified single variable domain antibodies with reduced binding to anti-drug-antibodies |
| EP3489258A1 (en) * | 2012-11-08 | 2019-05-29 | Eleven Biotherapeutics, Inc. | Il-6 antagonists and uses thereof |
| US10435475B2 (en) | 2014-03-07 | 2019-10-08 | Bristol-Myers Squibb Company | Method of using antibody polypeptides that antagonize CD40 to treat IBD |
| US9840553B2 (en) | 2014-06-28 | 2017-12-12 | Kodiak Sciences Inc. | Dual PDGF/VEGF antagonists |
| CA2981103A1 (en) * | 2015-03-31 | 2016-10-06 | Vhsquared Limited | Polypeptides |
| BR112017020948A2 (pt) | 2015-03-31 | 2018-07-10 | Ildong Pharm Co., Ltd. | composição farmacêutica, método para preparar um agente, método para tratar uma doença ocular e uso de uma proteína de fusão |
| ES2913200T3 (es) | 2015-03-31 | 2022-06-01 | Sorriso Pharmaceuticals Inc | Polipéptidos |
| SI3345613T1 (sl) | 2015-09-01 | 2023-10-30 | Il Dong Pharmaceutical Co., Ltd. | Sestavek za uporabo pri zdravljenju raka ali z angiogenezo povezane bolezni, ki obsega fuzijski protein iz tumor-penetrirajočega peptida in sredstva anti-VEGF |
| US11066465B2 (en) | 2015-12-30 | 2021-07-20 | Kodiak Sciences Inc. | Antibodies and conjugates thereof |
| WO2017125578A1 (en) | 2016-01-21 | 2017-07-27 | Vhsquared Limited | Polypeptides |
| SG11201807402PA (en) | 2016-03-31 | 2018-09-27 | Vhsquared Ltd | Compositions |
| WO2018060453A1 (en) | 2016-09-30 | 2018-04-05 | Vhsquared Limited | Compositions |
| US10329620B2 (en) | 2017-01-12 | 2019-06-25 | Cardioforecast Ltd. | Methods and kits for treating cardiovascular disease |
| SG11202008242XA (en) | 2018-03-02 | 2020-09-29 | Kodiak Sciences Inc | Il-6 antibodies and fusion constructs and conjugates thereof |
| CN113194980A (zh) * | 2018-10-09 | 2021-07-30 | 利兰斯坦福初级大学董事会 | 作为受体拮抗剂的工程化纤维细胞生长因子变体 |
| CN109234298A (zh) * | 2018-10-30 | 2019-01-18 | 南昌大学 | 一种卷曲乳杆菌atcc55221的构建及其在治疗产妇乳头皲裂中的应用 |
| KR20210102318A (ko) | 2018-12-06 | 2021-08-19 | 싸이톰스 테라퓨틱스, 인크. | 매트릭스 메탈로프로테이스-절단성 기질 및 세린 또는 시스테인 프로테이스-절단성 기질 그리고 이들의 사용 방법 |
| EP3986931A1 (en) | 2019-06-21 | 2022-04-27 | Sorriso Pharmaceuticals, Inc. | Polypeptides |
| CN114466864A (zh) * | 2019-06-21 | 2022-05-10 | 索瑞索制药公司 | 多肽 |
| CA3157509A1 (en) | 2019-10-10 | 2021-04-15 | Kodiak Sciences Inc. | Methods of treating an eye disorder |
| JP2023541816A (ja) | 2020-08-27 | 2023-10-04 | イノージ・セラピューティクス・コーポレイション | 自己免疫性疾患および癌を治療するための方法および組成物 |
| WO2022117569A1 (en) | 2020-12-02 | 2022-06-09 | Oncurious Nv | A ccr8 antagonist antibody in combination with a lymphotoxin beta receptor agonist antibody in therapy against cancer |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2148299B (en) | 1983-09-01 | 1988-01-06 | Hybritech Inc | Antibody compositions of therapeutic agents having an extended serum half-life |
| AU634186B2 (en) | 1988-11-11 | 1993-02-18 | Medical Research Council | Single domain ligands, receptors comprising said ligands, methods for their production, and use of said ligands and receptors |
| CA2016842A1 (en) | 1989-05-16 | 1990-11-16 | Richard A. Lerner | Method for tapping the immunological repertoire |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| DK0585287T3 (da) | 1990-07-10 | 2000-04-17 | Cambridge Antibody Tech | Fremgangsmåde til fremstilling af specifikke bindingsparelementer |
| PT1024191E (pt) | 1991-12-02 | 2008-12-22 | Medical Res Council | Produção de auto-anticorpos a partir de reportórios de segmentos de anticorpo e exibidos em fagos |
| TWI327599B (en) | 2000-11-28 | 2010-07-21 | Medimmune Llc | Methods of administering/dosing anti-rsv antibodies for prophylaxis and treatment |
| US20060073141A1 (en) * | 2001-06-28 | 2006-04-06 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| GB0118689D0 (en) | 2001-08-01 | 2001-09-19 | Psimedica Ltd | Pharmaceutical formulation |
| CN101143221A (zh) * | 2002-03-15 | 2008-03-19 | 布赖汉姆妇女医院 | 适合治疗剂全身性递送的中央气道给药 |
| US20060002935A1 (en) * | 2002-06-28 | 2006-01-05 | Domantis Limited | Tumor Necrosis Factor Receptor 1 antagonists and methods of use therefor |
| US7696320B2 (en) * | 2004-08-24 | 2010-04-13 | Domantis Limited | Ligands that have binding specificity for VEGF and/or EGFR and methods of use therefor |
| JP2006512895A (ja) * | 2002-06-28 | 2006-04-20 | ドマンティス リミテッド | リガンド |
| CA2824167C (en) | 2002-09-06 | 2018-09-25 | Amgen Inc. | Therapeutic human anti-il-1r1 monoclonal antibody |
| JP4601426B2 (ja) | 2002-09-06 | 2010-12-22 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 補体成分c5に対する抗体を使用する喘息の処置の方法 |
| GB0230203D0 (en) * | 2002-12-27 | 2003-02-05 | Domantis Ltd | Fc fusion |
| JP2006523090A (ja) * | 2002-12-27 | 2006-10-12 | ドマンティス リミテッド | リガンドに、そしてリガンド受容体に特異的な二重特異性単一ドメイン抗体 |
| DK1639011T3 (da) * | 2003-06-30 | 2009-02-16 | Domantis Ltd | Pegylerede enkelt-domæne antistoffer (dAb) |
| KR20070086896A (ko) * | 2004-12-02 | 2007-08-27 | 도만티스 리미티드 | 항il1r1 단일 도메인 항체 및 치료적 용도 |
| GB0521621D0 (en) | 2005-10-24 | 2005-11-30 | Domantis Ltd | Tumor necrosis factor receptor 1 antagonists for treating respiratory diseases |
| EA200801166A1 (ru) | 2005-12-01 | 2008-12-30 | Домантис Лимитед | Форматы конкурентного доменного антитела, которые связываются с рецептором интерлейкина 1 первого типа |
| TW200730539A (en) | 2005-12-01 | 2007-08-16 | Domantis Ltd | Noncompetitive domain antibody formats that bind interleukin 1 receptor type 1 |
| KR20080077261A (ko) * | 2005-12-06 | 2008-08-21 | 도만티스 리미티드 | Egfr 및/또는 vegf에 대해 결합 특이성이 있는리간드 및 그의 사용 방법 |
| LT2068889T (lt) | 2006-08-10 | 2020-02-10 | Roy C. Levitt | Anakinra, naudojama bronchiolito obliteranso sindromo gydymui |
| WO2008049897A1 (en) | 2006-10-27 | 2008-05-02 | Ablynx N.V. | Intranasal delivery of polypeptides and proteins |
| KR20100040840A (ko) | 2007-06-06 | 2010-04-21 | 도만티스 리미티드 | 폴리펩티드,항체 가변 도메인 및 길항제 |
| KR20100018040A (ko) | 2007-06-06 | 2010-02-16 | 도만티스 리미티드 | 프로테아제 내성 폴리펩티드를 선택하는 방법 |
-
2007
- 2007-12-13 GB GBGB0724331.4A patent/GB0724331D0/en not_active Ceased
-
2008
- 2008-06-03 US US12/663,498 patent/US8357780B2/en active Active
- 2008-06-03 JP JP2010510884A patent/JP2010529840A/ja active Pending
- 2008-06-03 EP EP08750795A patent/EP2162466A2/en not_active Withdrawn
- 2008-06-03 WO PCT/GB2008/050399 patent/WO2008149143A2/en active Application Filing
- 2008-06-03 JP JP2010510882A patent/JP2010528645A/ja active Pending
- 2008-06-03 US US12/663,501 patent/US20100254995A1/en not_active Abandoned
- 2008-06-03 WO PCT/GB2008/050403 patent/WO2008149146A2/en active Application Filing
- 2008-06-03 US US12/663,491 patent/US20100254972A1/en not_active Abandoned
- 2008-06-03 EP EP08750798A patent/EP2158218A2/en not_active Withdrawn
- 2008-06-03 US US12/663,509 patent/US20110086019A1/en not_active Abandoned
- 2008-06-03 CN CN200880102138A patent/CN101848935A/zh active Pending
- 2008-06-03 BR BRPI0813898A patent/BRPI0813898A2/pt not_active IP Right Cessation
- 2008-06-03 JP JP2010510883A patent/JP2010528646A/ja active Pending
- 2008-06-03 EP EP08750794A patent/EP2162465A2/en not_active Withdrawn
- 2008-06-03 WO PCT/GB2008/050400 patent/WO2008149144A2/en active Application Filing
-
2013
- 2013-02-11 US US13/763,768 patent/US9562090B2/en active Active
-
2016
- 2016-12-21 US US15/386,141 patent/US10072089B2/en active Active
-
2018
- 2018-07-27 US US16/047,197 patent/US20190040148A1/en not_active Abandoned
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102121043A (zh) * | 2010-12-16 | 2011-07-13 | 东华大学 | 一种亲和筛选菠萝蛋白酶的亲和配基的方法 |
| CN102121043B (zh) * | 2010-12-16 | 2013-06-05 | 东华大学 | 一种亲和筛选菠萝蛋白酶的亲和配基的方法 |
| CN111763247A (zh) * | 2012-09-25 | 2020-10-13 | 阿菲博迪公司 | 白蛋白结合多肽 |
| CN114716513A (zh) * | 2015-01-20 | 2022-07-08 | 西托姆克斯治疗公司 | 基质金属蛋白酶可切割且丝氨酸蛋白酶可切割底物及其使用方法 |
| CN107376036A (zh) * | 2017-06-23 | 2017-11-24 | 淮阴工学院 | 一种酶响应型多功能纳米涂层的构建方法 |
| CN107376036B (zh) * | 2017-06-23 | 2020-01-07 | 淮阴工学院 | 一种酶响应型多功能纳米涂层的构建方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| GB0724331D0 (en) | 2008-01-23 |
| US20100254972A1 (en) | 2010-10-07 |
| US8357780B2 (en) | 2013-01-22 |
| BRPI0813898A2 (pt) | 2019-09-24 |
| US20190040148A1 (en) | 2019-02-07 |
| US9562090B2 (en) | 2017-02-07 |
| US20110086019A1 (en) | 2011-04-14 |
| JP2010528646A (ja) | 2010-08-26 |
| WO2008149144A3 (en) | 2009-04-02 |
| EP2162465A2 (en) | 2010-03-17 |
| WO2008149146A2 (en) | 2008-12-11 |
| EP2162466A2 (en) | 2010-03-17 |
| EP2158218A2 (en) | 2010-03-03 |
| JP2010528645A (ja) | 2010-08-26 |
| WO2008149146A3 (en) | 2009-06-11 |
| WO2008149144A2 (en) | 2008-12-11 |
| US20100260763A1 (en) | 2010-10-14 |
| WO2008149143A2 (en) | 2008-12-11 |
| JP2010529840A (ja) | 2010-09-02 |
| US20140141093A1 (en) | 2014-05-22 |
| US20100254995A1 (en) | 2010-10-07 |
| US20170174775A1 (en) | 2017-06-22 |
| US10072089B2 (en) | 2018-09-11 |
| WO2008149143A3 (en) | 2009-04-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101848935A (zh) | 选择蛋白酶抗性多肽的方法 | |
| CN104311663B (zh) | 多肽、抗体可变域和拮抗剂 | |
| US8877186B2 (en) | Polypeptides, antibody variable domains and antagonists |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20100929 |