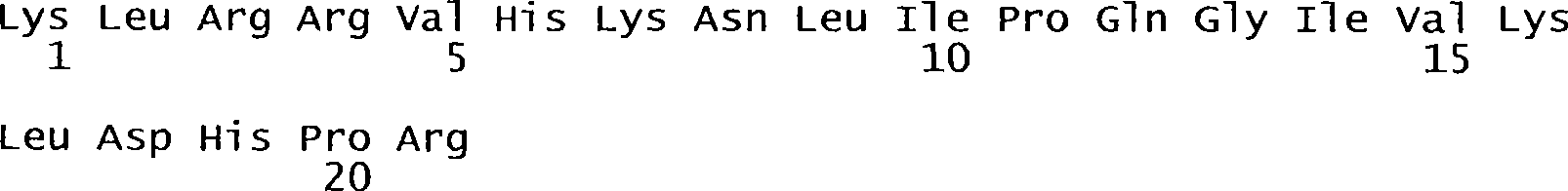CN101389314A - 生物活性fus1肽和纳米颗粒-多肽复合物 - Google Patents
生物活性fus1肽和纳米颗粒-多肽复合物 Download PDFInfo
- Publication number
- CN101389314A CN101389314A CNA2006800165915A CN200680016591A CN101389314A CN 101389314 A CN101389314 A CN 101389314A CN A2006800165915 A CNA2006800165915 A CN A2006800165915A CN 200680016591 A CN200680016591 A CN 200680016591A CN 101389314 A CN101389314 A CN 101389314A
- Authority
- CN
- China
- Prior art keywords
- peptide
- nano
- nanoparticle
- particle
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 524
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 253
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 156
- 230000000975 bioactive effect Effects 0.000 title claims abstract description 10
- 101100064720 Borrelia burgdorferi (strain ATCC 35210 / B31 / CIP 102532 / DSM 4680) fusA gene Proteins 0.000 title 1
- 239000002105 nanoparticle Substances 0.000 claims abstract description 230
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 162
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 113
- 108700025716 Tumor Suppressor Genes Proteins 0.000 claims abstract description 81
- 102000044209 Tumor Suppressor Genes Human genes 0.000 claims abstract description 81
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 51
- 239000000126 substance Substances 0.000 claims abstract description 29
- 210000004027 cell Anatomy 0.000 claims description 324
- 206010028980 Neoplasm Diseases 0.000 claims description 132
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 116
- 235000018102 proteins Nutrition 0.000 claims description 106
- 238000011282 treatment Methods 0.000 claims description 99
- 238000000034 method Methods 0.000 claims description 98
- 101100064718 Borrelia bavariensis (strain ATCC BAA-2496 / DSM 23469 / PBi) fusA1 gene Proteins 0.000 claims description 90
- 101100209555 Caenorhabditis elegans vha-17 gene Proteins 0.000 claims description 90
- 239000002502 liposome Substances 0.000 claims description 88
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 claims description 83
- 201000011510 cancer Diseases 0.000 claims description 83
- 239000000203 mixture Substances 0.000 claims description 83
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 claims description 82
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 65
- 150000002632 lipids Chemical class 0.000 claims description 64
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 claims description 58
- 235000012000 cholesterol Nutrition 0.000 claims description 58
- 210000004881 tumor cell Anatomy 0.000 claims description 51
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 44
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims description 40
- 239000008117 stearic acid Substances 0.000 claims description 40
- 230000001225 therapeutic effect Effects 0.000 claims description 38
- 239000005517 L01XE01 - Imatinib Substances 0.000 claims description 37
- 235000021355 Stearic acid Nutrition 0.000 claims description 37
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 claims description 37
- 108091000080 Phosphotransferase Proteins 0.000 claims description 32
- 230000006907 apoptotic process Effects 0.000 claims description 32
- 102000020233 phosphotransferase Human genes 0.000 claims description 32
- 238000002360 preparation method Methods 0.000 claims description 31
- -1 cKit Proteins 0.000 claims description 29
- 201000010099 disease Diseases 0.000 claims description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 29
- 239000000194 fatty acid Substances 0.000 claims description 28
- 150000004665 fatty acids Chemical group 0.000 claims description 27
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 24
- 229930195729 fatty acid Natural products 0.000 claims description 24
- 230000007935 neutral effect Effects 0.000 claims description 22
- 239000008187 granular material Substances 0.000 claims description 21
- 229960002411 imatinib Drugs 0.000 claims description 20
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 claims description 19
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 claims description 18
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 claims description 18
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 claims description 17
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 claims description 17
- 238000004458 analytical method Methods 0.000 claims description 17
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 claims description 17
- 230000001939 inductive effect Effects 0.000 claims description 17
- 230000003993 interaction Effects 0.000 claims description 17
- 230000004071 biological effect Effects 0.000 claims description 16
- 230000008685 targeting Effects 0.000 claims description 15
- 210000001519 tissue Anatomy 0.000 claims description 15
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 14
- 125000000539 amino acid group Chemical group 0.000 claims description 12
- 210000002706 plastid Anatomy 0.000 claims description 11
- 241001529453 unidentified herpesvirus Species 0.000 claims description 10
- TWJNQYPJQDRXPH-UHFFFAOYSA-N 2-cyanobenzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1C#N TWJNQYPJQDRXPH-UHFFFAOYSA-N 0.000 claims description 9
- 108700005087 Homeobox Genes Proteins 0.000 claims description 9
- TUNFSRHWOTWDNC-UHFFFAOYSA-N Myristic acid Natural products CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 claims description 9
- 102000001253 Protein Kinase Human genes 0.000 claims description 9
- 101710192266 Tegument protein VP22 Proteins 0.000 claims description 9
- 239000002078 nanoshell Substances 0.000 claims description 9
- 108060006633 protein kinase Proteins 0.000 claims description 9
- 210000000582 semen Anatomy 0.000 claims description 9
- 238000012916 structural analysis Methods 0.000 claims description 9
- XMWRBQBLMFGWIX-UHFFFAOYSA-N C60 fullerene Chemical compound C12=C3C(C4=C56)=C7C8=C5C5=C9C%10=C6C6=C4C1=C1C4=C6C6=C%10C%10=C9C9=C%11C5=C8C5=C8C7=C3C3=C7C2=C1C1=C2C4=C6C4=C%10C6=C9C9=C%11C5=C5C8=C3C3=C7C1=C1C2=C4C6=C2C9=C5C3=C12 XMWRBQBLMFGWIX-UHFFFAOYSA-N 0.000 claims description 8
- 235000021360 Myristic acid Nutrition 0.000 claims description 8
- 102000011195 Profilin Human genes 0.000 claims description 8
- 108050001408 Profilin Proteins 0.000 claims description 8
- 229910003472 fullerene Inorganic materials 0.000 claims description 8
- 239000002071 nanotube Substances 0.000 claims description 8
- 239000002096 quantum dot Substances 0.000 claims description 8
- 235000013399 edible fruits Nutrition 0.000 claims description 7
- 229920000642 polymer Polymers 0.000 claims description 7
- 230000005855 radiation Effects 0.000 claims description 7
- 239000004054 semiconductor nanocrystal Substances 0.000 claims description 7
- 238000005481 NMR spectroscopy Methods 0.000 claims description 6
- 229910052751 metal Inorganic materials 0.000 claims description 6
- 239000002184 metal Substances 0.000 claims description 6
- 229910052710 silicon Inorganic materials 0.000 claims description 6
- 239000010703 silicon Substances 0.000 claims description 6
- 239000000377 silicon dioxide Substances 0.000 claims description 6
- 235000012239 silicon dioxide Nutrition 0.000 claims description 6
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 claims description 5
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 claims description 5
- 230000000890 antigenic effect Effects 0.000 claims description 5
- 239000003085 diluting agent Substances 0.000 claims description 5
- 101150019028 Antp gene Proteins 0.000 claims description 4
- 238000012300 Sequence Analysis Methods 0.000 claims description 4
- BHONFOAYRQZPKZ-LCLOTLQISA-N chembl269478 Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(O)=O)C1=CC=CC=C1 BHONFOAYRQZPKZ-LCLOTLQISA-N 0.000 claims description 3
- 231100000433 cytotoxic Toxicity 0.000 claims description 3
- 230000001472 cytotoxic effect Effects 0.000 claims description 3
- 238000001647 drug administration Methods 0.000 claims description 3
- 108010062760 transportan Proteins 0.000 claims description 3
- 208000002699 Digestive System Neoplasms Diseases 0.000 claims description 2
- SNKAWJBJQDLSFF-NVKMUCNASA-N 1,2-dioleoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC SNKAWJBJQDLSFF-NVKMUCNASA-N 0.000 claims 5
- 101150044980 Akap1 gene Proteins 0.000 claims 1
- 101100494448 Caenorhabditis elegans cab-1 gene Proteins 0.000 claims 1
- 239000007928 intraperitoneal injection Substances 0.000 claims 1
- 230000004700 cellular uptake Effects 0.000 abstract 1
- 230000000694 effects Effects 0.000 description 72
- 102100036129 Tumor suppressor candidate 2 Human genes 0.000 description 64
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 64
- 101001061518 Homo sapiens RNA-binding protein FUS Proteins 0.000 description 53
- 101000659267 Homo sapiens Tumor suppressor candidate 2 Proteins 0.000 description 53
- 230000005764 inhibitory process Effects 0.000 description 52
- 229940024606 amino acid Drugs 0.000 description 44
- 230000006870 function Effects 0.000 description 42
- 235000001014 amino acid Nutrition 0.000 description 41
- 150000001413 amino acids Chemical class 0.000 description 41
- 206010041067 Small cell lung cancer Diseases 0.000 description 37
- 208000000587 small cell lung carcinoma Diseases 0.000 description 37
- 239000003153 chemical reaction reagent Substances 0.000 description 34
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 32
- 230000012010 growth Effects 0.000 description 31
- WTFXARWRTYJXII-UHFFFAOYSA-N iron(2+);iron(3+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[O-2].[Fe+2].[Fe+3].[Fe+3] WTFXARWRTYJXII-UHFFFAOYSA-N 0.000 description 31
- 239000000047 product Substances 0.000 description 31
- 230000008859 change Effects 0.000 description 30
- 238000006366 phosphorylation reaction Methods 0.000 description 30
- 230000001093 anti-cancer Effects 0.000 description 29
- 108700020796 Oncogene Proteins 0.000 description 28
- 239000003814 drug Substances 0.000 description 28
- 230000026731 phosphorylation Effects 0.000 description 28
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 27
- 239000003112 inhibitor Substances 0.000 description 26
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 24
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 24
- 229960002584 gefitinib Drugs 0.000 description 24
- 230000008034 disappearance Effects 0.000 description 23
- 230000037396 body weight Effects 0.000 description 22
- 150000003904 phospholipids Chemical class 0.000 description 22
- 239000003795 chemical substances by application Substances 0.000 description 21
- 230000014509 gene expression Effects 0.000 description 21
- 229940080856 gleevec Drugs 0.000 description 21
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 17
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 16
- 238000010521 absorption reaction Methods 0.000 description 16
- 230000004927 fusion Effects 0.000 description 16
- 238000011160 research Methods 0.000 description 16
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 15
- 208000020816 lung neoplasm Diseases 0.000 description 15
- 238000012545 processing Methods 0.000 description 15
- 108020004414 DNA Proteins 0.000 description 14
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 14
- 230000005291 magnetic effect Effects 0.000 description 14
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 description 13
- 102100033254 Tumor suppressor ARF Human genes 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- 230000001640 apoptogenic effect Effects 0.000 description 13
- 230000004663 cell proliferation Effects 0.000 description 13
- 238000006243 chemical reaction Methods 0.000 description 13
- 150000001875 compounds Chemical class 0.000 description 13
- 238000001114 immunoprecipitation Methods 0.000 description 13
- 230000002401 inhibitory effect Effects 0.000 description 13
- 238000000746 purification Methods 0.000 description 13
- 238000012384 transportation and delivery Methods 0.000 description 13
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 13
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 12
- 235000019197 fats Nutrition 0.000 description 12
- 238000011534 incubation Methods 0.000 description 12
- 238000002372 labelling Methods 0.000 description 12
- 230000000670 limiting effect Effects 0.000 description 12
- 239000002904 solvent Substances 0.000 description 12
- 239000000758 substrate Substances 0.000 description 12
- 101710150339 Tumor suppressor candidate 2 Proteins 0.000 description 11
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 description 11
- 238000000338 in vitro Methods 0.000 description 11
- 238000002347 injection Methods 0.000 description 11
- 229940090044 injection Drugs 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 201000005202 lung cancer Diseases 0.000 description 11
- 239000008194 pharmaceutical composition Substances 0.000 description 11
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 229940124597 therapeutic agent Drugs 0.000 description 11
- 238000001890 transfection Methods 0.000 description 11
- 230000008827 biological function Effects 0.000 description 10
- 238000002512 chemotherapy Methods 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 239000007788 liquid Substances 0.000 description 10
- 239000000463 material Substances 0.000 description 10
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 9
- 108700028369 Alleles Proteins 0.000 description 9
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 9
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 238000013459 approach Methods 0.000 description 9
- 230000000711 cancerogenic effect Effects 0.000 description 9
- 230000010261 cell growth Effects 0.000 description 9
- 238000005516 engineering process Methods 0.000 description 9
- 238000003384 imaging method Methods 0.000 description 9
- 239000010410 layer Substances 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 8
- 229920001817 Agar Polymers 0.000 description 8
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 8
- 239000008272 agar Substances 0.000 description 8
- 210000004204 blood vessel Anatomy 0.000 description 8
- 230000002209 hydrophobic effect Effects 0.000 description 8
- 238000001727 in vivo Methods 0.000 description 8
- 201000005296 lung carcinoma Diseases 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- 230000035945 sensitivity Effects 0.000 description 8
- 239000004475 Arginine Substances 0.000 description 7
- 108020004705 Codon Proteins 0.000 description 7
- 229920001503 Glucan Polymers 0.000 description 7
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 7
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 7
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 7
- 108010045292 Proto-Oncogene Proteins c-abl Proteins 0.000 description 7
- 102000005663 Proto-Oncogene Proteins c-abl Human genes 0.000 description 7
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 7
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 7
- 102000001742 Tumor Suppressor Proteins Human genes 0.000 description 7
- 108010040002 Tumor Suppressor Proteins Proteins 0.000 description 7
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 7
- 231100000315 carcinogenic Toxicity 0.000 description 7
- 230000006378 damage Effects 0.000 description 7
- 238000012217 deletion Methods 0.000 description 7
- 230000037430 deletion Effects 0.000 description 7
- 239000000499 gel Substances 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 150000003839 salts Chemical class 0.000 description 7
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 6
- 101100348617 Candida albicans (strain SC5314 / ATCC MYA-2876) NIK1 gene Proteins 0.000 description 6
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 6
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 6
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 6
- 239000004472 Lysine Substances 0.000 description 6
- 108010076504 Protein Sorting Signals Proteins 0.000 description 6
- 101100007329 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) COS1 gene Proteins 0.000 description 6
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 6
- 230000002421 anti-septic effect Effects 0.000 description 6
- 239000000427 antigen Substances 0.000 description 6
- 108091007433 antigens Proteins 0.000 description 6
- 102000036639 antigens Human genes 0.000 description 6
- 230000030833 cell death Effects 0.000 description 6
- 230000002759 chromosomal effect Effects 0.000 description 6
- 230000002950 deficient Effects 0.000 description 6
- 238000006073 displacement reaction Methods 0.000 description 6
- 238000009826 distribution Methods 0.000 description 6
- 210000003917 human chromosome Anatomy 0.000 description 6
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 6
- 229960000310 isoleucine Drugs 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 108700025694 p53 Genes Proteins 0.000 description 6
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 6
- DCWXELXMIBXGTH-UHFFFAOYSA-N phosphotyrosine Chemical compound OC(=O)C(N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-UHFFFAOYSA-N 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 238000012546 transfer Methods 0.000 description 6
- 239000000225 tumor suppressor protein Substances 0.000 description 6
- 238000001262 western blot Methods 0.000 description 6
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 5
- 241000275449 Diplectrum formosum Species 0.000 description 5
- 101150038178 FUS1 gene Proteins 0.000 description 5
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 5
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 5
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 5
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 5
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 5
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 5
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 5
- 102000043276 Oncogene Human genes 0.000 description 5
- 239000012722 SDS sample buffer Substances 0.000 description 5
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 5
- 239000004473 Threonine Substances 0.000 description 5
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 5
- 239000003005 anticarcinogenic agent Substances 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 229910052799 carbon Inorganic materials 0.000 description 5
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 5
- 239000011248 coating agent Substances 0.000 description 5
- 238000000576 coating method Methods 0.000 description 5
- 230000008878 coupling Effects 0.000 description 5
- 238000010168 coupling process Methods 0.000 description 5
- 238000005859 coupling reaction Methods 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 238000005538 encapsulation Methods 0.000 description 5
- 210000002950 fibroblast Anatomy 0.000 description 5
- 238000000799 fluorescence microscopy Methods 0.000 description 5
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 5
- 230000002779 inactivation Effects 0.000 description 5
- 238000007912 intraperitoneal administration Methods 0.000 description 5
- 210000004072 lung Anatomy 0.000 description 5
- 239000003068 molecular probe Substances 0.000 description 5
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 239000000829 suppository Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 5
- 239000004474 valine Substances 0.000 description 5
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 230000005778 DNA damage Effects 0.000 description 4
- 231100000277 DNA damage Toxicity 0.000 description 4
- 108010010803 Gelatin Proteins 0.000 description 4
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 4
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241001597008 Nomeidae Species 0.000 description 4
- 102000003923 Protein Kinase C Human genes 0.000 description 4
- 102000003890 RNA-binding protein FUS Human genes 0.000 description 4
- 108090000292 RNA-binding protein FUS Proteins 0.000 description 4
- 206010070834 Sensitisation Diseases 0.000 description 4
- 108091023040 Transcription factor Proteins 0.000 description 4
- 102000040945 Transcription factor Human genes 0.000 description 4
- 125000002252 acyl group Chemical group 0.000 description 4
- 230000003321 amplification Effects 0.000 description 4
- 230000005775 apoptotic pathway Effects 0.000 description 4
- 235000003704 aspartic acid Nutrition 0.000 description 4
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 4
- 239000012620 biological material Substances 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- 239000013592 cell lysate Substances 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 231100000135 cytotoxicity Toxicity 0.000 description 4
- 230000003013 cytotoxicity Effects 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000012636 effector Substances 0.000 description 4
- 230000002255 enzymatic effect Effects 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 239000007850 fluorescent dye Substances 0.000 description 4
- 238000001215 fluorescent labelling Methods 0.000 description 4
- 239000008273 gelatin Substances 0.000 description 4
- 229920000159 gelatin Polymers 0.000 description 4
- 235000019322 gelatine Nutrition 0.000 description 4
- 235000011852 gelatine desserts Nutrition 0.000 description 4
- 238000001415 gene therapy Methods 0.000 description 4
- 239000008103 glucose Substances 0.000 description 4
- 235000013922 glutamic acid Nutrition 0.000 description 4
- 239000004220 glutamic acid Substances 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 4
- 239000005556 hormone Substances 0.000 description 4
- 229940088597 hormone Drugs 0.000 description 4
- 229960003685 imatinib mesylate Drugs 0.000 description 4
- 238000003119 immunoblot Methods 0.000 description 4
- 208000032839 leukemia Diseases 0.000 description 4
- TWNIBLMWSKIRAT-VFUOTHLCSA-N levoglucosan Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@H]2CO[C@@H]1O2 TWNIBLMWSKIRAT-VFUOTHLCSA-N 0.000 description 4
- 208000037841 lung tumor Diseases 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 208000030159 metabolic disease Diseases 0.000 description 4
- 238000003199 nucleic acid amplification method Methods 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 4
- 238000001959 radiotherapy Methods 0.000 description 4
- 102000016914 ras Proteins Human genes 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 230000008313 sensitization Effects 0.000 description 4
- 230000008054 signal transmission Effects 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 101150091518 APAF1 gene Proteins 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 102000007469 Actins Human genes 0.000 description 3
- 108010085238 Actins Proteins 0.000 description 3
- 229920000936 Agarose Polymers 0.000 description 3
- 206010006187 Breast cancer Diseases 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- 208000005623 Carcinogenesis Diseases 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- 102100029951 Estrogen receptor beta Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- OZLGRUXZXMRXGP-UHFFFAOYSA-N Fluo-3 Chemical compound CC1=CC=C(N(CC(O)=O)CC(O)=O)C(OCCOC=2C(=CC=C(C=2)C2=C3C=C(Cl)C(=O)C=C3OC3=CC(O)=C(Cl)C=C32)N(CC(O)=O)CC(O)=O)=C1 OZLGRUXZXMRXGP-UHFFFAOYSA-N 0.000 description 3
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 3
- 101000962530 Homo sapiens Hyaluronidase-1 Proteins 0.000 description 3
- 101000962526 Homo sapiens Hyaluronidase-2 Proteins 0.000 description 3
- 101000712958 Homo sapiens Ras association domain-containing protein 1 Proteins 0.000 description 3
- 101000896379 Homo sapiens Transmembrane reductase CYB561D2 Proteins 0.000 description 3
- 101000740759 Homo sapiens Voltage-dependent calcium channel subunit alpha-2/delta-2 Proteins 0.000 description 3
- 102100039283 Hyaluronidase-1 Human genes 0.000 description 3
- 102100039285 Hyaluronidase-2 Human genes 0.000 description 3
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 3
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 3
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 102100033243 Ras association domain-containing protein 1 Human genes 0.000 description 3
- 201000000582 Retinoblastoma Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 102100021728 Transmembrane reductase CYB561D2 Human genes 0.000 description 3
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 3
- 102100037058 Voltage-dependent calcium channel subunit alpha-2/delta-2 Human genes 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 239000000443 aerosol Substances 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 201000008275 breast carcinoma Diseases 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000036952 cancer formation Effects 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 231100000504 carcinogenesis Toxicity 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- 210000004748 cultured cell Anatomy 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 235000018417 cysteine Nutrition 0.000 description 3
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 3
- 230000009849 deactivation Effects 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 208000016097 disease of metabolism Diseases 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 230000005284 excitation Effects 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 230000008676 import Effects 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 102000006240 membrane receptors Human genes 0.000 description 3
- 229930182817 methionine Natural products 0.000 description 3
- 230000017066 negative regulation of growth Effects 0.000 description 3
- 238000005457 optimization Methods 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 3
- 230000004962 physiological condition Effects 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 238000004321 preservation Methods 0.000 description 3
- 150000003141 primary amines Chemical class 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 102220159349 rs886062624 Human genes 0.000 description 3
- 238000005728 strengthening Methods 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000005760 tumorsuppression Effects 0.000 description 3
- 241000701161 unidentified adenovirus Species 0.000 description 3
- 239000013598 vector Substances 0.000 description 3
- KLFKZIQAIPDJCW-GPOMZPHUSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCC KLFKZIQAIPDJCW-GPOMZPHUSA-N 0.000 description 2
- NRJAVPSFFCBXDT-HUESYALOSA-N 1,2-distearoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCCCC NRJAVPSFFCBXDT-HUESYALOSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 2
- MEOVPKDOYAIVHZ-UHFFFAOYSA-N 2-chloro-1-(1-methylpyrrol-2-yl)ethanol Chemical compound CN1C=CC=C1C(O)CCl MEOVPKDOYAIVHZ-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 238000011735 C3H mouse Methods 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 102000008130 Cyclic AMP-Dependent Protein Kinases Human genes 0.000 description 2
- 108050006400 Cyclin Proteins 0.000 description 2
- 102100035353 Cyclin-dependent kinase 2-associated protein 1 Human genes 0.000 description 2
- 102100033270 Cyclin-dependent kinase inhibitor 1 Human genes 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102100024098 Deleted in lung and esophageal cancer protein 1 Human genes 0.000 description 2
- GZDFHIJNHHMENY-UHFFFAOYSA-N Dimethyl dicarbonate Chemical compound COC(=O)OC(=O)OC GZDFHIJNHHMENY-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 2
- 102100038595 Estrogen receptor Human genes 0.000 description 2
- 102000016621 Focal Adhesion Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108010067715 Focal Adhesion Protein-Tyrosine Kinases Proteins 0.000 description 2
- 102100022360 GATOR complex protein NPRL2 Human genes 0.000 description 2
- 206010064571 Gene mutation Diseases 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 102100021888 Helix-loop-helix protein 1 Human genes 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 101000945318 Homo sapiens Calponin-1 Proteins 0.000 description 2
- 101001053992 Homo sapiens Deleted in lung and esophageal cancer protein 1 Proteins 0.000 description 2
- 101000897691 Homo sapiens Helix-loop-helix protein 1 Proteins 0.000 description 2
- 101000652736 Homo sapiens Transgelin Proteins 0.000 description 2
- 101000915479 Homo sapiens Zinc finger MYND domain-containing protein 10 Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- MFGOTAHWOBKNNU-XMHGGMMESA-N Isodigeranyl Chemical group CC(C)=CCC\C(C)=C\CC(C)(C=C)CCC=C(C)C MFGOTAHWOBKNNU-XMHGGMMESA-N 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 244000147568 Laurus nobilis Species 0.000 description 2
- 235000017858 Laurus nobilis Nutrition 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- 101710151805 Mitochondrial intermediate peptidase 1 Proteins 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 208000003019 Neurofibromatosis 1 Diseases 0.000 description 2
- 208000024834 Neurofibromatosis type 1 Diseases 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 108010011536 PTEN Phosphohydrolase Proteins 0.000 description 2
- 102000014160 PTEN Phosphohydrolase Human genes 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 108010067902 Peptide Library Proteins 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- 102100036691 Proliferating cell nuclear antigen Human genes 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 102000052575 Proto-Oncogene Human genes 0.000 description 2
- 108700020978 Proto-Oncogene Proteins 0.000 description 2
- 101150040459 RAS gene Proteins 0.000 description 2
- 101001000212 Rattus norvegicus Decorin Proteins 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- PZBFGYYEXUXCOF-UHFFFAOYSA-N TCEP Chemical compound OC(=O)CCP(CCC(O)=O)CCC(O)=O PZBFGYYEXUXCOF-UHFFFAOYSA-N 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- 235000005212 Terminalia tomentosa Nutrition 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 102000002070 Transferrins Human genes 0.000 description 2
- 108010015865 Transferrins Proteins 0.000 description 2
- 102100031013 Transgelin Human genes 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 102100020695 Ubiquitin-conjugating enzyme E2 N Human genes 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 238000003277 amino acid sequence analysis Methods 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- 230000008485 antagonism Effects 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 230000000843 anti-fungal effect Effects 0.000 description 2
- 238000011319 anticancer therapy Methods 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- 238000003782 apoptosis assay Methods 0.000 description 2
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000036770 blood supply Effects 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 230000021164 cell adhesion Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 230000002301 combined effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 239000002872 contrast media Substances 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 239000012050 conventional carrier Substances 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 230000002559 cytogenic effect Effects 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- BIABMEZBCHDPBV-UHFFFAOYSA-N dipalmitoyl phosphatidylglycerol Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCCCCCCCCCC BIABMEZBCHDPBV-UHFFFAOYSA-N 0.000 description 2
- FVJZSBGHRPJMMA-UHFFFAOYSA-N distearoyl phosphatidylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCCCCCCCCCCCC FVJZSBGHRPJMMA-UHFFFAOYSA-N 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 230000013020 embryo development Effects 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 239000002532 enzyme inhibitor Substances 0.000 description 2
- 229940125532 enzyme inhibitor Drugs 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 238000012632 fluorescent imaging Methods 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 229960005277 gemcitabine Drugs 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 229910052737 gold Inorganic materials 0.000 description 2
- 238000003306 harvesting Methods 0.000 description 2
- 210000003128 head Anatomy 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- 230000002489 hematologic effect Effects 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 238000001794 hormone therapy Methods 0.000 description 2
- VKOBVWXKNCXXDE-UHFFFAOYSA-N icosanoic acid Chemical compound CCCCCCCCCCCCCCCCCCCC(O)=O VKOBVWXKNCXXDE-UHFFFAOYSA-N 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000007365 immunoregulation Effects 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 229940102223 injectable solution Drugs 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 230000007794 irritation Effects 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 238000000021 kinase assay Methods 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 230000005415 magnetization Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 238000009126 molecular therapy Methods 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 125000001419 myristoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 238000011580 nude mouse model Methods 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 230000008520 organization Effects 0.000 description 2
- 229940026778 other chemotherapeutics in atc Drugs 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- SECPZKHBENQXJG-FPLPWBNLSA-N palmitoleic acid Chemical compound CCCCCC\C=C/CCCCCCCC(O)=O SECPZKHBENQXJG-FPLPWBNLSA-N 0.000 description 2
- 230000000149 penetrating effect Effects 0.000 description 2
- 230000010412 perfusion Effects 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- DCWXELXMIBXGTH-QMMMGPOBSA-N phosphonotyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-QMMMGPOBSA-N 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 238000007747 plating Methods 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000005522 programmed cell death Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 230000006916 protein interaction Effects 0.000 description 2
- 108700042226 ras Genes Proteins 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 201000010174 renal carcinoma Diseases 0.000 description 2
- 238000002271 resection Methods 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000007789 sealing Methods 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 229940126586 small molecule drug Drugs 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000009182 swimming Effects 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 2
- 229940033663 thimerosal Drugs 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 231100000027 toxicology Toxicity 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- DCXXMTOCNZCJGO-UHFFFAOYSA-N tristearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCC DCXXMTOCNZCJGO-UHFFFAOYSA-N 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 238000002604 ultrasonography Methods 0.000 description 2
- 241000712461 unidentified influenza virus Species 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 230000000007 visual effect Effects 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- FTLYMKDSHNWQKD-UHFFFAOYSA-N (2,4,5-trichlorophenyl)boronic acid Chemical compound OB(O)C1=CC(Cl)=C(Cl)C=C1Cl FTLYMKDSHNWQKD-UHFFFAOYSA-N 0.000 description 1
- OZFAFGSSMRRTDW-UHFFFAOYSA-N (2,4-dichlorophenyl) benzenesulfonate Chemical compound ClC1=CC(Cl)=CC=C1OS(=O)(=O)C1=CC=CC=C1 OZFAFGSSMRRTDW-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 1
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- LVNGJLRDBYCPGB-LDLOPFEMSA-N (R)-1,2-distearoylphosphatidylethanolamine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[NH3+])OC(=O)CCCCCCCCCCCCCCCCC LVNGJLRDBYCPGB-LDLOPFEMSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- LZLVZIFMYXDKCN-QJWFYWCHSA-N 1,2-di-O-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC LZLVZIFMYXDKCN-QJWFYWCHSA-N 0.000 description 1
- FVXDQWZBHIXIEJ-LNDKUQBDSA-N 1,2-di-[(9Z,12Z)-octadecadienoyl]-sn-glycero-3-phosphocholine Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/C\C=C/CCCCC FVXDQWZBHIXIEJ-LNDKUQBDSA-N 0.000 description 1
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 description 1
- DSNRWDQKZIEDDB-SQYFZQSCSA-N 1,2-dioleoyl-sn-glycero-3-phospho-(1'-sn-glycerol) Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCC\C=C/CCCCCCCC DSNRWDQKZIEDDB-SQYFZQSCSA-N 0.000 description 1
- OZSITQMWYBNPMW-GDLZYMKVSA-N 1,2-ditetradecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCC OZSITQMWYBNPMW-GDLZYMKVSA-N 0.000 description 1
- OTEKOJQFKOIXMU-UHFFFAOYSA-N 1,4-bis(trichloromethyl)benzene Chemical compound ClC(Cl)(Cl)C1=CC=C(C(Cl)(Cl)Cl)C=C1 OTEKOJQFKOIXMU-UHFFFAOYSA-N 0.000 description 1
- WEYNBWVKOYCCQT-UHFFFAOYSA-N 1-(3-chloro-4-methylphenyl)-3-{2-[({5-[(dimethylamino)methyl]-2-furyl}methyl)thio]ethyl}urea Chemical compound O1C(CN(C)C)=CC=C1CSCCNC(=O)NC1=CC=C(C)C(Cl)=C1 WEYNBWVKOYCCQT-UHFFFAOYSA-N 0.000 description 1
- RYCNUMLMNKHWPZ-SNVBAGLBSA-N 1-acetyl-sn-glycero-3-phosphocholine Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCC[N+](C)(C)C RYCNUMLMNKHWPZ-SNVBAGLBSA-N 0.000 description 1
- PZNPLUBHRSSFHT-RRHRGVEJSA-N 1-hexadecanoyl-2-octadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)COC(=O)CCCCCCCCCCCCCCC PZNPLUBHRSSFHT-RRHRGVEJSA-N 0.000 description 1
- RFVFQQWKPSOBED-PSXMRANNSA-N 1-myristoyl-2-palmitoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)O[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)COC(=O)CCCCCCCCCCCCC RFVFQQWKPSOBED-PSXMRANNSA-N 0.000 description 1
- FVXDQWZBHIXIEJ-ZPPAUJSGSA-N 2,3-bis[[(9z,12z)-octadeca-9,12-dienoyl]oxy]propyl 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(=O)OCC(COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/C\C=C/CCCCC FVXDQWZBHIXIEJ-ZPPAUJSGSA-N 0.000 description 1
- JLVSRWOIZZXQAD-UHFFFAOYSA-N 2,3-disulfanylpropane-1-sulfonic acid Chemical compound OS(=O)(=O)CC(S)CS JLVSRWOIZZXQAD-UHFFFAOYSA-N 0.000 description 1
- 102100031599 2-(3-amino-3-carboxypropyl)histidine synthase subunit 1 Human genes 0.000 description 1
- TXLHNFOLHRXMAU-UHFFFAOYSA-N 2-(4-benzylphenoxy)-n,n-diethylethanamine;hydron;chloride Chemical compound Cl.C1=CC(OCCN(CC)CC)=CC=C1CC1=CC=CC=C1 TXLHNFOLHRXMAU-UHFFFAOYSA-N 0.000 description 1
- LRYZPFWEZHSTHD-HEFFAWAOSA-O 2-[[(e,2s,3r)-2-formamido-3-hydroxyoctadec-4-enoxy]-hydroxyphosphoryl]oxyethyl-trimethylazanium Chemical class CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](NC=O)COP(O)(=O)OCC[N+](C)(C)C LRYZPFWEZHSTHD-HEFFAWAOSA-O 0.000 description 1
- CFWRDBDJAOHXSH-SECBINFHSA-N 2-azaniumylethyl [(2r)-2,3-diacetyloxypropyl] phosphate Chemical compound CC(=O)OC[C@@H](OC(C)=O)COP(O)(=O)OCCN CFWRDBDJAOHXSH-SECBINFHSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- 101150090724 3 gene Proteins 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- 102100031928 40S ribosomal protein S29 Human genes 0.000 description 1
- 102100021546 60S ribosomal protein L10 Human genes 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- YYSFXUWWPNHNAZ-OSDRTFJJSA-N 851536-75-9 Chemical compound C1[C@@H](OC)[C@H](OCCOCC)CC[C@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CCC2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 YYSFXUWWPNHNAZ-OSDRTFJJSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 102100033410 Acidic leucine-rich nuclear phosphoprotein 32 family member C Human genes 0.000 description 1
- 102100033403 Acidic leucine-rich nuclear phosphoprotein 32 family member D Human genes 0.000 description 1
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 1
- 101710137115 Adenylyl cyclase-associated protein 1 Proteins 0.000 description 1
- 102100027211 Albumin Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 102000052594 Anaphase-Promoting Complex-Cyclosome Apc2 Subunit Human genes 0.000 description 1
- 108700031308 Antennapedia Homeodomain Proteins 0.000 description 1
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 108700020463 BRCA1 Proteins 0.000 description 1
- 102000036365 BRCA1 Human genes 0.000 description 1
- 101150072950 BRCA1 gene Proteins 0.000 description 1
- 108700020462 BRCA2 Proteins 0.000 description 1
- 102000052609 BRCA2 Human genes 0.000 description 1
- 102100035755 BRD4-interacting chromatin-remodeling complex-associated protein Human genes 0.000 description 1
- 102000051485 Bcl-2 family Human genes 0.000 description 1
- 108700038897 Bcl-2 family Proteins 0.000 description 1
- 102100021251 Beclin-1 Human genes 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 102100023995 Beta-nerve growth factor Human genes 0.000 description 1
- 102100037674 Bis(5'-adenosyl)-triphosphatase Human genes 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 101150008921 Brca2 gene Proteins 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 1
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 1
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 1
- 102100027221 CD81 antigen Human genes 0.000 description 1
- 101100008047 Caenorhabditis elegans cut-3 gene Proteins 0.000 description 1
- 101100014702 Caenorhabditis elegans gld-1 gene Proteins 0.000 description 1
- 102100039532 Calcium-activated chloride channel regulator 2 Human genes 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 1
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 102100028003 Catenin alpha-1 Human genes 0.000 description 1
- 102100035888 Caveolin-1 Human genes 0.000 description 1
- 108010072135 Cell Adhesion Molecule-1 Proteins 0.000 description 1
- 102000005483 Cell Cycle Proteins Human genes 0.000 description 1
- 108010031896 Cell Cycle Proteins Proteins 0.000 description 1
- 102100024649 Cell adhesion molecule 1 Human genes 0.000 description 1
- 101710150820 Cellular tumor antigen p53 Proteins 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- 102100030099 Chloride anion exchanger Human genes 0.000 description 1
- 108010049048 Cholera Toxin Proteins 0.000 description 1
- 102000009016 Cholera Toxin Human genes 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 101150094716 Ciao1 gene Proteins 0.000 description 1
- 101710130550 Class E basic helix-loop-helix protein 40 Proteins 0.000 description 1
- 101100007328 Cocos nucifera COS-1 gene Proteins 0.000 description 1
- 102100039193 Cullin-2 Human genes 0.000 description 1
- 108010025468 Cyclin-Dependent Kinase 6 Proteins 0.000 description 1
- 102000009512 Cyclin-Dependent Kinase Inhibitor p15 Human genes 0.000 description 1
- 108010009356 Cyclin-Dependent Kinase Inhibitor p15 Proteins 0.000 description 1
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 description 1
- 108010016788 Cyclin-Dependent Kinase Inhibitor p21 Proteins 0.000 description 1
- 102000004480 Cyclin-Dependent Kinase Inhibitor p57 Human genes 0.000 description 1
- 108010017222 Cyclin-Dependent Kinase Inhibitor p57 Proteins 0.000 description 1
- 101710176410 Cyclin-dependent kinase 2-associated protein 1 Proteins 0.000 description 1
- 229940083347 Cyclin-dependent kinase 4 inhibitor Drugs 0.000 description 1
- 102100026804 Cyclin-dependent kinase 6 Human genes 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 102100031127 Cysteine/serine-rich nuclear protein 1 Human genes 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 102100025269 DENN domain-containing protein 2B Human genes 0.000 description 1
- 108091028710 DLEU2 Proteins 0.000 description 1
- 101150005554 DLG3 gene Proteins 0.000 description 1
- 108010069941 DNA receptor Proteins 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 101150060155 Dcc gene Proteins 0.000 description 1
- 102100025314 Deleted in esophageal cancer 1 Human genes 0.000 description 1
- 102100031262 Deleted in malignant brain tumors 1 protein Human genes 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 102100028572 Disabled homolog 2 Human genes 0.000 description 1
- 102100024099 Disks large homolog 1 Human genes 0.000 description 1
- 102100029716 DnaJ homolog subfamily A member 3, mitochondrial Human genes 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 102100023274 Dual specificity mitogen-activated protein kinase kinase 4 Human genes 0.000 description 1
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 1
- 102100040610 Dynein regulatory complex subunit 4 Human genes 0.000 description 1
- 102100023877 E3 ubiquitin-protein ligase RBX1 Human genes 0.000 description 1
- 101710095156 E3 ubiquitin-protein ligase RBX1 Proteins 0.000 description 1
- 102100037964 E3 ubiquitin-protein ligase RING2 Human genes 0.000 description 1
- 102100038796 E3 ubiquitin-protein ligase TRIM13 Human genes 0.000 description 1
- 102100029671 E3 ubiquitin-protein ligase TRIM8 Human genes 0.000 description 1
- 102100032058 EARP and GARP complex-interacting protein 1 Human genes 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102100023226 Early growth response protein 1 Human genes 0.000 description 1
- 101150039808 Egfr gene Proteins 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- 102100030209 Elongin-B Human genes 0.000 description 1
- 102100039512 Esterase OVCA2 Human genes 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- 101150021185 FGF gene Proteins 0.000 description 1
- 101150043847 FOXD1 gene Proteins 0.000 description 1
- 102100031106 Fatty acid hydroxylase domain-containing protein 2 Human genes 0.000 description 1
- 102100037738 Fatty acid-binding protein, heart Human genes 0.000 description 1
- 102100038664 Fibrinogen-like protein 1 Human genes 0.000 description 1
- 101710126767 Filamin A-interacting protein 1-like Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 102100037057 Forkhead box protein D1 Human genes 0.000 description 1
- 102100028122 Forkhead box protein P1 Human genes 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010001515 Galectin 4 Proteins 0.000 description 1
- 102100039556 Galectin-4 Human genes 0.000 description 1
- 240000004859 Gamochaeta purpurea Species 0.000 description 1
- 230000010558 Gene Alterations Effects 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 102100036683 Growth arrest-specific protein 1 Human genes 0.000 description 1
- 206010018910 Haemolysis Diseases 0.000 description 1
- 208000028782 Hereditary disease Diseases 0.000 description 1
- 102100021455 Histone deacetylase 3 Human genes 0.000 description 1
- 101000866191 Homo sapiens 2-(3-amino-3-carboxypropyl)histidine synthase subunit 1 Proteins 0.000 description 1
- 101000704060 Homo sapiens 40S ribosomal protein S29 Proteins 0.000 description 1
- 101001108634 Homo sapiens 60S ribosomal protein L10 Proteins 0.000 description 1
- 101001117935 Homo sapiens 60S ribosomal protein L15 Proteins 0.000 description 1
- 101000732662 Homo sapiens Acidic leucine-rich nuclear phosphoprotein 32 family member C Proteins 0.000 description 1
- 101000732664 Homo sapiens Acidic leucine-rich nuclear phosphoprotein 32 family member D Proteins 0.000 description 1
- 101000802816 Homo sapiens BRD4-interacting chromatin-remodeling complex-associated protein Proteins 0.000 description 1
- 101000894649 Homo sapiens Beclin-1 Proteins 0.000 description 1
- 101000914479 Homo sapiens CD81 antigen Proteins 0.000 description 1
- 101000888580 Homo sapiens Calcium-activated chloride channel regulator 2 Proteins 0.000 description 1
- 101000859063 Homo sapiens Catenin alpha-1 Proteins 0.000 description 1
- 101000715467 Homo sapiens Caveolin-1 Proteins 0.000 description 1
- 101000746072 Homo sapiens Cullin-2 Proteins 0.000 description 1
- 101000737813 Homo sapiens Cyclin-dependent kinase 2-associated protein 1 Proteins 0.000 description 1
- 101000944380 Homo sapiens Cyclin-dependent kinase inhibitor 1 Proteins 0.000 description 1
- 101000922196 Homo sapiens Cysteine/serine-rich nuclear protein 1 Proteins 0.000 description 1
- 101000722264 Homo sapiens DENN domain-containing protein 2B Proteins 0.000 description 1
- 101000844721 Homo sapiens Deleted in malignant brain tumors 1 protein Proteins 0.000 description 1
- 101000915391 Homo sapiens Disabled homolog 2 Proteins 0.000 description 1
- 101001053984 Homo sapiens Disks large homolog 1 Proteins 0.000 description 1
- 101000866012 Homo sapiens DnaJ homolog subfamily A member 3, mitochondrial Proteins 0.000 description 1
- 101001115395 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 4 Proteins 0.000 description 1
- 101000966403 Homo sapiens Dynein light chain 1, cytoplasmic Proteins 0.000 description 1
- 101000816970 Homo sapiens Dynein regulatory complex subunit 4 Proteins 0.000 description 1
- 101001095815 Homo sapiens E3 ubiquitin-protein ligase RING2 Proteins 0.000 description 1
- 101000664589 Homo sapiens E3 ubiquitin-protein ligase TRIM13 Proteins 0.000 description 1
- 101000795300 Homo sapiens E3 ubiquitin-protein ligase TRIM8 Proteins 0.000 description 1
- 101000921326 Homo sapiens EARP and GARP complex-interacting protein 1 Proteins 0.000 description 1
- 101001049697 Homo sapiens Early growth response protein 1 Proteins 0.000 description 1
- 101001011846 Homo sapiens Elongin-B Proteins 0.000 description 1
- 101000609579 Homo sapiens Esterase OVCA2 Proteins 0.000 description 1
- 101001010910 Homo sapiens Estrogen receptor beta Proteins 0.000 description 1
- 101001066086 Homo sapiens Fatty acid hydroxylase domain-containing protein 2 Proteins 0.000 description 1
- 101001027663 Homo sapiens Fatty acid-binding protein, heart Proteins 0.000 description 1
- 101001031635 Homo sapiens Fibrinogen-like protein 1 Proteins 0.000 description 1
- 101001059893 Homo sapiens Forkhead box protein P1 Proteins 0.000 description 1
- 101001072723 Homo sapiens Growth arrest-specific protein 1 Proteins 0.000 description 1
- 101100177551 Homo sapiens HEMK1 gene Proteins 0.000 description 1
- 101100178964 Homo sapiens HYAL3 gene Proteins 0.000 description 1
- 101000899282 Homo sapiens Histone deacetylase 3 Proteins 0.000 description 1
- 101000911772 Homo sapiens Hsc70-interacting protein Proteins 0.000 description 1
- 101000993380 Homo sapiens Hypermethylated in cancer 1 protein Proteins 0.000 description 1
- 101000993376 Homo sapiens Hypermethylated in cancer 2 protein Proteins 0.000 description 1
- 101001056180 Homo sapiens Induced myeloid leukemia cell differentiation protein Mcl-1 Proteins 0.000 description 1
- 101001053708 Homo sapiens Inhibitor of growth protein 2 Proteins 0.000 description 1
- 101001001418 Homo sapiens Inhibitor of growth protein 4 Proteins 0.000 description 1
- 101000852815 Homo sapiens Insulin receptor Proteins 0.000 description 1
- 101001033788 Homo sapiens Integrator complex subunit 6 Proteins 0.000 description 1
- 101001034314 Homo sapiens Lactadherin Proteins 0.000 description 1
- 101001038427 Homo sapiens Leucine zipper putative tumor suppressor 2 Proteins 0.000 description 1
- 101001063878 Homo sapiens Leukemia-associated protein 1 Proteins 0.000 description 1
- 101000614020 Homo sapiens Lysine-specific demethylase 3B Proteins 0.000 description 1
- 101000578771 Homo sapiens MAP kinase-activated protein kinase 3 Proteins 0.000 description 1
- 101001057193 Homo sapiens Membrane-associated guanylate kinase, WW and PDZ domain-containing protein 1 Proteins 0.000 description 1
- 101000970561 Homo sapiens Myc box-dependent-interacting protein 1 Proteins 0.000 description 1
- 101000958781 Homo sapiens N-alpha-acetyltransferase 80 Proteins 0.000 description 1
- 101000973997 Homo sapiens Nucleosome assembly protein 1-like 4 Proteins 0.000 description 1
- 101000687346 Homo sapiens PR domain zinc finger protein 2 Proteins 0.000 description 1
- 101000701366 Homo sapiens Phospholipid-transporting ATPase IB Proteins 0.000 description 1
- 101000692464 Homo sapiens Platelet-derived growth factor receptor-like protein Proteins 0.000 description 1
- 101000583702 Homo sapiens Pleckstrin homology-like domain family A member 2 Proteins 0.000 description 1
- 101000933601 Homo sapiens Protein BTG1 Proteins 0.000 description 1
- 101000933604 Homo sapiens Protein BTG2 Proteins 0.000 description 1
- 101001130132 Homo sapiens Protein LDOC1 Proteins 0.000 description 1
- 101000772227 Homo sapiens Protein TSSC4 Proteins 0.000 description 1
- 101000735456 Homo sapiens Protein mono-ADP-ribosyltransferase PARP3 Proteins 0.000 description 1
- 101000695187 Homo sapiens Protein patched homolog 1 Proteins 0.000 description 1
- 101000855055 Homo sapiens Putative Wilms tumor upstream neighbor 1 gene protein Proteins 0.000 description 1
- 101000743264 Homo sapiens RNA-binding protein 6 Proteins 0.000 description 1
- 101000712969 Homo sapiens Ras association domain-containing protein 5 Proteins 0.000 description 1
- 101000606548 Homo sapiens Receptor-type tyrosine-protein phosphatase gamma Proteins 0.000 description 1
- 101000703463 Homo sapiens Rho GTPase-activating protein 35 Proteins 0.000 description 1
- 101001106322 Homo sapiens Rho GTPase-activating protein 7 Proteins 0.000 description 1
- 101001106309 Homo sapiens Rho GTPase-activating protein 8 Proteins 0.000 description 1
- 101000709025 Homo sapiens Rho-related BTB domain-containing protein 2 Proteins 0.000 description 1
- 101000974043 Homo sapiens Ribosome biogenesis protein NOP53 Proteins 0.000 description 1
- 101000864743 Homo sapiens Secreted frizzled-related protein 1 Proteins 0.000 description 1
- 101000632270 Homo sapiens Semaphorin-3B Proteins 0.000 description 1
- 101001047637 Homo sapiens Serine/threonine-protein kinase LATS2 Proteins 0.000 description 1
- 101000661807 Homo sapiens Suppressor of tumorigenicity 14 protein Proteins 0.000 description 1
- 101000628483 Homo sapiens Suppressor of tumorigenicity 7 protein-like Proteins 0.000 description 1
- 101000658608 Homo sapiens Tetraspanin-32 Proteins 0.000 description 1
- 101000702545 Homo sapiens Transcription activator BRG1 Proteins 0.000 description 1
- 101001087422 Homo sapiens Tyrosine-protein phosphatase non-receptor type 13 Proteins 0.000 description 1
- 101000740048 Homo sapiens Ubiquitin carboxyl-terminal hydrolase BAP1 Proteins 0.000 description 1
- 101000955064 Homo sapiens WAP four-disulfide core domain protein 1 Proteins 0.000 description 1
- 101000854908 Homo sapiens WD repeat-containing protein 11 Proteins 0.000 description 1
- 101000823778 Homo sapiens Y-box-binding protein 2 Proteins 0.000 description 1
- 101000730643 Homo sapiens Zinc finger protein PLAGL1 Proteins 0.000 description 1
- 101000859416 Homo sapiens cAMP-responsive element-binding protein-like 2 Proteins 0.000 description 1
- 241000701806 Human papillomavirus Species 0.000 description 1
- 102100021082 Hyaluronidase-3 Human genes 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 102100031612 Hypermethylated in cancer 1 protein Human genes 0.000 description 1
- 102100031613 Hypermethylated in cancer 2 protein Human genes 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 102000038455 IGF Type 1 Receptor Human genes 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 102100026539 Induced myeloid leukemia cell differentiation protein Mcl-1 Human genes 0.000 description 1
- 108090000191 Inhibitor of growth protein 1 Proteins 0.000 description 1
- 102000003781 Inhibitor of growth protein 1 Human genes 0.000 description 1
- 102100024067 Inhibitor of growth protein 2 Human genes 0.000 description 1
- 102100035677 Inhibitor of growth protein 4 Human genes 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100036721 Insulin receptor Human genes 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102100039133 Integrator complex subunit 6 Human genes 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 102100039648 Lactadherin Human genes 0.000 description 1
- 108010063045 Lactoferrin Proteins 0.000 description 1
- 102100032241 Lactotransferrin Human genes 0.000 description 1
- 102000002297 Laminin Receptors Human genes 0.000 description 1
- 108010000851 Laminin Receptors Proteins 0.000 description 1
- 101000740049 Latilactobacillus curvatus Bioactive peptide 1 Proteins 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- 102100040276 Leucine zipper putative tumor suppressor 2 Human genes 0.000 description 1
- 102100020872 Leucyl-cystinyl aminopeptidase Human genes 0.000 description 1
- 102100030893 Leukemia-associated protein 1 Human genes 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 102100040582 Lysine-specific demethylase 3B Human genes 0.000 description 1
- 102100026395 Lysine-specific demethylase PHF2 Human genes 0.000 description 1
- 101710128369 Lysine-specific demethylase phf2 Proteins 0.000 description 1
- 102100028397 MAP kinase-activated protein kinase 3 Human genes 0.000 description 1
- 108700012928 MAPK14 Proteins 0.000 description 1
- 239000002616 MRI contrast agent Substances 0.000 description 1
- 102100022211 MTRF1L release factor glutamine methyltransferase Human genes 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000024556 Mendelian disease Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 208000003445 Mouth Neoplasms Diseases 0.000 description 1
- 206010073148 Multiple endocrine neoplasia type 2A Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100077754 Mus musculus Mpp3 gene Proteins 0.000 description 1
- 101100263671 Mus musculus Vhl gene Proteins 0.000 description 1
- 241000238367 Mya arenaria Species 0.000 description 1
- 102100021970 Myc box-dependent-interacting protein 1 Human genes 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 1
- 102100038333 N-alpha-acetyltransferase 80 Human genes 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 208000008636 Neoplastic Processes Diseases 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 101001062108 Nicotiana tabacum Retinoblastoma-related protein 1 Proteins 0.000 description 1
- 108020004485 Nonsense Codon Proteins 0.000 description 1
- 101150074217 Nprl2 gene Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 102100022396 Nucleosome assembly protein 1-like 4 Human genes 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 102000038030 PI3Ks Human genes 0.000 description 1
- 108091007960 PI3Ks Proteins 0.000 description 1
- 102100024885 PR domain zinc finger protein 2 Human genes 0.000 description 1
- 235000021319 Palmitoleic acid Nutrition 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- 101710114878 Phospholipase A-2-activating protein Proteins 0.000 description 1
- 102100030447 Phospholipid-transporting ATPase IB Human genes 0.000 description 1
- 108010089430 Phosphoproteins Proteins 0.000 description 1
- 102000007982 Phosphoproteins Human genes 0.000 description 1
- 102100022427 Plasmalemma vesicle-associated protein Human genes 0.000 description 1
- 101710193105 Plasmalemma vesicle-associated protein Proteins 0.000 description 1
- 102100026554 Platelet-derived growth factor receptor-like protein Human genes 0.000 description 1
- 102100030926 Pleckstrin homology-like domain family A member 2 Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102100038277 Prostaglandin G/H synthase 1 Human genes 0.000 description 1
- 108050003243 Prostaglandin G/H synthase 1 Proteins 0.000 description 1
- 102000007066 Prostate-Specific Antigen Human genes 0.000 description 1
- 108010072866 Prostate-Specific Antigen Proteins 0.000 description 1
- 102100026036 Protein BTG1 Human genes 0.000 description 1
- 102100026034 Protein BTG2 Human genes 0.000 description 1
- 102100031705 Protein LDOC1 Human genes 0.000 description 1
- 102100029345 Protein TSSC4 Human genes 0.000 description 1
- 101710149951 Protein Tat Proteins 0.000 description 1
- 102100034935 Protein mono-ADP-ribosyltransferase PARP3 Human genes 0.000 description 1
- 102100028680 Protein patched homolog 1 Human genes 0.000 description 1
- 102000012500 Proto-Oncogene Proteins c-crk Human genes 0.000 description 1
- 102100020713 Putative Wilms tumor upstream neighbor 1 gene protein Human genes 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 101150020201 RB gene Proteins 0.000 description 1
- 101710178916 RING-box protein 1 Proteins 0.000 description 1
- 239000012083 RIPA buffer Substances 0.000 description 1
- 102100038150 RNA-binding protein 6 Human genes 0.000 description 1
- 101150062264 Raf gene Proteins 0.000 description 1
- 102100033239 Ras association domain-containing protein 5 Human genes 0.000 description 1
- 102100039661 Receptor-type tyrosine-protein phosphatase gamma Human genes 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 102000007503 Retinoblastoma-Binding Protein 7 Human genes 0.000 description 1
- 108010071000 Retinoblastoma-Binding Protein 7 Proteins 0.000 description 1
- 206010039101 Rhinorrhoea Diseases 0.000 description 1
- 102100030676 Rho GTPase-activating protein 35 Human genes 0.000 description 1
- 102100021443 Rho GTPase-activating protein 8 Human genes 0.000 description 1
- 102100032658 Rho-related BTB domain-containing protein 2 Human genes 0.000 description 1
- 102100022399 Ribosome biogenesis protein NOP53 Human genes 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 102100034187 S-methyl-5'-thioadenosine phosphorylase Human genes 0.000 description 1
- 101710136206 S-methyl-5'-thioadenosine phosphorylase Proteins 0.000 description 1
- 102000014400 SH2 domains Human genes 0.000 description 1
- 108050003452 SH2 domains Proteins 0.000 description 1
- 108091006464 SLC25A23 Proteins 0.000 description 1
- 108091006504 SLC26A3 Proteins 0.000 description 1
- 102000001332 SRC Human genes 0.000 description 1
- 108060006706 SRC Proteins 0.000 description 1
- 102100037205 Sal-like protein 2 Human genes 0.000 description 1
- 101710192308 Sal-like protein 2 Proteins 0.000 description 1
- 102100030058 Secreted frizzled-related protein 1 Human genes 0.000 description 1
- 102100027979 Semaphorin-3B Human genes 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- 102100024043 Serine/threonine-protein kinase LATS2 Human genes 0.000 description 1
- 102000013275 Somatomedins Human genes 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 102000004094 Stromal Interaction Molecule 1 Human genes 0.000 description 1
- 108090000532 Stromal Interaction Molecule 1 Proteins 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 102100026721 Suppressor of tumorigenicity 7 protein-like Human genes 0.000 description 1
- 229940100514 Syk tyrosine kinase inhibitor Drugs 0.000 description 1
- 102100033082 TNF receptor-associated factor 3 Human genes 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 102100034915 Tetraspanin-32 Human genes 0.000 description 1
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 description 1
- 108060008245 Thrombospondin Proteins 0.000 description 1
- 102000002938 Thrombospondin Human genes 0.000 description 1
- 101150079992 Timp3 gene Proteins 0.000 description 1
- 102000005406 Tissue Inhibitor of Metalloproteinase-3 Human genes 0.000 description 1
- 102100030951 Tissue factor pathway inhibitor Human genes 0.000 description 1
- 206010043966 Tongue neoplasm malignant stage unspecified Diseases 0.000 description 1
- 238000008050 Total Bilirubin Reagent Methods 0.000 description 1
- 102100031027 Transcription activator BRG1 Human genes 0.000 description 1
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 1
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 241000364021 Tulsa Species 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 108010091356 Tumor Protein p73 Proteins 0.000 description 1
- 102000018252 Tumor Protein p73 Human genes 0.000 description 1
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 description 1
- 102100027881 Tumor protein 63 Human genes 0.000 description 1
- 101710140697 Tumor protein 63 Proteins 0.000 description 1
- 102100033014 Tyrosine-protein phosphatase non-receptor type 13 Human genes 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 101710145727 Viral Fc-gamma receptor-like protein UL119 Proteins 0.000 description 1
- 102100038968 WAP four-disulfide core domain protein 1 Human genes 0.000 description 1
- 102100020705 WD repeat-containing protein 11 Human genes 0.000 description 1
- 108010036639 WW Domain-Containing Oxidoreductase Proteins 0.000 description 1
- 102000012163 WW Domain-Containing Oxidoreductase Human genes 0.000 description 1
- 102100032570 Zinc finger protein PLAGL1 Human genes 0.000 description 1
- DSNRWDQKZIEDDB-GCMPNPAFSA-N [(2r)-3-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-2-[(z)-octadec-9-enoyl]oxypropyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C/CCCCCCCC DSNRWDQKZIEDDB-GCMPNPAFSA-N 0.000 description 1
- CWRILEGKIAOYKP-SSDOTTSWSA-M [(2r)-3-acetyloxy-2-hydroxypropyl] 2-aminoethyl phosphate Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCCN CWRILEGKIAOYKP-SSDOTTSWSA-M 0.000 description 1
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000001785 acacia senegal l. willd gum Substances 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 239000010441 alabaster Substances 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 1
- 235000020661 alpha-linolenic acid Nutrition 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 238000002583 angiography Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000001387 anti-histamine Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000000636 anti-proteolytic effect Effects 0.000 description 1
- 230000002785 anti-thrombosis Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 229940114079 arachidonic acid Drugs 0.000 description 1
- 235000021342 arachidonic acid Nutrition 0.000 description 1
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 230000035578 autophosphorylation Effects 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 108010005713 bis(5'-adenosyl)triphosphatase Proteins 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 238000010241 blood sampling Methods 0.000 description 1
- 239000007767 bonding agent Substances 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 102100027985 cAMP-responsive element-binding protein-like 2 Human genes 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000003183 carcinogenic agent Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000009134 cell regulation Effects 0.000 description 1
- 230000017455 cell-cell adhesion Effects 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 239000005482 chemotactic factor Substances 0.000 description 1
- 239000012829 chemotherapy agent Substances 0.000 description 1
- 239000007958 cherry flavor Substances 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 230000001886 ciliary effect Effects 0.000 description 1
- SECPZKHBENQXJG-UHFFFAOYSA-N cis-palmitoleic acid Natural products CCCCCCC=CCCCCCCCC(O)=O SECPZKHBENQXJG-UHFFFAOYSA-N 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 230000005757 colony formation Effects 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 238000001218 confocal laser scanning microscopy Methods 0.000 description 1
- 210000000795 conjunctiva Anatomy 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- 238000002681 cryosurgery Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 230000002548 cytokinetic effect Effects 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000005202 decontamination Methods 0.000 description 1
- 230000003588 decontaminative effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- BPHQZTVXXXJVHI-UHFFFAOYSA-N dimyristoyl phosphatidylglycerol Chemical compound CCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCCCCCCCC BPHQZTVXXXJVHI-UHFFFAOYSA-N 0.000 description 1
- 229960003724 dimyristoylphosphatidylcholine Drugs 0.000 description 1
- MWRBNPKJOOWZPW-CLFAGFIQSA-N dioleoyl phosphatidylethanolamine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(COP(O)(=O)OCCN)OC(=O)CCCCCCC\C=C/CCCCCCCC MWRBNPKJOOWZPW-CLFAGFIQSA-N 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- BFMYDTVEBKDAKJ-UHFFFAOYSA-L disodium;(2',7'-dibromo-3',6'-dioxido-3-oxospiro[2-benzofuran-1,9'-xanthene]-4'-yl)mercury;hydrate Chemical compound O.[Na+].[Na+].O1C(=O)C2=CC=CC=C2C21C1=CC(Br)=C([O-])C([Hg])=C1OC1=C2C=C(Br)C([O-])=C1 BFMYDTVEBKDAKJ-UHFFFAOYSA-L 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 229940121647 egfr inhibitor Drugs 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 108700021358 erbB-1 Genes Proteins 0.000 description 1
- 108010038795 estrogen receptors Proteins 0.000 description 1
- 230000001076 estrogenic effect Effects 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- FKRCODPIKNYEAC-UHFFFAOYSA-N ethyl propionate Chemical compound CCOC(=O)CC FKRCODPIKNYEAC-UHFFFAOYSA-N 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000002270 exclusion chromatography Methods 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 201000003444 follicular lymphoma Diseases 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000021472 generally recognized as safe Nutrition 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 229940093181 glucose injection Drugs 0.000 description 1
- 150000002327 glycerophospholipids Chemical class 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 210000004565 granule cell Anatomy 0.000 description 1
- 239000003630 growth substance Substances 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000008588 hemolysis Effects 0.000 description 1
- 230000002607 hemopoietic effect Effects 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 230000006951 hyperphosphorylation Effects 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 108090000237 interleukin-24 Proteins 0.000 description 1
- 102000003898 interleukin-24 Human genes 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- LDHBWEYLDHLIBQ-UHFFFAOYSA-M iron(3+);oxygen(2-);hydroxide;hydrate Chemical compound O.[OH-].[O-2].[Fe+3] LDHBWEYLDHLIBQ-UHFFFAOYSA-M 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- CSSYQJWUGATIHM-IKGCZBKSSA-N l-phenylalanyl-l-lysyl-l-cysteinyl-l-arginyl-l-arginyl-l-tryptophyl-l-glutaminyl-l-tryptophyl-l-arginyl-l-methionyl-l-lysyl-l-lysyl-l-leucylglycyl-l-alanyl-l-prolyl-l-seryl-l-isoleucyl-l-threonyl-l-cysteinyl-l-valyl-l-arginyl-l-arginyl-l-alanyl-l-phenylal Chemical compound C([C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 CSSYQJWUGATIHM-IKGCZBKSSA-N 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 229940078795 lactoferrin Drugs 0.000 description 1
- 235000021242 lactoferrin Nutrition 0.000 description 1
- 208000003849 large cell carcinoma Diseases 0.000 description 1
- 238000002430 laser surgery Methods 0.000 description 1
- 230000013016 learning Effects 0.000 description 1
- 230000002122 leukaemogenic effect Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- XMGQYMWWDOXHJM-UHFFFAOYSA-N limonene Chemical compound CC(=C)C1CCC(C)=CC1 XMGQYMWWDOXHJM-UHFFFAOYSA-N 0.000 description 1
- 229960004488 linolenic acid Drugs 0.000 description 1
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 description 1
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 1
- 150000002634 lipophilic molecules Chemical class 0.000 description 1
- 108010013555 lipoprotein-associated coagulation inhibitor Proteins 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- GBMDVOWEEQVZKZ-UHFFFAOYSA-N methanol;hydrate Chemical compound O.OC GBMDVOWEEQVZKZ-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- OSWPMRLSEDHDFF-UHFFFAOYSA-N methyl salicylate Chemical compound COC(=O)C1=CC=CC=C1O OSWPMRLSEDHDFF-UHFFFAOYSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 230000004784 molecular pathogenesis Effects 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 206010051747 multiple endocrine neoplasia Diseases 0.000 description 1
- HOGDNTQCSIKEEV-UHFFFAOYSA-N n'-hydroxybutanediamide Chemical compound NC(=O)CCC(=O)NO HOGDNTQCSIKEEV-UHFFFAOYSA-N 0.000 description 1
- ZIUHHBKFKCYYJD-UHFFFAOYSA-N n,n'-methylenebisacrylamide Chemical compound C=CC(=O)NCNC(=O)C=C ZIUHHBKFKCYYJD-UHFFFAOYSA-N 0.000 description 1
- 208000010753 nasal discharge Diseases 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000027405 negative regulation of phosphorylation Effects 0.000 description 1
- 229940053128 nerve growth factor Drugs 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- CMUOJBJRZUHRMU-UHFFFAOYSA-N nitrourea Chemical compound NC(=O)N[N+]([O-])=O CMUOJBJRZUHRMU-UHFFFAOYSA-N 0.000 description 1
- 230000037434 nonsense mutation Effects 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 125000002811 oleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000006548 oncogenic transformation Effects 0.000 description 1
- 229940071462 oralone Drugs 0.000 description 1
- 239000007968 orange flavor Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 210000004681 ovum Anatomy 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000003076 paracrine Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 210000003516 pericardium Anatomy 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 210000004214 philadelphia chromosome Anatomy 0.000 description 1
- 150000003905 phosphatidylinositols Chemical class 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- BLFWHYXWBKKRHI-JYBILGDPSA-N plap Chemical compound N([C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(=O)[C@@H]1CCCN1C(=O)[C@H](CO)NC(=O)[C@@H](N)CCC(O)=O BLFWHYXWBKKRHI-JYBILGDPSA-N 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 210000004224 pleura Anatomy 0.000 description 1
- 229920002946 poly[2-(methacryloxy)ethyl phosphorylcholine] polymer Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- DXGIRFAFSFKYCF-UHFFFAOYSA-N propanehydrazide Chemical class CCC(=O)NN DXGIRFAFSFKYCF-UHFFFAOYSA-N 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 201000001514 prostate carcinoma Diseases 0.000 description 1
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 230000007026 protein scission Effects 0.000 description 1
- 239000002510 pyrogen Substances 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 230000003439 radiotherapeutic effect Effects 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 239000013558 reference substance Substances 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 229940085605 saccharin sodium Drugs 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000001338 self-assembly Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 210000001768 subcellular fraction Anatomy 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229960002317 succinimide Drugs 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 238000012385 systemic delivery Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 101150047061 tag-72 gene Proteins 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 238000010863 targeted diagnosis Methods 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 210000003437 trachea Anatomy 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- PBKWZFANFUTEPS-CWUSWOHSSA-N transportan Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(N)=O)[C@@H](C)CC)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)CN)[C@@H](C)O)C1=CC=C(O)C=C1 PBKWZFANFUTEPS-CWUSWOHSSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 1
- 150000003668 tyrosines Chemical class 0.000 description 1
- 210000003954 umbilical cord Anatomy 0.000 description 1
- 239000002691 unilamellar liposome Substances 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000003708 urethra Anatomy 0.000 description 1
- 208000029584 urinary system neoplasm Diseases 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 210000004127 vitreous body Anatomy 0.000 description 1
- 239000009637 wintergreen oil Substances 0.000 description 1
- 238000002689 xenotransplantation Methods 0.000 description 1
Images
Landscapes
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
Abstract
包含生物活性多肽结合纳米颗粒的纳米颗粒-多肽复合物,其中通过添加促进细胞摄入蛋白质的化学部分,修饰生物活性多肽。所述多肽可以是蛋白质或肽。在有些实施方案中,蛋白质或肽的氨基酸序列源自肿瘤抑制基因产物的氨基酸序列。
Description
发明背景
本申请要求享有2005年12月22日提交的美国临时申请系列号60/753,632和2005年3月14日提交的美国临时申请系列号60/661,680的利益,它们的所有内容和公开特别通过参考并入本文而无具体放弃。根据NIH的资助号P50CA70907-07和DOD的DAMD17002-1-0706,政府拥有本发明的权利。
1.发明领域
本发明总体上涉及分子生物学和癌症治疗领域。
2.相关技术描述
在细胞内起作用的蛋白质和肽的治疗用途在对癌症和其它疾病的治疗中非常有前景。但是,难以有效地将多肽导入细胞中。因而,需要将多肽导入细胞中的新方法。
癌症是许多因素存在的结果。突变可以发生在原癌基因中,造成细胞增殖的增加。突变也可以发生在正常功能是调节细胞增殖的肿瘤抑制基因中。DNA修复酶中的突变,会损害细胞在增殖之前修复损伤的能力。
肿瘤抑制基因是正常基因,它们的缺失(丧失或失活)可以导致癌症。肿瘤抑制基因编码减慢细胞生长和分裂的蛋白质。肿瘤抑制基因的野生型等位基因会表达抑制异常细胞增殖的蛋白质。当编码肿瘤抑制蛋白的基因突变或缺失时,得到的突变蛋白质或肿瘤抑制蛋白表达的完全缺乏可能不能正确地调节细胞增殖,异常的细胞增殖可能发生,尤其当已经存在对细胞调节机理的损害时。已经证实多个经充分研究的人肿瘤和肿瘤细胞系具有缺失的或无功能的肿瘤抑制基因。肿瘤抑制基因的实例包括但不限于,视网膜母细胞瘤易感性基因或RB基因,p53基因,在结肠癌中缺失的(DDC)基因和神经纤维瘤病1型(NF-1)肿瘤抑制基因(Weinberg,1991)。功能的丧失或肿瘤抑制基因的失活,可能在相当大数量的人癌症的起始和/或进展中起重要作用。
目前,对许多常见癌症类型的治疗仅有极少有效选择。对给定个体的疗程取决于诊断,疾病已经发展到的阶段,和诸如患者的年龄、性别、和总体健康等因素。癌症治疗的最常规选择是手术,放疗和化疗。这些治疗各自都伴有不同的副作用,且它们具有不同程度的功效。因而,需要继续开发癌症治疗,包括基于肿瘤抑制多肽的治疗。
发明概述
在一个方面,本发明提供了包含生物活性多肽结合纳米颗粒的纳米颗粒-多肽复合物,其中通过添加促进细胞摄入蛋白质的化学部分,修饰生物活性多肽。所述多肽可以是蛋白质或肽。在有些实施方案中,蛋白质或肽的氨基酸序列源自肿瘤抑制基因产物的氨基酸序列。示例性的肿瘤抑制蛋白是源自表4列出的肿瘤抑制基因的那些,包括CACNA2D2,PL6,101F6,NPR1.2,BLU,RASSF1,FUS1,HYAL2和HYAL1。
在其它实施方案中,所述肽可以包含肿瘤抑制基因产物的氨基酸序列的预测功能域,或这类域的生物活性变体。所述预测功能域可以通过对肿瘤抑制基因产物的计算机辅助序列分析鉴别出,且可以是诸如肉豆蔻酰化位点基序、PKA激酶基序、AKAP结合基序、或PDZII类域基序等结构域。
所述纳米颗粒可以是基于脂质的纳米颗粒,超顺磁性纳米颗粒,纳米壳,半导体纳米晶体,量子点(quantum dot),基于聚合物的纳米颗粒,基于硅的纳米颗粒,基于二氧化硅的纳米颗粒,基于金属的纳米颗粒,富勒烯或纳米管。在具体实施方案中,所述纳米颗粒是基于脂质的纳米颗粒或超顺磁性纳米颗粒。基于脂质的纳米颗粒的实例包括脂质体和DOTAP:胆固醇囊泡。
在有些实施方案中,所述化学部分是脂肪酸。优选地,所述脂肪酸是C4-C18脂肪酸。甚至更优选地,所述脂肪酸是硬脂酸或肉豆蔻酸。在其它实施方案中,所述化学部分是细胞穿透肽,例如源自HIV Tat、疱疹病毒VP22、果蝇(Drosophila)触角(Antennapedia)同源异型框基因产物、信号序列、融合序列、或内源性抗微生物多肽(protegrin)I的那些。
纳米颗粒-多肽复合物可以含有与纳米颗粒相结合的第二种生物活性多肽。两种多肽可以均是蛋白质或二者都可以是肽,或一种可以是蛋白质,另一种是肽。在具体实施方案中,第一种和第二种多肽均是生物活性肽,各自包含源自不同肿瘤抑制基因产物的氨基酸序列。纳米颗粒-多肽复合物也可以含有3种或更多种生物活性多肽,蛋白质和多肽任意组合。
另外,在有些实施方案中,包含超顺磁性纳米颗粒的纳米颗粒-多肽复合物包裹在脂质体或DOTAP:胆固醇囊泡之内。
在另一个方面,本发明提供了具有抗癌性质的分离的肽,其包含氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)或其生物活性变体。
分离的肽的长度优选是10-100个氨基酸残基、更优选10-75个残基、更优选10-50个残基、更优选10-25个残基、更优选10个残基。如本文所述,通过添加促进细胞摄入肽的化学部分,可以修饰任何分离的肽。并且,可以将任何分离的肽掺入任一种本文所述的纳米颗粒-多肽复合物中。
本发明也提供了药物组合物。药物组合物可以包含在药学可接受的稀释剂中的任一种本文所述的纳米颗粒-多肽复合物,或任一种基于氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)的肽。
本发明另外提供了向细胞递送蛋白质的方法。所述方法包含,制备任一种本文所述的纳米颗粒-多肽复合物,和在足以允许细胞摄入生物活性多肽的条件下,使细胞接触纳米颗粒-多肽复合物。在某些实施方案中,所述细胞是人体内的细胞。
在本发明中也提供了治疗受试者肿瘤的方法。所述方法包含,给受试者施用治疗有效量的任一种本文所述的纳米颗粒-多肽复合物,或任一种基于氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)的肽,其中纳米颗粒复合物中的多肽是基于肿瘤抑制基因产物的氨基酸序列。治疗另外可以包含,给受试者施用化疗剂、辐射或第二种生物活性多肽。
本发明也提供了制备纳米颗粒-多肽复合物的方法。在某些实施方案中,所述方法包含:a)鉴别生物活性多肽序列中的一个或多个功能域,b)制备包含至少一个功能域的肽,c)选择具有预期生物活性的肽,和d)通过使肽结合纳米颗粒,制备纳米颗粒-多肽复合物。在某些实施方案中,通过对肿瘤抑制基因产物的计算机辅助序列分析,鉴别功能域。在某些实施方案中,所述方法包括,通过添加促进细胞摄入肽的化学部分,修饰所述肽。
本发明也提供了抑制蛋白酪氨酸激酶的方法。所述方法包含,使所述激酶接触任一种本文所述基于氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)的肽。在某些具体实施方案中,所述激酶是EGFR,PDGFR,cKit,cAbl,或Erk。
本发明另外提供了诱导肿瘤细胞凋亡的方法。所述方法包含,使肿瘤细胞接触任一种基于氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQID NO:1)的本文所述肽或纳米颗粒-多肽复合物。
本发明也提供了用于磁共振成像的组合物。所述组合物包含任一种本文所述纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒。
本发明的一个方面涉及纳米颗粒-多肽复合物,其包含与纳米颗粒相结合的生物活性多肽,其中通过添加促进细胞摄入多肽的化学部分,修饰生物活性多肽。所述多肽可以是肽。所述肽的氨基酸序列可以源自肿瘤抑制基因产物的氨基酸序列。在某些实施方案中,所述肿瘤抑制基因是在表4中列出的基因,促凋亡基因,或细胞毒性基因。所述生物活性肽可以是FUS-1肽,触角同源异型框基因(Antp)肽,HIVTat肽,疱疹病毒VP22肽,模型两亲肽,transportan肽,SV 40 T抗原肽,或内源性抗微生物多肽I肽。在某些实施方案中,所述生物活性肽是FUS-1肽。FUS-1肽可以包含SEQ ID NO:1。在某些实施方案中,所述FUS-1肽是SEQ ID NO:1。生物活性肽可以包含KLALKLALKALKAALKLA(SEQ ID NO:2),RQIKIWFQNRRMKWKK(SEQ IDNO:3),GWTLNSAGYLLGKINLKALAALAKKIL(SEQ ID NO:4),MGLGLHLLVLAAALQGAWSQPKKKRKV(SEQ ID NO:5),GALFLGWLGAAGSTMGAWSQPKKKRKV(SEQ ID NO:6),GRKKRRQRRRPPQ(SEQID NO:7),RGGRLSYSRRRFSTSTGR(SEQ ID NO:8)或RRLSYSRRRF(SEQ IDNO:9)。生物活性肽可以包含KLALKLALKALKAALKLA(SEQ ID NO:2)。
所述肽可以包含肿瘤抑制基因产物的氨基酸序列的功能域。所述肽包含肿瘤抑制基因产物的氨基酸序列的预测功能域。预测功能域通过计算机辅助序列分析肿瘤抑制基因产物的氨基酸序列鉴别出来。所述多肽可以是蛋白质。蛋白质的氨基酸序列可以源自肿瘤抑制基因产物的氨基酸序列。肿瘤抑制基因可以是在表4中列出的基因。在某些实施方案中,所述肿瘤抑制基因是FUS-1。
纳米颗粒可以是基于脂质的纳米颗粒,超顺磁性纳米颗粒,纳米壳,半导体纳米晶体,量子点,基于聚合物的纳米颗粒,基于硅的纳米颗粒,基于二氧化硅的纳米颗粒,基于金属的纳米颗粒,富勒烯或纳米管。纳米颗粒可以是基于脂质的纳米颗粒。基于脂质的纳米颗粒可以是脂质体,中性脂质体,DOPC脂质体或DOTAP:胆固醇囊泡。脂质体可以是DOPC脂质体。在某些实施方案中,所述纳米颗粒是超顺磁性纳米颗粒。在某些实施方案中,所述纳米颗粒是超顺磁性纳米颗粒,且所述纳米颗粒-多肽复合物是在脂质体或DOTAP:胆固醇囊泡内。脂质体可以是DOPC脂质体。化学部分可以是脂肪酸(例如,C4-C18脂肪酸,硬脂酸或肉豆蔻酸)。化学部分可以是细胞穿透肽。细胞穿透肽可以源自HIV Tat,疱疹病毒VP22,或果蝇触角同源异型框基因产物。
在某些实施方案中,纳米颗粒-多肽复合物还包含与纳米颗粒相结合的第二种生物活性多肽。第一种和第二种生物活性多肽可以是生物活性肽,各自包含源自不同肿瘤抑制基因产物的氨基酸序列。纳米颗粒-多肽复合物还可以包含靶向部分,后者将纳米颗粒-多肽复合物靶向到组织或细胞。
本发明的另一个方面涉及纳米颗粒-多肽复合物,其包含与纳米颗粒相结合的生物活性多肽,其中通过添加硬脂酸部分,修饰生物活性多肽,且所述纳米颗粒是DOTAP:胆固醇囊泡,DOPC脂质体或超顺磁性纳米颗粒。
本发明的另一个方面涉及包含氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)的分离的肽或其生物活性变体。所述肽的长度可以是10-100,10-75,10-50,10-25或10个氨基酸残基。所述肽可以通过添加促进细胞摄入肽的化学部分进行修饰。化学部分可以是脂肪酸(例如,C4-C18脂肪酸,硬脂酸或肉豆蔻酸)或细胞穿透肽。细胞穿透肽可以源自HIV Tat,疱疹病毒VP22,或果蝇触角同源异型框基因产物。
本发明的另一个方面涉及纳米颗粒-多肽复合物,其包含本发明的生物活性肽和纳米颗粒。纳米颗粒可以是基于脂质的纳米颗粒(例如,脂质体或DOTAP:胆固醇囊泡),超顺磁性纳米颗粒,纳米壳,半导体纳米晶体,量子点,基于聚合物的纳米颗粒,基于硅的纳米颗粒,基于二氧化硅的纳米颗粒,基于金属的纳米颗粒,富勒烯或纳米管。在某些实施方案中,所述纳米颗粒是超顺磁性纳米颗粒,且所述纳米颗粒-多肽复合物是在脂质体或DOTAP:胆固醇囊泡内。
本发明的另一个方面涉及纳米颗粒-多肽复合物,其包含与纳米颗粒相结合的氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)的肽,其中所述肽通过添加硬脂酸部分进行修饰,且所述纳米颗粒是脂质体,DOTAP:胆固醇囊泡,DOPC脂质体或超顺磁性纳米颗粒。
本发明的另一个方面涉及治疗疾病的方法,其包含,给受试者施用药物组合物,该组合物包含在药学可接受的稀释剂中的本发明的肽或纳米颗粒-多肽复合物。所述疾病可以是癌症(例如,肺癌,NSCLC)。所述方法还可以包含,给受试者施用化疗剂(例如,伊马替尼(imatinib))。所述方法还可以包含,给受试者施用辐射或第二种生物活性多肽。
本发明的另一个方面涉及向细胞递送多肽的方法,其包含,制备本发明的纳米颗粒-多肽复合物,和在足以允许细胞摄入生物活性多肽的条件下,使细胞接触纳米颗粒-多肽复合物。
本发明的另一个方面涉及治疗受试者肿瘤的方法,其包含,给受试者施用治疗有效量的本发明的肽或纳米颗粒-多肽复合物,其中纳米颗粒复合物中的多肽是基于肿瘤抑制基因产物的氨基酸序列。所述施用可以是腹腔内的注射。所述肿瘤可以是胃肠肿瘤。
本发明的另一个方面涉及制备纳米颗粒-多肽复合物的方法,其包含,鉴别生物活性多肽序列中的一个或多个功能域,制备包含至少一个功能域的肽,选择具有预期生物活性的肽,和通过使肽结合纳米颗粒,制备纳米颗粒-多肽复合物。所述鉴别可以包含,使用计算机辅助结构分析。计算机辅助结构分析可以导致鉴别出推定蛋白激酶相互作用位点、推定肉豆蔻酰化位点、PDZ II类域基序或A激酶锚定蛋白(AKAP)基序。所述方法还可以包含,通过添加促进细胞摄入肽的化学部分,修饰所述肽。功能域可以是肿瘤抑制基因的氨基酸序列的预测功能域。
本发明的另一个方面涉及抑制蛋白酪氨酸激酶的方法,其包含,使激酶(例如,EGFR,PDGFR,cKit,cAbl,或Erk)接触本发明的肽。
本发明的另一个方面涉及诱导肿瘤细胞凋亡的方法,其包含使肿瘤细胞接触本发明的肽。
本发明的另一个方面涉及诱导肿瘤细胞凋亡的方法,其包含,使肿瘤细胞接触本发明的纳米颗粒-多肽复合物。
本发明的另一个方面涉及用于磁共振成像的组合物,其包含,本发明的纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒。
预见到,本文所述任意方法或组合物相对于本文所述任意其它方法或组合物都是可以实施的。
当在权利要求和/或说明书中与术语“包含”结合使用时,使用词语“一种”或“一个”可以表示“一种(个)”,但是它也与“一种(个)或多种(个)”、“至少一种(个)”和“一种(个)或超过一种(个)”的含义相一致。
从下面的详述,可以明白本发明的其它目的、特征和优点。但是,应当理解,详述和特定实施例,指示着本发明的特定实施方案,仅作为解释来提供,因为本领域技术人员从该详述会明白在本发明精神和范围内的各种不同变化和修改。
附图简述
下述附图构成本说明书的一部分,且包括在内用于进一步展示本发明的某些方面。参考这些附图中的一幅或多幅结合本文所述特定实施方案的详述,可以更好地理解本发明。
图1:Fus1蛋白质结构的示意分析,提供了在实施例中使用的Fus1肽的列表。
图2:各种肽的疏水常数。
图3:Fus1肽的预测极性。
图4:SPIO纳米颗粒-肽复合物的示意图。
图5:显示肽-DOTAP:胆固醇纳米颗粒、和肽-SPIO-DOTAP:胆固醇颗粒的示意图。
图6:Fus1肽对细胞生长的影响。
图7:Fus1肽在细胞中的IC50值。
图8:Fus1肽对细胞生长和细胞凋亡的影响。
图9:Fus1肽和吉非替尼(Gefitinib)的联合治疗的效果。
图10:Fus1肽对Gleevec-敏感的和Gleevec-抗性的细胞的影响。
图11:Fus1肽对细胞中c-Abl活性的影响。
图12:肽处理的细胞中c-Abl的相对活性。
图13:Fus1肽-纳米颗粒复合物对肿瘤细胞生长的抑制。
图14:用Fus1肽-纳米颗粒复合物处理的细胞中细胞凋亡的诱导。
图15:不同细胞系中的酪氨酸磷酸化。
图16:用STI(甲磺酸伊马替尼;也称作STI-571或Gleevec)处理Rat-1 SH2细胞的结果。
图17:用硬脂酸化的Fus1肽处理Rat-1 SH2细胞的结果。
图18:在软琼脂中用STI-571处理细胞的结果。
图19:在软琼脂中用STI-571处理细胞的结果。
图20:Fus 1肽对磷酸化的抑制。
图21:Fus 1肽对c-Abl激酶的线性抑制。
图22:DMSO或硬脂酸对c-Abl激酶无影响。
图23:在48小时中基于DOPC和DOTAP的包含Fus1肽的脂质体对非小细胞肺癌细胞(H1299细胞)的生长的影响。
图24A-C.硬脂酸Fus1肽对Abl酪氨酸激酶的浓度-依赖性抑制。图24A,硬脂酸修饰的Fus1肽对商品化的Abl酪氨酸激酶的抑制。图24B,硬脂酸Fus1肽对Abl酪氨酸激酶的线性抑制。图24C,非硬脂酸修饰的Fus1肽不抑制Abl酪氨酸激酶活性。
图25A-C.FUS1表达抑制c-Abl酪氨酸激酶活性。
图26A-C.图26A,将1000个H1299细胞平板接种在含有0uM、1uM、或5uM伊马替尼的0.35%软琼脂中。培养细胞18天,每2天更换含有各个相应浓度的伊马替尼的培养基。图26B,伊马替尼对软琼脂中H1299集落形成的剂量依赖性抑制。图26C,将1000个H1299细胞平板接种在含有10uM伊马替尼或未处理的0.35%软琼脂中。培养细胞18天,每2天更换含有各个相应浓度的伊马替尼的培养基。
例示性实施方案的描述
I.纳米颗粒-POLY肽复合物
本发明提供了用于向细胞递送多肽的组合物和方法。所述组合物和方法对任意生物活性蛋白质或肽具有普遍效用,并提供了用于治疗许多类型的疾病的治疗试剂。更具体地,本发明提供了纳米颗粒-多肽复合物,和使用这样的复合物向细胞内递送多肽的方法。所述复合物包含与纳米颗粒相结合的生物活性多肽。本文使用的“结合”指物理结合、化学结合或二者。例如,结合可以涉及共价键,疏水相互作用,包囊,表面吸附等。
在细胞内起作用的蛋白质和肽具有作为治疗药物的实质价值。对于源自酶缺失的代谢疾病,可以通过细胞内递送提供关键酶活性的蛋白质或肽,来治疗疾病。癌症的治疗也可以从向肿瘤细胞中导入蛋白质或肽药物获益,例如,通过导入会抑制癌基因、促进细胞凋亡、预防血管发生和/或恢复或提供肿瘤抑制基因产物功能的蛋白质和/或肽。通过提供细胞内递送多肽的组合物和方法,本发明提供了用于治疗众多不同疾病的有效治疗剂。
本发明可以提供有效治疗剂,其用于治疗涉及蛋白质功能或活性丧失、或蛋白质活性的不适当表达的疾病和病症。例如,代谢疾病包含超过1,000种遗传病症,其中存在代谢遗传缺陷。代谢涉及身体基本组分的形成(合成代谢)或基本身体组分的分解(分解代谢)。代谢途径的每个步骤由酶控制。遗传缺陷导致酶活性的降低或丧失。代谢病症可以造成身体任意系统和细胞的疾病,尽管疾病的严重性可能是不同的和不可预测的。有些缺陷会造成较少的问题,其它缺陷会导致严重疾病和死亡。本发明可以提供纳米颗粒-多肽复合物形式的治疗剂,其为受影响的细胞提供必要的酶活性,从而减轻或消除疾病状态。
或者,就涉及蛋白质活性的不适当表达的疾病而言,蛋白质活性抑制剂的应用可以提供实质益处。例如,许多疾病状态与蛋白激酶-介导的事件触发的异常细胞应答有关。这些疾病包括自身免疫病、炎性疾病、代谢疾病、神经疾病和神经变性疾病、癌症、心血管疾病、变态反应和哮喘、阿尔茨海默氏病和激素相关疾病等疾病。预期破坏酶活性或干扰蛋白激酶的细胞内定位的蛋白激酶抑制剂是用于治疗这样的疾病的有价值的治疗剂。实际上,已经鉴别出抑制蛋白激酶的催化活性的肽(Hvalby等,1994)和破坏蛋白激酶的亚细胞靶向的肽(Colledge和Scott,1999)。本发明提供了可以用于向细胞递送这些和其它抑制蛋白激酶的多肽的组合物和方法。因而,本发明提供了治疗多种疾病的通用方式。
多肽通常难以穿过细胞膜。蛋白质和肽通常具有带电荷的和不带电荷的氨基酸残基。带电荷的残基可以妨碍膜结合和向细胞内的膜运输。本发明通过例如将化学部分连接到生物活性多肽上来促进细胞摄入,克服了该困难。在本发明的某些实施方案中,这通过使生物活性多肽融合到促进细胞摄入的肽上来实现。
例如,已经从果蝇触角同源异型框基因(Antp)的第三个螺旋、HIVTat和疱疹病毒VP22鉴别出了细胞穿透肽(或“蛋白质转导域”),它们都含有带正电荷的富含精氨酸和赖氨酸残基的结构域(Schwarze等,2000;Schwarze等,1999)。另外,已经将源自信号序列的疏水肽鉴别为细胞穿透肽(Rojas等,1996;Rojas等,1998;Du等,1998)。已经证实,将这些肽偶联到标志蛋白质例如β-半乳糖苷酶上,会使标志蛋白质有效内化到细胞中,且已经使用含有这些肽的嵌合框内融合蛋白,体外和体内地将蛋白质递送到广谱细胞类型(Drin等,2002)。这些细胞穿透肽与根据本发明的生物活性多肽的融合,可以增强细胞对多肽的摄入。
在其它实施方案中,通过向多肽连接脂质例如硬脂酸或肉豆蔻酸,来促进细胞摄入。已经证实脂质化会增强肽通过进入细胞(REF)。脂质部分的结合是本发明增强细胞摄入多肽的另一种方式。下面进一步讨论了细胞摄入。
通过增强生物活性多肽的摄入,本发明可以减少治疗所需的蛋白质或肽的量。这又可以显著减少治疗成本,并增加治疗剂的供给。更低的剂量也可以使肽的潜在免疫原性最小化,并限制毒副作用。这样,本发明的组合物和方法会为治疗性治疗提供显著益处。
根据本发明,生物活性多肽可以结合纳米颗粒,以形成纳米颗粒-多肽复合物。在有些实施方案中,所述纳米颗粒是脂质体或其它基于脂质的纳米颗粒,例如基于脂质的囊泡(例如,DOTAP:胆固醇囊泡)。如在癌症治疗中使用的,脂质体利用癌新血管系统中增加的窗孔,来增加肿瘤部位的脂质体浓度。在其它实施方案中,所述纳米颗粒是基于氧化铁的超顺磁性纳米颗粒。直径范围为约10-100nm的超顺磁性纳米颗粒小得足以避免被脾隔离,但是又大得足以避免被肝清除。这样大小的颗粒可以穿透非常小的毛细血管,且可以在身体组织中有效分布。超顺磁性纳米颗粒-多肽复合物可以用作MRI造影剂,以鉴别和追踪摄入生物活性多肽的那些细胞。在某些实施方案中,所述纳米颗粒是半导体纳米晶体或半导体量子点,二者都可以用于光学成像。在其它实施方案中,所述纳米颗粒可以是纳米壳,它包含在二氧化硅核心外的金层。纳米壳的一个优点是,使用标准化学,可以将多肽缀合到金层上。在其它实施方案中,所述纳米颗粒可以是富勒烯或纳米管(Gupta等,2005)。
肽会被肾从循环中快速去除,且对血清中蛋白酶的降解是敏感的。通过使生物活性肽结合纳米颗粒,本发明的纳米颗粒-多肽复合物可以保护免受降解,并减少被肾清除。这会增加多肽的血清半衰期,从而减少有效治疗所需的多肽剂量。同样,这会降低治疗成本,并使免疫问题和治疗的毒性反应最小化。
根据本发明,纳米颗粒-多肽复合物可以靶向特定组织和细胞。这可以通过使细胞靶向部分缀合到纳米颗粒上来实现。靶向部分可以是但不限于,蛋白质,肽,脂质,甾族化合物,糖,碳水化合物或合成化合物。细胞靶向部分(例如配体)会识别和结合它们在细胞表面上的同源受体。类似地,抗体可以通过识别它们在细胞表面上的同源抗原,充当细胞靶向部分。通过提供靶向的纳米颗粒-多肽复合物,本发明可以增强疾病治疗的特异性,并增加进入靶向细胞的治疗剂的量。
根据本发明多肽与纳米颗粒的结合,提供了对多肽的高效、靶向递送,多肽的强细胞摄入,对经处理细胞的灵敏的分子成像,减少的治疗剂量和成本,和治疗的免疫问题和毒性作用最小化。本发明的纳米颗粒-多肽复合物提供了用于高效率且有效地治疗许多疾病的组合物和方法。
关于癌症,本发明提供了癌症治疗的组合物和方法。
现在公认,许多癌症至少部分地由遗传学的异常情况造成,后者导致一个或多个基因的过表达,或一个或多个异常或突变基因的表达。例如,在许多情况下,已知癌基因的表达会导致癌症的发生。"癌基因"是遗传上改变的基因,它的突变的表达产物会破坏正常的细胞功能或控制(Spandidos等,1989)。已经发现,迄今研究的大多数癌基因是作为正常细胞基因即"原癌基因"的编码区中的突变的结果而被"激活",所述突变导致表达的蛋白质产物中的氨基酸置换。该改变的表达产物会表现出参与肿瘤形成过程的异常生物学功能(Travali等,1990)。现在已经在不同程度上鉴别和表征了许多癌基因和癌基因家族,包括ras,myc,neu,raf,erb,src,fms,jun和abl(Travali等,1990)。
细胞癌基因的ras基因家族编码小GTP-结合蛋白。已经发现ras基因在许多种类的人肿瘤中突变。ras蛋白(Ras)是诱导生长和/或分化的刺激的转导中涉及的细胞内信号传递途径的重要组分,其通过raf基因编码的丝氨酸/苏氨酸蛋白激酶起作用。myc是编码转录因子的细胞癌基因,与转录因子Max形成结合DNA的异源寡聚体。Src和fms是酪氨酸蛋白激酶,如同abl一样。阻断或干扰癌基因活性的蛋白质和肽,可以作为抗癌剂,且是本发明的实施方案。
如上所述,肿瘤抑制基因是正常基因,它们的缺失(丧失或失活)可以导致癌症。肿瘤抑制基因可以编码减慢细胞生长和分裂的蛋白质。它们的丧失因而可以导致失调的细胞生长和癌症。因此,重新活化肿瘤抑制基因产物、或提供与肿瘤抑制基因产物有关的活性的蛋白质和肽,可以用作抗肿瘤治疗剂。肿瘤抑制基因蛋白质和肽可以用于本发明,且包含在本发明中。
刺激细胞凋亡的蛋白质或肽可以用作抗癌剂。细胞凋亡是细胞的程序性死亡。细胞凋亡是正常胚胎发育,维持成年组织的体内稳态,和抑制癌发生的基本过程(Kerr等,1972)。刺激癌细胞中的细胞凋亡的多肽,可以提供抗癌活性,且是本发明的一部分。
血管发生是肿瘤进展所必需的(Folkman和Shing,1992;Fidler和Ellis,1994;Folkman,1995;Hanahan和Folkman,1996)。血管发生是从先前存在的血管形成新的毛细血管。尽管直径1-2mm的肿瘤可以通过扩散接受所有营养物,进一步的生长依赖于通过血管发生形成足够的血液供给。因而,血管发生的抑制剂可以用作抗肿瘤剂。本发明包括起血管发生抑制剂作用的多肽。
在具体实施方案中,本发明提供了用于治疗癌症的肽和纳米颗粒-多肽复合物。可以凭经验或通过理论方法,鉴别出抗癌肽。为肿瘤抑制基因p53提供了凭经验鉴别抗癌肽的非限制性实例。p53基因编码转录因子。废除活性的p53基因突变会导致癌症。已经证实,包含来自p53转录因子羧基末端的氨基酸序列的肽,可以重新活化某些p53突变体,和重建对细胞生长的控制。因而,与p53羧基末端肽形成的纳米颗粒-多肽复合物,会提供治疗某些p53肿瘤的抗癌剂。
通过筛选组合肽文库,也可以实验地鉴别出抗癌肽。作为非限制性实例,可以筛选基于组合化学的肽-噬菌体文库或肽文库中会抑制癌基因蛋白质活性的肽。其它抗癌肽可以基于实验鉴别的细胞凋亡肽,例如肽KLAKLAKKLAKLAK(SEQ ID NO:10)和其它细胞凋亡肽(参见,例如,Ellerby等,1999)。新的或以前鉴别的抗癌肽在纳米颗粒-多肽复合物中的应用,显示了本发明用于治疗癌症的普遍适用性。
或者,通过分析肿瘤抑制基因产物的氨基酸序列中的预测功能域,可以鉴别出潜在抗癌肽。然后,通过本领域众所周知的适当测定,可以测定包含预测功能域的肽的抗癌活性。在实施例中描述了该方案的一个实例。发明人进行了FUS1基因产物的氨基酸序列分析,并鉴别出了预测的“A激酶锚定蛋白”(AKAP)基序。测试了含有该功能基序的肽的抑制不同酪氨酸激酶和阻断集落形成的能力。阳性活性确认,该蛋白质是抗癌剂。根据本发明,提供纳米颗粒-Fus1肽复合物治疗癌症的治疗剂。
如该实施例所证实的,本发明提供了鉴别基于肿瘤抑制基因产物的预测功能域的抗癌肽和蛋白质的方法。该方法是快速得到用作治疗剂的抗癌多肽和纳米颗粒-多肽复合物的有力方式。
一旦鉴别出抗癌蛋白或肽,可以基于蛋白质或肽的氨基酸序列制备这些多肽的变体。这些多肽和它们的变体都可以用于本发明,且包含在本发明中。
本发明可以用于将生物活性多肽递送给细胞。例如,本发明提供了治疗癌症的方法和组合物。癌症可以是任何下述类型的癌症:黑素瘤,非小细胞肺癌,小细胞肺癌,肺癌,肝癌,视网膜母细胞瘤,星形细胞瘤,成胶质细胞瘤,牙龈癌,舌癌,白血病,神经母细胞瘤,头,颈,乳房,胰腺,前列腺,肾,骨,睾丸,卵巢的癌症,间皮瘤,子宫颈,胃肠的癌症,淋巴瘤,脑,结肠,或膀胱的癌症。在某些实施方案中,所述癌症包含上皮癌细胞。在具体实施方案中,所述癌症是肺癌。
A.多肽
本文使用的术语“多肽”指蛋白质或肽。肽被认为具有3-100个氨基酸。蛋白质被认为具有超过100个氨基酸。
在某些实施方案中,多肽分子的大小可以包含但不限于,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,100,110,120,130,140,150,160,170,180,190,200,210,220,230,240,250,275,300,325,350,375,400,425,450,475,500,525,550,575,600,625,650,675,700,725,750,775,800,825,850,875,900,925,950,975,1000,1100,1200,1300,1400,1500,1750,2000,2250,2500或更多个氨基分子残基,和其中可推导出的任意范围。
在某些实施方案中,本发明的生物活性多肽可以包含3-2500、更优选3-1000、更优选3-500、更优选5-250、更优选7-250、更优选10-100、更优选10-50、更优选10-40、最优选10-35个氨基分子残基。
本文使用的“氨基分子”指任意氨基酸、氨基酸衍生物或氨基酸模仿物,如本领域普通技术人员已知的。在某些实施方案中,多肽的残基是连续的,没有任何非氨基分子间断氨基分子残基序列。在其它实施方案中,所述序列可以包含一个或多个非氨基分子部分。在具体实施方案中,多肽残基序列可以被一个或多个非氨基分子部分中断。
因此,术语“多肽”包括包含至少一个天然合成蛋白质中的20种常见氨基酸、或至少一个经修饰的或不常见的氨基酸(包括但不限于在下面表1中列出的那些)的氨基分子序列。
在某些实施方案中,所述纳米颗粒-多肽复合物包含生物相容的多肽。本文使用的术语“生物相容的”指,当根据本文所述方法和量应用或施用于给定生物时,几乎不产生或不产生显著的不利效果的物质。这样的不利或不希望的效果是显著的毒性或有害的免疫反应等。在优选的实施方案中,生物相容的多肽或纳米颗粒-多肽复合物通常是哺乳动物蛋白质或肽或合成的蛋白质或肽,它们各自基本上不含有毒素、病原体和有害免疫原。
通过本领域技术人员已知的任意技术,可以制备蛋白质和肽,包括通过标准分子生物学技术表达蛋白质和肽,从天然来源分离蛋白质和肽,或化学合成蛋白质和肽。以前已经公开了不同基因的核苷酸和多肽序列,且可以在本领域普通技术人员已知的计算机化数据库中找到。一个这样的数据库是国家生物技术信息中心的Genbank和GenPept数据库(可以在环球网上ncbi.nlm.nih.gov找到)。使用本文公开的或本领域普通技术人员已知的技术,可以扩增和/或表达这些已知基因的编码区。或者,蛋白质和肽的各种商品化制品是本领域技术人员已知的。
在某些实施方案中,多肽可以是分离的或纯化的。通常,“分离的”或“纯化的”指已经进行分级分离以去除各种其它多肽的特定多肽组合物,且该组合物基本上保持它的活性,这可以通过例如蛋白质测定来评估,如本领域普通技术人员关于特定或目标蛋白质或肽已知的。
在某些实施方案中,使用治疗有效量的多肽或纳米颗粒-多肽复合物来治疗受试者的肿瘤。治疗有效量是,当施用活性成分一次或一段时间时,会导致施用活性成分所针对的状况的改善或希望的变化的量。如已知的,该量随待治疗的状况的类型、特定活性成分、状况的严重性和患者特征等详细因素而变化。
1.变体
术语“多肽”、“蛋白质”和“肽”也包括蛋白质或肽的氨基酸序列变体。本发明多肽的氨基酸序列变体可以是置换、插入或缺失变体。缺失变体缺少对于功能或免疫原活性非必需的一个或多个天然蛋白质的残基,如缺少跨膜序列的整合膜蛋白的变体所例示的。另一个常见类型的缺失变体是缺少分泌信号序列或指导蛋白质结合细胞特定部位的信号序列的变体。插入突变体通常包含在多肽的非末端点添加物质。这可以包括,插入免疫反应性的表位或仅仅一个残基。下面讨论了称作融合蛋白的末端添加。
置换变体通常在多肽内的一个或多个位点含有一个氨基酸与另一个氨基酸的交换,且可以设计成用于调控多肽的一种或多种性质,例如抗溶蛋白性裂解的稳定性,而不丧失其它功能或性质。这类置换优选地是保守的,换而言之,将一个氨基酸替换为类似形状和电荷的氨基酸。保守置换是本领域众所周知的,包括例如:丙氨酸置换为丝氨酸;精氨酸置换为赖氨酸;天冬酰胺置换为谷氨酰胺或组氨酸;天冬氨酸置换为谷氨酸;半胱氨酸置换为丝氨酸;谷氨酰胺置换为天冬酰胺;谷氨酸置换为天冬氨酸;甘氨酸置换为脯氨酸;组氨酸置换为天冬酰胺或谷氨酰胺;异亮氨酸置换为亮氨酸或缬氨酸;亮氨酸置换为缬氨酸或异亮氨酸;赖氨酸置换为精氨酸;蛋氨酸置换为亮氨酸或异亮氨酸;苯丙氨酸置换为酪氨酸,亮氨酸或蛋氨酸;丝氨酸置换为苏氨酸;苏氨酸置换为丝氨酸;色氨酸置换为酪氨酸;酪氨酸置换为色氨酸或苯丙氨酸;和缬氨酸置换为异亮氨酸或亮氨酸。
术语“生物学功能等同”是本领域非常理解的,且在本文中进一步具体定义。因此,具有约70%至约80%、更优选约81%至约90%、或甚至更优选约91%至约99%的氨基酸与生物活性多肽的氨基酸相同或功能上等同的序列,在本发明的范围内,只要能维持多肽的生物活性。
术语“功能上等同的密码子”在本文中用于指编码相同氨基酸的密码子,例如精氨酸或丝氨酸的6个密码子,也指编码生物学上等同的氨基酸的密码子(参见下面的表2)。
表II
密码子表
也应当理解,氨基酸序列可以包含附加的残基,例如附加的N-或C-末端氨基酸,且仍然基本上如本文公开的序列之一所述,只要该序列满足上述标准,包括维持生物活性。
下面的讨论是基于蛋白质氨基酸的变化,以创建等同的、或甚至改进的第二代分子。例如,蛋白质结构中的某些氨基酸可以置换为其它氨基酸,而不显著丧失与抗体的抗原结合区或底物分子上的结合部位等结构的相互作用结合能力。由于蛋白质的相互作用能力和性质决定了蛋白质的生物功能活性,可以在蛋白质序列中产生某些氨基酸置换,但是仍然产生具有类似性质的蛋白质。发明人因而预见到,可以在本文所述多肽的氨基酸序列中产生多种不同的变化,而不显著丧失它们的生物效用或活性,如下面所讨论的。表2显示了编码特定氨基酸的密码子。
在产生这样的变化时,可以考虑氨基酸的亲水指数。亲水氨基酸指数在赋予蛋白质相互作用生物功能中的重要性,是本领域普遍理解的(Kyte & Doolittle,1982)。已经接受,氨基酸的相对亲水特性会促成所得到的蛋白质的二级结构,这又确定了蛋白质与其它分子(例如,酶,底物,受体,DNA,抗体,抗原等)的相互作用。
本领域还理解,可以在亲水性的基础上有效地进行类似氨基酸的置换。通过参考并入本文的美国专利4,554,101声称,蛋白质的最大局部平均亲水性(由它的邻近氨基酸的亲水性控制)与蛋白质的生物性质相关联。如美国专利4,554,101所详述的,已经为氨基酸残基指定了下面的亲水性值:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸*-0.5);半胱氨酸(-1.0);蛋氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);色氨酸(-3.4)。
应当理解,可以将氨基酸置换为另一个具有类似亲水性值的氨基酸,且仍然产生生物学等同的和免疫学等同的多肽。在这样的变化中,亲水性值在±2之内的氨基酸置换是优选的,在±1之内是特别优选的,在±0.5之内是更特别优选的。
如上所述,氨基酸置换通常是基于氨基酸侧链取代基的相对相似性,例如,它们的疏水性,亲水性,电荷,大小等。考虑各种前述特征的示例性置换是本领域技术人员众所周知的,包括:精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;和缬氨酸、亮氨酸和异亮氨酸。
制备根据本发明的多肽的另一个实施方案是肽模仿物的应用。模仿物是模仿蛋白质二级结构的元件的含肽分子。参见例如,Johnson等,1993。应用肽模仿物的基础原理是,蛋白质的肽主链的主要存在方式是,使氨基酸侧链朝向有利于分子相互作用(例如抗体和抗原的相互作用)的方向。预期肽模仿物允许类似于天然分子的分子相互作用。这些原理可以与上述原理结合使用,以改造具有本文所述多肽的许多天然性质、但是具有改变的或甚至改进的特征的二代分子。
在另一个实施方案中,肽含有D-氨基酸,而不是在生物蛋白质中常见的L-氨基酸。在化学合成肽的过程中,可以置换D-氨基酸。另外,预见到反转-D肽。反转-D肽保持与L-氨基酸肽相同的三级构象,并因此保持相同的活性,但是对体外和体内酶降解更稳定,因而具有比原始肽更大的治疗功效(Brady和Dodson,1994;Jameson等,1994)。
如本领域众所周知的,可以给蛋白质和肽缀合荧光的、化学发光的或其它类型的检测标签或标记。
2.融合蛋白
插入变体的一种专门类型是融合蛋白。该分子通常具有天然分子的全部或实质部分,其在N-或C-末端连接到第二种多肽的全部或一部分上。例如,融合可以采用来自其它物种的先导序列,以允许在异源宿主中重组表达蛋白质。另一种有用的融合包括添加免疫活性结构域,例如抗体表位,以促进融合蛋白的纯化。在融合接头处或附近包含切割位点,会促进在纯化后去除外来多肽。其它有用的融合包括连接功能域,例如来自酶(例如水解酶)的活性部位,糖基化结构域,细胞靶向信号或跨膜区域。特别优选的融合包含,将细胞穿透肽连接到多肽上,以促进细胞对多肽的摄入。
例如,可以在本发明中使用来自HIV Tat多肽、果蝇触角同源异型框基因(Antp)的第三个螺旋、流感病毒血凝素和/或疱疹病毒VP22多肽的肽,建立融合蛋白。这些蛋白质含有带正电荷的富含精氨酸和赖氨酸残基的结构域,且已经将源自信号序列和融合序列的疏水肽鉴别为细胞穿透肽。这些肽可以用于体外和体内地递送蛋白质到广谱细胞类型中。在本发明中,这些肽可以用于促进细胞摄入生物活性蛋白质和肽。
3.多肽纯化
可能需要纯化或分离本文所述的多肽。蛋白质纯化技术是本领域技术人员众所周知的。这些技术包含,在一个水平,将细胞环境粗分离成多肽和非多肽级分。将多肽与其它蛋白质和肽分离后,可以使用色谱和电泳技术进一步纯化目标多肽,以达到部分或完全纯化(或纯化至同质)。特别适用于制备纯肽的分析方法是离子交换色谱,排阻色谱;聚丙烯酰胺凝胶电泳;等电聚焦。纯化肽的特别有效的方法是快速蛋白质液相色谱和HPLC。
当使用术语“基本上纯化的”或“基本上分离的”时,该命名指蛋白质或肽构成组合物的主要组分的组合物,例如占组合物中蛋白质的约50%,约60%,约70%,约80%,约90%,约95%或更多。
4.促进细胞摄入
在有些实施方案中,通过添加促进细胞摄入多肽的化学部分,可以修饰所述多肽。增强细胞摄入的部分的实例包括但不限于:疏水基团(例如,脂质或脂肪酸),细胞穿透肽(参见,例如,美国专利6,610,657;Drin,等,2002),和某些金属螯合物。
脂肪酸通常是包含碳链、在链末端具有酸性部分(例如,羧酸)的分子。脂肪酸的碳链可以是任意长度,但是,碳链的长度优选地是至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20或更多个碳原子,和其中可推导的任意范围。在某些实施方案中,脂肪酸链部分中碳链长度是4-18个碳原子。在某些实施方案中,脂肪酸碳链可以包含奇数个碳原子,但是,链中偶数个碳原子在某些实施方案中可能是优选的。在碳链中仅包含单键的脂肪酸称作饱和的,而在链中包含至少一个双键的脂肪酸称作不饱和的。脂肪酸可以是分支的,尽管在本发明的优选实施方案中,它是不分支的。具体脂肪酸包括但不限于,亚油酸,油酸,棕榈酸,亚麻酸,硬脂酸,月桂酸,肉豆蔻酸,花生酸,棕榈油酸,花生四烯酸。
如上所述,已经鉴别出了多种细胞穿透肽。表III列出了一些这样的肽和它们的氨基酸序列。在某些实施方案中,细胞穿透肽具有多个正电荷,大小范围是10-27个氨基酸残基。预见到任意这样的肽适用于本发明。
表III
| 肽名称 | 序列 |
| MAP(模型两亲肽) | KLALKLALKALKAALKLA(SEQ ID NO:2) |
| pAntp43-58(或穿透素) | RQIKIWFQNRRMKWKK(SEQ ID NO:3) |
| Transportan | GWTLNSAGYLLGKINLKALAALAKKIL(SEQ ID NO:4) |
| SBP(来自SV40T抗原的基于信号序列的肽) | MGLGLHLLVLAAALQGAWSQPKKKRKV(SEQ ID NO:5) |
| FSB(来自SV40T抗原的基于融合序列的肽) | GALFLGWLGAAGSTMGAWSQPKKKRKV(SEQ ID NO:6) |
| Tat(HIV Tat肽) | GRKKRRQRRRPPQ(SEQ ID NO:7) |
| SynB1(来自内源性抗微生物多肽I) | RGGRLSYSRRRFSTSTGR(SEQ ID NO:8) |
| SynB3(来自内源性抗微生物多肽I) | RRLSYSRRRF(SEQ ID NO:9) |
在某些实施方案中,可以生成融合蛋白,其含有负责多肽的生物活性(例如,治疗)性质的区域以及提高细胞摄入蛋白质的区域。例如,在某些实施方案中,所述融合蛋白可以含有流感病毒血凝素蛋白的一部分或全部。
B.纳米颗粒
本文使用的术语“纳米颗粒”指具有1-1,000nm范围的尺度的任意材料。在有些实施方案中,纳米颗粒具有2-200nm范围的尺度,优选2-150nm,和甚至更优选2-100nm。在本发明中使用的纳米颗粒包括例如下述纳米级材料:基于脂质的纳米颗粒,超顺磁性纳米颗粒,纳米壳,半导体纳米晶体,量子点,基于聚合物的纳米颗粒,基于硅的纳米颗粒,基于二氧化硅的纳米颗粒,基于金属的纳米颗粒,富勒烯和纳米管(Ferrari,2005)。多肽与纳米颗粒的缀合,提供了具有潜在应用的结构,所述潜在应用用于靶向递送,控释,增强的细胞摄入和细胞内运输,以及体外和体内治疗肽的分子成像(West,2004;Stayton等,2000;Ballou等,2004;Frangioni,2003;Dubertret等,2002;Michalet等,2005;Dwarakanath等,2004)。
1.超顺磁性氧化铁(“SPIO”)纳米颗粒
超顺磁性氧化铁(“SPIO”)纳米颗粒已经试验性地用于磁共振成像(“MRI”)对比度增强,组织修复,免疫测定,细胞分离,和药物递送(Gupta,2004;Sestier等,1998;Wilhelm等,2003)。
通过本领域技术人员已知的任意方法(Gupta等,2005),可以制备和储存用于本发明的SPIO纳米颗粒。也可以使用商品化制备的SPIO纳米颗粒。为了结合多肽,可以给SPIO纳米颗粒包被聚合材料例如聚乙二醇或葡聚糖,多肽通过酰胺或酯键结合到聚合物表面。可以使用许多化学方案来结合多肽,包括碳化二亚胺化学,二异氰酸酯连接物,和琥珀酰亚胺基酯。已经用于结合多肽的连接物分子包括1-乙基-3-(3-二甲氨基丙基)碳化二亚胺盐酸盐,N-琥珀酰亚胺基3-(2吡啶基联硫基)丙酸酯,N-羟基琥珀酰亚胺,和N,N’亚甲双丙烯酰胺(Lewin等,2000;Roberts等,2002)。
例如,通过使用异双功能连接物的2步方法,将肽缀合到纳米颗粒上,可以制备SPIO纳米颗粒-肽复合物。首先,通过与表氯醇交联,衍生商品化制备的葡聚糖包被的SPIO颗粒(来自AdvancedMagnetics Inc.,Cambridge,MA的“Feridex I.V”或“Combidex”,或来自Guerbet,Aulnaysous-Bois,France的“Endorem”),然后与氨反应,以在葡聚糖包衣上生成氨基。然后,可以用SMCC修饰纳米颗粒,以提供马来酰亚胺部分(SPIO-SMCC)。其次,通过SPIO-SMCC中的马来酰亚胺基团与在TCEP还原二硫键之后得到的肽衍生物的巯基的反应,将肽-腙衍生物缀合到SPIO-SMCC上。通过紫外-可见光分光光度法,测定所得到的肽-SPIO缀合的比例,并通过G-25凝胶过滤柱的大小排阻色谱进一步纯化。浓缩纯化的缀合物,在-20℃保藏备用。使用类似的化学,将药物衍生物缀合到SPIO。关于SPIO的荧光标记,用DTPA异硫代氰酸酯螯合剂(I-24221,Molecular Probes)偶联上述SPIO葡聚糖衍生物的伯胺,以导入对多种金属离子的高亲和力结合位点,然后用Fluo-3钾(橙红)(F-3715,Molecular Probes)标记。通过共焦荧光成像或FACS分析,可以使用荧光标记的FP-SPIO纳米颗粒在体外和体内监测细胞摄入、细胞内运输、和生物分布。
可以在羧基末端修饰多肽,添加赖氨酸或半胱氨酸残基,以提供用于缀合到SPIO纳米颗粒上的游离伯胺或巯基官能团。类似地,可以将修饰的多肽缀合到其它纳米颗粒上,例如纳米壳,量子点,富勒烯和纳米管。
例如,在自动合成仪上使用标准Fmoc肽化学合成的过程中,可以将赖氨酸残基添加到肽上。可以以相同的方式,添加半胱氨酸残基。对于通过重组方法制备的多肽,可以将赖氨酸或半胱氨酸密码子添加到编码该多肽的DNA序列上,在重组表达系统中表达所得到的多肽。
2.基于脂质的纳米颗粒
基于脂质的纳米颗粒包括脂质体,脂质制品和基于脂质的囊泡(例如,DOTAP:胆固醇囊泡)。基于脂质的纳米颗粒可以是带正电荷的,带负电荷的或中性的。在某些实施方案中,所述基于脂质的纳米颗粒是带中性电荷的(例如,DOPC脂质体)。
a.脂质体
“脂质体”是一个总称,它包括通过生成包封的脂质双层或聚集体形成的多种单层和多层脂质载体。脂质体可以表征为具有双层膜的囊泡结构,通常包含磷脂,和通常包含水性组合物的内部介质。本发明的脂质体包括单层脂质体,多层脂质体和多泡脂质体。本发明的脂质体可以是带正电荷的,带负电荷的或带中性电荷的。在某些实施方案中,所述脂质体的电荷是中性的。
多层脂质体具有多个被水性介质分开的脂质层。当将包含磷脂的脂质悬浮于过量的水性溶液中时,它们自发形成。脂质组分经历自重排,然后形成密闭结构,并在脂质双层之间包入水和溶解的溶质(Ghosh和Bachhawat,1991)。亲脂分子或具有亲脂区域的分子也可以溶于脂质双层中,或与脂质双层结合。
在具体方面,多肽可以例如包封在脂质体的水性内部,散布在脂质体的脂质双层之内,通过与脂质体和多肽结合的连接分子结合到脂质体上,包入脂质体中,与脂质体复合等。
如本领域普通技术人员已知的,可以通过不同方法制备根据本发明使用的脂质体。例如,将磷脂(Avanti Polar Lipids,Alabaster,AL)、例如中性磷脂二油酰基磷脂酰胆碱(DOPC)溶于叔丁醇中。然后将脂质与生物活性多肽和/或其它组分相混合。将Tween 20加入脂质混合物,使得Tween 20是组合物重量的约5%。将过量叔丁醇加入该混合物,使得叔丁醇的体积是至少95%。涡旋混合物,在干冰/丙酮浴中冷冻,并低压冻干过夜。将低压冻干的制品保藏在-20℃,可以使用最长达3个月。当需要时,在0.9%盐水中重配低压冻干的脂质体。
或者,通过在容器内的溶剂中混合脂质,可以制备脂质体,所述容器例如玻璃梨形烧瓶。该容器应当具有比预期脂质体悬浮液的体积大10倍的体积。使用旋转蒸发器,在负压下在约40℃去除溶剂。根据脂质体的预期体积,通常在约5分钟至2小时内去除溶剂。可以在真空下在干燥器中进一步干燥组合物。干燥的脂质通常在约1周后抛弃,因为存在随着时间而变质的趋势。
通过摇动直到所有脂质膜重新悬浮,可以在无菌的无热原水中以约25-50mM磷脂水合干燥的脂质。然后可以将含水脂质体分成等份,分别置于小瓶中,低压冻干,并在真空下密封。
如上所述制备的干燥的脂质或低压冻干的脂质体可以脱水,并在蛋白质或肽溶液中重配,并用适当溶剂(例如,DPBS)稀释至适当浓度。然后,在涡旋混合仪中剧烈振摇混合物。通过在29,000×g离心去除未包封的其它物质,例如试剂,包括但不限于激素、药物、核酸构建体等,并洗涤脂质体沉淀。以适当的总磷脂浓度,例如约50-200mM,重新悬浮经洗涤的脂质体。根据标准方法,可以确定包封的其它物质或活性试剂的量。确定脂质体制品中包封的其它物质或活性试剂的量以后,可以将脂质体稀释至适当浓度,在4℃保藏备用。包含脂质体的药物组合物通常包含无菌的、药学可接受的载体或稀释剂,例如水或盐水溶液。
在其它替代方法中,可以根据其它已知实验室方法制备脂质体(例如,参见Bangham等,1965;Gregoriadis,1979;Deamer和Uster,1983;Szoka和Papahadjopoulos,1978,各自在相关部分通过参考并入本文)。可以用于本发明的其它脂质体包括阳离子脂质体,例如,如WO02/100435A1,美国专利5,962,016,美国申请2004/0208921,WO03/015757A1,WO04029213A2,美国专利5,030,453,和美国专利6,680,068中所述,它们都没有放弃地整体以参考方式并入本文。在WO04/002453A1中也描述了制备脂质体的方法。中性脂质可以掺入阳离子脂质体中(例如,Farhood等,1995)。在以参考方式并入本文的美国专利5,855,911中公开了可以在某些实施方案中使用的多种中性脂质体。这些方法的不同在于它们各自的包封水性物质的能力和它们各自的水性空间/脂质比。
脂质体的大小随合成方法而异。本发明中的脂质体可以是许多尺寸。在某些实施方案中,所述脂质体较小,例如,外径小于约100nm,约90nm,约80nm,约70nm,约60nm,或小于约50nm。在制备这样的脂质体中,可以使用本文所述的或本领域普通技术人员已知的任意方案。制备脂质体的其它非限制性实例记载在美国专利4,728,578,4,728,575,4,737,323,4,533,254,4,162,282,4,310,505,和4,921,706;国际申请PCT/US85/01161和PCT/US89/05040;英国专利申请GB2193095A;Mayer等,1986;Hope等,1985;Mayhew等1987;Mayhew等,1984;Cheng等,1987;和脂质体Technology,1984中,它们各自以参考方式并入本文。
b.中性脂质体
在某些实施方案中,基于脂质的纳米颗粒是中性脂质体(例如,DOPC脂质体)。本文使用的"中性脂质体”或“不带电荷的脂质体”定义为具有产生基本上中性的净电荷(基本上不带电荷的)的一种或多种脂质组分的脂质体。"基本上中性的"或"基本上不带电荷的"是指,在给定群体(例如,脂质体群体)内的极少(如果有任何的话)脂质组分包含未被另一组分的相反电荷抵消掉的电荷(即,少于10%的组分包含未抵消的电荷,更优选少于5%,最优选少于1%)。在某些实施方案中,中性脂质体可以主要包含在生理条件(即,在约pH7)下本身是中性的脂质和/或磷脂。
本发明的脂质体和/或基于脂质的纳米颗粒可以包含磷脂。在某些实施方案中,单一一类磷脂可以用于制备脂质体(例如,中性磷脂,例如DOPC,可以用于制备中性脂质体)。在其它实施方案中,超过一类磷脂可以用于制备脂质体。
磷脂包括,例如,磷脂酰胆碱,磷脂酰甘油,和磷脂酰乙醇胺;因为磷脂酰乙醇胺和磷脂酰胆碱在生理条件(即,在约pH 7)下是不带电荷的,这些化合物可以特别适用于制备中性脂质体。在某些实施方案中,磷脂DOPC用于制备不带电荷的脂质体。在某些实施方案中,可以使用非磷脂的脂质(例如,胆固醇)。
磷脂包括甘油磷脂和某些鞘脂。磷脂包括但不限于,二油酰基磷脂酰胆碱("DOPC"),卵磷脂酰胆碱("EPC"),二月桂酰基磷脂酰胆碱("DLPC"),二肉豆蔻酰基磷脂酰胆碱("DMPC"),二棕榈酰基磷脂酰胆碱("DPPC"),二硬脂酰基磷脂酰胆碱("DSPC"),1-肉豆蔻酰基-2-棕榈酰基磷脂酰胆碱("MPPC"),1-棕榈酰基-2-肉豆蔻酰基磷脂酰胆碱("PMPC"),1-棕榈酰基-2-硬脂酰基磷脂酰胆碱("PSPC"),1-硬脂酰基-2-棕榈酰基磷脂酰胆碱("SPPC"),二月桂酰基磷脂酰甘油("DLPG"),二肉豆蔻酰基磷脂酰甘油("DMPG"),二棕榈酰基磷脂酰甘油("DPPG"),二硬脂酰基磷脂酰甘油("DSPG"),二硬脂酰基鞘磷脂("DSSP"),二硬脂酰基磷脂酰乙醇胺("DSPE"),二油酰基磷脂酰甘油("DOPG"),二肉豆蔻酰基磷脂酸("DMPA"),二棕榈酰基磷脂酸("DPPA"),二肉豆蔻酰基磷脂酰乙醇胺("DMPE"),二棕榈酰基磷脂酰乙醇胺("DPPE"),二肉豆蔻酰基磷脂酰丝氨酸("DMPS"),二棕榈酰基磷脂酰丝氨酸("DPPS"),脑磷脂酰丝氨酸("BPS"),脑鞘磷脂("BSP"),二棕榈酰基鞘磷脂("DPSP"),二肉豆蔻基磷脂酰胆碱("DMPC"),1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱("DAPC"),1,2-二花生四烯酰基-sn-甘油-3-磷酸胆碱("DBPC"),1,2-dieicosenoyl-sn-甘油-3-磷酸胆碱("DEPC"),二油酰基磷脂酰乙醇胺("DOPE"),palmitoyloeoyl磷脂酰胆碱("POPC"),palmitoyloeoyl磷脂酰乙醇胺("POPE"),溶血磷脂酰胆碱,溶血磷脂酰乙醇胺,和二亚油酰基磷脂酰胆碱。
磷脂可以来自天然或合成来源。但是,在某些实施方案中,不使用来自天然来源的磷脂(例如卵或大豆磷脂酰胆碱,脑磷脂酸,脑或植物磷脂酰肌醇,心磷脂和植物或细菌磷脂酰乙醇胺)作为主要磷脂(即,占总磷脂组合物的50%或更多),因为这可能导致得到的脂质体不稳定和泄漏。
c.基于脂质的囊泡
考虑用于本发明的另一类基于脂质的纳米颗粒是基于脂质的囊泡。基于脂质的囊泡可以使用上述的一种或多种脂质制备。
在某些实施方案中,所述基于脂质的囊泡是DOTAP:胆固醇囊泡。DOTAP:胆固醇囊泡通过混合阳离子脂质DOTAP(1,2-双(油酰基氧)-3-(三甲基铵)-丙烷)和胆固醇来制备。用DNA制备的囊泡可以形成这样的结构(称作“三明治’),其中DNA看起来凝缩在2个脂质双层之间(美国专利6,770,291和6,413,544)。
可以如下面非限制性实例所述制备DOTAP:胆固醇-多肽复合物。如前所述(美国专利6,770,291和6,413,544;Templeton,1997)合成DOTAP:胆固醇(DC)纳米颗粒(大小为50-100nm)。简而言之,在氯仿中以1:1比例(20μM DOTAP和20μM胆固醇)混合DOTAP和胆固醇,并在冰冷却的旋转式蒸发器中蒸发。将得到的混合物重新悬浮于5%葡萄糖中,在55℃脉冲超声处理,并低压冻干。将低压冻干的产品溶于5%葡萄糖,通过递减大小(1.0,0.45,0.2,和0.1μm)的小型挤压机(Avanti Lipids,A1)进行挤压,产生50-100nm的平均粒径。类似地制备不含胆固醇的DOTAP。在4℃保存合成的纳米颗粒,并用于制备纳米颗粒复合物。
为了制备DOTAP:胆固醇-肽纳米颗粒,将20μg肽稀释在100μl5%葡聚糖水溶液(“D5W”)中,与等体积经稀释的DOTAP:胆固醇或单独的DOTAP(在D5W中将40μl 20mM μM DOTAP:胆固醇或单独的DOTAP稀释至总体积100μl)轻轻混合,这会产生100mg/ml肽和4mMDOTAP:胆固醇或DOTAP的终浓度。用不同比例的肽/DOTAP:胆固醇或DOTAP,优化配方。分别通过N4 Plus Submicron Particle Sizer(N4颗粒大小分析仪)和Delsa 440SX Zeta Potential Analyzer(BeckmanCoulter,Inc.,Fullerton,CA,USA)测得,得到的肽-纳米颗粒具有100-250nm的平均大小和+50mV的正电荷。
在本发明的有些实施方案中,将用超顺磁性纳米颗粒制备的纳米颗粒-多肽复合物掺入DOTAP:胆固醇囊泡。为了将肽-SPIO缀合物装配在DOTAP:胆固醇囊泡中,可以通过最佳化摩尔比的每种组分的自装配过程,将肽-SPIO缀合物包封在DOTAP:胆固醇囊泡中。通过首先在D5W中混合5-50μM肽-SPIO缀合物或5-50μM肽+0.1-1mg Fe(SPIO)/ml1小时,然后与等体积的在D5W中的40-100mM DOTAP:胆固醇囊泡相合并,装配肽-SPIO纳米颗粒,或各肽和SPIO组分。通过分光光度计测量分析在400nm的光密度,监测在D5W中肽-SPIO-DOTAP:胆固醇颗粒和胶体稳定性。通过FACS分析测定用Fluo-3标记的肽-SPIO缀合物转染的肿瘤细胞中的细胞摄入,优化包囊过程。
3.纳米颗粒的靶向
通过添加配体而不损害纳米颗粒递送其多肽有效负载的能力,实现靶向递送。预见到,这会递送到特定细胞、组织和器官。基于配体的递送系统的靶向特异性是基于配体受体在不同细胞类型上的分布。靶向配体可以与纳米颗粒非共价或共价结合,且可以通过本文讨论的许多方法,缀合到纳米颗粒上。
可以用于靶向纳米颗粒的蛋白质或肽的实例包括转铁蛋白质,乳铁蛋白质,TGF-α,神经生长因子,白蛋白质,HIV Tat肽,RGD肽,和胰岛素等(Gupta等,2005;Ferrari,2005)。
II.生物活性多肽
本发明提供了纳米颗粒-多肽复合物和使用这样的复合物向细胞递送多肽的方法。所述复合物包含与纳米颗粒相结合的生物活性多肽。“生物活性”多肽是具有一些希望的生物功能或活性的蛋白质或肽。作为一个实例,对于抗癌治疗希望的生物功能包括,抑制蛋白激酶,促进细胞凋亡,抑制血管发生等。因而,生物活性抗癌多肽可以是会抑制蛋白激酶、促进细胞凋亡或抑制血管发生的多肽。
根据本发明,通过使生物活性肽结合纳米颗粒,可以形成纳米颗粒-多肽复合物。特别预见到包含目标蛋白质的一个或多个功能域的生物活性肽。
A.创建生物活性多肽
本发明提供了鉴别和产生生物活性多肽(例如,生物活性肽)的方法。在某些实施方案中,生物活性多肽可以通过鉴别多肽中的一个或多个功能域来制备。
通过使用本领域众所周知的分子和细胞生物学方法进行结构-功能研究,可以凭经验确定蛋白质的功能域。例如,通过重组DNA方法,可以制备蛋白质的缺失突变体或置换突变体,且可以研究这样的突变蛋白质的生物性质。或者,通过氨基酸序列分析,可以鉴别蛋白质序列中的推定功能域,且可以设计含有这些预测功能域的肽并测试其生物活性。
在某些实施方案中,计算机辅助的结构分析可以用于鉴别多肽中的功能域。通常,计算机辅助的结构分析包含,评价基因的氨基酸和/或核苷酸序列。计算机辅助的结构分析可以用于鉴别例如功能域,例如蛋白激酶(例如,PKC)激活或相互作用位点,肉豆蔻酰化位点,PDZ II类域或A激酶锚定蛋白(AKAP)基序。计算机辅助的结构分析可以鉴别出推定功能域。推定功能域的鉴别可足以鉴别出生物活性肽。但是,如果需要确认功能域的活性,则可以使用本领域已知的多种不同生物测定来证实功能域的活性。用于进行计算机辅助结构分析的软件包括Scansite程序和在ExPASy蛋白质组学服务器上找到的其它分析程序。
在本发明的具体实施方案中,预见到具有抗癌性质的肽。这样的肽可以基于肿瘤抑制基因产物。
B.肿瘤抑制基因
肿瘤抑制癌基因起抑制过度细胞增殖的功能。这些基因的失活会破坏它们的抑制活性,导致失调的增殖。
一个研究较多的肿瘤抑制基因是p53。在通过化学致癌作用、紫外线辐射和几种病毒转化的许多细胞中,已经发现了高水平的突变型p53。p53基因是许多种人肿瘤中突变灭活的常见靶物,且已经证实是常见人癌症中最经常突变的基因。它在超过50%的人NSCLC(Hollstein等,1991)和许多种其它肿瘤中突变。
p53基因编码393个氨基酸的磷蛋白,后者可以与宿主蛋白质(例如大-T抗原和E1B)形成复合物。该蛋白质存在于正常组织和细胞中,但是其浓度与转化的细胞或肿瘤组织相比很小。
认为野生型p53是许多细胞类型中重要的生长调节剂。错义突变对于p53基因是常见的,且是癌基因的转化能力所必需的。点突变引起的单个遗传改变,可以产生致癌的p53。但是,与其它癌基因不同,已知p53点突变发生在至少30个不同密码子中,经常产生造成细胞表型漂移的显性等位基因,而无纯合性的降低。另外,许多这样的显性负等位基因看起来在生物中是耐受的,且在种系中传递。多种不同的突变型等位基因表现出从最小功能障碍至强穿透性的显性负等位基因(Weinberg,1991)。
细胞增殖的另一种抑制剂是p16。真核生物细胞周期的主要转换由细胞周期蛋白依赖性的激酶或CDK触发。一种CDK,细胞周期蛋白依赖性激酶4(CDK4),会调节通过G1的进展。该酶的活性可能是在G1晚期磷酸化Rb。CDK4的活性由激活亚基、D-型细胞周期蛋白、和抑制亚基控制,已经将p16INK4生物化学地表征为特异性地结合和抑制CDK4的蛋白质,因而可以调节Rb磷酸化(Serrano等,1993;Serrano等,1995)。因为p16INK4蛋白是CDK4抑制剂(Serrano,1993),该基因的缺失可能增强CDK4的活性,导致Rb蛋白的高度磷酸化。还已知p16会调节CDK6的功能。
p16INK4属于新描述的CDK-抑制蛋白类别,所述蛋白还包括p16B,p19,p21WAF1,和p27KIP1。p16INK4基因作图到9p21,即在许多肿瘤类型中频繁缺失的染色体区。p16INK4基因的纯合缺失和突变在人肿瘤细胞系中常见。该证据表明,p16INK4基因是肿瘤抑制基因。但是,该解释已经受到下述发现的挑战,即原代非培养肿瘤中p16INK4基因改变的频率远远低于培养的细胞系(Caldas等,1994;Cheng等,1994;Hussussian等,1994;Kamb等,1994;Kamb等,1994;Mori等,1994;Okamoto等,1994;Nobori等,1995;Orlow等,1994;Arap等,1995)。用质粒表达载体转染恢复野生型p16INK4功能,减少了有些人癌症细胞系的集落形成(Okamoto,1994;Arap,1995)。
在表IV中列出了根据本发明可以使用的其它肿瘤抑制基因。在表IV中列出的基因作为可以用于本发明的肿瘤抑制基因的非限制性实例而提供。此外,预见到实际上现在已知或可能以后发现的任意肿瘤抑制基因(例如,促凋亡基因,或对癌细胞是细胞毒性的基因)都可以用于本发明。预见到实际上表现出肿瘤抑制作用的任意人基因产物都可以用于衍生抗癌生物活性肽。
表IV
肿瘤抑制基因
| 基因 | 基因 | 基因 | 基因 |
| 101F6 | DAF-18 | HYAL2 | PTEN |
| ABR | D-APC | IGBP7 | PTPN13 |
| ADPRTL3 | DBC2 | IGSF4 | PTPRG |
| ANP32C | DCC | ING1 | RASSF1 |
| ANP32D | DDX26 | ING1L | RB1 |
| APC2 | DEC1 | ING4 | RBBP7 |
| APC | DLC1 | 1(2)tid | RBM6 |
| ARF | DLEC1 | 1(3)mbn | RBX1 |
| ARHGAP8 | DLEU1 | 1(3)mbt | RECK |
| ARHI | DLEU2 | LAPSER1 | RFP2 |
| AT1G14320 | DLG1 | LATS1 | RIS1 |
| ATM | DLGH1 | LATS2 | RPL10 |
| ATP8A2 | DLGH3 | LDOC1 | RPS29 |
| AXUD1 | DMBT1 | LOHIICR2A | RRM1 |
| BAP1 | DNAJA3 | LRPIB | S100A2 |
| BECN1 | DOC-1 | LUCA3 | SEMA3B |
| BIN1 | DPCH | MAD | SF1 |
| BRCA1 | DPH2L | MAP2K4 | SFRP1 |
| BRCA2 | EGR1 | MAPKAP3 | SLC22AK |
| BTG1 | FABP3 | MCC | SLC26A3 |
| BTG2 | FAT | MDC | SMARCA4 |
| Clorf1 | FGL1 | MEN1 | ST7 |
| C5orf4 | FHIT | ML-1 | ST7L |
| C5orf7 | FLJ10506 | MLH1 | ST13 |
| Cables | FOXD1 | MRV11 | ST14 |
| CACNA2D2 | FOXP1 | MTAP | STIM1 |
| CAP-1 | FT | MX11 | TCEB2 |
| CARS | FUS1 | NAP1L4 | THW |
| CAV1 | FUS2 | NBR2 | Timp3 |
| CD81 | GAK | NF1 | TP53 |
| CDC | GAS1 | NF2 | TP63 |
| CDK2AP1 | GAS11 | NORE1 | TRIM8 |
| CDKN1A | GLD-1 | NPR2L | Tsc2 |
| CDKN1C | GLTSCR1 | NtRb1 | TSG1-1 |
| CDKN2A | GLTSCR2 | OVCA2 | TSSC1 |
| CDKN2B | GRC5 | PDGFRL | TSSC3 |
| CDKN2X | GRLF1 | PHEMX | TSSC4 |
| 基因 | 基因 | 基因 | 基因 |
| Ciao1*** | HDAC3 | PHyde | VHL |
| CLCA2 | HEMK | PlG8 | Vhlh |
| CREBL2 | HIC1 | PlK3CG | WFDC1 |
| CTNNA1 | HRG22 | PlNX1 | WIT-1 |
| CUL2 | HSAL2 | PLAGL1 | WT1 |
| CW17R | HTS1 | PRDM2 | WWOX |
| DAB2 | HYAL1 | PTCH | p53 |
| bak | MDA-7 | p21 | bax |
| fas |
C.来自人染色体3p21.3的肿瘤抑制基因
肿瘤抑制基因(TSG)在人肺癌和其它癌症的发病机理中起重要作用。肺癌细胞携带多个已知显性和隐性癌基因的突变和缺失(Sekido等,1998;Virmani等,1998)。在染色体区域3p,5q,6p,8p,9p,和11p以及其它位点已经发现了已知的TSG,例如Rb,p53,和推定TSG(Sekido等,1998;Gazdar等,1994;Minna,1997)。新鲜肺肿瘤和肿瘤细胞的细胞遗传学和等位基因分型研究证实了在多个位点的肿瘤细胞等位基因丧失,表明存在一个或多个这样的TSG(Sekido等,1998;Virmani等,1998;Gazdar等,1994;Minna等,1997)。但是,已经证实在染色体3短臂(3p)上的细胞遗传学改变和等位基因缺失最频繁地涉及约90%的小细胞肺癌(SCLC)和>50%的非小细胞肺癌(NSCLC)(Sekido等,1998;Gazdar等,1994;Minna,1997;Daly等,1993)。SCLC和NSCLC是肺肿瘤的2个治疗组,由4个组织学类型组成。鳞状细胞-、腺-、和大细胞癌是在NSCLC组中。小细胞肺癌是在SCLC组中。约75%的肺肿瘤是NSCLC。NSCLC的转移发生得比SCLC晚。SCLC是实体瘤中转移性最高的之一(Mabry等,1998)。另外,已经在肺癌以外的其它几种癌症中观察到类似的3p改变,例如肾癌、乳腺癌、头颈癌、胰腺癌、肾癌、口腔癌和子宫颈癌(Roth,1998;Zbar等,1987;Gazdar等,1998;Sekido等,1998;Buchhagen等,1996;Gorunova等,1998;Hughson等,1998;Uzawa等,1998;Kersemaekers等,1998;Wistuba等,1997)。此外,已经在3p21.3处450-kb区域中定位和分离了通过肺癌中纯合缺失所定义的一组TSG(Sekido等,1998;Minna等,1997;Hung等,1995;Sekido等,1996;Wistuba等,1999)。肺癌肿瘤形成前的研究表明,3p21等位基因缺失是迄今检测的肺癌中最早的遗传异常,发生在增生病损中;这证实了一个或多个3p-隐性癌基因在许多人癌症的分子发病机理中起"看门人"的作用,包括肺癌,其中它可能涉及所有病例的>50%(Sekido等,1998;Minna等,71997;Hung等,1995;Sekido等,1996;Wistuba等,1999;Kohno等,1999;Wistuba等,1999)。
在人染色体3p21.3的120-kb关键肿瘤纯合缺失区(见于肺癌和乳腺癌中)中已经鉴别出一组基因。这些基因已经命名为CACNA2D2,PL6,101F6,NPR1.2,BLU,RASSF1,FUS1,HYAL2和HYAL1。研究了一些这样的基因的表达对几种类型的人NSCLC细胞的细胞增殖的影响。这些研究表明,FUS1,101F6,HYAL2和NPRL2以及其它基因是候选肿瘤抑制基因(Ji等,2000)。
腺病毒载体-或DOTAP:胆固醇纳米颗粒-介导的基因转移对3p21.3-缺陷型人肺癌细胞中野生型-FUS1功能的恢复,在体外和体内通过诱导细胞凋亡和细胞动力学改变而抑制这些肿瘤细胞的生长(Ito等,2004)。这证实了FUS1的肿瘤抑制活性。
III.药物制剂
本发明的药物组合物包含有效量的一种或多种肽,纳米颗粒-多肽复合物或其它试剂(溶于或分散在药学可接受的载体中)。短语"药学或药理学可接受的"指当施用给动物(例如,人,在适合时)时不会产生不利的、过敏性的或其它不良反应的分子实体和组合物。本领域技术人员考虑本说明书的公开内容,会明白含有至少一种肽或纳米颗粒-多肽复合物或其它活性成分的药物组合物的制备,如在以参考方式并入本文的Remington′s Pharmceutical Sciences,18th Ed.MackPrinting Company,1990中所例示的。此外,对于动物(例如,人)施用而言,应当理解制剂应当满足FDA生物标准办公室要求的无菌、致热原性、一般安全和纯度标准。
本文使用的"药学可接受的载体"包括任意和所有的溶剂,分散介质,包衣,表面活性剂,抗氧化剂,防腐剂(例如,抗细菌剂,抗真菌剂),等渗剂,吸收延迟剂,盐,防腐剂,药物,药物稳定剂,凝胶,粘合剂,赋形剂,崩解剂,润滑剂,甜味剂,矫味剂,染料,类似的物质和其组合,如本领域普通技术人员已知的(参见,例如,Remington′s Pharmceutical Sciences,18th Ed.Mack PrintingCompany,1990,pp.1289-1329,其以参考方式并入本文)。除了任何常规载体与活性成分不相容以外,预见到它在治疗或药物组合物中的应用。
药物组合物可以包含不同类型的载体,这取决于它是否以固体、液体或气雾剂形式施用,和这样的给药途径如注射是否需要是无菌的。本发明可以如下施用:静脉内地,真皮内地,动脉内地,腹腔内地,病损内地,颅内地,关节内地,前列腺内地,胸膜内地,气管内地,鼻内地,玻璃体内地,阴道内地,直肠内地,外用地,瘤内地,肌肉内地,腹膜内地,皮下地,结膜下地,膀胱内地,粘膜地,心包内地,脐带内地,眼内地,口服地,外表地,局部地,吸入(例如气雾剂吸入),注射,输注,连续输注,直接、通过导管、通过灌洗来局部灌注浸浴靶细胞,在乳剂中,在脂质组合物(例如,脂质体)中,或通过其它方法或前述方式的任意组合,如本领域普通技术人员已知的(参见,例如,Remington′s Pharmceutical Sciences,18th Ed.Mack PrintingCompany,1990,以参考方式并入本文)。
在某些实施方案中,腹腔内地施用所述药物组合物。在其它实施方案中,腹腔内地施用所述药物组合物,以治疗癌症(例如,癌性肿瘤)。例如,可以腹腔内地施用所述药物组合物,以治疗胃肠癌。在某些实施方案中,可能希望施用药物组合物到肿瘤内或附近。
在某些优选实施方案中,经口施用所述药物组合物以治疗癌症(例如,胃肠癌)。
通过身体和生理因素,例如体重、病症的严重性、待治疗疾病的类型、以前或并行的治疗干预、患者的特发病和给药途径,可以确定施用给患者的本发明组合物的实际剂量。在任何情况下,负责给药的从业医生会确定组合物中活性成分的浓度和适合个体受试者的剂量。
在某些实施方案中,药物组合物可以包含,例如,至少约0.1%的活性化合物。在其它实施方案中,例如,所述活性化合物可以占约2%-约75%重量单位,或约25%-约60%,和其中可推导的任意范围。在其它非限制性实例中,剂量也可以包含,每次施用约1微克/kg/体重,约5微克/kg/体重,约10微克/kg/体重,约50微克/kg/体重,约100微克/kg/体重,约200微克/kg/体重,约350微克/kg/体重,约500微克/kg/体重,约1毫克/kg/体重,约5毫克/kg/体重,约10毫克/kg/体重,约50毫克/kg/体重,约100毫克/kg/体重,约200毫克/kg/体重,约350毫克/kg/体重,约500毫克/kg/体重,至约1000mg/kg/体重或更多,和其中可推导的任意范围。在本文列出的数值的可推导范围的非限制性实例中,基于上述数值,可以施用约5mg/kg/体重至约100mg/kg/体重,约5微克/kg/体重至约500毫克/kg/体重,等。
在任何情况下,组合物可以包含各种不同的抗氧化剂,以延迟一种或多种组分的氧化。另外,使用防腐剂可以预防微生物作用,所述防腐剂例如各种不同的抗细菌剂和抗真菌剂,包括但不限于对羟苯甲酸酯(例如,对羟苯甲酸甲酯,对羟苯甲酸丙酯),三氯叔丁醇,苯酚,山梨酸,硫柳汞或其组合。
可以将一种或多种肽、纳米颗粒-多肽复合物或其它试剂配制成游离碱、中性或盐形式的组合物。药学可接受的盐,包括酸加成盐,例如,与蛋白质性组合物的游离氨基形成的盐,或与无机酸(例如,盐酸或磷酸)或有机酸(例如,乙酸,草酸,酒石酸或扁桃酸)形成的盐。与游离羧基形成的盐也可以衍生自无机碱(例如,氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁)或有机碱(例如,异丙胺,三甲胺,组氨酸或普鲁卡因)。
在其中组合物是液体形式的实施方案中,载体可以是溶剂或分散介质,其包含但不限于,水,乙醇,多元醇(例如,甘油,丙二醇,液体聚乙二醇等),脂质(例如,甘油三酯,植物油,脂质体)和其组合。例如通过使用包衣(例如卵磷脂),通过分散在载体(例如,液体多元醇或脂质)中而维持需要的粒度,使用表面活性剂(例如,羟丙基纤维素),或这些方法的组合,可以维持适当的流动性。在许多情况下,优选地包含等渗剂,例如,糖,氯化钠或其组合。
在其它实施方案中,本发明中可以使用滴眼液、鼻溶液或喷雾剂、气雾剂或吸入剂。这样的组合物通常设计成与靶组织类型相容。在一个非限制性实例中,鼻溶液通常是设计成在滴液或喷雾剂中施用给鼻道的水性溶液。将鼻溶液制备成在许多方面与鼻分泌物相类似,从而维持正常的纤毛作用。因而,在优选的实施方案中,水性鼻溶液通常是等渗的,或轻微缓冲至维持在pH约5.5-约6.5。另外,如果需要,可以在制剂中包含抗微生物防腐剂,类似于在眼制剂、药物中使用的那些,或适当的药物稳定剂。例如,各种不同的商品化的鼻制剂是已知的,包括抗生素或抗组胺药等药物。
在某些实施方案中,制备用于口服等途径给药的一种或多种肽或纳米颗粒-多肽复合物。在这些实施方案中,固体组合物可以包含,例如,溶液,悬浮液,乳剂,片剂,丸剂,胶囊剂(例如,硬或软壳明胶胶囊),持续释放制剂,含服组合物,含锭,酏剂,悬浮液,糖浆,薄片,或其组合。口服组合物可以与饮食食物直接掺合。用于经口给药的优选载体包含惰性稀释剂,可同化食用载体或其组合。在本发明的其它方面,口服组合物可以制备成糖浆或酏剂。糖浆或酏剂可以包含,例如,至少一种活性剂,甜味剂,防腐剂,矫味剂,染料,防腐剂,或其组合。
在某些优选实施方案中,口服组合物可以包含一种或多种粘合剂,赋形剂,崩解剂,润滑剂,矫味剂,和其组合。在某些实施方案中,组合物可以包含下述一种或多种:粘合剂,例如,西黄蓍胶,阿拉伯胶,玉米淀粉,明胶或其组合;赋形剂,例如,磷酸二钙,甘露醇,乳糖,淀粉,硬脂酸镁,糖精钠,纤维素,碳酸镁或其组合;崩解剂,例如,玉米淀粉,马铃薯淀粉,海藻酸或其组合;润滑剂,例如,硬脂酸镁;甜味剂,例如,蔗糖,乳糖,糖精或其组合;矫味剂,例如,薄荷,冬青油,樱桃香料,橙子香料等;或前述组合。当剂量单位形式是胶囊时,它可以在上述类型的物质之外还含有载体,例如液体载体。多种其它物质可以作为包衣或以其它方式修饰剂量单位的物理形式。例如,可以用虫胶、糖或二者包被片剂、丸剂或胶囊。
适用于其它给药模式的其它制剂包括栓剂。栓剂是不同重量和形状的固体剂型,通常通过插入直肠、阴道或尿道进行给药。插入后,栓剂会软化、融化或溶解在腔液中。通常,就栓剂而言,传统载体可以包括,例如,聚亚烷基二醇,甘油三酯或其组合。在某些实施方案中,可以从包含例如范围为约0.5%-约10%、优选约1%-约2%的活性成分的混合物制备栓剂。
通过将需要量的活性化合物掺入根据需要含有多种上述其它成分的适当溶剂中,然后进行过滤除菌,可以制备无菌注射溶液。通常,通过将各种灭菌活性成分掺入含有基础分散介质和/或其它成分的无菌介质中,制备分散系。在用于制备无菌注射溶液、悬浮液或乳剂的无菌粉末的情况下,优选的制备方法是真空干燥或冷冻干燥技术,它们会产生活性成分和来自先前无菌过滤的液体介质的任何其它希望的成分的粉末。如果需要,应当适当缓冲液体介质,在用足够的盐水或葡萄糖注射之前,首先使液体稀释剂等渗。也预见到用于直接注射的高度浓缩的组合物的制备,其中预见到使用DMSO作为溶剂会导致非常快速的穿透,将高浓度的活性试剂递送到小区域。
组合物必须在生产和保藏条件下是稳定的,并防止微生物(例如细菌和真菌)污染作用。应当理解,应当将内毒素污染保持最低(在安全水平),例如,低于0.5ng/mg蛋白质。
在具体实施方案中,通过在组合物中使用延迟吸收的试剂,例如,单硬脂酸铝,明胶或其组合,可以实现注射组合物的延长吸收。
IV.磁共振成像
在磁共振成像(MRI)中,患者躺在静磁场中,并使用射频(RF)脉冲以及空间和时间磁场梯度进行成像分析。MRI使用核自旋性质来收集图像数据。具有不成对核子(质子或中子)的核具有称作自旋的性质,这会产生可以用于进行MRI的非零磁矩(参见,例如,美国专利5,397,987)。氢核具有单个质子,且许多MRI技术利用氢核,因为它们在人组织中是普遍的。当将受试者置于主磁场中时,它的核按磁场的方向排列(即,沿着"磁化轴");核的朝向可以表达为磁化矢量(参见,例如,Horowitz,1995)。在磁共振的经典物理描述中,这些自旋核可以以围绕磁化轴的圆锥方式旋进,通常彼此相对异相。
为了在特定核的共振频率诱导同相自旋,在该共振频率传播大功率射频激发脉冲,经常在千瓦量级。该射频脉冲也会造成样品(例如,人脑)中的核相对于主磁场产生的磁化矢量进行旋转(参见,例如,Horowitz,1995)。样品中的自旋核产生射频信号,它会随时间衰减。在射频激发脉冲之后应用随时间改变的梯度磁场,以在空间上分辨衰减的射频信号。因而,射频激发脉冲和随时间改变的梯度磁场一起造成样品发射随时间改变的磁共振射频信号,后者称作"自由感应衰减"(FID)信号。磁共振(MR)扫描仪的天线会接收这些FID信号,这些MR成像信号传送到处理器。处理器使用这些信号产生MR图像,它们反映了自旋核的空间分布或化学环境。
使用造影剂来增加目标区域与背景之间的信号差异。超顺磁性纳米颗粒可以用作MRI的造影剂(Gupta等,2005;Ferrari,2005)。颗粒可以在组织(例如肿瘤)中累积,无论被动地还是通过靶向递送(Morawski等,2005)。也可以使用磁场来将这样的颗粒定位在特定组织中。靶向递送也可以包含掺入特定蛋白,例如如上所述的转铁蛋白。
本发明的超顺磁性纳米颗粒-多肽复合物可以用于MRI中,以鉴别摄入生物活性多肽的组织和细胞。
在使用之前,可以体外评价纳米颗粒(例如,肽-SPIO-DOTAP:胆固醇颗粒)的细胞毒性。人癌症细胞可以用于体外评价肽-SPIO-DOTAP:胆固醇颗粒对细胞生长的影响和细胞凋亡的诱导。作为一个非限制性实例,通过XTT测定,在96-孔平板中用1x104细胞/孔进行细胞毒性测量。用PBS冲洗细胞,与在无血清培养基中稀释至终浓度为约1-10mM肽-SPIO缀合物的肽-SPIO-DOTAP:胆固醇颗粒、和4-10mMDOTAP:胆固醇一起温育。肽,SPIO,和DOTAP:胆固醇颗粒在96-孔磁性板上用作对照30min(Dynal Biotech Inc.,Brown Deer,WI)。通过用PBS冲洗3次,去除过量的未结合的颗粒。然后,向孔中加入新鲜培养基。在处理后24,48,和72h,测定细胞毒性和细胞凋亡的诱导。根据生产商的说明书,使用XTT测定(Roche Biochemicals)测量细胞生存力,通过使用TUNEL-染色的FACS分析,测量细胞凋亡。肽-DOTAP:胆固醇颗粒可以用作阳性对照。
为了体外评价肽-SPIO纳米颗粒的细胞摄入和运输,通过FACS分析,可以将如上处理过的肿瘤细胞用于定量测量随肽-SPIO浓度而变化的Fluo-3-标记的肽-SPIO纳米颗粒的摄入。也可以通过磁共振(MR)测定细胞摄入并定量分析。作为一个非限制性实例,在42℃,将肽-SPIO-转染的H1299细胞以0,315,625,125,2500,5000,和10000细胞/ml的不同细胞浓度悬浮于15%明胶,然后冷却至室温,在1.5ml-微量离心机塑料管中形成明胶细胞块。使用4.7-T Bruker MR,得到幻影(phantoms)的T2-加权MR图像。3维梯度回音序列用于数据获取。序列参数是:TR25 msec,TE5.1 msec,和AC128。使用下述量纲矢向地定向3维板:FOV632.4cm,矩阵25612896。然后,在Paravision采集和处理软件包(Bruker,Germany)内重建斜投影(相对于磁体轴),以得到解剖相关的平面。通过具有不同几何学的类似序列,测量含有肽-SPIO-转染的H1299细胞的幻影:FOV6cm,矩阵256256,切片厚度1mm。在有些情况下,关于幻影MR仅测量一个切片。通过MR146,基于从肽-SPIO-DOTAP:胆固醇颗粒在溶液中的系列稀释液产生的标准曲线,计算细胞中的肽-SPIO浓度。通过使用锥虫蓝淬灭测定来熄灭胞外荧光,并使用共焦荧光显微镜来观察肽-SPIO缀合物的内在化,也可以使用Fluo-3-标记的肽-SPIO纳米颗粒来评价内在化。
为了体内评价纳米颗粒(例如,肽-SPIO-DOTAP:胆固醇或肽-SPIO-DOPC)的磁力驱动的靶向递送和治疗功效,人癌症小鼠可以用于评价肽-SPIO纳米颗粒的全身给药的磁力靶向递送和治疗功效。作为一个非限制性实例,通过前述的胸腔内注射,将肿瘤细胞接种进裸鼠。肿瘤细胞接种后7-10天,给小鼠注射100ml肽-SPIO-DOTAP:胆固醇颗粒,浓度为约5mM肽-SPIO缀合物、4mM DOTAP:胆固醇,将肽-DOTAP:胆固醇和SPIO-DOTAP:胆固醇颗粒用作对照,单独的PBS用作假对照。3只动物用于每个处理组,注射后5-30min肿瘤部位经历磁梯度场,预定场强度以及定位距离和区域基于在肺肿瘤部位10-30min的MRI。MRI用于治疗计划,定位和监测肽-SPIO分布和治疗后的治疗功效,其中使用4.7T,40cm Bruker Biospec MR仪器。
V.联合治疗
为了增加本发明的肽或纳米颗粒-多肽复合物的有效性,可能希望组合这些组合物和能有效治疗目标疾病的其它试剂。
作为一个非限制性实例,可以用本发明的抗癌生物活性肽或纳米颗粒-多肽复合物连同其它抗癌剂实施癌症的治疗。“抗癌”试剂能负面地影响受试者的癌症,例如,通过杀死癌细胞,诱导癌细胞的细胞凋亡,减少癌细胞的生长速率,减少转移的发生率或数量,减小肿瘤大小,抑制肿瘤生长,减少向肿瘤或癌细胞的血液供给,促进抗癌细胞或肿瘤的免疫应答,预防或抑制癌症的进展,或增加癌症患者的寿命。更通常地,这些其它组合物以能有效杀死或抑制细胞增殖的组合量提供。该过程可能包含,使细胞同时接触抗癌肽或纳米颗粒-多肽复合物和试剂或多种因子。这可以如下实现:通过使细胞接触包含两种试剂的单一组合物或药物制剂,或通过使细胞同时接触2种不同的组合物或制剂,其中一种组合物包含抗癌肽或纳米颗粒-多肽复合物,另一种包含第二种试剂。在具体实施方案中,抗癌肽可以是一种试剂,抗癌纳米颗粒-多肽复合物可以是另一种试剂。
使用抗癌肽或纳米颗粒-多肽复合物的治疗,可以在其它试剂治疗之前或之后,间隔时间从几分钟至几周。在将其它试剂和抗癌肽或纳米颗粒-多肽复合物分别应用于细胞的实施方案中,通常需要确保,在每次递送的时间之间没有经过显著长的时间段,从而使试剂和抗癌肽或纳米颗粒-多肽复合物仍然能对细胞发挥有利的联合作用。在这样的情况下,预见到可以使细胞在彼此相隔约12-24小时内、更优选彼此相隔约6-12小时内接触两种模态。在有些情况下,可能希望明显延长治疗的时间段,其中在各次给药之间经历几天(例如,2,3,4,5,6或7天)至几周(例如,1,2,3,4,5,6,7或8周)。
可以采用各种不同的组合,其中抗癌肽或纳米颗粒-多肽复合物是“A”,第二种试剂(例如放疗或化疗)是“B”:
A/B/A B/A/B B/B/A A/A/B A/B/B B/A/A A/B/B/B B/A/B/B
B/B/B/A B/B/A/B A/A/B/B A/B/A/B A/B/B/A B/B/A/A
B/A/B/A B/A/A/B A/A/A/B B/A/A/A A/B/A/A A/A/B/A
本发明的治疗性抗癌肽或纳米颗粒-多肽复合物向患者的施用,遵循施用化疗剂的一般方案,并考虑载体的毒性(如果存在)。预期可以根据需要重复治疗周期。还预见到,各种不同的标准治疗以及外科手术干预可以与所述过度增殖细胞治疗组合应用。
a.化疗
癌症治疗也包括许多与基于化学试剂和辐射的治疗的联合治疗。联合化疗剂包括,例如,吉非替尼,顺铂(CDDP),卡铂,丙卡巴肼,氮芥,环磷酰胺,喜树碱,异环磷酰胺,美法仑,苯丁酸氮芥,白消安,硝基脲,放线菌素D,柔红霉素,多柔比星,博来霉素,plicomycin,丝裂霉素,依托泊苷(VP16),他莫昔芬,雷洛昔芬,雌激素受体结合剂,紫杉醇,吉西他滨,诺维本,法呢基-蛋白质转移酶抑制剂,反铂,5-氟尿嘧啶,长春新碱,长春碱,Gleevac(甲磺酸伊马替尼),和甲氨蝶呤,或前述试剂的任意类似物或衍生物变体。在某些实施方案中,本发明可以与吉非替尼联合使用。在其它实施方案中,本发明可以与Gleevac(例如,可以向患者施用约400-约800mg/天的Gleevac)联合实施。在某些实施方案中,可以与本发明联合使用一种或多种化疗剂。
b.放疗
会造成DNA损伤且已经广泛使用的其它因子包括通常已知的γ-射线,X-射线,和/或向肿瘤细胞定向递送放射性同位素。也预见到其它形式的DNA损伤因子,例如微波和紫外辐射。最可能地,所有这些因子会对DNA、DNA前体、DNA的复制和修复、和染色体的装配和维持造成广范围的损伤。X-射线的剂量范围是,从长期(3-4周)的日剂量50-200伦琴,至单次剂量2000-6000伦琴。放射性同位素的剂量范围可以广泛变化,取决于同位素的半衰期、发射的辐射的强度和类型、和肿瘤细胞的摄入。
当应用于细胞时,术语“接触”和“暴露”在本文中用于描述将治疗性组合物和化疗剂或放疗剂递送给靶细胞或置于与靶细胞直接并置的过程。为了实现细胞杀死或停滞,将两种试剂以有效杀死细胞或阻止它分裂的组合量递送给细胞。
c.免疫治疗
免疫治疗剂通常依赖于免疫效应细胞和分子的应用,以靶向和破坏癌细胞。免疫效应物可以是,例如,对肿瘤细胞表面上的一些标志物特异性的抗体。抗体单独可以用作治疗的效应物,或它可以募集其它细胞,以实际上实现细胞杀死。抗体也可以缀合到药物或毒素(化疗剂,放射性核素,篦麻毒素A链,霍乱毒素,百日咳毒素等)上,并仅仅用作靶向试剂。或者,效应物可以是淋巴细胞,其携带与肿瘤细胞靶物直接或间接相互作用的表面分子。各种不同的效应细胞包括细胞毒性T细胞和NK细胞。
免疫治疗因而可以用作联合治疗的一部分,与本发明的肽或纳米颗粒-多肽复合物相联合。在下面讨论了联合治疗的一般方案。通常,肿瘤细胞必须携带一些适合靶向的标志物,即,不存在于大多数其它细胞上的标志物。存在许多肿瘤标志物,它们中的任一种都可适用于本发明上下文中的靶向。常见的肿瘤标志物包括癌胚抗原,前列腺特异性抗原,泌尿肿瘤相关抗原,胎儿抗原,酪氨酸酶(p97),gp68,TAG-72,HMFG,唾液酸Lewis抗原,MucA,MucB,PLAP,雌激素受体,层粘连蛋白受体,erb B和p155。
d.基因治疗
在另一个实施方案中,第二种治疗是基因治疗,其中在治疗性组合物之前、之后或与其同时施用治疗性多核苷酸。用于表达基因产物的病毒载体是本领域众所周知的,包括真核生物表达系统,例如腺病毒,腺伴随病毒,逆转录病毒,疱疹病毒,慢病毒,痘病毒包括痘苗病毒,和乳头瘤病毒包括SV40。或者,通过基于脂质的载体,例如脂质体或DOTAP:胆固醇囊泡,可以实现表达构建体的施用。所有这些方法是本领域众所周知的(参见,例如Sambrook等,1989;Ausubel等,1998;Ausubel,1996)。
编码下述基因产物之一的载体的递送,对靶组织具有联合的抗过度增殖作用。本发明包括许多种蛋白质,下面描述了其中的一些。
i.细胞增殖的抑制剂
如上所述,肿瘤抑制癌基因起抑制过度的细胞增殖的作用。这些基因的失活会破坏它们的抑制活性,导致失调的增殖。
可以用作根据本发明的第二种治疗的基因包括p53,p16,Rb,APC,DCC,NF-1,NF-2,WT-1,MEN-I,MEN-II,zacl,p73,VHL,MMAC1/PTEN,DBCCR-1,FCC,rsk-3,p27,p27/p16融合体,p21/p27融合体,抗血栓基因(例如,COX-1,TFPI),PGS,Dp,E2F,ras,myc,neu,raf,erb,fms,trk,ret,gsp,hst,abl,E1A,p300,参与血管发生的基因(例如,VEGF,FGF,血小板反应蛋白,BAI-1,GDAIF,或它们的受体),MCC和在表IV中列出的其它基因。
ii.程序性细胞死亡的调节剂
细胞凋亡,或程序性细胞死亡,是正常胚胎发育、维持成年组织的体内稳态、和抑制癌发生的基本过程(Kerr等,1972)。已经证实Bcl-2家族的蛋白质和ICE-样蛋白酶是其它系统细胞凋亡的重要调节剂和效应物。伴随滤泡性淋巴瘤发现的Bcl-2蛋白,在控制细胞凋亡和响应于不同细胞凋亡刺激的增强细胞存活中起重要作用(Bakhshi等,1985;Cleary和Sklar,Proc.Nat’1.Acad.Sci.USA,82(21):7439-43,1985;Cleary等,1986;Tsujimoto等,1985;Tsujimoto和Croce,1986)。进化上保守的Bcl-2蛋白现在被公认为是相关蛋白质家族的成员,其可以分成死亡激动剂或死亡拮抗剂。
在它的发现之后,证实了Bcl-2起抑制许多刺激触发的细胞死亡的作用。并且,现在显然存在Bcl-2细胞死亡调节蛋白家族,它们具有共同的结构和序列同源性。已经证实这些不同的家族成员具有与Bcl-2类似的功能(例如,BclXL,BclW,BclS,Mcl-1,A1,Bfl-1),或抵消Bcl-2功能和促进细胞死亡(例如,Bax,Bak,Bik,Bim,Bid,Bad,Harakiri)。
e.手术
约60%的癌症患者会接受某一类型的手术,包括预防性的、诊断性的或分期性的、治疗性的和姑息性的手术。治疗性的手术是可以与其它治疗联合使用的癌症治疗,所述其它治疗例如本发明的治疗,化疗,放疗,激素治疗,基因治疗,免疫治疗和/或可选的治疗。
治疗性的手术包括切除,其中物理地去除、切离和/或破坏癌组织的全部或一部分。肿瘤切除指物理地去除肿瘤的至少一部分。除了肿瘤切除以外,手术治疗包括激光手术,冷冻手术,电外科,和显微控制的手术(莫氏手术)。另外预见到,本发明可以与去除浅表癌、初癌、或附带量的正常组织联合使用。
切除一部分或全部癌性细胞、组织或肿瘤后,可能在体内形成空腔。通过灌注、直接注射或在该区域局部应用附加抗癌治疗,可以实现治疗。可以重复这样的治疗,例如,每1,2,3,4,5,6,或7天,或每1,2,3,4,和5周,或每1,2,3,4,5,6,7,8,9,10,11,或12个月。这些治疗也可以是不同的剂量。
f.其它试剂
预见到,其它试剂可以与本发明联合使用,以提高治疗的疗效。这些其它试剂包括免疫调控剂,影响细胞表面受体和GAP连接的上调的试剂,细胞抑制和分化试剂,细胞粘附的抑制剂,或增加过度增殖细胞对细胞凋亡诱导物的敏感性的试剂。免疫调控剂包括肿瘤坏死因子;干扰素α,β,和γ;IL-2和其它细胞因子;F42K和其它细胞因子类似物;或MIP-1,MIP-1β,MCP-1,RANTES,和其它趋化因子。另外预见到,细胞表面受体或它们的配体(例如Fas/Fas配体,DR4或DR5/TRAIL)的上调,会通过对过度增殖细胞建立自分泌或旁分泌作用,增强本发明诱导细胞凋亡的能力。通过升高GAP连接的数目来增加细胞间信号传递,会增加对邻近过度增殖细胞群体的抗过度增殖作用。在其它实施方案中,细胞生长抑制剂或分化剂可以与本发明联合使用,以提高治疗的抗过度增殖功效。预见到细胞粘附抑制剂会提高本发明的功效。细胞粘附抑制剂的实例是黏着斑激酶(FAK)抑制剂和洛伐他汀。另外预见到,会增加过度增殖细胞对细胞凋亡的敏感性的其它试剂,例如抗体c225,可以与本发明组合使用,以提高治疗功效。
激素治疗也可以与本发明联合使用,或与前述的任意其它癌症治疗组合使用。激素可以用于治疗某些癌症,例如乳腺癌、前列腺癌、卵巢癌或子宫颈癌,以降低某些激素例如睾酮或雌激素的水平或阻断其作用。该治疗经常与至少一种其它癌症治疗组合使用,作为一种治疗选择,或减少转移风险。
* * * * * * * *
包括下面的实施例用于展示本发明的优选实施方案。本领域技术人员应当明白,在下面的实施例中公开的技术代表发明人发现的会较好实现本发明的技术,因而可以视作构成实现它的优选模式。但是,本领域技术人员参考本说明书的公开内容后应当明白,可以对公开的具体实施方案作出许多改变,且仍然获得相似或类似的结果,而不背离本发明的精神和范围。
实施例
实施例1
FUS1是在人染色体3p21.3区中鉴别出的新肿瘤抑制基因(TSG),它在许多人癌症中经常改变或缺失,且已经证实起Apaf1-相关细胞凋亡途径的关键介质的功能,是有效的体外和体内肿瘤抑制剂。已经在大多数NSCLC和几乎所有SCLC中,发现了FUS1蛋白质的表达丧失和翻译后修饰缺陷。在体外和体内,腺病毒载体-或DOTAP:胆固醇纳米颗粒-介导的基因转移对3p21.3-缺陷型人肺癌细胞中wt-FUS1功能的恢复,通过诱导细胞凋亡和细胞动力学的改变,抑制这些肿瘤细胞的生长。在本研究中,发明人使用计算机辅助的Fus1蛋白质结构分析,发现了Fus1蛋白质序列中的几个潜在的PKC激活/相互作用位点和A激酶锚定蛋白(AKAP)-相互作用基序。基于这些功能域预测,发明人已经开发了一组直接衍生自wt-Fus1蛋白质序列的肽,包括含有wt-Fus1氨基酸序列(wt-FP)或功能突变(mt-FP)的肽。wt-FP源自在有些肺癌细胞系中检测到的突变型Fus1蛋白质之一中缺失的区域,且含有潜在AKAP信号传递/相互作用序列基序研究。功能障碍的mt-FP(其中几个高度疏水的氨基酸残基被替换为亲水残基,以改变生物功能上关键的疏水微环境)被设计用作wt-FP活性的对照。将18-C硬脂酸饱和脂肪酸链添加到每个肽的N-末端,使它可透过细胞,且也维持存在于正常细胞中的原始肉豆蔻酰化wt-FUS1蛋白质的功能完整性。
发明人评价了wt-FP的体外生物功能,发现硬脂酸-wt-FP(st-wt-FP)起有效蛋白酪氨酸激酶(PTK)抑制剂的功能,并表现出对NSCLC和SCLC细胞中的几种关键致癌PTK(例如EGFR,PDGFR,c-Kit,c-Abl,Erk)活性的抑制作用。也在用st-wt-FP处理的多种不同肺癌细胞中,观察到肿瘤细胞生长的显著抑制和细胞凋亡的诱导(与相同浓度的对照肽处理的细胞相比),IC50值范围是5-20μM。发明人研究使用wt-FP作为调控剂,以增强PTK抑制剂(例如吉非替尼和Gleevec)的化疗效力,以分别克服吉非替尼和Gleevec-敏感的和抗性的NSCLC和SCLC细胞的化疗抗性。发明人发现,wt-FUS1处理可以显著敏化对吉非替尼或Gleevec治疗的反应。在用wt-FP处理过的SCLC细胞中,观察到显著的生长抑制和细胞凋亡。在用wt-FP和gleevec的组合处理过的gleevec-抗性的H69R和N417细胞中,检测到与单独任一种试剂处理的细胞相比增强的生长抑制。在用单独wt-FP或wt-FP与gleevec的组合处理过的SCLC细胞中,也显著抑制了磷酸化的c-Abl和c-Kit蛋白质的活性,如使用免疫沉淀的磷酸-c-Abl或磷酸-c-Kit蛋白质的免疫印迹分析和活性测定所证实的。
发明人还开发了制备FP-纳米颗粒的方法和规程,其中使FP和其它非特异性对照肽(NSP)与用于体外和体内递送治疗肽的DOTAP或DOTAP:胆固醇纳米颗粒相复合。与用未复合的肽处理的细胞相比,在用FP-纳米颗粒处理过的细胞中,肽的细胞摄入显著增加,如通过使用荧光-标记的肽的荧光成像分析所证实的。与未处理的或用未复合的wt-FP、NSP或NSP-纳米颗粒对照处理过的细胞相比,在用wt-FP-纳米颗粒处理过的NSCLC细胞中,也观察到细胞凋亡的显著诱导。
结果证实了FP-纳米颗粒对NSCL和SCLC的体外和体内治疗功效,并暗示使用全身施用单独的FP-纳米颗粒或FP-纳米颗粒与其它化疗剂的组合来有效治疗肺癌和其它人癌症的平移应用。
结果
1.FUS1肽的设计和合成
计算机辅助的Fus1蛋白质结构分析揭示了Fus1蛋白质序列中的几个潜在的PKC激活/相互作用位点和A激酶锚定蛋白(AKAP)-相互作用基序,如图1所示。使用Scansite程序(Obenauer等,2003)和其它可以从(scansite.mit.edu)和ExPASy蛋白质组学服务器(us.expasy.org)得到的序列分析程序进行分析。基于这些功能域预测,发明人制备了一组直接衍生自wt-Fus1蛋白质序列的肽,包括含有wt-Fus1氨基酸序列(wt-FP)或功能突变(mt-FP)的肽。将18-C硬脂酸饱和脂肪酸链添加到每个肽的N-末端,使它是细胞透性的,也维持存在于正常细胞中的原始肉豆蔻酰(一种14-C饱和脂肪酸)化的wt-FUS1蛋白质的功能完整性。硬脂酸侧链也是它抑制酪氨酸激酶活性的生物活性所必需的,如同肉豆蔻酸对于wt-FUS1肿瘤抑制活性。
在得克萨斯大学M.D.Anderson癌症中心由Peptide SynthesisCore使用CLEAR树脂作为支持物,使用HBTU-HOBT作为偶联试剂,在Rainin Symphony Quartet自动肽合成仪上合成了FUS1肽(“FP”)。每个偶联步骤进行3小时,用5-倍过量的试剂重复2次。使用CF3CO2H-苯甲醚和水混合物(95%-2.5%-2.5%),进行切割3小时。使用在水中的0-70%乙腈的线性梯度(经40分钟),通过RP-HPLC纯化粗肽。每种溶剂含有0.1%三氟乙酸。
用5-倍过量的试剂,使用与氨基酸偶联相同的方法,进行与硬脂酸的缀合。使用摇床来更好地混合试剂。切割条件与FP的条件相同。使用Vydac半制备二苯基柱(RP 219TP510),通过RP-HPLC纯化粗硬脂酸-FP。
发明人已经发现,wt-FP源自在有些肺癌细胞系中检测到的突变型Fus1蛋白质之一中缺失的区域,且含有潜在蛋白激酶(PKA,PKC,和蛋白酪氨酸激酶)信号传递/相互作用序列基序。功能障碍的mt-FP(其中几个高度疏水的氨基酸残基被替换为亲水残基,以改变生物功能上关键的疏水微环境)被设计用作wt-FP活性的对照(图2),但是,这些肽的极性几乎未变,这可以确保在生理条件下类似的溶解度和可达性(图3)。将18-C硬脂酸饱和脂肪酸链添加到每个肽的N-末端,使它是细胞透性的,且也维持存在于正常细胞中的原始肉豆蔻酰(一种14-C饱和脂肪酸)化的wt-FUS1蛋白质的功能完整性(图1)。也合成了对蛋白激酶活性不表现出影响的非特异性对照肽(NSP),并用作对照(图1,AKAP-NSP)。要合成肉豆蔻酸-肽,用于与硬脂酸-肽对比。
2.DOTAP:Chol-复合的FUS1肽纳米颗粒的合成和制备
如所述(Templeton,1997)合成了DOTAP:胆固醇(“DC”)纳米颗粒(大小为50-100nm)。简而言之,以1:1比例(20μM DOTAP和20μM胆固醇)在氯仿中混合DOTAP和胆固醇,并在冰冷的旋转式蒸发器中蒸发。将得到的混合物重新悬浮于5%葡萄糖,在55℃脉冲超声处理,并低压冻干。将低压冻干的产品溶于5%葡萄糖,通过递减大小(1.0,0.45,0.2,和0.1μm)的小型挤压机(Avanti Lipids,A1)进行挤压,产生50-100nm的平均粒径。类似地还制备不含胆固醇的DOTAP,用作体外转染试剂,因为众所周知DC介导的转染在体外是无效的,且DOTAP最适合体外转染。在4℃保存合成的纳米颗粒,并用于制备DNA-纳米复合物。
DC-DNA纳米颗粒:为了制备含有表达基因的质粒DNA的纳米复合物,将150μg质粒DNA与20mM DOTAP:Chol纳米颗粒以300μ1体积相混合,产生150g DNA和4mM纳米颗粒的终浓度。DNA-纳米复合物的平均粒度范围是300-325nm,如使用N4粒度分析仪(Coulter,Miami,FL)所测定的,并带+45mV正电荷。
DC-肽纳米颗粒:为了制备肽-纳米颗粒,将20μg肽稀释于100μl D5W中,与等体积的稀释的DOTAP:胆固醇(DC)或DOTAP(D)(在D5W中将40μl 20mM DC或D稀释至总体积100μl)轻轻混合,这会产生100mg/ml肽和4mM DC或D的终浓度。用不同比例的肽/DC或D,优化配方。在图4和5中解释了肽-纳米颗粒的结构。得到的肽-纳米颗粒具有100-200nm的平均大小和+50mV的正电荷,分别通过N4Plus Submicron Particle Sizer(N4颗粒大小分析仪)和Delsa 440SXZeta Potential Analyzer(Beckman Coulter,Inc.,Fullerton,CA,USA)测得。
用荧光染料标记肽:根据生产商的说明书,使用蛋白质-荧光标记试剂盒(Molecular Probe,Eugene,OR),用Alex Fluor 555(Cy3-NHS酯,橙红)荧光染料来标记肽。使用Cy3-标记的肽,通过体外和体内荧光成像分析,来监测细胞摄入和肽-纳米颗粒的生物分布。简而言之,将约500mg肽溶于100ml 0.1M碳酸氢钠(pH 8.3)缓冲液(终浓度为5mg肽/ml)。将Cy3-琥珀酰亚胺酯(Cy3-NHS)溶于DMSO,终浓度为10mg/ml。混合100ml肽溶液和10ml Cy3-NHS溶液,在旋转下在室温温育混合物1小时(或在4℃过夜)。通过在Sephadex G-25柱上运行,纯化缀合产物,通过测量280nm OD和555nm OD,测定标记的效率,并使用生产商所述的方程进行计算。
肽与超顺磁性氧化铁(SPIO)纳米颗粒的缀合:发明人也使用NHS酯-胺反应,将肽直接与葡聚糖-包被的SPIO纳米颗粒(SP)缀合,然后用DC包封SP-纳米颗粒。
FP-腙衍生物的合成:根据公开的方法,用1-乙基-3-(3-二甲氨基丙基)碳化二亚胺(EDC)盐酸盐(σ,St.Louis,MO)激活FP的C-末端羧基,然后与3-(2-吡啶基联硫基)丙酸酰肼(PPA)(ProChem,Inc.,Rockford,IL)反应历经3天,以得到>90%FP-腙衍生物产物产率。通过HPLC追踪反应进展,使用Zorbax Rx C18柱(25cm×4.6mm),pH4.7的CH3OH-H2O(7:3)中10mM(NH4)(H2PO4)的等度梯度,流速为1ml/min。通过UV(280nm)检测FP-腙,游离FP和酰肼。Aldrich.
FP和SPIO的缀合:通过使用异双功能连接物的2步方法,将FP缀合到SPIO上。首先,通过与表氯醇交联,可衍生葡聚糖-包被的SPIO颗粒Feridex I.V.或Combidex(Advanced Magnetics Inc.,Cambridge,MA)或Endorem(Guerbet,Aulnaysous-Bois,France),然后与氨反应,以在葡聚糖包衣上产生氨基,然后用SMCC修饰,以提供马来酰亚胺部分(SPIO-SMCC)。其次,通过SPIO-SMCC中的马来酰亚胺基团与在TCEP还原二硫键之后得到的FP衍生物的巯基的反应,将FP衍生物缀合到SPIO-SMCC上。通过紫外-可见光分光光度法,测定所得到的FP-SPIO缀合的比例,并通过G-25凝胶过滤柱的大小排阻色谱进一步纯化。浓缩纯化的缀合物,在-20℃保藏备用。使用类似的化学,将药物衍生物缀合到SPIO。关于SPIO的荧光标记,用DTPA异硫氰酸酯螯合剂(I-24221,Molecular Probes)偶联上述SPIO葡聚糖衍生物的伯胺,以导入对许多金属离子的高亲和力结合位点,然后用Fluo-3钾(橙红)(F-3715,Molecular Probes)标记。通过共焦荧光成像或FACS分析,可以使用荧光标记的FP-SPIO纳米颗粒来体外和体内监测细胞摄入、细胞内运输和生物分布。
在体内将DC-SP-纳米颗粒(DC-SPN)用于全身递送治疗肽,并用于使用SPIO作为MR造影剂通过MR进行非侵入成像(图5)。
3.NSCLC和SCLC细胞中Fus1-衍生的肽和Gleevec对肿瘤细胞生长的抑制
细胞系。发明人具有对多种不同化疗药物(例如CDDP,紫杉醇,吉西他滨,吉非替尼,Gleevec,和其它PTK抑制剂)具有不同敏感性的NSCLN和SCLC细胞系的收藏。这些细胞系在临床上具有天然的药物敏感或抗性的特性,或通过从敏感的亲代系针对特定药物选择来建立。已经测定了这些细胞系中的特征如每种药物的IC50值,关键TSG例如3p21.3基因和p53)和致癌PTK(例如EGFR)的遗传和表达状态以及体内(在小鼠中)致肿瘤性。为了评价FUS1或FP与PTK抑制剂(包括吉非替尼(AstraZeneca),用于阻断EGFR;和LY294002(ComChem),用于抑制PI3K/Akt)对肿瘤细胞生长和细胞凋亡的联合作用,体外使用了4种人吉非替尼-抗性的NSCLC细胞系H1299,H460,H358,和A549,和2种吉非替尼-敏感的NSCLC系HCC827(具有EGFR功能突变的增益)和H1817(具有EGFR的激活扩增)。人SCLC细胞系gleevec-敏感的H69和H128,和gleevec-抗性的H69R和N417,用于评价Fus1肽、FP-纳米颗粒单独或与gleevec和其它小分子化疗药物组合的处理。
wt-FP处理对肿瘤细胞生长的抑制。为了评价wt-FP的生物活性,发明人通过XTT测定,通过直接应用硬脂酸-wt-FP,分析了wt-FP对肿瘤细胞生长的影响。发明人发现,与用功能突变型Fus1肽mt-FP2和mt-FP5、和非特异性对照肽(NSP)处理的细胞相比(图6),wt-FP表现出对NSCLC H1299和A549细胞生长的显著抑制作用(图6)。发明人也测定了st-wt-FP在NSCLC H1299(IC50=12.7μM)和A549(IC50=6.9μM)细胞以及可在没有添加生长因子下生长的正常支气管上皮CCD16(IC50=60μM)细胞中的IC50值(图7)。以对所有其它NSCLC细胞的IC80剂量,用st-wt-FP处理的正常细胞中没有观察到显著的细胞毒性,暗示着治疗性FP的肿瘤细胞选择性。类似地,也已经在wt-FP-处理的SCLC H128(图8A和C)和H146细胞(图8B和D)中,观察到与mt-FP-处理的或未处理的细胞对照相比,对肿瘤细胞生长的显著抑制(图8A和B)和细胞凋亡的增强诱导(图8C和D)。这些初步结果证实了使用wt-FP作为肺癌抗肿瘤治疗剂的潜力。
wt-FP与小分子药物PTK抑制剂的联合处理对肿瘤细胞生长的增强的抑制作用。使用我们实验室开发的等效线图解建模和统计方法,在体外定量和统计学地分析了FUS1-纳米颗粒或Fus1-肽加上PTK抑制剂的不同组合的联合作用。Fus1和PTK抑制剂之间的相互作用可以表征为协同作用、累加作用和拮抗作用。可以用假定最大转染效率的固定剂量的hTMC-FUS1-纳米颗粒转染细胞,或用不同浓度的FP处理,并与不同剂量的PTK抑制剂相组合。在预定的时间点,通过XTT测定来测量对细胞生长的影响。通过在对应等效线图上绘制观察到的实验数据,定量和统计地分析组合治疗剂对肿瘤细胞生长的影响。进行Wilcoxon氏符号秩检验,以对比观察数据的平均值与累加性预测的最小或最大值。如果观察数据的平均值等于或小于预测最大值,但是等于或大于预测最小值,认为组合效应是累加的。如果观察数据的平均值小于预测最小值,认为组合效应是协同的;如果大于预测最大值,是拮抗的,认为P≤0.05是显著的。使用Statistica软件(StatSoftInc.,Tulsa,Oklahoma),进行所有统计分析。来自这些体外实验的发现,会为我们提供FUS1和PTK抑制剂联合治疗实现的协同作用的经统计学检验的定量验证,并用作引导我们临床前和临床试验中联合治疗设计的数据库。
为了探查wt-FUS1基因产物或衍生的FUS1肽作为增强肺癌细胞中的化疗效力和克服药物抗性的化疗药物调控剂的能力,发明人评价了wt-FP+吉非替尼联合处理对吉非替尼-敏感的和抗性的NSCLC细胞的肿瘤细胞生长的影响。发明人发现,重新激活3p-缺陷的和吉非替尼-抗性的NSCLC H1299,H358,和H460细胞中的wt-FP,会显著敏化这些细胞对吉非替尼治疗的应答,如通过对肿瘤细胞生长的超过累加抑制作用所证实的(图9A)。在wt-FP和吉非替尼共同处理的H322和H460细胞中,也检测到对EGFR表达的显著抑制,如蛋白质印迹分析所证实的(图9B)。这些初步结果表明,wt-FP可能在调控肿瘤细胞对化疗剂(例如DNA损伤试剂顺铂和PTK EGFR抑制剂吉非替尼)的敏感性中起关键作用,且FUS1-纳米颗粒-介导的分子治疗与这些小分子化疗剂的联合治疗可以是对肺癌的有效治疗策略。
此外,发明人也检测了与任一种单独处理或与非特异性肽(NSP)或mt-FP对照的组合(图10)相比,SCLC Gleevec-敏感的H69-S(图10)和Gleevec-抗性的H69-R(图10)细胞分别对与wt-FP共同处理48h和96h的Gleevec的增强的敏感性。这些初步发现表明,Fus1肿瘤抑制蛋白的活性之一可能是干扰PTK功能。PTK抑制剂Gleveec+FUS1-纳米颗粒或Fus1-衍生的肽的联合治疗,可以是在肺癌中增强Gleveec的抗癌功效和克服Gleveec-抗性的有用策略。
4.NSCLC和SCLC细胞中Fus1-肽对PTK活性的抑制
蛋白酪氨酸激酶(PTK)在控制细胞增殖、分化、代谢和细胞凋亡的信号转导途径中起关键作用。PTK对蛋白质的磷酸化,是调节这些生物机制所必需的,这些途径中的缺陷可能导致许多人疾病,包括癌症。这些酶在细胞调节中的重要方面,得到了下述事实的证实,即对于许多激酶而言,已经鉴别出了对应的病毒癌基因产物。蛋白酪氨酸激酶活性经常与膜受体蛋白酪氨酸激酶(例如EGF-,PDGF-,CFS-,IGF-1和胰岛素受体)和可溶性非-受体酪氨酸激酶(例如p60c-Src,yes,lck,lyn,fyn)相关。测定PTK活性,允许表征蛋白酪氨酸激酶,阐明它们的生物功能以及辅助开发特定PTK抑制剂。
发明人根据生产商的说明书,使用酪氨酸激酶活性测定试剂盒(CHEMICON,Temecula,CA),分析了FP-处理过的NSCLC H1299和A549细胞中的c-Abl酪氨酸激酶活性。简而言之,用5μM的wt-FP或mut-FP处理1 x 107NSCLC H1299或A549细胞6小时,或用10μgwt-FUS1表达质粒DNA-DOTAP纳米颗粒转染24小时。在含有50mMTris-HCl(pH 8.0),150mM氯化钠,1%(w/v)去氧胆酸钠,1mM DTT,1%(v/v)NP-40,0.1%(w/v)SDS,和完全蛋白酶抑制剂(Roche)的RIPA缓冲液中,制备细胞裂解物。使用1mg蛋白质裂解物,进行小鼠抗-c-Abl抗体(BD Bioscience Pharmingen,San Diego,CA)蛋白质的免疫沉淀(IP)。将免疫沉淀的复合物重新悬浮于50μl PTK测定缓冲液中,后者含有5mM ATP,在TBS(25mM Tris,0.15M NaCl)pH 7.2中的50mM MgCl2,1mM DTT,0.01%硫柳汞,和完全蛋白酶抑制剂。然后,将c-Abl IP复合物与含有多个酪氨酸残基的合成的生物素化底物聚[Glu:Tyr,4:1]一起温育,且可以用广范围的PTK在30℃磷酸化45min。通过加入500mM EDTA,终止反应。通过结合链霉抗生物素-包被的平板,固定化磷酸化的和去磷酸化的底物。使用缀合到HRP上的磷酸酪氨酸单克隆抗体和随后的发色底物反应,观察磷酸化底物的级分。使用磷酸肽标准曲线,确定掺入酪氨酸激酶底物中的磷酸的量。在A549细胞中检测到c-Abl活性的显著抑制,该细胞通过wt-FP处理或wt-FUS1-纳米颗粒转染,表现出与那些未处理的对照或用mut-FP或Gleevec处理过的细胞(图11)相比,激活的(磷酸化的)c-Abl蛋白的高水平表达(数据未显示)。通过在H1299中用wt-FP处理,也抑制了c-Abl蛋白的活性,它具有比A549细胞低水平的c-Abl蛋白表达。
类似地,发明人也观察到,wt-FP肽和wt-Fus1蛋白质的外源表达2种处理,都强烈抑制c-abl酪氨酸激酶活性,如在SCLC N417中使用单克隆抗-磷酸-abl(Tyr-323-p)抗体通过最佳酪氨酸激酶肽底物的酪氨酸磷酸化所测得的(图12)。另外,在用wt-FP单独或与Gleevec的组合(wt-FP+G)处理48h的SCLC N417和H69细胞中,也检测到了wt-FP对几种PTK(包括c-abl和c-Kit)的活性的抑制作用,如使用抗-c-abl或抗-c-Kit抗体的免疫沉淀(IP)和使用抗-磷酸-Tyr(pY20)抗体的免疫印迹(IB)进行分析所证实的。
此外,在吉非替尼-敏感的NCC827和H1819细胞中,也在用FUS1-纳米颗粒或wt-FP单独或与吉非替尼组合处理过的细胞中检测到了磷酸化的EGFR,ERK和Akt蛋白质的显著抑制,如通过磷酸-EGFR、ERK或Akt-特异性抗体的蛋白质印迹分析所证实的。但是,在总PTK蛋白质水平没有检测到影响,表明FP会特异性地抑制激活的致癌TPK,并导致对由于EGFR的突变或异常扩增而具有高度激活的PTK活性的这些细胞中肿瘤细胞增殖和细胞凋亡的抑制。
5.肽-纳米颗粒在体外的增强的细胞摄入
发明人通过荧光成像分析,使用Cy3-fluor标记的肽,在NSCLCh1299细胞中对比了未复合的肽与肽-纳米颗粒的细胞摄入。在st-P-处理过的细胞中,观察到了弱的细胞摄入(微弱荧光),但是在非-硬脂酸肽-处理的细胞中没有观察到。在肽-和硬脂酸-肽(st-p)-纳米颗粒处理过的细胞中,观察到与相同浓度的未复合的肽处理过的细胞相比显著增强的细胞摄入,指示着肽-纳米颗粒介导的细胞摄入的高效率。
6.H1299细胞中FP-纳米颗粒处理对肿瘤细胞生长的抑制
发明人使用Fus1肽(FP)-纳米颗粒,来评价它对NSCLC H1299细胞中肿瘤细胞生长的影响。与用对照品处理过的那些细胞相比,在FP-纳米颗粒-处理过的细胞中观察到肿瘤细胞生长的显著抑制。与以更低剂量的肽(以IC20水平的FP)用FP处理的细胞相比,在FP-纳米颗粒-处理过的细胞中,也检测到对肿瘤细胞生长的显著增强的抑制。
7.FP-纳米颗粒体外处理对细胞凋亡的诱导
发明人使用原位细胞凋亡分析与TUNEL反应,通过荧光成像和FACS分析,评价了H1299细胞中单独FP或FP-纳米颗粒处理对细胞凋亡的诱导。与用非特异性的和mt-FP-纳米颗粒对照处理过的细胞相比,在用FP-纳米颗粒处理过的细胞中检测到细胞凋亡的显著诱导(图14)。通过使用原位TUNEL染色的荧光成像分析(2μM肽,72小时),观察到FP-纳米颗粒-处理过的H1299细胞中细胞凋亡的诱导。这些结果清楚地证实了FP-纳米颗粒的体外生物有效性。在携带人肿瘤的小鼠中,通过全身给药,评价FP-纳米颗粒的细胞摄入和治疗功效的实验正在进行。
8.治疗性基因和肽在DC-纳米颗粒中的包囊
发明人在DC或D纳米颗粒中包囊了治疗或报告基因表达质粒DNA和肽,以研究使用单一纳米颗粒递送多种治疗剂的可能性和潜力。发明人包囊了表达GFP的pDNA和Cy3-标记的FP肽,称作GFP-FP-纳米颗粒。在相同细胞中,可以同时检测到GFP表达(绿色荧光)和肽摄入(橙红),表明单一纳米颗粒有效递送了DNA和肽。在2小时和24小时,测量了H1299细胞中GFP DNA/NSP肽-纳米颗粒的细胞摄入(NSP终浓度=4μM)。
实施例2
FUS1是肺癌中涉及的肿瘤抑制基因。发明人已经发现,Fus1肽在体外抑制c-Abl酪氨酸激酶。有兴趣的是,抑制序列源自在有些肺癌细胞系中检测到的突变型Fus1蛋白质之一中缺失的区域。重要的是,硬脂酸修饰形式的该肽是抑制所需的。该硬脂酸-fus1肽也抑制由激活的c-Abl蛋白质致癌转化的成纤维细胞中的集落形成。这些发现表明,Fus1肿瘤抑制蛋白的活性之一是干扰c-Abl酪氨酸激酶功能。
在小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)中染色体臂3p上的一个等位基因的频繁缺失,提供了在该染色体区域存在肿瘤抑制基因(TSG)的有力证据。这些候选TSG之一(FUS1)没有表现出与任何已知基因的同源性。发现它在肺癌中仅具有极少突变,且通常在肺癌中在mRNA水平表达。几种NSCLC具有相同的无义突变,其源自异常mRNA剪接。该异常形式缺少在FUS1的C-末端或附近的序列,产生与野生型蛋白质的110个氨基酸相比82个氨基酸的截短预测蛋白质(Kondo等,2001)。
c-Abl酪氨酸激酶在所有组织中普遍表达。当它融合逆转录病毒Gag序列和Bcr序列时,它会变成致癌蛋白(Ben-Neriah等,1986)。c-ABL基因编码酪氨酸激酶。通过称作Abelson白血病病毒的复制缺陷型小鼠逆转录病毒,获取c-ABL基因的一部分。正常c-Abl的酪氨酸激酶活性受到高度调节,抑制剂存在于核(Wang,2000)和胞质(Butturini等,1996)中。c-Abl蛋白质存在于核和胞质中。核c-Abl功能包含对DNA损伤的应答(Wang,2000)。c-Abl的胞质功能包含细胞迁移和细胞粘附功能。重要的是,胞质c-Abl蛋白质的激活会导致致癌活性。例如,Gag-Abl蛋白质是一种参与在感染了Abelson白血病病毒的小鼠中引起白血病的有力癌蛋白。另外,Bcr-Abl癌蛋白是几种人白血病的成因因子。Gag-Abl和Bcr-Abl都具有高水平的酪氨酸激酶活性(Kloetzer等,1985)。
但是,c-ABL基因尚未涉入其它类型的癌症中。当然,c-Crk(c-Abl的主要底物)的过表达,已经与肺腺癌中的侵袭表型相关联(Miller等,2003)。在另一个研究中,c-Crk-11的免疫组织化学分析表明,肺和结肠癌中c-Crk-11的水平显著升高(Nishihara等,2002)。考虑到我们的下述发现,即Fus1肿瘤抑制蛋白可下调c-Abl,这些发现是令人感兴趣的。总之,这些观察表明,c-Abl途径可能在某些肺癌中激活。
方法和结果
Fus1肽会抑制c-Abl酪氨酸激酶。发明人使用Fus1肽,并在几个测定中观察到,它会强烈抑制Abl酪氨酸激酶,如最适底物的酪氨酸磷酸化所测得的。深度分析表明,Fus1肽会以剂量-依赖性的方式抑制c-Abl。观察到了Fus-1肽抑制商品化的Abl对Crk的磷酸化;对照组包括肽,DMSO,和(DMSO+硬脂酸)。估计IC50是30uM。该肽具有序列—硬脂酸-KLRRVHKNLIPQGIVKLDHR(SEQ ID NO:11)。发明人发现,硬脂酸部分是抑制所需的,但是硬脂酸本身不具有抑制作用。无硬脂酸的FUS1肽不会抑制商品化的Abl对Gst-Crk的磷酸化。
Fus1肽会抑制c-Abl转化的Rat-1细胞中的集落形成。发明人使用用激活的c-Abl酪氨酸激酶转化的Rat-1细胞,测试了该Fus1肽对集落形成的影响。发明人发现,硬脂酸-Fus-1肽会阻断集落形成。硬脂酸没有作用。令人感兴趣地,FUS1肽没有抑制ABL转化的细胞的增殖,仅仅抑制了导致集落形成的致癌活性。
c-Abl在人肺癌细胞系中被激活的证据。发明人分析了在FUS1基因中具有改变的2个肺癌细胞系,并分析了它们中激活的c-Abl的证据。在这些实验中,发明人使用检测人Abl的单克隆抗-Abl抗体(p6D)进行了免疫沉淀。针对包含氨基酸52-64的人Abl肽,制备了该单克隆抗体(Sun等,2001)。用抗-磷酸酪氨酸,抗-Abl(8E9)和p6D抗体,印迹免疫复合物。32D P210用作阳性对照,CCD16正常肺成纤维细胞用作阴性对照。NSCLC细胞H1299和A549表现出有活性的c-Abl。结果表明,A549细胞系包含激活的Abl-相关蛋白质,大小为约110kDa。通过使用2种不同的序列特异性的ABL抗体抗-Abl 8E9(对SH2结构域特异性的)和p6D抗-Abl单克隆抗体的印迹,对其进行检测。有趣的是,该Abl-相关蛋白质的大小小于真正的c-Abl蛋白(145kDa)。重要的是,用抗-磷酸酪氨酸检测了该Abl-相关蛋白质,表明它可有激酶活性。含有靠近氨基末端的序列(由p6D抗体识别)的缩短形式的c-Abl的存在,暗示着它可能在C-末端被截短。这可能是重要的,因为完整的c-Abl通过C-末端序列与肌动蛋白质丝相结合(Woodring等,2003)。另外,肌动蛋白质丝结合的c-Abl具有减少的酪氨酸激酶活性(Woodring等,J2003),表明肌动蛋白质丝结合会抑制c-Abl酪氨酸激酶。因此,c-Abl的C-末端的去除,可能是激活c-Abl的一种方式。
图27,图16,图17,图18和图19显示了其它实验的结果。
在证实硬脂酸化的Fus1肽KLRRVHKNLIPQGIVKLDHR(SEQ IDNO:11)对商品化的c-Abl酪氨酸激酶的抑制的其它实验中,将硬脂酸化的Fus1肽与仅含有SH2和SH1结构域的截短的商品化的(NewEngland Bio-Labs)cAbl酪氨酸激酶(45kD)、GST-CRK(Abl优选的底物)和32P-ATP合并。在30℃温育30min后,用2 x SDS样品缓冲液煮沸样品,上8% SDS PAGE凝胶。将凝胶干燥,暴露于磷酸成像仪。泳道1是无肽对照,泳道2-5分别是10,20,30,和40μM的肽。图20证实,该肽会抑制对GST-CRK的c-Abl酪氨酸磷酸化。也观察到了肽对c-Abl酪氨酸激酶的浓度依赖性的抑制。评价了无肽对照,DMSO对照,DMSO+硬脂酸对照,和20,25,30,35,40,45,50和55μM的肽。图21显示了肽对c-Abl酪氨酸激酶的线性抑制。该曲线代表着GST-CRK磷酸化的抑制。图22显示,DMSO和硬脂酸不会影响c-Abl酪氨酸激酶活性。
在其它实验中,证实了人肺癌细胞系含有Abl相关的酪氨酸磷酸化的蛋白质。在去污缓冲液中裂解Rat-1,Rat1 SH2(激活的Abl酪氨酸激酶),H1299(p53阴性)和A549(p53阳性)人肺癌细胞系。使用抗-Abl P6D单克隆抗体来免疫沉淀Abl蛋白质。使用蛋白A琼脂糖珠子断开免疫复合物。从珠子洗脱蛋白质,然后上SDS PAGE凝胶。印迹和封闭后,用抗-Abl 8E0(抗-Abl SH2域)抗体处理膜。使用8E9抗体、4G10抗体和P6D抗体,在A549细胞中观察到有活性的Abl。使用抗-磷酸酪氨酸抗体(4G10)进行免疫印迹。剥离膜上的8E9抗体,并用P6D抗-Abl抗体重新探测。
在其它实验中,研究了Fus1肽对c-Abl诱导的集落形成的影响。在细胞变成汇合后,用硬脂酸化的Fus1肽处理Rat-1 SH2细胞(10μMFus1肽,每2天更换培养基,直到观察到集落)。Rat-1 SH2细胞会表达GFP作为标志物。为经肽处理的发出绿色荧光的Rat-1 SH2细胞拍摄荧光照片。制备该视野的相差照片。也制备了未处理的Rat-2 SH2细胞的荧光照片,并制备相差照片。对(Rat-1 SH2+M74)和(Rat-1 SH2+硬脂酸)成像。DMSO(0.2%)和硬脂酸(30μM)对集落形成没有影响。
实施例3
FUS1-纳米颗粒和吉非替尼的联合处理对EGFR酪氨酸激酶活性和NSCLC细胞生长的协同抑制
设计成通过基因转移来恢复缺陷基因和基因产物在肿瘤抑制和细胞凋亡途径中的功能、并通过“智能药物”例如蛋白酪氨酸激酶抑制剂(PTKI)靶向关键信号传递途径中特异性的且经常发生的分子改变的新癌症治疗,会在根本上改变癌症治疗,并具有治疗肺癌的希望。FUS1是在人染色体3p21.3区中鉴别出的新肿瘤抑制基因(TSG),它在许多人癌症中经常改变或缺失,且已经证实起Apaf1-相关细胞凋亡途径中的关键介质的功能,是有效的体外和体内肿瘤抑制剂。考虑到我们最近的发现,即FUS1-介导的PTK抑制和FUS1与PTK和Apaf1蛋白质的直接相互作用,以及其它研究人员现在的发现,即在NSCL患者的吉非替尼-应答者中EGFR基因的激活突变,和这些突变在选择性激活细胞存活信号传递和阻断促细胞凋亡途径中的作用,在本研究中,发明人通过在吉非替尼-敏感的和抗性的NSCLC细胞中同时灭活细胞存活和增殖信号传递和激活促凋亡途径,探查了使用多功能FUS1作为增强吉非替尼的化疗效力和克服吉非替尼-抗性的调控剂的能力。发明人发现,在3p-缺陷的和吉非替尼-抗性的NSCLC H1299,H358,和H460细胞中,FUS1-纳米颗粒-介导的基因转移或wt-FUS1-衍生肽(wt-FP)的处理对wt-FUS1的重新激活,会显著敏化这些细胞对吉非替尼处理的应答,如对肿瘤细胞生长的超过累加抑制作用和对细胞凋亡的协同诱导所证实的。在用FUS1-纳米颗粒和非常低剂量的吉非替尼(在IC10的水平)共同处理过的吉非替尼-敏感的HCC827(具有EGFR的激活突变)和H1819(具有EGFR的扩增)细胞中,也观察到增强的生长抑制。在用FUS1-纳米颗粒或wt-FP单独或与吉非替尼组合处理过的细胞中,也检测到对磷酸化的EGFR和Erk蛋白质活性的显著抑制,如通过磷酸-EGFR或Erk-特异性抗体的蛋白质印迹分析所证实的。我们的结果表明,wt-Fus1可能在调控肿瘤细胞对化疗剂(例如PTKI)的敏感性中起关键作用,且FUS1-纳米颗粒-介导的分子治疗与这些小分子化疗剂的联合治疗可能是对肺癌的有效治疗策略。
实施例4
在体外和体内FUS1-纳米颗粒和Gleevec的联合处理对c-Abl和c-Kit活性的灭活和对SCLC细胞生长的抑制
FUS1是在关键人染色体3p21.3区中鉴别出的新肿瘤抑制基因,它在超过95%的SCLC细胞中具有LOH,或在有些SCLC中纯合地缺失。在测试的所有SCLC细胞中,FUS1蛋白质的表达是缺失的,并且FUS1-缺陷型肺癌细胞中wt-FUS1的重新激活会通过诱导细胞凋亡抑制它们的生长。另一方面,蛋白酪氨酸激酶(PTK)例如BCR-Abl,c-Kit和PDGFR在SCLC中经常改变和扩增,是重要的治疗靶物。已经证实小分子药物gleevec会通过靶向c-Kit/SCF途径,体外抑制SCLC细胞生长,但是在动物模型或人临床试验中没有表现出显著的治疗功效。发明人假设,DOTAP:Chol-复合的FUS1-纳米颗粒和gleevec的联合治疗策略,可能通过同时灭活致癌PTK信号传递和激活促细胞凋亡途径,促进对SCLC生长的协同抑制。与用GFP-纳米颗粒或肽对照处理的细胞相比,在用FUS1-纳米颗粒或wt-FUS1-衍生的肽(wt-FP)处理72h的SCLC H69,H128,H146,和N417细胞中,观察到显著的生长抑制和细胞凋亡,但是用FUS1蛋白质或肽的功能障碍突变体没有观察到。与用任一种试剂单独处理的细胞相比,在用FUS1-纳米颗粒或wt-FP与gleevec的组合处理过的gleevec-抗性的H69R和N417细胞中检测到增强的生长抑制。在FUS1-纳米颗粒或者wt-FP单独或与gleevec组合处理过的H69和N417细胞中,也显著抑制了磷酸化的c-Abl和c-Kit蛋白质的活性,如使用免疫沉淀的磷酸-c-Abl或磷酸-c-Kit蛋白质的免疫印迹分析和活性测定所证实的。发明人开发了胸内SCLC N417肿瘤异种移植裸鼠模型,并通过非侵入的和定量的MR成像分析,评价了FUS1-纳米颗粒全身治疗和Gleevec口服给药的治疗功效。发明人发现,在用FUS1-纳米颗粒单独或与gleevec组合治疗的小鼠中,在少于2周内显著抑制了N417肿瘤异种移植物的生长(P<0.001),但是在gleevec单独治疗的小鼠中没有检测到显著功效,如MR成像和体积分析所证实的。我们的结果清楚地证实了FUS1-纳米颗粒对SCLC的体外和体内治疗功效,并暗示全身施用FUS1-纳米颗粒单独或与其它化疗剂组合和MRI用于SCLC治疗的平移应用。
实施例5
FUS1单倍体机能不全的非小细胞肺癌中的激活的c-Abl
Abl蛋白在所有组织中广泛表达,但是致癌性激活形式的c-Abl限于造血恶性肿瘤(例如包含BCR-ABL融合体的费城染色体+慢性髓细胞性白血病)。c-Abl蛋白质是紧密调节的酪氨酸激酶,它位于胞质和核中。已知DNA损伤会引起核形式的c-Abl蛋白的激活。胞质c-Abl与生长因子受体信号传递、细胞运动性、和细胞粘附相关。已知Bcr蛋白质是c-Abl和Bcr-Abl癌蛋白的负调节剂(Lin等,2001;Ling等,2003)。另外,PAG会通过与SH3域的相互作用,下调c-Abl(Wen和Van Etten,1997)。在肺癌中,在小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)中经常观察到染色体臂3p的一个等位基因的缺失,提供了该染色体区中肿瘤抑制基因(TSG)的证据(Kondo等,2001;Uno等,2004)。已经在该关键染色体区中鉴别出了FUS1基因,并认为是新的肿瘤抑制基因。不清楚Fus1肿瘤抑制活性的机制。发明人已经发现,Fus1肽会体外抑制c-Abl酪氨酸激酶(IC50 35μM)。该抑制序列源自在有些肺癌细胞系中检测到的突变型Fus1蛋白质之一中缺失的区域。重要的是,硬脂酸(C18脂肪酸)修饰形式的该肽是抑制所需的,但是单独的硬脂酸不是抑制性的。感兴趣的是,认为结合到c-Abl的氨基末端区段上的肉豆蔻酸(C14)脂肪酸会参与c-Abl的自抑制(Hantschel等,2003)。发明人使用激活的c-Abl酪氨酸激酶转化的Rat-1细胞,测试了Fus1肽对集落形成的影响。发明人发现,硬脂酸-Fus-1肽(40μM)会阻断集落形成。这些发现表明,Fus1肿瘤抑制蛋白的活性之一是干扰c-Abl酪氨酸激酶功能。分析在该3p21.3区具有等位基因缺失的2个肺癌细胞系,所述缺失导致FUS1基因的单倍体机能不全,表明激活的c-Abl可能在FUS1缺失的肺癌中起作用。免疫沉淀/pTyr蛋白质印迹研究和体外Abl激酶测定证实,A549和H1299细胞系包含激活的c-Abl蛋白。其它研究正在进行中,以研究Fus1/Abl相互作用和鉴别FUS1内对c-Abl酪氨酸激酶抑制而言关键的序列。
实施例6
FUS1-纳米颗粒和吉非替尼的联合处理对非小细胞肺癌(NSCLC)中EGFR酪氨酸激酶和肿瘤细胞生长的协同抑制
FUS1是在人染色体3p21.3区中鉴别出的新肿瘤抑制基因(TSG),它在Apafl-相关细胞凋亡途径中起作用,是有效的肿瘤抑制剂。发明人探查了FUS1用于增强吉非替尼-敏感的和抗性的NSCLC细胞中吉非替尼的化疗效力和克服吉非替尼-抗性的用途。
方法和结果
发明人发现,在FUS1-缺陷的和吉非替尼-抗性的NSCLC H1299,H358,和H460细胞中FUS1-纳米颗粒-介导的基因转移对wt-FUS1的表达,会显著敏化对吉非替尼治疗的应答,如通过对肿瘤细胞生长的超过累加抑制作用和对细胞凋亡的协同诱导所证实的。在FUS1-纳米颗粒和低剂量的吉非替尼(IC10)共同处理的吉非替尼-敏感的HCC827(EGFR突变体)和H1819(EGFR扩增)细胞中,也观察到增强的生长抑制。在用FUS1-纳米颗粒单独或与吉非替尼组合处理过的细胞中,也检测到对磷酸化的EGFR蛋白的显著抑制,如磷酸-EGFR-特异性抗体的蛋白质印迹分析所证实的。与未处理或GFP-纳米颗粒处理过的细胞相比,在用FUS1-纳米颗粒处理的动物中在小于2周处理内检测到肿瘤生长的显著抑制(P<0.001),如通过MR成像和体积分析所证实的。通过冷冻组织样品中TUNEL染色的原位细胞凋亡测定,也检测到用FUS1-纳米颗粒处理过的小鼠的肿瘤细胞中细胞凋亡的诱导。发明人正在已经进行化疗的IV期NSCLC患者中,进行静脉内施用单试剂FUS1-纳米颗粒的I期研究。在迄今入选的7位患者中,较好地耐受治疗,生存中值是17多个月。
结论
我们的结果表明,wt-FUS1可能在调控肿瘤细胞对蛋白酪氨酸激酶抑制剂的敏感性中起关键作用。
实施例7
我们以前的实验证实,源自已知在来自有些肺癌细胞系的Fus1中缺失的Fus1序列的合成肽,会抑制商品化的Abl的激酶活性。发明人通过抗-Abl免疫沉淀(IP)/pTyr蛋白质印迹,筛选了2个人非小细胞肺癌(NSCLC)细胞系,A549和H1299,并检测到激活的c-Abl蛋白质。为了证实c-Abl在FUS1缺失的NSCLC细胞系中的激活,使用c-Abl抗体IP进行体外激酶测定。A549和H1299对激活的c-Abl是阳性的,而CCD16,即一种正常人肺成纤维细胞细胞系,是阴性的。
为了进一步研究c-Abl在NSCLC细胞系中的活性,在H1299细胞的软琼脂集落测定中使用甲磺酸伊马替尼(也称作STI-571或Gleevec),即一种已知的c-Abl酪氨酸激酶抑制剂。用伊马替尼(10μM)处理细胞,会导致与未处理对照相比集落数的几乎完全减少。与未处理的细胞相比,在有伊马替尼存在下形成的那些集落的大小减小。
为了测定Fus1对细胞内c-Abl的直接影响,将c-Abl cDNA与野生型FUS1或c-末端缺失的FUS1或空载体共转染进COS-1细胞。我们的数据表明,存在与野生型Fus1共表达有关的c-Abl酪氨酸磷酸化的减少,但是该减少在缺乏Fus1肽的抑制肽序列的FUS1缺失突变体中没有观察到。
参考本发明的公开内容,不经过度的试验,可以制备和执行本文公开的和要求保护的所有组合物和方法。尽管已经就优选实施方案描述了本发明的组合物和方法,本领域技术人员显而易见,可以将变化应用于组合物和方法、和本文所述方法的步骤或步骤次序中,而不背离本发明的构思、精神和范围。更具体地,显然可以将化学和生理上相关的某些试剂替换本文所述的试剂,同时达到相同或类似的结果。本领域技术人员显而易见的所有这样的类似的置换和修饰,视作在所附权利要求书定义的本发明的精神、范围和构思内。
实施例8
通过中性脂质体纳米颗粒递送FUS-1肽
在本实施例中使用的递送系统包含基于中性纳米颗粒(1,2-二油酰基-sn-甘油-3-磷脂酰胆碱(DOPC)(Avanti Polar Lipids,Alabaster,AL)的脂质体和肽(Fus 1)。在叔丁醇中制备DOPC原液(20mg/ml),并以90%:10%(v/v)(DOPC:吐温20)的比例,与在蒸馏水中稀释(1:1000)的吐温-20(Fisher Scientific,Fairlawn,NJ)相混合。向混合物加入过量的无水叔丁醇(95%叔丁醇,5%脂质,v/v),低压冻干过夜。将干脂质混合物与已经在蒸馏水中溶解的肽相混合。在这些实验中使用的DOPC和肽比例是10:1摩尔比(DOPC:肽)。稀释含有100μM肽的dd水,用于处理肺癌细胞(H1299)。阳离子脂质DOTA和肽用作阳性对照(DOTAP:肽(1:1),M/M)。
用递增剂量的空脂质体和含有fus 1肽(1,5,10,和20μM肽)的脂质体或含有染料-标记的肽(1,5,10,和20μM)的脂质体处理肺癌细胞(5000/孔)48h。在20和48h时间点,使用荧光显微镜观察脂质体的摄入。在处理20和48h,拍摄细胞照片研究形态学和生存力。在48h后,计数用空脂质体(对照)处理的细胞和用含有肽的脂质体处理的细胞的细胞生存力,将结果绘图(图23)。
实施例9
分析任选地含有FUS-1肽的DOPC和DOTAP:胆固醇纳米颗粒的毒性
给C3H小鼠注射含有肽(FUS-1肽或非特异性肽)的纳米颗粒,随后在注射后1,2和3周,分析各种毒理学参数。给对照小鼠(“IX组”)注射PBS。评价的毒理学参数包括血液学参数(即,红细胞计数“RBC”和白细胞计数“WBC”),肝功能分析(即,AST,ALT,和总胆红素分析)和肾功能分析(即,肌酸酐水平的评价)。使用了DOTAP:胆固醇纳米颗粒或DOPC(中性脂质体)纳米颗粒。施用给C3H小鼠的含有肽的纳米颗粒的量,从2mg/kg至5mg/kg。在下面的表V中总结了这些研究。
注:
1.由于样品的严重溶血,在第1周的一些血液学参数没有得到。
2.隔日通过尾静脉注射FP-纳米颗粒3次,每次剂量的总体积是200ul。
3.采血的时间点代表自最后处理的时间。
4.DC:DOTAP/胆固醇-纳米颗粒,FP:FUS1肽,NSP:非特异性肽。
实施例10
肿瘤抑制基因产物Fus1对c-Abl的抑制:缺乏FUS1表达的非小细胞肺癌细胞中c-Abl的致癌激活
硬脂酸-Fus1肽会抑制c-Abl的酪氨酸激酶活性。Fus1是与NSCLC有关的肿瘤抑制基因(Ji等,2002;Lerman和Minna,2000;Kondo等,2001)。从肺癌肿瘤细胞系分离了FUS1的C-末端缺失突变体(Kondo等,2001),它编码110个氨基酸野生型Fus1蛋白质的前80个氨基酸(Kondo等,2001)。发明人合成了源自在Fus1(1-80)中缺失的序列(KLR序列除外)的硬脂酸-Fus1肽(KLRRVHKNLIPQGIVKLDHR;SEQ IDNO:11)(参见表VI)。在使用细菌纯化的Abl激酶的Abl酪氨酸激酶测定中,该肽是强抑制性的(图24A)。令人惊奇地,缺乏硬脂酸N-末端部分的Fus1肽无Abl激酶抑制剂活性(图24B)。单独的硬脂酸也是非抑制性的。硬脂酸Bcr肽无Abl激酶抑制剂活性;与硬脂酸Fus1肽大致相同氨基酸数目的硬脂酸Bcr肽对细菌纯化的Abl激酶不具有任何抑制作用。总之,这些结果表明,硬脂酸部分和Fus1肽内的氨基酸序列是抑制c-Abl激酶所必需的。
如图24A所示,将硬脂酸Fus1肽与截短的商品化的仅含有SH2和SH1域的Abl酪氨酸激酶(45kD)(New England Bio-Labs)、GST-CRK(c-Abl优选底物)、100uM冷ATP、和32P ATP一起温育。在30度温育30分钟后,用2 x SDS样品缓冲液煮沸样品,上8% SDS PAGE凝胶。干燥凝胶,并暴露于磷酸成像仪。
图24B显示了硬脂酸Fus1肽对Abl酪氨酸激酶的线性抑制。该曲线代表GST-CRK磷酸化的抑制。非-硬脂酸修饰的Fus1肽没有抑制Abl酪氨酸激酶活性(图24C)。将45kD Abl酪氨酸激酶(New EnglandBioLabs)与0-60uM的非-硬脂酸Fus1肽、100uM冷ATP、和32P ATP、和GST-Crk一起温育。使用磷酸成像仪,对GST-Crk磷酸化定量。
在下面的表VI中,显示了Fus1氨基酸序列和硬脂酸-Fus1肽序列。下面标下划线的氨基酸序列是衍生出Fus1肽的区域。除了KLR N-末端以外,肽序列位于在有些NSCLC细胞系中表达的突变截短形式的FUS1[FUS1(1-80)]中缺失的区域(Kondo等,2001)。
表VI
Fus1肽:
硬脂酸-78KLRRVHKNLIPQGIVKLDHR
SEQ ID NO:11
Fus1氨基酸序列
1 mgasgskarg lwpfasaagg ggseaagaeq
31 alvrprgrav ppfvftrrgs mfydedgdla SEQ ID NO:12
61 hefyeetivt kngqkraklr rvhknlipqg
91 ivkldhprih vdfpvilyev
在NSCLC细胞系中c-Abl酪氨酸激酶被激活。检查了几种NSCLC细胞系中激活的c-Abl的存在(表VII)。A549和H1299细胞系含有酪氨酸激酶活性的c-Abl蛋白,如用抗-Abl P6D进行的免疫复合物激酶测定所测得的。来自这些细胞系的细胞裂解物的抗-Abl免疫复合物,也含有酪氨酸-磷酸化的c-Abl蛋白质。
表VII.NSCLC细胞系中减少的FUS1表达与激活的c-Abl活性相关联
| 细胞系 | FUS1表达 | 激活的c-Abl |
| 对照细胞系 | ||
| Rat 1 | 未知 | 否 |
| Rat1 SH2 | 未知 | 是 |
| 正常肺成纤维细胞 | ||
| CCD16 | 未知 | 否 |
| NSCLC | ||
| A549 | 否 | 是 |
| H358 | 否 | 是 |
| H1299 | 否 | 是 |
| H2089 | 否 | 是 |
| H2122 | 否 | 是 |
证实了NSCLC细胞系含有激活的c-Abl酪氨酸激酶。用抗-c-Abl抗体P6D温育来自Bcr-Abl阳性细胞系32D P210、正常肺成纤维细胞CCD16、和NSCLC细胞系H1299和A549的全细胞裂解物(Ling等,2003)。用蛋白A琼脂糖珠子断开P6D和免疫复合物。用2μCi 32P ATP在冰上温育蛋白A珠子20分钟。在2×SDS样品缓冲液中煮沸上清液,在8% SDS-PAGE凝胶上分析。用抗-c-Abl抗体P6D温育来自正常Rat 1细胞、c-Abl转化的Rat 1细胞、ABL转化的Ratl细胞(Ling等,2003)、和NSCLC细胞H1299和A549的全细胞裂解物。用蛋白A琼脂糖珠子收获P6D免疫复合物。在2×SDS样品缓冲液中煮沸蛋白A珠子,通过SDS-PAGE1分析。用抗-c-Abl抗体8E9探测bBlot(Guo等,1994)。然后剥离印迹,用磷酸酪氨酸抗体4G10(Upstate)探测。
COS1细胞中FUS1和c-ABL共表达会抑制c-Abl酪氨酸激酶活性。为了评价Fus1抑制激活的c-Abl的能力,我们在COS1细胞中共表达了这些cDNA,并测量酪氨酸-磷酸化的c-Abl的水平。c-ABL与FUS1的共表达,会抑制c-Abl在酪氨酸残基上的磷酸化(图25A)。相比之下,FUS(1-80)与c-ABL的共表达对c-Abl酪氨酸磷酸化几乎没有抑制作用(图25A)。令人感兴趣地,用N-末端Fus1抗体免疫沉淀Fus1连同Fus1一起共沉淀了c-Abl,表明Fus1与c-Abl结合。c-Abl的酪氨酸412的磷酸化,是c-Abl酪氨酸激酶激活的衡量指标。因此,我们评价了共表达FUS1之后c-Abl中磷酸酪氨酸412序列的水平(图25B)。FUS1与c-Abl的共表达,会强烈抑制c-Abl蛋白质中磷酸酪氨酸412的水平。相反地,FUS(1-80)与c-ABL的共表达,不会抑制酪氨酸412的磷酸化(图25B)。研究已经证实,Fus1的肉豆蔻酰化是它在NSCLC中的肿瘤抑制活性所需的。c-ABL与FUS1的肉豆蔻酰化-缺陷型突变体在COS1细胞中的共表达,导致与野生型FUS1和c-ABL的共表达相比磷酸酪氨酸c-Abl的微小降低(图25C)。因而,该结果表明,Fus1与c-Abl的相互作用会阻断它的酪氨酸激酶激活,作为自身磷酸化的结果,或通过另一上游激酶例如c-Src的Abl激活(Plattner等,1999)。
在图4a中,用c-ABL和野生型FUS1或FUS(1-80)共转染COS1细胞。在转染后48小时,收获细胞,用N-末端Fus1抗体温育裂解物。在2×SDS样品缓冲液中煮沸用蛋白A珠子收获的Fus1免疫复合物,并通过SDS-PAGE分析。用抗磷酸酪氨酸抗体4G10(Upstate)探测印迹。然后剥离印迹,并用抗-c-Abl抗体8E9重新探测。在图4b中,用c-Abl以及空载体、FUS(1-80)或野生型FUS1,共转染COS1细胞。在转染后48小时,收获细胞,并用抗-c-Abl P6D温育裂解物,如图4a中。用c-Abl抗-磷酸酪氨酸412(Abcam)探测印迹。然后剥离印迹,并用抗-c-Abl抗体8E9重新探测。
伊马替尼会抑制NSCLC细胞的集落形成。广泛已知甲磺酸伊马替尼(Gleevec)抑制Bcr-Abl的激活的酪氨酸激酶活性的能力(Druker等,1996)。发明人因此测试了伊马替尼对软琼脂中H1299细胞的集落形成的影响(图26A-C)。伊马替尼处理会以剂量依赖性的方式强烈抑制H1299细胞的集落形成能力;集落的数目和大小都受到抑制(图26A-C)。在这些测定中使用1-10uM的伊马替尼,因为以前的研究已经证实了在这些浓度对c-Abl激酶活性的强抑制(Zipfel等,2004)。
讨论。以前的研究已经证实了FUS1的抗肿瘤活性(Kondo等,2001;Uno等,2004),但是迄今尚未鉴别出FUS1基因的靶物。在我们的研究中,发现c-Abl受到Fus1蛋白质的负调节。使用源自在有些NSCLC患者中观察到的突变型FUS1(1-80)(Kondo等,2001)中缺乏的序列的FUS1肽,我们能抑制c-Abl激酶磷酸化Crk(c-Abl的正常靶物(17))的能力(图24A-C)。令人感兴趣地,仅仅硬脂酸修饰形式的FUS1肽对c-Abl激酶具有抑制作用(图24A-C)。已经证实,FUS1的肉豆蔻酰化是产生FUS1的肿瘤抑制作用所需的(Plattner等,1999)。令人感兴趣地,c-Abl(同种型1b)的N-末端也含有肉豆蔻酸残基,后者已经参与c-Abl的自身抑制(Hantschel等,2003)。通过COS1细胞中的共表达测定,证实了细胞培养物中野生型Fus1和c-Abl的相互作用(例如,图25A-C)。酪氨酸412的磷酸化,是导致c-Abl激酶激活的关键步骤(Brasher和Can Etten,2000)。相对于c-Abl与在有些NSCLC细胞系中发现的截短的FUS1(缺乏抑制肽序列)(Wang,2000)或空载体共表达时任一种信号的仅仅非常小量的降低,野生型FUS1和c-ABL的共表达会导致c-Abl的总磷酸酪氨酸水平和磷酸酪氨酸412含量水平的显著降低(图25A-C)。这些发现提供Fus1蛋白质直接抑制c-Abl酪氨酸激酶的有力证据。
这些结果证实,非小细胞肺癌(NSCLC)细胞系会表达酪氨酸激酶活性的c-Abl(图24A-C)。考虑到c-Abl是一种紧密调节的酪氨酸激酶,且它的致肿瘤性通常与白血病细胞中的嵌合蛋白质Bcr-Abl相关,该结果是令人感兴趣的。为了支持这些发现(显示c-Abl在NSCLC系中的激活),以已知会抑制c-Abl酪氨酸激酶的剂量,伊马替尼对NSCLC细胞系的处理以剂量依赖性的方式强有力地抑制软琼脂中的集落形成(图26A-C)。因此,我们的发现将c-Abl鉴别为肿瘤抑制基因产物FUS1的可能靶物,并表明c-Abl可能是有些形式的NCSLC的致肿瘤性的重要贡献者。因而,众所周知的c-Abl抑制剂伊马替尼看起来可能具有成功地治疗NSCLC的潜力。
参考文献
下面的参考文献就其提供补充本文所述内容的示例性程序细节或其它细节的程度,特别以参考方式并入本文。
美国专利4,162,282
美国专利4,310,505
美国专利4,533,254
美国专利4,554,101
美国专利4,728,575
美国专利4,728,578
美国专利4,737,323
美国专利4,921,706
美国专利5,030,453
美国专利5,397,987
美国专利5,855,911
美国专利5,962,016
美国专利6,413,544
美国专利6,610,657
美国专利6,680,068
美国专利6,770,291
美国申请2004/0208921
Arap等,Cancer Res.,55(6):1351-1354,1995.
Ausubel等,Current Protocols in Molecular Biology,John Wiley & Sons,Inc.,New York,N.Y.,1996;1998
Bakhshi等,Cell,41(3):899-906,1985.
Ballou等,Bioconjugate Chemistry,15:79-86,2004.
Ben-Neriah等,Science,233:212-214,1986.
Brady and Dodson,Nature,368:692-693,1994.
Buchhagen等,Head and Neck,18:529-537,1996.
Butturini等,Leukemia Res.,20(6):523-529,1996.
Caldas等,Nat.Genet.,8(1):27-32,1994.
Cheng等,Cancer Res.,54(21):5547-5551,1994.
Cheng等,Invest.Radiol.,22(1):47-55,1987.
Cleary and Sklar,Proc.Natl.Acad.Sci.USA,82(21):7439-43,1985.
Cleary等,J.Exp.Med.,164(1):315-320,1986.
Colledge and Scott,Trends in Cell Biology,9:216-221,1999.
Daly等,Oncogene,8:1721-1729,1993.
Drin等,AAPS Pharm.Sci.,4(4):1-7,2002.
Du等,J.Pept.Res.,51:235-243,1998.
Dubertret等,Science,298:1759-1762,2002.
Dwarakanath等,Biochem.Biophysical Res.Commun.,325:739-743,2004.
Ellerby等Nature Med.,9:1032-1038,1999.
Farhood等,Biochim.Biophys.Act,289-295,1995.
Ferrari,Nature Reviews,5:161-171,2005.
Fidler and Ellis,Cell,79(2):185-188,1994.
Folkman and Shing,J.Biol.Chem.,267(16):10931-10934,1992.
Folkman,Nature Med.,1:27-31,1995.
Frangioni,Current Opin.Chem.Biol.,7:626-634,2003.
Gazdar等In:Sym.Quant.Biol.,Cold Spring Harbor,59:565-572,1994.
Gazdar等,Intl.J.Cancer,78:766-774,1998.
Ghosh and Bachhawat,In:Liver Diseases,Targeted Diagnosis and TherapyUsing Specific Receptors and Ligands,Wu等(Eds.),Marcel Dekker,NY,87-104,1991.
Gorunova等,Genes Chrom.Cancer,23:81-99,1998.
Great Britain Appln.2193095 A
Gupta等,Biomaterials,26:3995-4021,2005.
Gupta等,Biomaterials,26:3995-4021,2005.
Gupta等,Biomaterials,26:3995-4021,2005.
Gupta,IEEE Trans.Nanobioscience.,3:66-73,2004.
Hanahan and Folkman,Cell,86(3):353-364,1996.
Hantschel等,Cell,112:845-857,2003.
Hollstein等,Science,253(5015):49-53,1991.
Hope等,1985
Horowitz,In:MRI Physics for Radiologists:A Visual Approach,1995
Hughson等,Cancer Genet.Cytogenet.,106:93-104,1998.
Hussussian等,Nat.Genet.,8(1):15-21,1994.
Hvalby等,Proc.Natl.Acad.Sci.USA,91:4761-4765,1994.
Ito等,Cancer Gene Therapy,11:733-739,2004.
Jameson等,Nature 368:744-746,1994
Ji等,Cancer Res.,62:2715-2720,2000.
Johnson等,J.Virol.,67:438-445,1993.
Kamb等,Nat.Genet.,8(1):23-26,1994.
Kamb等,Science,2674:436-440,1994.
Kerr等,Br.J.Cancer,26(4):239-257,1972.
Kerr等,Br.J.Cancer,26(4):239-257,1972.
Kersemaekers等,Intl.J.Cancer,79:411-417,1998.
Kloetzer等,Virology,140(2):230-238,1985.
Kohno等,Cancer,85:341-347,1999.
Kondo等,Oncogene,20:6258-6262,2001.
Kondo等,Oncogene,20:6258-6262,2001.
Kyte and Doolittle,J.Mol.Biol.,157(1):105-132,1982.
Lewin等,Nat.Biotechnol.,18:410-414,2000.
Lin等,Oncogene,20:1873-1881,2001.
Ling等,Cancer Res.,63:298-303,2003.
Liposome Technology,Gregoriadis(Ed.),Boca Raton,FL,CRC Press,1984.
Mabry等,In:Lung Cancer in the Genetic Basis of Human Cancer,Vogelsteinand Kinzler(Eds.),McGraw Hill,671-679,1998.
Mayer等,Biochim.Biophys.Acta,858(1):161-168,1986.
Mayhew等,Biochim.Biophys.Acta,775(2):169-174,1984.
Mayhew等,Methods Enzymol.,149:64-77,1987.
Michalet等,Science,307:538-544,2005.
Miller等,Oncogene,22:6006-6013,2003.
Minna等,In:Cancer:Principles and Practice of Oncology,5th Ed.,Philadelphia:Lippincott,849-857,1997.
Morawski等,Current Opinion Biotech.,16,89-92,2005.
Mori等,Cancer Res.,54(13):3396-3397,1994.
Nishihara等,Cancer Letter,180(1):55-61,2002.
Nobri等,Nature(London),368:753-756,1995.
Obenauer等,Nucleic Acids Res.,31(13):3635-3641,2003.
Okamoto等,Proc.Natl.Acad.Sci.USA,91(23):11045-11049,1994.
Orlow等,Cancer Res,54(11):2848-2851,1994.
Orlow等,Int.J.Oncol.,15(1):17-24,1994.
PCT申请PCT/US85/01161
PCT申请PCT/US89/05040
PCT申请WO 02/100435A1
PCT申请WO 03/015757A1
PCT申请WO 04/002453A1
PCT申请WO 04029213A2
Pure & Appl.Chem.,63(3):427-463,1991
Remington’s Pharmaceutical Sciences”15th Edition,pages 1035-1038 and1570-1580,1990.
Roberts等,Adv.Drug Del.Rev.,54(4):459-476,2002.
Rojas等,J.Biol.Chem.,271:27456-27461,1996.
Rojas等,Nature Biotechnol.,16:370-375,1998.
Roth,Forum,8:368-376,1998.
Sambrook等,In:Molecular Cloning:A Laboratory Manual,2nd Ed.,ColdSpring Harbor Press,Cold Spring Harbor,NY,1989
Schwarze等,Science,285:1569-1572,1999.
Schwarze等,Trends Cell Biol.,10:290-295,2000.
Sekido等,Biochimica.Biophysica.Acta,1378:F21-F59,1998.
Sekido等,Oncogene,16:3151-3157,1998.
Sekido等,Proc.Natl.Acad.Sci.USA,93:4120-4125,1996.
Serrano等,Nature,366:704-707,1993.
Serrano等,Science,267(5195):249-252,1995.
Sestier等,Electrophoresis,19:1220-1226,1998.
Spandidos等,Anticancer Res.,9(2):383-386,1989.
Stayton等,J.Controlled Release,65:203-220,2000.
Sun等,Biopolymers,60(1):61-75,2001.
Templeton,Nature Biotech.,15:647-652,1997.
Templeton,Nature Biotechnology,15:647-652,1997.
Travali等,FASEB J.,4(14):3209-3214,1990.
Tsujimoto and Croce,Proc.Natl.Acad.Sci.USA,83(14):5214-5218,1986.
Tsujimoto等,Science,228(4706):1440-1443,1985.
Uno等,Cancer Research,64:2969-2976,2004.
Uzawa等,Cancer Genet.Cytogenet.,107:125-131,1998.
Virmani等,Genes Chrom Cancer,21:308-319,1998.
Wang,Oncogene,19(49):5643-5650,2000.
Weinberg,Science,254(5035):1138-1146,1991.
Weinberg,Science,254:1138-1146,1991.
Wen and Van Etten,Genes and Development,11:2456-2467,1997.
West,Methods in Molec.Biol.,238:113-122,2004.
Wilhelm等,Biomaterials,24:1001-1011,2003.
Wistuba等,Cancer Res.,57:3154-3158,1997.
Wistuba等,Cancer Res.,59:1973-1979,1999.
Wistuba等,Oncogene,18:643-650,1999.
Woodring等,J.Cellular Science,116(Pt.13):2613-2626,2003.
Zbar等,Nature,327:721-724,1987。
Arlinghaus,Oncogene,21:8560-8567,2002.
Brasher and Van Etten,J.Biol.Chem.,275:35631-35637,2000.
Donaldson等,Proc.Natl.Acad.Sci.USA,99:14053-14058,2002.
Druker等,Nature Med.,2:561-566,1996.
Guo等,Blood,83:3629-3637,1994.
Hantschel等,Cell,112:845-957,2003.
Heisterkamp等,Nature,344:251-253,1990.
Ji等,Cancer Res.,62:2715-2720,2002.
Kondo等,Oncogene,20:6258-6262,2001.
Lerman and Minna,Cancer Res.,60:6116-6133,2000.
Ling等,Cancer Res.,63:298-303,2003.
Plattner等,Genes and Dev.,13:2400-2411,1999.
Taagepera等,Proc.Natl.Acad.Sci.USA,95:7457-7462,1998.
Uno等,Cancer Res.,64:2969-2976,2004.
Wang,Oncogene,19:5643-5650,2000.
Wen and Van Etten,Genes and Dev.,11:2456-2467,1997.
Woodring等,J.Cell Biol.,165:493-503,2004.
Zabarovsky等,Oncogene,21:6915-6935,2002.
Zipfel等,Current Biol.,14:1222-1231,2004。
序列表
<110>LIN,JACKI
ARLINGHAUS,RALPH B.
SUN,TONG
LIN,JI
OZPOLAT,BULENT
BERESTEIN-LOPEZ,GABRIEL
ROTH,JACK
<120>生物活性FUS1肽和纳米颗粒-多肽复合物
<130>UTFC:920WO
<140>PCT/US2006/009044
<141>2006-03-14
<150>60/661,680
<151>2005-03-14
<150>60/753,632
<151>2005-12-22
<160>12
<170>PatentIn Ver.2.1
<210>1
<211>21
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>1
<210>2
<211>18
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>2
<210>3
<211>16
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>3
<210>4
<211>27
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>4
<210>5
<211>27
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>5
<210>6
<211>27
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>6
<210>7
<211>13
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>7
<210>8
<211>18
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>8
<210>9
<211>10
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>9
<210>10
<211>14
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>10
<210>11
<211>20
<212>PRT
<213>人工序列
<220>人工序列的说明:合成肽
<223>
<400>11
<210>12
<211>110
<212>PRT
<213>人工序列
<220>
<223>人工序列的说明:合成肽
<400>12
Claims (74)
1.纳米颗粒-多肽复合物,其包含:
a)生物活性多肽,结合
b)纳米颗粒,
其中通过添加促进细胞摄入所述多肽的化学部分,修饰所述生物活性多肽。
2.权利要求1的纳米颗粒-多肽复合物,其中所述多肽是肽。
3.权利要求2的纳米颗粒-多肽复合物,其中所述肽的氨基酸序列源自肿瘤抑制基因产物的氨基酸序列。
4.权利要求3的纳米颗粒-多肽复合物,其中所述肿瘤抑制基因是在表4中列出的基因,促凋亡基因,或细胞毒性基因。
5.权利要求1的纳米颗粒-多肽复合物,其中所述生物活性肽是FUS-1肽,触角同源异型框基因(Antp)肽,HIV Tat肽,疱疹病毒VP22肽,模型两亲肽,transportan肽,SV 40 T抗原肽,或内源性抗微生物多肽I肽。
6.权利要求5的纳米颗粒-多肽复合物,其中所述生物活性肽是FUS-1肽。
7.权利要求5的纳米颗粒-多肽复合物,其中所述FUS-1肽包含SEQ ID NO:1。
8.权利要求5的纳米颗粒-多肽复合物,其中所述FUS-1肽是SEQ ID NO:1。
9.权利要求5的纳米颗粒-多肽复合物,其中所述生物活性肽包含KLALKLALKALKAALKLA(SEQ ID NO:2),RQIKIWFQNRRMKWKK(SEQ IDN0:3),GWTLNSAGYLLGKINLKALAALAKKIL(SEQ ID NO:4),MGLGLHLLVLAAALQGAWSQPKKKRKV(SEQI D NO:5),GALFLGWLGAAGSTMGAWSQPKKKRKV(SEQ ID NO:6),GRKKRRQRRRPPQ(SEQID NO:7),RGGRLSYSRRRFSTSTGR(SEQ ID NO:8)或RRLSYSRRRF(SEQ IDNO:9)。
10.权利要求9的纳米颗粒-多肽复合物,其中所述生物活性肽包含KLALKLALKALKAALKLA(SEQ ID NO:2)。
11.权利要求3的纳米颗粒-多肽复合物,其中所述肽包含肿瘤抑制基因产物的氨基酸序列的功能域。
12.权利要求3的纳米颗粒-多肽复合物,其中所述肽包含肿瘤抑制基因产物的氨基酸序列的预测功能域。
13.权利要求12的纳米颗粒-多肽复合物,其中所述预测功能域通过对所述肿瘤抑制基因产物的氨基酸序列的计算机辅助序列分析来鉴定。
14.权利要求1的纳米颗粒-多肽复合物,其中所述多肽是蛋白质。
15.权利要求13的纳米颗粒-多肽复合物,其中所述蛋白质的氨基酸序列源自肿瘤抑制基因产物的氨基酸序列。
16.权利要求14的纳米颗粒-多肽复合物,其中所述肿瘤抑制基因是在表4中列出的基因。
17.权利要求16的纳米颗粒-多肽复合物,其中所述肿瘤抑制基因是FUS-1。
18.权利要求1的纳米颗粒-多肽复合物,其中所述纳米颗粒是基于脂质的纳米颗粒,超顺磁性纳米颗粒,纳米壳,半导体纳米晶体,量子点,基于聚合物的纳米颗粒,基于硅的纳米颗粒,基于二氧化硅的纳米颗粒,基于金属的纳米颗粒,富勒烯或纳米管。
19.权利要求18的纳米颗粒-多肽复合物,其中所述纳米颗粒是基于脂质的纳米颗粒。
20.权利要求18的纳米颗粒-多肽复合物,其中所述基于脂质的纳米颗粒是脂质体,中性脂质体,DOPC脂质体或DOTAP:胆固醇囊泡。
21.权利要求20的纳米颗粒-多肽复合物,其中所述脂质体是DOPC脂质体。
22.权利要求18的纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒。
23.权利要求18的纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒,且所述纳米颗粒-多肽复合物是在脂质体或DOTAP:胆固醇囊泡内。
24.权利要求23的纳米颗粒-多肽复合物,其中所述脂质体是DOPC脂质体。
25.权利要求1的纳米颗粒-多肽复合物,其中所述化学部分是脂肪酸。
26.权利要求25的纳米颗粒-多肽复合物,其中所述脂肪酸是C4-C18脂肪酸。
27.权利要求25的纳米颗粒-多肽复合物,其中所述脂肪酸是硬脂酸或肉豆蔻酸。
28.权利要求1的纳米颗粒-多肽复合物,其中所述化学部分是细胞穿透肽。
29.权利要求28的纳米颗粒-多肽复合物,其中所述细胞穿透肽源自HIV Tat,疱疹病毒VP22,或果蝇触角同源异型框基因产物。
30.权利要求1的纳米颗粒-多肽复合物,还包含与纳米颗粒相结合的第二种生物活性多肽。
31.权利要求30的纳米颗粒-多肽复合物,其中第一种和第二种生物活性多肽是生物活性肽,各自包含源自不同肿瘤抑制基因产物的氨基酸序列。
32.权利要求1的纳米颗粒-多肽复合物,还包含靶向部分,后者将纳米颗粒-多肽复合物靶向组织或细胞。
33.纳米颗粒-多肽复合物,其包含:
a)生物活性多肽,结合
b)纳米颗粒,
其中通过添加硬脂酸部分修饰所述生物活性多肽,且所述纳米颗粒是DOTAP:胆固醇囊泡,DOPC脂质体或超顺磁性纳米颗粒。
34.分离的肽,其包含:
a)氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1);或
b)其生物活性变体。
35.权利要求34的肽,其中所述肽的长度是10-100个氨基酸残基。
36.权利要求35的肽,其中所述肽的长度是10-75个氨基酸残基。
37.权利要求36的肽,其中所述肽的长度是10-50个氨基酸残基。
38.权利要求37的肽,其中所述肽的长度是10-25个氨基酸残基。
39.权利要求38的肽,其中所述肽的长度是10个氨基酸残基。
40.权利要求34的肽,其中通过添加促进细胞摄入所述肽的化学部分,修饰所述肽。
41.权利要求40的肽,其中所述化学部分是脂肪酸。
42.权利要求41的肽,其中所述化学脂肪酸是C4-C18脂肪酸。
43.权利要求42的肽,其中所述脂肪酸是硬脂酸或肉豆蔻酸。
44.权利要求40的肽,其中所述化学部分是细胞穿透肽。
45.权利要求44的肽,其中所述细胞穿透肽源自HIV Tat,疱疹病毒VP22,或果蝇触角同源异型框基因产物。
46.纳米颗粒-多肽复合物,其包含:
a)权利要求34-45之任一项的生物活性肽
b)纳米颗粒。
47.权利要求46的纳米颗粒-多肽复合物,其中所述纳米颗粒是基于脂质的纳米颗粒,超顺磁性纳米颗粒,纳米壳,半导体纳米晶体,量子点,基于聚合物的纳米颗粒,基于硅的纳米颗粒,基于二氧化硅的纳米颗粒,基于金属的纳米颗粒,富勒烯或纳米管。
48.权利要求47的纳米颗粒-多肽复合物,其中所述纳米颗粒是基于脂质的纳米颗粒。
49.权利要求48的纳米颗粒-多肽复合物,其中所述基于脂质的纳米颗粒是脂质体或DOTAP:胆固醇囊泡。
50.权利要求47的纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒。
51.权利要求47的纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒,且所述纳米颗粒-多肽复合物是在脂质体或DOTAP:胆固醇囊泡内。
52.纳米颗粒-多肽复合物,其包含:
a)氨基酸序列KLRRVHKNLIPQGIVKLDHPR(SEQ ID NO:1)的肽,结合
b)纳米颗粒,
其中通过添加硬脂酸部分来修饰所述肽,且所述纳米颗粒是脂质体,DOTAP:胆固醇囊泡,DOPC脂质体或超顺磁性纳米颗粒。
53.治疗疾病的方法,其包括给受试者施用药物组合物,该组合物包含在药学可接受的稀释剂中的权利要求1-52之任一项的任一种肽或纳米颗粒-多肽复合物。
54.权利要求53的方法,其中所述疾病是癌症。
55.权利要求53的方法,还包括给受试者施用化疗剂。
56.权利要求55的方法,其中所述化疗剂是伊马替尼。
57.权利要求54的方法,其中所述癌症是肺癌。
58.权利要求57的方法,其中所述肺癌是NSCLC。
59.权利要求53的方法,还包括给受试者施用辐射。
60.权利要求53的方法,还包括给受试者施用第二种生物活性多肽。
61.向细胞递送多肽的方法,其包括:
a)制备权利要求1-33和46-52之任一项的任一种纳米颗粒-多肽复合物;和
b)在足以允许细胞摄入生物活性多肽的条件下,使细胞接触所述纳米颗粒-多肽复合物。
62.治疗受试者肿瘤的方法,其包括给受试者施用治疗有效量的权利要求1-52之任一项的任一种肽或纳米颗粒-多肽复合物,其中纳米颗粒复合物中的多肽是基于肿瘤抑制基因产物的氨基酸序列。
63.权利要求62的方法,其中所述施用是腹腔内注射。
64.权利要求62的方法,其中所述肿瘤是胃肠肿瘤。
65.制备纳米颗粒-多肽复合物的方法,其包括:
a)鉴别生物活性多肽序列中的一个或多个功能域;
b)制备包含至少一个功能域的肽;
c)选择具有预期生物活性的肽;和
d)通过使肽结合纳米颗粒,制备纳米颗粒-多肽复合物。
66.权利要求65的方法,其中所述鉴别包括使用计算机辅助结构分析。
67.权利要求66的方法,其中所述计算机辅助结构分析导致鉴别出推定蛋白激酶相互作用位点、推定肉豆蔻酰化位点、PDZ II类域基序或A激酶锚定蛋白(AKAP)基序。
68.权利要求65的方法,还包括通过添加促进细胞摄入肽的化学部分来修饰所述肽。
69.权利要求65的方法,其中所述功能域是肿瘤抑制基因的氨基酸序列的预测功能域。
70.抑制蛋白酪氨酸激酶的方法,其包括使所述激酶接触权利要求34-45之任一项的任一种肽。
71.权利要求70的方法,其中所述激酶是EGFR,PDGFR,cKit,cAb1,或Erk。
72.诱导肿瘤细胞凋亡的方法,其包括使肿瘤细胞接触权利要求34-45之任一项的任一种肽。
73.诱导肿瘤细胞凋亡的方法,其包括使肿瘤细胞接触权利要求46-51之任一项的任一种纳米颗粒-多肽复合物。
74.用于磁共振成像的组合物,其包含权利要求1-32和46-51之任一项的任一种纳米颗粒-多肽复合物,其中所述纳米颗粒是超顺磁性纳米颗粒。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US66168005P | 2005-03-14 | 2005-03-14 | |
| US60/661,680 | 2005-03-14 | ||
| US60/753,632 | 2005-12-22 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN101389314A true CN101389314A (zh) | 2009-03-18 |
Family
ID=40478313
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA2006800165915A Pending CN101389314A (zh) | 2005-03-14 | 2006-03-14 | 生物活性fus1肽和纳米颗粒-多肽复合物 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN101389314A (zh) |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102713612A (zh) * | 2009-07-02 | 2012-10-03 | 斯隆-凯特林癌症研究院 | 基于二氧化硅的荧光纳米颗粒 |
| CN104094119A (zh) * | 2011-10-21 | 2014-10-08 | 斯特姆詹尼克斯公司 | 用于胞内传递生物活性分子的官能化纳米粒子 |
| CN105694890A (zh) * | 2015-12-30 | 2016-06-22 | 深圳先进技术研究院 | 一种靶向近红外寿命可调晶格应变型量子点及其制备方法 |
| CN106632688A (zh) * | 2016-12-23 | 2017-05-10 | 华中科技大学同济医学院附属协和医院 | 一种用于修饰微泡的多肽以及靶向gbm的药物制剂 |
| CN108992464A (zh) * | 2018-09-30 | 2018-12-14 | 苏州大学 | 一种多肽-银纳米团簇复合物及其制备方法与应用 |
| CN110520144A (zh) * | 2017-02-19 | 2019-11-29 | 国家生物技术研究所公司 | 肽激酶抑制剂及其使用方法 |
| CN113786476A (zh) * | 2016-12-02 | 2021-12-14 | 泰加生物工艺学公司 | 纳米颗粒调配物 |
| CN114605501A (zh) * | 2022-04-07 | 2022-06-10 | 华中科技大学同济医学院附属协和医院 | 一种可拮抗fus蛋白rna结合活性的多肽fip-21及其应用 |
| CN114920799A (zh) * | 2022-02-19 | 2022-08-19 | 禾美生物科技(浙江)有限公司 | 一种具有抗黑眼圈活性的活性肽 |
-
2006
- 2006-03-14 CN CNA2006800165915A patent/CN101389314A/zh active Pending
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102713612A (zh) * | 2009-07-02 | 2012-10-03 | 斯隆-凯特林癌症研究院 | 基于二氧化硅的荧光纳米颗粒 |
| CN115990277A (zh) * | 2009-07-02 | 2023-04-21 | 斯隆-凯特林癌症研究院 | 基于二氧化硅的荧光纳米颗粒 |
| CN106822868A (zh) * | 2011-10-21 | 2017-06-13 | 斯特姆詹尼克斯公司 | 用于胞内传递生物活性分子的官能化纳米粒子 |
| CN104094119A (zh) * | 2011-10-21 | 2014-10-08 | 斯特姆詹尼克斯公司 | 用于胞内传递生物活性分子的官能化纳米粒子 |
| US9675708B2 (en) | 2011-10-21 | 2017-06-13 | Stemgenics, Inc. | Functionalized nanoparticles for intracellular delivery of biologically active molecules |
| CN105694890A (zh) * | 2015-12-30 | 2016-06-22 | 深圳先进技术研究院 | 一种靶向近红外寿命可调晶格应变型量子点及其制备方法 |
| CN113786476A (zh) * | 2016-12-02 | 2021-12-14 | 泰加生物工艺学公司 | 纳米颗粒调配物 |
| CN106632688B (zh) * | 2016-12-23 | 2020-06-05 | 华中科技大学同济医学院附属协和医院 | 一种用于修饰微泡的多肽以及靶向gbm的药物制剂 |
| CN106632688A (zh) * | 2016-12-23 | 2017-05-10 | 华中科技大学同济医学院附属协和医院 | 一种用于修饰微泡的多肽以及靶向gbm的药物制剂 |
| CN110520144A (zh) * | 2017-02-19 | 2019-11-29 | 国家生物技术研究所公司 | 肽激酶抑制剂及其使用方法 |
| CN110520144B (zh) * | 2017-02-19 | 2024-04-05 | 本-古里安大学B.G.内盖夫技术和应用公司 | 肽激酶抑制剂及其使用方法 |
| CN108992464A (zh) * | 2018-09-30 | 2018-12-14 | 苏州大学 | 一种多肽-银纳米团簇复合物及其制备方法与应用 |
| CN114920799A (zh) * | 2022-02-19 | 2022-08-19 | 禾美生物科技(浙江)有限公司 | 一种具有抗黑眼圈活性的活性肽 |
| CN114920799B (zh) * | 2022-02-19 | 2023-10-24 | 禾美生物科技(浙江)有限公司 | 一种具有抗黑眼圈活性的活性肽 |
| CN114605501A (zh) * | 2022-04-07 | 2022-06-10 | 华中科技大学同济医学院附属协和医院 | 一种可拮抗fus蛋白rna结合活性的多肽fip-21及其应用 |
| CN114605501B (zh) * | 2022-04-07 | 2023-06-30 | 华中科技大学同济医学院附属协和医院 | 一种可拮抗fus蛋白rna结合活性的多肽fip-21及其应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8859727B2 (en) | Bioactive FUS1 peptides and nanoparticle-polypeptide complexes | |
| CN101389314A (zh) | 生物活性fus1肽和纳米颗粒-多肽复合物 | |
| JP6956159B2 (ja) | 腫瘍溶解性アデノウイルスによる脳癌の処置方法 | |
| Wayne et al. | TRAIL-coated leukocytes that prevent the bloodborne metastasis of prostate cancer | |
| TWI433693B (zh) | 親脂藥物傳送媒介物及其使用方法 | |
| CN105378084B (zh) | 用于治疗癌症的方法和组合物 | |
| JP4402746B2 (ja) | リポソームアンチセンスオリゴデオキシヌクレオチドによるBcl―2タンパク質発現の阻害 | |
| KR101759888B1 (ko) | 종양 용해 백시니아 바이러스 병용 암 치료요법 | |
| Meng et al. | Integrin-targeted paclitaxel nanoliposomes for tumor therapy | |
| JP2000501394A (ja) | ガンの診断および処置のための方法および組成物 | |
| US20160068582A1 (en) | Conjugate comprising p21 protein for the treatment of cancer | |
| Chen et al. | Ferritin Nanocaged Doxorubicin Potentiates Chemo‐Immunotherapy against Hepatocellular Carcinoma via Immunogenic Cell Death | |
| CN112870194B (zh) | 治疗肝癌的组合物及其应用 | |
| Ren et al. | A neutrophil-mediated carrier regulates tumor stemness by inhibiting autophagy to prevent postoperative triple-negative breast cancer recurrence and metastasis | |
| Wu et al. | Targeted Delivery of PD‐L1‐Derived Phosphorylation‐Mimicking Peptides by Engineered Biomimetic Nanovesicles to Enhance Osteosarcoma Treatment | |
| JP2007501239A (ja) | 放射線治療と組み合わせたvegfアンタゴニストの使用 | |
| Zhang et al. | Elevating mitochondrial reactive oxygen species by mitochondria-targeted inhibition of superoxide dismutase with a mesoporous silica nanocarrier for cancer therapy | |
| CN113993554A (zh) | 选自食道、咽喉、肺、脑和肠的癌症的靶向化合物 | |
| BG63622B1 (bg) | Супресия на растежа на туморни клетки посредствомсиндекан- 1 ектоучастък | |
| Zhang et al. | Mitochondria targeted biomimetic platform for chemo/photodynamic combination therapy against osteosarcoma | |
| Yao et al. | GGP modified daunorubicin plus dioscin liposomes inhibit breast cancer by suppressing epithelial–mesenchymal transition | |
| JP6548060B2 (ja) | ホウ素中性子捕捉療法のための新規bsh複合体 | |
| CN112263565A (zh) | 一种用于癌症治疗的索拉非尼-基因共载纳米药物及其制备方法和应用 | |
| Prados et al. | Regression of established subcutaneous B16‐F10 murine melanoma tumors after gef gene therapy associated with the mitochondrial apoptotic pathway | |
| Liu et al. | Molecular design and anti‑melanoma activity of a novel bullfrog antibacterial peptide RGD‑chimera |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Open date: 20090318 |