CN100345847C - 新的联芳基甲酰胺 - Google Patents
新的联芳基甲酰胺 Download PDFInfo
- Publication number
- CN100345847C CN100345847C CNB018049362A CN01804936A CN100345847C CN 100345847 C CN100345847 C CN 100345847C CN B018049362 A CNB018049362 A CN B018049362A CN 01804936 A CN01804936 A CN 01804936A CN 100345847 C CN100345847 C CN 100345847C
- Authority
- CN
- China
- Prior art keywords
- azabicyclo
- oct
- methane amide
- furans
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/26—Psychostimulants, e.g. nicotine, cocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/06—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals
- C07D295/073—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals with the ring nitrogen atoms and the substituents separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D453/00—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids
- C07D453/02—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids containing not further condensed quinuclidine ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D475/00—Heterocyclic compounds containing pteridine ring systems
- C07D475/06—Heterocyclic compounds containing pteridine ring systems with a nitrogen atom directly attached in position 4
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Psychiatry (AREA)
- Addiction (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Heart & Thoracic Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Cardiology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Psychology (AREA)
- Dermatology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Plural Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本发明公开了式(I)的化合物或其对映异构体及其药用盐,其中A表示(II)、(III)、(IV)或(V),D表示氧原子或硫原子;E表示单键、氧原子、硫原子或NR10;R表示氢原子或甲基;Ar1表示5-或6-员芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子及0或1个硫原子;Ar2表示5-或6-员芳环或杂芳环,其中含有0至3个氮原子、0或1个氧原子及0或1个硫原子,或表示8-、9-或10-员稠合芳环或杂芳环系,其中含有0至3个氮原子,0至1个氧原子及0至1个硫原子;芳环Ar1和Ar2任选地被1或3个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、CN、NO2、NR1R2,CH2NR1R2、OR3、CH2OR3、CO2R4、CF3;R1、R2和R3独立地是C1-4烷基、芳基、杂芳基、C(O)R5、C(O)NHR6、C(O)R7、SO2R8,或者R1和R2可以一起是(CH2)jG(CH2)k,其中G是氧原子、硫原子、NR9或一个键;j是2至4;k是0至2;R4、R5、R6、R7、R8、R9及R10独立地是C1-4烷基、芳基或杂芳基;其条件是:(1)如果D表示氧原子,E表示单键且A表示(II)而Ar1或Ar2表示吡唑环,则该吡唑环上的所有任选的取代基应是氢原子;及(2)如果Ar1表示吡啶环,Ar2表示芳环且A表示(II),则该吡啶环上的所有取代基应是氢原子;及(3)式(I)不表示(a);制备这些化合物的方法,含有这些化合物的药物组合物及其在治疗特别是治疗或预防精神病和智力损害中的用途。
Description
技术领域
本发明涉及新的联芳基甲酰胺或其药用盐,它们的制备方法,含有它们的组合物以及它们在治疗中的用途。另一个目的是提供作为烟碱性乙酰胆碱受体(nAChRs)的有效配体的活性化合物。
背景技术
结合烟碱性乙酰胆碱受体的化合物在涉及胆碱能功能降低的一些疾病治疗中的用途已在McDonald等,(1995)“烟碱性乙酰胆碱受体:分子生物学、化学和药学”,第5章,Annual Reports in MedicinalChemistry,vol.30,pp.41-50,Academic Press Inc.,San Diego,CA;及Williams等,(1994)“神经元烟碱性乙酰胆碱受体”,DrugNews & Perspectives,vol.7,pp.205-223中讨论,其中所述疾病如早老性痴呆、认知或注意力紊乱、焦虑、抑郁、烟草戒断、神经保护、精神分裂症、痛觉缺失、图雷特氏病和帕金森氏病。
发明公开
按照本发明,现已发现下式I的化合物或其对映异构体及其药用盐是烟碱性乙酰胆碱受体的有效配体:
其中:
A表示:
D表示氧原子或硫原子;
E表示单键、氧原子、硫原子或NR10;
R表示氢原子或甲基;
Ar1表示5或6元芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子,及0或1个硫原子;
Ar2表示5或6元芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子,及0或1个硫原子;或
8、9或10元稠合芳环或杂芳环系,其中含有0至3个氮原子,0至1个氧原子,及0至1个硫原子;
其中当Ar2是未被取代的苯基时,Ar1不是吡唑基;
芳环Ar1和Ar2任选地被1至3个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、CN、NO2、NR1R2、CH2NR1R2、OR3、CH2OR3、CO2R4及CF3;但如果Ar1是苯基而Ar2是喹啉基,则Ar2被0、1、2或3个选自如下的取代基取代:C1-4烷基、C2-4链烯基、C2-4链炔基、CN、NO2、NR1R2、CH2NR1R2、OR3、CH2OR3和CO2R4;
R1、R2及R3独立地是C1-4烷基、芳基、杂芳基、C(O)R5、C(O)NHR6、C(O)R7、SO2R8,或R1和R2一起是(CH2)jG(CH2)k,其中G是氧原子、硫原子、NR9或一个键;
j是2至4;
k是0至2;
R4,R5,R6,R7,R8,R9及R10,独立地是C1-4烷基、芳基或杂芳基;其条件是:如果D表示氧原子,E表示单键及A表示:
且Ar1或Ar2表示吡唑环,则该吡唑环上的所有取代基是氢原子;且
如果Ar1表示吡啶环,Ar2表示芳环及A表示:
则该吡啶环上的所有取代基应是氢原子;且式I不表示:
除非另行说明,C1-4烷基在本文中指,例如,甲基、乙基、正丙基、正丁基、异丙基、异丁基、叔丁基、仲丁基,不论单独或作为其它基团的一部分,可以是直链或支链,且C3-4烷基也可以是成环,例如,环丙基、环丁基。烷基在本文中可以任选地被1至3个卤原子取代。
除非另行说明,芳基指苯环,其可以任选地被1至3个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、NR1R2、CH2NR1R2、OR3、CH2OR3、CO2R4、CN、NO2及CF3。
除非另行说明,杂芳基指5或6元芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子,及0或1个硫原子,条件是该环至少含有一个氮原子、氧原子,或硫原子,其可以任选地被一个或多个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、NR1R2、CH2NR1R2、OR3、CH2OR3、CO2R4、CN、NO2及CF3。
除非另行说明,卤素指氟、氯、溴或碘。
药用衍生物包括溶剂化物和盐。例如,式I的化合物可以与酸形成酸加成盐,酸如常规药用酸,例如,马来酸、盐酸、氢溴酸、磷酸、乙酸、富马酸、水杨酸、桔橼酸、乳酸、扁桃酸、酒石酸和加磺酸。
优选的本发明的化合物是式I的化合物或其对映异构体及其药用盐,其中A表示:
优选的本发明的实施方案包括式I的化合物,其中D表示氧原子;或其对映异构体及其药用盐。
优选的本发明的实施方案包括式I的化合物,其中E表示单键;或其对映异构体及其药用盐。
优选的本发明的实施方案包括式I的化合物,其中E表示氧原子或NR10;或其对映异构体及其药用盐。
优选的本发明的实施方案包括式I的化合物或其对映异构体及其药用盐,其中Ar1表示5或6元芳环或杂芳环,其中含有0或1个氮原子,0或1个氧原子及0或1个硫原子;其中,Ar1表示苯环、呋喃环或噻吩环的化合物是特别优选的。
优选的本发明的实施方案包括式I的化合物或其对映异构体及其药用盐,其中Ar2表示5或6元芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子及0或1个硫原子;其中,Ar1表示苯环、呋喃环、噻吩环或吡啶环的化合物是特别优选的。
优选的本发明的实施方案包括式I的化合物或其对映异构体及其药用盐,其中该芳环Ar1被-EAr2及甲酰胺或硫代甲酰胺基团、C(=D)NHA取代,但是再没有其它取代基;
优选的本发明的实施方案包括式I化合物,其中Ar1上的取代基-EAr2及甲酰胺或硫代甲酰胺基团、C(=D)NHA彼此位置是1,3-关系;或其对映异构体及其药用盐。
优选的本发明的实施方案包括式I的化合物,其中Ar1或Ar2被0或1个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、CN、NO2、NR1R2、CH2NR1R2、OR3、CH2OR3、CO2R4及CF3;或其对映异构体及其药用盐。
特别优选的本发明的实施方案也包括式I的化合物,其中A表示:
D表示氧原子;
E表示单键;
Ar1表示5或6元芳环或杂芳环,其中含有0或1个氮原子,0或1个氧原子及0或1个硫原子并首选表示苯环、呋喃环或噻吩环;
Ar2表示5或6元芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子及0或1个硫原子;
芳环Ar1被-EAr2和甲酰胺、C(=O)NHA取代,但是再没有其它取代基,且Ar1上的这些取代基首选彼此位置为1,3-关系;
Ar2被0或1个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、CN、NO2、NR1R2、CH2NR1R2、OR3、CH2OR3、CO2R4及CF3;或其对映异构体及其药用盐。
特别优选的本发明的实施方案包括式I的化合物,其中A表示:
D表示氧原子;
E表示氧原子或NH;
Ar1表示5或6元芳环或杂芳环,其中含有0或1个氮原子,0或1个氧原子及0或1个硫原子,并更优选表示苯环、呋喃环或噻吩环;
Ar2表示5或6元芳环或杂芳环,其中含有0至3个氮原子,0或1个氧原子及0或1个硫原子;
芳环Ar1被-EAr2和甲酰胺基团、C(=O)NHA取代,但是再没有其它取代基,且Ar1上的这些取代基更优选彼此位置为1,3-关系;
Ar2被0或1个选自如下的取代基取代:卤素、C1-4烷基、C2-4链烯基、C2-4链炔基、CN、NO2、NR1R2、CH2NR1R2、OR3、CH2OR3、CO2R4及CF3;或其对映异构体及其药用盐。
优选的本发明的实施方案包括式I的化合物及其药用盐,其中A表示:
且奎宁环中连接酰胺氮原子的碳原子是(R)构型。
优选的本发明的化合物包括下列化合物:
N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-噻吩基)苯甲酰胺);
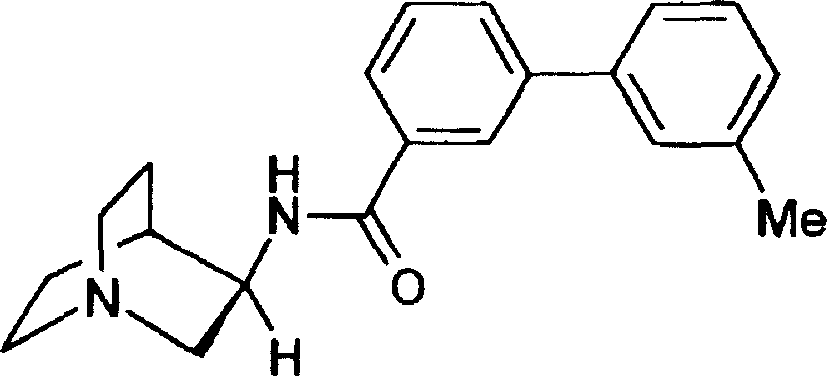
N-(1-氮杂双环[2.2.2]辛-3-基)(3-苯基苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-吡啶基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(3-(3-甲氧基苯基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-甲氧基苯基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-(N-乙酰基氨基)苯基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(3-(3-氟苯基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(3-(3-甲基苯基)苯甲酰胺):
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-噻吩基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3,5-二氯苯基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-萘基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-(4-氟苯基)苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(3-吡啶基)呋喃-2-甲酰胺);
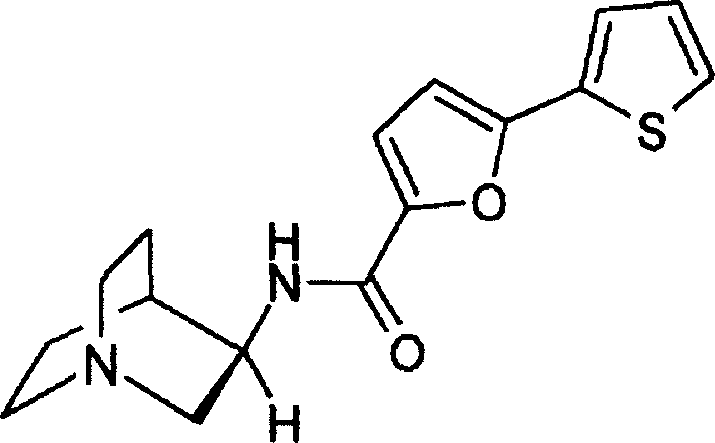
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-噻吩基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-苯并[b]呋喃基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-噻吩基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-甲氧基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.22]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-萘基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(3-甲基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-呋喃基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-呋喃基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(2-吡啶基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-(2-吡啶基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-(4-吡啶基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-(3-吡啶基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-乙氧基苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(3,5-二甲基异唑-4-基)-呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(3-吡啶基)噻吩-3-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氯苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻唑-3-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻唑-3-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(8-喹啉基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-3-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-苯基噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氰基苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-甲基氨基)苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-羟基苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基氨基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(4-吗啉基)苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(氨基甲基)苯基)噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯氧基噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲酰基苯基)噻吩-2-甲酰胺);及
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(羟基甲基)苯基)噻吩-2-甲酰胺)。
特别优选的本发明的化合物包括下列化合物:
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-苯基呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-噻吩基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-苯基苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(3-(3-吡啶基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-苯基呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-甲氧基苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[22.2]辛-3-基)(3-(2-甲氧基苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-(N-乙酰基氨基)苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-氟苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-甲基苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-噻吩基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3,5-二氯苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(3-(2-萘基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(4-氟苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-噻吩基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-苯并[b]呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-噻吩基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(3-甲氧基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-甲氧基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-萘基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)5-(3-呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(2-呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(3-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-(2-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-(2-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(4-(4-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-(3-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-乙氧基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-3-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)[5-(4-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻唑-3-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻唑-3-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(8-喹啉基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-(吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-(吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-3-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-苯基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氰基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-甲基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-羟基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)氨基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(4-吗啉基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(氨基甲基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-(5-苯氧基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲酰基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(羟基甲基)苯基)噻吩-2-甲酰胺);及其药用盐。
在这些化合物中,下列本发明的化合物是更特别优选的:
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-噻吩基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-苯基苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-乙酰基氨基)苯基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-噻吩基)苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-噻吩基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-苯并[b]呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-噻吩基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-萘基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-(2-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-N-乙酰基氨基)苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-乙氧基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-3-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(8-喹啉基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-3-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-苯基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氰基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-甲基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-羟基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)5-(3-吡啶基氨基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(4-吗啉基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(氨基甲基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯氧基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(羟基甲基)苯基)噻吩-2-甲酰胺);及其药用盐。
在这些化合物中,下列本发明的化合物是最特别优选的;
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-3-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2..2.2]辛-3-基)(4-苯基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氰基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-羟基苯基)噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯氧基噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(羟基甲基)苯基)噻吩-2-甲酰胺);
及其药用盐。
制备方法
在随后的反应方案和文本中,A,E,Ar1及Ar2除非另行说明,如上述式I所定义。
其中E表示单键的式I的化合物可以按照方案1给出的方法制备。
方案1
其中D表示氧原子而E表示单键的式I化合物可以由式VI的化合物制备,其中J表示在环Ar1与环Ar2成键位置上的卤素或OSO2CF3取代基,该制备是通过与式VII的适当的有机金属化合物在适宜的有机金属催化剂和溶剂的存在下反应。式VII的适宜化合物包括烃基代硼酸,其中M表示B(OH)2,以及有机锡化合物,其中M表示适宜的三烷基甲锡烷基,如三甲基甲锡烷基或三正丁基甲锡烷基。适宜的有机金属催化剂包括钯(0)复合物,如四(三苯基膦)钯(0),或三(二亚苄基丙酮)二钯(0)和适宜的三芳基膦或三芳基胂配体,如三苯基膦、三(邻甲苯基)膦或三苯基胂的联合形式。适宜的溶剂包括惰性醚溶剂,如1,2-二甲氧基乙烷、四氢呋喃或1,4-二烷,或醇,如乙醇,或其混合物。如果式VII的化合物是烃基代硼酸,优选除了其它试剂外存在适宜的碱。适宜的碱包括碳酸钠、碳酸铯及氢氧化钡。该反应在温度0-120℃,并优选在温度60-120℃下进行。
其中D表示氧原子而E表示单键的式I的化合物,也可以由式VIII的有机金属化合物制备,该制备在适宜的有机金属催化剂和溶剂的存在下通过与式IX化合物的反应进行,其中J表示卤素或OSO2CF3。适宜的式VIII的化合物包括烃基代硼酸,其中M表示B(OH)2及有机锡化合物,其中M表示适宜的三烷基甲锡烷基基团,如三甲基甲锡烷基或三正丁基甲锡烷基。适宜的有机金属催化剂包括钯(0)复合物,如四(三苯基膦)钯(0),或三(二亚苄基丙酮)二钯(0)和适宜的三芳基膦或三芳基胂配体的联合形式,如三苯基膦、三(邻甲苯基)膦或三苯基胂的联合形式。适宜的溶剂包括惰性醚溶剂,如1,2-二甲氧基乙烷,四氢呋喃或1,4-二烷,或醇,如乙醇,或其混合物。如果式VIII的化合物是烃基代硼酸,则优选除其它试剂外存在适宜的碱。适宜的碱包括碳酸钠、碳酸铯及氢氧化钡。该反应在温度0-120℃,并优选在温度60-120℃下进行。
其中D表示氧原子而E表示单键的式I的化合物,也可以由式X的化合物通过与式XI的适宜化合物反应来制备,其中L表示适宜的离去基,该反应使用适宜的酰化方法。适宜的离去基L包括:OH、卤素、O-烷基、O-芳基、OCO-烷基、OCO-芳基。适宜的酰化方法包括在0-120℃下在适宜的溶剂中用式XI的化合物处理式X的化合物。为了发生反应,碱的存在或当Y=OH时偶联剂的存在,也是必需的。用于该反应的适宜的碱包括:4-(N,N-二甲基氨基)吡啶,吡啶,三乙胺,N,N-二异丙基乙胺。优选的碱是N,N-二异丙基乙胺。当L=OH时适宜的偶联剂包括:碳二亚胺,如1,3-二环己基碳二亚胺或1-(3-二甲基氨基丙基-3-乙基碳二亚胺盐酸盐;试剂,如苯并三唑-1-基氧基三(二甲基氨基)六氟磷酸盐或苯并三唑-1-基氧基三(1-吡咯烷基)六氟磷酸盐;及脲试剂,如O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。优选的偶联剂是O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。
反应用的适宜的溶剂包括N,N-二甲基甲酰胺,二甲基亚砜,四氢呋喃或氟仿。优选的溶剂是N,N-二甲基甲酰胺。该反应优选在温度0-50℃并首选温度20-30℃下进行。
其中D表示硫原子而E表示单键的式I的化合物可以由其中D表示氧原子而E表示单键的式I的化合物通过与适宜的硫化物在适宜的溶剂中反应来制备。优选的硫化物是磷的硫化物,特别是4-甲氧基苯基硫羰基膦化硫二聚体(“Lawesson′s试剂”)及五硫化二磷。用于该反应的适宜的溶剂包括芳基烃溶剂,如甲苯或二甲苯。该反应在温度0-200℃,并优选在温度50-180℃下进行。
其中J表示卤素的式VI的某些化合物,可以由其中J表示氢原子的式VI的化合物通过与适宜的卤化试剂在适宜的溶剂中反应来制备。适宜的卤化试剂包括溴。适宜的溶剂包括乙酸。该反应优选在温度0-50℃,并首选温度0-25℃下进行。
其中J表示OSO2CF3的式VI的化合物,可以由其中J表示OH的式VI的化合物通过与三氟甲磺酸酐或其它三氟甲磺酰化试剂在碱和适宜的溶剂的存在下反应来制备。适宜的碱包括吡啶及2,6-二叔丁基吡啶。该反应优选在温度-78至120℃,并首选温度-78至0℃下进行。
其中J表示氢原子、卤素、OH或OSO2CF3的式VI的化合物,可以由式X的化合物通过与适宜的式XII的化合物,其中L表示适宜的离去基而J表示氢原子、卤素、OH或OSO2CF3,使用适宜的酰化方法反应来制备。适宜的离去基L包括:OH、卤素、O-烷基、O-芳基、OCO-烷基、OCO-芳基。适宜的酰化方法包括将式X的化合物用式XII的化合物在0-120℃下在适宜的溶剂中处理。碱的存在或者当L=OH时偶联剂的存在也可能是发生反应所必需的。该反应用适宜的碱包括:4-(N,N-二甲基氨基)吡啶、吡啶、三乙胺、N,N-二异丙基乙胺。优选的碱是N,N-二异丙基乙胺。当Y=OH时适宜的偶联剂包括:碳二亚胺,如1,3-二环己基碳二亚胺或1-(3-二甲基氨基丙基-3-乙基碳二亚胺盐酸盐;试剂,如苯并三唑-1-基氧基三(二甲基氨基)六氟磷酸盐或苯并三唑-1-基氧基三(1-吡咯烷基)六氟磷酸盐;及脲试剂,如O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。优选的偶联剂是O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。用于该反应的适宜的溶剂包括N,N-二甲基甲酰胺、二甲基亚砜、四氢呋喃或氯仿。优选的溶剂是N,N-二甲基甲酰胺。该反应优选在温度0-50℃,并首选温度20-30℃下进行。
其中M表示B(OH)2的式VIII的化合物可以由其中J表示氢原子、卤素或OSO2CF3的式VI的化合物通过本领域技术人员已知的方法来制备。例如其中J表示氢原子或卤素的式VI的化合物可以转变为其中M表示B(OH)2的式VIII的化合物,即通过转变为相应的芳基锂或芳基镁化合物,接着通过与硼酸三甲酯反应,并随后将所得硼酸酯水解。此反应在适宜的惰性溶剂,例如,四氢呋喃中进行。或者,其中J表示卤素或OSO2CF3的式VI的化合物可以转变为其中M表示B(OH)2的式VIII的化合物,即通过与双(频哪醇合)二硼和有机金属催化剂反应,接着将所得硼酸酯水解。进行此类转变的典型方法见,例如,OrganicSyntheses,1963,Coll.Vol.4,68;J.Org.Chem.1995,60,7508。
其中M表示三烷基甲锡烷基基团的式VIII的化合物可以由其中J表示氢原子、卤素或OSO2CF3的式VI的化合物,通过本领域技术人员已知的方法来制备。例如其中J表示氢原子或卤素的式VI的化合物可以转变为其中M表示三烷基甲锡烷基基团的式VIII的化合物,即通过转变为相应的芳基锂或芳基镁化合物,接着与适当的三烷基甲锡烷基卤化物反应。此反应在适宜的惰性溶剂,例如,四氢呋喃中进行。此反应在温度-78℃至20℃,优选在-78℃至0℃下进行。或者,其中J表示卤素或OSO2CF3的式VI的化合物可以转变为其中M表示三烷基甲锡烷基基团的式VIII的化合物,即通过与适当的双(三烷基锡)反应。此反应在适宜的惰性溶剂如四氢呋喃中,在适宜的有机金属催化剂如四(三苯基膦)存在下进行。该反应在温度0℃至150℃,优选在20℃至100℃下进行。
式VIII的化合物,其中M表示B(OH)2或三烷基甲锡烷基基团,可以由式X的化合物通过与适宜的式XIII的化合物反应来制备,其中L表示适宜的离去基,M表示B(OH)2或三烷基甲锡烷基基团,该制备使用适宜的酰化方法。适宜的离去基L包括:OH、卤素、O-烷基、O-芳基、OCO-烷基、OCO-芳基。适宜的酰化方法包括将式X的化合物用式XIII的化合物在0-120℃下在适宜的溶剂中处理。碱的存在或当L=OH时偶联剂的存在,也可能对发生此反应是必需的。该反应用适宜的碱包括:4-(N,N-二甲基氨基)吡啶、吡啶、三乙胺、N,N-二异丙基乙胺。优选的碱是N,N-二异丙基乙胺。当L=OH时适宜的偶联剂包括:碳二亚胺,如1,3-二环己基碳二亚胺或1-(3-二甲基氨基丙基-3-乙基碳二亚胺盐酸盐;试剂,如苯并三唑-1-基氧基三(二甲基氨基)六氟磷酸盐或苯并三唑-1-基氧基三(1-吡咯烷基)六氟磷酸盐;及脲试剂,如O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。优选的偶联剂是O-苯并三唑基-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。用于该反应的适宜的溶剂包括N,N-二甲基甲酰胺、二甲基亚砜、四氢呋喃或氯仿。优选的溶剂是N,N-二甲基甲酰胺。该反应优选在温度0-50℃,并首选温度20-30℃下进行。
式XI的化合物可以由式XII的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar1与环Ar2键形成的位置,与适当的式VII的有机金属化合物在适宜的有机金属催化剂和溶剂的存在下反应来制备。适宜的式VII的化合物包括烃基代硼酸,其中M表示B(OH)2和有机锡化合物,其中M表示适宜的三烷基甲锡烷基基团,如三甲基甲锡烷基或三正丁基甲锡烷基。适宜的有机金属催化剂包括钯(0)复合物,如四(三苯基膦)钯(0),或三(二亚苄基丙酮)二钯(0)和适宜的三芳基膦或三芳基胂配体,如三苯基膦、三(邻甲苯基)膦或三苯基胂的联合形式。适宜的溶剂包括惰性醚溶剂,如1,2-二甲氧基乙烷、四氢呋喃或1,4-二烷,或醇,如乙醇,或其混合物。如果式VII的化合物是烃基代硼酸,则优选除其它试剂外存在适宜的碱。适宜的碱包括碳酸钠、碳酸铯及氢氧化钡。该反应在温度0-120℃,并优选在温度60-120℃下进行。
式XI的化合物还可以由式XIII的有机金属化合物通过与其中J表示卤素或OSO2CF3的式IX的化合物在适宜的有机金属催化剂和溶剂的存在下反应来制备。适宜的式XIII的化合物包括烃基代硼酸,其中M表示B(OH)2和有机锡化合物,其中M表示适宜的三烷基甲锡烷基基团,如三甲基甲锡烷基或三正丁基甲锡烷基。适宜的有机金属催化剂包括钯(0)复合物,如四(三苯基膦)钯(0),或三(二亚苄基丙酮)二钯(0)和适宜的三芳基膦或三芳基胂配体,如三苯基膦、三(邻甲苯基)膦或三苯基胂的联合形式。适宜的溶剂包括惰性醚溶剂,如1,2-二甲氧基乙烷、四氢呋喃或1,4-二烷,或醇,如乙醇,或其混合物。如果式VIII的化合物是烃基代硼酸,则优选除其它试剂外存在适宜的碱。适宜的碱包括碳酸钠、碳酸铯及氢氧化钡。该反应在温度0-120℃,并优选在温度60-120℃下进行。
式VII的化合物和式XIII的化合物可以商购,或可以通过本领域技术人员已知的反应制备。具体地讲,将芳基卤化物或杂芳基卤化物转变为芳基或杂芳基烃基代硼酸或芳基或杂芳基三烷基氢化锡是本领域技术人员已知的方法,提供了将其中J表示卤素的式IX的化合物转变为式VII的化合物及其中J表示卤素的式XII的化合物转变为式XIII的化合物的方法。例如,烃基代硼酸可以由芳基或杂芳基卤化物通过转变为芳基锂或芳基镁化合物,接着与硼酸三甲酯反应来合成,或通过与双(频哪醇合)二硼和有机金属催化剂反应,接着水解所得硼酸酯来合成(见,例如,Organic Syntheses,1963,Coll.Vol.4,68;J.Org.Chem.1995,60,7508)。三烷基氢化锡可以由芳基或杂芳基卤化物通过转变为芳基锂或芳基镁化合物,接着与适当的氯三烷基锡反应来合成,或通过与适当的双(三烷基锡)和有机金属催化剂反应来合成。
式I的化合物,其中E表示氧原子、硫原子或NR10,可以按照方案2给出的方法来制备。
方案2
式I的化合物,其中D表示氧原子而E表示NR10,可以由式VI的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar1和环Ar2键形成的位置,通过与其中EH表示NHR10的适当的式XIV的胺反应来制备。此反应可以通过在惰性有机溶剂中在适宜的强碱的存在下加热进行。
适宜的惰性溶剂包括醚溶剂,如四氢呋喃、1,4-二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,烃溶剂,如苯或甲苯,或酰胺溶剂,如二甲基甲酰胺,或N-甲基-2-吡咯烷酮。优选的溶剂是四氢呋喃。适宜的强碱包括碱金属醇化物或胺化物碱,如叔丁醇钠或叔丁醇钾,双(三甲基甲硅烷基)胺化锂或二异丙基胺化锂。优选的强碱是叔丁醇钠。此反应可能需要并优选在有机金属催化剂的存在下进行。适宜的有机金属催化剂包括钯(0)与适宜的膦配体的复合物,优选三芳基膦配体并首选二配位基三芳基膦配体。优选的配体包括2,2′-双(二苯基膦基)-1,1′-联萘基或1,1′-双(二苯基膦基)二茂铁。此催化剂可以通过将适宜钯(0)源,如三(二亚苄基丙酮)二钯(0),与膦配体结合来合成,并可以事先合成和通过将钯源和膦配体加到此反应混合物中就地合成。该反应在温度0-150℃,并优选在温度60-120℃下进行。
式I的化合物,其中D表示氧原子而E表示NR10,可以由式IX的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar2与氮原子成键的位置,通过与其中EH表示NHR10的适当的式XV的胺反应来制备。此反应可以通过在惰性有机溶剂中在适宜的强碱的存在下加热进行。适宜的惰性溶剂包括醚溶剂,如四氢呋喃、1,4-二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,烃溶剂,如苯或甲苯,或酰胺溶剂,如二甲基甲酰胺,或N-甲基-2-吡咯烷酮。优选的溶剂是四氢呋喃。适宜的强碱包括碱金属醇化物或胺化物碱,如叔丁醇钠或叔丁醇钾,双(三甲基甲硅烷基)胺化锂或二异丙基胺化锂。优选的强碱是叔丁醇钠。此反应可能需要并优选在有机金属催化剂的存在下进行。适宜的有机金属催化剂包括钯(0)与适宜的膦配体的复合物,优选三芳基膦配体并首选二配位基三芳基膦配体。优选的配体包括2,2′-双(二苯基膦基)-1,1′-联萘基或1,1′-双(二苯基膦基)二茂铁。此催化剂可以通过将钯(0)的适宜来源,如三(二亚苄基丙酮)二钯(0),与膦配体混合来合成并可以事先合成和通过将钯来源和膦配体加到此反应混合物中就地合成。该反应在温度0-150℃,并优选在温度60-120℃下进行。
式I的化合物,其中D表示氧原子而E表示氧原子或硫原子,可以由式VI的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar1与氧原子成键的位置,通过与其中EH表示OH或SH的适当的式XIV的化合物反应来制备。此反应可以通过在惰性溶剂中在适宜的碱的存在下加热进行。此反应可能需要并优选在催化剂的存在下进行。适宜的惰性溶剂包括醚溶剂,如四氢呋喃、1,4-二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,酰胺溶剂,如二甲基甲酰胺,或N-甲基-2-吡咯烷酮,或碱性杂环芳族溶剂,如吡啶。优选的溶剂是吡啶。适宜的碱包括碱金属醇化物,或碱金属碳酸盐,如碳酸钾。适宜的有机金属催化剂包括铜或其盐,优选铜(I)盐并首选碘化铜(I)。该反应在温度0-150℃,并优选在温度100-150℃下进行。
式I的化合物,其中D表示氧原子而E表示氧原子或硫原子,还可以由式IX的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar2与氮原子成键的位置,通过与其中EH表示OH或SH的适当的式XV的化合物反应来制备。此反应可以通过在惰性溶剂中在适宜的碱的存在下加热进行。此反应可能需要并优选在催化剂的存在下进行。适宜的惰性溶剂包括醚溶剂,如四氢呋喃、1,4二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,酰胺溶剂,如N,N-二甲基甲酰胺,或N-甲基吡咯烷酮,或碱性杂环芳族溶剂,如吡啶。优选的溶剂是吡啶。适宜的碱包括碱金属醇化物,或碱金属碳酸盐,如碳酸钾。适宜的有机金属催化剂包括铜或其盐,优选铜(I)盐并首选碘化铜(I)。该反应在温度0-150℃,并优选在温度100-150℃下进行。
式I的化合物,其中D表示氧原子而E表示氧原子、硫原子或NR10,还可以由式X的化合物与其中E表示氧原子、硫原子或NR10而L表示适宜的离去基的适宜的式XVI的化合物反应来制备,该制备使用适宜的酰化方法。适宜的离去基L包括:OH、卤素、O-烷基、O-芳基、OCO-烷基、OCO-芳基。适宜的酰化方法包括将式X的化合物用式XI的化合物在0-120℃下在适宜的溶剂中处理。碱的存在或当Y=OH时偶联剂的存在,也可能对发生此反应是必需的。该反应用适宜的碱包括:4-(N,N-二甲基氨基)吡啶、吡啶、三乙胺、N,N-二异丙基乙胺。优选的碱是N,N-二异丙基乙胺。当L=OH时适宜的偶联剂包括:碳二亚胺,如1,3-二环己基碳二亚胺或1-(3-二甲基氨基丙基-3-乙基碳二亚胺盐酸盐;试剂,如苯并三唑-1-基氧基三(二甲基氨基)六氟磷酸盐或苯并三唑-1-基氧基三(1-吡咯烷基)六氟磷酸盐;及脲试剂,如O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。优选的偶联剂是0-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。用于该反应的适宜的溶剂包括N,N-二甲基甲酰胺、二甲基亚砜、四氢呋喃或氯仿。优选的溶剂是N,N-二甲基甲酰胺。该反应优选在温度0-50℃,并首选温度20-30℃下进行。
式XV的化合物,其中EH表示OH、SH或NHR10可以由式X的化合物通过与适宜的式XVII的化合物使用适宜的酰化反应来制备,其中L表示适宜的离去基而EH表示OH、SH或NHR10。适宜的离去基L包括:OH、卤素、O-烷基、O-芳基、OCO-烷基、OCO-芳基。适宜的酰化方法包括将式Xd化合物用式XVII的化合物在0-120℃下在适宜的溶剂中处理。碱的存在或当L=OH时偶联剂的存在,也可能对发生此反应是必需的。该反应用适宜的碱包括:4-(N,N-二甲基氨基)吡啶、吡啶、三乙胺、N,N-二异丙基乙胺。优选的碱是N,N-二异丙基乙胺。当L=OH时适宜的偶联剂包括:碳二亚胺,如1,3-二环己基碳二亚胺或1-(3-二甲基氨基丙基-3-乙基碳二亚胺盐酸盐;试剂,如苯并三唑-1-基氧基三(二甲基氨基)六氟磷酸盐或苯并三唑-1-基氧基三(1-吡咯烷基)六氟磷酸盐;及脲试剂,例如,O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。优选的偶联剂是O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐。用于该反应的适宜的溶剂包括N,N-二甲基甲酰胺、二甲基亚砜、四氢呋喃或氯仿。优选的溶剂是N,N-二甲基甲酰胺。该反应优选在温度0-50℃,并首选温度20-30℃下进行。
其中E表示NR10而R10表示烷基的式I、XIV、XV或XVII的化合物,可以由R10表示氢原子的相应通式的化合物通过适当的烷基化方法来制备。典型的烷基化方法包括用适当的烷基卤化物或磺酸酯和碱如氢化钠在适宜的溶剂如N,N-二甲基甲酰胺中处理,或用适当的醛或酮与适宜的还原剂在酸性催化剂的存在下并在惰性溶剂中进行还原烷基化反应。适宜的还原剂包括硼氢化钠和氰基硼氢化钠。优选的还原剂是硼氢化钠。适宜的惰性溶剂包括水、甲醇或乙醇。优选的溶剂是甲醇。适宜的酸催化剂包括乙酸或氯化锌。优选的酸催化剂是乙酸。此反应通常在温度0-100℃并优选在20-65℃下进行。
式I、XIV、XV或XVII的化合物,其中E表示NR10而R10表示芳基或杂芳基,可以由其中R10表示氢原子的相应通式的化合物通过与适当的芳族和杂芳族卤化物或三氟甲磺酸酯反应来制备。此反应可以通过在惰性有机溶剂中在适宜的强碱的存在下加热进行。适宜的惰性溶剂包括醚溶剂,如四氢呋喃、1,4-二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,烃溶剂,如苯或甲苯,或酰胺溶剂,如N,N-二甲基甲酰胺,或N-甲基-2-吡咯烷酮。优选的溶剂是四氢呋喃。适宜的强碱包括碱金属醇化物或胺化物碱,如叔丁醇钠或叔丁醇钾、双(三甲基甲硅烷基)胺化锂或二异丙基胺化锂。优选的强碱是叔丁醇钠。此反应可能需要并优选在有机金属催化剂的存在下进行。适宜的有机金属催化剂包括钯(0)与适宜的膦配体的复合物,优选三芳基膦配体并首选二配位基三芳基膦配体。优选的配体包括2,2′-双(二苯基膦基)-1,1′-联萘基或1,1′-双(二苯基膦基)二茂铁。此催化剂可以通过将钯(0)的适宜来源,如三(二亚苄基丙酮)二钯(0),与膦配体混合来合成,并可以事先合成和通过将钯来源和膦配体加到此反应混合物中就地合成。该反应在温度0-150℃,并优选在温度60-120℃下进行。
式I的化合物,其中D表示硫原子而E表示氧原子或NR10,可以由式I的化合物,其中D表示氧原子而E表示氧原子或NR10,通过与适宜的硫化物在适宜的溶剂中反应来制备。优选的硫化物为磷的硫化物,特别是4-甲氧基苯基硫羰基膦化硫二聚体(“Lawesson′s试剂”)及五硫化二磷。用于该反应的适宜的溶剂包括芳基烃溶剂,如甲苯或二甲苯。该反应在温度0-200℃,并优选在温度50-180℃下进行。
式XVI的化合物,其中D表示氧原子而E表示NR10,可以由式XII的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar1和环Ar2成键的位置,通过与其中EH表示NHR10的式XIV的适当的胺反应来制备,或者,由其中EH表示NHR10的式XVII的化合物通过与适当的式IX的化合物反应来制备,其中J表示卤素或OSO2CF3取代基,其在环Ar2与氮原子成键的位置。此反应可以通过在惰性有机溶剂中在适宜的强碱的存在下加热进行。适宜的惰性溶剂包括醚溶剂,如四氢呋喃、1,4-二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,烃溶剂,如苯或甲苯,或酰胺溶剂,如N,N-二甲基甲酰胺,或N-甲基-2-吡咯烷酮。优选的溶剂是四氢呋喃。适宜的强碱包括碱金属醇化物或胺化物碱,如叔丁醇钠或叔丁醇钾,双(三甲基甲硅烷基)胺化锂或二异丙基胺化锂。优选的强碱是叔丁醇钠。此反应可能需要并优选在有机金属催化剂的存在下进行。适宜的有机金属催化剂包括钯(0)与适宜的膦配体的复合物,优选三芳基膦配体并首选二配位基三芳基膦配体。优选的配体包括2,2′-双(二苯基膦基)-1,1′-联萘基或1,1′-双(二苯基膦基)二茂铁。此催化剂可以通过将钯(0)的适宜来源,如三(二亚苄基丙酮)二钯(0),与膦配体混合来合成,并可以事先合成和通过将钯来源和膦配体加到此反应混合物中就地合成。该反应在温度0-150℃,并优选在温度60-120℃下进行。
式XVI的化合物,其中D表示氧原子而E表示氧原子或硫原子,可以由式XII的化合物,其中J表示卤素或OSO2CF3取代基,其在环Ar1与氧原子或硫原子成键的位置,通过与其中EH表示OH或SH的适当的式XIV的化合物反应来制备,或者,由式XVII的化合物,其中EH表示OH或SH,通过与适当的式IX的化合物反应来制备,其中J表示卤素或OSO2CF3取代基,其在环Ar2与氧原子或硫原子成键的位置。此反应可以通过在惰性溶剂中在适宜的碱的存在下加热进行。此反应可能需要并优选在催化剂的存在下进行。适宜的惰性溶剂包括醚溶剂,如四氢呋喃,1,4-二烷、1,2-二甲氧基乙烷或二(2-甲氧基乙基)醚,酰胺溶剂,如N,N-二甲基甲酰胺,或N-甲基-2-吡咯烷酮,或碱性杂环芳族溶剂,如吡啶。优选的溶剂是吡啶。适宜的碱包括碱金属醇化物或碱金属碳酸盐,如碳酸钾。适宜的有机金属催化剂包括铜或其盐,优选铜(I)盐并首选碘化铜(I)。该反应在温度0-150℃,并优选在温度100-150℃下进行。
式IX、X及XII、XIV以及XVII的化合物是文献中已知的,它们可以商购或可以按照本领域技术人员已知的方法制备。
本领域技术人员应领会本发明化合物上的某些芳族取代基可以通过使用芳基取代反应来引入,或者通过官能基转化以修饰存在的取代基,或者二者结合。这些反应可以在上述方法前进行或在上述方法后立即进行,并作为本发明方法内容的一部分包括在本发明内。这些反应的试剂和反应条件是本领域已知的。可以使用的方法的特定实例包括但不限于芳环的亲电官能基化,如通过硝基化、卤化和酰化反应;将硝基转变为氨基,如通过还原反应,如通过催化氢化反应;氨基和羟基的酰化反应、烷基化反应、磺酰基化反应;通过转变为中间体重氮盐,接着通过重氮盐的亲核或游离基取代反应,用其它官能基置换氨基;或通过例如亲核或有机金属催化取代反应,用其它官能基取代卤素。
如果需要,可以用Greene和Wuts所著的标准教科书“Protectinggroups in Organic Synthesis”(第3版,1999)中所述保护基来保护羟基、氨基或其它反应性基团。
所述反应,除非另行说明,一般在约1至3个大气压下进行,优选在常压(约一个大气压下)进行。
除非另行说明,上述反应在惰性气体中进行,优选在氮气氛下进行。
通过标准技术可以从其反应混合物中分离本发明的化合物和中间体。
可以提及的式I化合物的酸加成盐,包括无机酸盐,如盐酸盐和氢溴酸盐;及与有机酸形成的盐,如甲酸盐、乙酸盐、马来酸盐、苯甲酸盐、酒石酸盐及富马酸盐。
式I化合物的酸加成盐可以通过其游离碱或盐、对映体或被保护的衍生物,与一个或多个当量的适当的酸反应来制备。此反应可以在溶剂或该盐不溶解的介质中进行,或者在该盐溶解的溶剂中进行,例如,水、二烷、乙醇、四氢呋喃或乙醚,或溶剂的混合物,它们可以在真空下或通过冻干除去。此反应可以是复分解反应或可以在离子交换树脂上进行。
式I的化合物存在互变异构体或对映异构体形式,所有这些包括在本发明的范围内。可以用常规技术,如分级结晶或手性HPLC,分离该化合物的外消旋混合物来分离多种光学异构体。或者,在不引起外消旋化的条件下反应,通过适当的旋光性起始物的反应来制备单一的对映异构体。
中间体
本发明的另一方面涉及中间体。有价值的中间体是方案1中式VI化合物。这些中间体用于合成式I的化合物,但是它们的用途不限于合成这些化合物。例如,式VI的化合物作为乙酰胆碱受体的配体是有活性的,因此,其具有式I化合物所述的用途。
因此,本发明还提供了式VI的化合物或其对映异构体及其药用盐:
其中:
Ar1表示苯、呋喃或噻吩环;
J表示卤素或OSO2CF3,其条件是当Ar1表示苯环时,J只能表示在甲酰胺基团的间或对位的溴、碘或OSO2CF3。
本发明此方面优选的化合物包括如下化合物:
N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(3-碘苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-碘苯甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-3-甲酰胺);或其对映异构体及其药用盐。
本发明此方面特别优选的化合物包括如下化合物:
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺);
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-碘苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-碘苯甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-3-甲酰胺);或其对映异构体及其药用盐。
中间体化合物也存在对映体形式并可以以纯对映体、外消旋体或其混合物的形式使用。
药物组合物
本发明的另一个方面涉及治疗或预哺乳动物优选人的、如下列举的、由于烟碱性乙酰胆碱受体神经传递功能障碍引起的病症或疾病的药物组合物,其中含有与惰性药用稀释剂或载体混合的、治疗或预防这些疾病或病症有效量的式I的化合物、其对映异构体或其药用盐。
对于上述用途,使用的剂量当然应随所用化合物、给药方式和需要的治疗而变化。但是,一般来说,当以约0.1mg至约20mg每千克动物体重的剂量给药时会有满意的效果,优选以均分剂量每天给药1至4次,或者以缓释的形式。对于男性,总日剂量位5mg至1,400mg,更优选10mg至100mg,及含有与固体或液体药用载体或稀释剂混合的2mg至1400mg的该化合物的适于口服的单位剂型。
式I的化合物,或其对映异构体及其药用盐,本身或以适当的药物制剂的形式用于肠道或非肠道给药。按照本发明的另一个方面,提供了药物组合物,其中含有与惰性药用稀释剂或载体混合的少于80%并更优选少于50%重量的本发明的化合物。
稀释剂和载体的实例为:对于片剂和锭剂:乳糖、淀粉、滑石、硬脂酸;对于胶囊:酒石酸和乳糖;对于注射溶液:水、醇、甘油、植物油;对于栓剂:天然和硬化油或腊。
还提供了制备此组合物的方法,其中包括将各组分混合。
实用性
本发明的另一个方面是本发明化合物、其对映异构体或其药用盐在制备治疗或预防下述疾病或病症之一的药物中的用途;以及治疗或预防上述疾病或病症之一的方法,其中包括给患者使用治疗有效量的本发明的化合物、或其对映异构体或或其药用盐。
本发明的化合物是烟碱性乙酰胆碱受体的激动剂。尽管不受理论的限制,还是相信α7nAChR(烟碱性乙酰胆碱受体)亚型的激动剂可用于治疗或预防精神病和智力损害,并与同样用途的化合物或也是α4nAChR亚型的激动剂的化合物相比具有优越性。因此,优选选择性针对α7nAChR亚型的化合物。本发明的化合物被当作药物,特别是治疗或预防精神病和智力损害的药物。精神病的实例包括神经分裂症,躁狂和躁狂抑郁及焦虑。智力损害的实例包括早老性痴呆、学习能力缺陷、认识力缺陷、注意力缺陷、Lewy Body痴呆、记忆力丧失及注意力缺陷机能亢进病。本发明的化合物还可以在治疗疼痛(包括慢性疼痛)中用作止痛药,并用于治疗和预防帕金森氏病、杭廷顿氏舞蹈病、图雷特氏病及其中胆碱能突触损失的神经变性疾病。该化合物还适用于治疗或预防时差反应,用于诱导戒烟,并用于治疗或预防尼古丁成瘾(包括接触含尼古丁物品导致的)。
还相信本发明的化合物用于治疗和预防溃疡性结肠炎。
药理学
在如下给出的实验中,可以检测本发明化合物的药理活性:
试验A-对α7nAChR亚型的亲和性检验
125I-α-环蛇毒素(BTX)结合大鼠海马膜。将大鼠海马在20体积的冷匀化缓冲液(HB:组分的浓缩物(mM):三(羟基甲基)氨基甲烷50;MgCl2 1;NaCl 120;KCl 5:pH 7.4)中匀化。将匀浆以1000g离心5分钟,保留上清夜并再次萃取此颗粒。将收集的上清夜以12000g离心20分钟,洗涤并再悬浮于HB中。将膜(30-80μg)用5nM[125I]α-BTX、1mg/mL BSA(牛血清白蛋白)、被测药物以及2mM CaCl2或0.5mM EGTA[乙二醇-双((3-氨基乙基醚)]在21℃下孵育2小时,然后过滤并在Whatman玻璃纤维(厚度C)上用Brandel细胞收集器洗涤4次。将此过滤器用1%(BSA/0.01%PEI(聚乙烯亚胺)在水中预处理,其对于低过滤器空白(0.07%的总计数每分钟)来说是严格的。非特异性结合用100μM(-)-尼古丁来描述,而特异性结合一般为75%。
试验B-检测对α4nAChR亚型的亲合性检验
[3H]-(-)-尼古丁结合
用Martino-Barrows和Kellar改良的方法(Mol Pharm(1987)31:169-174),如[125I]α-BTX结合实验那样,匀化大鼠脑(皮质和海马),以12000xg离心20分钟,洗涤两次,然后再悬浮于含100μM氟代磷酸二异丙基酯的HB中。在4℃下,20分钟后,将膜(约0.5mg)与3nM[3H]-(-)-尼古丁、被测药物、1μM阿托品以及2mM CaCl2或0.5mMEGTA在4℃下孵育1小时,然后过滤并在Whatman玻璃纤维(厚度C)(用0.5%PEI预处理1小时)上用Brandel细胞收集器过滤。非特异性结合用100μM碳酸胆碱来描述,而特异性结合一般为84%。
试验A和B的结合数据分析
IC50值和假Hill系数(nH)用非线性曲线配置程序ALLFIT(DeLean A,Munson P J和Rodbard D(1977)Am.J.Physiol.,235:E97-E102)来计算。饱和曲线符合一点模型,用非线性回归程序ENZFITTER(Leatherbarrow,R.J.(1987)),得到125I-α-BTX和[3H]-(-)-尼古丁配体的KD值分别为1.67和1.70nM。用Cheng-Prusoff总方程评估Ki值:
Ki=[IC50]/((2+([配体]/KD])n)1/n-1)
其中每当nH<1.5时使用n=1的值,而当nH≥1.5时使用n=2的值。检测样品一式三份,且一般±5%。用6种或多种药物浓度检测Ki值。在实验A和实验B中,本发明的化合物的结合亲和力(Ki)小于10μM,这表明它们预计具有有利的治疗活性。
本发明的化合物优点是它们毒性小、更有效、作用时间更长、活性范围更宽、更强力、产生副作用较少,更易于吸收,或具有其它有利的药理学性质。
总的实验方法
商用试剂不经进一步纯化即可使用。质谱用Hewlett Packard5988A或MicroMass Quattro-1质谱仪记录,并对于母分子离子以m/z报告。室温指20-25℃。
实施例
下列实施例是优选的非限制性实例,它们使本发明的优选方案具体化。
中间体1
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)
将(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐(655mg)、5-溴呋喃-2-甲酸(681mg)、1-羟基苯并三唑水合物(457mg),O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐(1.069g)和N,N-二异丙基乙基胺(2.5mL)在N,N-二甲基甲酰胺(10mL)中的混合物,搅拌至得到均匀的溶液,然后室温下放置过夜。将此溶液蒸发并将此残余物在氢氧化钠水溶液和氯仿之间分配。用硫酸镁干燥此氯仿层,过滤并蒸发,并将此残余物在固相萃取柱中的硅胶上进行色谱纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂。再将此化合物溶解于四氢呋喃(20mL),加入过量的氯化氢(5mL;1M乙醚溶液),并将此溶液蒸发,并再用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为无色固体(538mg);MS(ES+)299,301(MH+)。
中间体2
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)
将(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐(4g)、5-溴噻吩-2-甲酸(4.25g)、1-羟基苯并三唑水合物(2.77g)、O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐(6.6g)和N,N-二异丙基乙基胺(14mL)在N,N-二甲基甲酰胺(100mL)中的混合物,室温下搅拌过夜。将此溶液蒸发并将此残余物在氢氧化钠水溶液和氯仿之间分配。用硫酸镁干燥此氯仿层,过滤并蒸发。将此残余物通过快速色谱在硅胶上纯化并用5%-20%3.5N充氨气甲醇/氯仿混合物洗脱。蒸发溶剂得到黄色固体(5.87g);MS(ES+)315,317(MH+)。
中间体3
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)
将(S)-N-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐(1.9g)、5-溴噻吩-2-甲酸(1.97g)、1-羟基苯并三唑水合物(1.28g)、O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐(3.06g)和N,N-二异丙基乙基胺(8.3mL)在N,N-二甲基甲酰胺(20mL)中的混合物,室温下搅拌过夜。将此溶液蒸发并将此残余物在氢氧化钠水溶液和氯仿之间分配。将此氯仿层干燥(硫酸镁),过滤并蒸发。将此残余物通过快速色谱在硅胶上纯化并用5%-20%3.5M充氨气甲醇/氯仿混合物洗脱。蒸发溶剂得到白色固体(3g);MS(ES+)315,317(MH+)。
中间体4
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)
按照类似于制备中间体1所述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐和3-溴苯甲酸制备;将此化合物在硅胶上通过色谱纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂。再将此化合物溶解于四氢呋喃,加入过量的氯化氢(1M乙醚溶液)并将此溶液蒸发,并再用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为无色固体;MS(ES+)309,311(MH)。
中间体5
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴苯甲酰胺)
按照类似于制备中间体1所述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐和4-溴苯甲酸制备;将此化合物在硅胶上通过色谱纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂。再将此化合物溶解于四氢呋喃,加入过量的氯化氢(1M乙醚溶液)并将此溶液蒸发,并再用甲醇/叔丁基甲基醚重结晶得到此标题化合物的盐酸盐,为无色固体;MS(ES+)309,311(MH+)。
中间体6
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-碘苯甲酰胺)
按照类似于制备中间体1所述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐和3-碘苯甲酸制备;此化合物在硅胶上通过固相萃取纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂,接着在WatersBondapakC18柱上进行反相HPLC,用梯度乙腈和0.1%三氟乙酸作为洗脱剂。将含产品的馏分蒸发,将此残余物溶解于甲醇,加入过量的氯化氢溶液(4M在1,4-二烷中)并将此溶液蒸发得到此标题化合物的盐酸盐,为无色固体;MS(ES+)357(MH+)。
中间体7
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-碘苯甲酰胺)
按照类似于制备中间体1所述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐和4-碘苯甲酸制备;此化合物在硅胶上通过固相萃取纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂,接着在WatersBondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行反相HPLC。将含产品的馏分蒸发,将此残余物溶解于甲醇,加入过量的氯化氢溶液(4M在1,4-二烷中)并将此溶液蒸发得到此标题化合物的盐酸盐,为无色固体;MS(ES+)357(MH+)。
中间体8
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺)
(A)4-溴噻吩-2-甲酸
将氧化铬(VI)(20g)和浓硫酸(32g)溶解于水(50mL)并在彻底溶解时,用水将体积加至100mL。在0℃下搅拌下,将55mL所得溶液滴加到4-溴噻吩-2-甲醛(19.1g)的丙酮(200mL)溶液中。2小时后,用水稀释此溶液并用氯仿萃取。有机萃取物经水洗涤,然后用氢氧化钠水溶液萃取。通过小心地加入浓盐酸将此碱性混合物酸化再用氯仿萃取。有机层再干燥(硫酸镁),过滤并蒸发。所得固体用乙醚/己烷重结晶得到无色固体;MS(ES+)207,209(MH+)。
(B)(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺)
按照类似于制备中间体1所述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐和4-溴噻吩-2-甲酸制备。将蒸发此反应混合物得到的残余物在盐酸和氯仿之间分配。水层再用氢氧化钠水溶液碱化并用氯仿萃取。将有机萃取物干燥(硫酸镁),过滤并蒸发并将所得固体用乙酸乙酯/己烷重结晶得到此标题化合物,为无色固体:MS(ES+)315,317(MH+)。
中间体9
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-3-甲酰胺)
(A)5-溴噻吩-3-甲酸
将存在于乙酸(200mL)中的溴(46.5g)滴加到噻吩-3-甲酸(38g)的乙酸(300mL)溶液中。加毕,室温下继续搅拌30分钟。将此反应混合物倒入到2000mL的冰/水中并收集沉淀的固体,用水重结晶得到无色固体;MS(ES-)205,207(MH+)。
(B)(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-3-甲酰胺)
按照类似于制备中间体1所述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐和5-溴噻吩-3-甲酸制备。此化合物通过反相HPLC在Waters BondapakC18柱上纯化,用梯度的乙腈和0.1%三氟乙酸作为洗脱剂。将含产品的馏分蒸发,残余物溶解于甲醇中,加入过量的氯化氢溶液(4M在1,4-二烷中)并将此溶液蒸发。真空干燥后,得到此标题化合物的盐酸盐,为无色固体;MS(ES+)315,317(MH+)。
实施例1
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基呋喃-2-甲酰胺)
将存在于1,2-二甲氧基乙烷(6mL)、乙醇(1.5mL)和水(1mL)的混合物中的(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)盐酸盐(100mg)、苯基硼酸(45mg)、四(三苯基膦)钯(0)(20mg)、碳酸铯(547mg)在氮气氛下回流搅拌17小时。将此溶液蒸发并将此残余物溶解于氯仿。将此溶液用碳酸钠水溶液洗涤并将有机层干燥(硫酸镁),过滤并蒸发。用1∶1充氨气的甲醇∶氯仿的梯度以及氯仿进行HPLC纯化,得到此标题化合物,为无色固体(63mg);MS(ES+)297(MH+)。
实施例2
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-氟苯硼酸,用四(三苯基膦)钯(0)和碳酸钠,在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过硅胶固相萃取柱过滤纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂再通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发溶剂得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)315(MH+)。
实施例3
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-噻吩基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和3-噻吩硼酸,用四(三苯基膦)钯(0)和碳酸钠,在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发溶剂得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)313(MH+)。
实施例4
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-苯基苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过快速色谱在硅胶上纯化并用3%-10%3.5N充氨气甲醇/氯仿混合物洗脱。蒸发溶剂得到此标题化合物,为无色固体;MS(ES+)307(MH+)。
实施例5
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-吡啶基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-1氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和吡啶-3-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)308(MH+)。
实施例6
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)313(MH+)。
实施例7
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-甲氧基苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和3-甲氧基苯基硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)337(MH+)。
实施例8
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-甲氧基苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和2-甲氧基苯基硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)337(MH+)。
实施例9
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-(N-乙酰基氨基)苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和3-(N-乙酰基氨基)苯基硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)364(MH+)。
实施例10
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-氟苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和3-氟苯硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)325(MH+)。
实施例11
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3-甲基苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和3-甲基苯基硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)321(MH+)。
实施例12
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-噻吩基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和2-噻吩硼酸,用四(三苯基膦)钯(0)、碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)(MH+)。
实施例13
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(3,5-二氯苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和3,5-二氯苯基硼酸、四(三苯基膦)钯(0)、碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)375,377MH+)。
实施例14
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(2-萘基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和2-萘硼酸、四(三苯基膦)钯(0)、碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)357(MH+)。
实施例15
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-(4-氟苯基)苯甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(3-溴苯甲酰胺)和4-氟苯基硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)325(MH+)。
实施例16
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和吡啶-3-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的二盐酸盐,为无色固体:MS(ES+)298(MH+)。
实施例17
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-噻吩基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-噻吩硼酸、四(三苯基膦)钯(0)、碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)303(MH+)。
实施例18
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-苯并[b]呋喃基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和苯并[b]呋喃-2-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和1%三氟乙酸水溶液作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)337(MH+)。
实施例19
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和吡啶-4-硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)298(MH+)。
实施例20
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-噻吩基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和2-噻吩硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)303(MH+)
实施例21
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-甲氧基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体:MS(ES+)327(MH+)。
实施例22
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-甲氧基苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和2-甲氧基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)327(MH+)。
实施例23
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和4-氟苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters Bondapak(E)C18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)315(MH+)。
实施例24
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-萘基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和2-萘硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)347(MH+)。
实施例25
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲基苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-甲基苯基硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)311(MH+)。
实施例26
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-呋喃基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-呋喃硼酸,用四(三苯基膦)钯(0)和碳酸铯在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)287(MH+)。
实施例27
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-呋喃基)呋喃-2-甲酰胺)
将(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)(146mg)、2-(三正丁基甲锡烷基)呋喃(0.15mL)、三(二亚苄基丙酮)二钯(0)(13mg)、氯化锂(59mg)及三(邻甲苯基)膦(44mg)在1,2-二甲氧基乙烷(2mL)中的混合物在氮气氛下回流搅拌5小时。将此溶液过滤并蒸发。此化合物通过硅胶固相萃取柱过滤,用充氨气的甲醇/氯仿混合物作为洗脱剂进行纯化,再通过反相HPLC在WatersBondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体(59mg);MS(ES+)287(MH+)。
实施例28
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)呋喃-2-甲酰胺)
按照类似于实施例29描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和2-(三-正丁基甲锡烷基)吡啶制备。此化合物通过硅胶固相萃取柱过滤用充氨气的甲醇/氯仿混合物作为洗脱剂进行纯化,再通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的二盐酸盐,为淡黄色固体;MS(ES+)298(MH+)。
实施例29
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和吡啶-4-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH+)。
实施例30
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和吡啶-3-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH+)。
实施例31
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例27描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和2-(三-正丁基甲锡烷基)吡啶制备。此化合物通过硅胶固相萃取柱过滤用充氨气的甲醇/氯仿混合物作为洗脱剂进行纯化,再通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为淡黄色固体;MS(ES+)314(MH+)。
实施例32
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-(2-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例27描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺)和2-(三-正丁基甲锡烷基)吡啶制备。此化合物通过硅胶固相萃取柱过滤用充氨气的甲醇/氯仿混合物作为洗脱剂进行纯化,再通过反相HPLC在Waters BondapakC18柱用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的二盐酸盐,为淡黄色固体;MS(ES+)314(MH+)。
实施例33
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-(4-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺)和吡啶-4-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH+)。
实施例34
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-(3-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺)和吡啶-3-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH+)。
实施例35
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-(N-乙酰基氨基)苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中进行制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为黄色固体;MS(ES+)354(MH+)。
实施例36
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-硝基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在乙二醇二甲醚和水的混合物中进行制备。此化合物通过反相HPLC在Waters BondapakC18上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为黄色固体;MS(ES+)342(MH+)。
实施例37
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-三氟甲基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的盐酸盐,为无色固体;MS(ES+)365(MH+)。
实施例38
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-氯苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。真空干燥后,得到此标题化合物的盐酸盐,为无色固体;MS(ES+)331(MH+)。
实施例39
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-(N-乙酰基氨基)苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)370(MH+)。
实施例40
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-氟苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)331(MH+)。
实施例41
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-甲氧基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)343(NH+)。
实施例42
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-乙氧基苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-乙氧基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)357(MH+)。
实施例43
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3,5-二甲基异唑基-4-硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为无色固体;MS(ES+)316(MH+)。
实施例44
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3,5-二甲基异唑基-4-硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为无色固体;MS(ES+)332(MH+)。
实施例45
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-氨基苯基硼酸盐酸盐,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体:MS(ES+)328(MH+)。
实施例46
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-3-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-3-甲酰胺)和吡啶-3-硼酸,用四(三苯基膦)钯(0)及碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。然后蒸发含产物的馏分并将此残余物溶解于甲醇。加入过量的氯化氢溶液(1M在乙醚中)并将此溶液蒸发。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH+)。
实施例47
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氯苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-1氮杂双环[2.2.2]辛-3-基胺二盐酸盐和5-(4-氯苯基)糠酸制备;将此化合物在硅胶上通过色谱纯化,用充氨气的甲醇/氯仿混合物作为洗脱剂;MS(ES+)331,333(MH+)。
实施例48
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻唑-3-甲酰胺)
将(R)-N-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐(294mg)、2-(3-吡啶基)噻唑-4-甲酸(304mg)、1-羟基苯并三唑水合物(199mg)、O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐(473g)及N,N-二异丙基乙基胺(1.0mL)在N,N-二甲基甲酰胺(10mL)中的混合物,室温下搅拌过夜。将此溶液蒸发并将此残余物在氢氧化钠水溶液和氯仿之间分配。将此溶液蒸发并将此残余物通过反相HPLC在WatersBondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体(428mg);MS(ES+)315(MH+)。
实施例49
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻唑-3-甲酰胺)
将(R)-N-1-氮杂双环[2.2.2]辛-3-基胺二盐酸盐(236mg)、2-(4-吡啶基)噻唑-4-甲酸(243mg)、1-羟基苯并三唑水合物(159mg)、O-苯并三唑-1-基-N,N,N′,N′-四甲基脲四氟硼酸盐(379mg)及N,N-二异丙基乙基胺(0.82mL)在N,N-二甲基甲酰胺(10mL)中的混合物,室温下搅拌过夜。将此溶液蒸发并将此残余物在氢氧化钠水溶液和氯仿之间分配。将此溶液蒸发并将此残余物通过反相HPLC在WatersBondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体(428mg);MS(ES+)315(MH+)。
实施例50
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)噻吩-2-甲酰胺)
将甲醛(37%水溶液,0.18mL)加入到(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)-噻吩-2-甲酰胺)(92mg)的含1%乙酸的甲醇(5mL)溶液中。室温下30分钟后,加入氰基硼氢化钠(35mg)并将此反应混合物室温下搅拌1小时。将此溶液蒸发并将此残余物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体(54mg);MS(ES+)356(MH)。
实施例51
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(8-喹啉基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和8-喹啉硼酸、四(三苯基膦)钯(0)、碳酸钠在DME和水的混合物中制备。此化合物通过反相HPLC在WatersBondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)364(MH+)。
实施例52
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和吡啶-3-硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH)。
实施例53
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和吡啶-4-硼酸,用四(三苯基膦)钯(0)和碳酸钠在1,2-二甲氧基乙烷和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体;MS(ES+)314(MH+)。
实施例54
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)噻吩-2-甲酰胺)
按照类似于实施例27描述的方法,由(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和2-(三-正丁基甲锡烷基)吡啶。此化合物通过快速色谱纯化,用5%-20%3.5N充氨气的甲醇/氯仿混合物作为洗脱剂。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体:MS(ES+)314(MH+)
实施例55
(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(S)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和苯基硼酸,四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES)313(MH+)。
实施例56
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基噻吩-3-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-3-甲酰胺)和苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。蒸发含产物的馏分得到此标题化合物的三氟乙酸盐,为无色固体;MS(ES+)313(MH+)。
实施例57
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-苯基噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(4-溴噻吩-2-甲酰胺)和苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用乙酸乙酯重结晶得到此标题化合物的盐酸盐,为无色固体;MS(ES+)313(MH+)。
实施例58
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氰基苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-氰基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为无色固体;MS(ES+)338(MH)。
实施例59
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-甲基氨基)苯基)噻吩-2-甲酰胺)
将甲醇钠(14mL,0.5M甲醇溶液)加入到(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)噻吩-2-甲酰胺)(550mg)的甲醇(5mL)溶液中,然后加入低聚甲醛(117mg)。将此混合物加热回流1小时。将此反应混合物冷却至室温后,加入硼氢化钠(175mg),然后将此溶液加热回流2小时。加入氢氧化钾水溶液(1M,1.4mL)。再加热回流2小时,并将此反应混合物在室温下再放置16小时。蒸发溶剂并将此残余物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为无色固体(120mg);MS(ES+)342(MH+)。
实施例60
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-羟基苯基)噻吩-2-甲酰胺)
向(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)噻吩-2-甲酰胺)(900mg)中,加入48%氢溴酸水溶液(10mL)和冰乙酸(10mL)。加热回流4小时后,加入饱和碳酸钠水溶液和固体碳酸钠以调节pH为10。用氯仿萃取水层,并用硫酸镁干燥合并的萃取物。过滤并蒸发后,将残余物通过快速色谱纯化,用5%-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂。所得产物通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的盐酸盐,为无色固体(32mg);MS(ES+)329(MH+)。
实施例61
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基氨基)噻吩-2-甲酰胺)
将(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)(315mg)、3-氨基吡啶(188mg)、三(二亚苄基丙酮)二钯(0)(46mg)、外消旋-2,2′-双(二苯基膦基)-1,1′-联萘(62mg)及叔丁醇钠(192mg)在四氢呋喃(10mL)中的混合物,加热回流20小时。将此混合物过滤并将此残余物通过快速色谱纯化,用5%-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂。此化合物进一步通过反相HPLC在WatersBondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐,为黄色固体(77mg);MS(ES+)329(MH+)。
实施例62
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-氯苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过快速色谱纯化,用5%-20%3.5M充氨气甲醇/氯仿的梯度混合物作为洗脱剂得到此标题化合物,为无色固体;MS(ES+)347(MH+)。
实施例63
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(4-吗啉基)苯基)噻吩-2-甲酰胺)
将(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)噻吩-2-甲酰胺)(0.98g)、吗啉(0.5mL)、三(二亚苄基丙酮)二钯(0)(132mg)、外消旋-2,2′-双(二苯基膦基)-1,1′-联萘(180mg)和叔丁醇钠(554mg)在四氢呋喃(25mL)中的混合物,在氮气氛下加热回流20小时。将此混合物过滤并将此残余物通过快速色谱纯化,用5%-20%3.5M充氨气甲醇/氯仿的梯度混合物作为洗脱剂。然后,再将此混合物进行反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐固体(400mg);MS(ES+)398(MH+)。
实施例64
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(氨基甲基)苯基)噻吩-2-甲酰胺)
向(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氰基苯基)噻吩-2-甲酰胺)(311mg)的甲醇和乙酸(1∶1,10mL)溶液中,加入催化量的10%Pd-C并将此混合物在50p.s.i.下氢化36小时。将此混合物通过硅藻土垫过滤。先将此残余物通过快速色谱纯化,用5-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂,再通过反相HPLC在WatersBondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过将含产物的馏分碱化制备游离碱,用氯仿萃取,接着蒸发得到此标题化合物(23mg);MS(ES+)342(MH+)。
实施例65
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯氧基噻吩-2-甲酰胺)
向(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)(463mg)的吡啶(10mL)溶液中,加入苯酚(158mg)、碘化铜(32mg)和碳酸钾(97mg)。将此混合物在氮气氛、125℃下搅拌65小时。加入水并用氯仿萃取水层。蒸发后,将此残余物通过快速色谱纯化,用5-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂,然后通过反相HPLC在Waters BondapakC18柱上用梯度的乙腈和0.1%三氟乙酸作为洗脱剂进行纯化。通过将含产物的馏分碱化来制备游离碱,用氯仿萃取,接着蒸发得到此标题化合物(80mg);MS(ES+)329(MH+)。
实施例66
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴呋喃-2-甲酰胺)和3-氨基苯基硼酸,用四(三苯基膦)钯(0)和碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过快速色谱用5-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂进行纯化,然后通过反相HPLC在Waters BondapakC18柱上用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。通过将含产物的馏分碱化来制备游离碱,用氯仿萃取,接着蒸发得到此标题化合物;MS(ES+)312(MH+)。
实施例67
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)呋喃-2-甲酰胺)
向(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺)(220mg)的含1%乙酸的乙醇(10mL)溶液中,加入甲醛(0.26mL)。45分钟后,加入氰基硼氢化钠(89mg)。将此混合物搅拌4小时。加入水并通过加入固体碳酸钠将此溶液碱化至pH>10。用氯仿萃取水层并用硫酸镁干燥此萃取物,过滤并蒸发。此化合物通过快速色谱纯化,用5-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂。通过蒸发含产物的馏分,将此残余物溶解于甲醇,加入过量的氯化氢溶液(1M在乙醚中)并蒸发来制备盐酸盐。用甲醇/乙醚重结晶得到此标题化合物的二盐酸盐固体(141mg);MS(ES+)340(MH+)。
实施例68
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)-5-(3-甲酰基苯基)噻吩-2-甲酰胺)
按照类似于实施例1描述的方法,由(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-溴噻吩-2-甲酰胺)和3-甲酰基苯基硼酸、四(三苯基膦)钯(0)、碳酸钠在四氢呋喃、乙醇和水的混合物中制备。此化合物通过反相HPLC在Waters BondapakC18柱用梯度乙腈和0.1%三氟乙酸水溶液作为洗脱剂进行纯化。通过将含产物的馏分碱化来制备游离碱。用氯仿萃取水层并蒸发得到此标题化合物;MS(ES+)341(MH+)
实施例69
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(羟基甲基)苯基)噻吩-2-甲酰胺)
向(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲酰基苯基)噻吩-2-甲酰胺)(875mg)的甲醇(15mL)溶液中,加入硼氢化钠(97.2mg)。然后,将此混合物在室温下搅拌4小时。将此残余物在水和氯仿之间分配。将萃取物用硫酸镁干燥,过滤并蒸发,再将所得残余物通过快速色谱,用5-20%3.5M充氨气甲醇/氯仿混合物作为洗脱剂进行纯化,得到此标题化合物(547mg);MS(ES+)343(MH+)。
Claims (16)
1.式I的化合物或其对映异构体或其药用盐:
其中:
A是
D是氧原子或硫原子;
E是单键;
Ar1是含有1个氧原子的5元杂芳环;
Ar2是5或6元芳环或杂芳环,其中杂芳环含有1、2或3个选自氮原子、氧原子或硫原子的原子,其中氧原子或硫原子至多2个;或是8、9或10元稠合芳环或杂芳环系,其中含有1、2或3个氮原子、氧原子或硫原子,其中氧原子或硫原子至多2个;
其中芳环Ar1和Ar2被0、1、2或3个选自如下的取代基取代:卤素、C1-4烷基、CN、NO2、NR1R2、CH2NR1R2、OR3和CF3;但是如果Ar2是喹啉基,则Ar2被0、1、2或3个选自如下的取代基取代:C1-4烷基、CN、NO2、NR1R2、CH2NR1R2和OR2;
R1、R2和R3独立地是C1-4烷基、C(O)R5或C(O)NHR6;
j是2、3或4;
k是0、1或2;
R4、R6、R6、R7、R8、R9及R10独立地是C1-4烷基、芳基或杂芳基;
其条件是:
如果D代表氧原子,E代表单键,A代表:
且Ar2代表吡唑环,则该吡唑环上的所有的任选的取代基应是氢原子。
2.权利要求1所述的化合物,其中D表示氧原子。
3.权利要求1所述的化合物或其药用盐,其中Ar2表示苯基或5或6元杂芳环,其中杂芳环含有1、2或3个选自氮原子、氧原子或硫原子的原子,其中氧原子或硫原子不超过两个。
4.权利要求3所述的化合物,其中Ar2表示苯基、呋喃基、噻吩基或吡啶基。
5.权利要求4所述的化合物,其中Ar1被甲酰胺基或硫代甲酰胺基C(=D)NHA取代,但是再没有其它取代基。
6.权利要求5所述的化合物,其中Ar1上的-EAr2和甲酰胺基或硫代甲酰胺基C(=D)NHA取代基彼此是1,3-位关系。
7.权利要求4所述的化合物,其中Ar1或Ar2被0或1个选自如下的取代基取代:卤素、C1-4烷基、CN、NO2、NR1R2、CH2NR1R2、OR3和CF3。
8.权利要求1所述的化合物,其中Ar1表示呋喃基。
9.权利要求1所述的化合物,其中Ar1被甲酰胺基或硫代甲酰胺基C(=D)NHA取代,但是再没有其它取代基。
10.权利要求9所述的化合物,其中Ar1上的-EAr2和甲酰胺基或硫代甲酰胺基C(=D)NHA取代基彼此是1,3-位关系。
11.权利要求1所述的化合物,其中Ar1或Ar2被0或1个选自如下的取代基取代:卤素、C1-4烷基、CN、NO2、NR1R2、CH2NR1R2、OR3和CF3。
13.权利要求12所述的化合物或其对映异构体或其药用盐,其中Ar1表示呋喃环。
14.权利要求1所述的化合物或其药用盐,所述化合物选自如下:
N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-噻吩基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-苯并[b]呋喃基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-噻吩基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-甲氧基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-萘基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-呋喃基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-呋喃基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氯苯基)呋喃-2-甲酰胺);
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺),和
N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)呋喃-2-甲酰胺)。
15.权利要求1所述的化合物或其药用盐,所述化合物选自如下:
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-苯基呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-噻吩基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-苯并[b]呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-噻吩基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲氧基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-甲氧基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氟苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-萘基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-呋喃基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(2-吡啶基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N-乙酰基氨基)苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-硝基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-三氟甲基苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3,5-二甲基异唑-4-基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(4-氯苯基)呋喃-2-甲酰胺);
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-氨基苯基)呋喃-2-甲酰胺),和
(R)-N-(1-氮杂双环[2.2.2]辛-3-基)(5-(3-(N,N-二甲基氨基)苯基)呋喃-2-甲酰胺)。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE0000540-5 | 2000-02-18 | ||
| SE0000540A SE0000540D0 (sv) | 2000-02-18 | 2000-02-18 | New compounds |
| SE00005405 | 2000-02-18 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1400973A CN1400973A (zh) | 2003-03-05 |
| CN100345847C true CN100345847C (zh) | 2007-10-31 |
Family
ID=20278508
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB018049362A Expired - Fee Related CN100345847C (zh) | 2000-02-18 | 2001-02-15 | 新的联芳基甲酰胺 |
Country Status (34)
| Country | Link |
|---|---|
| US (3) | US7001914B2 (zh) |
| EP (1) | EP1259508B1 (zh) |
| JP (1) | JP4084570B2 (zh) |
| KR (1) | KR100769394B1 (zh) |
| CN (1) | CN100345847C (zh) |
| AR (1) | AR029798A1 (zh) |
| AT (1) | ATE252099T1 (zh) |
| AU (1) | AU782693B2 (zh) |
| BG (1) | BG106977A (zh) |
| BR (1) | BR0108456A (zh) |
| CA (1) | CA2397233A1 (zh) |
| CO (1) | CO5280046A1 (zh) |
| CZ (1) | CZ20022787A3 (zh) |
| DE (1) | DE60100996T2 (zh) |
| DK (1) | DK1259508T3 (zh) |
| EE (1) | EE05149B1 (zh) |
| ES (1) | ES2208556T3 (zh) |
| HK (1) | HK1050007A1 (zh) |
| HU (1) | HUP0301069A3 (zh) |
| IL (1) | IL150544A0 (zh) |
| IS (1) | IS6492A (zh) |
| MX (1) | MXPA02007543A (zh) |
| MY (1) | MY123580A (zh) |
| NO (1) | NO20023917L (zh) |
| NZ (1) | NZ520094A (zh) |
| PL (1) | PL202044B1 (zh) |
| PT (1) | PT1259508E (zh) |
| RU (1) | RU2263114C2 (zh) |
| SE (1) | SE0000540D0 (zh) |
| SK (1) | SK11792002A3 (zh) |
| TR (1) | TR200400072T4 (zh) |
| UA (1) | UA73540C2 (zh) |
| WO (1) | WO2001060821A1 (zh) |
| ZA (1) | ZA200205479B (zh) |
Families Citing this family (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE0000540D0 (sv) * | 2000-02-18 | 2000-02-18 | Astrazeneca Ab | New compounds |
| EP1381603A2 (en) | 2000-08-18 | 2004-01-21 | PHARMACIA & UPJOHN COMPANY | Quinuclidine-substituedaryl moieties for treatment of disease ( nicotinic acetylcholine receptor ligands ) |
| US6492385B2 (en) | 2000-08-18 | 2002-12-10 | Pharmacia & Upjohn Company | Quinuclidine-substituted heteroaryl moieties for treatment of disease |
| WO2002016357A2 (en) * | 2000-08-18 | 2002-02-28 | Pharmacia & Upjohn Company | Quinuclidine-substituted aryl moieties for treatment of disease (nicotinic acetylcholine receptor ligands) |
| US6492386B2 (en) * | 2000-08-18 | 2002-12-10 | Pharmacia & Upjohn Company | Quinuclidine-substituted aryl compounds for treatment of disease |
| US6599916B2 (en) | 2000-08-21 | 2003-07-29 | Pharmacia & Upjohn Company | Quinuclidine-substituted heteroaryl moieties for treatment of disease |
| EP1311505A2 (en) * | 2000-08-21 | 2003-05-21 | PHARMACIA & UPJOHN COMPANY | Quinuclidine-substituted heteroaryl moieties for treatment of disease ( nicotinic acetylcholine receptor ligands ) |
| AU2001282875A1 (en) | 2000-08-21 | 2002-03-04 | Pharmacia And Upjohn Company | Quinuclidine-substituted heteroaryl moieties for treatment of disease |
| PE20021019A1 (es) * | 2001-04-19 | 2002-11-13 | Upjohn Co | Grupos azabiciclicos sustituidos |
| AR036040A1 (es) | 2001-06-12 | 2004-08-04 | Upjohn Co | Compuestos de heteroarilo multiciclicos sustituidos con quinuclidinas y composiciones farmaceuticas que los contienen |
| AR036041A1 (es) | 2001-06-12 | 2004-08-04 | Upjohn Co | Compuestos aromaticos heterociclicos sustituidos con quinuclidina y composiciones farmaceuticas que los contienen |
| WO2003018585A1 (en) | 2001-08-24 | 2003-03-06 | Pharmacia & Upjohn Company | Substituted-heteroaryl-7-aza[2.2.1]bicycloheptanes for the treatment of disease |
| EP1425286B1 (en) * | 2001-09-12 | 2007-02-28 | Pharmacia & Upjohn Company LLC | Substituted 7-aza-[2.2.1]bicycloheptanes for the treatment of diseases |
| CZ2004408A3 (cs) | 2001-10-02 | 2005-03-16 | Pharmacia & Upjohn Company | Azabicyklicky substituované kondenzované heteroarylsloučeniny |
| EP1453828A2 (en) * | 2001-10-16 | 2004-09-08 | AstraZeneca AB | Azabicyclic compounds for the treatment of fibromyalgia syndrome |
| US6849620B2 (en) | 2001-10-26 | 2005-02-01 | Pfizer Inc | N-(azabicyclo moieties)-substituted hetero-bicyclic aromatic compounds for the treatment of disease |
| MXPA04003986A (es) * | 2001-10-26 | 2004-07-23 | Upjohn Co | Carboxamidas hetero-biciclicas n-azabiciclico sustituidas como agonistas nachr. |
| US6919359B2 (en) | 2001-11-08 | 2005-07-19 | Pfizer Inc | Azabicyclic-substituted-heteroaryl compounds for the treatment of disease |
| BR0214016A (pt) | 2001-11-09 | 2004-10-13 | Upjohn Co | Compostos azabicìclico-fenil-fundido heterocìclicos e seu uso como ligandos alfa 7 nachr |
| DE10156719A1 (de) * | 2001-11-19 | 2003-05-28 | Bayer Ag | Heteroarylcarbonsäureamide |
| DE10162375A1 (de) | 2001-12-19 | 2003-07-10 | Bayer Ag | Bicyclische N-Aryl-amide |
| DE10164139A1 (de) | 2001-12-27 | 2003-07-10 | Bayer Ag | 2-Heteroarylcarbonsäureamide |
| EP1480977A2 (en) | 2002-02-15 | 2004-12-01 | PHARMACIA & UPJOHN COMPANY | Substituted aryl compounds for treatment of disease |
| MXPA04008038A (es) | 2002-02-19 | 2004-11-26 | Upjohn Co | Carboxamidas heteroaromaticas biciclicas condensadas con puente de n para el tratamiento de enfermedades. |
| CA2476624A1 (en) | 2002-02-19 | 2003-08-28 | Pharmacia & Upjohn Company | Azabicyclic compounds for the treatment of disease |
| DE10211416A1 (de) | 2002-03-15 | 2003-09-25 | Bayer Ag | Essig- und Propionsäureamide |
| DE10211415A1 (de) * | 2002-03-15 | 2003-09-25 | Bayer Ag | Bicyclische N-Biarylamide |
| JP4542891B2 (ja) * | 2002-06-10 | 2010-09-15 | バイエル・シェーリング・ファルマ・アクチェンゲゼルシャフト | 2−ヘテロアリールカルボキサミド類 |
| WO2004013137A1 (en) | 2002-08-01 | 2004-02-12 | Pharmacia & Upjohn Company Llc | 1h-pyrazole and 1h-pyrrole-azabicyclic compounds with alfa-7 nachr activity |
| GB0220581D0 (en) | 2002-09-04 | 2002-10-09 | Novartis Ag | Organic Compound |
| PL377777A1 (pl) * | 2002-12-11 | 2006-02-20 | Pharmacia & Upjohn Company Llc | Leczenie chorób połączeniami agonistów receptora alfa 7-nikotynowego i innych związków |
| KR20050092777A (ko) * | 2003-01-22 | 2005-09-22 | 파마시아 앤드 업존 캄파니 엘엘씨 | 알파-7 nACh 수용체 전체 작용물질을 사용하는 질병의치료 |
| GB0310867D0 (en) * | 2003-05-12 | 2003-06-18 | Novartis Ag | Organic compounds |
| US20050129610A1 (en) * | 2003-06-24 | 2005-06-16 | Johns Hopkins University | Imaging agents and methods of imaging alpha7-nicotinic cholinergic receptor |
| DE10334724A1 (de) * | 2003-07-30 | 2005-02-24 | Bayer Healthcare Ag | N-Biarylamide |
| CN1914200A (zh) * | 2003-12-22 | 2007-02-14 | 阿斯利康(瑞典)有限公司 | 烟碱性乙酰胆碱受体配件 |
| JP2007515478A (ja) * | 2003-12-22 | 2007-06-14 | アストラゼネカ・アクチエボラーグ | ニコチン性アセチルコリンレセプターリガンド |
| PE20060437A1 (es) | 2004-06-18 | 2006-06-08 | Novartis Ag | COMPUESTOS AZA-BICICLONONANOS COMO LIGANDOS COLINERGICOS DE nAChR |
| GB0415746D0 (en) | 2004-07-14 | 2004-08-18 | Novartis Ag | Organic compounds |
| GB0424564D0 (en) | 2004-11-05 | 2004-12-08 | Novartis Ag | Organic compounds |
| WO2007001225A1 (en) * | 2005-06-29 | 2007-01-04 | Astrazeneca | Thiophene-2-carboxamide derivatives as alpha 7 nicotinic receptor modulators. |
| GB0521508D0 (en) | 2005-10-21 | 2005-11-30 | Novartis Ag | Organic compounds |
| GB0525673D0 (en) | 2005-12-16 | 2006-01-25 | Novartis Ag | Organic compounds |
| GB0525672D0 (en) | 2005-12-16 | 2006-01-25 | Novartis Ag | Organic compounds |
| JP4827986B2 (ja) | 2007-06-08 | 2011-11-30 | マンカインド コーポレ−ション | IRE−1αインヒビター |
| TW200911808A (en) * | 2007-07-23 | 2009-03-16 | Astrazeneca Ab | Novel compounds |
| SA08290475B1 (ar) | 2007-08-02 | 2013-06-22 | Targacept Inc | (2s، 3r)-n-(2-((3-بيردينيل)ميثيل)-1-آزا بيسيكلو[2، 2، 2]أوكت-3-يل)بنزو فيوران-2-كربوكساميد، وصور أملاحه الجديدة وطرق استخدامه |
| TW201031664A (en) | 2009-01-26 | 2010-09-01 | Targacept Inc | Preparation and therapeutic applications of (2S,3R)-N-2-((3-pyridinyl)methyl)-1-azabicyclo[2.2.2]oct-3-yl)-3,5-difluorobenzamide |
| BR112012008518A2 (pt) | 2009-10-13 | 2016-04-05 | Msd Oss Bv | derivado heterocíclico, e, composição farmacêutica |
| JP5749797B2 (ja) | 2010-05-17 | 2015-07-15 | フォルム ファーマシューティカルズ、インコーポレイテッド | (r)−7−クロロ−n−(キヌクリジン−3−イル)ベンゾ[b]チオフェン−2−カルボキサミド塩酸塩一水和物の結晶形 |
| KR101928505B1 (ko) * | 2011-01-28 | 2018-12-12 | 에스케이바이오팜 주식회사 | 피리돈 유도체 및 이를 포함하는 약학적 조성물 |
| KR101925971B1 (ko) * | 2011-01-28 | 2018-12-06 | 에스케이바이오팜 주식회사 | 피리돈 유도체 및 이를 포함하는 약학적 조성물 |
| GB201111704D0 (en) | 2011-07-07 | 2011-08-24 | Takeda Pharmaceutical | Novel compounds |
| GB201111705D0 (en) | 2011-07-07 | 2011-08-24 | Takeda Pharmaceutical | Compounds and their use |
| TWI589576B (zh) | 2011-07-15 | 2017-07-01 | 諾華公司 | 氮雜-雙環二芳基醚之鹽類及製造彼等或其前驅物之方法 |
| JO3115B1 (ar) | 2011-08-22 | 2017-09-20 | Takeda Pharmaceuticals Co | مركبات بيريدازينون واستخدامها كمثبطات daao |
| WO2013169646A1 (en) | 2012-05-08 | 2013-11-14 | Envivo Pharmaceuticals, Inc. | Methods of maintaining, treating or improving cognitive function |
| GB201209587D0 (en) | 2012-05-30 | 2012-07-11 | Takeda Pharmaceutical | Therapeutic compounds |
| CN105189482A (zh) | 2013-02-07 | 2015-12-23 | 武田药品工业株式会社 | 作为毒蕈碱m4受体激动剂的哌啶-1-基羧酸酯和氮杂卓-1-基羧酸酯 |
| AU2014282977B2 (en) | 2013-06-21 | 2018-06-14 | Takeda Pharmaceutical Company Limited | 1-sulfonyl piperidine derivatives as modulators of prokineticin receptors |
| GB201314286D0 (en) | 2013-08-08 | 2013-09-25 | Takeda Pharmaceutical | Therapeutic Compounds |
| GB201318222D0 (en) | 2013-10-15 | 2013-11-27 | Takeda Pharmaceutical | Novel compounds |
| GB201320905D0 (en) | 2013-11-27 | 2014-01-08 | Takeda Pharmaceutical | Therapeutic compounds |
| FI20145054L (fi) * | 2014-01-21 | 2015-07-22 | Tellabs Oy | Tiedonsiirtoverkon verkkoelementti |
| TW201613864A (en) | 2014-02-20 | 2016-04-16 | Takeda Pharmaceutical | Novel compounds |
| KR101623138B1 (ko) | 2014-10-28 | 2016-05-20 | 한국원자력연구원 | 베타 아밀로이드 플라크 검출 및 알츠하이머 질환 진단 또는 치료용 조성물 |
| GB201616839D0 (en) | 2016-10-04 | 2016-11-16 | Takeda Pharmaceutical Company Limited | Therapeutic compounds |
| GB201619514D0 (en) | 2016-11-18 | 2017-01-04 | Takeda Pharmaceuticals Co | Novel compounds |
| JP2021138648A (ja) | 2020-03-04 | 2021-09-16 | 武田薬品工業株式会社 | 経口固形製剤 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0190920A2 (en) * | 1985-02-04 | 1986-08-13 | Synthelabo | Method of enhancing memory or correcting memory deficiency with arylamido (and arylthioamido)azabicycloalkanes |
| EP0327335A1 (en) * | 1988-02-01 | 1989-08-09 | Synthelabo | Arylamido(and arylthioamido)-azabicycloalkanes for enhancing memory or correcting memory deficiency |
| JPH04247081A (ja) * | 1991-02-01 | 1992-09-03 | Takeda Chem Ind Ltd | 5員複素環酸アミド類 |
| EP0546181A1 (en) * | 1990-08-31 | 1993-06-16 | Nippon Shinyaku Company, Limited | Indole derivatives and their use as serotonin antagonists |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1416872A (en) * | 1972-03-10 | 1975-12-10 | Wyeth John & Brother Ltd | 4-aminoquinoline derivatives |
| FI791491A (fi) * | 1979-05-10 | 1980-11-11 | Kopo Konepohja Oy | Traebitshugg |
| FR2529548A1 (fr) * | 1982-07-02 | 1984-01-06 | Delalande Sa | Nouveaux derives de l'amino-3 quinuclidine, leur procede et leur application en therapeutique |
| SE9904176D0 (sv) | 1999-11-18 | 1999-11-18 | Astra Ab | New use |
| SE0000540D0 (sv) * | 2000-02-18 | 2000-02-18 | Astrazeneca Ab | New compounds |
| FR2809730B1 (fr) | 2000-05-31 | 2002-07-19 | Sanofi Synthelabo | Derives de 1,4-diazabicyclo[3.2.2] nonanebenzoxazole, -benzothiazole et -benzimidazole, leur preparation et leur application therapeutique |
| FR2809731B1 (fr) | 2000-05-31 | 2002-07-19 | Sanofi Synthelabo | Derives de 1,4-diazabicyclo-[3.2.2] nonane-pheylisoxazole, leur preparation et leur application en therapeutique |
| FR2809732B1 (fr) | 2000-05-31 | 2002-07-19 | Sanofi Synthelabo | DERIVES DE 4(-2-PHENYLTHIAZOL-5-yl)-1,4-DIAZABICYCLO-[3.2.2] NONANE, LEUR PREPARATION ET LEUR APPLICATION ENTHERAPEUTIQUE |
| TW593223B (en) | 2000-06-20 | 2004-06-21 | Merz Pharma Gmbh & Co Kgaa | 1-amino-alkylcyclohexanes as 5-HT3 and neuronal nicotinic receptor antagonists |
| US6492385B2 (en) * | 2000-08-18 | 2002-12-10 | Pharmacia & Upjohn Company | Quinuclidine-substituted heteroaryl moieties for treatment of disease |
| EP1381603A2 (en) | 2000-08-18 | 2004-01-21 | PHARMACIA & UPJOHN COMPANY | Quinuclidine-substituedaryl moieties for treatment of disease ( nicotinic acetylcholine receptor ligands ) |
| WO2002016357A2 (en) | 2000-08-18 | 2002-02-28 | Pharmacia & Upjohn Company | Quinuclidine-substituted aryl moieties for treatment of disease (nicotinic acetylcholine receptor ligands) |
| US6492386B2 (en) | 2000-08-18 | 2002-12-10 | Pharmacia & Upjohn Company | Quinuclidine-substituted aryl compounds for treatment of disease |
| US6599916B2 (en) | 2000-08-21 | 2003-07-29 | Pharmacia & Upjohn Company | Quinuclidine-substituted heteroaryl moieties for treatment of disease |
| EP1311505A2 (en) | 2000-08-21 | 2003-05-21 | PHARMACIA & UPJOHN COMPANY | Quinuclidine-substituted heteroaryl moieties for treatment of disease ( nicotinic acetylcholine receptor ligands ) |
| AU2001282875A1 (en) | 2000-08-21 | 2002-03-04 | Pharmacia And Upjohn Company | Quinuclidine-substituted heteroaryl moieties for treatment of disease |
| DE10045112A1 (de) | 2000-09-11 | 2002-03-21 | Merck Patent Gmbh | Verwendung von Indolderivaten zur Behandlung von Erkrankungen des zentralen Nervensystems |
| AU2002220517A1 (en) | 2000-12-01 | 2002-06-11 | Neurosearch A/S | 3-substituted quinuclidines and their use as nicotinic agonists |
| US20020086871A1 (en) | 2000-12-29 | 2002-07-04 | O'neill Brian Thomas | Pharmaceutical composition for the treatment of CNS and other disorders |
| CN1914200A (zh) * | 2003-12-22 | 2007-02-14 | 阿斯利康(瑞典)有限公司 | 烟碱性乙酰胆碱受体配件 |
| US7396830B2 (en) * | 2005-10-04 | 2008-07-08 | Bristol-Myers Squibb Company | Piperazine amidines as antiviral agents |
-
2000
- 2000-02-18 SE SE0000540A patent/SE0000540D0/xx unknown
-
2001
- 2001-02-12 AR ARP010100628A patent/AR029798A1/es unknown
- 2001-02-15 IL IL15054401A patent/IL150544A0/xx unknown
- 2001-02-15 JP JP2001560205A patent/JP4084570B2/ja not_active Expired - Fee Related
- 2001-02-15 DE DE60100996T patent/DE60100996T2/de not_active Expired - Fee Related
- 2001-02-15 RU RU2002118302/04A patent/RU2263114C2/ru active
- 2001-02-15 AU AU32594/01A patent/AU782693B2/en not_active Ceased
- 2001-02-15 CZ CZ20022787A patent/CZ20022787A3/cs unknown
- 2001-02-15 UA UA2002075475A patent/UA73540C2/uk unknown
- 2001-02-15 PL PL357565A patent/PL202044B1/pl not_active IP Right Cessation
- 2001-02-15 DK DK01904770T patent/DK1259508T3/da active
- 2001-02-15 SK SK1179-2002A patent/SK11792002A3/sk unknown
- 2001-02-15 EE EEP200200459A patent/EE05149B1/xx not_active IP Right Cessation
- 2001-02-15 HU HU0301069A patent/HUP0301069A3/hu unknown
- 2001-02-15 ES ES01904770T patent/ES2208556T3/es not_active Expired - Lifetime
- 2001-02-15 CN CNB018049362A patent/CN100345847C/zh not_active Expired - Fee Related
- 2001-02-15 EP EP01904770A patent/EP1259508B1/en not_active Expired - Lifetime
- 2001-02-15 WO PCT/SE2001/000329 patent/WO2001060821A1/en active IP Right Grant
- 2001-02-15 AT AT01904770T patent/ATE252099T1/de not_active IP Right Cessation
- 2001-02-15 NZ NZ520094A patent/NZ520094A/en unknown
- 2001-02-15 BR BR0108456-9A patent/BR0108456A/pt not_active Application Discontinuation
- 2001-02-15 PT PT01904770T patent/PT1259508E/pt unknown
- 2001-02-15 TR TR2004/00072T patent/TR200400072T4/xx unknown
- 2001-02-15 KR KR1020027010731A patent/KR100769394B1/ko not_active IP Right Cessation
- 2001-02-15 CA CA002397233A patent/CA2397233A1/en not_active Abandoned
- 2001-02-15 MX MXPA02007543A patent/MXPA02007543A/es active IP Right Grant
- 2001-02-16 MY MYPI20010711A patent/MY123580A/en unknown
- 2001-02-16 CO CO01012482A patent/CO5280046A1/es not_active Application Discontinuation
-
2002
- 2002-04-15 US US10/123,856 patent/US7001914B2/en not_active Expired - Fee Related
- 2002-07-09 ZA ZA200205479A patent/ZA200205479B/xx unknown
- 2002-08-02 BG BG106977A patent/BG106977A/bg unknown
- 2002-08-08 IS IS6492A patent/IS6492A/is unknown
- 2002-08-16 NO NO20023917A patent/NO20023917L/no not_active Application Discontinuation
-
2003
- 2003-03-28 HK HK03102250A patent/HK1050007A1/xx not_active IP Right Cessation
-
2006
- 2006-01-05 US US11/325,787 patent/US7214688B2/en not_active Expired - Fee Related
-
2007
- 2007-03-01 US US11/680,930 patent/US7491734B2/en not_active Expired - Fee Related
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0190920A2 (en) * | 1985-02-04 | 1986-08-13 | Synthelabo | Method of enhancing memory or correcting memory deficiency with arylamido (and arylthioamido)azabicycloalkanes |
| EP0327335A1 (en) * | 1988-02-01 | 1989-08-09 | Synthelabo | Arylamido(and arylthioamido)-azabicycloalkanes for enhancing memory or correcting memory deficiency |
| EP0546181A1 (en) * | 1990-08-31 | 1993-06-16 | Nippon Shinyaku Company, Limited | Indole derivatives and their use as serotonin antagonists |
| JPH04247081A (ja) * | 1991-02-01 | 1992-09-03 | Takeda Chem Ind Ltd | 5員複素環酸アミド類 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100345847C (zh) | 新的联芳基甲酰胺 | |
| CN1217943C (zh) | 新的用途和新的n-氮杂双环-酰胺衍生物 | |
| CN1144791C (zh) | 三唑化合物及其作为多巴胺d3配体的应用 | |
| CN1117077C (zh) | 用作nos抑制剂的6-苯基吡啶基-2-胺衍生物 | |
| CN1207283C (zh) | 4-氨基哌啶衍生物和它们作为药物的用途 | |
| CN1298717C (zh) | 奎宁环氨基甲酸酯衍生物及其作为m3拮抗剂的应用 | |
| CN1231473C (zh) | 取代的芳基吡嗪 | |
| CN1198825C (zh) | 8-苯基-6,9-二氢-[1,2,4]三唑并[3,4-i]嘌呤-5-酮衍生物 | |
| CN1268133A (zh) | 含有稠合环取代基的作为nos抑制剂的2-氨基吡啶 | |
| CN1662527A (zh) | 作为m3毒蕈碱性受体拮抗剂的吡咯烷鎓衍生物 | |
| CN1114598C (zh) | 芳族化合物和含有它们的药物组合物 | |
| CN1281604C (zh) | 取代吡唑化合物 | |
| CN1684962A (zh) | 吲唑、苯并噻唑和苯并异噻唑,以及它们的制备和用途 | |
| CN1432015A (zh) | 可用作细胞增殖抑制剂的被1,1-二氧代异噻唑烷取代的吲唑 | |
| CN1345320A (zh) | 用作烟碱性乙酰胆碱受体配体的二氮杂二环衍生物 | |
| CN1615300A (zh) | 苯并咪唑衍生物以及它们作为gnrh拮抗剂的用途 | |
| CN1665502A (zh) | Mchir拮抗剂 | |
| CN1823068A (zh) | 作为糖原合酶激酶3抑制剂的三唑并嘧啶衍生物 | |
| CN1829721A (zh) | 对α7烟碱乙酰胆碱受体具有亲和力的螺[1-氮杂二环[2.2.2]辛烷-3,5’-噁唑烷]-2’-酮衍生物 | |
| CN1628100A (zh) | γ-分泌酶抑制剂 | |
| CN1662498A (zh) | 作为高血压蛋白原酶抑制剂的新型四氢吡啶衍生物 | |
| CN101056634A (zh) | 奎宁环衍生物及它们作为毒蕈碱m3受体拮抗剂的用途 | |
| CN1297442A (zh) | 用作抗癌剂和抗增殖剂的5-氨基茚并[1,2-c]吡唑-4-酮类化合物 | |
| CN1675203A (zh) | 取代的1-哌嗪酰基哌啶衍生物,它们的制备方法和治疗用途 | |
| CN101048393A (zh) | 作为γ-分泌酶抑制剂的取代的N-芳基磺酰基杂环胺 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20071031 Termination date: 20100215 |