“DERIVADOS DE PIRIMIDINA FUNDIDOS, SEUS USOS, E COMPOSIÇÃO FARMACÊUTICA PARA INIBIÇÃO DA ATIVIDADE DE TIROSINA QUINASE” Pedido dividido do BR 1120120332538, depositado em 20/06/2011. CAMPO DA INVENÇÃO [001]A presente invenção refere-se a um novo derivado de pirimidina fundido contendo uma atividade inibitória para tirosinas quinases e uma composição farmacêutica, compreendendo a mesma como um ingrediente ativo.
FUNDAMENTO DA INVENÇÃO [002]Existem muitos sistemas de transdução de sinal em células que são funcionalmente ligados entre si para controlar a proliferação, crescimento, metástase e apoptose de células (William G. Kaelin Jr., Reviews Cancer 5, 689, 2005). O colapso do sistema de controle intracelular por fatores genéticos e ambientais provoca ampliação ou destruição anormal do sistema de transdução de sinal levando a geração de células de tumor (Douglas Hanahan e Robert A. Weinberg, Cell 100, 57, 2000).
[003]Proteínas tirosina quinase desempenham papéis importantes dita regulação celular (Irena Melnikova e James Golden, Nature Reviews Drug Discovery 3, 993, 2004), e sua expressão ou mutação anormal foi observada em células de câncer ou doenças autoimunes. A proteína tirosina quinase é uma enzima que catalisa o transporte de grupos fosfato a partir de ATP para tirosinas localizadas em substratos de proteína. Muitas proteínas do receptor do fator de crescimento funcionam como tirosina quinase para o transporte de sinais celulares. A interação entre os fatores de crescimento e seus receptores normalmente controla o crescimento celular, mas induz a transdução de sinal anormal causada pela mutação ou superexpressão de qualquer um dos receptores, muitas vezes induz vários tipos de câncer ou doenças autoimunes, como artrite reumatoide.
[004]No que diz respeito as funções destas tirsonas quinases, uma variedade de
2/111 fatores de crescimento e receptores dos mesmos foram investigados, e entre eles, fatores de crescimento epidérmico (EGF) e receptor EGF (EGFR) tirosina quinases foram intensamente estudados (Nancy E. Hynes e Heidi A. Lane, Nature Reviews Câncer 5, 341, 2005). Uma tirosina quinase EGFR é composta de um receptor e tirosina quinase e libera sinais extracelulares ao núcleo da célula através da membrana celular. Vários tirosinas quinases EGFR são classificadas com base em suas diferenças estruturais em quatro subtipos, ou seja, EGFR (Erb-Bl), Erb-B2, ErbB3 e Erb-B4, e sabe-se que mutações ativadas por EGFR, como mutação pontual L858R no éxon 21 e deleções in-frame no éxon 19 do domínio de tirosina quinase EGFR, são importante causa de câncer de pulmão de células não-pequenas.
[005]Gefitinib (AstraZeneca) foi desenvolvido inicialmente como uma pequena molécula para a inibição da tirosina quinase EGFR, que seletivamente e reversivelmente inibe EGFR (Erb-B1). Erlotinib (Roche) também tem características semelhantes. Estas drogas alvo para EGFR são eficazes para o câncer de pulmão de células não-pequenas (NSCLC) e fornecem terapêutica conveniente para pacientes com mutações ativadas por EGFR.
[006]No entanto, foi relatado que o desenvolvimento de resistência diminui a atividade de determinada droga usada em terapias alvo para EGFR. Já foi relatado que cerca de metade dos pacientes administrados com Gefitinib ou Erlotinib apresentou a resistência às drogas devido a indução da mutação EGFR T790M secundária (William Pao et al., Public Library of Science Medicine, 2(3), 225, 2005, Cancer Res, 67(24), 11924, 2007). Além disso, foi recentemente encontrado que inibidores irreversíveis direcionando para EGFR são mais benéficos para garantir excelente eficácia e superar o desenvolvimento de resistência, em comparação com os inibidores reversíveis convencionais como Gefitinib e Erlotinib (Danan Li et al., Cancer Cell 12, 81,2007; e Anja Michalczyk et al., Bioorganic & Medicinal Chemistry 16, 3482, 2008). Assim, inibidores irreversíveis como BIBW-2992 (Afatinib, Boeringer
3/111
Ingelheim) (C H Mom et al., British Journal of Cancer 98, 80, 2007), PF00299804 (Dacomitinib, Pfizer) (Engelman JA, et al., Cancer Res. 67, 11924, 2007), e AV-412 (AVEO Pharmaceuticals) (Tsuyoshi Suzuki et al., Cancer Sci. 98(12), 1977, 2007) foram desenvolvidos e estão atualmente no estágio clínico. Os compostos foram conhecidos por formar uma ligação covalente com cisteina 773 (Cys773) posicionado em um domínio de ATP de EGFR, bloqueando assim irreversivelmente a autofosforilação de EGFR e assim eficientemente inibindo a transdução de sinal de células de câncer (David W. Fry et al., Proc. Natl. Acad. Sci. U.S.A. 95, 12022, 1998), e apresentam atividades inibitórias maiores comparada aos inibidores reversíveis comercialmente disponível como inibidores duplos de EGFR/HER-2, ou inibidores pan-HER em atividades in vitro e em vários modelos in vivo de carcinomas (Jeff B. Smaill et al., J. Med. Chem. 42, 1803, 1999). No entanto, os compostos podem causar sérios efeitos colaterais, como erupções cutâneas, diarreia e perda de peso devido a atividades altas para EGFR WT (tipo selvagem) presentes nas células normais, quando são administrados em dose suficiente para superar a resistência induzida por mutações do EGFR T790M, e isso tem limitado sua aplicação clínica, (Martin L. Sos, et al., Cancer Res. 70, 868, 2010).
[007]Como evidenciado por testes clínicos dos inibidores irreversíveis em câncer de pulmão de células não-pequenas, os compostos apresentaram atividades melhoradas, mas ainda efeitos terapêuticos fracos no desenvolvimento de resistência de pacientes com câncer, em comparação aos inibidores reversíveis convencionais. Nesse sentido, tem havido uma necessidade permanente para o desenvolvimento de uma nova droga que é eficaz em cânceres resistentes e tem efeitos colaterais adversos.
[008]Entretanto, existem várias evidências de que células B (linfócitos B) e células T (linfócitos T) desempenham um papel fundamental na patogênese de doenças inflamatórias, doenças autoimunes e/ou doenças mediadas por imunidade.
4/111 [009]Por exemplo, a sinalização anormal pode induzir proliferação e diferenciação de célula B desregulada causando todos os tipos de linfoma, incluindo várias leucemias linfoides aguda ou crônica e pode causar a formação de autoanticorpos que levam a várias doenças inflamatórias, doenças autoimunes ou doenças mediadas por imunidade.
[010]Tirosina quinase de Bruton (BTK) é um membro da família TEC de tirosinas quinases, e desempenha um papel importante na ativação de célula B e transdução de sinal BTK desempenha um papel essencial na via de sinalização de células B que liga os estímulos de receptores (BCR) de células B na superfície de células B a resposta em células a jusante. Além disso, BTK é conhecida por ser um regulador crítico de desenvolvimento da célula B e ativação de células B madura e sobrevivência (Khan et al., Immunity 3, 283, 1995; Ellmeier et al., J. Exp. Med. 192, 1611, 2000; Kurosaki, Current Opinion in Immunology 12, 276, 2000; Schaeffer and Schwartzberg, Current Opinion in Immunology 12, 282, 2000). Assim, a inibição de BTK poderia ser uma abordagem terapêutica para bloquear processos de doença mediada por células B.
[011]Por exemplo, sabe-se que ratos deficientes em BTK são resistentes a artrite induzida por colágeno e inibidores BTK foram demonstradas eficácias dosedependente em um modelo de camundongo de artrite (Jansson e Holmdahl, Clin. Exp. Immunol. 94, 459, 1993; Pan et al., Chem. Med Chem. 2, 58, 2007). Assim, inibidores BTK eficazes podem ser útil no tratamento da artrite reumatoide.
[012]Além disso, BTK é também expresso por células que não as células B que podem estar envolvidas em processos de doença, ou seja, mastócitos derivados de medula óssea. Foi relatado que a desgranulação induzida por antígeno é suprimida em mastócitos derivadas de medula óssea deficientes em BTK (Iwaki et al., J. Biol. Chem. 280, 40261, 2005). Isso mostra que o BTK poderia ser útil para tratar as respostas de mastócitos patológicas como alergia e asma.
5/111 [013]Também, os monócitos, no qual atividade de BTK está ausente, mostraram diminuição da produção de TNF-α, após estimulação (Horwood et al. J Exp Med. 197, 1603, 2003). Portanto, inflamação mediada por TNF-α pode ser modulada por inibidores BTK.
[014]Além disso, BTK relatou desempenhar um papel na apoptose, como alguns dos reguladores (Islam and Smith, Immunol. Rev. 178, 49, 2000). Assim, inibidores de BTK poderiam ser úteis para o tratamento de certos linfomas de célula B e leucemias (Feldhahn et al., J. Exp. Med. 201, 1837, 2005).
[015]Enquanto isso, as células T desempenham um papel na transmissão de sinais liberados através do receptor de células T (TCR) na superfície das células a partir de células apresentadoras em efetores a montante por ativação de várias quinases intercelulares como janus quinases. Neste momento, elas secretam várias interleucinas (IL) ou interferon-γ para ativar vários leucócitos, bem como as células B. As proteínas quinases envolvidas na transdução de sinal em células T são Janus quinases (JAK) como JAK1, JAK2, JAK3 e TYK2, quinases de células T induzíveis por IL-2 (ITK) e família TEC de quinases como quinases de linfócitos em repouso (RLK).
[016]Janus quinases envolvendo JAK3 foram amplamente investigados como um alvo para doenças autoimunes e/ou inflamatórias. Entre estas, diferentes JAK2 envolvidas em hematose e homeostasia de eritrócito ou JAK1 expressa em vários tecidos, JAK3 é expressa em linfócitos e desempenha um papel muito importante na transdução de sinal através de várias citocinas, ou seja, IL-2, IL-4, IL-7, IL-9 e IL-15, que é mais atrativo (Flanagan et al, Journal of medicinal Chemistry, 53, 8468, 2010). De acordo com estudos em animais, JAK3 desempenha um papel na maturação de células B e células T, bem como na manutenção de funções de células T.
[017]Portanto, inibidores de JAK3 podem ser úteis no tratamento de artrite reumatoide, psoríase, dermatite atópica, lúpus, esclerose múltipla, diabetes tipo I e
6/111 complicações de diabetes, câncer, asma, distúrbios de tireoide autoimune, colite ulcerativa, doença de Crohn, doença de Alzheimer, leucemia, e outras indicações onde a imunossupressão poderia ser desejável, como transplante de órgão ou xeno transplante (Pesu M, Laurence A, Kishore N, et al., Immunol Rev 223, 132, 2008.; Kawahara A, Minami Y, Miyazaki T, et al., Proc Natl Acad Sci USA 92, 8724, 1995; Nosaka T, van Deursen JMA, Tripp RA, et al., Science 270, 800, 1995; Papageorgiou Ac, Wikman LEK., et al., Trends Pharm Sci 25, 558, 2004).
[018]Enquanto isso, outra família de TEC quinases também desempenha um papel importante na ativação de células T (Pamela L. Schwartzberg, et al., Nature Reviews Immunology 5, 284, 2005). Por exemplo, exclusão do ITK que é caracteristicamente expressa em células T em camundongos levou à diminuição da proliferação celular que é induzida pela estimulação através de receptores de células T e diminuiu a secreção de várias citocinas como IL-2, IL-4, IL-5, IL-10 e IFN-γ (Schaeffer et al., Science 284, 638, 1999; Fowell et al., Immunity 11, 399, 1999; Schaffer et al., Nature Immunology 2, 1183, 2001).
[019]Além disso, em camundongos deficientes de ITK, sintomas imunes de asma alérgica foram atenuados e a inflamação pulmonar, infiltração eosinofílica e produção de mucosa em resposta ao desafio com o alergeno ovalbumina foram drasticamente reduzidos (Muller et al., Journal of Immunology 170, 5056, 2003). Isso mostra que os inibidores do ITK seriam úteis no tratamento da asma.
[020]Além disso, ITK, também tem sido implicado na dermatite atópica. Este gene foi relatado por ser mais altamente expresso em células T de sangue periférico de pacientes com dermatite atópica grave, comparado com controles ou pacientes com dermatite atópica leve (Matsumoto et al., International archives of Allergy and Immunology 129, 327, 2002).
[021]Entretanto, as funções de RLK para ativar a secreção de IL-2 que é produzida por transdução de sinal de receptores de célula T de esplenócitos. Assim,
7/111 a inibição da RLK pode reduzir várias respostas por células T (Schaeffer et al., Nature Immunology 2, 1183, 2001; Schaeffer et al., Science 284, 638, 1999).
[022]Além disso, tirosina quinase de medula óssea (BMX) tem sido conhecida por estar envolvida na migração de células epiteliais e endoteliais (Pan et al., Mol. Cell. Biol. 2002, 22, 7512). Portanto, inibidores BMK poderão ser desenvolvidos como agentes anticâncer para inibir a metástase das células cancerígenas e angiogênese.
[023]Como acima, uma vez que a família de TEC quinases como BTK, ITK, RLK, BMX e outras e Janus quinases como JAK3 desempenham um papel fundamental na ativação de células B ou células T que está envolvido na patogênese de doenças inflamatórias, doenças autoimunes e doenças imunologicamente mediadas, um composto para inibir efetivamente as quinases pode ser útil como um agente terapêutico para diversas doenças inflamatórias, doenças autoimunes e doenças mediadas por imunidade.
[024]Além disso, um composto para inibir BTK envolvido na ativação de células B induzindo linfoma de células B, e BMX envolvido na metástase das células cancerígenas pode ser útil como um agente anticâncer, ou antitumoral.
[025]Portanto, o desenvolvimento de um composto, que pode inibir as quinases acima e inibir seletivamente as EGFRs variantes como mutações secundárias T790M bem como mutação pontual L858R no éxon 21 ou deleção in-frame no éxon 19, é um dos desafios muito importantes.
[026]Mesmo que tenha siso sugerido que inibidores irreversíveis do EGFR, que formam uma ligação covalente com cisteina 773 (Cys773) posicionada em um domínio de ATP de EGFR, pode mostrar efeitos inibitórios sobre as atividades da família TEC de quinases como BTK, ITK, RLK e BMX em que cisteína está presente em uma mesma posição da sequência de aminoácidos, bem como quinases como JAK3 ou BLK (Wooyoung Hur, et al., Bioorg. Med. Chem. Lett. 18, 5916, 2008), não foi desenvolvido para um composto que pode inibir irreversivelmente, seletivamente
8/111 e efetivamente variante de EGFR, BTK, JAK3, ITK, RLK, BMX e/ou BLK.
SUMÁRIO DA INVENÇÃO [027]Portanto, é um objeto da presente invenção fornecer um novo derivado de pirimidina fundido que seletivamente e efetivamente inibe cânceres ou tumores induzidos por uma fator de crescimento epidérmico (EGFR) do receptor de tirosina quinase ou uma mutante com reduzidos efeitos colaterais adversos.
[028]É outro objeto da presente invenção fornecer um novo derivado de pirimidina fundido que pode tratar cânceres, tumores, doenças inflamatórias, doenças autoimunes ou doenças imunologicamente mediadas por linfócitos B, linfócitos T anormalmente ativados, ou ambos, por repressão de não receptor de tirosina quinase como famílias TEC quinases (por exemplo, BTK, ITK, BMX ou RLK) e janus quinases (por exemplo, JAK3).
[029]É ainda outro objeto da presente invenção fornecer uma composição farmacêutica para prevenir ou tratar o câncer, tumores, doenças inflamatórias, doenças autoimunes, ou doenças imunologicamente mediadas, que compreende ditos novos derivados de pirimidina fundidos.
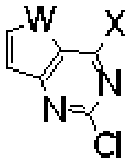
[030]Em conformidade com um aspecto da presente invenção, é fornecido um composto de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo:
(I) [031]em que, [032]W é O ou S;
[033]X é O, NH, S, SO ou SO2;
[034]Y é átomo de hidrogênio, átomo de halogênio, C1-6alquil ou C1-6alcoxi;
9/111 [035]A e B são cada um independentemente átomo de hidrogênio, átomo de halogênio, ou di(C1-6alquil)aminometil;
[036]Z é aril ou heteroaril contendo um ou mais substituintes selecionados do grupo que consiste de: átomo de hidrogênio, átomo de halogênio, hidroxi, nitro, ciano, C1-6alquil, C1-6alcoxi, C1-6alquilcarbonil, C1-6alcoxicarbonil, di(C16alquil)aminoC2-6alcoxicarbonil, amino, C1-6alquilamino, di(C1-6alquil)amino, carbamoil, C1-6alquilcarbamoil, di(C1-6alquil)carbamoil, di(C1-6alquil)aminoC2-6alquilcarbamoil, sulfamoil, C1-6alquilsulfamoil, di(C1-6alquil)sulfamoil, di(C1-6alquil)aminoC2- 6alquilsulfamoil, C1-6alquilsulfonyl, C1-6alquilsulfinyl, di(C1-6alquil)fosfonil, hidroxiC16alquil, hidroxicarbonilC1-6alquil, C1-6alcoxiC1-6alquil, C1-6alquilsulfonylC1-6alquil, C16alquilsulfinylC1-6alquil, di(C1-6alquil)fosfonilC1-6alquil, hidroxiC2-6alcoxi, C1-6alcoxiC26alcoxi, aminoC1-6alquil, C1-6alquilaminoC1-6alquil, di(C1-6alquil)aminoC1-6alquil, di(C16alquil)aminoacetil, aminoC2-6alcoxi, C1-6alquilaminoC2-6alcoxi, di(C1-6alquil)aminoC26alcoxi, hidroxiC2-6alquilamino, C1-6alcoxiC2-6alquilamino, aminoC2-6alquilamino, C16alquilaminoC2-6alquilamino, di(C1-6alquil)aminoC2-6alquilamino, heteroaril, heterociclo, heterocíclico oxi, heterocíclico tio, heterocíclico sulfinil, heterocíclico sulfonil, heterocíclico sulfamoil, heterocíclico C1-6alquil, heterocíclico C1-6alcoxi, heterocíclico amino, heterocíclico C1-6alquilamino, heterocíclico aminoC1-6alquil, heterocíclico carbonil, heterocíclico C1-6alquilcarbonil, heterocíclico carbonilC1-6alquil, heterocíclico C1-6alquiltio, heterocíclico C1-6alquilsulfinil, heterocíclico C1-6alquilsulfonil, heterocíclico aminocarbonil, heterocíclico C1-6alquilaminocarbonil, heterocíclico aminocarbonilC1-6alquil, heterocíclico carboxamido, e heterocíclico C16alquilcarboxamido;
[037]o aril refere-se a um C6-12 anel cíclico ou bicíclico aromático;
[038]os heteroaris cada um independentemente referem-se a um anel heteroaromático cíclico ou bicíclico de 5 a 12 membros contendo um ou mais N, O ou S;
10/111 [039]os heterociclos cada um independentemente referem-se a um heteroanel cíclico ou bicíclico saturado ou parcialmente insaturado de 3 a 12 membros contendo um ou mais N, O, S, SO ou SO2, em que um átomo de carbono formando o heterociclo opcionalmente tem um ou mais substituintes selecionados do grupo que consiste de C1-6alquil, hidroxi, hidroxiC1-6alquil, hidroxicarbonil, C1-6alcoxi, amino, C16alquilamino, di(C1-6alquil)amino, di(C1-6alquil)aminoC1-6alquil, di(C1-
6alquil)aminocarbonil, heterociclo, heterocíclico C1-6alquil, e heteroaril, e em que, contanto que o heterociclo opcionalmente compreende um átomo de nitrogênio, o átomo de nitrogênio opcionalmente tem um substituinte selecionado do grupo que consiste de átomo de hidrogênio, C1-6alquil, monohalogenoC1-6alquil, dihalogenoC16alquil, trihalogenoC1-6alquil, C3-6cycloalquil, hidroxiC2-6alquil, C1-6alcoxiC2-6alquil, C16alquilcarbonil, hidroxiC1-6alquilcarbonil, C1-6alcoxicarbonil, carbamoil, C16alquilcarbamoil, di(C1-6alquil)carbamoil, sulfamoil, C1-6alquilsulfamoil, di(C16alquil)sulfamoil, C1-6alquilsulfonil, aminoC2-6alquil, C1-6alquilaminoC2-6alquil, di(C16alquil)aminoC2-6alquil, di(C1-6alquil)aminoC1-6alquilcarbonil, heterociclo, heterocíclico oxi, heterocíclico tio, heterocíclico sulfinil, heterocíclico sulfonil, heterocíclico C16alquil, heterocíclico carbonil, heterocíclico C1-6alquilcarbonil, heterocíclico C16alquilsulfinil, and heterocíclico C1-6alquilsulfonil (em que, quando o átomo de nitrogênio forma amina terciária, este é opcionalmente de uma forma N-óxido); e [040]opcionalmente, o C1-6alquil é parcialmente insaturado ou tem uma fração C36cicloalquil, e um átomo de carbono no heterociclo existe em uma forma de carbonil.
[041]De acordo com outro aspecto da presente invenção, é fornecida uma composição farmacêutica para prevenção ou tratamento de cânceres, tumores, doenças inflamatórias, doenças autoimune, ou doenças imunologicamente mediadas que compreendem o composto de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo.
11/111
BREVE DESCRIÇÃO DOS DESENHOS [042]Os objetos e características acima e outros da presente invenção ficarão aparentes a partir da descrição a seguir da invenção, quando tomado em conjunto com os desenhos que acompanham, que respectivamente mostram:
[043]Fig. 1: mudança de tamanho de tumores por administração oral do composto obtido no exemplo 2 em camundongos nude xenoenxertados com células cancerígenas NCI-H1975;
[044]Fig. 2: mudança de peso corporal por administração oral do composto obtido no exemplo 2 em camundongos nude xenoenxertados com células cancerígenas NCI-H1975; e [045]Fig. 3: alteração no escore clínico de artrite por administração oral do composto obtido no exemplo 1 em um modelo de artrite induzido por colágeno (CIA).
DESCRIÇÃO DETALHADA DA INVENÇÃO [046]No composto de fórmula (I), exemplos preferenciais de Z incluem substituintes selecionados do grupo que consiste de fórmulas Z1 a Z203, mas não são limitados a estes:
|
0
N |
N |
0 |
Φ |
0 |
£ |
|
|
| Z4-O |
O=S=O |
o=S=o |
o=s=o X |
ò |
0
I |
o''·· |
O^
OH |
|
Z11 |
Z12 |
Z13 |
Z14 |
Z15 |
1
Z16 |
Z17 |
Z18 |
Z9 $
o4 „N^
Z10 $ 0 O^N''']
Z19
Z20
12/111
Z22 Z23
Z24 Z25 Z26
Z27 Z28 Z29
Z21
Z31 Z32
Z34 Z35 Z36
OSNH2
Z33
Z37
Z38
Z39
Z30
Z61
Z62
Z63 Z64 Z65
Z66 Z67 Z68 Z69
Z70
Z53 Z54 Z55
ToEf OpOEt
Z51 Z52
OH
Z42
1 O
Z43 Z44 Z45
Z56 Z57 Z58 Z59 Z60
Z41
Z46 Z47 Z48 Z49 Z50
13/111
oh
Z42
1 O
Z43 Z44 Z45
Z47 Z48 Z49
Z41
Z51
Z52 Z53 Z54
Z55 Z56
Z57 Z58 Z59
Z50
oSnh2
Z61 §
ô
Z67
Z71
Z81
Z82 Z83
Z74
N
N
O^N-%
Z68 Z69
Z60
Z80
Z86 Z87 Z88
Z90
Z84 Z85
Z89
Z91 Z92 Z93
Z98 Z99 Z100
Z101 Z102 Z103
Z104
Z105 Z106
Z107 Z108
Z109 Z110
14/111
Z111
Z114
Z121
HN
Ci
F
Z131
Z141
F
Φ ,N
Z122
Z123
- N \
Z126
Z127
Z118
ΛΑΑ
Z119
o
Z120
Z128 ci
Z124
Z125
ci
Z129 ® ~~
Z130
F
F
F
F /0
|
ò
N |
ò
1 |
Φ |
Λ
N
1 |
Λ
N
1 |
ò
N
1 |
õ
1 |
ò
n'
1 |
ô
N
1 |
|
Z132 |
Z133 |
Z134 |
Z135 |
Z136 |
Z137 |
Z138 |
Z139 |
Z140 |
F
Z142
F
Z143 .0
N
So-^
N_
Z144
Φ
0=S=0
F ò N
0=S=0 k
Z145
Z146 $
Φ .Nx
Z147
I
Z148
Z149
N
Z150
F
N
F
Cl
|
ò |
ò |
ò |
u |
|
Z157 |
Z158 |
Z159 |
Z160 |
Z151
Z152
Z153
Z154 ci
Z161 Z162 Z163
F
Z165
Z168 Z169
Z170
Z171 Z172 Z173 Z174 Z175
Z176 Z177 Z178 Z179 Z180
15/111
ci
Z181 Z182 Z183
Z186 Z187 Z188
Z189 Z190
Z191
Z184 Z185
N— /
Z192 Z193 Z194 Z195 Z196 Z197
Z198 Z199
Z200
Z201 Z202 Z203 [047]Exemplos mais preferenciais do composto de fórmula (I) de acordo com a presente invenção são como a seguir:
[048] /V-(3-(2-(2-metoxi-4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[049] /V-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[050] /V-(3-(2-(4-(4-íerí-butil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[051] /V-(3-(2-(4-(4-(2-fluor-etil)-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[052] /V-(3-(2-(4-(4-(2,2,2-trifluor-etil)-piperazin-1-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[053] /V-(3-(2-(4-(4-(2-metoxi-etil)-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[054] /V-(3-(2-(4-(4-(2-hidroxi-etil)-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
16/111 [055] /V-(3-(2-(4-(4-hidroxi-4-metil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[056] /V-(3-(2-(4-(3,4,5-trimetil-piperazin-1-il)-fenilamino)-tieno[3,2-ô]pirimidin-4iloxi)-fenil)-acrilamida;
[057] /V-(3-(2-(4-(5-metil-2,5-diaza-biciclo[2.2.1]hept-2-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[058] /V-(3-(2-(1-metil-2-oxo-2,3,4,5-tetrahidro-7H-benzo[P]azepin-7-ilamino)tieno[3,2-a]pirimidin-4-iloxi)-fenil)-acrilamida;
[059] /V-(3-(2-(2-metoxi-4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[060] /V-(3-(2-(2-metoxi-4-(1-metil-piperidin-3-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[061] /V-(3-(2-(3-fluor-4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d|pirimidin-4iloxi)fenil)acrilamida;
[062]Dietil(4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)fenil)fosfonato;
[063] N-(3-(2-(4-[1,4']bipiperidinil-1'-il-3-fluor-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[064] /V-(3-((2-((3-cloro-4-(4-metilpiperazin-1-il)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[065] /V-(3-(2-(4-(1-metilpiperidin-4-ilamino)-3-clorofenilamino)tieno[3,2-d]pirimidin4-iloxi)fenil)acrilamida;
[066] /V-(3-(2-(2-fluor-4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[067] /V-(3-(2-(3-metil-4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-a]pirimidin-4iloxi)fenil)acrilamida;
[068]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)-2-metil-N-(1metilpiperidin-4-il)benzamida;
17/111 [069] /V-(4-metil-3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[070] /V-(4-fluor-3-(2-(4-(4-metil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[071] /V-(4-metoxi-3-(2-(4-(4-metilpiperazin-1-il)-fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[072] /V-(3-(2-(5-(4-metilpiperazin-1-il)piridin-2-ilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[073]4-metil-piperazin-1 -carboxilic acid (4-(4-(3-acriloilamino-fenoxi)-tieno[3,2d]pirimidin-2-ilamino)-fenil)-amida;
[074] /V-(4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)-2-fluorfenil)-4metilpiperazin-1-carboxamida;
[075] /V-(3-(2-(4-(4-etilpiperazin-1-il)fenilamino)tieno[3,2-ô]pirimidin-4iloxi)fenil)acrilamida;
[076] /V-(3-(2-(4-(4-isopropil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[077] /V-(3-(2-(4-(4-(2,2-difluor-etil)-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin4-iloxi)-fenil)-acrilamida;
[078] /V-(3-(2-(4-imidazol-1-il-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[079] /V-(3-(2-(4-(piperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[080] /V-(3-(2-(4-(4-(2-dimetilamino-acetil)-piperazin-1-il)-3-fluor-fenilamino)tieno[3,2-d]pirimidin-4-iloxi)-fenil)-acrilamida;
[081] /V-(3-(2-(3-cloro-4-(piperazin-1-il)fenilamino)tieno[3,2-a]pirimidin-4iloxi)fenil)acrilamida;
[082] /V-(3-(2-(4-(4-(metilsulfonil)piperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4
18/111 iloxi)fenil)acrilamida;
[083] /V-(3-(2-(4-(4-acetilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[084] /V-(3-(2-(4-(4-(morfolin-4-carbonil)-piperazin-1-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[085] /V-(3-(2-(4-(1,4-dimetil-3-oxo-piperazin-2-il)-fenilamino)-tieno[3,2-d]pirimidin4-iloxi)-fenil)-acrilamida;
[086] /V-(3-(2-(4-morfolinofenilamino)tieno[3,2-d]pirimidin-4-iloxi)fenil)acrilamida;
[087] /V-(3-((2-((4-((2-(dimetilamino)etil)amino)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[088] /V-(3-((2-((4-((2-(4-metilpiperazin-1-il)etil)amino)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[089] /V-(3-(2-(4-tiomorfolinofenilamino)tieno[3,2-d]pirimidin-4-iloxi)fenil)acrilamida;
[090] /V-(3-(2-(4-(1-oxo-1À4-tiomorfolin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[091](S)-M-(3-(2-(4-(3-(dimetilamino)pirrolidin-1-il)fenilamino)tieno[3,2-d]pirimidin4-iloxi)fenil)acrilamida;
[092] /V-(3-(2-(4-(4-pirrolidin-1-il-piperidin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[093] /V-(3-(2-(4-[1,4']bipiperidinil-1'-il-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[094]1-(4-(4-(3-acriloilamino-fenoxi)-tieno[3,2-d]pirimidin-2-ilamino)-fenil)-piperidin4-carboxilic acid dimetilamida;
[095] /V-(3-(2-(4-(dimetilamino)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[096] /V-(3-(2-(4-(2-hidroxi-etil)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
19/111 [097] /V-(3-(2-(4-(2-dimetilamino-etil)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[098] /V-(3-(2-(3-cloro-4-fluorfenilamino)tieno[3,2-a]pirimidin-4-iloxi)fenil)acrilamida;
[099] /V-(3-(2-(4-hidroxifenilamino)tieno[3,2-d]pirimidin-4-iloxi)fenil)acrilamida;
[0100] /V-(3-((2-((4-acetilfenil)amino)tieno[3,2-d]pirimidin-4-il)oxi)fenil)acrilamida;
[0101] /V-(3-((2-((4-(1,4,5,6-tetrahidropirimidin-2-il)fenil)amino)tieno[3,2-d]pirimidin-4il)oxo)fenil)acrilamida;
[0102] /V-(3-(2-(3-fluor-2-metoxi-4-(4-metil-piperazin-1-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0103] /V-(3-(2-(4-(4-(4-etilpiperazin-1 -il)piperidin-1 -il)fenilamino)tieno[3,2-d]pirimidin4-iloxi)fenil)acrilamida;
[0104] /V-(3-(2-(4-(3H-imidazol-1 -il-pirrolidin-1 -il)-fenilamino]-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0105] /V-(3-(2-(4-(3-imidazol-1 -il-pirrolidin-1 -il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0106] /V-(3-(2-(4-(4-imidazol-1 -il-piperidin-1 -il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0107] /V-(3-(2-(4-(4-dimetilamino-piperidin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0108] /V-(3-(2-(4-(4-morfolin-4-il-piperidin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0109] /-(3-(2-(3-fluor-4-(4-pirrol idin-1 -il-piperidin-1 -il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0110] /V-(3-(2-(3-fluor-4-(4-morfolin-4-il-piperidin-1 -il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0111] /V-(3-(2-(3-cloro-4-(4-pirrolidin-1 -il-piperidin-1 -il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
20/111 [0112] /V-(3-(2-(3-cloro-4-(4-morfolin-4-il-piperidin-1 -il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0113] N-(3-(2-(4-(4-hidroxipiperidin-1 -il)fenilamino)tieno[3,2-P]pirimidin-4iloxi)fenil)acrilamida;
[0114] N-(3-((2-((4-(4-(hidroximetil)piperidin-1 -il)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0115] N-(3-((2-((4-(4-(2-hidroxietil)piperidin-1 -il)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0116] N-(3-(2-(4-(4-(etilsulfonil)piperazin-1 -il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0117] N-(3-(2-(4-((4-etilpiperazin-1 -il)metil)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0118] N-(3-(2-(4-dietilaminometil-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0119] N-(3-(2-(4-(4-morfolin-4-il-piperidin-1 -ilmetil)-fenilamino)-tieno[3,2-d]pirimidin4-iloxi)-fenil)-acrilamida;
[0120](E)-N-(3-((2-((4-(3-(dimetilamino)prop-1 -en-1 -il)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0121] N-(3-((2-((4-((1 -metilpiperidin-4-il)amino)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0122] N-(3-(2-(4-dietilaminometil-2-metoxi-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0123] N-(3-(2-(4-((4-metilpiperazin-1-il)metil)fenilamino)tieno[3,2-a]pirimidin-4iloxi)fenil)acrilamida;
[0124] N-(3-(2-(3-fluor-4-(4-metil-piperazin-1-ilmetil)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0125] N-(3-(2-(4-(piperidin-1-ilmetil)fenilamino)tieno[3,2-d]pirimidin-421/111 iloxi)fenil)acrilamida;
[0126] /V-(3-(2-(4-azetidin-1-ilmetil-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0127] /V-(3-(2-(4-pirrolidin-1-ilmetil-fenilamino)-tieno[3,2-ô]pirimidin-4-iloxi)-fenil)acrilamida;
[0128] /V-(3-(2-(4-(morfolinometil)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0129] /V-(3-((2-((4-((3-(dimetilamino)pirrolidin-1-il)metil)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0130] /V-(3-((2-((4-((4-hidroxipiperidin-1-il)metil)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0131] /V-(3-((2-((4-((4-(dimetilamino)piperidin-1 -il)metil)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0132]Dimetil(4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2il)amino)benzilfosfonato;
[0133] /V-(3-(2-(4-((dimetilamino)metil)-3-fluorfenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0134] /V-(3-(2-(4-((3-(dimetilamino)pirrolidin-1-il)metil)3-fluorfenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)acrilamida;
[0135] /V-(3-(2-(4-((4-(dimetilamino)piperidin-1-il)metil)3-fluorfenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)acrilamida;
[0136] /V-(3-(2-(4-((1-metilpiperidin-4-ilamino)metil)-3-fluorfenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0137] /V-(3-(2-(4-dimetilaminometil-2-metil-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0138] /V-(3-(2-(4-((4-(ciclopropilmetil)piperazin-1-il)metil)fenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)acrilamida;
22/111 [0139] N-(3-(2-(4-((4-(1 -metilpiperidin-4-il)piperazin-1 -il)metil)fenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)acrilamida;
[0140] N-(3-(2-(4-metanosulfonilmetil-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0141] N-(3-(2-(4-(2-metanosulfonil-etil)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0142] N-(3-(2-(3-cloro-4-(4-(1 -metil-piperidin-4-il)piperazin-1-ilmetil)fenilamino)tieno[3,2-d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0143] N-(3-(2-(4-(4-(1 -metilpiperidin-4-il)piperazin-1 -il)fenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)acrilamida;
[0144] N-(3-(2-(4-(4-ciclohexil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0145] N-(3-(2-(5-(4-etilpiperazin-1-il)piridin-2-ilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0146] N-(3-(2-(5-(4-(2-hidroxi-etil)-piperazin-1-il)-piridin-2-ilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0147] N-(3-(2-(4-(1 -(4-etilpiperazin-1 -il)etil)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0148] N-(3-(2-(4-(4-etilpiperazin-1-carbonil)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0149] N-(3-(2-(4-(4-(2-hidroxi-acetil)-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin4-iloxi)-fenil)-acrilamida;
[0150] N-(3-(2-(4-(4-(2-dimetilamino-acetil)-piperazin-1-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0151 ]2-(4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)fenil)acetic acid;
[0152] N-(3-((2-((4-(metilsulfinil)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
23/111 [0153] /V-(3-((2-((4-(metilsulfonil)fenil)amino)tieno[3,2-ô]pirimidin-4il)oxi)fenil)acrilamida;
[0154]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)-N-metilbenzamida;
[0155]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)-N,Ndimetilbenzamida;
[0156] N-(3-((2-((4-(morfolin-4-carbonil)fenil)amino)tieno[3,2-a]pirimidin-4il)oxi)fenil)acrilamida;
[0157] N-(3-((2-((4-(4-metilpiperazin-1-carbonil)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0158] N-(3-(2-(4-(4-(1 -metil-piperidin-4-il)-piperazin-1 -carbonil)-fenilamino)tieno[3,2-a]pirimidin-4-iloxi)-fenil)-acrilamida;
[0159] N-(3-(2-(4-(4-hidroxi-piperidin-1-carbonil)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0160] N-(3-(2-(4-(3-metilamino-pirrolidin-1-carbonil)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0161] N-(3-(2-(4-(3-dimetilamino-pirrolidin-1 -carbonil)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0162]4-(4-(3-acriloilamino-fenoxi)-tieno[3,2-a]pirimidin-2-ilamino)-N-(2dimetilamino-etil)-benzamida;
[0163] N-(3-(2-(3-cloro-4-(4-etilpiperazin-1-carbonil)fenilamino)tieno[3,2-d]pirimidin4-iloxi)fenil)acrilamida;
[0164] N-(3-((2-((3-cloro-4-((2-(dimetilamino)etil)amino)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0165]4-(4-(3-acriloilamino-fenoxi)-tieno[3,2-a]pirimidin-2-ilamino)-2-cloro-N,Ndimetil-benzamida;
[0166] N-(3-(2-(3-cloro-4-(4-etanosulfonil-piperazin-1-carbonil)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
24/111 [0167]4-((4-(3-acrilamidofenoxi)tieno[3,2-c/]pirimidin-2-il)amino-2-cloro-/\/-(1 metilpiperidin-4-il)benzamida;
[0168]/V-(3-(2-(4-(4-etilpiperazin-1 -ilsulfonil)fenilamino)tieno[3,2-c/]pirimidin-4iloxi)fenil)acrilamida;
[0169]/V-(3-((2-((4-((metilsulfinil)metil)fenil)amino)tieno[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0170]/V-(3-((2-((4-(2-(metilsulf inil)etil)fenil)amino)tieno[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0171 ]/V-(3-((2-((4-sulfamoilfenil)amino)tieno[3,2-c/]pirimidin-4-il)oxi)fenil)acrilamida;
[0172]/V-(3-((2-((4-(morfolinosulfonil)fenil)amino)tieno[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0173]/V-(3-((2-((4-(/V-ciclopropilsulfamoil)fenil)amino)tieno[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0174]M(3-((2-((4-(A/-(2-(dimetilamino)etil)sulfamoil)fenil)amino)tieno[3,2c/]pirimidin-4-il)oxi)fenil)acrilamida;
[0175]Λ/-(3-((2-((4-(Λ/-(1 -metilpiperidin-4-il)sulfamoil)fenil)amino)tieno[3,2c/]pirimidin-4-il)oxi)fenil)acrilamida;
[0176]Λ/-(3-((2-((4-(Λ/-(1 -isopropilpiperidin-4-il)sulfamoil)fenil)amino)tieno[3,2c/]pirimidin-4-il)oxi)fenil)acrilamida;
[0177]3-(dimetilamino)propil-4-((4-(3-acrilamidofenoxi)tieno[3,2-c/]pirimidin-2il)amino)benzoate;
[0178]/V-(3-(2-(4-(2-(4-etilpiperazin-1 -il)etil)fenilamino)tieno[3,2-c/]pirimidin-4iloxi)fenil)acrilamida;
[0179]/V-(3-(2-(4-(2-piperidin-1 -il-etil)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0180]A/-(3-(2-(4-(1,1 -dioxo-1 À6-tiomorfolin-4-il)-fenilamino)-tieno[3,2-c/]pirimidin-4iloxi)-fenil)-acrilamida;
25/111 [0181] /V-(3-(2-(4-(2-(4-etilpiperazin-1 -il)acetil)fenilamino)tieno[3,2-d|pirimidin-4iloxi)fenil)acrilamida;
[0182] /V-(3-(2-(4-(1-etilpiperidin-4-iloxi)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0183] /V-(3-(2-(3-fluor-4-(1-metil-piperidin-4-iloxi)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0184] /V-(3-(2-(4-(2-morfolinoetoxi)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0185] /V-(3-(2-(4-(2-metoxi-etoxi)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0186] /V-(3-((2-((4-(2-(dimetilamino)etoxi)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0187] /V-(3-((2-((4-(2-(dietilamino)etoxi)fenil)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0188] /V-(3-((2-((4-(2-(pirrolidin-1-il)etoxi)fenil)amino)tieno[3,2-d|pirimidin-4il)oxi)fenil)acrilamida;
[0189] /V-(3-((2-((2,3,4,5-tetrahidrobenzo[P][1,4]oxazepin-7-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0190] /V-(3-(2-(2,3-dihidro-benzo[1,4]dioxin-6-ilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0191] /V-(3-(2-(3-fluor-4-(2-metoxi-etoxi)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0192] /V-(3-(2-(4-(2-dimetilamino-etoxi)-3-fluor-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0193] /V-(3-(2-(4-(2-dietilamino-etoxi)-3-fluor-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0194] /V-(3-(2-(3-fluor-4-(2-(4-metil-piperazin-1-il)-etoxi)-fenilamino)-tieno[3,226/111
d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0195] /V-(3-(2-(3-metoxi-4-(2-morfolin-4-il-etoxi)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0196](E)-4-(dimetilamino)-N-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)but-2-enamida;
[0197] /V-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4ilamino)fenil)acrilamida;
[0198] /V-(3-(2-(4-(4-etil-piperazin-1-il)-fenilamino)-tieno[3,2-ô]pirimidin-4-ilamino)fenil)-acrilamida;
[0199] /V-(3-(2-(4-(4-isopropil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4ilamino)-fenil)-acrilamida;
[0200] /V-(3-(2-(4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3.2-ó]pirimidin-4-ilamino)fenil)-acrilamida;
[0201] /V-(3-(2-(4-(1-metil-piperidin-3-il)-fenilamino)-tieno[3,2-a]pirimidin-4-ilamino)fenil)-acrilamida;
[0202] /V-(3-(2-(4-dimetilaminometil-fenilamino)-tieno[3,2-d]pirimidin-4-ilamino)fenil)-acrilamida;
[0203] /V-(3-(2-(4-piperidin-1-ilmetil-fenilamino)-tieno[3,2-d]pirimidin-4-ilamino)-fenil)acrilamida;
[0204] /V-(3-(2-(4-(2-dimetilamino-etil)-fenilamino)-tieno[3,2-d]pirimidin-4-ilamino)fenil)-acrilamida;
[0205] /V-(3-((2-((4-(2-(4-metilpiperazin-1-il)etil)fenil)amino)tieno[3,2-d]pirimidin-4il)amino)fenil)acrilamida;
[0206] /V-(3-(2-(4-(2-dimetilamino-etoxi)-fenilamino)-tieno[3,2-d]pirimidin-4-ilamino)fenil)-acrilamida;
[0207] /V-(3-(2-(4-(3-dimetilamino-propoxi)-fenilamino)-tieno[3,2-d]pirimidin-4ilamino)-fenil)-acrilamida;
27/111 [0208] /V-(3-(2-(3-fluor-4-(4-metil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4ilamino)-fenil)-acrilamida;
[0209] /V-(3-(2-(3-fluor-4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4ilamino)-fenil)-acrilamida;
[0210] /V-(3-(2-(3-fluor-4-(1-metil-piperidin-4-ilamino)-fenilamino)-tieno[3,2d]pirimidin-4-ilamino)-fenil)-acrilamida;
[0211] /V-(3-(2-(2-metoxi-4-piperidin-1 -ilmetil-fenilamino)-tieno[3,2-d]pirimidin-4ilamino)-fenil)-acrilamida;
[0212] A/-(4-fluor-3-(2-(4-(4-metil-piperazin-1-il)-fenilamino)-tieno[3,2-d]pirimidin-4ilamino)-fenil)-acrilamida;
[0213] /V-(4-fluor-3-(2-(3-fluor-4-(4-metil-piperazin-1-il)-fenilamino)-tieno[3,2d]pirimidin-4-ilamino)-fenil)-acrilamida;
[0214] /V-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iltio)fenil)acrilamida;
[0215] /V-(3-(2-(3-fluor-4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4ilsulfanil)-fenil)-acrilamida;
[0216] /V-(3-(2-(3-fluor-4-morfolin-4-il-fenilamino)-tieno[3,2-d]pirimidin-4-ilsulfanil)fenil)-acrilamida;
[0217](£)-4-(dimetilamino)-M-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2d]pirimidin-4-iltio)fenil)but-2-enamida;
[0218] /V-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4ilsulfinil)fenil)acrilamida;
[0219](Z)-3-cloro-M-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0220](£)-3-cloro-M-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0221] /V-(3-(2-(4-(4-etilpiperazin-1-il)-2-metoxifenilamino)tieno[3,2-d|pirimidin-428/111 iloxi)fenil)acrilamida;
[0222] /V-(3-(2-(2-metoxi-4-morfolinofenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0223]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)-2-metoxi-N-(1metilpiperidin-4-il)benzamida;
[0224] /V-(3-(2-(4-(piperidin-1-il)fenilamino)tieno[3,2-ô]pirimidin-4iloxi)fenil)acrilamida;
[0225] /V-(3-(2-(4-(pirrolidin-1-il)fenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0226]1-(4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)fenil)piperidin-4carboxilic acid;
[0227] /V-(3-(2-(4-(4-dimetilaminometil-piperidin-1-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0228] /V-(3-(2-(4-(4-piperidin-1-ilmetil-piperidin-1-il)-fenilamino)-tieno[3,2-d]pirimidin4-iloxi)-fenil)-acrilamida;
[0229] /V-(3-(2-(4-(1-metil-1,2,3,6-tetrahidro-piridin-4-il)-fenilamino)-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0230] /V-(3-(2-(4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3,2-a]pirimidin-4-iloxi)fenil)-acrilamida;
[0231] /V-(3-(2-(4-(1-etil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0232] /V-(3-(2-(4-(1-isopropil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0233] /V-(3-(2-(4-(1-metil-piperidin-3-il)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0234] /V-(3-(2-(4-dimetilaminometil-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
29/111 [0235] /V-(3-(2-(3-cloro-4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0236]4-(4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-ilamino)-N-(2-(pirrolidin-1il)etil)benzamida;
[0237] /V-(3-((2-((4-(2-((1-metilpiperidin-4-il)amino)-2-oxoetil)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0238] /V-(3-(2-(4-(3-piperidin-1-il-propenil)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)fenil)-acrilamida;
[0239] /V-(3-(2-(4-(3-pirrolidin-1-il-propionilamino)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0240]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino-N-(tetrahidro-2Hpiran-4-il)benzamida;
[0241]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino-N-(1-metilpiperidin4-il)benzamida;
[0242]4-((4-(3-acrilamidofenoxi)tieno[3,2-d]pirimidin-2-il)amino)-N-(1isopropilpiperidin-4-il)benzamida;
[0243]4-(4-(3-acriloilamino-fenoxi)-tieno[3,2-d]pirimidin-2-ilamino)-3-metoxi-N-(2pirrolidin-1-il-etil)-benzamida;
[0244] /V-(3-(2-(4-(4-(N,N-dimetilsulfamoil)piperazin-1-il)fenilamino)tieno[3,2d]pirimidin-4-iloxi)fenil)acrilamida;
[0245] /V-(3-(2-(4-(2-(4-(etilsulfonil)piperazin-1-il)etil)fenilamino)tieno[3,2-d]pirimidin4-iloxi)fenil)acrilamida;
[0246] /V-(3-(2-(6-(4-metilpiperazin-1-il)piridin-3-ilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0247] /V-(3-((2-(piridin-3-ilamino)tieno[3,2-d]pirimidin-4-il)oxi)fenil)acrilamida;
[0248] /V-(3-((2-((6-morfolinopiridin-3-il)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
30/111 [0249] /V-(3-((2-((6-(4-isopropilpiperazin-1-il)piridin-3-il)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0250] /V-(3-((2-((6-(4-(1-metilpiperidin-4-il)piperazin-1-il)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0251] /V-(3-((2-((6-(4-(2-(dimetilamino)etil)piperazin-1-il)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0252] /V-(3-((2-((6-(4-(dimetilamino)piperidin-1-il)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0253] /V-(3-((2-((6-(4-(pirrolidin-1-il)piperidin-1-il)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0254] /V-(3-((2-((6-([1,4'-bipiperidin]-1'-il)piridin-3-il)amino)tieno[3,2-a]pirimidin-4il)oxi)fenil)acrilamida;
[0255] /V-(3-((2-((6-((4-metilpiperazin-1-il)metil)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0256] /V-(3-((2-((6-((2-(piperidin-1-il)etil)amino)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0257] /V-(3-((2-((6-((1-isopropilpiperidin-4-il)amino)piridin-3-il)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0258] /V-(3-((2-((6-(metilsulfinil)piridin-3-il)amino)tieno[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
[0259] /V-(3-(2-(3-fluor-4-morfolinofenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0260] /V-(3-((2-((3-fluor-4-((1-metilpiperidin-4-il)amino)fenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0261] /V-(3-((3-fluor-4-((1-isopropilpiperidin-4-il)amino)fenil)amino)tieno[3,2a]pirimidin-4-il)oxi)fenil)acrilamida;
[0262] /V-(3-(2-(3-fluor-4-(4-(metilsulfonil)piperazin-1-il)fenilamino)tieno[3,2
31/111
d]pirimidin-4-iloxi)fenil)acrilamida;
[0263] /V-(3-(2-(4-(4-(etanosulfonilpiperazin-1-il)-3-fluor-fenilamino)tieno[3,2d]pirimidin-4-iloxi)-fenil)acrilamida;
[0264] /V-(3-(2-(4-(2,6-c/s-dimetilmorfolino)-3-fluorfenilamino)tieno[3,2-d]pirimidin-4iloxi)fenil)acrilamida;
[0265] /V-(3-(2-(3-fluor-4-(1-metil-piperidin-4-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0266] /V-(3-(2-(3-fluor-4-(1-metil-piperidin-3-il)-fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0267] /V-(3-(2-(3-fluor-4-(2-morfolin-4-il-etoxi)fenilamino)-tieno[3,2-d]pirimidin-4iloxi)-fenil)-acrilamida;
[0268] /V-(3-((2-((4-((2-(dimetilamino)etil)amino)-3-fluorfenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0269] /V-(3-((2-((3,5-difluor-4-(4-metilpiperazin-1-il)fenil)amino)tieno[3,2-d]pirimidin4-il)oxi)fenil)acrilamida;
[0270] /V-(3-((2-((4-((2-(dimetilamino)etil)amino)-3,5-difluorfenil)amino)tieno[3,2d]pirimidin-4-il)oxi)fenil)acrilamida;
[0271] /V-(3-((2-((3,5-difluor-4-((1-metilpiperidin-4-il)amino)fenil)tieno[3,2-d]pirimidin4-il)oxi)fenil)acrilamida;
[0272] /V-(3-(2-(4-(1-amino-ciclopropil)-fenilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0273] /V-(3-(2-[1-(2-dimetilamino-acetil)-2,3-dihidro-1 H-indol-5-ilamino]-tieno[3,2d]pirimidin-4-iloxi)-fenil)-acrilamida;
[0274] /V-(3-(2-(1-metil-/H-indol-5-ilamino)-tieno[3,2-d]pirimidin-4-iloxi)-fenil)acrilamida;
[0275] /V-(3-((2-((4-(4-metilpiperazin-1-il)fenil)amino)furo[3,2-d]pirimidin-4il)oxi)fenil)acrilamida;
32/111 [0276]/V-(3-((2-((4-(4-isopropilpiperazin-1 -il)fenil)amino)furo[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0277]/V-(3-((2-((4-morfolinofenil)amino)furo[3,2-c/|pirimidin-4-il)oxi)fenil)acrilamida;
[0278]/V-(3-((2-((4-((dimetilamino)metil)fenil)amino)furo[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0279]/V-(3-((2-((4-((4-(dimetilamino)piperidin-1-il)metil)fenil)amino)furo[3,2c/]pirimidin-4-il)oxi)fenil)acrilamida;
[0280]/V-(3-((2-((3-fluor-4-(1 -metilpiperazin-4-il)fenil)amino)furo[3,2-c/]pirimidin-4il)oxi)fenil)acrilamida;
[0281]/V-(3-((2-((4-(2-dimetilamino)etil)amino)-3-fluorfenil)amino)furo[3,2-c/|pirimidin4-il)oxi)fenil)acrilamida;
[0282]/V-(3-((2-((3-fluor-4-((1-metilpiperidin-4-il)amino)fenil)amino)furo[3,2c/]pirimidin-4-il)oxi)fenil)acrilamida;
[0283]/V-(3-(2-(3-metoxi-4-(4-metil-piperazin-1-il)-fenilamino)-furo[3,2-c/]pirimidin-4iloxi)-fenil)-acrilamida; and [0284]/V-(3-((2-((4-sulfamoilfenil)amino)furo[3,2-c/]pirimidin-4-il)oxi)fenil)acrilamida.
[0285]O composto de fórmula (I) de acordo com a presente invenção pode ser preparado pelo procedimento mostrado no esquema de reação (I):
[0286]Esquema de reação (I)
N'=NO2or NHBoc
(V) y
Ν'
Ν'
(III)
(II) (I) [0287]em que,
33/111 [0288]A, B, W, X, Y e Z têm os mesmos significados como definido acima;
[0289]R é hidrogênio, metil, ou etil; e [0290]N' é nitro, ou amina protegida com tert-butiloxicarbonil (Boc).
[0291]Como mostrado no esquema de reação (I), um composto de fórmula (VIII) é submetido a uma reação de condensação com ureia em um solvente orgânico (por exemplo, N,N-dimetilformamida, N,N-dimetilacetamida ou N-metilpirrolidona) em uma temperatura variando de temperatura de refluxo a 200°C; ou com cianato de potássio sob uma condição ácida como 6% a 50% de ácido acético aquoso em uma temperatura variando de temperatura ambiente a 100°C, para obter um composto condensado de fórmula (VII).
[0292]O composto de fórmula (VII) assim obtido é refluxado com agitação na presença de um agente de clorninação (po/ exemplo, oxicloreto fosforoso ou cloreto de tionila) para obter um composto clorinados de fórmula (VI), seguido por uma reação em um solvente orgânico (por exemplo, dimetilsulfóxido, N,Ndimetilformamida, N,N-dimetilacetamida, N-metilpirrolidona, acetonitrila, tetrahidrofuran, 1,4-dioxano, tolueno ou benzeno) na presença de uma base inorgânica (por exemplo, carbonato de césio, carbonato de sódio ou carbonato de potássio) em uma temperatura variando de temperatura ambiente a 100°C, induzindo a substituição na posição C-4 position do composto de fórmula (VI) com anilina, fenol ou tiofenol derivado de fórmula (V), para obter um composto de fórmula (IV).
[0293]O composto de fórmula (IV) é reagido com Z-NH2 em uma solução alcoólica (por exemplo, 2-propanol ou 2-butanol) na presença de um ácido inorgânico (por exemplo, ácido clorídrico) ou ácido orgânico (por exemplo, ácido trifluoracético) em uma temperatura variando de 70°C até temperatura de refluxo; ou com Z-NH2 em um solvente orgânico (por exemplo, 1,4-dioxano) na presença de um catalisador de paládio (por exemplo, acetato de paládio (II) ou tris(dibenzilidenacetona)dipaládio(0),
34/111 e na presença de um ligante (por exemplo, bis(difenilfosfino)(Xanthene)(Xantphos) ou 2,2'-bis(disfenilfosfino)-1,1'-binaftil (BINAP)) e uma base inorgânica (por exemplo, carbonato de césio ou t-butóxido de sódio) em uma temperatura de cerca de 100°C, para obter um composto de fórmula (III) contendo um grupo Z-NH2.
[0294]O composto de fórmula (III) em que N' é grupo nitro é submetido a uma hidrogenação usando um catalisador de paládio/carbono, ou uma redução de reação mediada com Fe, para obter um composto anilina de fórmula (II) cujo um grupo nitro é substituído com um grupo amino. O composto de fórmula (III) em que N' é grupo amina protegido com íerí-butiloxicarbonil (Boc) é submetido a uma reação com um ácido (por exemplo, ácido trifluoracético ou ácido clorídrico) em um solvente orgânico (por exemplo, cloreto de metileno), para obter um composto anilina desprotegido de fórmula (II).
[0295]Subsequentemente, o composto anilina de fórmula (II) é submetido a uma reação com um cloreto de acriloil substituído com A e B, em um solvente orgânico (por exemplo, cloreto de metileno ou tetrohidrofurano) ou um solvente misto como 50% de tetrahidrofurano aquoso na presença de uma base inorgânica (por exemplo, bicarbonato de sódio) ou base orgânica (por exemplo, trietilamina ou diisopropiletilamina) em uma temperatura variando de -10°C a 10°C; ou com ácido acrílico substituído com A e B, em piridina usando um agente de acoplamento (por exemplo, 1-etil-3-(3-dimetilaminopropil)carbodiimida (EDCI) ou 2-(1H-7azabenzotriazol-1-il)-1,1,3,3-tetrametil urônio hexafluor fosfato metanoamínio (HATU)), para obter o composto inventivo de fórmula (I) contendo um grupo acrilamida.
[0296]O composto de fórmula (I) da presente invenção pode ainda ser preferencial na forma de um sal farmaceuticamente aceitável com um ácido inorgânico ou orgânico como ácido clorídrico, ácido bromídrico, ácido sulfúrico, ácido fosfórico, ácido nítrico, ácido acético, ácido glicólico, ácido láctico, ácido pirúvico, ácido
35/111 malônico, ácido succínico, ácido glutárico, ácido fumarico, ácido málico, ácido mandélico, ácido tartárico, ácido cítrico, ácido ascórbico, ácido palmítico, ácido maleico, ácido hidroximaleico, ácido benzoico, ácido hidroxibenzoico, ácido fenilacético, ácido cinâmico, ácido salicílico, ácido metanosulfônico, ácido benzenosulfônico e ácido toluenosulfônico.
[0297]O sal farmaceuticamente aceitável da presente invenção pode ser preparado por métodos convencionais, por exemplo, dissolvendo o composto de fórmula (I) em um solvente orgânico miscível em água como acetona, metanol, etanol e acetonitrila, adicionado a este um excesso de quantidade de um ácido orgânico ou uma solução aquosa de ácido inorgânico, para induzir a precipitação de sais da mistura resultante, removendo o solvente e deixando ácido livre do mesmo, e isolando os sais precipitados.
[0298]O composto inventivo de fórmula (I) ou o sal farmaceuticamente aceitável do mesmo pode incluir um hidrato e um solvato do mesmo.
[0299]Assim, a presente invenção fornece um uso do composto inventivo para a produção de um medicamento para prevenir ou tratar cânceres, tumores, doenças inflamatórias, doenças autoimunes, ou doenças mediadas imunologicamente.
[0300]Além disso, a presente invenção fornece uma composição farmacêutica para prevenir ou tratar cânceres, tumores, doenças inflamatórias, doenças autoimunes, ou doenças mediadas imunologicamente que compreendem o composto inventivo como um ingrediente ativo.
[0301]Ainda, a presente invenção fornece um método para prevenir ou tratar cânceres, tumores, doenças inflamatórias, doenças autoimunes, ou doenças mediadas imunologicamente, que compreende administrar o composto inventivo a um mamífero em necessidade do mesmo.
[0302]O composto inventivo de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo seletivamente e efetivamente inibe o crescimento de células
36/111 cancerígenas induzidas por um receptor de fator de crescimento epidérmico (EGFR) tirosina quinase ou uma mutante da mesma bem como as drogas contra resistência. Assim, a presente invenção fornece uma composição farmacêutica para prevenir ou tratar cânceres ou tumores induzidos por uma EGFR tirosina quinase ou uma mutante da mesma que compreende o composto de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo como um ingrediente ativo.
[0303]Exemplos representativos dos cânceres ou tumores podem incluir, entre outros, câncer hepático, carcinoma hepatocelular, câncer de tireoide, câncer colorretal, câncer testicular, câncer de osso, câncer oral, carcinoma de célula basal, câncer ovariano, tumor cerebral, carcinoma de bexiga, câncer de trato biliar, câncer de cabeça e pescoço, câncer colorretal, carcinoma vesical, câncer de língua, câncer esofágico, glioma, glioblastoma, câncer renal, melanoma maligno, câncer gástrico, câncer de mama, sarcoma, carcinoma de faringe, câncer uterino, câncer cervical, câncer de próstata, câncer retal, câncer pancreático, câncer pulmonar, câncer de pele, e outros cânceres sólidos.
[0304]O composto inventivo de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo pode fornecer efeitos anticâncer melhorados quando este é administrado em combinação com outro agente anticâncer para tratar cânceres ou tumores.
[0305]Exemplos representativos de agente anticâncer para tratar cânceres ou tumores podem incluir, entre outros, inibidores de transdução de sinal celular (por exemplo, imatinib, gefitinib, bortezomib, erlotinib, sorafenib, sunitinib, dasatinib, vorinostat, lapatinib, temsirolimus, nilotinib, everolimus, pazopanib, trastuzumab, bevacizumab, cetuximab, ranibizumab, pegaptanib, panitumumab e semelhantes), inibidores de mitose (por exemplo, paclitaxel, vincristina, vinblastina e semelhantes), agentes alquilantes (por exemplo, cisplatina, ciclofosfamida, cromabucil, carmustina e semelhantes), anti-metabólitos (por exemplo, metotrexato, 5-FU e semelhantes), agentes anticâncer intercalantes, (por exemplo, actinomicina, antraciclina,
37/111 bleomicina, mitomicina-C e semelhantes), inibidores de topoisomerase (por exemplo, irinotecano, topotecano, teniposideo e semelhantes), agentes imunoterápicos (por exemplo, interleucina, interferon e semelhantes) e agentes antihormonais (por exemplo, tamoxifeno, raloxifeno e semelhantes), e pelo menos um agente anticâncer selecionado do mesmo pode ser incluído na composição farmacêutica inventiva.
[0306]Ainda, o composto inventivo de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo seletivamente e efetivamente inibe tirosina quinase de Bruton (BTK), janus quinase 3 (JAK3), interleucina-2 induzindo quinase de célula T (ITK), quinase de linfócito em repouso (RLK), e tirosina quinase de medula óssea (BMX), que são principalmente expressas em linfócitos B e/ou linfócitos T anormalmente ativados. Nomeadamente, o composto inventivo de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo pode tratar ou prevenir cânceres, tumores, doenças inflamatórias, doenças autoimunes ou doenças mediadas imunologicamente causadas por linfócitos B, linfócitos T anormalmente ativados ou ambos. Portanto, a presente invenção ainda fornece uma composição farmacêutica para tratar ou prevenir cânceres, tumores, doenças inflamatórias, doenças autoimunes, ou doenças mediadas imunologicamente que compreendem o composto de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo como um ingrediente ativo.
[0307]Exemplos representativos de doenças inflamatórias, doenças autoimunes e doenças mediadas imunologicamente podem incluir, entre outros, artrite, artrite reumatoide, espondiloartropatia, artrite gotosa, osteoartrite, artrite juvenil, outras condições artríticas, lúpus, lúpus eritematoso sistêmico (SLE), doença relacionada a pele, psoríase, eczema, dermatite, dermatite atópica, dor, distúrbio pulmonar, inflamação pulmonar, síndrome de distresse respiratório do adulto (ARDS), sarcoidose pulmonar, doença inflamatória pulmonar crônica, doença pulmonar obstrutiva crônica (COPD), doença cardiovascular, arterosclerose, infarto do
38/111 miocárdio, falência cardíaca congestiva, lesão de reperfusão cardíaca, doença intestinal inflamatória, Doença de Crohn, colite ulcerativa, síndrome do intestino irritável, asma, síndrome de sjogren, doença de tireoide de autoimunidade, urticária (cnidose), esclerose múltipla, escleroderma, rejeição de transplante de órgão, enxerto heteroplástico, púrpura trombocitopênica idiopática (ITP), Doença de Parkinson, Doença de Alzheimer, doença associada a diabetes, inflamação, doença inflamatória pélvica, rinite alérgica, bronquite alérgica, sinusite alérgica, leucemia, linfoma, linfoma de célula B, linfoma de célula T, mieloma, leucemia linfoide aguda (ALL), leucemia linfoide crônica (CLL), leucemia mieloide aguda (AML), leucemia mieloide crônica (CML), leucemia de célula peluda, Doença de Hodgkin, linfoma nãoHodgkin, mieloma múltiplo, síndrome mielodisplástica (MDS), neoplasmas mieloproliferativas (MPN), linfoma de célula B grande difusa, e linfoma folicular.
[0308]O composto inventivo de fórmula (I) ou um sal farmaceuticamente aceitável do mesmo pode fornecer efeitos terapêuticos melhorados quando é administrado em combinação com outro agente terapêutico para tratar doenças inflamatórias, doenças autoimunes, ou doenças mediadas imunologicamente.
[0309]Exemplos representativos de agente terapêutico para tratar as doenças inflamatórias, doenças autoimunes, ou doenças mediadas imunologicamente podem incluir, entre outros, drogas esteroides (por exemplo, prednisona, prednisolona, metil prednisolona, cortisona, hidroxicortisona, betametasona, dexametasona e semelhantes), metotrexatos, leflunomidas, agentes anti-TNFa (por exemplo, etanorcept, infliximab, adalimunab e semelhantes), inibidores de calcineurina (por exemplo, tacrolimus, pimecrolimus e semelhantes) e drogas anti-histamínicas (por exemplo, difenidramina, hidroxizina, loratadina, ebastina, cetotifeno, cetirizina, levocetirizina, fexofenadina e semelhantes), e pelo menos um agente terapêutico selecionado do mesmo pode ser incluído na composição farmacêutica inventiva.
[0310]O composto inventivo de fórmula (I) ou um sal farmaceuticamente aceitável
39/111 do mesmo pode ser administrado oralmente ou parenteralmente como um ingrediente ativo em uma quantidade efetiva variando de cerca de 0,1 a 2.000 mg/kg, preferencialmente 1 a 1.000 mg/kg peso corporal por um dia em caso de mamíferos incluindo humanos (de aproximadamente 70 kg peso corporal) em uma única a 4 doses divididas por um dia, ou cronogramas on/off. A dosagem do ingrediente ativo pode ser ajustada à luz de vários fatores relevantes como a condição do sujeito a ser tratada, tipo e seriedade de doença, taxa de administração, e opinião médica. Em certos casos, uma quantidade menos do que a dosagem acima pode ser apropriada. Uma quantidade maior do que a dosagem acima pode ser usada a menos que cause efeito colateral deletério e dita quantidade pode ser administrada em doses divididas por dia.
[0311]A composição farmacêutica inventiva pode ser formulada de acordo com qualquer um dos métodos convencionais na forma de comprimido, grânulo, pó, cápsula, xarope, emulsão ou microemulsão para administração oral, ou para administração parenteral incluindo vias intramusculares, intravenosas e subcutâneas.
[0312]A composição farmacêutica inventiva para administração oral pode ser preparada por mistura do ingrediente ativo com um carreador como celulose, silicato de cálcio, amido de milho, lactose, sacarose, dextrose, fosfato de cálcio, ácido esteárico, estearato de magnésio, estearato de cálcio, gelatina, talco, surfactante, agente de suspensão, emulsificante e diluente. Exemplos de carreador empregados na composição injetável da presente invenção são água, uma solução salina, uma solução de glicose, uma solução tipo glicose, álcool, glicol, éter (por exemplo, polietileno glicol 400), óleo, ácido graxo, éster de ácido graxo, glicerídeo, um surfactante, um agente suspensão e um emulsificante.
[0313]A presente invenção é ainda descrita e ilustrada nos exemplos fornecidos abaixo, que são, no entanto, não pretendidos para limitar o escopo da presente invenção.
40/111 [0314]Exemplo 1: Preparação de A/-(3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-c/]pirimidina-4-iloxi)fenil)acrilamida
[0315]Etapa 1) Preparação de tieno[3,2-d]pirimidina-2,4(1 H,3H)-diona o
[0316]Metil 3-aminotiofeno-2-carboxilato (4,9 g, 31,3 mmol) e ureia (19 g, 187 mmol) foram dissolvidos em N,N-dimetilformamida (10 ml_), a temperatura de reação foi aumentada para 190 oC, seguido por agitação por 12 horas. Após a reação estar completa, a mistura de reação foi adicionada a 1N NaOH solução aquosa, resfriada até temperatura ambiente e filtrada sob uma pressão reduzida para remover o precipitado insolúvel. O filtrado foi acidificado (pH 2) com 2N HCI solução aquosa, e o sólido resultante foi filtrado sob uma pressão reduzida com lavagem usando água destilada. O sólido resultante foi seco sob uma pressão reduzida para obter o composto título (rendimento: 3,2 g, 61,5 %).
[0317]1 H-NMR (300MHz, CDCI3) δ 11,59 (s, 1H), 11,14 (s, 1H), 8,00 (d, 1H), 6,90 (d, 1H).
[0318]Etapa 2) Preparação de 2,4-diclorotieno[3,2-d]pirimidina
Cl
[0319]O composto (3,2 g, 19,4 mmol) obtido na etapa 1 foi dissolvido em oxicloreto fosforoso (12 ml_) e refluxado com agitação por 3 horas a 200 oC. Após a reação estar completa, a mistura de reação foi resfriada até temperatura ambiente e
41/111 adicionada sob gotejamento a 4 oC água destilada com agitação vigorosamente. O sólido resultante foi filtrado sob uma pressão reduzida com lavagem usando água destilada, e o sólido resultante foi seco sob uma pressão reduzida para obter o composto título (rendimento: 2,9 g, 73,3 %).
[0320]1 H-NMR (300MHz, DMSO-d6) δ 8,74 (d, 1H), 7,78 (d, 1H).
[0321]Etapa 3) Preparação de 2-cloro-4-(3-nitrophenoxi)tieno[3,2-d]pirimidina
Cl [0322]O composto (2,9 g, 14,2 mmol) obtido na etapa 2 foi dissolvido em N,Ndimetilsulfoneamida (70 ml_), e 3-nitrofenol (1,9 g, 14,2 mmol) e carbonato de césio (9,2 g, 28,4 mmol) foram adicionados a este, seguido por agitação temperatura ambiente por 1 hora. Após a reação estar completa, água destilada foi adicionada à mistura de reação, e o sólido resultante foi filtrado sob uma pressão reduzida com lavagem com água destilada. O sólido [0323]resultante foi seco sob uma pressão reduzida para obter o composto título (rendimento: 4,0 g, 91,8 %).
[0324] 1 H-NMR (300MHz, CDCI3) δ 8,25-8,17 (m, 2H), 8,08 (s, 1H), 7,69-7,66 (m, 2H), 7,57 (d, 1H).
[0325]Etapa 4) Preparação de N-(4-(4-metilpiperazin-1 -il)fenil)-4-(3nitrofenoxi)tieno[3,2-d]pirimidina-2-amina [0326]O composto (4 g, 12,9 mmol) obtido na etapa 3 foi dissolvido em 2-butanol (70 ml_), e 4-(4-metilpiperazin-1-il)benzenoamina (2,7 g, 12,9 mmol) e ácido
42/111 trifluoracético (1,5 mL, 12,9 mmol) foram adicionados a este. A mistura foi agitada a 100 oC por 16 horas para completar a reação, diluída com diclorometano, e então lavada com NaHCO3 solução aquosa saturada. A camada orgânica foi seca com sulfato de sódio anidro e então filtrada e destilada sob pressão reduzida. O resíduo foi separado por cromatografia em coluna (diclorometano : metanol = 20 : 1 (razão de volume)) para obter o composto título (rendimento: 2,67 g, 42 %).
[0327]1 H-NMR (300MHz, CDCI3) δ 8,20 (s, 1H), 7,91 (m, 1H), 7,84 (d, 1H), 7,66 (m, 2H), 7,36 (s, 1H), 7,26 (m, 2H), 6,57 (d, 1H), 6,29 (m, 1H), 3,82 (s, 3H), 3,19 (m, 4H), 2,62 (m, 4H), 2,36 (s, 3H).
[0328]Etapa 5) Preparação de 4-(3-aminofenoxi)-N-(4-(4-metilpiperazin-1il)fenil)tieno[3,2-d]pirimidina-2-amina [0329]Ferro (1,5 g, 27,1 mmol) e 12 N HCI solução aquosa (0,18 mL, 2,17 mmol) foram diluídos com 50 % etanol solução aquosa (30 mL), seguido por agitação a 100QC por 10 min. O composto (2,67 g, 5,42 mmol) obtido na etapa 4 foi dissolvido em 50% etanol solução aquosa (30 mL) e então adicionado ao frasco de reação em que ferro foi ativado, seguido por agitação a 100QC por 1 hora. Após a reação estar completa, a mistura de reação foi filtrado com celite para remover o ferro, e o filtrado foi diluído sob pressão reduzida. O resíduo foi diluído com diclorometano e lavado com NaHCO3 solução aquosa saturada. A camada orgânica foi seca com sulfato de sódio anidro e então filtrada e destilada sob pressão reduzida. O resíduo foi separado por cromatografia em coluna (diclorometano : metanol = 10:1 (razão de volume)) para obter o composto título (rendimento: 1,7 g, 67,8 %).
[0330]1 H-NMR (300MHz, CDCI3) δ 8,20 (s, 1H), 7,91 (m, 1H), 7,84 (d, 1H), 7,66
43/111 (m, 2H), 7,36 (s, 1H), 7,26 (m, 2H), 6,57 (d, 1H), 6,29 (m, 1H), 3,82 (s, 3H), 3,19 (m, 4H), 2,62 (m, 4H), 2,36 (s, 3H).
[0331]Etapa 6) Preparação de N-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2d]pirimidina-4-iloxi)fenil)acrilamida [0332]O composto (1,7 g, 3,69 mmol) obtido na etapa 5 e NaHCO3 (930 mg, 11,07 mmol) foram destilados com tetrahidrofurano (40 mL) e água destilada (6 mL), e cloreto de acriloil (0,36 mL, 3,69 mmol) foi adicionado a este lentamente a 0QC com agitação por 15 min. Após a reação estar completa, a mistura de reação foi destilada com diclorometano e então lavada com NaHCO3 solução aquosa saturada. A camada orgânica foi seca com sulfato de sódio anidro e então filtrada e destilada sob pressão reduzida, e o resíduo foi separado por cromatografia em coluna (clorofórmio : metanol = 20 : 1 (razão de volume)) para obter o composto título (rendimento: 1,3 g, 68,2 %).
[0333]1 H-NMR (300MHz, CDCI3) δ 7,96 (m, 1H), 7,83 (d, 1H), 7,70 (d, 1H), 7,61 (s, 1H), 7,45 (m, 2H), 7,25 (m, 2H), 7,01 (m, 1H), 6,45 (d, 1H), 6,35-6,32 (m, 3H), 5,71 (dd, 1H);
[0334]MS (ESI+): m/z = 517,1 [M+H]+.
[0335]O procedimento do Exemplo 1 foi repetido exceto para uso de vários derivados de amina representados por Z-NH2 (Z é o mesmo como definido acima) ao invés de 4-(4-metilpiperazin-1-il)benzenoamina na Etapa 4 para preparar os compostos dos Exemplos 2 a 156 que são mostrados nas Tabelas 1a a 1v abaixo.
<Tabela 1a>
|
Exemplo |
Estrutura |
Dados de análise |
|
2 |
Onh
O N^N |
1H-NMR (300MHz, CDCI3) δ 7,96 (m, 1H), 7,83 (d, 1H), 7,70 (d, 1H), 7,61 (s, 1H), 7,45 (m, 2H), 7,25 ( m, 2H), 7,01 (m, 1H), 6,45 (d, 1H), 6,35-6,32 (m, 3H), 5,71 (dd, 1H);
MS (ESI+): m/z= 517,1 [M+H]+, |
44/111
|
3 |
'IO F
- NH D Λ hPN |
1H-NMR (300MHz, CDCI3) δ 7,83 (d, 1H), 7,70 (s, 1H), 7,45 (m, 1H), 7,42 (m, 1H), 7,40 (m, 1H), 7,04 (m, 2H), 6,83 (dd, 1H), 6,80 (t, 1H), 6,43 (dd, 1H), 6,27 (dd, 1H), 5,76 (dd, 1H), 3,03 (m, 4H), 2,60 (m, 4H), 2,36 (s, 3H);
MS (ESI+): m/z = 505,10 [M+H]+. |
|
4 |
^AjH
0 O Η’-ΤΙ |
1H-NMR (300MHz,CDCIs) δ 7,99 (m, 1H), 7,87 (m, 1H), 7,73 (s, 1H), 7,46 (m, 2H), 7,29 (m, 1H), 7,00 (d, 1H), 6,79 (dd, 1H), 6,52 (t, 1H), 6,45 (dd, 1H), 6,26 (dd, 1H), 5,78 (dd, 1H), 2,86 (m, 4H), 2,57 (m, 4H), 2,35 (s, 3H);
MS (ESI+): m/z = 505,10 [M+H]+. |
|
5 |
m
F'-'nh -Λόο^
H S-í |
1H-NMR (300MHz, DMSO-ds) δ 10,35(s, 1H), 9,75(s, 1H), 8,33(d, 1H), 7,77(m, 1H), 7,48(m, 1H), 7,41 (m, 2H), 7,27(m, 2H), 7,01 (m, H), 6,43(m, 1H), 6,21 (dd, 1H), 5,75(dd, 1H), 2,97(s, 4H), 2,37(s, 4H), 2,19(S, 3H);
MS (ESI+): m/z = 523,2 [M+H]+. |
|
6 |
-¾ |
1H-NMR (300MHz, DMSO-ds) δ 10,34 (s, NH), 8,28 (d, 1H), 8,21 (S, NH), 7,71 (s, 1H), 7,56 (d, 1H), 7,45 (t, 1H), 7,40 (d, 1H), 7,29 (d, 1H), 7,06 (d, 1H), 6,51 (t, 1H), 6,45 (m, 1H), 6,38 (d, 1H), 5,75 (d, 1H), 3,76 (s, 3H), 2,90 (br, 4H), 2,44 (br, 4H), 2,21 (s, 3H); MS (ESI+): m/z = 535,0 [M+H]+. |
|
7 |
^NH |
1H-NMR (300MHz, DMSO-ds) δ 10,33 (brs, 1H), 9,51 (brs, 1H), 8,30-8,28 (m, 1H), 7,72-7,69 (m, 2H), 7,56 (m, 1H), 7,46-7,41 (m, 2H), 7,36-7,34 (m, 1H), 7,07-7,03 (m, 1H), 6,92-6,89 (m, 1H), 6,40-6,37 (m, 1H), 6,26 (m, 1H), 5,77-5,76 (m, 1H), 2,77 (m, 4H), 2,42 (m, 4H), 2,20 (s, 3H);
MS (ESI+):m/z= 521,1 [M+H]+, |
|
8 |
ΝΊ .
''A O njn |
1H-NMR (300MHz, CDCI3) δ 7,82 (d, 1H), 7,58 (d, 1H), 7,43 (t, 1H), 7,36 (d, 1H), 7,05 (dd, 1H), 6,80 (s, 1H), 6,77 (d, 2H), 6,45 (dd, 1H), 6,26 (d, 1H), 5,65 (dd, 1H), 3,40 (m, 4H), 2,76 (m, 4H); MS (ESI+): m/z = 501,13 [M+H]+. |
<Tabela 1b>
|
Exemplo |
Estrutura |
Dados de análise |
|
9 |
‘Ν'-'ι
0 Γ*'! t/h |
1H-NMR (300MHz, CDCI3) δ 7,83 (d, 1H), 7,70 (s, 1H), 7,45 (m, 1H), 7,42 (m, 1H), 7,40 (m, 1H), 7,04 (m, 2H), 6,83 (dd, 1H), 6,80 (t, 1H), 6,43 (dd, 1H), 6,27 (dd, 1H), 5,76 (dd, 1H), 3,03 (m, 4H), 2,60 (m, 4H), 2,36 (s, 3H);
MS (ESI+): m/z = 505,10 [M+H]+. |
|
10 |
YV,
O |
1H-NMR (300MHz, CDCI3) δ 7,81-7,79 (m, 1H), 7,59-7,49 (m, 2H), 7,42-7,37 (t, 1H), 7,29-7,26 (m, 2H), 7,05-7,02 (m, 1H), 6,90 (m, 1H), 6,81-6,78 (m, 2H), 6,46-6,40 (m, 1H), 6,28-6,24 (m, 1H), 5,78-5,75 (m, 1H), 3,14-3,11 (m, 4H), 2,63-2,60 (m, 4H), 2,52-2,45 (q, 2H), 1,16-1,11 (t, 3H);
MS (ESI+): m/z = 501,2 [M+H]+. |
45/111
|
11 |
A·'',
V-A-o-Vi |
1H-NMR (300MHz, CD3OD) δ 8,04 (d, 1H), 7,66 (m, 2H), 7,43 (t, 1H), 7,33 (d, 2H), 7,23 (d, 1H), 7,03 (m, 1H), 6,78 (d, 2H), 6,40 (m, 2H), 5,78 (m, 1H), 3,08 (m, 4H), 2,65 (m, 5H), 1,14 (d, 6H);
MS (ESI+): m/z = 515,04 [M+H]+. |
|
12 |
An —-
VV-fJH
w |
1H-NMR (300MHz, CDCI3) δ 7,81-7,80 (d, 1H), 7,60-7,57 (m, 2H), 7,44-7,32 (m, 4H), 7,06-7,03 (m, 1H), 6,83-6,78 (m, 3H), 6,47-6,41 (m, 1H), 6,29-6,20 (m, 1H), 5,80-5,76 (m, 1H), 3,13-3,10 (m, 4H), 2,76-2,73 (m, 4H), 1,12 (s, 9H); MS (ESI+): m/z529 [M+H]+. |
|
13 |
Aj,
□ r^j N^M -1----^.-1- |-| . J---Ú_| |
1H-NMR (300MHz, DMSO-d6) δ ; 10,35 (s, 1H), 9,21 (s, 2H), 8,24 (d, 1H), 7,68 (m, 1H), 7,61 (d, 1H), 7,44 (d, 1H), 7,38 (m, 2H), 7,29 (d, 1H), 7,03 (dd, 1H), 6,68 (d, 1H), 6,37 (dd, 1H), 6,27 (dd, 1H), 5,76 (dd, 1H), 2,93 (m, 4H), 2,58 (m, 4H), 2,25 (m, 1H), 1,74 (m, 5H), 1,19 (m,5H);
MS (ESI+): m/z =555 [M+H]+. |
|
14 |
R^NI->
co» |
1H-NMR (300MHz, CD3OD) δ 8,08-8,06 (d, 1H), 7,69-7,68 (m, 2H), 7,49-7,43 (t, 1H), 7,39-7,36 (d, 2H), 7,27-7,25 (d, 1H), 7,07 (m, 1H), 6,83-6,80 (d, 2H), 6,45-6,40 (m, 2H), 5,82-5,78 (m, 1H), 4,73-4,70 (t, 1 H), 4,57-4,54 (t, 1H), 3,143,11 (m, 4H), 2,85-2,82 (t, 1 H), 2,75-2,72 (m, 5H). |
|
15 |
F-T'”N“-1
F L-_.M.
O-NH
□ |V-j n:n |
1H-NMR (300MHz, DMSO-d6) δ 10,3 (s, 1H), 9,21 (s, 1H), 8,24 (d, 1H), 7,68 (m, 1H), 7,60 (d, 2H), 7,46 (s, 1H), 7,43 (m, 2H), 7,29 (d, 1H), 7,04 (dd, 1H), 6,69 (d, 2H), 6,41 (dd, 1H), 6,27 (dd, 1H), 6,16 (t, 1H), 5,75 (dd, 1H), 2,98 (m, 4H), 2,75 (t, 2H), 2,63 (m, 4H);
MS (ESI+): m/z = 537,2 [M+H]+. |
<Tabela 1c>
|
Exemplo |
Estrutura |
Dados de análise |
|
16 |
NH |
1H-NMR (300MHz, DMSO-d6) δ 10,34 (brs, 1H), 9,22 (brs, 1H), 8,26-8,24 (d, 1H), 7,67 (s, 1H), 7,62-7,60 (m, 1H), 7,46-7,39 (m, 3H), 7,31-7,29 (d, 1H), 7,05-7,02 (m, 1H), 6,70-6,68 (m, 2H), 6,46-6,37 (m, 1H), 6,27-6,21 (m, 1H), 5,77-5,74 (m, 1H), 3,25-3,15 (q, 2H), 2,98 (m, 4H), 2,71 (m,4H);
MS (ESI+): m/z = 554,97 [M+H]+. |
|
17 |
|
1H-NMR (300MHz, CDCI3) δ 7,81-7,79 (m, 1H), 7,55 (m, 2H), 7,42-7,32 (m, 3H), 7,23 (m, 1H), 7,05-7,02 (m, 1H), 6,90 (brs, 1H), 6,80-6,77 (m, 2H), 6,46-6,40 (m, 1H), 6,27-6,24 (m, 1H), 5,78-5,74 (m, 1H), 3,57-3,53 (t, 2H), 3,37 (s, 3H), 3,14-3,10 (m, 4H), 2,67-2,61 (m, 4H); MS (ESI+): m/z = 531,3 [M+H]+. |
46/111
|
18 |
V
O Ν'Ν |
1H-NMR (300MHz, DMSO-d6) δ 10,35 (brs, 1H), 9,22 (brs, 1H), 8,27-8,25 (d, 1H), 7,70-7,69 (m, 1H), 7,647,61 (m, 1H), 7,48-7,40 (m, 2H), 7,32-7,30 (m, 1H), 7,07-7,04 (m, 1H), 6,72-6,69 (m, 2H), 6,43-6,39 (m, 1H), 6,29-6,24 (m, 1H), 5,80-5,76 (m, 1H), 4,43-4,39 (t, 1 H), 3,56-3,50 (q, 2H), 2,98 (m, 4H), 2,51 (m, 4H), 2,442,40 (t, 2H);
MS (ESI+): m/z = 517,2 [M+H]+. |
|
19 |
0
^Ν->
0 f-'j N>1 |
1H-NMR (300MHz, DMSO-d6) δ 10,33 (brs, 1H), 9,41 (brs, 1H), 8,26-8,24 (m, 1H), 7,68-7,67 (m, 1H), 7,637,60 (m, 1H), 7,46-7,41 (m, 3H), 7,31-7,29 (m, 1H), 7,06-7,03 (m, 1H), 6,74-6,71 (m, 2H), 6,41-6,38 (m, 1H), 6,28-6,27 (m, 1H), 5,78-5,74 (m, 1H), 3,54-3,52 (m, 4H), 2,99-2,96 (m, 2H), 2,93-2,89 (m, 2H), 2,01 (s, 3H);
MS (ESI+): m/z = 515,3 [M+H]+. |
|
20 |
O
NH |
1H-NMR (300MHz, DMSO-d6) δ 10,45 (brs, 1H), 9,59 (brs, 1H), 8,31-8,30 (m, 1H), 7,88 (s, 1H), 7,80-7,43 (m, 4H), 7,37(d, 1H), 7,19-7,09 (m, 3H), 6,51-6,43 (m, 1H), 6,29-6,23 (m, 1H), 5,79-5,76 (m, 1H), 4,10 (s, 2H), 3,513,49 (m,4H), 3,21-3,18 (m,4H);
MS (ESI+): m/z = 531,1 [M+H]+. |
|
21 |
L^nh |
1H-NMR (300MHz, CDCI3) δ 7,85(d, 1H), 7,65-7,60 (m, 2H), 7,42-7,35 (m, 4H), 7,26 (d, 1H), 7,03-7,01 (m, 1H), 6,80.-6,87 (m, 2H), 6,41-6,41 (m, 1H), 6,35-6,32 (m, 1H), 5,77-5,74 (m, 1H), 3,83-3,74 (m, 4H), 3,19 (s, 2H), 3,15-3,06 (m, 4H), 2,32 (s, 6H);
MS (ESI+): m/z = 558,2 [M+H]+. |
|
22 |
O
<Ν·“·Ν^ι
‘AjH o Ι*Ί) N^N |
1H-NMR (300MHz, DMSO-d6) δ 10,38 (brs, 1H), 9,28 (brs, 1H), 8,31-8,26 (m, 2H), 7,68-7,62 (m, 2H), 7,487,43 (m, 2H), 7,31 (d, 1H), 7,08 (d, 1H), 6,74-6,71 (m, 2H), 6,49-6,40 (m, 1H), 6,29-6,23 (m, 1H), 5,79-5,76 (m, 1H), 3,59-3,57 (m, 4H), 3,34-3,28 (m, 4H), 3,183,17 (m,4H), 3,05-2,97 (m, 4H);
MS (ESI+): m/z = 586,2 [M+H]+. |
<Tabela 1d>
|
Exemplo |
Estrutura |
Dados de análise |
|
23 |
I. NH
O N ' N
N 'O A
H 5 f |
1H-NMR (300MHz, DMSO-d6) δ 10,34 (brs, 1H), 9,26 (brs, 1H), 8,27-8,25 (m, 1H), 7,68 (s, 1H), 7,63-7,60 (m, 1H),
7,47-7,42 (m, 3H), 7,32-7,30 (m, 1H), 7,07-7,03 (m, 1H),
6,77-6,74 (m, 2H), 6,42-6,38 (m, 1H), 6,28-6,22 (m, 2H),
5,79-5,75 (m, 1H), 3,22-3,20 (m, 4H), 3,10-3,08 (m, 4H),
2,91 (s, 3H);
MS (ESI+): m/z= 551,2 [M+H]+. |
47/111
|
24 |
SN .
<N.r .
' NH
O N TI
’ N ’ · ’ O ··;
H 5 |
1H-NMR (300MHz, DMSO-d6) δ 10,33 (brs, 1H), 9,25 (brs, 1H), 8,26-8,24 (d, 1H), 7,68-7,67 (m, 1H), 7,62-7,59 (m,
1H), 7,47-7,41 (m, 3H), 7,31-7,29 (d, 1H), 7,06-7,03 (m,
1H), 6,75-6,72 (m, 2H), 6,43-6,38 (m, 1H), 6,28-6,27 (m,
1H), 5,78-5,74 (m, 1H), 3,27-3,26 (m, 4H), 3,12-3,06 (q,
2H), 3,06-3,03 (m, 4H), 1,24-1,29 (f, 3H);
MS (ESI+): m/z = 565,09 [M+H]+. |
|
25 |
X-,
SNH
O . ’ ί M SN
H S - |
1H-NMR (300MHz, DMSO-d6) δ 10,33 (brs, 1H), 9,26 (brs, 1H), 8,26-8,24 (d, 1H), 7,68-7,67 (m, 1H), 7,63-7,60 (m,
1H), 7,46-7,41 (m, 3H), 7,31-7,30 (d, 1H), 7,06-7,03 (m,
1H), 6,74-6,71 (m, 2H), 6,41-6,38 (m, 1H), 6,28-6,27 (m,
1H), 5,78-5,74 (m, 1H), 3,27-3,24 (m, 4H), 3,04-3,01 (m,
4H), 2,78 (s, 6H);
MS (ESI+): m/z = 580,08 [M+H]+. |
|
26 |
’N>
^rn
O rj N^N |
1H-NMR (300MHz, CD3OD) δ ; 8,07 (d, 1H), 7,69 (m, 2H), 7,48 (t, 1H), 7,38 (d, 2H), 7,27 (d, 1H), 7,06 (dd, 1H), 6,82 (d, 2H), 6,44-6,40 (m, 2H), 5,82-5,78 (dd, 1H), 3,12 (m, 4H), 3,08 (m, 2H), 2,77 (m, 4H), 2,29 (s, 1H), 2,09 (m, 3H), 1,98 (m, 2H), 1,64 (m, 2H)
MS (ESI+): m/z = 570,3 [M+H]+. |
|
27 |
'N-Á, |
1H-NMR (300MHz, CDCI3) δ 10,35 (s, NH), 9,35 (s, NH), 8,25 (d, 1H), 7,68 (m, 2H), 7,41 (m, 3H), 7,30 (d, 1H), 7,04 (d, 1H), 6,71 (d, 2H), 6,45 (dd, 1H), 6,24 (d, 1H), 5,76 (d, 1H), 3,38 (m, 2H), 2,30 (m, 4H), 2,17 (s, 3H), 1,05 (s, 6H); MS (ESI+): m/z = 515,2 [M+H]+. |
|
28 |
,5,0.¾ |
1H-NMR (300MHz, CDCI3) δ 7,80-7,78 (d, 1H), 7,59 (m, 1H), 7,52 (m, 1H), 7,44-7,22 (m, 3H), 7,06-7,03 (m, 1H), 6,74 (s, 1H), 6,55-6,41 (m, 3H), 6,28-6,15 (m, 1H), 5,805,76 (m, 1H), 4,14 (s, 1H), 3,51-3,25 (m, 4H), 2,94-2,91 (m, 1H), 2,63-2,60 (m, 1H), 2,35 (s, 3H), 1,98-1,80 (m, 3H), 1,25-1,12 (m, 2H);
MS (ESI+): m/z= 499 [M+H]+. |
|
29 |
θ')
I'h_.N1__-^
0 N^N |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,27 (s, 1H), 8,29 (d, 1H), 7,71 (d, 1H), 7,64 (d, 1H), 7,48 (m, 2H), 7,34 (d, 1H), 7,08 (d, 1H), 6,74 (m, 2H), 6,45 (m, 1H), 6,27 (d, 1H), 5,80 (d, 1H), 3,72 (m, 4H), 2,98 (m, 4H);
MS (ESI+): m/z = 474,4 [M+H]+. |
<Tabela 1e>
|
Exemplo |
Estrutura |
Dados de análise |
|
30 |
s->
0 N’-N |
1H-NMR (300MHz, CDCI3) δ 7,82 (d, 1H), 7,58 (d, 1H), 7,43 (m, 1H), 7,36 (d, 1H), 7,05 (dd, 1H), 6,80 (s, 2H), 6,77 (d, 2H), 6,45 (dd, 1H), 6,26 (d, 1H), 5,65 (dd, 1H), 3,40 (m, 4H), 2,76 (m,4H);
MS (ESI+): m/z= 490,05 [M+H]+. |
48/111
|
31 |
0 |X ΝΛΝ |
1H-NMR (300MHz, DMSO-d6) δ 8,04 (brs, 1H), 7,84-7,82 (d, 1H), 7,61-7,57 (m, 2H), 7,43-7,37 (t, 1H), 7,36-7,33 (m, 2H), 7,25 (s, 1H), 7,05-7,02 (m, 2H), 6,79-6,76 (m, 2H), 6,41 (m, 1H), 6,32-6,29 (m, 1H), 5,77-5,74 (m, 1H), 3,883,79 (m, 2H), 3,42-3,34 (m, 2H), 2,91-2,81 (m, 4H);
MS (ESI+): m/z = 506,00 [M+H]+. |
|
32 |
<?n
Cl·
ΧΐΗ 0 ΝλΗ |
1H-NMR (300MHz, CDCI3) δ 7,86-7,84 (s, 1H), 7,60-7,53 (m, 3H), 7,46-7,43 (m, 1H), 7,40-7,36 (m, 2H), 7,07-7,04 (m, 1H), 6,99 (s, 1H), 6,79-6,76 (m, 2H), 6,48-6,43 (m, 1H), 6,30-6,21 (m, 1H), 5,82-5,78 (m, 1H), 3,74 (m, 4H), 3,113,10 (m, 4H);
MS (ESI+): m/z = 522,02 [M+H]+. |
|
33 |
-'NlH O γ'-,ι N^N VnU,^ |
1H-NMR (300MHz, DMSO-d6) δ 10,34 (brs, 1H), 9,04 (s, 1H), 8,22 (d, 1H), 7,69 (s, 1H), 7,61-7,55(m, 1H), 7,45-7,26 (m, 4H), 7,08-7,03 (m, 1H), 6,47-6,23 (m, 6H), 5,76 (d, 1H), 3,16-3,12 (m, 4H), 1,91 (m, 4H);
MS (ESI+): m/z= 458,16 [M+H]+. |
|
34 |
“Cx
0 N*N |
1H-NMR (300MHz, CDCI3) δ 7,79 (d, 1H), 7,54 (m, 1H), 7,35 (m, 2H), 7,32 (m, 2H), 7,25 (m, 1H), 7,23 (d, 1H), 6,75 (s, 1H), 6,46 (m, 1H), 6,25 (m, 1H), 5,77 (d, 1H), 3,35 (m, 1H), 3,11 (t, 1H), 2,83 (m, 2H), 2,32 (s, 6H), 2,18 (m, 1H), 1,72 (m, 1H);
MS (ESI+): m/z = 501,4 [M+H]+. |
|
35 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,33 (s, NH), 9,17 (s, NH), 8,25 (d, 1H), 7,73 (d, 2H), 7,59 (d, 1H), 7,47 (m, 3H), 7,30 (d, 1H), 7,23 (s, 1H), 7,07 (d, 1H), 6,92 (s, 1H), 6,47 (m, 2H), 6,27 (d, 1H), 5,77 (d, 1H), 5,00 (m, 1H), 3,62 (m, 1H), 3,44 (m,3H), 2,51 (m, 2H);
MS (ESI+): m/z = 524,2 [M+H]+. |
|
36 |
CSjh
0 NT|I
0 u |
1H-NMR (300MHz, DMSO-d6) δ 10,33 (s, NH), 9,13 (s, NH), 8,24 (d, 1H), 7,96 (s, 1H), 7,72 (t, 1H), 7,68 (d, 1H), 7,45 (t, 1H), 7,43 (m, 2H), 7,29 (d, 1H), 7,22 (s, 1H), 7,05 (dd, 1H), 6,91 (s, 1H), 6,42 (m, 3H), 6,26 (dd, 1H), 5,75 (dd, 1H), 4,99 (m, 1H), 3,61 (m, 1H), 3,41 (m, 3H), 2,49 (m, 2H);
MS (ESI+): m/z = 524,2 [M+H]+ |
<Tabela 1f>
|
Exemplo |
Estrutura |
Dados de análise |
|
37 |
o hSi |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,22 (s, 1H), 8,26 (d, 1H), 7,70 (s, 1H), 7,64 (m, 1H), 7,47 (d, 1H), 7,41 (m, 2H), 7,31 (d, 1H), 7,05 (d, 1H), 6,71 (m, 2H), 6,44 (m, 1H), 6,26 (m, 1H), 5,78 (m, 1H), 2,96 (t, 4H), 1,59 (m, 4H), 1,50 (m, 2H);
MS (ESI+): m/z= 472,10 [M+H]+. |
49/111
|
38 |
X |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,27 (s, 1H), 8,29 (d, 1H), 7,71 (d, 1H), 7,64 (d, 1H), 7,48 (m, 2H), 7,34 (d, 1H), 7,08 (d, 1H), 6,74 (m, 2H), 6,45 (m, 1H), 6,27 (d, 1H), 5,80 (d, 1H), 3,72 (m, 4H), 2,98 (m, 4H);
MS (ESI+): m/z= 515 [M+H]+. |
|
39 |
O Ν'·’Ν |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (s, 1H), 9,25 (s, 1H), 8,29 (d, 1H), 7,73 (m, 1H), 7,66 (m, 1H), 7,49 (d, 1H), 7,44 (m, 2H), 7,34 (d, 1H), 7,09 (m, 1H), 6,73 (m, 2H), 6,47 (m, 1H), 6,30 (m, 1H), 5,81 (m, 1H), 4,67 (d, 1H), 3,59 (m, 1H), 3,40 (m, 2H), 2,71 (m, 2H), 1,82 (m, 2H), 1,50 (m, 2H);
MS (ESI+): m/z= 488,4 [M+H]+. |
|
40 |
'^NH
0 Λ N^N |
1H-NMR (300MHz, CD3OD) δ 8,05 (S, 1H), 7,63 (d, 1H), 7,34 (m, 3H), 6,97 (d, 2H), 6,70 (S, 2H), 6,28 (m, 2H), 5,69 (d, 1H), 3,49 (s, 2H), 3,01 (m, 4H) 1,58 (m, 1H), 134 (m, 4H);
MS (ESI+):m/z= 501,1 [M+H]+. |
|
41 |
'---mu
α n-tj |
1H-NMR (300MHz, CDCI3) δ 7,80 (d, 1H), 7,61 (s, 1H), 7,56 (s, 1H), 7,48 (s, 1H), 7,44 (t, 1H), 7,40 (d, 2H), 7,25 (m, 1H), 7,05 (m, 1H), 6,82 (m, 3H), 6,45 (d, 1H), 6,30 (m, 1H), 5,77 (m, 1H), 3,55 (d, 2H), 2,62 (t, 2H), 2,27 (s, 6H), 2,20 (d, 2H), 1,82 (m, 3H), 1,37 (m, 2H);
MS (ESl+): m/z = 529 [M+H]+. |
|
42 |
0Tiu 'Fhh
O NTi
V^'kAoJi^ |
1H-NMR (300MHz, DMSO-d6) δ 10,35 (s, 1H), 9,20 (s, 1H), 8,25 (d, 1H), 7,68 (m, 1H), 7,61 (m, 1H), 7,44 (t, 1H), 7,37 (m, 2H), 7,30 (d, 1H), 7,05 (m, 1H), 6,68 (m, 2H), 6,43 (m, 1H), 6,25 (m, 1H), 5,77 (m, 1H), 3,48 (d, 2H), 2,55 (m, 2H), 2,34 (m, 4H), 2,17 (d, 2H), 1,85 (m, 2H), 1,57 (m, 5H), 1,42 (m, 4H);
MS (ESl+): m/z = 569 [M+H]+. |
|
43 |
Η0^-γ>
un
--- HH O (¢^ H-Si |
1H-NMR (300MHz, CD3OD) δ 8,04 (s, 1H), 7,66 (s, 1H), 7,35 (m, 3H), 7,03 (d, 2H), 6,81 (d, 2H), 6,38 (m, 2H), 5,78 (d, 1H), 3,50 (t, 2H), 3,01 (m, 4H) 1,49 (m, 1H), 1,43 (m, 2H), 1,34 (m,4H);
MS (ESI+): m/z = 515,2 [M+H]+. |
<Tabela 1g>
|
Exemplo |
Estrutura |
Dados de análise |
|
44 |
O |
1H-NMR (300MHz, DMSO-d6) δ 12,17 (brs, 1H), 10,31 (brs, 1H), 9,23 (brs, 1H), 8,25 (d, 1H), 7,69 (s, 1H), 7,62 (d, 1H),
7.47- 7,38 (m, 3H), 7,30 (d, 1H), 7,04 (d, 1H), 6,70 (d, 2H), 6,44-6,38 (m, 1H), 6,25 (dd, 1H), 5,78 (d, 1H), 3,42 (d, 2H),
2.48- 2,35 (m, 3H), 1,89-1,85 (m, 2H), 1,63-1,56 (m, 2H);
MS (ESI+): m/z = 516,16 [M+H]+. |
50/111
|
45 |
o |
1H-NMR (300MHz, DMSO) δ 10,35 (s, NH), 9,22 (s, NH), 8,31 (d, 1H), 7,69 (s, 1H), 7,48 (d, 2H), 7,39-7,31 (m, 3H), 7,28 (d, 1H), 7,07 (m, 1H), 6,73 (d, 2H), 6,48 (m, 1H), 6,29 (m, 1H), 5,79 (m, 1H), 3,55 (d, 2H), 3,04 (s, 3H), 2,72 (s, 3H), 2,67-2,57 (m, 3H), 1,67 (m, 4H);
MS (ESI+): m/z = 543,0 [M+H]+. |
|
46 |
5'C. or |
1H-NMR (300MHz, CD3OD) δ 8,08 (d, 1H), 7,80 (s, 1H), 7,68 (m, 2H), 7,43 (t, 1H), 7,39 (m, 2H), 7,27 (m, 2H), 7,06 (d, 1H), 7,03 (s, 1H), 6,87 (d, 2H), 6,44 (m, 2H), 5,81 (m, 1H), 4,23 (m, 1H), 3,68 (d, 2H), 2,84 (t, 2H), 2,24 (m, 4H); MS (ESI+): m/z = 538,2 [M+H]+. |
|
47 |
an,
V
D Γ·:ί>1 N4N |
1H-NMR (300MHz, CDCI3) δ 8,40 (s, NH), 7,77 (d, 1H), 7,68 (s, 1H), 7,63 (d, 1H), 7,33 (t, 1H), 7,32 (d, 2H), 7,21 (d, 1H), 7,11 (s, NH), 7,01 (d, 1H), 6,98 (d, 2H), 6,43 (m, 2H), 5,68 (m, 1H), 3,49(m, 2H), 2,73 (m, 4H), 2,56 (t, 2H), 2,27 (m, 1H), 2,04 (m, 2H), 1,92 (m, 4H), 1,74 (m, 2H);
MS (ESI+): m/z = 541,0 [M+H]+. |
|
48 |
%>,.
O N-N |
1H-NMR (300MHz, CD3OD) δ 8,05(d, 1H), 7,64 (d, 2H), 7,47 (t, 1H), 7,35 (d, 2H), 7,23 (d, 1H), 7,04 (d, 1H), 6,81 (d, 2H), 6,40 (m, 2H), 5,77 (dd, 1H), 4,78 (m, 2H), 3,61 (m, 2H), 3,25 (m, 2H), 2,67 (m, 2H), 2,56 (m, 2H), 2,46 (m, 1H), 2,01 (m, 2H), 1,71 (m, 2H), 1,51 (m, 2H);
MS (ESI+): m/z = 555,0 [M+H]+. |
|
49 |
->ΝΗ
□ i^ji Ν4Ν |
1H-NMR (300MHz, DMSO-d6) δ 10,3 (s, 1H), 9,13 (s, 1H), 8,17 (d, 1H), 7,65 (s, 1H), 7,53 (d, 1H), 7,34 (d, 1H), 7,32 (m, 2H), 7,29 (d, 1H), 6,98 (d, 1H), 6,63 (d, 2H), 6,34 (dd, 1H), 6,21 (d, 1H), 3,50 (m, 4H), 3,43 (m, 1H), 3,20 (brs, 1H);
MS (ESI+): m/z = 556,68 [M+H]+. |
|
50 |
^ΝΊ
Ν°ο» ο r^-j hSi |
1H-NMR (300MHz, DMSO-d6) δ 10,34 (s, 1H), 9,23 (s, 1H), 8,25 (d, 1H), 7,68 (s, 1H), 7,62 (d, 1H), 7,45 (d, 1H), 7,40 (m, 2H), 7,30 (d, 1H), 7,04 (m, 1H), 6,70 (m, 2H), 6,43 (m, 1H), 6,26 (m, 1H), 5,77 (m, 1H), 3,46 (m, 2H), 2,56 (m, 1H), 2,50 (m, 6H), 2,33 (m, 4H), 2,29 (m, 2H), 1,80 (m, 2H), 1,48 (m, 2H), 0,97 (t, 3H);
MS (ESI+): m/z = 584,3 [M+H]+. |
<Tabela 1h>
|
Exemplo |
Estrutura |
Dados de análise |
|
51 |
NH
0 r^jl N^N |
1H-NMR (300MHz, CDCI3) δ 7,85 (d, 1H), 7,67 (s, 1H), 7,56 (m, 1H), 7,43 (m, 3H), 7,31 (s, 1H), 7,21 (m, 2H), 7,06 (d, 1H), 6,46 (m, 1H), 6,27 (m, 1H), 5,98 (m, 1H), 5,78 (d, 1H), 3,12 (m, 2H), 2,69 (t, 2H), 2,57 (m, 2H), 2,42 (s, 3H);
MS (ESI+): m/z = 484,1 [M+H]+. |
51/111
|
52 |
'NH
0 N^N |
1H-NMR (300MHz, CDCI3) δ 8,13 (s, 1H), 7,83 (d, 1H), 7,76 (s, 1H), 7,52 (m, 1H), 7,39 (t, 1H), 7,34 (d, 2H), 7,25 (d, 1H), 7,11 (s, 1H), 7,02 (d, 3H), 6,36 (m, 2H), 5,74 (d, 1H), 3,01 (m, 2H), 2,41 (m, 1H), 2,37 (s, 3H), 2,31 (m, 2H), 2,09 (m, 2H), 1,85 (m, 2H);
MS (ESI+): m/z= 486,2 [M+H]+. |
|
53 |
-^N->
Ai
^NH 0 |->Τ··|Ι N'·: Ν |
1H-NMR (300MHz, CDCI3) δ 8,27 (s, 1H), 7,81 (d, 1H), 7,75 (s, 1H), 7,51 (d, 1H), 7,33 (m, 3H), 7,25 (d, 1H), 7,14 (s, 1H), 7,02 (s, 2H), 6,99 (s, 1H), 6,38 (m, 2H), 5,71 (m, 1H), 3,11 (m, 2H), 2,51 (q, 2H), 2,44 (m, 1H), 2,07 (m, 2H), 1,80 (m, 4H), 1,16 (t, 3H);
MS (ESI+): m/z = 500,2 [M+H]+. |
|
54 |
Aj^
:=---HH 0 A N'!;N |
1H-NMR (300MHz, CDCI3) δ 9,63 (s, 1 H), 8,21 (s, 1H), 7,84 (d, 1H), 7,48 (d, 1H), 7,35 (t, 1H), 7,20 (m, 4H), 6,94 (m, 3H), 6,67 (m, 1H), 6,39 (m, 1H), 5,65 (m, 1H), 3,35 (m, 2H), 3,28 (m, 1H), 2,67 (m, 2H), 2,50 (m, 1H), 2,40 (m, 2H), 1,84 (m, 2H), 1,35 (d, 6H);
MS (ESI+): m/z = 514,2 [M+H]+. |
|
55 |
Aa
0 A N'!;N |
1H-NMR (300MHz, CDCI3) δ 7,83 (d, 1H), 7,78 (s, 1H), 7,65 (s, 1H), 7,56 (d, 1H), 7,43 (m, 3H), 7,27 (d, 1H), 7,11 (s, 1H), 7,04 (m, 3H), 6,45 (m, 1H), 6,27 (m, 1H), 5,76 (m, 1H), 2,94 (m, 2H), 2,79 (m, 1H), 2,32 (s, 3H), 2,02 (m, 3H), 1,85 (m, 2H), 1,36 (m, 1H);
MS (ESI+): m/z = 486,2 [M+H]+. |
|
56 |
N=, |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (s, NH), 9,67 (s, NH), 8,33 (d, 1H), 8,08 (s, 1H), 7,73 (m, 3H), 7,58 (m, 2H), 7,47 (t, 1H), 7,34 (m, 3H), 7,08 (m, 2H), 6,43 (m, 1H), 6,27 (m, 1H), 5,74 (m, 1H);
MS (ESI+): m/z = 455,0 [M+H]+. |
|
57 |
'νΆκ,-ϊ,]
1 LAjh |
1H-NMR (300MHz, DMSO-d6) δ 10,34(s, 1H), 9,08(s, 1H), 8,35(d, 1H), 8,23(m, 1H), 7,65(d, 1H), 7,57(m, 1H), 7,42(m, 2H), 7,28(d, 1H), 7,04(m, 1H), 6,42(m, 2H), 6,28(m, 2H), 6,02(d, 1H), 5,74(dd, 1H), 2,67(m, 4H), 2,16(m, 2H), 1,84(m, 2H), 1,33(m, 2H), 0,97(m, 6H)
MS (ESI+): m/z= 475,2 [M+H]+. |
<Tabela 1i>
|
Exemplo |
Estrutura |
Dados de análise |
|
58 |
oAx, |
1H-NMR (300MHz, DMSO-d6) δ 10,34(s, 1H), 9,02(s, 1H), 8,22(d, 1H), 7,68(d, 1H), 7,62(m, 1H), 7,44(m, 1H), 7,27(m, 2H), 7,04(m, H), 6,42(m, 3H), 6,24(dd, 1H), 5,76(dd, 1H), 3,03(m, 2H), 2,49~2,32(m, 10H), 2,15(s, 3H);
MS (ESI+): m/z = 530,2 [M+H]+. |
52/111
|
59 |
-Λ,η |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,00 (s, 1H), 8,23 (d, 1H), 7,63 (m, 2H), 7,40 (m, 2H), 7,27 (m, 2H), 7,08 (m, 1H), 6,87 (m, 1H), 6,44 (m, 2H), 6,29 (d, 1H), 5,77 (d, 1H), 5,00 (d, 1H), 3,05 (m, 1H), 2,70 (m, 2H), 2,16 (s, 3H), 1,95 (m, 2H), 1,82 (m, 2H), 1,31 (m, 2H);
MS (ESI+): m/z = 501,2 [M+H]+. |
|
60 |
x, |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (brs, 1H), 9,12 (brs, 1H), 8,97 (brs, 1H), 8,26 (d, 1H), 7,73 (s, 1H), 7,61 (d, 1H), 7,49-7,31 (m, 4H), 7,10-7,06 (m, 1H), 6,57-6,41 (m, 3H), 6,30-6,25 (m, 1H), 5,81-5,77 (m, 1H);
MS (ESI+): m/z = 405,09 [M+H]+. |
|
61 |
- 'NH
αμ |
1H-NMR (300MHz, DMSO-d6) δ 10,34 (s, NH), 9,30 (s, NH), 8,28 (d, 1H), 7,72 (s, 1H), 7,60 (dd, 1H), 7,48-7,43 (m, 3H), 7,32 (d, 1H), 7,08 (dd, 1H), 6,72 (d, 2H), 6,44 (m, 1H), 6,29 (m, 1H), 5,79 (m, 1H), 4,00 (m, 2H), 3,63 (m, 2H), 3,27 (s, 3H);
MS (ESI+): m/z = 463,2 [M+H]+. |
|
62 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,31 (s, 1H), 8,28 (d, 1H), 7,72 (s, 1H), 7,59 (d, 1H), 7,44 (m, 3H), 7,33 (d, 1H), 7,07 (d, 1H), 6,69 (d, 2H), 6,39 (dd, 1H), 6,29 (d, 1H), 5,79 (d, 1H), 3,95 (t, 2H), 2,60 (t, 2H), 2,22 (s, 6H); MS (ESI+): m/z = 476,2 [M+H]+. |
|
63 |
τΑι
AM |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,30 (s, 1H), 8,27 (d, 1H), 7,72 (s, 1H), 7,60 (d, 1H), 7,45 (m, 3H), 7,32 (d, 1H), 7,07 (d, 1H), 6,69 (d, 2H), 6,41 (dd, 1H), 6,25 (d, 1H), 5,76 (d, 1H), 3,90 (t, 2H), 3,34 (m, 4H), 2,70 (t, 2H), 2,50 (m, 4H), 1,03 (s, 6H);
MS (ESI+): m/z = 504,2 [M+H]+. |
|
64 |
«Μ.
AM |
1H-NMR (300MHz, DMSO-d6) δ 10,38 (s, 1H), 9,33 (s, 1H), 8,27 (d, 1H), 7,72 (s, 1H), 7,60 (d, 1H), 7,47 (m, 3H), 7,33 (d, 1H), 7,05 (d, 1H), 6,70 (m, 2H), 6,44 (dd, 1H), 6,25 (d, 1H), 5,77 (d, 1H), 3,95 (t, 2H), 2,72 (t, 2H), 2,50 (m, 4H), 1,67 (m, 4H);
MS (ESI+): m/z = 502,2 [M+H]+. |
<Tabela 1j>
|
Exemplo |
Estrutura |
Dados de análise |
|
65 |
U-r,H
0 |
1H-NMR (300MHz, CDCI3) δ 8,14 (s, 1H), 7,80 (d, 1H), 7,61 (s, 1H), 7,48 (d, 1H), 7,34 (m, 3H), 7,24 (m, 2H), 6,99 (d, 1H), 6,72 (d, 2H), 6,39 (d, 1H), 6,25 (dd, 2H), 5,72 (d, 1H), 4,03 (t, 2H), 3,71 (m, 4H), 2,75 (t, 2H), 2,56 (m, 4H);
MS (ESI+): m/z = 518,4 [M+H]+. |
53/111
|
66 |
|
1H-NMR (300MHz, CDCI3) δ 7,82 (d, 1H), 7,63 (s, 1H), 7,43 (m, 6H), 7,04 (d, 1H), 6,89 (s, 1H), 6,76 (m, 2H), 6,45 (d, 1H), 6,26 (m, 1H), 5,74 (d, 1H), 4,23 (m, 2H), 2,77 (m, 2H), 2,47 (q, 2H), 2,33 (m, 2H), 2,04 (m, 2H), 1,80 (m, 2H), 1,12 (t, 3H);
MS (ESI+): m/z = 516,3 [M+H]+. |
|
67 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,38 (brs, 1H), 9,92 (brs, 1H), 8,34 (d, 1H), 7,87-7,31 (m, 8H), 7,09 (d, 1H), 6,466,37 (m, 1H), 6,23 (d, 1H), 5,75 (d, 1H), 3,91 (t, 4H), 1,201,12 (m, 6H);
MS (ESI+): m/z = 525,13 [M+H]+. |
|
68 |
'X„ |
1H-NMR (300MHz, DMSO-D6) δ 10,39 (s, 1H), 9,86 (s, 1H), 8,35 (d, 1H), 7,77 (m, 2H), 7,58 (m, 1H), 7,40 (m, 4H), 7,11 (d, 1H), 6,43 (dd, 1H), 6,25 (d, 1H), 5,77 (d, 1H), 2,65 (s, 3H);
MS (ESI+): m/z = 451,1 [M+H]+. |
|
69 |
'“Ό,Η |
1H-NMR (300MHz, DMSO-D6) δ 10,40 (s, 1H), 10,09 (s, 1H), 8,55 (m, 1H), 7,80 (m, 3H), 7,62 (m, 3H), 7,50 (m, 2H), 7,10 (m, 1H), 6,54 (dd, 1H), 6,28 (d, 1H), 5,79 (d, 1H), 3,10 (s, 3H);
MS (ESI+): m/z = 467,5 [M+H]+. |
|
70 |
'^LH |
1H-NMR (300MHz, DMSO-d6) δ 10,32 (s, 1H), 9,86 (s, 1H), 8,35 (d, 1H), 7,70 (m, 3H), 7,54 (m, 3H), 7,45 (m, 2H), 7,12 (s, 2H), 6,42 (m, 1H), 6,23 (dd, 1H), 5,75 (dd, 1H);
MS (ESI+): m/z = 468,1 [M+H]+. |
|
71 |
^?°3
'--' NH |
1H-NMR (300MHz, DMSO-d6) δ 10,38 (s, 1H), 10,02 (s, 1H), 8,36 (d, 1H), 7,78 (m, 3H), 7,68 (m, 2H), 7,57 (m, 2H), 7,36 (m, 1H), 7,10 (m, 1H), 6,48 (m, 1H), 6,21 (dd, 1H), 5,75 (dd, 1H), 1,99 (m, 1H), 0,41 (m, 2H), 0,34 (m, 2H); MS (ESI+): m/z = 508,1 [M+H]+. |
<Tabela 1k>
|
Exemplo |
Estrutura |
Dados de análise |
|
72 |
40.¾ |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,97 (s, 1H), 8,30 (d, 1H), 7,76 (m, 2H), 7,73-7,21 (m, 6H), 7,09 (m, 1H), 6,40 (m, 1H), 6,21 (dd, 1H), 5,74 (dd, 1H), 2,75 (m, 2H), 2,22 (m, 2H), 2,04 (s, 6H);
MS (ESI+): m/z = 539,2 [M+H]+. |
54/111
|
73 |
o |
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H), 10,00 (s, 1H), 8,37 (d, 1H), 7,74 (m, 3H), 7,46 (m, 6H), 7,12 (d, 1H), 6,44 (dd, 1H), 6,25 (d, 1H), 5,77 (d, 1H), 2,78 (m, 1H), 2,50 (m, 2H), 1,63 (m, 2H), 1,46 (m, 2H), 1,33 (m, 2H);
MS (ESI+): m/z = 565,2 [M+H]+. |
|
74 |
0 |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (s, 1H), 10,01 (s, 1H), 8,37 (d, 1H), 7,75 (m, 2H), 7,61-7,43 (m, 6H), 7,12 (m, 1H), 6,40 (m, 1H), 6,24 (dd, 1H), 5,76 (dd, 1H), 2,77 (m, 2H), 2,60 (m, 2H), 1,49 (m, 2H), 1,25 (m, 2H), 1,18 (m,2H), 0,87 (m, 6H);
MS (ESI+): m/z = 593,2 [M+H]+. |
|
75 |
--fdH
Λ-ΟΛ5 |
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H), 10,14 (s, 1H), 8,38 (d, 1H), 7,78 (m, 3H), 7,59 (m, 1H), 7,50 (m, 1H), 7,44 (m, 4H), 7,10 (m, 1H), 6,38 (m, 1H), 6,22 (dd, 1H), 5,76 (dd, 1H), 3,59 (s, 4H), 2,92 (s, 4H);
MS (ESI+): m/z = 538,1 [M+H]+. |
|
76 |
oo
t;h
0 nSi
vSAVA
H S - |
1H-NMR (300MHz, DMSO-d6) δ 10,41 (s, 1H), 10,13 (s, 1H), 8,39 (d, 1H), 7,60 (m, 8H), 7,10 (m, 1H), 6,41 (m, 1H), 6,25 (m, 1H), 5,75 (m, 1H), 2,76 (m, 4H), 2,38 (m, 4H), 2,29 (q, 2H), 0,91 (t, 3H).
MS (ESI+): m/z = 565,4 [M+H]+. |
|
77 |
Λχ
4^0.¾ |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (brs, 1H), 9,81 (brs, 1H), 8,37 (d, 1H), 7,78-7,71 (m, 4H), 7,62-7,58 (m, 1H), 7,52-7,49 (m, 2H), 7,17-7,09 (m, 1H), 6,48-6,39 (m, 1H), 6,25 (d, 1H), 5,77 (d, 1H), 2,46 (s, 3H);
MS (ESI+): m/z = 431,11 [M+H]+. |
|
78 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,39(s, 1H), 9,79(s, 1H), 8,34(d, 1H), 8,16(d, 1H), 7,67(s, 1H), 7,57(m, 4H), 7,46(m, 1H), 7,42(m, 1H), 7,11(m, 1H), 6,48(m, 1H), 6,28(dd, 1H), 5,75(dd, 1H), 2,74(s, 3H);
MS (ESI+): m/z= 446,1 [M+H]+. |
<Tabela 1l>
|
Exemplo |
Estrutura |
Dados de análise |
|
79 |
|
H-NMR (300MHz, DMSO-d6) δ 10,4 (brs, 1H), 9,80 (brs, 1H), 8,36-8,34 (m, 1H), 7,87 (s, 1H), 7,64-7,43 (m, 5H), 7,41(d, 2H), 7,13-7,10 (m, 1H), 6,46-6,41 (m, 1H), 6,286,23 (m, 1H), 5,79-5,75 (m, 1H), 3,31-3,17 (m, 2H), 2,632,50 (m, 2H),2,31 (s, 6H);
MS (ESI+): m/z = 503,1 [M+H]+. |
55/111
|
80 |
ο <11 Αν |
1H-NMR (300MHz, CDCI3) δ 9,02 (s, 1H), 7,85 (d, 2H), 7,83 (d, 3H), 7,46 (d, 1H), 7,26 (t, 2H), 6,96 (d, 1H), 6,39 (d, 1H), 5,68 (dd, 1H), 3,70 (bs, 1H), 3,61 (d, 1H), 2,87 (s, 2H), 2,79 (bs, 4H), 1,89 (bs, 4H);
MS (ESI+): m/z = 529,4 [M+H]+. |
|
81 |
w„ |
1H-NMR (300MHz, DMSO-d6) δ 10,38 (s, 1H), 9,79 (s, 1H), 8,35 (d, 1H), 8,02 (d, 2H), 7,77 (s, 1H), 7,51 (m, 4H), 7,45 (m, 1H), 7,42 (m, 1H), 6,43 (dd, 1H), 6,28 (d, 1H), 5,78 (d, 1H), 3,96 (m, 1H), 3,86 (m, 2H), 3,38 (m, 2H), 1,74 (m, 2H), 1,58 (m, 2H);
MS (ESI+): m/z = 516,2 [M+H]+. |
|
82 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H), 9,79 (s, 1H), 8,34 (d, 1H), 8,96 (d, 1H), 7,78 (s, 1H), 7,64 (m, 4H), 7,47 (m, 2H), 7,12 (d, 1H), 6,42 (dd, 1H), 6,28 (d, 1H), 5,77 (d, 1H), 3,69 (m, 1H), 2,75 (m, 2H), 2,16 (s, 3H), 1,92 (m, 2H), 1,73 (m, 2H), 1,55 (m,2H);
MS (ESI+): m/z = 529,2 [M+H]+. |
|
83 |
An^S ο
°“Υι |
1H-NMR (300MHz, DMSO-d6) δ 10,38 (s, 1H), 9,76 (s, 1H), 8,34 (d, 1H), 7,92 (d, 1H), 7,77 (s, 1H), 7,60 (m, 5H), 7,41 (m, 2H), 6,41 (dd, 1H), 6,25 (d, 1H), 5,76 (d, 1H), 3,68 (m, 1H), 2,77 (m, 2H), 2,64 (m, 1H), 2,14 (m, 2H), 1,75 (m, 2H), 1,48 (m, 2H), 0,94 (d, 6H);
MS (ESI+): m/z = 557,2 [M+H]+. |
|
84 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,34(s, 1H), 9,74(s, 1H), 8,31 (d, 1H), 7,60(s, 1H), 7,58(m, 3H), 7,48(m, 1H), 7,41 (m, 1H), 7,18(m, 2H), 7,08(m, 1H), 6,47(m, 1H), 6,27(dd, 1H), 5,75(dd, 1H), 2,92(s, 6H);
MS (ESI+): m/z = 460,1 [M+H]+. |
|
85 |
Αχ |
1H-NMR (300MHz, DMSO-d6) δ 10,42 (brs, 1H), 9,78 (brs, 1H), 8,36-8,34 (m, 1H), 7,78 (s, 1H), 7,62-7,40 (m, 5H), 7,26(d, 2H), 7,12-7,09 (m, 1H), 6,48-6,43 (m, 1H), 6,286,22 (m, 1H), 5,79-5,75 (m, 1H), 3,52-3,48 (m, 2H), 3,172,90 (m, 3H), 2,30-2,17 (m, 3H), 1,93-1,73 (m, 2H);
MS (ESI+): m/z = 515,2 [M+H]+. |
<Tabela 1m>
|
Exemplo |
Estrutura |
Dados de análise |
|
86 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,5 (brs, 1H), 9,80 (brs, 1H), 8,30-8,20 (m, 1H), 7,78 (s, 1H), 7,60-7,40 (m, 5H), 7,35(d, 2H), 7,20 (m, 1H), 6,50-6,40 (m, 1H), 6,306,20 (m, 1H), 5,80-5,70 (m, 1H), 3,60-3,50 (m, 4H), 2,80-2,60 (m, 1H), 2,30-2,00 (m, 7H), 1,80-1,60 (m, 1H);
MS (ESI+): m/z = 529,1 [M+H]+. |
56/111
|
87 |
Λ |
1H-NMR (300MHz, DMSO-d6) δ 10,50 (brs, 1H), 9,80 (brs, 1H), 8,40-8,35 (m, 1H), 7,80 (s, 1H), 7,60-7,30 (m, 4H), 7,25(d, 1H), 7,10-7,00 (m, 3H), 6,40-6,35 (m, 1H), 6,20-6,15 (m, 1H), 5,75-5,80 (m, 1H), 4,70 (s, 1H), 4,104,05 (m, 1H), 3,90-3,70 (m, 2H), 3,30 (s, 1H), 3,20-3,10 (m, 4H);
MS (ESI+): m/z = 516,2 [M+H]+. |
|
88 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,36-(s, 1H), 9,76(s, 1H), 8,35(d, 1H), 7,76(d, 1H), 7,58(m, 3H), 7,45(m, 1H), 7,39(m, 1H), 7,15(m, 2H), 7,08(m, 1H), 6,47(m, 1H), 6,22(dd, 1H), 5,75(dd, 1H), 3,58(m, 4H), 3,46(m, 4H); MS (ESI+): m/z= 502,2 [M+H]+. |
|
89 |
Λ-
^0¾ |
1H-NMR (300MHz, DMSO-d6) δ 10,34(s, 1H), 9,75(s, 1H), 8,35(d, 1H), 7,88(d, 1H), 7,76(d, 1H), 7,57(m, 4H), 7,46(m, 1H), 7,42(m, 1H), 7,10(m, 1H), 6,48(m, 1H), 6,28(dd, 1H), 5,78(dd, 1H), 3,45(m, 4H), 2,28(m, 4H), 2,10(s, 3H);
MS (ESI+): m/z= 515,2 [M+H]+. |
|
90 |
.WoNH
0 r'''> N^H |
1H-NMR (300MHz, CDCI3) δ 8,90 (s, 1H), 7,76 (d, 1H), 7,74 (s, 1H), 7,51 (s, 1H), 7,40 (s, 1H), 7,29-7,22 (m, 2H), 7,14 (d, 2H), 6,85 (d, 1H), 6,29 (d, 1H), 6,24 (s, 1H), 5,60 (d, 1H), 3,66-2,31 (m, 4H), 2,35 (t, 2H), 2,332,31 (m, 4H), 1,00 (t, 3H);
MS (ESI+): m/z= 528,63 [M+H]+. |
|
91 |
X-JI Ν'Ν |
1H-NMR (300MHz, CDCI3) δ 8,27(d, 1H), 7,79-7,77 (d, 1H), 7,57 (m, 1H), 7,34-7,09 (m, 5H), 6,99 (m, 1H), 6,37.-6,31 (m, 1H), 6,20-6,15 (m, 1H), 5,68-5,67 (m, 1H), 5,77-5,74 (m, 1H), 4,16-4,07 (m, 4H) 2,86-2,82 (m, 2H), 2,47 (m, 4H), 2,19 (m, 3H), 1,95 (m, 4H), 1,88-1,39 (m, 5H);
MS (ESI+): m/z= 598,2 [M+H]+. |
|
92 |
QVyNy-.
'-' Ά1Η 0 H^N |
1H-NMR (300MHz, CDCI3) δ 9,02 (s, 1H), 7,85 (d, 2H), 7,83 (d, 3H), 7,46 (d, 1H), 7,26 (t, 2H), 6,96 (d, 1H), 6,39 (d, 1H), 5,68 (dd, 1H), 3,70 (bs, 1H), 3,61 (d, 1H), 2,87 (s, 2H), 2,79 (bs, 4H), 1,89 (bs, 4H);
MS (ESI+): m/z= 529,4 [M+H]+. |
<Tabela 1n>
|
Exemplo |
Estrutura |
Dados de análise |
|
93 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,35 (s, 1H), 9,96 (s, 1H), 8,33 (d, 1H), 7,76 (m, 2H), 7,68 (m, 3H), 7,4 9(m, 1H), 7,42 (m, 1H), 7,40 (m, 1H), 7,08 (m, 1H), 6,40 (m, 1H), 6,20 (dd, 1H), 5,73 (dd, 1H), 4,20 (t, 2H), 2,30 (t, 2H), 2,12 (s, 6H), 1,76 (m, 2H);
MS (ESI+): m/z = 518,2 [M+H]+. |
57/111
|
94 |
0¼ |
1H-NMR (300MHz, DMS0-d6) δ 10,36 (s, 1H), 9,58 (s, 1H), 8,32 (d, 1H), 7,73 (s, 1H), 7,60 (m, 3H), 7,45 (t, 1H), 7,40 (d, 1H), 6,43 (dd, 1H), 6,22 (d, 1H), 5,78 (d, 1H), 3,85 (dd, 2H), 2,27 (s,3H);
MS (ESI+): m/z = 465,1 [M+H]+. |
|
95 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,38 (s, 1H), 9,62 (s, 1H), 8,32 (d, 1H), 7,73 (t, 1H), 7,62 (m, 3H), 7,47 (t, 1H), 7,40 (d, 1H), 7,16 (d, 2H), 7,10 (m, 1H), 6,40 (m, 1H), 6,25 (m, 1H), 5,77 (m, 1 H), 4,33 (s, 2H), 2,84 (s, 3H);
MS (ESI+): m/z = 481,1 [M+H]+. |
|
96 |
|
1H-NMR (300MHz, CDCI3) δ 10,36 (s, 1H), 9,45 (s, 1H), 8,30 (d, 1H), 7,74 (s, 1H), 7,48 (m, 4H), 7,36 (d, 1H), 7,07 (m, 3H), 6,40 (dd, 1H), 6,25 (d, 1H), 5,77 (d, 1H), 3,30 (m, 2H), 2,95 (m,2H), 2,54 (s, 3H);
MS (ESI+): m/z = 479,1 [M+H]+. |
|
97 |
^0-0¾ |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (s, 1H), 9,48 (s, 1H), 8,29 (d, 1H), 7,73 (s, 1H), 7,48 (m, 4H), 7,35 (d, 1H), 7,05 (m, 3H), 6,42 (m, 1H), 6,25 (m, 1H), 5,76 (m, 1H), 3,31 (m, 2H), 2,94 (s, 3H), 2,87 (m, 2H);
MS (ESI+): m/z = 495,1 [M+H]+. |
|
98 |
α^α„Η
O f-'π N’-M |
1H-NMR (300MHz, DMSO-d6) : δ 10,36 (brs, 1H), 9,40 (brs, 1H), 8,31-8,30 (d, 1H), 7,72-7,71 (m, 1H), 7,64-7,61 (m,
1H), 7,48-7,43 (m, 3H), 7,36-7,34 (d, 1H), 7,09-7,06 (m,
1H), 6,96-6,93 (m, 2H), 6,43-6,39 (m, 1H), 6,29-6,21 (m,
1H), 5,79-5,75 (m, 1H), 2,61 (m, 2H), 2,41 (m, 6H), 1,51
(m, 4H), 1,40 (m, 2H);
MS (ESI+): m/z = 500,2 [M+H]+. |
|
99 |
o t/rl
- 0 |
1H-NMR (300MHz, CDCI3 ) δ ; 7,84 (m, 1H), 7,69 (m, 1H), 7,52 (m, 1H), 7,42-7,33 (m, 3H), 7,06-7,00 (m, 4H), 6,47 (dd, 1H), 6,33 (dd, 1H), 5,75 (dd, 1H), 2,79-2,45 (m, 14H), 1,12 (t, 3H);
MS (ESI+): m/z = 529,4 [M+H]+. |
<Tabela 1o>
|
Exemplo |
Estrutura |
Dados de análise |
|
100 |
oo
S Ν '*·'
Ο 1 | N'N
H S |
1H-NMR (300MHz, CDCI3) δ 7,82 (t, 1H), 7,65 (s, 1H), 7,57 (m, 1H), 7,39 (m, 3H), 7,28 (m, 2H), 7,03 (m, 4H), 6,67 (m, 1H), 6,41 (m, 1H), 5,75 (m, 1H), 3,33 (s, 4H), 2,97 (m, 2H), 2,71 (m, 2H), 2,59 (brs, 6H), 1,38 (t, 3H); |
58/111
|
101 |
0 f<|l A
H s-í |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (s, 1H), 9,58 (s, 1H), 8,31 (d, 1H), 7,75 (s, 1H), 7,52 (m, 4H), 7,38 (d, 1H), 7,12 (m, 3H), 6,37 (m, 3H), 6,11 (m, 1H), 5,75 (d, 1H), 2,98 (d, 2H), 2,15 (s, 6H);
MS (ESI+): m/z= 472,2 [M+H]+. |
|
102 |
|
1H-NMR (300MHz, CDCI3) δ 8,40 (m, 1H), 7,94 (s, 1H),
7,86 (m, 1H), 7,44 (m, 2H), 7,33 (m, 3H), 7,17 (m, 2H),
7,04 (m, 2H), 6,42 (m, 3H), 6,34 (m, 1H), 5,71 (m, 1H),
3,24 (d, 2H), 2,47 (m, 4H), 1,75 (m, 4H), 1,54 (m, 2H); MS (ESI+): m/z = 512,2 [M+H]+. |
|
103 |
.oYaH
0 /i hA
A ’ |
1H-NMR (300MHz, DMSO-d6) δ 10,35 (s, 1H), 9,43 (s, 1H), 8,30 (d, 1H), 7,89 (d, 1H), 7,71 (s, 1H), 7,45 (m, 3H), 7,36 (d, 1H), 7,05 (m, 3H), 6,44 (dd, 1H), 6,25 (d, 1H), 5,76 (d, 1H), 3,43 (m, 1H), 2,70 (m, 2H), 2,14 (s, 3H), 1,94 (m, 2H), 1,66 (m, 2H), 1,40 (m,2H);
MS (ESI+): m/z = 543,3 [M+H]+. |
|
104 |
O N^N |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,22 (s, 1H), 8,26 (d, 2H), 7,70 (s, 1H), 7,64 (m, 1H), 7,47 (d, 1H), 7,41 (m, 1H), 7,31 (d, 1H), 7,05 (d, 2H), 6,71 (m, 1H), 6,44 (m, 1H), 6,26 (m, 2H), 5,78 (m, 1H), 2,96 (m, 2H), 1,59 (m, 2H), 1,50 (m, 1H);
MS (ESI+): m/z = 471,2 [M+H]+. |
|
105 |
, M
-^°°¾ |
1H-NMR (300MHz, DMSO-d6) δ 10,27 (brs, 1H), 9,35 (brs, 1H), 8,18 d, 1H), 7,61 .(s, 1H), 7,55 (d, 1H), 7,42-7,38 (m, 3H), 7,26-7,24 (d, 1H), 6,99(d, 1H), 6,96-6,92 (m, 2H), 6,34-6,29 (m, 1H), 6,18-6,13 (m, 1H), 5,68-5,67 (m, 1H), 3,45-3,44 (m, 2H), 3,13-3,09 (m, 1H), 2,84-2,80 (m, 1H), 2,72 (s, 3H), 1,90 (s, 3H);
MS (ESI+): m/z = 515,2 [M+H]+. |
|
106 |
ΛΠ
O';NH j.o.íj |
1H-NMR (300MHz, DMSO-d6) δ 9,47 (s, NH), 8,35 (m, 2H), 8,23 (dd, 1H), 7,82-7,75 (m, 2H), 7,38 (d, 1H), 7,09 (m, 1H), 6,92 (m, 1H), 6,58 (m, 1H), 4,12 (s, 4H);
MS (ESI+): m/z = 447,4 [M+H]+. |
<Tabela 1p>
|
Exemplo |
Estrutura |
Dados de análise |
|
107 |
OH |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,24 (s, 1H), 8,28 (d, 1H), 7,73 (m, 1H), 7,60 (m, 1H), 7,47 (dd, 1H), 7,32 (d, 1H), 7,08 (m, 2H), 6,82 (m, 1H), 6,57 (m, 1H), 6,42 (dd, 1H), 5,77 (dd, 1H), 4,77 (s, 1H), 3,85 (m, 2H), 3,02 (m, 2H), 1,81 (m,2H);
MS (ESI+): m/z = 460,1 [M+H]+. |
59/111
|
108 |
|
1 H-NMR (300MHz, DMSO-d6) δ 10,50 (brs, 1H), 9,60 (brs, 1H), 8,32-8,30 (m, 1H), 7,78-7,77 (m, 1H), 7,62-7,59 (m,
1H), 7,48-7,39 (m, 3H), 7,36-7,34 (m, 1H), 7,07-7,01 (m,
2H), 6,46-6,41 (m, 1H), 6,25-6,20 (m, 1H), 5,76-5,72 (m,
1H), 3,12 (s, 3H), 2,36 (m, 2H), 2,04-2,02 (m, 2H), 1,93-
1,89 (m, 2H);
MS (ESI+): m/z = 486,1 [M+H]+. |
|
109 |
Y“O-nh
0 N^N |
1H-NMR (300MHz, DMSO-d6) δ 9,47 (s, 1H), 8,28 (d, 1H), 7,80 (d, 1H), 7,73 (s, 1H), 7,57 (d, 1H), 7,45 (m, 2H), 7,33 (d, 1H), 7,20 (m, 1H), 7,07 (m, 1H), 6,41 (m, 1H), 6,23 (m, 1H), 5,75 (m, 1H), 4,07 (t, 2H), 3,12 (s, 2H), 2,91 (m, 2H), 2,23 (s, 6H);
MS (ESI+): m/z = 515,1 [M+H]+. |
|
110 |
δ«Η |
1H-NMR (300MHz, DMSO-d6) δ 10,35(s, 1H), 9,68(s, 1H), 8,76(s, 1H), 8,50(d, 1H), 8,06(d, 2H), 7,75(s, 1H), 7,56(m, 1H), 7,38(m, 2H), 7,05(m, 2H), 6,42(m, 1H), 6,23(dd, 1H), 5,70(dd, 1H);
MS (ESI+): m/z = 390,10 [M+H]+. |
|
111 |
0 iÚn |
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H), 9,43 (bm, 1H), 8,29 (d, 1H), 7,78 (m, 2H), 7,64 (d, 1H), 7,48 (t, 1H), 7,33 (d, 1H), 7,21 (m, 3H), 7,10 (m, 1H), 6,42 (m, 1H), 6,28 (d, 1H), 6,20 (m, 1H), 5,76 (m, 1H);
MS (ESI+): m/z = 441,7 [M+H]+. |
|
112 |
η~ί ,
h.N^Ó
U^q
0 A ntj |
1H-NMR (300MHz, CDCI3) δ 8,44 (bs, 1H), 7,96 (d, 1H), 7,94 (d, 1H), 7,66 (s, 1H), 7,45 (d, 2H), 7,31 (m, 1H), 7,20 (d, 1H), 6,98 (d, 1H), 6,43 (s, 1H), 6,35 (s, 1H), 6,27-6,24 (m, 2H), 5,65 (d, 1H), 3,72 (s, 3H), 3,10 (bs, 4H), 2,47 (bs, 4H), 2,45 (dd, 2H), 1,12 (t, 3H);
MS (ESI+): m/z = 531,2 [M+H]+. |
|
113 |
OA 1
U-N.^.Ò
kA^
0 Μ'Ι ΓίΝ |
1H-NMR (300MHz, DMSO-d6) δ 10,35 (s, 1H), 8,26 (d, 1H), 7,71 (m, 2H), 7,64 (m, 2H), 7,44 (dd, 1H), 7,31 (d, 1H), 7,07 (m, 1H), 6,59 (m, 1H), 6,40 (dd, 1H), 6,29 (m, 2H), 5,77 (dd, 1H), 3,77 (s, 3H), 3,73 (m, 4H), 3,03 (m, 4H) MS (ESI+): m/z = 504,08 [M+H]+. |
<Tabela 1q>
|
Exemplo |
Estrutura |
Dados de análise |
|
114 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,38 (brs, 1H), 8,31-8,30 (d, 1H), 7,84-7,72 (m, 3H), 7,63-7,60 (m, 1H), 7,48-7,43 (t, 1H), 7,36-7,34 (m, 1H), 7,09-7,06 (m, 1H), 6,84 (s, 1H), 6,61-6,58 (m, 1H), 6,49-6,40 (m, 1H), 6,29-6,24 (m, 1H), 5,80-5,76 (m, 1H), 3,81 (s, 3H), 3,18 (m, 2H), 2,54 (s, 3H), 1,91-1,71 (m, 6H);
MS (ESI+): m/z = 516,2 [M+H]+. |
60/111
|
115 |
AsL
0 r-X1 |
1H-NMR (300MHz, DMSO-d6) δ 10,64 (brs, 1H), 8,31-8,29 (m, 1H), 7,82-7,76 (m, 3H0, 7,70 (m, 1H), 7,44 (m, 1H), 7,35-7,33 (m, 1H), 7,05 (m, 1H), 6,85 (m, 1H), 6,55 (m, 1H), 6,45 (m, 1H), 6,27 (m, 1H), 5,80 (m, 1H), 3,81 (s, 3H), 3,32 (m, 2H), 3,20-2,95 (m, 3H), 2,72 (s, 3H), 1,95-1,80 (m, 3H), 1,60 (m, 1H);
MS (ESI+): m/z = 516,1 [M+H]+. |
|
116 |
ο λ wqi
'A ''°/j/ |
1H-NMR (300MHz, DMSO-d6) δ 10,30 (s, 1H), 9,27 (s, 1H), 8,28 (d, 1H), 7,70 (m, 1H), 7,68 (m, 1H), 7,45 (dd, 1H), 7,35 (m, 2H), 7,18 (m, 1H), 7,07 (m, 1H), 6,74 (m, 1H), 6,44 (dd, 1H), 6,27 (dd, 1H), 5,78 (dd, 1H), 3,97 (t, 2H), 3,60 (s, 3H), 3,56 (m, 4H), 2,63 (t, 2H), 2,46 (m, 4H);
MS (ESI+):m/z = 548,1 [M+H]+. |
|
117 |
|
1H-NMR (300MHz, CDCI3) δ 7,93 (m, 1H), 7,87 (d, 2H), 7,84 (s, 1H), 7,49 (m, 2H), 7,41 (s, 1H), 7,29 (d, 1H), 7,14 (d, 1H), 7,02 (d, 1H), 6,37 (m, 2H), 5,70 (m, 1H), 3,89 (s, 3H), 3,63 (t, 2H), 2,85 (t, 2H), 2,75 (m, 4H), 1,90 (m, 4H); MS (ESI+): m/z = 558,9 [M+H]+. |
|
118 |
O O'
W |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,79 (s, 1H), 8,35 (d, 1H), 7,78 (m, 2H), 7,58 (m, 3H), 7,32 (m, 2H), 7,30 (d, 1H), 7,10 (d, 1H), 6,44 (dd, 1H), 6,25 (d, 1H), 5,78 (d, 1H), 3,73 (s, 3H), 2,62 (m, 2H), 2,16 (s, 3H), 2,03 (m, 2H), 1,78 (m, 2H), 1,50 (m,2H);
MS (ESI+): m/z = 559,2 [M+H]+. |
|
119 |
r |
1H-NMR (300MHz, CDCI3) δ 7,86 (d, 1H), 7,76 (s, 1H), 7,43 (m, 3H), 7,28 (m, 1H), 6,99 (t, 2H), 6,76 (t, 1H), 6,40 (m, 2H), 5,73 (m, 1H), 3,71 (m, 4H), 3,17 (s, 2H), 2,95 (m, 4H), 2,31 (s, 6H);
MS (ESI+): m/z = 575,9 [M+H]+. |
|
120 |
Ο=°Ν . F
“Ό.
O r**S N : N
H fi |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (brs, 1H), 9,56 (brs, 1H), 8,33-8,31 (d, 1H), 7,74 (m, 1H), 7,61-7,43 (m, 3H), 7,39-7,38 (m, 1H), 7,27 (m, 1H), 7,10-7,07 (m, 1H), 6,87 (m, 1H), 6,43-6,39 (m, 1H), 6,28-6,22 (m, 1H), 5,79-5,75 (m, 1H), 3,24 (m, 4H), 2,98 (m, 4H), 2,93 (s, 3H);
MS (ESI+): m/z = 591,06 [M+Na]+. |
<Tabela 1r>
|
Exemplo |
Estrutura |
Dados de análise |
|
121 |
°SN-> F
X
O (% N ' M
H S |
1H-NMR (300MHz, DMSO-d6) 510,35 (brs, 1H), 9,55 (brs, 1H), 8,32-8,30 (d, 1H), 7,79 (s, 1H), 7,60-7,43 (m, 3H), 7,39-7,37 (d, 1H), 7,28-7,25 (m, 1H), 7,09-7,06 (m, 1H), 6,89-6,82 (t, 1H), 6,47-6,38 (m, 1H), 6,28-6,22 (m, 1H), 5,78-5,75 (m, 1H), 3,20-3,07 (m, 6H), 2,94 (m, 4H), 1,261,21 (t,3H). |
61/111
|
122 |
θ') F
ο nSi |
1H-NMR (300MHz, DMSO-d6) δ 9,53 (s, 1H), 8,30 (m, 1H), 7,73 (s, 1H), 7,46 (m, 3H), 7,38 (d, 1H), 7,25 (m, 1H), 7,07 (d, 1H), 6,84 (d, 1H), 6,41 (m, 1H), 6,26 (d, 1H), 3,63 (m, 4H), 2,86 (m,4H);
MS (ESI+): m/z= 492,54 [M+H]+. |
|
123 |
oA F
O |
1H-NMR (300MHz, CDCI3) δ 7,86 (d, 1H), 7,71 (s, 1H), 7,53 (m, 2H), 7,46 (m, 2H), 7,29 (d, 1H), 7,14 (s, 1H), 7,05 (m, 1H), 6,93 (m, 1H), 6,78 (t, 1H), 6,45 (dd, 1H), 6,25 (m, 1H), 5,79 (dd, 1H), 3,87 (m, 2H), 3,15 (d, 2H), 2,39 (t, 2H), 1,23 (d, 6H);
MS (ESI+): m/z = 520,2 [M+H]+ |
|
124 |
->NH
□ N^N |
1H-NMR (300MHz, CDCI3) δ 7,86 (d, 1H), 7,79 (s, 1H), 7,67 (s, 1H), 7,42 (m, 2H), 6,97 (m, 1H), 6,90 (s, 1H), 6,77 (d, 1H), 6,46 (t, 1H), 6,40 (d, 1H), 6,29 (dd, 1H), 5,76 (d, 1H), 3,42 (d, 2H), 3,09 (m, 2H), 2,95 (m, 2H), 2,06 (m, 6H);
MS (ESI+): m/z = 559,2 [M+H]+. |
|
125 |
|
1H-NMR (300MHz, CDCI3) δ 7,87 (d, 1H), 7,78 (s, 1H), 7,48 (d, 1H), 7,25 (d, 1H), 7,01 (d, 1H), 7,00 (d, 1H), 6,82 (t, 1H), 6,47 (m, 2H), 5,70 (m, 1H), 4,42 (t, 1H), 4,37 (m, 1H), 3,33 (m, 4H), 2,58 (m, 4H), 2,35 (m, 1H), 1,95 (m, 2H), 1,78 (m, 2H), 1,63 (m, 4H), 1,46 (m, 2H);
MS (ESI+): m/z = 573,0 [M+H]+. |
|
126 |
F
:l'''NH
□ r^Ti nX
^·μ-Μ·Γι^\Γ |
1H-NMR (300MHz, DMSO-d6) δ 10,33 (s, 1H), 9,49 (s, 1H), 8,30 (d, 1H), 7,71 (s, 1H), 7,59 (d, 1H), 7,46 (m, 2H), 7,20 (d, 1H), 7,05 (d, 1H), 6,40 (dd, 1H), 6,26 (d, 1H), 5,77 (d, 1H), 3,68 (m, 4H), 3,19 (d, 2H), 2,71 (m, 1H), 2,67 (m, 4H), 2,20 (m, 2H), 1,81 (m, 2H), 1,47 (m, 2H);
MS (ESI+): m/z = 575,1 [M+H]+. |
|
127 |
'°é
^.,¾ |
1H-NMR (300MHz, CDCI3) δ 7,98 (s, 1H), 7,91 (d, 1H), 7,45 (m, 2H), 7,32 (m, 2H), 7,04 (m, 3H), 6,43 (m, 2H), 5,78 (m, 1H), 3,04 (m, 2H), 2,78 (m, 1H), 2,40 (s, 3H), 2,17 (m, 2H), 1,85 (m, 4H);
MS (ESI+): m/z = 504,2 [M+H]+. |
<Tabela 1s>
|
Exemplo |
Estrutura |
Dados de análise |
|
128 |
|
1H-NMR (300MHz, CDCI3) δ 7,86 (d, 1H), 7,79 (s, 1H), 7,69 (s, 1H), 7,46 (m, 3H), 7,30 (d, 1H), 7,19 (s, 1H), 7,02 (m, 2H), 6,91 (m, 1H), 6,45 (m, 1H), 6,29 (m, 1H), 5,78 (m, 1H), 3,09 (m, 1H), 2,92 (m, 2H), 2,32 (s, 3H), 1,95 (m, 2H), 1,77 (m, 3H), 1,44 (m, 1H);
MS (ESI+): m/z = 504,2 [M+H]+ |
62/111
|
129 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,27 (s, 1H), 8,27 (d, 1H), 7,71 (s, 1H), 7,61 (d, 1H), 7,40 (m, 3H), 7,10 (m, 2H), 6,58 (m, 1H), 6,50 (dd, 1H), 6,40 (d, 1H), 5,78 (d, 1H), 4,58 (d, 1H), 3,10 (m, 1H), 2,72 (m, 2H), 2,17 (s, 3H), 2,00 (m, 2H), 1,80 (m, 2H), 1,44 (m, 2H);
MS (ESI+): m/z = 519,2 [M+H]+. |
|
130 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,34 (s, 1H), 9,25 (s, 1H), 8,27 (d, 1H), 7,69 (s, 1H), 7,60 (d, 1H), 7,36 (m, 3H), 7,10 (m, 2H), 6,55 (m, 1H), 6,40 (dd, 1H), 6,25 (d, 1H), 5,77 (d, 1H), 4,52 (d, 1H), 3,10 (m, 1H), 2,66 (m, 2H), 2,15 (m, 2H), 1,83 (m, 2H), 1,35 (m, 2H), 0,96 (d, 6H);
MS (ESI+): m/z = 547,2 [M+H]+. |
|
131 |
F
Ό'Ύ'Λ |
1H-NMR (300MHz, CDCI3) δ 7,84 (d, 1H), 7,63 (s, 1H), 7,46 (dd, 1H), 7,37 (m, 2H), 7,24 (t, 1H), 7,02 (m, 1H), 6,83 (m, 2H), 6,43 (m, 1H), 6,24 (m, 1H), 5,72 (dd, 1H), 4,11 (t, 2H), 3,73 (t, 2H), 3,43 (s, 3H);
MS (ESI+): m/z = 481,0 [M+H]+. |
|
132 |
Wl |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,51 (s, 1H), 8.,31 (d, 1H), 7,75 (s, 1H), 7,54 (m, 2H), 7,45 (m, 1H), 7,28 (m, 1H), 7,15 (m, 1H), 6,90 (m, 1H), 6,40 (m, 1H), 6,21 (m, 1H), 5,70 (m, 1 H), 4,00 (t, 2H), 2,59 (t, 2H), 2,20 (s, 6H);
MS (ESI+): m/z = 494,2 [M+H]+. |
|
133 |
T“Ó- |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,50 (s, 1H), 8.,30 (d, 1H), 7,74 (m, 1H), 7,56 (m, 2H), 7,44 (dd, 1H), 7,37 (d, 1H), 7,35 (d, 1H), 7,15 (m, 1H), 6,95 (m, 1H), 6,43 (dd, 1H), 6,25 (dd, 1H), 5,65 (dd, 1H), 4,02 (m, 2H), 2,80 (m, 2H), 2,56 (m, 4H), 0,97 (m, 6H);
MS (ESI+): m/z = 522,1 [M+H]+. |
|
134 |
O r<’j Ν'N |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,51 (s, 1H), 8.,31 (m, 1H), 7,74 (m, 1H), 7,57 (m, 2H), 7,45 (dd, 1H), 7,38 (d, 1H), 7,22 (m, 1H), 7,08 (m, 1H), 6,94 (m, 1H), 6,43 (dd, 1H), 6,24 (dd, 1H), 5,76 (dd, 1H), 4,02 (t, 2H), 2,64 (t, 2H), 2,49 (m, 4H), 2,30 (m, 4H), 2,14 (s, 3H);
MS (ESI+): m/z = 549,2 [M+H]+. |
<Tabela 1t>
|
Exemplo |
Estrutura |
Dados de análise |
|
135 |
F
’-Ah |
1H-NMR (300MHz, CDCI3) δ 7,86 (d, 1H), 7,78 (s, 1H), 7,51 (d, 1H), 7,41 (m, 2H), 7,24 (m, 1H), 7,02 (m, 1H), 6,90 (d, 1H), 6,81 (t, 1H), 6,44 (m, 1H), 6,27 (m, 1H), 5,77 (d, 1H), 4,11 (t, 2H), 3,75 (t, 4H), 2,80 (t, 2H), 2,59 (t, 4H);
MS (ESI+): m/z = 536,3 [M+H]+. |
63/111
|
136 |
|
1H-NMR (300MHz, DMSO-d6) : δ 10,36 (brs, 1H), 9,54 (brs, 1H), 8,30-8,29 (d, 1H), 7,73 (s, 1H), 7,58-7,55 (m, 2H),
7,46-7,41 (t, 1H), 7,37-7,35 (d, 1H), 7,22-7,20 (m, 1H),
7,08-7,05 (m, 1H), 6,97-6,91 (m, 1H), 6,46-6,38 (m, 1H),
6,26-6,21 (m, 1H), 5,77-5,74 (m, 1H), 4,14 (m, 1H), 2,66
(m, 2H), 2,22 (m, 5H), 1,84 (m, 2H), 1,62-1,59 (m, 2H); MS (ESI+): m/z = 520,2 [M+H]+. |
|
137 |
H F |
1H-NMR (300MHz, DMSO-d6) δ 10,32(s, 1H), 9,55(s, 1H), 8,30(d, 1H), 7,73(m, 1H), 7,54(m, 1H), 7,43(m, 1H), 7,39(m, 1H), 7,23(m, 2H), 7,06(m, H), 6,43(m, 1H), 6,21 (dd, 1H), 5,75(dd, 1H), 3,58(d, 1H), 3,02(m, 1H), 2,49(m, 2H), 2,11 (s, 3H), 1,84(t, 2H), 1,67(d, 2H), 1,35(m, 2H);
MS (ESI+): m/z = 537,2 [M+H]+. |
|
138 |
θτ' Λ CJ
-<:NH
J^ÕnTA, |
1H-NMR (300MHz, CDCI3) δ 7,85 (d, 1H), 768 (dd, 2H), 7,47 (m 1H), 7,39 (m, 1H), 7,20 (dd, 1H), 7,06 (d, 1H), 6,88 (s, 2H), 6,42 (d, 1H), 6,29 (dd, 1H), 5,78 (d, 1H), 3,28 (m, 2H), 2,80 (m, 2H), 2,01 (m, 2H), 1,98 (m, 5H), 1,25 (m, 3H); MS (ESl+): m/z = 575 [M+H]+. |
|
139 |
:l'''NH |
1H-NMR (300MHz, DMSO-d6) δ 10,6 (brs, 1H), 10,4 (s, 1H), 9,57 (s, 1H), 8,33 (d, 1H), 7,74 (s, 1H), 7,65 (d, 1H), 7,38 (m, 1H), 7,09 (d, 1H), 6,95 (d, 1H), 6,42 (dd, 1H), 6,23 (d, 1H), 5,79 (d, 1H), 3,99 (d, 2H), 3,78 (m, 2H), 3,48 (d, 2H), 3,25 (d, 2H), 2,63 (m, 2H), 2,16 (m, 2H), 1,82 (m, 2H); MS (ESI+): m/z = 591 [M+H]+. |
|
140 |
0 Ν'Μ |
1H-NMR (300MHz, CDCI3) δ 7,85 (m, 2H), 7,42 (m, 2H), 7,37 (m, 2H), 7,33 (m, 2H), 7,03 (m, 4H), 6,41 (m, 1H), 6,33 (m, 1H), 5,73 (m, 1H), 3,73 (m, 1H), 3,08 (m, 2H), 2,23 (m, 2H), 1,82 (m,4H);
MS (ESI+):m/z= 519,1 [M+H]+. |
|
141 |
H Cl _ούΝΗ 0 γ'^Τι ΙΝΙΛΝ |
1H-NMR (300MHz, CD3OD) δ 8,04 (d, 1H), 7,68 (d, 1H), 7,57 (m, 1H), 7,49 (d, 1H), 7,42 (t, 3H), 7,24-7,16 (m, 2H), 7,03-7,01 (m, 1H), 6,59 (d, 1H), 6,42-6,38 (m, 2H), 5,795,75 (m, 1H), 3,32-3,30 (m, 1H), 2,86-2,82 (m, 2H), 2,312,22 (m, 5H), 2,09-1,99 (m, 2H), 1,56-1,45 (m, 2H);
MS (ESI+): m/z = 535,16 [M+H]+. |
<Tabela 1u>
|
Exemplo |
Estrutura |
Dados de análise |
|
142 |
O Çl |
1H-NMR (300MHz, DMSO-D6) δ 10,24 (s, 1H), 8,40 (m, 2H), 7,61 (s, 1H), 7,45 (m, 1H), 7,26 (m, 4H), 6,87 (m, 1H), 6,39 (dd, 1H), 6,23 (d, 1H), 5,75 (d, 1H), 3,56 (m, 1H), 2,73 (m, 2H), 2,15 (s, 3H), 1,95 (m, 2H), 1,77 (m, 2H), 1,55 (m, 2H);
MS (ESI+): m/z = 563,2 [M+H]+. |
64/111
|
143 |
|
1H-NMR (300MHz, CDCI3) δ 8,04 (m, 1H), 7,89 (d, 1H), 7,45 (m, 2H), 7,36 (m, 1H), 7,27 (d, 1H), 7,15 (m, 1H), 7,03 (dd, 1H), 6,98 (dd, 1H), 6,43 (d, 1H), 6,27 (d, 1H), 5,75 (d, 1H), 3,12(s, 3H), 2,85 (s, 3H);
MS (ESl+): m/z= 494 [M+H]+. |
|
144 |
'-'o ífb N |
1H-NMR (300MHz, CDCI3) δ 8,32 (d, 1H), 8,08 (s, 1H), 7,84 (s, 1H), 7,60 (s, 1H), 7,40 (m, 1H), 7,30 (m, 1H), 7,22 (d, 1H), 6,98 (m, 2H), 6,45 (d, 1H), 6,30 (dd, 1H), 5,79 (d, 1H), 4,11 (m, 2H), 3,95 (m, 2H), 3,41 (m, 2H), 3,21 (m, 2H), 1,24 (t, 2H), 1,25 (s, 3H);
MS (ESI+): m/z = 627,7 [M+H]+. |
|
145 |
.3,0.¾ |
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H), 9,61 (s, 1H), 8,33 (d, 1H), 7,90 (d, 1H), 7,78 (s, 1H), 7,57 (m, 1H), 7,45 (m, 4H), 7,07 (m, 2H), 6,41 (dd, 1H), 6,25 (d, 1H), 5,76 (d, 1H), 3,64 (m, 1H), 2,74 (m, 2H), 2,15 (s, 6H), 1,94 (m, 2H), 1,73 (m, 2H), 1,49 (m,2H);
MS (ESI+): m/z = 543,2 [M+H]+. |
|
146 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,24(s, 1H), 8,28(d, 1H), 8,26(m, 1H), 7,69(m, 1H), 7,59(m, 1H),
7,45(m, 1H), 7,34(m, 1H), 7,32(m, 1H), 7,08(m, 1H),
6,63(m, 1H), 6,33(m, 1H), 6,28(dd, 1H), 5,77(dd, 1H),
3,62(m, 4H), 2,69(m, 1H), 2,48(m, 4H), 1,07(d, 6H);
MS (ESI+): m/z = 516,20 [M+H]+. |
|
147 |
uü
---NH O <Ti N^N ''^N' |
1H-NMR (300MHz, DMSO-d6) δ 10,36(s, 1H), 9,22(s, 1H), 8,32(m, 1H), 8,26(m, 1H), 7,78(m, 1H), 7,68(m, 1H), 7,58(m, 1H), 7,41 (m, 2H), 7,31 (m, H), 7,05(m, 1H), 6,64(m, 1H), 6,42(m, 3H), 6,24(dd, 1H), 5,76(dd, 1H), 3,33(m, 2H), 2,49~2,37(m, 10H), 2,13(s, 6H);
MS (ESI+): m/z = 515,2 [M+H]+. |
|
148 |
L--AN·'-
<jíAHH O N^H |
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,30(s, 1H), 8,27(m, 1H), 8,25(m, 1H), 7,75(m, 1H), 7,68(m, 1H),
7,58(m, 1H), 7,43(m, 1H), 7,31 (m, 1H), 7,04(m, 1H),
6,60(m, 1H), 6,43(m, 1H), 6,28(dd, 1H), 5,76(dd, 1H),
3,31(m, 5H), 2,76(m, 2H), 2,50(m, 4H), 2,12(s, 3H),
1,74(m,4H), 1,38(m, 2H);
MS (ESI+): m/z = 571,30 [M+H]+. |
<Tabela 1v>
|
Exemplo |
Estrutura |
Dados de análise |
|
149 |
--- mu |
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,24(s, 1H), 8,28(d, 1H), 8,26(m, 1H), 7,69(m, 1H), 7,59(m, 1H),
7,45(m, 1H), 7,34(m, 1H), 7,32(m, 1H), 7,08(m, 1H),
6,63(m, 1H), 6,33(m, 1H), 6,28(dd, 1H), 5,77(dd, 1H),
3,65(m, 4H), 3,57(m, 4H);
MS (ESI+): m/z = 474,2 [M+H]+. |
65/111
|
150 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,35(s, 1Η), 9,18(s, 1H), 8,28(m, 1H), 8,25(m, 1H), 7,73(m, 1H), 7,59(m, 1H),
7,45(m, 1H), 7,40(m, 1H), 7,30(m, 1H), 7,03(m, 1H),
6,64(m, 1H), 6,43(m, 1H), 6,28(dd, 1H), 5,76(dd, 1H),
3,32(m, 2H), 2,63(m, 2H), 2,23(m, 1H), 2,15(s, 6H),
1,74(m,2H), 1,29(m, 2H);
MS (ESI+): m/z = 516,2 [M+H]+. |
|
151 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,36(s, 1H), 9,24(s, 1H), 8,31 (d, 1H), 8,25(m, 1H), 7,82(m, 1H), 7,79(m, 1H),
7,55(m, 1H), 7,40(m, 1H), 7,33(m, 1H), 7,05(m, 1H),
6,63(m, 1H), 6,33(m, 1H), 6,28(dd, 1H), 5,77(dd, 1H),
4,01(m, 2H), 3,16(m, 2H), 2,78(m, 2H), 2,51(m, 2H),
2,12(m, 1H), 1,88(m, 2H), 1,67(m,4H), 1,44(m, 2H);
MS (ESI+): m/z = 542,2 [M+H]+. |
|
152 |
- ΝΗ
νΗο0/ |
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,18(s, 1H), 8,36(m, 1H), 8,25(m, 1H), 7,73(m, 1H), 7,69(m, 1H),
7,47(m, 1H), 7,41 (m, 1H), 7,31 (m, 1H), 7,04(m, 1H),
6,61 (m, 1H), 6,45(m, 1H), 6,29(dd, 1H), 5,76(dd, 1H),
4,08(m, 2H), 3,43(m, 1H), 2,65(m, 2H), 2,49(m, 4H),
1,72(m, 2H), 1,39(m, 4H), 1,36(m, 4H);
MS (ESI+): m/z = 556,2 [M+H]+. |
|
153 |
σΑχ |
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,24(s, 1H), 8,31 (d, 1H), 8,26(m, 1H), 7,82(m, 1H), 7,79(m, 1H),
7,58(m, 1H), 7,42(m, 1H), 7,32(m, 1H), 7,05(m, 1H),
6,63(m, 1H), 6,33(m, 1H), 6,28(dd, 1H), 5,76(dd, 1H),
3,67(m,4H), 3,28(m, 4H);
MS (ESI+): m/z = 516,2 [M+H]+. |
|
154 |
/Αχ |
1H-NMR (300MHz, DMSO-d6) δ 10,34(s, 1H), 9,08(s, 1H), 8,35(d, 1H), 8,23(m, 1H), 7,65(d, 1H), 7,57(m, 1H), 7,42(m, 2H), 7,28(d, 1H), 7,04(m, 1H), 6,42(m, 2H), 6,28(m, 2H), 6,02(d, 1H), 5,74(dd, 1H), 2,67(m, 4H), 2,16(m, 2H), 1,84(m, 2H), 1,33(m, 2H), 0,97(m, 6H);
MS (ESI+): m/z = 530,2 [M+H]+. |
|
155 |
Αχ |
1H-NMR (300MHz, DMSO-d6) δ 10,39(s, 1H), 10,05(s, 1H), 8,86(s, 1H), 8,37(d, 1H), 8,31 (d, 1H), 7,80(s, 1H), 7,45~7,63(m, 4H), 7,10(d, 1H), 6,39(m, 1H), 6,22(dd, 1H), 5,75(dd, 1H);
MS (ESI+): m/z = 452,1 [M+H]+. |
|
156 |
/0.¾ |
1H-NMR (300MHz, DMSO-d6) : δ 10,38 (brs, 1H), 9,33 (s, 1H), 8,31-8,29 (d, 1H), 7,88 (s, 1H), 7,71 (s, 1H), 7,65-7,61 (m, 2H), 7,48-7,43 (t, 1H), 7,36-7,34 (d, 1H), 7,09-7,02 (m, 2H), 6,48-6,41 (m, 1H), 6,27-6,21 (m, 1H), 5,78-5,75 (m, 1H), 4,52-4,41 (m, 1H), 3,53-3,44 (m, 2H), 3,03 (m, 4H), 2,66-2,48 (m, 6H);
MS (ESI+): m/z = 518 [M+H]+. |
[0336]Exemplo 157: Preparação de A/-(3-(2-(4-(4-metil-4-oxi-piperazin-1-il)fenilamino)-tieno[3,2-c/]pirimidina-4-iloxi)-fenil)-acrilamida
66/111
[0337]O composto (100 mg, 0,21 mmol) obtido no Exemplo 1 foi dissolvido em diclorometano (2 mL), e ácido m-cloroperbenzoico (71 mg, 0,42 mmol) foi adicionado a este, seguido por agitação a 45°C por 12 horas. Após a reação estar completa, a mistura de reação foi diluída com diclorometano e lavada com NaHCO3 solução aquosa saturada. A camada orgânica foi seca com sulfato de sódio anidro e então filtrada e destilada sob pressão reduzida, and o resíduo foi separado por cromatografia em coluna (clorofórmio saturado com amônia : metanol = 4 : 1 (razão de volume)) para obter o composto título (rendimento: 25 mg, 40 %).
[0338]1H-NMR (300MHz, DMSO-d6) δ 10,38 (s, NH), 9,27 (s, NH), 8,28 (d, 1H), 7,74 (s, 1H), 7,60 (d, 1H), 7,46 (m, 3H), 7,33 (d, 1H), 7,05 (d, 1H), 6,78 (d, 2H), 6,43 (m, 1H), 6,28 (m, 1H), 5,76 (m, 1H), 3,57 (m, 4H), 2,98 (s, 3H), 2,95 (m, 2H), 2,50 (m, 2H);
[0339]MS (ESI+): m/z = 503,1 [M+H]+.
[0340]Exemplo 158: Preparação de N-(3-(2-(4-(piperazin-1-il)fenilamino)-tieno[3,2
d]pirimidina-4-iloxi)-fenil)-acrilamida
[0341]Etapa 1) Preparação de éster tert-butil de ácido 4-(4-(4-(3-acriloylaminofenoxi)-tieno[3,2-d]pirimidina-2-ilamino)-fenil)-piperazin-1-carboxílico
67/111
[0342]O procedimento da etapa 4 do Exemplo 1 foi repetido exceto para usar tertbutil 4-(4-aminofenil)piperazin-1-carboxilato ao invés de 4-(4-metilpiperazin-1il)benzenoamina para obter o composto título (rendimento: 610 mg, 91 %).
[0343]1 H-NMR (300MHz, CDCI3) δ 7,82-7,80 (m, 1H), 7,59-7,52 (m, 3H), 7,43-7,34 (m, 3H), 7,06-7,03 (m, 1H), 6,92 (s, 1H), 6,80-6,77 (m, 2H), 6,47-6,41 (m, 1H), 6,276,24 (m, 1H), 5,79-5,75 (m, 1H), 3,57 (m, 4H), 3,02-2,99 (m, 4H), 1,48 (s, 9H).
[0344]Etapa 2) Preparação de N-(3-(2-(4-(piperazin-1-il)-fenilamino)-tieno[3,2d]pirimidina-4-iloxi)-fenil)-acrilamida [0345]O composto (600 mg, 1,05 mmol) obtido na etapa 1 foi dissolvido em diclorometano (10 mL), e ácido trifluoracético (1,62 mL, 21,0 mmol) foi adicionado a este, seguido por agitação em temperatura ambiente por 1 hora. Após a reação estar completa, a mistura de reação foi destilada sob uma pressão reduzida para remover solvente, alcalificar (pH 8) com NaHCO3 solução aquosa saturada, e extraída com clorofórmio 2 vezes. A camada orgânica foi separada, lavada com água e salmoura saturada, seca com sulfato de sódio anidro, e então filtrada e destilada sob pressão reduzida. O resíduo foi separado por cromatografia em coluna (clorofórmio : metanol = 10:1 (razão de volume)) para obter o composto título (rendimento: 316 mg, 72 %).
[0346]1 H-NMR (300MHz, CDCI3) δ 10,28 (brs, 1H), 9,15 (brs, 1H), 8,26-8,24 (m, 1H), 7,68 (s, 1H), 7,62-7,59 (m, 1H), 7,50-7,41 (m, 1H), 7,31-7,29 (m, 1H), 7,06-7,00 (m, 1H), 6,74-6,71 (m, 2H), 6,44-6,38 (m, 1H), 6,27-6,21 (m, 1H), 5,78-5,74 (m, 1H), 3,31 (m, 4H), 3,04-2,96 (m, 4H);
[0347]MS (ESI+): m/z = 473,4 [M+H]+.
68/111 [0348]O procedimento do Exemplo 158 foi repetido exceto para usar tert-butil 4-(4amino-2-clorofenil)piperazin-1 -carboxilato ou éster tert-butil de ácido [1-(4aminofenil)ciclopropil]carbâmico ao invés de tert-butil 4-(4-aminofenil)piperazin-1carboxilato na etapa 4, para preparar os compostos dos Exemplos 159 e 160 que são apresentados na Tabela 2 abaixo.
cTabela 2>
|
Exemplo |
Estrutura |
Dados de análise |
|
159 |
HN'i Cl |
1H-NMR (300MHz, DMSO-ds) δ 9,54 (brs, 1H), 8,30 (d, 1H), 7,867,71 (m, 2H), 7,59 (d, 1H), 7,47-7,41 (m, 2H), 7,35 (d, 1H), 7,05 (m, 1H), 6,92 (m, 1H), 6,39-6,50 (m, 1H), 6,27-6,16 (m, 1H), 5,775,74 (m, 1H), 2,99-2,89 (m, 8H);
MS (ESI+): m/z = 507,13 [M+H]+. |
|
160 |
|
1H-NMR (300MHz, CDCI3) δ 7,85 (d, 1H), 7,66 (m, 2H), 7,55 (m,
1H), 7,42 (m, 2H), 7,15 (d, 2H), 7,11 (d, 1H), 7,01 (s, 1H), 6,42 (d,
1H), 6,25 (dd, 1H), 5,79 (d, 1H), 0,96 (m, 2H), 0,89 (m, 2H); MS (ESI+): m/z= 444 [M+H]+. |
[0349]Exemplo 161: Preparação de (Z)-3-cloro-N-(3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-d]pirimidina-4-iloxi)fenil)acrilamida 'N*X '3nh
[0350]0 composto (50 mg, 0,12 mmol) obtido na etapa 5 do Exemplo 1 foi dissolvido em piridina (1,5 mL), e ácido cis-3-cloroacrilico (18 mg, 0,17 mmol) e sal clorídrico do ácido N-(3-dimetilaminopropil)-N’-etilcarbodiimida (44 mg, 0,23 mmol) foram adicionados a este, seguido por agitação em temperatura ambiente por 1 hora. Após a reação estar completa, a mistura de reação foi diluída com um solvente misturado (clorofórmio : 2-propanol = 3:1 (razão de volume)) e lavado com salmoura saturada. A camada orgânica foi seca com sulfato de sódio anidro e então filtrada e destilada sob pressão reduzida. O resíduo foi separado por cromatografia
69/111 em coluna (diclorometano: metanol = 6:1 (razão de volume)) para obter o composto título (rendimento: 15 mg, 24 %).
[0351 ]1 H-NMR (300MHz, CDCI3) δ 8,24 (s, 1H), 7,82 (d, 1H), 7,62 (s, 1H), 7,57 (d, 1H), 7,44 (d, 1H), 7,39 (d, 1H), 7,35 (s, 1H), 7,26 (d, 1H), 7,08 (m, 1H), 6,98 (s, 1H), 6,81 (d, 2H), 6,62 (d, 1H), 6,34 (d, 1H), 3,13 (t, 4H), 2,59 (t, 4H), 2,36 (s, 3H);
[0352]MS (ESI+): m/z = 521,4 [M+H]+.
[0353]O procedimento do Exemplo 161 foi repetido exceto para usar ácido trans-3cloroacrílico e ácido (E)-4-(dimetilamino)-2-butenoico para preparar os compostos dos Exemplos 162 e 163 que são mostrados na tabela 3 abaixo.
cTabela 3>
|
Exemplo |
Estrutura |
Dados de análise |
|
162 |
<N- |
1H-NMR (300MHz, CDCI3) δ 7,82 (d, 1H), 7,62 (m, 2H), 7,55 (d, 1H), 7,42 (s, 1H), 7,41 (d, 1H), 7,35 (d, 2H), 7,25 (d, 1H), 7,08 (d, 1H), 6,92 (s, 1H), 6,81 (d, 2H), 6,40 (d, 1H), 3,14 (t, 4H), 2,61 (t, 4H), 2,38 (s, 3H);
MS (ESI+): m/z = 521,3 [M+H]+. |
|
163 |
Ο Λ νλν |
1H-NMR (300MHz, CDCI3) δ 7,80 (d, 1H), 7,56 (m, 2H), 7,41 (d, 2H), 7,36 (d, 2H), 7,25 (d, 1H), 6,99 (d, 1H), 6,95 (m, 1H), 6,90 (s, 1H), 6,80 (d, 2H), 6,07 (m, 1H), 3,12 (t, 4H), 3,10 (d, 2H), 2,59 (t, 4H), 2,36 (s, 3H) 2,27 (s, 6H);
MS (ESI+): m/z = 544,2 [M+H]+. |
[0354] Exemplo 164: Preparação de N-(4-metil-3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-d]pyrimidin-4-iloxi)fenil)acrilamida [0355]Um procedimento semelhante como o procedimento do Exemplo 1 foi conduzido para uso de 2-metil-5-nitrofenol(25 mmol), ao invés de 3-nitrofenol na etapa 3), para obter o composto título (30 mg, final rendimento: 34%).
[0356]1 H-NMR (300MHz,DMSO-d6) δ 10,27 (s, 1H), 9,21 (s, 1H), 8,25 (d, 1H), 7,62 (s, 1H), 7,55 (d, 1H), 7,33 (m, 4H), 6,69 (m, 2H), 6,39 (m, 1H), 6,25 (m, 1H), 5,75 (d, 1H), 2,96 (m, 4H), 2,42 (m, 4H), 2,20 (s, 3H), 2,07 (s, 3H);
[0357]MS (ESI+): m/z = 501,2 [M+H]+.
[0358]Um procedimento semelhante como o procedimento do Exemplo 164 foi
70/111 conduzido para usar 2-fluor-5-nitrofenol e 2-metoxi-5-nitrofenol, para obter compostos do Exemplo 165 e Exemplo 166, respectivamente.
<Tabela 4>
|
Exemplo |
Estrutura |
Dados de análise |
|
165 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H), 9,30 (s, 1H), 8,31 (d,
1H), 7,83 (m, 1 H), 7,64 (m, 1 H), 7,46 (dd, 1 H), 7,38 (m, 2H), 7,34 (d,
1 H), 6,71 (m, 1 H), 6,41 (dd, 1H), 6,27 (dd, 1 H), 5,79 (dd, 1H), 3,00 (m, 4H), 2,44 (m, 4H), 2,22 (s, 3H); MS (ESI+):m/z = 505,2 [M+H]+. |
|
166 |
Ν'Τ
uNH 0 ^'|Τ-°ΝΛΝ
Τ θ'Τ |
1H-NMR (300MHz,DMSO-de) δ 10,18 (s, 1H), 9,20 (s, 1H), 8,24 (d,
1H), 7,63 (m, 2H), 7,35 (d, 2H). 7,29 (d, 1 H), 7,20 (d, 1 H), 6,69 (d, 2H), 6,36 (dd, 1H), 6,22 (dd, 1 H), 5,75 (dd, 1 H), 3,68 (s, 3H), 2,98 (m, 4H), 2,44 (m, 4H), 2,20 (s, 3H);
MS (ESI+): m/z = 517,2 [M+H]+. |
Exemplo 167: Preparação de N-(3-(2-(5-(4-metilpiperazin-1-il)piridin-2ilamino)tieno[3,2-d]pirimidin-4-iloxi)fenil)acrilamida n-i
ΤΤΝΗ
O nàn
[0359]Etapa 1) Preparação de N-(5-(4-metilpiperazin-1 -il)piridin-2-il)-4-(3nitrofenoxi)tieno[3,2-d]pirimidin-2-amina
[0360]0,6 g (1,94 mmol) do composto obtido na etapa 3 do Exemplo 1 e 0,75 g (3,88 mmol) de 5-(4-metilpiperazin-1-il)piridin-2-amina foram dissolvidos em 8 ml de 1,4-dioxano, e 178mg (0,2 mmol) de tris(dibenzilideneacetona)dipaládio(O) e 122 mg (0,2 mmol) de 2,2'-bis(difenilfosfino)-1,1 '-binafti foram adicionados a este, e agitados
71/111 por 5 minutos em temperatura ambiente. 1,27 g (3,88 mmol) de carbonato de césio foi adicionado a este, e agitado por 3 horas a 100°C. Na conclusão da reação, a mistura resultante foi resfriada até temperatura ambiente e filtrada por um leito pequeno de filtro Celite, e diluído com diclorometano e lavado com água. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob pressão reduzida. O resíduo resultante foi separado por cromatografia em coluna (diclorometano : metanol (20:1, v/v)) para obter 630 mg do composto título (rendimento: 70 %).
[0361]1 H-NMR (300MHz, DMSO-d6) δ 9,42 (s, 1H), 8,33 (m, 2H), 8,20 (m, 1H), 7,91 (m, 2H), 7,80 (m, 1H), 7,59 (m, 1H), 7,39 (m, 1H), 7,05 (m, 1H), 3,05 (m, 4H), 2,49 (m, 4H), 2,22 (s, 3H).
[0362]Etapa 2) Preparação de N-(3-(2-(5-(4-metilpiperazin-1 -il)piridin-2ilamino)tieno[3,2-d]pirimidin-4-iloxi)fenil)acrilamida [0363]O procedimento da etapa 5) e 6) do Exemplo 1 foram repetidos sequencialmente exceto para usar o composto obtido na etapa 1) (1,35 mmol), ao invés de N-(4-(4-metilpiperazin-1 -il)f eni l)-4-(3-n itrof enoxi)tieno[3,2-d]pi ri m idi n-2amina, para obter 50 mg do composto título (rendimento final: 34 %).
[0364]1 H-NMR (300MHz, DMSO-d6) δ 10,50 (s, 1H), 9,37 (s, 1H), 8,10 (d, 1H), 7,90 (d, 1H), 7,72 (m, 1H), 7,64 (m, 2H), 7,47 (dd, 1H), 7,37 (d, 1H), 7,09 (m, 2H), 6,42 (dd, 1H), 6,25 (dd, 1H), 5,77 (dd, 1H), 3,01 (m, 4H), 2,42 (m, 4H), 2,22 (s, 3H);
[0365]MS (ESI+): m/z = 488,3[M+H]+.
[0366]O procedimento do Exemplo 167 ou um procedimento semelhante foi repetido exceto para usar vários derivados de amina de Z-NH2(Z tem o mesmo significado como definido na presente invenção), ao invés de 5-(4-metilpiperazin-1il)piridin-2-amina na etapa 1) do Exemplo 167, para obter os compostos títulos de Exemplos 168 a 205 como mostrado nas Tabelas 5a a 5f.
<Tabela 5a>
|
Exemplo |
Estrutura |
Dados de análise |
72/111
|
168 |
ζ'νί <Ν'Π
TM NH
0 ΝΛΝ
s |
1H-NMR (300MHz, CDCI3) δ 7,94 (d, 1H), 7,91 (d, 1H), 7,85 (d, 1H), 7,63 (s, 1H), 7,60 (m, 1H), 7,55 (s, 1H), 7,43 (d, 1H), 7,41 (d, 1H), 7,31 (d, 1H), 7,10 (dd, 1H), 7,02 (dd, 1H), 6,45 (dd, 1H), 6,23 (m, 1H), 5,79 (dd, 1H), 3,14 (t, 4H), 2,62 (t, 4H), 2,48 (q, 2H), 1,14 (t, 3H);
MS (ESI+): m/z= 502,4 [M+H]+. |
|
169 |
Λ·~& |
1H-NMR (300MHz, DMSO-d6) δ 10,35(s, 1H), 9,62(s, 1H), 8,77(s, 1H), 8,30(d, 1H), 7,99(m, 1H), 7,71 (m, 1H), 7,54(m, 1H), 7,37(m, 2H), 7,06(m, 2H), 6,41 (m, 1H), 6,21 (dd, 1H), 5,74(dd, 1H), 3,45(m, 2H), 2,32(m, 8H), 2,12(s, 3H);
MS (ESI+): m/z= 502,2 [M+H]+. |
|
170 |
FÂh
0 r^i N^N
s |
1H-NMR (300MHz, DMSO-d6) δ 10,35 (brs, 1H), 9,71 (brs, 1H), 8,33-8,31 (m, 1H), 7,85-7,84 (m, 1H), 7,74 (s, 1H), 7,56-7,37 (m, 3H), 7,17-7,11 (t, 1H), 7,087,05 (m, 1H), 6,45-6,36 (m, 1H), 6,25-6,20 (m, 1H), 5,77-5,73 (m, 1H);
MS (ESI+): m/z = 441,3 [M+H]+. |
|
171 |
^NH
0 ΜΑ N'N
s |
1H-NMR (300MHz, DMSO-d6) δ 10,35 (s, 1H), 9,12 (s, 1H), 8,25 (d, 1H), 7,63 (m, 2H), 7,42 (m, 4H), 7,06 (m, 1H), 6,50 (m, 3H), 6,24 (m, 1H), 5,77 (m, 1H), 2,78 (s, 3H);
MS (ESI+): m/z = 432,3 [M+H]+. |
|
172 |
'N^l H ^ΝΊί^Ύ^ΐ] o |
1H-NMR (300MHz, DMSO-d6) δ 10,60 (s, 1H), 9,45 (s, 1H), 8,29 (s, 2H), 7,70 (m, 1H), 7,58 (m, 1H), 7,46 (m, 3H), 7,34 (m, 1H), 7,17 (m, 2H), 7,09 (m, 1H), 6,40 (dd, 1H), 6,26 (dd, 1H), 5,77 (dd, 1H), 3,42 (m, 4H), 2,29 (m, 4H), 2,17 (s, 3H);
MS (ESI+): m/z= 530,2 [M+H]+. |
|
173 |
'W„H |
1H-NMR (300MHz, DMSO-d6) δ 10,34 (s, 1H), 9,46 (s, 1H), 8,29(d, 1H), 7,72 (s, 1H), 7,60 (m, 1H), 7,48 (m, 3H), 7,35 (d, 1H), 7,07 (d, 1H), 6,99 (d, 2H), 6,40 (m, 1H), 6,23 (m, 1H), 5,75 (m, 1H), 3,22 (s, 2H), 2,06 (s, 6H);
MS (ESI+): m/z= 446,4 [M+H]+. |
|
174 |
>όνη θ Ι^ΪΙ νΑ
Η |
1H-NMR (300MHz, CDCI3) δ 7,87-7,83 (m, 2H), 7,48 (m, 1H), 7,42-7,37 (t, 1H), 7,33-7,30 (m, 2H), 7,207,17 (m, 2H), 7,10 (brs, 1H), 7,02-6,99 (m, 1H), 6,436,37 (m, 2H), 5,73-5,69 (m, 1H), 3,48 (s, 2H), 2,712,64 (m, 4H), 1,08-1,03 (t, 6H);
MS (ESI+): m/z = 473,96 [M+H]+. |
cTabela 5b>
|
Exemplo |
Estrutura |
Dados de análise |
73/111
|
175 |
|
1H-NMR (300MHz, CDCI3) δ 8,06 (s, 1H), 7,87 (d, 1H), 7,44 (s, 1H), 7,36 (m, 1H), 7,33 (m, 3H), 7,04 (m, 3H), 7,02 (s, 1H), 6,39 (d, 1H), 6,27 (dd, 1H), 5,72 (d, 1H), 3,48 (s, 2H), 3,18 (m, 4H), 2,03 (m, 2H);
MS (ESI+): m/z = 458,17 [M+H]+. |
|
176 |
|
1H-NMR (300MHz, CDCI3) δ 9,75 (brs, 1H), 8,37 (s, 1H), 7,87 (d, 2H), 7,46 (m, 2H), 7,37 (d, 1H), 7,21 (m, 3H), 6,96 (d, 1H), 6,63 (dd, 1H), 6,36 (dd, 1H), 5,67 (d, 1H), 3,85 (s, 2H), 3,02 (m, 4H), 2,17 (m, 4H);
MS (ESI+): m/z = 472,2 [M+H]+. |
|
177 |
xmNH
H S·^ |
1H-NMR (300MHz, CD3OD) δ 8,07 (d, 1H), 7,72 (S, 1H), 7,60 (d, 1H), 7,48-7,42 (m, 3H), 7,28 (d, 1H), 7,10-7,03 (m, 3H), 6,43-6,38 (m, 2H), 5,80-5,76 (m, 1H), 3,59-3,47 (m, 2H), 2,91-2,74 (m, 3H), 2,50-2,47 (m, 6H), 2,30-2,22 (m, 7H), 2,01-1,99 (m, 1H), 1,72-1,71 (m, 1H);
MS (ESI+): m/z= 515,22 [M+H]+. |
|
178 |
σ'X
0 A ΝλΝ
s |
1H-NMR (300MHz, CDCI3) δ 8,03 (s, 1H), 7,80 (d, 1H), 7,78-7,28 (m, 4H), 7,19 (s, 2H), 6,88 (d, 1H), 6,57 (dd, 1H), 6,27 (d, 1H), 5,59 (d, 1H), 3,78 (s, 2H), 2,75 (t, 4H), 1,82 (t, 4H), 1,53-1,51 (m, 2H);
MS (ESI+): m/z = 486,3 [M+H]+. |
|
179 |
ηοΟΎΧ
0 Ν^Ν
Η S-V |
1H-NMR (300MHz, DMSO-d6) δ 10,42 (brs, 1H), 9,61 (brs, 1H), 8,32 (d, 1H), 7,74-7,08 (m, 9H), 6,45-6,40 (d, 1H), 6,26 (dd, 1H), 5,77 (dd, 1H), 3,74-3,62 (m, 2H), 2,75-2,71 (m, 2H), 2,13-2,06 (m, 2H), 1,88-1,85 (m, 2H), 1,62-1,52 (m, 3H);
MS (ESI+): m/z= 502,18 [M+H]+. |
|
180 |
-ΝΟΧΐΝΗ
W
Η |
1H-NMR (300MHz, DMSO-d6) δ 10,33 (brs, 1H), 9,45 (brs, 1H), 8,28 (d, 1H), 7,71 (S, 1H), 7,60 (d, 1H), 7,50-7,42 (m, 3H), 7,34 (d, 1H), 7,08-7,05 (m, 1H), 6,98 (d, 2H), 6,466,37 (m, 1H), 6,27-6,21 (m, 1H), 5,75 (dd, 1H), 3,33-3,21 (m, 2H), 2,76-2,72 (m, 2H), 2,11 (s, 6H), 1,99-1,96 (m, 1H), 1,84-1,77 (m, 2H), 1,66-1,62 (m, 2H), 1,28-1,04 (m, 2H);
MS (ESI+): m/z= 529,23 [M+H]+. |
|
181 |
r/nx
°C0 r^i] hrljl |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, NH), 9,47 (s, NH), 8,32 (d, !H), 7,73 (s, 1H), 7,64 (d, 1H), 7,52 (m, 3H), 7,38 (d, !H), 7,11 (d, 1H), 7,02 (d, 1H), 6,43 (dd, 1H), 6,24 (d, 1H), 5,76 (d, 1H), 3,59 (s, 1H), 3,47 (m, 1H), 3,31 (m, 4H), 2,76 (m, 2H), 2,43 (m, 4H), 1,86 (m, 2H), 1,79 (m, 2H), 1,36 (m, 2H);
MS (ESI+): m/z = 571,2 [M+H]+. |
cTabela 5c>
|
Exemplo |
Estrutura |
Dados de análise |
74/111
|
182 |
.í?'Cnh
0 í^i i/n |
1H-NMR (300MHz, DMSO-d6) δ 7,97 (d, 1H), 7,55 (m, 1H), 7,45 (m, 1H), 7,30 (m, 3H), 7,25 (d, 1H), 6,95 (m, 3H), 6,29 (m, 2H), 6,02 (m, 1H), 3,41 (s, 2H), 2,55 (m, 8H), 2,36 (s, 3H);
MS (ESI+):m/z= 501,11 [M+H]+. |
|
183 |
JCCnh
0 i/n |
1H-NMR (300MHz, CD3OD) δ 8,08 (d, 1H), 8,02 (m, 1H), 7,61 (m, 1H), 7,46 (m, 3H), 7,27 (d, 1H), 7,08 (m, 3H), 6,46 (d, 1H), 6,39 (d, 1H), 5,78 (m, 1H), 3,47 (s, 2H), 2,56 (br, 8H), 2,46 (q, 2H), 1,13 (t, 3H);
MS (ESI+): m/z = 515,4 [M+H]+. |
|
184 |
^N.J A^nh 0 í^F) N^N |
1H-NMR (300MHz, CDCI3) δ 8,10 (s, 1H), 7,82 (d, 1H), 7,69 (s, 1H), 7,47 (m, 1H), 7,40 (s, 1H), 7,37 (d, 1H), 7,34 (d, 1H), 7,26 (d, 1H), 7,10 (m, 3H), 7,02 (d, 1H), 6,42 (m, 1H), 6,25 (m, 1H), 5,73 (m, 1H), 3,29 (q, 1H), 2,46 (m, 8H), 2,39 (q, 2H), 1,34 (d, 3H), 1,06 (t, 3H);
MS (ESI+): m/z = 529,3 [M+H]+. |
|
185 |
vro,,
0 A ΝΛΝ |
1H-NMR (300MHz, CDCI3) δ 7,85-7,83 (d, 1H), 7,50-7,22 (m, 6H), 7,14-7,11 (m, 2H), 7,06-7,01 (m, 2H), 6,46-6,41 (m, 2H), 6,30-6,21 (m, 1H), 5,78-5,75 (m, 1H), 3,46 (s, 2H), 2,51 (m, 6H), 2,28 (d, 2H), 1,76 (m, 2H), 0,88-0,83 (m, 1H), 0,53-0,47 (m, 2H), 0,12-0,07 (m, 2H);
MS (ESI+): m/z= 541,4 [M+H]+. |
|
186 |
qNj U.NH
A N^N XVp |
1H-NMR (300MHz, CDCI3) δ 7,84 (d, 1H), 7,61 (m, 2H), 7,49 (m, 1H),7,43 (d, 3H), 7,19 (d, 2H), 6,97 (s, 1H), 6,45 (d, 1H), 6,26 (d, 1H), 5,78 (d, 1H), 3,48 (d, 2H), 3,43 (s, 1H), 2,89 (d, 2H), 2,57 (m, 4H), 2,46 (m, 3H), 2,25 (s, 3H), 1,91 (t, 2H), 1,70 (m, 3H), 1,60 (s, 2H). |
|
187 |
<croNH o í^íl νΆ
n A^qAA
H S-U |
1H-NMR (300MHz, CDCI3) δ 7,82 (m, 2H), 7,62 (s, 1H), 7,48 (d, 1H), 7,38 (m, 2H), 7,13 (m, 3H), 7,04 (d, 1H), 6,42 (dd, 1H), 6,24 (m, 1H), 5,76 (dd, 1H), 3,68 (m, 4H), 3,47 (s, 2H), 2,40 (m, 4H); MS (ESI+): m/z = 488,17 [M+H]+. |
|
188 |
Hvo |
1H-NMR (300MHz, DMSO-d6) δ 10,40 (s, 1H),
9,42 (s, 1H), 8,29 (d, 1H), 7,74 (s, 1H), 7,58 (d, 1H), 7,47 (m, 4H), 7,04 (m, 2H), 6,44 (dd, 1H),
6,25 (d, 1H), 5,71 (d, 1H), 3,70 (s, 3H);
MS (ESI+): m/z= 447,64 [M+H]+. |
<Tabela 5d>
|
Exemplo |
Estrutura |
Dados de análise |
75/111
|
189 |
O
MeO-P^^h
MeÓ
o r^ii n4n
H S-y |
1 H-NMR (300MHz, DMSO-d6) δ 10,37 (brs, 1H), 9,49 (brs, 1H), 8,30 (d, 1H) 7,73 (s, 1H), 7,59-7,47 (m, 4H), 7,37 (d, 1H), 7,03-7,00 (m, 3H), 6,48-6,41 (m, 1H), 6,31-6,29 (m, 1H), 5,79-5,92 (m, 1H), 3,59 (s, 3H), 3,55 (s, 3H), 3,16 (s, 2H);
MS (ESl·): m/z =511,11 [M+H]+. |
|
190 |
“M |
1H-NMR (300MHz, DMSO-d6) δ 10,4 (s, 1H), 9,39 (s, 1H), 8,29 (d, 1H), 7,49 (d, 2H), 7,44 (m, 3H), 7,35 (d, 1H), 7,08 (dd, 1H), 6,95 (d, 2H), 6,42 (q, 1H), 6,24 (dd, 1H), 5,77 (dd, 1H), 3,51 (m, 2H), 2,60 (m, 2H);
MS (ESl·): m/z = 433 [M+H]+. |
|
191 |
|
1H-NMR (300MHz, CDCI3) δ 7,83 (d, 1H), 7,54 (s, 1H), 7,45 (s, 1H), 7,41 (d, 1H), 7,38 (m, 1H), 7,35 (m, 2H), 7,03 (m, 2H), 7,00 (s, 1H), 6,43 (d, 1H), 6,31 (t, 3H), 5,74 (dd, 1H), 2,53 (m, 2H), 2,48 (m, 2H), 2,30 (s, 6H);
MS (ESI+): m/z = 460 [M+H]+. |
|
192 |
MÓ 0
úánh 0 Π N^N |
1H-NMR (300MHz, CDCI3) δ 7,81 (d, 1H), 7,69 (s, 1H), 7,38-7,29 (m, 4H), 7,25-7,19 (m, 3H), 7,00 (d, 1H), 6,40 (d, 1H), 6,34 (dd, 1H), 5,72 (d, 1H), 3,66 (s, 2H), 3,42-3,40 (m, 2H), 2,40-2,38 (m, 4H), 1,581,55 (m, 4H), 1,01 (t, 3H); |
|
193 |
ThOÇ |
1H-NMR (300MHz, CDCI3) δ 9,01 (s, 1H), 7,97 (s, 1H), 7,86 (d, 2H), 7,71 (s, 1H), 7,46 (m, 2H), 7,28 (m, 1H), 7,00 (m, 1H), 6,95 (d, 1H), 6,78 (s, 1H), 6,43 (m, 2H), 5,69 (m, 1H), 3,90 (s, 2H), 3,84 (s, 3H), 2,94 (m, 4H), 1,15 (m, 6H);
MS (ESI+): m/z= 504,2 [M+H]+. |
|
194 |
o r^íi νλν
V^-MoAA H S-V |
1H-NMR (300MHz, CD3OD) δ 8,10 (d, 1H), 7,78 (s,
1H), 7,61-7,56 (m, 2H), 7,47-7,42 (m, 1H), 7,32 (d,
1H), 7,20-7,05 (m, 3H), 6,50-6,33 (m, 2H), 5,78 (d,
1H), 3,58 (s, 2H), 2,32 (s, 6H);
MS (ESI+): m/z= 464,15 [M+H]+. |
|
195 |
>-oAnh
JAÁ
H S-^ |
1H-NMR (300MHz, CD3OD) δ 8,10 (d, 1H), 7,787,77 (m, 1H), 7,59-7,42 (m, 3H), 7,32 (d, 1H), 7,157,04 (m, 3H), 6,43-6,38 (m, 2H), 5,78 (dd, 1H), 3,59-3,57 (m, 2H), 2,91-2,88 (m, 1H), 2,88-2,75 (m, 2H), 2,52-2,48 (m, 1H), 2,32-2,20 (m, 6H), 2,091,92 (m, 1H), 1,78-1,63 (m, 1H);
MS (ESI+): m/z= 533,21 [M+H]+. |
cTabela 5e>
|
Exemplo |
Estrutura |
Dados de análise |
76/111
|
196 |
H S-0 |
1H-NMR (300MHz, CD3OD) δ 8,16 (d, 1H), 7,82 (s, 1H), 7,50-7,44 (m, 3H), 7,33 (d, 1H), 7,19-7,05 (m, 3H), 6,51-6,34 (m, 2H), 5,80 (dd, 1H), 3,49-3,45 (m, 2H), 2,98-2,94 (m, 2H), 2,41-2,01 (m, 9H), 1,901,81 (m, 2H), 1,69-1,42 (m, 2H);
MS (ESI+): m/z = 547,22 [M+H]+. |
|
197 |
θ r^ii N |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, 1H), 9,71 (s, 1H), 8,33 (d, 1H), 7,76 (s, 1H), 7,50 (m, 4H), 7,29 (m, 1H), 7,07 (m, 2H), 6,43 (dd, 1H), 6,24 (dd, 1H), 5,76 (dd, 1H), 3,36 (s, 2H), 2,33 (m, 8H), 2,08 (s,3H);
MS (ESI+): m/z = 519,2 [M+H]+. |
|
198 |
'N^I F
H ^NH ο r^Ti νλν
H S-v |
1H-NMR (300MHz, CD3OD) δ 8,11 (d, 1H), 7,747,73 (m, 1H), 7,60-7,58 (m, 2H), 7,45 (t, 1H), 7,32 (d, 1H), 7,17-7,12 (m, 2H), 7,07-7,04 (m, 1H), 6,486,33 (m, 2H), 5,79-5,76 (m, 1H), 3,78-3,77 (m, 2H), 2,94-2,90 (m, 2H), 2,55-2,52 (m, 1H), 2,30 (s,3H), 2,15-1,89 (m, 4H), 1,53-1,49 (m, 2H);
MS (ESI+): m/z = 533,21 [M+H]+. |
|
199 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,35(s, 1H), 9,27(s, 1H), 8,27(m, 1H), 7,72(m, 1H), 7,57(m, 1H), 7,46(m, 1H), 7,35(m, 2H), 7,15(m, H), 7,06(m, 1H), 6,52(m, 2H), 6,43(m, 3H), 6,23(dd, 1H), 5,76(dd, 1H), 3,05(m, 2H), 2,44(m, 2H), 2,17(s, 3H);
MS (ESI+): m/z= 493,2 [M+H]+. |
|
200 |
1 F^^NH
^njOo<^ H |
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,51 (s, 1H), 8,29(d, 1H), 7,74(m, 1H), 7,46(m, 1H), 7,41 (m, 1H), 7,37(m, 1H), 7,23(m, 2H), 7,05(m, H), 6,43(m, 1H), 6,21 (dd, 1H), 5,75(dd, 1H), 4,30(m, 1H), 3,11(m, 2H), 2,33(t, 2H), 2,12(s, 6H);
MS (ESI+): m/z = 511,2 [M+H]+. |
|
201 |
'N*> i_i F
*-νΛΑι
OtHO0^ |
1H-NMR (300MHz, DMSO-d6) δ 10,39 (s, 1H), 9,70 (s, 1H), 8.,37 (d, 1H), 8,08 (s, 1H), 7,80 (d, 1H), 7,60 (m, 2H), 7,50 (m, 2H), 7,27 (m, 1H), 7,12 (m, 2H), 6,43 (m, 1H), 6,31 (m, 1H), 5,82 (m, 1H), 3,41 (m, 4H), 2,33 (m, 4H), 2,24 (s, 3H);
MS (ESI+): m/z = 548,2 [M+H]+. |
|
202 |
bO^»
'Ν~-Ο N^N |
1H-NMR (300MHz, CDCI3) δ 7,86 (d, 1H), 7,66 (m, 3H), 7,38 (m, 2H), 7,28 (d, 1H), 7,21 (m, 2H), 7,13 (s, 1H), 7,03 (m, 1H), 6,45 (m, 1H), 6,27 (m, 1H), 5,77 (m, 1H), 3,54 (s, 2H), 2,65 (m, 8H), 2,26 (s, 3H), 1,90 (m, 4H), 1,45 (m, 4H);
MS (ESI+): m/z = 618,2 [M+H]+. |
<Tabela 5f>
|
Exemplo |
Estrutura |
Dados de análise |
77/111
|
203 |
O Cl
-n-/ M-nh
0 νλν
s |
1H-NMR (300MHz, CD3OD) δ 8,07 (d, 1H), 7,83 (s, 1H), 7,77 (s, 1H), 7,53 (d, 1H), 7,42 (d, 2H), 7,29 (d, 1H), 7,03 (d, 1H), 6,41 (s, 1H), 6,38 (d, 1H), 5,77 (dd, 1H), 3,76-3,74 (m, 2H), 3,26-3,24 (m, 2H), 2,48 (dd, 2H), 2,44 (d, 2H), 2,37 (m, 1H), 1,09 (t, 3H);
MS (ESI+): m/z= 563,4 [M+H]+. |
|
204 |
«ACVÍg H S-^ |
1H-NMR (300MHz, DMSO-d6) δ 10,33(s, 1H), 9,22(s, 1H), 8,24(m, 1H), 7,75(m, 1H), 7,57(m, 1H), 7,42(m, 1H), 7,30(m, 2H), 7,14(m, H), 7,06(m, 1H), 6,52(m, 2H), 6,43(m, 3H), 6,23(dd, 1H), 5,76(dd, 1H), 3,05(m, 2H), 2,44(m, 2H), 2,17(s, 3H);
MS (ESI+): m/z= 509,1 [M+H]+. |
|
205 |
|
1H-NMR (300MHz, CDCI3) δ 7,97 (s, 1H), 7,86 (d, 1H), 7,83 (d, 1H), 7,73 (s, 1H), 7,48 (d, 1H), 7,41 (t, 1H), 7,28 (d, 1H), 7,06 (m, 2H), 6,99 (d, 1H), 6,81 (s, 1H), 6,46 (dd, 1H), 6,30 (dd, 1H), 5,79 (dd, 1H), 3,38 (s, 2H), 2,28 (s, 3H), 2,26 (s, 6H);
MS (ESI+): m/z= 459,94 [M+H]+. |
[0367]Exemplo 206: Preparação de /V-(3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-c/]pirimidin-4-ilamino)fenil)acrilamida
[0368]O procedimento do Exemplo 1 foi repetido exceto para usar 3nitrobenzenoamina (0,05 mmol), ao invés de 3-nitrofenol na etapa 3) do Exemplo 1, para obter 5 mg do composto título (rendimento final: 55 %).
[0369] 1 H-NMR (300MHz, CDCI3) δ 8,10 (m, 1H), 7,90 (d, 1H), 7,51 (m, 3H), 7,42 (m, 1H), 7,28 (t, 1H), 7,10 (d, 1H), 6,89 (d, 2H), 6,39 (m, 2H), 5,79 (d, 1H), 3,29 (m, 4H), 2,68 (m, 4H), 2. 38 (s, 3H);
[0370]MS (ESI+): m/z = 486,2 [M+H]+.
[0371 ]O procedimento do Exemplo 206 ou um procedimento semelhante foi repetido exceto para usar vários derivados de amina de Z-NH2(Z tem o mesmo significado como definido na presente invenção), ao invés de 5-(4-metilpiperazin-1
78/111 il)piridin-2-amina in Exemplo 1, para obter os compostos títulos de Exemplos 207 to
217 como mostrado nas Tabelas 6a e 6b. <Tabela 6a>
|
Exemplo |
Estrutura |
Dados de análise |
|
207 |
|
1H-NMR (300MHz, DMSO-d6) δ 8,14 (s, NH), 7,80 (d,
1H), 7,68 (d, 1H), 7,59 (s, NH), 7,42 (m, 2H), 7,32 (m,
2H), 7,00 (m, 2H), 6,49 (d, 1H), 6,31 (m, 1H), 5,77 (d,
1H), 3,00 (d, 2H), 2,75 (m, 1H), 2,34 (s, 3H), 2,08 (m,
2H), 1,75 (m, 4H);
MS (ESI+): m/z = 500,2 [M+H]+. |
|
208 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,12 (s, NH), 9,59 (s, NH), 8,80 (s, NH), 8,01 (m, 2H), 7,59 (m 3H), 7,41 (d, 1H), 7,31 (t, 1H), 7,19 (d, 1H) 6,80 (d, 2H), 6,48 (m, 1H), 6,25 (d, 1H), 5,78 (d, 1H), 3,01 (br, 4H), 2,71 (m, 1H), 2,61 (br, 4H), 1,01 (d, 6H);
MS (ESI+): m/z = 514,2 [M+H]+. |
|
209 |
'°O |
1H-NMR (300MHz, DMSO-d6) δ 10,20 (s, 1H), 9,53 (s, 1H), 9,00 (s, 1H), 8,07 (m, 2H), 7,67 (d, 2H), 7,50 (m, 2H), 7,29 (dd, 1H), 7,18 (d, 1H), 7,02 (d, 2H), 6,46 (dd, 1H), 6,25 (dd, 1H), 5,74 (dd, 1H), 2,88 (m, 2H), 2,35 (m, 1H), 2,22 (s, 3H), 2,01 (m, 2H), 1,62 (m, 4H);
MS (ESI+): m/z = 485,2 [M+H]+. |
|
210 |
|
1H-NMR (300MHz, CDCI3) δ 8,09 (s, 1H), 7,66-7,65 (d, 1H), 7,59-7,56 (m, 2H), 7,51 (brs, 1H), 7,40-7,31 (m, 3H), 7,23-7,21 (d, 1H), 7,17-7,14 (m, 2H), 7,09 (s, 1H), 6,75 (s, 1H), 6,50-6,44 (m, 1H), 5,81-5,77 (m, 1H), 6,30 (m, 1 H), 2,97-2,80 (m, 1 H), 2,32 (s, 3H), 1,97-1,75 (m, 6H); MS (ESI+): m/z = 485,2 [M+H]+. |
|
211 |
O r^h N^N |
1H-NMR (300MHz, DMSO-d6) δ 10,13 (s, 1H), 9,49 (s, 1H), 8,84 (s, 1H), 8,04 (m, 2H), 7,62 (m, 2H), 7,53 (m, 1H), 7,40 (m, 1H), 7,28 (m, 1H), 7,16 (m, 1H), 6,75 (m 2H), 6,44 (m, 1H), 6,24 (m, 1H), 5,74 (m, 1H), 3,95 (t, 2H), 2,57 (t, 2H), 2,19 (s, 6H);
MS (ESI+): m/z = 475,2 [M+H]+. |
|
212 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,20 (s, 1H), 9,50 (s, 1H), 8,87 (s, 1H), 8,05 (m, 2H), 7,63 (m, 2H), 7,55 (m, 1H), 7,42 (m, 1H), 7,31 (m, 1H), 7,17 (m, 1H), 6,76 (m 2H), 6,47 (m, 1H), 6,25 (m, 1H), 5,75 (m, 1H), 3,91 (t, 2H), 2,34 (t, 2H), 2,14 (s, 6H), 1,80 (m, 2H);
MS (ESI+): m/z = 489,2 [M+H]+. |
|
213 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,14 (s, 1H), 9,54 (s, 1H), 8,99 (s, 1H), 8,06-8,03 (m, 2H), 7,69-7,67 (m, 2H), 7,56-7,54 (m, 1H), 7,45-7,42 (m, 1H), 7,32-7,27 (m, 1H), 7,19-7,18 (d, 1H), 7,05-7,02 (m, 2H), 6,47-6,41 (m, 1H), 6,29-6,22 (m, 1H), 5,77-5,73 (m, 1H), 2,67 (m, 4H), 2,38 (s, 6H); |
79/111
| |
|
MS (ESI+): m/z = 459,1 [M+H]+. |
<Tabela 6b>
|
Exemplo |
Estrutura |
Dados de análise |
|
214 |
|
1H-NMR (300MHz, CDCI3) δ 8,13 (s, 1H), 7,68-7,66 (d, 1H), 7,59-7,56 (m, 2H), 7,42-7,32 (4H), 7,24-7,22 (d, 1H), 7,16-7,13 (m, 2H), 7,05 (s, 1H), 6,96 (s, 1H), 6,506,44 (m, 1H), 6,22 (m, 1H), 5,82-5,78 (m, 1H), 2,81 -2,52 (m, 12H), 2,32 (s, 3H);
MS (ESI+): m/z = 514,2 [M+H]+. |
|
215 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,06 (s, NH), 9,50 (s,
NH), 9,02 (s, NH), 8,00 (d, 1H), 7,96 (s, 1H), 7,63 (d,
1H), 7,46 (d, 1H), 7,37 (m, 2H), 7,25 (t, 1H), 7,12 (d,
1H), 6,81 (t, 1H), 6,41 (m, 1H), 6,19 (d, 1H), 5,64 (d,
1H), 2,91 (m, 4H), 2,41 (m, 4H), 2,13 (s, 3H);
MS (ESI+): m/z = 504,2 [M+H]+. |
|
216 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,12 (s. NH), 9,60 (s, NH), 9,21 (s, NH), 8,08 (d, 1H), 8,01 (s, 1H), 7,77 (d,
1H), 7,53 (d, 1H), 7,41 (m, 2H), 7,34 (t, 1H), 7,21 (d,
1H), 7,07 (t, 1H), 6,45 (m, 1H), 6,26 (d, 1H), 5,72 (d,
1H), 2,85 (m, 2H), 2,60 (m, 1H), 1,90 (m, 2H), 1,64 (m,
4H);
MS (ESI+): m/z = 503,2 [M+H]+. |
|
217 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,23 (s, NH), 9,49 (s, NH), 8,84 (s, NH), 8,02 (d, 1H), 7,57 (m, 2H), 7,41 (d,
1H), 7,29 (m, 2H), 7,18 (d, 1H), 6,65 (t, 1H), 6,48 (m,
1H), 6,43 (m, 1H), 5,75 (d, 1H), 4,50 (d, 1H), 3,11 (m,
1H), 2,70 (m, 2H), 2,16 (s, 3H), 2,01 (m, 2H), 1,80 (m,
2H), 1,40 (m,2H);
MS (ESI+): m/z = 518,2 [M+H]+. |
[0372]Exemplo 218: Preparação de A/-(4-fluor-3-(2-(4-(4-metil-piperazin-1-il)fenilamino)-tieno[3,2-d]pirimidin-4-ilamino)-fenil)-acrilamida
[0373]Etapa 1) Preparação de N-(4-fluor-3-nitro-fenil)-acrilamida
80/111
[0374]2 g (12,81 mmol) de 4-fluor-3-nitroanilina e 3,2 g (38,43 mmol) de bicarbonato de sódio foram diluídos em 20 mL de tetrahidrofurano e 5 mL de água destilada, e 1,14 mL (14,09 mmol) de cloreto de acriloil foi lentamente adicionado a este a 0 °C, e agitado por 1 hora. Na conclusão da reação, a mistura resultante foi diluída com etilacetato e lavado com uma solução aquosa saturada de bicarbonato de sódio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob uma pressão reduzida para obter 2 g do composto título (rendimento: 74 %).
[0375]1H-NMR (300MHz, DMSO-d6) δ 10,58 (s, 1H), 8,58 (m, 1H), 7,91(m, 1H), 7,54 (t, 1H), 6,35 (m, 2H), 5,81(m, 1H);
[0376]Etapa 2) Preparação de N-(3-amino-4-fluor-fenil)-acrilamida
[0377]2,65 g (47,59 mmol) de ferro e 0,31 mL (3,80 mmol) de 12 N ácido clorídrico aquoso foram diluídos em 40 mL de 50 % etanol aquoso e agitado por 1 hora a 100°C. 2,00 g (9,51 mmol) do composto obtido na etapa 1 foi adicionado a este, e agitado por 1 hora a 100°C. Na conclusão da reação, a mistura resultante foi filtrada em um leito pequeno de filtro Celite para remover o ferro, e destilado sob pressão reduzida. O resíduo resultante foi diluído com diclorometano e lavado com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob pressão reduzida. O resíduo resultante foi separado por cromatografia em coluna (n-hexano : etilacetato (1:1, v/v)) para obter 1,5 g do composto título (rendimento: 75 %).
[0378]1 H-NMR (300MHz, DMSO-d6) δ 9,87 (s, 1H), 7,17 (m, 1H), 6,89 (t, 1H), 6,75 (m, 1H), 6,39 (m, 1H), 6,20 (m, 1H), 5,70 (m, 1H), 5,16 (s, 2H);
81/111 [0379]Etapa 3) Preparação de N-(3-(2-cloro-tieno[3,2-d]pirimidin-4-ilamino)-4-fluorfenil)-acrilamida [0380]O composto obtido na etapa 2) do Exemplo 1 e 461 mg (2,22 mmol) do composto obtido na etapa 2) foram dissolvidos em 5 ml de 1-propanol, e 0,6 mL (3,33 mmol) de diisopropiletilamina foi adicionado a este, e agitado por 24 horas a 110°C. Na conclusão da reação, a mistura resultante foi resfriada até 0°C para formar sólido, e filtrado sob uma pressão reduzida enquanto lavado com propanol. O sólido resultante foi seco em pressão reduzida para obter 270 mg do composto título (rendimento: 36 %).
[0381]1H-NMR (300MHz, DMSO-d6) δ 10,31 (s, 1H), 10,22(s, 1H), 8,25 (d, 1H), 7,86 (m, 1H), 7,59 (m, 1H), 7,40 (d, 1H), 7,32 (t, 1H), 6,42 (m, 1H), 6,29 (m, 1H), 5,76 (m, 1H);
[0382]Etapa 4) Preparação de N-(4-fluor-3-(2-(4-(4-metil-piperazin-1-il)-fenilamino)tieno[3,2-d]pirimidin-4-ilamino)-fenil)-acrilamida [0383]100 mg (0,30 mmol) do composto obtido na etapa 3) foi dissolvido em 3 ml de 2-butanol, e 55 mg (0,28 mmol) de 4-(4-metilpiperazin-1-il)benzenoamina e 42 μ£ (0,57 mmol) de ácido trifluoracético foram adicionados a este, e agitado por 5 horas a 100°C. Na conclusão da reação, a mistura resultante foi diluída com etilacetato e lavada com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob pressão reduzida. O resíduo resultante foi separado por cromatografia em coluna (diclorometano : metanol (10:1, v/v)) para obter 77 mg do composto título (rendimento: 50 %).
[0384]1H-NMR (300MHz, DMSO-d6) δ 10,26 (s, 1H), 9,38 (s, 1H), 8,77 (s, 1H), 8,02 (d, 1H), 7,82 (d, 1H), 7,62 (m, 1H), 7,44 (d, 2H), 7,30 (t, 1H), 7,15 (d, 1H), 6,68
82/111 (m, 2H), 6,40 (m, 1H), 6,22 (m, 1H), 5,73 (m, 1H), 2,96 (m, 4H), 2,42 (m, 4H), 2,20 (s,
3H);
[0385]MS (ESI+): m/z = 504,1 [M+H]+.
[0386]Exemplo 219: Preparação de N-(4-fluor-3-(2-(3-fluor-4-(4-metil-piperazin-1il)-fenilamino)-tieno[3,2-d]pirimidin-4-ilamino)-fenil)-acrilamida [0387]Um procedimento semelhante como o procedimento da etapa 4) do Exemplo 218 foi conduzido para usar 3-fluor-4-(4-metilpiperazin-1-il)anilina (0,03 mmol), ao invés de 4-(4-metilpiperazin-1-il)benzenoamina na Etapa 4) do Exemplo 218, para obter 8 mg do composto título (rendimento final: 50%).
[0388]1H-NMR (300MHz, DMSO-d6) δ 10,25 (s, 1H), 9,50 (s, 1H), 9,08 (s, 1H), 8,07 (d, 1H), 7,85 (d, 1H), 7,59 (m, 2H), 7,26 (m, 2H), 7,19 (d, 1H), 6,78 (t, 1H), 6,38 (m, 1H), 6,27 (m, 1H), 5,75 (m, 1H), 2,87 (m, 4H), 2,25 (m, 4H), 2,21 (s, 3H);
[0389]MS (ESI+): m/z = 522,2 [M+H]+.
[0390]Exemplo 220: Preparação de N-(3-(2-(4-dimetilaminometil-fenilamino)tieno[3,2-d]pirimidin-4-ilamino)-fenil)-acrilamida [0391]Um procedimento semelhante ao procedimento da Etapa 4) do Exemplo 218 foi conduzido para usar 0,67 g (1,94 mmol) of N-(3-(2-cloro-tieno[3,2-d]pirimidin-4ilamino)fenil)acrilamida obtido na etapa 1) a 3) do Exemplo 218 e 0,29 g (1,94 mmol) de 4-((dimetilamino)metil)anilina para obter 0,69 g dos compostos títulos (rendimento: 80 %).
[0392]1H-NMR (300MHz, CDCl3) δ 8,11 (d, 2H), 7,63 (dd, 3H), 7,55 (m, 4H), 7,18
83/111 (m, 2H), 7,05 (s, 1H), 6,45 (d, 1H), 6,30 (q, 1H), 5,74 (d, 1H), 3,38 (s, 2H), 2,01 (s, 6H);
[0393JMS (ESI+): m/z = 467,1 [M+H]+.
[0394]Um procedimento semelhante ao procedimento do Exemplo 220 foi conduzido para usar 4-(piperidin-1 -il)metilfenilamina e 2-metoxi-4-(piperidin-1il)metilfenilamina para obter os compostos títulos de Exemplos 221 e 222 como mostrado na Tabela 7.
cTabela 7>
|
Exemplo |
Estrutura |
Dados de análise |
|
221 |
cm,H |
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, NH), 8,32 (d, 1H), 8,30 (m, 2H), 7,61 (d, 1H), 7,36 (d, 1H), 7,09 (d, 1H), 6,88 (s, NH), 6,61 (d, 1H), 6,42 (dd, 1H), 6,23 (d, 1H), 5,75 (d, 1H), 3,79 (s, 3H), 3,33 (s, 2H), 2,28 (br, 4H), 1,48 (br, 4H), 1,24 (br, 2H); MS (ESI+): m/z = 485,2 [M+H]+. |
|
222 |
|
1H-NMR (300MHz, DMSO-d6) δ 10,36 (s, NH), 8,32 (d, 1H), 8,30 (m, 2H), 7,61 (d, 1H), 7,48 (t, 1H), 7,36 (d, 1H), 7,09 (d, 1H), 6,88 (s, NH), 6,61 (d, 1H), 6,42 (dd, 1H), 6,23 (d, 1H), 5,75 (d, 1H), 3,79 (s, 3H), 3,33 (s, 2H), 2,28 (br, 4H), 1,48 (br, 4H), 1,24 (br, 2H);
MS (ESI+): m/z = 516,1 [M+H]+. |
[0395]Exemplo 223: Preparação de N-(3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-d]pirimidin-4-iltio)fenil)acrilamida
N ] <-N
[0396]Etapa 1) Preparação de tert-butil 3-(2-clorotieno[3,2-d]pirimidin-4iltio)fenilcarbamato
[0397]1,1 g (5,32 mmol) do composto obtido na etapa 2) do Exemplo 1 foi
84/111 dissolvido em 30 ml de N,N-dimetilsulfonamida, e 1,2 g (5,32 mmol) de tert-butil-3mercaptofenilcarbamato e 3,4 g (10,6 mmol) de carbonato de césio foram adicionados a este, e agitado por 1 hora em temperatura ambiente. Na conclusão da reação, a água destilada foi adicionada à mistura resultante para formar um sólido, e a mistura resultante foi filtrada sob uma pressão reduzida enquanto lavando com água destilada. O sólido resultante foi seco em pressão reduzida para obter 1,5 g do composto título (rendimento: 70 %).
[0398]1H-NMR (300MHz, CDCl3) δ 7,92 (d, 1H), 7,77 (s, 1H), 7,56 (d, 1H), 7,457,36 (m, 3H), 1,54 (s, 9H).
[0399]Etapa 2) Preparação de tert-butil 3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-d]pirimidin-4-iltio)fenilcarbamato
[0400]1,5 g (3,72 mmol) do composto obtido na etapa 1) foi dissolvido em 30 ml de 2-butanol, e 0,8 g (3,72 mmol) de 4-(4-metilpiperazin-1-il)benzenoamina e 0,4 mL (3,72 mmol) de ácido trifluoracético foram adicionados a este. A mistura foi agitada por 10 horas a 100°C, na conclusão da reação, diluída com diclorometano e lavada com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi seca em Na2SO4 anidro, e filtrado e destilado sob pressão reduzida. O resíduo foi separado por cromatografia em coluna (diclorometano : metanol (20:1, v/v)) para obter 1,0 g do composto título (rendimento: 46 %).
[0401]1H-NMR (300MHz, CDCl3) δ 7,73 (d, 1H), 7,63 (m, 1H), 7,60 (m, 1H), 7,397,30 (m, 2H), 7,28-7,21(m, 2H), 7,15 (d, 1H), 6,76 (d, 2H), 3,25 (m, 4H), 2,58 (m, 4H), 2,33 (s, 3H), 1,54 (s, 9H).
[0402]Etapa 3) Preparação de 4-(3-aminofeniltio)-N-(4-(4-metilpiperazin-1
85/111 il)fenil)tieno[3,2-d]pirimidin-2-amina
[0403]1,0 g (1,82 mmol) do composto obtido na etapa 2) foi dissolvido em 20 ml de diclorometano, e 10 mL de ácido trifluoracético foi adicionado a este, e agitado por 2 horas em temperatura ambiente. Na conclusão da reação, a mistura resultante foi destilada sob uma pressão reduzida para remover solvente, e o resíduo resultante foi basificado (pH=8) com uma solução saturada aquosa de bicarbonato de sódio, e extraído com clorofórmio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob uma pressão reduzida e seca para obter 603 mg do composto título (rendimento: 75 %).
[0404]1H-NMR (300MHz, CD3OD) δ 7,96 (d, 1H), 7,33 (d, 2H), 7,21 (t, 1H), 7,17 (d, 1H), 7,02 (m, 1H), 6,94 (m, 2H) 6,80 (d, 2H), 3,14 (m, 4H), 2,65 (m, 4H).
[0405]Etapa 4) Preparação de N-(3-(2-(4-(4-metilpiperazin-1-il)fenilamino)tieno[3,2d]pirimidin-4-iltio)fenil)acrilamida [0406]Um procedimento semelhante como o procedimento da etapa 6) do Exemplo 1 foi conduzido para usar o composto obtido na etapa 3), ao invés do composto obtido na etapa 5), para obter 452 mg do composto título (rendimento: 67%).
[0407]1H-NMR (300MHz, CDCl3) δ 7,78 (m, 1H), 7,75 (d, 1H), 7,46-7,41 (m, 3H), 7,20 (d, 2H), 7,18 (d, 1H), 6,77 (d, 2H), 6,41 (d, 1H), 6,21 (dd, 1H), 5,78 (d, 1H), 3,12 (m, 4H), 2,60 (m, 4H), 2,36 (s, 3H);
[0408]MS (ESI+): m/z = 503,7 [M+H]+.
[0409]O procedimento do Exemplo 223 ou um procedimento semelhante foi repetido exceto para usar 3-fluor-4-morfolin-4-ilfenilamina e 3-fluor-4-(1-metilpiperidin-4-il)fenilamina, ao invés de 54-(4-metilpiperazin-1-il)fenilamina na etapa 2)
86/111 do Exemplo 223, para obter os compostos títulos de Exemplos 224 e 225 como mostrado na Tabela 8.
cTabela 8>
|
Exemplo |
Estrutura |
Dados de análise |
|
224 |
^NH |
1H-NMR (300MHz, DMSO-d6) δ 10,37 (s, 1H), 9,57 (s, 1H), 8,24 (d, 1H), 8,01 (s, 1H), 7,98 (m, 1H), 7,50 (t, 1H), 7,41 (m, 1H), 7,31 (m, 2H), 7,15 (m, 1H), 6,73 (m, 1H), 6,42 (m, 1H), 6,27 (m, 1H), 5,74 (m, 1H), 3,70 (m, 4H), 2,85 (m, 4);
MS (ESI+): m/z= 508,1 [M+H]+. |
|
225 |
^NH |
1H-NMR (300MHz, DMSO-d6) δ 8,60 (s, 1H), 8,53 (d, 1H), 8,36 (d, 1H), 8,00 (d, 1H), 7,62 (t, 1H), 7,46 (d, 2H), 7,32 (d, 1H), 6,93 (d, 2H), 3,83 (d, 2H), 3,48 (d, 2H), 3,12 (m, 4H), 2,83 (s, 3H);
MS (ESI+): m/z = 520,2 [M+H]+. |
[041 OJExemplo 226: Preparação de (E)-4-(dimetilamino)-N-(3-(2-(4-(4metilpiperazin-1-il)fenilamino)tieno[3,2-d]pirimidin-4-iltio)fenil)but-2-enamida
N-i '—-N
NH
I O νλν
[0411 ]40 mg (0,09 mmol) do composto obtido na etapa 2 do Exemplo 223 foi dissolvido em 1,5 mL de piridina, e 22 mg (0,14 mmol) de cloridrato de ácido (E)-4(dimetilamino)-2-butenoico e 35 mg (0,18 mmol) de cloridrato N-(3dimetilaminopropil)-N'-etilcarbodiimida foram adicionados a este, e agitado por 30 minutos a 80QC. Na conclusão da reação, a mistura resultante foi diluída com solvente misturado de clorofórmio : 2-propanol (3 : 1(v/v)) e lavado com salina saturada. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob pressão reduzida. O resíduo resultante foi separado por cromatografia em coluna (diclorometano : metanol = 6:1 (v/v)) para obter 2 mg do composto título (rendimento: 4 %).
87/111 [0412] 1 H-NMR (300MHz, CDCI3) δ 8,10 (m, 1 H), 8,02 (d, 1 H), 7,93 (s, 1H), 7,50 (t,
H), 7,42 (m, 1 H), 7,21 (m, 3H), 6,90 (m, 1 H), 6,74 (d, 2H), 6,28 (d, 1 H), 3,20 (d, 2H), 3,10 (t, 4H), 2,66 (t, 4H), 2,39 (s, 3H), 2,17 (s, 6H);
[0413]MS (ESI+): m/z = 560,2 [M+H]+.
[0414]Exemplo 227: Preparação de N-(3-(2-(4-(4-metilpiperazin-1il)fenilamino)tieno[3,2-d]pirimidin-4-ilsulfinil)fenil)acrilamida
[0415]11 mg (0,02 mmol) do composto obtido no Exemplo 223 foi dissolvido em 1,0 mL de diclorometano, e 20 mg (0,04 mmol) de ácido m-cloroperoxibenzoico foi adicionado a este, e agitado por 60 minutos em temperatura ambiente. Na conclusão da reação, a mistura resultante foi diluída com clorofórmio e lavada com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob pressão reduzida. O resíduo resultante foi separado por cromatografia em coluna (diclorometano : metanol = 6:1 (v/v)) para obter 3,0 mg do composto título (rendimento: 25 %).
[0416]1 H-NMR (300MHz, CD3OD) δ 8,08 (m, 1H), 8,01 (d, 1 H), 7,92 (m, 1H), 7,51 (t, 1H), 7,46 (m, 1 H), 7,22 (m, 3H), 6,73 (d, 1H), 6,38 (m, 2H), 5,76 (dd, 1 H), 3,633,56 (m, 4H), 3,42-3,34 (m, 4H), 3,23 (s, 3H);
[0417]MS (ESI+): m/z = 519,3 [M+H]+.
[0418]Exemplo 228: Preparação de N-(3-((2-((4-(4-metilpiperazin-1il)fenil)amino)furo[3,2-d]pirimidin-4-il)oxi)fenil)acrilamida
88/111
[0419]Etapa 1) Preparação de 2-cloro-4-(3-nitrofenoxi)-furo[3,2-d]pirimidina
[0420]6,4 g (33,9 mmol) of 2,4-diclorofuro[3,2-d]pirimidina (ver: Número de publicação internacional WO 2008073785 e WO 2008152394) foi dissolvido em 32 mL de metanol, e 5,7 g (40,6 mmol) de 3-nitrofenol e 12 mL (67,7 mmol) de diisopropiletilamina foram adicionados a este, e agitado por 24 horas em temperatura ambiente. Na conclusão da reação, o sólido resultante foi filtrado e seco em sob uma pressão reduzida para obter 6,3 g do composto título (rendimento: 64 %).
[0421]1 H-NMR (300MHz, DMSO-d6) δ 8,61 (s, 1H), 8,33 (s, 1H), 8,21 (d, 1H), 7,90 (d, 1H), 7,79 (m, 1H), 7,27 (s, 1H);
[0422]Etapa 2) Preparação de N-[4-(4-metil-piperazin-1-il)-fenil]-4-(3-nitrofenoxi)furo[3,2-d]pirimidin-2-amina
[0423]2,5 g (8,6 mmol) do composto obtido na etapa 1) foi dissolvido em 50 ml de 2-butanol, e 2,0 g (10,3 mmol) de 4-(4-metil-piperazin-1 -il)anilina e 1,5 mL (8,6 mmol) de ácido trifluoracético foram adicionados a este. A mistura de reação foi agitada por 12 horas a 100°C, na conclusão da reação, diluída com diclorometano e lavada com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi
89/111 separada, seca em Na2SO4 anidro, e filtrada e destilada sob uma pressão reduzida e seca. O resíduo resultante foi separado por cromatografia em coluna (diclorometano : metanol = 20 : 1 (v/v)) para obter 2,0 g do composto título (rendimento: 53 %).
[0424]1H-NMR (300MHz, CDCl3) δ 8,20 (s, 2H), 7,85 (s, 1H), 7,64 (s, 2H), 7,30 (s, 1H), 6,79 (m, 4H), 3,14 (m, 4H), 2,60 (m, 4H), 2,37 (s, 3H);
[0425]Etapa 3) Preparação de 4-(3-aminofenoxi)-N-[4-(4-metil-piperazin-1-il)-fenil]furo[3,2-d]pirimidin-2-amina
[0426]1,3 g (22,4 mmol) de ferro e 2 mL de 12 N ácido clorídrico aquoso foram diluídos em 10 mL de 50 % etanol aquoso e agitado por 10 minutos a 100°C. 2,0 g (4,5 mmol) do composto obtido na etapa 2) foi dissolvido em 10 ml de 50 % etanol aquoso, adicionado ao frasco onde o ferro foi ativado, e agitado por 1 hora a 100°C. Na conclusão da reação, a mistura resultante foi filtrada em um leito pequeno de filtro Celite para remover o ferro, e destilada sob pressão reduzida. O resíduo resultante foi diluído com diclorometano e lavado com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob uma pressão reduzida para obter 1,8 g do composto título (rendimento: 97 %).
[0427]1H-NMR (300MHz, CDCl3) δ 7,79 (s, 1H), 7,32 (d, 2H), 7,24 (m, 1H), 6,84 (m, 2H), 6,75 (s, 1H), 6,65 (m, 3H), 3,22 (m, 4H), 2,60 (m, 4H), 2,36 (s, 3H);
[0428]Etapa 4) Preparação de N-(3-{2-[4-(4-metil-piperazin-1-il)-fenilamino]furo[3,2-d]pirimidin-4-iloxi}-fenil)-acrilamida [0429]1,8 g (4,3 mmol) do composto obtido na etapa 3) e 1,1 g (23,0 mmol) de
90/111 bicarbonato de sódio foram diluídos com 20 ml de tetrahidrofurano e 5 mL de água destilada, e 0,4 mL (4,3 mmol) de cloreto de acriloil foi lentamente adicionado a este a 0QC, e agitado por 30 minutos. Na conclusão da reação, a mistura resultante foi diluída com diclorometano e lavada com uma solução saturada aquosa de bicarbonato de sódio. A camada orgânica foi separada, seca em Na2SO4 anidro, e filtrada e destilada sob uma pressão reduzida e seca. O resíduo resultante foi separado por cromatografia em coluna (clorofórmio : metanol = 20 : 1 (v/v)) para obter 940 mg do composto desejado (rendimento: 46 %).
[0430)1 H-NMR (300MHz, CD3OD) δ 8,04 (s, 1H), 7,68 (d, 2H), 7,45 (t, 1H), 7,32 (d, 2H), 7,03 (d, 1H), 6,78 (m, 3H), 6,45 (m, 2H), 5,80 (d, 1H), 3,08 (m, 4H), 2,61 (m, 4H), 2,35 (s, 3H);
[0431JMS (ESI+): m/z = 470,2 [M+H]+.
[0432)0 procedimento do Exemplo 228 ou um procedimento semelhante foi repetido exceto para usar vários derivados de amina de Z-NH2(Z tem o mesmo significado como definido na presente invenção), ao invés de 4-(4-metilpiperazin-1il)benzenoamina na etapa 2) do Exemplo 228, para obter os compostos títulos de Exemplos 229 a 237 como mostrado nas Tabelas 9a e 9b.
cTabela 9a>
|
Exemplo |
Estrutura |
Dados de análise |
|
229 |
O N^N
H O-» |
1H-NMR (300MHz, CD3OD) δ 8,04 (s, 1H), 7,67 (d, 2H), 7,45 (t, 1H), 7,31 (d, 2H), 7,04 (d, 1H), 6,78 (m, 3H), 6,40 (m, 2H), 5,79 (d, 1H), 3,23 (m, 4H), 2,76 (m, 5H), 1,15 (d, 6H);
MS (ESI+): m/z = 498,2 [M+H]+. |
|
230 |
o®
O N^N
N
H O^f |
1H-NMR (300MHz, CD3OD) δ 8,03 (s, 1H), 7,73 (s, 2H), 7,45 (m, 1H), 7,31 (d, 2H), 7,04 (m, 1H), 6,82 (s, 3H), 6,49 (m, 2H), 5,80 (d, 1H), 3,81 (m, 4H), 3,01 (m, 4H);
MS (ESI+): m/z = 457,1 [M+H]+. |
91/111
|
231 |
O N^N
H O-J |
1H-NMR (300MHz, CD3OD) δ 8,14 (s, 1H), 7,83 (s, 2H), 7,70 (s, 1H), 7,50 (m, 2H), 7,33 (m, 1H), 7,11 (d, 2H), 6,87 (s, 1H), 6,47 (m, 2H), 5,83 (d, 1H), 3,66 (s, 2H), 2,16 (s, 6H);
MS (ESI+): m/z= 429,1 [M+H]+. |
|
232 |
ανίΑη
‘o f^n N^N
H O-# |
1H-NMR (300MHz, CD3OD) δ 8,03 (s, 1H), 7,70 (s, 1H), 7,60 (d, 1H), 7,40 (m, 3H), 7,02 (d, 3H), 6,79 (s, 1H), 6,40 (m, 2H), 5,76 (d, 1H), 3,30 (m, 2H), 2,90 (d, 2H), 2,25 (d, 6H), 2,15 (m, 1H), 2,00 (m, 2H), 1,80 (m, 2H), 1,50 (m, 2H);
MS (ESI+): m/z= 512,2 [M+H]+. |
|
233 |
O
HzNoOl ^-^NH o r^n iAn ^Ν^οΆ H O-ü |
1H-NMR (300MHz, CD3OD) δ 8,13 (s, 1H), 7,70 (s, 1H), 7,60 (m, 3H), 7,45 (m, 2H), 7,05 (m, 1H), 6,89 (s, 1H), 6,69 (m, 1H), 6,38 (m, 2H), 5,77 (d, 1H);
MS (ESI+): m/z= 451,1 [M+H]+. |
|
234 |
|
1H-NMR (300MHz, CDCI3) δ 7,96 (s, 1H), 7,64 (brs, 1H), 7,587,52 (m, 2H), 7,40-7,37 (m, 1H), 7,12 (m, 1H), 7,04 (m, 1H), 6,94-6,92 (m, 2H), 6,80-6,74 (m, 2H), 6,40 (m, 1H), 6,29-6,25 (m, 1H), 5,79-5,75 (m, 1H), 3,79 (s, 3H), 3,48 (s, 3H), 3,02 (m, 4H), 2,61 (m, 4H), 2,35 (s, 3H);
MS (ESI+): m/z= 501,2 [M+H]+. |
|
235 |
^NH o n^n
H Q-U |
1H-NMR (300MHz, CD3OD) δ 8,07 (s, 1H), 7,75 (s, 1H), 7,47 (m, 1H), 7,41 (m, 2H), 7,04 (m, 3H), 6,83 (s, 1H), 6,38 (m, 2H), 5,77 (d, 1H), 2,99 (d, 2H), 2,71 (m, 1H), 2,32 (s, 3H), 2,15 (m, 2H), 1,76 (m, 4H);
MS (ESI+): m/z= 487,2 [M+H]+. |
|
< |
abela 9b> |
|
Exemplo |
Estrutura |
Dados de análise |
|
236 |
h Ç
H O-? |
1H-NMR (300MHz, CD3OD) δ 8,01 (s, 1H), 7,73 (s, 1H), 7,58 (d, 1H), 7,43 (m, 2H), 7,28 (q, 1H), 7,02 (m, 2H), 6,77 (s, 1H), 6,57 (t, 1H), 6,40 (m, 2H), 5,77 (q, 1H), 3,21 (m, 2H), 2,60 (m, 2H), 2,32 (s, 6H);
MS (ESI+): m/z= 476,2 [M+H]+. |
|
237 |
O N^N
H O-# |
1H-NMR (300MHz, CD3OD) δ 8,04 (s, 1H), 7,70 (s, 1H), 7,60 (d, 1H), 7,43 (t, 1H), 7,26 (d, 1H), 7,04 (m, 2H), 6,79 (s, 1H), 6,62 (t, 1H), 6,40 (m, 2H), 5,77 (d, 1H), 3,30 (s, 1H), 2,85 (d, 2H), 2,31(s, 3H), 2,16 (m, 2H), 1,90 (m, 2H), 1,48 (m, 2H);
MS (ESI+): m/z = 502,2 [M+H]+. |
ÍQ4331Exemplo de preparação 1
92/111 [0434]Comprimidos para administração oral compreendendo cada um dos compostos de fórmula (I) obtidos nos Exemplos 1 a 237 como um ingrediente ativo foram preparados por método convencional baseado na receita da Tabela 10.
<Tabela 10>
|
Ingrediente |
Quantidade /comprimido |
|
Ingrediente ativo |
100 mg |
|
Amido de milho |
80 mg |
|
Lactose |
80 mg |
|
Estearato de magnésio |
5 mg |
Exemplo de preparação 2 [0435]Cápsulas de gelatina dura para administração oral compreendendo cada um dos compostos de fórmula (I) obtidos nos Exemplos 1 a 237 como um ingrediente ativo foram preparados por método convencional baseado na receita da Tabela 11.
<Tabela 11>
|
Ingrediente |
Quantidade /comprimido |
|
Ingrediente ativo |
100 mg |
|
Amido de milho |
40 mg |
|
Lactose |
80 mg |
|
Celulose cristalina |
80 mg |
|
Estearato de magnésio |
5 mg |
Exemplo de preparação 3 [0436]Formulações de injeção compreendendo cada um dos compostos de fórmula (I) obtidos nos Exemplos 1 a 237 como um ingrediente ativo foram preparados pelo método convencional baseado na receita da tabela 12, em que quando um sal do composto de fórmula (I) foi usado, o valor do pH não foi manipulado.
<Tabela 12>
|
Ingrediente |
Quantidade /comprimido |
|
Ingrediente ativo |
20 mg |
|
5% solução de glicose |
10 ml |
|
HCl (1N) |
Ajustado ao pH 4 |
Exemplo de preparação 4
93/111 [0437]Formulações injetáveis compreendendo cada um dos compostos de fórmula (I) obtidos nos Exemplos 1 a 237 como um ingrediente ativo foram preparados por método convencional baseado na receita da Tabela 13.
<Tabela 13>
|
Ingrediente |
Quantidade /comprimido |
|
Ingrediente ativo |
20 mg |
|
Polietilenoglicol 400 |
2 ml |
|
Água estéril |
8 ml |
[0438]Exemplo teste 1: Teste de inibição para crescimento de célula cancerígena expressão EGFR [0439]Para identificar que os compostos inventivos nos Exemplos 1 a 237 seletivamente inibem no crescimento da célula cancerígena que expressa EGFR mutantes comprados do que EGFR WT, o teste de inibição dos compostos inventivos no crescimento de célula de câncer foi conduzido a seguir. Para o teste, uma linhagem de célula de câncer de pele, A431 super expressando EGFR tipo selvagem (WT), uma linhagem de célula de câncer pulmonar, HCC827 cujos inframe é excluído na posição 19 éxon em EGFR tirosina quinase, e NCI-H1975 expressando EGFR L858R/T790M mutante que tem resistência aos inibidores de EGFR aprovados como Gefitinib ou Erlotinib foram empregados.
[0440]O teste de inibição dos compostos inventivos no crescimento de célula cancerígena foi conduzido em linhagens de células A431 (ATCC CRL-1555), HCC827 (ATCC CRL-2868) e NCI-H1975 (ATCC CRL-5908).
[0441]A linhagem celular celA431 foi incubada em um meio DMEM com alta glicose (meio de Eagle modificado por Dulbecco) suplementado com 10% de soro bovino fetal (FBS) e 1% penicilina/estreptomicina (Gibco BRL), e linhagens de células HCC827 e NCI-H1975 foram incubadas em um meio RPMI complementado com 10% FBS, 1% penicilina/estreptomicina e 1% piruvato de sódio.
[0442]As linhagens celulares armazenadas em tanque de nitrogênio líquido foram cada uma rapidamente descongeladas a 37°C, e centrifugadas para remover o meio.
94/111
O pellet de célula resultante foi misturado com um meio de cultura, incubado em um frasco de cultura a 37°C sob 5% CO2 por 2 a 3 dias, e o meio foi removido. As células restantes foram lavadas com DPBS (salina tamponada em fosfato de Dulbecco) e separados do frasco usando Tripsina-EDTA. As células separadas foram diluídos com um meio de cultura e uma concentração de 1 X 105 A431 células/ml, exceto que no caso de células HCC827 e NCI-H1975, a diluição foi conduzida em 5 X 104 células/ml. 100 pl da solução de célula diluída foi adicionada a cada poço de uma placa de 96 poços, e incubada a 37°C sob 5% CO2 por 1 dia. As células NCI-H1975 foram privadas em um meio RPMI-1640 contendo 0,1% FBS e 1% penicilina/estreptomicina para maximizar as atividades de reação da célula nos compostos testes no dia seguinte.
[0443]Os compostos obtidos nos Exemplos 1 a 237 foram cada um dissolvido em 99,5% dimetilsulfóxido (DMSO) a uma concentração de 25 mM. No caso em que o composto teste não foi solúvel em DMSO, 1% HCl foi adicionado a este e tratado em um banho de água a 40°C por 30 mins até uma dissolução completa foi obtida. A solução de DMSO contendo composto teste foi diluída com um meio de cultura em uma concentração final de 100 μΜ, e então diluída 10 vezes serialmente a 10-6 μΜ (uma concentração final de DMSO foi menos do que 1%).
[0444]O meio foi removido de cada poço da placa de 96 poços. E então, 100 pl de uma solução do composto teste foi adicionado a cada poço mantendo as culturas de células, e a placa foi incubada a 37°C sob 5% CO2 por 72 horas (exceto que células NCI-H1975 foram incubadas por 48 horas). Após remover o meio da placa, 50 pl de 10% ácido tricloroacético foi adicionada a cada poço, e a placa foi mantida a 4°C por 1 hora para fixar as células ao fundo da placa. A solução adicionada de 10% ácido tricloroacético foi removido de cada poço, a placa foi seca, 100 pl de um solução de corante SRB (Sulforhodamina-B) em uma concentração de 0,4% dissolvido em 1% ácido acético foi adicionado a este, e a mistura resultante foi reagida por 10 mins em
95/111 temperatura ambiente. Após remover a solução corante, a placa foi lavada com água, e o poço seco. Quando a solução de corante não foi efetivamente removido por água, 1% ácido acético foi usado. 150 pl de 10 mM base trisma foi adicionada a cada poço, e a absorbância a 540 nm de comprimento de onda foi determinado com um leitor de microplaca. Em caso de NCI-H1975, as viabilidades celulares foram determinadas conforme a absorbância a 490 nm em comprimento de onda usando solução Celltiter 96 Aqueous One (MTS, promega).
[0445]GI50, a concentração em que 50% de inibição ocorre, foi avaliado com base na diferença entre a densidade final das células teste e a densidade inicial das células incubadas em um poço não tratado com o composto teste que foi considerado como 100%. O cálculo de GI50 e a análise de resultado foram conduzidos usando Microsoft Excel, e os resultados são mostrados nas Tabelas 14a a 14f. Em que, A significa que GI50< 50 nM, B significa que GI50 é 50-100 nM, C significa que GI50 é 100-1,000 nM, e D significa que GI50 > 1.000 nM.
<Tabela 14a>
|
Gl50 |
|
Exemplo |
HCC827 |
NCI-H1975 |
A431 |
|
EGFR DelE746_A750 |
EGFR L858R/T790M |
EGFR WT |
|
1 |
A |
A |
D |
|
2 |
B |
B |
D |
|
3 |
A |
A |
D |
|
4 |
B |
B |
D |
|
6 |
B |
A |
- |
|
7 |
A |
A |
- |
|
8 |
A |
A |
D |
|
9 |
A |
A |
- |
|
10 |
A |
A |
C |
|
11 |
A |
A |
C |
|
12 |
A |
A |
- |
|
13 |
A |
A |
C |
|
14 |
A |
B |
- |
96/111
|
15 |
A |
A |
- |
|
16 |
B |
A |
- |
|
17 |
A |
A |
- |
|
18 |
A |
A |
- |
|
22 |
A |
B |
- |
|
23 |
B |
A |
D |
|
24 |
A |
B |
D |
|
25 |
B |
B |
- |
|
26 |
A |
A |
D |
|
27 |
A |
A |
- |
|
28 |
B |
A |
- |
|
29 |
B |
A |
D |
|
30 |
C |
A |
D |
|
31 |
A |
A |
D |
|
32 |
A |
A |
D |
|
35 |
A |
A |
- |
|
36 |
B |
A |
- |
<Tabe a 14b>
| GI50 |
|
Exemplo |
HCC827 |
NCI-H1975 |
A431 |
|
EGFR DelE746_A750 |
EGFR L858R/T790M |
EGFR WT |
|
37 |
C |
A |
D |
|
38 |
A |
A |
- |
|
40 |
A |
B |
|
|
41 |
A |
A |
- |
|
42 |
A |
A |
D |
|
45 |
A |
A |
- |
|
46 |
A |
A |
- |
|
47 |
A |
A |
- |
|
48 |
A |
A |
D |
|
49 |
A |
A |
- |
|
50 |
A |
C |
D |
|
51 |
A |
A |
D |
|
52 |
A |
A |
D |
|
53 |
A |
A |
D |
|
54 |
A |
A |
D |
97/111
|
55 |
A |
A |
- |
|
56 |
B |
A |
- |
|
57 |
A |
C |
- |
|
59 |
A |
C |
- |
|
60 |
C |
C |
- |
|
61 |
B |
A |
- |
|
62 |
A |
A |
D |
|
65 |
A |
A |
D |
|
66 |
A |
A |
D |
|
69 |
B |
A |
- |
|
71 |
B |
A |
- |
|
72 |
A |
A |
- |
|
76 |
A |
B |
D |
|
77 |
A |
A |
- |
|
78 |
B |
B |
- |
|
79 |
A |
C |
- |
|
80 |
A |
A |
D |
<Tabela 14c>
| GI50 |
|
Exemplo |
HCC827 |
NCI-H1975 |
A431 |
|
EGFR DelE746_A750 |
EGFR L858R/T790M |
EGFR WT |
|
82 |
A |
A |
D |
|
83 |
A |
A |
C |
|
84 |
B |
B |
- |
|
90 |
A |
A |
D |
|
92 |
A |
A |
- |
|
93 |
B |
B |
- |
|
94 |
A |
A |
D |
|
95 |
A |
A |
- |
|
97 |
B |
A |
- |
|
98 |
A |
A |
- |
|
99 |
B |
A |
D |
|
100 |
A |
A |
D |
|
102 |
A |
B |
- |
|
103 |
C |
A |
- |
|
106 |
B |
A |
- |
98/111
|
107 |
A |
A |
D |
|
108 |
B |
B |
- |
|
109 |
A |
A |
D |
|
111 |
B |
A |
- |
|
112 |
A |
A |
D |
|
114 |
B |
A |
- |
|
115 |
A |
A |
- |
|
116 |
A |
A |
- |
|
117 |
A |
B |
- |
|
118 |
A |
B |
- |
|
119 |
A |
A |
- |
|
120 |
A |
A |
D |
|
121 |
B |
A |
- |
|
122 |
A |
A |
D |
|
123 |
B |
B |
- |
|
124 |
A |
A |
- |
|
125 |
A |
A |
D |
<Tabela 14d>
| GI50 |
|
Exemplo |
HCC827 |
NCI-H1975 |
A431 |
|
EGFR DelE746_A750 |
EGFR L858R/T790M |
EGFR WT |
|
126 |
A |
A |
- |
|
127 |
A |
A |
- |
|
128 |
A |
A |
D |
|
129 |
A |
A |
D |
|
130 |
A |
A |
- |
|
131 |
B |
A |
- |
|
132 |
A |
A |
- |
|
133 |
A |
A |
- |
|
134 |
A |
A |
- |
|
135 |
B |
A |
- |
|
136 |
A |
A |
- |
|
138 |
A |
A |
- |
|
139 |
A |
A |
- |
|
140 |
B |
B |
- |
|
142 |
A |
A |
D |
99/111
|
143 |
B |
A |
- |
|
144 |
A |
B |
- |
|
148 |
A |
A |
- |
|
154 |
B |
B |
- |
|
156 |
A |
B |
- |
|
158 |
A |
C |
D |
|
159 |
A |
A |
D |
|
160 |
A |
A |
- |
|
165 |
A |
A |
D |
|
167 |
A |
A |
D |
|
168 |
A |
A |
D |
|
169 |
A |
B |
- |
|
172 |
B |
A |
- |
|
173 |
A |
A |
C |
|
174 |
A |
A |
- |
|
175 |
A |
A |
- |
|
176 |
A |
A |
D |
<Tabela 14e>
| GI50 |
|
Exemplo |
HCC827 |
NCI-H1975 |
A431 |
|
EGFR DelE746_A750 |
EGFR L858R/T790M |
EGFR WT |
|
178 |
A |
A |
D |
|
180 |
A |
A |
D |
|
181 |
A |
A |
D |
|
182 |
A |
A |
D |
|
183 |
A |
A |
D |
|
184 |
A |
A |
D |
|
185 |
A |
A |
D |
|
186 |
A |
A |
D |
|
187 |
B |
A |
D |
|
189 |
A |
A |
D |
|
190 |
A |
A |
- |
|
191 |
A |
A |
- |
|
196 |
A |
B |
- |
|
197 |
A |
A |
- |
|
199 |
A |
A |
D |
100/111
|
201 |
A |
B |
- |
|
202 |
B |
A |
- |
|
203 |
A |
A |
D |
|
205 |
A |
A |
- |
|
206 |
A |
A |
D |
|
207 |
A |
A |
- |
|
208 |
A |
A |
- |
|
209 |
A |
A |
- |
|
210 |
A |
A |
- |
|
211 |
A |
A |
- |
|
212 |
B |
B |
- |
|
213 |
B |
A |
- |
|
214 |
B |
A |
- |
|
215 |
A |
A |
- |
|
216 |
A |
A |
- |
|
217 |
A |
B |
- |
|
218 |
A |
B |
D |
<Tabela 14f>
| GI50 |
|
Exemplo |
HCC827 |
NCI-H1975 |
A431 |
|
EGFR DelE746_A750 |
EGFR L858R/T790M |
EGFR WT |
|
219 |
A |
A |
D |
|
220 |
A |
A |
- |
|
221 |
A |
A |
- |
|
222 |
B |
B |
- |
|
223 |
A |
A |
D |
|
224 |
A |
A |
- |
|
225 |
A |
A |
- |
|
228 |
A |
A |
C |
|
229 |
A |
A |
C |
|
232 |
B |
B |
- |
|
234 |
A |
A |
D |
|
235 |
A |
A |
- |
|
237 |
A |
A |
D |
|
Erlotinib |
A |
D |
B |
|
Lapatinib |
C |
D |
B |
101/111
[0449]Como mostrado nas Tabelas 14a a 14f, quase todos os compostos inventivos mostrou uma atividade anticâncer excelente por seletivamente inibindo o crescimento de células de câncer pulmonar de célula não pequena HCC827 e NCIH1975 (NSCLC) que expressam EGFR mutantes (GI50= A ou B), com nenhuma atividade anticâncer em célula A431 que expressa EGFR WT (GI50 = D). Ditos mecanismos de inibição dos compostos da invenção são muito diferentes daquelas tirosinas quinases EGFR comercialmente vendidas (por exemplo, Erlotinib e Lapatinib) ou o material sendo desenvolvido (BIBW2992).
[0450]Como mostrado na tabela 14f, Erlotinib como o inibidor de EGFR de primeira geração foi muito efetivo na inibição de crescimento de linhagens de células NSCLC que expressam EGFR mutantes (HCC827, GI50= A), enquanto este não forneceu atividade contra linhagens de células NSCLC expressando mutação pontual EGFR T790M (NCI-H1975, GI50= D). Ainda, o atualmente comercializado Lapatinib que inibe ambos EGFR e HER-2 mostraram uma atividade de inibição fraca (HCC827, GI50= C) ou nenhuma atividade de inibição (NCI-H1975, GI50= D) contra linhagens de células NSCLC. Ainda, o inibidor irreversível contendo estrutura quinazolina, BIBW2992 (Boehringer Ingelheim, atualmente no estágio de fase III), apresentou uma inibição forte atividade contra pan-HER e efetivamente inibiu todas as linhagens de célula cancerígena reveladas nas Tabelas 14a a 14f incluindo a linhagem celular A431 (GI50= A). No entanto, dito inibidor irreversível contendo a estrutura quinazolina pode causar vários efeitos adversos (por exemplo, diarreia, erupção de pele e perda de peso) quando tratado em uma quantidade para inibir EGFR T790M, e, portanto, ainda tem uma necessidade para desenvolver uma droga segura para superar os problemas do desenvolvimento de resistência de EGFR T790M. Portanto, os compostos inventivos apresentaram uma atividade de inibição altamente melhorada contra EGFR mutantes incluindo EGFR T790M, com nenhuma atividade de inibição contra EGFR WT expressa em célula normal, que sugere que os
102/111 compostos inventivos podem ser usados como drogas anticâncer mais efetivas e seguras a pacientes NSCLC.
[0451]Exemplo teste 2: Teste de inibição para atividades de EGFR WT e L858R/T790M quinase [0452]As atividades de inibição dos compostos inventivos obtidos nos Exemplos 1 a 237 contra EGFR WT e EGFR L858R/T790M quinase foram determinados usando kit de ensaio z-lyte quinase (Invitrogen, PV3191). As quinases usadas no teste foram adquiridas de Invitrogen.
[0453]Os compostos obtidos nos Exemplos 1 a 237 foram cada um preparado a 10 mM de solução DMSO, e uma solução contendo 4% DMSO foram preparados do mesmo e diluído c uma concentração de 1 pM a 0,0001 pM. Então, um valor Kd aproximado de cada quinase foi calculado e diluído usando um tampão quinase (50 mM HEPES (PH 7,4), 10 mM MgCl2, 1 mM EGTA e 0,01% BRIJ-35) a 1 a 100 ng/concentração do ensaio. O teste foi conduzido em placas de fundo chato de poliestireno de 384 poços. 5 pl da solução diluída de cada composto foi adicionada a cada poço, e 10 pl de uma mistura de substrato peptídeo e quinase em uma concentração apropriada e 5 pl de 5~300 pM de solução de ATP foram sucessivamente adicionado a este e a placa foi incubada em um agitador em temperatura ambiente por 60 minutos. Após 60 mins, 10 pl de reagente de coloração foi adicionada à mistura resultante para iniciar uma reação de fluorescência de substrato peptídeo e uma solução de terminação foi adicionada a este para terminar a reação. Um valor de fluorescência de cada poço foi determinado com um medido de fluorescência (Molecular Device) a 400 nm (filtro de excitação) e 520 nm (filtro de emissão). A atividade de inibição dos compostos teste contra as quinases foi determinada como um percentual de fosforilação (%) comparado com um grupo de controle, de acordo com o protocolo do kit, e medido para IC50, a concentração de eixo x em que a 50% de inibição foi observada. O cálculo de IC50 e a análise de
103/111 resultado foram conduzidos usando Microsoft Excel. Os resultados são mostrados na Tabela 15. Em que, A significa que IC50 < 50 nM, B significa que IC50 é 50-100 nM, C significa que IC50 é100-1,000 nM, e D significa que IC50 > 1,000 nM.
<Tabela 15>
| IC50 |
|
Exemplo |
EGFR WT |
EGFR L858R/T790M |
|
1 |
C |
A |
|
2 |
D |
A |
|
48 |
C |
A |
|
115 |
D |
A |
|
122 |
D |
A |
|
206 |
C |
A |
|
215 |
D |
A |
|
Erlotinib |
A |
C |
|
Lapatinib |
B |
D |
|
BIBW2992 |
A |
A |
[0454]Como mostrado na Tabela 15, os compostos inventivos mostraram uma atividade de inibição relativamente baixa contra EGFR WT relacionado com os efeitos adversos os efeitos adversos (IC50= C ou D), enquanto este mostrou uma excelente atividade de inibição contra EGFR L858R/T790M mutantes contendo uma resistência aos inibidores atividade comercialmente disponíveis de EGFR (IC50= A). Como os resultados do Exemplo de Teste 1, ditos mecanismos de inibição dos compostos da invenção são muito diferentes daquelas tirosinas quinases EGFR comercialmente vendidas (por exemplo, Erlotinib e Lapatinib) ou o material sendo desenvolvido (BIBW2992) que fortemente inibe EGFR WT (IC50=A ou B). Portanto, os compostos inventivos são efetivamente e droga segura empregáveis aos pacientes com NSCLC mostrando uma atividade de inibição efetivamente excelente contra EGFR mutantes incluindo EGFR T790M com nenhuma atividade de inibição contra EGFR WT expressa em célula normal.
[0455]Exemplo teste 3: Teste de inibição para atividades de BTK e JAK3 quinase
104/111 [0456]As atividades de inibição dos compostos da invenção obtidos nos Exemplos 1 a 237 contra BTK e JAK3 quinases foram determinados, respectivamente. O procedimento do exemplo de teste 2 foi repetido exceto que BTK e JAK3 quinases (Invitrogen) foram empregadas ao invés de usar a EGFR quinase. Os resultados são mostrados nas Tabelas 16a a 16c. Em que, A significa que IC50< 50 nM, B significa que IC50 é 50-100 nM, C significa que IC50 é 100-1,000 nM, e D significa que IC50 > 1,000 nM.
<Tabela 16a>
|
IC50 |
|
Exemplo |
BTK |
JAK3 |
|
1 |
A |
A |
|
3 |
A |
B |
|
7 |
A |
B |
|
9 |
A |
A |
|
11 |
A |
A |
|
21 |
A |
B |
|
28 |
A |
A |
|
29 |
A |
A |
|
36 |
B |
B |
|
40 |
B |
B |
|
41 |
B |
B |
|
42 |
A |
B |
|
44 |
B |
B |
|
47 |
B |
B |
|
48 |
A |
A |
|
50 |
A |
B |
|
51 |
A |
B |
|
53 |
A |
A |
|
55 |
B |
A |
|
57 |
A |
B |
|
59 |
A |
B |
|
62 |
A |
A |
105/111
|
66 |
A |
B |
|
67 |
A |
A |
|
68 |
B |
A |
|
70 |
A |
A |
|
72 |
A |
A |
|
73 |
A |
B |
|
74 |
A |
B |
|
79 |
A |
A |
<Tabela 16b>
|
IC50 |
|
Exemplo |
BTK |
JAK3 |
|
82 |
A |
A |
|
83 |
A |
A |
|
85 |
A |
A |
|
88 |
B |
B |
|
89 |
A |
B |
|
91 |
A |
B |
|
95 |
B |
B |
|
99 |
A |
B |
|
103 |
A |
A |
|
104 |
A |
A |
|
105 |
B |
A |
|
125 |
A |
A |
|
127 |
B |
B |
|
129 |
A |
A |
|
130 |
B |
A |
|
141 |
A |
B |
|
142 |
A |
A |
|
145 |
A |
A |
|
146 |
B |
B |
|
148 |
A |
B |
|
151 |
B |
B |
|
152 |
A |
B |
106/111
|
154 |
A |
B |
|
169 |
A |
B |
|
173 |
A |
A |
|
174 |
A |
B |
|
177 |
A |
A |
|
179 |
A |
A |
|
180 |
A |
A |
|
181 |
A |
A |
<Tabela 16c>
| IC50 |
|
Exemplo |
BTK |
JAK3 |
|
182 |
A |
B |
|
183 |
B |
B |
|
187 |
B |
B |
|
199 |
A |
A |
|
203 |
A |
B |
|
219 |
A |
A |
|
223 |
A |
A |
|
228 |
A |
A |
|
229 |
A |
A |
|
232 |
A |
A |
|
233 |
A |
A |
|
237 |
A |
A |
[0457]Como mostrado nas Tabelas 16a a 16c, o composto inventivo mostrou uma inibição excelente contra BTK e JAK quinases (IC50= A ou B).
[0458]Exemplo teste 4: Teste de inibição para atividades de BMX, ITX e RLK quinase [0459]O composto obtido no Exemplo 1 foi medido para sua atividade inibitória em família de TEC quinases, ou seja, BMX, ITK, TEX e RLK. A medição foi conduzida no mesmo processo como no Exemplo 2, exceto para usar BMX, ITK, TEC e RLK
107/111 enzimas (Invitrogen) ao invés de EGFR enzima. Os resultados são mostrados na Tabela 17. A letra ‘A’ na tabela significa IC50 < 50 nM, ‘B’ significa IC50 = 50-100 nM, ‘C’ significa IC50 = 100-1,000 nM, e ‘D’ significa IC50 >1,000 nM.
<Tabela 17>
| IC50 |
|
Exemplo |
BMX |
ITK |
RLK |
|
1 |
A |
B |
A |
[0460]Como mostrado na Tabela 17, o composto do Exemplo 1 de acordo com a presente invenção efetivamente inibiu família TEC quinases como BTK, BMX, ITK, e RLK quinases (IC50 = A ou B).
[0461]Exemplo teste 5: Teste de eficácia anticâncer em camundongos nude xenoenxertado com células de câncer NCI-H1975 [0462]O composto de acordo com a presente invenção (Exemplo 2) foi testado para seu efeito anticâncer e toxicidade em camundongos nude xenoenxertados com células de câncer NCI-H1975 que mostra resistência a Erlotinib anteriormente aprovado para o tratamento de câncer pulmonar de célula não pequena, devido à aquisição de mutação pontual EGFR T790M. Para avaliar a eficácia anticâncer e toxicidade do composto de acordo com a presente invenção, BIBW2992 (Boehringer Ingelheim), que atualmente apresenta atividade excelente a câncer pulmonar de célula não pequena e está ativamente sob desenvolvimento, foi ainda usado no teste.
[0463]A célula NCI-H1975 (célula de câncer pulmonar) foi adquirida de American Type Culture Collection (ATCC). Após a formação de tumor por injeção subcutânea com 1x108 células/0,3 mL de suspensão de célula de tumor nas costas dos camundongos, passagens foram conduzidas e tumor em pelo menos a terceira geração foi usada no teste.
[0464]No teste, um tumor na sexta geração isolado de um indivíduo foi cortado em um tamanho de 30 mg, e transplantado subcutaneamente nos flancos direitos de camundongos usando um 12-gauge trocar. O volume de tumor (V) é calculado a partir da seguinte equação 1 após medição de um grande diâmetro (L) e um curto
108/111 diâmetro (S) usando um paquímetro duas vezes por semana por 18 dias de teste. Todos os materiais de teste foram oralmente administrados uma vez por dia por um total de 10 dias, e a taxa de inibição de crescimento do tumor (IR: taxa de inibição de crescimento de tumor (%) calculado com base em um controle tratado com veículo) e a perda de peso corporal máxima (mBWL: perda de peso corporal máxima calculada baseado no peso corporal imediatamente antes da administração) foram calculados usando as seguintes equações 2 e 3. Os resultados são mostrados nas Tabelas 6 e Figs. 1 e 2.
[0465]<Equação 1>
[0466]V = L x S2/2 [0467]Em que, L é um diâmetro longo e S é um diâmetro curto.
[0468]<Equação 2>
[0469]IR (%) = (1-(RTG do grupo de tratamento do material teste)/(RTG do grupo controle)) x 100 [0470]Em que, RTG é um crescimento de tumor relativo, que é o volume de tumor médio em um dia particular baseado no volume de tumor médio.
[0471]<Equação 3>
[0472]mBWL (%) = (1-( peso corporal médio no dia x / peso corporal médio imediatamente antes da administração)) x 100 [0473]Em que, dia x é um dia em que a perda de peso corporal é a maior durante o teste.
[0474]A seguir a tabela 18 está o resultado de IR e mBWL em um modelo NCIH1975 in vivo.
<Tabela 18>
|
Composto |
BIBW2992 |
Exemplo 2 |
|
Dose |
50 mg/kg |
70 mg/kg |
|
IR1 |
77% |
75% |
|
mBWL 2) |
9,1% |
-7,6% |
[0475]medido no dia 16 após a administração;
109/111 [0476]medido no dia 10 após a administração;
[0477]O composto da presente invenção não inibiu EGFR WT e apresentou uma atividade excelente em EGFR mutante especifica a câncer pulmonar de célula não pequena (mutante ativa: EGFR DelR746_A750, EGFR L858R; mutação adquirida: EGFR T790M). Como mostrado na Tabela 18 e Figs 1 e 2, inibidores de EGFR apresentaram eficácias comparáveis a BIBW2992 em NCI-H1975, um modelo animal que é o mais difícil mostrar a eficácia (IR = 77% vs 75%), enquanto este não apresentou qualquer efeito colateral resultou de ações farmacológicas como doenças dermatológicas e perda de peso corporal (BIBW2992: 9,1% de perda de peso, Exemplo 2: 7,6% de ganho de peso em dose terapeuticamente equivalente). Estes resultados experimentais mostram que os compostos de acordo com a presente invenção seletivamente e efetivamente inibem o crescimento de câncer e a resistência a droga causada por mutação de EGFR enquanto não mostrando efeitos colaterais.
[0478]Exemplo teste 6: Inibição de artrite induzida por colágeno em camundongos [0479]Para avaliar a eficácia do composto de acordo com a presente invenção para artrite reumatoide, o composto foi submetido a teste de inibição de artrite em um modelo de artrite induzido por colágeno (CIA). O modelo CIA é um modelo amplamente usado, representativo, autoimune de artrite, artrite do qual é induzido por injeção de uma mistura de colágeno tipo II e um adjuvante imunológico a um camundongo específico contendo um complexo principal de histocompatibilidade (MHC) classe II com H-2q ou H-2r e assim células T CD4+ e células B especificamente responsivas ao colágeno tipo II são anormalmente ativadas.
[0480]Camundongos machos DBA/1J (8 semanas de idade) foram primeiro imunizadas por injeção intradérmica de 0,7 mL de m líquido em suspensão em que um volume igual de 2 mg/mL de colágeno tipo II é emulsificado em 4 mg/mL de adjuvante de Freund completo suplementado com bactéria de tuberculose. Após 21
110/111 dias, os camundongos foram, em segundo lugar, imunizados pela injeção como acima, exceto para uso de um líquido em suspensão em que um volume igual de 2 mg/mL de colágeno tipo II é emulsificado em adjuvante de Freund incompleto sem bactéria de tuberculose. Após 1 semana de segunda imunização, os camundongos foram avaliados para escores clínicos baseado na Tabela 10 e sete animais foram agrupados de modo que a média de grupo experimental está entre 1 e 2. As amostras de teste e o veículo de certas concentrações foram oralmente administrados em uma quantidade de 10 mL por peso corporal para 14 dias, todos os dias, usando um Sonde. Os escores clínicos de artrite (David D Brand et al., Nature Protocol. 2(5), 1269, 2007) foram avaliados três vezes por dia.
[0481]O composto do Exemplo 1 reduzi o edema e dilação até o último dia (14 dias) do teste em grupos de 10 mg/kg e 30 mg/kg comparado a um grupo de controle, e significantemente reduziu edema, inflamação e dilatação em um grupo de 30 mg/kg (Fig. 3).
[0482]Como mostrado nas Tabelas 16a, 16b e 16c e Fig. 3, o composto de acordo com a presente invenção inibiu as atividades de BTK e JAK3 quinases, e as inibições reduziram edema, inflamação e dilatação bem como valores de anticorpo anti-colágeno em um modelo CIA de artrite autoimune, comparado a um grupo controle, e ainda reduziu a formação de pannus na testagem histopatológica. Os resultados acima em um modelo de roedor de artrite sugere que o composto de acordo com a presente invenção pode fornecer efeitos clínicos para pacientes com artrite reumatoide.
[0483]Além disso, o composto de acordo com a presente invenção significativamente reduziu a secreção de interleucina-6 (IL-6) e TNF-α em células mononucleares de sangue periférico humano (PBMCs) e esplenócitos de camundongo abundantes em T, linfócitos B, citos e magrófagos após o tratamento de forbol-12-miristato-13-acetato (PMA), fitohemaglutinina (PHA), lonomicina, e
111/111 outros que estimulam os linfócitos, comparado a um grupo de controle. Isto demonstra que o composto de acordo com a presente invenção inibe a ativação de linfócitos.
<Tabela 19>
Avaliação de escores clínicos de artrite
|
Taxa |
Características |
|
0 |
Sem edema e dilatação em patas, tornozelos, e articulações do tornozelo |
|
1 |
Dilatação e edema leve em tornozelos ou articulações do tornozelo |
|
2 |
Dilatação e edema leve geralmente de articulações de tornozelo a tornozelos |
|
3 |
Dilatação e edema de articulações de tornozelo a articulações de dedos |
|
4 |
Edema grave ou tetraplegia espástica em articulações em geral, patas e dedos |
[0484]Enquanto a invenção foi descrita com relação as modalidades acima específicas, deve ser reconhecido que várias modificações e alterações podem ser preparadas à invenção por especialistas na técnica que ainda está dentro do escopo da invenção como definido pelas reivindicações anexadas.