Virus (biologie)
| Virus | ||||
|---|---|---|---|---|

| ||||
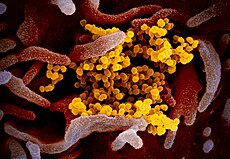
| SARS-CoV-2, een van de coronavirussen | ||||
| Virusclassificatie | ||||
|
(Geen rang): Virus | ||||
| Imperia | ||||
| ||||
Een virus is een klein deeltje van organisch materiaal dat zich uitsluitend kan vermenigvuldigen in cellen van levende wezens. Wanneer een virus een levende cel binnendringt zal deze cel – de zogenaamde gastheercel – vele kopieën van het oorspronkelijke virus gaan produceren. Virussen infecteren alle vormen van leven, van dieren, schimmels en planten tot micro-organismen als bacteriën en archaea. Ze komen in alle ecosystemen voor en zijn zeer talrijk in de bodem, de lucht en water. De wetenschap die virussen onderzoekt heet virologie, een deelgebied van de microbiologie.
Virussen hebben een relatief eenvoudige structuur. Een individueel virusdeeltje wordt een virion genoemd en bevat aan de binnenzijde het genetisch materiaal. Dit bestaat uit een lang DNA- of RNA-molecuul dat instructies bevat voor het maken van eiwitten. Een virus is altijd voorzien van een eiwitmantel, de capside, die het genetisch materiaal omgeeft en beschermt. In sommige gevallen is een buitenomhulsel van lipiden aanwezig, de envelop. De meeste virussen zijn zo klein dat ze met een lichtmicroscoop niet kunnen worden waargenomen, ongeveer honderd keer zo klein als de meeste bacteriën.
Virussen verspreiden zich op verschillende manieren, bijvoorbeeld via uitgeademde aerosolen of via vectoren als muggen en teken. Om binnendringende virussen uit te schakelen hebben gewervelde dieren een complex immuunsysteem. Sommige voor de mens gevaarlijke virussen, zoals herpesvirussen of hiv, kunnen aan het immuunsysteem ontsnappen. Ter voorkoming van virale infecties zijn verschillende vaccins ontwikkeld. Dankzij succesvolle vaccinatiestrategieën zijn enkele beruchte virusziekten inmiddels uitgeroeid.
De evolutionaire oorsprong van virussen is onduidelijk. Ze zijn vermoedelijk verschillende keren ontstaan uit 'ontsnapte' stukken DNA of RNA van levende organismen. Over de vraag of virussen zelf levend zijn, bestaat evenmin consensus. Hoewel ze genetisch materiaal bezitten en evolueren, hebben ze geen eigen stofwisseling en ze zijn niet in staat om zichzelf voort te planten. Voor hun replicatie zijn ze volledig afhankelijk van hun gastheer. Virussen worden om deze reden wel omschreven als "organismen aan de rand van het leven".
Geschiedenis
[bewerken | brontekst bewerken]
De beginselen van de virologie gaan terug tot de late 19e eeuw. In 1883 ontdekte Adolf Mayer, een Duits landbouwkundige, dat hij de ziekte van zijn tabaksplanten kon overdragen door het sap van zieke bladeren op gezonde planten te wrijven.[1] Hij slaagde er niet in de besmettelijke ziekteverwekker te vinden en suggereerde dat de ziekte veroorzaakt werd door zeer kleine bacteriën die onzichtbaar waren onder de microscoop.[2] Deze hypothese werd een decennium later getest door Dmitri Ivanovski, een Russische bioloog die het sap van geïnfecteerde tabaksplanten door een speciaal filter liet gaan dat ontworpen was om bacteriën tegen te houden. Ook na filtratie was het sap nog steeds besmettelijk voor de tabaksplanten.[3]
In 1898 herhaalde de Nederlandse microbioloog Martinus Beijerinck de experimenten en kwam tot de conclusie dat er in het filtraat een nieuw soort pathogeen zou moeten zitten. Hij constateerde dat de pathogeen zich alleen in levende cellen kon vermenigvuldigen. Hij veronderstelde dat het ging om een replicerend deeltje dat veel kleiner en eenvoudiger is dan een bacterie en introduceerde hierbij de term virus.[4] Beijerinck wordt beschouwd als een van de belangrijkste grondleggers van de virologie.[2][5]
De vermoedens van Beijerinck werden in 1935 bevestigd toen de Amerikaan Wendell Stanley het besmettelijke deeltje kristalliseerde, dat tegenwoordig bekend is als het tabaksmozaïekvirus, en de eigenschappen ervan verder beschreef. Niet lang daarna werd de elektronenmicroscoop uitgevonden en konden virussen voor het eerst zichtbaar worden gemaakt.[3] Duidelijk werd dat virussen omgeven zijn door een manteltje van eiwitten en net als levende organismen een nucleïnezuur hebben waarin genetische informatie vastligt.[6]
Vanaf de tweede helft van de 20e eeuw werden duizenden nieuwe virussen ontdekt. Het meeste onderzoek werd verricht naar bacteriofagen, maar ook veel planten- en dierenvirussen kregen een naam en beschrijving. Dankzij nieuwe cultiveringsmethoden werden diverse medische aspecten opgehelderd.[7] In 1963 werd het hepatitis B-virus ontdekt door Baruch Blumberg, en in 1965 beschreef Howard Martin Temin het eerste retrovirus. Het enzym reverse-transcriptase, dat retrovirussen gebruiken voor hun vermenigvuldiging, werd ontdekt in 1970. In 1983 isoleerde het team van Luc Montagnier voor het eerst het retrovirus dat nu bekendstaat als hiv.[8] Ondanks de toegenomen kennis blijven opkomende virussen de aandacht vragen van wetenschap en samenleving.[9]
Microbiologie
[bewerken | brontekst bewerken]Eigenschappen
[bewerken | brontekst bewerken]Virussen vormen een geheel op zichzelf staande groep van biologische agentia. Ze kenmerken zich in de eerste plaats door hun infectieuze natuur: om zich te vermenigvuldigen zijn virussen genoodzaakt de cellen van een gastheer binnen te dringen. De geïnfecteerde gastheercel zal op basis van het virale genetisch materiaal nieuwe virusdeeltjes gaan produceren. Tijdens een infectie worden de cellulaire processen beïnvloed en kan er schade aan cellen ontstaan. Veelal volgen dan bepaalde ziekteverschijnselen, zodat virussen vaak als ziekteverwekker, als pathogeen worden gekarakteriseerd.[10]
Al sinds het begin van de 20e eeuw is er een discussie gaande over de vraag of virussen als een levensvorm of als levenloze organische structuren moeten worden beschouwd.[11] Virussen vertonen verschillende eigenschappen die doen denken aan volwaardig leven: ze bezitten genen die voor eiwitten coderen, ze evolueren door middel van natuurlijke selectie,[12] en hun vermenigvuldiging vindt plaats door middel van replicatie en zelfassemblage.[13] Daar staat tegenover dat virussen geen eigen stofwisseling hebben. Alle energie en moleculen die nodig zijn voor hun vermenigvuldiging, onttrekken ze aan hun gastheer.[a] Een geïsoleerd virus is biologisch inert.[16] Geaccepteerde vormen van leven zijn daarnaast altijd opgebouwd uit een of meer cellen. De afwezigheid van stofwisseling en een cellulaire bouw maken dat virussen meestal worden uitgesloten van levende micro-organismen.[17][18][19]
Structuur
[bewerken | brontekst bewerken]Virussen zijn zeer klein. De diameter ligt gewoonlijk tussen de 20 en 300 nanometer, dat is ongeveer honderd keer zo klein als de meeste bacteriën. De uitwendige structuur of morfologie is uiteenlopend. De meeste virussen zijn niet met een lichtmicroscoop waar te nemen: onderzoekers maken gebruik van elektronenmicroscopen om hun structuur te ontrafelen.[20] Om het contrast tussen virusdeeltjes en de achtergrond te vergroten, worden de virusdeeltjes gekleurd met oplossingen van zware metalen, zoals wolfraam, die de elektronen verstrooien. De verstrooide elektronen worden opgevangen door een detector, zodat het virusdeeltje digitaal wordt afgetekend.[21]
Het complete virusdeeltje, zoals het buiten de gastheercel voorkomt, noemt men een virion. Het bestaat uit een nucleïnezuur, omgeven door een beschermende eiwitmantel, de capside. De capside is uit een aantal identieke subeenheden, capsomeren, opgebouwd.[20] Sommige virussen hebben hieromheen een envelop van lipiden. De capside wordt gecodeerd door het virale genoom en de vorm ervan kan tussen virusfamilies sterk verschillen.[22] De capside is relatief stevig en kan mechanisch worden onderzocht door middel van atoomkrachtmicroscopie.[23] Er wordt globaal onderscheid gemaakt tussen vier morfologieën:
Helixvormig
[bewerken | brontekst bewerken]- Virussen in de vorm van een helix zijn samengesteld uit één type capsomeer dat rond een centrale as is gewonden tot een lange, spiraalvormige structuur. Het genetische materiaal, meestal enkelstrengs RNA, wordt binnen de eiwithelix gestabiliseerd door interacties tussen het negatief geladen nucleïnezuur en de positief geladen eiwitten. De lengte van de capside is evenredig aan de lengte van het nucleïnezuurmolecuul en de breedte is afhankelijk van de grootte en rangschikking van capsomeren. Het tabaksmozaïekvirus is een voorbeeld van een helixvirus.[20]
Icosaëdrisch
[bewerken | brontekst bewerken]- De meeste virussen die dieren infecteren hebben de vorm van een regelmatig twintigvlak, van een icosaëder. Een regelmatig twintigvlak is de gunstigste manier om een stabiele, gesloten mantel te vormen uit identieke capsomeren.[24] Het minimaal vereiste aantal capsomeren is twaalf, elk samengesteld uit vijf identieke subunits. Veel virussen, zoals het rotavirus, hebben meer dan twaalf capsomeren en lijken daardoor bolvormig.[20]
Omgeven door een envelop
[bewerken | brontekst bewerken]- Sommige virussoorten zijn omgeven door een buitenomhulsel, de virusenvelop, die uit een dubbellaag van lipiden bestaat. Het virus maakt deze envelop niet zelf aan, maar is gevormd uit het celmembraan van de gastheer. Bekende voorbeelden van virussen met een envelop zijn influenzavirussen, hiv en coronavirussen.[25] Wanneer de envelop wordt vernietigd, bijvoorbeeld door zeep, wordt de virion inactief.[20]
Complex
[bewerken | brontekst bewerken]- De complexe virussen hebben een capside die uit zowel een helix als regelmatig twintigvlak bestaat, en vaak nog extra structuren bezit zoals eiwitstaarten of een complexe buitenwand. Vooral bacteriofagen vertonen dergelijke complexe structuren: deze virussen hebben een icosaëdrische kop die in verbinding staat met een helixvormige staart, een zeshoekige basis en enkele uitstekende eiwitfilamenten, hun 'pootjes'. Hun 'lichaam' werkt als een moleculaire injectiespuit. De faag hecht zich met zijn pootjes aan de bacteriële gastheer vast en injecteert vervolgens zijn genoom naar binnen.[26]
Virussen die afwijken van deze gangbare morfologieën zijn onder meer het pokkenvirus en het mimivirus. Het pokkenvirus bevat een schijfvormige structuur, de nucleoïde, waarin het genetisch materiaal is opgeslagen. Hieromheen bevindt zich een inwendig membraan. Het pokkenvirus is pleomorf en kan zowel ovale als rechthoekige vormen aannemen.[27] Het mimivirus is een reuzenvirus, de capside ervan is meer dan 400 nm breed en heeft een draderig oppervlak. Reuzenvirussen zijn zo groot dat sommige soorten in eerste instantie voor bacteriën werden aangezien. Het mimivirus heeft een opmerkelijk groot genoom, waarin genen voorkomen die zelfs voor een rudimentaire stofwisseling coderen.[28]
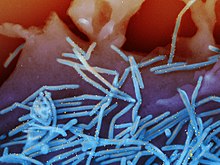
- Elektronenmicroscopische opnames van virusdeeltjes die uit cellen vrijkomen
-
Het nieuwe coronavirus SARS-CoV-2 uit gekweekte cellen van een patiënt
-
Het respiratoir syncytieel virus op longepitheelcellen
-
Krim-Congo-hemorragische koortsvirus uit cellen van een patiënt
Genoom
[bewerken | brontekst bewerken]| Eigenschap | Parameters |
|---|---|
| Nucleïnezuur |
|
| Vorm |
|
| Streng-configuratie |
|
| Sense |
|
Het genetisch materiaal of genoom van virussen is divers en variabel. Virussen vertonen een grotere diversiteit in genoomstructuur dan alle planten, schimmels, dieren, archaea of bacteriën bijeen. De kleinste virussen hebben maar drie genen, de grootste hebben er honderden of duizenden. Er zijn miljoenen verschillende soorten virussen bekend, maar daarvan zijn maar enkele duizenden soorten in detail beschreven.[29] Vanaf het begin van de 21e eeuw raakte sequencing van virussen in een stroomversnelling.[30][31] De database van het NCBI telde in 2020 meer dan 190.000 complete genoomsequenties.
Alle levende wezens op aarde hebben een genoom dat opgebouwd is uit dubbelstrengs DNA. Virussen onttrekken zich aan deze wetmatigheid: hun genomen bestaan ofwel uit DNA of uit RNA, en komen voor in een dubbelstrengse dan wel enkelstrengse configuratie.[32] De meeste RNA-virussen zijn enkelstrengs en de meeste DNA-virussen dubbelstrengs, maar hierop zijn uitzonderingen. Van alle virussen die geneeskundig relevant zijn voor de mens, is het genoom inmiddels gesequenced en grotendeels geannoteerd.
Een viraal genoom kan lineair of circulair zijn. Lineaire genomen hebben twee uiteinden, net zoals bij de chromosomen van de mens. Een circulair genoom is een gesloten ring en heeft een grotere stabiliteit. Bij sommige virussen is het genoom opgedeeld in een aantal losse stukken die onafhankelijk functioneren. Dergelijke genomen wordt gesegmenteerd genoemd. Bij gesegmenteerde RNA-virussen codeert elk segment vaak voor één eiwit. Soms komen de segmenten in verschillende virions voor.[33]
Enkelstrengse virale genomen kunnen ofwel sense (positief) of antisense (negatief) zijn, afhankelijk van hun nucleotidesequentie. Bij een positief enkelstrengs RNA-virus kan het genoom direct als mRNA fungeren. Een genoom van een negatief enkelstrengs RNA-virus is daarentegen complementair aan het mRNA. Bij deze virussen moet het genoom dus eerst worden omgezet naar een kopie voordat het gereed is voor translatie.[32] Een satellietvirus is een virus waarvan het genoom zo klein is, dat het virus niet voor het eigen replicatie-apparaat codeert, maar voor vermenigvuldiging volledig afhankelijk van een ander virus is. Het hepatitis D-virus is een satellietvirus van het hepatitis B-virus.
Genetische mutatie
[bewerken | brontekst bewerken]Virussen staan bekend om hun hoge mutatiefrequentie en snelle evolutie. Het genetisch materiaal van virussen is doorgaans instabieler dan dat van levende organismen, wat betekent dat hun genen sneller veranderen. Veranderingen in het genetisch materiaal van een virus kunnen leiden tot veranderingen in virale eiwitten, zoals de structuur van de capside. Op deze manier beïnvloeden mutaties de eigenschappen van het virus, bijvoorbeeld de besmettelijkheid of de virulentie. De hoge mutatiefrequentie van virussen is het gevolg van hun ongecontroleerde replicatiewijze. Foutjes die optreden tijdens replicatie worden bij veel virussen niet gecorrigeerd.[c] Het resultaat is dat virussen van nature zeer heterogene populaties vormen waarin duizenden varianten voorkomen, een fenomeen dat quasi-species wordt genoemd.[17]
Virussen als het influenzavirus veranderen hun genetisch materiaal op basis van twee verschillende evolutiemechanismen: antigene drift en antigene shift. Antigene drift is het proces waarbij kleine mutaties onder invloed van een selectiedruk in de loop der tijd accumuleren in het genoom, zodat geleidelijk nieuwe eigenschappen ontstaan. Veruit de meeste mutaties hebben geen invloed op de eiwitfunctie, maar sommigen bieden het virus een evolutionair voordeel. Antigene drift kan ervoor zorgen dat virussen resistentie ontwikkelen tegen een antiviraal middel of ontsnappen aan het immuunsysteem.[34][35]
Soms komt het voor dat twee stukken genetisch materiaal, afkomstig van twee verschillende virussen door recombinatie of reassortment vermengd raken tot een nieuw genoom. Doordat er sprake is van een totaal nieuwe combinatie van genetisch materiaal, ontstaat er een nieuw type virus. Dit proces noemt men antigene shift. In zeldzame gevallen kan een antigene shift een pandemie veroorzaken.[36] Recombinatie verloopt vooral gemakkelijk bij virussen met een gesegmenteerd genoom. De genoomsegmenten van deze virussen kunnen zodanig recombineren dat er 'nakomelingen' ontstaan met nieuwe unieke kenmerken. Recombinatie komt voor in zowel RNA- als DNA-virussen.[35]
Replicatiecyclus
[bewerken | brontekst bewerken]Een virusdeeltje kan zich niet zelfstandig voortplanten. Om zich te vermenigvuldigen is het virus genoodzaakt om gebruik te maken van de stofwisseling en machinerie van een levende gastheercel. Een virale infectie begint met een virion die zich vasthecht aan het oppervlak van een gastheercel. Het virusdeeltje brengt vervolgens zijn DNA of RNA de gastheercel in. De cel wordt hierdoor geprogrammeerd om honderden tot duizenden kopieën van het oorspronkelijke virus aan te maken. Nadat het genetisch materiaal is gekopieerd en de capside-eiwitten zijn aangemaakt, voegen deze zich spontaan samen tot nieuwe virions. De duizenden virions komen vrij en kunnen nieuwe cellen infecteren.[32]
De replicatiecyclus kent vijf belangrijke stappen:
- Aanhechting. De virion hecht zich vast aan het oppervlak van een geschikte gastheercel. Eiwitten die zich op de capside bevinden gaan interacties aan met eiwitten op de gastheercel. Alleen bij een sterke interactie vindt aanhechting plaats.[37]
- Internalisatie. Het genetisch materiaal wordt naar binnen geleid. Bij dierlijke cellen zal de hele virion de gastheercel binnengaan. Bij cellen met een celwand zoals planten en bacteriën wordt het genoom meestal geïnjecteerd, terwijl de capside buiten blijft.[38]
- Synthese. De eiwitmantel valt uit elkaar en het genetisch materiaal komt vrij in het cytoplasma. Het vrijgekomen genetisch materiaal zal in de cel worden gekopieerd (replicatie), en door ribosomen vertaald tot virale eiwitten (translatie).
- Assemblage. Het gekopieerde genetisch materiaal wordt met nieuwe capside-eiwitten verpakt tot nieuwe virions. Dit assemblageproces verloopt spontaan.
- Vrijlating. De virions verlaten de cel door middel van afsnoering of lyse. Bij afsnoering wordt het virus omsloten door een klein gedeelte van het gastheer-membraan. Bij lyse barst de cel open, zodat alle virions tegelijkertijd vrijkomen.
Replicatie van dierenvirussen
[bewerken | brontekst bewerken]Een belangrijk aspect bij de infectie van mens of dier is de aanwezigheid van de virusenvelop. Veel dierenvirussen, met name de RNA-virussen, hebben een lipide dubbellaag om zich heen. In de envelop zijn naar buiten stekende glycoproteïnen verankerd, die een interactie aangaan met receptoren op de gastheercel. Na vasthechting wordt de virion veelal door middel van endocytose opgenomen. Synthese en verwerking van de virale glycoproteïnen vindt plaats in het cytoplasma of het endoplasmatisch reticulum. Van daaruit worden de eiwitten getransporteerd naar de buitenzijde van het celmembraan. De nieuwe virions zullen vervolgens de cel verlaten en daarbij een deel van het celmembraan, inclusief de virale glycoproteïnen, om zich heen sluiten, dus afsnoeren.[39] Sommige virussen ontlenen hun envelop niet aan het celmembraan maar aan het kernmembraan of golgi-apparaat. Dit is bijvoorbeeld het geval bij herpesvirussen.[40]
De ingewikkeldste replicatiecyclus komt voor bij een groep RNA-virussen die retrovirussen worden genoemd. Deze virussen beschikken over een speciaal enzym genaamd reverse-transcriptase. Dit enzym kan een DNA-molecuul synthetiseren op basis van een RNA-sjabloon.[d] Wanneer een retrovirus een cel infecteert, zal het reverse-transcriptase een viraal DNA-molecuul produceren. Dit losse DNA-molecuul integreert in een van de chromosomen van de gastheer. Het virale DNA maakt in feite deel uit van het gastheergenoom en zal door de cel tot expressie worden gebracht. Van medisch belang is het retrovirus hiv dat zich in T-cellen integreert.[39]
Replicatie van bacteriofagen
[bewerken | brontekst bewerken]Veel basisprincipes van de virologie, in het bijzonder de mechanismen van virusreplicatie, zijn tijdens het onderzoek naar bacteriofagen ontdekt. Dat zijn virussen die bacteriën infecteren.[32] Bacteriofagen en sommige andere virussen gebruiken twee karakteristieke replicatiecycli om zich te vermenigvuldigen: de lytische cyclus en de lysogene cyclus.[41] Kenmerkend voor de lytische cyclus is het laatste stadium van de infectie, waarbij de bacteriële cel lyseert, openbarst terwijl de fagen vrijkomen. Dergelijke fagen kunnen binnen enkele uren een volledige bacteriële kolonie vernietigen. De meeste bacteriofagen leven echter samen met hun gastheer in de lysogene cyclus. Deze cyclus laat toe dat een faag zich repliceert zonder de gastheercel te doden. Het genoom van de faag integreert in het chromosoom van de bacterie en wordt zo doorgegeven aan dochtercellen. Op een gegeven moment kan het virus loskomen en de lytische cyclus activeren.[39][42]
Gastheerbereik
[bewerken | brontekst bewerken]
Bij alle levensvormen zijn virussen bekend. Planten, dieren, schimmels en micro-organismen kunnen door een virus geïnfecteerd worden. De meeste virussen zijn gespecialiseerd op een beperkt aantal gastheren. Interacties tussen de capside van het virus en receptoren op de cel zorgen ervoor dat het virus zich alleen aan een specifieke gastheercel kan hechten. Vermoedelijk zijn deze receptoren evolutionaire overblijfselen; ze hebben hun functie verloren maar werden later door virussen aangegrepen voor infectie.[39]
Sommige virussen hebben een breed gastheerbereik. Het westnijlvirus is bijvoorbeeld in staat om muggen, vogels, paarden en mensen te infecteren.[43] Andere virussen hebben een veel smaller gastheerbereik en zijn maar voor één specifieke soort besmettelijk. Zo is het mazelenvirus geheel op de menselijke soort gespecialiseerd. Een virale infectie is bovendien vaak beperkt tot een bepaald weefseltype. Het verkoudheidsvirus slaat bijvoorbeeld alleen toe in de epitheelcellen van de luchtwegen, en hiv bindt alleen aan receptoren die voorkomen op bepaalde immuuncellen.[39]
Virusziekten bij de mens
[bewerken | brontekst bewerken]
Virussen zijn de oorzaak van een grote verscheidenheid aan menselijke ziekten. Voorbeelden van bekende virale infectieziekten zijn onder meer verkoudheid, griep, waterpokken en koortslip. Ernstigere ziekten zoals hondsdolheid, ebola, aids, vogelgriep en SARS hebben eveneens een virale etiologie. De mate waarin een virus zijn gastheer ziek maakt noemt men de virulentie.[45]
Ziekteverschijnselen van virale infecties kunnen op verschillende wijzen tot stand komen. Lyserende virussen ontregelen de cel tijdens hun replicatie in dusdanige mate dat de cel doodgaat en uiteenvalt. Bij meercellige organismen leidt dit tot weefselschade en mogelijk zelfs tot orgaanfalen. Naast directe celdood kan een virale infectie ook aanleiding geven tot een overmatige immuunrespons. Het lichaam geeft dan te veel antilichamen, cytotoxische T-cellen, ontstekingsstimulerende cytokinen of complement-eiwitten af, waardoor de lichaamseigen weefsels beschadigd raken.[46]
Hoewel virussen de gezondheid van een organisme kunnen verstoren, zijn er ook veel soorten die ongemerkt met de gastheer samenleven. Een bekend voorbeeld is het herpes-simplexvirus, dat maandenlang in dormante toestand in het menselijk lichaam kan circuleren. Dit fenomeen wordt latentie genoemd en komt ook voor bij andere herpesvirussen, waaronder het epstein-barrvirus, dat de ziekte van Pfeiffer veroorzaakt, en het varicellazostervirus, dat waterpokken en gordelroos veroorzaakt.[47] Onder zeldzame omstandigheden kan een latent virus voordelig zijn voor de gastheer, doordat het virus het immuunsysteem versterkt.[48]
Epidemiologie en virusuitbraken
[bewerken | brontekst bewerken]De epidemiologie bestudeert het voorkomen en de verspreiding van ziekten in populaties. Epidemiologen verzamelen kwantitatieve gegevens over een ziekte en proberen daarmee de determinanten ervan op te sporen. De virale epidemiologie is erop gericht manieren te vinden om de verspreiding van virussen in kaart te brengen en in te perken. Met behulp van statistische modellen kunnen epidemiologen de effecten voorspellen van interventies zoals immunisaties, groepsbehandelingen, screening en isolatiemaatregelen.[49]
Het belangrijkste verspreidingsmechanisme van virussen in populaties is horizontale overdracht, overdracht van persoon tot persoon.[e] Horizontale overdracht treedt op bij onderling contact en uitwisseling van lichaamsvloeistoffen. Hieronder vallen ook uitgeademde aerosolen waarin virusdeeltjes voorkomen en dierlijke vectoren, zoals muggen, vlooien en teken, die het virus van gastheer naar gastheer brengen.[50] Karakteristiek voor virussen is dat ze vaak gespecialiseerd zijn in een specifieke overdrachtsroute. De snelheid waarmee virale infecties worden overgedragen, hangt af van factoren als bevolkingsdichtheid, het aandeel vatbare individuen, de kwaliteit van de gezondheidszorg en het seizoen.[51][52]
Epidemiologen zoeken naar manieren om de infectieketen tijdens een virusuitbraak te doorbreken. Een eerste stap is het vinden van de bron van de uitbraak en identificatie van het virus. Wanneer de virusstam bekend is, kan de transmissieketen worden doorbroken door het opbouwen van groepsimmuniteit, het liefst door vaccinatie.[49] Totdat een vaccin is ontwikkeld, zijn sanitaire voorzieningen en ontsmetting van groot belang om de mens en zijn omgeving vrij te houden van virusdeeltjes. Na een zekere incubatieperiode, de tijd tussen moment van besmetting en de eerste symptomen, begint er een periode van overdraagbaarheid: de tijd waarin een besmet individu een ander kan besmetten. Kennis van de lengte van beide periodes is essentieel bij het beheersen van uitbraken.[53]
Epidemieën en pandemieën
[bewerken | brontekst bewerken]
Wanneer een zeer hoog aantal individuen in een populatie, gemeenschap of regio besmet raakt, spreekt men van een epidemie. Een epidemie die grote delen van de wereld treft, wordt een pandemie genoemd. Recente voorbeelden van pandemieën zijn aids, de Mexicaanse griep en ziekten van nieuwe coronavirussen.[53] Bij de opkomst en neergang van virusziekten in de samenleving spelen vele factoren een rol. Behalve de genetische flexibiliteit van virussen zijn ook sociaal-culturele factoren van belang.[f]
Gedurende de 20e eeuw vonden vier pandemieën plaats die veroorzaakt werden door het influenzavirus. De Spaanse griep die in 1918 tientallen miljoenen slachtoffers eiste, was hiervan veruit de dodelijkste. Opmerkelijk bij de Spaanse griep was, dat ook gezonde jongvolwassenen ernstig ziek werden. Dit in tegenstelling tot andere griepuitbraken, die voornamelijk een gevaar vormen voor ouderen of mensen met een anderszins verzwakt immuunsysteem.[55]
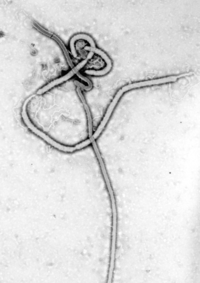
Verschillende zeer dodelijke virale stammen behoren tot de filovirussen. Dit zijn filamenteuze virussen die bij de mens hemorragische koorts veroorzaken. Het marburgvirus, ontdekt in 1967, kreeg in april 2005 veel media-aandacht na een uitbraak in Angola.[56] Het ebolavirus heeft sinds 1976, toen het voor het eerst werd vastgesteld, met tussenpozen uitbraken met hoge sterftecijfers veroorzaakt. De ernstigste uitbraak vond plaats in West-Afrika tussen 2013 en 2016.[57]
Het Severe Acute Respiratory Syndrome SARS en het Middle East respiratory syndrome MERS zijn luchtweginfecties die door nieuwe typen coronavirussen worden veroorzaakt. Van coronavirussen is algemeen bekend dat ze milde infecties veroorzaken bij mensen, dus de virulentie en de snelle verspreiding van SARS-infecties, die in juli 2003 ongeveer 800 doden veroorzaakten, waren betrekkelijk onverwacht.[58]
Een gerelateerd coronavirus ontstond in november 2019 in Wuhan. Het virus, SARS-CoV-2 genaamd, verspreidde zich in hoog tempo over de continenten. In diverse delen van de wereld werden strenge maatregelen genomen om de verspreiding tegen te gaan. Het internationale verkeer werd stilgelegd, openbare ruimtes werden gesloten en in veel dichtbevolkte steden werden lockdowns afgekondigd.[59]
Kanker
[bewerken | brontekst bewerken]Aan het ontstaan van kanker liggen verschillende erfelijke en omgevingsfactoren ten grondslag. Van virussen is al sinds het begin van de 20e eeuw een rol bij de ontwikkeling van tumoren vastgesteld, of tenminste aannemelijk gemaakt.[60] De bekendste vormen van kanker die door virussen worden veroorzaakt zijn levercelcarcinoom en baarmoederhalskanker, door het hepatitis B-virus en het humaan papillomavirus.[61] Andere carcinogene virussen zijn bijvoorbeeld het epstein-barrvirus, het merkelcelpolyomavirus en het humaan herpesvirus 8. Het mechanisme waarmee deze virussen kanker verwekken is grondig bestudeerd, alhoewel sommige details nog niet zijn opgehelderd. Tijdens een infectie integreert het virale genoom in het DNA van de gastheercel. Bepaalde genen van de gastheer, bijvoorbeeld genen die betrokken zijn bij de celcyclus- en celgroeimachinerie, kunnen daarbij ontregeld raken. Via een complex meerstapsproces zal de getroffen cel zich uiteindelijk ongebreideld gaan delen en een tumor veroorzaken.[60] De frequentie van virale kankers kan door vaccinatie preventief worden verminderd.[62]
Afweer en bestrijding
[bewerken | brontekst bewerken]Immuunsysteem
[bewerken | brontekst bewerken]De mens heeft zoals alle gewervelde dieren een complex afweersysteem om virale infecties te bestrijden. Menselijke orgaansystemen zijn allereerst omgeven door dicht op elkaar liggende epitheelcellen. Deze cellen vormen een fysieke en chemische barrière voor ziekteverwekkers: ze produceren slijm en vocht die afvoerend werken en rijk zijn aan antimicrobiële stoffen. Daarnaast komen in het lichaam fagocyten voor: grote witte bloedcellen die lichaamsvreemde deeltjes, waaronder virussen en bacteriën, aftasten en opruimen. Het epitheel en de fagocyten zijn onderdeel van het aangeboren immuunsysteem. Het aangeboren immuunsysteem is vaak voldoende om een infectie te voorkomen. Wanneer een virusdeeltje toch het lichaam binnendringt en zich vermenigvuldigt, komt het verworven immuunsysteem op gang, dat specifiek de binnengedrongen virussoort zal proberen te elimineren.[63]
De verworven afweer is erop gericht zowel vrije virusdeeltjes als geïnfecteerde lichaamscellen te neutraliseren. Het belangrijkste mechanisme om vrije virusdeeltjes te bestrijden is de productie van antilichamen, de humorale afweer. Antilichamen zijn eiwitten die aan de bloedbaan worden afgegeven en zich specifiek aan de viruscapside kunnen binden. Na binding is het virus niet langer infectieus. Zoogdieren produceren een breed scala aan antilichamen. Vooral IgM en IgG zijn voor neutralisatie van virussen van belang.[g] Hoge waarden van IgG in het bloed wijzen meestal op immuniteit.
De bestrijding van geïnfecteerde cellen gebeurt via cytotoxische T-cellen, door cellulaire afweer. Lichaamscellen die door een virus zijn geïnfecteerd zullen antigenen, kleine fragmentjes van de virale eiwitten, op hun membraan afzetten. Wanneer een T-cel een verdacht antigeen tegenkomt, zal de cel door speciale cytotoxische T-cellen worden gedood en opgeruimd.[h] De cellulaire afweer tegen virussen wordt begunstigd door interferonen. Dat zijn hormoonachtige stofjes die met de virusreplicatie interfereren.[65]
Veel virussen blijken de afweermechanismen van de gastheer te kunnen beïnvloeden, waardoor zij de immuunrespons omzeilen. Hiv ontwijkt het immuunsysteem bijvoorbeeld door antigeenvariatie, door voortdurend de aminozuursequentie van zijn capside-eiwitten te veranderen. De immuunrespons van de gastheer is hierdoor altijd aspecifiek en het virus veroorzaakt een chronische infectieziekte. Andere ontwijkingsstrategieën zijn onder meer remming van fagocytose, verhulling van antigeenpresentatie, resistentie tegen cytokinen en ontsnapping aan apoptose.[66][67]
Preventie en behandeling
[bewerken | brontekst bewerken]Een virus is volledig afhankelijk van de stofwisseling en machinerie van de gastheercel. Om deze reden is het moeilijk een gerichte behandeling tegen een virusinfectie te ontwikkelen die geen schade toebrengt aan de gastheer zelf. Immers, processen remmen die ook voor de gastheercel zelf van belang zijn, leidt snel tot toxische effecten. De meest effectieve geneeskundige benadering om virusziekten tegen te gaan is vaccinatie. Voorts is er ook een aantal antivirale middelen ontwikkeld die specifiek op de virale processen ingrijpen en de replicatiecyclus verhinderen.
Vaccins
[bewerken | brontekst bewerken]Vaccinatie is de meest succesvolle toepassing van immunologische principes in de gezondheidszorg. Een vaccin is een middel dat een gerichte immuunrespons opwekt zonder dat daarbij ziekteverschijnselen ontstaan. Na toediening is het gevaccineerde individu beschermd tegen de betreffende ziekteverwekker.[68] Al lang voor de ontdekking van virussen werd vaccinatie toegepast om virusziekten te voorkomen. Het inzetten van vaccins bij grote delen van de bevolking heeft ertoe geleid dat de morbiditeitsgraad, dus het aantal zieken, en het sterftecijfer van virusziekten als polio, mazelen, bof en rodehond in de loop van de tijd drastisch zijn gedaald.[69][70] Pokken en runderpest zijn dankzij vaccinatie uitgeroeid.[71]
Om vaccins te produceren worden biotechnologische technieken aangewend. Klassieke vaccinpreparaten bestaan uit gedode of sterk verzwakte virusdeeltjes. Deze zijn dus niet meer ziekteverwekkend, maar bevatten wel de antigenen die het immuunsysteem activeren. Ook kan een vaccin worden bereid dat uitsluitend de capside-eiwitten bevat (subunit-vaccin).[68] Meer recente technologieën met een beter veiligheidsprofiel of sterkere immuunrespons zijn bijvoorbeeld de RNA-vaccins en vectorvaccins. RNA-vaccins zorgen voor de synthese van lichaamsvreemde eiwitten, bijvoorbeeld spike-eiwitten, waarop het immuunsysteem kan ingrijpen. Vectorvaccins werken volgens hetzelfde principe, maar maken gebruik van aangepaste virusdeeltjes die het genetisch materiaal van de ziekteverwekker in gastheercellen brengen.[72]
Antivirale middelen
[bewerken | brontekst bewerken]
Antivirale middelen zijn stoffen die interfereren met de replicatiecyclus van virussen. De meeste antivirale middelen die op de markt zijn gebracht behoren tot de nucleosideanalogen: op DNA-bouwstenen gelijkende moleculen die virussen tijdens replicatie onbedoeld in hun genoom opnemen. Vanaf het moment dat een nucleosideanalogon is ingebouwd, stopt de polymerisatie van de keten. Het genetisch materiaal kan dan niet verder worden gekopieerd. Voorbeelden van bekende nucleosideanalogen zijn aciclovir, stavudine en remdesivir.[73][74] Antivirale middelen kunnen ook de vasthechting aan de gastheercel verhinderen of virale enzymen blokkeren.
De meeste virusremmers werken alleen tegen specifieke soorten, dus hebben een geringe therapeutische breedte. Tegen hiv, hepatitis B en C, herpesvirussen en influenzavirussen bestaat inmiddels een uitgebreid arsenaal aan antivirale middelen, maar tegen veel andere virusinfecties nog niet of nauwelijks. Om resistentie tegen antivirale middelen te voorkomen worden vaak combinatietherapieën toegepast. Het gelijk voorschrijven van verschillende virusremmers met verschillende aangrijpingspunten vergroot het antivirale effect en beperkt de kans op resistentie aanzienlijk.[75]
Infectie van andere levensvormen
[bewerken | brontekst bewerken]Dierenvirussen
[bewerken | brontekst bewerken]Virussen kunnen zich in veel verschillende diersoorten vermeerderen. Dieren die nauw samenleven met de mens, zoals honden, katten en paarden zijn vatbaar voor ernstige virale infecties. Parvovirussen kunnen bijvoorbeeld dodelijke ziektes veroorzaken bij jonge honden of katten.[76] Uiteraard zijn ook bij ongewervelde dieren, zoals bij de honingbij, veel virussen bekend. De meeste virussen leven ongemerkt met hun gastheer samen en veroorzaken geen tekenen van ziekte.[77]
Kennis van dierenvirussen is ook voor de menselijke gezondheid van belang. Onder bepaalde omstandigheden kunnen ze namelijk overspringen op de mens en aanleiding geven tot een epidemie.[78] Virussen die zoönosen veroorzaken zijn meestal afkomstig van een gewerveld dier en worden vaak via bijtende geleedpotigen verspreid. Virussen die door geleedpotigen worden overgebracht zijn arbovirussen. Zoönotische transmissie berust op toeval en kan soms via een tussengastheer verlopen. Hondsdolheid is een voorbeeld van een zoönotische infectieziekte die rechtstreeks van een besmet roofdier op de mens over kan springen.[79]
Plantenvirussen
[bewerken | brontekst bewerken]
Er zijn veel verschillende plantenvirussen bekend. Vooral de virussen die cultuurgewassen aantasten zijn goed bestudeerd. Plantenvirussen worden door kleine organismen van plant tot plant overgedragen, die het virus bij zich dragen. Dergelijke organismen worden vectoren genoemd. Dit zijn meestal insecten, maar ook sommige schimmels, rondwormen en eencellige protisten kunnen een vector zijn. Wanneer de bestrijding van een virale plantenziekte economisch rendabel is, bijvoorbeeld bij meerjarige fruitsoorten, wordt vaak gekozen voor het uitroeien van de vector en voor het verwijderen van alternatieve gastheren zoals onkruid.[80]
Planten hebben verschillende afweermechanismen tegen virussen. Een wijdverspreid verdedigingsmechanisme is de aanwezigheid van zogenaamde resistentiegenen (R-genen). Een R-gen zorgt ervoor dat de cellen rond de geïnfecteerde plaats afsterven, zodat de infectie zich niet verspreidt. Het resultaat is vaak met het blote oog te zien, zoals vlekjes op groenten. Geïnfecteerde plantencellen produceren bovendien allerlei antivirale stoffen, zoals salicylzuur, stikstofmonoxide en reactieve zuurstofmoleculen. Deze neutraliseren de virusdeeltjes of interfereren met hun replicatie.[81]
Bacteriofagen
[bewerken | brontekst bewerken]
Bacteriofagen, of kortweg fagen, zijn een wijdverspreide en diverse groep virussen die bacteriën infecteren. Ze zijn buitengewoon talrijk in vrijwel alle ecosystemen, maar voornamelijk in het water. Een milliliter zeewater bevat ongeveer 250 miljoen bacteriofagen, ruim tien keer het aantal bacteriën.[82] Een bacteriofaag hecht zich aan de celwand van een bacterie en brengt zijn genetisch materiaal via een injectiemechanisme bij de bacterie naar binnen. Enzymen van het virus tunnelen door de celwand en komen in het cytoplasma terecht. Korte tijd na de infectie, soms al binnen twintig minuten, barst de bacteriële cel open waardoor er honderden nieuw gevormde faagdeeltjes vrijkomen.[32]
De belangrijkste manier waarop bacteriën zich tegen bacteriofagen verdedigen, is door enzymen te produceren die het DNA van het virus vernietigen. Deze enzymen, zogenaamde restrictie-endonucleasen, knippen het DNA dat bacteriofagen in de bacterie injecteren, kapot. Bacteriën bevatten daarnaast een ingenieus systeem dat hen in staat stelt fragmenten van het faag-DNA waarmee ze in contact komen, op te slaan, zodat ze bij een tweede infectie de replicatie kunnen blokkeren via een vorm van RNA-interferentie. Dit mechanisme, dat bekendstaat als CRISPR, is te vergelijken met de verworven immuniteit van dieren.[83]
Classificatie
[bewerken | brontekst bewerken]Virussen worden ingedeeld in taxonomische groepen op basis van morfologie, genoomstructuur en replicatiewijze.[22] Vanaf het midden van de 20e eeuw werd het eerste classificatiesysteem voor virussen ontwikkeld. Dit systeem was in lijn met de voor planten en dieren gangbare taxonomie van Linnaeus en bevatte soort, geslacht, familie en orde.[84] Het systeem bleef lange tijd in zwang en werd gaandeweg verbeterd. Binnen de moderne virusclassificatie neemt de rang familie een belangrijke plaats in. Virusfamilies, herkenbaar aan het achtervoegsel -viridae, hebben doorgaans dezelfde eigenschappen en zijn, ook vanuit medisch perspectief, meestal goed te onderscheiden.[85]
In 1966 werd het International Committee on Taxonomy of Viruses ICTV opgericht. Het ICTV stelde zich ten doel een inclusieve, consensus-gebaseerde taxonomie te creëren die de evolutie van virussen weerspiegelt. Het leek eerst door de hoge mutatiesnelheid onmogelijk om verre verwantschappen tussen virustaxa met zekerheid vast te stellen. Als aanvulling op de conventionele hiërarchie werd daarom ook het classificatiesysteem van Baltimore gebruikt. Vanaf 2018 werd het classificatiesysteem van het ICTV, dankzij een sterke toename van kennis omtrent de vroege evolutie van virussen, grondig herzien.[86]
ICTV-classificatie
[bewerken | brontekst bewerken]Het International Committee on Taxonomy of Viruses is verantwoordelijk voor het beoordelen en ratificeren van veranderingen op het gebied van virustaxonomie. Dankzij zeer snelle ontwikkelingen in DNA-sequencing sinds de jaren 2010 kon een taxonomisch systeem worden samengesteld dat de volledige diversiteit van virussen behelst. Omdat verschillende basale evolutionaire relaties werden opgehelderd, kregen de taxonomische niveaus fylum, rijk en imperium een plaats in het systeem. De ICTV-classificatie bestond in 2020 uit 6 imperia, 10 rijken, 17 fyla, 2 subfyla, 39 klassen, 59 orden, 8 onderorden, 189 families, 136 onderfamilies, 2224 geslachten, 70 ondergeslachten en 9110 soorten.[87] De huidige hiërarchie is als volgt opgebouwd.
- Imperium (-viria)
Classificatie van Baltimore
[bewerken | brontekst bewerken]
Viroloog en Nobelprijswinnaar David Baltimore bedacht in 1971 een zevengroepig classificatiesysteem.[88] Het systeem bood wetenschappers de mogelijkheid om de aard en moleculaire eigenschappen van virussen binnen een gedefinieerde groep te voorspellen of af te leiden. Samen met de ICTV-classificatie werd de Baltimore-classificatie een van de meest gangbare manieren om virusdiversiteit in te delen.[89][90][91]
De Baltimore-classificatie is gebaseerd op de structuur van het genoom en de daarmee samenhangende wijze van replicatie. Alle virussen maken tijdens hun replicatie messenger-RNA aan en dit kan afhankelijk van de genoomstructuur op basis van zeven verschillende mechanismen. Het genoom kan enkelstrengs (ss) of dubbelstrengs (ds) zijn, RNA of DNA bevatten, en kan gebruik maken van reverse-transcriptase (RT). Daarnaast kunnen ssRNA-virussen sense (+) of antisense (–) zijn.[89] Zodoende zijn virussen te verdelen in zeven groepen:
| Groep | Naam | Afkorting | Voorbeelden |
|---|---|---|---|
| Groep I | Dubbelstrengs DNA-virussen | dsDNA-virus | Adenovirussen, herpesvirussen |
| Groep II | Enkelstrengs DNA-virussen | ssDNA-virus | Parvovirussen |
| Groep III | Dubbelstrengs RNA-virussen | dsRNA-virus | Reovirussen |
| Groep IV | Positief enkelstrengs RNA-virussen | (+)ssRNA-virus | Coronavirussen, picornavirussen |
| Groep V | Negatief enkelstrengs RNA-virussen | (−)ssRNA-virus | Influenzavirussen |
| Groep VI | Enkelstrengs RNA-retrovirussen | ssRNA-RT-virus | Retrovirussen |
| Groep VII | Dubbelstrengs DNA-retrovirussen | dsDNA-RT-virus | Hepadnavirussen |
Nomenclatuur
[bewerken | brontekst bewerken]Virussen werden in de vroege dagen van de virologie naar hun pathogene eigenschappen of hun ontdekker genoemd. Zo werd de virusfamilie die leveraandoeningen veroorzaakt Hepadnaviridae genoemd, hepar betekent lever. Het was vanaf het begin van de jaren 1950 tot het midden van de jaren 1960, een periode waarin veel nieuwe virussen werden ontdekt, gebruikelijk om virusnamen samen te stellen met behulp van afkortingen en initialen.[22] Zo werd de naam Picornaviridae afgeleid van pico en RNA, en Papovaviridae van papilloma, polyoma en vacuole. Moderne virusnomenclatuur staat onder toezicht van het ICTV. Het benoemen van een nieuw taxon is gebonden aan verschillende regels.[92]
Oorsprong en evolutie
[bewerken | brontekst bewerken]Ondanks uitgebreid wetenschappelijk onderzoek is nog veel onduidelijk over de wijze en het tijdstip waarop virussen in de loop van de evolutie zijn ontstaan. Omdat virussen geen fossiele resten achterlaten, is het onderzoek naar hun oorsprong en evolutie gebaseerd op moleculaire technieken, zoals sequencing. Virussen zijn waarschijnlijk al zeer vroeg in de evolutie ontstaan. Een aanwijzing daarvoor zijn de sterke overeenkomsten tussen virussen die zich repliceren in eukaryoten, in bacteriën en in archaea, de drie domeinen van het leven. Een vroeg ontstaan verklaart ook waarom virale eiwitten weinig overeenkomst met eiwitten uit levende cellen vertonen.[17] Globaal zijn er drie belangrijke hypothesen voorgesteld die het ontstaan van virussen verklaren: de ontsnappingshypothese, de reductiehypothese en de co-evolutiehypothese.[93][94][95]

Ontsnappingshypothese
[bewerken | brontekst bewerken]- De meeste virologen zijn voorstander van de hypothese dat virussen verzelfstandigde onderdelen zijn van cellulair DNA of RNA, in de vorm van stukjes nucleïnezuur die uit oercellen zijn 'ontsnapt'. Deze hypothese is in lijn met het feit dat cellen stukjes genetisch materiaal met naburige cellen kunnen uitwisselen.[i] Een tweede aanwijzing voor de ontsnappingshypothese is de gelijkenis tussen het virusgenoom en het genoom van zijn gastheer. Sommige virale genen zijn vrijwel identiek aan de genen van de gastheer, iets dat er op kan duiden dat zij verwant of ver verwant zijn.[39]
Reductiehypothese
[bewerken | brontekst bewerken]- Virussen kunnen uit kleine oercellen zijn ontstaan, die op grotere cellen parasiteerden. Gedurende een vergaande parasitische reductie gingen alle genen die niet nodig waren voor de vermenigvuldiging van de oercel verloren, zodat enkel een nucleïnezuur en enkele eiwitten overbleven. Parasitaire bacteriën zoals Chlamydia kunnen zich, net als virussen, alleen in gastheercellen voortplanten. Van deze organismen is duidelijk aangetoond dat zij gedurende hun evolutie eigenschappen zijn verloren die hen in staat stelden zelfstandig te leven, zoals delen van hun stofwisseling.[96]
Co-evolutiehypothese
[bewerken | brontekst bewerken]- Deze hypothese stelt dat virussen eerder dan of gelijktijdig met de eerste cellen op aarde verschenen, en dat virussen in een later stadium afhankelijk werden van cellulair leven. Volgens de huidige inzichten is het leven 3,5 tot 4 miljard jaar geleden ontstaan, vermoedelijk uit een RNA-wereld. De veronderstelling dat niet-cellulair leven voorafging aan cellulair leven, stemt overeen met het aannemelijke feit dat de allereerste levensvormen enkel gebaseerd waren op zelfreplicerende RNA-moleculen.[96][97] Het bestaan van viroïden lijkt deze hypothese te staven.[98]
Er zijn verschillende problemen met deze drie (klassieke) hypotheses. De ontsnappingshypothese verklaart niet hoe capsides en andere virale structuren zijn ontstaan. De reductiehypothese verklaart niet waarom zelfs de kleinste cellulaire parasieten op geen enkele manier op de huidige virussen lijken. De co-evolutiehypothese houdt geen rekening met het feit dat virussen per definitie afhankelijk zijn van gastheercellen. Aan de hand van recentere analyses uit de genomica en structuurbiologie konden nieuwe, meer genuanceerde hypotheses worden opgesteld die beter in lijn liggen met de moleculaire data.[96][93]
Virussen kennen een grillige evolutionaire geschiedenis, die verweven is met de evolutie van cellulair leven. In sommige hedendaagse organismen zijn sporen gevonden van virale genen, die miljoenen jaren geleden geïntegreerd zijn in het DNA van de voorouderlijke gastheer. Dergelijke sporen maken het mogelijk om de vroege evolutie van virussen in kaart te brengen.[99] Inzicht in de evolutie van virussen wordt bemoeilijkt doordat ze vrijwel zeker niet monofyletisch zijn: er zijn meerdere afstammingslijnen onafhankelijk van elkaar ontstaan.[94] Hoe virussen in de universele levensboom passen, blijft hierdoor een groot, onopgelost vraagstuk.
Onderzoek en toepassingen
[bewerken | brontekst bewerken]Kweek van virussen
[bewerken | brontekst bewerken]
Virussen kunnen gekweekt worden in speciale celculturen. Gevoelige cellijnen worden daarbij besmet met een gewenste virusstam. De replicatie kan worden gevolgd door regelmatig het aantal infectieuze virusdeeltjes (de zogeheten titer) in het kweekmedium te bepalen. Een klassieke bevinding daarbij is dat het virus aan het begin van het proces ‘verdwijnt’ in de cellen.[17] Dit komt doordat de virussen binnen het cytoplasma ontmanteld zijn en daardoor geen zichtbare of biochemische voetafdruk meer vertonen. Na enkele uren stijgt het aantal infectieuze virusdeeltjes in het kweekmedium weer. Met behulp van centrifugatie- en filtratietechnieken kunnen de virusdeeltjes uit de celcultuur worden geïsoleerd.[100]
Celkweeksystemen spelen een grote rol in het experimenteel virologisch onderzoek, zoals identificatie of analyse van moleculaire eigenschappen. In het verleden was viruskweek ook van belang in de diagnostiek van virusinfecties. Door technische vooruitgangen is de virale diagnostiek inmiddels grotendeels gebaseerd op de specifieke detectie van virale DNA- of RNA-moleculen door middel van PCR of RT-PCR.[17]
Levenswetenschappen
[bewerken | brontekst bewerken]
Virussen worden in diverse wetenschapsgebieden toegepast, met name in de moleculaire biologie en celbiologie. Door cellen te infecteren met gemanipuleerde virusdeeltjes kunnen kunstmatig bepaalde celprocessen op gang worden gebracht, zodat men deze met behulp van biochemische of microscopische technieken kan volgen. Virussen hebben hierdoor een rol gespeeld in de ontrafeling van vele basismechanismen van de moleculaire biologie, zoals DNA-replicatie, transcriptie, verwerking van RNA, translatie en eiwitlokalisatie.[101]
Virussen kunnen gebruikt worden om een gewenst stukje DNA in cellen te introduceren. Het DNA-vervoerende virus wordt een virale vector genoemd. Virale vectoren worden onder andere ingezet bij de behandeling van erfelijke ziekten, omdat ze in staat zijn ziekte-kritische genen te verwijderen of ontbrekende genen in te voegen.[101] In sommige landen worden bacteriofagen gebruikt ter bestrijding van bacteriële infecties, als een alternatief voor antibiotica. Deze geneeswijze is in de belangstelling gekomen vanwege de wereldwijde toename van resistentie tegen antibiotische middelen.[102] Virussen worden daarnaast gebruikt voor de industriële productie van farmaceutische eiwitten, zoals vaccin-antigenen en antilichamen.[103]
Virotherapie
[bewerken | brontekst bewerken]Genetisch gemanipuleerde virussen kunnen ingezet worden bij de behandeling van ziekten. Er zijn bijvoorbeeld virusstammen ontwikkeld die specifiek kankercellen infecteren en deze daarbij doden, terwijl gezonde lichaamscellen met rust worden gelaten. Deze zogenaamde oncolytische virussen zijn voor enkele vormen van kanker inmiddels door de klinische trials gekomen, en zijn goedgekeurd voor toepassing in het ziekenhuis.[104][105] Andere noemenswaardige medische toepassingen van virussen zijn gentherapie, het inzetten van virale vectoren om genetische aandoeningen te verhelpen, en immunotherapie, het sturen van het immuunsysteem met behulp van virusdeeltjes of -eiwitten om bepaalde ziektes te bestrijden.[106]
Nanotechnologie
[bewerken | brontekst bewerken]Vanuit het perspectief van de nanotechnologie en materiaalkunde kunnen virussen worden beschouwd als organische nanodeeltjes. Op hun eiwitmantel zijn verschillende moleculaire groepen aanwezig, die men voor praktische of experimentele doeleinden kan aanwenden. De grootte en vorm van de capside, evenals het aantal en de aard van de functionele groepen op hun oppervlak zijn zeer precies bepaald in het genetisch materiaal. Deze eigenschappen kunnen met behulp van genetische technieken en chemische modificaties relatief eenvoudig aangepast worden.[107] De aanpasbaarheid en chemische veelzijdigheid van de capside maakt dat virussen zeer geschikt zijn voor materiaalkundig en nanotechnologisch onderzoek. Virussen zijn om deze reden gebruikt voor toepassingen in gebieden als elektronica, molecuulfysica, geneesmiddelenontwikkeling en medische technologie.[108][109][110]
Zie ook
[bewerken | brontekst bewerken]Noten
- ↑ Bij parasieten, zoals de bacteriën Chlamydia en Rickettsia, is dit niet ongewoon. Toch worden dergelijke parasieten wel als levende organismen beschouwd (bijv. doordat ze hun eigen ribosomen aanmaken).[14][15]
- ↑ In verschillende stadia van levenscyclus.
- ↑ Bij levende organismen wordt het nieuw gevormde DNA continu gecontroleerd en worden eventuele fouten gecorrigeerd (proofreading mechanism). Bij veel virussen ontbreekt een dergelijk correctiemechanisme.
- ↑ Dit is het tegenovergestelde van de gebruikelijke richting in de biologie (DNA → RNA). De naam retrovirus is dan ook afgeleid van dit fenomeen (retro betekent 'achterwaarts').
- ↑ Dit mechanisme staat tegenover verticale overdracht: de overdracht van moeder op kind.
- ↑ Vooral in gebieden waar mens en dier dicht op elkaar leven, blijken de grootste risico’s te bestaan voor het ontstaan van nieuwe epidemieën.[54] In de tweede helft van de 20e eeuw zijn door zoönoses ruim 350 nieuwe infectieziekten en varianten van bestaande infectieziekten ontstaan.[49]
- ↑ IgM wordt maar enkele weken door de cellen van het immuunsysteem geproduceerd. IgG wordt voor onbepaalde tijd geproduceerd en is het meest effectief tegen virussen.[64]
- ↑ Antigenen van een virus worden in de lymfoïde organen gepresenteerd door professionele fagocyten. Nadat een T-cel het virale antigeen herkent, wordt deze geactiveerd. De geactiveerde T-cel zal zich na verloop van tijd ontwikkelen tot onder meer cytotoxische T-cellen, die bijdragen aan de immuunrespons door geïnfecteerde lichaamscellen (en daarmee het virus) te neutraliseren.[63]
- ↑ Kandidaten voor de eerste virale genomen zijn mobiele genetische elementen zoals plasmiden (naakte stukjes DNA die tussen cellen kunnen bewegen) of transposons (DNA-fragmenten die zich voortdurend verplaatsen binnen het genoom).
Referenties
- ↑ Vlak J. (2007). Adolf Mayer (1843-1942) en zijn betekenis voor de Virologie als wetenschap. Gewasbescherming 38 (3): 81-85. Vrije toegang tot artikel.
- ↑ a b (en) Campbell et al, p. 609.
- ↑ a b (en) Oldstone M. (2014). History of virology. Encyclopedia of Microbiology: 608-612. PMC 7150144.
- ↑ (en) van Kammen, A. (1999). Beijerinck’s contribution to the virus concept — an introduction In: 100 Years of Virology. Springer, pp. 1-8. ISBN 978-3-7091-6425-9.
- ↑ (en) Bos, L (2000). 100 years of virology: from vitalism via molecular biology to genetic engineering. Trends in Microbiology 8 (2): 82-87. DOI: S0966-842X(99)01678-9.
- ↑ (en) Stanley WM, Lauffer MA (1939). Disintegration of tobacco mosaic virus in urea solutions. Science 89 (2311): 345–347. ISSN: 0036-8075. PMID 17788438. DOI: 10.1126/science.89.2311.345.
- ↑ (en) Shors T, pp. 74–78.
- ↑ (en) Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT (1983). Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science 220 (4599): 868–71. PMID 6189183. DOI: 10.1126/science.6189183.
- ↑ (en) Mahy, B.W.J. (2009). Desk Encyclopedia of Human and Medical Virology. Academic Press, 583–587. ISBN 978-0-12-375147-8. Gearchiveerd op 5 mei 2021.
- ↑ Jong, M. de (2010). Onbegrensde invloeden . Amsterdam University Press, p. 6. ISBN 978-90-5629-650-6.
- ↑ (en) López-García P, Moreira D. (2012). Viruses in Biology. Evo Edu Outreach 5: 389–398. DOI: 10.1007/s12052-012-0441-y.
- ↑ (en) Holmes EC (2007). Viral evolution in the genomic age. PLOS Biology 5 (10): e278. PMID 17914905. DOI: 10.1371/journal.pbio.0050278.
- ↑ (en) Perlmutter J, Hagan M. (2015). Mechanisms of Virus Assembly. Annu Rev Phys Chem 66: 217–239. PMID 25532951. DOI: 10.1146/annurev-physchem-040214-121637.
- ↑ (en) Dimmock et al. p. 17.
- ↑ (en) Brown, N. & Bhella, D., Are viruses alive?. Microbiological society (10-03-2016). Gearchiveerd op 21 maart 2021. Geraadpleegd op 16-03-2021.
- ↑ (en) Koonin EV, Starokadomskyy P (2016). Are viruses alive? The replicator paradigm sheds decisive light on an old but misguided question. Studies in History and Philosophy of Biological and Biomedical Sciences 59: 125–34. PMID 26965225.
- ↑ a b c d e (nl) Hoepelman et al, pp. 3–8.
- ↑ (en) Moreira D, López-García P. (2009). Ten reasons to exclude viruses from the tree of life. Nat Rev Microbiol 7: 306–311. DOI: 10.1038/nrmicro2108.
- ↑ (en) Farnsworth, K. (2021). An organisational systems-biology view of viruses explains why they are not alive. Biosystems 200: 104324. DOI: 10.1016/j.biosystems.2020.104324.
- ↑ a b c d e (en) Mahy et al, pp. 33–43.
- ↑ (en) Laue, M. (2010). Electron Microscopy of Viruses. Methods in Cell Biology 96: 1-20. DOI: 10.1016/S0091-679X(10)96001-9.
- ↑ a b c (en) Baron S. (1996). Medical Microbiology, 4th edition, "Chapter 41: Structure and Classification of Viruses". ISBN 0-9631172-1-1. Gearchiveerd op 5 mei 2021. Vrije toegang tot hoofdstuk.
- ↑ (en) Falvo MR, Washburn S, Superfine R, Finch M, Brooks FP, Chi V, Taylor RM (1997). Manipulation of individual viruses: friction and mechanical properties. Biophysical Journal 72 (3): 1396–403. PMID 9138585. DOI: 10.1016/S0006-3495(97)78786-1.
- ↑ (en) Louten, J. (2016). Virus Structure and Classification. Essential Human Virology: 19-29. DOI: 10.1016/B978-0-12-800947-5.00002-8.
- ↑ (en) Weissenhorn W, Dessen A, Calder L. (1999). Structural basis for membrane fusion by enveloped viruses. Molecular Membrane Biology 16 (1): 3-9. DOI: 10.1080/096876899294706.
- ↑ (en) Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (2004). The bacteriophage T4 DNA injection machine. Current Opinion in Structural Biology 14 (2): 171–80. PMID 15093831. DOI: 10.1016/j.sbi.2004.02.001.
- ↑ (en) Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (1970). Experience with electron microscopy in the differential diagnosis of smallpox. Applied Microbiology 20 (3): 497–504. PMID 4322005. DOI: 10.1128/AEM.20.3.497-504.1970.
- ↑ (en) Suzan-Monti M, La Scola B, Raoult D (2006). Genomic and evolutionary aspects of Mimivirus. Virus Research 117 (1): 145–55. PMID 16181700. DOI: 10.1016/j.virusres.2005.07.011.
- ↑ (en) Breitbart M, Rohwer F (2005). Here a virus, there a virus, everywhere the same virus?. Trends in Microbiology 13 (6): 278–84. PMID 15936660. DOI: 10.1016/j.tim.2005.04.003.
- ↑ (en) Brister J, Ako-Adjei D, Bao Y, Blinkova O. (2015). NCBI viral genomes resource. Nucleic acids research, 43, D571–D577. DOI:10.1093/nar/gku1207.
- ↑ (en) Pennisi E (2011). Microbiology. Going viral: exploring the role of viruses in our bodies. Science 331 (6024): 1513. PMID 21436418. DOI: 10.1126/science.331.6024.1513.
- ↑ a b c d e (en) Madigan et al. pp. 260–274.
- ↑ (en) McDonald S, Nelson M, Turner P. et al. (2016). Reassortment in segmented RNA viruses: mechanisms and outcomes. Nat Rev Microbiol 14, 448-460. DOI:10.1038/nrmicro.2016.46.
- ↑ (en) Moss RB, Davey RT, Steigbigel RT, Fang F (2010). Targeting pandemic influenza: a primer on influenza antivirals and drug resistance. The Journal of Antimicrobial Chemotherapy 65 (6): 1086–93. PMID 20375034. DOI: 10.1093/jac/dkq100.
- ↑ a b (en) Baron S. (1996). Medical Microbiology, 4th edition, "Chapter 43: Viral Genetics". ISBN 0-9631172-1-1. Gearchiveerd op 5 mei 2021. Vrije toegang tot hoofdstuk.
- ↑ (en) Hampson AW, Mackenzie JS (2006). The influenza viruses. The Medical Journal of Australia 185 (S10): S39–43. PMID 17115950. DOI: 10.5694/j.1326-5377.2006.tb00705.x.
- ↑ (en) Más V, Melero JA (2013). Structure and Physics of Viruses. Subcellular Biochemistry, "Entry of enveloped viruses into host cells: membrane fusion", pp. 467-87. ISBN 978-94-007-6551-1.
- ↑ (en) Dimmock et al. p. 71.
- ↑ a b c d e f (en) Campbell et al, pp. 611–618.
- ↑ (en) Mettenleiter, TC. (2002). Herpesvirus Assembly and Egress. Journal of Virology 76 (4): 1537–1547. PMID 11799148. DOI: 10.1128/JVI.76.4.1537-1547.2002.
- ↑ Prinsen J, van der Leij F (2015). De bouwstenen van het leven. Wageningen Academic Publishers, p. 141. ISBN 978-90-8686-270-2.
- ↑ (en) Clokie MR, Millard AD, Letarov AV, Heaphy S. (2011). Phages in nature. Bacteriophage 1 (1): 31-45. PMID 21687533. DOI: 10.4161/bact.1.1.14942.
- ↑ (en) Brault, AC. (2009). Changing patterns of West Nile virus transmission. Veterinary Research 40 (2): 43. PMID 19406093. DOI: 10.1051/vetres/2009026.
- ↑ (en) Fisher B, Harvey R, Champe P. (2007). Lippincott's Illustrated Reviews: Microbiology. Lippincott Williams & Wilkins, pp. 367-392. ISBN 978-0-7817-8215-9.
- ↑ (nl) Hoepelman et al. p. 25.
- ↑ (en) Rouse BT, Sehrawat S (2010). Immunity and immunopathology to viruses: what decides the outcome?. Nature Reviews. Immunology 10 (7): 514–26. PMID 20577268. DOI: 10.1038/nri2802.
- ↑ (en) Margolis TP, Elfman FL, Leib D (2007). Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory ganglia. Journal of Virology 81 (20): 11069-74. PMID 17686862. DOI: 10.1128/JVI.00243-07.
- ↑ (en) Barton ES, White DW, Cathelyn JS, Brett-McClellan KA (2007). Herpesvirus latency confers symbiotic protection from bacterial infection. Nature 447 (7142): 326-29. PMID 17507983. DOI: 10.1038/nature05762.
- ↑ a b c (nl) Hoepelman et al. pp. 37–39.
- ↑ (en) Antonovics J, Wilson AJ, Forbes MR, Hauffe HC (2017). The evolution of transmission mode. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 372 (1719). PMID 28289251. DOI: 10.1098/rstb.2016.0083.
- ↑ (en) Platonov AE (2006). The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia. Vestnik Rossiiskoi Akademii Meditsinskikh Nauk (2): 25–29. PMID 16544901.
- ↑ (en) Burrell CJ, Howard CR, Murphy FA. (2017). Epidemiology of Viral Infections. Fenner and White's Medical Virology: 185-203. PMC 7150207. DOI: 10.1016/B978-0-12-375156-0.00013-8.
- ↑ a b (en) Shors, Chapter 6: "Epidemiology".
- ↑ Galama, J. (2001). Opkomende virusinfecties. Ned Tijdschr Geneeskd 145 (13): 616-619.
- ↑ (en) Reid A, Taubenberger J, Fanning T. (2001). The 1918 Spanish influenza: integrating history and biology. Microbes and Infection 3 (1): 81-87. PMID 11226857. DOI: 10.1016/S1286-4579(00)01351-4.
- ↑ (en) Towner JS, Khristova ML, Sealy TK, Vincent MJ. (2006). Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola. Journal of Virology 80 (13): 6497–516. PMID 16775337. DOI: 10.1128/JVI.00069-06.
- ↑ (en) 2014-2016 Ebola Outbreak in West Africa. Center for Disease Control and Prevention (2019). Gearchiveerd op 2 februari 2021. Geraadpleegd op 02-02-2021.
- ↑ (en) Wong AT, Chen H, Liu SH, Hsu EK, Luk KS. (2017). From SARS to Avian Influenza Preparedness in Hong Kong. Clinical Infectious Diseases 64 (2): S98–S104. PMID 28475794. DOI: 10.1093/cid/cix123.
- ↑ (en) Ashraf B. (2020). Economic impact of government interventions during the COVID-19 pandemic: International evidence from financial markets. Journal of behavioral and experimental finance 27: 100371. DOI: 10.1016/j.jbef.2020.100371.
- ↑ a b (en) Krieken J, Medema R. (2017). Leerboek oncologie. Bohn Stafleu van Loghum, "Fundamentele aspecten van kanker". ISBN 978-90-368-0442-4. Vrije toegang tot hoofdstuk.
- ↑ (en) Hausen, H. (1991). Viruses in human cancers. Science 254 (5035): 1167-1173. DOI: 10.1126/science.1659743.
- ↑ (en) Udakis, L., Viruses and cancer. Microbiology society (2012). Gearchiveerd op 5 mei 2021. Geraadpleegd op 04-02-2021.
- ↑ a b Rijkers G, Kroese F, Kallenberg C. (2016). Immunologie. Bohn Stafleu van Loghum, pp. 3-22. ISBN 978-90-368-0257-4.
- ↑ (en) Baron S. (1996). Medical Microbiology, 4th edition, "Chapter 50: Immune Defenses". ISBN 0-9631172-1-1. Gearchiveerd op 5 mei 2021. Vrije toegang tot hoofdstuk.
- ↑ (en) Le Page C, Génin P, Baines MG, Hiscott J. (2000). Interferon activation and innate immunity. Reviews in Immunogenetics 2 (3): 374-86. PMID 11256746.
- ↑ (en) Hilleman MR (2004). Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections. Proceedings of the National Academy of Sciences of the United States of America 101 (2): 14560–66. PMID 15297608. DOI: 10.1073/pnas.0404758101.
- ↑ (nl) Hoepelman et al. pp. 35–36.
- ↑ a b Rijkers G, Kroese F, Kallenberg C. (2016). Immunologie. Bohn Stafleu van Loghum, pp. 430-433. ISBN 978-90-368-0257-4.
- ↑ (en) Greenwood, B. (2014). The contribution of vaccination to global health: past, present and future. Philos Trans R Soc Lond B Biol Sci 369 (1645): 20130433. DOI: 10.1098/rstb.2013.0433.
- ↑ (en) Andre F, Booy R, Bock H, Clemens J., Vaccination greatly reduces disease, disability, death and inequity worldwide. Bulletin of the World Health Organization (2008). Gearchiveerd op 24 februari 2021. Geraadpleegd op 26-02-2021.
- ↑ (en) Roser M, Ochmann S, Behrens H, Ritchie H, Dadonaite B. (2014). Eradication of Diseases. Our World in Data. Geraadpleegd op 26-02-2021.
- ↑ (en) Brisse M, Vrba S, Kirk N, Liang Y, Ly, H. (2020). Emerging Concepts and Technologies in Vaccine Development. Front. Immunol. 11 (583077). DOI: 10.3389/fimmu.2020.583077.
- ↑ (en) Bogner E, Holzenburg A.. New Concepts of Antiviral Therapy. Springer Science & Business Media, pp. 191-195. ISBN 978-0-387-31047-3.
- ↑ (en) De Clercq E, Li G. (2016). Approved Antiviral Drugs over the Past 50 Years. Clinical Microbiology Reviews 29 (3): 695-747. DOI: 10.1128/CMR.00102-15.
- ↑ (nl) Hoepelman et al. pp. 52–53.
- ↑ (en) Carmichael LE (2005). An annotated historical account of canine parvovirus. Journal of Veterinary Medicine. B, Infectious Diseases and Veterinary Public Health 52 (7–8): 303-11. PMID 16316389. DOI: 10.1111/j.1439-0450.2005.00868.x.
- ↑ (en) Hajek, A.E. (2017). Ecology of Invertebrate Diseases. John Wiley & Sons Ltd, "Viruses". ISBN 978-1-119-25610-6.
- ↑ Steenbergen van, J. (2019). Zoönosen, voorkomen in Nederland en dreiging voor de toekomst. Bijblijven 30: 7-25. DOI: 10.1007/s12414-019-0097-4.
- ↑ (en) Dimmock et al, p. 269.
- ↑ (en) Shors pp. 799–807
- ↑ (en) Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (2005). Mechanisms of plant resistance to viruses. Nature Reviews. Microbiology 3 (10): 789-98. PMID 16132037. DOI: 10.1038/nrmicro1239.
- ↑ (en) Bergh O, Børsheim KY, Bratbak G, Heldal M (1989). High abundance of viruses found in aquatic environments. Nature 340 (6233): 467-68. PMID 2755508. DOI: 10.1038/340467a0.
- ↑ (en) Mojica FJ, Rodriguez-Valera F (2016). The discovery of CRISPR in archaea and bacteria. The FEBS Journal 283 (17): 3162-69. DOI: 10.1111/febs.13766.
- ↑ (en) Lwoff A, Horne R, Tournier P (1962). A system of viruses. Cold Spring Harbor Symposia on Quantitative Biology 27: 51–55. PMID 13931895. DOI: 10.1101/sqb.1962.027.001.008.
- ↑ (nl) Hoepelman et al. pp. 9–13.
- ↑ (en) Gorbalenya A, Krupovic M. (2020). The New Scope of Virus Taxonomy: Partitioning the Virosphere Into 15 Hierarchical Ranks. Nat Microbiol 5 (5): 668–674. PMID 32341570. PMC 7186216. DOI: 10.1038/s41564-020-0709-x.
- ↑ Virus Taxonomy: 2020 Release. talk.ictvonline.org. International Committee on Taxonomy of Viruses. Gearchiveerd op 24 mei 2021. Geraadpleegd op 26-05-2021.
- ↑ (en) Baltimore, D. (1974). Expression of animal virus genomes. Bacteriol Rev 35: 235-241. PMID 4329869. PMC 378387.
- ↑ a b (en) Greene SE, Reid A. (2013). Viruses Throughout Life & Time: Friends, Foes, Change Agents. Washington (DC): American Society for Microbiology. DOI:10.1128/AAMCol.Jul.2013. Vrije toegang
- ↑ (en) van Regenmortel MH, Mahy BW (2004). Emerging issues in virus taxonomy. Emerging Infectious Diseases 10 (1): 8–13. PMID 15078590. PMC 3322749. DOI: 10.3201/eid1001.030279.
- ↑ (en) Mayo MA (1999). Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses. Archives of Virology 144 (8): 1659–66. PMID 10486120. DOI: 10.1007/s007050050620.
- ↑ (en) The International Code of Virus Classification and Nomenclature (2018). International Committee on Taxonomy of Viruses. Geraadpleegd op 23-01-2020.
- ↑ a b (en) Krupovic M, Dolja V, Koonin E. (2019). Origin of viruses: primordial replicators recruiting capsids from hosts. Nature Reviews Microbiology 17: 449-458. DOI: 10.1038/s41579-019-0205-6.
- ↑ a b (en) Forterre, P. (2006). The origin of viruses and their possible roles in major evolutionary transitions. Virus Research 117 (1): 5-16. DOI: 10.1016/j.virusres.2006.01.010.
- ↑ (en) Mahy et al, pp. 11–21.
- ↑ a b c (en) Regenmortel M, Mahy B. (2010). Desk Encyclopedia of General Virology. Academic Press, "Origin of Viruses", pp. 24-27. ISBN 978-0-12-375162-1.
- ↑ (en) Alberts, B (2015). Molecular biology of the Cell, 6th. Garland Science, 362–366. ISBN 978-0815340720.
- ↑ (en) Di Serio F, Navarro B, Flores R. (2017). Origin and evolution of viroids. In Viroids and Satellites (pp. 125-134). Academic press. DOI:10.1016/B978-0-12-801498-1.00012-7.
- ↑ (en) Warke S, Tembhurne P, Bobade S, Ingle V. (2019). Paleovirology: Blessing or Curse of Ancient Viruses: A Review. Agricultural Reviews 40 (4): 329-333. DOI: 10.18805/ag.R-1786.
- ↑ (en) Carter J, Saunders V, Saunders V. (2007). Virology: Principles and Applications. John Wiley & Sons, "Chapter 2: Methods used in Virology". ISBN 978-0-470-02386-0.
- ↑ a b (en) Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Molecular Cell Biology, 4th. W. H. Freeman, New York, "Viruses: Structure, Function, and Uses".
- ↑ (en) Furfaro L, Payne M, Chang B. (2018). Bacteriophage Therapy: Clinical Trials and Regulatory Hurdles. Front. Cell. Infect. Microbiol.. DOI: 10.3389/fcimb.2018.00376.
- ↑ (en) Lico C, Chen Q, Santi L. (2008). Viral vectors for production of recombinant proteins in plants. J Cell Physiol. 216 (2): 366-77. PMID 18330886. DOI: 10.1002/jcp.21423.
- ↑ (en) Berkrot, B., FDA approves Amgen's injected immunotherapy for melanoma. Reuters (oktober 2015). Gearchiveerd op 5 mei 2021. Geraadpleegd op 14 april 2021.
- ↑ (en) Harrington K, Freema D, Kelly B. (2019). Optimizing oncolytic virotherapy in cancer treatment. Nat Rev Drug Discov 18: 689–706. DOI: 10.1038/s41573-019-0029-0.
- ↑ (en) Mietzsch M, Agbandje-McKenna M. (2017). The Good That Viruses Do. Annual Review of Virology 4: 3-5. DOI: 10.1146/annurev-vi-04-071217-100011.
- ↑ (en) Manchester M, Steinmetz N. (2009). Viruses and Nanotechnology. Springer-Verlag Berlin Heidelberg, "Chemical Modification of Viruses and Virus-Like Particles". ISBN 978-3-642-08888-9.
- ↑ (en) Singh P, Gonzalez M, Manchester M. (2006). Viruses and their uses in nanotechnology. Drug development research 67 (1): 23-41. DOI: 10.1002/ddr.20064.
- ↑ (en) Fischlechner M, Donath E. (2007). Viruses as building blocks for materials and devices. Angewandte Chemie 46 (18): 3184–93. PMID 17348058. DOI: 10.1002/anie.200603445.
- ↑ (en) Steinmetz, N. (2010). Viral nanoparticles as platforms for next-generation therapeutics and imaging devices. Nanomedicine: Nanotechnology, Biology and Medicine 6 (5): 634–641. PMID 20433947. DOI: 10.1016/j.nano.2010.04.005.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Virus op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Literatuur
- (en) Mahy B, Ter Meulen, V. (2007). Topley and Wilson's Microbiology and Microbial Infections, 10th ed. John Wiley & Sons Inc, "Virology". ISBN 978-0-470-66027-0.
- (en) Madigan M, Bender K, Buckley D. (2018). Brock Biology of Microorganisms, 15th ed. Pearson Education, "Chapter 8: Viruses and their replication". ISBN 978-1-292-23510-3.
- (en) Campbell N, Urry L, Cain M. (2017). Biology: A Global Approach, 11th edition. Pearson Education, "Chapter 26: Introduction to Viruses". ISBN 978-1-292-17043-5.
- Hoepelman A, Kroes A, Sauerwein R. (2016). Microbiologie en infectieziekten. Bohn Stafleu van Loghum. ISBN 978-90-368-1116-3.
- (en) Dimmock N, Easton A, Leppard K. (2007). Introduction to Modern Virology, 6th ed. Blackwell Publishing. ISBN 978-1-4051-3645-7.
- (en) Shors, T. (2017). Understanding Viruses, 3rd ed. Jones and Bartlett Publishers. ISBN 978-1-284-02592-7.