Quiralitat (química)

La quiralitat és una propietat que tenen algunes molècules de no ser superposables a la seva imatge especular. En general això passa amb la presència d'un àtom de carboni asimètric, és a dir un àtom de carboni amb quatre substituents diferents.
Convencions de nomenclatura
Segons la configuració: d- i l-
Un isòmer òptic pot ser anomenat segons la configuració espacial dels seus àtoms. El sistema d/l ho fa relacionant la molècula amb el gliceraldehid. El gliceraldehid és una molècula quiral i els seus dos isòmers s'etiqueten d i l (típicament en tipografia versaleta, en treballs publicats). Es poden dur a terme certes manipulacions químiques en el gliceraldehid sense alterar-ne la configuració. En aquest sistema, els compostos s'anomenen per analogia amb el gliceraldehid, que en general provoca designacions no ambigües.
Segons la configuració: R- i S-
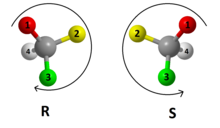
Pels químics, el sistema R/S és el sistema de nomenclatura més important per anomenar els enantiòmers, en el qual no intervé una molècula de referència com el gliceraldehid.
S'etiqueta cada centre quiral R o S, d'acord amb un sistema en el qual s'assigna a cada substituent una prioritat, segons les regles de Cahn-Ingold-Prelog que es basen en el nombre atòmic. Situant el substituent de menor prioritat allunyat d'un observador, si la prioritat dels tres substituents restants decreix en sentit de les agulles del rellotge, al centre quiral se li assigna la configuració R (del llatí Rectus, dreta). Si, en canvi, la prioritat decreix en sentit antihorari, la configuració és S (del llatí Sinister, esquerra).
Segons l'activitat òptica: (+)- i (-)-
Un enantiòmer es pot anomenar segons el sentit en el que és capaç de rotar el pla de llum polaritzada. Si el sentit és el de les agulles del rellotge, se li assigna la configuració (+). Si, en canvi, el sentit de la rotació és antihorari, se li assigna el signe (-). Els isòmers (+) i (-) també es poden anomenar d- i l-, respectivament (de dextrorotatori i levorotatori). Tanmateix les etiquetes d- i l- poden confondre's amb les d- i l-, de manera que aquesta nomenclatura està desaconsellada per la IUPAC.
Quiralitat de les amines
Les amines terciàries són quirals d'una forma similar als compostos de carboni: l'àtom de nitrogen té quatre substituents, comptant el parell electrònic lliure. Tot i això, la barrera energètica per la inversió de l'estereocentre és, en general, d'uns 30 kJ/mol, la qual cosa vol dir que els dos estereoisòmers s'interconverteixen ràpidament a temperatura ambient.
Així doncs, amines del tipus NHRR' no poden ser resoltes òpticament i les del tipus NRR'R" només poden ser resoltes en el cas que els tres substituents (R, R' i R") estiguin fixats en l'espai, en estructures cícliques com en la base de Tröger. Plantilla:Enllaç AD

